Настоящее изобретение относится к области медицинской диагностики. Оно обеспечивает новые средства, включая диагностические наборы и способы сканирования всего организма, направленные, в числе прочего, на оценку физиологических процессов, воздействий, связанных с образом жизни и окружающей средой, раннюю диагностику и мониторинг заболеваний и их лечение.
Полное сканирование организма представляет собой сканирование всего тела субъекта для поддержки диагностики и лечения здорового состояния и болезней. Оно также может быть известно как КТ всего организма, если используют технологию компьютерной томографии (КТ), хотя существует много технологий медицинской визуализации, которые могут выполнять полное сканирование организма. Полное сканирование организма теоретически может обнаружить смертельные заболевания (например, рак) на ранних стадиях, что может спасти жизнь. В то же время на практике преимущества известных в настоящее время способов полного сканирования организма могут не перевешивать риски и затраты. Таким образом, возникают разногласия по поводу использования способов полного сканирования организма при скрининге пациентов, у которых еще не диагностировано заболевание, или у которых отсутствуют симптомы, указывающие на заболевание. Как и при любом тесте, используемом для скрининга заболевания, необходимо взвесить риски КТ-сканирования всего организма по сравнению с пользой от выявления излечимого заболевания на ранней стадии. По сравнению с большинством других рентгенодиагностических процедур, КТ приводит к относительно высоким дозам облучения, что может быть связано с очень небольшим, но значительным увеличением возможности развития рака у человека в будущем. Важно отметить, что современные методики визуализации требуют дорогостоящего оборудования, с помощью которого можно анализировать только одного субъекта одновременно. В отличие от этого, анализ крови можно выполнять параллельно для многих людей, а необходимое для него оборудование широко доступно во многих диагностических лабораториях. Кроме того, для анализа крови пациенту не нужно ехать в центр скрининга, а достаточно отбора образца крови на месте с его последующей транспортировкой.
Авторы настоящего изобретения признают необходимость альтернативных средств и способов сканирования всего организма субъекта, при которых польза от выявления излечиваемого заболевания на ранней стадии намного перевешивает риск. Они разработали концептуально новую систему сканирования всего организма, предназначенную для оценки физиологических процессов, скрининга состояния здоровья в целом и ранней диагностики и мониторинга заболеваний и их терапии (например, лечения). Она включает проточно-цитометрическое сканирование организма (FlowBoScan) или сканирование тканевых макрофагов (TiMaScan) с использованием тканевых макрофагов в крови в качестве показателя нарушенного гомеостаза тканей и заболевания. Указанный новый инструмент не предполагает какого-либо воздействия вредных излучений на организм. В противоположность этому, TiMaScan можно выполнить с использованием легкодоступных образцов, полученных из организма, например, периферической крови.
Во всех тканях в организме человека и животных поддерживается тонкое гомеостатическое равновесие между пролиферацией и гибелью клеток, главным образом запрограммированной гибелью клеток путем апоптоза (тип I) и аутофагии (тип II). В зависимости от типа ткани уровень гомеостатической активности является более высоким или низким. Например, эпителиальные клетки в кишечнике, гемопоэтические клетки в костном мозге и эпителий кожи характеризуются высокой интенсивностью обновления, в то время как эта интенсивность обновления снижена в других тканях, например, нервной системе, печени, почках и мышцах. Тем не менее клеточный гомеостаз поддерживается во всех тканях или на высоком, или на более низком уровне. В дополнение к базовому уровню гомеостаза процессы активации, регенерации и старения влияют на гомеостаз пролиферации и гибели клеток, приводя к росту или инволюции. Например, активация за счет частого использования приводит к повышению базового уровня гомеостаза до более высокого уровня гомеостаза, например, увеличению объема и состава мышц за счет специфических физических упражнений при занятиях спортом и инволюции таких мышц при прекращении тренировок. Кроме того, износ кожи при тяжелом труде или воздействии химических веществ утолщает кожу ладоней и подошв; такие мозоли исчезают при прекращении износа.
Определенные состояния могут менять или даже нарушать уровень клеточного гомеостаза, например:
- повреждение тканей (травмы или хирургическое вмешательство) и последующее восстановление;
- функциональное стрессовое воздействие на системы органов, например, злоупотребление алкоголем и нарушение функции печени, или участие в марафоне и триатлоне и истощение мышц; (преждевременная) возрастная инволюция (старение);
- подавление и последующая регенерация, например, с помощью таких лекарств, как кортикостероиды;
- воспаление и последующее восстановление за счет регенерации и/или фиброза, например, при аутоиммунных заболеваниях;
- инфекционные длительные вялотекущие и постепенно развивающиеся заболевания, например, туберкулез, болезнь Лайма, Ку-лихорадка и др.;
- нарушение регуляции пролиферации с последующей гиперплазией и, возможно, также последующей дисплазией и злокачественной трансформацией.
Несмотря на высокие уровни гомеостатической пролиферации и апоптоза, мертвые клетки или погибающие клетки редко наблюдают в срезах тканей. По-видимому, мертвые клетки и апоптозные клетки быстро и эффективно удаляются тканевыми макрофагами. Справедливо предположить, что каждый отдельный тканевый макрофаг обслуживает определенную (ограниченную) область вовлеченной ткани и может эффективно удалять апоптозные клетки и другие повреждения тканей. Поскольку каждый тканевый макрофаг, скорее всего, обрабатывает ограниченное количество апоптозных клеток (например, от 20 до 40 клеток, в зависимости от размера и типа клеток), объем/размер зоны наблюдения зависит от типа ткани и уровня гомеостатической активности вовлеченной ткани. Чем выше уровень гомеостаза или выше уровень восстановления или пролиферации, тем больше тканевых макрофагов нужно для удаления продуктов распада из вовлеченной ткани и избежания структурных изменений ткани с функциональной недостаточностью ткани. Следовательно, количество тканевых макрофагов на объем ткани может меняться в зависимости от типа ткани, активности ткани, возникновения воспаления или восстановления после повреждения и т.д. После того как тканевые макрофаги выполняют локальную задачу в их области действия, указанные зрелые макрофаги покидают свои области действия и мигрируют через лимфатические сосуды в кровь с целью дальнейшего удаления из организма, вероятно, в селезенке.
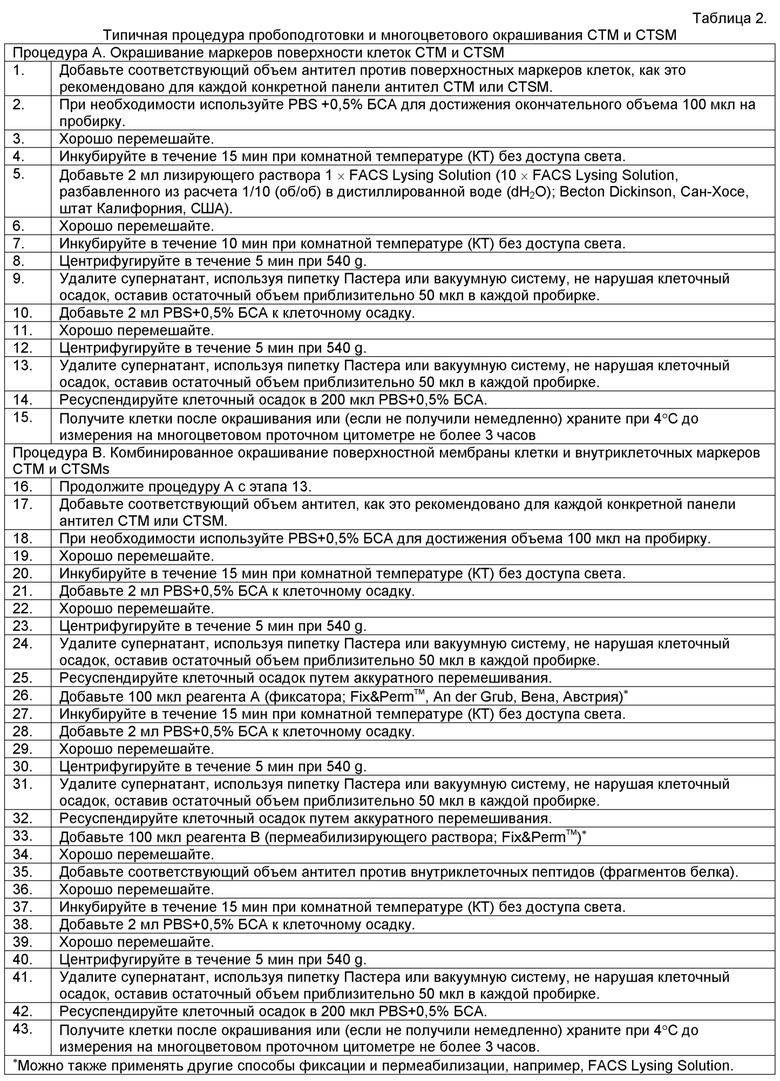
Посредством пути дифференцировки моноцитов в костном мозгу непрерывно продуцируетются классические моноциты CD14high/CD16- (моноциты, "поступающие в ткань"), которые становятся доступны в крови и могут рекрутироваться в качестве воспалительных моноцитов в пораженные ткани, где они созревают в гетерогенную (het) популяцию тканевых макрофагов с CD14high/CD16+ и CD14high/CD16high (Фигура 1). После того как указанные клетки выполняют свои задачи контроля и фагоцитоза, они становятся зрелыми макрофагами и мигрируют через систему лимфатических сосудов в виде CDl4het/CD16het СТМ в кровь (моноциты/макрофаги, "уходящие из ткани"), где они являются неустойчивыми клетками и обладают коротким временем жизни (Фигура 1).
По меньшей мере частично, СТМ обнаруживаются в периферической крови. В нормальной крови обнаруживается небольшая популяция СТМ, характеризующихся гетерогенной экспрессией CD14 и CD16. Уровень указанных СТМ увеличивается при старении и при определенных клинических состояниях, например, после трансплантации стволовых клеток (SCT) и в случае воспаления, сепсиса, рака и чрезмерных физических нагрузок (Фигура 2).
Предполагаемый процесс миграции и рециркуляции подтверждается тем фактом, что относительные частоты классических моноцитов и СТМ отличаются в зависимости от местоположения: низкая частота гетерогенных CD14+/CD16+ и CD14dim/CD16high СТМ в костном мозге и крови, но более высокая частота в лимфе (Таблица 1) (Orfao et al., неопубликованные результаты).
Относительные частоты классических моноцитов и СТМ*
Справедливо предположить, что и у здоровых лиц, и при лечении заболеваний, ряд фрагментов белков и пептидов в фагосомах каждого тканевого макрофага состоит из тканеспецифических пептидов, так как область контроля тканевых макрофагов, скорее всего, ограничена тканью одного типа, возможно, даже небольшим участком ткани в пределах некоторой ткани. Следовательно, общая популяция СТМ в крови в заданный момент времени отражает уровень гомеостаза всех тканей во всем организме. На основании набора фагосомальных пептидов каждый СТМ следует отнести по происхождению к своей ткани. Относительный состав циркулирующих тканеспецифических макрофагов (CTSM), вероятно, стабильней в отношении их относительного и абсолютного количества в крови, а также к содержания в них фрагментов белка и пептидов, происходящих из различных тканей, с учетом возрастных, связанных с полом, метаболизмом и активностью различий, поскольку такие различия влияют на клеточный гомеостаз. Существенно, что гомеостатические изменения (например, повреждение тканей) в любой области организма приводят к изменению относительного и абсолютного количества и относительного состава внутриклеточных уровней фрагментов белка и пептидов в популяции циркулирующих тканевых макрофагов. Такие изменения могут затрагивать одно или более из различных субпопуляций СТМ и CTSM, и могут включать отсутствие эпитопа, экспрессируемого в норме, аномальную экспрессию эпитопа, отсутствующего в норме, или измененные уровни экспрессии эпитопа, экспрессируемого в норме.
В соответствии с настоящим изобретением авторы разработали систему, использующую уникальное сочетание маркеров клеточной поверхности для обнаружения и идентификации циркулирующих тканевых макрофагов (СТМ) и их субпопуляций в крови, ориентированную на распознавание эпитопов в продуктах, полученных за счет внутриклеточного процессинга и деградации (например, одной или более протеазами) белков (например, пептидов), локально захваченных в ткани одиночным СТМ. Особые возможности новой системы касаются возможности скрининга всех СТМ в образце крови в отношении происхождения отдельных субпопуляций СТМ и определения указанных субпопуляций на основе комбинации множества фрагментов тканеспецифических белков или пептидов; кроме того, дальнейшее деление указанных циркулирующих тканеспецифических макрофагов (CTSM) на субпопуляции может быть основано на экспрессии других пептидов, например, происходящих от аномально экспрессируемых белков, например, онкобелков. Таким образом, вся совокупнасть СТМ отражает процессы, происходящие в различных тканях всего организма, как гомеостатических, так и нарушенных. Измерение этих субпопуляций СТМ позволяет контролировать состояние здоровья и выполнять скрининг конкретных заболеваний, в том числе тканевой локализации указанных заболеваний. После установления диагноза можно использовать мониторинг соответствующей субпопуляции СТМ для отслеживания индивидуального статуса с течением времени, например, для оценки исчезновения или стабильности течения заболевания и/или для оценки эффективности лечения.
Таким образом, в одном варианте реализации настоящее изобретение обеспечивает способ определения состояния здоровья субъекта, раннего обнаружения повреждения тканей, ранней диагностики и мониторинга заболевания и/или оценки эффективности лечения субъекта с использованием циркулирующих тканевых макрофагов (СТМ) как показателя нарушенного гомеостаза ткани и наличия заболевания, причем указанный способ включает этапы:
a) Обеспечения биологического образца для тестирования от субъекта, предпочтительно человека, причем указанный образец содержит циркулирующие тканевые макрофаги (СТМ);
b) окрашивания указанных СТМ панелью дифференциально меченных различных антител против набора опорных маркеров с целью идентификации и подсчета по меньшей мере одной, предпочтительно по меньшей мере двух субпопуляций СТМ, причем опорные маркеры представляют собой CD14, CD16 и IREM2 (CD300e), а также, предпочтительно, HLADR и/или CD45;
c) фиксации, пермеабилизации и окрашивания СТМ с использованием одного или нескольких антител для обнаружения против одного или более эпитопов по меньшей мере одного протеазо-индуцированного фрагмента белка, полученного в результате внутриклеточной деградации белка, не принадлежащего СТМ, отдельными СТМ в тканях, из которых они происходят, тем самым идентифицируя по меньшей мере одна субпопуляция циркулирующих тканеспецифических макрофагов (CTSM);
d) анализа с применением многопараметрической проточной цитометрии указанных окрашенных СТМ и CTSM с целью определения количества сигналов каждого отдельного меченого антитела, связанного с отдельными клетками;
e) определения относительного и абсолютного количества отдельных клеток в субпопуляций СТМ и специфической(ких) субпопуляции (ях) CTSM, экспрессирующих каждый из измеренных внутриклеточных эпитопов;
f) расчета (i) относительного и абсолютного количества клеток в субпопуляции СТМ и специфической(ких) субпопуляции (ях) CTSM, каждое из которых происходит из различных нормальных и измененных тканей, что определяют с помощью оцениваемого набора отдельных протеазо-индуцированных фрагментов белка, и ii) количества связанного с антителами сигнала, ассоциированного с каждым отдельным оцениваемым внутриклеточным пептидом, с целью получения профиля окрашивания CTSM, а также;
g) сравнения тестируемого профиля окрашивания CTSM с нормальным профилем окрашивания CTSM для каждой оцениваемой ткани, причем аномальный профиль окрашивания свидетельствует о повреждении тканей, нарушенном гомеостазе ткани, наличии заболевания и/или эффективности лечения по сравнению с устойчивостью.
IREM2 означает "иммунный рецептор 2, экспрессируемый миелоидными клетками". В номенклатуре CD-антигенов этот белок обозначают как CD300E или CD300e. Этот белок также известен как CD300LE [член семейства LE, подобный молекуле CD300]. Экспрессия IREM2, по-видимому, ограничена моноцитами, макрофагами и дендритными клеткми и подавляется при дифференцировке.
HLADR представляет собой поверхностный МНС-рецептор II класса, кодируемый комплексом лейкоцитарных антигенов человека в области 6р21.31 хромосомы 6. HLADR является αβ-гетеродимерным рецептором клеточной поверхности, причем каждая субъединица содержит 2 внеклеточных доменов, мембранный домен и цитоплазматический хвост. Как α, так и β-цепи закреплены в мембране. Комплекс HLADR и его лиганда, пептида длиной 9 аминокислот или более, представляет собой лиганд для Т-клеточного рецептора (TCR).
В настоящем документе аббревиатура "СТМ" обозначает циркулирующие тканевые макрофаги. Термин " субпопуляции СТМ" относится к различным подмножествам СТМ, в том числе CD14high/CD16+, CD14high/CD16high СТМ, CD14+/CD16high, CD14low/CD16high, CD14-/CD16high, CD14-/CD16low СТМ, CD11c+/CD16+, CD11c+/CD16high, CD11c+/CD16low CTM, CD33high/CD16+, CD33high/CD16high, CD33+/CD16high, CD33+/CD16low CTM, CD300e+/CD16+, CD300e+/CD16high, CD300e+/CD16low CTM, CD16+, CD16high, CD16low CTM, CD 14high/CD 16+/CD300e+/HLADR+, CD14high/CD 16high/CD300e+/HLADR+, CD14+/CD16high/CD300e+/HLADR+, CD14-/CD16high/CD300e+/HLADR+ и CD14-/CD16low/CD300e+/HLADR+.
"CTSM" относится к циркулирующим тканеспецифическим макрофагам, для которых тканеспецифичность определяется внутриклеточным окрашиванием фрагментов (пептидов), полученных в результате расщепления тканеспецифических белков протеазами. "протеазо-индуцированные фрагменты белков" представляют собой фрагменты или пептиды, происходящие от белков, не принадлежащих СТМ, поглощенных, процесированных и расщепленных протеазами в фагосомах макрофагов. Выражение "опорные маркеры" относится к повторяющемуся набору маркеров для идентификации и подсчета совокупности СТМ и субпопуляций СТМ; в дополнение к указанным маркерам для идентификации субпопуляций СТМ, в частности, тканеспецифических макрофагов, так называемых субпопуляций CTSM, можно применять окрашивание дополнительных мембранных маркеров и о внутриклеточных компонентов.
В соответствии с настоящим изобретением, набор опорных маркеров включает по меньшей мере антитела к маркерам CD14, CD16 и CD300e, предпочтительно дополненные антителами к HLADR и/или CD45. В одном варианте реализации применяют комбинацию CD14, CD16 и CD300e. В другом варианте реализации применяют комбинацию CD14, CD16, CD300e и HLADR. В предпочтительном случае дополнительно включают антитела к одному или более из маркеров CD11с, CD33, CD35, CD36, CD45 и CD64. Особенно предпочтительны антитела к CD45, CD36 и/или CD64. Очень полезные наборы (панели) антител включают или состоят из антител против CD14, CD16, CD300e и CD64; CD14, CD16, HLADR и CD64; CD14, CD16, CD300e, HLADR и CD64; CD14, CD16, CD300e, HLADR и CD45; CD14, CD16, CD300e, HLADR, CD64 и CD36. В одном аспекте окрашивание СТМ выполняют с помощью панели дифференциально меченных различных антител против маркеров CD14, CD16, CD11c, CD33, CD36, CD45, CD64, CD123, CD86, CD300e и HLA-DR. В специфическом аспекте окрашивание СТМ выполняют с помощью панели дифференциально меченных различных антител против маркеров CD14, CD16, CD300e, HLADR, CD45, CD64 и CD36. Это позволяет точно селективно пропускать (гейтировать) все моноциты и все СТМ, точно различать моноциты и СТМ и субпопуляции СТМ (Фигура 3).
В данной области техники описан анализ макрофагов для выявления поглощенных белков немакрофагального происхождения. В то же время, преимущества применения проточной цитометрии при выделении субпопуляций из популяции макрофагов на основе положительного отбора клеток, экспрессирующих по меньшей мере три специфических маркера поверхности (CD14, CD16, CD300e плюс HLA-DR и/или CD45), в соответствии с настоящим изобретением ранее не описывали или не предполагали.
Japink et al. (Gastroenterology, Elsevier, Vol.134, no. 4, (2008-04-01), page A-487) описывают определение внутриклеточного онкоэмбрионального антигена (СЕА) в CD14+/CD16+-клeткax из образцов крови с помощью проточной цитометрии с целью раннего обнаружения новообразований ободочной и прямой кишки или их рецидива.
Herwig et al. (European Urology Suppl., Vol. 5, No. 2, (2006-04-01), page 275, XP 005522982; and J. of Urology, Vol.181, No. 4 (2009-04-01), pg. 653, XP 025979386) описывают анализ мононуклеаров периферической крови CD14+/CD16+ с применением многоцветовой проточной цитометрии для определения внутриклеточного PSA (простатоспецифического антигена) при диагностике рака предстательной железы.
В WO 2010/015633 описан способ, позволяющий характеризовать молекулярные маркеры, которые внутриклеточно всасываются из ткани макрофагами крови, рециркулирующими из ткани в кровеносную систему. С этой целью определяют СD14/СD16-положительную популяцию-мишень, необязательно в комбинации с отрицательным отбором клеток, экспрессирующих CD56, CD57 и/или CD161.
WO 2009/1000953 относится к анализу активированных макрофагов (CD14/CD16) для выявления внутриклеточных фрагментов бета-амилоида. Фрагменты бета-амилоида обнаруживают с помощью MALDI-TOF-MS (масс-спектрометрией с времяпролетной ионизацией лазерной десорбцией и использованием матрицы) после лизиса клеток, для формирования пула клеточных лизатов, и иммунопреципитации. Комбинацию антител против CD45, CD14, CD16 и CD19 применяют для идентификации популяции активированных макрофагов и В-клеток.
Almeida et al. (Clin. Immunol. Vol. 100, No. 3, pp.325-338, 2001) провели сравнительный анализ морфологических, цитохимических, иммунофенотипическах и функциональных характеристик линий нормальных клеток периферической крови человека: клеток (-)/CD16(+)/HLA-DR(+)/CD14(low), моноцитов CD14(+) и дендритных клеток CD16(-). Описана сортировка мононуклеарных клеток с использованием комбинации антител против CD14, CD16 и HLADR, а также других маркеров, специфических для определенных направлений дифференцировки (например, CD3 для исключения Т-лимфоцитов, CD19 для исключения В-клеток и CD56 для исключения NK-клеток). Отсортированные клетки затем анализируют с помощью морфологического и цитохимического исследования моноцит-специфических характеристик. Внутриклеточное окрашивание процессированных тканеспецифических белков не было описано или не предлагалось.
Способ, основанный на применении многоцветной проточной цитометрии, представленный в настоящем документе, предпочтительно включает конкретные стратегии селективного пропускания (гейтирования) основанного поверхностной экспрессии CD14, CD16 и CD300e (IREM2), предпочтительно, CD14, CD16, CD300e (IREM2) и HLADR, в комбинации с анализом бокового светорассеяния (SSC) (Фигура 4). Стратегия селективного пропускания моноцитарно-макрофагальной клеточной популяции состоит из этапа включения (пропускания) и этапа идентификации субпопуляции. Целью этапа включения является пропускание как "классических моноцитов" (моноцитов, "поступающих в ткань"), так и тканевых макрофагов (моноциты/макрофаги, "уходящие из ткани" = циркулирующие тканевые макрофаги; СТМ). На последующих этапах следует различить классические моноциты и СТМ и, в частности, следует определить субпопуляции в популяции СТМ. Таким образом, в одном варианте реализации настоящего изобретения стратегия селективного пропускания включает (i) стратегию селективного пропускания для включения классических моноцитов и СТМ, с последующей (ii) стратегией селективного пропускания путем идентификации субпопуляций для различения классических моноцитов и СТМ и для идентификации одной или более субпопуляций в популяции СТМ.
Можно рассматривать различные стратегии селективного пропускания. Простейшая стратегия для обнаружения всех классических моноцитов и подавляющего большинства СТМ и некоторых субпопуляций СТМ включает окрашивание с использованием по меньшей мере CD14, CD16 и CD300e. Все классические моноциты и большинство (но не все) СТМ обнаруживают с помощью селективного пропускания (гейтирования) по комбинации бокового светорассеяния (SSC) и CD300e (IREM2)+-клеток (отбором клеток с низким и средним SSC, экспрессирующих CD300e). Более точная стратегия для обнаружения всех классических моноцитов и практически всех СТМ и некоторых субпопуляций СТМ включает окрашивание с использованием по меньшей мере CD14, CD16, CD300e и HLADR. Все классические моноциты, а также практически все СТМ обнаруживают посредством селективного пропускания по комбинации бокового светорассеяния (SSC) в комбинации с CD300e и HLADR (т.е. отбором клеток с низким и средним SSC, одновременно экспрессирующих CD300e и HLADR). Высокоточная стратегия для обнаружения всех классических моноцитов и всех СТМ и некоторых субпопуляций СТМ включает окрашивание с использованием по меньшей мере CD14, CD16, CD45, CD300e и HLADR. Все поступающие и все уходящие моноциты/макрофаги можно обнаружить посредством селективного пропускания по комбинации бокового светорассеяния (SSC) и CD45, CD300e и HLADR-положительных клеток. Конкретнее, отбирают клетки с CD45 и низким и средним SSC, одновременно экспрессирующие CD300e и HLADR (Фигура 4А и В). Соответственно, этап включения может включать один из следующих вариантов:
(i) окрашивание с использованием по меньшей мере CD14, CD16 и CD300e и селективное пропускание по комбинации SSC и СD300е+-клеток для отбора клеток с низким и средним SSC, экспрессирующих CD300e;
(ii) окрашивание с использованием по меньшей мере CD14, CD16, CD300e и HLADR и селективное пропускание по комбинации бокового светорассеяния (SSC) и CD300e и HLADR+-клеток для отбора клеток с низким и средним SSC, одновременно экспрессирующих CD300e и HLADR, либо
(iii) окрашивание с использованием по меньшей мере CD14, CD16, CD45, CD300e и HLADR
и селективное пропускание по комбинации SSC и CD45, CD300e и HLADR-положительных клеток, предпочтительно селективное пропускание клеток с CD45 и низким и средним SSC, одновременно экспрессирующих CD300e и HLADR (Фигура 4А-D).
Настоящее изобретение также обеспечивает несколько стратегий селективного пропускания для идентификации субпопуляций СТМ. В одном варианте реализации указанная стратегия позволяет идентифицировать классические моноциты (CD14+/CD16-) и некоторые субпопуляции СТМ. Субпопуляции СТМ определяют в пределах одного из вышеуказанных гейтов включения, предпочтительно с использованием по меньшей мере SSC, CD300e и HLADR, на основе дополнительного использования по меньшей мере CD14 и CD16. Соответственно, в одном варианте реализации стратегия селективного пропускания включает идентификацию классических (CD14+/CD16-) моноцитов и двух основных субпопуляций СТМ, идентифицируемых как CD14high/CD16low - CD14high/CD16high и CD14low/CD16high - CD14-/CD16high и CD14-/CD16low (Фигура 4D).
В еще одном варианте реализации стратегия селективного пропускания субпопуляций состоит из трех этапов, обеспечивающих более точное обнаружение классических моноцитов и нескольких субпопуляций СТМ в пределах одной из вышеуказанных комбинации параметров включения (предпочтительно с использованием по меньшей мере SSC, CD300e и HLADR), на основе дополнительного использования по меньшей мере CD14, CD16 и CD64.
На первом этапе идентифицируют классические моноциты и более зрелые стадии СТМ с помощью селективного пропускания по CD64low (СТМ поздней стадии) против CD64high (классические моноциты и СТМ ранней стадии). Целью второго этапа является различение моноцитов и СТМ путем отбора всех других ранних СТМ-клеток (по сравнению с классическими моноцитами) по фенотипу CD16+/CD14+. Следовательно, отобранные клетки, определяемые как CD64low и как CD16+/CD64high, должны составлять полную совокупность СТМ, а все остальные гейтированные клетки, отобранные на этапе общего селективного пропускания, должны соответствовать классическим моноцитам. На третьем этапе на основе уровней экспрессии CD64, CD14 и CD16 среди отобранных клеток СТМ можно далее подразделить на отдельные совокупности, связанные с функциональными свойствами или созреванием: от CD64high/CD14high/CD16low до CD64high/CD14high/CD16high, CD64high/CD14low/CD16high, CD64low/CD14-/CD16high и CD64low/CD14-/CD16low. Соответственно, в одном аспекте этап идентификации субпопуляций включает:
- селективное пропускание клеток CD64low, представляющих собой СТМ поздней стадии, в отличие CD64high, представляющих собой классические моноциты и СТМ ранней стадии, а затем
- различение моноцитов и СТМ путем отбора всех других СТМ-клеток ранней стадии (по сравнению с классическими моноцитами) по фенотипу CD16+/CD14+ и определение всей совокупности СТМ как CD64low и как CD 16+/CD64high, а затем
- дальнейшее подразделение отобранных СТМ на основе уровней экспрессии CD64, CD14 и CD16 на отдельные совокупности, связанные с функциональными свойствами или созреванием, причем предпочтительно указанные отдельные совокупности представляют собой CD64high/CD14high/CD16low - CD64high/CD14high/CD16high, CD64high/CDl4low/CD16high, CD64low/CD14-/CD16high и CD64low/CD14-/CD16low.
В еще одном варианте осуществления настоящее изобретение обеспечивает стратегию, обеспечивающую идентификацию дополнительных субпопуляций в популяции СТМ, что может быть полезным в случае определенных образцов (например, периферической крови детей или костного мозга взрослых), содержащих предшественники классических моноцитов. Использование CD36 в комбинации с CD64 способствует лучшей идентификации всех стадий созревания как классических моноцитов, так и СТМ на третьем этапе предшествующей стратегии в следующих субпопуляциях (Фигура 4Е-Н):
- Классические моноциты: от клеток CD64high/CD36lo (предшественники классических моноцитов) до CD64high/CD36high (реальные зрелые моноциты);
- субпопуляции СТМ: от CD64high/CD36high/CD14high/CD16low до CD64highCD36high/CD 14high/CD 16high, от CD64high/CD36highCD 14low/CD16high и CD64low/CD36high/CD14-/CD16high до CD64low/CD14-/CD16low/CD36- до клеток с низким содержанием антигенов.
Настоящее описание также обеспечивает способ, включающий этап дальнейшего подразделения отобранных СТМ на основе CD14, CD16, CD36 и CD64, предпочтительно включая идентификацию по меньшей мере одной из следующих субпопуляций СТМ: от CD64high/CD36high/CD14high/CD16low до CD64high/CD36high/CD 14high/CD 16high, CD64high/CD36high/CD14low/CD 16high, CD64low/CD36high/CD14-/CD16high и CD64low/CD14-/CD16low/CD36- до клеток с низким содержанием антигенов (Фигура 4 и Фигура 5).
Можно применять биологический образец любого типа, выделенный из организма субъекта-млекопитающего, обычно субъекта-человека, заведомо или предположительно содержащий циркулирующие тканевые макрофаги. Например, биологический образец для тестирования включает периферическую кровь, асцитную жидкость, плевральный выпот, спинномозговую жидкость, костный мозг, лимфатический узел, лимфатическую жидкость, синовиальную жидкость или суспензию одиночных клеток, полученную из плотной ткани. Особенно подходящей является периферическая кровь, так как ее легко получить от субъекта с помощью малоинвазивной процедуры, например, венепункции.
Способ согласно настоящему изобретению предпочтительно выполняют в формате с несколькими пробирками, который дает возможность объединить информацию о субпопуляциях CTSM. Это основано на справедливом предположении, что в условиях нормального гомеостаза каждый отдельный CTSM может быть положителен в отношении пептидов (фрагментов белков) только из одной ткани. Таким образом, также обеспечивается способ, при котором две или более аликвоты одного и того же биологического тестируемого образца параллельно к окраске на одни и те же опорные маркера для идентификации субпопуляций СТМ, окрашивают различными дополнительными антителами для более подробного выявления субпопуляций в отдельных популяциях CTSM, согласно ткани, из которой они происходят, на основе обнаружения протеазо-индуцированных фрагментов белка, происходящих от тканеспецифичных белков с целью сканирования гомеостатического состояния и возможного нарушения тканевого гомеостаза в тканях всего организма.
Herwig et al. (2004, 2005, ЕР 1516182) и Leers et al. (2008) описали обнаружение у больных раком предстательной железы циркулирующих CD14het/CD16het тканевых макрофагов, которые, как утверждалось, содержат внутриклеточный простата-специфический антиген (PSA). Leers et al. (2008) сделали вывод, что частота PSA-положительных тканевых макрофагов в крови постепенно возраствает при сравнении доброкачественной гиперплазии с локализованным раком предстательной железы и с метастатическим раком предстательной железы (Leers et al, Am J Clin Pathol 2008). В то же время, они представили данные проточной цитометрии, по-видимому, содержащие ложноположительные результаты по отношению к окрашиванию по PSA:
- PSA-положительные клетки не обнаруживались в виде отдельной популяции, помимо отделенной от популяции СТМ при установке "контролируемых" маркеров;
- Казалось бы, PSА-положительные CD14dim/CD16high тканевые макрофаги, встречающиеся с высокой частотой, находятся в необычном положении как на графике светорассеяния, так и на графике CD14 по сравнению с CD16, что указывает на образование дублетов и, следовательно, на потенциальные ложноположительные результаты по отношению к PSA.
Таким образом, несмотря на то, что СТМ, встречающиеся с повышенной частотой, вполне могут происходить из предстательной железы, окончательное доказательство этого за счет окрашивания на PSA не является убедительным. Скорее всего, это вызвано недостаточной реакционной способностью применявшихся антител в отношении пептидов PSA в популяции CTSM. В этом контексте следует отметить, что выбор примененных антител против PSA основывался на распознавании интактного белка PSA, а не эпитопов фрагментов или пептидов, полученных при внутриклеточном процессинге и деградации PSA. Следовательно, исходный эпитоп PSA, распознаваемый антителом против PSA, скорее всего, утрачивался в пептидах PSA, которые были представлены в CTSM, и поэтому не поддавался обнаружению.
Стратегии селективного пропускания по Herwig et al. (European Urology Suppl., Vol. 5, No. 2, (2006-04-01), page 275, XP 005522982; and J. of Urology, Vol. 181, No. 4 (2009-04-01), pg. 653, XP 025979386), Leers et al. (2008), Brozek (WO 2010/015633) и Japink et al. (Gastroenterology, Elsevier, Vol. 134, no. 4, (2008-04-01), page A-487) недостаточны для включения всех СТМ и недостаточны для исключения всех клеток, не являющихся СТМ. В основном это вызвано тем, что вышеупомянутые ученые выбрали селективное пропускание с включением на основании лишь SSC и CD45, или отрицательный отбор на основании CD19, CD56, CD57 или CD161 без подтверждения соответствующего исключения мультиплетов клеток. Такие стратегии селективного пропускания приводят к ложноположительным результатам, а также могут привести к ложноотрицательным результатам.
В отличие от предыдущих работ других авторов (Herwig et al., Leers et al. и Japink et al.) и нашей собственной группы, в настоящем документе мы предлагаем процедуру идентификации всех отдельных субпопуляций классических моноцитов и СТМ на основе отбора с применением дополнительных положительных маркеров (СD300е+-клетки и предпочтительно также HLADR+) без необходимости исключения других клеток, например, Т-, NK- и В-лимфоцитов. Такая процедура обеспечивает простое прямое исключение СD300е-лимфоцитов, в то же время облегчает идентификацию CD14-/CD16low СТМ поздней стадии, которые обычно исключаются, если выбор СТМ основан исключительно на CD14+- и/или СВ16+-клетках (Фигура 4 и Фигура 5).
Диагностический набор для СТМ без представленных в настоящем документе маркеров включения и маркеров субпопуляции СТМ невозможно надежно применять в рамках повседневной рутинной диагностики, где требуются точные относительные и абсолютные количественные показания клеточных популяций.
Этап с) способа, обеспечиваемого в настоящем документа, включает выявление по меньшей мере одной субпопуляции циркулирующих тканеспецифичных макрофагов (CTSM) с использованием одного или нескольких антител для обнаружения, направленных против одного или нескольких эпитопов по меньшей мере одного протеазо-индуцированного фрагмента белка, образованного при внутриклеточной деградации белка отдельными СТМ в тканях, из которых они происходят. Специалист в данной области техники должен понимать, что согласно концепции, лежащей в основе настоящего изобретения, могут применяться различные подходы. Например, антитела для обнаружения включают антитела для внутриклеточного окрашивания (Фигура 6):
a) одного или более эпитопов одиночного протеазо-индуцированного фрагмента белка, происходящего от процессируемого внутри клетки тканеспецифического белка;
b) одного или более эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих от одного процессируемого внутри клетки тканеспецифического белка;
c) одного или более эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих от двух или более процессированных внутри клетки тканеспецифических белков здоровых клеток одиночного органа или ткани;
d) одного или более эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих от двух или более процессированных внутри клетки тканеспецифических белков аномальных клеток одиночного органа или ткани;
e) одного или более эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих от двух или более процессированных внутри клетки тканеспецифических белков здоровых и аномальных клеток одиночного органа или ткани, включая комбинацию по меньшей мере одного антитела против пептидных эпитопов нормального белка и по меньшей мере одного антитела против пептидных эпитопов аномального белка, а также;
f) одного или более эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих от двух или более процессированных внутри клетки тканеспецифических белков здоровых или аномальных клеток из двух или более органов или тканей;
В одном варианте реализации панель опорных реагентов, применяемых для выявления субпопуляций СТМ, объединяют с одним или несколькими реагентами, направленными против одного или нескольких эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих из двух или более процессированных внутри клетки белков здоровых или аномальных клеток из двух или более органов или тканей. Панель реагентов, применяемых для выявления субпопуляций СТМ, можно объединять с одним или несколькими реагентами против одного или нескольких эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, полученных из двух или более процессированных внутри клетки белков здоровых или аномальных клеток из двух или более различных органов или тканей, включая комбинацию по меньшей мере двух реагентов, каждый из которых направлен против пептидных эпитопов, происходящих из отдельных органов или тканей, причем по меньшей мере один из них происходит из видоизмененной ткани.
В одном варианте реализации указанное по меньшей мере одно антитело для обнаружения обеспечивает обнаружение одного или нескольких пептидных эпитопов, происходящих от аномального белка, причем предпочтительно указанный аномальный белок выбран из группы, состоящей из онкогенных белков, мутировавших белков, гибридных белков, белков-производных аллергена и белков, происходящих из патогенного организма, например, вируса, бактерии, паразита или гриба.
С учетом протеаз, присутствующих в макрофагах, и тканеспецифических или специфических по отношению к заболеванию белков можно предсказать (по меньшей мере частично), какие пептиды будут присутствовать в фагосомах каждой субпопуляции CTSM. Разработка антител против соответствующих фрагментов тканеспецифических белков или пептидов обеспечит подробную характеристику циркулирующих тканевых макрофагов и идентификацию нескольких субпопуляций различных CTSM. После оценки состава всей совокупности СТМ и CTSM возможно обнаружить и идентифицировать изменения размера и относительного состава популяций СТМ и CTSM по отношению к изменениям, например, гомеостаза ткани, связанным со старением, тканевым стрессом, определенными заболеваниями или способами лечения.
Таким образом, исследование размера и состава совокупности CTM-CTSM обеспечивает показатель гомеостаза ткани и нарушений гомеостаза ткани. Следовательно, мониторинг во времени обеспечит понимание возникновения гомеостатических изменений, вызванных определенными видами деятельности, старением, заболеванием, лечением и т.д. Поэтому проточно-цитометрический анализ субпопуляций CTSM обеспечивает диагностический инструмент для оценки целостности тканей и/или повреждения тканей. Таким образом, проточно-цитометрический скрининг субпопуляций CTSM является чувствительным способом сканирования всего организма, так называемого "Проточной-цитометрическое сканирование организма" (Flow cytometric Body Scanning FlowBoScan) или "Сканирование тканевых макрофагов" (Tissue Macrophage Scan, TiMaScan).
FlowBoScan or TiMaScan, по всей вероятности, более чувствительны, чем классическая КТ или другие виды сканирования всего организма и систем визуализации, поскольку категория CTSM обеспечивает расширенное сканирование организма за счет коллекции "тканевого мусора" (апоптозные и мертвые клетки) всех тканей, сосредоточенной в одиночных клетках, с особым вниманием к тканям с нарушенным гомеостазом, например, при повреждении, воспаление и раке, и т.д. Следовательно, сканирование на основе CTSM, описанное в настоящем документе, сможет обнаружить повреждение тканей или заболевания на ранней стадии как при диффузном распределении дефектов на низком уровне, так при их присутствии в виде небольших фокальных дефектов. Кроме того, после установления диагноза и начала лечения можно осуществлять мониторинг соответствующей субпопуляции CTSM с целью получения представления об эффективности терапии, т.е. исчезновения (или неисчезновения) CTSM, связанных с заболеванием.
Параллельно с мониторингом эффективности лечения можно также осуществлять мониторинг токсичности предоставленной терапии путем анализа субпопуляций CTSM, происходящих из других тканей, которые также более подвержены к воздействию терапии в качестве нежелательного побочного эффекта, например, токсичности цитотоксических препаратов, связанной с гемопоэтическими клетками. Следовательно, возможно даже корректировать интенсивность терапии в соответствии с результатами объединенных CTSM. В настоящее время важность этой формы индивидуальной медицины возрастает для предотвращения поздних осложнений и, тем самым, повышения качества жизни (Alllison, Nature Biotechnol 2008).
Может показаться, что предложенное измерение нарушения гомеостаза ткани в способе согласно настоящему изобретению на первый взгляд напоминает измерение белков сыворотки. Однако в сыворотке можно обнаружить лишь часть белков (например, трансаминазы печени, PSA и другие сериновые протеазы семества калликреина или миоглобин). Кроме того, повышенные уровни указанных белков сыворотки характерны лишь в случае значительного повреждения тканей, например, инфаркта миокарда или повреждения печени. Другие тканевые белки с трудом обнаруживаются в сыворотке, в соответствии с физиологическими механизмами, скрывающими аутоантигены от иммунного надзора с помощью специализированных транспортных белков, С-реактивного белка (СРВ) и других белков плазмы и путем разрушения тканевых белков протеазами локальных клеток и воспалительных или фагоцитирующих клеток (например, тканевых макрофагов). Наконец, высвобожденные тканеспецифические белки разбавляются в большом объеме тканевых жидкостей (например, лимфы) и сыворотки организма, обычно достигая необнаруживаемых концентраций при нормальном гомеостазе и ранних стадиях нарушения нормальныого гомеостаза.
Системы для обнаружения и идентификации субпопуляций CTSM, описанные в настоящем документе, ориентированы на обнаружение эпитопов фрагментов, происходящих от процессированных внутри клетки и гидролизованных в одиночных CTSM-клетках белков (например, пептидов). Система называется "FlowBoScan" или "TiMaScan" и представляет собой проточно-цитометрическое полное сканирование организма путем оценки относительной и абсолютной частоты СТМ и субпопуляций СТМ и тканеспецифических субпопуляций указанных СТМ, представляющих собой CTSM и субпопуляции CTSM.
Особые преимущества описанной системы касаются возможности скрининга всей совокупности CTSM в образце крови для оценки происхождения отдельных субпопуляций CTSM и определения указанных субпопуляций на основе комбинации множественных фрагментов (пептидов), происходящих от тканеспецифических белков, в том числе от аномально экспрессирующихся или ассоциированных с заболеванием белков, например, онкобелков, гибридных белков, белков-производных аллергена и белков микробного происхождения. Таким образом, общая совокупность CTSM отражает процессы, происходящие в различных тканях всего организма, как гомеостатических, так и нарушенных.
Клетки-мишени в крови включают СD16+-тканевые макрофаги (например, CD14het/CD16het СТМ), а также СD14++/СВ16-моноциты и различные популяции циркулирующих дендритных клеток, например, миелоидных (CD11c+/CD14-/CD16-/HLADR+) и плазмоцитарных (CD11c-/CD123++/CD14-/CD16-/HLADR+) дендритных клеток и предшественников дендритных клеток. CTSM, происходящие из различных органов и тканей, циркулируют в лимфатической сосудистой системе и крови при нормальных физиологических условиях. Таким образом, помимо крови, они также могут находиться в тканях, из которых они происходят, а также других жидкостях организма, например, в числе прочего, в асцитной жидкости, плевральном выпоте, лимфатической жидкости, попадающей в местные или региональные лимфатические узлы. В настоящем изобретении авторы главным образом (но не исключительно) сосредоточились на совокупности CTSM в крови.
Для идентификации и подсчета CTSM в крови удобно использовать многопараметрическую проточную цитометрию. Целью проточно-цитометрической процедуры является одновременная идентификация общей популяции СТМ в образцах крови и оценка их характеристик на уровне отдельной клетки по отношению к внутриклеточному присутствию одного или более эпитопов одного или нескольких фрагментов или пептидов тканеспецифических и/или ассоциированных с заболеванием белков, процессированных тканевыми макрофагами в одном или многих органах и тканях (идентификация субпопуляций CTSM).
Для этого образец крови окрашивают комбинацией двух групп дифференциально меченых маркеров-антител (см. Таблицу 2):
1. Целью первого набора (опорных) маркеров является определение и подсчет различных субпопуляций СТМ;
2. Вторая группа маркеров предназначена для одновременного внутриклеточного обнаружения одного или более эпитопов фрагментов белка или пептидов, полученных при деградации одного или более белков, процессированных отдельными СТМ в тканях, из которых они происходят.
Антитела снабжены обнаруживаемой меткой, обеспечивающей их раздельное обнаружение и количественное определение. Обнаруживаемые (например, флуорохромные) метки известны в данной области техники. Например, панель дифференциально меченых реагентов-антител состоит из комбинации совместимых флуорохромов, выбранных из флуоресцеинизотиоцианата (FITC), фикоэритрина (РЕ), белка хлорофилла перидиней (РеrСР), аллофикоцианина (АРС), Alexa Fluor 488, Alexa 647, Alexa 710, Alexa Fluor 405, цианина 5 (Cу5), цианина 5.5 (Cу5.5), Pacific Blue (PacB), бриллиантового фиолетового (например, BV421), Horizon Violet 450 (HV450), Pacific Orange (PacO), HV500, Krome Orange, OC515, квантовых точек и их конъюгатов, соединенных с РЕ, АРС или РеrСР (например РЕ/Су5, РЕ/Су5.5, РЕ/Су7, РеrСР/Су5.5, АРС/Су7, PR-техасский красный), АРССу750 или любого дополнительного совместимого флуорохрома или тандема флуорохромов.
В еще одном варианте реализации панель дифференциально меченых реагентов-антител состоит из комбинации совместимых радиоизотопов.
Для идентификации СТМ требуется минимум 3, предпочтительно 4, опорных маркера. Этот набор опорных маркеров содержит по меньшей мере CD14, CD16 и CD300e и, предпочтительно, также HLADR. Дополнительные пригодные для применения маркеры включают лейкоцитарные поверхностные антигены CD11с, CD33, CD36, CD45 и/или CD64 (например, CD14/CD16, CD11c/CD16, CD33/CD16, CD64/CD16, CD11c/CD14/CD16, CD33/CD14/CD16, CD33/CD11c/CD16, CD300e/CD14/CD16, CD300e/HLADR/CD14/CD16, CD300e/HLADR/CD64/CD16/CD14, CD300e/CD11c/CD16/CD64, CD300e/HLADR/CD64/CD36/CD16/CD14, или комбинации этих маркеров с добавлением CD45). Как правило, тонких различий в экспрессии одиночного поверхностного маркера (или даже двух маркеров) не всегда может быть достаточно для точного распознавания всех СТМ и субпопуляций СТМ (Фигура 2С), но при оценке общего профиля многих маркеров с помощью многофакторного анализа, например, анализа главных компонент (principal component analysis, РСА), например, с помощью автоматизированного разделения популяций (режим APS в программе Infinicyt), или многомерного масштабирования (multidimensional scaling, MDS), можно более точно идентифицировать СТМ и субпопуляции СТМ (Фигура 3). В примере, показанном на Фигуре 3, показаны двумерные представления первой главной компоненты по сравнению со второй и третьей главной компоненты по сравнению с четвертой для CD14het/CD16het-клеток, окрашенных по CD14, CD16 и нескольким другим опорным маркерам, в режиме APS1 и APS2. Наиболее эффективные комбинации параметров для выявления различий между классическими моноцитами и СТМ применяют путем уменьшения значения главных компонент 1, 2, 3 и 4, соответственно.
Соответственно, настоящее изобретение также обеспечивает способ определения состояния здоровья субъекта, раннего обнаружения повреждения тканей, ранней диагностики и мониторинга заболевания и/или для оценки эффективности лечения субъекта с использованием циркулирующих тканевых макрофагов (СТМ) как показателя нарушенного гомеостаза ткани и заболевания, причем указанный способ включает этапы:
a) Получения тестируемого биологического образца от субъекта, причем указанный образец содержит циркулирующие тканевые макрофаги (СТМ);
b) окрашивания указанных СТМ с использованием панели дифференциально меченых различных антител против опорных маркеров CD14, CD16, СD300е и, предпочтительно, также HLADR, CD64 и CD36, с целью идентификации и подсчета различных субпопуляций СТМ (Фигуры 4 и 5);
c) анализа окрашенных СТМ с применением многопараметрической проточной цитометрии указанных с целью определения количества сигналов каждого отдельного меченого антитела, ассоциированных с отдельными клетками, причем указанный анализ включает многофакторный анализ, предпочтительно, анализ главных компонент (РСА), например, с помощью автоматизированного разделения популяций (режим APS в программе Infinicyt), или многомерное масштабирование (MDS) (Фигуры 4 и 5);
d) определения относительного и абсолютного количества отдельных клеток в пределах каждой субпопуляции СТМ;
e) расчета (i) относительного и абсолютного количества клеток в пределах каждой субпопуляции СТМ, а также;
f) сравнения тестируемого профиля окрашивания СТМ с нормальным профилем окрашивания СТМ для каждой оцениваемой ткани, причем аномальный профиль окрашивания свидетельствует о повреждении тканей, нарушенном гомеостазе ткани, наличии заболевания и/или эффективности лечения по сравнению с устойчивостью.
РСА представляет собой математическую процедуру, использующую ортогональное преобразование набора наблюдаемых значений возможно взаимосвязанных переменных в набор значений невзаимосвязанных переменных, называемых главными компонентами. Количество главных компонент меньше или равно количеству исходных переменных. Это преобразование определяют таким образом, что первая главная компонента обладает максимально возможной дисперсией (то есть, характеризуется максимально возможной изменчивостью данных), а каждая последующая компонента, в свою очередь, обладает максимально возможной дисперсией при условии ортогональности к (отсутствия корреляции с) предыдущим компонентам. Главные компоненты гарантированно являются независимыми только в случае, когда набор данных в совокупности имеет нормальное распределение. РСА чувствителен к относительному масштабированию исходных переменных. В зависимости от области применения его также называют дискретным преобразованием Кархунена-Лоэва (Karhunen-Loeve transform, KLT), преобразованием Хотеллинга или собственно ортогональным разложением (proper orthogonal decomposition, POD). В качестве альтернативы для РСА можно применять MDS или любой другой общепринятый вид многофакторного анализа.
В предпочтительном варианте реализации оценка вышеописанных окрашенных образцов включает ≥4-цветовую проточную цитометрию, а в более предпочтительном варианте реализации ≥5-цветовую проточную цитометрию, причем ≥1 (один или более) используемых маркеров (цветов) соответствуют маркерам, идентифицирующим внутриклеточные эпитопы фрагментов или пептидов, полученных при деградации одного или нескольких тканеспецифичных и/или ассоциированных с заболеванием белков, локально захваченных в ткани, из которой происходят макрофаги, и процессированных СТМ, а другие маркеры являются опорными маркерами, соответственно.
В дополнение к вышеперечисленным опорным маркерам для специфического исключения популяций клеток, не являющихся СТМ, можно применять другие маркеры, например, CD 15 и/или CD24 можно применять для исключения нейтрофилов, CD56 и/или CD7 - для исключения NK-клеток, CD3 - для Т-лимфоцитов, CD19 и/или CD20 - для В-клеток, a CD123 - для плазмоцитоидных дендритных клеток.
Окрашивание СТМ и других клеточных популяций в образце включает окрашивание как поверхностных маркеров клеточной мембраны, так и внутриклеточных маркеров с помощью обычных методик прямой иммунофлюоресценции в сочетании с различными хорошо описанными способами фиксации клеток, пермеабилизации клеток и процедурами и реагентами для лизиса эритроцитов (см. Таблицу 2).
Примечательно, что для отдельного образца периферической крови количество эпитопов фрагментов белка или пептидов одного или нескольких тканеспецифичных и/или ассоциированных с заболеванием белков, процессированных СТМ, может быть больше допустимого количества для измерения в комбинации с выбранными опорными маркерами вследствие ограниченных возможностей применяемого проточного цитометра при многоцветовом анализе. В таком случае требуется отобрать несколько аликвот одного и того же образца периферической крови, каждую из которых окрашивают одним и тем же набором опорных маркеров и различными (частично перекрывающимися или не перекрывающимися) панелями эпитопов одного или нескольких тканеспецифичных и/или ассоциированных с заболеванием белков, процессированных СТМ.
После измерения на проточном цитометре с использованием обычных процедур регистрации данных в таком случае можно успешно применить инструменты объединения данных и расчета в составе программного обеспечения Infinicyt (Cytognos SL, Саламанка, Испания) с целью создания единого файла данных, содержащего все измерения эпитопов, ассоциированных с фрагментами белка, для отдельных клеток, содержащихся в популяциях СТМ в образце. Для идентификации клеток СТМ и их (суб)популяций, представляющих интерес, на основании опорных маркеров и маркеров для оценки характеристик можно применять стратегию многомерного селективного пропускания, например, реализованную в программном обеспечении Infinicyt, основанную на использовании последовательных булевых логических элементов, анализе главных компонент и многомерном масштабировании, соответственно. Стратегии селективного пропускания, которые можно применять, описаны выше в настоящем документе.
Кроме того, можно применять общепринятые процедуры оценки абсолютного количества клеток в общей популяции СТМ и их отдельных субпопуляциях на единицу объема образца параллельно с расчетом точного количества клеток на единицу объема образца. Такие процедуры могут использовать волюметрические подходы или доступные для приобретения гранулы внутреннего контроля, например, гранулы TrueCOUNT (Becton Dickinson Biosciences, Сан-Хосе, штат Калифорния, США), FlowCOUNT (Beckman Coulter, Майами, штат Флорида, США) или PerfectCOUNT (Cytognos SL).
Специалист в данной области техники должен понимать и принимать во внимание, что настоящее изобретение, включающее проточно-цитометрические исследования при анализе СТМ, можно применять для (раннего обнаружения) различных заболеваний, расстройств или других физиологических изменений и аномалий. Настоящее изобретение обеспечивает диагностические наборы, содержащие реагенты для проведения анализа на основе концепции, описанной в настоящем документе.
Диагностический набор может включать, в первом контейнере, набор опорных маркеров, содержащий дифференциально-меченые антитела для идентификации и подсчета по меньшей мере двух, предпочтительно по меньшей мере трех различных субпопуляций CD14high/CD16+, CD14high/CD16high, CD14+/CD16high, CD14low/CD16high CD14-/CD16high, CD14-/CD16low, CD11c+/CD16+, CD11c+/CD16high, CD11c+/CD16low, CD33high/CD16+, CD33high/CD16high, CD33+/CD16high, CD33+/CD16low, CD300e+/CD16+, CD300e+/CD16++ и CD300e+/CD16low CTM. Настоящее изобретение обеспечивает диагностический набор, содержащий, в первом контейнере, набор опорных маркеров, содержащий дифференциально-меченые антитела, причем опорные маркеры представляют собой CD300e, CD14 и CD16, а также, предпочтительно, HLADR. Указанный набор необязательно включает инструкции по применению набора для идентификации и подсчета по меньшей мере одного, предпочтительно по меньшей мере двух, более предпочтительно по меньшей мере трех субпопуляций СТМ, предпочтительно в соответствии со способом, описанным в настоящем документе.
Первый контейнер включает антитела к маркерам CD14, CD16 и CD300e, предпочтительно CD14, CD16, CD300e и HLA-DR. В более предпочтительном случае присутствует по меньшей мере одно дополнительное антитело, выбранное из группы антител к маркеру CD36, CD64 или CD45. Например, применяют, по меньшей мере, набор антител к CD14, CD16, CD300e, HLADR и CD45, необязательно в комбинации с антителом против CD64. В конкретном аспекте первый контейнер включает антитела к маркерам CD14, CD16, CD300e, HLADR, CD64 и CD36.
В предпочтительном варианте реализации диагностический набор содержит, в первом контейнере, набор опорных маркеров, включающий дифференциально-меченые антитела для идентификации и подсчета по меньшей мере одного, предпочтительно по меньшей мере двух, а более предпочтительно - по меньшей мере трех субпопуляций СТМ, причем опорные маркеры представляют собой CD14, CD16, CD300e и, предпочтительно, также HLADR. В особенно предпочтительном аспекте настоящее изобретение обеспечивает набор, включающий комбинацию антител против CD14, CD16, CD300e, HLADR, CD45, CD64 и CD36 (Фигура 4), причем каждое из антител конъюгировано с отдельной обнаруживаемой меткой. Например, набор включает антитело против CD 14, конъюгированное с флуорохромом 1 (FL1), антитело против CD16, конъюгированное с флуорохромом 2 (FL2), антитело против CD300e, конъюгированное с флуорохромом 3 (FL3), антитело против HLADR, конъюгированное с флуорохромом 4 (FL4), антитело против CD45, конъюгированное с флуорохромом 5 (FL5), антитело против CD64, конъюгированное с флуорохромом 6 (FL6), и антитело против CD36, конъюгированное с флуорохромом 7 (FL7). Специалист в данной области техники должен понимать, что можно применять любую подходящую комбинацию флуорохромов. Например, набор включает комбинацию флуорохромов АРСН7 (например, антитело против CD14-APCH7), РЕСу7 (например, антитело против CD16-РЕСу7), АРС (например, антитело против CD300e-APC), РасВ (например, антитело против HLADR-PacB), FITC (например, антитело против CD36-FITC) и РЕ (например, антитело против CD64-PE).
Для идентификации тканеспецифических циркулирующих макрофагов, набор может содержать во втором контейнере по меньшей мере одно меченое антитело для обнаружения, обеспечивающее обнаружение одного или более эпитопов по меньшей мере одного протеазо-индуцированного фрагмента белка, полученного при внутриклеточной деградации белка отдельными СТМ в тканях, из которых они происходят.
Следует понимать, что мишени(ь) антител(а) для обнаружения можно выбрать в зависимости от конкретного состояния или заболевания, представляющего интерес. Пригодные для этого антитела (конъюгированные с флуорохромом) доступны для приобретения. На Фигуре 7 показан произвольный набор различных вариантов применения, при каждом из которых требуются различные антитела для обнаружения. В пункте 9 формулы изобретения заявки WO 2010/015633 (включенной в настоящий документ посредством ссылки) описан список мишеней для антител, которые можно применять.
Полезные соображения для выбора мишени антитела для обнаружения включают следующее. Антиген предпочтительно не является секретируемым белком, например, PSA, СЕА и т.д., из-за возможности того, что высокие уровни этого белка в сыворотке образуют диффузный "фон" в пределах или в дополнение к субпопуляциям СТМ. Кроме того, тканеспецифический белок предпочтительно должен экспрессироваться в незрелых клетках той же ткани. Более того, выбранные домены/эпитопы белка предпочтительно не должны встречаться в другой области "протеома", т.е. в других белках.
Еще одним важным фактором, который следует принимать во внимание, является тот факт, что большинство тканей формирует нормальный фон для СТМ, положительных по маркерам ткани, в крови, ввиду уровня гомеостатической активности между пролиферацией и апоптозом клеток. Тем не менее, некоторые внешние эпителиальные слои, скорее всего, не формируют указанный "нормальный фон". Например, постоянно обновляющийся кишечный эпителий здорового человека в большинстве случаев слущивается в просвет кишечника, что подразумевает практическое отсутствие СТМ, несущих фрагменты белка, специфические для кишечника, в крови. Однако если клетки кишечного эпителия трансформируются в инвазивные злокачественные клетки, локальные СТМ будут фагоцитировать апоптозные злокачественные клетки и обнаруживаться в крови в виде CTSM, несущих фрагменты белка, специфические для кишечника (например, толстой кишки). Обнаружение (повышенного количества) циркулирующих CTSM, несущих фрагменты белка, специфические для толстой кишки, можно применять в рамках общенациональных программ скрининга для раннего выявления рака толстой кишки. То же самое, скорее всего, действительно для клеток легочного эпителия, которые слущиваются в альвеолы и бронхи и, по всей вероятности, фагоцитируются альвеолярными макрофагами, которые удаляются из организма через бронхи (слизь, удаляемая за счет движения ресничек с мокротой). Тем не менее, инвазивные эпителиальные клетки (как при раке легких) приводят к появлению CTSM, положительных по легочному эпителию, в крови. Наконец, сопоставимый процесс будет происходить в коже, где нормальные меланоциты теряются с поверхности кожи, что отличается от клеток меланомы, которые становятся инвазивными путем прохождения через базальную мембрану. Только при таких условиях можно обнаружить Melan-A-положительные CTSM в крови на фоне низкого фонового уровня Melan-A-положительных клеток, происходящих из сетчатки.
Очень важным дополнительным применением способа или набора согласно настоящему изобретению является обнаружение неэндогенных (т.е. экзогенных) фрагментов белка, например, в случае бессимптомно развивающихся инфекционных заболеваний. В частности, в случае бессимптомно развивающихся инфекционных заболеваний, с большим трудом поддающихся диагностике. Например, очень трудно диагностировать (внелегочный) туберкулез, потому что все используемые в настоящее время серологические и ПЦР-тесты демонстрируют высокий уровень ложных результатов. Обнаружение фрагментов белков, специфических для Mycobacterium, в субпопуляциях СТМ в крови обеспечивает исключительный альтернативный и потенциально более надежный диагностический инструмент, также пригодный для оценки распространения заболевания по организму. То же самое справедливо для заболеваний, вызванных другими возбудителями, например, аспергиллеза, болезни Лайма и Ку-лихорадки.
В одном конкретном варианте реализации настоящее изобретение обеспечивает диагностический набор, в котором второй контейнер включает по меньшей мере одно антитело для обнаружения одного или более эпитопов, полученных при внутриклеточной деградации белков, специфических для сердечной мышцы (например, тропонина или СК-МВ), белков, специфических для почек/клубочка, белков, специфических для печени или белков, специфических для легких, с целью оценки приживления органа после трансплантации и отторжения трансплантата у пациентов с трансплантацией сердца, почки, печени или легкого, соответственно.
Во втором варианте реализации диагностический набор, в котором второй контейнер включает по меньшей мере одно антитело для обнаружения одного или более эпитопов, полученных при внутриклеточной деградации белков, специфических для сердечной мышцы, обеспечивает средства и способы для обнаружения стенокардии или обширной ишемии сердца (при инфаркте миокарда). TSM конечной стадии из поврежденной сердечной мышцы мигрируют через лимфатическую систему в кровь, где их можно обнаружить в относительно и абсолютно высоких количествах в виде CTSM, содержащих фрагменты белков, происходящих от белков, специфических для сердечной мышцы (Фигура 7А). Такой анализ может быть полезен для ранней диагностики прогрессирующей стенокардии и/или для мониторинга степени и восстановления инфаркта миокарда.
В еще одном варианте реализации второй контейнер в наборе согласно настоящему изобретению включает по меньшей мере одно антитело для обнаружения одного или более эпитопов, полученных при внутриклеточной деградации белков кости, например, остеокальцина, остеопонтина или щелочной фосфатазы костей, что позволяет оценить сложность и степень переломов костей и прогрессирование ремоделирования кости после переломов костей и хирургических вмешательств. Например, можно осуществить мониторинг костной ткани, например, у пациентов с сложными переломами костей. Регулярный подсчет CTSM, содержащих фрагменты белков, специфических для кости (например, пептиды остеокальцина, остеопонтина и/или щелочной фосфатазы кости) позволяют осуществлять такой мониторинг (Фигура 7В).
В еще одном варианте реализации настоящее изобретение обеспечивает набор, например, для ранней диагностики и мониторинга злокачественных новообразований, в котором второй контейнер включает по меньшей мере одно антитело для обнаружения, направленное против одного или более протеазно-индуцированных фрагментов белка, полученных при внутриклеточной деградации белка эпителия, предпочтительно белка эпителия молочной железы, белка эпителия пищевода, белка эпителия желудка, белка эпителия поджелудочной железы, белка эпителия толстой кишки, белка эпителия прямой и сигмовидной кишки, белка эпителия щитовидной железы, белка эпителия легких или бронхов, белка эпителия предстательной железы, белка эпителия мочевого пузыря, белка эпителия шейки матки, белка эпителия матки, белка меланомы, белка клубочка почки, или против другого маркера эпителиальных клеток. Раннюю диагностику и мониторинг инвазивного рака толстой кишки можно осуществить с помощью обнаружения в крови CTSM, содержащих фрагменты белков, специфичные для эпителия толстой кишки (Фигура 7С). Такой вариант применения особенно ценен для пациентов с семейным коли-полипозом, поскольку регулярный мониторинг (например, проводимый ежегодно или каждые 6 месяцев) может обеспечить раннюю диагностику прогрессирования коли-полипоза в инвазивный рак толстой кишки.
В пятом варианте реализации настоящее изобретение обеспечивает средства и способы раннего обнаружения метастазов рака молочной железы в печени. Скрининг метастазов в печень (или в другие органы, например, кости и легкие) у пациентов с раком молочной железы возможен за счет поиска CTSM, одновременно содержащих фрагменты белка, полученные как эпителиальных белков молочной железы, так и из белков, специфических для печени (Фигура 7D). Совместное присутствие фрагментов белка двух различных типов из двух совершенно различных тканей в одном отдельно взятом CTSM указывает на наличие метастазов, например, метастазов в печень, кости, легкие или центральную нервную систему (ЦНС). В одном варианте реализации способ согласно изобретению включает совместное обнаружение фрагментов тканеспецифических белков печени или кости, а также клеток карциномы как показатель метастазов карциномы молочной железы, рака предстательной железы и т.д. в печень или кости.
Прогрессивный и инвазивный рак предстательной железы необходимо обнаруживать на ранней стадии. Настоящее изобретение обеспечивает средства и способы скрининга пациентов с раком предстательной железы на наличие CTSM, содержащих пептиды, происходящие как от белков эпителия предстательной железы, так и от белков, специфических для кости (Фигура 7Е) или других типов белков, например, печени, легких и центральной нервной системы. Сопоставимые подходы для обнаружения и мониторинга метастазов возможны при всех типах рака.
Еще один вариант реализации изобретения относится к атеросклерозу, где тканевые макрофаги проникают в атеросклеротические бляшки и, по всей вероятности, непосредственно возвращаются в кровеносный сосуд после выполнения своей задачи. Такие CTSM содержат фрагменты эндотелиальных белков, например, эндотелина 1 (Фигура 7F). Диагностический набор для такого анализа (например, с целью оценки атеросклероза и степени повреждения эндотелия у пациентов с атеросклерозом) может, таким образом, включать по меньшей мере одно антитело для обнаружения одного или более эпитопов, полученных при внутриклеточной деградации эндотелиальных белков (например, эндотелина 1),
Другой вариант реализации относится к способам и наборам для ранней диагностики и мониторинга заболевания головного мозга или нервов, в частности, болезни Альцгеймера, при которой по меньшей мере одно антитело для обнаружения обеспечивает обнаружение одного или более эпитопов, полученных при внутриклеточной деградации белков, специфических для головного мозга и нервов, например Ароε4 или белка-предшественника амилоида (АРР). Диагноз болезни Альцгеймера часто задерживается и с трудом подтверждается. Кроме того, мониторинг прогрессирования заболевания является усложненной процедурой. Следовательно, независимый диагностический анализ по изобретению может способствовать уходу за пациентами с болезнью Альцгеймера и их семьями, например, для раннего поддерживающего лечения, а также своевременного управления финансами. Это можно осуществить путем обнаружения повышенного или повышающегося уровня CTSM, содержащих фрагменты или пептиды, происходящие от Ароε4-гидролизованного АРР и/или других тканеспецифичных или ассоциированных с заболеваниями центральной нервной системы (ЦНС) белков (Фигура 7G). Повышенные количества CTSM, положительных по АРР-пептиду, может указывать на раннюю стадию болезни Альцгеймера, а дальнейшее повышение таких АРР-положительных CTSM может указывать на прогрессирование болезни.
Набор, включающий по меньшей мере одно антитело для обнаружения одного или нескольких эпитопов, полученных при внутриклеточной деградации белков, специфических для головного мозга, также находит применение при ранней диагностике нарушений мозгового кровообращения (CVA), например, у пациентов с периодическими транзиторными ишемическими приступами (TIA) и при последующем наблюдении за масштабом и восстановлением инфаркта головного мозга.
Еще один вариант реализации относится к рассеянному склерозу (MS). Диагностика MS является сложной процедурой J, и независимый диагностический анализ, который также можно использовать для мониторинга прогрессирования заболевания, является выгодным. Это можно осуществить с помощью способа, представленного в настоящем документе, включающего точное обнаружение относительных и абсолютных частот CTSM, содержащих миелин-специфичные пептиды, полученные при разрушении миелиновых оболочек, покрывающих нервы (Фигура 7Н).
Представлен диагностический набор для ранней диагностики и подтверждения аутоиммунных заболеваний и мониторинга аутоиммунных заболеваний, например, апластической анемии, сахарного диабета I типа, тиреоидита, аутоиммунного цистита, синдрома Шегрена, аутоиммунного гломерулонефрита, ревматоидного артрита, системной склеродермии и других аутоиммунных заболеваний соединительной ткани. Такой набор может включать, во втором контейнере, по меньшей мере одно антитело для обнаружения одного или нескольких эпитопов, полученных при внутриклеточной деградации белка, выбранного из группы, состоящей из фактора Касла, белков, специфических для островков Лангерганса, или инсулина, белков эпителия щитовидной железы, белков эпителия мочевого пузыря, белков, специфических для слезной железы и/или слюнной железы, белков, специфических для клубочка почки, белков, специфических для синовиальной мембраны, белков, специфических для мышц и соединительной ткани. Например, раннюю диагностику или подтверждение токсического или аутоиммунного тиреоидита можно осуществить путем обнаружения относительных и абсолютных частот CTSM, содержащих фрагменты белка, происходящие от белков, специфических для щитовидной железы (Фигура 7I).
Диагностика синдрома Шегрена представляет собой сложный процесс и обычно производится после существенной задержки, также вследствие сложной дифференциальной диагностики. Повышенное количество CTSM, содержащих фрагменты белков околоушной слюнной или слезной железы, может оказать существенную поддержку для диагностического процесса (Фигура 7J).
У маленьких детей из семей с частым развитием сахарного диабета 1 типа можно выполнять мониторинг наличия CTSM, содержащих фрагменты или пептиды белков из островков Лангерганса или других специфических белков, например, инсулина (Фигура 7К). Такой скрининг обеспечит раннюю диагностику до развития явного диабета, тем самым обеспечивая раннее вмешательство с помощью иммуномодуляции или иммуносупрессии.
Кроме того, диагноз не всегда легко установить у пациентов с системной склеродермией. Поэтому систему СТМ можно применять для ранней диагностики фиброза и васкулопатии за счет присутствия фрагментов белков соединительной ткани и белков эндотелиальных клеток (Фигура 7L).
У пациентов с системной красной волчанкой (СКВ) часто развивается прогрессирующий гломерулонефрит, в конечном итоге приводящий к необратимой почечной недостаточности. Такое повреждение почек, как правило, обнаруживают на поздней стадии, когда большинство функций почек уже утрачено и, следовательно, иммуносупрессивная терапия уже ничего не дает. Поэтому авторы изобретения предлагают регулярный мониторинг у всех больных СКВ с целью обнаружения наличия и возрастания количества CTSM, содержащих фрагменты белков, специфических для почек (Фигура 7М). Ранняя диагностика повреждения почек (задолго до обнаруживаемого повышения уровня креатинина) обеспечит раннее вмешательство с помощью иммуномодуляции или другого иммуносупрессивного лечения.
Другой вариант реализации относится к заболеваниям, вызываемым микроорганизмами (инфекциям), например, болезни Лайма. Диагностика болезни Лайма часто является сложной процедурой вследствие нетипичной клинической картины и/или отсутствия классических симптомов, например, поражений кожи, связанных с укусом клеща. Задержки диагностики осложнений у пациентов с болезнью Лайма может привести к необратимому повреждению органов. Следовательно, независимый диагностический анализ для диагностики болезни Лайма является клинически значимым. Его можно осуществить путем обнаружения CTSM, содержащих пептиды Borrelia-специфичных белков (Фигура 7N). Предпочтительно, эпитопы, выбранные для наработки антител, не должны зависеть от штамма Borrelia, так что каждый тип инфекции Borrelia можно обнаружить с помощью одного анализа. В противном случае можно применять множественные антитела против пептидов из нескольких различных штаммов Borrelia для идентификации штамма Borrelia, вызвавшего болезнь Лайма у конкретного пациента.
Общепринятые тесты для диагностики туберкулеза обладают рядом ограничений, особенно в случае внелегочного туберкулеза. Разработано несколько вариантов анализа в сыворотке на основе антител, однако все они дают сбои, по крайней мере при диагностике внелегочного туберкулеза. В то же время обнаружение CTSM, содержащих фрагменты Mycobacterium tuberculosis, может способствовать точной диагностике внелегочного туберкулеза (Фигура 7O).
Пациенты с гранулопенией весьма подвержены аспергиллезу. Чем раньше осуществляют диагностику аспергиллеза, тем лучше исход заболевания. Следовательно, мониторинг всех больных с гранулопенией с целью обнаружения присутствия (и повышения) CTSM, содержащих фрагменты Aspergillus, независимо от штамма, мог бы являться разумной мерой (Фигура 7Р).
Таким образом, настоящее изобретение также обеспечивает диагностический набор, в котором второй контейнер включает по меньшей мере одно антитело для обнаружения одного или нескольких эпитопов, полученных при внутриклеточной деградации белков патогенного организма, например, вируса, бактерии, грибка, например, вируса гепатита, Borrelia, Mycobacterium или Aspergillus для раннего обнаружения (или подтверждения диагноза) и мониторинга гепатита, болезни Лайма, туберкулеза, проказы или аспергиллеза. В конкретном аспекте, диагностический набор предназначен для ранней диагностики и мониторинга локализации костного туберкулеза и аспергиллеза, и включает, во втором контейнере, по меньшей мере одно антитело для обнаружения одного или нескольких эпитопов, полученных при внутриклеточной деградации белков костей, а также по меньшей мере одно антитело для обнаружения одного или нескольких эпитопов, полученных при внутриклеточной деградации белка Mycobacterium или Aspergillus.
Настоящее изобретение также находит применение в области мониторинга подготовки спортсменов при тренировке их выносливости с целью более точного определения недостаточной тренированности или перетренированности. Виды спорта со значительной физической нагрузкой требуют тщательно проработанной программы тренировок для достижения правильного статуса подготовки в нужный момент соревнований. Оптимальная частота и интенсивность тренировок могут существенно различаться между отдельными лицами и могут зависеть от физических, экологических и генетических (расовых) факторов, которые в настоящее время неизвестны. Кроме того, у отдельных спортсменов может отличаться восстановление после физических упражнений высокого уровня. Руководство тренировками и восстановлением спортсменов в спорте со значительной физической нагрузкой можно поддерживать за счет тщательного мониторинга совокупности CTSM, положительных по пептидам, происходящих от скелетных белков (Фигура 7Q). Это может привести к лучшему руководству спортсменами при расписании их тренировок с целью предотвращения перетренированности и недостаточной тренированности и к значительному улучшению отдельных спортивных результатов.
Другой вариант реализации относится к оценке повреждения тканей, например для оценки хирургических навыков стажеров-хирургов или для оценки двух или более различных хирургических процедур при одинаковых медицинских показаниях. Для такой оценки можно использовать обнаружение и подсчет СТМ или CTSM (содержащих пептиды скелетных мышц и соединительной ткани, например, пептиды-производные коллагена) (рисунок 7R). Настоящее изобретение обеспечивает диагностический комплект, в котором второй контейнер включает по меньшей мере одно антитело для обнаружения одного или нескольких эпитопов, полученных при внутриклеточной деградации скелетных мышц. Комплект находит применение в области мониторинга и руководства тренировками и восстановлением спортсменов при (международных) спортивных мероприятиях, например, в видах спорта, требующих значительной физической нагрузки (например, марафоне, триатлоне, катании на коньках, плавании, велоспорте, лыжных гонках).
В еще одном варианте реализации настоящее изобретение можно применять с целью оценки личного профиля CTSM для состояния здоровья. Распределение субпопуляций CTSM, скорее всего, несколько отличается между отдельными людьми, потому что такая композиция зависит от возраста и других параметров, например, стиля жизни, привычек (например, курения и употребления алкоголя), а также таких мероприятий, как спортивные. Регулярный (например, ежегодный или проводимый раз в 6 месяцев) мониторинг отдельных лиц может дать хорошее представление о состоянии здоровья и обеспечить раннее обнаружение и диагностику заболеваний. Настоящее изобретение обеспечивает разработку персонализированных профилей CTSM, которые можно применять при скрининге конкретных рисков и опасностей, например:
- Воздействия профессиональных факторов (промышленных токсинов и т.д.);
- Стиля жизни, привычек (курения, приема пищи, употребления алкоголя и т.д.);
- Семейных заболеваний (сердечно-сосудистой системы, рака, болезни Альцгеймера и т.д.)
У отдельного человека можно проводить мониторинг специфической персонализированной комбинации тканеспецифичных пептидов с целью профилактики и/или ранней диагностики.
Краткое описание чертежей
Фигура 1. СБ16+-тканевые макрофаги в крови происходят не непосредственно от классических CD14++/CD16--моноцитов, а от тканевых макрофагов, активно участвовавших в надзоре и фагоцитозе в тканях и рециркулировавших через лимфатическую систему в кровь (Van Dongen and Orfao, неопубликованные данные).
Фигура 2. Несколько типов субпопуляций моноцитов/макрофагов можно обнаружить за счет точных стратегий селективного пропускания с применением проточной цитометрии с последующим анализом картины окрашивания по CD14 и CD16. А. У здоровых доноров классические моноциты представляют собой CD14+/CD16-, в то время как популяция СТМ демонстрирует гетерогенную (het) экспрессию CD14 и CD16, что указывает на то, что указанная популяция состоит из нескольких субпопуляций. В. У пациентов с инфекционным заболеванием (например, Francisella tularensis), уровень CD14het/CD16het относительно и абсолютно повышен. С.Некоторые субпопуляции СТМ можно идентифицировать на точечной диаграмме CD14-CD16 пациента с инфекцией Francisella tularensis (Orfao A. et al., неопубликованные результаты).
Фигура 3. Точное установление различий между классическими моноцитами CD14high/CD16- и более неоднородными СТМ можно усовершенствовать путем анализа главных компонент (режим APS в программе Infinicyt; Cytognos, Саламанка, Испания) всех оцениваемых маркеров, например, CD14, CD16, CD33, CD45, CD64, CD123, СD300е и HLADR. А. точечные диаграммы CD14/CD16 и CD14/CD123 показывают, что классические моноциты и СТМ представляют собой непрерывное множество. В. Анализ главных компонент всех 8 маркеров в APS 1 показывает, что классические моноциты и СТМ представляют собой отдельные популяции. В режиме APS 2 указанные две популяции выглядят близкородственными.
Фигура 4. Окрашивание с целью выявления экспрессии CD14, CD16, CD36, CD45, CD64, CD300e и HLADR лейкоцитами крови приводит к высокоточному распознаванию классических моноцитов и по меньшей мере трех субпопуляций СТМ: субпопуляции ранних СТМ, поздних CD36+ СТМ и поздних CD36- СТМ. При представленном окрашивании выполняют первое селективное пропускание по промежуточному SSC и CD45 (график А), с последующим селективным пропусканием, с включением клеток, положительных по CD300e и HLADR (график В). Включенные клетки представляют собой все классические моноциты и все СТМ, которые затем можно протестировать с применением маркеров CD14 и CD16 (график С), что приводит к выявлению трех основных субпопуляций: классических моноцитов, ранних СТМ и поздних СТМ (график D). Точное распознавание ранних СТМ и дальнейшее выявление субпопуляций СТМ возможно с применением CD64 и CD36 (графики Е и F). Повышенные уровни экспрессии CD64 характерны для ранних СТМ (и классических моноцитов), в то время как все другие субпопуляции СТМ экспрессируют CD64 на более низких уровнях (график F). СТМ с пониженным уровнем CD64 (поздние СТМ) характеризуются гетерогенной экспрессией CD36 от высоких уровней до отсутствия (графики Е и F). Режим APS при использовании всех семи оцениваемых маркеров демонстрирует четкое разделение различных популяций моноцитов/макрофагов (график G), т.е. классических моноцитов, субпопуляций ранних СТМ и поздних СТМ, включая субпопуляцию поздних CD36- СТМ (график Н).
Фигура 5. Окрашивание лейкоцитов крови по CD14, CD16, CD36, CD45, CD64, CD300e и HLADR приводит к точному распознаванию классических моноцитов и субпопуляций СТМ. Указанные моноциты и субпопуляции СТМ могут отличаться по составу в зависимости от возраста (детского, подросткового, зрелого, пожилого), типа заболевания (местного, системного и т.д.), стадии заболевания (острой, хронической, вялотекущей и т.д.). На графике А показана картина популяций клеток CD300e/HLADR, обычно встречающихся у взрослых. В отличие от этого, образец крови больного ребенка на графике В демонстрирует другую картину с выраженным присутствием популяции CD16low/CD14-/CD36-/CD64low СТМ, которые присутствуют в небольшом количестве или отсутствуют в крови взрослых. Примечание: большинство поздних CD36- СТМ в крови взрослых экспрессируют CD16 на высоком уровне.
Фигура 6. Результаты окрашивания образцов крови 9 здоровых контрольных субъектов и 9 пациентов, у которых диагностирована глиома, по CD14/CD16/CD45/CD300e/HLADR/GFAP. Мишенью антитела против GFAP являлся N-концевой эпитоп указанного белка. График А: примеры окрашивания по GFAP у здорового контрольного субъекта (левый график) и у пациента с глиомой (правый график). У пациента с глиомой выявили кластер GFAP-положительных ранних СТМ, в то время как у здорового контрольного субъекта такие клетки не обнаружены. График В: процент GFAP+-клеток в пределах популяции ранних СТМ в зависимости от процента ранних СТМ среди общей популяции СD300е+-клеток (моноциты и СТМ) и размера глиомы. Практически у всех пациентов с глиомой (7/9) содержание ранних GFAP+-CTM превышало 1%. Важно отметить, что частота GFAP-положительных клеток также демонстрировала некоторую степень корреляции с размером опухолевой массы глиомы.
Фигура 7. Примеры повышения CTSM при различных типах заболеваний или медицинских состояний. А. Инфаркт миокарда. В. Перелом кости. С. Рак толстой кишки. D. Метастазы рака молочной железы. Е. Метастазы рака в кость. F. Атеросклероз. G. Болезнь Альцгеймера. Н. Рассеянный склероз. I. Аутоиммунный тиреоидит. J. Синдром Шегрена. К. Сахарный диабет 1 типа. L. Системная склеродермия. М. Гломерулонефрит у пациентов с СКВ. N. Болезнь Лайма. О. Туберкулез. Р. Аспергиллез легких. Q. Мышечная тренировка. R. Хирургическое вмешательство с повреждением тканей.
ПРИМЕР 1
Применение сканирования состояния здоровья с применением проточной цитометрии на основе CTSM: Определяли распределение субпопуляций CTSM и, за счет этого, физиологические и нефизиологические изменения гомеостаза обновления, поддержания, восстановления, старения и апоптоза клеток.
1. Физиологические состояния: рост, старение, беременность, менопауза, физическая активность, циркадные ритмы;
- Рост у детей: развитие органов во младенчестве, детстве, подростковом возрасте, например, высокая активность костей (рост и ремоделирование) и соответствующее увеличение субпопуляции CTSM, содержащих пептиды костного происхождения;
- Высокая активность совокупности клеток-предшественников лимфоидного ряда для продукции большого количества В - и Т-лимфоцитов у детей младшего возраста, что находит отражение в больших размерах тимуса у маленьких детей;
- Возрастные изменения: старение с инволюцией органов и увеличением субпопуляции CTSM;
- Беременность: плацентарная функция и дисфункция (раннее выявление интоксикации плаценты и сроков родоразрешения);
- Инволюция тимуса и снижение продукции Т-клеток: отрицательный отбор многих Т-клеток (~90%) в тимусе;
- Функция яичников: обнаружение (преждевременной) менопаузы по снижению CTSM яичников.
- Формирование костей и плотность костной ткани: оценка формирования и резорбции костей в процессе возрастных изменений, например, в период полового созревания/подростковом возрасте, при возрастных изменениях и ранней менопаузе.
2. Образ жизни: например:
- Курение: оценка повреждения легких путем измерений баланса клеток слизистой и эпителиальных клеток;
- Алкоголь: оценка повреждения печени в связи с употреблением алкоголя;
- Спорт: оценка CTSM мышечного происхождения при занятиях спортом, требующих значительной физической нагрузки (например, марафоном, триатлоном) для разработки индивидуальных программ тренировок для ведущих спортсменов с дифференциальными возможностями восстановления;
- Воздействие солнечных лучей/УФ на кожу: измерение пептидов кожного эпителия и пептидов меланина для оценки уровня воздействия УФ и связанных с ним повреждений (процента поверхности и интенсивности УФ-облучения).
3. Воздействие факторов окружающей среды
Прямая оценка токсичных компонентов в тканевых макрофагах или непрямое измерение токсичности в пораженных тканях, например, в случае воздействия:
- Асбеста;
- Нейротоксических материалов в красках;
- Последствий облучения после происшествий, связанных с атомной энергией.
4. Общее повреждение тканей (кожи, слизистых, мышц и/или кости):
- Травма: степень травмы и мониторинг хода восстановления;
- Хирургические вмешательства: например, оценка послеоперационного повреждения тканей как показатель "качества операции", например, для оценки технических навыков стажеров в хирургии.
- Действие сепсиса с множественными поражениями всего организма.
- Повреждение органа и другие нежелательные токсические побочные эффекты медицинского вмешательства, например, при лечении рака.
- Влияние температуры на определенные ткани, например, ожоговые раны (размер, глубина и процент поверхности тела);
- Переломы костей, сложность и масштаб переломов (например, измерение пептидов остеокальцина и/или пептидов остеопонтина и/или пептидов щелочной фосфатазы костей).
5. Воспалительные и аутоиммунные заболевания:
- Степень аутоиммунных заболеваний, например, системной склеродермии;
- Болезнь Шегрена: ранняя диагностика и четкое определение поражения слезных и слюнных желез путем измерения специфических эпителиальных пептидов;
- Аутоиммунный цистит; измерение CTSM, содержащих пептиды эпителия мочевого пузыря;
- Гломерулонефрит: степень повреждения почек при аутоиммунном нефрите или раннее обнаружение поражения почек у пациентов с системной красной волчанкой (СКВ) или раннее обнаружение процессов отторжения у пациентов после трансплантации почки;
- Ревматоидный артрит: обнаружение компонентов сустава (пептидов синовиальной мембраны) в CTSM;
- Васкулит: например, височный артериит с CTSM, содержащими пептиды эндотелиальных клеток.
6. Неврологические и нейродегенеративные расстройства:
- Болезнь Альцгеймера: ранняя диагностика с помощью CTSM, содержащих пептиды белков, ассоциированных с заболеванием, например, мутированного Арое4 и АРР.
- Рассеянный склероз: например, обнаружение пептидов миелина в CTSM.
- Болезнь Паркинсона
- Прионные заболевания, например, болезнь Кройцфельдта-Якоба
7. Инфекционные заболевания (в частности, с длительным вялотекущим и скрытым характером)
Совместное обнаружение тканеспецифических пептидов и микроорганизм-специфических пептидов в одной и той же субпопуляции TSM:
- Микобактериальные инфекции: затрудненная диагностика у БЦЖ-положительных пациентов и у детей;
- Ку-лихорадка: затрудненная диагностика и затрудненная оценка эффективности лечения;
- Болезнь Лайма: обнаружение пептидов, происходящих из Borrelia, у пациентов с неопределенными симптомами, у которых диагностика заболевания остается проблемой;
- Гепатит В и гепатит С: мониторинг повреждения печени и/или пептидов, происходящих от вирусных белков.
- Диагностика инвазивных грибковых и дрожжевых инфекций: затрудненная диагностика инфекций Aspergillus; обнаружение грибковых антигенов в циркулирующих тканевых макрофагах и идентификация пораженных тканей путем идентификации вовлеченных CTSM.
8. Метаболические расстройства:
- Ожирение: например, различные профили фрагментов белков, происходящих из адипоцитов, специфические для заболевания;
- Диабет 1-го типа (юношеский инсулинзависимый диабет): обнаружение на ранней стадии, до основных повреждений инсулинпродуцирующих клеток поджелудочной железы;
- Диабет 2-го типа (с поздним началом): повышенное количество CD14dim/CD16++-тканевых макрофагов с пониженной функцией (продукции цитокинов), при наличии атеросклеротических осложнений;
- Лечение тестостероном при гипогонадизме: повышение количества тканевых макрофагов при их пониженной функции.
9. Заболевания неизвестного происхождения:
Например: обнаружение пептидов мышечного происхождения и других маркеров заболевания (например, компонентов вирусов):
- Фибромиалгия;
- Синдром хронической усталости: обнаружение вирусных компонентов в тканевых макрофагах.
- Лихорадка неизвестного происхождения (идиопатическая): определение профиля CTSM, как прямого показателя повреждения определенной ткани.
10. Злокачественные новообразования:
В случае большинства карцином можно использовать эпителиальный мембранный антиген в качестве общего маркера в комбинации с одним или более тканеспецифических маркеров
- Карциномы в целом: например, пептиды ЕМА (эпителиального мембранного антигена);
- Карцинома молочной железы: например, пептиды антигена СА 15-3;
- Карцинома щитовидной железы: например, пептиды RET в качестве опухолевого маркера;
- Карцинома пищевода;
- Карцинома желудка;
- Карцинома толстой кишки: например, пептиды онкоэмбрионального антигена (СЕА);
- Карцинома прямой кишки/сигмовидной кишки;
- Карцинома легких;
- Карцинома матки или шейки матки:
- Карцинома предстательной железы: например, пептиды PSA и ERG;
- Карцинома мочевого пузыря;
- Меланома: например, пептиды меланина; MART-1/Melan-A
- Карцинома поджелудочной железы;
- Карцинома почек и т.д.;
- Нейробластома: например, пептиды дисиалоганглиозида GD2;
- Опухоли головного мозга: например, GFAP (Фигура 6);
- Мезотелиома: скрининг работников, подвергающихся воздействию асбеста, и диагностика на ранних стадиях с помощью пептидов мезотелиального происхождения в циркулирующих тканевых макрофагах;
- Редкие виды рака, которые трудно диагностировать, например, опухоли гипофиза.
11. Раннее обнаружение и мониторинг метастазов опухолей:
Совместное обнаружение пептидов опухолевого происхождения и пептидов инфильтрированной ткани в одной и той же субпопуляции CTSM, например:
- Метастазы карциномы молочной железы в кости или печень: совместное обнаружение пептидов, происходящих из молочной железы и кости или печени в одной и той же субпопуляции TSM;
- Метастазы карциномы толстой кишки в печень: совместное обнаружение пептидов, происходящих из толстой кишки и печени в одной и той же субпопуляции CTSM;
- Метастазы карциномы предстательной железы в кости: совместное обнаружение пептидов, происходящих из толстой кишки и костей в одной и той же субпопуляции CTSM;
- Внутрисосудистая В-клеточная лимфома: совместное обнаружение пептидов эндотелиального и В-клеточного происхождения в одной и той же субпопуляций CTSM (обнаружены высокие уровни тканевых макрофагов: >10% лейкоцитов крови)
- Интрацеребральная лимфома: совместное обнаружение пептидов ЦНС и В-клеток в одних и тех же CTSM.
12. Сердечно-сосудистые заболевания:
- Стенокардия: Аномалии ЭКГ с или без инфаркта миокарда;
- Нарушение свертывания крови у пациентов с риском развития тромбоза
- Атеросклеротические поражения у пациентов с сахарным диабетом II типа
ПРИМЕР 2
Окрашивание глиального фибриллярного кислого белка (GFAP) в СТМ пациентов с глиомой и здоровых людей.
Материалы и способы
Свежеотобранные образцы крови от пациентов с глиомой (n=9) на момент постановки диагноза (до хирургического вмешательства) и здоровых контрольных субъектов (n=9) подвергали окрашиванию поверхности мембраны с использованием CD300e(UP-H2)-АРС (Immunostep, Саламанка, Испания), CD14(MO-P9)-APCH7 (BD Biosciences, Сан-Хосе, штат Калифорния, США), CD16(3G8)-PECy7 (BD Biosciences, Сан-Хосе, штат Калифорния, США), CD45(HI30)-PacO (InVitrogen, Гранд-Айленд, штат Нью-Йорк, США), и HLADR(L243)-PacB (BioLegend, Сан-Диего, штат Калифорния, США) в соответствии с процедурой окрашивания, описанной в Таблице 2 (Процедура А, этапы 1-13). После окрашивания поверхности мембраны образцы подвергали внутриклеточному окрашиванию с использованием антитела против GFAP (N-18)-PE в соответствии с процедурой окрашивания, описанной в Таблице 2 (Процедура В, этапы 16-43). Мишенью антитела против GFAP являлся N-концевой эпитоп указанного белка; антитело получили из Santa Cruz Biotechnology (Санта-Круз, штат Калифорния, США). Фиксацию и пермеабилизацию клеток осуществляли с применением Fix & Perm (An der Grub, Вена, Австрия). Окрашенные клетки измеряли с помощью многоцветового проточного цитометра FACSCanto II (BD Biosciences), данные анализировали с помощью программного обеспечения Infinicyt (Cytognos, Саламанка, Испания). Селективное пропускание моноцитов и СТМ основывалось на гейтировании по промежуточному SSC и экспрессии CD45 и последующем гейтировании по CD300e и HLADR-положительности (общую картину окрашивания см. на Фигуре 4). Затем выполняли дальнейший анализ экспрессии CD16 и CD14 с последующей оценкой внутриклеточного окрашивания по GFAP (см. Фигуру 6А).
Результаты
Процент ранних СТМ выражали по отношению к общей тестируемой популяции (классические моноциты + все СТМ), а GFAP-положительность выражали в виде процента положительных клеток в пределах популяции ранних СТМ. У всех здоровых контрольных субъектов содержание ранних СТМ составляло менее 10%, а у 6/9 здоровых контрольных субъектов - менее 5%. Процент GFAP-положительных ранних СТМ у девяти здоровых контрольных субъектов составлял менее 1% (0,6%, 0,7%, и у 7 субъектов - 0%) (см. Фигуру 6В). У пациентов с глиомой содержание ранних СТМ составляло более 5% в 8/9 случаев и более 10% в 4/9 случаев. Процент GFAP-положительных ранних СТМ варьировался от ~1% до ~31% (0,9%, 1,0%, 1,3%, 1,4%, 2,5%, 4,5%, 8,7%, 29,9%, 30,7%). Процент GFAP-положительных СТМ демонстрировал некоторую степень корреляции с размером опухолевой массы глиомы (см. Фигуру 6В).
| название | год | авторы | номер документа |
|---|---|---|---|
| КЛЕТОЧНАЯ СИСТЕМА НАПРАВЛЕННОЙ ДОСТАВКИ ФАРМАЦЕВТИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА ИЛИ МЕТКИ | 2016 |
|
RU2771323C2 |
| ГЕМАТОПОЭТИЧЕСКИЕ СТВОЛОВЫЕ КЛЕТКИ И СПОСОБЫ ЛЕЧЕНИЯ НЕОВАСКУЛЯРНЫХ ЗАБОЛЕВАНИЙ ГЛАЗ С ИХ ПОМОЩЬЮ | 2004 |
|
RU2345780C2 |
| СПОСОБ ПРИЖИЗНЕННОГО ОПРЕДЕЛЕНИЯ МОРФОФУНКЦИОНАЛЬНЫХ ХАРАКТЕРИСТИК СОЕДИНИТЕЛЬНО-ТКАННЫХ ОБОЛОЧЕК ГЛАЗНОГО ЯБЛОКА ПРИ СТАЦИОНАРНОЙ МИОПИИ | 2014 |
|
RU2595802C2 |
| СПОСОБ ПРИЖИЗНЕННОГО ОПРЕДЕЛЕНИЯ МОРФОФУНКЦИОНАЛЬНЫХ ХАРАКТЕРИСТИК СОЕДИНИТЕЛЬНО-ТКАННЫХ ОБОЛОЧЕК ГЛАЗНОГО ЯБЛОКА ПРИ СТАЦИОНАРНОЙ МИОПИИ ВЫСОКОЙ СТЕПЕНИ | 2014 |
|
RU2575574C1 |
| ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ, НЕ ПРИНАДЛЕЖАЩИЕ К ЧЕЛОВЕЧЕСКОМУ РОДУ ЖИВОТНЫЕ И СПОСОБ ИХ ИСПОЛЬЗОВАНИЯ | 2013 |
|
RU2642319C2 |
| ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ НЕ ПРИНАДЛЕЖАЩИЕ К ЧЕЛОВЕЧЕСКОМУ РОДУ ЖИВОТНЫЕ И СПОСОБ ИХ ИСПОЛЬЗОВАНИЯ | 2013 |
|
RU2768282C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СУБПОПУЛЯЦИОННОГО СОСТАВА КЛЕТОК КОЖИ И ПОЛУЧЕНИЯ ЦИТОИММУНОГРАММЫ КОЖИ | 2016 |
|
RU2630607C1 |
| ГЕМАТОПОЭТИЧЕСКИЕ СТВОЛОВЫЕ КЛЕТКИ И СПОСОБЫ ЛЕЧЕНИЯ НЕОВАСКУЛЯРНЫХ ЗАБОЛЕВАНИЙ ГЛАЗ С ИХ ПОМОЩЬЮ | 2006 |
|
RU2389497C2 |
| НОВАЯ СУБПОПУЛЯЦИЯ CD8CD45RC КЛЕТОК TREG И ЕЕ ПРИМЕНЕНИЯ | 2016 |
|
RU2766691C2 |
| ИНГИБИТОР ИММУНОСУПРЕССИИ, СВЯЗАННЫЙ С РАКОМ | 2018 |
|
RU2805232C2 |
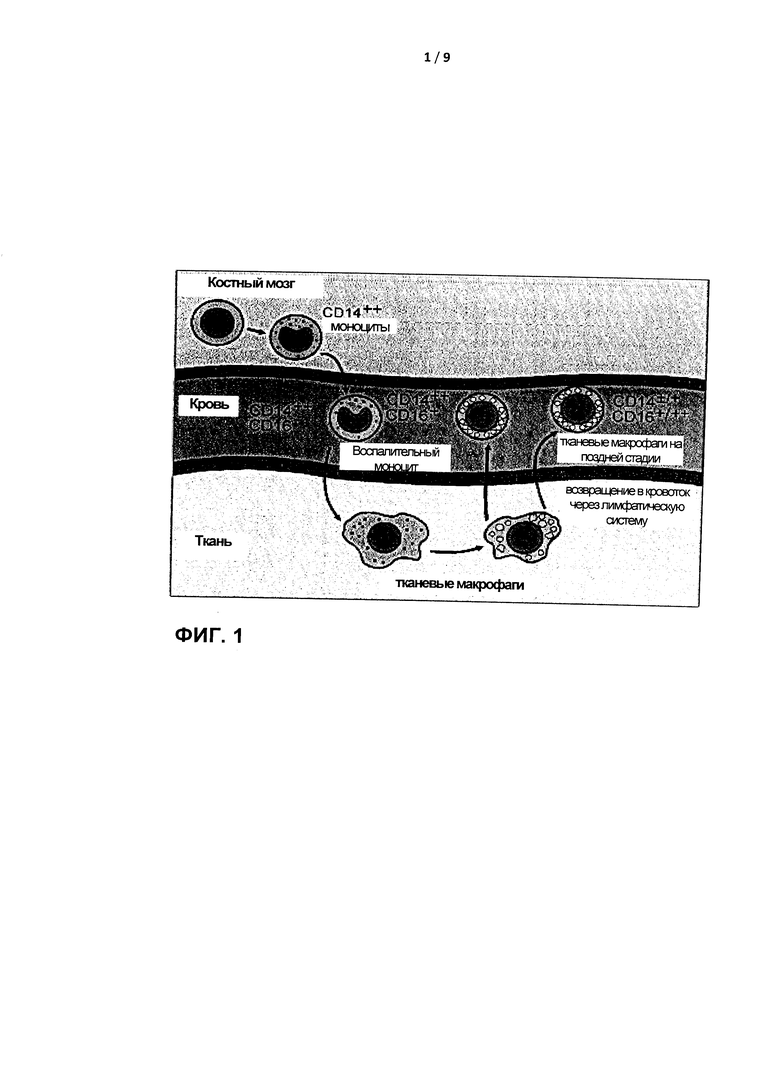
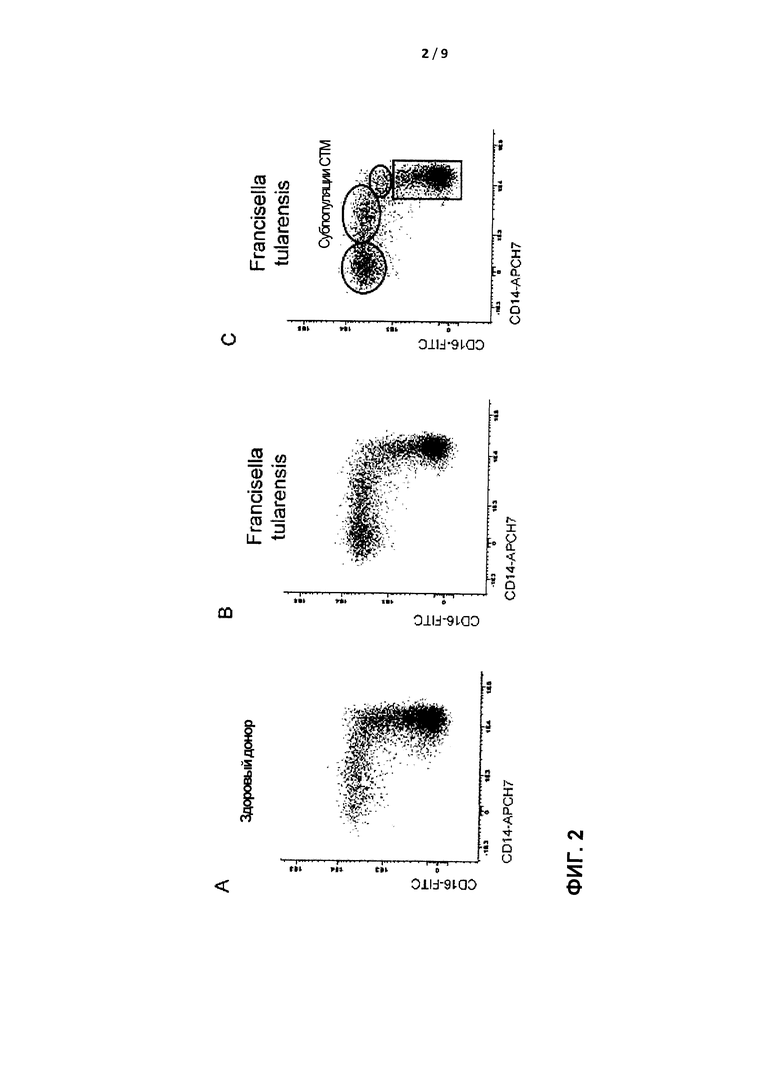
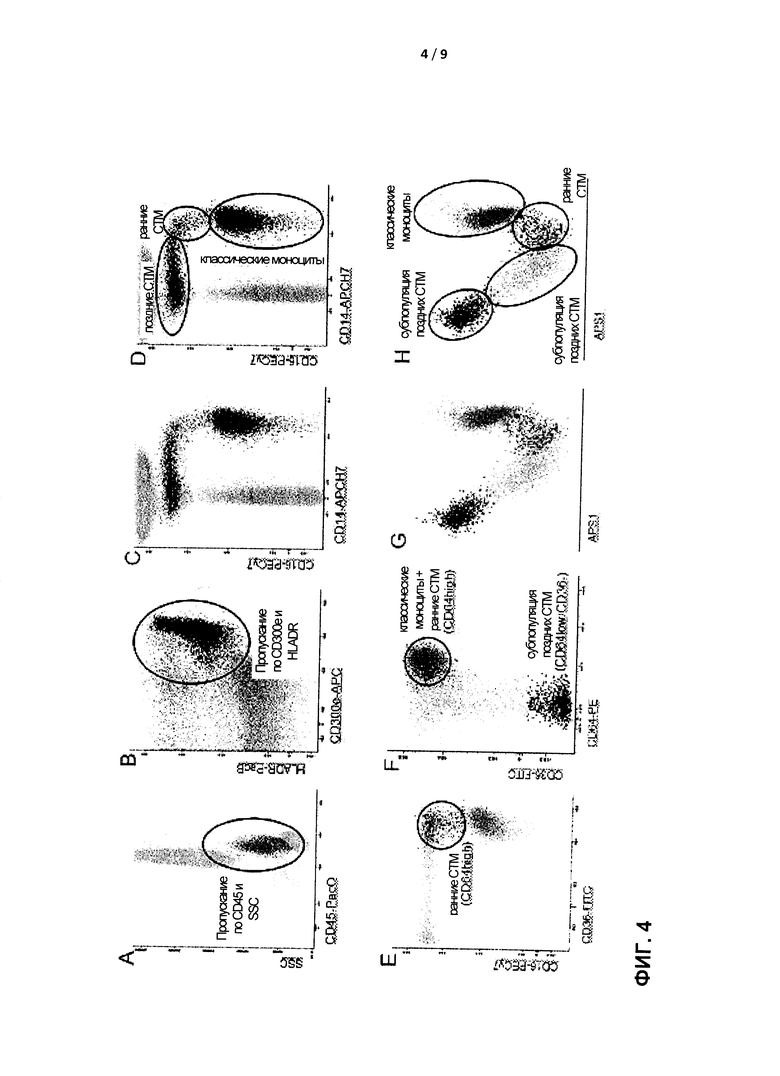
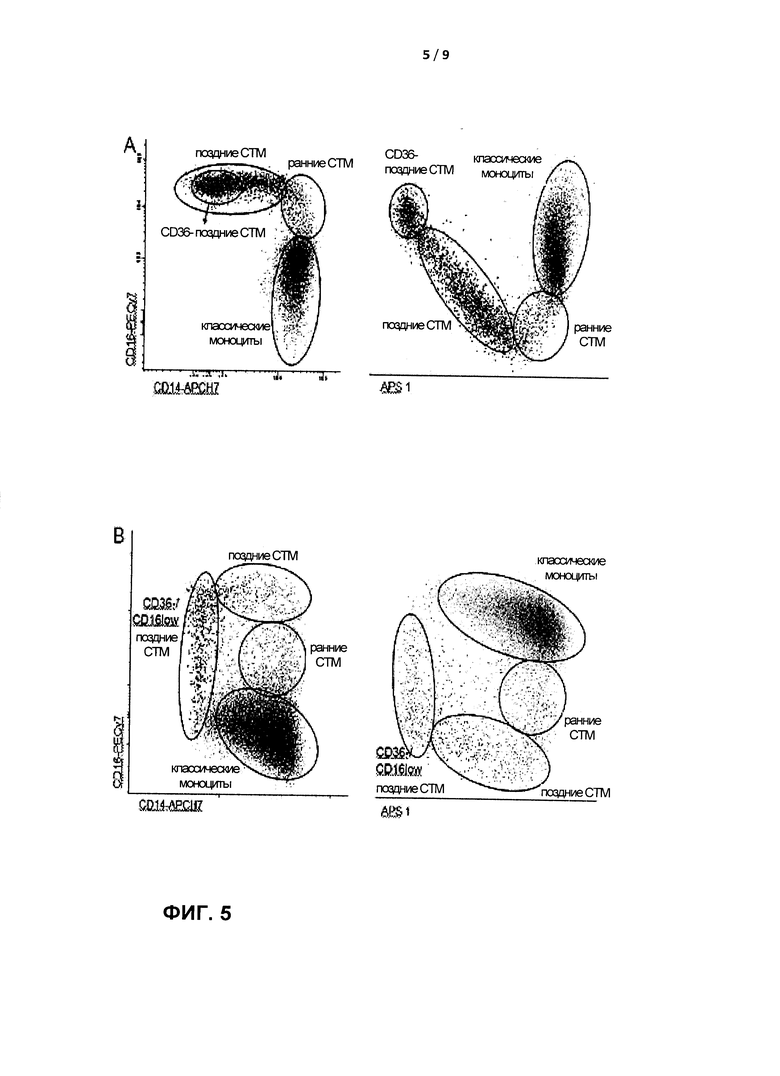
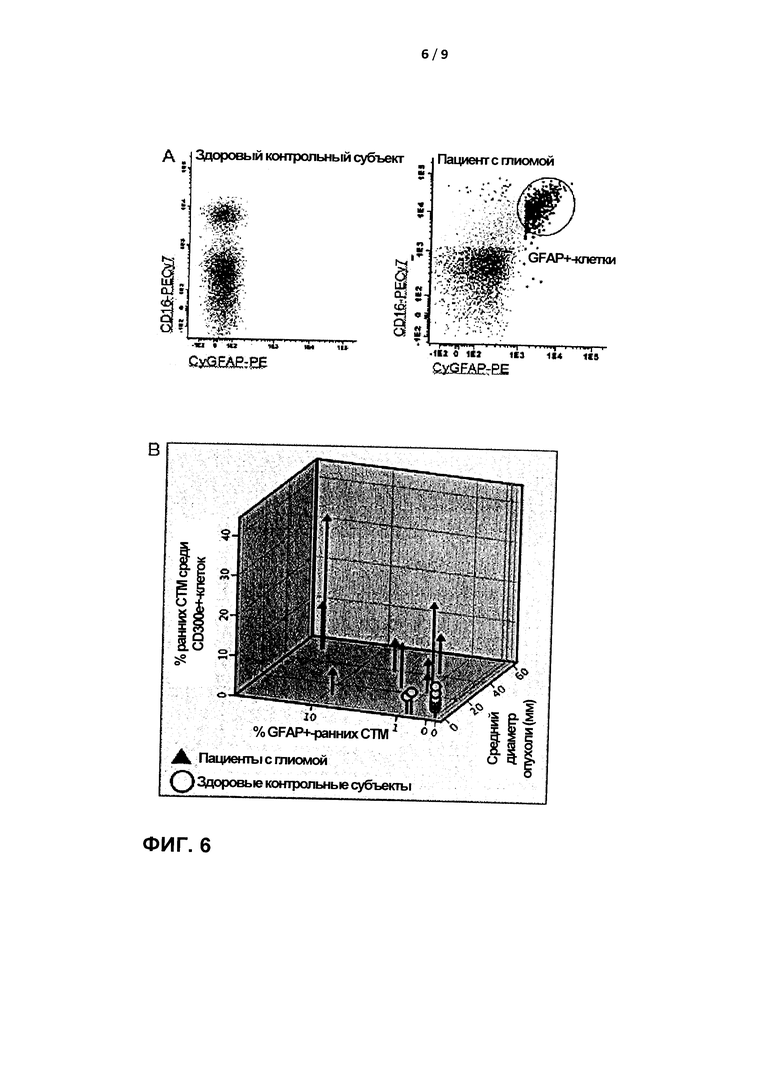
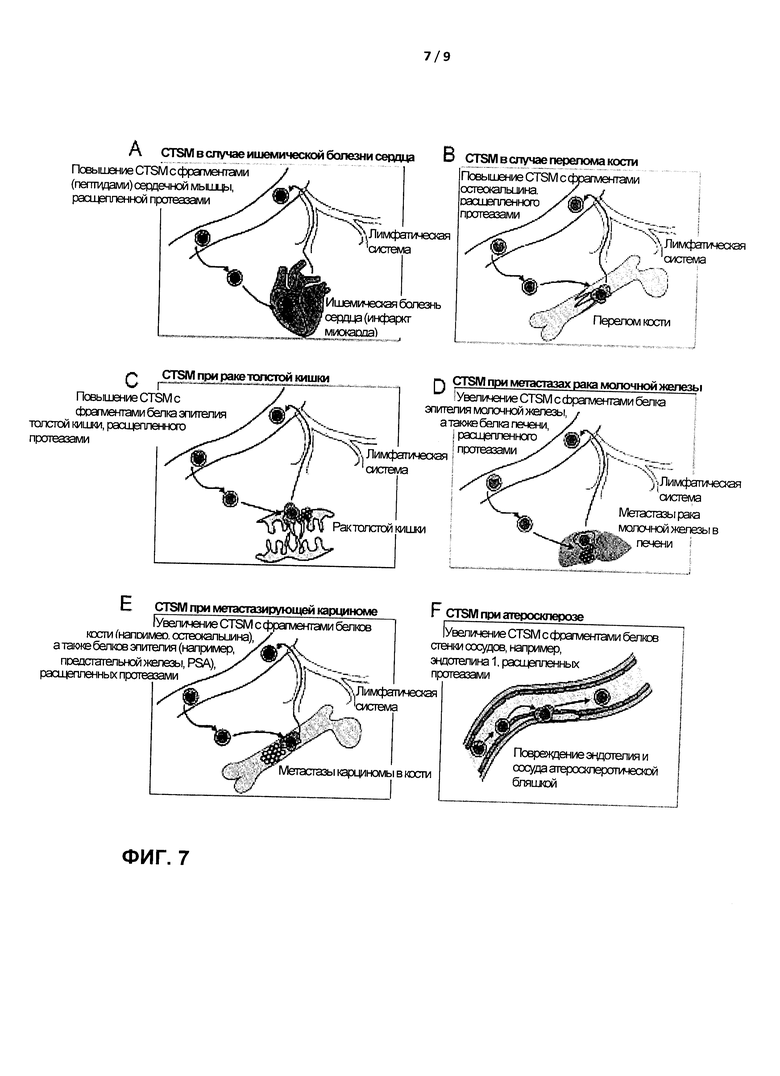
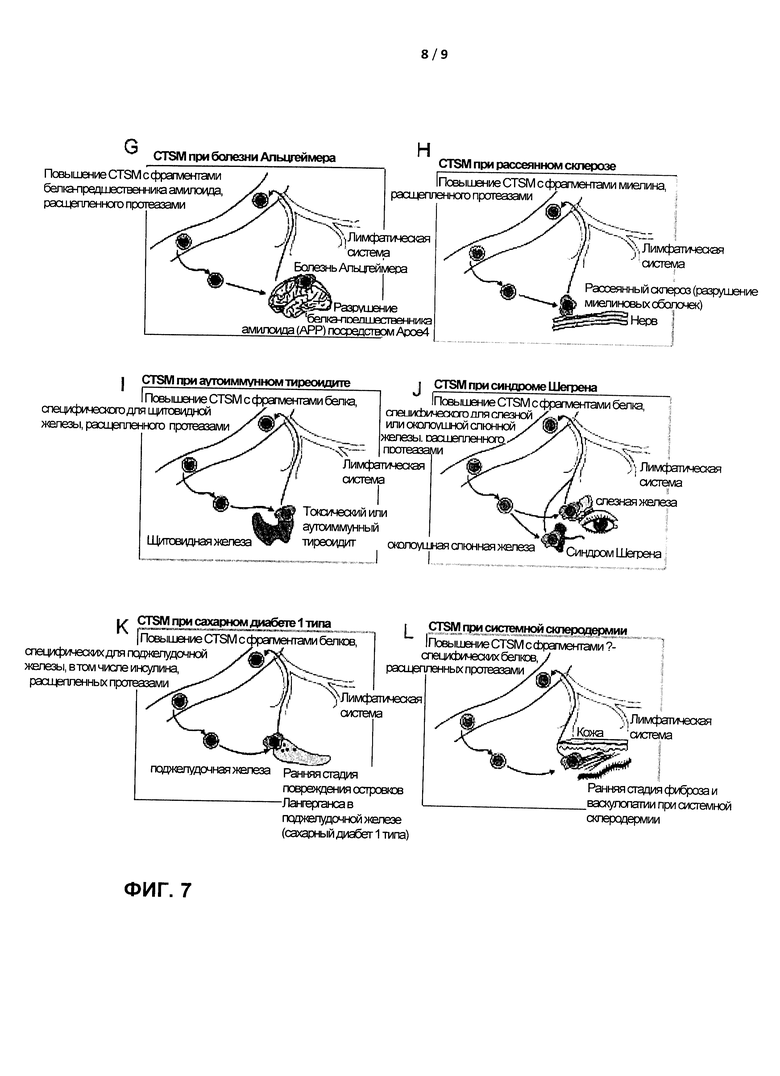
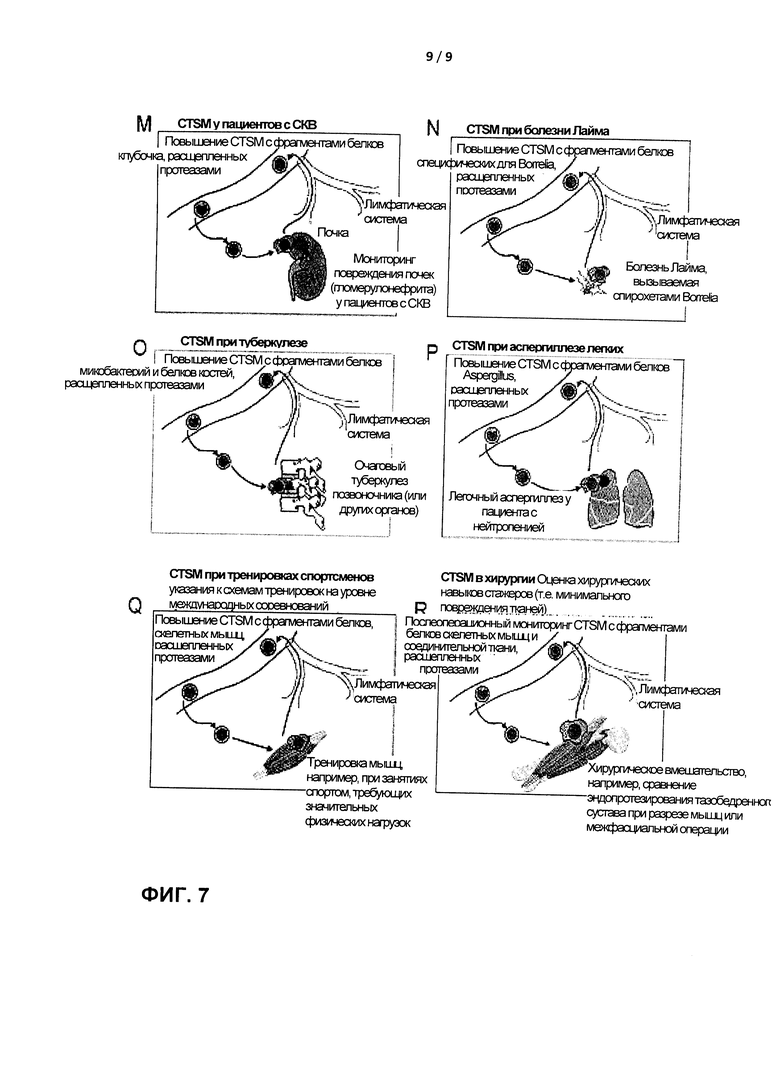
Группа изобретений относится к медицине, а именно к иммунологии, и может быть использована для ранней диагностики и мониторинга заболевания у субъекта с использованием циркулирующих тканевых макрофагов. Способ включает этапы: a) обеспечения биологического образца для тестирования от указанного субъекта, причем указанный образец содержит циркулирующие тканевые макрофаги (СТМ); b) окрашивания указанных СТМ с использованием панели дифференциально меченых различных антител против опорных маркеров CD14, CD16, CD300e, CD36 и HLADR с целью идентификации и подсчета различных субпопуляций СТМ; c) фиксации, пермеабилизации и окрашивания СТМ с использованием одного или нескольких антител для обнаружения против одного или более эпитопов по меньшей мере одного протеазо-индуцированного фрагмента белка, полученного в результате внутриклеточной деградации не принадлежащего СТМ белка, отдельными СТМ в тканях, из которых они происходят, тем самым идентифицируя по меньшей мере одну субпопуляцию циркулирующих тканеспецифических макрофагов (CTSM). Далее проводят анализ с применением многопараметрической проточной цитометрии указанных окрашенных СТМ и CTSM путем селективного пропускания по опорным маркерам CD14, CD16, CD300e, CD36 и HLADR с целью определения количества сигналов каждого определенного меченого антитела, связанного с отдельными клетками. Определяют относительное и абсолютное количество отдельных клеток в каждой субпопуляции СТМ и каждой специфической субпопуляции CTSM, экспрессирующих каждый из измеренных внутриклеточных эпитопов. Расчет относительного и абсолютного количества клеток проводят в каждой субпопуляции СТМ и каждой специфической субпопуляции CTSM, каждое из которых происходит из различных нормальных и измененных тканей, что определяют с помощью оцениваемого набора отдельных протеазо-индуцированных фрагментов белка. Проводят определение количества связанного с антителами сигнала, ассоциированного с каждым отдельным оцениваемым внутриклеточным пептидом, с целью получения профиля окрашивания CTSM. А также сравнивают тестируемый профиль окрашивания CTSM с нормальным профилем окрашивания CTSM для каждой оцениваемой ткани, причем повышенное количество CTSM свидетельствует о наличии заболевания. Группа изобретений относится также к набору для ранней диагностики и мониторинга заболевания у субъекта с использованием циркулирующих тканевых макрофагов. Использование данной группы изобретений позволяет проводить раннюю диагностику и мониторинг заболевания у субъекта с использованием циркулирующих тканевых макрофагов по опорным маркерам CD14, CD16, CD300e, CD36 и HLADR. 2 н. и 21 з.п. ф-лы, 2 табл., 2 пр., 7 ил.
1. Способ ранней диагностики и мониторинга заболевания у субъекта с использованием циркулирующих тканевых макрофагов как показателя нарушенного гомеостаза ткани и наличия заболевания, указанный способ включает этапы:
a) обеспечения биологического образца для тестирования от указанного субъекта, причем указанный образец содержит циркулирующие тканевые макрофаги (СТМ);
b) окрашивания указанных СТМ с использованием панели дифференциально меченых различных антител против опорных маркеров CD14, CD16, CD300e, CD36 и HLADR, с целью идентификации и подсчета различных субпопуляций СТМ;
c) фиксации, пермеабилизации и окрашивания СТМ с использованием одного или нескольких антител для обнаружения против одного или более эпитопов по меньшей мере одного протеазо-индуцированного фрагмента белка, полученного в результате внутриклеточной деградации не принадлежащего СТМ белка, отдельными СТМ в тканях, из которых они происходят, тем самым идентифицируя по меньшей мере одну субпопуляцию циркулирующих тканеспецифических макрофагов (CTSM);
d) анализа с применением многопараметрической проточной цитометрии указанных окрашенных СТМ и CTSM путем селективного пропускания по опорным маркерам CD14, CD16, CD300e, CD36 и HLADR с целью определения количества сигналов каждого определенного меченого антитела, связанного с отдельными клетками;
e) определения относительного и абсолютного количества отдельных клеток в каждой субпопуляции СТМ и каждой специфической субпопуляции CTSM, экспрессирующих каждый из измеренных внутриклеточных эпитопов;
f) расчета (i) относительного и абсолютного количества клеток в каждой субпопуляции СТМ и каждой специфической субпопуляции CTSM, каждая из которых происходит из различных нормальных и измененных тканей, что определяют с помощью оцениваемого набора отдельных протеазо-индуцированных фрагментов белка, и ii) количества связанного с антителами сигнала, ассоциированного с каждым отдельным оцениваемым внутриклеточным пептидом, с целью получения профиля окрашивания CTSM, а также;
g) сравнения тестируемого профиля окрашивания CTSM с нормальным профилем окрашивания CTSM для каждой оцениваемой ткани, причем повышенное количество CTSM свидетельствует о наличии заболевания.
2. Способ по п. 1, отличающийся тем, что ранняя диагностика включает раннее обнаружение повреждения тканей.
3. Способ по п. 1, отличающийся тем, что этап b) дополнительно включает окрашивание антителами к одному или более из маркеров CD45 и CD64.
4. Способ по любому из пп. 1-3, отличающийся тем, что этап d) включает выполнение стратегии селективного пропускания, основанной на экспрессии CD300e, CD14, CD16, CD36 и HLADR, на поверхности клеток, в комбинации с анализом бокового светорассеяния (SSC).
5. Способ по п. 4, отличающийся тем, что указанная стратегия селективного пропускания состоит из (i) этапа включения, для включения как классических моноцитов, так и СТМ, на основании экспрессии CD300e и HLADR, в сочетании с анализом бокового светорассеяния (SSC), и (ii) последующего этапа идентификации субпопуляций для различения классических CD14high/CD16-моноцитов и СТМ и идентификации субпопуляций в популяции СТМ.
6. Способ по п. 5, включающий одно из следующего:
(i) окрашивание с использованием по меньшей мере CD300e, CD14 и CD16 и селективное пропускание по комбинации SSC и CD300e+-клеток для отбора клеток с низким до среднего SSC, экспрессирующих CD300e;
(ii) окрашивание с использованием по меньшей мере CD300e, CD14, CD16 и HLADR и селективное пропускание по комбинации бокового светорассеяния (SSC) и CD300e+- и HLADR+-клеток для отбора клеток с низким до среднего SSC, одновременно экспрессирующих CD300e и HLADR, либо
(iii) окрашивание с использованием по меньшей мере CD300e, CD14, CD16, CD45 и HLADR и селективное пропускание по комбинации SSC и CD300e+, CD45+ и HLADR+-
клеток, включая селективное пропускание клеток с CD45 с низким до среднего SSC, одновременно экспрессирующих CD300e и HLADR.
7. Способ по п. 5 или 6, отличающийся тем, что указанный этап идентификации субпопуляций включает идентификацию классических (CD14high/CD16-) моноцитов и двух основных субпопуляций СТМ, идентифицируемых как клетки CD14high/CD16low - CD14high/CD16high, CD14low/CD16high и CD14-/CD16high - CD14-/CD16low.
8. Способ по п. 5 или 6, отличающийся тем, что указанный этап идентификации субпопуляций СТМ включает:
- селективное пропускание по CD64low, представляющим собой СТМ поздней стадии, в отличие от CD64high, представляющих собой классические моноциты и СТМ ранней стадии, а затем
- различение моноцитов и СТМ путем отбора всех других СТМ-клеток ранней стадии по сравнению с классическими моноцитами по фенотипу CD16+/CD14+ и определение всей категории СТМ как CD64low и как CD16+/CD14+/CD64high, а затем
- дальнейшее подразделение отобранных СТМ на основе уровней экспрессии CD64, CD14 и CD16 на отдельные категории, связанные с функциональными свойствами или созреванием, причем указанные отдельные категории представляют собой CD64high/CD14high/CD16low CD64high/CD14high/CD16high, CD64high/CD14low/CD16high, CD64low/CD14-/CD16high и CD64low/CD14-/CD16low.
9. Способ по п. 8, отличающийся тем, что указанный этап дальнейшего подразделения отобранных СТМ основывается на CD64, CD14, CD16 и CD36, включая идентификацию по меньшей мере одного из следующих субпопуляций СТМ: от CD64high/CD36high/CD14high/CD16low до CD64high/CD36high/CD14high/CD16high, CD64high/CD36high/CD14low/CD16high, CD64low/CD36high/CD14-/CD16high и CD64low/CD14-/CD16low/CD36 - до клеток с низким содержанием антигенов.
10. Способ по п. 1, отличающийся тем, что биологический образец для тестирования включает периферическую кровь, асцитную жидкость, плевральный выпот, спинномозговую жидкость, костный мозг, лимфатический узел, лимфатическую
жидкость, синовиальную жидкость или суспензию одиночных клеток, полученную из плотной ткани.
11. Способ по любому из пп. 1-3, 5, 6, 9 или 10, отличающийся тем, что этап с) включает внутриклеточное окрашивание:
a. одного или более эпитопов одиночного протеазо-индуцированного фрагмента белка, происходящего от процессируемого внутри клетки тканеспецифического белка;
b. одного или более эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих от одного процессируемого внутри клетки тканеспецифического белка;
c. одного или более эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих от двух или более процессированных внутри клетки тканеспецифических белков здоровых клеток одиночного органа или ткани;
d. одного или более эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих от двух или более процессированных внутри клетки тканеспецифических белков аномальных клеток одиночного органа или ткани;
e. одного или более эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих от двух или более процессированных внутри клетки тканеспецифических белков здоровых и аномальных клеток одиночного органа или ткани, включая комбинацию по меньшей мере одного антитела против пептидных эпитопов нормального белка и по меньшей мере одного антитела против пептидных эпитопов аномального белка, а также;
f. одного или более эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих от двух или более процессированных внутри клетки тканеспецифических белков здоровых или аномальных клеток из двух или более органов или тканей.
12. Способ по любому из пп. 1-3, 5, 6, 9 или 10, отличающийся тем, что указанное по меньшей мере одно из антител для обнаружения обеспечивает обнаружение одного или нескольких пептидных эпитопов, происходящих от аномального белка, при этом указанный аномальный белок выбран из группы, состоящей из онкогенных белков,
мутировавших белков, гибридных белков, белков-производных аллергена и белков, происходящих из патогенного организма, например вируса, бактерии, паразита или гриба.
13. Способ по любому из пп. 1-3, 5, 6, 9 или 10, отличающийся тем, что панель дифференциально меченых антител состоит из комбинации совместимых флуорохромов, выбранных из флуоресцеинизотиоцианата (FITC), фикоэритрина (РЕ), белка хлорофилла перидиней (PerCP), аллофикоцианина (АРС), Alexa Fluor 488, Alexa 647, Alexa 710, Alexa Fluor 405, цианина 5 (Cy5), цианина 5.5 (Cy5.5), Pacific Blue (PacB), Horizon Violet 450 (HV450), Pacific Orange (PacO), бриллиантового фиолетового (BV), HV500, OC515, Krome Orange, квантовых точек и их конъюгатов, соединенных с РЕ, АРС или PerCP или любого дополнительного совместимого флуорохрома или тандема флуорохромов.
14. Диагностический набор для ранней диагностики и мониторинга заболевания у субъекта с использованием циркулирующих тканевых макрофагов, содержащий, в первом контейнере, дифференциально-меченые антитела против набора опорных маркеров, причем указанные опорные маркеры представляют собой CD300e, CD14, CD16, CD36 и HLADR, и инструкции по применению указанного набора для идентификации и подсчета по меньшей мере одной субпопуляции СТМ.
15. Диагностический набор по п. 14, отличающийся тем, что указанный первый контейнер включает антитела к маркерам CD300e, CD14, CD16 и HLADR, и по меньшей мере одно антитело, выбранное из группы антител к маркеру CD36, CD64 или CD45.
16. Диагностический набор по п. 15, отличающийся тем, что указанный первый контейнер включает антитела против CD300e, CD14, CD16, HLADR, CD45, CD64 и CD36.
17. Диагностический набор по любому из пп. 14-16, дополнительно включающий второй контейнер, включающий по меньшей мере одно меченое антитело для обнаружения против одного или более эпитопов по меньшей мере одного протеазо-индуцированного фрагмента белка, полученного при внутриклеточной деградации белка, не принадлежащего СТМ, отдельными СТМ в тканях, из которых они происходят.
18. Диагностический набор по п. 17, отличающийся тем, что указанный второй контейнер включает по меньшей мере одно антитело для обнаружения против одного или более протеазо-индуцированного фрагмента белка, полученного при внутриклеточной деградации белка эпителия, выбранного из группы, состоящей из белка эпителия молочной железы, белка эпителия пищевода, белка эпителия желудка, белка эпителия поджелудочной железы, белка эпителия толстой кишки, белка эпителия прямой и сигмовидной кишки, белка эпителия щитовидной железы, белка эпителия легких или бронхов, белка эпителия предстательной железы, белка эпителия мочевого пузыря, белка эпителия шейки матки, белка эпителия матки, белка меланомы, белка клубочка почки, или против другого маркера эпителиальных клеток, и инструкции по применению при ранней диагностике и мониторинге злокачественных новообразований.
19. Диагностический набор по п. 17, отличающийся тем, что указанный второй контейнер включает по меньшей мере одно антитело для обнаружения одного или более эпитопов, полученных при внутриклеточной деградации белков, специфических для головного мозга и нервов, выбранных из группы, состоящей из Ароε4, белка-предшественника амилоида (АРР), GFAP и миелина, и инструкции по применению при ранней диагностике и мониторинге болезни Альцгеймера, глиомы или рассеянного склероза.
20. Диагностический набор по п. 18, отличающийся тем, что указанный второй контейнер включает по меньшей мере одно антитело для обнаружения одного или более эпитопов, полученных при внутриклеточной деградации белков, специфических для головного мозга и нервов, выбранных из группы, состоящей из Ароε4, белка-предшественника амилоида (АРР), GFAP и миелина, и инструкции по применению при ранней диагностике и мониторинге болезни Альцгеймера, глиомы или рассеянного склероза.
21. Диагностический набор по п. 17, отличающийся тем, что указанный второй контейнер включает по меньшей мере одно антитело для обнаружения одного или более эпитопов, полученных при внутриклеточной деградации белков, специфических для сердечной мышцы, белков, специфических для почек/клубочка, белков, специфических для печени, или белков, специфических для легких, и инструкции по применению при оценке приживления органа после трансплантации и отторжения трансплантата у пациента, подвергшегося, соответственно, трансплантации сердца, почки, печени или легкого.
22. Диагностический набор по любому из пп. 18-20, отличающийся тем, что указанный второй контейнер включает по меньшей мере одно антитело для обнаружения одного или более эпитопов, полученных при внутриклеточной деградации белков, специфических для сердечной мышцы, белков, специфических для почек/клубочка, белков, специфических для печени, или белков, специфических для легких, и инструкции по применению при оценке приживления органа после трансплантации и отторжения трансплантата у пациента, подвергшегося, соответственно, трансплантации сердца, почки, печени или легкого.
23. Диагностический набор по п. 22, отличающийся тем, что указанный второй контейнер включает по меньшей мере одно антитело для обнаружения одного или более эпитопов, полученных при внутриклеточной деградации белков, специфических для сердечной мышцы, выбранных из группы, состоящей из тропонина и CK-МВ.
| Brckalo T | |||
| et al | |||
| ТКАЦКИЙ СТАНОК | 1920 |
|
SU300A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Aguilar H | |||
| et al | |||
| Molecular characterization of a novel immune receptor restricted to the monocytic lineage // J Immunol | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| WO 2010015633 A1, 11.02.2010 | |||
| WO 2009100953 A2, 20.08.2009. | |||
Авторы
Даты
2017-11-15—Публикация
2012-03-05—Подача