ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к лечению состояния иммуносупрессии, которое может встречаться во время ракового заболевания.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Избегание опухолью иммунологического надзора является главным серьезным препятствием при планировании эффективных противораковых терапевтических стратегий. Несмотря на то, что были сделаны значительные успехи в понимании того, как раковые заболевания уклоняются от разрушительной силы иммунитета, принимаемые меры по противодействию избегания опухолями иммунологического надзора не удовлетворяют потребности.
Длительная выживаемость пациента считается "золотым стандартом" успеха в лечении рака, несмотря на то, что с позиции пациента, конечной целью является выживаемость без признаков заболевания. Все чаще считается, что длительная выживаемость и выживаемость без признаков заболевания в большей степени зависит от усиления собственной иммунной системы пациента для формирования эффективного противоопухолевого ответа. Сведения, свидетельствующие о сильном иммунном ответе на терапию, даже до такой степени, что идуцируются аутоиммунные симптомы, могут быть положительным показателем длительной выживаемости у раковых пациентов (Burkholder et al., 2014, Biochimica et Biophysica Acta, Vol. 1845 : 182-201).
Несмотря на то, что целый ряд агентов подвергали скринингу в отношении их противоопухолевого действия, и их отбор был одобрен для лечения раковых пациентов, химиотерапия, лучевая терапия и хирургическое вмешательство остаются главными принципами стандартных противораковых терапевтических стратегий (Vinay et al., 2015, Seminars in cancer biology, Vol. 35 : 5185-5198). Обратной стороной данных терапий является их способность вызывать временную иммуносупрессию, которая, в свою очередь, повышает риск инфицирования и также вероятно будет снижать способность иммунной системы ингибировать дальнейшее развитие рака.
Идентификация адаптированных глобальных стратегий лечения рака охватывает определение степени, до которой терапии, стимулирующие иммунную систему, могут усиливать стандартные противораковые терапии. В данной области настоятельно рекомендуется, чтобы большинство, если не все, глобальных стратегий лечения рака включало связанные с ними средства, которые повышают противораковый иммунитет, независимо от вида используемого противоракового лечения.
Иммунотерапии обладают потенциалом для лечения рака, поскольку иммунотерапии действуют через механизм, который отличен от химиотерапии или лучевой терапии, и поскольку они представляют виды лечения, основанные не на перекрестной устойчивости, с полностью отличающимся спектром токсических эффектов. Как T-, так и B-клетки могут распознавать широкий круг возможных опухолевых антигенов посредством генетической рекомбинации их соответствующих рецепторов, и, что более важно, как T-, так и B-клетки могут различать небольшие различия антигенов между нормальными и трансформированными клетками, обеспечивая специфичность при одновременной минимизации токсичности.
О важности иммунного ответа на рак известно много лет. Однако, недавние достижения в иммуноонкологии значительно улучшили понимание взаимодействия иммунной системы и рака. Иммуноредактирование относится к процессу, при котором иммунная система может изменять прогрессирование опухоли. Оно регулирует как количество, так и качество опухоли. Процесс иммуноредактирования опухоли имеет три различные фазы: элиминации, равновесия и избегания. Фаза избегания может встречаться на уровне опухоли или на уровне микросреды опухоли. На уровне микросреды, рекрутинг регуляторных Т-клеток (Treg) и супрессорных клеток миелоидного происхождения (MDSC) или экспрессия белка запрограммированной гибели клетки - 1 (PD-1)/лиганда белка запрограммированной гибели клетки 1 (PD-L1) в иммунных инфильтратах могут приводить к иммуносупрессивной микросреде опухоли.
Все из макрофагов, ассоциированных с опухолью (TAM), фибробластов, ассоциированных с опухолью, Treg и растворимых факторов, продуцируемых супрессорными клетками, способствуют иммуносупрессии, вызванной раком. TAM могут управлять множественными проопухолевыми процессами, включая иммуносупрессию, ангиогенез и секрецию непосредственных факторов роста опухоли.
Таким образом, иммунная система играет важную роль в контроле и уничтожении рака. Тем не менее, на фоне злокачественности могут существовать множественные механизмы иммуносупрессии, которые препятствуют эффективному противоопухолевому иммунитету.
Терапия на основе антител, направленная против нескольких негативных иммунологических регуляторов (контрольные точки) в настоящее время продемонстрировала значимый успех и вероятно будет главным компонентом лечения пациентов с различными злокачественными опухолями.
Первая из таких молекул, которая, как показано, ингибирует и пролиферацию T-клеток, и продукцию IL-2, представляла собой цитотоксический Т-лимфоцит-ассоциированный белок 4 (CTLA-4). После этого открытия усилия были направлены на блокирование этого ингибиторного пути в попытке активировать "дремлющие" T-клетки, направленные на раковые клетки. Первое антитело, направленное против CTLA-4, ипилимумаб, было быстро введено в клинические испытания и было одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для лечения метастатической меланомы в 2011 году. После успеха ипилимумаба были исследованы другие иммунные контрольные точки как возможные мишени для ингибирования. Одним таким взаимодействием было взаимодействие T-клеточного рецептора белка запрограммированной гибели клеток (PD-1) и его лиганда, обнаруженного на многих опухолевых клетках, лиганда белка запрограммированной гибели клеток 1 (PD-L1).
Однако, эти антитела являются эффективными при ограниченных типах опухолей (главным образом при меланоме, видах рака легкого, видах рака почки) и, даже в чувствительных опухолях, важная доля пациентов остается устойчивой.
Из имеющихся в настоящее время знаний о стратегиях противораковой терапии следует, что в большинстве случаев будут придерживаться двойных подходов, которые ориентированы на то, чтобы (i) устранить иммуносупрессирующие факторы/механизмы, и (ii) усилить активность, направленную на уничтожение опухоли, таким образом, чтобы достичь успешной терапии рака.
Таким образом, в данной области все еще существует необходимость в предложении дополнительных терапевтических стратегий лечения раковых заболеваний. Особенно существует потребность в новых средствах для уменьшения или блокирования иммуносупрессии, которая может происходить у раковых пациентов, таким образом, чтобы определять новые успешные стратегии противоракового лечения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединению, несущему гликомодифицированный Fc-фрагмент, для его применения в качестве ингибитора иммуносупрессии в лечении иммуносупрессии, ассоциированной с раком.
Следует отметить, что настоящее изобретение относится к соединению, несущему гликомодифицированный Fc-фрагмент, для его применения в качестве ингибитора T-клеточной иммуносупрессии в лечении иммуносупрессии, ассоциированной с раком.
Настоящее изобретение охватывает соединение, несущее гликомодифицированный Fc-фрагмент, для его применения в качестве ингибитора CD8+ T-клеточной иммуносупрессии в лечении иммуносупрессии, ассоциированной с раком.
В некоторых воплощениях указанное соединение, несущее гликомодифицированный Fc-фрагмент, представляет собой соединение, несущее гипофукозилированный Fc-фрагмент.
В некоторых воплощениях соединение, несущее гликомодифицированный Fc-фрагмент, содержит две аминокислотные цепи SEQ ID NO: 70.
В некоторых воплощениях указанное соединение, несущее гликомодифицированный Fc-фрагмент, представляет собой гликомодифицированное антитело и в особенности гипофукозилированное антитело.
В некоторых воплощениях указанное гликомодифицированное антитело направлено против опухолеассоциированного антигена.
В некоторых воплощениях указанный опухолеассоциированный антиген выбран из группы, содержащей HER2, HER3, HER4 и AMHRII.
В некоторых воплощениях указанное антитело выбрано из группы, содержащей антитела 3C23K, 9F7F11, H4B121 и HE4B33, раскрытые в данном документе, а так же их варианты.
В некоторых воплощениях указанное лечение рака включает введение указанному индивидууму дополнительного противоракового агента.
В некоторых воплощениях указанное лечение рака включает введение указанному индивидууму ингибитора ингибиторной иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, PD-L2, BTLA, CTLA-4, A2AR, B7-H3 (CD276), B7-H4 (VTCN1), IDO, KIR, LAG3, TIM-3, VISTA, CD137, OX40, OX40L и B7S1.
В некоторых воплощениях указанный ингибитор состоит из антитела, направленного против указанной ингибиторной иммунной контрольной точки, или его антигенсвязывающего фрагмента.
Настоящее изобретение также относится к фармацевтической композиции, содержащей (i) соединение, несущее гликомодифицированный Fc-фрагмент, и (ii) ингибитор ингибиторной иммунной контрольной точки.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1: Гликомодифицированное mAb 3C23K (GM102) уменьшает T-клеточное ингибирование, вызванное макрофагами.
Фиг. 1A: Измерение пролиферации PBT, соместно культивируемых с макрофагами MDM2, нацеленными на опухолевые клетки COV434-AMHRII. MDM2 стимулировали клеточной линией COV434-AMHRII, опсонизированной нерелевантным mAb R565 (изотип Ctrl), антителом FcKO против AMHRII или антителом 3C23K против AMHRII, в течение 4 суток перед сокультивированием в течение еще 4 суток с Т-клетками периферической крови (также обозначенные как "PBT"), предварительно активированными антителом против CD3/CD28. Данные представляют индекс деления (то есть среднее число клеточных делений, которое претерпевает клетка в исходной популяции) предварительно активированных CD8+ T-клеток +/- стандартное отклонение (данные соответствуют трем независимым экспериментам; р-значения * меньше 0,05). Абсцисса, слева направо: (i) н.а. (неактивированные) T-клетки Ctrl, (ii) a. (активированные) T-клетки Ctrl, (iii) изотип Ctrl, (iv) FcKO и (v) 3C23K.
Фиг. 1B: Измерение пролиферации PBT, сокультивируемых с макрофагами MDM2, нацеленными на mAb, обработанными полистироловыми гранулами. MDM2 стимулировали полистироловыми гранулами без покрытия в качестве контроля, или с покрытием либо антителом FcKO против AMHRII, либо антителом 3C23K против AMHRII в течение 24 часов перед сокультивацией в течение еще 4 суток с предварительно активированными PBT, загруженными фиолетовым красителем для выявления клеток (CellTrace Violet). Данные представляют собой индекс деления (то есть среднее число клеточных делений, которое претерпела клетка в исходной популяции) предварительно активированных CD8+ T-клеток +/- стандартное отклонение (данные соответствуют трем независимым экспериментам; р-значения ** меньше 0,01). "н.а" относится к неактивированным и "a." - к активированным T-клеткам. Абсцисса, слева направо: (i) н.а. T-клетки Ctrl, (ii) a. T-клетки Ctrl, (iii) необработанные гранулы, (iv) FcKO и (v) 3C23K.
Фиг 2: Гликомодифицированное антитело 3C23K (GM102) не влияет на пролиферацию человеческих T-лимфоцитов. T-клетки, загруженные CellTrace Violet, активировали микрочастицами, покрытыми CD3/CD28, в присутствии или при отсутствии 10 мкг/мл мАТ (моноклональное антитело) 3C23K против AMHRII. Спустя 3 суток разведение CellTrace Violet оценивали посредством проточной цитометрии и представляли в виде необработанных данных (Фиг. 2A) и в виде % T-клеток, которые поделились 1, 2, 3 или 4 раза (Фиг. 2B). На Фиг. 2B на оси ординат показан процент в каждом пике; снизу вверх: (i) 0 делений, (ii) 1 деление, (iii) 2 деления, (iv) 3 деления и (v) 4 деления.
Фиг. 3: Активация TAM-подобных макрофагов соединением, несущим гликомодифицированный Fc.
На Фиг. 3A проиллюстрировано снижение уровня экспрессии маркеров, ассоциированных с макрофагами фенотипа M2, как например Sepp1 (мРНК - фиг. 3A-1), Stab1 (мРНК - фиг. 3A-2), FOLFR2 (мРНК - фиг. 3A-3) и CD163 (Белок - фиг. 3A-4). В рамках слева показаны макрофаги типа M2, выросшие в лунках без антител. В центральных рамках показаны макрофаги типа M2, культивируемые в лунках с антителом FcKO. В рамках справа проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом R18H2, фукозилированным на низком уровне.
На Фиг. 3B-1 (экспрессия мРНК) и фиг. 3B-2 (экспрессия белка) проиллюстрировано повышение уровня экспрессии CD16. В рамках слева проиллюстрированы макрофаги типа M2, выросшие в лунках без антител. В центральных рамках проиллюстрированы макрофаги типа M2, культивируемые в лунках без антитела FcKO. В рамках справа проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом R18H2, фукозилированным на низком уровне.
На фиг. 3C-1 (экспрессия мРНК), фиг. 3C-2 (экспрессия мРНК) и фиг. 3C-3 (экспрессия белка) проиллюстрировано повышение уровня экспрессии CD64. В рамках слева проиллюстрированы макрофаги типа M2, выросшие в лунках без антител. В центральных рамках проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом FcKO. В рамках справа проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом R18H2, фукозилированным на низком уровне.
На Фиг. 3D проиллюстрировано повышение уровня провоспалительных факторов, обычно экспрессируемых макрофагами типа M1, как например, TNFα (фактор некроза опухоли альфа) (Фиг. 3D-1), IL1β (Фиг. 3D-2). В рамках слева проиллюстрированы макрофаги типа M2, выросшие в лунках без антител. В центральных рамках проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом FcKO. В рамках справа проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом R18H2, фукозилированным на низком уровне.
На Фиг. 3E проиллюстрировано снижение уровней мРНК гена и кодирующего иммуносупрессирующего фактора TGFα. В рамке слева проиллюстрированы макрофаги типа M2, выросшие в лунках без антител. В центральной рамке проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом FcKO. В рамке справа проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом R18H2, фукозилированным на низком уровне.
На Фиг. 3F проиллюстрировано снижение уровней мРНК гена и кодирующего иммуносупрессирующего фактора IDO1. В рамке слева проиллюстрированы макрофаги типа M2, выросшие в лунках без антител. В центральной рамке проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом FcKO. В рамке справа проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом R18H2, фукозилированным на низком уровне.
На Фиг. 3G-1 (экспрессия мРНК) и фиг. 3G-2 (экспрессия белка) проиллюстрировано снижение уровня иммуносупрессирующего фактора IL10. В рамках слева проиллюстрированы макрофаги типа M2, выросшие в лунках без антител. В центральных рамках проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом FcKO. В рамках справа проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом R18H2, фукозилированным на низком уровне.
На Фиг. 3H (экспрессия мРНК) проиллюстрировано снижение уровня проангиогенного фактора PDGFα. В рамке слева проиллюстрированы макрофаги типа M2, выросшие в лунках без антител. В центральной рамке проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом FcKO. В рамке справа проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом R18H2, фукозилированным на низком уровне.
На Фиг. 3I (экспрессия мРНК) проиллюстрировано снижение уровня проангиогенных факторов VEGFβ (фактор роста эндотелия сосудов). В рамке слева проиллюстрированы макрофаги типа M2, выросшие в лунках без антител. В центральной рамке показаны макрофаги типа M2, культивируемые в лунках с антителом FcKO. В рамке справа проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом R18H2, фукозилированным на низком уровне.
На Фиг. 3J (экспрессия мРНК) проиллюстрировано снижение уровня проангиогенных факторов HGF. В рамке слева проиллюстрированы макрофаги типа M2, выросшие в лунках без антител. В центральной рамке проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом FcKO. В рамке справа проиллюстрированы макрофаги типа M2, культивируемые в лунках с антителом R18H2, фукозилированным на низком уровне.
На Фиг. 3K проиллюстрирована экспрессия PDL2 на поверхности макрофагов M2. В белой рамке проиллюстрированы макрофаги типа M2, культивируемые в лунках без антитела FcKO. В черной рамке проиллюстрированы макрофаги M2, культивируемые в лунках с антителом R18H2, фукозилированным на низком уровне.
Фиг. 4: Гликомодифицированное антитело 3C23K (GM102) блокирует иммуносупрессию, что приводит к активации иммунной системы.
Фиг. 4A: ADCC (антителозависимая клеточная цитотоксичность), образованная TAM-подобными макрофагами на клетках SKOV3-AMHRII, инкубируемых в течение 4 ч и при 37°C с антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевается 3C23K YB2/0). Представлены данные от 3 доноров макрофагов, анализируемых в трехкратной повторности.
Фиг. 4B: Цитолиз раковых клеток SKOV3-AMHRII под действием TAM-подобных макрофагов, инкубируемых 4 суток с антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевается 3C23K YB2/0). Представлены данные от 3 доноров макрофагов, анализируемых в трехкратной повторности.
Фиг. 4C: Процент CD8 (CD8+CD25+) макрофагов памяти после четырех суток совместной инкубации TAM-подобных макрофагов с раковыми клетками SKOV3-AMHRII и антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевается 3C23K YB2/0). Представлены данные от 3 доноров макрофагов, анализируемых в трехкратной повторности.
Фиг. 4D: Процент Th1 (CD4+CD183+) макрофагов, спустя четверо суток совместной инкубации TAM-подобных макрофагов с раковыми клетками SKOV3-AMHRII и антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевается 3C23K YB2/0). Представлены данные от трех доноров макрофагов, анализируемых в трехкратной повторности.
Фиг. 4E: Процент Th2 (CD4+CD183-) макрофагов после четырех суток совместной инкубации TAM-подобных макрофагов с раковыми клетками SKOV3-AMHRII и антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевается 3C23K YB2/0). Представлены данные по 3 донорам макрофагов, анализируемых в трехкратной повторности.
Фиг. 4F: Выявление CXCL9 в культуральной среде после четырех суток совместной инкубации TAM-подобных макрофагов с раковыми клетками SKOV3-AMHRII и антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевается 3C23K YB2/0). Представлены данные по 3 донорам макрофагов, анализируемых в трехкратной повторности.
Фиг. 4G: Выявление CXCL10 в культуральной среде после четырех суток совместной инкубации TAM-подобных макрофагов с раковыми клетками SKOV3-AMHRII и антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевается 3C23K YB2/0). Представлены данные по 3 донорам макрофагов, анализируемых в трехкратной повторности.
Фиг. 4H: Выявление CCL2 в культуральной среде после четырех суток совместной инкубации TAM-подобных макрофагов с раковыми клетками SKOV3-AMHRII и антителами против AMHRII. Ввиду разной исходной линии для каждого донора данные (в трех повторностях) по 3 донорам устанавливают индивидуально. Для каждого донора слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевается 3C23K YB2/0).
Фиг. 4I: Выявление IL1β в культуральной среде после четырех суток совместной инкубации TAM-подобных макрофагов с раковыми клетками SKOV3-AMHRII и антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевается 3C23K YB2/0). Представлены данные по 3 донорам макрофагов, анализируемых в трех повторностях.
Фиг. 4J: Выявление IL6 в культуральной среде после четырех суток совместной инкубации TAM-подобных макрофагов с раковыми клетками SKOV3-AMHRII и антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20. Представлены данные по 3 донорам макрофагов, анализируемых в трех повторностях.
Фиг. 4K: Выявление CCL5 в культуральной среде после четырех суток совместной инкубации TAM-подобных макрофагов с раковыми клетками SKOV3-AMHRII и антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевает 3C23K YB2/0). Представлены данные по 3 донорам макрофагов, анализируемых в трех повторностях.
Фиг. 4L: Выявление IL12 в культуральной среде после четырех суток совместной инкубации недифференцированных макрофагов с раковыми клетками SKOV3-AMHRII и антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевается 3C23K YB2/0). Представлены данные по 3 донорам макрофагов, анализируемых в трех повторностях.
Фиг. 4M: Выявление IL6 в культуральной среде после четырех суток совместной инкубации недифференцированных макрофагов с раковыми клетками SKOV3-AMHRII и антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевается 3C23K YB2/0). Представлены данные по 3 донорам макрофагов, анализируемых в трех повторностях.
Фиг. 4N: Выявление IL1β в культуральной среде после четырех суток совместной инкубации недифференцированных макрофагов с раковыми клетками SKOV3-AMHRII и антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевается 3C23K YB2/0). Представлены данные по 3 донорам макрофагов, анализируемых в трех повторностях.
Фиг. 4O: Выявление IL23 в культуральной среде после четырех суток совместной инкубации недифференцированных макрофагов с раковыми клетками SKOV3-AMHRII и антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевается 3C23K YB2/0). Представлены данные по 3 донорам макрофагов, анализируемых в трех повторностях.
Фиг. 4P: Выявление CXCL9 в культуральной среде после четырех суток совместной инкубации недифференцированных макрофагов с раковыми клетками SKOV3-AMHRII и антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевается 3C23K YB2/0). Представлены данные по 3 донорам макрофагов, анализируемых в трех повторностях.
Фиг. 4R: Выявление CXCL10 в культуральной среде после четырех суток совместной инкубации недифференцированных макрофагов с раковыми клетками SKOV3-AMHRII и антителами против AMHRII. Слева направо: 3C23K-FcKO, 3C23K CHO и 3C23K YB20 (подразумевается 3C23K YB2/0). Представлены данные по 3 донорам макрофагов, анализируемых в трех повторностях.
Фиг. 5: Активация макрофагов, находящихся в опухолевой ткани раковых пациентов, которым вводят гликомодифицированное антитело.
Фиг. 5A (cd16) и 5B (гранзим): Результаты иммунофлуоресцентного анализа клеточных маркеров, проводимого в опухолевой ткани ракового пациента, которому вводят антитело 3C23K.
Фиг. 5A: Процент CD16 позитивной опухолевой ткани у пациента 04-01 и пациента 01-01 до (исходное значение) и на лечении. В черной рамке проиллюстрирован пациент 04-01 и в серой рамке проиллюстрирован пациент 01-01.
Фиг. 5B: Процент клеток у пациента 01-01 до (исходное значение) и на лечении. В черной рамке проиллюстрирован процент клеток CD8+ GZB+/мм2; в серой рамке проиллюстрирован процент клеток CD16+ GZB+/мм2; и в белой рамке представлен процент NKp46+GZB+/мм2.
Фиг. 6: Активация NK-клеток (Natural killer cells - Естественные киллеры), моноцитов и ICOS+ T-клеток у раковых пациентов, которым вводят гликомодифицированное антитело.
Фиг. 6A: Количественная оценка посредством проточной цитометрии (средняя интенсивность потока) CD4+ ICOS+ клеток в образцах крови пациентов, проходящих лечение GM102 (3C23K). Образцы отбирали в цикле 1 до (C1J0) и во время (C1J0+4H) инъекции GM102 (3C23K), затем перед циклом 2 и 3 (C2J1 и C3J1, соответственно).
Фиг. 6B: Количественная оценка посредством проточной цитометрии (средняя интенсивность потока) CD8+ ICOS+ клеток в образцах крови пациентов, проходящих лечение GM102 3C23K в Gustave Roussy. Образцы отбирали в цикле 1 до (C1J0) и во время (C1J0+4H) инъекции GM102 (3C23K), затем перед циклом 2 и 3 (C2J1 и C3J1 соответственно).
Фиг. 7: Процент классических, промежуточных и неклассических субпопуляций моноцитов в пределах CD14+ клеток у пациентов после и на лечении.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Используя in vitro модель раковой ткани, содержащей раковые клетки и клетки иммунной системы, такие как T-клетки и макрофаги, авторы настоящего изобретения обнаружили, что ингибирование активации T-клеток может быть неожиданно вызвано макрофагами, ассоциированными с опухолью M2 (TAM).
Также авторы изобретения показали, что такое ингибирование активации T-клеток, вызванное TAM, может быть уменьшено или блокировано добавлением к данной in vitro модели раковой ткани гликомодифицированных антител. Гликомодифицированные антитела и в особенности гипофукозилированные антитела, как известно в данной области, связываются с высокой аффинностью с Fc-рецепторами и, в частности, Fc-рецепторами, находящимися на мембране макрофагов, в особенности FcγRIIIa (также называемым в данной области "CD16a").
Не желая быть связанными какой-либо конкретной теорией, авторы изобретения полагают, что связывание гликомодифицированных антител с Fc-рецепторами, находящимися на мембране макрофагов, вызывает высвобождение растворимых факторов, например, высвобождение цитокинов, оказывающее действие, блокирующее ингибирование, на T-клетки, находящиеся в пределах среды опухолевой ткани, или в качестве альтернативы активацию T-клеток, находящихся в пределах среды опухолевой ткани. Таким образом, авторы изобретения полагают, что гликомодифицированные антитела, в результате блокирования ингибирования T-клеток или активации T-клеток, способны уменьшать или блокировать ингибирование иммунного ответа против раковых клеток, которое происходит у некоторых индивидуумов страдающего от рака.
Авторы изобретения дополнительно показали в данном документе, что опухолевые клетки как таковые являются несущественными в эффекте активации иммунной системы, которая достигается в присутствии гликомодифицированных антител.
Кроме того, авторы изобретения показали, что указанные гликомодифицированные антитела, которые, как показано, связываются с высокой аффинностью с Fc-гамма рецепторами TAM-подобных макрофагов, вызывают превращение TAM-подобных макрофагов иммуносупрессивного фенотипа M2 в не иммуносупрессивный фенотип M1 с сопутствующим снижением уровня иммуносупрессивных цитокинов, таких как IL-10. Авторы изобретения также показали, что в присутствии гликомодифицированного антитела, как описано в данном документе, указанные TAM-подобные макрофаги имеют более высокий уровень экспрессии провоспалительных цитокинов, таких как IL-1 бета, без значимого изменения в экспрессии проопухолевых генов, таких как VEGF альфа, VEGF бета, PDGF бета (фактор роста тромбоцитов бета) и фактор роста гепатоцитов.
Также в данном документе показано, что введение гликомодифицированного антитела, как описано в данном документе, вызывает повышение уровня CD8+ T-клеток ракового пациента. Не желая быть связанными какой-либо конкретной теорией, авторы изобретения полагают, что гликомодифицированное антитело, поскольку оно вызывает высвобождение макрофагами цитокинов, активирующих T-клетки, позволяет устранять ингибирование T-клеток, встречающееся у раковых пациентов, испытывающих состояние иммуносупрессии, что, таким образом, приводит к активации CD8+ T-клеток.
Кроме того, в данном документе показано, что гликомодифицированное антитело, как описано в данном документе, вызывает повышение уровня CD4+ T-клеток фенотипа Th1 и снижение уровня CD4+ T-клеток фенотипа Th2. Ожидается, что такое изменение в соотношении между T-клетками Th1 и Th2, способствует усилению иммунного ответа на опухолевые клетки.
Авторы изобретения также показали, что гликомодифицированное антитело, как описано в данном документе, модулирует экспрессию цитокинов, таких как IL1 бета, IL6, IL10, IL12 и IL23.
В данном документе также показано, что гликомодифицированное антитело, как описано в данном документе, вызывает снижение продукции наивными макрофагами иммуносупрессивных цитокинов, таких как IL-10.
Кроме того, авторы изобретения показали, что введение гликомодифицированного антитела, как описано в данном документе, раковому пациенту вызывает увеличение числа CD16+ (Fc гамма RIII+) клеток в опухолевой ткани. Таким образом, введение гликомодифицированного антитела, как описано в данном документе, раковому пациенту приводит к повышению уровня противораковых активированных макрофагов в пределах опухолевой ткани. Кроме того, было показано, что введение гликомодифицированного антитела, как описано в данном документе, раковому пациенту повышает уровень активированных макрофагов, продуцирующих гранзим B в опухолевой ткани, чье ингибирование состояния иммуносупрессии будет способствовать цитолизу опухолевых клеток. Кроме того, введение гликомодифицированного антитела, как описано в данном документе, раковому пациенту также увеличивает число NK-клеток в опухолевой ткани, чье ингибирование иммуносупрессии будет равным образом способствовать уничтожению опухолевых клеток.
Авторы настоящего изобретения также показали, что введение гликомодифицированного антитела, как описано в данном документе, раковому пациенту (i) повышает уровень экспрессии CD16 (Fc гамма RIII) NK-клетками, (ii) повышает уровень экспрессии CD69 на моноцитах и (iii) повышает уровень экспрессии ICOS (индуцируемый T-клеточный костимулятор) на T-клетках, которые являются другими параметрами, которые осуществляют ингибирование состояния иммуносупрессии, испытываемого раковыми пациентами.
В целом, данные авторов изобретения демонстрируют, что гликомодифицированные антитела способны уменьшать или блокировать супрессию противораковой активности T-клеток, индуцируемую макрофагами.
Результаты авторов изобретения позволили им представить терапевтические средства на основе введения гликомодифицированных антител, причем указанные терапевтические средства нацелены на уменьшение или блокирование состояния иммуносупрессии, которое может встречаться у индивидуумов страдающего от рака.
Не желая быть связанными какой-либо конкретной теорией, авторы изобретения полагают, что иммуностимулирующий эффект, который вызван гликомодифицированными антителами, обусловлен высокой аффинностью указанных гликомодифицированных атител в отношении Fc-рецепторов, находящихся на клеточной мембране и, в особенности, в отношении Fc-рецепторов, находящихся на мембране макрофагов, независимо от того, обладает ли указанное антитело релевантной антигенсвязывающей областью или нет.
Как показано в примерах данного документа, уменьшение или блокирование состояния иммуносупрессии достигается даже в модели, в которой отсутствуют клетки, экспрессирующие опухолевый антиген, что может означать, что связывания указанных гликомодифицированных антител с опухолевым антигеном и уменьшения опухолевой нагрузки, вызываемого собственно фагоцитозом, может не требоваться для того, чтобы вызвать эффект активации иммунной системы, и в особенности может не требоваться для уменьшения или блокирования ингибирования T-клеток, вызываемого макрофагами. Иными словами, авторы настоящего изобретения полагают, что блокирование ингибирования T-клеток под действием указанных гликомодифицированных антител относится к поведению данных антител в качестве соединений, несущих гликомодифицированный Fc-фрагмент.
Настоящее изобретение относится к соединению, несущему гликомодифицированный Fc-фрагмент, для его применения в качестве ингибитора иммуносупрессии в лечении индивидуума от рака.
Настоящее изобретение относится к соединению, несущему гликомодифицированный Fc-фрагмент, для его применения для предупреждения или лечения состояния иммуносупрессии у индивидуума страдающего от рака.
Настоящее изобретение относится к применению соединения, несущего гликомодифицированный Fc-фрагмент, в качестве ингибитора иммуносупрессии для получения лекарственного средства для лечения рака.
Настоящее изобретение относится к применению соединения, несущего гликомодифицированный Fc-фрагмент, для получения лекарственного средства для предупреждения или лечения состояния иммуносупрессии у индивидуума страдающего от рака.
Настоящее изобретение относится к способу лечения рака, включающему стадию введения индивидууму, нуждающемуся в этом, соединения, несущего гликомодифицированный Fc-фрагмент, в качестве ингибитора иммуносупрессии.
Настоящее изобретение относится к способу предупреждения или лечения состояния иммуносупрессии у индивидуума страдающего от рака, включающему стадию введения индивидууму, нуждающемуся в этом, соединения, несущего гликомодифицированный Fc-фрагмент.
Настоящее изобретение относится к соединению, несущему гликомодифицированный Fc-фрагмент, для его применения для уменьшения или блокирования состояния иммуносупрессии, вызванного ингибированием T-клеток, индуцируемым макрофагами, встречающимся у индивидуума страдающего от рака.
Настоящее изобретение относится к применению соединения, несущего гликомодифицированный Fc-фрагмент, для получения лекарственного средства для уменьшения или блокирования состояния иммуносупрессии, вызванного ингибированием T-клеток, индуцируемым макрофагами, встречающимся у индивидуума страдающего от рака.
Настоящее изобретение также относится к способу уменьшения или блокирования состояния иммуносупрессии, вызываемого ингибированием T-клеток, индуцируемым макрофагами, встречающимся у индивидуума страдающего от рака, включающему стадию введения индивидууму, нуждающемуся в этом, соединения, несущего гликомодифицированный Fc-фрагмент.
Из предыдущих воплощений следует, что раковые индивидуумы, к которым относится настоящее изобретение, представляют собой индивидуумы, которые также находятся под воздействием иммуносупрессии.
В некоторых воплощениях раковые индивидуумы, к которым относится настоящее изобретение, представляют собой индивидуумы, которые также находятся под воздействием иммуносупрессии, которая вызвана противораковым лечением.
Определения
Согласно изобретению под выражением "включающий", как например, в выражении "включающий стадии", также понимают "состоящий из", как например, в выражении "состоящий из стадий".
В том виде, в котором они используются в данном документе, термины "иммуносупрессия, ассоциированная с раком", "иммуносупрессия, связанная с раком", "состояние иммуносупрессии", когда они относятся к индивидууму, страдающему от рака, означают физиологическое состояние, охватывающее ситуации, в которых CD8+ T-клетки обладают своей способностью к активации, которая уменьшена или блокирована, то есть обладают своей способностью активироваться, которая частично или полностью ингибирована.
Для иллюстрации индивидуум страдающего от рака, который переносит состояние иммуносупрессии, согласно настоящему изобретению может определяться аналитическим способом in vitro, включающим стадию измерения способности к пролиферации CD8+ T-клеток периферической крови, содержащихся в образце, ранее отобранном у указанного индивидуума, T-клетки периферической крови которого подвергались стадии предварительной активации перед измерением их способности к пролиферации.
Таким образом, в некоторых воплощениях состояние иммуносупрессии может быть выявлено у анализируемого индивидуума, когда способность CD8+ T-клеток к пролиферации у указанного анализируемого индивидуума ниже, чем референсное значение способности CD8+ T-клеток к пролиферации, что указывает на отсутствие состояния иммуносупрессии. В некоторых воплощениях указанное референсное значение способности CD8+ T-клеток к пролиферации может представлять собой среднее значение способности к пролиферации CD8+ T-клеток, которое обнаруживается у здоровых индивидуумов, которые не иммуносупрессированы. В некоторых других воплощениях указанное референсное значение может представлять собой пороговое значение, позволяющее провести различие между (i) значениями способности CD8+ T-клеток к пролиферации, которые ниже (или, в качестве альтернативы, выше, в зависимости от используемых единиц измерения), чем пороговое значение, что указывает на состояние иммуносупрессии, и (ii) значениями способности CD8+ T-клеток к пролиферации, которые выше (или, в качестве альтернативы, ниже, в зависимости от используемых единиц измерения), чем пороговое значение, что свидетельствует об отсутствии состояния иммуносупрессии.
В некоторых воплощениях значение способности CD8+ T-клеток к пролиферации представляет собой значение индекса деления CD8+ T-клеток, как проиллюстрировано в примерах данного документа.
В том виде, в котором они используются в данном документе, термины "лечить", "лечащий", "лечение" и тому подобное относятся к уменьшению или облегчению расстройства и/или связанных с ним симптомов. Следует понимать, что, хотя и не исключено, лечение расстройства или состояния не требует того, чтобы расстройство, состояние или связанные с ними симптомы были полностью устранены.
В том виде, в котором они используются в данном документе, термины "предупредить", "предупреждающий", "предупреждение", "профилактическое лечение" и т. п. относятся к уменьшению вероятности развития расстройства или состояния у субъекта, который не имеет, но подвержен риску или склонен к развитию расстройства или состояния.
В том виде, в котором он используются в данном документе, термин "соединение, несущее гликомодифицированный Fc-фрагмент", охватывает любое соединение, содержащее Fc-фрагмент антитела, который обладает измененным гликозилированием, делающим возможным связывание указанного Fc-фрагмента с высокой аффинностью с Fc-рецепторами и в особенности с Fc-рецепторами, находящимися на мембране макрофагов, в том числе с Fc-рецепторами, находящимися на мембране макрофагов, ассоциированных с опухолью.
В некоторых воплощениях Fc-содержащий белок содержит один или более чем один полипептид.
Используемый здесь термин "белок, несущий Fc-фрагмент" относится к белку, содержащему Fc-фрагмент, слитый с по меньшей мере одной другой гетерологичной белковой единицей или полипептидом.
Соединения, несущие гликомодифицированный Fc-фрагмент, охватывают (i) собственно гликомодифицированные Fc-фрагменты, (ii) гибридные соединения, содержащие гликомодифицированный Fc-фрагмент, который ковалентно связан с небелковой группой, и (iii) белковые соединения, содержащие гликомодифицированный Fc-фрагмент, который связан с белковой группой.
Белковые соединения, несущие гликомодифицированный Fc-фрагмент, охватывают белки, в которых указанный гликомодифицированный Fc-фрагмент ковалентно связан с антигенсвязывающим доменом антитела, как например, ковалентно связан с вариабельными областями антитела.
Белковые соединения, несущие гликомодифицированный Fc-фрагмент, охватывают белки, в которых указанный гликомодифицированный Fc-фрагмент ковалентно связан, непосредственно или опосредованно, с одним или более чем одним другим Fc-фрагментом, как например, ковалентно связан с одним или более чем одним другим гликомодифицированным Fc-фрагментом. Иллюстративные примеры такого соединения, несущего гликомодифицированный Fc-фрагмент, охватывают соединения, известные в данной области, как "Fc-мультимеры", такие как описанные, например, Thiruppathi et al. (2014, J Autoimmun, Vol. 52 : 64-73), Jain et al. (2012, Arthritis Research and Therapy, Vol. 14: R192), или Zhou et al. (2017, Blood advances, Vol. 1 (n°6): DOI 10.1182/biooadvances.2016001917).
В некоторых предпочтительных воплощениях соединения, несущие гликомодифицированный Fc-фрагмент, согласно изобретению охватывают гликомодифицированные антитела.
В некоторых предпочтительных воплощениях гликомодифицированные антитела охватывают антитела, направленные на антиген, ассоциированный с опухолью.
В том виде, в котором он используется в данном документе, термин "антитело" относится к таким сборкам (например, молекулы интактного антитела, фрагменты антитела или их варианты), которые обладают значимой известной специфичной иммунореактивной активностью в отношении исследуемого антигена и, в особенности, иммунореактивной активностью в отношении исследуемого антигена, ассоциированного с опухолью. Антитела и иммуноглобулины содержат легкую и тяжелую цепи с межцепочечной ковалентной связью между ними или без нее.
Легкие цепи иммуноглобулинов подразделяются или на тип каппа, или на тип лямбда (κ, λ). Каждый тип тяжелой цепи может быть связан либо с легкой цепью типа каппа, либо с легкой цепью типа лямбда. В общем, легкая и тяжелая цепи ковалентно связаны друг с другом, и "хвостовые" части двух тяжелых цепей связаны друг с другом посредством ковалентных дисульфидных связей или нековалентных связей, когда иммуноглобулины получают посредством гибридом, B-клеток или генетически модифицированных клеток-хозяев.
Как легкая, так и тяжелая цепи подразделяются на области структурной и функциональной гомологии. Термин "область" относится к части или фрагменту цепи иммуноглобулина или антитела и включает константную область или вариабельные области, а также более дискретные части или фрагменты указанных областей. Например, вариабельные области легкой цепи включают "области, определяющие комплементарность" или "CDR", распределенные среди "каркасных областей" или "FR", как определено в данном документе.
Области тяжелой или легкой цепей иммуноглобулина могут быть определены как "константная" (C) или "вариабельная" (V) в зависимости от относительного недостатка варьирования последовательности в пределах областей разных членов класса в случае "константной области" или значимого варьирования в пределах областей разных членов класса в случае "вариабельных областей".
Условно считается, что нумерация доменов вариабельных, константных областей возрастает, когда они отдаляются от антигенсвязывающего сайта или N-конца иммуноглобулина или антитела. N-конец каждой тяжелой и легкой цепи иммуноглобулина представляет собой вариабельную область и на C-конце находится константная область; домены CH3 и CL содержат карбокси-конец тяжелой и легкой цепи, соответственно. Соответственно, домены легкой цепи иммуноглобулина расположены в ориентации VL-CL, в то время как домены тяжелой цепи расположены в ориентации VH-CH1-шарнир-CH2-CH3.
Положения аминокислот в константной области тяжелой цепи, включая положения аминокислот в доменах CH1, шарнира, CH2, CH3 и CL, могут быть пронумерованы в соответствии с системой нумерации Kabat (см. Kabat et al., в "Sequences of Proteins of Immunological Interest", U.S. Dept. Health and Human Services, 5th edition, 1991). В качестве альтернативы положения аминокислот антитела могут быть пронумерованы в соответствии с системой нумерации EU (см. Kabat et al., там же).
В том виде, в котором он используется в данном документе, термин "Fc-область" определен как фрагмент константной области тяжелой цепи, начинающийся в шарнирной области, непосредственно выше сайта расщепления папаином (то есть остаток 216 в IgG, принимая за первый остаток константной области тяжелой цепи 114), и заканчивающийся на C-конце антитела. Соответственно, полная Fc-область содержит по меньшей мере шарнирный домен, домен CH2 и домен CH3.
Используемый здесь термин "Fc-фрагмент" относится к молекуле, содержащей последовательность неантигенсвязывающего фрагмента, полученной в результате расщепления антитела или полученной другими средствами, либо в мономерной, либо мультимерной форме, и может содержать шарнирную область. Исходный иммуноглобулиновый источник Fc-фрагмента может быть человеческого происхождения и может представлять собой любой из иммуноглобулинов, такой как IgG1 или IgG2. Fc-фрагменты состоят из мономерных полипептидов, которые могут быть связаны в димерные или мультимерные формы посредством ковалентной (то есть, посредством дисульфидных связей) и нековалентной ассоциации. Число межмолекулярных дисульфидных связей между мономерными субъединицами Fc-фрагментов находится в интервале от 1 до 4, в зависимости от класса (например, IgG, IgA, и IgE) или подкласса (например, IgG1, IgG2, IgG3, IgA1 и IgGA2). Одним из примеров Fc-фрагмента является димер с дисульфидной связью, полученный в результате расщепления IgG папаином. Используемый здесь термин "Fc-фрагмент" является общим для мономерных, димерных и мультимерных форм.
Используемый здесь термин "белок, несущий Fc-фрагмент" или "белок, содержащий Fc-фрагмент" относится к белку, который содержит Fc-домен или его фрагмент, связывающийся с Fc-рецептором, содержащий N-гликан. В некоторых воплощениях N-гликан представляет собой N-связанные двухантенные гликаны, присутствующие в домене CH2 константной (Fc) области иммуноглобулина (например, в положении 297 по EU). "N-гликаны" присоединены к амидному атому азота остатка аспарагина или аргинина в белке через N-ацетилглюкозаминовый остаток. Данные "N-связанные сайты гликозилирования" встречаются в первичной структуре пептида, содержащей, например, аминокислотную последовательность аспарагин-X-серин/треонин, где X представляет собой любой аминокислотный остаток, за исключением пролина и аспарагиновой кислоты. Такие N-Гликаны полностью описаны, например, в Drickamer K, Taylor ME (2006). Introduction to Glycobiology, 2nd ed., которая включена в данный документ посредством ссылки во всей полноте.
В одном из воплощений "N-гликан" относится к Asn-297 N-связанным двухантенным гликанам, находящимся в домене CH2 константной (Fc) области иммуноглобулина. Данные олигосахариды могут содержать концевую маннозу, N-ацетил-глюкозамин, галактозу или сиаловую кислоту.
Используемый здесь термин "гликомодифицирование" относится к любому принятому в данной области способу изменения профиля гликоформ композиции связывающего белка. Такие способы включают экспрессию композиции связывающего белка в генетически модифицированной клетке-хозяине (например, клетке CHO), которая была генетически модифицирована для того, чтобы экспрессировать гетерологичную гликозилтрансферазу или гликозидазу. В других воплощениях способы гликомодифицирования включают культивирование клетки-хозяина в условиях, которые подобраны для конкретных профилей гликоформ.
Используемый здесь термин "гликомодифицированный Fc-фрагмент" охватывает (i) гипергалактозилированный Fc-фрагмент, (ii) гипоманнозилированный Fc-фрагмент, который охватывает аманнозилированный Fc-фрагмент, и (iii) гипофукозилированный Fc-фрагмент, который охватывает афуколизированный Fc-фрагмент. В том виде, в котором он используется в данном документе, гликомодифицированный фрагмент охватывает Fc-фрагмент, имеющий измененное гликозилирование, которое выбрано из группы, содержащей одно или более чем одно из следующих измененных гликозилирований: (i) гипергалактозилирование, (ii) гипоманнозилирование и (iii) гипофукозилирование. Следовательно, гликомодифицированный Fc-фрагмент, в том виде, в котором он используется согласно изобретению, охватывает иллюстративные примеры гипергалактозилированного, гипоманнозилированного и гипофукозилированного Fc-фрагмента.
Специалист в данной области может ссылаться на хорошо известные методики получения гипергалактозилированных Fc-фрагментов, гипоманнозилированных фрагментов и гипофукозилированных Fc-фрагментов, которые, как известно, связываются с Fc-рецепторами с более высокой аффиностью, чем немодифицированные Fc-фрагменты.
Используемый здесь термин "гипергалактозилированная популяция" относится к популяции связывающих белков, содержащих Fc-домен, в которых содержание галактозы N-гликана повышено по сравнению с референсной популяцией связывающих белков, содержащих Fc-домен, имеющих такую же аминокислотную последовательность. Гипергалактозилированная популяция может быть выражена, как имеющая повышенное число Gl и G2 гликоформ, по сравнению с референсной популяцией связывающих белков, содержащих Fc-домен.
Используемый здесь термин "гипоманнозилированная популяция" относится к популяции связывающих белков, содержащих Fc-домен, в которой содержание маннозы N-гликана снижено, по сравнению с референсной популяцией связывающих белков, содержащих Fc-домен, имеющих такую же аминокислотную последовательность. Гипоманнозилированная популяция может быть выражена, как имеющая уменьшенное число олигоманнозных гликоформ (например, M3-M9 гликоформы), по сравнению с референсной популяцией связывающих белков, содержащих Fc-домен. В некоторых воплощениях содержание маннозы определяют измерением содержания одной или более чем одной олигоманнозной гликоформы, выбранной из группы, состоящей из Man3, Man4, Man5, Man6, Man7, Man8 и Man9. В других воплощениях содержание олигоманнозы определяют измерением по меньшей мере Man5, Man6 и Man7. В некоторых воплощениях содержание олигоманнозы определяют измерением всех гликоформ M3-M9.
Используемые здесь термины "G0 гликоформа", "Gl гликоформа" и "G2 гликоформа" относятся к гликоформам N-гликана, которые имеют ноль, один или два концевых галактозных остатка, соответственно. Эти термины включают гликоформы G0, Gl и G2, которые фукозилированы или содержат остаток бисектного N-ацетилглюкозамина. В некоторых воплощениях гликоформы Gl и G2 дополнительно содержат остатки сиаловой кислоты, связанные с одним или обоими концевыми галактозными остатками с образованием гликоформ G1S1, G2S1 и G2S2. Используемые здесь термины "гликоформа G1S1", "гликоформа G2S1" и " гликоформа G2S2" относятся к гликоформам N-гликана, которые имеют остаток сиаловой кислоты, связанный с единственным концевым галактозным остатком в гликоформе G1, одним из концевых галактозных остатков в гликоформе G2 или обоими концевыми галактозными остатками в гликоформе G2, соответственно. Данные термины включают гликоформы G1S1, G2S1 и G2S2, которые фукозилированы или содержат остаток бисектного N-ацетилглюкозамина. В некоторых воплощениях остатки сиаловой кислоты гликоформ G1S1, G2S1 и G2S2 связаны связями альфа-2,6-сиаловая кислота с концевым галактозным остатком каждой гликоформы для усиления противовоспалительной активности связывающей молекулы (см., например, Anthony et al., PNAS 105: 19571-19578, 2008).
Определение "гипофукозилированный" или "афукозилированный", приведенное ниже, в том виде, в котором оно применяется к конкретным воплощениям состоящего из антитела соединения, несущего гликомодифицированный Fc, относится к большинству исследуемых соединений, несущих гликомодифицированный Fc.
Препарат "гипофукозилированного" антитела относится к препарату антитела, в котором меньше чем 50% N-связанных олигосахаридных цепей содержат α1,6-фукозу, присоединенную к домену CH2. Обычно меньше чем примерно 40%, меньше чем примерно 30%, меньше чем примерно 20%, меньше чем примерно 10% или меньше чем 5% или меньше чем 1% N-связанных олигосахаридных цепей содержат α1,6-фукозу, присоединенную к домену CH2 в препарате "гипофукозилированного" антитела. В том виде, в котором он используется в данном документе, препарат антитела, в котором меньше чем 50% N-связанных олигосахаридных цепей содержат α1,6-фукозу, присоединенную к домену CH2, охватывает препарат, в котором меньше чем 49%, 48%, 47%, 46%, 45%, 44%, 43%, 42%, 41%, 40%, 39%, 38%, 37%, 36%, 35%, 34%, 33%, 32%, 31%, 30%, 29%, 28%, 27%, 26%, 25%, 24%, 23%, 22%, 21%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или меньше чем 1% N-связанных олигосахаридных цепей содержат α1,6-фукозу, присоединенную к домену CH2.
Таким образом, термины "афукозилированный" и "нефукозилированный" используются взаимозаменяемо в данном документе и относятся к антителу, у которого недостаточно α1,6-фукозы в углеводе, присоединенной к домену CH2 тяжелой цепи IgG. В Umana et al., Nat. Biotechnol 17:176-180, 1999 описан бисектный GlcNac, приводящий к 10-кратной ADCC. В Umana et al., 1999 отмечается, что такие бисектные молекулы приводят к меньшему фукозилированию. В Davies et al., Biotechnol. Bioeng. 74:288-294, 2001 описаны клетки CHO со вставленным ферментом β1-4-N-ацетилглюкозаминилтрансфераза III (GnTIII) (который приводит к получению структуры бесектного GlcNac), что приводит к повышенной ADCC антител против CD20. Для иллюстрации в патенте США № 6602684 описаны клетки, модифицированные для получения бисектных гликопротеинов GlcNac.
Дополнительные примеры способов уменьшения фукозилирования препарата антитела предложены в Shields et al., J Biol Chem 277:26733-26740, 2002, где описаны клетки CHO (Lec13) с недостатком фукозилирования с получением IgG1 и дополнительно описано, что связывание IgG1 с недостатком фукозы с человеческим Fc гамма RIIIA улучшалось вплоть до 50-ти раз и увеличивалась ADCC. Кроме того, в Shinkawa et al., J Biol Chem 278:3466-3473, 2003 сравнивается IgG, полученный в YB2/0 и клетках CHO. Клетки YB2/0 имели уменьшенное фукозилирование и повышенное содержание бисектного GlcNac. В Niwa et al., Clinc. Cancer Res. 1-:6248-6255, 2004 сравниваются антитела против CD20 с антителами, полученными в клетках YB2/0 (низкий уровень фукозилирования) и наблюдалась повышенная ADCC в случае последних. Примеры методик для получения афукозилированных антител предложены, например, в Kanda et al., Glycobiology 17:104-118, 2006. В Пат. США № 6946292 (Kanda) описаны клетки, нокаутированные по фукозилтрансферазе, продуцирующие афукозилированные антитела. В патенте США № 7214775 и заявке PCT № WO 00/61739 описаны препараты антител, в которых 100% антител афукозилированы.
Также еще известны другие методики модификации гликозилирования, такие как методики, описанные в заявках на патент США № US 2007/248600; US 2007/178551 (методы технологии GlycoFi с использованием модифицированных клеток низших эукариот (дрожжи) с получением "человеческих" структур гликозилирования); US 2008/060092 (методы технологии Biolex с использованием модифицированных растений с получением "человеческих" структур гликозилирования) и US 2006/253928 (в котором также описывалось модифицирование растений с получением "человеческих" антител).
Дополнительные методики снижения уровня фукозы включают технологию ProBioGen (von Horsten et al., Glycobiology, (предварительная электронная публикация 23 июля 2010 года); технологию Potelligent™ (Biowa, Inc. Princeton, N.J.); и технологию модификации гликозилирования GlycoMAb™ (GLYCART biotechnology AG, Цюрих, Швейцария).
Содержание N-связанного олигосахарида антитела можно анализировать способами, известными в данной области. Далее приведен пример такого способа: Антитела подвергают расщеплению ферментом - N-гликозидазой F (Roche; TaKaRa). Высвобожденные углеводы анализируют посредством времяпролетной масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией (MALDI-TOF MS) с режимом детекции положительно заряженных ионов (Papac et al., Glycobiol. 8: 445-454, 1998). Состав моносахаридов затем характеризуют посредством модифицированной высокоэффективной анионообменной хроматографии (HPAEC) (Shinkawa et al., J. Biol. Chem. 278: 3466-3473, 2003).
В некоторых воплощениях соединения по изобретению, несущие гликомодифицированный Fc-фрагмент, получают в линии культивируемых клеток-хозяев млекопитающего (например, линяя клеток CHO). В некоторых воплощениях линия клеток-хозяев была гликомодифицирована для получения гипергалактозилированных и/или гипоманнозилированных связывающих белков по изобретению. В некоторых иллюстративных воплощениях связывающие белки по изобретению получают из гликомодифицированной клетки CHO. В одном из иллюстративных воплощений гликомодифицированная клетка CHO содержит гетерологичный ген галактозилтрансферазы (например, галактозилтрансфераза бета 1,4 мыши). В другом иллюстративном воплощении гликомодифицированная клетка CHO содержит нокдаун одной из аллелей гена бета-галактозидазы.
Согласно настоящему раскрытию термин "3C23K" означает гуманизированное моноклональное антитело 3C23K против AMHRII. AMHRII может также называться MSRII.
Согласно настоящему раскрытию термин "GM102" означает гуманизированное антитело против AMHRII, имеющее легкую и тяжелую цепи, имеющие такие же аминокислотные последовательности, как и антитело 3C23K, но которое было гликомодифицировано и, более конкретно, гипофукозилировано. "GM102" может также называться в данном документе "R18H2".
Согласно настоящему раскрытию термин "клетки YB2/0" (EMABling®) или "YB20" означает клеточные линии для изготовления рекомбинантных моноклональных гипофукозилированных антител.
Согласно настоящему раскрытию 3C23K-CHO состоит из антитела 3C23K с нормальным уровнем гликозилирования, которое охватывает антитело 3C23K, которое было получено посредством клеточных линий CHO.
Согласно настоящему раскрытию 3C23K-FcKO состоит из антитела 3C23K, лишенного Fc-фрагмента.
Соединения, несущие гликомодифицированный Fc-фрагмент
Термины "соединение, несущее гликомодифицированный Fc-фрагмент", "молекула, несущая гликомодифицированный Fc-фрагмент", "соединение, содержащее гликомодифицированный Fc-фрагмент" и "молекула, содержащая гликомодифицированный Fc-фрагмент" могут быть использованы взаимозаменяемо в данном документе для обозначения соединения, которое содержит Fc-фрагмент антитела, который обладает измененным гликозилированием, что обеспечивает указанному Fc-фрагменту более высокую аффинность в отношении Fc-рецептора, по сравнению с таким же Fc-фрагментом, обладающим неизмененным гликозилированием.
В некоторых предпочтительных воплощениях соединение, несущее гликомодифицированный Fc-фрагмент, обладает более высокой аффинностью в отношении FcγRIIIa (также называемого "CD16a"), чем Fc-фрагмент, который не был подвергнут гликомодифицированию.
Это проиллюстрировано в примерах соединением, несущим гипофукозилированный Fc-фрагмент, называемым "3C23K", которое обладает высокой аффинностью в отношении человеческого FcγRIIIa (CD16a), со значением константы Kd, как измерено хорошо известным способом Biacore®, меньше чем 50 нМ.
В некоторых предпочтительных воплощениях соединение, несущее гликомодифицированный Fc-фрагмент, состоит собственно из гликомодифицированного Fc-фрагмента, таким образом, соединение не содержит антигенсвязывающей области.
В некоторых предпочтительных воплощениях соединение, несущее гликомодифицированный Fc-фрагмент, состоит из белка, несущего гликомодифицированный Fc-фрагмент, в котором указанный гликомодифицированный Fc-фрагмент ковалентно связан с другой белковой группой, то есть или с (i) белком, содержащим антигенсвязывающую область, или с (ii) белком, который не содержит антигенсвязывающую область.
В некоторых из этих предпочтительных воплощений указанное соединение, несущее гликомодифицированный Fc-фрагмент, содержит только один гликомодифицированный Fc-фрагмент.
Таким образом, настоящее изобретение охватывает применение соединений, несущих гликомодифицированный Fc-фрагмент, содержащих (i) полипептидное мономерное звено, содержащее гликомодифицированный Fc-фрагмент, и (ii) другой полипептид, который ковалентно связан с указанным полипептидным мономерным звеном. Указанный другой полипептид может представлять собой антигенсвязывающую область антитела, такую как VH и VL цепи антитела. Указанный другой полипептид может представлять собой группу в виде лиганд-связывающего белка, как например, рецепторный белок, подобно, например, рецептору VEGF или VEGF-связывающему домену рецептора VEGF, или подобно, например, TNF-альфа-рецептору или TNF-связывающему домену TNF-альфа-рецептора.
В некоторых из этих предпочтительных воплощений указанная другая белковая группа может содержать другой Fc-фрагмент и в особенности другой гликомодифицированный Fc-фрагмент. В некоторых воплощениях указанные два гликомодифицированных Fc-фрагмента имеют идентичные аминокислотные последовательности. В некоторых других воплощениях данные два гликомодифицированных Fc-фрагмента имеют отличающиеся аминокислотные последовательности. В некоторых воплощениях данные два Fc-фрагмента имеют идентичные аминокислотные последовательности, но имеют отличающиеся измененные профили гликозилирования. В некоторых других воплощениях данные два Fc-фрагмента имеют идентичные аминокислотные последовательности и имеют идентичный измененный профиль гликозилирования.
Таким образом, соединения, несущие гликомодифицированный Fc-фрагмент, охватывают белковые соединения, содержащие более чем один Fc-фрагмент, при условии, что по меньшей мере один из Fc-фрагментов, содержащихся в них, гипоманнозилирован, гипергалактозилирован или гипофукозилирован.
Как уже упоминалось в настоящем описании изобретения, соединения, несущие Fc-фрагмент, содержащие больше чем один Fc-фрагмент, такие как содержащие два, три, четыре, пять или шесть Fc-фрагментов, хорошо известны в данной области, и могут быть названы "Fc-мультимеры". Такие конструкции Fc-мультимер в особенности раскрыты Thiruppathi et al. (2014, J Autoimmun, Vol. 52 : 64-73), Jain et al. (2012, Arthritis Research and Therapy, Vol. 14 : R192) или Zhou et al. (2017, Blood advances, Vol. 1 (n°6) : DOI 10.1182/biooadvances.2016001917).
Таким образом, соединения, несущие гликомодифицированный Fc, которые можно использовать согласно изобретению, охватывают мультимерный слитый белок, содержащий два или более полипептидных мономерных звена, (i) где каждое полипептидное мономерное звено содержит Fc-фрагмент, и (ii) где по меньшей мере одно полипептидное мономерное звено содержит гликомодифицированный Fc-фрагмент, как например, содержит гипоманнозилированный Fc-фрагмент, гипергалактозилированный Fc-фрагмент или гипофукозилированный Fc-фрагмент.
Такие Fc-мультимеры также раскрыты в патентной заявке США № US 2017/088063.
В некоторых воплощениях соединений Fc-мультимеров указанные соединения также содержали в себе антигенсвязывающий домен, такой как, например, антигенсвязывающие домены, раскрытые Zhang et al. (2016, J Immunol, Vol. 196, 1165-1176).
В некоторых предпочтительных воплощениях соединение, несущее гликомодифицированный Fc-фрагмент, состоит из гликомодифицированного антитела, как проиллюстрировано в примерах данного документа.
В некоторых предпочтительных воплощениях соединение, несущее гликомодифицированный Fc-фрагмент, состоит из соединения, несущего гипофукозилированный Fc-фрагмент, такого как гипофукозилированное антитело, как проиллюстрировано в примерах данного соединения.
В некоторых других воплощениях соединение, несущее гликомодифицированный Fc-фрагмент, и более точно, соединение, несущее гипофукозилированный Fc-фрагмент, состоит из соединения, несущего афукозилированный Fc-фрагмент, как например, афукозилированное антитело.
В других воплощениях соединение, несущее гликомодифицированный Fc-фрагмент, состоит из соединения, несущего гипергалактозилированный Fc-фрагмент, как например, гипергалактозилированное антитело.
В еще одних воплощениях соединение, несущее гликомодифицированный Fc-фрагмент, состоит из соединения, несущего гипоманнозилированного Fc-фрагмента, как например, гипоманнозилированное антитело.
Как уже раскрыто в настоящем описании изобретения, уменьшение или блокирование иммуносупрессии, такой как иммуносупрессия, вызванная макрофагами, встречающаяся при раковом заболевании, посредством соединения, несущего гликомодифицированный Fc-фрагмент, как например, гликомодифицированное антитело, не требует наличия опухолевых клеток, и, таким образом, не требует связывания указанного антитела с опухолевыми клетками-мишенями.
Это объясняет то, почему авторы изобретения полагают, что уменьшение или блокирование иммуносупрессии и, в особенности, ингибирования активации T-клеток, будет достигнуто посредством соединений, несущих гликомодифицированный Fc-фрагмент, которые не содержат антигенсвязывающую область, таких как соединения, которые не содержат область, связывающую антиген, ассоциированный с опухолью.
Однако, также в примерах данного документа проиллюстрировано, что уменьшение или блокирование иммуносупрессии достигается при использовании гликомодифицированных антител в качестве соединений, несущих гликомодифицированный Fc-фрагмент.
Кроме того, авторы настоящего изобретения полагают, что полезные эффекты соединения, несущего гликомодифицированный Fc-фрагмент, определенного в данном документе, можно дополнительно усиливать при использовании соединения, несущего гликомодифицированный Fc-фрагмент, состоящего из гликомодифицированного антитела, направленного против соответствующего опухолеассоциированного антигена, которое подразумевает гликомодифицированное антитело, направленное против опухолеассоциированного антигена, который экспрессируется опухолевыми клетками, находящимися в опухолевой ткани или в жидкостях организма ракового индивидуума, подлежащего лечению.
Таким образом, в некоторых предпочтительных воплощениях соединение, несущее гликомодифицированный Fc-фрагмент, состоит из гликомодифицированного антитела, направленного против опухолеспецифичного антигена, экспрессируемого опухолевыми клетками ракового индивидуума, подлежащего лечению.
В некоторых предпочтительных воплощениях указанное гликомодифицированное антитело состоит из гипофукозилированного антитела, как проиллюстрировано в примерах данного документа.
Не желая быть связанными какой-либо конкретной теорией, авторы изобретения полагают, что использование гликомодифицированного антитела, направленного против опухолеассоциированного антигена, экспрессируемого опухолевыми клетками ракового индивидуума, подлежащего лечению, (i) позволяет уменьшать или блокировать иммуносупрессию, как например, ингибирование активации T-клеток, в частности, ингибирование активации CD8+ T-клеток, например иммуносупрессию, вызванную макрофагами, и (ii) позволяет уничтожать опухолевые клетки, экспрессирующие опухолеассоциированный антиген, против которого направлено указанное гликомодифицированное антитело, как например, посредством ADCC или ADC активности.
Используемый здесь термин "опухолеассоциированный антиген" относится к антигену, который презентирован или может быть презентирован на поверхности, который расположен на или в опухолевых клетках. Данные антигены могут быть презентированы на поверхности клетки с внеклеточной частью, которая часто объединена с трансмембранной и цитоплазматической частью молекулы. Эти антигены могут быть в некоторых воплощениях презентированы только опухолевыми клетками, а не нормальными, то есть неопухолевыми клетками. Опухолевые антигены могут исключительно экспрессироваться на опухолевых клетках или могут представлять опухолеспецифичную мутацию, по сравнению с неопухолевыми клетками. В таком воплощении соответствующий антиген может называться опухолеспецифичным антигеном или опухолеассоциированным антигеном (также обозначенным "TAA"). Некоторые антигены презентированы как опухолевыми клетками, так и неопухолевыми клетками, которые также могут называться опухолеассоциированными антигенами. Данные опухолеассоциированные антигены могут быть сверхэкспрессированы на опухолевых клетках по сравнению с неопухолевыми клетками или быть доступными для связывания с антителом в опухолевых клетках, благодаря менее компактной структуре опухолевой ткани, по сравнению с неопухолевой тканью. В некоторых воплощениях опухолеассоциированный поверхностный антиген расположен на сосудистой системе опухоли.
Список опухолеассоциированных антигенов при этом раскрыт в публикации Liu et al. (2016, European Journal of Cancer Care, doi : 10/1111/ecc.12446), на которую специалист в данной области может ссылаться.
Список опухолевых антигенов, распознаваемых T-клетками, раскрыт Renkvist et al. (2001, Cancer immunology and immunotherapy, Vol. 50 (n°1) 3-15), на что специалист в данной области также может ссылаться.
Иллюстративные примеры опухолеассоциированного поверхностного антигена представляют собой CD10, CD19, CD20, CD22, CD33, Fms-подобную тирозинкиназу 3 (FLT-3, CD135), хондроитин сульфат протеогликан 4 (CSPG4, хондроитин сульфат протеогликан, ассоциированный с меланомой), рецептор эпидермального фактора роста (EGFR), Her2neu, Her3, IGFR, CD133, IL3R, белок активации фибробластов (FAP), CDCP1, дерлин l, тенасцин, frizzled 1-10, сосудистые антигены VEGFR2 (KDR/FLK1), VEGFR3 (FLT4, CD309), PDGFR-a (CD140a), PDGFR-β (CD140b) эндоглин, CLEC14, Tem1-8, и Tie2. Дополнительные примеры могут включать A33, CAM PATH-1 (CDw52), карциноэмбриональный антиген (CEA), карбоангидразу IX (MN/CA IX), CD21, CD25, CD30, CD34, CD37, CD44v6, CD45, CD133, de2-7 EGFR, EGFRvlll, EpCAM, Ep-CAM, Фолат-связывающий белок, G250, Fms-подобную тирозинкиназу 3 (FLT-3, CD135), c-Kit (CD1 17), CSF1 R (CD1 15), HLA-DR, IGFR, IL-2-рецептор, IL3R, MCSP (хондроитин сульфат протеогликан клеточной поверхности, ассоциированный с меланомой), Muc-1, простатический специфический мембранных антиген (PSMA), антиген стволовых клеток предстательной железы (PSCA), простатический специфический антиген (PSA) и TAG-72. Примеры антигенов, экспрессируемых на внеклеточном матриксе опухолей, представляют собой тенасцин и белок активации фибробластов (FAP).
Предпочтительные опухолеассоциированные антигены (TAA) могут быть выбраны из группы, содержащей CD45, IL-3Ra (также называемый CD123), CD33, CD20, CD22, CD19, EpCAM (также называемый "молекулой клеточной адгезии эпителия"), HER2, TROP-2 (также называемый "поверхностным антигеном трофобластной клетки 2"), GNMB (также называемый "гликопротеиновой неметастатической меланомой B"), MMP9, EGFR, PD-L1 (CD274), CTLA4, GM3, мезотелин, рецептор фолиевой кислоты 1, экстра-домен B фибронектина, эндоглин, CD22, IL-1 альфа, HER3, cMet, фосфатидилсерин, MUC5AC, NeuGc ганглиозиды, CD2, CD38, EGFR, HGF/SF, PD1, GD2, ST4 и рецептор фолиевой кислоты альфа.
Наиболее предпочтительные опухолеассоциированные антигены согласно настоящему изобретению представляют собой антигены, выбранные из группы, содержащей HER2, HER3, HER4 и AMHRII.
Предпочтительные воплощения гликомодифицированных антител, которые можно использовать согласно настоящему изобретению, выбраны из группы, включающей гликомодифицированные антитела, обозначенные в данном документе как 3C23K, 9F7F11, H4B121 и HE4B33.
Иллюстративные воплощения соединения, несущего гликомодифицированный Fc-фрагмент
Иллюстративные воплощения соединений, несущих Fc-фрагмент, охватывают соединения, содержащие гликомодифицированный Fc-фрагмент, содержащий две аминокислотные цепи SEQ ID NO: 70, описанные в данном документе.
Аминокислотная цепь SEQ ID NO: 70 состоит из константной области тяжелой цепи человеческого антитела IgG1, содержащей домен CH1, шарнирную область, домен CH2 и домен CH3.
Как раскрыто в примерах, соединение, несущее гликомодифицированный Fc-фрагмент, и в особенности соединение, несущее гипофукозилированный Fc-фрагмент, может быт получено способом, включающим стадию экспрессии последовательности нуклеиновой кислоты, кодирующей указанный Fc-фрагмент в клетках YB2/0. Такой способ может представлять собой хорошо известный способ, называемый EMABling®, который описан в примерах.
В некоторых воплощениях соединение, несущее гликомодифицированный Fc-фрагмент, и в особенности соединение, несущее гипофукозилированный Fc-фрагмент, может быть получено способом, включающим стадию экспрессии последовательности нуклеиновой кислоты SEQ ID NO: 69 в клетках YB2/0.
В некоторых воплощениях указанное соединение, несущее гликомодифицированный Fc-фрагмент, состоит из гликомодифицированного антитела и в особенности гипофукозилированного антитела; содержащего указанный гликомодифицированный Fc-фрагмент, содержащий две аминокислотные цепи SEQ ID NO: 70.
Воплощения гликомодифицированных антител, содержащих гликомодифицированные Fc-фрагменты, описаны ниже в данном документе.
Антитела в качестве соединений, несущих гликомодифицированный Fc-фрагмент
Таким образом, воплощения соединения, несущего гликомодифицированный Fc-фрагмент, состоят из антител и в особенности гликомодифицированных антител, направленных против опухолеассоциированных антигенов.
В некоторых воплощениях соединения, несущие гликомодифицированный Fc-фрагмент, охватывают гликомодифицированные мультиспецифичные антитела и в особенности гликомодифицированные биспецифичные антитела. Для иллюстрации данные гликомодифицированные антитела охватывают антитела, содержащие гликомодифицированный Fc-фрагмент, как описано в данном документе, и (i) первую антигенсвязывающую область, которая связывается с опухолевым антигеном, и (ii) вторую антигенсвязывающую область, которая связывается с T-клеточным антигеном, таким как CD3 или белок ингибиторной иммунной контрольной точки, например, с целью одновременного (i) нацеливания на клетки, экспрессирующие опухолевый антиген, и (ii) активации T-клеток.
Иллюстративные примеры таких гликомодифицированных антител охватывают антитела, которые направлены против опухолеассоциированных антигенов, таких как AMHRII, HER2, HER3 и HER4.
Такие антитела могут быть описаны в связи с их антигенсвязывающими областями и в особенности их вариабельной областью тяжелой цепи (VH) и вариабельной областью легкой цепи (VL).
Иллюстративные воплощения антител против AMHRII
В заявке PCT № PCT/FR2011/050745 (международная публикация № WO/2011/141653) и патенте США № 9012607, каждый из которых включен в данный документ посредством ссылки во всей своей полноте, раскрыты новые гуманизированные антитела, которые происходят из мышиного антитела 12G4. Данные гуманизированные антитела могут быть использованы в качестве AMHRII-связывающих агентов для цели настоящего изобретения. В конкретных воплощениях, раскрытых в заявке PCT № WO/2011/141653, антитела представляют собой антитела, идентифицированные как 3C23 и 3C23K. Последовательности нуклеиновых кислот и полипептидные последовательности данных антител предложены в данном документе в виде SEQ ID NO: 1-16. В некоторых аспектах изобретения исследуемые антитела против AMHRII могут быть обозначены как "содержащие легкую цепь, содержащую SEQ ID NO: и тяжелую цепь, содержащую SEQ ID NO: ". Таким образом, в разных воплощениях, особенно предпочтительные антитела содержат:
а) легкую цепь, содержащую SEQ ID NO: 2, и тяжелую цепь, содержащую SEQ ID NO: 4 (последовательности VL и VH 3C23 без лидерных последовательностей);
б) легкую цепь, содержащую SEQ ID NO: 6, и тяжелую цепь, содержащую SEQ ID NO: 8 (последовательности VL и VH 3C23K без лидерных последовательностей);
в) легкую цепь, содержащую SEQ ID NO: 10, и тяжелую цепь, содержащую SEQ ID NO: 12 (легкая и тяжелая цепи 3C23 без лидерных последовательностей);
г) легкую цепь, содержащую SEQ ID NO: 14, и тяжелую цепь, содержащую SEQ ID NO: 16 (легкая и тяжелая цепи 3C23K без лидерных последовательностей).
Другие антитела (например, гуманизированные или химерные антитела) могу быть основаны на последовательностях тяжелой и легкой цепей, описанных в данном документе.
Иллюстративные воплощения антител против AMHRII, включающие/содержащие CDR, содержащие (или состоящие из) следующие последовательности:
- CDRL-1: RASX1X2VX3X4X5A (SEQ ID NO: 71), где X1 и X2 представляют собой, независимо, S или P, X3 представляет собой R или W или G, X4 представляет собой T или D, и X5 представляет собой I или T;
- CDRL-2 представляет собой PTSSLX6S (SEQ ID NO: 72), где X6 представляет собой K или E; и
- CDRL-3 представляет собой LQWSSYPWT (SEQ ID NO: 73);
- CDRH-1 представляет собой KASGYX7FTX8X9HIH (SEQ ID NO: 74), где X7 представляет собой S или T, X8 представляет собой S или G и X9 представляет собой Y или N;
- CDRH-2 представляет собой WIYPX10DDSTKYSQKFQG (SEQ ID NO: 75), где X10 представляет собой G или E и
- CDRH-3 представляет собой GDRFAY (SEQ ID NO: 76).
Антитела (например, химерные или гуманизированные) в объеме данной заявки включают антитела, раскрытые в следующей таблице: антитело 3C23K определено следующими последовательностями:
- SEQ ID NO: 17 для аминокислотной последовательности VH;
- SEQ ID NO: 34 для аминокислотной последовательности VL.
В Таблице 1 ниже перечислены гуманизированные антитела против AMHRII, которые можно использовать согласно изобретению.
Таблица 1: антитела против AMHRII
Иллюстративные воплощения антител против HER3
Иллюстративные воплощения гликомодифицированных антител против HER3 представляют собой антитела, которые обозначены в данном документе как 9F7F11 и H4B121.
Антитело 9F7F11 содержит (i) вариабельную область тяжелой цепи SEQ ID NO: 63 и (ii) вариабельную область легкой цепи SEQ ID NO: 64.
Антитело H4B121 содержит (i) вариабельную область тяжелой цепи SEQ ID NO: 65 и (ii) вариабельную область легкой цепи SEQ ID NO: 66.
Иллюстративные воплощения антител против HER4
Иллюстративное воплощение антитела против HER4 представляет собой антитело, которое в данном документе называется HE4B33.
Антитело HE4B33 содержит (i) вариабельную область тяжелой цепи SEQ ID NO: 67 and (ii) вариабельную область легкой цепи SEQ ID NO: 68.
Для ясности, все указанные описанные выше антитела содержат гликомодифицированный Fc-фрагмент, как описано в данном документе, и в особенности содержат гипофукозилированный Fc-фрагмент, как описано в данном документе.
В некоторых предпочтительных воплощениях данные антитела содержат гликомодифицированный Fc-фрагмент, имеющий две гликомодифицированные аминокислотные цепи SEQ ID NO: 70, и в особенности гипофукозилированный Fc-фрагмент, имеющий две гипофукозилированные аминокислотные цепи SEQ ID NO: 70.
Комбинация соединения, несущего гликомодифицированный Fc-фрагмент, с одним или более чем одним другим активным веществом
Соединение, несущее гликомодифицированный Fc-фрагмент, как определено в данном документе, поскольку оно позволяет уменьшать или блокировать состояние иммуносупрессии у раковых пациентов, является полезным для усиления противораковой активности известных видов противоракового лечения, которые включают виды хирургического лечения, виды лечения на основе лучевой терапии и виды лечения на основе химиотерапии.
Кроме того, соединение, несущее гликомодифицированный Fc-фрагмент, как определено в данном документе, поскольку оно позволяет уменьшать или блокировать состояние иммуносупрессии у раковых пациентов, как считают, возможно, действует в качестве активного вещества, которое будет усиливать полезное действие других соединений, нацеленных на блокирование иммуносупрессии или нацеленных на индуцирование иммуностимуляции или иммуноактивации у раковых пациентов с иммуносупрессией. Кроме того, соединения, несущие гликомодифицированный Fc-фрагмент, могли бы также способствовать действию против устойчивости раковых клеток к данным ингибиторам иммуносупресси (ингибиторы контрольных точек) или иммуностимулирующим агентам.
Таким образом, в других аспектах соединение, несущее гликомодифицированный Fc-фрагмент, как определено в данном документе, может быть использовано в сочетании с другим противораковым лечением, и в частности, в сочетании с одним или более чем одним отличающимся соединением, состоящим из противораковых средств.
В другом аспекте настоящее изобретение относится к соединению, несущему гликомодифицированный Fc-фрагмент, для его применения в качестве ингибитора иммуносупрессии в противораковом лечении индивидуума в сочетании с одним или более чем одним отличным противораковым средством.
Кроме того, настоящее изобретение относится к применению соединения, несущего гликомодифицированный Fc-фрагмент, в сочетании с одним или более чем одним отличным противораковым средством для получения лекарственного средства для лечения рака.
Настоящее изобретение также относится к способу лечения рака, включающему стадию введения нуждающемуся в этом индивидууму соединения, несущего гликомодифицированный Fc-фрагмент, в сочетании с одним или более чем одним отличным противораковым средством.
Противораковые средства охватывают соединения, которые обладают противораковой активностью, такие как антипролиферативные активные вещества, причем большое число этих соединений хорошо известно специалисту в данной области. Противораковые средства также охватывают ингибиторы белков ингибиторных иммунных контрольных точек, как это подробно описано в настоящем описании изобретения.
Термин "противораковое средство" используют в соответствии с его общепринятым обычным значением, и он относится к композиции (например, соединение, лекарственное средство, антагонист, ингибитор, модулятор), обладающей противоопуховлевыми свойствами или способностью ингибировать рост или пролиферацию клеток. В некоторых воплощениях противораковое средство представляет собой химиотерапевтическое средство. В некоторых воплощениях противораковое средство представляет собой средство, идентифицированное в данном документе, обладающее полезностью в способах лечения рака. В некоторых воплощениях противораковое средство представляет собой средство, одобренное FDA или схожим органом надзора страны, отличной от США, для лечения рака.
В некоторых воплощениях указанные противораковые средства не состоят из соединений, происходящих из антител, таких как собственно антитела или их антигенсвязывающие фрагменты или антигенсвязывающие форматы.
Примеры противораковых средств, которые не состоят из антител, включают без ограничений следующими противораковыми средствами: ингибиторы MEK (например, MEK1, MEK2 или MEK1 и MEK2) (например, XL518, CI-1040, PD035901, селуметиниб/AZD6244, GSK1120212/траметиниб, GDC-0973, ARRY-162, ARRY-300, AZD8330, PD0325901, U0126, PD98059, TAK-733, PD318088, AS703026, BAY 869766), алкилирующие агенты (например, циклофосфамид, ифосфамид, хлорамбуцил, бусульфан, мелфалан, мехлорэтамин, урамустин, тиотепа нитрозомочевина, азотистые иприты (например, мехлорэтамин, циклофосфамид, хлорамбуцил, мелфалан), этиленимин и метилмеламины (например, гексаметилмеламин, тиотепа), алкилсульфонаты (например, бусульфан), нитрозомочевины (например, кармустин, ломустин, семустин, стрептозоцин), триазены (декарбазин)), антиметаболиты (например, 5-азатиоприн, лейковорин, капецитабин, флударабин, гемцитабин, пеметрексед, ралтитрексед, аналог фолиевой кислоты (например, метотрексат) или аналоги пиримидина (например, фторурацил, флоксуридин, Цитарабин), аналоги пуринов (например, меркаптопурин, тиогуанин, пентостатин и т.д.), растительные алкалоиды (например, винкристин, винбластин, винорелбин, виндезин, подофиллотоксин, паклитаксель, доцетаксель и т.д.), ингибиторы топоизомераз (например, иринотекан, топотекан, амсакрин, этопозид (VP16), этопозида фосфат, тенипозид и т.д.), противоопухолевые антибиотики (например, доксорубицин, адриамицин, даунорубицин, эпирубицин, актиномицин, блеомицин, митомицин, митоксантрон, пликамицин и т.д.), соединения на основе платины или средства, содержащие платину (например, цисплатин, оксалоплатин, карбоплатин), антрацендион (например, митоксантрон), замещенная мочевина (например, гидроксимочевина), производное метилгидразина (например, прокарбазин), адренокортикальный супрессор (например, митотан, аминоглутетимид), эпиподофиллотоксины (например, этопозид), антибиотики (например, даунорубицин, доксорубицин, блеомицин), ферменты (например. L-аспарагиназа), ингибиторы сигнального пути митоген-активируемой протеинкиназы (например, U0126, PD98059, PD184352, PD0325901, ARRY-142886, SB239063, SP600125, BAY 43-9006, вортманнин или LY294002, ингибиторы Syk, ингибиторы mTOR, госсифол, генасенс, полифенол E, хлорофузин, полностью трансретиноевая кислота (ATRA - all trans-retinoic acid), бриостатин, родственный фактору некроза опухоли лиганд, индуцирующий апоптоз (TRAIL - tumor necrosis factor-related apoptosis-inducing ligand), 5-аза-2'-дезоксицитидин, полностью трансретиноевая кислота, доксорубицин, винкристин, этопозид, гемцитабин, иматиниб (Gleevec®), гелданамицин, 17-N-аллиламино-17-деметоксигелданамицин (17-AAG), флавопиридол, LY294002, бортезомиб, трастузумаб, BAY 11-7082, PKC412, PD184352, 20-эпи-1, 25 дигидроксивитамин D3; 5-этинилурацил; абиратерон; акларубицин; ацилфульвен; адеципенол; адозелезин; алдеслейкин; антагонисты ALL-TK; алтретамин; амбамустин; амидокс; амифостин; аминолевулиновая кислота; амрубицин; амсакрин; анагрелид; анастрозол; андрографолид; ингибиторы ангиогенеза; антагонист D; антагонист G; антареликс; антидорзализирующий морфогенетический белок 1; антиандроген карциномы предстательной железы; антиэстроген; антинеопластон; антисмысловые олигонуклеотиды; афидиколин глицинат; модуляторы генов апоптоза; регуляторы апоптоза; апуриновая кислота; ara-CDP-DL-PTBA; деаминаза аргинина; асулакрин; атаместан; атримустин; аксинастатин 1; аксинастатин 2; аксинастатин 3; азасетрон; азатоксин; азатирозин; производные баккатина III; баланол; батимастат; антагонисты BCR/ABL; бензохлорины; бензоилстауроспорин; производные бета-лактама; бета-алетин; бета-кламицин В; бетулиновая кислота; ингибитор bFGF; бикалутамид; бисантрен; бисазиридинилспермин; биснафид; бистратен А; бизелезин; брефлат; бропиримин; будотитан; бутионин сульфоксимин; кальципотриол; кальфостин C; производные камптотецина; канарипокс IL-2; капецитабин; аминотриазол-карбоксамид; карбоксиамидотриазол; CaRest M3; CARN 700; происходящий из хряща ингибитор; карзелезин; ингибиторы казеин-киназы (ICOS); кастаноспермин; цекропин B; цетрореликс; хлорины; хлорхиноксалина сульфамид; цикапрост; цис-порфирин; кладрибин; аналоги кломифена; клотримазол; коллисмицин A; коллисмицин B; комбретастатин A4; аналоги комбретастатина; конагенин; крамбесцидин 816; криснатол; криптофицин 8; производные криптофицина A; курацин A; циклопентантрахиноны; циклоплатам; ципемицин; цитарабина окфосфат; цитолитический фактор; цитостатин; дакликсимаб; децитабин; дегидродидемнин B; деслорелин; дексаметазон; дексифосфамид; дексразоксан; дексверапамил; диазикуон; дидемнин B; дидокс; диэтилнорспермин; дигидро-5-азацитидин; 9-диоксамицин; дифенилспиромустин; докозанол; доласетрон; доксифлуридин; дролоксифен; дронабинол; дуокармицин SA; эбселен; экомустин; эдельфозин; эдреколомаб; эфлорнитин; элемен; эмитефур; эпирубицин; эпристерид; аналог эстрамустина; агонисты эстрогена; антагонисты эстрогена; этанидазол; этопозида фосфат; эксеместан; фадрозол; фазарабин; фенретинид; филграстим; финастерид; флавопиридол; флезеластин; флуастерон; флударабин; фтордауноруницина гидрохлорид; форфенимекс; форместан; фостриецин; фотемустин; гадолиния тексафирин; нитрат галлия; галоцитабин; ганиреликс; ингибиторы желатиназы; гемцитабин; ингибиторы глутатиона; гепсульфам; херегулин; гексаметилен бисацетамид; гиперицин; ибандроновая кислота; идарубицин; идоксифен; идрамантон; илмофозин; иломастат; имидазоакридоны, имиквимод; иммуностимулирующие пептиды; ингибитор рецептора инсулиноподобного фактора роста-1; агонисты интерферона; интерфероны; интерлейкины; иобенгуан; йододоксорубицин; 4-ипомеанол; ироплакт; ирсогладин; изобенгазол; изогомогаликондрин B; итасетрон; ясплакинолид; кахалалид F; ламелларин-N триацетат; ланреотид; лейнамицин; ленограстим; лентинана сульфат; лептолстатин; летрозол; лейкемия-ингибирующий фактор; лейкоцитарный альфа-интерферон; лейпролид плюс эстроген + прогестерон; лейпрорелин; левамизол; лиарозол; аналог линейного полиамина; липофильный дисахарид-пептид; липофильные соединения платины; лиссоклинамид 7; лобаплатин; ломбрицин; лометрексол; лонидамин; лозоксантрон; локсорибин; луртотекан; тексафирин лютеция; лизофуллин; лизирующие пептиды; майтансин; манностатин A; маримастат; мазопрокол; маспин; ингибиторы матрилизина; ингибиторы матриксной металлопротеиназы; меногарил; мербарон; метерелин; метиониназа; метоклопрамид; ингибитор МИФ (фактор ингибиррования миграции макрофагов); мифепристон; милтефозин; миримостим; двуцепочечная РНК с ошибочно спаренными основаниями; митогуазон; митолактол; аналоги митомицина; митонафид; митотоксин фактор роста фибробластов-сапорин; митоксантрон; мофаротен; молграмостим; человеческий хорионический гонадотропин; монофосфорилированный липид A плюс стрептокиназа (sk - streptokinase) клеточной стенки микобактерий; мопидамол; ингибитор генов множественной устойчивости к лекарственным средствам; терапия на основе супрессора множественных опухолей 1; ипритовое противораковое средство; микапероксид B; экстракт клеточной стенки микобактерий; мириапорон; N-ацетилдиналин; N-замещенные бензамиды; нафарелин; нагрестип; налоксон плюс пентазоцин; напавин; нафтерпин; нартограстим; недаплатин; неморубицин; неридроновая кислота; нейтральная эндопептидаза; нилутамид; нисамуцин; модуляторы оксида азота; нитроксидный антиоксидант; нитруллин; O6-бензилгуанин; октреотид; окиценон; олигонуклеотиды; онапристон; ондансетрон; ондансетрон; орацин; пероральный индуктор цитокинов; ормаплатин; осатерон; оксалиплатин; оксауномицин; палауамин; пальмитоилризоксин; памидроновая кислота; панакситриол; паномифен; парабактин; пазеллиптин; пэгаспаргаза; пелдезин; пентосана полисульфат натрия, пентостатин; пентрозол; перфлуброн; перфосфамид; периллиловый спирт; феназиномицин; фенилацетат; ингибиторы фосфатазы; пицибанил; пилокарпина гидрохлорид; пирарубицин; пиритрексим; плацетин A; плацетин B; ингибитор активатора плазминогена; комплекс платины; соединения платины; комплекс платина-триамин; порфимер натрия; порфиромицин; преднизон; пропилбис-акридон; простагландин J2; ингибиторы протеасомы; иммуномодулятор на основе белка А; ингибитор протеинкиназы C; ингибиторы протеинкиназы C, микроводорослей; ингибиторы протеинтирозинфосфатазы; ингибиторы фосфорилазы пуриновых нуклеозидов; пурпурины; пиразолоакридин; конъюгат пиридоксилированный гемоглобин-полиоксиэтилен; raf-антагонисты; ралтитрексед; рамосетрон; ингибиторы фарнезил-протеинтрансферазы ras; ингибиторы ras; ингибитор ras-GAP; диметилированный ретеллиптин; рутения Re 186 этидронат; ризоксин; рибозимы; RII ретинамид; рохитукин; ромуртид; роквинимекс; рубигинон B1; рубоксил; сафингол; сэйнтопин; SarCNU; саркофитол A; сарграмостим; миметики Sdi 1; семустин; обуслевленный старением ингибитор 1; смысловые олигонуклеотиды; ингибиторы сигнальной трансдукции; модуляторы сигнальной трансдукции; одноцепочечный антигенсвязывающий белок; сизофуран; собузоксан; натрия боркаптат; натрия фенилацетат; солверол; соматомедин-связывающий белок; сонермин; спарфозовая кислота; спикамицин D; спиромустин; спленопентин; спонгистатин 1; скваламин; ингибитор стволовых клеток; ингибиторы деления стволовых клеток; стипиамид; ингибиторы стромелизина; сульфинозин; антагонист сверхактивного вазоактивного интестинального пептида; сурадиста; сурамин; свайнсонин; синтетические гликозаминогликаны; таллимустин; тамоксифена метйодид; тауромустин; тазаротен; текогалан натрия; тегафур; теллурапирилий; ингибиторы теломеразы; темопорфин; темозоломид; тенипозид; тетрахлордекаоксид; тетразомин; талибластин; тиокоралин; тромбопоэтин; миметик тромбопоэтина; тимальфазин; агонист рецептора тимопоэтина; тимотринан; тиреостимулирующий гормон; олово-этилэтиопурпурин; тирапазамин; титаноцена дихлорид; топсентин; торемифен; фактор тотипотентных стволовых клеток; ингибиторы трансляции; третиноин; триацетилуридин; трицирибин; триметрексат; трипторелин; трописетрон; туростерид; ингибиторы тирозинкиназы; тирфостины; ингибиторы UBC; убенимекс; фактор, ингибирующий рост, происходящий из мочеполового синуса; антагонисты рецептора урокиназы; вапреотид; вариолин B; геннная терапия на основе эритроцитов, системы векторов; веларезол; верамин; вердины; вертепорфин; винорелбин; винксалтин; витаксин; ворозол; занотерон; зениплатин; зиласкорб; зиностатин стималамер; адриамицин, дактиномицин, блеомицин, винбластин, цисплатин, ацивицин; акларубицин; акодазол гидрохлорид; акронин; адозелезин; алдеслейкин; алтретамин; амбомицин; аметантрон ацетат; аминоглутетимид; амсакрин; анастрозол; антрамицин; аспарагиназа; асперлин; азацитидин; азетепа; азотомицин; батимастат, бензодепа; бикалутамид; бисантрен гидрохлорид; биснафид димезилат; бизелезин; блеомицин сульфат; брехинар натрия; бропиримин; бусульфан; кактиномицин; калустерон; карацемид; карбетимер; карбоплатин; кармустин; карубицин гидрохлорид; карзелезин; кеденефингол; хлорамбуцил; циролемицин; кладрибин; криснатол мезилат; циклофосфамид; цитарабин; декарбазин; даунорубицин гидрохлорид; децитабин; дексормаплатин; дезагуанин; дезагуанин мезилат; диазихинон; доксорубицин; доксорубицин гидрохлорид; дролоксифен; цитрат дролоксифен; пропионат дромостанолон; дуазомицин; эдатрексат; эфлорнитин гидрохлорид; элсамитруцин; энлоплатин; энпромат; эпипропидин; гидрохлорид эпирубицин; эрбулозол; эсорубицин гидрохлорид; эстрамустин; эстрамустина натрия фосфат; этанидазол; этопозид; этопозид фосфат; этоприн; фадрозола гидрохлорид; фазарабин; фенретинид; флоксуридин; фосфат флударабин; фтороурацил; флуроцитабин; фосхидон; натрий фостриецин; гемцитабин; гемцитабина гидрохлорид; гидроксимочевина; идарубицина гидрохлорид; ифосфамид; иимофозин; интерлейкин I1 (включая рекомбинантный интерлейкин II или rIL2), интреферон альфа-2а; интерферон альфа-2b; интерферон альфа-n1; интерферон альфа-n3; интерферон бета-1а; интерферон гамма-1b; ипроплатин; иринотекана гидрохлорид; ланреотида ацетат; летрозол; лейпролида ацетат; лиарозола гидрохлорид; натрий лометрексол; ломустин; лозоксантрона гидрохлорид; мазопрокол; маитанзин; мехлоретамин гидрохлорид; мегестрола ацетат; меленгестрола ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метотрексат натрия; метоприн; метуредепа; митиндомид; митосарцин; митокромин; митогиллин; митомалцин; митомицин; митоспер; митотан; митоксантрона гидрохлорид; микофеноловая кислота; нокодазол; ногаламицин; ормаплатин; оксисуран; пегаспаргаз; пелиомицин; пентамустин; пепломицина сульфат; перфосфамид; пипоброман; пипосульфан; пироксантрона гидрохлорид; пликамицин; пломестан; порфимер натрия; порфиромицин; преднимустин; прокарбазина гидрохлорид; пуромицин; пуромицина гидрохлорид; пиразофурин; рибоприн; роглетимид; сафингол; сафингола гидрохлорид; семустин; симтразен; натрия спарфосат; спарсомицин; спирогермания гидрохлорид; спиромустин; спироплатин; стрептонигрин; стрептозоцин; сулофенур; талисомицин; текогалан натрия; тегафур; телоксантрона гидрохлорид; темопорфин; тенипозид; тероксирон; тестоластон; тиамиприн; тиогуанин; тиотепа; тиазофурин; тирапазамин; торемифена цитрат; трестолон ацетат; трицирибина фосфат; триметрексат; триметрексата глюкуронат; трипторелин; тубулозола гидрохлорид; урацил иприт; уредепа; вапреотид; вертепорфин; винбластина сульфат; винкристина сульфат; виндесин; виндесина сульфат; винепидина сульфат; винглицината сульфат; винлейрозина сульфат; винорелбина тартрат; винрозидина сульфат; винзолидина сульфат; ворозол; зениплатин; зиностатин; зорубицина гидрохлорид; средства, которые осуществляют арест клеток в фазах G2-M и/или модулируют образование или стабильность микротрубочек, (например, Taxol™ (а именно паклитаксел), Taxotere™, соединения, содержащие скелет таксана, эрбулозол (а именно R-55104), доластатин 10 (а именно DLS-10 и NSC-376128), мивобулин изетионат (а именно в виде CI-980), винкристин, NSC-639829, дискодермолид (а именно в виде NVP-XX-A-296), ABT-751 (Абботт, а именно E-7010), алториртины (например, алториртин A и алториртин C), спонгистатины (например, спонгистатин 1, спонгистатин 2, спонгистатин 3, спонгистатин 4, спонгистатин 5, спонгистатин 6, спонгистатин 7, спонгистатин 8 и спонгистатин 9), цемадотина гидрохлорид (а именно LU-103793 и NSC-D-669356), эпотилоны (например, эпотилон A, эпотилон B, эпотилон C (а именно дезоксиэпотилон А или dEpoA), эпотилон D (а именно KOS-862, dEpoB и дезоксиэпотилон В), эпотилон E, эпотилон F, N-оксид эпотилона B, N-оксид эпотилона А, 16-аза-эпотилон В, 21-аминоэпотилон В (то есть BMS-310705), 21-гидроксиэпотилон D (а именно дезоксиэпотилон F и dEpoF), 26-флуороэпотилон, ауристатин РЕ (а именно NSC-654663), соблидотин (а именно TZT-1027), LS-4559-Р (Фармациа, также известный как LS-4577), LS-4578 (Фармациа, а именно LS-477-P), LS-4477 (Фармациа), LS-4559 (Фармациа), RPR-112378 (Авентис), винкристина сульфат, DZ-3358 (Даиичи), FR-182877 (Фудзисава, а именно WS-9885B), GS-164 (Такеда), GS-198 (Такеда), KAR-2 (Академия наук Венгрии), BSF-223651 (BASF, а именно ILX-651 и LU-223651), SAH-49960 (Лилли/Новартис), SDZ-268970 (Лилли/Новартис), AM-97 (Армад/Киова Хакко), АМ-132 (Армад), АМ-138 (Армад/Киова Хакко), IDN-5005 (Индена), Криптофицин 52 (а именно LY-355703), АС-7739 (Адзиномото, а именно AVE-8063A и CS-39.HCl), АС-7700 (Адзиномото, а именно AVE-8062, AVE-8062A, CS-39-L-Ser.HCl и RPR-258062A), витилевуамид, тубулизин А, канаденсол, центауреидин (а именно NSC-106969), T-138067 (Туларик, а именно T-67, TL-138067 и TI-138067), COBRA-1 (Институт Паркера Хьюза, а именно DDE-261 и WHIН10 (Канзасский Государственный Университет), H16 (Канзасский Государственный Университет), онкоцидин A1 (а именно ВТО-956 и DIME), DDE-313, (Институт Паркера Хьюза), фиджианолид В, лаулималид, SPA-2 (Институт Паркер Хьюза), SPA-1 (Институт Паркера Хьюза, а именно SPIKET-P), 3-IAABU (Цитоскелет/Школа медицины медицинского центра Маунт-Синай, а именно MF-569), наркозин (также известный как NSC-5366), наскапин, D-24851 (Аста Медика), А-105972 (Абботт), гемиастерлин, 3-BAABU (Цитоскелет/ Школа медицины медицинского центра Маунт-Синай, а именно Mf-191), TMPN (Аризонский Государственный Университет), ванадоцена ацетилацетонат, T-138026 (Туларик), монсатрол, инаноцин (а именно NSC-698666), 3-1AABE (Цитоскелет/ Школа медицины медицинского центра Маунт-Синай), А-204197 (Абботт), T-607 (Туларик, а именно T-900607), RPR-115781 (Авентис), элеутеробины (такие как десметилэлеутеробин, дезаэтилэлеутеробин, изоэлеутеробин А и Z-элеутеробин), карибаэозид, карибаэолин, халихондрин В, D-64131 (Аста Медика), D-68144 (Аста Медика), диазонамид А, А-293620 (Абботт), NPI-2350 (Нереус), таккалонолид A, TUB-245 (Авентис), А-259754 (Аббот), диозостатин, (-)-фенилагистин (а именно NSCL-96F037), D-68838 (Аста Медика), D-68836 (Аста Медика), миосеверин В, D-43411 (Зентарис, а именно D-81862), А-289099 (Абботт), А-318315 (Абботт), HTI-286 (а именно SPA-110, соль трифторацетат) (Уайет), D-82317 (Зентарис), D-82318 (Зентарис), SC-12983 (NCI), ресверастатина натрия фосфат, BPR-OY-007 (Национальные научно-исследовательские институты здоровья) и SSP-250411 (Санофи), стероиды (например, дексаметазон), финастерид, ингибиторы ароматазы, антагонисты гонадотропин-рилизинг-гормона (GnRH - gonadotropin-releasing hormone), такие как гозерелин или лейпролид, адренокортикостероиды (например, преднизон), прогестины (например, гидроксипрогестерона капроат, мегестрол ацетат, медроксипрогестерона ацетат), эстрогены (например, диэтилстильбэстрол, этинилэстрадиол), антиэстроген (например, тамоксифен), андрогены (например, пропионат тестостерона, флуоксиместерон), антиандроген (например, флутамид), иммуностимулирующие средства (например, Bacillus Calmette-Guérin (BCG), левамизол, интерлейкин-2, альфа-интерферон и т.д.), триптолид, гомогаррингтонин, дактиномицин, доксорубицин, эпирубицин, топотекан, итраконазол, виндезин, церивастатин, винкристин, дезоксиаденозин, сертралин, питавастатин, иринотекан, клофазимин, 5-нонилокситриптамин, вемурафениб, дабрафениб, эрлотиниб, гефинитиб, ингибиторы EGFR, нацеленная на рецептор эпидермального фактора роста (EGFR) терапия или терапевтическое средство (например, гефитиниб (Iressa™), эрлотиниб (Tarceva™), цетуксимаб (Erbitux™), лапатиниб (Tykerb™), панитумумаб (Vectibix™), вандетаниб (Caprelsa™), афатиниб/BIBW2992, CI-1033/канертиниб, нератиниб/HKI-272, CP-724714, TAK-285, AST-1306, ARRY334543, ARRY-380, AG-1478, дакомитиниб/PF299804, OSI-420/дезметилэрлотиниб, AZD8931, AEE788, пелитиниб/EKB-569, CUDC-101, WZ8040, WZ4002, WZ3146, AG-490, XL647, PD153035, BMS-599626), сорафениб, иматиниб, сунитиниб, дазатиниб, гормональные терапии или тому подобное. Подробности путей введения, доз и схем лечения противораковыми средствами известны в данной области, например, как описано в "Cancer Clinical Pharmacology" (2005) ed. By Jan H. M. Schellens, Howard L. McLeod and David R. Newell, Oxford University Press.
В некоторых других воплощениях указанные дополнительные противораковые средства состоят из противораковых антител, которые отличаются от одного или более чем одного соединения, несущего Fc, которое используют для ингибирования иммуносупрессии, связанной с раком. Противораковые антитела охватывают моноклональные антитела (например, моноклональные антитела против CD20, против HER2, против CD52, против HLA-DR и против VEGF), иммунотоксины (например, конъюгат моноклональное антитело против CD33 - калихеамицин, конъюгат моноклональное антитело против CD22 - экзотоксин псевдомонад и т.д.), радиоиммунотерапию (например, моноклональное антитело против CD20, конъюгированное с 111In, 90Y или 131I и т.д.). В некоторых воплощениях данные противораковые антитела могут быть сами гликомодифицированы, как например, гипофукозилированы.
Противораковые средства также охватывают средства, которые, как известно, активируют или реактивируют противораковую активность иммунной системы. Средства, которые активируют или реактивируют противораковую активность иммунной системы, охватывают средства, которые предпочтительно представляют собой средства, которые ингибируют ингибиторные иммунные контрольные точки. Данные средства могут называться в данном документе "ингибиторами ингибиторных иммунных контрольных точек" или "ингибиторами иммунных контрольных точек". Как известно в данной области, ингибитор иммунных контрольных точек состоит из средства, которое ингибирует активность белков ингибиторных иммунных контрольных точек.
Термин "белок иммунной контрольной точки" известен в данной области. В пределах известного значения данного термина специалисту будет понятно, что на уровне "белков иммунных контрольных точек" иммунная система подает ингибирующие сигналы к своим компонентам для уравновешивания иммунных реакций. Известные белки иммунных контрольных точек содержат CTLA-4, PDl и его лиганд PD-Ll и PD-L2, и кроме того LAG-3, BTLA, B7H3, B7H4, TIM3, KIR. Пути, включающие LAG3, BTLA, B7H3, B7H4, TIM3 и KIR, как принято в данной области, составляют пути с участием иммунных контрольных точек, похожие на CTLA-4- и PD-1-зависимые пути (см, например, Pardoll, 2012. Nature Rev Cancer 12:252-264; Mellman et al., 2011. Nature 480:480- 489).
В настоящем изобретении ингибитор белка иммунной контрольной точки представляет собой любое соединение, ингибирующее функцию белка иммунной контрольной точки. Ингибирование включает ослабление функции и полную блокаду. В частности, белок иммунной контрольной точки представляет собой белок иммунной контрольной точки человека. Таким образом, ингибитор белка иммунной контрольной точки предпочтительно представляет собой ингибитор белка иммунной контрольной точки человека. Белки иммунных контрольных точек описаны в данной области техники (см., например, Pardoll, 2012. Nature Rev. cancer 12: 252-264). Назначение белка иммунной контрольной точки включает экспериментальную демонстрацию стимуляции ответа, опосредованного T-лимфоцитами, стимулированными антигенным рецептором, посредством ингибирования белка иммунной контрольной точки in vitro или in vivo, например, мыши с недостатком в экспрессии белка иммунной контрольной точки демонстрируют усиленные антиген-специфичные ответы, опосредованные T-лимфоцитами, или признаки аутоиммунитета (как например, раскрыто в Waterhouse et al., 1995. Science 270:985-988; Nishimura et al., 1999. Immunity 11:141-151). Это также может включать демонстрацию ингибирования стимулированных антигенным рецептором CD4+ или CD8+ T-клеточных ответов вследствие преднамеренной стимуляции белка иммунной контрольной точки in vitro или in vivo (например, Zhu et al., 2005. Nature Immunol. 6:1245-1252). Предпочтительные ингибиторы белков иммунных контрольных точек представляют собой антитела, которые специфично распознают белки иммунных контрольных точек. Известен целый ряд ингибиторов CTLA-4, PD1, PDL-1, PD-L2, LAG-3, BTLA, B7H3, B7H4, TIM3 и KIR и по типу данных известных ингибиторов белков иммунных контрольных точек в (ближайшем) будущем могут быть разработаны альтернативные ингибиторы иммунных контрольных точек. Например, ипилимумаб представляет собой полностью человеческое блокирующее CTLA-4 антитело, в настоящее время имеющееся в продаже под названием Yervoy (Bristol-Myers Squibb). Второй ингибитор CTLA-4 представляет собой тремелимумаб (на который ссылаются в Ribas et al., 2013, J. Clin. Oncol. 31:616-22). Примеры ингибиторов PD-1 без ограничения включают гуманизированные антитела, блокирующие человеческий PD-1, такие как ламбролизумаб (например, раскрытый как hPD109A, и его гуманизированные производные h409All, h409A16 и h409A17 в WO2008/156712; Hamid et al., N. Engl. J. Med. 369: 134-144 2013), или пидилизумаб (раскрытый в Rosenblatt et al., 2011. J Immunother. 34:409-18), а также полностью гуманизированные антитела, такие как ниволумаб (ранее известный как MDX-1106 или BMS-936558, Topalian et al., 2012. N. Eng. J. Med. 366:2443-2454, раскрытый в US8008449). Другие ингибиторы PD-1 могут включать презентации растворимого лиганда PD-1, включая без ограничения слитый белок PD-L2 Fc, также известный как B7-DC-Ig или AMP-244 (раскрытые в Mkrtichyan M, et al. J Immunol. 189:2338-47 2012) и другие ингибиторы PD-1, исследуемые и/или разрабатываемые в настоящее время для применения в терапии. Кроме того, ингибиторы иммунных контрольных точек могут включать без ограничения гуманизированные или полностью человеческие антитела, блокирующие PD-L1, такие как MEDI-4736 (раскрытое в WO2011066389), MPDL328 OA (раскрытое в US8217149) и MIH1 (Affymetrix, получаемое посредством eBioscience (16.5983.82)) и другие ингибиторы PD-L1, исследуемые в настоящее время. Согласно данному изобретению ингибитор иммунной контрольной точки предпочтительно выбран из ингибитора CTLA-4, PD-1 или PD-L1, такого как ингибитор, выбранный из известных ингибиторов CTLA-4, PD-1 или PD-L1, упомянутых выше (ипилимумаб, тремелимумаб, лабролизумаб, ниволумаб, пидилизумаб, AMP-244, MEDI-4736, MPDL328 OA, MIH1). Известные ингибиторы данных белков иммунных контрольных точек могут быть использованы как таковые или могут быть использованы аналоги, в частности, химерные, гуманизированные или человеческие формы антител.
Как будет понятно специалисту, для определенных антител, упомянутых выше, могут быть использованы альтернативные и/или эквивалентные названия. Такие альтернативные и/или эквивалентные названия взаимозаменяемы в контексте настоящего изобретения. Например, известно, что ламбролизумаб также известен под альтернативными и эквивалентными названиями MK-3475 и пембролизумаб.
Выбор ингибитора иммунной контрольной точки для ингибиторов PDl и PD-L1, таких как известный упомянутый выше ингибитор PD-1 или PD-L1, является более предпочтительным, и наиболее предпочтительно делают выбор из ингибитора PD-1, такого как ингибитор PDl, упомянутый выше. В предпочтительных воплощениях ингибитор PDl представляет собой ниволумаб или пембролизумаб или другое антитело - антагонист против человеческого PDl.
Изобретение также включает выбор других ингибиторов иммунных контрольных точек, которые, как известно в данной области, стимулируют иммунные ответы. Настоящее изобретение включает ингибиторы, которые прямо или косвенно стимулируют или усиливают антиген-специфичные T-лимфоциты. Данные другие ингибиторы иммунных контрольных точек включают, без ограничения, средства, нацеленные на белки иммунных контрольных точек и пути, включающие PD-L2, LAG3, BTLA, B7H4 и TIM3. Например, ингибиторы человеческого PD-L2, известные в данной области, включают MIH18 (раскрытый в Pfistershammer et al., 2006. Eur J Immunol. 36:1104-13). Другой пример, ингибиторы LAG3, известные в данной области, включают растворимый LAG3 (IMP321 или LAG3-Ig, раскрытые в WO2009044273 и в Brignon et al., 2009. Clin. Cancer Res. 15:6225-6231), а также мышиные или гуманизированные антитела, блокирующие человеческий LAG3 (например, IMP701, раскрытое в или происходящее из WO2008132601), или полностью человеческие антитела, блокирующие человеческий LAG3 (как например, раскрыто в EP 2320940). Предложен другой пример применения блокирующих средств в отношении BTLA, включая, без ограничения, антитела, блокирующие взаимодействие человеческого BTLA со своим лигандом (как например, 4C7, раскрытое в WO2011014438). Предложен еще один пример применения средств, нейтрализующих B7H4, включая, без ограничения, антитела к человеческому B7H4 (раскрытые в WO 2013025779 Al и в WO 2013067492) или растворимые рекомбинантные формы B7H4 (такие, как раскрыто в US20120177645 или клон H74 против B7H4 человека: eBiocience # 14-5948). Предложен еще один пример средств, нейтрализующих B7-H3, включая, без ограничения, антитела, нейтрализующие человеческий B7-H3 (например, MGA271, раскрытое как BRCA84D и производные в US 20120294796) . Предложен еще один пример средств, нацеленных на TIM3, включая, без ограничения, антитела, нацеленные на человеческий TIM3 (например, как раскрыто в WO 2013006490, или блокирующее антитело F38-2E2 против человеческого TIM3, раскрытое Jones et al., J Exp Med. 2008 Nov 24; 205 ( 12 ): 2763-79). Известные ингибиторы белков иммунных контрольных точек могут быть использованы в своей известной форме, или могут быть использованы аналоги, в частности, химерные формы антител, наиболее предпочтительно гуманизированные формы.
Изобретение также включает выбор более чем одного ингибитора иммунной контрольной точки, выбранного из ингибиторов CTLA-4, PD-1 или PDL1 для комбинации с соединением, несущим гликомодифицированный Fc-фрагмент, в пределах разных аспектов изобретения. Например, терапия ипилимумабом (антитело против CTLA4) совместно с ниволумабом (антитело против PDl) показала клиническую активность, которая, по-видимому, отличается от активности, полученной при монотерапии (Wolchok et al., 2013, N. Eng. J. Med., 369:122-33). Также включены сочетания средств, которые, как было показано, улучшают эффективность ингибиторов контрольных точек, таких как лирилумаб (также известный как антитело против KIR, BMS-986015 или IPH2102, как раскрыто в US8119775 и Benson et al., Blood 120:4324-4333 (2012)) в сочетании с ипилимумабом (Rizvi et al., ASCO 2013, и clinicaltrials.gov NCT01750580) или в сочетании с ниволумабом (Sanborn et al., ASCO 2013, и clinicaltrials.gov NCT01714739), средства, нацеленные на LAG3, объединенные с антителом против PD-1 (Woo et al., 2012 Cancer Res. 72:917-27) или антителом против PD-Ll (Butler NS et al., Nat Immunol. 2011 13:188-95), средства, нацеленные на ICOS, в сочетании с антителом против CTLA-4 (Fu et al., Cancer Res. 2011 71:5445-54), или средства, нацеленные на 4-1BB, в сочетании с антителом против CTLA-4 (Curran et al., PLoS One. 2011 6 (4) el 9499).
Согласно настоящему изобретению предпочтительные белки-мишени ингибиторных иммунных контрольных точек охватывают белки, выбранные из группы, содержащей PD-1, PD-L1, PD-L2, BTLA, CTLA-4, A2AR, B7-H3 (CD276), B7-H4 (VTCN1), IDO, KIR, LAG3, TIM-3 и VISTA.
Предпочтительные ингибиторы исследуемого белка ингибиторной иммунной контрольной точки, раскрытые в данном документе, состоят из антител, направленных против указанного исследуемого белка ингибиторной иммунной контрольной точки, и которые ингибируют активность указанного исследуемого белка ингибиторной контрольной точки.
Таким образом, в некоторых предпочтительных воплощениях ингибиторы белков ингибиторных иммунных контрольных точек, которые могут быть использованы согласно настоящему изобретению, охватывают ингибиторы, выбранные из группы, содержащей антитела, направленные на один из PD-1, PD-L1, PD-L2, BTLA, CTLA-4, A2AR, B7-H3 (CD276), B7-H4 (VTCN1), IDO, KIR, LAG3, TIM-3 и VISTA.
Раковые заболевания в пределах настоящего изобретения включают лейкоз, острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, миелобластный промиелоцит, миеломоноцитарный моноцитарный эритролейкоз, хронический лейкоз, хронический миелоцитарный (гранулоцитарный) лейкоз, хронический лимфоцитарный лейкоз, мантийноклеточную лимфому, первичную лимфому центральной нервной системы, лимфому Беркитта и B-клеточную лимфому маргинальной зоны, истинную полицитемию, Лимфому Ходжкина, неходжкинскую лимфому, множественную миелому, макроглобулинемию Вальденстрема, болезнь тяжелых цепей, солидные опухоли, саркомы и карциномы, фибросаркому, миксосаркому, липосаркому, хондросаркому, остеобластическую саркому, остеосаркому, хордому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиому, мезотелиому, саркому Юинга, лейомиосаркому, рабдомиосаркому, саркому толстой кишки, колоректальную карциному, рак поджелудочной железы, рак молочной железы, рак яичника, рак предстательной железы, плоскоклеточную карциному, базальноклеточную карциному, аденокарциному, карциному потовых желез, карциному сальной железы, папиллярную карциному, папиллярную аденокарциному, цистаденокарциному медуллярный рак, бронхогенную карциному, почечно-клеточную карциному, гепатому, карциному желчного протока, хориокарциному, семиному, эмбриональный рак, опухоль Вильма, рак шейки матки, рак матки, опухоль яичка, карциному легкого, мелкоклеточную карциному легкого, немелкоклеточную карциному легкого, карциному мочевого пузыря, эпителиальную карциному, глиому, астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, акустическую невриному, олигодендроглиому, менингиому, меланому, нейробластому, ретинобластому, назофарингеальную карциному, рак пищевода, базальноклеточную карциному, рак желчных протоков, рак мочевого пузыря, рак кости, рак головного мозга и центральной нервной системы (ЦНС), рак шейки матки, хориокарциному, виды колоректального рака, рак соединительной ткани, рак пищеварительной системы, рак эндометрия, рак пищевода, рак глаза, рак головы и шеи, рак желудка, внутриэпителиальное новообразование, рак почки, рак гортани, рак печени, рак легкого (мелкоклеточный, крупноклеточный), меланому, нейробластому, рак ротовой полости (например, губы, языка, ротовой полости и глотки), рак яичника, рак поджелудочной железы, ретинобластому, рабдомиосаркому, рак прямой кишки; рак дыхательной системы, саркому, рак кожи, рак желудка, рак яичка, рак щитовидной железы, рак матки и рак мочевыделительной системы, но не ограничиваются ими.
Фармацевтические композиции и терапевтические способы
Как уже описано в других частях описания настоящего изобретения, соединение, несущее гликомодифицированный Fc-фрагмент, как определено в данном документе, можно преимущественно использовать в ходе комбинированного лечения с одной или более чем одной противораковой терапией и, в особенности, в ходе комбинированного лечения с одним или более чем одним дополнительным противораковым средством, в том числе в ходе комбинированного лечения с одним или более чем одним ингибитором белка ингибиторной иммунной контрольной точки.
Согласно данным воплощениям указанное соединение, несущее гликомодифицированный Fc-фрагмент, и указанное(ые) дополнительное(ые) противораковое(ые) средство(ва) "вводят совместно".
Используемый здесь термин "совместное введение" относится к введению по меньшей мере двух разных веществ, достаточно близко во времени, для модуляции иммунного ответа. Предпочтительно, совместное введение относится к одновременному введению по меньшей мере двух разных веществ.
Таким образом, термин "совместно вводимые" относится к двум или более чем двум компонентам комбинации, вводимой таким образом, что терапевтическое или профилактическое действие указанной комбинации может быть сильнее, чем терапевтическое или профилактическое действие одного из двух компонентов, вводимых по отдельности. Два компонента можно совместно вводить одновременно или последовательно. Одновременно совместно вводимые компоненты могут быть предоставлены в одной или более чем одной фармацевтической композиции. Последовательное совместное введение двух или более чем двух компонентов включает случаи, в которых компоненты вводят таким образом, чтобы каждый компонент мог присутствовать в месте лечения в одно и то же время. В качестве альтернативы, последовательное совместное введение двух компонентов может включать случаи, в которых по меньшей мере один компонент был выведен из места лечения, но по меньшей мере один эффект на клетку от введения данного компонента (например, продукция цитокинов, активация определенной популяции клеток и т.п.) сохраняется в месте лечения до тех пор, пока в место лечения не будет введен один или более чем один дополнительный компонент. Таким образом, совместно вводимая комбинация может, в определенных обстоятельствах, включать компоненты, которые никогда не существуют в химической смеси друг с другом.
В некоторых воплощениях выбранное соединение, несущее гликомодифицированный Fc-фрагмент, и одно или более чем одно дополнительное противораковое средство одновременно вводят раковому индивидууму, подлежащему лечению, и данные два активных вещества могут содержаться в одной и то же фармацевтической композиции или в качестве альтернативы могут содержаться в отдельных фармацевтических композициях. Данные две отдельные фармацевтические композиции могут быть смешаны вместе перед применением и затем введены раковому индивидууму, подлежащему лечению. В других воплощениях данные две фармацевтические композиции могут быть введены раковому индивидууму, подлежащему лечению, за короткий временной интервал, например, в пределах временного интервала 2-5 минут.
Настоящее изобретение дополнительно относится к фармацевтической композиции, содержащей (i) соединение, несущее гликомодифицированный Fc-фрагмент, и (ii) одно или более чем одно отличное противораковое средство.
Настоящее изобретение охватывает фармацевтическую композицию, содержащую (i) соединение, несущее гликомодифицированный Fc-фрагмент, и (ii) один или более чем один ингибитор белка ингибиторной иммунной контрольной точки.
В некоторых предпочтительных воплощениях указанное соединение, несущее гликомодифицированный Fc-фрагмент, представляет собой гликомодифицированное антитело, направленное против опухолевого антигена.
В некоторых воплощениях опухолевый антиген выбран из группы, состоящей из HER2, HER3, HER4 и AMHRII.
В некоторых воплощениях указанное гликомодифицированное антитело выбрано из группы, состоящей из гликомодифицированных антител под названием 3C23K или их варианта, 9F7F11, H4B121 и HE4B33, которые подробно раскрыты в настоящем описании изобретения.
В некоторых воплощениях указанный ингибитор белка ингибиторной иммунной контрольной точки выбран из группы, состоящей из ингибиторов PD-1, PD-L1, PD-L2, BTLA, CTLA-4, A2AR, B7-H3 (CD276), B7-H4 (VTCN1), IDO, KIR, LAG3, TIM-3 и VISTA.
В некоторых воплощениях указанный ингибитор состоит из антитела, направленного против указанного белка ингибиторной иммунной контрольной точки, или его антигенсвязывающего фрагмента.
Способы получения и введения субъекту соединений, несущих гликомодифицированные Fc, и в более общем смысле пептидов по настоящему раскрытию хорошо известны или легко определяются специалистами в данной области. Путь введения полипептидов согласно настоящему раскрытию может быть пероральным, парентеральным, ингаляционным или местным. Используемый здесь термин "парентеральное" включает внутривенное, внутриартериальное, внутриперитонеальное, внутримышечное, подкожное, ректальное или вагинальное введение. В то время как все данные виды введения явно рассматриваются как находящиеся в пределах объема настоящего раскрытия, форма для введения могла бы представлять собой раствор для инъекции, в частности, для внутривенной или внутриартериальной инъекции или капли. Обычно, подходящая фармацевтическая композиция для инъекции может содержать буфер (например, ацетатный, фосфатный или цитратный буфер), поверхностно-активное вещество (например, полисорбат), возможно стабилизатор (например, человеческий альбумин) и т.д. Однако в других способах, совместимых с настоящим изобретением, соединения, несущие гликомодифицированный Fc, могут быть доставлены прямо к месту неблагоприятных клеточных популяций, усиливая, таким образом, воздействие на больную ткань терапевтического средства.
Препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примеры неводных растворителей представляют собой пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, включая физиологический раствор и буферизованные среды. В композициях и способах по настоящему раскрытию фармацевтически приемлемые носители включают 0,01-0,1 M или 0,05 M фосфатный буфер или 0,8% физиологический раствор, но не ограничиваются ими. Другие общепринятые парентеральные носители включают растворы фосфата натрия, декстрозу Рингера, декстрозу и хлорид натрия, лактат Рингера или нелетучие масла. Внутривенные носители включают жидкие и питательные наполнители, наполнители на основе электролитов, такие как наполнители на основе декстрозы Рингера, и тому подобное. Также могут быть представлены консерванты и другие добавки, такие как, например, противомикробные препараты, антиоксиданты, хелатирующие агенты и инертные газы и т.п. Более конкретно, фармацевтические композиции, подходящие для инъецируемого применения, включают стерильные водные растворы (в случаях, когда водорастворимые) или дисперсии и стерильные порошки для экстемпорального приготовления стерильных инъецируемых растворов или дисперсий. В таких случаях композиция должна быть стерильной и должна быть жидкостью до такой степени, чтобы мочь легко вводиться через шприц. Она должна быть стабильной в условиях изготовления и хранения и также должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п) и их подходящие смеси. Соответствующую текучесть можно поддерживать, например, посредством применения покрытия, такого как лецитин, посредством поддержания требуемого размера частиц в случае дисперсии и посредством применения поверхностно-активных веществ.
В любом случае, стерильные инъецируемые растворы могут быть получены в результате включения активного соединения (например, собственно соединения, несущего гликомодифицированный Fc-фрагмент, или в сочетании с другими активными веществами) в требуемом количестве в соответствующем растворителе с одним ингредиентом или комбинацией ингредиентов, перечисленных в данном документе, при необходимости, с последующей стерилизацией на фильтре. В общем, дисперсии получают посредством включения активного соединения в стерильный носитель, который содержит основную дисперсионную среду и требуемые другие ингредиенты из ингредиентов, перечисленых выше. В случае стерильных порошков для получения стерильных инъецируемых растворов, способы получения обычно включают вакуумную сушку и лиофильную сушку, которые приводят к получению порошка активного ингредиента плюс любого дополнительного желательного ингредиента из его раствора, ранее стерилизованного на фильтре. Препараты для инъекций обрабатывают, наполняют ими контейнеры, такие как ампулы, пакетики, бутыли, шприцы или флаконы, и герметично закрывают в стерильных условиях в соответствии со способами, известными в данной области. Кроме того, препараты могут быть упакованы и продаваться в виде набора, такого как наборы, описанные в заявках на патент США US 09/259337 и US 09/259338, каждая из которых включена в данный документ посредством ссылки.
Эффективные дозы композиций по настоящему изобретению для лечения описанных выше состояний варьируют в зависимости от многих разных факторов, включая средства введения, мишень, физиологическое состояние пациента, является ли пациент человеком или животным, других вводимых лекарственных средств, и того, является ли лечение профилактическим или терапевтическим. Обычно, пациент представляет собой человека, но также можно лечить млекопитающих, не являющихся человеком, включая трансгенных млекопитающих. Дозировки лечения можно подбирать с использованием распространенных способов, известных специалистам в данной области, с оптимизацией безопасности и эффективности.
Соединения, несущие гликомодифицированный Fc-фрагмент, по настоящему раскрытию можно вводить многократно. Интервалы между единичными дозировками могут быть еженедельными, ежемесячными или ежегодными. Интервалы могут быть также нерегулярными, как указано посредством измерения уровней указанного соединения, несущего гликомодифицированный Fc-фрагмент, в крови у пациента. В некоторых способах дозировку регулируют для достижения концентрации соединения, несущего гликомодифицированный Fc-фрагмент, в плазме и в особенности концентрации гликомодифицированного антитела, составляющей 1-1000 мкг/мл и в некоторых способах 25-300 мкг/мл. В качестве альтернативы, соединения, несущие гликомодифицированный Fc-фрагмент, могут быть введены в виде композиции с замедленным высвобождением, в случае чего требуется менее частое введение. В случае гликомодифицированных антител дозировка и частота варьируют в зависимости от периода полувыведения антитела у пациента. В общем, гуманизированные антитела демонстрируют самый продолжительный период полувыведения, за которыми следуют химерные антитела и антитела, не являющиеся человеческими.
Фармацевтические композиции согласно настоящему раскрытию обычно включают фармацевтически приемлемый, нетоксичный, стерильный носитель, такой как физиологический раствор, нетоксичные буферы, консерванты и т.п. Для целей настоящей заявки фармацевтически эффективное количество соединения, несущего гликомодифицированный Fc-фрагмент, будет означать количество, достаточное для достижения полезного эффекта, например, для уменьшения или блокирования состояния иммуносупрессии, встречающегося у ракового пациента. Конечно, фармацевтические композиции по настоящему изобретению могут быть введены в единичных или многократных дозах для обеспечения фармацевтически эффективного количества соединения, несущего гликомодифицированный Fc-фрагмент.
ПРИМЕРЫ
Пример 1: Синтез соединения, несущего гликомодифицированный Fc-фрагмент
A. Материалы и методы
Клонирование химерного 12G4, гуманизированного 12G4 и 3C23K
Химерное 12G4 (ch12G4) конструировали и экспрессировали, как описано ранее (27). Кратко, ДНК-последовательности VL и VH последовательно субклонировали в полицистронный вектор CHK622-08, который содержит промотор, последовательность Козака и последовательности константных областей каппа/IgG1 человека.
ДНК-последовательности, кодирующие гуманизированные VL и VH 12G4 (h12G4), синтезировали с использованием Genscript и затем клонировали в CHK622-08 посредством расщепления и лигирования, как описано выше, что приводило к получению вектора HK622-18. ДНК-последовательности, кодирующие VL и VH 3C23K с созревшей аффинностью, получали посредством направленного мутагенеза фагового клона 3C23 с введением мутации VL E68K. Сигнальные пептиды добавляли посредством ПЦР-сборки с использованием гуманизированных вариабельных областей h12G4 в качестве матрицы и затем клонировали в HK622-18, как описано выше. Полученный вектор, который экспрессирует гуманизированное антитело 3C23K с созревшей аффинностью, называли HK622-18 MAO 3C23K.
Получение и очистка ch12G4, h12G4 и 3C23K
Разные молекулы стабильно экспрессировали, как описано ранее (Siberil et al., 2006, Clin Immunol Orlando Fla, Vol 118 : 170-179). Клетки CHO-S, HEK293 или YB2/0 стабильно трансфицировали соответствующими линеаризованными экспрессионными векторами. Антитела Ch12G4, h12G4 и 3C23K получали в клетке YB2/0 с использованием EMS (Invitrogen), 5% фетальной телячьей сыворотки (FCS) с сверхнизким уровнем IgG (PAA) и 0,5 г/л G418 на протяжении 5-7 суток. 3C23K-CHO-S получали в клетках CHO-S с использованием ProCHO4 (Lonza), 4 мМ глутамина и 1 г/л G418 на протяжении 7 суток.
MAb очищали из супернатантов культуры посредством аффинной хроматографии с использованием сефарозы с белком A (GE-Healthcare). Уровни агрегатов и эндотоксинов определяли посредством гель-фильтрации на Superdex HR/200 (GE-Healthcare) и посредством ЛАЛ-теста (лизат амебоцитов Limulus), соответственно. Качество и чистоту антител отслеживали посредством SDS-PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия) и окрашивания Кумасси. Кроме того, профили гликозилирования и процентное содержание центральной фукозы каждого очищенного антитела определяли посредством лазер-индуцируемой флуоресценции - высокоэффективного капиллярного электрофореза (HPCE-Lif) (51).
SPR-анализ
SPR (surface plasmon resonance - поверхностный плазмонный резонанс)-анализы проводили на приборе Bia3000 или T200 при 25°C в HBS-EP (GE Healthcare). Для измерений аффинности осуществляли ковалентную иммобилизацию MISRII (1000 RU) на сенсорном чипе CM5 с использованием активации EDC/NHS в соответствии с инструкциями изготовителя (GE Healthcare). Разные концентрации (0,5-128 нМ) 12G4 или 3C23K инъецировали на иммобилизованный рецептор в течение 180 секунд. После 400 секунд диссоциации в подвижном буфере сенсорный чип регенерировали, используя Gly-HCl pH 1,7. Значения KD, принимая во внимание аффинность и авидность, рассчитывали с использованием модели подгонки Ленгмюра 1:1 (BiaEvaluation3.2, GE Healthcare). Измерения комплекса антитело-FcγR проводили посредством титрования за один цикл при 100 мкл/мин на FcγR (Sigma), захваченном на антителе против His (R&D Systems), ковалентно иммобилизованном на уровне 4000-5000 RU. Гамма-рецептор инъецировали на уровне 20 нМ на протяжении 60 секунд, и инъецировали пять возрастающих концентраций антитела (время инъекции составляло 60 секунд). После стадии диссоциации, составляющей 600 секунд в подвижном буфере, поверхности сенсора регенерировали, используя 5 мкл раствора Глицин-HCl, pH 1,7. Кинетические параметры оценивали по сенсограммам с ипользованием неоднородных моделей подгонки лиганда или устойчивого состояния на пробном выпуске программного обеспечения T200 3,0 (GE healthcare). Все сенсограммы корректировали посредством вычитания слабого сигнала из контрольной референсной поверхности (без какого-либо иммобилизованного белка) и холостых инъекций буфера перед оцениванием подгонки.
Антитела
Мышиное MAb 12G4 против MISRII было описано Salhi et al. и Kersual et al. (17,22). В качестве нерелевантных антител использовали антиидиотипическое MAb EMABling®против химерного IgG1 к фактору VIII R565 и MAb 35A7 против CEA (17).
Результаты
Химеризация, гуманизация и созревание аффинности
Гуманизированное антитело 3C23K исходно получали из вариабельных областей мышиного MAb 12G4 (Sahli et al., 2004, Biochem J, Vol. 379 : 785-793). Процедура гуманизации включала прививку CDR (MAb h12G4) и созревание аффинности посредством случайного мутагенеза и фагового дисплея, что приводило к конечной молекуле 3C23K.
На первой стадии матрицы-кандидаты человека для прививки CDR идентифицировали посредством введения по отдельности последовательностей доменов VL и VH в поисковую программу IMGT/DomainGapAlign (28) и посредством сведения поиска к последовательностям человека в IMGT/GENE-DB (29). Ближайший ген VH человека, IGHV1-3*01, демонстрировал 67,34% инентичности с мышиным аналогом. Данная идентичность возрастала вплоть до 92,85% после прививки мышиных CDR-IMGT 12G4 в FR-IMGT человека. Ближайший ген VL человека, IGK1-9*01, демонстрировал 62,76% идентичности с мышиным аналогом. Однако, IGKV1-5*01 являлся предпочтительным, поскольку инструмент IMGT/GeneFrequency (28) указывал на то, что IGK1-9*01 не очень часто экспрессируется. IGKV1-5*01 обладает идентичностью 58,51% с VL 12G4, которая повышалась до 88,29% после прививки.
Для лучшего определения характеристик связывания клон 3C23K преобразовывали в виде антитела IgG1, продуцируемого в клетках YB2/0, и анализировали посредством поверхностного плазмонного резонанса (SPR). Антитело 3C23K демонстрировало более высокую аффинность связывания (KD составляет 5,5x10-11 M), чем мышиное 12G4 (KD составляет 7,9x10-10 M). Данное последнее значение было очень близким со значением, опубликованным в исходном описании MAb 12G4 (KD составляет 8,6x10-10 M) (22). Увеличение аффинности связывания также подтвержали посредством проточной цитометрии с использованием клеток COV434-MISRII.
Получение 3C23K в клетках YB2/0, CHO или HEK293, анализ гликозилирования и влияние на связывание с рецепторами Fcγ
С помощью анализа олигосахаридов 3C23K, экспрессируемого в клетках YB2/0 (версия EMABling®; 3C23K) (27), CHO-S (3C23K-CHO) или HEK293 (3C23K-HEK293) (используемых в качестве клеток сравнения для функциональных анализов), обнаружили два четко различающихся профиля гликозилирования. Процентные содержания фукозилированных, галактозилированных и бисектных GlcNAc изоформ составляли 33,0%, 57,2% и 1,8% для 3C23K и 94,6%, 54,4% и 2,0% для 3C23K-CHO, соответственно. Влияние данных различий в гликозилировании на связывание с FcγR анализировали посредством SPR. Аффинность связывания для hFcγRIIIa и hFcγRIIIb четко повышалась после уменьшения уровня фукозы (1-12 нМ и 86,0 нМ для 3C23K, по сравнению с 31-164 нМ и 378 нМ для 3C23K-HEK293, соответственно), но не для других FcγR (hFcγRI, hFcγRIIa, hFcγRIIb) (см. также Таблицу 2 в Примере 2 ниже).
Затем, 3C23K экспрессировали в клетках YB2/0 с использованием технологии EMABling® с увеличением взаимодействия антитела с Fc-рецептором CD16 с низкой/средней аффинностью, который главным образом экспрессируется на NK-клетках и макрофагах (Siberil et al., 2006, Clin Immunol Orlando Fla, Vol. 118 : 170-179). Даннное свойство связано с более низким уровнем экспрессии гена Fut8 в клетках миеломы крысы YB2/0 по сравнению с другими широко используемыми линиями клеток, таких как клетки CHO ((Siberil et al., 2006, Clin Immunol Orlando Fla, Vol. 118 : 170-179).
Как ожидалось, 3C23K-YB2/0 демонстрировали более высокую аффинность связывания в отношении CD16, чем 3C23K с высоким содержанием фукозы.
Пример 2: Анализ гликанов антитела 3C23K (GM102)
Исходная информация:
GM102 представляет собой гуманизированное моноклональное антитело, продуцируемое в клетках YB2/0 (гибридома крысы YB2/3HL), с использованием клона 18H2.
Углеводные группы расположены на ASN295 тяжелой цепи.
а) Результаты анализа гликанов для GM102: - Таблица 2
б) Характеристика референсного стандартного PB01
С помощью анализа данных углеводных остатков посредством СВЭЖХ (сверхэффективная жидкостная хроматография)-HILIC (жидкостная хроматография гидрофильных взаимодействий)-FD после N-дегликозилирования посредством PNGазы F и мечения высвобожденных углеводных остатков обнаружили наличие 6 главных углеводных группировок:
1. нефукозилированные (G0) 51,1%
2. фукозилированные (G0F) 12,8%
3. моногалактозилированные нефукозилированные (G1)10,2%
4. моногалактозилированные фукозилированные (G1F) 4,3 %
5. агликозилированные нефукозилированные (G0B) 9,9%
6. фукозилированные с бисектным GlcNAc (G0FB) 3,4%
Общее содержание фукозилированных остатков составило 23%.
Таблица 3: Сопоставимость основных форм N-гликозилирования в PB#01 реф. и LC#02
Пример 3: Высокая аффинность соединений, несущих гликомодифицированный Fc-фрагмент, в отношении Fc-рецепторов
A. Материалы и методы
Анализ на основе поверхностного плазмонного резонанса (SPR):
Антитела против гистидина (R&D Systems) иммобилизовали на приборе T200 при 25°C в HBS-EP при скорости потока 10 мкл/мин на сенсорном чипе CM5 с использованием активации EDC/NHS в соответствии с инструкциями изготовителя (GE Healthcare). Их ковалентно иммобилизовали на уровне 6900RU в проточной ячейке Fc2, и получали контрольную референсную поверхность (проточной ячейки Fc1) с использованием такой же химической обработки, но без антител против His.
Все кинетические измерения в Fc1 и Fc2 проводили посредством титрования за один цикл на приборе T200 при 25°C в HBS-EP при 100 мкл/мин. Каждый человеческий гамма-рецептор (R&D Systems) был захвачен на иммобилизованных антителах против His при 20 нМ в течение 60 с. Инъецировали пять возрастающих концентраций антитела (время инъекции составляло 120 с). После стадии диссоциаци 600 с в подвижном буфере поверхности сенсора регенерировали используя 5 мкл раствора глицин-HCl, pH 1,7. Все сенсограммы корректировали посредством вычитания слабого сигнала из контрольной референсной поверхности и холостых инъекций буфера. Кинетические параметры оценивали на основе сенсограмм, используя неоднородные модели лиганда или модели двух состояний на пробном выпуске программы T200.
Б. Результаты
Результаты измерения констант аффинности (Kd) гипофукозилированного антитела 3C23K против AMHRII в отношении человеческих Fc-рецепторов изображены ниже в Таблице 4.
Таблица 4
Константы аффинности выражены как KD в нМ.
* KD рассчитывали посредством использования неоднородной модели подгонки лиганда.
** значения KD определяли посредством модели реакции двух состояний, когда подгонка не подчинялась неоднородной модели лиганда.
Пример 4: Антитело со сниженным содержанием фукозы блокирует опухолеассоциированную иммуносупрессию, индуцируемую макрофагами, при раке
A. Материалы и методы
Иммунологический анализ in vitro:
Анализ пролиферации T-клеток проводили, как указано ниже. Кратко, CMFDA-(5-хлорметилфлуоресцеин диацетат) окрашенные COV434-AMHRII обрабатывали 1 ч при 4°C 10 мкг/мл нерелевантного mAb R565, либо антитела FcKO против AMHRII, либо mAb 3C23K против AMHRII, и инкубировали с неокрашенными MDM2 в течение 4 суток перед добавлением окрашенных CellTrace Violet (Molecular Probes®, Life Technologies™) T-клеток, предварительно активированных CD3/CD28 магнитными микрочастицами Dynabeads в соотношении MDM2:T-клетка 1:8. После 4 суток периода дополнительной инкубации клетки собирали и окрашивали антителом PerCP против CD8, антителом PE-Cy7 против CD11b и антителом AF647 против CD4 (BD Pharmingen®) перед анализом на основе проточной цитометрии. Погибшие клетки исключали посредством окрашивания закрепляемым красителем для определения жизнеспособности eFluor® 506 (eBioscience®) перед окрашиваниями антителами. Пролиферацию T-клеток анализировали на CD8+ (CD11b-) гейтированных T-клетках посредством измерения разведения CellTrace Violet, соответствующего делениям клеток. Индекс деления, эквивалентный среднему числу делений клеток, которому подвергалась клетка в исходной популяции, рассчитывали с помощью FlowJo (TreeStar, версия 7.6.5). Рассчитывали индекс деления, эквивалентный среднему числу делений клеток, которому подвергалась клетка в исходной популяции.
Б. Результаты
Четко установлено, что макрофаги в опухолях подавляют T-клеточные противоопухолевые активности. Авторы изобретения выдвинули гипотезу о том, что взаимодействие макрофагов с антителом 3C23K против AMHRII меняет их супрессорную функцию в отношении T-клеток. Для проверки данной гипотезы клетки-мишени COV434-AMHRII обрабатывали либо нерелевантным mAb R565, или mAb FcKO против AMHRII или 3C23K против AMHRII и сокультивировали с MDM в течение 4 суток перед добавлением PBT, предварительно активированных CD3/CD28. Пролиферацию CD8+ T- клеток анализировали посредством проточной цитометрии. Как и ожидалось, в присутствии контрольных mAb (нерелевантные mAb изотипического контроля R565 и mAb FcKO против AMHRII) или при отсутствии обработки, MDM сильно повреждали пролиферацию T-клеток. Следует отметить, MDM-опосредованная иммуносупрессия T-клеток значимо уменьшалась, когда сокультивируемые опухолевые клетки обрабатывали mAb 3C23K против AMHRII, как видно из большого увеличения индекса деления CD8 T-клеток (Фиг. 1A).
Уменьшение числа опухолевых клеток может частично объяснять данный "иммуностимулирующий" эффект, поскольку опухолевые клетки, как известно, осуществляют супрессорные функции в отношении T-клеток. Для проверки того, может ли mAb 3C23K против AMHRII также воздействовать на MDM, делая их менее иммуносупрессивными, авторы изобретения спланировали эксперимент без опухолевых клеток. Полистироловые микрочастицы Inert Sphero® использовали в качестве замены для опухолевых клеток-мишеней. Данные микрочастицы обрабатывали mAb на фоне тех же опухолевых клеток, то есть MDM сначала сокультивировали с микрочастицами, обработанными mAb, перед сокультивацией с активированными PBT. В данных условиях пролиферация CD8+ T-клеток частично восстанавливалась, когда MDM сокультивировали с полистироловыми микрочастицами Sphero®, покрытыми 3C23K (Фиг. 1B). В качестве контроля авторы изобретения проверяли, что 3C23K не влияло на пролиферацию T-клеток, наблюдаемую при отсутсвии MDM (Фиг. 2). Данные эксперименты дают веские основания полагать, что 3C23K непосредственно меняет супрессорную способность MDM в отношении T-клеток.
В общем, данные результаты демонстрируют, что гуманизированное гликомодифицированное моноклональное антитело 3C23K против AMHRII эффективно нацелено на опухолевые клетки-мишени посредством антигенсвязывающего сайта и направлено на проопухолевые макрофаги против опухолевых клеток посредством распознавания Fc-домена. Таким образом, mAb-активированные макрофаги стимулируют ADCC и ADCP (антителозависимый клеточный фагоцитоз) против опухолевых клеток, и они ослабляли свое иммуносупрессивное поведение в отношении T-клеток.
Обсуждение результатов
ADCC/ADCP может быть не единственным механизмом, индуцируемым макрофагами при обработке mAb. Опухолеассоциированные макрофаги, как было описано, подавляют активацию T-клеток (Biswas et al., 2010, Nat. Immunol., Vol. 11 (n°10) : 889-896), и настоящие данные, демонстрирующие контактирования лимфоцитов и макрофагов, подтверждают идею о прямом перекрестном взаимодействии между обоими типами клеток. Используя анализы in vitro, авторы изобретения обнаружили, что взаимодействие FcR с 3C23K сокращает иммуносупрессивный фенотип макрофагов. В таких условиях предварительно активированные T-клетки восстанавливают свою пролиферативную способность, которая была блокирована при отсутствии 3C23K. Представление о том, что терапевтические mAb могут активировать иммунные клетки врожденного иммунитета, а также иммунные клетки приобретенного иммунитета, согласуется с ранними исследованиями. В моделях опухоли мыши было продемонстрировано, что обработка Ab против опухолевых антигенов вызывала клеточный иммунный ответ с участием T-клеток, который требовался для длительной выживаемости (Montalvao et al., 2013, J Clin Invest, Vol. 123 : 5098-5103; Gül et al., 2014, J clin Invest, Vol. 124 : 812-823). Однако, индукция приобретенных иммунных ответов у раковых пациентов, которые прошли лечение противоопухолевыми mAb, еще широко не исследована.
Механизм, посредством которого 3C23K меняет фенотип макрофагов, ослабляя T-клеточную супрессию, на данный момент не известен. Однако, могут быть выработаны разные гипотезы. Было показано, что взаимодействие антител с Fc-рецепторами, экспрессируемыми макрофагами, запускает несколько сигнальных каскадов, которые регулируют функцию данных клеток (Biswas et al., 2010, Nat. Immunol., Vol. 11 (n°10) : 889-896). Предварительные данные авторов настоящего изобретения показывают, что макрофаги, активированные в результате взаимодействия FcR с 3C23K, продуцируют несколько провоспалительных цитокинов, включая IL-1 бета и IL-6, которые, как было описано, оказывают полезное действие на T-клетки (Grugan et al., 2012, J Immunol., Vol. 189 : 5457-5466). Непрямое действие также возможно. В частности, гибель опухолевых клеток может приводить к высвобождению нескольких молекул молекулярных фрагментов, ассоциированных с повреждениями (DAMP), таких как кальретикулин, который, в свою очередь, активирует иммунные клетки врожденного и приобретенного иммунитета (Yatim et al., 2017, Nat Rev Immunol, Vol. 17(n°4) : 262-275). Роль дендритных клеток в опосредовании данной иммуногенной гибели клеток хорошо описана. Данные также указывают на то, что кальретикулин, высвобождаемый во время гибели клеток, активирует макрофаги, которые продуцируют IL-6 и TNF-α, склонные к оказанию положительного действия на T-клетки (Duo et al., 2014, Int J Mol Sci, Vol. 15(n°2) : 2916-2928).
Пример 5: Активация TAM-подобных макрофагов гликомодифицированным соединением, несущим Fc
A. Материалы и методы
Получение человеческих макрофагов моноцитарного происхождения
Мононуклеарные клетки периферической крови (PBMC) получали от здоровых доноров крови
PBMC выделяли классическим способом, используя позитивную магнитную селекцию CD14+ клеток. Моноциты культивировали при 37°C, 5% CO2 в RPMI, подолненной 10% эмбриональной телячьей сывороткой, затем дифференцировали в макрофаги типа M2 посредством добавления 50 нг/мл M-CSF (макрофагальный колониестимулирующий фактор) в течение 4 суток. Фенотип превращенных макрофагов типа M2 представляет собой CD14выс., CD163выс., IL10выс., IL12низк.
Активация in vitro макрофагов под действием антител
10 мкг/мл раствора фукозилированного на низком уровне антитела против AMHRII, называемого R18H2, или его аналога FcKO, без какого-либо связывания с Fcγ-рецепторами, адсорбировали на 24-луночных планшетах посредством инкубации при 4°C в течение 24 часов. Данные экспериментальные условия имитировали ситуацию, когда антитела распознают свой антиген. Несвязанные антитела отбрасывали в результате промывки раствором PBS. Макрофаги типа M2 (106 клеток/мл культуральной среды) затем инкубировали при 37°C в течение 1- 3 суток в лунках, покрытых антителами (или нет в случае отрицательного контроля).
Анализ макрофагов после активации антителами
Макрофаги, инкубируемые с антителами, стимулируют 100 нг/мл LPS (липополисахарид) на протяжении 6 или 24 часов перед анализом посредством, соответственно, ПЦР в реальном времени или проточной цитометрии. Транскрипцию генов PDGFα, VEGFβ, HGF, TGFβ, IDO1, IL10, Sepp1, Stab1, FOLR2, CD64a, CD64b и CD16a количественно оценивали и нормализовали с использованием генов RPS18, B2M и EF1a в качестве референсных генов.
Изменение экспрессии подтверждали на уровне белка посредством проточной цитометрии для мембранных белков, экспрессируемых макрофагами, и, для растворимых факторов, таких как IL10, IL1β или TNFα, посредством классического анализа ELISA (твердофазный иммуноферментный анализ) с образцами из культуральных сред.
Б. Результаты
Антитела, адсорбированные на многолуночных планшетах, дифференцировано стимулировали макрофаги типа M2, в зависимости от их способности связываться с Fcγ-рецепторами макрофагов. В целом, когда макрофаги типа M2 культивировали в лунках без какого-либо антитела, не наблюдали никакого значимого изменения маркеров. С антителом FcKO наблюдали только незначительное изменение, что соответствовало неспецифичному связыванию данных белков с макрофагами. Напротив, когда макрофаги взаимодействовали с фукозилированным на низком уровне антителом R18H2, явное уменьшение определенных классических маркеров макрофагов типа M2, таких как Sepp1, Stab1, FOLFR2 и CD163, происходило после 3 суток инкубации, как показано на Фиг. 3А. Данные изменения указывают на то, что тип макрофагов мог меняться при стимуляции фукозилированным на низком уровне антителом. Данные изменения сопровождались повышением уровня Fcγ-рецепторов, которые связываются с антителами и участвуют в ADCC и фагоцитозе, подобно CD16 (Фиг. 3B) и CD64 (Фиг. 3C).
Интересно, что профиль цитокинов и растворимых пептидов, выявляемый в культуральной среде макрофагов M2 после 3 суток с антителом R18H2, фукозилированным на низком уровне, привел к обнаружению явного повышения уровня провоспалительных факторов, обычно экспрессируемых макрофагами M1, такими как TNFβ, IL1β (Фиг. 3D) или IL6 (данные не показаны). Кроме того, также наблюдали снижение уровня иммуносупрессирующих факторов, подобно TGFβ, IDO1 и IL10 (Фиг. 3E, Фиг. 3F, Фиг. 3G), и проангиогенных факторов, подобно PDGFα, VEGFβ и HGF (Фиг. 3H, Фиг. 3I, Фиг. 3J).
Кроме того, снижение уровня экспрессии PDL2 на поверхности макрофагов M2 при стимуляции антителом R18H2 с низким уровнем фукозилирования (как показано на Фиг. 3K), вместе со снижением уровня IL10, указывает на тенденцию к меньшей иммуномупрессивную активности данных макрофагов с модифицированным фенотипом.
В общем итоге, данные результаты показали, что связывание антител с низким содержанием фукозы с макрофагами M2, приводит к сдвигу к промежуточному фенотипу макрофагов, между M2 и M1, и к изменениям нескольких факторов, приводя к непрямому противоопухолевому действию через ингибирование ангиогенеза и стимуляцию иммунной системы.
Пример 6: Антитело 3C23K блокирует иммуносупрессию, что приводит к активации иммунной системы
А. Материалы и методы
Получение человеческих макрофагов моноцитарного происхождения (MDM)
Мононуклеарные клетки периферической крови (PBMC) получали от здоровых доноров крови (Etablissement Français de Sang, EFS).
Человеческие моноциты выделяли из PBMC с использованием набора для выделения моноцитов II при негативной селекции (Macs Miltenyi), как рекомендовано протоколом изготовителя. Моноциты культивировали при 37°C и 5% CO2 в SFM для макрофагов (бессывороточная среда) (Gibco) с добавлением L-глутамина (Invitrogen) и пенициллина/стрептомицина (PS, Invitrogen).
Выделенные моноциты хранили недифференцированными (NS, нестимулированными) или дифференцировали в противоопухолевые (M1-подобные) или проопухолевые макрофаги (TMA-подобные) на протяжении трех суток посредством стимулирования IFN-γ (интерферон гамма) (Macs Miltenyi, 100 ед./мл) плюс LPS (100 нг/мл, Sigma) или M-CSF (Macs Miltenyi, 200 ед./мл) плюс IL-10 (Macs Miltenyi, 50 ед./мл) соответственно.
Анализ антителозависимой клеточной цитотоксичности (ADCC)
SKOV-R2+ клетки предварительно обрабатывали при 4°C 10 мкг/мл антител против AMHRII: GM102 (также называемое 3C23K-YB20), 3C23K-CHO или 3C23K-FcKO. SKOV-R2+ клетки-мишени загружали BATDA (бис-ацетоксиметил-2,2′:6′,2″-терпиридин-6,6″-дикарбоксилат), ресуспендировали в DMEM (среда Иглу, модифицированная по Дульбекко) (Gibco), дополненной L-глутамином, PS и 10% инактивированной нагреванием FCS, и добавляли в эффекторные клетки (макрофаги человека) в соотношении 1:1, при 37°C на 4 ч.
ADCC измеряли посредством использования анализа цитотоксичности на основе EuTDA DELFIA (усиленный диссоциацией лантанидный флуоресцентный иммуноанализ) (PerkinElmer). После 4 ч инкубации мишени и эффекторных клеток супернатант инкубировали с раствором Eu3+, и измеряли флуоресценцию (Envision, PerkinElmer). Данные относили к максимальному (клетки-мишени с Triton) и минимальному (только эффекторные клетки) лизису и подгоняли к сигмоидальной модели "доза-ответ".
Оценка посредством проточной цитометрии цитотоксического действия макрофагов c антителами на линию опухолевых клеток карциномы яичника (SKOV-R2+ клетки)
SKOV-R2+ клетки окрашивали с помощью набора для определения пролиферации клеток CellTraceTM Violet (Molecular Probes™, Life technology), ресуспендировали в среде Иглу, модифицированной по Дульбекко (DMEM, Gibco), дополненной L-глутамином, PS и 10% инактивированной нагреванием фетальной телячьей сывороткой (FCS, Sigma), и добавляли к каждому типу макрофагов человека в соотношении 1:1 в присутствии каждого из 3 антител против AMHRII.
Для оценки числа и пролиферации SKOV-R2+ клеток предварительно обработанные или необработанные макрофаги человека активировали опухолевыми клетками на протяжении 3, 4 и 5 суток. Число SKOV-R2+ клеток рассчитывали посредством выявления флуоресцентно меченых клеток, и их пролиферацию оценивали посредством разведения CellTrace.
Популяцию 10000 клеток анализировали для каждой экспериментальной точки. Все анализы проводили в проточном цитометре BD Fortessa с программным обеспечением Diva, за исключением разведения CellTrace, анализируемого посредством использования программного обеспечения Modfit.
Оценка дифференцировки макрофагов посредством выявления экспрессии рецепторов на макрофагах человека
Экспрессию рецепторов (CD11b, CD163, CD36, CD206, CD14, CD16, CD32, CD64, CD80, CD282) оценивали посредством проточной цитометрии в мембране макрофагов человека после (i) дифференциации и после (ii) 3 суток сокультивирования дифференцированных макрофагов человека и SKOV-R2+ опухолевых клеток (обрабатанных разными антителами против AMHRII).
Рецепторы выявляли, используя Cd11b-FITC, CD163-PE, CD36-PE, CD206-APC, CD16-VioBright 515, CD64-PerCP-Vio700, CD80-PE, CD32-PE-Vio770, CD282 (TLR2)-APC, CD14-APC-Vio770 (Miltenyi), и сравнивали с соответствующим изотипическим контролем.
Популяцию 10000 клеток анализировали для каждой экспериментальной точки. Мертвые клетки (позитивные клетки) удаляли из анализа после мечения закрепляемым красителем для выявления жизнеспособности (Miltenyi). Анализы проводили с сортировкой CD14 или Cd11b позитивных клеток. Все анализы проводили на проточном цитометре BD Fortessa с программным обеспечением Diva.
Поляризация Th1/Th2 T-CD4 и активация T-CD8
Человеческие T-клетки выделяли из PBMC с использованием набора для выделения T-клеток Pan (Macs Miltenyi) при негативной селекции, как рекомендовано протоколом изготовителя. После выделения клетки окрашивали набором для выявления пролиферации клеток CellTraceTM Violet (Molecular Probes™, Life technology), ресуспендировали в среде RPMI 1640 (Gibco) с добавлением L-глутамина, PS и 10% инактивированной нагреванием FCS, и добавляли в сокультуру макрофагов человека и SKOV-R2+ опухолевых клеток (обработанных разными антителами против AMHRII, упомянутыми выше), в соотношении 1:8 на 4 суток.
Для оценки поляризации Th1/Th2 T-CD4 T-клетки метили CD183 (CD183 (CXCR3)-APC, Miltenyi), и анализы проводили с сортировкой CD4 позитивных клеток (CD4-VioBright FITC, Miltenyi).
Для оценки активации T-CD8 T-клетки метили CD183 (CD183 (CXCR3)-APC, Miltenyi) и CD25 (CD25-PE, Miltenyi), и анализы проводили с сортировкой CD8 позитивных клеток (CD8-PE-Vio770, Miltenyi).
Пролиферацию T-CD4 и T-CD8 клеток оценивали посредством разведения CellTrace, и анализы проводили с сортировкой CD4 позитивных клеток или CD8 позитивных клеток.
Популяцию 10000 клеток анализировали для каждой экспериментальной точки. Все анализы проводили на проточном цитометре BD Fortessa с программным обеспечением Diva, за исключением разведения CellTrace, анализируемого посредством использования программного обеспечения Modfit.
Продукция цитокинов и хемокинов
Высвобождение цитокинов (IL-1β, IL-2, IL-6, IL-10, IL-12, IL-23, TNF-α и TGF-β) и хемокинов (CCL2, CCL4, CCL5, CXCL9 и CXCL10) количественно оценивали в супернатанте (i) дифференцированных макрофагов человека, (ii) после 3 суток сокультивирования дифференцированных макрофагов человека и SKOV-R2+ опухолевых клеток (обработанных разными антителами против AMHRII) и (iii) после еще 4 суток данного сокультивирования с T-клетками.
Количественную оценку высвобождения цитокинов и хемокинов проводили посредством иммуноанализов AlphaLisa в соответствии с инструкциями изготовителя (набор AlphaLisa, PerkinElmer).
Б. Результаты
Все эксперименты проводили с PBMC от трех разных и независимых здоровых доноров. ADCC, измеренную в присутствии макрофагов, недифференцированных или дифференцированных в TAM-подобные макрофаги (с добавлением M-CSF и IL-10), обнаружили отчетливо более высокой в случае антитела 3C23K-YB20 с низким содержанием фукозы, в сравнении с 3C23K-CHO или 3C23K-FcKO, используемыми в качестве неактивного контроля. Данные по TAM-подобным макрофагам представлены на Фиг. 4A. Данная цитолитическая активность могла бы объяснить, по меньшей мере частично, уменьшение уровня опухолевых клеток после четырех суток совместной инкубации с TAM-подобными макрофагами. Данное уменьшение также было выше в случае 3C23K YB20, чем в случае 3C23K-CHO, как показано на Фиг. 4B.
Когда T-клетки добавляли к сокультуре TAM-подобных макрофагов и опухолевых клеток, наблюдали повышение процентного содержания CD8+ лимфоцитов памяти (Фиг. 4C). Также обнаруживалась тенденция повышения уровня Th1 CD4 регуляторных T-клеток в тех же экспериментальных условиях (Фиг. 4D), одновременно со снижением уровня Th2 CD4+ T-клеток (Фиг. 4E). Все данные модуляции согласуются с повышением длительной противоопухолевой активности, опосредованной T-клетками. Все данные изменения были больше в случае 3C23K-YB20, чем в случае 3C23K-CHO и 3C23K-FcKO.
Интересно, что профиль цитокинов и хемокинов, выявляемых в среде сокультуры TAM-подобные макрофаги плюс опухолевые клетки в присутствии антитела 3C23K против AMHRII-YB20, позволил обнаружить отчетливое повышение уровня CXCL9 (Фиг. 4F) и CXCL10 (Фиг. 4G), двух факторов, участвующих в рекрутинге T-клеток, и CCL2, фактора, участвующего в рекрутинге макрофагов, тогда как исходный уровень данного последнего фактора отличался у каждого донора (Фиг. 4H). Кроме того, когда в данную сокультуру добавляли T-клетки, увеличение уровня двух провоспалительных цитокинов, IL6 (Фиг. 4I) и IL1b (Фиг. 4J), и CCL5 (Фиг. 4K), фактора, ассоциированного с инфильтрацией T-клеток, выявляли посредством 3C23K-YB20, также выше, чем в случае 3C23K-CHO и 3C23K-FcKO.
В общем, данные результаты показали, что добавление 3C23K-YB20 к сокультуре опухолевые клетки плюс TAM-подобные макрофаги, затем плюс T-клетки, то есть условия, имитирующие патологическую ситуацию в опухоли, приводило к непосредственному лизису опухолевых клеток и активации противоопухолевого T-клеточного ответа. Все данные наблюдения в случае 3C23K-YB20 были выше, чем в случае других анализируемых антител против AMHRII.
Что интересно, благоприятное действие 3C23K-YB20 не ограничивалось условиями с TMA-подобными макрофагами. Похожие эксперименты с нестимулированными (NS) макрофагами, сокультивируемыми с опухолевыми клетками и антителами, позволили продемонстрировать увеличение уровня провоспалительных факторов, таких как IL12 (Фиг. 4L), IL6 (Фиг. 4M) и IL1b (Фиг. 4N), наряду со снижением уровня IL23 (Фиг. 4O), проопухолевого и проангиогенного цитокина. Кроме того, как описано выше в отношении TAM-подобных макрофагов, также наблюдали увеличение уровня CXCL9 (Фиг. 4P) и CXCL10 (Фиг. 4R), двух противоангиогенных хемокинов, участвующих в рекрутинге T-клеток. Все данные изменения были более значимы в случае антитела 3C23K-YB20 с низким содержанием фукозы, чем в случае других антител. Данные результаты дают веские основания полагать, что 3C23K-YB20 могло бы влиять на противоопухолевую активность T-клеток посредством недифференцированных макрофагов, а также посредством TAM-подобных макрофагов.
Пример 7: Активация макрофагов, находящихся в опухолевой ткани раковых пациентов, которым вводят гликомодифицированное антитело
A. Материалы и методы
Для идентификации множественных мишеней в одном и том же срезе ткани в данном исследовании используют мультиплексный иммунофлуоресцентный анализ на основе TSA. Усиление сигнала с помощью тирамида (TSA) основано на запатентованной методике, в основе которой лежит катализированное репортером отложение (CARD) с использованием дериватизированного тирамида. В присутствии небольших количеств пеоксида водорода иммобилизованная HRP (пероксидаза хрена) превращает меченый субстрат (тирамид) в короткоживущий чрезвычайно реакционноспособное промежуточное соединение. Затем молекулы активированного субстрата очень быстро взаимодействуют и ковалентно связываются с богатыми электронами областями расположенных рядом белков. Данное связывание активированных молекул тирамида происходит только непосредственно рядом с сайтами, с которыми связан активирующий фермент HRP. Множественное отложение меченого тирамида происходит за очень малый период времени (обычно в пределах 3-10 минут). Последующее выявление метки приводит к эффективно большому усилению сигнала. Преимущество данной технологии заключается в том, что многие первичные антитела, вырабатываемые у одного и того же вида, могут быть выявлены на одном и том же срезе ткани. Каждую реакцию останавливают, когда произошло осаждение TSA-флуорохрома. Данную процедуру можно повторять до достижения 5 мишеней. В лаборатории авторов настоящего изобретения для автоматизации данной процедуры имеется автоматизированное устройство для окраски препаратов Ventana Discovery ULTRA. Данный прибор делает возможным эффективное, воспроизводимое, не требующее нахождения персонала у прибора окрашивание FFPE (фиксированный в формалине и заключенный в парафин) срезов ткани.
В мультиплексном применении используют следующие флуорофоры, раскрытые ниже в Таблице 5:
Данные флуорофоры, системы вторичных антител и первичные антитела представляют специфичные реагенты анализа. Все другие вспомогательные реагенты, используемые для проведения окрашивания (буфер для предварительной обработки, промывочный и денатурирующий буферы), считаются реагентами общего назначения. Ограничения анализа определяются доступной и используемой платформой визуализации. Все полные изображения срезов получены с использованием панорамного сканера P250 от 3DHistech, который оснащен подходящими фильтрами для разделения используемых флуорофоров (Родамин 6G, RED610, DCC, FAM, Cy5). Однако, из-за спектральных характеристик сигналы DAPI (4',6-диамидино-2-фенилиндол) и DCC на настоящий момент не могут быть разделены. Таким образом, ядерный контрастный краситель был исключен.
Разработка мультиплексного иммунофлуоресцентного анализа требовалась для следующих маркеров/целей:
- Цитокератин (CK), CD3, CD4, CD8, FoxP3 для лимфоцитов
- CK, CD14, HLADR, CD206 и/или CD163 для макрофагов
- CK, CD56, CD15, гранзим, DC lamp для дендритных клеток, полиморфноядерных клеток, естественных киллеров
- CK, CD45, CD16, CD32 и CD64 для эффекторных клеток в сравнении с иммунными клетками
Данные четыре мультиплексных анализа проверяли следующим последовательным мечением:
1. Клон антитела 2GV6 против CD3, клон антитела SP35 против CD4, клон антитела C8/144B против CD8, клон антитела D2W8E против FoxP3 и смесь клонов антител против CK AE1/AE3.
2. Клон антитела EPR3653 против CD14, клон антитела KP-1 против CD68, клон антитела MRQ-26 против CD163, клон антитела EPR11226 против MHC-II и смесь клонов антител AE1/AE3 против CK.
3. Клон антитела SP175 против CD16, клон поликлонального антитела против гранзима B, клон антитела C8/144B против CD8 и антитело против NKp46.
4. Клон антитела MMA против CD15, клон антитела 3D3 против CD64, клон поликлонального антитела против CD206 и клон антитела 13A205 против LAMP3.
Б. Результаты
Во время I фазы исследования GM102 наличие нескольких типов клеток исследовали, используя мультиплексное флуоресцентное окрашивание и анализ на FFPE парных и базовых биопсиях карциномы яичника. Мультиплексное окрашивание охватывало иммунные инфильтраты и оценку дифференциации моноцитов/макрофагов и фагоцитарной активности. Исходные образцы были отобраны на биопсию за 7-15 суток до лечения GM102, и вторые биопсии проводились спустя 1,5 месяца лечения.
Поскольку исследовали только две парные биопсии, воздействие лечения GM102 оценивали только описательным образом, без статистического анализа наблюдаемых явлений. Исходные базовые образцы отличались переменным присутствием иммуного инфильтрата. Наиболее значимым наблюдением данного исследования является влияние GM102 на популяцию моноцит-подобных CD16+ клеток (Фиг. 5А), тип клеток, который уже исходно присутствовал в большом количестве. При лечении GM102 CD16+ окрашенная область значительно увеличивалась в случае исследуемых пациентов, что, однако, не находило отражения в увеличении плотности CD16+ клеток, так, будто бы CD16+ клетки загружались CD16 при обработке GM102. Данное наблюдение указывает на активацию CD16+ клеток, эффекторных клеток (главным образом макрофагов), участвующих в противоопухолевой активности GM102.
Кроме того, при лечении GM102 наблюдали повышение уровня экспрессии гранзима B (Фиг. 5B). Гранзим B представляет собой член семейства гранулярных сериновых протеаз, массой 29 кДа, хранящйся специфично в NK-клетках или цитотоксических T-клетках. Цитотоксические T-лимфоциты (CTL) и естественные киллеры (NK) обладают общей способностью распознавать, связываться и лизировать специфичные клетки-мишени. Полагают, что они защищают своего хозяина посредством лизирования клеток, несущих на своей поверхности "не свои" антигены, обычно пептиды или белки, полученные в результате инфицирования внутриклеточными патогенами. Гранзим B является крайне важным для быстрой индукции апоптоза клеток-мишеней под действием CTL в опосредованном клетками иммунном ответе (Rousalova & Krepela, 2010, Int. J. Oncol. 37: 1361-1378; Vaskoboinik at al., 2015, Nat. rev. Immunol. 15: 388-400). Цитотоксические T-лимфоциты (CTL) и клетки естественные киллеры (NK) являются главными участниками в устранении неопластических и инфицированных вирусом клеток. Однако, в данных биопсиях клетки естественные-киллеры, как визуализировано с помощью NKp46, наблюдались только спорадически и представляли собой CD8+ лимфоциты. Данное наблюдение подтвердило в клинических образцах, что лечение GM102 вызывало цитолитическую активность CD8+ T-лимфоцитов.
Пример 8: Активация NK-клеток, моноцитов и ICOS+ T-клеток у раковых пациентов, которым вводят гликомодифицированное антитело
A. Материалы и методы
В I фазе исследования GM102 отбор в качестве образцов 5 мл крови в 4 временных точках планировали для каждого из пациентов эскалационных когорт. Временные точки представляли собой следующие: за Сутки 1 до первой инфузии GM102 (под названием C1J1-SOI) и конец первой инфузии GM102 (под названием C1J1- EO1), в сутки 15, перед второй инфузией GM102 (C1J15-SOI) и в равновесном состоянии, то есть в сутки 57, конец второго 28-дневного цикла (C3J1-SOI).
В целях научного исследования несколько разных маркеров отслеживали в каждой клинической точке данного исследования.
В Gustave Roussy включали пять пациентов. LIO (Laboratoire d’Immunomonitoring en Oncologie) получала в общей сложности 15 образцов, как подробно описано ниже в таблице 6.
Таблица 6
SOI: Начало инфузии; EOI: Конец инфузии
*Образец, отобранный в EOI, 9 февраля 2017 года, и полученный спустя сутки в LIO;
** Образец, отобранный в EOI, 29 мая 2017 года, и полученный спустя сутки в LIO.
Все полученные образцы анализировали. PBMC выделяли из всех образцов и хранили в ящике, предназначенном для Gamamabs - GM102 исследования, в резервуаре с жидким азотом с ограниченным доступом для уполномоченного персонала. Все используемые материалы подробно описаны ниже в таблицах 7, 8 и 9:
Таблица 7
1000 мкл, регулируемая, ручная
20 мкл, регулируемая, ручная
Таблица 8
Таблица 9
без Mg, без Ca
месяцев
Среды для криоконсервации
Fisher
PBMC выделяли согласно следующей процедуре:
1. Продезинфицировать пробирку для крови посредством протирки ее Anios.
2. Взять 50 мл пробирки, предварительно заполненные 15 мл фиколла, и медленно наслоить 35 мл разведенной крови поверх фиколла, будучи осторожными, чтобы не перемешать, - два слоя должны быть четко разделены (В случае других объемов сохранять соотношение разведенная кровь:фиколл, равное примерно 2/3).
3. Прочно закрыть пробирку и центрифугировать при 400g в течение 20 мин при комнатной температуре (RT), РЕЗКО ПРЕКРАТИТЬ.
4. Использовать стерильную одноразовую пипетку, объемом 10 мл, для восстановления слоя (кольца) мононуклеарных клеток и перенести в новую пробирку, объемом 50 мл. (Возможно: верхняя фаза может быть отброшена перед восстановлением кольца).
5. Добавить PBS вплоть до 50 мл и центрифугировать при 800 об/мин в течение 15 мин при 15°C.
6. Сразу же отбросить супернатант, используя пипетку, и остановиться на высоте 3 мл до дна.
7. Встряхнуть для ресуспендирования осадка.
8. Добавить 50 мл PBS поверх оставшегося клеточного осадка и перемешать для тщательного ресуспендирования.
9. Центрифугировать при 300g в течение 10 мин при 15°C.
10. Встряхнуть пробирку и добавить 1 или 2 мл PBS для подсчета клеток.
PBMC хранили в соответствии со следующим способом:
1. Поместить 90 мкл Blue Hayem в 96-луночный планшет и добавить 10 мкл ранее ресуспендированного осадка для подсчета только PBMC.
2. Поместить 90 мкл трипанового синего в 96-луночный планшет и добавить 10 мкл ранее ресуспендированного осадка для подсчета только живых клеток.
3. Подсчитать клетки на счетной камере Малассе и заморозить от 5 до 10 миллионов живых клеток в Hyclone (1 мл на криопробирку).
4. Положить криопробирки в камеру "Mr Freeze" и поместить ее на -80°C по меньшей мере на 24 часа перед переносом их в резервуар с азотом в Gamamabs - GM102 контейнере.
Иммунофенотипирование крови проводили посредством проточной цитометрии с помощью следующего способа и маркеров, описанных ниже в таблицах 10-17.
Таблица 10
1000 мкл, регулируемая, ручная
регулируемая, ручная
Таблица 11
Таблица 12
coulter
Без Mg, без Ca
месяцев
coulter
Таблица 13. Панель Duraclone:
Таблица 14: Панель жидких препаратов
Таблица 15
активация
Таблица 16
Таблица 17
- Устранить супернатант посредством переворачивания
- Добавить 3 мл 1X PBS и перемешать на вибромешалке
- Центрифугировать 5 мин, 300g
- Устранить супернатант посредством переворачивания
- Суспендировать осадок в 250 мкл PBS1X
- Приобрести пробирку с цитометром Gallios
Б. Результаты
Каждый маркер, перечисленный выше, оценивали и анализировали на протяжении лечения. У 5 анализируемых пациентов не идентифицировали значимого изменения в отношении основных популяций циркулирующих клеток иммунной системы (N-клетки, моноциты, нейтрофилы, эозинофилы и CD4+, CD8+ T-клетки и Treg).
Некоторые маркеры указывали на активацию моноцитов и NK-клеток. Значимое повышение уровня экспрессии CD16 наблюдали на NK-клетках у C1J1-EOI и C1J15 после снижения во время инъекции GM102 (Фиг: 6A). Статистически незначимую тенденцию к повышению также наблюдали в случае экспрессии CD69 на моноцитах (Фиг: 6B). В то время как его иммунорегуляторная роль остается неясной, уровень экспрессии CD69, как известно, повышается после активации клеток иммунной системы (Sancho et al.,2005, Trends in Immunology, Vol. 26 (3): 137-140). Данные возрастания могут быть истолкованы как признаки активации моноцитов и NK-клеток.
Интересно отметить, что главным и значимым изменением являлось повышение уровня экспрессии ICOS на T-клетках у C1J1-EOI и C1J15 (фиг: 6C). ICOS представляет собой рецептор, участвующий в активации T-клеток (Yao et al., 2013, Nature Reviews, Vol. 12 : 130-146; Mahoney et al., 2015, Nature Reviews,Vol.14 : 561-584), и он известен как фармакодинамический маркер ипилимумаба, антитела против CTLA4, ингибитора иммунной контрольной точки (Tang et al., 2013, American association for cancer Reseatch Journal, Vol. 1(4) : 229-234). Таким образом, данное возрастание подтверждает у пациентов, что GM102 может коренным образом изменять иммуносупрессию.
Пример 9: Воздействие GM102 на циркулирующие моноциты
A. Материалы и методы
В фазе I исследования GM102 отбор 5 мл образца крови в 4 временных точках планировали для каждого из пациентов эскалационных когорт. Временные точки представляют собой следующие: за Сутки 1 до первой инфузии GM102 (под названием C1J1-SOI) и конец первой инфузии GM102 (под названием C1J1- EO1), в сутки 15, перед второй инфузией GM102 (C1J15-SOI) и в равновесном состоянии, то есть в сутки 57, конец второго 28-дневного цикла (C3J1-SOI).
В целях научного исследования несколько разных маркеров отслеживали в каждой клинической точке данного исследования.
PBMC человека выделяли из крови способом на основе центрифугирования в градиенте плотности на Lymphoprep (Abcys). Для инфильтрации популяции лимфоцитов и их активации PBMC метили следующими антителами: CD45-VioGreen, CD3-VioBlue, CD4-APCVio770, CD8-PerCP, CD25-PE, CD56-APC, CD19-PEVio770 и CD69-FITC (Myltenyi Biotec).
Для моноцитов крови классические, промежуточные и неклассические популяции оценивали со следующими антителами: CD45-VioGreen, CD16-PE и CD14-PerCPVio700 (Myltenyi Biotec). Подходящие изотипические антитела с соответствующими флуорохромами использовали для определения неспецифичного фонового окрашивания. Все окрашивание проводили на 100 мкл PBS-/- 1% инактивированной нагреванием фетальной телячьей сыворотки. Популяцию 10000 клеток анализировали для каждой точки данных. Все анализы проводили на проточном цитометре BD Fortessa с программным обеспечением Diva.
Б. Результаты
Процентные содержания T-клеток, NK-клеток и моноцитов перед первой инфузией 3C23K, как было обнаружено, варьировали среди пациентов, указывая на различную иммунокомпетентность среди пациентов. На лечении и после лечения не наблюдали значительного изменения в популяции T-клеток и NK-клеток. Напротив, изменения наблюдали в случае субпопуляций моноцитов.
Моноциты крови человека являются гетерогенными и традиционно подразделяются на три субпопуляции на основе экспрессии CD14 и CD16. "Классические моноциты" (CD14высок CD16-) представляют 90-95% общего числа моноцитов у здоровых доноров, тогда как "неклассические" (CD14низк CD16+) и "промежуточные" (CD14высок CD16+) популяции представлены в меньшей степени (5-10%).
В 3-х из 4-х пациентов с аденокарциномой яичника доля "классических моноцитов" была сильно уменьшена у пациента перед первой инфузией (среднее значение составляет 37,5%), по сравнению со здоровым пациентом. Данное явление обычно наблюдают у пациентов с раком яичника. Следовательно, доля промежуточных моноцитов перед первой инфузией была увеличена у пациента с аденокарциномой яичника (среднее значение составляет 46,5%), по сравнению со здоровыми донорами.
Интересен тот факт, что измерение процентного содержания на лечении и после лечения 3C23K привело к обнаружению большого увеличения субпопуляции классических моноцитов, сопровождающегося уменьшением доли субпопуляции промежуточных моноцитов у пациентов (со средними значениями 54,6% и 30,5%, соответственно), примером чего является пациент 04-06 на Фиг. 7. Такие изменения субпопуляций моноцитов также наблюдали в образцах крови 4 пациентов, обследуемых в соответствии с таким же протоколом в институте Борде. Данные изменения являются признаками модификации фенотипов моноцитов. Недавно были описаны изменения субпопуляций моноцитов в ответ на ингибиторы иммунных контрольных точек (Krieg C., Nowicka M., Guglietta S., Schindler S., Hartmann F. J., Weber L. M., et al. . (2018). High-dimensional single-cell analysis predicts response to anti-PD-1 immunotherapy. Nat Med. 24, 144-153), что приводило к активации лимфоцитов (в результате блокировки ингибиторных сигналов). Данные авторов настоящего изобретения показали, что 3C23K, без какого-либо связывания с иммунной контрольной точкой, может также модифицировать соотношения субпопуляций моноцитов, что могло бы, как следствие, активировать лимфоциты.
Таблица 18: Последовательности
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ГАМАМА ФАРМА
ИНСТИТУТ НАСЬОНАЛЬ ДЕ ЛА САНТЕ Э ДЕ ЛА РЕШЕРШ МЕДИКАЛЬ (ИНСЕРМ)
<120> ИНГИБИТОР ИММУНОСУПРЕССИИ, АССОЦИИРОВАННОЙ С РАКОМ
<130> PR80324
<150> EP17305619
<151> 2017-05-29
<160> 76
<170> BiSSAP 1.3.6
<210> 1
<211> 318
<212> ДНК
<213> Искуственная последовательность
<220>
<223> 3C_23 VL без лидерной последовательности
<220>
<223> 3C_23 VL без лидерной последовательности
<220>
<221> CDS
<222> 1..318
<400> 1
gac atc cag atg aca cag tcc cca tct acc ctg tct gct tcc gtg gga 48
gat cgg gtg act atc acc tgc aga gca agc tcc tcc gtg agg tac atc 96
gct tgg tac cag cag aag cca gga aag gcc cca aag ctg ctg acc tac 144
cca acc tcc tcc ctg gaa tcc ggg gtg ccc agc aga ttc tca ggc agt 192
ggc tcc ggc acc gaa ttc acc ctg acc atc agc tca ctg cag cct gac 240
gac ttc gca acc tac tac tgt ctg cag tgg agt agc tac cct tgg aca 288
ttc ggc ggc ggc acc aag gtg gag atc aag 318
<210> 2
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> [CDS]:1..318 из SEQ ID NO: 1
<220>
<223> Синтетическая конструкция [CDS]:1..318 из SEQ ID NO: 1
<400> 2
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 3
<211> 345
<212> ДНК
<213> Искуственная последовательность
<220>
<223> 3C_23 VH без лидерной последовательности
<220>
<223> 3C_23 VH без лидерной последовательности
<220>
<221> CDS
<222> 1..345
<400> 3
cag gtg cgg ctg gtg cag agc ggg gcc gag gtg aag aag cct gga gcc 48
tca gtg aag gtg agt tgc aag gcc tcc ggt tac acc ttc acc agc tac 96
cac atc cac tgg gtc aga cag gct ccc ggc cag aga ctg gag tgg atg 144
ggc tgg atc tac cct gga gat gac tcc acc aag tac tcc cag aag ttc 192
cag ggt cgc gtg acc att acc agg gac acc agc gcc tcc act gcc tac 240
atg gag ctg tct tcc ctg aga tct gag gat acc gca gtc tac tac tgt 288
aca cgg ggg gac cgc ttt gct tac tgg ggg cag ggc act ctg gtg acc 336
gtc tcg agc 345
<210> 4
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> [CDS]:1..345 из SEQ ID NO: 3
<220>
<223> Синтетическая конструкция [CDS]:1..345 из SEQ ID NO: 3
<400> 4
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 5
<211> 318
<212> ДНК
<213> Искуственная последовательность
<220>
<223> 3C_23K VL без лидерной последовательности
<220>
<223> 3C_23K VL без лидерной последовательности
<220>
<221> CDS
<222> 1..318
<400> 5
gac atc cag atg aca cag tcc cca tct acc ctg tct gct tcc gtg gga 48
gat cgg gtg act atc acc tgc aga gca agc tcc tcc gtg agg tac atc 96
gct tgg tac cag cag aag cca gga aag gcc cca aag ctg ctg acc tac 144
cca acc tcc tcc ctg aaa tcc ggg gtg ccc agc aga ttc tca ggc agt 192
ggc tcc ggc acc gaa ttc acc ctg acc atc agc tca ctg cag cct gac 240
gac ttc gca acc tac tac tgt ctg cag tgg agt agc tac cct tgg aca 288
ttc ggc ggc ggc acc aag gtg gag atc aag 318
<210> 6
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> [CDS]:1..318 из SEQ ID NO: 5
<220>
<223> Синтетическая конструкция [CDS]:1..318 из SEQ ID NO: 5
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 7
<211> 345
<212> ДНК
<213> Искуственная последовательность
<220>
<223> 3C_23K VH без лидерной последовательности
<220>
<223> 3C_23K VH без лидерной последовательности
<220>
<221> CDS
<222> 1..345
<400> 7
cag gtg cgg ctg gtg cag agc ggg gcc gag gtg aag aag cct gga gcc 48
tca gtg aag gtg agt tgc aag gcc tcc ggt tac acc ttc acc agc tac 96
cac atc cac tgg gtc aga cag gct ccc ggc cag aga ctg gag tgg atg 144
ggc tgg atc tac cct gga gat gac tcc acc aag tac tcc cag aag ttc 192
cag ggt cgc gtg acc att acc agg gac acc agc gcc tcc act gcc tac 240
atg gag ctg tct tcc ctg aga tct gag gat acc gca gtc tac tac tgt 288
aca cgg ggg gac cgc ttt gct tac tgg ggg cag ggc act ctg gtg acc 336
gtc tcg agc 345
<210> 8
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> [CDS]:1..345 из SEQ ID NO: 7
<220>
<223> Синтетическая конструкция [CDS]:1..345 из SEQ ID NO: 7
<400> 8
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 9
<211> 639
<212> ДНК
<213> Искуственная последовательность
<220>
<223> 3C_23 легкая цепь без лидерной последовательности
<220>
<223> 3C_23 легкая цепь без лидерной последовательности
<220>
<221> CDS
<222> 1..639
<400> 9
gac atc cag atg aca cag tcc cca tct acc ctg tct gct tcc gtg gga 48
gat cgg gtg act atc acc tgc aga gca agc tcc tcc gtg agg tac atc 96
gct tgg tac cag cag aag cca gga aag gcc cca aag ctg ctg acc tac 144
cca acc tcc tcc ctg gaa tcc ggg gtg ccc agc aga ttc tca ggc agt 192
ggc tcc ggc acc gaa ttc acc ctg acc atc agc tca ctg cag cct gac 240
gac ttc gca acc tac tac tgt ctg cag tgg agt agc tac cct tgg aca 288
ttc ggc ggc ggc acc aag gtg gag atc aag cgg acc gtc gcc gca cca 336
agt gtc ttc atc ttc ccg cca tct gat gag cag ttg aaa tct gga act 384
gcc tct gtt gtg tgc ctg ctg aat aac ttc tat ccc aga gag gcc aaa 432
gta cag tgg aag gtg gat aac gcc ctc caa tcg ggt aac tcc cag gag 480
agt gtc aca gag cag gac agc aag gac agc acc tac agc ctc agc agc 528
acc ctg acg ctg agc aaa gca gac tac gag aaa cac aaa gtc tac gcc 576
tgc gaa gtc acc cat cag ggc ctg agc tcg ccc gtc aca aag agc ttc 624
aac agg gga gag tgt 639
<210> 10
<211> 213
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> [CDS]:1..639 из SEQ ID NO: 9
<220>
<223> Синтетическая конструкция [CDS]:1..639 из SEQ ID NO: 9
<400> 10
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 11
<211> 1335
<212> ДНК
<213> Искуственная последовательность
<220>
<223> 3C_23 тяжелая цепь без лидерной последовательности
<220>
<223> 3C_23 тяжелая цепь без лидерной последовательности
<220>
<221> CDS
<222> 1..1335
<400> 11
cag gtg cgg ctg gtg cag agc ggg gcc gag gtg aag aag cct gga gcc 48
tca gtg aag gtg agt tgc aag gcc tcc ggt tac acc ttc acc agc tac 96
cac atc cac tgg gtc aga cag gct ccc ggc cag aga ctg gag tgg atg 144
ggc tgg atc tac cct gga gat gac tcc acc aag tac tcc cag aag ttc 192
cag ggt cgc gtg acc att acc agg gac acc agc gcc tcc act gcc tac 240
atg gag ctg tct tcc ctg aga tct gag gat acc gca gtc tac tac tgt 288
aca cgg ggg gac cgc ttt gct tac tgg ggg cag ggc act ctg gtg acc 336
gtc tcg agc gcc agc acc aag ggc cca tcg gtc ttc ccc ctg gca ccc 384
tcc tcc aag agc acc tct ggg ggc aca gcg gcc ctg ggc tgc ctg gtc 432
aag gac tac ttc ccc gaa ccg gtg acg gtg tcg tgg aac tca ggc gcc 480
ctg acc agc ggc gtg cac acc ttc ccg gct gtc cta cag tcc tca gga 528
ctc tac tcc ctc agc agc gtg gtg acc gtg ccc tcc agc agc ttg ggc 576
acc cag acc tac atc tgc aac gtg aat cac aag ccc agc aac acc aag 624
gtg gac aag aaa gtt gag ccc aaa tct tgt gac aaa act cac aca tgc 672
cca ccg tgc cca gca cct gaa ctc ctg ggg gga ccg tca gtc ttc ctc 720
ttc ccc cca aaa ccc aag gac acc ctc atg atc tcc cgg acc cct gag 768
gtc aca tgc gtg gtg gtg gac gtg agc cac gaa gac cct gag gtc aag 816
ttc aac tgg tac gtg gac ggc gtg gag gtg cat aat gcc aag aca aag 864
ccg cgg gag gag cag tac aac agc acg tac cgt gtg gtc agc gtc ctc 912
acc gtc ctg cac cag gac tgg ctg aat ggc aag gag tac aag tgc aag 960
gtc tcc aac aaa gcc ctc cca gcc ccc atc gag aaa acc atc tcc aaa 1008
gcc aaa ggg cag ccc cga gaa cca cag gtg tac acc ctg ccc cca tcc 1056
cgg gat gag ctg acc aag aac cag gtc agc ctg acc tgc ctg gtc aaa 1104
ggc ttc tat ccc agc gac atc gcc gtg gag tgg gag agc aat ggg cag 1152
ccg gag aac aac tac aag acc acg cct ccc gtg ctg gac tcc gac ggc 1200
tcc ttc ttc ctc tac agc aag ctc acc gtg gac aag agc agg tgg cag 1248
cag ggg aac gtc ttc tca tgc tcc gtg atg cat gag gct ctg cac aac 1296
cac tac acg cag aag agc ctc tcc ctg tct ccg ggt aaa 1335
<210> 12
<211> 445
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> [CDS]:1..1335 из SEQ ID NO: 11
<220>
<223> Синтетическая конструкция [CDS]:1..1335 из SEQ ID NO: 11
<400> 12
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 13
<211> 639
<212> ДНК
<213> Искуственная последовательность
<220>
<223> 3C_23K легкая цепь без лидерной последовательности
<220>
<223> 3C_23K легкая цепь без лидерной последовательности
<220>
<221> CDS
<222> 1..639
<400> 13
gac atc cag atg aca cag tcc cca tct acc ctg tct gct tcc gtg gga 48
gat cgg gtg act atc acc tgc aga gca agc tcc tcc gtg agg tac atc 96
gct tgg tac cag cag aag cca gga aag gcc cca aag ctg ctg acc tac 144
cca acc tcc tcc ctg aaa tcc ggg gtg ccc agc aga ttc tca ggc agt 192
ggc tcc ggc acc gaa ttc acc ctg acc atc agc tca ctg cag cct gac 240
gac ttc gca acc tac tac tgt ctg cag tgg agt agc tac cct tgg aca 288
ttc ggc ggc ggc acc aag gtg gag atc aag cgg acc gtc gcc gca cca 336
agt gtc ttc atc ttc ccg cca tct gat gag cag ttg aaa tct gga act 384
gcc tct gtt gtg tgc ctg ctg aat aac ttc tat ccc aga gag gcc aaa 432
gta cag tgg aag gtg gat aac gcc ctc caa tcg ggt aac tcc cag gag 480
agt gtc aca gag cag gac agc aag gac agc acc tac agc ctc agc agc 528
acc ctg acg ctg agc aaa gca gac tac gag aaa cac aaa gtc tac gcc 576
tgc gaa gtc acc cat cag ggc ctg agc tcg ccc gtc aca aag agc ttc 624
aac agg gga gag tgt 639
<210> 14
<211> 213
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> [CDS]:1..639 из SEQ ID NO: 13
<220>
<223> Синтетическая конструкция [CDS]:1..639 из SEQ ID NO: 13
<400> 14
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 15
<211> 1335
<212> ДНК
<213> Искуственная последовательность
<220>
<223> 3C_23K тяжелая цепь без лидерной последовательности
<220>
<223> 3C_23K тяжелая цепь без лидерной последовательности
<220>
<221> CDS
<222> 1..1335
<400> 15
cag gtg cgg ctg gtg cag agc ggg gcc gag gtg aag aag cct gga gcc 48
tca gtg aag gtg agt tgc aag gcc tcc ggt tac acc ttc acc agc tac 96
cac atc cac tgg gtc aga cag gct ccc ggc cag aga ctg gag tgg atg 144
ggc tgg atc tac cct gga gat gac tcc acc aag tac tcc cag aag ttc 192
cag ggt cgc gtg acc att acc agg gac acc agc gcc tcc act gcc tac 240
atg gag ctg tct tcc ctg aga tct gag gat acc gca gtc tac tac tgt 288
aca cgg ggg gac cgc ttt gct tac tgg ggg cag ggc act ctg gtg acc 336
gtc tcg agc gcc agc acc aag ggc cca tcg gtc ttc ccc ctg gca ccc 384
tcc tcc aag agc acc tct ggg ggc aca gcg gcc ctg ggc tgc ctg gtc 432
aag gac tac ttc ccc gaa ccg gtg acg gtg tcg tgg aac tca ggc gcc 480
ctg acc agc ggc gtg cac acc ttc ccg gct gtc cta cag tcc tca gga 528
ctc tac tcc ctc agc agc gtg gtg acc gtg ccc tcc agc agc ttg ggc 576
acc cag acc tac atc tgc aac gtg aat cac aag ccc agc aac acc aag 624
gtg gac aag aaa gtt gag ccc aaa tct tgt gac aaa act cac aca tgc 672
cca ccg tgc cca gca cct gaa ctc ctg ggg gga ccg tca gtc ttc ctc 720
ttc ccc cca aaa ccc aag gac acc ctc atg atc tcc cgg acc cct gag 768
gtc aca tgc gtg gtg gtg gac gtg agc cac gaa gac cct gag gtc aag 816
ttc aac tgg tac gtg gac ggc gtg gag gtg cat aat gcc aag aca aag 864
ccg cgg gag gag cag tac aac agc acg tac cgt gtg gtc agc gtc ctc 912
acc gtc ctg cac cag gac tgg ctg aat ggc aag gag tac aag tgc aag 960
gtc tcc aac aaa gcc ctc cca gcc ccc atc gag aaa acc atc tcc aaa 1008
gcc aaa ggg cag ccc cga gaa cca cag gtg tac acc ctg ccc cca tcc 1056
cgg gat gag ctg acc aag aac cag gtc agc ctg acc tgc ctg gtc aaa 1104
ggc ttc tat ccc agc gac atc gcc gtg gag tgg gag agc aat ggg cag 1152
ccg gag aac aac tac aag acc acg cct ccc gtg ctg gac tcc gac ggc 1200
tcc ttc ttc ctc tac agc aag ctc acc gtg gac aag agc agg tgg cag 1248
cag ggg aac gtc ttc tca tgc tcc gtg atg cat gag gct ctg cac aac 1296
cac tac acg cag aag agc ctc tcc ctg tct ccg ggt aaa 1335
<210> 16
<211> 445
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> [CDS]:1..1335 из SEQ ID NO: 15
<220>
<223> Синтетическая конструкция [CDS]:1..1335 из SEQ ID NO: 15
<400> 16
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 17
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> 3C23K/3C23
<220>
<223> 3C23K/3C23
<400> 17
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 18
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> 3C23KR/6B78
<220>
<223> 3C23KR/6B78
<400> 18
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 19
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> 5B42
<220>
<223> 5B42
<400> 19
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Ala Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 20
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> K4D-24/6C59
<220>
<223> K4D-24/6C59
<400> 20
Arg Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 21
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> K4D-20
<220>
<223> K4D-20
<400> 21
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Asn
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 22
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> K4A-12" <223> K4A-12
<220>
<223> K4A-12
<220>
<223> K4A-12
<400> 22
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 23
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> K5D05" <223> K5D05
<220>
<223> K5D05
<220>
<223> K5D05
<400> 23
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 24
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> K5D-14" <223> K5D-14
<220>
<223> K5D-14
<220>
<223> K5D-14
<400> 24
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 25
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> K4D-123" <223> K4D-123
<220>
<223> K4D-123
<220>
<223> K4D-123
<400> 25
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Ser Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 26
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> K4D-127/6C07" <223> K4D-127/6C07
<220>
<223> K4D-127/6C07
<220>
<223> K4D-127/6C07
<400> 26
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Thr Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 27
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> 5C14" <223> 5C14
<220>
<223> 5C14
<220>
<223> 5C14
<400> 27
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Phe Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 28
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> 5C26" <223> 5C26
<220>
<223> 5C26
<220>
<223> 5C26
<400> 28
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Met Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 29
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> 5C27" <223> 5C27
<220>
<223> 5C27
<220>
<223> 5C27
<400> 29
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Pro Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 30
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> 5C60" <223> 5C60
<220>
<223> 5C60
<220>
<223> 5C60
<400> 30
Gln Val Arg Leu Val Gln Ser Gly Ala Lys Val Arg Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 31
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> 6C13" <223> 6C13
<220>
<223> 6C13
<220>
<223> 6C13
<400> 31
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Glu Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 32
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> 6C18" <223> 6C18
<220>
<223> 6C18
<220>
<223> 6C18
<400> 32
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 33
<211> 115
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> 6C54" <223> 6C54
<220>
<223> 6C54
<220>
<223> 6C54
<400> 33
Gln Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Asp Arg Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 34
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> 3C23K" <223> 3C23K
<220>
<223> 3C23K
<220>
<223> 3C23K
<400> 34
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 35
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-K55E" <223> L-K55E
<220>
<223> L-K55E
<220>
<223> L-K55E
<400> 35
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 36
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-T48I, L-P50S" <223> L-T48I, L-P50S
<220>
<223> L-T48I, L-P50S
<220>
<223> L-T48I, L-P50S
<400> 36
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
35 40 45
Ser Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 37
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> LT48I, L-K55E" <223> LT48I, L-K55E
<220>
<223> LT48I, L-K55E
<220>
<223> LT48I, L-K55E
<400> 37
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
35 40 45
Pro Thr Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 38
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> LS27P, L-S28P" <223> LS27P, L-S28P
<220>
<223> LS27P, L-S28P
<220>
<223> LS27P, L-S28P
<400> 38
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Pro Pro Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 39
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-M4L, L-T20A" <223> L-M4L, L-T20A
<220>
<223> L-M4L, L-T20A
<220>
<223> L-M4L, L-T20A
<400> 39
Asp Ile Gln Leu Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Ala Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 40
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-S27P" <223> L-S27P
<220>
<223> L-S27P
<220>
<223> L-S27P
<400> 40
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Pro Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 41
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-M4L, L-S9P, L-R31W" <223> L-M4L, L-S9P, L-R31W
<220>
<223> L-M4L, L-S9P, L-R31W
<220>
<223> L-M4L, L-S9P, L-R31W
<400> 41
Asp Ile Gln Leu Thr Gln Ser Pro Pro Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Trp Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 42
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-M4L" <223> L-M4L
<220>
<223> L-M4L
<220>
<223> L-M4L
<400> 42
Asp Ile Gln Leu Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 43
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-I33T" <223> L-I33T
<220>
<223> L-I33T
<220>
<223> L-I33T
<400> 43
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Thr
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 44
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-M4L, L-K39E" <223> L-M4L, L-K39E
<220>
<223> L-M4L, L-K39E
<220>
<223> L-M4L, L-K39E
<400> 44
Asp Ile Gln Leu Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Glu Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 45
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-T22P" <223> L-T22P
<220>
<223> L-T22P
<220>
<223> L-T22P
<400> 45
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Pro Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 46
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-Y32D" <223> L-Y32D
<220>
<223> L-Y32D
<220>
<223> L-Y32D
<400> 46
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Asp Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 47
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-Q37H" <223> L-Q37H
<220>
<223> L-Q37H
<220>
<223> L-Q37H
<400> 47
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr His Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 48
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-G97S" <223> L-G97S
<220>
<223> L-G97S
<220>
<223> L-G97S
<400> 48
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Ser Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 49
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-S12P" <223> L-S12P
<220>
<223> L-S12P
<220>
<223> L-S12P
<400> 49
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Pro Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 50
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-19A" <223> L-19A
<220>
<223> L-19A
<220>
<223> L-19A
<400> 50
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Ala Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 51
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-T72A" <223> L-T72A
<220>
<223> L-T72A
<220>
<223> L-T72A
<400> 51
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Ala Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 52
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-R31W" <223> L-R31W
<220>
<223> L-R31W
<220>
<223> L-R31W
<400> 52
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Trp Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 53
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-M4L, L-M39K" <223> L-M4L, L-M39K
<220>
<223> L-M4L, L-M39K
<220>
<223> L-M4L, L-M39K
<400> 53
Asp Ile Gln Leu Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Met Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 54
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-I2N" <223> L-I2N
<220>
<223> L-I2N
<220>
<223> L-I2N
<400> 54
Asp Asn Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 55
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-G63C, L-W91C" <223> L-G63C, L-W91C
<220>
<223> L-G63C, L-W91C
<220>
<223> L-G63C, L-W91C
<400> 55
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Cys Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Cys Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 56
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-R31G" <223> L-R31G
<220>
<223> L-R31G
<220>
<223> L-R31G
<400> 56
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Gly Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 57
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-I75F" <223> L-I75F
<220>
<223> L-I75F
<220>
<223> L-I75F
<400> 57
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Phe Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 58
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-I2T" <223> L-I2T
<220>
<223> L-I2T
<220>
<223> L-I2T
<400> 58
Asp Thr Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 59
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-I2T, L-K42R" <223> L-I2T, L-K42R
<220>
<223> L-I2T, L-K42R
<220>
<223> L-I2T, L-K42R
<400> 59
Asp Thr Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Arg Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 60
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-Y49H" <223> L-Y49H
<220>
<223> L-Y49H
<220>
<223> L-Y49H
<400> 60
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr His
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 61
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-M4L, L-T20S, L-K39E" <223> L-M4L, L-T20S, L-K39E
<220>
<223> L-M4L, L-T20S, L-K39E
<220>
<223> L-M4L, L-T20S, L-K39E
<400> 61
Asp Ile Gln Leu Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Glu Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 62
<211> 106
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> L-T69P" <223> L-T69P
<220>
<223> L-T69P
<220>
<223> L-T69P
<400> 62
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Arg Tyr Ile
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Thr Tyr
35 40 45
Pro Thr Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Pro Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 63
<211> 117
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> 9F7F11_VH
<220>
<223> 9F7F11_VH
<400> 63
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Asp Gly Gly Gly Val Thr Tyr Tyr Pro Asp Thr Ile
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Tyr Gly Leu Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 64
<211> 107
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> 9F7F11_VL
<220>
<223> 9F7F11_VL
<400> 64
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Ile Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Asn Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 65
<211> 120
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> H4B121_VH
<220>
<223> H4B121_VH
<400> 65
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Gln Trp Pro Asn Tyr Gly Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 66
<211> 110
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> H4B121_VL
<220>
<223> H4B121_VL
<400> 66
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Ala Ala Pro Gly Gln
1 5 10 15
Lys Val Thr Ile Ser Cys Pro Gly Ser Ser Ser Asn Ile Gly Asn Asn
20 25 30
Tyr Val Ser Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Asn Asn Glu Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Thr Ser Gly Thr Ser Ala Thr Leu Asp Ile Thr Asp Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Thr Tyr Tyr Cys Gly Ala Trp Asp Asn Thr Leu
85 90 95
Gly Val Tyr Val Leu Gly Thr Gly Thr Gln Leu Thr Val Leu
100 105 110
<210> 67
<211> 119
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> HE4B33_VH
<220>
<223> HE4B33_VH
<400> 67
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Arg Gly Tyr Tyr Asp Pro Phe Asp Val Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 68
<211> 110
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> HE4B33_VL
<220>
<223> HE4B33_VL
<400> 68
Gln Ser Val Val Thr Gln Pro Pro Ser Val Ser Ala Ala Pro Gly Gln
1 5 10 15
Lys Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn
20 25 30
Tyr Val Ser Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Asn Asn Lys Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser
50 55 60
Ala Ser Lys Ser Gly Thr Ser Ala Thr Leu Asp Ile Thr Gly Leu Gln
65 70 75 80
Thr Gly Asp Glu Ala His Tyr Tyr Cys Gly Ala Trp Asp Ser Ser Leu
85 90 95
Ser Val Ala Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 69
<211> 990
<212> ДНК
<213> Искуственная последовательность
<220>
<223> Fc-фрагмент IGHG1
<220>
<223> Fc-фрагмент IGHG1
<400> 69
gccagcacca agggcccatc ggtcttcccc ctggcaccct cctccaagag cacctctggg 60
ggcacagcgg ccctgggctg cctggtcaag gactacttcc ccgaaccggt gacggtgtcg 120
tggaactcag gcgccctgac cagcggcgtg cacaccttcc cggctgtcct acagtcctca 180
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacccagacc 240
tacatctgca acgtgaatca caagcccagc aacaccaagg tggacaagaa agttgagccc 300
aaatcttgtg acaaaactca cacatgccca ccgtgcccag cacctgaact cctgggggga 360
ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct 420
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg 480
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga gcagtacaac 540
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 600
gagtacaagt gcaaggtctc caacaaagcc ctcccagccc ccatcgagaa aaccatctcc 660
aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatc ccgggatgag 720
ctgaccaaga accaggtcag cctgacctgc ctggtcaaag gcttctatcc cagcgacatc 780
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 840
ctggactccg acggctcctt cttcctctac agcaagctca ccgtggacaa gagcaggtgg 900
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacg 960
cagaagagcc tctccctgtc tccgggtaaa 990
<210> 70
<211> 330
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> Fc-фрагмент IGHG1
<220>
<223> Fc-фрагмент IGHG1
<220>
<221> ВАРИАНТ
<222> 97
<223> Xaa означает K или R
<220>
<221> ВАРИАНТ
<222> 239
<223> Xaa означает D или E
<220>
<221> ВАРИАНТ
<222> 241
<223> Xaa означает L или M
<400> 70
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Xaa Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Xaa Glu
225 230 235 240
Xaa Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 71
<211> 10
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> CDRL-1 антитела против AMHRII
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa в положении 4 представляет собой S или P
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa в положении 5 представляет собой S или P
<220>
<221> ВАРИАНТ
<222> 7
<223> Xaa в положении 7 представляет собой или or W или G
<220>
<221> ВАРИАНТ
<222> 8
<223> Xaa в положении 8 представляет собой T или D
<220>
<221> ВАРИАНТ
<222> 9
<223> Xaa в положении 9 представляет собой I или T
<400> 71
Arg Ala Ser Xaa Xaa Val Xaa Xaa Xaa Ala
1 5 10
<210> 72
<211> 7
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> CDRL-2 антитела против AMHRII
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa в положении 6 представляет собой K или E
<400> 72
Pro Thr Ser Ser Leu Xaa Ser
1 5
<210> 73
<211> 9
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> CDRL-3 антитела против AMHRII
<400> 73
Leu Gln Trp Ser Ser Tyr Pro Trp Thr
1 5
<210> 74
<211> 13
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> CDRH-1 антитела против AMHRII
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa в положении 6 представляет собой S или T
<220>
<221> ВАРИАНТ
<222> 9
<223> Xaa в положении 9 представляет собой S или G
<220>
<221> ВАРИАНТ
<222> 10
<223> Xaa в положении 10 представляет собой Y или N
<400> 74
Lys Ala Ser Gly Tyr Xaa Phe Thr Xaa Xaa His Ile His
1 5 10
<210> 75
<211> 17
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> CDRH-2 антитела против AMHRII
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa в положении 5 представляет собой G или E
<400> 75
Trp Ile Tyr Pro Xaa Asp Asp Ser Thr Lys Tyr Ser Gln Lys Phe Gln
1 5 10 15
Gly
<210> 76
<211> 6
<212> ПРТ
<213> Искуственная последовательность
<220>
<223> CDRH-3 антитела против AMHRII
<400> 76
Gly Asp Arg Phe Ala Tyr
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Соединения, связывающие AMHRII, для профилактики или лечения раковых заболеваний | 2018 |
|
RU2816523C2 |
| РЕКОМБИНАНТНЫЕ КЛЕТКИ ДРОЖЖЕЙ, ПРОДУЦИРУЮЩИЕ ПОЛИМОЛОЧНУЮ КИСЛОТУ, И ИХ ИСПОЛЬЗОВАНИЯ | 2016 |
|
RU2758138C2 |
| АНТИТЕЛА ПРОТИВ BTN3A И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ РАКА ИЛИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2800726C2 |
| Соединения, связывающие AMHRII, для профилактики или лечения раковых заболеваний легкого | 2018 |
|
RU2797506C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К BTN2, И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2821703C2 |
| ИММУНОЦИТОКИНЫ НА ОСНОВЕ IL-15 И IL-15Rα ДОМЕНА SUSHI | 2012 |
|
RU2763298C2 |
| ВАРИАНТЫ КИСЛОЙ АЛЬФА-ГЛЮКОЗИДАЗЫ И ИХ ИСПОЛЬЗОВАНИЕ | 2017 |
|
RU2780410C2 |
| ГЕННАЯ ТЕРАПИЯ ГИПОФОСФАТЕМИЧЕСКИХ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ФАКТОРОМ РОСТА ФИБРОБЛАСТОВ 23 | 2020 |
|
RU2815545C2 |
| Выделенное антитело к CD45RC человека, нуклеиновая кислота, вектор экспрессии, клетка, фармацевтическая композиция, их применение, in vitro способ обнаружения hCD45RC | 2019 |
|
RU2826421C2 |
| АНТИТЕЛА, ИНДУЦИРУЮЩИЕ ИММУННУЮ ТОЛЕРАНТНОСТЬ, ИНДУЦИРОВАННЫЕ ЛИМФОЦИТЫ И ТЕРАПЕВТИЧЕСКИЙ АГЕНТ/СПОСОБ КЛЕТОЧНОЙ ТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ ИНДУЦИРОВАННЫХ ЛИМФОЦИТОВ | 2019 |
|
RU2816592C2 |

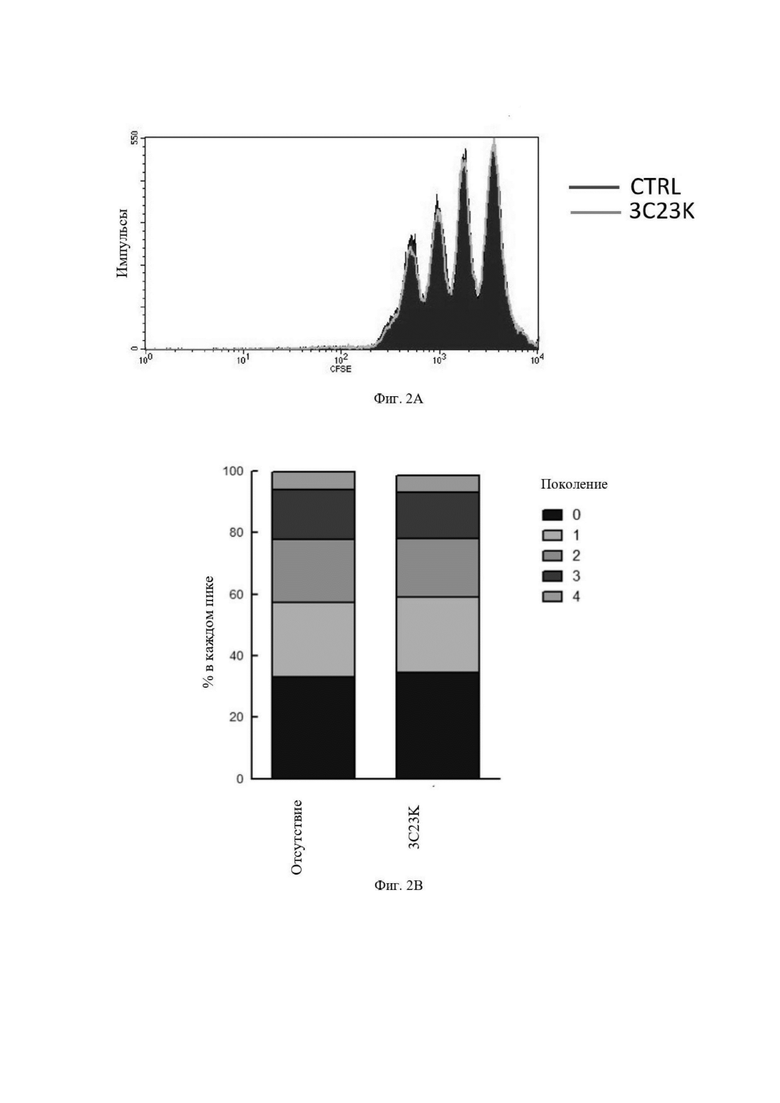
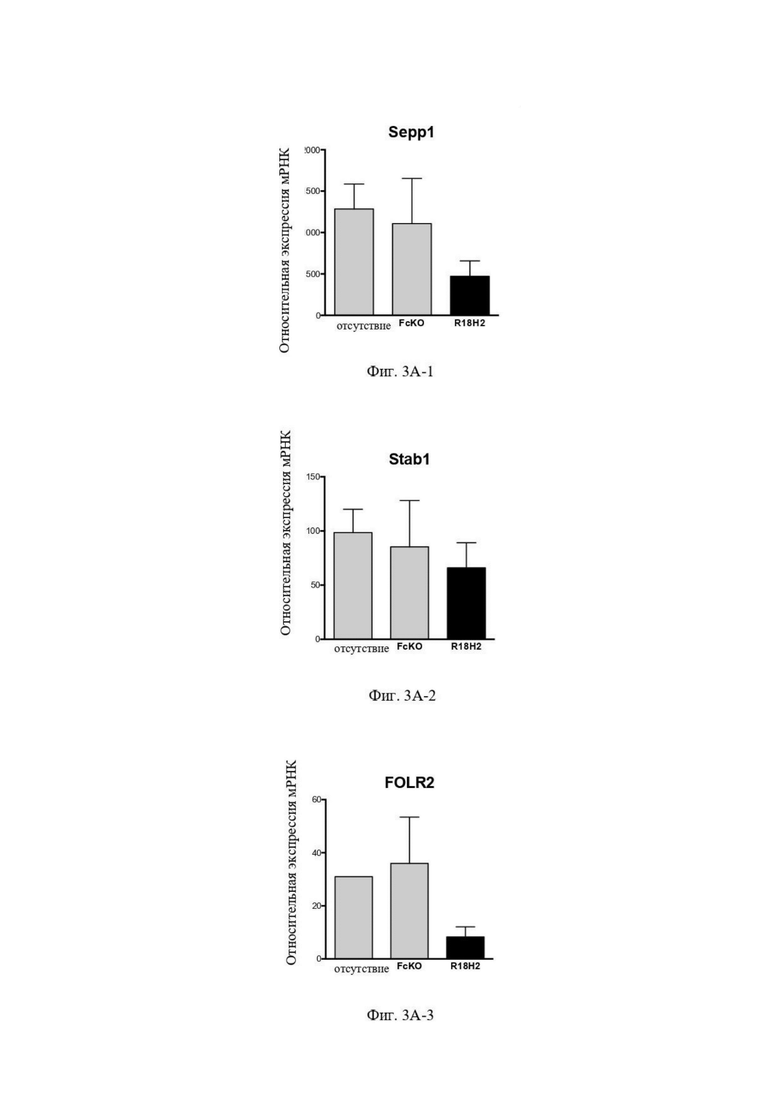
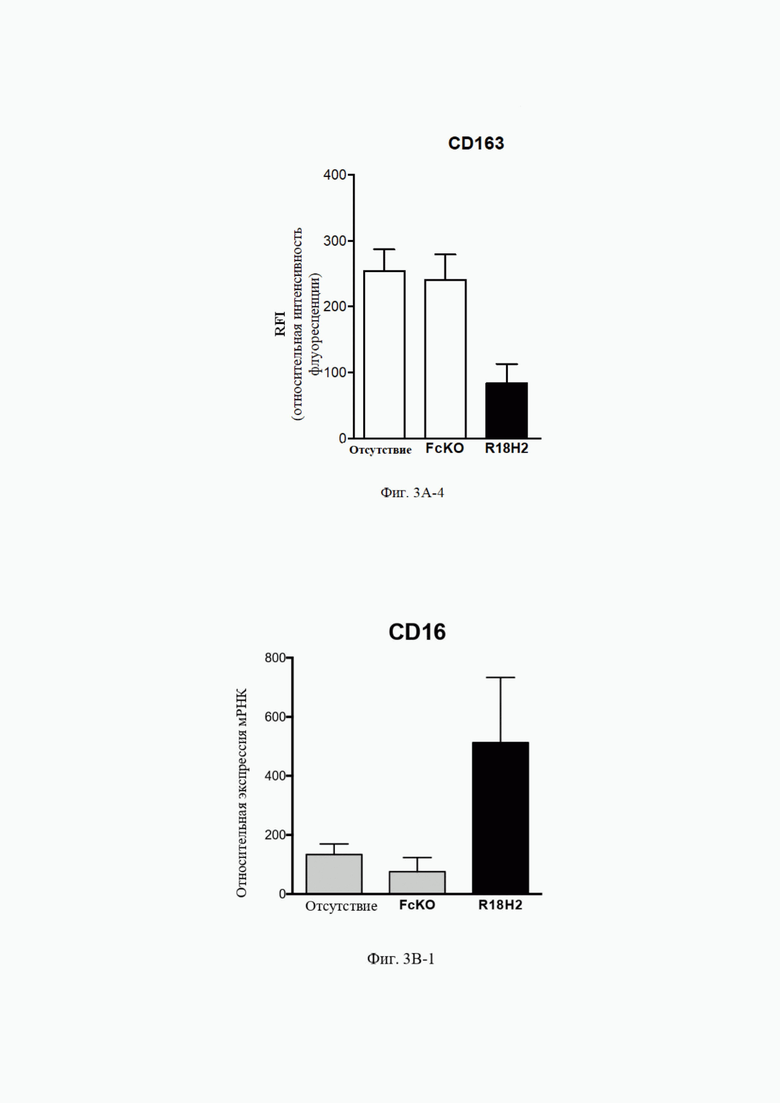
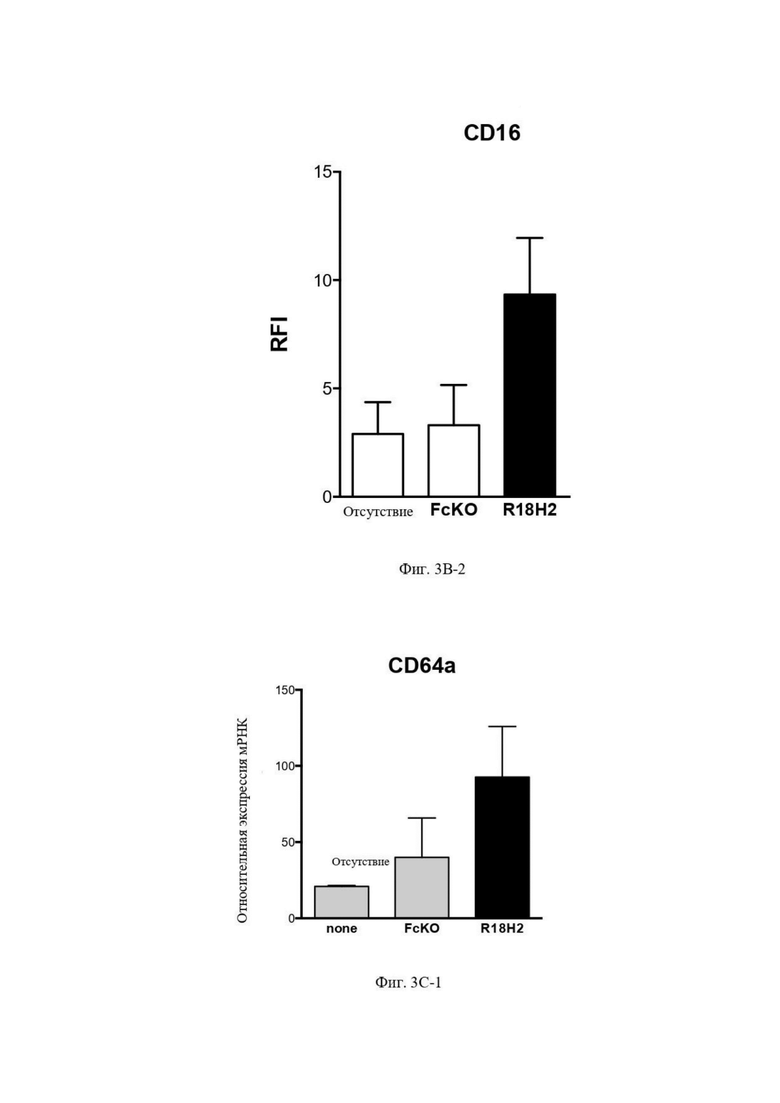
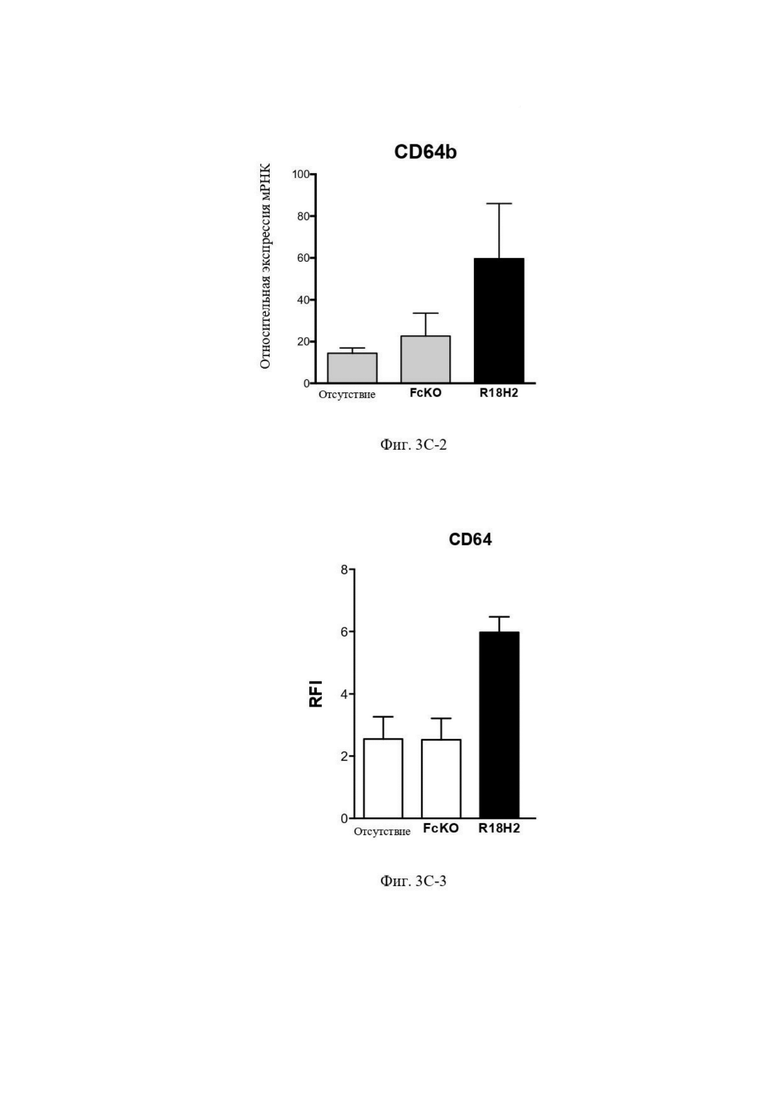
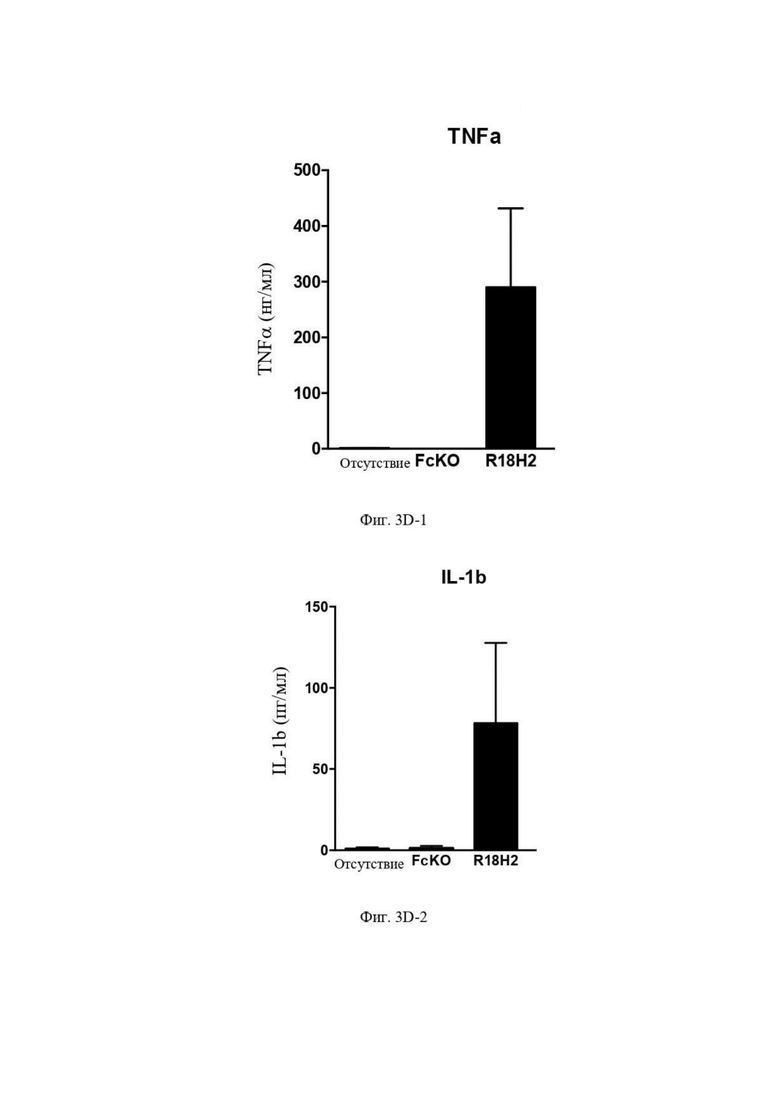
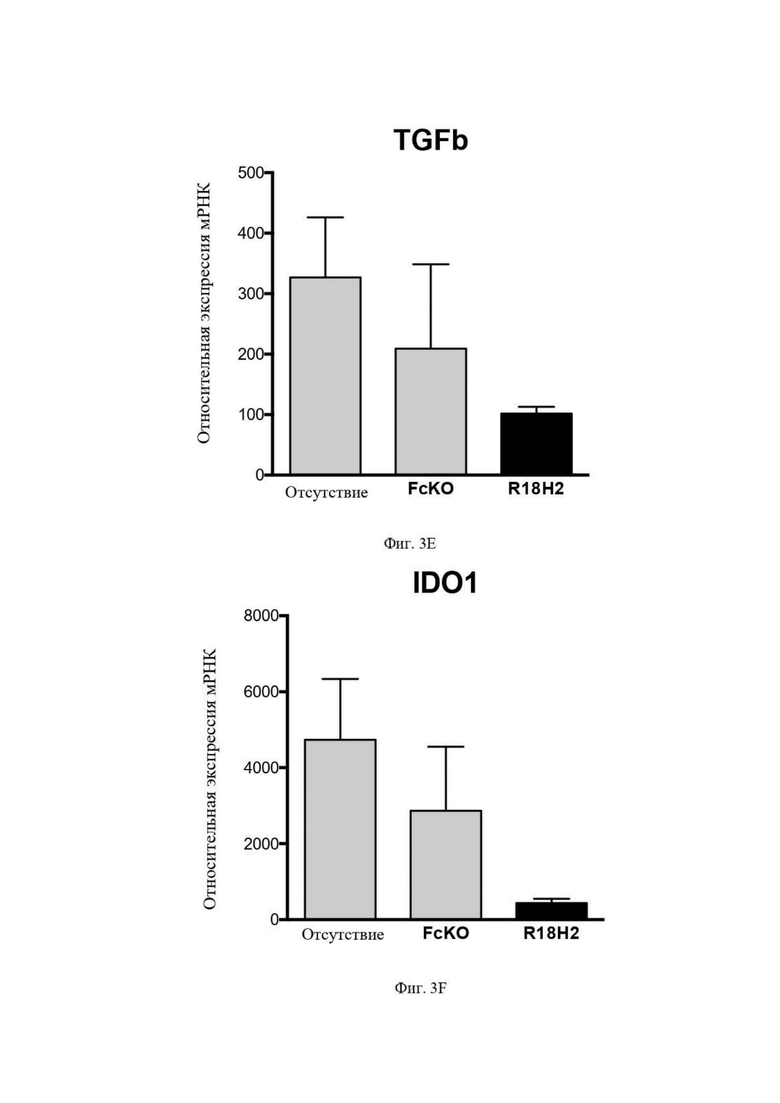
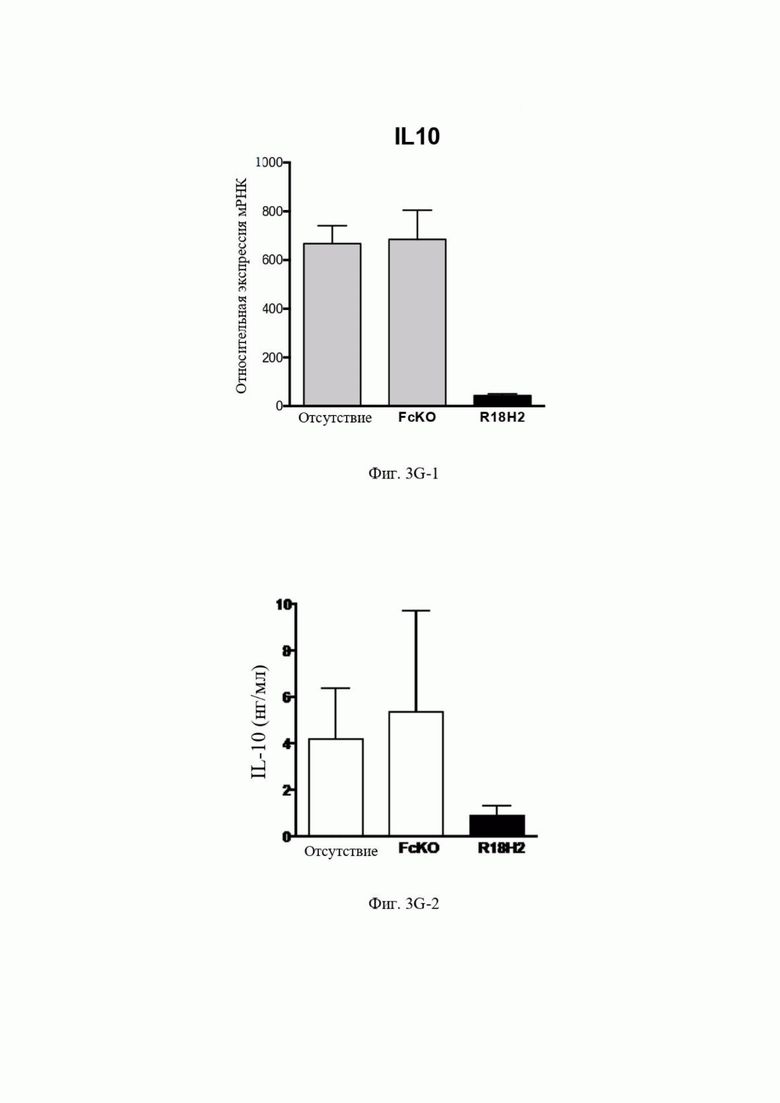
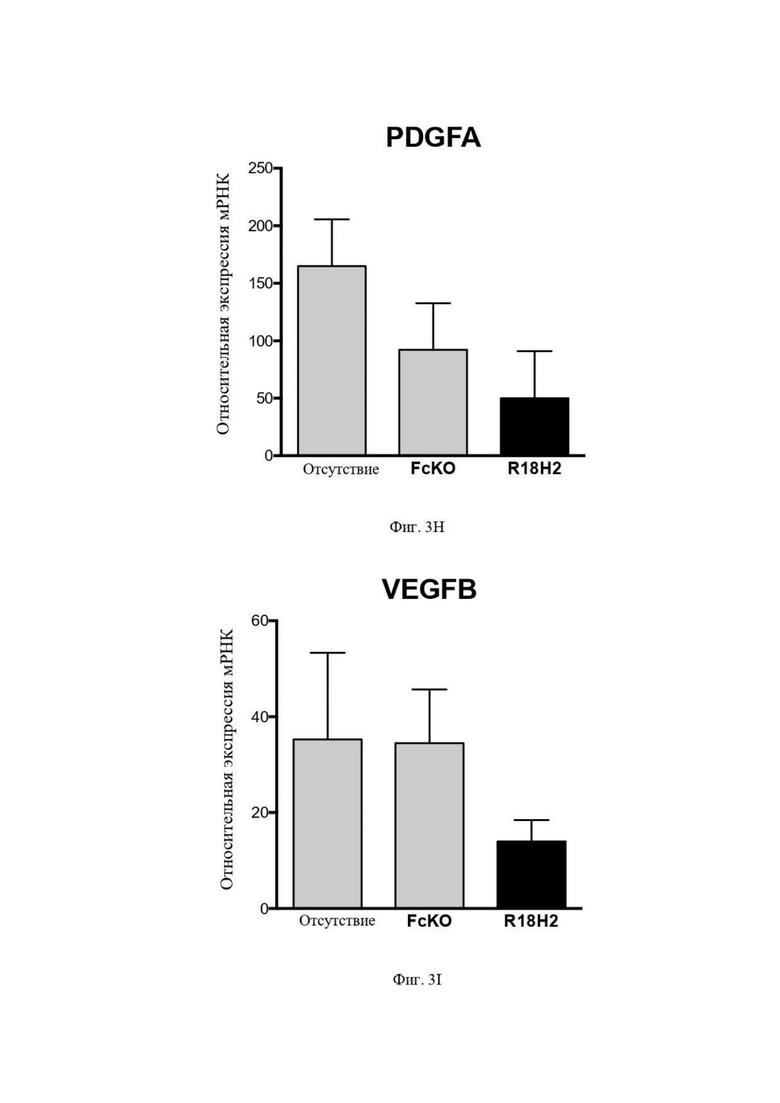
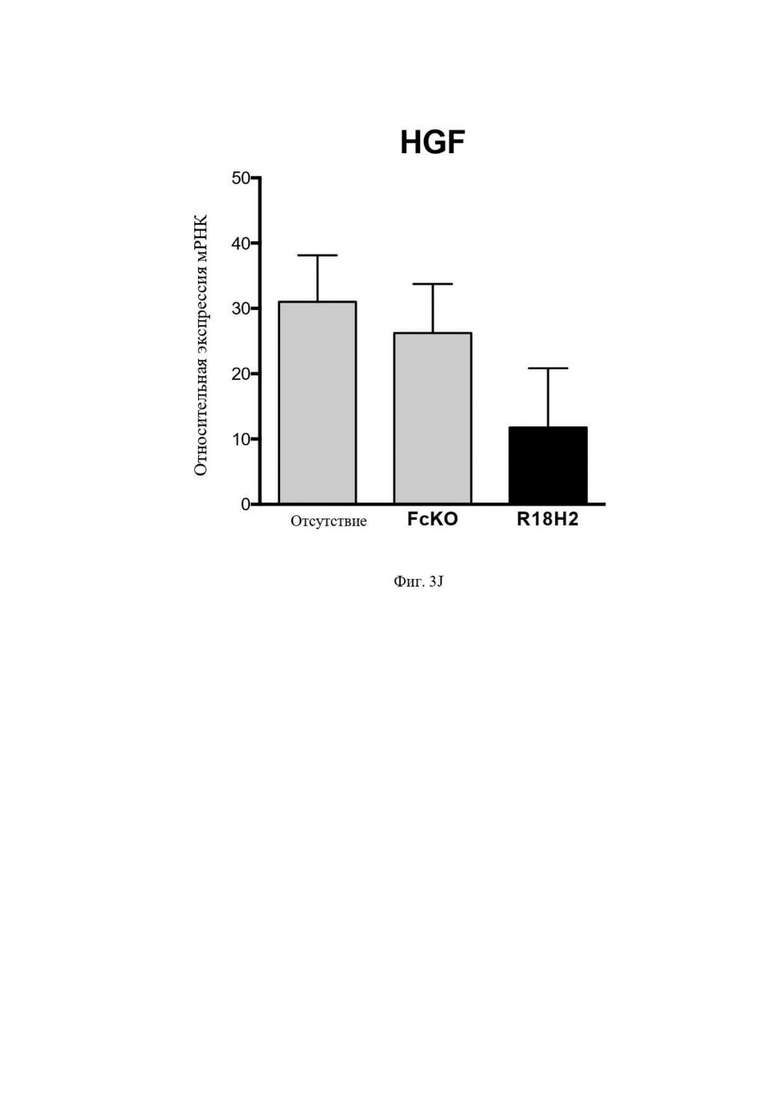
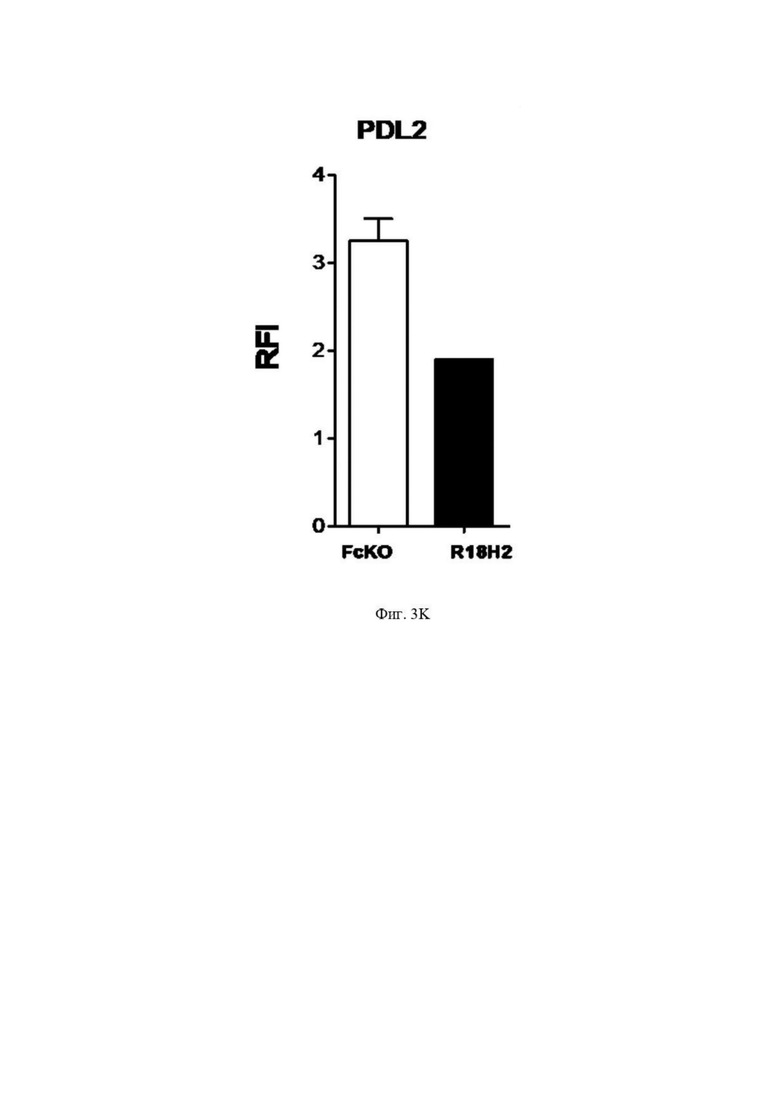

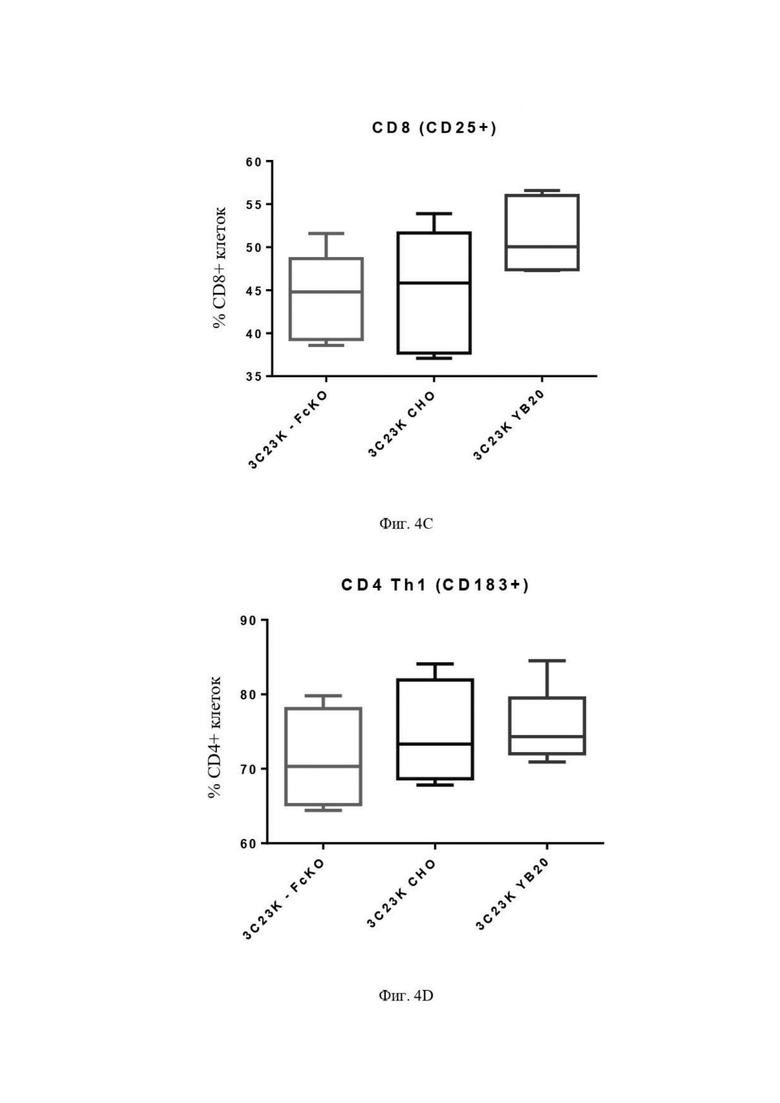
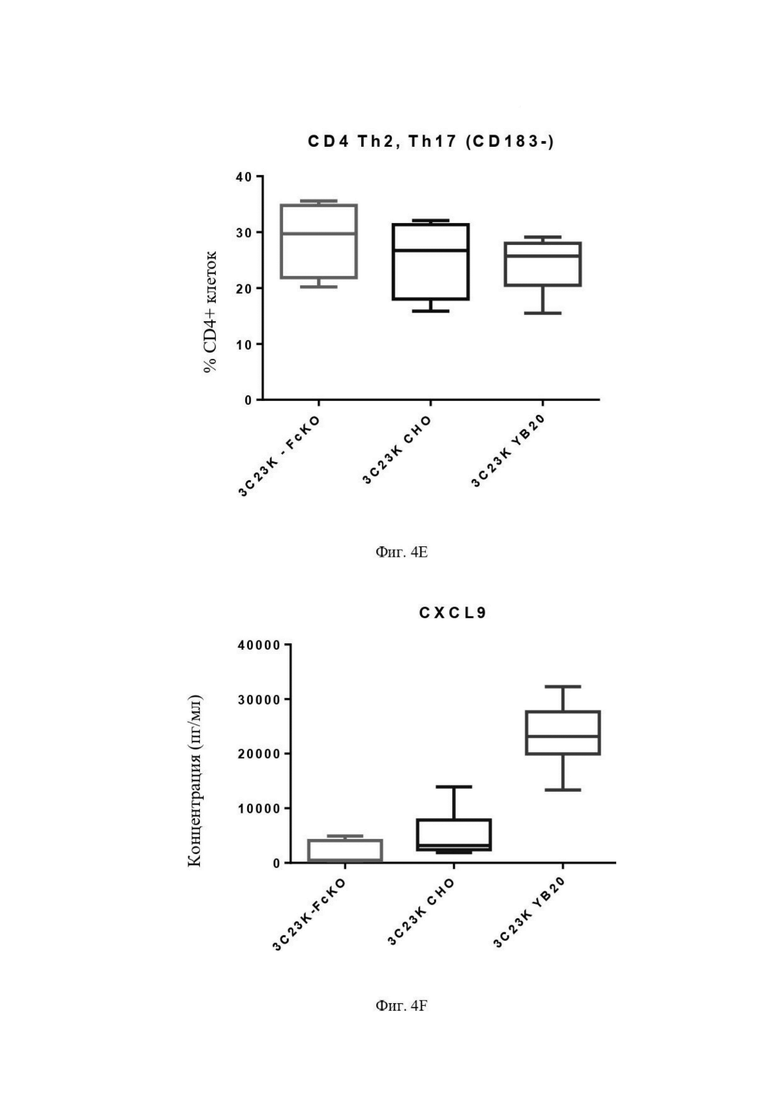
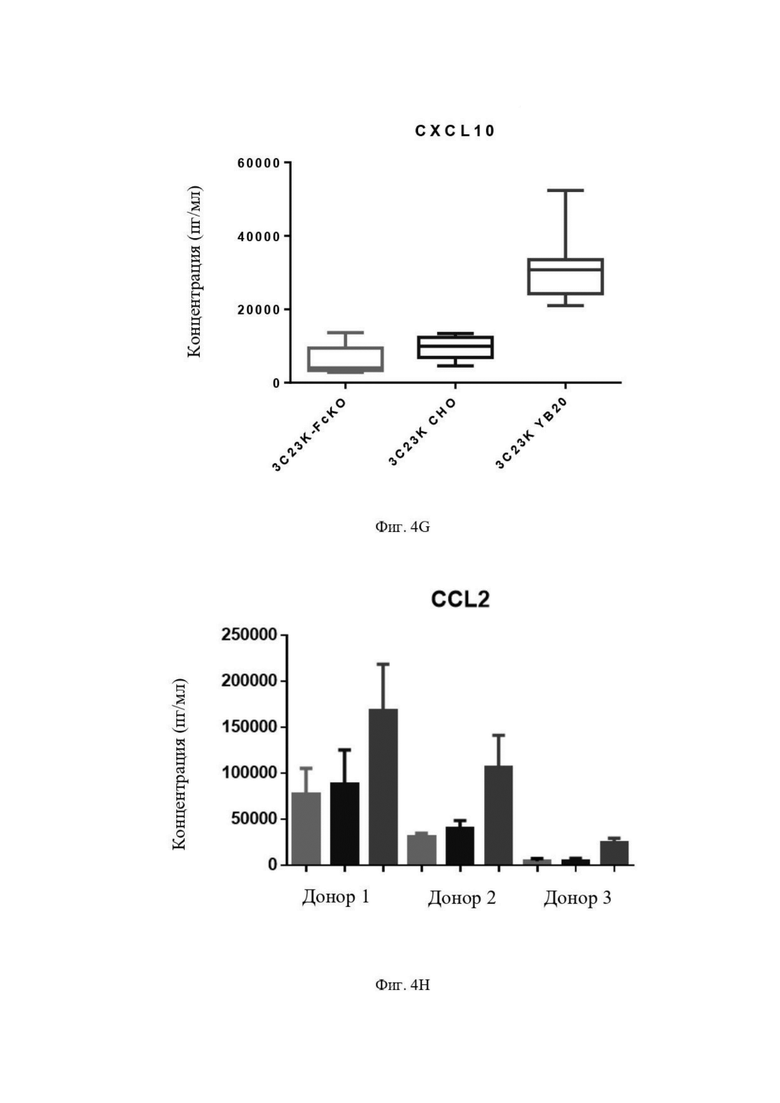
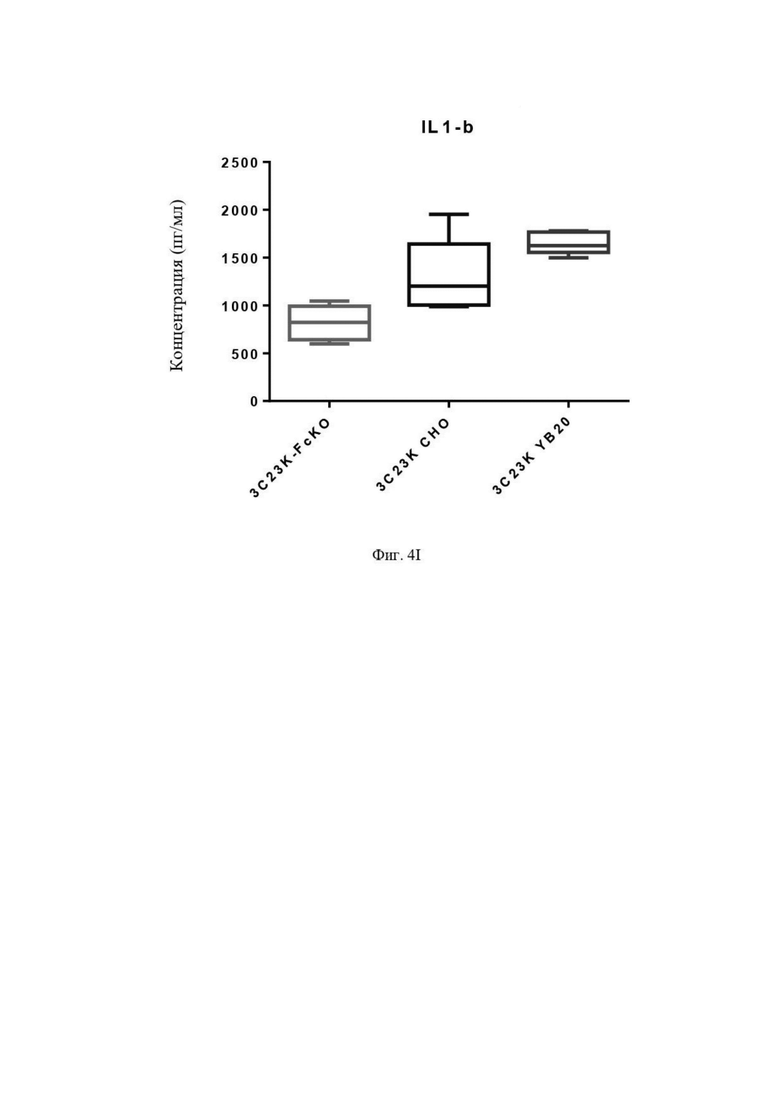
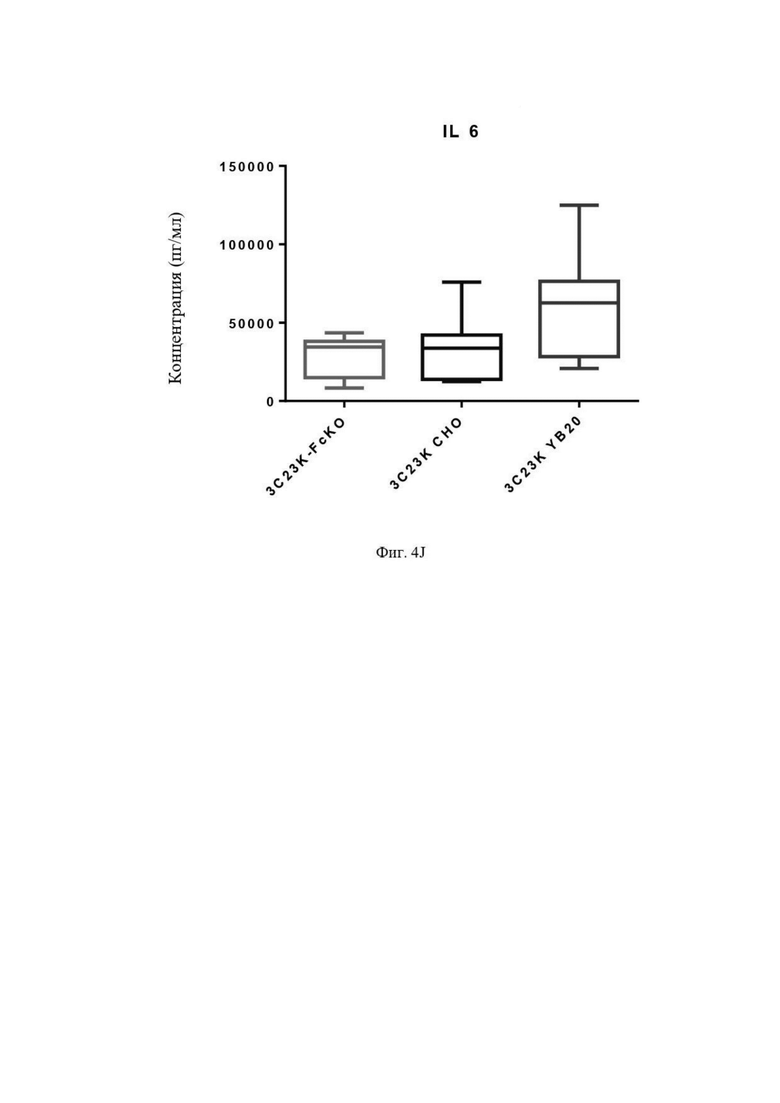
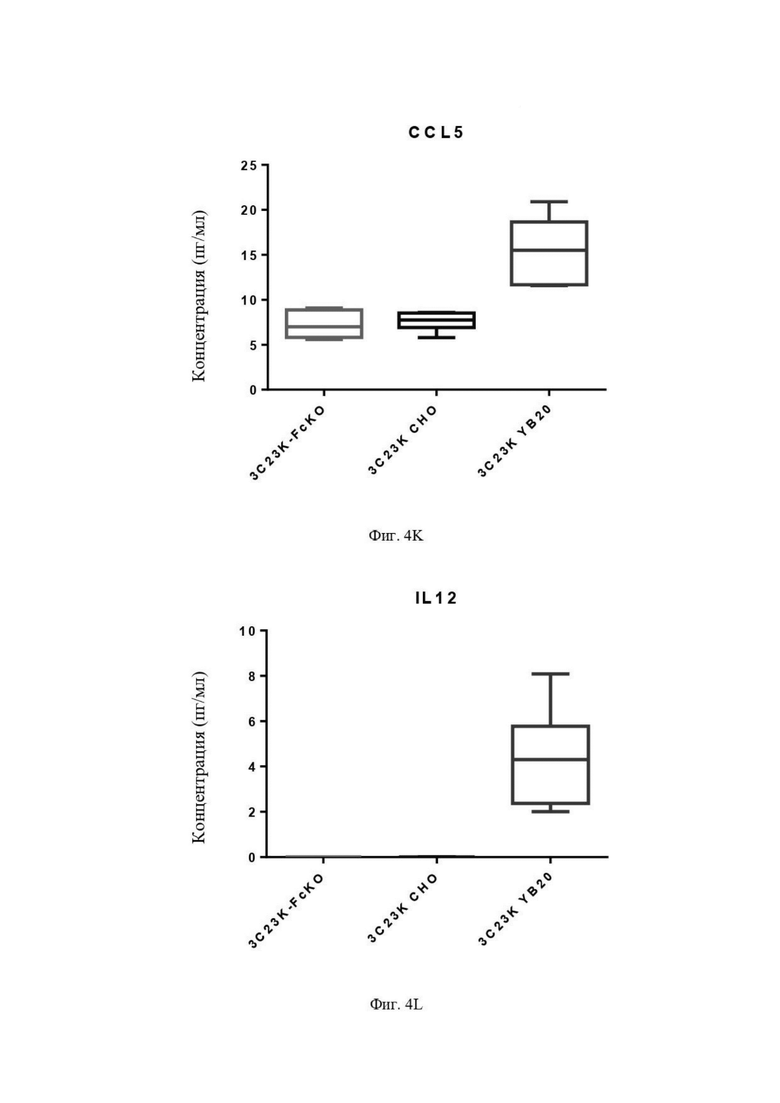

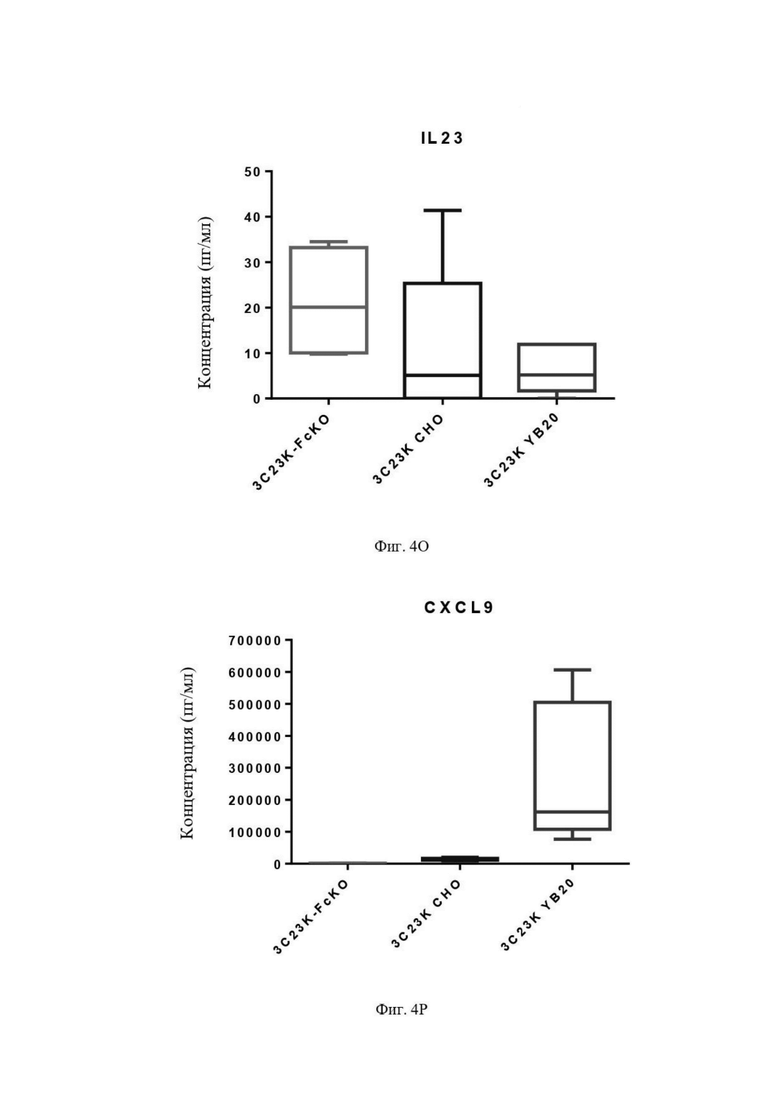
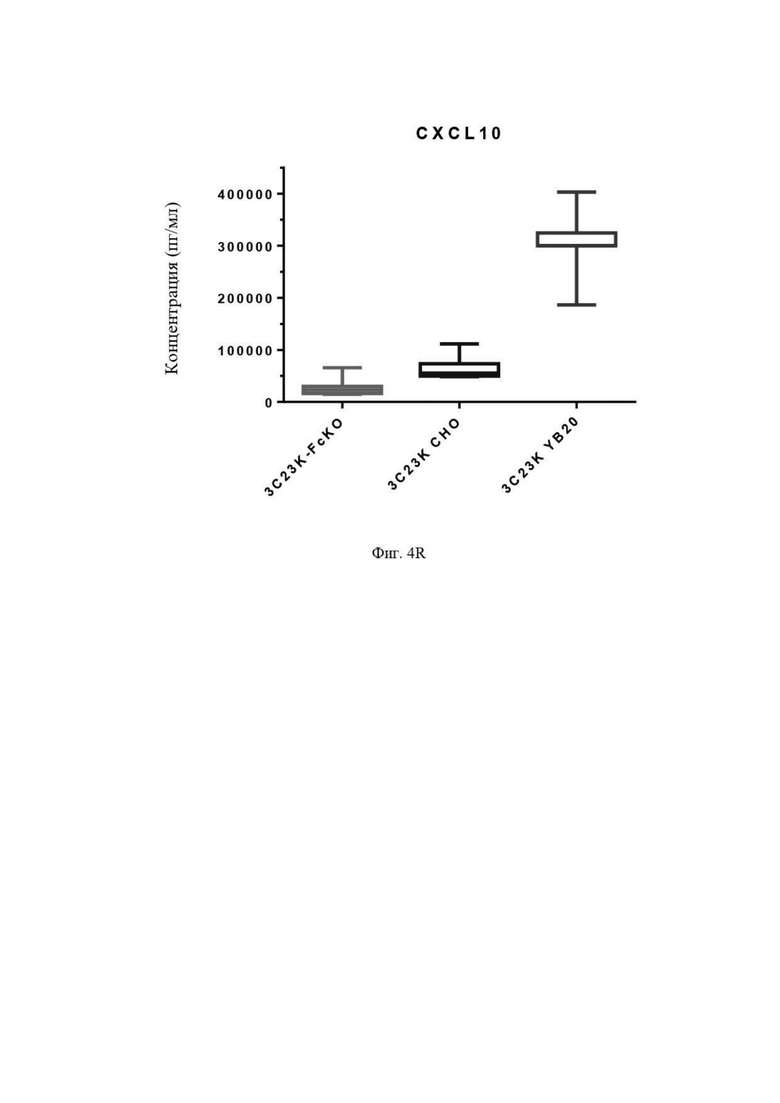
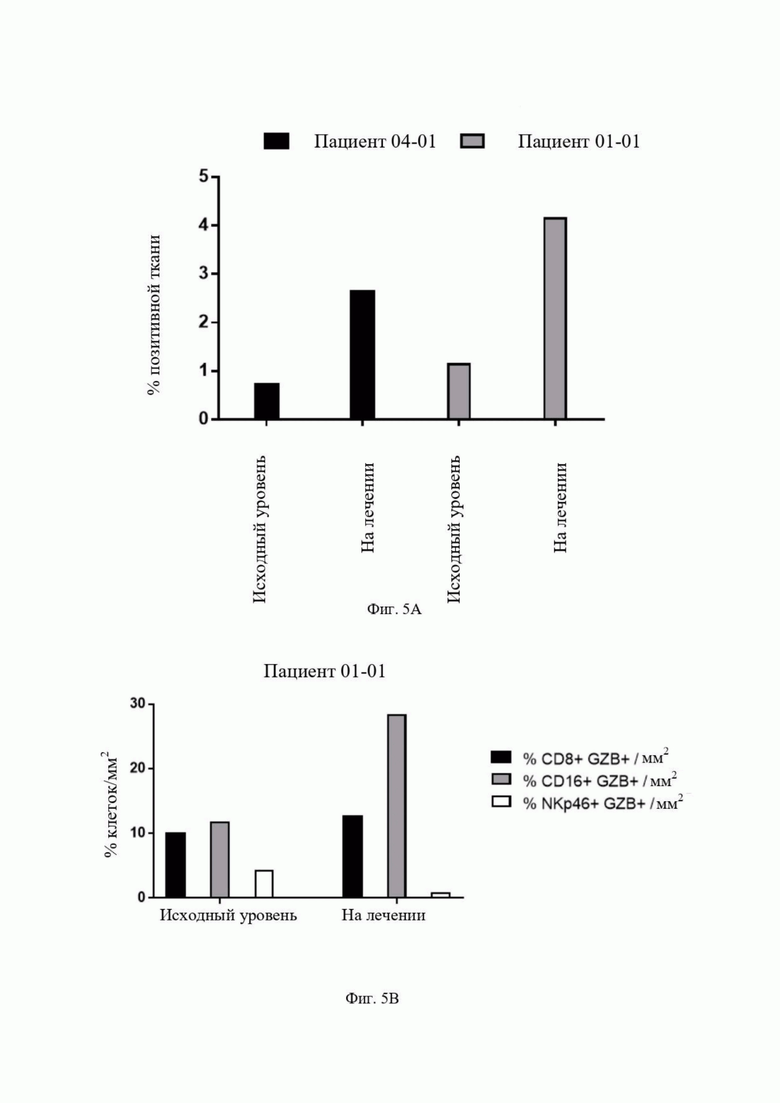
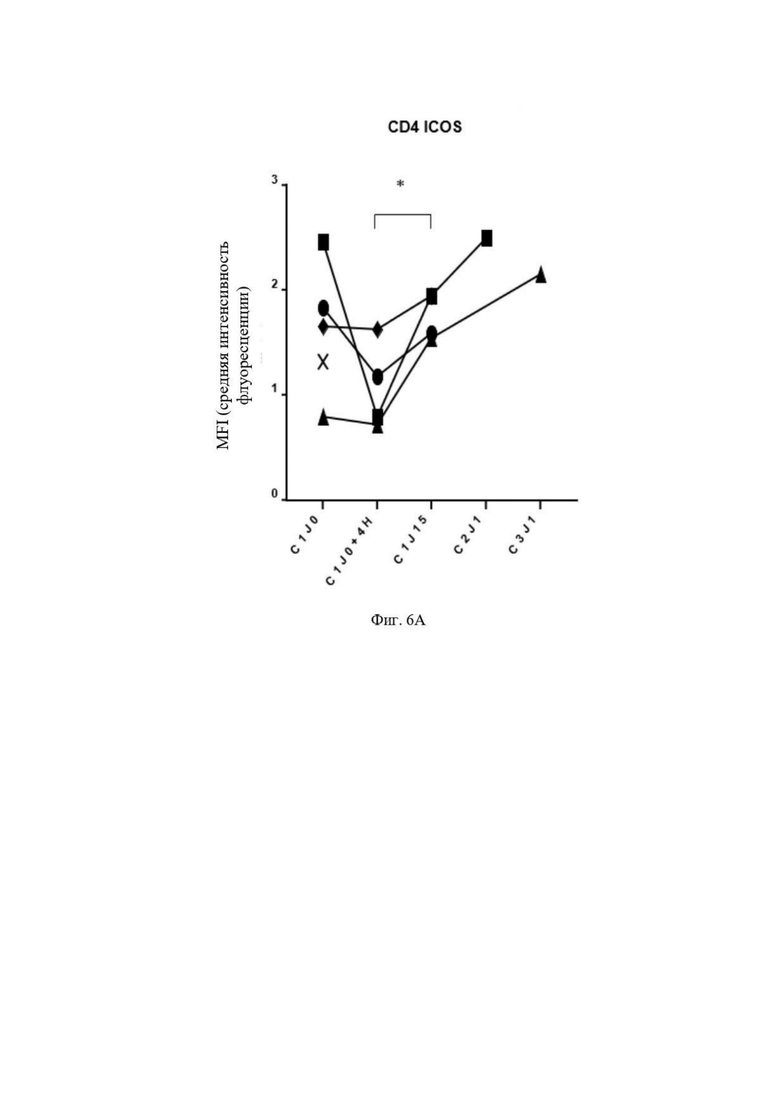
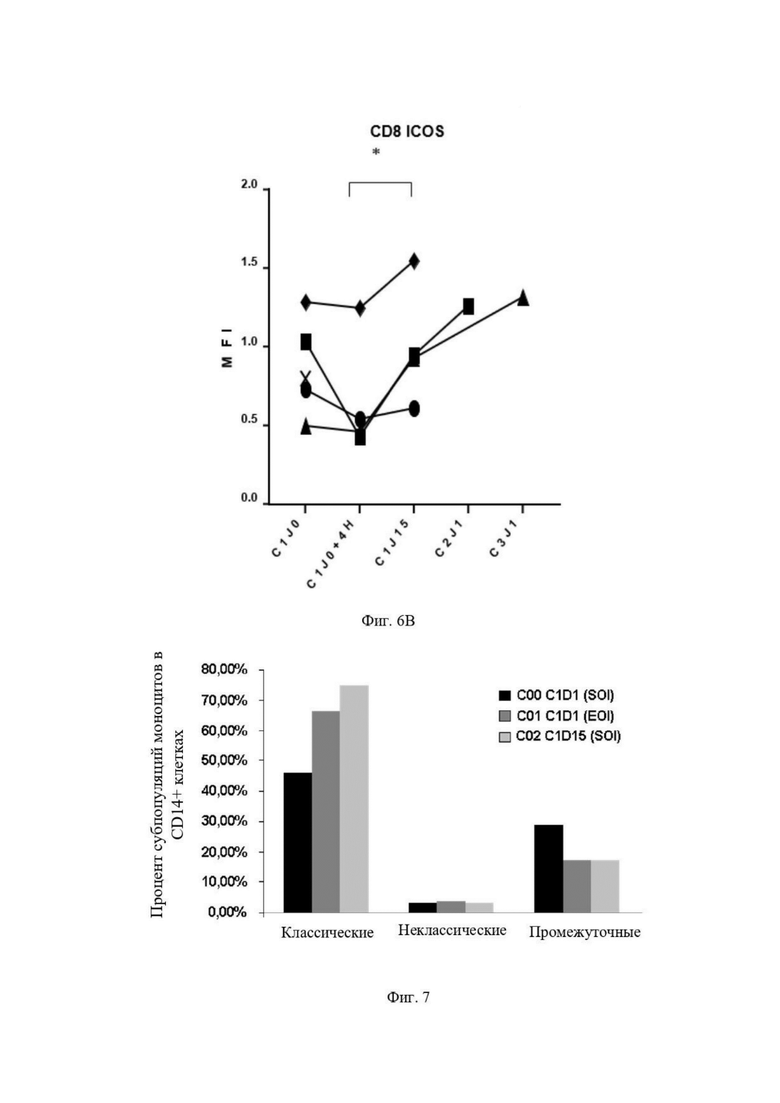
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая применение соединения, несущего гликомодифицированный Fc-фрагмент, в качестве ингибитора иммуносупрессии в лечении иммуносупрессии, ассоциированной с раком, и фармацевтическую композицию для лечения иммуносупрессии, ассоциированной с раком, содержащую эффективное количество (i) соединения, несущего гликомодифицированный Fc-фрагмент, и эффективное количество (ii) ингибитора белка ингибиторной иммунной контрольной точки. В одном из вариантов реализации соединение, несущее гликомодифицированный Fc-фрагмент, представляет собой гликомодифицированное антитело. Изобретение расширяет арсенал средств лечения иммуносупрессии, ассоциированной с раком. 2 н. и 11 з.п. ф-лы, 45 ил., 18 табл., 9 пр.
1. Применение соединения, несущего гликомодифицированный Fc-фрагмент, в качестве ингибитора иммуносупрессии в лечении иммуносупрессии, ассоциированной с раком, которое представляет собой гликомодифицированное антитело.
2. Применение соединения, несущего гликомодифицированный Fc-фрагмент, по п. 1, где указанное гликомодифицированное антитело направлено против опухолевого антигена.
3. Применение соединения, несущего гликомодифицированный Fc-фрагмент, по п. 2, где опухолевый антиген выбран из группы, состоящей из рецептора эпидермального фактора роста, тип 2 (HER2), рецептора эпидермального фактора роста, тип 3 (HER3), рецептора эпидермального фактора роста, тип 4 (HER4) и рецептора антимюллеровского гормона, тип 2 (AMHRII).
4. Применение соединения, несущего гликомодифицированный Fc-фрагмент, по любому из пп. 1-3, где указанное гликомодифицированное антитело выбрано из группы, состоящей из:
(i) гликомодифицированного антитела 3C23K против AMHRII, содержащего:
a) легкую цепь, содержащую SEQ ID NO: 2, и тяжелую цепь, содержащую SEQ ID NO: 4;
b) легкую цепь, содержащую SEQ ID NO: 6, и тяжелую цепь, содержащую SEQ ID NO: 8;
c) легкую цепь, содержащую SEQ ID NO: 10, и тяжелую цепь, содержащую SEQ ID NO: 12;
d) легкую цепь, содержащую SEQ ID NO: 14, и тяжелую цепь, содержащую SEQ ID NO: 16;
(ii) гликомодифицированного антитела 9F7F11 против HER3, содержащего (i) вариабельную область тяжелой цепи с SEQ ID NO: 63 и (ii) вариабельную область легкой цепи с SEQ ID NO: 64;
(iii) гликомодифицированного антитела H4B121 против HER3, содержащего (i) вариабельную область тяжелой цепи с SEQ ID NO: 65 и (ii) вариабельную область легкой цепи с SEQ ID NO: 66; и
(iv) гликомодифицированного антитела HE4B33 против HER4, содержащего (i) вариабельную область тяжелой цепи с SEQ ID NO: 67 и (ii) вариабельную область легкой цепи с SEQ ID NO: 68.
5. Применение соединения, несущего гликомодифицированный Fc-фрагмент, по любому из пп. 1-4, где указанное лечение рака включает дополнительное введение указанному индивидууму ингибитора белка ингибиторной иммунной контрольной точки.
6. Применение соединения, несущего гликомодифицированный Fc-фрагмент, по п. 5, где указанный ингибитор белка ингибиторной иммунной контрольной точки выбран из группы, состоящей из ингибиторов белка запрограммированной гибели клетки 1 (PD-1), лиганда белка запрограммированной гибели клетки 1 (PD-L1), лиганда белка запрограммированной гибели клетки 2 (PD-L2), B- и T-лимфоцитарного аттенюатора (BTLA), цитотоксического Т-лимфоцит-ассоциированного белка 4 (CTLA-4), рецептора аденозина A2A (A2AR), белка-гомолога 3 B7 (B7-H3) (CD276), белка-гомолога 4 B7 (B7-H4) (VTCN1), индоламин-2,3-диоксигеназы (IDO), иммуноглобулинподобного рецептора клеток-киллеров (KIR), белка гена активации лимфоцитов-3 (LAG3), белка-3, содержащего Т-клеточный иммуноглобулин и муцин (TIM-3) и V-доменного иммуноглобулинового супрессора активации Т-клеток (VISTA).
7. Применение соединения, несущего гликомодифицированный Fc-фрагмент, по п. 6, где указанный ингибитор состоит из антитела, направленного против указанного белка ингибиторной иммунной контрольной точки, или его антигенсвязывающего фрагмента.
8. Фармацевтическая композиция для лечения иммуносупрессии, ассоциированной с раком, содержащая эффективное количество (i) соединения, несущего гликомодифицированный Fc-фрагмент, и эффективное количество (ii) ингибитора белка ингибиторной иммунной контрольной точки, при этом соединение, несущее гликомодифицированный Fc-фрагмент, представляет собой гликомодифицированное антитело.
9. Фармацевтическая композиция по п. 8, где указанное гликомодифицированное антитело направлено против опухолевого антигена.
10. Фармацевтическая композиция по п. 9, где опухолевый антиген выбран из группы, состоящей из рецептора эпидермального фактора роста, тип 2 (HER2), рецептора эпидермального фактора роста, тип 3 (HER3), рецептора эпидермального фактора роста, тип 4 (HER4) и рецептора антимюллеровского гормона, тип 2 (AMHRII).
11. Фармацевтическая композиция по любому из пп. 8-10, где указанное гликомодифицированное антитело выбрано из группы, состоящей из:
(i) гликомодифицированного антитела 3C23K против AMHRII, содержащего:
a) легкую цепь, содержащую SEQ ID NO: 2, и тяжелую цепь, содержащую SEQ ID NO: 4;
b) легкую цепь, содержащую SEQ ID NO: 6, и тяжелую цепь, содержащую SEQ ID NO: 8;
c) легкую цепь, содержащую SEQ ID NO: 10, и тяжелую цепь, содержащую SEQ ID NO: 12;
d) легкую цепь, содержащую SEQ ID NO: 14, и тяжелую цепь, содержащую SEQ ID NO: 16;
(ii) гликомодифицированного антитела 9F7F11 против HER3, содержащего (i) вариабельную область тяжелой цепи с SEQ ID NO: 63 и (ii) вариабельную область легкой цепи с SEQ ID NO: 64;
(iii) гликомодифицированного антитела H4B121 против HER3, содержащего (i) вариабельную область тяжелой цепи с SEQ ID NO: 65 и (ii) вариабельную область легкой цепи с SEQ ID NO: 66; и
(iv) гликомодифицированного антитела HE4B33 против HER4, содержащего (i) вариабельную область тяжелой цепи с SEQ ID NO: 67 и (ii) вариабельную область легкой цепи с SEQ ID NO: 68.
12. Фармацевтическая композиция по любому из пп. 8-11, в которой указанный ингибитор белка ингибиторной иммунной контрольной точки выбран из группы, состоящей из ингибиторов белка запрограммированной гибели клетки 1 (PD-1), лиганда белка запрограммированной гибели клетки 1 (PD-L1), лиганда белка запрограммированной гибели клетки 2 (PD-L2), B- и T-лимфоцитарного аттенюатора (BTLA), цитотоксического Т-лимфоцит-ассоциированного белка 4 (CTLA-4), рецептора аденозина A2A (A2AR), белка-гомолога 3 B7 (B7-H3) (CD276), белка-гомолога 4 B7 (B7-H4) (VTCN1), индоламин-2,3-диоксигеназы (IDO), иммуноглобулинподобного рецептора клеток-киллеров (KIR), белка гена активации лимфоцитов-3 (LAG3), белка-3, содержащего Т-клеточный иммуноглобулин и муцин (TIM-3) и V-доменного иммуноглобулинового супрессора активации Т-клеток (VISTA).
13. Фармацевтическая композиция по любому из пп. 8-12, в которой указанный ингибитор белка ингибиторной иммунной контрольной точки состоит из антитела, направленного против указанного белка ингибиторной иммунной контрольной точки, или его антигенсвязывающего фрагмента.
| Rinpei Niwa et al., Enhancement of the Antibody-Dependent Cellular Cytotoxicity of Low-Fucose IgG1 Is Independent of FcyRIIIa Functional Polymorphism | |||
| Clinical Cancer Research, 2004, Vol | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Toyohide Shinkawa et al., The Absence of Fucose but Not the Presence of Galactose or Bisecting N-Acetylglucosamine of Human IgG1 Complex-type | |||
Авторы
Даты
2023-10-12—Публикация
2018-05-29—Подача