ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
1. Область изобретения
Настоящее изобретение относится к конъюгату, в котором непептидильный полимерный линкер и константная область иммуноглобулина специфично связаны посредством ковалентной связи с аминокислотным остатком бета-цепи инсулина, за исключением ее N-конца, и к способу его получения.
2. Описание предшествующего уровня техники
Инсулин представляет собой пептид, секретируемый из бета-клеток человеческой поджелудочной железы в качестве вещества, играющего очень важную роль в контролировании уровня глюкозы в крови организма. В случаях, когда не происходит правильной секреции инсулина или секретированный инсулин не оказывает нужного действия в организме, уровень глюкозы в крови не может контролироваться в организме и повышается, вызывая посредством этого состояние, называемое диабетом. Случай, описанный выше, называют сахарным диабетом 2 типа, а случай повышения уровня глюкозы в крови из-за отсутствия секреции инсулина из поджелудочной железы, называют сахарным диабетом 1 типа. Сахарный диабет 2 типа лечат пероральным гипогликемическим агентом, содержащим химическое вещество в качестве основного компонента, и некоторых пациентов также лечат инсулином. С другой стороны для лечения диабета 1 типа необходимо введение инсулина.
Терапия инсулином, широко применяемая в настоящее время, представляет собой способ введения инсулина инъекцией до и после приема пищи. Тем не менее, для такой терапии инсулином его необходимо вводить постоянно три раза в сутки, что приводит к значительным неудобствам для пациентов. Было предпринято множество попыток преодоления таких проблем. Одной из них была попытка доставки пептидных лекарственных средств в организм посредством ингаляции через полости рта или нос, за счет увеличения проницаемости биологических мембран для пептидных лекарств. Однако такой метод демонстрирует существенно меньшую эффективность доставки пептидов а организм, по сравнению с инъекцией. Соответственно, поддержание активности пептидных лекарственных средств in vivo в необходимых условиях все еще связано со множеством трудностей.
Также был предложен способ для задержки поглощения после подкожного введения избытка лекарственных средств. В соответствии с этим, был представлен способ поддержания концентрации лекарственного средства в крови при всего лишь одном введении в сутки. Некоторые такие продукты утверждены в качестве лекарственных средств (например, Lantus, Sanofi-Aventis), и их применяют для пациентов в настоящее время. Было проведено исследование с модификацией инсулина жирными кислотами для усиления связывания полимера-инсулина и для увеличения продолжительности сохранения связыванием с альбумином, присутствующим в месте введения и в крови, и лекарственные средства, изготовленные с применением такого способа, утверждены в качестве лекарственных средств (Levemir, NovoNordisk). Тем не менее, побочным эффектом таких способов является боль в месте введения, и, кроме того, проведение инъекций один раз в сутки все еще приводит к значительным неудобствам для пациентов.
В то же время, согласно сообщениям, N- или С-концевая область, например, аминокислотный остаток в положении 29, бета-цепи инсулина не оказывает существенного влияния на связывание инсулина с рецептором инсулина (Jens Brange and Aage Volund, Adv. Drug Deliv. Rev., 35(2-3): 307-335 (1999); Peter Kurtzhals et al., Diabetes, 49(6): 999-1005 (2000)).
Соответственно, авторы настоящего изобретения провели исследования, разработав способ модификации аминокислотного остатка в С-концевой области бета-цепи инсулина с использованием непептидильного полимера и константной области иммуноглобулина, и обнаружили, что этот способ приводит к получению конъюгата, имеющего более высокую аффинность связывания с рецептором инсулина, чем конъюгаты, полученные модификацией других сайтов инсулина, таких как N-конец, завершив посредством этого настоящее изобретение.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является обеспечение конъюгата инсулина, получаемого сайт-специфичным связыванием Fc-области иммуноглобулина с аминокислотным остатком бета-цепи инсулина, за исключением ее N-конца, через непептидильный полимер, и способа его получения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
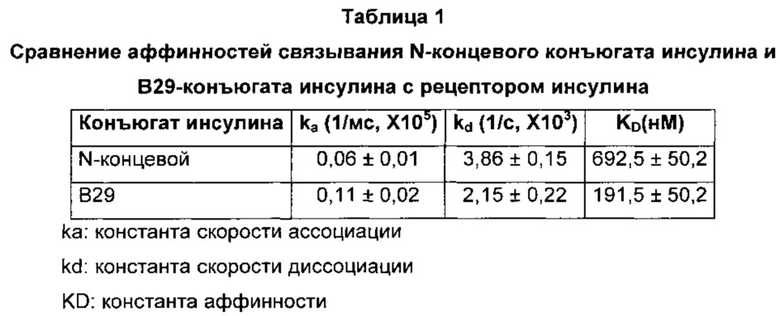
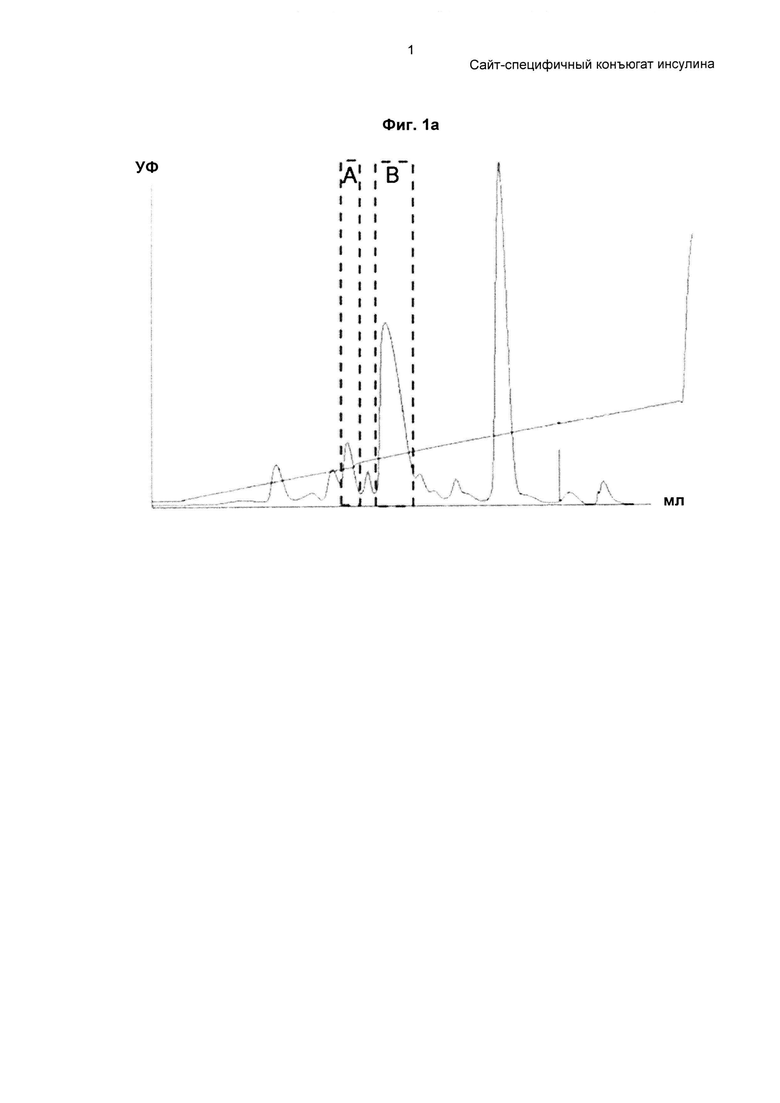
На ФИГ. 1А-1В показан профиль и фотография SDS-PAGE-геля монопегилированного инсулина, очищенного с использованием колонки Source 15S.
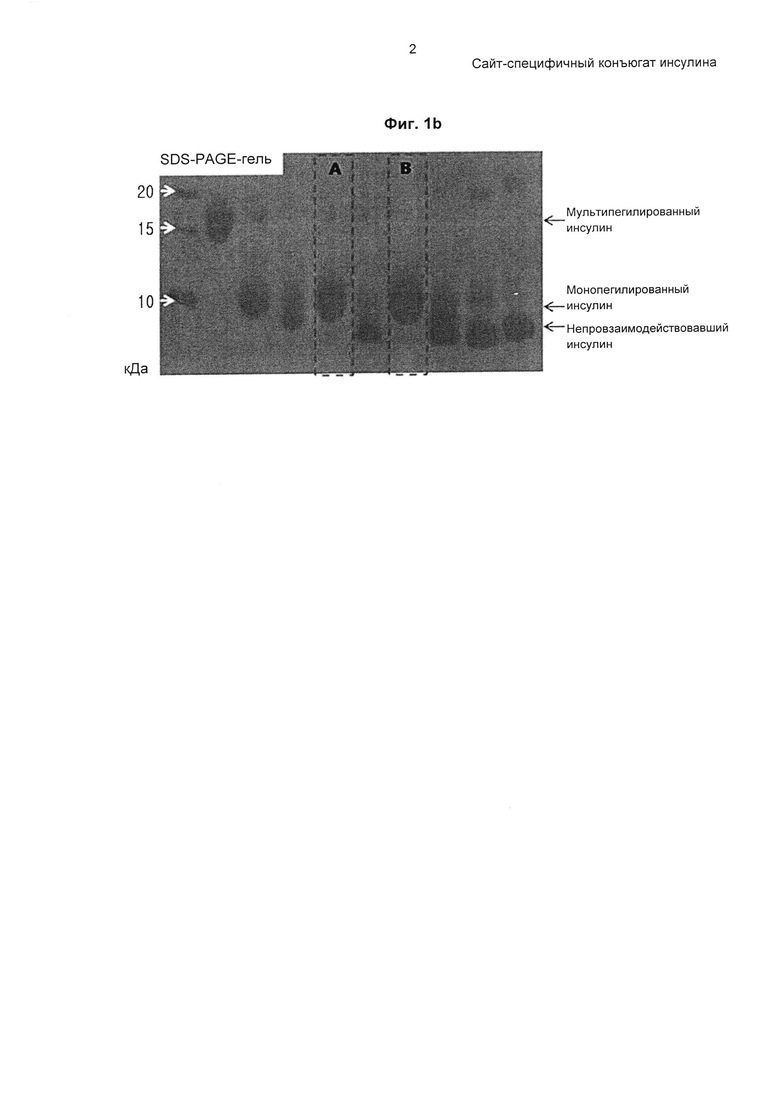
На ФИГ. 2-3 показан инсулин-PEG, полученный в результате сайт-специфичного пегилирования по 29-му аминокислотному остатку бета-цепи.
На ФИГ. 3 показан результат анализа чистоты конечного очищенного конъюгата.
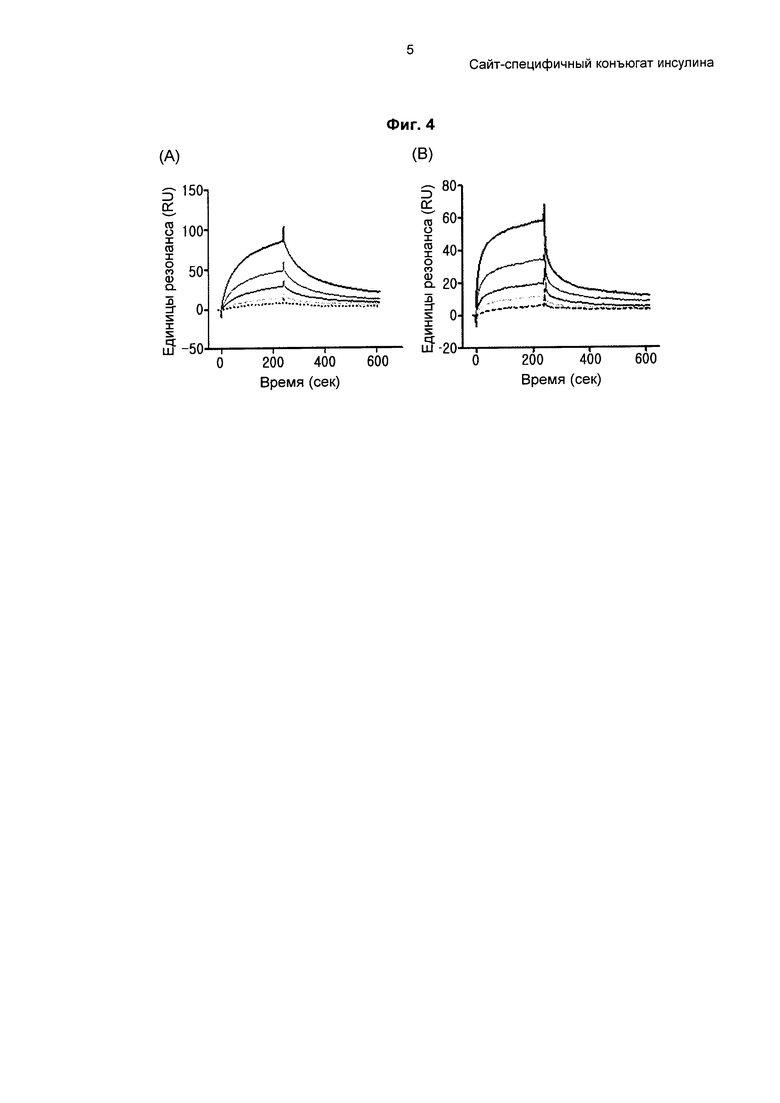
На ФИГ. 4 показаны сенсограммы связывания конъюгата инсулина с рецептором инсулина, на которых (А) соответствует N-концевому конъюгату инсулина, (В) соответствует В29-конъюгату инсулина и каждая кривая сверху вниз соответствует концентрации вещества 1000, 500, 250, 125 или 62,5 нМ.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДОЧТИТЕЛЬНЫХ ВОПЛОЩЕНИЙ
В одном аспекте для выполнения указанной выше задачи согласно настоящему изобретению предложен конъюгат инсулина, характеризующийся тем, что инсулин и Fc-область иммуноглобулина связаны друг с другом через непептидильный полимерный линкер, выбранный из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимера этиленгликоля и пропиленгликоля, полиоксиэтилированного полиола, поливинилового спирта, полисахарида, декстрана, поливинилэтилового эфира, биоразлагаемого полимера, липидного полимера, хитина, гиалуроновой кислоты и их комбинации, и один конец непептидильного полимера связан с аминокислотным остатком бета-цепи инсулина, за исключением ее N-конца, а другой его конец связан с Fc-областью иммуноглобулина.
Предпочтительно, непептидильный полимер может быть связан с любым из аминокислотных остатков в положениях 20-29 бета-цепи инсулина.
Более предпочтительно, непептидильный полимер может быть связан с любым из аминокислотных остатков в положениях 25-29 бета-цепи инсулина.
Намного более предпочтительно, непептидильный полимер может быть связан с лизиновым остатком в положении 29 бета-цепи инсулина.
Предпочтительно, аминокислотный остаток бета-цепи инсулина, с которым связан непептидильный полимер, может иметь аминогруппу или тиоловую группу.
Предпочтительно, инсулин может представлять собой нативный инсулин или вариант, который получен одним из способов замены, добавления, удаления и модификации некоторых аминокислот нативного инсулина или их комбинацией, производное инсулина, агонист инсулина или его фрагмент.
Предпочтительно, оба конца непептидильного полимера могут быть связаны с аминогруппой или тиоловой группой боковой цепи аминокислотного остатка Fc-области иммуноглобулина и бета-цепи инсулина, соответственно.
Предпочтительно, аминокислота может представлять собой природную или неприродную аминокислоту.
Предпочтительно, Fc-область иммуноглобулина может быть агликозилированной.
Предпочтительно, Fc-область иммуноглобулина состоит из одного-четырех доменов, выбранных из группы, состоящей из доменов СН1, СН2, СН3 и СН4.
Предпочтительно, Fc-область иммуноглобулина может дополнительно содержать шарнирную область.
Предпочтительно, Fc-область иммуноглобулина может представлять собой Fc-область, имеющую происхождение от IgG, IgA, IgD, IgE или IgM.
Предпочтительно, каждый домен Fc-области иммуноглобулина может представлять собой гибрид доменов из разных источников, имеющих происхождение от иммуноглобулинов, выбранных из группы, состоящей из IgG, IgA, IgD, IgE и IgM.
Предпочтительно, Fc-область иммуноглобулина может представлять собой димер или мультимер, состоящий из одноцепочечных иммуноглобулинов, состоящих из доменов из одного и того же источника.
Предпочтительно, Fc-область иммуноглобулина может представлять собой Fc-область IgG4.
Предпочтительно, Fc-область иммуноглобулина может представлять собой человеческую агликозилированную Fc-область IgG4.
Предпочтительно, непептидильный полимер может связываться с аминогруппой или тиоловой группой боковой цепи аминокислотного остатка бета-цепи инсулина с образованием пептидной, гемитиоацетальной, иминной или тиодиоксопирролидинильной связи.
Предпочтительно, оба конца непептидильного полимера могут независимо иметь реакционноспособную группу, выбранную из группы, состоящей из альдегидной группы, пропиональдегидной группы, бутиральдегидной группы, малеимидной группы и сукцинимидного производного.
Предпочтительно, сукцинимидное производное может представлять собой сукцинимидилкарбоксиметил, сукцинимидилвалерат, сукцинимидилметилбутаноат, сукцинимидилметилпропионат, сукцинимидилбутаноат, сукцинимидилпропионат, N-гидроксисукцинимид или сукцинимидил карбонат.
Предпочтительно, оба конца непептидильного полимера могут иметь бутиральдегидную реакционноспособную группу или сукцинимидилвалератную реакционноспособную группу, соответственно.
В другом аспекте согласно настоящему изобретению предложена композиция инсулина длительного действия, имеющая улучшенные продолжительность действия и стабильность in vivo, содержащая конъюгат инсулина.
Предпочтительно, композиция может быть использована для лечения диабета.
В еще одном аспекте согласно настоящему изобретению предложен способ получения конъюгата инсулина, включающий стадии: (1) ковалентного связывания непептидильного полимера с аминокислотным остатком бета-цепи инсулина, за исключением ее N-конца; (2) выделения комплекса инсулина, в котором непептидильный полимер ковалентно связан с аминокислотным остатком бета-цепи инсулина, за исключением ее N-конца, из реакционной смеси со стадии (1), и (3) ковалентного связывания Fc-области иммуноглобулина с другим концом непептидильного полимера выделенного комплекса с получением конъюгата инсулина, в котором Fc-область иммуноглобулина и инсулин связаны с каждым концом непептидильного полимера.
Предпочтительно, непептидильный полимер может связываться с аминогруппой или тиоловой группой боковой цепи аминокислотного остатка бета-цепи инсулина с образованием пептидной, гемитиоацетальной, иминной или тиодиоксопирролидинильной связи.
Предпочтительно, каждый из обоих концов непептидильного полимера может независимо иметь альдегидное производное, малеимидное производное или сукцинимидное производное в качестве реакционноспособной группы.
Предпочтительно, оба конца непептидильного полимера могут быть связаны с аминогруппой или тиоловой группой боковой цепи аминокислотного остатка бета-цепи инсулина, за исключением ее N-конца, и Fc-области иммуноглобулина, соответственно.
Предпочтительно, каждый из обоих концов непептидильного полимера может независимо иметь альдегидное производное или сукцинимидное производное в качестве реакционноспособной группы.
Предпочтительно, стадию (1) можно проводить в щелочной среде при рН 9,0 плюс/минус 2.
Предпочтительно, молярное соотношение инсулина и непептидильного полимера на стадии (1) может составлять от 1:1,5 до 1:10.
Предпочтительно, молярное соотношение комплекса инсулина и Fc-области иммуноглобулина на стадии (3) может составлять от 1:1 до 1:10.
В одном аспекте для выполнения указанной выше задачи согласно настоящему изобретению предложен конъюгат инсулина, характеризующийся тем, что инсулин и Fc-область иммуноглобулина связаны друг с другом через непептидильный полимерный линкер, выбранный из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимера этиленгликоля и пропиленгликоля, полиоксиэтилированного полиола, поливинилового спирта, полисахарида, декстрана, поливинилэтилового эфира, биоразлагаемого полимера, липидного полимера, хитина, гиалуроновой кислоты и их комбинации, и один конец непептидильного полимера связан с аминокислотным остатком бета-цепи инсулина, за исключением ее N-конца, а другой его конец связан с Fc-областью иммуноглобулина.
В настоящем изобретении инсулин представляет собой вид физиологически активного пептида, секретируемый из поджелудочной железы, когда уровень глюкозы в крови становится высоким, который функционирует для контроля уровней глюкозы в крови за счет стимулирования проникновения глюкозы из крови в печень, скелетные мышцы и жировую ткань, с ее депонированием в форме гликогена и посредством подавления метаболического использования жира в качестве источника энергии. При использовании в настоящем описании термин «инсулин» включает агонисты, предшественники, производные, фрагменты или варианты инсулина, а также нативный инсулин. Предпочтительно, инсулин включает, без ограничения, нативный инсулин, быстро действующий инсулин и длительно действующий инсулин.
Нативный инсулин представляет собой гормон, секретируемый из поджелудочной железы и играющий критическую роль в контроле уровней глюкозы в крови, стимулируя поглощение глюкозы клетками и ингибируя липолиз. Инсулин, обладающий функцией регуляции уровней глюкозы в крови, образуется из предшественника проинсулина, не обладающего функцией регулирования уровней глюкозы в крови, посредством ряда процессов. Аминокислотные последовательности нативного инсулина являются следующими.
Альфа-цепь:
Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn (SEQ ID NO: 1).
Бета-цепь:
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys-Thr (SEQ ID NO: 2).
Предпочтительно, инсулин может представлять собой нативный инсулин или вариант, который получен одним из способовего замены, добавления, удаления и модификации некоторых аминокислот нативного инсулина или их комбинацией, производное инсулина, агонист инсулина или его фрагмент.
Агонист инсулина означает вещество, связывающееся с рецептором инсулина, демонстрируя биологическую активность, равную биологической активности инсулина, структура которого не связана со структурой инсулина.
Производное инсулина означает пептид, демонстрирующий по меньшей мере 80%-ю гомологию аминокислотной последовательности, по сравнению с нативным инсулином, имеющий некоторые группы аминокислотных остатков, измененные химическим замещением (например, альфа-метилированием, альфа-гидроксилированием), удалением (например, дезаминированием) или модификацией (например, N-метилированием, гликозилированием, жирными кислотами), и обладающий функцией контролирования глюкозы в крови организма.
Фрагмент инсулина означает фрагмент, в котором одна или более чем одна аминокислота добавлены или удалены с амино- или карбоксильного конца инсулина, в котором добавленные аминокислоты могут представлять собой неприродные аминокислоты (например, аминокислоты D-типа) и этот фрагмент инсулина обладает функцией контролирования уровня глюкозы в крови организма.
Вариант инсулина означает пептид, отличающийся от инсулина по одной или более чем одной аминокислотной последовательности и сохраняющий функцию контролирования глюкозы в крови организма.
Кроме того, соответствующие способы получения агонистов, производных, фрагментов и вариантов инсулина могут быть применены независимо или в комбинации. Например, пептид инсулина по настоящему изобретению также включает пептид, в котором одна или более чем одна аминокислота отличаются от аминокислот нативного инсулина и N-концевой аминокислотный остаток дезаминирован, и обладающий функцией контролирования уровня глюкозы в крови организма.
В определенном воплощении инсулин, используемый в настоящем изобретении, может быть получен по рекомбинантной технологии и также возможен синтез инсулина твердофазным способом.
Конъюгат инсулина по настоящему изобретению характеризуется тем, что его получают ковалентным связыванием бета-цепи инсулина и Fc-области иммуноглобулина с каждым концом непептидильного полимера в качестве линкера, где непептидильный полимер имеет реакционноспособные группы на обоих концах. Предпочтительно, оба конца непептидильного полимера могут быть связаны с аминогруппой или тиоловой группой боковой цепи аминокислотного остатка Fc-области иммуноглобулина и бета-цепи инсулина, соответственно.
В связи с этим, аминокислота может представлять собой природную или неприродную аминокислоту, без ограничения, при условии, что аминокислота содержит аминогруппу или тиоловую группу для образования ковалентной связи с непептидильным полимером.
В настоящем изобретении было обнаружено, что аффинность связывания с рецепторами инсулина различается при использовании разных сайтов связывания PEG-Fc в бета-цепи инсулина в процессе получения конъюгата полиэтиленгликоля (PEG) и константной области иммуноглобулина (далее называемой Fc иммуноглобулина или Fc) для улучшения стабильности инсулина в крови. Кроме того, авторы настоящего изобретения продемонстрировали сайт связывания, повышающий аффинность связывания инсулина, улучшая его активность. Например, они определили сайт связывания, улучшающий стабильность в крови при связывании с PEG-Fc и не снижающий активность без ингибирования связывания с рецепторами инсулина. В случае использования альфа-цепи инсулина для получения конъюгата, его активность существенно снижается. Поэтому предполагалось исследовать оптимальный сайт связывания на бета-цепи инсулина. В результате, было подтверждено, что сайтом связывания непептидильного полимера может быть любой аминокислотный остаток, имеющий аминогруппу или тиоловую группу, за исключением N-конца бета цепи инсулина.
Предпочтительно, непептидильный полимер может быть связан с любым из аминокислотных остатков в положениях 20-29 бета-цепи инсулина. Более предпочтительно, непептидильный полимер может быть связан с любым из аминокислотных остатков в положениях 25-29 бета-цепи инсулина. Намного более предпочтительно, непептидильный полимер может быть связан с лизиновым остатком в положении 29 бета-цепи инсулина.
Предпочтительно, аминокислотный остаток бета-цепи инсулина, с которым связан непептидильный полимер, может иметь аминогруппу или тиоловую группу. Например, аминокислотный остаток может представлять собой, без ограничения, лизин, цистеин или их производное.
В конкретном воплощении настоящего изобретения конъюгаты получали связыванием PEG-Fc с N-концом или остатком лизина в положении 29 бета-цепи инсулина, соответственно, и анализировали аффинность связывания соответствующих конъюгатов инсулина с рецепторами инсулина. В результате, конъюгат инсулина, полученный связыванием PEG-Fc с остатком лизина в положении 29 бета-цепи инсулина, продемонстрировал более высокую аффинность связывания (приблизительно в 3,6 раза больше), чем конъюгат инсулина, полученный связыванием PEG-Fc с N-концом бета-цепи инсулина (Пример 4, Таблица 1). Такое повышение аффинности связывания с рецепторами инсулина указывает на повышенную активность соответствующего конъюгата инсулина.
Однако сайт связывания с непептидильным полимером для получения конъюгата, сохраняющего активность инсулина и имеющего улучшенную стабильность, не ограничен остатком в положении 29 бета-цепи инсулина. Объем настоящего изобретения также включает конъюгаты, полученные связыванием непептидильного полимера с бета-цепью инсулина, предпочтительно с C-концевой областью, более предпочтительно любым из аминокислотных остатков в положениях 20-29 и намного более предпочтительно любым из аминокислотных остатков в положениях 25-29. Например, нативный инсулин может быть ковалентно связан с непептидильным полимером через ε-аминогруппу одиночного лизинового остатка в положении 29 бета-цепи. Вариант или производное инсулина, содержащие аминокислотный остаток, имеющий аминогруппу или тиоловую группу, в других местах могут также быть связаны с непептидильным полимером в соответствующем аминокислотном положении, и эти конъюгаты также включены в объем настоящего изобретения.
При получении конъюгата, сохраняющего активность инсулина, аминокислотный остаток бета-цепи инсулина может быть заменен остатком лизина или цистеина с целью удобства получения. Например, для получения конъюгата инсулина можно с легкостью использовать производное инсулина, полученное заменой аминокислотного остатка на С-конце бета-цепи инсулина остатком лизина или цистеина, и конъюгат инсулина, полученный с использованием этого производного инсулина, также включен в объем настоящего изобретения.
При использовании в настоящем описании термин «непептидильный полимер» означает биологически совместимый полимер, полученный связыванием двух или более повторяющихся единиц, где повторяющиеся единицы связаны друг с другом любой ковалентной связью, за исключением пептидной связи. Непептидильный полимер, используемый в настоящем изобретении, может быть выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимера этиленгликоля и пропиленгликоля, полиоксиэтилированного полиола, поливинилового спирта, полисахарида, декстрана, поливинилэтилового эфира, биоразлагаемого полимера, такого как PLA (полимолочная кислота) и PLGA (полимолочная-гликолевая кислота), липидного полимера, хитина, гиалуроновой кислоты, и их комбинаций, и, предпочтительно, полиэтиленгликоля (PEG). Их производные, хорошо известные в данной области и легко получаемые специалистами в данной области, также включены в объем настоящего изобретения.
Пептидный линкер, используемый в слитом белке, полученном типичным способом внутрирамочного слияния, имеет недостатки, состоящие в том, что он легко расщепляется in vivo протеолитическими ферментами, и поэтому, вопреки ожиданиям, носитель не может в достаточной степени увеличить период полувыведения активного лекарственного средства из крови. Тем не менее, в настоящем изобретении для сохранения периода полувыведения пептида из крови, сходного с периодом полувыведения носителя, может быть использован полимер, обладающий устойчивостью к протеолитическим ферментам. Таким образом, может быть использован любой непептидильный полимер, без ограничения, при условии, что он представляет собой полимер, обладающий вышеуказанной функцией, то есть полимер, обладающий устойчивостью к протеолитическим ферментам in vivo. Молекулярная масса непептидильного полимера входит в диапазон от 1 до 100 кДа и предпочтительно входит в диапазон от 1 до 20 кДа. Кроме того, непептидильный полимер по настоящему изобретению, связанный с физиологически активным полипептидом, может представлять собой один полимер или комбинацию разных типов полимеров.
Непептидильный полимер, используемый в настоящем изобретении, имеет реакционноспособную группу, способную связываться с Fc-областью иммуноглобулина и белковым лекарственным средством.
Предпочтительно, непептидильный полимер может связываться с аминогруппой или тиоловой группой боковой цепи аминокислотного остатка бета-цепи инсулина с образованием пептидной, гемитиоацетальной, иминной или тиодиоксопирролидинильной связи.
Неограничивающие примеры реакционноспособных групп на обоих концах непептидильного полимера могут включать альдегидную группу, такую как пропиональдегидная группа или бутиральдегидная группа, малеимидную группу и сукцинимидное производное. Сукцинимидное производное может представлять собой, без ограничения, сукцинимидилкарбоксиметил, сукцинимидилвалерат, сукцинимидилметилбутаноат, сукцинимидилметилпропионат, сукцинимидилбутаноат, сукцинимидилпропионат, N-гидроксисукцинимид или сукцинимидилкарбонат. Может быть использована любая, без ограничения, реакционноспособная группа, способная к селективному образованию ковалентной связи с аминогруппой или тиоловой группой аминокислотного остатка Fc-области иммуноглобулина и бета-цепи инсулина.
Реакционноспособные группы на обоих концах непептидильного полимера могут быть одинаковыми или отличаться друг от друга. Например, непептидильный полимер может иметь сукцинимидную группу на одном конце и альдегидную группу, такую как пропиональдегидная группа или бутиральдегидная группа, на другом конце. При использовании полиэтиленгликоля с реакционноспособными гидроксигруппами на обоих концах в качестве непептидильного полимера гидроксигруппа может быть активирована с образованием различных функциональных групп известными химическими реакциями, или для получения белкового конъюгата по настоящему изобретению может быть использован имеющийся в продаже полиэтиленгликоль с модифицированной реакционноспособной группой.
Предпочтительно, непептидильный полимер может иметь бутиральдегидную группу и сукцинимидилвалератную реакционноспособную группу на обоих концах, соответственно.
При использовании в настоящем описании термин «Fc-область иммуноглобулина» относится к белку, содержащему константную область 2 тяжелой цепи (СН2) и константную область 3 тяжелой цепи (СН3) иммуноглобулина, исключая вариабельные области тяжелой и легкой цепей, константную область 1 тяжелой цепи (СН1) и константную область 1 легкой цепи (CL1) иммуноглобулина. Она может дополнительно содержать шарнирную область при константной области тяжелой цепи. Кроме того, Fc-область иммуноглобулина по настоящему изобретению может содержать всю Fc-область или ее часть, включая константную область 1 тяжелой цепи (СН1) и/или константную область 1 легкой цепи (CL1), за исключением вариабельных областей тяжелой и легкой цепей иммуноглобулина, при условии, что она имеет эффект, по существу сходный с эффектом нативной формы или превосходящий его. Кроме того, она может представлять собой область с делецией относительно большой части аминокислотной последовательности СН2 и/или СН3. То есть, Fc-область иммуноглобулина по настоящему изобретению может содержать: (1) домен СН1, домен СН2, домен СН3 и домен СН4; (2) домен СН1 и домен СН2; (3) домен СН1 и домен СН3; (4) домен СН2 и домен СН3; (5) комбинацию одного или более чем одного домена и шарнирной области иммуноглобулина (или части шарнирной области); и (6) димер поризвольного домена константных областей тяжелой цепи и константной области легкой цепи.
Fc-область иммуноглобулина безопасна для применения в качестве носителя лекарственного средства, поскольку она представляет собой биоразлагаемый полипептид, который метаболизируется in vivo. Кроме того, Fc-область иммуноглобулина имеет относительно небольшую молекулярную массу, по сравнению с полноразмерными молекулами иммуноглобулинов, и поэтому она предпочтительна с точки зрения получения, очистки и выхода конъюгата. Fc-область иммуноглобулина не содержит Fab-фрагмента, являющегося очень неоднородным из-за различий аминокислотных последовательностей в соответствии с подклассами антител, и, таким образом, можно ожидать, что Fc-область иммуноглобулина может значительно увеличить однородность веществ и быть менее антигенной в крови.
Fc-область иммуноглобулина может иметь происхождение от человека или других животных, включая коров, коз, свиней, мышей, кроликов, хомяков, крыс, морских свинок, и, предпочтительно, от человека. Кроме того, Fc-область иммуноглобулина может представлять собой Fc-область, имеющую происхождение от IgG, IgA, IgD, IgE и IgM, или полученную с использованием их комбинаций или гибридов. Предпочтительно, она имеет происхождение от IgG или IgM, являющихся одними из наиболее распространенных белков человеческой крови, и, наиболее предпочтительно, от IgG, о котором известно, что он увеличивает период полувыведения лиганд-связывающих белков.
В то же время, при использовании в настоящем описании термин «комбинация» означает, что полипептиды, кодирующие одноцепочечные Fc-области иммуноглобулинов одного и того же происхождения, соединены с одноцепочечным полипептидом другого происхождения с образованием димера или мультимера. То есть, возможно получение димера или мультимера из двух или более фрагментов, выбранных из группы, состоящей из Fc-фрагментов IgG, Fc-фрагментов IgA, Fc-фрагментов IgM, Fc-фрагментов IgD и Fc-фрагментов IgE.
При использовании в настоящем описании «гибрид» означает, что в одноцепочечной Fc-области иммуноглобулина присутствуют последовательности, кодирующие две или более Fc-области иммуноглобулинов разного происхождения. В настоящем изобретении возможны различные типы гибридов. То есть, возможны доменные гибриды, состоящие из одного-четырех доменов, выбранных из группы, состоящей из СН1, СН2, СН3 и СН4 Fc IgG, Fc IgM, Fc IgA, Fc IgE и Fc IgD, и они могут содержать шарнирную область.
С другой стороны, IgG подразделяются на подклассы IgG1, IgG2, IgG3 и IgG4, и настоящее изобретение включает их комбинации и гибриды. Предпочтительны подклассы IgG2 и IgG4, а наиболее предпочтительна Fc-область IgG4, которая редко обладает эффекторными функциями, такими как комплемент-зависимая цитотоксичность (CDC).
То есть, в качестве носителя лекарственного средства по настоящему изобретению наиболее предпочтительной Fc-областью иммуноглобулина является негликозилированная Fc-область, имеющая происхождение от человеческого IgG4. Fc-область, имеющая происхождение от человека, более предпочтительна Fc-области, имеющей происхождение от источника, не являющегося человеком, которая может действовать в организме человека как антиген и приводить к нежелательным иммунным ответам, таким как образование нового антитела против антигена.
В то же время, Fc-область иммуноглобулина может быть представлена в форме с нативными сахарными цепями, увеличенными сахарными цепями, по сравнению с нативной формой, или уменьшенными сахарными цепями, по сравнению с нативной формой, или может быть представлена в дегликозилированной форме. Увеличение, уменьшение или удаление сахарных цепей Fc иммуноглобулина может быть проведено способами, известными в данной области, такими как химический способ, ферментный способ и генно-инженерный способ с использованием микроорганизма. В данном случае, удаление сахарных цепей из Fc-области приводит к резкому снижению аффинности связывания с комплементом (dq) и снижению или утрате антителозависимой клеточно-опосредованной цитотоксичности или комплемент-зависимой цитотоксичности, что позволяет избежать ненужных иммунных ответов in vivo. В свзяи с этим, Fc-область иммуноглобулина в дегликозилированной или агликозилированной форме может быть более подходящей в качестве носителя лекарственного средства для задачи настоящего изобретения.
При использовании в настоящем описании «дегликозилирование» означает ферментативное удаление сахарных группировок из Fc-области, а «агликозилирование» означает, что Fc-область получена в негликозилированной форме с использованием прокариотического организма, предпочтительно Е. coli.
Кроме того, Fc-область иммуноглобулина по настоящему изобретению включает производные (мутанты) ее последовательности, а также нативную аминокислотную последовательность. Аминокислотная последовательность производного отличается от нативной аминокислотной последовательности делецией, вставкой, неконсервативной или консервативной заменой одного или более аминокислотных остатков или их комбинациями. Например, в Fc IgG в качестве подходящей мишени для модификации могут быть использованы аминокислотные остатки, важные для связывания, в положениях 214-238, 297-299, 318-322 или 327-331. Кроме того, возможны различные другие производные, включая производные, имеющие делецию области, способной образовывать дисульфидную связь, делецию нескольких аминокислотных остатков на N-конце нативной формы Fc или добавление метионинового остатка к N-концу нативной формы Fc. Кроме того, для устранения эффекторных функций делеция может присутствовать в сайте связывания комплемента, таком как сайт связывания C1q, и сайте ADCC (антителозависимой клеточно-опосредованной цитотоксичности). Методики получения таких производных последовательности Fc-области иммуноглобулина раскрыты в WO 97/34631 и WO 96/32478.
В данной области известны аминокислотные замены в белках и пептидах, которые обычно не изменяют активность молекул (H. Neurath, R.L. Hill, The Proteins, Academic Press, New York, 197 9). Наиболее часто встречающимися заменами являются Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu, Asp/Gly в обоих направлениях.
Если желательно, Fc-область может быть модифицирована путем фосфорилирования, сульфатирования, акрилирования, гликозилирования, метилирования, фарнезилирования, ацетилирования, амидирования или тому подобным.
Указанные выше производные Fc являются производными, обладающими биологической активностью, идентичной биологической активности Fc-области иммуноглобулина по настоящему изобретению, или улучшенной структурной стабильностью при нагревании, изменении рН или тому подобном. Кроме того, эти константные области иммуноглобулинов могут быть получены из нативных форм, выделенных от человека и других животных, включая коров, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, или могут представлять собой их рекомбинанты или производные, полученные из трансформированных животных клеток или микроорганизмов. В данном случае, они могут быть получены из нативного иммуноглобулина путем выделения полноразмерных иммуноглобулинов из организма человека или животного и их обработкой протеолитическим ферментом. Папаин расщепляет нативный иммуноглобулин на Fab- и Fc-области, а обработка пепсином приводит к получению pF'c и F(ab)2. Возможно проведение эксклюзионной хроматографии этих фрагментов для выделения Fc или pF'c.
Предпочтительно, Fc-область иммуноглобулина человеческого происхождения может представлять собой рекомбинантную константную область иммуноглобулина, полученную из микроорганизма.
В настоящем изобретении связывание Fc-области иммуноглобулина и непептидильного полимера происходит посредством образования ковалентной связи между той терминальной реакционноспособной группой непептидильного полимера, которая не связана с инсулином, и аминогруппой или тиоловой группой аминокислотного остатка Fc-области иммуноглобулина, аналогично связыванию бета-цепи инсулина с непептидильным полимером. Таким образом, непептидильный полимер связан с N-концом Fc-области иммуноглобулина или аминогруппой остатка лизина или тиоловой группой остатка цистеина Fc-области иммуноглобулина. В этом отношении, нет ограничений по положению аминокислотного остатка, с которым связан непептидильный полимер, в Fc-области иммуноглобулина.
В еще одном аспекте согласно настоящему изобретению предложена композиция инсулина длительного действия с улучшенной активностью in vivo, содержащая конъюгат инсулина. Композиция длительного действия может представлять собой композицию для лечения диабета.
Кроме того, согласно настоящему изобретению предложен способ лечения диабета введением композиции длительного действия инсулина субъекту, нуждающемуся в этом.
При использовании в настоящем описании «введение» означает введение заданного вещества пациенту определенным подходящим способом. Конъюгат по настоящему изобретению может быть введен любым обычным способом введения, при условии, что этот способ позволяют ему достичь желаемой ткани. Возможно осуществление внутрибрюшинного, внутривенного, внутримышечного, подкожного, внутрикожного, перорального, местного, интраназального, внутрилегочного и ректального введения, но настоящее изобретение не ограничено ими. Тем не менее, поскольку пептиды пасщепляются при пероральном введении активные ингредиенты композиции для перорального введения следует снабжать покрытием или изготавливать с защитой от расщепления в желудке. Предпочтительно, настоящая композиция может быть введена в инъекционной форме. Кроме того, композиция длительного действия может быть введена с использованием определенного аппарата, позволяющего доставлять активные ингредиенты в клетку-мишень.
Композиция длительного действия, содержащая конъюгат по настоящему изобретению, может содержать фармацевтически приемлемые носители. Фармацевтически приемлемый носитель для перорального введения может включать связывающий агент, смазывающий агент, разрыхлитель, эксципиент, солюбилизатор, диспергатор, стабилизатор, суспендирующий агент, краситель, отдушку или тому подобное. Фармацевтически приемлемый носитель для инъекционных препаратов может включать буферный агент, консервант, обезболивающий агент, солюбилизатор, изотонический агент и стабилизатор. Фармацевтически приемлемый носитель для препаратов для местного введения может включать основу, эксципиент, смазывающий агент, консервант или тому подобное. Композиция длительного действия по настоящему изобретению может быть включена во множество лекарственных форм в комбинации с вышеуказанными фармацевтически приемлемыми носителями. Например, композиция для перорального введения может быть изготовлена в форме таблеток, пастилок, капсул, эликсиров, суспензий, сиропов или пластинок. Композиция для инъекционных препаратов может быть изготовлена в форме однодозовой ампулы или многодозового контейнера. Композиция может также быть изготовлена в форме растворов, суспензий, таблеток, пилюль, капсул и препаратов с длительным высвобождением.
С другой стороны, примеры носителей, эксципиентов и разбавителей, подходящих для композиции, включают лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмал, аравийскую камедь, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, вода, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния, минеральные масла или тому подобное. Кроме того, композиция может дополнительно содержать наполнители, антикоагулянты, смазывающие агенты, увлажнители, отдушки, антисептики или тому подобное.
Кроме того, композицию длительного действия по настоящему изобретению могут определять несколько родственных факторов, включая типы заболеваний, подлежащих лечению, пути введения, возраст, пол, массу тела пациента и тяжесть заболевания, а также тип лекарственного средства, используемого в качестве активного компонента. Поскольку фармацевтическая композиция по настоящему изобретению имеет отличные продолжительность действия и титр in vivo, это существенно снижает частоту введения фармацевтической композиции по настоящему изобретению.
Композиция длительного действия по настоящему изобретению улучшает стабильность инсулина in vivo, сохраняя его активность, и, таким образом, она эффективна для лечения диабета.
В еще одном аспекте согласно настоящему изобретению предложен способ получения конъюгата инсулина, включающий стадии: (1) ковалентного связывания непептидильного полимера с аминокислотным остатком бета-цепи инсулина, за исключением ее N-конца; (2) выделения комплекса инсулина, в котором непептидильный полимер ковалентно связан с аминокислотным остатком бета-цепи инсулина, за исключением ее N-конца, из реакционной смеси со стадии (1), и (3) ковалентного связывания Fc-области иммуноглобулина с другим концом непептидильного полимера выделенной связи с получением конъюгата инсулина, в котором Fc-область иммуноглобулина и инсулин связаны с каждым концом непептидильного полимера.
Как описано выше, непептидильный полимер может предпочтительно быть связан с аминогруппой или тиоловой группой боковой цепи аминокислотного остатка бета-цепи инсулина с образованием пептидной, гемитиоацетальной, иминной или тиодиоксопирролидинильной связи. В этой связи, каждый из обоих концов непептидильного полимера независимо представляет собой, без ограничения, альдегидное производное, малеимидное производное или сукцинимидное производное в качестве реакционноспособной группы.
Как описано выше, оба конца непептидильного полимера могут предпочтительно быть связаны с аминогруппой или тиоловой группой боковой цепи аминокислотного остатка бета-цепи инсулина, за исключением ее N-конца, и Fc-области иммуноглобулина, соответственно.
Предпочтительно, непептидильный полимер может иметь альдегидное поризводное группу и сукцинимидное производное в качестве реакционноспособных групп на обоих концах, соответственно. В этой связи, стадию (1) можно осуществлять в щелочной среде при рН 9,0 плюс/минус 2. Если реакция может быть осуществлена в кислой среде при рН ниже 7, непептидильный полимер может быть связан с N-концевой аминогруппой. Упомянутый выше диапазон рН можно корректировать в зависимости от разновидности реакционноспособной группы непептидильного полимера и разновидности взаимодействующей с ней реакционноспособной группы аминокислотного остатка бета-цепи инсулина, например, аминогруппы или тиоловой группы. Например, если PEG, имеющий сукцинимидное производное в качестве реакционноспособной группы, используют в качестве непептидильного полимера, и он предназначен для связывания с аминогруппой лизина в инсулине, то рН корректируют до 9,0, что приводит к образованию о комплекса инсулина, в котором непептидильный полимер селективно связан с аминогруппой лизина, а не с N-концевой аминогруппой.
На стадии (1) связывания непептидильного полимера с бета-цепью инсулина, молярное соотношение инсулина и полимера в реакционной смеси может предпочтительно составлять от 1:1,5 до 1:10 и более предпочтительно равно 1:2. Далее, на стадии (3) ковалентного связывания Fc-области иммуноглобулина с другим концом непептидильного полимера комплекса инсулина, молярное соотношение комплекса инсулина и Fc-области иммуноглобулина может предпочтительно составлять от 1:1 до 1:10 и более предпочтительно равно 1:1,2.
В конкретном воплощении настоящего изобретения инсулин независимо пегилировали с высоким выходом с использованием PEG-линкера, независимо содержащего сукцинимидные и альдегидные реакционноспособные группы на обоих концах, и пегилирование остатка по положению 29 бета-цепи инсулина определяли методом картирования (ФИГ. 2-3). Далее, авторы настоящего изобретения соединили константную область иммуноглобулина с полученным таким образом монопегилированным инсулином, получив конъюгат «инсулин - непептидильный полимер - константная область иммуноглобулина».
Анализировали аффинность связывания полученного конъюгата инсулина с рецепторами инсулина. В результате, конъюгат инсулина продемонстрировал приблизительно в 3,6 раза большую аффинность связывания, чем конъюгат, полученный связыванием PEG-Fc с N-концом инсулина, что указывает на более высокую эффективность конъюгата по настоящему изобретению.
Далее настоящее изобретение будет описано более подробно со ссылкой на примеры. Тем не менее, эти примеры приведены лишь в иллюстративных целях, и изобретение не следует ограничивать этими примерами.
Пример 1: Реакция пегилирования аминокислоты по 29 положению бета-цепи инсулина и очистка монопегилированного инсулина
Порошок инсулина растворяли в 10 мМ HCl и затем подвергали взаимодействию с 3.4К бутиральдегидом-PEG-сукцинимидилвалератом (PEG, имеющим бутиральдегидную группу и сукцинимидилвалератную группу в качестве функциональных групп на каждом конце, Laysan Bio, Inc., USA) при комнатной температуре в течение приблизительно 1 часа при молярном соотношении инсулин : PEG 1:2 и концентрации инсулина 1,5 мг/мл для пегилирования аминокислотного остатка по 29 положению бета-цепи инсулина. Эту реакцию проводили в 60,8 мМ борате натрия и 45%-м изопропаноле при рН 9,0. Реакционный раствор очищали на колонке Source S (GE Healthcare), используя буфер, содержащий цитрат натрия (рН 3,0) и 45%-й этанол, и градиент концентрации KCl, с получением монопегилированного инсулина (ФИГ. 1а и 1b).
Пример 2: Идентификация сайта пегилирования монопегилированного инсулина
Для идентификации сайта связывания 3.4К PEG в инсулине, пегилированном согласно примеру 1, использовали метод Glu-C-картирования. 10 мкг эндопротеиназы Glu-C в концентрации 1 мг/мл добавляли к 50 мкг монопегилированного инсулина в концентрации 1 мг/мл. Реакционный раствор представлял собой 50 мМ HEPES при рН 7,5, и реакцию проводили при 25°С в течение 8 часов. Затем добавляли 50 мкл 1 н HCl для остановки реакции. Для картирования применяли обращенно-фазовую HPLC (высокоэффективная жидкостная хроматография). Результат представлен на ФИГ. 2.
Как показано на ФИГ. 2, наблюдали смещение пика, содержащего аминокислоту по 29 положению бета-цепи инсулина, что указывает на пегилирование аминокислоты по 29 положению бета-цепи инсулина 3.4К PEG.
Пример 3: Получение конъюгата монопегилированного инсулина и Fc иммуноглобулина
Для получения конъюгата «инсулин - PEG - Fc-фрагмент иммуноглобулина» монопегилированный инсулин, полученный способом согласно примеру 1, и Fc-фрагмент иммуноглобулина подвергали взаимодействию в молярном соотношении 1:1,2 при общем уровне белка 20 мг/мл при 25°С в течение 13 часов. При этом реакционный раствор содержал 100 мМ HEPES и 2 M хлорид натрия (NaCl) при рН 8,2 а также дополнительно содержал 20 мМ цианборгидрида натрия в качестве восстановителя.
По завершении реакции реакционный раствор пропускали через колонку Source Q (GE Healthcare) для разделения и очистки непровзаимодействовавшего инсулина, непровзаимодействовавшего Fc-фрагмента иммуноглобулина, конъюгата «инсулин - PEG - Fc-фрагмент иммуноглобулина» и конъюгата Fc-фрагмента иммуноглобулина с двумя или более монопегилированными инсулинами («инсулин - PEG») с использованием буфера Tris-HCl (рН 7,5) и градиента концентрации NaCl.
Затем колонку Source ISO (GE Healthcare) использовали для удаления любых остаточных Fc иммуноглобулинов и конъюгатов с несколькими инсулинами, получая таким образом конъюгат «инсулин - PEG - Fc иммуноглобулина». В данном случае, элюирование проводили с использованием градиента концентрации сульфата аммония, содержащего Tris-HCl (рН 7,5). Чистоту полученного таким образом конъюгата анализировали посредством обращенно-фазовой HPLC, ионообменной хроматографии и эксклюзионной хроматографии (ФИГ. 3).
Пример 4: Измерение аффинности связывания конъюгатов инсулина с рецепторами инсулина в зависимости от сайта связывания PEG-Fc с бета-цепью инсулина
Для измерения аффинности связывания конъюгата инсулина, полученного путем связывания PEG-Fc с N-концом инсулина, и конъюгата инсулина, полученного путем связывания PEG-Fc с В29, с рецепторами инсулина применяли SPR (поверхностный плазмонный резонанс, BIACORE 3000). В качестве рецепторов инсулина использовали ECD (внеклеточный домен), который экспрессировали в клетках HEK293F и затем очищали. Рецепторы инсулина, экспрессированные таким образом, иммобилизовали на чипе СМ5 аминным сочетанием, наносили от 1 мкМ до 6,25 нМ N-концевого или В29-конъюгата инсулина, и измеряли аффинности их связывания. Эти конъюгаты инсулина разводили буфером для связывания (HBS-EP), связывали с чипом для иммобилизации конъюгатов инсулина в течение 4 минут и проводили диссоциацию в течение 6 минут. Затем, для связывания с конъюгатами инсулина в различных концентрациях на конъюгаты инсулина, связанные с рецепторами инсулина, наносили 50 мМ NaCl/5 мМ NaOH в течение приблизительно 30 секунд. Аффинность связывания анализировали с помощью модели связывания Langmuir 1:1 в программе BIAevaluation. Результаты представлены на ФИГ. 4.
Как показано на ФИГ. 4, было обнаружено, что как N-концевой, так и В29-конъюгат инсулина связывались с рецепторами инсулина зависимым от концентрации образом. Аффинность связывания этих конъюгатов инсулина с рецепторами инсулина показана в Таблице 1. Более подробно, В29-конъюгат инсулина имеет приблизительно в 1,8 раза большую константу скорости ассоциации, чем N-концевой конъюгат инсулина, что указывает на то, что связывание В29-конъюгата инсулина с рецептором инсулина происходит быстрее, чем в случае N-концевого конъюгата инсулина. В29-конъюгат инсулина имеет приблизительно в 1,8 раза меньшую константу скорости диссоциации, чем N-концевой конъюгат инсулина, что указывает на то, что после связывания связывание В29-конъюгата инсулина с рецептором инсулина более стабильно. Результаты сравнения аффинностей связывания N-концевого и В29-конъюгатов инсулина продемонстрировали, что аффинность связывания В29-конъюгата инсулина приблизительно в 3,6 раза выше аффинности связывания N-концевого конъюгата инсулина.
На основании приведенного выше описания специалисту в данной области будет ясно, что различные модификации и изменения могут быть осуществлены без выхода за рамки объема и сущности изобретения. Поэтому следует понимать, что приведенное выше описание во всех аспектах является иллюстративным, но не ограничивающим. Объем изобретения определен в приложенной формуле изобретения, но не в предшествующем описании, и поэтому подразумевают, что формула изобретения включает все изменения и модификации, не выходящие за рамки границ и пределов формулы изобретения или эквивалентов таких границ и пределов.
Эффект изобретения
Конъюгат инсулина по настоящему изобретению демонстрирует существенно повышенную аффинность связывания с рецепторами инсулина, значительно улучшая посредством этого активность инсулина in vivo, благодаря чему он может быть использован в разработке композиции инсулина длительного действия с высокой эффективностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения комплекса физиологически активного полипептида | 2012 |
|
RU2624129C2 |
| Новый аналог инсулина и его применение | 2014 |
|
RU2676729C2 |
| ЖИДКАЯ КОМПОЗИЦИЯ ДЛИТЕЛЬНО ДЕЙСТВУЮЩИХ ИНСУЛИНА И ИНСУЛИНОТРОПНОГО ПЕПТИДА | 2013 |
|
RU2643766C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ДИАБЕТА, СОДЕРЖАЩАЯ КОНЪЮГАТ ИНСУЛИНА ДЛИТЕЛЬНОГО ДЕЙСТВИЯ И КОНЪЮГАТ ИНСУЛИНОТРОПНОГО ПЕПТИДА ДЛИТЕЛЬНОГО ДЕЙСТВИЯ | 2012 |
|
RU2606840C2 |
| Композиция для лечения гиперлипидемии, содержащая производное оксинтомодулина | 2013 |
|
RU2642267C2 |
| Композиция для лечения гиперлипидемии, содержащая производное оксинтомодулина | 2013 |
|
RU2768853C1 |
| КОНЪЮГАТ, СОДЕРЖАЩИЙ ОКСИНТОМОДУЛИН И ФРАГМЕНТ ИММУНОГЛОБУЛИНА, И ЕГО ПРИМЕНЕНИЕ | 2012 |
|
RU2607365C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ | 2013 |
|
RU2635966C2 |
| Улучшенный способ получения конъюгата физиологически активного полипептида с высоким выходом | 2014 |
|
RU2677796C9 |
| Улучшенный способ получения конъюгата физиологически активного полипептида | 2013 |
|
RU2639256C2 |


Настоящее изобретение относится к области биотехнологии, конкретно к конъюгату белка инсулина с Fc-областью иммуноглобулина, и может быть использовано в медицине. Изобретение позволяет получить конъюгат инсулина с иммуноглобулином, в котором его составные части сайт-селективно связаны ковалентной связью через непептидный полимер-линкер. Конъюгат по настоящему изобретению обладает повышенной рецепторной активностью и улучшенными фармакокинетическими характеристиками. 3 н. и 26 з.п. ф-лы, 4 ил., 1 табл., 4 пр.
1. Конъюгат инсулина для лечения диабета, в котором инсулин и Fc-область иммуноглобулина связаны друг с другом через непептидильный полимерный линкер, выбранный из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимера этиленгликоля и пропиленгликоля, полиоксиэтилированного полиола, поливинилового спирта, полисахарида, декстрана, поливинилэтилового эфира, биоразлагаемого полимера, липидного полимера, хитина, гиалуроновой кислоты и их комбинации, и один конец непептидильного полимера связан с любым из аминокислотных остатков в положениях 25-29 бета-цепи инсулина, а другой его конец связан с Fc-областью иммуноглобулина;
где
непептидильный полимер связан с аминогруппой или тиоловой группой аминокислотного остатка Fc-области иммуноглобулина,
указанная аминогруппа присутствует на N-конце или боковой цепи остатка лизина Fc-области иммуноглобулина и указанная тиоловая группа присутствует на боковой цепи остатка цистеина Fc-области иммуноглобулина; и
где
инсулин выбран из группы, состоящей из следующего (1)-(4):
(1) нативный инсулин, содержащий первый пептид с SEQ ID NO: 1 и второй пептид с SEQ ID NO: 2;
(2) вариант инсулина, содержащий первый пептид с SEQ ID NO: 1 и второй пептид с SEQ ID NO: 2, в котором один или более чем один аминокислотный остаток SEQ ID NO: 1 и/или SEQ ID NO: 2 отличается от аминокислотной последовательности нативного инсулина (1) посредством замены, удаления, модификации и/или добавления, где вариант инсулина сохраняет функцию контролирования уровня глюкозы в крови организма субъекта, которому вводят указанный вариант инсулина;
(3) пептид, являющийся производным инсулина, который имеет по меньшей мере 80%-ю идентичность аминокислотной последовательности с нативным инсулином (1), где химическая группа одного или более чем одного аминокислотного остатка SEQ ID NO: 1 и/или SEQ ID NO: 2 химически модифицирована, и где пептид, являющийся производным инсулина, сохраняет функцию контролирования уровня глюкозы в крови организма субъекта, которому вводят указанный вариант инсулина; и
(4) фрагмент нативного инсулина (1), имеющий одну или более чем одну аминокислоту, удаленную с N-конца или С-конца нативного инсулина (1), или имеющий неприродную аминокислоту, где фрагмент сохраняет функцию контролирования уровня глюкозы в крови организма субъекта, которому вводят указанный вариант инсулина.
2. Конъюгат инсулина по п. 1, в котором непептидильный полимер связан с остатком лизина в положении 29 бета-цепи инсулина.
3. Конъюгат инсулина по п. 1, в котором аминокислотный остаток бета-цепи инсулина, с которым связан непептидильный полимер, имеет аминогруппу или тиоловую группу.
4. Конъюгат инсулина по п. 1, в котором оба конца непептидильного полимера связаны с аминогруппой или тиоловой группой боковой цепи аминокислотного остатка Fc-области иммуноглобулина и бета-цепи инсулина соответственно.
5. Конъюгат инсулина по п. 4, в котором аминокислота представляет собой природную или неприродную аминокислоту.
6. Конъюгат инсулина по п. 1, в котором Fc-область иммуноглобулина агликозилирована.
7. Конъюгат инсулина по п. 1, в котором Fc-область иммуноглобулина состоит из одного-четырех доменов, выбранных из группы, состоящей из доменов CH1, СН2, СН3 и СН4.
8. Конъюгат инсулина по п. 7, в котором Fc-область иммуноглобулина дополнительно содержит шарнирную область.
9. Конъюгат инсулина по п. 1, в котором Fc-область иммуноглобулина представляет собой Fc-область, имеющую происхождение от IgG, IgA, IgD, IgE или IgM.
10. Конъюгат инсулина по п. 9, в котором каждый домен Fc-области иммуноглобулина представляет собой гибрид доменов из разных источников, имеющих происхождение от иммуноглобулинов, выбранных из группы, состоящей из IgG, IgA, IgD, IgE и IgM.
11. Конъюгат инсулина по п. 9, в котором Fc-область иммуноглобулина представляет собой димер или мультимер, состоящий из одноцепочечных иммуноглобулинов, состоящих из доменов из одного и того же источника.
12. Конъюгат инсулина по п. 9, в котором Fc-область иммуноглобулина представляет собой Fc-область IgG4.
13. Конъюгат инсулина по п. 9, в котором Fc-область иммуноглобулина представляет собой человеческую агликозилированную Fc-область IgG4.
14. Конъюгат инсулина по п. 1, в котором непептидильный полимер связан с аминогруппой или тиоловой группой боковой цепи аминокислотного остатка бета-цепи инсулина с образованием пептидной, гемитиоацетальной, иминной или тиодиоксопирролидинильной связи.
15. Конъюгат инсулина по п. 1, в котором каждый из обоих концов непептидильного полимера независимо имеет реакционноспособную группу, выбранную из группы, состоящей из альдегидной группы, пропиональдегидной группы, бутиральдегидной группы, малеимидной группы и сукцинимидного производного.
16. Конъюгат инсулина по п. 15, в котором сукцинимидное производное представляет собой сукцинимидилкарбоксиметил, сукцинимидилвалерат, сукцинимидилметилбутаноат, сукцинимидилметилпропионат, сукцинимидилбутаноат, сукцинимидилпропионат, N-гидроксисукцинимид или сукцинимидилкарбонат.
17. Конъюгат инсулина по п. 15, в котором оба конца непептидильного полимера имеют бутиральдегидную реакционноспособную группу или сукцинимидилвалератную реакционноспособную группу соответственно.
18. Конъюгат инсулина по п. 1, в котором инсулин представляет собой нативный инсулин или имеет по меньшей мере 80% гомологию с нативным инсулином.
19. Конъюгат инсулина по п. 1, в котором
инсулин выбран из группы, состоящей из следующего (1)-(4):
(1) нативный инсулин, содержащий первый пептид с SEQ ID NO: 1 и второй пептид с SEQ ID NO: 2;
(2) вариант инсулина, содержащий первый пептид с SEQ ID NO: 1 и второй пептид с SEQ ID NO: 2, в котором один аминокислотный остаток SEQ ID NO: 1 и/или один аминокислотный остаток SEQ ID NO: 2 отличается от аминокислотной последовательности нативного инсулина (1) посредством замены, удаления, модификации и/или добавления, где вариант инсулина сохраняет функцию контролирования уровня глюкозы в крови организма субъекта, которому вводят указанный вариант инсулина;
(3) пептид, являющийся производным инсулина, где химическая группа одного аминокислотного остатка SEQ ID NO: 1 и/или одного аминокислотного остатка SEQ ID NO: 2 химически модифицирована, и где пептид, являющийся производным инсулина, сохраняет функцию контролирования уровня глюкозы в крови организма субъекта, которому вводят указанный вариант инсулина; и
(4) фрагмент нативного инсулина (1), имеющий одну аминокислоту, удаленную с N-конца нативного инсулина (1), и/или одну аминокислоту, удаленную с С-конца нативного инсулина (1), или имеющий неприродную аминокислоту, где фрагмент сохраняет функцию контролирования уровня глюкозы в крови организма субъекта, которому вводят указанный вариант инсулина.
20. Конъюгат инсулина по п. 1, в котором инсулин представляет собой
нативный инсулин или
вариант инсулина, содержащего первый пептид с SEQ ID NO: 1 и второй пептид с SEQ ID NO: 2, в котором один аминокислотный остаток SEQ ID NO: 1 и/или один аминокислотный остаток SEQ ID NO: 2 отличается от аминокислотной последовательности нативного инсулина посредством замены, где вариант инсулина сохраняет функцию контролирования уровня глюкозы в крови организма субъекта, которому вводят указанный вариант инсулина.
21. Композиция инсулина длительного действия, имеющая увеличенную продолжительность действия и повышенную стабильность in vivo, содержащая конъюгат инсулина по любому из пп. 1-20 и фармацевтически приемлемый носитель.
22. Композиция инсулина длительного действия по п. 21, используемая для лечения диабета.
23. Способ получения конъюгата инсулина по п. 1, включающий стадии:
(1) ковалентного связывания непептидильного полимера с любым из аминокислотных остатков в положениях 25-29 бета-цепи инсулина; где стадию (1) проводят в щелочной среде при рН 9,0 плюс/минус 2;
(2) выделения комплекса инсулина, в котором непептидильный полимер ковалентно связан с аминокислотным остатком бета-цепи инсулина из реакционной смеси со стадии (1), и
(3) ковалентного связывания Fc-области иммуноглобулина с другим концом непептидильного полимера выделенного комплекса с получением конъюгата инсулина, в котором Fc-область иммуноглобулина и инсулин связаны с каждым концом непептидильного полимера;
где
непептидильный полимер связан с аминогруппой или тиоловой группой аминокислотного остатка Fc-области иммуноглобулина,
указанная аминогруппа присутствует на N-конце или боковой цепи остатка лизина Fc-области иммуноглобулина и указанная тиоловая группа присутствует на боковой цепи остатка цистеина Fc-области иммуноглобулина; и
где
инсулин выбран из группы, состоящей из следующего (1)-(4):
(1) нативный инсулин, содержащий первый пептид с SEQ ID NO: 1 и второй пептид с SEQ ID NO: 2;
(2) вариант инсулина, содержащий первый пептид с SEQ ID NO: 1 и второй пептид с SEQ ID NO: 2, в котором один или более чем один аминокислотный остаток SEQ ID NO: 1 и/или SEQ ID NO: 2 отличается от аминокислотной последовательности нативного инсулина (1) посредством замены, удаления, модификации и/или добавления, где вариант инсулина сохраняет функцию контролирования уровня глюкозы в крови организма субъекта, которому вводят указанный вариант инсулина;
(3) пептид, являющийся производным инсулина, который имеет по меньшей мере 80%-ю идентичность аминокислотной последовательности с нативным инсулином (1), где химическая группа одного или более чем одного аминокислотного остатка SEQ ID NO: 1 и/или SEQ ID NO: 2 химически модифицирована, и где пептид, являющийся производным инсулина, сохраняет функцию контролирования уровня глюкозы в крови организма субъекта, которому вводят указанный вариант инсулина; и
(4) фрагмент нативного инсулина (1), имеющий одну или более чем одну аминокислоту, удаленную с N-конца или С-конца нативного инсулина (1) или имеющий неприродную аминокислоту, где фрагмент сохраняет функцию контролирования уровня глюкозы в крови организма субъекта, которому вводят указанный вариант инсулина.
24. Способ по п. 23, где непептидильный полимер связывается с аминогруппой или тиоловой группой боковой цепи аминокислотного остатка бета-цепи инсулина с образованием пептидной, гемитиоацетальной, иминной или тиодиоксопирролидинильной связи.
25. Способ по п. 23, где каждый из обоих концов непептидильного полимера независимо имеет альдегидное производное, малеимидное производное или сукцинимидное производное в качестве реакционноспособной группы.
26. Способ по п. 23, где оба конца непептидильного полимера связаны с аминогруппой или тиоловой группой боковой цепи аминокислотного остатка бета-цепи инсулина и Fc-области иммуноглобулина соответственно.
27. Способ по п. 23, где каждый из обоих концов непептидильного полимера независимо имеет бутиральдегидную группу или сукцинимидилвалератную реакционноспособную группу.
28. Способ по любому из пп. 23-27, где молярное соотношение инсулина и непептидильного полимера на стадии (1) составляет от 1:1,5 до 1:10.
29. Способ по любому из пп. 23-27, где молярное соотношение комплекса инсулина и Fc-области иммуноглобулина на стадии (3) составляет от 1:1 до 1:10.
| US 20130028918 A1, 13.01.2013 | |||
| PATEL L.N | |||
| et al., Conjugation with Cationic Cell-Penetrating Peptide Increases Pulmonary Absorption of Insulin, Mol Pharm., 2009 v | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Катодный усилитель | 1923 |
|
SU492A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| WO 2012165915 A2, 06.12.2012 | |||
| WO 2011122921 A2, 06.10.2011 | |||
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ СВЯЗАННЫХ С ОЖИРЕНИЕМ ЗАБОЛЕВАНИЙ, СОДЕРЖАЩАЯ КОНЪЮГАТ ИНСУЛИНОТРОПНОГО ПЕПТИДА | 2008 |
|
RU2446816C2 |
Авторы
Даты
2019-01-21—Публикация
2014-02-26—Подача