Область техники
Настоящее изобретение относится к способу стабилизации жирных кислот, присутствующих в образце, таком как биологические жидкости. Настоящее изобретение дополнительно относится к твердому носителю, который способен стабилизировать жирные кислоты, нанесенные на него, а также к способу его получения. Настоящее изобретение дополнительно относится к способу определения состава жирных кислот в образце.
Уровень техники
Высокое потребление омега-3 жирных кислот, в особенности эйкозапентаеновой кислоты (ЕРА) и докозагексаеновой кислоты (DHA), было ассоциировано со снижением сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, диабета и артрита у взрослых, а также улучшенным умственным развитием у недоношенных новорожденных. В итоге, органы здравоохранения во всем мире в настоящее время рекомендуют увеличение потребления омега-3 жирных кислот, например, путем употребления 2-3 блюд, содержащих рыбу, в неделю.
Диетические рекомендации применительно к омега-3 жирным кислотам для защиты сердца включают повышение потребления рыбы до двух блюд с жирной рыбой в неделю или употребление 600 или 400 мг/день длинноцепочечных омега-3 жирных кислот мужчинами и женщинами, соответственно. Хотя известно, что данные рекомендации в клинических испытаниях будут увеличивать клеточные уровни омега-3 жирной кислоты до уровня в пределах кардиозащитного диапазона, практически не существует данных в отношении того, как данные рекомендации влияют на статус жирных кислот у населения в целом. Поскольку статус жирных кислот в крови представляет собой полезный маркер для оценки риска возникновения заболеваний сердца у населения и с его помощью выявляют тех индивидуумов, для которых будет полезным добавление к пище омега-3 жирных кислот, оценка статуса жирных кислот является важной.
Определение профилей жирных кислот в образцах крови человека, которые используют в качестве маркера статуса жирных кислот в органах человека, стало важным средством для того, чтобы понять взаимосвязь между потреблением с пищей жирных кислот и статусом жирных кислот, поскольку уровни в крови, как полагают, отражают биологические функции, а кровь является доступной для отбора при исследованиях на человеке. Однако стандартные подходы к анализу жирных кислот в крови включают отбор венозной крови и дорогостоящие, трудоемкие, многоэтапные способы, что ограничивает их полезность в качества средства для скрининга. Соответственно, требуется быстрый, недорогой и надежный способ измерения клеточных уровней омега-3 жирных кислот.
До недавнего времени такой быстрый и надежный тест для определения уровня омега-3 жирных кислот, присутствующих в крови человека (известного как омега-3 индекс), не был доступен. За последние несколько лет ряд компаний рекламировали тест с использованием пятна крови, в котором после прокалывания пальца пятно крови помещают на небольшой кусочек фильтровальной бумаги с антиоксидантом(антиоксидантами) или без антиоксиданта(антиоксидантов). После высушивания фильтровальную бумагу отправляют в центральную лабораторию для анализа. Было заявлено, что жирные кислоты в пятне крови стабильны в течение недель, и что можно получить надежное измерение омега-3 индекса. Авторы настоящего изобретения предприняли попытки воспроизвести данные тесты и обнаружили, что со временем происходит значительное разрушение жирных кислот.
Одним таким продуктом является набор для получения образцов крови Fluka, разработанный Sigma-Aldrich для непосредственного определения n-3 и n-6 длинноцепочечных полиненасыщенных жирных кислот в пятнах крови. В единственном исследовании долгосрочной стабильности, проведенном на образцах пятен крови, отобранных с использованием бумаги из набора Fluka, которые хранили при комнатной температуре, было продемонстрировано значительное снижение уровней длинноцепочечных полиненасыщенных жирных кислот (в виде процентного содержания от общего содержания жирных кислот) через 1 месяц (Min et al. Prostaglandins, Leukotrienes and Essential Fatty Acids, 2011 84, 13-18). Таким образом, окисление длинноцепочечных полиненасыщенных жирных кислот делает применение этого способа с использованием пятна крови нецелесообразным, поскольку для сравнения результатов потребовалось бы проведение анализа всех образцов в установленный срок после отбора.
Следовательно, существует потребность в простом, быстром и надежном способе определения содержания жирных кислот в крови, при котором разрушение жирных кислот при хранении крови сведено к минимуму или устранено.
Авторы настоящего изобретения обнаружили, что жирные кислоты в высушенном пятне крови можно стабилизировать в течение месяцев при условиях окружающей среды. Авторы настоящего изобретения дополнительно обнаружили, что высокоточного определения состава жирных кислот в крови при хранении на твердом носителе в течение месяцев можно достичь путем стабилизации жирных кислот и путем контроля примесей в твердом носителе.
Сущность изобретения
В первом аспекте настоящее изобретение предоставляет способ стабилизации жирных кислот, причем способ предусматривает нанесение жирных кислот или образца, содержащего жирные кислоты, на твердый носитель, который содержит твердую подложку, по меньшей мере одно хелатообразующее средство и по меньшей мере один антиоксидант, где твердая подложка содержит менее приблизительно 2 мкг/см2 примесей.
Образец может представлять собой биологический образец.
Биологический образец может представлять собой биологическую жидкость, например, кровь, слюну, грудное молоко, мочу, сперму, плазму крови, синовиальную жидкость, сыворотку и т.п.
Биологическая жидкость может представлять собой биологическую жидкость млекопитающего.
Образец может представлять собой жидкость, содержащую жирные кислоты, например, биологическую жидкость.
Жирные кислоты могут представлять собой или могут включать ненасыщенные жирные кислоты.
Жирные кислоты могут представлять собой или могут включать длинноцепочечные полиненасыщенные жирные кислоты (LCPUFA).
Жирные кислоты могут представлять собой или могут включать омега-3 жирные кислоты, например, ЕРА, DHA и т.п.
Во втором аспекте настоящее изобретение предоставляет способ определения состава жирных кислот в образце, содержащем жирные кислоты, причем способ предусматривает:
(а) нанесение образца на твердый носитель, содержащий твердую подложку, по меньшей мере одно хелатообразующее средство и по меньшей мере один антиоксидант, где твердая подложка содержит менее приблизительно 2 мкг/см2 примесей, в результате чего образец является сорбированным на твердой подложке;
(b) определение состава жирных кислот в образце, сорбированном на твердой подложке.
Образец может представлять собой биологический образец. В одном варианте осуществления биологический образец представляет собой биологическую жидкость, например, кровь, слюну, грудное молоко, мочу, сперму, плазму крови, синовиальную жидкость, сыворотку и т.п.
Способ может предусматривать определение количества жирных кислот одного или нескольких классов в образце в виде доли от общего содержания липидов в образце или в виде доли от общего содержания жирных кислот в образце.
Образец можно наносить на твердый носитель в количестве, составляющем менее приблизительно 100 мкл, или менее приблизительно 50 мкл, или менее приблизительно 20 мкл.
Этап (b) можно осуществлять спустя недели или месяцы после этапа (а).
Следующие утверждения относятся к первому и второму аспектам.
Твердая подложка может содержать менее приблизительно 1 мкг/см2 примесей или менее приблизительно 0,5 мкг/см2 примесей.
Примеси могут представлять собой насыщенные жирные кислоты.
Твердая подложка может представлять собой бумагу, подложку на бумажной основе или подложку на стеклянной основе.
Подложка на бумажной основе может представлять собой бумагу с нанесенным силикагелем.
Подложка на стеклянной основе может представлять собой фильтр из стеклянного микроволокна.
По меньшей мере одно хелатообразующее средство может представлять собой этилендиаминтетрауксусную кислоту (EDTA), аскорбиновую кислоту, или их соли, или лимонную кислоту или ее соли.
По меньшей мере один антиоксидант может представлять собой бутилгидрокситолуол (ВНТ), бутилгидроксианизол (ВНА) или трет-бутилгидрохинон.
Предусмотрены любые комбинации вышеуказанных хелатообразующих средств и антиоксидантов.
В одном варианте осуществления хелатообразующее средство представляет собой аскорбиновую кислоту и/или EDTA, а антиоксидант представляет собой ВНТ.
Твердый носитель может быть представлен в виде полосы.
Полоса может иметь размеры приблизительно 1 см × 3 см.
Антиоксидант (антиоксиданты) может присутствовать на твердом носителе в количестве от приблизительно 0,001 мг до приблизительною мг, или в количестве от приблизительно 0,01 мг до приблизительно 5 мг, или в количестве от приблизительно 0,01 до приблизительно 1 мг, или в количестве от приблизительно 0,01 мг до приблизительно 0,5 мг. В одном варианте осуществления антиоксидант (антиоксиданты) присутствует/присутствуют в количестве приблизительно 0,1 мг.
Хелатообразующее средство (средства) может присутствовать на твердом носителе в количестве от приблизительно 0,001 мг до приблизительно 10 мг, или в количестве от приблизительно 0,01 мг до приблизительно 5 мг, или в количестве от приблизительно 0,01 мг до приблизительно 1 мг, или в количестве от приблизительно 0,05 мг до приблизительно 0,5 мг. В одном варианте осуществления хелатообразующее средство (средства) присутствует/присутствуют в количестве приблизительно 0,25 мг. В другом варианте осуществления хелатообразующее средство (средства) присутствует/присутствуют в количестве приблизительно 0,5 мг.
В одном варианте осуществления первого аспекта настоящее изобретение предоставляет способ стабилизации жирных кислот, причем способ предусматривает нанесение жирных кислот или образца, содержащего жирные кислоты, на твердый носитель, содержащий бумагу с нанесенным силикагелем, EDTA и/или аскорбиновую кислоту, а также ВНТ.
В другом варианте осуществления первого аспекта настоящее изобретение предоставляет способ стабилизации жирных кислот, причем способ предусматривает нанесение жирных кислот или образца, содержащего жирные кислоты, на твердый носитель, содержащий фильтр из стеклянного микроволокна, EDTA и/или аскорбиновую кислоту, а также ВНТ.
В третьем аспекте настоящее изобретение предоставляет твердый носитель, причем указанный носитель содержит твердую подложку, по меньшей мере одно хелатообразующее средство и по меньшей мере один антиоксидант, где твердая подложка содержит менее приблизительно 2 мкг/см2 примесей.
Твердый носитель может быть предназначен для стабилизации жирных кислот и/или для применения при определении состава жирных кислот в образце.
Жирные кислоты могут представлять собой или могут включать ненасыщенные жирные кислоты.
Жирные кислоты могут представлять собой или могут включать LCPUFA.
Жирные кислоты могут представлять собой или могут включать омега-3 жирные кислоты, например, ЕРА, DHA и т.п.
Твердая подложка может содержать менее приблизительно 1 мкг/см2 примесей или менее приблизительно 0,5 мкг/см2 примесей.
Примеси могут представлять собой насыщенные жирные кислоты.
Твердая подложка может представлять собой бумагу, подложку на бумажной основе или подложку на стеклянной основе.
Подложка на бумажной основе может представлять собой бумагу с нанесенным силикагелем.
Подложка на стеклянной основе может представлять собой фильтр из стеклянного микроволокна.
По меньшей мере одно хелатообразующее средство может представлять собой EDTA, аскорбиновую кислоту, или их соли, или лимонную кислоту или ее соли.
По меньшей мере один антиоксидант может представлять собой бутилгидрокситолуол, бутилгидроксианизол или трет-бутилгидрохинон.
Предусмотрены любые комбинации вышеуказанных хелатообразующих средств и антиоксидантов.
В одном варианте осуществления хелатообразующее средство представляет собой аскорбиновую кислоту и/или EDTA, а антиоксидант представляет собой ВНТ.
Твердый носитель может быть представлен в виде полосы.
Полоса может иметь размеры приблизительно 1 см × 3 см.
Антиоксидант (антиоксиданты) может присутствовать на твердом носителе в количестве от приблизительно 0,001 мг до приблизительно 10 мг, или в количестве от приблизительно 0,01 мг до приблизительно 5 мг, или в количестве от приблизительно 0,01 мг до приблизительно 1 мг, или в количестве от приблизительно 0,01 мг до приблизительно 0,5 мг. В одном варианте осуществления антиоксидант (антиоксиданты) присутствует/присутствуют в количестве приблизительно 0,1 мг.
Хелатообразующее средство (средства) может присутствовать на твердом носителе в количестве от приблизительно 0,001 мг до приблизительно 10 мг, или в количестве от приблизительно 0,01 мг до приблизительно 5 мг, или в количестве от приблизительно 0,01 мг до приблизительно 1 мг, или в количестве от приблизительно 0,05 мг до приблизительно 0,5 мг. В одном варианте осуществления хелатообразующее средство (средства) присутствует/присутствуют в количестве приблизительно 0,25 мг.
В одном варианте осуществления третьего аспекта настоящее изобретение предоставляет твердый носитель, причем указанный носитель содержит бумагу с нанесенным силикагелем, EDTA и/или аскорбиновую кислоту, а также ВНТ.
В другом варианте осуществления третьего аспекта настоящее изобретение предоставляет твердый носитель, причем указанный носитель содержит фильтр из стеклянного микроволокна, EDTA и/или аскорбиновую кислоту, а также ВНТ.
В четвертом аспекте настоящее изобретение предоставляет способ получения твердого носителя, содержащего твердую подложку, по меньшей мере одно хелатообразующее средство и по меньшей мере один антиоксидант, причем указанный способ предусматривает обеспечение твердого носителя, содержащего твердую подложку, и нанесение на твердый носитель по меньшей мере одного хелатообразующего средства и по меньшей мере одного антиоксиданта, где твердая подложка содержит менее приблизительно 2 мкг/см2 примесей.
Твердая подложка, хелатообразующее средство и антиоксидант могут быть такими, как определено в вышеизложенных аспектах.
Твердая подложка может содержать менее приблизительно 1 мкг/см2 примесей или менее приблизительно 0,5 мкг/см2 примесей.
По меньшей мере один антиоксидант и по меньшей мере одно хелатообразующее средство можно наносить на твердый носитель в виде одного раствора или отдельных растворов, одного раствора, содержащего по меньшей мере один антиоксидант, и одного раствора, содержащего по меньшей мере одно хелатообразующее средство.
Раствор (растворы) может содержать спирт и воду, например, этанол и воду.
Концентрация по меньшей мере одного антиоксиданта в растворе может составлять от приблизительно 0,1 мг/мл до приблизительно 10 мг/мл или от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл.
Концентрация по меньшей мере одного хелатообразующего средства в растворе может составлять от приблизительно 1 мг/мл до приблизительно 10 мг/мл или от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл.
Твердый носитель может быть представлен в виде полосы.
Количество раствора, нанесенного на полосу, может составлять от приблизительно 1 до 500 мкл или от приблизительно 1 до 100 мкл.
Полоса может иметь размеры приблизительно 1 см × 3 см.
Примеси могут представлять собой насыщенные жирные кислоты.
В пятом аспекте настоящее изобретение предоставляет набор, содержащий твердый носитель в соответствии с третьим аспектом.
Набор может быть предназначен для применения при стабилизации жирных кислот и/или для применения при определении состава жирных кислот в образце.
Набор может дополнительно содержать острый предмет для получения образца, содержащего жирные кислоты, от субъекта, например, биологической жидкости, такой как кровь.
Краткое описание чертежей
Далее будет описан предпочтительный вариант осуществления лишь в качестве примера со ссылкой на прилагаемые графические материалы, где:
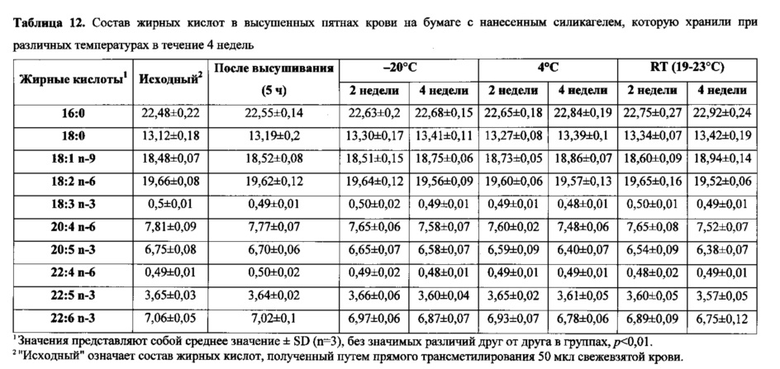
на фиг 1 показан уровень LCPUFA, сохраняющийся в пятнах крови, отобранных на два типа бумаги, предварительно обработанной различными взятыми отдельно антиоксидантами или хелаторами железа после 4 недель хранения.
На фиг. 2 показано изменение состава жирных кислот в пятнах крови при использовании диагностического набора Fluka на протяжении 2 месяцев хранения.
На фиг. 3 показано изменение состава жирных кислот в пятнах крови на бумаге Whatman с нанесенным силикагелем на протяжении 2 месяцев хранения.
На фиг. 4 показана корреляция содержания ЕРА+DHA между высушенным пятном капиллярной крови (DBS) и общим содержанием липидов, экстрагированных из цельной крови. Содержание EPA+DHA в DBS (ось x) по сравнению с общим содержанием липидов, экстрагированных из цельной крови (ось y), причем (EPA+DHA) (%) в цельной крови = DBS (EPA+DHA) (%)×1,068-0,139 (r=0,9971, P<0,0001).
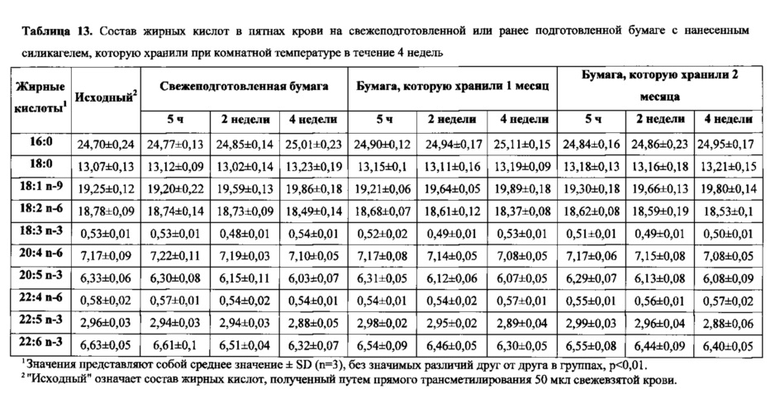
На фиг. 5 показана корреляция содержания ЕРА+DHA между высушенным пятном капиллярной крови и общим содержанием липидов в плазме. Содержание EPA+DHA в DBS (ось x) по сравнению с общим содержанием липидов в плазме (ось y), причем общее содержание липидов в плазме (EPA+DHA)(%)=DBS (EPA+DHA) (%)×1,108-1,554 (r=0,9869, P<0,0001).
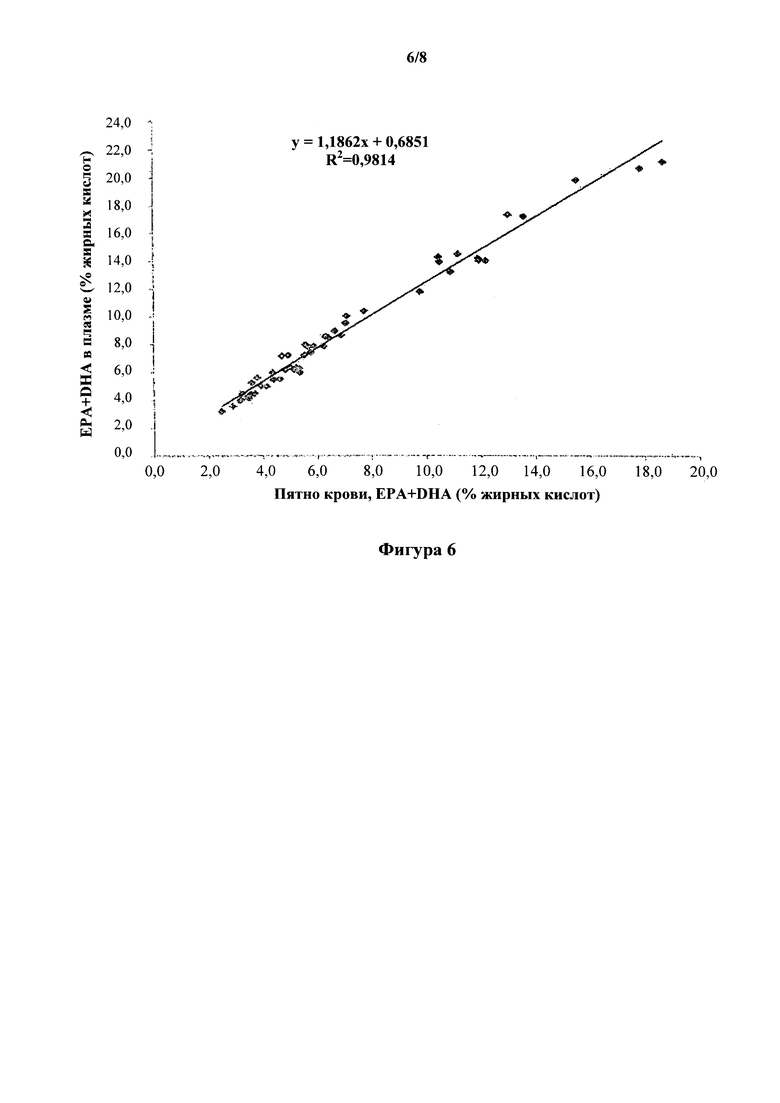
На фиг. 6 показана корреляция содержания ЕРА+DHA между высушенным пятном капиллярной крови и фосфолипидами плазмы. Содержание EPA+DHA в DBS (ось x) по сравнению с фосфолипидами плазмы (ось y), причем фосфолипиды плазмы (EPA+DHA) (%)=DBS (EPA+DHA) (%)×1,186+0,685 (r=0,9814, P<0,0001).
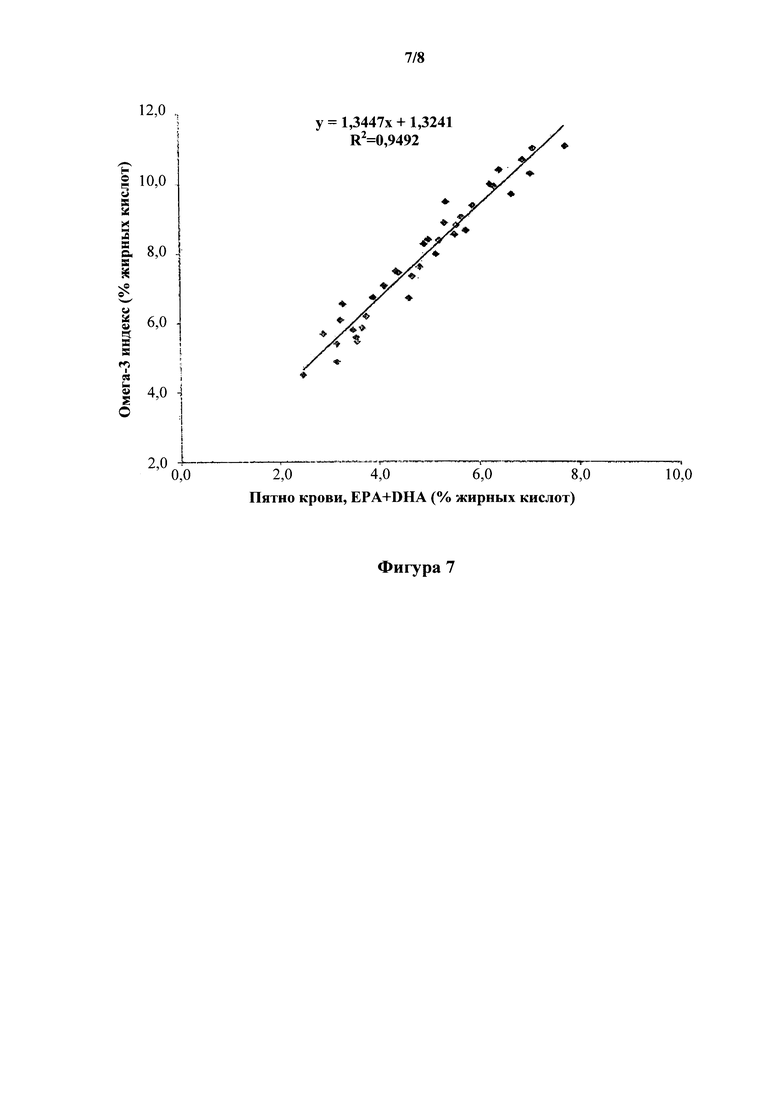
На фиг. 7 показана корреляция уровня ЕРА+DHA между высушенным пятном капиллярной крови и омега-3 индексом (RBC EPA+DHA), причем содержание ЕРА+DHA в DBS (ось x) представлено по сравнению с омега-3 индексом (ось у), омега-3 индекс (%) = капиллярное DBS (EPA+DHA) (%)×1,345+1,32 (r=0,9492, P<0,0001).
На фиг. 8 показан состав жирных кислот в пятнах крови на свежеподготовленной и предварительно подготовленной бумаге, которую хранили при комнатной температуре в течение 4 недель. Значения представляют собой среднее ±SD (n=3), без значимого различия друг от друга, p<0,01. "Исходный" означает состав жирных кислот, полученный путем прямого трансметилирования 50 мкл свежевзятой крови.
Определения
Ниже приведены некоторые определения, которые могут быть полезны для понимания описания настоящего изобретения. Они предназначены в качестве общих определений и никоим образом не ограничивают объем настоящего изобретения лишь этими выражениями, но используются для лучшего понимания следующего описания.
В данном описании, если контекст не требует иного, слово "содержать" или его варианты, такие как "содержит" или "содержащий", следует понимать как подразумевающие включение указанного этапа, или элемента, или целого числа, или группы этапов, или элементов, или целых чисел, но не исключение какого-либо другого этапа, или элемента, или целого числа, или группы элементов, или целых чисел. Таким образом, в контексте данного описания выражение "содержащий" обозначает "главным образом включающий, но не обязательно исключительно".
В контексте данного описания выражение "приблизительно" понимают как относящееся к диапазону чисел, которые специалист в данной области техники будет считать эквивалентными изложенному значению в контексте достижения той же функции или результата.
В контексте данного описания выражения в форме единственного числа относятся к одному или более одного (т.е. по меньшей мере одному) грамматическому объекту изделия. В качестве примера "элемент" означает один элемент или более одного элемента.
В контексте данного описания выражение "биологическая жидкость" понимают как включающее любую жидкость, которая возникает в теле человека или животного, включая секретируемые или экскретируемые жидкости. Неограничивающие примеры биологических жидкостей включают следующие: кровь, сперма, плазма крови, сыворотка, в том числе сыворотка крови, слюна, пот, моча, грудное молоко, желчь и перитонеальная жидкость.
В контексте данного описания выражение "хелатообразующее средство" понимают как включающее любое соединение, способное к образованию комплексов с многовалентными ионами, включая ионы многовалентных металлов группы II и группы III, а также ионы переходных металлов.
В контексте данного описания выражения "сорбировать" и "сорбированный" понимают как означающие, что соответствующий объект абсорбирован или адсорбирован или иным образом введен в твердую подложку или на твердую подложку.
В контексте данного описания выражение "биологический образец" понимают как означающее образец, который получают от живого организма, например, растений, животных (в том числе человека), грибов, бактерий, водорослей и т.п.
В контексте данного описания выражение "подложка на бумажной основе" понимают как обозначающее подложку, которая содержит, включает или имеет в составе бумагу. Подложка на бумажной основе может содержать по меньшей мере 5% (вес/вес), по меньшей мере 10% (вес/вес), по меньшей мере 20% (вес/вес), по меньшей мере 30% (вес/вес), по меньшей мере 40% (вес/вес), по меньшей мере 50% (вес/вес), по меньшей мере 60% (вес/вес), по меньшей мере 70% (вес/вес), по меньшей мере 80% (вес/вес), или по меньшей мере 90% (вес/вес), или по меньшей мере 95% (вес/вес), или по меньшей мере 99% (вес/вес) бумаги.
В контексте данного описания выражение "подложка на стеклянной основе" понимают как обозначающее подложку, которая содержит, включает или имеет в составе стекло. Подложка на стеклянной основе может содержать по меньшей мере 5% (вес/вес), по меньшей мере 10% (вес/вес), по меньшей мере 20% (вес/вес), по меньшей мере 30% (вес/вес), по меньшей мере 40% (вес/вес), по меньшей мере 50% (вес/вес), по меньшей мере 60% (вес/вес), по меньшей мере 70% (вес/вес), по меньшей мере 80% (вес/вес), или по меньшей мере 90% (вес/вес), или по меньшей мере 95% (вес/вес), или по меньшей мере 99% (вес/вес) стекла.
В контексте данного описания выражение "подложка на целлюлозной основе" понимают как обозначающее подложку, которая содержит, включает или имеет в составе целлюлозу. Подложка на целлюлозной основе может содержать по меньшей мере 5% (вес/вес), по меньшей мере 10% (вес/вес), по меньшей мере 20% (вес/вес), по меньшей мере 30% (вес/вес), по меньшей мере 40% (вес/вес), по меньшей мере 50% (вес/вес), по меньшей мере 60% (вес/вес), по меньшей мере 70% (вес/вес), по меньшей мере 80% (вес/вес), или по меньшей мере 90% (вес/вес), или по меньшей мере 95% (вес/вес), или по меньшей мере 99% (вес/вес) целлюлозы.
Подробное описание изобретения
Настоящее изобретение в целом относится к способу стабилизации жирных кислот, присутствующих в образце, и к твердому носителю для применения при стабилизации жирных кислот и для применения при определении состава жирных кислот в образце. Настоящее изобретение также относится к способу определения состава жирных кислот в образце, содержащем жирные кислоты. Настоящее изобретение дополнительно включает способ получения твердого носителя для применения при стабилизации жирных кислот и для применения при определении состава жирных кислот в образце.
Способ по первому аспекту настоящего изобретения предоставляет простое, безопасное, удобное и надежное средство для стабилизации жирных кислот, присутствующих в образцах. Авторы настоящего изобретения обнаружили, что при использовании данного способа жирные кислоты, присутствующие в крови, грудном молоке и плазме крови, можно стабилизировать при комнатной температуре на срок до 9 недель с минимальным разрушением.
Твердый носитель включает твердую подложку, на которой сорбировано по меньшей мере одно хелатообразующее средство и по меньшей мере один антиоксидант. Твердые подложки, подходящие для применения по настоящему изобретению, включают любой материал, способный сорбировать по меньшей мере одно хелатообразующее средство, по меньшей мере один антиоксидант и жидкость. Примеры таких подложек включают без ограничения бумагу, подложки на стеклянной основе, подложки на бумажной основе, подложки на целлюлозной основе, гидрофильные полимеры, политетрафторэтилен, стекловолокно и пористую керамику. В одном варианте осуществления твердая подложка представляет собой подложку на бумажной основе, например, бумагу с нанесенным силикагелем, которая включает бумагу, покрытую силикагелем, и бумагу, пропитанную силикагелем. Подходящие разновидности бумаги с нанесенным силикагелем включают такие, которые доступны от Whatman, Inc. под номером 3668-915. Эти разновидности бумаги содержат целлюлозу и крупнопористый силикагель и характеризуются толщиной приблизительно 0,27 мм и скоростью потока приблизительно 100 мм за 30 минут (для воды). Другие неограничивающие примеры бумаги и подложек на бумажной основе включают фильтровальную бумагу и бумагу для хроматографии.
В альтернативном варианте осуществления твердая подложка представляет собой подложку на стеклянной основе, такой как стекловата, или фильтр из стеклянного микроволокна, и, в частности, фильтр из стеклянного микроволокна, содержащий боросиликатное стекло или состоящий из боросиликатного стекла. Подходящие фильтры из стеклянного микроволокна включают такие, которые доступны от Whatman Inc. под номерами А1820-047, В1821-047, С182-047 и D1823-047.
Авторы настоящего изобретения обнаружили, что примеси, присутствующие в твердых подложках на бумажной основе, могут препятствовать точному определению количества соответствующих классов жирных кислот в виде доли от общего содержания липидов, в частности, если объем жидкости, нанесенной на твердую подложку является низким (т.е. менее приблизительно 20 мкл). В данном контексте выражение "примесь" или "примеси" можно понимать как обозначающее соединение или соединения, присутствие которых в твердой подложке может увеличивать или уменьшать вычисляемую долю класса жирных кислот в виде доли от общего содержания липидов в образце, нанесенном на подложку, по сравнению с вычисляемой долей класса жирных кислот в виде доли от общего содержания липидов в образце до нанесения на твердую подложку. Такие примеси включают, например, насыщенные жирные кислоты (например, 16:0 и 18:0), сложные эфиры насыщенных жирных кислот, смоляные кислоты (например, абиетиновая кислота, изопимаровая кислота, декстропимаровая кислота и левопимаровая кислота) и сложные эфиры смоляных кислот, которые переходят в бумагу при производстве. Хотя возможно использовать чистую твердую подложку в качестве контроля для внесения поправок на примеси при расчете долей жирных кислот, это добавляет дополнительный этап к способу и, следовательно, снижает производительность. Авторы настоящего изобретения обнаружили, что точное определение количества соответствующих классов жирных кислот в виде доли от общего содержания липидов в жидкости можно оптимизировать путем обеспечения того, что примеси в твердой подложке составляют менее приблизительно 2 мкг/см2. Соответственно, в вариантах осуществления по первому, второму, третьему и четвертому аспектам твердая подложка содержит примеси в количестве менее приблизительно 2 мкг/см2, или менее приблизительно 1,9 мкг/см2, или менее приблизительно 1,8 мкг/см2, или менее приблизительно 1,7 мкг/см2, или менее приблизительно 1,6 мкг/см2, или менее приблизительно 1,5 мкг/см2, или менее приблизительно 1,4 мкг/см2, или менее приблизительно 1,3 мкг/см2, или менее приблизительно 1,2 мкг/см2, или менее приблизительно 1,1 мкг/см2, или менее приблизительно 1 мкг/см2, или менее приблизительно 0,9 мкг/см2, или менее приблизительно 0,8 мкг/см2, или менее приблизительно 0,7 мкг/см2, или менее приблизительно 0,6 мкг/см2, или менее приблизительно 0,5 мкг/см2, или менее приблизительно 0,4 мкг/см2, или менее приблизительно 0,35 мкг/см2, или менее приблизительно 0,3 мкг/см2, или менее приблизительно 0,25 мкг/см2, или менее приблизительно 0,2 мкг/см2, или менее приблизительно 0,15 мкг/см2, или менее приблизительно 0,1 мкг/см2, или менее или равном приблизительно 0,15 мкг/см2, или менее или равном приблизительно 0,12 мкг/см2. В качестве альтернативы, твердая подложка может содержать примеси в количестве от приблизительно 0,005 мкг/см2 до приблизительно 0,5 мкг/см2, или в количестве от приблизительно 0,005 мкг/см2 до приблизительно 0,3 мкг/см2, или в количестве от приблизительно 0,005 мкг/см2 до приблизительно 0,1 мкг/см2, или в количестве от приблизительно 0,005 мкг/см2 до приблизительно 0,2 мкг/см2, или в количестве от приблизительно 0,005 мкг/см2 до приблизительно 0,15 мкг/см2. В альтернативных вариантах осуществления по первому, второму, третьему или четвертому аспектам перед нанесением жирных кислот или образца, содержащего жирные кислоты, твердая подложка содержит насыщенные жирные кислоты и/или смоляные кислоты в количестве менее приблизительно 2 мкг/см2, или менее приблизительно 1,9 мкг/см2, или менее приблизительно 1,8 мкг/см2, или менее приблизительно 1,7 мкг/см2, или менее приблизительно 1,6 мкг/см2, или менее приблизительно 1,5 мкг/см2, или менее приблизительно 1,4 мкг/см2, или менее приблизительно 1,3 мкг/см2, или менее приблизительно 1,2 мкг/см2, или менее приблизительно 1,1 мкг/см2, или менее приблизительно 1 мкг/см2, или менее приблизительно 0,9 мкг/см2, или менее приблизительно 0,8 мкг/см2, или менее приблизительно 0,7 мкг/см2, или менее приблизительно 0,6 мкг/см2, или менее приблизительно 0,5 мкг/см2, или менее приблизительно 0,4 мкг/см2, или менее приблизительно 0,3 мкг/см2, или менее приблизительно 0,25 мкг/см2, или менее приблизительно 0,2 мкг/см2, или менее приблизительно 0,15 мкг/см2, или менее приблизительно 0,1 мкг/см2, или менее приблизительно или равно приблизительно 0,15 мкг/см2, или менее или равном приблизительно 0,12 мкг/см2, или перед нанесением жирных кислот или образца, содержащего жирные кислоты, твердая подложка содержит насыщенные жирные кислоты и/или смоляные кислоты в количестве от приблизительно 0,005 мкг/см2 до приблизительно 0,5 мкг/см2, или в количестве от приблизительно 0,005 мкг/см2 до приблизительно 0,3 мкг/см2, или в количестве от приблизительно 0,005 мкг/см2 до приблизительно 0,2 мкг/см2, или в количестве от приблизительно 0,005 мкг/см2 до приблизительно 0,1 мкг/см2, или в количестве от приблизительно 0,005 мкг/см2 до приблизительно 0,15 мкг/см2.
Как описано в примерах в данном документе, путем контроля количества примесей, присутствующих в твердой подложке, и путем стабилизации жирных кислот, присутствующих в образце, возможно определять состав жирных кислот в образце в течение недель или месяцев после нанесения образца на твердую подложку с очень высокой степенью точности. Таким образом, если требуется точное определение содержания жирных кислот в образце, таком как кровь, например, индивидуум может попросту проколоть свой палец, поместить пятно крови на твердый носитель, дать возможность ему высохнуть, а затем отправить его по почте в центральную лабораторию для анализа. В связи с увеличенной стабильностью жирных кислот на твердом носителе, нет необходимости ни в охлаждении твердого носителя, ни в экспресс-пересылке образца. Также устранена необходимость в венепункции, как и необходимость в использовании чистой бумаги для получения образцов или некоторых других средств в качестве контроля для внесения поправок на примеси в твердом носителе. Соответственно, в другом аспекте настоящее изобретение относится к способу определения состава жирных кислот в образце, содержащем жирные кислоты, причем способ предусматривает:
(a) нанесение образца на твердый носитель, содержащий твердую подложку, по меньшей мере одно хелатообразующее средство и по меньшей мере один антиоксидант, где твердая подложка содержит менее приблизительно 2 мкг/см2 примесей, в результате чего образец становится сорбированным на твердой подложке;
(b) определение состава жирных кислот в образце, сорбированном на твердой подложке.
Этап (b) можно осуществлять при помощи способов, хорошо известных специалистам в данной области техники, например, путем дериватизации жирных кислот в высушенном сорбированном образце и анализа полученных в результате дериватизированных соединений при помощи газовой хроматографии (GC). В одном варианте осуществления жирные кислоты в высушенном сорбированном образце превращают в сложные метиловые эфиры жирных кислот путем прямого трансметилирования, например, путем нагревания при 70°C в растворе 1% H2SO4 в метаноле в течение 3 часов. Затем сложные метиловые эфиры экстрагируют в органический растворитель (такой как гептан) и гептан, содержащий сложные метиловые эфиры жирных кислот, вводят в газовый хроматограф. Идентификации и количественного определения сложных метиловых эфиров жирных кислот можно добиться путем сравнения значений времени удерживания и значений площади пика неизвестных образцов с таковыми у коммерческих стандартов липидов с использованием системы обработки данных Hewlett-Packard Chemstation (см. пример 1 в данном документе).
Соответственно, в одном варианте осуществления этап (b) предусматривает:
(i) экстрагирование по меньшей мере части образца, сорбированного на твердой подложке, для обеспечения экстракта, содержащего дериватизированные, например, эстерифицированные жирные кислоты;
(ii) определение состава жирных кислот в образце исходя из количеств дериватизированных жирных кислот.
Эстерифицированные жирные кислоты могут представлять собой сложные C1-С6алкиловые эфиры, например, сложные метиловые эфиры.
Способ может предусматривать определение количества жирных кислот одного или нескольких классов (предпочтительно ненасыщенных жирных кислот) в образце в виде доли (например, процентного содержания) от общего содержания липидов, присутствующих в образце, или в виде доли от общего содержания жирных кислот, присутствующих в образце. Например, способ может предусматривать определение количества одной или нескольких из следующих ненасыщенных жирных кислот: 18:1 n-9, 18:2 n-6, 20:4 n-6, 20:5 n-3, 2:5 n-3 и 2:6 n-3. Этап (b) можно осуществлять спустя недели или месяцы после этапа (а). Например, этап (b) можно осуществлять в пределах приблизительно 12 месяцев, в пределах приблизительно 9 месяцев, в пределах приблизительно 8 месяцев, в пределах приблизительно 7 месяцев, в пределах приблизительно 6 месяцев, в пределах приблизительно 5 месяцев, в пределах приблизительно 4 месяцев, в пределах приблизительно 3 месяцев, в пределах приблизительно 2 месяцев или в пределах приблизительно 1 месяца после этапа (а). В некоторых вариантах осуществления этап (b) осуществляют в пределах приблизительно 12 недель, в пределах приблизительно 11 недель, в пределах приблизительно 10 недель, в пределах приблизительно 9 недель, в пределах приблизительно 8 недель, в пределах приблизительно 7 недель, в пределах приблизительно 6 недель, в пределах приблизительно 5 недель, в пределах приблизительно 4 недель, в пределах приблизительно 3 недель, в пределах приблизительно 2 недель или в пределах приблизительно 1 недели после этапа (а).
Для того, чтобы дополнительно свести к минимуму возможность загрязнения гидрофобными веществами, которые могут способствовать погрешностям определения состава жирных кислот, образец, полученный на этапе (а), предпочтительно хранят в пакете из целлофана до осуществления этапа (b). Предпочтительно образец хранят в пакете из целлофана в темноте при температуре окружающей среды.
Как правило, образец представляет собой биологический образец, однако специалистам в данной области техники будет понятно, что способы и носители по настоящему изобретению являются применимыми по отношению к любому образцу, содержащему жирные кислоты и, в частности, ненасыщенные жирные кислоты, которые в особенности чувствительны к разрушению. В некоторых вариантах осуществления биологический образец представляет собой биологическую жидкость. Неограничивающие примеры биологических жидкостей включают следующие: кровь, слюна, грудное молоко, моча, сперма, плазма крови, синовиальная жидкость и сыворотка. В альтернативных вариантах осуществления образец может представлять собой масло, например, пищевое масло, такое как рыбий жир или растительное масло, которое содержит ненасыщенные жирные кислоты, для которого требуется определение состава жирных кислот. Может требоваться определение состава жирных кислот в таких маслах с целью контроля качества и/или для оценки срока хранения. В другом варианте осуществления масло может представлять собой масло, полученное из созданной при помощи генной инженерии сельскохозяйственной культуры (например, канолы), которая была выведена для получения увеличенных количеств выбранных жирных кислот, например, омега-3 жирных кислот, в качестве доли от полученного общего содержания липидов. В этом случае способ из второго аспекта можно использовать для количественного определения увеличения количества омега-3 жирных кислот в качестве доли от полученного общего содержания липидов.
Образец можно наносить на твердый носитель в количестве, которое составляет менее приблизительно 100 мкл, или менее приблизительно 90 мкл, или менее приблизительно 80 мкл, или менее приблизительно 70 мкл, или менее приблизительно 60 мкл, или менее приблизительно 50 мкл, или менее приблизительно 40 мкл, или менее приблизительно 30 мкл, или менее приблизительно 25 мкл, или менее приблизительно 20 мкл, или приблизительно 20 мкл.
В других вариантах осуществления образец можно наносить на твердый носитель в количестве от приблизительно 10 мкл до приблизительно 250 мкл, или от приблизительно 10 мкл до приблизительно 150 мкл, или от приблизительно 10 мкл до приблизительно 100 мкл, или от приблизительно 10 мкл до приблизительно 75 мкл, или от приблизительно 10 мкл до приблизительно 60 мкл, или от приблизительно 30 мкл до приблизительно 60 мкл, или от приблизительно 10 мкл до приблизительно 20 мкл, или от приблизительно 10 мкл до приблизительно 30 мкл, или приблизительно 50 мкл.
Твердая подложка, используемая по настоящему изобретению, содержит по меньшей мере одно хелатообразующее средство, которое является сорбированным на ней. Хелатообразующие средства хорошо известны специалистам в данной области техники. Хелатоообразующие средства, подходящие для применения по настоящему изобретению, включают без ограничения следующие: EDTA, этиленгликоль-O,O'-бис(2-аминоэтил)-N,N,N',N'-тетрауксусная кислота (EGTA), триэтаноламин, салициловая кислота, диэтилентриаминпентауксусная кислота, диэтилентриамин-N,N,N',N',N"-пентауксусная кислота, N,N-бис(2-(бис-(карбоксиметил)амино)этил)глицин, диэтилентриаминпентауксусная кислота, [[(карбоксиметил)имино]бис(этиленнитрило)]тетрауксусная кислота, N,N-бис(карбоксиметил)глицин, тригликольаминовая кислота, трилон А, α, α', α''-триметиламинтрикарбоновая кислота, три(карбоксиметил)амин, аминотриуксусная кислота, кислота Hampshire NTA, нитрило-2,2',2''-триуксусная кислота, Titriplex I, нитрилотриуксусная кислота и дефероксамин.
Твердая подложка, используемая по настоящему изобретению, содержит по меньшей мере один антиоксидант, который является сорбированным на ней. Антиоксиданты, подходящие для использования по настоящему изобретению, включают без ограничения следующие: ресвератрол, трет-бутилгидрохинон, ВНТ, ВНА, лимонная кислота, цитрат, аскорбиновая кислота, аскорбат, флавоноиды, такие как бакалеин, и антиоксидантные растительные экстракты.
Антиоксидант (антиоксиданты) может присутствовать на твердом носителе в количестве от приблизительно 0,001 мг до приблизительно 10 мг, или в количестве от приблизительно 0,01 мг до приблизительно 1 мг, или в количестве от приблизительно 0,01 мг до приблизительно 0,5 мг. В одном варианте осуществления антиоксидант (антиоксиданты) присутствует в количестве приблизительно 0,1 мг.
Хелатообразующее средство (средства) может присутствовать на твердом носителе в количестве от приблизительно 0,001 мг до приблизительно 10 мг, или в количестве от приблизительно 0,01 мг до приблизительно 1 мг, или в количестве от приблизительно 0,05 мг до приблизительно 0,5 мг. В одном варианте осуществления хелатообразующее средство (средства) присутствует/присутствуют в количестве приблизительно 0,25 мг. В другом варианте осуществления хелатообразующее средство (средства) присутствует/присутствуют в количестве приблизительно 0,5 мг.
Настоящее изобретение дополнительно относится к способу получения твердого носителя, содержащего твердую подложку, по меньшей мере одно хелатообразующее средство и по меньшей мере один антиоксидант, причем указанный способ предусматривает обеспечение твердого носителя, содержащего твердую подложку, и нанесение на твердый носитель по меньшей мере одного хелатообразующего средства и по меньшей мере одного антиоксиданта, где твердая подложка содержит менее приблизительно 2 мкг/см2 примесей.
Твердая подложка, хелатообразующее средство и антиоксидант могут быть такими, как определено в данном документе. По меньшей мере один антиоксидант и по меньшей мере одно хелатообразующее средство можно наносить на твердый носитель в виде одного раствора или отдельных растворов, одного раствора, содержащего по меньшей мере один антиоксидант, и одного раствора, содержащего по меньшей мере одно хелатообразующее средство. В качестве альтернативы, если по меньшей мере один антиоксидант и/или по меньшей мере одно хелатообразующее средство представляют собой жидкости, то каждый можно наносить на твердый носитель без примесей.
Раствор (растворы) может содержать органический растворитель и воду, например, спирт (такой как метанол или этанол) и воду.
Концентрация по меньшей мере одного антиоксиданта в растворе может составлять от приблизительно 0,1 мг/мл до приблизительно 10 мг/мл или от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл. Концентрация по меньшей мере одного хелатообразующего средства в растворе может составлять от приблизительно 1 мг/мл до приблизительно 10 мг/мл или от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл. Количество раствора, наносимого на полосу, может составлять от приблизительно 1 до 500 мкл, или от приблизительно 1 до 100 мкл, или приблизительно 50 мкл. Как правило, раствор наносят по каплям.
Твердый носитель может быть любой формы (например, круглой, прямоугольной, квадратной и т.п.), но, как правило, представлен в виде полосы. Полоса может иметь размеры от приблизительно 1 см × 1 см до приблизительно 1 см × 3 см, однако, предусмотрены полосы альтернативного размера. Как правило, твердый носитель является тонким (т.е. от 1 до 2 мм), поскольку это обеспечивает недорогую и быструю пересылку в центральную лабораторию в стандартном конверте.
Настоящее изобретение дополнительно относится к набору, содержащему твердый носитель в соответствии с третьим аспектом. Набор может дополнительно содержать острый предмет (например, скарификатор, иглу и т.п.) для получения образца, содержащего жирные кислоты, от субъекта, например, биологической жидкости. В одном варианте осуществления биологическая жидкость представляет собой кровь. Предпочтительно, острый предмет может быть предварительно стерилизованным, с тем чтобы свести к минимуму риск возникновения инфекции у субъекта после его использования. Набор может дополнительно содержать инструкции по применению.
Примеры
Далее настоящее изобретение будет более подробно описано, лишь с целью иллюстрирования, с учетом следующих примеров. Примеры предназначены для иллюстрирования данного изобретения и никоим образом не должны быть истолкованы как ограничивающие общность раскрытия всего описания.
Пример 1. Стабилизация пятен крови на бумаге для хроматографии с силикагелем Whatman с использованием комбинации из ВНТ и аскорбиновой кислоты/EDTA
Материалы и методики
Бумага для получения образцов крови
Для получения пятна крови использовали два типа бумаги: бумага из набора для получения образцов крови Fluka (Sigma-Aldrich, Бухс, Швейцария) и бумага для хроматографии с силикагелем Whatman (46×57 см, Whatman, Бакингем, Соединенное Королевство). У Sigma-Aldrich (Сент-Луис, Миссури) приобрели два коммерческих фенольных антиоксиданта, бутилгидрокситолуол и третичный бутилгидрохинон (TBHQ). У Chem-supply Company (Джиллмен, Южная Австралия) приобрели средства, хелатирующие железо, L-аскорбиновую кислоту и EDTA.
Растворы антиоксиданта/хелатора (стабилизатора)
Получали четырнадцать составов стабилизатора для стабилизации жирных кислот в пятнах крови на бумаге для получения образцов обоих типов (таблица 1). Для определения оптимальной концентрации антиоксиданта с целью контроля окисления липидов в пятнах крови тестировали оба вида антиоксидантов (ВНТ и TBHQ) при трех различных концентрациях (0,5 мг/мл, 2 мг/мл и 4 мг/мл) (таблица 1). В качестве хелатора железа использовали L-аскорбиновую кислоту и EDTA при уровнях 5 мг/мл. Каплю каждого состава стабилизатора (~50 мкл) равномерно распределяли по полосам бумаги для получения образцов и высушивали на воздухе перед отбором крови на бумагу.

Получение образцов
Кровь отбирали из латеральной подкожной вены руки у одного здорового добровольца, регулярно употребляющего рыбий жир и имеющего очень высокое содержание ЕРА и DHA в крови. Прямого трансметилирования жирных кислот в цельной крови добивались путем смешивания свежевзятой крови (~50 мкл) с 2 мл 1% (объем/объем) H2SO4 (18М, чистый для анализа, BDH, Суссекс, Соединенное Королевство) в безводном метаноле в 5 мл закупоренном флаконе (Wheaton, Милвилл, США) и нагревания при 70°C в течение 3 ч. Полученные в результате сложные эфиры жирных кислот (FAME) экстрагировали в гептан и вводили в GC для анализа в соответствии с ранее утвержденными способами (1). Пятна крови получали путем абсорбирования капли свежевзятой крови (~50 мкл) на полосах бумаги для получения образцов крови (1×3 см) обоих типов при отсутствии или в присутствии составов стабилизатора (таблица 1), при этом все пятна крови высушивали на воздухе при температуре окружающей среды в течение 6 ч. Как только пятна крови высыхали, их разделяли на 4 группы. Первую группу сразу же подвергали трансэстерификации в соответствии с той же методикой, что и для свежевзятой крови. Для определения, произошла ли какая-либо потеря LCPUFA в результате окисления в образцах пятен крови при высушивании на воздухе и для получения исходного значения состава жирных кислот в пятнах крови, полученные для этих образцов результаты сравнивали с теми, которые были получены путем прямого измерения состава жирных кислот в свежевзятой крови. Пятна крови в оставшихся трех группах хранили в пакетах из целлофана в темноте при температуре окружающей среды, и состав жирных кислот в этих образцах определяли либо через 2 недели, либо через 4 недели, либо через 9 недель после отбора крови. Все образцы обрабатывали в трех повторностях.
Анализ с использованием газовой хроматографии
FAME отделяли и определяли количественно с использованием GC (Hewlett-Packard 6890; Пало-Альто, Калифорния, США), оснащенного капиллярной колонкой ВРХ70 50 м×0,32 мм с толщиной фазы 0,25 мкм (SGC Pty Ltd., Виктория, Австралия), инжектором PTV и пламенно-ионизационным детектором (FID). Температуру в инжекторе устанавливали на 250°C и температуру FID на 300°C, а также использовали программируемый диапазон температур (140-240°C). В качестве газа-носителя использовали гелий при скорости потока в колонке 35 см в секунду, а отношение деления потока на входе устанавливали на 20:1. Идентификации и количественного определения FAME добивались путем сравнения значений времени удерживания и значений площади пика неизвестных образцов с таковыми у коммерческих стандартов липидов (Nu-Chek Prep Inc., Элизайан, Миннесота, США) с использованием системы обработки данных Hewlett-Packard Chemstation.
Статистические анализы
Все статистические анализы проводили с использованием PASW Statistic 18. Значения выражали в виде среднего значения ± стандартное отклонение (SD). Однофакторный дисперсионный анализ использовали для определения значимых различий между значениями процентного содержания жирных кислот от общего содержания липидов в крови после высушивания на воздухе. Влияния типа бумаги и состава стабилизатора на изменения процентного содержания жирных кислот в одном и том же образце крови со временем тестировали с использованием двухфакторного дисперсионного анализа. Если при помощи дисперсионного анализа определяли значимые взаимодействия между типом бумаги и составом стабилизатора, то изменения жирных кислота со временем определяли по отдельности для различных типов бумаги при помощи однофакторного дисперсионного анализа и апостериорного критерия Тьюки, причем p<0,05 принимали как статистически значимый.
Результаты
Влияние разновидностей бумаги и концентрации антиоксиданта
При отсутствии антиоксидантов и хелаторов железа пятна крови, полученные на бумаге Fluka или на бумаге с силикагелем, демонстрировали значительное снижение содержания LCPUFA при измерении после 4-недельного периода хранения при сравнении с теми пятнами крови, которые получали на разновидностях бумаги, предварительно обработанной антиоксидантом (фиг. 1). Пятна крови, полученные на предварительно обработанной ВНТ бумаге, сохраняли высокое процентное содержание LCPUFA по сравнению с таковыми, которые получали на разновидностях бумаги, предварительно обработанной другим антиоксидантом или хелаторами железа при всех трех концентрациях, после 4 недель хранения при температуре окружающей среды (фиг. 1). Оптимальная защита, обеспечиваемая ВНТ, по-видимому, наблюдалась при концентрации 2 мг/мл. Следует отметить, что LCPUFA в пятнах крови, по-видимому, являлись более стабильными на бумаге, покрытой силикагелем, чем на бумаге Fluka.
Влияние хелаторов железа
Помещали пятно крови на оба типа бумаги и пятну давали возможность высохнуть в течение 6 часов, результатом чего была потеря LCPUFA по сравнению с эквивалентным количеством крови, подвергнутой прямой трансэстерификации в подкисленном метаноле (таблицы 2 и 3). Было продемонстрировано, что прямая трансэстерификация представляет собой надежный способ определения состава жирных кислот липидов крови. В пятнах крови, полученных на разновидностях бумаги, обработанной лишь ВНТ, обнаруживали значительное снижение процентного содержания эйкозапентаеновой кислоты (ЕРА, 20:5n-3) и докозагексаеновой кислоты (DHA, 2:6n-3) от общего содержания липидов в крови. Однако состав жирных кислот, определяемый в пятнах крови, абсорбированных на одной из разновидностей бумаги для получения образцов, которую предварительно обрабатывали смесью ВНТ и одним из хелаторов железа (L-аскорбиновой кислотой или EDTA), значительно не отличался от результатов, полученных для свежевзятой крови (см. таблицу 2 и таблицу 3). Кроме того, независимо от используемых составов стабилизатора, пятна крови, полученные на бумаге с силикагелем Whatman, неизменно демонстрировали состав жирных кислот, который был более сходен с таковым в свежевзятой крови по сравнению с пятнами крови, полученными на бумаге из набора для получения образцов крови Fluka.
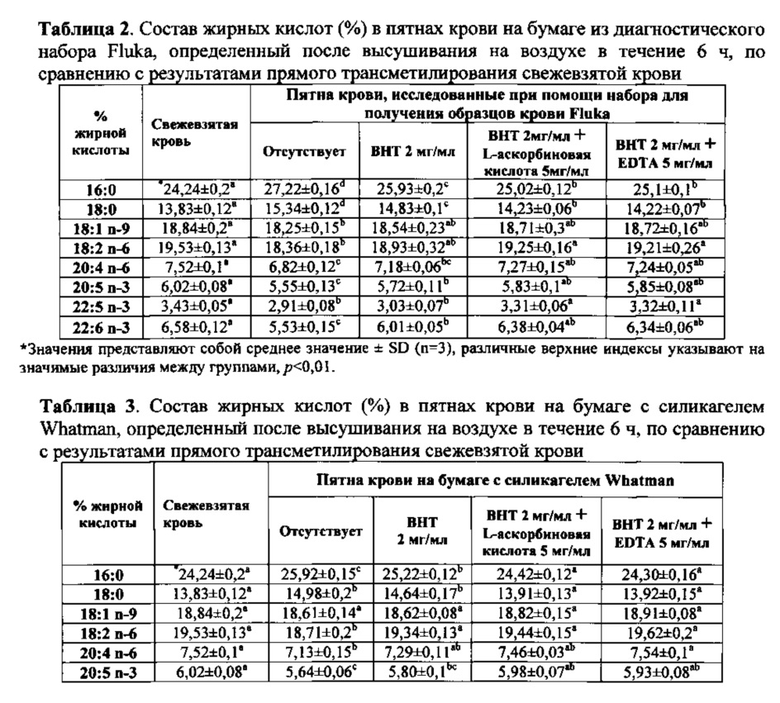

Влияние долгосрочного хранения на состав жирных кислот в пятнах крови
Пятна крови, полученные на бумаге из диагностического набора Fluka, которые хранили в течение периода 9 недель, демонстрировали значимое различие составов жирных кислот по сравнению с пятнами крови, измерение в которых проводили сразу же после высушивания на воздухе в течение 6 ч (фиг. 2, p<0,01). Независимо от используемого состава стабилизатора, уровни омега-6 жирных кислот (линоленовая кислота, LA, 18:2n-6; арахидоновая кислота, АА, 20:4n-6) и омега-3 ЕРА и DHA, измеренные в пятне крови, полученном с использованием диагностического набора Fluka, были значительно ниже значений, измеренных при исходном уровне, уже через 2 недели после хранения, и уровни продолжали снижаться в течение 9-недельного периода хранения. С другой стороны, процентное содержание от общего содержания насыщенных жирных кислот, измеренное в пятнах крови, постоянно увеличивалось в течение периода хранения (фиг. 2).
Если пятна крови получали на бумаге с силикагелем Whatman без какого-либо стабилизатора, то наблюдали значительное снижение процентного содержания ЕРА и DHA от общего содержания липидов в пятнах крови после 2 недель хранения (фиг. 3, p<0,01), однако, потери были меньшими, чем наблюдали для бумаги Fluka за такой же период. При обработке с помощью ВНТ бумаги с силикагелем Whatman значительные снижения уровней ЕРА и DHA не наблюдались до 4 недель после хранения. После добавления как ВНТ, так и хелаторов железа (L-аскорбиновая кислота или EDTA) на бумагу с силикагелем Whatman процентное содержание всех LCPUFA в образцах пятен крови значительно не отличалось от исходных значений даже после 9 недель хранения при комнатной температуре (фиг. 3).
Обсуждение
Если для оценки статуса LCPUFA у индивидуумов предполагается повсеместное внедрение в практику методики с использованием пятна крови, то исследователи должны быть уверены в том, что данный способ является точным и стабильным с течением времени. Учитывая, что при помещении крови на фильтровальную бумагу LCPUFA крови будет, естественно, подвергаться воздействию воздуха, исследователей интересовала стабильность LCPUFA в образцах пятен крови, полученных таким образом (2). С коммерческой точки зрения методику с использованием пятна крови рекламировали потребителям, предлагая им отправлять по почте образцы на подготовленной бумаге для получения оценки их омега-3 индекса (ЕРА+DHA). Подобный тест предполагает, что жирные кислоты в крови, в особенности ЕРА и DHA, являются стабильными от момента помещения пятна до анализа образца в отдаленной лаборатории. Очевидно, что при использовании диагностического набора будет происходить зависимое от времени окисление этих омега-3 жирных кислот независимо от того, покрыта ли бумага ВНТ. Сообщали, что даже при обработке с помощью ВНТ разновидностей бумаги для получения образцов лишь приблизительно 60% от содержания n-3 LCPUFA в образцах сохранялось после хранения в течение 1 месяца при температуре окружающей среды (2).
Наибольшей стабильности состава жирных кислот в пятнах крови можно добиться при помощи комбинирования антиоксиданта ВНТ с хелатором железа (L-аскорбиновая кислота или EDTA) и бумаги с силикагелем в качестве бумаги для получения образцов, поскольку это позволяет поддерживать исходные уровни ЕРА и DHA в пятне крови даже после 2 месяцев хранения при температуре окружающей среды.
В заключение результаты данного исследования указывают на то, что стабилизирующая система, состоящая из комбинации ВНТ, хелатора и бумаги с силикагелем, может предотвращать значительную потерю в результате окисления LCPUFA в пятнах крови в течение по меньшей мере 2 месяцев при хранении при температуре окружающей среды. Данный способ обладает потенциалом обеспечивать точную оценку статуса жирных кислот в образцах капиллярной крови после долгосрочного хранения и, таким образом, обеспечивает возможность сравнения образцов, которые хранили на протяжении различных периодов времени.
Пример 2. Стабилизация пятен плазмы крови на бумаге для хроматографии с силикагелем Whatman с использованием комбинации из ВНТ и EDTA
Кровь отбирали у субъекта, который регулярно употреблял одну капсулу рыбьего жира в день. Образец крови центрифугировали при 3000 об./мин. в течение 10 минут при 4°C для разделения плазмы и эритроцитов. Каплю плазмы (~50 мкл) подвергали прямой трансэстерификации и полученные в результате FAME анализировали при помощи GC для получения исходного значения состава жирных кислот от общего содержания липидов в плазме. Остаток плазмы разделяли на две порции, причем первую порцию хранили при -20°C и анализировали состав жирных кислот с помощью прямой трансэстерификации через 1, 2 и 4 недели. Вторую порцию помещали в виде пятна на бумагу для хроматографии с силикагелем Whatman (46×57 см, Whatman, Бакингем, Соединенное Королевство (~50 мкл на бумагу), пропитанную 2 мг/мл ВНТ и 5 мг/мл EDTA, и высушивали на воздухе в течение 5-6 ч. Затем пятна плазмы хранили в пакетах из целлофана в темноте при комнатной температуре (19-23°C), и состав жирных кислот в этих образцах определяли через 1, 2 и 9 недель после отбора крови. Все образцы обрабатывали в трех повторностях. Результаты показаны в таблице 4.
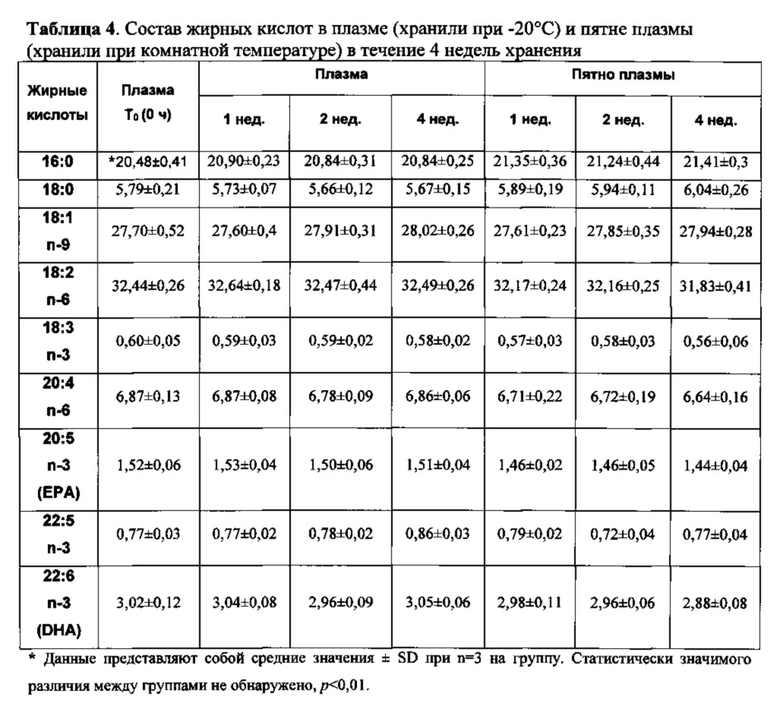
Пример 3. Стабилизация пятен грудного молока на бумаге для хроматографии с силикагелем Whatman с использованием комбинации из ВНТ и EDTA
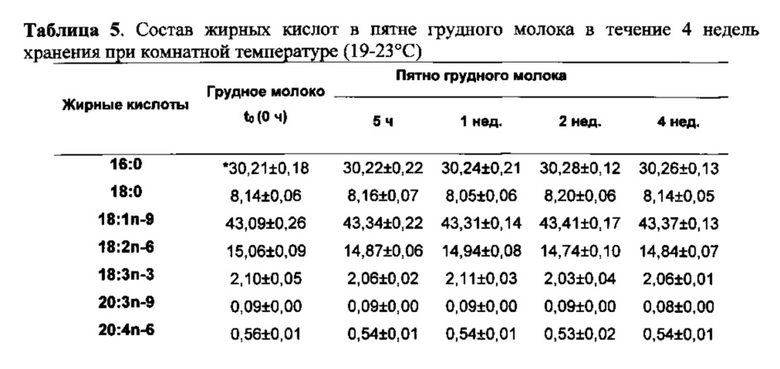
Грудное молоко получали от лактирующего в течение 5 месяцев субъекта, который не принимал добавку с рыбьим жиром. Каплю грудного молока (~50 мкл) подвергали прямой трансэстерификации и полученные в результате FAME анализировали при помощи GC для получения исходного значения состава жирных кислот от общего содержания липидов в грудном молоке. Остаток грудного молока помещали в виде пятна на бумагу для хроматографии с силикагелем Whatman (46×57 см, Whatman, Бакингем, Соединенное Королевство (~50 мкл на бумагу), пропитанную 2 мг/мл ВНТ и 5 мг/мл EDTA, и высушивали на воздухе в течение 5-6 ч. Как только пятна грудного молока высыхали, их разделяли на 4 группы. Первую группу сразу же подвергали трансэстерификации в соответствии с той же методикой трансэстерификации, что и для свежего грудного молока. Для определения, произошла ли какая-либо потеря LCPUFA в результате окисления в образцах пятен грудного молока при высушивании на воздухе и для получения исходного значения состава жирных кислот в пятнах грудного молока, полученные для данных образцов результаты сравнивали с теми, которые были получены путем прямого измерения состава жирных кислот в свежем грудном молоке. Остаток из трех групп пятен грудного молока хранили в пакетах из целлофана в темноте при комнатной температуре (19-23°C), и состав жирных кислот в этих образцах определяли через 1, 2 и 4 недели после получения грудного молока. Все образцы обрабатывали в трех повторностях. Результаты показаны в таблице 5.

Пример 4. Примеси из бумаги и других источников
Материалы и методики
Бумага для получения пятен крови
В качестве разновидностей бумаги для получения пятен крови использовали пять типов бумаги, два из которых представляют собой коммерчески разработанные разновидности бумаги для получения пятен крови: набор для получения образцов крови Fluka (Sigma-Aldrich, Бухс, Швейцария) и карточка для получения образцов Whatman 903 (Whatman, Бакингем, Соединенное Королевство); и три разновидности бумаги для хроматографии: бумага для хроматографии Whatman 3ММ (46×57 см, Whatman, Бакингем, Соединенное Королевство), бумага для хроматографии с силикагелем Whatman (46×57 см, Whatman, Бакингем, Соединенное Королевство) и фильтр из стеклянного микроволокна Whatman (GF/B 47 мм, Whatman, Бакингем, Соединенное Королевство).
Получение образцов
У одного здорового добровольца, достигшего 30 лет, отбирали из латеральной подкожной вены руки приблизительно 5 мл крови и обрабатывали сразу же после получения. Свежевзятую цельную кровь (~50 мкл) смешивали с 2 мл 1% (объем/объем) H2SO4 (18М, чистый для анализа, BDH, Суссекс, Соединенное Королевство) в безводном метаноле в 5 мл закупоренном флаконе (Wheaton, Милвилл, США) и подвергали прямому трансметилированию путем нагревания при 70°C в течение 3 ч. Полученные в результате сложные эфиры жирных кислот (FAME) экстрагировали в гептан и вводили в GC для анализов в соответствии с ранее утвержденным способом (1). Во время отбора крови две дополнительные аликвоты образца крови (25 мкл и 50 мкл, соответственно) помещали на полосы бумаги (1×1 см) и обрабатывали в соответствии с той же методикой, что и для свежевзятой крови. Полосы чистой бумаги для получения образцов эквивалентной площади (1×1 см) без крови обрабатывали в соответствии с той же методикой в качестве контролей. Все образцы обрабатывали в трех повторностях.
Для оценки потенциальных примесей из источников, отличных от бумаги, при отборе образцов, обработке и хранении, полосами чистого фильтра из стеклянного микроволокна Whatman (1×1 см) вытирали 10 см2 площади поверхности различных материалов, используемых в лаборатории, в том числе перчатку из латекса, нитриловую перчатку, полиэтиленовый (РЕ) пакет с застежкой, пакет из алюминиевой фольги с застежкой или пакет из целлофана. Далее образцы бумаги, которой вытирали, подвергали трансметилированию с использованием вышеописанного способа и анализировали при помощи GC. Для определения примесей, которые поступают из перчаток и пакетов, содержание примесей в чистом фильтре из стеклянного микроволокна вычитали из содержания примесей в фильтрах из стеклянного микроволокна, при помощи которых вытирали. Все образцы обрабатывали в трех повторностях.
Анализ с использованием газовой хроматографии
FAME отделяли и определяли количественно с использованием GC (Hewlett-Packard 6890; Пало-Альто, Калифорния, США), оснащенного капиллярной колонкой ВРХ70 50 м×0,32 мм с толщиной фазы 0,25 мкм (SGC Pty Ltd., Виктория, Австралия), инжектором PTV и пламенно-ионизационным детектором (FID). Температуру в инжекторе устанавливали на 250°C и температуру FID на 300°C, а также использовали программируемый диапазон температур (140-240°C). В качестве газа-носителя использовали гелий при скорости потока в колонке 35 см в секунду, а отношение деления потока на входе устанавливали на 20:1. Идентификации и количественного определения FAME достигали путем сравнения значений времени удерживания и значений площади пика неизвестных образцов с таковыми у коммерческих стандартов липидов (Nu-Chek Prep Inc., Элизайан, Миннесота, США) с использованием системы обработки данных Hewlett-Packard Chemstation.
Статистические анализы
Все статистические анализы проводили с использованием PASW Statistic 18. Значения выражали в виде среднего значения ± стандартное отклонение (SD). Однофакторный дисперсионный анализ использовали для определения значимого различия между процентными содержаниями жирных кислот от общего содержания липидов в крови, а p<0,05 использовали для определения статистической значимости.
Результаты и обсуждение
Различные результаты при использовании образцов пятен крови и свежевзятой крови
По сравнению с измерением в свежевзятой крови, анализ 25 мкл крови, помещенной в виде пятна как на бумагу с силикагелем, так и на фильтр из стеклянного микроволокна, дает идентичные результаты для состава жирных кислот. В то же время капли крови объемом 25 мкл на бумаге из диагностического набора Fluka или на карточке для получения образцов Whatman 903 имели значительно более низкое процентное содержание омега-3 жирных кислот и арахидоновой кислоты (АА, 20:4 n-6) от общего содержания липидов в крови по сравнению с измерением в свежевзятой крови (таблица 6). Это явное снижение доли омега-3 и А-А в образцах пятен крови было компенсировано значительным повышением процентных содержаний насыщенных жирных кислот, пальмитиновой кислоты (16:0) и стеариновой кислоты (18:0), измеренных в этих образцах. При увеличении объема пятна крови до 50 мкл состав жирных кислот, измеренный в пятнах крови, полученных с помощью диагностического набора Fluka, незначительно отличался по сравнению со свежевзятой кровью, однако, анализ пятен крови объемом 50 мкл на карточке для получения образцов Whatman 903 по-прежнему дает существенно отличающийся профиль жирных кислот по сравнению с таковым в свежевзятой крови (таблица 7).
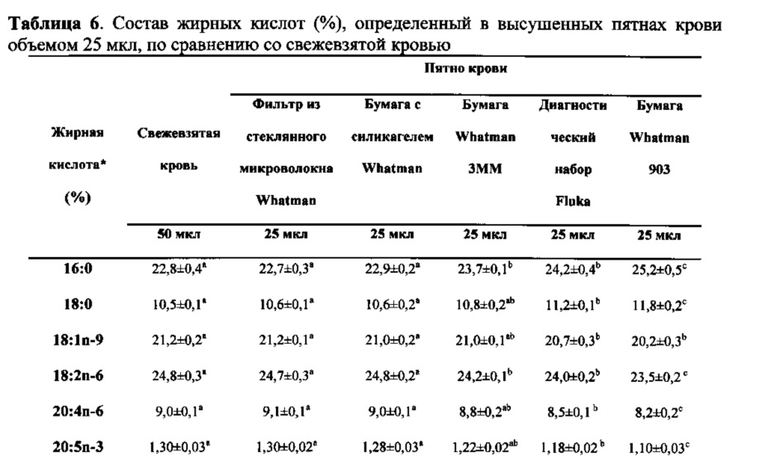

Представленные здесь результаты четко демонстрируют, что результаты анализа статуса жирных кислот из образцов пятен крови могут отличаться от таковых, полученных в результате анализа свежевзятой цельной крови. Набор для получения образцов крови Fluka и карточка для получения образцов Whatman 903 представляют собой коммерческие продукты, которые широко используют для получения образцов крови, а бумагу для хроматографии Whatman 3ММ также часто используют в качестве бумаги для получения образцов крови в клинических испытаниях. Однако, низкие объемы крови (25 мкл) на любом из этих трех типов бумаги давали сомнительные результаты статуса жирных кислот, если их использовали для прямой оценки LCPUFA в капле цельной крови. Из этих данных становится ясно, что примеси из этих разновидностей бумаги для получения образцов крови препятствуют точному определению количества жирных кислот соответствующих классов в виде доли от общего содержания липидов. Использование чистой бумаги для получения образцов для внесения поправок на примеси является допустимым для отдельного анализа состава жирных кислот. Однако варьирующее количество примесей из различных типов бумаги для получения образцов крови и возможность того, что количество примесей, присутствующих в бумаге одного типа, варьирует по всему листу или между партиями, делает нецелесообразным использование поправочного коэффициента, который основан на примесях из чистой бумаги с любой степенью достоверности, в особенности в крупномасштабных клинических испытаниях.
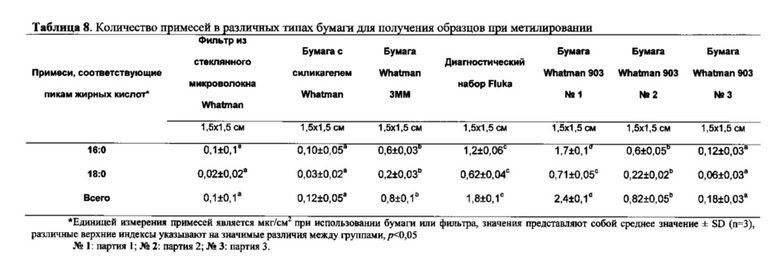
Примеси из различных разновидностей бумаги
Авторы настоящего изобретения обнаружили, что две основные примеси во всех типах бумаги для получения образцов соответствовали насыщенным жирным кислотам 16:0 и 18:0 (таблица 8). Это объясняет повышение процентного содержания насыщенных жирных кислот 16:0 и 18:0, которые выявляли в образцах пятен крови, по сравнению с таковыми в свежевзятой крови. Кроме того, общее количество примесей варьирует в различными типами бумаги для получения образцов, например, бумага с силикагелем Whatman содержала лишь 0,1 мкг/см2 примесей, тогда как некоторые партии бумаги Whatman 903 содержали приблизительно в 25 раз больше этого количества. Промывание бумаги растворителями и даже обработка бумаги с применением методики трансметилирования не удаляли примеси, что приводило к предположению, что жирные кислоты являются неотъемлемым компонентом бумаги.
При более ранних исследованиях пятен крови утверждали, что пик GC не наблюдали после обработки только бумаги для получения образцов, однако, авторы настоящего изобретения обнаружили пики, соответствующие примесям, во всех типах протестированной бумаги для получения образцов. Это может представлять собой тот случай, когда малые количества примесей в бумаге для получения образцов могут приводить к незначительному изменению результата анализа состава жирных кислот. Например, бумага с силикагелем Whatman и фильтр из стеклянного микроволокна демонстрировали одинаковый результат по отношению к составу жирных кислот по сравнению с таковым у свежевзятой крови. Однако, для тех разновидностей бумаги, которые содержат высокие количества примесей, например, бумага из диагностического набора Fluka и бумага для получения образцов Whatman 903, результаты состава жирных кислот явно отличались от таковых для свежевзятой крови, если объем отобранной крови был небольшим. Данные примеси могут представлять собой смоляные кислоты или жирные кислоты, поскольку и те, и другие присутствуют в древесине в виде либо свободных кислот, либо различных сложных эфиров, из которой в итоге получают эти разновидности бумаги. Сообщали о смолах и жирных кислотах в обработанных образцах воды, полученных на бумажной фабрике, в том числе насыщенных жирных кислотах 16:0 и 18:0. Таким образом, очевидно, что эти кислоты или их сложные эфиры могут оставаться в качестве загрязнений в конечном бумажном продукте и приводить к появлению примесей при оценке состава жирных кислот в пятнах крови, полученных на этих разновидностях бумаги.
Потенциальные примеси из других источников
В лаборатории исследовали источники примесей путем касания бумагой материалов, в том числе перчаток из латекса, нитриловых перчаток, РЕ пакетов с застежкой, пакетов из алюминиевой фольги с застежкой или пакетов из целлофана (таблица 9). Перчатки из латекса содержат значительное количество примесей, однако, практически не обнаружили загрязнения от нитриловых перчаток. Каждый из РЕ пакета и пакета из алюминиевой фольги содержал большое количество примесей, соответствующих олеиновой кислоте (18:1 n-9) и эруковой кислоте (2:1 n-9), однако, пакет из целлофана не приводил в результате к появлению какого-либо значительного загрязнения.
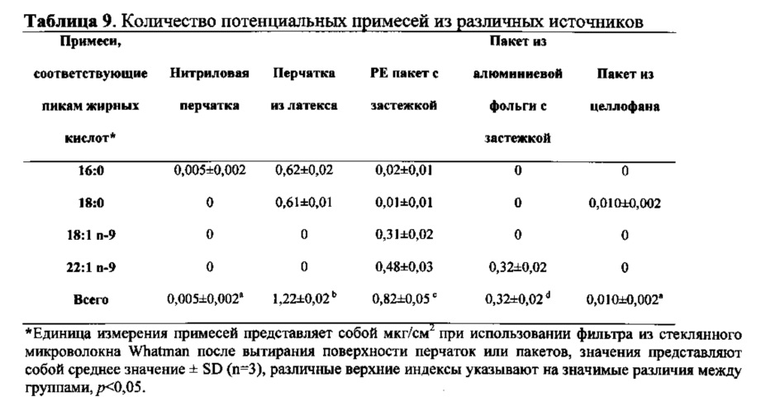
Перчатки из латекса, РЕ пакеты и пакеты из алюминиевой фольги широко используют во многих лабораториях. Ранее не проводили исследований, предметом которых являются перчатки из латекса в качестве источника загрязнения в экспериментах, при этом в существующих исследованиях сообщается лишь о том, что перчатки из латекса могут высвобождать эндотоксины, которые могут вызывать аллергию. Однако эти эксперименты указывают на то, что даже эти широко используемые лабораторные предметы характеризуются способностью к выделению гидрофобных примесей и могут способствовать изменению результатов исследований состава жирных кислот в крови, в особенности, если объем образца крови является низким. Таким образом, для сведения к минимуму возможных проблем, связанных с загрязнением от перчаток и пакетов, рекомендуется использование нитриловых перчаток и пакетов из целлофана во время получения, обработки и хранения образцов пятен крови.
В итоге, все типы бумаги для получения образцов выделяют примеси и эти примеси характеризуются способностью к изменению результатов анализов образцов высушенных пятен крови, в особенности, если объем пятна крови является низким. Поскольку либо промывание, либо трансметилирование бумаги, либо даже вычитание значения для контрольного образца не являются эффективными стратегиями для удаления примесей из бумаги, выбор бумаги для получения образцов, которая содержит минимальное количество примесей, важен для экспресс-анализа состава жирных кислот. Авторы настоящего изобретения не смогли обнаружить какие-либо существенные примеси для бумаги с силикагелем Whatman и фильтра из стеклянного микроволокна Whatman, и они показали результаты состава жирных кислот, идентичные таковым в свежевзятой крови, даже если количество крови на бумаге было низким (25 мкл). Кроме того, экспериментальные результаты, представленные в данном документе, также показывают, что использование нитриловых перчаток и пакетов из целлофана может предотвратить возможное загрязнение образцов пятен крови во время получения образцов, обработки и хранения.
Пример 5. Сравнение измерений статуса жирных кислот в пятне капиллярной крови и общепринятых измерений
У 50 субъектов отбирали как капиллярную, так и венозную кровь. Среди всех субъектов 35 изредка употребляли добавку с рыбьим жиром или, если употребляли регулярно, то лишь в малых количествах (<3 мл в день), тогда как 15 из них употребляли высокие количества добавки с рыбьим жиром (~15 мл, МАХЕРА).
Каплю капиллярной крови (30-50 мкл) абсорбировали на бумаге с силикагелем Whatman, пропитанной 2 мг/мл ВНТ и 5 мг/мл EDTA, и высушивали на воздухе в течение 5-6 ч при комнатной температуре (19-23°C). Как только образцы пятен крови высыхали, их подвергали трансэтерификации, и полученные в результате FAME анализировали при помощи GC. Из крови, полученной путем венепункции, 500 мкл цельной крови экстрагировали хлороформом/изопропанолом (2:1, объем/объем) для определения общего содержания липидов. Остальную кровь центрифугировали при 3000 об./мин в течение 10 мин при 4°C для разделения плазмы и эритроцитов (RBC). Общее содержание липидов в плазме и RBC экстрагировали с использованием хлороформа/метанола (2:1, объем/объем) или хлороформа/изопропанола (2:1, объем/объем) соответственно, а фракцию фосфолипидов отделяли от общего содержания липидов при помощи тонкослойной хроматографии. Результаты показаны в таблице 10.
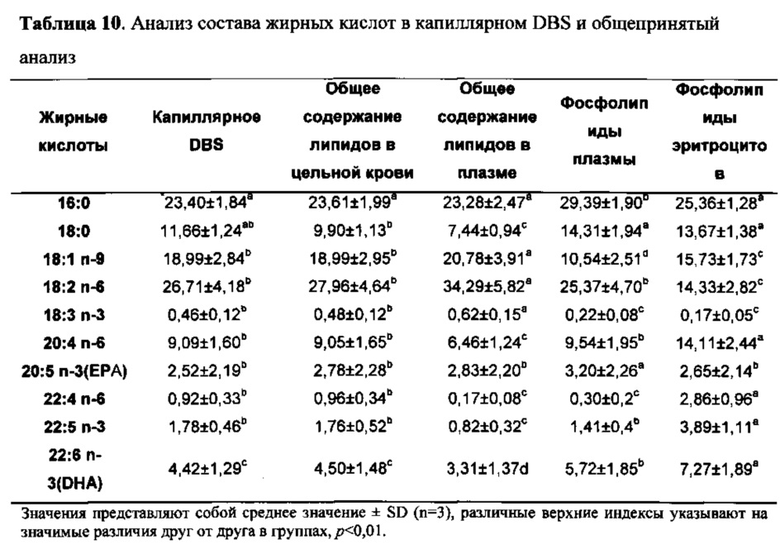
Поскольку статус жирных кислот у индивидуумов можно охарактеризовать различными способами, важным является сравнение спектра жирных кислот в высушенном пятне крови с результатами стандартных способов характеристики жирных кислот в крови. Они включают экстракт цельной крови, фосфолипиды плазмы и жирные кислоты эритроцитов. Кроме того, группы жирных кислот, такие как ЕРА+DHA (омега-3 индекс), в каждой из этих фракций крови сравнивали со сходными группами, обнаруженными в высушенных пятнах крови.
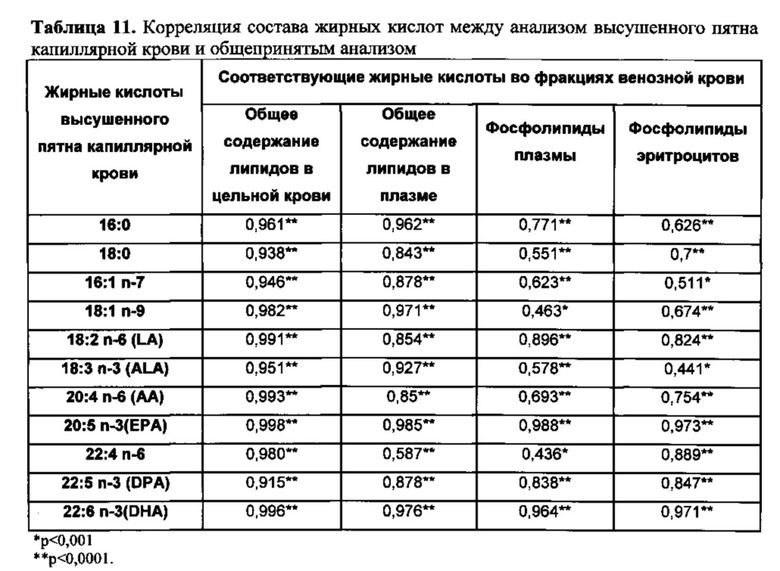
Результаты в данном документе демонстрируют, что существует высокая степень корреляции между составом жирных кислот в высушенных пятнах крови и соответствующими значениями жирных кислот, выявленных в стандартных фракциях крови (таблица 11), и это можно выразить в виде простых уравнений (см. фигуры 4-7).
Пример 6. Влияние температуры хранения на стабильность жирных кислот
Тестировали влияние температуры хранения на стабильность жирных кислот в высушенном пятне крови. Кровь помещали в виде пятна на бумагу для хроматографии с силикагелем Whatman, пропитанную 2 мг/мл ВНТ и 5 мг/мл EDTA, и высушивали на воздухе в течение 5 часов. Образцы высушенного пятна крови хранили при -20°C, 4°C и комнатной температуре (19-23°C) в пакетах из алюминиевой фольги с застежкой в присутствии влагопоглотителя. Анализировали состав жирных кислот в образцах высушенных пятен крови, как описано выше, через 5 часов, 2 недели и 4 недели. Результаты показаны ниже в таблице 12.
В целом, не обнаружены значимые различия состава жирных кислот среди образцов высушенных пятен крови, которые хранили при -20°C, 4°C и комнатной температуре (19-23°C) в течение 4 недель хранения.
Пример 7. Влияние срока хранения на твердый носитель
Тестировали влияние периода хранения на стабильность твердого носителя. Бумагу для хроматографии с силикагелем Whatman пропитывали 2 мг/мл ВНТ и 5 мг/мл EDTA и хранили в течение 1 месяца и 2 месяцев до использования. Кровь помещали в виде пятна как на хранившуюся бумагу, так и на бумагу, обработанную свежеприготовленным раствором стабилизатора (2 мг/мл ВНТ+5 мг/мл EDTA). Пятна крови высушивали на воздухе в течение 5 часов, а затем хранили при комнатной температуре (19-23°C) в пакетах из алюминиевой фольги с застежкой в присутствии влагопоглотителя. Анализировали состав жирных кислот в образцах высушенных пятен крови, как описано выше, через 5 часов, 2 недели и 4 недели. Результаты показаны ниже в таблице 13 и на фиг. 8.
В целом, результаты демонстрируют, что твердые носители, которые предварительно подготовили за 2 месяца до использования, характеризуются такой же эффективностью при стабилизации LCPUFA, как и свежеподготовленные твердые носители. Несмотря на то, что в этом примере срок хранения исследовали в течение 2 месяцев, данные результаты четко указывают на возможность того, что предварительно подготовленные твердые носители могут иметь более длительный срок хранения.
Источники информации
1. W.C. Tu, et al. 2010. Omega-3 long chain fatty acid synthesis is regulated more by substrate levels than gene expression. Prostaglandins, Leukotrienes and Essential Fatty Acids, 83, 61-68.
2. Min, Y.J., et al. 2011. Effect of storage temperature and length on fatty acid composition of fingertip blood collected on filter paper. Prostaglandins, Leukotrienes and Essential Fatty Acids, 84, 13-18.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ТРАНСДЕРМАЛЬНОЙ ТЕРАПЕВТИЧЕСКОЙ СИСТЕМЫ, СОДЕРЖАЩАЯ АЛПРАЗОЛАМ | 2018 |
|
RU2694232C1 |
| КОМПОЗИЦИИ НА ОСНОВЕ ЧАСТИЧНО ФТОРИРОВАННЫХ АЛКАНОВ, СОДЕРЖАЩИЕ ЭТИЛОВЫЕ ЭФИРЫ ОМЕГА-3 ЖИРНЫХ КИСЛОТ | 2019 |
|
RU2808451C2 |
| ПЕРОРАЛЬНАЯ КОМПОЗИЦИЯ С ЭФФЕКТОМ, НАПРАВЛЕННЫМ ПРОТИВ СТАРЕНИЯ КОЖИ | 2010 |
|
RU2533277C2 |
| СОХРАНЕНИЕ ДОКОЗАГЕКСАЕНОВОЙ КИСЛОТЫ (DHA) В ПРОЦЕССЕ ПЕРЕРАБОТКИ КАНОЛЫ | 2012 |
|
RU2621555C2 |
| КОМПОЗИЦИИ КОРМА ДЛЯ ДОМАШНИХ ЖИВОТНЫХ | 2016 |
|
RU2727670C1 |
| ПРИМЕНЕНИЕ ОМЕГА-3 ЖИРНЫХ КИСЛОТ ПРИ ЛЕЧЕНИИ ОСТЕОАРТРИТА У ПСОВЫХ | 2004 |
|
RU2422140C2 |
| СПОСОБ ОБНАРУЖЕНИЯ НАЛИЧИЯ МИКРООРГАНИЗМОВ В БИОЛОГИЧЕСКОМ ОБРАЗЦЕ | 2007 |
|
RU2435865C2 |
| АНТИБАКТЕРИАЛЬНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СЛОЖНЫЙ ЭФИР БЕНЗОЙНОЙ КИСЛОТЫ, И СПОСОБЫ ПОДАВЛЕНИЯ БАКТЕРИАЛЬНОГО РОСТА ПОСРЕДСТВОМ ЕЕ ПРИМЕНЕНИЯ | 2017 |
|
RU2729079C1 |
| ПЕРОРАЛЬНАЯ КОМПОЗИЦИЯ С ЭФФЕКТОМ, НАПРАВЛЕННЫМ ПРОТИВ СТАРЕНИЯ КОЖИ | 2007 |
|
RU2434642C2 |
| РАПАМИЦИН ДЛЯ ЛЕЧЕНИЯ ЛИМФАНГИОЛЕЙОМИОМАТОЗА | 2014 |
|
RU2707285C2 |




Настоящее изобретение относится к способу стабилизации жирных кислот, присутствующих в образце, таком как биологические жидкости (например, кровь, слюна, грудное молоко, моча, сперма, плазма и сыворотка крови), причем способ предусматривает нанесение жирных кислот или образца, содержащего жирные кислоты, на твердый носитель, который содержит твердую подложку, по меньшей мере одно хелатообразующее средство и по меньшей мере один антиоксидант, где твердая подложка содержит менее 2 мкг/см2 примесей, где примеси представляют собой одно или более соединений, выбранных из группы, состоящей из насыщенных жирных кислот, сложных эфиров насыщенных жирных кислот, смоляных кислот и сложных эфиров смоляных кислот. Настоящее изобретение дополнительно относится к способу определения состава жирных кислот в образце при хранении на таком носителе. причем способ предусматривает: (a) нанесение образца на твердый носитель, содержащий твердую подложку, по меньшей мере одно хелатообразующее средство и по меньшей мере один антиоксидант, где твердая подложка содержит менее 2 мкг/см2 примесей, в результате чего образец становится сорбированным на твердой подложке; (b) определение состава жирных кислот в образце, сорбированном на твердой подложке, где примеси представляют собой одно или более соединений, выбранных из группы, состоящей из насыщенных жирных кислот, сложных эфиров насыщенных жирных кислот, смоляных кислот и сложных эфиров смоляных кислот. Также изобретение относится к твердому носителю и способу его получения. 5 н. и 69 з.п. ф-лы, 8 ил., 13 табл.
1. Способ стабилизации жирных кислот, причем способ предусматривает нанесение жирных кислот или образца, содержащего жирные кислоты, на твердый носитель, который содержит твердую подложку, по меньшей мере одно хелатообразующее средство и по меньшей мере один антиоксидант, где твердая подложка содержит менее 2 мкг/см2 примесей, где примеси представляют собой одно или более соединений, выбранных из группы, состоящей из насыщенных жирных кислот, сложных эфиров насыщенных жирных кислот, смоляных кислот и сложных эфиров смоляных кислот.
2. Способ по п. 1, где твердая подложка содержит менее 1 мкг/см2 примесей.
3. Способ по п. 2, где твердая подложка содержит менее 0,5 мкг/см2 примесей.
4. Способ по любому из пп. 1-3, где примеси представляют собой насыщенные жирные кислоты.
5. Способ по любому из пп. 1-3, где твердая подложка выбрана из группы, состоящей из следующего: бумага, подложка на стеклянной основе, подложка на бумажной основе, подложка на целлюлозной основе, гидрофильные полимеры, политетрафторэтилен, стекловолокно и пористая керамика.
6. Способ по любому из пп. 1-3, где твердая подложка выбрана из группы, состоящей из следующего: бумага, подложка на бумажной основе и подложка на стеклянной основе.
7. Способ по любому из пп. 1-3, где твердая подложка представляет собой бумагу с нанесенным силикагелем.
8. Способ по любому из пп. 1-3, где твердая подложка представляет собой фильтр из стеклянного микроволокна.
9. Способ по любому из пп. 1-3, где образец представляет собой биологический образец.
10. Способ по п. 9, где биологический образец представляет собой биологическую жидкость.
11. Способ по п. 10, где биологическая жидкость выбрана из группы, состоящей из следующего: кровь, слюна, грудное молоко, моча, сперма, плазма и сыворотка крови.
12. Способ по п. 11, где биологическая жидкость представляет собой кровь.
13. Способ по любому из пп. 1-3, 10-12, где по меньшей мере одно хелатообразующее средство представляет собой этилендиаминтетрауксусную кислоту, аскорбиновую кислоту, или их соли, или лимонную кислоту или ее соли.
14. Способ по любому из пп. 1-3, 10-12, где по меньшей мере один антиоксидант представляет собой бутилгидрокситолуол, бутилгидроксианизол или трет-бутилгидрохинон.
15. Способ по любому из пп. 1-3, 10-12, где хелатообразующее средство представляет собой аскорбиновую кислоту и/или этилендиаминтетрауксусную кислоту, а антиоксидант представляет собой бутилгидрокситолуол.
16. Способ по любому из пп. 1-3, 10-12, где жирные кислоты представляют собой ненасыщенные жирные кислоты.
17. Способ по любому из пп. 1-3, 10-12, где твердый носитель представлен в виде полосы.
18. Способ по п. 17, где полоса имеет размеры 1 см × 3 см.
19. Способ по любому из пп. 1-3, 10-12, 18, где антиоксидант (антиоксиданты) присутствует на твердом носителе в количестве от 0,01 мг до 1 мг.
20. Способ по любому из пп. 1-3, 10-12, 18, где хелатообразующее средство (средства) присутствует на твердом носителе в количестве от 0,01 мг до 1 мг.
21. Способ стабилизации жирных кислот по п. 1, причем способ предусматривает нанесение жирных кислот или жидкости, содержащей жирные кислоты, на твердый носитель, содержащий фильтр из стеклянного микроволокна или бумагу с нанесенным силикагелем, этилендиаминтетрауксусную кислоту, и/или аскорбиновую кислоту, и бутилгидрокситолуол.
22. Способ определения состава жирных кислот в образце, содержащем жирные кислоты, причем способ предусматривает:
(a) нанесение образца на твердый носитель, содержащий твердую подложку, по меньшей мере одно хелатообразующее средство и по меньшей мере один антиоксидант, где твердая подложка содержит менее 2 мкг/см2 примесей, в результате чего образец становится сорбированным на твердой подложке;
(b) определение состава жирных кислот в образце, сорбированном на твердой подложке,
где примеси представляют собой одно или более соединений, выбранных из группы, состоящей из насыщенных жирных кислот, сложных эфиров насыщенных жирных кислот, смоляных кислот и сложных эфиров смоляных кислот.
23. Способ по п. 22, где твердая подложка содержит менее 1 мкг/см2 примесей.
24. Способ по п. 22, где твердая подложка содержит менее 0,5 мкг/см2 примесей.
25. Способ по любому из пп. 22-24, где примеси представляют собой насыщенные жирные кислоты.
26. Способ по любому из пп. 22-24, где твердая подложка выбрана из группы, состоящей из следующего: бумага, подложка на стеклянной основе, подложка на бумажной основе, подложка на целлюлозной основе, гидрофильные полимеры, политетрафторэтилен, стекловолокно и пористая керамика.
27. Способ по любому из пп. 22-24, где твердая подложка выбрана из группы, состоящей из следующего: бумага, подложка на бумажной основе и подложка на стеклянной основе.
28. Способ по любому из пп. 22-24, где твердая подложка представляет собой бумагу с нанесенным силикагелем.
29. Способ по любому из пп. 22-24, где твердая подложка представляет собой фильтр из стеклянного микроволокна.
30. Способ по любому из пп. 22-24, где образец представляет собой биологический образец.
31. Способ по п. 30, где биологический образец представляет собой биологическую жидкость.
32. Способ по п. 31, где биологическая жидкость выбрана из группы, состоящей из следующего: кровь, слюна, грудное молоко, моча, сперма, плазма и сыворотка крови.
33. Способ по п. 32, где биологическая жидкость представляет собой кровь.
34. Способ по любому из пп. 22-24, 31-33, где по меньшей мере одно хелатообразующее средство представляет собой этилендиаминтетрауксусную кислоту, аскорбиновую кислоту, или их соли, или лимонную кислоту или ее соли.
35. Способ по любому из пп. 22-24, 31-33, где по меньшей мере один антиоксидант представляет собой бутилгидрокситолуол, бутилгидроксианизол или трет-бутилгидрохинон.
36. Способ по любому из пп. 22-24, 31-33, где хелатообразующее средство представляет собой аскорбиновую кислоту и/или этилендиаминтетрауксусную кислоту, а антиоксидант представляет собой бутилгидрокситолуол.
37. Способ по любому из пп. 22-24, 31-33, где этап (b) предусматривает:
(i) экстрагирование по меньшей мере части образца, сорбированного на твердой подложке, для обеспечения экстракта, содержащего дериватизированные жирные кислоты;
(ii) определение состава жирных кислот в образце исходя из количеств дериватизированных жирных кислот.
38. Твердый носитель для стабилизации жирных кислот и/или определения состава жирных кислот в образце, причем указанный носитель содержит твердую подложку, по меньшей мере одно хелатообразующее средство и по меньшей мере один антиоксидант, где твердая подложка содержит менее 2 мкг/см2 примесей, где примеси представляют собой одно или более соединений, выбранных из группы, состоящей из насыщенных жирных кислот, сложных эфиров насыщенных жирных кислот, смоляных кислот и сложных эфиров смоляных кислот.
39. Твердый носитель по п. 38, где твердая подложка содержит менее 1 мкг/см2 примесей.
40. Твердый носитель по п. 39, где твердая подложка содержит менее 0,5 мкг/см2 примесей.
41. Твердый носитель по любому из пп. 38-40, где примеси представляют собой насыщенные жирные кислоты.
42. Твердый носитель по любому из пп. 38-40, где твердая подложка выбрана из группы, состоящей из следующего: бумага, подложка на стеклянной основе, подложка на бумажной основе, подложка на целлюлозной основе, гидрофильные полимеры, политетрафторэтилен, стекловолокно и пористая керамика.
43. Твердый носитель по любому из пп. 38-40, где твердая подложка выбрана из группы, состоящей из следующего: бумага, подложка на бумажной основе и подложка на стеклянной основе.
44. Твердый носитель по любому из пп. 38-40, где твердая подложка представляет собой бумагу с нанесенным силикагелем.
45. Твердый носитель по любому из пп. 38-40, где твердая подложка представляет собой фильтр из стеклянного микроволокна.
46. Твердый носитель по любому из пп. 38-40, где по меньшей мере одно хелатообразующее средство представляет собой этилендиаминтетрауксусную кислоту, аскорбиновую кислоту, или их соли, или лимонную кислоту, или ее соли.
47. Твердый носитель по любому из пп. 38-40, где по меньшей мере один антиоксидант представляет собой бутилгидрокситолуол, бутилгидроксианизол или трет-бутилгидрохинон.
48. Твердый носитель по любому из пп. 38-40, где хелатообразующее средство представляет собой аскорбиновую кислоту и/или этилендиаминтетрауксусную кислоту, а антиоксидант представляет собой бутилгидрокситолуол.
49. Твердый носитель по любому из пп. 38-40, где твердый носитель представлен в виде полосы.
50. Твердый носитель по п. 49, где полоса имеет размеры 1 см × 3 см.
51. Твердый носитель по любому из пп. 38-40, 50, где антиоксидант (антиоксиданты) присутствует на твердом носителе в количестве от 0,01 мг до 1 мг.
52. Твердый носитель по любому из пп. 38-40, 50, где хелатообразующее средство(средства) присутствует на твердом носителе в количестве от 0,01 мг до 1 мг.
53. Твердый носитель по п. 38, причем указанный носитель содержит фильтр из стеклянного микроволокна или бумагу с нанесенным силикагелем, этилендиаминтетрауксусную кислоту, и/или аскорбиновую кислоту, и бутилгидрокситолуол.
54. Способ получения твердого носителя, содержащего твердую подложку, по меньшей мере одно хелатообразующее средство и по меньшей мере один антиоксидант, причем указанный способ предусматривает обеспечение твердого носителя, содержащего твердую подложку, и нанесение на твердый носитель по меньшей мере одного хелатообразующего средства и по меньшей мере одного антиоксиданта, где твердая подложка содержит менее 2 мкг/см2 примесей, где примеси представляют собой одно или более соединений, выбранных из группы, состоящей из насыщенных жирных кислот, сложных эфиров насыщенных жирных кислот, смоляных кислот и сложных эфиров смоляных кислот.
55. Способ по п. 54, где твердая подложка содержит менее 1 мкг/см2 примесей.
56. Способ по п. 55, где твердая подложка содержит менее 0,5 мкг/см2 примесей.
57. Способ по любому из пп. 54-56, где примеси представляют собой насыщенные жирные кислоты.
58. Способ по любому из пп. 54-56, где твердая подложка выбрана из группы, состоящей из следующего: бумага, подложка на стеклянной основе, подложка на бумажной основе, подложка на целлюлозной основе, гидрофильные полимеры, политетрафторэтилен, стекловолокно и пористая керамика.
59. Способ по любому из пп. 54-56, где твердая подложка выбрана из группы, состоящей из следующего: бумага, подложка на бумажной основе и подложка на стеклянной основе.
60. Способ по любому из пп. 54-56, где твердая подложка представляет собой бумагу с нанесенным силикагелем.
61. Способ по любому из пп. 54-56, где твердая подложка представляет собой фильтр из стеклянного микроволокна.
62. Способ по любому из пп. 54-56, где по меньшей мере одно хелатообразующее средство представляет собой этилендиаминтетрауксусную кислоту, аскорбиновую кислоту, или их соли, или лимонную кислоту или ее соли.
63. Способ по любому из пп. 54-56, где по меньшей мере один антиоксидант представляет собой бутилгидрокситолуол, бутилгидроксианизол или трет-бутилгидрохинон.
64. Способ по любому из пп. 54-56, где хелатообразующее средство представляет собой аскорбиновую кислоту и/или этилендиаминтетрауксусную кислоту, а антиоксидант представляет собой бутилгидрокситолуол.
65. Способ по любому из пп. 54-56, где по меньшей мере один антиоксидант и по меньшей мере одно хелатообразующее средство наносят на твердый носитель в виде одного раствора или отдельных растворов, одного раствора, содержащего по меньшей мере один антиоксидант, и одного раствора, содержащего по меньшей мере одно хелатообразующее средство.
66. Способ по п. 65, где раствор (растворы) содержат спирт и воду.
67. Способ по п. 65, где концентрация по меньшей мере одного антиоксиданта в растворе составляет от 0,1 мг/мл до 10 мг/мл.
68. Способ по п. 65, где концентрация по меньшей мере одного хелатообразующего средства в растворе составляет от 1 мг/мл до 10 мг/мл.
69. Способ по любому из пп. 54-56, 66-68, где твердый носитель представлен в виде полосы.
70. Способ по п. 65, где количество раствора, нанесенного на полосу, составляет от 1 до 500 мкл.
71. Способ по п. 69, где полоса имеет размеры 1 см × 3 см.
72. Набор для определения состава жирных кислот в образце, содержащий твердый носитель по любому из пп. 38-53, и инструкции для его применения.
73. Набор по п. 72, который дополнительно содержит острый предмет для получения образца, содержащего жирные кислоты, от субъекта.
74. Набор по п. 73, где образец представляет собой кровь.
| WO 2005116081, 07.03.2007 | |||
| WO 2011073236, 23.06.2011. |
Авторы
Даты
2017-12-21—Публикация
2013-01-11—Подача