ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[01] Настоящее изобретение относится к способам и фармацевтическим композициям, содержащим рапамицин, которые предназначены для доставки в легкие, предпочтительно путем ингаляции, в целях профилактики и лечения лимфангиолейомиоматоза.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[02] Лимфангиолейомиоматоз (ЛАМ) представляет собой мультисистемное заболевание, поражающее от 30 до 40% женщин с туберозным склерозным комплексом (TSC), часто является смертельным заболеванием и характеризуется обширной пролиферацией аномальных клеток с аберрантным ростом в легких, сходных с гладкомышечными клетками. Пролиферация этих клеток (называемых ЛАМ-клетками) приводит к тому, что в легких образуются кисты, а в аксиальных лимфатических сосудах образуются наполненные жидкостью кистозные структуры (называемые лимфангиолейомиомами). В результате возникает прогрессирующая кистозная деструкция легочной паренхимы, обструкция лимфатических сосудов, дыхательных путей и прогрессирующая дыхательная недостаточность. Дополнительно, ЛАМ-клетки могут образовывать опухоли. Обычно это медленно растущие гамартомы, называемые ангиомиолипомами. Ангиомиолипомы в почках могут быть причиной почечной недостаточности у больных ЛАМ. Аномальная пролиферация ЛАМ-клеток обусловлена, по меньшей мере, частично, инактивирующей мутацией в одном из генов опухолевой супрессии, TSC1 или TSC2, в туберозном склерозном комплексе. Гены TSC являются отрицательными регуляторами мишени рапамицина млекопитающих (mTOR). Путь mTOR представляет собой важную контрольную точку для клеточного роста, метаболизма и выживания клеток. В результате инактивации генов TSC ЛАМ-клетки осуществляют конститутивную активацию mTOR и многих других киназ в пути mTOR, включая Akt и S6K.
[03] Лимфангиолейомиоматоз обычно возникает у женщин детородного возраста, хотя может также наблюдаться у мужчин. Более всего ЛАМ распространен среди женщин, имеющих туберозный склерозный комплекс (TSC), но, вместе с тем, ЛАМ может также возникать у людей без клинических проявлений TSC, а также у людей, не имеющих зародышевых мутаций в генах-супрессорах TSC1 или TSC2. Эти случаи называют спорадическим ЛАМ. Таким образом, ЛАМ может протекать в спорадической, не-наследуемой форме, а также в ассоциации с туберозным склерозным комплексом.
[04] Хотя прогрессирование ЛАМ может происходить медленно, в конечном счете он приводит к дыхательной недостаточности и смерти. Через десять лет после появления симптомов нарушение дыхания наблюдалось у 55% больных, 20% больных получали кислород и 10% больных умерли. См., например, Johnson et al. 2004 Thorax. Survival and disease progression in UK patients with lymphangioleiomyomatosis. В настоящее время не существует одобренного лекарственного средства для лечения или профилактики ЛАМ. Основные варианты лечения включают применение пероральной формы рапамицина вне зарегистрированных показаний (сиролимус, который одобрен FDA (Управлением по контролю за продуктами питания и лекарственными средствами США) для профилактики отторжения органов и трансплантации почек, см. ниже), или применение пероральной формы эверолимуса вне зарегистрированных показаний.
[05] Рапамицин представляет собой макроциклический триеновый антибиотик, продуцируемый Streptomyces hygroscopicus. См., например, патент США № 3929992. Рапамицин является ингибитором mTOR. Иммунодепрессивные и противовоспалительные свойства рапамицина первоначально обозначили его применение в области трансплантации и при лечении аутоиммунных заболеваний. Например, известно его применение для предотвращения образования гуморальных (IgE-подобных) антител в ответ на аллергическую стимуляцию альбумином, для ингибирования активации Т-клеток у мышей и для продления периода выживания трансплантированных органов у гистонесовместимых грызунов. В моделях аутоиммунных заболеваний у грызунов рапамицин подавляет иммуно-опосредованные события, связанные с системной красной волчанкой, коллаген-индуцированным артритом, аутоиммунным сахарным диабетом I типа, аутоиммунным миокардитом, экспериментальным аллергическим энцефаломиелитом, болезнью трансплантат против хозяина и аутоиммунным увеоретинитом.
[06] Рапамицин также имеет международное непатентованное название "сиролимус" (см., например, заявку на сокращенную процедуру регистрации препарата ANDA № 201578, Dr. Reddys Labs Ltd., одобренную 28 мая 2013г.). Сиролимус одобрен FDA и зарегистрирован для продажи в Соединенных Штатах Америки для профилактики отторжения органов и трансплантации почек под торговым названием Рапамун (Rapamune) от компании Wyeth (Pfizer). Поставляется в форме раствора для приема внутрь (1 мг/мл) или таблеток (в различных дозировках). Компания Wyeth (Pfizer) также зарегистрировала для продажи его производное для внутривенного введения под торговым названием Торисел (Torisel, темсиролимус), предназначенный для лечения распространенной почечно-клеточной карциномы. Темсиролимус представляет собой водорастворимое пролекарство сиролимуса. Подразделение Cordis компании Johnson&Johnson зарегистрировало для продажи выделяющий сиролимус коронарный стент под торговым наименованием Cypher. В этом случае антипролиферативное действие сиролимуса предотвращает рестеноз коронарных артерий после баллонной ангиопластики. В патенте US 2010/0305150 авторов Berg et al. (Novartis) описаны производные рапамицина для лечения и профилактики нейрокожных расстройств, например, обусловленных TSC, включающих туберозный склероз, а также расстройств, обусловленных нейрофиброматозом 1 типа (NF-1). Рапамицин и его производные дополнительно описаны в публикации Nishimura, T. et al. (2001) Am. J. Respir. Crit. Care Med. 163: 498-502 и в патентах США №№ US 6384046 и US 6258823.
[07] Применение рапамицина в клинически одобренных случаях имеет ряд известных побочных эффектов, включающих легочную токсичность (в инструкции для Рапамуна имеется предупреждение, что он не предназначен для пациентов, перенесших трансплантацию легких), повышенный риск развития рака и сходные с диабетом симптомы. Рапамицин связан с возникновением легочной токсичности, обычно в виде интерстициального пневмонита, но также отмечены случаи легочного альвеолярного протеиноза. См., например, публикации Nocera et al., Sirolimus Therapy in Liver Transplant Patients: An Initial Experience at a Single Center, Transplantation Proceedings (2008), 40(6), 1950-1952; Perez et al., Interstitial Pneumonitis Associated With Sirolimus in Liver Transplantation: A Case Report, Transplantation Proceedings (2007), 39(10), 3498-3499; Hashemi-Sadraei et al., Sirolimus-associated diffuse alveolar hemorrhage in a renal transplant recipient on long-term anticoagulation, Clinical Nephrology (2007), 68(4), 238-244; Pedroso et al., Pulmonary alveolar proteinosis - a rare pulmonary toxicity of sirolimus, Transplant International (2007), 20(3), 291-296. Причины рапамицин-индуцированной легочной токсичности не известны.
[08] Также выявлены тяжелые респираторные побочные эффекты, связанные с применением сиролимуса в качестве противоопухолевой терапии при продолжительном введении, в результате чего уровень его концентрации в циркулирующей в крови становится выше 1 нг/мл. Например, в отчете 2009 года была зафиксирована легочная токсичность пролекарства сиролимуса, темсиролимуса, и отмечено, что "интерстициальная болезнь легких является редким побочным эффектом применения темсиролимуса у больных раком почки". Aparicio et al., Clinical & Translational Oncology (2009), 11(8), 499-510; Vahid et al., Pulmonary complications of novel antineoplastic agents for solid tumors, Chest (2008) 133:528-538. Дополнительно, согласно проведенному в 2012 году мета-анализу, сделан вывод, что у 10% онкологических больных, которым вводили темсиролимус или эверолимус, может проявляться умеренная токсичность с ухудшением качества жизни и, в некоторых случаях лечение прерывается. См. See Iacovelli et al., Incidence and risk of pulmonary toxicity in patients treated with mTOR inhibitors for malignancy. A meta-analysis of published trials, Acta oncologica (2012), 51(7), 873-879. Кроме того, проведенные на крысах фармакологические исследования безопасности темсиролимуса показали снижение частоты дыхания, а также инфильтрацию альвеолярными макрофагами и воспаление в легких (см. Фармакологический обзор по темсиролимусу, NDA 22088 (Заявка на одобрение нового лекарственного средства), доступна на сайте FDA США). Указанные побочные эффекты наблюдались в условиях относительно высоких концентраций этого лекарственного препарата в объеме циркулирующей крови в результате системного введения.
[09] Несмотря на возможную токсичность для легких, пероральное введение рапамицина демонстрирует предварительные перспективы его применения в качестве потенциального лекарства против ЛАМ. См. New Eng. J. Medicine 364: 1595-1606 (2011) и публикации Hammes and Krymskaya, Horm. Cancer 4(2):70-7 (2013); см. также Ando et al. Respir Investig. 51(3):175-8 (2013) “The efficacy and safety of low-dose sirolimus for treatment of lymphangioleiomyomatosis”. Вместе с тем, клинические данные также указывают на недостатки рапамицина в этом контексте и необходимость в усовершенствованных лекарственных препаратах и терапевтических схемах для лечения ЛАМ. Основными недостатками рапамицина являются необходимость постоянного применения этого препарата, и самое главное состоит в связи рапамицина с другими побочными действиями (в дополнение к потенциальной легочной токсичности). Например, в 24-месячном нерандомизированном открытом исследовании, проведенном с участием 20 пациентов, была изучена способность вводимого перорально сиролимуса уменьшать ангиомиолипомы, представляющие собой медленно растущие гамартомы, которые могут приводить к почечной недостаточности у пациентов с TSC или спорадическим ЛАМ. Bissler et al. (2008) Sirolimus for angiomyolipoma in tuberous sclerosis complex or lymphangioleiomyomatosis. N. Engl. J. Med. 358(2):140-151. В этом исследовании наблюдался "некоторый" регресс ангиомиолипом в течение периода лечения, но при этом выявлена тенденция к их увеличению после прекращения лечения. Тяжелые побочные эффекты, связанные с сиролимусом, представляли собой диарею, пневмонию, пиелонефрит, целлюлит (от укуса животного), стоматит и кровоизлияние из почечной ангиомиолипомы. Дозировки определялись исходя из желательных уровней в сыворотке крови, в целях профилактики реакции отторжения у пациентов после трансплантации почек, при этом дозы варьировались от 1 до 15 нг/мл (уровень сиролимуса в крови). В другом аналогичном исследовании (фаза 2, нерандомизированное открытое исследование) участвовали 16 пациентов с TSC или спорадическим ЛАМ, которые перорально принимали сиролимус в течение до двух лет. Davies et al (2011) Sirolimus therapy for angiomyolipoma in tuberous sclerosis and sporadic lymphangioleiomyomatosis: a phase 2 trial. Clin Cancer Res 17(12):4071-4081. В этом исследовании устойчивые уровни концентрации сиролимуса в крови составляли от 3 до 10 нг/мл, при этом более чем у половины пациентов поддерживался функциональный уровень от 3 до 6 нг/мл. При лечении сиролимусом наблюдался устойчивый регресс почечных ангиомиолипом. Вместе с тем, по мере продолжения лечения сохранялась реакция опухоли на лечение, но вместе с тем, в течение второго года лечения наблюдалось незначительное дополнительное сморщивание. Побочные действия, связанные с сиролимусом, включали мукозит полости рта, респираторные инфекции и протеинурию. В другом исследовании с участием 10 пациентов с подтвержденным прогрессированием ЛАМ, введение сиролимуса было прекращено у 3 пациентов по причине тяжелой рецидивирующей инфекции нижних дыхательных путей или сиролимус-индуцированного пневмонита. Neurohr et al., Is sirolimus a therapeutic option for patients with progressive pulmonary lymphangioleiomyomatosis? Respiratory Research (2011), 12:66. В этом исследовании было показано, что "сиролимус может рассматриваться в качестве варианта лечения у больных с быстрым ухудшением ЛАМ", но было отмечено, что его "введение может быть связано с тяжелыми побочными действиями на дыхательную систему, требующими прекращения лечения у некоторых больных" и что "прекращение введения сиролимуса является обязательным перед трансплантацией легких". И, наконец, было проведено 12-месячное рандомизированное двойное слепое клиническое исследование с участием 89 пациентов, при этом диагноз ЛАМ был у 46 пациентов, и период последующего наблюдения составил 12 месяцев. McCormack et al. (2011) Efficacy and safety of sirolimus in lymphangioleiomyomatosis. N. Engl. J. Med. 364:1595-1606. У пациентов поддерживался уровень сиролимуса в крови от 5 до 15 нг/мл. В этом исследовании при введении сиролимуса стабилизировалась функция легких, снижался уровень фактора роста эндотелия сосудов VEGF-D в сыворотке крови и выявлена связь такого лечения с уменьшением симптомов и улучшением качества жизни. Но для стабилизации легочной функции требуется непрерывное лечение. Важно отметить, что во всех упомянутых клинических исследованиях использовались пероральные формы сиролимуса. Это объясняется тем, что успешность применения аэрозольной формы рапамицина для доставки непосредственно в легкие считается крайне маловероятной, с точки зрения известной легочной токсичности рапамицина, примеры которой приведены в вышеупомянутых публикациях.
[10] В заявке на патент США автора Lehrer, опубликованной в 2013 году, отражено мнение, что "рапамицин (сиролимус) не может безопасно вводиться ингаляционным путем по причине его широко подтвержденной легочной токсичности, интерстициального пневмонита". См. патент США 20130004436, со ссылкой на Chhajed et al. (2006) 73: 367-374. Патентная заявка Lehrer относится к композициям и способам для лечения и профилактики рака легких и лимфангиолейомиоматоза. Хотя некоторые более ранние публикации, такие как патент США № 5080899 Sturm et al. ( поданный в феврале 1991 года) и патент США № 5635161 (поданный в июне 1995 года), содержат некоторые общие описания рапамицина в форме для доставки ингаляционным путем, и такие общие описания не были подкреплены какими-либо доказательствами и созданы до многочисленных сообщений о случаях рапамицин-индуцированной легочной токсичности, выявленной после его более широкого распространения в качестве предназначенного для трансплантации иммунодепрессанта и в качестве предназначенного для противоракового применения ингибитора пролиферации клеток, о чем свидетельствуют вышеупомянутые публикации.
[11] В патенте WO 2011/163600 описана аэрозольная композиция такролимуса, который, как и рапамицин, относится к макролиду лактону. Но такролимус имеет химические отличия от сиролимуса, и молекулярной мишенью такролимуса является кальциневрин, а не mTOR, и в отличие от рапамицина, такролимус не проявляет легочной токсичности и действительно показан для предотвращения отторжения после трансплантаций легких.
[12] В связи с общим признанием потенциальной рапамицин-индуцированной легочной токсичности, фармацевтическая композиция, содержащая рапамицин для доставки в легкие при лечении ЛАМ, не считается практически применимым вариантом лечения людей.
[13] Доставка лекарств в легкие путем ингаляции является важным способом лечения различных состояний, включающих такие распространенные локальные состояния, как кистозный фиброз, пневмония, бронхиальная астма и хроническая обструктивная болезнь легких, некоторых системных заболеваний, включающих иммунодефицит, эритропоэз, диабет, рак легких, применение для заместительной гормональной терапии, контроля боли и т.д. См. публикации Yi et al. J. Aerosol Med. Pulm. Drug Deliv. 23:181-7 (2010). Средства, показанные для лечения рака легких путем ингаляции, включают цисплатин, карбоплатин, таксаны и антрациклины. См., например, патенты США №№ 6419900, 6419901, 6451784, 6793912 и опубликованные заявки на патент США №№ US 2003/0059375 и US 2004/0039047. Дополнительно, для лечения метастаз легкого были предложены доксорубицин и темозоломид в форме для ингаляционного введения. См., например, патент США № 7288243 и опубликованную заявку на патент США № 2008/0008662.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1: Результаты жидкостной хроматографии с тандемной масс-спектрометрической детекцией (LC-MS/MS) рапамицина в крови мышей в концентрации 10,6 нг/мл (вверху) и внутреннего стандарта (IS) (внизу).
Фигура 2: Репрезентативные хроматограммы рапамицина легочном гомогенате мышей в концентрации 10,6 нг/мл (вверху) и внутреннего стандарта IS (внизу).
Фигура 3: Калибровочная кривая для рапамицина в крови мышей.
Фигура 4: Калибровочная кривая для рапамицина в легочном гомогенате мышей.
Фигура 5: Репрезентативные хроматограммы рапамицина (вверху) и внутреннего стандарта IS (внизу) в крови от мыши 2-07 после введения рапамицина путем орофарингеальной аспирации (ОФА).
Фигура 6: Репрезентативные хроматограммы рапамицина (вверху) и внутреннего стандарта IS (внизу) в гомогенате легких от мыши 2-07 после введения рапамицина путем ОФА.
Фигура 7: Фосфорилирование S6 в легочных клетках мыши после введения рапамицина с помощью ОФА и пероральным путем.
Фигура 8: Прогнозируемые показатели концентрации рапамицина в крови при легочном введении, которое осуществляется ежедневно один раз в день.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[14] Настоящее изобретение частично основано на открытии удивительных фармакокинетических свойств рапамицина при его доставке непосредственно в легкие, в исследованиях на животных. Неожиданно было обнаружено, что введение рапамицина непосредственно в легкие создает более высокую концентрацию этого препарата в легочной ткани по сравнению с концентрацией в крови. В этом состоит отличие от прогнозируемой фармакокинетики, поскольку лекарственные препараты на основе высоколипофильных малых молекул, такие как рапамицин, обычно быстро диффундируют из легких в кровеносную систему, а затем равномерно перераспределяются в пределах объема распределения. Кроме того, этот препарат сохраняется в легких при концентрациях, достаточно высоких для наличия терапевтического эффекта. И, наконец, прямое введение в легкие также не вызывает какой-либо острой или хронической токсичности в дыхательных путях, что представляет собой еще один неожиданный результат в плане связи рапамицина с легочной токсичностью, в частности, в виде интерстициального пневмонита.
[15] Согласно изобретению, существует потребность в фармацевтических композициях рапамицина, его пролекарствах, производных и аналогах, которые доставляются непосредственно в легкие, предпочтительно путем ингаляции, для достижения эффективного местного лечения и профилактики заболеваний и расстройств, обусловленных сигнальным путем мишени рапамицина (TOR). Такое локализованное лечение уменьшает или устраняет токсичность и побочные эффекты, в том числе эффекты, которые связаны с повышенной концентрацией рапамицина в крови, в результате системной доставки этого лекарственного препарата. Целью настоящего изобретения является удовлетворение этой потребности.
[16] Настоящее изобретение относится к композициям рапамицина для доставки непосредственно в легкие, в которых обеспечено количество рапамицина, эффективное для ингибирования сигнального пути mTOR в легких, при отсутствии токсичности или с низкой токсичностью для легочной ткани, и в результате чего уровень в крови рапамицина составляет менее чем приблизительно 1 нг/мл. Предполагается, что композиции по изобретению будут иметь улучшенный профиль безопасности, особенно в плане их хронического или длительного применения, по сравнению с существующими лекарственными формами рапамицина, которые создают устойчивую концентрацию в крови в диапазоне от 1 нг/мл до 15 нг/мл. Это предположение обусловлено низкой легочной токсичностью композиций по изобретению в сочетании с вероятностью отсутствия или значительного уменьшения побочных эффектов от системного воздействия рапамицина из-за достижения очень низких уровней в крови рапамицина. Таким образом, ожидается, что в композициях по настоящему изобретению будет показан более высокий уровень терапевтического индекса по сравнению с существующими лекарственными формами с внутривенной доставкой или доставкой через желудочно-кишечный тракт.
[17] Настоящее изобретение относится к композициям и способам для лечения и профилактики ЛАМ с помощью фармацевтической композиции, содержащей рапамицин, которая разработана для доставки в легкие, предпочтительно путем ингаляции. В одном варианте осуществления настоящее изобретение относится к способу лечения и профилактики ЛАМ у человека, нуждающегося в таком лечении, при этом указанный способ содержит введение субъекту аэрозольной композиции, содержащей рапамицин (также известный под названием сиролимус), или его пролекарство или его производное. Композиции по настоящему изобретению могут быть использованы по отдельности или в комбинации с одним или несколькими дополнительными лекарственными средствами или терапевтическими схемами для лечения ЛАМ. Дополнительно, композиции по настоящему изобретению могут содержать рапамицин, или его пролекарство или его производное в качестве единственного терапевтического вещества в композиции, или рапамицин может быть приготовлен в рецептуре с одним или несколькими дополнительными терапевтическими веществами в монолитной лекарственной форме.
[18] Таким образом, настоящее изобретение относится к фармацевтической сухой порошковой композиции, предназначенной для доставки в легкие, которая содержит некоторое количество микрочастиц лекарственного препарата, частицы носителя и один или несколько необязательных наполнителей, для применения в лечении лимфангиолейомиоматоза у человека, при этом препарат выбран из рапамицина, или его пролекарства или его производного.
[19] В одном варианте осуществления количество лекарственного препарата в композиции составляет от 50 до 500 микрограмм, от 50 до 250 микрограммов или от 50 до 150 микрограмм.
[20] В одном варианте осуществления лекарственный препарат представляет собой рапамицин. В одном варианте осуществления лекарственный препарат выбран из группы, состоящей из эверолимуса, темсиролимуса, ридафоролимуса, умиролимуса и зотаролимуса.
[21] В одном варианте осуществления микрочастицы состоят из частиц лекарственного препарата, имеющих средние диаметры приблизительно от 0,1 до 10 мкм или приблизительно от 1 до 5 микрон. В одном варианте осуществления средний диаметр частицы составляет приблизительно от 1,5 до 4 мкм, приблизительно от 1,5 до 3,5 микрон или приблизительно от 2 до 3 микрон.
[22] Носитель может быть выбран из группы, состоящей из арабинозы, глюкозы, фруктозы, рибозы, маннозы, сахарозы, трегалозы, лактозы, мальтозы, крахмалов, декстрана, маннита, лизина, лейцина, изолейцина, дипальмитилфосфатидилхолина, лецитина, полимолочной кислоты, поли(молочной-со-глутаминовой) кислоты и ксилита, и смеси любых из вышеуказанных веществ. В одном варианте осуществления изобретения носитель содержит или состоит из смеси двух разных носителей. Частицы носителя могут иметь диаметр в пределах от до 200 микрон, от 30 до 100 мкм или менее 10 мкм. Если носитель состоит из смеси двух разных носителей, каждый носитель состоит из частиц с разным диапазоном размеров, измеренных в виде среднего диаметра частиц. В одном варианте осуществления носитель состоит из смеси двух разных носителей, именуемых первым носителем и вторым носителем. Первый носитель состоит из частиц, имеющих диаметр в диапазоне приблизительно от 30 до 100 микрон, и второй носитель состоит из частиц, имеющих диаметр менее 10 микрон. Соотношение двух разных носителей находится в диапазоне от 3:97 до 97:3. В одном варианте осуществления носитель состоит из смеси двух разных лактозных носителей.
[23] Соотношение лекарственного препарата и носителя в порошке может составлять от 0,5% до 2% (вес./вес.). В одном варианте осуществления соотношение лекарственного препарата и носителя в порошке составляет 1% (вес./вес.).
[24] Количество лекарственного препарата в композиции может составлять приблизительно от 0,5% до 20% (вес./вес.) в пересчете на общий вес композиции. В одном варианте осуществления количество лекарственного препарата составляет приблизительно от 1% до 2% (вес./вес.).
[25] В одном варианте осуществления в композиции присутствует один или несколько необязательных наполнителей, выбранных из фосфолипидов и металлической соли жирной кислоты, и из смеси указанных выше веществ. В одном варианте осуществления фосфолипид выбран из дипальмитилфосфатидилхолина и лецитина. В одном варианте осуществления солью металла жирной кислоты является стеарат магния. В одном варианте осуществления наполнитель или наполнители нанесены на частицы носителя в весовом соотношении носитель : крупная частица носителя в пределах от 0,01 до 0,5%.
[26] В одном варианте осуществления количество лекарственного препарата в композиции представляет собой количество, эффективное для ингибирования биологической активности mTORC1. В одном варианте осуществления количество лекарственного препарата представляет собой количество, эффективное для ингибирования фосфорилирования белка S6K. В одном варианте осуществления количество лекарственного препарата представляет собой количество, эффективное для достижения возможной для вдыхания дозы от 5 до 400 мкг с доставкой в легкие. В одном варианте осуществления вдыхаемая доза составляет приблизительно 10, приблизительно 50, приблизительно 100 или приблизительно 250 мкг. В одном варианте осуществления количество лекарственного препарата представляет собой количество, эффективное для достижения минимального уровня в крови у субъекта, составляющего менее 5 нг/мл, менее 2 нг/мл, менее 1 нг/мл, менее 0,5 нг/мл или менее 0,25 нг/мл. В одном варианте осуществления минимальный уровень в крови составляет менее 1 нг/мл, менее 0,5 нг/мл или менее 0,25 нг/мл. В одном варианте осуществления количество лекарственного препарата представляет собой количество, эффективное для получения концентрации лекарственного препарата в легочной ткани от 1 нг/г до 1 микрограмм (мкг)/г. В одном варианте осуществления концентрация лекарственного препарата в легочной ткани составляет приблизительно 10 нг/г, приблизительно 25 нг/г, приблизительно 50 нг/г, приблизительно 100 нг/г или приблизительно 200 нг/г. В одном варианте осуществления в легких сохраняется терапевтический уровень лекарственного препарата, составляющий приблизительно 1 нг/г, приблизительно 10 нг/г, приблизительно 25 нг/г, приблизительно 50 нг/г или приблизительно 100 нг/г в течение определенного периода времени после введения субъекту, предпочтительно человеку, и этот период времени выбран из периодов приблизительно от 6 до 10 часов, приблизительно от 6 до 14 часов, приблизительно от 6 до 24 часов и приблизительно от 6 до 72 часов. В одном варианте осуществления выбран период времени, составляющий приблизительно 10 часов, приблизительно 14 часов, приблизительно 24 часа и приблизительно 72 часа.
[27] В одном варианте осуществления композиция содержит фракцию мелкодисперсных частиц (FPF), превышающую 20%, при этом подходящая доза мелкодисперсных частиц (FPD) варьируется в диапазоне от 10 мкг до 2 мг, предпочтительно составляет менее 0,5 мг, в течение последующего периода хранения от 1 до 12 месяцев или от 1 до 36 месяцев. В одном варианте осуществления доза, доставляемая пациенту, которая называется доставляемой дозой (DD), или выделяемой дозой (ED), находится в диапазоне от 25 мкг до 2,5 мг, предпочтительно менее 0,5 мг.
[28] В одном варианте осуществления композиция дополнительно содержит одно или несколько дополнительных терапевтических веществ. Одно или несколько дополнительных терапевтических веществ могут быть выбраны из антагониста эстрогена (например, летрозол, тамоксифен), статина (например, симвастатин), ингибитора Src (например, саракатиниб) и ингибитора рецептора VEGF (например, пазопаниб). В одном варианте осуществления одно или несколько дополнительных терапевтических веществ выбраны из летрозола, тамоксифена, симвастатина, саракатиниба, пазопаниба и иматиниба.
[29] В одном варианте осуществления композиция доставляет количество лекарственного препарата, эффективного для улучшения функции легких субъекта, которую измеряют по форсированной жизненной емкости легких (ФЖЕЛ) и объему форсированного выдоха (ОФВ1). В одном варианте осуществления композиция доставляет количество лекарственного препарата, эффективного для уменьшения размера или количества плеврального выпота, выявленного посредством рентгенографического обследования.
[30] В одном варианте осуществления композиция подобрана для введения один раз в день.
[31] В одном варианте осуществления композиция получена способом мокрого шлифования, содержащего следующие этапы: получение водной суспензии лекарственного препарата, воздействие на суспензию препарата микрофлюидизацией и распылительная сушка полученных частиц для образования сухого порошка.
[32] В одном варианте осуществления лекарственный препарат представляет собой рапамицин, носитель состоит из смеси двух разных лактозных носителей, первый носитель состоит из частиц со средним диаметром в диапазоне приблизительно от 30 до 100 мкм, и второй носитель состоит из частиц со средним диаметром менее 10 мкм, при этом соотношение двух разных носителей составляет приблизительно от 97:3 до 3:97, и количество рапамицина составляет от 25 до 1400 мкг.
[33] Настоящее изобретение также относится к стандартной лекарственной форме для лечения лимфангиолейомиоматоза, содержащей композицию по любому из п.п.1-31, в которой количество лекарственного препарата составляет приблизительно от 15 до 2500 микрограммов, от 25 до 250 микрограммов или от 50 до 150 микрограммов. В одном варианте осуществления количество лекарственного препарата составляет приблизительно от 50 до 250 мкг. В одном варианте осуществления лекарственная форма представляет собой капсулу, подходящую для использования в ингаляторе сухого порошка (DPI). В одном варианте осуществления капсула содержит от 1 мг до 100 мг порошка или от 10 мг или 40 мг порошка. Капсула может представлять собой желатиновую, пластиковую или целлюлозную капсулу, или быть в виде блистера фольга/фольга или фольга/пластик, подходящего для использования в устройстве DPI.
[34] Настоящее изобретение также относится к фармацевтической упаковке или набору, содержащему описанные в изобретении композицию или единичную лекарственную форму, и инструкции по применению.
[35] Настоящее изобретение также относится к устройству для доставки сухого порошка, содержащему резервуар, в котором содержится композиция или единичная лекарственная форма, описанная в настоящем изобретении. Резервуар может представлять собой встроенную камеру внутри такого устройства, капсулу или блистер. В одном варианте осуществления устройство выбрано из следующих моделей: Plastiape® RS01 модель 7, Plastiape® RS00 модель 8, XCaps®, Handihaler®, Flowcaps® TwinCaps® и Aerolizer®.
[36] Настоящее изобретение также относится к способу лечения лимфангиолейомиоматоза у нуждающегося в таком лечении субъекта - человека, и указанный способ содержит введение человеку путем ингаляции композиции или единичной лекарственной формы, описанной в изобретении.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[37] Настоящее изобретение относится к способам и композициям для лечения и профилактики ЛАМ у субъекта - человека, нуждающегося в таком лечении. Человек, нуждающийся в таком лечении, является человеком с диагностированным ЛАМ. В одном варианте осуществления человек является женщиной. В одном варианте осуществления человек является мужчиной. В одном варианте осуществления у человека диагностирован туберозный склерозный комплекс. В одном варианте осуществления у человека диагностирован спорадический ЛАМ. В одном варианте осуществления способы содержат введение субъекту путем ингаляции композиции, содержащей рапамицин в подходящем носителе, и, необязательно, одно или несколько дополнительных веществ. Термин "рапамицин" используется в общем смысле в данном изобретении для обозначения непосредственно рапамицина, также упоминаемого как сиролимус, а также его пролекарств (таких как темсиролимус) и их производных. Производные рапамицина включают соединения, которые структурно подобны рапамицину, относятся к тому же химическому классу, являются аналогами рапамицина или представляют собой фармацевтически приемлемые соли рапамицина или его производных. Более подробное описание и примеры рапамицина, его пролекарств и производных представлены в следующем разделе.
[38] Композиции, описанные в изобретении, представляют собой композиции, которые могут быть в виде аэрозоля, для получения вдыхаемых частиц или капель, содержащих рапамицин или его пролекарство или его производное (в совокупности именуемых "лекарственным препаратом"). В одном варианте осуществления лекарственный препарат выбран из сиролимуса, эверолимуса и темсиролимуса. В одном варианте осуществления лекарственный препарат представляет собой сиролимус. Композиции могут содержать лекарственный препарат, носитель и, необязательно, одну или несколько добавок. Композиции могут быть в виде водного раствора, сухого порошка или в смеси одного или нескольких фармацевтически приемлемых пропеллентов и носителя, как это подробно описано ниже в разделе под названием "Композиции для ингаляции".
[39] Настоящее изобретение также относится к способам лечения и профилактики ЛАМ у нуждающегося в таком лечении субъекта - человека, и указанные способы содержат этап введения композиции по изобретению в легкие субъекта. В одном варианте осуществления вводимая доза рапамицина достаточна для достижения минимального уровня лекарственного препарата в крови субъекта от 0,01 до 0,15 нг/мл, от 0,075 до 0,350 нг/мл, от 0,150 до 0,750 нг/мл, от 0,750 до 1,5 нг/мл или от 1,5 до 5 нг/мл. В одном варианте осуществления вводимая доза рапамицина достаточна для достижения минимального уровня лекарственного препарата в крови субъекта менее 5 нг/мл, менее 2 нг/мл, менее 1 нг/мл или менее 0,5 нг/мл. В одном варианте осуществления вводимая доза рапамицина достаточна для достижения концентрации рапамицина в легочной ткани в диапазоне от 1 нг/г до 1 мкг/г. В предпочтительном варианте осуществления вышеуказанные терапевтические уровни рапамицина достигаются путем введения описанной в изобретении композиции один раз в день, и предпочтительно, общая суточная доза рапамицина, вводимая субъекту, составляет менее 2 мг или менее 1 мг в день. Другие аспекты легочной доставки и дозирования, в том числе комбинированных лекарственных средств, описаны ниже в разделе под названием "Легочное введение и дозировка".
[40] Способы и композиции по настоящему изобретению являются эффективными для лечения ЛАМ у субъекта, нуждающегося в таком лечении, предпочтительно, у человека. Количество лекарственного препарата, эффективного для лечения ЛАМ ("эффективное количество" или "терапевтически эффективное количество") относится к количеству лекарственного препарата (например, рапамицина), которое является достаточным, чтобы уменьшить или облегчить прогрессирование, степень тяжести и/или продолжительность ЛАМ или одного или нескольких симптомов ЛАМ, чтобы предотвратить ухудшение ЛАМ, вызвать регрессию ЛАМ или предотвратить развитие или возникновение одного или нескольких симптомов, связанных с ЛАМ, или усилить или улучшить профилактический или терапевтический эффект (эффекты) другого лекарственного средства (например, профилактического или терапевтического средства) в отношении к степени тяжести или возникновению одного или нескольких симптомов ЛАМ, или в отношении развития или прогрессирования ЛАМ. В конкретных вариантах осуществления, в плане лечения ЛАМ, терапевтически эффективное количество относится к количеству лекарственного препарата (например, терапевтического средства), которое ингибирует или уменьшает пролиферацию ЛАМ-клеток, ингибирует или уменьшает распространение ЛАМ-клеток (метастазирование), или уменьшает размер опухоли, или улучшает показатели ФЖЕЛ или ОФВ1, или уменьшает количество плеврального выпота, обнаруживаемого с помощью рентгенографического обследования. В предпочтительном варианте осуществления изобретения терапевтически эффективное количество лекарственного средства (например, терапевтического средства) снижает пролиферацию ЛАМ-клеток или размер опухоли по меньшей мере на 5%, предпочтительно по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по сравнению с контролем (например, с фосфатно-буферным солевым раствором ("ФБР")). Таким образом, в контексте способов по настоящему изобретению, термины "лечить" и "лечение" относятся к уменьшению степени тяжести, продолжительности или прогрессирования ЛАМ или одного или нескольких симптомов, связанных с ЛАМ. В конкретных вариантах осуществления эти термины могут относиться к ингибированию пролиферации или к уменьшению пролиферации ЛАМ-клеток, к ингибированию или уменьшению распространения (метастазирования) ЛАМ-клеток или развития или прогрессирования ЛАМ-ассоциированного рака, или к сокращению размера ЛАМ-ассоциированной опухоли, или к уменьшению или вовлечению аксиальных лимфатических сосудов.
[41] В одном варианте осуществления способов по изобретению рапамицин вводят в дозе, эффективной для улучшения функции легких субъекта, измеренной по форсированной жизненной емкости легких (ФЖЕЛ) и объему форсированного выдоха (ОФВ1). В другом варианте осуществления рапамицин вводят в дозе, эффективной для уменьшения размера или количества плеврального выпота у субъекта, обнаруживаемого с помощью рентгенографического обследования. В одном варианте осуществления рапамицин вводят в дозе, эффективной для улучшения одного или нескольких из следующих показателей: функциональной остаточной емкости, сывороточного VEGF-D, качества жизни и функциональной работоспособности, расстояния при ходьбе за 6 минут и диффузионной емкости легких для окиси углерода. В одном варианте осуществления уровень в крови рапамицина, доставляемого легочным путем, достигает эффективных показателей для ограничения роста ЛАМ-ассоциированных опухолей в легких и в удаленных от легких локализациях. В одном варианте осуществления эффективность введенной дозы рапамицина измеряют с помощью какого-либо одного или нескольких из перечисленных выше способов.
[42] В некоторых вариантах осуществления способы по изобретению являются эффективными для контроля ЛАМ у субъекта, имеющего ЛАМ. В этом контексте термины "контроль" и "контролировать" относятся к полезным эффектам, которые субъект получает от лечения, не приводящего к выздоровлению. В одном варианте осуществления у субъекта контролируется ЛАМ, если его прогрессирование замедляется или прекращается во время лечения рапамицином в соответствии со способами по настоящему изобретению. В другом варианте осуществления у субъекта контролируется ЛАМ, если один или несколько симптомов, связанных с ЛАМ, улучшается или стабилизируется (т.е. симптом не ухудшается в течение курса лечения).
[43] В одном варианте осуществления способы по изобретению предназначены для субъектов, "нечувствительных" или "рефрактерных" к доступному в настоящее время лечению ЛАМ. В этом контексте термины "нечувствительный" и "рефрактерный" относятся к реакции субъекта на лечение, которая не является клинически адекватной для облегчения одного или нескольких симптомов, связанных с ЛАМ. Термины "субъект" и "пациент" используются взаимозаменяемо в данном раскрытии изобретения. Эти термины относятся к животному, предпочтительно к млекопитающему, включая не-приматов (например, корова, свинья, лошадь, кошка, собака, крыса, мышь) и приматов (например, шимпанзе, обезьяны, такие как обезьяны Сynomolgous и человек), и более предпочтительно, эти термины относятся к человеку. В предпочтительном варианте осуществления субъектом является человек.
[44] Термины "предотвратить", "предотвращение" и "профилактика" относятся к предотвращению рецидивов, развития, прогрессирования или наступления одного или нескольких симптомов ЛАМ в результате введения одного или нескольких соединений, определенных в соответствии со способами по изобретению, или введения комбинации такого соединения и известного лекарственного средства против заболевания или расстройства.
[45] В контексте фармацевтических композиций по изобретению "носитель" относится, например, к жидкому или твердому материалу, такому как растворитель, разбавитель, стабилизатор, адъювант, наполнитель, вспомогательное вещество, пропеллент или вещество для транспорта, с помощью которого создается рецептура рапамицина для доставки.
Примеры фармацевтически приемлемых носителей для использования в композициях по изобретению включают без ограничения сухие порошковые носители, такие как лактоза, манноза, аминокислоты, циклодекстрин, дипальмитилфосфатидилхолин, углеводородные и фторуглеродные пропелленты, сжатые газы, стерильные жидкости, вода, буферный солевой раствор, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п.), масла, детергенты, суспендирующие вещества, углеводы (например, глюкоза, лактоза, сахароза или декстран), антиоксиданты (например, аскорбиновая кислота или глутатион), хелатирующие вещества, низкомолекулярные белки или их подходящие смеси. Носитель для аэрозольных сухих порошковых композиций рапамицина, при его наличии, предпочтительно выбран из группы, состоящей из сахаридов и сахарного спирта. В одном варианте осуществления носителем, при его наличии, является лактоза.
[46] Термин "фармацевтически приемлемый" указывает на одобрение регулирующим органом федерального правительства или правительства штата, или включение в перечень фармакопеи США или других общепризнанных фармакопей, таких как Европейская фармакопея, для применения у животных, и более конкретно, у людей. Один из способов солюбилизации лекарств, плохо растворимых в воде или нерастворимых в воде, заключается в образовании соли этого лекарства или получении пролекарства, которое имеет более высокую растворимость само по себе или которое может быть использовано для получения водорастворимой соль пролекарства. Способы образования солей и фармацевтически приемлемых солевых форм известны в данной области и включают без ограничения соли кислотных или основных групп, которые могут присутствовать в представляющем интерес лекарстве или пролекарстве. Соединения, которые являются основными по своей природе, способны образовывать большое разнообразие солей с различными неорганическими и органическими кислотами. Кислоты, которые могут быть использованы для получения фармацевтически приемлемых кислотно-аддитивных солей таких основных соединений, представляют собой кислоты, которые образуют нетоксичные кислотно-аддитивные соли, то есть соли, содержащие фармакологически приемлемые анионы, включающие без ограничения соли серной, лимонной, малеиновой, уксусной, щавелевой кислот, гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, p-толуолсульфонат и памоат (то есть, 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)). Соединения, которые являются кислотными по своей природе, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или соли щелочноземельных металлов и, в частности, соли кальция, магния, лития, натрия, цинка, калия и железа.
[47] В одном варианте осуществления в способах и композициях по изобретению используется водорастворимое пролекарство или производное рапамицина, предпочтительно темсиролимус или родственное соединение. В одном варианте осуществления в способах и композициях по изобретению используется рапамицин (сиролимус).
Рапамицин
[48] Рапамицин представляет собой макроциклический лактон, продуцируемый Streptomyces hygroscopicus. Его химическое название (IUPAC) представляет собой (3S, 6R, 7E, 9R, 10R, 12R, 14S, 15E, 17E, 19E, 21S, 23S, 26R, 27R, 34aS)-9,10,12,13,-14,21,22,23,24,25,26,27,32,33,34,34a-гексадекагидро-9,27-дигидрокси-3 -[(1R)-2-[(1S,3R,4R)-4-гидрокси-3-метоксициклогексил]-1-метилэтил]-10,21-диметокс-y-6,8,12,14,20,26-гексаметил-23,27-эпокси-3Н-пиридо [2,1-c][1,4]оксаазациклогентриаконтин-1,5,11,28,29(4H,6H,31H)-пентон.
[49] Это соединение имеет молекулярную формулу C51H79NO13, его молекулярная масса составляет 914,172 г/моль. Его структура представлена ниже.
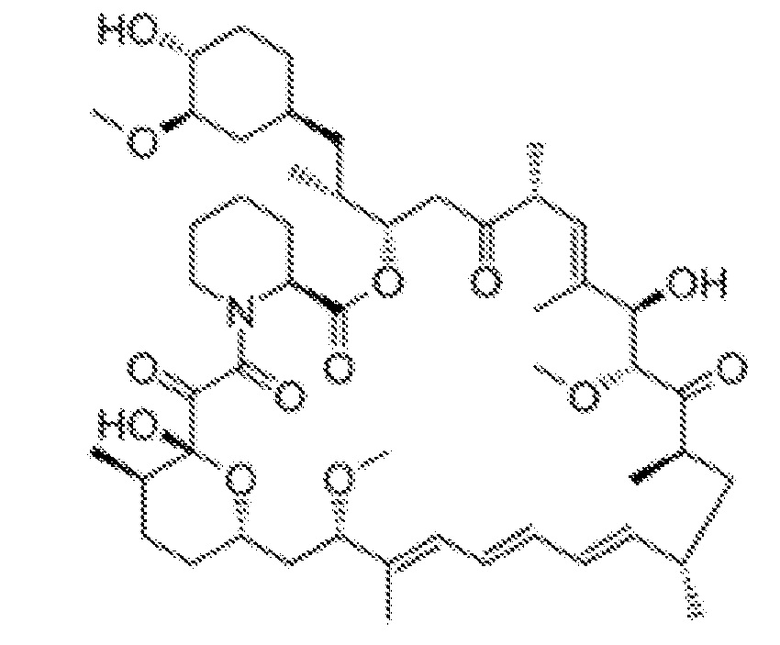
[50] Рапамицин представляет собой порошок, имеющий цвет от белого до почти белого, и считается нерастворимым в воде, имея очень низкую растворимость только 2,6 мкг/мл. Рапамицин свободно растворяется в бензиловом спирте, хлороформе, ацетоне и ацетонитриле. Нерастворимость рапамицина в воде представляет особые технические проблемы при создании его рецептур. При изготовлении рапамицина в виде пероральной лекарственной формы его готовят как пероральный раствор в виде твердой дисперсии (WO 97/03654) и в виде таблетки, содержащей наноразмерные (менее 400 нм) частицы (US 5989591). Но эти способы имеют недостатки в виде существенной вариабельности в плане растворения активного вещества и, следовательно, его биодоступности. В другом способе создания рецептуры используется кристаллический порошок. Согласно известным в данной области способам, превращение кристаллической формы лекарственного препарата с низкой растворимостью в его аморфную форму может значительно увеличивать его растворимость. Это также верно в отношении рапамицина, но, вместе с тем, его аморфная форма чрезвычайно химически нестабильна. Фармацевтические лекарственные формы, содержащие аморфный рапамицин (сиролимус), описаны в патентах WO 06/039237 и WO 06/094507 (композиция с модифицированным высвобождением, содержащая сиролимус и глицерилмоностеарат в концентрации 49,25%). Усовершенствованная стабильная пероральная лекарственная форма рапамицина описана в патенте США 8053444. В этой лекарственной форме используется сложный эфир жирной кислоты и полимер (например, поливинилпирролидон (ПВП), гидроксипропилцеллюлоза (ГПЦ) или гидроксипропилметилцеллюлоза (ГПМЦ)) в композиции для повышения стабильности сиролимуса без отрицательного влияния на его скорость высвобождения. Согласно патенту США 8053444, сложный эфир жирной кислоты в концентрации более 10% вес./вес. подавляет скорость высвобождения сиролимуса из композиции, в этой связи этого следует избегать, поскольку в результате может происходить недостаточная абсорбция из желудочно-кишечного тракта. Предпочтительная концентрация сложного эфира жирной кислоты (сложный эфир глицерина) составляет от 1% до 5% или от 5% до 9%. В одном варианте осуществления аэрозольные композиции рапамицина по настоящему изобретению не содержат сложный эфир жирной кислоты в комбинации с полимером. В одном варианте осуществления аэрозольные композиции рапамицина по настоящему изобретению содержат сложный эфир жирной кислоты в концентрации, превышающей 10% или более 12%, в пересчете на вес композиции.
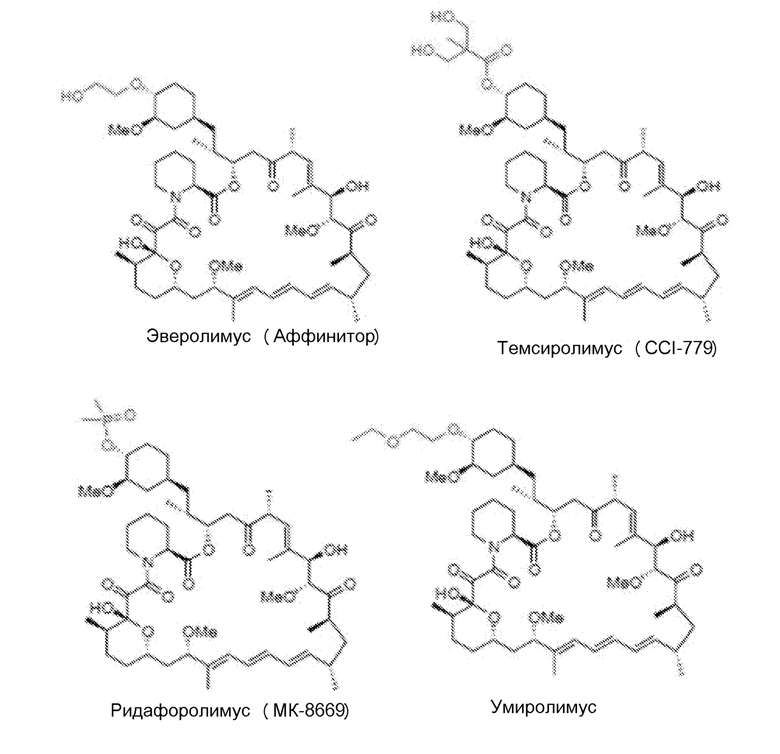
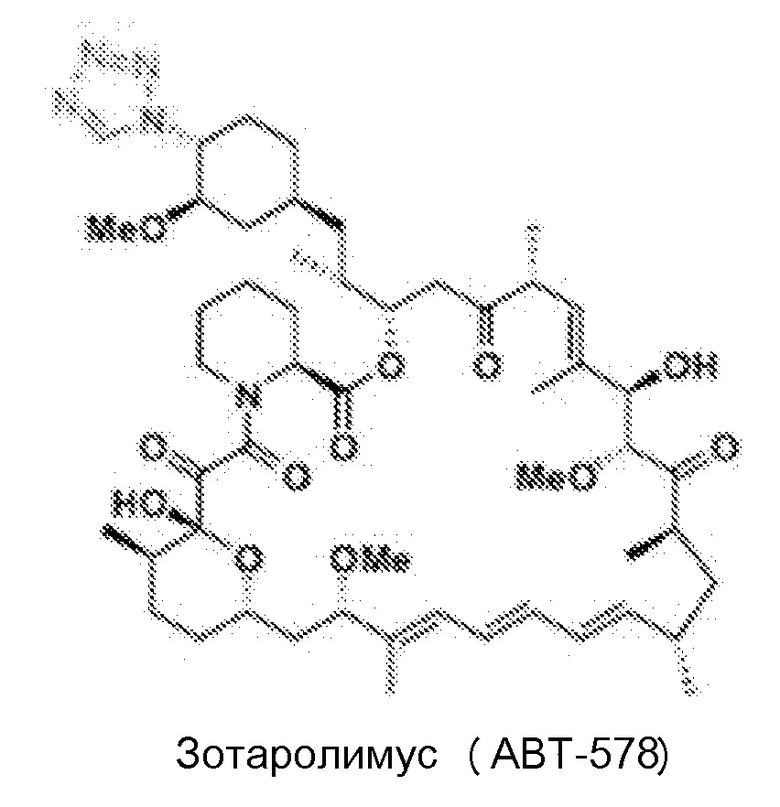
[51] Рапамицин и его производные (включая аналоги) и пролекарства, пригодные для применения в композициях и способах по изобретению, включают рапамицин (сиролимус) и их пролекарства или производные, которые являются ингибиторами клеточного сигнального пути mTOR, и предпочтительно ингибиторами непосредственно mTOR. В одном варианте осуществления производное или пролекарство рапамицина является ингибитором mTOR, выбранным из группы, состоящей из следующего: эверолимус (Affinitor/Аффинитор; RAD001), темсиролимус (CCI-779), ридафоролимус (ранее известный как дефоролимус; АР23573), умиролимус (Biolimus/Биолимус A9), зотаролимус (ABT-578), новолимус, миолимус, AP23841, KU-0063794, INK-128, EX2044, EX3855, EX7518, AZD08055 и OSI027. Другие производные известны специалисту в данной области и включают в себя, например, О-замещенное производное, в котором гидроксильная группа в циклогексильном кольце сиролимуса заменяется на -OR1, при этом R1 необязательно является замещенным алкилом, ациламиноалкилом или аминоалкилом.
[52] В одном варианте осуществления соединение для использования в аэрозольных композициях и способах по изобретению представляет собой производное рапамицина, выбранное из группы, состоящей из эверолимуса, темсиролимуса, ридафоролимуса, умиролимуса и зотаролимуса. Химические структуры эверолимуса, темсиролимуса, ридафоролимуса, умиролимуса и зотаролимуса приведены ниже.
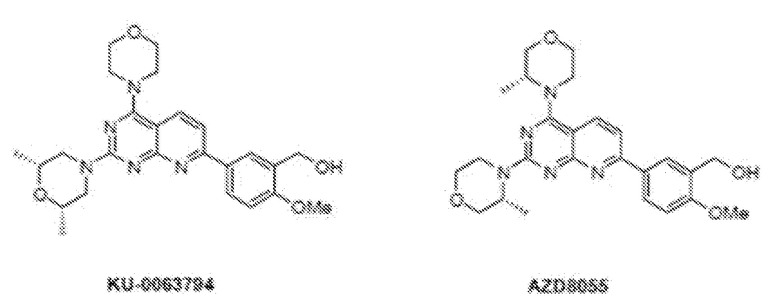
[53] В одном варианте осуществления соединение для использования в аэрозольных композициях и способах по настоящему изобретению представляет собой ингибитор mTOR, выбранный из группы, состоящей из KU-0063794, AZD8055, INK128 и ВОС-027. Химические структуры ингибиторов mTOR KU-0063794, AZD8055, INK128 и ВОС-027 приведены ниже.
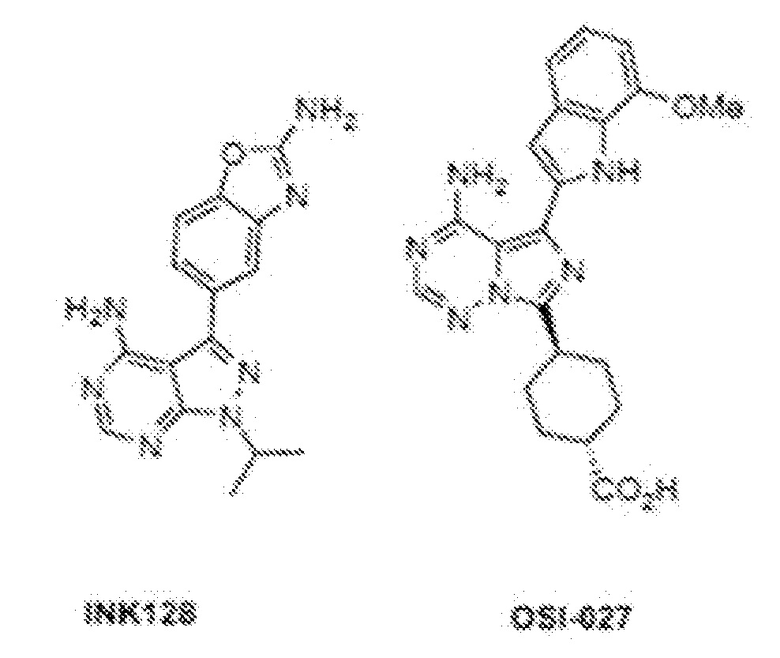
[54] Особенно предпочтительными для использования в способах и композициях по настоящему изобретению являются сиролимус, темсиролимус и эверолимус. В одном варианте осуществления соединение для использования в аэрозольных композициях и способах по изобретению выбрано из группы, состоящей из сиролимуса, темсиролимуса и эверолимуса. В одном варианте осуществления соединение представляет собой сиролимус или эверолимус.
Композиции для ингаляции
[55] Настоящее изобретение относится к приспособленным для введения путем ингаляции фармацевтическим композициям, содержащим рапамицин или его пролекарство или его производное, в виде водного раствора, сухого порошка или в смеси одного или нескольких фармацевтически приемлемых пропеллентов и носителя. В одном варианте осуществления рапамицин инкапсулирован в фармацевтически приемлемом соединении, материале или матрице. В одном варианте осуществления рапамицин инкапсулирован в липосомной композиции или в нелипосомной композиции.
[56] Композиции по настоящему изобретению представляют собой композиции рапамицина, которые могут быть в аэрозольной форме и подходят для легочной доставки лекарственного препарата субъекту-человеку путем ингаляции. Термин "аэрозоль" используется в данном контексте для обозначения коллоидной системы, в которой дисперсная фаза состоит из твердых или жидких частиц, и дисперсионная среда представляет собой газ. В одном варианте осуществления газом является воздух, и композиция представляет собой композицию в виде раствора, подходящего для введения через небулайзер, или композицию в виде сухого порошка, подходящего для введения через устройство - сухой порошковый ингалятор. Обычно средний диаметр вдыхаемых частиц или капель находится в диапазоне от 0,10 до 10 мкм. Размер частиц или капель выбран таким образом, чтобы была максимальной целевая доставка, осуществляемая или непосредственно в легкие (если мишенью является легочная ткань) или системно (если легкие задействованы з качестве альтернативного пути для системного введения). Размер предпочтительно находится в диапазоне приблизительно от 0,5 до 5 мкм, если терапевтической мишенью являются непосредственно легкие, или составляет менее 3 микрон для системной доставки через легкие. Размер измеряется .в соответствии со способами, известными в данной области и описанными, например, в фармакопее США в главах 905 и 601. Например, размер измеряется как массовый медианный аэродинамический диаметр (MMAD). В одном варианте осуществления усредненный или средний диаметр частиц, содержащих описанные в изобретении композиции, измеряется как MMAD.
[57] В одном варианте осуществления дисперсная фаза аэрозоля состоит из жидких частиц или капель. В этом контексте понятия "жидкие частицы" и "капли" используются взаимозаменяемо.
В этом варианте осуществления композиция по настоящему изобретению является композицией в виде раствора. В одном варианте осуществления дисперсная фаза аэрозоля состоит из твердых частиц. В этом варианте осуществления композиция по изобретению представляет собой сухую порошковую композицию. Микронизированные частицы такого размера могут быть получены способами, известными в данной области, например, путем механического измельчения (размалывания), преципитацией из докритических или сверхкритических растворов, распылительной сушки, сушки вымораживанием или лиофилизацией.
[58] В общем, вдыхаемые частицы подвергаются осаждению с помощью одного из двух механизмов - импакции, обычно преимущественно применяемой для более крупных частиц, и седиментации, преимущественно применяемой для мелких частиц. Импакция происходит, если импульс вдыхаемой частицы достаточен для того, чтобы частица не следовала за потоком воздуха и сталкивалась с физиологической поверхностью. В противоположность этому, седиментация происходит в основном в глубоких отделах легких, когда очень маленькие частицы, которые попали с потоком вдыхаемого воздуха, сталкиваются с физиологическими поверхностями в результате случайной диффузии в потоке воздуха. Аэрозольные композиции по изобретению для достижения желаемого терапевтического эффекта предпочтительно приспособлены для максимального осаждения или путем импакции (в верхних дыхательных путях) или путем седиментации (в альвеолах).
[59] Количество лекарственного препарата, доставляемое пациенту из устройства для доставки, такого как небулайзер, дозирующий ингалятор под давлением (pMDI) или ингалятор сухого порошка (DPI), называется доставляемой дозой. Ее можно определить in vitro с помощью моделируемой ингаляции путем определения количества лекарственного препарата, высвобождаемого из устройства доставки. Это называется выделяемой дозой (ED), которую измеряют в соответствии со способами, известными в данной области, например, приведенными в Фармакопее США (USP) и Европейской фармакопее, например, в главе 601 и главе 905 USP. Таким образом, "выделяемая доза" считается эквивалентом доставляемой дозы.
[60] Количество лекарственного препарата, поступающее из устройства для доставки в легкие пациента, называется вдыхаемой дозой. Ее можно определить in vitro путем определения дозы мелкодисперсных частиц (FPD) при измерении с использованием каскадных импакторов, таких как импактор Next Generation (NGI), в соответствии со способами, известными в данной области, например, изложенных в Фармакопее США и Европейской фармакопее, например, в главах 601 и 905 USP.
[61] Количество лекарственного препарата, высвобождаемого в мелкодисперсных вдыхаемых частицах из устройства для доставки, называется фракцией мелкодисперсных частиц (FPF) композиции. FPF представляет собой фракцию лекарственного препарата в доставляемой дозе, которую потенциально можно вдохнуть. Таким образом, FPF представляет собой соотношение FPD к ED (выделяемой или доставляемой дозе). Эти характеристики композиции измеряют в соответствии со способами, известными в данной области, например, изложенными в Фармакопее США и Европейской фармакопее, например, в главе 601 USP и монографии 2.9.18 из Европейской фармакопеи.
[62] В одном варианте осуществления композиции рапамицина по настоящему изобретению, которые могут быть в виде аэрозоля, имеют показатель FPF, превышающий 20%, с соответствующим значениями FPD в диапазоне от 10 мкг до 2 мг, предпочтительно менее 0,5 миллиграммов, даже после длительного хранения, например, после хранения в течение периода от 1 до 12 месяцев, или после хранения от 1 до 36 месяцев. В одном варианте осуществления доставленная пациенту доза, доставляемая доза (DD) или выделяемая доза (ED) находятся в диапазоне от 25 мкг до 2,5 мг, предпочтительно менее 0,5 мг.
[63] В некоторых вариантах осуществления рапамицин инкапсулирован в фармацевтически приемлемом соединении, материале или матрице. В одном варианте осуществления рапамицин инкапсулирован в липосомной композиции или нелипосомной композиции.
Композиции на основе водного раствора
[64] В одном варианте осуществления композиция по настоящему изобретению, которая может быть в виде аэрозоля, представляет собой рецептуру водного раствора рапамицина, приспособленного для легочной доставки через небулайзер, в том числе через компрессорные небулайзеры, сетчатые небулайзеры с вибрацией и статической сеткой, или мембранные небулайзеры. Таким образом, композиция в виде раствора приспособлена для возможности образования аэрозольных капелек вдыхаемого размера с диаметром приблизительно от 0,1 до 10 микрон, как описано выше. В одном варианте осуществления композиция представляет собой композицию распыляемого водного раствора, состоящего из рапамицина (сиролимуса), или его пролекарства или его производного, растворенного в воде, этаноле и низкомолекулярном полиоле, и необязательно включающего поверхностно-активное вещество. В одном варианте осуществления композиция водного раствора имеет вязкость меньше 20 мПа⋅с, меньше 10 мПа⋅с или меньше 5 мПа⋅с, и поверхностное натяжение по меньшей мере 45 дин/см, предпочтительно больше 60 дин/см. Предпочтительно, композиция имеет вязкость ниже 5 мПа⋅с и поверхностное натяжение выше 45 дин/см. В одном варианте осуществления композиция имеет вязкость меньше 20 мПа⋅с, вязкость ниже 10 мПа⋅с, или вязкость меньше 5 мПа⋅с и поверхностное натяжение по меньшей мере 45 дин/см, предпочтительно больше 60 дин/см.
[65] В одном варианте осуществления композиция водного раствора состоит из рапамицина, воды, этанола и низкомолекулярного полиола, выбранного из глицерина и пропиленгликоля. В одном варианте осуществления композиция водного раствора состоит из рапамицина, воды и низкомолекулярного полиола, выбранного из глицерина и пропиленгликоля, причем этанол является необязательным компонентом. Композиция может также содержать неионное поверхностно-активное вещество, предпочтительно полиэтиленгликоль ПЭГ 100, или полисорбат, предпочтительно полисорбат 80 ("PS80"), фосфолипид, предпочтительно природный фосфолипид, такой как лецитин, и предпочтительно гидрогенизированный соевый лецитин, и антиоксидант или стабилизатор, предпочтительно динатриевая соль ЭДТА. В одном варианте осуществления неионное поверхностно-активное вещество выбрано из группы, состоящей из полиэтиленгликоля (ПЭГ) ПЭГ 100, ПЭГ 1000 и полисорбата 80 (также упоминаемого как Твин™ 80, моноолеат сорбит или полиоксиэтилен сорбит олеат), и их смеси.
[66] Количество рапамицина в водном растворе составляет приблизительно от 0,001% до 0,01% веса (% по весу или % вес/вес) в пересчете на общий вес раствора. В одном варианте осуществления рапамицин присутствует в растворе в концентрации приблизительно от 0,01 мг/мл приблизительно до 0,1 мг/мл. В одном варианте осуществления количество рапамицина составляет от 0,001% до 0,01% вес./вес. в пересчете на общий вес раствора.
[67] В одном варианте осуществления концентрация рапамицина в растворе составляет приблизительно от 0,01 до 0,1 мг/мл, количество низкомолекулярного полиола составляет от 5 до 35% вес./вес., количество присутствующего этанола составляет от 5 до 20% вес./вес., и количество неионного поверхностно-активного вещества составляет от 1 до 200 частей на миллион (ррm) вес./вес. Предпочтительно, количество неионного поверхностно-активного вещества составляет менее 100 частей на миллион (вес./вес.). Количество необязательного антиоксиданта/стабилизатора варьируется от нуля до менее чем 0,01% вес./вес.
[68] В одном варианте осуществления композиция водного раствора по изобретению не содержит одну или несколько добавок или наполнителей, выбранных из группы, состоящей из полиэтиленгликоля, лецитина, ЭДТА, блок-сополимера и циклодекстрина.
[69] Композиция водного раствора представляет собой однофазный водный раствор, в котором рапамицин находится в полностью растворенном состоянии. Основными сорастворителями в композиции являются этанол и низкомолекулярный полиол, выбранный из глицерина и пропиленгликоля. Рапамицин не является суспензией или эмульсией, и раствор нельзя охарактеризовать как коллоидный раствор или дисперсия. Композиция водного раствора по изобретению не имеет коллоидных структур, таких как мицеллы или липосомы. Количество фосфолипида, при его наличии, слишком мало для образования липосом или для преципитации рапамицина. А суммарное количество фосфолипидов и неионного поверхностно-активного вещества слишком мало, чтобы изменить поверхностное натяжение. Следовательно, ни фосфолипид, ни неионное поверхностно-активное вещество не присутствуют в количестве, достаточном, чтобы в общепринятом смысле действовать в качестве поверхностно-активного вещества. В этом контексте термин поверхностно-активное вещество относится к веществу, действие которого заключается в уменьшении поверхностного натяжения раствора или межфазного натяжения между жидкостью и любыми твердыми частицами лекарственного препарата в растворе таким образом, что поверхностно-активное вещество начинает действовать как детергент, смачивающее вещество, эмульгатор или диспергирующее вещество. Напротив, неионное поверхностно-активное вещество в композиции раствора по изобретению служит для блокирования адсорбции лекарственного препарата в полиэтиленовом контейнере, в который упакован конечный продукт, таким образом, предотвращая потерю активности лекарственного препарата посредством абсорбции в контейнере.
[70] Соответственно, в одном варианте осуществления композиция водного раствора представляет собой однофазный водный раствор, в котором рапамицин находится в полностью растворенном состоянии, раствор не содержит мицелл или липосом, и раствор не является эмульсией, дисперсией или суспензией.
[71] В одном варианте осуществления композиция раствора является стерильной. В одном варианте осуществления композиция раствора стерилизуется путем фильтрации через фильтр 0,2 мкм. В одном варианте осуществления композиция раствора не подвергается термической стерилизации, например, путем обработки в автоклаве, или воздействия радиации.
[72] В одном варианте осуществления настоящее изобретение относится к упаковке, содержащей один или несколько контейнеров, или флаконов (эти термины используются как взаимозаменяемые), заполненных композицией стерильного водного раствора. Предпочтительно, контейнеры представляют собой емкости с единичной дозой. В одном варианте осуществления контейнеры представляют собой полимерные флаконы, предпочтительно полиэтиленовые флаконы. В одном варианте осуществления контейнер или флакон заполнены композицией стерильного водного раствора по изобретению, и произведены способом, содержащим этапы изготовления флакона с помощью выдувного формования и немедленно после этого наполнения флакона в асептических условиях стерильно-фильтрованной композицией по изобретению, с последующей термической герметизацией флакона сразу же после наполнения.
[73] В одном варианте осуществления водная аэрозольная композиция по изобретению содержит или состоит из следующего:
- рапамицин (или его пролекарство или его производное) в количестве приблизительно от 0,001% до 0,01% вес./вес.,
- пропиленгликоль приблизительно от 5% до 35% вес./вес.,
- этанол приблизительно от 5% до 20% вес./вес.,
- полисорбат 80 приблизительно от 1 до 200 частей на миллион вес./вес.,
- лецитин приблизительно от 1 до 100 частей на миллион вес./вес., и
- вода,
при этом количество воды достаточно для достижения концентрации рапамицина в диапазоне от 0,01 до 0,1 мг/мл. Необязательно может быть добавлен усилитель стабильности, такой как динатриевая соль ЭДТА в количестве ниже 0,01% вес./вес.
[74] Для водных и других жидких систем под нормальным давлением существуют различные небулайзеры (включая небулайзеры малого объема) для приведения композиций в состояние аэрозолей. В компрессорных небулайзерах применяется струйная технология и используется сжатый воздух для создания жидкого аэрозоля. Такие устройства являются коммерчески доступными, например, Healthdyne Technologies, Inc.; Invacare, Inc.; Mountain Medical Equipment, Inc.; Pari Respiratory, Inc.; Mada Medical, Inc.; Puritan-Bennet; Schuco, Inc., DeVilbiss Health Care, Inc.; и Hospitak, Inc.. Ультразвуковые небулайзеры работают на основе механической энергии в виде вибрации пьезоэлектрического кристалла для генерации капель жидкости, которые можно вдыхать. Такие небулайзеры коммерчески доступны, как например, продукция Omron Healthcare, Inc. и DeVilbiss Health Care, Inc.
[75] В одном варианте осуществления водная аэрозольная композиция по изобретению доставляется через вибрационный небулайзер, доступный от компаний Aerogen, Pari, Philips или Omron. В одном варианте осуществления водная аэрозольная композиция по изобретению упакована в контейнер, подходящий для использования с небулайзером с вибрирующей сеткой, например, Aeroneb® Go (Aerogen, дистрибьютор - Philips Respironics), I-Neb® (Philips) или Е-Flow® (Pari), или аналогичный небулайзер. В одном варианте осуществления водная аэрозольная композиция по изобретению доставляется посредством мембранного небулайзера, такого как Respimat® от Boeringher-Ingelheim.
[76] Таким образом, в одном варианте осуществления настоящее изобретение относится к фармацевтической композиции в форме распыляемого водного раствора, подходящего для введения путем ингаляции субъекту-человеку, и этот водный раствор содержит рапамицин или его пролекарство или его производное, предпочтительно выбранное из сиролимуса, эверолимуса и темсиролимуса, и воду, этанол и низкомолекулярный полиол. В одном варианте осуществления низкомолекулярным полиолом является глицерин, или пропиленгликоль или их смесь. В одном варианте осуществления композиция дополнительно содержит неионное поверхностно-активное вещество, выбранное из группы, состоящей из ПЭГ 100, ПЭГ 1000 и полисорбата 80, и их смеси. В одном варианте осуществления количество неионного поверхностно-активного вещества в композиции составляет от 1 до 200 частей на миллион вес./вес., предпочтительно менее чем 100 частей на миллион вес./вес. в пересчете на вес композиции. В одном варианте осуществления композиция дополнительно содержит фосфолипид, антиоксидант или химический стабилизатор. В одном варианте осуществления количество антиоксиданта или химического стабилизатора в композиции составляет менее чем 0,01% вес./вес. в пересчете на вес композиции. В одном варианте осуществления антиоксидант или химический стабилизатор представляет собой ЭДТА. В одном варианте осуществления количество рапамицина в композиции составляет от 0,001 до 0,01% вес./вес. в пересчете на вес композиции.
[77] В одном варианте осуществления композиция не содержит одну или несколько добавок или наполнителей, выбранных из группы, состоящей из полиэтиленгликоля, лецитина, ЭДТА, блок-сополимера, и циклодекстрина.
[78] В одном варианте осуществления композиция не имеет коллоидных структур, выбранных из мицелл и липосом.
[79] В одном варианте осуществления композиция подходит для введения с помощью небулайзера любого типа из компрессорных небулайзеров, сетчатых небулайзеров с вибрацией и статической сеткой, или мембранных небулайзеров.
[80] В одном варианте осуществления композиция имеет вязкость ниже 20 мПа⋅с, предпочтительно менее 10 мПа⋅с, наиболее предпочтительно менее 5 мПа⋅с, и поверхностное натяжение менее 45 дин/см, предпочтительно по меньшей мере 50 дин/см.
[81] Настоящее изобретение также относится к способу получения фармацевтической композиции по изобретению в виде распыляемого водного раствора, и указанный способ содержит стерилизацию раствора фильтрованием через фильтр с размером пор 0,2 мкм или меньше, и сбор стерильного фильтрата в сосуде-накопителе в асептических условиях. В одном варианте осуществления способ получения дополнительно содержит перенос стерильного фильтрата в контейнер, укупоренный в асептических условиях. В одном варианте осуществления контейнер/укупорка представляет собой полиэтиленовый флакон с единичной дозой. В одном варианте осуществления флакон производится путем выдувного формования непосредственно перед переносом стерильного фильтрата во флакон. В одном варианте осуществления способ дополнительно содержит этап термической герметизации флакона сразу же после переноса стерильного фильтрата во флакон.
Сухие порошковые композиции
[82] В одном варианте осуществления аэрозольная композиция по настоящему изобретению представляет собой сухой порошок, содержащий измельченные частицы рапамицина, или его пролекарства или его производного, в качестве терапевтического вещества (также называемого "лекарственным препаратом"), частицы с диаметром от 0,1 до 10 мкм и средним диаметром приблизительно от 0,5 до 4,5 мкм, приблизительно от 1 до 4 мкм, приблизительно от 1 до 3,5 мкм, приблизительно от 1,5 до 3,5 мкм или приблизительно от 2 до 3 мкм. Сухая порошковая композиция подходит для применения и в ингаляторе сухого порошка (DPI) или в дозирующем ингаляторе под давлением (pMDI). Количество рапамицина в сухом порошке составляет приблизительно от 0,5 до 20% (вес./вес.) в пересчете на общий вес порошка. В одном варианте осуществления количество рапамицина составляет приблизительно 1% или 2% (вес./вес.).
[83] В одном варианте осуществления получают микронизированный рапамицин с помощью мокрого шлифования или размола на струйной мельнице, как описано ниже, для получения частиц с диаметром в диапазоне приблизительно от 0,5 до 4,5 мкм, приблизительно от 1 до 4 мкм, или приблизительно от 2 до 3 мкм, и частицы рапамицина смешивают на лактозных частицах носителя в соотношении лекарственный препарат/носитель в пределах от 0,5 до 2% вес./вес., с предпочтительным соотношением 1%.
[84] В одном варианте осуществления частицы лекарственного препарата слегка уплотняют в хрупкой матрице, которая находится в устройстве для доставки (ингалятор сухого порошка). При срабатывании устройства для доставки из матрицы соскабливается часть частиц лекарственного препарата, которые рассеиваются на вдохе при дыхании, тем самым частицы лекарственного препарата в поступают в дыхательные пути. В качестве альтернативы частицы лекарственного препарата могут быть в виде свободно текучего порошка, находящегося в резервуаре устройства для доставки (ингалятор сухого порошка). Резервуар может представлять собой встроенную камеру внутри такого устройства, или капсулу, блистер, или аналогичный предварительно сформированный резервуар, который вставляется в устройство до его приведения в действие. При срабатывании устройства запускается дисперсия части частиц лекарственного препарата из резервуара и их рассеивание при вдыхании, таким образом, происходит ингаляционная доставка частиц лекарства в дыхательные пути.
[85] В одном варианте осуществления сухая порошковая композиция состоит из частиц лекарственного препарата и носителя, выбранного из группы, состоящей из арабинозы, глюкозы, фруктозы, рибозы, маннозы, сахарозы, трегалозы, лактозы, мальтозы, крахмалов, декстрана, маннита, лейцина, лизина, изолейцина, дипальмитилфосфатидилхолина, лецитина, полимолочной кислоты, поли(молочной-со-глутаминовой) кислоты и ксилита, или смеси любых из вышеуказанных веществ. В одном варианте осуществления изобретения носителем является лактоза, в частности, в форме моногидрата. В одном варианте осуществления сухая порошковая композиция содержит смесь двух или более носителей.
[86] В одном варианте осуществления сухая порошковая композиция содержит лекарственный препарат и смесь по меньшей мере двух разных носителей. В одном варианте осуществления соотношение лекарственного препарата и носителя находится в диапазоне приблизительно от 0,5 до 20% (вес./вес.). В одном варианте осуществления частицы лекарственного препарата имеют диаметр в диапазоне от 0,1 до 10 мкм, при этом средний диаметр составляет приблизительно от 1 до 4, от 1 до 3,5, или от 1,5 до 3,5, или от 2 до 3 мкм. Частицы носителя могут иметь диаметр в диапазоне от 2 до 200 мкм.
[87] В одном варианте осуществления композиция содержится в блистерной упаковке или в резервуаре устройства DPI. В одном варианте осуществления сухая порошковая композиция заранее помещена в желатиновую, крахмальную, целлюлозную или полимерную капсулу или в блистеры фольга/фольга или фольга/пластик, подходящие для использования в устройстве DPI. Каждая капсула или блистер может содержать от 1 до 100 мг сухой порошковой композиции. Капсулы или блистеры могут быть вставлены в ингалятор сухого порошка (DPI), например, в такие устройства, как Aerolizer®, Plastiape® RS01 модель 7 и Plastiape® RS00 модель 8, XCaps®, FlowCaps®, Arcus®, Diskhaler® или Microdose®. При срабатывании устройства DPI капсула или блистера разрывается, и происходит диспергирование порошка при вдыхании, тем самым лекарственный препарат доставляется в дыхательные пути.
[88] В одном варианте осуществления сухая порошковая композиция содержится в ингаляторе сухого порошка (DPI), выбранного из устройств Accuhaler®, Conix™ Rotahaler®, TwinCaps®, XCaps®, FlowCaps®, Turbuhaler®, NextHaler®, CycloHaler®, Revolizer™, Diskhaler®, Diskus®, Spinhaler, Handihaler®, микродозного ингалятора, GyroHaler®, OmniHaler®, Clickhaler®, Duohaler® (Vectura) и ингалятора ARCUS® (Civitas Therapeutics). В одном варианте осуществления настоящее изобретение относится к устройству DPI, содержащему описанную в изобретении сухую порошковую композицию. В одном варианте осуществления устройство выбрано из группы, состоящей из XCaps, FlowCaps, Handihaler, TwinCaps, Aerolizer®, Plastiape® RS01 модель 7 и Plastiape® RS00 модель 8. В одном варианте осуществления устройство, содержащее упомянутую композицию, выбрано из группы, состоящий из GyroHaler®, OmniHaler®, Clickhaler®, Duohaler® и ингалятора ARCUS®.
[89] Предпочтительно делают более крупные частицы носителя (размером более 5 мкм), чтобы избежать депонирования материала-носителя в глубоких отделах легких. В одном варианте осуществления частицы носителя имеют диаметр в диапазоне от 1 до 200 мкм, от 30 до 100 мкм или менее 10 мкм. В одном варианте осуществления частицы носителя представляют собой смесь из двух носителей, один из которых состоит из частиц приблизительно от 30 до 100 микрон, а другой имеет частицы менее 10 мкм. Два разных носителей находятся в соотношении в диапазоне от 3:97 до 97:3. В одном варианте осуществления сухая порошковая композиция состоит из лекарственного препарата и носителя в соотношении от 0,5 до 20% (вес./вес.), и частицы лекарственного препарата имеют диаметр от 0,1 до 10 мкм, при этом средний диаметр составляет менее 3,5 мкм. В одном варианте осуществления материал-носитель представляет собой кристаллический материал-носитель. Предпочтительно кристаллический материал-носитель является кристаллическим по меньшей мере на 90%, предпочтительно более чем на 95%, и при этом носитель не абсорбирует или, по существу не абсорбирует воду при комнатной температуре при условиях относительной влажности 80% или ниже. Примерами таких кристаллических носителей являются моногидрат лактозы и моногидрат глюкозы. Количество носителя в композиции составляет от 1 до 99,0% или больше в пересчете на сухой вес порошка, предпочтительно от 5 до 99%, от 10 до 99%, от 20 до 99%, от 30 до 99%, от 40 до 99% или 50 до 99%.
[90] В одном варианте осуществления сухая порошковая композиция находится внутри резервуара в устройстве доставки (сухой порошковый ингалятор). Резервуар может представлять собой встроенную камеру внутри такого устройства, или капсулу, блистер, или аналогичный предварительно сформированный резервуар, который вставляется в устройство до его приведения в действие. При срабатывании устройства диспергируется часть частиц лекарственного препарата из резервуара и они рассеиваются на вдохе при дыхании, таким образом, частицы лекарства доставляются в дыхательные пути.
[91] В одном варианте осуществления лекарственный препарат присутствует в виде мелкоизмельченного порошка вместе с фармацевтически приемлемым носителем. В этом контексте термин "мелкоизмельченный" относится к размеру частиц в диапазоне, подходящем для вдыхания, как рассмотрено выше. Предпочтительно лекарственный препарат микронизирован таким образом, что средний диаметр частиц находится в диапазоне от 10 микрон или меньше. В одном варианте осуществления частицы рапамицина (или его пролекарства или его производного) в сухой порошковой композиции, описанной в изобретении, имеют средний диаметр (MMAD или Dv50), составляющий от 0,5 до 10 мкм, от 0,5 до 6 мкм, от 1 до 5 мкм, от 1 до 4 мкм, от 1 до 3 мкм, или от 2 до 3 мкм. Значение MMAD или Dv50 относится к размеру частиц, меньше которого имеют 50% всего объема частиц.
[92] В одном варианте осуществления сухая порошковая композиция рапамицина дополнительно содержит одну или несколько добавок, выбранных из описанных ниже добавок. В одном варианте осуществления одна или несколько добавок содержит или состоит из стеарата магния. В одном из аспектов данного варианта осуществления стеарат магния присутствует в количестве от 0,001 до 10% в пересчете на сухой вес порошка, предпочтительно в количестве от 0,01 до 5% или от 0,01 до 2%. В другом варианте осуществления добавка содержит или состоит из фосфолипидов, таких как лецитин (который представляет собой смесь фосфатидилхолинов) в количестве от 0,1% до 1% в пересчете на сухой вес порошка, предпочтительно от 0,2% до 0,6%. В одном из аспектов данного варианта осуществления добавку наносят на материал-носитель до этапа смешивания носителя с частицами рапамицина или одновременно со смешиванием. Желаемая степень покрытия материала-носителя может быть достигнута, например, с помощью этапа интенсивного смешивания, в ходе которого на носитель наносится покрытие с добавкой, или за счет большой продолжительности смешивания с низкой интенсивностью, или с помощью комбинации низкой и высокой интенсивности смешивания. Низкоэнергетические устройства для смешивания сухих порошков с получением смеси известны в данной области и включают, например, V-смесители, двухконусные смесители, смесители с наклонным конусом, смесители с кубическим барабаном, бункерные смесители, смесители с горизонтальным или вертикальным барабаном, статические смесители непрерывного действия и динамические смесители непрерывного действия. Другие устройства с более высоким уровнем интенсивности включают смесители с большим усилием сдвига, известные специалистам в данной области.
[93] В некоторых вариантах осуществления сухой порошок находится в капсуле. В одном варианте осуществления капсула представляет собой желатиновую капсулу, пластиковую капсулу или целлюлозную капсулу или имеет вид блистера фольга/фольга или фольга/пластик. Во всех случаях капсула или блистер подходят для использования в устройстве DPI, предпочтительно в дозированных единицах вместе с носителем в таком количестве, чтобы общий вес порошка в каждой капсуле был доведен до величины от 1 мг до 100 мг. В качестве альтернативы, сухой порошок может находиться в резервуаре мультидозного устройства DPI.
[94] Размер частиц рапамицина может быть уменьшен до желательного уровня микрочастиц с помощью общепринятых способов, например, путем измельчения в воздушно-струйной мельнице, шаровой мельнице или вибрационной мельнице, путем мокрого шлифования, микропреципитации, распылительной сушки, лиофилизации или рекристаллизации из докритических или сверхкритических растворов. Измельчение на струйной мельнице или размол в данном контексте относится к микронизации сухих частиц лекарственного препарата с помощью механических способов. В технологиях микронизации не требуется приготовление раствора, жидкой массы или суспензии лекарственного препарата. Вместо этого, частицы лекарственного препарата механически уменьшаются в размерах. Из-за относительно высокой энергии, которая используется при микронизации, в некоторых вариантах осуществления желательно включать материал-носитель в смеси, совместно микронизированной с рапамицином. В этом контексте, материал-носитель поглощает часть энергии микронизации, которая в противном случае может оказывать побочное воздействие на структуру рапамицина. В одном варианте осуществления способом струйного размола получают частицы рапамицина с размером в диапазоне от 1 до 4 или от 2 до 3 мкм.
[95] Мокрое шлифование, как описано в US2013/0203717 предполагает использование усилия высокого сдвига для уменьшения размера частиц лекарственного препарата в суспензии или в жидкой массе. При мокром шлифовании могут быть задействованы только частицы лекарственного препарата или дополнительные частицы, называемые измельчающей средой. В одном варианте осуществления размер частиц рапамицина может быть уменьшен до желаемого уровня с помощью способа мокрого шлифования, который содержит мокрый размол, в частности, путем кавитации при повышенном давлении, при этом рапамицин суспендируют в воде или другом растворителе, в котором он нерастворим, с последующей распылительной сушкой суспензии для получения рапамицина в виде сухого порошка. В одном варианте осуществления частицы рапамицина с размером в диапазоне от 1 до 4 или от 2 до 3 мкм получают способом мокрого шлифования, который содержит приготовление суспензии рапамицина, микрофлюидизацию этой суспензии и распылительную сушку полученных частиц для получения сухого порошка. Рапамицин может быть суспендирован в антирастворителе, выбранном из группы, состоящей из пропилового или бутилового спирта, воды и этилацетата. В одном варианте осуществления суспензия представляет собой водную суспензию.
[96] Распылительная сушка обычно включает получение раствора, жидкой массы или суспензии лекарственного препарата, распыление этого раствора, жидкой массы или суспензии для образования частиц и последующее выпаривание среды раствора, жидкой массы или суспензии для получения частиц. Раствор, жидкая масса или суспензия могут быть образованы при докритических или сверхкритических условиях. Этап выпаривания можно осуществлять путем повышения температуры атмосферы, в которой происходит распыление, или путем снижения давления, или с помощью комбинации этих способов. В одном варианте осуществления порошковая композиция, содержащая рапамицин, производится путем распылительной сушки водной дисперсии рапамицина с получением сухого порошка, состоящего из агрегированных частиц рапамицина, размер которых подходит для легочной доставки, как описано выше. Размер агрегированных частиц можно регулировать (увеличивать или уменьшать), чтобы мишенью были или глубокие отделы легких или отделы верхних дыхательных путей, такие как верхние отделы бронхиального дерева или слизистая оболочка носа. Это может быть достигнуто, например, за счет увеличения концентрации рапамицина в высушенной распылением дисперсии или за счет увеличения размера капли, образуемой в распылительной сушилке.
[97] В качестве альтернативы, сухой порошок может быть изготовлен с помощью сушки вымораживанием (лиофилизации) водного раствора, дисперсии или эмульсии лекарственного препарата, или с помощью комбинации распылительной сушки и сушки вымораживанием.
[98] В одном варианте осуществления сухая порошковая композиция производится путем лиофилизации водной дисперсии рапамицина и одной или нескольких дополнительных добавок. В одном варианте осуществления порошки содержат рапамицин, агрегированный с добавкой, при ее наличии, при этом размер частиц в такой смеси находится в пределах вдыхаемого диапазона, как описано выше.
[99] В одном варианте осуществления водная дисперсия рапамицина и одной или нескольких необязательных добавок дополнительно содержит растворенный разбавитель, такой как лактоза или маннит, и при лиофилизации дисперсии образуются вдыхаемые разбавляющие частицы, каждая из которых содержит по меньшей мере одну частицу заключенного в нее препарата и частицу добавки, при ее наличии.
[100] В одном варианте осуществления сухой порошок содержит липосомы, нагруженные рапамицином. Липосомы, нагруженные лекарством, могут быть получены способами, известными в данной области, например, с использованием технологии, описанной для такролимуса авторами M. Chougale, et al. Int. J. Nanomedicine 2:625-688 (2007). Коротко, рапамицин, гидрогенизированный фосфатидилхолин (HSPC) и холестерин растворяют в смеси метанола и хлороформа, а затем подвергают обработке для образования сухой тонкой пленки, например, в испарителе Rotaevaporator. Липосомы подвергают гидратации, и липосомальную дисперсию пропускают через гомогенизатор высокого давления для уменьшения размера. Полученные гранулы классифицируют по размеру пузырьков и проценту захвата лекарства, и гранулы с эквивалентным желаемым количеством рапамицина затем диспергируют в подходящей среде и подвергают распылительной сушке для получения частиц с размером, желательным для ингаляции. Высушенный распылением порошок может быть помещен в капсулы, канистры или блистерные упаковки для введения.
[101] В одном варианте осуществления частицы сухого порошка могут быть получены путем осаждения из сверхкритического или докритического раствора.
[102] Сухие порошковые композиции могут находиться в подходящем устройства - сухом порошковом ингаляторе, или в капсуле или блистере, предназначенном для использования в таком устройстве. Примеры таких устройств приведены выше и включают Accuhaler®, Aerolizer®, Plastiape® RS01 модель 7, Plastiape® RS00 модель 8, ConixTM, Rotahaler®, TwinCaps®, XCaps®, FlowCaps®, Turbuhaler®, NextHaler®, CycloHaler®, Revolizer ТМ, Diskhaler®, Diskus®, Spinhaler, Handihaler®, микродозный ингалятор, GyroHaler®, OmniHaler®, Clickhaler® или Duohaler® (Vectura) или активируемый вдохом ингалятор ARCUS® (Civitas Therapeutics). В одном варианте осуществления настоящее изобретение относится к устройству DPI, содержащему сухую порошковую композицию, описанную в изобретении. В одном варианте осуществления устройство выбрано из группы, состоящей из XCaps, FlowCaps, Handihaler, TwinCaps, Aerolizer®, Plastiape® RS01 модель 7 и Plastiape® RS00 модель 8.
Композиции на основе пропеллента
[103] В другом варианте осуществления настоящего изобретения рецептура рапамицина представляет собой композицию на основе пропеллента, которая также упоминается в изобретении под общим названием "композиция pMDI". Композиция pMDI подходит для доставки с помощью таких устройств, как дозирующий ингалятор под давлением (pMDI). В одном варианте осуществления эта композиция содержит рапамицин, пропеллент и растительное масло или фармацевтически приемлемое производное растительного масла. Пропеллент предпочтительно выбран из 1,1,1,2-тетрафторэтана (HFA134a) и 1,1,1,2,3,3,3-гептафторопропана (HFA227), или их смеси. В одном варианте осуществления растительное масло выбрано из оливкового масла, сафлорового масла и соевого масла. Рапамицин может быть в растворе или в суспензии в пропелленте. В этом контексте понятие "в суспензии" относится к тому, что рапамицин присутствует в форме частиц, диспергированных в пропелленте. В одном варианте осуществления рапамицин является микронизированным и присутствует в пропелленте в суспензии. В одном варианте осуществления композиция дополнительно содержит смачивающее вещество или сорастворитель, такой как этанол. В одном варианте осуществления композиция дополнительно содержит полигидрокси-спирт, такой как пропиленгликоль.
[104] Подходящие пропелленты известны в данной области и включают, например, галоген-замещенные углеводороды, например, фтор-замещенные метаны, этаны, пропаны, бутаны, циклопропаны или циклобутаны, в частности, 1,1,1,2-тетрафторэтан (HFA134a) и 1,1,1,2,3,3,3-гептафторпропан (HFA227) или их смеси.
[105] В одном варианте осуществления композиция содержит микронизированный рапамицин, этанол, подходящий пропеллент, такой, как HFA 134a, HFA 227, или смесь подходящих пропеллентов, и необязательно одно или несколько поверхностно-активных веществ. В одном варианте осуществления композиция дополнительно содержит смазывающее вещество.
[106] В одном варианте осуществления композиция содержит рапамицин, пропеллент и растительное масло. В одном аспекте композиция не содержит добавку или поверхностно-активное вещество. Например, композиция не содержит этанол, полигидрокси-спирт (например, пропиленгликоль) или поверхностно-активное вещество (например, триолеат сорбита, моноолеат сорбита или олеиновую кислоту).
[107] В одном варианте осуществления композиция на основе пропеллента содержит сжатый воздух, углекислый газ, азот или сжиженный газ-вытеснитель, выбранный из группы, состоящей из n-пропана, n-бутана, изобутана или их смеси, или 1,1,1,2-тетрафторэтана (HFA134a) и 1,1,1,2,3,3,3-гептафторпропана (HFA227), или их смеси, с добавлением или без добавления полярного сорастворителя, такого как спирт. Композиция может представлять собой раствор или суспензию. В суспензиях частицы лекарственного препарата имеют диаметр от 0,1 до 10 мкм, и средний диаметр составляет менее 3,5 мкм.
[108] Композицию на основе пропеллента получают способами, известными в данной области, например, путем мокрого размола крупнодисперсного рапамицина и необязательной добавки, в жидком пропелленте, как при атмосферном давлении, так и в условиях высокого давления. В некоторых вариантах осуществления добавка представляет собой поверхностно-активное вещество, которое служит для предотвращения агрегации (слипания или кристаллизации), с целью облегчения равномерного дозирования, а также (или альтернативно) для получения предпочтительной фракции мелкодисперсных частиц (FPF). В одном аспекте поверхностно-активное вещество выбрано из сорбитантриолеата, моноолеата сорбита или олеиновой кислоты. В качестве альтернативы, сухие порошки, содержащие частицы лекарственного препарата, получают из водных дисперсий частиц лекарственного препарата путем распылительной сушки или сушки вымораживанием, как описано выше, и полученные порошки диспергируют в подходящие пропелленты для использования в общепринятых дозирующих ингаляторах под давлением (pMDI). В одном варианте осуществления устройством для ингаляции является ингалятор Respimat™.
[109] В одном варианте осуществления аэрозольные композиции рапамицина на основе пропеллента, по настоящему изобретению, являются стабильными в отношении увеличения размера частиц или изменения морфологии кристаллов рапамицина в течение длительных периодов времени.
Способ изготовления стерильных лекарственных форм с единичными дозами
[110] В одном варианте осуществления композиции по настоящему изобретению являются стерильные композиции. В одном варианте осуществления стерильные композиции представляют собой стерильные единичные лекарственные формы. В одном варианте осуществления стерильная единичная лекарственная форма представляет собой капсулу, подходящую для использования в распылительном устройстве.
[111] В одном варианте осуществления готовую композицию стерилизуют в контейнере-укупорке под термическим воздействием, например, путем автоклавирования или облучения. В одном варианте осуществления сначала стерилизуют составные части композиции подходящим способом, включающим стерилизующую фильтрацию для жидких компонентов и облучение или автоклавирование для твердых или жидких веществ, и этот подход дополнительно содержит сохранение стерильности стерильных компонентов с помощью их упаковки в герметичные контейнеры, объединение компонентов в смесительной емкости в соответствующих пропорциях и заполнение полученного продукта в контейнер-укупорку, при этом все выполняют в асептическом блоке. Недостаток этого способа заключается в его высокой стоимости и необходимости сложных асептических технологий обработки. Соответственно, он применяется в основном для обработки суспензий частиц или коллоидных дисперсий, липосомальных композиций или эмульсий, которые нельзя пропускать через субмикронный фильтр для стерилизации. И, наконец, в одном из вариантов осуществления конечную композицию подвергают стерилизующей фильтрации через субмикронный фильтр, предпочтительно фильтр калибром 0,2 мкм. В одном варианте осуществления композиции по изобретению представляют собой однофазные водные растворы, стерилизованные способом стерилизующей фильтрации. В противоположность этому, эмульсии и липосомальные композиции обычно не являются достаточно стабильными при условиях высокого усилия сдвига в ходе стерилизующей фильтрации и таким образом, не являются предпочтительными для этого способа.
[112] В одном варианте осуществления композиции по изобретению представляют собой однофазные водные растворы, которыми заполняют контейнер-укупорку, например, флакон, изготовленный из полимера, предпочтительно из полиэтилена, или, альтернативно, стеклянный флакон. Автоклавирование и облучение не подходят в случае полимерного флакона, из-за высокой вероятности возникновения химической неустойчивости лекарственного препарата и/или наполнителей в композиции екарственного препарата, а также этого контейнера, и из-за образования нежелательных примесей. В одном варианте осуществления композиции по настоящему изобретению стерилизуют с помощью способа, который не включает нагревание (автоклавирование) или облучение, а вместо этого включает стерилизующую фильтрацию. В соответствии с этим вариантом осуществления, однофазные водные растворы рапамицина предпочтительно стерилизуют путем фильтрования через фильтр с размером пор 0,2 мкм или меньше. В одном варианте осуществления стерильный фильтрат собирают в накопительной емкости, расположенном в асептическом блоке. В одном варианте осуществления стерильный фильтрат переносят из накопительной емкости в контейнер-укупорку в асептическом блоке. Предпочтительно контейнер-укупорка представляет собой полимерный флакон, предпочтительно флакон с единичной дозой, и наиболее предпочтительно, представляет собой флакон из полиэтилена с единичной дозой. В одном варианте осуществления полимерный флакон делают путем выдувного формования непосредственно перед его заполнением, а затем термически герметизируют сразу после заполнения. Этот способ можно также называть "непрерывным способом упаковывания" или "выдувание-наполнение-запаивание". Такой способ особенно предпочтителен для композиций по изобретению, которые являются однофазными водными растворами рапамицина, поскольку для этого способа не требуется нагревание или облучение, которые могут вызывать разрушение или самого лекарственного препарата, наполнителей композиции или контейнер-укупорку.
Легочное введение и дозировка
[113] Настоящее изобретение относится к композициям и способам для лечения и профилактики ЛАМ путем введения рапамицина в дыхательные пути, предпочтительно в легкие, путем ингаляции. Легочное введение предпочтительно осуществляют путем ингаляции аэрозоля через рот и горло в легкие, но также можно проводить ингаляцию аэрозоля через нос. Таким образом, в одном варианте осуществления аэрозоль доствляется интраназально. В другом варианте осуществления аэрозоль доставляется перорально.
[114] Композиции и способы по настоящему изобретению преимущественно предназначены для направленной доставки терапевтически эффективного количества рапамицина в легкие при одновременном снижении количества рапамицина в крови, и для системной доступности до очень низких или неопределимых значений. В одном варианте осуществления количество рапамицина в однократной дозе сухой порошковой композиции, описанной в изобретении, приблизительно составляет от 5 до 500 мкг или приблизительно от 100 до 300 мкг, или приблизительно от 50 до 250 мкг. Направленная доставка низкой дозы рапамицина непосредственно в легкие минимизирует системное воздействие и обеспечивает улучшенный терапевтический индекс по сравнению с пероральными лекарственными формами.
[115] В одном варианте осуществления введение рапамицина путем ингаляции в соответствии со способами по изобретению повышает терапевтический индекс рапамицина. В этом контексте, применительно к субъекту-человеку, терапевтический индекс представляет собой коэффициент сравнения дозы, которая вызывает терапевтический эффект (ED50), с дозой, которая вызывает токсичность (TD50) у 50% населения. Отношение представлено в виде TD50/ED50. В одном варианте осуществления введение рапамицина путем ингаляции в соответствии со способами по изобретению уменьшает один или несколько токсических эффектов, связанных с пероральным введением рапамицина, таким образом, увеличивая терапевтический индекс рапамицина.
[116] Настоящее изобретение включает в себя композиции в форме растворов и порошков, которые могут быть в аэрозольной форме. Таким образом, рапамицин можно вводить в соответствии со способами по изобретению в виде водного аэрозоля, сухого порошка в аэрозоле или аэрозоля на основе пропеллента.
[117] В одном варианте осуществления вводимая доза рапамицина достаточна для достижения минимального уровня в крови у субъекта, составляющего от 0,01 до 0,15 нг/мл, от 0,075 до 0,350 нг/мл, от 0,150 до 0,750 нг/мл, от 0,750 до 1,5 нг/мл или от 1,5 до 5 нг/мл. В одном варианте осуществления вводимая доза рапамицина достаточна для достижения минимального уровня в крови у субъекта, который составляет менее 5 нг/мл, менее 2 нг/мл, менее 1 нг/мл или менее 0,5 нг/мл.
[118] В одном варианте осуществления вводимая доза рапамицина достаточна для достижения концентрации рапамицина в легочной ткани в диапазоне от 1 нг/г до 1 мкг/г.
[119] В одном варианте осуществления вводимая доза рапамицина составляет от 10 до 100 микрограммов, от 50 до 250 микрограммов, от 100 до 500 микрограммов (от 0,1 до 0,5 миллиграммов), от 500 до 1000 мкг (от 0,5 до 1 миллиграмма) или от 1000 до 2000 мкг (от 1 до 2 мг). В одном варианте осуществления количество вводимого рапамицина составляет менее 1 мг, менее 0,75 мг, менее 0,5 мг или менее 0,25 мг. Предпочтительное вводимое количество рапамицина составляет менее 0,5 мг.
[120] В одном варианте осуществления рапамицин вводят один раз в день.
[121] В одном варианте осуществления общая суточная доза рапамицина находится в диапазоне от 10 до 100 микрограммов, от 50 до 250 микрограммов, от 100 до 500 микрограммов (от 0,1 до 0,5 миллиграммов), от 500 до 1000 мкг (от 0,5 до 1 мг) или от 1000 до 2000 мкг (от 1 до 2 мг). В одном варианте осуществления общая суточная доза рапамицина составляет менее 1 мг, менее 100 мкг, менее 50 мкг, менее 10 мкг или менее 1 мкг. В одном варианте осуществления общая суточная доза рапамицина составляет менее 500 нанограмм, менее 250 нанограмм, менее 100 нанограмм, менее 50 нанограмм или менее 10 нанограмм. В одном варианте осуществления общая суточная доза рапамицина, вводимая субъекту, составляет менее 2 мг или менее 1 мг в день.
[122] В одном варианте осуществления композицию по изобретению вводят субъекту один раз в день. В одном варианте осуществления композицию по изобретению вводят два раза или три раза в день. Предпочтительно, композицию вводят один раз или два раза в день, или реже, чем один раз в день.
[123] В одном варианте осуществления способы по настоящему изобретению содержат введение рапамицина легочным путем в комбинации с одним или несколькими дополнительными терапевтическими веществами, выбранными из группы, состоящей из правастатина, прогестерона, тамоксифена, агонистов гонадотропин-рилизинг-гормона (ГнРГ), доксициклина, ингибитора Src, ингибитора аутофагии (например, гидроксихлорохин), ингибитора VEGF-C или -D, и ингибитора рецептора VEGF. В одном варианте осуществления одно или несколько дополнительных терапевтических веществ выбраны из статина, прогестерона, тамоксифена и агонистов гонадотропин-рилизинг-гормона (ГнРГ). В одном варианте осуществления одно или несколько дополнительных терапевтических веществ выбраны из антагонистов эстрогена, статина, ингибитора Src и ингибитора VEGF-R. В одном варианте осуществления одно или несколько дополнительных терапевтических веществ выбраны из группы, состоящей из летрозола, тамоксифена, симвастатина, саракатиниба, пазопаниба, иматиниба и их комбинаций. Одно или несколько дополнительных веществ могут быть введены таким же путем, как и рапамицин, или разными путями введения. Например, это вещество может быть введено путем ингаляции, интраназально, перорально или внутривенно.
[124] В одном варианте осуществления способы по настоящему изобретению содержат введение рапамицина легочным путем в комбинации с одним или несколькими дополнительными терапевтическими средствами. В одном варианте осуществления одно или несколько дополнительных терапевтических средств выбраны из анти-эстрогенной терапии, гормональной терапии, противораковой химиотерапии и лучевой терапии. В одном варианте осуществления способы по изобретению содержат введение рапамицина легочным путем в комбинации с анти-эстрогенной терапией или гормональной терапией.
[125] В некоторых вариантах осуществления способы включают легочное введение композиции по изобретению в качестве первичной терапии. В других вариантах осуществления введение композиции по настоящему изобретению является адъювантной терапией. В любом случае, способы настоящего изобретения предусматривают введение композиции по изобретению в комбинации с одним или несколькими дополнительными терапевтическими средствами для лечения заболевания или расстройства. Термины "терапия" и "терапевтическое средство" относятся к любому способу, протоколу и/или веществу, которые могут быть использованы для профилактики, лечения, контроля или облегчения заболевания или расстройства, или одного или нескольких его симптомов. В некоторых вариантах осуществления терапия выбрана из химиотерапии, лучевой терапии, гормональной терапии и анти-эстрогенной терапии.
[126] Предпочтительно, введение фармацевтической композиции, содержащей рапамицин, или его пролекарство или его производное в соответствии со способами по изобретению, в комбинации с одним или несколькими дополнительными терапевтическими средствам вызывает синергетическую реакцию у субъекта, имеющего ЛАМ. В этом контексте термин "синергический" относится к эффективности комбинации, которая является более эффективной, чем аддитивные эффекты любого единственного терапевтического средства. В одном варианте осуществления синергический эффект комбинированной терапии рапамицином в соответствии с настоящим изобретением позволяет использовать более низкие дозы и/или менее частое введение по меньшей мере одного терапевтического средства в комбинации, по сравнению с его дозой и/или частотой введения вне комбинации. В другом варианте осуществления синергический эффект проявляется в предотвращении или уменьшении неблагоприятных или нежелательных побочных эффектов, связанных с применением какого-либо терапевтического средства из комбинации в качестве единственного средства.
Доставка с помощью небулайзера
[127] В одном варианте осуществления композицию рапамицина делают в виде водного раствора, который подходит для распыления и доставляется через небулайзер. Чтобы привести композиции в состояние аэрозоля, можно использовать различные небулайзеры (включая небулайзеры малого объема) для водных и других жидких систем, не находящихся под давлением. В компрессорных небулайзерах применяется струйная технология и для создания жидкого аэрозоля используется сжатый воздух. Такие устройства являются коммерчески доступными, например, Healthdyne Technologies, Inc.; Invacare, Inc.; Mountain Medical Equipment, Inc.; Pari Respiratory, Inc.; Mada Medical, Inc.; Puritan-Bennet; Schuco, Inc., DeVilbiss Health Care, Inc.; и Hospitak, Inc.. Ультразвуковые небулайзеры работают на основе механической энергии, а именно, вибрации пьезоэлектрического кристалла, для образования вдыхаемых капель жидкости, и такие небулайзеры коммерчески доступны, например, продукция Omron Healthcare, Inc. и DeVilbiss Health Care, Inc. Небулайзер может представлять собой, например, общепринятый пневматический небулайзер, такой как небулайзер Airjet, или ультразвуковой небулайзер, который может содержать композицию раствора в количестве, например, от 1 до 50 мл, обычно от 1 до 10 мл.
[128] В одном варианте осуществления водная аэрозольная композиция по изобретению приспособлена для доставки через небулайзер, содержащий вибрационную или фиксированную сетку. Например, используют устройства, такие как AERx® (Aradigm), RESPIMAT® (Boehringer Ingelheim), I-Neb® (Philips) или MicroAire® (компания Omron), в которых раствор лекарственного препарата выталкивается через отверстие мембраны или сетку с помощью поршня или под действием пневматического давления или пьезоэлектрического кристалла. Альтернативно, раствор может прокачиваться через вибрирующую сетку небулайзера, такого как E-Flow® (Pari) или Aeroneb® Go (Aerogen). Эти устройства позволяют использовать значительно меньшие распыляемые объемы, например, от 10 до 100 мкл, и имеют более высокую эффективность доставки по сравнению с общепринятыми распылителями.
Доставка сухого порошка
[129] В одном варианте осуществления сухие порошковые композиции по изобретению доставляются с помощью устройства без пропеллента - ингалятора сухого порошка (DPI). В одном варианте осуществления порошок находится в желатиновых или пластиковых капсулах, или в блистерах, подходящих для использования в устройстве DPI. В одном варианте осуществления порошок поставляется в единичной лекарственной форме и в единицах дозирования от 5 мг до 100 мг порошка на капсулу. В другом варианте осуществления сухой порошок находится в резервуаре многодозового устройства для ингаляции сухого порошка. В одном варианте осуществления ингаляционное устройство содержит аэрозольный флакон, снабженный клапаном, который подобран для доставки отмеренной дозы композиции, например, от 10 до 100 мкл, например, от 25 до 50 мкл, то есть устройство представляет собой дозирующий ингалятор.
[130] В одном варианте осуществления устройство DPI представляет собой устройство на блистерной основе, такие как GyroHaler® или OmniHaler® (оба от компании Vectura), устройство на резервуарной основе, такие как Clickhaler® или Duohaler® (Vectura) и ингалятор ARCUS® (Civitas Therapeutics). В одном варианте осуществления устройство DPI выбрано из ингаляторов Pulmatrix™, и Hovione Twincaps и XCaps™. В одном варианте осуществления устройство выбрано из группы, состоящей из XCaps, Plastiape® RS01 модель 7 и Plastiape® RS00 модель 8.
[131] В одном варианте осуществления устройство DPI выбрано из группы, состоящей из Accuhaler®, Aerolizer®, Plastiape® RS01 модель 7, Plastiape® RS00 модель 8, ConixTM, Rotahaler®, TwinCaps®, XCaps®, FlowCaps®, Turbuhaler®, NextHaler®, CycloHaler®, Revolizer ТМ, Diskhaler®, Diskus®, Spinhaler, Handihaler®, микродозного ингалятора, GyroHaler®, OmniHaler®, Clickhaler® или Duohaler® (Vectura), или активируемого вдохом ингалятора ARCUS® (Civitas Therapeutics).
[132] В одном варианте осуществления устройство DPI выбрано из группы, состоящей из Arcus™, Aspirair™, Axahaler™, Breezhaler™, Clickhaler™, Conix Dry™, Cricket™, Dreamboat™, Genuair™, Gemini™, Inspiromatic™, iSPERSE™, MicroDose™, Next DPI™, Prohaler™, Pulmojet™, Pulvinal™, Solis™, Taifun™, Taper Dry™, Trivai™, Novolizer™, Podhaler™, Skyehaler™, Spiromax™, Twincaps/Flowcaps™ и Turbuhaler™. В одном варианте осуществления устройство DPI приспособлено для доставки сухого порошка из капсулы или блистера, содержащих единичную дозу сухого порошка, или многодозовое устройство для ингаляции сухого порошка приспособлено для доставки при срабатывании, например, от 5 до 25 мг сухого порошка.
Доставка с помощью дозирующего ингалятора под давлением (pMDI)
[133] В другом варианте осуществления рапамицин доставляется в виде аэрозольных частиц из контейнера или диспенсера, находящихся под давлением и содержащих подходящий пропеллент, как описано выше, в сочетании с композициями на основе пропеллента. В одном варианте осуществления ингалятор представляет собой ингалятор на основе пропеллента, такой как устройство pMDI, выделяющее отмеренные дозы рапамицина при каждом срабатывании. Типичное устройство pMDI содержит контейнер, в котором находится лекарственный препарат, клапан, дозирующий лекарственный препарат и мундштук. В одном из аспектов этого варианта осуществления рапамицин представляет собой суспензию в пропелленте. В контексте этого варианта осуществления рапамицин приготовлен в виде мелкого порошка, который суспендируют в сжиженном пропелленте или смеси пропеллентов. Суспензию затем сохраняют в герметичном контейнере под давлением, достаточным для поддержания пропеллента в жидком состоянии. В другом варианте осуществления рапамицин приготовлен в виде раствора. В контексте этого варианта осуществления рапамицина растворен в сжиженном пропелленте или смеси пропеллентов. В одном варианте осуществления композиция дополнительно содержит стабилизатор в количестве, подходящем для придания композиции устойчивости против осаждения, отстаивания или флокуляции в течение времени, достаточного для того, чтобы воспроизводить дозирование рапамицина после перемешивания композиции. Стабилизатор может присутствовать в избытке в количестве приблизительно от 10 частей по весу приблизительно до 5000 частей по весу в пересчете на один миллион частей от общего веса аэрозольной композиции. В одном варианте осуществления изобретения жидким носителем является 1,1,1,2-тетрафторэтан, 1,1,1,2,3,3,3-гептафторпропан или их смесь. В другом варианте осуществления изобретения жидкий носитель представляет собой углеводород (например, n-бутан, пропан, изопентан или их смесь). Композиция может дополнительно содержать сорастворитель (например, этанол или другой подходящий сорастворитель).
[134] В одном варианте осуществления способов по изобретению содержащая рапамицин аэрозольная композиция дополнительно содержит дополнительный лекарственный препарат. В одном из аспектов этого варианта осуществления дополнительный препарат выбран из группы, состоящей из кортикостероидов, антагонистов рецептора эстрогена, антихолинергических средств, бета-агонистов, нестероидных противовоспалительных средств, антибиотиков из группы макролидов, бронхолитических средств, ингибиторов лейкотриеновых рецепторов, антагонистов мускариновых рецепторов, кромолина сульфата и их комбинации.
Добавки
[135] Аэрозольные композиции согласно изобретению могут содержать одну или несколько добавок, в дополнение к любому носителю или разбавителю (такому как лактоза или маннит), который присутствует в композиции. В одном варианте осуществления одна или несколько добавок содержит или состоит из одного или нескольких поверхностно-активных веществ. Поверхностно-активные вещества обычно имеют одну или несколько длинных алифатических цепей, таких как жирные кислоты, которые дают им возможность встраиваться непосредственно в липидные структуры клеток для усиления проницаемости и абсорбции лекарственного препарата. Обычно для характеристики относительной гидрофильности и гидрофобности поверхностно-активных веществ используется эмпирический параметр, а именно гидрофильно-липофильный баланс (показатель "ГЛБ"). Поверхностно-активные вещества с более низкими значениями ГЛБ являются более гидрофобными и обладают большей растворимостью в маслах, тогда как поверхностно-активные вещества с более высокими значениями ГЛБ являются более гидрофильными и характеризуются большей растворимостью в водных растворах. Таким образом, гидрофильными поверхностно-активными веществами, как правило, считаются вещества, у которых значение ГЛБ больше, чем приблизительно 10, и гидрофобными поверхностно-активными веществами, как правило, считаются вещества, у которых значение ГЛБ менее чем приблизительно 10. Вместе с тем, указанные значения ГЛБ являются только ориентиром, так как для многих поверхностно-активных веществ значения ГЛБ могут отличаться не менее чем приблизительно на 8 единиц ГЛБ в зависимости от эмпирического способа, выбранного для определения значения ГЛБ.
[136] В перечень поверхностно-активных веществ для использования в аэрозольных композициях по настоящему изобретению входят полиэтиленгликоль (ПЭГ)-жирные кислоты и моно- и диэфиры ПЭГ-жирных кислот, сложные эфиры глицерина и ПЭГ, продукты переэтерификации спиртов и масел, полиглицерил- жирные кислоты, сложные эфиры пропиленгликоля и жирных кислот, производные стеринов и стеролов, сложные эфиры полиэтиленгликоля и сорбита и жирных кислот, алкилэфиры полиэтиленгликоля, сахар и его производные, алкилфенолы полиэтиленгликоля, блок-сополимеры полиоксиэтилена-полиоксипропилена (РОЕ-РОР), сложные эфиры сорбита и жирных кислот, ионные поверхностно-активные вещества, жирорастворимые витамины и их соли, водорастворимые витамины и их амфифильные производные, аминокислоты и их соли, и органические кислоты и их сложные эфиры и ангидриды. Ниже более подробно описано каждое из упомянутых веществ.
Сложные эфиры ПЭГ и жирных кислот
[137] Несмотря на то, что сам по себе полиэтиленгликоль (ПЭГ) не действует в качестве поверхностно-активного вещества, различные сложные эфиры ПЭГ и жирных кислот обладают полезными поверхностно-активными свойствами. Среди моноэфиров ПЭГ и жирных кислот, наиболее полезными в вариантах осуществления настоящего изобретения являются эфиры лауриновой кислоты, олеиновой кислоты и стеариновой кислоты. Предпочтительные гидрофильные поверхностно-активные вещества включают ПЭГ-8 лаурат, ПЭГ-8 олеат, ПЭГ-8 стеарат, ПЭГ-9 олеат, ПЭГ-10 лаурат, ПЭГ-10 олеат, ПЭГ-12 лаурат, ПЭГ-12 олеат, ПЭГ-15 олеат, ПЭГ-20 лаурат и ПЭГ-20 олеат. Значение ГЛБ находится в диапазоне от 4 до 20.
[138] Диэфиры полиэтиленгликоля и жирных кислот также подходят для использования в качестве поверхностно-активных веществ в композициях согласно вариантам осуществления настоящего изобретения. Наиболее предпочтительные гидрофильные поверхностно-активные вещества включают ПЭГ-20 дилаурат, ПЭГ-20 диолеат, ПЭГ-20 дистеарат, ПЭГ-32 дилаурат и ПЭГ-32 диолеат. Значение ГЛБ находится в диапазоне от 5 до 15.
[139] В общем, смеси поверхностно-активных веществ также могут быть полезными в вариантах осуществления настоящего изобретения, в том числе смеси двух или нескольких коммерческих поверхностно-активных веществ, а также смеси поверхностно-активных веществ с другой добавкой или добавками. Несколько сложных эфиров жирных кислот ПЭГ зарегистрированы для продажи в виде смесей или моно- и диэфиров.
Сложные эфиры жирных кислот, полиэтиленгликоля и глицерина
[140] Предпочтительные гидрофильные поверхностно-активные вещества представляют собой ПЭГ-20 глицериллаурат, ПЭГ-30 глицериллаурат, ПЭГ-40 глицериллаурат, ПЭГ-20 глицерилолеат и ПЭГ-30 глицерилолеат.
Продукты переэтерификации спиртов и масел
[141] Большое количество поверхностно-активных веществ различной степени гидрофобности или гидрофильности может быть получено путем реакции спиртов или полиспирта с различными природными и/или гидрогенизированными маслами. Чаще всего используемые масла представляют собой касторовое масло, или гидрогенизированное касторовое масло или пищевое растительное масло, такое как кукурузное масло, оливковое масло, арахисовое масло, пальмоядровое масло, абрикосовое масло или миндальное масло. Предпочтительные спирты включают глицерин, пропиленгликоль, этиленгликоль, полиэтиленгликоль, сорбит и пентаэритрит. В перечень поверхностно-активных веществ на основе переэтерифицированных спиртов и масел предпочтительно входят такие гидрофильные поверхностно-активные вещества, как ПЭГ-35 касторовое масло (Incrocas-35), ПЭГ-40 касторовое масло (Cremophor RH 40), ПЭГ-25 триолеат (TAGAT.RTM. TO), ПЭГ-60 глицериды кукурузы (Crovol M70), ПЭГ-60 миндальное масло (Crovol A70), ПЭГ-40 пальмоядровое масло (Crovol PK70), ПЭГ-50 касторовое масло (Emalex C-50), ПЭГ-50 касторовое масло (Emalex НС-50), ПЭГ-8 каприловые/каприновые глицериды (Labrasol) и ПЭГ-6 каприловые/каприновые глицериды (Softigen 767). Предпочтительные гидрофобные поверхностно-активные вещества этого класса включают ПЭГ-5 гидрогенизированное касторовое масло, ПЭГ-7 гидрогенизированное касторовое масло, ПЭГ-9 гидрогенизированное касторовое масло, ПЭГ-6 кукурузное масло (Labrafil.RTM. М 2125 CS), ПЭГ-6 миндальное масло (Labrafil.RTM. М 1966 CS), ПЭГ-6 масло из абрикосовых косточек (Labrafil.RTM. M 1944 CS), ПЭГ-6 оливковое масло (Labrafil.RTM. М 1980 CS), ПЭГ-6 арахисовое масло (Labrafil.RTM. М 1969 CS), ПЭГ-6 гидрогенизированное пальмоядровое масло (Labrafil.RTM. М 2130 BS), ПЭГ-6 пальмоядровое масло (LabrafiLRTM. M 2130 CS), ПЭГ-6 триолеин (Labrafil.RTM.b M 2735 CS), ПЭГ-8 кукурузное масло (LabrafiLRTM. WL 2609 BS), ПЭГ-20 глицериды кукурузы (Crovol M40) и ПЭГ-20 миндальные глицериды (Crovol А40).
Полиглицерил - жирные кислоты
[142] Сложные эфиры полиглицерина и жирных кислот также являются подходящими поверхностно-активными веществами для использования в вариантах осуществления настоящего изобретения. Среди сложных эфиров полиглицерила - жирных кислот предпочтительные гидрофобные поверхностно-активные вещества включают полиглицерил-олеат (Plurol Oleique), полиглицерил-2 диолеат (Nikkol DGDO), полиглицерил-10 триолеат, полиглицерил стеарат, полиглицерил лаурат, полиглицерил миристат, полиглицерил пальмитат и полиглицерил линолеат. Предпочтительные гидрофильные поверхностно-активные вещества включают полиглицерил-10 лаурат (Nikkol Decaglyn 1-L), полиглицерил-10 олеат (Nikkol Decaglyn 1-0) и полиглицерил-10 моно, диолеат (Caprol.RTM. ПЭГ 860), полиглицерил-10 стеарат, полиглицерил-10 лаурат, полиглицерил-10 миристат, полиглицерил-10 пальмитат, полиглицерил-10 линолеат, полиглицерил-6 стеарат, полиглицерил-6 лаурат, полиглицерил-6 миристат, полиглицерил-6 пальмитат и полиглицерил-6 линолеат. Также предпочтительными поверхностно-активными веществами являются полиглицерил-полирицинолеаты (Polymuls).
Сложные эфиры пропиленгликоля и жирных кислот
[143] Сложные эфиры пропиленгликоля и жирных кислот являются поверхностно-активные веществами, подходящими для использования в вариантах осуществления настоящего изобретения. В этом классе поверхностно-активных веществ предпочтительные гидрофобные поверхностно-активные вещества включают пропиленгликоль монолаурат (Lauroglycol FCC), пропиленгликоль рицинолеат (Propymuls), пропиленгликоль моноолеат (Myverol P-06), пропиленгликоль дикаприлат / дикапрат (Captex.RTM. 200) и пропиленгликоль диоктаноат (Captex.RTM. 800).
Стерин и стериновые производные
[144] Стерины и производные стеринов представляют собой поверхностно-активные вещества, подходящие для использования в вариантах осуществления настоящего изобретения. Предпочтительные производные включают производные полиэтиленгликоля. Предпочтительным поверхностно-активным веществом в этом классе является эфир ПЭГ-24 и холестерина (Solulan С-24).
Сложные эфиры полиэтиленгликоль-сорбита и жирных кислот
[145] Доступны различные сложные эфиры ПЭГ-сорбита и жирных кислот, подходящие для использования в качестве поверхностно-активных веществ в вариантах осуществления настоящего изобретения. Среди ПЭГ-сорбитановых сложных эфиров жирных кислот предпочтительные поверхностно-активные вещества включают ПЭГ-20 сорбитмонолаурат (Твин-20), ПЭГ-20 сорбитмонопальмитат (твин-40), ПЭГ-20 сорбитмоностеарат (Твин-60), и ПЭГ-20 сорбитмоноолеат (Твин-80).
Алкилэфиры полиэтиленгликоля
[146] Эфиры полиэтиленгликоля и алкиловых спиртов являются подходящими поверхностно-активными веществами для использования в вариантах осуществления настоящего изобретения. Предпочтительные эфиры включают ПЭГ-3 олеиловый эфир (Volpo 3) и ПЭГ-4 лауриловый эфир (Brij 30).
Сахар и его производные
[147] Производные сахаров представляют собой поверхностно-активные вещества, подходящие для использования в вариантах осуществления настоящего изобретения. Предпочтительные поверхностно-активные вещества этого класса включают сахарозу монопальмитат, сахарозу монолаурат, деканоил-N-метилглюкамид, n-децил-β-D-глюкопиранозид, n-децил-β-D-мальтопиранозид, n-додецил -D-глюкопиранозид, n-додецил-β-D-мальтозид, гептаноил-N-метилглюкамид, n-гептил-β-D-глюкопиранозид, n-heptyl-β-D-тиоглюкозид, n-гексил-β-В-глюкопиранозид, нонаноил-N-метилглюкамид, n-нонил-β-D-глюкопиранозид, октаноил-N-метилглюкамид, n-октил-β-D-глюкопиранозид и октил-β-D-тиоглюкопиранозид.
Алкилфенолы полиэтиленгликоля
[148] Для использования в вариантах осуществления настоящего изобретения подходят некоторые ПЭГ-алкилфенольные поверхностно-активные вещества, такие, как ПЭГ 10-100 нонилфенол и ПЭГ-15-100 октилфенолэфир, Тилоксапол, октоксинол и ноноксинол.
Блок-сополимеры полиоксиэтилена-полиоксипропилена (РОЕ-РОР)
[149] Блок-сополимеры POE-POP представляют собой уникальный класс полимерных поверхностно-активных веществ. Уникальная структура поверхностно-активных веществ с гидрофильным POE остатком и гидрофобным POP остатком в строго определенных соотношениях и положениях создает широкое разнообразие поверхностно-активных веществ, подходящих для использования в вариантах осуществления настоящего изобретения. Эти поверхностно-активные вещества доступны под различными торговыми марками, включающими вещества серии Synperonic PE (ICI), серии Pluronic.RTM. (BASF), Emkalyx, Lutrol (BASF), Supronic, Monolan, Pluracare и Plurodac. Указанные полимеры можно обозначить под общим термином "полоксамер" (CAS 9003-11-6). Эти полимеры имеют формулу: HO(C2H4O)a(C3H6O)b(C2H4O)aH, где "а" и "b" обозначают количество единиц полиоксиэтилена и полиоксипропилена соответственно.
[150] Предпочтительные гидрофильные поверхностно-активные вещества этого класса включают полоксамеры 108, 188, 217, 238, 288, 338 и 407. Предпочтительные гидрофобные поверхностно-активные вещества этого класса включают полоксамеры 124, 182, 183, 212, 331, и 335.
Сложные эфиры сорбита и жирных кислот
[151] Сложные эфиры сорбита и жирных кислот представляют собой поверхностно-активные вещества, подходящие для использования в вариантах осуществления настоящего изобретения. Среди таких эфиров предпочтительные гидрофобные поверхностно-активные вещества включают сорбит монолаурат (Arlacel 20), сорбит монопальмитат (Span-40), сорбит моноолеат (Span-80), сорбит моностеарат.
[152] Амфифильное производное витамина С сорбитмонопальмитат (который обладает активностью витамина C), может выполнять две важные функции в системах солюбилизации. Во-первых, сорбитмонопальмитат имеет эффективные полярные группы, которые могут модулировать микроокружение. Эти полярные группы являются теми же группами, которые делают сам витамин С (аскорбиновую кислоту) одним из наиболее доступных водорастворимых органических твердых соединений: растворимость аскорбиновой кислоты в воде составляет приблизительно до 30% вес./вес. (например, очень близка к растворимости хлорида натрия). И во-вторых, при повышении уровня рН происходит преобразование фракции аскорбилпальмитата до более растворимой соли, такой как аскорбилпальмитат натрия.
Ионные поверхностно-активные вещества
[153] Ионные поверхностно-активные вещества, включающие катионные, анионные и цвиттерионные поверхностно-активные вещества, являются подходящими гидрофильными поверхностно-активными веществами для использования в вариантах осуществления настоящего изобретения. Предпочтительные ионные поверхностно-активные вещества включают соли четвертичного аммония, соли жирных кислот и желчных солей. В частности, предпочтительные ионные поверхностно-активные вещества включают бензалкония хлорид, бензетония хлорид, цетилпиридиния хлорид, додецил триметиламмония бромид, додецилсульфаты натрия, диалкилметилбензил аммония хлорид, эдрофония хлорид, домифена бромид, диалкилэфиры натрий сульфон-янтарной кислоты, диоктилнатрийсульфосукцинат, натрия холат и натрия таурохолат. Предпочтительными добавками являются упомянутые соли четвертичного аммония. Они могут быть растворены и в органических растворителях (таких как этанол, ацетон и толуол) и в воде. Они особенно полезны для покрытия медицинских устройств, поскольку упрощают технологию подготовки и нанесения покрытия и имеют хорошие адгезионные свойства. Нерастворимые в воде лекарства обычно растворяются в органических растворителях.
Жирорастворимые витамины и их соли
[154] Витамины А, D, Е и К во множестве их различных форм и форм провитаминов считаются жирорастворимыми витаминами, и в дополнение к этому, также существует ряд других витаминов и витаминных источников или близкородственных веществ, которые являются жирорастворимыми и имеют полярные группы и относительно высокие коэффициенты распределения октанол-вода. Известно, что общий класс таких соединений имеет историю безопасного использования и высокий коэффициент соотношения пользы и риска, что делает их полезными в качестве добавок в вариантах осуществления настоящего изобретения.
[155] Далее приведены примеры производных и/или источников жирорастворимых витаминов, которые также полезны в качестве добавок: альфа-токоферол, бета-токоферол, гамма-токоферол, дельта-токоферол, токоферол ацетат, эргостерин, 1-альфа-гидроксихолекальциферол, витамин D2, витамин D3, альфа-каротин, бета-каротин, гамма-каротин, витамин А, фурсултиамин, метилолрибофлавин, октотиамин, просультиамин, рибофлавин, винтиамол, дигидровитамин К1, менадиолдиацетат, менадиолдибутират, менадиолдисульфат, менадиол, витамин К1, оксид витамина К1, витамины К2 и витамин К-S (II). Фолиевая кислота также относится к этому типу веществ, и хотя она растворима в воде при физиологическом значении рН, в ее рецептуре может использоваться форма свободной кислоты. Другие производные жирорастворимых витаминов, полезных в вариантах осуществления настоящего изобретения, могут быть легко получены с помощью хорошо известных химических реакций с гидрофильными молекулами.
Водорастворимые витамины и их амфифильные производные
[156] К водорастворимым витаминам относятся витамины В, С, U, пантотеновая кислота, фолиевая кислота и некоторые из витаминов/провитаминов группы менадиона в своих многочисленных различных формах. Они также могут образовывать амфифильные формы в виде конъюгата или комплекса с гидрофобными остатками или поливалентными ионами, и такие амфифильные формы имеют относительно высокие коэффициенты распределения октанол-вода и полярные группы. Опять же, такие соединения могут обладать низкой токсичностью и высоким коэффициентом соотношения риска и пользы, что делает их полезными в качестве добавок в вариантах осуществления настоящего изобретения. Соли указанных веществ также могут быть полезны в настоящем изобретении в качестве добавок. Примеры водорастворимых витаминов и их производных включают без ограничения ацетиамин, бенфотиамин, пантотеновую кислоту, цетотиамин, циклотиамин, декспантенол, ниацинамид, никотиновую кислоту, пиридоксаль-5-фосфат, никотинамид аскорбат, рибофлавин, рибофлавин фосфат, тиамин, фолиевую кислоту, менадиолдифосфат, менадион бисульфит натрия, менадоксим, витамин В12, витамин К5, витамин К6, витамин К6 и витамин U. Кроме того, как упоминалось выше, фолиевая кислота в виде соли также является растворимой в воде, при широком диапазоне рН, в том числе при физиологическом уровне рН.
[157] Соединения, в которых присутствует амино- или другая основная группа, можно легко модифицировать с помощью простой кислотно-щелочной реакции с кислотой, содержащей гидрофобную группу, такой как жирная кислота (в частности, лауриновая, олеиновая, миристиновая, пальмитиновая, стеариновая или 2-этилгексановая кислота), слаборастворимой аминокислотой, бензойной кислотой, салициловой кислотой или кислотным жирорастворимым витамином (таким как рибофлавин). Другие соединения могут быть получены путем взаимодействия такой кислоты с другой группой в витамине, такой как гидроксильная группа, с образованием связи, например, сложноэфирной связи и т.д. Производные водорастворимого витамина, содержащие кислотную группу, могут быть получены в реакции с веществом, содержащим гидрофобную группу, таким как стеариламин или рибофлавин, например, для получения соединения, полезного в вариантах осуществления настоящего изобретения. Связывание цепи пальмитата с витамином С приводит к образованию аскорбилпальмитата.
Аминокислоты и их соли
[158] Другие полезные добавки в вариантах осуществления настоящего изобретения представляют собой аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, цистин, глутаминовую кислоту, глутамин, глицин, гистидин, пролин, изолейцин, лейцин, лизин, метионин, фенилаланин, серин, треонин, триптофан, тирозин, валин, а также их производные
[159] Некоторые аминокислоты в своей цвиттерионной форме и/или в форме соли с одновалентным или многовалентным ионом имеют полярные группы, относительно высокие коэффициенты распределения октанол-вода, и могут быть полезными в вариантах осуществления настоящего изобретения. В контексте настоящего описания "малорастворимой аминокислотой" считается аминокислота, растворимость которой в небуферной воде составляет менее чем приблизительно 4% (40 мг/мл). К таким аминокислотам относятся цистин, тирозин, триптофан, лейцин, изолейцин, фенилаланин, аспарагин, аспарагиновая кислота, глутаминовая кислота и метионин.
Органические кислоты и их эфиры и ангидриды
[160] Примерами таких соединений являются уксусная кислота и ангидрид, бензойная кислота и ангидрид, ацетилсалициловая кислота, дифлунизал, 2-гидроксиэтил эфир салициловой кислоты, диангидрид диэтилентриаминопентауксусной кислоты, этилендиамин-тетрауксусный диангидрид, малеиновая кислота и ангидрид, янтарная кислота и ангидрид, дигликолевой ангидрид, глутаровый ангидрид, аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, щавелевая кислота, аспарагиновая кислота, никотиновая кислота, 2-пирролидон-5-карбоновая кислота и 2-пирролидон.
[161] Эти сложные эфиры и ангидриды растворимы в органических растворителях, таких как этанол, ацетон, метилэтилкетон, этилацетат. Нерастворимые в воде лекарственные препараты можно растворять в органическом растворителе с упомянутыми сложными эфирами и ангидридами, а затем с легкостью наносить на медицинское устройство, и затем подвергать гидролизу при высоком уровне рН. Гидролизованные ангидриды или сложные эфиры представляют собой кислоты или спирты, которые являются растворимыми в воде и могут эффективно осуществлять перенос лекарства из устройства в стенки сосудов.
ПРИМЕРЫ
[162] Настоящее изобретение далее описано в следующих примерах, которые не ограничивают объем изобретения, приведенный в формуле изобретения.
Пример 1: Водная аэрозольная композиция
Водная композиция рапамицина, в качестве примера, была получена с использованием следующих компонентов:
[163] Методика смешивания: в мерной колбе янтарного цвета объемом 1000 мл смешивали 250 г пропиленгликоля и 250 г этанола до однородного состояния. Затем в растворе пропиленгликоля и этанола последовательно растворяли вначале 100 мг рапамицина, затем 20 мг полисорбата 80. Добавляли воду, чтобы довести объем до 1000 мл, и взбалтывали или применяли ультразвук до достижения однородности и полного растворения рапамицина. Хранили при контролируемой температуре в защищенном от света места.
Пример 2: Сухая порошковая композиция
[164] Серия 06RP68.HQ00008 и 06RP68.HQ00009. Каждая из этих двух композиций представляет собой смесь микронизированных частиц лекарства (рапамицин), диспергированных на поверхности частиц лактозного носителя. Конечная композиция каждой серии содержит 1% (вес./вес.) частиц лекарственного препарата со средним диаметром приблизительно 2,60 мкм и 3,00 мкм, соответственно. Частицы лекарственного препарата, имеющие размер в подходящем диапазоне, изготовлены путем мокрого шлифования (06RP68.HQ00008) или размола на струйном измельчителе (06RP68.HQ00009), как описано ниже. В этом примере используется 1% (вес./вес.) рапамицин, но, вместе с тем, можно практиковать диапазон от 0,5 до 20%. Частицы носителя состоят из смеси двух носителей, а именно, Respitose® SV003, присутствующего в количестве 95,5% (вес./вес.) и имеющего размеры частиц приблизительно от 30 до 100 микрон (эквивалентный сферический диаметр), и Respitose® LH300 (Lactohale 300), присутствующего в количестве 5,5% (вес./вес.) и имеющего размер частиц менее 10 мкм (эквивалентный сферический диаметр). После смешивания упомянутые смеси анализировали для подтверждения гомогенности и содержания лекарственного препарата в количестве 1%.
[165] Чтобы уменьшить агломерацию частиц лекарственного препарата и способствовать аэрозолизации частиц лекарственного препарата, в него необязательно вводят несколько других наполнителей. Необязательные наполнители включают фосфолипиды, такие как дипальмитилфосфатидилхолин (DPPC) и лецитин, а также соли металлов жирных кислот, такие как стеарат магния. Они могут быть нанесены на частицы носителя в весовом соотношении наполнителя и крупной частицы носителя в диапазоне от 0,01 до 0,5%.
[166] Заполнение капсул: для получения лекарственного продукта 20 мг порошковых смесей из серии 06RP68.HQ00008 и серии 06RP68.HQ00009 были загружены в гидроксипропилметилцеллюлозные капсулы (ГПМЦ) размера № 3. Для этих смесей практически реализуемо загружать в капсулы 3-го размера от 5 до 35 миллиграммов препарата и высвобождать загруженную смесь из капсулы больше чем на 95% при срабатывании устройств Plastiape® RS01 модель 7 или Plastiape® RS00 модель 8, при скорости потока в диапазоне от 60 до 100 литров в минуту.
Пример 3: Определение рапамицина в легких и крови мышей C57BL6 после введения путем орофарингеальной аспирации (ОФА) и перорального введения через зонд
[167] Это исследование было проведено с целью оценки концентрации рапамицина у самцов мышей C57BL/6 после введения рапамицина в очень высокой целевой дозе 1 мг/кг через зонд и орофарингеальной аспирации (ОФА). Был разработан способ анализа рапамицина в крови и легочном гомогенате мышей с использованием жидкостной хроматографии с тандемной масс-спектрометрической детекцией (LC-MS/MS). Были проанализированы калибровочные кривые рапамицина с использованием трех вариантов концентрации в диапазоне от 1 нг/мл до 2000 нг/мл в крови мышей, и в диапазоне от 2 нг/мл до 20000 нг/мл в легочном гомогенате мышей. Показатели достоверности, точности и линейности были в пределах ожидаемых диапазонов.
[168] В предварительных исследованиях оценивали эффективность доставки носителя в легкие посредством орофарингеальной аспирации в объеме 50 мкл на одну мышь путем введения красителя Эванса синего. Присутствие синего красителя только в легких было подтверждено визуально, при этом отсутствие синего красителя в желудке показало, что с помощью используемой методики удалось избежать попадания в желудок.
[169] Рапамицин вводили самцам мышей C57BL/6 (n = 6) через зонд в дозе 1,0 мг/кг перорально или посредством ОФА. Пероральная доза была разработана с использованием фармацевтической пероральной жидкой композиции рапамуна Rapamune Oral® (Pfizer). Рапамицин для ОФА готовили путем растворения тестируемого препарата в соответствующем объеме этилового спирта, а затем добавляли соответствующий объем воды с получением раствора 10%-ного раствора этанола при концентрации рапамицина 1 мг/мл. Рапамицин вводили двум группам по 6 самцов мышей C57BL/6 путем ОФА под анестезией изофлураном. Дополнительная группа из 6 мышей получала только носитель (10% этанола в воде). Через 1 час после введения группа из 6 мышей, получавших рапамицин перорально и посредством ОФА, была умерщвлена, забор крови проводили путем пункции сердца, и легкие иссекали. Остальным мышей в каждой группе вводили рапамицин или носитель путем ОФА и наблюдали их дополнительно в течение трех дней. При аутопсии на 72-ом часу осуществляли забор крови путем пункции сердца и иссекали легкие. В течение периода 72 часа после введения дозы у мышей, которым вводили рапамицин или носитель, побочных эффектов не наблюдалось.
[170] Концентрацию рапамицина определяли в собранной крови и в гомогенате легких с помощью LC-MS/MS. Через 1 час после введения рапамицина путем ОФА концентрация рапамицина была примерно в 6 раз выше в легочной ткани (3794±1259 нг/г ткани), чем в крови (641±220 нг/мл). После перорального введения аналогичной дозы рапамицина концентрации рапамицина в легких и крови через 1 час составляли 71±43 нг/г и 23±16 нг/мл, соответственно. Значения концентрации в легочном гомогенате после ОФА были в 53 раза выше, чем значения после перорального введения такой же высокой дозы (1 мг/кг) рапамицина. Данные показывают, что доставка более низких доз рапамицина в легкие (уровни дозы, которые не насыщают систему) приводит к концентрации рапамицина в легких, которая может быть достигнута путем перорального введения, но при значительно меньшем уровне рапамицина в крови, чем при пероральном введении.
Материалы и способы
[171] Испытываемое вещество: сиролимус (рапамун, рапамицин) MW 914,172, C51N79NO12, номер CAS: 53123-88-9. Источник (для перорального введения через зонд): Rapamune Oral® (Pfizer), Лот №: MWGT, срок годности: 07.2016. Источник (для ОФА): рапамицин (сиролимус) твердая форма, LC Laboratories, Woburn М.А., Лот №: ASW-127, срок годности: 12.2023.
[172] Животные: Самцы мышей C57BL/6, приблизительно в возрасте 8 недель, получены в лаборатории Charles River Laboratories, Inc, Inc, Raleigh, NC. Животных кормили сертифицированным для грызунов кормом Purina Chow # 5002 и давали водопроводную воду без ограничения. Анализ каждой серии корма на содержание питательных веществ и возможных примесей проводился поставщиком, проверялся директором исследования и регистрировался в журнале исследования. Корма хранились при температуре приблизительно 60-70°F, срок их использования не мог превышать шести месяцев от даты размола. Мышей содержали в поликарбонатных клетках с верхней решеткой из нержавеющей стали и бутылкой с водой внутри (по одной мыши в каждой клетке). Клетки для мышей имели размеры приблизительно 11,5"×7,5"×5" высоты (70 кв. дюймов площади пола). Подстилка, с которой контактировали мыши, представляла собой опилки из твердых пород Sani-Chips (P. J. Murphy Forest Products Co.; Montville, NJ). Мышей содержали на карантине в течение 5 дней перед началом исследования. Перед выпуском животных из карантина их обследовал ветеринар или уполномоченный специалист. Температура и относительная влажность в RTI помещениях для животных непрерывно контролировалась, регулировалась и регистрировалась с помощью автоматизированной системы (система Siebe/Barber - Colman Network 8000 с просмотром 4.4.1 программное обеспечение Signal® [Siebe Environmental Controls (SEC)/Barber-Colman Company; Loves Park, IL]). Желательные условия окружающей среды представляли собой температуру в диапазоне от 64 до 79°F (от 18°C до 26°C) и относительную влажность от 30 до 70%, при 12-часовом цикле освещения в сутки. В конце прижизненной фазы мышей умерщвляли путем чрезмерного воздействия диоксида углерода.
[173] Подготовка химического анализа: готовили краситель Эванс синий в количестве 0,5% вес/объем в стерильной дистиллированной воде. Препарат Rapamune Oral® вводили перорально в том виде, в котором он поставляется. Рапамицин (твердый) растворяли в этаноле и разводили стерильной дистиллированной водой для получения конечной концентрации 0,5 мг/мл в 10%-ном этаноле.
[174] Введение дозы: каждое животное взвешивали перед введением для количественного определения вводимой дозы. Однократную дозу через зонд вводили с помощью стеклянного шприца 100 мкл (Hamilton, Reno, NV), снабженного иглой из нержавеющей стали 20-G с шаровидным наконечником для зондового введения (Popper&Sons Inc., New Hyde Park, NY). Введенную дозу для каждого животного определяли по весу полного шприца минус вес пустого шприца. Время введения регистрировали. Введение доз животным проводили с разнесением по времени, чтобы можно было забирать кровь в соответствующие точки времени. Введенные дозы композиций для каждой группы показаны ниже.
[175] В группе животных с введением путем орофарингеальной аспирации каждой мыши вводили однократную дозу рапамицина (50 мкл) под анестезией изофлураном, используя стеклянный шприц 100 мкл (Hamilton, Reno, NV), снабженный иглой из нержавеющей стали 20-G с шаровидным наконечником для зондового введения
(Popper&Sons Inc., New Hyde Park, NY). Мышей взвешивали перед введением дозы, и регистрировали вес дозы введенного рапамицина. Каждую мышь анестезировали изофлураном и обездвиживали с открытым ртом. Язык удерживали с одной стороны рта с помощью пинцета, и медленно впрыскивали дозу в дистальную часть ротовой полости. Ноздри закрывали пальцем в течение двух вдохов для гарантированной аспирации (Rao et al., 2003).
Краткая схема исследования
[176] Сбор образцов крови и легких: по окончании исследования (через 1 час или 72 часа после введения) мышей анестезировали путем воздействия CO2, и кровь собирали путем пункции сердца с использованием гидрофосфата ЭДТА в качестве антикоагулянта. Легочную ткань иссекали и разделяли на правое и левое легкое. Левое легкое использовали для анализа, а правое легкое быстро замораживали в жидком азоте и хранили при -70°С для последующего анализа.
[177] Анализ образцов на рапамицин способом LC-MS/MS: подготовку LC-MS/MS для анализа рапамицина в легких и крови проводили на основе опубликованной методики Wu et al. (2012). Согласно опубликованному способу, объемы крови и легочного гомогената были значительно уменьшены. В качестве внутреннего стандарта использовали триамцинолон.
[178] Легочный гомогенат был приготовлен путем гомогенизации взвешенных образцов легких с помощью шарикоподшипников 2,8 мм в гомогенизаторе SPEX SamplePrep 2010 Geno/Grinder, с тканью и деионизованной водой (1:3 вес/объем).
[179] Концентрации стандартов были подобраны таким образом, что каждый стандарт исходил из альтернативного маточного стандартного раствора. Для количественного определения анализируемого вещества была использована шести-точечная калибровочная кривая, каждая из которых была построена трижды. Для построения кривой использовалась простая модель линейной регрессии с взвешиванием или без взвешивания. Диапазон определяемых концентраций составлял от 1 до 2000 нг/мл в крови и от 2 до 2000 нг/мл в гомогенате легких.
[180] Приемлемыми считались следующие рабочие параметры способа: коэффициент детерминации, r2 ≥ 0,98 для отношения концентрация - ответ; точность ≤± 15% (при концентрациях выше предела количественного определения LOQ) или ≤± 20% (для концентрации выше LOQ) от номинального значения. Коэффициент r2 во всем анализе превышал 0,999.
[181] Тридцать (30) мкл матрицы, 30 мкл пикового раствора (метанол для заготовок и образцов), 10 мкл внутреннего стандартного раствора (в MeOH) и 90 мкл MeOH накапывали пипеткой в микроцентрифужные пробирки, кратковременно встряхивали на вортексе и затем центрифугировали в течение 6 минут при 10000 оборотов в минуту примерно при 4°С. Аликвотное количество (90 мкл) супернатанта переносили в объемные вставки LC, после чего анализировали способом LC-MS/MS (Таблица 2).
Способ LC-MS/MS
[182] Сбор данных и отчет: данные исследования были собраны и представлены в системе Debra™ версии 5.5.10.72 (LabLogic Systems Ltd., Sheffield, Англия). В них входят данные о весе тела животного, вводимой дозе, времени введения и времени взятия образцов. Расчеты по введенным дозам и времени сбора образцов были приведены в отчете в системе Debra™.
Результаты
[183] Анализ рапамицина: анализ рапамицина был проведен с образцами крови и легочного гомогената в объеме по 30 мкл. Показаны примеры хроматограмм для рапамицина и внутреннего стандарта в крови и легких (фигуры 1 и 2). До начала построения кривых исследуемых образцов были получены тройные калибровочные кривые для легких и крови, с целью проверки эффективности способа. Диапазон калибровки составлял от 1,0 до 2000 нг/мл для крови и от 1 до 20000 нг/мл для легочного гомогената. Легочный гомогенат был подготовлен с использованием 1 г легочной ткани, гомогенизированной в 3 объемах воды, с получением гомогената 1:4. На фигурах 3 и 4 показаны калибровочные кривые для крови, легочного гомогената и растворителя.
[184] Орофарингеальная аспирация: перед введением рапамицина путем орофарингеальной аспирации вводили краситель Эванс синий для подтверждения доставки дозы в легкие путем ОФА. Мышей анестезировали изофлураном и вводили краситель Эванс синий путем ОФА, с помощью шприца, снабженного тупой иглой. Сразу же после ОФА мышей умерщвляли и визуально обследовали легкие и желудок, для гарантии доставки красителя Эванса синего в легкие и его отсутствия в желудке. Четырем мышам был успешно введен краситель Эванс синий, при этом весь краситель был выявлен в легких и отсутствовал в желудке.
[185] Введение рапамицина: вес дозы введенного раствора определяли путем взвешивания заполненного шприца с раствором дозы перед введением и взвешиванием после введения. Данные о весе дозы введенного раствора использовали для расчета количества введенного рапамицина. Время введения регистрировали как точку 0. Животные в группах 2 и 3 были подвергнуты эвтаназии через 1 час после введения дозы. Животные в группах 4 и 5 наблюдались в течение 72 часов после введения дозы. Не наблюдалось каких-либо существенных клинических признаков ни в одной из групп.
[186] Анализ крови и легких на рапамицин: анализировали содержание рапамицина в крови мышей и гомогенате левого легкого во всех собранных образцах (6 и 7). Образцы правого легкого от каждого животного были сохранены для возможного дальнейшего анализа. Сводные данные об образцах представлены в таблице 3.
Концентрация рапамицина в крови и легких после перорального и отофарингеального (ОФА) введения рапамицина мышам (1 мг/кг)
(нг/г ткани)
(нг/мл)
[187] Во всех наборах образцов была трехкратно проанализирована калибровочная кривая в такой последовательности: стандартный набор, повторная выборка 1, стандартный набор, повторная выборка 2, стандартный набор. Через 1 час после ОФА рапамицина концентрация рапамицина в легочной ткани была примерно в 6 раз выше (3794±1259 нг/г ткани), чем в крови (641±220 нг/мл). После перорального введения аналогичной дозы рапамицина концентрации рапамицина в легких и крови в точке времени 1 час составляли 71±43 нг/г и 23±16 нг/мл, соответственно. Значения концентрации в легочных гомогенатах после ОФА были в 53 раза выше, чем значения концентрации после перорального введения такой же высокой дозы (1 мг/кг) рапамицина.
Обсуждение
[188] В этом исследовании была изучена концентрация рапамицина в крови и легочной ткани после зондового введения рапамицина в готовой лекарственной пероральной форме, а также после орофарингеального введения (ОФА) в виде суспензии, полученной в 10% водном растворе этанола. До 72 часа после введения дозы путем ОФА не выявлено побочных эффектов у мышей, получавших рапамицин или носитель. Перед введением рапамицина был разработан способ анализа, и проводилось введение красителя в легкие с помощью ОФА с целью подтверждения. Концентрации рапамицина в легких после ОФА были в 6 раз выше, чем в крови. Через 72 часа после ОФА концентрация рапамицина в крови была ниже предела количественного определения, но в легких он был обнаружен. Это исследование показало, что рапамицин обладает системной доступностью после введения в легкие, и что его концентрации в легочной ткани значительно превышают концентрацию в крови в ранних и поздних точках времени после доставки в легкие.
[189] Эти результаты дополнительно показывают, что рапамицин, доставляемый непосредственно в легкие, достигает неожиданно высокой локальной концентрации лекарственного препарата в ткани легких по сравнению с кровью. Этот результат был совершенно неожиданным в свете известных фармакологических характеристик рапамицина, предполагающих приблизительно равные концентрации лекарственного препарата в легочной ткани и в крови, поскольку известно, что рапамицин равномерно распределяется во всех тканях организма и должен быстро удаляться из легких вследствие его высокой липофильности. Соответственно, полученные результаты указывают на то, что прямое введение рапамицина в легкие должно создавать возможность достижения достаточно высокой доставляемой дозы для терапевтической эффективности, и при этом системная доступность рапамицина практически не определяется, таким образом устраняется токсичность, связанная с пероральным введением, которая обусловлена системным воздействием препарата. Согласно более ранним исследованиям, токсичность непосредственно для легких также является проблемой, но результаты настоящего изобретения неожиданно показали, что относительно высокие количества рапамицина не оказывают острого токсичного действия на легочную ткань.
ССЫЛКИ
Crowe, A., Bruelisauer, A. & Duerr, L. (1999). Absorption and intestinal metabolism of SDZ-RAD and rapamycin in rats. Drug Metabolism and Disposition, 27, 627-632.
Rao, G. V. S., Tinkle, S., Weissman, D. N., Antonini, J. M., Kashon, M. L., Salmen, R., Hubbs, A. F. (2003). Efficacy of a technique for exposing the mouse lung to particles aspirated from the pharynx. Journal of Toxicology and Environmental Health. Part A, 66(15), 1441-52. doi:10.1080/15287390306417.
Wu, K., Cohen, E. E. W., House, L. K., Ramírez, J., Zhang, W., Ratain, M. J., & Bies, R. R. (2012). Nonlinear population pharmacokinetics of sirolimus in patients with advanced cancer. CPT: Pharmacometrics & Systems Pharmacology, 1(October), e17. doi:10.1038/psp.2012.18.
Пример 4: Фосфорилирование S6 в легочных клетках мышей после перерального введения рапамицина и путем ОФА
[190] Как указано выше, проведенные эксперименты с демонстрацией тканевого распределения рапамицина в легких и крови после перорального введения и ОФА показали, что прямое введение рапамицина в легкие должно создавать возможность достижения достаточно высокой доставляемой дозы для терапевтической эффективности, и в то же время при этом иметь почти неопределяемую системную доступность, тем самым одновременно улучшая терапевтическую эффективность и устраняя многие токсические эффекты, связанные с пероральным введением рапамицина. Для подтверждения этого подхода авторы использовали наличие фосфорилированного белка S6 в легочной ткани мышей в качестве биомаркера для активности mTOR. Использовали линию мышей (C57BL/6), у которых эпителиальные клетки дыхательных путей и альвеол конститутивно имеют активный (фосфорилированный, "р") белок S6. Обычно белок S6 фосфорилируется посредством S6K, которая расположена в 5'-3' направлении от mTORC1 и активируется в направлении 5'-3' от факторов роста, таких как эпидермальный фактор роста (EGF), протеинкиназа В (АКТ), регулируемая внеклеточными сигналами киназа (ERK) и рибосомальная S6 киназа (RSK). mTORC1 способствует росту и пролиферации клеток путем стимуляции анаболических механизмов, таких как биосинтез липидов, белков и органелл, и путем подавления катаболических механизмов, таких как аутофагия. Сигнальный путь mTORC1 воспринимает и интегрирует внутриклеточные и внеклеточные сигналы, включающие факторы роста, кислород, аминокислоты и энергетическое состояние, в целях регуляции широкого круга клеточных механизмов, таких как синтез белков и липидов и аутофагия. Путь mTORC1 крайне чувствителен к рапамицину.
[191] В настоящем исследовании легочная ткань была взята у мышей C57BL/6, которым вводили, как описано выше, или носитель (n = 6), или рапамицин в дозе 1 мг/кг путем ОФА (n = 6) или через зонд (n = 6) в двух точках времени после введения дозы, через 1 час и через 72 часа. Как указано выше, через 1 час после ОФА рапамицин был выявлен в крови в концентрации 641 нг/мл и в легких в концентрации 3794 нг/г ткани, и через 72 часа по прежнему обнаруживался в легких в концентрации 12,5 нг/г, при этом в крови в этой точке времени рапамицин не определялся. И напротив, после перорального введения (через зонд) через 1 час рапамицин был обнаружен в крови в концентрации 23 нг/мл и в легких в концентрации 71 нг/г ткани, и через 72 часа не определялся ни в легких, ни в крови. Как показывают данные на фигурах 1 и 2, уровень фосфорилирования S6 (PS6) был снижен в значительной степени после введения рапамицина в точке времени 1 час и путем ОФА и пероральным путем, и оставался подавленным через 72 часа при введении путем ОФА. Уровень PS6 был максимальным в контроле с введением носителя, поскольку у этих мышей конститутивно активен сигнальный путь mTOR. Эти данные показывают, что доставляемая доза рапамицина, достаточная для достижения концентрации лекарственного препарата в легких приблизительно 70 нг/г, по существу полностью подавляет сигнальный путь mTOR в легочной ткани, что измеряют по белку PS6, и что сигнальный путь mTOR остается подавленным при таком низком уровне, как 12,5 нг/г. Эти результаты подтверждают подход авторов изобретения в отношении применения ингаляционной формы рапамицина для лечения заболеваний и расстройств, таких как ЛАМ, которые характеризуются аномально высокой активностью пути mTOR, и в подтверждение этого продемонстрировано, что ингаляционную форму рапамицина можно вводить в гораздо более низких дозах, чем пероральную форму рапамицина, с одновременным достижением высокой терапевтической эффективности и очень низкой токсичности.
Пример 5: Уменьшение размера частиц рапамицина для ингаляционных композиций
[192] Размер частиц рапамицина был уменьшен до желаемого диапазона 2,0 мкм < Dv50 < 3,0 мкм с помощью способа мокрого шлифования или размола на струйной мельнице. Для размола на струйной мельнице использовали лабораторное устройство MCOne от Jetpharma при следующих условиях эксплуатации: давление трубки Вентури от 2 до 4 бар, давление при размоле 3-5 бар, скорость подачи 90 г/ч. Подаваемые суспензии для мокрого шлифования были приготовлены с использованием очищенной воды. На этапе уменьшения размера использовали микроструйный гомогенизатор высокого давления, и полученную суспензию подвергали распылительной сушке. Подробное описание способа мокрого шлифования приведено ниже.
[193] Гомогенизатор высокого давления, используемый на этапе измельчения в ходе мокрого шлифования, представлял собой опытный микроструйный гомогенизатор высокого давления, снабженный модулем дополнительной обработки (200 микрон) и камерой взаимодействия 100 микрон. Устройство работало примерно при 455 бар (приблизительно 30 бар в усиливающего модуле гидравлического давления). После микрофлюидизации жидкость удаляли с помощью распылительной сушки, с получением сухого порошка. Лабораторная распылительная сушилка SD45 (BÜCHI, усовершенствованная модель B-290) была оснащена двухпоточными форсунками (колпачок и диаметр составляли 1,4 и 0,7 мм соответственно). Для сбора высушенного продукта последовательно использовали два циклона (первый представлял собой стандартный циклон Buchi и второй представлял собой высокопроизводительный циклон Buchi). Устройство для распылительной сушки работало с азотом и в режиме одного прохода, т.е. без рециркуляции сушильного азота. Аспиратор, выдувающий азот, был установлен на уровне 100% своей мощности (скорость потока при максимальной мощности составляет приблизительно 40 кг/ч). Скорость потока распыления азота доводили до значения в ротаметре 40±5 мм. Перед подачей суспензии продукта распылительную сушилку стабилизировали очищенной водой, при этом скорость потока доводили до 6 мл/мин (20% в перистальтическом насосе). Подбирали температуру на входе для достижения заданной температуры на выходе (45°C). После стабилизации показателей температуры подаваемую в распылительную сушилку очищенную воду заменяли на суспензию продукта (сохраняя ту же скорость потока, применяемую в ходе стабилизации), и температуру на входе опять подбирали для достижения заданной температуры на выходе. В конце подаваемую маточную суспензию еще раз заменяли на очищенную воду, чтобы промыть линию подачи и выполнить контролируемую остановку. Сухой продукт в емкостях для сбора под обоими циклонами взвешивали и рассчитывали выход продукта как весовой процент сухого продукта по отношению к общему количеству твердых веществ в суспензии, подаваемой в гомогенизатор высокого давления.
[194] Распределение частиц по размерам анализировали с помощью лазерной дифракции. Определение характеристик твердой фазы (для полиморфной формы и чистоты) проводили с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), рентгеновской порошковой дифракции (XRPD) и дифференциальной сканирующей калориметрии (MDSC). Содержание воды определяли по способу Карла Фишера.
[195] Кристаллический порошок рапамицина получали путем размола на струйной мельнице с монодисперсным распределением частиц по размерам, составляющим Dv10 - 1,5 мкм, DV50 - 2,7 мкм и DV90 - 4,9 мкм, как показано в приведенной ниже таблице.
[196] Путем мокрого шлифования был получен порошок кристаллического рапамицина с монодисперсным распределением частиц по размерам, составляющим Dv10 -1,0 мкм, DV50 - 2,4 мкм и DV90 - 5,0 мкм.
[197] Оба способа приводят к получению частиц рапамицина в пределах желаемого диапазона, и ни один из способов не оказывает влияние на полиморфную форму или чистоту рапамицина. В приведенных ниже таблицах показаны данные технологического контроля при размоле на струйной мельнице и при мокром шлифовании. Эти данные показывают, что с помощью обоих способов можно получать размеры частиц по стандарту API в пределах желаемого диапазона, не влияя на чистоту или полиморфную форму API.
Данные размола на струйной мельнице
(% область)
Данные мокрого шлифования
(% область)
Пример 6: Испытание характеристик аэрозоля для сухих порошковых композиций
[198] Капсулы, полученные в примере выше, были помещены в нижеуказанное в таблице устройство, приведенное затем в действие. Рабочие характеристики аэрозоля, поступающего из устройств/капсул, содержащих смеси серии 06RP68.HQ00008 и серии 06RP68.HQ00009, были получены с использованием импактора нового поколения (NGI) в соответствии со способами, описанными в USP, главы 905 и 601. Тестирование аэрозолей проводили при скорости потока от 60 до 100 литров в минуту (LPM). Значения дозы мелкодисперсных частиц (FPD) и фракции мелкодисперсных частиц (FPF) приведены в таблицах ниже. Также показаны значения среднемассового аэродинамического диаметра (MMAD) и геометрического стандартного отклонения (GSD).
Серия 06RP68.HQ00008 (мокрое шлифование) + Plasitape RS01 модель 7
Серия 06RP68.HQ00008 (мокрое шлифование) + Plastiape RS00 модель 8
Серия 06RP68.HQ00009 (размол на струйной мельнице) + Plastiape RS01 модель 7
Серия 06RP68.HQ00009 (размол на струйной мельнице) + Plastiape RS00 модель 8
[199] На основании полученных данных о рабочих характеристиках аэрозоля, предпочтительными являются частицы лекарственного препарата, полученные способом мокрого шлифования. У них выявлены более высокая доза мелкодисперсных частиц, более высокая фракция мелкодисперсных частиц и распределение частиц по размерам, что будет проявляться в проницаемости и в центральные и в периферические области легких и в меньшей степени оседания в полости рта.
Пример 7: Фармакокинетическое моделирование рапамицина
[200] Исходя из характеристик аэрозоля 06RP68.HQ00008 (мокрое шлифование) + модель Plasitape RS01, как показано выше, и результатов экспериментов на животных, описанных в примере 3, можно ожидать, что ингаляционная доставка рапамицина непосредственно в легкие человека аналогичным образом приведет к получению устойчивых концентраций в легких, достаточно высоких для терапевтической эффективности, но при этом оказывающих низкое системное воздействие (низкие концентрации в крови), таким образом, эффективно минимизируются побочные эффекты, обусловленные системным воздействием. Была разработана двухкомпонентная фармакокинетические модель для прогнозирования концентрации в крови и легких у людей после повторного введения дозы один раз в день (QD) с использованием композиции и ингалятора DPI согласно таблице 7. Для этой фармакокинетической модели были использованы параметры фармакокинетики человека из Краткого обоснования решения о регистрации Рапамуна (Rapamune®, NDA 21-110 и NDA 21-083): предполагается, что объем распределения составляет 780 литров, клиренс составляет 0,0003/мин и период полувыведения составляет 42,3 часа (исходя из эквивалентности внутривенному введению рапамицина). По оценкам, период полуабсорции рапамицина из легких приблизительно составляет 0,5 часа, аналогично другим высоко липофильным соединениям, таким как флутиказона пропионат, для которых доступны данные о легочной абсорбции. Биодоступность рапамицина, депонированного в легких, принимается приблизительно равной 100%. Биодоступность рапамицина, абсорбируемого через ЖКТ посредством орофарингеального депонирования, или поступающего из верхних дыхательных путей путем мукоцилиарного клиренса, принимается за 14%, согласно данным Краткого обоснования решения о регистрации Рапамуна. Для типичного человеческого вдоха при скорости потока 60 литров в минуту, как показано в таблице 7, доза мелкодисперсных частиц составляла 57 мкг, и фракция мелкодисперсных частиц составляла 40%.
[201] По фармакокинетической модели прогнозируется достижение устойчивого состояния средней концентрации через 11 дней, как показано на фигуре 8. Согласно фигуре 8, при повторном введении дозы 57 микрограммов один раз в день, доставляемой в легкие, создается минимальная концентрации в крови приблизительно 0,150 нг/мл, что значительно ниже концентрации 5-15 нг/мл, которую описали McCormack et al. (2011), “Efficacy and safety of sirolimus in lymphangioleiomyomatosis”, N. Engl. J. Med. 364:1595-1606. При условии, что масса легочной ткани составляет 850 г, в легких не происходит обмен веществ и период полуабсорбции составляет 30 минут, рапамицин в дозе 57 микрограмм, доставленный в легкие, может создавать терапевтическую концентрацию в легочной ткани, при этом локальная концентрация рапамицина в легких превышает приблизительно 60 нг/г.
ЭКВИВАЛЕНТЫ
[202] Специалист в данной области техники понимает или может выявить только с помощью рутинных экспериментов множество эквивалентов конкретных вариантов осуществления изобретения, описанных в настоящем документе. Предполагается. Что такие эквиваленты охватываются нижеследующей формулой изобретения.
[203] Все ссылки, приведенные в настоящем изобретении, включены в него в качестве ссылок в полном объеме и для всех целей, в той же степени, как если бы каждая отдельная публикация или патент или заявка на патент была конкретно и отдельно указана для включения в качестве ссылки в полном объеме для всех целей.
[204] Объем настоящего изобретения не следует ограничивать конкретными вариантами осуществления, описанными в данном документе. В действительности, различные модификации изобретения, в дополнение к описанным, станут очевидными для специалистов в данной области из приведенного выше описания и прилагаемых чертежей. Предполагается, что такие модификации входят в объем прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| РАПАМИЦИН-СОДЕРЖАЩАЯ КОМПОЗИЦИЯ, ВВОДИМАЯ ПУТЕМ ИНГАЛЯЦИИ ДЛЯ ЛЕЧЕНИЯ ВОЗРАСТНЫХ ЗАБОЛЕВАНИЙ | 2015 |
|
RU2718583C2 |
| ИНГАЛЯЦИОННАЯ ЛЕКАРСТВЕННАЯ ФОРМА РАПАМИЦИНА ДЛЯ ЛЕЧЕНИЯ ЛЕГОЧНОЙ ГИПЕРТЕНЗИИ | 2015 |
|
RU2732908C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЛЕГОЧНОЙ ГИПЕРТЕНЗИИ | 2019 |
|
RU2830582C2 |
| ПЭГИЛИРОВАННАЯ ЛИПИДНАЯ НАНОЧАСТИЦА С БИОАКТИВНЫМ ЛИПОФИЛЬНЫМ СОЕДИНЕНИЕМ | 2016 |
|
RU2737893C2 |
| СТЕНТ ИЗ ОГОЛЕННОГО МЕТАЛЛА С РЕЗЕРВУАРАМИ, ВЫДЕЛЯЮЩИМИ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ | 2011 |
|
RU2573107C2 |
| СТЕНТ, ВЫДЕЛЯЮЩИЙ РАПАМИЦИН | 2010 |
|
RU2563429C2 |
| СТЕНТ, ВЫДЕЛЯЮЩИЙ ДВА ЛЕКАРСТВЕННЫХ ВЕЩЕСТВА | 2010 |
|
RU2552086C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2159107C2 |
| ЛЕЧЕНИЕ И ПРЕДУПРЕЖДЕНИЕ ВИЧ-ИНФЕКЦИИ | 2010 |
|
RU2569058C2 |
| КОМПОЗИЦИИ ДЛЯ ВВЕДЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2009 |
|
RU2554814C2 |
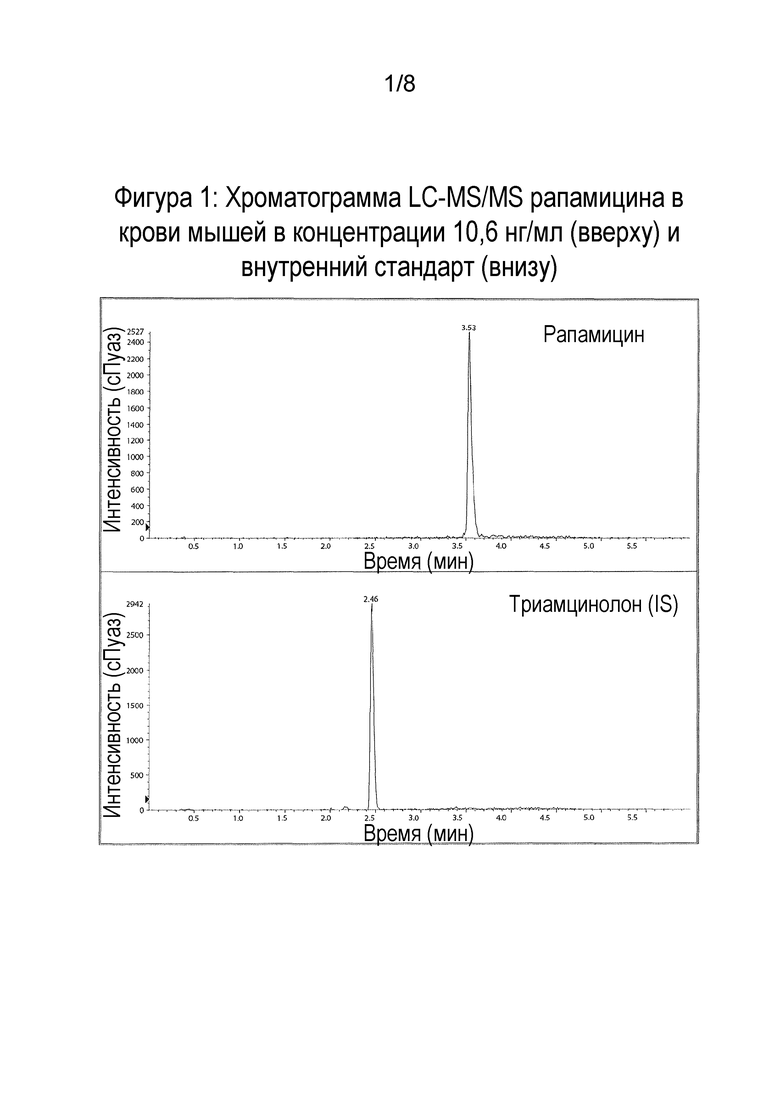
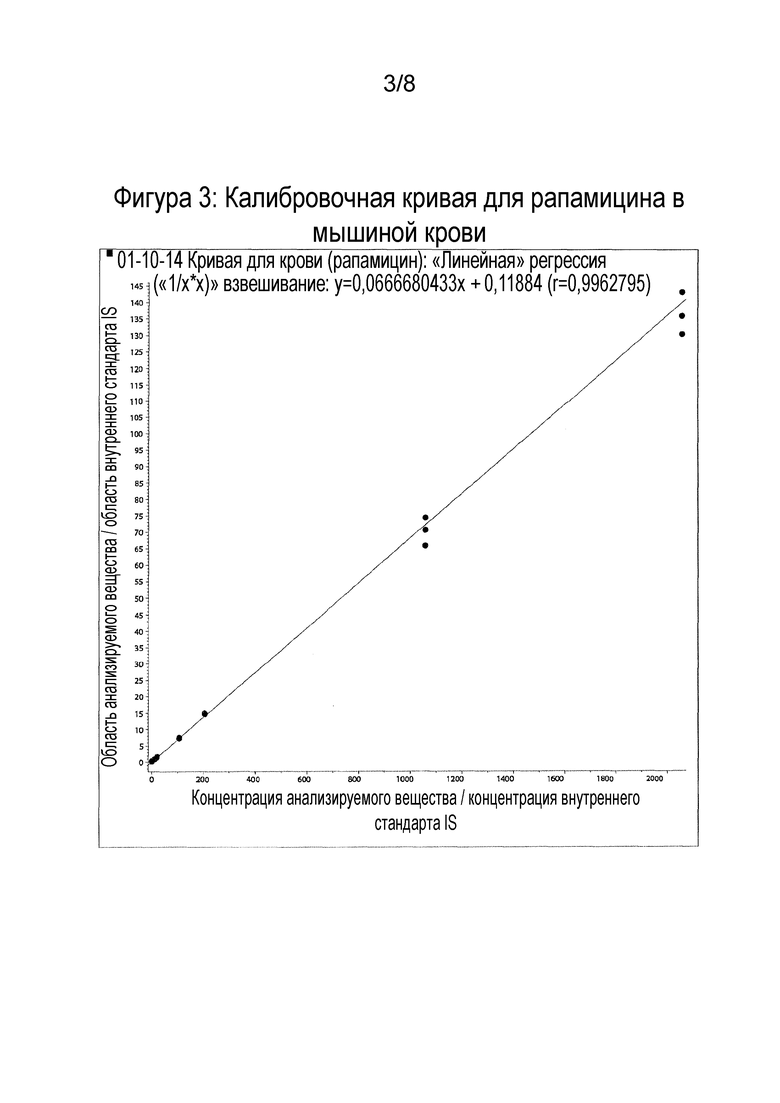
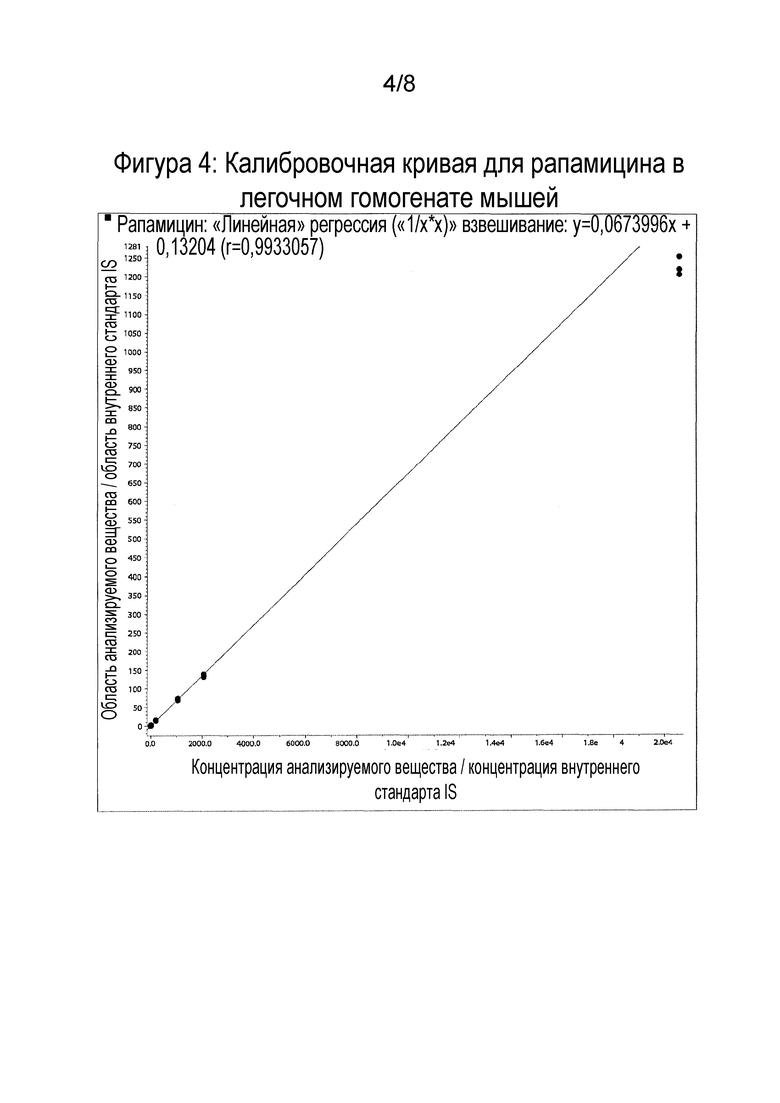
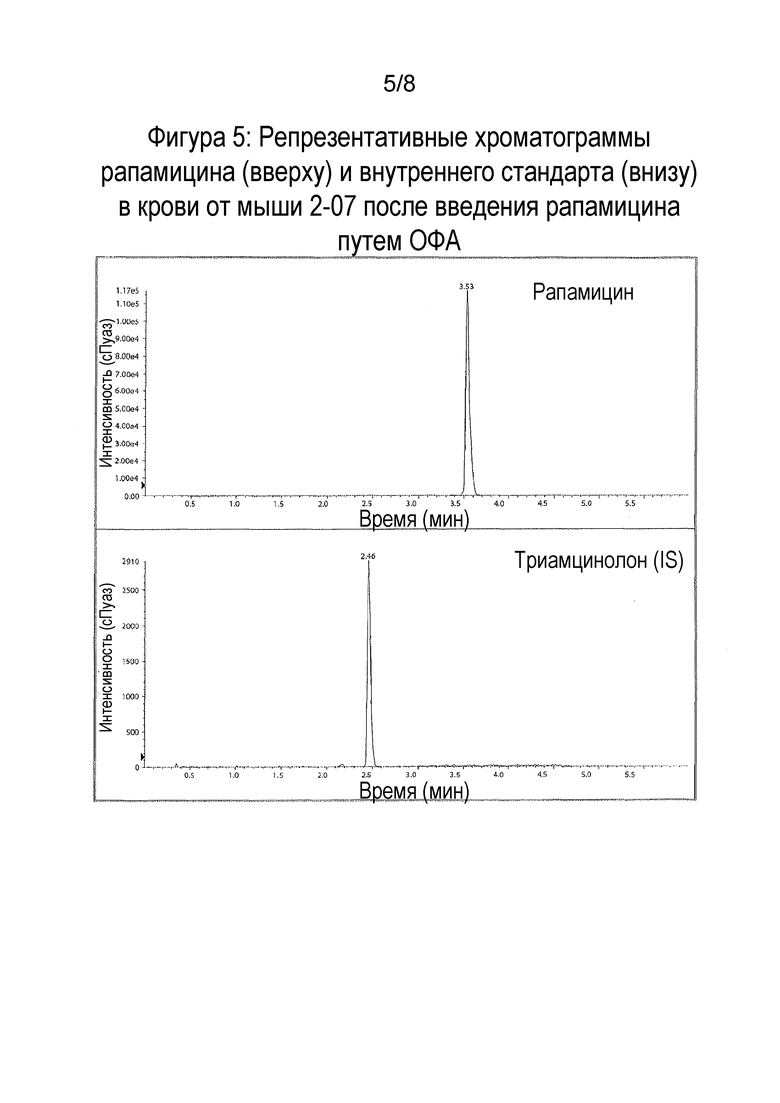
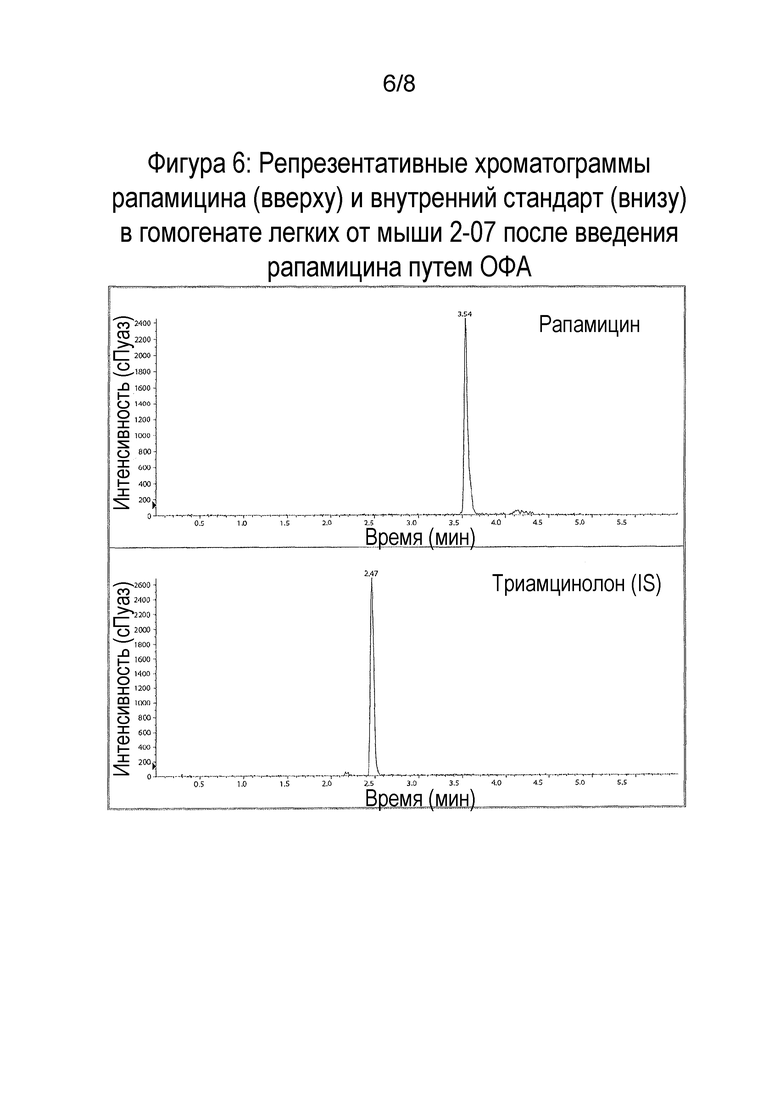
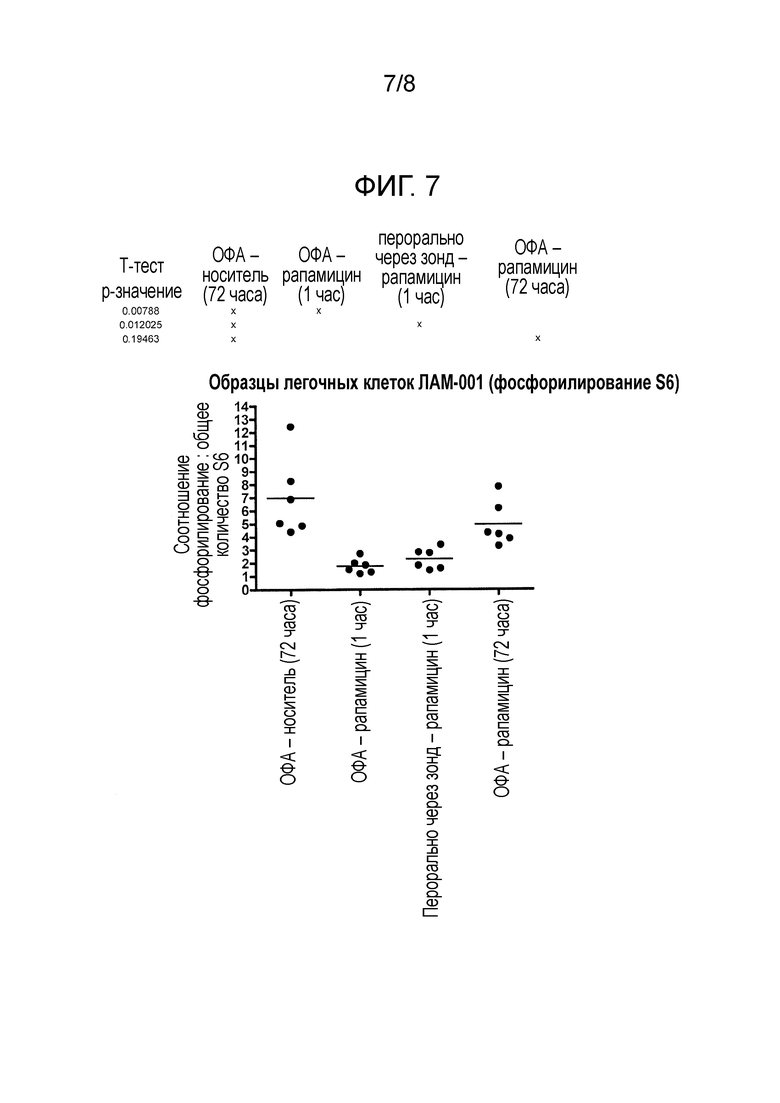
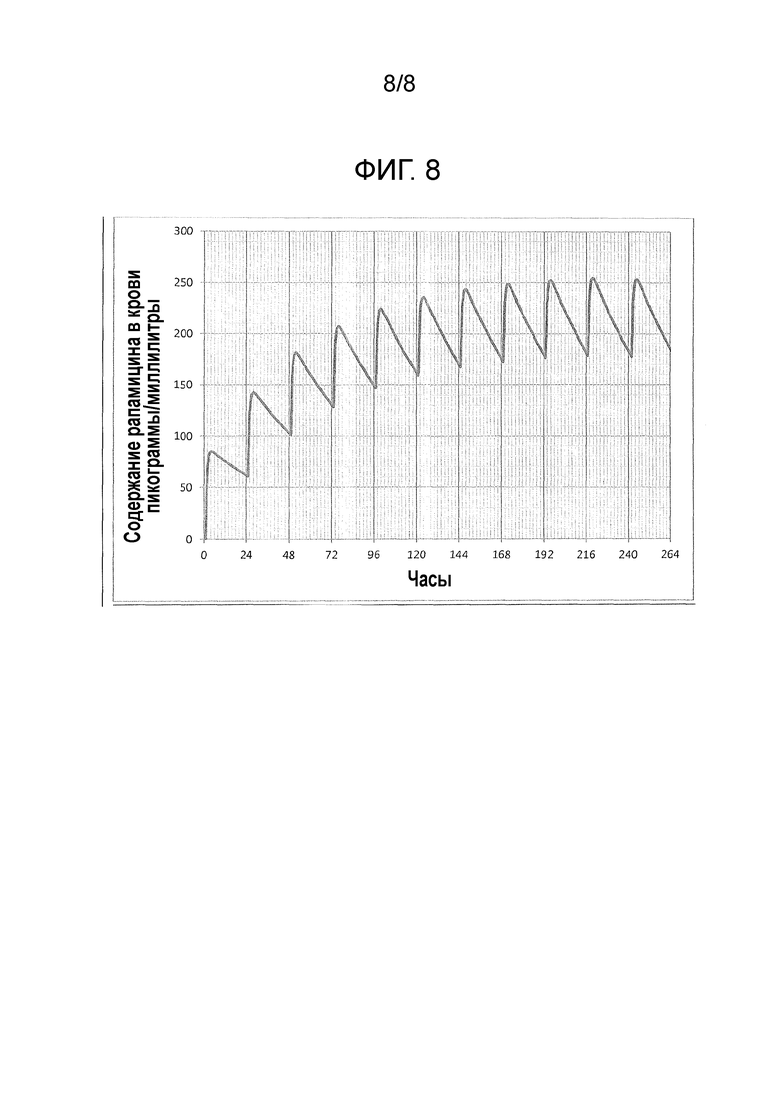
Настоящее изобретение относится к сухой порошковой фармацевтической композиции для легочной доставки для лечения лимфангиолейомиоматоза у нуждающегося в таком лечении человека. Композиция содержит микронизированный рапамицин, частицы носителя, где носитель включает смесь двух разных лактозных носителей, и один или более необязательных наполнителей, выбранных из фосфолипида и соли металла жирной кислоты. Микронизированный рапамицин имеет массовый медианный аэродинамический диаметр (MMDA) от 1 до 5 микрон. Рапамицин является единственным терапевтическим веществом в композиции. Доставка сухого порошка рапамицина осуществляется с помощью ингалятора. Также описан способ лечения лимфангиолейомиоматоза путем ингаляции сухой порошковой композиции рапамицина. Композиция по изобретению обеспечивает высокую локальную концентрацию рапамицина в ткани легких при ингаляционном пути введения. 3 н. и 15 з.п. ф-лы, 8 ил., 9 табл., 7 пр.
1. Сухая порошковая фармацевтическая композиция для легочной доставки для лечения лимфангиолейомиоматоза у человека, содержащая микронизированный рапамицин, частицы носителя, где носитель включает смесь двух разных лактозных носителей и один или более необязательных наполнителей, выбранных из фосфолипида и соли металла жирной кислоты, где микронизированный рапамицин имеет массовый медианный аэродинамический диаметр (MMDA) от 1 до 5 микрон и рапамицин является единственным терапевтическим веществом в композиции.
2. Композиция по п.1, где микронизированный рапамицин присутствует в композиции в количестве от 50 до 500 мкг.
3. Композиция по п.1, где носитель состоит из смеси двух разных лактозных носителей.
4. Композиция по п.1, где соотношение двух разных носителей находится в диапазоне от 3:97 до 97:3.
5. Композиция по п.1, в которой соотношение рапамицина и носителя в порошке составляет от 0,5 до 2% вес./вес.
6. Композиция по п.1, в которой фосфолипид выбран из дипальмитилфосфатидилхолина и лецитина.
7. Композиция по п.1, в которой соль металла жирной кислоты представляет собой стеарат магния.
8. Композиция по п.7, в которой необязательный наполнитель или наполнители присутствует и стеарат магния нанесен в виде покрытия на частицы носителя.
9. Композиция по п.1, в которой количество рапамицина представляет собой количество, эффективное для ингибирования биологической активности mTORC1.
10. Композиция по п.9, в которой количество рапамицина представляет собой количество, эффективное для ингибирования фосфорилирования белка S6.
11. Композиция по п.1, в которой количество рапамицина представляет собой количество, эффективное для достижения вдыхаемой дозы от 5 до 400 мкг, доставляемой в легкие.
12. Композиция по п.1, при этом фракция мелкодисперсных частиц (FPF) указанной композиции превышает 20%, и соответствующая доза мелкодисперсных частиц (FPD) находится в диапазоне от 10 мкг до 500 мкг, в течение срока хранения от 1 до 12 месяцев или от 1 до 36 месяцев.
13. Композиция по п.1, где указанная композиция приспособлена для введения один раз в день.
14. Композиция по п.1, в которой носитель состоит из смеси двух разных лактозных носителей, первый носитель состоит из частиц, имеющих средний диаметр в диапазоне от 30 до 100 мкм, и второй носитель состоит из частиц, имеющих средний диаметр менее 10 микрон, и соотношение двух разных носителей составляет приблизительно от 97:3 до 3:97.
15. Ингалятор для доставки сухого порошка, содержащий резервуар, в котором содержится композиция по любому из пп. 1-14.
16. Ингалятор по п.15, в котором резервуар представляет собой встроенную камеру внутри такого устройства, капсулу или блистер.
17. Ингалятор по п.15, где устройство выбрано из Plastiape® RS01 модель 7, Plastiape® RS00 модель 8, XCaps®, Handihaler®, Flowcaps® TwinCaps® и Aerolizer®.
18. Способ лечения лимфангиолейомиоматоза у нуждающегося в таком лечении человека, включающий введение субъекту путем ингаляции композиции по любому из пп.1-14.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| US 5478578 A, 26.12.1995 | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| ПРОТИВООПУХОЛЕВЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ПРОИЗВОДНОЕ РАПАМИЦИНА И ИНГИБИТОР АРОМАТАЗЫ | 2004 |
|
RU2355399C2 |
| ИМИДАЗОХИНОЛИНЫ В КАЧЕСТВЕ ДВОЙНЫХ ИНГИБИТОРОВ ЛИПИДКИНАЗЫ И mTOR | 2008 |
|
RU2478387C2 |
Авторы
Даты
2019-11-26—Публикация
2014-10-07—Подача