Перекрестная ссылка на родственную заявку
Настоящая заявка испрашивает приоритет предварительной патентной заявки США №61/550165, поданной 21 октября 2011 г., которая во всей своей полноте включается в данный документ посредством ссылки.
Уровень техники, к которой относится изобретение
Род Brassica (капуста) включает канолу, одну из наиболее важных в мире масличных культур, причем эту важную масличную культуру выращивают в географических регионах с умеренным климатом. Канола традиционно характеризуется как Brassica napus L., вид, полученный в результате межвидового скрещивания видов Brassica rapa (репа) и Brassica oleracea (капуста огородная), в котором содержание эруковой кислоты и глюкозинолатов устранено или значительно сокращено посредством традиционной селекции. Основная масса масла канолы присутствует в форме растительных масел, производимых для питания человека. Кроме того, растет рынок для использования масла канолы в промышленных приложениях.
Род Brassica составляют три диплоидных вида, каждый из которых характеризует уникальный геном, который называется «геном A», «геном B» или «геном C». Растения вида Brassica rapa (репа) имеют диплоидный геном A. Растения вида Brassica nigra (горчица черная) имеют диплоидный геном В. Растения вида Brassica oleracea (капуста огородная) имеют диплоидный геном C. Гибриды этих видов можно производить посредством скрещивания между двумя из диплоидных видов. Канола представляет собой амфидиплоидный вид, который рассматривается как продукт гибридизации вида Brassica oleracea, имеющего диплоидный геном C, и вида Brassica rapa, имеющего диплоидный геном A. Цитогенетическое исследование обнаружило, что геномы AA и CC проявляют степень родства, будучи частично гомологичными по отношению друг к другу, и считается, что они произошли от генома их общего предка (Prakash и Hinata, 1980 г.). Хотя технически они классифицируются как диплоидные, геномы обоих видов-предшественников имеют высокое процентное содержание областей, которые дублируют друг друга (Song et al., 1991 г.). Генетический анализ обнаружил, что вид Brassica napus получил десять хромосом от генома AA вида Brassica rapa и девять хромосом от генома СС вида Brassica oleracea в качестве материнского донора (Song et al., 1992 г.).
Качество пищевого и технического масла, получаемого из определенного ассортимента разнообразных семян канолы, определяется составляющими его жирными кислотами, поскольку тип и количество ненасыщенных жирных кислот имеют значение для пищевого и промышленного применения. Традиционное масло канолы содержит приблизительно 60% олеиновой кислоты (C18:1), 20% линолевой кислоты (C18:2) и 10% линоленовой кислоты (18:3). Уровни полиненасыщенной линоленовой кислоты, которые являются типичными для традиционной канолы, оказываются нежелательными, поскольку масло легко окисляется, причем на скорость окисления влияют несколько факторов, в том числе присутствие кислорода, воздействие света и тепла, а также присутствие в масле природных или добавленных веществ, которые препятствуют и способствуют окислению. Окисление вызывает неприятный запах и прогорклый вкус в результате повторной жарки (индуцированное окисление) или в процессе хранения в течение продолжительного периода (автоокисление). Окисление может также изменять смазочные и вязкие свойства масла канолы.
Свойства масла канолы, которое проявляет пониженные уровни полиненасыщенных жирных кислот и повышенные уровни мононенасыщенной олеиновой кислоты по сравнению с традиционным маслом канолы, связаны с повышенной устойчивостью к окислению. Подверженность отдельных жирных кислот к окислению зависит от степени их ненасыщенности. Таким образом, скорость окисления линоленовой кислоты, молекула которой содержит три двойные связи между атомами углерода, в 25 раз превышает скорость окисления олеиновой кислоты, молекула которой содержит только одну двойную связь между атомами углерода, и в два раза превышает скорость окисления линолевой кислоты, молекула которой содержит две двойные связи между атомами углерода. Линолевая и линоленовая кислоты также вносят наибольший вклад во вкус и запах, потому что они легко образуют гидропероксиды. Масло, имеющее высокое содержание олеиновой кислоты (не менее чем 70% олеиновой кислоты), подвержено окислению в меньшей степени в процессе хранения, жарки и очистки, и его можно нагревать до более высокой температуры без образования дыма, что делает его более подходящим в качестве кулинарного масла.
Качество масла канолы определяется составляющими его жирными кислотами, такими как олеиновая кислота (C18:1), линолевая кислота (C18:2) и линоленовая кислота (C18:3). Из большинства культурных сортов канолы, как правило, производят масло, содержащее приблизительно от 55 до 65% олеиновой кислоты и от 8 до 12% линоленовой кислоты. Высокие концентрации линоленовой кислоты приводят к тому, что масло становится неустойчивым и приобретает неприятный запах, в то время как высокие уровни олеиновой кислоты повышают устойчивость к окислению и питательную ценность масла. Таким образом, выведение культурных сортов канолы с повышенным содержанием олеиновой кислоты и пониженным содержанием линоленовой кислоты является в высокой степени желательным для повышения качества масла канолы.
Были определены два локуса и их геномное положение, локализованное от культурного сорта канолы, который обладает повышенным содержанием олеиновой кислоты и пониженным содержанием линоленовой кислоты. Один локус производит основной эффект, и второй локус производит второстепенный эффект на образование повышенного содержания олеиновой кислоты и пониженного содержания линоленовой кислоты. Основной локус для высокого содержания олеиновая кислота (C18:1) был определен в гене десатуразы-2 жирных кислот (fad-2), и он расположен на группе сцепления N5. Второй второстепенный локус расположен на группе сцепления N1. Один основной локус количественных признаков (ЛКП) для линоленовой кислоты (C18:3) представляет собой ген десатуразы-3 жирных кислот генома С (fad-Зс) и расположен на группе сцепления N14. Второй основной ЛКП расположен на группе сцепления N4 и представляет собой ген десатуразы-3 жирных кислот генома A (fad-3а). Геномные последовательности генов fad-2 и fad-3c были амплифицированы и секвенированы из индуцированного этилметансульфонатом (ЭМС) мутантного и (немутантного) культурного сорта канолы дикого типа. Сравнение аллельных последовательностей генов fad-2 и fad-3c мутантного и дикого типов обнаружило однонуклеотидные полиморфизмы (ОНП) в генах из индуцированных ЭМС мутантных растений. На основании различий последовательностей между аллелями мутантного и дикого типов были разработаны два маркера ОНП, соответствующие мутациям генов fad-2 и fad-3c (Ни et al., 2006).
Существующие до настоящего времени способы получения семян гибрида Brassica первого поколения (F1) имеют ограничения в отношении стоимости и чистоты семян. Как правило, для этих способов требуются устойчивые, родственно-несовместимые и самонесовместимые, почти гомозиготные родительские генеалогические линии, причем данные родительские генеалогические линии можно произвести только после многократного самоопыления для получения инбредных линий. Кроме того, близкородственное скрещивание (инбридинг) для развития и сохранения родительских линий осуществляется посредством трудоемких технологий, таких как почечное опыление, поскольку системы производства гибридных семян рода Brassica на основе самонесовместимых признаков должно использовать растения, имеющие сильную самонесовместимость. Условия окружающей среды в течение процесса разведения, такие как температура и влажность, как правило, влияют на липидный метаболизм растений и, таким образом, влияют также на уровень содержания жирных кислот (Harwood, 1999 г.). Таким образом, изменчивость условий окружающей среды делает фенотипическую селекцию растений менее надежной. Deng и Scarth (1998 г.) обнаружили, что повышение температуры после цветения значительно снижает уровни C18:3 и повышает уровни C18:1. Аналогичные результаты были получены и в других исследованиях (Yermanos и Goodin, 1965 г.; Canvin, 1965 г.).
Селекция в целях низкого содержания линоленовой кислоты является особенно проблематичной, поскольку содержание C18:3 представляет собой мультигенный признак и наследуется рецессивным образом с относительно низкой способностью наследования. Генетический анализ популяции, полученной в результате скрещивания сорта Stellar (имеющего низкое содержание C18:3 на уровне 3%) и сорта Drakkar (имеющего «традиционное» содержание C18:3 на уровне от 9 до 10%), показал, что признак низкого содержания C18:3 регулируют два основных локуса, которые производят аддитивные эффекты, обозначенные L1 и L2 (Jourdren et al., b, 1996 г.). Было обнаружено, что эти два основных локуса, которые регулируют содержание C18:3, соответствуют двум генам fad-3 (десатураза-3 жирных кислот), причем один из них содержит геном А (происходящий от вида Brassica rapa), а другой содержит геном C (происходящий от вида Brassica oleracea) (Jourdren et al., 1996 г.; Barret et al.,, 1999 г.).
Признаки, которые постоянно изменяются вследствие генетических факторов (аддитивных, доминантных и эпистатических) и воздействий окружающей среды, обычно называют термином «количественные признаки». Количественные признаки могут отличаться от «качественных» или «дискретных» признаков на основании двух факторов: влияние условий окружающей среды на экспрессию генов, которые производят непрерывное распределение фенотипов; и сложная картина сегрегации, которую производит мультигенное наследование. Определение одной или нескольких областей генома, связанных с экспрессией количественного признака, привело к открытию локусов количественных признаков (ЛКП). Thormann et al. (1996 г.) картировали два ЛКП, которые объясняли 60% изменчивости содержания линоленовой кислоты, а затем Somers et al. (1998 г.) определили три ЛКП, которые в совокупности объясняли 51% фенотипической изменчивости содержания C18:3. Трехлокусную аддитивную модель также описали Chen и Beversdorf (1990 г.). Rucker и Robbelen (1996 г.) показали, что несколько второстепенных генов наиболее вероятно принимают участие на стадии десатурации.
Способность наследования содержания C18:3 была оценена на уровне от 26 до 59% (Kondra и Thomas, 1975 г.) (где изменчивость способности наследования представляет собой функцию генетических факторов, а не факторов окружающей среды). Сложность наследования содержания линоленовой кислоты может быть обусловлена тем, что линоленовая кислота может быть синтезирована как путем десатурации C18:2, так и путем увеличения цепи C16:3 (Thompson, 1983 г.).
В отличие от линоленовой кислоты, наследование содержания олеиновой кислоты является менее сложной, и способность наследования содержания олеиновой кислоты является относительно высокой. Согласно сообщениям высокое содержание олеиновой кислоты регулирует основной локус, так называемый ген fad-2 (десатураза-2 жирных кислот), который кодирует фермент, ответственный за десатурацию олеиновой кислоты в линолевую кислоту (C18:2) (Tanhuanpaa et al., 1998 г.; Schierholt et al., 2001 г.). Все функциональные генные копии гена fad-2, которые были описаны и картированы до настоящего времени, расположены на происходящей из генома A группе сцепления N5 (Scheffler et al.,, 1997 г.; Schierholt et al.,, 2000 г.). Chen и Beversdorf (1990) сообщили, что накопление олеиновой кислоты регулируется в двух сегрегационных генетических системах, причем одна воздействует на удлинение цепи, а вторая участвует в десатурации. Способность наследования содержания C18:1 была оценена на уровне от 53% до 78% (Kondra и Thomas 1975 г.) и 94% (Schierholt и Becker, 1999 г.), соответственно. Вследствие повышенной способности наследования, на экспрессию содержания C18:1 в меньшей степени воздействуют условия окружающей среды, и она является относительно устойчивой (Schierholt и Becker, 1999 г.).
Было обнаружено, что в зародышевой плазме канолы Nexera™ (Nexera™ представляет собой товарный знак компании Dow AgroSciences, LLC) один или два гена регулируют содержание C18:1 и, по меньшей мере, три гена участвуют в экспрессии C18:3. При сегрегации потомства распределение содержания C18:3 в семенах является непрерывный, и в результате этого оказывается затруднительным определение генотипических классов с желательными уровнями содержания C18:3. Кроме того, существует низкая корреляция содержание жирных кислот между растениями, выращиваемыми в оранжерее (GH) и в полевых условиях, что делает еще более проблематичным надежную селекцию оранжерейных растений с желательными уровнями содержания C18:3.
Можно использовать разнообразные способы для обнаружения присутствия конкретного гена в образце растительной ткани. Один пример представляет собой способ пиросеквенирования, который описал Winge (Innov. Pharma. Tech. 00:18-24, 2000 г.). Согласно данному способу, олигонуклеотид должен перекрывать последовательность вставленной ДНК и прилегающей к ней геномной ДНК. С олигонуклеотидом гибридизуется одноцепочечный продукт ПЦР (ампликон) из рассматриваемой области (т.е. один праймер во вставленной последовательности и один во фланкирующей геномной последовательности), и осуществляется инкубация, при которой присутствуют ДНК-полимераза, аденозинтрифосфат (АТФ), сульфурилаза, люцифераза, апираза, аденозин-5'-фосфосульфат и люциферин. Дезоксирибонуклеозидтрифосфаты (дНТФ) добавляют индивидуально, и их введение приводит к световому сигналу, который измеряется. Световой сигнал показывает присутствие трансгенной вставленной/фланкирующей последовательности вследствие успешной амплификации, гибридизации и удлинения цепи на одно или несколько оснований (этот способ обычно используется для начального секвенирования, а не для обнаружения конкретного гена, когда он известен).
Флуоресцентная поляризация представляет собой еще один способ, который можно использовать, чтобы обнаруживать ампликон. Согласно данному способу, олигонуклеотид должен перекрывать соединение геномной фланкирующей и вставленной ДНК. С олигонуклеотидом гибридизуется одноцепочечный продукт ПЦР из рассматриваемой области (один праймер во вставленной ДНК и один праймер в последовательности фланкирующей геномной ДНК), и осуществляется инкубация, при которой присутствуют ДНК-полимераза и содержащий флуоресцентную метку дидезоксирибонуклеозидтрифосфат (ддНТФ). Удлинение цепи на одно основание приводит к введению ддНТФ. Степень введения можно измерять как изменение поляризации, используя флуорометр. Изменение поляризации показывает присутствие трансгенной вставленной/фланкирующей последовательности вследствие успешной амплификации, гибридизации и удлинения цепи на одно основание.
Были описаны молекулярные маяки для использования в обнаружении последовательностей. Вкратце, молекулярные маяки включают осуществляющий РПЭФ (резонансный перенос энергии флуоресценции) олигонуклеотидный зонд, который может быть устроен таким образом, что зонд РПЭФ перекрывает соединение фланкирующей геномной и вставленной ДНК. Уникальная структура зонда РПЭФ приводит к тому, что она содержит вторичную структуру, которая сохраняет в непосредственной близости флуоресцентные и гасящие фрагменты. Зонд РПЭФ и праймеры ПЦР (один праймер в последовательности вставленной ДНК и один праймер во фланкирующей геномной последовательности) циклически обрабатывают в присутствие термоустойчивой полимеразы и дНТФ. После успешной амплификации ПЦР гибридизация зонда РПЭФ с целевой последовательностью приводит к удалению вторичной структуры зонда и пространственному разделению флуоресцентных и гасящих фрагментов. Флуоресцентный сигнал показывает, что присутствует фланкирующая геномная/трансгенная вставленная последовательность вследствие успешной амплификации и гибридизации.
Исследования с гидролитическим зондом, также известные как ПЦР TaqMan® (TaqMan® представляет собой зарегистрированный товарный знак компании Roche Molecular Systems, Inc.), предлагают способ обнаружения и количественного определения присутствия of последовательности ДНК. Вкратце, в методе ПЦР TaqMan® используется олигонуклеотидный зонд РПЭФ, который содержит часть олигонуклеотида в трансгене и другую часть олигонуклеотида во фланкирующей геномной последовательности для обнаружения определенного события. Зонд РПЭФ и праймеры ПЦР (один праймер во вставленной последовательности ДНК и один праймер во фланкирующей геномной последовательности) циклически обрабатывают в присутствии термоустойчивой полимеразы и дНТФ. Гибридизация зонда РПЭФ и последующий гидролиз в течение стадии амплификации ПЦР вследствие 5'-экзонуклеазной активности полимеразы термофильной бактерии Thermus aquaticus (Taq) приводят к расщеплению связи и отделению флуоресцентного фрагмента от гасящего фрагмента на зонде РПЭФ. Флуоресцентный сигнал показывает, что фланкирующая/трансгенная вставленная последовательность присутствует вследствие успешной гибридизации и амплификации.
Молекулярные маркеры можно также использовать для специфического определения последовательности ДНК. Выбор молекулярных маркеров осуществляется на основании генотипов и, таким образом, является независимым от воздействия окружающей среды. Молекулярные маркеры способствуют устранению проблемы ненадежной селекции растений в оранжерее, что обусловлено низкой корреляцией содержания жирных кислот между растениями, выращиваемыми в оранжерее, и растениями, выращиваемыми в полевых условиях. Следует отметить, что молекулярные маркеры, прочно связанные с генами, которые регулируют содержание C18:1 и C18:3, могут способствовать ранней селекции растений, несущих гены высокого содержания C18:1 и низкого содержания C18:3. Селекция с помощью маркеров на ранней стадии может способствовать экономии оранжерейного пространства, повышению эффективности использования оранжереи и сокращению трудоемкости селекции в полевых условиях.
Более конкретно, молекулярные маркеры обладают следующими преимуществами по сравнению с морфологическими маркерами: молекулярные маркеры могут быть высокополиморфными, в то время как морфологические маркеры являются строго зависимыми от фенотипа; морфологические маркеры могут вмешиваться в подсчет определенных количественных фенотипов, в то время как молекулярные маркеры проявляют соотношение 1:1 между генотипом и фенотипом (таким образом, обеспечивается однозначный подсчет всех возможных генотипов для данного локуса); и эпистатические взаимодействия, как правило, ограничивают число морфологических маркеров, которые можно использовать в популяции, в то время как молекулярные маркеры не вступают в эпистатические взаимодействия.
Было определено, что различные типы молекулярных маркеров, таких как маркеры статистически амплифицированной полиморфной ДНК (САПД) (Tanhuanpaa et al.,, 1995 г.; Ни et al.,, 1995 г.; Rajcan et al.,, 1999 г.; Jourdren et al.,, 1996 г.), маркеры полиморфизма длины рестрикционных фрагментов (ПДРФ) (Thormann et al.,, 1996 г.) и маркеры характеризуемой последовательностью амплифицированной области (ХПАО) (Ни et al.,, 1999 г.), связаны с низкими уровнями C18:3 у вида Brassica napus. Молекулярные маркеры были также определены для высокого содержания C18:1. Было определено, что маркер САПД связан с ЛКП, который влияет на концентрацию олеиновой кислоты у яровой репы масличной (подвид Brassica rapa oleifera вида Brassica rapa), а затем его превратили в маркер ХПАО (Tanhuanpaa et al.,, 1996 г.). Schierholt et al., (2000 г.) идентифицировали три маркера полиморфизма длины амплифицированного фрагмента (ПДАФ), связанные с мутацией в сторону повышенного содержания олеиновой кислоты у озимого рапса масличного (Brassica napus L.). Tanhuanpaa et al., (1998 г.) разработали аллель-специфичный маркер ПЦР для олеиновой кислоты, сравнивая аллели дикого типа и высокого содержания олеиновой кислоты локуса гена fad-2 у яровой репы масличной (подвид Brassica rapa oleifera вида Brassica rapa). Однако большинство этих маркеров представляют собой низкопроизводительные маркеры, такие как САПД, ПДАФ и ПДРФ, которые не являются подходящими для крупномасштабного автоматизированного исследования.
Сущность изобретения
Настоящее изобретение относится, в частности, к исследованиям методом ПЦР TaqMan® по конечной точке для обнаружения и высокопроизводительного анализа зиготности гена fad-2 канолы. Настоящее изобретение также относится, в частности, к использованию ДНК дикого типа в качестве стандарта для применения в определении зиготности. Эти и другие родственные процедуры можно использовать для уникальной идентификации зиготности и изменчивости линий канолы, включающих исследуемый ген.
Настоящее изобретение также предлагает соответствующие наборы для определения зиготности и изменчивости в образце, например, канолы.
Таким образом, согласно варианту осуществления настоящего изобретения, предлагается ПЦР TaqMan® в качестве универсальной основы для высокопроизводительного анализа зиготности и селекции. Использование метода ПЦР TaqMan® по конечной точке, который предлагает настоящее изобретение, представляет собой надежное, точное и высокопроизводительное приложение для анализа зиготности fad-2 и селекции канолы.
Краткое описание фигур
Фиг. 1 представляет участок последовательности гена fad-2 (SEQ ID NO: 1), иллюстрирующий положение мутации fad-2 с, которую определили Hu et al., (200 6 г.).
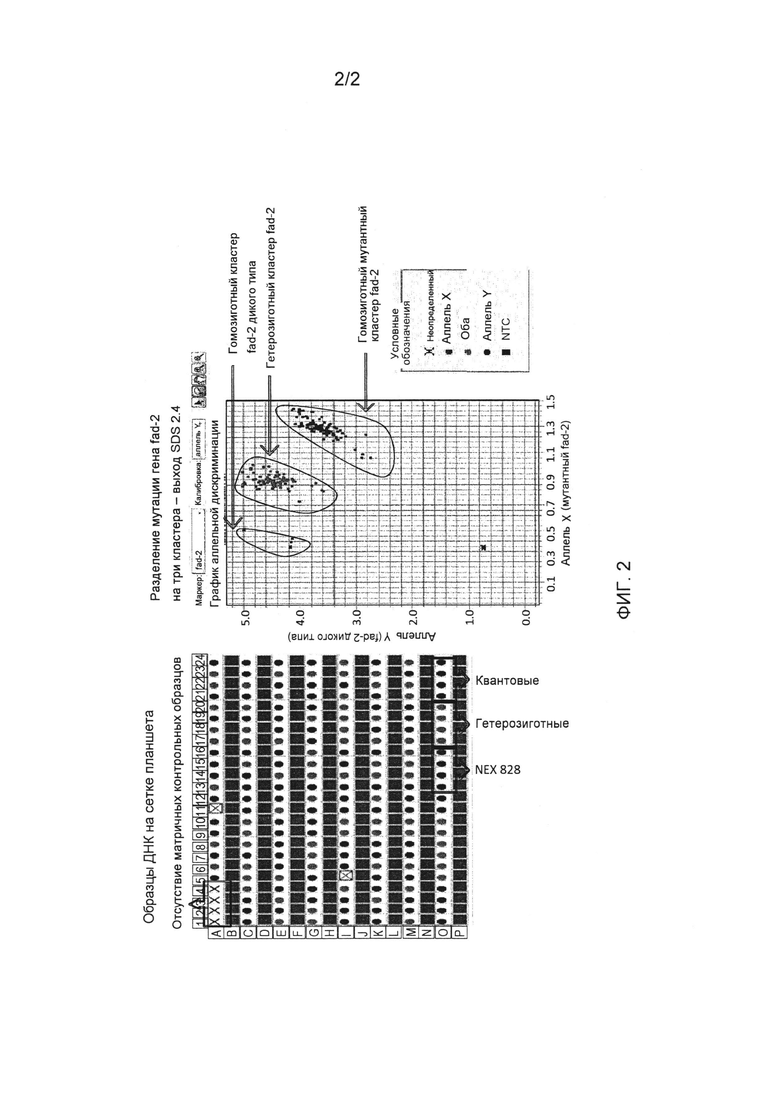
Фиг. 2 представляет пример результатов анализа зиготности (канолы), иллюстрирующий три генотипа fad-2 после исследования TaqMan® по конечной точке; данные результаты получены с использованием программного обеспечения SDS 2.4, поставляемого компанией Applied Biosystems (Фостер-сити, штат Калифорния, США).
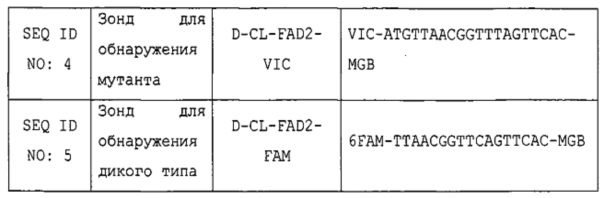
Краткое описание последовательностей SEQ ID NO: 1 представляет собой участок последовательности гена fad-2, иллюстрирующий положение мутации fad-2c.
SEQ ID NO: 2 представляет собой прямой праймер D-CL-FAD-2-F, который связывает фланкирующую геномную последовательность.
SEQ ID NO: 3 представляет собой обратный праймер D-CL-FAD-2-R2, который связывает вставляемую последовательность.
SEQ ID NO: 4 представляет собой зонд D-CL-FAD-2-VIC для предпочтительного связывание мутировавшего гена fad-2, имеющего однонуклеотидный полиморфизм С→Т.
SEQ ID NO: 5 представляет собой зонд D-CL-FAD-2-FAM для обнаружения гена fad-2 дикого типа.
Подробное описание изобретения
Настоящее изобретение относится, в частности, к исследованиям методом ПЦР TaqMan® по конечной точке для обнаружения и высокопроизводительного анализа зиготности гена fad-2 канолы. Настоящее изобретение также относится, в частности, к использованию ДНК дикого типа в качестве стандарта для применения в определении зиготности. Эти и другие родственные процедуры можно использовать для уникальной идентификации зиготности и изменчивости линий канолы, включающих исследуемый ген. Настоящее изобретение также предлагает соответствующие наборы для определения зиготности и изменчивости в образце, например, канолы. Таким образом, согласно варианту осуществления настоящего изобретения, предлагается ПЦР TaqMan® в качестве универсальной основы для высокопроизводительного анализа зиготности и селекции. Использование метода ПЦР TaqMan® по конечной точке, который предлагает настоящее изобретение, представляет собой надежное, точное и высокопроизводительное приложение для анализа зиготности fad-2 и селекции канолы.
Новые исследования согласно настоящему изобретению были разработаны, в частности, на основании мутации однонуклеотидного полиморфизма (ОНП) аллеля fad-2 reported by Hu et al., (2006). В данном исследовании используются две области праймера и два зонда MGB, чтобы обнаруживать аллели fad-2 мутантного и дикого типа (см. таблицу 1). Праймеры и зонды TaqMan® для обнаружения этой мутации SNP предназначены, в частности, для программного обеспечения Primer Express от компании Applied Biosystems (Остин, штат Техас) с использованием последовательностей гена fad-2. Данное новое исследование гена fad-2 методом TaqMan® было подтверждено с использованием ДНК, экстрагированной из растений канолы, которые относятся к гомозиготному, гемизиготному и дикому типу (отсутствие мутации) гена fad-2. Исследование гена fad-2 методом TaqMan® было также оптимизировано для осуществления, в частности, с использованием в режиме реального времени системы ПЦР 7900 НТ от компании Applied Biosystems в форматах 96 или 384 лунки в условиях ПЦР с быстрым циклическим изменением температуры.

В исследовании использовали образцы листьев NEX845 и Quantum. Для подтверждения данного исследования использовали ДНК выведенных популяций канолы.
Аспекты настоящего изобретения включают способы разработки и/или получения диагностических молекул нуклеиновых кислот, примеры которых представлены и/или предложены в настоящем документе. Конкретные праймеры и зонды для метода TaqMan® были разработаны, как подробно описано в настоящем документе, в частности, согласно последовательностям ДНК, которые расположены точно или вблизи выше или ниже определенных в настоящем документе конкретных SNP гена fad-2.
Таким образом, согласно некоторым вариантам осуществления, настоящее изобретение относится к определению зиготности производящих масло растений канолы. Настоящее изобретение относится, в частности, к обнаружению присутствия ОНП, согласно описанию в настоящем документе, в целях определения того, содержит ли потомство от полового скрещивания рассматриваемые ОНП, а также зиготности потомства. Кроме того, предусмотрены способы обнаружения, которые могут оказаться полезными, например, для соблюдения требований, определяющих предпродажное разрешение и маркировку продуктов питания, произведенных из рекомбинантных культурных растений.
Настоящее изобретение относится, в частности, к исследованию на основе флуоресцентного метода ПЦР TaqMan® по конечной точке использованием эндогенного немутантного гена fad-2 в качестве контрольного образца для высокопроизводительного анализа зиготности растения канолы.
Настоящее изобретение также относится, в частности, к разработке биплексного метода ПЦР TaqMan® по конечной точке для анализа зиготности канолы. Кроме того, настоящее изобретение относится, в частности, к разработке наборов для исследования гена fad-2 выращиваемой канолы.
Как правило, исследования методом TaqMan® по конечной точке основаны на стратегии «плюс/минус», согласно которой «плюс» означает, что образец является положительным для исследуемого гена, а «минус» означает, что образец является отрицательным для исследуемого гена. В этих исследованиях, как правило, используется один набор олигонуклеотидных праймеров и два олигонуклеотидных зонда, причем один зонд предпочтительно гибридизуется с мутировавшим SNP fad-2, а другой зонд предпочтительно гибридизуется с последовательностью fad-2 дикого типа, соответственно.
Преимущества, связанные с настоящим изобретением, включают уменьшение его зависимости от качества и количества ДНК. Кроме того, для настоящего изобретения не требуется продолжительная начальная стадия денатурации, которая, если не осуществляется надлежащим образом, может часто делать безуспешными другие исследования по обнаружению ОНП. Кроме того, настоящее изобретение предлагает способ эффективного анализа многочисленных образцов канолы высокопроизводительным образом на промышленной основе. Еще одно преимущество настоящего изобретения представляет собой экономию времени. Предлагаемое исследование методом TaqMan® по конечной точке для анализа зиготности канолы и анализа селекции предоставляет преимущества по сравнению с другими прикладными форматами, в частности, в целях анализа большого числа образцов.
Настоящее изобретение относится, в частности, к анализу селекции растений. Настоящее изобретение предлагает новый способ обнаружения SNP в растениях канолы, которые влияют на уровни содержания олеиновой и линоленовой кислот в исследуемых растениях.
Кроме того, становится возможным обнаружение присутствия исследуемых ОНП, используя другие известные способы обнаружения нуклеиновых кислот, такие как ПЦР или гибридизация ДНК с применением содержащих нуклеиновые кислоты зондов, которые описаны в настоящем документе. В настоящем документе обсуждаются исследования определенного события методом ПЦР (см. также статью Windels et al., Med. Fac. Landbouww, Univ. Gent (Факультет медицины и сельского хозяйства Гентского университета), 1999 г., 64/5b:459462).
При использовании в настоящем документе, термин «потомство» означает любое поколение потомства родительского растения.
Способы обнаружение согласно настоящему изобретению являются особенно полезными в сочетании с селекцией растений, например, для определения зиготности потомства растений после того, как родительское растение, включающее рассматриваемый ОНП, скрещивается с другим растением. Исследуемые приложения и способы благоприятствуют программам селекции канолы, а также процессам контроля качества. Наборы обнаружения методом ПЦР для линий канолы, способы их применения и исследования, которые описаны в настоящем документе, теперь можно осуществлять и использовать. Кроме того, настоящее изобретение может благоприятствовать регистрации продуктов и обслуживанию продуктов.
Растение канолы, включающее желательное сочетание гена fad-2, можно выводить, осуществляя сначала половое скрещивание первого родительского растения канолы, представляющее собой растение канолы, выращенное из семени любой из линий, которые указаны в настоящем документе, и второго родительского растения канолы, получая в результате этого множество растений первого поколения; затем осуществляя селекцию из первого поколения растений, обладающих желательным геном fad-2, как предусмотрено в настоящем изобретении; проводя самоопыление первого поколения растений, получая в результате этого множество растений второго поколения; и затем осуществляя селекцию из второго поколения растений, обладающих желательным геном fad-2 согласно настоящему изобретению. Эти стадии могут дополнительно включают возвратное скрещивание первого поколения растений или второго поколения растений со вторым родительским растением канолы или третьим родительским растением канолы. После этого можно выращивать урожай канолы, включающий семена канолы согласно настоящему изобретению или соответствующее потомство.
Настоящее изобретение дополнительно включает способы осуществления скрещивания с использованием растения канолы, включающего желательное сочетание гена fad-2, в качестве, по меньшей мере, одного родительского растения. Например, настоящее изобретение включает гибридное растение первого поколения F1, имеющее в качестве одного или обоих родительских растений любые растения канолы, включающие желательное сочетание гена fad-2. Кроме того, в объем настоящего изобретения входят семена, производимые такими гибридными растениями первого поколения F1. Настоящее изобретение включает способ идентификации семян гибридного растения первого поколения F1 посредством скрещивания выбранного в качестве примера растения с другим (например, инбредным родительским) растением, получение урожая и исследование полученных в результате гибридных семян с использованием способа согласно настоящему изобретению. Растения канолы, которые используются для производства гибридных растений первого поколения F1, могут представлять собой женские родительские растения или мужские родительские растения.
Кроме того, следует понимать, что можно производить трансгенные растения, которые содержат гены fad-2, описанные в настоящем документе. Кроме того, трансгенные растения, включающие генетические характеристики fad-2, которые описаны в настоящем документе, можно скрещивать с растениями, включающими другое генетическое сочетание, и в результате этого получается потомство, содержащее независимо сегрегируемые экзогенные гены. Путем самоопыления соответствующего потомства можно производить растения, которые являются гомозиготными в отношении дополнительных экзогенных генов. Кроме того, предусмотрены возвратное скрещивание с родительским растением и скрещивание с нетрансгенным растением из другой линии, а также вегетативное размножение. В технике также известны и другие способы разведения, обычно используемые для получения различных растений и признаков. Разведение посредством возвратного скрещивания используется для переноса генов, которые легко подвергаются интрогрессии и несут признак, обладающий высокой способностью наследования, в желательное гомозиготное культурное растение или инбредную линию, которая является рекуррентной родительской линией. Источник передаваемого признака называется термином «родитель-донор». Предполагается, что получаемое в результате растение должно иметь признаки рекуррентного родительского (например, культурного) растения, и что желательный признак передается от родителя-донора. После исходного скрещивания выбираются экземпляры, обладающие фенотипом родителя-донора, которые повторно скрещиваются (возвратное скрещивание) с рекуррентным родительским растением. Предполагается, что получаемое в результате растение должно иметь признаки рекуррентного родительского (например, культурного) растения, и что желательный признак передается от родителя-донора. Способ согласно настоящему изобретению представляет собой высокопроизводительное основанное на флуоресценции исследование ПЦР TaqMan® по конечной точке для обнаружения трансгена fad-2 в растениях потомства и определение уровня зиготности в растениях потомства.
Средства согласно настоящему изобретению, например, олигонуклеотидные праймеры и зонды, можно применять для способов скрещивания с использованием маркера (СИМ). Средства согласно настоящему изобретению, например, олигонуклеотидные праймеры и зонды, можно применять в родственных исследованиях, таких как исследования полиморфизма длины амплифицированного фрагмента (ПДАФ), исследования полиморфизма длины рестрикционных фрагментов (ПДРФ), исследования статистически амплифицированной полиморфной ДНК (САПД), в которых идентифицируются генетически связанные агрономически полезные признаки посредством обнаружения SNP или простых повторяющих последовательностей (ППП), используя общедоступные методики, которые известны в технике. Описанные в настоящем документе SNP можно наблюдать в потомстве от скрещивания с растением канолы согласно настоящему изобретению (или в потомстве его и любого другого культурного растения канолы или его разновидности), используя способы СИМ. Молекулы ДНК можно использовать в качестве маркеров для данного признака, и способы СИМ, которые являются хорошо известными в технике, можно использовать для наблюдения SNP в растениях канолы, где, по меньшей мере, одно растение канолы согласно настоящему изобретению или его потомство представляет собой растение родителя или предка. Способы согласно настоящему изобретению можно использовать для идентификации любой разновидности канолы, которая имеет исследуемые ОНП, описанные в настоящем документе.
Способы согласно настоящему изобретению включают способ получения растения канолы, включающего сочетание ОНП, которые определены в настоящем документе, причем вышеупомянутый способ включает скрещивание с растением согласно настоящему изобретению. Более конкретно, вышеупомянутые способы могут включать скрещивание двух растений согласно настоящему изобретению или одного растения согласно настоящему изобретению и любого другого растения. Примерные способы могут дополнительно включать селекцию потомства от вышеупомянутого скрещивания посредством анализа вышеупомянутого потомства в отношении SNP согласно настоящему изобретению, которые могут быть обнаружены с использованием настоящего изобретения. Например, настоящее изобретение можно использовать для наблюдения зиготности растений канолы в ходе циклов скрещивания с растениями, включающими другие желательные признаки, такие как агрономические признаки, в том числе признаки, которые исследуются в разнообразных примерах, описанных в настоящем документе. Растения, включающие исследуемые SNP и желательные признаки, можно также обнаруживать, идентифицировать, выбирать и быстро использовать, например, в следующих циклах скрещивания. Исследуемые ОНП/признаки можно также сочетать в процессе скрещивания и наблюдать согласно настоящему изобретению вместе с другими признаками, например, такими как возможный признак (признаки) устойчивости к насекомым и/или признаки устойчивости к гербицидам. Один вариант осуществления последнего представляет собой растение, включающее один или несколько исследуемых SNP в сочетании с геном, кодирующим устойчивость к гербицидам, таким как глифосат.
Согласно некоторым вариантам осуществления настоящего изобретения, предложены последовательности ДНК, которые включают соседний фрагмент, который можно использовать в качестве последовательности праймера, чтобы производить ампликон как продукт для диагностики одного или нескольких растений канолы, имеющих ген fad-2.
Согласно родственным вариантам осуществления, предложены последовательности ДНК, которые включают, по меньшей мере, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более соседних нуклеотидов части последовательностей ДНК гена fad-2, которые определены в настоящем документе, или соответствующих комплементов. Такие последовательности могут оказаться полезными как праймеры ДНК в способах амплификации ДНК. Ампликоны, производимые с использованием этих праймеров, можно использовать для диагностики любого сочетания и зиготности разновидностей канолы, содержащих ген fad-2, которые упомянуты в настоящем документе. Таким образом, настоящее изобретения также включает ампликоны, производимые такими праймерами ДНК и гомологичными праймерами.
Согласно следующим вариантам осуществления настоящего изобретения, предлагаются способы получения SNP fad-2, которые предусмотрены настоящим изобретением, причем вышеупомянутый способ включает следующие стадии: (a) половое скрещивание первой родительской линии канолы, включающей один из ОНП, описанных в настоящем документе, и передающей один из признаков содержания олеиновой и/или линоленовой кислоты, которые описаны в настоящем документе, и второй родительский линия канолы, в которой отсутствуют данные ОНП, и получение в результате этого множества растений потомства; и (b) селекция растений потомства посредством использования молекулярных маркеров. Такие способы могут необязательно включать дополнительную стадию возвратного скрещивания растения потомства со второй родительской линии канолы для осуществления разведения гомозигот или получения гомозиготного растения канолы, которое включает вышеупомянутые признаки гена fad-2.
Согласно еще одному аспекту настоящего изобретения, предлагаются способы определения зиготности потомства от скрещивания с вышеупомянутыми растениями канолы, имеющими ген fad-2. Вышеупомянутые способы могут включать контакт образца, включающего ДНК канолы, с набором праймеров согласно настоящему изобретению. Когда вышеупомянутые праймеры используются в реакции амплификации нуклеиновых кислот с геномной ДНК, по меньшей мере, от одного из вышеупомянутых растений канолы, образуется первый ампликон, который представляет собой средство диагностики, по меньшей мере, для одного из вышеупомянутых SNP канолы, имеющей ген fad-2 или гены дикого типа. Такие способы дополнительно включают осуществление реакции амплификации нуклеиновых кислот, в результате которой образуется первый ампликон, и обнаружение первого ампликона зондами, специфичными для SNP гена fad-2, который описан в настоящем документе, и генов дикого типа. Способы дополнительно включают осуществление приложений плавления аллельной дискриминации ампликонов, имеющих ренатурированные описанные зонды, и сравнение относительной флуоресценции зондов, используемых в приложении плавления аллельной дискриминации (например, с флуоресценцией известных контрольных образцов). Относительная флуоресценция зондов показывает, содержит ли образец рассматриваемый ОНП, и если содержит, то является ли гетерозиготный или гомозиготным для ОНП.
Наборы для обнаружения ДНК можно разрабатывать, используя композиции, описанные в настоящем документе, в сочетании со способами, которые являются хорошо известными в технике обнаружения ДНК. Эти наборы оказываются полезными для идентификации исследуемых SNP канолы в образце, и их можно использовать в способах разведения растений канолы, содержащих данную ДНК. Наборы содержат последовательности ДНК, которые являются гомологичными или комплементарными по отношению к ампликонам, которые, например, описаны в настоящем документе. Эти последовательности ДНК можно использовать в реакциях амплификации ДНК или в качестве зондов в способе гибридизации ДНК. Наборы могут также содержать реагенты и материалы, необходимые для осуществления способа обнаружения.
Термин «зонд» означает выделенную молекулу нуклеиновой кислоты, к которой присоединена традиционная обнаруживаемая метка или репортерная молекула (такая как радиоактивный изотоп, лиганд, хемилюминесцентное вещество или фермент). Такой зонд является комплементарным по отношению к цепочке целевой нуклеиновой кислоты, в случае настоящего изобретения, к цепочке геномной ДНК от одного из вышеупомянутых растений канолы, включающих рассматриваемые гены fad-2, в том числе от растения канолы или от образца, который включает ДНК от данного события. Зонды согласно настоящему изобретению включают не только дезоксирибонуклеиновые или рибонуклеиновые кислоты, но также полиамиды и другие зондовые материалы, которые специфически присоединяются к целевой последовательности ДНК и которые можно использовать для обнаружения данной целевой последовательности ДНК.
Были разработаны специфические зонды, включающие флуоресцентный репортер (флуорофор) и гаситель, который гибридизуется с целевой ДНК между праймерами ПЦР. Молекула флуорофора присоединяется к олигонуклеотидному зонду в процессе синтеза олигонуклеотидного зонда, и в результате этого олигонуклеотидный зонд получает метку. К олигонуклеотидному зонду можно присоединять и другие молекулы, такие как молекулы гасителя. Присоединение этих молекул к олигонуклеотидному зонду не нарушает функцию олигонуклеотидного зонда при гибридизации к одноцепочечной ДНК и образовании новой цепочки ДНК посредством процесса амплификации.
В технике разработаны и известны многочисленные флуорофоры, которые возбуждаются при определенных длинах волны. Возбуждение флуорофора приводит к созданию флуорофором флуоресцентного сигнала, который может быть погашен гасителем, расположенным в непосредственной близости к флуорофору. Когда гаситель диссоциирует от флуорофора, флуоресцентный сигнал больше не гасится, и накопление флуоресцентного сигнала, который прямо пропорционален количеству целевой ДНК, можно обнаруживать в режиме реального времени, используя автоматический флуорометр. Флуорофоры можно использовать в сочетании, в котором спектры возбуждения и излучения значительно различаются, таким образом, чтобы иметь возможность одновременного обнаружения двух или более флуорофоров. Согласно некоторым предпочтительным вариантам осуществления, флуорофоры включают флуоресцентный краситель HEX, флуоресцентный краситель ТЕТ, флуоресцентный краситель Cy 3, флуоресцентный краситель Cy 3.5, флуоресцентный краситель Cy 5, флуоресцентный краситель Cy 5.5, флуоресцентный краситель Cy 7 или флуоресцентный краситель ROX. Согласно одному предпочтительному варианту осуществления, флуорофор для использования в данном способе представляет собой гомогенную исследовательскую систему для обнаружения в процессе ПЦР с использованием РПЭФ согласно настоящему изобретению, включая флуоресцентный краситель FAM или флуоресцентный краситель JOE.
Разработаны и известны в технике гасители, которые гасят флуорофоры при определенной длине волны. Когда гаситель находится в непосредственной близости к флуорофору, флуорофор передает энергию гасителю. Гаситель передает эту энергию и возвращается в свое природное основное состояние посредством излучательного распада или без излучения. При неизлучательном или темном распаде энергия, передаваемая от флуорофора, высвобождается в форме молекулярных колебаний.
При выборе гасителя рассматриваются такие качества, как низкая фоновая флуоресценция, высокая чувствительность и максимальное спектральное перекрывание, чтобы получить гаситель, который может обеспечивать более широкое использование флуорофоров. Согласно некоторым предпочтительным вариантам осуществления, гасители включают гасители Dabcyl, гасители Tamra, гаситель Qxl, гаситель Iowa black FQ, гаситель Iowa black RQ или гаситель IR Dye QC-1. Согласно особенно предпочтительному варианту осуществления, гаситель представляет собой гаситель Blackhole, нанесенный в качестве метки на олигонуклеотидный праймер, который является антисмысловым по отношению к меченому FAM олигонуклеотиду.
Термин «праймеры» означает выделенные/синтезированные нуклеиновые кислоты, которые присоединяются к цепочке комплементарной целевой ДНК посредством гибридизации нуклеиновой кислоты, в результате чего образуется гибрид праймера и цепочки целевой ДНК, а затем растягиваются вдоль цепочки целевой ДНК посредством полимеразы, например, ДНК-полимеразы. Согласно настоящему изобретению, пары праймеров используются для амплификации последовательности целевой нуклеиновой кислоты, например, посредством полимеразной цепной реакции (ПЦР) или другими традиционными способами амплификации нуклеиновых кислот.
Длина зондов и праймеров составляет, как правило, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 11 1, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499, 500 или более полинуклеотидов. Такие зонды и праймеры гибридизуются специфически с целевой последовательностью в строго определенных условиях гибридизации. Предпочтительные зонды и праймеры согласно настоящему изобретению имеют последовательность, полностью аналогичную целевой последовательности, хотя зонды, которые отличаются от целевой последовательности и сохраняют способность гибридизации с целевой последовательностью, можно создавать традиционными способами.
Способы получения и использования зондов и праймеров описаны, например, в книге «Молекулярное клонирование: лабораторный справочник», второе издание, т. 1-3, под ред. Sarabrook et al.,, издательство Cold Spring Harbor Laboratory Press, Колд-Спринг-Харбор, штат Нью-Йорк, 1989 г. Пары ПЦР-праймера можно производить из известной последовательности, например, посредством использования компьютерных программ, предназначенных для данной цели.
Праймеры и зонды на основе последовательностей ДНК выше и ниже ОНП, которые описаны в настоящем документе, можно использовать, чтобы подтверждать (и исправлять в случае необходимости) описанные последовательности посредством традиционных способов, например, осуществляя реклониование и секвенирование таких последовательностей.
Зонды и праймеры на основе нуклеиновых кислот согласно настоящему изобретению гибридизуются в строго определенных условиях с целевой последовательностью ДНК. Как правило, можно использовать любой традиционный способ гибридизации или амплификации нуклеиновых кислот, чтобы определять присутствие ДНК из образца fad-2. Молекулы нуклеиновых кислот или их фрагмент способны к специфической гибридизации с другими молекулами нуклеиновых кислот в определенных условиях. При упоминании в настоящем документе говорят, что две молекулы нуклеиновых кислот способны к специфической гибридизации друг с другом, если эти две молекулы способны образовывать антипараллельную двухцепочечную структуру нуклеиновой кислоты. Говорят, что молекула нуклеиновой кислоты является «комплементарной» по отношению к другой молекуле нуклеиновой кислоты, если они проявляют полную комплементарность. При упоминании в настоящем документе говорят, что молекулы «проявляют полную комплементарность», когда каждый нуклеотид одной молекулы является комплементарным по отношению к нуклеотиду другой молекулы. Говорят, что две молекулы являются «минимально комплементарными», если они могут гибридизоваться друг с другом, обеспечивая достаточную устойчивость, которая позволяет им оставаться присоединенными друг к другу, по меньшей мере, в традиционных условиях «низкой строгости». Аналогичным образом, говорят, что молекулы являются «комплементарными», если они могут гибридизоваться друг с другом, обеспечивая достаточную устойчивость, которая позволяет им оставаться присоединенными друг к другу в традиционных условиях «высокой строгости». Традиционные условия строгости описали Sambrook et al., (1989 г.). Таким образом, отклонения от полной комплементарности являются допустимыми при том условии, что такие отклонения не полностью лишают молекулы способности образовывать двухцепочечную структуру. Чтобы молекула нуклеиновой кислоты служила в качестве праймера или зонда, ей требуется только быть достаточно комплементарной в своей последовательности, чтобы иметь способность образовывать устойчивую двухцепочечную структуру при использовании определенного растворителя и концентраций солей.
При упоминании в настоящем документе практически гомологичная последовательность представляет собой последовательность нуклеиновой кислоты, которая специфически гибридизуется к комплементарной последовательности нуклеиновой кислоты, с которой ее сравнивали в условиях высокой строгости. Термин «строгие условия» функционально определяется по отношению к гибридизации зондовой нуклеиновой кислоты и целевой нуклеиновой кислоты (т.е. по отношению к определенной рассматриваемой последовательность нуклеиновой кислоты) посредством специфической процедуры гибридизации, обсуждаемой в книге Sambrook et al., (1989 г.), с. 9.52-9.55. См. также Sambrook et al., (1989 г.), с. 9.47-9.52 и 9.56-9.58. Соответственно, можно использовать нуклеотидные последовательности согласно настоящему изобретению вследствие их способности селективно образовывать двойные молекулы с комплементарными удлинениями фрагментов ДНК.
В зависимости от рассматриваемого приложения, можно использовать переменные условия гибридизации для достижения различных степеней селективности зонда по отношению к целевой последовательности. Для приложений, требующих высокой селективности, как правило, используют относительно строгие условия для образования гибридов, например, выбирают условия относительно низкой концентрации соли и/или высокой температуры, например, концентрация составляет от приблизительно 0,50 мМ до приблизительно 2,00 мМ MgCl2 при температуре от приблизительно 50°C до приблизительно 75°C. Можно одновременно изменять температуру и концентрацию соли или сохранять постоянную температуру или концентрацию соли при изменении другого параметра. Такие селективные условия преодолевают в небольшой степени, если вообще преодолевают, несоответствие между зондом и матрицей или целевой цепочкой. Обнаружение последовательностей ДНК посредством гибридизация хорошо известно специалистам в данной области техники, и описания патентов США №4965188 и 5176995 представляют собой примерные способы гибридизационного анализа.
Согласно одному примерному варианту осуществления настоящего изобретения, нуклеиновая кислота специфически гибридизуется с одним или несколькими праймерами (или ампликонами, или другими последовательностями), которые представлены в качестве примеров или предлагаются в настоящем документе, включая комплементы и их фрагменты, в условиях высокой строгости. Согласно одному аспекту настоящего изобретения, маркерная молекула нуклеиновой кислоты, используемая в настоящем изобретении, имеет последовательность нуклеиновой кислоты, которая определена в настоящем документе как одна из примерных последовательностей, или комплементы и/или их фрагменты.
Согласно следующему аспекту настоящего изобретения, маркерная молекула нуклеиновой кислоты, которая используется в настоящем изобретении, имеет идентичность последовательности, составляющую от 80% до 100% или от 90% до 100% по отношению к таким последовательностям нуклеиновых кислот. Согласно следующему аспекту настоящего изобретения, маркерная молекула нуклеиновой кислоты, которая используется в настоящем изобретении, имеет идентичность последовательности, составляющую от 95%, 96%, 97%, 98% и/или 99% до 100% по отношению к таким последовательностям. Такие последовательности можно использовать в качестве маркеров в способах разведения растений для идентификации потомства от генетического скрещивания. Гибридизацию зонда и целевой молекулы ДНК можно обнаруживать, используя любое число способов, которые являются известными специалистам в данной области техники и которые могут включать, но не ограничиваются этим, флуоресцентные метки, радиоактивные метки, метки на основе антител и хемилюминесцентные метки.
Что касается амплификации целевой последовательность нуклеиновой кислоты (например, посредством ПЦР) с использованием определенной амплификационной пары праймеров, «строгие условия» представляют собой условия, которые позволяют паре праймеров гибридизоваться преимущественно и с высокой степенью предпочтения с целевыми последовательностями нуклеиновых кислот, и в результате этого пара праймеров имеет возможность связывания и предпочтительно производить уникальный ампликон.
Термин «специфический (по отношению к целевой, последовательности)» означает, что зонд или праймер гибридизуется в строгих условиях гибридизации преимущественно и с высокой степенью предпочтения с последовательностью нуклеиновой кислоты в образце, включающем целевую последовательность.
При упоминании в настоящем документе термин «амплифицированная ДНК» или «ампликон» означает продукт амплификации нуклеиновой кислоты целевой последовательности нуклеиновой кислоты, которая составляет часть матрицы нуклеиновой кислоты. Например, для определения того, что растение канолы, получаемое в результате полового скрещивания, содержит рассматриваемый ОНП, который описан в настоящем документе, ДНК, выделенную из образца ткани растения канолы, можно вводить в процесс амплификация нуклеиновой кислоты с использованием пары праймеров, которые включают праймер, полученный из расположенной выше или ниже последовательности в геноме растения канолы вблизи положения ОНП, и второй праймер, полученный их другого конца расположенной выше или ниже последовательности в геноме растения канолы вблизи положения ОНП, и в результате этого получается ампликон, который можно использовать для обнаружения присутствия ОНП. Ампликон имеет такую длину и последовательность, которые также позволяют обнаруживать ген fad-2 дикого типа или мутировавший ген. Ампликон может иметь различную длину, которая представляет собой суммарную длину пары праймеров плюс одна пара нуклеотидных оснований и/или суммарную длину пары праймеров плюс приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133,134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499, или 500, 750, 1000, 1250, 1500, 1750, 2000, или более пар нуклеотидных оснований (плюс или минус любое из приращений, перечисленных выше). Элемент пары праймеров, извлеченный из геномной последовательности растения, может находиться на расстоянии от последовательности ОНП. Это расстояние может составлять от одной нуклеотидной пары оснований вплоть до приблизительно двадцати тысяч нуклеотидных пар оснований. Используемый термин «ампликон» определенно исключает димеры праймеров, которые могут образовываться в реакции термической амплификации ДНК.
Амплификацию нуклеиновой кислоты можно осуществлять, используя любой из разнообразных известных в технике способов амплификации нуклеиновой кислоты, включая ПЦР. В технике известны разнообразные способы амплификации, которые описаны, в том числе, в патенте США №4683195 и патенте США №4683202. Разработаны способы амплификации ПЦР, которые позволяют амплифицировать вплоть до 22 тысяч оснований геномной ДНК. Эти способы, а также и другие известные в технике способы амплификации ДНК можно использовать для практического осуществления настоящего изобретения. Последовательность SNP fad-2 можно проверять посредством амплификации такой последовательности с использованием праймеров, полученных из последовательностей, которые описаны в настоящем документе, осуществляя стандартное секвенирование ДНК ампликона ПЦР или клонированной ДНК.
Ампликон, производимый этими способами, можно обнаруживать множеством способов. Электрофорез в агарозном геле и окрашивание бромидом этидия представляет собой распространенный и хорошо известный способ обнаружения ампликонов ДНК. Еще один такой способ представляет собой генетический битовый анализ, где используется олигонуклеотид ДНК, который одновременно перекрывает соседнюю фланкирующую геномную последовательность ДНК и вставленную последовательность ДНК. Олигонуклеотид иммобилизуется в лунках микролуночного планшета. После ПЦР рассматриваемой области (с использованием одного праймер во вставленной последовательности и одного праймера в соседней фланкирующей геномной последовательности) одноцепочечный продукт ПЦР может гибридизоваться с иммобилизованным олигонуклеотидом и служить в качестве матрицы для реакции увеличения цепочки на одно основание с использованием ДНК-полимеразы и меченых ддНТФ, специфических для следующего ожидаемого основания. Считываемые показания могут представлять собой сигнал на основе флуоресценции или иммуноферментного твердофазного анализа (ИФА). Данный сигнал показывает присутствие вставленной/фланкирующей последовательности вследствие успешной амплификации, гибридизации и удлинения на одно основание.
ПЦР TaqMan® представляет собой способ обнаружения и количественного определения присутствия последовательности ДНК. Вкратце, производится олигонуклеотидный зонд РПЭФ, который перекрывает рассматриваемый ОНП. Зонд РПЭФ и праймеры ПЦР (по меньшей мере, один, расположенный выше, и, по меньшей мере, один, расположенный ниже рассматриваемого ОНП) циклически обрабатывают в присутствии термически устойчивой полимераз и дНТФ.
После амплификации можно осуществлять аллельный дискриминационный анализ (с использованием описанного выше гидролитического зонда TaqMan®) для определения присутствия рассматриваемого SNP и зиготности образца. В процессе аллельного дискриминационного анализа два различных гибридизацинных зонда (один зонд, включающий нуклеотид, комплементарный по отношению к последовательности ОНП, и другой зонд, включающий нуклеотид, комплементарный по отношению к последовательности дикого типа; причем каждый зонд включает различные введенные в них флуорофоры) гибридизуются с ампликоном и гидролизуются, и в результате этого из зонда высвобождаются фрагменты гасителя вследствие 51-экзонуклеазной активности полимеразы метки, и производится флуоресценция. Сравнение относительной флуоресценции зонда, специфической для гена дикого типа, и зонда, специфического для ОНП, представляет собой показатель присутствия и зиготности рассматриваемого ОНП.
Все патенты, патентные заявки, промежуточные заявки и публикации, которые упоминаются или цитируются в настоящем документе, во всей своей полноте включаются в него посредством ссылки в такой степени, в которой они не противоречат определенному описанию настоящего изобретения.
Следующие примеры представлены, чтобы проиллюстрировать процедуры практического осуществления настоящего изобретения и продемонстрировать определенные предпочтительные варианты осуществления настоящего изобретения. Эти примеры не следует истолковывать как ограничительные. Специалисты в данной области техники должны понимать, что технологии, которые описаны в следующих примерах, представляют собой конкретные подходы, используемые для иллюстрации предпочтительных вариантов для их практического осуществления. Однако в свете настоящего изобретения специалисты в данной области техники должны понимать, что многочисленные изменения могут быть внесены в данные конкретные варианты осуществления для получения одинаковых или аналогичных результатов без отклонения от идеи и выхода за пределы объема настоящего изобретения. Если не определены другие условия, все процентные доли означают массовые соотношения, а все пропорции растворителей в смесях означают объемные соотношения, если не указано иное.
Если не определены другие условия, используются следующие сокращения.
п.о. - пара оснований
°C - градус Цельсия
ДНК - дезоксирибонуклеиновая кислота
РПЭФ - резонансный перенос энергии флуоресценции
ДИГ - дигоксигенин
ЭДТК - этилендиаминтетрауксусная кислота
т.о. - тысяча оснований
мкг - микрограмм
мкл - микролитр
мл - миллилитр
М - молярная масса
ПЗ - перекрывающийся зонд
ПЦР - полимеразная цепная реакция
РТЕ - растительная транскрипционная единица
ДСН - додецилсульфат натрия
ОНП - однонуклеотидный полиморфизм
СРП - стандартная рабочая процедура
ХЦН - буферный раствор, содержащий смесь хлорида натрия и цитрата натрия, pH=7,0
ТБЭ - буферный раствор, содержащий смесь трис(гидроксиметил)аминометана, борной кислоты и ЭДТК, pH=8,3
В - вольт
Примеры
Пример 1. Исследование fad-2 методом TaqMan® по конечной точке
Исследование по конечной точке было предназначено для обнаружения мутации SNP fad-2 и определения состояния зиготности растений канолы, содержащих мутацию гена fad-2 в выращиваемых популяциях. Два праймера были предназначены для связывания высококонсервативных последовательностей ДНК, расположенных выше и ниже относительно гена fad-2. Эти праймеры амплифицировали содержащий 91 пару оснований фрагмент ДНК, который перекрывал SNP fad-2 в мутировавших и немутировавших растениях канолы. Мутация fad-2 у канолы была описана в работе Ни et al., (2006 г.) и охарактеризована как SNP цитозин (С)→тимин (Т), расположенный в области экспрессии гена fad-2 (фиг. 1). Два нефлуоресцентных связывающихся с малой бороздой гасителя (MGBNFQ) TaqMan® в качестве зондов были предназначены с FAM и VIC в качестве репортеров-красителей для обнаружения присутствия гена fad-2of дикого типа и мутировавшего гена fad-2 (который состоит из ОНП), соответственно. Эти зонды были предназначены, чтобы обеспечивать повышенную специфичность (например, имея большее сродство) для обнаружения fad-2 дикого типа и SNP fad-2, соответственно. Способ обнаружения TaqMan® для растений канолы, содержащих SNP fad-2, был исследован по отношению к разновидности канолы NEX 828 (содержащей SNP fad-2), контрольной разновидности канолы Quantum (не содержащей SNP fad-2) и образцу ДНК, выделенной из растений, известных как гетерозиготные для SNP fad-2. Исследование методом TaqMan® по конечной точке использовали, чтобы определять присутствие SNP fad-2, а также определять зиготность исследуемых растений в высокопроизводительном формате, например, в формате 96- и 384-луночных планшетов.
Пример 1.1. Выделение геномной ДНК
В данном исследовании использовали образцы геномной ДНК (гДНК) из 625 различных растений канолы, содержащих SNP fad-2, и контрольных растений канолы, содержащих fad-2 дикого типа. Выделение гДНК осуществляли, используя модифицированный набор Qiagen MagAttract для исследования ДНК растений от компании Qiagen (Валенсия, штат Калифорния). Для выделения гДНК на каждый образец использовали по четыре диска, вырезанных из свежих листьев канолы. Количественное определение гДНК осуществляли способом Pico Green согласно инструкциям продавца (компания Molecular Probes, Юджин, штат Орегон). Для цели данного исследования образцы разбавляли водой, в которой отсутствовала дезоксирибонуклеаза, и полученная в результате концентрация составляла 5 нг/мкл.
Пример 1.2. Исследование методом TaqMan® и результаты
Специфические праймеры и зонды TaqMan®s были предназначены для использования в исследовании методом TaqMan® по конечной точке. Эти праймеры и зонды были предназначены для амплификации и обнаружения области гена fad-2, включающей рассматриваемый ОНП. Эти реагенты можно использовать в перечисленных ниже условиях для обнаружения мутировавшего гена fad-2 в растениях канолы. В таблице 1 перечислены последовательности праймеров и зондов, которые были разработаны для специфического обнаружения SNP fad-2 в растениях канолы.
Реакционные смеси ПЦР для амплификации представляли собой следующие: концентрированная смесь 1x TaqMan GTExpress, 0,9 мкМ прямого праймера (SEQ ID NO: 2), 0,9 мкМ обратного праймера (SEQ ID NO: 3), 0,2 мкМ мутантного зонда fad-2 (SEQ ID NO: 4), 0,2 мкМ зонда дикого типа (SEQ ID NO: 5), 15 нг гДНК в суммарном объеме 6 мкл. Реакционную смесь амплифицировали, используя следующие условия циклической термической обработки: две начальные стадии при 50°C в течение 2 минут и при 95°C в течение 30 секунд; затем 40 циклов по 3 секунды при 95°C и 30 секунд при 62°C. Реакционные смеси выдерживали при 10°C до извлечения из устройства для термической циклической обработки. ПЦР в условиях термической циклической обработки можно осуществлять, используя систему ПЦР в режиме реального времени ABI-Applied Biosystems 7900 НТ или устройства для термической циклической обработки Applied Biosystems Verity от компании Life Technologies (Карлсбад, штат Калифорния). Планшеты с образцами содержали контрольный образец ДНК из растений канолы, которые были гомозиготными по отношению к SNP fad-2 (NEX 828), гетерозиготными по отношению к SNP fad-2 или гомозиготными по отношению к fad-2 дикого типа (Quantum). Кроме того, был использованы нематричный контрольный образцы, в котором не содержалась ДНК. После амплификации флуоресцентные сигналы (VIC и FAM) по конечной точке считывали, используя систему ПЦР в режиме реального времени ABI-Applied Biosystems 7900 НТ, согласно процедуре считывания планшета для аллельной дискриминации, которая описана производителем. Данные анализировали, используя программное обеспечение SDS 2.4 от компании Life Technologies (Карлсбад, штат Калифорния), чтобы определить относительную флуоресценцию каждого образца (фиг. 2).
Способ обнаружения TaqMan® для SNP fad-2 канолы исследовали, используя известные гомозиготные и гемизиготные образцы, а также образцы дикого типа. Анализ флуоресценции, которую производил каждый зонд (реагирующий образец), по сравнению с флуоресценцией, которую производили зонды контрольных образцов, позволял определять зиготность каждого образца. Для исследования использовали два различных обратных праймера. Праймер D-CL-FAD-2-R (SEQ ID NO: 6) не функционировал с такой же эффективностью, как праймер D-CL-FAD-2-R2 (SEQ ID NO: 3). Праймер D-CL-FAD-2-R2 (SEQ ID NO: 3) присоединялся к геномной ДНК с более высокой специфичностью и обеспечивал более надежное обнаружение of SNP fad-2. Данное исследование продемонстрировало высокую специфичность обнаружения SNP fad-2 и генов дикого типа канолы и не производило и не усиливало какие-либо обнаруживаемые ложноположительные результаты от контрольных образцов. Эти праймеры и зонды можно использовать для обнаружения SNP fad-2 и гена fad-2 дикого типа канолы, и данные условия и реагенты являются применимыми к исследованиям зиготности.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ЗИГОТНОСТИ ГЕНА FAD3 В КАНОЛЕ | 2012 |
|
RU2630998C2 |
| МАТЕРИАЛЫ И МЕТОДЫ ДЛЯ ОБНАРУЖЕНИЯ ГЕНА АРИЛОКСИАЛКАНОАТДИОКСИГЕНАЗЫ (AAD-12) В РАСТЕНИЯХ | 2012 |
|
RU2644249C2 |
| ДЕТЕКЦИЯ AAD-1 ОБЪЕКТА DAS-40278-9 | 2010 |
|
RU2577143C2 |
| ДЕТЕКТИРОВАНИЕ AAD-12-СОБЫТИЯ 416 У СОИ | 2010 |
|
RU2573898C2 |
| КАНОЛА HO/LL С УСТОЙЧИВОСТЬЮ К ЗАБОЛЕВАНИЮ КИЛОЙ КРЕСТОЦВЕТНЫХ | 2012 |
|
RU2711934C2 |
| КАНОЛА HO/LL С УСТОЙЧИВОСТЬЮ К ЗАБОЛЕВАНИЮ КИЛОЙ КРЕСТОЦВЕТНЫХ | 2012 |
|
RU2618846C2 |
| ПРИМЕНЕНИЕ СПЕЦИФИЧЕСКИХ МАРКЕРОВ ГЕНА КОРИЧНЕВОЙ СРЕДНЕЙ ЖИЛКИ 3 (BROWN MIDRIB-3) У КУКУРУЗЫ ДЛЯ ИНТРОГРЕССИИ ПРИЗНАКОВ | 2011 |
|
RU2593958C2 |
| МОЛЕКУЛЯРНЫЕ МАРКЕРЫ ГЕНА RLM4 РЕЗИСТЕНТНОСТИ К ЧЕРНОЙ НОЖКЕ BRASSICA NAPUS И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2718584C2 |
| МОЛЕКУЛЯРНЫЕ МАРКЕРЫ ГЕНА RLM2 РЕЗИСТЕНТНОСТИ К ЧЕРНОЙ НОЖКЕ BRASSICA NAPUS И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2717017C2 |
| ТРАНСГЕННЫЙ ОБЪЕКТ СОИ MON 87708 И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2010 |
|
RU2624025C2 |



Изобретение относится к области биохимии, в частности к способу определения зиготности гена fad-2 растения канолы. Также раскрыт набор для осуществления указанного способа. Изобретение позволяет определить зиготность гена fad-2. 2 н. и 9 з.п. ф-лы, 2 ил., 1 табл., 1 пр.
1. Способ определения зиготности гена fad-2 растения канолы, причем вышеупомянутый способ включает:
получение образца геномной ДНК из растения канолы, где образец геномной ДНК содержит последовательность гена fad-2 дикого типа, последовательность мутантного гена fad-2, имеющего С→Т однонуклеотидный полиморфизм, или их комбинацию;
гибридизацию образца геномной ДНК с первым праймером и вторым праймером, причем указанный первый праймер содержит SEQ ID NO: 2, и указанный второй праймер содержит SEQ ID NO: 3;
подвергание вышеупомянутого образца условиям полимеразной цепной реакции (ПЦР), при которых образуется ампликон;
предоставление возможности каждого из первого зонда и второго зонда гибридизоваться с ампликоном в течение периода времени при температуре от 50 до 70°С, где указанный первый зонд содержит SEQ ID NO: 5, и указанный второй зонд содержит SEQ ID NO: 4, где каждый из указанного первого зонда и указанного второго зонда мечен флуоресцентным красителем и гасителем, где указанный первый зонд гибридизуется с геном fad-2 дикого типа, и указанный второй зонд гибридизуется с мутантным геном fad-2, где мутантный ген fad-2 содержит С→Т однонуклеотидный полиморфизм (SNP);
увеличение вышеупомянутой температуры после периода времени;
измерение флуоресценции указанного первого зонда, указанного второго зонда или их комбинации; и
определение зиготности вышеупомянутого гена fad-2 растения канолы, где указанное растение канолы является гомозиготным по указанному гену fad-2 дикого типа при выявлении флуоресценции указанного первого зонда; указанное растение канолы является гомозиготным по указанному мутантному гену fad-2 при выявлении флуоресценции указанного второго зонда; и указанное растение канолы является гетерозиготным по указанному гену fad-2 дикого типа и указанному мутантному гену fad-2 при выявлении флуоресценции как указанного первого зонда, так и указанного второго зонда.
2. Способ по п. 1, в котором вышеупомянутый ампликон состоит из 91 пары оснований.
3. Способ по п. 1, в котором мутантный ген fad-2, имеющий однонуклеотидный полиморфизм(SNP), содержит SEQ ID NO: 1.
4. Способ по п. 1, причем вышеупомянутый способ используют для проверки интрогрессии скрещивания кроссбредных растений канолы.
5. Способ по п. 1, в котором вышеупомянутый первый зонд включает FAM в качестве вышеупомянутого флуоресцентного красителя на конце 5' вышеупомянутого первого зонда и гаситель MGB на конце 3' вышеупомянутого первого зонда.
6. Способ по п. 1, в котором вышеупомянутый второй зонд метят VIC на конце 5' вышеупомянутого второго зонда и гасителем MGB на конце 3' вышеупомянутого второго зонда.
7. Способ по п. 1, причем результаты флуоресценции в вышеупомянутом способе анализируют непосредственно в планшет-ридере.
8. Способ по п. 1, в котором вышеупомянутый образец ДНК получают из растения канолы в поле.
9. Способ по п. 1, в котором увеличение указанной температуры включает повышение вышеупомянутой температуры при практически равномерном приращении в течение периода времени.
10. Способ по п. 1, в котором вышеупомянутую флуоресценцию, производимую каждым из вышеупомянутого первого зонда и указанного второго зонда в течение стадии увеличения указанной температуры, измеряют в течение каждого приращения указанной стадии увеличения указанной температуры.
11. Набор для осуществления способа по п. 1, причем вышеупомянутый набор включает вышеупомянутый первый праймер, представленный SEQ ID NO: 2, вышеупомянутый второй праймер, представленный SEQ ID NO: 3, вышеупомянутый первый зонд, представленный SEQ ID NO: 5, и вышеупомянутый второй зонд, представленный SEQ ID NO: 4.
| WO 2002036831 A2 от 10.05.2002 | |||
| WO 20040072259 A2 от 26.08.2004 | |||
| JIN H.J | |||
| and et.al., Identification of functional BrFAD2-1 gene encoding microsomal delta-12 fatty acid desaturase from Brassica rapa and development of Brassica napus containing high oleic acid contents, Plant Cell Rep (March 2011) n.30, pp.1881-1892 | |||
| BARKLEY N.A | |||
| end et.al., A real-time PCR genotyping assay to detect FAD2A SNPs in peanuts (Arachis hypogaea L.) Electronic Journal of Biotechnology, 2010, n.13 pp.0717-3458 | |||
| СОЕВОЕ МАСЛО С ВЫСОКОЙ ОКИСЛИТЕЛЬНОЙ СТАБИЛЬНОСТЬЮ | 1997 |
|
RU2162642C2 |
Авторы
Даты
2017-12-21—Публикация
2012-10-19—Подача