Притязание на приоритет
Настоящая заявка притязает на приоритет по дате подачи предварительной заявки на выдачу патента США с регистрационным номером 61/334073, поданной 12 мая 2010, «Use of brown midrib-3 gene specific markers in maize for trait introgression».
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее описание, в общем, относится к селекции растений. Предлагаются способы определения зиготности растений, содержащих мутации коричневой средней жилки (brown midrib 3, bm3). Способы, раскрытые в описании, кроме того, применимы для усовершенствования способа селекции BMR-содержащих линий растений.
УРОВЕНЬ ТЕХНИКИ
Лигнины являются универсальными компонентами в растениях, которые поперечно связываются с углеводами, такими как гемицеллюлозы, в клеточной стенке. Полимеры лигнина снижают расщепление волокон у жвачных, и степень лигнификации может быть обратно пропорциональна перевариваемости кормовых культур. Cherney et al. (1991) Adv. Agron. 46:157-98. Кукуруза, содержащая мутацию коричневой средней жилки brown midrib (BMR) имеет красновато-коричневую пигментацию средней жилки листа, что ассоциировано со значимо сниженным содержанием лигнина, измененным составом лигнина и улучшенной перевариваемостью. Было идентифицировано, по меньшей мере, четыре независимых мутации BMR у кукурузы. Kuc et al. (1968) Phytochemistry 7:1435-6. В случае всех таких мутаций, названных «bm1, bm2, bm3 и bm4», имеется пониженное содержание лигнина по сравнению с контрольной кукурузой. Мутации bm3 включают инсерции (bm3-1), делеции (bm3-2) и инсерции/делеции (bm3-3) в гене O-метилтрансферазы кофеиновой кислоты (COMT, например, GenBank Accession No. M73235). Morrow et al. (1997) Mol. Breeding 3:351-7; Vignols et al. (1995) Plant Cell 7:407-16.
Ген COMT контролирует ферментативные активности, вовлеченные в биосинтез лигнина. COMT использует S-аденозилметионин для трансметилирования кофеиновой кислоты, что приводит к образованию феруловой кислоты. В конечном итоге из феруловой кислоты образуются конифериловый спирт и синапиловый спирт. Сочетание кониферилового, ферулового и синапилового спиртов в присутствии свободных радикалов приводит к продукции лигнина. Мутации Bm3 были охарактеризованы, и считается, что они ингибируют трансметилирование кофеиновой кислоты вследствие инактивации генов. Guillet-Claude et al. (2004) Theor. Appl. Genet. 110: 126-35; Piquemal et al. (2002) Plant Physiology 130: 1-11; He et al. (2003) Crop Sci. 43: 2240-51; Morrow et al. (1997) Mol. Breeding 3: 351-7; Vignols et al. (1995) Plant Cell 7: 407-16. Однако не разработано быстрого способа для специфичного выявления и тестирования зиготности конкретного растения по локусу bm3.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем описании раскрыты способы высокопроизводительной основанной на ПЦР молекулярной характеристики сортов кукурузы BMR (например, мутантов bm3), которые могут значительно улучшить процесс селекции BMR-содержащих линий. Раскрыты способы определения зиготности образца растительной ткани, и следовательно растения, из которого получен образец, посредством определения присутствия или отсутствия аллелей мутанта bm3 и COMT дикого типа. Таким образом, предлагается анализ зиготности на основе ПЦР с регистрацией в конечной точке с использованием зондов, работающих по принципу гидролиза (который в настоящем описании указана как анализ TaqMan®), который специфично выявляет и тестирует состояние зиготности в локусе bm3. Раскрыты анализы, в которых используют биплексы олигонуклеотидов, специфичных к мутанту bm3 и к соответствующим последовательностям дикого типа, в одном и том же анализе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 включает схематичное представление гена COMT с мутациями bm3 и олигонуклеотиды, сконструированные для частичной амплификации гена COMT (~1,8 т.п.н.).
На фиг.2 изображена амплификация неполной последовательности гена COMT из двенадцати линий bm3 и трех линий не-bm3 (линий дикого типа). ПЦР-продукты визуализировали в 2% E-Gel® и затем экстрагировали, используя 0,8% E-Gel®, для последующего клонирования в векторе pCR4-TOPO®.
На фиг.3 показано выравнивание консенсусных последовательностей мутантов bm3 и генов COMT дикого типа. Три ранее описанных делеционных/инсерционных мутаций подчеркнуты.
На фиг.4 включает схематичное представление гена COMT с праймерами, специфичными к мутации bm3 и интактному гену COMT. (A) Ген COMT с пунктирными линиями означает делецию bm3. Специфичные для гена COMT праймеры находятся в пределах сайта делеции. (B) Мутантный ген bm3. Специфичные для bm3 олигонуклеотиды находятся в месте соединения, где прямой и обратные олигонуклеотиды, фланкирующие сайт делеции, и зонд охватывают делетированную область.
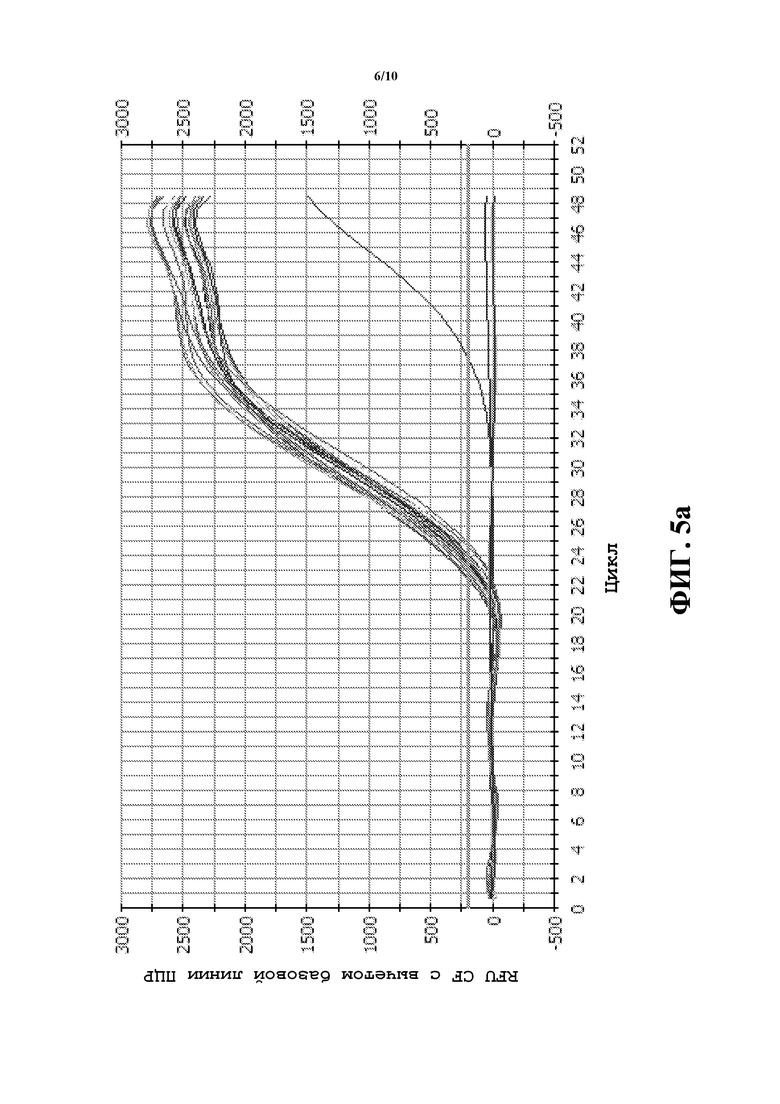
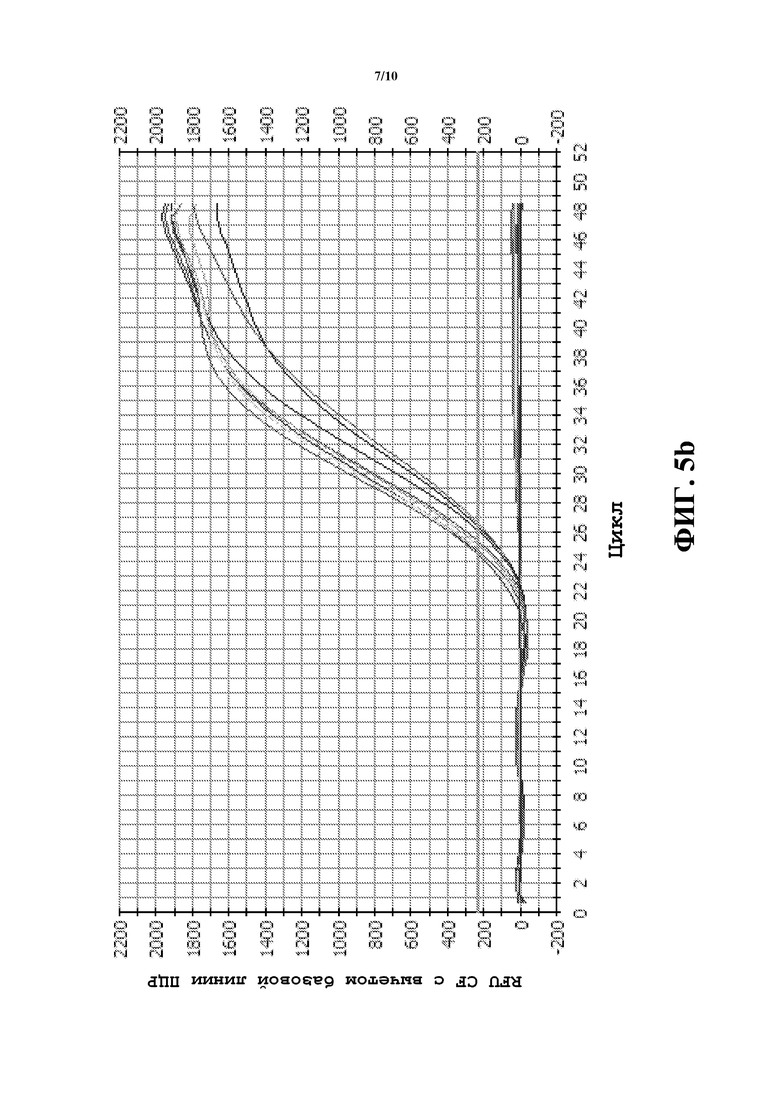
Фиг.5a и 5b содержат графики ПЦР-амплификации в реальном времени, где показаны относительные единицы флуоресценции (RFU) для bm3 (a) с использованием FAM и (b) для COMT дикого типа с использованием VIC (заменяли Hex из-за ограничений прибора для ПЦР в реальном времени). Экспоненциальную фазу амплификации наблюдали с 22 по 36 цикл как в случае гена bm3, так и в случае гена COMT дикого типа.
На фиг.6 показаны определения генотипов, осуществляемые с использованием анализа, различающего аллели на основе измерения в относительных единицах флуоресценции FAM для аллеля 1 (гомозиготный bm3) и VIC (заменяемого Hex из-за ограничения прибора) в случае аллеля 2 (гомозиготный COMT дикого типа) в цикле 30.
На фиг.7 показаны определения зиготности bm3, осуществляемые с использованием анализа TaqMan® с регистрацией в конечной точке. После завершения ПЦР и регистрации флуоресценции получали график распределения как описано ниже: SOB1 = сигнал выше фона FAM (сигнал образца выше среднего фонового сигнала при 535 нм), SOB2 = сигнал выше фона VIC (сигнал образца выше среднего фонового сигнала при 560 нм). Определения генотипа осуществляли, используя SOB1/SOB2<1 для дикого типа, 1<SOB1/SOB2<5 для гемизигот и SOB1/SOB2>5 для гомозигот, в случае использования логарифмического масштаба.
На фиг.8 показаны определения зиготности bm3, осуществляемые с использованием анализа TaqMan® с регистрацией в конечной точке. Необработанные данные интенсивности флуоресценции, полученные непосредственно из устройства для считывания планшетов, анализировали в KLIMS (лабораторной системе управления информацией KBioscience). Строили график, на котором RFU (относительные единицы флуоресценции) для FAM откладывали на оси x, а для VIC откладывали на оси y. Определения зиготности осуществляли на основе кластерного разделения при просмотре кластеров.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Нуклеотидные последовательности, перечисленные в прилагаемом списке последовательностей, показаны с использованием стандартных буквенных сокращений для оснований нуклеотидов, которые определены в 37 C.F.R. §1.822. Показана только одна нить каждой последовательности нуклеиновой кислоты, но следует понимать, что комплементарная нить включена при любой ссылке на показанную нить. В прилагаемом списке последовательностей:
SEQ ID NO:1 показывает последовательность прямого праймера (BM35_F), используемого для амплификации неполного гена COMT кукурузы: TACTCTACTGGCTGCGGCTAGC.
SEQ ID NO:2 показывает последовательность обратного праймера (BM35_R), используемого для амплификации неполного гена COMT кукурузы: TAACCTTGATTGTTATTACTCGCACATGG.
SEQ ID NO:3 показывает последовательность олигонуклеотида (BM1234R) из гена COMT, используемую секвенирования неполного гена COMT кукурузы: ATCAGCATCAGCCAGGCAGG.
SEQ ID NO:4 показывает последовательность прямого праймера (BM3_F), используемого для идентификации мутантного аллеля bm3: AAAAAGAACGAGGTTGCAAAAGATA.
SEQ ID NO:5 показывает последовательность обратного праймера (BM3_R), используемого для идентификации мутантного аллеля bm3: TTAGAATCCACGACATGCAAGAG.
SEQ ID NO:6 показывает последовательность зонда (BM3_Probe), используемого для идентификации мутантного аллеля bm3, с FAM на 5'-конце и MGBNFQ на 3'-конце: FAM-ACAAACCAAAGGATGTCG-MGBNFQ.
SEQ ID NO:7 показывает последовательность прямого праймера (COMT_F), используемого для идентификации аллеля COMT дикого типа: CGCACTCGACGACGATGAC.
SEQ ID NO:8 показывает последовательность обратного праймера (COMT_R), используемого для идентификации аллеля COMT дикого типа: CACGCTGCTCAAGAACTGCTA.
SEQ ID NO:9 показывает последовательность зонда (COMT _Probe), используемого для амплификации аллеля COMT дикого типа, с VIC на 5'-конце, и MGBNFQ на 3'-конце: VIC-CATTTTCCGGCAGCGC-MGBNFQ.
SEQ ID NO:10 показывает нуклеотидную последовательность bm3.
SEQ ID NO:11 показывает неполную нуклеотидную последовательность COMT.
СПОСОБ (СПОСОБЫ) ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
I. Обзор нескольких вариантов
В настоящем описании раскрыты способы высокопроизводительной основанной на ПЦР молекулярной характеристики сортов кукурузы bm3, которые могут значительно улучшить процесс селекции BMR-содержащих линий растений. В конкретных вариантах способ может включать в себя получение образца, содержащего изолированную геномную ДНК растения кукурузы, осуществление контакта изолированной геномной ДНК, по меньшей мере, с одной молекулой нуклеиновой кислоты, содержащей нуклеотидную последовательность, способную гибридизоваться с последовательностью SEQ ID NO:10 в условиях высокой жесткости и, по меньшей мере, одной молекулой нуклеиновой кислоты, содержащей нуклеотидную последовательность, способную гибридизоваться с последовательностью SEQ ID NO:11 в условиях высокой жесткости, и определение зиготности мутации bm3 в изолированной геномной ДНК из растения кукурузы. В конкретных вариантах, по меньшей мере, одна молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, способную гибридизоваться с последовательностью SEQ ID NO:10 в условиях высокой жесткости, и по меньшей мере, одна молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, способную гибридизоваться с последовательностью SEQ ID NO:11 в условиях высокой жесткости, имеют длину от 10 до 35 нуклеотидов. В некоторых вариантах, по меньшей мере, одна молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, способную гибридизоваться с последовательностью SEQ ID NO:10 в условиях высокой жесткости, по меньшей мере, на 95% идентична от 10 до 35 непрерывно следующим друг за другом нуклеотидам последовательности SEQ ID NO:10. В некоторых вариантах, по меньшей мере, одна молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, способную гибридизоваться с последовательностью SEQ ID NO:11 в условиях высокой жесткости, по меньшей мере, на 95% идентична от 10 до 35 непрерывно следующим друг за другом нуклеотидам последовательности SEQ ID NO:11. В некоторых вариантах нуклеотидная последовательность, способная гибридизоваться с последовательностью SEQ ID NO:11 в условиях высокой жесткости не способна гибридизоваться с последовательностью SEQ ID NO:10 в условиях высокой жесткости. В некоторых вариантах, по меньшей мере, одна молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, способную гибридизоваться с последовательностью SEQ ID NO:10 или SEQ ID NO:11 выбрана из группы, состоящей из последовательностей SEQ ID NO:1-9.
Также раскрыты способы идентификации мутации BMR в растениях кукурузы. В некоторых вариантах способ может включать в себя воздействие на геномную ДНК из растения кукурузы молекулы нуклеиновой кислоты, способной гибридизоваться с последовательностью SEQ ID NO:10 в условиях высокой жесткости. В конкретных вариантах молекула нуклеиновой кислоты, способная гибридизоваться с последовательностью SEQ ID NO:10 в условиях высокой жесткости, может быть выбрана из группы, состоящей из последовательностей SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6.
Далее раскрыты способы надежной и предсказуемой интрогрессии признака низкого содержания лигнина (например, посредством интрогрессии аллеля bm3) в зародышевую плазму растений. В некоторых вариантах способ может включать в себя возвратное скрещивание растения, имеющего мутацию в гене COMT, с другим растением, получение образца изолированной геномной ДНК из растения-потомка, полученного при скрещивании, осуществление контакта образца изолированной геномной ДНК, по меньшей мере, с одной молекулой нуклеиновой кислоты, содержащей нуклеотидную последовательность способную гибридизоваться с последовательностью SEQ ID NO:11 в условиях высокой жесткости, и отбор потомства от скрещивания, которое содержит мутацию в гене COMT, посредством размножения растения, из которого получен образец изолированной геномной ДНК, которая связывается в условиях высокой жесткости, по меньшей мере, с одной молекулой нуклеиновой кислоты, содержащая нуклеотидную последовательность, способную гибридизоваться с последовательностью SEQ ID NO:11 в условиях высокой жесткости, с получением таким образом генетически сконструированного растения, в котором признак низкого содержания лигнина был интрогрессирован в зародышевую плазму генетически сконструированного растения.
Также раскрыты растения кукурузы с генотипом и/или зиготностью, определенной высокопроизводительными основанными на ПЦР молекулярными способами согласно изобретению, а также генетически сконструированные растения кукурузы, проявляющие признак низкого содержания лигнина, которые получены согласно раскрытым в описании способам надежной и предсказуемой интрогрессии признака низкого содержания лигнина в зародышевую плазму растения кукурузы.
II. Сокращения
BMR - коричневая средняя жилка
MGBNFQ - связывающийся с малой бороздкой не флюоресцирующий тушитель
FAM - 6-карбоксифлуоресцеин
ПЦР - полимеразная цепная реакция
RFU - относительные единицы флуоресценции
VIC - 6-карбоксиродамин.
III. Термины
В описании и таблицах, которые следуют далее, использован ряд терминов. Чтобы обеспечить соответствующее ясное понимание описания и формулы изобретения, включающих в себя объем, который определяют такие термины, предлагаются следующие определения:
Возвратное скрещивание. Возвратное скрещивание представляет собой процесс, в котором селекционер повторно скрещивает гибридное потомство снова с одним из родителей, например, гибрид первого поколения F1 с одним из родительских генотипов гибрида F1.
Кукуруза BMR: В используемом в настоящем описании смысле термин «кукуруза BMR» относится к сортам кукурузы, которые содержат мутацию коричневой средней жилки, такую как мутации, охарактеризованные как bm1, bm2, bm3 и bm4. Сорта кукурузы BMR обычно имеют красновато-коричневую пигментацию средней жилки листа. Также кукуруза BMR обычно характеризуется более низким содержанием лигнина, более высокой перевариваемостью волокон и более высоким потреблением сухого вещества. Не ограничивающие примеры сортов кукурузы BMR включают F2F297, F2F383, F2F488, F2F449, F2F566, F2F610, F2F622, F2F665, F2F633, F2F682, F2F721, F2F700 и F2F797.
Гибридизация: Олигонуклеотиды и их аналоги гибридизуются посредством образования водородных связей, которые включают образованием водородных связей Уотсона-Крика, образование водородных связей по Хугстену или обратных водородных связей по Хугстену между комплементарными основаниями. В общем, молекулы нуклеиновой кислоты состоят из азотистых оснований, которые представляют собой либо пиримидины (цитозин (C), урацил (U) и тимин (T)), либо пурины (аденин (A) и гуанин (G)). Такие азотистые основания образуют водородные связи между пиримидином и пурином, и связывание пиримидина с пурином называют «спариванием оснований». Более конкретно, A будет образовывать водородные связи с T или U, а G будет связываться с C. «Комплементарное» относится к спариванию оснований, которое происходит между двумя отдельными последовательностями нуклеиновой кислоты или двумя отдельными областями одной и той же последовательности нуклеиновой кислоты.
«Специфично гибиридизуемый» и «специфично комплементарный» являются терминами, которые указывают достаточную степень комплементарности для того, чтобы происходило стабильное и специфичное связывание между олигонуклеотидом и ДНК- или РНК-мишенью. Олигонуклеотид должен быть на 100% комплементарен последовательности своей мишени, чтобы быть специфично гибридизуемым. Олигонуклеотид является специфично гибридизуемым, когда связывание олигонуклеотида с молекулой ДНК- или РНК-мишени мешает нормальному функционированию ДНК- или РНК-мишени, и существует достаточная степень комплементарности, чтобы избежать неспецифичного связывания олигонуклеотида с последовательностями, не являющимися мишенями, в таких условиях, в которых требуется специфичное связывание, например, в физиологических условиях в случае анализом или систем in vivo. Такое связывание называют специфичной гибридизацией.
Условия гибридизации, приводящие к конкретной степени жесткости, будут варьировать в зависимости от природы выбранного способа гибридизации и состава и длины гибридизующихся последовательностей нуклеиновой кислоты. В общем, температура гибридизации и ионная сила (особенно концентрация Na+ и/или Mg2+) буфера для гибридизации будут вносить вклад в жесткость гибридизации, впрочем, и время промывки также влияет на жесткость. Расчеты в отношении условий гибридизации, необходимые для достижения конкретной степени жесткости, обсуждаются в Sambrook et al. (ed.), Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989, главы 9 и 11.
В целях настоящего описания «жесткие условия» охватывают условия, в которых гибридизация будет происходить, если имеется менее 25% несоответствующих спариваний между гибридизуемой молекулой и последовательностью-мишенью. «Жесткие условия» могут быть дополнительно определены по конкретным уровням жесткости. Так в используемом в настоящем описании смысле условия «низкой жесткости» представляют собой условия, в которых молекулы, имеющие более 25% несоответствующих спариваний, не будут гибридизоваться. Условия «умеренной жесткости» представляют собой условия, в которых молекулы, имеющие более 15% несоответствующих спариваний, не будут гибридизоваться, и условия «высокой жесткости» представляют собой условии, в которых последовательность, имеющая более 10% несоответствующих спариваний, не будут гибридизоваться. Условия «очень высокой жесткости» представляют собой условия, в которых последовательности, имеющие более 6% несоответствующих оснований, не будут гибридизоваться.
В конкретных вариантах условия жесткости будут включать в себя гибридизацию при 60°C в основной смеси для генотипирования TaqMan® (Applied Biosystems, Foster City, CA, № в каталоге 4371355), разбавленной в соответствии с инструкциями производителя.
Изолированный: «Изолированный» биологический компонент (такой как нуклеиновая кислота или белок) по существу отделен, получен отдельно или очищен от других биологических компонентов клетки организма, в котором компонент существует в природе, т.е. от другой хромосомной и внехромосомной ДНК и РНК и белков. Молекулы нуклеиновой кислоты и белки, которые были «изолированы», включают молекулы нуклеиновой кислоты и белки, очищенные стандартными способами очистки. Термин также охватывает нуклеиновые кислоты и белки, полученные в результате рекомбинантной экспрессии в клетке-хозяине, а также химически синтезированные молекулы нуклеиновой кислоты, белки и пептиды.
Олигонуклеотид: Олигонуклеотид представляет собой короткий полимер нуклеиновой кислоты. Олигонуклеотиды могут быть образованы расщеплением более длинных участков нуклеиновой кислоты или полимеризацией отдельных нуклеотидных предшественников. Автоматизированные синтезаторы позволяют осуществлять синтез олигонуклеотидов длиной до нескольких сотен пар оснований. Так как олигонуклеотиды могут связываться с комплементарной нуклеотидной последовательностью, их можно применять в качестве зондов для выявления ДНК или РНК. Олигонуклеотиды, состоящие из ДНК (олигодезоксирибонуклеотиды), можно использовать в ПЦР, способе амплификации небольших последовательностей ДНК. В случае ПЦР олигонуклеотид обычно называют «праймером», который позволяет ДНК-полимеразе удлинять олигонуклеотид и реплицировать комплементарную нить.
Зиготность: В используемом в настоящем описании смысле термин «зиготность» относится к сходству или отсутствию сходства аллелей гена наследуемого признака организма. Если два аллеля одинаковы, организм является «гомозиготным» по данному признаку. Если два аллеля отличаются, организм является «гетерозиготным» по данному признаку. Если один аллель отсутствует, организм является «гемизиготным». Если отсутствуют оба аллеля, организм является «нуль-зиготным».
Если специально не объясняется иное, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, которое обычно подразумевают специалисты в области, к которой относится настоящее изобретение. Определения обычных терминов молекулярной биологии можно найти, например, в Lewin B., Genes V, Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); and Meyers R.A. (ed.), Molecular Biology and Biotechnology: A Comprehensive Desk Reference, VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8).
IV. Высокопроизводительный способ определения генотипа и зиготности кукурузы BMR
A. Краткое описание
В настоящем разделе описан специфичный для гена ПЦР-анализ TaqMan® с регистрацией в конечной точке, обычно используемый для анализа зиготности кукурузы BMR или предполагаемой кукурузы BMR. В конкретных примерах используют биплекс олигонуклеотидов, специфичных к делеции bm3 и к соответствующим последовательностям дикого типа в одном и том же анализе. В таких примерах зиготность может быть определена по присутствию/отсутствию аллелей мутанта bm3 и COMT дикого типа. Анализ был предложен для группы высокопроизводительных геномных анализов для дальнейшего применения, и анализ может значительно улучшить процесс селекции в случае проектов по интрогрессии BMR.
B. Кукуруза с коричневой средней жилкой (brown midrib)
Растения кукурузы brown midrib (коричневая средняя жилка (BMR)) характеризуются коричневой пигментацией средней жилки листа на стадии V4-V6 и светло-коричневой окраской паренхимы после выбрасывания султанов. Гибридная кукуруза brown midrib содержит генную мутацию, которая вызывает более низкое содержание лигнина в ткани растения кукурузы, например, мутацию bm2 или мутацию bm3. Ген brown midrib3 локализован в коротком плече хромосомы 4, и аллель bm3 является рецессивным. Ген brown midrib2 локализован в длинном плече хромосомы 1, и аллель bm2 также является рецессивным. Полимеры лигнина ограничивают усвоение волокон растения кукурузы. Сниженное содержание лигнина в кукурузе brown midrib приводит к тому, что силосование осуществляют с использованием волокон, которые лучше перевариваются, чем обычная кукуруза. Испытания по кормлению животных показали примерно на 10 процентов большее усвоение и повышенную продукцию молока при использовании силоса из кукурузы BMR по сравнению с обычным силосом.
Предлагаются способы, которые позволяют идентифицировать мутации bm3. Раскрытые способы могут быть применимы, например, для идентификации конкретного растения кукурузы или конкретного сорта кукурузы, как, например, кукурузы BMR. Раскрытые способы также могут быть применимы для надежной и предсказуемой интрогрессии признака BMR в зародышевую плазму кукурузы в результате скрещивания кукурузы BMR с другими сортами кукурузы, или в результате скрещивания кукурузы BMR, содержащей первую мутацию BMR, с кукурузой BMR, содержащей вторую мутацию BMR (например, скрещивания сорта кукурузы bm1 с сортом кукурузы bm3). Множество мутаций BMR известно специалистам в данной области, и некоторые мутации BMR были охарактеризованы (например, картированы и секвенированы). Раскрытые способы могут быть применимы для идентификации мутации BMR, определения генотипа и/или зиготности растения или сорта кукурузы BMR и для интрогрессии любой мутации BMR в зародышевую плазму кукурузы.
C. Анализ на основе ПЦР с регистрацией в конечной точке
В настоящей публикации описан специфичный для гена анализ на основе ПЦР TaqMan® с регистрацией в конечной точке, обычно используемый для анализа зиготности кукурузы BMR или предполагаемой кукурузы BMR. В конкретных вариантах специфичный для гена анализ на основе ПЦР TaqMan® с регистрацией в конечной точке может быть применим для анализа зиготности кукурузы в случае мутации bm3.
Праймеры и зонды для применения в специфичном для гена анализе на основе ПЦР TaqMan® с регистрацией в конечной точке могут быть сконструированы на основе известной мутации в представляющем интерес гене. Например, праймеры и зонды для bm3-специфичного анализа могут быть сконструированы на основе делеции 978 п.н. на 3'-конце гена O-метилтрансферазы кофеиновой кислоты (COMT). В биплексных реакциях, в которых олигонуклеотиды, специфичные для мутации (например, bm3) и для ненарушенного гена дикого типа (например, COMT) используют в одном и том же анализе, специфичные олигонуклеотиды будут избирательно амплифицировать последовательность любого одного или обоих генов: мутантного гена и/или гена дикого типа, которые присутствуют в образце геномной ДНК.
В некоторых вариантах в bm3-специфичном анализе амплифицируют фрагмент, который имеет длину 71 п.н., который является уникальным для сайта соединения, где 978 п.н. нуклеотидной последовательности были делетированы из гена COMT дикого типа. В некоторых вариантах специфичный для мишени олигонуклеотидный зонд (например, BM3_Probe (SEQ ID NO:6)) гибридизуется в условиях высокой жесткости с последовательностью-мишенью в образце геномной ДНК между двумя ПЦР-праймерами (например, BM3_F (SEQ ID NO:4) и BM3_R (SEQ ID NO:5)).
В некоторых вариантах в специфичном для гена COMT дикого типа анализе амплифицируют фрагмент гена COMT, который имеет длину 65 п.н. и который локализован в экзоне 2 (делетированном в мутантах bm3), так что не-bm3-последовательности в локусе COMT не могут быть амплифицированы. В некоторых вариантах специфичный для мишени олигонуклеотидный зонд (например, COMT_Probe (SEQ ID NO:9)) гибридизуется в условиях высокой жесткости с последовательностью-мишенью в образце геномной ДНК между двумя ПЦР-праймерами (например, COMT_F (SEQ ID NO:7), и COMT_R (SEQ ID NO:8)).
Специфичные для мишени олигонуклеотиды можно метить, например, флуоресцирующими красителями (например, FAM, VIC и MGBNFQ), которые могут обеспечить быстрый количественный анализ специфичного для мишени флуоресцентного сигнала. ПЦР-продукты можно измерить после предварительного определения количества циклов, например, когда реакция находится в ранней экспоненциальной фазе. Образцы для негативного контроля могут содержать геномную ДНК из любого сорта кукурузы, например, без мутации bm3. Образцы для позитивного контроля могут содержать геномную ДНК из сорта кукурузы с мутацией BMR, такой как делеционная мутация bm3 в гене COMT. Контрольные гемизиготные образцы могут содержать либо геномную ДНК из сорта кукурузы, который судя по предварительному определению является гемизиготным в отношении мутации bm3; либо гемизиготный образец может содержать равные доли негативной контрольной ДНК и ДНК из сорта кукурузы, который судя по предварительной оценке является гомозиготным по bm3.
ДНК можно выделить (например, экстрагировать и очистить) из ткани растения кукурузы способами, известными специалистам в данной области. Коммерческие наборы для выделения ДНК доступны, например, из Qiagen, Inc. В некоторых вариантах пробойником вырезали диски из листьев конкретного растения и переносили в пробирки для сбора. Пробойник можно очищать после каждого отбора образца 70% спиртом, промывать в воде и сушить. Буфер для экстракции ДНК может быть приготовлен согласно рекомендациям производителя. Затем ДНК может быть выделена с использованием набора согласно инструкциям производителя. Наконец, концентрация выделенной ДНК может быть определена с использованием, например, набора для количественной оценки Quant-iTTM PicoGreen® (Invitrogen, Carlsbad, CA) и спектрофотометра или любым другим подходящим способом.
После того как получены или иным образом стали доступны праймеры, зонды и образец (образцы) геномной ДНК, может быть проведена ПЦР-реакция, чтобы идентифицировать представляющие интерес последовательности нуклеиновой кислоты (например, последовательности, специфичные для мутации BMR) в образце (образцах) геномной ДНК. В конкретных вариантах получают отдельные реакционные смеси для ПЦР, которые содержат все компоненты реакции, за исключением образца (образцов) геномной ДНК. В случае биплексных реакционных смесей, содержащих праймеры и специфичные для генов зонды для мутанта bm3 и COMT кукурузы дикого типа, реакционные смеси могут содержать фермент, буфер для реакции, прямой и обратный праймеры для мутации bm3 мутация, прямой и обратный праймеры для гена COMT дикого типа, специфичный для гена зонд для мутации bm3, специфичный зонд для гена COMT и воду. В некоторых системах ПЦР-анализа (например, в ПЦР-анализах TaqMan®), фермент и буфер могут присутствовать в одном компоненте набора (например, в основной смеси для генотипирования TaqMan®; Applied Biosystems, Foster City, CA, № в каталоге 4371355).
После того как реакционная смесь приготовлена может быть добавлен образец (образцы) геномной ДНК и начата реакция. Нет необходимости в нормализации количеств геномной ДНК в образце. Однако специалист в данной области может достичь лучших результатов при использовании образцов геномной ДНК с относительно равными концентрациями.
В некоторых вариантах ПЦР-анализ (например, ПЦР-анализ TaqMan®) может быть подготовлен с соответствующими контролями. Например, реакция в многолуночном планшете может быть осуществлена с использованием контрольных лунок, содержащих: (1) негативный контроль (контроли) с реагентами, но без образца ДНК; (2) гомозиготный позитивный контроль (контроли), содержащий геномную ДНК кукурузы bm3; (3) и гемизиготный позитивный контроль (контроли), который описан выше. Затем ДНК амплифицируют в ПЦР в подходящих условиях цикла. Например, в некоторых вариантах с использованием системы ПЦР GenAmp® 9700, может быть один начальный цикл денатурации при 95°C в течение 15 минут с последующими 30 циклами денатурации (92°C в течение 15 секунд) и отжигом/элонгацией (60°C в течение 60 секунд). Специалисты в данной области понимают, что условия цикла ПЦР можно варьировать по желанию специалиста и получить сравнимые результаты.
D. Определение генотипа и/или зиготности
ПЦР-анализ (например, ПЦР-анализ TaqMan® с регистрацией в конечной точке) можно применять для анализа генотипа и/или зиготности кукурузы BMR или предполагаемой кукурузы BMR. В некоторых вариантах специфичный для гена олигонуклеотидный зонд можно метить репортером (например, флуоресцирующим остатком). В случае анализов с использованием флуореметрической регистрации продукты ПЦР-реакции можно анализировать в спектрофлуориметре (например, Tecan GENiosTM; Mannedorf, Switzerland), используя установки длин волн возбуждения и эмиссии, подходящие для регистрации зонда (зондов). Например, флуоресцирующий краситель FAM можно измерять при длине волны возбуждения 485 нм и длине волны эмиссии 535 нм. Альтернативно, флуоресцирующий краситель VIC можно измерять при длине волны возбуждения 525 нм и длине волны эмиссии 560 нм.
После завершения ПЦР-реакции и регистрации зондов можно составить таблицу и построить график распределения, используя, например, любое подходящее компьютерное графическое обеспечение. Результаты, полученные с использованием ДНК дикого типа, гемизигот и гомозигот со сходным генотипическим фоном могут служить в качестве негативных и позитивных контролей. В расщепляющейся популяции могут быть получены три кластера точек данных, позволяющих визуально определить результат для образца как вероятно относящегося к одному из сегрегированных кластеров. Альтернативно можно использовать компьютерную программу для анализа данных, чтобы рассчитать вероятность того, что результат для образца относится к любому сегрегированному кластеру, при этом наиболее вероятный кластер служит в качестве указания для образца. Когда осуществляют визуальное определение, граница каждого кластера может быть произвольной, например, когда три кластера точек данных ясно видимы.
Необработанные данные об интенсивности флуоресценции также можно анализировать непосредственно с устройства для считывания планшетов, используя подходящий пакет для анализа, такой как KLIMS (лабораторная система управления информацией KBioscience). Может быть построен график с относительными единицами флуоресценции сигнала флуоресценции, генерируемого специфичным зондом для мутантного аллеля, отложенными на одной оси, и RFU сигнала флуоресценции, генерируемого зондом, специфичным для аллеля дикого типа, отложенными по другой оси. Затем могут быть осуществлены определения зиготности на основе разделения кластеров на графическом дисплее данных.
Образцы, которые не содержат мутантной геномной ДНК (например, мутации BMR), могут давать результат, получаемый только в виде регистрации флуоресценции ПЦР-продукта дикого типа. Образцы, содержащие гемизиготную или гомозиготную мутантную геномную ДНК, могут давать результат, получаемый в виде регистрации RFU для зонда, специфичного для мутанта, выше, чем в случае негативного фонового контроля. Если образец дает неадекватные результаты, геномная ДНК в образце может быть ненадлежащего качества и/или присутствовать в ненадлежащем количестве, и следует заново приготовить ДНК и осуществить новую ПЦР-реакцию. Предпочтительно негативный контрольный образец, не содержащий образца ДНК, дает очень низкую результаты при регистрации специфичного для гена зонда (зондов). Также предпочтительно известные гомозиготные контроли дают только высокие результаты при регистрации мутантной ДНК или ДНК дикого типа в контроле, и известные гемизиготные контроли дают высокие результаты при регистрации и мутантной ДНК и ДНК дикого типа.
«Контрольный прогон» способа ПЦР и определения генотипа и/или зиготности можно осуществить со всеми подходящими контролями перед скринингом образцов. Дополнительная оптимизация способов может требоваться для компонентов, которые могут быть разными в применениях (например, способ получения геномной ДНК, ДНК-полимераза Taq, олигонуклеотиды, лабораторное оборудование и т.д.). Могут быть установлены условия ПЦР и термоциклирования, в которых амплифицируются как мутантные последовательности, так и последовательности дикого типа на известной матрице геномной ДНК с приемлемыми уровнями регистрации зондов (например, приемлемыми значениями RFU для флуоресцентно меченых олигонуклеотидных зондов).
E. Интрогрессия признака низкого содержания лигнина в зародышевую плазму растения
В данном разделе описаны способы получения растения кукурузы с низким содержанием лигнина (например, кукурузы BMR), посредством обычной селекции растений на основе полового размножения. Способы могут включать в себя скрещивание первого родительского растения кукурузы, которое содержит в своем геноме, по меньшей мере, одну копию мутации BMR (например, bm3, bm3-1, bm3-2), со вторым родительским растением кукурузы, для того чтобы получить потомство F1. Первым растением может быть любое растение кукурузы BMR, включая, например, сорта кукурузы BMR F2F297, F2F383, F2F488, F2F449, F2F566, F2F610, F2F622, F2F665, F2F633, F2F682, F2F721, F2F700 и F2F797. Вторым родительским растением кукурузы может быть любое растение кукурузы, которое способно давать жизнеспособное потомство растений кукурузы (например, семена) при скрещивании с первым растением кукурузы. Первое и второе родительские растения кукурузы могут быть растениями одного и того же вида кукурузы (например, Zea mays (маис)). Способы могут дополнительно включать в себя самоопыление потомства F1 с получением потомства F2. Способы могут дополнительно включать в себя получение одного или нескольких поколений от возвратного скрещивания растений потомства F1 или F2 с растением той же линии или генотипа, что и первое или второе родительское растение кукурузы. Альтернативно потомство F1 от первого скрещивания или любого последующего скрещивания можно скрещивать с третьим растением кукурузы, которое является растением другой линии или генотипа, чем первое или второе растение.
В некоторых вариантах растения потомства подвергают анализу для определения генотипа и/или зиготности согласно изобретению. После того, как растения потомства были генотипированы и/или была определена их зиготность, специалист может отобрать те растения в потомстве, которые имеют требуемый генетический состав. Такие отобранные растения-потомки можно использовать для дальнейшего скрещивания, самоопыления или культивирования. Способы интрогрессии мутации BMR, которые контролируются согласно раскрытым способам, уменьшают или исключают культивирование и/или размножение растений, которые не имеют требуемого генетического состава, и таким образом обеспечивают требуемую надежность и предсказуемость (за счет ожидаемых Менделевских картин наследования).
Следующие далее примеры приведены для иллюстрации некоторых конкретных признаков и/или вариантов. Следующие примеры не следует рассматривать как ограничивающие изобретение конкретными описанными признаками или вариантами.
ПРИМЕРЫ
Пример 1: Материалы и способы
Растительный и генетический материал. Получали образцы листьев кукурузы, содержащих гомозиготные аллели bm3 и гомозиготные аллели COMT дикого типа.
Выделение суммарной геномной ДНК и количественная оценка. Восемь дисков листа вырезали пробойником в случае каждого образца и измельчали до тонкодисперсного порошка, используя измельчитель Genogrinder® 2000. ДНК экстрагировали с использованием набора для 96-луночного планшета Qiagen DNeasyTM (Valencia, CA). Перед ПЦР образцы ДНК количественно оценивали, используя набор для определения количества Quant-iTTM PicoGreen® (Invitrogen, Carlsbad, CA), используя инструкции производителя.
Клонирование и секвенирование неполного гена COMT. Фрагменты геномной ДНК кукурузы неполного гена COMT амплифицировали из двенадцати линий bm3 и трех образцов не-bm3 (смотри таблицу 1), используя олигонуклеотиды BM35_F (5'-TACTCTACTGGCTGCGGCTAGC-3'; SEQ ID NO: 1) и BM34_R (5'-TAACCTTGATTGTTATTACTCGCACATGG-3'; SEQ ID NO:2) с применением системы для ПЦР ABI GeneAmp® 9700 (Applied Biosystems, Foster City, CA) в реакционных смесях, содержащих 2,5 единицы TaKaRa LA TaqTM (Takara Bio Inc., Shiga, Japan), 400 нМ dNTP, 200 нМ прямого (BM35_F) и обратного праймеров (BM34_R) и 30 нг геномной ДНК. Программа ПЦР начиналась с двух минут денатурации при 94°C с последующими 30 циклами при 94°C в течение 45 секунд, при 55°C в течение 45 секунд и при 72°C в течение двух минут. Продукты ПЦР визуализировали в 2% E-Gel® (Invitrogen, Carlsbad, CA) и затем экстрагировали в 0,8% E-Gel® CloneWellsTM. Затем очищенные продукты ПЦР клонировали в векторе pCR4-TOPO® (Invitrogen, Carlsbad, CA) согласно инструкции производителя. Отобранные колонии выращивали в течение ночи в 1X среде для замораживания, содержащей 2,5% LB (10 г триптона, 10 г NaCl и 5 г дрожжевого экстракта в 1 л среды LB), 36 мМ K2HPO4, 13 мМ KH2PO4, 1,7 мМ цитрата натрия, 6,8 мМ (NH4)2SO4, 4,4% глицерина, 0,4 мМ MgSO4·7H2O, 12,5 мкг/мл хлорамфеникола (добавляемого непосредственно перед использованием) и 50 мкг/мл канамицина. Затем отобранные колонии отправляли в Cogenics® (Houston, TX) для секвенирования с использованием промотора T7 и T3, а также BM1234R (5'-ATCAGCATCAGCCAGGCAGG-3'; SEQ ID NO:3), который локализован в гене COMT. Последовательности анализировали с использованием компьютерной программы Sequencher® 4.8. Мутации bm3 идентифицировали, сравнивая консенсусные последовательности из линий bm3 с образцами COMT дикого типа.
Список из двенадцати инбредных линий bm3 и трех инбредных линий не-bm3, используемых для клонирования и секвенирования генов COMT
Дизайн ПЦР-анализа TaqMan® и подтверждение. На основе консенсусных последовательностей ДНК из линий bm3 конструировали праймеры (BM3_F; SEQ ID NO:4 и BM3_R; SEQ ID NO:5) и зонд (BM3_Probe; SEQ ID NO:6), специфичные для места соединения, в котором неполные последовательности из гена COMT на 3'-конце были делетированы, для идентификации мутантного аллеля; праймеры (COMT_F и COMT_R) и зонд (COMT_Probe) в делетированной области для идентификации аллелей дикого типа. Праймер Express 3.0 использовали для проектирования анализа TaqMan®. Все праймеры и зонды, меченные двойным образом красителями FAM или VIC и связывающимся с малой бороздкой не флюоресцирующий тушителем I (MGBNFQ), синтезировали в Applied Biosystems (Foster City, CA). Все праймеры и зонды растворяли в 1X трис-EDTA до 100 мкМ. Основную смесь для генотипирования TaqMan® (Applied Biosystems, Foster City, CA, № в каталоге 4371355) использовали для всех реакций ПЦР.
Реакционные смеси для ПЦР в реальном времени в объеме 20 мкл готовили согласно таблице 2, используя 96-луночный планшет и оптическую систему iCycler® (BioRad, Hercules, CA), начинали с 15 минут денатурации при 95°C с последующими 50 циклами при 92°C в течение 15 секунд и при 60°C в течение 1 минуты. Сигналы флуоресценции регистрировали в конце каждого цикла.
ПЦР-смеси для каждой биплексной реакции
в конечном объеме 20 мкл
(2X, cat#4371355)
ПЦР-анализы TaqMan® с регистрацией в конечной точке в объеме 10 мкл готовили согласно таблице, используя 384-луночные планшеты. Систему для ПЦР ABI GeneAmp® 9700 (Applied Biosystems, Foster City, CA) использовали для амплификации, начиная с 15 минутной денатурации при 95°C с последующими 30 циклами при 92°C в течение 15 секунд и при 60°C в течение 1 минуты. ПЦР-продукты измеряли в спектрофлуориметре (Tecan GENiosTM, Mannedorf, Switzerland) после оптимального количества циклов, когда реакции были в ранней экспоненциальной фазе, используя рекомендованные установки прибора (FAM (мутант bm3): возбуждение - 485 нм, эмиссия - 535 нм; VIC (COMT дикого типа): возбуждение - 525 нм, эмиссия - 560 нм).
ПЦР-смеси для каждой биплексной реакции
в конечном объеме 10 мкл
(2X, cat#4371355)
Анализ данных. Для ПЦР в реальном времени порог флуоресценции вычисляли автоматически, когда его значение было немного выше фона, используя компьютерную программу iCycler®. Пороговый цикл (значение Ct) определяли по количеству циклов, необходимых для генерирования флуоресценции выше установленного порога. Затем использовали анализ, различающий аллели, для определения генотипов.
После завершения ПЦР TaqMan® с регистрацией в конечной точке и регистрации флуоресценции вычисляли сигнал выше фона репортерного красителя 1 (SOB1) и сигнала выше фона репортерного красителя 2 (SOB2). Строили график распределения, откладывая номера образцов и абсолютные отношения SOB1/SOB2 в логарифмическом масштабе. Образцы растений дикого типа, гемизиготных и гомозиготных, со сходным генетическим фоном использовали в качестве контролей. Определения генотипов осуществляли на основе разделения кластеров.
Необработанные данные интенсивности флуоресценции, полученные непосредственно из устройства для считывания планшетов, также анализировали, используя KLIMS (лабораторную систему управления информацией KBioscience). Строили графики, на которых RFU (относительные единицы флуоресценции) для FAM откладывали на оси x, а для VIC откладывали на оси y. Определения зиготности осуществляли на основе кластерного разделения при просмотре кластеров.
Пример 2: Анализ последовательностей неполных мутаций bm3 гена COMT
Для планирования специфичного для гена анализа TaqMan® в случае мутантов bm3 необходима точная информация о последовательностях. Поэтому конструировали два олигонуклеотида, чтобы амплифицировать неполный ген COMT (фиг.1) с геномной ДНК двенадцати линий bm3 и трех линий не-bm3 (фиг.2). Такие фрагменты клонировали в векторе pCR4-TOPO® и отправляли в Cogenics, Inc. для секвенирования с использованием промотора T7 и T3, а также BM1234R (SEQ ID NO:3). BM1234R локализован в середине гена COMT и был использован для получения информации о полноразмерной последовательности. Последовательности высокого качества из девяти линий bm3 анализировали и выравнивали, используя Sequencher® 4.8. Консенсусные последовательности из линий bm3 сравнивали с образцами дикого типа. Идентифицировали множество делеционных/инсерционных мутаций на 3'-конце гена COMT. Например, были подтверждены три мутации, которые подчеркнуты (фиг.3).
Дизайн и подтверждение специфичного для генов анализа. Все линии bm3, которые были тестированы, содержат крупную делеционную мутацию в 3'-экзоне гена COMT. Затем мутацию использовали для конструирования специфичного для генов анализа TaqMan®. Фиг.4 является схематичным представлением, показывающим локализацию олигонуклеотидов. Праймеры и зонды, специфичные для гена COMT дикого типа локализованы в участке делеции длиной 978 п.н.. Праймеры и зонды, специфичные для bm3, локализованы в месте соединения, при этом прямой и обратный олигонуклеотиды, фланкирующие участок делеции, и зонд охватывают область делеции.
Двенадцать известных линий bm3 и три линии не-bm3 использовали для тестирования специфичного для генов анализа TaqMan®. Шесть гемизиготных образцов получали, объединяя равные количества ДНК из линий bm3 и линий не-bm3. ПЦР в реальном времени использовали для проверки эффективности анализа. Олигонуклеотиды, специфичные для мутантов bm3 и для соответствующих последовательностей дикого типа объединяли в одном и том же анализе. FAM использовали для наблюдением за ампликоном bm3, и VIC использовали для наблюдения за ампликоном COMT дикого типа. Экспоненциальную фазу амплификации наблюдали в период от 22 до 36 цикла как в случае генов bm3, так и в случае гена COMT дикого типа (фиг.5a и 5b). Точные определения генотипов получали, используя анализ определения аллелей, основанный на измерении FAM для аллеля 1 и VIC для аллеля 2 в 30 цикле (фиг.6).
Проверка анализа зиготности TaqMan® с регистрацией в конечной точке. Один 96-луночный планшет с образцами ДНК популяций bm3, сегрегирующих как гомозиготные, гемизиготных и нулевые (дикий тип) использовали для тестирования и проверки анализа TaqMan® с регистрацией в конечной точке. Одним из преимуществ ПЦР TaqMan® с регистрацией в конечной точке является простота применения. ПЦР TaqManR) с регистрацией в конечной точке не требует более дорогостоящего устройства для ПЦР в реальном времени. Любое обычное устройство для ПЦР, подходящее для 96- или 384-луночных планшетов, и устройство для считывания планшетов, способное регистрировать соответствующий сигнал флуоресценции, достаточны для осуществления анализа.
На основании результатов, полученных в результате осуществления ПЦР в реальном времени, 30 циклов реакции ПЦР могут эффективно отделить гены bm3 от генов COMT дикого типа. Реакцию ПЦР заканчивали 30 циклом. После завершения ПЦР TaqMan® и регистрации флуоресценции вычисляли сигналы флуоресценции FAM (bm3) выше фона (H2O) в качестве сигнала выше фона 1 (SOB1); и VIC (COMT дикого типа) выше фоны 2 (SOB2). Строили график распределения, используя SOB1/SOB2 в логарифмическом масштабе (фиг.7). Контроли дикого типа, гемизиготные и гомозиготные контроли со сходным генетическим фоном служили в качестве негативных и позитивных контролей. В сегрегирующей популяции получали три кластера точек данных, позволяющих визуально определить точки отсечения. В случае примера, показанного на фиг.7, три кластера точек данных ясно видны. Точки данных для дикого типа находятся ниже 1, для гемизиготных образцов в диапазоне от 1 до 5, и для гомозиготных образцов выше 5.
Необработанные данные интенсивности флуоресценции, полученные непосредственно из устройства для считывания планшетов, также анализировали, используя KLIMS (лабораторную систему управления информацией KBioscience). Строили график, на котором RFU (относительные единицы флуоресценции) для FAM откладывали на оси x, а для VIC откладывали на оси y. Определения зиготности осуществляли на основе кластерного разделения при просмотре кластеров (фиг.8). Так как FAM использовали для наблюдения за амплификацией bm3, а VIC использовали для наблюдения за амплификацией COMT дикого типа, образцы с интенсивными сигналами FAM и слабым или отсутствующим сигналом VIC являются гомозиготными по bm3; образцы с интенсивными сигналами VIC и слабыми или отсутствующим сигналом FAM являются COMT дикого типа (нулевыми); и образцы с интенсивными сигналами и FAM и VIC являются гемизиготными.
Определения генотипа и зиготности в результате такого специфичного для гена bm3 ПЦР-анализа TaqMan® с регистрацией в конечной точке на 100% совпадали с фенотипическими данными, собранными в полевых условиях. Указанный анализ обеспечивает простой и точный способ характеристики статуса зиготности bm3 высокопроизводительным образом.
Пример 3: Интрогрессия мутации bm3
Зиготность растения кукурузы в отношении мутации bm3 определяют, как описано выше. Определяют, что растение кукурузы является гомозиготным по мутации bm3. Растение скрещивают обычным способом скрещивания с растением кукурузы, которое, как известно, является гомозиготным по гену COMT дикого типа, и растением кукурузы, гомозиготным по мутации bm3. В результате скрещивания получают потомство F1. Потомство F1 от скрещивания затем подвергают самоопылению, получая потомство F2. Получают образцы геномной ДНК потомства F2 и определяют зиготность растений в потомстве F2 как описано выше.
Отбирают растения потомства F2, которые являются гомозиготными по мутации bm3. Затем отобранное потомство анализируют в отношении низкого содержания лигнина, и потомство, которое имеет требуемые низкие уровни лигнина далее подвергают селекции посредством скрещивании и самоопыления и полученное потомство культивируют.
Хотя настоящее изобретение описано в данной публикации в отношении некоторых предпочтительных вариантов, специалистам в данной области будет понятно, что оно не ограничено таким образом. И может быть осуществлено множество дополнений, удалений и модификаций предпочтительных вариантов, не выходя за рамки объема изобретения, которое заявлено далее. Кроме того, отличительные признаки одного варианта можно сочетать с признаками другого варианта и при этом все еще оставаться в рамках объема изобретения, предусмотренного авторами изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕН И ВАРИАЦИИ, СВЯЗАННЫЕ С ФЕНОТИПОМ BM1, МОЛЕКУЛЯРНЫЕ МАРКЕРЫ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2617958C2 |
| ГЕН-СПЕЦИФИЧЕСКИЙ АНАЛИЗ НА FLUORY2 В МАИСЕ ДЛЯ ИНТРОГРЕССИИ МУЧНИСТОГО ПРИЗНАКА (FL2) | 2013 |
|
RU2661110C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЗИГОТНОСТИ ГЕНА FAD3 В КАНОЛЕ | 2012 |
|
RU2630998C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЗИГОТНОСТИ ГЕНА FAD-2 КАНОЛЫ С ИСПОЛЬЗОВАНИЕМ ПЦР С ДЕТЕКЦИЕЙ ПО КОНЕЧНОЙ ТОЧКЕ | 2012 |
|
RU2639508C2 |
| ТРАНСГЕННЫЙ ОБЪЕКТ КУКУРУЗЫ MON95275 И СПОСОБЫ ЕГО ОБНАРУЖЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2836053C1 |
| ДЕТЕКЦИЯ AAD-1 ОБЪЕКТА DAS-40278-9 | 2010 |
|
RU2577143C2 |
| ТРАНСГЕННЫЙ ОБЪЕКТ СОИ MON 87708 И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2010 |
|
RU2624025C2 |
| Количественный метод определения экспрессии аллелей GNAO1 здоровой формы и с мутацией c.607 G>A | 2021 |
|
RU2777663C1 |
| Панель последовательностей олигонуклеотидов для определения мутации Q61R гена NRAS в опухолевых образованиях щитовидной железы | 2019 |
|
RU2688189C1 |
| МАТЕРИАЛЫ И МЕТОДЫ ДЛЯ ОБНАРУЖЕНИЯ ГЕНА АРИЛОКСИАЛКАНОАТДИОКСИГЕНАЗЫ (AAD-12) В РАСТЕНИЯХ | 2012 |
|
RU2644249C2 |














Изобретение относится к области биохимии, в частности к способу определения зиготности аллеля мутанта bm3 и аллеля СОМТ дикого типа с использованием ткани растения кукурузы. Также раскрыт способ надежной и предсказуемой интрогрессии признака низкого содержания лигнина в зародышевую плазму растения. Изобретение позволяет эффективно определять зиготность аллеля мутанта bm3 и аллеля СОМТ дикого типа. 2 н. и 9 з.п. ф-лы, 8 ил., 3 табл., 3 пр.
1. Способ определения зиготности аллеля мутанта bm3 и аллеля СОМТ дикого типа с использованием ткани растения кукурузы, при этом способ включает в себя:
получение образца изолированной геномной ДНК из ткани растения кукурузы;
осуществление контакта в условиях высокой жесткости изолированной геномной ДНК с первой молекулой нуклеиновой кислоты, имеющей нуклеотидную последовательность, содержащую 10-35 смежных нуклеотидов комплемента bm3 полинуклеотида SEQ ID NO: 10, где первая молекула нуклеиновой кислоты не способна гибридизоваться с SEQ ID NO: 11 в условиях высокой жесткости, и второй молекулой нуклеиновой кислоты, имеющей нуклеотидную последовательность, содержащую 10-35 смежных нуклеотидов комплемента СОМТ полинуклеотида SEQ ID NO: 11, где вторая молекула нуклеиновой кислоты не способна гибридизоваться с SEQ ID NO: 10 в условиях высокой жесткости; и
выявление гибридизации между первой и второй молекулой и геномной ДНК, тем самым определяя зиготность аллеля мутанта bm3 и аллеля СОМТ дикого типа в изолированной геномной ДНК.
2. Способ по п. 1, где
осуществление контакта изолированной геномной ДНК с первой и второй молекулой нуклеиновой кислоты в условиях высокой жесткости включает осуществление контакта выделенной геномной ДНК с
(a) молекулой нуклеинокислотного праймера, имеющей нуклеотидную последовательность, которая идентична комплементу первого bm3 полинуклеотида, состоящего из 10-35 смежных нуклеотидов последовательности SEQ ID NO: 10;
(b) молекулой нуклеинокислотного праймера, имеющей нуклеотидную последовательность, которая идентична комплементу второго иного bm3 полинуклеотида, состоящего из 10-35 смежных нуклеотидов последовательности SEQ ID NO: 10; где способ дополнительно включает контактирование выделенной геномной ДНК с
(c) молекулой нуклеинокислотного праймера, имеющей нуклеотидную последовательность, которая идентична комплементу первого СОМТ полинуклеотида, состоящего из 10-35 смежных нуклеотидов последовательности SEQ ID NO: 11; и
(d) молекулой нуклеинокислотного праймера, имеющей нуклеотидную последовательность, которая идентична комплементу второго иного СОМТ полинуклеотида, состоящего из 10-35 смежных нуклеотидов последовательности SEQ ID NO: 11,
где способ дополнительно включает амплификацию с использованием праймеров (a) и (b) нуклеотидной последовательности между первым и вторым bm3 полинуклеотидом, если выделенная геномная ДНК содержит первый и второй bm3 полинуклеотид, и амплификацию с использованием праймеров (с) и (d) нуклеотидной последовательности между первым и вторым СОМТ полинуклеотидом, если выделенная геномная ДНК содержит первый и второй СОМТ полинуклеотид, где реакционная смесь для амплификации включает:
первую молекулу нуклеинокислотного зонда меченого первым репортером, имеющую нуклеотидную последовательность, которая является комплементом из 10-35 смежных нуклеотидов амплифицированной нуклеотидной последовательности геномной ДНК между комплементом праймера (а) и комплементом праймера (b), где первая молекула нуклеинокислотного зонда не способна гибридизоваться с SEQ ID NO: 11 в условиях высокой жесткости, и
вторую молекулу нуклеинокислотного зонда, которая мечена вторым иным репортером, имеющую нуклеотидную последовательность, которая является комплементом из 10-35 смежных нуклеотидов амплифицированной нуклеотидной последовательности геномной ДНК между комплементом праймера (с) и комплементом праймера (d), где вторая молекула нуклеинокислотного зонда не способна гибридизоваться с SEQ ID NO: 10 в условиях высокой жесткости; и
где определение зиготности аллеля мутации bm3 и аллеля СОМТ дикого типа в изолированной геномной ДНК включает выявление уровней первого и второго репортера.
3. Способ по п. 2, в котором первый репортер и второй репортер являются флуоресцирующими красителями с отличающимися спектрами возбуждения/эмиссии.
4. Способ по п. 3, в котором первым репортером является FAM, а вторым репортером является VIC.
5. Способ по п. 1, в котором первая молекула нуклеиновой кислоты имеет длину от 15 до 30 нуклеотидов.
6. Способ по п. 1, в котором первая молекула нуклеиновой кислоты выбрана из группы, состоящей из последовательностей SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6.
7. Способ по п. 1, в котором первая молекула нуклеиновой кислоты мечена первым флуоресцирующим красителем, и вторая молекула нуклеиновой кислоты мечена вторым флуоресцирующим красителем со спектрами возбуждения/эмиссии, которые отличаются от спектров возбуждения/эмиссии первого флуоресцирующего красителя.
8. Способ по п. 7, в котором первая молекула нуклеиновой кислоты мечена FAM, и вторая молекула нуклеиновой кислоты мечена VIC.
9. Способ по п. 2, в котором реакция амплификации представляет собой ПЦР-реакцию.
10. Способ по п. 2, в котором реакция амплификации представляет собой реакцию, не основанную на ПЦР.
11. Способ надежной и предсказуемой интрогрессии признака низкого содержания лигнина в зародышевую плазму растения, при этом указанный способ включает в себя:
скрещивание растения, имеющего аллель мутанта bm3, с другим растением;
получение образца изолированной геномной ДНК из растения-потомка, полученного при скрещивании;
осуществление контакта изолированной геномной ДНК с одной молекулой нуклеиновой кислоты, имеющей нуклеотидную последовательность, которая идентична комплементу из 10-35 смежных нуклеотидов bm3 полинуклеотида SEQ ID NO: 10, где молекула нуклеиновой кислоты не способна гибридизоваться с SEQ ID NO: 11 в условиях высокой жесткости; и
отбор потомства от скрещивания, которое имеет аллель мутанта bm3, посредством размножения растения, из которого получен образец, включающий геномную ДНК, которая гибридизуется в условиях высокой жесткости с молекулой нуклеиновой кислоты, с получением таким образом генетически сконструированного растения, при этом путем интрогрессии признак низкого содержания лигнина введен в зародышевую плазму генетически сконструированного растения.
Авторы
Даты
2016-08-10—Публикация
2011-05-11—Подача