Область техники, к которой относится изобретение
Настоящее изобретение относится к саморасщепляющемуся химерному белку, включающему целевой белок, пептид, состоящий из аминокислотной последовательности, представленной LPXTG, домен Сортазы А, обладающий функцией расщепления, и метку, которые последовательно расположены в направлении от амино-конца; нуклеиновой кислоте, кодирующей то же самое; экспрессирующему вектору, включающему нуклеиновую кислоту настоящего изобретения, и клетке, трансформированной экспрессирующим вектором настоящего изобретения. Кроме того, настоящее изобретение относится к способу очистки целевого белка, включающему культивирование, растворение и очистку трансформированной клетки, и способу получения конъюгата терапевтическое антитело- лекарственное средство с использованием способа очистки.
Предшествующий уровень техники
В связи с развитием генной инженерии и биологии было осуществлено много попыток произвести или получить большое количество специфического белка, используемого в индустрии или для лечения различных видов болезней. Соответственно, для получения искомого белка интенсивно развивались технология комбинирования белков, технология массового производства, и технология очистки и т.п.
Зачастую необходимый человеку целевой белок может быть получен культивированием клеток, трансформированных экспрессирующим целевой белок вектором так, чтобы экспрессировался целевой белок. По возможности белок может быть экспрессирован в эукариотических клетках, прокариотических клетках, и т.п., а в конкретных случаях, белок может быть экспрессирован в трансформированных растениях или трансформированных животных. Например, предпринималась попытки экспрессии белка в секретирующих молоко животных таким образом, чтобы получить целевой белок в их молоке. В этом случае, целевой белок может быть выделен и очищен из культуры клеток или молока.
В случае экспрессии белка в животных, растениях или микроорганизмах, для которых не существуют способов получения целевого белка через отдельный путь секреции, возникает необходимость в способах извлечения белка из органов хранения или из клетки(ок). Следует отметить, что получение целевого белка из трансформированных клеток сложно осуществить. Соответственно, для более легкого получения белка зачастую используется способ, в котором вместо целевого белка дикого типа используется рекомбинантный целевой белок, дополнительно содержащий метку.
Очистка с использованием метки является одним из способов, демонстрирующим значительно более высокую эффективность по сравнению с другими методами очистки белков, при этом используемые метки в основном подразделяются на пептидные метки и белковые метки. Пептидная метка состоит из короткой последовательности аминокислот и представляет собой, например, His-метку (гистидиновую метку). Это, например, часто используемая гексагистидиновая метка (His6-метка). Гистидиновый пептид имеет специфическое химическое сродство к никелю, так что химерные белки, содержащие соответствующую метку, можно очистить с достижением высокой степени чистоты на колонке, содержащей никель. Белковая метка является меткой, содержащей определенные домены и т.п., при этом используется свойство этих доменов связываться со специфическими компонентами. Белковая метка включает, например, GST-метку (глутатион S-трансферазную метку). GST-метка может быть очищена с достижением высокой степени чистоты с помощью колонки, где в качестве удерживающей среды используется глутатион, который является субстратом GST.
Поскольку описанная выше метка для очистки белка объединенная и экспрессированная с целевым белком может нарушать структуру или функцию целевого белка, привлекли внимание способы получения целевого белка, предусматривающие вырезание метки из белка. Обычный способ требует вначале осуществить процесс получения белка, включающего метку, затем процесс отщепления метки, и процесс очистки только целевого белка. По мере осуществления этих процессов целевой белок теряется, количество полученного в конце белка уменьшается, при этом стоимость и время соответствующих процессов достаточно велики. Соответственно, необходимо разработать способ минимизации потерь целевого белка в процессе отщепления метки, и очистки бежа с сохранением преимущества способа очистки белка с использованием метки.
С учетом данных предпосылок был разработан способ очистки белка с использованием домена сортазы А, имеющего функцию саморасщепления, и участка расщепления, распознаваемого этим доменом (Мао H et al., Protein Expr. Purif. 2004; 37(l):253-63). Сортаза A (SrtA, 60-206 ак) представляет собой фермент, который распознает последовательность сайта расщепления (LPXTG, где X представляет собой любую аминокислоту), и в условиях, когда присутствует кальций и триглицин происходит каталитическая реакция 2, в результате которой осуществляется разрез между треонином (Τ) и глицином (G). Способ очистки белка с использованием обычной сортазы А представляет собой способ, включающий стадию получения рекомбинантного экспрессирующего вектора, включающего полинуклеотид, кодирующий метку-Сортазу А (60 ~ 206 ак) -LPXTG-целевой белок; экспрессии белка в клетке-хозяине, и связывание измельченных клеток-хозяев с колонкой, связывающей метку; стадию удаления примесей; стадию введения кальций и/или триглицин-содержащего раствора и осуществления реакции; и стадию получения белка, который приспособлен для одновременной очистки белка и удаления метки в ходе однократного использования колонки. Тем не менее, способ с использованием обычного домена сортазы А, имеющего функцию расщепления, характеризуется недостатком, который заключается в том, что эффективность очистки целевого белка является низкой.
Таким образом, авторы настоящего изобретения завершили настоящее изобретение, создав возможность получения значительного выхода белка, по сравнению с обычным способом, что было сделано посредством введения в состав химерного белка домена сортазы А, имеющего функцию расщепления, и применении линкера между сортазой А и последовательностью для расщепления.
Краткое описание изобретения
Задачей настоящего изобретения заключается в создании саморасщепляющегося химерного белка, включающего пептид, состоящий из аминокислотной последовательности, представленной LPXTG, домена сортазы А, имеющего функцию расщепления, и метки, которые последовательно расположены начиная с амино-конца.
Другой задачей настоящего изобретения является обеспечение нуклеиновой кислоты, включающей нуклеотидную последовательность, кодирующую химерный белок и экспрессирующего вектора, включающего нуклеиновую кислоту.
Другой задачей настоящего изобретения является обеспечение клетки, трансформированной экспрессирующим вектором.
Описание чертежей
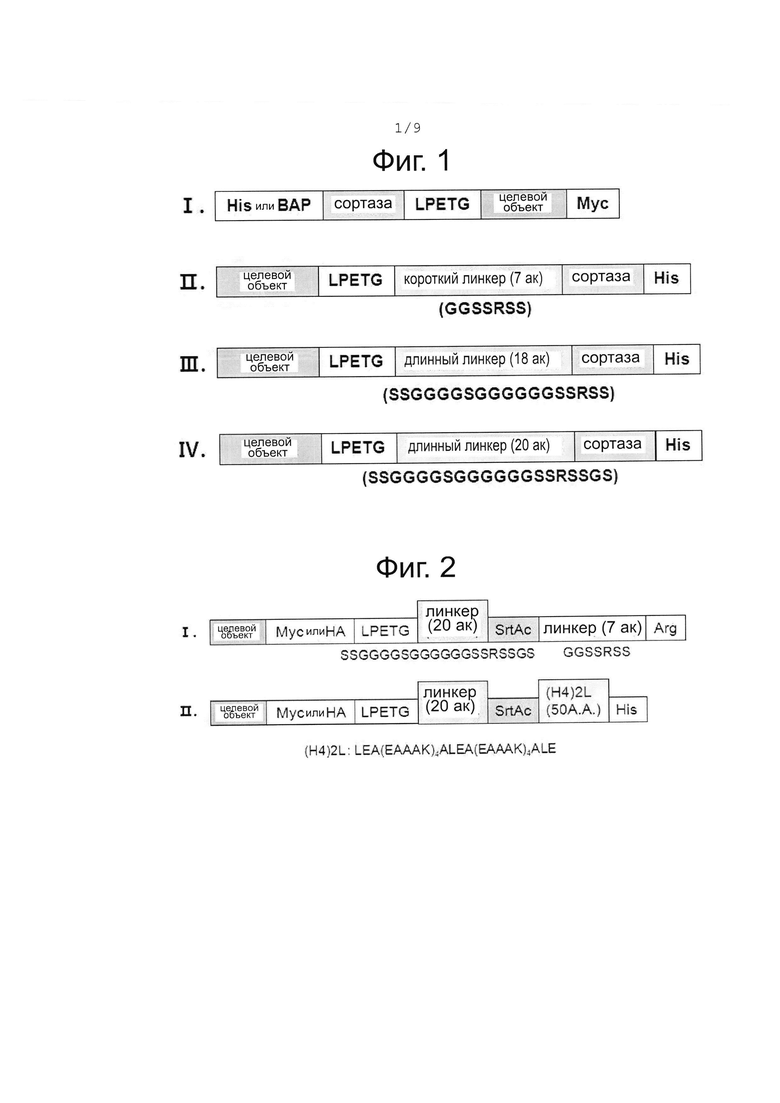
На фиг. 1 представлена структура обычного химерного белка, где целевой белок расположен на карбоксильном конце (I), и структуры химерных белков по настоящему изобретению, в которых целевые белки находятся на амино-концах, а линкеры имеют разную длину (II ~ IV).
На фиг. 2 приведена структура химерного белка, где введен гибкий линкер (I) или структура химерного белка, где введен спиральный линкер (II), для оптимизации пептидного линкера.
На фиг. 3 приведена структура химерного белка, где введен заряженный линкер (СН-линкер или АН-линкер) для оптимизации пептидного линкера.
На фиг. 4 представлены структуры химерных белков, которые различаются по длине линкера, где линкер добавляется или нет перед меткой.
Фиг. 5 является схемой, демонстрирующей способ очистки белка с использованием обычной саморасщепляющейся кассеты с сортазой А.
На фиг. 6 показаны результаты окрашивания SDS-PAGE-гелей кумасси синим для подтверждения экспрессии химерных белков с различных типов экспрессирующих векторов;
На фиг. 7А показана экспрессия белка в случае, когда его очищали с использованием обычной саморасщепляющейся кассеты с сортазой А, а на фиг. 7В показано будет ли белок экспрессироваться (А) и расщепленный целевой белок очищаться (анти-Мус) (дорожки 5 и 6).
Фиг. 8 является схемой, демонстрирующей способ очистки, где используется саморасщепляющаяся кассета с сортазой А по настоящему изобретению.
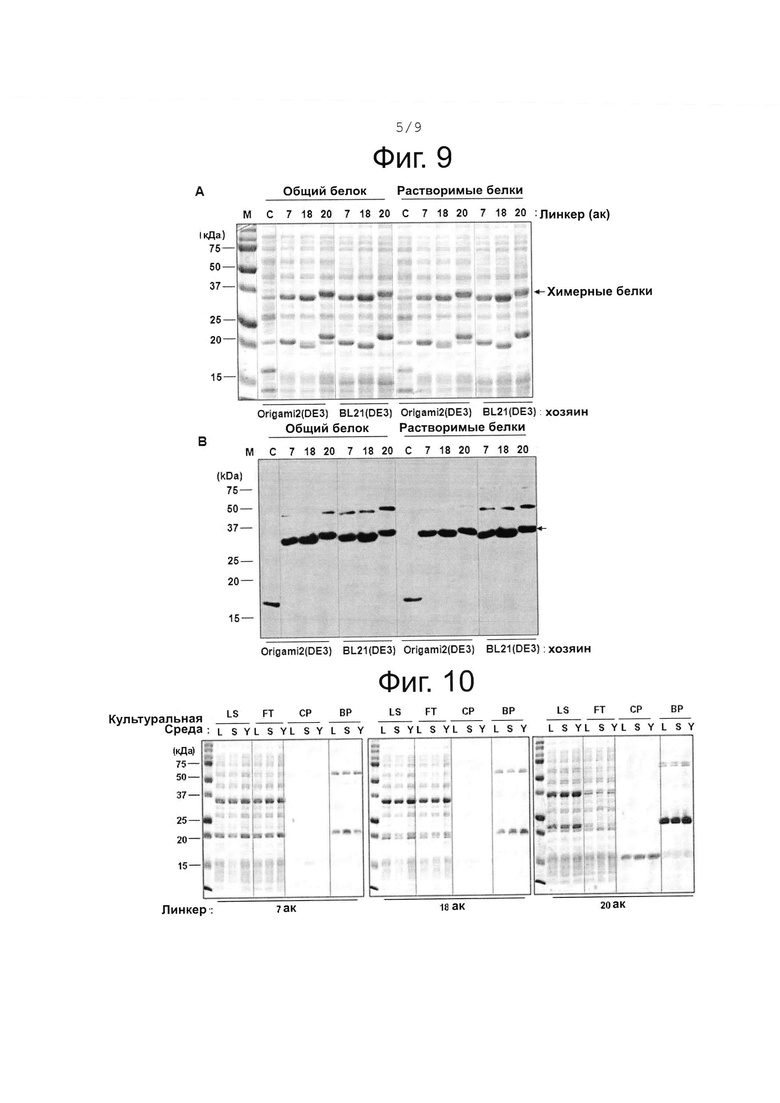
На фиг. 9 показан уровень экспрессии химерных белков из различных клеток-хозяев E.coli (Origami2 (DE3), и BL21 (DE3)), трансформированных экспрессирующими векторами, включающими саморасщепляющуюся кассету с сортазой А по настоящему изобретению, где использовались линкеры различной длины (7,18, 20 ак).
На фиг. 10 показаны результаты, подтверждающие наличие экспрессии (LS, загруженный образец) при культивировании клеток, трансформированных экспрессирующими векторами по настоящему изобретению, с различными линкерами в средах LB (L), SB (S), 2xYT (Y), с последующим связыванием (FT элюат; BP, связанный белок) и очисткой (CP, расщепленный белок).
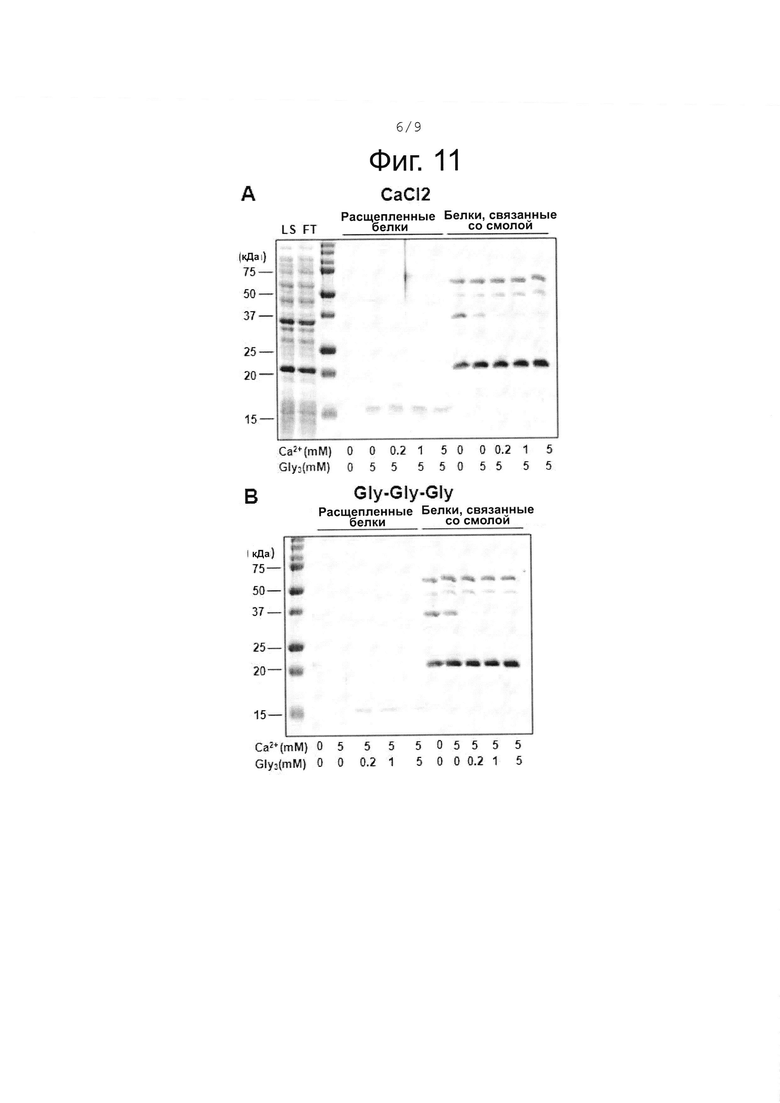
На фиг. 11 показано сравнение выхода расщепленного белка в зависимости от наличия или отсутствия кальция и триглицина в различных концентрациях, что сделано для оптимизации буфера для расщепления.
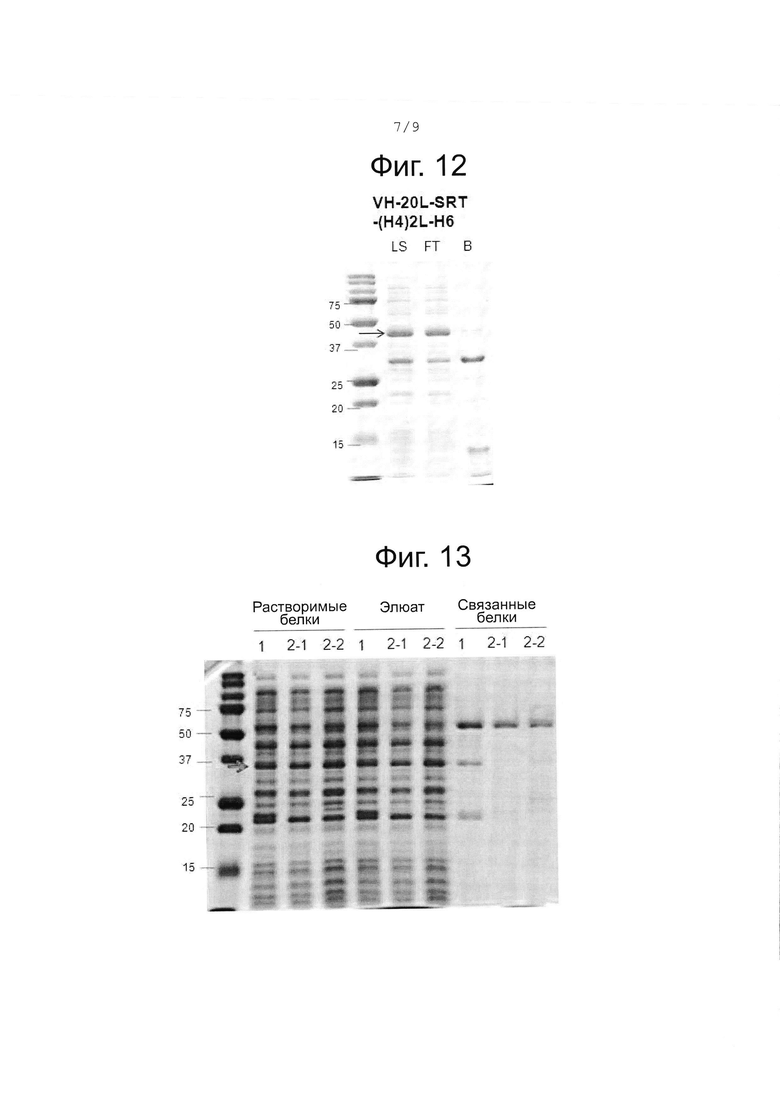
На фиг. 12 приведены результаты, демонстрирующие уровень экспрессии и связывания химерного белка при добавлении к нему спирального линкера.
На фиг. 13 представлены результаты, демонстрирующие уровень экспрессии и связывания химерного белка с гибким линкером (7 АА) между доменом сортазы А, имеющим функцию расщепления, и меткой (2-1 или 2-2) и химерного белка без гибкого линкера (1).
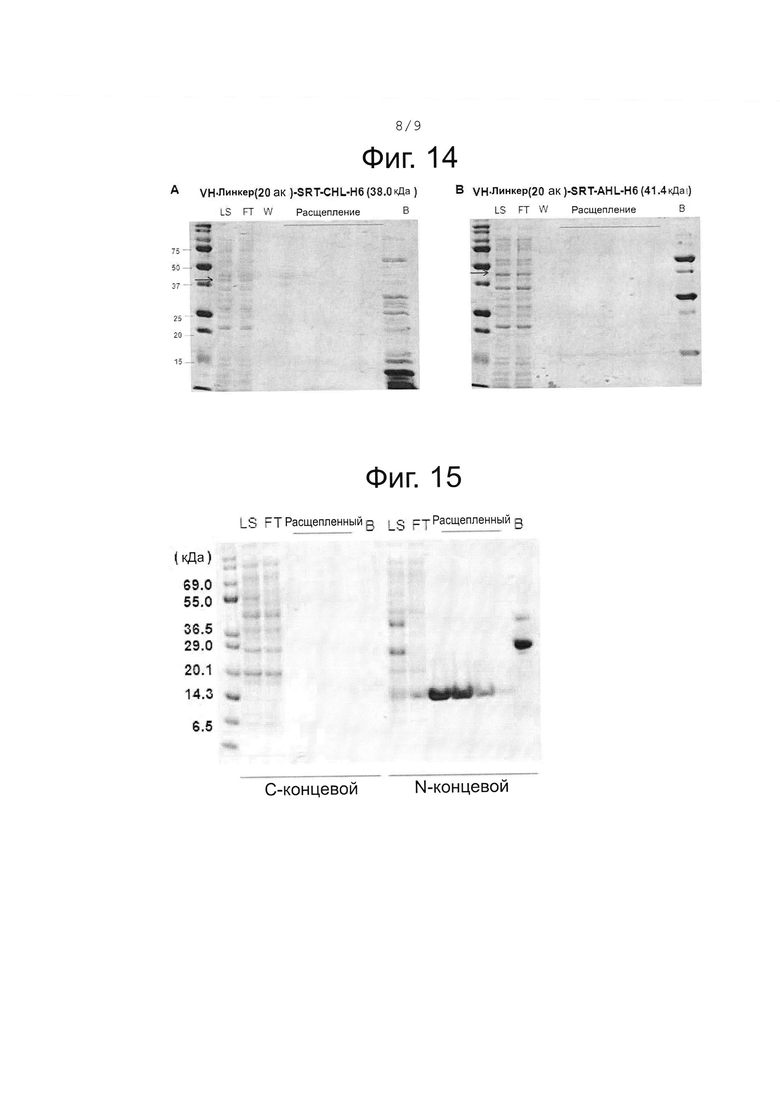
На фиг. 14 показаны результаты экспрессии, связывания и очистки химерного белка, к которому добавлен заряженный линкер (СН-линкер или АН-линкер).
На фиг. 15 приведены результаты, демонстрирующие уровень экспрессии, связывания и очистки химерного белка, в случае использования обычной саморасщепляющейся кассеты с сортазой А, где химерный белок содержит целевой белок на карбоксильном конце (С-конце), и где химерный белок, содержит кассету расщепления с сортазой А настоящего изобретения, причем целевой белок находится на амино-конце (N-конце) химерного белка.
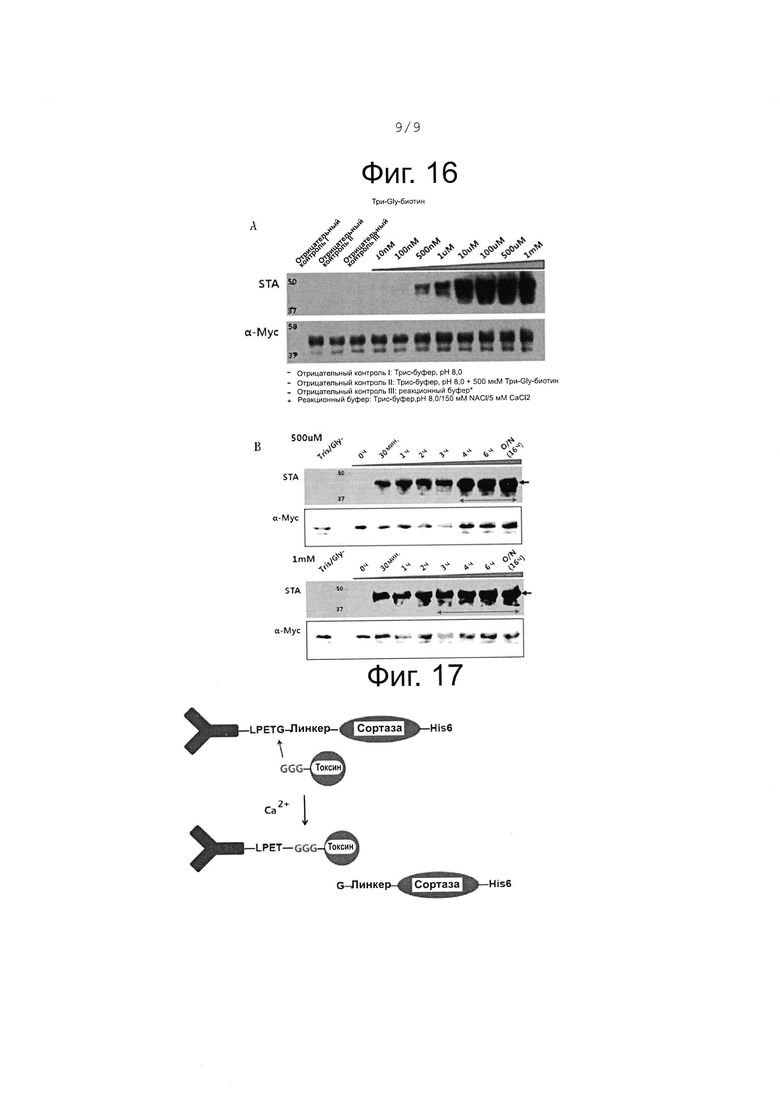
На фиг. 16 представлены результаты анализа концентрации (А) и времени реакции (В) конъюгата триглицина-биотина для определения оптимальных условий конъюгации целевого белка с лекарственным средством.
На фиг. 17 показан способ получения конъюгата антитело-лекарственное средство (ADC) путем выполнения реакции конъюгации химерного белка, включенного в саморасщепляющуюся кассету, где химерный белок может быть представлен как «антитело-линкер-сортаза» с триглицином-лекарственным средством (GGG-лекарственное средство) в буфере для расщепления.
Лучший вариант осуществления изобретения
Если не указано иное, все технические и научные термины, используемые в настоящем описании, имеют значения, как правило, понятные специалистам в той области техники, к которой относится настоящее изобретение. В общем, номенклатура, используемая в настоящем описании и описанных ниже примерах, хорошо известна в технических областях и широко используется.
В качестве примера воплощения настоящего изобретения для достижения вышеописанных целей, в настоящем изобретении предлагается саморасщепляющийся химерный белок, содержащий целевой белок, пептид, состоящий из аминокислотной последовательности, представленной LPXTG, домен сортазы А, имеющий функцию расщепления, и метку.
В частности, саморасщепляющийся химерный белок по настоящему изобретению включает:
(i) целевой белок;
(ii) пептид, представленный формулой I ниже:
[Формула I]
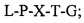
(iii) домен сортазы А, обладающий функцией расщепления, и
(iv) метку, где (i)-(iv) последовательно расположены от амино-конца до карбоксильного конца химерного белка, а в последовательности формулы 1, L представляет собой лейцин, Ρ представляет собой пролин, X представляет собой любую аминокислоту, Τ представляет собой Треонин, G представляет собой Глицин.
Обычный саморасщепляющийся химерный белок, содержащий домен сортазы А, имеющий функцию расщепления, содержит целевой белок на карбоксильном конце; однако в этом случае выход целевого белка после очистки зачастую низок. В настоящем изобретении подтверждено, что эффективность связывания химерного белка с колонкой и эффективность расщепления значительно улучшается, и, следовательно, выход очистки при получения целевого бежа заметно увеличивается (фиг. 15), при расположении целевого белка на амино-конце относительно сортазы А.
Предпочтительно, если саморасщепляющийся химерный белок по настоящему изобретению дополнительно включает пептидный линкер между пептидом, состоящим из аминокислотной 1 последовательности, представленной LPXTG, и доменом сортазы А, обладающим функцией расщепления.
«Целевой белок» относится к любому белку, который необходимо получить с высокой чистотой или в большом количестве для специальных целей, и включает, без ограничения перечисленным, белок дикого типа, вариант белка, новый рекомбинантный белок, и т.п. Целевой белок может быть белком, который должен быть получен с высокой чистотой или в большом количестве для промышленных, медицинских, научных целей, и т.п., предпочтительно, может быть рекомбинантным белком для фармацевтической области или исследований, и более предпочтительно, может быть выбран из группы, состоящей из полимерных белков, гликопротеинов, цитокинов, факторов роста, белков крови, вакцин, гормонов, ферментов и антител. Более предпочтительно, целевой белок может быть целой частью легкой цепи или тяжелой цепи антитела, или их частью, а наиболее предпочтительно, целевой белок может быть вариабельной областью легкой цепи (VL) или вариабельной областью тяжелой цепи (VH) антитела.
«Пептид, состоящий из аминокислотной последовательности, представленной LPXTG» относится к пептиду, состоящему из аминокислотной последовательности лейцин - пролин - любая аминокислота - треонин - глицин, которая является последовательностью узнавания для сортазы А, имеющей функцию расщепления белка. То есть сортаза А распознает последовательность LPXTG и расщепляет связь между треонином и глицином, таким образом, что участок, содержащий LPXT и участок, содержащий G, разделяются. X в пептиде, состоящем из аминокислотной последовательности LPXTG данного изобретения, может быть любой аминокислотой, например, может быть глутаминовой кислотой (Е).
«Сортаза A (Srt А)» в настоящем изобретении представляет собой белок, обладающий функцией присоединения поверхностного белка к клеточной стенке грамположительных бактерий, в отношении которого известно, что он связывает свободную карбоксильную группу треонина со свободной аминогруппой пентаглицина в клеточной стенке и т.п., путем расщепления связи между треонином и глицином в последовательности LPXTG.
В принципе, сортаза А представляет собой пептидазу, обладающую функцией распознавания и расщепления последовательности LPXTG. Сортаза А или Srt А, и тому подобное, в настоящем изобретении может относиться взаимозаменяемо как к домену сортазы А, имеющему функцию расщепления, так и к целому белку. В настоящем изобретении, может быть использован любой домен сортазы А, имеющий функцию расщепления. Предпочтительно, сортаза А может быть получена из бактерий, например, золотистого стафилококка (S. aureus), а более предпочтительно, домен сортазы А, имеющий функцию расщепления, может состоять из аминокислотной последовательности SEQ ID NO: 8.
«Метка» в настоящем изобретении относится к аминокислотной последовательности, пептиду или домену белка и т.п., которая встроена в рекомбинантный белок для мечения или получения белка, и способ очистки белка с помощью метки является способом, демонстрирующим значимо более высокую эффективность по сравнению с различными другими технологиями очистки белков. В этом случае, используемая метка подразделяется на пептидную метку и белковую метку. Например, метка в настоящем изобретении, может быть выбрана из группы, состоящей из полигистидиновой метки, GST метки (глутатион-S-трансферазной метки), НА-метки (гемагглютининовой метки), FLAG-метки, Мус-метки, метки из мальтоза-связьгвающего белка, метки из хитин-связывающего белка и флуоресцентной метки, без ограничения перечисленным. Предпочтительно, метка может быть полигистидиновой пептидной меткой, более предпочтительно, пептидной меткой, включающей от 6 до 12 гистидинов, а наиболее предпочтительно, полигистидиновая пептидная метка включает 10 гистидинов.
Метка служит для присоединения полноразмерного химерного белка, соединенного с меткой, к колонке, которая может связывать метку. В конечном счете, может быть получен целевой белок, включенный в химерный белок.
«Саморасщепляющийся химерный белок» в настоящем изобретении относится к белку, включающему одновременно домен, имеющий функцию расщепления, и последовательность, распознаваемую и расщепляемую этим доменом. В заданных условиях домен, имеющий функцию расщепления, активируется для распознавания и расщепления последовательности узнавания в том же белке. В настоящем изобретении, химерный белок может включать домен, полученный из сортазы А, который обладает функцией расщепления, и последовательность LPXTG, распознаваемую этим доменом, а также дополнительно включающий другие составляющие.
«Саморасщепляющаяся кассета» в настоящем изобретении относится к набору доменов, включающему домен, имеющий функцию расщепления, и последовательность, распознаваемую и расщепляемую этим доменом. Предпочтительно это может быть набором доменов, включающим обладающим функцией расщепления домен, полученный из сортазы А, и LPXTG, распознаваемую этим доменом.
«Пептидный линкер» в настоящем изобретении представляет собой пептид используемый для задания физической и химической дистанции или связи между одним доменом и другим доменом в химерном белке. Химерный белок по настоящему изобретению может включать в себя линкер между сортазой А и пептидом LPXTG. Линкер может быть природным линкером, гибким линкером, спиральным линкером, заряженным линкером (СН-линкером или АН-линкером) или биспиральным линкером, и т.п. Гибкий линкер по настоящему изобретению может иметь общую формулу (GaSb)n (а равно от 1 до 10, b равно от 1 до 10, n равно от 1 до 10), в частности, может включать последовательность (G4S).
Аминокислоты составляющие аминокислотную последовательность в данном описании представлены однобуквенными обозначениями, которые обычно используются в соответствующей области техники. В основном, в гибких линкерах не отмечена отталкивание или интеграция между аминокислотами линкера, и, таким образом, линкер характеризуются гибким движением. Спиральный линкер по настоящему изобретению может иметь общую формулу А(ЕААК)mA (где m равно 2~5), и может быть 50 ак (Н4)2 линкера (LEA(EAAAK)4ALEA(EAAAK)4AL, SEQ ID NO: 1). Заряженный линкер по настоящему изобретению может быть положительно или отрицательно заряженным линкером, а положительно заряженный линкер может быть СН-линкером (TRARLSKELQAAQARLGADMEDVCGRLVQYRG, SEQ ID NO: 2), а отрицательно заряженным линкер может быть АН-линкер (KEQQNAFYEILHLPNLNEEQRNGFIQSLKDDPSQSANLLAEAKKL, SEQ ID NO: 3).
Суперспиральный линкер может обладать способностью связываться с другим суперспиральным доменом или линкером, сохраняя при этом спиральную трехмерную структуру, и может быть представлен одной из SEQ ID NO: 9-16, или SEQ ID NO: 48-55.
Предпочтительно, пептидный линкер по настоящему изобретению может быть гибким линкером, и может иметь форму Sc(SG4)l(GGSSRSS)GdSe (SEQ ID NO: 4). В Sc(SG4)l(GGSSRSS)GdSe, с равно 0-5, d равно 0-5, е равно 0 -5, и 1 равно 0 -10. В настоящем изобретении, длина пептидного линкера не важна, и длина линкера может варьировать в зависимости от целевых белков для доступности активного сайта. Предпочтительно, линкер может иметь от 19 до 40 аминокислот, а более предпочтительно от 19 до 25 аминокислот. Наиболее предпочтительно, чтобы линкер мог быть пептидным линкером, состоящим из аминокислотной последовательности, представленной SEQ ID NO: 7.
В том случае, когда целевой белок представляет собой вариабельную область антитела, в одном примере осуществления настоящего изобретения была проведена оптимизация линкера путем изменения длины линкера, количества линкеров, и типов линкеров, с тем, чтобы проанализировать влияние линкера на выход целевого белка.
При сравнении выходов целевых белков (примеры 5-1, фиг. 9 и 10) с учетом использования линкеров различной длины, 7 ак (SEQ ID NO: 5), 18 ак (SEQ ID NO: 6) и 20 ак (SEQ ID NO: 7), было подтверждено, что выход целевого белка был увеличен в случае использования линкера с длиной 20 ак.
Кроме того, дополнительно оценивали эффект снижения интерференции между доменами на выход целевого белка от (пример 5-2), что проводилось путем включения дополнительного линкера между доменом сортазы А, имеющем функцию расщепления, и меткой (помимо этого линкера в белке также имеется линкер между последовательностью распознавания LPXTG и доменом сортазы А, имеющем функцию расщепления) (фиг. 2). В частности, сравнивали (1) белок из клетки, трансформированной вектором, экспрессирующим химерный белок, имеющим структуру целевой белок (VH) - LPETG - линкер (20 ак) - сортаза А - His-метка с (2) белком из клетки, трансформированной вектором, экспрессирующим химерный белок, имеющий структуру целевой белок (VH) - LPETG- линкер (20 ак) - сортаза А - линкер (7 ак) - His-метка (фиг. 13). В случае (1) было подтверждено связывание белков с колонкой (Связанные белки); однако, в случае (2). связавшиеся с колонкой белки практически не найдены. То есть, добавление линкера на С-конец сортазы А не приводит к увеличению связывания химерного белка с колонкой.
Было проанализировано влияние на выход целевого белка от введения спирального линкера или заряженного линкера между доменом сортазы А, обладающим расщепляющей функцией, и меткой (пример 5-3, фиг. 12 и 14). В частности, было показано, что химерный белок плохо связывается с колонкой (фиг. 12) в том случае, когда между доменом сортазы А, имеющем функцию расщепления, и меткой дополнительно был установлен спиральной линкер, с сохранением при этом гибкого линкера (20 ак) между последовательностью распознавания LPXTG и доменом сортазы А, имеющим функцию расщепления.
Кроме того, в случае, когда заряженные линкеры, такие как положительно заряженной линкер (СН-линкер, SEQ ID NO: 2) или отрицательно заряженный линкер (АН-линкер, SEQ ID NO: 3), дополнительно вставляли между доменом сортазы А, имеющем функцию расщепления, и меткой, с сохранением при этом гибкого линкера (20 ак) между последовательностью распознавания LPXTG и доменом сортазы А, имеющим функцию расщепления, было показано, что химерный белок плохо связывается с колонкой, и белок, получившийся в результате расщепления, практически не обнаруживался (фиг. 14).
Саморасщепляющийся химерный белок по настоящему изобретению может содержать аминокислотную последовательность, представленную SEQ ID NO: 17 или 18. Это относится к химерному белку, включающему вариабельную область антитела в качестве целевого белка, последовательности распознавания LPETG, пептидный линкер, домен сортазы А, имеющий функцию расщепления (60 ~ 206 ак) и метку для связывания на колонке (His9), расположенные последовательно начиная с амино-конца.
В соответствии с другим воплощением настоящего изобретения, предлагается нуклеиновая кислота, включающая нуклеотидную последовательность, кодирующую саморасщепляющийся химерный белок по настоящему изобретению. Нуклеотидная последовательность, кодирующая химерный белок по настоящему изобретению, может быть нуклеотидной последовательностью, кодирующей аминокислотную последовательность SEQ ID NO: 17 или 18, предпочтительно, SEQ ID NO: 56 или 57.
В соответствии с другим воплощением настоящего изобретения предлагается экспрессирующий вектор, включающий нуклеиновую кислоту, описанную выше.
«Экспрессирующий вектор» в настоящем изобретении относится к вектору, содержащему функциональный промотор и т.п., для экспрессии специфических генов в специфических прокариотических или эукариотических клетках-хозяевах. Каркас вектора может быть изменен в зависимости от клеток-хозяев. Вектор по настоящему изобретению может быть вектором, который можно экспрессировать в E.coli, более предпочтительно, вектором pET21b, pLIC, рЕТ23а (Novagen).
В соответствии с другим воплощением настоящего изобретения, предлагается клетка, трансформированная экспрессирующим вектором, как описано выше.
Клетка, которая являющаяся мишенью для трансформации, представляет собой клетку-хозяина, может быть эукариотической или прокариотической клеткой-хозяином. В настоящем изобретении, клетка-хозяин предпочтительно может быть Escherichia coli, а более предпочтительно, штаммы Е. coli Origami2 (DE3) или Ε. coli BL21 (DE3).
В одном из примеров воплощения настоящего изобретения, сравнивали трансформацию и экспрессию в E.coli Origami2 (DE3) и E.coli BL21 (DE3), для чего данные клетки-хозяева трансформировали экспрессирующими векторами по настоящему изобретению (фиг. 9). Как было подтверждено на фиг. 9, с точки зрения экспрессии между Origami2 и ВL21 не было большой разницы.
В соответствии с другим воплощением настоящего изобретения, предлагается способ очистки белка-мишени включающий: культивирование клеток по настоящему изобретению для получения клеточных лизатов; и очистку целевого белка из клеточных лизатов.
Предпочтительно очистка целевого белка из клеточных лизатов может включать: нанесение клеточных лизатов на колонку, которая связывает метку, присутствующую в химерном белке; промывку колонки; уравновешивание колонки буфером для расщепления, включающем по меньшей мере одно соединение из группы, состоящей из кальция и триглицина, для осуществления реакции расщепления; и сбор буфера для расщепления из колонки с получением целевого белка, из которого удалена метка.
«Колонка» в настоящем изобретении представляет собой устройство, осуществляющее функции выделения и/или очистки специфических компонентов, белков и соединений, путем внесения на нее раствора смеси, включающей специфический компонент, белки и соединения, и прохождения раствора смеси через внутреннюю часть колонки. В частности, в настоящем изобретении колонка используется для выделения и очистки, что осуществляется путем фиксации внутри колонки соединений, компонентов, белков и т.п., которые способы связываться с конкретной меткой, включенной в химерный белок, за счет чего белки, имеющие метку, присоединяются к внутренней части колонки. Если метка, включенная в химерный белок, представляет собой His-метку (метка, включающая гистидин), то может быть использована колонка Ni-NTA, обладающая связывающей способностью никеля, а если метка, включенная в химерный белок, представляет собой GST, то может быть использована колонка, включающая глутатион в качестве фиксирующей среды.
«Буфер для расщепления» в настоящем изобретении означает буфер, активирующий домен, имеющий функцию расщепления, в частности, буфер активации сортазы А. Буфер для расщепления может содержать кальций и/или триглицин, предпочтительно, может содержать, по меньшей мере, триглицин. Кроме того, буфер для расщепления может предпочтительно содержать от 0,1 до 10 мМ кальция и от 0,1 до 10 мМ триглицина, а более предпочтительно, от 0,2 до 5 мМ кальция и от 0,2 до 5 мМ триглицина.
В одном из примеров воплощения настоящего изобретения был проанализирован выход отщепленного белка при включении или не включении кальция или триглицина и при изменении их концентрации в буфере, что было сделано с целью определить оптимальные условия реакции расщепления. Выход отщепленного белка, полученный с помощью буфера для расщепления, в котором одно из веществ, выбранное из кальция и триглицина, находится в фиксированной концентрации 5 мМ, а другое из вышеуказанных веществ находится в концентрации 0, 0,2, 1 или 5 мМ, сравнивали с группой отрицательного контроля, где буфер не включал как кальций, так и триглицин. В группе отрицательного контроля расщепленный белок (около 15 кДа) не наблюдался вообще, а в случае включения хотя бы одного из кальция и триглицина, наблюдался расщепленный белок. Кроме того, было показано, что в случае включения определенного количества триглицина и варьируемой концентрации кальция, не было большой разницы в количестве полученного расщепленного белка. А в случае включения определенного количества кальция и варьируемой концентрации триглицина, а именно в случае без включения триглицина, было получено незначительное количество расщепленного белка. Таким образом подтверждено, что включение в буфер для расщепления триглицина играет важную роль в функции расщепления сортазы.
«Конъюгат терапевтическое антитело-лекарственное средство (ADC)» в настоящем изобретении состоит из трех компонентов, включая лекарственное средство, антитело и линкер, связывающий лекарственное средство и антитело, а технология конъюгата терапевтическое антитело-лекарственное средство представляет собой способ, в котором лекарственное средство поступает в опухолевые клетки с помощью. антитела, специфически связывающегося со специфическим антигеном, экспрессируемым на поверхности опухолевых клеток.
В соответствии с настоящим изобретением может быть получен конъюгат терапевтическое антитело-лекарственное средство. В частности, для его создания лекарственное средство связывают с С-концом триглицина, который является производным, индуцирующим расщепление саморасщепляющейся кассеты, включающей 'антитело-линкер-сортаза' на амино-конце, сортазой А по последовательности для расщепления (LPXTG). Таким образом при получении или синтезе 'триглицина-лекарственного средства (GGG-лекарственного средства)' путем присоединения лекарственного средства к С-концу триглицина, с последующим использованием его для реакции расщепления саморасщепляющейся кассеты, содержащей 'антитело-линкер-сортазу', может быть получено 'антитело-линкер-лекарственное средство (антитело-линкер-LPETGGG-лекарственное средство)'.
В частности, лекарственное средство, пригодное для введения в состав конъюгата терапевтическое антитело-лекарственное средство по настоящему изобретению может включать любое соединение, часть соединения или группу, обладающие эффектом цитотоксичности или ингибирования пролиферации клеток, включающие:
(i) химиотерапевтическое средство, способное функционировать в качестве ингибитора микротубулина, митотического ингибитора, ингибитора топоизомеразы или ДНК-интеркалятора;
(ii) белковый токсин, способный функционировать в качестве фермента;
(iii) микроРНК, миРНК, кшРНК, способные ингибировать экспрессию конкретного гена (онкогена); и
(iv) радиоактивный изотоп, и т.п.
Препарат может включать различные противоопухолевое или противораковые агенты, включая мейтансиноид, ауристатин, доластатин, трихотицен, CC1065 (цитотоксичное соединение), калихеамицин и другие энедииновые антибиотики, таксан, антрациклин, метотрексат, адриамицин, виндезин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин, дауномицин и его стереоизомеры, изостеры, аналоги или производные, ферменты такие, как другие интеркалирующие агенты, и их фрагменты, такие как нуклеолитические ферменты, антибиотики и токсины (бактериального, грибного, растительного или животного происхождения), ферментативно активные токсины, или низкомолекулярные токсины) и цисплатин, СРТ-11, доксорубицин, паклитаксел и доцетаксел, и т.п., при этом настоящее изобретение не ограничивается перечисленным.
В одном из примеров воплощения настоящего изобретения определяли оптимальные условия реакции расщепления с целью приготовления конъюгата терапевтическое антитело-лекарственное средство, путем оценки выхода полученного расщепленного белка при включении или не включении триглицина-биотина и изменения концентраций. Выход полученного целевого белка при использовании буфера для расщепления сравнивали с выходом в группе отрицательного контроля; где буфер включал триглицин-биотин в концентрации 0, 10 нМ, 100 нМ, 500 нМ, 1 мкМ, 10 мкМ, 100 мкМ, 500 мкМ, 1 мМ. В группе отрицательного контроля связывание целевого белка (примерное 45 кДа) с биотином обнаружено не было, а самый большой выход реакции связывания можно было наблюдать при концентрации от 500 мкМ до 1 мМ. Также с использованием вышеуказанных концентраций триглицин-биотина было определено оптимальное время реакции расщепления. Выход конъюгата целевой белок-биотин анализировали после проведения реакции в течение 0, 30 минут, 1, 2, 3, 4, 6 часов, и 16 часов, и сравнивали с группой отрицательного контроля. Самое большое количество триглицина-биотина можно было наблюдать в реакции связывания, осуществляемой в течение от 4 до 16 часов.
Хотя в предпочтительном варианте буфер для расщепления включает от 0,1 до 10 мМ кальция и от 500 нМ до 1 мМ триглицина-лекарственного средства (GGG-лекарственного средства), настоящее изобретение не ограничивается указанным. Аналогично, время, необходимое для связывания целевого белка с триглицином-лекарственным средством (GGG- лекарственным средством), предпочтительно составляет от 4 до 16 часов, но настоящее изобретение не ограничивается указанным.
Целевой белок предпочтительно представляет собой антитело против поверхностного опухолевого антигена, но настоящее изобретение не ограничивается указанным.
Далее настоящее изобретение будет описано более подробно со ссылкой на следующие примеры. Эти примеры предназначены только для иллюстрации данного изобретения, и специалистам в данной области очевидно, что объем настоящего изобретения не следует истолковывать как ограниченный данными примерами.
Пример 1. Создание экспрессирующего вектора
1-1. Реакционный раствор и условия ПЦР
Композиция реакционного раствора для ПЦР и условия проведения ПЦР для различных генов и создания векторов, используемых в настоящем изобретении, были следующими.
Реакционный раствор для ПЦР (50 мкл) готовили смешиванием 2,5 мМ смеси dNTP (5 мкл), 5Х буфера (PrimeStar 10 мкл), 100 мкМ прямого и обратного праймеров (соответственно, по 1 мкл), 100 нг/мкл матричной ДНК (1 мкл), 2,5 Ед./мкл полимеразы PrimeStar (0,5 мкл) и дистиллированной воды (31,5 мкл).
Приготовленный раствор ПЦР использовали для проведения двухстадийной ПЦР, в которой 29 раз повторяли цикл, где цикл включает стадию при 98°С в течение 10 секунд и стадию при 68°С в течение 1 минуты. Образцы, полученные после завершения ПЦР, хранили при 4°С.
1-2: Получение ВАР-Сортаза-LPETG-Мишень (VL)
Сначала последовательность ДНК, кодирующую ВАР (пептид акцептора биотина) амплифицировали с помощью ПЦР с использованием праймера 1_sfi (5'-CAG GCC ccgtg GCG GCC GCA GGC AGC AGC CTG GAC AAC АТС TTC GCC GAG-3': SEQ ID NO: 19) или праймера 1 (5'-ATG ATGT CAT GCA GGC AGC AGC CTG GAC AAC АТС TTC GCC GAG-3': SEQ ID NO: 20), и праймера 2 (5'-CTG TTC CAT GTG CCA GAT CTC CTT CTG GGC GAA CTC GTC GTT GAT-3': SEQ ID NO: 21).
ДНК, кодирующую аминокислотную последовательность SrtA, полученную из Staphylococcus aureus (S.aureus) (учетный номер GenBank Accession No. AF162687), с 60 по 206 аминокислоты, амплифицировали с помощью ПЦР с использованием праймера 3 (5'-АТС GAG TGG САС GAA ATG CAG GCT AAG CCG CAG ATT CCG-3': SEQ ID NO: 22) и праймера, 4 (5'-GCC GGT СТС GGG AAG СТТ СТТ GAC СТС GGT AGC GAC ААА-3': SEQ ID NO: 23).
Вторичную последовательность ДНК, кодирующую LPETG-мишень (VL) амплифицировали с помощью ПЦР с использованием праймера, 5 (5'-CAG GCT ТСС ТАА CGA GAC CGG CCA CGA TAT GAC GAT ТСА GAGC-3': SEQ ID NO: 24), праймера 6 (5'-АСТ CGA АСС CGC CGT ACG ТТТ ТАТ СТС TAC СТТ TGT-3': SEQ ID NO: 25) и матрицы мишени (VL).
Затем, после того как описанные выше три продукта ПЦР смешивали друг с другом, последовательность ДНК, кодирующая BAP-SrtA-kLPETG-целевой объект (VL), что представляет собой химеру, имеющую сайт Hind III между SrtAc-LPETG и последовательностью, кодирующей мишень, амплифицировали с помощью ПЦР с использованием праймера 1_sfi или праймера 1 и праймера 7 (5'-taatggccggcctggcc GCG GCC GCT ТАА AGA ТСТ ТСТ ТСА СТА АТТ ААСТТ-3': SEQ ID NO: 26).
Фрагменты ДНК, полученные таким образом, гидролизовали с помощью NdeI и NotI, и лигировали в вектор рЕТ23а (Novagen), индуцирующий экспрессию в цитоплазме, расщепляли SfiI, и лигировали ВАР-сортаза-LPETG-целевой объект-Мус (I на фиг. 1) в pCom3x, который является вектором, индуцирующим экспрессию в периплазме.
1-3: Получение целевой объект (VL) -kLPETG-линкер-Сортаза-H9
Последовательность ДНК, кодирующую целевой объект-LPETG-линкер (7 ак) связанный с линкером (7 ак) (GGSSRSS: SEQ ID NO: 5) амплифицировали с помощью ПЦР с использованием праймера 8 (5'-ATG ТСА TAT GGA ТСА CAT GAT GAC АСА GAGT-3': SEQ ID NO: 27) и праймера 9 (5'- ggaaccaccgccggtctcgggaag AAG АТС TTC TTC ACT AAT TAAC-3 ': SEQ ID NO: 28).
Последовательность ДНК, кодирующую целевой объект-LPETG-линкер (18 ак) связанную с линкером (18 ак) (SSGGGGSGGGGGGSSRSS: SEQ ID NO: 6) амплифицировали с помощью ПЦР с использованием праймера 8 и праймера 10 (5'-GGA AGA AGA ТСТ GGA АСС АСС ССС АСС АСС GCC GCC АСС CGA GCC АСС GCC GGA TGA СТС GGT GGG AAG AAG АТ-3': SEQ ID NO: 29) и в результате путем ПЦР получали целевой объект-LPETG-линкер (7 ак).
Последовательность ДНК, кодирующую линкер(7ак)-SrtA(60-206), амплифицировали с помощью ПЦР с использованием праймера 11 (5'-gag асе ggc ggt ggt tcc tct aga tct tcc cag gct aag ccg cag att-3': SEQ ID NO: 30) и праймера 12 (5'-taat GC GGC CGC tta atgatggtg ATG GTG ATG ATG ATG ATGGC-3': SEQ ID NO: 31).
Последовательность ДНК, кодирующую линкер(18ак)-SrtA(60-206), амплифицировали с помощью ПЦР с использованием праймера 13 (5'-TCG AAG gtggttcctctagatcttcc GTC GCG GGA ATT TAT-3': SEQ ID NO: 32) и праймера 14 (5'-ATG taatggccggcctggcctta atgatggtg GTG ATG ATG ATG ATG GC-3': SEQ ID NO: 33).
Последовательность ДНК, кодирующую линкер (20 ак) -SrtA (60-206) с линкером (20 ак) (SSGGGGSGGGGGGSSRSSGS: SEQ ID NO: 7) амплифицировали с помощью ПЦР с использованием праймера 15 (5'-GGT ТСС TCT AGA ТСТ ТСС GGA AGC cag gct aag ccg cag att-3': SEQ ID NO: 34) и праймера 14.
Последовательность ДНК, кодирующую линкер (20ак) -SrtA (60-206)-линкер (7 ак), с линкером (20 ак) (SSGGGGSGGGGGGSSRSSGS: SEQ ID NO: 7), присоединенным к N-концу, и линкером (7 ак) (GGSSRSS: SEQ ID NO: 5), присоединенным к С-концу, амплифицировали с помощью ПЦР с использованием праймера 15, праймера 16 (5'-ATG ATG ATG GCG AGA GCT ACG GCT GCT GCC GCC CTT GAC CTC GGT AGC GAC AAA GA -3': SEQ ID NO: 35), и праймера, 17 (5'-TAA TGC GGC CGC TTA ATG ATG GTG ATG GTG ATG ATG ATG ATG GCG AGA GCT ACG GCT-3*: SEQ ID NO: 36).
Последовательность ДНК, кодирующую линкер (20 ак) -SrtA (60-206) - (Н4) 2L линкер (50 ак), с линкером (20 ак) (SSGGGGSGGGGGGSSRSSGS: SEQ ID NO: 11), присоединенным к N-концу, и (Н4) 2L линкером (50 ак)(SEQ ID NO: 1), присоединенным к С-концу, амплифицировали с помощью ПЦР с использованием праймера 15, праймера 18 (5'-ACG ACG ACG ACG GCG CTC CAG TGC CTT AGC AGC GGC TTC CTT AGC AGC AGC CTC CTT AGC AGC TGC TTC TTT CGC TGC GGC TTC CGC TTC CAA CGC TTT С-3': SEQ ID NO: 37), и праймера 19 (5'-ТАА TGC GGC CGC TTA ACG GCG ACG ACG GCG ACG ACG ACG ACG GCG CTC CAG T-3': SEQ ID NO: 38).
Последовательность ДНК с линкером (20 ак) (SSGGGGSGGGGGGSSRSSGS: SEQ ID NO: 7), присоединенным к N-концу, и кодирующую TRA- N-конца СН-линкера (32 ак), амплифицировали с помощью ПЦР с использованием праймера 15, праймер 20 (5'-GTG ССС GCG TCT TGA ССТ CGG TAG CGA CAA AGA ТСТТ-3': SEQ ID NO: 39), a CH-линкер частично амплифицировали с использованием праймера 21 (5'- GCT GTC CAA GGA GCT GCA GGC GGC GCA GGC CCG GCT GGG CGC GGA CAT G-3': SEQ ID NO: 40), праймера 22 (5'-GCG GTA CTG CAC CAG GCG GCC GCA CAC GTC CTC CAT GTC CGC GCC CAG CCGG-3': SEQ ID NO: 41), и праймера 23 (5'- GAG GTC AAG ACG CGG GCA CGG CTG TCC AAG GAG CTG CAG-3': SEQ ID NO: 42) и праймера 24 (TAA 5'-TAA Τ GC GGC CGC TTA ATG ATG CTG ATG GTG ATG GCC GCG GTA CTG CAC CAG GC-3': SEQ ID NO: 43), а последовательности ДНК, кодирующую линкер (20 ак)-SrtA (60-206) -CHL-линкер (32 ак) с линкером (20 ак) (SSGGGGSGGGGGGSSRSSGS: SEQ ID NO: 7), связанным с N-концом, и CHL-линкером (32 ак)(TRARLSKELQAAQARLGADMEDVCGRLVQYRG: SEQ ID NO: 2), связанным с С-концом, амплифицировали перекрывающимся ПНР с использованием смеси праймеров 15 и 24, продукта ПЦР, полученного выше (линкер (20 ак) -SrtA (60-206) -CHL(TRA-)) и CHL-линкера (32 ак) (TRARLSKELQAAQARLGADMEDVCGRLVQYRG: SEQ ID NO: 2).
Последовательность ДНК, кодирующая линкер (20 ак) (SSGGGGSGGGGGGSSRSSGS: SEQ ID NO: 11), связанный с N-концом и KEQ- N-конца АН-линкера (45 ак) амплифицировали с помощью праймера 15 и праймера 25 (5'-CGG АТС АСС СТТ GAC СТС GGT AGC GAC AAA GAT СТТ-3': SEQ ID NO: 44), а АН-линкер амплифицировали с использованием праймера 26 (5'-GAG GTC AAG GGT GAT CCG AAA GCT GAC AAC AAA TTC-3': SEQ ID NO: 45) и праймера 27 (5'- GTG ATG ATG ATG ATG GTG AGC TTT TGG TGC TTG TGC АТС AT-3': SEQ ID NO: 46), с использованием вектора pIG20 в качестве матрицы. Последовательность ДНК, кодирующую линкер (20 ак) -SrtA (60-206) -AHL-линкер (45 ак) с АН-линкером (45 ак) (KEQQNAFYEILHLPNLNEEQRNGFIQSLKDDPSQSAN LLAEAKKL: SEQ ID NO: 3) связан с С-концом амплифицировали с помощью перекрывающегося ПЦР с использованием смеси праймера 15, праймера 28 (ТАА 5'- ТАА Τ GC GGC CGC ТТА ATG ATG GTG ATG GTG ATG ATG ATG ATG GTG AGC TTT TGG-3': SEQ ID NO: 47), и продукта, полученного ранее с помощью ПЦР (линкера (20 ак) -SrtA (60-206) -AHL (KEQ-)) и AHL-линкера (45 ак) (KEQQNAFYEILHLPNLNEEQRNGFIQSLKDDPSQSANLLAEAKKL: SEQ ED NO: 3).
Наконец, целевой объект (VL) -LPETG-линкер (7 ак) -Сортаза -Н9 (II на фиг. 1) амплифицировали с помощью перекрывающейся ПЦР с использованием смеси праймера 8, праймера 12 и продукта, полученного ранее с помощью ПЦР (целевой объект-LPETG-линкер (7 ак) и линкер (7 ак) -SrtA).
Ген, кодирующий целевой объект (VL) -LPETG-линкер (18 ак) -Сортаза-Н9 (III на фиг. 1) амплифицировали с помощью перекрывающегося ПЦР с использованием смеси праймера 8, праймера 14 и продукта, полученного ранее с помощью ПЦР (целевой объект -LPETG-линкер (18 ак) и линкера (18 ак)-SrtA).
Ген, кодирующий мишень (VL) -LPETG-линкер (20 ак) -Сортаза-Н9 (IV на фиг. 1) амплифицировали с помощью перекрывающегося ПЦР с использованием смеси праймера 8, праймера 14 и продукта, полученного ранее с помощью ПЦР (целевой объект-LPETG-линкер (20 ак) и линкера (20 ак)-SrtA).
Ген, кодирующий целевой объект (VL) -LPETG-линкер (20 ак) -сортаза-линкер (7 ак) -Н9 (I на фиг. 2) амплифицировали с помощью перекрывающегося ПЦР с использованием смеси праймера 8, праймера 17 и продукта, полученного ранее с помощью ПЦР (целевой объект -LPETG-линкер (20 ак) и линкера (20 ак) -SrtA-линкера (7 ак)).
Ген, кодирующий целевой объект (VL) -LPETG-линкер (20 АА) -сортаза- (Н4) 2L линкер (50 АА) -Н9 (II на фиг. 2) амплифицировали с помощью перекрывающегося ПЦР с использованием праймера 8, праймера 19, и продукта, полученного ранее с помощью ПЦР (целевой объект -PETG-линкер (20 ак) и линкера (20 ак) -SrtA- (Н4) 2L линкера (50 ак)).
Ген, кодирующий целевой объект (VL) -LPETG-линкер (20 АА) -сортаза-CHL линкер (32 ак) -Н9 (I на фиг. 3) амплифицировали с помощью перекрывающегося ПЦР с использованием смеси праймера 8, праймера 24 и продукта, полученного ранее с помощью ПЦР (целевой объект -LPETG-линкер (20 ак) и линкера (20 ак)-SrtA-CHL линкера (32 ак)).
Ген, кодирующий целевой объект (VL) -LPETG-линкер (20 ак) -сортаза-АНТ-линкер (45 ак) -Н9 (II на фиг. 3) амплифицировали с помощью перекрывающегося ПЦР с использованием смеси праймера 8, праймера 28 и продукта, полученного ранее с помощью ПЦР (целевой объект -LPETG-линкер (20 ак) и линкера (20 ак) -SrtA-AHL линкера (45 ак)).
Фрагменты ДНК, полученные таким образом, гидролизовали с помощью NdeI и NotI, и последовательность лигировали в вектор рЕТ23а (Novagen), который является вектором, экспрессирующим целевой объект -LPETG-другой линкер-сортаза-R9, целевой объект -LPETG-другой линкер-сортаза-Н6, или целевой объект -LPETG-другой линкер-сортаза-Н9, которые являются химерными белками.
Целевой объект -LPETG-другой линкер-сортаза-119, целевой объект -LPETG-другой линкер-сортаза-Н6, или целевой объект -LPETG-другой линкер-сортаза-Н9, представляющие собой химерный белок, имеют сайт HindIII между мишенью и последовательностью, кодирующей LPETG- другой линкер-сортаза-119, LPETG-другой линкер-сортаза-Нб, или LPETG-другой линкер-сортаза-Н9. Затем, для экспрессии,, все генные конструкции гидролизовали NdeI и Hind III, и лигировали с pET23a-LPETG-другой линкер-сортаза-119, pET23a-LPETG-другой линкер-сортаза-Н6, или рЕТ23а-LPETG-другой линкер-сортаза -Н9.
Пример 2. Подтверждение экспрессии в растворимом состоянии
Анализы экспрессии были осуществлены с помощью E.coli Origami2 (DE3) или BL21 (DE3). Одиночную бактериальную колонию инокулировали в среду dYT (30 мл), содержащую 100 мг/л ампициллина и 0,5% (масс/об.) глюкозы и культивировали течение ночи при 37°С. Предварительную культуру инокулировали в 0,3 л среды LB, SB, или DYT (100 мг/л ампициллина, 50 мМ K2HPO4), и культивировали при 37°С (1 л колбе с перегородками, при 200 об./мин.). Когда значение OD 600 достигало 0,6, для индукции экспрессии добавляли IPTG таким образом, чтобы получить конечную концентрацию 0,5 мМ. Культивирование проводили при 18°С в течение 18 часов. Клетки собирали центрифугированием (10000 об/мин, 10 минут, 4°С), суспендировали в 30 мл 50 мМ Трис-HCl (рН 8,0) и 150 мМ NaCl, и измельчали с помощью ультразвуковых волн (ультразвуковая обработка). Сырой экстракт центрифугировали (10000 об./мин., 30 минут, 4°С), и надосадочную жидкость фильтровали с фильтром 0,2 мм и наносили непосредственно на Ni FF хроматографическую колонку, как описано в примере 3 ниже.
Пример 3. Очистка на Ni-NTA
Надосадочную жидкость лизата наносили на 5 мл Ni-NTA (GE) колонку, промывали более чем 20 колоночными объемами буфера А (50 мМ Трис-Cl, рН 8,0, 150 мМ NaCl, 30 мМ имидазола, и 5 мМ ВМЕ), и промывали более чем 5 объемами буфера В (50 мМ Трис-Cl, рН 8,0, 150 мМ NaCl). После промывки аликвоту белок-связывающая смола уравновешивали в буфере для расщепления (буфер В включающий 5 мМ CaCl2 и 5 мМ три-Gly), и проводили реакцию при 25°С в течение 1 часа.
Соответствующий процесс протекал, как показано на фиг. 5 и 8. На фиг. 5 показан способ очистки обычного химерного белка, в котором сортаза А связана с С-концом, показанным на фиг. 1, а на фиг. 8 показан способ очистки химерного белка по настоящему изобретению, в котором сортаза А связана с N-концом.
Чистоту белка анализировали окрашиванием гелей SDS-PAGE с помощью кумасси синего. Кроме того, осуществление экспрессии и очистки для некоторых образцов было подтверждено вестерн-блоттингом.
Пример:4. Подтверждение экспрессии и очистка химерного белка с сортазой
Была проанализирована эффективность очистки в зависимости от того, находится ли целевой белок на N-конце или С-конце собранного химерного белка с учетом структуры химерных белков.
Осуществление экспрессии было подтверждено в клеточных лизатах, полученных в примере 2 выше из клетки-хозяина (E.coli), трансформированной экспрессирующим вектором, полученным путем вставки химерного белка, показанного в I на ФИГ 1 в рЕТ23а, и pLIC. Клеточные лизаты очищали путем связывания с колонкой Ni-NTA (GE), как описано в примере 3, и белки были получены в состоянии, в котором они связались с колонкой.
Экспрессию и очистку подтверждали окрашиванием кумасси синим и вестерн-блоттингом с использованием метки Мус, связанной с целевым белком.
Как показано на фиг. 6, химерный белок хорошо экспрессировался вне зависимости от векторов, и, как показано на фиг. 7, химерный белок, включающий целевой белок на С-конце, не мог связаться с колонкой, а активность после очистки обнаруживалась в редких случаях (дорожки 5, 6 на фиг. 7В).
Для того чтобы проанализировать влияние от расположения целевого белка на эффективность очистки, химерные белки, имеющие целевые белки на N- и С-концах, сравнивали друг с другом с точки зрения эффективности очистки. Очистка была проанализирована с помощью экспериментов согласно примерам 2 и 3.
Как показано на фиг. 15, расщепленный белок (расщепленный) не детектировался в том случае, когда целевой белок располагался на С-конце. Между тем, было подтверждено, что расщепленный белок присутствует со значимо высокой степенью чистоты в том случае, когда целевой белок располагался на N-конце. Как было подтверждено сравнением дорожки Ls и дорожки элюата (FT) и анализом связывания белков на колонке, в тех случаях, когда целевой белок располагался на С-конце, химерный белок плохо связывался с колонкой; между тем, когда целевой белок располагался на N-конце, химерные белки связывались со значительно более высокой частотой, и большинство связанных химерных белков было расщеплено.
Пример 5. Тест оптимизации линкера
5-1. Оптимизация длины линкера,
Осуществление экспрессии было подтверждено в клеточных лизатах, полученных культивированием Origami2 (DE3) или BL21 (DE3), трансформированные векторами экспрессирующими химерный белок, показанный в II-IV на фиг. 1 в LB, среде SB или dYT, и осуществлением способа, показанного в примере 2. Клеточные лизаты были очищены связыванием с колонкой Ni-NTA (GE), как описано в примере 3, и белки были обнаружены в состоянии, в котором они связались с колонкой.
Экспрессия и очистка целевого белка были проанализированы окрашиванием кумасси синим и вестерн-блоттингом с использованием антитела против НА-метки в случае VH и с использованием антитела против Мус-метки в случае VL.
Как показано на фиг. 9, экспрессия была успешной и не наблюдались различия между клетками-хозяевами (Origami2 или BL21).
Кроме того, как показано на фиг. 10, можно видеть, что химерный белок хорошо экспрессировался вне зависимости от культурального раствора, в котором культивировались клетки (положение 33 кДа в дорожке образца загрузки (LS)). Кроме того, большая часть белка, связанного с колонкой, была расщеплена (полосы 33 кДа отсутствуют во всех дорожках со связанным белком (BP)).
Между тем, при изменении длины линкера, было показано, что в случае использования 7 ак линкера (GGSSRSS, SEQ ID NO: 5) и 18 ак линкера (SSGGGGSGGGGGGSSRSS, SEQ ID NO: 6) белки, из которых была удалена метка (расположенные на уровне 15 кДа в дорожке расщепленного белка (CP)), были слабо представлены.. Между тем, при использовании 20 ак линкера (SSGGGGSGGGGGGSSRSSGS, SEQ ID NO: 7) белок, из которого был удалена метка, был обнаружен в большом количестве и с высокой чистотой.
Причиной того, что выход целевого белка при использовании 20 ак линкера был значимо выше, чем выход белка при использовании 7 ак линкера, заключается в том, что, химерный белок, включающий 20 ак линкер, экспрессировался (сверхэкспрессировался) в большем количестве, что выявили при сравнении количества данного белка (дорожка LS), и белка с 7 ак линкером. Однако было обнаружено, что химерный белок, содержащий 18 ак линкер, сверхэкспрессировался примерно так же, как белок, включающий 20 ак линкер. При проведении сравнения дорожек LS и дорожкой FT было отмечено, что толстая полоса сверхэкспрессированного химерного белка (около 33 кДа), содержащего 20 ак линкер, исчезла в дорожке FT при прохождении через колонку, что подтверждает, что химерный белок, содержащий 20 ак линкер, имел значимо более высокую частоту связывания с колонкой. Дополнительно было показано, что для белка, включающего 20 ак линкер,, части белка (расположенные на уровне 20 кДа в дорожке связанного белка (BP)) были удалены, тогда как в колонке была значимо шире представлена включенная оставшаяся метка.
Соответственно, было подтверждено, что структура, в которой между саморасщепляющейся частью и сортазой вставлен 20 ак линкер, характеризуется значимо более высоким выходом получаемого целевого белка.
5-2: Возможность изменения выхода при добавлении линкера
Для того чтобы проанализировать изменение выхода в случае наличия линкера на С-а также на N-конце домена сортазы А, использовали химерный белок, полученный вставкой дополнительного линкера между доменом сортазы А и His-меткой.
На фиг. 13 представлено сравнение между случаем (1), трансформированным вектором, экспрессирующим химерный белок, имеющий структуру целевой белок (VH)-LPETG-линкер (20 ак)-сортаза A-His 6, и случаем (2), трансформированным, вектором, экспрессирующим химерный белок, имеющий структуру целевой белок (VH)-HA-LPETG-линкер (20 ак)-сортазаА-линкер (7 ак)-His 6.
Разница между (1) и (2) заключается в наличии линкера (7 ак, GGSSRSS) за сортазой А. Степени экспрессии и связывания с колонкой двух химерных белков были выявлены при окрашивании кумасси синим.
Как продемонстрировано на фиг. 13, обнаруживались сильные полосы на уровне частей химерного белка (33 кДа) в обоих случаях (1) и (2). Тем не менее, было показано, что белки в (1) связались с колонкой (связанные белки); а в (2) по сравнению с (1), было практически не обнаружено связанных с колонкой белков. То есть, добавление линкера (7 ак) к С-концу сортазы А мешает связыванию химерного белка с колонкой.
5-3: Изменение линкера
Частоту связывания с колонкой или выход проанализировали путем замены линкеров, содержащих множество глицина и серина и один аргинин на различные типы линкеров, способных уменьшить интерференцию между доменами.
Во-первых, была проведена замена на спиральный линкер. В химерном белке, имеющем структуры I и II фиг. 2, использовали спиральный линкер, имеющий общую формулу А(ЕААК)nA (n=2-5), в частности, (Н4) 2-линкер LEA(EAAAK)4ALEA(EAAAK)4ALE, 50 ак, SEQ ID NO: 1) (n=4), экспрессировали химерный белок и проанализировали частоту связывания белка на колонке.
Как показано на фиг. 12, соответствующие химерные белки сверхэкспрессировались, но незначительно связывались с колонкой. Было подтверждено, что спиральный линкер, использованный в соответствующих химерных белках, не обладает эффектом повышения частоты связывания.
Далее, была проведена замена на положительно заряженный линкер (CHL, TRARLSKELQAAQARLGADMEDVCGRL VQYRG, SEQ ID NO: 2) или отрицательно заряженный линкер (AHL, KEQQNAFYEILHLPNLNEE QRNGFIQSLKDDPSQSANLLAEAKKL, SEQ ID NO: 3). Структуры химерных белков с использованием линкеров приведены в I и II на фиг. 3. Была проанализирована частота связывания и выход двух полученных химерных белков.
Как показано на фиг. 14, химерный белок, включающий CHL (фиг. 14А), показал значимо более слабую экспрессию, и незначительно связался с колонкой. При этом химерный белок, включающий AHL (фиг. 14 В), продемонстрировал в некоторой степени сверхэкспрессию и связался с колонкой в заранее определенном количестве; однако расщепленный белок был плохо представлен. Было показано, что заряженный линкер, использованный в соответствующих химерных белках, не имеет значительного эффекта с точки зрения увеличения частоты связывания или выхода.
Пример 6. Оптимальные условия для реакции расщепления Как известно, для того, чтобы сортаза А распознала и расщепила последовательность расщепления (LPXTG), необходимы кальций и/или триглицин. В настоящем изобретении, выход белка расщепления был проанализирован при включении или не включении кальция или триглицина и в случае изменения концентраций для определения оптимальных условий реакции расщепления.
В частности, выход получения белка расщепления с помощью буфера для расщепления в котором смешаны одно вещество, выбранное из числа кальция и триглицина, имеющее фиксированную концентрацию 5 мМ и другое из вышеуказанных веществ в концентрации 0, 0,2, 1 или 5 мМ, сравнивали с группой отрицательного контроля без включения как кальция, так и триглицина.
Как показано на фиг. 11, в группе отрицательного контроля, белок расщепления (около 15 кДа) не наблюдался вообще, а в случае включения как минимум кальция или триглицина, наблюдался расщепленный белок. Между тем, было подтверждено, что в случае включения 5 мМ триглицина и контролируемой концентрации кальция от 0 до 5 мМ, не было большой разницы в количестве полученного расщепленного белка. В свою очередь в случае включения 5 мМ кальция и контролируемой концентрации триглицина от 0 до 5 мМ, в частности, в случае не включения триглицина, расщепленный белок был получен в очень малом количестве (фиг. 11В). Однако как только включали триглицин. то получаемое количество расщепленного белка различалось лишь незначительно.
Это означает, что триглицин, включенный в буфер для расщепления, играет важную роль в функции расщепления сортазы, а разность концентраций не оказывает существенного влияния.
Пример 7. Оптимизация получения конъюгата терапевтическое антитело-лекарственное средство
7-1. Оптимизация концентрации
В данном примере определяли оптимальную концентрацию триглицина для эффективного связывания с лекарственным средством. В качестве лекарственного средства, использовали биотин, объединенный с триглицином. Реакционную смесь получали смешиванием лекарственного средства в каждой из концентраций 0,10 нМ, 100 нМ, 500 нМ, 1 мкМ, 10 мкМ, 100 мкМ, 500 мкМ, и 1 мМ с реакционным буфером (50 мМ Трис-буфер, рН 8,0/150 мМ NaCl/5 мМ CaCl2) и конъюгаты целевых белков-биотина сравнивали с группами отрицательного контроля. Группы отрицательного контроля были представлены в следующих трех условиях 1: 50 мМ Трис-буфер, рН 8,0/2: 50 мМ Трис-буфер, рН 8,0+500 μ M триглицинсульфат-биотин/3: реакционный буфер. Общую концентрацию целевого белка из реакции конъюгации целевого белка-биотина анализировали с помощью вестерн-блоттинга, с использованием Мус-метки, связанной с целевым белком, а степень реакции конъюгации целевого белка и биотина подтверждали с помощью стрептавидина.
В результате в группах отрицательного контроля с тремя вышеописанными условиями, конъюгат целевого белка биотина (около 45 кДа) не наблюдался вообще, а активная реакция конъюгации наблюдалась в условии триглицин-биотин с концентрацией 500 мкМ и 1 мМ, также успешное прохождение реакций конъюгации можно было наблюдать в условии триглицин-биотин с концентрацией 100 мкМ, но частота реакции была ниже по сравнению с реакцией конъюгации в условии триглицина-биотин с концентрацией 500 мкМ и 1 мМ (фиг. 16А).
7-2: Оптимизация времени реакции
Оптимальное время реакции анализировали с помощью стандартной концентрации триглицина-биотина, описанной в примере 7-1 выше. Реакционную смесь готовили с использованием целевых белков, каждый с фиксированной концентрацией 500 мкМ или lmM, со временем реакции 0, 30 мин, 1, 2, 3, 4, 6 и 16 часов. Затем конъюгаты целевой белок-биотин сравнивали с группой отрицательного контроля.
Согласно результату, полученному вестерн-блоттингом по аналогии с примером 7-1, конъюгат целевого белка-биотина не наблюдался в группе отрицательного контроля; большое количество реакций конъюгации наблюдалось в триглицине-биотине в концентрации 500 мкМ в течение 4-6 часов; и лучшая эффективность была показана в случае реакции конъюгации длительностью 16 часов. Кроме того, в случав использования триглицина-биотина с концентрацией 1 мМ подтверждено, что превосходная эффективность конъюгации может наблюдалась во всех реакциях конъюгации в течение от 4 до 6 часов и 16 часов (фиг. 16В).
По итогам вышеописанных результатов, можно отметить, что химерный белок, имеющий структуру целевой белок-LPETG-линкер (20 ак)-сортаза-метка имел значимо более высокий выход из-за превосходной способности связывания с колонкой, и превосходной активностью саморасщепления сортазы А, и что с помощью химерного белка может быть легко получен конъюгат терапевтического антитела-лекарственного средства.
Промышленная применимость
Настоящее изобретение относится к саморасщепляющемуся химерному белку, включающему саморасщепляющуюся кассету, состоящую из домена сортазы А, обладающего функцией расщепления, и пептида, включающего аминокислотную последовательность LPXTG, которая является последовательностью распознаваемой доменом сортазы А, обладающим функцией расщепления. Данный белок характеризуется таким преимуществом, что процесс очистки и процесс удаления метки с целевого белка можно завершить всего лишь за одну стадию очистки, без проведения отдельных процессов. Химерный белок может широко использоваться в различных областях, где требуются высокоочищенные белки в большом количестве, поскольку способность химерного белка связываться с колонкой и его способность к саморасщецлению повышены, а целевой белок, из которого удалена метка, может быть получен с высокой чистотой, а способ очистки и способ удаления метки с целевого белка могут быть проведены в буфере для расщепления за значимо более короткий период времени и потребуется меньше усилий для очистки, при этом потеря получаемых белков будет небольшой вследствие использования всего лишь одной стадии, если целевой белок расположен на амино-конце. В частности, химерный белок пригоден для получения конъюгата терапевтическое антитело-лекарственное средство.
Настоящее изобретение было подробно описано с приведением примеров его воплощения и конкретных признаков, но специалистам в данной области техники очевидно, что эти конкретные технологии являются всего лишь предпочтительными воплощениями, и таким образом объем настоящего изобретения не ограничен данными воплощениями. Таким образом, фактический объем настоящего изобретения будет определен прилагаемой формулой изобретения и ее эквивалентами.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИБЛИОТЕКА FV НА ОСНОВЕ КОМБИНАЦИЙ БЕЛКОВ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2014 |
|
RU2639505C2 |
| ФЕРМЕНТАТИВНАЯ ОДНОРЕАКТОРНАЯ РЕАКЦИЯ ДВОЙНОГО КОНЪЮГИРОВАНИЯ ПОЛИПЕПТИДОВ ЗА ОДНУ СТАДИЮ С ИСПОЛЬЗОВАНИЕМ СОРТАЗЫ | 2015 |
|
RU2711364C2 |
| НОВЫЕ СПОСОБЫ ОПОСРЕДОВАННОГО ФЕРМЕНТАМИ КОНЪЮГИРОВАНИЯ ПОЛИПЕПТИДОВ С ИСПОЛЬЗОВАНИЕМ СОРТАЗЫ | 2015 |
|
RU2714963C2 |
| КОНЪЮГАТЫ АНТИТЕЛ С ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ, ХАРАКТЕРИЗУЮЩИЕСЯ ВЫСОКОЙ IN VIVO ПЕРЕНОСИМОСТЬЮ | 2018 |
|
RU2764031C2 |
| КОМПОЗИЦИИ АНТИТЕЛ К ROR1 И СООТВЕТСТВУЮЩИЕ СПОСОБЫ | 2017 |
|
RU2766190C2 |
| СПОСОБ ПОЛУЧЕНИЯ И ОТБОРА МОЛЕКУЛ, ВКЛЮЧАЮЩИХ ПО МЕНЬШЕЙ МЕРЕ ДВЕ РАЗЛИЧНЫЕ ГРУППИРОВКИ, И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2646159C2 |
| МЕЧЕННЫЕ СОРТАЗОЙ НЕЙРОТОКСИНЫ КЛОСТРИДИЙ | 2020 |
|
RU2801120C2 |
| СЛИТЫЙ БЕЛОК, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ ФАКТОРА VII | 2011 |
|
RU2585231C2 |
| ПРОФИЛАКТИКА, ЛЕЧЕНИЕ И ДИАГНОСТИКА ИНФЕКЦИИ, ВЫЗВАННОЙ БАКТЕРИЯМИ P.GINGIVALIS | 2009 |
|
RU2535898C2 |
| НОВЫЕ ПЕПТИДЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2583579C2 |





















Изобретение относится к области биохимии, в частности к саморасщепляющемуся химерному белку для очистки целевого белка, нуклеиновой кислоте, его кодирующей, а также к вектору и клетке-хозяину, содержащим вышеуказанную нуклеиновую кислоту. Также раскрыт способ очистки целевого белка, предусматривающий культивирование вышеуказанной клетки. Изобретение также относится к способу получения конъюгата терапевтического антитела-лекарственного средства с использованием вышеуказанного химерного белка. Изобретение позволяет эффективно осуществлять очистку целевого белка. 6 н. и 23 з.п. ф-лы, 17 ил., 7 пр.
1. Саморасщепляющийся химерный белок для очистки целевого белка, содержащий:
(i) целевой белок;
(ii) пептид, представленный формулой I ниже;
(iii) домен сортазы А, обладающий функцией расщепления;
(iv) метку, которая введена в химерный белок с целью мечения или получения целевого белка в химерном белке,
где (i)-(iv) последовательно расположены от амино-конца до карбоксильного конца химерного белка,
[Формула I]
L-P-X-T-G,
L представляет собой лейцин, Р представляет собой пролин, X представляет собой любую аминокислоту, Т представляет собой треонин, G представляет собой глицин, и
пептидный линкер между пептидом, представленный Формулой I по (ii), и доменом сортазы А, обладающим расщепляющей функцией, по (iii) для задания физической или химической дистанции или связи между (ii) и (iii) в химерном белке, где линкер представлен Sc(SG4)l(GGSSRSS)GdSe, в котором S представляет серин, G представляет глицин, R представляет аргинин, с равно 0-5, d равно 0-5, е равно 0-5, и l равно 0-10.
2. Саморасщепляющийся химерный белок по п. 1, в котором X в формуле I является глутаминовой кислотой.
3. Саморасщепляющийся химерный белок по п. 1, отличающийся тем, что пептидный линкер состоит из 7, 18 или 20 аминокислот.
4. Саморасщепляющийся химерный белок по п. 1, отличающийся тем, что пептидный линкер содержит аминокислотную последовательность, представленную в SEQ ID NO: 7.
5. Саморасщепляющийся химерный белок по п. 1, отличающийся тем, что сортаза А получена из Staphylococcus aureus (S. aureus).
6. Саморасщепляющийся химерный белок по п. 1, в котором домен сортазы А, обладающий функцией расщепления, включает аминокислотную последовательность, представленную в SEQ ID NO: 8.
7. Саморасщепляющийся химерный белок по п. 1, отличающийся тем, что метка выбрана из группы, состоящей из полигистидиновой метки, глутатион-S-трансферазной метки, гемагглютининовой метки, FLAG-метки, Мус-метки, метки из мельтозо-связывающего белка, метки из хитин-связывающего белка и флуоресцентной метки.
8. Саморасщепляющийся химерный белок по п. 7, отличающийся тем, что метка представляет собой полигистидиновую метку.
9. Саморасщепляющийся химерный белок по п. 8, отличающийся тем, что полигистидиновая метка включает 6-12 последовательных гистидинов.
10. Саморасщепляющийся химерный белок по п. 1, отличающийся тем, что целевой белок выбран из группы, состоящей из полимерных белков, гликопротеинов, цитокинов, факторов роста, составляющих крови, вакцин, гормонов, ферментов и антител.
11. Саморасщепляющийся химерный белок по п. 1, отличающийся тем, что целевой белок представляет собой часть или полную легкую или тяжелую цепь антитела.
12. Саморасщепляющийся химерный белок по п. 11, отличающийся тем, что целевой белок является вариабельной областью легкой цепи (VL) или вариабельной областью тяжелой цепи (VH) антитела.
13. Саморасщепляющийся химерный белок по п. 1, в котором химерный белок содержит аминокислотную последовательность, представленную в SEQ ID NO: 17 или 18.
14. Нуклеиновая кислота, кодирующая саморасщепляющийся химерный белок по любому из пп. 1-13.
15. Экспрессирующий вектор, содержащий нуклеиновую кислоту по п. 14.
16. Клетка-хозяин для экспрессии химерного белка по любому одному из пп. 1-13, трансформированная экспрессирующим вектором по п. 15.
17. Клетка-хозяин по п. 16, отличающаяся тем, что клетка-хозяин представляет собой прокариотическую или эукариотическую клетку.
18. Клетка-хозяин по п. 16, в котором клетка-хозяин представляет Escherichia coli.
19. Клетка-хозяин по п. 16, в котором Escherichia coli представляет собой Origami2 (DE3) или BL21 (DE3).
20. Способ очистки целевого белка, включающий: (1) культивирование клетки по пункту 16 для получения клеточных лизатов; и (2) очистку целевого белка из клеточных лизатов, который включает саморасщепление химерного белка для получения целевого белка.
21. Способ очистки целевого белка по п. 20, в котором стадия (2) включает:
(a) нанесение клеточных лизатов на колонку, связывающую метку из химерного белка;
(b) промывание колонки;
(c) уравновешивание колонки с помощью буфера для расщепления, включающего по меньшей мере одно, выбранное из группы, состоящей из кальция и триглицина, для проведения реакции расщепления; и
(d) получение буфера для расщепления из колонки для получения целевого белка с удаленной меткой.
22. Способ очистки целевого белка по п. 21, в котором буфер для расщепления в стадии (с) включает, по меньшей мере, триглицин.
23. Способ очистки целевого белка по п. 21, отличающийся тем, что буфер для расщепления в стадии (с) включает 0,1-10 мМ кальция и 0,1-10 мМ триглицина.
24. Способ очистки целевого белка по п. 23, отличающийся тем, что буфер для расщепления в стадии (с) включает 0,2-5 мМ кальция и 0,2-5 мМ триглицина.
25. Способ получения конъюгата терапевтического антитела-лекарственного средства, включающий:
(1) взаимодействие саморасщепляющегося химерного белка по п. 1 с триглицином-лекарственным средством в буфере для расщепления, включающем кальций для конъюгации триглицин-лекарственного средства с целевым белком и получение буфера для расщепления;
(2) извлечение конъюгата целевого белка, в котором удалена метка, с триглицин-лекарственным средством.
26. Способ получения конъюгата терапевтического антитела-лекарственного средства по п. 25, отличающийся тем, что буфер для расщепления на стадии (1) содержит от 0,1 до 10 мМ кальция.
27. Способ получения конъюгата терапевтического антитела-лекарственного средства по п. 25, в котором стадия (1) включает от 500 мкМ до 1 мМ триглицина-лекарственного средства (GGG-лекарственного средства).
28. Способ получения конъюгата терапевтического антитела-лекарственного средства по п. 25, в котором стадия (1) включает взаимодействие саморасщепляющегося химерного белка по п. 1 с триглицином-лекарственным средством (GGG-лекарственным средством) в течение 3-16 часов.
29. Способ получения конъюгата терапевтического антитела-лекарственного средства по п. 25, в котором целевой белок представляет собой антитело против поверхностного опухолевого антигена.
| WO 2005051976 A2, 09.06.2005 | |||
| WO 2011056911 A2, 12.05.2011 | |||
| WO 2013003555 A1, 03.01.2013 | |||
| WO 2007108013 A2, 27.09.2007 | |||
| СПОСОБ ИДЕНТИФИКАЦИИ, ВЫДЕЛЕНИЯ И ПОЛУЧЕНИЯ АНТИГЕНОВ ОПРЕДЕЛЕННОГО ПАТОГЕНА | 2002 |
|
RU2289817C2 |
Авторы
Даты
2017-12-21—Публикация
2014-04-25—Подача