Область техники
Данное изобретение относится к способу конструирования библиотеки Fv, который основан на комбинации белков, способу скрининга желаемого антитела с использованием сконструированной библиотеки Fv, антителу Fv, выбранному этим способом скрининга, и библиотеке Fv, сконструированной способом конструирования библиотеки Fv.
Уровень техники
Антитела являются белками, продуцируемыми В-лимфоцитами иммунной системы в ответ на антигены, они узнают эти антигены и связываются с ними. Такие антитела считаются потенциальными новыми лекарственными средствами для лечения заболеваний. Для нахождения антител желаемой функциональности конструировали различные библиотеки антител и путем скрининга отбирали функциональные антитела из них. Такие библиотеки антител конструируют с использованием технологии рекомбинации генов. Как правило, гены, кодирующие белки антител, экстрагируют из В-клеток человека для конструирования библиотек генов антител, и антитела, имеющие желаемую специфичность связывания антигена, отбирают скринингом из этих библиотек. Технология библиотек антител оказалось революционной в конструировании антител, таких как антитела человека. Наиболее примечательной характеристикой антительного ответа является то, что антитело, специфичное к определенному типу или форме антигена, может быть получено в пределах одной недели, если этот антиген является чужеродным веществом, отличающимся от компонентов in vivo. Антитела продуцируются В-лимфоцитами, и один В-лимфоцит продуцирует только один тип антитела. Известно, что в теле человека существует множество В-лимфоцитов и каждый В-лимфоцит на своей клеточной мембране экспрессирует антитело, имеющее уникальную антигенсвязывающую специфичность. В общем, известно, что в теле человека существует антигенсвязывающее разнообразие примерно 108. При внедрении антигена в тело быстро пролиферируют только те В-лимфоциты, которые экспрессируют антитело, специфически связывающееся с этим антигеном, при этом продуцируя большое количество этого антитела, и в результате концентрация этого антитела в сыворотке быстро увеличивается, тем самым быстро элиминируется внедрившийся антиген. Таким образом, в теле человека существует разнообразие антител в нескольких сотен миллионов, и это разнообразие антител называют репертуаром антител. Когда путем сбора крови отбирают достаточное количество В-лимфоцитов из тела человека, после чего из этих клеток выделяют мРНК и синтезируют кДНК, кодирующую вариабельные области тяжелой цепи и легкой цепи антитела посредством полимеразной цепной реакции с обратной транскрипцией, можно относительно простым образом сконструировать репертуар антител человека в форме генов in vitro. Ключ технологии библиотеки антител заключается в экспрессии (или дисплее) этого репертуара генов антител в виде белков, при этом «привязав» каким-либо образом к ним ген, кодирующий данное антитело (связывание генотип-фенотип), благодаря чему можно тестировать отобранное из библиотеки антитело на связывание со специфическим антигеном и получить ген, кодирующий это специфическое антитело. Здесь не требуется идеальное повторение иммунитета, и этот репертуар может либо быть отображен в виде Fab антител, имеющих антигенсвязывающую функцию, либо в виде фрагментов антитела, называемых scFv (одноцепочечный вариабельный фрагмент), в котором вариабельные домены тяжелой цепи и вариабельные домены легкой цепи (VH и VL) соединены. В данном документе дисплей классифицируют как фаговый дисплей, рибосомный дисплей, дрожжевой дисплей и т.п. в соответствии с типом среды, которая используется для связи генотип-фенотип, и антитело, имеющее желаемые антигенсвязывающие характеристики, может быть получено без индукции иммунного ответа введением антигена. Однако имеются дефекты, заключающиеся в том, что требуется хорошее знание специальных методов и технологий для конструирования библиотек антител и их скрининга, и при этом нелегко получать высокоаффинные антитела, и, следовательно, после скрининга антител часто выполняются процедуры оптимизации антител, такие как созревание аффинности. Кроме того не может быть выполнен функциональный анализ в клетках млекопитающих вследствие таких проблем, как токсичность, в частности во время первой стадии скрининга. Такие дефекты становятся барьером для развития терапевтических антител, так как терапевтические антитела должны не просто связываются с антигенами, но и иметь терапевтические функции.
Среди библиотек антител в настоящее время наиболее часто используют библиотеки фагового дисплея. Собственно Humira (моноклональное антитело человека к TNF-альфа), которое сейчас является доступным в продаже терапевтическим агентом для лечения ревматоидного артрита, является терапевтическим антителом, полученным с использованием технологии фагового дисплея. Идеальная библиотека антител должна содержать огромное разнообразие антител, чтобы путем скрининга могли быть выявлены высокоаффинные клоны антител, имеющие желаемую антигенсвязывающую специфичность. Для этой цели следует сконструировать библиотеку, содержащую примерно 1010-1011 антител. Однако очень трудно сконструировать библиотеку, имеющую подобный размер, клонированием генов антител, и это считается наиболее значительной проблемой в создании библиотек фагового дисплея. Кроме того, имеется следующий недостаток, заключающийся в том, что функциональный анализ не может быть непосредственно выполнен, так как сами фаги действуют так, что они являются токсичными.
Наиболее большим преимуществом технологии рибосомного дисплея является бесклеточная система, и, теоретически, с помощью данной технологии могут быть легко сконструированы библиотеки, имеющие большой размер, примерно 1013. Таким образом, технология рибосомного дисплея является выгодной для поиска высокоафинных антител (обычно когда размер библиотеки антител больше, возможность наличия в ней антител с высокой аффинностью тоже больше). Кроме того, поскольку ПЦР-амплификация выполнима в технологии рибосомного дисплея, может быть использована склонная к ошибкам ПЦР-амплификация и т.п., и, следовательно, введение мутации для искусственного индуцирования является очень легким. Однако технология рибосомного дисплея также имеет проблемы токсичности и различные проблемы с постановкой эксперимента. По этой причине технологию рибосомного дисплея используют в основном для конструирования библиотек антител нативного происхождения.
В технологии дрожжевого дисплея имеются много технических ограничений для приготовления библиотек антител, имеющих разнообразие 109 или более, так как требуется процесс введения рекомбинантного вектора в штамм S.cerevisiae и размер клеток дрожжей является большим. Поэтому технологию дрожжевого дисплея используют в основном для конструирования мутантной библиотеки уже установленных антигенспецифических антител, для скрининга высокоаффинных антител и для отбора скринингом высокоаффинных антител из мутантной библиотеки.
Однако во всех таких библиотеках антител антитела не разделены индивидуально, а смешаны все вместе. Кроме того, подобные библиотеки антител имеют недостатки, которые заключаются в том, что скрининг антитела к антигену-мишени, основанный на его функции (активности), фактически является невозможным, и можно лишь скринировать антитела на основе их связывания с антителом. Первые антитела-кандидаты, полученные в этой процедуре, испытывают на их функцию в следующей стадии для отбора антител, имеющих нужные функции. В большинстве случаев в этой стадии отбора получают антитела, которые легко связываются, но не имеют функции. Таким образом, требуется новый способ, который преодолевает этот недостаток данного способа скрининга. Другими словами, требуется способ скрининга антител на основе их функции с самого начала. Однако существующие библиотеки находятся в состоянии, в котором различные антитела смешаны вместе, и невозможно отбирать скринингом индивидуальные антитела на основе их функции. Таким образом, если будет возможно индивидуально очищать и хранить все антитела в специальной адресуемой библиотеке, подобной библиотекам низкомолекулярных соединений, можно будет подвергать скринингу антитела на основе их функции. Однако, поскольку антитела являются белками, требуются процессы для экспрессии и очистки антител, получается, что фактически невозможно сконструировать библиотеку 100000 или 1000000 различных антител. Другими словами, общепринятые способы имеют недостатки, заключающиеся в том, что когда в состав библиотеки входит 1000000 белков, требуется очистка 1000000 белков, и количество требуемых очисток белка увеличивается экспоненциально по мере увеличений разнообразия. Общепринятые технологии конструирования библиотек включают в себя технологию конструирования библиотеки объединением VH и VL на уровне ДНК в векторе (U.S. Pat No. 8,178,320), технологию конструирования библиотеки легких цепей и тяжелых цепей на уровне ДНК (U.S. Pat No. 7,858,559), etc. Однако эти технологии конструирования библиотек имеют недостатки, заключающиеся в том, что требуется очистка желаемого количества белков для конструирования библиотеки, имеющей разнообразие, удовлетворяющего комбинации этих белков на уровне ДНК. Кроме того, функции этих антител в сконструированной библиотеке не могут быть немедленно проанализированы вследствие огромного количества этих антител, и по этой причине требуется дополнительная стадия уменьшения количества антител, которые предполагается скринировать на связывание с антигенами и затем анализировать их функцию, и нужное антитело может быть упущено во время этого скрининга. В частности, в общепринятых способах конструирования библиотек Fv должны экспрессироваться с комбинациями на уровне ДНК, и, следовательно, требуется очистка белков, соответствующая разнообразию библиотеки. Таким образом, общепринятыми способами конструирования библиотек нельзя сконструировать библиотеку, содержащую индивидуальные разделенные антитела.
При таких обстоятельствах авторы данного изобретения приложили многочисленные усилия для получения библиотеки, в которой антитела индивидуально разделены, так что они могут быть подвергнуты скринингу по функции. Авторы этого изобретения уделяли внимание конструированию библиотеки, в которой комбинации происходили на уровне белков, в отличие от общепринятых технологий конструирования библиотеки, и было обнаружено, что библиотека Fv на основе комбинации белков может быть сконструирована объединением VH и VL на уровне белка, завершая тем самым создание данного изобретения.
Подробное описание изобретения
Техническая проблема
Одной целью данного изобретения является обеспечение способа конструирования библиотеки Fv (вариабельный фрагмент) на основе комбинирования белков.
Другой целью данного изобретения является обеспечение способа выявления скринингом желаемого антитела с использованием библиотеки Fv, сконструированной вышеуказанным способом.
Еще одной целью данного изобретения является обеспечение желаемого антитела Fv, выявленного вышеупомянутым способом скрининга.
Еще одной целью данного изобретения является обеспечение библиотеки Fv, сконструированной вышеупомянутым способом конструирования библиотеки Fv на основе комбинирования белков.
Техническое решение
Для достижения вышеуказанных целей, в первом аспекте, данное изобретение обеспечивает библиотеку Fv (вариабельных фрагментов) на основе комбинирования белков и способ для ее конструирования. В частности, данное изобретение обеспечивает библиотеку Fv, основанную на комбинировании белков, причем эта библиотека Fv содержит белки домена VH, связанные с белками домена VL.
Данное изобретение обеспечивает также способ конструирования библиотеки Fv на основе комбинаций белков, причем этот способ конструирования библиотеки Fv основан на комбинировании белков и содержит стадии: (а) приготовления белков домена вариабельной области тяжелой цепи (VH) и белков домена вариабельной области легкой цепи (VL) и (b) спаривания белков домена VH и белков домена VL, приготовленных в стадии (а), друг с другом.
Краткое описание чертежей
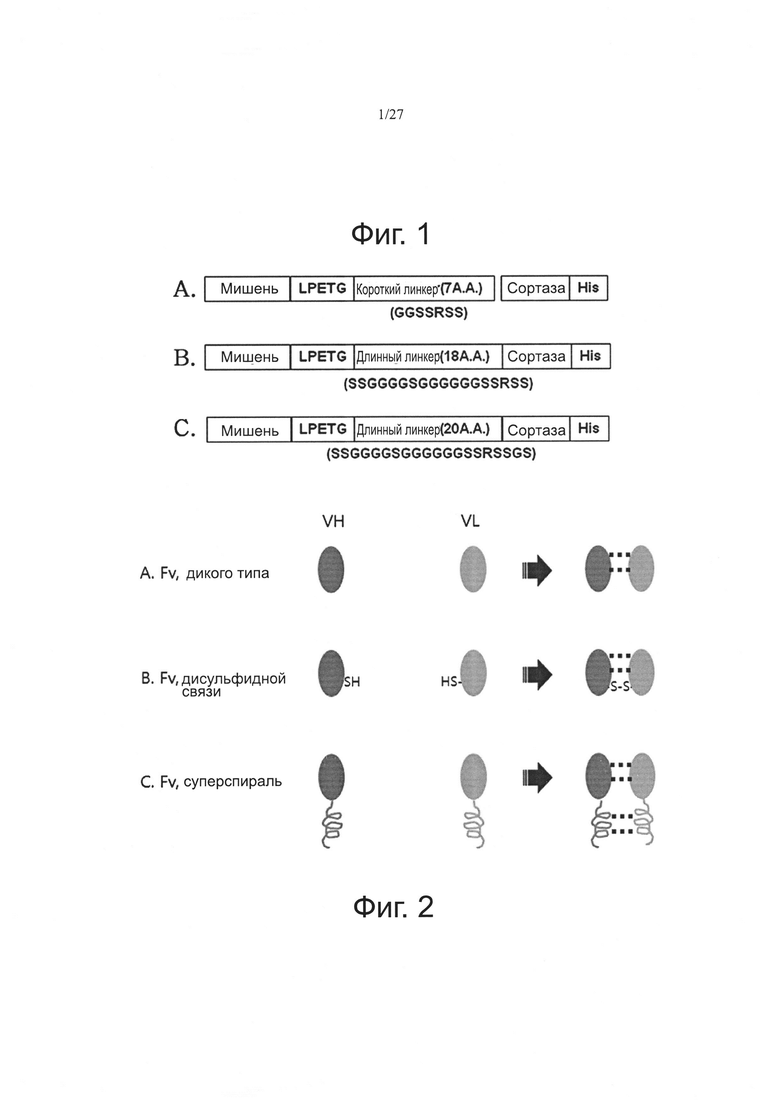
Фиг. 1 схематически показывает слитые белки, каждый из которых содержит мишень-LPETG-линкер (имеющий различную длину)-Sortase-His тег. (А): линкер, состоящий из 7 аминокислот, (В): линкер, состоящий из 18 аминокислот, и (С) линкер, состоящий из 20 аминокислот.
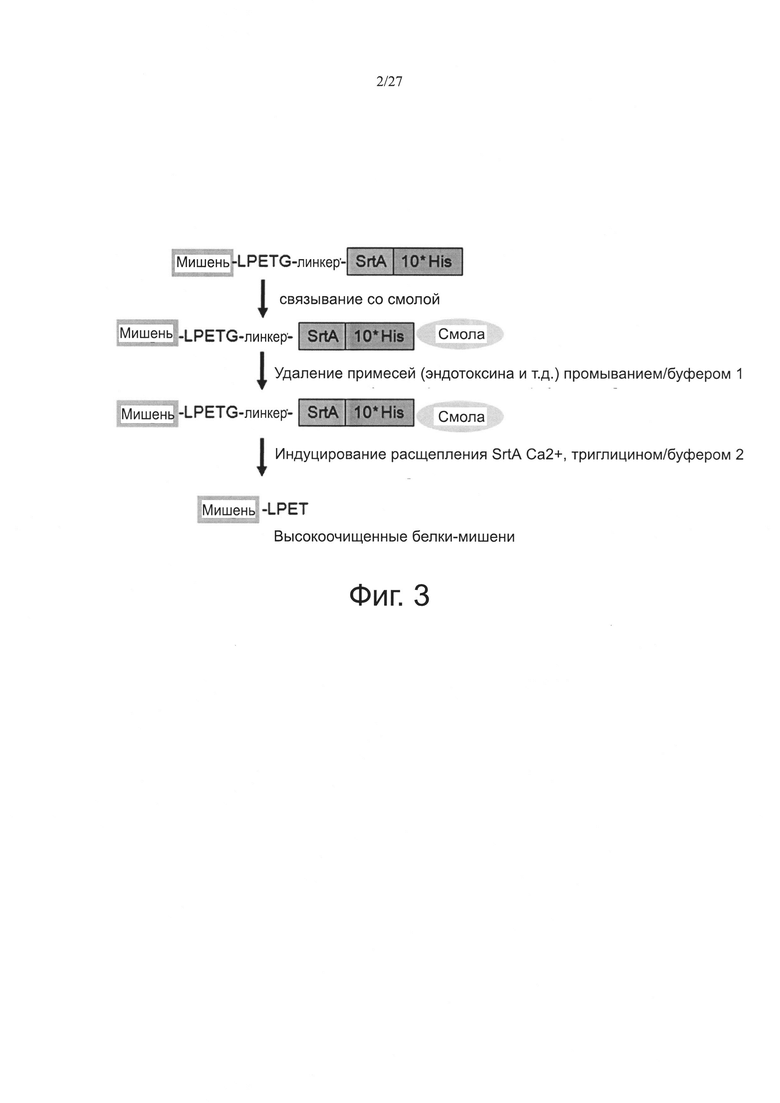
Фиг. 2 схематически показывает связывание путем спаривания для конструирования библиотеки Fv на основе комбинаций белков по данному изобретению. (А): спаривание между дикими типами; (В): спаривание дисульфидными связями и (С) спаривание суперспиралью.
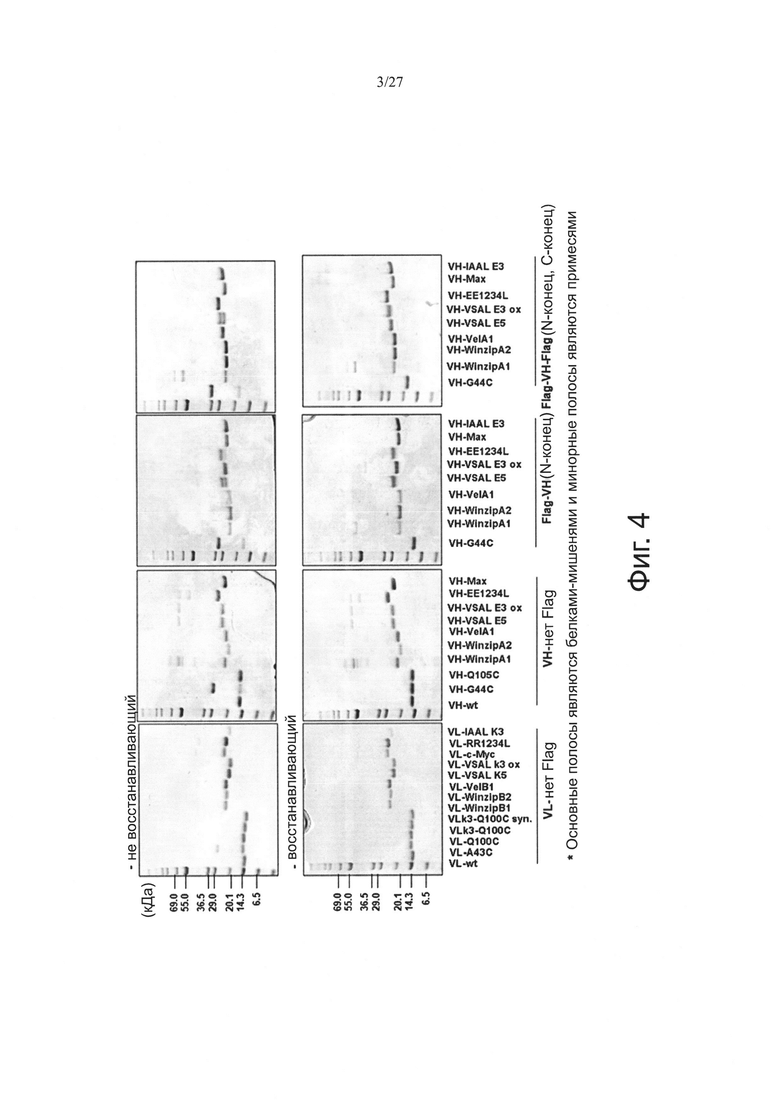
Фиг. 3 схематически показывает простой процесс очистки белка.
Фиг. 4 показывает результаты SDS-PAGE (ДСН-ПААГ) очищенных мутантов VL и VH.
Фиг. 5 показывает, что экспрессия VH-G44C, который является белком домена VH, не имеющим метки Flag, Flag-VH-G44C, имеющим метку Flag на N-конце, и белком Flag-VH-G44C-Flag, имеющим метку Flag на N-конце и С-конце, увеличивается в присутствии метки Flag.
Фиг. 6 показывает сравнение выходов экспрессии и очистки рекомбинантных белков с присутствием и отсутствием сортазы и присутствием и отсутствием Flag.
Фиг. 7 является схематическим видом, показывающим способ анализа связи VH-VL различным типом спаривания.
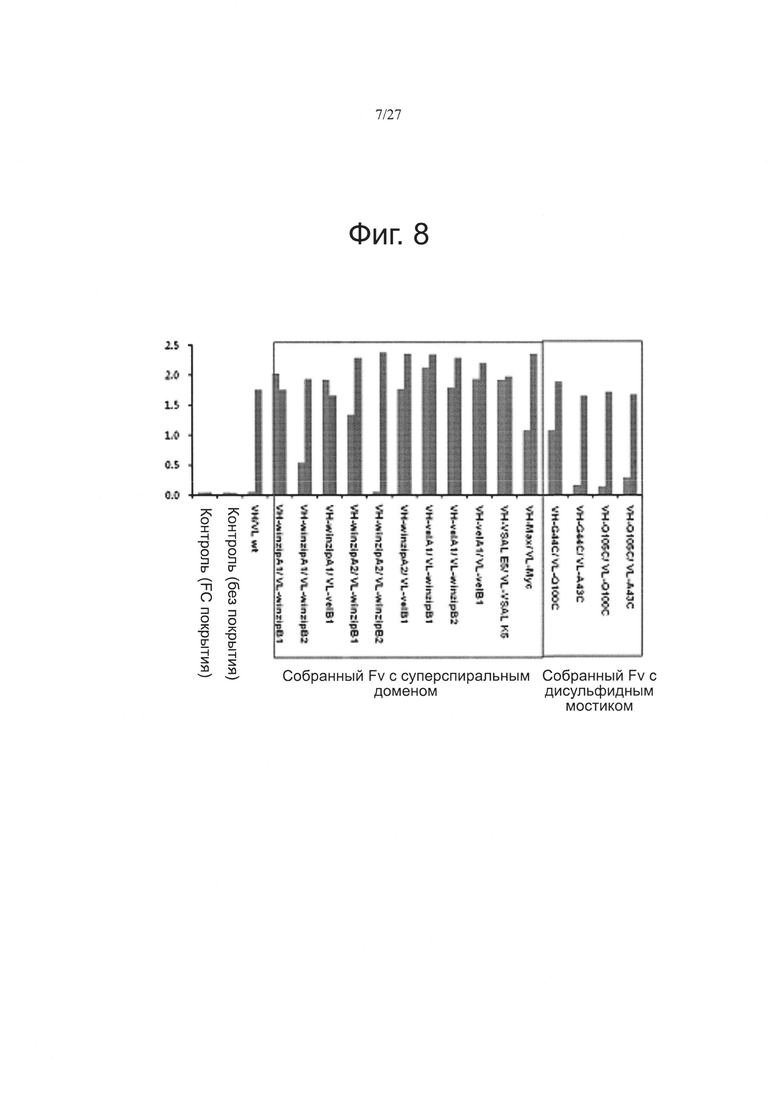
Фиг. 8 показывает результаты ELISA анализа спаривания VH-VL.
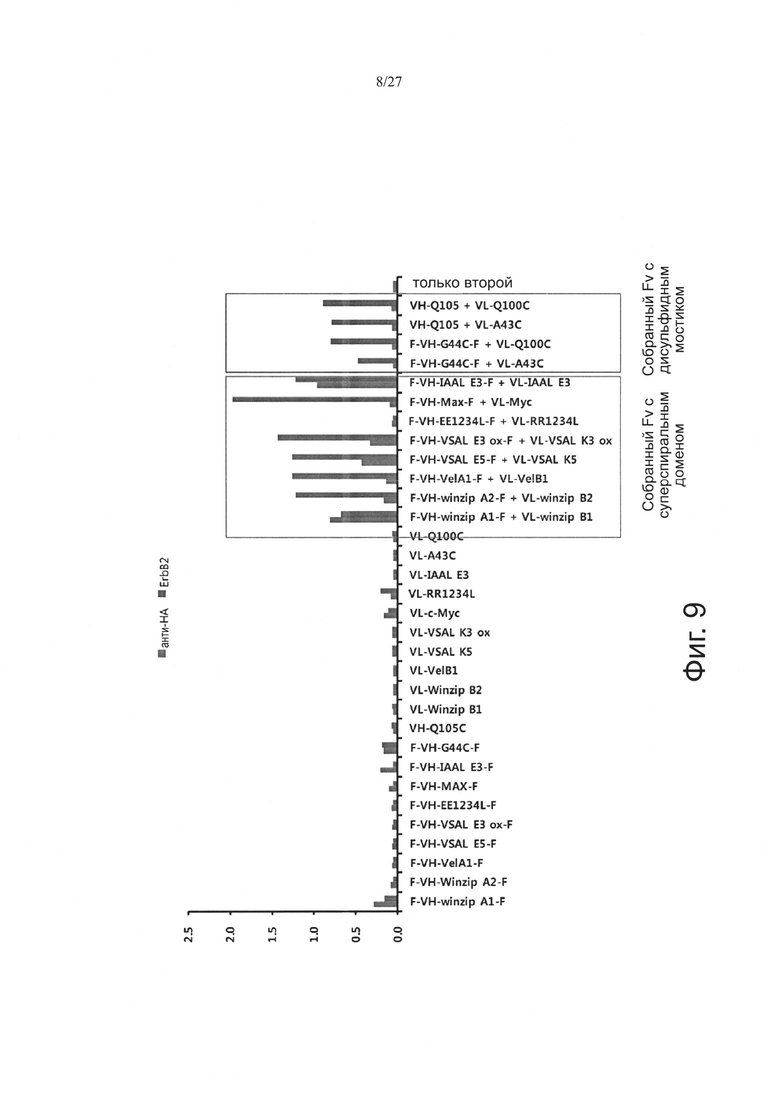
Фиг. 9 показывает результаты ELISA анализа спаривания Flag-VH и Flag-VL.
Фиг. 10 показывает результаты SDS-PAGE (ДСН-ПААГ) пары VH-VL, в которой введены мутации на цистеин.
Фиг. 11 показывает результаты SDS-PAGE, показывающие, что спаривание Flag-VH и Flag-VL увеличивает спаривание VH и VL.
Фиг. 12 показывает результаты SEC-HPLC VL-IAALK3, Flag-VH-IAALE3-Flag и собранного Fv.
Фиг. 13 показывает результаты MALDI-TOF анализа VL, VH и собранного Fv дикого типа.
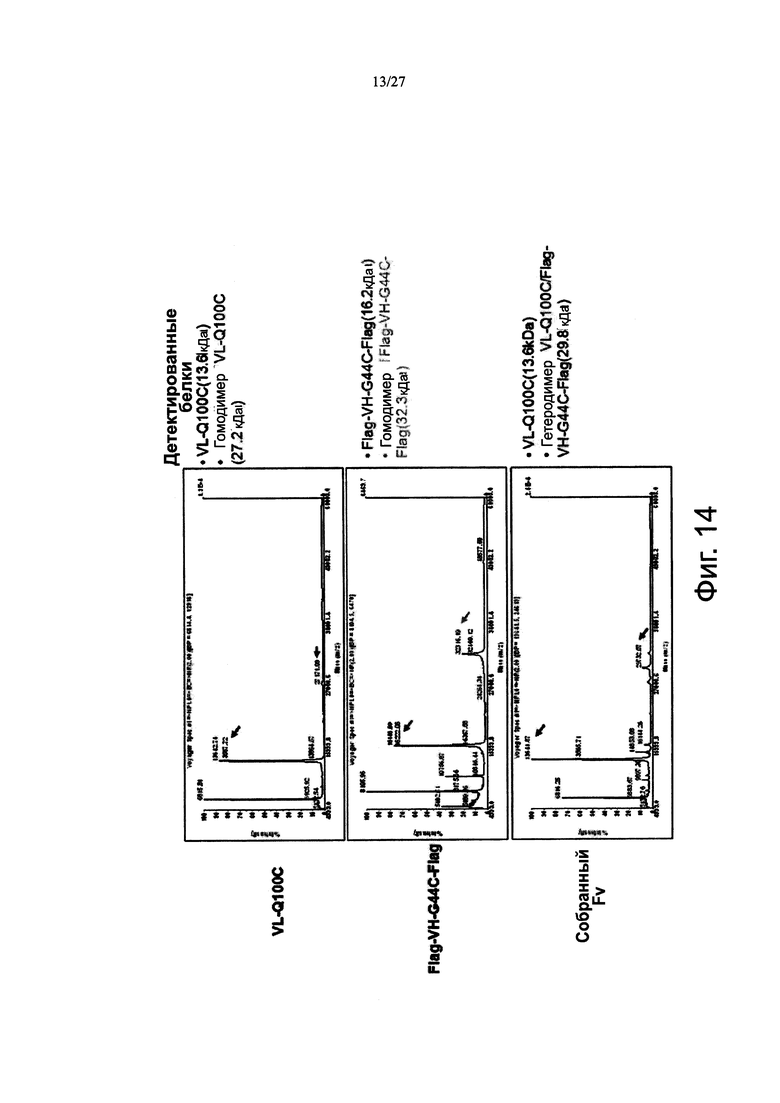
Фиг. 14 показывает результаты анализа MALDI-TOF VL-Q100C, Flag-VH-G44C-Flag и собранного Fv.
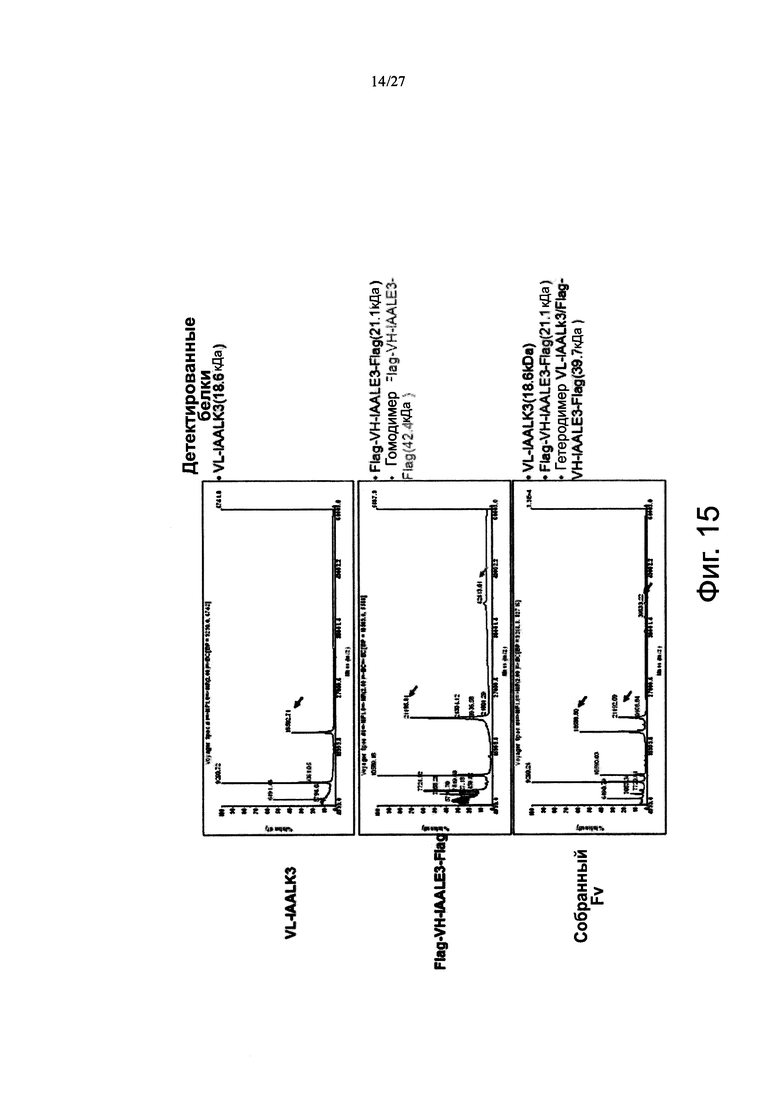
Фиг. 15 показывает результаты MALDI-TOF анализа VL-IAALK3, Flag-VH-IAALE3-Flag и собранного Fv.
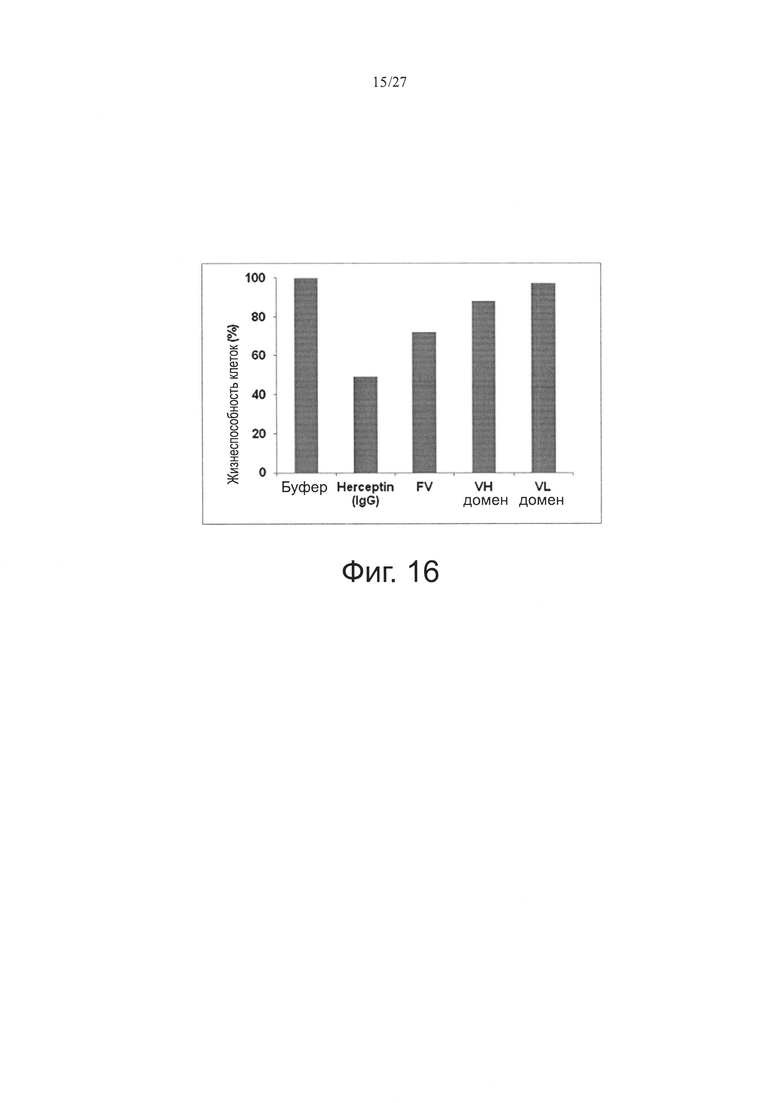
Фиг. 16 показывает результаты анализа действия антитела 4D5 Fv на пролиферацию клеток ВТ-47 посредством анализа CCK8 (Dojjindo).
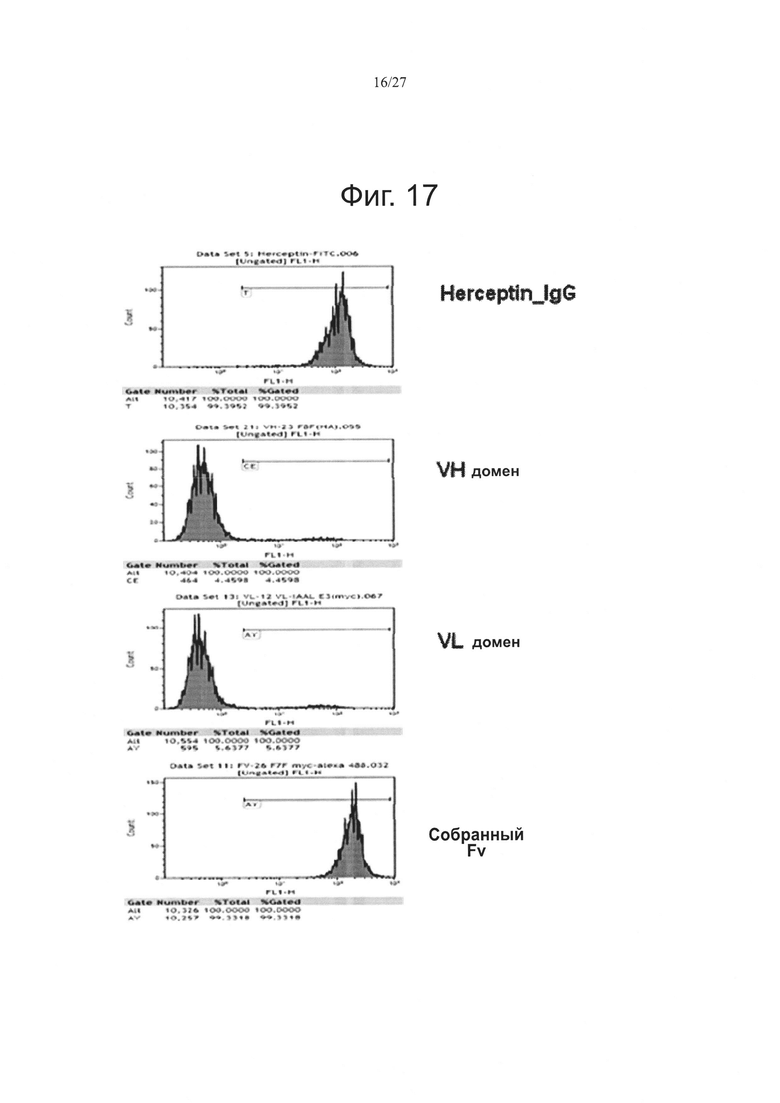
Фиг. 17 показывает результаты мониторинга профилей связывания 4D5 IgG, VH домена, VL домена и собранных антител Fv c поверхностью Her2-экспрессирующих клеток ВТ-474 посредством FACS.
Фиг. 18 показывает схему отбора VH CDR3 и VL CDR3 для схемы CDR в соответствии с распределением длины аминокислотного остатка.
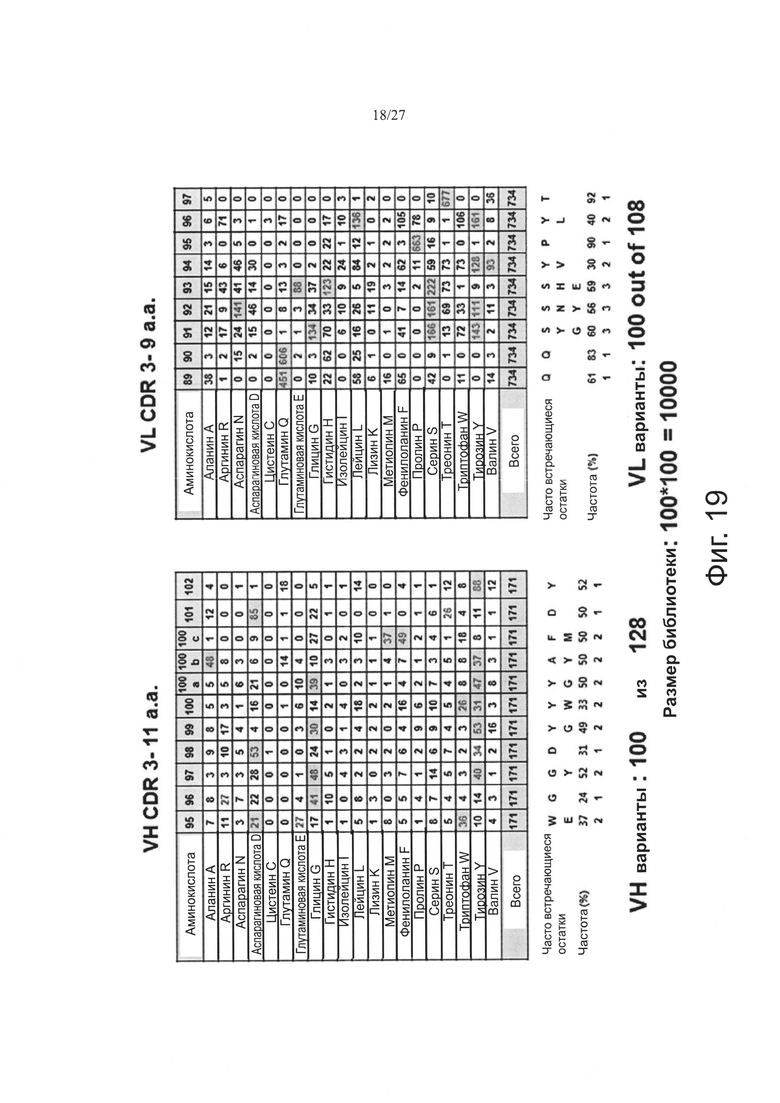
Фиг. 19 показывает результаты анализа высокой частоты для введения разнообразия VH CDR и VL CDR.
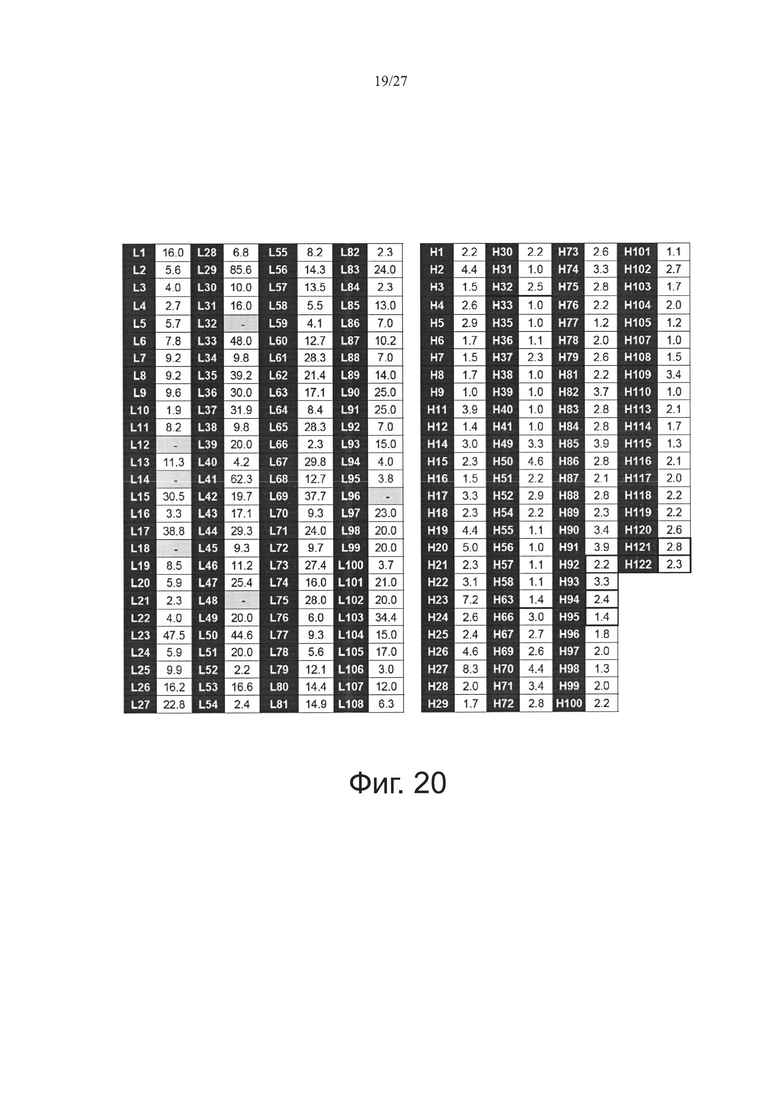
Фиг. 20 показывает результаты построения библиотеки, имеющей разнообразие в соответствии с примером данного изобретения.
Фиг. 21 показывает результаты анализа SEC-HPLC 25 Fv, сконструированных объединением 5 VH с 5 VL.
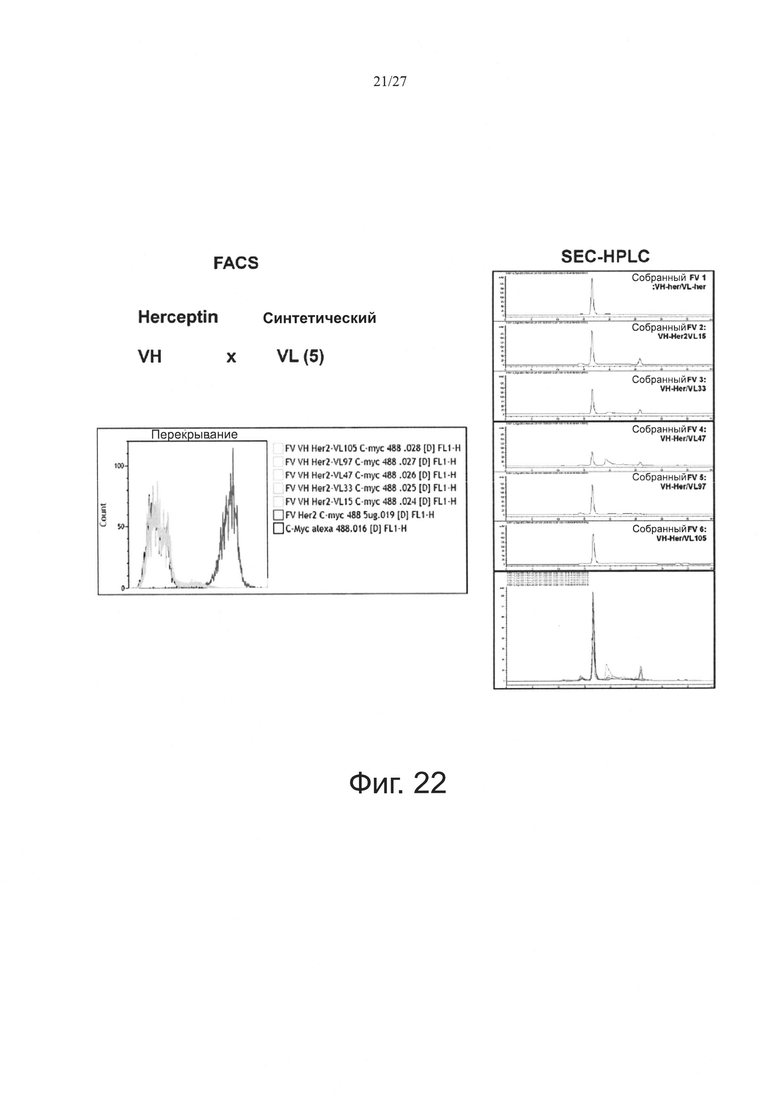
Фиг. 22 показывает результаты FACS и анализа SEC-HPLC собранных Fv, приготовленных объединением 4D5 VH с 5 синтетическими VL.
Фиг. 23 показывает процесс скрининга библиотек.
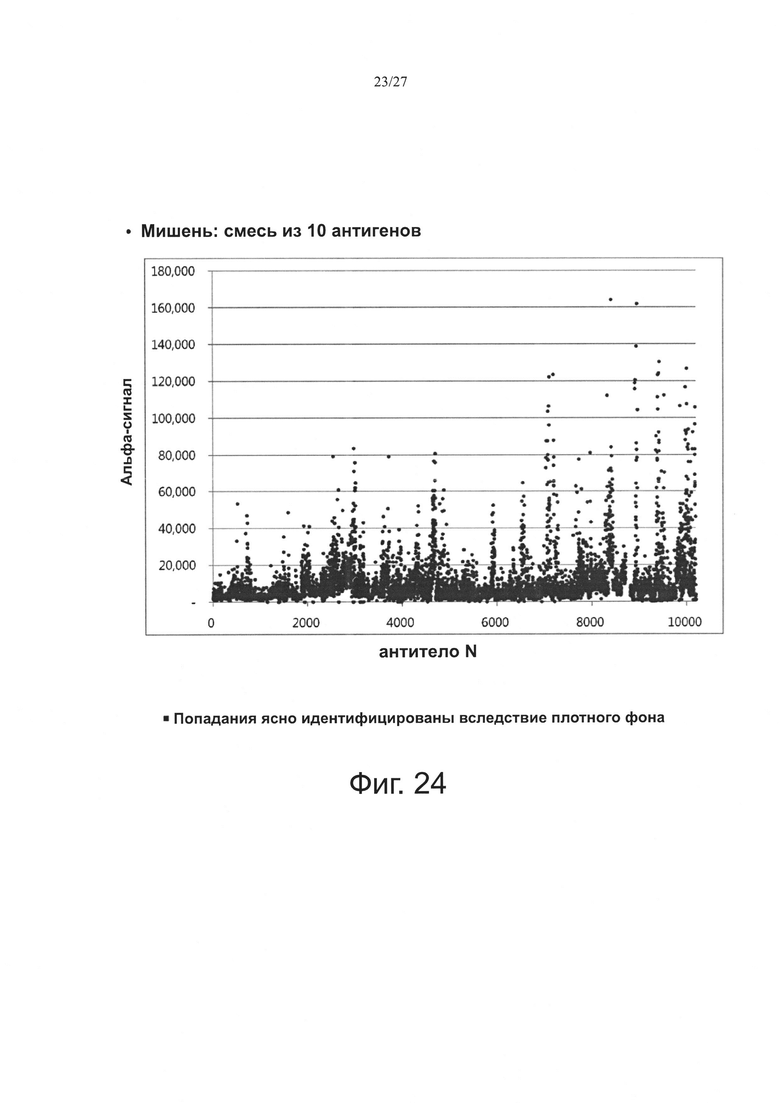
Фиг. 24 показывает результаты скрининга взаимодействий между индивидуальными Fv и 10 смешанными антигенами посредством альфа-анализа.
Фиг. 25 показывает результаты скрининга взаимодействий между связыванием Fv со смешанными антигенами и индивидуальными антигенами во второй стадии скрининга.
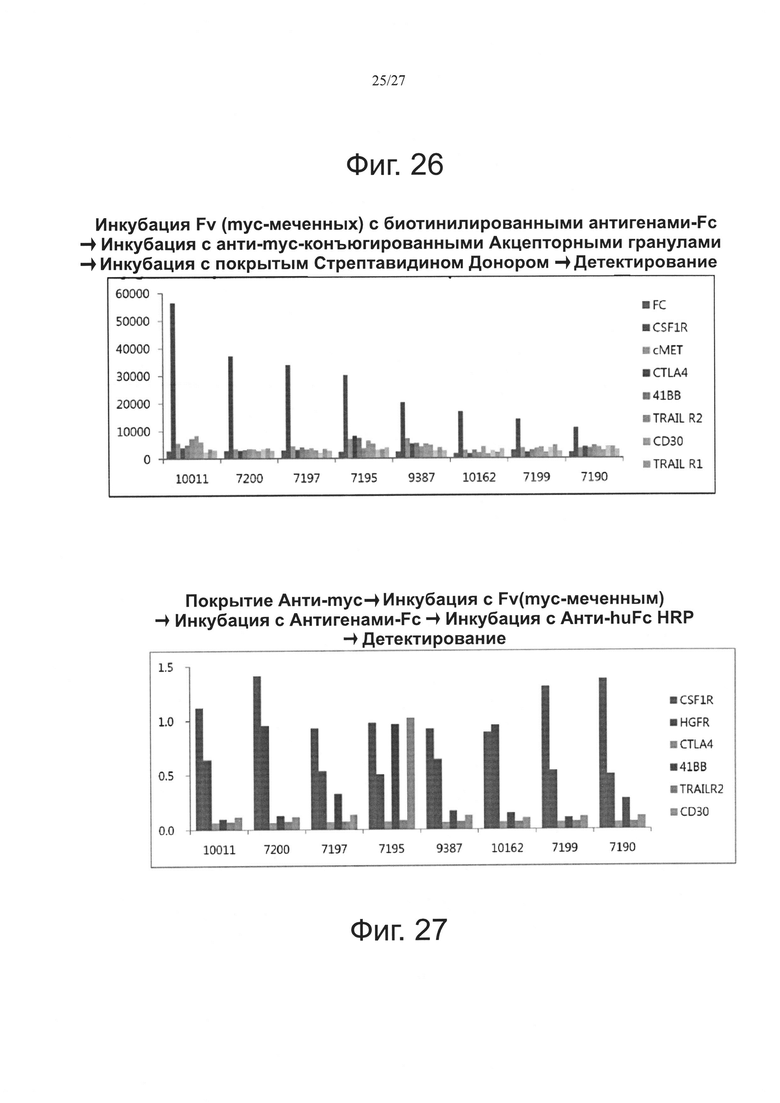
Фиг. 26 является графиком, показывающим результаты альфа-анализа на Fv, которые связываются в основном с CSF1R.
Фиг. 27 показывает результаты ELISA для взаимодействия Fv, для которых в альфа-анализе было подтверждено, что они в основном связываются с CSF1R.
Фиг. 28 показывает результаты Вестерн-блоттинга для взаимодействия Fv, для которых в альфа-анализе было подтверждено, что они в основном связываются с CSF1R.
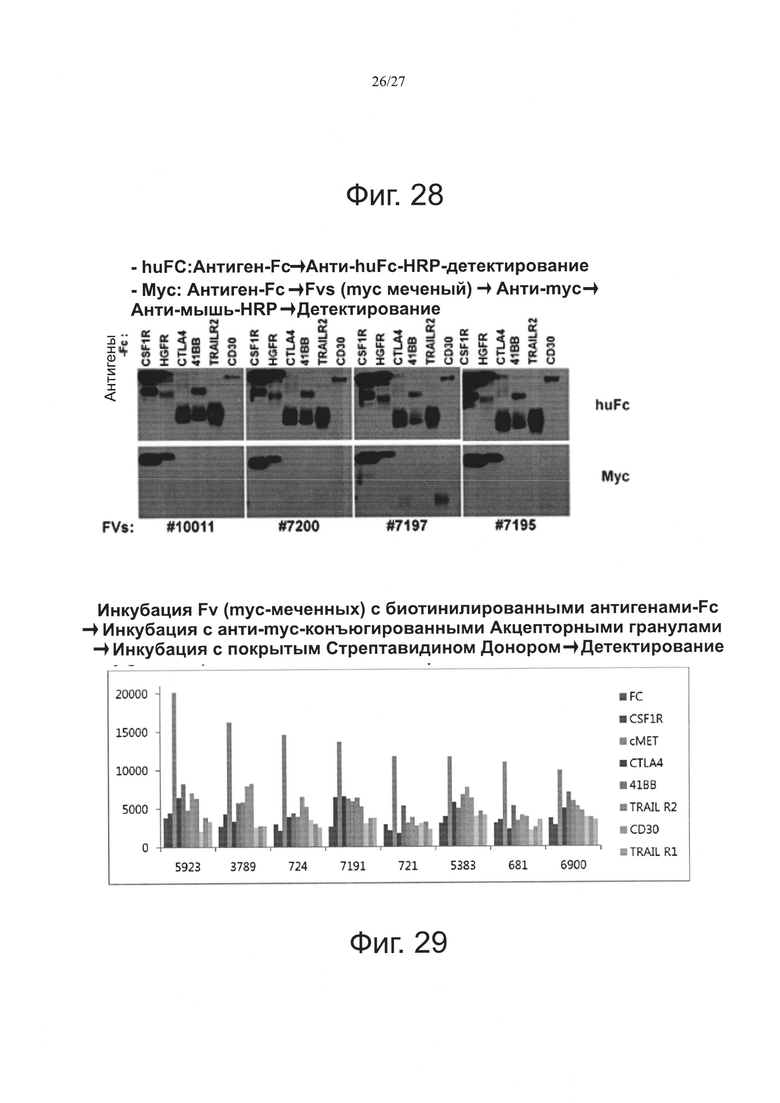
Фиг. 29 является графиком, показывающим результаты альфа-анализа для Fv, которые связываются в основном с с-МЕТ.
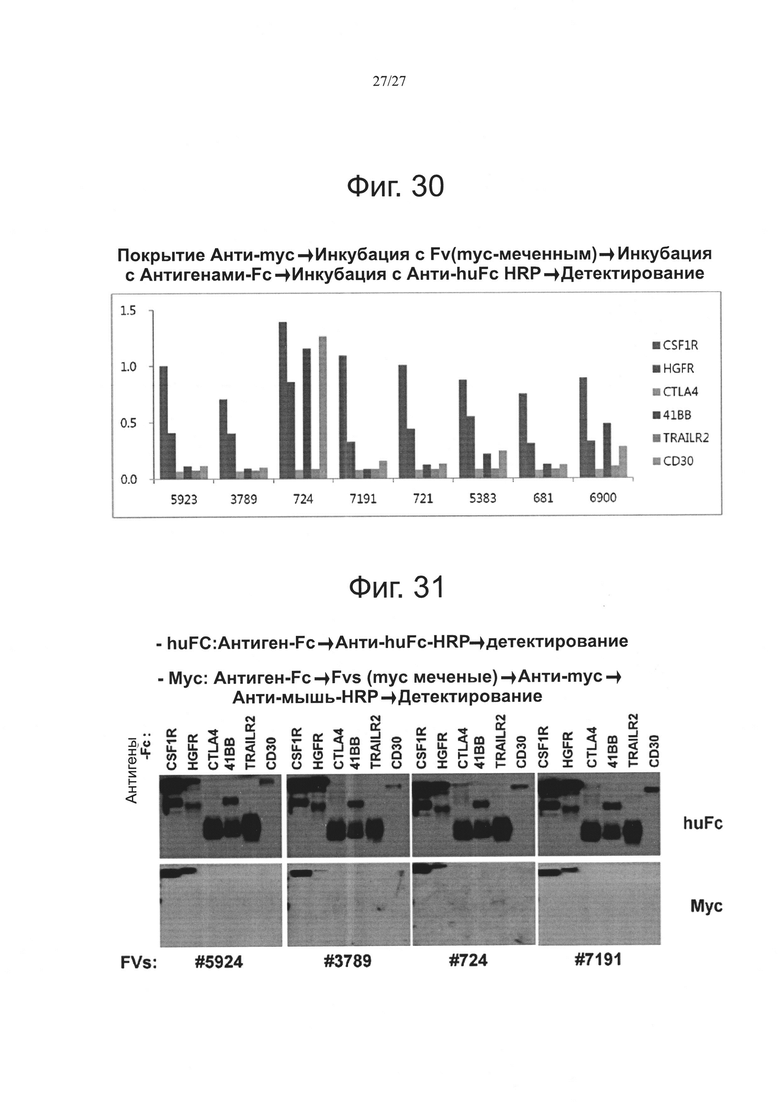
Фиг. 30 показывает результаты ELISA для взаимодействия Fv, для которых в альфа-анализе было подтверждено, что они в основном связываются с с-МЕТ.
Фиг. 31 показывает результаты Вестерн-блоттинга для взаимодействия Fv, для которых в альфа-анализе было подтверждено, что они в основном связываются с с-МЕТ.
Наилучший способ осуществления данного изобретения
В данном контексте термин "библиотека Fv (вариабельных фрагментов)" относится к коллекции некоторого количества разнообразных Fv. В данном контексте термин "Fv (вариабельный фрагмент)" относится к минимальному фрагменту антитела, который является частью Fab (антигенсвязывающий фрагмент) области этого антитела, который состоит из вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL). Для целей данного изобретения эта библиотека Fv (вариабельных фрагментов) может быть библиотекой Fv, основанной на комбинировании белков.
Известные библиотеки конструировали путем объединения антител на уровне ДНК для получения репертуара генов антител, которые лежат в основе разнообразия антител. Обычно антитела продуцируются В-лимфоцитами, и один В-лимфоцит продуцирует только один тип антитела. Известно, что в теле человека существуют множество В-лимфоцитов, и каждый В-лимфоцит экспрессирует на клеточной мембране антитело, имеющее уникальную специфичность связывания антигена. Кроме того, известно, что в теле человека существует антигенсвязывающее разнообразие приблизительно 108. Таким образом, разнообразие антител в теле человека составляет нескольких сотен миллионов. Для образования репертуара, который является таким разнообразием антител, должна быть сконструирована комбинация нескольких сотен миллионов ДНК, и из них должны быть приготовлены антитела. Например, когда должна быть сконструирована библиотека, имеющая разнообразие 108, должны быть синтезированы 100,000,000 ДНК и должны быть выполнены 100000000 очисток белков для конструирования библиотеки выделенных антител, но это является фактически невозможным. Однако, в соответствии с данным изобретением, библиотека Fv, содержащая специально адресованные антитела, может быть сконструирована экспрессией и очисткой 10000 VH доменов и 10000 VL доменов, то есть экспрессией и очисткой только 20000 доменов. Этот способ конструирования библиотеки Fv, основанный на комбинировании белков, был впервые разработан авторами данного изобретения. Предложенный способ конструирования библиотеки Fv, основанный на комбинировании белков, характеризуется тем, что библиотека Fv, содержащая желаемые комбинации белков, может быть сконструирована спариванием очищенных доменов VH и доменов VL вне клеток, а не внутри клеток.
Предпочтительно, библиотека Fv делает возможным функциональный анализ ее индивидуальных членов.
Предпочтительно, функциональный анализ индивидуальных членов может содержать, или, более предпочтительно, может не содержать стадию предварительного скрининга, основанную на связывании с мишенью.
Как описано выше, обычные библиотеки являются библиотеками на основе ДНК. В этом случае экспрессия из ДНК и выделение белков антител требуют множества процессов экспрессии и очистки, и, следовательно, эти антитела не разделяются индивидуально в этой библиотеке, но смешиваются вместе в ней. По этой причине требуется стадия выделения и очистки белков для анализа функции этих антител. Однако, как описано выше, эта стадия является практически неосуществимой. По этой причине антитела сначала подвергают скринингу на основе их связывания с веществом-мишенью, таким как антиген, и затем только антитела, связанные с этим веществом-мишенью, испытывают на их функцию во второй стадии скрининга. Однако, когда антитела скринируют на основе их связывания с последовательностью-мишенью, как описано выше, антитело, имеющее желаемую функцию, может в результате отсутствовать. Однако члены библиотеки Fv данного изобретения могут быть индивидуально разделены и, следовательно, могут быть индивидуально проанализированы без предварительной стадии скрининга на основе связывания с мишенью. Соответственно с библиотекой Fv данного изобретения антитела Fv, имеющие практическую функцию, могут быть не упущены и выявлены скринингом.
Для цели данного изобретения библиотека Fv может быть библиотекой Fv, включающей в себя домены VH и домены VL и сконструированной комбинированием белков домена вариабельной области тяжелой цепи (VH) и белков домена вариабельной области легкой цепи (VL), но также могут включать иные антигенсвязывающие формы антител, в том числе СН-содержащие фрагменты, имеющие антигенсвязывающую способность (например, Fab', F(ab')2, Fab, Fv и rIgG), а также полноразмерные антитела. Также антитела могут включать рекомбинантные одноцепочечные фрагменты Fv (scFv), бивалентные или биспецифические молекулы, диатела, триатела и тетратела. Эти бивалентные и биспецифические молекулы, например, описаны Kostelny et al. (1992, J. Immunol., 148:1547), Pack and Pluckthun (1992, Biochemistry, 31:1579), Hollinger et al. (1993, Supra), Gruber et al. (1994, J. Immunol., 5368), Zhu et al. (1997, Protein Sci., 6:781 et al.), Hu et al. (1996, Cancer Res., 56:3055), Adams et al. (1993, Cancer Res., 53:4026) и McCartney et al. (1995, Protein Eng., 8:301).
Полноразмерные антитела включают IgA, IgD, IgE, IgM и IgG, и IgG, который подразделен на подтипы IgG1, IgG2, IgG3 и IgG4. Fab содержит вариабельную область легкой цепи, вариабельную область тяжелой цепи, константную область легкой цепи и первый константный домен тяжелой цепи (СН1) и имеет один антигенсвязывающий сайт. Fab' отличается от Fab тем, что он содержит шарнирный район, включающий в себя по меньшей мере остаток цистеина С-концевой области домена СН1 тяжелой цепи. Антитело F(ab')2 получается, когда остатки цистеина в шарнирном районе Fab' образуют дисульфидную связь.
Стадия (а) приготовления белков домена вариабельной области (VH) тяжелой цепи и белков домена вариабельной области (VL) легкой цепи могут быть предпочтительно выполнена с введением желаемого разнообразия в белок домена VH и белок домена VL. Введение разнообразия может быть выполнено любым известным способом мутации. Кроме того, белки домена VH и белки домена VL могут быть получены любым известным способом. Для конструирования библиотеки Fv, включающей в себя белки домена VH и белки домена VL, последовательности белков могут быть выбраны с использованием базы данных, включающей в себя все третичные структуры белков человека, такой как PDB (Protein Data Bank) и SCOP (Structural Classification of Protein). Кроме того, последовательности белков для конструирования этой библиотеки могут быть выбраны из различных баз данных, включающих известные последовательности белков человека или не человека, но объем данного изобретения не ограничивается ими. Кроме того, последовательности VH и VL могут быть выбраны из известных последовательностей вариабельных районов, таких как последовательности, доступные в базе данных Кабата (www.bioinf.org.uk/abs/simkab.html) и базе данных NCBI (www.ncbi.nlm.nkh.gov), и из баз данных, таких как UniProt (www.ebi.uniprot.org) и PRF/SEQDB (www.prf.or.jp), для создания библиотеки последовательностей VH и VL. Кроме того, они могут быть дополнены коллекцией последовательностей VH и VL человека, полученных прямым секвенированием амплифицированной мРНК VH и VL из одного или нескольких доноров. Различные комбинации доменов могут быть рассмотрены для проектирования белков доменов VH и VL. При селекции последовательностей могут быть отобраны (известным способом) только последовательности доменов антител, исключая Т-клеточные рецепторы или другие Ig-последовательности. В одном примере воплощения данного изобретения, последовательности доменов антитела были отобраны с использованием программы HMMER в PISEC sever (Пример 6).
Белки домена VH и белки домена VL могут быть белками человека или белками не-человека.
Предпочтительно, может быть введена мутация в CDR (участки, определяющие комплементарность) белка домена VH или белка домена VL. Этот CDR может быть выбран из одного или нескольких из CDR1, CDR2 и CDR3. Предпочтительно, CDR может быть одним, двумя или тремя CDR, выбранными из CDR1, CDR2 и CDR3, но не ограничиваясь этим. Более предпочтительно, он может быть CDR3, но мутация может быть введена в любой CDR без ограничения, в зависимости от типа желаемого антитела. В одном примере данного изобретения разнообразие может быть изменено введением мутации в CDR3 при фиксированных CDR1 и CDR2 (Пример 8).
Предпочтительно, мутация может быть введена в каркасную последовательность в белке домена VH или белке домена VL.
Предпочтительно, спаривание белок-белок на стадии (b) - это случайное спаривание белков домена VH и белков домена VL, полученных на стадии (а), друг с другом, и может быть выбрано из группы, включающей: (i) спаривания между доменами дикого типа; (ii) спаривания за счет дисульфидных связей между цистеинами, вводимыми в белки доменов; (iii) спаривания слиянием между суперспиральными доменами; (iv) спаривания посредством взаимодействия белок-белок и (v) их комбинаций. Здесь, (i)-(iv) включают в себя без ограничения любой известный способ спаривания. Например, спаривание белок-белок может выполняться каждым из (i)-(iv) или комбинацией двух или более из (i)-(iv).
Предпочтительно, вариант (i) спаривания между доменами дикого типа может выполняться известным способом спаривания между белками домена VH дикого типа и белками домена VL дикого типа. В одном примере данного изобретения было подтверждено спаривание белков дикого типа (Экспериментальный Пример 2).
Предпочтительно, в варианте (ii) спаривания через дисульфидные связи между цистеинами цистеин может быть введен в каждый из белков домена VH и белков домена VL известным способом, так что белки домена VH и белки домена VL могут быть спарены посредством образования дисульфидных связей между цистеинами, введенными в них. В одном примере осуществления данного изобретения было подтверждено подобное бисульфидное связывание (спаривание) (Экспериментальные Примеры 1-4).
Предпочтительно, в варианте (iii) спаривание за счет слияния между доменами в виде суперспирали домен суперспирали может быть введен в каждый из белков домена VH и белков домена VL, так что белки домена VH и белки домена VL могут быть спарены друг с другом связью в виде суперспирали. Этот домен суперспирали может быть получен из известных баз данных и может быть получен с использованием способа, описанного Katja M. Arndt et al. (J. Mol. Biol. (2001) 312, 221-228). Кроме того, могут предпочтительно использоваться последовательности, описанные Jennifer R. et al. (J. Biol. Chem. (2002) 277, 37272-37279), J.R. Litowski (J. peptide Res. (2001) 58, 477-492), Jesus Fernandez-Rodriguez et al. (protein science(2012) 21, 511-591), Katja M. Arndt et al. (Structure(2002) 10, 1235-1248), Katja M. Arndt et al. (J. Biol. Chem. (2000) 295, 627-639), etc., но любые домены с суперспиралью, имеющие регулярность, могут быть использованы в данном изобретении. Домен суперспирали, который используют в данном изобретении, не ограничивается последовательностями, описанными в приведенных выше статьях. В одном примере осуществления данного изобретения было подтверждено спаривание суперспиралью (Экспериментальные Примеры 1-4).
Предпочтительно, вариант (iv) спаривания посредством белок-белковых взаимодействий предусматривает спаривание посредством известного взаимодействия белок-белок. Например, может быть использовано спаривание белок-белок, такое как лещиновая "молния", как у доменов JUN и FOS. Кроме того, могут быть использованы иные известные взаимодействия, в том числе нековалентное взаимодействие, сконструированный домен СН и сконструированная поверхность взаимодействия.
В одном варианте осуществления спаривание в стадии (b) может достигаться случайным спариванием или направленным спариванием.
Предпочтительно, этот способ конструирования библиотеки Fv на основе комбинирования белков может дополнительно содержать стадию (с) идентификации (ID) номеров, присваиваемых индивидуальным компартментам, в которых хранят желаемые собранные Fv.
Эти собранные Fv могут быть получены случайным спариванием или направленным спариванием. В случае направленного спаривания способ может предусматривать конструирование библиотеки таким образом, что домены VH и домены VL, информация о которых является известной, не перекрываются. Предпочтительно, в случае направленного спаривания этот способ может предусматривать спаривание известных VH и VL для получения собранных Fv, восстановление собранных Fv, хранение этих восстановленных Fv в индивидуальных компартментах с присвоенными номерами ID и подтверждение информации об этих доменах VH и VL в индивидуальных компартментах с присвоенными номерами ID.
Поскольку члены библиотеки Fv данного изобретения могут быть разделены индивидуально, данное изобретение может предоставить библиотеку с членами, которые могут храниться в индивидуальных компартментах. Эти индивидуальные компартменты с присвоенными номерами ID могут находиться в различных устройствах, таких как чашки, тест-пробирки, чипы и т.п., но не ограничивающихся ими. Кроме того, эти компартменты могут дополнительно включать в себя буфер, стабилизатор белка или т.п.
В другом аспекте, данное изобретение предусматривает способ выявления скринингом желаемого антитела Fv, причем этот способ включает стадии: (а) конструирования библиотеки Fv путем комбинирования белков в соответствии с вышеуказанным способом конструирования библиотеки Fv; и (b) выполнения индивидуального функционального анализа на желаемое свойство, характеристику или активность с использованием библиотеки Fv.
Способ конструирования библиотеки Fv является таким, как описанный выше.
Предпочтительно, этими желаемыми свойством, характеристикой или активностью могут быть пролиферация, дифференцировка клеток или смерть клеток.
Этими желаемыми свойством, характеристикой или активностью могут быть агрегация белок-белок, увеличенная стабильность белка, увеличенная растворимость белка, введение сайта гликозилирования, введение сайта конъюгации, уменьшение иммуногенности, увеличение экспрессии белка, увеличение аффинности к антигену, уменьшение аффинности к антигену, изменение аффинности связывания, изменение иммуногенности или усиление специфичности, но не ограничивающиеся ими.
Предпочтительно, этот способ скрининга может дополнительно содержать стадию (с) определения идентификационного номера (ID) компартмента, в котором хранится желаемое антитело Fv.
Предпочтительно, способ скрининга может содержать стадии: (с) определение идентификационного номера (ID) компартмента, в котором хранится желаемое антитело Fv,; и (d) определение белка домена VH и белка домена VL антитела Fv из этого идентифицированного компартмента.
Если белок домена VH и белок домена VL антитела Fv идентифицированного компартмента идентифицированы, можно амплифицировать только желаемое антитело Fv, содержащее комбинацию белка домена VH и белка VL.
Предпочтительно, этот способ скрининга может дополнительно содержать стадии: (с) идентификации ID-номера компартмента, в котором хранится желаемое Fv; и (d) идентификации ДНК-последовательности антитела Fv.
Если антитело Fv из этого идентифицированного компартмента определено и последовательность ДНК или аминокислоты легко анализируется, может быть амплифицировано только желаемое антитело Fv.
В другом аспекте, данное изобретение обеспечивает желаемое антитело Fv, которое отобрали этим способом скрининга.
В другом аспекте, данное изобретение обеспечивает библиотеку Fv, основанную на комбинации белков, сконструированную способом конструирования библиотеки Fv, основанным на комбинировании белков.
Примеры
В дальнейшем данное изобретение будет описано более подробно со ссылкой на примеры. Квалифицированному в данной области специалисту будет очевидно, что эти примеры приведены только для иллюстративных целей и не должны толковаться как ограничение объема предложенного изобретения. Соответственно, объем изобретения будет определяться прилагаемыми пунктами формулы изобретения и их эквивалентами.
Пример 1. Получение экспрессирующего вектора
1-1: Приготовление ВАР-сортаза-LPETG-мишень (VL)
Условия ПЦР, используемые в Примере 1 данного изобретения, являются следующими.
ПЦР-смесь состояла из 31,5 мкл дистиллированной воды, 10 мкл 5Х PrimeSTAR буфера, 5 мкл dNTP (2,5 мМ), 1 мкл прямого праймера (100 мкМ), 1 мкл обратного праймера (100 мкМ), 1 мкл матрицы (100 нг/мкл) и 0,5 мкл полимеразы PrimeSTAR (2,5 μ/мкл). ПЦР выполняли в течение 30 циклов, каждый из которых содержит нагревание до 98°С в течение 10 с и нагревание до 68°С в течение 1 мин, и продукт ПЦР хранили при 4°С.
В качестве матрицы синтезировали и использовали ВАР, сортазу и последовательность-мишень.
Используемые праймеры являются следующими.
Сначала ДНК-последовательность, кодирующую ВАР (пептид акцептора биотина), амплифицировали посредством ПЦР с использованием праймера 1_sfi (5'-ccgtggcccaggcggcc GCA AGCAGC GGC CTG AAC GAC АТС TTC GAG GCC-3': SEQ ID NO: 1) или праймера 1 (5'-ATGT CATATG GCA AGCAGC GGC CTG AAC GAC АТС TTC GAG GCC-3': SEQ ID NO: 2) и праймера 2 (5'-CTGCATTTCGTGCCACTCGATCTTCTGGGCCTCGAAGATGTCGTT-3': SEQ ID NO: 3).
ДНК-последовательность, кодирующую аминокислотную последовательность, содержащую аминокислоты 60 - 206 SrtA (GenBank Accession No. AF162687), амплифицировали посредством ПЦР с использованием праймера 3 (5'-АТС GAG TGG САС GAA ATG CAG GCT AAG CCG CAG ATT CCG-3': SEQ ID NO: 4) и праймера 4 (5'-GCCGGTCTCGGGAAGCTTCTTGACCTCGGTAGCGACAAA-3': SEQ ID NO: 5).
Вторую ДНК-последовательность, кодирующую LPETG-мишень (VL), амплифицировали посредством ПЦР с использованием праймера 5 (5'-CAG ТАА GCT ТСС CGA GAC CGG CGAT АТС CAG ATG ACT CAG AGC-3': SEQ ID NO: 6), праймера 6 (5'-ACTCGAACCCGCCGTACGTTTTATCTCTACCTTTGT-3': SEQ ID NO: 7) и матрицы-мишени (VL).
Затем эти три ПЦР-продукта смешивали друг с другом и затем ДНК-последовательность, кодирующую слитый белок BAP-SrtA-kLPETG-target (VL), имеющий сайт HindIII между SrtAc-LPETG и кодирующей мишень последовательностью, амплифицировали посредством ПЦР с использованием праймера 1_sfi или праймера 1 и праймера 7 (5'-taat ggccggcctggcc GC GGC CGC TTAAAGATCTTCTTCACTAATTAACTT-3': SEQ ID NO: 8).
Полученный ДНК-фрагмент расщепляли NdeI и NotI, лигировали в вектор рЕТ23а vector (Novagen), расщепляли SfiI и затем лигировали в вектор pCom3x, который экспрессирует слитый белок ВАР-сортаза-LPETG-мишень.
1-2: Получение мишени (VL)-kLPETG-другой линкер-Сортаза-Н10
ДНК-последовательность, кодирующую мишень-LPETG-линкер (7 а.к.), где связанный линкер (7 а.к.) представлен (GGSSRSS: SEQ ID NO: 9), амплифицировали посредством ПЦР с использованием праймера 8 (5'-ATGT CATATG GAC ATT CAG ATG АСА CAG AGT-3': SEQ ID NO: 12) и праймера 9 (5'-ggaaccaccgccggtctcgggaagAAGATCTTCTTCACTAATTAAC-3': SEQ ID NO: 13).
С использованием праймера 8, праймера 10 (5'-GGA AGA ТСТ AGA GGA АСС АСС ССС АСС АСС GCC CGA GCC АСС GCC АСС GGA TGA GCC GGT СТС GGG AAG AAG АТ-3': SEQ ID NO: 14) и продукта ПЦР мишень-LPETG-линкер (7 а.к.) ДНК-последовательность, кодирующую мишень-LPETG-линкер (18 а.к.), связанный с линкером (18 а.к.) (SSGGGGSGGGGGGSSRSS: SEQ ID NO: 10), амплифицировали посредством ПЦР.
ДНК-последовательность, кодирующую линкер (7 a.к.)-SrtA (60-206), амплифицировали посредством ПЦР с использованием праймера 11 (5'-gag acc ggc ggt ggt tcc tct aga tct tcc cag gct aag ccg cag att-3': SEQ ED NO: 15) и праймера 12 (5'-taat GC GGC CGC tta atgatggtgATGGTGATGATGATGATGGC-3': SEQ ID NO: 16).
ДНК-последовательность, кодирующую линкер (18 a.к.)-SrtA (60-206), амплифицировали посредством ПЦР с использованием праймера 13 (5'-gtggttcctctagatcttcc tcg aag gtc gcg gga tat att-3': SEQ ID NO: 17) и праймера 14 (5'-taat ggccggcctggcc tta atgatggtgatggtgatgatgatgatggc-3': SEQ ID NO: 18).
ДНК-последовательность, кодирующую линкер (20 а.к.)-SrtA (60-206), связанный с линкером (20 а.к.) (SSGGGGSGGGGGGSSRSSGS: SEQ ID NO: 11), амплифицировали посредством ПЦР с использованием праймера 15 (5'-ggt tcc tct aga tct tcc gga agc cag gct aag ccg cag att-3': SEQ ID NO: 19) и праймера 14.
Наконец, мишень (VL)-LPETG-Линкер (7 а.к.)-Sortase-H10 (фиг. 1Α) амплифицировали перекрывающейся ПЦР с использованием праймера 8, праймера 12 и смеси ПЦР-продуктов (мишень-LPETG-линкера (7 а.к.) и линкера (7 а.к.)-SrtA).
Один ген, кодирующий мишень-(VL)-LPETG-линкер (18 а.к.)-Сортаза-Н10 (фиг. 1В), амплифицировали перекрывающейся ПЦР с использованием праймера 8, праймера 14 и смеси ПЦР-продуктов (мишень-LPETG-линкер (18 а.к.) и линкер (18 а.к.)-SrtA).
Ген, кодирующий мишень-(VL)-LPETG-линкер (20 а.к.)-Сортаза-Н10 (фиг. 1С), амплифицировали перекрывающейся ПЦР с использованием праймера 8, праймера 14 и смеси ПЦР-продуктов (мишень-LPETG-линкер (18 а.к.) и линкер (20 а.к.)-SrtA).
Каждый из полученных ДНК-фрагментов расщепляли NdeI и NotI и лигировали с вектором рЕТ23а (Novagen), который экспрессирует слитый белок мишень-LPETG-другой линкер-Сортаза-Н10.
Этот слитый белок мишень-kLPETG-линкер (20 а.к.)-Сортаза-Н10 имеет сайт HindIII между мишенью и последовательностью, кодирующей kLPETG-линкер-(20 а.к.)-Сортаза-Н10. Затем, для экспрессии, все эти генные конструкты расщепляли с использованием NdeI и HindIII и лигировали с pET23a-kLPETG-mRKep (20а.к.)-Сортаза-H10.
Пример 2. Анализ экспрессии
Все эксперименты по экспрессии выполняли с использованием Е. coli Origami2(DE3). Отдельную бактериальную колонию инокулировали в среду dYT (30 мкл), содержащую 100 мкг/л ампициллина и 0,5 (м/о) ампициллина и 0,5% (м/о) глюкозы, и культивировали в течение ночи при 37°C. Эту предварительную культуру инокулировали в 0,3 л среды dYT (100 мг/л ампициллина и 50 мМ K2HPO4) и культивировали при 37°С (колба на 1 л с перегородками, 200 об/мин). Когда величина OD600 достигала 0,6, IPTG добавляли до конечной концентрации 0,5 мМ для индуцирования экспрессии. Эту культуру поддерживали при 18°С в течение 18 часов. Клетки собирали центрифугированием (10000 об/мин, 10 мин, 4°C), суспендировали с 30 мл 50 мМ Трис-HCl (рН 8,0) и 150 мМ NaCl и лизировали обработкой ультразвуком. Суммарный экстракт центрифугировали (10000 об/мин, 30 мин, 4°С) и супернатант фильтровали через фильтр 0,2 мм и наносили непосредственно на Ni FF хроматографию Примера 3 ниже.
Пример 3. Ni-NTA-очистка
Супернатант этого лизата нагружали на 5 мл Ni-NTA (GE) колонку и эту колонку промывали 20-кратным колоночным объемом буфера А (50 мМ Трис-Cl, рН 8,0, 150 мМ NaCl, 30 мМ имидазол и 5 мМ ВМЕ), и затем 5-кратным колоночным объемом буфера В (50 мМ Трис-Cl, рН 8,0, 150 мМ NaCl). После промывания аликвоту белок-связанной смолы уравновешивали расщепляющим буфером (буфером В, содержащим 5 мМ CaCl2 и 5 мМ три-Gly) и затем инкубировали при 25°С в течение 1 часа.
Чистоту белка анализировали гель-электрофорезом в SDS-PAGE (ДСН-ПААГ), и молекулярную массу белка анализировали MALDI-TOF MS (масс-спектроскопией). Выход белка определяли количественно УФ-спектрофотометрией при 280 нм с рассчитанной величиной.
Пример 4. Спаривание антител доменов VH и VL
Реакцию связывания доменов VH и VL в гетеродимеры Fv выполняли смешиванием одинаковых объемов VH и VL. Для условия спаривания 100 мкг/мл белка VH и 100 мкг/мл белка VL смешивали друг с другом в 50 мМ Трис-буфера (рН 8,0) и инкубировали при комнатной температуре в течение 1 часа.
Это связывание между доменами VH и VL в данном изобретении является спариванием между доменами дикого типа, спариванием дисульфидными связями или связыванием в виде суперспирали, и схематичный вид каждого способа связывания показан на фиг. 2.
Собранный Fv анализировали посредством ELISA и эксклюзионной хроматографии, и молекулярную массу этого белка анализировали с использованием MALDI-TOF MS. Кроме того, Fv, связанный дисульфидной связью, анализировали электрофорезом на геле SDS-PAGE и посредством ELISA.
Конкретно, микропланшет (Nunc, Maxisorp) покрывали в течение ночи 300 нг антигена (Erbb2) и захватывающего антитела в карбонатном/бикарбонатном буфере (рН 9,6) при 4°С. Этот планшет промывали 0,05% PBS-T и затем блокировали PBS-T, содержащим 3% обезжиренного молока, при 37°С в течение 1 часа. Собранный Fv (1-0,5 мкг) добавляли в планшет и инкубировали при 37°С в течение 1 часа. Планшет промывали и инкубировали с разведением 1:2500 конъюгированного с пероксидазой хрена анти-HA или myc антитела в PBS-T, содержащем 3%-ное обезжиренное молоко. Этот планшет инкубировали при 37°С в течение 1 часа, промывали и затем разводили раствором субстрата ТМВ (Sigma)/пероксидазы. Реакцию останавливали 2N H2SO4 и оптическую плотность считывали при 450 нм.
Пример 5. HPLC анализ
Жидкостную хроматографию высокого разрешения (HPLC) выполняли с системой (HPLC) Agilent 1260 series, имеющей диодный решетчатый детектор. Колонку (7,80×300 мм BioSep-SEC-s2000) покупали из Phenomenex. 50 мМ KH2PO4 и 100 мМ KCl (рН 6,5) использовали в качестве подвижной фазы.
Пример 6. Коллекция последовательностей антител
PSI-BLAST использовали здесь для поиска в базе данных всех последовательностей в PDB, файле неизбыточных последовательностей pdbaanr, доступном на веб-сайте PISCES, с использованием области вариабельных доменов из структуры антител в PDB вход 1Q9R. Выбирали только последовательности с идентичностью выше 35% и E-величиной, большей чем 1,0×10-20, так что оставались только домены антител (в том числе были исключены Т-клеточные рецепторы и другие Ig-последовательности). Полученные последовательности тяжелых цепей и легких цепей собирали при 90%-ной идентичности с использованием сервера PISCES. Множественные выравнивания последовательностей, последовательности тяжелой цепи и последовательности легкой цепи производили отдельно с использованием Clustal W, собирали вручную и редактировали. Затем эти выравнивания использовали для создания тяжелой цепи и легкой цепи специфических скрытых моделей Маркова с использованием программы HMMER. Один профиль НММ является статистической моделью выравнивания множества последовательностей семейства белков, включающей в себя позиционно-специфические инсерционные вероятности. Это делает их хорошо подходящими для определения положений CDR, которые встречаются в известных положениях в последовательностях вариабельных доменов и которые различаются по длине. Эти НММ использовали для поиска pdbaa (набора всех белковых последовательностей в PDB, в том числе избыточных), доступных из сервера PISCES (http://dunbrack.fccc.edu/PISCES.php). Величины порогов для баллов HMMER и Е-величин выбирали таким образом, что при поиске белковых последовательностей pdbaa только последовательности тяжелых цепей и легких цепей оценивались выше, чем порог. Последовательности, обнаруживаемые обоими HMMs, приписывали к последовательности с более высоким баллом и меньшей E-величиной. Как κ, так и λ легкие цепи оцениваются выше, чем предельные частоты для НММ легкой цепи. Эти профили HMMs, один для тяжелой цепи и один для легкой цепи, были дополнительно использованы для идентификации специфических сохраненных положений каркасов до и после каждого CDR.
Пример 7. Анализ CDR
Одну выровненную коллекцию повторно выровненных последовательностей VH и VL антител использовали для анализа длины и состава CDR. CDR в каждом выравнивании группировали в соответствии с длиной CDR. Индивидуальные группы классифицировали как канонические (консенсусные) структуры в соответствии с Chothia et al. (Conformations of immunoglobulin hypervariable regions. Nature. 1989; 342: 877-883). Все анализы выполняли с использованием Excel.
Пример 8. Верификация эффективного образования антитела Fv путем комбинирования белков и его активности
Эффективное образование и активность антитела Fv комбинированием белков подтверждали введением мутаций в белки VH и VL с использованием хорошо известного HERCEPTLN в качестве модели.
Экспериментальный Пример 1. Подтверждение простой очистки саморасщеплением слитого белка
Подтверждено, что домен VH или домен VL белка-мишени может быть просто отделен от слитого белка способами из Примеров 1-3 выше.
Конкретно, для Flag-VH-линкер-суперспираль-HA-Flag-LPETG-линкера (7, 18 или 20 а.к.)-SrtA-His10 использовали следующие последовательности.
Конкретно, Flag (DYKD: SEQ ID NO: 20), VH (EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYT RYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRWGGDGFYAMDYWGQGT LVTVSS: SEQ ID NO: 21), линкер (SLEGTGGTSGSTSGTGGSSRSSST: SEQ ID NO: 22) и HA (YPYDVPDYAK: SEQ ID NO: 23), и последовательности в виде суперспирали показаны в таблице 1 ниже.

Конкретно, для VL-линкер-суперспираль-myc-LPETG-линкера (7, 18 или 20 а.к.)-SrtA-His10 использовали следующие последовательности.
VL(DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSAS FLYSGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIK: SEQ ID NO: 32), линкер (ALEGTGSSTGSSTGPGGSSRSSST: SEQ ID NO: 33) и myc (EQKLISEEDLKLPET: SEQ ID NO: 34) использовали, и использовали последовательности с последовательностями суперспирали в таблице 2 ниже.

Последовательность Flag-VH (H-G44C или H-Q105C)-HA-Flag-LPETG-линкер (7, 18 или 20 а.к.)-StrA-His10, имеющая введенную в нее мутацию на цистеин, была такой же, как последовательность, описанная выше, за исключением VH, показанной в таблице 3 ниже.

Последовательность VL (L-A43C или L-Q100C)-MYC-LPETG-линкер (7, 18 или 20 а.к.)-StrA-His10, имеющая введенную в нее мутацию на цистеин, была такой же, как последовательность, описанная выше, за исключением VL, показанной в таблице 4 ниже.

Этот простой способ очистки схематично показан на фиг. 3.
Результаты электрофореза SDS-PAGE (ДСН-ПААГ) VL и VH, очищенных по способу фиг. 3, показаны на фиг. 4. Кроме того, фиг. 5 показывает выход очистки посредством метки Flag. Такие результаты суммированы на фиг. 6.
Информация на этих последовательностях, показанных на фиг. 4, была получена из базы данных BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi). Последовательности, показанные на фиг. 3 и 4, были случайным образом мутированы введением цистеинов в поверхность раздела между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи 4D5 (HERCEPTIN®) для образования гетеродимеров.
В результате выход очистки VL в неслитой системе был 10 мг/л, и выход очистки VH был 0,2 мг/л. Таким образом, показано, что выход очистки увеличивался приблизительно в 3-6,5 раз, когда использовали способ слитой Сортазы, созданный авторами данного изобретения (фиг. 6). Кроме того, было показано, что уровень экспрессии увеличивался приблизительно в 2-55 раз, когда использовали метку Flag (фиг. 6).
Экспериментальный Пример 2. Анализ пар VH-VL при уровне белка посредством анализа ELISA
Пары VH-VL анализировали посредством ELISA в соответствии со способом Примера 4. Фиг. 7 схематично показывает этот способ ELISA.
Конкретно, были сконструированы метка VH-HA и метка VL-myc и 16 пар в целом, включающих в себя пару дикого типа (wt), 11 пар с доменами в виде суперспиралей, анализировали анализом ELISA. Результаты ELISA пар VH-VL показаны на фиг. 8. В результате было показано, что все эти пары наблюдались при сходных уровнях, когда они действительно связывались с антигенами. Когда анализ выполняли с анти-HA-пары-анти-myc HRP без антигена, дикий тип не показывал сигнала, и среди 11 спариваний с доменами в виде суперспиралей, VH winzipA1/VL winzipB2, обнаруживали низкий сигнал и VH winzipA2/VL winzipB2 не обнаруживал сигнала. Среди 4 пар с дисульфидными связями только VH G44C/VL Q100C показывали сигнал (фиг. 8, светлый столбик: анти-HA/Fv/анти-myc HRP, правый столбик: Erbb2/Fv/анти-myc HRP).
Кроме того, конструировали Flag-меченые VH и VL, и в целом 12 пар, включающих в себя 8 пар суперспиральными доменами и 4 пары с дисульфидными связями, анализировали при помощи ELISA. В результате, было показано, что все пары казались похожими, когда они не были связаны с антигенами. Когда анализ выполняли с анти-НА-парами-анти-myc HRP без антигена, VH winzipA1/VL winzipB1 и VH IAAL Е3/VL IAAL K3 среди восьми пар суперспиральными доменами, обнаруживали высокие сигналы. Кроме того, четыре пары с дисульфидными связями не обнаруживали сигнал в ELISA, но показывали спаривание в других анализах (SDS-PAGE, MALDI-TOF-MS и т.д.) (фиг. 9).
Приведенные выше результаты подтверждают, что домены белка VH и VL данного изобретения могут дать библиотеку Fv, имеющую разнообразие за счет случайного спаривания.
Экспериментальный Пример 3. Анализ пар VH-VL на уровне белка посредством анализа SDS-PAGE (ДСН-ПААГ)
Пары VH-VL анализировали посредством SDS-PAGE в соответствии со способом Примера 4. На фиг. 10 приведены пары VH-VL с дисульфидными связями, образованными между цистеинами, введенными путем мутации в VL и VH. В результате было показано, что VL-Q100C/VH-G44C, VL-A43C/VH-Q100C и VL-A43C/VH-G44C были спаренными дисульфидными связями с образованием гетеродимеров (фиг. 10).
Также, среди пар VH-VL с дисульфидными связями, образованными цистеинами, введенными путем мутации в VL и VH, пары VH-VL с дисульфидными связями между Flag-VH и VL показаны на фиг. 11. В результате было показано, что VLk1-Q100C/F-VH-G44C-F, VLk1-Q100C/F-VH-G44C и VLk1-Q100C/VH-G44C были спарены дисульфидными связями с образованием гетеродимеров и обнаруживали увеличенную скорость продуцирования (фиг. 11).
Приведенные выше результаты подтверждают, что домены белка VH и VL данного изобретения могут обеспечивать получение библиотеки Fv, имеющей разнообразие за счет случайного спаривания.
Экспериментальный Пример 4. Анализ пар VH-VL на уровне белка анализом SEC-HPLC
Пары VH-VL анализировали эксклюзионной хроматографией (SEC-HPLC) в соответствии со способами Примеров 4 и 5.
Условия SEC-HPLC являются следующими:
Колонка 7,80×300 мм BioSep-SEC-s2000
Подвижная фаза: PBS, рН 7.4
Скорость потока колонки: 0,5 мл/мин
Температура колонки: 25°С
Детектор УФ оптической плотности: 280 нм, 210 нм
Объем инъекции: 100 мкл
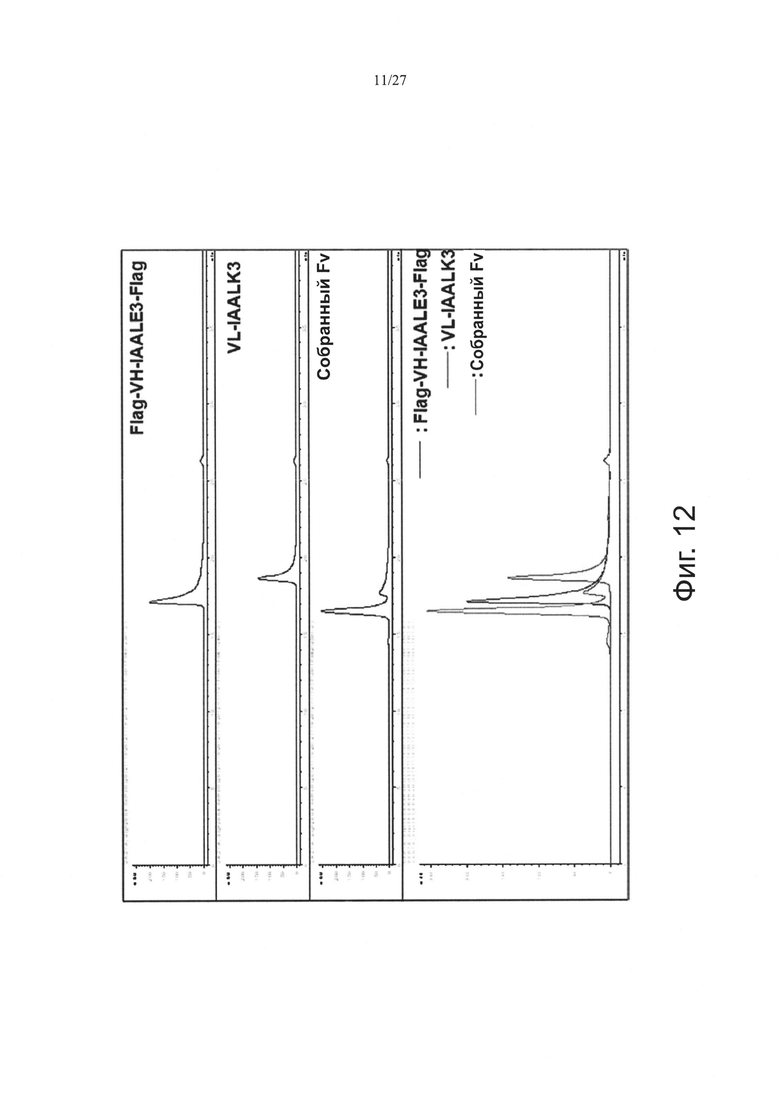
Фиг. 12 показывает результаты эксклюзионной хроматографии VL-IAALK3, Flag-VH-IAALE3-Flag и собранных Fv.
Конкретно, были сконструированы Flag-меченая VH-HA метка и VL-myc метка, и всего получено 16 пар, включающих в себя одну пару дикого типа (wt), 11 пар со суперспиральными доменами и 4 пары с дисульфидными связями, анализировали эксклюзионной хроматографией. Фиг. 12 показывает результаты эксклюзионной хроматографии VL-IAALK3, Flag-VH-IAALE3-Flag и собранных Fv. В результате показано, что собранные Fv, Flag-VH-IAALE3-Flag и VL-IAALK3 детектировались в этом порядке.
В других результатах для VL-IAALK3, Flag-VH-IAALE3-Flag и собранного Fv, в том числе пары дикого типа, VH или VL не детектировались, и собранный Fv имел величину молекулярной массы, сравнимую с VH или VL, и детектировался рано. Однодоменное антитело VH или VL было трудно анализировать вследствие высокой гидрофобности, известного свойства этих антител, а большинство собранных Fv детектировали, при этом высокогидрофобные остатки, экспонированные на поверхности каждого однодоменного антитела доменом, были скрыты в собранном Fv и изменяли его гидрофильность.
Приведенные выше результаты подтверждают, что домены белка VH и VL данного изобретения могут обеспечивать получение библиотеки Fv, имеющей разнообразие в результате спаривания.
Экспериментальный Пример 5. Анализ молекулярной массы пар VH-VL с использованием MALDI-TOF MS-анализа
Молекулярные массы пар VH-VL анализировали с использованием MALDI-TOF MS в соответствии со способами Примеров 4 и 5.
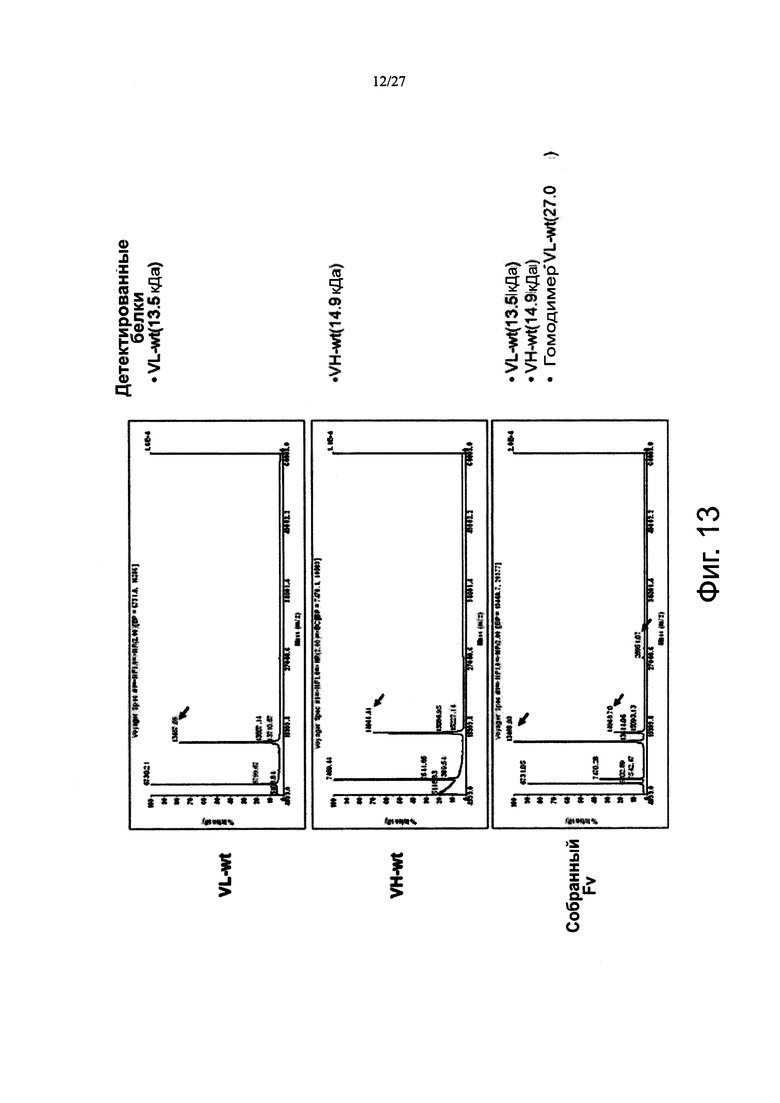
Фиг. 13 показывает результаты анализа молекулярных масс VL-Q100C, Flag-VH-G44C-Flag и Fv, и фиг. 15 показывает результаты анализа молекулярных масс VL-IAALK3, Flag-VH-IAALE3-Flag и Fv.
Молекулярная масса каждого из VL и VH для wt могла быть точно определена, а молекулярная масса собранного Fv не была определена (фиг. 13). Спаривание может быть подтверждено на основе молекулярных масс VL-Q100C (13,6 кДа), Flag-VH-G44C-Flag (16,2 кДа) и Fv (29,8 кДа) (фиг. 14). Кроме того, спаривание может быть определено на основе молекулярных масс VL-IAALK3 (18,6 кДа), Flag-VH-IAALE3-Flag (21,2 кДа) и Fv (39,8 кДа) (фиг. 15).
Экспериментальный Пример 6. Верификация активности собранного Fv на клеточном уровне
Действие антитела 4D5 Fv на рост клеток ВТ-474 анализировали CCK8-анализом (Dojjindo), и результаты этого анализа представлены на фиг. 16. Как можно видеть из фиг. 16, клетки ВТ-474 рака молочной железы человека сверхэкспрессируют HER-2 на своей поверхности, и их рост уменьшался под воздействием собранного 4D5 Fv до степени, сходной со степенью уменьшения роста под воздействием 4D5 IgG-антитела.
После мечения непрямой иммунофлуоресценцией уровень экспрессии Her2 на клеточной поверхности анализировали посредством FACS с последовательным использованием 4D5 IgG и FITC-конъюгированного анти-человек-Fc. Связывание каждого из VH домена, VL домена и собранных антител FV к клеткам ВТ-474 подтверждали мечением этих клеток 1 мкг анти-с-Мус-антитела в течение 1 часа и затем мечением этих клеток Alexa 488-конъюгированным анти-мышь антителом с последующим FACS.
Профили связывания 4D5 IgG, домена VH, домена VL и собранных антител Fv с Her2-экспрессирующей клеточной поверхностью клеток ВТ-474 подвергали мониторингу с использованием FACS, и эти результаты показаны на фиг. 17. Результаты анализа с коммерчески доступным 4D5 IgG (положительный контроль) показали, что HER-2 сверхэкспрессировался в клетках ВТ-474.
Экспериментальный пример 7. Конструирование библиотеки
Функциональную комбинаторную белковую библиотеку, полученную путем спаривания белков VH and VL, конструировали с хорошо известным конъюгатом антиген-антитело. Природный иммунный репертуар может создавать антитела, которые распознают по существу любой антиген с высокой специфичностью и аффинностью. Узнавание антигена опосредовано шестью определяющими комплементарность участками (CDR), которые представляют собой большую поверхность для контакта с антигеном. Последовательности CDR являются гипервариабельными, но на общую композицию функциональных CDR, в общем, влияют несколько типов аминокислот. В библиотеке данного изобретения функциональное разнообразие было ограничено малыми субпопуляциями функциональных групп, которые особенно хорошо пригодны для опосредования молекулярного распознавания. Библиотеку данного изобретения создавали введением часто встречающихся последовательностей, важных для образования комплексов антиген-антитело, в CDR3 тяжелой цепи и легкой цепи каждого ключевого антитела выбранного каркаса, обеспечивая подходящую укладку и высокие выходы экспрессии. Все длины CDR фиксировали при высокой частоте из собранных антител. Композиции и CDR 1 и 2 были сконструированы с наиболее изобилующими остатками собранных антител. Библиотека данного изобретения имела комбинированную вариабельность 104 антител посредством спаривания VH (100) и VL (100). Сегменты VH3, VLk3 и VLk1 зародышевой линии человека обнаруживаются в антителах, реконструированных при очень высокой частоте, и легко экспрессируются и спариваются.
Авторы данного изобретения синтезировали ДНК-последовательности CDR1, CDR2 и CDR3 в каркасе VH3-66 и VLk1 и вводили разнообразие в CDR-H3 и CDR-L3 с использованием часто встречающихся последовательностей, важных для образования комплексов антиген-антитело.
Конструирование библиотеки выполняли в соответствии со способами Примеров 6-8. В качестве каркаса использовали VH3-66 и VLK3. Большинство гетеродимеров были HV3, HV1, HV4, KV3 и KV1.
Были установлены длины CDR, наиболее часто встречающиеся. Конкретно, CDR H1 фиксировали при длине 10 аминокислот; CDR Н2 фиксировали при длине 10 аминокислот; CDR Н3 фиксировали при длине 11 аминокислот; CDR L1 фиксировали при длине 11 аминокислот; CDR L2 фиксировали при длине 7 аминокислот и CDR L3 фиксировали при длине 9 аминокислот. Типичные содержания CDR Н3 и CDR L3, появляющиеся при высокой частоте, показаны на фиг. 18.
Экспериментальный Пример 8. Конструирование библиотеки
Для разнообразия конструкции CDR1 и CDR2 фиксировали с остатками, имеющими наивысшие остатки, и CDR3 конструировали с высокочастотными остатками. Пример этого показан на фиг. 19. 100 доменов VH и 100 доменов VL объединяли для конструирования библиотеки, имеющей разнообразие 100×100=10000. Эти результаты показаны на фиг. 20. Среди 10000 FV, сконструированных комбинированием белков, 25 FV, сконструированных с использованием 5 VH и 5 VL, анализировали посредством SEC-HPLC, и результаты этого анализа показаны на фиг. 21.
Комбинирование 4D5 VH и пяти синтетических VL анализировали FACS и SEC-HPLC, и эти результаты показаны на фиг. 22. Собранные FV, сконструированные с использованием комбинации 4D5 VH и пяти синтетических VL, анализировали посредством SEC-HPLC. Однако было показано, что собранные Fv не связываются с клетками ВТ-474.
Экспериментальный Пример 9. Скрининг библиотеки
Для скрининга библиотек были отобраны 10 антигенов, включающих в себя Fc-конъюгированные CTLA4, 41 ВВ, TRAL RI, сМЕТ, TRALI R2, CD40, Frizzled рецептор 7, CD30, IL-17R и CSF1-R. В первой стадии скрининга взаимодействие индивидуальных FV с 10 смешанными антигенами анализировали альфа-анализом (Amplified Luminescent Proximity Homogeneous Assay), и во второй стадии скрининга скринингу подвергали взаимодействие отобранных антител с индивидуальными антителами. Процесс скрининга библиотеки показан на фиг. 23.
Этот альфа-анализ является анализом на основе близости донорских гранул и акцепторных гранул. В этом анализе биотинилированные антигены могут захватываться покрытыми стрептавидином гранулами, и myc-меченый FV может связываться с анти-myc-конъюгированными акцепторными гранулами. Донорская гранула и акцепторная гранула становятся соседними друг с другом благодаря взаимодействиям антигена-FV. Донорская гранула возбуждается при 680 нм в результате эмиссии синглетного кислорода, и сигнал флуоресценции, амплифицированный синглетным кислородом, испускается из акцепторной гранулы для детектирования альфа-сигнала.
Фиг. 24 показывает результаты скрининга взаимодействия индивидуальных Fv с 10 смешанными антигенами с использованием этого альфа-анализа. На фиг. 24 эта Y-ось показывает альфа-сигнал и Х-ось показывает 10000 подвергнутых скринингу FVs. Как можно видеть в них, различные антитела в диапазоне от высоких сигналов до низких сигналов были скринированы вблизи фона.
Во второй стадии скрининга взаимодействие между связыванием FVs со смешанными антигенами и индивидуальными антигенами подвергали скринингу, и результаты этого скрининга показаны на фиг. 25. Антитела, показывающие специфичность в отношении CSF1R, MET, CD30 и TRAIL-R1, могли быть найдены, и могли быть найдены антитела, имеющие мультиспецифичность в отношении комбинации различных антигенов.
Фиг. 26 показывает результаты альфа-анализа для связывания Fvs в основном с CSF1R. На фиг. 26 можно видеть различные антитела, показывающие различие в альфа-сигналах. Взаимодействие связывания Fv в основном с CSF1R в альфа-анализе анализировали посредством ELISA, и результаты этого анализа показаны на фиг. 27. Показано, что большинство Fv не связывались как с CSF1R, так и с c-MET(HGFR). Кроме того, некоторые Fv, включающие в себя Fv #7197 и #7195, показывали мультиспецифичность.
Взаимодействие Fv с подтвержденным связыванием в основном с CSF1R в альфа-анализе анализировали Вестерн-блоттингом, и результаты этого анализа показаны на фиг. 28. Было показано, что большинство из этих Fv не связывались ни с CSF1R, ни с с-MET(HGFR).
Фиг. 29 показывает результаты альфа-анализа в отношении связывания Fvs с с-МЕТ. На фиг. 29 можно видеть различные антитела, показывающие различие в альфа-сигналах.
Взаимодействие Fv с подтверждением связывания в основном только с с-МЕТ в альфа-анализе анализировали посредством ELISA, и результаты этого анализа показаны на фиг. 30. Было показано, что большинство идентифицированных Fv не связывались ни с CSF1R, ни с c-MET(HGFR). Кроме того, некоторые Fv, в том числе Fv #724 и #6900, обнаруживали мультиспецифичность.
Взаимодействие Fv с подтверждением связывания только с с-МЕТ в альфа-анализе анализировали посредством Вестерн-блоттинга, и результаты этого анализа показаны на фиг. 31. Как можно видеть на фиг. 31, большинство из этих Fv не связывались ни с CSF1R, ни с c-MET(HGFR).
Из вышесказанного квалифицированным в данной области специалистам, к которым относится данное изобретение, будет понятно, что данное изобретение может проводиться в других конкретных вариантах без изменения технической сущности или его характерных признаков. В этом отношении должно быть понятно, что вышеупомянутые примеры являются иллюстративными во всех аспектах, но не являются ограничивающими. Объем этого изобретения должен считаться как включающий смысл и объем прилагаемых пунктов изобретения и все изменения и модифицированные формы, которые происходят из концепции их эквивалентов, а не подробное описание.
Промышленная применимость
Данное изобретение является платформой для конструирования новых библиотек Fv. Более конкретно, данное изобретение может обеспечивать платформу для создания новых антител, которая может существенно уменьшать время и стоимость, требуемые для очистки и скрининга за счет комбинирования VH и VL на уровне белка, в отличие от общепринятых способов комбинирования доменов антител на уровне ДНК.
Вследствие такой технической характеристики терапевтические антитела, имеющие практическую функцию, могут быть проанализированы скринингом за гораздо меньшее время и с существенно уменьшенными расходами в сравнении с общепринятыми способами, и ингибиторы, регуляторы и т.п. могут быть также разработаны без ограничения на их мишенях.
Кроме того, библиотека данного изобретения не имеет проблем токсичности в отличие от общепринятых библиотек, и, следовательно, их функция может быть немедленно анализирована, так что антитела, имеющие различные функции, могут быть выявлены скринингом. Кроме того, библиотеку данного изобретения можно скринировать для выявления функциональных антител, которые участвуют в клеточной пролиферации, дифференцировке, смерти клеток или т.п., или она делает возможным найти границу между нормой и аномалией (заболевание, феномен или состояние) клеток или индивидуумов с использованием антител. Другими словами, библиотека данного изобретения может применяться для получения лекарственных средств на основе антител и может быть также использована в различных приложениях, включающих диагностику различных заболеваний, анализ способности дифференцировки стволовых клеток, стимуляцию дифференцировки стволовых клеток, исследования механизмов заболеваний, скрининг антител, получение ингибиторов и регуляторов и картирование антител (фингерпринтинг) для различных состояний (дифференцировки и отсутствия дифференцировки, группы заболевания и нормальной группы).
Хотя данное изобретение было описано подробно со ссылкой на специфические признаки, квалифицированному в данной области специалисту будет очевидно, что это описание приведено только для предпочтительного варианта и не ограничивает объем данного изобретения. Таким образом, существенный объем данного изобретения будет определен прилагаемыми пунктами формулы изобретения и их эквивалентами.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЧИСТКИ БЕЛКА, ВКЛЮЧЕННОГО В САМОРАСЩЕПЛЯЮЩУЮСЯ КАССЕТУ, И ЕГО ПРИМЕНЕНИЕ | 2014 |
|
RU2639527C2 |
| АНТАГОНИСТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2005 |
|
RU2401842C2 |
| СВЯЗЫВАЮЩИЕ ЭЛЕМЕНТЫ С ИЗМЕНЕННЫМИ ДИВЕРСИФИЦИРОВАННЫМИ ДОМЕНАМИ ОСТОВА | 2017 |
|
RU2778694C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2011 |
|
RU2774414C2 |
| АНТИГЕН, АССОЦИИРОВАННЫЙ С РЕВМАТОИДНЫМ АРТРИТОМ | 2013 |
|
RU2649368C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2011 |
|
RU2663123C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С ВНЕКЛЕТОЧНЫМ ДОМЕНОМ ТИРОЗИНКИНАЗНОГО РЕЦЕПТОРА (ALK) | 2007 |
|
RU2460540C2 |
| ТЕРАПЕВТИЧЕСКИЕ DLL4-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2011 |
|
RU2605928C2 |
| АНТИТЕЛА ПРОТИВ CD19 ЧЕЛОВЕКА, ОБЛАДАЮЩИЕ ВЫСОКОЙ АФФИННОСТЬЮ | 2016 |
|
RU2761077C1 |
| ТЕРАПЕВТИЧЕСКИЕ DLL4-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2010 |
|
RU2570639C2 |























Изобретения относятся к способу конструирования библиотеки Fv, способу скрининга желаемого антитела с использованием этой сконструированной библиотеки Fv и библиотеке Fv, сконструированной способом конструирования библиотеки Fv. Представленный способ конструирования библиотеки Fv включает стадии: (а) приготовления белков домена вариабельной области тяжелой цепи (VH), экспрессированных в клетках, и белков домена вариабельной области легкой цепи (VL), экспрессированных в клетках; (b) спаривания белков домена VH и белков домена VL, приготовленных на стадии (а), вне клетки, чтобы сформировать собранные Fv; и (c) хранения собранных Fv со стадии (b) в индивидуальных компартментах, получивших индивидуальные идентификационные номера, причем функция каждого индивидуального Fv в индивидуальных компартментах анализируется без прескрининга, основанного на связывании с мишенью. Изобретения позволяют существенно уменьшить количество процессов очистки белков, снижая таким образом расходы и затраченное время в сравнении с общепринятыми библиотеками на основе ДНК. 3 н. и 14 з.п. ф-лы, 31 ил., 4 табл., 9 пр.
1. Способ конструирования библиотеки Fv, содержащей индивидуально разделенные Fv, основанный на комбинировании белков, включающий стадии:
(a) приготовления белков домена вариабельной области тяжелой цепи (VH), экспрессированных в клетках, и белков домена вариабельной области легкой цепи (VL), экспрессированных в клетках; и
(b) спаривания белков домена VH и белков домена VL, приготовленных на стадии (а), вне клетки, чтобы сформировать собранные Fv;
(c) хранения собранных Fv со стадии (b) в индивидуальных компартментах, получивших индивидуальные идентификационные номера;
где функция каждого индивидуального Fv в индивидуальных компартментах анализируется без прескрининга, основанного на связывании с мишенью.
2. Способ по п. 1, где стадия (b) предусматривает спаривание белков домена VH и белков домена VL случайным спариванием или направленным спариванием.
3. Способ по п. 1, где библиотека Fv допускает функциональный анализ ее индивидуальных членов по желаемому свойству, характеристике или активности.
4. Способ по п. 3, где желаемым свойством, характеристикой или активностью являются пролиферация клеток, дифференциация или смерть клеток.
5. Способ по п. 1, где белок домена VH и белок домена VL имеют желаемую вариабельность, которую в них ввели.
6. Способ по п. 1, где белки домена VH и белки домена VL произведены из человека или не из человека.
7. Способ по п. 1, где на стадии (а) желаемая вариабельность введена в белок домена VH и белок домена VL путем введения мутации в CDR (участок, определяющий комплементарность) или каркас в белке домена VH или белке домена VL.
8. Способ по п. 7, где этим CDR является CDR1, CDR2 или CDR3.
9. Способ по п. 1, где спаривание белок-белок на стадии (b) выбрано из группы, включающей: (i) спаривания между доменами дикого типа; (ii) спаривания дисульфидными связями между цистеинами, введенными в домены белков; (iii) спаривания суперспиралью из слияния между суперспиральными доменами; (iv) спаривания взаимодействием белок-белок и (v) их комбинаций.
10. Способ скрининга желаемых антител Fv, имеющих желаемую функцию, где способ включает стадии:
(a) конструирования библиотеки Fv, основанной на комбинации белков, согласно способу по любому из пп. 1-9 и
(b) выполнения функционального анализа на индивидуальных членах библиотеки Fv на желаемое свойство, характеристику или активность с использованием этой библиотеки Fv.
11. Способ по п. 10, где желаемым свойством, характеристикой или активностью являются пролиферация клеток, дифференциация или смерть клеток.
12. Способ по п. 10, дополнительно предусматривающий стадию (с) определения идентификационного (ID) номера компартмента, в котором хранится желаемое антитело Fv.
13. Способ по п. 10, дополнительно предусматривающий стадию (d) идентификации белка домена VH и белка домена VL антитела Fv из идентифицированного компартмента стадии (с).
14. Способ по п. 10, дополнительно предусматривающий стадию (d) идентификации последовательности отдельного антитела Fv из идентифицированного компартмента.
15. Библиотека Fv, полученная с использованием способа по п. 1, включающая белки домена VH, индивидуально связанные с белками домена VL, чтобы сформировать собранные Fv, где белки домена VH и белки домена VL экспрессированы из клеток и очищены из лизатов клеток, причем белки домена VH и белки домена VL спарены вне клетки,
где собранные Fv, каждый из них, хранятся в индивидуальных компартментах, получивших идентификационные номера,
где функция каждого Fv в индивидуальных компартментах анализируется без прескрининга, основанного на связывании с мишенью.
16. Библиотека Fv по п. 15, где спаривание белок-белок на стадии (b) выбрано из группы, включающей: (i) спаривания между доменами дикого типа; (ii) спаривания дисульфидными связями между цистеинами, введенными в домены белков; (iii) спаривания суперспиралью из слияния суперспиральных доменов; (iv) спаривания взаимодействиями белок-белок и их комбинаций.
17. Библиотека Fv по п. 15, где мутацию вводят в CDR (участок, определяющий комплементарность) или каркас в белке домена VH или белке домена VL.
| ACHIM KNAPPIK et al., Fully Synthetic Human Combinatorial Antibody Libraries (HuCAL) Based on Modular Consensus Frameworks and CDRs Randomized with Trinucleotides, J | |||
| Mol | |||
| Biol., 2000, Vol.296, pp.57-86 | |||
| STEFANIE URLINGER et al., A New Antibody Library Concept, AB Engineering, San Diego, Dec | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Н.В | |||
| ТИКУНОВА и др., Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител, Acta naturae, 2009, 3, с.22-31. | |||
Авторы
Даты
2017-12-21—Публикация
2014-01-24—Подача