ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к обогащению кормов для животных микроэлементами в высокобиодоступной, абсорбируемой форме.
УРОВЕНЬ ТЕХНИКИ
Присутствие незаменимых металлов, иногда называемых микроэлементами, в достаточном количестве и в биологически доступной форме в рационе требуется для поддержания здоровья и благосостояния домашних животных и птицы. Поскольку незаменимые металлы, такие как медь, железо, марганец и цинк, часто содержатся в недостаточном количестве в типичных кормовых компонентах, то дополнительные количества этих питательных веществ часто добавляют в корм для домашних животных и птицы. Многие серийно выпускаемые кормовые добавки были разработаны для обеспечения незаменимых металлов в формах, которые являются легко биологически усвояемыми. Степень биологической усвояемости питательных веществ часто называется «биодоступностью». Биодоступность незаменимых металлов зависит от физических и/или химических свойств формы, в которой металл присутствует в рационе. Повышение биодоступности добавляемых металлов имеет практическое значение, так как оно позволяет использовать более низкие концентрации металлов в рационе для удовлетворения потребности животных в питательных веществах, одновременно снижая потенциальное вредное воздействие высоких уровней этих металлов как на животных, так и на окружающую среду.
На рынке имеется несколько серийно выпускаемых продуктов, в которых микроэлементы являются более биодоступными, чем соответствующий неорганический источник металла. Повышенная биодоступность связана с соединением металла с органической молекулой, обычно известной как лиганд. Это соединение или связывание приводит к повышению доступности металла для усвояемости животными, то есть повышенной биодоступности. Повышенная биодоступность незаменимых элементов в таких продуктах является результатом повышенной растворимости, более высокой стабильности в желудочно-кишечном тракте, повышенной абсорбции в кровоток и/или улучшенной метаболической усвояемости.
Различные виды продуктов, которые содержат микроэлементы, связанные с органическим лигандом, имеются на рынке. Их можно классифицировать в различные группы, исходя из химической природы лиганда, используемого при производстве продукта. В одной группе продуктов аминокислоты используют в качестве лигандов, которые образуют комплексы или хелаты с металлом. Примеры таких продуктов описаны в патентах США 3941818, 3950372, 4067994, 4863898, 4900561, 4948594, 4956188, 5061815, 5278329, 5583243 и 6166071. Вторая группа кормовых добавок включает соли металлов и короткоцепочечных карбоновых кислот, таких как пропионовая кислота (смотри патенты США 5591878, 5707679, 5795615 и 5846581). Третья группа добавок микроэлементов классифицируется Ассоциацией американских официальных контролеров по качеству кормов как протеинат металла и определяется как «продукт, полученный в результате хелатирования растворимой соли с аминокислотами и/или частично гидролизованным белком». Примеры таких продуктов описаны в патентах США 3440054, 3463858, 3775132, 3969540, 4020158, 4076803, 4103003, 4172072 и 5698724.
Известный патентообладатель настоящей заявки имеет в прошлом синтезированные и запатентованные комплексы металлов с аминокислотами в качестве более биодоступного источника незаменимых элементов. Далее приведены примеры этих патентов: в патентах США 3941818, 3950372, 4021569, 4039681 и 4067994 раскрываются комплексы 1:1 альфа-аминокислот, предпочтительно DL-метионина, с переходными металлами: цинком, хромом, марганцем и железом. Образование подобных комплексов с L-метионином раскрывается в патенте США 5278329. В патентах США 4900561 и 4948594 раскрываются комплексы меди с альфа-аминокислотами, содержащими концевые аминогруппы. Комплексы меди, марганца, цинка и железа с альфа-гидроксильными алифатическими карбоновыми кислотами описаны в патентах США 4956188 и 5583243. В патентах США 4670269 и 4678854 раскрываются комплексы кобальта с полиоксикислотой, такой как глюкогептановая кислота. Комплексы аминокислоты L-лизина с микроэлементами раскрываются в патенте США 5061815. Эффективность соединений, раскрытых в этих патентах, была подтверждена данными, приведенными в некоторых из этих патентов и в многочисленных научных публикациях и технических отчетах.
Вышеуказанные патенты описывают использование чистых синтетических или природных аминокислот. В патенте США 5698724 патентообладателем настоящей заявки раскрывается синтез комплексов незаменимых элементов с природными аминокислотами, полученными в результате гидролиза белков. Так как этот патент выдан, то большое количество исследований технического уровня показало, что металлы из этих комплексов являются более биодоступными, чем металлы из неорганических источников.
Этилендиамин (ЭДА) хорошо известен в области химии и является структурным элементом многих соединений и полимеров. Он также является важным лигандом для комплексообразования металлов. В этом качестве он был химически модифицирован для предоставления одного из лучших и хорошо известных хелатообразующих веществ ЭДТА (этилендиаминтетрауксусной кислоты). Поиск хорошего лиганда для химического комплексообразования металлов полностью отличается от поиска хорошего лиганда для доставки металла при кормлении животных для обеспечения продуктивности животных. Существует много факторов, которые определяют, будет ли эффективным лиганд для доставки минерального вещества животному. Часто трудно оценить эффективность конкретного металлического лиганда, поскольку неорганическое минеральное вещество является эффективным в пищевом отношении источником минерального вещества. Многие факторы определяют, подходят ли органические источники металлов для обеспечения биодоступного источника микроэлементов. Хороший носитель микроэлементов должен представлять собой органическую молекулу, которая обеспечивает растворимость в физиологических условиях, стабильность в кислой среде желудка; она должна быть способна обеспечить абсорбцию в неизменном виде через стенку кишечника, и она должна высвобождать микроэлемент в организме животного для использования, а не выводить его из организма.
Повышенная активность или эффективность органического микроэлемента должна определяться тщательным подбором исследования с тем, чтобы убедиться, что вы определяете реакцию активности по сравнению с реакцией минерального вещества. Обычно требуется сравнение одинаковых концентраций металлов с неорганическим контролем. Абсорбция комплекса металл-лиганд в неизменном виде требуется, чтобы признать его органическим микроэлементом. Если диссоциация происходит до абсорбции, то не ожидается отличий в активности по сравнению с неорганическими минеральными веществами.
С учетом всего вышеуказанного эффективный органический микроэлемент должен быть растворимым и стабильным в физиологических условиях, и минеральное вещество должно абсорбироваться в неизменном виде. Известными лигандами, которые используются в области кормления животных, являются пропионовая кислота, аминокислоты, оксикислоты, протеинаты и тому подобное.
Соответственно, основная задача настоящего изобретения заключается в предоставлении предпочтительно малой молекулы лиганда для металлов меди, железа, цинка и марганца в форме, которая является высокоабсорбируемой, растворимой в физиологических условиях, стабильной в кислой среде желудка, абсорбируемой в неизменном виде и способной высвобождать минеральное вещество в организме животного, а не выводить его из организма.
Другая задача настоящего изобретения заключается в предоставлении вышеуказанных металлических лигандов в легко обрабатываемой форме, и которые легко получить и легко использовать для обогащения.
Способ и средства решения вышеуказанных, а также других задач будут понятны из последующего подробного описания изобретения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Применение этилендиаминовых комплексов металлов, предпочтительно меди, цинка, железа и марганца, в высокоабсорбируемой форме при кормлении животных.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 - график проницаемости клеток для Cu-ЭДА.
Фиг.2 - график сравнения полученных на птице результатов для Zn-ЭДА, и ZnO, и песка.
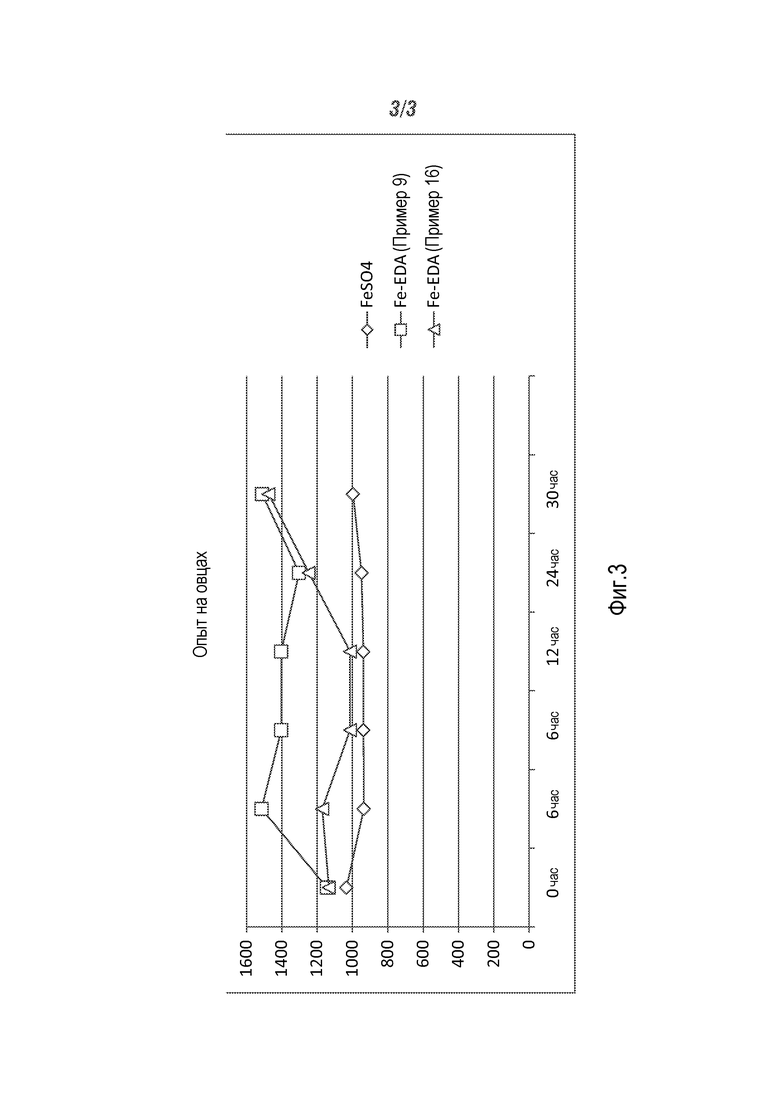
Фиг.3 - график сравнения полученных в примере 20 на овцах результатов.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Важно отметить, что органической частью лиганда по настоящему изобретению является только этилендиамин, не этилендиаминтетрауксусная кислота (ЭДТА) или другие крупные молекулы. Это важно, поскольку более мелкая молекула означает меньшую массу и повышает вероятность эффективной абсорбции на высоком уровне через стенку кишечника и ассимиляции в биосистему животного, а не просто прохождение через систему и выделение в виде экскрементов. Конечно, если имеет место последнее, то она просто расходуется без какой-либо питательной пользы для животного.
Насколько известно автору изобретения, ЭДА не использовали в качестве лиганда для доставки металлов, несмотря на то, что он хорошо известен как комплексообразователь металлов. Он имеет ряд преимуществ по сравнению с некоторыми из вышеперечисленных органических металлических лигандов предшествующего уровня техники. Он является малым по размеру, что допускает более высокие концентрации металлов по сравнению с некоторыми другими лигандами. Он образует стабильный комплекс, в то время как некоторые другие органические лиганды образуют слишком слабый комплекс, такие как оксикислоты и кислоты с прямой углеводородной цепью. Этилендиамин преодолевает эти проблемы. Трудно прогнозировать, какой органический микроэлемент будет эффективным. Легко понять, какой не будет действовать из-за проблем с растворимостью и стабильностью, но может или нет комплекс абсорбироваться, должно быть определено посредством экспериментов. За счет его малого размера, растворимости и способности абсорбироваться он соответствует всем требованиям к эффективному органическому комплексу микроэлемента. Общая структура этих комплексов выглядит следующим образом:
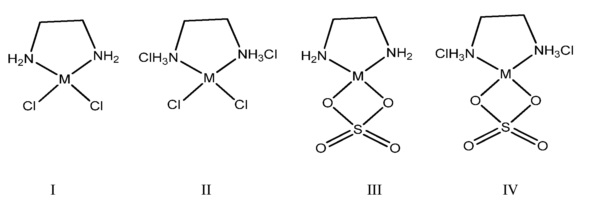
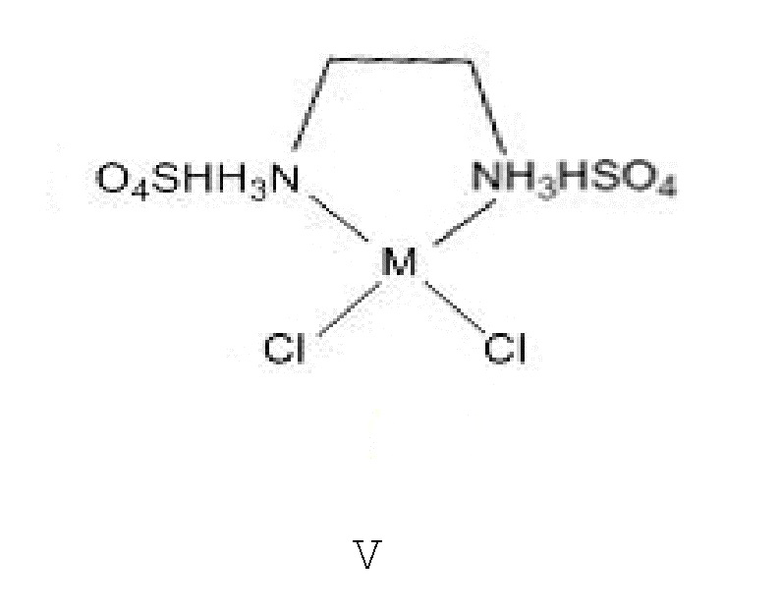
Противоион будет изменяться в зависимости от того, какое металлическое вещество используется для образования. Например, ZnCl2 будут содержать противоионы хлорида, а ZnSO4 будет содержать противоионы сульфата. Предпочтительными металлами являются Zn, Fe, Mn, Cu. В зависимости от условий синтеза комплекс можно получить со свободным амином, а также с протонированным амином. Эти структуры демонстрируют протонированный амин (II, IV и V), который также будет действовать. Противоион может быть любым анионом, используемым для уравновешивания зарядов, и обеспечивать нейтральный лиганд. Однако наиболее вероятными и предпочтенными являются хлорид или бисульфат-анион (на аминоподобной структуре V). В том смысле, в котором здесь используется термин «противоион», он относится и к противоиону для металла и к противоиону для азота, если он протонируется.
Продукты можно использовать в форме без носителя или с нетоксичным носителем. Подходящие носители включают кислый фосфат кальция, карбонат кальция, диоксид кремния, измельченные початки кукурузы, сыворотку, целлюлозу и другие древесные волокна и сахарную пудру или смесь любого из вышеперечисленного.
В следующих примерах получения и применения кормовых добавок представлены лиганды ЭДА для цинка, меди, железа и марганца, и их сравнивают с неорганическими источниками для демонстрации биодоступности малых молекул.
Эти примеры следует рассматривать как иллюстративные и неограничивающие. Несмотря на то, что заявитель использовал ЭДА только с четырьмя указанными здесь металлами, можно также получить и использовать комплексы с другими металлами, такими как хром и тому подобное.
ПРИМЕРЫ
ПРИМЕР 1
Хлорид цинка-ЭДА
1,2-диаминоэтан дигидрохлорид - хлорид цинка (II)
ЭДА (100 мл, 1,5 моль) растворяли в 1 л деионизированной воды и нагревали до температуры 50°С. К этому раствору добавляли конц. соляную кислоту (437,5 мл, 5,25 моль) и раствор перемешивали в течение 15 мин. Оксид цинка (50,3 г, 1,5 моль) добавляли в одну порцию и перемешивали в течение 45 мин или до тех пор, пока суспензия не стала раствором. По окончании реакционную смесь высушивали в вакуумном сушильном шкафу с получением белого твердого вещества (314 г).
МСМ: 27% Zn
1H ЯМР (D2O, 300 МГц) δ 3,23 (шир. с, 4H)
ИК (KBr): 1598, 1574, 1493, 1444 см-1
Анал. найдено: C 9,79; Н 3,73; N 11,13; Cl 51,24.
ПРИМЕР 2
Хлорид цинка-ЭДА
1,2-диаминоэтан дигидрохлорид - хлорид цинка (II)
Дигидрохлорид ЭДА (22 г, 0,16 моль) растворяли в 200 мл деионизированной воды и нагревали до температуры 40°C. К этому раствору добавляли хлорид цинка (23,6 мл, 0,16 моль), который растворяли в отдельном сосуде. Данный раствор нагревали в течение 2 ч при температуре 40°C при непрерывном перемешивании. По окончании реакционную смесь высушивали в вакуумном сушильном шкафу с получением белого твердого вещества (34 г).
МСМ: 26% Zn
1H ЯМР (D2O, 300 МГц) δ 3,40 (шир. с, 4H)
ИК (KBr): 1581, 1486, 1465 см-1
Анал. найдено: C 8,97; Н 3,55; N 10,21; Cl 52,36.
ПРИМЕР 3
Сульфат цинка-ЭДА
1,2-диаминоэтан гидросульфид - сульфат цинка (II)
ЭДА (33 мл, 0,5 моль) растворяли в 250 мл деионизированной воды и нагревали до температуры 50°С. Гептагидрат ZnSO4 суспендировали в 50 мл деионизированной воды в отдельном сосуде и перемешивали в течение 5 мин с использованием магнитной мешалки. Суспензию добавляли в одну порцию в реакционный сосуд. Суспензию осветляли добавлением конц. H2SO4 (36н, 28 мл). Затем раствор нагревали в течение 1,5 ч при температуре 50°С и затем упаривали в вакуумном сушильном шкафу с получением белого твердого вещества (127 г).
МСМ: 20,9% Zn
1H ЯМР (D2O, 300 МГц) δ 3,39 (с, 4H)
ИК (KBr): 1595, 1573, 1490, 1473 см-1
Анал. найдено: C 7,55; H 3,07; N 8,64; S 19,37.
ПРИМЕР 4
Хлорид меди-ЭДА
1,2-диаминоэтан дигидрохлорид - хлорид меди (II)
ЭДА (33 мл, 0,5 моль) растворяли в 250 мл деионизированной воды и нагревали до температуры 50°C. Дигидрат хлорида меди (85,24 г, 0,5 моль) суспендировали в 50 мл деионизированной воды в отдельном сосуде и перемешивали в течение 5 мин с использованием магнитной мешалки. Суспензию добавляли в одну порцию в реакционный сосуд. Суспензию осветляли добавлением конц. HCl (12М, 83 мл). Затем раствор нагревали в течение 1,5 ч при температуре 50°С и затем упаривали в вакуумном сушильном шкафу с получением сине-зеленого твердого вещества (100 г).
МСМ: 21,4% Cu
1H ЯМР (D2O, 300 МГц) δ 3,24 (шир. с, 4H)
ИК (KBr): 1573, 1493 см-1
Анал. найдено: C 10,42; H 3,89; N 11,76; Cl 53,40.
ПРИМЕР 5
Хлорид меди-ЭДА
1,2-диаминоэтан дигидрохлорид - хлорид меди (II)
Дигидрохлорид ЭДА (100 г, 0,7 моль) растворяли в 600 мл деионизированной воды и нагревали до температуры 40°C. К этому раствору добавляли хлорид меди (100,76 г, 0,76 моль), который был растворен в отдельном сосуде. Этот раствор нагревали в течение 2 ч при температуре 60°C при непрерывном перемешивании. По окончании реакционную смесь высушивали в вакуумном сушильном шкафу с получением белого твердого вещества (178 г).
МСМ: 23,54% Cu
1H ЯМР (D2O, 300 МГц) δ 3,17 (с, 4H)
ИК (KBr): 1576, 1502 см-1
Анал. найдено: C 9,12; H 3,77; N 10,36; Cl 52,73.
ПРИМЕР 6
Хлорид меди-ЭДА - CuO
1,2-диаминоэтан дигидрохлорид - хлорид меди (II)
ЭДА (33 мл, 0,5 моль) растворяли в 250 мл деионизированной воды и нагревали до температуры 50°C. Оксид меди (39,8 г, 0,5 моль) добавляли в одну порцию в реакционный сосуд. Суспензию осветляли добавлением конц. HCl (12М, 166 мл). Затем раствор нагревали в течение 2,5 ч при температуре 50°С и затем упаривали в вакуумном сушильном шкафу с получением светло-желтого твердого вещества (143 г).
МСМ: 23,68% Cu
ИК (KBr): 1571, 1495 см-1
Анал. найдено: C 8,16; H 3,53; N 9,18; Cl 51,73.
ПРИМЕР 7
Сульфат меди-ЭДА
1,2-диаминоэтан дигидросульфат - сульфат меди (II)
ЭДА (33 мл, 0,5 моль) растворяли в 250 мл деионизированной воды и нагревали до температуры 50°C. Пентагидрат сульфата меди (124,9 г, 0,5 моль) суспендировали в 50 мл деионизированной воды в отдельном сосуде и перемешивали в течение 5 мин с использованием магнитной мешалки. Суспензию добавляли в одну порцию в реакционный сосуд. Суспензию осветляли добавлением конц. H2SO4 (36н, 28 мл). Затем раствор нагревали в течение 1,5 ч при температуре 50°С и затем упаривали в вакуумном сушильном шкафу с получением голубого твердого вещества (180 г).
МСМ: 17,9% Cu
1H ЯМР (D2O, 300 МГц) δ 3,22 (шир. с, 4H)
ИК (KBr): 1616, 1545, 1507, 1486 см-1
Анал. найдено: C 6,09; H 4,22; N 6,81; S 15,89.
ПРИМЕР 8
Сульфат железа-ЭДА
1,2-диаминоэтан дигидросульфат - сульфат железа (II)
ЭДА (33 мл, 0,5 моль) растворяли в 250 мл деионизированной воды и нагревали до температуры 50°C. Гептагидрат FeSO4 (139,01 г, 0,5 моль) суспендировали в 50 мл деионизированной воды в отдельном сосуде и перемешивали в течение 5 мин с использованием магнитной мешалки. Суспензию добавляли в одну порцию в реакционный сосуд. Суспензию осветляли добавлением конц. H2SO4 (36н, 28 мл). Затем раствор нагревали в течение 1,5 ч при температуре 50°С и затем упаривали в вакуумном сушильном шкафу с получением светло-зеленого твердого вещества (153,74 г).
МСМ: 16,1% Fe
ИК (KBr): 1611, 1530, 1509 см-1
Анал. найдено: C 6,45; H 3,50; N 7,24; S 20,09.
ПРИМЕР 9
Хлорид железа-ЭДА
1,2-диаминоэтан дигидрохлорид - хлорид железа (II)
ЭДА (33 мл, 0,5 моль) растворяли в 250 мл деионизированной воды и нагревали до температуры 50°C. Тетрагидрат хлорида железа (99,4 г, 0,5 моль) суспендировали в 50 мл деионизированной воды в отдельном сосуде и перемешивали в течение 5 мин с использованием магнитной мешалки. Суспензию добавляли в одну порцию в реакционный сосуд. Суспензию осветляли добавлением конц. HCl (12М, 83 мл). Затем раствор нагревали в течение 1,5 ч при температуре 50°С и затем упаривали в вакуумном сушильном шкафу с получением светло-зеленого твердого вещества (111 г).
МСМ: 22,7% Fe
ИК (KBr): 1617, 1509 см-1
Анал. найдено: C 8,72; H 3,62; N 9,88; Cl 50,44.
ПРИМЕР 10
Хлорид марганца-ЭДА
1,2-диаминоэтан дигидрохлорид - хлорид марганца (II)
ЭДА (33 мл, 0,5 моль) растворяли в 250 мл деионизированной воды и нагревали до температуры 50°C. Тетрагидрат хлорида марганца (99 г, 0,5 моль) суспендировали в 50 мл деионизированной воды в отдельном сосуде и перемешивали в течение 5 мин с использованием магнитной мешалки. Суспензию добавляли в одну порцию в реакционный сосуд. Суспензию осветляли добавлением конц. HCl (12М, 83 мл). Затем раствор нагревали в течение 1,5 ч при температуре 50°С и затем упаривали в вакуумном сушильном шкафу с получением светло-розового твердого вещества (119 г).
МСМ: 21,7% Mn
ИК (KBr): 1620, 1616, 1511, 1505 см-1
Анал. найдено: C 9,12; H 3,85; N 10,42; Cl 53,65.
ПРИМЕР 11
Хлорид марганца-ЭДА - MnO
1,2-диаминоэтан дигидрохлорид - хлорид марганца (II)
ЭДА (33 мл, 0,5 моль) растворяли в 250 мл деионизированной воды и нагревали до температуры 50°C. Оксид марганца (43,5 г, 0,5 моль) добавляли в одну порцию в реакционный сосуд. Суспензию осветляли добавлением конц. HCl (12М, 166 мл). Затем раствор нагревали в течение 2,5 ч при температуре 50°С и затем упаривали в вакуумном сушильном шкафу с получением светло-розового твердого вещества (131 г).
МСМ: 25,08% Mn
ИК (KBr): 1617, 1590, 1509 см-1
Анал. найдено: C 8,57; H 3,61; N 9,57; Cl 48,51.
ПРИМЕР 12
Сульфат марганца-ЭДА
1,2-диаминоэтан дигидросульфат - сульфат марганца (II)
ЭДА (33 мл, 0,5 моль) растворяли в 250 мл деионизированной воды и нагревали до температуры 50°C. Моногидрат MnSO4 (84,5 г, 0,5 моль) суспендировали в 50 мл деионизированной воды в отдельном сосуде и перемешивали в течение 5 мин с использованием магнитной мешалки. Суспензию добавляли в одну порцию в реакционный сосуд. Суспензию осветляли добавлением конц. H2SO4 (36н, 28 мл). Затем раствор нагревали в течение 1,5 ч при температуре 50°С и затем упаривали в вакуумном сушильном шкафу с получением светло-розового твердого вещества (146 г).
МСМ: 16,5% Mn
ИК (KBr): 1675, 1638, 1609, 1532 см-1
Анал. найдено: C 7,09; H 3,30; N 8,10; S 19,78.
ПРИМЕР 13
Хлорид цинка-ЭДА - (МеОН)
1,2-диаминоэтан - хлорид цинка (II)
Хлорид цинка (II) (102 г, 0,75 моль) растворяли в 800 мл метанола при температуре 60°C с образованием прозрачного раствора. Этилендиамин (50 мл, 0,75 моль) медленно добавляли вследствие сильно экзотермического характера реакции. Светло-белое твердое вещество сразу же осаждали из раствора и эту суспензию перемешивали в течение еще одного часа. Белое твердое вещество (115 г) фильтровали и высушивали в вакуумном сушильном шкафу.
1H ЯМР (D2O, 300 МГц) δ 3,01 (д, 4H)
ИК (KBr): 1573 см-1
МСМ: 32,7% Zn
Анал. найдено: C 12,34; H 4,19; N 14,2; Cl 35,83.
ПРИМЕР 14
Хлорид меди-ЭДА - (МеОН)
1,2-диаминоэтан - хлорид меди (II)
Дигидрат хлорида меди (II) (56 г, 0,33 моль) растворяли в 500 мл метанола при температуре 60°C с образованием изумрудно-зеленого раствора. Этилендиамин (22 мл, 0,33 моль) медленно добавляли вследствие экзотермического характера реакции. Светло-голубое твердое вещество сразу же осаждали из раствора и эту суспензию перемешивали в течение еще одного часа. Светло-голубое твердое вещество (61 г) фильтровали и высушивали в вакуумном сушильном шкафу.
1H ЯМР (D2O, 300 МГц) δ 3,16 (с, 4H)
ИК (KBr): 1570 см-1
МСМ: 33,4% Cu
Анал. найдено: C 12,44; H 4,13; N 14,14; Cl 36,16.
ПРИМЕР 15
Хлорид марганца-ЭДА - (МеОН)
1,2-диаминоэтан - хлорид марганца (II)
Хлорид марганца (II) (55 г, 0,44 моль) растворяли в 500 мл метанола при температуре 60°C с образованием светло-коричневого раствора. Этилендиамин (29,4 мл, 0,44 моль) медленно добавляли вследствие экзотермического характера реакции. Светло-бежевое твердое вещество сразу же осаждали из раствора и эту суспензию перемешивали в течение еще одного часа. Светло-бежевое твердое вещество (67 г) фильтровали и высушивали в вакуумном сушильном шкафу до проведения анализа.
ИК (KBr): 1591, 1510 см-1
МСМ: 22% Mn
Анал. найдено: C 15,08; H 4,84; N 13,28; Cl 30,77.
ПРИМЕР 16
Хлорид железа-ЭДА - (МеОН)
1,2-диаминоэтан - хлорид железа (II) (20788-115) - (МеОН)
Тетрагидрат хлорида железа (II) (50 г, 0,25 моль) растворяли в 500 мл метанола при температуре 60°C с образованием темно-зеленого раствора. Этилендиамин (16,8 мл, 0,25 моль) медленно добавляли вследствие экзотермического характера реакции. Темно-зеленое твердое вещество сразу же осаждали из раствора и эту суспензию перемешивали в течение еще одного часа. Темно-зеленое твердое вещество превращалось в темно-красное твердое вещество (38 г) после фильтрования и высушивания в вакуумном сушильном шкафу.
1H ЯМР (D2O, 300 МГц) δ 3,17 (шир. с, 4H)
ИК (KBr): 1510 см-1
МСМ: 26,5% Fe
Анал. найдено: C 12,16; H 5,03; N 10,89; Cl 32,31.
ПРИМЕР 17
Сульфат хлорид цинка-ЭДА
1,2-диаминоэтан дигидрохлорид - хлорид цинка (II)
Гидрохлорид ЭДА (22 г, 0,16 моль) растворяли в 100 мл деионизированной воды и нагревали до температуры 50°С. К этому раствору добавляли гептагидрат сульфата цинка (50,3 г, 0,17 моль). Раствор перемешивали при температуре 50°С в течение еще 2 ч. По окончании реакционную смесь высушивали в вакуумном сушильном шкафу с получением белого твердого вещества (58 г).
МСМ: 22,5% Zn
ИК (KBr): 1595, 1574, 1491, 1474 см-1
ПРИМЕР 18
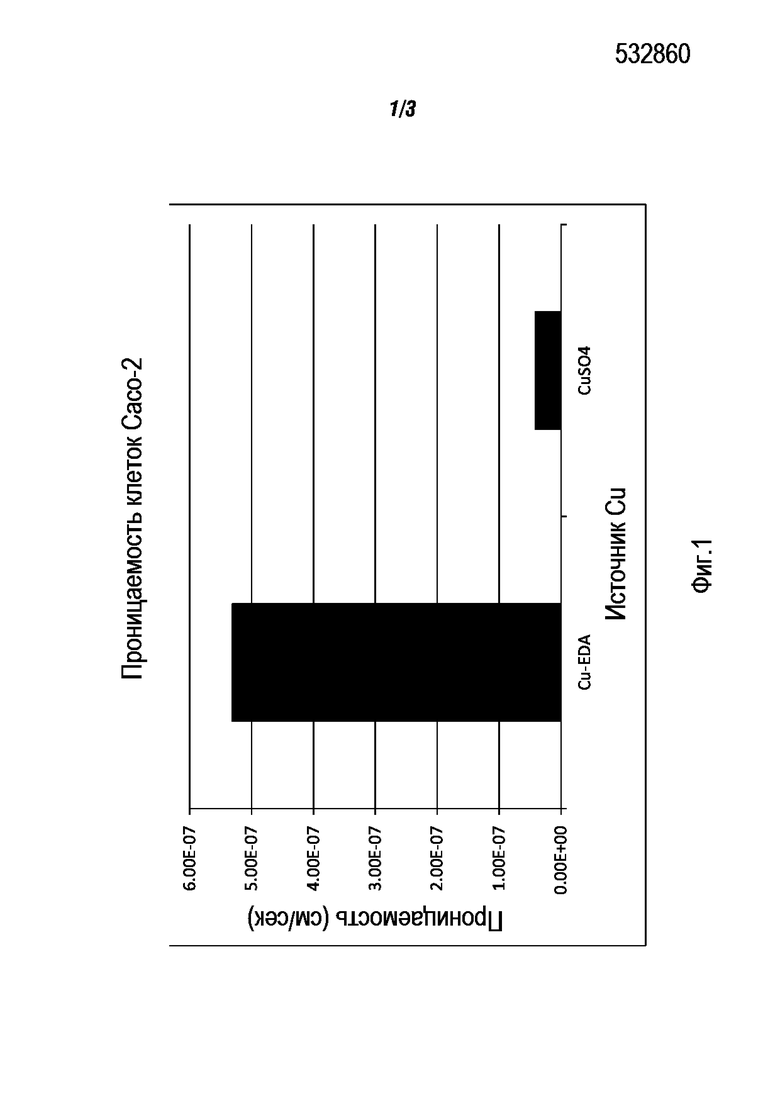
Cu2+ переносили в буферный солевой раствор Хенкса (HBSS) с рН от 5,5 до 7,4 при температуре 37ºС. Концентрация Cu2+ составляла 100 мкг/мл. Каждая экспериментальная точка представляет собой среднее значение трех определений. Использовали модель культуры клеток Сасо-2 (гетерогенной эпителиальной колоректальной аденокарциномы человека), которая одобрена FDA для определения характера абсорбции лекарственного средства. Испытуемый раствор с соответствующими концентрациями продукта загружали на апикальную (донорную) сторону. Донорные образцы (2500 мкл) и акцепторный образец отбирали через 0, 3 и 6 ч с последующим добавлением 2500 мкл свежего донорного раствора на донорной стороне или 2500 мкл свежего буфера на акцепторной стороне. Содержание металлов измеряли методом ICP-OES.
На Фиг.1 представлены в графическом виде результаты и показано явное превосходство Cu-ЭДА над CuSO4.
ПРИМЕР 19
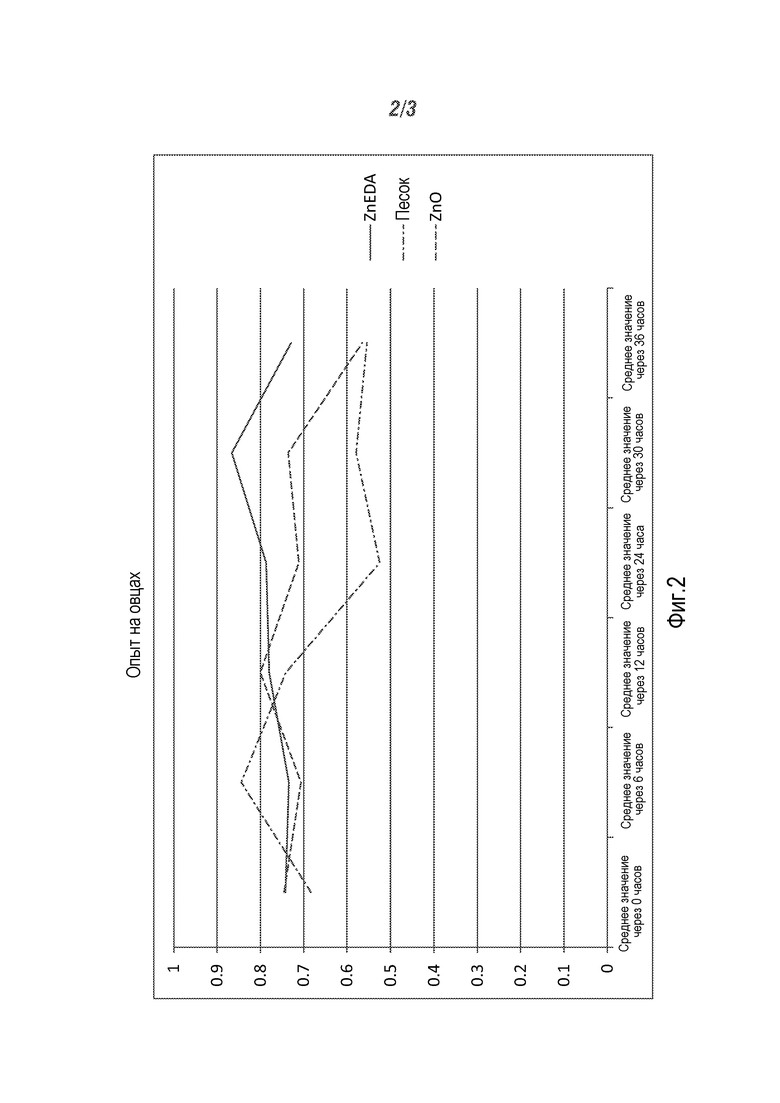
Овцы
Овцам вводили болюс с 250 мг цинка в виде ZnSO4 на момент времени 0. Затем через 6 часов они получали другой болюс или без цинка (песок), с оксидом цинка или Zn-ЭДА. Концентрации сывороточного цинка были самыми высокими и сохранялись на более высоком уровне в течение более длительного периода времени с Zn-ЭДА, чем другими видами обработки. Результаты представлены на Фиг.2.
Пример 20
Опыт на птице
Животными являлись бройлеры петухи породы Кобб. Эксперимент начали с животными в возрасте 1 день. ZnSO4 использовали в качестве сравнительного примера с применением 80 м.д. цинка из ZnSO4. Zn-ЭДА заменял 40 м.д. цинка, таким образом, что имелось 40 м.д. Zn из ZnSO4 и 40 м.д. цинка из Zn-ЭДА и было сравнимо с 80 м.д. Zn из ZnSO4. Использовали современные кормовые интеграторы для бройлеров. Они содержат 500 FTU фитазы и фермент НКП (фермент, расщепляющий некрахмальные полисахариды). Режим кормления предназначен для обеспечения 75-го процентиля AgriStat. Эксперимент имел полностью рандомизированный дизайн. Имелось 12 повторностей на обработку и 21 птица в повторности.
В следующей таблице 1 приведены данные, представляющие результаты опыта на бройлерах петухах породы Кобб. Она демонстрирует статистически значительным образом улучшение конверсии корма и снижение смертности при применении на практике изобретения.
b Замененные 40 м.д. Zn из источника сульфата
c Содержание Zn для Zn-ЭДА составляло 24,1
В следующих примерах овцам осуществляли болюсное введение, как описано в примере 19, и затем определяли абсорбцию в кровь через различные интервалы времени. По некоторым причинам концентрация через 30 часов представляется наилучшей наблюдаемой точкой для установления различий, основываясь на результатах прошлых экспериментов с ЭДА.
Пример 21
Fe-ЭДА (пример 9) и Fe-ЭДА (пример 16) испытывали на абсорбцию железа в кровь по сравнению с болюсным введением FeSO4. Как видно на Фиг.3, образцы Fe-ЭДА были лучше в каждом интервале времени, чем неорганический сульфат железа, особенно через 30 часов.
Пример 22
Испытания, как описано в примерах 19 и 21, проводились с MnSO4 по сравнению с Mn-ЭДА из примера 10. Во всех точках абсорбция марганца в кровь овец составляла более низкую концентрацию по сравнению с другими испытуемыми лигандами. Это может быть особенностью самого Mn. Однако данные через 30 часов показали статистически достоверное различие по сравнению с неорганическим MgSO4.
30 часов
Исходя из вышеизложенного, можно отметить, что изобретение действительно решает все поставленные задачи.
Группа изобретений относится к области кормопроизводства. Композиция для пищевого обогащения микроэлементами рациона животных содержит: нетоксичный носитель и комплекс этилендиаминовый лиганд (ЭДА)-металл формулы: M(ЭДА)X, где М представляет собой металл, выбранный из группы, состоящей из цинка, железа, меди и марганца, ЭДА представляет собой этилендиамин, лигированный с металлом, а Х представляет собой противоионы, выбранные для обеспечения нейтрального металла и/или лиганда. Способ пищевого обогащения рациона животных микроэлементами включает скармливание животному эффективного количества комплекса этилендиаминовый лиганд (ЭДА)-металл указанной выше формулы: M(ЭДА)X. При этом животное может представлять собой домашний скот или птицу. Нетоксичный носитель может быть выбран из группы, состоящей из сахаров, ферментационного остатка, кормового зерна, муки из кукурузных початков, целлюлозы и других древесных волокон и сыворотки. Эффективное количество указанного комплекса металл-лиганд является достаточным для удовлетворения дневной потребности животного в выбранном металле. Группа изобретений обеспечивает обогащение кормов для животных микроэлементами в высокобиодоступной форме, что обеспечивается за счёт повышенной растворимости предложенного комплекса, более высокой стабильности в желудочно-кишечном тракте, повышенной абсорбции в кровоток и/или улучшенной метаболической усвояемости. 2 н. и 10 з.п. ф-лы, 3 ил., 1 табл., 22 пр.
1. Способ пищевого обогащения рациона животных микроэлементами, включающий
скармливание животному эффективного количества комплекса этилендиаминовый лиганд (ЭДА)-металл формулы:
M(ЭДА)X,
где М представляет собой металл, выбранный из группы, состоящей из цинка, железа, меди и марганца, ЭДА представляет собой этилендиамин, лигированный с металлом, а Х представляет собой противоионы, выбранные для обеспечения нейтрального металла и/или лиганда.
2. Способ по п. 1, в котором животное представляет собой домашний скот или птицу.
3. Способ по п. 1, в котором перед скармливанием комплекс нейтральный этилендиаминовый лиганд-металл смешивают с нетоксичным носителем.
4. Способ по п. 3, в котором носитель выбран из группы, состоящей из сахаров, ферментационного остатка, кормового зерна, муки из кукурузных початков, целлюлозы и других древесных волокон и сыворотки.
5. Способ по п. 4, в котором эффективное количество указанного комплекса металл-лиганд является достаточным для удовлетворения дневной потребности животного в выбранном металле.
6. Композиция для пищевого обогащения микроэлементами рациона животных, содержащая:
нетоксичный носитель; и
комплекс этилендиаминовый лиганд (ЭДА)-металл формулы:
M(ЭДА)X,
где М представляет собой металл, выбранный из группы, состоящей из цинка, железа, меди и марганца, ЭДА представляет собой этилендиамин, лигированный с металлом, а Х представляет собой противоионы, выбранные для обеспечения нейтрального металла и/или лиганда.
7. Композиция по п. 6, в которой носитель выбран из группы, состоящей из сахаров, ферментационного остатка, кормового зерна, муки из кукурузных початков, целлюлозы и других древесных волокон и сыворотки.
8. Композиция по п. 6, в которой металл представляет собой цинк.
9. Композиция по п. 6, в которой металл представляет собой железо.
10. Композиция по п. 6, в которой металл представляет собой медь.
11. Композиция по п. 6, в которой металл представляет собой марганец.
12. Композиция по п. 6, в которой Х представляет собой противоион, выбранный из группы, состоящей из хлорида, сульфата и бисульфата.
| US 20120231112 A1, 13.09.2012 | |||
| US 2960406 A1, 15.11.1960 | |||
| US 3876810 A, 08.04.1975 | |||
| БАРАШКОВ Г.К | |||
| Медицинская бионеорганика | |||
| Основы, аналитика, клиника | |||
| - М.: Изд-во БИНОМ, 2011, с | |||
| Способ получения морфия из опия | 1922 |
|
SU127A1 |
Авторы
Даты
2017-12-25—Публикация
2014-06-17—Подача