ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[00001] Настоящая заявка представляет собой не являющуюся предварительной заявку, заявляющую приоритет по предварительной заявке на патент США сер. №61/589681, поданной 23 января 2012, содержание которой полностью включено в настоящую заявку путем ссылки.
ОБЛАСТЬ ТЕХНИКИ
[00002] Существует постоянная потребность в способах улучшенной длительной доставки лекарственных средств людям и животным.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00003] Инъецируемый жидкий депообразующий материал может быть использован для внедрения твердого устройства для длительной доставки лекарственного средства человеку или животному без необходимости разреза тела. Это может быть применимо к чувствительным зонам, таким как глаз, где разрез может быть рискованным. Поскольку материал может быть в жидкой форме, размер устройства может быть не ограничен диаметром иглы. Например, твердый имплантат может быть введен, только если он имеет площадь поперечного сечения, позволяющую ему проходить через иглу. Таким образом, для инъецируемых жидких депообразующих материалов может быть использована игла меньшего размера. Также может быть обеспечено более гибкое дозирование, чем в случае с твердым имплантатом, поскольку количество введенного депообразующего материала может легко меняться.
[00004] Некоторые варианты реализации включают в себя композитный материал доставки лекарственного средства, содержащий: множество микрочастиц, диспергированных в композиции среды. Микрочастицы могут содержать: лекарственное средство; и покрытие, содержащее биологически разрушаемый материал или биологически разлагаемый материал. Состав среды может содержать лекарственное средство, диспергированное в депообразующем материале. Состав среды перед введением может быть в жидкой форме, и может быть сконфигурирован с возможностью значительного увеличения вязкости в течение или после инъецирования в организм млекопитающего для того, чтобы форма среды после инъецирования была твердой или гелеобразной.
[00005] Также описаны способы лечения глазных заболеваний или повреждений, предусматривающие инъецирование описанного в настоящей заявке композитного материала доставки лекарственного средства в глаз млекопитающего в случае необходимости.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00006] Как правило, описанные в настоящей заявке композитные материалы доставки лекарственного средства содержат множество микрочастиц, диспергированных в композиции среды. В данном композитном материале доставки лекарственного средства лекарственное средство может присутствовать как в микрочастицах, так и в композиции среды, или может присутствовать только в микрочастицах. Состав среды может содержать депообразующий материал и лекарственное средство, диспергированное в депообразующем материале. Микрочастица может содержать лекарственное средство, и необязательно может содержать другие материалы, такие как биологически разлагаемый полимер или биологически разрушаемый полимер, и может содержать биологически разрушаемое или биологически разлагаемое покрытие. Таким образом, композитный материал доставки лекарственного средства может быть in vivo, in-situ системой доставки лекарственного средства. Микрочастицы могут состоять из отдельного лекарственного средства или покрытых частиц лекарственного средства или покрытых полимерных частиц лекарственного средства или микросфер, где покрытие содержит биологически разрушаемый или биологически разлагаемый материал.
[00007] Перед введением среда может быть жидкой, например жидкостью низкой вязкости. Низкая вязкость может позволять инъецирование среды. Если среду водили в организм млекопитающего, среда может значительно увеличивать вязкость для того, чтобы форма среды в организме была твердой или гелеобразной. Значительное увеличение вязкости предусматривает любое увеличение вязкости, что будет значительно увеличивать сложность инъецирования жидкости через иглу, например, увеличение по меньшей мере приблизительно на 1000 сП, по меньшей мере приблизительно на 10000 сП, по меньшей мере приблизительно на 100000 сП, по меньшей мере приблизительно на 500000 сП или по меньшей мере приблизительно на 1000000 сП. Твердое вещество содержит материал определенной формы. Гель содержит материал определенной формы при нормальных условиях, но который может течь после применения внешней силы, которая больше гравитационной силы.
[00008] Состав среды содержит любую композицию, содержащую депообразующий материал. Депообразующий материал содержит материал, который может быть в жидкой форме перед введением, и может быть со значительно увеличенной вязкостью, чтобы образовать твердое вещество или гель в течение или после инъецирования в организм млекопитающего. Примеры депообразующих материалов включают в себя без ограничения REGEL®, комплекс изобутирата ацетата сахарозы, сополимер лактида с гликолидом (PLGA) в органическом растворе, полилактид (PLA) в органическом растворе, и т.д.
[00009] Некоторые депообразующие материалы могут содержать PLGA или PLA, растворенные в органическом растворителе, например, в растворимом в воде органическом растворителе. При инъецировании состава среды растворитель диспергирует, покидая депо PLGA или PLA, погруженных в водную среду физиологической жидкости. Поскольку PLGA или PL А не растворимы в водной среде, они могут быстро осаждаться с образованием твердого вещества при соприкосновении с физиологической жидкостью. Примеры подходящих органических растворителей для композиции среды PLGA или PLA могут включать в себя без ограничения N-метил-2-пирролидон, пропиленгликоль, диметилсульфоксид, тетрагидрофуран, триацетин, этилбензоат, бензилбензоат, и т.д. Согласно некоторым вариантам реализации органический растворитель может содержать N-метил-2-пирролидон, бензилбензоат или их комбинацию. Депообразующий материал РЕОА/М-метил-2-пирролидон доступен от Atrix Lab под торговым названием ELIGARD®. Депообразующий материал PLGA/бензилбензоат доступен от Alza под торговым названием ALZAMER®.
[00010] Некоторые депообразующие материалы могут содержать изобутират ацетата сахарозы, растворенный в смешивающемся с водой органическом растворителе, таком как этанол, бензиловый спирт, и т.д. Раствор имеет низкую вязкость, что может улучшать легкость введения при помощи иглы небольшого размера. При инъецировании вязкость изобутирата ацетата сахарозы может возрастать с образованием геля или твердого вещества. Депообразующий материал изобутирата ацетата сахарозы доступен от Durect под торговым названием SABER®.
[00011] Некоторые депообразующие материалы могут содержать теплочувствительный биологически разлагаемый триблочный сополимер, содержащий гидрофобные блоки PLGA (А) и гидрофильные блоки полиэтиленгликоля (PEG) (В) с конфигурацией блока ABA или BAB. REGEL®, разработанный MacroMed, представляет собой триблочный сополимер ABA, который является растворимым в воде. Водный раствор REGEL представляет собой свободнотекучую жидкость при 15°C, и он превращается в гель при температуре тела при инъецировании. Скорость высвобождения лекарственного средства может быть отрегулирована переменой гидрофильного/гидрофобного содержимого, концентрации полимера, молекулярной массы и/или полидисперсности триблочного сополимера.
[00012] Некоторые депообразующие материалы могут содержать Poloxamer 407, триблочный сополимер, содержащий центральный гидрофобный блок полипропиленгликоля, который прикрыт двумя блоками PEG. Это представляет собой растворимое в воде неионное поверхностно-активное вещество, которое образует водный раствор со свойствами обратимого термического гелеобразования. Раствор с содержанием более чем 20% полимера проявляет низкую вязкость при низких температурах, но быстро образует жесткую полутвердую гелевую сеть при температуре тела.
[00013] Некоторые депообразующие материалы могут содержать GELSITE® (доступный от DelSite Biotech. Inc.). GELSITE® представляет собой кислотный полисахарид природного происхождения, выделенный и очищенный из растения алоэ. Полимер в водном растворе при инъецировании образует гель в присутствии кальция, тем самым захватывая лекарственное средство и обеспечивая длительное высвобождение.
[00014] Множество микрочастиц диспергировано в составы среды. Термин «диспергировано» включает в себя смешивание микрочастиц в составе среды для того, чтобы основная фракция микрочастиц, например, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90% или по меньшей мере приблизительно 99%, находилась в контакте с или была окружена составом среды. Отдельные микрочастицы или кластеры микрочастиц могут быть диспергированы в составе среды. Микрочастицы могут быть диспергированы приблизительно гомогенным образом или могут быть диспергированы гетерогенно.
[00015] Микрочастица включает в себя лекарственное средство, включая любое соединение или вещество, одобренное в официальной фармакопее США, официальной гомеопатической фармакопее США или официальном национальном формуляре, или любое дополнения к любому из этого; и любое соединение или вещество, предназначенное для применения при диагностике, обработке, смягчении, лечении или предупреждении заболевания у людей и других животных; и любое вещество, отличное от пищи или воды, предназначенное для воздействия на структуру или любую функцию организма человека или других животных.
[00016] Некоторые примеры лекарственных средств могут включать в себя без ограничения: ингибиторы АПФ, эндогенные цитокины, агенты, влияющие на базальную мембрану, агенты, влияющие на рост эндотелиальных клеток, адренергические агонисты или блокаторы, холинэргические агонисты или блокаторы, ингибиторы альдозоредуктазы, анальгетики, анестетики, противоаллергические агенты, противовоспалительные агенты, антигипертензивные агенты, прессоры, антибактериальные агенты, противовирусные агенты, противогрибковые агенты, противопротозойные агенты, противоинфекционные агенты, противораковые агенты, антиметаболиты, антиангиогенные агенты, ингибиторы тирозинкиназы, антибиотики, такие как аминогликозиды, например, гентамицин, канамицин, неомицин и ванкомицин; амфениколы, например, хлорамфеникол; цефалоспорины, например, цефазолин HCl; пенициллины, например, ампициллин, пенициллин, карбенициллин, оксициллин, метициллин; линкозамиды, например, линкомицин; полипептидные антибиотики, такие как полимиксин и бацитрацин; тетрациклины, такие как тетрациклин; хинолоны, такие как цикпрофлаксин, и т.д.; сульфонамиды, такие как хлорамин Т; и сульфоны, такие как сульфаниловая кислота в качестве гидрофильного компонента, противовирусные лекарственные средства, например, ацикловир, ганцикловир, видарабин, азидотимидин, дидеоксиинозин, дидеоксицитозин, дексаметазон, ципрофлаксин, растворимые в воде антибиотики, такие как ацикловир, ганцикловир, видарабин, азидотимидин, дидеоксиинозин, дидеоксицитозин; эпинефрин; изофлурфат; адриамицин; блеомицин; митомицин; ara-С; актиномицин D; скополамин; и т.п., анальгетики, такие как кодеин, морфин, кеторолак, напроксен, и т.д., анестетики, например, лидокаин; адренергические агенты, такие как α-адреноблокаторы, β-адреноблокаторы, α-адренергические агонисты, такие как агонисты альфа-2 адренорецептора, β-адренергические агонисты, например, эфедрин, эпинефрин, тимолол, бримонидин, и т.д.; ингибитор альдозоредуктазы, например, эпалрестат, поналрестат, сорбинил, толрестат; противоаллергические агенты, например, кромолин, беклометазон, дексаметазон и флунизолид; колхицин, антигельминтные агенты, например, ивермектин и сурамин натрий; противоамебные агенты, например, хлорохин и хлортетрациклин; и противогрибковые агенты, например, амфотерицин, и т.д., антиангиогенные соединения, такие как анекортава ацетат, ретиноиды, такие как тазаротен, средства против глаукомы, такие как бримонидин (ALPHAGAN® и ALPHAGAN Р®), ацетозоламид, биматопрост (LUMIGAN®), тимолол, мебефунолол; мемантин; 2МЕ2; противоопухолевые агенты, такие как винбластин, винкристин, интерфероны; α, β и γ, антиметаболиты, такие как аналоги фолиевой кислоты, пуриновые аналоги и пиримидиновые аналоги; иммуносупрессанты, такие как азатиприн, циклоспорин и мизорибин; миотические агенты, такие как карбахол, мидриатические агенты, такие как атропин, и т.д., ранибизумаб, бевацизумаб, ингибиторы протеаз, такие как апротинин, камостат, габексат, вазодилататоры, такие как брадикинин, и т.д., и различные факторы роста, такие как эпидермальный фактор роста, основной фактор роста фибробластов, факторы роста нервов, и т.п. Согласно некоторым вариантам реализации лекарственное средство представляет собой тимолол, бримонидин, биматопрост, кеторолак, дексаметазон, мемантин, преднизолона ацетат, триамцинолона ацетонид, ранибизумаб или бевацизумаб. Ссылка на лекарственное средство включает в себя фармацевтически приемлемую соль или пролекарство лекарственного средства.
[00017] Согласно некоторым вариантам реализации в составе могут быть использованы два или более различных лекарственных средств. Лекарственные средства могут быть смешаны вместе в любой из микросфер, или могут быть смешаны вместе в составе среды, или могут быть разделены. Например, один набор микросфер может содержать одно лекарственное средство, а другой набор микросфер может содержать второе лекарственное средство. Согласно некоторым вариантам реализации состав, содержащий первый набор микросфер, содержащих ранибизумаб или бевацизумаб, и второй набор микросфер, содержащих другое лекарственное средство, может быть использован для лечения дегенерации желтого пятна или диабетической ретинопатии.
[00018] После увеличения вязкости материала среды с образованием твердого вещества или геля, микрочастицы и лекарственное средство, не часть микрочастицы («лекарственный препарат в матрице»), могут быть инкапсулированы в твердое вещество или гель, так, чтобы контакт между физиологической жидкостью и материалом среды мог быть ограниченным. С течением времени водная физиологическая жидкость может медленно пропитывать материал среды и высвобождать лекарственный препарат в матрице. В конечном итоге физиологическая жидкость также может начать проникать в микрочастицы таким образом, что лекарственное средство может начать высвобождаться из микрочастиц. Состав лекарственного препарата в матрице может высвобождаться вплоть до 1 месяца, вплоть до 2 месяцев, вплоть до 3 месяцев или возможно дольше после введения.
[00019] Жидкий состав среды, например, жидкий состав среды с низкой вязкостью, может обеспечивать доставку лекарственного средства через очень небольшую иглу, например, приблизительно 25 калибра или приблизительно 30 калибра. С применением небольшой иглы может быть снижен риск серьезных побочных эффектов, вызываемых иглой. Использование небольшой иглы может быть особенно выгодным для инъекции состава, содержащего лекарственное средство, в стекловидное тело глаза. Для инъекции в заднюю часть глаза, например, стекловидное тело, игла меньшего размера понижает вероятность серьезных побочных эффектов, вызываемых иглой, таких как, эндофтальмит, отслоение сетчатки, витреальное отслоение, острая боль, и т.д.
[00020] Инъецирование жидкого состава среды с низкой вязкостью, который отверждается или становится гелеобразным in vivo, обеспечивает преимущества в существенной безопасности над другими способами имплантации твердых устройств. Например, при помощи инъецирования жидкости длительного высвобождения в твердый состав можно избежать хирургической имплантации твердого устройства подобного размера в глаз. Узкая игла может минимизировать травму глаза по сравнению с хирургической имплантацией, и, таким образом, может минимизировать потерю витреальной жидкости, может понижать вероятность отслоения сетчатки и витреального отслоения и может значительно понижать риск инфекции, такой как эндофтальмит.
[00021] Затвердевающая или гелеобразующая среда может захватывать микрочастицы и частицы лекарственного средства, как только состав входит в стекловидное тело. Жидкие составы, содержащие микрочастицы или частицы лекарственного средства, которые не подвергаются фазовому превращению, могут «загрязнять» и/или оседать на задней стороне сетчатки, что может вызывать временную слепоту. Более того, составы, которые загрязняют, могут оседать на линзах, где они могут вызывать помутнения стекловидного тела или образование пятен. Небольшие частицы также могут эндоцитозироваться в пределах клетки, где они быстро распадались и «сбрасывались», тем самым начиная местные воспалительные реакции.
[00022] Проницаемость микрочастицы может начаться после высвобождения из среды значительного количества лекарственного средства. Если толщина покрытий микрочастицы варьирует в пределах множества микрочастиц, частицы с более тонкими покрытиями могут начать высвобождать лекарственное средство раньше частиц с более толстыми покрытиями. Таким образом, диапазон толщины покрытий может помочь контролировать высвобождение лекарственного средства с течением времени. Множество микросфер могут обладать различными материалами покрытия, поскольку различные материалы покрытия позволяют различные свойства высвобождения. Таким образом, многообразие материалов покрытия может помочь контролировать высвобождение лекарственного средства с течением времени.
[00023] Микрочастицы содержат любые частицы с размером в диапазоне приблизительно микрон или мкм, или меньше, например, от приблизительно 0,01 мкм до приблизительно 1000 мкм, от приблизительно 1 мкм до приблизительно 300 мкм, от приблизительно 10 мкм до приблизительно 100 мкм. Микрочастицы могут быть любой формы, например, приблизительно сферической (например, микросферы), сфероидальной, эллиптической, цилиндрической, стержневой, и т.д.
[00024] Поскольку микрочастицы очень небольшие, они могут быть доставлены через очень небольшую иглу, например, приблизительно 25 калибра или приблизительно 30 калибра. С применением небольшой иглы может быть снижен риск серьезных побочных эффектов, вызываемых иглой, что объяснялось выше.
[00025] Как описано выше, микрочастица содержит лекарственное средство и покрытие. Покрытие содержит биологически разрушаемый материал или биологически разлагаемый материал.
[00026] Биологически разлагаемый материал содержит любой материал, который разрушается in vivo. Биологически разрушаемые материалы не обязательно химически разрушались in vivo, но могут диспергировать или растворяться in vivo таким образом, что могут высвобождать терапевтически эффективное количество лекарственного средства в течение периода, который значительно больше обычного in vivo срока лекарственного средства. Примеры биологически разрушаемых материалов включают в себя без ограничения поливинилпирролидин (PVP), карбоксиметилцеллюлозу (CMC), поливинилхлорид (PVC), гидроксипропилметилцеллюлозу (НРМС), сложный полиортоэфир, и т.п.
[00027] Биологически разлагаемый материал содержит материал, который химически разлагается in vivo таким образом, что может высвобождать терапевтически эффективное количество лекарственного средства в течение периода, который значительно больше обычного in vivo срока лекарственного средства. Биологически разлагаемый материал может быть простым полимером или сополимером, или любой комбинацией или смесью полимеров. Примеры биологически разлагаемых полимерных материалов могут включать в себя без ограничения полимеры, полученные из мономеров, такие как сложные эфиры, эфиры, ангидриды, амиды, сложные ортоэфиры, которые при распаде приводят к физиологически приемлемым продуктам распада. Полимерные материалы могут быть сшитыми или не сшитыми. Если они сшиты, они могут быть сшиты слегка, например, шиты менее чем на 5% или 1%.
[00028] Некоторые биологически разлагаемые полимерные материалы могут включать в себя полимеры гидроксиалифатических карбоновых кислот, или гомо-, или сополимеры, и полисахариды. Среди интересующих сложных полиэфиров также находятся гомо- или сополимеры D-молочной кислоты, L-молочной кислоты, рацемической молочной кислоты, гликолевой кислоты, капролактон, и их комбинации. Для некоторых сополимеров гликолевой и молочной кислоты на биологическое разложение может влиять соотношение гликолевой кислоты к молочной.
[00029] Согласно некоторым вариантам реализации биологически разлагаемый полимерный материал может содержать PLA, PLGA, полиангидрид, сложные полиортоэфиры (РОЕ), и т.д., или их комбинации. Согласно некоторым вариантам реализации полилактид может присутствовать в количестве от приблизительно 2% до приблизительно 100%, от приблизительно 2% до приблизительно 20%, от приблизительно 20% до приблизительно 30%, от приблизительно 30% до приблизительно 40%, от приблизительно 40% до приблизительно 50%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70%, от приблизительно 70% до приблизительно 80%, от приблизительно 80% до приблизительно 90% или от приблизительно 90% до приблизительно 100% по массе полимерного материала. Согласно некоторым вариантам реализации сополимер лактида с гликолидом может присутствовать в количестве от приблизительно 2% до приблизительно 100%, от приблизительно 2% до приблизительно 20%, от приблизительно 20% до приблизительно 30%, от приблизительно 30% до приблизительно 40%, от приблизительно 40% до приблизительно 50%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70%, от приблизительно 70% до приблизительно 80%, от приблизительно 80% до приблизительно 90% или от приблизительно 90% до приблизительно 100% по массе полимерного материала.
[00030] Полилактид, полимолочная кислота или PLA включает в себя поли-(D,L-лактид), и также может быть идентифицирован под CAS-номером 26680-10-4, и может быть представлен формулой:
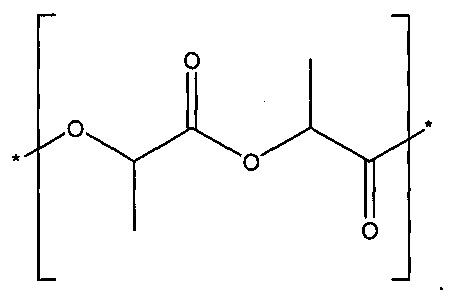
[00031] Сополимер молочной и гликолевой кислот, сополимер лактида с гликолидом, или PLGA включает в себя сополимер (D,L-лактида с гликолидом), также идентифицированный под CAS-номером 26780-50-7, и может быть представлен формулой:
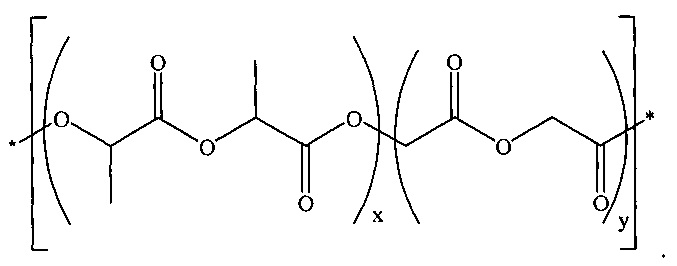
[00032] Таким образом, PLGA включает в себя один или более блоков повторяющихся звеньев D,L-лактида и один или более блоков повторяющихся звеньев гликолида, где размер и количество соответствующих блоков может меняться.
[00033] Молярный процент каждого мономера в сополимере молочной и гликолевой кислот (PLGA) может быть в количестве 0-100%, приблизительно 15-85%, приблизительно 25-75% или приблизительно 35-65%. Согласно некоторым вариантам реализации D,L-лактид может быть в количестве от приблизительно 50% до приблизительно 75%, от приблизительно 48% до приблизительно 52% или приблизительно 50%; или от приблизительно 73% до приблизительно 77% или приблизительно 75% полимера PLGA на молярной основе. В сущности, баланс полимера может быть повторяющимися гликолидными звеньями. Например, содержание гликолида может быть от приблизительно 25% до приблизительно 50%, от приблизительно 23% до приблизительно 27%, или приблизительно 25%; или от приблизительно 48% до приблизительно 52%, или приблизительно 50% полимера PLGA на молярной основе. Другие группы, такие как концевые или кэп-группы, могут присутствовать в небольших количествах. Согласно некоторым вариантам реализации сополимеры PLGA использовали совместно с полилактидными полимерами.
[00034] Согласно некоторым вариантам реализации покрытие может содержать PLA, PLGA, PVP, CMC, PVC, НРМС, сложный полиортоэфир, PEG или т.п.
[00035] Согласно некоторым вариантам реализации множество микросфер обладают 3 различными покрытиями, первая группа содержит PLGA покрытие, вторая группа содержит PLA покрытие и третья группа содержит РОЕ покрытие.
[00036] Толщина покрытия может меняться. Согласно некоторым вариантам реализации покрытие может обладать толщиной от приблизительно 1 мкм до приблизительно 5 мкм, приблизительно 1 мкм, приблизительно 2 мкм, приблизительно 3 мкм, приблизительно 4 мкм, приблизительно 5 мкм, или любой толщиной в диапазоне, ограниченном, или в пределах любых из этих значений.
[00037] Согласно некоторым вариантам реализации множество микрочастиц может обладать несколькими различными толщинами покрытия. Например, микрочастицы могут обладать 2, 3, 4, 5 или более различными толщинами покрытия и/или типами материалов покрытия. Согласно некоторым вариантам реализации микрочастицы могут обладать:
a) 2 толщинами покрытия, например: приблизительно 1 мкм и приблизительно 2 мкм, 1 мкм и 3 мкм, 1 мкм и 4 мкм, 1 мкм и 5 мкм, 2 мкм и 3 мкм, 2 мкм и 4 мкм, 2 мкм и 5 мкм, 3 мкм и 4 мкм, 3 мкм и 5 мкм, 4 мкм и 5 мкм, и т.д;
b) 3 толщинами покрытия, например, 1 мкм, 2 мкм и 3 мкм; 1 мкм, 2 мкм и 4 мкм; 1 мкм, 3 мкм и 4 мкм; 2 мкм, 3 мкм и 4 мкм; 1 мкм, 2 мкм и 5 мкм; 1 мкм, 3 мкм и 5 мкм; 2 мкм, 3 мкм и 5 мкм; 1 мкм, 4 мкм и 5 мкм; 2 мкм, 4 мкм и 5 мкм; 3 мкм, 4 мкм и 5 мкм; 1 мкм, 2 мкм, 3 мкм, 4 мкм и 5 мкм; и т.д.
c) 4 толщинами покрытия, например, 2 мкм, 3 мкм, 4 мкм и 5 мкм; 1 мкм, 3 мкм, 4 мкм и 5 мкм; 1 мкм, 2 мкм, 4 мкм и 5 мкм; 1 мкм, 2 мкм, 3 мкм и 5 мкм; 1 мкм, 2 мкм, 3 мкм и 4 мкм; и т.д.; или
d) 5 толщинами покрытия, например, 1 мкм, 2 мкм, 3 мкм, 4 мкм и 5 мкм; и т.д.
[00038] Согласно некоторым вариантам реализации множество микросфер может содержать микросферу первого типа, содержащую PLA покрытие с толщиной приблизительно 1 мкм; микросферу второго типа, содержащую PLA покрытие с толщиной приблизительно 2 мкм; микросферу третьего типа, содержащую PLA покрытие с толщиной приблизительно 3 мкм; микросферу четвертого типа, содержащую PLA покрытие с толщиной приблизительно 4 мкм; и микросферу пятого типа, содержащую PLА покрытие с толщиной приблизительно 5 мкм.
[00039] Некоторые примеры с приблизительно 1 мкм могут включать в себя без ограничения 0,5 мкм, 0,6 мкм, 0,7 мкм, 0,8 мкм, 0,9 мкм, 1,0 мкм, 1,1 мкм, 1,2 мкм, 1,3 мкм, 1,4 мкм, и т.д.
[00040] Некоторые примеры с приблизительно 2 мкм могут включать в себя без ограничения 1,5 мкм, 1,6 мкм, 1,7 мкм, 1,8 мкм, 1,9 мкм, 2,0 мкм, 2,1 мкм, 2,2 мкм, 2,3 мкм, 2,4 мкм, и т.д.
[00041] Некоторые примеры с приблизительно 3 мкм могут включать в себя без ограничения 2,5 мкм, 2,6 мкм, 2,8 мкм, 2,8 мкм, 2,9 мкм, 3,0 мкм, 3,1 мкм, 3,2 мкм, 3,3 мкм, 3,4 мкм, и т.д.
[00042] Некоторые примеры с приблизительно 4 мкм могут включать в себя без ограничения 3,5 мкм, 3,6 мкм, 3,7 мкм, 3,8 мкм, 3,9 мкм, 4,0 мкм, 4,1 мкм, 4,2 мкм, 4,3 мкм, 4,4 мкм, и т.д.
[00043] Некоторые примеры с приблизительно 5 мкм могут включать в себя без ограничения 4,5 мкм, 4,6 мкм, 4,7 мкм, 4,8 мкм, 4,9 мкм, 5,0 мкм, 5,1 мкм, 5,2 мкм, 5,3 мкм, 5,4 мкм, и т.д.
[00044] Вдобавок к покрытию биологически разрушаемым материалом или биологически разлагаемым материалом, микрочастица может включать в себя биологически разрушаемый материал или биологически разлагаемый материал внутри покрытия с лекарственным средством, и, таким образом, дополнительно может продлить доставку лекарственного средства. Если внутренняя сторона микрочастицы содержит биологически разрушаемый материал или биологически разлагаемый материал, количество может меняться. Согласно некоторым вариантам реализации биологически разрушаемый материал или биологически разлагаемый материал может присутствовать в количестве от приблизительно 10% до приблизительно 90%, от приблизительно 10% до приблизительно 30%, от приблизительно 30% до приблизительно 70%, от приблизительно 30% до приблизительно 40%, от приблизительно 40% до приблизительно 50%, от приблизительно 50% до приблизительно 60%, от приблизительно 70% до приблизительно 90% или от приблизительно 50% до приблизительно 85% микрочастицы по массе.
[00045] Количество лекарственного средства в микрочастице может меняться. Согласно некоторым вариантам реализации лекарственное средство может присутствовать в количестве от приблизительно 10% до приблизительно 90%, от приблизительно 10% до приблизительно 30%, от приблизительно 30% до приблизительно 70%, от приблизительно 30% до приблизительно 40%, от приблизительно 40% до приблизительно 50%, от приблизительно 50% до приблизительно 60% или от приблизительно 70% до приблизительно 90% микрочастицы по массе.
[00046] Согласно некоторым вариантам реализации микрочастицы могут содержать PLGA, PLA, или их комбинацию, заполненные терапевтически эффективным агентом, и биологически разлагаемое или биологически разрушаемое покрытие.
[00047] Согласно некоторым вариантам реализации композитный материал доставки лекарственного средства может доставлять эффективное количество лекарственного средства к месту инъекции в течение более длительного периода времени, чем: состав, содержащий материал среды и такое же количество лекарственного средства без любых микрочастиц, и/или множество микрочастиц, содержащих такое же количество лекарственного средства без любого материала среды.
[00048] Согласно некоторым вариантам реализации композитный материал доставки лекарственного средства может обеспечивать длительное высвобождение лекарственного средства в течение периода от приблизительно 1 месяца до приблизительно 3 лет, от приблизительно 2 месяцев до приблизительно 2 лет, от приблизительно 3 месяцев до приблизительно 12 месяцев, по меньшей мере приблизительно 2 месяца, приблизительно 3 месяца, приблизительно 6 месяцев, приблизительно 12 месяцев, или более. Это длительное высвобождение может понижать риск серьезных осложнений, вызываемых иглой, поскольку оно может снижать частоту инъекций. Снижение частоты инъекций в глаз может понижать риск серьезных осложнений, вызываемых иглой, и может быть предпочтительным у пациентов. Таким образом, система доставки лекарственного средства, которая позволяет инъекции с промежутком по меньшей мере приблизительно 3 месяца, с промежутком приблизительно 6 месяцев, с промежутком приблизительно 9 месяцев, с промежутком приблизительно 12 месяцев, или дольше, может быть желательной.
[00049] Согласно некоторым вариантам реализации псевдо-нулевой порядок доставки лекарственного средства может быть получен за длительный период времени путем изменения (1) толщины покрытия микрочастиц, заполненных лекарственным средством, (2) общего числа различных толщин покрытий на микрочастицах, заполненных лекарственным средством, (3) числа микрочастиц в пределах каждой покрывающей группы и/или (4) биологически разлагаемого или биологически разрушаемого полимера, используемого для получения микрочастиц.
[00050] Композитный материал доставки лекарственного средства может быть использован для лечения любого глазного заболевания или повреждения, включая без ограничения следующее:
[00051] МАКУЛОПАТИИ/ДЕГЕНЕРАЦИЯ СЕТЧАТКИ: не экссудативная возрастная дегенерация желтого пятна (ARMD), экссудативная возрастная дегенерация желтого пятна (ARMD), неоваскуляризация хороидеи, диабетическая ретинопатия, острая макулярная нейроретинопатия, центральная серозная хориопатия, кистозный макулярный отек, диабетический макулярный отек.
[00052] УВЕИТ/РЕТИНИТ/ХОРИОИДИТ: острая мультифокальная пластинчатая пигментная эпителиопатия, болезнь Бехчета, дробьевидная ретинопатия, инфекции (сифилис, лаймская болезнь, туберкулез, токсоплазмоз), интермедиарный увеит (Pars Planitis), мультифокальный хориоидит, синдром множественных быстро исчезающих белых пятен (MEWDS), глазной саркоидоз, задний склерит, серпигинозный хориоидит, субретинальный фиброз и увеитный синдром, синдром Фогта-Коянаги-Харада.
[00053] СОСУДИСТЫЕ ЗАБОЛЕВАНИЯ/ЭКССУДАТИВНЫЕ ЗАБОЛЕВАНИЯ: окклюзионное поражение артерии сетчатки, окклюзия центральной вены сетчатки, диссеминированная внутрисосудистая коагулопатия, окклюзия ветви вены сетчатки, гипертензивные изменения глазного дна, глазной ишемический синдром, артериальная микроаневризма сетчатки, болезнь Коутса, парафовеальная телеангиэктазия, окклюзия вены половины сетчатки, папиллофлебит, окклюзия центральной артерии сетчатки, окклюзия ветви артерии сетчатки, заболевание сонной артерии (CAD), ангиит матовой ветви, серповидно-клеточная ретинопатия и другие гемоглобинопатии, ангиоидные полосы сетчатки, семейная экссудативная форма витреоретинопатии, болезнь Илза.
[00054] ТРАВМАТИЧЕСКИЕ/ХИРУРГИЧЕСКИЕ: симпатическая офтальмия, уверальное заболевание сетчатки, отслоение сетчатки, травма, воздействие лазера, фотодинамическая терапия, фотокоагуляция, недостаточная перфузия в течение операции, радиационная ретинопатия, ретинопатия трансплантата костного мозга.
[00055] ПРОЛИФЕРАТИВНЫЕ НАРУШЕНИЯ: пролиферативная витреальная ретинопатия и эпиретинальные мембраны, пролиферативная диабетическая ретинопатия, ретинопатия недоношенных (ретролентальная фиброплазия).
[00056] ИНФЕКЦИОННЫЕ НАРУШЕНИЯ: глазной гистоплазмоз, глазной токсокароз, синдром предполагаемого гистоплазмоза глаз (POHS), эндофтальмит, токсоплазмоз, заболевание сетчатки, связанное с ВИЧ инфекцией, хориоидальное заболевание, связанное с ВИЧ инфекцией, увеальное заболевание, связанное с ВИЧ инфекцией, вирусный ретинит, острый ретинальный некроз, прогрессивный внешний ретинальный некроз, грибковое ретинальное заболевание, глазной сифилис, глазной туберкулез, диффузный односторонний подострый нейроретинит, миаз.
[00057] ГЕНЕТИЧЕСКИЕ НАРУШЕНИЯ: пигментный ретинит, системные нарушения со связанными ретинальными дистрофиями, наследственная постоянная куриная слепота, колбочковая дегенерация, желтопятнистая абиотрофия сетчатки, болезнь Беста, узорчатая дистрофия пигментированного эпителия сетчатки, связанный с Х-хромосомой ретиносхизис, дистрофия глазного дна Сорсби, доброкачественная концентрическая макулопатия, кристаллическая дистрофия Биетти, эластическая псевдоксантома, синдром Ослера-Вебера.
[00058] РАЗРЫВ/ПЕРФОРАЦИЯ СЕТЧАТКИ: отслоение сетчатки, макулярное отверстие, огромный разрыв сетчатки.
[00059] ОПУХОЛИ: заболевание сетчатки, связанное с опухолями, солидными опухолями, метастазом опухоли, доброкачественными опухолями, например, гемангиома, нейрофиброма, трахома и пиогенная гранулема, наследственный гипертрофия RPE, увеальная меланома задней части глаза, хориоидальная гемангиома, хориоидальная остеома, хориоидальный метастаз, комбинированная гамартома сетчатки и пигментированного эпителия сетчатки, ретинобластома, вазопролиферативные опухоли глазного дна, астроцитома сетчатки, внутриглазные лимфомы.
[00060] ПРОЧЕЕ: точечная внутренняя хориоидопатия, острая задняя мультифокальная плакоидная пигментная эпителиопатия, миопическая дегенерация сетчатки, острый ретинальный пигментный эпителиит, глазное воспаление и иммунные нарушения, глазные сосудистые дисфункции, отторжение ткани роговицы, неоваскулярная глаукома и т.п.
Пример 1
[00061] Партию микросфер, заполненных лекарственным средством, разделяли на 3 части. Первую часть покрывали PLGA. Вторую часть покрывали PLA со второй толщиной. Третью часть покрывали сложным полиортоэфиром [РОЕ] с третьей толщиной. РОЕ представляет собой полимер поли(сложного ортоэфира), полученный конденсационной полимеризацией 3,9-диэтилиден-2,4,8,10-тетраоксаспиро[5.5]ундекана (DETOSU), циклогександиметанола (CDM), триэтиленгликоля (TEG) и 1,10-дидекандиола (DD). Триэтиленгликоля гликолид (TEG-GL) добавляли в качестве скрытого кислотного катализатора для начала гидролиза скелета РОЕ. Молекулярная масса полимера РОЕ составляет от приблизительно 30000 до приблизительно 35000 дальтон. Покрытые микросферы из трех групп смешивали с затвердевающей депообразующей средой, содержащей то же лекарственное средство. Как только суспензию ввели в стекловидное тело через узкую иглу, она почти моментально отверждается, захватывая микросферы. Поскольку депо медленно разрушается, из него сначала высвобождается лекарственное средство. За ним следовало высвобождение из микросфер в первой группе, второй группе и третьей группе, соответственно.
Пример 2
[00062] Микросферы PLGA, заполненные соединением 1 с PLA покрытиями толщиной 1, 2, 3, 4 и 5 мкм соответственно, являлись суспендированными в составе соединения 1 в ReGel и значения вязкости, pH и ионной силы были откорректированы. Суспензию микросфер затем лиофилизировали для стойкости и хранения (микросферы также могут быть лиофилизированы в присутствии «свободного» лекарственного средства для обеспечения болюсной дозы, при необходимости, после разведения и инъекции). После разведения составы, которые сохраняли при 5°C, вводили через иглу 30 калибра в стекловидное тело животного, и состав моментально становился гелеобразным при температуре стекловидного тела, прибл. 37°C, захватывая микросферы.
[00063] Оказавшись в стекловидном теле, ReGel начал высвобождать соединение 1. Поскольку ReGel биологически разрушается, высвобождалось дополнительное лекарственное средство, и покрытые микросферы начинали подвергаться действию водной среды в пределах стекловидного тела. Поскольку микросферы подвергались действию водной среды при 37°C, покрытия начинали биологически разрушаться.
[00064] Микросферы с покрытием 1 мкм обладали своей PLGA матрицей, содержащей лекарственное средство, которая первой подвергалась действию, и начинали высвобождать соединение 1. При этом микросферы с неповрежденным покрытием еще не высвобождали лекарственное средство. При продолжении времени покрытия на микросферах с толщиной 2 мкм распадались и начинали подвергаться действию своей матрицы PLGA, содержащей лекарственное средство, и лекарственное средство начинало высвобождаться. В это же время количество лекарственного средства в ReGel и микросфер с покрытием 1 мкм начинало уменьшаться.
[00065] Несколько позже покрытие в 3 мкм на третьей группе микросфер удаляли биологическим путем, и эта группа начинала высвобождать соединение 1, поскольку высвобождение лекарственного средства из первых высвобождающих микросфер (например, у которых покрытия 1 мкм и 2 мкм) уменьшалось. Это сопровождалось, несколько позже, распадом покрытий толщиной 4 мкм и 5 мкм из микросфер с самым толстым покрытием, и далее высвобождалось дополнительное лекарственное средство.
[00066] Если не отмечено иное, все числа, выражающие количество ингредиентов, свойства, такие как молекулярная масса, условия реакции и т.д., используемые в описании и формуле изобретения, следует понимать как модифицированные во всех случаях термином «приблизительно». Соответственно, если не отмечено противоположное, числовые параметры, изложенные в описании и приложенной формуле изобретения, являются приближенными величинами, которые могут изменяться в зависимости от желаемых свойств, которые хотели получить. По меньшей мере, и не с целью ограничения применения теории эквивалентов к объему формулы изобретения, каждый числовой параметр следует истолковывать по меньшей мере с учетом числа сообщенных значащих цифр и с применением общепринятых способов округления.
[00067] Формы единственного числа и подобные ссылки, используемые в контексте описания настоящего изобретения (особенно в контексте следующей формулы изобретения), истолковывали как охватывающие и форму единственного числа, и форму множественного, если иначе не отмечено в описании или четко не противоречит контексту. Все описанные в настоящем документе способы могут быть выполнены в любом подходящем порядке, если иначе не отмечено в описании или это четко не противоречит контексту. Применение любых и всех примеров, или типичных выражений (например, «такой как»), обеспеченных в настоящем документе, предусмотрено только для лучшего освещения настоящего изобретения, и оно не определяет ограничение объема любого пункта формулы изобретения. Никакое выражение в описании не следует толковать как обозначающее любой не заявленный элемент, существенный для практического осуществления настоящего изобретения.
[00068] Группировки альтернативных элементов или вариантов реализации, раскрытые в настоящем описании, не следует толковать как ограничивающие. Каждый член группы может быть упомянут и заявлен отдельно или в любой комбинации с другими членами группы или другими встречающимися в ней элементами. Ожидалось, что один или более членов группы могут быть включены в, или удалены из, группы по причинам удобства и/или патентоспособности. Если возникает любое такое включение или удаление, считается, что обозначение содержит группу как модифицированную, тем самым удовлетворяя описание всех групп Маркуша, используемых в приложенной формуле изобретения.
[00069] В настоящем изобретении описаны определенные варианты реализации, включая лучший вариант, известный изобретателям, для выполнения изобретения. Разумеется, вариации этих описанных вариантов реализации будут очевидны специалистам настоящей области техники на основании прочтения вышепредставленного описания. От квалифицированных специалистов изобретатель ожидает использования таких вариаций соответствующим образом, и настоящее изобретение изобретатель намерен осуществлять на практике иным образом, отличающимся от описанного здесь особым образом. Соответственно, формула изобретения включает в себя все модификации и эквиваленты объекта, описанного в формуле изобретения, как позволено действующим законом. Более того, рассматривается любая комбинация вышеописанных элементов во всех возможных для них вариациях, если не отмечено иное или иным образом четко не противоречит контексту.
[00070] В заключение, следует понимать, что варианты реализации, раскрытые в настоящем описании, являются иллюстративными основами формулы изобретения. Другие модификации, которые могут быть использованы, находятся в пределах объема формулы изобретения. Таким образом, в качестве примера, а не ограничения, альтернативные варианты осуществления могут быть использованы согласно изложенному в настоящем описании. Соответственно, формула изобретения не ограничена вариантами изобретения так, как представлено и описано.
Группа изобретений относится к медицине, в частности к системам доставки лекарственного средства в глаз. Композитный материал для доставки лекарственного средства в глаз, содержит состав среды, который содержит лекарственное средство, депообразующий материал и микрочастицы, при этом лекарственное средство находится и в депообразующем материале, и в микрочастицах. Лекарственное средство, находящееся в депообразующем материале, диспергировано в нем. Микрочастицы, диспергированные в составе среды, содержат лекарственное средство и покрыты покрытием, содержащим биологически разрушаемый материал или биологически разлагаемый материал. Состав среды находится в жидкой форме перед введением и сконфигурирован с возможностью увеличения вязкости после инъецирования в организм млекопитающего для того, чтобы форма среды после инъецирования была твердой или гелеобразной. Также охарактеризован способ лечения глазного заболевания или повреждения, предусматривающий инъецирование вышеуказанного композитного материала. Группа изобретений обеспечивает продолжительное, контролируемое высвобождение лекарственного средства за счет его наличия как в микрочастицах с биоразрушаемым или биоразлагаемым покрытием, так и в депообразующем материале среды. 2 н. и 19 з.п. ф-лы, 2 пр.
1. Композитный материал для доставки лекарственного средства в глаз, содержащий: состав среды, который содержит:
лекарственное средство;
депообразующий материал; и
микрочастицы;
при этом лекарственное средство находится и в депообразующем материале и в микрочастицах,
лекарственное средство, находящееся в депообразующем материале, диспергировано в нем;
при этом микрочастицы, диспергированные в составе среды, содержат: указанное лекарственное средство; и
при этом микрочастицы покрыты покрытием, содержащим биологически разрушаемый материал или биологически разлагаемый материал;
причем состав среды находится в жидкой форме перед введением и сконфигурирован с возможностью увеличения вязкости после инъецирования в организм млекопитающего для того, чтобы форма среды после инъецирования была твердой или гелеобразной.
2. Композитный материал по п. 1, отличающийся тем, что лекарственное средство представляет собой тимолол, бримонидин, биматопрост, кеторолак, дексаметазон, мемантин, преднизолона ацетат, триамцинолона ацетонид, ранибизумаб или бевацизумаб.
3. Композитный материал по п. 1 или 2, отличающийся тем, что лекарственное средство представляет собой ранибизумаб.
4. Композитный материал по п. 1 или 2, отличающийся тем, что покрытие содержит полилактид, сополимер лактида с гликолидом, поливинилпирролидин, карбоксиметилцеллюлозу, PVC, гидроксиметилпропилцеллюлозу, сложный полиортоэфир или полиэтиленгликоль.
5. Композитный материал по п. 1 или 2, отличающийся тем, что покрытие содержит полилактид.
6. Композитный материал по п. 1 или 2, отличающийся тем, что покрытие имеет толщину от 1 до 5 мкм.
7. Композитный материал по п. 1 или 2, отличающийся тем, что множество микрочастиц содержит:
микросферу первого типа, содержащую полимерное покрытие, имеющее толщину 1 мкм;
микросферу второго типа, содержащую полимерное покрытие, имеющее толщину 2 мкм;
микросферу третьего типа, содержащую полимерное покрытие, имеющее толщину 3 мкм;
микросферу четвертого типа, содержащую полимерное покрытие, имеющее толщину 4 мкм; и
микросферу пятого типа, содержащую полимерное покрытие, имеющее толщину 5 мкм.
8. Композитный материал по п. 1 или 2, отличающийся тем, что микрочастицы дополнительно содержат сополимер лактида с гликолидом, полилактид или их комбинацию, заполненные лекарственным средством.
9. Композитный материал по п. 1 или 2, отличающийся тем, что депообразующий материал содержит: биологически разлагаемый сополимер, содержащий блоки сополимера лактида с гликолидом и блоки полиэтиленгликоля, комплекс изобутирата ацетата сахарозы, сополимер лактида с гликолидом в органическом растворе или полилактид в органическом растворе.
10. Композитный материал по п. 9, отличающийся тем, что полимер представляет собой полилактидный полимер.
11. Способ лечения глазного заболевания или повреждения, предусматривающий инъецирование композитного материала по любому из пп. 1-10 в глаз млекопитающего в случае необходимости.
12. Способ по п. 11, отличающийся тем, что глазное заболевание представляет собой дегенерацию желтого пятна или диабетическую ретинопатию.
13. Способ по п. 11 или 12, отличающийся тем, что лекарственное средство представляет собой тимолол, бримонидин, биматопрост, кеторолак, дексаметазон, мемантин, преднизолона ацетат, триамцинолона ацетонид, ранибизумаб или бевацизумаб.
14. Способ по п. 11 или 12, отличающийся тем, что лекарственное средство представляет собой ранибизумаб.
15. Способ по п. 11 или 12, отличающийся тем, что покрытие содержит полилактид, сополимер лактида с гликолидом, поливинилпирролидин, карбоксиметилцеллюлозу, PVC, гидроксиметилпропилцеллюлозу, сложный полиортоэфир или полиэтиленгликоль.
16. Способ по п. 11 или 12, отличающийся тем, что покрытие содержит полилактид.
17. Способ по п. 11 или 12, отличающийся тем, что покрытие имеет толщину от 1 мкм до 5 мкм.
18. Способ по п. 11 или 12, отличающийся тем, что множество микрочастиц содержит:
микросферу первого типа, содержащую полимерное покрытие, имеющее толщину 1 мкм;
микросферу второго типа, содержащую полимерное покрытие, имеющее толщину 2 мкм;
микросферу третьего типа, содержащую полимерное покрытие, имеющее толщину 3 мкм;
микросферу четвертого типа, содержащую полимерное покрытие, имеющее толщину 4 мкм; и
микросферу пятого типа, содержащую полимерное покрытие, имеющее толщину 5 мкм.
19. Способ по п. 11 или 12, отличающийся тем, что микрочастицы дополнительно содержат сополимер лактида с гликолидом, полилактид или их комбинацию, заполненные лекарственным средством.
20. Способ по п. 11 или 12, отличающийся тем, что депообразующий материал содержит: биологически разлагаемый сополимер, содержащий блоки сополимера лактида с гликолидом и блоки полиэтиленгликоля, комплекс изобутирата ацетата сахарозы, сополимер лактида с гликолидом в органическом растворе или полилактид в органическом растворе.
21. Способ по п. 20, отличающийся тем, что полимер представляет собой полилактидный полимер.
| ОФТАЛЬМИЧЕСКИЕ КОМПОЗИЦИИ В ФОРМЕ ДЕПО ДЛЯ ПЕРИОКУЛЯРНОГО ИЛИ СУБКОНЪЮНКТИВАЛЬНОГО ВВЕДЕНИЯ | 2002 |
|
RU2316315C2 |
| US 5441732 A, 15.08.1995 | |||
| EP 1568359 A1, 31.08.2005 | |||
| US 20070196415 A1, 23.08.2007 | |||
| US 2010203151 A1, 12.08.2010 | |||
| WO 2007012974 A2, 01.02.2007 | |||
| ЧУЕШОВ В.И | |||
| Промышленная технология лекарств, том 1, Харьков, издательство НФАУ, 2002, с | |||
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
Авторы
Даты
2018-11-16—Публикация
2013-01-22—Подача