Изобретение относится к медицине, а именно к медицинской генетике и сердечно-сосудистой хирургии, и может быть использовано для определения вероятного риска развития синдрома полиорганной недостаточности у пациентов в послеоперационном периоде коронарного шунтирования на основании геномных маркеров.
Несмотря на то, что в раннем послеоперационном периоде коронарного шунтирования системный воспалительный ответ является физиологическим механизмом адаптации к хирургической травме и реперфузионным повреждениям, у некоторых пациентов он протекает патологически неконтролируемо и продолжительно, что приводит к развитию синдрома полиорганной недостаточности (СПОН), в некоторых случаях заканчивающегося летальным исходом.
Известен способ, предложенный Jabandziev с соавторами, на основе анализа ДНК 598 детей с системным воспалительным ответом [Jabandziev, Р., Smerek, М., Michalek, J., Fedora, М., Kosinova, L. Hubacek, J.A., Michalek, J. Multiple gene-to-gene interactions in children with sepsis: a combination of five gene variants predicts outcome of life-threatening sepsis // Crit Care. - 2014. - №18 (1). - R1. doi: 10.1186/cc13174], где риск синдрома полиорганной недостаточности оценивают по пяти генным полиморфизмам, а именно rs5743507 гена BPI, rs2232618 гена LBP, rs4986790 гена TLR4, rs2227956 гена HSP70 и rs1800795 гена IL6, при этом сочетание мутантного аллеля rs2232618 и аллелей «дикого типа» полиморфизмов rs2232618 и rs4986790; сочетание аллелей «дикого типа» полиморфизмов rs2232618, rs4986790 и rs1800795; а также сочетание аллелей «дикого типа» полиморфизмов rs5743507 и rs2227956 ассоциированы с высоким риском септических осложнений.
Недостатком способа является то, что он не позволяет прогнозировать риск развития синдрома полиорганной недостаточности, обусловленного системным воспалительным ответом неинфекционного генеза, а также вследствие особенностей детского возраста не применим к оценке рисков у взрослого населения. Кроме того, вследствие тестирования на выборке пациентов с патологией, не относящейся к кардиохирургической, способ не может быть использован для пациентов, перенесших коронарное шунтирование.
Известен способ прогнозирования риска развития синдрома полиорганной недостаточности у кардиохирургических больных, включающий оценку дисфункции органов и систем в послеоперационном периоде с определением ее значимости, в том числе по известным шкалам APACHE II и EuroSCORE [Пат. 2422092 Рос. Федерация МПК А61В 10/00. Способ прогнозирования риска развития полиорганной недостаточности у кардиохирургических больных / Плотников Г.П., Григорьев Е.В., Хаес Б.Л., Барбараш Л.С. и пр.; патентообладатель Учреждение Росс. акад. мед. наук «Научно-иссл. инст-т комплексных проблем сердечно-сосудистых заболеваний СО РАМН (RU) №2010100786/14, заявл. 11.01.10, опубл. 27.06.11, Бюл. №18. - 8 с.]. В основе способа лежит оценка состоявшихся событий и факторов риска. Причем к состоявшимся событиям, имеющим вероятность риска не менее 50%, относят искусственное кровообращение на протяжении более 150 минут или повторное искусственное кровообращение, расширение объема операции, наличие мультифокального сосудистого поражения, наличие дисфункции органа или системы с тяжестью состояния при поступлении из операционной по шкале APACHE II более 18 баллов. А к факторам с вероятностью риска не менее 30% относят кровопотерю при тканевом поражении, наличие шока, выраженность системного воспалительного ответа по принятым критериям, трансфузию, превышающую две дозы эритроцитарной массы или донорской плазмы, рестернотомию и исходную тяжесть состояния по шкале EuroSCORE более 2,5%. Вероятность риска развития синдрома полиорганной недостаточности более 50% прогнозируют при наличии сочетания событий и факторов риска.
Недостатком способа является то, что он также не позволяет прогнозировать риск развития синдрома полиорганной недостаточности, обусловленного системным воспалительным ответом неинфекционного генеза, а также не учитывает генетические факторы пациента, хотя наследственная компонента общепризнанно играет важную роль в развитии различных осложнений после кардиохирургических оперативных вмешательств.
Наиболее близким к заявляемому является способ ранней диагностики осложненного системного воспалительного ответа у пациентов, оперированных в условиях искусственного кровообращения [Пат. 2463606 Рос. Федерация МПК G01N 33/53 Способ ранней диагностики осложненного системного воспалительного ответа у пациентов, оперированных в условиях искусственного кровообращения / Головкин А.С., Матвеева В.Г., Григорьев Е.В., Шукевич Д.Л. и пр.; патентообладатель УРАМН НИИ КПССЗ СО РАМН (RU) №2011134573/15, заявл. 17.08.11, опубл. 10.10.12., Бюл. №28. - 8 с.]. Способ включает анализ клинико-лабораторных критериев, а также определение концентрации растворимой формы триггерного рецептора, экспрессируемого на миелоидных клетках (sTREM-1) в дооперационном периоде (sTи) и в любой момент после операции (sTпо) с использованием искусственного кровообращения. При этом развитие осложненного системного воспалительного ответа диагностируют при коэффициенте прироста sTREM-1 ≥ 1,5.
Недостатком способа являются: низкая чувствительность и специфичность в отношении дифференцировки инфекционного и неинфекционного генезов системной воспалительной реакции, трудоемкость (2-кратный забор крови: до операции и через 18 часов после), чувствительность метода твердофазного иммуноферментного анализа и время ожидания результата, отсутствие необходимой связи с клиническими и анамнестическими данными пациента. Несмотря на то, что растворимая форма белка sTREM-1 является маркером инфекционного и неинфекционного генеза, его количественное содержание может зависеть от многих факторов: прием лекарственных препаратов (статинов), имеющихся воспалительных процессов и т.д., что может дать ложную оценку риска.
Выявление генетических детерминант при скрининговом предоперационном обследовании потенциальных реципиентов позволит выявить лиц с высоким риском синдрома полиорганной недостаточности после коронарного шунтирования, что даст возможность скорректировать послеоперационную терапию и таким образом снизить риск возможных осложнений и улучшить прогноз для пациентов в послеоперационном периоде.
Техническим результатом изобретения является прогнозирование риска развития синдрома полиорганной недостаточности после коронарного шунтирования путем определения полиморфизмов генов-кандидатов и расчета суммарного риска по оценочной шкале на основании баллового эквивалента.
Предлагаемый способ основан на результатах исследования, выполненного в Федеральном государственном бюджетном научном учреждении «Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний» и включающего 588 пациентов, перенесших коронарное шунтирование вследствие ишемической болезни сердца. Из общего числа пациентов - 560 (95,24%) характеризовались нормальным послеоперационным течением, а у 28 больных (4,76%) в послеоперационном периоде был диагностирован синдром полиорганной недостаточности.
В качестве потенциальных факторов риска синдрома полиорганной недостаточности оценивали клинические факторы, с наибольшей частотой встречающиеся в группе исследования (таблица 1), и геномные маркеры (таблица 2). Все факторы были введены в прогностическую модель при проведении бинарной логистической регрессии с пошаговым включением и исключением предикторов.
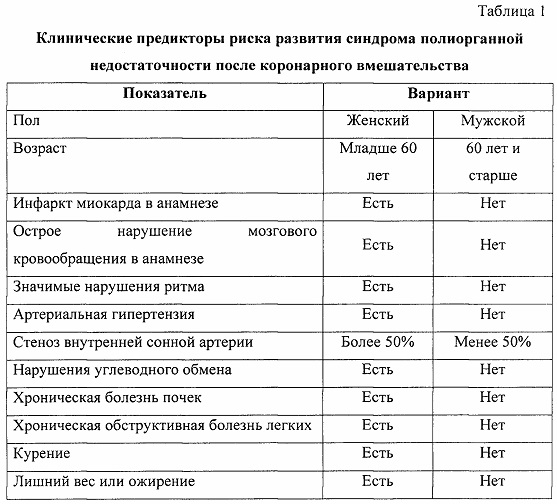
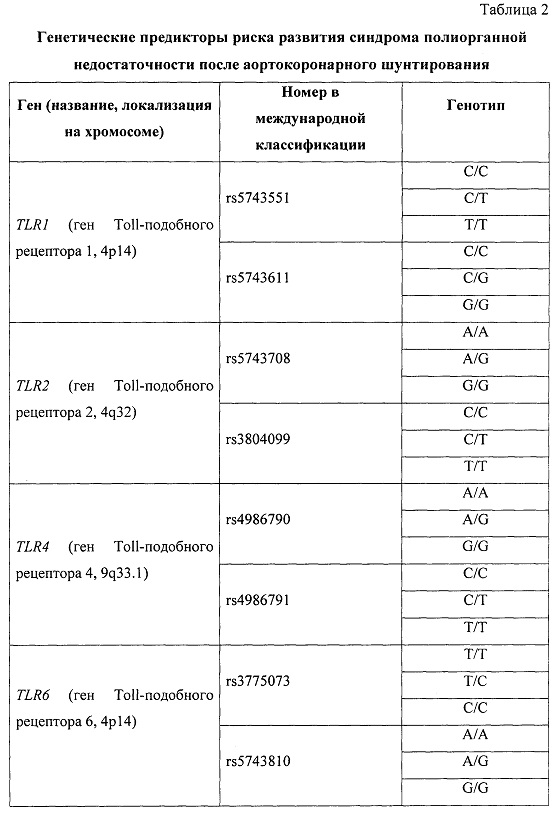
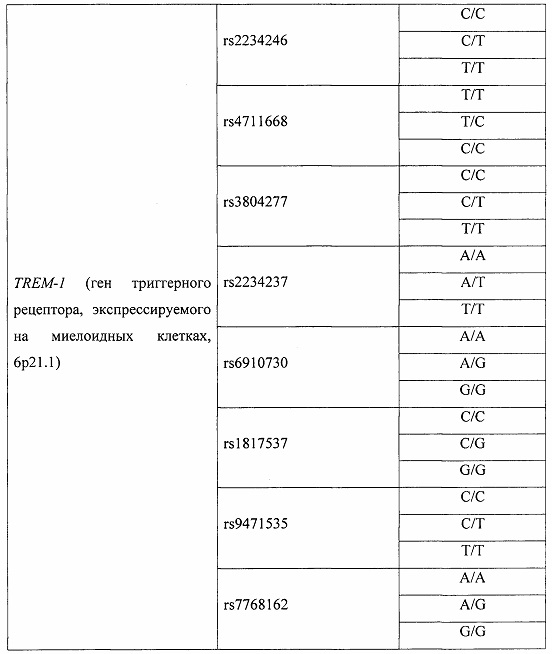
В результате из 72 факторов риска (48 генотипов 16 полиморфизмов 5 генов и 24 варианта 12 клинических факторов) были определены четыре фактора, имеющих статистически значимую прогностическую ценность: генотип Т/Т полиморфизма rs3775073 гена TLR6, генотип Т/Т полиморфизма rs2234246 гена TREM-1, наличие хронической обструктивной болезни легких и возраст 60 лет и старше (таблица 3).
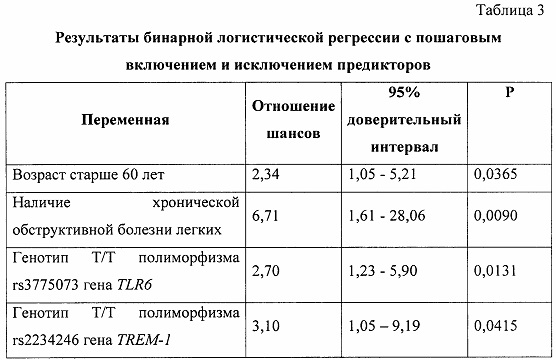
Примечание: Р - вероятность отвергнуть верную нулевую гипотезу.
Построение оценочной шкалы риска синдрома полиорганной недостаточности после коронарного шунтирования осуществляли при помощи бинарной логистической регрессии с пошаговым включением и исключением предикторов. В данной модели зависимой переменной являлся диагностированный синдром полиорганной недостаточности; переменные вводились в модель при Р менее 0,05, а исключались при Р более 0,1.
Исходя из полученных результатов отношения шансов, отражающих риск развития синдрома полиорганной недостаточности после коронарного шунтирования, получили классификационную шкалу, в которой каждому прогностическому критерию соответствует оценочный балл, а суммарное значение критериев позволяет определить вероятный риск развития синдрома полиорганной недостаточности в послеоперационном периоде коронарного шунтирования (таблица 4).
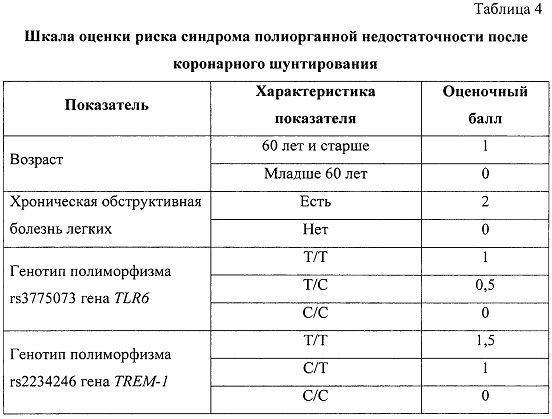
При этом минимальный риск развития синдрома полиорганной недостаточности определяют при сумме баллов от 0 до 2,5, средний риск при сумме от 3,0 до 4,0 баллов, а высокий риск при суммарном значении от 4,5 до 5,5 баллов.
Максимально возможное суммарное значение риска, полученное в данной шкале, равняется 5,5 баллов, что является обязательной рекомендацией к персонализации плана терапии пациента в послеоперационном периоде.
При оценке качества прогностической модели установлено, что правильность классификации пациентов по группам с синдромом и без синдрома полиорганной недостаточности с применением оценочных критериев составляет 95,07%, Р=0,0003.
Качество бинарной классификации оценивали с помощью построения ROC-кривой. При этом площадь под ROC-кривой равнялась 0,742 (95% доверительный интервал 0,705-0,777; стандартная ошибка 0,055), что является удовлетворительным показателем классифицирующей модели.
Способ прогнозирования риска развития синдрома полиорганной недостаточности после коронарного шунтирования осуществляют следующим образом. У пациентов, которым планируется оперативное вмешательство, в период предоперационной подготовки забирают кровь из периферической вены, выделяют ДНК и проводят молекулярно-генетическое тестирование с определением генотипов пациента по полиморфизмам rs3775073 гена TLR6 и rs2234246 гена TREM-1. При этом высокий риск развития синдрома полиорганной недостаточности после коронарного шунтирования определяют у пациентов с хронической обструктивной болезнью легких, носителей генотипа Т/Т полиморфизма rs2234246 гена TREM-1, а также лиц в возрасте 60 лет и старше в сочетании с генотипом Т/Т полиморфизма rs3775073 гена TLR6. В противном случае риск развития синдрома полиорганной недостаточности минимален.
Ниже приведены примеры реализации предложенного изобретения.
Пример 1.
Пациентка Л., 63 года, поступила планово в кардиологическое отделение для подготовки к коронарному шунтированию с диагнозом:
Основной: Ишемическая болезнь сердца. Стенокардия ФК III. ПИКС (05.11.2011 г.). ТЛТ актилизе 05.11.11. Пролапс ТК. Недостаточность ТК II ст. ХСН II А. ФК II. Гипертоническая болезнь III стадии, риск 4.
Сопутствующий: Сахарный диабет 2 типа средней степени тяжести, компенсация. Осложненный макроангиопатией. Полипоз желчного пузыря. Глаукома. Двусторонний неврит слухового нерва. Атрофический гастрит. Хронический вторичный дуоденит.
Результаты обследования: ЭКГ - Ритм синусовый с ЧСС 64 в мин. Замедление в/предсердной проводимости. Рубцовые изменения миокарда з/нижн, з/баз обл.; ЭХО-КГ - Сократительная способность миокарда удовлетворительная. ПТК с нарушением гемодинамики клапана. Умеренно выраженный стеноз АК. Кальциноз II ст.; ЦДС э/краниальных отделов брахиоцефальных артерий - высокое вхождение ПА в ПК справа; ЦДС артерий нижних конечностей - нарушений гемодинамики не выявлено; Коронарография - Тип кровотока правый. Множественное поражение коронарного русла. Противопоказаний к оперативному лечению нет. При проведении прямой реваскуляризации миокарда при необходимости - коррекция трикуспидальной недостаточности.
Генетический профиль: rs3775073 гена TLR6 генотип С/С, rs2234246 гена TREM-1 генотип С/С.
Результаты оценочной шкалы риска развития полиорганной недостаточности
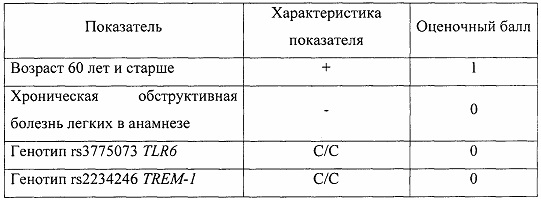
Суммарный показатель составил 1 балл, что позволило сделать заключение о минимальном риске развития полиорганной недостаточности после АКШ.
В условиях искусственного кровообращения выполнено бимаммарокоронарное шунтирование (ПМЖВ - ЛВГА in sity, ПКА - ПВГА), аортокоронарное шунтирование ВТК и OA аутовеной. Длительность операции - 5 часов 09 мин. Время искусственного кровообращения - 108 мин, окклюзия аорты - 73 мин. Интероперационная кровопотеря в 1 сутки - 500 мл. EuroScore 4 (2,7%) SOFA до операции - 1 балл. SOFA в первые сутки после операции - 2 балла.
Послеоперационный период протекал с минимальными явлениями двустороннего гидроторакса с положительной динамикой на фоне консервативной терапии и заживлением швов первичным натяжением.
Койко-день в АРО: 2; койко-день в стационаре после операции: 13.
Пациентка выписана в удовлетворительном состоянии.
Пример 2.
Пациент М., 64 года, мужчина, госпитализирован в кардиохирургическое отделение для планового проведения коронарного шунтирования. Диагноз при поступлении:
Основной: Ишемическая болезнь сердца. ХСН II А. ФК III. Постинфарктный (III, V - 2010 г) кардиосклероз. Гипертоническая болезнь III стадии, риск 4. ХИНК 1.
Сопутствующий: Хронический атрофический гастрит, хронический вторичный дуоденит вне обострения. ДГПЖ I-II ст. Хронический цистит неактивная фаза.
Результаты обследования: ЭКГ - Ритм синусовый, 72 в мин. Замедление в/предсердной проводимости. Гипертрофия, систолическая перегрузка ЛЖ; ЭХО-КГ - Сократительная способность миокарда ЛЖ умеренно снижена; ЦДС э/краниальных отделов брахиоцефальных артерий - Признаки атеросклероза сонных артерий, стеноз ПА справа; ЦДС артерий нижних конечностей - окклюзия ПБА с обеих сторон, ЗББА слева, стеноз подколенной артерии слева; Коронарография - Тип кровотока правый. Множественное поражение коронарного русла.
Генетический профиль: rs3775073 гена TLR6 генотип Т/Т, rs2234246 гена TREM-1 генотип С/Т.
Результаты оценочной шкалы риска развития полиорганной недостаточности


Суммарный показатель составил 3 балла, что позволило сделать заключение о среднем риске развития полиорганной недостаточности после коронарного шунтирования.
Операция выполнена в условиях искусственного кровообращения: бимаммарокоронарное шунтирование: левая ВГА с ПНА in situ, свободная правая ВГА композитным шунтом от левой ВГА к ВТК. Длительность операции - 6 часов 24 мин. Время искусственного кровообращения - 87 мин, без пережатия аорты. Интероперационная кровопотеря в 1 сутки - 350 мл. EuroScore 4 (3,51%). SOFA до операции - 2 балла. SOFA в первые сутки после операции - 4 балла.
На вторые сутки послеоперационного периода (как проявление гипоперфузионного синдрома) развилась динамическая кишечная непроходимость. Проведена лапаротомия с выведением концевой илеостомы в правую подвздошную область.
В дальнейшем послеоперационный период протекал с явлениями полиорганной недостаточности (с преобладанием дыхательной, энтеральной, сердечно-сосудистой недостаточности).
Койко-день в АРО: 13; койко-день в стационаре после операции: 31.
Пример 3.
Пациент П., 62 года, мужчина, поступил в ОРХМДиЛ для проведения ЧКВ ПНА. При установочной КАГ - тромбоз стентов в ПКА. Тактика пересмотрена в пользу АКШ.
Основной диагноз: Мультифокальный атеросклероз. Ишемическая болезнь сердца. Стенокардия ФК III. Постинфарктный (04.2010 г.) кардиосклероз. ХСН II А. III ФК. Гипертоническая болезнь III стадии, риск 4. ХИГМ II степени с формированием кистозно-глиозной трансформации в левой гемисфере мозжечка. Церебральный атеросклероз. Резидуальный период ОНМК неуточненной давности и характера, с обратным неврологическим дефицитом.
Сопутствующий диагноз: Нарушение толерантности к углеводам. ХОБЛ I степени. Хронический бронхит. ДН I стадии. Атрофический гастрит. МКБ. Киста правой почки. Хронический пиелонефрит, н/ф. Хронический цистит, н/ф. Ожирение I степени. Аппендэктомия (2001 г.).
Результаты обследования: ЭКГ - ритм синусовый, ЧСС 74 удара в мин. Замедление в/предсердной проводимости. Гипертрофия, дистрофические изменения и систолическая перегрузка миокарда ЛЖ. В динамике без ухудшений, ЧСС 60 ударов в минуту; ЭХО-КГ - Сократительная способность миокарда ЛЖ умеренно снижена. Диастолическая дисфункция миокарда ЛЖ I типа. Склеротические изменения Ао, АК; ЦДС э/краниальных отделов брахиоцефальных артерий - Стенозы ОСА с двух сторон. Стеноз ВСА слева. КЭЭ справа (1994 г). Окклюзия ВСА справа; ЦДС артерий нижних конечностей - Нарушений гемодинамики не выявлено; Коронарография - Множественное окклюзионно-стенотическое поражение коронарного русла. ВГА с обеих сторон 3 мм. Тромбоз стентов ПКА; МСКТ экстракраниальных артерий - стенозы обеих ОСА и левой ВСА. Окклюзия правой ВСА. S-образная извитость левой ПА.
Генетический профиль: rs3775073 гена TLR6 генотип Т/Т, rs2234246 гена TREM-1 генотип Т/Т.
Результаты оценочной шкалы риска развития полиорганной недостаточности
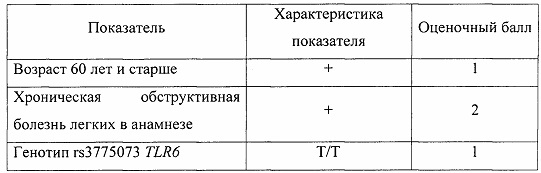

Суммарный показатель составил 5,5 баллов, что позволило сделать заключение о чрезвычайно высоком риске развития полиорганной недостаточности после коронарного шунтирования.
Операция «на работающем сердце» и ВАБК: бимаммарокоронарное шунтирование ПМЖВ и I ВТК. Длительность операции - 6 часов 00 минут. Время пережатия ПМЖВ=12 мин, ВТК=19 мин. Интероперационная кровопотеря в 1 сутки - 150 мл. EuroScore 3 (2,05%) SOFA до операции - 0 балл. SOFA в первые сутки после операции - 5 баллов.
Послеоперационный период протекал на фоне декомпенсации ХОБЛ с положительным эффектом на фоне консервативной терапии. По ЭКГ регистрировалось течение послеоперационного перикардита. На 5-е сутки послеоперационного периода выявлен диастаз тела грудины. После компенсации ХОБЛ и гипергликемии принято решение о ресторнотомии, пластики грудины, установки проточно-промывной системы. Проводилась консервативная терапия перевязки, функционировала промывная система. На 19-е сутки после оперативного вмешательства развился инфаркт миокарда со сложными нарушениями ритма, острая сердечно-сосудистая и дыхательная недостаточность. Отек легких. Отек головного мозга. На 20-е сутки констатирована биологическая смерть.
Изобретение относится к области медицины, в частности к медицинской генетике и сердечно-сосудистой хирургии. Предложен способ прогнозирования риска развития синдрома полиорганной недостаточности у пациентов после коронарного шунтирования. Проводят анализ клинико-анамнестических показателей и молекулярно-генетическое тестирование с определением полиморфизмов генов TLR6 и TREM-1. Каждому прогностическому критерию присваивают оценочный балл. Минимальный риск прогнозируют при сумме баллов от 0 до 2,5. Средний риск - при сумме от 3,0 до 4,0 баллов. Высокий риск - от 4,5 до 5,5 баллов. Изобретение обеспечивает эффективное прогнозирование риска развития синдрома полиорганной недостаточности после коронарного шунтирования путем определения полиморфизмов генов-кандидатов и расчета суммарного риска по оценочной шкале на основании баллового эквивалента. 7 табл., 3 пр.
Способ прогнозирования риска развития синдрома полиорганной недостаточности у пациентов после коронарного шунтирования, включающий анализ клинико-анамнестических показателей и молекулярно-генетическое тестирование с определением генотипов пациента по полиморфизмам генов TLR6 и TREM-1, отличающийся тем, что каждому прогностическому критерию присваивают оценочный балл, так возраст пациента от 60 лет и старше оценивают в 1 балл, наличие хронической обструктивной болезни легких в 2 балла, генотип Т/Т полиморфизма rs3775073 гена TLR6 - 1 балл, генотип Т/С полиморфизма rs3775073 гена TLR6 - 0,5 баллов, генотип Т/Т полиморфизма rs2234246 гена TREM-1 - 1,5 балла, генотип С/Т полиморфизма rs2234246 гена TREM-1 - 1 балл, а вероятный риск развития полиорганной недостаточности определяют по суммарному показателю оценочных баллов, выявленных критериев, когда минимальный риск прогнозируют при сумме баллов от 0 до 2,5, средний риск при сумме от 3,0 до 4,0 баллов, а высокий риск при суммарном значении от 4,5 до 5,5 баллов.
| СПОСОБ ПРОГНОЗИРОВАНИЯ РЕСПИРАТОРНОГО ДИСТРЕСС-СИНДРОМА ВЗРОСЛЫХ И ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТИ ПРИ КОРОНАРНОМ ШУНТИРОВАНИИ С ИСПОЛЬЗОВАНИЕМ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ | 1997 |
|
RU2138049C1 |
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ ОСЛОЖНЕННОГО СИСТЕМНОГО ВОСПАЛИТЕЛЬНОГО ОТВЕТА У ПАЦИЕНТОВ, ОПЕРИРОВАННЫХ В УСЛОВИЯХ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ | 2011 |
|
RU2463606C1 |
| GOLOVKIN A.S | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Cytokine | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
Авторы
Даты
2018-01-15—Публикация
2017-05-17—Подача