Последние три десятилетия заболеваемость раком почки в Европе непрерывно растет. В России по темпам прироста рак почки занимает первое место. Примерно у трети больных к моменту диагноза выявляются отдаленные метастазы, и у 30-40% возникает рецидив болезни. Рак почки - сложное гетерогенное заболевание характеризующийся рядом подтипов: светлоклеточный рак почки (СРП) (80% - 90%), папиллярный рак почки (6% - 15%), хромофобный рак почки (2% - 5%).
Рак почки не проявляется симптоматически до поздней стадии заболевания. Более 50% случаев рака почки выявляется случайно при проведении абдоминальной компьютерной томографии или ультразвуковом обследовании по другим медицинским показаниям. Однако эти методы, а также магниторезонансные изображения не позволяют надежно дифференцировать злокачественные опухоли от доброкачественных новообразований. Методы лабораторной диагностики в значительной мере являются косвенными. Поэтому все чаще используются биопсии, особенно в случаях рентгенологически неопределенной или малой массы почек, чтобы верифицировать диагноз. Подробно этот вопрос рассмотрен в рекомендациях Европейского общества урологов и других работах. Американская урологическая ассоциация также поддерживает проведение биопсии при малой массе опухоли. При анализе результатов 5228 биопсий была показана адекватность их использования для диагностики злокачественной опухоли. Вместе с тем, при использовании для биопсии менее травматичных тонких игл точность диагностики существенно снижается, что связывают с недостаточностью материала для гистологического исследования и зависимостью от квалификации гистолога, позволяющей идентифицировать опухоль.
Известен способ диагностики рака почки путем внутривенного введения Тс-димеркаптосукциновой кислоты, нефросцинтиграфии в течение первой минуты и полипозиционной нефросцинтиграфии через 4-5 ч и диагностики рака при совпадении повышенной или неравномерной васкуляризащш с дефектом накопления через 4-5 ч, отличающийся тем, что, с целью определения степени распространенности рака, дополнительно после полипозиционной ангионефросцинтиграфии проводят сцинтиграфию всего тела и при выявленииочага повышенного накопления в скелете диагностируют метастаз рака (SU 1135035).
Известен способ диагностики папиллярной почечноклеточной карциномы (ППК), включающий следующие стадии:
а) получение исходной пары образцов ткани от пациента, где один из образцов получен из предположительно пораженной раком ткани, а второй получен из прилегающей гистологически нормальной ткани ("условной нормы");
б) выделение и очистка препаратов РНК из исходной пары образцов;
в) синтез одноцепочечной или двуцепочечной кДНК на матрице РНК с использованием олигонуклеотидных праймеров;
г) проведение количественной реакции амплификации фрагмента гена CALL с использованием кДНК, полученной на стадии в), в качестве матрицы, и пары геноспецифичных олигонуклеотидных праймеров SEQ ID NO: 1 и 2;
После изложенного производят сравнение количества амплифицированного фрагмента ДНК CALL для образца, полученного из предположительно пораженной раком ткани, с количеством амплифицированного фрагмента ДНК для образца, полученного из нормальной ткани, где указанные количества амплифицированного фрагмента ДНК отражают изменение содержания мРНК гена CALL, причем уменьшение содержания мРНК гена CALL служит диагностическим признаком ППК.
При этом последовательность праймеров и зонда представлена SEQ ID NO: 1, 2 и 3. На стадии г) количественная реакция амплификации фрагмента гена CALL представляет собой ПЦР в режиме реального времени. На стадии д) в качестве внутреннего контроля для тканей почки используют гены GUSB и/или RPN1, кодирующие бета-глюкуронидазу и рибофорин 1 соответственно. Для реализации способа применяется набор праймеров и зонда для осуществления полимеразной цепной реакции в режиме реального времени для количественной оценки содержания мРНК гена CALL, имеющих последовательность SEQ ID NO: 1, 2 и 3. (RU 2014135723, решение о выдаче патента от 27.10.2016).
Известен способ диагностики светлоклеточной почечно-клеточной карциномы (СПК), включающий следующие стадии:
а) получение исходной пары образцов ткани от пациента, где один из образцов получен из предположительно пораженной раком ткани, а второй получен из прилегающей гистологически нормальной ткани («условной нормы»);
б) выделение и очистка препаратов РНК из исходной пары образцов;
в) синтез одноцепочечной или двуцепочечной кДНК на матрице РНК с использованием олигонуклеотидных праймеров;
г) проведение количественной реакции амплификации фрагмента гена NETO2 с использованием кДНК, полученной на стадии в), в качестве матрицы, и пары геноспецифичных олигонуклеотидных праймеров и зонда с последовательностями SEQ ID NO: 1, 2 и 3;
д) сравнение количества амплифицированного фрагмента ДНК NETO2 для образца, полученного из предположительно пораженной раком ткани, с количеством амплифицированного фрагмента ДНК для образца, полученного из нормальной ткани, где указанные количества амплифицированного фрагмента ДНК отражают изменение содержания мРНК гена NETO2, причем повышение содержания мРНК гена NETO2 служит диагностическим признаком СПК.
На стадии г) количественная реакция амплификации фрагмента гена NET02 представляет собой ПЦР в режиме реального времени.
На стадии д) в качестве внутреннего контроля для тканей почки используют гены GUSB и/или RPN1, кодирующие бета-глюкуронидазу и рибофорин 1 соответственно.
Для реализации способа применяется набор праймеров и зонда для осуществления полимеразной цепной реакции в режиме реального времени для количественной оценки содержания мРНК гена NETO2, имеющих последовательность SEQ ID NO: 1, 2 и 3.
(RU №2545998 по заявке 2012141232, прототип)
Недостатками известных способов являются невозможность ранней диагностики заболевания, длительность их реализации, неполная достоверность и трудность дифференциальной диагностики, т.е. возможности отличить светлоклеточный почечно-клеточный рак от других типов рака почки.
Проблемой, решаемой настоящим изобретением, является создание эффективного способа ранней диагностики рака почки и расширение арсенала способов диагностики рака почки. Для решения проблемы актуально развитие методов, позволяющих быстро и эффективно диагностировать опухоль.
Техническим результатом изобретения является повышение чувствительности, обеспечение быстрой дифференциальной диагностики, т.е. возможности отличить светлоклеточный почечно-клеточный рак от других типов рака почки, лучшая чувствительность и специфичность, а также возможность достоверной диагностики в целом почечно-клеточного рака, независимо от типа.
Сущность изобретения состоит в том, что способ диагностики рака почки заключается в том, что в качестве исследуемых образцов используют парные экспериментальные и контрольные образцы ткани почки в предположительно опухолевой и гистологически нормальной ткани пациента, соответственно, производят выделение и очистку РНК образцов, проверяют наличие и качество РНК на наличие четких полос 18S и 28S РНК при условии отсутствия детектируемой электрофоретически примеси ДНК, определяют концентрацию водного раствора РНК и осуществляют обратную транскрипцию РНК, перед которой выравнивают концентрации РНК образцов в опухолевой и нормальной ткани, после чего осуществляют количественное определение экспрессии мРНК ассоциированных с развитием рака почки генов в операционном материале парных образцов опухолевой и нормальной ткани с использованием полимеразной цепной реакции в реальном времени (ПЦР-РВ), предусматривающей детекцию и регистрацию интенсивности флуоресцентного сигнала репортерного красителя после каждого цикла для мониторинга ПЦР, после чего сравнивают относительные количества целевой последовательности мРНК генов в опухолевой и нормальной ткани как значения уровней экспрессии мРНК генов СА9, HIG2, STC2 в опухолевой ткани относительно нормальной, при этом повышенным или пониженным считают уровень экспрессии гена из группы СА9, HIG2, STC2 в опухоли, отличающийся в 2 и более раза от его экспрессии в нормальной ткани, причем указанное повышение содержания мРНК по меньшей мере одного гена из группы СА9, HIG2, STC2 служит диагностическим признаком скПКР.
Предпочтительно, для подготовки каждого исследуемого образца, составляют смесь общим объемом 25 мкл, содержащую: по 0,25 мкМ каждого оригинального олигонуклеотида (праймера); по 200 мкМ каждого нуклеозидтрифосфата; 1,0 единица активности taq - полимеразы (СибЭнзим, Россия); буфер для ПЦР (670 мМ трис pH 8,8, 166 мМ сульфата аммония, 20 мМ MgCl2 и 0,1% Tween20); интеркалирующий краситель SYBR Green1 0,1 мкл (100×), затем полученную смесь встряхивают на вортексе и центрифугируют в течение 5 с, а амплификацию проводят в термоциклере в режиме:
первоначальная денатурация 95°С - 15 мин

причем в диапазоне температуры 60,0°С - 95,0°С производят снятие кривой плавления ПЦР продуктов с шагом в 1°С.
Предпочтительно, для полимеразной цепной реакции в реальном времени (ПЦР-РВ) используют праймеры следующего состава:
- для ПЦР-РВ гена HIG2:
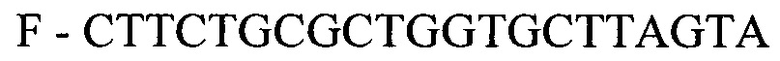
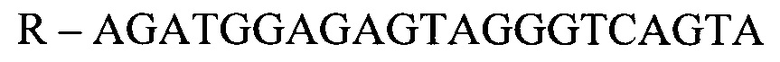
- для ПЦР-РВ гена СА9:
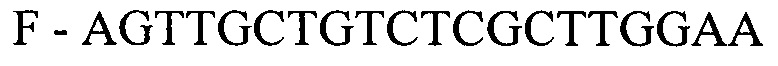
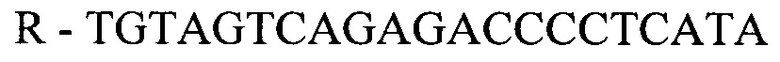
- для ПЦР-РВ гена STC2:
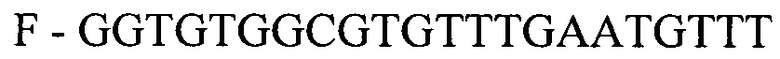
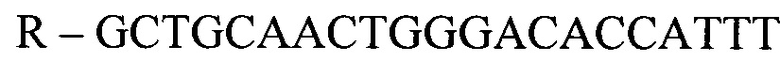 ,
,
где F и R - прямой и обратный праймеры, соответственно.
Предпочтительно, для подготовки каждого исследуемого образца, составляют смесь общим объемом 20 мкл, содержащую: 1 мкл TaqMan® Gene Expression Assay, 10 мкл TaqMan® Gene Expression Master Mix, 1,6 мкл комплементарной ДНК, полученной при обратной транскрипции, 7,4 мкл деионизированной воды, а затем полученную смесь встряхивают на вортексе и центрифугируют в течение 5 с, а амплификацию проводят в термоциклере в режиме:
50,0°С - 2 мин - 1 цикл
95,0°С - 10 мин - 1 цикл
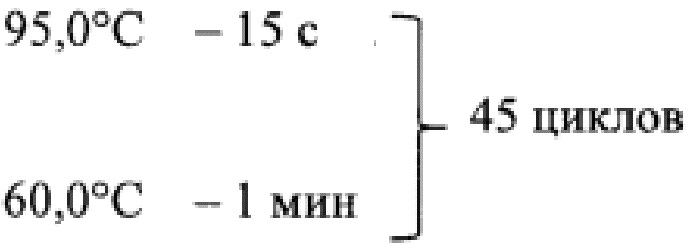
Предпочтительно, для количественного выражения транскрипции того или иного гена и получения значения сравниваемых уровней экспрессии генов в опухолевой ткани относительно нормальной используют контрольный ген GAPDH с определением значения уровней экспрессии мРНК этого гена.
Предпочтительно, проверяют наличие и качество РНК используя электрофорез в 1,8% агарозном геле, а концентрацию водного раствора РНК определяют на спектрофотометре.
Предпочтительно, обратную транскрипцию проводят, используя набор ImProm-II™ Reverse Transcriptase (Promega, США).
Предпочтительно, полимеразную цепную реакцию в реальном времени (ПЦР-РВ) проводят с использованием набора на основе 2-кратной универсальной реакционной смеси праймеров и флюоресцентно-меченного олигонуклеотида для каждого определяемого гена - СА9, HIG2, STC2 и гена контроля GAPDH.
При этом в случае пониженной экспрессии гена STC2 при повышенной экспрессии гена СА9 или HIG2 делают вывод о наличии дифференциального признака светлоклеточного почечно-клеточного рака.
Как правило, каждое определение экспрессии ассоциированных с развитием рака почки генов мРНК проводят трехкратно.
Способ диагностики рака почки реализуется следующим образом.
Полимеразная цепная реакция в реальном времени позволяет определять экспрессию генов в малом количестве клеток в образце злокачественной опухоли. В настоящей работе выявлены гены, дифференциальная экспрессия которых позволяет выявлять светлоклеточный почечно-клеточный рак (скПКР) с высокой чувствительностью и специфичностью.
Для количественной оценки уровня мРНК в образцах ткани почки (опухолевой и прилежащей условно нормальной) наиболее подходящим является метод полимеразной цепной реакции в реальном времени (ПЦР-РВ). Этот метод служит «золотым стандартом» для определения экспрессии мРНК.
Преимущество метода полимеразной цепной реакции в реальном времени (ПЦР-РВ) в том, что он позволяет выявить и определить количество исследуемых ДНК-мишеней непосредственно в экспериментальных образцах. Компьютерный анализ, отсутствие постамплификационных манипуляций, стандартизация результатов позволяют исключить субъективизм при их интерпретации, свести к минимуму риск загрязнения и связанных с ним ложноположительных результатов ПЦР, упростить и ускорить процедуру генодиагностики.
Система ПЦР-РВ основана на детекции и определении количества флуоресцентного репортерного красителя. Этот сигнал возрастает прямо пропорционально количеству ПЦР продукта в реакции. Благодаря записи интенсивности флуоресцентного сигнала после каждого цикла возможен мониторинг ПЦР во время экспоненциальной фазы, когда первое заметное увеличение количества ПЦР-продукта коррелирует с исходным содержанием матрицы. Чем больше стартовое количество копий ДНК-матрицы, тем раньше и значительнее наблюдается увеличение флуоресцентного сигнала. Чистота получаемого ПЦР продукта контролируется с помощью кривых плавления и в 8% ПААГ.
Для выделения РНК использовали набор RNeasy Mini Kit (QIAGEN, США). Выделение производили согласно инструкции к набору. Наличие и качество РНК проверяли, используя электрофорез в 1,8% агарозном геле. Качественными считали образцы РНК, демонстрирующие четкие полосы 18S и 28S РНК, без детектируемой электрофоретически примеси ДНК. Концентрацию водного раствора РНК определяли на спектрофотометре Nanodrop 1000 (Thermo Scientific, США). Обратную транскрипцию проводили, используя набор ImProm-II™ Reverse Transcriptase (Promega, США). Перед проведением реакции обратной транскрипции концентрации РНК выравнивались в контрольных и экспериментальных образцах. Количественное определение экспрессии генов осуществляли с использованием полимеразной цепной реакции в реальном времени (ПЦР-РВ) на приборе Step One Plus фирмы Applied Biosystems (США). Этот прибор позволяет одновременно исследовать 96 образцов, что реализует принцип множественного анализа экспрессии мРНК в операционном материале парных образцов ткани почки и может быть тиражирован в силу распространенности приборов такого типа. Каждое измерение проводили трехкратно. ПЦР-РВ проводили двумя способами:
1) на основе разработанной системы, включающей 25 мкл реакционной смеси следующего состава - по 0,25 мкМ каждого оригинального олигонуклеотида (праймера); по 200 мкМ каждого нуклеозидтрифосфата; 1,0 единица активности taq - полимеразы (СибЭнзим, Россия); буфер для ПЦР (670 мМ трис pH 8,8, 166 мМ сульфата аммония, 20 мМ MgCl2 и 0,1% Tween20); интеркалирующий краситель SYBR Green1 0,1 мкл (100×).
Праймеры (затравки) - это синтезированные олигонуклеотиды, комплементарные последовательности ДНК гена по краям амплифицируемого фрагмента ДНК. Каждый из праймеров комплементарен одной из цепей двуцепочечной матрицы и ограничивает начало и конец амплифицируемого участка.
Для ПЦР-РВ использовали праймеры следующего состава:
- для ПЦР-РВ гена HIG2:
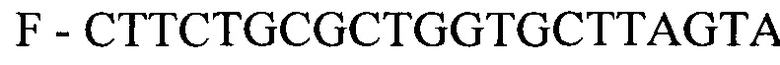
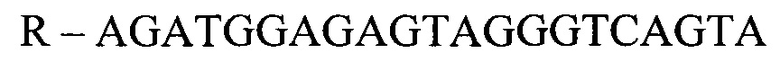
- для ПЦР-РВ гена СА9:
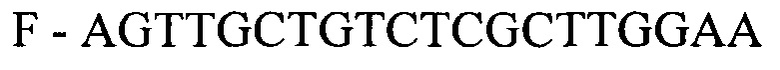
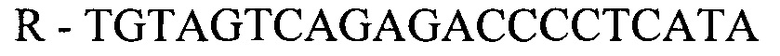
- для ПЦР-РВ гена STC2:
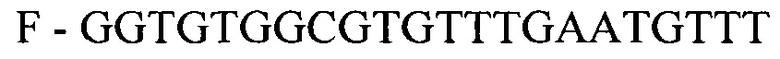
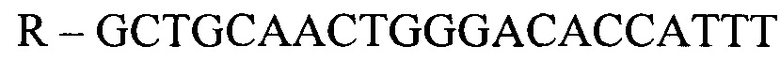
где F и R - прямой и обратный праймеры соответственно.
Определение последовательностей праймеров проводили с использованием последовательностей ДНК генов, приведенных в GenBank с идентификационными номерами Gene ID: 29923, Gene ID: 768, Gene ID: 8614 для генов HIG2, CA9 и STC2, соответственно.
Амплификацию проводили в следующем режиме: первоначальная денатурация 95°С - 15 мин

снятие кривой плавления 60°-95°С (шаг 1°С).
По кривой плавления определяют качество и специфичность ПЦР в реальном времени. При образовании только специфического продукта амплификации на кривой плавления имеется один пик температуры. При появлении неспецифического продукта амплификации (в случае отклонении от оптимальных условий) это отражается на кривой плавления в виде дополнительного широкого пика в области более низкой, по сравнению со специфическим продуктом, температуры. Таким образом, контроль специфичности ПЦР-РВ является необходимым этапом в анализе данных, полученных этим методом. В соответствии с нашими результатами такая оценка специфичности по температуре плавления соответствует электрофоретической, полученной с использованием чувствительного метода детекции результатов электрофореза. Анализ кривых плавления является достаточно чувствительным для обеспечения контроля вклада неспецифических продуктов амплификации ДНК в кинетические кривые.
2) С использованием наборов для определения экспрессии всех исследуемых генов производства Applied Biosystems (США) TaqMan® Gene Expression Assays в соответствии с инструкцией изготовителя. Для проведения реакции использовали наборы фирмы Applied Biosystems: TaqMan® Gene Expression Master Mix (2-кратная универсальная реакционная смесь для исследования уровня экспрессии генов методом ПЦР-РВ) и TaqMan® Gene Expression Assay (реакционная смесь праймеров и флюоресцентно-меченного олигонуклеотида) для каждого определяемого гена - СА9, HIG2, STC2 и гена контроля GAPDH.
Для каждого образца составлялась смесь общим объемом 20 мкл, содержавшая: 1 мкл TaqMan® Gene Expression Assay, 10 мкл TaqMan® Gene Expression Master Mix, 1,6 мкл комплементарной ДНК, 7,4 мкл деионизированной воды. Полученную смесь встряхивали на вортексе и центрифугировали в течение 5 с. Амплификацию проводили в термоциклере Step One Plus (Applied Biosystems, США) в режиме:
50,0°С - 2 мин - 1 цикл
95,0°С - 10 мин - 1 цикл
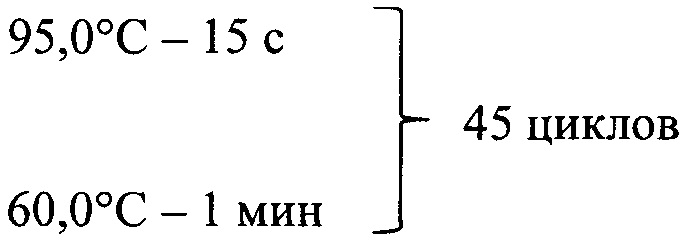
Для анализа полученных результатов использовали встроенную программу Applied Biosystems Step One Plus, которая позволяет сравнить относительные количества целевой последовательности РНК в опухолевой и нормальной ткани. Для количественного выражения транскрипции того или иного гена необходимо наличие эндогенного (внутреннего) контроля. Обычно для этого используются гены, характеризующиеся наиболее постоянной экспрессией, (так называемые «гены домашнего хозяйства»). В качестве контрольного использовали ген GAPDH. В результате обработки измерений получены значения уровней экспрессии генов в опухолевой ткани относительно нормальной. Повышенным или пониженным считали уровень экспрессии гена в опухоли, отличающийся в 2 и более раза от экспрессии в нормальной ткани.
Статистическую обработку результатов проводили с помощью пакета стандартных программ Statistica 10. Уровень значимости для выявленных различий принимали равным 0,01.
По результатам скринингового анализа экспрессии 200 генов в парных образцах опухоль рака почки/нормальная ткань почки были выбраны 5 генов, демонстрирующих наибольшую частоту повышенной экспрессии на 1-3 стадиях развития рака почки: СА9, NDUFA4L2, HIG2, EGLN3, STC2. Экспрессия указанных генов была изучена среди 45 парных образцов опухоль рака почки/нормальная ткань почки. Полученные частоты повышенной по отношению к контролю экспрессии при светлоклеточном почечно-клеточном раке (скПКР) приведены в таблице 1.
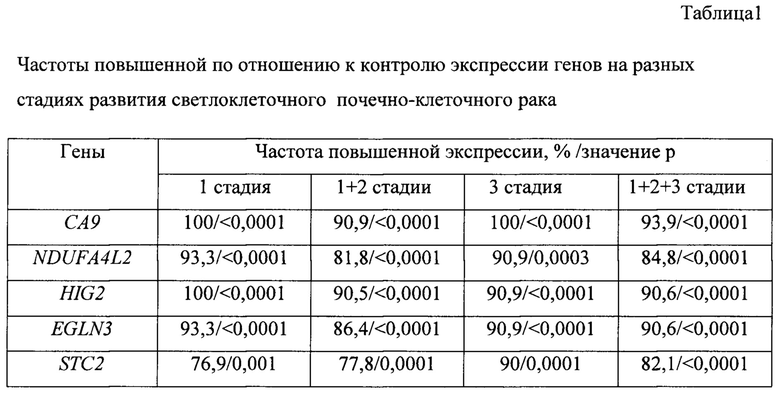
Как видно из данных в табл. 1, все изученные гены с высоким уровнем значимости повышенно экспрессируются относительно контроля на всех трех стадиях развития скПКР.
Ген СА9 (carbonic anhydrase IX) кодирует карбоксиангидразу 9-го типа, являющуюся трансмембранным членом семейства карбоксиангидраз. СА9 катализирует обратимое гидратирование диоксида углерода в гидрокарбонат, позволяя, таким образом, опухолевым клеткам поддерживать нейтральный pH внутри клетки, закисляя при этом внеклеточное микроокружение. Карбоксиангидраза 9 функционально вовлечена в раковую прогрессию как фактор, способствующий выживанию раковых клеток при гипоксии и ацидозе через регуляцию pH и клеточной адгезии и экспрессируется в опухолях при скПКР.
Ген EGLN3 (egl nine homolog 3; также именуемый как prolyl hydroxylase domain-containing protein 3, PHD3) кодирует гидроксилазу, экспрессия которой является HIF1 зависимой и способствует предупреждению апоптоза в клетках в условиях гипоксического стресса. При нормальных условиях PHD3 гидроксилирует HIF1A, который затем связывается с VHL, убиквитинируется и деградирует через протеосому. Была выявлена еще одна важная функция PHD3 - гидроксилирование и активация HIF1A коактиватора PKM2.
Ген HIG2 (hypoxia inducible gene 2), индуцируемый гипоксией ген 2, является важным стимулирующим фактором роста опухолевых клеток. В ряде работ было показано, что HIG2 является прямой мишенью HIF1 и принимают непосредственное участие в липидном обмене в условиях гипоксии при раке. Повышенная экспрессия HIG2 часто обнаруживается при скПКР и коррелирует с плохим прогнозом у пациентов.
Ген NDUFA4L2 (NADH dehydrogenase (ubiquinone) 1 alpha subcomplex subunit 4-like 2 дегидрогеназы (убихинон) 1 подкомплекса субъединица 4 типа) является компонентом дыхательной цепи в митохондриях. Эта субъединица 1 альфа подкомплекса дыхательной цепи, локализованного на внутренней стороне митохондриальной мембраны. Этот ген имеет выраженную зависимость экспрессии от гипоксии, более того в промоторе NDUFA4L2 обнаружены сайты связывания для HIF-1. Вероятно, физиологическая роль NDUFA4L2 заключается в тонкой регуляции окислительного фосфорилирования через взаимодействия с другими субъединицами внутри комплекса и гиперэкспрессия его при раке может коррелировать с нарушением энергетического метаболизма. Значение функционирования этого гена при раке почки изучено мало. Известно, что этот ген повышенно экспрессируется при скПКР и коррелирует с плохим прогнозом.
Ген STC2 (stanniocalcin 2) кодирует гликопротеиновый гормон, вовлеченный в почках в регуляцию транспорта кальция и фосфора. Станинокальцин 2 играет важную роль в ответе на неправильно сложенные белки. STC2 может выполнять роль позитивного регулятора опухолевой прогрессии при гипоксии.
Все изученные гены имеют существенные функции, связанные с развитием злокачественной опухоли. На основе полученных данных была проведена оценка чувствительности и специфичности при потенциальном использовании экспрессии указанных генов в качестве диагностических маркеров скПКР (таблица 2).
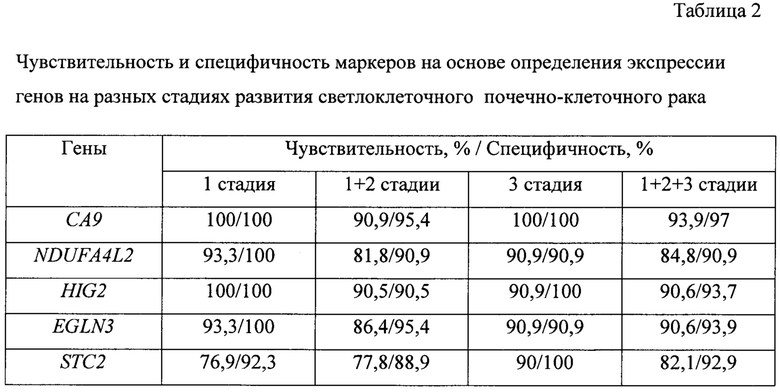
Полученные результаты демонстрируют хорошие показатели чувствительности и специфичности в определении скПКР для всех изученных генов на трех начальных стадиях прогрессии этого рака. Наилучшие показатели, особенно на первой стадии, наиболее важной для ранней диагностики, наблюдались для генов СА9 и HIG2.
Если для первой стадии полученные чувствительность и специфичность являются максимально возможными, то для опухолей, находящихся на других стадиях, эти величины несколько ниже. В связи с этим была проведена оценка возможности повышения чувствительности при определении двух генов. Одновременный анализ экспрессии генов СА9 и HIG2, при котором в расчет берется повышенная экспрессия хотя бы одного из этих генов, позволяет увеличить чувствительность выявления скПКР до 96,8% (95% ДИ: 81,7%-99,9%) при специфичности 92,9% (95% ДИ 76,5%-99,1%). Существенно, что в случае отрицательного результата теста вероятность отсутствия скПКР составляет 96,3% (95% ДИ: 81,0%-99,9%).
Хотя скПКР является преобладающим, на другие типы почечно-клеточного рака приходится 15%-20% случаев. Представляло интерес определить характер экспрессии изучаемых генов и при иных, чем светлоклеточный, типах рака. При изучении экспрессии генов СА9 и HIG2 в выборке из 12 образцов, включающей папиллярный, хромофобный раки и онкоцитому, было найдено повышение экспрессии какого-либо из этих генов в 41,7% случаев. При этом оказалось, что в таком же проценте случаев экспрессия СА9 понижена. Изучение всех пяти генов показало наибольшую частоту пониженной экспрессии при других, чем скПКР, типах опухолей для гена STC2 - 83,3% (р=0,0006). То есть ген STC2 с высокой частотой экспрессируется понижено относительно контроля в иных по отношению к светлоклеточному типах опухолей почки. Характеристики его экспрессии позволяют с чувствительностью 83,3% (95% ДИ: 51.59%-97.91%) и специфичностью 91,7% (95% ДИ: 61.52%-99.79%) детектировать эти типы ПКР. Пониженная экспрессия гена STC2 позволяет дифференцировать светлоклеточный и другие типы рака (р=0,0002).
Анализ панели из трех генов - СА9, HIG2 и STC2 - по схеме: экспрессия генов СА9 и HIG2 повышена, STC2 понижена, показал, что при скПКР одновременно повышенная экспрессия генов СА9 или HIG2 и пониженная экспрессия STC2 наблюдается в 3% случаев, при других типах ПКР был отмечен один такой случай.
Следовательно, экспрессионная панель из генов СА9, HIG2 и STC2 с высокой достоверностью позволяет диагностировать скПКР, отличая его от других типов почечно-клеточного рака. В целом, хотя разработанная панель ориентирована на диагностику скПКР, она позволяет выявлять и другие типы почечно-клеточного рака. Оценочно, почечно-клеточный рак в среднем может быть выявлен в 94% случаев исходя из долей светлоклеточного и других типов ПКР как 80% и 20% соответственно.
Повышенная экспрессия СА9 может быть связана с гипометилированием этого гена при скПКР. Для гена STC2 также характерно гипометилирование и повышение числа копий при светлоклеточном ПКР. Эти данные соответствуют цитогенетическим наблюдениям, указывающим на частую амплификацию хромосомы 5q, где находится STC2, при скПКР, и ее отсутствие при папиллярном и хромофобном раке почки. Более того, при хромофобном ПКР хромосома 5 часто делетирована. Приведенные результаты могут служить структурным основанием впервые выявленных нами отличий в уровне мРНК гена STC2 между случаями скПКР и других типов ПКР.
Компьютерный анализ, отсутствие при реализации данного способа постамплификационных манипуляций, стандартизация результатов позволяют исключить субъективизм при их интерпретации, свести к минимуму риск загрязнения и связанных с ним ложноположительных результатов ПЦР, упростить и ускорить процедуру генодиагностики.
Таким образом, разработан способ, в котором используется новая панель, включающая три гена (СА9, HIG2 и STC2), которая позволяет с высокой чувствительностью и специфичностью диагностировать ранний светлоклеточный рак почки, отличая его от других типов опухолей почки, на основе определения уровня мРНК методом ПЦР в реальном времени. Такой подход позволяет быстро (в течение 1 дня) диагностировать скПКР.
Кроме того, он открывает возможность неинвазивной диагностики рака почки в дальнейшем с помощью определения мРНК найденных диагностических генов в плазме крови пациентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования выживаемости больных светлоклеточным почечно-клеточным раком | 2018 |
|
RU2699792C1 |
| СПОСОБ ДИАГНОСТИКИ СВЕТЛОКЛЕТОЧНОЙ ПОЧЕЧНОКЛЕТОЧНОЙ КАРЦИНОМЫ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2545998C2 |
| СПОСОБ ДИАГНОСТИКИ ПАПИЛЛЯРНОЙ ПОЧЕЧНОКЛЕТОЧНОЙ КАРЦИНОМЫ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2014 |
|
RU2605829C2 |
| СПОСОБ ДИАГНОСТИКИ СВЕТЛОКЛЕТОЧНОЙ ПОЧЕЧНОКЛЕТОЧНОЙ КАРЦИНОМЫ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2545995C2 |
| СПОСОБ ДИАГНОСТИКИ СВЕТЛОКЛЕТОЧНОЙ ПОЧЕЧНОКЛЕТОЧНОЙ КАРЦИНОМЫ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2009 |
|
RU2393472C1 |
| СПОСОБ ПРОГНОЗА МЕТАСТАЗИРОВАНИЯ ОПУХОЛЕЙ РАКА ЖЕЛУДКА | 2021 |
|
RU2806432C2 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЧЕВОГО ПУЗЫРЯ (ВАРИАНТЫ) И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2011 |
|
RU2469323C2 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПО УРОВНЮ мРНК TGEβ и TNFα В ПЛАЗМЕ КРОВИ | 2019 |
|
RU2742209C1 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ И РАКА ЯИЧНИКОВ ПО УРОВНЮ мРНК ММР-9 В ПЛАЗМЕ КРОВИ | 2020 |
|
RU2745424C1 |
| СПОСОБ ДИАГНОСТИКИ РАКА ТОЛСТОЙ КИШКИ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2374647C1 |
Изобретение относится к области медицины и предназначено для диагностики светлоклеточного почечно-клеточного рака (скПКР). В качестве исследуемых образцов используют образцы ткани почки в предположительно опухолевой и гистологически нормальной ткани пациента. Проверяют наличие и качество РНК на наличие 18S и 28S при условии отсутствия детектируемой примеси ДНК. Осуществляют количественное определение экспрессии мРНК ассоциированных с развитием скПКР генов с использованием ПЦР-РВ. Сравнивают значения уровней экспрессии мРНК генов СА9, HIG2, STC2 в опухолевой ткани относительно нормальной. Повышенным или пониженным считают уровень экспрессии гена в опухоли, отличающийся в 2 и более раза от его экспрессии в нормальной ткани. В случае пониженной экспрессии гена STC2 при повышенной экспрессии гена СА9 или HIG2, делают вывод о наличии скПКР. Изобретение обеспечивает повышение чувствительности и достоверности диагностики почечно-клеточного рака. 8 з.п. ф-лы, 2 табл.
1. Способ диагностики светлоклеточного почечно-клеточного рака (скПКР), при котором в качестве исследуемых образцов используют парные экспериментальные и контрольные образцы ткани почки в предположительно опухолевой и гистологически нормальной ткани пациента, соответственно, производят выделение и очистку РНК образцов, проверяют наличие и качество РНК на наличие четких полос 18S и 28S РНК при условии отсутствия детектируемой электрофоретически примеси ДНК, определяют концентрацию водного раствора РНК и осуществляют обратную транскрипцию РНК, перед которой выравнивают концентрации РНК образцов в опухолевой и нормальной ткани, после чего осуществляют количественное определение экспрессии мРНК ассоциированных с развитием скПКР генов в операционном материале парных образцов опухолевой и нормальной ткани с использованием полимеразной цепной реакции в реальном времени (ПЦР-РВ), предусматривающей детекцию и регистрацию интенсивности флуоресцентного сигнала репортерного красителя после каждого цикла для мониторинга ПЦР, после чего сравнивают относительные количества целевой последовательности мРНК генов в опухолевой и нормальной ткани как значения уровней экспрессии мРНК генов СА9, HIG2, STC2 в опухолевой ткани относительно нормальной, при этом повышенным или пониженным считают уровень экспрессии гена из группы СА9, HIG2, STC2 в опухоли, отличающийся в 2 и более раза от его экспрессии в нормальной ткани, и, в случае пониженной экспрессии гена STC2 при повышенной экспрессии гена СА9 или HIG2, делают вывод о наличии скПКР.
2. Способ по п.1, отличающийся тем, что для подготовки каждого исследуемого образца составляют смесь общим объемом 25 мкл, содержащую: по 0,25 мкМ каждого оригинального олигонуклеотида (праймера); по 200 мкМ каждого нуклеозидтрифосфата; 1,0 единица активности Taq - полимеразы (СибЭнзим, Россия); буфер для ПЦР (670 мМ трис рН 8,8, 166 мМ сульфата аммония, 20 мМ MgCl2 и 0,1% Tween20); интеркалирующий краситель SYBR Greenl 0,1 мкл (100х), затем полученную смесь встряхивают на вортексе и центрифугируют в течение 5 с, а амплификацию проводят в термоциклере в режиме:
первоначальная денатурация 95°С - 15 мин
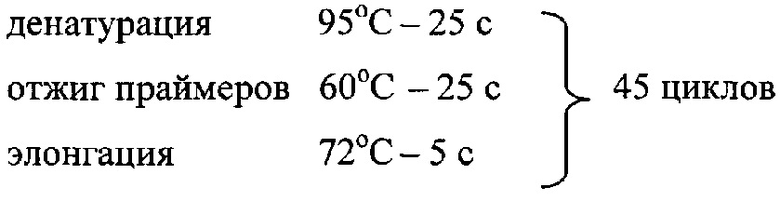
денатурация 95°С - 15 с,
причем в диапазоне температуры 60,0°С-95,0°С производят снятие кривой плавления ПЦР продуктов с шагом в 1°С.
3. Способ по любому из пп. 1, 2, отличающийся тем, что для полимеразной цепной реакции в реальном времени (ПЦР-РВ) используют праймеры следующего состава:
- для ПЦР-РВ гена HIG2:
F - CTTCTGCGCTGGTGCTTAGTA
R - AGATGGAGAGTAGGGTCAGTA
- для ПЦР-РВ гена СА9:
F - AGTTGCTGTCTCGCTTGGAA
R - TGTAGTCAGAGACCCCTCATA
- для ПЦР-РВ гена STC2:
F - GGTGTGGCGTGTTTGAATGTTT
R - GCTGCAACTGGGACACCATTT,
где F и R - прямой и обратный праймеры соответственно.
4. Способ по п. 1, отличающийся тем, что для подготовки каждого исследуемого образца составляют смесь общим объемом 20 мкл, содержащую: 1 мкл TaqMan® Gene Expression Assay, 10 мкл TaqMan ® Gene Expression Master Mix, 1,6 мкл комплементарной ДНК, полученной при обратной транскрипции, 7,4 мкл деионизированной воды, а затем полученную смесь встряхивают на вортексе и центрифугируют в течение 5 с, а амплификацию проводят в термоциклере в режиме:
50,0°С - 2 мин - 1 цикл
95,0°С - 10 мин - 1 цикл
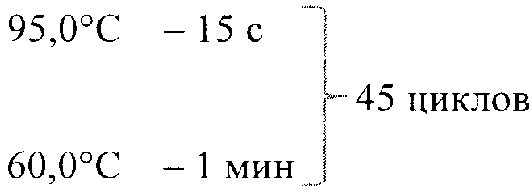
5. Способ по любому из пп. 1, 2, 4, отличающийся тем, что для количественного выражения транскрипции того или иного гена и получения значения сравниваемых уровней экспрессии генов в опухолевой ткани относительно нормальной используют контрольный ген GAPDH с определением значения уровней экспрессии мРНК этого гена.
6. Способ по любому из пп. 1, 2, 4, отличающийся тем, что проверяют наличие и качество РНК, используя электрофорез в 1,8% агарозном геле, а концентрацию водного раствора РНК определяют на спектрофотометре.
7. Способ по любому из пп. 1-4, отличающийся тем, что обратную транскрипцию проводят, используя набор ImProm-II™ Reverse Transcriptase (Promega, США).
8. Способ по любому из пп. 1, 2, 4, отличающийся тем, что полимеразную цепную реакцию в реальном времени (ПЦР-РВ) проводят с использованием набора на основе 2-кратной универсальной реакционной смеси праймеров и флюоресцентно-меченного олигонуклеотида для каждого определяемого гена - СА9, HIG2, STC2 и гена контроля GAPDH.
9. Способ по любому из пп. 1, 2, 4, отличающийся тем, что каждое определение экспрессии ассоциированных с развитием скПКР генов мРНК проводят трехкратно.
| СПОСОБ ДИАГНОСТИКИ СВЕТЛОКЛЕТОЧНОЙ ПОЧЕЧНОКЛЕТОЧНОЙ КАРЦИНОМЫ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2545998C2 |
| GIRGIS A.H | |||
| et al | |||
| Multilevel whole-genome analysis reveals candidate biomarkers in clear cell renal cell carcinoma | |||
| Cancer Res | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| OSUNKOYA A.O | |||
| et al | |||
| Diagnostic biomarkers for renal cell carcinoma: selection using novel bioinformatics systems for microarray data analysis | |||
| Hum Pathol | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Найдено из Интернет: URL: https://www.ncbi.nlm.nih.gov/pubmed/19695674 | |||
| TOGASHI A | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Cancer Res | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
Авторы
Даты
2018-02-02—Публикация
2016-12-26—Подача