По настоящей заявке испрашивается приоритет предварительной заявки на патент Австралии 2010904233, которая была подана 20 сентября 2010 и озаглавленная «Получение сыворотки», содержание которой вводятся в настоящее описание в качестве ссылки.
Область, к которой относится изобретение
В общих чертах, настоящее изобретение относится к прокоагулянтам, которые могут быть использованы в целях получения высококачественных проб сыворотки крови для анализов на патологию и других биологических анализов.
Предшествующий уровень
Устройства для забора крови, включая пробирки, используются для забора крови в целях получения сыворотки или плазмы, которые, в свою очередь, используются для биохимических или других лабораторных анализов.
Сыворотку получают путем свертывания пробы крови и последующего центрифугирования этой пробы для отделения сгустка крови, включая клетки, от сыворотки. В настоящее время используются пластиковые пробирки (вместо стеклянных) и для ускорения процесса свертывания крови необходимо применение прокоагулянтов (в большинстве случаев, тонко измельченных частиц двуокиси кремния). Для проведения биологических анализов предпочтительно использовать сыворотку, а не плазму, если только этот анализ не является срочным, поскольку, известно, что свертывание крови в пробирке для получения сыворотки происходит очень медленно. В большинстве пробирок, выпускаемых промышленностью, даже в присутствии прокоагулянтов, минимальное время, необходимое для свертывания крови, рекомендованное производителями, составляет 30 минут для проб крови, взятых у здоровых пациентов, и гораздо больше (обычно 60 минут или более) для проб, взятых у пациентов, которым были введены терапевтические антикоагулянты, такие как варфарин или гепарин. Для забора проб у пациентов в экстренных ситуациях (в отделениях скорой помощи, в отделениях интенсивной терапии и операционных и т.п.), такое время является слишком продолжительным, а поэтому, в этих случаях, предпочтительнее использовать плазму, которая может быть получена гораздо быстрее, чем сыворотка. Альтернативным средством достижения этой цели является получение пробирок для забора крови в целях получения сыворотки, которые были недавно разработаны компанией Becton-Dickinson (и известны под названием BD Rapid Serum Tube, BDT или BD RST), и которые содержат тромбин, предназначенный для повышения скорости и степени свертывания крови в пробах крови.
Плазму получают путем забора крови в пробирки, содержащие антикоагулянты, и последующего центрифугирования, которое может быть осуществлено сразу после забора крови в целях отделения клеток и получения плазмы для анализа. В этих пробирках, наиболее часто используемым антикоагулянтом является литий-гепарин. Другими антикоагулянтами, используемыми в некоторых пробирках в целях получения плазмы для оценки небольшого числа других аналитов, используются цитрат, фторид натрия/оксалат калия и EDTA.
Неполное свертывание
В процессе свертывания крови при получении пробы сыворотки происходит превращение фибриногена в фибрин и захват тромбоцитов и других клеток фибриновой сетью. После центрифугирования, сыворотку отделяют от сгустка крови либо с помощью сепаратора сыворотки, имеющегося в устройстве для забора крови, либо путем взятия аликвот сыворотки и помещения их во второй контейнер для предупреждения контактов с клетками. Такое разделение позволяет пробе оставаться стабильной в течение продолжительного периода времени. Такая стабильность является очень важным фактором, особенно в том случае, если пробы анализируют не сразу, или если требуется проведение повторного анализа или дополнительных анализов.
В некоторых пробах сыворотки, после рекомендованного времени ожидания, свертывание происходит не полностью. Такая проблема неполного свертывания особенно актуальна для пациентов, подвергающихся антикоагулятной терапии, либо в случае сбора проб при пункциях или при введении канюли с использованием антикоагулянтов. В процессе забора крови, образец может быть также загрязнен антикоагулянтами. Свертывание такой крови может происходить гораздо дольше, чем указывается производителями, либо она, фактически, никогда не будет полностью свертываться в стандартной пробирке для получения сыворотки (например, кровь, взятая у пациентов, подвергнутых хирургической операции на сердце, которые были полностью гепаринизированы). Если пробу сыворотки подвергали центрифугированию еще до завершения свертывания, то свертывание может еще продолжаться в сыворотке и приводить к образованию сгустков, микросгустков или фибриновых нитей, что может создавать определенные проблемы в проведении анализов и в определении аналитов. Образование микросгустков и фибриногеновых нитей во время получения пробы может также происходить в пробирках с плазмой, особенно при их хранении при низких температурах. Если после забора крови, пробирки с литий-гепарином периодически не переворачивать, то это может приводить к образованию небольших сгустков вокруг резиновой пробки. Капельки крови, которая не является гепаринизированной, со временем будут свертываться, и эти сгустки уже не будут разлагаться после гепаринизации.
Даже самые мельчайшие сгустки могут давать клинически значимые ошибки при анализе. Таким образом, для получения точных результатов, образцы должны быть оценены визуально или с использованием автоматических систем детектирования, если они позволяют определить отсутствие фибриновых нитей или сгустков. В случае присутствия нитей или сгустков нерастворимого вещества необходимо взятие части из пробы и ее помещения в новый контейнер, и осуществление повторного центрифугирования перед проведением тест-анализа. Пробы, которые подвергаются повторному латентному свертыванию, могут быть перенесены в пробирку с литий-гепарином для остановки процесса свертывания. Этот процесс занимает дополнительное время. Кроме того, фибриновые нити или сгустки не всегда могут быть обнаружены (например, они могут быть обнаружены даже после взятия проб лаборантом), и последующие ошибки выборочного исследования могут повлиять на назначение лечения пациенту, основанное на неточных результатах анализа.
Загрязнение пробирок с плазмой клетками
Пробы, полученные в пробирках с плазмой, а в частности, с плазмой, обработанной литий-гепарином, могут быть загрязнены клетками. В пробирках с гелем, включающим литий-гепарин, при их центрифугировании, всегда присутствует небольшой «слой, напоминающий лейкоцитарную пленку» и покрывающий гель, находящийся на дне пробирки с плазмой. Этот слой содержит фибрин, клетки и клеточную строму. Быстрое движение геля в процессе центрифугирования приводит к сохранению некоторого числа клеток в плазме. При смешивании пробы плазмы (например, в процессе взятия части из пробы или в процессе обработки), она становится мутной, что обусловлено наличием суспензии клеточного материала и фибрина, которая нарушает целостность пробы. Кроме того могут образовываться агрегаты тромбоцитов, которые могут также содержать фибрин и/или лейкоциты. Эти агрегаты могут быть достаточно крупными, то есть различимыми невооруженным глазом, и называются «состоящим из частиц белым веществом» из-за их типичного белого цвета, и такие агрегаты создают проблемы, аналогичные обсуждаемым выше проблемам, связанным с неполным свертыванием.
Присутствие клеток в пробе может влиять на концентрации аналита. Концентрации некоторых аналитов (например, глюкозы) могут снижаться под действием клеточной активности, а концентрации других аналитов (например, лактат-дегидрогеназы, калия, фосфата) могут повышаться в результате утечки или лизиса клеток.
Взаимодействия аналитов
Хотя обычно концентрации аналитов, измеренные в пробирках с сывороткой или плазмой, не отличаются друг от друга, однако имеются некоторые исключения.
Пробирки для получения плазмы, в которых используется гепарин, являются неподходящими для анализов на присутствие гепарина или клеток. Пробирки с плазмой, включающие литий-гепарин, являются неподходящими для анализа на литий. Плазма может оказаться ненадежной для проведения дополнительных анализов или повторных анализов из-за присутствия клеток и образования нерастворимого фибрина после длительного хранения при 2-8°C.
Кроме того, имеются сообщения о том, что некоторые пробирки с сывороткой или плазмой давали неточные результаты в отношении уровней аналитов, что обусловлено их взаимодействием с прокоагулянтами или антикоагулянтами в пробирках, или с другими веществами (Ciuti et al., 1989; Cowley et al., 1985; Davidson et al., 2006; Dimeski et al., 2004; Dimeski et al., 2005; Dimeski et al., 2010; Hartland et al., 1999; Miles et al., 2004; O’Keane et al., 2006; Wannaslip et al., 2006).
Размер пробы
Для снижения объема крови, забираемой у пациентов, желательно уменьшить размер пробы, необходимой для анализа, особенно у тяжело больных пациентов, пациентов, подвергающихся переливанию крови и у детей. Поэтому, оптимальным размером пробы должна быть такая проба, которая позволяет провести все необходимые анализы с использованием лишь одной пробирки для забора крови. Для этого были разработаны методы анализа с использованием очень небольших объемов проб (например, 2 мкл), таких, чтобы одна пробирка с сывороткой или плазмой могла быть использована по меньшей мере для 21 анализа, но, при этом, она могла бы быть использована для 50-60 или даже 70-80 анализов, в зависимости от объема пробы, необходимого для каждого анализа. Однако там, где возникают сомнения в точности определения концентрации конкретного аналита в пробирке с сывороткой или плазмой, то может оказаться необходимым использование как пробирки для получения сыворотки, так и пробирки для получения плазмы пациента, что не позволяет достичь желаемой цели по снижению объема крови, забираемой у пациента.
В общих чертах, следует отметить, что проблемы, связанные с использованием современных способов получения сыворотки и плазмы из крови, указывают на то, что для получения своевременных надежных результатов анализов проб крови более широкого ряда необходима разработка более совершенных способов.
Активаторы протромбина, происходящие от змеиного яда
Многие змеиные яды содержат активаторы протромбина, способствующие быстрому свертыванию крови у их жертвы. Такими активаторами протромбина являются протеолитические ферменты, которые превращают протромбин, присутствующий в крови, в тромбин, что в свою очередь вызывает свертывание крови.
Хотя известно, что активаторы протромбина змеиного яда представляют собой прокоагулянты, однако также известно, что они обладают протеолитической активностью, подобной трипсиновой активности (Schieck et al., 1972; Parker, H. W. and Grandison A. G. C., 1977; Masci, P. P., 1986; Nicholson et al., 2006; Lavin and Masci, 2009). Считается, что активаторы протромбина, в результате эволюционных изменений, приобрели прокоагулянтные и протеолитические свойства, то есть они могут убивать или поражать жертву (Masci, P. P., 1986, страница 143). Так, например, было показано, что экарин (активатор протромбина, выделенный из яда змеи Echis carinatus) обладает прокоагулянтной активностью, а также некоторыми другими протеолитическими свойствами, такими как фибриногенолиз, желатинолиз, казеинолиз и геморагия (Schieck et al., 1972), а активатор протромбина, выделенный из яда змеи Pseudonaja textilis (PtPA) обладает активностью, направленной против ряда хромогенных пептидных субстратов для различных протеолитических ферментов (Masci, P.P., 1986).
Многие анализы аналитов, которые могут быть осуществлены на пробах крови, сыворотки или плазмы, содержащих белки, включают анализы на выявление белков-аналитов (например, общего белка, альбумина); анализы на ферментативную активность белков крови (например, гамма-глутамил-транспептидазы, используемой в анализе на гамма-глутамил-трансферазу, аспартат-аминотрансферазу, лактат-дегидрогеназу, креатин-киназу, липазу); анализы с использованием белков в качестве реагентов (например, иммуноанализы); анализы с использованием ферментов в аналитическом методе (например, глюкозо-оксидазы). Другими обычно проводимыми анализами с использованием белка являются анализы на глюкозу, мочевину, урат, аланин-аминотрансферазу, креатин-киназу, холестерин липопротеина высокой плотности, холестерин, триглицериды, трансферрин, реактивный белок С, тропонин, кортизол, свободный тироксин, свободный трииодтиронин, тиреотропный фактор и ферритин.
Поэтому, эти активаторы протромбина змеиного яда, несмотря на их прокоагулянтные свойства, никогда не рассматривались как кандидаты на их использование в пробирках с сывороткой для анализов аналитов, из-за их протеолитической активности, которая приводит к разложению исследуемых аналитов (например, если аналитом является белок), или к разложению белков, используемых в реакции для оценки уровней аналита (например, если анализ аналита проводят с использованием белка, такого как глюкозо-оксидаза).
Пробирки с тромбином
Недавно промышленностью стали выпускаться тромбинсодержащие пробирки такие, как пробирки для «более быстрого» свертывания крови, поскольку известно, что тромбин обладает прокоагулянтной и протеолитической активностью, а также, известно, что тромбин обладает высокой специфичностью в отношении разрыва связей в фибриногене, в активированном белке С (APC) и в факторе Va. Поэтому, в отличие от известной трипсин-подобной активности активаторов протромбина змеиного яда, тромбин, предположительно, не влияет на результаты анализа аналита.
В исследованиях, на основе которых было разработано настоящее изобретение, было обнаружено, что тромбинсодержащие пробирки не могут быть использованы для всех проб крови. Известно, что тромбин быстро и полностью ингибируется комплексом гепарин-антитромбин III, присутствующим в гепаринизированных пробах крови. В исследованиях с использованием пробирок BD RST было обнаружено, что эти пробирки являются непригодными для свертывания взятых у пациента проб крови, содержащих высокие дозы гепарина (Dimeski et al., 2010).
Разработка настоящего изобретения
Авторами настоящего изобретения неожиданно было обнаружено, что при использовании устройств для забора крови, включая пробирки, активаторы протромбина обычно способны продуцировать за приемлемый промежуток времени высококачественную сыворотку из проб крови широкого ряда (включая пробы крови, взятой у пациентов, подвергнутых терапии высокими концентрациями прокоагулянтов, включая гепарин), снижать время, затрачиваемое на получение проб сыворотки, а также риск возникновения проблем при проведении анализа, связанных с неполным свертыванием и контаминации клетками и клеточными компонентами.
Кроме того, авторами настоящего изобретения было также неожиданно обнаружено, что пробы сыворотки, полученные из проб крови путем добавления активаторов протромбина, давали такие же результаты при проведении стандартных биохимических анализов широкого ряда, как и анализы проб сыворотки, полученных в стандартных пробирках для забора крови.
Такое открытие позволяет предположить, что активаторы протромбина могут быть использованы в целях получения сыворотки для анализа аналитов широкого ряда, и адаптированы для применения в контейнерах для забора крови в целях получения проб сыворотки, используемых для детектирования аналитов, для проведения родственных анализов и методов, описанных ниже.
Описание сущности изобретения
В соответствии с одним из аспектов, настоящее изобретение относится к применению коагулирующей композиции, содержащей активатор протромбина или, в основном, состоящей, или состоящей из активатора протромбина, в целях получения пробы сыворотки, которая может быть использована для детектирования аналита.
Активатор протромбина (иногда называемый протромбиназой), обладает соответствующей трипсин-подобной активностью и активирует протромбин (то есть превращает протромбин в тромбин).
Настоящее изобретение также относится к контейнеру для получения пробы сыворотки, которая может быть использована для детектирования представляющего интерес аналита, присутствующего в пробе, где контейнер содержит коагулирующую композицию, содержащую активатор протромбина или, в основном, состоящую, или состоящую из активатора протромбина, определенного в настоящей заявке.
В другом своем аспекте, настоящее изобретение относится к применению коагулирующей композиции, содержащей активатор протромбина или, в основном, состоящей, или состоящей из активатора протромбина, определенного в настоящей заявке, в целях получения или изготовления контейнера для получения пробы сыворотки, которая может быть использована для детектирования аналита. В другом своем аспекте, настоящее изобретение относится к контейнеру, включающему коагулирующую композицию, содержащую активатор протромбина или, в основном, состоящую, или состоящую из активатора протромбина, определенного в настоящей заявке, и пробу крови, где указанный контейнер применяется в целях получения пробы сыворотки, которая может быть использована для детектирования аналита.
В другом аспекте, настоящее изобретение относится к способу получения пробы сыворотки для детектирования представляющего интерес аналита, где указанный способ включает контактирование пробы крови с коагулирующей композицией, содержащей активатор протромбина или, в основном, состоящей, или состоящей из активатора протромбина, определенного в настоящей заявке, в течение периода времени и в условиях, достаточных для получения пробы сыворотки. В соответствии с этим, способ осуществляют в контейнере, который в общих чертах определен выше. В соответствии с этим, кровь приводят в контакт с коагулирующей композицией в течение периода времени и в условиях, достаточных для получения пробы сыворотки и коагулированных клеток. В соответствии с этим, способ также включает отделение пробы сыворотки от коагулированных клеток. В некоторых вариантах осуществления изобретения, способ также включает смешивание коагулирующей композиции и пробы крови, которое осуществляют с использованием контейнера, содержащего пробу крови, путем добавления в этот контейнер коагулирующей композиции, или с использованием контейнера, содержащего коагулирующую композицию, путем добавления или сбора в этот контейнер проб крови.
Настоящее изобретение также относится к пробе сыворотки, полученной путем осуществления контакта пробы крови с коагулирующей композицией, описанной в общих чертах выше, в течение периода времени и в условиях, достаточных для получения пробы сыворотки.
Настоящее изобретение также относится к способам детектирования представляющего интерес аналита. В общих чертах, эти способы, по существу, включают анализ пробы сыворотки, полученной способом согласно изобретению, на присутствие или количество представляющего интерес аналита.
Настоящее изобретение также относится к способам определения наличия, отсутствия или тяжести заболевания или состояния у индивидуума, где наличие, отсутствие или тяжесть заболевания, или состояния связаны с присутствием, отсутствием или аберрантным количеством представляющего интерес аналита у индивидуума. Обычно, эти способы включают получение пробы сыворотки, полученной методами, которые в общих чертах описаны выше; и детектирование присутствия, отсутствия или аберрантного количества аналита в пробе сыворотки в целях определения наличия, отсутствия или тяжести заболевания или состояния у индивидуума.
Краткое описание последовательностей
Ниже приводится краткое описание последовательностей, представленных в Списке последовательностей.
Pseudechis porphyriacus
Краткое описание чертежей
На фигуре 1 показан профиль элюирования при выделении экарина, каринактивазы-1 и каринактивазы-2 из яда E. carinatus посредством гель-фильтрации на колонке с Superdex 200, как описано в примере 1a. Яд E. carinatus (157 мг, 122 единицы A280) подвергали гель-фильтрации на Superdex 200 (2,5×95 см) с использованием 0,05 M трис-HCl-буфера при pH 8,0. Объединенные фракции (28,3 единицы A280) трех активаторов протромбина (экарина, каринактивазы-1 и каринактивазы-2) показаны чертой.
На фигуре 2 показан профиль элюирования при хроматографии на сефарозе Blue для активных (прокоагулянтных) фракций, полученных с помощью гель-фильтрации на Superdex 200, как описано в примере 1a (также показано на фигуре 1). Активные фракции подвергали колоночной хроматографии на сефарозе Blue и элюировали линейным градиентом NaCl. Было собрано 3 мл фракций. Эти фракции, показанные горизонтальными линиями, представляют собой объединенные фракции каринактивазы-1, каринактивазы-2 и экарина соответственно.
На фигуре 3 показан профиль элюирования при хроматографии разведенного яда P. textilis (50 мг в 5 мл) на колонке (2,5×95 см) с сефакрилом S-300 в 0,05М трис-HCl-буфере, pH 7,4; 4°C; скорость потока, 17 мл/ч; A280 (●); удельная активность S-2222 (○); «A» и «B» представляют пустой объем (167 мл) и объем элюирования пика активности S-2222 (250 мл) соответственно, как описано в примере 1b.
На фигуре 4 показан профиль элюирования яда P. textilis (1 г:30 мл) при проведении аффинной хроматографии на Con A-сефарозе, как описано в примере 1b. Стрелкой показано положение введения 0,2 M метил-α-D-маннопиранозида для элюирования PtPA (отмеченного «a»).
На фигуре 5 представлены результаты электрофореза в нативном ПААГ при pH 8,6 для объединенных фракций, помеченных «a» на фигуре 4, где дорожка A соответствует 25 мкг, а дорожка В соответствует 50 мкг.
На фигуре 6 представлены результаты электрофореза в нативном ПААГ при pH 8,6 для очищенного PtPA, где гель был окрашен кумасси синим, а гель-дубликат разрезали на 5 мм-срезы, каждый из которых уравновешивали 1 мл аналитической смеси S-2222 для определения локализации активности, как описано в примере 1b. На этом графике представлена кривая зависимости активности S-2222 (по оси Y отложена «Скорость гидролиза S-222 (ΔΑ410/мин)») от числа гелевых срезов (по оси X отложено «Число гелевых срезов»).
На фигуре 7 представлены результаты электрофореза в ДСН-ПААГ для аффинно очищенных препаратов PtPA и OsPA в восстанавливающих условиях и в невосстанавливающих условиях, как описано в примере 1b, где дорожки (слева направо) представляют собой: маркер; восст. OsPA (1 мг/мл); восст. PtPA (1 мг/мл); восст. OsPA (2 мг/мл); восст. PtPA (2 мг/мл); невосст. OsPA (1 мг/мл); невосст. PtPA (1 мг/мл); невосст. OsPA (2 мг/мл); невосст. PtPA (2 мг/мл); маркер, где «восст.» означает компоненты в присутствии β-меркаптоэтанола (то есть восстановленные), а «невосст.» означает компоненты в отсутствие β-меркаптоэтанола (то есть невосстановленные).
На фигуре 8 представлен профиль элюирования при выделении нотекарина из яда N. scutatus с помощью хроматографии на Sephacryl S-300, как описано в примере 1c. Объединенные фракции нотекарина показаны чертой над обозначением «PA».
На фигуре 9 представлены результаты электрофореза в нативном ПААГ при pH 8,9 для активаторов протромбина: каринактивазы-1, каринактивазы-2, экарина, PtPA, OsPA и нотекарина, полученных, как описано в примерах 1a, 1b и 1c. На этой фигуре, цифры означают: (I) протромбин; (II) альфа-тромбин; (III) экарин; (IV) каринактивазу-1; (V) каринактивазу-2; (VI) PtPA; (VII) OsPA; (VIII) нотекарин (загружали 20 мкг каждого активатора протромбина).
На фигуре 10 представлена ДСН-ПААГ-характеризация активаторов протромбина, полученных, как описано в примерах 1a, 1b и 1c, в присутствии β-меркаптоэтанола, где дорожки соответствуют: (1) каринактивазе-1; (2) каринактивазе-2; (3) экарину; (4) PtPA; (5) OsPA; (6) нотекарину; (7) тромбину; и (M) маркеру молекулярной массы.
На фигуре 11 представлена ДСН-ПААГ-характеризация активаторов протромбина, полученных, как описано в примерах 1a, 1b и 1c, в отсутствие β-меркаптоэтанола, где дорожки соответствуют: (1) каринактивазе-1; (2) каринактивазе-2; (3) экарину; (4) PtPA; (5) OsPA; (6) нотекарину; (7) тромбину; и (M) маркеру молекулярной массы.
На фигуре 12 проиллюстрирован электрофорез в ПААГ с ДСН в отсутствие β-меркаптоэтанола (A) и в присутствии β- меркаптоэтанола (B) для образцов, инкубированных в течение 5 минут при комнатной температуре в присутствии 5 мМ Ca2+, и в присутствии следующих активаторов протромбина: каринактивазы-1 (дорожка 2); каринактивазы-2 (дорожка 3); экарина (дорожка 4); PtPA (дорожка 5); OsPA (дорожка 6); нотекарина (дорожка 7). На дорожке 1 показан образец протромбина человека только в буфере (без активатора протромбина), на дорожке 8 показан образец α-тромбина высокой степени очистки (без активатора протромбина), а "m" означает маркер молекулярной массы. Этот эксперимент более подробно описан в примере 2a.
На фигуре 13 показан ДСН-ПААГ-анализ превращения протромбина (14 мкΜ) в активный тромбин посредством PtPA (6 нМ) и нотекарина (6 нМ) в зависимости от времени, как описано в примере 2b.
На фигуре 14 показано снабженное примечаниями изображение части результатов ДСН-ПААГ, представленных на фигуре 13, где выбранные полосы элюировали и подвергали N-концевому секвенированию с помощью масс-спектрометрического анализа для идентификации специфических молекулярных доменов.
На фигуре 15 представлен график зависимости оптической плотности pNA, полученной для S-2238 при различных концентрациях тромбина, образовавшегося за 155 секунд, как описано в примере 2d. Вычисления, приведенные с правой стороны графика, соответствуют каждой кривой на графике, например, самые верхние числа соответствуют самой верхней кривой и т.д.
На фигуре 16 представлен график стандартной кривой, построенной по данным, полученным на фигуре 15; и, в частности, по уравнениям для каждой реакции, проведенной в течение 180 секунд, были построены кривые с разными углами наклона, как показано на фигуре 15, в зависимости от концентрации тромбина, как показано на фигуре 15, и по этим углам наклона было составлено уравнение регрессии, как показано на фигуре 16.
На фигуре 17 представлен график зависимости скорости продуцирования тромбина под действием активаторов протромбина в концентрации 0,6 нМ, а именно: PtPA, OsPA, экарина (Ecr), нотекарина (Ntcr), каринактивазы-1 (CA-1) и каринактивазы-2 (CA-2) в течение 180 секунд, как описано в примере 2d.
На фигуре 18 представлена кривая, построенная исходя из анализа на катализируемый тромбином гидролиз S-2238, как описано в примере 2e. Концентрации тромбина указаны на монотонно возрастающих кривых.
На фигуре 19 представлены графики активации протромбина под действием PtPA, взятого в концентрациях, указанных в примере 2e.
На фигуре 20 представлены графики активации протромбина под действием OsPA, взятого в концентрациях, указанных в примере 2e.
На фигуре 21 представлены графики активации протромбина под действием экарина, взятого в концентрациях, указанных в примере 2e.
На фигуре 22 представлены графики активации протромбина под действием каринактивазы-1, взятой в концентрациях, указанных в примере 2e.
На фигуре 23 представлены графики активации протромбина под действием каринактивазы-2, взятой в концентрациях, указанных в примере 2e.
На фигуре 24 представлены графики активации протромбина под действием нотекарина, взятого в концентрациях, указанных в примере 2e.
На фигуре 25 представлен пример тромбоэластограммы (ТЭГ) (часть образования сгустка) с указанными параметрами свертывания, как обсуждается в разделе «Примеры».
На фигуре 26 представлены монотонно возрастающие кривые для гидролиза S-2238 под действием различных концентраций тромбина от 45 до 225 нМ, взятых в дубликате, в течение 5-минутного инкубирования в нормальной обработанной цитратом плазме, как описано в примере 3g.
На фигуре 27 представлена стандартная кривая для тромбина, построенная в логарифмической форме по наклону кривых для реакции, представленных на фигуре 26 и полученных за 5-минутный период инкубирования, где на оси х отложены ln наклона кривой (единицы оптической плотности/минуту), а на оси y отложены ln концентрации (молярные концентрации тромбина).
На фигуре 28 проиллюстрированы анализы на тромбин, оставшийся после удаления сгустка крови в сыворотке, полученной в трех различных концентрациях PtPA (в дубликате), как описано в примере 3g.
На фигуре 29 проиллюстрированы анализы на тромбин, оставшийся после удаления сгустка крови в сыворотке, полученной в трех различных концентрациях OsPA (в дубликате), как описано в примере 3g.
На фигуре 30 представлен график зависимости наклона кривых, представленных на фигуре 28 (в соответствии с концентрациями тромбина) от концентрации PtPA, как описано в примере 3g.
На фигуре 31 представлен график наклона кривых, представленных на фигуре 29 (в соответствии с концентрациями тромбина) в зависимости от концентрации OsPA, как описано в примере 3g.
На фигуре 32 представлены монотонно возрастающие кривые для гидролиза S-2238 под действием остаточного тромбина, присутствующего в сыворотке после удаления сгустка в присутствии 4300 нМ (10 МЕ) гепарина, как описано в примере 3g. Тромбин был получен с использованием PtPA и OsPA или был добавлен.
На фигуре 33 представлены кривые реакции для образцов, содержащих различные концентрации гепарина и полученных с использованием 1,5 нМ PtPA, как описано в примере 3g.
На фигуре 34 представлены кривые реакции для образцов, содержащих различные концентрации гепарина и полученных с использованием 1,5 нМ OsPA, как описано в примере 3g.
На фигуре 35 проиллюстрированы изменения оптической плотности за период 5 минут в объединенной «нормальной» плазме, обработанной цитратом, где каждая линия соответствует пробиркам BD RST, заполненным различными объемами нормальной объединенной плазмы, обработанной цитратом, как описано в примере 3h.
На фигуре 36 представлена кривая зависимости наклона кривых, представленных на фигуре 35, от соответствующих концентраций тромбина, полученных исходя из стандартной кривой, представленной на фигуре 16, как описано в примере 3h.
На фигуре 37 проиллюстрированы изменения оптической плотности за период 5 минут в объединенной «нормальной» плазме, обработанной цитратом, где каждая линия соответствует пробиркам BD RST, заполненным 1 мл или 4 мл нормальной объединенной плазмы, обработанной цитратом, и гепарином в различных концентрациях, как описано в примере 3h.
На фигуре 38 представлены ТЭГ-кривые для сравнения обычной пробирки; выпускаемых промышленностью пробирок для получения сыворотки; и PtPA-содержащей пробирки, описанных в примере 4c.
На фигуре 39 представлены ТЭГ-кривые, построенные по данным, полученным, как описано в примере 5a.
На фигуре 40 представлены ТЭГ-кривые, построенные по данным, полученным с участием добровольца «W1», как описано в примере 5c.
На фигуре 41 представлены ТЭГ-кривые, построенные по данным, полученным с участием добровольца «W2», как описано в примере 5c.
На фигуре 42 представлены ТЭГ-кривые для свертывания рекальцифицированной и обработанной цитратом крови, полученной от участника, которому был введен гепарин и PtPA или OsPA, как описано в примере 5d.
На фигуре 43 представлены ТЭГ-кривые, построенные по данным, полученным, как описано в примере 5е.
На фигуре 44 представлены ТЭГ-кривые, построенные по данным, полученным, как описано в примере 6a.
На фигуре 45 представлены ТЭГ-кривые, построенные по данным, полученным, как описано в примере 6b.
На фигуре 46 представлены кривые зависимости времени свертывания крови после введения змеиного яда, содержащего активатор протромбина и полученного от змей вида: Pseudonaja textilis (Pt), Oxyuranus scutelatus (Os), Oxyuranus microlepidotus (Om), Notechis scutatus (Ns) и Echis carinatus (Ec) от различных концентраций яда, как описано в примере 7.
На фигуре 47 показана пробирка Greiner с плазмой, содержащая гелеобразный осадок, как описано в примере 8.
На фигуре 48 проиллюстрировано свертывание крови (латентное) после центрифугирования в нескольких пробирках, как описано в примере 8.
На фигуре 49 проиллюстрировано сравнение проб сыворотки в различных пробирках, как описано в примере 8.
На фигуре 50 показан диапазон концентраций фибриногена/fdp/FDP, измеренных в пробирках Greiner с сывороткой, полученной от 48 произвольно отобранных пациентов, нуждающихся в определении аналита, как описано в примере 9a. Вертикальная линия указывает, что среднее значение составляет 17,5 мкл/мл, а диапазон составляет 4,4-32 мкг/мл.
На фигуре 51 проиллюстрировано сравнение концентраций фибриногена/fdp/FDP, измеренных с помощью ELISA в 36 нормальных пробах сыворотки, полученных в пробирках Greiner для сыворотки (GS) с добавлением или без добавления PtPA, как описано в примере 9b.
На фигуре 52 проиллюстрированы концентрации фибриногена/fdp/FDP, измеренные с помощью ELISA в 9 нормальных пробах крови, собранных в четыре различные пробирки для сыворотки (GS): пробирки Greiner для сыворотки (GRS), пробирки для сыворотки BD (BDS), пробирки с BD RST и PtPA (300 нг/мл), как описано в примере 9b.
На фигуре 53 проиллюстрированы концентрации фибриногена/fdp/FDP, измеренные с помощью ELISA в сыворотке, взятой из 5 нормальных проб крови, собранных в пробирки Greiner для сыворотки (GRS), в пробирки Greiner без добавок, содержащие 300 нг/мл PtPA (PTPA), в пробирки Greiner без добавок, содержащие 125 нг/мл OsPA (OSPA), и в пробирки Greiner без добавок, содержащие 0,16 ед./мл очищенного экарина (ECARIN), как описано в примере 9b. Вертикальные линии означают среднее ± стандартное отклонение.
На фигуре 54 проиллюстрированы концентрации фибриногена/fdp/FDP, измеренные с помощью ELISA-анализа сыворотки, взятой у 3 пациентов при диализе почек и собранной в пробирки Greiner для сыворотки (GRS), в пробирки с BD SST II (BDS), в пробирки BD RST (BDRST) и в пробирки Greiner без добавок, содержащие 1,2 мкг/4 мл PtPA (PTPA), как описано в примере 9c.
На фигуре 55 проиллюстрированы концентрации фибриногена/fdp/FDP, измеренные с помощью ELISA-анализа плазмы и сыворотки, взятых у 2 пациентов с болезнями сердца и собранных в пробирки Greiner для плазмы (GRLH), в пробирки Greiner для сыворотки (GRS); в пробирки BD RST (BDRST); в пробирки Vacuette™ без добавок, содержащие 300 нг/мл PtPA (PTPA); в пробирки Greiner Vacuette™ без добавок, содержащие 125 нг/мл OsPA (OSPA); в пробирки Vacuette™ без добавок, содержащие 0,31 ед./мл экарина (EC1); и в пробирки Greiner Vacuette™ без добавок, содержащие 0,63 ед./мл экарина (EC2), как описано в примере 9c.
На фигуре 56 проиллюстрированы окрашенные по Гимзе предметные стекла Cytospin, на которых содержание клеток превышает гелевый барьер, как описано в примере 9b, где предметные стекла, слева направо, соответствуют: (P) - PtPA-сыворотка; (S) - сыворотка Greiner; (LH) - разведенная плазма Greiner, включающая литий-гепарин; и (LH) - неразведенная плазма Greiner, включающая литий-гепарин.
На фигуре 57 проиллюстрировано определение общего белка, осуществляемое стандартными методами, разработанными в Pathology Queensland, на нормальных пробах сыворотки и плазмы (n=26), на всех пробах сыворотки и плазмы (n=61) и на пробах, взятых у пациентов с болезнями сердца (n=11), как описано в примере 12a.
На фигуре 58 показано время свертывания плазмы под действием двух различных концентраций PtPA в выбранные моменты времени в течение двух недель (336 часов) во время хранения при различных температурах, как описано в примере 15a.
На фигуре 59 проиллюстрирована активность OsPA в отношении хромогенного субстрата S-2765 после облучения в стандартных пробирках Greiner (P) и в пробирках Greiner для сыворотки, содержащих двуокись кремния и поверхностно-активное вещество (siP), как описано в примере 15b.
На фигуре 60 проиллюстрирована активность OsPA в отношении свертывания обработанной цитратом плазмы в стандартных пробирках Greiner (P) и в пробирках Greiner для сыворотки, содержащих двуокись кремния и поверхностно-активное вещество, как описано в примере 15b.
На фигуре 61 проиллюстрирована активность (A405/мм) OsPA в отношении хромогенного субстрата S-2765 в течение периода времени до 14 дней при 23°C по сравнению с активностью свежего разведения маточного раствора, как описано в примере 15c.
На фигуре 62 представлен пример инструмента (медицинского инструмента для «экспресс-теста» в форме шприца), изготовленного для забора высококачественной сыворотки для анализа, как описано в примере 17.
Подробное описание изобретения
1. Определения
Если это не оговорено особо, то все технические и научные термины, используемые в настоящей заявке, имеют значения, в основном, понятные среднему специалисту в области, к которой относится изобретение. Хотя для осуществления настоящего изобретения, как в теории, так и на практике, могут быть применены любые методы и материалы, аналогичные или эквивалентные описанным в настоящем документе методам и материалам, однако предпочтительными являются методы и материалы, описанные в настоящей заявке. В соответствии с этим, термины, используемые в настоящем описании, определены ниже.
Слово «приблизительно» означает, что значения количества, уровня, величины, числа, частоты, процента, размерности, размера, объема, массы или длины могут отличаться максимум на 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1% от указанных значений количества, уровня, величины, числа, частоты, процента, размерности, размера, объема, массы или длины.
Термин «биологически активный фрагмент», относящийся к фрагментам сравниваемой или полноразмерной полинуклеотидной или полипептидной последовательности, означает фрагмент, обладающий активностью, которая составляет по меньшей мере приблизительно 0,1, 0,5, 1, 2, 5, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98, 99% от активности сравниваемой последовательности. В объем настоящего изобретения входят биологически активные фрагменты, включая фрагменты, имеющие длину по меньшей мере приблизительно 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 40, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000 нуклеотидов или остатков, которые кодируют или содержат активность сравниваемого полинуклеотида или полипептида. Репрезентативные биологически активные фрагменты обычно участвуют во взаимодействии, например, во внутримолекулярном или в межмолекулярном взаимодействии. Межмолекулярным взаимодействием может быть специфическое связывание или ферментативное взаимодействие (например, такое взаимодействие может быть временным, при этом, ковалентная связь либо образуется, либо разрывается). Биологически активными фрагментами полноразмерного полипептида являются пептиды, которые могут содержать аминокислотные последовательности, по существу, аналогичные аминокислотным последовательностям (предполагаемого) полноразмерного полипептида, или происходящие от указанных последовательностей. Обычно, биологически активные фрагменты содержат домен или мотив, обладающий по меньшей мере одной активностью полноразмерного полипептида. В соответствии с этим, биологически активный фрагмент обладает активностью, которая составляет приблизительно не менее чем 1%, 10%, 25%, 50% от активности полноразмерного полипептида, от которого он происходит.
«Кодирующая последовательность» означает любую последовательность нуклеиновой кислоты, которая кодирует полипептидный продукт гена. В отличие от этого, термин «некодирующая последовательность» означает любую последовательность нуклеиновой кислоты, которая не участвует в кодировании полипептидного продукта гена.
В настоящем описании, если это не противоречит контексту описания, при использовании слов «включать», «включает» или «включающий» подразумевается, что данный объект включает указанную стадию или указанный элемент, или группу стадий, или элементов, но не исключает присутствия любой другой стадии или любого другого элемента, или группы стадий, или элементов. Таким образом, использование слова «включающий» и т.п. указывает на то, что перечисленные элементы являются необходимыми или обязательными, а все остальные элементы являются необязательными и могут присутствовать или не присутствовать. Словосочетание «состоящий из» означает «включающий» только те перечисленные элементы, которые следуют за словами «состоящий из». Таким образом, словосочетание «состоящий из» означает, что перечисленные элементы являются необходимыми или обязательными, и, при этом, не могут присутствовать какие-либо другие элементы. Словосочетание «по существу, состоящий из» означает, что данный объект включает все элементы, перечисленные после этого словосочетания, и ограниченно, может включать другие элементы, которые не влияют на действие или активность или сообщают такую активность или такое действие, которые конкретно указаны в описании перечисленных элементов. Таким образом, словосочетание «по существу, состоящий из» означает, что перечисленные элементы являются необходимыми или обязательными, а другие элементы, которые являются необязательными, могут присутствовать или не присутствовать, в зависимости от того, влияют ли они на активность или действие перечисленных элементов или нет.
Термины «комплементарный» и «комплементарность» относятся к полинуклеотидам (то есть к последовательностям нуклеотидов), которые образуют пары в соответствии с правилами спаривания оснований. Так, например, последовательность «A-G-T» комплементарна последовательности «T-C-A». Комплементарность может быть «частичной», при которой лишь некоторые основания нуклеиновых кислот образуют пары в соответствии с правилами спаривания оснований. В другом случае, комплементарность нуклеиновых кислот может быть «полной» или «абсолютной». Степень комплементарности цепей нуклеиновых кислот существенно влияет на эффективность и жесткость гибридизации между цепями нуклеиновых кислот.
Термины «соответствует» или «соответствующие» означают, что (a) полинуклеотид имеет нуклеотидную последовательность, которая, в основном, идентична или комплементарна всей или части сравниваемой полинуклеотидной последовательности, или кодируют аминокислотную последовательность, идентичную аминокислотной последовательности в данном пептиде или белке; или (b) пептид или полипептид имеет аминокислотную последовательность, которая, в основном, идентична последовательности аминокислот в сравниваемом пептиде или белке.
Используемый в настоящем документе термин «детектирование аналита» означает определение присутствия, отсутствия, количества или концентрации одного или нескольких аналитов в образце.
Термин «ген» означает единицу наследуемой генетической информации, которая занимает конкретный локус на хромосоме и состоит из транскрипционных и/или трансляционных регуляторных последовательностей и/или из кодирующей области и/или нетранслируемых последовательностей (то есть интронов, 5’- и 3’-нетранслируемых последовательностей).
Термин «гомология» означает процент нуклеиновых кислот или аминокислот, которые являются идентичными или представляют собой идентичные консервативные замены. Гомология может быть определена с помощью программ сравнения последовательностей, таких как программа GAP (Devereux et al., 1984), которая включена в настоящее описание в качестве ссылки. С помощью этой программы, последовательности, длина которых аналогична длине указанных в настоящем документе последовательностей или, по существу, отличается от длины этих последовательностей, сравнивают путем введения пробелов при выравнивании этих последовательностей, где такие пробелы определяют, например, с помощью алгоритма сравнения, входящего в программу GAP.
Термин «клетка-хозяин» включает отдельную клетку или клеточную культуру, которая может быть или является реципиентом для любого(ых) рекомбинантного(ых) вектора(ов) или выделенного полинуклеотида согласно изобретению. Клетки-хозяева включают потомство одной клетки-хозяина, и такое потомство необязательно должно быть полностью идентично (по своей морфологии или по общему ДНК-комплементу) исходной родительской клетке, что обусловлено природными, случайными или спонтанными мутациями и/или заменами. Клетка-хозяин включает клетки, трансфицированные или инфицированные in vivo или in vitro рекомбинантным вектором, или полинуклеотидом согласно изобретению. Клеткой-хозяином, содержащей рекомбинантный вектор согласно изобретению, является рекомбинантная клетка-хозяин.
Используемый в настоящем документе термин «гибридизация» означает спаривание комплементарных нуклеотидных последовательностей с образованием гибрида ДНК-ДНК или гибрида ДНК-РНК. Комплементарными последовательностями оснований являются последовательности, способные образовывать пары в соответствии с правилами спаривания оснований. В ДНК, A образует пару с Т, а С образует пару с G. В РНК, U образует пару с A, а C образует пару с G. В соответствии с этим, используемые в настоящем документе термины «спаривание» и «ошибочное спаривание» означают возможную гибридизацию пары нуклеотидов в комплементарных цепях нуклеиновых кислот. Соответствующие друг другу пары нуклеотидов подвергаются эффективной гибридизации, например, образуют классические пары оснований A-T и G-C, упомянутые выше. Ошибочное спаривание нуклеотидов представляет собой другие комбинации нуклеотидов, которые не способны подвергаться эффективной гибридизации.
Термин «выделенный» относится к веществу, которое, в основном, или, по существу, не содержит компонентов, которые обычно присутствуют в его природном состоянии. Так, например, используемый в настоящем документе термин «выделенный полинуклеотид» означает полинуклеотид, отделенный от последовательностей, которые он фланкирует в природном окружении, например, ДНК-фрагмент, отделенный от смежных фланкирующих последовательностей, присутствующих в его природном окружении. Альтернативно, используемые в настоящем документе термины «выделенный пептид» или «выделенный полипептид» и т.п. означают пептидную или полипептидную молекулу, выделенную in vitro и/или очищенную от его клеточного окуржения и от других клеточных компонентов, то есть молекулу, которая не ассоциируется с веществами in vivo.
Термин «выделенный из» означает, что указанный полипептид или комплекс, например, выделен из конкретного источника или происходит от этого источника.
Используемый в настоящем документе термин «олигонуклеотид» означает полимер, состоящий из множества нуклеотидных остатков (дезоксирибонуклеотидов или рибонуклеотидов, или родственных структурных вариантов, или их синтетических аналогов), связанных фосфодиэфирными связями (или их родственными структурными вариантами или их синтетическими аналогами). Таким образом, термин «олигонуклеотид» обычно означает нуклеотидный полимер, в котором нуклеотидные остатки и связи между этими остатками присутствуют в природе, причем, следует отметить, что в это понятие также входят различные аналоги, включая, но не ограничиваясь ими, пептидсодержащие нуклеиновые кислоты (PNA), фосфорамидаты, фосфортиоаты, метилфосфонаты, 2-O-метилрибонуклеиновые кислоты и т.п. Точный размер молекулы может варьироваться в зависимости от конкретной цели ее применения. Олигонуклеотид обычно имеет относительно небольшую длину, в основном, приблизительно от 10 до 30 нуклеотидных остатков, но этот термин может также означать молекулы любой длины, хотя термины «полинуклеотид» или «нуклеиновая кислота» обычно относятся к крупным олигонуклеотидам.
Используемый в настоящем документе термин «функционально присоединенный» относится к структурному гену, находящемуся под регуляторном контролем промотора, который регулирует транскрипцию и, необязательно, трансляцию гена. При конструировании комбинаций гетерологичного промотора/структурного гена обычно, предпочтительно, чтобы генная последовательность или промотор находились на определенном расстоянии от сайта инициации транскрипции гена, которое приблизительно равно расстоянию между генной последовательностью или промотором и геном, находящимся под его контролем в природных условиях, то есть геном, от которого происходит указанная генная последовательность или промотор. Как известно специалистам, допустимо некоторое варьирование такого расстояния, не приводящее к потери функции. Аналогичным образом, предпочтительное положение элемента регуляторной последовательности по отношению к гетерологичному гену, находящемуся под его контролем, определяется положением такого элемента в природных условиях, то есть по отношению к генам, от которых он происходит.
Используемые в настоящем документе термины «пациент», «субъект» и «индивидуум» являются синонимами и относятся к пациентам, субъектам и индивидуумам, таким как человек или другие млекопитающие, и включают любого из пациентов, субъектов и индивидуумов, которые нуждаются в детектировании уровней аналита или в определении наличия, отсутствия или тяжести заболевания или состояния в соответствии с настоящим изобретением. Однако следует отметить, что термин «пациент» не означает, что у данного индивидуума имеются симптомы заболевания. Подходящими млекопитающими, входящими в объем настоящего изобретения, являются, но не ограничиваются ими, приматы (например, человек, шимпанзе), сельскохозяйственные животные (например, овцы, коровы, лошади, ослы, свиньи), лабораторные животные (например, кролики, мыши, крысы, морские свинки, хомячки), животные-компаньоны (например, кошки, собаки) и хищные дикие животные (например, лисицы, олени, собаки динго).
Используемые в настоящем документе термины «полинуклеотид» или «нуклеиновая кислота» означают мРНК, РНК, кРНК, кДНК или ДНК. Эти термины обычно означают полимерную нуклеотидную форму длиной по меньшей мере в 10 оснований, либо рибонуклеотиды или дезоксинуклеотиды, либо модифицированную нуклеотидную форму любого типа. Эти термины включают одноцепочечные и двухцепочечные формы ДНК.
Термины «полинуклеотидный вариант» и «вариант» и т.п. означают полинуклеотиды, имеющие последовательность, по существу, идентичную последовательности сравниваемого полинуклеотида или полинуклеотидов, которые гибридизуются со сравниваемой последовательностью в жестких условиях гибридизации, определяемых ниже. Эти термины также включают полинуклеотиды, которые отличаются от исходного полинуклеотида тем, что в них присутствует добавление, делеция или замена по меньшей мере одного нуклеотида. В соответствии с этим, термины «полинуклеотидный вариант» и «вариант» включают полинуклеотиды, в которых один или несколько нуклеотидов были добавлены, делетированы или заменены другими нуклеотидами. В этой связи следует отметить, что в исходный полинуклеотид могут быть внесены некоторые изменения, включая мутации, добавления, делеции и замены, так, чтобы модифицированный полинуклеотид сохранял биологическую функцию или активность исходного полинуклеотида. Термины «полинуклеотидный вариант» и «вариант» также включают природные аллельные варианты.
Используемые в настоящем документе термины «полипептид», «пептид» и «белок» являются синонимами и означают полимер, состоящий из аминокислотных остатков, а также варианты и синтетические аналоги такого полимера. Таким образом, эти термины относятся к аминокислотным полимерам, в которых один или несколько аминокислотных остатков представляют собой синтетические не-природные аминокислоты, такие как химический аналог соответствующей природной аминокислоты, а также природные аминокислотные полимеры.
Термин «полипептидный вариант» означает полипептиды, которые отличаются от исходного полипептида тем, что в них присутствует добавление, делеция или замена по меньшей мере одного аминокислотного остатка. В некоторых вариантах осуществления изобретения, полипептидный вариант отличается от исходного полипептида одной или несколькими заменами, которые могут быть консервативными или неконсервативными. В некоторых вариантах осуществления изобретения, полипептидный вариант включает консервативные замены, и в этой связи следует отметить, что некоторые аминокислоты могут быть заменены другими аминокислотами, которые обладают аналогичными свойствами широкого ряда, не влияющими на природную активность данного полипептида. Полипептидные варианты также включают полипептиды, в которых одна или несколько аминокислот были добавлены, делетированы или заменены другими аминокислотными остатками.
Термин «праймер» означает олигонуклеотид, который, при его спаривании с ДНК-цепью, способен инициировать синтез продукта удлинения праймера в присутствии соответствующего полимеризующего агента. Для максимальной эффективности амплификации, предпочтительно, чтобы такой праймер был одноцепочечным, однако, альтернативно, он может быть двухцепочечным. Праймер должен иметь длину, достаточную для инициации синтеза продуктов удлинения в присутствии полимеризующего агента. Длина праймера зависит от многих факторов, включая применение, температуру, условия проведения реакции на матрице, другие реагенты и источник праймеров. Так, например, в зависимости от сложности структуры последовательности-мишени, олигонуклеотидный праймер обычно содержит 15-35 или более нуклеотидных остатков, хотя он может содержать и меньшее число нуклеотидных остатков. Праймерами могут быть крупные полинуклеотиды, такие как полинуклеотиды, имеющие длину приблизительно от 200 нуклеотидных остатков и до нескольких тысяч нуклеотидов или более. Могут быть выбраны праймеры, которые являются «по существу комплементарными» последовательности на матрице, с которой они должны гибридизоваться и служить в качестве сайта инициации синтеза. Термин «по существу комплементарный» означает, что праймер является в достаточной степени комплементарным для гибридизации с полинуклеотидом-мишенью. При этом, предпочтительно, чтобы праймер не содержал ошибочных спариваний с матрицей, с которой он должен гибридизоваться, но это не играет решающей роли. Так, например, не-комплементарные нуклеотидные остатки могут быть присоединены к 5’-концу праймера, а остальная часть последовательности праймера является комплементарной матрице. Альтернативно, некомплементарные нуклеотидные остатки или фрагмент некомплементарных нуклеотидных остатков могут быть распределены по всему праймеру при условии, что праймерная последовательность будет комплементарна последовательности матрицы в степени, достаточной для гибридизации с этой последовательностью и образования матрицы для синтеза продукта удлинения праймера.
«Зонд» означает молекулу, которая связывается с конкретной последовательностью или с подпоследовательностью, или с другой частью другой молекулы. Если это не оговорено особо, то термин «зонд» обычно означает полинуклеотидный зонд, который связывается с другим полинуклеотидом, часто называемым «полинуклеотидом-мишенью», посредством спаривания комплементарных оснований. В зависимости от жесткости условий гибридизации, зонды могут связываться с полинуклеотидами-мишенями, последовательности которых не являются полностью комплементарными последовательностям зонда. Зонды могут быть помечены непосредственно или опосредованно.
Термин «контрольный результат» включает результат, полученный для одного и того же индивидуума в другой момент времени; результат, полученный от здорового индивидуума или группы здоровых индивидуумов, или результат, полученный в аналитическом тесте с использованием стандарта.
Используемые в настоящем документе термины «регуляторный элемент» или «регуляторная последовательность» означают последовательности нуклеиновой кислоты (например, ДНК), необходимые для экспрессии функционально присоединенной кодирующей последовательности в конкретной клетке-хозяине. Регуляторными последовательностями, подходящими для прокариотических клеток, являются, например, промотор и, необязательно, цис-действующая последовательность, такая как последовательность оператора и сайт связывания с рибосомой. Регуляторными последовательностями, подходящими для эукариотических клеток, являются промоторы, сигналы полиаденилирования, энхансеры транскрипции, энхансеры трансляции, лидерные или трейлерные последовательности, которые модулируют стабильность мРНК, а также нацеливающие последовательности, которые доставляют продукт, кодируемый транскрибированным полинуклеотидом, во внутриклеточный компартмент клетки или во внеклеточное пространство.
Используемый в настоящем документе термин «идентичность последовательностей» означает степень идентичности последовательностей на нуклеотидном или аминокислотном уровне, оцениваемую в окне сравнения. Таким образом, «процент идентичности последовательностей» вычисляют путем сравнения двух оптимально выровненных последовательностей в окне сравнения и определения числа положений, в которых основания нуклеиновой кислоты (например, A, T, C, G, I) или аминокислотные остатки (например, Ala, Pro, Ser, Thr, Gly, Val, Leu, Ile, Phe, Tyr, Trp, Lys, Arg, His, Asp, Glu, Asn, Gln, Cys и Met) являются идентичными в обеих последовательностях, в результате чего получают число соответствующих положений, затем это число делят на общее число положений в окне сравнения (то есть на размер окна), результат умножают на 100 и получают процент идентичности последовательностей. В соответствии с настоящим изобретением, термин «идентичность последовательностей» можно определить как «процент соответствий», вычисленный с помощью компьютерной программы DNASIS (Версия 2.5 для Windows; поставляемая в пакете программ Hitachi Software Engineering Co., Ltd., South San Francisco, California, USA) с использованием стандартных параметров по умолчанию, указанных в ссылочном материале, прилагаемом к данной программе.
Термин «сходство последовательностей» означает процент числа аминокислот, которые являются идентичными или имеют консервативные замены, указанные ниже в таблице 2. Сходство может быть определено с использованием программ для сравнения последовательностей, таких как GAP (Devereux et al., 1984). С помощью этой программы, последовательности, длина которых аналогична длине указанных в настоящем документе последовательностей или, по существу, отличается от длины этих последовательностей, сравнивают путем введения пробелов при выравнивании этих последовательностей, где такие пробелы определяют, например, с помощью алгоритма сравнения, входящего в программу GAP.
Терминами, используемыми в настоящем документе для описания сходства последовательностей в отношении двух или более полинуклеотидов или полипептидов, являются «исходная последовательность», «окно сравнения», «идентичность последовательностей», «процент идентичности последовательностей» и «в основном, идентичные последовательности». «Исходная последовательность» имеет длину по меньшей мере 12, часто 15-18, а еще чаще по меньшей мере 25 мономерных единиц, включая нуклеотидные и аминокислотные остатки. Поскольку каждый из двух полинуклеотидов может содержать (1) последовательность (то есть только часть полноразмерной полинуклеотидной последовательности), которая является одной и той же для двух полинуклеотидов, и (2) последовательность, которая отличается у двух полинуклеотидов, то сравнение последовательностей двух (или более) полинуклеотидов обычно осуществляют путем сопоставления последовательностей двух полинуклеотидов по «окну сравнения» для идентификации и сравнения локальных областей в целях определения сходства последовательностей. «Окно сравнения» означает концептуальный сегмент по меньшей мере из 6 смежных положений, обычно составляющий приблизительно 50-100, а чаще всего приблизительно 100-150 положений, в которых последовательность сопоставляют со сравниваемой последовательностью, имеющей такое же число смежных положений, после оптимального выравнивания двух последовательностей. Для оптимального выравнивания двух последовательностей, окно сравнения может включать добавления или делеции (то есть пробелы), составляющие приблизительно 20% или менее по сравнению со сравниваемой последовательностью (не содержащей добавлений или делеций). Оптимальное выравнивание последовательностей для сопоставления в окне сравнения может быть осуществлено посредством компьютеризированной реализации алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете компьютерных программ Wisconsin Genetics Software Package Release 7.0, Genetics Computer Group, 575 Science Drive Madison, WI, USA) или путем оценки и наилучшего выравнивания (то есть получения наивысшего процента гомологии в окне сравнения), достигаемого с применением любого из различных выбранных методов. Может быть также упомянуто семейство программ BLAST, например, описанных Altschul et al., 1997. Подробное обсуждение анализа последовательностей можно найти в Разделе 19.3 руководства Ausubel et al., «Current Protocols in Molecular Biology», John Wiley & Sons Inc., 1994-1998, Chapter 15.
Используемый в настоящем документе термин «жесткость» относится к условиям гибридизации, таким как температура и ионная сила, а также присутствие или отсутствие некоторых органических растворителей в процессе гибридизации и промывки. Чем выше жесткость, тем выше степень комплементарности между иммобилизованными нуклеотидными последовательностями-мишенями и меченными полинуклеотидными последовательностями зонда, которые остаются гибридизованными с мишенью после промывки. Термин «высокая степень жесткости» означает температурные условия и ионные концентрации, при которых будут гибридизоваться только нуклеотидные последовательности, имеющие большое число комплементарных оснований. Требуемая жесткость зависит от типа нуклеотидной последовательности и от различных компонентов, присутствующих в процессе гибридизации. Обычно, условия жесткости выбирают так, чтобы температура была приблизительно на 10-20°C ниже, чем точка плавления (Tm) конкретной последовательности при определенной ионной силе и при определенном рН. Tm представляет собой температуру (при определенной ионной силе и при определенном рН), при которой 50% последовательности-мишени будет гибридизоваться с комплементарным зондом.
Термин «трансформация» означает изменение генотипа организма, например, бактерий, дрожжей, млекопитающих, птиц, рептилий, рыб или растений в результате введения чужеродной или эндогенной нуклеиновой кислоты.
Термин «вектор» означает полинуклеотидную молекулу, а предпочтительно, молекулу ДНК, происходящую, например, от плазмиды, бактериофага, дрожжей или вируса, в которые был встроен или клонирован полинуклеотид. Вектор, предпочтительно, содержит один или несколько уникальных рестрикционных сайтов и может автономно реплицироваться в определенной клетке-хозяине, включая клетку-мишень или ткань-мишень, или клетку- или ткань-предшественника, либо он может интегрироваться в геноме определенного хозяина, так, чтобы это приводило к получению репродуцируемой клонированной последовательности. В соответствии с этим, указанным вектором может быть автономно реплицирующийся вектор, то есть вектор, существующий в виде внехромосомного элемента, репликация которого не зависит от репликации хромосомы, например, в виде линейной или замкнутой кольцевой плазмиды; в виде внехромосомного элемента, мини-хромосомы или искусственной хромосомы. Вектор может содержать любой элемент, обеспечивающий ауторепликацию. Альтернативно, вектором может быть вектор, который, при его введении в клетку-хозяина, интегрируется в геном и реплицируется вместе с хромосомой(ами), в которую(ые) он был интегрирован. Векторная система может содержать один вектор или одну плазмиду, два или более векторов или две или более плазмид, которые вместе содержат общую ДНК, введенную в геном клетки-хозяина, или транспозон. Выбор вектора обычно зависит от совместимости вектора с клеткой-хозяином, в которую он был введен. В данном случае, указанный вектор, предпочтительно, представляет собой вирусный вектор или вектор, происходящий от вируса, которые являются функциональными в клетках животного, а предпочтительно, млекопитающего. Такой вектор может происходить от поксвируса, аденовируса или дрожжей. Вектор может также включать селективный маркер, такой как ген резистентности к антибиотикам, который может быть использован для отбора подходящих трансформантов. Примеры таких генов резистентности известны специалистам, и ими являются ген nptll, который сообщает резистентность к антибиотикам, таким как канамицин и G418 (Geneticin®), и ген hph, который сообщает резистентность к антибиотику гигромицину B.
Используемые в настоящем документе термины «дикого типа» и «природный» являются синонимами и относятся к гену или генному продукту, который обладает свойствами гена или генного продукта, если он был выделен из природного источника. Ген или генный продукт дикого типа (например, полипептид) представляет собой такой ген или генный продукт, который наиболее часто встречается у определенной популяции, а поэтому имеет условное обозначение «нормальная» форма гена или форма гена «дикого типа».
2. Активаторы протромбина
Настоящее изобретение частично основано на обнаружении того факта, что активаторы протромбина представляют собой подходящие коагулирующие агенты для получения сыворотки, которые, несмотря на их известную протеолитическую активность, используются для детектирования аналитов. Активаторы протромбина (иногда называемые протромбиназами) обладают трипсин-подобной активностью и активируют протромбин (то есть превращают протромбин в тромбин, который, в свою очередь, превращает фибриноген в фибрин и, следовательно, приводит к образованию сгустков крови).
В некоторых вариантах осуществления изобретения, активатором протромбина является экзогенный активатор протромбина. Используемый в настоящем документе термин «экзогенный активатор протромбина» означает активатор протромбина, выделенный из источника, отличающегося от пробы крови, из которой может быть получена проба сыворотки.
2.1 Активаторы протромбина дикого типа или природные активаторы протромбина
Активаторы протромбина, используемые в настоящем изобретении, могут представлять собой активаторы протромбина дикого типа или природные активаторы протромбина, включая активаторы протромбина, полученные от любого подходящего организма, включая змеиные, человеческие, коровьи и бактериальные активаторы протромбина. Активатор протромбина может включать полноразмерный полипептид дикого типа или природный полипептид.
В некоторых вариантах осуществления изобретения, активатором протромбина является змеиный активатор протромбина. В соответствии с этим, активатор протромбина представляет собой активатор протромбина змеиного яда. Активаторы протромбина змеиного яда обычно подразделяются на четыре группы (A, B, C и D) в зависимости от их структуры, функции и требований для кофакторов.
В соответствии с этим, активатор протромбина змеиного яда представляет собой активатор протромбина группы А. Активаторы протромбина группы А представляют собой металлопротеиназы, состоящие из трех доменов: металлопротеиназы, дизинтегрина и Cys-богатого домена. Домен металлопротеиназы содержит консенсусную последовательность HEXXHXXGXXH, соответствующую активному сайту, образующему хелатный комплекс с цинком. Эти активаторы протромбина присутствуют по меньшей мере в ядах гадюк нескольких видов, и такими активаторами являются экарин, выделенный из яда змеи Echis carinatus, и баспарин, выделенный из яда змеи Bothrops asper.
В соответствии с этим, активатором протромбина змеиного яда является активатор протромбина группы В. Активаторами протромбина группы В являются металлопротеиназы, состоящие из двух субъединиц, связанных друг с другом нековалентной связью, а именно металлопротеиназы и лектин-подобного димера типа C, связанного дисульфидной связью. Эти активаторы протромбина присутствуют в ядах гадюк нескольких видов, и такими активаторами являются каринактиваза-1 и каринактиваза-2, выделенные из яда Echis carinatus, и мультактиваза, выделенная из яда Echis multisquamatus.
В соответствии с этим, активатор протромбина змеиного яда представляет собой активатор протромбина группы С. Активаторы протромбина группы С представляют собой сериновые протеазы и напоминают комплекс фактор Ха-фактор Va млекопитающего. Псеутарин C (или PtPA) и оскутарин C (или OsPA) представляют собой активаторы протромбина группы С, выделенные из ядов змей Pseudonaja textilis и Oxyuranus scutellatus соответственно. Омикарин C представляет собой активатор протромбина, выделенный из яда змеи Oxyuranus microlepidotus.
В соответствии с этим, активатор протромбина змеиного яда представляет собой активатор протромбина группы D. Активаторы протромбина группы D представляют собой сериновые протеазы, которые функционально сходны с фактором Xa млекопитающего. Порфарин D (от Pseudechis porphyriacus), нотекарин D (от Notechis scutatus scutatus), трокарин D (от Tropidechis carinatus), гопсарин D (от Hoplocephalus stephensi) и нотекарин D (от Notechis ater niger) представляют собой активаторы протромбина группы D.
Описание змеиных активаторов протромбина приводится в публикации Kini, R. M. (2005), и активаторы, полученные, в частности, из яда австралийских аспидов (активаторы протромбина группы C и D) описаны в публикации St. Pierre et al. (2005), содержание которой во всей своей полноте включено в настоящее описание в качестве ссылки. В этих двух работах, змеиные активаторы протромбина были подразделены на группы A-D, описанные выше. Такая классификация используется вместо применяемой ранее системы классификации на группы I-III (используемая ранее группа I включает группы A и B; группа II сейчас называется группой D, а группа III называется группой C), кроме того, ранее иногда использовались дополнительные группы IV (активаторы протромбина змеиного яда, которые расщепляют пептидные связи в протромбине, но не превращают протромбин в ферментативно активный продукт, то есть тромбин или мейзотромбин) и V (бактериальные активаторы протромбина), описанные в ранее опубликованных статьях, включая статьи Rosing, J. et al. (1991) и Rosing, J. et al. (1992), содержание которых во всей своей полноте включено в настоящее описание в качестве ссылки. Объяснение такого изменения систем классификации можно найти в работе Kini, R, M, et al. (2001), содержание которой во всей своей полноте включено в настоящее описание в качестве ссылки.
В конкретных вариантах осуществления изобретения, активатор протромбина получают из яда змей семейства Elapidae, иллюстративными примерами которых являются виды, принадлежащие к роду Demansia, Hoplocephalus, Notechis, Oxyuranus, Pseudechis, Pseudonaja, Rhinoplocephalus и Tropidechis, включая, но не ограничиваясь ими, Demansia vestigiata, Hoplocephalus stephensii, Notechis ater humphreysi, Notechis ater niger, Notechis ater serventyi, Notechis flinkders, Notechis humphreysi, Notechis niger, Notechis occidentalis, Notechis scutatus, Notechis scutatus scutatus, Notechis serventyi, Oxyuranus microlepidotus, Oxyuranus scutellatus, Pseudechis porphyriacus, Pseudonaja affinis, Pseudonaja inframaculata, Pseudonaja nuchalis, Pseudonaja textilis, Rhinoplocephalus nigrescens и Tropidechis carinatus.
В конкретных вариантах осуществления изобретения, активатор протромбина получают из яда змей семейства Viperidae, иллюстративными примерами которых являются виды, принадлежащие к роду Botrhops, Echis и Trinteresurus, включая, но не ограничиваясь ими, Bothrops alternatus, Bothrops asper, Bothrops atrox, Bothrops atrox asper, Bothrops brasili, Bothrops castelnaudi, Bothrops columbiensis, Bothrops erythromelas, Bothrops fonsecai, Bothrops itapetiningae, Bothrops jararaca, Bothrops neuwiedi, Bothrops venezuelensis, Echis carinatus, Echis coloratus, Echis multisquamatus и Trinteresurus okinavensis.
В конкретных вариантах осуществления изобретения, активатор протромбина получают из яда змей семейства Colubridae, иллюстративными примерами которых являются виды, принадлежащие к роду Dispholidus, Rhabdophis и Thelotornis, включая, но не ограничиваясь ими, Dispholidus typus, Rhabdophis tigrinus tigrinus, Thelotornis kirtlandii и Thelotornis capensis.
В некоторых вариантах осуществления изобретения, змеиный активатор протромбина происходит или был получен из змеиного яда. Очистка и характеризация PtPA, полученного из змеиного яда P. textilis, описана в публикациях Masci (1986) и Masci et al., (1998), а активатор протромбина OsPA, полученный из яда O. scutellatus описан в публикации Speijer et al., (1986), где все указанные публикации во всей своей полноте вводятся в настоящее описание в качестве ссылки. Очистка и характеризация экарина, полученного из яда Echis carinatus, описана в публикациях Morita, T et al. (1981) и Nishida, S et al. (1995), очистка и характеризация каринактивазы, полученной из яда Echis carinatus, описана в публикациях Yamada, D et al. (1996), очистка и характеризация мультактивазы, полученной из яда Echis multisquamatus, описана в публикациях Yamada, D. et al., (1997), а очистка и характеризация нотекарина, полученного из яда Notechis scutatus, описана в публикации Tans, G et al., (1985), где каждая из указанных публикаций во всей своей полноте включено в настоящее описание в качестве ссылки.
В некоторых вариантах осуществления изобретения, активатором протромбина является активатор протромбина млекопитающего. Активаторы протромбина млекопитающего включают активаторы протромбина, происходящие из крови и/или ткани человека, и активаторы протромбина, происходящие из крови и/или ткани коров.
В некоторых вариантах осуществления изобретения, активатором протромбина является бактериальный активатор протромбина. Бактериальные активаторы протромбина происходят от Staphylococcus aureus, Peptococcus indolicus, Bacteroides melaninogenicus и Pseudomonas aeruginosa (Rosing, J. et al. (1991)).
Как известно специалистам, активатор протромбина может содержать один или несколько полипептидов, либо, по существу, состоять или состоять из указанных полипептидов. В некоторых вариантах осуществления изобретения, активатор протромбина содержит один полипептид, или, по существу, состоит или состоит из указанного полипептида. В других вариантах осуществления изобретения, активатор протромбина содержит более чем один полипептид, включая, но не ограничиваясь ими, комплексы полипептидов, или, по существу, состоит или состоит из таких полипептидов. Если активатор протромбина содержит более чем один полипептид или, по существу, состоит или состоит из таких полипептидов, то каждый полипептид может происходить от организмов одного и того же рода или от различных родов и/или от одного и того же вида или от различных видов.
В некоторых вариантах осуществления изобретения, активатор протромбина содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:1, 2, 3, 4, 7, 8, 11, 12, 13, 16, 18, 26, 27, 28, 29, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 51 и 52, или содержит аминокислотную последовательность, кодируемую нуклеотидной последовательностью, выбранной из последовательностей SEQ ID NO:5, 6, 9, 10, 14, 15, 17, 19, 20, 21, 22, 23, 24, 25, 31, 33, 35, 37, 39, 41, 43, 45, 47 и 49.
2.2 Химерные активаторы протромбина и слитые полипептиды
В настоящем изобретении также рассматривается применение активаторов протромбина, содержащих химерный полипептид. Используемый в настоящем документе термин «химерный полипептид» включает первый полипептидный компонент, содержащий полипептид, происходящий от первого организма и связанный со вторым полипептидным компонентом, происходящим от второго организма. В некоторых вариантах осуществления изобретения, первый организм и второй организм принадлежат к различным родам. В других вариантах осуществления изобретения, первый организм и второй организм принадлежат к различным видам одного и того же рода. В некоторых вариантах осуществления изобретения, активатор протромбина содержит химерный полипептид, который напоминает комплекс «фактор Xa-фактор Va», где первый полипептид содержит фактор Xa-подобный полипептид, а второй полипептид содержит фактор Va-подобный полипептид. В некоторых конкретных вариантах осуществления изобретения, первый полипептид содержит аминокислотную последовательность, выбранную из последовательностей, представленных в SEQ ID NO:26, 27, 28, 29, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48 и 50, или содержит аминокислотную последовательность, кодируемую нуклеотидной последовательностью, выбранной из последовательностей, представленных в SEQ ID NO:19, 20, 21, 22, 23, 24, 25, 31, 33, 35, 37, 39, 41, 43, 45, 47 и 49, а второй полипептид содержит аминокислотную последовательность, выбранную из последовательностей, представленных в SEQ ID NO:7, 8, 11, 12, 13, 16 и 18, или содержит аминокислотную последовательность, кодируемую нуклеотидной последовательностью, выбранной из последовательностей, представленных в SEQ ID NO:5, 6, 9, 10, 14, 15 и 17.
В настоящем изобретении также рассматривается применение активаторов протромбина, содержащих слитый полипептид. Используемый в настоящем документе термин «слитый полипептид» включает первый полипептидный компонент, связанный со вторым полипептидным компонентом. Первый полипептидный компонент может происходить от первого организма, а второй полипептидный компонент может происходить от второго организма. В некоторых вариантах осуществления изобретения, первый организм и второй организм принадлежат к различным родам. В других вариантах осуществления изобретения, первый организм и второй организм принадлежат к различным видам одного и того же рода. Первый полипептидный компонент или второй полипептидный компонент слитого полипептида может соответствовать всей аминокислотной последовательности дикого типа или всей природной аминокислотной последовательности или ее части (например, описанному в настоящем документе фрагменту). Второй полипептидный компонент может быть присоединен к N-концу или С-концу первого полипептидного компонента.
2.3. Фрагменты полипептидов дикого типа или природных полипептидов
Активатор протромбина может содержать фрагмент полноразмерного полипептида дикого типа или природного полипептида, где указанный активатор протромбина обладает протромбин-активирующей активностью.
Обычно, фрагменты полноразмерного полипептида могут участвовать во взаимодействии, например, во внутримолекулярном или в межмолекулярном взаимодействии. Такими фрагментами являются пептиды, содержащие аминокислотные последовательности SEQ ID NO:2, 3, 4, 51 и 52, и пептиды, содержащие аминокислотные последовательности, которые имеют достаточное сходство с аминокислотными последовательностями (предполагаемого) полноразмерного полипептида или происходят от указанных аминокислотных последовательностей, например, аминокислотных последовательностей SEQ ID NO: 1, 7, 8, 11, 12, 13, 16, 18, 26, 27, 28, 29, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48 и 50, или аминокислотных последовательностей, кодируемых нуклеотидной последовательностью, выбранной из последовательностей SEQ ID NO:5, 6, 9, 10, 14, 15, 17, 19, 20, 21, 22, 23, 24, 25, 31, 33, 35, 37, 39, 41, 43, 45, 47 и 49, где указанный фрагмент включает меньшее количество аминокислот, чем полноразмерный полипептид и обладает одной из активностей этого полипептида.
2.4. Варианты природных активаторов протромбина (полипептида)
В настоящем изобретении также рассматриваются активаторы протромбина, содержащие полипептид(ы), который(ые) представляет(ют) собой вариант(ы) природного(ых) полипептида(ов) или полипептида(ов) дикого типа. Активаторы протромбина, содержащие один или несколько полипептидных вариантов согласно изобретению, являются биологически активными, то есть они сохраняют протромбин-активирующую активность.
Такие «варианты» активаторов протромбина включают полипептиды, происходящие от нативного полипептида, где указанные полипептиды образуются из соответствующего(их) нативного(ых) полипептида(ов) в результате делеции (так называемого усечения) или добавления одной или нескольких аминокислот к N-концу и/или C-концу нативного(ых) полипептида(ов); делеции или добавления одной или нескольких аминокислот в одном или нескольких сайтах нативного(ых) полипептида(ов); или замены одной или нескольких аминокислот в одном или нескольких сайтах нативного(ых) полипептида(ов). Эти варианты активаторов протромбина могут образовываться, например, в результате полиморфизма генов или модификаций, внесенных человеком.
Другими неограничивающими примерами полипептидных вариантов являются полипептидный предшественник или полипептид в форме зимогена, и в форме, образующейся после процессинга полноразмерного полипептида или его предшественника, или полипептида в форме зимогена.
Варианты полипептида дикого типа или природного полипептида имеют последовательность, которая по меньшей мере на 40%, 50%, 60%, 70%, обычно по меньшей мере на 75%, 80%, 85%, обычно приблизительно на 90%, 91%, 92%, 93%, 94%, 95% или более, а в основном, приблизительно на 96%, 97%, 98% или более (и все целые значения процентов в промежуточных интервалах между указанными значениями) аналогична или идентична аминокислотной последовательности полипептида дикого типа или природного полипептида, включая, но не ограничиваясь ими, последовательности SEQ ID NO: 1, 2, 3, 4, 7, 8, 11, 12, 13, 16, 18, 26, 27, 28, 29, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 51 и 52, или аминокислотные последовательности, кодируемые нуклеотидными последовательностями SEQ ID NO: 5, 6, 9, 10, 14, 15, 17, 19, 20, 21, 22, 23, 24, 25, 31, 33, 35, 37, 39, 41, 43, 45, 47 и 49, как было определено с помощью описанных в настоящем документе программ по выравниванию последовательностей, в которых используются параметры по умолчанию. Вариант полипептида дикого типа или природного полипептида, который входит в объем термина «полипептидный вариант», может отличаться от указанного полипептида обычно максимум на 200, 100, 50 или 20 аминокислотных остатков или, если это необходимо, по меньшей мере на 1-15, по меньшей мере на 1-10, например, на 6-10, по меньшей мере на 5, по меньшей мере на 4, 3, 2 аминокислотных остатков, или даже на 1 аминокислотный остаток. В некоторых вариантах осуществления изобретения, полипептидный вариант отличается от соответствующих последовательностей SEQ ID NO: 1, 2, 3, 4, 7, 8, 11, 12, 13, 16, 18, 26, 27, 28, 29, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 51 или 52, или от аминокислотных последовательностей, кодируемых нуклеотидными последовательностями SEQ ID NO: 5, 6, 9, 10, 14, 15, 17, 19, 20, 21, 22, 23, 24, 25, 31, 33, 35, 37, 39, 41, 43, 45, 47 или 49, по меньшей мере на 1 аминокислотный остаток, но менее чем на 15, 10 или 5 аминокислотных остатков. В других вариантах осуществления изобретения, полипептидный вариант отличается от соответствующих последовательностей SEQ ID NO: 1, 2, 3, 4, 7, 8, 11, 12, 13, 16, 18, 26, 27, 28, 29, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 51 или 52, или от аминокислотных последовательностей, кодируемых нуклеотидными последовательностями SEQ ID NO: 5, 6, 9, 10, 14, 15, 17, 19, 20, 21, 22, 23, 24, 25, 31, 33, 35, 37, 39, 41, 43, 45, 47 или 49, по меньшей мере на один остаток, но менее чем на 20%, 15%, 10% или 5% от всего числа остатков.
Полипептид может быть модифицирован различными способами, включая аминокислотные замены, делеции, усечения и инсерции. Методы таких модификаций, в основном, известны специалистам. Так, например, варианты аминокислотных последовательностей полипептида могут быть получены посредством мутаций, введенных в ДНК. Методы мутагенеза и модификаций нуклеотидных последовательностей хорошо известны специалистам. См., например, публикации Kunkel (1985), Kunkel et al., (1987), патент США 4873192, Watson et al., (1987) и цитируемые там работы. Руководство по введению соответствующих аминокислотных замен, не влияющих на биологическую активность представляющего интерес белка, можно найти в описании модели Dayhoff et al. (1978). Методы скрининга генных продуктов комбинаторных библиотек, полученных посредством точковых мутаций или усечения, и методы скрининга библиотек кДНК генных продуктов, обладающих выбранным свойством, известны специалистам. Такие методы могут быть адаптированы для быстрого скрининга генных библиотек, полученных посредством комбинаторного мутагенеза полипептидов. Рекурсивный комбинированный мутагенез (REM), то есть способ, позволяющий повышать частоту функциональных мутаций в библиотеках, может быть использован в комбинации со скринирующими анализами для идентификации полипептидных вариантов, см., например, Arkin et al. (1992) и Delagrave et al. (1993). При этом, могут оказаться желательными консервативные замены, такие как замена одной аминокислоты другой аминокислотой, имеющей аналогичные свойства, как более подробно обсуждается ниже.
Полипептидные варианты, по сравнению с родительской (например, природной или исходной) аминокислотной последовательностью, могут содержать консервативные аминокислотные замены в различных положениях по всей последовательности. «Консервативной аминокислотной заменой» является замена, при которой аминокислотный остаток заменен аминокислотным остатком, имеющим аналогичную боковую цепь. Семейства аминокислотных остатков, имеющих аналогичные боковые цепи, были определены в литературе, и такие семейства, в основном, могут быть подразделены на подклассы:
Кислотный остаток: Такой остаток имеет отрицательный заряд, что обусловлено потерей иона H при физиологическом рН, и этот остаток захватывается водным раствором и старается занять положение на поверхности пептида в той конформации, в которой он присутствует, если этот пептид находится в водной среде при физиологическом рН. Аминокислотами, имеющими кислотную боковую цепь, являются глутаминовая кислота и аспарагиновая кислота.
Основный остаток: Такой остаток имеет положительный заряд, что обусловлено присоединением иона H при физиологическом рН или при одном или двух других значениях рН (например, гистидин), и этот остаток захватывается водным раствором и старается занять положение на поверхности пептида в той конформации, в которой он присутствует, если этот пептид находится в водной среде при физиологическом рН. Аминокислотами, имеющими основную боковую цепь, являются аргинин, лизин и гистидин.
Заряженные остатки: Эти остатки являются заряженными при физиологическом рН, а поэтому такими остатками являются аминокислотные остатки, имеющие кислотные или основные боковые цепи (то есть глутаминовая кислота, аспарагиновая кислота, аргинин, лизин и гистидин).
Гидрофобные остатки: Такие остатки являются незаряженными при физиологическом рН, и эти остатки отталкиваются водным раствором и стараются занять внутренние положения в пептиде в той конформации, в которой он присутствует, если этот пептид находится в водной среде. Аминокислотами, имеющими гидрофобную боковую цепь, являются тирозин, валин, изолейцин, лейцин, метионин, фенилаланин и триптофан.
Нейтральные/полярные остатки: Такие остатки являются не заряженными при физиологическом рН, но эти остатки не достаточно отталкиваются водным раствором, чтобы занять внутренние положения в пептиде в той конформации, в которой он присутствует, если этот пептид находится в водной среде. Аминокислотами, имеющими нейтральную/полярную боковую цепь, являются аспарагин, глутамин, цистеин, гистидин, серин и треонин.
В настоящем описании некоторые аминокислоты также охарактеризованы как «небольшие», поскольку их боковые цепи не являются слишком крупными, чтобы сообщать гидрофобность, даже если отсутствуют полярные группы. «Небольшие» аминокислоты, за исключением пролина, представляют собой аминокислоты с четырьмя атомами углерода или менее, если на боковой цепи присутствует по меньшей мере одна полярная группа, и с тремя атомами углерода или менее, если такая группа отсутствует. Аминокислотами, имеющими небольшую боковую цепь, являются глицин, серин, аланин и треонин. В данном случае, в отдельный ряд можно выделить кодируемую геном вторичную аминокислоту пролин, поскольку известно, что такая аминокислота влияет на вторичную конформацию пептидных цепей. Структура пролина отличается от структуры всех остальных природных аминокислот тем, что его боковая цепь связана с атомом азота α-аминогруппы, а также α-углерода. Существует несколько матриц с аналогичными аминокислотами (например, матрица PAM120 и матрица PAM250, описанные, например, в публикации Dayhoff et al. (1978) и Gonnet et al. (1992)), однако они включают пролин, который принадлежит к той же самой группе, к которой относятся глицин, серин, аланин и треонин. В соответствии с настоящим изобретением, пролин относят к классу «небольших» аминокислот.
Степень притяжения или отталкивания, необходимая для классификации на полярные или неполярные остатки, является условным понятием, а поэтому аминокислоты, конкретно рассматриваемые в настоящем изобретении, были классифицированы как аминокислоты, принадлежащие к той или другой группе. Большинство аминокислот, которые не имеют конкретных названий, могут быть классифицированы по их известным свойствам.
Аминокислотные остатки могут быть также отнесены к другим подклассам, таким как циклические или нециклические аминокислоты и ароматические или неароматические аминокислоты, и такая классификация сама указывает на группы-заместители боковых цепей остатков, и эти остатки могут быть подразделены на «небольшие» или «крупные». Остаток считается небольшим, если он содержит всего четыре атома углерода или менее, включая углерод карбоксильной группы, при условии, что присутствует дополнительный полярный заместитель; либо три или менее атома, если он отсутствует. Очевидно, что небольшие остатки всегда являются неароматическими. Аминокислотные остатки, в зависимости от их структурных свойств, могут принадлежать к двум или более классам. Для аминокислот природных белков существуют подклассы, которые описаны в таблице 1, представленной ниже.
Подклассы аминокислот
Консервативные аминокислотные замены также подразделяются на группы по их боковым цепям. Так, например, в группу аминокислот, имеющих алифатические боковые цепи, входят глицин, аланин, валин, лейцин и изолейцин; в группу аминокислот, имеющих алифатические-гидроксильные боковые цепи, входят серин и треонин; в группу аминокислот, имеющих амидсодержащие боковые цепи, входят аспарагин и глутамин; в группу аминокислот, имеющих ароматические боковые цепи, входят фенилаланин, тирозин и триптофан; в группу аминокислот, имеющих основные боковые цепи, входят лизин, аргинин и гистидин, а в группу аминокислот, имеющих серусодержащие боковые цепи, входят цистеин и метионин. Так, например, имеются основания предположить, что замена лейцина на изолейцин или валин, замена аспартата на глутамат; замена треонина на серин; или аналогичная замена аминокислоты на структурно родственную аминокислоту не будет оказывать значительного влияния на свойства полученного полипептидного варианта. Успех в получении функционального полипептида в результате аминокислотной замены может быть легко подтвержден с помощью анализа на его активность. Консервативные замены показаны в таблице 2, озаглавленной «Репрезентативные и предпочтительные замены». Аминокислотные замены, входящие в объем настоящего изобретения, осуществляют, в основном, путем выбора замен, которые не оказывают значительного влияния на (a) структуру пептидного остова молекулы в области замены, (b) заряд или гидрофобность молекулы в сайте-мишени, или (c) объем боковой цепи. После введения замен, эти варианты могут быть скринированы на биологическую активность.
Репрезентативные и предпочтительные аминокислотные замены
Альтернативно, аналогичные аминокислоты, подходящие для осуществления аминокислотных замен, могут быть подразделены на группы по трем категориям, исходя из идентичности боковых цепей. В первую группу входят глутаминовая кислота, аспарагиновая кислота, аргинин, лизин, гистидин, где каждая из этих аминокислот имеет заряженные боковые цепи; во вторую группу входят глицин, серин, треонин, цистеин, тирозин, глутамин, аспарагин, а в третью группу входят лейцин, изолейцин, валин, аланин, пролин, фенилаланин, триптофан, метионин, как описано Zubay, G. (1993).
Таким образом, предсказанный заменимый аминокислотный остаток в полипептиде обычно заменяют другим аминокислотным остатком того же семейства, имеющим ту же самую боковую цепь. Альтернативно, в полноразмерную генную последовательность, кодирующую полипептид, или в ее часть могут быть внесены неспецифические мутации, например, посредством насыщающего мутагенеза, и полученные мутанты могут быть скринированы на активность родительского полипептида для идентификации мутантов, сохраняющих такую активность. После мутагенеза кодирующих последовательностей, кодируемый пептид может быть рекомбинантно экспрессирован, а затем может быть определена активность такого пептида. «Заменимым» аминокислотным остатком является остаток, который может быть заменен в последовательности полипептида дикого типа так, чтобы такая замена не ингибировала или существенно не изменяла одну или более активностей исходного полипептида. В соответствии с этим, такая замена не должна влиять на одну из этих активностей, например, такая активность должная составлять по меньшей мере 20%, 40%, 60%, 70% или 80% от активности дикого типа. «Незаменимым» аминокислотным остатком является остаток, замена которого в последовательности исходного полипептида дикого типа будет приводить к ингибированию активности родительской молекулы, до такой степени, что она будет составлять менее чем 20% от активности дикого типа.
В соответствии с этим, в настоящем изобретении также рассматриваются варианты природных полипептидных последовательностей или их биологически активных фрагментов, где указанные варианты отличаются от природной последовательности добавлением, делецией или заменой одного или более аминокислотных остатков. В общих чертах, варианты будут иметь последовательность, которая по меньшей мере приблизительно на 30, 40, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% аналогична последовательности родительского или исходного полипептида, например, последовательности SEQ ID NO: 1, 2, 3, 4, 7, 8, 11, 12, 13, 16, 18, 26, 27, 28, 29, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 51 или 52, или последовательности родительского или исходного полипептида, например, кодируемого нуклеотидной последовательностью SEQ ID NO: 5, 6, 9, 10, 14, 15, 17, 19, 20, 21, 22, 23, 24, 25, 31, 33, 35, 37, 39, 41, 43, 45, 47 или 49. При этом, желательно, чтобы варианты имели последовательность, которая будет по меньшей мере на 30, 40, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% идентична последовательности родительского полипептида, например, SEQ ID NO: 1, 2, 3, 4, 7, 8, 11, 12, 13, 16, 18, 26, 27, 28, 29, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 51 или 52, или последовательности родительского полипептида, например, кодируемого нуклеотидной последовательностью SEQ ID NO: 5, 6, 9, 10, 14, 15, 17, 19, 20, 21, 22, 23, 24, 25, 31, 33, 35, 37, 39, 41, 43, 45, 47 или 49. Кроме того, в настоящем изобретении рассматриваются последовательности, отличающиеся от нативных или родительских последовательностей добавлением, делецией или заменой 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 30, 40, 50, 60,70, 80, 90, 100 или более аминокислот, но сохраняющие свойства родительского полипептида. Полипептидами также являются полипептиды, кодируемые полинуклеотидами, которые гибридизуются в условиях жесткости, определенных в настоящей заявке, в частности, в условиях высокой жесткости, с родительскими кодирующими полинуклеотидными последовательностями или с их некодирующими цепями, как описано ниже. Репрезентативные последовательности родительского полинуклеотида представлены в SEQ ID NO: 5, 6, 9, 10, 14, 15, 17, 19, 20, 21, 22, 23, 24, 25, 31, 33, 35, 37, 39, 41, 43, 45, 47 и 49.
В некоторых вариантах осуществления изобретения, полипептидные варианты отличаются от исходной последовательности по меньшей мере на один аминокислотный остаток, но не более чем на 50, 40, 30, 20, 15, 10, 8, 6, 5, 4, 3 или 2 аминокислотных остатков. В других вариантах осуществления изобретения, полипептидные варианты отличаются от соответствующих последовательностей SEQ ID NO: 1, 2, 3, 4, 7, 8, 11, 12, 13, 16, 18, 26, 27, 28, 29, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 51 или 52, или от аминокислотных последовательностей, кодируемых нуклеотидными последовательностями SEQ ID NO: 5, 6, 9, 10, 14, 15, 17, 19, 20, 21, 22, 23, 24, 25, 31, 33, 35, 37, 39, 41, 43, 45, 47 или 49, по меньшей мере на 1%, но не более чем на 20%, 15%, 10% или 5% остатков. (Если для такого сравнения необходимо выравнивание, то последовательности должны быть выровнены по максимальному сходству. Последовательности, образующие петли в результате делеций, инсерций или ошибочных спариваний, рассматриваются как последовательности, имеющие отличия). Эти отличия представляют собой соответствующие различия или изменения в положении заменимого остатка или консервативные замены.
Варианты белка могут быть идентифицированы путем скрининга комбинаторных библиотек мутантов, например, усеченных мутантов белка. Библиотеки или фрагменты, например, N-концевые, С-концевые или внутренние фрагменты белок-кодирующей последовательности могут быть использованы для генерирования различных популяций фрагментов в целях скрининга и последующего отбора вариантов белка.
Методы скрининга генных продуктов комбинаторных библиотек, полученных путем точковых мутаций или усечения, и методы скрининга библиотек кДНК генных продуктов, обладающих выбранным свойством, известны специалистам. Такие методы могут быть адаптированы для быстрого скрининга генных библиотек, созданных посредством комбинаторного мутагенеза белков.
Некоторые варианты змеиного активатора протромбина, экарина, описаны в патенте США 6413737.
2.5. Варианты природных активаторов протромбина (нуклеотидов)
В настоящем изобретении также рассматриваются активаторы протромбина, содержащие полипептид(ы), кодируемый(ые) вариантом(ами) полинуклеотида(ов) дикого типа или природного(ых) полинуклеотида(ов), кодирующего(их) полипептид(ы) дикого типа или природный(е) полипептид(ы).
Варианты полинуклеотидов дикого типа или природных полинуклеотидов имеют последовательность, которая по меньшей мере на 40%, 50%, 60%, 70%, обычно по меньшей мере на 75%, 80%, 85%, 87%, 88%, 89%, обычно приблизительно на 90%, 91%, 92%, 93%, 94%, 95% или более, в основном, приблизительно на 96%, 97%, 98% или более (и целые значения процентов в промежуточных интервалах между указанными значениями) аналогична или идентична нуклеотидной последовательности полинуклеотида дикого типа или природного полинуклеотида, включая, но не ограничиваясь ими, последовательности SEQ ID NO: 1, 2, 3, 4, 7, 8, 11, 12, 13, 16, 18, 26, 27, 28, 29, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 51 или 52, или последовательности SEQ ID NO:5, 6, 9, 10, 14, 15, 17, 19, 20, 21, 22, 23, 24, 25, 31, 33, 35, 37, 39, 41, 43, 45, 47 и 49, или их комплемент, как было определено с помощью описанных в настоящем документе программ по выравниванию последовательностей, в которых используются параметры по умолчанию.
Репрезентативные нуклеотидные последовательности, кодирующие полипептиды, охватывают полноразмерные гены, а также части полноразмерных или, по существу, полноразмерных нуклеотидных последовательностей генов или их транскриптов, или ДНК-копий этих транскриптов. Части нуклеотидной последовательности могут кодировать полипептидные части или сегменты, сохраняющие биологическую активность нативного полипептида. Часть нуклеотидной последовательности, кодирующей биологически активный фрагмент полипептида, может кодировать по меньшей мере приблизительно 20, 21, 22, 23, 24, 25, 30, 40, 50, 60, 70, 80, 90, 100, 120, 150, 300 или 400 смежных аминокислотных остатков, или почти все аминокислоты, присутствующие в полноразмерном полипептиде.
Также рассматриваются варианты нуклеотидных последовательностей. Варианты нуклеиновой кислоты могут быть природными вариантами, такими как аллельные варианты (имеющие один и тот же локус), гомологи (имеющие различные локусы) и ортологи (происходящие от различных организмов), либо они могут быть не-природными вариантами. Природные варианты, например, варианты, описанные выше, могут быть идентифицированы хорошо известными методами молекулярной биологии, например, методами полимеразной цепной реакции (ПЦР) и гибридизации, известными специалистам. Не-природные варианты могут быть получены методами мутагенеза, включая мутагенез полинуклеотидов, клеток или организмов. Варианты могут содержать нуклеотидные замены, делеции, инверсии и инсерции. Модификация может присутствовать либо в кодирующих, либо в не-кодирующих областях, или в обеих областях. Такие модификации могут продуцировать консервативные и неконсервативные аминокислотные замены (по сравнению с кодируемым продуктом). Что касается нуклеотидных последовательностей, то консервативными вариантами являются последовательности, которые, благоларя вырожденности генетического кода, кодируют аминокислотную последовательность исходного полипептида. Вариантами нуклеотидных последовательностей также являются синтетические нуклеотидные последовательности, например, последовательности, которые были получены, например, с помощью сайт-направленного мутагенеза, но которые все же кодируют данный полипептид. Вообще говоря, варианты конкретной нуклеотидной последовательности могут иметь последовательность, которая будет по меньшей мере приблизительно на 30%, 40% 50%, 55%, 60%, 65%, 70%, в основном, по меньшей мере приблизительно на 75%, 80%, 85%, 86%, 87%, 88%, 89%, предпочтительно, приблизительно на 90%, 91%, 92%, 93%, 94%, 95% или более, наиболее предпочтительно, приблизительно на 96%, 97%, 98% или более идентична конкретной нуклеотидной последовательности, как было определено с помощью описанных в настоящем документе программ по выравниванию последовательностей, в которых используются параметры по умолчанию.
Нуклеотидные последовательности могут быть использованы для выделения соответствующих последовательностей и аллелей из других организмов, в частности, из ядов других змей. Методы гибридизации последовательностей нуклеиновой кислоты хорошо известны специалистам. Кодирующие последовательности, происходящие от других организмов, могут быть выделены хорошо известными методами исходя из их идентичности кодирующим последовательностям, описанным в настоящей заявке. В этих методах, полноразмерная кодирующая последовательность или ее часть используется в качестве зонда, который селективно гибридизуется с другими кодирующими последовательностями, присутствующими в популяции клонированных геномных ДНК-фрагментов или кДНК-фрагментов (то есть геномных библиотек или библиотек кДНК), происходящих от выбранного организма (например, змеи). В соответствии с этим, в настоящем изобретении также рассматриваются полинуклеотиды, которые гибридизуются с исходными нуклеотидными последовательностями или с их комплементами в жестких условиях, описанных ниже. Используемые в настоящем документе термины «гибридизуются в условиях низкой жесткости, умеренной жесткости, высокой жесткости или очень высокой жесткости» определяют условия гибридизации и промывки.
Руководство по осуществлению реакций гибридизации можно найти в публикации Ausubel et al., см. выше, разделы 6.3.1-6.3.6. В этой публикации описаны методы с использованием водных и безводных растворов, и в данном случае может быть применен любой из этих методов. Указанные в настоящем документе условия гибридизации низкой жесткости включают и охватывают использование по меньшей мере приблизительно 1% об./об.-15% об./об. формамида и по меньшей мере приблизительно 1 M-2 M соли для гибридизации при 42°C, и по меньшей мере приблизительно 1 M-2 M соли для промывки при 42°C. Условия гибридизации низкой жесткости могут также включать использование 1% альбумина бычьей сыворотки (BSA), 1 мМ EDTA, 0,5 M NaHPO4 (pH 7,2), 7% ДСН для гибридизации при 65°C, и (i) 2 x SSC, 0,1% ДСН; или (ii) 0,5% BSA, 1 мМ EDTA, 40 мМ NaHPO4 (pH 7,2), 5% ДСН для промывки при комнатной температуре. Один из вариантов условий гибридизации низкой жесткости включает гибридизацию в 6 x хлориде натрия/цитрате натрия (SSC) приблизительно при 45°C, а затем две промывки в 0,2 x SSC, 0,1% ДСН по меньшей мере при 50°C (температура промывок может быть повышена до 55°C в условиях низкой жесткости). Условия гибридизации умеренной жесткости включают и охватывают использование по меньшей мере приблизительно 16% об./об.-30% об./об. формамида и по меньшей мере приблизительно 0,5 M-0,9 M соли для гибридизации при 42°C, и по меньшей мере приблизительно 0,1 M-0,2 M соли для промывки при 55°C. Условия гибридизации умеренной жесткости могут также включать использование 1% альбумина бычьей сыворотки (BSA), 1 мМ EDTA, 0,5 M NaHPO4 (pH 7,2), 7% ДСН для гибридизации при 65°C, и (i) 2 x SSC, 0,1% ДСН; или (ii) 0,5% BSA, 1 мМ EDTA, 40 мМ NaHPO4 (pH 7,2), 5% ДСН для промывки при 60-65°C. Один из вариантов условий гибридизации умеренной жесткости включает гибридизацию в 6 x SSC приблизительно при 45°C, а затем одну или несколько промывок в 0,2 x SSC, 0,1% ДСН при 60°C. Условия гибридизации высокой жесткости включают и охватывают использование по меньшей мере приблизительно 31% об./об.-50% об./об. формамида и приблизительно 0,01 M-0,15 M соли для гибридизации при 42°C, и приблизительно 0,01 M-0,02 M соли для промывки при 55°C. Условия гибридизации высокой жесткости могут также включать использование 1% BSA, 1 мМ EDTA, 0,5 M NaHPO4 (pH 7,2), 7% ДСН для гибридизации при 65°C, и (i) 0,2 x SSC, 0,1% ДСН; или (ii) 0,5% BSA, 1 мМ EDTA, 40 мМ NaHPO4 (pH 7,2), 1% ДСН для промывки при температуре, превышающей 65°C. Один из вариантов условий гибридизации высокой жесткости включает гибридизацию в 6 x SSC приблизительно при 45°C, а затем одну или несколько промывок в 0,2 x SSC, 1% ДСН при 65°C.
В некоторых вариантах осуществления изобретения, полипептид кодируется полинуклеотидом, который гибридизуется с описанной нуклеотидной последовательностью в условиях гибридизации низкой, умеренной, высокой или очень высокой жесткости. Один из вариантов гибридизации в условиях очень высокой жесткости включает гибридизацию с использованием 0,5 M фосфата натрия, 7% ДСН при 65°C, а затем одну или несколько промывок в 0,2 x SSC, 1% ДСН при 65°C.
Другие жесткие условия гибридизации хорошо известны специалистам, и при этом, совершенно очевидно, что оптимизация специфичности гибридизации зависит от различных факторов. Оптимизация жесткости конечных промывок позволит достичь высокой степени гибридизации. Подробное описание примеров можно найти в руководствах Ausubel et al., см. выше, на страницах 2.10.1-2.10.16 и Sambrook, J. et al. (2001) в разделах 1.101-1.104.
Хотя промывки в жестких условиях обычно проводят при температурах приблизительно 42°C-68°C, однако следует отметить, что гибридизация в жестких условиях может быть проведена и при других температурах. Максимальная степень гибридизации обычно достигается приблизительно при температуре 20°C-25°C, которая ниже Tm для образования гибрида ДНК-ДНК. Хорошо известно, что Tm представляет собой температуру плавления или температуру, при которой диссоциируются две комплементарных полинуклеотидных последовательности. Методы оценки Tm хорошо известны специалистам (Ausubel et al., см. выше, на странице 2.10.8). В общих чертах, Tm дуплекса ДНК с абсолютно точным спариванием оснований может быть приближенно определена по формуле:
Tm=81,5+16,6(logl0 M)+0,41(%G+C)-0,63(% формамида)-(600/длину),
где: M представляет собой концентрацию Na+, предпочтительно, в пределах 0,01-0,4 моль; %G+C представляет собой сумму гуаниновых и цитозиновых оснований, выраженную в процентах от общего числа оснований, и составляющую в пределах 30%-75% G+C; % формамида равен концентрации формамида по объему; длина равна числу пар оснований в ДНК-дуплексе. Tm ДНК-дуплекса снижается приблизительно на 1°C при каждом увеличении числа случайного ошибочного спаривания оснований на 1%. Промывку обычно осуществляют при Tm - 15°C в условиях высокой жесткости или при Tm - 30°C в условиях умеренной жесткости.
В одном из примеров осуществления гибридизации, мембрану (например, нитроцеллюлозную мембрану или найлоновую мембрану), содержащую иммобилизованную ДНК, гибридизуют в течение ночи при 42°C в буфере для гибридизации (50% деионизованный формамид, 5 x SSC, 5 x раствор Денхардта (0,1% фиколл, 0,1% поливинилпирролидон и 0,1% алюбумин бычьей сыворотки), 0,1% ДСН и 200 мг/мл денатурированной ДНК спермы лосося), содержащем меченный зонд. После этого, мембрану подвергают двум последовательным промывкам в условиях умеренной жесткости (то есть 2 x SSC, 0,1% ДСН в течение 15 минут при 45°C, а затем 2 x SSC, 0,1% ДСН в течение 15 минут при 50°C), а затем двум последовательным промывкам в условиях более высокой жесткости (то есть 0,2 x SSC, 0,1% ДСН в течение 12 минут при 55°C, а затем раствором 0,2 x SSC и 0,1% ДСН в течение 12 минут при 65-68°C.
3. Получение активаторов протромбина
Активаторы протромбина могут быть получены любым подходящим способом, известным специалистам.
Так, например, активаторы протромбина могут быть получены любым стандартным методом, таким как выделение полипептида из природных источников, включая, но не ограничиваясь ими, змеиный яд, кровь и продукты, полученные из крови (например, сыворотка). Методами очистки являются аффинная хроматография, включая аффинную хроматографию на лектине (например, на агглютинине семян пшеницы), или другие методы выделения. Идентичность и чистота полученного активатора протромбина могут быть определены, например, с помощью электрофороза на полиакриламидном геле с ДСН или с помощью хроматографии, такой как высокоэффективная жидкостная хроматография (ВЭЖХ). Так, например, очистка и характеризация псеутарина C (также обозначаемого PtPA), выделенного из яда змеи P. textilis, описана в публикации Masci (1986) и Masci et al. (1988), а очистка и характеризация оскутарина С (OsPA), выделенного из яда змеи O. scutellatus, описана в публикации Speijer et al. (1986), которые во всей своей полноте вводятся в настоящее описание в качестве ссылки. Очистка экарина, выделенного из яда змеи E. carinatus, описана в публикации Morita, T et al. (1981), содержание которой во всей своей полноте включено в настоящее описание в качестве ссылки.
Альтернативно, активаторы протромбина могут быть получены из яда культуры железистых клеток известными методами, включая, например, метод, описанный в публикации Yamanouye, N., et al. (2007), где описана первичная культура секреторных клеток, выделенных из ядовитой железы Bothrops jararaca для получения яда in vitro, и содержание этой публикации включено в настоящее описание в качестве ссылки в полном объеме.
Альтернативно, активаторы протромбина могут быть синтезированы методом химического синтеза, например, синтеза в растворе или твердофазного синтеза, описанного, например, в главе 9 публикации Atherton and Shephard (1989) и в публикации Roberge et al. (1995).
Альтернативно, активаторы протромбина могут быть получены рекомбинантными методами. Так, например, активаторы протромбина, используемые в настоящем изобретении, могут быть получены способом, включающим стадии: (a) получения конструкции, содержащей полинуклеотидную последовательность, кодирующую полипептид и функционально присоединенную к регуляторному элементу; (b) введения указанной конструкции в клетку-хозяина; (c) культивирования клетки-хозяина для экспрессии полипептида; (d) выделения полипептида из указанной клетки-хозяина. Если активатор протромбина содержит комплекс или два полипептида, то такой активатор протромбина может быть получен способом, включающим стадии: (a) получения конструкции, содержащей полинуклеотидную последовательность, кодирующую первый полипептид и функционально присоединенную к регуляторному элементу; (b) введения указанной конструкции в клетку-хозяина; (c) культивирования клетки-хозяина для экспрессии первого полипептида; (d) выделения полипептида из указанной клетки-хозяина; повторения стадий (a)-(d) для второго полипептида; и присоединения первого полипептида ко второму полипептиду. В репрезентативных примерах, нуклеотидная последовательность, кодирующая полипептид, кодирует по меньшей мере биологически активную часть последовательностей SEQ ID NO: 5, 6, 9, 10, 14, 15, 17, 19, 20, 21, 22, 23, 24, 25, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, или их вариантов.
Рекомбинантные активаторы протромбина могут быть соответствующим образом получены с применением стандартных протоколов, описанных в руководствах Sambrook, J. et al. (2001), в частности, в главах 16 и 17; Ausubel et al. (1994, выше), в частности, в главах 10 и 16; и Coligan et al., Current Protocols in Protein Science (John Wiley & Sons, Inc. 1995-1997), в частности, в главах 1, 5 и 6. Так, например, рекомбинантное продуцирование змеиного фактора V и змеиного фактора X, которые могут быть использованы для получения активаторов протромбина группы С и группы D, описано в публикациях Filippovic, I. et al. (2005) и Bos, M. H. A. et al. (2009), каждая из которых во всей своей полноте включена в настоящее описание в качестве ссылки. Репрезентативный способ рекомбинантного продуцирования экарина и вариантов экарина описан в публикации Yonemura, H. et al. (2004) и в патенте США 6413737, содержание которых вводится в настоящее описание в качестве ссылки в полном объеме.
4. Контейнеры
В настоящем изобретении рассматривается любой подходящий контейнер для получения подходящей пробы сыворотки. Существует много подходящих хорошо известных контейнеров, включая контейнеры, описанные в патенте США 4227620; в патенте США 4256120; в патенте США 6416717; в патенте США 6592613; в патенте США 6686204; в патенте США 7488287; в патенте США 7699828; в Европейском патенте 0628816; и выпускаемые промышленностью контейнеры, включая контейнеры, описанные в примерах настоящей заявки.
В некоторых вариантах осуществления изобретения, контейнерами, используемыми в соответствии с настоящим изобретением, являются пробирки, включая стеклянные или пластиковые пробирки. Подходящим для этого пластиком являются поливинилхлорид, полипропилен, полиэтилентерефталат и полистирол.
Из этих контейнеров может быть откачен воздух, а их конец может быть герметично закрыт соответствующей протыкаемой пробкой или крышкой. Это позволяет использовать двустороннюю иглу, которую одним концом вводят в вену пациента, а другим концом протыкают пробку или крышку, закрывающую конец пробирки, так чтобы вакуум в пробирке всасывал пробу крови в пробирку через иглу.
Контейнеры могут иметь любой подходящий размер. В некоторых вариантах осуществления изобретения, контейнеры изготавливают так, чтобы в них можно было поместить 50 мкл-10 мл пробы крови. В соответствии с этим, контейнеры могут быть изготовлены так, чтобы в них можно было поместить по меньшей мере 50 мкл, 100 мкл, 150 мкл, 200 мкл, 250 мкл, 300 мкл, 350 мкл, 400 мкл, 450 мкл, 500 мкл, 1 мл, 2 мл, 3 мл, 4 мл, 5 мл, 8 мл или 10 мл пробы крови.
В некоторых вариантах осуществления изобретения, контейнеры содержат коагулирующую композицию, содержащую 0,01-100 мкг активатора протромбина, в основном, состоящую или состоящую из 0,01-100 мкг активатора протромбина. В соответствии с этим, контейнеры содержат коагулирующую композицию, содержащую 0,1-10 мкг активатора протромбина, в основном, состоящую или состоящую из 0,1-10 мкг активатора протромбина. В репрезентативных вариантах осуществления изобретения, контейнеры содержат коагулирующую композицию, содержащую 0,1-10 мкг активатора протромбина, в основном состоящую или состоящую из 0,1-10 мкг активатора протромбина, и включают 4 мл пробы крови, где конечная концентрация активатора протромбина в 4 мл пробы крови составляет 25 нг/мл-2,5 мкг/мл.
В некоторых вариантах осуществления изобретения, контейнеры содержат коагулирующую композицию, содержащую 0,0005-15 мкг/мл активатора протромбина, в основном состоящую или состоящую из 0,0005-15 мкг/мл активатора протромбина. В соответствии с этим, контейнеры содержат коагулирующую композицию, содержащую 0,005-10 мкг активатора протромбина, в основном состоящую или состоящую из 0,005-10 мкг активатора протромбина.
В некоторых вариантах осуществления изобретения, контейнеры содержат коагулирующую композицию, содержащую 0,0005-15 ед./мл активатора протромбина, в основном состоящую или состоящую из 0,0005-15 ед./мл активатора протромбина. В соответствии с этим, контейнеры содержат коагулирующую композицию, содержащую 0,0015-10 ед./мл активатора протромбина, в основном состоящую или состоящую из 0,0015-10 ед./мл активатора протромбина. В некоторых вариантах осуществления изобретения, единица измерения представляет собой единицу измерения активатора протромбина, определяемую как 1 единица, которая активирует протромбин с продуцированием одной единицы амидолитической активности при рН 8,4 при 37°C, и 1 амидолитическая единица, которая гидролизует 1,0 мкмоль N-п-тозил-Gly-Pro-Arg-п-нитроанилида в минуту при рН 8,4 при 37°C.
В некоторых вариантах осуществления изобретения, коагулирующая композиция может присутствовать в контейнере до добавления в него пробы крови. В некоторых вариантах осуществления изобретения, коагулирующая композиция может быть добавлена в контейнер после добавления в него пробы крови.
Если коагулирующая композиция содержится в контейнере до добавления пробы крови, то она может быть добавлена в контейнер любым подходящим методом, известным специалистам. В некоторых вариантах осуществления изобретения, коагулирующую композицию растворяют в подходящем растворителе, а затем добавляют в контейнер и сушат на внутренней поверхности контейнера. Растворителем может быть нейтральный буфер. Коагулирующая композиция в растворе может быть осушена на внутренней поверхности контейнера путем сушки распылением или сушки вымораживанием, либо любым другим подходящим методом, известным специалистам. В некоторых других вариантах осуществления изобретения, коагулирующую композицию растворяют в подходящем растворителе и добавляют в контейнер без сушки, а поэтому контейнер содержит водный раствор, содержащий коагулирующую композицию. Растворителем может быть нейтральный буфер.
В некоторых вариантах осуществления изобретения, сферы покрывают коагулирующей композицией, а затем эти сферы добавляют в контейнер. Такими сферами могут быть стеклянные сферы или синтетические резиновые сферы, включая полистироловые и пропиленовые сферы. Сферы могут иметь сферическую форму. В некоторых вариантах осуществления изобретения, средний диаметр сфер составляет от 0,1 мм до 1 мм.
В некоторых вариантах осуществления изобретения, контейнер предназначен для отделения сыворотки от коагулированных клеток после свертывания. В некоторых вариантах осуществления изобретения, контейнер включает или содержит гель, который создает барьер между коагулированными клетками и пробой сыворотки. В некоторых вариантах осуществления изобретения, контейнер имеет подходящую форму и содержит материал, подходящий для центрифугирования в целях отделения или сохранения выделенных коагулированных клеток и пробы сыворотки. В некоторых вариантах осуществления изобретения, пробу сыворотки отделяют от коагулированных клеток, либо коагулированные клетки отделяют от пробы сыворотки.
В некоторых вариантах осуществления изобретения, контейнер может содержать один или несколько дополнительных компонентов. Другими компонентами, помимо коагулирующей композиции, могут быть, например, один или несколько кофакторов, одно или несколько поверхностно-активных веществ и/или один или несколько коагулирующих средств.
5. Дополнительные компоненты
В настоящей заявке определена описанная в настоящем документе коагулирующая композиция, состоящая или по существу состоящая из активатора протромбина, или содержащая активатор протромбина.
Термин «содержит» (и т.п.), используемый в разделе «Описание сущности изобретения» и в аналогичных разделах, имеющихся в настоящей заявке, означает, что коагулирующая композиция включает активатор протромбина и может также включать любые один или несколько дополнительных компонентов. Таким образом, активатор протромбина является обязательным компонентом, а все остальные компоненты являются необязательными и могут присутствовать или не присутствовать. Другими компонентами могут быть, например, один или несколько кофакторов, одно или несколько поверхностно-активных веществ и/или один или несколько дополнительных коагулирующих средств.
Термин «в основном, состоит из» (и т.п.), используемый в разделе «Описание сущности изобретения» и в аналогичных разделах, имеющихся в настоящей заявке, означает, что коагулирующая композиция включает активатор протромбина и может также включать любые один или несколько других компонентов, при условии, что эти компоненты не будут влиять на активность или действие активатора протромбина, или будут сообщать активность или действие активатора протромбина. Таким образом, активатор протромбина является обязательным компонентом, а другие компоненты являются необязательными и могут присутствовать или не присутствовать, в зависимости от того, влияют ли они на активность или действие активатора протромбина или нет.
Термин «состоит из» (и т.п.), используемый в разделе «Описание сущности изобретения» и в аналогичных разделах, имеющихся в настоящей заявке, означает, что коагулирующая композиция включает только активатор протромбина. Таким образом, словосочетание «состоит из» означает, что активатор протромбина является обязательным компонентом, а другие компоненты (такие как кофакторы или коагулирующие агенты) могут не присутствовать.
В соответствии с некоторыми вариантами, коагулирующая композиция может содержать змеиный яд, включая, но не ограничиваясь им, неочищенный змеиный яд. В некоторых других вариантах осуществления изобретения, коагулирующая композиция может содержать препарат активатора протромбина, полученный путем частичной или полной очистки змеиного яда. Такие препараты могут быть получены любым подходящим методом, включая хроматографические методы и методы гель-фильтрации, включая методы, описанные в настоящей заявке и в других работах. В некоторых других вариантах осуществления изобретения, коагулирующая композиция может содержать очищенный активатор протромбина или выделенный активатор протромбина. Очищенный и выделенный активаторы протромбина могут быть получены любым подходящим методом, известным специалистам, включая методы, описанные в настоящей заявке и в других работах.
5.1. Кофакторы
Способность определенных в настоящем документе активаторов протромбина активировать протромбин с его превращением в тромбин, может быть повышена путем добавления кофакторов, включая, но не ограничиваясь ими, кальций, фосфолипид(ы) и полипептиды, обладающие FVa-активностью.
5.2. Поверхностно-активные вещества
Подходящими поверхностно-активными веществами являются любое подходящее поверхностно-активное вещество, включая, но не ограничиваясь ими, додецилсульфат натрия (ДСН), лаурилсульфат аммония, лауретсульфат натрия и миретсульфат натрия.
5.3. Коагулирующие средства
Коагулирующие средства или коагулянты относятся к классу природных коагулирующих средств или не-природных коагулирующих средств, способных стимулировать каскад реакций свертывания крови (см., например, патент США 6686204).
Подходящими коагулирующими средствами являются, но не ограничиваются ими, диатомовая земля, микрочастицы или частицы неорганических силикатов, микрочастицы двуокиси кремния, стеклянные микрочастицы, эллагиновая кислота, тромбин, гепариназа, тромбопластин, батроксобин, гидроксиаппатит, каолин, каолиновые частицы, протромбин (включая протромбиновые микрочастицы), фибриноген и деполимеризованный коллаген.
6. Пробы сыворотки
Как обсуждалось выше, настоящее изобретение частично основано на обнаружении того факта, что определенные в настоящем документе активаторы протромбина представляют собой подходящие коагулирующие средства для получения проб сыворотки, которые могут быть использованы для детектирования аналитов. Пробой сыворотки, подходящей для детектирования аналитов, является проба сыворотки приемлемого качества, как обсуждается в настоящей заявке, и/или проба сыворотки, которая может быть получена за соответствующий период времени, как обсуждается в настоящей заявке.
6.1 Качество сыворотки
При получении пробы сыворотки, подходящей для детектирования аналитов, важным фактором является уровень удаления фибриногена из сыворотки в процессе свертывания крови. Сыворотка, содержащая остаточный фибриноген или частично расщепленный фибриноген, или фибрин, образовавшийся в результате неполного свертывания крови, может давать неточные данные анализа, что обусловлено выпадением осадка (в виде микросгустков или полос), латентным свертыванием после центрифугирования и нахождением сыворотки на хранении. Следовательно, полное или почти полное свертывание является важным фактором, гарантирующим получение сыворотки наивысшего качества и точность результатов анализа.
В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к применению коагулирующей композиции, содержащей активатор протромбина, в основном, состоящей или состоящей из активатора протромбина, в целях получения сыворотки для детектирования аналита, где сыворотка содержит ≤30 мкг/мл фибриногена или продуктов, родственных фибриногену/фибрину. В более конкретных вариантах осуществления изобретения, сыворотка содержит ≤25 мкг/мл, ≤20 мкг/мл, ≤15 мкг/мл, ≤10 мкг/мл, ≤8 мкг/мл или ≤6 мкг/мл фибриногена или продуктов, родственных фибриногену/фибрину.
В некоторых вариантах осуществления изобретения, сыворотка содержит ≤30%, ≤20%, ≤10%, ≤9%, ≤8%, ≤7%, ≤6%, ≤5%, ≤4%, ≤3%, ≤2%, ≤1%, ≤0,5%, ≤0,2%, ≤0,1% фибриногена или продуктов, родственных фибриногену/фибрину, присутствующих в исходном образце, из которого была получена сыворотка.
Уровни фибриногена и/или продуктов, родственных фибриногену/фибрину, могут быть детектированы любым подходящим известным методом, включая «сэндвич»-иммуноанализ, с использованием антител от MP Biomedicals и стандартных препаратов фибриногена, закупаемых у NIBSC, Potters Bar, Hertsfordshire, London, UK.
Другим важным фактором при получении пробы сыворотки, подходящей для детектирования аналитов, является активность или число клеток, или клеточного дебриса, оставшихся в сыворотке после свертывания. Присутствие клеток во время хранения и проведения анализа сыворотки или плазмы может давать два эффекта. Во-первых, клетки могут подвергаться лизису с высвобождением клеточного содержимого (например, калия, лактат-дегидрогеназы) в сыворотку или плазму. Это может приводить к значимому различию между измерениями, сделанными непосредственно после центрифугирования, и измерениями, сделанными после хранения. Во-вторых, клетки могут сохранять свою метаболическую активность и могут поглощать значительное количество микроэлементов (например, глюкозы) и высвобождать продукты метаболизма (например, лактат) после хранения. Изменения могут наблюдаться в пробах, содержащихся во многих пробирках, даже если эти пробы хранятся в течение рекомендованных 30 минут, обычно необходимых для свертывания крови, и если указанные пробы были взяты у здоровых участников эксперимента. Следовательно, степень клеточной контаминации является важным критерием качества проб сыворотки и важным преимуществом использования именно сыворотки, а не плазмы.
В соответствии с этим, в некоторых вариантах осуществления изобретения, проба сыворотки содержит менее чем 50%, 40%, 30%, 20%, 10%, 5% или 1% от числа клеток, содержащихся в пробе крови, из которой она была получена.
В некоторых вариантах осуществления изобретения, проба сыворотки имеет измененную лактат-дегидрогеназную активность или измененную концентрацию фосфата (обычно измеряемую в ед./л и ммоль/л соответственно), которая составляет <25%, <20%, <15% или <10% за период времени 24 часа, 12 часов, 8 часов, 6 часов, 5 часов, 4 часа, 3 часа, 2 часа, 1 час или 30 минут. В некоторых вариантах осуществления изобретения, проба сыворотки имеет измененную концентрацию глюкозы или калия (обычно измеряемую в ммоль/л), которая составляет <5%, <4%, <3%, <2%, <1%, <0,5% или <0,1% за период времени 24 часа, 12 часов, 8 часов, 6 часов, 5 часов, 4 часа, 3 часа, 2 часа, 1 час или 30 минут (например, начиная со времени получения пробы сыворотки). Методы измерения лактат-дегидрогеназной активности хорошо известны специалистам, см., например, публикацию Dimeski, G., et al. (2004), содержание которой во всей своей полноте включено в настоящее описание в качестве ссылки.
Концентрация гемоглобина в пробе сыворотки может быть также использована для того, чтобы определить, может ли данная проба сыворотки быть подходящей для детектирования аналитов. В соответствии с этим, в некоторых вариантах осуществления изобретения, проба сыворотки имеет концентрацию гемоглобина, составляющую <150 мг/л, <100 мг/л, <90 мг/л, <80 мг/л, <70 мг/л, <60 мг/л, <50 мг/л, <40 мг/л, <30 мг/л, <20 мг/л, или <10 мг/л.
6.2 Время свертывания
Для проведения анализов проб, предпочтительно, использовать сыворотку, а не плазму, если только этот анализ не является срочным, поскольку, известно, что свертывание крови в пробирке с сывороткой происходит очень медленно. Другая проблема, связанная со временем свертывания крови, заключается в том, что продолжительное время свертывания может приводить к клинически значимым изменениям концентрации аналита, что обусловлено клеточной активностью пробы крови, и эта проблема особенно актуальна при лейкоцитозе.
Таким образом, в некоторых своих вариантах, настоящее изобретение относится к способу получения пробы сыворотки для детектирования представляющего интерес аналита, где указанный способ включает приведение в контакт пробы крови с коагулирующей композицией, содержащей определенный в настоящем документе активатор протромбина, в основном, состоящей или состоящей из указанного активатора, где пробу сыворотки получают через 25, 20, 15, 10, 8, 6, 5, 4, 3, 2, 1 или 0,5 минут после ее контактирования с коагулирующей композицией.
7. Пробы крови
Как обсуждается в настоящей заявке, желательно получить такую коагулирующую композицию, которая подходила бы для получения пробы сыворотки из всех проб крови, или контейнер, содержащий коагулирующую композицию, которая будет обладать способностью свертывать все пробы крови за соответствующий период времени.
Примерами проб крови различных типов, подходящих для анализа, являются: кровь, взятая у здоровых индивидуумов; кровь, содержащая цитрат; кровь с добавлением EDTA; кровь, взятая у пациентов, прошедших терапию антикоагулянтами, такими как гепарин, варфарин, цитрат или ривароксабан; кровь, взятая у пациентов, которым были введены антитромботические средства, включая аспирин; кровь, взятая у пациентов с тромбоцитопенией (у пациентов с низким содержанием тромбоцитов), и кровь, взятая у пациентов с aPTT (с активированным парциальным тромбопластиновым временем).
В некоторых вариантах осуществления изобретения, пробой крови является проба цельной крови. В некоторых других вариантах осуществления изобретения, пробой крови является проба сыворотки, полученная из пробы цельной крови. В этом случае, желательно, например, чтобы такими пробами сыворотки были пробы более высокого качества, включая пробы сыворотки, в которых количество фибриногена или продуктов, родственных фибриногену/фибрину, и/или количество клеток или клеточного материала в пробе сыворотки и/или количество гемоглобина является слишком большим для того, чтобы использовать эту пробу сыворотки в качестве образца для детектирования аналитов. Так, например, проба сыворотки может обнаруживать микросгустки или латентное свертывание. В некоторых других вариантах осуществления изобретения, проба крови представляет собой пробу плазмы, полученную из пробы цельной крови. Так, например, проба плазмы может содержать микросгустки или латентное свертывание.
8. Детектирование аналитов
В некоторых своих вариантах осуществления, настоящее изобретение также относится к способам детектирования аналита, где указанный способ включает анализ пробы сыворотки, полученной способом согласно изобретению, для определения присутствия или количества представляющего интерес аналита.
В конкретных вариантах осуществления изобретения, проба сыворотки, полученная способом согласно изобретению, может быть использована для тестирования более чем одного аналита, а поэтому такая проба сыворотки может быть использована в этих целях. Как обсуждается в настоящей заявке, в большинстве случаев, желательно провести анализ для детектирования более чем одного аналита на пробе крови, взятой у пациента, и использование одной пробы сыворотки по меньшей мере для 20 анализов или даже больше, а иногда для 50-60 или даже 70-80 анализов не является таким уж редким. Следует отметить, что в своих конкретных вариантах осуществления, настоящее изобретение относится к получению пробы сыворотки, где указанная проба сыворотки имеет объем и качество, достаточные для проведения анализа всех нужных аналитов на одной пробе сыворотки. Преимущество этого метода заключается в снижении объема крови, взятой у индивидуума, и времени, затрачиваемого на проведение анализа аналитов.
Репрезентативные анализы аналитов описаны ниже. Проведение таких анализов аналитов может быть осуществлено различными методами, хорошо известными специалистам.
8.1 Натрий (Na+)
В этом анализе определяют количество натрия в пробе сыворотки или плазмы. Натрий играет важную роль в водно-солевом балансе организма. Низкие уровни натрия могут указывать на слишком большое поглощение воды, сердечную недостаточность, почечную недостаточность, или на потерю натрия организмом, вызванную диареей или рвотой. Высокие уровни натрия могут указывать на слишком большое поглощение соли или на недостаточное поглощение воды.
8.2 Калий (К+)
В этом анализе определяют количество калия в пробе сыворотки или плазмы. Присутствие очень высоких уровней калия (гиперкалиемия) может наблюдаться в результате развития почечного заболевания, диабета, кетоацидоза или в результате приема лекарственных средств, которые снижают количество калия, выделяемого из организма. Присутствие очень низких уровней калия (гипокалиемия) может быть обусловлено обезвоживанием, например, оно может наблюдаться в результате диареи или рвоты, или при избыточной потливости. Снижение уровней калия может быть также обусловлено приемом лекарственных средств, например, диуретиков, которые вызывают потерю калия в почках.
Мониторинг уровней калия часто проводят у пациентов, принимающих диуретики или сердечные лекарственные средства; у пациентов с высоким кровяным давлением или заболеванием почек; у пациентов с острым ацидозом и алкалозом, и у пациентов, которым были проведены диализ почек или внутривенная терапия с использованием капельницы.
8.3 Хлорид (Cl-)
В этом анализе определяют количество хлорида в сыворотке или в плазме. Уровень хлорида обычно определяют для того, чтобы установить, имеется ли у данного пациента дисбаланс электролитов. Низкий уровень хлорида и нормальный уровень натрия могут указывать на рвоту или потерю желудочного сока.
8.4 Бикарбонат (HCO3-)
В этом анализе определяют количество трех форм диоксида углерода (бикарбоната, угольной кислоты и растворенного диоксида углерода) в сыворотке или в плазме. Этот анализ часто проводят у пациентов с нарушением дыхательной системы. Высокий уровень диоксида углерода может быть обусловлен развитием некоторых заболеваний, включая хроническую обструктивную болезнь легких, эмфизему, пневмонию, синдром Кушинга или алкоголизм, или рвоту. Низкий уровень диоксида углерода может быть обусловлен развитием некоторых заболеваний, включая пневмонию, цирроз, гипервентиляцию легких, диабет, обезвоживание, почечную или сердечную недостаточность.
8.5 Глюкоза (Gluc)
В этом анализе определяют количество глюкозы в сыворотке или в плазме. Уровни глюкозы часто определяют у пациентов с симптомами высокого содержания глюкозы в крови (гипергликемии) или гипогликемии; у беременных или у пациентов с диабетом.
8.6 Мочевина (Urea)
В этом анализе определяют количество мочевины в сыворотке или в плазме. Этот анализ позволяет исследовать функцию почек и проводить мониторинг эффективности диализа.
8.7 Креатинин (Creat)
В этом анализе определяют количество креатинина в сыворотке или в плазме. Этот анализ является необходимым для исследования функции почек и для мониторинга эффективности лечения почечного заболевания.
8.8 Урат (Urate)
В этом анализе определяют количество урата (или мочевой кислоты) в сыворотке или в плазме. Высокие уровни мочевой кислоты могут указывать на признаки подагры. Уровни мочевой кислоты также определяют у пациентов, проходящих химиотерапию или лучевую терапию, для диагностики синдромов лизиса опухоли.
8.9 Общий белок (TP или T Prot)
В этом анализе определяют количество общего белка в сыворотке или в плазме. Хотя результаты анализа на общий белок могут не указывать на наличие конкретного заболевания, однако высокие или низкие уровни белка часто указывают на необходимость проведения дополнительных анализов для выявления возможной патологии. Анализы на общий белок часто проводят для выявления некоторых нарушений функции печени, заболеваний почек, наличия множественной миеломы и определения состояния отечности.
8.10 Альбумин (Alb)
В этом анализе определяют количество альбумина в сыворотке или в плазме. Анализы на уровни альбумина часто проводят для выявления заболеваний печени или почек, или для определения состояния питания, особенно у госпитализированных пациентов.
8.11 Общий билирубин (T Bili)
В этом анализе определяют количество билирубина в сыворотке или в плазме. Анализы на уровни билирубина проводят для выявления и мониторинга расстройств печени, таких как желтуха, или заболеваний печени, таких как цирроз. Уровни билирубина также определяют у детей для детектирования некоторых редких генетических заболеваний и для предупреждения поражений головного мозга у детей с желтухой.
8.12 Щелочная фосфатаза (ALP)
В этом анализе определяют количество щелочной фосфатазы в сыворотке или в плазме. Этот анализ обычно проводят для выявления заболеваний печени или костей и для мониторинга их лечения.
8.13 Гамма-глутамил-трансфераза (GGT)
В этом анализе определяют количество гамма-глутамил-трансферазы в сыворотке или в плазме. Этот анализ проводят для выявления заболеваний печени и заболеваний, вызываемых злоупотреблением алкоголем. Этот анализ также проводят для того, чтобы определить, вызвано ли повышение уровня ALP наличием заболеваний печени или костей.
8.14 Аланин-аминотрансфераза (ALT)
В этом анализе определяют количество аланин-аминотрансферазы в сыворотке или в плазме. Этот анализ также проводят для выявления заболевания печени.
8.15 Аспартат-аминотрансфераза (AST)
В этом анализе определяют количество аспартат-аминотрансферазы в сыворотке или в плазме. Этот анализ также проводят для выявления поражения печени, поражения мышц и других состояний, поскольку данный фермент присутствует в клетках многих органов и тканей.
8.16 Лактат-дегидрогеназа (LD)
В этом анализе определяют количество лактат-дегидрогеназы в сыворотке или в плазме. Этот анализ обычно проводят для выявления причины возникновения поражения ткани организма и для определения участка такого поражения, для диагностики ишемии ткани и для мониторинга ее прогрессирования.
8.17 Креатин-киназа (СК)
В этом анализе определяют количество креатин-киназы в сыворотке или плазме. Уровень креатин-киназы оценивают у пациентов с болями в области грудной клетки, с болями в мышцах или со слабостью мышц для того, чтобы определить, являются ли они причиной сердечного приступа и поражения других мышц организма.
8.18 Общий кальций (TCa)
В этом анализе определяют количество кальция в сыворотке или в плазме. Уровни кальция часто определяют у пациентов с заболеваниями почек, костей или нервов, или у пациентов с симптомами, связанными со значительным повышением или снижением уровней кальция.
8.19 Фосфат (Pi или Phos)
В этом анализе определяют количество фосфата в сыворотке или в плазме. Уровни фосфата могут быть определены при исследовании результатов анализа на аномальные уровни кальция. Уровни фосфата могут быть также определены у пациентов с расстройствами почек, у пациентов с прогрессирующим диабетом, или у пациентов, которые принимали кальций- или фосфатсодержащие добавки.
8.20 Магний (Mg2+)
В этом анализе определяют количество магния в сыворотке или в плазме. Этот анализ также проводят для определения наличия у пациента симптомов, связанных со слишком высоким или слишком низким содержанием магния, включая слабость, раздражительность, сердечную аритмию, тошноту или диарею. Уровни магния могут быть также определены в целях выявления аномальных уровней кальция или калия.
8.21 Липаза (Lipase)
В этом анализе определяют количество липазы в сыворотке или в плазме. Этот анализ обычно проводят для диагностики панкреатита или других заболеваний поджелудочной железы.
8.22 Холестерин (Chol)
В этом анализе определяют количество холестерина в сыворотке или в плазме. Уровни холестерина могут быть определены в целях выявления риска развития болезни сердца.
8.23 Триглицериды (Trig)
В этом анализе определяют количество триглицеридов в сыворотке или в плазме. Этот анализ, как и анализ на уровни холестерина, обычно проводят для выявления риска развития болезни сердца.
8.24 Холестерин липопротеина высокой плотности (HDL-C или HDL)
В этом анализе определяют количество холестерина ЛВП в сыворотке или в плазме. Этот анализ обычно проводят для выявления риска развития болезни сердца.
8.25 Железо (Fe2+)
В этом анализе определяют количество железа в сыворотке или в плазме. Уровни железа определяют для выявления наличия у пациента низких или высоких уровней железа. Низкие уровни железа могут вызывать анемию и обычно связаны с длительным или сильным кровотечением, с беременностью или с быстрым ростом (у детей). Высокие уровни железа могут следствием генетического заболевания, либо интенсивного переливания крови.
8.26 Трансферрин (Trf)
В этом анализе определяют количество трансферрина в сыворотке или в плазме. Трансферрин представляет собой белок плазмы, который переносит железо в печень, селезенку и костный мозг через кровоток. Таким образом, уровень трансферрина в крови определяют для выявления причины развития анемии, для оценки метаболизма железа (например, при железодефицитной анемии) и для оценки способности крови переносить железо.
8.27 Реактивный белок С (CRP)
В этом анализе определяют количество реактивного белка С в сыворотке или в плазме. Этот анализ также проводят для выявления наличия воспаления, для определения его тяжести и для мониторинга реакции на лечение.
8.28 Кортизол (Cortisol)
В этом анализе определяют количество кортизола в сыворотке или в плазме. Уровни кортизола определяют для облегчения диагностики синдрома Кушинга или болезни Аддисона.
8.29 Свободный тироксин (fT4)
В этом анализе определяют количество свободного тироксина в сыворотке или в плазме. Этот анализ обычно проводят для диагностики гипотиреоидита или гипертиреоидита.
8.30 Тиреотропный гормон (TSH)
В этом анализе определяют количество тиреотропного гормона в сыворотке или в плазме. Этот анализ обычно проводят для выявления, диагностики и мониторинга расстройств щитовидной железы.
8.31 Ферритин
В этом анализе определяют количество ферритина в пробе сыворотки или плазмы. Низкие уровни ферритина указывают на дефицит железа. Повышенные уровни указывают на избыток железа, например, при гемахроматозе.
8.32 Тропонин (TnI)
В этом анализе определяют количество тропонина в сыворотке или в плазме. Этот анализ обычно проводят у пациентов с болями в грудной клетке для определения наличия у этого пациента поражения миокарда.
8.33 Гемолитический индекс
В анализе на гемолитический индекс определяют степень лизиса эритроцитов. Гемолиз является наиболее частой проблемой, с которой сталкиваются специалисты в биохимических лабораториях. Этот анализ, предпочтительно, проводят в целях детектирования гемолиза in vitro и оценки пробы на ее пригодность для анализа на некоторые или на все аналиты, и в целях диагностики гемолитической анемии (наследственного сфероцитоза, спонтанного гемолиза; заболевания, связанного с дефицитом ферментов эритроцитов). В настоящее время, гемолиз или гемолитический индекс (концентрацию свободного гемоглобина в сыворотке или в плазме) оценивают во всех основных биохимических лабораториях. Затем, полученную величину используют в качестве критерия для того, чтобы определить, какие аналиты и какой уровень гемолиза могут вызывать или не вызывать развитие заболевания.
8.34 Иктерический индекс
Оценка иктерического индекса позволяет получить величину, которая указывает на относительный уровень билирубина в тест-пробе, и эту оценку проводят только спектрофотометрическим методом. Этот метод применяется для определения пригодности данной пробы для детектирования некоторых аналитов и для перекрестной оценки точности результатов анализа на билирубин в тех редких случаях, когда нельзя применять фотометрические методы оценки общего билирубина. Было показано, что иктерический индекс дает величину, позволяющую детектировать интерференцию парапротеинов рака (осаждение билирубина и ложный высокий общий билирубин) методом определения общего билирубина Roche (Sheppard et al., 2005), где иктерический индекс остается неизменным. Билирубин, при его высоких концентрациях (например, >200 мкΜ/л), может влиять на результаты некоторых анализов на креатинин, как обсуждается в работе Dimeski et al., 2008.
8.35 Липемический индекс
Липемический индекс может быть использован для предсказания возможного искажения результатов анализа, вызванного липемией.
9. Методы диагностики
Настоящее изобретение также относится к способам диагностики наличия, отсутствия или тяжести заболевания, или состояния у индивидуума, где наличие, отсутствие или тяжесть заболевания, или состояния связано с присутствием, отсутствием или аберрантным количеством представляющего интерес аналита у индивидуума. Эти способы, в основном, включают получение пробы сыворотки в соответствии с методами, в общих чертах описанными выше; и детектирование присутствия, отсутствия или аберрантного количества аналита в пробе сыворотки в целях определения наличия, отсутствия или тяжести заболевания, или состояния у индивидуума.
В некоторых вариантах осуществления изобретения, способы согласно изобретению включают сравнение результата аналитического теста со стандартным результатом для установления диагноза.
Заболеванием или состоянием могут быть соответствующие заболевания или состояния, которые могут быть диагностированы с использованием пробы сыворотки, включая, но не ограничиваясь ими, заболевания или состояния, описанные выше со ссылкой на различные аналитические тесты.
В некоторых вариантах осуществления изобретения, указанные способы могут включать определение наличия или отсутствия заболевания или состояния, которое ранее не было диагностировано у индивидуума. В других вариантах осуществления изобретения, указанные способы могут включать определение наличия, отсутствия или тяжести заболевания или состояния, которое ранее было диагностировано у указанного индивидуума. Указанные способы могут включать сравнение полученного результата с результатом, полученным у индивидуума в более ранний период. Альтернативно, результатом, используемым для сравнения, может быть результат, полученный с помощью стандартного анализа.
В некоторых вариантах осуществления изобретения, указанные способы осуществляют в медицинских учреждениях, таких как лаборатория по исследованию. В некоторых других вариантах осуществления изобретения, такими способами являются «экспресс-анализы» («анализа на месте») с применением портативных анализаторов. Используемый в настоящем документе термин «экспресс-метод» означает метод, который осуществляют непосредственно на месте нахождения пациента. «Экспресс-методы» становятся все более популярными в больницах и в других условиях, когда желательно получить быстрые результаты, и такие методы часто осуществляют с использованием переносных, портативных и транспортируемых инструментов и тест-наборов.
Преимущества экспресс-метода заключается в том, что он позволяет быстро получить результаты анализа у постели госпитализированного больного, в частности, в машинах скорой помощи, а также на дому или в хирургическом отделении (например, с использованием капелек капиллярной крови, полученных путем укола).
Устройствами для экспресс-анализа, производимыми в настоящее время промышленностью, являются анализатор для иммуноанализа, поставляемый компанией Siemens под названием Siemens’ DCA Vantage Analyzer; устройство для экспресс-тестов Retro-STATUS HIV/CD4 350, поставляемое компанией Millenium Biotechnology, Inc., которое используется для одновременного определения инфекционного ВИЧ-статуса у пациента, а также его истинного иммунного статуса; и устройство для анализа Triage PLGF, поставляемое компанией Alere, International, которое используется для диагностики преэклампсии на ранней стадии.
10. Инструменты для исследований
В настоящем изобретении также рассматривается применение инструментов для исследований, в которых используются пробы сыворотки, полученные в соответствии с настоящим изобретением. Эти способы, в основном, включают получение пробы сыворотки с применением методов, в общих чертах описанных выше; и использование пробы сыворотки в научных исследованиях, включая но не ограничиваясь ими, исследования в области геномики, протеомики, метаболизма, общей биологии, молекулярной визуализации или в аналитических исследованиях.
Подходящие средства для исследований хорошо известны специалистам и описаны в публикации Scaros, O. et al., 2005, содержание которой вводится в настоящее описание в качестве ссылки. Геномика включает фармакогеномику, которая занимается исследованиями по корреляции генетических факторов и характера экспрессии генов с реакцией организма на терапевтические препараты. Протеомика позволяет проводить анализы на избыточное количество и распределение белков в системе. Исследования по метаболизму или определение биохимического профиля представляют исследования по содержанию метаболитов в системе. В общей биологии рассматривается вся биологическая система как одна функциональная единица, продуцирующая модели поведения, которые потенциально позволяют предсказать, каким образом эта система будет реагировать на раздражители. Молекулярная визуализация позволяет продемонстрировать уровень специфической молекулярной мишени и функциональное состояние такой мишени in vivo, и может быть использована в методах диагностики.
Для лучшего понимания настоящего изобретения и для его практического осуществления, ниже представлены конкретные предпочтительные варианты осуществления изобретения, которые должны рассматриваться как их неограничивающие примеры.
Примеры
Пример 1: Очистка и характеризация активаторов протромбина, выделенных из змеиного яда
Пример 1a: Очистка и характеризация экарина, каринактивазы-1 и каринактивазы-2, выделенных из яда Echis carinatus
В этом примере описана очистка и характеризация активатора протромбина группы А, называемого экарином, и двух активаторов протромбина группы В, называемых каринактивазой-1 (СА-1) и каринактивазой-2 (CA-2), выделенных из яда Echis carinatus.
Лиофилизованный яд Echis carinatus (157 мг; Sigma Chemical Co, USA; cat. № V8250) растворяли в 8 мл 0,05 M трис-HCl-буфера, pH 8,0, и оставляли на 30 минут для растворения, а затем центрифугировали (1000 х g, 10 минут) для удаления нерастворимых веществ. Разведенный осветленный раствор в объеме 7,7 мл загружали на хроматографическую колонку для гель-фильтрации с Superdex 200 (cat. № 17-1043-02) (2,5×95 см) GE Healthcare Bio-Sciences, Sweden) с использованием того же самого трис-HCl-буфера для элюирования. Скорость потока в колонке составляла 20 мл/час, и было собрано 4 мл фракций (по 15 минут на фракцию). Активные фракции определяли по их коагулирующей активности в нормальной обработанной цитратом плазме, как более подробно описано ниже. Объединенные фракции, содержащие всего 100 мл активаторов протромбина, имели общую A280 = 28,3 единиц. На фигуре 1 представлен профиль элюирования при выделении экарина, каринактивазы-1 и каринактивазы-2 из яда E. carinatus путем гель-фильтрации на колонке с Superdex 200, как описано выше. Объединенные фракции трех активаторов протромбина (экарина, каринактивазы-1 и каринактивазы-2) показаны чертой на фигуре 1.
Эти объединенные фракции наносили непосредственно на колонку с сефарозой Blue (2,0×12 см) (Cibacron Blue 3G, связанная с сефарозой 6 Fast Flow; cat. № 17-0948-01) (GE Healthcare Bio-Sciences, Sweden), предварительно уравновешенную тем же самым 0,05 M трис-HCl-буфером, pH 8,0. После промывки приблизительно 2 колоночными объемами исходного буфера, связанное вещество элюировали линейным градиентом NaCl в том же самом буфере (0-1,0 M; 200 мл в каждом химическом стакане). Каринактивазу-1 выделяли в виде несвязанных фракций, а каринактивазу-2 и экарин элюировали 0,2 и 0,5 M NaCl соответственно. Активность активаторов протромбина идентифицировали с помощью анализа на свертывание нормальной обработанной цитратом плазмы в присутствии 30 мМ кальция и в отсутствие кальция, как более подробно описано ниже. Фракции (3 мл, каждую), обладающие удельной активностью активаторов протромбина, объединяли по их соответствующей удельной коагулирующей активности в зависимости от времени свертывания, а затем концентрировали до 1 мг/мл на мембране YM 10 в концентраторе для смешанных клеток Amicon Model № 42. Все хроматографические процедуры осуществляли при 4°С с помощью перистальтического насоса Gilson в черно-пурпурной камере, установленной на требуемой скорости потока, и снабженной двухволновым УФ-детектором Altex, установленным на два аттенюатора 280 нм, и коллектором для сбора фракций LKB 7000 ULTRORAC, снабженным устройством для ограниченного по времени сбора фракций. На фигуре 2 показан профиль элюирования на хроматографической колонке с сефарозой Blue Sepharose, где черточки указывают на объединенные фракции каринактивазы-1, каринактивазы-2 и экарина. Полученные фракции хранили либо при 4°С в буфере, либо при -20°C в буфере, либо при -20°C в 50% глицериновом буфере. Эти фракции (препараты), содержащие активаторы протромбина, использовали во всех последующих экспериментах, если это не оговорено особо.
Активность активаторов протромбина анализировали методом, описанным Masci et al., 1988. По существу, такой аналитический метод включает анализы на свертывание, осуществляемые с помощью устройства Hyland-Clotek, описанного Austen, D. E., et al. 1975. Свежесобранную обработанную цитратом плазму, взятую у здоровых добровольцев, использовали для каждой группы экспериментов. Анализы на время свертывания для препаратов осуществляли в соответствии с критериями, определенными для активаторов протромбина группы А и группы В, как описано Kini, R. M., 2005. Эти анализы осуществляли в присутствии кальция (30 мМ Ca2+) для идентификации активаторов протромбина группы В (каринактивазы-1 и каринактивазы-2) и в отсутствие кальция для идентификации активатора протромбина группы А (экарина). Гидролитическую активность, направленную на пептид-п-нитроанилид S-2238, посредством которой оценивают степень образование тромбина под действием активаторов протромбина, определяли путем уравновешивания 0,90 мл 0,02 M трис-HCl-буфера, pH 7,4, в присутствии или в отсутствие 10 мМ CaCl2, и 100 мкл S-2238 (3 мМ в воде) в клеточном компартменте спектрофотометра (Hitachi U2800) при 25°C. Реакцию инициировали добавлением 25 мкл-аликвоты препарата активатора протромбина к протромбину (250 нМ), и высвобождаемый н-нитроанилин измеряли на 405 нм. Одна единица активности эквивалентна гидролизу 1 пмоль субстрата/минуту. Анализы, проводимые с использованием других пептидных нитроанилидов в качестве субстрата, осуществляли в одно и то же время при конечной концентрации 100 мкМ.
Пример 1b: Очистка и характеризация PtPA, выделенного из яда Pseudonaia textilis, и OsPA, выделенного из яда Oxyuranus scutellatus
В этом примере описана очистка и характеризация активаторов протромбина группы С, выделенных из яда змей Pseudonaia textilis и Oxyuranus scutellatus. Эти активаторы протромбина сокращенно обозначаются PtPA и OsPA соответственно.
Сухой лиофилизованный яд P. textilis разводили в 0,05 M трис-HCl c pH=7,4. На фигуре 3 представлен профиль элюирования разведенного яда P. textilis на колонке с сефакрилом S-300 в 0,05 трис-HCl-буфере, pH 7,4. «A» означает пустой объем, а «B» означает объем элюирования (Ve) для PtPA, который, на этой колонке, составляет 250 мл и эквивалентен молекулярной массе приблизительно 250 кДа. Оптическая плотность на 280 нм (A280) под «B» составляет 40% от всех единиц A280, нанесенных на колонку. Аналогичный эксперимент, проводимый на яде O. scutellatus с помощью гель-фильтрации, показал, что приблизительно 10% от всех единиц A280, нагруженных на колонку, элюировалось на пике 250 кДа (соответствующем активатору протромбина).
Аффинную хроматографию на Con A-сефарозе 4B в 0,05 M трис-HCl, pH 7,4, проводили для выделения активатора протромбина из неочищенного яда P. textilis и O. scutellatus. Элюирующий буфер представляет собой 0,2 M метил-α-D-маннопиранозид, содержащий 0,01% азида натрия. Профиль элюирования на Con A-сефарозе для PtPA представлен на фигуре 4. Стрелкой показано положение введения элюирующего буфера, а «a» означает фракции, собранные с получением активатора протромбина. На фигуре 5 представлены результаты электрофореза в нативном ПААГ при pH 8,6. Пик для «a» на фигуре 4 указывает на главную полосу белка, и следовые количества минорной полосы при загрузке 25 мкг (А) и 50 мкг (В) на дорожку. В параллельном эксперименте, 250 кДа-полосу вырезали из геля, и было обнаружено, что она обладает фактор Xa-подобной активностью, направленной против хромогенного субстрата S-2222, в результате чего такая полоса была идентифицирована как PtPA (фигура 6). Аналогичный профиль элюирования наблюдался для OsPA.
PtPA и OsPA дополнительно охарактеризовывали с помощью электрофореза в ПААГ с ДСН в присутствии β-меркаптоэтанола (обозначено «восст.»), и в отсутствие β-меркаптоэтанола (обозначено «невосст.») (фигура 7). Очевидно, что несколько полос соответствуют обоим PtPA и OsPA, представляющим собой компоненты полипептидных цепей.
PtPA- и OsPA-содержащие препараты, полученные в соответствии с этим методом, были использованы во всех последующих экспериментах, если это не оговорено особо.
Пример 1c: Очистка и характеризация нотекарина, выделенного из яда Notechis scutatus
Активатор протромбина группы D, называемый нотекарином, очищали из яда Notechis scutatus с помощью гель-фильтрации на сефакриле S-300 (5,0×9,5 см) методом, аналогичным методу, описанному выше в примере 1b для активаторов протромбина группы С. Профиль элюирования представлен на фигуре 8, где «PA» означает фракцию, содержащую нотекарин.
Нотекаринсодержащие препараты, полученные в соответствии с этим методом, были использованы во всех последующих экспериментах, если это не оговорено особо.
Пример 1d: Дополнительная характеризация каринактивазы-1, каринактивазы-2, экарина, PtPA, OsPA и нотекарина
Препараты активаторов протромбина, полученные, как описано в примерах 1а, 1b и 1c, были дополнительно охарактеризованы, как описано ниже.
Был проведен электрофорез в нативном ПААГ для протромбина, альфа-тромбина и активаторов протромбина при pH 8,9, и полученные результаты были представлены на фигуре 9, где цифры означают: (I) протромбин; (II) альфа-тромбин; (III) экарин; (IV) каринактивазу-1; (V) каринактивазу-2; (VI) PtPA; (VII) OsPA; (VIII) нотекарин (загружали 20 мкг каждого активатора протромбина).
Препараты активаторов протромбина были также дополнительно охарактеризованы с помощью электрофорез в ДСН-ПААГ в присутствии (фигура 10) и в отсутствие (фигура 11) β-меркаптоэтанола. На каждой из этих фигур, дорожки соответствуют: (1) каринактивазе-1; (2) каринактивазе-2; (3) экарину; (4) PtPA; (5) OsPA; (6) нотекарину; (7) тромбину; и (M) маркеру молекулярной массы. PtPA-содержащая проба на дорожке (4) и OsPA-содержащая проба на дорожке (5) были аналогичны пробам, используемым для получения результатов, представленных на фигуре 7.
В каждом случае, электрофорез в ДСН-ПААГ показал, что в предполагаемых областях присутствуют полосы белка, и что эти препараты также не являются гомогенными. Концентрации белка в препаратах активаторов протромбина вычисляли, исходя из соотношения: 1 мг/мл раствора имеет A280=1, а молярные концентрации вычисляли путем деления концентрации белка на указанные в литературе величины молекулярных масс. Поэтому, молярные концентрации, указанные в последующих описанных в настоящем документе экспериментах и используемые в этих препаратах, имели наивысшую оценку, поскольку указанные препараты не являются гомогенными.
Пример 2: Превращение протромбина в тромбин под действием активаторов протромбина
Пример 2a: Пятиминутный период инкубирования
Этот эксперимент проводили для того, чтобы определить, какое количество протромбина будет превращаться в тромбин под действием шести различных активаторов протромбина, выделенных из змеиного яда и полученных, как описано в примере 1, а именно препаратов, содержащих экарин, каринактивазу-1, каринактивазу-2, PtPA, OsPA и нотекарин, после инкубирования в течение пяти минут при комнатной температуре.
Эксперимент осуществляли следующим образом.
Был получен 20 мМ буфер HEPES, pH 7,4, 150 мМ NaCl, 5 мМ CaCl2, 0,05% поверхностно-активного вещества p20.
Раствор протромбина человека в 0,05 M трис-HCl, pH 7,4, получали путем разведения маточного раствора очищенного протромбина человека (17,8 мг/мл; #HCP-0200; HTI, USA) в отношении 1/50 дистиллированной водой с получением рабочего раствора в количестве 0,36 мг/мл до конечной концентрации в пробирке, составляющей 72 мкг/мл или 0,99 мкΜ. Для загрузки геля использовали 0,36 мг/л раствора протромбина.
Маточные растворы препаратов активаторов протромбина, полученных, как описано ранее, разводили до конечных концентраций 6 нМ.
Маточный раствор альфа-тромбина (10 мг/мл, #HCT-0020; HTI, USA) разводили (1/30) дистиллированной водой, содержащей 0,01% твина-20, с получением 0,33 мг/л рабочего раствора тромбина, который затем загружали на гель для проведения электрофореза в ПААГ с ДСН.
Затем получали пробы в объемах, представленных в таблице 3, и эти пробы инкубировали в течение пяти минут при комнатной температуре.
Объемы каждой пробы для инкубирования
Активаторами протромбина в вышеуказанных пробах являются: (1) активатор протромбина отсутствует (протромбин человека только в буфере); (2) каринактиваза-1; (3) каринактиваза-2; (4) экарин; (5) PtPA; (6) OsPA; (7) нотекарин; и (8) α-тромбин с высокой степенью очистки (без активатора протромбина).
Гелями, используемыми для электрофореза в ДСН-ПААГ, являются мини-гели nUView Precast Mini Gels (#NB10-420, 4-20%), содержащие рабочий трис-глициновый буфер (#BG-143). Был получен буфер для проб (#BG-145) (NuSEP, Australia) (то есть невосстанавливающий буфер для проб) и восстанавливающий буфер для проб, состоящий из буфера для проб и 5% β-меркаптоэтанола (#44143, BDH, UK).
После 5-минутного инкубирования, 40 мкл-аликвоты от каждой пробы переносили в эквивалентный объем невосстанавливающего буфера для пробы или восстанавливающего буфера для пробы. Затем пробы инкубировали в течение 10 минут при 100°C в нагревательном блоке. 25 мкл-аликвоты каждой пробы и 12 мкл предварительно окрашенного маркера молекулярной массы (#SM067l Page Ruler Prestained Protein Ladder, Fermentas, Hanover, MD, USA) загружали на гели. Гели подвергали электрофорезу при 100 В на устройстве для электрофореза в ПААГ Mini-Protein II Cell PAGE apparatus (Bio-Rad) до тех пор, пока фронтальный краситель не достигал дна геля. Гели окрашивали кумасси бриллиантовым голубым G (#B-0770, Sigma) (0,25% масс/об кумасси бриллиантового голубого G, 45% метанол, 10% уксусная кислота), и избыток красителя удаляли с использованием обесцвечивающего агента (45% метанол, 45% воды и 10% уксусная кислота).
Результаты представлены на фигуре 12, где на фигуре 12A проиллюстрирован ДСН-ПААГ-гель, полученный с использованием буфера для проб без β-меркаптоэтанола (невосстанавливающий буфер для проб), а на фигуре 12B проиллюстрирован ДСН-ПААГ-гель, полученный с использованием буфера для проб, содержащего 5% β-меркаптоэтанол (восстанавливающий буфер для проб). Номера проб, указанные выше в таблице 3, соответствуют номерам дорожек на гелях, указанных на фигуре 12, а «m» означает маркер молекулярной массы.
Этот эксперимент продемонстрировал полное превращение протромбина в тромбин за пять минут под действием PtPA и OsPA, но совсем незначительное превращение под действием других препаратов активаторов протромбина в этих условиях.
Пример 2b: Время превращения под действием PtPA и нотекарина
Было определено время превращение протромбина (14 мкМ) в тромбин под действием PtPA (6 нМ) и нотекарина (6 нМ), и результаты электрофореза в ДСН-ПААГ, проведенного методом, описанным в примере 2а, представлены на фигуре 13, где каждая дорожка пронумерована в соответствии со временем инкубирования, указанным ниже в таблице 4.
Время инкубирования для каждой дорожки, показанной на фигуре 13
Эти результаты показали, что в превращении протромбина в тромбин, PtPA является более эффективным, чем нотекарин, но, при этом, нотекарин давал полное расщепление протромбина в течение более длительного периода проведения реакции.
Пример 2c: N-концевое секвенирование выбранных полос, исходя из результатов, полученных в примере 2b
Полосы, выбранные исходя из результатов электрофореза в ДСН-ПААГ, полученных, как описано в примере 2b, продуцировались под действием PtPA и нотекарина на протромбин (то есть фрагментации протромбина с образованием тромбина), а затем эти полосы элюировали и подвергали N-концевому секвенированию с помощью масс-спектрометрического анализа для присвоения этим последовательностям специфических молекулярных доменов. Результаты представлены на фигуре 14. N-концевое секвенирование, проводимое с помощью электрофореза в ДСН-ПААГ, подтвердило превращение протромбина в альфа-тромбин под действием PtPA и нотекарина, на что указывала крупная полоса с N-концевой последовательностью IVEGSDA, которая соответствовала тяжелой цепи альфа-тромбина.
Пример 2d: Оценка тромбина, проводимая с помощью кинетического анализа
Этот эксперимент проводили для определения количества тромбина, образующегося из протромбина под действием каждого из нижеследующих активаторов протромбина: экарина; каринактивазы-1; каринактивазы-2; PtPA; OsPA; и нотекарина при концентрации 0,6 нМ, с помощью кинетического анализа.
Был проведен непрерывный мониторинг оптической плотности п-нитроанилина (pNA), образованного из хромогенного субстрата тромбина S-2238 на 405 нм, для проб, содержащих различные концентрации тромбина, и для проб, содержащих один из перечисленных выше активаторов протромбина.
Для исследования тромбина брали каждую кювету, содержащую 50 мкл субстрата S-2238 (134 мкΜ), 50 мкл тромбина в различных концентрациях (в пределах 0,25-30 нМ) и 900 мкл буфера HEPES. На фигуре 15 представлены монотонно возрастающие кривые для гидролиза S-2238 под действием тромбина, используемые для построения стандартной кривой, представленной на фигуре 16.
Для исследования активаторов протромбина брали каждую кювету, содержащую 50 мкл протромбина (247 нМ), 10 мкл (0,6 нМ) активатора протромбина (экарина; каринактивазы-1; каринактивазы-2; PtPA; OsPA; или нотекарина), 100 мкл (267 мкМ) субстрата S-2238 и 840 мкл буфера HEPES. Наклон кривых реакции каждого активатора протромбина, определяли за время 155 секунд, и количество тромбина, образованного в течение 155 секунд, считывали по стандартной кривой, представленной на фигуре 16, как показано на фигуре 17 и в таблице 5.
Количество тромбина, образованного под действием 0,6 нМ активаторов протромбина за 155 секунд
Как и предполагалось, все препараты активаторов протромбина продуцировали тромбин, но и в этом случае, наиболее эффективными являются PtPA и OsPA.
Полученные результаты показали, что активаторы протромбина группы С (PtPA и OsPA) являются наиболее эффективными ферментами в отношении гидролиза протромбина с его превращением в тромбин. Это было подтверждено количеством образующегося тромбина, способного гидролизовать субстрат S-2238 с образованием цветного продукта pNA. Следующим из наиболее активных активаторов протромбина является экарин, который, как было показано, гидролизует ~4% S-2238, а за ним идут каринактиваза-2 (2,5%), каринактиваза-1 и, наконец, нотекарин (<1%), которые являются наименее эффективными активаторами протромбина в этой очищенной системе. Активаторы протромбина группы D (например, нотекарин) требуют присутствия фактора Va, кальция и фосфолипида, которые отсутствуют в указанной системе, но все они присутствуют в крови.
Пример 2e: Кинетические исследования сравнительных скоростей образования тромбина из протромбина под действием активаторов протромбина
Этот эксперимент был разработан для определения скорости образования тромбина, который продуцируется из чистого протромбина под действием каждого из препаратов активаторов протромбина.
Каждая кювета содержала 50 мкл протромбина (247 нМ), 10 мкл различных активаторов протромбина, 100 мкл (267 мкΜ) субстрата S-2238 и 840 мкл буфера HEPES.
Были построены монотонно возрастающие кривые гидролиза S-2238 (тромбиновая активность) для каждого активатора протромбина в 3-5 различных концентрациях в пределах 0,006-6 нМ. Полученные данные анализировали с использованием компьютерной программы для анализа данных кинетической реакции ферментов DynaFit 4.04.64 (BioKin Ltd, Watertown, MA, USA) (Kuzmic, P., 1996).
Кривая, построенная по данным анализа катализируемого тромбином гидролиза S-2238, представлена на фигуре 18.
Кинетические параметры вычисляли следующим образом:
Модель: B → B + pNA + P (псевдоконстанта скорости первого порядка для гидролиза S-2238 под действием тромбина), где:
B = тромбин;
pNA = п-нитроанилин;
P = продукт ингибирования; и
S-2238 присутствует в избытке, а поэтому он не был включен в реакционную смесь.
Ниже приведены дифференциальные уравнения:
d[B]/dt = -kb[B]+kb[B];
d[pNA]/dt = +kb[B]; и
d[P]/dt = +kb[B].
В таблице 6 представлены вычисленные кинетические параметры для тромбина.
Вычисленные кинетические параметры для тромбина
%
Определение константы скорости для активаторов протромбина:
Модель:
A + Z → A + B: ka (константа скорости второго порядка для активации протромбина);
B → B + pNA + P: kb; где
A = активатор протромбина.
Ниже приведены дифференциальные уравнения:
d[A]/dt = -ka[A][Z]+ka[A][Z];
d[Z]/dt = -ka[A][Z]
d[B]/dt = +ka[A][Z]-kb[B]+kb[B];
d[pNA]/dt = +kb[B]; и
d[P]/dt = +kb[B].
В таблице 7 представлены вычисленные кинетические параметры для PtPA.
Вычисленные кинетические параметры для PtPA
%
Скорость образования тромбина:
= ka (с-1 M-1)×60 (с)×10-6
= 40,3 мкΜ тромбина/мин/M протромбина/M активатора
= 40,3 нмоль тромбина/мл/мин/мкмоль протромбина/мкмоль активатора
На фигуре 19 представлены кривые активации протромбина под действием PtPA, иллюстрирующие скорости реакции PtPA в различных концентрациях (0,006-0,12 нМ) с протромбином, а затем скорости реакции продуцированного тромбина с хромогенным субстратом S-2238, и кривая наилучшего соответствия для PtPA-активации протромбина. Пунктирные линии соответствуют результатам эксперимента, а сплошные линии представляют вычисленные кривые наилучшего соответствия. Эти экспериментальные и вычисленные монотонно возрастающие кривые указывают на хорошее соответствие.
Затем оценивали кинетические параметры для OsPA, и эти данные представлены в таблице 8.
Вычисленные кинетические параметры для OsPA
%
Скорость образования тромбина:
= 44,0 нмоль тромбина/мл/мин/мкмоль протромбина/мкмоль активатора
На фигуре 20 представлены кривые активации протромбина под действием OsPA, иллюстрирующие скорости реакции OsPA в различных концентрациях (0,006-0,24 нМ) с протромбином, а затем скорости реакции продуцированного тромбина с хромогенным субстратом S-2238, и кривая наилучшего соответствия для OsPA-активации протромбина. Пунктирные линии соответствуют результатам эксперимента, а сплошные линии представляют вычисленные кривые наилучшего соответствия. Эти экспериментальные и вычисленные монотонно возрастающие кривые указывают на хорошее соответствие.
Затем оценивали кинетические параметры для экарина, и эти данные представлены в таблице 9.
Вычисленные кинетические параметры для экарина
Скорость образования тромбина:
= 2,76 мкΜ тромбина/мин/мкМ протромбина/мкМ активатора
= 2,76 нмоль тромбина/мл/мин/мкмоль протромбина/мкмоль активатора
На фигуре 21 представлены кривые активации протромбина под действием экарина, иллюстрирующие скорости реакции экарина в различных концентрациях (0,24-1,2 нМ) с протромбином, а затем скорости реакции продуцированного тромбина с хромогенным субстратом S-2238, и кривая наилучшего соответствия для активации протромбина под действием экарина. Пунктирные линии соответствуют результатам эксперимента, а сплошные линии представляют вычисленные кривые наилучшего соответствия. Эти экспериментальные и вычисленные монотонно возрастающие кривые указывают на хорошее соответствие.
Затем оценивали кинетические параметры для каринактивазы-1, и эти данные представлены в таблице 10.
Вычисленные кинетические параметры для каринактивазы-1
Скорость образования тромбина:
= 0,24 мкΜ тромбина/мин/мкМ протромбина/мкМ активатора
= 0,24 нмоль тромбина/мл/мин/мкмоль протромбина/мкмоль активатора
На фигуре 22 представлены кривые активации протромбина под действием каринактивазы-1, иллюстрирующие скорости реакции каринактивазы-1 в различных концентрациях (0,24-1,2 нМ) с протромбином, а затем скорости реакции продуцированного тромбина с хромогенным субстратом S-2238, и кривая наилучшего соответствия для активации протромбина под действием каринактивазы-1. Пунктирные линии соответствуют результатам эксперимента, а сплошные линии представляют вычисленные кривые наилучшего соответствия. Эти экспериментальные и вычисленные монотонно возрастающие кривые указывают на хорошее соответствие.
Затем оценивали кинетические параметры для каринактивазы-2, и эти данные представлены в таблице 11.
Вычисленные кинетические параметры для каринактивазы-2
%
Скорость образования тромбина:
= 1,91 мкΜ тромбина/мин/мкМ протромбина/мкМ активатора
= 1,91 нмоль тромбина/мл/мин/мкмоль протромбина/мкмоль активатора
На фигуре 23 представлены кривые активации протромбина под действием каринактивазы-2, иллюстрирующие скорости реакции каринактивазы-2 в различных концентрациях (0,24-1,2 нМ) с протромбином, а затем скорости реакции продуцированного тромбина с хромогенным субстратом S-2238, и кривая наилучшего соответствия для активации протромбина под действием каринактивазы-2. Пунктирные линии соответствуют результатам эксперимента, а сплошные линии представляют вычисленные кривые наилучшего соответствия. Эти экспериментальные и вычисленные монотонно возрастающие кривые указывают на хорошее соответствие.
Затем оценивали кинетические параметры для нотекарина, и эти данные представлены в таблице 12.
Вычисленные кинетические параметры для нотекарина
%
Скорость образования тромбина:
= 0,043 мкΜ тромбина/мин/мкМ протромбина/мкМ активатора
= 0,043 нмоль тромбина/мл/мин/мкмоль протромбина/мкмоль активатора
На фигуре 24 представлены кривые активации протромбина под действием нотекарина, иллюстрирующие скорости реакции нотекарина в различных концентрациях (0,24-6,0 нМ) с протромбином, а затем скорости реакции продуцированного тромбина с хромогенным субстратом S-2238, и кривая наилучшего соответствия для активации протромбина под действием нотекарина. Пунктирные линии соответствуют результатам эксперимента, а сплошные линии представляют вычисленные кривые наилучшего соответствия. Эти экспериментальные и вычисленные монотонно возрастающие кривые указывают на хорошее соответствие.
Систематизированные данные вычисленных констант скорости активации и скорости образования тромбина для каждого из активаторов протромбина представлены в таблице 13.
Систематизированные данные вычисленных констант скорости активации и скорости образования тромбина для различных активаторов протромбина
ka (c-1 нМ-1)
(нмоль тромбина/мл/мин/мкмоль протромбина/мкмоль активатора)
Какой-либо реакции между различными активаторами протромбина и субстратом тромбина S-2238 не наблюдалось, а также не наблюдалось какой-либо реакции между протромбином и S-2238. Полученные данные констант скорости активации подтвердили, что активаторы протромбина группы C (PtPA и OsPA) обладают наибольшей активностью в отношении гидролиза протромбина с его последующим превращением в тромбин. Фактически, эти активаторы являются более чем в 20 раз более эффективными, чем экарин и каринактиваза-2, более чем в 200 раз более эффективными, чем каринактиваза-1, и приблизительно в 1000 раз более эффективными, чем нотекарин. Вычисленные скорости образования тромбина обнаруживали одинаковый коэффициент эффективности, причем, активаторы группы С были способны продуцировать наибольшее количество тромбина, а за ними, по эффективности, следуют экарин, каринактиваза-2, каринактиваза-1 и, наконец, нотекарин, который является наименее эффективным. Как показано в примере 2d, нотекарину, для его активности, требуются кофакторы.
Материалы и методы, применяемые в нижеследующих примерах
В нижеследующих примерах описано применение вышеописанных материалов и методов, если это не оговорено особо.
(A) Контейнеры для получения проб
Типичный контейнер (например, пробирка) для получения пробы сыворотки или пробы плазмы содержит: (1) гелевый барьер, который используется для отделения клеток (и сгустка в случае сыворотки) от плазмы или сыворотки во время центрифугирования, и который позволяет не проводить последующего повторного смешивания; (2) поверхностно-активное вещество, покрывающее внутреннюю стенку, что позволяет продотвращать прилипание клеток и белка к стенкам пробирки и минимизировать последующий клеточный лизис; и (3) прокоагулянт, который усиливает процесс свертывания крови (например, частицы двуокиси кремния), и который используется для получения пробы сыворотки, или антикоагулянт (например, литий-гепарин, цитрат или EDTA), который используется для получения пробы плазмы.
В этих примерах, для получения проб сыворотки или проб плазмы был использован ряд коммерчески доступных пробирок, описанных ниже.
Пробирка для плазмы Greiner Vacuette™. Эта пробирка представляет собой пробирку-сепаратор для отделения плазмы и поставляется Greiner под номером заказа 456083. Внутреннюю стенку пробирки покрывают путем распыления осушенного литий- гепарина (89 МЕ), который действует как антикоагулирующее средство. На дне пробирки также содержится разделительный гель. В соответствии с требованиями Greiner, этот гель должен создавать стабильный барьер между клетками плазмы и крови, что будет обеспечивать стабильность препарата в течение периода времени до 48 часов. Объем заполнения составляет 5,0 мл.
Пробирка для плазмы Becton Dickinson (BD) Vacutainer™ (BD PST II). Эта пробирка представляет собой пробирку-сепаратор для отделения плазмы и поставляется BD под номером заказа 367375. Каждая пробирка содержит 77 МЕ/мл литий-гепарина (0,2-1,0 мг), используемого в качестве антикоагулянта. Эта пробирка содержит акриловый гель (0,8-1,9 г), который образует барьер между клетками и плазмой во время центрифугирования. В соответствии с требованиями BD, этот гель обеспечивает повышенную чистоту плазмы, на что указывает снижение уровня фибрина и детектируемых лейкоцитов, эритроцитов и тромбоцитов, и более высокую стабильность аналитов, то есть большинство аналитов были стабильными в пробирке в течение 24 часов при 25°C. Объем заполнения составляет 4,0 мл.
Пробирка для сыворотки Greiner Vacuette™. Эта пробирка поставляется Greiner под номером заказа 456078. Указанная пробирка содержит частицы двуокиси кремния, используемые в качестве активатора свертывания крови. Объем заполнения составляет 4,0 мл. Рекомендованное время свертывания крови в этой пробирке составляет 30 минут.
Пробирка для сыворотки Becton Dickinson (BD) Vacutainer™ (BD SST II). Эта пробирка поставляется BD под номером заказа 367954. Указанная пробирка используется для получения и отделения пробы сыворотки. Каждая пробирка содержит 0,20-2,56 мг аморфной двуокиси кремния (или кварцевого стекла), используемого в качестве коагулирующего агента, а также гель (0,90-3,50 г), который образует барьер между сгустком и сывороткой после центрифугирования. Время свертывания крови, рекомендованное BD для этой пробирки, составляет 30 минут. Объем заполнения составляет 4,0 мл.
Пробирка для быстрого получения сыворотки Becton Dickinson (BD) Vacutainer™ (BD RST). Эта пробирка поставляется BD под номером заказа 368771. Указанная пробирка содержит терапевтическое коагулирующее средство на основе тромбина и гель. В соответствии с требованиями BD, в этих пробирках, свертываемость пробы сыворотки должна достигаться через пять минут (то есть быстрее, чем в стандартной коммерчески доступной пробирке для сыворотки), и эта сыворотка должна давать «минимальное образование фибрина». Объем заполнения составляет 4,0 мл.
Пробирка без добавок Greiner Vacuette™. Эти пробирки представляют собой простые пластиковые пробирки, поставляемые Greiner под номером заказа 45400, в которые были добавлены активаторы протромбина в определенных концентрациях, как описано ниже в примерах.
Пробирка для сыворотки Sarstedt. Эта пробирка поставляется под каталожным номером 5092503 и имеет светло-коричневый верх и объем заполнения 4,7 мл. Такие пробирки содержат частицы двуокиси кремния и гелевый барьер.
Простая пробирка Terumo. Эта пробирка поставляется под торговым знаком VENOSAFE и под каталожным номером VF-076SP и имеет объем заполнения 6,0 мл. Эти пробирки содержат частицы двуокиси кремния и гелевый барьер.
Пробирка с красным верхом Terumo (RT). Эта пробирка поставляется под торговым знаком VENOSAFE и под каталожным номером VF-108SAS и имеет объем заполнения 8,0 мл. Эти пробирки имеют внутренее покрытие из двуокиси кремния и содержат гелевый барьер.
Цитратсодержащая пробирка Greiner Vacuette™. Эта пластиковая пробирка содержит 3,2% цитрата и имеет объем заполнения 4,0 мл. Эта пробирка имеется в продаже под каталожным номером 454327.
EDTA-содержащая пробирка Greiner Vacuette™ K2. Эта пластиковая пробирка содержит 8 мМ EDTA и имеет объем заполнения 4,0 мл. Эта пробирка имеется в продаже под каталожным номером 454023.
(B) Анализы проб - Анализатор CLOTEK
В анализаторе Clotek (Hyland, USA) используется пробирка для проб, содержащая магнитный шарик, который качается в вертикальной плоскости при помещении пробирки в аппарат. Магнитный стальной шарик поддерживается в определенном положении благодаря магнитному полю, а сама пробирка качается. В эту пробирку добавляют пробу, буфер ± кальций и прокоагулянт, а затем включают таймер. Тромбин превращает фибриноген в фибриновые сгустки, и время, необходимое для образования детектируемого сгустка, называется временем свертывания. При образовании сгустка стальной шарик удаляют из магнитного поля суспензии и с пути светового луча, что приводит к пересечению фотоэлемента световым лучом и к остановке таймера (Austen, D. E., et al., 1975 и Starr, H., et al., 1980).
(C) Анализы проб - Тромбоэластография
Метод тромбоэластографии (ТЭГ) позволяет определить свертывание цельной крови путем измерения скорости образования сгустка крови и лизиса, и эластические свойства сгустка крови в процессе его образования и лизиса. ТЭГ-анализ проводили, как описано в некоторых нижеследующих примерах.
ТЭГ-анализ осуществляли на тромбоэластографе Thrombelastograph® 5000 (TEG, Haemoscope Corporation Pty Ltd, Niles, IL, USA) с помощью аналитической компьютерной программы TEG Analytical Software, версия 4.
Параметры свертывания, используемые в настоящем документе для ТЭГ-анализа, представлены ниже:
R - время реакции (секунды/минуты): время от начала проведения анализа до тех пор, пока амплитуда на ТЭГ-графиках не составляла 2 мм, что указывало на детектируемое образование сгустка;
α - угол: параметр, определяющий скорость образования фибрина и перекрестного связывания (то есть повышения концентрации сгустка);
MA - максимальная амплитуда (мм): максимальная концентрация сгустка;
TMA - время (секунды/минуты) от начала анализа до достижения MA; и
К - время (сек): время от начала образования сгустка до того времени, когда амплитуда кривой достигнет 20 мм.
Пример ТЭГ-кривой (часть кривой, соответствующей образованию сгустка) с вышеуказанными параметрами свертывания представлен на фигуре 25. Не были включены лишь параметры свертывания, представляющие собой параметры лизиса сгустка.
Пример 3: Свертывание проб плазмы под действием активаторов протромбина, выделенных из яда
Пример 3a: Время свертывания нормальной и обработанной цитратом плазмы под действием PtPA и коровьего тромбина
Время свертывания объединенной обработанной цитратом плазмы (комбинированной плазмы, полученной от 6 здоровых участников) под действием PtPA (полученного, как описано в примере 1d) и коровьего α-тромбина (3276 ед./мг; Sigma Chemical Co.), при добавлении кальция (10 мМ) и без добавления кальция, определяли в пробах, взятых в дубликатах.
Результаты указаны в таблице 14, где величины представляют собой среднее для двух экспериментов.
Время свертывания обработанной цитратом плазмы под действием PtPA и коровьего тромбина, измеренное на устройстве Hyland-Clotek (секунды)
PtPA эффективно свертывал обработанную цитратом плазму в концентрации по меньшей мере 0,1 пМ с рекальцификацией или без рекальцификации. При концентрации 1 нМ, свертывание крови происходило приблизительно за 6 секунд, что близко к минимальному времени свертывания, достигаемого при концентрации 100 нМ, которое составляет 4,2 секунды.
Эти результаты также показали, что PtPA является приблизительно в 3×104 раз более эффективным в отношении свертывания обработанной цитратом плазмы (с рекальцификацией или без нее), чем коровий тромбин, на молярном уровне. Так, например, в присутствии 10 мМ добавленного кальция, свертывание крови при 1 пМ PtPA происходит за такое же время, как и свертывание в присутствии 30 нМ тромбина, а свертывание крови при 0,1 пМ PtPA происходит почти за такое же время, как и свертывание в присутствии 3 нМ тромбина (в таблице 14, эти величины выделены жирным шрифтом).
Пример 3b: Время свертывания нормальной обработанной цитратом плазмы под действием активаторов протромбина
В этом эксперименте была использована плазма, описанная в примере 3a.
Каждая пробирка Clotek содержала 100 мкл нормальной «объединенной» и обработанной цитратом плазмы, 100 мкл трис-буфера (150 мМ трис-HC1, 150 мМ NaCl, pH 7,4), 50 мкл 0,2 M CaCl2 или физиологического раствора и 50 мкл каждого из прокоагулянтов (либо препарата активаторов протромбина, либо тромбина).
Результаты свертывания нормальной «объединенной» и обработанной цитратом плазмы под действием препаратов активаторов протромбина и тромбина (с рекальцификацией и без нее) представлены в таблицах 15 и 16. В этих (и в других) таблицах, CA-1 представляет собой каринактивазу-1, а CA-2 представляет собой каринактивазу-2.
Время свертывания нормальной «объединенной» и обработанной цитратом плазмы под действием различных препаратов активаторов протромбина и тромбина в присутствии кальция
Время свертывания нормальной «объединенной» и обработанной цитратом плазмы под действием различных препаратов активаторов протромбина и тромбина в отсутствие кальция
Результаты показали, что в присутствии добавленного кальция, все активаторы протромбина (группы A-D) эффективно свертывали нормальную обработанную цитратом плазму.
В обработанной цитратом плазме, кальций полностью не истощался. Концентрация общего кальция в нормальной обработанной цитратом плазме составляла ~1,3 ммоль/л, а концентрация ионизованного кальция была недетектируемой (<0,25 ммоль/л). Однако цитрат представляет собой агент, который образует хелатный комплекс с кальцием, и связывается с кальцием в пробе, в результате чего свободный кальций становится трудно доступным для его использования в образовании сгустка. Кальций является частью протромбиназного комплекса и играет важную роль в катализе реакции превращения протромбина в тромбин. Цитрат также связывается с ионами других металлов, включая ионы магния и цинка. Количество цитрата, присутствующего в пробирке, составляет 0,109 моль/л, что более чем достаточно для образования хелатного комплекса с ионами всех металлов в пробирке.
Эти результаты показали, что эффективность экарина, то есть активатора протромбина группы А в отношении свертывания плазмы увеличивается более чем в два раза в присутствии добавленного кальция, следовательно, кальций значительно повышает способность экарина ускорять процесс образования сгустков. Активность активаторов протромбина группы B, то есть каринактивазы-1 и каринактивазы-2, значительно снижается в отсутствие кальция, то есть приблизительно в 4 раза, что подтверждает способность кальция усиливать коагулирующую активность под действием этих активаторов протромбина. Активность нотекарина, то есть активатора протромбина группы D, стимулируется в присутствии добавленного кальция, и его потребность в кальции наиболее заметна при снижении концентрации нотекарина, причем добавление кальция приводит к повышению его эффективности на ~30%.
Активность самого тромбина в меньшей степени зависит от отсутствия добавленного кальция. Сам тромбин продуцируется в пробе посредством каскада реакций коагуляции, в которых превращение протромбина в тромбин требует присутствия кальция. Поэтому, количество образовавшегося тромбина из протромбина пробы снижается в отсутствие кальция.
Зависимость прокоагулянтов от кальция снижается, если они присутствуют в высоких концентрациях, что обусловлено их активностью. Результаты показали, что активаторы протромбина группы С, то есть PtPA и OsPA, были наиболее эффективными в отношении свертывания нормальной «объединенной» и обработанной цитратом плазмы в присутствии или в отсутствие добавленного кальция. Действительно, в отсутствие кальция, способности этих двух прокоагулянтов к свертыванию имеют минимальное различие. В присутствии и в отсутствие добавленного кальция, для достижения свертывания за <5 минут требуется ~0,1 нМ активаторов протромбина группы С.
Пример 3c: Время свертывания обработанных цитратом проб плазмы и фибриногеновых проб под действием PtPA
Способность PtPA к свертыванию указанных ниже проб рекальцифицированной и обработанной цитратом плазмы и пробы очищенного фибриногена определяли в нижеследующих пробах, взятых в дубликате:
(i) обработанной цитратом плазмы;
(ii) обработанной цитратом плазмы, адсорбированной Al(OH)3 (Al(OH)3-адсорбция приводит к удалению протромбина и других белков, содержащих γ-карбоксиглутамат (GLA));
(iii) обработанной цитратом плазмы, взятой у пациентов после длительной терапии варфарином (где Международное нормализованное отношение (INR) составляет более чем 4,0);
(iv) обработанной цитратом плазмы, взятой у пациентов после длительной терапии варфарином (где Международное нормализованное отношение (INR) составляет более чем 4,0), где указанная плазма была адсорбирована Al(OH)3;
(v) обработанной цитратом плазмы, не содержащей фактора X и взятой от пациентов с врожденным дефицитом этого фактора;
(vi) обработанной цитратом плазмы, не содержащей фактора V и взятой от пациентов с врожденным дефицитом этого фактора; и
(vii) очищенного человеческого фибриногена (2 мг/мл в изотоническом растворе), адсорбированного Al(OH)3 (для удаления следовых количеств протромбина).
Что касается пунктов (iii) и (iv), то известно, что варфарин ингибирует γ-карбоксилазу печени, то есть фермент, который вводит γ-карбоксильные группы в 10 N-концевых остатков глутаминовой кислоты протромбина. Поэтому, обработанная варфарином плазма содержит некарбоксилированный предшественник протромбина, дескарбоксипротромбин, который не удалялся посредством Al(OH)3-адсорбции.
Что касается пунктов (v) и (vi), то известно, что фактор Xa и фактор Va являются основными компонентами человеческого протромбиназного комплекса. Фактор X-дефицитная и фактор V- дефицитная плазма поставляется Ortho-Diagnostics, USA.
Результаты представлены в таблице 17.
Время свертывания обработанных цитратом проб плазмы (i)-(vi) и фибриногеновой пробы (vii)
# PtPA не добавляли, и ко всем пробам добавляли 0,1 единицы коровьего тромбина (Parke-Davis, в настоящее время Pfizer, USA), используемого в качестве положительного контроля. Быстрое свертывание, наблюдаемое после добавления тромбина, подтверждает присутствие фибриногена во всех пробах.
Результаты, представленные в таблице 17, показали, что:
(1) протромбин необходим для свертывания под действием PtPA, поскольку Al(OH)3 -адсорбированная и обработанная цитратом плазма (плазма (ii)) не свертывается под действием PtPA;
(2) PtPA свертывает обработанную варфарином плазму (пробы (iii) и (iv)), что указывает на то, что дескарбоксипротромбин может превращаться в α-тромбин под действием PtPA;
(3) данные для Al(OH)3-адсорбированной и обработанной варфарином плазмы (проба (iv)) подтвердили, что дескарбоксипротромбин превращается в α-тромбин, поскольку следовые количества нормального протромбина в обработанной варфарином плазме могут быть удалены под действием Al(OH)3;
(4) Фактор Xa является необязательным для свертывания под действием PtPA (данные для пробы (v));
(5) Фактор Va является необязательным для свертывания под действием PtPA (данные для пробы (vi)); и
(6) PtPA не обладает способностью свертывать пробу с раствором фибриногена, а поэтому он не может действовать как тромбин-подобный фермент.
В целом, полученные результаты показали, что свертывание, индуцированное PtPA, обусловлено активацией протромбина; дескарбоксипротромбин эффективно превращается в тромбин под действием PtPA; факторы Xa и Va являются необязательными для активации протромбина под действием PtPA; а PtPA не превращает фибриноген в фибрин в этих условиях.
Пример 3d: Свертывание EDTA-обработанной плазмы
Небольшой, но все-таки значительный процент проб (проб сыворотки или проб плазмы, обработанной литий-гепарином), полученных для биохимического анализа, содержал EDTA в качестве примеси. Поэтому важно определить, являются ли активаторы протромбина эффективными в отношении свертывания EDTA-обработанной плазмы и EDTA-обработанной цельной крови. Поэтому, этот пример приводится ниже как пример 5b для сравнения результатов исследований EDTA-обработанной плазмы и EDTA-обработанной цельной крови.
Пример 3e: Свертывание обработанной цитратом плазмы, взятой у пациентов, подвергавшихся лечению варфарином, под действием активаторов протромбина
Варфарин обычно используется как антикоагулянт, а поэтому, этот эксперимент проводили для того, чтобы определить, влияет ли терапия варфарином на способность активаторов протромбина, а именно экарина, каринактивазы-1, каринактивазы-2, PtPA; OsPA; и нотекарина свертывать пробы, взятые у пациентов, подвергавшихся лечению варфарином.
Были отобраны взятые у участников эксперимента пробы плазмы с разным временем свертывания (соответствующим дозам варфарина) исходя из INR (1,1-7,6), и эти пробы были протестированы с использованием различных прокоагулянтов (активаторов протромбина и тромбина).
Пробирки Clotek содержали 100 мкл плазмы, обработанной литий-гепарином, 100 мкл трис-буфера (150 мМ трис-HCl, 150 мМ NaCl, pH 7,4), 50 мкл 0,2 M CaCl2 и 50 мкл каждого прокоагулянта.
Результаты представлены в таблицах 18 и 19. В этих и других таблицах, CA-l представляет собой каринактивазу-1, а CA-2 представляет собой каринактивазу-2.
Время свертывания (секунды) рекальцифицированной и обработанной цитратом плазмы, взятой у пациентов, подвергавшихся лечению варфарином, под действием активаторов протромбина
Время свертывания (секунды) рекальцифицированной и обработанной цитратом плазмы, взятой у пациентов, подвергавшихся лечению варфарином, под действием PtPA и тромбина
Варфарин способствует снижению синтеза нормального фактора-X (FX) и протромбина из их активных предшественников (дескарбоксифактора-Х и дескарбоксипротромбина). Протромбин и дескарбоксипротромбин представляют собой субстраты, на которые нацелены активаторы протромбина. Снижение количества протромбина означает снижение количества тромбина под действием активаторов протромбина, а следовательно, и увеличение времени свертывания. Сам тромбин не ингибируется варфарином, а поэтому варфарин не влияет на время свертывания под действием тромбина, как наблюдалось в этом эксперименте. Результаты данного эксперимента показали, что каринактиваза-1 является лишь активатором протромбина, который не обладает способностью к свертыванию проб плазмы при INR ≥ 2,9. Результаты показали, что PtPA и OsPA являются наиболее эффективными прокоагулянтами для плазмы, взятой у пациентов, подвергавшихся лечению варфарином.
Пример 3f: Свертывание FV-дефицитной и FX-дефицитной плазмы под действием активаторов протромбина
Препараты активаторов протромбина тестировали на их способность свертывать коммерчески доступную FV-дефицитную плазму (#0008466150) и FX-дефицитную плазму (#0008466350) (Instrumentation Laboratory, Lexington, MA, USA) с использованием анализатора Clotek (Hyland USA).
Пробирка Clotek содержала 100 мкл FV- или FX-дефицитной плазмы, 100 мкл трис-буфера (150 мМ трис-HCl, 150 мМ NaCl, pH 7,4), 50 мкл 0,2 M CaCl2 и 50 мкл каждого прокоагулянта. Все прокоагулянты использовали в концентрации 30 нМ, и кроме того, был проведен анализ дополнительной пробы, содержащей каринактивазу-1 в концентрации 100 нМ.
Результаты представлены в таблице 20.
Время свертывания (секунды) FV- или FX-дефицитной плазмы под действием препаратов активаторов протромбина и тромбина
Нотекарин не обладал способностью свертывать FV-дефицитную плазму за 5 минут, а его коагулирующая активность была также снижена в отсутствие FX. Кроме того, коагулирующая активность активаторов протромбина группы А и группы В также снижалась в отсутствие FV или FX. Очевидно, что активаторы протромбина группы С, а именно PtPA и OsPA, были наиболее эффективными в отношении свертывания плазмы, и для этого не требовалось присутствия FV или FX.
Время свертывания FV- и FX-дефицитной плазмы под действием тромбина было значительно выше, то есть более чем в 3 раза выше по сравнению со временем свертывания нормальной «объединенной» и обработанной цитратом плазмы.
Пример 3g: Оценка количества тромбина, продуцированного под действием PtPA и OsPA в нормальной, гепаринизированной и обработанной цитратом плазме
В этом эксперименте оценивали количество тромбина, продуцируемого под действием PtPA и OsPA в различных концентрациях и в присутствии гепарина.
Нормальная обработанная цитратом плазма была взята у здорового участника и помещена в различные пробирки (пробирки Greiner с цитратом), которые были сразу центрифугированы с последующим выделением объединенной и обработанной цитратом плазмы.
Используемый тромбин представляет собой тромбин-JMI, Topical (коровий) 5000USP (GenTrac Inc, King Pharmacia, Middleton, WI, USA). Единицы USP эквивалентны МЕ, а одна МЕ равна 9 нМ. Используемый субстрат тромбина представляет собой S-2238 (25 мг маточного раствора с MW 626 Да растворяли в 15 мл с получением 2,67 мМ раствора (#820324 Chromogeinix IL Lexington MA, USA). Используемый гепарин представляет собой 5000 МЕ/5 мл (1000 МЕ/мл) натрий-гепарина, Pfizer, NZ. Для гепарина, 190,9 МЕ = 1 мг (Camenzind, et al. 1997); a для вычисления молярных концентраций, MWt составляет ~ 12000 Да. Используемый буфер представляет собой 20 мМ буфер Hepes; 150 мМ NaCl; pH 7,4; 0,05% поверхностно-активного вещества p20.
Пробирки, используемые для инкубирования плазмы, содержали 0,5 мл обработанной цитратом плазмы, 50 мкл 0,5 M CaCl2, и 5-40 мкл тромбина или активатора протромбина плюс 20 мкл гепарина с конечными концентрациями 860, 300 и 8600 нМ (2, 10 и 20 МЕ) или физиологический раствор. Пробирки инкубировали в течение 5 минут при комнатной температуре. Точно через 5 минут, сгусток наматывали кольцом на две деревянные палочки-аппликатора, удаляли и отбрасывали.
Для проведения анализов на тромбиновую активность использовали спектрофотометрическую кювету, содержащую 930 мкл буфера, 50 мкл S-2238 и 20 мкл очищенной сыворотки, которая оставалась после удаления сгустка из каждой пробирки при инкубировании, проводимом, как описано выше. Мониторинг изменения оптической плотности проводили на 405 нм в течение 5 минут.
На фигуре 26 проиллюстрированы активности остаточного тромбина в этих пробирках, в которые был добавлен тромбин в различных концентрациях. Для каждой кривой, ее наклон на время 275 секунд был определен с использованием интервала 250-300 секунд, и по этим наклонам кривых и по концентрациям тромбина была построена стандартная кривая в логарифмическом формате, то есть кривая линейной зависимости для более высокой концентрации тромбина, как показано на фигурах 26 и 27.
Рекальцифицированная плазма (без прокоагулянта) свертывалась приблизительно за 37 минут при комнатной температуре. Все тромбинсодержащие пробы обнаруживали латентное свертывание. При наименьшей концентрации тромбина наблюдалось самое длительное время латентного свертывания (~3 минуты). Время до образования латентного сгустка снижалось по мере увеличения концентрации тромбина. Пробы с концентрациями >200 нМ тромбина обнаруживали латентное свертывание сразу после удаления сгустка при взятии аликвот сыворотки. В это время из пробирки необходимо удалить второй сгусток для гарантии того, что количество пробы будет достаточным для проведения фотометрического анализа.
Ниже представлены результаты для проб, содержащих различные концентрации активаторов протромбина PtPA и OsPA, но без гепарина. Спектрофотометрические данные для проб, содержащих различные концентрации PtPA, представлены на фигуре 28, а данные для проб, содержащих различные концентрации OsPA, представлены на фигуре 29.
Затем были построены графики для концентраций тромбина, образованного под действием PtPA, в зависимости от наклона кривых, полученных за 5-минутное инкубирование, и эти результаты представлены на фигуре 30, а также были построены графики для концентраций тромбина, образованного под действием OsPA, в зависимости от наклона кривых, полученных за 5-минутное инкубирование, и эти результаты представлены на фигуре 31.
Была проведена оценка концентрации тромбина, образующегося под действием PtPA и OsPA в различных концентрациях, и сохраняющего свою активность в сыворотке, и эти концентрации указаны в таблице 21.
Оценка активного тромбина, присутствующего в сыворотке и образующегося под действием PtPA и OsPA в различных концентрациях, как было определено по уравнению регрессии для построения стандартной кривой, фигура 27
5 минут/секунды
Полученные результаты показали, что достаточно большие количества тромбина продуцировались даже при 1,2 нМ PtPA и OsPA. PtPA и OsPA в очень небольших количествах были способны к полному свертыванию рекальцифицированной нормальной обработанной цитратом плазмы за <5 минут. Какого-либо латентного свертывания не наблюдалось, что указывает на то, что количество продуцируемого тромбина было достаточным для полного катализа фибриногена и предупреждения латентного свертывания, что должно обеспечивать получение сыворотки очень высокого качества.
Для проб, содержащих различные концентрации гепарина, были получены следующие результаты.
Во-первых, определяли концентрацию тромбина, оставшегося в сыворотке в качестве компонента в результате активности тромбина, PtPA и OsPA в присутствии 4300 нМ (10 МЕ) гепарина, как показано на фигуре 32 (изменение A405 для гидролиза S-2238/минуту, отложенное по оси y, пропорционально концентрации тромбина). Тромбин в концентрации 135 нМ не давал полного свертывания пробы плазмы, и в этом случае, образовывался «хлопьевидный» сгусток небольшого размера, составляющего лишь 2-3 мм. Действие активаторов протромбина в концентрациях 6,1 нМ приводило к свертыванию пробы, содержащей 4300 нМ (10 МЕ) гепарина приблизительно за одну минуту, а латентное свертывание не наблюдалось даже после хранения при комнатной температуре в течение 24 часов.
Затем проводили исследование для того, чтобы определить, будет ли такая реакция протекать аналогичным образом при других концентрациях гепарина. Нормальную объединенную и обработанную цитратом плазму получали из лаборатории Queensland по исследованию нарушения свертывания крови при Клинике принцессы Александры (Coagulation Laboratory Queensland, Pathology, Princess Alexandra Hospital), поскольку плазмы, взятой у здорового участника эксперимента, было недостаточно. Результаты представлены на фигуре 33 (PtPA) и на фигуре 34 (OsPA).
Оценивали количество тромбина, образующегося под действием PtPA и OsPA в концентрации 1,5 нМ, и сохраняющего свою активность в сыворотке, и это количество указано в таблице 22.
Оценка активного тромбина, присутствующего в сыворотке и образующегося под действием PtPA и OsPA в концентрации 1,5 нМ, как было определено по уравнению регрессии для построения стандартной кривой, фигура 27
Пробы, содержащие 860 и 4300 нМ (2 и 10 МЕ) гепарина, обнаруживали свертывание через две минуты и не обнаруживали латентного свертывания. Сгусток был твердым, но не настолько твердым, как это наблюдалось в пробах, не содержащих гепарина. Проба, содержащая 860 нМ (2 МЕ) гепарина, обладала тромбиновой активностью, которая составляла приблизительно 25% от тромбиновой активности проб плазмы, не содержащих гепарина. В противоположность этому, проба, содержащая 8600 нМ (20 МЕ) гепарина, давала «гелеобразный» сгусток (скорее напоминающий сгустки, образующиеся в тромбинсодержащих пробах) за 3 минуты, и обнаруживала латентное свертывание за 5 минут. Объяснения получения такой формы монотонно прогрессирующих кривых при более высоких концентрациях гепарина, показанных на фигурах 33 и 34, пока не дано.
Пример 3h: Оценка количества тромбина, образующегося в пробирке BD RST нормальной объединенной и обработанной цитратом плазмой, и оценка действия гепарина
Этот эксперимент проводили для оценки количества тромбина, образующегося и присутствующего в активной форме в пробирке BD RST, заполненной плазмой в различных объемах. Кроме того, было также исследовано влияние гепарина на свертывание в пробирках BD RST.
Нормальную объединенную и обработанную цитратом плазму (<24-часовую) получали из лаборатории Queensland по исследованию нарушения свертывания крови при Клинике принцессы Александры (Coagulation Laboratory Queensland, Pathology, Princess Alexandra Hospital).
Для построения стандартной кривой использовали пробирки BD RST, которые содержали 1, 2, 3 и 4 мл обработанной цитратом плазмы и 50 мкл 0,5 M CaCl2. Эти пробирки переворачивали 8-10 раз для смешивания и инкубировали в течение 5 минут. Сгусток наматывали кольцом на две деревянные палочки-аппликаторы, удаляли и отбрасывали.
Спектрофотометрическая кювета содержала 930 мкл буфера, 50 мкл S-2238 и 20 мкл очищенной сыворотки, которая оставалась после удаления сгустка из каждой вышеуказанной пробирки BD RST. Мониторинг изменения оптической плотности проводили на 405 нм в течение 5 минут, и результаты были представлены на фигуре 35. Концентрации тромбина оценивали исходя из наклонов кривых с использованием стандартной кривой, представленной на фигуре 16, и строили график зависимости от наклона кривых, представленных на фигуре 35. Исходные концентрации тромбина в пробирке BD RST и остальные концентрации тромбина в сыворотке, не содержащей сгустка и взятой из четырех проб, составляли: 135 и 4,3; 67,5 и 1,4; 45 и 0,5; и 33,8 и 0,3 нМ соответственно. Очевидно, что большая часть тромбина была удалена в процессе удаления сгустка, поскольку он был связан с фибриновым сгустком.
В отличие от проб с чистым тромбином, описанных в примере 3g, каждая проба в каждой из пробирок BD RST свертывалась за одну минуту, и, при этом, латентного свертывания не наблюдалось. Однако концентрация сгустка была гораздо меньше, чем это наблюдалось в случае PtPA или OsPA, как описано в примере 3g.
Для проб, содержащих различные объемы обработанной цитратом плазмы и различные концентрации гепарина, мониторинг изменения оптической плотности каждой пробы проводили на 405 нМ в течение 5 минут, и результаты этого мониторинга были представлены на фигуре 37. Объяснения получения такой формы монотонно возрастающих кривых при высоких концентрациях гепарина пока не дано.
Ни одна проба не обнаруживала полного свертывания в присутствии гепарина в любой из трех концентраций. Самый плотный сгусток наблюдался в пробах, содержащих 830 нМ (2 МЕ) гепарина и 1 мл плазмы, хотя этот сгусток был рыхлым по сравнению с твердым сгустком, образовавшимся в отсутствие гепарина. Самый хрупкий из образовавшихся сгустков наблюдался в пробирке, заполненной 4 мл плазмы и содержащей 8600 нМ (20 МЕ) гепарина. Этот сгусток напоминал «сахарную вату» и наблюдался только в части пробы. Через 5 минут, все пробирки, содержащие гепарин, обнаруживали относительно латентное свертывание. Фактическая форма кривой для концентраций гепарина 4300 и 8600 нМ (10 и 20 МЕ) была очень похожа на форму кривых, построенных для PtPA и OsPA.
Углы наклона и оценка активного тромбина в присутствии различных концентраций гепарина и различных концентраций тромбина представлены в таблице 23.
Оценка активного тромбина в присутствии различных концентраций гепарина и различных концентраций тромбина в пробирках BD RST, проводимая с помощью уравнения регрессии, полученного исходя из стандартной кривой, представленной на фигуре 36
(МЕ)[нМ]
Результаты показали, что одинаковые номинальные концентрации тромбина (в столбце 2) продуцировали аналогичные активные концентрации тромбина в присутствии гепарина в различных концентрациях. Концентрации тромбина, измеренные после свертывания, были в несколько раз ниже номинальных концентраций.
Пример 4: Свертывание проб цельной крови, взятых у здоровых участников эксперимента, под действием активаторов протромбина
Пример 4a: Свертывание под действием экарина
Для проведения этого эксперимента, экарин, выделенный из яда Echis carinatus, закупали у Sigma (номер по каталогу EO 504-1VL; номер партии 128K 1536). Обработанную цитратом кровь (пул из трех проб с нормальными профилями свертывания) получали из лаборатории Queensland по исследованию нарушения свертывания крови при Клинике принцессы Александры, Pathology Queensland, Princess Alexandra Hospital, Queensland, Australia.
Один сосуд с экарином (50 единиц) разводили в 100 мкл H2O с получением маточного раствора в концентрации 500 единиц/мл. Разведения этого маточного раствора в дистиллированной воде (1:100, то есть 5 единиц/мл; 1:1000, то есть 0,5 единиц/мл; 1:10000, то есть 0,05 единиц/мл) использовали в ТЭГ-анализах. Каждая смесь для анализа состояла из 310 мкл обработанной цитратом крови, 20 мкл 0,2 M CaCl2 и 10 мкл физиологического раствора (контроль) или разведения экарина. Поэтому, диапазон концентраций экарина в смесях для анализа составлял 0-0,15 единиц/мл. Все эксперименты дублировали. Результаты представлены в таблице 24.
ТЭГ-результаты для свертывания рекальцифицированных и обработанных цитратом проб крови под действием экарина
Добавление экарина к рекальцифицированной и обработанной цитратом крови приводило к зависимому от концентрации снижению как времени R, так и ТМА, и к небольшому увеличению MA. При наибольшей из тестируемых концентраций, то есть 0,15 единиц/мл, экарин способствовал снижению времени R от 6,95 до 2,1 минут и к снижению TMA от 26,45 до 15,75 минут. При наименьшей из тестируемых концентраций экарина, то есть 0,0015 единиц/мл, какого-либо значимого эффекта в отношении времени свертывания и концентрации сгустка не наблюдалось, тогда как экарин в концентрации 0,015 единиц/мл давал промежуточный эффект.
Эти результаты позволяют предположить, что экарин должен быть также эффективным активатором протромбина с точки зрения быстрого получения сыворотки для анализов аналитов в клинической лаборатории.
Пример 4b: Свертывание нормальной «объединенной» рекальцифицированной и обработанной цитратом крови под действием шести активаторов протромбина
Были использованы очищенные препараты экарина, каринактивазы-1, каринактивазы-2, PtPA, OsPA и нотекарина, полученные, как описано в примере 1. Свертывание нормальной «объединенной» и обработанной цитратом крови (как описано в примере 4a) под действием шести активаторов протромбина, под действием тромбина и в пробирках BD RST исследовали с помощью ТЭГ, как описано в примере 4a.
Результаты представлены в таблице 25.
ТЭГ-исследования свертывания нормальной «объединенной» рекальцифицированной и обработанной цитратом крови под действием различных прокоагулятнов
Эти результаты еще раз подтвердили данные по свертыванию плазмы (пример 3) и показали, что все активаторы протромбина являются очень эффективными в отношении свертывания крови, и что активаторы протромбина группы С (PtPA и OsPA) являются наиболее эффективными в отношении свертывания нормальной «объединенной» рекальцифицированной и обработанной цитратом цельной крови. Так, например, с использованием 9 пМ PtPA и OsPA, время R составляло приблизительно 5 минут, а максимальная плотность сгустка подтверждалась данными по MA. Следующим по наилучшей эффективности активатором протромбина является нотекарин, то есть активатор протромбина группы D, который давал время R=5 минут, а максимальная плотность сгустка достигалась при минимальной концентрации 0,09-0,009 нМ. Хотя сам нотекарин не содержит FVa, однако FV, присутствующий в плазме, превращается в активную форму под действием небольшого количества тромбина, образованного нотекарином-FXa. Следующим по наилучшей эффективности активатором протромбина является экарин, то есть активатор протромбина группы А, который давал желательное время R, а максимальная плотность сгустка достигалась при минимальной концентрации 0,9-3,2 нМ. Наименее эффективными активаторами протромбина являются активаторы протромбина группы В, а именно каринактиваза-1 и каринактиваза-2, которым для достижения времени R <5 минут и максимальной плотности сгустка требуются концентрации от ≥9 до ≥3 нМ. Минимальной концентрацией тромбина, необходимой для достижения нужного времени R и макисмальной плотности сгустка, является концентрация ≥3 нМ.
Пример 4c: Сравнения коммерчески доступных пробирок для сыворотки и PtPA-содержащих пробирок
У здоровых участников эксперимента делали забор крови с использованием сертифицированной иглы «бабочки» в указанные ниже пробирки, такие как:
(1) 4,0 мл-пробирка Greiner VacuetteTM без добавок;
(3) пробирка для сыворотки Greiner Vacuette™;
(4) пробирка для сыворотки BD Vacutainer™;
(5) пробирка для сыворотки Sarstedt;
(6) пробирка Terumo RT; и
(7) простая пробирка Terumo.
Пробирки заполняли только что взятой кровью до требуемой отметки и сразу перемешивали в течение 30 секунд путем осторожного переворачивания 8-10 раз. Затем, 340 мкл пробы переносили в ТЭГ-чашку для непосредственного проведения анализа. Этот метод забора крови позволяет быстро отдавать пробу крови для ТЭГ-анализа сразу после смешивания в коммерчески доступной пробирке, причем, для проведения ТЭГ-анализа не требуется добавления антикоагулянтов или рекальцификации. 330 мкл-аликвоту крови из простой пробирки (1) переносили непосредственно в ТЭГ-чашку и добавляли 10 мкл (1,41 мкг) PtPA (2), а затем сразу начинали анализ.
Все ТЭГ-анализы проводили в дубликатах. ТЭГ-параметры (среднее из проб, взятых в дубликате) представлены ниже в таблице 26.
Результаты ТЭГ для крови, взятой у здорового участника эксперимента, в различных пробирках
ТЭГ-параметры, указанные в таблице 26, представлены на ТЭГ-графике на фигуре 38, где: кривая A соответствует простой пластиковой пробирке (1); кривая В соответствует простой пробирке, в которую был добавлен PtPA (2); кривая С соответствует пробирке Greiner для сыворотки (3); кривая D соответствует пробирке BD для сыворотки (4); кривая Е соответствует пробирке Sarstedt для сыворотки (5); кривая F соответствует пробирке Terumo RT (6); а кривая G соответствует пробирке Terumo для сыворотки (7).
Проба крови в пробирке с PtPA (2) свертывалась очень быстро (R-время = 0,8 минут) в ТЭГ-чашке. Время R для коммерчески доступных пробирок (3)-(7) варьировалось от 3,0 минут для пробирки Greiner (3) до 13,4 минут для пробирки Terumo (7). Указанное время R сравнимо со временем R 14,3 минут для простой пробирки (1). Очевидно, что разница во времени R между коммерчески доступными пробирками объясняется присутствием различных прокоагулянтов и добавок, и/или различными количествами прокоагулянтов или добавок в этих пробирках.
Образование сгустков во всех пробирках наблюдалось также визуально. В коммерчески доступных пробирках, сгусток образовывался за стандартное время 30 минут. Пробы в пробирках с PtPA оставляли на 5 минут. Эти пробирки визуально оценивали на образование сгустка перед их загрузкой в центрифугу. Все пробирки центрифугировали при 3000 х g в течение 10 минут при 20°C. Пробы хранили при комнатной температуре, при ~21°C, в течение периода времени до 6 часов и оценивали через каждый час на латентное образование сгустка. Во всех пробирках, включая PtPA-содержащую пробирку, образовывались твердые сгустки, причем, в PtPA-содержащей пробирке, через 2 минуты образовывался твердый неподвижный сгусток. Какого-либо латентного свертывания не наблюдалось ни в одной из пробирок в течение 6 часов после сбора.
Этот пример показал, что введение небольшого количества PtPA приводит к более быстрому свертыванию по сравнению со свертыванием в любой из анализируемых коммерчески доступных пробирок, что указывает на возможность быстрого продуцирования сыворотки, которое, в свою очередь, позволяет сократить время до проведения анализа на аналиты в клинической лаборатории.
Пример 4d: Свертывание нормальной обработанной цитратом крови под действием PtPA, OsPA, экарина, а также в некоторых коммерчески доступных пробирках
Этот эксперимент проводили для сравнения действия трех активаторов протромбина: PtPA, OsPA и экарина, в трех обычно используемых коммерчески доступных пробирках для свертывания крови, а именно в пробирке Greiner для сыворотки, в пробирке BD SST II и в пробирке BD RST.
Кровь, взятую у здорового участника эксперимента, забирали в цитратсодержащую пробирку.
В ТЭГ-чашку добавляли 30 мкл активаторов протромбина (в ТЭГ-чашке, концентрация PtPA и OsPA составляла 0,56 нМ, а концентрация экарина составляла 5,3 нМ), 20 мкл 0,2 M CaCl2 и 290 мкл обработанной цитратом крови.
В коммерчески доступные пробирки для сыворотки добавляли 1 мл дистиллированной воды и оставляли на качалке приблизительно на 2 часа для смешивания до тех пор, пока содержимое пробирки не растворялось. Пробирка BD RST содержала 135 нМ коровьего тромбина (33,8 нМ/мл крови), а концентрация, используемая в этом эксперименте в ТЭГ-чашке, составляла 53 нМ/мл. В ТЭГ-чашку добавляли 45 мкл растворенного содержимого коммерчески доступных пробирок, 20 мкл 0,2 M CaCl2 и 275 мкл обработанной цитратом крови.
Результаты представлены в таблице 27.
ТЭГ-данные для PtPA, OsPA, экарина и для обычно используемых коммерчески доступных пробирок для сыворотки, содержащих нормальную кровь, взятую у здорового участника эксперимента
Полученные результаты продемонстрировали, что обычно используемые коммерчески доступные пробирки для сыворотки показали разное время, за которое происходило образование заметного сгустка, детектируемого с помощью ТЭГ (время R), причем это время составляло в пределах 0,5-6,4 минут для рекальцифицированной и обработанной цитратом крови, взятой у здорового участника эксперимента. Производителями этих пробирок было рекомендовано минимальное время свертывания, составляющее 30 минут до центрифугирования пробирок для сыворотки. Эти результаты также показали, что PtPA и OsPA в концентрации 0,5 нМ образовывали эквивалентный сгусток за время R <2 минут, что подтверждало, что они являются наиболее подходящими для анализа в качестве прокоагулянта, который может быть использован для быстрого получения сыворотки.
Пример 5: Свертывание проб цельной крови, содержащих антикоагулянты, под действием активаторов протромбина
Многие пробы крови брали у пациентов, подвергавшихся лечению антикоагулянтами, такими как гепарин, варфарин и цитрат. Кроме того, некоторые пробы крови брали в пробирки, содержащие антикоагулянты, такое как EDTA и цитрат; либо эти пробы были контаминированы антикоагулянтами во время забора крови. Следующие эксперименты проводили в целях исследования свертывания проб крови, содержащих антикоагулянты, под действием активаторов протромбина.
Пример 5a: Зависимость свертывания обработанной цитратом или EDTA крови, взятой у здорового участника эксперимента, от концентрации
Был проведен ТЭГ-анализ, в котором каждая смесь для ТЭГ-анализа состояла из 310 мкл крови, обработанной цитратом или EDTA, 20 мкл CaCl2 (0,2 M) и 10 мкл физиологического раствора или раствора активатора протромбина в различных концентрациях (маточные растворы - PtPA, 4,8 мг/мл или OsPA, 2,0 мг/мл). Результаты представлены на фигуре 39 и в таблицах 28 и 29 для PtPA, и в таблицах 30 и 31 для OsPA.
ТЭГ-результаты для свертывания нормальной обработанной цитратом крови под действием PtPA
ТЭГ-результаты для свертывания рекальцифицированной EDTA-обработанной крови под действием PtPA
ТЭГ-результаты для свертывания нормальной обработанной цитратом крови под действием OsPA
ТЭГ-результаты для свертывания рекальцифицированной EDTA-обработанной крови под действием OsPA
Время R для рекальцифицированной крови без добавления активатора протромбина составляло приблизительно 10 минут и снижалось до 1 минуты или 1,3 минут в присутствии 1,41 мкг/мл PtPA (таблицы 28 и 29). Скорость свертывания была высокой (угол = 54-72°) (от 0,0141 до 1,41), и были получены очень плотные сгустки с величинами MA 60-70 мм. Время R для свертывания рекальцифицированной крови, которое без добавления активатора протромбина составляло приблизительно 10 минут, снижалось до 0,8 минут в присутствии 0,59 мкг/мл OsPA (таблицы 30 и 31).
Очевидно, что очень короткое время R и большой угол α, наблюдаемые после добавления PtPA или OsPA, можно объяснить продуцированием очень большого количества тромбина, а последующие реакции (превращения фибриногена в фибрин, активации фактора XIII, перекрестного связывания мономеров фибрина) ограничены по своей скорости и дают сравнительно небольшое увеличение TMA.
ТЭГ-результаты, указанные в таблицах 28, 29, 30 и 31, представлены на фигуре 39, где ТЭГ-график на фигуре A соответствует результатам таблицы 28 (для обработанной цитратом крови и PtPA); ТЭГ-график на фигуре В соответствует результатам таблицы 29 (для EDTA-обработанной крови и PtPA); ТЭГ-график на фигуре С соответствует результатам таблицы 30 (для обработанной цитратом крови и OsPA), а ТЭГ-график на фигуре D соответствует результатам таблицы 31 (для EDTA-обработанной крови и OsPA).
На фигуре 39, кривые, обозначенные А на каждом ТЭГ-графике, соответствуют 14,1 мкг/мл для PtPA и 5,88 мкг/мл для OsPA; кривые, обозначенные B, соответствуют 1,41 мкг/мл для PtPA и 0,588 мкг/мл для OsPA; кривые, обозначенные C, соответствуют 0,141 мкг/мл для PtPA и 0,0588 мкг/мл для OsPA; кривые, обозначенные D, соответствуют 0,0141 мкг/мл для PtPA и 0,00588 мкг/мл для OsPA; кривые, обозначенные E, соответствуют 0,00141 мкг/мл для PtPA и 0,000588 мкг/мл для OsPA; а кривые, обозначенные F, соответствуют 0 мкг/мл PtPA или 0 мкг/мл OsPA.
В целом, PtPA и OsPA обладали высокой эффективностью в отношении свертывания рекальцифицированной крови, обработанной цитратом и EDTA, в зависимости от концентрации. Таким образом, практически, кровь, собранная в EDTA-содержащую пробирку, может быстро свертываться при добавлении PtPA или OsPA, в результате чего может быть получена сыворотка для биохимического и другого лабораторного анализа.
Пример 5b: Свертывание EDTA-содержащей плазмы и крови, взятой у здорового участника эксперимента
Как упоминалось выше в примере 3d, небольшой, но значимый процент проб (проб сыворотки или плазмы, обработанной литий-гепарином), полученных для биохимического анализа, был контаминирован EDTA. Поэтому важно определить, являются ли активаторы протромбина эффективными в отношении свертывания EDTA-содержащей плазмы и EDTA-содержащей цельной крови. Для этой цели был осуществлен эксперимент, где проводили сравнение EDTA-содержащей плазмы и EDTA-содержащей цельной крови.
Кровь брали у здорового пациента в EDTA-содержащую пробирку Greiner, включающую 1,8 мг/мл (6,2 ммоль) EDTA, добавленного до нужной отметки. При этой концентрации, EDTA обладал способностью связываться со всеми ионами металлов (включая Ca2+, Mg2+, Fe2+, Zn2+ и Cu2+), присутствующих в пробирке. Для получения EDTA-содержащей плазмы, часть каждой пробы центрифугировали в соответствии со стандартными протоколами.
Пробирка Clotek содержала 100 мкл EDTA-обработанной плазмы, 100 мкл трис-буфера (150 мМ трис-HCl, 150 мМ NaCl, pH 7,4), 50 мкл 0,2 M CaCl2 или трис-буфера и 50 мкл каждого прокоагулянта.
ТЭГ-чашка содержала 20 мкл 0,2 M CaCl2 или физиологического раствора, 60 мкл прокоагулянта и 260 мкл EDTA-обработанной крови.
Для проведения эксперимента в пробирках BD RST, содержимое двух пробирок растворяли в 1 и 4 мл дистиллированной воды соответственно, смешивали в течение 5 минут, и 60 мкл содержимого пробирки использовали в ТЭГ-чашке в качестве прокоагулянта.
Результаты исследования свертывания плазмы представлены в таблице 32 и в таблице 33.
Время свертывания EDTA-обработанной плазмы, взятой у здорового участника эксперимента, под действием различных прокоагулянтов (активаторов протромбина и тромбина) в различных концентрациях в присутствии кальция
Время свертывания EDTA-обработанной плазмы, взятой у здорового участника эксперимента, под действием различных прокоагулянтов (активаторов протромбина и тромбина) в различных концентрациях в отсутствие кальция
Результаты исследования по свертыванию плазмы в пробирках BD RST представлены в таблице 34.
Время свертывания в пробирках BD RST в присутствии и в отсутствие кальция
EDTA представляет собой агент, который образует хелатный комплекс с металлом, а в частности, с кальцием, и тем самым предупреждает процесс свертывания крови, обычно происходящий в природе.
Полученные результаты показали, что кальций-зависимые активаторы протромбина, а именно каринактиваза-1 (CA-1) и каринактиваза-2 (CA-1) не свертывают EDTA-обработанную плазму даже в концентрации 50 нМ за необходимое время < 5 минут, хотя они были способны к последующей рекальцификации плазмы. Эффект экарина был значимым: в отсутствие рекальцификации, время свертывания составляло более чем 5 минут. Добавление кальция в избыточном количестве приводило лишь к умеренному уменьшению времени свертывания под действием PtPA и OsPA (например, PtPA в концентрации 0,1 нМ, от 190 секунд до 98,6 секунд). Хотя в других описанных в настоящем документе примерах было высказано предположение, что нотекарин является менее эффективным прокоагулянтом, чем PtPA и OsPA, однако результаты показали, что он представляет собой активатор протромбина, на действие которого меньше всего влияет отсутствие кальция. Добавление кальция в избыточном количестве приводило к 3-кратному увеличению свертываемости плазмы под действием тромбина.
Результаты исследования свертывания цельной крови представлены в таблице 35.
ТЭГ-результаты, указывающие на влияние различных прокоагулянтов на EDTA-обработанную кровь в присутствии и в отсутствие кальция
Этот эксперимент показал, что при использовании EDTA-обработанной цельной крови вместе с прокоагулянтами возникают определенные проблемы. В отличие от EDTA-обработанной плазмы, ни один из прокоагулянтов не обладал способностью к свертыванию EDTA-обработанной крови в отсутствие рекальцификации. Свертывания крови не достигалось даже при очень высокой концентрации PtPA (690 нМ). Однако все прокоагулянты были способны свертывать EDTA-обработанную кровь в том случае, если она была рекальцифицированной. Быстрое и полное свертывание крови достигалось даже при очень низкой концентрации PtPA (1 нМ). EDTA представляет собой антикоагулянт, который обычно используют для сохранения клеточной морфологии, и EDTA, благодаря образования хелатного комплекса с кальцием, также предотвращает активацию и агрегацию тромбоцитов.
Было проведено два дополнительных эксперимента по свертыванию плазмы с использованием 30 нМ PtPA. В первом эксперименте, вместо трис-буфера, в пробирку Clotek добавляли воду, и проба в этой пробирке свертывалась за 6,4 секунды. Во втором эксперименте, буфер не использовали, а добавляли только 200 мкл EDTA плюс 50 мкл PtPA, и в этом случае, время свертывания составляло 5,4 секунды. В ТЭГ-исследовании, в ТЭГ-чашку добавляли нижеследующие растворы: 50 мкл трис-буфера, 60 мкл PtPA, 230 мкл EDTA-обработанной крови, и в этом случае, свертывания крови не наблюдалось. Кроме того, пробирку BD RST заполняли EDTA-обработанной кровью до нужной отметки, и через 60 минут наблюдалось лишь частичное свертывание крови. Результаты этих экспериментов показали, что в том случае, если присутствует EDTA, можно рассчитывать, что при добавлении кальция вместе с прокоагулянтом, будет происходить свертывание.
Пример 5c: Свертывание крови, взятой у участников эксперимента, подвергавшихся лечению варфарином
Было определено влияние PtPA и OsPA на свертывание проб крови, взятых у двух участников эксперимента («W1» и «W2»), подвергавшихся лечению варфарином.
Параметры свертывания крови, взятой у каждого участника эксперимента, были определены в соответствии со стандартными протоколами свертывания крови, и эти параметры представлены в таблице 36, где:
aPTT = активированное парциальное тромбопластиновое время;
PT = протромбиновое время;
INR = Международное нормализованное отношение; и
Fib-D = протромбиновое время, определяемое по уровню фибриногена.
Параметры свертывания крови, взятой у участников эксперимента, подвергавшихся терапии антикоагулянтами
Результаты, представленные в таблице 36, подтвердили, что кровь, взятая у участников Wl и W2, не свертывалась, как и предполагалось.
Затем проводили ТЭГ-анализ. Каждая смесь для ТЭГ-анализа состояла из 310 мкл обработанной цитратом крови, 20 мкл CaCl2 (0,2 M) и 10 мкл физиологического раствора или раствора активаторов протромбина (PtPA или OsPA) и, конечная тестируемая концентрация активаторов протромбина составляла от 0 до 14,1 мкг/мл.
Результаты ТЭГ-анализа представлены ниже в таблицах 37, 38 и 39. Представленные в таблицах величины получены из данных ТЭГ-анализа, как показано на фигурах 40 и 41.
ТЭГ-результаты для свертывания обработанной цитратом крови, взятой у участника W1, под действием OsPA
ТЭГ-результаты для свертывания обработанной цитратом крови, взятой у участника W1, под действием PtPA
ТЭГ-результаты для свертывания обработанной цитратом крови, взятой у участника W2, под действием PtPA
TEG-графики, построенные по данным, указанным в таблицах 37 и 38, проиллюстрированы на фигуре 40, где ТЭГ-график A построен по данным, представленным в таблице 37 (OsPA), а ТЭГ-график B построен по данным, представленным в таблице 38 (PtPA). На фигуре 40, на графике А, кривая, обозначенная (i), соответствует 5,88 мкг/мл OsPA; кривая, обозначенная (ii), соответствует 0,588 мкг/мл OsPA; кривая, обозначенная (iii), соответствует 0,0588 мкг/мл OsPA, а кривая, обозначенная (iv), соответствует 0 мкг/мл. На фигуре 40, на графике В, кривая, обозначенная (i), соответствует 14,1 мкг/мл PtPA, кривая, обозначенная (ii), соответствует 1,41 мкг/мл PtPA, кривая, обозначенная (iii), соответствует 0,0141 мкг/мл PtPA, а кривая, обозначенная (iv), соответствует 0 мкг/мл.
На фигуре 41, кривая, обозначенная (i), соответствует 14,1 мкг/мл PtPA; кривая, обозначенная (ii), соответствует 1,41 мкг/мл PtPA, кривая, обозначенная (iii), соответствует 0,0141 мкг/мл PtPA, а кривая, обозначенная (iv), соответствует 0 мкг/мл.
В целом, оба PtPA и OsPA в низких концентрациях способствуют быстрому свертыванию проб крови, взятых у участников эксперимента, подвергавшихся лечению варфарином, причем такие параметры, как время R, величины α и величины MA были аналогичны параметрам, наблюдаемым в сравнительных экспериментах для крови, взятой у здорового участника эксперимента (см. выше таблицы 28-31). Эти результаты подтвердили наблюдение для обработанной варфарином плазмы, как описано в примере 3c.
Пример 5d: Свертывание крови, взятой у участника эксперимента, которому была введена высокая доза гепарина, под действием PtPA и OsPA
Кровь брали у участника эксперимента («H1»), которому было введено 35000 МЕ гепарина за 30 минут до забора крови. Было определено, что концентрация гепарина составляла приблизительно 7 МЕ/мл крови. Кровь забирали стандартным шприцом, а затем переносили в пробирку с цитратом Greiner Vacuette™.
Результаты определения параметров свертывания крови у участника эксперимента представлены в таблице 40.
Параметры свертывания крови у участника эксперимента, которому был введен гепарин
В таблице 40 представлены все известные параметры свертывания, а именно: aPTT = активированное парциально тромбопластиновое время; PT = протромбиновое время; INR = международное нормалированное отношение; TT = тромбиновое время; PTNH = протаминсульфатное время; REPT = время восстановления; Fib-D = протромбиновое время, определяемое по уровню фибриногена.
Результаты, представленные в таблице 40, входят в интервал ожидаемых результатов для пробы с высоким содержанием гепарина.
Затем был проведен ТЭГ-анализ. Каждая смесь для ТЭГ-анализа состояла из 310 мкл обработанной цитратом крови, 20 мкл CaCl2 (0,2 M) и 10 мкл физиологического раствора или раствора активаторов протромбина (РА).
Результаты ТЭГ-анализа представлены ниже в таблице 41 и на фигуре 42.
Результаты ТЭГ-анализа на свертывание крови, взятой у участника эксперимента, которому были введены очень высокие дозы гепарина
В представленной выше таблице 41, «n.c.» означает отсутствие свертывания.
Результаты проведения ТЭГ-анализа, представленные в таблице 41, проиллюстрированы на фигуре 42, где кривая, обозначенная A, соответствует результатам, полученным в отсутствие активатора протромбина; кривая, обозначенная B, соответствует 14,1 мкг/мл PtPA, а кривая, обозначенная C, соответствует 5,9 мкг/мл OsPA.
PtPA и OsPA, при всех тестируемых концентрациях, обладали способностью быстро свертывать обработанную цитратом кровь, взятую у участника эксперимента, которому был введен гепарин. Величины ТЭГ-параметров (время R, TMA, угол, MA) были сравнимы с величинами, полученными для крови, взятой у здорового участника эксперимента, что указывало на то, что активность активаторов протромбина не ингибировалась гепарином, присутствующим в пробе крови в определенной концентрации.
Пример 5e: Свертывание крови, взятой у участника эксперимента, которому была введена предельная доза гепарина, в PtPA-содержащей пробирке и в пробирке BD RST.
10 мл пробы крови брали у участника эксперимента, которому была проведена операция на сердце, и которому было введено 38000 МЕ гепарина за 30 минут до взятия пробы крови. Эту кровь забирали стандартным шприцом, и через 10 минут отдавали в лабораторию для анализа.
Пробирку BD RST заполняли до нужной отметки, переворачивали/смешивали в течение 30 секунд, и 340 мкл этой крови переносили в ТЭГ-чашку в канал 1.
330 мкл пробы крови, взятой у участника эксперимента, которому вводили первоначальную дозу гепарина, добавляли к 10 мкл PtPA (конечная концентрация 1,41 мкг/мл) в ТЭГ-чашку в канал 2.
Результаты ТЭГ-анализа представлены в таблице 42 и на фигуре 43.
Результаты ТЭГ-анализа гепаринизированной крови в пробирке BD RST с PtPA
Для пробирки BD RST, время R составляло 6,2 минуты с максимальной амплитудой (MA) 11,5 мм, что указывало на лишь частичное свертывание. Плотность этого сгустка больше не увеличивалась в течение всего 2-часового анализа.
Для PtPA, время R составляло 0,7 минут, максимальная амплитуда (MA) составляла 43,8 мм, а время до достижения максимальной амплитуды составляло 9,8 минут, что указывало на быстрое образование плотного и стабильного сгустка.
Результаты, представленные в таблице 42, также указаны на фигуре 43 в виде ТЕГ-графика, где кривая «A» представляет собой кривую для ТЭГ-чашки в канале 2 (PtPA), а кривая «В» представляет собой кривую для ТЭГ-чашки в канале 1 (пробирка BD RST).
Также проводили визуальный мониторинг свертывания крови забранной стандартным шприцом, и крови в пробирке BD RST. В стандартном шприце, свертывания крови не наблюдалось в течение периода времени вплоть до 2 дней. Кровь в пробирке BD RST обнаруживала частичное свертывание в течение 30 минут, а полное свертывание происходило за 24 часа.
В целом, проба с высоким содержанием гепарина быстро и полностью свертывалась в пробирке, содержащей PtPA, но очень медленно и не полностью свертывалась в пробирке BD RST.
Пример 5f: Свертывание гепаринсодержащих проб крови под действием активаторов протромбина
Способность активаторов протромбина змеиного яда к свертыванию крови, взятой у здорового участника эксперимента в пробирку Greiner, включающую литий-гепарин (18 МЕ гепарина на мл крови), определяли с помощью ТЭГ-анализа, результаты которого представлены в таблице 43. Цитратную пробу брали для сравнения величин MA.
ТЭГ-результаты для крови, взятой у здорового участника эксперимента и собранной в пробирку Greiner с литий-гепарином
Результаты этого эксперимента для цельной крови с литий-гепарином показали, что некоторые прокоагулянты обладали способностью свертывать гепаринизированную кровь при более низких концентрациях, а другие прокоагулянты были неспособны свертывать кровь даже при самых высоких концентрациях, тестируемых в этом эксперименте. Результаты показали, что прокоагулянты группы С (PtPA и OsPA) наиболее эффективно свертывали кровь, собранную в пробирки Greiner с литий-гепарином, причем, для достижения времени R в 5 минут требовались концентрации OsPA и PtPA ≥ 9 нМ. Эти концентрации были значимо ниже, чем концентрации, необходимые для достижения MA (~61) в рекальцифицированной цитратной крови. Не ограничиваясь какой-либо конкретной теорией, следует отметить, что комплекс ATIII-гепарин, очевидно, ингибирует образование тромбина, а следовательно, предотвращает образование обычного или более плотного сгустка. Минимальные концентрации, необходимые для других активаторов протромбина, составляют >56 нМ для экарина и каринактивазы-1, >100 нМ для каринактивазы-1 и >32 нМ для нотекарина. Тромбин в концентрациях 6 и 25 нМ в пробирках BDRST вообще не свертывал кровь.
И в этом случае, не ограничиваясь какой-либо конкретной теорией, следует отметить, что, по всей вероятности, активаторы протромбина группы С (OsPA и PtPA) продуцируют значительно большее количество тромбина в течение более продолжительного периода времени с избыточным продуцированием комплекса ATIII-гепарин, который ингибирует тромбин и FXa, а следовательно, и процесс свертывания.
Пример 5g: Свертывание нормальной «объединенной» и обработанной цитратом плазмы с добавлением различных концентраций гепарина
Этот эксперимент осуществляли для определения концентраций различных активаторов протромбина, необходимых для свертывания плазмы при добавлении гепарина в различных концентрациях в целях имитации уровней гепарина, которые могут быть обнаружены в плазме пациентов, которым был введен гепарин.
Нормальная «объединенная» и обработанная цитратом плазма имела общую концентрацию кальция, доведенную до 2,71 ммоль/л, а затем в эту плазму добавляли аликвоты гепарина до конечных концентраций гепарина в пробирке Clotek, которые составляли 0,8, 2,0, 10 и 20 МЕ/мл, и которые могут встречаться в пробах крови пациентов. Кроме того, 1 мл-аликвоты обработанной цитратом плазмы распределяли по пробиркам Greiner с литий-гепарином, а затем смешивали на шейкере в течение 15 минут до тех пор, пока концентрация литий-гепарина не составляла 90 МЕ/мл. Пробирка Clotek содержала 100 мкл плазмы с натрий- или литий-гепарином, 100 мкл трис-буфера (150 мМ трис-HCl, 150 мМ NaCl, pH 7,4) и 50 мкл каждого прокоагулянта.
Результаты эксперимента по свертыванию проб гепаринсодержащей плазмы под действием каждого активатора протромбина представлены в таблицах 44-49, а результаты для тромбина представлены в таблице 50.
PtPA-индуцированное свертывание нормальной «объединенной» и обработанной цитратом плазмы, в которую был добавлен гепарин, или которая была распределена по пробиркам Greiner с литий-гепарином
OsPA-индуцированное свертывание нормальной «объединенной» и обработанной цитратом плазмы, в которую был добавлен гепарин, или которая была распределена по пробиркам Greiner с литий-гепарином
(МЕ/мл)
Индуцированное нотекарином свертывание нормальной «объединенной» и обработанной цитратом плазмы, в которую был добавлен гепарин, или которая была распределена по пробиркам Greiner с литий-гепарином
(МЕ/мл)
Индуцированное экарином свертывание нормальной «объединенной» и обработанной цитратом плазмы, в которую был добавлен гепарин, или которая была распределена по пробиркам Greiner с литий-гепарином
(МЕ/мл)
Индуцированное каринактивазой-1 свертывание нормальной «объединенной» и обработанной цитратом плазмы, в которую был добавлен гепарин, или которая была распределена по пробиркам Greiner с литий-гепарином
(МЕ/мл)
Индуцированное каринактивазой-2 свертывание нормальной «объединенной» и обработанной цитратом плазмы, в которую был добавлен гепарин, или которая была распределена по пробиркам Greiner с литий-гепарином
(МЕ/мл)
Индуцированное тромбином свертывание нормальной «объединенной» и обработанной цитратом плазмы, в которую был добавлен гепарин, или которая была распределена по пробиркам Greiner с литий-гепарином
Как показано в описанном выше эксперименте (пример 5f), присутствие гепарина (и ингибирование тромбина под действием комплекса ATIII-гепарин) создает значительные препятствия для частичного или полного свертывания крови под действием прокоагулянтов. Результаты этого эксперимента указывают на относительную эффективность прокоагулянтов в свертывании гепаринизованной плазмы.
Эти результаты показали, что PtPA и OsPA являются наиболее эффективными активаторами протромбина в отношении предотвращения антикоагулирующего действия комплекса ATIII-гепарин. Для свертывания плазмы, содержащей очень высокие концентрации гепарина, которые могут присутствовать в пробах пациента, требуются очень низкие концентрации PtPA (12-20 нМ). Интересным фактом является то, что PtPA является единственным активатором протромбина, который эффективно свертывает гепаринизованную плазму, содержащуюся в пробирке Greiner с литий-гепарином, за время <5 минут и почти при минимальной концентрации PtPA 12 нМ, даже когда концентрация гепарина составляла 90 МЕ/мл по сравнению с пробой, содержащей 20 МЕ/мл гепарина. Вполне возможно, что действие PtPA лишь усиливается поверхностно-активным веществом, присутствующим в пробирке Greiner с литий-гепарином. Для свертывания плазмы, содержащей 20 МЕ гепарина, требуется концентрация OsPA >36 нМ и концентрация экарина >60 нМ, и оба этих активатора были неспособны свертывать гепаринизованную плазму в пробирке Greiner с литий-гепарином за <5 минут соответственно. Каринактиваза-2 и нотекарин были неспособны свертывать плазму, содержащую ≥ 10 МЕ гепарина, а каринактиваза-1 неспособна свертывать плазму, содержащую >0,8 МЕ гепарина за необходимое время <5 минут, даже если их концентрация составляла 120 нМ. Исследования тромбина показали, что тромбин был способен свертывать пробу с наименьшей концентрацией гепарина 0,8 МЕ/мл только, когда его концентрация составляла 100 нМ. А поэтому кажется маловероятным, что в пробирке BD RST со 135 нМ тромбина, пробы, содержащие >2 МЕ/мл гепарина будут свертываться за требуемое время в 5 минут.
Пример 5h: Свертывание плазмы с литий-гепарином, взятой у здорового участника эксперимента
Пробы, собранные в пробирки Greiner с литий-гепарином, вероятно, представляют собой пробы с наиболее высоким содержанием гепарина, которые могут быть получены в лаборатории, а особенно, если эти пробирки не заполнены до рекомендованного объема. Целью этого эксперимента является получение руководства по минимальной концентрации прокоагулянтов, необходимой для свертывания всех других проб, которые могут быть получены от пациентов, которым был введен антикоагулянт гепарин, и для получения сыворотки высокого качества.
Пробирки Greiner с литий-гепарином заполняли до рекомендованной отметки, что позволяло получить концентрацию гепарина 18 МЕ/мл. Пробирки Clotek содержали 100 мкл плазмы с литий-гепарином, 100 мкл трис-буфера (150 мМ трис-HC1, 150 мМ NaCl, pH 7,4) и 50 мкл каждого прокоагулянта. ТЭГ-чашки содержали 60 мкл прокоагулянта и 260 мкл крови участника эксперимента, собранной в пробирку Greiner с литий-гепарином.
В две пробирки BD RST добавляли деионизованную воду (BDRST1 - 1 мл; BDRST2 - 4 мл), и эти пробирки оставляли в шейкере на 30 минут для смешивания до растворения тромбина, после чего содержимое пробирок использовали, как и в случае других прокоагулянтов.
Результаты экспериментов по свертыванию плазмы с литий-гепарином под действием каждого прокоагулянта представлены в таблице 51.
Исследование по свертыванию плазмы с литий-гепарином, собранной в пробирки Greiner с литий-гепарином
Этот эксперимент проводили для оценки эффективности прокоагулянтов в отношении свертывания гепаринизованной плазмы в пробирках для забора крови. Было обнаружено, что для свертывания крови за <5 минут, минимальные концентрации для экарина и каринактивазы-2 должны составлять в пределах от 12 до 36 нМ, для каринактивазы-1 - >120 нМ, а для нотекарина - от 4 до 12 нМ. Для тромбина необходима концентрация >120 нМ. Пробирка BD RST была протестирована также при 7,7 и 27 нМ тромбина, и обе эти концентрации обеспечивали свертывание крови за время >5 минут, что позволяет предположить, что BDRST может оказаться неэффективной для свертывания проб, взятых у пациентов, которым вводили высокие дозы гепарина. Эти результаты показали, что активаторы протромбина группы С (PtPA и OsPA) были бесспорно наиболее эффективными в свертывании плазмы с литий-гепарином, полученной из крови здорового участника эксперимента, собранной в пробирки Greiner с литий-гепарином; причем для свертывания за <5 минут, требуемая концентрация для PtPA составляла 0,1-1 нМ, а для OsPA, она составляла 1-4 нМ соответственно.
Пример 5i: Свертывание крови и плазмы, взятых у пациента после операции на сердце, которому была введена наивысшая доза гепарина
Наивысшую концентрацию гепарина вводят внутривенно при проведении сложных хирургических операций, таких как операция на сердце. Если пробы собирают для биохимического анализа в период времени, когда достигается максимальная гепаринизация, то результаты должны быть получены, по возможности, за наиболее короткое время. Если используется сыворотка, то необходимо, чтобы ее свертывание под действием прокоагулянта было завершено ко времени доставки этой пробы сыворотки в лабораторию, то есть за < 10 минут.
Гепарин, который вводят пациентам, представляет собой натрий-гепарин, а в пробирках или в шприцах для забора крови присутствует литий-гепарин. Максимальное количество гепарина, вводимое таким пациентам, составляет ~45000 МЕ. Эти пациенты были также подвергнуты гемодилюции (то есть объем плазмы крови был увеличен до ~ 4 л), что давало концентрацию гепарина ~ 10 МЕ на мл плазмы.
Этот эксперимент проводили для того, чтобы определить, может ли прокоагулянт в выбранных концентрациях свертывать кровь, взятую у пациента, которому была сделана операция на сердце и которому была введена «наивысшая» доза гепарина, и для получения сыворотки высокого качества. Участнику эксперимента вводили 37000 МЕ гепарина, и приблизительно через 30 минут после вливания гепарина брали пробу, соответствующую ~ 9,3 МЕ гепарина на 1 мл плазмы. Часть пробы крови центрифугировали с получением плазмы.
Для проведения эксперимента по свертыванию плазмы брали пробирку Clotek, содержащую 100 мкл плазмы, взятой у пациента после операции на сердце, 100 мкл трис-буфера (150 мМ трис-HC1, 150 мМ NaCl, pH 7,4) и 50 мкл каждого прокоагулянта.
Для проведения эксперимента по свертыванию цельной крови использовали ТЭГ-чашку, содержащую 60 мкл прокоагулянта и 260 мкл крови, взятой у участника эксперимента. Полностью гепаринизованная кровь сама не свертывается.
Для проведения эксперимента в пробирках BD RST-1, содержимое двух пробирок BDRST растворяли в 1 и 4 мл дистиллированной воды соответственно, и 60 мкл раствора использовали в ТЭГ-чашке в качестве прокоагулянта.
Для проведения эксперимента в пробирках BDRST-2, эти пробирки заполняли 1 и 4 мл крови соответственно, а затем пробирки 10 раз переворачивали (~ 30 секунд) и 340 мкл крови переносили в ТЭГ-чашку.
Результаты эксперимента по свертыванию плазмы пациента под действием каждого прокоагулянта представлены в таблице 52, а результаты для цельной крови представлены в таблице 53.
Время свертывания плазмы в секундах, взятой у «полностью гепаринизованного» пациента после операции на сердце, под действием различных активаторов протромбина, тромбина и содержимого пробирок BD RST в различных концентрациях
В результате этого эксперимента были определены концентрации каждого прокоагулянта, которые необходимы для свертывания плазмы за требуемое время <5 минут. Максимальная концентрация активатора, необходимая для свертывания за период приблизительно 5 минут, составляет 4 нМ для PtPA, 1-3 нМ для OsPA, 3 нМ для нотекарина, >12 нМ для каринактивазы-2, >36 нМ для экарина, >60 нМ для каринактивазы-1 и >120 нМ для тромбина. Интересно отметить, что эффективность нотекарина сравнима с эффективностью активаторов группы C.
Результаты ТЭГ-исследования по свертыванию крови, взятой у пациента после операции на сердце, которому была введена «очень высокая доза гепарина», под действием различных прокоагулянтов
Концентрации различных активаторов протромбина, необходимые для достижения времени R <5 минут и для достижения максимальной плотности сгустка, составляли: 6 нМ для PtPA, 2,3 нМ для OsPA, 3-11 нМ для нотекарина, 11-34 нМ для экарина, 11-34 нМ для каринактивазы-2 и 57-112 нМ для каринактивазы-1.
Неожиданно было обнаружено, что нотекарин образовывал сгустки при более высоких значениях MA, чем активаторы протромбина группы А и В, и не ограничиваясь какой-либо теорией, можно лишь отметить, что добавление таких активаторов в кровь указанных пациентов может повышать эффективность свертывания.
Наиболее плотные сгустки, как показала MA, наблюдались в присутствии PtPA и OsPA, а наиболее рыхлые сгустки наблюдались в присутствии таких активаторов протромбина, как каринактиваза-1 и каринактиваза-2.
Тромбин в пробирках BD RST (эксперимент с использованием пробирки BDRST-2 с 135 нМ тромбина) продуцировал неполное свертывание и давал рыхлые сгустки, на что указывала MA. В этих пробах, по всей вероятности, происходило латентное свертывание сыворотки после центрифугирования.
Пример 5i: Свертывание нормальной «объединенной» и обработанной цитратом плазмы, в которую был добавлен ривароксабан
Этот эксперимент проводили для определения влияния одного из новых ингибиторов фактора Xa, используемых в качестве антикоагулянтов, а именно ривароксабана, на способность прокоагулянтов к свертыванию крови.
Одну таблетку ривароксабана (10 мг, молекулярная масса 435, Xarelto, Bayer Schering Pharm, Germany) измельчали в 5 мл деионизованной воды (2 мг/мл) и оставляли на 30 минут для перемешивания, после чего центрифугировали для удаления нерастворившихся частиц. Обычная суточная терапевтическая доза составляла 10-40 мг. Для индивидуума весом 70 кг (~3000 мл плазмы), общее количество плазмы составляло 0,14-0,57 мг/кг (0,0033-0,013 мг/мл). Полученные концентрации, тестируемые в пробирке Clotek, составляли: 0,0033, 0,0083, 0,017, 0,033 и 0,17 мг/мл.
Пробирки Clotek содержали 50 мкл трис-буфера (150 мМ трис- HC1, 150 мМ NaCl, pH 7,4), 50 мкл 0,2 мМ CaCl2, 100 мкл нормальной «объединенной» и обработанной цитратом плазмы, 50 мкл трис-буфера или антикоагулянта в различных концентрациях, и 50 мкл активатора протромбина (30 нМ).
Время свертывания представлено в таблице 54.
Время свертывания (секунды) нормальной «объединенной» и обработанной цитратом плазмы, в которую был добавлен ривароксабан
Полученные результаты показали, что ривароксабан оказывал минимальное действие на прокоагулянты в терапевтической концентрации в пределах 0,0033-0,013 мг/мл плазмы, которые могут встречаться у пациентов. Однако при более высоких концентрациях, ривароксабан оказывал значительное ингибирующее действие на свертывание в присутствии каждого из прокоагулянтов. Такой эффект может быть обусловлен ингибированием фактора Xa, продуцируемого из человеческого FX в плазме под действием тромбина, генерируемого прокоагулянтами.
Пример 5k: Свертывание крови, взятой у пациента, которому проводили антикоагулянтную терапию цитратом
В предшествующих экспериментах было показано, что активаторы протромбина способны свертывать обработанную цитратом кровь, собранную в цитратсодержащие пробирки Greiner. Целью этого эксперимента является подтверждение того, что введение цитрата in vivo не оказывает негативного действия на свертывание крови под действием активаторов протромбина.
В этом примере, пациенту вводили 3,0 ммоль цитрата на литр крови. Кровь забирали в стандартный 50 мл-шприщ (BD Plastipak #300866) для рутинного лабораторного анализа, из которого <3 мл оставляли для проведения очень ограниченного исследования только PtPA.
Были получены следующие величины параметров свертывания крови: PT 13 сек (RR 9-13), INR 1,3, APTT 45 сек (RR 24-39), фибриноген (продукт превращения) 7,2 г/л (RR 1,7-4,5), которые подтверждали отсутствие свертывания крови.
ТЭГ-чашка содержала 20 мкл 0,2 M CaCl2 или физиологического раствора, 5 PtPA и 320 мкл цитратной крови.
Результаты эксперимента представлены в таблице 55.
Результаты ТЭГ для участника эксперимента, которому был введен антикоагулянт цитрат
Полученные результаты показали, что концентрация цитрата, используемая для антикоагулянтной терапии пациентов, не создает проблем со свертыванием крови при использовании PtPA в качестве прокоагулянта в рекальцифицированной и не-рекальцифицированной крови. Концентрация цитрата в крови, собранной в пробирки Greiner с цитратом, составляла 3,2% или 109 мМ, и эта концентрация приблизительно в 36 раз превышала концентрацию цитрата, которую получал пациент. Кроме того, в этом случае каких-либо проблем со свертыванием крови не ожидалось, поскольку пациенты, которым вводили цитрат, находились под непрерывным наблюдением по поводу уровней ионизовнного кальция, который пополнялся по мере необходимости. Время R в нормальной «объединенной» и обработанной цитратом крови составляло 6,4 минут (как показано в таблице 43), в отличие от времени R и у этого пациента, которое составляло 4,8 минут. Рекальцификация приводит к тому, что содержание кальция начинает превышать необходимый уровень, а поэтому, теоретически, она не должна вносить какие-либо изменения. Таким образом, очевидно, что указанное различие обусловлено более высокими концентрациями факторов свертывания, включая фибриноген, которые составляют 7,2 г/л.
Пример 6: Свертывание проб цельной крови, взятых у участников эксперимента, у которых наблюдались пролонгированные профили свертывания крови или низкое число тромбоцитов
У некоторых пациентов наблюдались параметры продолжительного свертывания крови и/или пониженное число тромбоцитов, что было результатом медикаментозного лечения или вызвано генетическими факторами (например, гемофилией). Были проведены последующие эксперименты для того, чтобы определить, могут ли PtPA или OsPA быстро свертывать пробы крови у таких пациентов.
Пример 6a: Участники эксперимента с продолжительным временем свертывания крови
Кровь, взятую у 4 участников эксперимента («A», «В», «С» и «D») с продолжительным aPTT, которое указывало на нарушение природного пути метаболизма, получали из больницы принцессы Александры (Pathology Queensland, Princess Alexandra Hospital, Queensland, Australia). Были определены параметры свертывания для каждого участника эксперимента, и эти параметры представлены в таблице 56.
Параметры свертывания* для каждого участника эксперимента
Был проведен ТЭГ-анализ. Каждая смесь для ТЭГ-анализа состояла из 310 мкл цитратной крови, полученной из проб, взятых у участников A-D, 20 мкл CaCl2 (0,2 M) и 10 мкл физиологического раствора или PtPA (в конечной концентрации 1,41 мкг/мл). CaCl2 добавляли на время 0 для инициации свертывания.
ТЭГ-кривые для четырех проб представлены на фигуре 44, а параметры ТЭГ для этих кривых представлены в таблице 57.
ТЭГ-результаты для свертывания проб крови, взятых у участников эксперимента с аномальными параметрами свертывания
TEG-графики, построенные для четырех проб, представлены на фигуре 44, где ТЭГ-график A соответствует участнику А, и на этом графике, две кривых, обозначенных (i), соответствуют контролю, то есть физиологическому раствору, в который был добавлен кальций, а две кривых, обозначенных (ii), соответствуют пробам с PtPA. ТЭГ-график В соответствует участнику В, и на этом графике, две кривых, обозначенных (i), соответствуют контролю, то есть физиологическому раствору, в который был добавлен кальций, а две кривых, обозначенных (ii), соответствуют пробам с PtPA. ТЭГ-график С соответствует участнику С, и на этом графике, кривая, обозначенная (i), соответствуют контролю, то есть физиологическому раствору, а четыре кривых, обозначенных (ii), соответствуют пробам с PtPA. ТЭГ-график D соответствует участнику D, и на этом графике, две кривых, обозначенных (i), соответствуют контролю, то есть физиологическому раствору, а две кривых, обозначенных (ii), соответствуют пробам с PtPA. Для пациента С такие измерения проводили с тремя повторностями, что обусловлено в высокой степени аномальными параметрами свертывания. Данные, приведенные в таблице 57, представляют собой усредненные ТЭГ-данные.
В целом, в пробах крови, взятых у участников A-D, время aPTT составляет в пределах от 44 до >200 секунд, что указывает на нарушение природного каскада реакции свертывания крови. В пробах без PtPA, свертывания не наблюдалось, либо оно было очень слабым. Во всех случаях, PtPA (1,41 мкг/мл) вызывал быстрое свертывание, время которого снижалось до 1-2 минут. Таким образом, PtPA является эффективным в отношении быстрого свертывания крови у пациентов с нарушением каскада реакций свертывания крови.
Пример 6b: Участники эксперимента с низким числом тромбоцитов
У участников с низким числом тромбоцитов, время свертывания было значительно выше, чем время свертывания крови у здоровых индивидуумов. Это обусловлено тем, что тромбоциты имеют фосфолипидную поверхность, на которой образуется протромбиназный комплекс, способствующий ускорению свертывания крови.
Пробы крови, взятые у четырех участников с низким числом тромбоцитов («E», «F», «G» и «H»), получали из больницы принцессы Александры, Queensland, Австралия. Параметры свертывания, определенные для каждого участника эксперимента, представлены в таблице 58, и эти параметры подтверждали низкое число тромбоцитов у этих участников.
Параметры свертывания крови для каждого участника
Был проведен ТЭГ-анализ. Каждая смесь для ТЭГ-анализа состояла из 310 мкл цитратной крови, полученной из проб, взятых у участников Е-Н, 20 мкл CaCl2 (0,2 M) и 10 мкл физиологического раствора или раствора активатора протромбина (либо PtPA в конечной концентрации 1,41 мкг/мл или 14,1 мкг/мл, либо OsPA в конечной концентрации 0,59 мкг/мл или 5,9 мкг/мл).
ТЭГ-кривые представлены на фигуре 45, а параметры ТЭГ представлены в таблицах 59 и 60.
ТЭГ-результаты для PtPA-индуцированного свертывания проб крови, взятых у участников эксперимента с низким числом тромбоцитов
ТЭГ-результаты для OsPA-индуцированного свертывания проб крови, взятых у участников эксперимента с низким числом тромбоцитов
TEG-графики представлены на фигуре 45, где график A соответствует результатам, полученным для участника Е, график В соответствует результатам, полученным для участника F; график С соответствует результатам, полученным для участника G, а график D соответствует результатам, полученным для участника Н. На каждом графике, кривая, обозначенная (i), соответствует данным, полученным в отсутствие PtPA или OsPA; кривая, обозначенная (ii), соответствует 14,1 мкг/мл PtPA; кривая, обозначенная (iii), соответствует 1,41 мкг/мл PtPA; кривая, обозначенная (iv), соответствует 5,88 мкг/мл OsPA, а синяя кривая соответствует 0,588 мкг/мл OsPA.
В целом, оба PtPA и OsPA быстро свертывали кровь, взятую у участников с низким числом тромбоцитов, в результате чего образовывались сгустки высокой плотности.
Пример 7: Сравнение активностей свертывания под действием яда, содержащего активаторы протромбина
Пять свежеразведенных ядов, выделенных у змей Pseudonaja textilis (Pt), Oxyuranus scutellatus (Os), Oxyuranus microlepidotus (Om), Notchis scutatus (Ns), и Echis carinatus (Ec), разводили в дистиллированной воде с получением маточного раствора в концентрации 50 мг/мл. Затем маточный раствор снова разводили с получением рабочего раствора в концентрации 6 мг/мл, и измеряли его активность в отношении свертывания рекальцифицированной цитратной плазмы. Яды, взятые в дубликатах для каждой концентрации в данном анализе, серийно разводили от 2 мг/мл до 500 пг/мл. Результаты представляли собой среднее для двух измерений. Смесь для анализа состояла из 100 мкл 0,02 M буфера Hepes, pH 7,4, в который было добавлено 10 мМ кальция плюс 100 мкл цитратной плазмы, и время свертывания (в секундах) измеряли начиная со времени добавления разведения яда.
Результаты представлены в таблице 61 и на фигуре 46.
Время свертывания крови под действием змеиных ядов, содержащих активаторы протромбина в различных концентрациях
Как видно из таблицы 61 и фигуры 46, все пять ядов в концентрации 500 пг/мл очень эффективно свертывали рекальцифицированную цитратную плазму. Яды, содержащие активатор протромбина группы C (Pt, Os и Om) в концентрации 500 пг/мл, были наиболее активны в свертывании крови, которое достигалось менее чем за 50 секунд.
Пример 8: Осаждение и лантентное свертывание проб плазмы и сыворотки, полученных с использованием коммерчески доступных пробирок или PtPA-содержащих пробирок, и оценка влияния на тропонин I
Как обсуждалось в предшествующих разделах настоящего описания, при использовании коммерчески доступных пробирок для сыворотки и плазмы, специалисты сталкиваются с рядом проблем, таких как латентное свертывание или отсутствие свертывания (в пробирках для сыворотки), образование микросгустков и фибриногеновых нитей (в пробирках для сыворотки или плазмы), осаждение белков и утечка клеточного материала (в пробирках для сыворотки или плазмы). Для того, чтобы определить, будут ли возникать некоторые из указанных проблем в случае использования пробирки, содержащей активатор протромбина, пробы крови в коммерчески доступных пробирках подвергали визуальному осмотру и сравнивали с пробами крови в PtPA-содержащих пробирках. Полученные результаты представлены на фигурах 47-49.
Пример 8a: Осаждение и латентное свертывание
На фигуре 47 представлены результаты для плазмы, полученной из пробы крови, собранной в коммерчески доступную пробирку Greiner (с литий-гепарином). В этой пробирке отмечены четыре секции (на этой фигуре, сверху вниз): плазма; гелеобразный осадок; разделительный гель; клетки, осажденные центрифугированием. Гелеобразный осадок состоял из фибриногена и других белков плазмы, и образовывался при хранении пробирки при 2-8°C. Этот осадок может негативно влиять на работу устройства и на определение аналита. Такой осадок наблюдался приблизительно в ~5% проб плазмы с литий-гепарином.
На фигуре 48 представлены результаты получения сыворотки в трех коммерчески доступных пробирках для сыворотки: левая пробирка (GS) представляет собой пробирку Greiner для сыворотки; средняя пробирка (BDS) представляет собой пробирку BD для сыворотки; а правая пробирка (BDT) представляет собой пробирку BD RST. В этой пробирке отмечены четыре секции (на этой фигуре, сверху вниз): осажденные клетки; разделительный гель; латентное свертывание; сыворотка. Свертывание после центрифугирования (латентное свертывание) наблюдалось в супернатантах или в компоненте сыворотки во всех трех пробирках. Пробирки переворачивали для демонстрации наличия сгустков. Эти латентные сгустки могут негативно влиять на работу оборудования и на функциональные анализы.
Фигура 49 состоит из двух равных частей. Левая часть иллюстрирует результаты получения сыворотки из одной пробы крови, взятой у того же самого полностью «гепаринизированного» пациента, в трех коммерчески доступных пробирках (слева направо): в пробирке Greiner Vacuette™ для сыворотки (GS), в пробирке BD Vacutainer™ для сыворотки/SST II (BDS) и в пробирке BD RST (BDT), а также в пробирке Greiner 5 Vacuette™ без добавок, которая содержала PtPA. В этих пробирках отмечены три секции (на данной фигуре, сверху вниз): сыворотка; разделительный гель; осажденные клетки. Содержимое всех четырех пробирок, представленных на фигуре 49, центрифугировали, а затем оставляли на ночь, после чего, сыворотку из каждой пробирки переносили в пробирку из прозрачного стекла и фотографировали, как показано в правой части фигуры 49 (слева направо: пробирки GS, BDS, BDT и PtPA). Сыворотки во всех трех коммерчески доступных пробирках свертывались, на что указывало образование сгустка на стенках пробирок, а также наблюдались фибриновые нити, но, при этом, какого-либо явного осаждения в сыворотке в PtPA-содержащей пробирке не наблюдалось, а прозрачность этой пробирки значительно превышала прозрачность, наблюдаемую в пробирках с другими пробами.
Пример 8b: Уровни тропонина I
Было обнаружено, что по меньшей мере некоторые ложноположительные результаты, указывающие на повышение уровней тропонина I (одного из наиболее специфических показателей сердечных приступов), были обусловлены осаждением/латентным свертыванием проб сыворотки и плазмы.
Уровни тропонина I в пробах крови, взятых у 64 участников, измеряли с использованием проб сыворотки и плазмы, полученных в коммерчески доступных пробирках и в PtPA-содержащих пробирках.
Пробы сыворотки и плазмы получали из крови каждого участника в пяти коммерчески доступных пробирках: в пробирке для плазмы Greiner VacuetteТМ; в пробирке BD PST II; в пробирке для сыворотки Greiner VacuetteТМ; в пробирке BD SST II; и в пробирке BD RST, а также в пробирках Greiner Vacuette™ без добавок, но содержащих PtPA (1,2 мкг/4 мл), и эти пробы анализировали на тропонин I (TnI) с помощью анализа Beckman Coulter AccuTnI.
Для участников 18, 20, 38 и 63 были получены четыре отличающихся результата, указанные в таблице 62. Участниками 18 и 38 были здоровые индивидуумы, а участниками 20 и 63 были пациенты, которым была сделана операция на сердце, и которым был введен гепарин. Были получены три ложноположительных результата (для участников 18, 20 и 38). Повторное центрифугирование аликвоты, взятой из первой пробирки, и последующий повторный анализ дали, как и ожидалось, отрицательные результаты по сравнению с результатами, полученными для других пробирок с той же самой пробой крови. Дополнительный результат дал исключительно высокие значения (участник 63). Повторное центрифугирование аликвоты и повторный анализ дали результат, сравнимый с результатом, полученным для других пробирок.
Тот факт, что центрифугирование проб давало в высокой степени отличающиеся результаты, позволяет предположить, что такие отличающиеся результаты обусловлены латентным свертыванием/образованием осадка, дающими неточную выборку. В случае PtPA-содержащих пробирок для сыворотки, каких-либо отличающихся результатов получено не было.
Анализ на тропонин I, дающий отличающиеся результаты
(0,004)
(0,015)
(0,002)
(0,690)
(0,704)
(0,665)
(0,650)
(0,579)
(0,734)
В целом, осаждение и латентное свертывание, наблюдаемые в процессе получения проб плазмы и сыворотки в коммерчески доступных пробирках, создают значительные проблемы при определении аналита. Тогда как при получении пробы сыворотки с использованием PtPA, какого-либо осаждения или образования микросгустков не наблюдалось.
Пример 9: Уровни фибриногена, гидролизованного фибриногена и фибрина в пробах плазмы и сыворотки
Растворимый фибриноген, растворимый частично гидролизованный фибриноген (fdp) и неполимеризованный фибрин (FDP) представляют собой компоненты, присутствующие в пробах сыворотки и плазмы, которые являются нежелательными для определения аналита, как обсуждалось в предшествующих разделах настоящего описания. Вкратце, уровни фибриногена/fdp/FDP в пробах сыворотки высокого качества должны быть минимальными во избежание их последующего превращения в нерастворимый фибрин (микросгустки) в стандартных условиях получения сыворотки, особенно при хранении. Микросгустки или фибриновые нити могут негативно влиять на работу оборудования и на определение аналита. Для проб сыворотки, полученных стандартными методами, концентрация фибриногена/fdp/FDP в пробе, очевидно, зависит от уровня введения пациенту/индивидууму антикоагулянтов, от состояния здоровья пациента (например, от наличия заболевания печени), от типа контейнера для сбора проб и, в редких случаях, от неадекватного смешивания проб в пробирке. В этом примере, концентрация фибриногена/fdp/FDP в пробах сыворотки и плазмы, полученных в различных пробирках, была исследована в целях определения условий для получения пробы сыворотки «высокого качества».
Концентрации фибриногена/fdp/FDP в сыворотке и в плазме измеряли с помощью иммуноферментного сэндвич-анализа (ELISA), описанного ниже. В этом анализе использовали поликлональную антисыворотку против фибриногена, которая распознает растворимый фибриноген, fdp и FDP.
В ELISA-методе использовали антисыворотку против фибриногена (в виде очищенной IgG-фракции: AHFAS) и антисыворотку против фибриногена, конъюгированную с пероксидазой хрена (AHFAS-ПХ). Препараты каждой из этих сывороток закупали у MP Biochemical, USA. Фибриноген, соответствующий международному стандарту, закупали у NIBSC, London, и разводили из рабочего маточного раствора в концентрации 1 мг/мл в 50% глицерина/физиологического раствора.
Промывочный буфер состоял из 0,05 M фосфатного буфера, pH 7,4, 0,5 M NaCl, 0,05% твина 20 и 1% BSA, а связывающий буфер представляет собой 0,1 M бикарбонатный буфер, pH 9,6.
Рабочие разведения антител получали путем разведения маточных растворов AHFAS и AHFAS-ПХ 1:500 в связывающем буфере. Раствор субстрата ПХ состоял из 20 мМ тетраметилбензидина, 0,4 мл 30% H2O2 и 50 мкл 0,05 M цитратного буфера, pH 4,0, в 50 мл реакционного раствора.
96-луночные планшеты для ELISA-анализа Nunc IMMUNOSORB (Thermo Fisher Scientific, Rochester, NY) покрывали 100 мкл рабочего разведения AHFAS на лунку путем инкубирования планшетов с AHFAS при 4°C в течение ночи. Затем планшеты блокировали 100 мкл 2% альбумина бычьей сыворотки (Sigma Chemical, Co) в промывочном буфере при 4°C в течение ночи, а затем три раза промывали промывочным буфером.
Пробы крови, взятые у здоровых добровольцев и у пациентов (с болезнями сердца и почек), собирали в нижеследующие пробирки:
Пробирки Greiner для сыворотки (GS или GRS);
Пробирки BD для сыворотки (BDS);
Пробирки BD RST (BDT или BD RST);
Пробирки Greiner без добавок, в которые было добавлено 1,2 мкг PtPA, полученного из маточного раствора PtPA в концентрации 4,8 мг/мл (PtPA);
Пробирки Greiner без добавок, в которые было добавлено 0,5 мкг OsPA, полученного из маточного раствора OsPA в концентрации 2,0 мг/мл (OsPA);
Пробирки Greiner без добавок, в которые было добавлено 0,6 ед. экарина;
Пробирки Greiner без добавок, в которые было добавлено 1,2 ед. экарина;
Пробирки Greiner без добавок, в которые было добавлено 0,63 ед./4 мл экарина (пример 9b);
Пробирки Greiner без добавок, в которые было добавлено 1,25 ед./4 мл экарина (пример 9с);
Пробирки Greiner без добавок, в которые было добавлено 2,5 ед./4 мл экарина (пример 9с);
Пробирки Greiner Vacuette™ для плазмы (GRLH);
Пробирки BD Vacutainer™ для плазмы (PST II) (BDLH);
Цитратсодержащую пробирку Greiner Vacuette™ (3,2% цитрат) для плазмы (CIT); и
EDTA-содержащую пробирку Greiner Vacuette™ К2 (1,5-2,2 мг/мл EDTA) для плазмы (EDTA).
Пробы плазмы и сыворотки, полученные в каждой из вышеуказанных пробирок, получали в соответствии со стандартной процедурой получения пробы для анализа аналитов в больнице Pathology Queensland (Австралия), где кровь брали в каждую пробирку, а затем эту пробирку оставляли до проведения центрифугирования при 3000×g. Пробирки BD RST, а также PtPA-, OsPA- и экаринсодержащие пробирки оставляли на 5 минут, а все остальные пробирки оставляли на 30 минут, для обычной крови, и на 60 минут для крови, обработанной антикоагулянтами.
Из каждой пробирки брали 100 мкл-аликвоты проб плазмы или сыворотки (разведенных 1/1000 и 1/10 соответственно) с тремя повторностями. Серийные разведения фибриногенового стандарта (11 разведений в пределах концентраций 1000 нг/мл - 10 нг/мл) наносили в дубликатах. Планшеты инкубировали в течение ночи при 4°C.
Планшеты шесть раз промывали промывочным буфером для удаления несвязанных компонентов и инкубировали в течение ночи при 4°C со 100 мкл рабочего раствора AHFAS-ПХ на лунку. Затем планшеты снова 6 раз промывали промывочным буфером, после чего добавляли 100 мкл раствора субстрата ПХ на лунку.
Мониторинг развития синей окраски проводили в темноте до тех пор, пока оптическая плотность A450 нм не достигала значения 1,0 при концентрации фибриногена 1 мкг/мл. Затем реакцию прекращали добавлением 100 мкл 1,0 M раствора серной кислоты на лунку, в результате чего появлялась желкая окраска. После этого, планшеты считывали на A450 нм на планшет-ридере Thermo Scientific Multisk с помощью компьютерной программы Ascent.
Пример 9a: Уровни фибриногена/fdp/FDP в 48 пробах сыворотки, забранной у пациентов в пробирки Greiner для сыворотки (GS)
Концентрацию фибриногена/fdp/FDP измеряли описанным выше ELISA-методом в пробах сыворотки, взытых из пробирок Greiner для сыворотки (GS) и полученных от 48 произвольно выбранных пациентов, которые нуждались в детектировании аналитов в клинических условиях.
Результаты представлены на фигуре 50. Концентрация фибриногена/fdp/FDP в этих пробах составляла в пределах 4,4-32 мкг/мл, а концентрация фибриногена в этих пробах плазмы составляла 2,0-5,0 мг/мл. Эти данные показали, что 99% фибриногена или более было удалено в процессе свертывания крови в стандартных коммерчески доступных пробирках для сыворотки. Эти данные давали нормальный интервал уровней фибриногена в препарате сыворотки в пробирках Greiner для сыворотки, полученном из проб крови у госпитализированных пациентов.
Пример 9b: Уровни фибриногена/fdp/FDP в нормальных пробах сыворотки и плазмы
Для исследования влияния добавления PtPA (300 нг/мл или 1,2 мкг/4 мл-пробирку) на уровни фибриногена/fdp/FDP было отобрано 36 нормальных проб сыворотки (как было определено в анализе на протромбиновое время, aPTT и фибриноген). Сыворотку получали в пробирках Greiner для сыворотки (первые пробирки) в соответствии со стандартной процедурой Pathology Queensland, а затем, из каждой пробирки Greiner для сыворотки брали две равные 1 мл-аликвоты проб сыворотки и переносили в простые пластиковые пробирки (вторые пробирки). В одну из пробирок добавляли PtPA (300 нг/мл или 1,2 мкг/4 мл-пробирку), а в другую пробирку добавляли равный объем (50 мкл) физиологического раствора с получением соответствующей пары вторых пробирок.
Концентрацию фибриногена/fdp/FDP в каждой второй пробирке измеряли вышеописанным ELISA-методом, и полученные результаты были представлены на фигуре 51. В обеих вторых пробирках, уровень остаточного фибриногена снижался до уровня, составляющего менее 1% от всего уровня фибриногена, присутствующего в крови. Однако добавление PtPA приводило к дальнейшему снижению уровней фибриногена/fdp/FDP в среднем с 12,8 мкг/мл до 11,8 мкг/мл. В анализе, проводимом с использованием парного t-критерия, такое снижение было значимым (p<0,04). Таким образом, PtPA был способен дополнительно снижать уровни фибриногена/fdp/FDP в сыворотке даже в сыворотке здорового индивидуума, в которой остаточные уровни фибриногена/fdp/FDP и без того были очень низкими. Очень небольшие остаточные количества (<1,0%), вероятно, принадлежат молекулам, которые реагируют с антителом, но не способны полимеризоваться с образованием нерастворимого сгустка.
Затем 9 нормальных проб крови были собраны в четыре различных пробирки для сыворотки: пробирки Greiner для сыворотки, пробирки BD для сыворотки, пробирки BD RST и PtPA-содержащие пробирки Greiner Vacuette™ без добавок. Концентрацию фибриногена/fdp/FDP в каждой второй пробирке определяли вышеописанным ELISA-методом, и полученные результаты были представлены на фигуре 52. Концентрация фибриногена была значительно ниже в сыворотке, полученной в PtPA-содержащей пробирке Greiner Vacuette™ без добавок.
Затем определяли концентрацию фибриногена/fdp/FDP в сыворотке, полученной с использованием OsPA и экарина. Пробы сыворотки получали из крови 5 здоровых участников эксперимента и собирали в пробирки Greiner для сыворотки (GRS) и в пробирки Greiner без добавок, содержащие OsPA (0,50 мкг/4 мл-пробирку), экарин (0,63 единицы/4 мл-пробирку) и PtPA (1,2 мкг/4 мл-пробирку). Концентрацию фибриногена/fdp/FDP в сыворотке в каждой пробирке определяли вышеописанным ELISA-методом. Результаты представлены на фигуре 53. Во всех случаях, остаточные уровни фибриногена/fdp/FDP составляли менее чем 1% от всех уровней, присутствующих в нормальной крови или плазме.
Эксперимент 9c: Уровни фибриногена/fdp/FDP в пробах сыворотки, полученных от пациентов, которым был введен гепарин
У пациентов, подвергающихся диализу почек, необходимо поддерживть умеренные уровни гепарина (1000-10000 ед. гепарина во время лечения) во избежание образования тромбов в процессе диализа. 3 пациента из этой категории были выбраны для оценки эффективности свертывания крови, взятой у пациентов, подвергающихся диализу, в PtPA-содержащих пробирках (1,2 мкг/4 мл-пробирку) и в пробирках BD RST за 5 минут инкубирования, по сравнению со свертыванием крови, собранной в пробирку Greiner для сыворотки (GRS) и пробирки BD (BD SST II) для забора крови в целях получения сыворотки за 30-минутный период свертывания крови. Эффективность свертывания оценивали путем определения концентрации фибриногена/fdp/FDP в соответствующей сыворотке вышеописанным ELISA-методом.
Результаты, представленные на фигуре 54, показали, что остаточные уровни фибриногена/fdp/FDP в PtPA-продуцируемой сыворотке из гепаринизированной крови были сравнимы с уровнями фибриногена/fdp/FDP в PtPA-продуцируемой сыворотке из нормальной крови (фигуры 51 и 53). В противоположность этому, остаточные уровни фибриногена/fdp/FDP в сыворотке, продуцируемой в пробирках GRS, BDS и BD RST, были гораздо выше. На этих уровнях, образование латентных сгустков и микросгустков, по всей вероятности, происходит в присутствии гепарина. Величины, представленные на фигуре 54 для GRS, BDS и BDRST, являются минимальными при одном разведении пробы.
Пробы крови, взятой от 2 пациентов после операции на сердце (которым было введено 25000-41000 единиц гепарина), собирали в нижеследующие пробирки: пробирки Greiner для плазмы; пробирки Greiner для сыворотки; пробирки BD для сыворотки; пробирки BD RST; пробирки Greiner Vacuette™ без добавок, в которые был добавлен PtPA (1,2 мкг/4 мл-пробирку); пробирки Greiner Vacuette™ без добавок, в которые был добавлен OsPA (0,50 мкг/4 мл-пробирку); пробирки Greiner Vacuette™ без добавок, в которые было добавлено 1,25 единиц/л экарина/4 мл-пробирку (EC1); или пробирки Greiner Vacuette™ без добавок, в которые было добавлено 2,5 единиц/л экарина/4 мл-пробирку (EC2).
Концентрацию фибриногена/fdp/FDP в сыворотке и в плазме в каждой пробирке определяли вышеописанным ELISA-методом, и полученные результаты были представлены на фигуре 55. Концентрация фибриногена/fdp/FDP значительно снижалась в сыворотке, полученной в пробирках, содержащих активатор протромбина, по сравнению с пробирками для плазмы и с другими пробирками для сыворотки. Кроме того, время свертывания в пробирках, содержащих активатор протромбина, составляло лишь пять минут, тогда как в других пробирках, оно составляло 30 минут, а в пробирках для крови, обработанной антикоагулянтами, оно составляло 60 минут.
В целом, в пробирках, содержащих активаторы протромбина, могли продуцироваться пробы сыворотки с меньшей концентрацией остаточного фибриногена/fdp/FDP, чем пробы сыворотки в коммерчески доступных пробирках для сыворотки или плазмы. Для нормальных проб, этот эффект был относительно незначителен. Однако в случае гепаринизированных проб активаторы протромбина могли продуцировать сыворотку с низким остаточным уровнем фибриногена по сравнению с сывороткой, полученной в коммерчески доступных пробирках для сыворотки. Полученные результаты позволяют предположить, что достаточно низкая концентрация остаточного фибриногена/fdp/FDP может достигаться с использованием активатора протромбина, что дает возможность избежать образования латентного сгустка или осадка во всех пробах сыворотки. Такая возможность продуцировать сыворотку «высокого качества», полученную от пациентов, которым были введены высокие дозы антикоагулянтов (например, при лечении болезней сердца и диализе), и из «полностью гепаринизированных» проб, взятых у пациентов после операции на сердце, является ценным фактором.
Пример 10: Концентрация гемоглобина в пробах плазмы и сыворотки
Гемолитический индекс обычно определяют в биохимических лабораториях для оценки уровня гемоглобина, присутствующего в пробах сыворотки и плазмы, а следовательно, и степени лизиса клеток. Лизис клеток крови всех типов, включая эритроциты, лейкоциты и тромбоциты, может происходить in vivo во время забора крови и получения сыворотки/плазмы, а также после хранения. Лизис клеток in vitro обычно происходит во время сбора проб или переноса проб иглами небольшого калибра или с помощью устройств для переноса, обычно под давлением. Лизис эритроцитов in vivo может происходить сам по себе при гемолитической анемии. Во время лизиса клеток in vitro, содержимое клеток высвобождается в сыворотку или плазму, что приводит к ложному изменению результатов для некоторых аналитов; при этом, высвобождение содержимого клеток может даже приводить к разведению других аналитов в случае интенсивного гемолиза. В случае присутствия гемоглобина в плазме или в сыворотке могут возникать проблемы во время спектрального анализа и проблемы, связанные с перекрестной реакцией гемоглобина с другими клеточными аналитами. Сыворотка обычно имеет несколько более высокий уровень гемоглобина, чем плазма с литий-гепарином, что в значительной степени обусловлено процессом свертывания крови, приводящем к лизису небольшого числа клеток по мере увеличения и сокращения объема сгустка. Поэтому, низкая концентрация гемоглобина является важным критерием для получения пробы сыворотки «высокого качества».
Нижеследующий эксперимент был осуществлен в целях сравнения содержания гемоглобина в сыворотке, продуцированой в присутствии и в отсутствие PtPA, и в плазме, продуцированой с использованием литий-гепарина. Пробы крови брали у 2 пациентов, которым был введен антикоагулянт цитрат, и у 9 здоровых участников эксперимента. Пробы собирали в пробирки Greiner для плазмы, пробирки Greiner для сыворотки и в пробирки Greiner VacuetteТМ без добавок, содержащие PtPA (1,2 мкг/4 мл крови). Пробирки Greiner для плазмы и пробирки Greiner Vacuette™ без добавок, содержащие PtPA, центрифугировали в течение 5 минут после сбора, а пробирки Greiner Vacuette™ без добавок (без PtPA) центрифугировали в течение 30 минут. Через 30 минут после центрифугирования, пробы анализировали на гемоглобин. Результаты представлены в таблице 63.
Концентрации гемоглобина в пробах плазмы и сыворотки
Средняя концентрация гемоглобина в пробах плазмы составляла 55 мг/л, что было несколько ниже, чем концентрация гемоглобина в пробирках Greiner для сыворотки, которая составляла 67 мг/л, как и ожидалось в соответствии с данными, приведенными в литературе. Средняя величина для сыворотки с PtPA составляла 46 мг/л, и эта величина была значительно ниже величины, наблюдаемой для сыворотки Greiner, и даже ниже величины, наблюдаемой для плазмы. Стандартное отклонение среднего было высоким, что обусловлено индивидуальной вариабельностью для различных индивидуумов. Какого-либо значимого различия в оценках пробирок этих трех типов для любого одного индивидуума не наблюдалось. Для оценки значимости этих различий был проведен анализ данных для 11 проб крови с использованием парных двусторонних t-критериев. Были получены следующие результаты:
Пробирки Greiner для плазмы и пробирки Greiner для сыворотки: p = 0,1243
Пробирки Greiner для сыворотки и PtPA-содержащие пробирки Greiner Vacuette™ без добавок: p = 0,0188 (статистически значимая величина P<0,05)
Пробирки Greiner для плазмы и PtPA-содержащие пробирки Greiner Vacuette™ без добавок: p = 0,1038
Исходя из этого примера можно сделать выводы, что:
(1) Концентрация гемоглобина в пробах плазмы, полученных в пробирках Greiner для плазмы, была ниже, чем концентрация в гемоглобина в сыворотке, полученной в пробирках Greiner для сыворотки, как и ожидалось в соответствии с данными, приведенными в литературе;
(2) Концентрация гемоглобина в сыворотке, полученной в PtPA-содержащих пробирках Greiner Vacuette™ без добавок, была значительно ниже, чем концентрация гемоглобина в сыворотке Greiner. Более низкий уровень гемоглобина в этих пробах сыворотки может указывать на гораздо более быструю скорость свертывания и на ограничение лизиса клеток в процессе такого свертывания; и
(3) Средняя концентрация гемоглобина в пробах сыворотки с PtPA была ниже, чем концентрация гемоглобина в пробах плазмы, и это различие было минимально значимым (p=0,1038).
Таким образом, использование PtPA-содержащих пробирок позволяло получить сыворотку более высокого качества с точки зрения содержания в ней гемоглобина, чем использование коммерчески доступной пробирки Greiner для сыворотки.
Пример 11: Присутствие клеток и клеточного содержимого в пробах плазмы и сыворотки
Плазма с литий-гепарином, полученная в коммерчески доступных пробирках, содержала остаточные клетки в суспензии или в лейкоцитарной пленке в верхней части гелевого барьера, находящегося в контакте с плазмой после центрифугирования. Сыворотка, полученная из проб, взятых у здорового участника эксперимента и собранная в коммерчески доступные пробирки, содержала меньшее число клеток, находящихся в контакте с сывороткой (по сравнению с клетками, находящимися в контакте с плазмой). Хранение плазмы и сыворотки по меньшей мере в течение 7 дней при 2-8°C осуществляли в соответствии с требованиями Регуляторных органов Австралии, утвержденными Совещательным Комитетом по Аккредитации Специалистов в Национальной Лаборатории (National Pathology Laboratory Accreditation Advisory Council (NPACC)), занимающихся проведением повторного анализа или дополнительных анализов. В процессе хранения и анализа сыворотки или плазмы, присутствие клеток может давать два эффекта. Во-первых, клетки могут подвергаться лизису с высвобождением клеточного содержимого (например, K+, лактат-дегидрогеназы) в сыворотку или плазму. Это может приводить к значимым различиям в измерениях, сделанных сразу после центрифугирования и сделанных после хранения. Во-вторых, клетки остаются метаболически активными и могут утилизовать значительные количества микроэлементов (например, глюкозы) с последующим высвобождением продуктов метаболизма (например, лактата) после хранения. Изменения могут наблюдаться даже в пробах крови во многих пробирках в том случае, если эти пробы хранились в течение обычно рекомендуемого времени свертывания 30 минут, и если эти пробы были взяты у здоровых участников эксперимента.
Поэтому, степень клеточной контаминации является важным критерием качества проб сыворотки и важным преимуществом использования сыворотки, а не плазмы.
Нижеследующие эксперименты осуществляли для сравнения сыворотки, полученной с использованием PtPA, с сывороткой, полученной в пробирках Greiner для сыворотки, и с плазмой, которая включала литий-гепарин и была получена в пробирках Greiner для плазмы. Степень контаминации проб сыворотки и плазмы клетками и клеточным содержимым может быть оценена с использованием нескольких показателей контаминации. Были использованы три показателя клеточной контаминации: повышение лактат-дегидрогеназной активности (LD) после хранения; снижение концентрации глюкозы после хранения; и прямое наблюдение клеток.
Пример 11a: Сравнение PtPA-сыворотки с плазмой, включающей литий-гепарин и полученной от здоровых участников эксперимента в коммерчески доступных пробирках
Кровь брали у 10 здоровых участников эксперимента в пробирки Greiner для плазмы и в PtPA-содержащие пробирки Greiner для сыворотки, полученные следующим образом. Внутреннюю поверхность пробирок Greiner для сыворотки очищали для удаления прокоагулянтов/добавок Greiner путем заполнения пробирок стерильной деионизованной водой, а затем пробирки переворачивали ~20 раз, оставляли на 10 минут, и внутреннюю стенку и внутреннюю часть крышки пробирки тщательно протирали стерильным ватным тампоном, не повреждая гелевый барьер. Затем содержимое отбрасывали, и пробирки снова заполняли деионизованной водой /переворачивали /3 раза промывали деионизованной водой. И наконец, очищенные пробирки помещали в сушильную печь при 40°C до полного высыхания всех капелек воды, а затем добавляли PtPA (1,2 мкг/4 мл крови). Затем кровь забирали в пробирки. Две пробирки (пробирку Greiner для плазмы и PtPA-содержащую пробирку) с пробой, полученной от каждого участника эксперимента, центрифугировали и сразу анализировали на уровни лактат-дегидрогеназы (LD) и глюкозы (время ноль). Образцы оставляли при комнатной температуре (21°C) и снова анализировали в течение ~8 часов на том же самом анализаторе. Результаты представлены в таблицах 64 и 65.
LD-активность (ед./л) проб, взятых у 10 участников эксперимента и проанализированных во время 0 и через 8 часов после центрифугирования и хранения при 21°C.
Концентрация глюкозы (ммоль/л) в пробах, взятых у 10 участников эксперимента и проанализированных во время 0 и
через 8 часов после центрифугирования и хранения при 21°C
В пробах сыворотки, содержащихся в PtPA-пробирках, уровни LD и глюкозы изменялись на 0,6% и 1,5% за 8 часов, тогда как в пробах, содержащихся в пробирках Greiner для плазмы, эти уровни изменялись на 12,5% и 9,1% соответственно. В пробах плазмы, присутствие клеток приводило к израсходованию глюкозы, а уровень LD повышался, что обусловлено ее утечкой из клеток, подвергнувшихся лизису.
Полученные результаты подтвердили, что свертывание крови, содержащей PtPA, способствовало эффективному удалению клеток, и тем самым, предотвращало какие-либо значимые изменения уровней наиболее ценных аналитов, глюкозы и LD, в течение периода времени до 8 часов. Таким образом, включение PtPA в пробирку для сыворотки позволяет получить стабильную высококачественную сыворотку из проб крови, взятых у здоровых участников эксперимента.
Пример 11b: Клеточная контаминация сыворотки и плазмы, полученных от пациентов, которым вводили антикоагулянты
Пробы крови брали у двух участников эксперимента (P1 и P2), которым была сделана операция на сердце, и которым вводили всего: P1 - 30000, и P2 - 35000 единиц гепарина непосредственно перед забором крови (через 15 минут после введения гепарина). Пробы собирали в стандартные 50 мл-шприцы (BD Plastipak REF #300866), заполненные ~30 мл крови. Шприцы отдавали в лабораторию через 15 минут после забора крови. Были использованы нижеследующие пробирки, заполненные кровью: пробирка Greiner для плазмы, пробирка Greiner для сыворотки и пробирка Greiner для сыворотки (очищенная в соответствии с вышеописанной процедурой), содержащая PtPA (1,2 мкг/4 мл крови). Пробирки для плазмы и пробирки, содержащие PtPA, центрифугировали сразу после их передачи в лабораторию. Пробирку Greiner для сыворотки оставляли на 60 минут перед центрифугированием. Пробы анализировали, а затем оставляли при комнатной температуре (21°C) и снова анализировали через 24 часа на том же самом анализаторе. Результаты представлены в таблицах 66 и 67.
LD-активность (ед./л) проб, взятых у 2 участников эксперимента после операции на сердце и проанализированных на время 0 и через 24 часа после центрифугирования и хранения при 21°C
Концентрация глюкозы (ммоль/л) проб, взятых у 2 участников после операции на сердце и проанализированных во время 0 и через 24 часа после центрифугирования и хранения при 21°C
В пробах сыворотки, полученных с использованием PtPA, уровни LD и глюкозы отличались на -3 и -0,9% за 24 часа; в плазме с литий-гепарином, уровни LD и глюкозы отличались на 9% и -14,8%, а в пробах сыворотки, уровни LD и глюкозы отличались на 13% и -13,9% соответственно. Как и в случае группы здоровых участников, описанном в примере 11а, присутствие клеток в плазме приводило к израсходованию глюкозы, а в случае лизиса клеток, активность LD повышалась. Пробирки Greiner для сыворотки давали, как и ожидалось, результаты, аналогичные результатам, полученным для плазмы, поскольку эти пробы никогда не свертывались.
В пробирке Greiner для сыворотки, свертывания крови не наблюдалось, а также не наблюдалось какого-либо латентного свертывания ни визуально, ни в анализаторах в течение 24 часов после центрифугирования. Пробы, находящиеся в PtPA-содержащих пробирках, свертывались через 3-5 минут. 3 пробирки для участника PI были сфотографированы для иллюстрации присутствия клеток на поверхности гелевого барьера. В PtPA-содержащей пробирке, очень небольшое число клеток присутствовало на поверхности или внутри гелевого барьера, а в двух других пробирках, клетки визуально наблюдались по всему гелевому барьеру и за пределами гелевого барьера.
Из каждой из 3 пробирок, большая часть содержимого плазмы или сыворотки была осторожно удалена без нарушения слоя на верхней части гелевого барьера, в результате чего в пробирке оставалось приблизительно 0,5 мл плазмы или сыворотки. Оставшуюся плазму или сыворотку в каждой пробирке повторно смешивали с лейкоцитарной пленкой и переносили в центрифугу с предметными стеклами, Cytospin (Shandon-Elliott Cytospin, Shandon-EHiott Instruments Limited) для концентрирования клеток и получения окрашенного по Гимзе предметного стекла с клетками; клеточной стромы и т.п. для анализа под микроскопом. Предметные стекла (показанные на фигуре 56) явно указывали на присутствие избыточного количества клеток в плазме, немного меньшее количество клеток в сыворотке Greiner и минимальное число клеток в сыворотке, полученной с использованием PtPA.
Эти результаты подтвердили, что свертывание крови под действием PtPA достигалось даже у так называемых «полностью гепаринизированных» участников эксперимента за очень короткий период времени, <5 минут. После центрифугирования, число оставшихся клеток было минимальным и недостаточным для того, чтобы оно могло влиять на LD-активность или концентрацию глюкозы.
Пример 11c: Влияние длительного хранения проб сыворотки и плазмы, взятых у одного пациента после операции на сердце, на уровни аналитов
3 пробы, взятые у пациента после операции на сердце P2, которые сначала хранили в течение 24 часов при комнатной температуре (21°C) в первых пробирках, затем хранили еще 13 дней при 4°C (всего 14 дней или 336 часов после сбора), после чего эти пробы снова анализировали на K+, глюкозу, LD и фосфат (Pi). Результаты представлены в таблице 68.
Концентрация аналитов в пробах сыворотки и плазмы, взятых у участника после операции на сердце и проанализированных на время 0 и через 24 часа и 336 часов после центрифугирования
В отличие от плазмы с литий-гепарином и «сыворотки» в пробирках Greiner, в пробе PtPA-сыворотки наблюдались незначимые различия в уровнях K+ и глюкозы, а результаты, полученные для LD и Pi, имели минимальные изменения.
В этом сценарии экстремальной ситуации, сыворотка, полученная с использованием PtPA, позволяет легко получить наиболее стабильную пробу, которую можно оставить в лаборатории для дополнительного исследования аналитов на более длительные сроки и получить подтверждение точности результатов. 20%-ное снижение LD-активности в PtPA-пробе было, вероятно, обусловлено денатурацией присутствующей LD после хранения.
Общие выводы
PtPA-продуцированная сыворотка дает спорную стабильность с точки зрения концентраций аналитов, что, по всей вероятности, обусловлено неполным удалением клеток из описанных выше компонентов плазмы или сыворотки, находящихся поверх гелевого барьера в процессе свертывания и/или центрифугирования проб для всех пациентов. Результаты, полученные авторами путем прямого наблюдения, указывали на относительное отсутствие клеток в PtPA-продуцированной сыворотке по сравнению с плазмой Greiner с литий-гепарином, полученной от здоровых участников эксперимента или от пациентов, которым были введены высокие дозы гепарина.
Пример 12: Детектирование биохимических аналитов в пробах плазмы и сыворотки, полученных в коммерчески доступных пробирках, и в пробах сыворотки, полученных с использованием активаторов протромбина, выделенных из яда (экарина, PtPA и OsPA)
Как обсуждалось в предшествующих разделах настоящего описания, современные коммерчески доступные пробирки для забора крови не позволяют своевременно получить полностью свернутую сыворотку из всех проб крови, такую, чтобы ее качество и время между ее получением и анализом в биохимических лабораториях удовлетворяли необходимому выбору оптимального курса лечения пациента. Результаты, полученные в вышеописанных примерах, продемонстрировали, что активаторы протромбина могут быть использованы для быстрого получения высококачественной пробы сыворотки с низкими уровнями фибриногена/fdp/FDP и без клеточной контаминации (как может быть определено путем визуального наблюдения, по прозрачности сыворотки и с помощью анализа) из крови, взятой у широкого ряда пациентов/индивидуумов.
Поэтому важно определить, могут ли активаторы протромбина негативно влиять на анализ аналитов, обычно проводимый для лечения госпитализированных больных. Активаторы протромбина представляют собой протеолитические ферменты, которые, в принципе, могут расщеплять сывороточные белки или белки, используемые в аналитических методах, что может негативно влиять на результаты анализа. В аналитических методах, белки используют либо в качестве представляющего интерес аналита, либо в качестве реагентов (например, ферментов, антител), используемых для детектирования представляющих интерес аналитов.
В этом примере описаны исследования, проводимые для того, чтобы определить, может ли сыворотка, полученная с использованием активаторов протромбина, давать результаты анализа, аналогичные результатам анализа плазмы и сыворотки, полученных в современных коммерчески доступных пробирках с применением современных промышленных методов.
Не редки случаи, когда требуется провести анализ на более чем 30 биохимических аналитов, и этот анализ необходимо провести в одной пробирке для исследования сыворотки или плазмы. Поскольку число аналитов увеличивается и аналитический объем на каждый аналит снижается, то усовершенствование технологического процесса позволит проводить еще большее число анализов в одной пробирке. Следовательно, важно, чтобы добавки в пробирках, а в частности, прокоагулянты, были инертными и не оказывали какого-либо негативного влияния на анализ аналитов, а также важно, чтобы проба имела наивысшее качество, обеспечивающее наибольшую точность при анализе аналитов.
Нижеследующие эксперименты для каждого из 33 анализов проводили в соответствии со стандартными процедурами анализов, перечисленных ниже:
Тест 1: Натрий (Na+ )
Тест 2: Калий (K*)
Тест 3: Хлорид (Cl-)
Тест 4: Бикарбонат (HCO3-)
Тест 5: Глюкоза (Gluc)
Тест 6: Мочевина (Urea)
Тест 7: Креатинин (Creat)
Тест 8: Урат (Urate)
Тест 9: Общий белок (TP или T Prot)
Тест 10: Альбумин (Alb)
Тест 11: Общий билирубин (T Bili)
Тест 12: Щелочная фосфатаза (ALP)
Тест 13: Гамма-глутамилтрансфераза (GGT)
Тест 14: Аланин-аминотрансфераза (ALT)
Тест 15: Аспартат-аминотрансфераза (AST)
Тест 16: Лактат-дегидрогеназа (LD)
Тест 17: Креатин-киназа (CK)
Тест 18: Общий кальций (TCa)
Тест 19: Фосфат (Pi или Phos)
Тест 20: Магний (Mg2+)
Тест 21: Липаза (Lipase)
Тест 22: Холестерин (Chol)
Тест 23: Триглицериды*
Тест 24: Холестерин липопротеина высокой плотности (HDL-C или HDL)
Тест 25: Железо (Fe2+)
Тест 26: Трансферрин (Trf)
Тест 27: Реактивный белок С (CRP)
Тест 28: Кортизол (Cortisol)
Тест 29: Свободный тироксин (FT4)
Тест 30: Тиреотропный гормон (TSH)
Тест 31: Ферритин (Ferritin)
Тест 32: Тропонин (TnI)
Тест 33: Гемолитический индекс (Haem index)**
Тест 34: Иктерический индекс*
Тест 35: Липемический индекс*
* В этих экспериментах, триглицериды не определяли, поскольку в PtPA-препарате присутствует глицерин. В этом исследовании также не определяли иктерический и липемический индексы.
** См. также пример 10.
Аналитические тесты
Анализ проводили на общих биохимических анализаторах Beckman DxC800 и на анализаторе для иммуноанализа DxI800 (Beckman Coulter, Fullerton, CA, USA). Пробы загружали на одно и то же оборудование в одно и то же время через 1-2 часа после центрифугирования, за исключением случаев рекуррентного латентного свертывания.
Уровни тестируемых аналитов и полуколичественного гемолиза указаны в таблицах результатов. Верхний предел погрешности коэффициентов изменчивости между партиями (CV) для двух и трех значений концентраций, соответствующих внутреннему контролю качества для 35 аналитов, протестированных на анализаторах Beckman DxC800 и анализаторе DxI800 соответственно, представлен в таблице 69. Авторами также было определено активированное парциальное тромбопластиновое время (aPTT) на ACTOPS (Лабораторное оборудование, Lexington MA, USA), поскольку трудно определить точную концентрацию антикоагулянта в пробах крови участников эксперимента во время забора пробы у индивидуумов, госпитализированных по поводу болезни сердца и диализа. Во всех случаях, результаты соответствовали указанным уровням антикоагулянтов.
Анализ данных
Анализ полученных результатов каждого теста осуществляли следующим образом. Для каждого теста в пробирках каждого типа вычисляли среднее и стандартное отклонения (SD). Также вычисляли разность (фактическую и в %) между каждой парой результатов каждого теста для двух разных пробирок (например, между результатом для PtPA-пробирки и результатом для пробирки Greiner для сыворотки). Затем % разности сравнивали с величинами для разных партий, полученными на анализаторах (таблица 69) для того, чтобы определить, существует ли аналитически значимое различие между различными пробирками для сыворотки и между различными пробирками для сыворотки и пробирками для плазмы. Данные, полученные для участников эксперимента, также разделяли на данные для здоровых участников и участников, которым вводили антикоагулянты, а затем проводили тот же самый анализ. Если в любой из трех пробирок не проводили оценку аналита (что могло быть обусловлено рекуррентным латентным свертыванием, дающим непригодную пробу; недостаточностью забранной пробы, отказом в предоставлении анализатора или нехваткой реагентов), то этот результат не учитывали при вычислении из-за изменения числа анализируемых проб на анализ.
Погрешность при анализе контроля качества (QC) на анализаторах Beckman DxC800 и DxI800 (*DxI800)
Пример 12a: Сравнение PtPA-сыворотки с сывороткой и литий-гепаринсодержащей плазмой, полученными в коммерчески доступных пробирках
Был набран всего 61 участник. Все эти участники были взрослыми индивидуумами, то есть мужчинами и женщинами в возрасте >18 лет. Эти участники были разделены на две группы: 26 здоровых добровольцев и 35 пациентов, которым были введены антикоагулянты.
Из 35 пациентов, которым были введены антикоагулянты, один пациент был амбулаторным больным, который проходил лечение низкими дозами варфарина, а 34 пациента были стационарными больными.
Из 34 стационарных больных, 11 пациентам была сделана операция на сердце, 8 пациентов находились на лечении в кардиологических отделениях, а 15 пациентов проходили диализ.
11 стационарным больным, которым была сделана операция на сердце, вводили всего 25000-41000 единиц гепарина во время забора крови, который осуществляли через 30 минут после вливания гепарина. Пробы брали у пациентов после операции по шунтированию (когда кровь поступает не при работе сердца, а с помощью аппарата искусственного кровообращения).
8 пациентов, находящихся на лечении в кардиологическом отделении, были отобраны в ночь перед забором проб, и этим пациентам было проведено внутривенное (i.v.) вливание гепарина, то есть 950-1450 единиц гепарина в час. Семи пациентам продолжали внутривенно (i.v.) вливать гепарин (забор крови начинали через ≥12 часов после внутривенного вливания гепарина) во время забора проб, а другому пациенту была назначена хирургическая операция в тот день, когда вливание прекращали приблизительно за три часа до взятия проб (забор крови начинали через >9 часов после внутривенного вливания гепарина и прекращали через ~3 часа после внутривенного вливания гепарина). Исходя из полученных данных было установлено, что у этих пациентов, концентрации гепарина в инфузате и скорость инфузии оставались неизменными между началом внутривенного вливания гепарина и забором крови.
Из 15 стационарных больных, проходящих диализ, 12 пациентам проводили внутривенное вливание гепарина, 1 пациенту вводили варфарин/гепарин (~1750-7000 единиц гепарина, сначала вводили ударную дозу гепарина, а затем каждый час вводили высокие дозы гепарина), а 2 пациентам вводили клексан. Забор крови у этих пациентов проводили по меньшей мере через один час после начала диализа.
Кровь брали в соответствии со стандартизированным протоколом забора крови. Такую кровь брали путем венопункции у здоровых добровольцев, с помощью шунта у пациентов с болезнью сердца и через систему гемотрансфузии у пациентов, проходящих диализ. Были использованы нижеследующие пробирки:
Цитратсодержащая пробирка Greiner Vacuette™ (для исследования на свертывание);
PtPA-содержащая пробирка Greiner Vacuette™ без добавок (1,2 мкг/4 мл) (PtPA);
Пробирка Greiner Vacuette™ для плазмы (GLH);
Пробирка BD Vacutainer™ для плазмы/PST II (BDLH);
Пробирка Greiner Vacuette™ для сыворотки (GRS);
Пробирка BD для сыворотки/SST II (BDS); и
Пробирка BD RST (BD RST).
Кровь для PtPA-содержащей пробирки забирали в стандартный шприц, а затем из шприца переносили в PtPA-содержащую пробирку Greiner, у которой отсутствовала игла для минимизации клеточного лизиса.
Пробирки Greiner для сыворотки и пробирки BD SST оставляли для свертывания крови как обычно на 30 минут для здоровых участников, и на 60 минут для участников, которым были введены антикоагулянты. Эти пробирки визуально оценивали на образование сгустков перед их загрузкой в центрифугу.
Пробирки BD RST и PtPA-пробирки визуально оценивали на образование сгустков в течение 5 минут для всех участников, начиная с момента забора крови (в пунктах флеботомии или в отделении больницы). BD RST-пробы, взятые у здоровых участников и участников, которым были введены антикоагулянты, и у которых через 5 минут образовывались твердые сгустки, центрифугировали сразу после доставки в лабораторию (<20 минут). Если свертывание крови было неполным, то пробы снова оценивали через каждые 10-15 минут на свертывание и оставляли максимум на 60 минут для свертывания. Пробирки с литий-гепарином и с PtPA центрифугировали сразу после доставки в лабораторию (<20 минут после забора).
Все пробирки центрифугировали при 3000 х g в течение 10 минут при 20°C в центрифугах с качающимися стаканами, а затем помещали на хранение при ~21°C. Эти пробирки визуально оценивали на латентное свертывание сразу после центрифугирования и непосредственно перед загрузкой в анализаторы. Эти пробирки (первые пробирки) использовали для анализа, за исключением тех случаев, когда наблюдалось латентное свертывание. В пробирках, в которых наблюдалось латентное свертывание, сыворотку из первых пробирок переносили в пробирку для аликвот, затем снова центрифугировали для удаления сгустков, и прозрачную сыворотку преносили в другую пробирку для аликвот (вторую пробирку), которую использовали для анализа. Пробирка Greiner без добавок не содержала гелевого барьера для сыворотки, и полученную таким образом, PtPA-продуцированную сыворотку переносили во вторую пробирку для анализа во избежание повторного смешивания и длительного контакта с клетками.
Результаты
Результаты представлены в таблице 70. Кроме того, репрезентативные результаты измерения уровня общего белка (TP) представлены на фигуре 57. На левом графике указаны средние величины результатов со стандартным отклонением, полученных для всех здоровых индивидуумов (n=26) и для пробирок каждого типа. На центральном графике указаны средние величины для всех пациентов (n=61) и для пробирок каждого типа. На правом графике указаны средние величины для всех пациентов с болезнью сердца (n=11) и для пробирок каждого типа. Единицы, отложенные на оси у, представляют собой г/л белка. Величины ошибок (вертикальные черточки) представляют собой стандартное отклонение.
Сравнение PtPA-пробирок для сыворотки с коммерчески доступными пробирками для сывороток, взятых у здоровых участников эксперимента и у участников, которым были введены антикоагулянты. Каких-либо значимых различий для любых аналитов не наблюдалось. Этот вывод был сделан исходя из сравнения полученных в анализе средних величин, представленных в таблице 70, и описанного выше статистического анализа с использованием парного критерия.
Сравнение PtPA-пробирок для сыворотки с коммерчески доступными пробирками для плазмы, содержащей литий-гепарин и взятой у здоровых участников эксперимента и у участников, которым были введены антикоагулянты. Как и ожидалось, значимые различия наблюдались для некоторых аналитов (К+, TP, AST и Pi), поскольку между плазмой и сывороткой существуют четко установленные различия. Данные анализа для сыворотки, полученные в коммерчески доступных пробирках для сыворотки, и данные, полученные для PtPA-пробирок, аналогичным образом отличались от данных, полученных для плазмы.
Аналитические данные для 32 аналитов в пробах сыворотки и плазмы
± 2,24
± 2,44
±2,38
±2,29
±2,34
±2,38
± 0,59
± 0,63
± 0,65
± 0,62
± 0,60
± 0,60
± 3,8
± 4,2
±4,1
±4,0
±3,8
±3,9
± 2,8
± 3,0
±2,7
±3,1
±2,9
±3,0
±2,09
±2,15
±2,11
±2,07
±2,11
±2,08
±112,8
±115,0
±114,7
±116,0
±116,0
±116,6
±0,11
±0,12
±0,12
±0,11
±0,11
±0,12
±13,0
±13,2
±13,3
±12,6
±12,5
±12,6
±8,3
±8,1
±8,1
±8,3
±8,3
±8,3
±3,8
±3,7
±3,4
±3,6
±4,0
±3,8
±26,9
±26,5
±26,6
±26,9
±27,5
±26,9
±17,6
±17,0
±16,9
±17,1
±17,1
±17,5
±37,7
±37,5
±36,9
±34,9
±38,7
±39,1
±110,0
±113,1
±110,7
106,0
±120,0
±119,2
±250,3
±250,0
±242,8
±241,3
±259,6
±253,3
±0,26
±0,24
±0,24
±0,26
±0,26
±0,26
±0,28
±0,28
±0,28
±0,30
±0,30
±0,30
±0,19
±0,20
0,19
±0,18
±0,20
±0,20
±9,0
±9,0
±8,9
±9,0
±9,2
±9,0
±0,6
±0,58
±0,60
±0,58
±0,58
±0,59
±6,6
±6,5
±6,7
±6,7
±6,7
±6,6
±0,74
±0,71
±0,72
±0,73
±0,73
±0,77
±49,3
±49,5
±50,5
±46,8
±52,3
±52,4
±247
±241
±254
±249
±248
±250
±4,1
±3,7
±3,6
±3,9
±3,9
±3,7
±2,12
±2,05
±2,12
±2,10
±2,02
±2,08
±5,33
±6,06
±5,75
±4,77
±5,25
±5,75
±0,7
±0,7
±0,7
±0,7
±0,7
±0,7
§ означает непараметрическое распределение. Величину p определяли с рангового парного критерия Уилкоксона
Пример 12b: Сравнение сыворотки, содержащей PtPA, OsPA и экарин, с сывороткой и плазмой, полученными в коммерчески доступных пробирках
Была набрана группа из 7 участников, и эта группа состояла из 5 здоровых добровольцев разных полов, то есть 4 мужчин и 1 женщины, и 2 пациентов, которым была сделана операция на сердце (все участники имели возраст >18 лет). Двум пациентам с болезнью сердца вводили 34000 и 43000 единиц гепарина через 30 минут после вливания гепарина.
Кровь брали у здоровых участников эксперимента путем венопункции в соответствии со стандартизированным протоколом забора крови в пробирку Greiner для цитратной плазмы; в пробирку Greiner для сыворотки; в пробирку Greiner для плазмы; и в стандартный шприц (Thermo 10 мл #CE0197) для PtPA-, OsPA- или экаринсодержащих пробирок Greiner без добавок (концентрация активаторов протромбина в этих 4 мл-пробирках составляла: 1,2 мкг PtPA, 0,5 мкг OsPA и 0,625 единиц экарина для здоровых участников и 1,25 единиц для пациентов после операции на сердце). Кровь из этого шприца переносили в пробирки Greiner, которые на содержали добавок, включали активаторы протромбина, и были безыгольными, что позволяло минимизировать клеточный лизис.
У участников с болезнью сердца, кровь забирали стандартным шприцом (30 мл) во время шунтирования. Эту кровь доставляли в лабораторию через 15 минут и распределяли по различным пробиркам, перечисленным выше.
Пробирки Greiner для сыворотки оставляли на стандартное время для свертывания 30 минут, рекомендованное для здоровых участников эксперимента, и на 60 минут для пациентов после операции на сердце, а затем пробирки визуально оценивали на образование сгустка перед их загрузкой в центрифугу. PtPA-, OsPA- и экаринсодержащие пробы визуально оценивали на образование сгустков в течение 3 и 5 минут для всех участников, начиная с момента забора крови (в пунктах флеботомии для здоровых участников эксперимента и в отделении больницы для пациентов после операции на сердце). Пробирки, содержащие литий-гепарин, PtPA, OsPA и экарин, центрифугировали сразу после доставки в лабораторию (через <30 минут после забора крови).
Все пробирки центрифугировали при 3000 х g в течение 10 минут при 20°C в центрифугах с качающимися стаканами, а затем помещали на хранение при ~21°C. Эти пробирки визуально оценивали на латентное свертывание сразу после центрифугирования и непосредственно перед загрузкой в анализаторы. Для анализа использовали первые пробирки Greiner. Пробирка Greiner без добавок не содержала гелевого барьера для сыворотки, и сыворотку, полученную с использованием активаторов протромбина, переносили в пробирки для аликвот (вторые пробирки) во избежание повторного смешивания и длительного контакта с клетками.
Результаты
Результаты, представленные в таблице 71, подтвердили следующие выводы:
1. Сравнение сыворотки, продуцируемой активаторами протромбина, и сыворотки Greiner не выявило каких-либо значимых различий для любых аналитов.
2. Сравнение сыворотки, продуцируемой активаторами протромбина, и плазмы Greiner с литий-гепарином указывало, как и ожидалось, на значимые различия для некоторых аналитов (К+, TP, AST и Pi), поскольку между плазмой и сывороткой существуют четко установленные различия. Данные анализа для сыворотки, полученные в коммерчески доступных пробирках для сыворотки, и данные, полученные для сыворотки с использованием активаторов протромбина, аналогичным образом отличались от данных, полученных для плазмы.
Данные для каждого аналита, полученные от трех различных змеиных прокоагулянтов, и проб, полученных в пробирках Greiner
* Анализ осуществляли в анализаторе для иммуноанализа DxI800.
Краткое описание примера 12
Кровь, взятая у всех здоровых участников эксперимента и от участников, которым вводили антикоагулянты, и которые были ранжированы по дозам, начиная с участника, получившего наименьшую дозу, и до полностью «гепаринизированного» участника, свертывалась в течение 5 минут в PtPA-, OsPA- и экаринсодержащих пробирках с образованием твердых неподвижных сгустков. В любой сыворотке, продуцируемой под действием активаторов протромбина, какого-либо латентного свертывания вызуально не наблюдалось, и не было детектировано на анализаторах. Несмотря на то, что активаторы протромбина представляют собой протеолитические ферменты, они не оказывали какого-либо аналитически или клинически значимого действия на любой из тестируемых аналитов, независимо от того, являются ли такие аналиты белками, или белками, используемыми в качестве реакционноспособных соединений в аналитических методах. Между сывороткой, полученной в коммерчески доступной пробирке, и сывороткой, полученной с использованием активаторов протромбина, каких-либо значимых различий для любых аналитов не наблюдалось. Аналитические и клинические различия, наблюдаемые для аналитов в плазме с литий-гепарином, полученной в коммерчески доступной пробирке, и в сыворотке, полученной с использованием активаторов протромбина, соответствовали опубликованным данным.
Пример 13: Дополнительный биохимический анализ на аналиты в пробах плазмы и сыворотки, полученных в коммерчески доступных пробирках, и в пробах сыворотки, полученных с использованием активаторов протромбина, выделенных из яда (нотекарина и каринактивазы-2)
Этот пример является продолжением примера 12 и в нем описано применение той же самой методики.
Пример 13a: Определение аналитов
Кровь от 5 здоровых участников эксперимента забирали в пробирки Greiner без добавок (Cat No 454001), в которые добавляли 25 мкл нотекарина или каринактивазы-2 с получением концентраций 12 нмоль/мл и 45 нмоль/мл соответственно. Пробирки Greiner Vacuette для сыворотки (Cat No 456078; GS) использовали в качестве контроля. Пробирки GS оставляли на 30 минут для свертывания в соответствии с рекомендациями производителей, а затем центрифугировали. Пробирки, содержащие активаторы протромбина, оценивали на свертывание сразу после добавления крови.
В пробирках с нотекарином и каринактивазой-2, свертывание наблюдалось через 2 минуты, и эти пробирки отдавали в лабораторию и центрифугировали через 7-15 минут после забора крови. Сгустки, образовавшиеся в пробирках, содержащих указанные активаторы, были твердыми, а образования какого-либо латентного сгустка не наблюдалось и не детектировалось.
Затем, пробы анализировали на 31 аналит, и результаты анализа представлены в таблице 72. Для 27 аналитов, полученные величины были аналогичными в пределах экспериментальной ошибки, при этом, различия между парными результатами были меньше наименее значимого изменения (LSC%). Результаты, в которых различия были больше установленных LSC (выделенных жирным шрифтом), могут быть объяснены следующим образом:
(1) Для LD, несколько более низкие активности в пробах с двумя активаторами протромбина могут быть следствием более низкой клеточной контаминации по сравнению с сывороткой Greiner;
(2) Высокий уровень триглицеридов (Trig) в пробе с нотекарином обусловлен действием глицерина, в котором хранился нотекарин;
(3) Сыворотка с нотекарином обнаруживала более высокие уровни AST, однако эти различия были клинически незначимыми;
(4) Результаты по тропонину для пяти пациентов были слишком низкими для точной дифференциации.
Результаты анализа для проб сыворотки, полученных с использованием нотекарина и каринактивазы-2
(%)
§ = Результаты, отличия которых превышают LSC и/или CAL
Пример 13b: Стабильность аналитов
Пробирки Greiner для сыворотки промывали (5 раз дистиллированной водой) для удаления поверхностно-активного вещества и прокоагулянта, но c сохранением гелевого барьера, а затем эти пробирки сушили в печи. После этого в пробирки добавляли нотекарин и каринактивазу-2 (25 мкл-аликвоты) до конечных концентраций 12 нмоль/мл и 45 нмоль/мл соответственно. У здорового добровольца брали кровь (5 мл) в одну пробирку, содержащую нотекарин, и в одну пробирку, содержащую каринактивазу-2. Через 5 минут пробирки центрифугировали. Уровни K+, глюкозы, LD и фосфата определяли через 3 соответствующих интервалов времени после получения пробы. Пробы хранили при 23°C в течение 5 часов, а затем в течение 5-26,5 часов при 4°C. Также определяли уровень гемоглобина.
Результаты представлены в таблице 73.
Стабильность аналитов в пробах сыворотки, продуцированной под действием нотекарина и каринактивазы-2
Уровень гемоглобина <50 мг/л рассматривался как клинически незначимый. Таким образом, эти результаты показали, что пробы сыворотки, полученные с использованием активаторов протромбина, по существу, не содержали гемоглобина (поэтому наблюдался очень низкий гемолиз в процессе свертывания крови) и вообще не содержали клеточных примесей. Если присутствовали клетки или клеточный дебрис, то, как и ожидалось, концентрация К+, LD и фосфата повышалась, а концентрация глюкозы снижалась после хранения. Взятые пробы сыворотки анализировали на клетки методом Cytospin. Было детектировано очень незначительное число клеток.
В целом, пробы сыворотки, полученные с использованием активатора протромбина группы В (каринактивазы-2) и активатора протромбина группы D (нотекарина), были высокого качества, на что указывали полное свертывание, результаты анализа и отсутствие клеточных примесей.
Пример 14: Биохимический анализ на аналиты в пробах плазмы и сыворотки, полученных в коммерчески доступных пробирках, и в пробах сыворотки, полученных с использованием ядов, содержащих активаторы протромбина
В этом примере описана та же методика анализа аналитов, которая была описана в примерах 12 и 13.
Как описано в предшествующих примерах, было неожиданно обнаружено, что активаторы протромбина змеиного яда могут оказаться подходящими для их использования в клинических условиях в качестве прокоагулянтов. В этой связи возникает вопрос, можно ли использовать неочищенные яды, содержащие эти активаторы протромбина, в приборах для свертывания крови без предварительной очистки активаторов протромбина.
Поэтому, для того, чтобы определить, можно ли использовать яды для быстрого получения высококачественной сыворотки из проб крови человека, были разработаны и проведены нижеследующие эксперименты. Количество используемого яда приблизительно в четыре раза превышало количество очищенных активаторов протромбина, применяемых в предшествующих экспериментах, и это можно объяснить тем, что яды, помимо активаторов протромбина, содержат и другие белки.
Пример 14a: Применение неочищенных ядов P. textilis и O. scutellatus в качестве прокоагулянтов в пробирках для свертывания
Кровь брали у 2 здоровых добровольцев в 10 пробирок Greiner без добавок (#454001, Griener Bio-One, Kremsmuster, Austraia) (емкостью 4 мл), содержащих 2 и 4 мкг (для 4 мкг яда O. scutellatus, в дубликате) яда P. textilis или О. scutellatus. Для сравнения, пробы крови также забирали в стандартные пробирки Greiner для сыворотки (#456071, Greiner Bio-One, Kremsmuster, Austraia).
По визуальным наблюдениям, свертывание в ядсодержащих пробирках полностью завершалось за 2 минуты. Пробы в ядсодержащих пробирках центрифугировали через 15 минут, а пробы в пробирках Greiner для сыворотки центрифугировали через 30 минут. Пробы центрифугировали при 3000 х g, в течение 10 минут и при 20°C (в центрифуге Hereaus 1S-R, Germany). Сыворотку, взятую из пробирок Greiner без добавок, сразу переносили в простые пластиковые пробирки Beckman (#448778, Beckman coulter, Brea, CA, USA) для наблюдения и анализа. Латентное свертывание наблюдалось приблизительно в половине (в 6 из 10) ядсодержащих пробирок, но ни не наблюдалось ни в одной из пробирок Greiner для сыворотки. Это указывает на то, что в некоторых пробирках, свертывание было неполным при используемых концентрациях яда. Пробы в простых пластиковых пробирках снова центрифугировали для удаления клеток, клеточной стромы и латентных сгустков, после чего полученную прозрачную сыворотку анализировали в течение 2 часов на 31 аналит. Анализ проб на 31 аналит осуществляли в течение 2 часов после центрифугирования на общем биохимическом анализаторе Beckman DxC800 и на иммуноанализаторе Dx1800 immuno-analyser (Beckman Coulter, Brea, CA, USA). Каких-либо клинически значимых отличий в уровнях тестируемых концентраций, полученных для 12 сывороток (4 сывороток P. textilis, 6 сывороток O. scutellatus и 2 сывороток Greiner), не наблюдалось.
Результаты представлены в таблице 74.
Результаты анализа для проб сыворотки, полученных с использованием ядов P. textilis и O. scutellatus
(%)
Анализ проводили на анализаторах Beckman DxC800 и *DxI800. Br2 - 2,0 мкг яда коричневой змеи; Br4 - 4,0 мкг яда коричневой змеи; T2 - 2,0 мкг яда тайпана; T4 и T4R - 4,0 мкг яда тайпана.
В целом, авторами настоящего изобретения было обнаружено, что неочищенные яды P.textilis и O.scutellatus представляют собой прокоагулянты, которые могут быть использованы для получения сыворотки в пробирках для свертывания крови. В целях предотвращения латентного свертывания и сохранения аналитической целостности необходимо определить оптимальные концентрации ядов.
Пример 14b: Применение неочищенного яда E. carinatus в качестве прокоагулянта в пробирках для свертывания
Для того, чтобы определить, можно ли использовать яд E. carinatus для быстрого получения высококачественной сыворотки из проб крови человека, были проведены нижеследующие эксперименты.
Кровь брали у 2 здоровых добровольцев в 10 пробирок Greiner без добавок (#454001, Griener Bio-One, Kremsmuster, Austraia) (емкостью 4 мл), содержащих 4 мкг яда E. carinatus. Для сравнения, пробы крови также одновременно забирали в стандартные пробирки Greiner для сыворотки (#456071, Greiner Bio-One, Kremsmuster, Austraia).
По визуальным наблюдениям, свертывание в ядсодержащих пробирках полностью завершалось за 3 минуты. Пробы в ядсодержащих пробирках центрифугировали через 10 минут, а пробы в пробирках Greiner для сыворотки центрифугировали через 30 минут. Пробы центрифугировали при 3000×g, в течение 10 минут при 20°C (в центрифуге Hereaus 1S-R, Germany). Сыворотку, взятую из пробирок Greiner без добавок, сразу переносили в простые пластиковые пробирки Beckman (#448778, Beckman coulter, Brea, CA, USA) для наблюдения и анализа. Латентное свертывание не наблюдалось ни в ядсодержащих пробирках, ни в пробирках Greiner для сыворотки. Пробы в простых пластиковых пробирках снова центрифугировали для удаления любых клеток, появившихся во время переноса сыворотки, после чего полученную прозрачную сыворотку анализировали в течение 2 часов на 31 аналит. Анализ проб на 31 аналит осуществляли в течение двух часов после центрифугирования на общем биохимическом анализаторе Beckman DxC800 и на иммуноанализаторе DxI800 (Beckman Coulter, Brea, CA, USA). Результаты представлены в таблице 75. Результаты, полученные для сыворотки E. carinatus и сыворотки Greiner, обнаруживали клинически значимые различия в уровнях AST и HDL, но не обнаруживали каких-либо различий в отношении других аналитов в тестируемых концентрациях.
Результаты анализа проб сыворотки, полученных с использованием яда змеи Echis carinatus
(%)
Анализ проводили на анализаторах Beckman DxC800 и *DxI800.
EC4 = 4,0 мкг яда Echis carinatus.
Поскольку эти результаты были лишь результатами предварительных исследований, то необходимо провести дополнительные исследования для определения причин клинически значимых различий в результатах для AST и HDL.
В целом, авторами настоящего изобретения было показано, что неочищенный яд E. carinatus может быть использован в качестве прокоагулянта в пробирках для свертывания крови. В целях предотвращения латентного свертывания и сохранения аналитической целостности необходимо точно определить оптимальную концентрацию яда и провести дополнительное исследование на взаимодействие аналитов.
Пример 15: Исследования на стабильность
Для использования активатора протромбина яда в качестве компонента в устройстве для забора крови необходимо, чтобы этот активатор удовлетворял трем критериям стабильности:
(1) Стабильность во время хранения в контейнерах: Необходимо сохранять стабильность материала в течение всего периода времени после очистки и до его применения для получения пробирок. В рекомендациях некоторых поставщиков, такой период хранения может составлять несколько месяцев. Хранение может быть осуществлено в виде концентрированного водного раствора или лиофилизованного твердого вещества. При необходимости, хранение может осуществляться в рефрижераторе.
(2) Стабильность в процессе получения: Необходимо сохранять стабильность в процессе приготовления устройства для забора крови. Очевидно, что этот процесс включает добавление аликвот маточного раствора активатора протромбина в пробирки, которые уже содержат другие компоненты, такие как разделительный гель, поверхностно-активное вещество и, возможно, прокоагулянт, состоящий из частиц. После этого проводят сушку с получением поверхностного слоя активатора протромбина, а затем пробирки герметично закрывают в вакууме и стерилизуют путем облучения.
(3) Стабильность во время хранения устройства до его применения: Необходимо, чтобы активатор сохранял почти всю свою активность в течение периода времени по меньшей мере 12 месяцев при комнатной температуре, обычно при 23°С, предпочтительно, в течение более длительного периода времени при повышенной температуре.
Данные экспериментов, проводимых до настоящего времени, позволяют предположить, что необходимо создать условия, которые будут удовлетворять этим требованиям по меньшей мере для некоторых активаторов протромбина яда.
Пример 15a: Стабильность во время хранения в контейнерах
Была определена стабильность PtPA при его хранении в виде разведенного раствора в забуференном фосфатом физиологическом растворе, pH 7, в стандартных пластиковых пробирках Эппердорфа при температурах в определенном интервале. Результаты анализа на свертывание плазмы представлены на фигуре 58. Эти результаты показали, что какой-либо значимой потери активности свертывания через две недели (336 часов) при 4°С или 25°C не наблюдалось. Аналогичные результаты были получены при измерении активности PtPA, направленной против хромогенного субстрата S-2222 для фактора Ха. При 37°C, потеря значительной активности PtPA наблюдалась через 168 часов.
В родственных экспериментах было продемонстрировано, что при pH 7,4 и при оптимальной температуре хранения, добавление ионов кальция в буфер для хранения приводил к стабилизации активности свертывания плазмы.
Эти эксперименты показали, что необходимо создать такие условия для хранения PtPA и близкородственного OsPA в контейнере, чтобы они могли сохранять всю или почти всю свою активность после хранения в течение длительных периодов времени.
Пример 15b: Стабильность в процессе получения:
Этот эксперимент проводили для того, чтобы определить влияние гамма-излучения на активность OsPA, добавленного в пробирки для забора крови в виде разведенного раствора.
Маточный раствор OsPA (1,089 мг/мл; 4,36 мМ) разводили 1:25 добавлением 0,02 M буфера Hepes, pH 7,4. 50 мкл этого буфера добавляли в каждую из 5 простых пробирок для забора крови, которые не содержали других добавок, и которые были подвергнуты гамма-облучению (16 мегаБк), и в 5 аналогичных пробирок для забора крови, которые не облучали. Аналогичным образом, 50 мкл разведенного OsPA добавляли в каждую из 10 пробирок Greiner для забора крови, содержащих двуокись кремния (пробирки Greiner для сыворотки), и 5 из этих пробирок облучали.
После гамма-облучения, все пробирки доводили до концентрации 2,0 мл добавлением 0,02 M буфера Hepes, pH 7,4. Затем брали аликвоты и тестировали на гидролитическую активность, направленную против S-2765, и на активность свертывания нормальной цитратной плазмы, в которую было добавлено 10 мМ кальция.
Результаты, представленные на фигурах 59 и 60, показали, что облучение не оказывало какого-либо влияния ни на активность свертывания рекальцифицированной цитратной плазмы, ни на гидролитическую активность, направленную против хромогенного субстрата S-2765.
Добавление OsPA (1,5 нМ) в простую пробирку для забора крови приводило к значительной потери активности по сравнению со свежеразведенным OsPA. Это можно объяснить гидрофобным связыванием OsPA с простой пластиковой пробиркой. Добавление OsPA в пробирки для забора крови, содержащие двуокись кремния, приводило к восстановлению более чем 95% гидролитической и коагулирующей активности. И в этом случае, при гамма-облучении, какой-либо потери активности не наблюдалось.
В заключение можно сказать, что гамма-облучение OsPA в пробирке для забора крови не влияло ни на гидролитическую активность, ни на коагулирующую активность. Добавление OsPA в пробирку для свертывания крови, содержащую двуокись кремния, гелевый барьер и поверхностно-активное вещество, которые до настоящего времени считались наиболее эффективной комбинацией, приводило к свертыванию нормальной крови менее чем за 1 минуту.
Пример 15c: Стабильность во время хранения устройства
Аликвоты (50 мкл) разведенного раствора OsPA в 0,02 M буфере Hepes, pH 7,4 (1,5 нМ) помещали в стандартные пробирки Greiner для сыворотки. Каждую пробирку вращали для покрытия ее поверхности OsPA, а затем эти пробирки помещали в вакуумную сушилку и продували потоком сухого азота, после чего подавали низкий вакуум в течение 3 дней при 23°C для сушки. Сушильный шкаф открывали, продували азотом и пробирки снова герметично закрывали. Затем пробирки хранили при комнатной температуре (23°C). Через определенный период времени, три пробирки открывали, содержимое снова растворяли в 2 мл воды и анализировали на фактор Xa-специфический субстрат S-2222. Результаты, представленные на фигуре 61, показали, что активность OsPA (выраженная как увеличение A405/мин), направленная против S-2222, существенно не изменялась при хранении в виде сухого поверхностного слоя в пробирках Greiner для сыворотки в течение 14 дней при 23°C. Все анализы проводили с тремя повторностями. На фигуре 61, правый столбец соответствует активности свежеразведенного образца маточного раствора OsPA (4,05 мкМ), и его активность была аналогична активности, наблюдаемой в пробирках, что указывает на то, что данный метод, используемый для приготовления пробирок, не приводит к какой-либо значимой потере активности OsPA.
Пример 16: Приготовление пробирки для забора крови
Все коммерчески доступные в настоящее время пробирки для сыворотки и плазмы являются пластиковыми и содержат ряд компонентов, которые были разработаны поставщиками в целях повышения качества проб в этих пробирках. Как обсуждалось выше, некоторые контейнеры (например, пробирки) для получения пробы сыворотки или пробы плазмы содержат:
(1) гелевый барьер, который служит для отделения клеток (и сгустка, в случае сыворотки) от супернатанта (сыворотки или плазмы) после центрифугирования и для предотвращения повторного смешивания. Гель добавляют в виде теплой жидкости, которая отверждается после охлаждения до комнатной температуры;
(2) поверхностно-активное вещество, напыленное на внутреннюю поверхность пластиковой пробирки поверх гелевого барьера и предназначенное для снижения степени прилипания клеток, дебриса и сгустков, а также для снижения клеточного лизиса; и
(3) прокоагулянт/антикоагулянт, который обычно состоит из частиц, и который напыляют в виде суспензии на внутреннюю поверхность пробирки поверх поверхностно-активного вещества.
В настоящем изобретении рассматривается пробирка для сыворотки (например, пластиковая пробирка), содержащая компоненты (l), (2) и (3), описанные выше, где указанную пробирку приготавливают сначала путем добавления компонентов (1) и (2), а затем в эту пробирку добавляют компонент (3). Компонент (3) включает прокоагулянт, содержащий коагулирующую композицию, которая включает определенный в настоящем документе активатор протромбина, а также, по существу, состоит, или состоит из указанного активатора, так, например, компонент (3) может включать уже присутствующие состоящие из частиц прокоагулянты, используемые в некоторых коммерчески доступных пробирках для сыворотки. Количество активатора протромбина в каждой пробирке может быть определено с использованием экспериментальных данных, подробно описанных выше, и с применением известных рутинных методов. Затем из пробирок откачивают воздух, и пробирки стерильно закрывают. После этого пробирки хранят при комнатной температуре.
Также рассматривается пробирка для сыворотки (например, пластиковая пробирка), содержащая компонент (3) и, но необязательно, компоненты (1) и/или (2). Количество активатора протромбина в каждой пробирке может быть определено с использованием экспериментальных данных, подробно описанных выше, и с применением известных рутинных методов. Затем из пробирок откачивают воздух, после чего их стерильно закрывают, и эти пробирки можно хранить при комнатной температуре.
Пример 17: Вариант «экспресс-теста»
Как обсуждалось выше, термин «экспресс-тест» означает тест, который осуществляют непосредственно возле места нахождения пациента. «Экспресс-тесты» становятся все более популярными в больницах и в других местах, где желательно получить быстрые результаты. Такие тесты осуществляют с помощью различных инструментов, которые являются относительно недорогостоящими и имеют небольшой размер, то есть являются портативными.
В современной практике, многие устройства для «экспресс-тестов» функционируют следующим образом: капельку крови наносят на мембрану, которая сохраняет клетки крови, но позволяет плазме диффундировать через эту мембрану в микрофлюидизатор со множеством каналов, в которых проводится ряд анализов. Как обсуждалось выше, сыворотка, используемая в качестве пробы для биохимических анализов или других лабораторных анализов, имеет преимущества перед плазмой. В этом варианте изобретения рассматривается применение коагулирующих композиций, включающих активатор протромбина, или, по существу, состоящих, или состоящих из указанного активатора протромбина, в целях приготовления сыворотки в устройстве с сывороткой для «экспресс-теста».
В одном из таких устройств, подходящих для их применения в стационаре и в амбулаторной хирургии, пробу крови, полученную путем венопункции, забирают в шприц (или аналогичное устройство), содержащий коагулирующую композицию, включающую активатор протромбина, или по существу, состоящую, или состоящую из активатора протромбина, где получение такой композиции достигается за ~30 секунд. Конструкция этого устройства позволяет осуществлять фильтрацию или центрифугирование для быстрого отделения сыворотки от сгустка. Полученную таким образом сыворотку используют в уже существующих микрофлюидизаторах для проведения биохимических или других лабораторных анализов, причем, ряд возможных анализов возрастает, если в этих уже существующих устройствах для экспресс-теста, анализируемой пробой является сыворотка, а не плазма. Кроме того, проба сыворотки может быть сохранена для последующего анализа в клинической лаборатории.
Фильтрующее устройство в описанном выше шприце может иметь фильтрующий механизм, который через 5 минут позволяет подавать сыворотку в секцию для анализа. В соответствии с этим, шприц может быть разделен на отделения, как проиллюстрировано на фигуре 62, где указанный шприц имеет следующие обозначенные детали:
A - входное отверстие, имеющее иглу-адаптер для забора крови, который должен отвинчиваться для уменьшения размера выступающей части;
B - отверстие для закапывания сыворотки или входное отверстие для иглы с пробой для экспресс-теста;
C - клапаны, пропускающие кровь и останавливающие подачу крови в отделение с сывороткой;
D - поршневой фильтр, который должен выталкивать сыворотку в отделение для сыворотки (переднюю часть шприца);
E - отверстие для подачи крови в отделение для крови;
F - отделение, в котором присутствуют ионы, способствующие свертыванию крови.
На фигуре 62, элемент G покрыт коагулирующей композицией на своей внутренней стороне для инициации процесса свертывания на данном участке. Затем, путем нажима, сыворотка проталкивается через фильтр (D).
В другом варианте, такое устройство для экспресс-теста включает капиллярную систему, где часть этого устройства покрыта коагулирующей композицией, содержащей активатор протромбина и абсорбент, или по существу, состоящей, или состоящей из указанного активатора и абсорбента, и может проталкивать сыворотку в реакционную камеру для анализа.
В другом таком устройстве, коагулирующая композиция, содержащая активатор протромбина, или по существу, состоящая, или состоящая из указанного активатора протромбина, может быть связана с мембраной микрофлюидизатора так, чтобы это приводило к быстрому свертыванию капелек крови, присутствующих на мембране. Полученная таким образом сыворотка диффундирует в устройство, где ее анализируют вместо плазмы, которую обычно анализируют в таких устройствах.
Краткое описание примеров
Своевременное получение пробы, подходящей для анализа, является главным фактором, учитываемым специалистами по оснащению клинических биохимических лабораторий. Известно, что сыворотка является более чистой пробой, но поскольку для ее полного свертывания требуется время (для полного свертывания в большинстве современных коммерчески доступных пробирок необходимо 30 минут плюс время на проведения аналиаза в соответствии со стандартными протоколами), а число пациентов, которым проводят антикоагулирующую терапию в последнее время постоянно возрастает, то обычно используют плазму, особенно, в клиниках. Однако в пробах плазмы может происходить латентное свертывание (свертывание после центрифугирования), что приводит к ошибкам в анализах и отодвигает время получения важных результатов. Некоторые из этих проблем обсуждаются в приведенных выше примерах.
Результаты, приведенные в вышеуказанных примерах, также показали, что применение активаторов протромбина позволяет очень быстро получить высококачественную сыворотку из проб крови у пациентов широкого ряда, включая пациентов, подвергавшихся лечению антикоагулянтами. Таким образом, предлагается подходящая альтернатива пробиркам для плазмы с литий-гепарином и стандартным пробиркам для сыворотки, а именно предлагаются пробирки, в которых:
- завершение процесса свертывания происходит приблизительно за <5 минут (время, необходимое для доставки проб в лабораторию), что позволяет быстро проводить анализ после забора проб крови, и, в свою очередь снизить время на ее анализ по сравнению с временем, необходимым для анализа проб плазмы в пробирках для плазмы, и улучшить результаты анализов по сравнению с результатами, получаемыми в большинстве современных пробирок для сыворотки;
- и в то же время, это дает возможность получить выкококачественные пробы сыворотки из крови, взятой у здоровых индивидуумов и у всех индивидуумов, подвергавшихся лечению антикоагулянтами, где в указанных пробах в клинических условиях будет происходить минимальное взаимодействие аналита с клеточным дебрисом и/или будет сведено до минимума образование латентных микросгустков; и
- получить одну пробу сыворотки, которая может быть использована для очень широкого ряда анализов, обычно проводимых в клинических условиях; причем, проба сыворотки имеет преимущество перед пробой плазмы в анализах на аналиты, а получение всего одной пробы уменьшит потребление дефицитных ресурсов (позволит снизить количество крови, забираемой у пациентов в критическом состоянии, сэкономить рабочее время и снизить материальные затраты благодаря приготовлению меньшего числа пробирок для забора крови).
Настоящее описание приводится в целях иллюстрации предпочтительных вариантов осуществления изобретения, и не должно рассматриваться как ограничение изобретения каким-либо вариантом или конкретным набором признаков. Для каждого специалиста очевидно, что, исходя из описания настоящей заявки, в конкретные варианты настоящего изобретения могут быть внесены различные модификации и изменения, не выходящие за рамки объема настоящего изобретения. Все такие модификации и изменения входят в объем прилагаемой формулы изобретения.
Библиография
Altschul, S. F., Madden, T. L., Schäffer, A. A., Zhang, J., Zhang, Z., Miller, W., Lipman, D. J., “Gapped BLAST and PSI-BLAST: a new generation of protein database search programs.” Nucleic Acids Res. 1997 Sep 1; 25(17): 3389-402.
Arkin, A. P., Youvan, D. C., “An algorithm for protein engineering: simulations of recursive ensemble mutagenesis” 1992 Proc. Natl. Acad. Sci. USA 89: 7811-7815.
Atherton, E., Shephard, R. C., Solid Phase Peptide Synthesis - A Practical Approach 1989, IRL Press, Oxford England.
Austen, D. E., Rhymes, I. L., “Laboratory manual of blood coagulation” (1975) Blackwell Scientific Publications, London, p37.
Bos, M. H. A., Boltz, M., St Pierre, L., Masci, P. P., de Jersey, J., Lavin, M. F., Camire, R. M., “Venom factor V from the common brown snake escapes hemostatic regulation through procoagulant adaptations” Blood 16 July 2009; 114(3): 686-692.
Camenzind, E., Bakker, W. H., Reijs, A., van Geijlswijk, I. M., Boersma, E., Kutryk, M. J., Krenning, E. P., Roelandt, J. R., Serruys, P. W., “Site-specific intracoronary heparin delivery in humans after balloon angioplasty. A radioisotopic assessment of regional pharmacokinetics.” Circulation 1997; 96: 154-65.
Ciuti, R., Rinaldi, G., “Serum and plasma compared for use in 19 common chemical tests performed in the Hitachi 737 analyzer.” Clin Chem. 1989; 35: 1562-3.
Cowley, D. M., Nagle, B. A., Chalmers, A. H., Sinton, T. J., “Effects of platelets on collection of specimens for assay of ammonia in plasma.” Clin Chem 1985; 31: 332.
Davidson, A. S., Darn, S. M., Sodi, R., “Can lithium heparin plasma be used for protein electrophoresis and paraprotein identification?” Ann Clin Biochem 2006; 43: 31-34.
Dayhoff, M. O., Schwartz, R. M., Orcutt, B. C., et al., “A model of evolutionary change in proteins. Matrices for determining distance relationships” 1978 In Atlas of protein sequence and structure (Dayhoff, M. O. ed.), vol5, pp345-358, National Biomedical Research Foundation, Washington DC.
Delagrave, S., Goldman, E. R., Youvan, D. C., “Recursive ensemble mutagenesis” Apr 1993 Protein Eng. 6(3): 327-31.
Devereux, J., Haeberli, P., Smithies, O., “A comprehensive set of sequence analysis programs for the VAX.” Nucleic Acids Res. 1984 Jan 11; 12(1 Pt 1): 387-95.
Dimeski, G., Masci, P.P., Trabi, M., Lavin, M.F., de Jersey, J., “Evaluation of the Becton-Dickinson rapid serum tube: does it provide a suitable alternative to lithium heparin plasma tubes?” Clin Chem Lab Med 2010; 48(5): 2111-2120.
Dimeski, G., Badrick, T., Flatman, R., Ormiston, B., “Roche IFCC Methods for Lactate Dehydrogenase Tested for Duplicate Errors with Greiner and Becton-Dickinson Lithium-Heparin and Greiner Serum Samples” Clin Chem 2004; 50(12): 2391-2392.
Dimeski, G., Carter, A., “Rare IgM Interference with Roche/Hitachi Modular Glucose and γ-Glutamyltransferase Methods in Heparin Samples” Clin Chem 2005; 51(11): 2202-2204.
Dimeski, G., Clague, A. E., Hickman, P. E., “Correcting and reporting of potassium results in haemolysed samples” Ann. Clin. Biochem. 2005; 42: 119-123.
Dimeski, G., McWhinney, B., Jones, B., Mason, R., Carter, A., “Extent of bilirubin interference in Beckman-Coulter creatinine methods.” Ann Clin Biochem 2008; 45:91-92.
Filippovich, I., Sorokina, N., St Pierre, L., Filght, S., de Jersey, J., Perry, N., Masci, P. P., Lavin, M. F. “Cloning and functional expression of venom prothrombin activator protease from Pseudonaja textilis with whole blood procoagulant activity” British Journal of Haematology 2005; 131: 237-246.
Gonnet, G. H., Cohen, M. A., Benner, S. A., “Exhaustive matching of the entire protein sequence database” Jun 5 1992 Science 256(5062): 1443-5.
Hartland, A. J., Neary, R. H., “Serum potassium is unreliable as an estimate of in vivo plasma potassium” Clin Chem 1999; 45:1091-1092.
Kini, R. M., Morita, T., Rosing, J., “Classification and Nomenclature of Prothrombin Activators Isolated from Snake Venoms” Thromb. Haemost. 2001 85:710-711.
Kini, R. M., “The intriguing world of prothrombin activators from snake venom” Toxicon (2005) 45: 1133-1145.
Kunkel, T. A., “Rapid and Efficient site-specific mutagenesis without phenotypic selection” 1985 Proc. Natl. Acad. Sci. USA, 82: 488-492.
Kunkel, T. A., Roberts, J. D., Zakour, R. A., “Rapid and Efficient site-specific mutagenesis without phenotypic selection” 1987 Methods in Enzymol. 154: 367-382.
Kuzmic, P., “Program DYNAFIT for the Analysis of Enzyme Kinetic Data: Application to HIV Proteinase” 1996 Anal. Biochem. 237: 260-273.
Lavin, M. F., Masci, P. P., “Prothrombinase complexes with different physiological roles” Thromb Haemost 2009; 102: 421-423.
Masci, P. P., “The Effects of Australian Snake Venoms on Coagulation and Fibrinolysis” Thesis for Masters of Science in the subject of Biochemistry, July 1986, University of Queensland, St Lucia, Brisbane, Australia.
Masci, P. P., Whitaker, A. N., de Jersey, J., “Purification and characterization of a prothrombin activator from the venom of the Australian brown snake, Pseudonaja textilis textilis” Biochem. Int. 1988; 17(5):825-835.
Miles, R. R., Roberts, R. F., Putnam, A. R., Roberts, W. L., “Comparison of serum and heparinized plasma samples for measurement of chemistry analytes.” Clin Chem 2004; 50: 1704-5.
National Pathology Laboratory Accreditation Advisory Council - Requirements for the Retention of Laboratory Records and Diagnostic Material (Fifth Edition 2009), available online at:
http://www.health.gov.au/internet/main/publishing.nsf.Content/0392138A9970DFD1CA257371000D9200/$File/NPAAC%20Pub%20-%20Ret%20Records%20040110.pdf
Nishida, S., Fujita, T., Kohno, N., Atoda, H., Morita, T., Takeya, H., Kido, I., Paine, M. J. I., Kawabata, S-i., Iwanaga, S. “cDNA Cloning and Deduced Amino Acid Sequence of Prothrombin Activator (Ecarin) from Kenyan Echis carinatus venom.” Biochemistry 1995; 34: 1771-1778.
Morita, T., Iwanaga, S., “Prothrombin activator from Echis carinatus venom” Meth Enzymol 1981; 80-pt. C: 303-311.
Nicholson, J., Mirtschin, P., Madaras, F., Venning, M., Kokkinn, M., “Digestive properties of the venom of the Australian Coastal Taipan, Oxyuranus scultellatus (Peters, 1867)” Toxicon 2006: 48: 422-428.
O’Keane M. P., Cunningham, S. K., “Evaluation of three different specimen types (serum, plasma lithium heparin and serum gel separator) for analysis of certain analytes: clinical significance of differences in results and efficiency in use.” Clin Chem Lab Med. 2006; 44: 662-8.
Parker, H. W., Grandison, A. G. C., “Snakes: A natural history” University of Queensland Press, St. Lucia, Queensland 1977: pp5, 59 and 87.
Roberge, J. Y., Beebe, X., Danishefsky, S. J., “A strategy for a convergent synthesis of N-linked glycopeptides on a solid support” Science 1995 269(5221); 202-204.
Rosing, J., Tans, G., “Inventory of Exogenous Prothrombin Activators” Thrombosis and Haemostasis (Stuttgart) 1991 65(2): 627-630.
Rosing, J., Tans, G., “Structural and Functional Properties of Snake Venom Prothrombin Activators” Toxicon 30(12): 1515-1527, 1992.
Sambrook, J., Russell, D. W., Molecular cloning. A laboratory manual (third edition) 2001; Cold Spring Harbor Laboratory Press.
Schieck, A., Kornalik, F., Habermann, E. “The prothrombin-activating principle from Echis carinatus venom. I. Preparation and biochemical properties” Naunyn-Schmiedeberg’s Arch Pharmacol. 1972; 272: 402-416.
Sheppard, C.A., Allen, R.C., Austin, G.E., Young, A.N., Ribeiro, M.A., Fantz, C.R., “Paraprotein interference in automated chemistry analyzers.” Clin Chem 2005 Jun;51(6): 1077-8.
Smith, G. F., Craft, T. J., “Heparin reacts stoichiometrically with thrombin during thrombin inhibition in human plasma.” Biochem. Biophys. Res. Commun. 1976; 71: 738-45.
Sonder, S. A., Fenton, J. W., “Thrombin specificity with tripeptide chromogenic substrates: comparison of human and bovine thrombins with and without fibrinogen clotting activities” Clin. Chem. 1986;32:934-7.
Speijer, H., Goversriemslag, J. W. P., Zwaal, R. F. A., Rosing, J., “Prothrombin activation by an activator from the venom of Oxyuranus scutellatus (Taipan snake)” J. Biol. Chem. 1986; 261(28): 3258-3267.
Starr, H., Rhodes, P., Lam-Po-Tang, P. R., Archer, G. T., “Prothrombin times: an evaluation of four thromboplastins and four machines.” Pathology 1980; 12: 567-574.
St Pierre, L., Masci, P., Filippovich, I., Sorokina, N., Marsh, N., Miller, D. J., Lavin, M. F., “Comparative Analysis of Prothrombin Activators from the Venom of Australian Elapids” Mol. Biol. Evol. 2005; 22(9): 1853-1864.
Tans, G., Govers-Riemslag, J. W., van Rijn, J. L., Rosing, J. J., “Purification and properties of a prothrombin activator from the venom of Notechis scutatus scutatus” Biol. Chem. 1985 Aug 5; 260(16): 9366-72.
Thorelli, E., Kaufman, R. J., Dahlbäck, B., “Cleavage requirements of factor V in tissue-factor induced thrombin generation.” Thromb. Haemost. 1998 Jul; 80(1) 92-98.
Wannaslip, N., Sribhen, K., Pussara, N., Hwanpuch, T., Wangchaijaroekit, S., Opartkiattikul, N., “Heparin is unsuitable anticoagulant for the detection of plasma ammonia.” Clin Chimica Acta 2006; 371: 196-7.
Watson, J. D., Hopkins, N. H., Roberts, J. W., Steitz, J. A., Weiner, A. M. Molecular Biology of the Gene. fourth edition, 1987 The Benjamin/Cummings Publishing Co., Inc., Menlo Park, California.
Yamada, D., Sekiya, F., Morita, T., “Isolation and Characterization of Carinactivase, a Novel Prothrombin Activator in Echis carinatus Venom with a Unique Catalytic Mechanism” J. Biol. Chem. 1996; 271(9): 5200-5207.
Yamada, D., Morita, T., “Purification and Characterization of a Ca2+-Dependent Prothrombin Activator, Multactivase, from the Venom of Echis multisquamatus” J. Biochem. 1997; 122: 991-997.
Yamanouye, N., Kerchove, C. M., Moura-da-Silva, A. M., Carneiro, S. M., Markus, R. P., “Long-term primary culture of secretory cells of Bothrops jararaca gland for venom production in vitro” Nature Protocols 2007; 1: 2763-2766.
Yonemura, H., Imamura, T., Soejima, K., Nakahara, Y., Morikawa, W., Ushio, Y., Kamachi, Y., Nakatake, H., Sugawara, K., Nakagaki, T., Nozaki, C., “Preparation of Recombinant α-Thrombin: High-Level Expression of Recombinant Human Prethrombin-2 and Its Activation by Recombinant Ecarin” J. Biochem. 2004; 135: 577-582.
Zubay, G., Biochemistry, third edition Wm.C. Brown Publishers, Oxford (1993).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ КОАГУЛОПАТИЙ С ИСПОЛЬЗОВАНИЕМ СУЛЬФАТИРОВАННЫХ ПОЛИСАХАРИДОВ | 2005 |
|
RU2347574C2 |
| Способ определения антикоагулянтного потенциала плазмы крови для диагностики предтромботических состояний | 2024 |
|
RU2835822C1 |
| Способ выявления дефицитов факторов свертывания крови методом тромбоэластометрии | 2019 |
|
RU2699798C1 |
| Способ контроля антикоагулянтной терапии | 2012 |
|
RU2607658C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ПОЛУЧЕНИЯ СЫВОРОТКИ С ТРОМБИНОМ ОТ ОДНОГО ДОНОРА | 2013 |
|
RU2589648C2 |
| Способ определения фибриногена при рекальцификации цитратной плазмы и оценка его функциональности | 2019 |
|
RU2703541C1 |
| ПРЯМОЙ ИНГИБИТОР ТРОМБИНА, ОБЛАДАЮЩИЙ АНТИПРОЛИФЕРАТИВНЫМ ДЕЙСТВИЕМ | 2007 |
|
RU2369615C2 |
| ДИАГНОСТИКА ТРОМБОЭМБОЛИЧЕСКИХ ЗАБОЛЕВАНИЙ ВЕН ПУТЕМ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ D-ДИМЕРОВ И РАСТВОРИМОГО ФИБРИНА | 2007 |
|
RU2475760C2 |
| Определение циркулирующего тромбина в тесте активации системы комплемента | 2019 |
|
RU2709341C1 |
| ДНК-АПТАМЕРЫ, ВЗАИМОДЕЙСТВУЮЩИЕ С ПРОТРОМБИНОМ | 2018 |
|
RU2703799C1 |













































































































































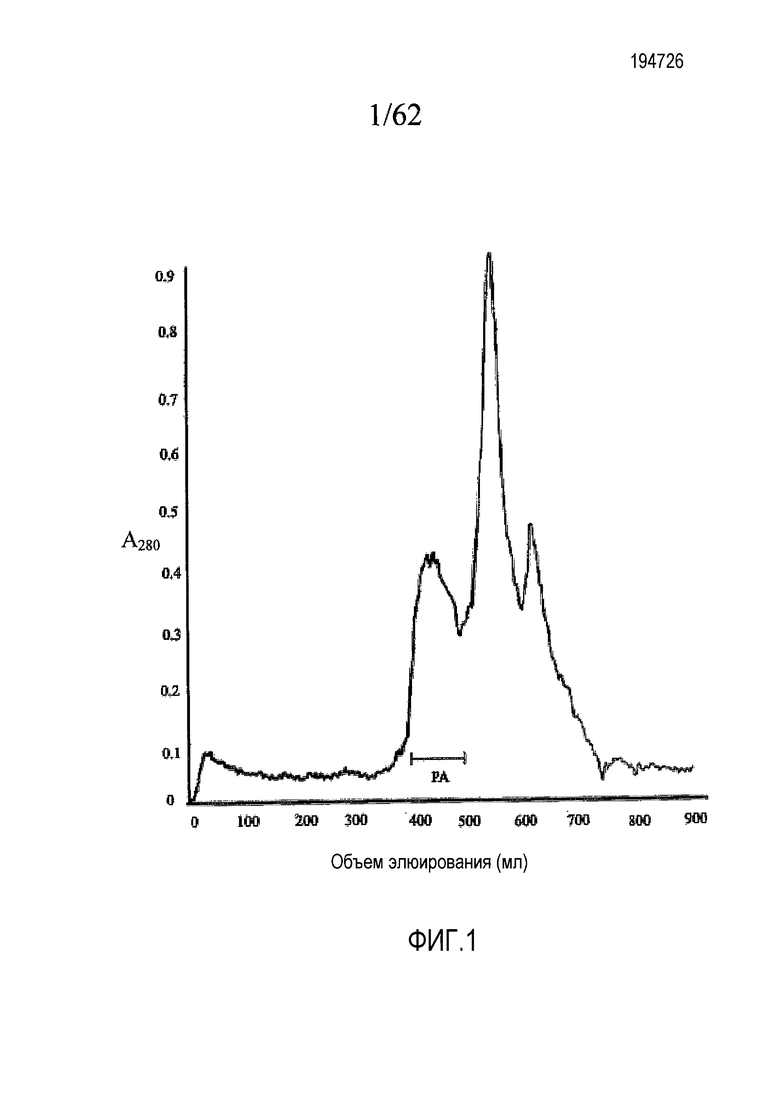
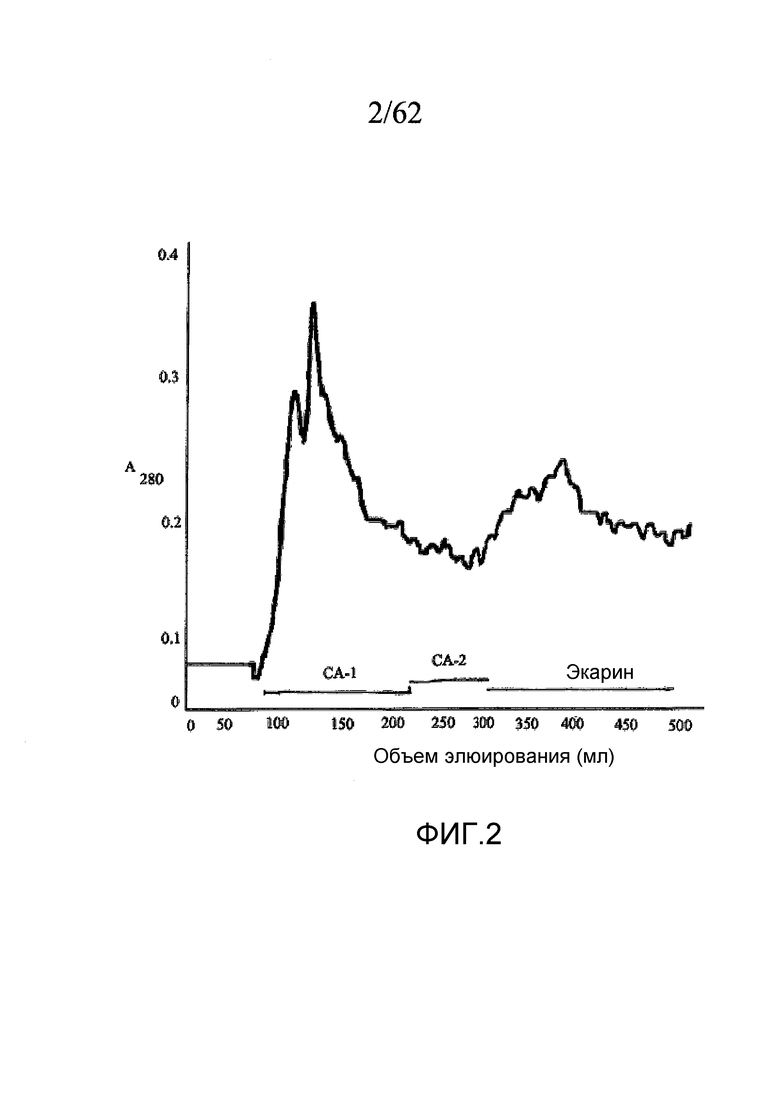
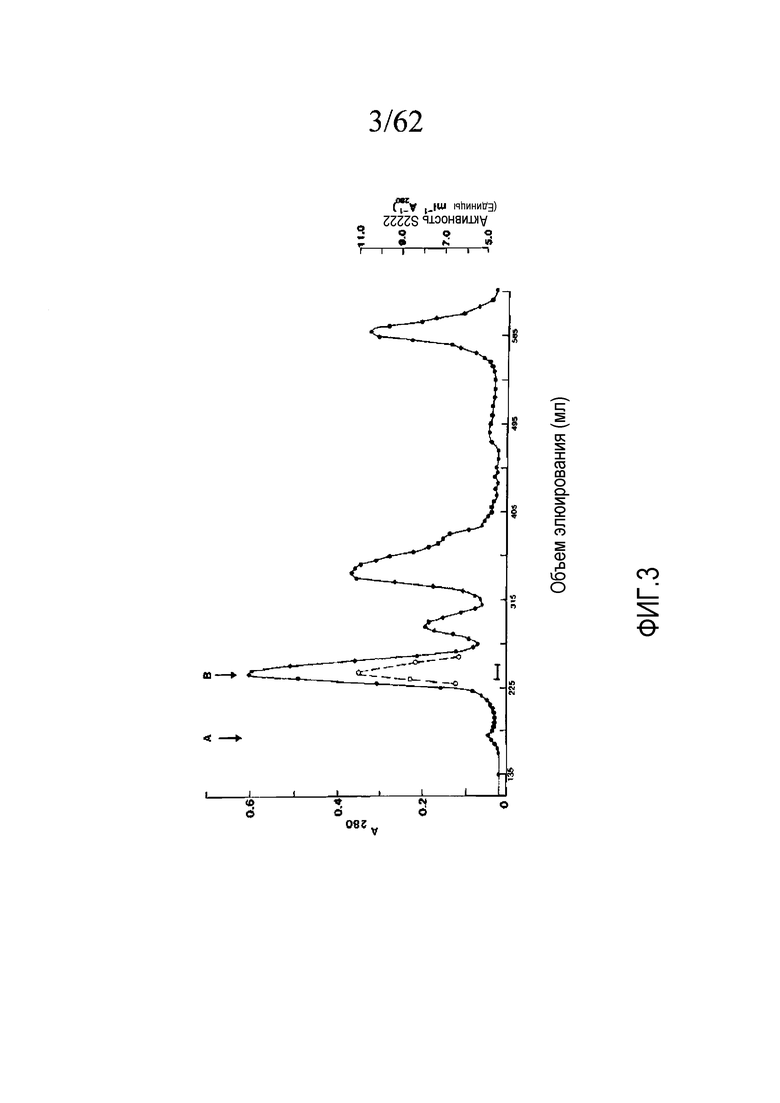
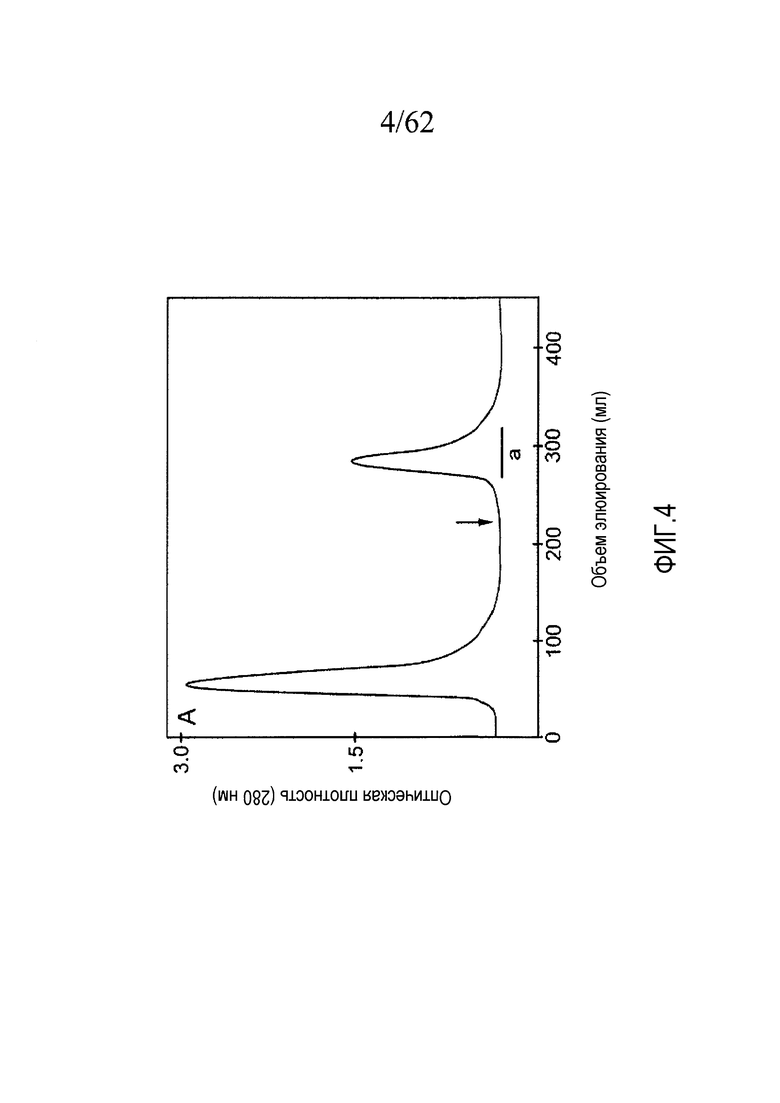
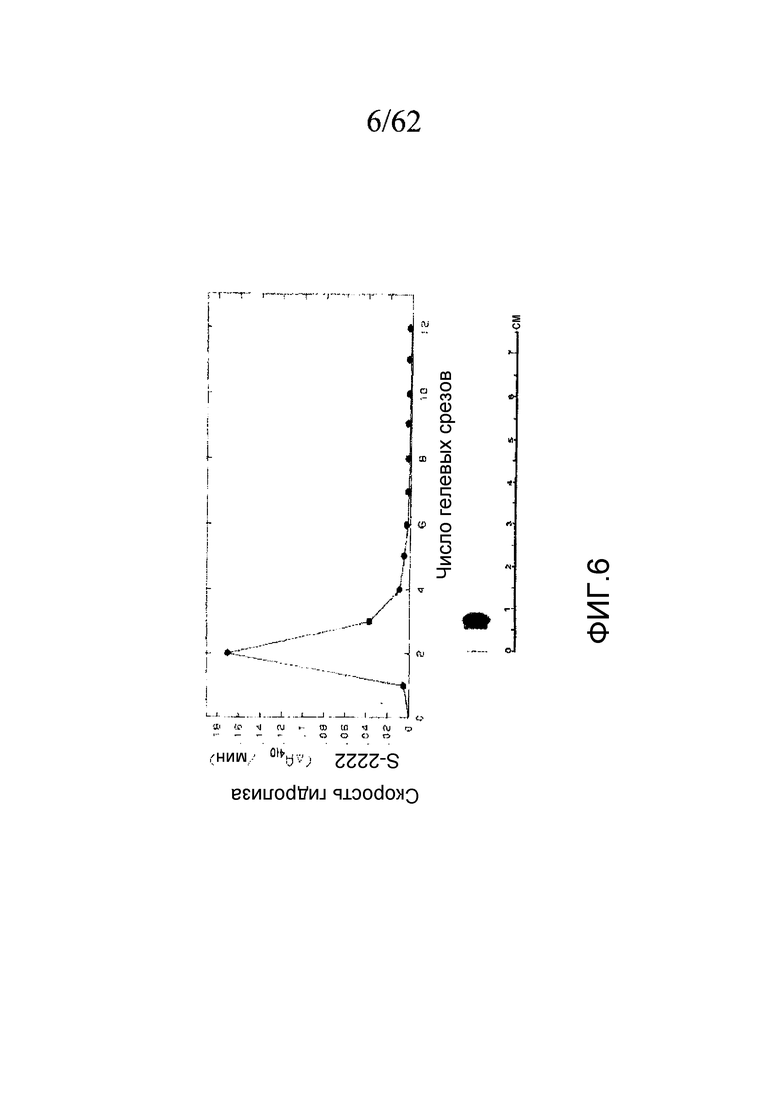
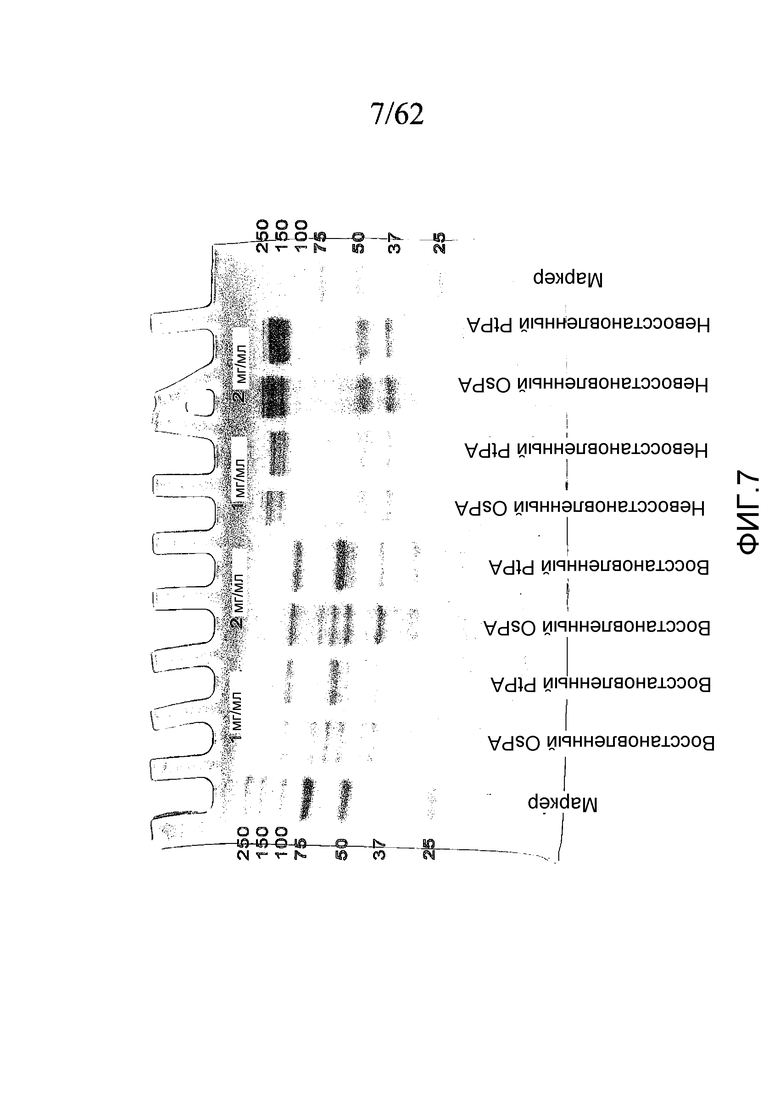
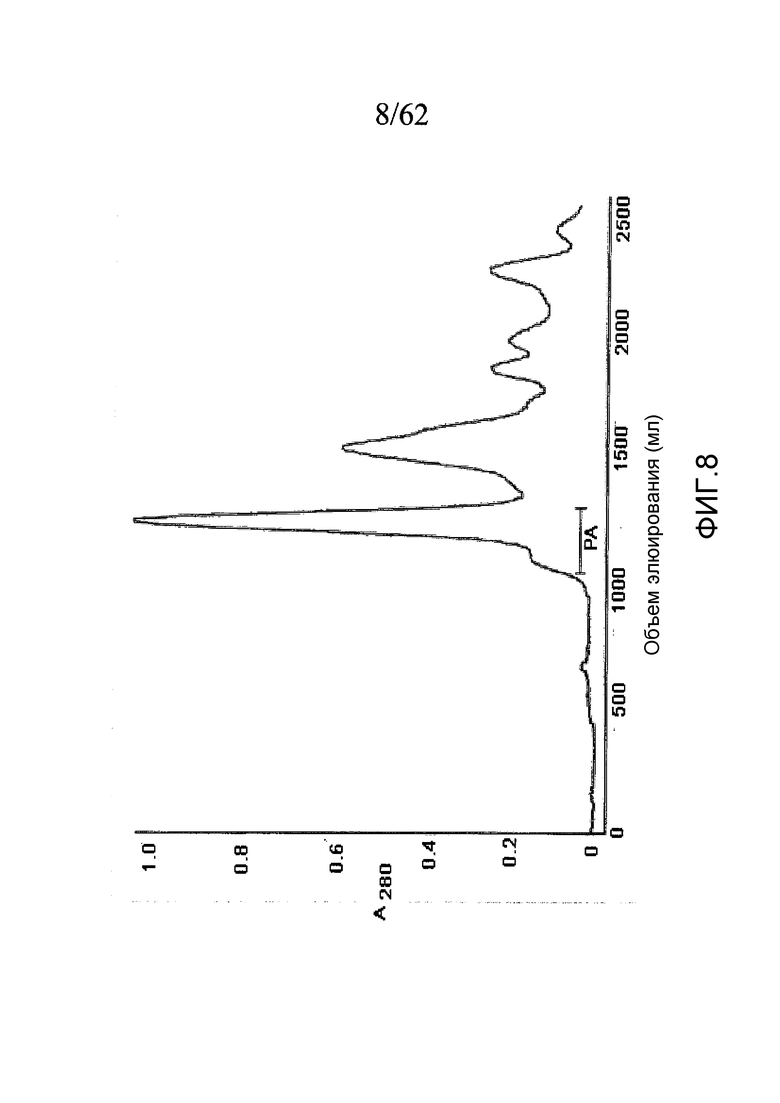
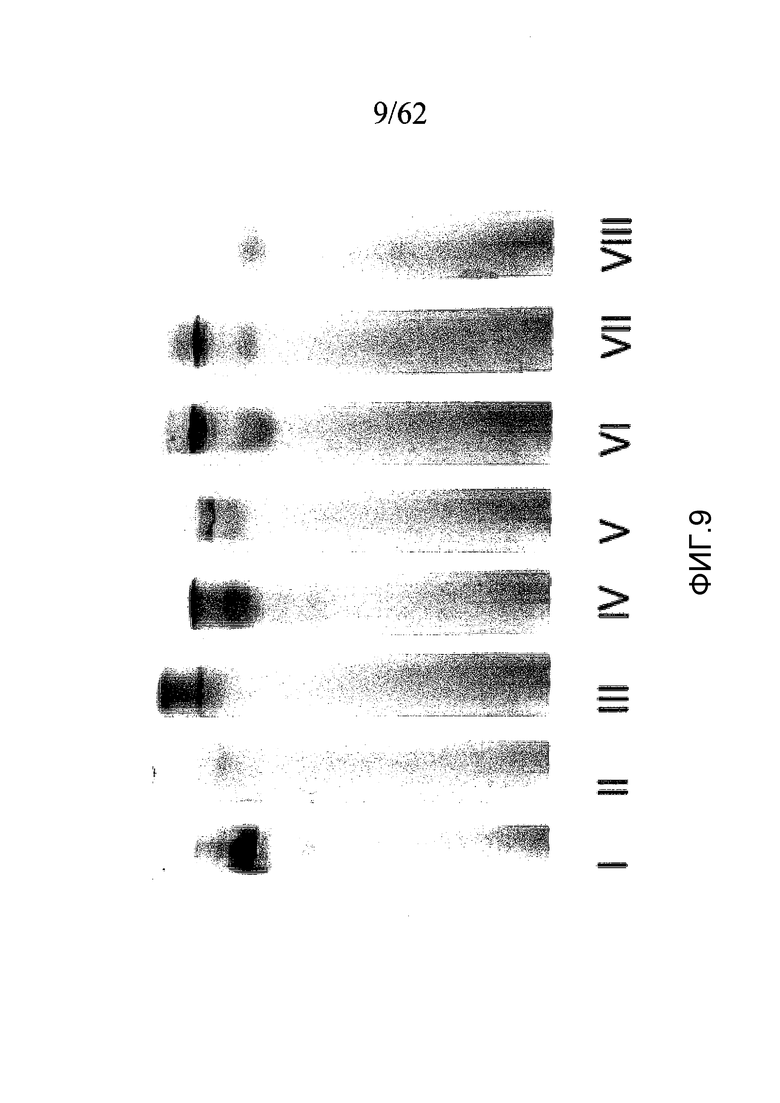
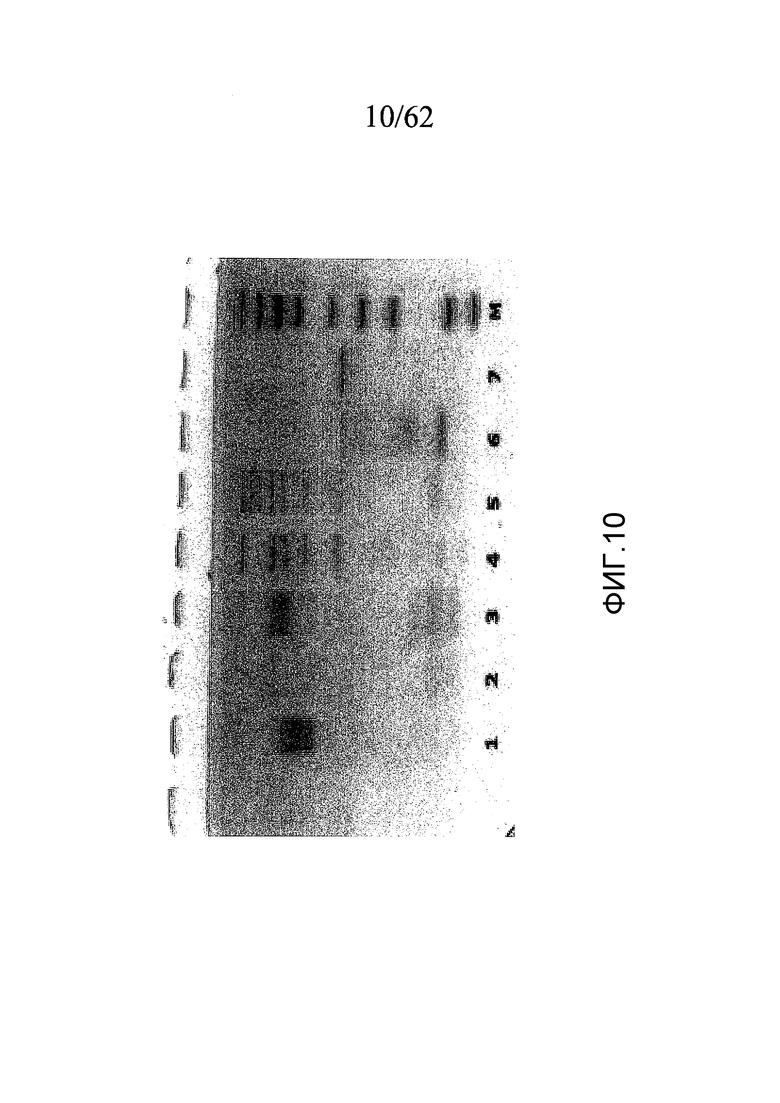
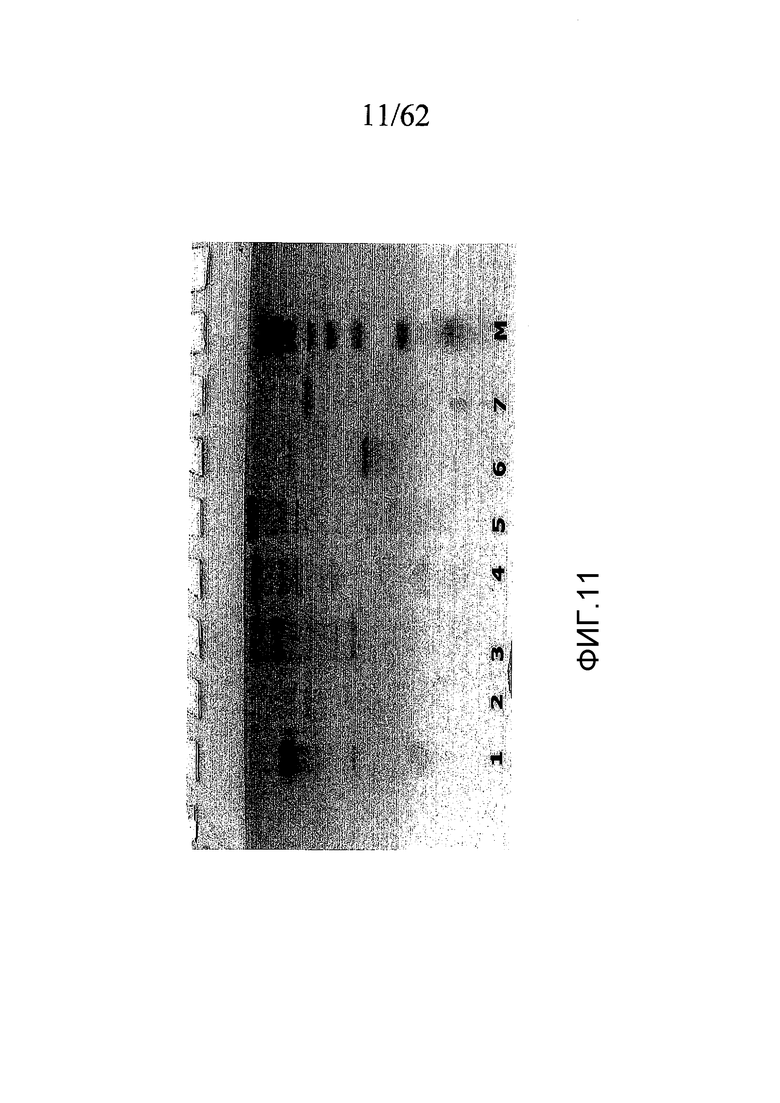
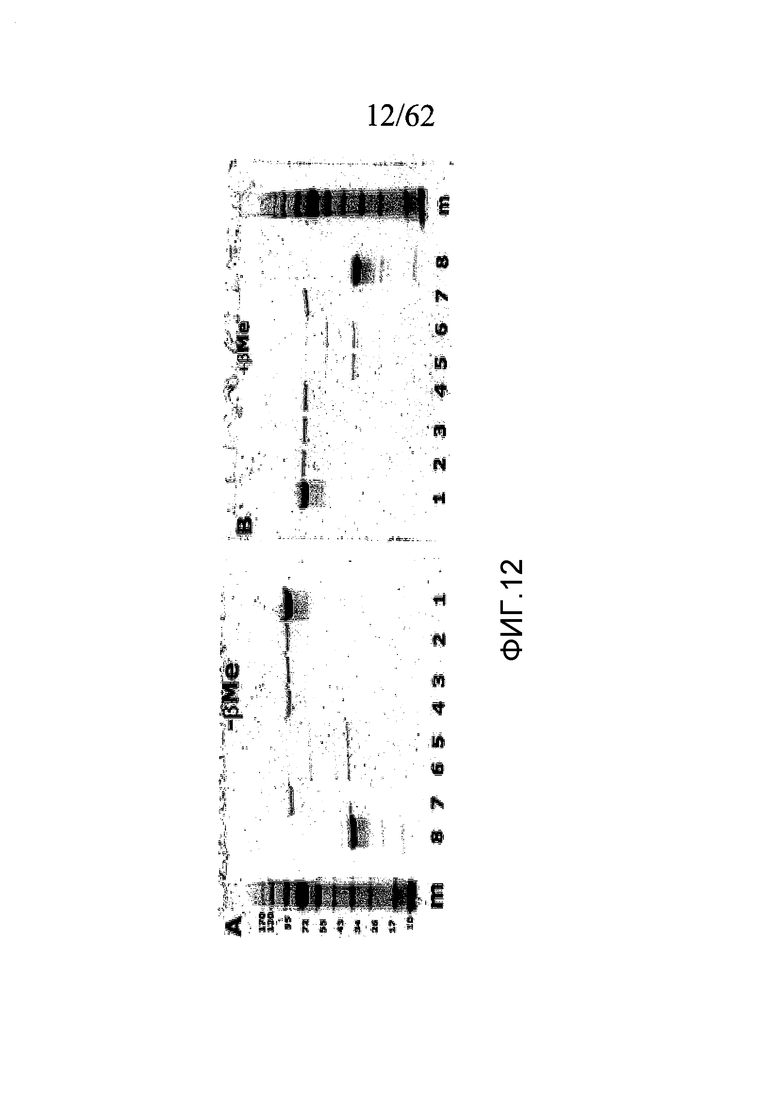
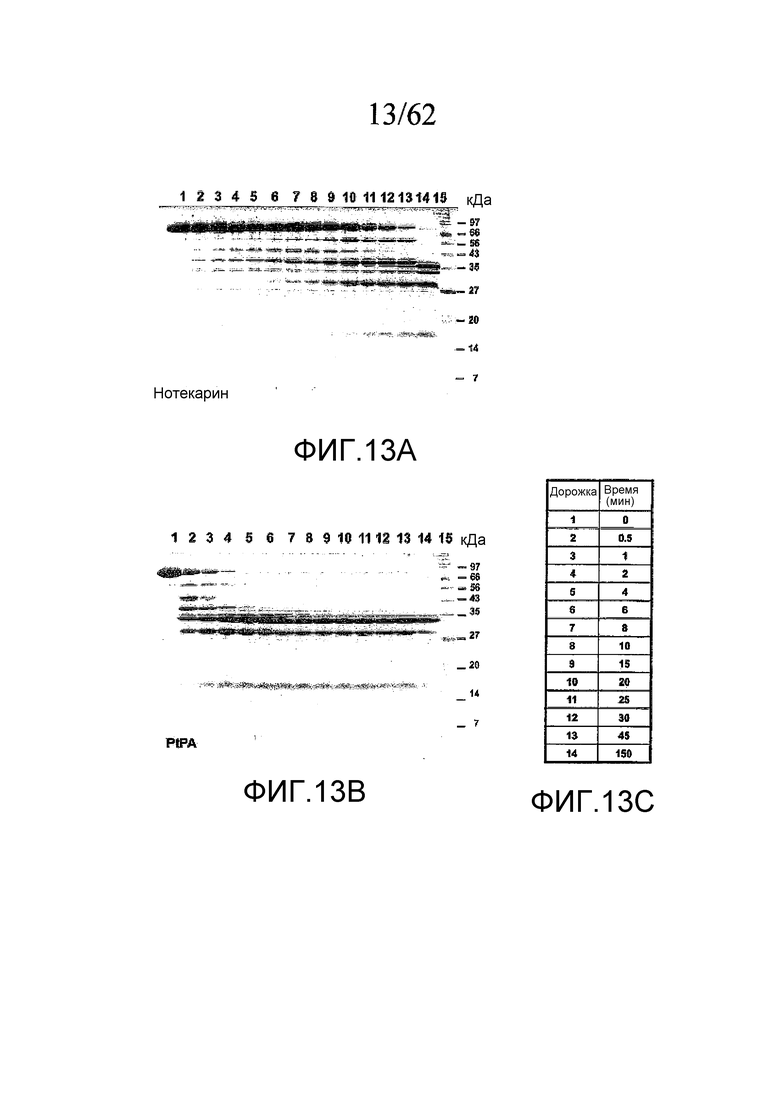
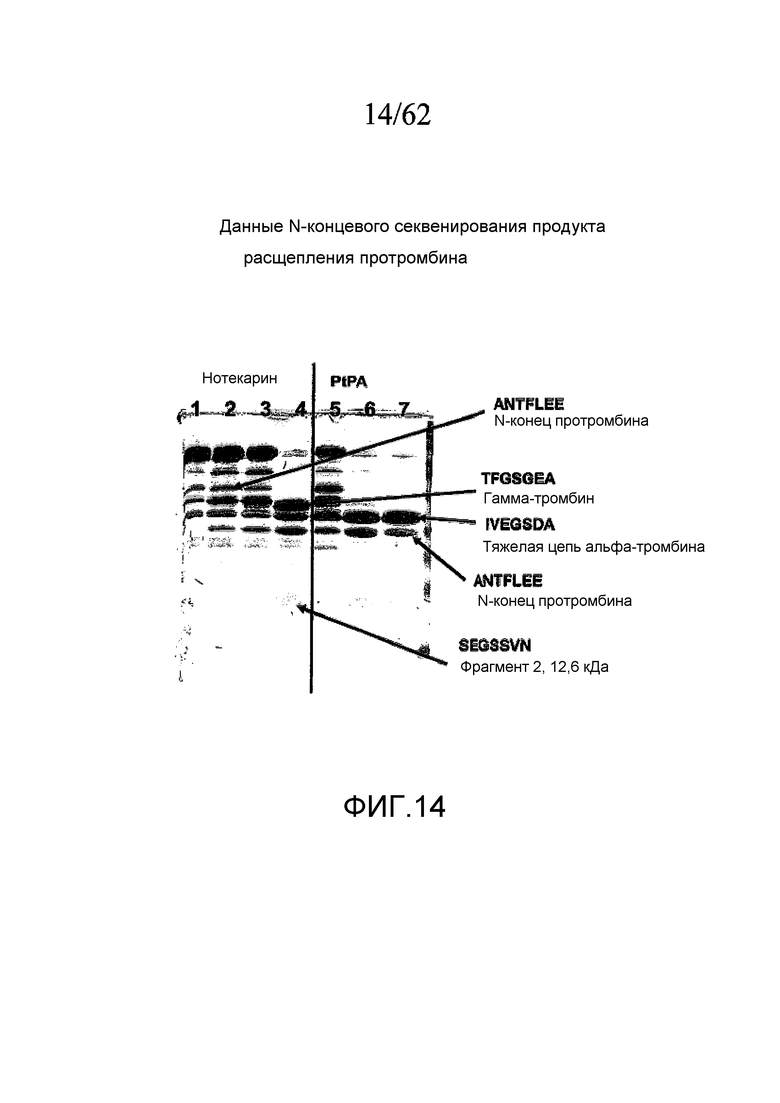
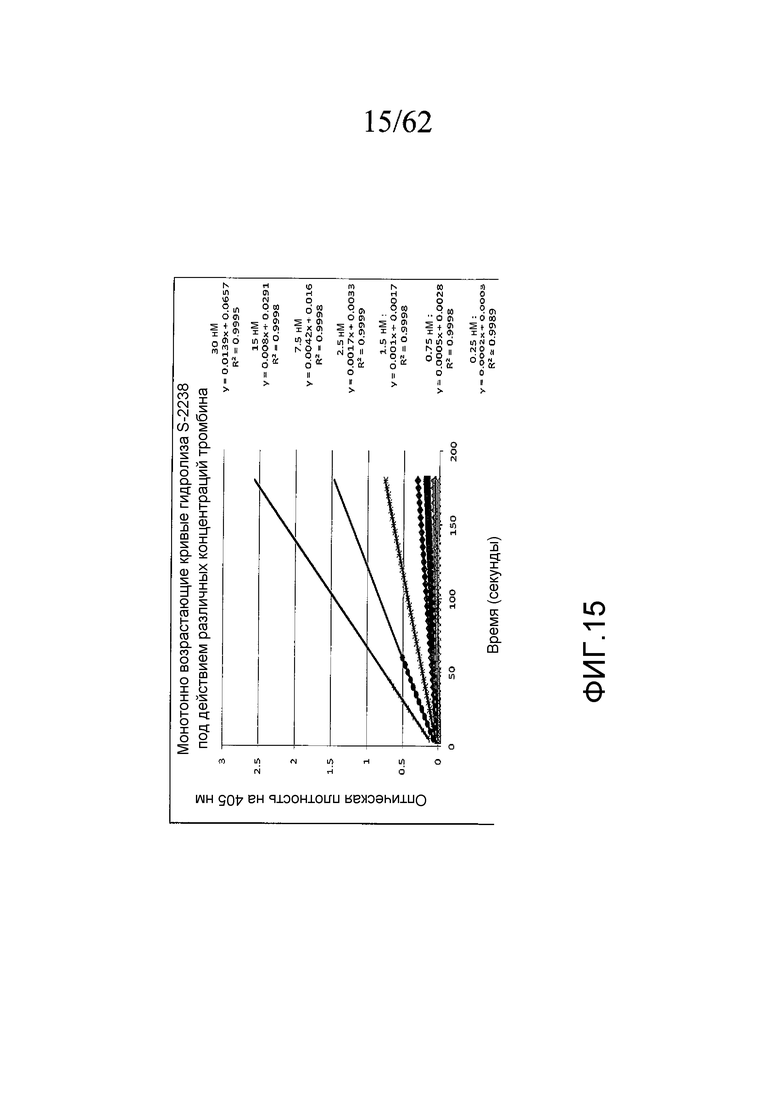
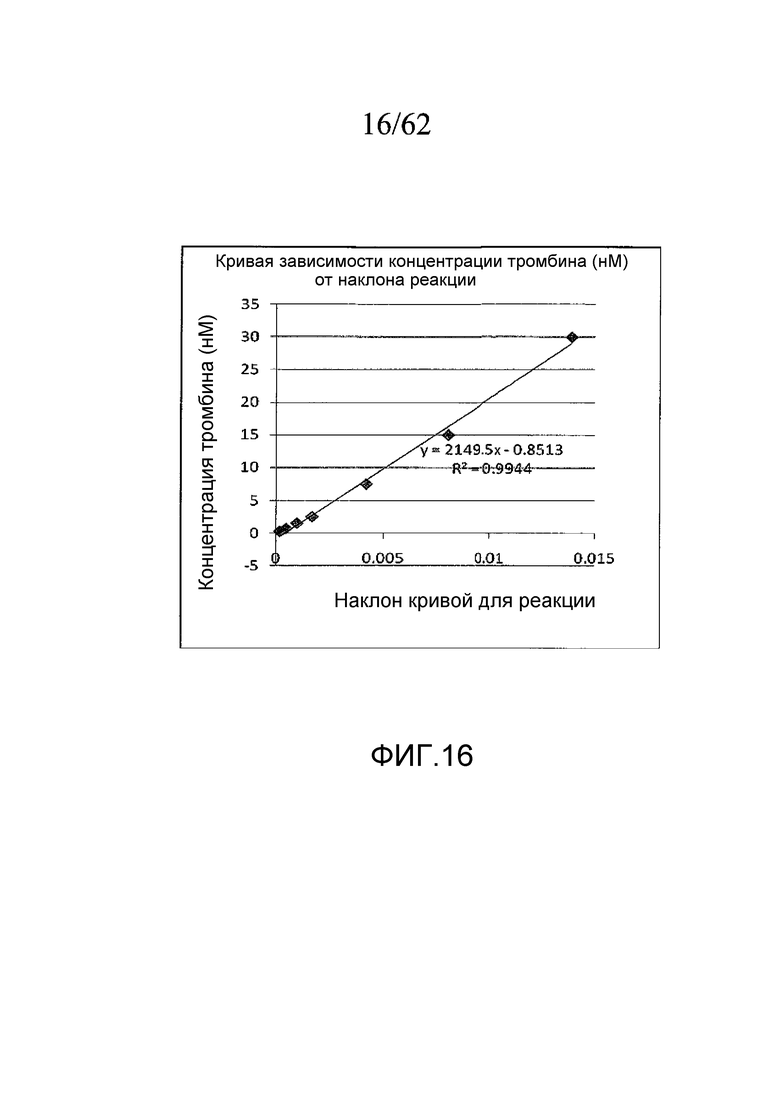
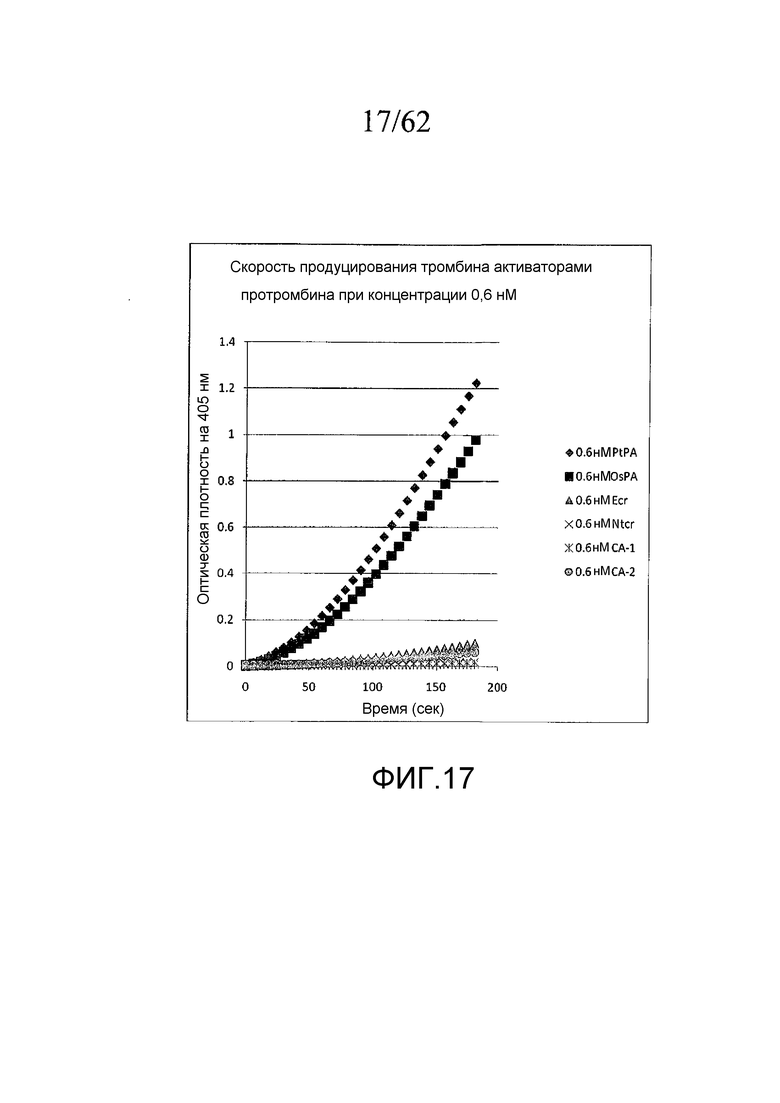
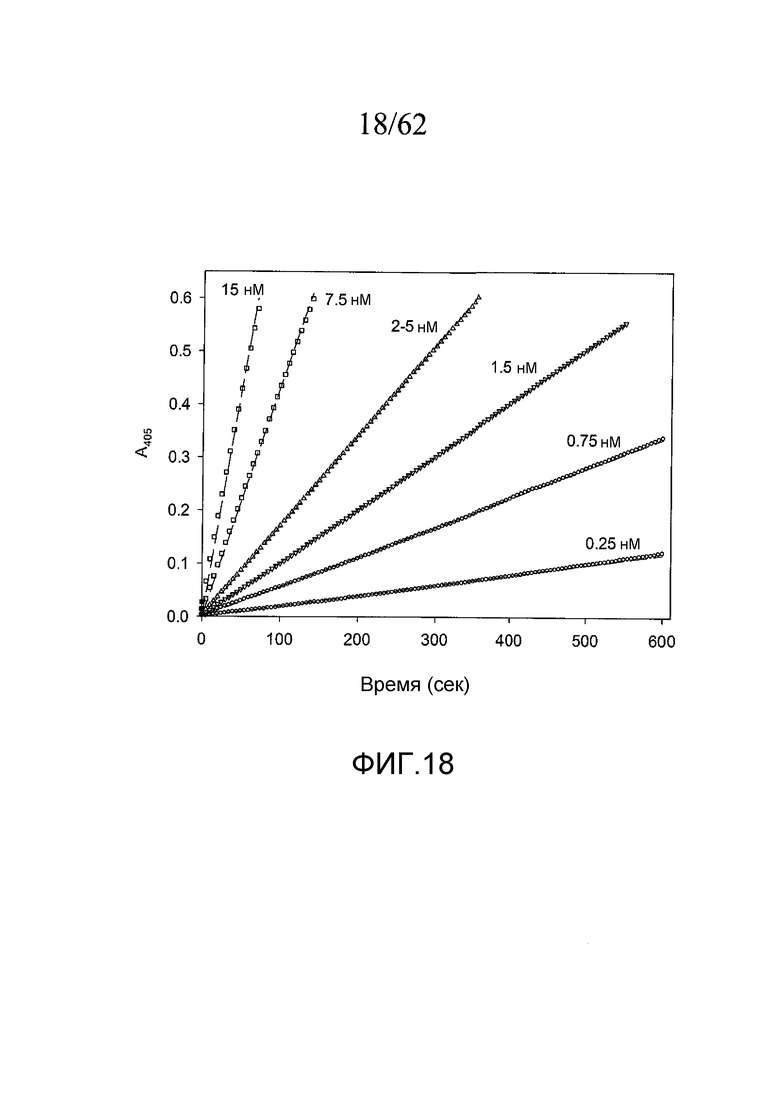
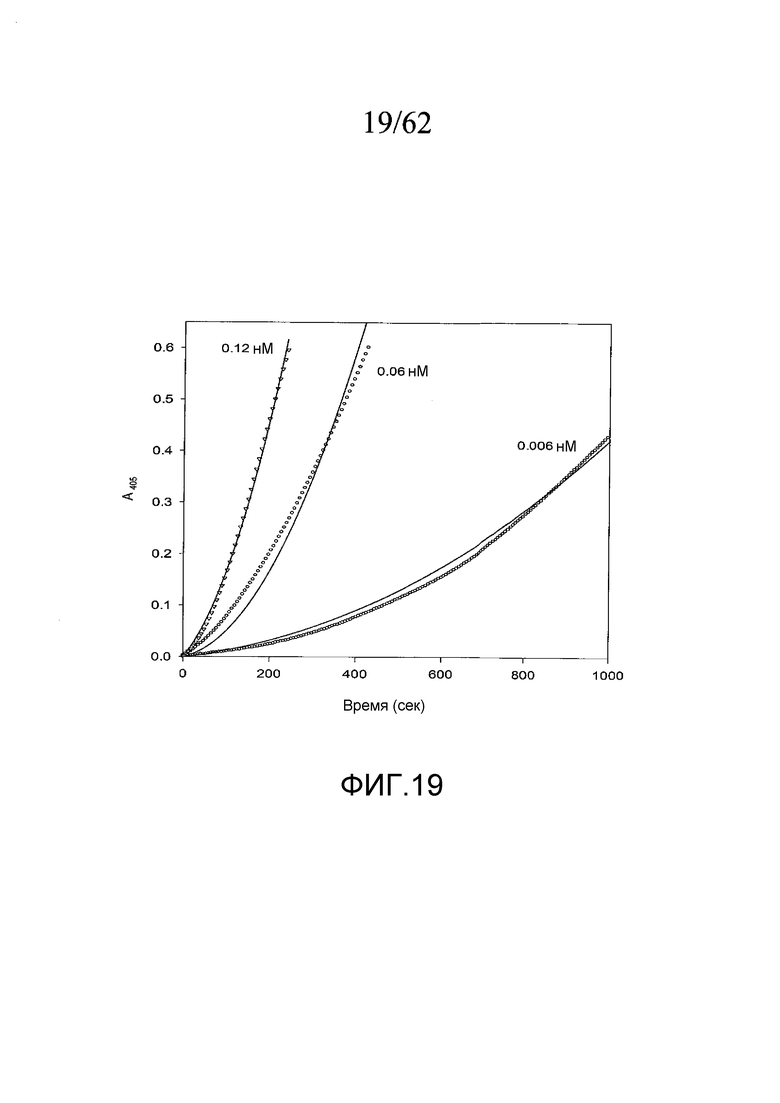
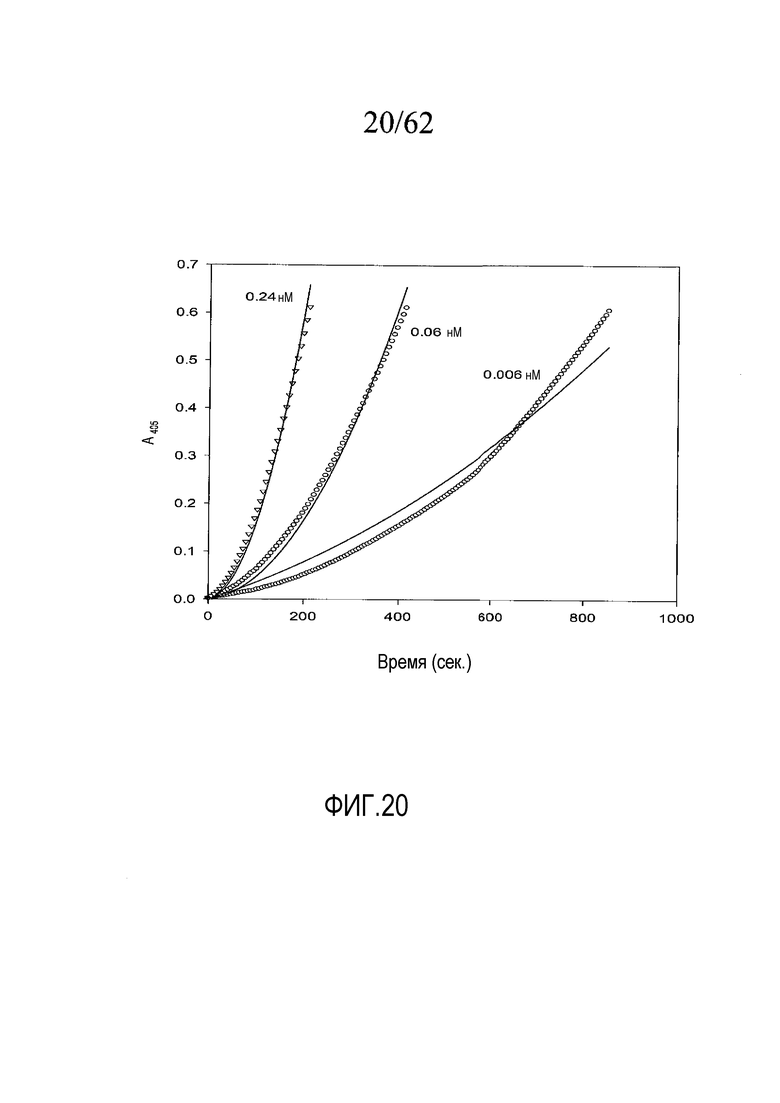
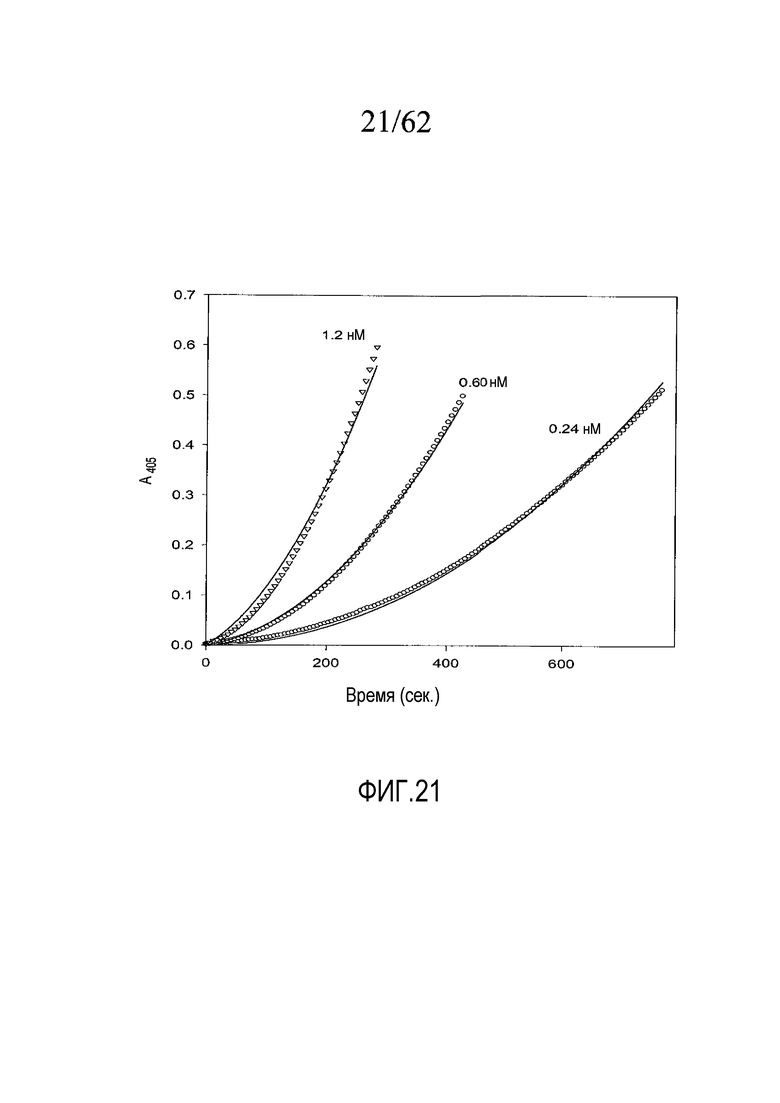
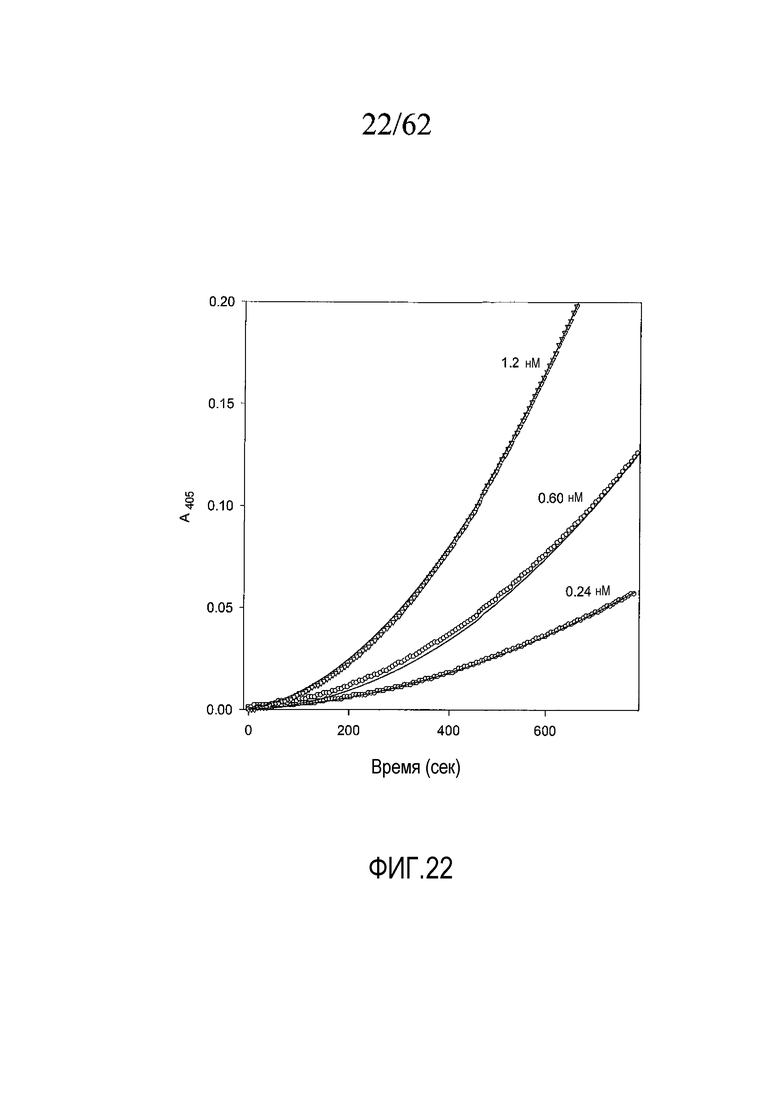
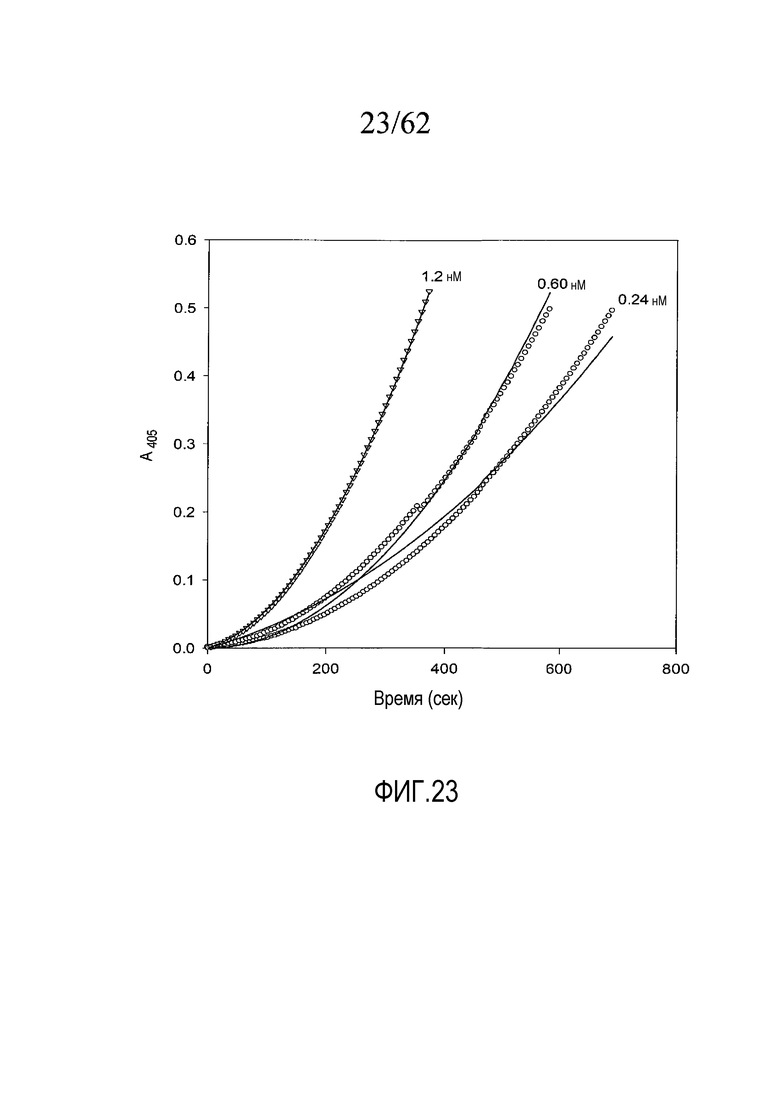
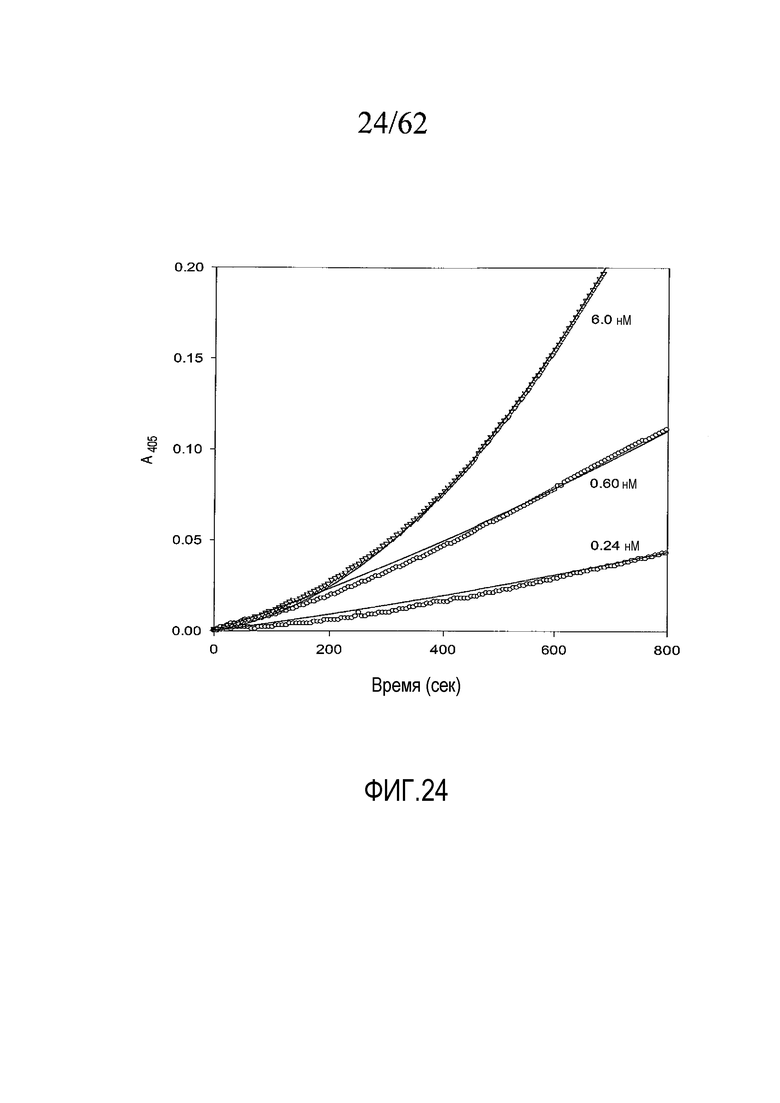
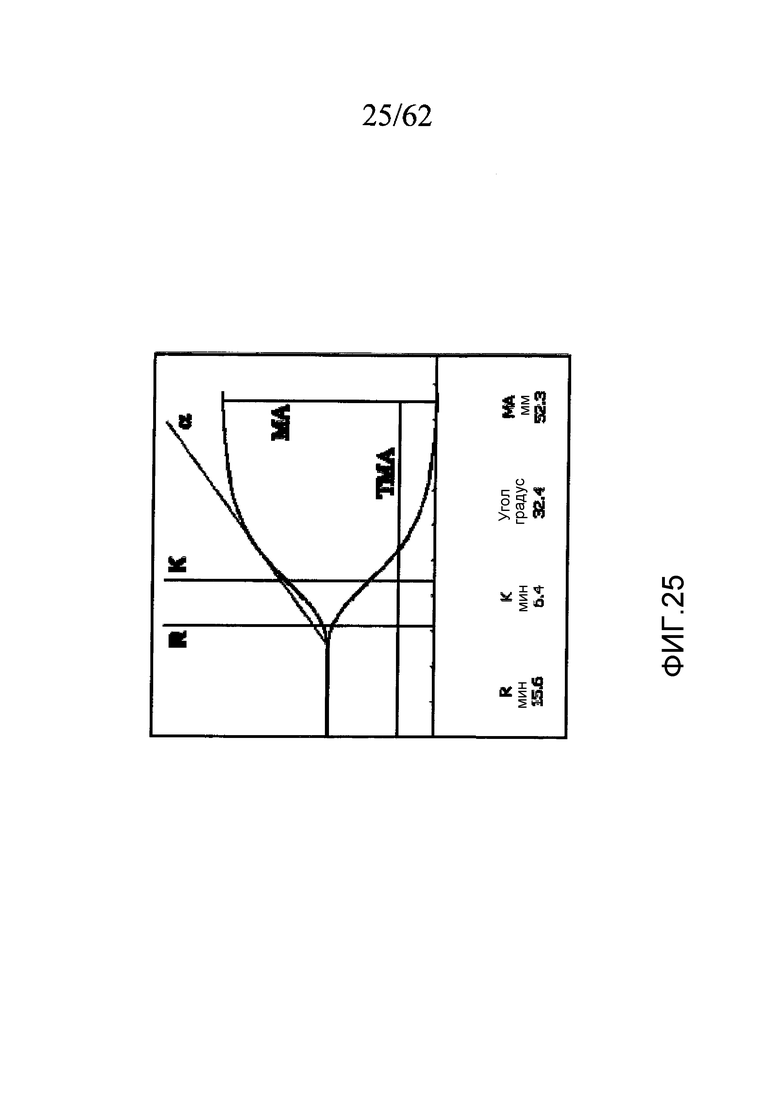
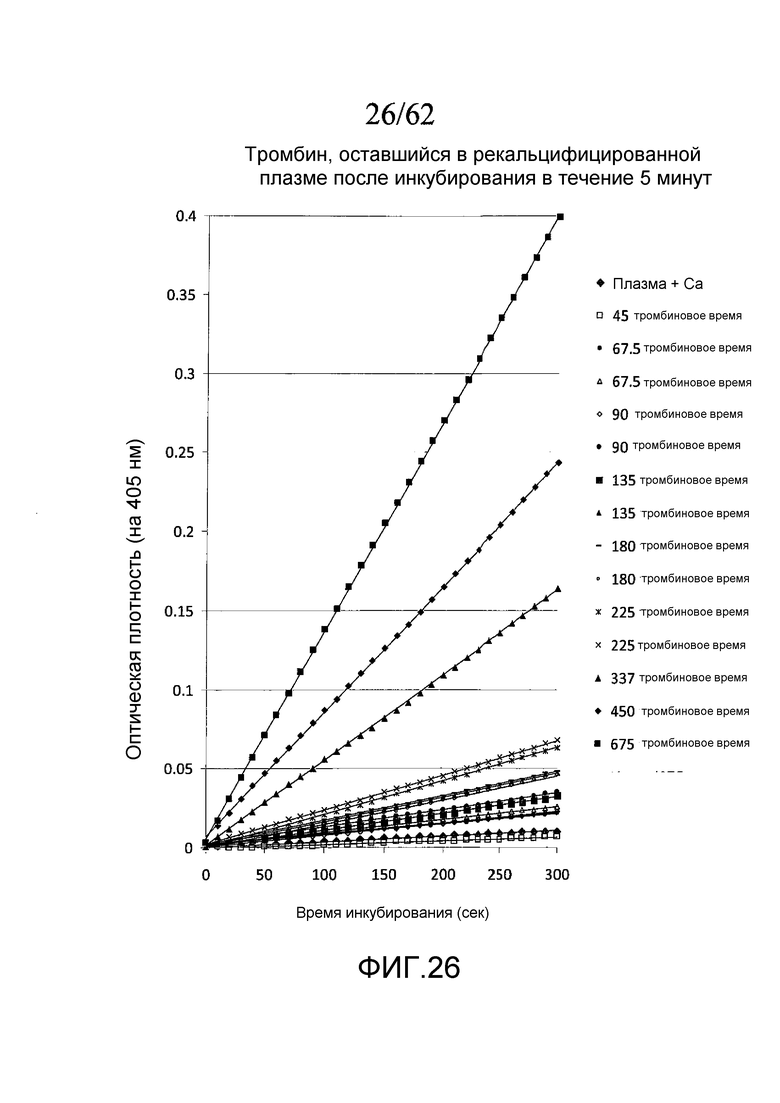

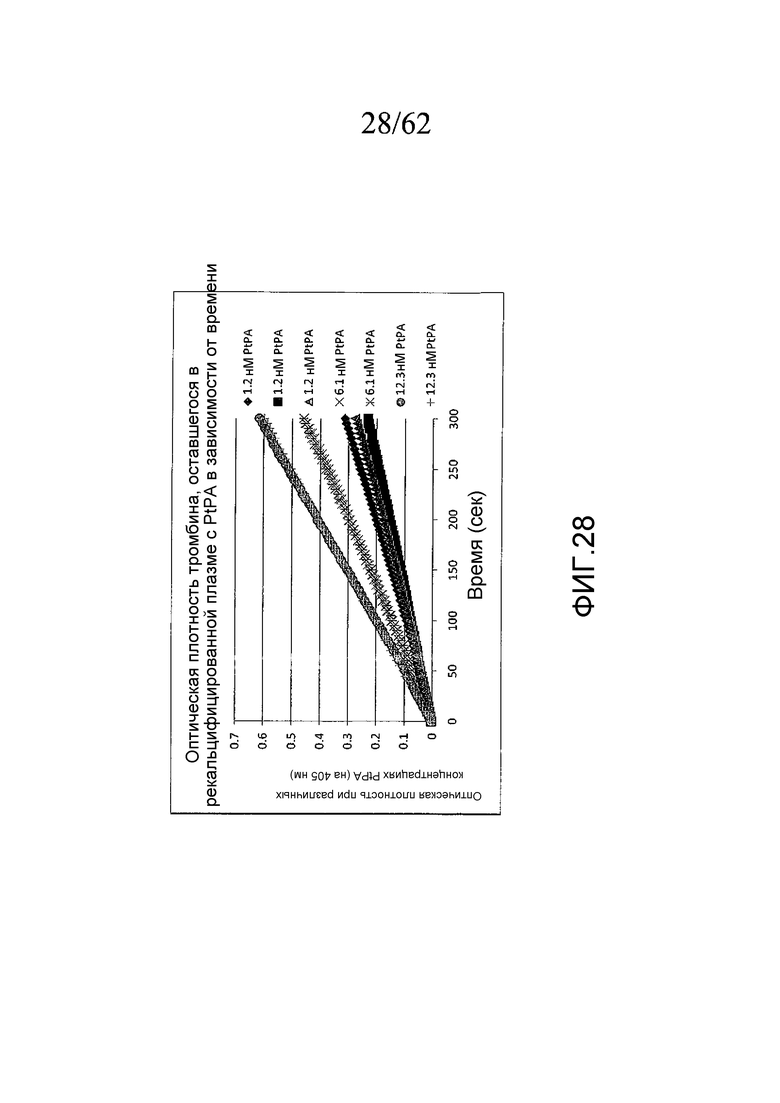
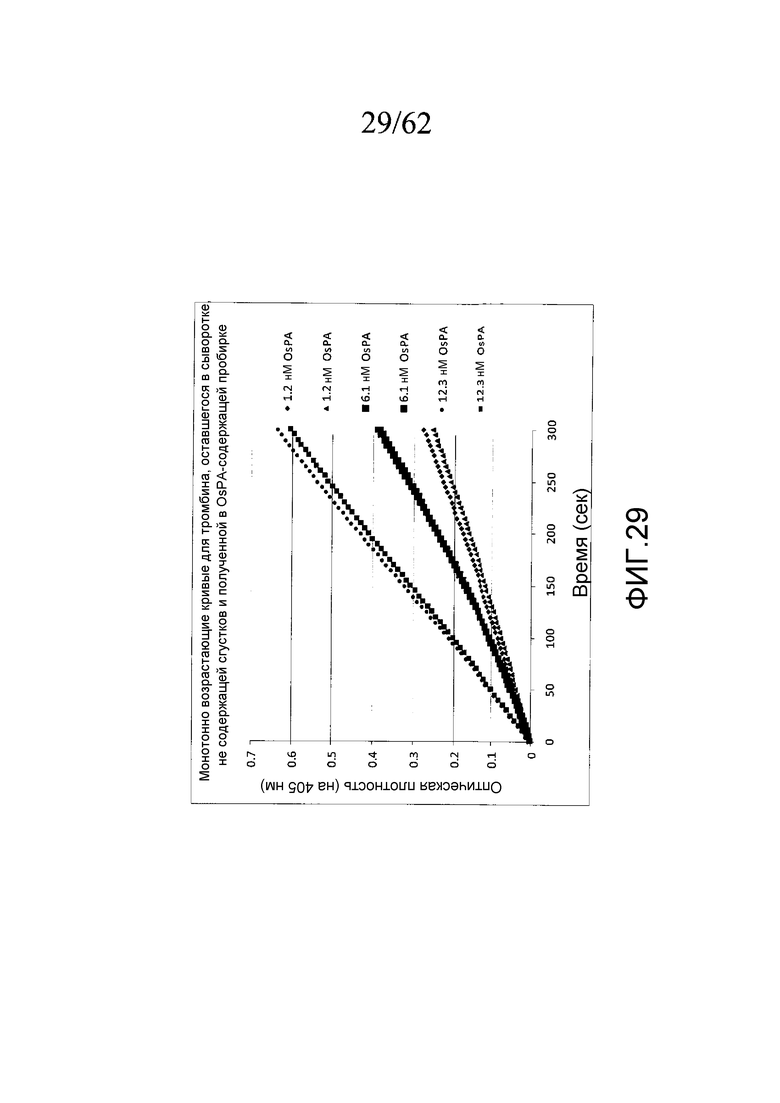
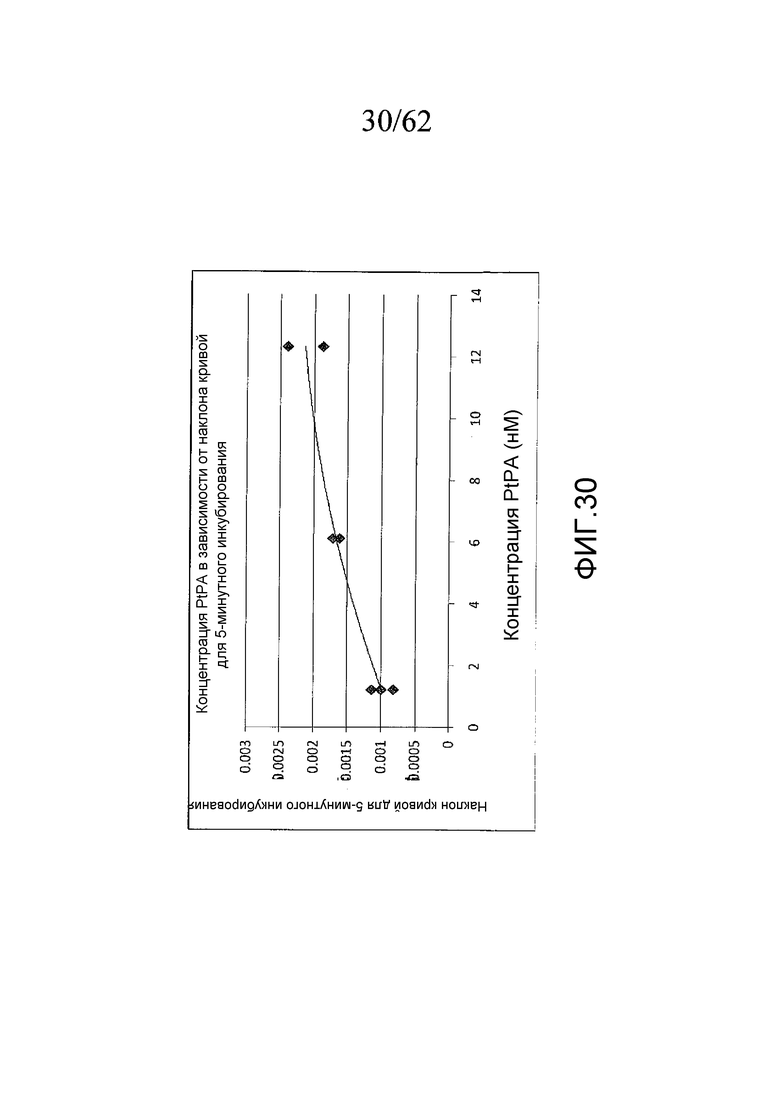
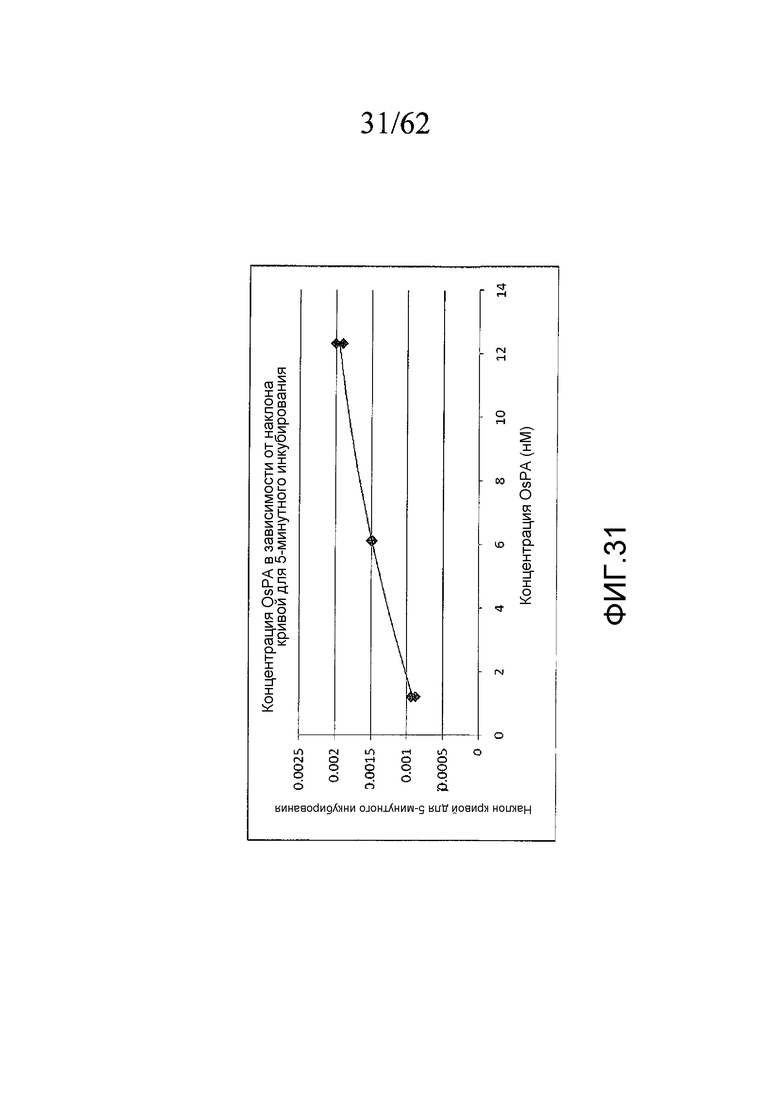
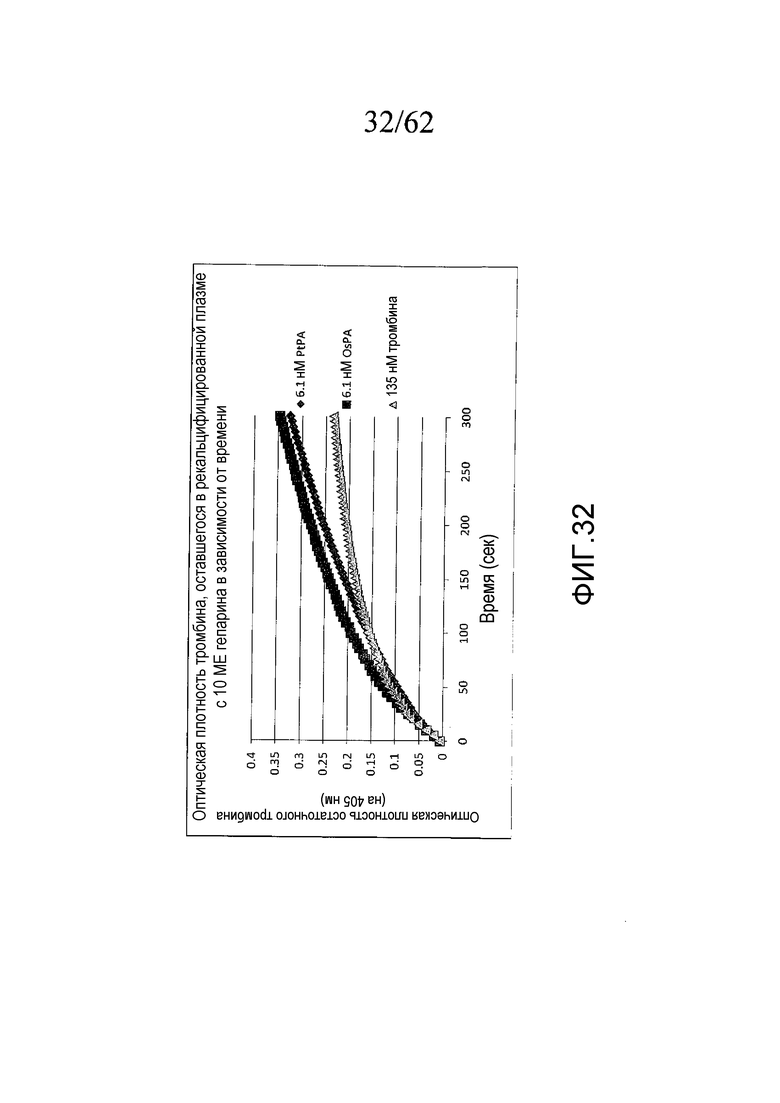
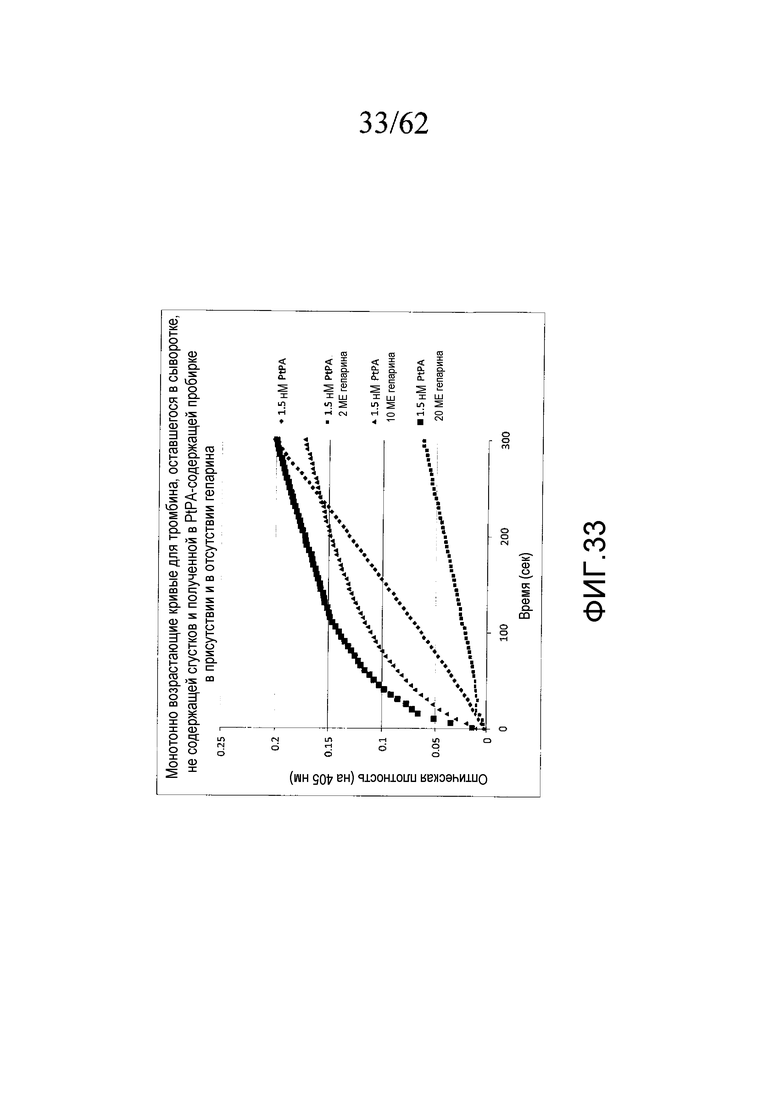
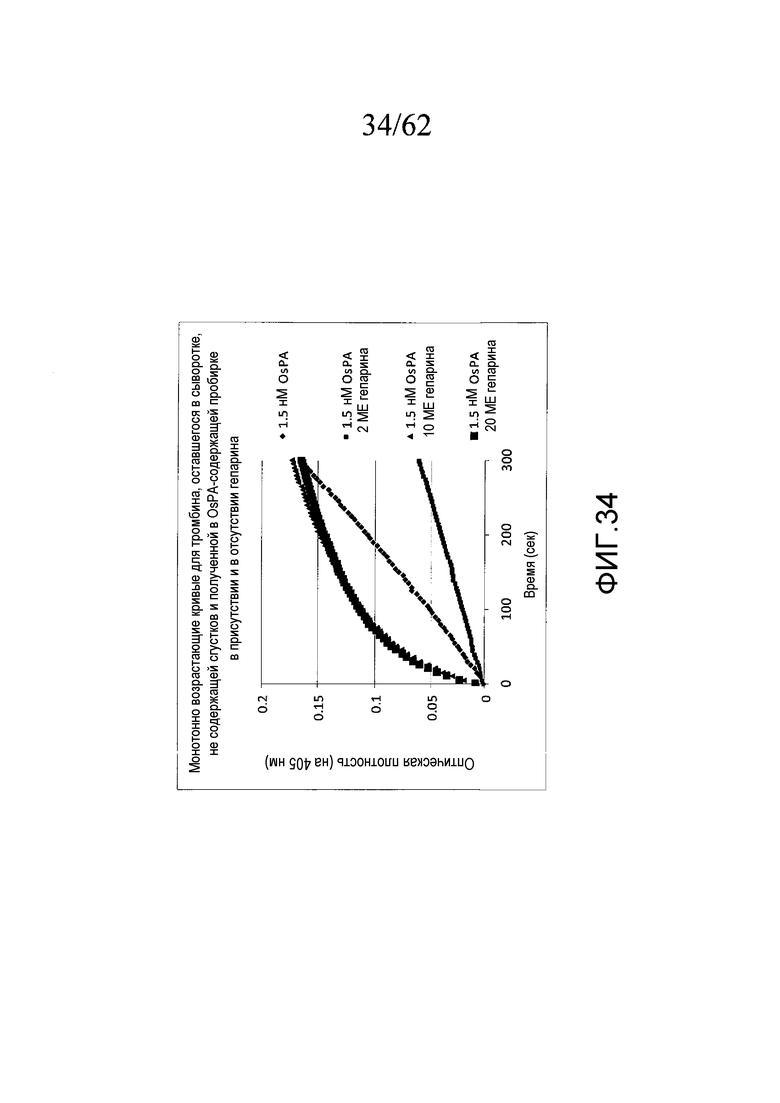

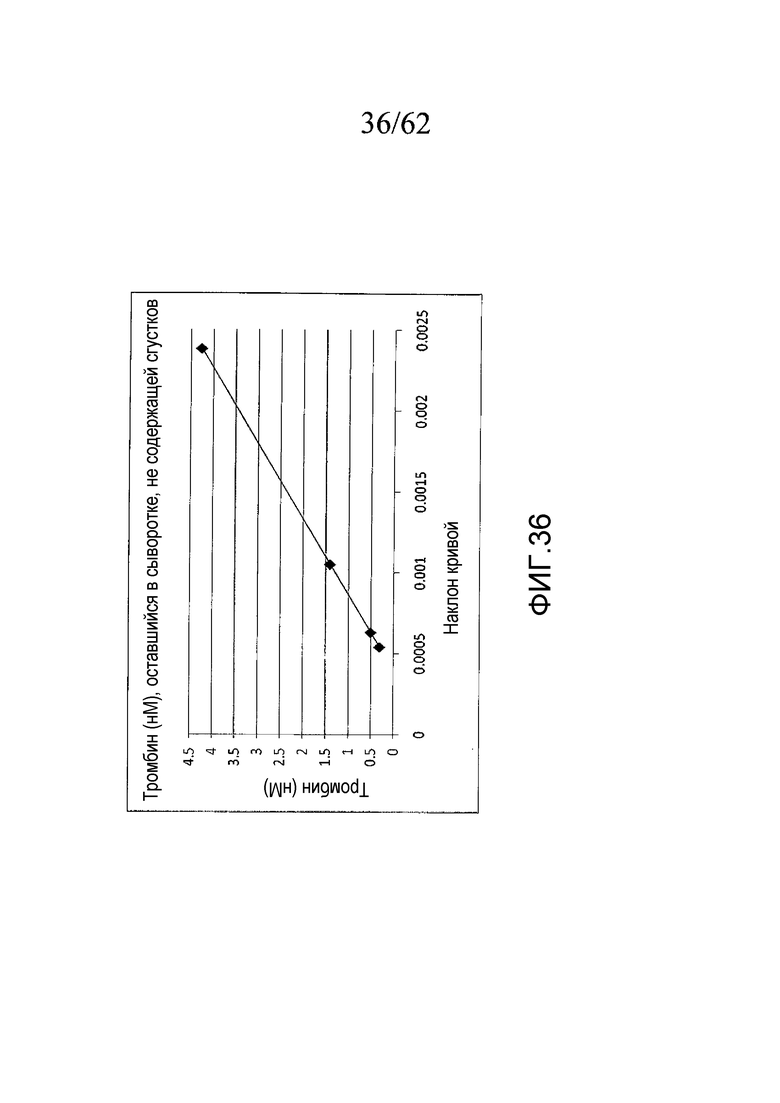
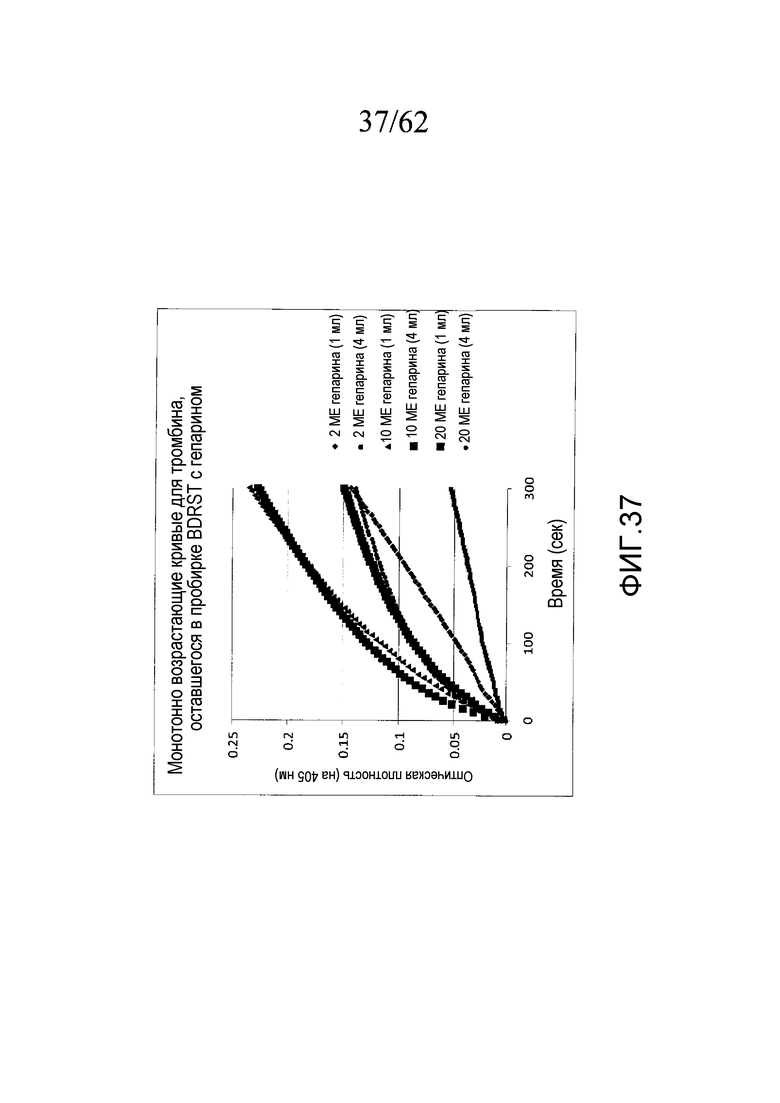
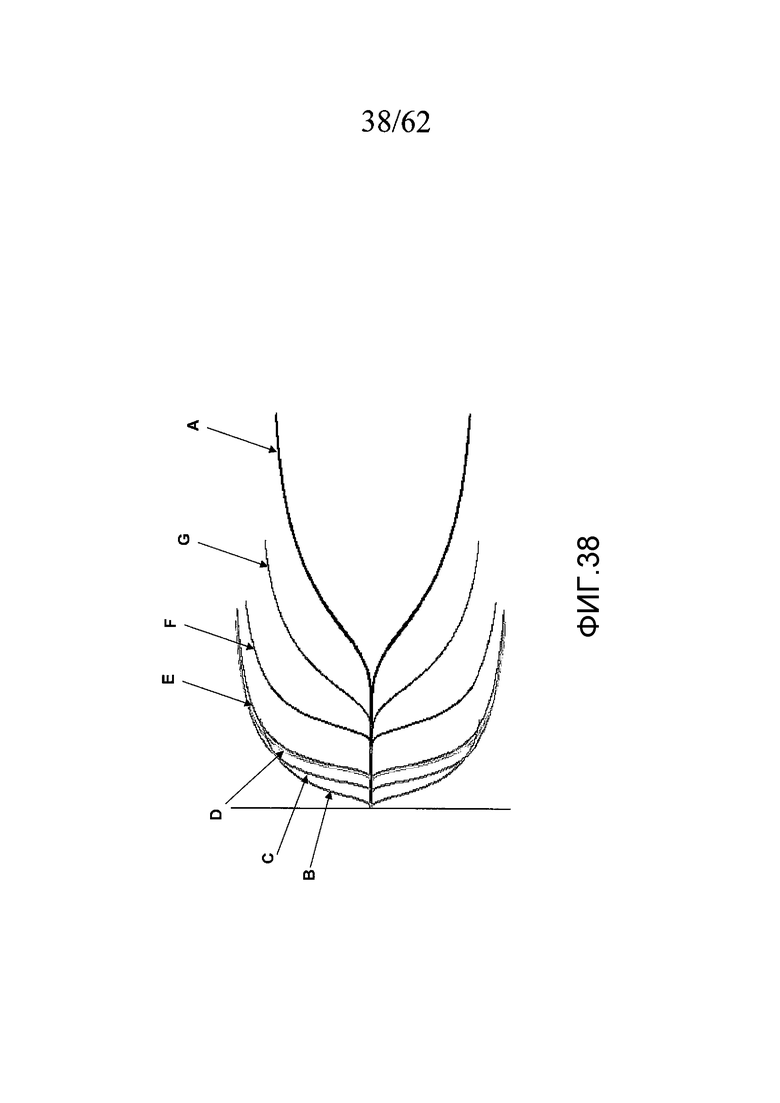
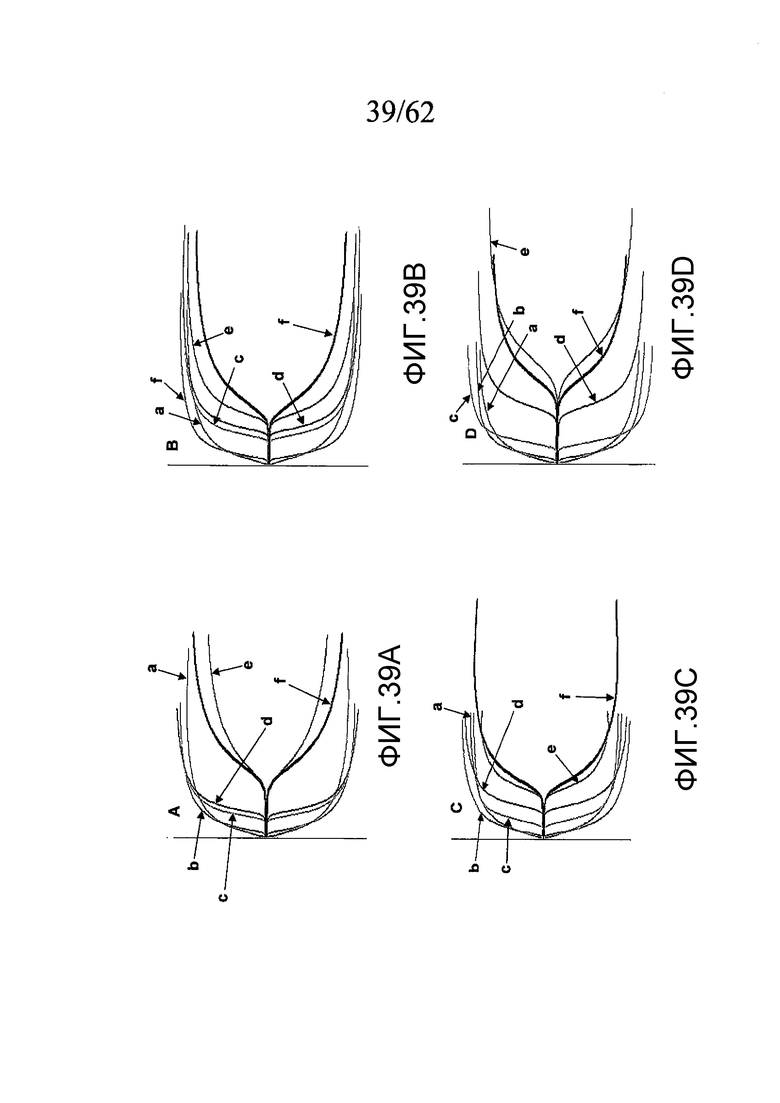
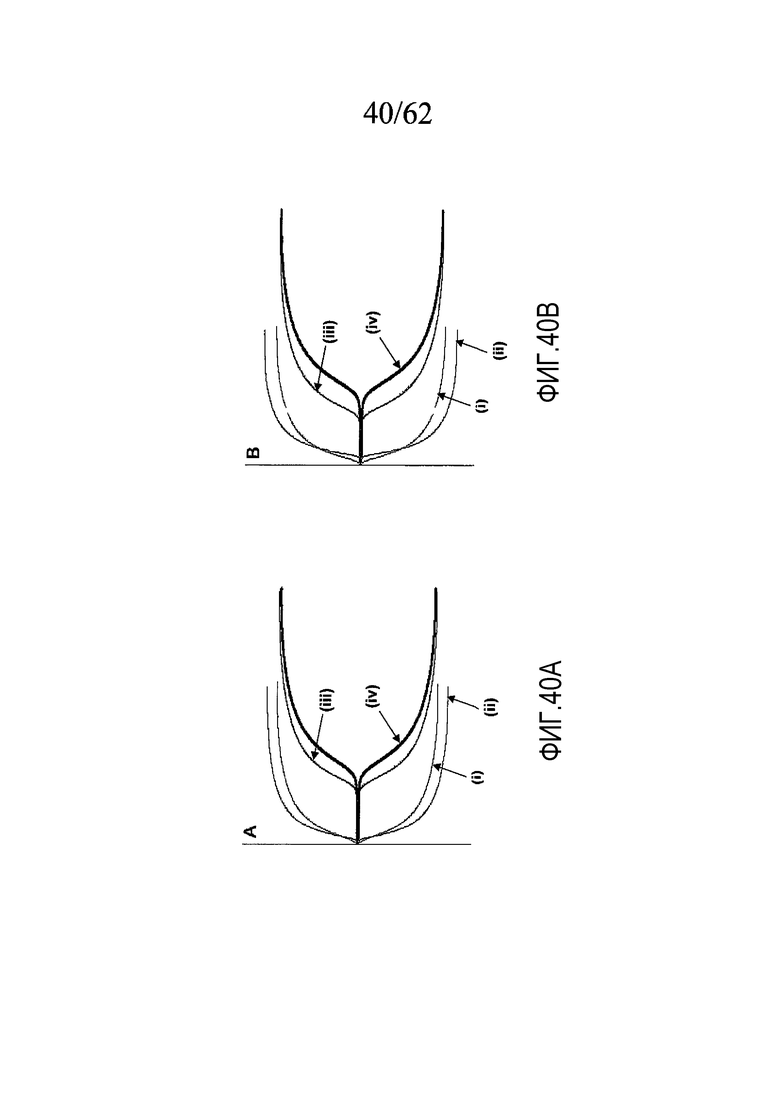
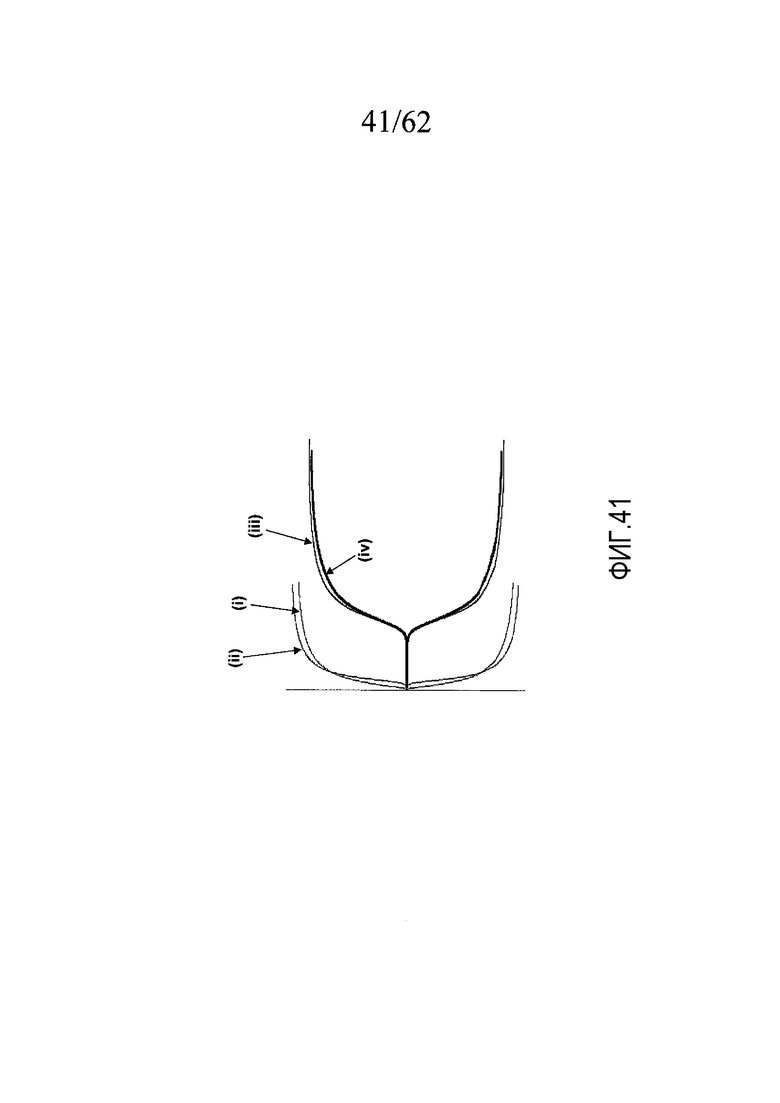
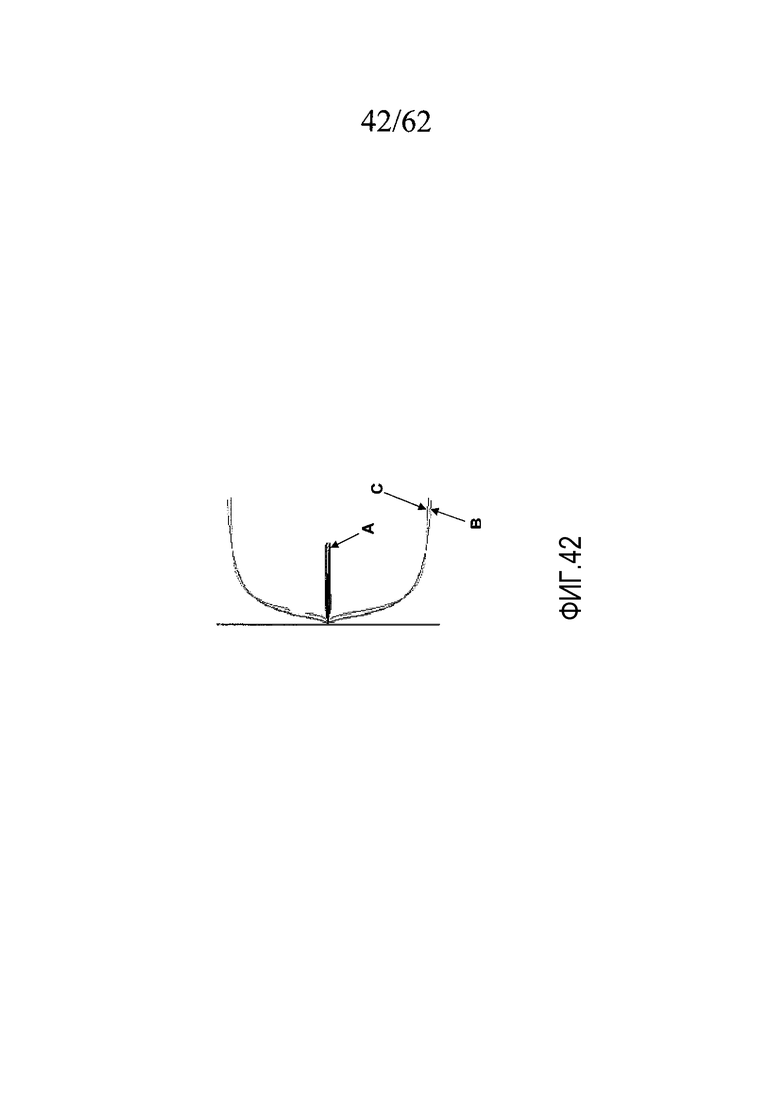
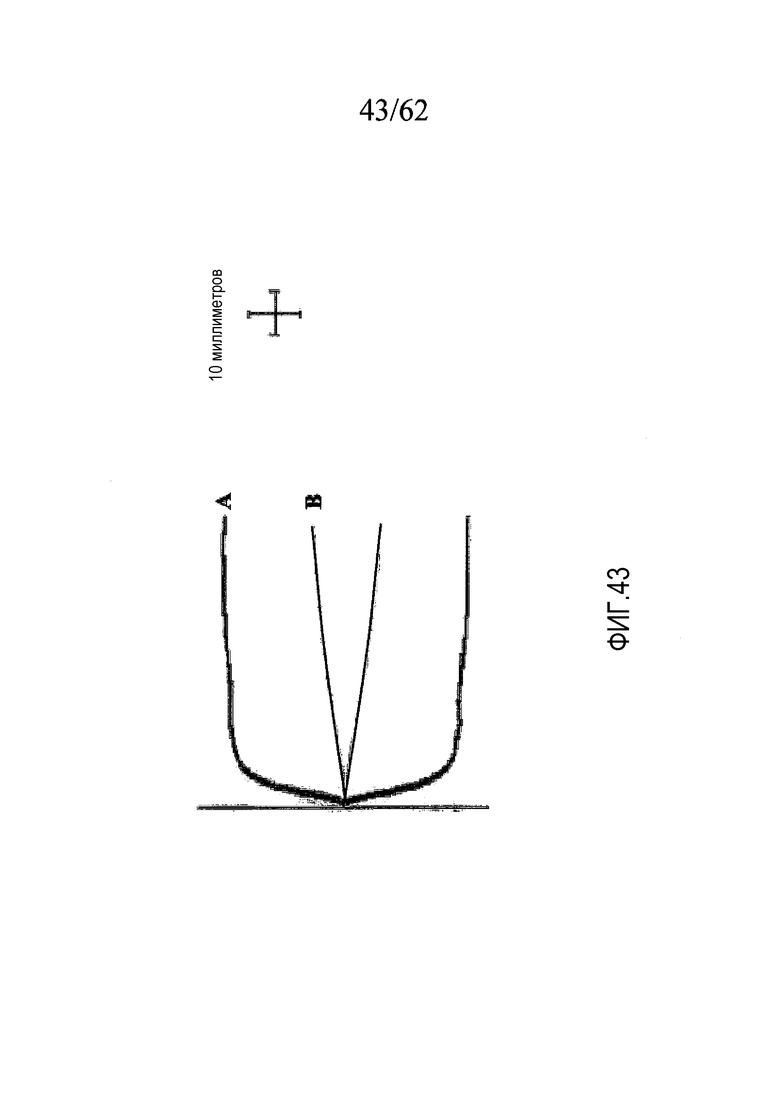
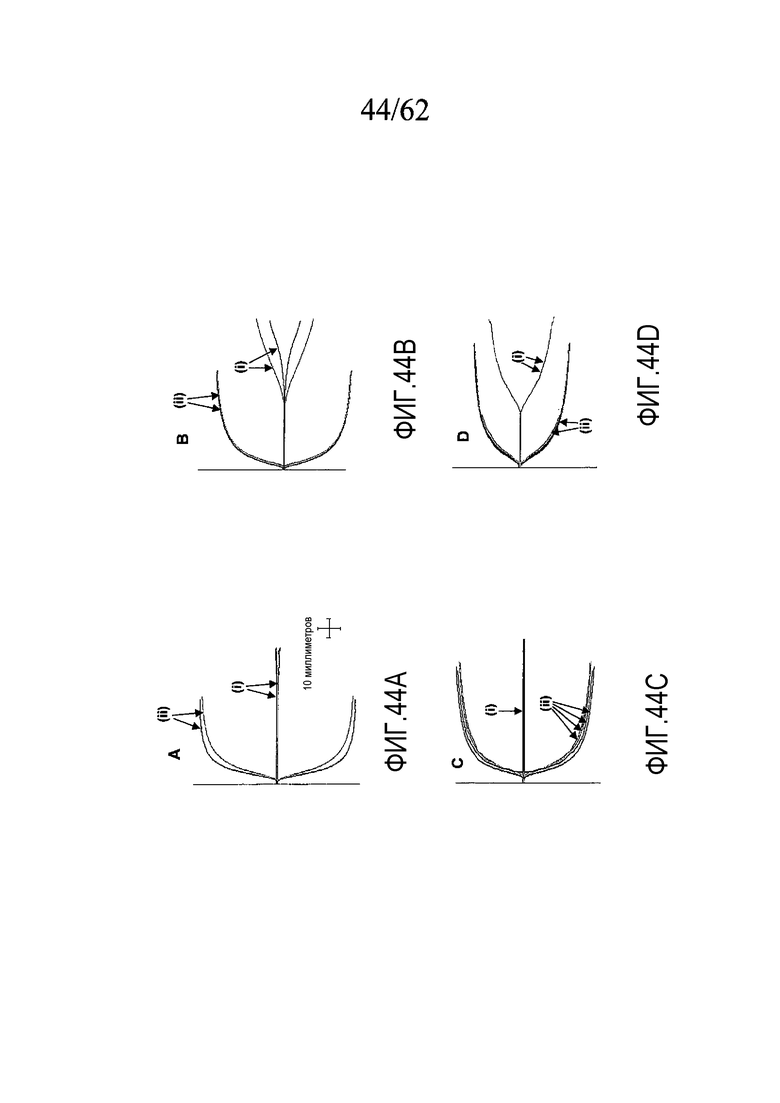
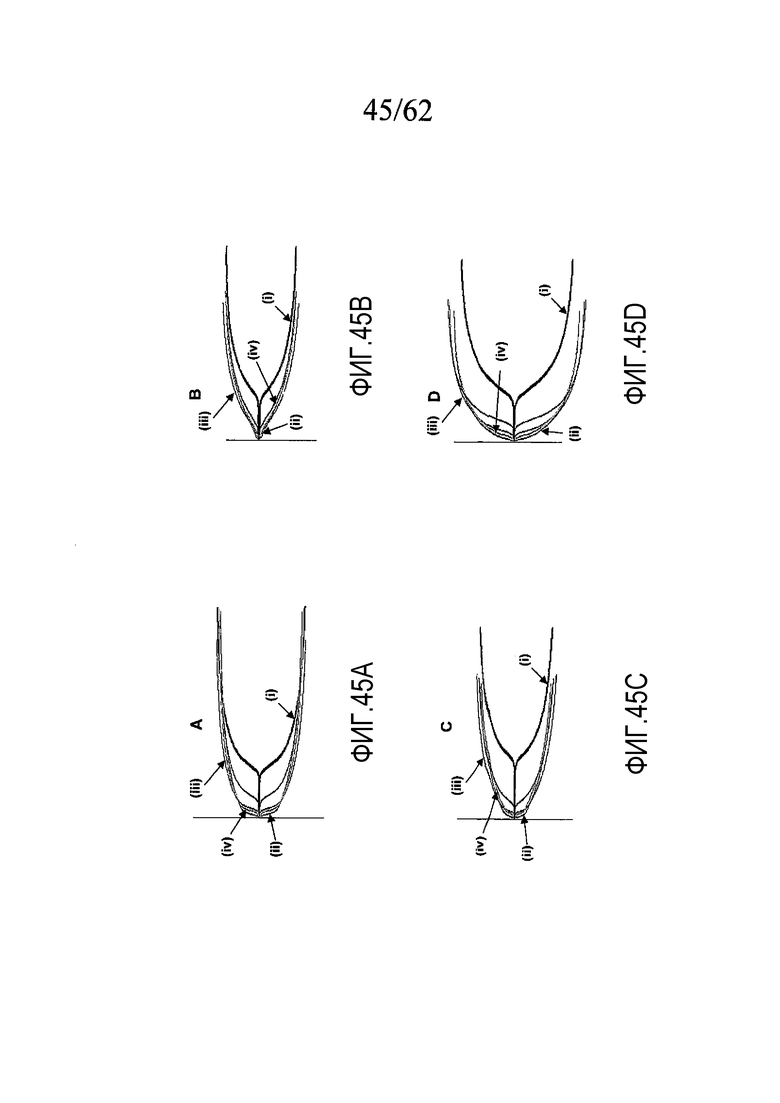
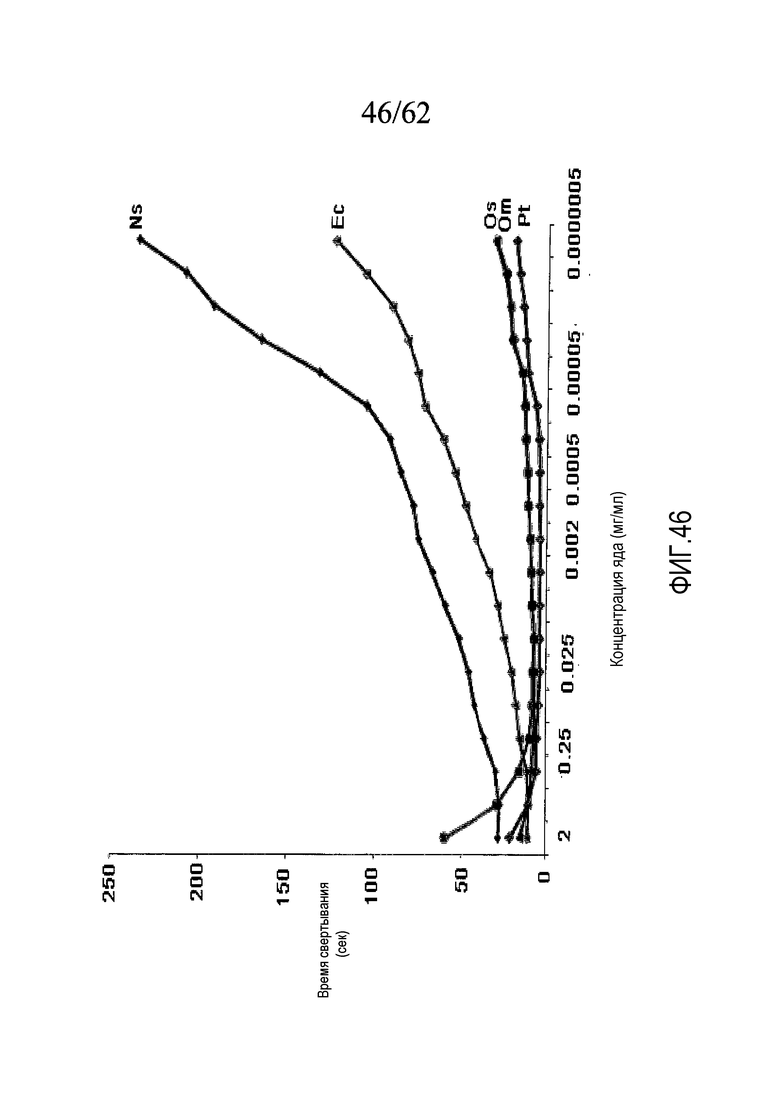
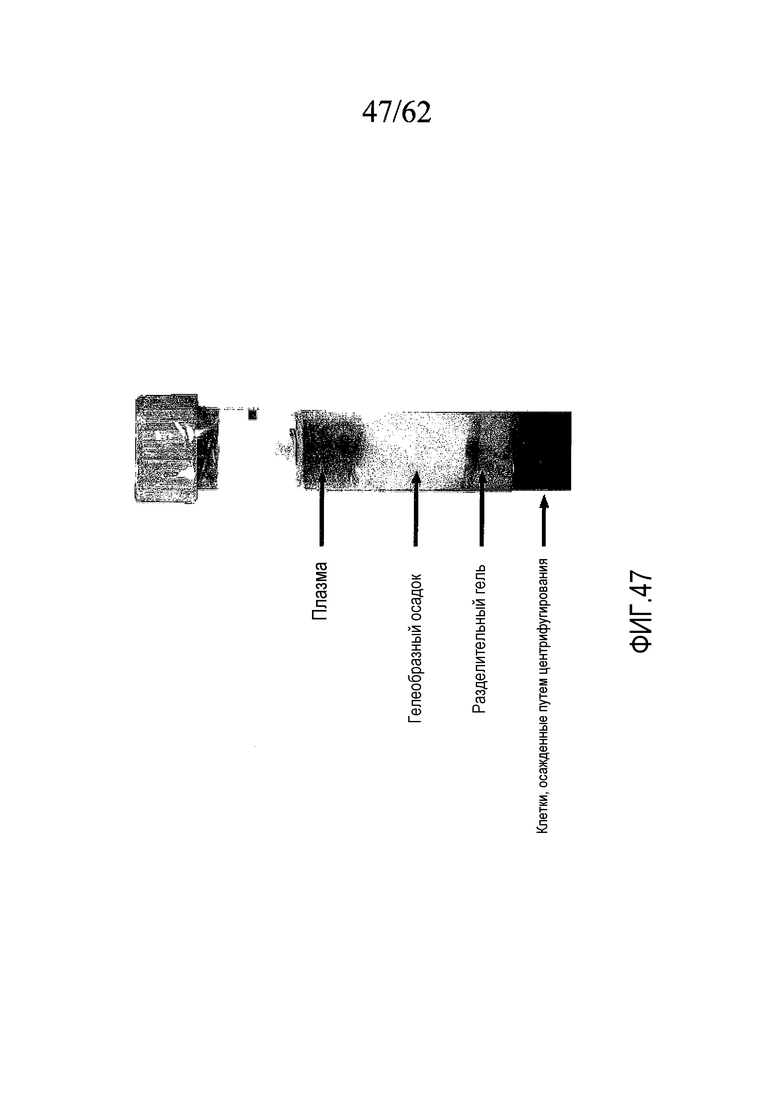

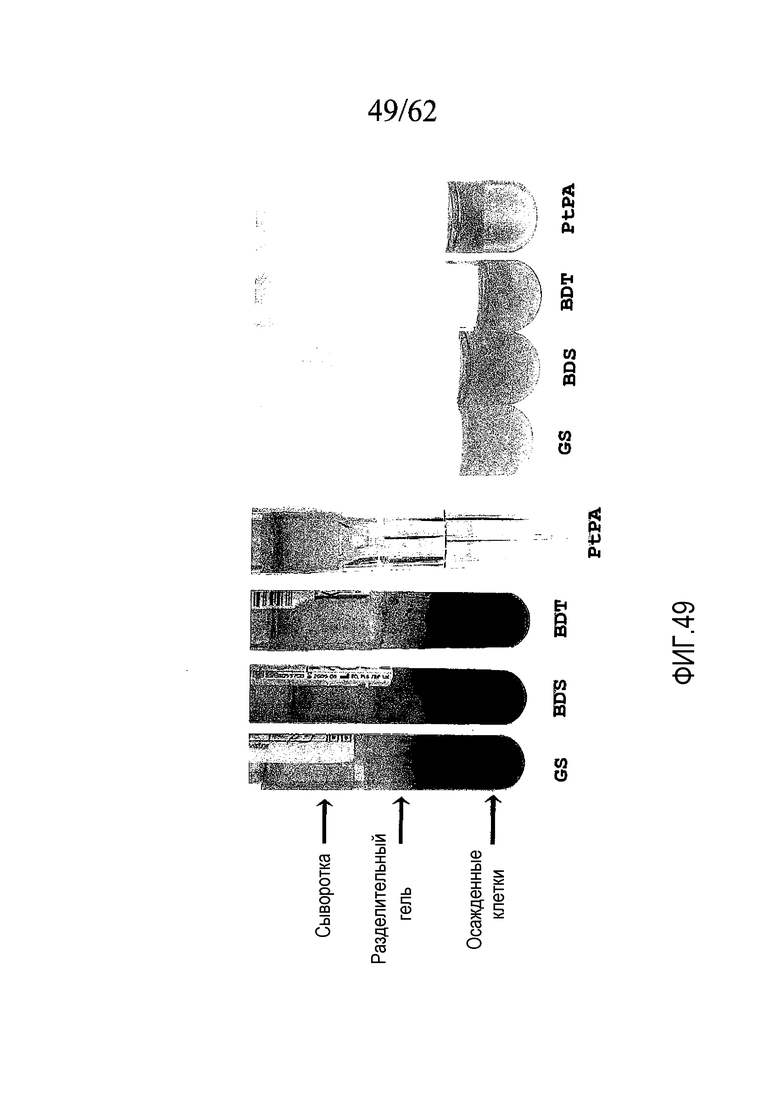







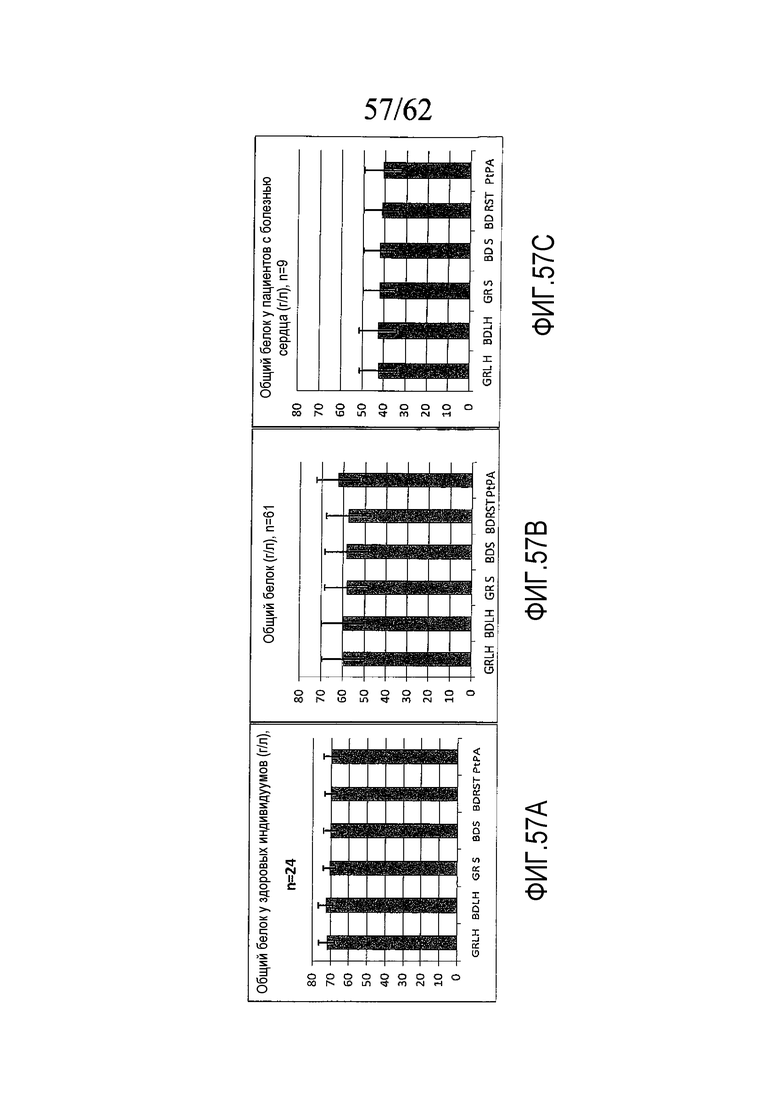

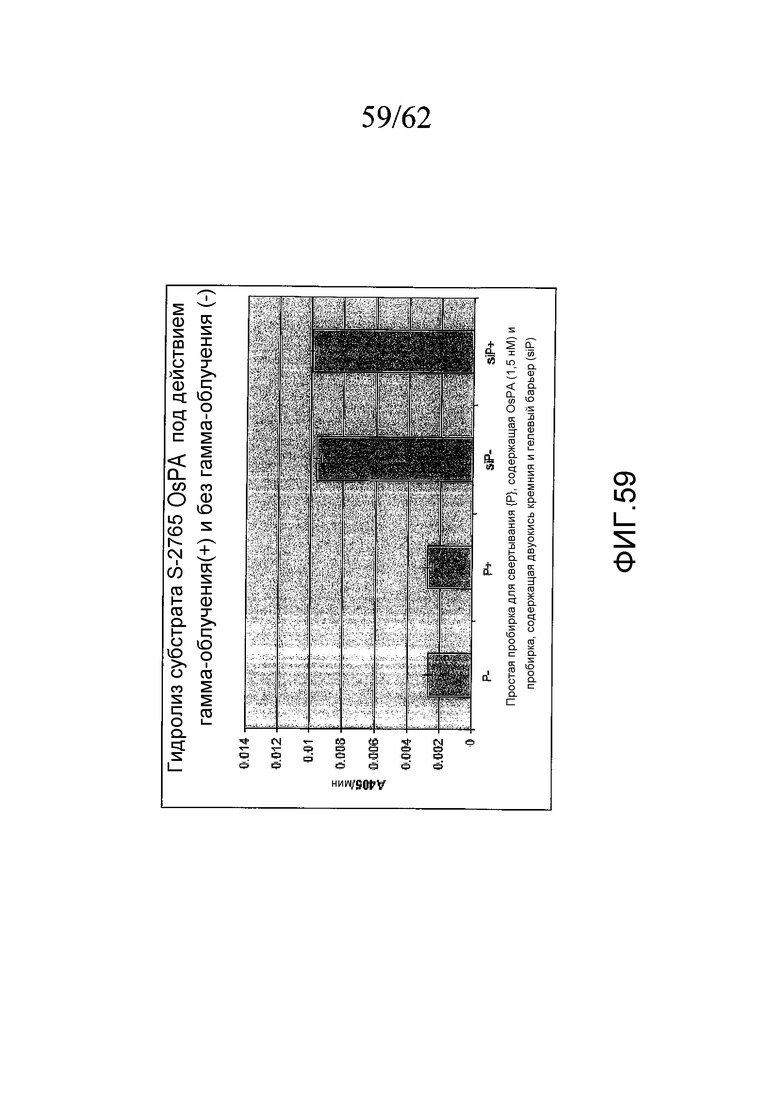

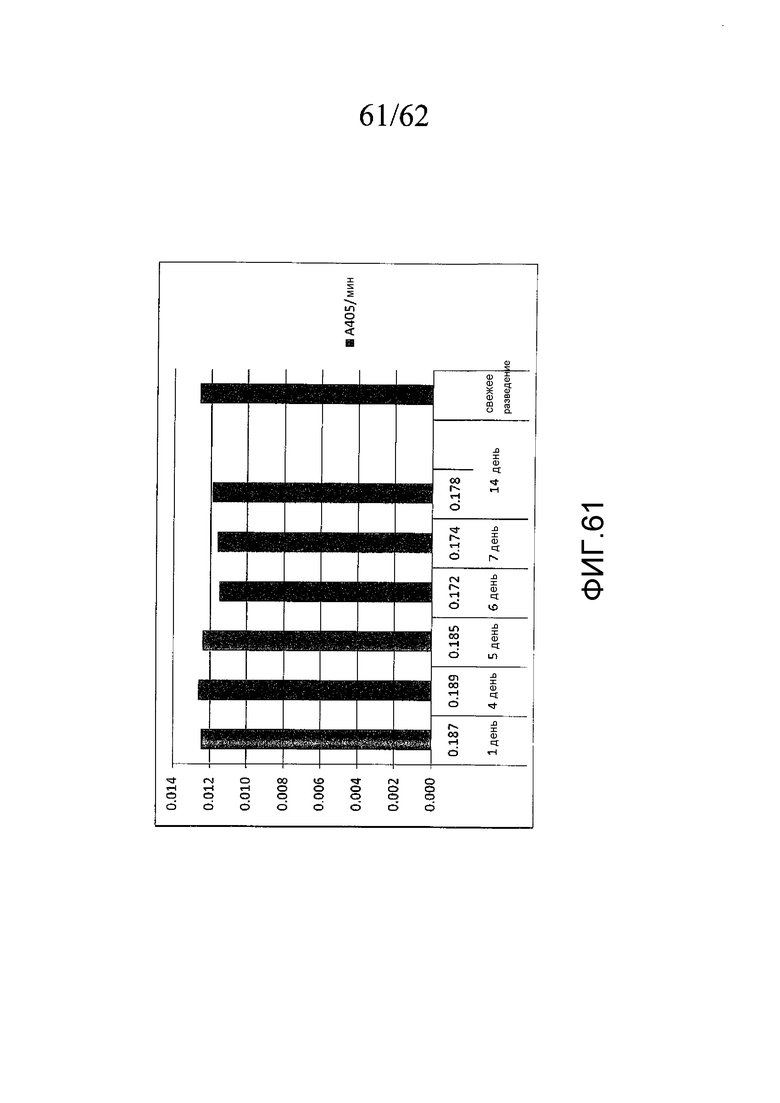
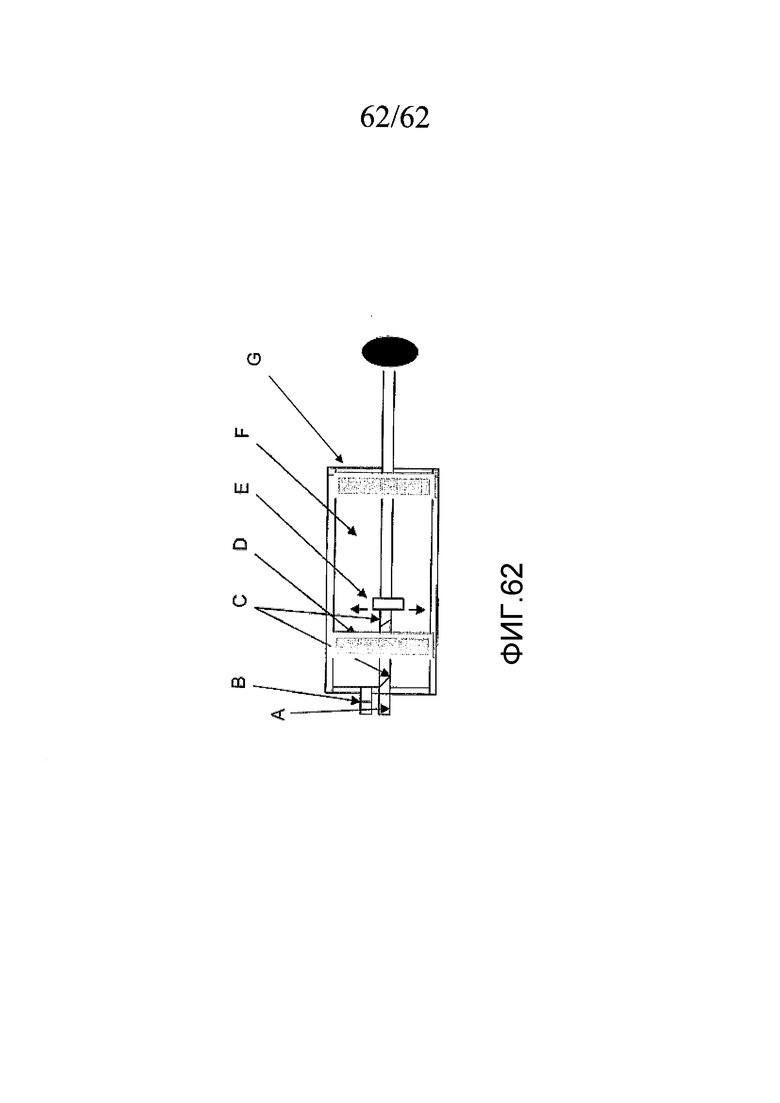
Изобретение относится к применению коагулирующих композиций, содержащих в основном выделенные или по меньшей мере частично очищенный активатор протромбина змеиного яда, а также к контейнерам, содержащим указанные коагулирующие композиции, и к родственным способам применения.9 н. и 5 з.п. ф-лы, 69 ил., 75 табл.
1. Применение коагулирующей композиции для получения пробы сыворотки, используемой для детектирования аналитов, где коагулирующая композиция в основном состоит из выделенного или по меньшей мере частично очищенного активатора протромбина змеиного яда.
2. Контейнер для получения пробы сыворотки, которая может быть использована для детектирования представляющего интерес аналита, присутствующего в указанной пробе сыворотки, где контейнер содержит коагулирующую композицию, в основном состоящую из выделенного или по меньшей мере частично очищенного активатора протромбина змеиного яда, и где контейнер является вакуумным для всасывания крови в контейнер.
3. Контейнер для получения пробы сыворотки, которая может быть использована для детектирования представляющего интерес аналита, присутствующего в пробе сыворотки, где контейнер содержит пробу цельной крови и коагулирующую композицию, в основном состоящую из выделенного или по меньшей мере частично очищенного активатора протромбина змеиного яда.
4. Применение коагулирующей композиции, в основном состоящей из выделенного или по меньшей мере частично очищенного активатора протромбина змеиного яда, в целях получения или изготовления контейнера для получения пробы сыворотки, пригодной для детектирования аналита.
5. Способ анализа пробы сыворотки на наличие, отсутствие или количество представляющего интерес аналита, где способ включает приведение в контакт пробы крови с коагулирующей композицией, в основном состоящей из выделенного или по меньшей мере частично очищенного активатора протромбина змеиного яда, и анализирование пробы сыворотки на наличие, отсутствие или количество представляющего интерес аналита.
6. Способ диагностики на наличие, отсутствие или тяжесть заболевания или состояния у индивидуума, где наличие, отсутствие или тяжесть заболевания, или состояния связаны с присутствием, отсутствием или аберрантным количеством представляющего интерес аналита у индивидуума, и где способ включает анализ пробы сыворотки способом по п.5 в целях определения наличия, отсутствия или тяжести заболевания или состояния у индивидуума.
7. Применение по п.1 или 4, или контейнер по п.2 или 3, или способ по п.5 или 6, где активатор протромбина представляет собой активатор протромбина группы А.
8. Контейнер по п.7, где активатор протромбина выбран из экарина и баспарина..
9. Применение по п.1 или 4, или контейнер по п.2 или 3, или способ по п.5 или 6, где активатор протромбина представляет собой активатор протромбина группы B.
10. Контейнер по п.9, где активатор протромбина выбран из каринактивазы-1, каринактивазы-2 и мультактивазы.
11. Применение по п.1 или 4, или контейнер по п.2 или 3, или способ по п.5 или 6, где активатор протромбина представляет собой активатор протромбина группы C.
12. Контейнер по п.11, где активатор протромбина выбран из псеутарина C, оскутарина C и омикарина C.
13. Применение по п.1 или 4, или контейнер по п.2 или 3, или способ по п.5 или 6, где активатор протромбина представляет собой активатор протромбина группы D.
14. Применение по п.1 или 4, или контейнер по п.2 или 3, или способ по п.5 или 6, где активатор протромбина выбран из порфарина D, нотекарина D, трокарина D, гопсарина D и нотекарина D.
| US 5089415 A1, 29.05.2008 | |||
| US 7745192 B2, 29.06.2010 | |||
| Способ количественного определения фибриногена в плазме крови | 1983 |
|
SU1146002A1 |
| Приспособление для задерживания остатков топлива, в целях дожигания у заднего шлакового конца цепной решетки | 1926 |
|
SU14516A1 |
| US 6562837 B1, 13.05.2003. | |||
Авторы
Даты
2018-02-06—Публикация
2011-09-20—Подача