ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Эта заявка испрашивает приоритет по предварительной заявке США номер 61/877,517, поданной 13 сентября 2013, которая включена в настоящий документ посредством ссылки во всей своей полноте.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит перечень последовательностей, поданный через EFS-Web и включенный в настоящий документ посредством ссылки во всей своей полноте. Указанная ASCII копия создана 28 августа 2014, называется 2014.AUG.28 P5704R1-WO Sequence Listing.txt и имеет размер 34,811 байт.
ОБЛАСТЬ ТЕХНИКИ
Предусмотрены очищенные рекомбинантные полипептиды, выделенные из клеток-хозяев яичника китайского хомячка, в том числе антитела, такие как терапевтические антитела, и способы получения и применения таких полипептидов.
УРОВЕНЬ ТЕХНИКИ
Целый ряд лекарственных средств для лечения астмы и других респираторных расстройств находятся в продаже или на стадии разработки. Одной из мишеней в терапии астмы является IL-13. IL-13 представляет собой плейотропный цитокин TH2, продуцируемый активированными T клетками, NKT клетками, базофилами, эозинофилами и тучными клетками, и, как было показано в доклинических моделях, он играет важную роль в патогенезе астмы. Ранее были описаны антагонисты IL-13, в том числе анти-IL-13 антитела. На основе некоторых таких антител были разработаны терапевтические средства для применения человеком. Недавно, в ряде исследований была продемонстрирована клиническая активность моноклональных антител против IL-13 для лечения астмы (Смотрите, например, Corren et al., 2011, N. Engl. J. Med. 365, 1088-1098; Gauvreau et al., 2011, Am. J. Respir. Crit. Care Med. 183, 1007-1014; Ingram and Kraft, 2012, J. Allergy Clin. Immunol. 130, 829-42; Webb, 2011, Nat Biotechnol 29, 860-863). Среди них, лебрикизумаб, гуманизированное антитело IgG4, которое нейтрализует активность IL-13 и улучшает функцию легких у астматиков, у которых несмотря на лечение, которое, в большинстве случаев, проводили ингаляционными кортикостероидами и длительно действующим агонистом бета2-адренергического рецептора, наблюдались симптомы заболевания (Corren et al., 2011, N. Engl. J. Med. 365, 1088-1098).
Помимо этого, было показано, что IL-13 вовлечен во многие другие аллергические и фиброзные расстройства. Например, такие опосредованные IL13 заболевания и/или состояния включают аллергическую астму, неаллергическую (эндогенную) астму, аллергический ринит, атопический дерматит, аллергический конъюктивит, экзему, крапивницу, пищевые аллергии, хроническую обструктивную болезнь легких, язвенный колит, инфекции RSV, увеит, склеродермию и остеопороз, но не ограничиваются ими.
Для того чтобы рекомбинантные биофармацевтические белки были одобрены для введения пациентам-людям, важно удалять из конечного биологического продукта остаточные примеси, образующиеся в процессе их производства и очистки. Эти компоненты, свызанные с процессом получения, включают белки культуральной среды, иммуноглобулиновые аффинные лиганды, вирусы, эндотоксин, ДНК и белки клеток-хозяев. Эти примеси из клеток-хозяев включают специфичные для процесса получения белки клеток-хозяев (HCP), которые представляют собой связанные с процессом примеси/загрязнители в биологических препаратах, получаемых с помощью технологии рекомбинантных ДНК. Несмотря на то, что HCP, как правило, присутствуют в готовом лекарственном веществе в небольших количествах (части на миллион или нанограммы на миллиграмм предполагаемого рекомбинантного белка), следует признать, что HCP являются нежелательными, и их количество должно быть минимизировано. Например, администрация США по пищевым продуктам и лекарственным веществам (FDA) требует, чтобы биофармацевтические средства, предназначенные для использования человеком in vivo, содержали как можно меньше посторонних примесей, и также требует проводить тесты с целью обнаружения и количественного измерения содержания потенциальных загрязнителей/примесей, таких как HCP.
Методы очистки белков от клеточного дебриса изначально зависят от места экспрессии белка. Некоторые белки секретируются клетками непосредственно в окружающую среду для роста; другие продуцируются внутриклеточно. Для последних белков первая стадия процесса очистки включает лизис клеток, который может быть осуществлен разнообразными способами, включая механическое воздействие, осматический шок или ферментативную обработку. В результате такого разрушения все содержимое клеток высвобождается в гомогенат, но при этом образуются субклеточные фрагменты, которые трудно удалить из-за их маленького размера. Обычно их удаляют центрифугированием или фильтрацией. Та же проблема возникает в случае секретируемых белков, поскольку происходит естественная гибель клеток и внутриклеточные белки высвобождаются из клеток-хозяев в ходе цикла производства белка.
После получения раствора, содержащего интересующий белок, его отделение от других белков, продуцируемых клеткой, обычно достигается с использованием комбинации разных хроматографических методов. Как правило, в этих методах разделение белковых смесей осуществляется по заряду, степени гидрофобности или размеру. Доступен целый ряд разных хроматографических смол для каждого из этих методов, что позволяет тонко оптимизировать схему очистки для конкретного белка. Суть всех этих способов разделения в том, что белки могут либо двигаться с разной скоростью вниз по длинной колонке, за счет чего достигается их физическое разделение, которое тем больше, чем дальше белки проходят вниз по колонке, либо белки могут селективно связываться с разделительной средой и далее дифференциально элюироваться различными растворителями. В некоторых случаях, целевой белок отделяют от примесей, когда примеси специфично связываются с колонкой, а целевой белок нет, то есть целевой белок остается в "проскоке".
Ионообменная хроматография представляет собой процедуру, применимую для очистки ионизированных молекул. Ионизированные молекулы разделяются на основе неспецифического электростатического взаимодействия их заряженных групп с противоположно заряженными молекулами, прикрепленными к твердофазной подложке, в результате задерживаются те ионизированные молекулы, которые сильнее взаимодействуют с твердой фазой. Суммарный заряд каждого типа ионизированных молекул и его сродство к матрице варьирует в зависимости от количества заряженных групп, заряда каждой группы и природы молекул, конкурирующих за взаимодействие с заряженной твердофазной матрицей. По причине этих различий происходит разделение различных типов молекул с помощью ионообменной хроматографии. В ходе типичной процедуры очистки белков с использованием ионообменной хроматографии смесь из множества белков, полученных из клетки-хозяина, например, в культуре клеток млекопитающих, наносят на ионообменную колонку. После того как не связывающиеся молекулы проходят через колонку (вымываются), условия корректируют, например, путем изменения рН, концентрации противоионов и тому подобного, в ступенчатом или градиентном режиме, чтобы снять с твердой фазы неспецифически задержанный на ней ионизированный целевой белок, отделяя его от белков, имеющих другие характеристики заряда. Анионообменная хроматография включает конкуренцию между целевой анионной молекулой и отрицательно заряженным противоионом за взаимодействие с положительно заряженной молекулой, прикрепленной к твердофазной матрице, при значениях pH и в условиях конкретного процесса разделения. В противоположность этому, катионообменная хроматография включает конкуренцию между целевой катионной молекулой и положительно заряженным противоионом за взаимодействие с отрицательно заряженной молекулой, прикрепленной к твердофазной матрице, при значениях pH и в условиях конкретного процесса разделения. Комбинированная ионообменная хроматография (также называемая мультимодальной ионообменной хроматографией) включает использование комбинации катионообменной и анионообменной хроматографических сред в одной стадии. В частности, "комбинированный" относится к твердофазной подложке, к которой ковалентно присоединена смесь катионообменных, анионообменных и гидрофобных фрагментов.
Хроматография белков на колонке с гидроксиапатитом включает неспецифическое взаимодействие заряженных аминогрупп или карбоксильных групп белка с противоположно заряженными группами на гидроксиапатите, где суммарный заряд гидроксиапатита и белка контролируется значением pH буфера. Элюцию осуществляют, замещая неспецифическую пару белок-гидроксиапатит ионами, такими как Ca2+ или Mg2+. Отрицательно заряженные группы белка замещаются отрицательно заряженными соединениями, такими как фосфаты, в результате чего происходит элюция белка, имеющего отрицательный суммарный заряд.
Хроматография гидрофобных взаимодействий (HIC), как правило, используется для очистки и разделения молекул, таких как белки, основываясь на различиях в гидрофобности их поверхностей. Гидрофобные группы белка неспецифично взаимодействуют с гидрофобными группами, связанными с хроматографической матрицей. Различия в числе и природе гидрофобных групп на поверхности белка приводят к тому, что белки с разной скоростью движутся по HIC колонке (неодинаковое удержание белков на HIC колонке), что приводит к разделению белков в сложных белковых смесях.
Аффинная хроматография, основанная на специфичном, зависящем от структуры (т.е., пространственная комплементарность) взаимодействии между белком, который подлежит очистке, и иммобилизованным агентом захвата, является стандартным вариантом очистки некоторых белков, таких как антитела. Белок A, например, используется в качестве адсорбента для аффинной хроматографии белков, таких как антитела, содержащих область Fc. Белок A представляет собой белок клеточной стенки Staphylococcus aureas массой 41 кДа, который с высокой аффинностью (примерно 10-8M для человеческих IgG) связывается с областью Fc антител.
Очистку рекомбинантных полипептидов, как правило, осуществляют с использованием хроматографии связывания и элюирования (B/E) или хроматографии со сбором проскока (F/T). Они кратко описаны ниже.
Хроматография связывания и элюирования (B/E): в ходе хроматографии B/E продукт обычно наносят для максимизации динамической емкости связывания (DBC) с хроматографическим материалом и далее подбирают условия промывки и элюции таким образом, чтобы добиться максимальной чистоты продукта в элюате.
Были описаны различные способы B/E для использования совместно с аффинной хроматографией на белке A, включая различные промежуточные промывочные буферы. Например, в патентах США номер 6,127,526 и 6,333,398 описан промежуточный этап промывки в процессе хроматографии на белке A с использованием гидрофобных электролитов, например, хлорида тетраметиламмония (TMAC) и хлорида тетраэтиламмония (TEAC), для удаления загрязнителей, но не иммобилизованного белка A или целевого белка, связавшегося с белком A на колонке. В патенте США номер 6,870,034 описаны дополнительные способы и промывочные буферы для использования в процессе аффинной хроматографии на белке А.
Хроматография со сбором проскока (F/T): при использовании хроматографии F/T условия нанесения подбирают таким образом, чтобы примеси прочно связывались с хроматографическим материалом, а продукт оставался в проскоке. Хроматография F/T обеспечивает высокую плотность нанесения для стандартных препаратов моноклональных антител (MAb).
Мы установили, что в препаратах рекомбинантного анти-IL13 MAb и в некоторых других рекомбинантных полипептидах, полученных в клетках CHO, фосфолипаза B-подобный фермент 2 является единственным типом CHOP, присутствующим в избыточном количестве в доступных антителах по данным анализа методом ELISA на общие CHOP. Использованные в настоящем документе термины "PLB2" и "PLBL2" и "PLBD2" используются взаимозаменямо и относятся к "фосфолипаза B-подобному ферменту 2" или его синониму, "фосфолипаза B-домен-подобному ферменту 2". Некоторые научные публикации, касающиеся PLBL2, включают Lakomek, K. et al., BMC Structural Biology 9:56 (2009); Deuschi, et al., FEBS Lett 580:5747-5752 (2006). PLBL2 синтезируется в виде пре-про-фермента с исходной молекулярной массой примерно 66000. Первоначальная лидерная последовательность удаляется, и в процессе посттрансляционной модификации потенциально добавляются 6 манноза-6-фосфатных (M-6-P) групп. M-6-P представляет собой специфическую модификацию, которая направляет этот фермент в лизосому через M-6-P рецептор. PLBL2 содержит 6 цистеинов, два из которых имеют свободные сульфгидрильные группы, и четыре образуют дисульфидные связи. В кислых условиях PLBL2 далее расщепляется на N- и C-концевые фрагменты, имеющие молекулярную массу 32000 и 45000, соответственно. По аналогии с другими лизосомальными ферментами, это расщепление является стадией активации, обеспечивающей доступ субстрата в активный сайт.
Гомология между аминокислотными последовательностями PLBL2 хомячка и человека составляет примерно 80%. Считается, что фермент расщепляет любую цепь жирной кислоты в составе фосфолипидов, образующих клеточные мембраны. Существуют и другие фосфолипазы с другой субстратной специфичностью. Аналогичная ферментативная активность есть у микроорганизмов, где она часто является фактором вирулентности. Несмотря на то, что микроорганизмы имеют аналогичную ферментативную активность, белок, обеспечивающий такую активность, отличается от белка млекопитающих, и гомология между последовательностями фермента PLBL2 микроорганизмов и млекопитающих является низкой. Фосфолипазы продуцируют свободные жирные кислоты (FFA) в качестве одного из продуктов гидролиза субстрата. Свободные жирные кислоты сами по себе являются потенциальным иммуносигнальным фактором. В результате дегидрирования FFA превращаются в арахидоновую кислоту, которая потенциально участвует в воспалительных каскадах, включающих эйкозаноиды.
Идентифицировав PLBL2 в качестве единственного HCP (CHOP) в препаратах рекомбинантных анти-IL13 моноклональных антител и некоторых других рекомбинантных полипептидов, продуцируемых в клетках CHO, мы разработали реагенты, способы и наборы для специфичного, чувствительного и количественного определения уровня PLBL2 в препаратах анти-IL-13 моноклональных антител (и других продуктах рекомбинантных полипептидов) на разных стадиях очистки. Они кратко описаны в Примерах ниже и также в предварительных заявках на патент США номер 61/877,503 и 61/991,228. Кроме того, сложной задачей оказалась разработка крупномасштабного, надежного и эффективного процесса очистки анти-IL13 MAb (и других продуктов рекомбинантных полипептидов), приводящего к получению достаточно чистых MAb (включая удаление PLBL2) для применения человеком в терапевтических целях, в том числе на поздней стадии клинического и коммерческое использования. Описанное в настоящем документе изобретение удовлетворяет некоторым описанным выше потребностям и обеспечивает ряд других преимуществ.
Все ссылки, цитированные в настоящем документе, в том числе заявки на патенты и опубликованные заявки на патенты, включены в настоящий документ посредством ссылки во всей своей полноте.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение основано, по меньшей мере, частично, на разработке улучшенного процесса очистки рекомбинантных полипептидов, продуцируемых клетами яичника китайского хомячка (CHO), который обеспечивает существенное снижение уровня PLBL2 хомячка в очищенном продукте. Рекомбинантные полипептиды, очищенные в соответствии со способами настоящего изобретения, в том числе терапевтические антитела, такие как анти-IL13 антитело, могут иметь пониженную иммуногенность при введении человеческим субъектам.
Соответственно, в одном из аспектов, предусмотрены композиции, включающие анти-IL13 моноклональное антитело, очищенное из клеток CHO, включающие анти-IL13 антитело и остаточное количество PLBL2 хомячка. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 20 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 15 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 10 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 8 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 3 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 2 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 1 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 0,5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка находится в диапазоне между 0,5 нг/мг и 20 нг/мг, или между 0,5 нг/мг и 15 нг/мг, или между 0,5 нг/мг и 10 нг/мг, или между 0,5 нг/мг и 8 нг/мг, или между 0,5 нг/мг и 5 нг/мг, или между 0,5 нг/мг и 3 нг/мг, или между 0,5 нг/мг и 2 нг/мг, или между 0,5 нг/мг и 1 нг/мг, или между пределом количественного определения в анализе (LOQ) и 1 нг/мг. В некоторых вариантах воплощения, анти-IL13 антитело включает три CDR тяжелой цепи, CDR-H1, имеющую аминокислотную последовательность SEQ ID NO.: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO.: 2, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO.: 3, и три CDR легкой цепи, CDR-L1, имеющую аминокислотную последовательность SEQ ID NO.: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO.: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO.: 6. В некоторых вариантах воплощения, анти-IL13 антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 7. В некоторых вариантах воплощения, анти-IL13 антитело включает вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 9. В некоторых вариантах воплощения, анти-IL13 антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 10. В некоторых вариантах воплощения, анти-IL13 антитело включает легкую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 14. В некоторых вариантах воплощения, анти-IL13 антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 7, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 9. В некоторых вариантах воплощения, анти-IL13 антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 10, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 14. В некоторых вариантах воплощения, количество PLBL2 хомячка в композиции количественно определяют с использованием иммунологического анализа или масс-спектрометрического анализа. В некоторых вариантах воплощения, иммунологический анализ представляет собой ELISA на все белки клеток яичника китайского хомячка или ELISA на PLBL2 хомячка. В некоторых вариантах воплощения, масс-спектрометрический анализ представляет собой LC-MS/MS.
В другом аспекте, предусмотрены препараты анти-IL13 моноклональных антител, выделенные и очищенные из клеток CHO с помощью процесса, включающего стадию хроматографии гидрофобных взаимодействий (HIC). В некоторых вариантах воплощения, очищенный препарат включает анти-IL13 антитело и остаточное количество PLBL2 хомячка. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 20 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 15 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 10 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 8 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 3 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 2 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 1 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 0,5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка находится в диапазоне между 0,5 нг/мг и 20 нг/мг, или между 0,5 нг/мг и 15 нг/мг, или между 0,5 нг/мг и 10 нг/мг, или между 0,5 нг/мг и 8 нг/мг, или между 0,5 нг/мг и 5 нг/мг, или между 0,5 нг/мг и 3 нг/мг, или между 0,5 нг/мг и 2 нг/мг, или между 0,5 нг/мг и 1 нг/мг, или между пределом количественного определения в анализе (LOQ) и 1 нг/мг. В некоторых вариантах воплощения, стадия HIC включает применение смолы PHENYL SEPHAROSETM 6 Fast Flow (High Sub). В некоторых вариантах воплощения, стадия HIC включает применение колонки со смолой в режиме сбора проскока. В некоторых вариантах воплощения, стадия HIC включает применение уравновешивающего буфера и промывочного буфера, где уравновешивающий буфер и промывочный буфер включают 50 мМ ацетат натрия, pH 5,0. В некоторых вариантах воплощения, проскок контролируют по поглощению при 280 нанометрах, и проскок собирают между 0,5 OD и 1,5 OD. В некоторых вариантах воплощения, проскок собирают в объеме максимум 8 объемов колонки. В некоторых вариантах воплощения, процесс дополнительно включает стадию аффинной хроматографии. В некоторых вариантах воплощения, аффинная хроматография представляет собой хроматографию на белке A. В некоторых вариантах воплощения, процесс дополнительно включает стадию ионообменной хроматографии. В некоторых вариантах воплощения, ионообменная хроматография представляет собой анионообменную хроматографию. В некоторых вариантах воплощения, анти-IL13 антитело включает три CDR тяжелой цепи, CDR-H1, имеющую аминокислотную последовательность SEQ ID NO.: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO.: 2, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO.: 3, и три CDR легкой цепи, CDR-L1, имеющую аминокислотную последовательность SEQ ID NO.: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO.: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO.: 6. В некоторых вариантах воплощения, анти-IL13 антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 7. В некоторых вариантах воплощения, анти-IL13 антитело включает вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 9. В некоторых вариантах воплощения, анти-IL13 антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 10. В некоторых вариантах воплощения, анти-IL13 антитело включает легкую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 14. В некоторых вариантах воплощения, анти-IL13 антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 7, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 9. В некоторых вариантах воплощения, анти-IL13 антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 10, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 14. В некоторых вариантах воплощения, количество PLBL2 хомячка количественно определяют с использованием иммунологического анализа или масс-спектрометрического анализа. В некоторых вариантах воплощения, иммунологический анализ представляет собой ELISA на все белки клеток яичника китайского хомячка или ELISA на PLBL2 хомячка. В некоторых вариантах воплощения, масс-спектрометрический анализ представляет собой LC-MS/MS.
В еще одном аспекте, предусмотрены очищенные препараты анти-IL13 моноклональных антител, выделенные из клеток CHO. В некоторых вариантах воплощения, препарат антитела очищают с помощью процесса, включающего первую стадию аффинной хроматографии на белке A, вторую стадию анионообменной хроматографии и третью стадию хроматографии гидрофобных взаимодействий (HIC), в результате которого получают очищенный препарат. В некоторых вариантах воплощения, очищенный препарат включает анти-IL13 антитело и остаточное количество PLBL2 хомячка. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 20 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 15 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 10 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 8 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 3 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 2 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 1 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 0,5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка находится в диапазоне между 0,5 нг/мг и 20 нг/мг, или между 0,5 нг/мг и 15 нг/мг, или между 0,5 нг/мг и 10 нг/мг, или между 0,5 нг/мг и 8 нг/мг, или между 0,5 нг/мг и 5 нг/мг, или между 0,5 нг/мг и 3 нг/мг, или между 0,5 нг/мг и 2 нг/мг, или между 0,5 нг/мг и 1 нг/мг, или между пределом количественного определения в анализе (LOQ) и 1 нг/мг. В некоторых вариантах воплощения, стадия аффинной хроматографии включает применение смолы MABSELECT SURETM, стадия анионообменной хроматографии включает применение смолы Q SEPHAROSETM Fast Flow, и стадия HIC включает применение смолы PHENYL SEPHAROSETM 6 Fast Flow (high sub). В некоторых вариантах воплощения, стадия аффинной хроматографии включает применение колонки со смолой MABSELECT SURETM в режиме связывания и элюирования, стадия анионообменной хроматографии включает применение колонки со смолой Q SEPHAROSETM Fast Flow в режиме связывания и элюирования, и стадия HIC включает применение колонки со смолой PHENYL SEPHAROSETM 6 Fast Flow (High Sub) в режиме сбора проскока. В некоторых вариантах воплощения, анти-IL13 антитело включает три CDR тяжелой цепи, CDR-H1, имеющую аминокислотную последовательность SEQ ID NO.: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO.: 2, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO.: 3, и три CDR легкой цепи, CDR-L1, имеющую аминокислотную последовательность SEQ ID NO.: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO.: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO.: 6. В некоторых вариантах воплощения, анти-IL13 антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 7. В некоторых вариантах воплощения, анти-IL13 антитело включает вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 9. В некоторых вариантах воплощения, анти-IL13 антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 10. В некоторых вариантах воплощения, анти-IL13 антитело включает легкую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 14. В некоторых вариантах воплощения, анти-IL13 антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 7, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 9. В некоторых вариантах воплощения, анти-IL13 антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 10, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 14. В некоторых вариантах воплощения, количество PLBL2 хомячка количественно определяют с использованием иммунологического анализа или масс-спектрометрического анализа. В некоторых вариантах воплощения, иммунологический анализ представляет собой ELISA на все белки клеток яичника китайского хомячка или ELISA на PLBL2 хомячка. В некоторых вариантах воплощения, масс-спектрометрический анализ представляет собой LC-MS/MS.
В еще одном аспекте предусмотрены способы очистки рекомбинантного белка, полученного в клетках CHO, где способ обеспечивает получение очищенного препарата, включающего рекомбинантный полипептид и остаточное количество PLBL2 хомячка. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 20 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 15 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 10 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 8 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 3 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 2 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 1 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 0,5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка находится в диапазоне между 0,5 нг/мг и 20 нг/мг, или между 0,5 нг/мг и 15 нг/мг, или между 0,5 нг/мг и 10 нг/мг, или между 0,5 нг/мг и 8 нг/мг, или между 0,5 нг/мг и 5 нг/мг, или между 0,5 нг/мг и 3 нг/мг, или между 0,5 нг/мг и 2 нг/мг, или между 0,5 нг/мг и 1 нг/мг, или между пределом количественного определения в анализе (LOQ) и 1 нг/мг. В некоторых вариантах воплощения, рекомбинантный полипептид выбран из фактора роста, цитокина, антитела, фрагмента антитела и иммуноадгезина. В некоторых вариантах воплощения, рекомбинантный полипептид представляет собой антитело. В некоторых вариантах воплощения, антитело представляет собой гуманизированное моноклональное антитело. В некоторых вариантах воплощения, антитело представляет собой IgG1, или IgG2, или IgG3, или IgG4. В некоторых вариантах воплощения, антитело представляет собой IgG1. В некоторых вариантах воплощения, антитело представляет собой IgG2. В некоторых вариантах воплощения, антитело представляет собой IgG3. В некоторых вариантах воплощения, антитело представляет собой IgG4. В некоторых вариантах воплощения, способ включает стадию хроматографии гидрофобных взаимодействий (HIC). В некоторых вариантах воплощения, стадия HIC включает применение смолы PHENYL SEPHAROSETM 6 Fast Flow (High Sub).
В некоторых вариантах воплощения указанных выше способов очистки, очищенное антитело представляет собой анти-IL13. В некоторых вариантах воплощения, антитело представляет собой лебрикизумаб. В некоторых вариантах воплощения, стадия HIC включает применение колонки со смолой в режиме сбора проскока. В некоторых вариантах воплощения, стадия HIC включает применение уравновешивающего буфера и промывочного буфера, где уравновешивающий буфер и промывочный буфер включают 50 мМ ацетат натрия, pH 5,0. В некоторых вариантах воплощения, проскок контролируют по поглощению при 280 нанометрах, и проскок собирают между 0,5 OD и 1,5 OD. В некоторых вариантах воплощения, проскок собирают в объеме максимум 8 объемов колонки. В некоторых вариантах воплощения, способ дополнительно включает стадию аффинной хроматографии. В некоторых вариантах воплощения, аффинная хроматография представляет собой хроматографию на белке A. В некоторых вариантах воплощения, способ дополнительно включает стадию ионообменной хроматографии. В некоторых вариантах воплощения, ионообменная хроматография представляет собой анионообменную хроматографию. В некоторых вариантах воплощения, способы включают первую стадию аффинной хроматографии на белке A, вторую стадию анионообменной хроматографии и третью стадию хроматографии гидрофобных взаимодействий (HIC). В некоторых вариантах воплощения, стадия аффинной хроматографии включает применение смолы MABSELECT SURETM, стадия анионообменной хроматографии включает применение смолы Q SEPHAROSETM Fast Flow, и стадия HIC включает применение смолы PHENYL SEPHAROSETM 6 Fast Flow (high sub). В некоторых вариантах воплощения, стадия аффинной хроматографии включает применение колонки со смолой MABSELECT SURETM в режиме связывания и элюирования, стадия анионообменной хроматографии включает применение колонки со смолой Q SEPHAROSETM Fast Flow в режиме связывания и элюирования, и стадия HIC включает применение колонки со смолой PHENYL SEPHAROSETM 6 Fast Flow (High Sub) в режиме сбора проскока. В некоторых вариантах воплощения, количество PLBL2 хомячка количественно определяют с использованием иммунологического анализа или масс-спектрометрического анализа. В некоторых вариантах воплощения, иммунологический анализ представляет собой ELISA на все белки клеток яичника китайского хомячка или ELISA на PLBL2 хомячка. В некоторых вариантах воплощения, масс-спектрометрический анализ представляет собой LC-MS/MS.
В некоторых вариантах воплощения указанных выше способов очистки, очищенное антитело представляет собой анти-Abeta. В некоторых вариантах воплощения, анти-Abeta антитело представляет собой кренезумаб. В некоторых вариантах воплощения, анти-Abeta антитело включает три CDR тяжелой цепи, CDR-H1, имеющую аминокислотную последовательность SEQ ID NO.:23, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO.:24, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO.:25, и три CDR легкой цепи, CDR-L1, имеющую аминокислотную последовательность SEQ ID NO.:26, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO.:27, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO.:28. В некоторых вариантах воплощения, анти-Abeta антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.:29. В некоторых вариантах воплощения, анти-Abeta антитело включает вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.:30. В некоторых вариантах воплощения, анти-Abeta антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.:29, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.:30. В некоторых вариантах воплощения, стадия HIC включает применение колонки со смолой в режиме сбора проскока. В некоторых вариантах воплощения, стадия HIC включает применение уравновешивающего буфера и промывочного буфера, где уравновешивающий буфер и промывочный буфер включают 150 мМ ацетат натрия c pH 5,0. В некоторых вариантах воплощения, стадия HIC включает применение уравновешивающего буфера и промывочного буфера, где уравновешивающий буфер и промывочный буфер включают 150 мМ ацетат натрия c pH 4,0. В некоторых вариантах воплощения, стадия HIC включает применение уравновешивающего буфера и промывочного буфера, где уравновешивающий буфер и промывочный буфер включают 150 мМ ацетат натрия, 240 мМ сульфат натрия, pH 4,0. В некоторых вариантах воплощения, стадия HIC включает применение уравновешивающего буфера и промывочного буфера, где уравновешивающий буфер и промывочный буфер включают 150 мМ ацетат натрия, 240 мМ сульфат натрия, pH 5,0. В некоторых вариантах воплощения, плотность нанесения составляет 300 г/л. В некоторых вариантах воплощения, плотность нанесения составляет 100 г/л. В некоторых вариантах воплощения, проскок контролируют по поглощению при 280 нанометрах, и проскок собирают, начиная с 0,5 OD, и в объеме 10 объемов колонки. В некоторых вариантах воплощения, способ дополнительно включает стадию аффинной хроматографии. В некоторых вариантах воплощения, аффинная хроматография представляет собой хроматографию на белке A. В некоторых вариантах воплощения, способы дополнительно включают стадию комбинированной хроматографии. В некоторых вариантах воплощения, способы включают первую стадию аффинной хроматографии на белке A, вторую стадию комбинированной хроматографии и третью стадию хроматографии гидрофобных взаимодействий (HIC). В некоторых вариантах воплощения, стадия аффинной хроматографии включает применение смолы MABSELECT SURETM, стадия комбинированной хроматографии включает применение смолы CAPTOTM Adhere, и стадия HIC включает применение смолы PHENYL SEPHAROSETM 6 Fast Flow (high sub). В некоторых вариантах воплощения, стадия аффинной хроматографии включает применение колонки со смолой MABSELECT SURETM в режиме связывания и элюирования, стадия комбинированной хроматографии включает применение колонки со смолой CAPTOTM Adhere в режиме сбора проскока, и стадия HIC включает применение колонки со смолой PHENYL SEPHAROSETM 6 Fast Flow (High Sub) в режиме сбора проскока. В некоторых вариантах воплощения, количество PLBL2 хомячка количественно определяют с использованием иммунологического анализа или масс-спектрометрического анализа. В некоторых вариантах воплощения, иммунологический анализ представляет собой ELISA на все белки клеток яичника китайского хомячка или ELISA на PLBL2 хомячка. В некоторых вариантах воплощения, масс-спектрометрический анализ представляет собой LC-MS/MS.
В еще одном дополнительном аспекте указанных выше способов очистки, очищенное антитело представляет собой IgG1. В некоторых вариантах воплощения, антитело представляет собой анти-IL17 A/F. В некоторых вариантах воплощения, анти-IL17 A/F антитело включает три CDR тяжелой цепи, CDR-H1, имеющую аминокислотную последовательность SEQ ID NO.:15, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO.:16, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO.:17, и три CDR легкой цепи, CDR-L1, имеющую аминокислотную последовательность SEQ ID NO.:18, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO.:19, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO.:20. В некоторых вариантах воплощения, анти-IL17 A/F антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.:21. В некоторых вариантах воплощения, анти-IL17 A/F антитело включает вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.:22. В некоторых вариантах воплощения, анти-IL17 A/F антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.:21, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.:22. В некоторых вариантах воплощения, стадия HIC хроматографии включает применение уравновешивающего буфера и промывочного буфера, где уравновешивающий буфер и промывочный буфер включают 50 мМ ацетат натрия, pH 5,5. В некоторых вариантах воплощения, проскок контролируют по поглощению при 280 нанометрах, и проскок собирают, начиная с 0,5 OD, и в объеме 10 объемов колонки. В некоторых вариантах воплощения, способ дополнительно включает стадию аффинной хроматографии. В некоторых вариантах воплощения, аффинная хроматография представляет собой хроматографию на белке A. В некоторых вариантах воплощения, способы дополнительно включают стадию катионообменной хроматографии. В некоторых вариантах воплощения, способы включают первую стадию аффинной хроматографии и вторую стадию катионообменной хроматографии перед стадией хроматографии гидрофобных взаимодействий. В некоторых вариантах воплощения, стадия аффинной хроматографии включает применение смолы MABSELECT SURETM, стадия катионообменной хроматографии включает применение смолы POROS 50 HS, и стадия HIC включает применение смолы PHENYL SEPHAROSETM 6 Fast Flow (high sub). В некоторых вариантах воплощения, стадия аффинной хроматографии включает применение колонки со смолой MABSELECT SURETM в режиме связывания и элюирования; стадия катионообменной хроматографии включает применение колонки со смолой PORO 50 HS в режиме связывания и элюирования, и стадия HIC включает применение колонки со смолой PHENYL SEPHAROSETM 6 Fast Flow (High Sub) в режиме сбора проскока.
В еще одном аспекте, предусмотрены препараты моноклонального анти-Abeta, антитела очищенные из клеток CHO с помощью процесса, включающего стадию хроматографии гидрофобных взаимодействий (HIC). В некоторых вариантах воплощения, очищенный препарат включает анти-Abeta антитело и остаточное количество PLBL2 хомячка. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 20 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 15 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 10 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 8 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 3 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 2 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 1 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 0,5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка находится в диапазоне между 0,5 нг/мг и 20 нг/мг, или между 0,5 нг/мг и 15 нг/мг, или между 0,5 нг/мг и 10 нг/мг, или между 0,5 нг/мг и 8 нг/мг, или между 0,5 нг/мг и 5 нг/мг, или между 0,5 нг/мг и 3 нг/мг, или между 0,5 нг/мг и 2 нг/мг, или между 0,5 нг/мг и 1 нг/мг, или между пределом количественного определения в анализе (LOQ) и 1 нг/мг. В некоторых вариантах воплощения, стадия HIC включает применение смолы PHENYL SEPHAROSETM 6 Fast Flow (High Sub). В некоторых вариантах воплощения, стадия HIC включает применение колонки со смолой в режиме сбора проскока. В некоторых вариантах воплощения, стадия HIC включает применение уравновешивающего буфера и промывочного буфера, где уравновешивающий буфер и промывочный буфер включают 150 мМ ацетат натрия, pH 5,0. В некоторых вариантах воплощения, стадия HIC включает применение уравновешивающего буфера и промывочного буфера, где уравновешивающий буфер и промывочный буфер включают 150 мМ ацетат натрия, pH 4,0. В некоторых вариантах воплощения, стадия HIC включает применение уравновешивающего буфера и промывочного буфера, где уравновешивающий буфер и промывочный буфер включают 150 мМ ацетат натрия, 240 мМ сульфат натрия, pH 4,0. В некоторых вариантах воплощения, стадия HIC включает применение уравновешивающего буфера и промывочного буфера, где уравновешивающий буфер и промывочный буфер включают 150 мМ ацетат натрия, 240 мМ сульфат натрия, pH 5,0. В некоторых вариантах воплощения, плотность нанесения составляет 300 г/л. В некоторых вариантах воплощения, плотность нанесения составляет 100 г/л. В некоторых вариантах воплощения, проскок контролируют по поглощению при 280 нанометрах, и проскок собирают, начиная с 0,5 OD, и в объеме 10 объемов колонки. В некоторых вариантах воплощения, процесс дополнительно включает стадию аффинной хроматографии. В некоторых вариантах воплощения, аффинная хроматография представляет собой хроматографию на белке A. В некоторых вариантах воплощения, процесс дополнительно включает стадию комбинированной хроматографии. В некоторых вариантах воплощения, анти-Abeta антитело включает три CDR тяжелой цепи, CDR-H1, имеющую аминокислотную последовательность SEQ ID NO.: 23, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO.: 24, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO.: 25, и три CDR легкой цепи, CDR-L1, имеющую аминокислотную последовательность SEQ ID NO.: 26, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO.: 27, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO.: 28. В некоторых вариантах воплощения, анти-Abeta антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 29. В некоторых вариантах воплощения, анти-Abeta антитело включает вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 30. В некоторых вариантах воплощения, анти-Abeta антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 29, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 30. В некоторых вариантах воплощения, количество PLBL2 хомячка количественно определяют с использованием иммунологического анализа или масс-спектрометрического анализа. В некоторых вариантах воплощения, иммунологический анализ представляет собой ELISA на все белки клеток яичника китайского хомячка или ELISA на PLBL2 хомячка. В некоторых вариантах воплощения, масс-спектрометрический анализ представляет собой LC-MS/MS.
В одном из аспектов, предусмотрены препараты анти-IL17 A/F моноклонального антитела, выделенные и очищенные из клеток CHO с помощью процесса, включающего стадию хроматографии гидрофобных взаимодействий (HIC). В некоторых вариантах воплощения, очищенный препарат включает анти-IL17 A/F антитело и остаточное количество PLBL2 хомячка. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 20 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 15 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 10 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 8 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 3 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 2 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 1 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 0,5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка находится в диапазоне между 0,5 нг/мг и 20 нг/мг, или между 0,5 нг/мг и 15 нг/мг, или между 0,5 нг/мг и 10 нг/мг, или между 0,5 нг/мг и 8 нг/мг, или между 0,5 нг/мг и 5 нг/мг, или между 0,5 нг/мг и 3 нг/мг, или между 0,5 нг/мг и 2 нг/мг, или между 0,5 нг/мг и 1 нг/мг, или между пределом количественного определения в анализе (LOQ) и 1 нг/мг. В некоторых вариантах воплощения, стадия HIC включает применение смолы PHENYL SEPHAROSETM 6 Fast Flow (High Sub). В некоторых вариантах воплощения, стадия HIC включает применение колонки со смолой в режиме сбора проскока. В некоторых вариантах воплощения, стадия HIC включает применение уравновешивающего буфера и промывочного буфера, где уравновешивающий буфер и промывочный буфер включают 50 мМ ацетат натрия, pH 5,5. В некоторых вариантах воплощения, проскок контролируют по поглощению при 280 нанометрах, и проскок собирают, начиная с 0,5 OD, и в объеме 10 объемов колонки. В некоторых вариантах воплощения, процесс дополнительно включает стадию аффинной хроматографии. В некоторых вариантах воплощения, аффинная хроматография представляет собой хроматографию на белке A. В некоторых вариантах воплощения, процесс дополнительно включает стадию катионообменной хроматографии. В некоторых вариантах воплощения, анти-IL17 A/F антитело включает три CDR тяжелой цепи, CDR-H1, имеющую аминокислотную последовательность SEQ ID NO.: 15, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO.: 16, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO.: 17, и три CDR легкой цепи, CDR-L1, имеющую аминокислотную последовательность SEQ ID NO.: 18, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO.: 19, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO.: 20. В некоторых вариантах воплощения, анти- IL17 A/F антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 21. В некоторых вариантах воплощения, анти- IL17 A/F антитело включает вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 22. В некоторых вариантах воплощения, анти- IL17 A/F антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 21, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 32. В некоторых вариантах воплощения, количество PLBL2 хомячка количественно определяют с использованием иммунологического анализа или масс-спектрометрического анализа. В некоторых вариантах воплощения, иммунологический анализ представляет собой ELISA на все белки клеток яичника китайского хомячка или ELISA на PLBL2 хомячка. В некоторых вариантах воплощения, масс-спектрометрический анализ представляет собой LC-MS/MS.
В еще одном аспекте, предусмотрены композиции, включающие анти-Abeta моноклональное антитело, очищенное из клеток CHO, включающие анти-Abeta антитело и остаточное количество PLBL2 хомячка. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 20 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 15 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 10 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 8 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 3 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 2 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 1 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 0,5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка находится в диапазоне между 0,5 нг/мг и 20 нг/мг, или между 0,5 нг/мг и 15 нг/мг, или между 0,5 нг/мг и 10 нг/мг, или между 0,5 нг/мг и 8 нг/мг, или между 0,5 нг/мг и 5 нг/мг, или между 0,5 нг/мг и 3 нг/мг, или между 0,5 нг/мг и 2 нг/мг, или между 0,5 нг/мг и 1 нг/мг, или между пределом количественного определения в анализе (LOQ) и 1 нг/мг. В некоторых вариантах воплощения, анти-Abeta антитело представляет собой кренезумаб. В некоторых вариантах воплощения, анти-Abeta антитело включает три CDR тяжелой цепи, CDR-H1, имеющую аминокислотную последовательность SEQ ID NO.:23, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO.:24, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO.:25, и три CDR легкой цепи, CDR-L1, имеющую аминокислотную последовательность SEQ ID NO.:26, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO.:27, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO.:28. В некоторых вариантах воплощения, анти-Abeta антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.:29. В некоторых вариантах воплощения, анти-Abeta антитело включает вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.:30. В некоторых вариантах воплощения, анти-Abeta антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.:29, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.:30.
В еще одном аспекте, предусмотрены композиции, включающие анти-IL17 A/F моноклональное антитело, очищенное из клеток CHO, включающие анти-IL17 A/F антитело и остаточное количество PLBL2 хомячка. В некоторых вариантах воплощения, композиция включает анти-IL17 A/F антитело и остаточное количество PLBL2 хомячка, где количество PLBL2 хомячка составляет менее 20 нг/мг, или менее 15 нг/мг, или менее 10 нг/мг, или менее 8 нг/мг, или менее 5 нг/мг, или менее 3 нг/мг, или менее 2 нг/мг, или менее 1 нг/мг, или менее 0,5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 20 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 15 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 10 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 8 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 3 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 2 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 1 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 0,5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка находится в диапазоне между 0,5 нг/мг и 20 нг/мг, или между 0,5 нг/мг и 15 нг/мг, или между 0,5 нг/мг и 10 нг/мг, или между 0,5 нг/мг и 8 нг/мг, или между 0,5 нг/мг и 5 нг/мг, или между 0,5 нг/мг и 3 нг/мг, или между 0,5 нг/мг и 2 нг/мг, или между 0,5 нг/мг и 1 нг/мг, или между пределом количественного определения в анализе (LOQ) и 1 нг/мг. В некоторых вариантах воплощения, анти-IL17 A/F антитело включает три CDR тяжелой цепи, CDR-H1, имеющую аминокислотную последовательность SEQ ID NO.:15, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO.:16, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO.:17, и три CDR легкой цепи, CDR-L1, имеющую аминокислотную последовательность SEQ ID NO.:18, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO.:19, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO.:20. В некоторых вариантах воплощения, анти-IL17 A/F антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.:21. В некоторых вариантах воплощения, анти-IL17 A/F антитело включает вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.:22. В некоторых вариантах воплощения, анти-IL17 A/F антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.:21, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.:22.
В одном из аспектов, предусмотрены способы лечения опосредованного IL-13 расстройства, включающие введение композиции для лечения, включающей анти-IL13 моноклональное антитело, очищенное из клеток CHO, и остаточное количество PLBL2 хомячка. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 20 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 15 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 10 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 8 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 3 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 2 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 1 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка составляет менее 0,5 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка находится в диапазоне между 0,5 нг/мг и 20 нг/мг, или между 0,5 нг/мг и 15 нг/мг, или между 0,5 нг/мг и 10 нг/мг, или между 0,5 нг/мг и 8 нг/мг, или между 0,5 нг/мг и 5 нг/мг, или между 0,5 нг/мг и 3 нг/мг, или между 0,5 нг/мг и 2 нг/мг, или между 0,5 нг/мг и 1 нг/мг, или между пределом количественного определения в анализе (LOQ) и 1 нг/мг. В некоторых вариантах воплощения, анти-IL13 антитело включает три CDR тяжелой цепи, CDR-H1, имеющую аминокислотную последовательность SEQ ID NO.: 1, CDR-H2, имеющую аминокислотную последовательность SEQ ID NO.: 2, и CDR-H3, имеющую аминокислотную последовательность SEQ ID NO.: 3, и три CDR легкой цепи, CDR-L1, имеющую аминокислотную последовательность SEQ ID NO.: 4, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO.: 5, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO.: 6. В некоторых вариантах воплощения, анти-IL13 антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 7. В некоторых вариантах воплощения, анти-IL13 антитело включает вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 9. В некоторых вариантах воплощения, анти-IL13 антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 10. В некоторых вариантах воплощения, анти-IL13 антитело включает легкую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 14. В некоторых вариантах воплощения, анти-IL13 антитело включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 7, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO.: 9. В некоторых вариантах воплощения, анти-IL13 антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 10, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 14. В некоторых вариантах воплощения, композицию для лечения вводят подкожно один раз каждые четыре недели. В некоторых вариантах воплощения, композицию для лечения вводят подкожно один раз каждые восемь недель. В некоторых вариантах воплощения, композицию для лечения вводят подкожно один раз каждые 12 недель. В некоторых вариантах воплощения, пациента лечат один раз каждые четыре недели на протяжении, по меньшей мере, одного месяца. В некоторых вариантах воплощения, пациента лечат один раз каждые четыре недели на протяжении, по меньшей мере, трех месяцев. В некоторых вариантах воплощения, пациента лечат один раз каждые четыре недели на протяжении, по меньшей мере, шести месяцев. В некоторых вариантах воплощения, пациента лечат один раз каждые четыре недели на протяжении, по меньшей мере, девяти месяцев. В некоторых вариантах воплощения, пациента лечат один раз каждые четыре недели на протяжении, по меньшей мере, 12 месяцев. В некоторых вариантах воплощения, пациента лечат один раз каждые четыре недели на протяжении, по меньшей мере, 18 месяцев. В некоторых вариантах воплощения, пациента лечат один раз каждые четыре недели на протяжении, по меньшей мере, двух лет. В некоторых вариантах воплощения, пациента лечат один раз каждые четыре недели на протяжении более двух лет. В некоторых вариантах воплощения, опосредованное IL-13 расстройство представляет собой астму. В некоторых вариантах воплощения, опосредованное IL-13 расстройство представляет собой идиопатический легочный фиброз. В некоторых вариантах воплощения, опосредованное IL-13 расстройство представляет собой атопический дерматит. В некоторых вариантах воплощения, опосредованное IL-13 расстройство выбрано из аллергической астмы, неаллергической (эндогенной) астмы, аллергического ринита, атопического дерматита, аллергического конъюктивита, экземы, крапивницы, пищевых аллергий, хронической обструктивной болезни легких, язвенного колита, инфекции RSV, увеита, склеродермии и остеопороза.
В другом аспекте, введение композиции для лечения пациенту в соответствии с любым описанным выше способом является менее иммуногенным в отношении PLBL2 хомячка по сравнению с введением композиции сравнения, где композиция сравнения включает анти-IL13 моноклональное антитело, очищенное из клеток-хозяев яичника китайского хомячка, и остаточное количество PLBL2 хомячка, количество которого больше 30 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка в композиции сравнения больше, чем 50 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка в композиции сравнения больше, чем 100 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка в композиции сравнения больше, чем 200 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка в композиции сравнения больше, чем 300 нг/мг. В некоторых вариантах воплощения, количество PLBL2 хомячка в композиции сравнения составляет между 30 нг/мг и 300 нг/мг, или между 30 нг/мг и 200 нг/мг, или между 30 нг/мг и 100 нг/мг, или между 30 нг/мг и 50 нг/мг.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фигуре 1 показаны уровни CHOP в пулах анти-IL13 MAb, полученных с использованием белка A, обработанных каприловой кислотой, как описано в Примере 2. (A) Осаждение пула, полученного с использованием белка A, каприловой кислотой при pH 4,5; (B) Осаждение пула, полученного с использованием A, каприловой кислотой при pH 5,0. Уровни CHOP в нг/мг отмечены вдоль вертикальной оси; процент каприловой кислоты отмечен вдоль горизонтальной оси, каждый столбик представляет собой значение, полученное в результате 2-кратного серийного разведения.
На Фигуре 2 показаны общие уровни CHOP в обработанной добавками HCCF с анти-IL13 MAb с последующей хроматографией на белке A и последующей катионообменной хроматографией на POROS® 50HS, как описано в Примере 2. Скорректированные уровни CHOP в нг/мл отмечены на вертикальной оси; добавки (контроль, 0,6M гуанидин или 0,6M аргинин) указаны на горизонтальной оси, каждый столбик представляет собой значение, полученное в результате 2-кратного серийного разведения, как указано.
На Фигуре 3 показаны общие уровни CHOP в пулах UFDF анти-IL13 MAb, подвергнутых очистке на разных HIC смолах при разных концентрациях соли и значениях pH, как описано в Примере 2. (A) смола OCTYL-SEPHAROSE® Fast Flow; (B) смола PHENYL SEPHAROSETM 6 Fast Flow (low sub); (C) смола BUTYL-SEPHAROSE® 4 Fast Flow; (D) смола PHENYL SEPHAROSETM 6 Fast Flow (high sub); наибольшее разведение CHOP (в ppm) указано на вертикальной оси, и концентрации сульфата натрия отмечены на горизонтальной оси; pH (5,5, 6,0, 7,0 или 8,0) указан в подписях к Фигуре.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если не определено иное, все технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно понимается специалистом в области, к которой относится это изобретение. Singleton et al., Dictionary of Microbiology and Molecular Biology 2nd ed., J. Wiley & Sons (New York, N.Y. 1994) и March, Advanced Organic Chemistry Reactions, Mechanisms and Structure 4th ed., John Wiley & Sons (New York, N.Y. 1992) являются для специалиста в данной области техники общим руководством для многих терминов, использованных в настоящей заявке.
НЕКОТОРЫЕ ОПРЕДЕЛЕНИЯ
С целью интерпретации данного описания будут применяться нижеследующие определения, и всякий раз, когда это уместно, термины, используемые в единственном числе, будут также включать множественное число, и наоборот. В том случае, если любое определение, приведенное ниже, не соответствует таковому в любом из документов, включенных в настоящий документ посредством ссылки, определение, приведенное ниже, должно рассматриваться как основное.
Использованные в этом описании и прилагаемой формуле изобретения формы единственного числа включают также указание множественного числа, если в контексте ясно не указано иное. Таким образом, например, ссылка на "белок" или "антитело" включает множество белков или антител, соответственно; ссылка на "клетку" включает смесь клеток и тому подобное.
Термин "обнаружение" используется в настоящем документе в широком смысле и включает как качественное, так и количественное измерение целевой молекулы. Обнаружение включает определение только факта присутствия целевой молекулы в образце, а также определение того, присутствует ли целевая молекула в образце в обнаруживаемом количестве.
"Образец" относится к небольшой части большего количества материала. Обычно, тестирование в соответствие со способами, описанными в настоящем документе, осуществляют с использованием образца. Образец, как правило, получают из препарата рекомбинантного полипептида, полученного, например, из культивируемых клеток-хозяев. Образец может быть получен, например, из собранной культуральной жидкости, из внутрипроизводственного пула, отобранного на определенной стадии процесса очистки, или из конечного очищенного продукта, но не ограничаясь вышеперечисленным.
Термин "продукт", как описано в настоящем документе, представляет собой вещество, которое должно быть очищено различными хроматографическими способами; например, полипептид.
Термины "полипептид" или "белок" используются в настоящем документе взаимозаменяемо и относятся к полимерам аминокислот любой длины. Полимер может быть линейным или разветвленным, он может включать модифицированные аминокислоты и может также включать не аминокислоты. Термины дополнительно включают аминокислотный полимер, который был модифицирован естественным образом или в результате вмешательств; например, образование дисульфидной связи, гликозилирование, липидизация, ацетилирование, фосфорилирование или любые другие манипуляции или модификации, такие как конъюгация с меченым компонентом. Также данное определение включает, например, полипептиды, содержащие один или несколько аналогов аминокислот (включая, например, неприродные аминокислоты и тому подобное), а также другие модификации, известные в данной области техники. Использованные в настоящем документе термины "полипептид" и "белок", в частности, включают антитела.
"Очищенный" полипептид (например, антитело или иммуноадгезин) означает, что чистота полипептида была увеличена, так что полипептид существует в более чистой форме по сравнению с формой, в которой он существует в природной среде, и/или по сравнению с изначально синтезированной и/или амплифицированной в лабораторных условиях формой. Чистота представляет собой относительный термин и не означает обязательно абсолютную чистоту.
Использованный в настоящем документе термин "эпитопно меченый" относится к химерному полипептиду, включающему полипептид, слитый с "полипептидом-меткой". Число остатков в полипептиде-метке достаточно, чтобы обеспечить эпитоп, против которого может быть получено антитело, но в том же время полипептид-метка достаточно короткий, чтобы не влиять на активность полипептида, с которым он слит. Полипептид-метка предпочтительно также является достаточно уникальным, так что антитело практически не дает перекрестных реакций с другими эпитопами. Подходящие полипептиды-метки обычно имеют, по меньшей мере, шесть аминокислотных остатков, обычно примерно от 8 до 50 аминокислотных остатков (в некоторых случаях, примерно от 10 до 20 аминокислотных остатков).
Термины "активный" или "активность" для целей настоящего документа относится к форме (формам) полипептида, которая сохраняет целевую биологическую и/или иммунологическую активность, где "биологическая" активность относится к биологической функции (ингибирующей или стимулирующей), обусловленной полипептидом, но отличной от его способности индуцировать продукцию антитела против антигенного эпитопа на полипептиде, и "иммунологическая" активность относится к способности полипептида индуцировать продукцию антитела против антигенного эпитопа на полипептиде.
Термин "антагонист" используется в настоящем документе в широком смысле и включает любые молекулы, которые частично или полностью блокируют, ингибируют или нейтрализуют биологическую активность природного полипептида, например, цитокина. Аналогично, термин "агонист" используется в настоящем документе в широком смысле и включает любую молекулу, которая имитирует биологическую активность природного полипептида. Подходящие молекулы агонистов или антагонистов, в частности, включают антитела или фрагменты антител, фрагменты или варианты аминокислотной последовательности природных полипептидов и тому подобное. Способы идентификации агонистов или антагонистов полипептида могут включать контакт полипептида с потенциальной молекулой агонистом или антагонистом и измерение обнаруживаемого изменения одной или нескольких биологических активностей, в норме связанных с полипептидом.
Полипептид, "который связывается с" целевым антигеном, например, ассоциированным с опухолью целевым полипептидным антигеном, представляет собой полипептид, который связывается с антигеном с достаточной аффинностью, так что полипептид используется в качестве реагента в анализе, диагностического и/или терапевтического агента для направленного взаимодействия с образцом, содержащим антиген, клетки или ткани, экспрессирующие антиген, и не обладает значительной кросс-реактивностью в отношении других полипептидов.
В отношении связывания полипептида с целевой молекулой термины "специфическое связывание" с конкретным полипептидом или эпитопом на конкретном целевом полипептиде, или "специфично связывается с" конкретным полипептидом или эпитопом на конкретном целевом полипептиде, или "специфичный к" конкретному полипептиду или эпитопу на конкретном целевом полипептиде означают связывание, которое измеримо отличается от неспецифического взаимодействия. Специфическое связывание можно измерить, например, сравнивая связывание молекулы и связывание контрольной молекулы, которая обычно представляет собой молекулу, имеющую аналогичную структуру, но не обладающую связывающей активностью. Например, специфическое связывание можно определить по конкуренции за связывание с контрольной молекулой, сходной с целевой молекулой, например, используя избыток немеченой целевой молекулы. В этом случае специфическое связывание присутствует, если связывание меченой целевой молекулы с зондом конкурентно ингибируется избытком немеченой целевой молекулы.
Термин "антитело" используется в настоящем документе в широком смысле и включает различные структуры антител, включая, но не ограничиваясь ими, моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), образованные, по меньшей мере, из двух интактных антител, и фрагменты антител, при условии, что они обладают желаемой биологической активностью. Термин "иммуноглобулин" (Ig) и термин "антитело" являются в настоящем документе взаимозаменяемыми.
Антитела представляют собой встречающиеся в природе молекулы иммуноглобулинов, имеющие различную структуру и характерную для иммуноглобулинов укладку цепи. Например, антитела IgG имеют две "тяжелых" цепи и две "легких" цепи, которые связаны дисульфидными связями с образованием функционального антитела. Каждая тяжелая и легкая цепь в отдельности включают "константную" (C) и "вариабельную" (V) области. V области определяют антигенсвязывающую специфичность антитела, а C области обеспечивают структурный каркас молекулы и участвуют во взаимодействиях с иммунными эффекторами, не связанных со специфичностью по отношению к антигену. Антигенсвязывающая специфичность антитела или антигенсвязывающего фрагмента антитела представляет собой способность антитела специфично связываться с конкретным антигеном.
Антигенсвязывающая специфичность антитела определяется структурными характеристиками V области. Вариабельность не распределена равномерно между 110 аминокислотами вариабельных доменов. Наоборот, V области состоят из относительно инвариантных участков, называемых каркасными областями (FR), из 15-30 аминокислот, разделенных более короткими очень вариабельными участками, называемыми "гипервариабельными областями", каждый из которых имеет в длину 9-12 аминокислот. Каждый вариабельный домен нативных тяжелых и легких цепей включает четыре FR, в основном принимающих конфигурацию β-листа, соединенных тремя гипервариабельными областями, которые образуют петли, соединяющие структуры β-листа и, в некоторых случаях, образующие часть структуры β-листа. Гипервариабельные области в каждой цепи удерживаются в непосредственной близости друг от друга за счет FR и вместе с гипервариабельными областями из другой цепи вносят вклад в образование антигенсвязывающего сайта антител (смотрите, Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Константные домены не участвуют непосредственно в связывании антитела с антигеном, но обуславливают различные эффекторные функции, такие как участие антитела в антителозависимой клеточноопосредованной цитотоксичности (ADCC).
Каждая V область, как правило, включает три определяющие комплементарность области ("CDR", каждая из которых содержит "гипервариабельную петлю") и четыре каркасных области. Антигенсвязывающий сайт, минимальная структурная единица, необходимая для связывания со значительной аффинностью с конкретным целевым антигеном, следовательно, как правило, будет включать три CDR и, по меньшей мере, три, предпочтительно, четыре, каркасные области, расположенные между ними, чтобы удерживать и представлять CDR в соответствующей конформации. Классические четырехцепочечные антитела имеют антигенсвязывающие сайты, которые определяются совместно доменами VH и VL. У некоторых антител, таких как верблюжьи и акульи антитела, отсутствуют легкие цепи и имеются сайты связывания, образованные только тяжелыми цепями. Могут быть получены генноинженерные одноцепочечные иммуноглобулины, в которых сайты связывания образованы только тяжелыми цепями или только легкими цепями, в отсутствии кооперации между VH и VL.
Использованный в настоящем документе термин "гипервариабельная область" относится к некоторым аминокислотным остаткам антител, которые отвечают за связывание антигена. Гипервариабельная область может включать аминокислотные остатки из "определяющей комплементарность области" или "CDR", как обсуждалось выше (например, вблизи остатков примерно 24-34 (L1), 50-56 (L2) и 89-97 (L3) в VL и вблизи остатков примерно 31-35B (H1), 50-65 (H2) и 95-102 (H3) в VH (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)), и/или остатки из "гипервариабельной петли" (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в VL и 26-32 (H1), 52A-55 (H2) и 96-101 (H3) в VH (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)).
"Каркасные" остатки или остатки "FR" представляют собой остатки вариабельного домена, отличные от остатков гипервариабельной области, как это определено в настоящем документе.
"Фрагменты антител" включают часть интактного антитела, предпочтительно включающую его антигенсвязывающую область. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; диатела; тандемные диатела (taDb), линейные антитела (например, патент США номер 5,641,870, Пример 2; Zapata et al., Protein Eng. 8(10):1057-1062 (1995)); антитела с одним плечом, антитела с единственным вариабельным доменом, миниантитела, одноцепочечные молекулы антител; мультиспецифические антитела, образованные из фрагментов антител (например, включая, но не ограничиваясь ими, Db-Fc, taDb-Fc, taDb-CH3, (scFV)4-Fc, ди-scFv, би-scFv или тандем (ди,три)-scFv); и биспецифические активаторы T-клеток (BiTE).
В результате расщепления антител папаином образуются два идентичных антигенсвязывающих фрагмента, называемых фрагментами "Fab", каждый с одним антигенсвязывающим сайтом, и остаточный фрагмент "Fc", название которого отражает его способность легко кристаллизоваться. Обработка пепсином дает фрагмент F(ab')2, который имеет два антигенсвязывающих сайта и еще способен перекрестно связывать антиген.
"Fv" представляет собой минимальный фрагмент антитела, который содержит полный антигенраспознающий и антигенсвязывающий сайт. Эта область состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи, находящихся в прочной, нековалентной связи друг с другом. Именно в этой конфигурации три гипервариабельные области каждого вариабельного домена взаимодействуют с образованием антигенсвязывающего сайта на поверхности димера VH-VL. В совокупности, шесть гипервариабельных областей обуславливают антигенсвязывающую специфичность антитела. Тем не менее, даже один вариабельный домен (или половина Fv, содержащая только три гипервариабельные области, специфичные к антигену) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью, чем полный сайт связывания.
Фрагмент Fab дополнительно содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab за счет добавления нескольких остатков на карбоксильном конце домена CH1 тяжелой цепи, включая один или несколько остатков цистеинов из шарнирной области антитела. Fab'-SH в настоящем документе представляет собой обозначение для Fab', в котором остаток (остатки) цистеина константных доменов несут, по меньшей мере, одну свободную тиольную группу. Фрагменты F(ab')2 антител первоначально были получены как пары Fab'-фрагментов с шарнирными цистеинами между ними. Также известны другие химические способы связывания фрагментов антител.
"Легкие цепи" антител (иммуноглобулинов) из любого вида позвоночных на основании аминокислотных последовательностей их константных доменов могут быть отнесены к одному из двух четко отличающихся типов, называемых каппа (κ) и лямбда (λ).
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей, антитела могут быть отнесены к разным классам. Существует пять основных классов интактных антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть далее подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Константные домены тяжелой цепи, которые соответствуют разным классам антител, называются α, δ, ε, γ и μ, соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
"Одноцепочечные Fv" или "scFv" фрагменты антител включают домены VH и VL антитела, где эти домены присутствуют в единственной полипептидной цепи. В некоторых вариантах воплощения, полипептид Fv дополнительно включает полипептидный линкер между доменами VH и VL, который позволяет scFv формировать нужную структуру для связывания антигена. Обзор scFv можно найти в Plückthun, The Pharmacology of Monoclonal antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994).
Термин "диатела" относится к небольшим фрагментам антител с двумя антигенсвязывающими сайтами, где фрагменты включают вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в той же самой полипептидной цепи (VH - VL). При использовании линкера, который является слишком коротким, чтобы позволить двум доменам одной и той же цепи спариваться друг с другом, домены вынуждены спариваться с комплементарными доменами другой цепи и формировать два антигенсвязывающих сайта. Диатела описаны более подробно, например, в EP 404,097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993).
Термин "мультиспецифическое антитело" используется в настоящем документе в широком смысле и, в частности, охватывает антитело, которое обладает полиэпитопной специфичностью. Такие мультиспецифические антитела включают, но не ограничиваются ими, антитело, включающее вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), где единица VHVL обладает полиэпитопной специфичностью, антитела, имеющие два или несколько доменов VL и VH, где каждая единица VHVL связывается со своим эпитопом, антитела, имеющие два или несколько одиночных вариабельных домена, где каждый одиночный вариабельный домен связывается со своим эпитопом, полноразмерные антитела, фрагменты антител, такие как Fab, Fv, dsFv, scFv, диатела, биспецифические диатела, триатела, три-функциональные антитела, фрагменты антител, связанные ковалентно или нековалентно. "Полиэпитопная специфичность" относится к способности специфично связываться с двумя или несколькими разными эпитопами на одной и той же или разных мишенях. Термин "моноспецифическое" относится к способности связываться только с одним эпитопом. В соответствии с одним из вариантов воплощения, мультиспецифическое антитело представляет собой антитело IgG, которое связывается с каждым эпитопом с аффинностью от 5 мкМ до 0,001 пМ, от 3 мкM до 0,001 пМ, от 1 мкМ до 0,001 пМ, от 0,5 мкМ до 0,001 пМ или от 0,1 мкМ до 0,001 пM.
Выражение "однодоменные антитела" (sdAb) или "антитела с единственным вариабельным доменом (SVD)" обычно относится к антителам, в которых единственный вариабельный домен (VH или VL) может обеспечивать связывание антигена. Другими словами, чтобы распознавать целевой антиген, единственному вариабельному домену не нужно взаимодействовать с другим вариабельным доменом. Примеры однодоменных антител включают антитела, полученные из верблюдовых (ламы и верблюды) и хрящевых рыб (например, акул-нянек), и антитела, которые получены рекомбинантными способами из человеческих и мышиных антител (Nature (1989) 341:544-546; Dev Comp Immunol (2006) 30:43-56; Trend Biochem Sci (2001) 26:230-235; Trends Biotechnol (2003):21:484-490; WO 2005/035572; WO 03/035694; Febs Lett (1994) 339:285-290; WO00/29004; WO 02/051870).
Использованный в настоящем документе термин "моноклональное антитело" относится к антителу, полученному из популяции по существу гомогенных антител, т.е., индивидуальные антитела, входящие в состав популяции, являются идентичными и/или связываются с одним и тем же эпитопом, за исключением возможных вариантов, которые могут возникать в процессе получения моноклонального антитела, но такие варианты обычно присутствуют в минорных количествах. В противоположность препаратам поликлональных антител, которые, как правило, включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против единственной детерминанты на антигене. В дополнение к их специфичности, моноклональные антитела имеют преимущество в том, что они не загрязнены другими иммуноглобулинами. Модификатор "моноклональное" указывает на характер антитела как полученного из по существу гомогенной популяции антител, и не должен быть истолкован как требующий получения антитела любым конкретным способом. Например, моноклональные антитела для применения в соответствии со способами, предусмотренными в настоящем документе, могут быть получены гибридомным способом, впервые описанным Kohler et al., Nature 256:495 (1975), или могут быть получены способами с использованием рекомбинантных ДНК (смотрите, например, патент США номер 4,816,567). "Моноклональные антитела" также могут быть выделены из фаговых библиотек антител с использованием методов, описанных, например, в Clackson et al., Nature 352:624-628 (1991) и Marks et al., J. Mol. Biol. 222:581-597 (1991).
В настоящем документе моноклональные антитела, в частности, включают "химерные" антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из конкретного вида или принадлежащих конкретному классу или подклассу антител, тогда как оставшаяся часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они обладают желаемой биологической активностью (патент США номер 4,816,567; Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)). Целевые химерные антитела в настоящем документе включают "приматизированные" антитела, включающие антигенсвязывающие последовательности вариабельных доменов из антител приматов, не относящихся к человеку (например, мартышковых, таких как бабуин, макака-резус или яванский макак), и человеческие последовательности константных областей (патент США номер 5,693,780).
"Гуманизированные" формы не человеческих (например, мышиных) антител представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из не человеческого иммуноглобулина. По большей части, гуманизированные антитела представляют собой человеческие иммуноглобулины (антитело-реципиент), в которых остатки из гипервариабельной области реципиента замещены на остатки из гипервариабельной области не человеческого антитела (антитело-донор), такого как мышиное, крысиное, кроличье антитело или антитело примата, не относящегося к человеку, обладающего желаемой специфичностью, аффинностью и емкостью. В некоторых случаях, остатки каркасной области (FR) человеческого иммуноглобулина замещены на соответствующие не человеческие остатки. Более того, гуманизированные антитела могут включать остатки, которые не обнаруживаются в антителе-реципиенте или в антителе-доноре. Эти модификации сделаны для дальнейшего улучшения активности антитела. В общем, гуманизированное антитело будет содержать по существу все из, по меньшей мере, одного и, как правило, двух вариабельных доменов, в которых все или по существу все гипервариабельные петли соответствуют таковым в не человеческих иммуноглобулинах, и все или по существу все FR представляют собой FR из последовательности человеческого иммуноглобулина, за исключением упомянутой выше замены (замен) в FR. Гуманизированное антитело необязательно будет дополнительно включать, по меньшей мере, часть константной области иммуноглобулина, как правило, человеческого иммуноглобулина. Для получения более подробной информации, смотрите, Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
Для целей настоящего документа "итактное антитело" представляет собой антитело, включающее вариабельные домены тяжелой и легкой цепей, а также область Fc. Константные домены могут иметь последовательность нативных константных доменов (например, последовательность человеческих нативных константных доменов) или представлять собой вариант их аминокислотной последовательности. Предпочтительно, интактное антитело имеет одну или несколько эффекторных функций.
"Нативные антитела" обычно представляют собой гетеротетрамерные гликопротеины, имеющие размер примерно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, тогда как число дисульфидных связей между тяжелыми цепями может быть разным для разных изотипов иммуноглобулинов. Каждая тяжелая и легкая цепь также имеют регулярно расположенные внутрицепочечные дисульфидные связи. Каждая тяжелая цепь на одном конце содержит вариабельный домен (VH), за которым следует несколько константных доменов. Каждая легкая цепь на одном конце имеет вариабельный домен (VL) и константный домен на другом конце; константный домен легкой цепи выровнен с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи выровнен с вариабельным доменом тяжелой цепи. Определенные аминокислотные остатки, как полагают, образуют область контакта между вариабельными доменами легкой цепи и тяжелой цепи.
"Процент (%) идентичности аминокислотных последовательностей" в отношении последовательности полипептида сравнения определяют как процент аминокислотных остатков в последовательности кандидата, идентичных аминокислотным остаткам в последовательности полипептида сравнения, после выравнивания последовательностей и внесения разрывов, если необходимо, для получения максимального процента идентичности последовательностей и без учета каких-либо консервативных замен как составляющей идентичности последовательностей. Выравнивание с целью определения процента идентичности аминокислотных последовательностей можно осуществить разными способами, которые находятся в пределах компетентности специалиста в данной области техники, например, используя компьютерное программное обеспечение, находящееся в открытом доступе, такое как программы BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить соответствующие параметры для выравнивания последовательностей, в том числе любые алгоритмы, необходимые для получения максимального выравнивания между сравниваемыми полноразмерными последовательностями. Для целей настоящего документа, тем не менее, значения % идентичности аминокислотных последовательностей получают, используя компьютерную программу для сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 была разработана Genentech, Inc. и ее исходный код был подан вместе с пользовательской документацией в бюро регистрации авторских прав США, город Вашингтон, округ Колумбия, 20559, где был зарегистрирован под номером U.S. Copyright Registration No. TXU510087. Программа ALIGN-2 находится в открытом доступе в Genentech, Inc., Южный Сан-Франциско, Калифорния, или может быть скомпилирована в соответствии с исходным кодом. Программа ALIGN-2 должна быть скомпилирована для использования на операционной системе UNIX, в том числе Digital UNIX V4,0D. Все параметры для сравнения последовательностей установлены программой ALIGN-2 и не варьируются.
В ситуациях, когда ALIGN-2 используется для сравнения аминокислотных последовательностей, % идентичности аминокислотных последовательностей для данной аминокислотной последовательности A и данной аминокислотной последовательности B (можно альтернативно перефразировать так: данная аминокислотная последовательность A имеет некоторый % или обладает некоторым % идентичности аминокислотных последовательностей с данной аминокислотной последовательностью B) рассчитывается, как указано ниже:
100 умножить на X/Y,
где X представляет собой число аминокислотных остатков, представляющих собой идентичные совпадения, как определено с помощью программы для выравнивания последовательностей ALIGN-2 при выравнивании A и B, и где Y представляет собой общее число аминокислотных остатков в B. Следует понимать, что там, где длина аминокислотной последовательности A не равна длине аминокислотной последовательности B, % идентичности аминокислотной последовательности A с B не будет равен % идентичности аминокислотной последовательности B с A. Если специально не указано иное, все значения % идентичности аминокислотных последовательностей, использованные в настоящем документе, получены, как описано в непосредственно предшествующем абзаце с использованием компьютерной программы ALIGN-2.
Термины "анти-IL-13 антитело" и "антитело, которое связывается с IL-13", относятся к антителу, которое способно связываться с IL-13 с аффинностью, достаточной для того, чтобы антитело могло использоваться в качестве диагностического и/или терапевтического агента для направленного взаимодействия с IL-13. В некоторых вариантах воплощения, степень связывания анти-IL-13 антитела с неродственным белком, не являющимся IL-13, составляет менее примерно 10% от связывания антитела с IL-13, где измерение проводят, например, с помощью радиоиммунологического анализа (RIA). В некоторых вариантах воплощения, антитело, которое связывается с IL-13, имеет константу диссоциации (Kd), равную ≤ 1 мкМ, ≤ 100 нМ, ≤ 10 нМ, ≤ 1 нМ, ≤ 0,1 нМ, ≤ 0,01 нМ или ≤ 0,001 нМ (например, 10-8 M или меньше, например, от 10-8 M до 10-13 M, например, от 10-9 M до 10-13 M). В некоторых вариантах воплощения, анти-IL-13 антитело связывается с эпитопом IL-13, являющимся консервативным для различных видов.
"Опосредованное IL-13 расстройство" означает расстройство, связанное с избыточным уровнем IL-13 или его избыточной активностью, при котором атипичные симптомы проявляются из-за высокого уровня или активности IL-13 локально и/или в организме в целом. Примеры опосредованных IL-13 расстройств включают рак (например, неходжкинская лимфома, глиобластома), атопический дерматит, аллергический ринит, астму, фиброз, воспалительное заболевание кишечника, болезнь Крона, воспалительные расстройства легких (в том числе фиброз легких, например IPF), COPD и фиброз печени.
Термин "респираторное расстройство" включает астму (например, аллергическую и не аллергическую астму (например, из-за инфекции, например, вызванной респираторно-синцитиальным вирусом (RSV), например, у детей младшего возраста)); бронхит (например, хронический бронхит); хроническую обструктивную болезнь легких (COPD) (например, эмфизему (например, вызванную курением эмфизему); состояния, включающие воспаление дыхательных путей, эозинофилию, фиброз и избыточное образование слизи, например, муковисцидоз, фиброз легких и аллергический ринит, но не ограничиваются ими. Примеры заболеваний, которые могут характеризоваться воспалением дыхательных путей, избыточной секрецией в дыхательных путях и обструкцией дыхательных путей включают астму, хронический бронхит, бронхоэкстаз и муковисцидоз.
Термин "терапевтический агент" относится к любому агенту, который используется для лечения заболевания. Терапевтический агент может представлять собой, например, полипептид (полипептиды) (например, антитело, иммуноадгезин или пептидное антитело), аптамер или низкомолекулярную молекулу, которая может связываться с белком или молекулой нуклиновой кислоты, кодирующей мишень (т.е., миРНК) и тому подобное.
"Голое антитело" представляет собой антитело (как определено в настоящем документе), которое не конъюгировано с гетерологичной молекулой, такой как цитотоксический фрагмент или радиоактивная метка.
Термины "клетка-хозяин", "линия клеток-хозяев" и "культура клеток-хозяев" используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, включая потомки таких клеток. Клетки-хозяева включают "трансформантов" и "трансформированные клетки", которые включают первично трансформированную клетку и ее потомков независимо от числа пассажей. Содержащиеся в потомках клетки нуклеиновые кислоты могут быть не полностью идентичны нуклеиновым кислотам, содержащимся в родительской клетке, поскольку могут содержать мутации. Мутантные потомки, которые проявляют такую же функцию или биологическую активность, которую отбирали или искали при скрининге у исходно трансформированнаых клеток, также включены в настоящий документ.
Использованный в настоящем документе термин "вектор" относится к молекуле нуклеиновой кислоты, способной осуществлять репликацию другой нуклеиновой кислоты, с которой она связана. Термин включает вектор как самореплицирующуюся структуру нуклеиновой кислоты, а также вектор, встроенный в геном клетки-хозяина, в которую он был введен. Некоторые векторы способны вызывать экспрессию нуклиновых кислот, с которыми они функционально связаны. Такие векторы называются в настоящем документе "векторами экспрессии".
"Выделенное" антитело представляет собой антитело, которое было отделено от компонента его природной среды. В некоторых вариантах воплощения, антитело имеет чистоту более чем 95% или 99%, где чистоту определяют, например, с помощью электрофореза (например, SDS-PAGE, изоэлектрофокусирование (IEF), капиллярный электрофорез) или хроматографии (например, ионообменной или обращено-фазовой HPLC). Обзор способов оценки чистоты антитела смотрите, например, в Flatman et al., J. Chromatogr. B 848:79-87 (2007).
Термин "последовательный", использованный в настоящем документе в отношении хроматографии, означает, что после первой хроматографии следует вторая хроматография. Между первой хроматографией и второй хроматографией могут быть включены дополнительные стадии.
Термин "непрерывный", использованный в настоящем документе в отношении хроматографии, означает, что первый хроматографический материал и второй хроматографический материал соединены либо непосредственно, либо через некоторый другой механизм, который обеспечивает непрерывный потом между двумя хроматографическими материалами.
"Примеси" и "загрязнители" относятся к материалам, которые отличаются от целевого продукта полипептида. Примеси и загрязнители включают, без ограничений, вещества клетки-хозяина, такие как CHOP, в том числе CHOP единственного вида; выщелоченный белок A; нуклеиновую кислоту; вариант, фрагмент, агрегат или производное целевого полипептида; другой полипептид; эндотоксин; вирусный загрязнитель; компонент культуральной среды и тому подобное. В некоторых примерах, загрязнитель может представлять собой белок клетки-хозяина (HCP), например, бактериальной клетки, такой как клетка E. coli, клетки насекомых, прокариотической клетки, эукариотической клетки, дрожжевой клетки, клетки млекопитающих, клетки птицы, клетки гриба, но не ограничиваясь ими.
Термины "белок клетки яичника китайского хомячка" и "CHOP" используются взаимозаменяемо и относятся к смеси белков клетки-хозяина ("HCP"), полученных из культуры клеток яичника китайского хомячка ("CHO"). HCP или CHOP обычно присутствуют в виде примесей в культуральной среде или лизате (например, собранная культуральная жидкость ("HCCF")), включающих целевой белок, такой как антитело или иммуноадгезин, экспрессируемый в клетке CHO. Количество CHOP, присутствующее в смеси, включающей целевой белок, представляет собой показатель степени чистоты целевого белка. HCP или CHOP включают целевой белок, экспрессируемый клеткой-хозяином, такой как клетка-хозяин CHO, но не ограничиваются им. Как правило, количество CHOP в белковой смеси выражено в частях на миллион по сравнению с количеством целевого белка в смеси. Понятно, что если клетка-хозяин представляет собой клетку млекопитающего другого типа, клетку E. coli, дрожжевую клетку, клетку насекомых или растительную клетку, HCP относится к белкам, отличным от целевого белка, обнаруживаемым в лизате клетки-хозяина.
Термины "частей на миллион" или "ppm" используются в настоящем документе взаимозаменяемо и относятся к степени чистоты целевого белка, очищенного с помощью способа согласно настоящему документу. Единицы ppm относятся к количеству HCP или CHOP в нанограммах/миллилитр к количеству целевого белка в миллиграммах/миллилитр (т.е., CHOP ppm = (CHOP, нг/мл)/(целевой белок, мг/мл), где белки находятся в растворе). Если белки сухие (например, лиофилизированные), ppm относится к (CHOP, нг)/(целевой белок, мг). Количество примесей также может быть выражено в "нг/мг", которое используется взаимозаменяемо с ppm.
"Очистка" полипептида из композиции, включающей полипептид и одну или несколько примесей, означает увеличение степени чистоты полипептида в композиции за счет удаления (полного или частичного), по меньшей мере, одной примеси из композиции.
"Стадия очистки" может представлять собой часть общего процесса очистки, в результате которого получается "гомогенная" композиция, которая используется в настоящем документе для обозначения композиции, включающей менее 100 ppm HCP (100 нг/мг) в композиции, включающей целевой белок, или менее 90 ppm (90 нг/мг), или менее 80 ppm (80 нг/мг), или менее 70 ppm (70 нг/мг), или менее 60 ppm (60 нг/мг), или менее 50 ppm 50 нг/мг), или менее 40 ppm (40 нг/мг), или менее 30 ppm (30 нг/мг), или менее 20 ppm (20 нг/мг), или менее 10 ppm (10 нг/мг), или менее 5ppm (5 нг/мг), или менее 3ppm (3 нг/мг) или менее 1 ppm (1 нг/мг). В некоторых вариантах воплощения, HCP представляет собой HCP единственного вида. В одном из вариантов воплощения, HCP единственного вида представляет собой PLBL2 хомячка.
В настоящем документе "композиция", которая подлежит очистке, включает целевой полипептид и одну или несколько примесей или загрязнителей. Композиция может быть "частично очищенной" (т.е., композиция была подвергнута одной или нескольким стадиям очистки) или может быть получена непосредственно из клетки-хозяина или организма-хозяина, продуцирующего полипептид (например, композиция может включать собранную культуральную жидкость).
Термины "белок A" и "ProA" используются взаимозаменяемо в настоящем документе и включают белок A, полученный из его природного источника, белок A, полученный синтетически (например, с помощью пептидного синтеза или рекомбинантных методов), и его варианты, которые сохраняют способность связываться с белками, имеющими область CH2/CH3, такую как область Fc. Белок A коммерчески доступен из различных источников. Белок A обычно иммобилизован на материале твердофазной подложки. Термин "ProA" также относится к смоле для аффинной хроматографии или колонке, содержащей хроматографическую твердофазную матрицу, к которой ковалентно присоединен белок A.
Термин "хроматография" относится к процессу, в ходе которого происходит отделение целевого растворенного вещества от других растворенных веществ в смеси в результате разницы в скоростях, с которыми индивидуальные растворенные вещества смеси мигрируют через неподвижную фазу под воздействием подвижной фазы, или в процессах связывания и элюции.
Термины "аффинная хроматография" и "белковая аффинная хроматография" используются в настоящем документе взаимозаменяемо и относятся к методу разделения белков, в котором целевой белок или целевое антитело обратимо и специфично связываются с биоспецифичным лигандом. Как правило, биоспецифичный лиганд ковалентно присоединен к материалу хроматографической твердой фазы и доступен для целевого белка в растворе, поскольку раствор контактирует с материалом хроматографической твердой фазы. Целевой белок (например, антитело, фермент или рецепторный белок) в процессе хроматографии остается специфично связанным с определенной аффинностью с биоспецифичным лигандом (например, антиген, субстрат, кофактор или гормон), тогда как другие растворенные вещества и/или белки в растворе не проявляют заметного или специфичного связывания с лигандом. Связывание целевого белка с иммобилизованным лигандом позволяет загрязняющим белкам или белковым примесям пройти через хроматографическую колонку, в то время целевой белок остается связанным с иммобилизованным лигандом на материале твердой фазы. Специфично связавшийся целевой белок далее удаляют в активной форме с иммобилизованного лиганда, используя низкий pH, высокий pH, высокую концентрацию соли, конкурентный лиганд и тому подобное, и он проходит через хроматографическую колонку с элюирующим буфером, без загрязняющих белков или белковых примесей, которые уже прошли через колонку раньше. В качестве лиганда для очистки соответствующего специфично связывающегося с ним белка может быть использован любой компонент, например, антитело.
Термин "не аффинная хроматография" и "не аффинная очистка" относится к процессу очистки, в котором не используется аффинная хроматография. Не аффинная хроматография включает хроматографические методы, основанные на неспецифических взаимодействиях между целевой молекулой (такой как белок, например, антитело) и твердофазной матрицей.
Термин "специфическое связывание", использованный в настоящем документе в контексте хроматографии для описания взаимодействий между целевой молекулой и лигандом, связанным с твердофазной матрицей, относится к обычно обратимому связыванию целевого белка с лигандом за счет комбинированных эффектов пространственной комплементарности белка и структур лигандов в сайте связывания, сочетающихся с электростатическими силами, водородными связями, гидрофобными силами и/или ван-дер-ваальсовыми силами в сайте связывания. Чем выше пространственная комплементарность и сильнее другие силы в сайте связывания, тем выше будет специфичность связывания белка с его соответствующим лигандом. Неограничивающие примеры специфического связывания включают связывание антитела с антигеном, связывание фермента с субстратом, связывание фермента с кофактором, хелатирование ионов металлов, связывание ДНК-связывающего белка с ДНК, регуляторные белок-белковые взаимодействия и тому подобное. Как правило, аффинность специфического связывания в аффинной хроматографии составляет примерно от 10-4 до 10-8 M в свободном виде в растворе.
Термин "неспецифическое связывание", использованный в настоящем документе в контексте хроматографии для описания взаимодействий между целевой молекулой и лигандом или другим соединением, связанным с твердой матрицей, относится к связыванию целевого белка с лигандом или соединением на твердофазной матрице за счет электростатических сил, водородных связей, гидрофобных сил и/или ван-дер-ваальсовых сил в месте взаимодействия, но не за счет структурной комплементарности, которая усиливает эффекты сил, не связанных со структурой. Примеры неспецифических взаимодействий включают электростатические, гидрофобные и ван-дер-ваальсовы силы, а также водородные связи, но не ограничиваются ими.
"Соль" представляет собой соединение, образующееся в результате реакции между кислотой и основанием. Примеры солей включают ацетат (например, ацетат натрия), цитрат (например, цитрат натрия), хлорид (например, хлорид натрия), сульфат (например, сульфат натрия) или калиевую соль, но не ограничиваются ими.
Использованный в настоящем документе термин "растворитель" относится к жидкому веществу, которое может растворять или диспергировать одно или несколько других веществ с образованием раствора. Растворители включают водные и органические растворители, где некоторые органические растворители включают неполярный растворитель, этанол, метанол, изопропанол, ацетонитрил, гексиленгликоль, пропиленгликоль и 2,2-тиодигликоль.
Термин "детергент" относится к ионным и неионным сурфактантам, таким как полисорбаты (например, полисорбаты 20 или 80); полоксамеры (например, полоксамер 188); Тритон; додецилсульфата натрия (SDS); лаурилсульфат натрия; октилгликозид натрия; лаурил-, миристил-, линолеил- или стеарил-сульфобетаин; лаурил-, миристил-, линолеил- или стеарил-саркозин; линолеил-, миристил- или цетил-бетаин; лауроамидопропил-, кокамидопропил-, линолеамидопропил-, миристамидопропил-, пальмидопропил- или изостерамидопропил-бетаин (например, лауроамидопропил); миристамидопропил-, пальмидопропил- или изостеарамидопропил-диметиламин; метилкокоилтаурат натрия или метилолеилтаурат динатрия; и сурфактанты серии MONAQUATTM (Mona Industries, Inc., Патерсон, Нью-Джерси), полисорбат, такой как полисорбат 20 (TWEEN 20®) или полисорбат 80 (TWEEN 80®).
В настоящем документе "полимер" представляет собой молекулу, образованную путем ковалентного связывания двух или более мономеров, где мономеры не являются аминокислотными остатками. Примеры полимеров включают, но не ограничиваются ими, полиэтиленгликоль, полипропиленгликоль и сополимеры (например, PLURONICS™, PF68 и тому подобные), полиэтиленгликоль (PEG), например, PEG 400 и PEG 8000.
Термины "ионообменный" и "ионообменная хроматография" относятся к хроматографическому процессу, в ходе которого целевое растворенное вещество (такое как белок) в смеси взаимодействует с заряженным соединением, связанным (например, ковалентно присоединенным) с ионообменным материалом твердой фазы, при этом целевое растворенное вещество неспецифично взаимодействует с заряженным соединением сильнее или слабее по сравнению с растворенными примесями или загрязнителями в смеси. Загрязняющее растворенное вещество в смеси элюируется с колонки с ионообменным материалом быстрее или медленнее, чем целевое растворенное вещество, или связывается или не связывается со смолой в отличие от целевого растворенного вещества. "Ионообменная хроматография", в частности, включает катионообменную, анионообменную и комбинированную хроматографию.
Фраза "ионообменный материал" относится к твердой фазе, которая заряжена отрицательно (т.е. катионообменная смола) или положительно (т.е. анионообменная смола). Заряд может быть обусловлен присоединением к твердой фазе одного или нескольких заряженных лигандов, например, путем ковалентного связывания. Альтернативно или дополнительно, заряд может быть свойством самой твердой фазы (например, как в случае диоксида кремния, который несет общий отрицательный заряд).
"Твердая фаза" означает неводную матрицу, к которой могут быть присоединены один или несколько заряженных лигандов. Твердая фаза может представлять собой колонку для очистки, дисперсную фазу дискретных частиц, мембрану или фильтр и тому подобное. Примеры материалов для формирования твердой фазы включают полисахариды (такие как агароза и целлюлоза) и другие механически стабильные матрицы, такие как диоксид кремния (например, стекло с контролируемым размером пор), поли(стиролдивинил)бензол, полиакриламид, керамические частицы и их производные.
"Катионообменная смола" относится к твердой фазе, которая заряжена отрицательно и которая, таким образом, несет свободные катионы для обмена с катионами в водном растворе, проходящем через твердую фазу. Отрицательно заряженный лиганд, присоединенный к твердой фазе с образованием катионообменной смолы, может, например, представлять собой карбоксилат или сульфонат. Коммерчески доступные катионообменные смолы включают, но не ограничиваются ими, карбоксиметилцеллюлозу, сульфопропил (SP), иммобилизованный на агарозе (например, SP-SEPHAROSE FAST FLOW (или SP-SEPHAROSE HIGH PERFORMANCE)), и сульфонил, иммобилизованный на агарозе (например, S-SEPHAROSE FAST FLOW), и POROS®HS.
"Комбинированные ионообменные смолы" относятся к твердой фазе, которая модифицирована ковалентным присоединением катионных, анионных и гидрофобных фрагментов. Комбинированные ионообменные смолы также называют "мультимодальными ионообменными смолами". Комбинированные ионообменные смолы являются коммерчески доступными и включают, например, BAKERBOND ABX, содержащую слабые катионообменные группы, низкую концентрацию анионообменных групп и гидрофобные лиганды, присоединенные к силикагелевой твердофазной подложке. Дополнительные примеры комбинированных ионообменных смол включают смолу CAPTOTM Adhere, смолу QMA, смолу CAPTOTM MMC, смолу MEP HyperCel, смолу HEA HyperCel, смолу PPA HyperCel или мембрану ChromaSorb или Sartobind STIC, но не ограничиваются ими. В некоторых вариантах воплощения, комбинированный материал представляет собой смолу CAPTOTM Adhere.
Термин "анионообменная смола" используется в настоящем документе для обозначения твердой фазы, которая заряжено положительно, например, имеет один или несколько положительно заряженных лигандов, таких как четвертичные аминогруппы, присоединенных к ней. Коммерчески доступные анионообменные смолы включают DEAE целлюлозу, QAE SEPHADEX, FAST Q SEPHAROSETM и Q SEPHAROSETM FAST FLOW.
"Буфер" представляет собой раствор, устойчивый к изменениям pH за счет сопряженного действия его кислотно-основных компонентов. В зависимости от таких параметров как, например, нужный pH, могут быть использованы различные буферы, которые описаны в Buffers. A Guide for the Preparation and Use of Buffers in Biological Systems, Gueffroy, D., ed. Calbiochem Corporation (1975). В некоторых случаях, буфер может иметь pH в диапазоне от примерно 2 до примерно 9, альтернативно, от примерно 3 до примерно 8, альтернативно, от примерно 4 до примерно 7 альтернативно, от примерно 5 до примерно 7. Неограничивающие примеры буферов, которые будут контролировать pH в этом диапазоне, включают MES, MOPS, MOPSO, Tris, HEPES, фосфатный, ацетатный, цитратный, сукцинатный и аммиачный буфер, а также их комбинации.
Термин "хроматография гидрофобных взаимодействий" или "HIC" используется в настоящем документе для обозначения хроматографического процесса, в ходе которого молекулы разделяются на основе их гидрофобности. Примеры смол, которые могут быть использованы для HIC, включают, но не ограничиваются ими, фенил-, бутил-, октил- сефарозу (SEPHAROSE), BUTYL-SEPHAROSE® 4 Fast Flow, PHENYL SEPHAROSETM High Performance, PHENYL SEPHAROSETM 6 Fast Flow (low sub) и PHENYL SEPHAROSETM 6 Fast Flow (high sub). Как правило, молекулы образца наносят на HIC колонку в буфере с высокой концентрацией соли. Соль в буфере взаимодействует с молекулами воды и уменьшает сольватацию молекул в растворе, что приводит к экспонированию гидрофобных участков молекул образца и, следовательно, к их адсорбции на HIC колонке. Чем более гидрофобна молекула, тем более низкая концентрация соли необходима для обеспечения связывания. Как правило, для элюции образцов с колонки используют градиент понижающегося содержания соли. Из-за снижения ионной силы в большей степени начинают экспонироваться гидрофильные участки молекул, и молекулы элюируются с колонки в порядке увеличения гидрофобности. Элюцию образца также можно осуществить путем добавления к элюирующему буферу мягких органических модификаторов или детергентов.
"Буфер для нанесения" представляет собой буфер, который используется для нанесения композиции, включающей молекулу целевого полипептида и одну или несколько примесей, на ионообменную смолу. Буфер для нанесения имеет такие значения проводимости и/или pH, которые обеспечивают связывание целевой молекулы полипептида (и обычно одной или нескольких примесей) с ионообменной смолой, или такие значения проводимости и/или pH, которые обеспечивают прохождение целевого белка через колонку, в то время как примеси связываются со смолой.
"Промежуточный буфер" используется для элюции одной или нескольких примесей с ионообменной смолы до осуществления элюции целевой молекулы полипептида. Промежуточный буфер имеет такие значения проводимости и/или pH, которые обеспечивают элюцию одной или нескольких примесей с ионообменной смолы, но не приводят к элюции значительного количества целевого полипептида.
Использованный в настоящем документе термин "промывочный буфер" относится к буферу, используемому для промывки или уравновешивания ионообменной смолы перед осуществлением элюции целевой молекулы полипептида. В некоторых случаях, для удобства, промывочный буфер и буфер для нанесения могут быть одинаковыми, но это необязательно.
"Элюирующий буфер" используется для элюции целевого полипептида с твердой фазы. Элюирующий буфер имеет такие значения проводимости и/или pH, которые обеспечивают элюцию целевого полипептида с ионообменной смолы.
"Регенерирующий буфер" может быть использован для регенерации ионообменной смолы, чтобы ее можно было использовать повторно. Регенерирующий буфер имеет проводимость и/или pH, необходимые для удаления практически всех примесей и целевого полипептида с ионообменной смолы.
Термин "проводимость" относится к способности водного раствора проводить электрический ток между двумя электродами. Раствор проводит ток за счет ионного транспорта. Поэтому, с увеличением количества ионов, присутствующих в водном растворе, будет увеличиваться проводимость раствора. Единицей измерения проводимости является миллисименс на сантиметр (мСм/см) и проводимость можно измерить, используя имеющейся в продаже измеритель проводимости, например, измеритель проводимости от Orion. Проводимость раствора можно изменить путем изменения концентрации содержащихся в нем ионов. Например, чтобы достигнуть желаемой проводимости, может быть изменена концентрация буферного агента и/или концентрация соли (например, NaCl или KCl) в растворе.
"pI" или "изоэлектрическая точка" полипептида относится к значению pH, при котором положительный заряд полипептида уравновешен его отрицательным зарядом. pI может быть рассчитана как суммарный заряд аминокислотных остатков или остатков сиаловых кислот присоединенных углеводов полипептида или может быть определена с помощью изоэлектрического фокусирования.
"Связывание" молекулы с ионообменным материалом означает контакт молекулы с ионообменным материалом в соответствующих условиях (pH/проводимость), который приводит к тому, что молекула обратимо иммобилизуется в ионообменном материале или на ионообменном материале за счет ионных взаимодействий между молекулой и заряженной группой или заряженными группами ионообменного материала.
"Промывка" ионообменного материала означает пропускание соответствующего буфера через ионообменный материал.
"Элюировать" молекулу (например, полипептид или примеси) с ионообменного материала означает удалить молекулу с ионообменного материала за счет такого изменения ионной силы буфера, окружающего ионообменный материал, что буфер начинает конкурировать с молекулой за заряженные сайты связывания на ионообменном материале.
"Ультрафильтрация" является формой мембранной фильтрации, при проведении которой гидростатическое давление проталкивает жидкость через полупроницаемую мембрану. Взвешенные твердые частицы и растворенные вещества с высокой молекулярной массой остаются над мембраной, в то время как вода и низкомолекулярные растворенные вещества проходят через мембрану. В некоторых примерах, ультрафильтрационные мембраны имеют размер пор в диапазоне от 1 до 100 нм. Термины "ультрафильтрационная мембрана" и "ультрафильтрационный фильтр" являются взаимозаменяемыми.
"Диафильтрация" представляет собой способ, который включает применение ультрафильтрационных мембран для удаления солей или других растворенных микрокомпонентов из раствора. Маленькие молекулы отделяются от раствора за счет того, что крупные молекулы остаются в ретентате. В данном процессе используются селективные полупроницаемые (пористые) мембранные фильтры (фильтрационные мембраны) для разделения компонентов растворов и суспензий в зависимости от их молекулярного размера.
Использованный в настоящем документе термин "фильтрат" относится к той части образца, которая проходит через фильтрационную мембрану.
Использованный в настоящем документе термин "ретентат" относится к той части образца, которая, по существу, задерживается фильтрационной мембраной.
Термин "фармацевтическая лекарственная форма" относится к препарату, который находится в такой форме, чтобы обеспечить эффективную биологическую активность содержащегося в нем активного ингредиента, и который не содержит дополнительных компонентов, являющихся недопустимо токсичными для субъекта, которому будет вводиться лекарственная форма.
"Фармацевтически приемлемый носитель" относится к ингредиенту в фармацевтической лекарственной форме, отличному от активного ингредиента, и являющемуся нетоксичным для субъекта. Фармацевтически приемлемый носитель включает буфер, эксципиент, стабилизатор или консервант, но не ограничиваются ими.
Использованный в настоящем документе термин "лечение" относится к клиническому вмешательству в попытке изменить естественное течение состояния у индивидуума, подвергающегося лечению, и может быть осуществлено для профилактики или в ходе клинической патологии. Желательные эффекты лечения включают предотвращение возникновения или рецидива заболевания, ослабление симптомов, уменьшение любых прямых или косвенных патологических последствий заболевания, предотвращение метастазов, уменьшение скорости прогрессирования заболевания, улучшение или временное облегчение болезненного состояния и ремиссию или улучшение прогноза, но не ограничиваются ими. В некоторых вариантах воплощения, антитела используют для задержки развития заболевания или замедления прогрессирования заболевания.
Указание в настоящем документе значения или параметра с термином "примерно" включает (и описывает) вариации, характерные для этого значения или параметра как такового. Например, указание "примерно X" включает указание "X".
АНТИ-IL13 АНТИТЕЛА
В некоторых вариантах воплощения, предусмотрены выделенные и очищенные антитела, которые связываются с IL-13. Примеры анти-IL13 антител известны и включают, например, лебрикизумаб, IMA-026, IMA-638 (также называемое анрукинзумаб, INN номер 910649-32-0; QAX-576), тралокинумаб (также называемое CAT-354, CAS номер 1044515-88-9); AER-001, ABT-308 (также называемое гуманизированным антителом 13C5.5), но не ограничиваются ими. Примеры таких анти-IL13 антител и других ингибиторов IL13 раскрыты, например, в WO 2005/062967, WO2008/086395, WO2006/085938, US 7,615,213, US 7,501,121, WO2007/036745, WO2010/073119, WO2007/045477. В одном из вариантов воплощения, анти-IL13 антитело представляет собой гуманизированное IgG4 антитело. В одном из вариантов воплощения, анти-IL13 антитело представляет собой лебрикизумаб. В одном из вариантов воплощения, анти-IL13 антитело включает три CDR тяжелой цепи, CDR-H1 (SEQ ID NO.: 1), CDR-H2 (SEQ ID NO.: 2) и CDR-H3 (SEQ ID NO.: 3). В одном из вариантов воплощения, анти-IL13 антитело включает три CDR легкой цепи, CDR-L1 (SEQ ID NO.: 4), CDR-L2 (SEQ ID NO.: 5) и CDR-L3 (SEQ ID NO.: 6). В одном из вариантов воплощения, анти-IL13 антитело включает три CDR тяжелой цепи и три CDR легкой цепи, CDR-H1 (SEQ ID NO.: 1), CDR-H2 (SEQ ID NO.: 2), CDR-H3 (SEQ ID NO.: 3), CDR-L1 (SEQ ID NO.: 4), CDR-L2 (SEQ ID NO.: 5) и CDR-L3 (SEQ ID NO.: 6). В одном из вариантов воплощения, анти-IL13 антитело включает вариабельную область тяжелой цепи, VH, имеющую аминокислотную последовательность, выбранную из SEQ ID NO. 7 и 8. В одном из вариантов воплощения, анти-IL13 антитело включает вариабельную область легкой цепи, VL, имеющую аминокислотную последовательность SEQ ID NO.: 9. В одном из вариантов воплощения, анти-IL13 антитело включает вариабельную область тяжелой цепи, VH, имеющую аминокислотную последовательность, выбранную из SEQ ID NO. 7 и 8, и вариабельную область легкой цепи, VL, имеющую аминокислотную последовательность SEQ ID NO.: 9. В одном из вариантов воплощения, анти-IL13 антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 10, или SEQ ID NO.: 11, или SEQ ID NO.: 12, или SEQ ID NO.: 13. В одном из вариантов воплощения, анти-IL13 антитело включает легкую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 14. В одном из вариантов воплощения, анти-IL13 антитело включает тяжелую цепь, имеющую аминокислотную последовательность, выбранную из SEQ ID NO.: 10, SEQ ID NO.: 11, SEQ ID NO.: 12 и SEQ ID NO.: 13, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO.: 14.
В другом аспекте, анти-IL-13 антитело включает последовательность вариабельного домена тяжелой цепи (VH), имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO.: 8. В некоторых вариантах воплощения, последовательность VH, имеющая, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательности, содержит замены (например, консервативные замены), вставки или делеции по сравнению с последовательностью сравнения, но анти-IL-13 антитело, включающее такую последовательность, сохраняет способность связываться с человеческим IL-13. В некоторых вариантах воплощения, в SEQ ID NO.: 8 были заменены, изменены путем вставки и/или делеции всего от 1 до 10 аминокислот. В некоторых вариантах воплощения, замены, вставки или делеции присутствуют в областях за пределами CDR (т.е., в FR). Необязательно, анти-IL13 антитело включает последовательность VH в SEQ ID NO.: 8, включая посттрансляционные модификации этой последовательности.
В другом аспекте, предусмотрено анти-IL-13 антитело, где антитело включает вариабельный домен легкой цепи (VL), имеющий, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO.: 9. В некоторых вариантах воплощения, последовательность VL, имеющая, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательности, содержит замены (например, консервативные замены), вставки или делеции по сравнению с последовательностью сравнения, но анти-IL-13 антитело, включающее такую последовательность, сохраняет способность связываться с человеческим IL-13. В некоторых вариантах воплощения, в SEQ ID NO.: 9 были заменены, изменены путем вставки и/или делеции всего от 1 до 10 аминокислот. В некоторых вариантах воплощения, замены, вставки или делеции присутствуют в областях за пределами CDR (т.е., в FR). Необязательно, анти-IL13 антитело включает последовательность VL в SEQ ID NO.: 9, включая посттрансляционные модификации этой последовательности.
В еще одном варианте воплощения, анти-IL-13 антитело включает область VL, имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO.: 9, и область VH, имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO.: 8.
В таблице ниже приведены аминокислотные последовательности областей CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 и CDR-L3 лебрикизумаба, а также последовательности VH, VL, тяжелой цепи и легкой цепи. Как указано в Таблице 1 ниже, VH и тяжелая цепь могут включать N-концевой глутамин, и тяжелая цепь может дополнительно включать C-концевой лизин. Как хорошо известно в данной области, N-концевые остатки глутамина могут образовывать пироглутамат, и С-концевые остатки лизина могут быть удалены в ходе процесса получения.
Таблица 1. Аминокислотные последовательности анти-IL13 антитела (лебрикизумаб).
(SEQ ID NO.:1)
(SEQ ID NO.:2)
(SEQ ID NO.:3)
(SEQ ID NO.:4)
(SEQ ID NO.:5)
(SEQ ID NO.:6)
(SEQ ID NO.:7)
(SEQ ID NO.:8)
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ala Tyr
Ser Val Asn Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
Ala Met Ile Trp Gly Asp Gly Lys Ile Val Tyr Asn Ser Ala Leu Lys
Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Val Leu
Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala
Gly Asp Gly Tyr Tyr Pro Tyr Ala Met Asp Asn Trp Gly Gln Gly Ser
Leu Val Thr Val Ser Ser
(SEQ ID NO.:9)
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys Ser Val Asp Ser Tyr
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Asn Asn
Glu Asp Pro Arg Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
(SEQ ID NO.:10)
IWGDGKIVYN SALKSRLTIS KDTSKNQVVL TMTNMDPVDT ATYYCAGDGY
YPYAMDNWGQ GSLVTVSSAS TKGPSVFPLA PCSRSTSEST AALGCLVKDY
FPEPVTVSWN SGALTSGVHT FPAVLQSSGL YSLSSVVTVP SSSLGTKTYT
CNVDHKPSNT KVDKRVESKY GPPCPPCPAP EFLGGPSVFL FPPKPKDTLM
ISRTPEVTCV VVDVSQEDPE VQFNWYVDGV EVHNAKTKPR EEQFNSTYRV
VSVLTVLHQD WLNGKEYKCK VSNKGLPSSI EKTISKAKGQ PREPQVYTLP
PSQEEMTKNQ VSLTCLVKGF YPSDIAVEWE SNGQPENNYK TTPPVLDSDG
SFFLYSRLTV DKSRWQEGNV FSCSVMHEAL HNHYTQKSLS LSLG
(SEQ ID NO.:11)
IWGDGKIVYN SALKSRLTIS KDTSKNQVVL TMTNMDPVDT ATYYCAGDGY
YPYAMDNWGQ GSLVTVSSAS TKGPSVFPLA PCSRSTSEST AALGCLVKDY
FPEPVTVSWN SGALTSGVHT FPAVLQSSGL YSLSSVVTVP SSSLGTKTYT
CNVDHKPSNT KVDKRVESKY GPPCPPCPAP EFLGGPSVFL FPPKPKDTLM
ISRTPEVTCV VVDVSQEDPE VQFNWYVDGV EVHNAKTKPR EEQFNSTYRV
VSVLTVLHQD WLNGKEYKCK VSNKGLPSSI EKTISKAKGQ PREPQVYTLP
PSQEEMTKNQ VSLTCLVKGF YPSDIAVEWE SNGQPENNYK TTPPVLDSDG
SFFLYSRLTV DKSRWQEGNV FSCSVMHEAL HNHYTQKSLS LSLG
(SEQ ID NO.:12)
IWGDGKIVYN SALKSRLTIS KDTSKNQVVL TMTNMDPVDT ATYYCAGDGY
YPYAMDNWGQ GSLVTVSSAS TKGPSVFPLA PCSRSTSEST AALGCLVKDY
FPEPVTVSWN SGALTSGVHT FPAVLQSSGL YSLSSVVTVP SSSLGTKTYT
CNVDHKPSNT KVDKRVESKY GPPCPPCPAP EFLGGPSVFL FPPKPKDTLM
ISRTPEVTCV VVDVSQEDPE VQFNWYVDGV EVHNAKTKPR EEQFNSTYRV
VSVLTVLHQD WLNGKEYKCK VSNKGLPSSI EKTISKAKGQ PREPQVYTLP
PSQEEMTKNQ VSLTCLVKGF YPSDIAVEWE SNGQPENNYK TTPPVLDSDG
SFFLYSRLTV DKSRWQEGNV FSCSVMHEAL HNHYTQKSLS LSLGK
(SEQ ID NO.:13)
IWGDGKIVYN SALKSRLTIS KDTSKNQVVL TMTNMDPVDT ATYYCAGDGY
YPYAMDNWGQ GSLVTVSSAS TKGPSVFPLA PCSRSTSEST AALGCLVKDY
FPEPVTVSWN SGALTSGVHT FPAVLQSSGL YSLSSVVTVP SSSLGTKTYT
CNVDHKPSNT KVDKRVESKY GPPCPPCPAP EFLGGPSVFL FPPKPKDTLM
ISRTPEVTCV VVDVSQEDPE VQFNWYVDGV EVHNAKTKPR EEQFNSTYRV
VSVLTVLHQD WLNGKEYKCK VSNKGLPSSI EKTISKAKGQ PREPQVYTLP
PSQEEMTKNQ VSLTCLVKGF YPSDIAVEWE SNGQPENNYK TTPPVLDSDG
SFFLYSRLTV DKSRWQEGNV FSCSVMHEAL HNHYTQKSLS LSLGK
(SEQ ID NO.: 14)
LIYLASNLES GVPDRFSGSG SGTDFTLTIS SLQAEDVAVY YCQQNNEDPR
TFGGGTKVEI KRTVAAPSVF IFPPSDEQLK SGTASVVCLL NNFYPREAKV
QWKVDNALQS GNSQESVTEQ DSKDSTYSLS STLTLSKADY EKHKVYACEV
THQGLSSPVT KSFNRGEC
ДРУГИЕ РЕКОМБИНАНТНЫЕ ПОЛИПЕПТИДЫ
Рекомбинантные полипептиды, продуцируемые в клетках CHO, могут быть очищены в соответстви со способами, описанными в настоящем документе, для удаления или снижения уровня PLBL2 хомячка, так что остается только остаточное количество или необнаруживаемое количество PLBL2 хомячка. Такие полипептиды включают, без ограничений, факторы роста, цитокины, иммуноглобулины, антитела, пептидные антитела и тому подобное.
Некоторые примеры антител включат антитела к Abeta, антитела к IL17A/F и антитела к CMV. Примеры анти-Abeta антител и способы получения таких антитела были описаны ранее, например, в WO2008011348, WO2007068429, WO2001062801 и WO2004071408. Примеры анти-IL17 A/F антител и способы получения таких антител были описаны ранее, например, в WO 2009136286 и патенте США номер 8,715,669. Примеры анти-CMV антител, включая анти-CMV-MSL, и способы получения таких антител были описаны ранее, например, в WO 2012047732.
Примеры полипептидов включают белки млекопитающих, такие как, например, CD4, интегрины и их субъединицы, такие как бета7, гормон роста, включая человеческий гормон роста и бычий гормон роста; рилизинг-фактор гормона роста; паратиреоидный гормон; тиреотропный гормон; липопротеины; ct-1-антитрипсин; A-цепь инсулина; B-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания крови, такие как фактор VIIIC, фактор IX, тканевой фактор и фактор фон Виллебранда; препятствующие свертыванию факторы крови, такие как белок C; предсердный натрийуретический фактор; сурфактант легких; активатор плазминогена, такой как урокиназа или тканевой активатор плазминогена (t-PA, например, Activase®, TNKase®, Retevase®); бомбазин; тромбин; фактор некроза опухоли-α и -β; энкефалиназа; RANTES (хемокин, экспрессируемый и секретируемый T-клетками в норме при активации); человеческий воспалительный белок макрофагов (MIP-I-a); сывороточный альбумин, такой как человеческий сывороточный альбумин; мюллерова ингибирующая субстанция; мышиный гонадотропин-ассоциированный пептид; ДНКаза; ингибин; активин; фактор роста эндотелия сосудов (VEGF); IgE, рецепторы для гормонов или факторов роста; интегрин; белок А или D; ревматоидные факторы; нейротрофический фактор, такой как костный нейротрофический фактор (BDNF), нейротропин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6) или фактор роста нервов, такой как NGF-β; тромбоцитарный фактор роста (PDGF); фактор роста фибробластов, такой как aFGF и bFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-α и TGF-β, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный фактор роста-I и -II (IGF-I и IGF-II); des(1-3)-IGF-I (мозговой IGF-I); белки, связывающие инсулиноподобный фактор роста; другие CD белки, такие как CD3, CD8, CD19 и CD20; эритропоэтин (EPO); тромбопоэтин (TPO); остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (BMP); интерферон, такой как интерферон-α, -β или -γ; колониестимулирующие факторы (CSF), например, M-CSF, GM-CSF и G-CSF; интерлейкины (IL), например, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, IL-31, IL-32, IL-33 и так далее; супероксиддисмутаза; T-клеточные рецепторы; поверхностные мембранные белки; фактор ускорения распада комплемента (DAF); вирусный антиген, такой как, например, часть оболочки ВИЧ; транспортные белки; хоминг-рецепторы; аддрессины; регуляторные белки; интегрины, такие как CD11a, CD11b, CD11c, CD18, субъединицы интегринов, такие как альфа4, альфаE, бета7; молекулы клеточной адгезии, такие как ICAM, VLA-4 и VCAM; ассоциированный с опухолью антиген, такой как рецептор HER1, (EGFR), HER2, HER3 или HER4; Apo2L/TRAIL и фрагменты любого из перечисленных выше полипептидов; а также иммуноадгезины и антитела, связывающиеся с ними; и биологически активные фрагменты или варианты перечисленных выше белков.
Дополнительные примеры полипептидов включают полипептиды мозга, включая, но не ограничиваясь ими, бета-секретазу 1 (BACE1), Abeta, рецептор эпидермального фактора роста (EGFR), рецептор эпидермального фактора роста человека 2 (HER2), tau, аполипротеин E (ApoE), альфа-синуклеин, CD20, хантингтин, прионный белок (PrP), богатую лейциновыми повторами киназу 2 (LRRK2), паркин, пресенилин 1, пресенилин 2, гамма секретазу, рецептор смерти 6 (DR6), белок-предшественник амилоида (APP), рецептор нейтрофинов p75 (p75NTR), P-селектин и каспазу 6, и фрагменты перечисленных выше полипептидов; а также иммуноадгезины и антитела, связывающиеся с ними; и биологически активные фрагменты или варианты перечисленных выше белков.
Другие примеры полипептидов включают терапевтические антитела и иммуноадгезины, включая, но не ограничиваясь ими, антитела, включая фрагменты антител, к одному или нескольким из нижеследующих антигенов: HER1 (EGFR), HER2 (например, трастузумаб, пертузумаб), HER3, HER4, VEGF (например, бевацизумаб, ранибизумаб), MET (например, онартузумаб), CD20 (например, ритуксимаб, обинутузумаб, окрелизумаб), CD22, CD11a, CD11b, CD11c, CD18, ICAM, VLA-4, VCAM, IL-17A и/или F, IgE (например, омализумаб), DR5, CD40, Apo2L/TRAIL, EGFL7 (например, парсатузумаб (parsatuzumab)), NRP1, интегрин бета7 (например, этролизумаб), IL-13 (например, лебрикизумаб), Abeta (например, кренезумаб, гантенерумаб (gantenerumab)), P-селектин (например, инклакумаб (inclacumab)), IL-6R (например, тоцилизумаб (tociluzumab)), IFNα (например, ронтализумаб (rontalizumab)), M1prime (например, квилизумаб (quilizumab)), митоген-активируемая протеинкиназа (MAPK), OX40L, TSLP, фактор D (например, лампализумаб (lampalizumab)) и рецепторы, такие как рецептор к IL-9, рецептор к IL-5, альфа-цепь рецептора IL-4, альфа 1 цепь рецептора IL-13 и альфа 2 цепь рецептора IL-13, OX40, TSLP-R, IL-7R альфа (корецептор для TSLP), IL17RB (рецептор для IL-25), ST2 (рецептор для IL-33), CCR3, CCR4, CRTH2, Fc epsilon RI и Fc epsilon RII/CD23 (рецепторы для IgE). Другие примеры антител включают, но не ограничиваются антителами, выбранными из антитела против эстрогенового рецептора, антитела против прогестеронового рецептора, анти-p53 антитела, анти-катепсин D антитела, анти-Bcl-2 антитела, анти-E-кадгерин антитела, анти-CA125 антитела, анти-CA15-3 антитела, анти-CA19-9 антитела, анти-c-erbB-2 антитела, анти-P-гликопротеин антитела, анти-CEA антитела, антитела против белка ретинобластомы, антитела против окобелка ras, анти-Lewis X антитела, анти-Ki-67 антитела, анти-PCNA антитела, анти-CD3 антитела, анти-CD4 антитела, анти-CD5 антитела, анти-CD7 антитела, анти-CD8 антитела, анти-CD9/p24 антитела, анти-CD10 антитела, анти-CD11c антитела, анти-CD13 антитела, анти-CD14 антитела, анти-CD15 антитела, анти-CD19 антитела, анти-CD23 антитела, анти-CD30 антитела, анти-CD31 антитела, анти-CD33 антитела, анти-CD34 антитела, анти-CD35 антитела, анти-CD38 антитела, анти-CD41 антитела, анти-LCA/CD45 антитела, анти-CD45RO антитела, анти-CD45RA антитела, анти-CD39 антитела, анти-CD100 антитела, анти-CD95/Fas антитела, анти-CD99 антитела, анти-CD106 антитела, анти-убиквитин антитела, анти-CD71 антитела, анти-c-myc антитела, антитела против цитокератинов, антитела против виментинов, антитела против белков HPV, антитела против каппа легких цепей, антитела против лямбда легких цепей, антитела против меланосомы, антитела против простатоспецифического антигена, анти-S-100 антитела, антитела против tau антигена, анти-фибрин антитела, антитела против кератинов и анти-Tn-антиген антитела.
НЕКОТОРЫЕ СПОСОБЫ ОЧИСТКИ
Белок, который подлежит очистке с использованием способов, описанных в настоящем документе, обычно получают рекомбинантными методами. Способы получения рекомбинантных белков описаны, например, в патентах США номер 5,534,615 и 4,816,567, специально включенных в настоящий документ посредством ссылки. В некоторых вариантах воплощения, целевой белок продуцируется клеткой CHO (смотрите, например, WO 94/11026). Примеры белков, включая анти-IL13 моноклональные антитела (анти-IL13 MAb), которые могут быть очищены с использованием процессов, описанных в настоящем документе, были описаны выше.
При использовании рекомбинантных методов белок может продуцироваться внутриклеточно, в периплазматическом пространстве или может секретироваться непосредственно в среду. Если белок продуцируется внутриклеточно, на первой стадии дебрис в форме частиц, либо фрагменты клеток-хозяев, либо лизированные фрагменты удаляют центрифугированием или ультрафильтрацией. Когда белок секретируется в среду, рекомбинантные клетки-хозяева могут быть отделены от культуральной среды, например, с помощью тангенциальной поточной фильтрации.
Для очистки препарата анти-IL13 MAb используется белок A, иммобилизованный на твердой фазе. В некоторых вариантах воплощения, твердая фаза представляет собой колонку, имеющую поверхность из стекла, диоксила кремния, агарозы или полистирола для иммобилизации белка A. В некоторых вариантах воплощения, твердая фаза представляет собой колонку из стекла с контролируемым размером пор или колонку из кремниевой кислоты. В некоторых случаях, колонка покрыта реагентом, таким как глицерол, чтобы предотвратить неспецифическое связывание с колонкой. Колонка PROSEP A™, коммерчески доступная от Bioprocessing Limited, является примером колонки из стекла с контролируемым размером пор и с белком A, которая покрыта глицерином. Другие примеры колонок, предусмотренных настоящим документом, включают колонку POROS® 50 ATM (полистирол), или колонку rProtein A SEPHAROSE FAST FLOW™ (агароза), или колонку MABSELECT SURETM (агароза), доступные от GE Healthcare Life Sciences (агароза).
Твердую фазу для хроматографии на белке A уравновешивают подходящим буфером. Например, уравновешивающий буфер может представлять собой 25 мМ Tris, 25 мМ NaCl, pH 7,70 + 0,20.
Препарат, полученный из рекомбинантных клеток-хозяев и содержащий примеси и/или загрязнители, наносят на уравновешенную твердую фазу с применением буфера для нанесения, который может быть таким же, как уравновешивающий буфер. Поскольку препарат, содержащий примеси/загрязнители, проходит через твердую фазу, белок адсорбируется на иммобилизованном белке A, и другие примеси/загрязнители (такие как белки клеток яичника китайского хомячка, CHOP, если белок продуцируется в клетке CHO) могут неспецифично связываться с твердой фазой.
На следующей стадии, осуществляемой последовательно, происходит удаление примесей/загрязнителей, связавшихся с твердой фазой, антителом и/или белком A, промывкой твердой фазы на промежуточной стадии промывки. После нанесения твердая фаза может быть уравновешена уравновешивающим буфером до промежуточной стадии промывки.
Промежуточный промывочный буфер может включать соль и необязательно дополнительное соединение, такое как (a) детергент (например, полисорбат, например, полисорбат 20 или полисорбат 80); (b) растворитель (такой как гексиленгликоль); и (c) полимер (такой как полиэтиленгликоль [PEG]).
Используемая соль может быть выбрана в зависимости от целевого белка. Примеры солей включают ацетат натрия, цитрат натрия и фосфат калия, но не ограничиваются ими.
Количество соли и дополнительного соединения (если оно присутствует) в композиции должно быть таким, что суммарное их количество достаточно для элюции примеси (примесей)/загрязнителя (загрязнителей), по существу, без удаления целевого белка. Примеры концентраций соли в таких промывочных буферах составляют от примерно 0,1 М до примерно 2 M или от примерно 0,2 M до примерно 0,6 M. Используемые концентрации детергента составляют от примерно 0,01% до примерно 5%, или примерно от 0,1% до 1%, или примерно 0,5%, например, когда детергент представляет собой полисорбат. Примеры концентрации растворителя составляют примерно от 1% до 40% или от примерно 5 до примерно 25%. Когда дополнительное соединение представляет собой полимер (например, PEG 400 или PEG 8000), его концентрация может составлять, например, от примерно 1% до примерно 20% или от примерно 5% до примерно 15%.
pH промежуточного промывочного буфера составляет, как правило, от примерно 4 до примерно 8, или от примерно 4,5 до примерно 5,5, или примерно 5,0. В одном из вариантов воплощения, pH составляет 7,00 + 0,10.
После промежуточной стадии промывки, описанной выше, целевой белок снимают с колонки. Это, как правило, достигается применением подходящего элюирующего буфера. Белок, например, может быть элюирован с колонки с применением элюирующего буфера, имеющего низкий pH (кислые условия), например, в диапазоне от примерно 2 до примерно 5 или в диапазоне от примерно 2,5 до примерно 3,5. Примеры элюирующих буферов для этой цели включают цитратный или ацетатный буферы.
Препарат элюированного белка может быть подвергнут дополнительным стадиям очистки либо до, либо после стадия хроматографии на белке A. Примеры дополнительных стадий очистки включают хроматографию на гидроксиапатите; диализ; аффинную хроматографию с использованием антитела для захвата белка; хроматографию гидрофобных взаимодействий (HIC); осаждение сульфатом аммония; анионообменную или катионообменную хроматографию; осаждение этанолом; обращено-фазовую HPLC; хроматографию на оксиде кремния; хроматофокусирование; ультрафильтрацию-диафильтрацию (UFDF) и гель-фильтрацию. В примерах в настоящем документе, за стадией хроматографии на белке A следуют стадии анионообменной (например, на Q-Sepharose-Fast Flow) или мультимодальной (например, комбинированной) ионообменной хроматографии (например, на CAPTOTM Adhere) и HIC (например, на PHENYL SEPHAROSETM 6 fast flow - high sub).
Белок, выделенный таким образом, может быть составлен в виде лекарственной формы с фармацевтически приемлемым носителем и использован для различных диагностических, терапевтических или других применений, известных для таких молекул.
В некоторых вариантах воплощения любых описанных в настоящем документе способов, хроматографический материал представляет собой ионообменный хроматографический материал; например, материал для анионообменной хроматографии. В некоторых вариантах воплощения, материал для анионообменной хроматографии представляет собой твердую фазу, которая заряжена положительно и содержит свободные анионы для обмена с анионами в водном растворе, проходящем через твердую фазу. В некоторых вариантах воплощения любых описанных в настоящем документе способов, анионообменный материал может представлять собой мембрану, монолитный материал или смолу. В одном варианте воплощения, анионообменный материал может представлять собой смолу. В некоторых вариантах воплощения, анионообменный материал может включать первичный амин, вторичный амин, третичный амин или четвертичный ион аммония, полиаминную функциональную группу или диэтиламиноэтильную функциональную группу. В некоторых вариантах воплощения, приведенных выше, материал для анионообменной хроматографии представляет собой колонку для анионообменной хроматографии. В некоторых вариантах воплощения, приведенных выше, материал для анионообменной хроматографии представляет собой мембрану для анионообменной хроматографии.
В некоторых вариантах воплощения любых описанных в настоящем документе способов, в качестве ионообменного материала может использоваться традиционный хроматографический материал или конвекционный хроматографический материал. Конвекционные хроматографические материалы включают, например, перфузионные материалы (например, поли(стирол-дивинилбензольная) смола) и диффузные материалы (например, смола на основе поперечно сшитой агарозы). В некоторых вариантах воплощения поли(стирол-дивинилбензольная) смола может представлять собой смолу POROS®. В некоторых вариантах воплощения, смола на основе поперечно сшитой агарозы может представлять собой смолу сульфопропил-сефарозу Fast Flow ("SPSFF"). Конвекционный хроматографический материал может представлять собой мембрану (например, полиэфирсульфоновую) или монолитный материал (например, поперечно сшитый полимер). Мембрана из полиэфирсульфона может представлять собой мембрану Mustang. Монолитный материал из поперечно сшитого полимера может представлять собой поперечно сшитый поли(глицидилметакрилат-со-этилендиметакрилат).
Примеры анионообменных материалов включают POROS® HQ 50, POROS® PI 50, POROS® D, Mustang Q, Q SEPHAROSETM FF и DEAE Сефарозу, но не ограничиваются ими.
В некоторых аспектах, хроматографический материал представляет собой материал для хроматографии гидрофобных взаимодействий. Хроматография гидрофобных взаимодействий (HIC) представляет собой метод жидкостной хроматографии, в котором разделение биомолекул происходит в зависимости от их гидрофобности. Примеры хроматографических материалов для HIC включают Toyopearl hexyl 650, Toyopearl butyl 650, Toyopearl phenyl 650, Toyopearl ether 650, Source, Resource, Sepharose Hi-Trap, октилсефарозу, PHENYL SEPHAROSETM high performance, PHENYL SEPHAROSETM 6 fast flow (low sub) и PHENYL SEPHAROSETM 6 fast flow (high sub), но не ограничиваются ими. В некоторых вариантах воплощения, приведенных выше, хроматографический материал для HIC представляет собой хроматографическую колонку для HIC. В некоторых вариантах воплощения, приведенных выше, хроматографический материал для HIC представляет собой хроматографическую мембрану для HIC.
В некоторых аспектах, хроматографический материал представляет собой материал для аффинной хроматографии. Примеры материалов для аффинной хроматографии включают хроматографические материалы, дериватизированный белком A или белком G, но не ограничиваются ими. Примеры материалов для аффинной хроматографии включают Prosep-VA, Prosep-VA Ultra Plus, сефарозу с белком А fast flow, Tyopearl Protein A, MAbSelect, MABSELECT SURETM и MABSELECT SURETM LX, но не ограничиваются ими. В некоторых вариантах воплощения, приведенных выше, материал для аффинной хроматографии представляет собой колонку для аффинной хроматографии. В некоторых вариантах воплощения, приведенных выше, материал для аффинной хроматографии представляет собой мембрану для аффинной хроматографии.
В зависимости от таких показателей, как, например, желаемый pH буфера, желаемая проводимость буфера, характеристики целевого белка и способа очистки, могут быть использованы различные буферы. В некоторых вариантах воплощения любых описанных в настоящем документе способов, способы включают использование буфера. Буфер может представлять собой буфер для нанесения, уравновешивающий буфер или промывочный буфер. В некоторых вариантах воплощения, один или несколько буферов, выбранных из буфера для нанесения, уравновешивающего буфера и/или промывочного буфера, являются одинаковыми. В некоторых вариантах воплощения, буфер для нанесения, уравновешивающий буфер и/или промывочный буфер представляют собой разные буферы. В некоторых вариантах воплощения любых описанных в настоящем документе способов, буфер включает соль. Буфер для нанесения может включать хлорид натрия, ацетат натрия или их смесь. В некоторых вариантах воплощения, буфер для нанесения представляет собой буфер с хлоридом натрия. В некоторых вариантах воплощения, буфер для нанесения представляет собой буфер с ацетатом натрия.
В настоящем документе термин нанесение представляет собой нанесение композиции на хроматографический материал. Буфер для нанесения представляет собой буфер, используемый для нанесения композиции, включающей целевой продукт, на хроматографический материал. Хроматографический материал может быть уравновешен уравновешивающим буфером перед нанесением композиции, подлежащей очистке. В некоторых примерах, промывочный буфер используется после нанесения композиции на хроматографический материал и до элюции целевого полипептида с твердой фазы. Тем не менее, некоторое количество целевого продукта, например, полипептида, может быть удалено с хроматографического материала промывочным буфером (например, в режиме сбора проскока).
В настоящем документе термин элюция представляет собой удаление продукта, например, полипептида, с хроматографического материала. Элюирующий буфер представляет собой буфер, используемый для элюции полипептида или другого целевого продукта с хроматографического материала. Во многих случаях физические характеристики элюирующего буфера отличаются от физических характеристик буфера для нанесения. Например, проводимость элюирующего буфера может отличаться от проводимости буфера для нанесения, или pH элюирующего буфера может отличаться от pH буфера для нанесения. В некоторых вариантах воплощения, проводимость элюирующего буфера ниже, чем проводимость буфера для нанесения. В некоторых вариантах воплощения, проводимость элюирующего буфера выше, чем проводимость буфера для нанесения. В некоторых вариантах воплощения, pH элюирующего буфера ниже, чем pH буфера для нанесения. В некоторых вариантах воплощения, pH элюирующего буфера выше, чем pH буфера для нанесения. В некоторых вариантах воплощения, проводимость и pH элюирующего буфера отличается от проводимости и pH буфера для нанесения. Элюирующий буфер может иметь любую комбинацию более высокой или низкой проводимости и более высокого или низкого pH.
Проводимость относится к способности водного раствора проводить электрический ток между двумя электродами. Раствор проводит ток за счет ионного транспорта. Поэтому с увеличением количества ионов, присутствующих в водном растворе, будет увеличиваться проводимость раствора. Основной единицей измерения проводимости является сименс (или мо), мо (мСм/см) и проводимость можно измерить, используя имеющейся в продаже измеритель проводимости, например от Orion. Поскольку электролитическая проводимость является способностью ионов в растворе проводить электрический ток, проводимость раствора может быть изменена за счет изменения концентрации ионов в растворе. Например, концентрация буферного агента и/или концентрация соли (например, хлорида натрия, ацетата натрия или хлорида натрия) в растворе может быть изменена, чтобы получить желаемую проводимость. Предпочтительно, для получения нужной проводимости в различных буферах изменяют концентрацию соли.
В некоторых вариантах воплощения любых описанных в настоящем документе способов, скорость потока меньше примерно 50 объемов колонки/ч, 40 объемов колонки/ч или 30 объемов колонки/ч. Скорость потока может составлять примерно между 5 объемами колонки/ч и 50 объемами колонки/ч, 10 объемами колонки/ч и 40 объемами колонки/ч или 18 объемами колонки/ч и 36 объемами колонки/ч. В некоторых вариантах воплощения, скорость потока составляет примерно 9 объемов колонки/ч, 18 объемов колонки/ч, 25 объемов колонки/ч, 30 объемов колонки/ч, 36 объемов колонки/ч или 40 объемов колонки/ч. В некоторых вариантах воплощения любых описанных в настоящем документе способов, скорость потока составляет меньше примерно 100 см/ч, 75 см/ч или 50 см/ч. Скорость потока может составлять примерно между 25 см/ч и 150 см/ч, 25 см/ч и 100 см/ч, 50 см/ч и 100 см/ч или 65 см/ч и 85 см/ч или 50 см/ч и 250 см/ч или 100 см/ч и 250 см/ч или 150 см/ч и 250 см/ч.
Высота слоя представляет собой высоту используемого хроматографического материала. В некоторых вариантах воплощения любого из описанных в настоящем документе способов, высота слоя больше, чем примерно 3 см, 10 см или 15 см. Высота слоя может составлять между 3 см и 35 см, 5 см и 15 см, 3 см и 10 см или 5 см и 8 см. В некоторых вариантах воплощения, высота слоя составляет примерно 3 см, 5 см, 10 см или 15 см. В некоторых вариантах воплощения, высоту слоя определяют, основываясь на количестве полипептида или загрязнителей в веществе, наносимом на колонку.
В некоторых вариантах воплощения, хроматографию осуществляют в колонке носителя, объем которого составляет больше примерно 1 мл, 2 мл, 3 мл, 4 мл, 5 мл, 6 мл, 7 мл, 8 мл, 9 мл, 10 мл, 15 мл, 20 мл, 25 мл, 30 мл, 40 мл, 50 мл, 75 мл, 100 мл, 200 мл, 300 мл, 400 мл, 500 мл, 600 мл, 700 мл, 800 мл, 900 мл, 1 л, 2 л, 3 л, 4 л, 5 л, 6 л, 7 л, 8 л, 9 л, 10 л, 25 л, 50 л, 100 л, 200 л, 400 л или 450 л.
В некоторых вариантах воплощения, в процессе хроматографии собирают фракции. В некоторых вариантах воплощения, объем собранных фракций составляет более чем примерно 0,01 объемов колонки, 0,02 объемов колонки, 0,03 объемов колонки, 0,04 объемов колонки, 0,05 объемов колонки, 0,06 объемов колонки, 0,07 объемов колонки, 0,08 объемов колонки, 0,09 объемов колонки, 0,1 объемов колонки, 0,2 объемов колонки, 0,3 объемов колонки, 0,4 объемов колонки, 0,5 объемов колонки, 0,6 объемов колонки, 0,7 объемов колонки, 0,8 объемов колонки, 0,9 объемов колонки, 1,0 объема колонки, 2,0 объемов колонки, 3,0 объемов колонки, 4,0 объемов колонки, 5,0, объемов колонки. В некоторых вариантах воплощения, фракции, содержащие продукт, например, полипептид, объединяют. В некоторых вариантах воплощения, объединяют фракции, содержащие полипептид из нанесенных фракций и из элюированных фракций. Количество полипептида во фракции может быть определено специалистом в данной области техники; например, количество полипептида во фракции может быть определено с помощью УФ спектроскопии. В некоторых вариантах воплощения, фракции, содержащие обнаруживаемый фрагмент полипептида, объединяют.
В некоторых вариантах воплощения любых описанных в настоящем документе способов, по меньшей мере, одна примесь или загрязнитель представляет собой одно или несколько веществ, выбранных из веществ клеток-хозяев, таких как CHOP; выщелоченного белка A; нуклеиновой кислоты; варианта, фрагмента, агрегата или производного целевого полипептида; другого полипептида; эндотоксина; вирусного загрязнителя; компонента культуральной среды, гентамицина и тому подобного. В некоторых примерах, примесь или загрязнитель могут представлять собой белок из клетки-хозяина (HCP), например, бактериальной клетки, такой как клетка E. coli, клетки насекомых, прокариотической клетки, эукариотической клетки, дрожжевой клетки, клетки млекопитающих, клетки птицы, клетки гриба, но не ограничиваясь ими.
Белки клеток-хозяев (HCP) представляют собой белки из клеток, в которых продуцируется полипептид. Например, CHOP представляют собой белки из клеток-хозяев, т.е. белки клеток яичника китайского хомячка. Количество CHOP можно измерить с помощью иммуноферментного анализа ("ELISA") или масс-спектрометрического анализа. В некоторых вариантах воплощения любых описанных в настоящем документе способов, количество HCP (например, CHOP) снижено более чем примерно на 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 % или 95 %. Количество HCP может быть снижено примерно на величину между 10 % и 99 %, 30% и 95%, 30 % и 99 %, 50% и 95%, 50 % и 99 %, 75 % и 99 % или 85 % и 99 %. В некоторых вариантах воплощения, количество HCP снижено примерно на 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 85 %, 90 %, 95 % или 98 %. В некоторых вариантах воплощения, снижение определяют, сравнивая количество HCP в композиции, полученной после стадии (стадий) очистки, с количеством HCP в композиции до стадии (стадий) очистки.
В некоторых вариантах воплощения любых описанных в настоящем документе способов, способы дополнительно включают получение очищенного полипептида. В некоторых вариантах воплощения, очищенный полипептид получают после любой стадии очистки, описанной в настоящем документе. Стадия хроматографии может представлять собой анионообменную хроматографию, HIC или хроматографию на белке A. В некоторых вариантах воплощения, первая стадия хроматографии представляет собой хроматографию на белке A, за ней следует анионообменная или мультимодальная ионообменная хроматография и далее HIC.
В некоторых вариантах воплощения, полипептид дополнительно очищают после хроматографии с помощью вирусной фильтрации. Вирусная фильтрация заключается в удалении вирусных загрязнителей из полипептидной фракции, подлежащей очистке. Примеры вирусной фильтрации включают ультрафильтрацию и микрофильтрацию. В некоторых вариантах воплощения полипептид, очищают с использованием фильтра для парвовирусов.
В некоторых вариантах воплощения, полипептид концентрируют после хроматографии. Примеры способов концентрирования известны в данной области техники и включают ультрафильтрацию и диафильтрацию, но не ограничиваются ими.
В некоторых вариантах воплощения любых описанных в настоящем документе способов, способы дополнительно включают комбинирование полипептида, очищенного в соответствии со способами очистки, с фармацевтически приемлемым носителем.
Моноклональные антитела
В некоторых вариантах воплощения, антитела, очищенные в соответствии со способами настоящего изобретения, представляют собой моноклональные антитела. Моноклональные антитела получают из популяции, по существу, гомогенных антител, т.е. индивидуальные антитела, входящие в состав популяции, являются идентичными и/или связываются с одним и тем же эпитопом, за исключением возможных вариантов, которые могут возникать в процессе получения моноклонального антитела, но такие варианты обычно присутствуют в минорных количествах. Таким образом, модификатор "моноклональное" указывает на характер антитела, которое не является смесью отдельных или поликлональных антител.
Например, моноклональные антитела могут быть получены с использованием гибридомного способа, впервые описанного Kohler et al., Nature 256:495 (1975), или могут быть получеными способами рекомбинантных ДНК (патент США номер 4,816,567).
В гибридомном способе мышь или другое подходящее животное-хозяин, такое как хомяк, иммунизируют, как описано в настоящем документе, для активации лимфоцитов, которые продуцируют или могут продуцировать антитела, которые будут специфично связываться с полипептидом, использованным для иммунизации. Альтернативно, лимфоциты могут быть иммунизированы in vitro. Далее осуществляют слияние лимфоцитов с клетками миеломы, используя подходящий агент, вызывающий слияние клеток, такой как полиэтиленгликоль, с обрзованием клетки гибридомы (Goding, Monoclonal antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986)).
Клетки гибридомы, полученные таким образом, высаживают и растят в подходящей культуральной среде, которая предпочтительно содержит одно или несколько веществ, которые ингибируют рост или выживаемость неслившихся, родительских клеток миеломы. Например, если в родительских клетках миеломы отсутствует фермент гипоксантин-гуанинфосфорибозилтрансфераза (HGPRT или HPRT), культуральная среда для гибридом, как правило, будет включать гипоксантин, аминоптерин и тимидин (среда HAT), которые предотвращают рос рост дефицитных по HGPRT клеток.
В некоторых вариантах воплощения, клетки миеломы представляют собой клетки, которые эффективно сливаются, поддерживают на высоком уровне стабильную продукцию антитела выбранными антителопродуцирующими клетками и являются чувствительными к среде, такой как среда HAT. В некоторых вариантах воплощения, линия клеток миеломы включает линии клеток мишиной миеломы, такие как линии клеток миеломы, полученные из мышиных опухолей MOPC-21 и MPC-11, доступные из Salk Institute Cell Distribution Center, Сан-Диего, Калифорния, США, и клетки SP-2 или X63-Ag8-653, доступные из американской коллекции типовых культур, Роквилл, Мэриленд, США. Также для продукции человеческих моноклональных антител были описаны человеческие линии клеток миеломы и мышиные-человеческие линии клеток гетеромиеломы (Kozbor, J. Immunol. 133:3001 (1984); Brodeur et al., Monoclonal antibody Production Techniques and Applications pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой растут клетки гибридомы, используют для оценки продукции моноклональных антител, направленных против антигена. В некоторых вариантах воплощения, специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяют иммунопреципитацией или с помощью анализа связывания in vitro, такого как радиоиммунологический анализ (RIA) или иммуноферментный анализ (ELISA).
Аффинность связывания моноклонального антитела может быть определена, например, с помощью анализа Скэтчарда, как описано в Munson et al., Anal. Biochem. 107:220 (1980).
После идентификации гибридомных клеток, которые продуцируют антитела нужной специфичности, аффинности и/или активности, клоны могут быть субклонированы методом серийных разведений, и выращены стандартными способами (Goding, Monoclonal antibodies: Principles and Practice pp. 59-103 (Academic Press, 1986)). Подходящие для этой цели культуральные среды включают, например, среду D-MEM или RPMI-1640. Кроме того, клетки гибридомы могут быть выращены in vivo в виде асцитных опухолей у животных.
Моноклональные антитела, секретируемые субклонами, подходящим образом отделяют от культуральной среды, асцитной жидкости или сыворотки, используя общепринятые способы очистки иммуноглобулинов, такие как, например, хроматография на сефарозе с белком A, хроматография с гидроксиапатитом, гель-электрофорез, диализ или аффинная хроматография.
ДНК, кодирующая моноклональные антитела, может быть легко выделена и секвенирована общепринятыми методами (например, используя олигонуклеотидные зонды, которые могут специфично связываться с генами, кодирующими тяжелые и легкие цепи мышиных антител). В некоторых вариантах воплощения, в качестве источника такой ДНК служат клетки гибридомы. После выделения ДНК может быть введена в векторы экспрессии, которыми далее трансфицируют клетки-хозяева, такие как клетки E. coli, клетки COS обезьяны, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые не продуцируют иммуноглобулиновый полипептид, чтобы синтезировать моноклональные антитела в рекомбинантных клетках-хозяевах. Обзорные статьи по рекомбинантной экспрессии ДНК, кодирующей антитело, в бактериях включают Skerra et al., Curr. Opinion in Immunol. 5:256-262 (1993) и Plückthun, Immunol. Revs., 130:151-188 (1992).
В другом варианте воплощения, антитела или фрагменты антител могут быть выделены из фаговой библиотеки антител, созданной с использованием методов, описанных в McCafferty et al., Nature 348:552-554 (1990). В Clackson et al., Nature 352:624-628 (1991) и Marks et al., J. Mol. Biol. 222:581-597 (1991) описано выделение мышиных и человеческих антител, соответственно, с использованием фаговых библиотек. В последующих публикациях описано получение высокоаффинных (диапазон нМ) человеческих антител посредством перетасовки цепей (Marks et al., Bio/Technology 10:779-783 (1992)), а также с использованием комбинаторной инфекции и рекомбинации in vivo в качестве стратегий для создания очень больших фаговых библиотек (Waterhouse et al., Nuc. Acids. Res. 21:2265-2266 (1993)). Таким образом, эти методы представляют собой приемлемые альтернативы традиционным гибридомным методам для получения и выделения моноклональных антител.
ДНК дополнительно может быть модифицирована, например, заменой мышиных последовательностей, кодирующих константные домены тяжелой и легкой цепей, на гомологичные человеческие последовательности (патент США номер 4,816,567; Morrison et al., Proc. Natl Acad. Sci. USA 81:6851 (1984)) или путем ковалентного связывания всех или некоторых последовательностей, кодирующих не иммуноглобулиновый полипептид, с последовательностью, кодирующей иммуноглобулины.
Как правило, такие не иммуноглобулиновые полипептиды заменяют константные домены антитела, или они заменяют вариабельные домены антигенсвязывающего активного центра антитела для создания химерного бивалентного антитела, включающего один антигенсвязывающий активный центр, обладающий специфичностью в отношении антигена, и другой антигенсвязывающий активный центр, обладающий специфичностью в отношении другого антигена.
В некоторых вариантах воплощения любого из описанных в настоящем документе способов, антитело представляет собой IgA, IgD, IgE, IgG или IgM. В некоторых вариантах воплощения, антитело представляет собой моноклональное антитело IgG.
Гуманизированные антитела
В некоторых вариантах воплощения, антитело представляет собой гуманизированное антитело. Способы гуманизации нечеловеческих антител были описаны в данной области техники. В некоторых вариантах воплощения, гуманизированное антитело содержит один или несколько аминокислотных остатков, введенных в него из не человеческого источника. Эти не человеческие аминокислотные остатки часто называются "импортированными" остатками, и, как правило, они взяты из вариабельного домена, служащего для "импорта" ("импортирующий"). Гуманизация, в основном, может быть осуществлена в соответствии со способом, предложенным Winter и соавторами (Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-327 (1988); Verhoeyen et al., Science 239:1534-1536 (1988)), путем замены соответствующих последовательностей человеческого антитела на последовательности гипервариабельных областей. Соответственно, такие "гуманизированные" антитела представляют собой химерные антитела (патент США номер 4,816,567), в которых последовательность, по существу меньшая, чем последовательность интактного человеческого вариабельного домена, была заменена на соответствующую последовательность из вида, не относящегося к человеку. На практике, гуманизированные антитела, как правило, представляют собой человеческие антитела, в которых некоторые остатки гипервариабельной области и, возможно, некоторые остатки FR заменены на остатки из аналогичных сайтов антител грызунов.
Выбор человеческих вариабельных доменов как легкой, так и тяжелой цепи, которые используются для получения гуманизированных антител, очень важен для снижения их антигенности. В соответствии с так называемым способом "наилучшего соответствия" последовательность вариабельного домена антитела грызунов скринируют против всей библиотеки известных человеческих последовательностей вариабельных доменов. Человеческую последовательность, которая ближе всего к последовательности грызуна, далее принимают в качестве человеческой каркасной области (FR) для гуманизированного антитела (Sims et al., J. Immunol. 151:2296 (1993); Chothia et al., J. Mol. Biol. 196:901 (1987)). В другом способе используется конкретная каркасная область, полученная из консенсусной последовательности всех человеческих антител конкретной подгруппы вариабельных областей легкой или тяжелой цепи. Одна и та же каркасная область может быть использована для нескольких разных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA 89:4285 (1992); Presta et al., J. Immunol. 151:2623 (1993)).
Кроме того, важно, чтобы гуманизированные антитела сохраняли высокую аффинность к антигену и другие благоприятные биологические свойства. Для достижения этой цели, в некоторых вариантах воплощения способов, гуманизированные антитела получают с помощью процесса анализа исходных последовательностей и различных предполагаемых гуманизированных продуктов, используя трехмерные модели исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов широко доступны и известны специалистам в данной области техники. Доступны компьютерные программы, которые приводят и отображают возможные трехмерные конформационные структуры выбранных кандидатов иммуноглобулиновых последовательностей. Изучение этих изображений позволяет анализировать вероятную роль остатков в функционировании иммуноглобулиновой последовательности кандидата, т.е. анализировать остатки, которые влияют на способность кандидата иммуноглобулина связываться с его антигеном. Следовательно, остатки FR могут быть выбраны из реципиентной и импортирующей последовательностей и объединены таким образом, чтобы получить требуемые характеристики антитела, такие как повышенная аффинность к целевому антигену (антигенам). В общем, остатки гипервариабельной области непосредственно и наиболее существенно участвуют в связывании антигена и влияют на связывании антигена.
Человеческие антитела
В некоторых вариантах воплощения, антитело представляет собой человеческое антитело. В качестве альтернативы гуманизации могут быть созданы человеческие антитела. Например, в настоящее время можно получать трансгенных животных (например, мышей), которые способны при иммунизации продуцировать полный репертуар человеческих антител в отсутствии эндогенной продукции иммуноглобулинов. Например, было описано, что гомозиготная делеция соединительной области (JH) гена тяжелой цепи антитела в химерных мышах и мышах с герминативными мутациями приводит к полному ингибированию эндогенной продукции антител. Перенос человеческого набора иммуноглобулиновых генов зародышевого типа в таких мышей с герминативными мутациями будет приводить к продукции человеческих антител при антигенной стимуляции. Смотрите, например, Jakobovits et al., Proc. Natl. Acad. Sci. USA 90:2551 (1993); Jakobovits et al., Nature 362:255-258 (1993); Bruggermann et al., Year in Immuno. 7:33 (1993); и патенты США номер 5,591,669; 5,589,369; и 5,545,807.
Альтернативно, для получения человеческих антител и фрагментов антител in vitro из репертуаров генов вариабельного (V) домена иммуноглобулинов из иммунизированных доноров может быть использована технология фагового дисплея (McCafferty et al., Nature 348:552-553 (1990)). В соответствии с этим методом, гены V домена антитела клонируют в рамку гена мажорного или минорного полипептида оболочки нитевидного бактериофага, такого как M13 или fd, и он экспрессируется в виде функциональных фрагментов антител на поверхности фаговой частицы. Поскольку нитевидная частица содержит копию одноцепочечной ДНК, представляющую собой геном фага, отбор на основе функциональных свойств антитела также приводит к отбору гена, кодирующего антитело, обладающего такими свойствами. Таким образом, фаг имитирует некоторые свойства B клеток. Фаговый дисплей может быть осуществлен в разных форматах; обзор фагового дисплея представлен, например, в Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3:564-571 (1993). Для фагового дисплея могут быть использованы несколько источников сегментов V-генов. Clackson et al., Nature 352:624-628 (1991) выделили широкий набор анти-оксазолон антител из небольшой случайной комбинаторной библиотеки V генов, полученной из селезенки иммунизированных мышей. Репертуар V генов из иммунизированных человеческих доноров может быть сформирован, и антитела к разнообразному набору антигенов (в том числе к собственным антигенам) могут быть выделены, по существу, следуя методам, описанным в Marks et al., J. Mol. Biol. 222:581-597 (1991) или Griffith et al., EMBO J. 12:725-734 (1993). Смотрите, также, патенты США номер 5,565,332 и 5,573,905.
Человеческие антитела также могут быть получены in vitro с помощью активированных B клеток (смотрите, патенты США номер 5,567,610 и 5,229,275).
Фрагменты антител
В некоторых вариантах воплощения, антитело представляет собой фрагмент антитела. Были разработаны различные методы для получения фрагментов антител. Традиционно, эти фрагменты получали путем протеолитического расщепления интактных антител (смотрите, например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al., Science 229:81 (1985)). Тем не менее, эти фрагменты теперь могут быть получены непосредственно с помощью рекомбинантных клеток-хозяев. Например, фрагменты антител могут быть выделены из фаговых библиотек антител, как обсуждалось выше. Альтернативно, фрагменты Fab'-SH могут быть непосредственно получены из E. coli и химически соединены с образованием фрагментов F(ab')2 (Carter et al., Bio/Technology 10:163-167 (1992)). В соответствии с другим подходом, фрагменты F(ab')2 могут быть выделены непосредственно из культуры рекомбинантных клеток-хозяев. Другие способы получения фрагментов антител будут понятны квалифицированному практикующему специалисту. В других вариантах воплощения, целевое антитело представляет собой одноцепочечный фрагмент Fv (scFv). Смотрите, WO 93/16185; патент США номер 5,571,894; и патент США номер 5,587,458. Фрагмент антитела также может представлять собой "линейное антитело", например, как описано в патенте США номер 5,641,870. Такие линейные фрагменты антител могут быть моноспецифическими или биспецифическими.
В некоторых вариантах воплощения, предусмотрены фрагменты антител, описанные в настоящем документе. В некоторых вариантах воплощения, фрагмент антитела представляет собой антигенсвязывающий фрагмент. В некоторых вариантах воплощения, антигенсвязывающий фрагмент выбран из группы, состоящей из фрагмента Fab, фрагмента Fab', фрагмента F(ab')2, scFv, Fv и диатела.
Химерные полипептиды
Полипептиды, описанные в настоящем документе, могут быть модифицированы определенным образом с образованием химерных молекул, включающих полипептид, слитый с другим, гетерологичным полипептидом или аминокислотной последовательностью. В некоторых вариантах воплощения, химерная молекула включает полипептид, слитый с полипептидом-меткой, который обеспечивает эпитоп, с которым селективно связывается антитело против метки. Эпитопная метка обычно расположена на аминоконце или карбоксильном конце полипептида. Присутствие таких эпитопно-меченых форм полипептида может быть обнаружено с использованием антитела против полипептида-метки. Кроме того, наличие эпитопной метки позволяет легко очистить полипептид с помощью аффинной очистки с использованием антитела против метки или другого типа аффинной матрицы, которая связывается с эпитопной меткой.
Другие
Другой тип ковалентной модификации полипептида включает связывание полипептида с одним из множества небелковых полимеров, например, полиэтиленгликолем, полипропиленгликолем, полиоксиалкиленами или сополимерами полиэтиленгликоля и полипропиленгликоля. Полипептид также может быть заключен в микрокапсулы, полученные, например, методами коацервации или полимеризации на границе фаз (например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы, соответственно), в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы раскрыты в Remington's Pharmaceutical Sciences, 18th edition, Gennaro, A.R., Ed., (1990).
ПОЛУЧЕНИЕ ПОЛИПЕПТИДОВ
Полипептиды, использованные в способах очистки, описанных в настоящем документе, могут быть получены с использованием способов, хорошо известных в данной области техники, в том числе рекомбинантных способов. В нижеследующих разделах даны указания относительно этих способов.
Полинуклеотиды
Термины "полинуклеотид" или "нуклеиновая кислота", используемые в настоящем документе взаимозаменяемо, относятся к полимерам нуклеотидов любой длины и включают ДНК и РНК.
Полинуклеотиды, кодирующие полипептиды, могут быть получены из любого источника, включая, но не ограничиваясь ими, библиотеки кДНК, полученные из ткани, которая, как полагают, содержит мРНК полипептида и экспрессирует его на обнаруживаемом уровне. Соответственно, полинуклеотиды, кодирующие полипептид, могут быть легко получены из библиотеки кДНК, созданной из человеческой ткани. Ген, кодирующий полипептид, также может быть получен из геномной библиотеки или известными синтетическими методами (например, автоматизированный синтез нуклеиновых кислот).
Например, полинуклеотид может кодировать молекулу полноразмерной иммуноглобулиновой цепи, такой как легкая цепь или тяжелая цепь. Полная тяжелая цепь включает не только вариабельную область тяжелой цепи (VH), но также константную область тяжелой цепи (CH), которая, как правило, будет включать три константных домена: CH1, CH2 и CH3; и "шарнирную" область. В некоторых ситуациях, наличие константной области желательно.
Другие полипептиды, которые могут кодироваться полинуклеотидом, включают антигенсвязывающие фрагменты антител, такие как однодоменные антитела ("dAb"), Fv, scFv, Fab', F(ab')2 и "миниантитела". Миниантитела (как правило) представляют собой бивалентные фрагменты антител, из которых удален домен CH1 и CK или CL. Поскольку миниантитела меньше обычных антител, они должны лучше проникать в ткань при клиническом /диагностическом применении, но, являясь бивалентными, они должны сохранять более высокую аффинность связывания, чем моновалентные фрагменты антител, такие как dAb. Соответственно, если из контекста не следует иное, термин "антитело", используемый в настоящем документе, включает не только молекулы полноразмерных антител, но также антигенсвязывающие фрагменты антител, принадлежащие к обсуждавшимся выше типам. Предпочтительно, каждая каркасная область, присутствующая в кодируемом полипептиде, будет включать, по меньшей мере, одну аминокислотную замену по сравнению с соответствующей человеческой акцепторной каркасной областью. Таким образом, например, каркасные области могут включать всего три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать или пятнадцать аминокислотных замен по сравнению с акцепторной каркасной областью.
Подходящие полинуклеотиды, описанные в настоящем документе, могут быть выделены и/или очищены. В некоторых вариантах воплощения, полинуклеотиды представляют собой выделенные полинуклеотиды.
Термин "выделенный полинуклеотид" предназначен для указания того, что молекула удалена из своей нормальной или природной среды, или отделена от своей нормальной или природной среды, или была получена таким образом, что она не находится в своей нормальной или природной среде. В некоторых вариантах воплощения, полинуклеотиды представляют собой очищенные полинуклеотиды. Термин очищенный указывает на то, что были удалены, по меньшей мере, некоторые загрязняющие молекулы или вещетва.
Подходящие полинуклеотиды по существу очищены таким образом, что соответствующие полинуклеотиды являются доминирующими (т.е., наиболее представленными) полинуклеотидами в композиции.
Экспрессия полинуклеотидов
Описание ниже относится, в первую очередь, к получению полипептидов за счет культивирования клеток, трансформированных или трансфицированных вектором, содержащим полинуклеотиды, кодирующие полипептид. Конечно, предполагается, что для получения полипептидов могут быть использованы альтернативные способы, хорошо известные в данной области техники. Например, соответствующая аминокислотная последовательность или ее часть могут быть получены путем прямого пептидного синтеза с использованием методов твердофазного синтеза (смотрите, например, Stewart et al., Solid-Phase Peptide Synthesis W.H. Freeman Co., San Francisco, Calif. (1969); Merrifield, J. Am. Chem. Soc. 85:2149-2154 (1963)). Синтез белка in vitro может быть осуществлен с использованием ручных или автоматизированных методов. Автоматизированный синтез может быть осуществлен, например, с использованием синтезатора Applied Biosystems Peptide Synthesizer (Foster City, Calif.), следуя инструкциям производителя. Различные части полипептида могут быть синтезированы химическим путем отдельно и далее объединены с использованием химических или ферментативных способов для получения нужного полипептида.
Полинуклеотиды, как описано в настоящем документе, помещены в вектор экспрессии (векторы экспрессии) для осуществления продукции полипептидов. Термин "контролирующие последовательности" относятся к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине. Контролирующие последовательности включают промоторы (например, ассоциированные в естественных условиях промоторы или гетерологичные промоторы), сигнальные последовательности, энхансерные элементы и последовательности терминации транскрипции, но не ограничиваются ими.
Полинуклеотид является "функционально связанным", когда он помещен в функциональную зависимость от другой полинуклеотидной последовательности. Например, нуклеиновые кислоты для препоследовательности или секреторной лидерной последовательности функционально связаны с нуклеиновыми кислотами для полипептида, если он экспрессируется в виде белка-предшественника, который участвует в секреции полипептида; промотор или энхансер функционально связаны с кодирующей последовательностью, если они влияют на транскрипцию последовательности; или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если он расположен так, что это облегчает трансляцию. Обычно, "функционально связанный" означает, что соединенные последовательности нуклеиновых кислот граничат друг с другом и, в случае секреторной лидерной последовательности, граничат друг с другом и находятся в одной рамке считывания. Тем не менее, энхансеры не обязательно должны граничить с функционально связанной с ними последовательностью. Связывание осуществляется за счет лигирования по подходящим сайтам рестрикции. Если таких сайтов не существует, используют синтетические олигонуклеотидные адапторы или линкеры в соответствии с общепринятой практикой.
В случае антител, легкая и тяжелая цепи могут быть клонированы в один и тот же вектор экспрессии или в разные векторы экспрессии. Сегменты нуклеиновых кислот, кодирующие иммуноглобулиновые цепи, функционально связаны с контролирующими последовательностями в векторе экспрессии (векторах экспрессии), который обеспечивает экспрессию иммуноглобулиновых полипептидов.
Векторы, содержащие полинуклеотидные последовательности (например, последовательности, кодирующие вариабельную тяжелую и/или вариабельную легкую цепи, и, необязательно, последовательности, контролирующие экспрессию) могут быть введены в клетку-хозяин хорошо известными способами, которые отличаются в зависимости от типа клетки-хозяина. Например, для прокариотических клеток обычно применяют трансфекцию с использованием хлорида кальция, тогда как для других клеток-хозяев могут быть использованы обработка фосфатом кальция, электропорация, липофекция, биолистика или трансфекция с помощью вирусов. (Смотрите, обычно Sambrook et al., Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Press, 2nd ed., 1989). Другие способы, используемые для трансформации клеток млекопитающих, включают использование полибрена, слияния протопластов, липосом, электропорации и микроинъекции. Для создания трансгенных животных могут быть осуществлены микроинъекции трансгенов в оплодотворенные ооциты, или трансген может быть введен в геном эмбриональных стволовых клеток, и ядра таких клеток могут быть перенесены в безъядерные ооциты.
Векторы
Термин "вектор" включает векторы экспрессии, трансформирующие векторы и векторы-переносчики.
Термин "вектор экспрессии" означает конструкцию, способную осуществлять экспрессию in vivo или in vitro.
Термин "трансформирующий вектор" означает конструкцию, которая может быть перенесена из одного хозяина в другого хозяина, которые могут быть одного вида или разных видов. Если конструкция может передаваться от одного вида другому, например, из плазмиды Escherichia coli в другую бактерию, такую как бактерия из рода Bacillus, то трансформирующий вектор иногда называется "вектором-переносчиком". Это может быть даже конструкция, которая может передаваться из плазмиды E. coli в Agrobacterium и в растение.
Векторы могут быть трансформированы в подходящую клетку-хозяина, как описано ниже, для обеспечения экспрессии полипептида. Различные векторы являются общедоступными. Вектор, например, может быть в форме плазмиды, космиды, вирусной частицы или фага. Соответствующая нуклеотидная последовательность может быть вставлена в вектор с помощью различных методик. В общем, ДНК встраивают в соответствующий сайт расщепления эндонуклеазов рестрикции (сайты расщепления эндонуклеазой рестрикции) с использованием методов, известных в данной области техники. Для конструирования подходящих векторов, содержащих один или несколько таких компонентов, использует стандартные методы лигирования, известные специалисту в данной области.
Векторы могут представлять собой, например, плазмиду, вирус или фаговый вектор, в которых имеется точка начала репликации, необязательно, промотор для экспрессии указанного полинуклеотида и, необязательно, регулятор промотора. Векторы могут содержать один или несколько генов селектируемого маркера, которые хорошо известны в данной области техники.
Эти векторы экспрессии, как правило, реплицируются в организмах-хозяевах либо в виде эписом, либо являясь интегральной частью хромосомной ДНК.
Клетки-хозяева
Клетка-хозяин может представлять собой, например, бактериальную клетку, дрожжевую клетку или другую клетку гриба, клетку насекомых, растительную клетку или клетку млекопитающих.
Для получения полипептида может быть использован генетически созданный трансгенный многоклеточный организм-хозяин. Организм может представлять собой, например, трансгенное млекопитающее (например, трансгенную линию коз или мышей).
Подходящие прокариоты включают, но не ограничиваются ими, эубактерии, такие как грамотрицательные или грамположительные организмы, например, Enterobacteriaceae, такие как E. coli. Различные штаммы E. coli являются общедоступными, например, штамм E. coli K12 MM294 (ATCC 31,446); E. coli X1776 (ATCC 31,537); штамм E. coli W3110 (ATCC 27,325) и K5 772 (ATCC 53,635). Другие подходящие прокариотические клетки-хозяева включают Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P), Pseudomonas, такие как P. aeruginosa и Streptomyces. Эти примеры носят иллюстративный характер и не предназначены для ограничения. Штамм W3110 является особенно предпочтительным штаммом-хозяином или родительским штаммом-хозяином, поскольку обычно используется в качестве штамма-хозяина для получения продукта рекомбинантного полинуклеотида. Предпочтительно, клетка-хозяин секретирует минимальное количество протеолитических ферментов. Например, штамм W3110 может быть модифицирован таким образом, что содержит генетическую мутацию в генах, кодирующих эндогенные для клетки-хозяина полипептиды, например, включая штамм E. coli W3110 1A2, имеющий полный генотип tonA; штамм E. coli W3110 9E4, имеющий полный генотип tonA ptr3; штамм E. coli W3110 27C7 (ATCC 55,244), имеющий полный генотип tonA ptr3 phoA E15 (argF-lac)169 degP ompT kan'; штамм E. coli W3110 37D6, имеющий полный генотип tonA ptr3 phoA E15 (argF-lac)169 degP ompT rbs7 ilvG kan'; штамм E. coli W3110 40B4, который представляет собой штамм 37D6, утративший устойчивость к канамицину из-за делеционной мутации degP; и штамм E. coli, имеющий мутантную периплазматическую протеазу. Альтернативно, могут быть использованы способы клонирования in vitro, например, ПЦР или другие полимеразные реакции нуклеиновых кислот.
В эти прокариотические клетки-хозяева могут быть введены векторы экспрессии, которые, как правило, будут содержать контролирующие экспрессию последовательности, совместимые с клеткой-хозяином (например, точка начала репликации). Кроме того, может присутствовать любое количество различных хорошо известных промоторов, таких как система промоторов лактозного оперона, система промоторов триптофанового оперона (trp), система промоторов бета-лактамазного оперона или система промоторов из фага лямбда. Промоторы, как правило, будут контролировать экспрессию, необязательно, с последовательности-оператора и будут содержать последовательность сайта связывания рибосомы и тому подобные последовательности для инициации и завершения транскрипции и трансляции.
Для экспрессии могут быть использованы эукариотические микроорганизмы. Эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, являются подходящими хозяевами для клонирования или экспрессии в них векторов, кодирующих полипептид. Saccharomyces cerevisiae представляют собой обычно используемый низший эукариотический микроорганизм-хозяин. Другие организмы-хозяева включают Schizosaccharomyces pombe; Kluyveromyces, такие как, например, K. lactis (MW98-8C, CBS683, CBS4574), K. fragilis (ATCC 12,424), K. bulgaricus (ATCC 16,045), K. wickeramii (ATCC 24,178), K. waltii (ATCC 56,500), K. drosophilarum (ATCC 36,906), K. thermotolerans и K. marxianus; yarrowia (EP 402,226); Pichia pastoris; Candida; Trichoderma reesia; Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и нитчатые грибы, такие как, например, Neurospora, Penicillium, Tolypocladium и Aspergillus, такие как A. nidulans и A. niger. Метилотрофные дрожжи подходят для целей настоящего документа и включают дрожжи, которые могут расти на метаноле, выбранные из родов Hansenula, Candida, Kloeckera, Pichia, Saccharomyces, Torulopsis и Rhodotorula, но не ограничиваются ими. Saccharomyces являются предпочтительными в качестве дрожжей-хозяев при использовании подходящих векторов, содержащих последовательности, контролирующие экспрессию (например, промоторы), точку начала репликации, последовательности терминации и подобные последовательности, если это необходимо. Обычные промоторы включают промотор 3-фосфоглицераткиназы и других гликолитических ферментов. Индуцибельные промоторы дрожжей включают, среди прочих, промоторы из генов алкогольдегидрогеназы, изоцитохрома C и ферментов, ответственных за утилизацию мальтозы и галактозы.
Помимо микроорганизмов для экспрессии и продукции полипептидов, как описано в настоящем документе, также могут быть использованы клетки культуры тканей млекопитающих, и, в некоторых случаях, это является предпочтительным (смотрите, Winnacker, From Genes to Clones VCH Publishers, N.Y., N.Y. (1987). Для некоторых вариантов воплощения, предпочтительными могут быть эукариотические клетки, поскольку в данной области техники был создан ряд подходящих линий клеток-хозяев, способных секретировать гетерологичные полипептиды (например, интактные иммуноглобулины), и они включают линии клеток CHO, различные линии клеток Cos, клетки HeLa, предпочтительно, линии клеток миеломы, или трансформированные B клетки, или гибридомы. В некоторых вариантах воплощения, клетка-хозяин млекопитающих представляют собой клетку CHO.
В некоторых вариантах воплощения, клетка-хозяин представляет собой клетку-хозяина позвоночных. Примерами используемых линий клеток-хозяев млекопитающих являются линия клеток почек обезьяны CV1, трансформированная SV40 (COS-7, ATCC CRL 1651); человеческие эмбриональные клетки почек (293 или клетки 293, субклонированные для роста в суспензионной культуре); клетки почки детеныша хомяка (BHK, ATCC CCL 10); клетки яичника китайского хомячка/-DHFR (линия CHO или CHO-DP-12); мышиные клетки Сертоли; клетки почек обезьяны (CV1 ATCC CCL 70); клетки почек африканской зеленой мартышки (VERO-76, ATCC CRL-1587); человеческие клетки карциномы шейки матки (HELA, ATCC CCL 2); клетки почек собаки (MDCK, ATCC CCL 34); клетки печени серой крысы (BRL 3A, ATCC CRL 1442); человеческие клетки легких (W138, ATCC CCL 75); человеческие клетки печени (Hep G2, HB 8065); опухоль молочной железы мышей (MMT 060562, ATCC CCL51); клетки TRI; клетки MRC 5; клетки FS4 и человеческие клетки гепатомы (Hep G2).
ЛЕКАРСТВЕННЫЕ ФОРМЫ И СПОСОБЫ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОЙ ФОРМЫ
В настоящем документе также предусмотрены лекарственные формы и способы создания лекарственных форм, включающих полипептиды (например, антитела), очищенные способами, описанными в настоящем документе. Например, очищенный полипептид может быть совмещен с фармацевтически приемлемым носителем.
Лекарственные формы, содержащие полипептид, в некоторых вариантах воплощения, могут быть получены для хранения путем смешивания полипептида, имеющего требуемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в форме лиофилизированных лекарственных форм или водных растворов.
Использованные в настоящем документе "носители" включают фармацевтически приемлемые носители, эксципиенты или стабилизаторы, являющиеся нетоксичными для клетки или млекопитающего, в которых они вводятся в используемых дозах и концентрациях. Часто физиологически приемлемый носитель представляет собой водный раствор с буфером pH.
Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают буферы, такие как фосфатный, цитратный, гистидиновый буфер и буферы на основе других органических кислот; антиоксиданты, в том числе аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (примерно меньше 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, в том числе глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, Zn-белковые комплексы); и/или неионные сурфактанты, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG).
В некоторых вариантах воплощения, полипептид в лекарственной форме, содержащей полипептид, сохраняет функциональную активность.
Лекарственные формы, используемые для введения in vivo, должны быть стерильными. Это легко достигается фильтрацией через стерильные фильтрационные мембраны.
Лекарственные формы в настоящем документе могут дополнительно содержать более одного активного соединения, если этого требует конкретное показание, подвергающееся лечению, предпочтительно, они могут содержать активные соединения с взаимодополняющими активностями, которые не оказывают отрицательного влияния друг на друга. Например, в дополнение к полипептиду лекарственная форма может при необходимости включать в одной лекарственной форме дополнительный полипептид (например, антитело). Альтернативно или дополнительно, композиция может дополнительно включать химиотерапевтический агент, цитотоксический агент, цитокин, ингибитор роста, антигормональный агент и/или кардиозащитный агент. Такие молекулы могут присутствовать в комбинации в количествах, эффективных для предполагаемых целей.
Примеры лекарственных форм анти-IL13 антител, описанных в настоящем документе, предусмотрены в международной опубликованной патентной заявке номер WO 2013/066866.
ИЗДЕЛИЯ
Полипептиды, очищенные способами, описанными в настоящем документе, и/или лекарственные формы, содержащие полипептиды, очищенные способами, описанными в настоящем документе, могут содержаться в изделии. Изделие может включать контейнер, содержащий полипептид и/или лекарственную форму, содержащую полипептид. В некоторых вариантах воплощения, изделие включает: (a) контейнер, содержащий композицию, включающую полипептид и/или лекарственную форму, содержащую описанный в настоящем документе полипептид, в контейнере; и (b) листок-вкладыш с инструкциями для введения лекарственной формы субъекту.
Изделие включает контейнер и этикетку или листок-вкладыш, помещенный в контейнер или иным образом связанный с ним. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы и тому подобное. Контейнеры могут быть изготовлены из разных материалов, таких как стекло или пластик. Контейнер содержит лекарственную форму и может иметь стерильное входное отверстие (например, контейнер может представлять собой мешок с раствором для внутривенного введения или флакон, имеющий пробку, прокалываемую иглой для подкожных инъекций). По меньшей мере, один активный агент в композиции представляет собой полипептид. В этикетке или листке-вкладыше указано, что композиция используется субъектом, и приведены конкретные указания относительно дозировок и интервалов между дозировками для предусмотренного полипептида и любого другого лекарственного средства. Изделие может дополнительно включать другой материал, наличие которого желательно с коммерческой и потребительской точек зрения, в том числе другие буферы, разбавители, фильтры, иглы и шприцы. В некоторых вариантах воплощения, контейнер представляет собой шприц. В некоторых вариантах воплощения, шприц является частью инъекционного устройства. В некоторых вариантах воплощения, инъекционное устройство представляет собой автоинжектор.
"Листок-вкладыш" используется для обозначения инструкций, обычно включаемых в коммерческие упаковки терапевтических продуктов, в котором содержится информация о показаниях, применениях, дозировках, введении, противопоказаниях, других терапевтических продуктах, с которыми совместим упакованный продукт, и/или предупреждениях, касающихся применения таких терапевтических продуктов.
Примеры изделий, содержащих лекарственные формы анти-IL13 антител, описанных в настоящем документе, предусмотрены в международной опубликованной заявке номер WO 2013/066866.
Дополнительные детали изобретения проиллюстрированы следующими не ограничивающими Примерами. Раскрытия всех ссылок в описании специально включены в настоящий документ посредством ссылки.
ПРИМЕРЫ
Как использовано в Примерах ниже и везде в настоящем документе, "PLB2", "PLBL2" и "PLBD2" являются взаимозаменяемыми и относятся к "фосфолипаза B подобному ферменту 2" или, в качестве синонима, к "фосфолипаза B-домен подобному ферменту 2".
ПРИМЕР 1. Общие способы
Материалы и способы для всех Примеров соответствовали приведенным ниже, если в Примере не указано иное.
Исходные концентрированные растворы MAb
Исходные концентрированные растворы MAb во всех примерах были выбраны из промышленных, экспериментальных или мелкосерийных партий культур клеток, полученных в Genentech (Южный Сан-Франциско, Калифорния, США). После периода ферментации клеточной культуры клетки отделяли и, в некоторых случаях, осветвленную жидкость (собранная культуральная жидкость, HCCF) очищали с помощью хроматографии на белке A и одной или нескольких дополнительных стадий хроматографии и фильтрации, как указано в Примерах ниже.
Количественная оценка MAb
Концентрацию антитела определяли по поглощению при 280 и 320 нм, используя спектрофотометр для УФ-видимой части спектра (8453 модель G1103A; Agilent Technologies; Санта Клара, Калифорния, США) или NanoDrop 1000 модель ND-1000 (Thermo Fisher Scientific; Уолтем, Массачусетс, США). Концентрация веществ, не являющихся антителами (т.е. примесей), была слишком низкой, чтобы заметно влиять на поглощение в УФ области. Если было необходимо, образцы разбавляли соответствующим невзаимодействующим разбавителем в диапазоне 0,1-1,0 оптических единиц. Приготовление образцов и УФ измерения проводили в двух повторах и записывали среднее значение. Коэффициенты поглощения MAb варьировали от 1,42 до 1,645/мг⋅мл⋅см.
Общая количественная оценка белка клеток-хозяев CHO (CHOP)
Для количественной оценки уровней общего белка клеток-хозяев, называемых CHOP, использовали ELISA. ELISA, использованный для обнаружения белков CHO в продуктах, был основан на ELISA в формате сэндвич-анализа. Афинно очищенным поликлональным антителом к CHOP покрывали 96-луночный микротитрационный планшет. Стандарты, контроли и образцы наносили в двух повторах в две отдельные лунки. CHOP, если они присутствуют в образце, связываются с поверхностью планшета, покрытой антителом (поликлональное анти-CHOP). После стадии инкубации в планшет добавляли анти-CHOP поликлональное антитело, конъюгированное с пероксидазой хрена (HRP). После финальной стадии отмывки проводили количественную оценку CHOP, добавляя раствор тетраметилбензидина (TMB), также доступный как SUREBLUE RESERVETM от KPL, Kirkegaard & Perry Laboratories, Inc., ГейтерсбЕрг, Мэриленд, номер по каталогу 53-00-03), который при взаимодействии с ферментом HRP дает колориметрический сигнал. Оптическую плотность (OD) при 450 нм измеряли в каждой лунке. Для построения стандартной кривой использовали пятипараметрическую программу аппроксимации кривой по точкам (SOFTMAX® Pro, Molecular Devices, Саннивэйл, Калифорния), и концентрацию CHOP в образцах рассчитывали по построенной стандартной кривой. Диапазон результатов количественного анализа для ELISA на общие CHOP составил от 5 до 320 нг/мл. Концентрация CHOP в нг/мл относится к количеству CHOP в образце с использованием стандарта CHOP в качестве калибранта. Соотношение CHOP (в нг/мг или ppm) относится к рассчитанному соотношению концентрации CHOP к концентрации продукта и, в некоторых случаях, представляло собой регистрируемый показатель для тестируемых способов. ELISA на общие CHOP может быть использован для количественной оценки общего уровня CHOP в образце, но не подходит для количественной оценки концентрации индивидуальных белков.
Анализ ELISA с мышиным моноклональны антителом против PLBL2 хомячка
Получение мышиных моноклональных антител против PLBL2 хомячка и разработка анализа ELISA для обнаружения и количественной оценки PLBL2 в препарате рекомбинантных полипептидов с применением таких антител описано в предварительных заявках на патент США номер 61/877,503 и 61/991,228. Кратко, анализ проводили, как описано ниже.
Мышиным моноклональным антителом 19C10 покрывали 96-луночный микротитрационный планшет с половинным объемом лунок в концентрации 0,5 мкг/мл в карбонатном буфере (0,05M карбонат натрия, pH 9,6), в течение ночи при 2-8°C. После покрытия поверхности планшета ее блокировали блокирующим буфером (0,15M NaCl, 0,1M фосфат натрия, 0,1% рыбьего желатина, 0,05% полисорбата 20, 0,05% Proclin® 300 [Sigma-Aldrich]; также называемым раствором для разведения) для предотвращения неспецифического связывания белков. Стандарты, контроли и образцы разбавляли в растворе для разведения (0,15M NaCl, 0,1M фосфат натрия, 0,1% рыбьего желатина, 0,05% полисорбата 20, 0,05% Proclin® 300 [Sigma-Aldrich]) и далее наносили в двух повторах в отдельные лунки и инкубировали в течение 2 ч при комнатной температуре (22-27°C). PLBL2, если он присутствует в образце, будет связываться с антителом (также в настоящем документе используется термин «захватываться» антителом), покрывающим поверхность планшета. После стадии инкубации, описанной выше, несвязанные вещества отмывали с помощью промывочного буфера (0,05% полисорбата 20/PBS [номер по каталогу Corning cellgro 99-717-CM]), и мышиное моноклональное антитело 15G11 против PLBL2, конъюгированное с биотином, разбавляли раствором для разведения до концентрации 0,03125 мкг/мл и добавляли в лунки микротитрационного планшета.
Конъюгацию с биотином осуществляли следующим образом. Набор для биотинилирования был получен от Pierce Thermo Scientific, (P/N 20217, E-Z Link NHS-Biotin), и стрептавидин-HRP (SA-HRP) был получен от Jackson Immuno, номер по каталогу 016-030-084. Инструкции в наборе Pierce Kit были следующими. Кратко, IgG диализировали в PBS, pH 7,4, и биотин добавляли к белку и смешивали при комнатной температуре в течение 1 ч. Меченое антитело далее диализировали против PBS, pH 7,4, для удаления избытка биотина, фильтровали и определяли концентрацию белка по поглощению при 280 нм (A280).
После 2 ч стадии инкубации с биотинилированным 15G11 при комнатной температуре, в лунки микротитрационного планшета добавляли стрептавидин HRP (разбавление 1:200000 в буфере для разведения). После финальной стадии отмывки с помощью промывочного буфера (как описано выше) окрашивание получали (для количественной оценки PLBL2) путем добавления раствора TMB (50 мкл/лунку) (SUREBLUE RESERVETM из KPL, Kirkegaard & Perry Laboratories, Inc., ГейтерсбЕрг, Мэриленд, номер по каталогу 53-00-03) с последующей инкубацией при комнатной температуре в течение 10-20 минут. Детекцию проводили, оценивая оптическую плотность (OD) при 450 нм в каждой лунке, используя Molecular Devices SpectraMax M5e. Для построения стандартной кривой использовали четырехпараметрическую программу аппроксимации кривой по точкам (SoftMax Pro v5.2 rev C) и концентрации PLBL2 в образцах вычисляли в линейном диапазоне стандартной кривой. Значения в линейном диапазоне стандартной кривой использовали для вычисдения номинальной концентрации PLBL2 (нг/мг или ppm). Линейный диапазон приблизительно находился между EC10 - EC85 или 1,5 - 40 нг/мл и немного варьировал для разных планшетов. Значения, полученные для PLBL2 с использованием этого метода ELISA, были сопоставимы с оценками, полученными другими способами (например, с помощью LC-MS/MS, ELISA с поликлональными антителами на PLBL2 или ELISA на общие CHOP с разбавлением до LOQ анализа).
Анализ ELISA с кроличьим поликлональным антителом против PLBL2 хомячка
Получение кроличьх поликлональных антител против PLBL2 хомячка и разработка анализа ELISA для обнаружения и количественной оценки PLBL2 в препарате рекомбинантных полипептидов с применением таких антител описано в предварительных заявках на патент США номер 61/877,503 и 61/991,228. Кратко, анализ проводили, как описано ниже.
Аффинно очищенным кроличьм поликлональным антителом покрывали 96-луночный микротитрационный планшет с половинным объемом лунок в концентрации 0,5 мкг/мл в карбонатном буфере (0,05M карбонат натрия, pH 9,6), в течение ночи при 2-8°C. После покрытия поверхности планшета ее блокировали блокирующим буфером (0,15M NaCl, 0,1M фосфат натрия, 0,1% рыбьего желатина, 0,05% полисорбата 20, 0,05% Proclin® 300 [Sigma-Aldrich]; также называемым раствором для разведения) для предотвращения неспецифического связывания белков. Стандарты, контроли и образцы разбавляли в растворе для разведения (0,15M NaCl, 0,1M фосфат натрия, 0,1% рыбьего желатина, 0,05% полисорбата 20, 0,05% Proclin® 300 [Sigma-Aldrich]) и далее наносили в двух повторах в отдельные лунки и инкубировали в течение 2 ч при комнатной температуре (22-27°C). PLBL2, если он присутствует в образце, будет связываться с антителом (также в настоящем документе используется термин «захватываться» антителом), покрывающим поверхность планшета. После стадии инкубации, описанной выше, несвязанные вещества отмывали с помощью промывочного буфера (0,05% полисорбата 20/PBS [номер по каталогу Corning cellgro 99-717-CM]), и аффинно очищенное кроличье поликлональное антитело, конъюгированное с пероксидазой хрена (HRP), разбавляли раствором для разведения до концентрации 40 нг/мл и добавляли в лунки микротитрационного планшета.
Конъюгацию с HRP проводили следующим образом. Набор для конъюгирования HRP был получен от Pierce Thermo Scientific, (P/N 31489, E-Z Link Plus Activated Peroxidase and Kit). Инструкции в наборе Pierce Kit были следующими. Кратко, IgG диализировали в карбонат-бикарбонатном буфере, pH 9,4, и активированную пероксидазу EZ-Link Plus добавляли к белку и смешивали при комнатной температуре в течение 1 ч. Далее для стабилизации конъюгации и гашения реакции добавляли цианоборогидрид натрия и буфер гашения. Меченое антитело далее диализировали против PBS, pH 7,4, фильтровали и определяли концентрацию белка по поглощению при 280 нм (A280).
После 2 ч стадии инкубации с кроличьим поликлональным антителом, конъюгированным с HRP, при комнатной температуре проводили финальную стадию промывки с помощью промывочного буфера (описано выше). После этого окраску получали (для количественной оценки PLBL2) путем добавления раствора TMB (50 мкл/лунку) (SUREBLUE RESERVETM из KPL, Kirkegaard & Perry Laboratories, Inc., ГейтерсбЕрг, Мэриленд, номер по каталогу 53-00-03) с последующей инкубацией при комнатной температуре в течение 10-20 минут. Детекцию проводили, оценивая оптическую плотность (OD) при 450 нм в каждой лунке, используя Molecular Devices SpectraMax M5e. Для построения стандартной кривой использовали пятипараметрическую программу аппроксимации кривой по точкам (SoftMax Pro v5.2 rev C) и концентрации PLBL2 в образцах вычисляли в линейном диапазоне стандартной кривой. Значения в линейном диапазоне стандартной кривой использовали для вычисления номинальной концентрации PLBL2 (в нг/мг или ppm). Диапазон количественной оценки анализа составил 0,5 -50 нг/мл. Значения, полученные для PLBL2 с использованием этого метода ELISA, были сопоставимы с оценками, полученными другими способами (например, с помощью LC-MS/MS, ELISA с поликлональными антителами на PLBL2 или ELISA на общие CHOP с разбавлением до LOQ анализа).
Анализ LC-MS/MS
Для количественной оценки PLBL2 с помощью LC-MS/MS использовали систему Waters Acquity H-Class Bio UPLC и масс-спектрометр AB Sciex TripleTOF 5600+. Образцы и калибровочные стандарты (рекомбинантный PLBL2, добавленный в препарат рекомбинантного гуманизированного моноклонального антитела, полученного из мышиной линии клеток NS0 [линия клеток NS0 не содержит PLBL2 хомячка]) восстанавливали и расщепляли трипсином. Всего в систему UPLC с колонкой Waters BEH300 C18 с размером частиц 1,7 μм вводили 40 мкг триптического гидролизата образца. Для элюции пептидов использовали линейный градиент ацетонитрила при скорости потока 300 мкл/мин и температуре колонки 60°C.
Пептиды, элюированные с UPLC, были введены в масс-спектрометр методом электроспрейной ионизации в режиме ионизации положительно заряженных ионов. Температура в источнике ионов была установлена на 400°C, напряжение на IonSpray составляло 5500 В, и декластеризующее напряжение было равно 76 В. Для фрагментации выбранных ионов пептидов использовали настройку энергии соударения, равную 32. Масс-спектрометр был настроен на работу в режиме высокоразрешающего мониторинга множественных реакций (MRMHR) для четырех конкретных пептидов из PLBL2 и MRM-переходов для их дочерных ионов. Отбор ионов-предшественников был произведен в квадрупольном масс-спектрометре в пределах окна отбора ионов по отношению массы к заряду (m/z) шириной 1,2 а.е.м. Дочерние ионы для каждого родительского иона были отделены друг от друга с помощью времяпролетного масс-спектрометра и выбраны для количественной оценки в пределах окна шириной 0,025 а.е.м.
Концентрацию PLBL2 в образцах определяли, измеряя определенные сигналы четырех переходов, откалиброванных с использованием стандартов с точностью определения 2-500 ppm и линейной аппроксимации. В таблице 2 ниже приведен список пептидов из белка PLBL2, измеряемых с помощью LC-MS/MS.
Таблица 2. Список пептидов из PLBL2, измеряемых с помощью LC-MS/MS
(SEQ ID NO: 31)
(SEQ ID NO: 32)
(SEQ ID NO: 33)
(SEQ ID NO: 34)
[0100] ПРИМЕР 2. Улучшенный процесс очистки для снижения содержания PLBL2 хомячка
[0101] Для обеспечения раннего этапа клинических испытаний был разработан процесс очистки для анти-IL13 MAb (лебрикизумаб), продуцируемого CHO, который называется в настоящем документе "Исходный процесс". В Исходном процессе используются следующие хроматографические стадии в следующем порядке: аффинная хроматография на белке A (MABSELECT SURETM), за которой следует катионообменная хроматография (POROS® HS) и далее - ионообменная хроматография (Q SEPHAROSETM Fast Flow). Были включены дополнительные стадии инактивации и фильтрации вирусов и конечная стадия ультрафильтрации-диафильтрации (UFDF). Конечный продукт (лекарственное вещество) получали в виде лекарственной формы в концентрации 125 мг/мл в 20 мМ ацетате гистидина с 6% сахарозы, 0,03% полисорбата 20, pH 5,7.
Используя анализ ELISA на общие CHOP (описан в Примере 1 выше), для внутрипроизводственных промежуточных продуктов и лекарственного вещества, очищенного в соответствии с Исходным процессом, мы обнаружили нетипичную зависимость от разведения, характеризующуюся > 20% коэффициентом вариации внутри нормализованных серий разведений образцов. Эта зависимость от разведения проиллюстрирована данными, представленными в Таблице 3, в которых каждому последующему двухкратному разведению продукта анти-IL13 MAb соответствовали более высокие уровни CHOP (выражены в ppm), как показано с помощью ELISA на общие CHOP. Используя чувствительные аналитические способы, такие как LC-MS/MS, мы определили, что причиной такой нетипичной зависимости от разведения являлись CHOP единственного вида или HCP. В частности, мы установили, что причиной такой зависимости от разведения, наблюдавшейся в анализе ELISA на общие CHOP, был избыток антигена. Дальнейшее исследование позволило нам определить, что HCP единственного вида представляет собой фосфолипаза B-подобный фермент 2 хомячка (PLBL2). Разбавляя образцы продукта до предела количественного определения в анализе (LOQ), мы смогли оценить уровень PLBL2 в клинических партиях лебрикизумаба, очищенного с использованием Исходного процесса, и определить, что уровень присутствующего в них PLBL2 составлял более 300 ppm (300 нг/мг) и выше.
Таблица 3. Разведение продукта и уровни CHOP
Этот наблюдаемый уровень примесей (> 300 ppm) CHOP единственного вида считается нежелательным в продуктах MAb, предназначенных для клинического и/или терапевтического применения человеком, в особенности, на поздней стадии клинических испытаний и позже. Например, такие уровни могут быть иммуногенными при введении человеческим субъектам, как описано в Примере 3.
Соответственно, мы исследовали различные модификации Исходного процесса, как кратко изложено ниже. На основании результатов этих исследований мы разработали улучшенный процесс очистки, подробно описанный ниже и называемый в настоящем документе "Улучшенным процессом". В результате применения Улучшенного процесса получают очищенный продукт анти-IL13 MAb (лебрикизумаб), содержащий существенно сниженные уровни PLBL2.
Попытки модифицирования процесса очистки для снижения уровня PLBL2 включали способы, независимые от Исходного процесса, в том числе осаждение, тестирование различных добавок к HCCF, дополнительные промывки колонки, хроматографию гидрофобных взаимодействий и комбинированную хроматографию. Для контроля эффективности каждой из исследуемых модификаций для снижения общего содержания CHOP и/или уровней PLBL2 использовали один или несколько анализов, описанных в Примере 1. Различные исследуемые модификации описаны ниже.
Осаждение CHOP каприловой кислотой в HCCF и пуле после белка A
Осаждение каприловой кислотой было описано ранее, включая его применение в промышленном получении моноклональных антител (Wang et al., BioPharm International; Downstream Processing 2010, p4-10, Oct2009; Brodsky et al., Biotechnology and Bioengineering, 109(10):2589, 2012) для селективного осаждения примесей от целевых белков. Каприловая кислота, также известная как октановая кислота, представляет собой насыщенную жирную кислоту с восемью атомами углерода (формула CH3(CH2)6COOH). Были проведены исследования с анти-IL13 MAb с целью определения того, будет ли осаждение собранной культуральной жидкости (HCCF) или пула, полученного с использованием белка A, каприловой кислотой приводить к снижению CHOP и/или снижению зависимости от разведения в ELISA на общие CHOP.
В качестве исходного источника анти-IL13 MAb для этих исследований использовали HCCF и пул после белка A из 1000 л собранной жидкости. 1% (объем/объем) каприловой кислоты добавляли к HCCF и разные концентрации каприловой кислоты (0% - 3% объем/объем) добавляли к пулам, полученным с использованием белка A, при pH 4,5 или pH 5,0. Образцы перемешивали в течение ≥ 5 часов при температуре окружающей среды, фильтровали через фильтр 0,2 мкм и разбавляли раствором для разведения, предназначенным для проведения ELISA на общие CHOP, для обнаружения и количесвенной оценки с помощью ELISA на общие CHOP. Титр анти-IL13 MAb в HCCF до и после обработки каприловой кислотой определяли с помощью титрационного HPLC анализа, который проводили в соответствии со стандартными способами, известными в данной области техники.
Обработка HCCF 1% объем/объем каприловой кислоты приводила к снижению CHOP приблизительно в 5 раз, и выход анти-IL13 MAb составлял 91%. Когда пулы после белка A обрабатывали различными концентрациями каприловой кислоты в диапазоне 0 - 3% объем/объем, мы наблюдали уменьшение выхода > 20% при pH 5,0 и не наблюдали уменьшения выхода при pH 4,5. Когда мы оценивали общие CHOP в этих пулах после белка A, обработанных каприловой кислотой, мы обнаружили 2 кратное - 3 кратное снижение CHOP (Фиг. 1A и B). Тем не менее, как также показано на Фиг. 1A и B, зависимость от разведения все еще будет наблюдаться для каждого тестируемого условия, что указывает на то, что осаждение каприловой кислотой не было эффективным для решения проблемы зависимости от разведения, наблюдаемой при проведении ELISA на общие CHOP, и, следовательно, также не будет эффективным для снижения уровней PLBL2 в этом продукте.
Добавки к HCCF
В предыдущей работе Sisodiya et al., Biotech J. 7:1233 (2012) было показано, что добавление, например, гуанидин гидрохлорида или хлорида натрия к HCCF может приводить к снижению уровня CHOP в пулах, очищенных далее на белке A. Поскольку также было показано, что аргинин снижает уровни CHOP, если использовать его для промывки колонок с белком A (Millipore Technical Bulletin, Lit. No. TB1024EN00, Rev. A, December, 2005; Millipore Technical Bulletin, Lit. No. 1026EN00, July, 2006, доступен на сайте www.Millipore.com), мы включили его в качестве добавки к HCCF. Различные соли, хаотропные агенты и каприловую кислоту добавляли к анти-IL13 MAb HCCF для оценки эффективности каждого из них для снижения взаимодействия продукта и CHOP в процессе связывания продукта с MABSELECT SURETM (MSS) при проведении хроматографии на белке A. Тестировали следующие добавки к HCCF: 0,6M гуанидин, 0,6M аргинин, 0,6M NaCl, фосфатно-солевой буферный раствор и 1% каприловую кислоту.
Образцы, обработанные каждой из добавок к HCCF, подвергали хроматографии на белке A на MSS. pH пулов, полученных с использованием белка A, доводили до значения 4,9 и далее очищали с помощью стадии катионообменной хроматографии на POROS® HS в условиях, указанных в Исходном процессе. Пулы после белка A и пулы после POROS® HS разбавляли и исследовали с помощью ELISA на общие CHOP. Пулы после белка A с доведенным рН также тестировали на SEC-HPLC в соответствии с известными в данной области техники способами оценки % агрегатов, % вариантов и тому подобного.
Выходы на MABSELECT SURETM были несколько ниже для экспериментов, в которых к HCCF добавляли гуанидин или аргинин. Среди всех протестированных добавок к HCCF гуанидин и аргинин были наиболее эффективными для заметного снижения уровней CHOP (смотрите Таблицу 4) и, как оказалось, снижали зависимость от разведения для пулов, полученных с использованием белка A (данные не показаны). Последующая обработка пулов, полученных с использованием белка A, на POROS® HS, тем не менее, показала, что зависимость от разведения, наблюдаемая в ELISA на CHOP, сохраняется для соответствующих пулов, полученных с использованием POROS®, как показано на Фиг. 2. Соответственно, данные демонстрируют, что добавление гуанидина или аргинина к HCCF не эффективно для снижения уровней PLBL2 в этом продукте.
Таблица 4. Добавки к HCCF и их влияние на CHOP
Промывка колонки с белком A (MABSELECT SURETM)
Мы наблюдали, что при проведении хроматографии на белке A в более ранних фракциях с MABSELECT SURETM (MSS), содержащих продукт, элюировалось больше зависимого от развдения CHOP. Это позволило предположить, что дополнительная стадия промывки MSS перед элюцией может привести к снижению CHOP/PLBL2. Была протестирована способность нескольких вариантов промывок MSS снижать уровни CHOP/PLBL2 в пулах после белка A. Для этого исследования в качестве материала для нанесения был использован пул очищенного анти-IL13 MAb после UFDF. Пул после UFDF разбавляли до 1,7 мг/мл (приблизительный титр в HCCF) и наносили на MSS с содержанием смолы 29 г/л. Были протестированы различные промывочные растворы, например, 0,5M аргинин с pH 8,5, 0,5M аргинин с pH 9,5 с добавлением и без добавления 1% полисорбата 20, 0,5M TMAC с pH 7,1, 25 мМ MOPS с pH 7,1 действие которых сравнивали с промывочным раствором с высокой концентрацией соли с pH 7,0. Продукт элюировали в кислых условиях (pH 2,8) и фракции объединяли, начиная с 0,5 OD (A280), и до общего объема, равного 2,4 объема колонки. Каждый пул после доведения pH разбавляли и анализировали, используя ELISA на общие CHOP. Обобщающие результаты сводятся к тому, что ни одно из условий промывок не приводило к удовлетворительному снижению уровня CHOP/PLBL2 или зависимости от разведения в ELISA на общие CHOP. Таким образом, представляется маловероятным, чтобы мы смогли подобрать такие условия промывки колонки с белком A, которые были бы эффективными для снижения уровней PLBL2 в этом продукте анти-IL13 MAb, и мы не проводили дальнейшие исследования в этом направлении.
Промывка катионообменной колонки (POROS® HS)
Основываясь на теоретических вычислениях с использованием аминокислотной последовательности анти-IL13 MAb и примеси PLBL2, мы оценили, что pI PLBL2 составляет приблизительно 6,0, и она аналогична таковой для анти-IL13 MAb (pI 6,1). Мы также рассчитали, что разница в суммарном заряде между анти-IL13 MAb и PLBL2 будет значительной при ≤ pH 4 и ≥ pH 10. В связи с этим, мы тестировали раличные промывочные растворы с низким pH на стадии катионообменной хроматографии с POROS® HS в Исходном процессе для определения того, будут ли они эффективны для селективного снижения уровня общих CHOP и/или PLBL2 и зависимости от разведения. Были протестированы следующие промывочные растворы при pH 4: (i) ацетатный градиент, 300 мМ - 1,000 мМ в объеме 20 объемов колонки (CV); (ii) цитратный градиент, 100 мМ - 500 мМ в объеме 20 CV; (iii) стадия промывки 260 мМ цитратом; и (iv) градиент аргинина до 15 мСм/см (единица измерения проводимости) в объеме 20 CV.
Результаты показали, что анти-IL13 MAb и CHOP не удалось элюировать при pH 4 ацетатным градиентом до тестируемой концентрации соли, равной 1M. Увеличение количества цитрата или ацетата приводило к тому, что продукт становился нерастворим и выпадал в осадок. Все промывочные раствторы при pH 4 давали низкие выходы на стадии с POROS® HS, и ни один из промывочных растворов не приводил к значительному снижению зависимости CHOP от разведения. Соответственно, применение промывочных растворов с низким pH для промывки катионообменной колонки не было эффективно для снижения уровней PLBL2 в этом продукте.
Гидроксиапатитовая смола и смола CAPTOTM Adhere
Макропористая смола на основе керамического гидроксиапатита (CHT) I типа, 40 мкм, (BioRad) состоит из фосфата кальция (Ca5(PO4)3OH)2, организованного в повторяющиеся гексагональные структуры. На смоле присутствуют два различных сайта связывания: C-сайты с набором 5 дуплетов ионов кальция и P-сайты, содержащие триплеты фосфатов, содержащие пары -OH. Эта смола обладает комбинированными свойствами, и было показано, что с помощью нее можно отделять сложные примеси, такие как агрегаты (P. Gagnon, New Biotechnology 25(5):287 (2009)).
Для определения начальных условий проведения хроматографии на колонке CHT, мы осуществили высокопроизводительный роботизированный скрининг смолы CHT I типа, 40 мкм, тестируя ее в диапазоне pH 6,5 - 8,0 и используя различные концентрации хлорида натрия и фосфата натрия для элюции. Такой высокопроизводительный автоматизированный скрининг был описан ранее, например, в Wensel et al., Biotechnol. Bioeng. 100:839 (2008). Образцы после такого скрининга тестировали с помощью ELISA на общие CHOP.
CAPTOTM Adhere (GE Healthcare) представляет собой комбинированную смолу, которая обладает как ионными, так и гидрофобными свойствами. Основная матрица представляет собой твердую агарозу, и лиганд представляет собой N-бензил-N-метилэтаноламин. Способность этой смолы снижать уровни общих CHOP и/или PLBL2 оценивали сначала с помощью высокопроизводительного скрининга, а далее в соответствующих условиях на колонке.
Первоначальные исследования для определения начальных условий проведения хроматографии на колонке CAPTOTM Adhere проводили с использованием высокопроизводительного роботизированного скрининга, аналогичного описанному выше, для тестирования связывания анти-IL13 MAb с CAPTOTM Adhere при двух значениях плотности нанесения (5 г/л смолы и 40 г/л смолы). Также тестировали соли и диапазоны pH: 25 мМ - 200 мМ ацетата натрия и pH 4,0 - 6,5. Материал для нанесения представлял собой пул после UFDF, полученный в Исходном процессе, содержащий приблизительно 200 ppm общих CHOP при LOQ по данным ELISA на общие CHOP. Образцы несвязавшегося материала (проскок) на CAPTOTM Adhere разбавляли и анализировали с использованием ELISA на общие CHOP.
Результаты были следующими. В случае хроматографии CHT ни одно из протестированных условий по существу не приводило к снижению уровня общих CHOP или PLBL2 или не влияло на зависимость от разведения. Кроме того, выходы были низкими, и не достигалась очистка высокомолекулярных соединений. Для хроматографии на CAPTOTM Adhere выходы были низкими, и для проанализированных веществ была показана зависимость от разведения в ELISA на общие CHOP. Соответственно, применение CHT и смолы CAPTOTM Adhere далее не исследовалось, поскольку было ясно, что мы с малой долей вероятности подберем такие условия применения смолы, которые будут эффективны для снижения уровней PLBL2 в этом продукте анти-IL13 MAb.
Смолы и мембраны для хроматографии гидрофобных взаимодействий
Сначала мы протестировали мембранный адсорбер для HIC, называемый Sartobind и произведенный Sartorius. Sartobind представляет собой основную матрицу из регенерированной целлюлозы с ковалентно связанными гидрофобными фенильными лигандными группами.
Тестируемая мембрана представляла собой устройство Sartobind HIC объемом 3 мл (высота слоя 8 мм). Мы довели содержание фосфата калия в пуле POROS® HS, полученном в Исходном процессе, до 0,55 M, pH 7,0, и использовали скорость потока, равную 10 мл/мин. Продукт элюировали 0,55 M фосфатом калия с pH 7,0 (собирали в виде несвязавшихся фракций в 3 мл фракции).
Мы наблюдали, что анти-IL13 MAb стали опалесцирующими и мутными при кондиционировании до содержания фосфата калия 0,55 M, что потребовало дополнительной стадии фильтрации через 0,2 мкм фильтр. Результаты продемонстрировали снижение уровня общих CHOP, тем не менее, для оставшихся CHOP все еще наблюдалась зависимость от разведения в ELISA на общие CHOP. Дальнейшее изучение использования этой мембраны не проводили, поскольку нам представлялось маловероятным, что мы найдем условия, эффективные для снижения уровней PLBL2 в этом продукте.
Далее, для оценки нескольких разных смол для HIC мы использовали высокопроизводительный скрининг. Смолы OCTYL-SEPHAROSE® Fast Flow (FF), BUTYL-SEPHAROSE® 4 Fast Flow, PHENYL SEPHAROSETM 6 Fast Flow (high sub) и PHENYL SEPHAROSETM 6 Fast Flow (low sub) были получены от GE Healthcare. Были выбраны эти четыре смолы, поскольку они покрывали широкий диапазон гидрофобности (OCTYL-SEPHAROSE® Fast Flow является наименее гидрофобной, далее следует PHENYL SEPHAROSETM 6 Fast Flow (low sub) и BUTYL-SEPHAROSE® 4 Fast Flow, наиболее гидрофобной является PHENYL SEPHAROSETM 6 Fast Flow (high sub). Мы протестировали эффективность нескольких комбинаций pH и концентраций солей для снижения уровня PLBL2 в препаратах анти-IL13 MAb. Препарат анти-IL13 MAb, использованный для экспериментов со смолой HIC, представлял собой пул после UFDF при осуществлении Исходного процесса. Концентрация анти-IL13 MAb составляла 180 мг/мл и плотность нанесения составляла 40 мг антитела/мл смолы. Мы тестировали pH 5,5 (25 мМ ацетат натрия), pH 6,0 (25 мМ MES), pH 7,0 (25 мМ MOPS) и pH 8,0 (25 мМ Tris) и концентрации сульфата натрия в диапазоне между 0 мМ и 400 мМ. Для каждого тестируемого условия собирали образцы проскока, разбавляли и тестировали их с помощью анализа ELISA на общие CHOP.
Результаты показаны на Фиг. 3A-D. С увеличением концентрации соли мы наблюдали снижение содержания общих CHOP в проскоке для каждой смолы. Для смолы OCTYL-SEPHAROSE® Fast Flow (Фиг. 3A) были продемонстрированы наиболее высокие уровни общих CHOP, применение смолы PHENYL SEPHAROSETM 6 Fast Flow (high sub) приводило к снижению уровней уровня общих CHOP до очень низких значений, даже в случае более низких концентраций соли (Фиг. 3D), а для смол PHENYL SEPHAROSETM 6 Fast Flow (low sub) и BUTYL-SEPHAROSE® Fast Flow были показаны промежуточные уровни общих CHOP. Интересно, что также наблюдался минимальный эффект pH на удаление CHOP при применении любой из смол, за исключением PHENYL SEPHAROSETM 6 Fast Flow (high sub) в условиях низкой концентрации соли (Фиг. 3D). Для этой смолы в условиях низкой концентрации соли более высокие значения pH приводили к большему содержанию CHOP во фракции проскока (Фиг. 3D). На основании этих результатов, применение PHENYL SEPHAROSETM 6 Fast Flow (high sub) представлялось перспективным, и она была выбрана для проведения дальнейших исследований, которые включали применение колонки либо в режиме связывания и элюирования, либо в режиме сбора проскока.
Для применения HIC с применением смолы PHENYL SEPHAROSETM 6 Fast Flow (high sub) в режиме связывания и элюирования необходимо кондиционировать анти-IL13 MAb перед нанесением солью, чтобы обеспечить связывание антитела со смолой. Увеличение концентрации соли приводит к увеличению динамической емкости связывания (мг анти-IL13/мл смолы) для нанесения продукта на смолу. Но с увеличением концентрации соли в продукте мы наблюдали помутнение и формирование высокомолекулярных соединений (HMW), в частности, в комбинации с низким pH.
Как упоминалось выше, PHENYL SEPHAROSETM 6 Fast Flow (high sub) также можно использовать в режиме сбора проскока, и такое применение также требует меньше соли для кондиционирования перед нанесением. С точки зрения, например, качества и стабильности продукта предпочтительным будет являться продукт с меньшей мутностью и меньшим содержанием HMW, и меньшей концентрацией соли, требуемой для кондиционирования перед нанесением. Соответственно, мы провели процесс оптимизации применения смолы PHENYL SEPHAROSETM 6 Fast Flow (high sub) в режиме сбора проскока.
Для оптимизации процесса мы исследовали многочисленные параметры хроматографии на колонке для HIC, включая концентрацию при нанесении, pH при нанесении, молярность соли при нанесении, плотность нанесения на смолу, высоту слоя, скорость потока, температуру, pH уравновешивающего буфера и молярность. Для этих экспериментов мы контролировали содержание общих CHOP с помощью ELISA на общие CHOP, а также содержание PLBL2 с помощью LC-MS/MS. Некоторые примеры данных приведены в Таблице 5. Данные в Таблице 5 демонстрируют, что колонка для HIC, используемая в указанных условиях в режиме сбора проскока была эффективной для существенного снижения уровней PLBL2 по сравнению с высокими уровнями в пуле после белка A. Уровни PLBL2 после HIC были снижены в несколько сотен раз по сравнению с уровнями в пуле после белка A.
Таблица 5. Уровни общих CHOP и уровни PLBL2 при различных условиях применения колонки для HIC
(высота слоя, скорость потока)
Используя LC-MS/MS анализ на PLBL2 и другие типичные анализы качества продукта (например, SE-HPLC, CE-SDS, iCIEF) для выбора параметров процесса, оценивая характеристики качества продукта и снижение уровня PLBL2, мы установили, что следующие условия являются предпочтительными для осуществления хроматографии на колонке для HIC: уравновешивающий и промывочный буфер: 50 мМ ацетат натрия, pH 5,0; плотность нанесения целевого вещества: 100 г/л, скорость потока: 150 см/ч, 22°C ± 3°C. Некоторые небольшие вариации этих условий также могут быть желательны, например, 25°C ± 3°C или 27°C ± 3°C. Оптическую плотность (OD) контролировали по поглощению при 280 нм (A280), и пул (т.е., проскок) собирали между 0,5 OD и 1,5 OD или после промывки 8 объемами колонки.
Как упоминалось выше, Исходный процесс представлял собой аффинную хроматографию на белке A (MABSELECT SURETM), далее катионообменную хроматографию (POROS® HS) с последующей анионообменной хроматографией (Q SEPHAROSETM Fast Flow). После разработки процесса, приводящего к снижению уровней PLBL2, как описано выше, мы решили ввести в процесс соответствующие измененения. Соответственно, мы исследовали следующие варианты: добавление колонки HIC к Исходному процессу (таким образом, процесс включал применение четырех колонок), замену колонки HIC на колонку CEX, либо на колонку AEX, и в конце мы исследовали порядок колонок. Мы обнаружили, что процесс с применением трех колонок, аффинной хроматографии на белке A (MABSELECT SURETM), далее анионообменной хроматографии (Q SEPHAROSETM Fast Flow) с последующей HIC в режиме сбора проскока (PHENYL SEPHAROSETM 6 Fast Flow (high sub)) был наиболее удобным и наиболее эффективным для снижения уровня PLBL2 в конечном лекарственном веществе. Этот процесс с применением трех колонок подробно описан ниже.
Первая стадия аффинной хроматографии представляла собой процесс связывания и элюирования с применением смолы MABSELECT SURETM. После уравновешивания колонки (25 мМ хлорид натрия, 25 мМ Tris, pH 7,7), HCCF наносили на колонку и промывали уравновешивающим буфером и промывочным буфером с высокой концентрацией соли с pH 7,0. Анти-IL13 MAb элюировали с колонки в кислых условиях (pH 2,8).
Вторую стадию анионообменной хроматографии проводили в режиме связывания и элюирования с применением смолы Q SEPHAROSETM Fast Flow (QSFF). После уравновешивания колонки (50 мМ Tris, pH 8,0), pH пула анти-IL13 с колонки MABSELECT SURETM доводили до значения 8,05 и наносили пул на колонку. Колонку промывали (50 мМ Tris, pH 8,0) и анти-IL13 MAb элюировали с колонки 85 мМ хлоридом натрия, 50 мМ Tris с pH 8,0.
Третью и последнюю стадию хроматографии гидрофобных взаимодействий проводили в режиме сбора проскока с применением смолы PHENYL SEPHAROSETM 6 Fast Flow (High Sub). После уравновешивания колонки (50 мМ ацетат натрия с pH 5,0) pH пула анти-IL13 с колонки QSFF доводили до значения 5,0 и наносили пул на колонку. Анти-IL13 MAb проходило через колонку, и колонку дополнительно промывали уравновешивающим буфером (50 мМ ацетат натрия с pH 5,0). Анти-IL13 MAb собирали, основываясь на измерении A280, и объединяли фракции между 0,5 и 1,5 OD или фракции в объеме максимум 8 объемов колонки.
Как и в случае Исходного процесса, были включены дополнительные стадии инактивации и фильтрации вирусов и конечная стадия ультрафильтрации-диафильтрации (UFDF). Конечный продукт (лекарственное вещество) было получено в виде лекарственной формы в концентрации 125 мг/мл в 20 мМ ацетате гистидина с 6% сахарозы, 0,03% полисорбата 20, pH 5,7.
Сравнение Исходного процесса с Улучшенным процессом по содержанию общих CHOP и PLBL2, измеренному с помощью ELISA на общие CHOP и моноклонального ELISA на PLBL2, соответственно, приведено в Таблицах 6 (Исходный процесс) и 7 (Улучшенный процесс). Данные в Таблице 6 ясно демонстрируют, что в результате применения Исходного процесса получается очищенный продукт (пул после UFDF), содержащий высокие уровни общих CHOP (179, 310 и 189 нг/мг в трех разных экспериментах) и высокие уровни PLBL2 (242, 328 и 273 нг/мг в трех разных экспериментах), тогда как данные в Таблице 7 ясно демонстрируют, что Улучшенный процесс был вполне эффективным для получения очищенного продукта со значительно сниженными уровнями общих CHOP (1,1, < 0,9, 2,8 и 3,4 нг/мг в четырех разных экспериментах) и значительно сниженными уровнями PLBL2 (0,21, 0,42, 0,35 и 0,24 нг/мг в четырех разных экспериментах). С учетом данных, приведенных выше, данные в Таблице 7 демонстрируют, что проведение хроматографии на колонке для HIC в условиях, описанных выше, оказалось особенно эффективным для снижения уровней общих CHOP и PLBL2 в препаратах анти-IL13 MAb.
Таблица 6. Уровни CHOP и PLBL2 на различных стадиях Исходного процесса очистки анти-IL13 MAb
Таблица 7. Уровни CHOP и PLBL2 на различных стадиях Улучшенного процесса очистки анти-IL13 MAb
В итоге, столкнувшись с проблемой нелинейной зависмости от разведения, связанной с высокими уровнями CHOP единственного вида в очищенных препаратах анти-IL13 MAb, мы сначала идентифицировали CHOP единственного вида как PLBL2 хомячка, примесь, которая не была ранее описана в препаратах рекомбинантных белков, получаемых из клеток CHO. Далее мы определили условия очистки, эффективные для снижения уровней PLBL2 в препаратах анти-IL13 MAb. И наконец, мы исследовали эти условия очистки в рамках общего процесса очистки, улучшенного по сравнению с исходным процессом очистки анти-IL13 MAb. В Улучшенном процессе используется колонка для HIC в режиме сбора проскока для снижения уровней PLBL2 в комбинации со стадией аффинной хроматографии и стадией анионообменной хроматографии. Мы показали, что Улучшенный процесс является надежным и эффективным способом значительного снижения уровней PLBL2 хомячка в препаратах анти-IL13 MAb. Мы показали, что Улучшенный процесс вопроизводимо снижает уровни PLBL2 приблизительно в 1000 раз по сравнению с Исходным процессом. Такое снижение уровней PLBL2 важно для получения очищенного продукта анти-IL13 MAb, подходящего для терапевтического применения пациентами на поздней стадии клинических испытаний и далее.
Процесс очистки для снижения уровня PLBL2 хомячка в препаратах анти-Abeta антител
Далее мы решили оценить, будут ли способы очистки, описанные выше, в частности, способы с применением колонки для HIC на конечной стадии хроматографии, также эффективны для снижения уровней PLBL2 в препаратах других антител. Для этого эксперимента мы выбрали анти-Abeta антитело, полученное в клетках CHO. Примеры анти-Abeta антител и способы получения таких антител были описаны ранее, например, в WO2008011348, WO2007068429, WO2001062801 и WO2004071408. В этих конкретных экспериментах мы использовали анти-Abeta антитело, называемое кренезумаб. Как описано для анти-IL13 MAb, мы исследовали различные смолы и буферы для второй колонки после аффинной колонки с белком A, и мы исследовали различные буферы и условия хроматографии для колонки HIC, чтобы выбрать те смолы, буферы и условия, которые являются оптимальными с точки зрения качества и стабильности продукта анти-Abeta, а также с точки зрения удаления PLBL2 хомячка.
Мы обнаружили, что процесс с применением трех колонок, включающий аффинную хроматографию на белке A (MABSELECT SURETM), далее применение комбинированной смолы (CAPTOTM Adhere) с последующей HIC в режиме сбора проскока (PHENYL SEPHAROSETM 6 Fast Flow (high sub)), был удобен и эффективен для снижения уровня PLBL2 в конечном лекарственном веществе. Этот процесс с применением трех колонок подробно описан ниже.
Первая стадия аффинной хроматографии представляла собой процесс связывания и элюирования с применением смолы MABSELECT SURETM, аналогичный описанному выше для анти-IL13 MAb.
Вторую стадию комбинированной хроматографии проводили в режиме сбора проскока с применением смолы CAPTOTM Adhere. После уравновешивания колонки (20 мМ MES, 150 мМ ацетат натрия, pH 6,25), pH пула анти-Abeta с колонки MABSELECT SURETM доводили до значения 6,25 и наносили пул на колонку. Фракции объединяли, начиная с 0,5 OD в ходе фазы нанесения. После завершения нанесения колонку промывали уравновешивающим буфером (20 мМ MES, 150 мМ ацетат натрия, pH 6,25) в объеме, равном 5 объемам колонки (CV), и все 5 CV также собирали.
Третью и последнюю стадию хроматографии гидрофобных взаимодействий проводили в режиме сбора проскока с применением смолы PHENYL SEPHAROSETM 6 Fast Flow (High Sub). После уравновешивания колонки (50 мМ ацетат натрия с pH 5,0) pH пула анти-Abeta после колонки CAPTOTM Adhere доводили до значения 5,0 и наносили пул на колонку. Анти-Abeta MAb проходило через колонку, и колонку дополнительно промывали уравновешивающим буфером (150 мМ ацетат натрия с pH 5,0). Пул анти-Abeta MAb собирали в ходе фазы нанесения, основываясь на A280, начиная объединять фракции с 0,5 OD. Колонку промывали 10 CV уравновешивающего буфера (150 мМ ацетат натрия с pH 5,0), и все 10 CV также собирали. Как и в случае анти-IL13 MAb, были включены дополнительные стадии инактивации и фильтрации вирусов и конечная стадия ультрафильтрации-диафильтрации (UFDF).
Результаты применения указанного выше процесса в ходее четырех разных экспериментов по очистке приведены в Таблице 8 ниже.
Таблица 8. Уровни PLBL2 на различных стадиях очистки анти-Abeta MAb с применением HIC
(нг/мг, по данным ELISA)
Результаты, приведенные в Таблице 8, демонстрируют, что применение смолы для HIC на конечной стадии хроматографии приводит к эффективному снижению оставшихся уровней PLBL2 в препарате анти-Abeta MAb до количества, сопоставимого с количеством, наблюдавшимся для анти-IL13 MAb. Желаемые результаты с точки зрения выхода продукта и снижения уровня PLBL2 получали уже при значении плотности нанесения, равном 300 г/л, однако при снижении плотности нанесения на колонку для HIC с 300 г/л до 100 г/л наблюдали дальнейшее снижение уровня остаточного PLBL2.
Мы также исследовали два других условия для стадии хроматографии HIC, pH при нанесении и молярность сульфата при нанесении. В рамках этих экспериментов мы начали с пула после CAPTOTM Adhere, содержащего 51 нг/мг PLBL2 (измерено с помощью ELISA), 15 мМ ацетата натрия, pH 5,5. Мы довели pH при нанесении и молярность сульфата при нанесении до значений, представленных в Таблице 9 ниже, используя концентрированные растворы, содержащие 0 мМ сульфата натрия или 800 мМ сульфата натрия, с разными значениями pH. Мы протестировали каждое значение pH при нанесении, указанное в Таблице 9, в условиях низкой молярности сульфата (0 мМ) и высокой молярности сульфата (240 мМ). Каждое условие мы тестировали при значении плотности нанесения, равном 60 г/л. Результаты, представленные в Таблице 9, демонстрируют, что уменьшение pH при нанесении до pH 4 или pH 5 или увеличение молярности сульфата при нанесении (до 240 мМ сульфата) были эффективными для снижения уровней PLBL2 в конечном пуле после HIC. Комбинация pH 4,0 и 240 мМ сульфата во время нанесения была особенно эффективна для минимизации количества оставшегося PLBL2 в пуле после HIC.
Таблица 9. Уровни PLBL2 в пуле после HIC для разных значений pH при нанесении и молярности сульфата при нанесении
(0 мМ)
(240 мМ)
Соответственно, применение смолы для HIC на конечной стадии хроматографии в процессе очистки полипептидов, поученных в клетках CHO, таких как анти-IL13 MAb и анти-Abeta MAb, описанные в настоящем документе, приводит к эффективному снижению остаточного количества PLBL2 хомячка до очень низких уровней, например, до 1 нг/мг или меньше, в пуле после HIC.
Процесс очистки для снижения уровня PLBL2 хомячка в препаратах антител IgG1
Далее мы оценили, будут ли способы очистки, описанные выше для препаратов анти-IL13 и анти-Abeta антител IgG4, в частности, способы с применением колонки для HIC на конечной стадии хроматографии, также эффективны для снижения уровней PLBL2 в препаратах антител IgG1. Для этих экспериментов мы выбрали анти-IL17 A/F антитело, которое представляет собой антитело IgG1 и которое получено в клетках CHO. Примеры анти-IL17 A/F антител и способы получения таких антител были описаны ранее, например, в WO 2009136286 и патенте США номер 8,715,669. Как описано для анти-IL13 и анти-Abeta MAb, мы исследовали различные смолы (в частности, PHENYL SEPHAROSETM FF [low sub] и PHENYL SEPHAROSETM FF [high sub]) и буферы (в частности, 50 мМ ацетат натрия, pH 5,5, и 50 мМ Tris, 85 мМ, ацетат натрия, pH 8,0) для колонки HIC, чтобы выбрать те смолы и буферы, которые являются оптимальными с точки зрения качества и стабильности продукта анти-IL17 A/F, а также с точки зрения удаления PLBL2 хомячка.
Мы обнаружили, что процесс с применением трех колонок, включающий аффинную хроматографию на белке A (MABSELECT SURETM), далее катионообменную хроматографию (POROS® 50HS) в режиме связывания и элюирования и HIC (PHENYL SEPHAROSETM 6 Fast Flow (high sub)) в режиме сбора проскока, был удобен и эффективен для снижения уровня PLBL2 в конечном лекарственном веществе. Этот процесс с применением трех колонок подробно описан ниже.
Первая стадия аффинной хроматографии представляла собой процесс связывания и элюирования с применением смолы MABSELECT SURETM, аналогичный описанному выше для анти-IL13 MAb и анти-Abeta MAb.
Вторую стадию катионообменной хроматографии проводили в режиме связывания и элюирования с применением смолы POROS® 50HS. После уравновешивания колонки (40 мМ ацетат натрия, pH 5,5), pH пула анти-IL17 A/F после MABSELECT SURETM доводили до значения pH 5,0 и пул наносили на колонку. Колонку промывали (40 мМ ацетатом натрия, pH 5,5) и далее анти-IL17 A/F антитело элюировали с колонки градиентом ацетата натрия от 40 до 400 мМ, pH 5,5. Фракции объединяли, основываясь на A280, начиная с ≥ 0,5 OD и заканчивая при ≤ 2,0 OD в течение фазы градиентной элюции.
Третью и последнюю стадию хроматографии гидрофобных взаимодействий проводили в режиме сбора проскока с применением смолы PHENYL SEPHAROSETM 6 Fast Flow (High Sub). После уравновешивания колонки (50 мМ ацетат натрия с pH 5,5) пул анти-IL17 A/F после колонки POROS® 50HS непосредственно наносили на колонку без доведения pH. Анти-IL17 A/F MAb проходило через колонку. Фракции анти-IL17 A/F MAb объединяли, основываясь на A280, начиная в фазе нанесения при ≥ 0,5 OD. Колонку промывали 10 CV уравновешивающего буфера (50 мМ ацетат натрия, pH 5,5) и элюируемые фракции собирали в течение фазы промывки, и объединяли при ≤ 1,0 OD.
Результаты применения указанного выше процесса в ходе одного эксперимента очистки приведены в Таблице 10 ниже.
Таблица 10. Уровни PLBL2 на различных стадиях очистки анти-IL17 A/F MAb с применением HIC
Результаты, приведенные в Таблице 10, демонстрируют, что применение смолы HIC на конечной стадии хроматографии приводит к эффективному снижению остаточных уровней PLBL2 в препарате анти-IL17 A/F MAb (IgG1) до количества, сопоставимого с количеством, наблюдаемым для анти-IL13 и анти-Abeta MAb (IgG4).
Анти-CMV Антитело
В дополнение к тестированию анти-IL17 A/F, мы протестировали другое MAb IgG1, анти-CMV-MSL антитело, которое также было получено в клетках CHO. Примеры анти-CMV антител, включая анти-CMV-MSL, и способы получения таких антител были описаны ранее, например, в WO 2012047732.
Мы снова обнаружили, что процесс с применением трех колонок, включающий аффинную хроматографию на белке A (MABSELECT SURETM), далее применение катионообменной хроматографии (POROS® 50HS) в режиме связывания и элюирования и HIC (PHENYL SEPHAROSETM 6 Fast Flow (high sub)) в режиме сбора проскока, был удобен и эффективен для снижения уровня PLBL2 в конечном лекарственном веществе. Этот процесс с применением трех колонок подробно описан ниже.
Первая стадия аффинной хроматографии представляла собой процесс связывания и элюирования с применением смолы MABSELECT SURETM, аналогичный описанному выше для анти-IL13 MAb, анти-IL13, анти-Abeta и анти-IL17 A/F MAb.
Вторую стадию катионообменной хроматографии проводили в режиме связывания и элюирования с применением смолы POROS® 50HS. После уравновешивания колонки (40 мМ ацетат натрия, pH 5,5), pH пула анти-CMV-MSL после MABSELECT SURETM доводили до значения pH 5,0 и пул наносили на колонку. Колонку промывали (40 мМ ацетатом натрия, pH 5,5) и далее анти-CMV-MSL антитело элюировали с колонки градиентом ацетата натрия от 40 до 400 мМ, pH 5,5. Фракции объединяли, основываясь на A280, начиная с ≥ 0,5 OD и заканчивая при ≤ 1,0 OD в течение фазы градиентной элюции.
В этом конкретном экспериментестадию вирусной фильтрации осуществляли между стадиями катионообменной хроматографии и хроматографии гидрофобных взаимодействий с использованием Viresolve Pro в качестве фильтра и фильтра Fluorodyne UEDF в качестве предварительного фильтра.
Третью и последнюю стадию хроматографии гидрофобных взаимодействий проводили в режиме сбора проскока с применением смолы PHENYL SEPHAROSETM 6 Fast Flow (High Sub). После уравновешивания колонки (50 мМ ацетат натрия с pH 5,5) пул анти-CMV-MS после колонки POROS® 50HS непосредственно наносили на колонку без доведения pH. Анти-CMV-MSMAb проходило через колонку. Фракции анти-CMV-MS MAb объединяли, основываясь на A280, начиная в фазе нанесения при ≥ 0,5 OD. Колонку промывали 10 CV уравновешивающего буфера (50 мМ ацетат натрия, pH 5,5) и элюируемые фракции собирали в течение фазы промывки, и объединяли при ≤ 0,5 OD.
Результаты применения указанного выше процесса в ходе одного эксперимента очистки приведены в Таблице 11 ниже.
Таблица 11. Уровни PLBL2 на различных стадиях очистки анти-CMV-MSL MAb с помощью HIC
Результаты, приведенные в Таблице 11, демонстрируют, что применение смолы HIC на конечной стадии хроматографии приводит к эффективному снижению остаточных уровней PLBL2 в препарате анти-CMV-MSL MAb до количества, сопоставимого с количеством, наблюдаемым для анти-IL13, анти-Abeta и анти-IL17 A/F MAb. Соответственно, применение смолы HIC на конечной стадии хроматографии в процессе очистки полипептидов, поученных в клетках CHO, таких как анти-IL13 MAb и другие MAb, описанные в настоящем документе, приводит к эффективному снижению остаточного количества PLBL2 хомячка до очень низких уровней, например, до 1 нг/мг или меньше, в пуле после HIC. Таким образом, мы показали, что применение стадии хроматографии HIC, как описано в настоящем документе, для снижения уровней PLBL2, было так же эффективно для MAb IgG1, как и для MAb IgG4, что свидетельствует о применимости данного способа, в общем, для снижения уровней PLBL2 хомячка в препаратах рекомбинантных полипептидов.
ПРИМЕР 3. Оценка выработки человеческих антител против PLBL2 хомячка у пациентов, которым были введены композиции анти-IL13 MAb, содержащие разные количества PLBL2 хомячка
Для оценки потенциального влияния примеси PLBL2 CHO мы разработали анализ ELISA (анализ ELISA, где антитело играет роль мостика между иммобилизированным и меченым антигенами) для обнаружения антител к PLBL2 хомячка в человеческих субъектах, которые получали анти-IL13 MAb, лебрикизумаб. Образцы сыворотки крови от пациентов, принимавших участие в различных клинических исследованиях лебрикизумаба, были проанализированы на наличие антител против PLBL2 хомячка до введения дозы и после введения дозы, а также были проанализированы образцы сыворотки крови от пациентов, получавших плацебо. Детали клинических исследований были описаны ранее (WO 2012/083132, Corren et al., N Engl J Med 365:1088-98 (2011)), и только наиболее значимые детали этих исследований приведены ниже.
В анализе ELISA, где антитело играет роль мостика между иммобилизированным и меченым антигенами, который был разработан и валидирован для обнаружения антител к PLBL2 хомячка в сыворотке крови человека, использовали два конъюгированных реагента для захвата антител любого изотипа против PLBL2 хомячка: очищенный PLBL2 хомячка, конъюгированный с биотином (биотин-PLBL2) и очищенный PLBL2 хомячка, конъюгированный с дигоксигенином (DIG-PLBL2). Получение и очистку PLBL2 хомячка осуществляли, используя стандартные способы, известные специалистам в данной области техники и также описанные в предварительных заявках на патент США номер 61/877,503 и 61/991,228, и конъюгацию с биотином или DIG осуществляли, используя стандартные способы, известные специалистам в данной области техники. В этом полугомогенном анализе ELISA, где антитело играет роль мостика между иммобилизированным и меченым антигенами, 75 мкл/лунку раствора для конъюгации, содержащего в качестве растворителя раствор для разведения (PBS/0,5% BSA/0,05% Полисорбат 20/0,05% ProClin 300, pH 7,4 ± 0,1) и по 3 мкг/мл биотин-PLBL2 и DIG-PLBL2, инкубировали в полипропиленовых пробирках Micronic (National Scientific Supply Co.; Клермонт, Калифорния) в течение ночи (16 - 24 часов) при температуре окружающей среды совместно с 75 мкл/лунку разбавленных 1:20 образцов сыворотки крови и с контрольными образцами в растворе для разведения. После инкубации 100 мкл/лунку смеси переносили из пробирок Micronic в 96-луночные планшеты, покрытые стрептавидином (StreptaWell™ High Bind; Roche Diagnostics; Индианаполис, Индиана), которые предварительно 3 раза отмыли 400 мкл/лунку промывочного буфера (PBS/0,05% полисорбат 20) в автоматическом устройстве для отмывки планшетов (BioTek ELx405), и инкубировали при температуре окружающей среды в течение 2 часов ± 10 минут. Планшет отмывали 4 раза 400 мкл/лунку промывочного буфера в устройстве для отмывки планшетов, далее добавляли 100 мкл/лунку мышиного антитела против дигоксина, конъюгированного с пероксидазой хрена (HRP) (Jackson ImmunoResearch, номер по каталогу 200-032-156), в концентрации 400 нг/мл и инкубировали при температуре окружающей среды в течение 2 часов ± 10 минут для детекции. После того как планшет был 4 раза отмыт 400 мкл/лунку промывочного буфера в устройстве для отмывки планшетов, в лунки планшета добавляли 100 мкл/лунку смеси, содержащей раствор субстрата пероксидазы (тетраметилбензидин) (0,4 г/л TMB) и раствор B пероксидазы (0,02% пероксид водорода) (KPL, номер по каталогу 50-76-03) в соотношении 1:1, и инкубировали при температуре окружающей среды в течение 18 - 28 минут для развития окраски, после чего реакцию останавливали добавлением 100 мкл/лунку 1 M фосфорной кислоты. Поглощение измеряли при 450 нм и при 630 нм для сравнения. В качестве положительного контроля в анализе использовали конструкцию моноклонального антитела, содержащую специфичную определяющую комплементарность область (CDR) из мышиного антитела против PLBL2 хомячка и человеческую каркасную область IgG1. Относительная чувствительность анализа с использованием этого антитела составила 25 нг/мл. Эксперименты по анализу толерантности к лекарственному средству, в которых использовалось это антитело, продемонстрировали, что концентрация лебрикизумаба в сыворотке вплоть до 50 мкг/мл или концентрация PLBL2 хомячка вплоть до 1 мкг/мл не приводит к искажениям результатов или кросс-реактивности в анализе.
Для осуществления этого анализа образцы сыворотки крови сначала подвергали скринингу в этом анализе при минимальном разведении, равном 1/20. Образцы, которые по результатам скрининга определяли как серопозитивные, далее использовали для подтверждения их специфичности к PLBL2 хомячка с использованием конкурентного подтверждающего анализа. Если образец также определяли как серопозитивный, далее делали его серийные разведения для получения значения титра. Серопозитивные ответы регистрировали в титрационных единицах, которые представляют собой log10 коэффициента разбавления, при котором сигнал от образца равен сигналу в пороговой точке анализа (пороговое значение для определения серопозитивности).
Четыре клинических исследования, в которых образцы от пациентов анализировали с использованием описанного выше анализа ELISA на антитела против PLBL2 хомячка, кратко описаны ниже.
Исследование 1 представляло собой Фазу II рандомизированного двойного слепого плацебо-контролируемого исследования, проводимого с целью подтверждения концепции и оценки эффектов лебрикизумаба на пациентов с астмой, болезнь которых не удавалось адекватно контролировать в ходе длительной терапии ингаляционными кортикостероидами (ICS). Всего было рандомизировано 219 пациентов, 106 из которых получили, по меньшей мере, одну 250 мг подкожную дозу (SC) лебрикизумаба, и 92 получили шесть ежемесячных доз.
Исследование 2 представляло собой Фазу II рандомизированного двойного слепого плацебо-контролируемого исследования, проводимого с целью определения оптимальной дозы у пациентов с астмой, которые не подвергались терапии ICS. Пациенты получали одну из трех доз (500, 250 или 125 мг) лебрикизумаба или плацебо путем SC введения. Исследуемое лекарственное средство вводили четыре раза в течение периода, равного 12 неделям. Всего 158 пациентов получили, по меньшей мере, одну дозу лебрикизумаба, и 145 пациентов получили все четыре дозы.
Исследование 3 представляло собой Фазу I исследования фармакокинетики лебрикизумаба у здоровых добровольцев японцев и представителей европеоидной расы. Три отдельные когорты, включающие 20 здоровых субъектов японцев и представителей европеоидной расы (по 10 субъектов каждой расовой группы), были рандомизированы для получения лебрикизумаба (125, 250 и 375 мг SC) и плацебо в соотношении 7:3. Субъекты получали однократную дозу в 1 день и далее оставались под наблюдением в течение 120 дней. Всего 42 субъектов получили однократную дозу лебрикизумаба.
В исследованиях 1-3 всего приняли участие 306 субъектов, у 264 из которых была астма, и они получили, по меньшей мере, одну дозу вещества, содержащего PLBL2 хомячка. Воздействие PLBL2 хомячка было разным в зависимости от полученной дозы лебрикизумаба.
Исследование 4 представляло собой Фазу IIb рандомизированных двойных слепых плацебо-контролируемых исследований для оценки эффективности и безопасности лебрикизумаба у пациентов с неконтролируемой астмой, которые использовали ICS и второй контролирующий препарат. Пациенты получали одну из трех доз (250, 125 или 37,5 мг) лебрикизумаба или плацебо посредством SC введения ежемесячно. В Исследовании 4 всего было рандомизировано 463 пациентов, 347 из которых получили, по меньшей мере, одну дозу лебрикизумаба. Воздействие PLBL2 хомячка было разным в зависимости от полученной дозы лебрикизумаба.
В Таблице 12 ниже суммирована информация по каждому Исследованию 1-4, отражающая диапазон уровней PLBL2 хомячка у субъектов, подвергнутых его воздействию, и доз лебрикизумаба.
Таблица 12. Воздействие PLBL2 хомячка в клинических испытаниях лебрикизумаба
aДиапазон в четырех разных партиях клинического препарата.
Ретроспективный анализ выбранных временных точек из Исследования 1 был осуществлен с использованием описанного выше анализа на антитела против PLBL2 хомячка с целью обнаружения антител к PLBL2 хомячка. Анализировали как образцы от субъектов, получавших плацебо, так и образцы от субъектов, получавших лебрикизумаб, с целью определения уровня уже существующего ответа, а также оценки выработки антител в ответ на введение лебрикизумаба. В группе плацебо было 113 субъектов, и 106 субъектов получили, по меньшей мере, одну дозу лебрикизумаба. Для анализа были выбраны следующие временные точки: 0, 29, 85, 141, 225 день и досрочное завершение. Образцы отбирали до введения следующей дозы; таким образом, образцы, получаемые на 29 день, отбирали до введения второй дозы. Процент субъектов, серопозитивных по антителам против PLBL2 хомячка в каждую временную точку, рассчитывали как отношение числа серопозитивных субъектов в каждой временной точке к общему числу протестированных субъектов в каждой временной точке. Данные приведены в Таблице 13.
Таблица 13. Результаты для антитела против PLBL2 хомячка в Исследовании 1
a Из 8 субъектов, получавших лебрикизумаб и досрочно завершивших исследование лекарственного средства, только у 3 наблюдались побочные эффекты, ставшие причиной завершении исследования лекарственного средства.
6 субъектов, получавших плацебо в Исследовании 1, были серопозитивными до начала введения доз в 0 день и оставались серопозитивными на протяжении всего исследования. То, что образцы от этих субъектов являются серопозитивными, было подтверждено с помощью подтверждающего конкурентного анализа, при этом титр антител в 0 день составлял от 1,6 до 2,9 титрационных единиц. Значения титров антител, полученные во время последущих визитов, были такими же, как титры, полученные в 0 день. У нескольких других субъектов, получавших плацебо, также наблюдался низкоуровневый положительный ответ в процессе Исследования.
Среди субъектов, получавших лебрикизумаб в Исследовании 1, 98% (104/106) были серопозитивными по антителу (у них наблюдался положительный ответ) после введения дозы и оставались серопозитивными до конца исследования, при этом большинство субъектов стали серопозитивными после получения, по меньшей мере, двух доз лебрикизумаба. Титры после получения дозы составляли от 1,35 до 4,76 титрационных единиц, при этом титры обычно повышались с течением времени. Клиническое значение выработки антител против PLBL2 хомячка неизвестно. В этом исследовании не были выявлены клинически значимые опасные явления и, учитывая высокую встречаемость антител к PLBL2 хомячка, было невозможно установить корреляцию между выработкой антител и событиями, связанными с безопасностью.
Промежуточный анализ также был проведен на образцах, собранных в Исследовании 4. С целью определения уровня уже существующего ответа, а также оценки выработки антител против PLBL2 хомячка в ответ на введение лебрикизумаба анализировали как образцы, полученные от субъектов, получавших плацебо, так и образцы от субъектов, получавших дозу лебрикизумаба. Всего было 116 субъектов, получавших плацебо, и 347 субъектов, которые получили, по меньшей мере, одну дозу лебрикизумаба. Образцы от 92 субъектов, получавших плацебо, и 268 субъектов, получавших лебрикизумаб, представлены в этом массиве данных. Результаты показаны в Таблице 14.
Таблица 14. Результаты для антитела против PLBL2 хомячка в Исследовании 4 для субъектов, которые ранее не подвергались воздействию Лебрикизумаба.
a Из 12 субъектов, получавших лебрикизумаб и досрочно завершивших исследование лекарственного средства, только у 4 наблюдались побочные эффекты, ставшие причиной завершении исследования лекарственного средства.
У четырех субъектов, получавших в Исследовании 4 плацебо, которые были серопозитивными до начала введения доз в 0 день, отмечался низкоуровневый положительный ответ, который был несколько выше предела обнаружения в анализе. Низкоуровневые ответы также наблюдались в некоторых, но не во всех последующих временных точках.
15 субъектов, получавших лебрикизумаб в Исследовании 4, которые были серопозитивными до начала введения доз в 0 день, оставались серопозитивными в последующие временные точки, при этом титр антител увеличивался после введения нескольких доз. Кроме того, в Исследовании 4 принимало участие 10 субъектов, которые ранее получали лебрикизумаб в Исследовании 1. Девяти из этих субъектов далее повторно вводили лебрикизумаб в Исследовании 4, а 1 субъект получал плацебо. Все 10 субъектов были серопозитивными до начала введения доз в 0 день Исследования 4 и продолжали оставаться серопозитивными в последующие временные точки. Данные для этих 10 субъектов были исключены из Таблицы 14 из-за того, что они ранее подвергались воздействию лебрикизумаба.
Среди субъектов, получавших лебрикизумаб в Исследовании 4, наблюдались различия в уровне положительного ответа между группами, получавшими разные дозы. Тем не менее, поскольку эти данные являются неполными, сейчас не могут быть сделаны выводы о значимости этих различий. Аналогично данным из Исследования 1, большинство субъектов стали серопозитивными после получения, по меньшей мере, двух доз лебрикизумаба. Титры после получения дозы составляли от 1,68 до 4,55 титрационных единиц, при этом титры обычно повышались с течением времени. Поскольку этот массив данных является неполным, процент серопозитивных субъектов и диапазон значений титра могут изменяться по мере накопления дополнительных данных.
В результате промежуточной оценки безопасности в Исследовании 4 был получен профиль, аналогичный такому профилю, полученному в ранних завершенных исследованиях, в которых не были зарегистрированы клинически значимые опасные явления, в том числе не были зарегистрированы анафилаксия или тяжелые реакции гиперчувствительности. Следует отметить, что у 6 из 9 пациентов, получавших лебрикизумаб в Исследовании 1 и далее повторно получавших лебрикизумаб в Исследовании 4, не было зарегистрировано никаких побочных эффектов во время предварительного анализа, и только у 1 пациента наблюдались локальные реакции в месте инъекции. На сегодняшний день в клинических испытаниях не было выявлено никаких клинических последствий такой ответной выработки антител против PLBL2 хомячка.
Мы также провели оценку в группе, получавшей дозу 125 мг в Исследовании 2, и эти результаты показаны в Таблице 15.
Таблица 15. Результаты для антитела против PLBL2 хомячка в Исследовании 2
a Из 2 субъектов, получавших лебрикизумаб и досрочно завершивших исследование лекарственного средства, ни у кого не наблюдались побочные эффекты, которые могли бы стать причиной завершении исследования лекарственного средства.
Два субъекта в Исследовании 2, которые были серопозитивными до начала введения доз в 0 день, продолжали оставаться серопозитивными во все последующие временные точки, при этом титр увеличивался после введения нескольких доз. Среди субъектов в Исследовании 2, получавших 125 мг лебрикизумаба, 87% (46/53) были серопозитивными по антителу после введения дозы и оставались серопозитивными до конца исследования, при этом большинство субъектов стали серопозитивными после получения, по меньшей мере, двух доз лебрикизумаба. Титры после получения дозы составляли от 1,51 до 4,09 титрационных единиц, при этом титры обычно повышались с течением времени.
Заключения
Для оценки потенциального влияния примеси PLBL2 CHO мы разработали анализ для обнаружения антител к PLBL2 хомячка у субъектов, получавших препараты лебрикизумаба, содержащие значительные уровни PLBL2 хомячка. На основании полного массива данных из Исследования 1 и Исследования 2 для группы, получающей дозу 125 мг, а также на основании частичного массива данных из Исследования 4 был сделан вывод о том, что наличие PLBL2 хомячка в препаратах лебрикизумаба вызывало иммунный ответ у большинства субъектов, подвергшихся воздействию PLBL2 хомячка.
У ряда субъектов как в группе, получающей плацебо, так и в группах, получающих разные дозы лебрикизумаба, наблюдалась уже существующая иммунореактивность в анализе на антитела против PLBL2 хомячка. Причина такого уже существующего ответа неизвестна; реактивность антител к белкам клеток-хозяев CHO ранее была описана и подтверждена для образцов нормальной сыворотки крови людей, не подвергавшихся ранее воздействию биологических продуктов, полученных из CHO (Xue et al., The AAPS Journal 12(1):98-106 (2010)). Тем не менее, не существует опубликованных данных в отношении CHOP единственного вида, PLBL2.
В случае субъектов с уже существующей иммунореактивностью, определенной в анализе на антитела против PLBL2 хомячка в начале исследования, наблюдался устойчивый рост титров антител после введения лебрикизумаба. В случае субъектов, у которых не было обнаружено таких антител в начале исследования, большинство субъектов во всех четырех исследованиях стали серопозитивными после, по меньшей мере, двух введений лебрикизумаба и оставались серопозитивными во всех временных точках.
Клиническая значимость выработки антител против PLBL2 хомячка не известна. Несмотря на то, что у исследуемых субъектов наблюдался высокий уровень антител к PLBL2 хомячка, невозможно установить наличие корреляции между наличием антител и событиями, связанными с безопасностью. Важно, что в этих завершенных или промежуточных исследованиях не было выявлено никаких опасных явлений и, в частности, не было зарегистрированных случаев анафилаксии, анафилактоидных реакций или тяжелых реакций гиперчувствительности. Тем не менее, сохраняется опасение, что продолжительное воздействие повторных доз может повысить вероятность нежелательных эффектов, таких как анафилаксия, гиперчувствительность и отложение иммунных комплексов, особенно в популяции пациентов с астмой и в популяции пациентов с другими аллергическими реакциями или реакциями гиперчувствительности. Соответственно, на поздней стадии клинических исследований и далее, когда повторные дозы нти-IL13 MAb могут использоваться в течение продолжительного периода времени, пациентам важно вводить препараты анти-IL13 MAb (например, лебрикизумаба), которые содержат значительно сниженные уровни PLBL2 хомячка, чтобы минимизировать иммуногенность настолько, насколько это возможно.
Дополнительные последовательности антител предусмотрены в Таблице 16 ниже.
Таблица 16. Аминокислотные последовательности анти-IL17 A/F антитела (SEQ ID NOS.: 15-22) и аминокислотные последовательности анти-Abeta антитела (SEQ ID NOS.: 23-30).
(SEQ ID NO.:15)
(SEQ ID NO.:16)
(SEQ ID NO.:17)
(SEQ ID NO.:18)
(SEQ ID NO.:19)
(SEQ ID NO.:20)
(SEQ ID NO.:21)
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
Ser Gly Ile Asn Trp Ser Ser Gly Gly Ile Gly Tyr Ala Asp Ser Val
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
Ala Arg Asp Ile Gly Gly Phe Gly Glu Phe Tyr Trp Asn Phe Gly Leu
Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser
(SEQ ID NO.:22)
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Arg Ser Tyr
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Pro
Ala Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
(SEQ ID NO.:23)
SEQ ID NO.:24)
SEQ ID NO.: 25)
(SEQ ID NO.:26)
(SEQ ID NO.: 27)
(SEQ ID NO.: 28)
(SEQ ID NO.: 29)
(SEQ ID NO.: 30)
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ДЖЕНЕНТЕК, ИНК. И ДР.
<120> СПОСОБЫ И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ОЧИЩЕННЫЕ РЕКОМБИНАНТНЫЕ ПОЛИПЕПТИДЫ
<130> P5704R1-WO
<140>
<141>
<150> 61/877,517
<151> 2013-09-13
<160> 34
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 1
Ala Tyr Ser Val Asn
1 5
<210> 2
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 2
Met Ile Trp Gly Asp Gly Lys Ile Val Tyr Asn Ser Ala Leu Lys Ser
1 5 10 15
<210> 3
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 3
Asp Gly Tyr Tyr Pro Tyr Ala Met Asp Asn
1 5 10
<210> 4
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 4
Arg Ala Ser Lys Ser Val Asp Ser Tyr Gly Asn Ser Phe Met His
1 5 10 15
<210> 5
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 5
Leu Ala Ser Asn Leu Glu Ser
1 5
<210> 6
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 6
Gln Gln Asn Asn Glu Asp Pro Arg Thr
1 5
<210> 7
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 7
Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln Thr
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ala Tyr Ser
20 25 30
Val Asn Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu Ala
35 40 45
Met Ile Trp Gly Asp Gly Lys Ile Val Tyr Asn Ser Ala Leu Lys Ser
50 55 60
Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Val Leu Thr
65 70 75 80
Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala Gly
85 90 95
Asp Gly Tyr Tyr Pro Tyr Ala Met Asp Asn Trp Gly Gln Gly Ser Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 8
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 8
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ala Tyr
20 25 30
Ser Val Asn Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Ala Met Ile Trp Gly Asp Gly Lys Ile Val Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Val Leu
65 70 75 80
Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Gly Asp Gly Tyr Tyr Pro Tyr Ala Met Asp Asn Trp Gly Gln Gly Ser
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 9
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 9
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ser Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys Ser Val Asp Ser Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Arg Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
<210> 10
<211> 443
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 10
Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln Thr
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ala Tyr Ser
20 25 30
Val Asn Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu Ala
35 40 45
Met Ile Trp Gly Asp Gly Lys Ile Val Tyr Asn Ser Ala Leu Lys Ser
50 55 60
Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Val Leu Thr
65 70 75 80
Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala Gly
85 90 95
Asp Gly Tyr Tyr Pro Tyr Ala Met Asp Asn Trp Gly Gln Gly Ser Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440
<210> 11
<211> 444
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 11
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ala Tyr
20 25 30
Ser Val Asn Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Ala Met Ile Trp Gly Asp Gly Lys Ile Val Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Val Leu
65 70 75 80
Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Gly Asp Gly Tyr Tyr Pro Tyr Ala Met Asp Asn Trp Gly Gln Gly Ser
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440
<210> 12
<211> 444
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 12
Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln Thr
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ala Tyr Ser
20 25 30
Val Asn Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu Ala
35 40 45
Met Ile Trp Gly Asp Gly Lys Ile Val Tyr Asn Ser Ala Leu Lys Ser
50 55 60
Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Val Leu Thr
65 70 75 80
Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala Gly
85 90 95
Asp Gly Tyr Tyr Pro Tyr Ala Met Asp Asn Trp Gly Gln Gly Ser Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 13
<211> 445
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 13
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ala Tyr
20 25 30
Ser Val Asn Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Ala Met Ile Trp Gly Asp Gly Lys Ile Val Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Val Leu
65 70 75 80
Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Gly Asp Gly Tyr Tyr Pro Tyr Ala Met Asp Asn Trp Gly Gln Gly Ser
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 14
<211> 218
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 14
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ser Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys Ser Val Asp Ser Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Arg Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 15
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 15
Asp Tyr Ala Met His
1 5
<210> 16
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 16
Gly Ile Asn Trp Ser Ser Gly Gly Ile Gly Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 17
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 17
Asp Ile Gly Gly Phe Gly Glu Phe Tyr Trp Asn Phe Gly Leu
1 5 10
<210> 18
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 18
Arg Ala Ser Gln Ser Val Arg Ser Tyr Leu Ala
1 5 10
<210> 19
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 19
Asp Ala Ser Asn Arg Ala Thr
1 5
<210> 20
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 20
Gln Gln Arg Ser Asn Trp Pro Pro Ala Thr
1 5 10
<210> 21
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 21
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Asn Trp Ser Ser Gly Gly Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Asp Ile Gly Gly Phe Gly Glu Phe Tyr Trp Asn Phe Gly Leu
100 105 110
Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 22
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 22
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Arg Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Pro
85 90 95
Ala Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 23
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 23
Gly Phe Thr Phe Ser Ser Tyr Gly Met Ser
1 5 10
<210> 24
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 24
Ser Ile Asn Ser Asn Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Lys
1 5 10 15
<210> 25
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 25
Gly Asp Tyr
1
<210> 26
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 26
Arg Ser Ser Gln Ser Leu Val Tyr Ser Asn Gly Asp Thr Tyr Leu His
1 5 10 15
<210> 27
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 27
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 28
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 28
Ser Gln Ser Thr His Val Pro Trp Thr
1 5
<210> 29
<211> 438
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 29
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Val
35 40 45
Ala Ser Ile Asn Ser Asn Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Gly Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
115 120 125
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
180 185 190
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
210 215 220
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
225 230 235 240
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
245 250 255
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
260 265 270
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
275 280 285
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
290 295 300
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
305 310 315 320
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
325 330 335
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
340 345 350
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
355 360 365
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
370 375 380
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
385 390 395 400
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
405 410 415
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
420 425 430
Leu Ser Leu Ser Leu Gly
435
<210> 30
<211> 219
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 30
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asn Gly Asp Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 31
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 31
Ser Val Leu Leu Asp Ala Ala Ser Gly Gln Leu Arg
1 5 10
<210> 32
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 32
Gly Leu Glu Asp Ser Tyr Glu Gly Arg
1 5
<210> 33
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 33
Ala Phe Ile Pro Asn Gly Pro Ser Pro Gly Ser Arg
1 5 10
<210> 34
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 34
Val Thr Ser Phe Ser Leu Ala Lys
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Антитела со сниженным связыванием с технологическими примесями | 2017 |
|
RU2771330C2 |
| НОВЫЕ АНТИ-IL13 АНТИТЕЛА И ИХ ИСПОЛЬЗОВАНИЕ | 2020 |
|
RU2752833C1 |
| СПОСОБЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ, СВЯЗАННЫЕ С ИНГИБИРОВАНИЕМ TH2 | 2020 |
|
RU2832013C2 |
| БИСПЕЦИФИЧЕСКИЕ ТРЕХВАЛЕНТНЫЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С КЛАУДИНОМ 6 ИЛИ КЛАУДИНОМ 18.2, И CD3, ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ С ЭКСПРЕССИЕЙ КЛАУДИНА | 2017 |
|
RU2798988C2 |
| МОЛЕКУЛА РЕЦЕПТОРА IL4/IL13 ДЛЯ ВЕТЕРИНАРНОГО ПРИМЕНЕНИЯ | 2018 |
|
RU2795591C2 |
| АНТИ-IL31 АНТИТЕЛА ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2018 |
|
RU2795485C2 |
| СВЯЗЫВАЮЩИЕСЯ С CD38 И PD-L1 МОЛЕКУЛЫ | 2017 |
|
RU2764201C2 |
| АНТИ-МЕЗОТЕЛИН АНТИТЕЛО И ЕГО КОНЪЮГАТ С ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ | 2019 |
|
RU2747995C1 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ IL4R, И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2834713C1 |
| АНТИТЕЛА К РЕЦЕПТОРУ IL4 ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2837141C2 |
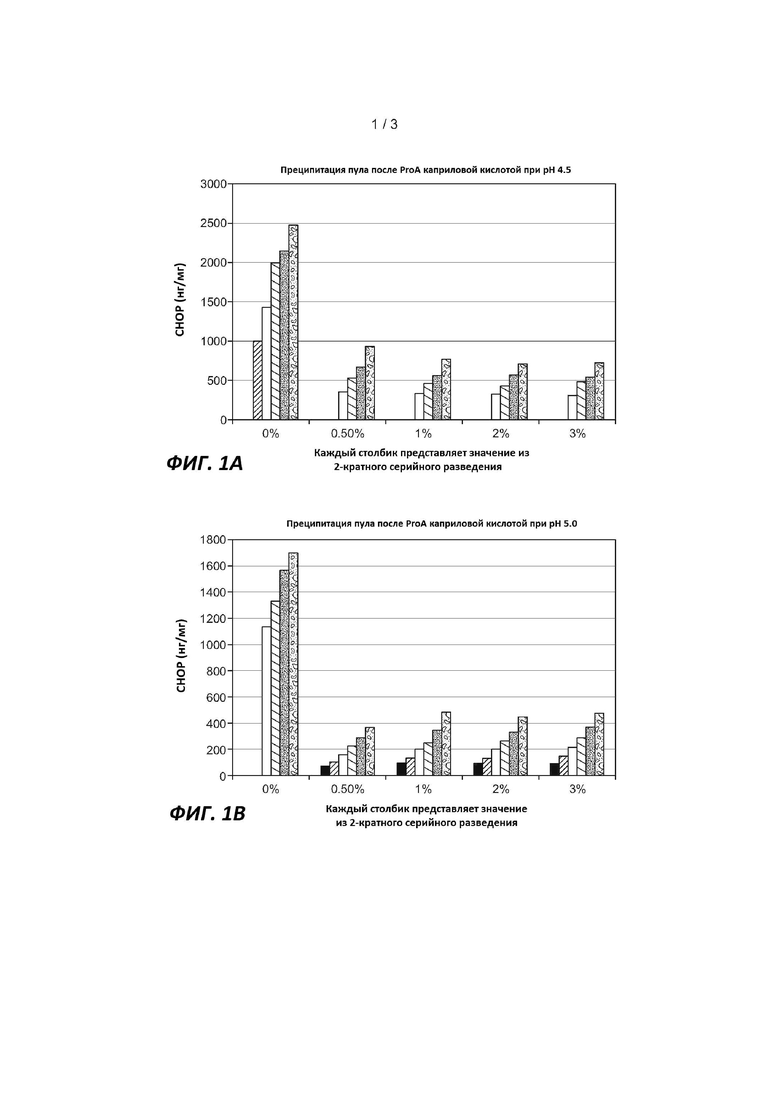
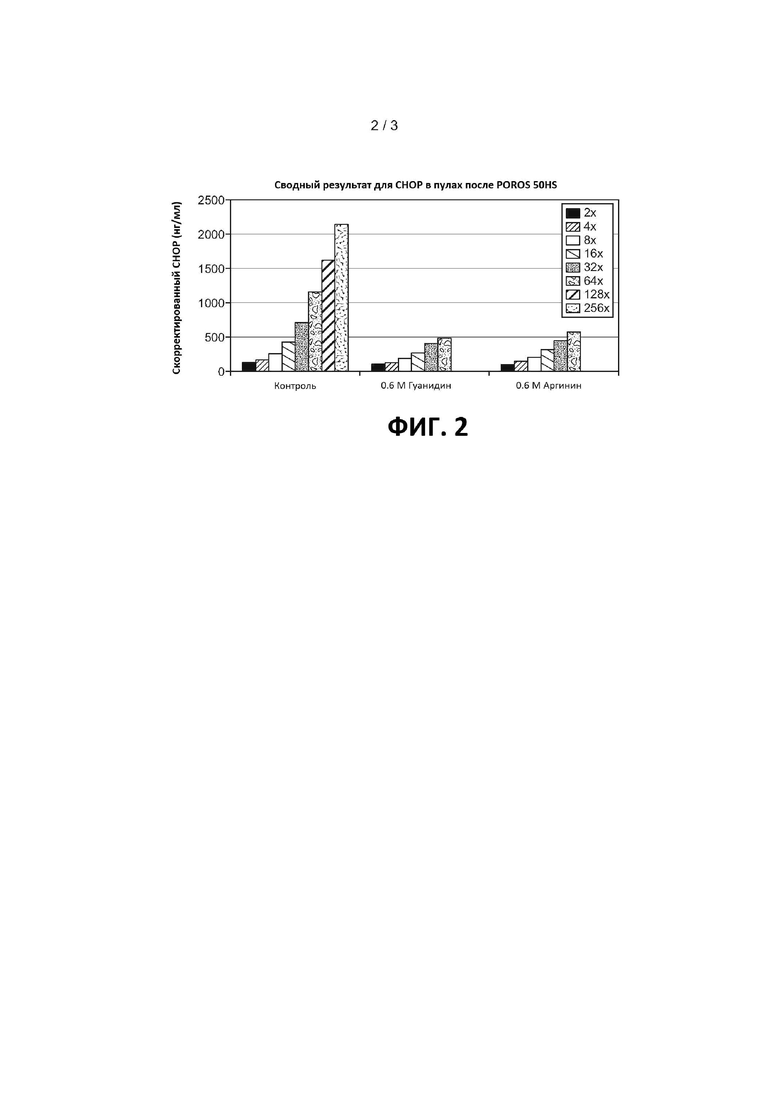
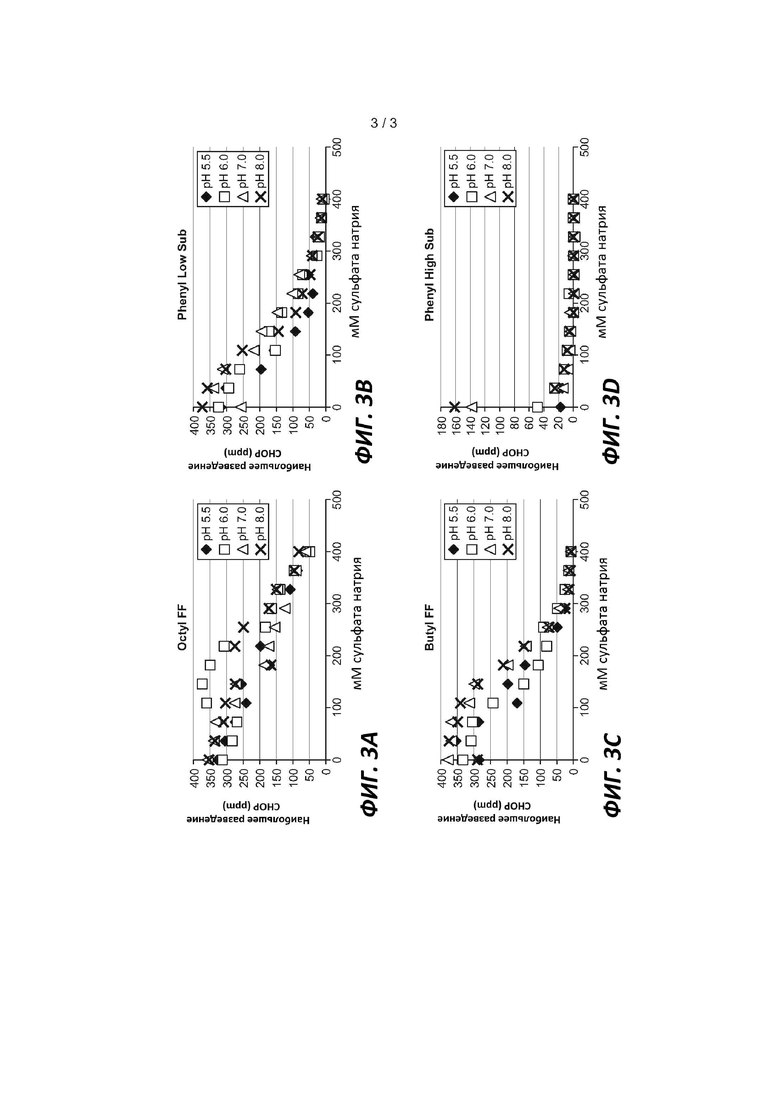
Изобретение относится к области биотехнологии. Описан способ очистки рекомбинантного полипептида, получаемого в клетках-хозяевах яичника китайского хомячка, характеризующихся уровнями фосфолипазы В-подобного фермент 2 (PLBL2) больше чем 100 нг/мг, включающий стадию хроматографии гидрофобных взаимодействий (HIC), где способ обеспечивает получение очищенного препарата, включающего рекомбинантный полипептид и остаточное количество PLBL2 хомячка. Изобретение расширяет арсенал способов очистки рекомбинантных полипептидов. 28 з.п. ф-лы, 7 ил., 16 табл., 3 пр.
1. Способ очистки рекомбинантного полипептида, получаемого в клетках-хозяевах яичника китайского хомячка, характеризующихся уровнями фосфолипазы В-подобного фермент 2 (PLBL2) больше чем 100 нг/мг, включающий стадию хроматографии гидрофобных взаимодействий (HIC), где способ обеспечивает получение очищенного препарата, включающего рекомбинантный полипептид и остаточное количество PLBL2 хомячка.
2. Способ по п. 1, где остаточное количество PLBL2 хомячка составляет менее 20 нг/мг, или менее 15 нг/мг, или менее 10 нг/мг, или менее 8 нг/мг, или менее 5 нг/мг, или менее 3 нг/мг, или менее 2 нг/мг, или менее 1 нг/мг, или менее 0,5 нг/мг.
3. Способ по п. 1 или 2, где стадия HIC включает применение высокозаместительной смолы PHENYL SEPHAROSE™ 6 Fast Flow.
4. Способ по п. 3, где стадия HIC включает применение колонки с высокозаместительной смолой PHENYL SEPHAROSE™ 6 Fast Flow в режиме сбора проскока.
5. Способ по любому из пп. 1-4, где рекомбинантный полипептид выбран из фактора роста, цитокина, антитела, фрагмента антитела и иммуноадгезина.
6. Способ по п. 5, где рекомбинантный полипептид представляет собой антитело.
7. Способ по п. 6, где антитело представляет собой гуманизированное моноклональное антитело.
8. Способ по п. 7, где антитело представляет собой IgG1, или IgG2, или IgG3, или IgG4.
9. Способ по п. 1 или 2, где стадия HIC включает применение колонки со смолой в режиме сбора проскока и включает применение уравновешивающего буфера и промывочного буфера, где уравновешивающий буфер и промывочный буфер - каждый включает 50 мМ ацетата натрия, рН 5,0.
10. Способ по п. 9, где проскок контролируют по поглощению при 280 нанометрах и проскок собирают между 0,5 и 1,5 оптической плотности (OD).
11. Способ по п. 9, где проскок собирают в объеме максимум 8 объемов колонки.
12. Способ по п. 9, дополнительно включающий стадию аффинной хроматографии.
13. Способ по п. 12, где аффинная хроматография представляет собой хроматографию на белке А.
14. Способ по п. 9, дополнительно включающий стадию ионообменной хроматографии.
15. Способ по п. 14, где ионообменная хроматография представляет собой анионообменную хроматографию.
16. Способ по п. 9, включающий первую стадию аффинной хроматографии на белке А и вторую стадию анионообменной хроматографии перед стадией хроматографии гидрофобных взаимодействий (HIC).
17. Способ по п. 16, где стадия аффинной хроматографии включает применение смолы MABSELECT SURE™, стадия анионообменной хроматографии включает применение смолы Q SEPHAROSE™ Fast Flow и стадия HIC включает применение высокозаместительной смолы PHENYL SEPHAROSE™ 6 Fast Flow.
18. Способ по п. 17, где:
стадия аффинной хроматографии включает применение колонки со смолой MABSELECT SURE™ в режиме связывания и элюирования;
стадия анионообменной хроматографии включает применение колонки со смолой Q SEPHAROSE™ Fast Flow в режиме связывания и элюирования, и
стадия HIC включает применение колонки с высокозаместительной смолой PHENYL SEPHAROSE™ 6 Fast Flow в режиме сбора проскока.
19. Способ по п. 1 или 2, где стадия HIC включает применение колонки со смолой в режиме сбора проскока и включает применение уравновешивающего буфера и промывочного буфера, где уравновешивающий буфер и промывочный буфер каждый включают 150 мМ ацетат натрия, рН 5,0.
20. Способ по п. 19, где проскок контролируют по поглощению при 280 нанометрах и проскок собирают начиная с 0,5 оптической плотности (OD) и в объеме 10 объемов колонки.
21. Способ по п. 19, дополнительно включающий стадию аффинной хроматографии.
22. Способ по п. 21, где аффинная хроматография представляет собой хроматографию на белке А.
23. Способ по п. 19, дополнительно включающий стадию комбинированной хроматографии.
24. Способ по п. 19, включающий первую стадию аффинной хроматографии на белке А и вторую стадию комбинированной хроматографии перед стадией хроматографии гидрофобных взаимодействий (HIC).
25. Способ по п. 24, где стадия аффинной хроматографии включает применение смолы MABSELECT SURE™, стадия комбинированной хроматографии включает применение CAPTO™ Adhere и стадия HIC включает применение высокозаместительной смолы PHENYL SEPHAROSE™ 6 Fast Flow.
26. Способ по п. 25, где:
стадия аффинной хроматографии включает применение колонки со смолой MABSELECT SURE™ в режиме связывания и элюирования;
стадия комбинированной хроматографии включает применение колонки со смолой CAPTO™ Adhere в режиме сбора проскока и
стадия HIC включает применение колонки с высокозаместительной смолой PHENYL SEPHAROSE™ 6 Fast Flow в режиме сбора проскока.
27. Способ по п. 26, где количество PLBL2 хомячка количественно определяют с использованием иммунологического анализа или масс-спектрометрического анализа.
28. Способ по п. 27, где иммунологический анализ представляет собой ELISA на все белки клеток яичника китайского хомячка или ELISA на PLBL2 хомячка.
29. Способ по п. 27, где масс-спектрометрический анализ представляет собой LC-MS/MS.
| WO 2007036745 A2, 05.04.2007 | |||
| US 20110064719 A1, 17.03.2011 | |||
| НОВЫЕ АНТИ-IL 13 АНТИТЕЛА И ИХ ИСПОЛЬЗОВАНИЕ | 2004 |
|
RU2487887C2 |
| US 8491904 B2, 23.07.2013. | |||
Авторы
Даты
2023-04-06—Публикация
2014-09-12—Подача