Область техники, к которой относится изобретение
Настоящее изобретение относится к композициям, которые содержат биспецифическое антитело, функционально замещающее фактор свертывания крови VIII (FVIII), которое связывается с фактором свертывания крови IX (FIX) и/или активированным фактором свертывания крови IX (FIXa) и фактором свертывания крови X (FX).
Предпосылки создания изобретения
Были обнаружены биспецифические антитела, функционально замещающие VIII, которые связываются с фактором свертывания крови IX (FIX) и/или активированным фактором свертывания крови IX (FIXa) и фактором свертывания крови X (FX) (не патентная литература 1 и/или 2; патентная литература 1-3). Биспецифическое антитело эмицизумаб (АСЕ910) ослабляет снижение реакции коагуляции, обусловленное дефицитом и дисфункцией FVIII, посредством функционального замещения FVIII; поэтому клинические опыты проводят на страдающих гемофилией А пациентах.
Разработаны многочисленные композиции в виде растворов, содержащие антитела, и композиции в виде растворов, содержащие антитела в высокой концентрации, данные о которых которые опубликованы до настоящего времени, они представляют собой композиции, полученные с использованием гистидина и аргинина (патентная литература 4) и композиции, полученные с использованием гистидин/аспартатного буфера (патентная литература 5). В то же время опубликованы данные о стабильной жидкой фармацевтической композиции антитела, содержащей амилоид β (Аβ), в которой в качестве буфера используется гистидин/гистидин-HCl (патентная литература 6).
Однако не имеется опубликованных данных о стабильных композициях в виде растворов, содержащих вышеуказанные биспецифические антитела, в которых подавляется образование агрегатов и/или компонентов с зарядовой гетерогенностью.
Список процитированной литературы
Патентные документы
Патентный документ 1 WO2005/035756;
Патентный документ 2 WO 2006/109592;
Патентный документ 3 WO 2012/067176;
Патентный документ 4 WO 2002/030463;
Патентный документ 5 WO 2011/090088;
Патентный документ 6 WO 2013/131866.
Не патентные документы
Не патентный документ 1 Nat Med. 2012; 18(10):1570-74;
Не патентный документ 2 PLoS One. 2013; 8(2):е57479.
Краткое изложение сущности изобретения
Задачи, положенные в основу настоящего изобретения
Задача, положенная в основу настоящего изобретения, заключалась в том, чтобы разработать стабильные композиции в виде растворов, содержащие эмицизумаб (АСЕ910), который представляет собой биспецифическое антитело, функционально замещающее FVIII, которое связывается с FIX и/или FIXa и FX.
Средства решения указанных задач
В результате специального исследования, проведенного для решения вышеуказанной задачи, при создании настоящего изобретения было обнаружено, что композиция в виде раствора с рН от 4,5 до 6,5, который содержит вышеуказанное биспецифическое антитело в концентрации от 20 до 180 мг/мл, 10-40 мМ гистидин/аспартатный буфер, полоксамер 188 в концентрации от 0,2 до 1 мг/мл и 100-300 мМ аргинин, может представлять собой стабильную содержащую антитело композицию в виде раствора, в которой подавляется образование агрегатов и/или компонентов с зарядовой гетерогенностью, что позволило создать настоящее изобретения.
В настоящем изобретении конкретно предложено следующее:
[1] Композиция в виде содержащего антитело раствора с рН от 4,5 до 6,5, которая содержит:
биспецифическое антитело в концентрации от 20 до 180 мг/мл, в котором первый полипептид и третий полипептид образуют пару, и второй полипептид и четвертый полипептид образуют пару, где первый полипептид содержит Н-цепь, содержащую аминокислотные последовательности CDR 1, 2 и 3 Н-цепи SEQ ID NO: 1, 2 и 3 (CDR Н-цепи антитела Q499) соответственно; второй полипептид содержит Н-цепь, содержащую аминокислотные последовательности CDR 1, 2 и 3 Н-цепи SEQ ID NO: 4, 5 и 6 (CDR Н-цепи антитела J327) соответственно; и
третий полипептид и четвертый полипептид содержат общую L-цепь содержащую аминокислотные последовательности CDR 1, 2 и 3 L-цепи SEQ ID NO: 7, 8 и 9 (CDR L-цепи антитела L404) соответственно;
гистидин/аспартатный буфер в концентрации от 10 до 40 мМ;
полоксамер 188 в концентрации от 0,2 до 1 мг/мл; и
аргинин в концентрации от 100 до 300 мМ.
[2] Композиция в виде содержащего антитело раствора по п. [1], в которой в биспецифическом антителе первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, где первый полипептид содержит Н-цепь, содержащую аминокислотную последовательность SEQ ID NO: 10; второй полипептид содержит Н-цепь, содержащую аминокислотную последовательность SEQ ID NO: 11 и третий полипептид и четвертый полипептид содержат общую L-цепь, имеющую SEQ ID NO: 12.
[3] Композиция в виде содержащего антитело раствора по п. [1] или п. [2], в которой концентрация полоксамера 188 составляет 0,5 мг/мл.
[4] Композиция в виде содержащего антитело раствора по одному из п.п. [1]-[3], в которой указанное значение рН составляет 6,0.
[5] Композиция в виде содержащего антитело раствора по одному из п.п. [1]-[4], в которой концентрация гистидин/аспартатного буфера составляет 20 мМ.
[6] Композиция в виде содержащего антитело раствора по одному из п.п. [1]-[5], в которой концентрация аргинина составляет 150 мМ.
[7] Композиция в виде содержащего антитело раствора по одному из п.п. [1]-[6], которая практически не содержит иона хлора или иона ацетата.
[8] Композиция в виде содержащего антитело раствора с рН 6, которая содержит:
биспецифическое антитело в концентрации от 20 до 180 мг/мл, в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, где первый полипептид содержит Н-цепь, содержащую аминокислотную последовательность SEQ ID NO: 10; второй полипептид содержит Н-цепь, содержащую аминокислотную последовательность SEQ ID NO: 11; и третий полипептид, и четвертый полипептид содержат общую L-цепь, имеющую SEQ ID NO: 12;
L-гистидин/аспартатный буфер в концентрации 20 мМ;
полоксамер 188 в концентрации 0,5 мг/мл; и
L-аргинин в концентрации 150 мМ.
[9] Композиция в виде содержащего антитело раствора по одному из п.п. [1]-[8], предназначенная для применения путем подкожного введения.
[10] Композиция в виде содержащего антитело раствора по одному из п.п. [1]-[9], предназначенная для применения при лечении гемофилии А.
[11] Способ стабилизации антитела в содержащей антитело композиции в виде раствора, который включает добавление к раствору гистидин/аспартатного буфера, полоксамера 188 и аргинина, где концентрация гистидин/аспартатного буфера составляет от 10 до 40 мМ, концентрация полоксамера 188 составляет от 0,2 до 1 мг/мл и концентрация аргинина составляет от 100 до 300 мМ.
[12] Способ подавления ассоциации (образования агрегатов) антитела в содержащей антитело композиции в виде раствора, который включает добавление гистидин/аспартатного буфера, полоксамера 188 и аргинина к раствору, где концентрация гистидин/аспартатного буфера составляет от 10 до 40 мМ, концентрация полоксамера 188 составляет от 0,2 до 1 мг/мл и концентрация аргинина составляет от 100 до 300 мМ.
[13] Способ снижения уровня компонента с зарядовой гетерогенностью в содержащей антитело композиции в виде раствора, который включает добавление гистидин/аспартатного буфера к раствору, где концентрация гистидин/аспартатного буфера составляет от 10 до 40 мМ.
Эффекты изобретения
В настоящем изобретении предложены содержащие антитело композиции, обладающие очень высокой стабильностью. Кроме того, в настоящем изобретении предложены также содержащие антитело композиции, в которых подавляется образование агрегатов и/или компонентов с зарядовой гетерогенностью, когда они находятся в растворенном состоянии.
Краткое описание чертежей
На чертежах показано:
на фиг. 1 - фотография, демонстрирующая присутствие нерастворимых чужеродных субстанций после осуществления описанных в примере 8 тестов на встряхивание, (а: 0 мг/мл полоксамера 188; б: 0,5 мг/мл полоксамера 188);
на фиг. 2 - графики, на которых представлено количество нерастворимых микрочастиц (количество микрочастиц/мл), присутствующих после осуществления описанных в примере 8 тестов на встряхивание и замораживания-оттаивания.
Средства для осуществления изобретения
Настоящее изобретение подробно описано ниже.
В настоящем изобретении предложена композиция в виде раствора с рН от 4,5 до 7,5, которая содержит: эмицизумаб (АСЕ910) в концентрации от 20 до 180 мг/мл, который представляет собой биспецифическое антитело, функционально замещающее FVIII, которое связывается с FIX и/или FIXa и FX; гистидин/аспартатный буфер в концентрации от 10 до 40 мМ; полоксамер 188 в концентрации от 0,2 до 1 мг/мл; и аргинин в концентрации от 100 до 300 мМ.
Эмицизумаб (АСЕ910), который представляет собой указанное выше биспецифическое антитело, описан ниже.
Биспецифическое антитело (Q499-z121/J327-z119/L404-k), в котором первый полипептид и третий полипептид образуют пару и второй поли пептид и четвертый полипептид образуют пару; где первый полипептид содержит Н-цепь, содержащую аминокислотные последовательности CDR 1, 2 и 3 Н-цепи, имеющие SEQ ID NO: 1, 2 и 3 (CDR Н-цепи Q499) соответственно; второй полипептид содержит Н-цепь, содержащую аминокислотные последовательности CDR 1, 2 и 3 Н-цепи, имеющие SEQ ID NO: 4, 5 и 6 (CDR Н-цепи J327) соответственно; и третий полипептид и четвертый полипептид содержат общую L-цепь, содержащую аминокислотные последовательности CDR 1, 2 и 3 L-цепи, имеющие SEQ ID NO: 7, 8 и 9 (CDR L-цепи L404) соответственно.
Более конкретно, указанное выше биспецифическое антитело представляет собой биспецифическое антитело, в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару; где первый полипептид содержит Н-цепь, содержащую аминокислотную последовательность вариабельной области Н-цепи SEQ ID NO: 13, второй полипептид содержит Н-цепь, содержащую аминокислотную последовательность вариабельной области Н-цепи SEQ ID NO: 14, и третий полипептид и четвертый полипептид содержат общую L-цепь, содержащую аминокислотную последовательность вариабельной области L-цепи SEQ ID NO: 15.
Более конкретно, указанное выше биспецифическое антитело представляет собой биспецифическое антитело (Q499-z121/J327-z119/L404-k), в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару; где первый полипептид содержит Н-цепь, содержащую аминокислотную последовательность SEQ ID NO: 10, второй полипептид содержит Н-цепь, содержащую аминокислотную последовательность SEQ ID NO: 11, и третий полипептид и четвертый полипептид содержат общую L-цепь, имеющую SEQ ID NO: 12. Такие антитела можно получать с помощью методов, описанных в WO 2005/035756, WO 2006/109592, WO 2012/067176, и т.п.
На концентрацию антитела в композиции, предлагаемой в настоящем изобретении, не накладываются конкретные ограничения, но предпочтительно она составляет от 20 до 180 мг/мл. Примерами являются 20, 30, 40, 120, 150 и 180 мг/мл. Верхний предел концентрации антитела в композиции, предлагаемой в настоящем изобретении, не ограничен конкретной величиной, но обычно он составляет 250 мг/мл.
На антитела, применяемые согласно настоящему изобретению, не накладывается конкретных ограничений, при условии, что они связываются с требуемым антигеном, и они могут представлять собой поликлональные или моноклональные антитела. Предпочтительными являются моноклональные антитела, поскольку в этом случае можно стабильно получать гомогенные антитела.
Аминокислоты в аминокислотных последовательностях, предлагаемых в настоящем изобретении, можно подвергать пост-трансляционным модификациям (например, модификация N-концевого глутамина с превращением его в пироглутаминовую кислоту путем пироглутаминирования хорошо известна специалистам в данной области). Естественно, такие подвергнутые пост-трансляционной модификации аминокислоты могут присутствовать в антителах, применяемых согласно настоящему изобретению.
В контексте настоящего изобретения выражение «функциональное замещение FVIII» означает распознавание FIX или FIXa и FX и стимулирование обусловленной FIXa активации FX (стимулирование образования FXa посредством FIXa). Стимулирующую образование FXa активность можно оценивать, например, с помощью измерительной системы, включающей FXIa, FX, синтетический субстрат S-2222 (синтетический субстрат FXa) и фосфолипиды. Такая измерительная система позволяет продемонстрировать корреляцию между серьезностью заболевания и клиническими симптомами в случаях гемофилии A (Rosen S., Andersson М., Blomback М. и др., Clinical applications of a chromogenic substrate method for determination of FVIII activity, Thromb Haemost; 54, 1985, cc. 811-823).
В контексте настоящего изобретения понятие «общая L-цепь» относится к L-цепи, которая может образовывать пары с каждой из двух или большего количества различных Н-цепей и обладает способностью связываться с каждым антигеном. В настоящем описании понятие «различные Н-цепи» предпочтительно (но, не ограничиваясь только этим) относится к Н-цепям антител к различным антигенам; оно относится к Н-цепям, аминокислотные последовательности которых отличаются друг от друга. Общие L-цепи можно получать, например, согласно методу, описанному в WO 2006/109592.
В контексте настоящего изобретения понятие «стабильная содержащая антитело композиция» относится к композиции, в которой затруднено образование агрегатов и/или компонентов с зарядовой гетерогенностью из белков, таких как антитела, т.е. к композициям, в которых при их нахождении в растворе затруднено протекание вредных (приводящих к ухудшению качества) реакций, включая образование нерастворимых агрегатов, растворимых агрегатов, компонентов с зарядовой гетерогенностью.
Понятие «компоненты с зарядовой гетерогенностью» относится к компонентам, имеющим заряды на поверхности белка, которые отличны от зарядов главного компонента вследствие деаминирования, окисления, гидролиза и подобных им реакций.
В контексте настоящего изобретения понятие «полипептид», как правило, относится к пептидам и белкам длиной примерно десять аминокислот или более. Как правило, они представляют собой полученные из биологического источника полипептиды, но они не ограничены только указанными полипептидами и могут представлять собой, например, полипептиды, содержащие созданную искусственным путем последовательность. Кроме того, они могут представлять собой любые встречающиеся в естественных условиях полипептиды, синтетические полипептиды, рекомбинантные полипептиды или т.п. Кроме того, под понятие полипептиды, предлагаемые в настоящем изобретении, подпадают также фрагменты вышеуказанных полипептидов.
Понятие «антитело» используется в наиболее широком смысле и антитела могут представлять собой моноклональные антитела, поликлональные антитела, димеры, мультимеры, мультиспецифические антитела (например, биспецифические антитела), производные антител и модифицированные антитела (Miller K. и др., J Immunol., 170(9), 2003, cc. 4854-4861), если они обладают требуемой биологической активностью. Антитела могут представлять собой мышиные антитела, человеческие антитела, гуманизированные антитела, химерные антитела или антитела из других видов, или они могут представлять собой искусственные синтезированные антитела. Антитела, представленные в настоящем описании, могут представлять собой молекулы иммуноглобулина любого типа (например, IgG, IgE, IgM, IgD и IgA), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса. Иммуноглобулины могут происходить из животных любого вида (например, человека, мышей или кроликов). Понятия «антитело», «иммунный глобулин» и «иммуноглобулин» используют взаимозаменяемо в их наиболее широком смысле.
Понятие «биспецифическое антитело» относится к антителу, имеющему две вариабельные области, каждая из которых распознает различные эпитопы, при этом указанные вариабельные области находятся в одной и той же молекуле антитела. Биспецифические антитела могут представлять антитела, которые распознают два или большее количество различных антигенов, или антитела, которые распознают два или большее количество различных эпитопов одного и того же антигена. Биспецифические антитела могут представлять собой не только полные антитела, но и производные антител.
В качестве антител можно применять рекомбинантные антитела, полученные с применением методов генетической инженерии. Рекомбинантное антитело можно получать путем клонирования ДНК, кодирующей антитело, из гибридом или продуцирующих антитело клеток, таких как сенсибилизированные лимфоциты, которые продуцируют антитела; путем встраивания их в векторы и затем интродуцирования его в хозяев (клетки-хозяева) с получением антитела.
Биспецифические антитела представляют собой (но, не ограничиваясь только ими) антитела IgG-типа; например, биспецифические антитела IgG-типа могут секретироваться гибридной гибридомой (квадромой), полученной путем слияния двух типов гибридом, продуцирующих антитела IgG-типа (Milstein С. и др., Nature, 305, 1983, cc. 537-540). Их можно также секретировать путем интродукции в клетки генов L-цепи и Н-цепи, образующих два типа представляющих интерес IgG, т.е. в общей сложности четырех типов генов, для совместной экспрессии генов.
Антитела, предлагаемые в настоящем изобретении, можно получать методами, известными специалистам в данной области. Более конкретно, ДНК, кодирующую представляющее интерес антитело, встраивают в экспрессионный вектор. Встраивание в экспрессионный вектор осуществляют таким образом, чтобы экспрессия происходила под контролем регулирующих экспрессию областей, таких как энхансер и промотор. Затем трансформируют клетки-хозяева с использованием указанного экспрессионного вектора для обеспечения экспрессии антитела. В этом случае можно использовать соответствующие комбинации хозяина и экспрессионного вектора.
Предлагаемые в настоящем изобретении антитела, полученные описанными выше методами, можно выделять из клеток-хозяев или из их окружения (из среды и т.д.) и очищать с получением практически чистых гомогенных антител. Антитела можно выделять и очищать стандартными методами, применяемыми для выделения и очистки антител, и на методы не накладывается никаких ограничений. Например, антитела можно выделять и очищать, подбирая и объединяя соответствующим образом методы хроматографии на колонках, фильтрации, ультрафильтрации, обессоливания, осаждения растворителем, экстракции растворителем, дистилляции, иммунопреципитации, электрофореза в полиакриламидном геле в присутствии ДСН, изоэлектрического фокусирования, диализа, перекристаллизации и т.п.
В предпочтительном объекте изобретения гистидин/аспартатный буфер в композиции, предлагаемой в настоящем изобретении, представляет собой буфер, полученный путем титрования раствора, такого как водный раствор, дополненный гистидином в виде свободной аминокислоты, с использованием жидкости, такой как водный раствор, содержащий аспарагиновую кислоту в виде свободной аминокислоты. В альтернативном варианте буфер можно приготавливать путем добавления аминокислот в обратном порядке или путем прямого титрования с использованием порошков.
При создании настоящего изобретения проводили тесты по замораживанию-оттаиванию, тесты на ускоренное старение при повышенной температуре, тесты на долговременное хранение и тесты по криоконсервации для оценки влияния различных добавок на стабильность образцов, содержащих указанные выше антитела, в процессе их хранения. В результате этого при создании настоящего изобретения было установлено, что образование агрегатов и/или компонентов с зарядовой гетерогенностью подавляется при использовании гистидинового буфера по сравнению с вариантами, в которых применяют фосфатный буфер, нитратный буфер и ацетатный буфер.
Кроме того, при создании настоящего изобретения было установлено, что образование агрегатов и/или компонентов с зарядовой гетерогенностью подавляется при использовании аспарагиновой кислоты, которая представляет собой кислую аминокислоту, в качестве вида противоиона для буфера, т.е. путем применения в качестве буфера гистидин/аспартатного буфера.
Концентрация (количество) гистидин/аспартатного буфера в композициях, предлагаемых в настоящем изобретении, предпочтительно составляет от 10 до 100 мМ и более предпочтительно от 10 до 40 мМ. Кроме того, примеры концентрации (количества) гистидин/аспартатного буфера включают 10, 20 и 40 мММ.
Кроме того, было установлено, что по сравнению с хлоридом натрия, который согласно опубликованным данным должен являться стабилизатором для содержащих антитело композиций, добавление аргинина оказывает более высокие стабилизирующие воздействия (т.е. воздействия, подавляющие образование агрегатов, и воздействия, подавляющие образование компонентов с зарядовой гетерогенностью).
Концентрация (количество) аргинина в композициях, предлагаемых в настоящем изобретении, предпочтительно составляет от 100 до 300 мМ. Примеры концентрации (количества) аргинина включают 100, 150, 200 и 300 мМ.
Значение рН раствора композиции, предлагаемой в настоящем изобретении, предпочтительно составляет от 4,5 до 6,5, более предпочтительно от 5,5-6,5, и еще более предпочтительно от 5,5 до 6. Примеры значений рН включают 5,5 и 6.
Поверхностно-активные вещества, содержащиеся в композициях, предлагаемых в настоящем изобретении, представляют собой, например, полисорбат 20 (PS20) и плуроник F-68 (полоксамер 188: полиэтилен(160)полиоксипропилен(30)гликоль), при этом полоксамер 188 является наиболее предпочтительным. Количество полоксамера 188 (или РХ188), добавленного к композиции, предлагаемой в настоящем изобретении, предпочтительно составляет от 0,2 до 1 мг/мл. Примеры количества полоксамера 188, добавленного к композиции, включают 0,2, 0,5, 0,8 и 1 мг/мл.
Гистидин, применяемый согласно настоящему изобретению, может представлять собой сам гистидин или его производное, при этом наиболее предпочтительным является L-гистидин. Аргинин, применяемый согласно настоящему изобретению, может представлять собой сам аргинин, его производное или его соль, при этом наиболее предпочтительным является L-аргинин или его соль. Предпочтительные соли аргинина включают аспартат аргинина и глутамат аригинина.
Композиции, предлагаемые в настоящем изобретении, могут дополнительно содержать аминокислоты. Предпочтительными аминокислотами для применения согласно настоящему изобретению являются встречающиеся в естественных условиях аминокислоты или производные аминокислот, при этом наиболее предпочтительными аминокислотами являются L-метионин и L-пролин.
Композиции, предлагаемые в настоящем изобретении, могут дополнительно содержать сахара. Предпочтительными сахарами для применения согласно настоящему изобретению являются сахароза, трегалоза, меглумин и сорбит.
Количество аминокислоты или сахара, добавленного к композициям, предлагаемым в настоящем изобретении, как правило, составляет от 1 до 1000 мМ, предпочтительно от 5 до 500 мМ и более предпочтительно от 10 до 300 мМ.
Композиции, предлагаемые в настоящем изобретении, могут дополнительно содержать неорганические соли. Предпочтительными неорганическими солями, применяемыми согласно настоящему изобретению, являются соли магния и соли кальция.
Кроме того, предпочтительно, чтобы композиции, предлагаемые в настоящем изобретении, не содержали анионов, отличных от аспарагиновой кислоты, применяемой в качестве противоиона для буфера (забуферивающий агент) или стабилизатора. В одном из вариантов осуществления изобретения примеры таких композиций включают композиции, которые практически не содержат иона хлора или иона ацетата. «Практически не содержат иона хлора или иона ацетата» означает, что концентрации иона хлора и иона ацетата, составляют, например, 5 мМ или менее, предпочтительно 2 мМ или менее и более предпочтительно 1 мМ или менее. Обладающие высокой стабильностью композиции, которые содержат антитело, можно получать без повышения осмотического давления путем применения аспарагиновой кислоты, которая в качестве противоиона обладает сильным стабилизирующим действием, и за счет того, что практически не включают ион хлора или ион ацетата, обладающие слабым стабилизирующим действием.
При необходимости композиции, предлагаемые в настоящем изобретении, могут дополнительно содержать соответствующие криопротектанты, суспендирующие агенты, солюбилизирующие агенты, обеспечивающие изотоничность агенты, консерванты, ингибиторы абсорбции, разбавители, эксципиенты, регуляторы значения рН, анальгетики, содержащие серу восстановители, антиоксиданты и т.п.
Криопротектанты включают, например, сахара, такие как трегалоза, сахароза и сорбит.
Солюбилизирующие агенты включают, например, отвержденное полиоксиэтиленом касторовое масло, полисорбат 80, никотинамид, полиоксиэтиленсорбитанмонолаурат, макрогол и этиловый эфир жирных кислот и касторового масла.
Обеспечивающие изотоничность агенты включают, например, хлорид натрия, хлорид калия и хлорид кальция.
Консерванты включают, например, метил-пара-гидроксибензоат, этил-пара-гидроксибензоат, сорбиновую кислоту, фенол, крезол и хлоркрезол.
Ингибиторы адсорбции включают, например, человеческий сывороточный альбумин, лецитин, декстран, сополимер этиленоксида и пропиленоксида, гидроксипропилцеллюлозу, метилцеллюлозу, отвержденное полиоксиэтиленом касторовое масло и полиэтиленгликоль.
Содержащие серу восстановители включают, например, агенты, содержащие сульфгидрильные группы, такие как N-ацетилцистеин, N-ацетилгомоцистеин, тиоктовую кислоту, тиодигликоль, тиоэтаноламин, тиоглицерин, тиосорбит, тиогликолевую кислоту и ее соли, тиосульфат натрия, глутатион и тиоалкановые кислоты, имеющие от одного до семи атомов углерода.
Антиоксиданты включают, например, эриторбовую кислоту, дибутилгидрокситолуол, бутилгидроксианизол, α-токоферол, ацетат токоферола, L-аскорбиновую кислоту и ее соли, пальмитат L-аскорбиновой кислоты, стеарат L-аскорбиновой кислоты, бисульфит натрия, сульфит натрия, триамилгаллат, пропилгаллат и хелатирующие агенты, такие как динатриевая соль этилендиаминтетрауксусной кислоты (ЭДТК), пирофосфат натрия и метафосфат натрия.
В одном из вариантов осуществления изобретения композиция, предлагаемая в настоящем изобретении, представляет собой следующую композицию:
содержащую антитело композицию в виде раствора с рН 6, которая содержит:
биспецифическое антитело в концентрации от 20 до 180 мг/мл, в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, где первый полипептид содержит Н-цепь, содержащую аминокислотную последовательность SEQ ID NO: 10, второй полипептид содержит Н-цепь, содержащую аминокислотную последовательность SEQ ID NO: 11, и третий полипептид и четвертый полипептид содержат общую L-цепь, имеющую SEQ ID NO: 12;
L-гистидин/аспартатный буфер в концентрации 20 мМ;
полоксамер 188 в концентрации 0,5 мг/мл; и
L-аргинин в концентрации 150 мМ;
или
содержащую антитело композицию в виде раствора с рН 6, которая содержит:
биспецифическое антитело эмицизумаб (АСЕ910) в концентрации от 20 до 180 мг/мл,
L-гистидин/аспартатный буфер в концентрации 20 мМ;
полоксамер 188 в концентрации 0,5 мг/мл; и
L-аргинин в концентрации 150 мМ.
В другом варианте осуществления изобретения композиция, предлагаемая в настоящем изобретении, представляет собой следующую композицию:
содержащую антитело композицию в виде раствора с рН 6, которая содержит:
биспецифическое антитело в концентрации от 20 до 180 мг/мл, в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, где первый полипептид содержит Н-цепь, содержащую аминокислотную последовательность SEQ ID NO: 10, второй полипептид содержит Н-цепь, содержащую аминокислотную последовательность SEQ ID NO: 11, и третий полипептид и четвертый полипептид содержат общую L-цепь, имеющую SEQ ID NO: 12;
L-гистидин/аспартатный буфер в концентрации 20 мМ;
PS20 в концентрации 0,05 мг/мл; и
L-аргинин в концентрации 150 мМ;
или
содержащую антитело композицию в виде раствора с рН 6, которая содержит:
биспецифическое антитело эмицизумаб (АСЕ910) в концентрации от 20 до 180 мг/мл,
L-гистидин/аспартатный буфер в концентрации 20 мМ;
PS20 в концентрации 0,05 мг/мл; и
L-аргинин в концентрации 150 мМ.
Содержащие антитело композиции, предлагаемые в настоящем изобретении, можно вводить пациенту посредством любого пригодного пути, например, путем болюсной инъекции или непрерывной инфузии в течение определенного периода времени, внутривенно, внутримышечно или подкожно. Предпочтительным является внутривенное введение или подкожное введение.
Доза эмицизумаба (АСЕ910) составляет, например, от 0,001 до 1000 мг/кг, а интервал между введениями составляет по меньшей мере один день или более.
Более конкретно, например, после введения эмицизумаба (АСЕ910) в начальной дозе 1 мг/кг эмицизумаб (АСЕ910) можно вводить в постоянной (поддерживающей) дозе 0,3 мг/кг один раз в неделю. В альтернативном варианте, например, после введения эмицизумаба (АСЕ910) в начальной дозе 3 мг/кг эмицизумаб (АСЕ910) можно вводить в постоянной дозе 1 мг/кг один раз в неделю. В другом примере после введения эмицизумаба (АСЕ910) в начальной дозе 3 мг/кг эмицизумаб (АСЕ910) можно вводить в постоянной дозе 3 мг/кг один раз в неделю.
Содержащие антитело композиции, предлагаемые в настоящем изобретении, можно применять для лечения заболеваний, которые развиваются и/или прогрессируют вследствие снижения уровня или дефицита активности FVIII и/или активированного фактора свертывания крови VIII (FVIIIa). Например, их можно применять для лечения гемофилии А, гемофилии А, при которой образуется ингибитор FVIII/FVIIIa, приобретенной гемофилии А, болезни фон Виллебранда (но, не ограничиваясь только ими).
Другим вариантом осуществления настоящего изобретения является способ стабилизации антитела в содержащей антитело композиции в виде раствора. Предпочтительно способ стабилизации антитела в содержащей антитело композиции в виде раствора включает добавление к раствору гистидин/аспартатного буфера, полоксамера 188 и аргинина.
Другим вариантом осуществления настоящего изобретения является способ снижения ассоциации (образование агрегатов) антитела в содержащей антитело композиции в виде раствора. Предпочтительно способ снижения ассоциации (образование агрегатов) антитела в содержащей антитело композиции в виде раствора включает добавление к раствору гистидин/аспартатного буфера, полоксамера 188 и аргинина.
Кроме того, указанные выше способ стабилизации антитела и способ снижения ассоциации (образование агрегатов) антитела включают добавление к раствору гистидин/аспартатного буфера, полоксамера 188 и аргинина и при этом предпочтительно концентрация антитела составляет от 20 до 180 мг/мл, концентрация гистидин/аспартатного буфера составляет от 10 до 40 мМ, концентрация полоксамера 188 составляет от 0,2 до 1 мг/мл, концентрация аргинина составляет от 100 до 300 мМ и значение рН составляет от 4,5 до 6,5; или более предпочтительно концентрация антитела составляет от 20 до 180 мг/мл, концентрация гистидин/аспартатного буфера составляет 20 мМ, концентрация полоксамера 188 составляет 0,5 мг/мл, концентрация аргинина составляет 150 мМ и значение рН составляет 6.
Другим вариантом осуществления настоящего изобретения является способ снижения уровня компонента с зарядовой гетерогенностью в содержащей антитело композиции. Предпочтительно способ снижения уровня компонента с зарядовой гетерогенностью в содержащей антитело композиции включает добавление к раствору гистидин/аспартатного буфера. Более предпочтительно способ снижения уровня компонента с зарядовой гетерогенностью в содержащей антитело композиции включает добавление к раствору гистидин/аспартатного буфера, при этом концентрация гистидин/аспартатного буфера составляет от 10 до 40 мМ или составляет 20 мМ.
В другом варианте осуществления настоящего изобретения способ снижения уровня компонента с зарядовой гетерогенностью в содержащей антитело композиции включает добавление к раствору гистидин/аспартатного буфера, полоксамера 188 и аргинина. Более предпочтительно, способ снижения уровня компонента с зарядовой гетерогенностью в содержащей антитело композиции включает добавление к раствору гистидин/аспартатного буфера, полоксамера 188 и аргинина, при этом предпочтительно концентрация антитела составляет от 20 до 180 мг/мл, концентрация гистидин/аспартатного буфера составляет от 10 до 40 мМ, концентрация полоксамера 188 составляет от 0,2 до 1 мг/мл, концентрация аргинина составляет от 100 до 300 мМ и значение рН составляет от 4,5 до 6,5, или более предпочтительно концентрация антитела составляет от 20 до 180 мг/мл, концентрация гистидин/аспартатного буфера равна 20 мМ, концентрация полоксамера 188 составляет 0,5 мг/мл, концентрация аргинина равна 150 мМ и значение рН составляет 6.
В указанном выше способе стабилизации антитела, способе снижения ассоциации (образования агрегатов) антитела и способе снижения уровня компонента с зарядовой гетерогенностью антитело предпочтительно представляет собой биспецифическое антитело и более предпочтительно эмицизумаб (АСЕ910).
В контексте настоящего описания объекты, к которым относится выражение «содержащий» включают объекты, к которым относится выражение «практически состоящий из» и объекты, к которым относится выражение «состоящий из».
Численные величины, указанные в настоящем описании, могут варьироваться в определенных пределах, например, в зависимости от инструментария или оборудования, условий проведения измерения и процедуры, применяемых специалистами в данной области, если только они находятся в пределах, позволяющих осуществлять изобретение, например, они могут включать отклонение примерно на 10%.
Все патенты и ссылки, специально процитированные в настоящем описании, полностью включены в указанную заявку в качестве ссылки.
Настоящее изобретение проиллюстрировано ниже с помощью примеров, которые не ограничивают его объем.
Примеры
Пример 1
Подавляющие образование агрегатов воздействия гистидина в процессе ускоренного старения при повышенной температуре гуманизированного антитела IgG4-класса АСЕ910
(1) Материалы
АСЕ910 представляет собой биспецифическое гуманизированное антитело IgG4-класса, распознающее как фактор свертывания крови IX, так и фактор свертывания крови X, которое, как считается, предупреждает кровотечение при гемофилии А посредством функционального замещения активированного фактора свертывания крови VIII.
(2) тестируемые образцы
Получали жидкие составы с рН 6,0, содержащие АСЕ910 в концентрации 100 мг/мл, NaCl в концентрации 150 ммолей/л и один из следующих буферов: фосфатный буфер в концентрации 20 ммолей/л; цитратный буфер в концентрации 20 ммолей/л; ацетатный буфер в концентрации 20 ммолей/л; и гистидиновый буфер в концентрации 20 ммолей/л. В стеклянные флаконы вносили от 5 до 15 мкл соответствующих композиций.
Полученные таким образом содержащие гуманизированное антитело композиции в виде раствора оставляли выстаиваться в терморегулируемой бане при 25°С в течение восьми недель и затем использовали в качестве тестируемых образцов.
(3) Методы измерения и расчета количества агрегатов АСЕ910
Количества агрегатов в образцах измеряли с помощью гель-фильтрации (SEC) с использованием колонки G3000SWXL (фирма Tosoh) с фосфатным буфером (50 ммолей/л, рН 7,0), применяя хлорид кальция в концентрации 300 ммолей/л в качестве подвижной фазы при скорости потока 0,5 мл/мин.
Было установлено, что среди обнаруженных пиков пик с наибольшей площадью и высотой соответствует мономеру, а пики, предшествующие мономеру, в совокупности представляли собой пики, соответствующие агрегатам (виды с большой молекулярной массой, HMWS).
Для всех пиков рассчитывали площади пиков и затем рассчитывали относительную площадь представляющего интерес пика с использованием следующего уравнения:
относительная площадь представляющего интерес пика (%) = 100 × (площадь представляющего интерес пика)/(площадь представляющего интерес пика + общая площадь пика остальных пиков)
(4) Результаты
Полученные результаты представлены в таблице 1.
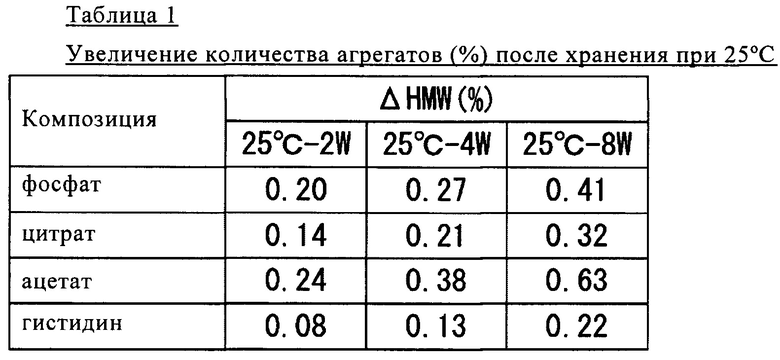
Как продемонстрировано в таблице 1, в случае добавления гистидина в концентрации 20 ммолей/л в образце после ускоренного старения при повышенной температуре 25°С в течение восьми недель выявлено сильное подавляющее образование агрегатов воздействие.
Пример 2
Подавляющие образование агрегатов воздействия, обусловленные концентрацией соли и присутствием аргинина, в процессе ускоренного старения при повышенной температуре и замораживания-оттаивания гуманизированного антитела IgG4-класса АСЕ910
(1) Материалы
Применяли антитело, описанное в примере 1.
(2) Тестируемые образцы
Получали жидкие составы с рН 6,0, содержащие АСЕ910 в концентрации 100 мг/мл, гистидин в концентрации 20 ммолей/л и одну из следующих добавок: NaCl в концентрации 50 ммолей/л; NaCl в концентрации 75 ммолей/л; NaCl в концентрации 150 ммолей/л; и аргинин в концентрации 150 ммолей/л. В стеклянные пузырьки вносили от 5 до 15 мкл соответствующих композиций.
Полученные таким образом содержащие гуманизированное антитело композиции в виде раствора оставляли выстаиваться в терморегулируемой бане при 25°С в течение восьми недель или подвергали десяти циклам замораживания-оттаивания (F/T) (5°С/-20°С) и затем использовали в качестве тестируемых образцов.
(3) Методы измерения и расчета количества агрегатов АСЕ910
Применяли методы, описанные в примере 1.
(4) Результаты
Полученные результаты представлены в таблице 2.
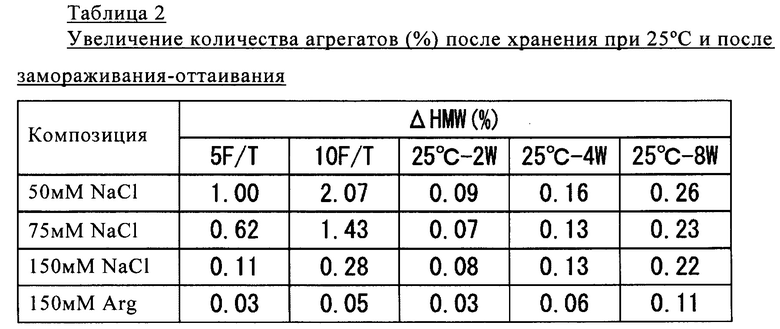
Как продемонстрировано в таблице 2, в случае добавления аргинина в концентрации 150 ммолей/л в образце после ускоренного старения при повышенной температуре 25°С в течение восьми недель и после замораживания-оттаивания выявлено сильное подавляющее образование агрегатов воздействие.
Пример 3
Подавляющие образование агрегатов воздействия, обусловленные аспарагиновой кислотой, в процессе замораживания-оттаивания гуманизированного антитела IgG4-класса АСЕ910
(1) Материалы
Применяли антитело, описанное в примере 1.
(2) Тестируемые образцы
Получали жидкие составы с рН 6,0, содержащие АСЕ910 в концентрации 100 мг/мл, гистидин в концентрации 20 ммолей/л, и NaCl в концентрации 150 ммолей/л или натриевую соль L-аспарагиновой кислоты в концентрации 150 ммолей/л в качестве противоиона. В стеклянные пузырьки вносили от 5 до 15 мкл соответствующих композиций.
Полученные таким образом содержащие гуманизированное антитело композиции в виде раствора подвергали десяти циклам замораживания-оттаивания (F/T) (5°С/-20°С) и затем использовали в качестве тестируемых образцов.
(3) Методы измерения и расчета количества агрегатов АСЕ910
Применяли методы, описанные в примере 1.
(4) Результаты
Полученные результаты представлены в таблице 3.
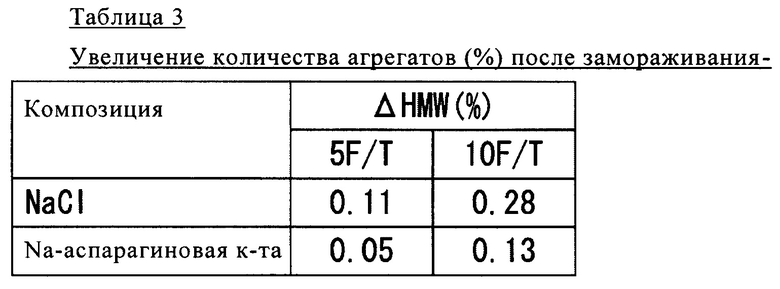
Как продемонстрировано в таблице 3, в случае добавления аспарагиновой кислоты в образце после замораживания-оттаивания выявлено сильное подавляющее образование агрегатов воздействие.
Пример 4
Подавляющие образование агрегатов и компонентов с зарядовой гетерогенностью воздействия при различных значениях рН в процессе ускоренного старения при повышенной температуре гуманизированного антитела IgG4-класса АСЕ910
(1) Материалы
Применяли антитело, описанное в примере 1.
(2) Тестируемые образцы
Получали жидкие составы с рН 6,0, содержащие АСЕ910 в концентрации 100 мг/мл, гистидин-аспарагиновую кислоту в концентрации 20 ммолей/л, и аргинин-аспарагиновую кислоту в концентрации 150 ммолей/л, и имеющие значение рН 4,5, 5,0, 5,5, 6,0, 6,5, 7,0 или 7,5. В стеклянные пузырьки вносили от 5 до 15 мкл соответствующих композиций.
Полученные таким образом содержащие гуманизированное антитело композиции в виде раствора оставляли выстаиваться в терморегулируемой бане при 25°С в течение восьми недель и затем использовали в качестве тестируемых образцов.
(3) Методы измерения и расчета количества агрегатов АСЕ910
Применяли методы, описанные в примере 1.
(4) Методы измерения и расчета количества компонентов АСЕ910 с зарядовой гетерогенностью
Количество компонентов с зарядовой гетерогенностью в образце измеряли с помощью ионообменной хроматографии (IEC) с использованием колонки BioPro QA-F (фирма YMC), применяя буфер Трис-HCl (20 ммолей/л, рН 7,8) в качестве подвижной фазы А и буфер Трис-HCl (20 ммолей/л, рН 7,8), содержащий хлорид натрия (500 ммолей/л), в качестве подвижной фазы Б, при скорости потока 0,5 мл/мин.
Среди обнаруженных пиков пик с наибольшей площадью и высотой обозначали как пик основного вещества, а пики, обнаруженные после пика основного вещества, все в совокупности обозначали как кислотный пик.
Для всех пиков рассчитывали площади пиков и затем рассчитывали относительную площадь представляющего интерес пика с использованием следующего уравнения:
относительная площадь представляющего интерес пика (%) = 100 × (площадь представляющего интерес пика)/(площадь представляющего интерес пика + общая площадь пика остальных пиков)
(5) Результаты
Полученные результаты представлены в таблице 4.
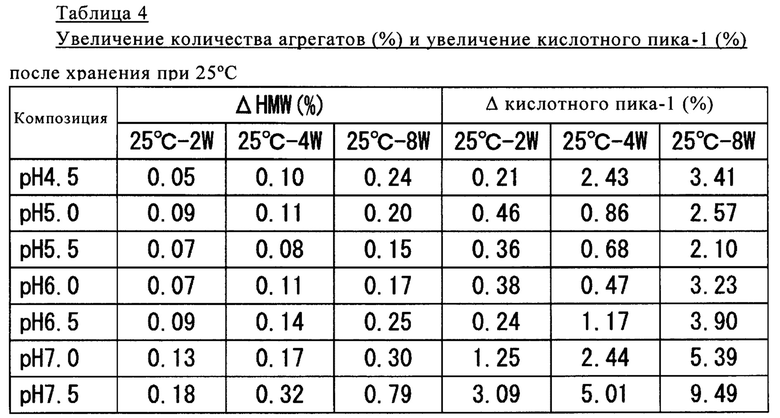
Как продемонстрировано в таблице 4, для образцов с рН от 4,5 до 6,5 и, прежде всего, с рН 5,5 и рН 6,0, после хранения при 25°С обнаружено сильное подавляющее образование агрегатов и компонентов с зарядовой гетерогенностью воздействие.
Пример 5
Подавляющие образование агрегатов и компонентов с зарядовой гетерогенностью зависящие от концентрации гистидина воздействия в процессе ускоренного старения при повышенной температуре гуманизированного антитела IgG4-класса АСЕ910
(1) Материалы
Применяли антитело, описанное в примере 1.
(2) Тестируемые образцы
Получали жидкие составы с рН 6,0, содержащие АСЕ910 в концентрации 100 мг/мл, аргинин в концентрации 150 ммолей/л и гистидин-аспарагиновую кислоту в концентрации 5, 10, 20 или 40 ммолей/л. В стеклянные пузырьки вносили от 5 до 15 мкл соответствующих композиций.
Полученные таким образом содержащие гуманизированное антитело композиции в виде раствора оставляли выстаиваться в терморегулируемой бане при 25°С в течение восьми недель и затем использовали в качестве тестируемых образцов.
(3) Методы определения и расчета количества агрегатов АСЕ910
Применяли методы, описанные в примере 1.
(4) Методы измерения и расчета уровня компонентов АСЕ910 с зарядовой гетерогенностью
Применяли методы, описанные в примере 4.
(5) Результаты
Полученные результаты представлены в таблице 5.
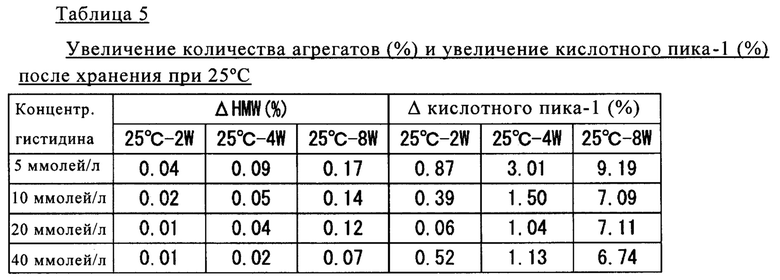
Как продемонстрировано в таблице 5, для образцов, содержащих гистидин-аспарагиновую кислоту в концентрации 10 ммолей/л или более, после хранения при 25°С обнаружено сильное подавляющее образование агрегатов и компонентов с зарядовой гетерогенностью воздействие.
Пример 6
Подавляющие образование агрегатов воздействия, зависящие от концентрации аргинина, в процессе замораживания-оттаивания, ускоренного старения при повышенной температуре и криоконсервации гуманизированного антитела IgG4 АСЕ910
(1) Материалы
Применяли антитело, описанное в примере 1.
(2) Тестируемые образцы
Получали жидкие составы с рН 6,0, содержащие АСЕ910 в концентрации 100 мг/мл, гистидин-аспарагиновую кислоту в концентрации 20 ммолей/л и аргинин в концентрации 75, 100, 150, 200 или 300 ммолей/л. В стеклянные пузырьки вносили от 5 до 15 мкл соответствующих композиций.
Полученные таким образом содержащие гуманизированное антитело композиции в виде раствора подвергали десяти циклам замораживания-оттаивания (5°С/-20°С) или оставляли выстаиваться в терморегулируемой бане при 25°С в течение восьми недель или при -20°С в течение шести месяцев и затем использовали в качестве тестируемых образцов.
(3) Методы измерения и расчета количества агрегатов АСЕ910
Применяли методы, описанные в примере 1.
(4) Результаты
Полученные результаты представлены в таблице 6.
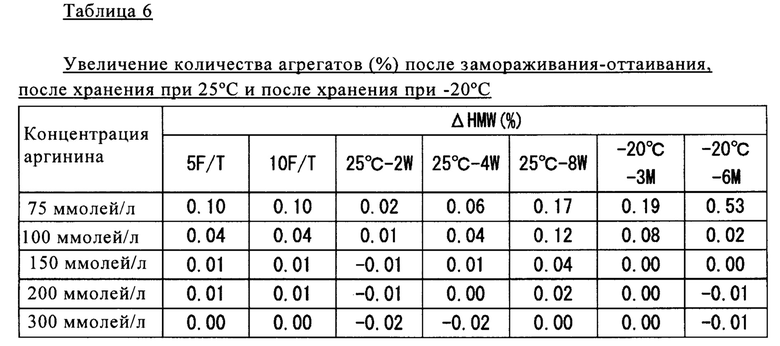
Как продемонстрировано в таблице 6, для образцов, содержащих аргинин в концентрации 100 ммолей/л или более, после замораживания-оттаивания, после хранения при 25°С и после хранения при -20°С обнаружено сильное подавляющее образование агрегатов воздействия.
Пример 7
Подавляющие образование нерастворимых чужеродных субстанций и нерастворимых микрочастиц воздействия, обусловленные полоксамером 188, в процессе хранения при 5°С гуманизированного антитела IgG4-класса АСЕ910
(1) Материалы
Применяли антитело, описанное в примере 1.
(2) Тестируемые образцы
Получали жидкие составы с рН 6,0, содержащие АСЕ910 в концентрации 80 мг/мл, гистидин-аспарагиновую кислоту в концентрации 20 ммолей/л, аргинин в концентрации 150 ммолей/л и одну из следующих добавок: полоксамер 188 в концентрации 0 мг/мл; полоксамер 188 в концентрации 0,2 мг/мл; полоксамер 188 в концентрации 0,5 мг/мл; полоксамер 188 в концентрации 1,0 мг/мл; полисорбат 20 в концентрации 0,05 мг/мл и полисорбат 20 в концентрации 1,0 мг/мл. В стеклянные пузырьки вносили по 1,0 мл соответствующих композиций.
Полученные таким образом содержащие гуманизированное антитело композиции в виде раствора оставляли выстаиваться в холодильнике при 5°С в течение пяти месяцев и затем использовали в качестве тестируемых образцов.
(3) Метод обнаружения нерастворимых чужеродных субстанций
Оценивали присутствие нерастворимых чужеродных субстанций, для чего помещали образец на платформу для образца на стенд для визуального исследования, вращали платформу и обследовали пузырек.
(4) Метод измерения количества нерастворимых микрочастиц
Количество нерастворимых микрочастиц в растворе определяли с помощью счетчика микрочастиц в жидкости (фирма Hach Ultra Analytics, модель 9703).
(5) Результаты
Полученные результаты представлены в таблице 7.
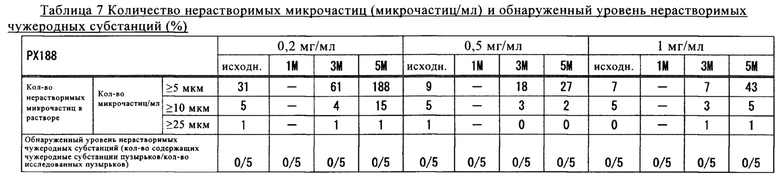
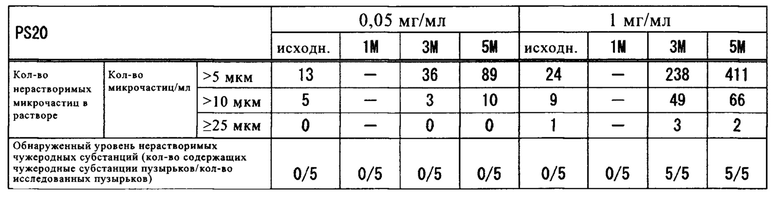
Как продемонстрировано в таблице 7, для образцов, содержащих PS20 в концентрации 0,05 мг/мл, и образцов, содержащих полоксамер 188 в концентрации 0,2 мг/мл или более, после хранения при 5°С обнаружено сильное подавляющее образование нерастворимых микрочастиц и чужеродных субстанций воздействие.
Пример 8
Подавляющие образование нерастворимых чужеродных субстанций и нерастворимых микрочастиц воздействия, обусловленные полоксамером 188, в процессе осуществления теста на стресс при встряхивании и хранения в условиях замораживания-оттаивания гуманизированного антитела IgG4-класса АСЕ910
(1) Материалы
Применяли антитело, описанное в примере 1.
(2) Тестируемые образцы
Получали жидкие составы с рН 6,0, содержащие АСЕ910 в концентрации 150 мг/мл, гистидин-аспарагиновую кислоту в концентрации 20 ммолей/л, аргинин-аспарагиновую кислоту в концентрации 150 ммолей/л и одну из следующих добавок: полоксамер 188 в концентрации 0 мг/мл; полоксамер 188 в концентрации 0,2 мг/мл; полоксамер 188 в концентрации 0,5 мг/мл; и полоксамер 188 в концентрации 0,8 мг/мл. В стеклянные пузырьки вносили по 0,9 мл соответствующих композиций.
Полученные таким образом содержащие гуманизированное антитело композиции в виде раствора подвергали встряхиванию в течение 24 ч при скорости 200 колебаний/мин с использованием шейкера при комнатной температуре или десяти циклам замораживания-оттаивания (5°С/-20°С) и затем использовали в качестве тестируемых образцов.
(3) Метод обнаружения нерастворимых чужеродных субстанций
Применяли метод, описанный в примере 7.
(4) Метод измерения количества нерастворимых микрочастиц
Применяли метод, описанный в примере 7.
(5) Результаты
Полученные результаты представлены в таблице 8 и на фиг. 1 и 2.
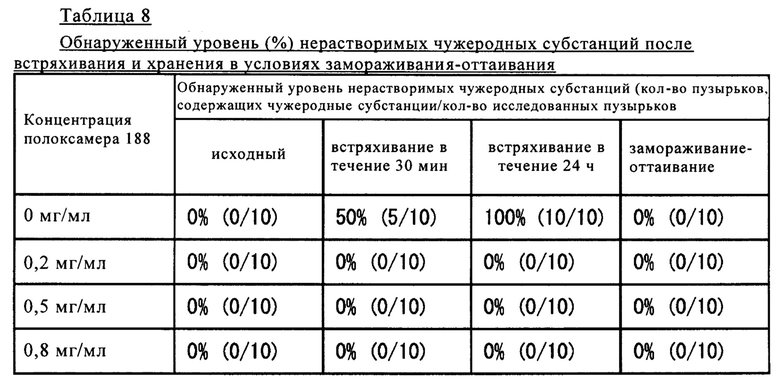
Как продемонстрировано в таблице 8 и на фиг. 1 и 2, для образцов, содержащих полоксамер 188 в концентрации 0,2 мг/мл или более, после подвергания тесту на стресс при встряхивании и хранения в условиях замораживания-оттаивания обнаружено сильное подавляющее образование нерастворимых микрочастиц и чужеродных субстанций воздействие.
Пример 9
Воздействия концентрации гуманизированного антитела IgG4-класса АСЕ910 на стабильность в процессе ускоренного старения при повышенной температуре и хранения в условиях замораживания-оттаивания
(1) Материалы
Применяли антитело, описанное в примере 1.
(2) Тестируемые образцы
Получали жидкие составы с рН 6,0, содержащие гистидин-аспарагиновую кислоту в концентрации 20 ммолей/л, аргинин-аспарагиновую кислоту в концентрации 150 ммолей/л, полоксамер 188 в концентрации 0,5 мг/мл и АСЕ910 в концентрации 20, 30, 40, 120, 150 или 180 мг/мл. В стеклянные пузырьки вносили по 0,65 мл соответствующих композиций.
Полученные таким образом содержащие гуманизированное антитело композиции в виде раствора оставляли выстаиваться в терморегулируемой бане при 40°С в течение восьми недель или подвергали пяти или десяти циклам замораживания-оттаивания (25°С/-20°С) и затем использовали в качестве тестируемых образцов.
(3) Методы измерения и расчета количества агрегатов АСЕ910
Применяли методы, описанные в примере 1.
(4) Методы измерения и расчета уровня компонентов АСЕ910 с зарядовой гетерогенностью
Количество компонентов с зарядовой гетерогенностью в образце измеряли с помощью анионообменной хроматографии (AIEC) с применением колонки TSKgel Q-STAT (фирма Waters), используя буфер Трис-HCl (50 ммолей/л, рН 8,0) в качестве подвижной фазы А и буфер Трис-HCl (50 ммолей/л, рН 8,0), содержащий хлорид натрия (200 ммолей/л) в качестве подвижной фазы Б при скорости потока 0,5 мл/мин.
Среди обнаруженных пиков пик с наибольшей площадью и высотой определяли как пик основного вещества, пики, обнаруженные раньше пика основного вещества, в совокупности обозначали как  пики, а пики, обнаруженные после пика основного вещества, в совокупности обозначали как кислотные пики.
пики, а пики, обнаруженные после пика основного вещества, в совокупности обозначали как кислотные пики.
Кроме того, количество компонентов с зарядовой гетерогенностью в образце измеряли с помощью катионообменной хроматографии (CIEC) с применением колонки ProPac WCX-10G (фирма Thermo Scientific) с использованием буфера, содержащего Трис в концентрации 9,6 ммоля/л, пиперазин в концентрации 6,0 ммолей/л и имидазол в концентрации 11.0 ммолей/л (рН 6,0), в качестве подвижной фазы А и буфер, содержащий Трис в концентрации 9,6 ммоля/л, пиперазин в концентрации 6,0 ммолей/л, имидазол в концентрации 11,0 ммолей/л и NaCl в концентрации 100 ммолей/л (рН 10,1), в качестве подвижной фазы Б при скорости потока 0,5 мл/мин.
Среди обнаруженных пиков пик с наибольшей площадью и высотой определяли как соответствующий бифункциональному антителу пик (БиАт-пик, пики, обнаруженные раньше БиАт-пика, в совокупности обозначали как Pre-пики, а пики, обнаруженные после БиАт-пика, в совокупности обозначали как Post-пики.
Для всех пиков рассчитывали площади пиков и затем рассчитывали относительную площадь представляющего интерес пика с использованием следующего уравнения:
относительная площадь представляющего интерес пика (%) = 100 × (площадь представляющего интерес пика)/(площадь представляющего интерес пика + общая площадь пика остальных пиков)
(4) Результаты
Полученные результаты представлены в таблице 9. Обозначения «SE», «АЕ» и «СЕ» указывают на то, что результаты получены методом гель-фильтрации, анионообменной хроматографии и катионообменной хроматографии соответственно.
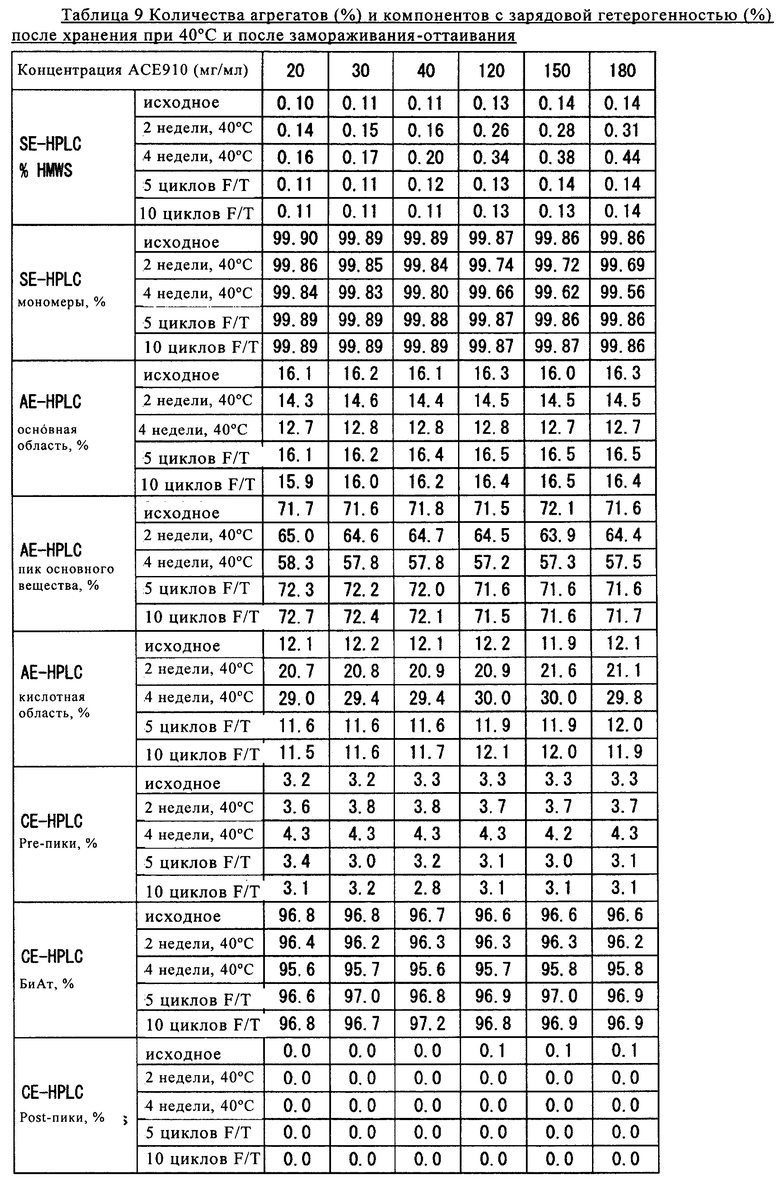
Данные, представленные в таблице 9, в которой сравниваются образцы, содержащие АСЕ910 в концентрациях от 20 мг/мл до 180 мг/мл, убедительно демонстрируют, что образцы обладают эквивалентной достаточной стабильностью после хранения при 40°С и после замораживания-оттаивания.
Промышленная применимость
По сравнению с обычными композициями содержащие антитело композиции в виде раствора, предлагаемые в настоящем изобретении, обладают более высокой стабильностью в растворенном состоянии и характеризуются пониженным образованием агрегатов белков, таких как молекулы антитела, после хранения при низких температурах, температуре окружающей среды и высоких температурах, а также после замораживания-оттаивания. Содержащие антитело композиции в виде раствора, предлагаемые в настоящем изобретении, в которых затруднено прохождение вредных реакций, можно применять, например, для лечения гемофилии А путем подкожного введения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Чугаи Сейяку Кабусики Кайся
<120> Препарат, содержащий антитело
<130> C1-A1602P
<140> PCT/JP2017/016658
<141> 2017-04-27
<150> JP 2016-090590
<151> 2016-04-28
<160> 15
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region CDR1
<400> 1
Tyr Tyr Asp Ile Gln
1 5
<210> 2
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region CDR2
<400> 2
Ser Ile Ser Pro Ser Gly Gln Ser Thr Tyr Tyr Arg Arg Glu Val Lys
1 5 10 15
Gly
<210> 3
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region CDR3
<400> 3
Arg Thr Gly Arg Glu Tyr Gly Gly Gly Trp Tyr Phe Asp Tyr
1 5 10
<210> 4
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region CDR1
<400> 4
Asp Asn Asn Met Asp
1 5
<210> 5
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region CDR2
<400> 5
Asp Ile Asn Thr Arg Ser Gly Gly Ser Ile Tyr Asn Glu Glu Phe Gln
1 5 10 15
Asp
<210> 6
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region CDR3
<400> 6
Arg Lys Ser Tyr Gly Tyr Tyr Leu Asp Glu
1 5 10
<210> 7
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region CDR1
<400> 7
Lys Ala Ser Arg Asn Ile Glu Arg Gln Leu Ala
1 5 10
<210> 8
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region CDR2
<400> 8
Gln Ala Ser Arg Lys Glu Ser
1 5
<210> 9
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region CDR3
<400> 9
Gln Gln Tyr Ser Asp Pro Pro Leu Thr
1 5
<210> 10
<211> 448
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain
<400> 10
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Tyr
20 25 30
Asp Ile Gln Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Pro Ser Gly Gln Ser Thr Tyr Tyr Arg Arg Glu Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Thr Gly Arg Glu Tyr Gly Gly Gly Trp Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Lys Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn Arg Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 11
<211> 444
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain
<400> 11
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asn
20 25 30
Asn Met Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Asn Thr Arg Ser Gly Gly Ser Ile Tyr Asn Glu Glu Phe
50 55 60
Gln Asp Arg Val Ile Met Thr Val Asp Lys Ser Thr Asp Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr His Cys
85 90 95
Ala Arg Arg Lys Ser Tyr Gly Tyr Tyr Leu Asp Glu Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
260 265 270
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440
<210> 12
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain
<400> 12
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Arg Asn Ile Glu Arg Gln
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Glu Leu Leu Ile
35 40 45
Tyr Gln Ala Ser Arg Lys Glu Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Arg Tyr Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Asp Pro Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 13
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 13
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Tyr
20 25 30
Asp Ile Gln Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Pro Ser Gly Gln Ser Thr Tyr Tyr Arg Arg Glu Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Thr Gly Arg Glu Tyr Gly Gly Gly Trp Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 14
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 14
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asn
20 25 30
Asn Met Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Asn Thr Arg Ser Gly Gly Ser Ile Tyr Asn Glu Glu Phe
50 55 60
Gln Asp Arg Val Ile Met Thr Val Asp Lys Ser Thr Asp Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr His Cys
85 90 95
Ala Arg Arg Lys Ser Tyr Gly Tyr Tyr Leu Asp Glu Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 15
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region
<400> 15
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Arg Asn Ile Glu Arg Gln
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Glu Leu Leu Ile
35 40 45
Tyr Gln Ala Ser Arg Lys Glu Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Arg Tyr Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Asp Pro Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ АНТИ-TRBV9 АНТИТЕЛА И ЕЕ ПРИМЕНЕНИЕ | 2022 |
|
RU2826886C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ПРЕДУПРЕЖДЕНИЯ И/ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ, КОТОРОЕ РАЗВИВАЕТСЯ ИЛИ ПРОГРЕССИРУЕТ ВСЛЕДСТВИЕ СНИЖЕНИЯ ИЛИ УТРАТЫ АКТИВНОСТИ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ VIII И/ИЛИ АКТИВИРОВАННОГО ФАКТОРА СВЕРТЫВАНИЯ КРОВИ VIII | 2015 |
|
RU2721910C2 |
| МУЛЬТИСПЕЦИФИЧЕСКАЯ АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, ОБЛАДАЮЩАЯ ЗАМЕЩАЮЩЕЙ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТЬЮ КОФАКТОРА КОАГУЛИРУЮЩЕГО ФАКТОРА КРОВИ VIII, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ УКАЗАННУЮ МОЛЕКУЛУ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2018 |
|
RU2812909C2 |
| АНТИТЕЛО, КОТОРОЕ ОБЛАДАЕТ СПОСОБНОСТЬЮ НЕЙТРАЛИЗОВАТЬ СУБСТАНЦИЮ, ОБЛАДАЮЩУЮ АКТИВНОСТЬЮ, АЛЬТЕРНАТИВНОЙ ФУНКЦИИ ФАКТОРА СВЕРТЫВАНИЯ VIII (FVIII) | 2015 |
|
RU2737145C2 |
| СОВМЕСТНЫЕ СОСТАВЫ АНТИ-LAG3 АНТИТЕЛА И АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2822192C2 |
| СПОСОБ ИЗМЕРЕНИЯ РЕАКТИВНОСТИ FVIII | 2015 |
|
RU2752595C2 |
| ВАРИАНТЫ FC-ОБЛАСТИ С ИЗМЕНЕННЫМ СВЯЗЫВАНИЕМ С НЕОНАТАЛЬНЫМ FC-РЕЦЕПТОРОМ (FCRN) ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2830231C2 |
| АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ РЕЦЕПТОРА ИНТЕРЛЕЙКИНА 36 (IL-36R) | 2016 |
|
RU2745898C2 |
| СОСТАВ, СОДЕРЖАЩИЙ АНТИТЕЛО | 2019 |
|
RU2806628C2 |
| АНТИТЕЛА К CD38 И СОСТАВЫ | 2020 |
|
RU2826957C2 |

Группа изобретений относится к медицине и касается содержащей антитело композиции в виде раствора с pH от 4,5 до 6,5 для лечения заболеваний, которые развиваются и/или прогрессируют из-за уменьшения или дефицита активности FVIII и/или активированного фактора свертывания крови VIII , которая содержит биспецифическое антитело в концентрации от 20 до 180 мг/мл, в котором первый полипептид и третий полипептид образуют пару, и второй полипептид и четвертый полипептид образуют пару, где первый полипептид содержит H-цепь, содержащую аминокислотные последовательности CDR 1, 2 и 3 H-цепи, имеющие SEQ ID NO: 1, 2 и 3 (CDR H-цепи Q499) соответственно, второй полипептид содержит H-цепь, содержащую аминокислотные последовательности CDR 1, 2 и 3 H-цепи, имеющие SEQ ID NO: 4, 5 и 6 (CDR H-цепи J327) соответственно, а третий полипептид и четвертый полипептид содержат общую L-цепь, содержащую аминокислотные последовательности CDR 1, 2 и 3 L-цепи SEQ ID NO: 7 8 и 9 (CDR L-цепи L404) соответственно, гистидин/аспартатный буфер в концентрации 20 мМ, полоксамер 188 в концентрации от 0,2 до 1 мг/мл и аргинин в концентрации от 100 до 300 мМ. Группа изобретений также касается способа стабилизации антитела в содержащей антитело композиции в виде раствора, который включает добавление гистидин/аспартатного буфера, полоксамера 188 и аргинина к раствору, способа подавления образования агрегатов антитела в содержащей антитело композиции в виде раствора, который включает добавление гистидин/аспартатного буфера, полоксамера 188 и аргинина к раствору. Группа изобретений обеспечивает улучшенную стабильность антитела в растворе. 5 н. и 7 з.п. ф-лы, 9 пр., 2 ил., 9 табл.
1. Содержащая антитело композиция в виде раствора с pH от 4,5 до 6,5 для лечения заболеваний, которые развиваются и/или прогрессируют из-за уменьшения или дефицита активности FVIII и/или активированного фактора свертывания крови VIII , которая содержит биспецифическое антитело в концентрации от 20 до 180 мг/мл, в котором первый полипептид и третий полипептид образуют пару, и второй полипептид и четвертый полипептид образуют пару, где первый полипептид содержит H-цепь, содержащую аминокислотные последовательности CDR 1, 2 и 3 H-цепи, имеющие SEQ ID NO: 1, 2 и 3 (CDR H-цепи Q499) соответственно, второй полипептид содержит H-цепь, содержащую аминокислотные последовательности CDR 1, 2 и 3 H-цепи, имеющие SEQ ID NO: 4, 5 и 6 (CDR H-цепи J327) соответственно, а третий полипептид и четвертый полипептид содержат общую L-цепь, содержащую аминокислотные последовательности CDR 1, 2 и 3 L-цепи SEQ ID NO: 7, 8 и 9 (CDR L-цепи L404) соответственно, гистидин/аспартатный буфер в концентрации 20 мМ, полоксамер 188 в концентрации от 0,2 до 1 мг/мл и аргинин в концентрации от 100 до 300 мМ.
2. Содержащая антитело композиция в виде раствора по п. 1, в которой в биспецифическом антителе первый полипептид и третий полипептид образуют пару, и второй полипептид и четвертый полипептид образуют пару, где первый полипептид содержит H-цепь, содержащую аминокислотную последовательность SEQ ID NO: 10, второй полипептид содержит H-цепь, содержащую аминокислотную последовательность SEQ ID NO: 11, а третий полипептид и четвертый полипептид содержат общую L-цепь, содержащую SEQ ID NO: 12.
3. Содержащая антитело композиция в виде раствора по п. 1 или 2, в которой концентрация полоксамера 188 составляет 0,5 мг/мл.
4. Содержащая антитело композиция в виде раствора по одному из пп. 1-3, в которой указанное значение pH составляет 6.
5. Содержащая антитело композиция в виде раствора по одному из пп. 1-4, в которой концентрация аргинина составляет 150 мМ.
6. Содержащая антитело композиция в виде раствора по одному из пп. 1-5, которая не содержит иона хлора или иона ацетата.
7. Содержащая антитело композиция в виде раствора с pH 6 для лечения заболеваний, которые развиваются и/или прогрессируют из-за уменьшения или дефицита активности FVIII и/или активированного фактора свертывания крови VIII, которая содержит биспецифическое антитело в концентрации от 20 до 180 мг/мл, в котором первый полипептид и третий полипептид образуют пару, и второй полипептид и четвертый полипептид образуют пару, где первый полипептид содержит H-цепь, содержащую аминокислотную последовательность SEQ ID NO: 10, второй полипептид содержит H-цепь, содержащую аминокислотную последовательность SEQ ID NO: 11, а третий полипептид и четвертый полипептид содержат общую L-цепь SEQ ID NO: 12, L-гистидин/аспартатный буфер в концентрации 20 мМ, полоксамер 188 в концентрации 0,5 мг/мл и L-аргинин в концентрации 150 мМ.
8. Содержащая антитело композиция в виде раствора по одному из пп. 1-7 для подкожного введения.
9. Содержащая антитело композиция в виде раствора по одному из пп. 1-8 для лечения гемофилии A.
10. Способ стабилизации антитела в содержащей антитело композиции в виде раствора, который включает добавление гистидин/аспартатного буфера, полоксамера 188 и аргинина к раствору, где концентрация гистидин/аспартатного буфера составляет от 20 мМ, концентрация полоксамера 188 составляет от 0,2 до 1 мг/мл, и концентрация аргинина составляет от 100 до 300 мМ, где антитело представляет собой биспецифическое антитело в концентрации от 20 до 180 мг / мл, в котором первый полипептид и третий полипептид образуют пару, и второй полипептид и четвертый полипептид образуют пару, где первый полипептид содержит H-цепь, содержащую аминокислотную последовательность SEQ ID NO: 10, второй полипептид содержит H-цепь, содержащую аминокислотную последовательность SEQ ID NO: 11, и третий полипептид и четвертый полипептид содержат общую L-цепь SEQ ID NO: 12.
11. Способ подавления образования агрегатов антитела в содержащей антитело композиции в виде раствора, который включает добавление гистидин/аспартатного буфера, полоксамера 188 и аргинина к раствору, где концентрация гистидин/аспартатного буфера составляет 20 мМ, концентрация полоксамера 188 составляет от 0,2 до 1 мг/мл, и концентрация аргинина составляет от 100 до 300 мМ, где антитело представляет собой биспецифическое антитело в концентрации от 20 до 180 мг/мл, в котором первый полипептид и третий полипептид образуют пару, и второй полипептид и четвертый полипептид образуют пару, где первый полипептид содержит H-цепь, содержащую аминокислотную последовательность SEQ ID NO: 10, второй полипептид содержит H-цепь, содержащую аминокислотную последовательность SEQ ID NO: 11, и третий и четвертый полипептиды содержат общую L-цепь SEQ ID NO: 12.
12. Способ снижения уровня компонента с зарядовой гетерогенностью в содержащей антитело композиции, которая включает добавление гистидин/аспартатного буфера, полоксамера 188 и аргинина в раствор, где концентрация гистидин/аспартатного буфера составляет 20 мМ, концентрация полоксамера 188 составляет от 0,2 до 1 мг/мл, и концентрация аргинина составляет от 100 до 300 мМ, где антитело представляет собой биспецифическое антитело в концентрации от 20 до 180 мг/мл, в котором первый полипептид и третий полипептид образуют пару, и второй полипептид и четвертый полипептид образуют пару, где первый полипептид содержит H-цепь, содержащую аминокислотную последовательность SEQ ID NO: 10, второй полипептид содержит H-цепь, содержащую аминокислотную последовательность SEQ ID NO: 11, и третий и четвертый полипептиды содержат общую L-цепь SEQ ID NO: 12, и где компонент с гетерогенным зарядом представляет собой компонент, имеющий поверхностные заряды белка, которые отличаются от зарядов основного компонента из-за дезамидирования, окисления или гидролиза.
| СМЕСИТЕЛЬ СЫПУЧИХ МАТЕРИАЛОВ ГРАВИТАЦИОННОГО ТИПА | 2013 |
|
RU2526963C1 |
| СПОСОБ ТЕРМИЧЕСКОЙ ОБРАБОТКИ МАГНИТОТВЁРДЫХ СПЛАВОВ НА ОСНОВЕ СИСТЕМЫ ЖЕЛЕЗО-ХРОМ-КОБАЛЬТ | 2003 |
|
RU2238985C1 |
| SAMPEI S | |||
| et al., Identification and Multidimensional Optimization of an Asymmetric Bispecific IgG Antibody Mimicking the Function of Factor VIII Cofactor Activity.PLoS One | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
Авторы
Даты
2021-05-19—Публикация
2017-04-27—Подача