Область техники, которой относится настоящее изобретение
Настоящее изобретение относится к антителам и их фрагментам, которые действуют как антагонисты собачьего фактора роста нервов. Настоящее изобретение относится к способам их получения и к терапевтическому применению этих антител и фрагментов в лечении состояний, связанных с фактором роста нервов, таких как боль, имеющие отношение к боли нарушения и состояния, которые приводят в результате к появлению хронической боли у собак.
Предшествующий уровень техники настоящего изобретения
Фактор роста нервов (NGF) представляет собой природный секретируемый белок, который состоит из полипептидных цепей альфа, бета и гамма. NGF является членом семейства нейротрофинов и задействован в ряде различных ролей. NGF способствует выживанию и дифференцировке сенсорных и симпатических нейронов и участвует в передаче сигнала через два мембраносвязанных рецептора, р75, низкоаффинный рецептор NGF, и TrkA, трансмембранная тирозинкиназа и высокоаффинный рецептор NGF. Связывание NGF с TrkA или р75 приводит в результате к повышению экспрессии нейропептидов в сенсорных нейронах.
Было описано применение антагонистов NGF для лечения боли и болевой чувствительности у людей (Cattaneo А., Сшт.Ор. Mol. Ther. 2010 12(1):94-106). Например, в международной патентной заявке № WO 2006/131951 описана гуманизированная форма крысиного моноклонального антитела альфаD11 (αD11, aD11). Антитело αD11 характеризуется специфичностью связывания с мышиным NGF, но также, как известно, связывается с человеческой и крысиной формами NGF. Перед введением людям требуется гуманизация происходящего из крысы моноклонального антитела αD11 с целью сведения к минимуму выработки нейтрализующих антител, что приводит в результате к образованию человеческих антител против мышиного антигена (НАМА), направленных против происходящих из крысы антител. Более того, замена мышиных константных доменов на человеческие константные домены дает возможность выбора последующих эффекторных функций.
Купирование боли у собак в настоящее время обеспечивают посредством введения анальгезирующих лекарственных средств нескольких классов, в том числе местных анестезирующих средств и анестезирующих средств общего действия, опиоидных анальгезирующих средств, α2-агонистов, нестероидных противовоспалительных средств (NSAID) и стероидов. Каждый из них требует частого введения, а также характеризуется ограничениями по эффективности и безопасности. Соответственно, существует потребность в редко принимаемом, действующем длительное время и эффективном виде средства облегчения боли для собак, страдающих от хронической боли, как например, животные с онкологической болью или артритом.
Хотя NGF экспрессируется в собачьих тканях и молекула собачья NGF была охарактеризована (Eisele I. Wood IS. German AJ. Hunter L. Trayhum P." Adipokine gene expression in dog adipose tissues and dog white adipocytes differentiated in primary culture" Hormone & Metabolic Research. 37(8):474-81, 2005 Genbank XP_540250), не было описано ни применение антагониста собачьего NGF, ни применение блокирования опосредованной NGF передачи сигнала у собак для предупреждения или ослабления боли. Применение у собак известных антител, которые действуют как антагонисты) NGF у других видов, не будет осуществимым из-за продукции нейтрализующих антител. Кроме того, продукция химерного антитела, содержащего происходящие от собаки константные домены и вариабельные домены, происходящие из известного антитела против NGF, такого как альфаD11, не может гарантировать связывание с собачьим NGF. Кроме того, такое антитело может проявлять перекрестную реактивность в отношении других целевых эпитопов, которые могут иметься у собак, но отсутствовать у вида, из которого антитело изначально происходит. Кроме того, выработка нейтрализующих антител будет ограничивать длительное терапевтическое введение антитела собакам, что является особенно важным требованием при лечении связанного с хронической болью состояния или ракового состояния. Аналогично, продукция канинизированной формы антитела против NGF с использованием CDR-прививания или родственной технологии также могут приводить к продукции нейтрализующих антител и могут впоследствии проявлять снижение аффинности и авидности связывания антигена. Соответственно, существует серьезная потребность в связывающих элементах, которые действуют как антагонисты собачьего NGF при использовании для лечения боли у собак, причем партнеры связывания сохраняют высокие уровни аффинности и авидности связывания при избежании выработки нейтрализующих антител против них.
Краткое раскрытие настоящего изобретения
После длительных исследований авторами настоящего изобретения был неожиданно найден способ получения антител, который позволяет получать неиммуногенные антитела и связывающие фрагменты, которые специфично связываются с собачьим NGF и которые нейтрализуют биологическую активность NGF. В частности, в настоящем документе продемонстрировано, что совершенно неожиданно связывание антител и связывающих фрагментов по настоящему изобретению с собачьим NGF ограничивает биологическую активность собачьего NGF посредством ингибирования связывания собачьего NGF с высокоаффинным рецептором TrkA или с рецептором р75. Это, в свою очередь, предотвращает повышение экспрессии нейропептидов в сенсорных нейронах с получаемым в результате эффектом, который заключается в том, что ощущение боли будет уменьшаться или устраняться. Антитела были получены с использованием методов рекомбинантной ДНК и неожиданно оказались неиммуногенными, то есть, чтобы при введении собаке эти антитела не индуцировали выработку нейтрализующих антител против них. Такая находка является полностью неожиданным, поскольку антитела не получали с использованием стандартных методик, таких как CDR-прививание и т.п.
Согласно первому аспекту настоящего изобретения предусматривается способ получения антитела, подходящего для применения у собаки, включающий или состоящий, по существу, из следующих стадий:
- получение донорного антитела вида, отличного от собаки, причем донорное антитело характеризуется специфичностью связывания в отношении целевого антигена, присутствующего у собак;
- сравнение каждого аминокислотного остатка в аминокислотной последовательности каркасных участков донорного антитела с каждым аминокислотным остатком, присутствующем в соответствующем положении в аминокислотной последовательности каркасных участков одного или нескольких собачьих антител для идентификации одного или нескольких аминокислотных остатков в пределах аминокислотной последовательности каркасных участков донорного антитела, которые отличаются от одного или нескольких аминокислотных остатков в соответствующем положении в пределах аминокислотной последовательности каркасных участков одного или нескольких собачьих антител; и
- замещение одного или нескольких идентифицированных аминокислотных остатков в донорном антителе одним или несколькими аминокислотными остатками, присутствующими в соответствующем положении в одном или нескольких собачьих антителах.
В способе согласно настоящему изобретению модифицируют донорное антитело для применения у собаки таким образом, чтобы модифицированное антитело не содержало в любом положении в пределах каркасных участков какую-либо аминокислоту, которая будет чужеродной в этом положении у собак. Модифицированное антитело, таким образом, сохраняет специфичность и аффинность донорного антитела в отношении целевого антигена, но важно то, что оно модифицировано так, чтобы не создавать потенциально чужеродных эпитопов. Таким образом, модифицированное антитело не распознается как чужеродное у собак и, следовательно, не вызывает у собак иммунный ответ, который может приводить к нейтрализации эффективности антитела, особенно после длительного введения.
Согласно определенным вариантам осуществления стадию, на которой замещают один или несколько идентифицированных аминокислотных остатков, включает замещение одного или нескольких идентифицированных аминокислотных остатков одним или несколькими аминокислотными остатками, присутствующими в соответствующем положении, которые характеризуются наибольшей гомологией с одним или несколькими замещаемыми аминокислотными остатками.
Согласно определенным вариантам осуществления способ дополнительно предусматривает стадию замены константных доменов тяжелой цепи и/или легкой цепи донорного антитела константными доменами тяжелой и/или легкой цепи, происходящей из собачьего антитела. Как правило, константный домен тяжелой цепи заменяют собачьим константным доменом типа НСА или HCD.
Согласно определенным вариантам осуществления целевой антиген представляет собой фактор роста нервов (NGF).
Способ согласно первому аспекту изобретения не предусматривает CDR-прививание. Антитела, полученные в соответствии со способом согласно первому аспекту изобретения, содержат CDR донорного антитела, канинизированные каркасные участки, полученные в соответствии со способом согласно первому аспекту изобретения, и собачьи константные домены.
Настоящее изобретение относится к антителам, полученным в соответствии с первым аспектом настоящего изобретения, таким как антитела, описанные ниже.
Таким образом, в соответствии с дополнительным аспектом изобретения предусмотрено канинизированное антитело или его связывающий фрагмент, который специфично связывается с собачьим фактором роста нервов (NGF). Как правило, канинизированное антитело или его связывающий фрагмент нейтрализует биологическую функцию NGF, связавшись с ним. То есть связывание канинизированного антитела или связывающего фрагмента с NGF блокирует способность NGF связываться с рецептором TrkA или с рецептором р75. Согласно определенным вариантам осуществления канинизированное антитело или его связывающий фрагмент связывается с NGF с KD аффинности связывания 1×10-8 или менее.
Согласно следующему или родственному аспекту изобретения предусмотрено нейтрализующее антитело или его антигенсвязывающий фрагмент, которые способны к специфическому связыванию с собачьим фактором роста нервов (NGF), причем антитело или связывающий фрагмент антитела содержат, состоят или по существу состоят из вариабельного участка легкой цепи, содержащего аминокислотную последовательность SEQ ID NO:1 или SEQ ID NO:3 или аминокислотную последовательность, которая характеризуется идентичностью по отношению к ним, составляющей по меньшей мере 85, 90, 95 или 99%. Согласно определенным вариантам осуществления указанная идентичность характерна для участка длиной по меньшей мере приблизительно 15 аминокислот, предпочтительно приблизительно 20 аминокислот, более предпочтительно приблизительно 25 аминокислот.
Согласно некоторым вариантам осуществления нейтрализующее антитело представляет собой моноклональное антитело. Согласно некоторым вариантам осуществления антитело представляет собой химерное антитело. Согласно некоторым вариантам осуществления антитело представляет собой канинизированное антитело, т.е. антитело, которое характеризуется аминокислотной последовательностью, претерпевшей деиммунизацию, так что при введении собаке на него не вырабатываются нейтрализующие антитела. Согласно определенным вариантам осуществления канинизированное антитело получают в соответствии со способом получения антитела согласно первому аспекту изобретения. Как правило, константные домены тяжелой цепи антитела выбирают или модифицируют путем замены или делеции аминокислоты таким образом, чтобы константные домены не опосредовали нисходящие эффекторные функции.
Согласно некоторым вариантам осуществления антитело или связывающий фрагмент антитела содержит, состоит из или по существу состоит из легкой цепи, содержащей аминокислотную последовательность SEQ ID NO:5 или SEQ ID NO:10 или аминокислотную последовательность, которая характеризуется относительно них по меньшей мере 85, 90, 95 или 99% гомологией последовательности. Согласно определенным вариантам осуществления указанная идентичность характерна для участка длиной по меньшей мере приблизительно 15 аминокислот, предпочтительно приблизительно 20 аминокислот, более предпочтительно приблизительно 25 аминокислот.
Согласно следующему или родственному аспекту изобретения предусмотрено нейтрализующее антитело или его антигенсвязывающий фрагмент, которые способны к специфическому связыванию с собачьим фактором роста нервов (NGF), причем антитело или связывающий фрагмент антитела содержат, состоят или по существу состоят из вариабельного участка тяжелой цепи, содержащего аминокислотную последовательность SEQ ID NO:2 или SEQ ID NO:4 или аминокислотную последовательность, которая характеризуется идентичностью по отношению к ним, составляющей по меньшей мере 85, 90, 95 или 99%. Согласно определенным вариантам осуществления указанная идентичность характерна для участка длиной по меньшей мере приблизительно 15 аминокислот, предпочтительно приблизительно 20 аминокислот, более предпочтительно приблизительно 25 аминокислот.
Как правило, вариабельная область тяжелой цепи (VH) соединена с дополнительной аминокислотной последовательностью, которая содержит по меньшей мере один константный домен иммуноглобулина. Согласно определенным вариантам осуществления константный домен иммуноглобулина происходит из антитела подкласса IgG (иммуноглобулин G), образуя полноразмерную тяжелую цепь канинизированного антитела согласно настоящему изобретению. Известно четыре различных собачьих константных домена. Как правило, указанные константные домены содержат СН1, СН2 и СН3 наряду с подходящим линкером (или «шарниром»), расположенным между доменами СН1 и СН2. Как правило, антитело против собачьего NGF согласно настоящему изобретению содержит вариабельный домен тяжелой цепи, соединенный с константным доменом, причем константный домен не опосредует нисходящие эффекторные функции, такие как связывание комплемента, ADCC, связывание Fc-рецептора и т.п. Как правило, указанная тяжелая цепь содержит собачью тяжелую цепь изотипа А или D.
Согласно определенным вариантам осуществления антитело или связывающий фрагмент антитела содержат, состоят или по существу состоят из тяжелой цепи, содержащего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13 и SEQ ID NO:14, или аминокислотную последовательность, которая характеризуется идентичностью по отношению к ним, составляющей по меньшей мере 85, 90, 95 или 99%. Согласно определенным вариантам осуществления указанная идентичность характерна для участка длиной по меньшей мере приблизительно 15 аминокислот, предпочтительно приблизительно 20 аминокислот, более предпочтительно приблизительно 25 аминокислот.
Согласно определенным дополнительным вариантам осуществления антитело или связывающий фрагмент может содержать тяжелую цепь, причем по меньшей мере один аминокислотный остаток в константном домене заменен или удален для предупреждения гликозилирования этого аминокислотного остатка. Таким образом, согласно определенным дополнительным вариантам осуществления антитело или связывающий фрагмент антитела содержат, состоят или по существу состоят из тяжелой цепи, содержащего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21 и SEQ ID NO:22, или аминокислотную последовательность, которая характеризуется идентичностью по отношению к ним, составляющей по меньшей мере 85, 90, 95 или 99%. Согласно определенным вариантам осуществления указанная идентичность характерна для участка длиной по меньшей мере приблизительно 15 аминокислот, предпочтительно приблизительно 20 аминокислот, более предпочтительно приблизительно 25 аминокислот.
Согласно некоторым вариантам осуществления предпочтительными являются антитела или фрагменты, содержащие константный домен тяжелой цепи, который не опосредует нисходящие эффекторные функции, такие как связывание комплемента, ADCC, связывание Fc-рецептора и т.п. Такие тяжелые цепи могут содержать тяжелые цепи происходящего от собаки подтипа IgG-A и могут характеризоваться аминокислотной последовательностью SEQ ID NO:6, 11, 15 или 19. Кроме того, такие тяжелые цепи могут содержать тяжелые цепи происходящего от собаки подтипа IgG-D и могут характеризоваться аминокислотной последовательностью SEQ ID NO:9, 14, 18 и 22.
Согласно следующему или родственному аспекту настоящее изобретение относится к нейтрализующему антителу или его антигенсвязывающему фрагменту, которые способны к специфическому связыванию с собачьим фактором роста нервов (NGF), причем антитело или связывающий фрагмент антитела содержат, состоят или по существу состоят из легкой цепи и тяжелой цепи, где вариабельный участок легкой цепи (VL) содержит аминокислотную последовательность SEQ ID NO:1 или SEQ ID NO:3 или аминокислотную последовательность, которая характеризуется идентичностью по отношению к ним, составляющей по меньшей мере 85, 90, 95 или 99%, и где вариабельный участок тяжелой цепи (VH) содержит, состоит или по существу состоит из аминокислотной последовательности, которая идентична или по существу гомологична аминокислотной последовательности SEQ ID NO:2 или SEQ ID NO:4 или аминокислотной последовательности, которая характеризуется относительно них идентичностью последовательности по меньшей мере 85, 90, 95 или 98%. Согласно определенным вариантам осуществления указанная идентичность характерна для участка длиной по меньшей мере приблизительно 15 аминокислот, предпочтительно приблизительно 20 аминокислот, более предпочтительно приблизительно 25 аминокислот.
Согласно определенным вариантам осуществления антитело или связывающий элемент содержит легкую цепь, которая содержит, состоит или по существу состоит из аминокислотной последовательности SEQ ID NO:5 или SEQ ID NO:10 или последовательности, которая характеризуется идентичностью по отношению к ним, составляющей по меньшей мере 85%, более предпочтительно of 95% и наиболее предпочтительно по меньшей мере 98%. Согласно определенным вариантам осуществления указанная идентичность характерна для участка длиной по меньшей мере приблизительно 15 аминокислот, предпочтительно приблизительно 20 аминокислот, более предпочтительно приблизительно 25 аминокислот.
Согласно определенным вариантам осуществления антитело или связывающий элемент содержит тяжелую цепь, которая содержит, состоит или по существу состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13 и SEQ ID NO:14, или последовательности, которая характеризуется идентичностью по отношению к ним, составляющей по меньшей мере 85%, более предпочтительно of 95% и наиболее предпочтительно по меньшей мере 98%. Согласно определенным вариантам осуществления указанная идентичность характерна для участка длиной по меньшей мере приблизительно 15 аминокислот, предпочтительно приблизительно 20 аминокислот, более предпочтительно приблизительно 25 аминокислот.
Согласно определенным вариантам осуществления антитело может быть конъюгировано с по меньшей мере одной репортерной молекулой.
Согласно определенным дополнительным вариантам осуществления по меньшей мере один остаток в по меньшей мере одном из константных доменов можно заместить или удалить с целью предотвращения гликозилирования этого остатка. Соответственно, согласно определенным дополнительным вариантам осуществления канинизированное антитело или связывающий фрагмент антитела содержит, состоит из или состоит, по существу, из тяжелой цепи, содержащей аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21 и SEQ ID NO:22, или аминокислотную последовательность с по меньшей мере 85%, более предпочтительно 95% и наиболее предпочтительно по меньшей мере 98% идентичностью с ней. Согласно определенным вариантам осуществления указанная идентичность распространяется в длину по меньшей мере приблизительно на 15 аминокислот, предпочтительно приблизительно на 20 аминокислот, более предпочтительно приблизительно на 25 аминокислот.
Авторами настоящего изобретения, кроме того, был определен ряд каркасных участков (FR), которые можно комбинировать с гипервариабельными участками (CDR) с образованием канинизированных вариабельных доменов тяжелой и легкой цепи. Каждый из доменов тяжелой и легкой цепи характеризуется 4 каркасными участками, обозначенными FR1, FR2, FR3 и FR4.
Молекула антитела может содержать вариабельный домен тяжелой цепи, содержащий участки CDR1, CDR2 и CDR3 и связанные располагающиеся между ними каркасные участки. CDR вариабельного домена тяжелой цепи (VH) известны как HCDR, причем эти CDR находятся в следующих положениях в соответствии с системой нумерации по Kabat: VHCDR1 - остатки 31-35 по Kabat, VHCDR2 - остатки 50-65 по Kabat, VHCDR3 - остатки 95-102 по Kabat (Kabat ЕА et al. (1991) Sequences of proteins of immunological interest, 5th edition. Bethesda: US Department of Health and Human Services).
Более того, антитело дополнительно содержит вариабельный домен легкой цепи, содержащий участки CDR1, CDR2 и CDR3 и связанные располагающиеся между ними каркасные участки. CDR вариабельного домена легкой цепи (VL) известны как LCDR, причем эти CDR находятся в следующих положениях аминокислотных остатков в соответствии с системой нумерации по Kabat: VLCDR1 - остатки 24-34 по Kabat, VLCDR2 - остатки 50-56 по Kabat, VLCDR3 - остатки 89-97 по Kabat.
Вариабельный домен легкой или тяжелой цепи содержит четыре каркасных участка, FR1, FR2, FR3 и FR4, расположенные между CDR в следующем порядке: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4.
Согласно еще одному дополнительному аспекту настоящее изобретение распространяется на антитело против NGF или его связывающий NGF фрагмент, причем антитело или связывающий фрагмент антитела содержит вариабельный участок легкой цепи, содержащий по меньшей мере одно из:
каркасного участка FR1, состоящего из или содержащего аминокислотную последовательность SEQ ID NO:23 или SEQ ID NO:24,
каркасного участка FR2, состоящего из или содержащего аминокислотную последовательность SEQ ID NO:25,
каркасного участка FR3, состоящего из или содержащего аминокислотную последовательность SEQ ID NO:26 или SEQ ID NO:27,
каркасного участка FR4, состоящего из или содержащего аминокислотную последовательность SEQ ID NO:28,
и/или вариабельный участок тяжелой цепи, содержащий по меньшей мере одно из:
каркасного участка FR1, состоящего из или содержащего аминокислотную последовательность SEQ ID NO:29,
каркасного участка FR2, состоящего из или содержащего аминокислотную последовательность SEQ ID NO:30,
каркасного участка FR3, состоящего из или содержащего аминокислотную последовательность SEQ ID NO:31 или SEQ ID NO:32,
каркасного участка FR4, состоящего из или содержащего аминокислотную последовательность SEQ ID NO:33.
Как правило, CDR легкой и тяжелой цепи происходят из антитела, которое характеризуется специфичностью связывания с NGF.
Как правило, получение канинизированного антитела против собачьего NGF по настоящему изобретению не требует введения обратной мутации в каркасные участки вариабельных доменов легкой или тяжелой цепи.
Согласно определенным вариантам осуществления вариабельный домен легкой цепи, содержащий указанный по меньшей мере один описанный выше каркасный участок, соединен с происходящим из собаки константным доменом легкой цепи, как правило, с константным доменом каппа легкой цепи, но необязательно с легкой цепью лямбда. Согласно определенным вариантам осуществления указанная легкая цепь содержит участок FR1, характеризующийся аминокислотной последовательностью SEQ ID NO:23 или SEQ ID NO:24, участок FR2 с аминокислотной последовательностью SEQ ID NO:25, участок FR3 с аминокислотной последовательностью SEQ ID NO:26 или SEQ ID NO:27 и участок FR4 с аминокислотной последовательностью SEQ ID NO:28 или каркасный участок с аминокислотной последовательностью, которая характеризуется по меньшей мере 85, 90, 95 или 98% идентичностью последовательности с вышеизложенными. Согласно определенным вариантам осуществления указанная идентичность распространяется в длину по меньшей мере приблизительно на 5 аминокислот, предпочтительно приблизительно 10 аминокислот.
Согласно определенным дополнительным вариантам осуществления вариабельный участок тяжелой цепи, содержащий по меньшей мере один из каркасных участков, описанных выше, соединен с одним происходящим из собаки константным доменом тяжелой цепи. Согласно определенным вариантам осуществления аминокислотная последовательность константного домена не содержит какие-либо посттрансляционные модификации, или ее можно модифицировать с удалением любого или всех остатков, которые могут подвергаться N- или O-гликозилированию, так, чтобы константные домены были агликозилированными. Согласно определенным вариантам осуществления тяжелая цепь содержит участок FR1 с аминокислотной последовательностью SEQ ID NO:29, участок FR2 с аминокислотной последовательностью SEQ ID NO:30, участок FR3 с аминокислотной последовательностью SEQ ID NO:31 или SEQ ID NO:32 и участок FR4 с аминокислотной последовательностью SEQ ID NO:33 или каркасный участок с аминокислотной последовательностью, которая характеризуется по меньшей мере 85, 90, 95 или 98% идентичностью последовательности с вышеизложенными. Согласно определенным вариантам осуществления указанная идентичность распространяется в длину по меньшей мере приблизительно на 5 аминокислот, предпочтительно приблизительно 10 аминокислот.
Согласно определенным дополнительным вариантам осуществления в каркасных участках, описанных в настоящем документе, могут быть выполнены модификации. То есть авторами настоящего изобретения было выявлено, что в отношении некоторых остатков в каждом каркасном участке существует выбор аминокислотных остатков, которые могут находиться в указанном положении. Важно, чтобы эти модификации в каркасном участке не приводили в результате к конформационным изменениям в гипервариабельных участках, поскольку это может изменять специфичность связывания и/или аффинность получаемого в результате антитела. Согласно определенным вариантам осуществления настоящее изобретение распространяется на введение 2 или более аминокислотных замен в аминокислотные остатки каркасных участков вариабельного участка легкой цепи и/или вариабельного участка тяжелой цепи.
Соответственно, согласно определенным дополнительным вариантам осуществления настоящее изобретение распространяется на полипептиды, такие как антитело или его антигенсвязывающий фрагмент, которые содержат вариабельный домен легкой цепи с участком FR1, содержащим аминокислотную последовательность SEQ ID NO:23, которая была модифицирована одной или несколькими из следующих аминокислотных замен (где аминокислоты обозначены своими однобуквенными кодами): аминокислотный остаток Q в положении 3 (Q3) заменен аминокислотным остатком V, Т5 представляет собой М, S7 представляет собой Т, А9 представляет собой L, L13 представляет собой V, Q15 представляет собой Р или R, E16 представляет собой G, К 18 представляет собой Т или Р, VI 9 представляет собой А, Т20 представляет собой S, и Т22 представляет собой S. Кроме того, могут быть сделаны одна или несколько из следующих замен: Т5 представляет собой I, А9 представляет собой Р, S12 представляет собой A, S14 представляет собой R или Т, E16 представляет собой D, E17 представляет собой D, K18 представляет собой А, Е или L, Т22 представляет собой Y, и С23 представляет собой Y.
Согласно определенным вариантам дополнительным осуществления вариабельный домен легкой цепи содержит участок FR1, содержащий аминокислотную последовательность SEQ ID NO:24, которую можно модифицировать одной или несколькими из следующих аминокислотных замен: аминокислотный остаток V в положении 3 (V3) заменен аминокислотным остатком Q, Т5 представляет собой М, S7 представляет собой Т, А9 представляет собой L, L13 представляет собой V, Q15 представляет собой Р или R, E16 представляет собой G, К 18 представляет собой Т или Р, V19 представляет собой А, Т20 представляет собой S, и Т22 представляет собой S. Кроме того, могут быть сделаны одна или несколько из следующих замен: Т5 представляет собой I, А9 представляет собой Р, S12 представляет собой A, S14 представляет собой R или Т, E16 представляет собой D, E17 представляет собой D, K18 представляет собой А, Е или L, Т22 представляет собой Y, и С23 представляет собой Y.
Согласно определенным дополнительным вариантам осуществления участок FR2 легкой цепи, характеризующийся аминокислотной последовательностью SEQ ID NO:25, можно модифицировать одной или несколькими из следующих аминокислотных замен: Y2 представляет собой F, Q3 представляет собой R, А9 представляет собой S, K11 представляет собой Q, и L12 представляет собой R. Кроме того, Y2 может представлять собой I или L, Q3 может представлять собой I или L, Q4 может представлять собой Н, К5 может представлять собой R, Р6 может представлять собой А или S, G7 может представлять собой D, А9 может представлять собой Р или Т, K11 может представлять собой Е или R, L12 может представлять собой А, G, Р или S, 114 может представлять собой L, и Y15 может представлять собой Е, F, N, S или V.
Согласно определенным дополнительным вариантам осуществления участок FR3 легкой цепи, характеризующийся аминокислотной последовательностью SEQ ID NO:26, можно модифицировать одной или несколькими из следующих аминокислотных замен: S4 представляет собой D, E14 представляет собой D, Y15 представляет собой F, S16 представляет собой Т, L17 представляет собой F, Т18 представляет собой K, N20 представляет собой S, L22 представляет собой V, S24 представляет собой Р, V27 представляет собой A, F31 представляет собой Y. Кроме того, G1 может представлять собой A, V2 может представлять собой А, Р3 может представлять собой S, F6 может представлять собой L или V, S7 может представлять собой I, G8 может представлять собой А, Т13 может представлять собой А, S16 может представлять собой R, Т18 может представлять собой R, S24 может представлять собой А, Е25 может представлять собой D, G, I или N, V27 может представлять собой G, S или Т, А28 может представлять собой G, и V29 может представлять собой I или L.
Согласно определенным дополнительным вариантам осуществления вариабельный домен легкой цепи имеет участок FR3, содержащий аминокислотную последовательность SEQ ID NO:27, которую можно модифицировать одной или несколькими из следующих аминокислотных замен: S4 представляет собой D, E14 представляет собой D, F15 представляет собой Y, S16 представляет собой Т, L17 представляет собой F, Т18 представляет собой K, S20 представляет собой N, L22 представляет собой V, Р24 представляет собой S, V27 представляет собой A, Y31 представляет собой F. Кроме того, G1 может представлять собой A, V2 может представлять собой А, РЗ может представлять собой S, F6 может представлять собой L или V, S7 может представлять собой I, G8 может представлять собой А, Т 13 может представлять собой А, S16 может представлять собой R, Т 18 может представлять собой R, S24 может представлять собой А, Е25 может представлять собой D, G, I или N, V27 может представлять собой G, S или Т, А28 может представлять собой G, и V29 может представлять собой I или L.
Согласно определенным дополнительным вариантам осуществления участок FR4 легкой цепи, имеющий аминокислотную последовательность SEQ ID NO:28, можно модифицировать одной или несколькими из следующих аминокислотных замен: Е8 представляет собой D. Кроме того, G2 может представлять собой S, A3 может представлять собой Р, Q или Т, G4 может представлять собой Е, Т5 может представлять собой Р, K6 может представлять собой Q или S, V7 может представлять собой L или W, Е8 может представлять собой R, или L9 может представлять собой I.
Согласно определенным дополнительным вариантам осуществления участок FR1 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO:29, можно модифицировать одной или несколькими из следующих аминокислотных замен: D10 представляет собой G, N13 представляет собой Q, G15 представляет собой Т, G16 представляет собой Е, Т17 представляет собой S, Т 19 представляет собой R, V24 представляет собой A, S28 представляет собой Т, L29 представляет собой F, Т30 представляет собой S. Кроме того, Е1 может представлять собой D или G, V2 может представлять собой Е, G, I, L или М, Q3 может представлять собой А, Е, Н, K, L, Р, R, S или V, L4 может представлять собой Р или V, V5 может представлять собой А, Е, L или М, Е6 может представлять собой А или Q, S7 может представлять собой F, L или Т, G9 может представлять собой Е, D10 может представлять собой А, Е, N или Т, L11 может представлять собой Q, R, V или W, VI 2 может представлять собой А, I или М, N13 может представлять собой К или R, P14 может представлять собой F или Т, G15 может представлять собой А или Е, G16 может представлять собой А, Т 17 может представлять собой Р, L18 может представлять собой R, T19 может представлять собой G, К или V, L20 может представлять собой I или V, S21 может представлять собой Y, V23 может представлять собой А, Е, I или L, V24 может представлять собой G, I, S или Т, S25 может представлять собой G, Р или Т, G26 может представлять собой D, R или Т, F27 может представлять собой D, I, L, S, Т или V, S28 может представлять собой А, D, I, L, М, N, Р или R, L29 может представлять собой I, М или V, Т30 может представлять собой D, G, Н, I, K, N, R, V.
Согласно определенным дополнительным вариантам осуществления участок FR2 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO:30, можно модифицировать одной или несколькими из следующих аминокислотных замен: L6 представляет собой Р, R8 представляет собой K, Е11 представляет собой Q, G14 представляет собой А. Кроме того, W1 может представлять собой С, V2 может представлять собой A, F, I или L, Q4 может представлять собой Н или L, A5 может представлять собой D, G, Р, S, Т или V, G7 может представлять собой Е, L или R, R8 может представлять собой А, Е, G, М или Q, G9 может представлять собой D, Е, R, Т или V, L10 может представлять собой F, М или Р, Е11 может представлять собой D, Н, L, Р или R, W12 может представлять собой С, F, L, М, S или Y, V13 может представлять собой F, I или L, G14 может представлять собой L, S или Т.
Согласно определенным дополнительным вариантам осуществления участок FR3 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO:31, можно модифицировать одной или несколькими из следующих аминокислотных замен: L2 представляет собой F, Т5 представляет собой S, Т8 представляет собой N, S9 представляет собой A, S11 представляет собой N, V13 представляет собой L, F14 представляет собой Y, К 16 представляет собой Q, H18 представляет собой N, Q21 представляет собой R, S22 представляет собой А, Т27 представляет собой V, R32 представляет собой K. Кроме того, R1 может представлять собой Q, L2 может представлять собой V, Т3 может представлять собой А, I или S, 14 может представлять собой L, М, Т или V, Т5 может представлять собой А или F, R6 может представлять собой K, D7 может представлять собой Е или N, Т8 может представлять собой D, G, I или S, S9 может представлять собой D, G, Р, Т или V, К10 может представлять собой Е, G, М, N, Q или R, S11 может представлять собой D, Н, К или R, Т12 может представлять собой А, I, М или S, V13 может представлять собой А, I или М, F14 может представлять собой Н, S или Т, L15 может представлять собой I, K16 может представлять собой А, D, Е, Н или R, M17 может представлять собой L, H18 может представлять собой D, K, Р, R, S или Т, S19 может представлять собой D, G, N, R или Т, L20 может представлять собой V, Q21 может представлять собой G, I, K, S или Т, S22 может представлять собой D, G, Р, Т или V, Е23 может представлять собой А, D или V, Т25 может представлять собой А, М или S, A26 может представлять собой G или V, Т27 может представлять собой F, I, K, L, М или Q, Y28 может представлять собой Н, Y29 может представлять собой F или Н, A31 может представлять собой С, G, L, М, R, S, Т или V, R32 представляет собой A, D, Е, G, I, L, М, N, Р, Q, S, Т или V.
Согласно определенным дополнительным вариантам осуществления вариабельный домен тяжелой цепи имеет участок FR3, содержащий аминокислотную последовательность SEQ ID NO:32, которую можно модифицировать одной или несколькими из следующих аминокислотных замен: L2 представляет собой F, T5 представляет собой S, Т8 представляет собой N, S9 представляет собой A, S11 представляет собой N, V13 представляет собой L, F14 представляет собой Y, Q16 представляет собой K, H18 представляет собой N, R21 представляет собой Q, S22 представляет собой А, Т27 представляет собой V, R32 представляет собой K. Кроме того, R1 может представлять собой Q, L2 может представлять собой V, Т3 может представлять собой А, I или S, 14 может представлять собой L, М, Т или V, T5 может представлять собой А или F, R6 может представлять собой K, D7 может представлять собой Е или N, Т8 может представлять собой D, G, I или S, S9 может представлять собой D, G, Р, Т или V, K10 может представлять собой Е, G, М, N, Q или R, S11 может представлять собой D, Н, K или R, T12 может представлять собой А, I, М или S, V13 может представлять собой А, I или М, F14 может представлять собой Н, S или Т, L15 может представлять собой I, K16 может представлять собой А, D, Е, Н или R, Ml 7 может представлять собой L, HI 8 может представлять собой D, K, Р, R, S или Т, S19 может представлять собой D, G, N, R или Т, L20 может представлять собой V, Q21 может представлять собой G, I, K, S или Т, S22 может представлять собой D, G, Р, Т или V, Е23 может представлять собой А, D или V, Т25 может представлять собой А, М или S, A26 может представлять собой G или V, Т27 может представлять собой F, I, K, L, М или Q, Y28 может представлять собой Н, Y29 может представлять собой F или Н, А31 может представлять собой С, G, L, М, R, S, Т или V, R32 представляет собой А, D, Е, G, I, L, М, N, Р, Q, S, Т или V.
Согласно определенным дополнительным вариантам осуществления участок FR4 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO:33, можно модифицировать одной или несколькими из следующих аминокислотных замен: L6 представляет собой S. Кроме того, W1 может представлять собой L, G2 может представлять собой А или S, Q3 может представлять собой D, Н, Р или R, T5 может представлять собой А, I, N или S, L6 может представлять собой Р, Q или R, V7 может представлять собой I, L или Р, Т8 может представлять собой A, F, I, L, P, S или Y, V9 может представлять собой A, S10 может представлять собой А, С, Р или Т, S11 может представлять собой А, L или Р.
Согласно определенным вариантам осуществления вышеизложенных аспектов настоящего изобретения антитело представляет собой моноклональное антитело. Как правило, антитело представляет собой канинизированное антитело.
Согласно определенным вариантам осуществления вышеизложенных аспектов настоящего изобретения канинизированное нейтрализующее NGF антитело согласно настоящему изобретению или связывающий фрагмент, полученный из него, специфично связывается с собачьим NGF (фактор роста нервов) со связывающей способностью, характеризующейся равновесной константой диссоциации (KD) 1×10-8 или менее. Более того, предпочтительно, чтобы канинизированные антитела согласно настоящему изобретению не являлись перекрестно-реактивными с любыми другими связывающими эпитопами, присутствующими у собак (отличающимися от NGF), и, кроме того, чтобы при введении собаке не образовывались нейтрализующие антитела против антител согласно настоящему изобретению. Более того, предпочтительно, чтобы константные домены антитела не опосредовали какие-либо последующие эффекторные функции, включающие без ограничения: связывание и активацию комплемента, ADCC и связывание Fc с рецептором и его активацию.
Согласно определенным вариантам осуществления вышеизложенных аспектов настоящего изобретения антитело или его антигенсвязывающий фрагмент характеризуются временем полужизни в сыворотке собак, составляющим по меньшей мере одну неделю. Как правило, время полужизни в сыворотке составляет по меньшей мере 8 суток. Как правило, антитело не является иммуногенным у собак.
Согласно определенным вариантам осуществления вышеизложенных аспектов настоящего изобретения антитело или его антигенсвязывающий фрагмент могут быть очищены или очищаются в соответствии с методикой, предусматривающей анионообменную хроматографию, хроматографию на основе гидрофобных взаимодействий и гель-хроматографию. Согласно альтернативным вариантам осуществления антитело или его антигенсвязывающий фрагмент могут быть очищены или очищаются в соответствии с методикой, предусматривающей аффинную хроматографию captoadhere с последующей анионообменной хроматографией.
Согласно определенным вариантам осуществления антитело или его антигенсвязывающий фрагмент не опосредуют последующих эффекторных функций. Как правило, антитело или связывающий фрагмент содержат собачью тяжелую цепь изотипа А или D.
Согласно определенным вариантам осуществления канинизированное антитело получают в соответствии со способом получения антитела согласно первому аспекту настоящего изобретения.
Согласно определенным дополнительным вариантам осуществления в антителах согласно настоящему изобретению можно выполнить модификации в отношении аминокислотной последовательности константных участков тяжелой цепи. Указанная модификация может включать добавление, замещение или удаление одного или нескольких аминокислотных остатков. Указанные изменения аминокислот, как правило, осуществляют с целью модификации функциональных характеристик антитела. Например, модификация аминокислот можно осуществить для ограничения нисходящих эффекторных функций, опосредованных константными доменами антитела, например, для ограничения способности антитела связываться с Fc рецепторами, активировать комплемент или индуцировать ADCC. Более того, в аминокислотных остатках шарнирного участка константного домена тяжелой цепи можно выполнить модификации с тем, чтобы модифицировать период полувыведения антитела из кровотока при введении собаке.
Настоящее изобретение распространяется на фрагменты антитела, которые связываются с собачьим NGF и ограничивают его способность связываться с рецепторами р75 или TrkA.
Согласно определенным вариантам осуществления связывающий фрагмент антитела может содержать последовательности тяжелой цепи и легкой цепи согласно настоящему изобретению, соединенные гибким линкером с образованием одноцепочечного антитела.
Одноцепочечный Fv (scFv) содержит VH и VL домен. VH и VL домены связаны с образованием сайта связывания мишени. Эти 2 домена ковалентно связаны пептидным линкером. Молекула scFv может иметь вид VL-линкер-VH в случаях, когда вариабельный домен легкой цепи требуется на N-конце, или VH-линкер-VL в случаях, когда VH домен требуется на N-конце.
Соответственно, согласно определенным дополнительным вариантам осуществления антигенсвязывающий фрагмент представляет собой фрагмент одноцепочечного Fv (scFv) антитела. Согласно определенным дополнительным вариантам осуществления связывающий фрагмент антитела выбран из группы, состоящей, без ограничения, из Fab фрагмента антитела. Fab' фрагмента антитела, F(ab')2 фрагмента антитела, Fv фрагмента антитела, scFV фрагмента антитела и подобного.
Согласно некоторым вариантам осуществления настоящее изобретение предусматривает мультиспецифичные или мультивалентные антитела, содержащие антитело против NGF или связывающий фрагмент согласно настоящему изобретению, связанные или соединенные с иными антителами с различными специфичностями связывания для применения в комбинированной терапии. Мультиспецифичное антитело содержит по меньшей мере одно антитело или связывающий фрагмент, специфичный к первому эпитопу NGF, и по меньшей мере один сайт связывания, специфичный к другому эпитопу, присутствующему на NGF, или к отличающемуся антигену. Мультивалентное антитело содержит антитела или связывающие фрагменты антитела, которые характеризуются специфичностью связывания с тем же эпитопом NGF. Соответственно, согласно определенным вариантам осуществления настоящее изобретение распространяется на антитело-слитый белок, содержащий четыре или более Fv участков или Fab участков канинизированных антител согласно настоящему изобретению. Еще один дополнительный вариант осуществления распространяется на антитело-слитый белок, содержащий один или несколько Fab участков, происходящих из описанного в настоящем документе антитела, вместе с одним или несколькими Fab или Fv участками из антител, специфичных к NGF. Согласно определенным дополнительным вариантам осуществления настоящее изобретение распространяется на биспецифичное антитело, в котором антитело или его связывающий фрагмент согласно настоящему изобретению связано с вторичным антителом или его связывающим фрагментом, который характеризуется связыванием, специфичным в отношении вторичной мишени, причем указанная мишень не является NGF. Предпочтительно указанная вторичная мишень содействует предотвращению опосредованной NGF передачи сигнала через рецепторы р75 или TrkA. Такие мультивалентные, биспецифичные или мультиспецифичные антитела можно получить с помощью ряда методов с использованием рекомбинации, которые будут хорошо известны специалисту в настоящей области техники.
Еще один дополнительный аспект настоящего изобретения предусматривает нейтрализующее антитело против нейротрофина, содержащее вариабельный домен легкой цепи, имеющий аминокислотную последовательность SEQ ID NO:1 или SEQ ID NO:3, и/или вариабельный домен тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO:2 или SEQ ID NO:4. Согласно определенным вариантам осуществления нейротрофин представляет собой собачий фактор роста нервов (NGF).
Еще один дополнительный аспект настоящего изобретения предусматривает способ лечения, подавления или ослабления боли у собаки, включающий следующие стадии:
- получения терапевтически эффективного количества антитела против собачьего NGF или его антигенсвязывающего фрагмента и
- введения его собаке, нуждающейся в этом.
Согласно определенным вариантам осуществления антитело представляет собой канинизированное антитело.
Согласно определенным вариантам осуществления антитело содержит вариабельный домен легкой цепи, содержащий аминокислотную последовательность SEQ Ш NO:1 или SEQ ID NO:3 или последовательность, которая характеризуется по меньшей мере 85% идентичностью с ней, и/или вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:2 или SEQ ID NO:4 или аминокислотную последовательность, которая характеризуется по меньшей мере 85% гомологией последовательности с ней.
Согласно определенным дополнительным вариантам осуществления канинизированное антитело содержит легкую цепь, имеющую аминокислотную последовательность SEQ ID NO:5 или SEQ ID NO 10, или последовательность, характеризующуюся по меньшей мере 85% идентичностью последовательности с ней, и/или тяжелую цепь, которая содержит, состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13 или SEQ ID NO:14 или последовательности, характеризующейся по меньшей мере 85% и более предпочтительно по меньшей мере 98% идентичностью аминокислот с ней.
Согласно определенным вариантам осуществления антитело против собачьего NGF или его антигенсвязывающий фрагмент представляет собой любое из предусмотренного вышеуказанными аспектами настоящего изобретения.
Согласно определенным вариантам осуществления боль представляет собой нейропатическую боль. В частности, боль может представлять собой периоперационную боль, послеоперационную боль или боль после хирургического вмешательства. Послеоперационная боль может возникать после любой операционной процедуры, которая у собак может включать без ограничения ортопедическую операцию, операцию на мягких тканях, процедуры овариогистерэктомии, процедуры кастрации и т.п.Согласно определенным дополнительным вариантам осуществления боль представляет собой хроническую боль, связанную с раком или раковым состоянием (онкологическую боль). Согласно определенным дополнительным вариантам осуществления боль связана с или возникает в результате ревматоидного артрита или остеоартрита. Согласно определенным вариантам осуществления боль представляет собой воспалительную боль или зудящую боль.
Согласно еще одному дополнительному аспекту настоящего изобретения предусмотрен способ лечения артрита или артритного состояния у собаки, включающий следующие стадии:
- получения терапевтически эффективного количества антитела против собачьего NGF согласно настоящему изобретению или его антигенсвязывающего фрагмента и
- введения его собаке, нуждающейся в этом.
Согласно определенным вариантам осуществления антитело представляет собой канинизированное антитело. Согласно определенным вариантам осуществления канинизированное антитело содержит вариабельный домен легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:1 или SEQ ID NO:3 или последовательность, которая характеризуется по меньшей мере 85% идентичностью с ней, и/или вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:2 или SEQ ID NO:4 или аминокислотную последовательность, которая характеризуется по меньшей мере 85% гомологией последовательности с ней.
Согласно определенным вариантам осуществления артрит или артритное состояние включает состояния, выбранные из группы, состоящей из иммуноопосредованного полиартрита, ревматоидного артрита, остеоартрита и связанных состояний.
Как правило, лечение артрита или артритного состояния включает ослабление, подавление, снижение, замедление или задержку появления боли, связанной с или относящейся к артритному состоянию.
Дополнительный аспект настоящего изобретения предусматривает способ лечения состояния, вызванного, связанного с или приводящего в результате к повышенной экспрессии собачьего NGF или повышенной чувствительности к NGF у субъекта-собаки, причем указанный способ предусматривает следующие стадии:
- получения терапевтически эффективного количества канинизированного антитела против собачьего NGF согласно настоящему изобретению или его антигенсвязывающего фрагмента и
- введения его собаке, нуждающейся в этом.
Согласно еще одному дополнительному аспекту настоящего изобретения предусматривается способ лечения индуцируемой к пролиферации NGF опухоли у собаки и состояний, связанных с ней, включающий следующие стадии:
- получение терапевтически эффективного количества антитела против собачьего NGF согласно настоящему изобретению или его антигенсвязывающего фрагмента и
- введения его собаке, нуждающейся в этом.
Согласно определенным вариантам осуществления опухоль представляет собой остеосаркому. Согласно определенным вариантам осуществления опухоль индуцируется к пролиферации аутокринным или паракринным NGF.
Согласно определенным вариантам осуществления вышеизложенные способы согласно настоящему изобретению дополнительно предусматривают стадию, на которой совместно вводят по меньшей мере одно дополнительно средство, которое может усиливать и/или дополнять эффектность антитела против NGF согласно настоящему изобретению. Например, антитело или его антигенсвязывающий фрагмент можно вводить совместно с по меньшей мере одним анальгезирующим средством, NSAID, опиоидом, кортикостероидом или стероидом.
Примеры подходящих анальгезирующих средств включают без ограничения буторфанол, бупренорфин, фентанил, флуниксин меглумин, мерпидин, морфин, налбуфин и их производные. Подходящие NSAID включают без ограничения ацетаминофен, ацетилсалициловую кислоту, карпрофен, этодолак, кетопрофен, мелоксикам, фирококсиб, робенакоксиб, деракоксиб и подобное.
Согласно определенным дополнительным вариантам осуществления по меньшей мере одно дополнительное средство может представлять собой терапевтически активное средство, которое может представлять собой одно или несколько из группы, выбранной из антибиотика, противогрибкового терапевтического средства, антипротозойного терапевтического средства, противовирусного терапевтического средства или подобных терапевтических средств. Более того, по меньшей мере одно дополнительное средство может представлять собой ингибитор медиатора(медиаторов) воспаления, такой как антагонист рецептора PGE, иммунодепрессивное средство, такое как циклоспорин, или противовоспалительный глюкокортикоид. Согласно определенным дополнительным вариантам осуществления по меньшей мере одно дополнительное средство может представлять собой средство, которое применяют для лечения когнитивной дисфункции или нарушения, такого как потеря памяти или связанные состояния, которые могут становиться все более распространенными у старых собак. Кроме того, по меньшей мере одно дополнительное средство может представлять собой противогипертоническое средство или другое соединение, применяемое для лечения сердечно-сосудистой дисфункции, например для лечения гипертензии, ишемии миокарда, застойной сердечной недостаточности и подобного. Кроме того, по меньшей мере одно дополнительное средство может представлять собой диуретическое средство, сосудорасширяющее средство, антагонист бета-адренергических рецепторов, ингибитор ангиотензин-II-превращающего фермента, блокатор кальциевых каналов и ингибитор HMG-CoA-редуктазы.
Согласно определенным вариантам осуществления антитело или антигенсвязывающий фрагмент вводят собаке, нуждающейся в этом, в ходе вышеизложенных способов в дозе, находящейся в диапазоне от приблизительно 0,01 мг/кг массы тела до приблизительно 10 мг/кг массы тела, в частности от 0,03 мг/кг массы тела до приблизительно 3 мг/кг массы тела.
Согласно различным дополнительным аспектам настоящее изобретение распространяется на композицию, содержащую антитело или его связывающий фрагмент согласно любому вышеизложенному аспекту настоящего изобретения. Согласно определенным вариантам осуществления композиция дополнительно содержит по меньшей мере один фармацевтически приемлемый носитель.
Еще один дополнительный аспект настоящего изобретения предусматривает фармацевтическую композицию для лечения боли или состояния, приводящего в результате или вызванного хронической болью у собаки, или опухоли, пролиферацию в которой индуцирует NGF, содержащую фармацевтически эффективное количество канинизированного антитела против собачьего NGF согласно настоящему изобретению вместе с по меньшей мере одним фармацевтически приемлемым носителем, наполнителем или разбавителем.
Согласно определенным вариантам осуществления композиция может дополнительно содержать по меньшей мере одно анальгезирующее средство, NSAID, опиоид, кортикостероид или стероид.
Согласно различным дополнительным аспектам настоящее изобретение распространяется на выделенную нуклеиновую кислоту, которая кодирует антитело или связывающие фрагменты антитела согласно настоящему изобретению.
Соответственно, еще один дополнительный аспект настоящего изобретения предусматривает выделенную нуклеиновую кислоту, которая кодирует антитело или антигенсвязывающий фрагмент согласно любому из вышеизложенных аспектов настоящего изобретения.
Согласно определенным вариантам осуществления полинуклеотид кодирует вариабельный домен легкой цепи канинизированного антитела против собачьего NGF или фрагмента антитела с аминокислотной последовательностью SEQ ID NO:1 или SEQ ID NO:3 или легкую цепь с аминокислотной последовательностью SEQ ID NO:5 или SEQ ID NO: 10.
Согласно определенным дополнительным вариантам осуществления полинуклеотид кодирует вариабельный домен тяжелой цепи антитела против собачьего NGF или фрагмента антитела с аминокислотной последовательностью SEQ ID NO:2 или SEQ ID NO:4 или тяжелую цепь с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:6-SEQ ID NO:9, SEQ ID NO:11-SEQ ID NO:14, SEQ ID NO:15-SEQ ID NO:18 и SEQ ID NO:19-SEQ ID NO:22.
Согласно определенным вариантам осуществления выделенная нуклеиновая кислота дополнительно кодирует одну или несколько регуляторных последовательностей, функционально связанных с ней.
Согласно дополнительному аспекту предусматривается вектор экспрессии, содержащий полинуклеотид, кодирующий вариабельный домен тяжелой и/или легкой цепи или константный домен тяжелой и/или легкой цепи согласно настоящему изобретению. Согласно определенным вариантам осуществления вектор экспрессии дополнительно содержит одну или несколько регуляторных последовательностей. Согласно определенным вариантам осуществления вектор представляет собой плазмидный или ретровирусный вектор.
Еще один дополнительный аспект предусматривает клетку-хозяина, включающую вектор экспрессии согласно вышеизложенному аспекту настоящего изобретения. Дополнительный аспект настоящего изобретения предусматривает клетку-хозяина, которая вырабатывает антитело согласно любому из вышеизложенных аспектов настоящего изобретения.
Еще один дополнительный аспект настоящего изобретения предусматривает способ получения нейтрализующего антитела против собачьего NGF, включающий стадию, на которой культивируют клетку-хозяина согласно вышеизложенному аспекту настоящего изобретения с обеспечением экспрессии клеткой нейтрализующего антитела против собачьего NGF.
Еще один дополнительный аспект настоящего изобретения предусматривает способ очистки антитела против собачьего NGF согласно настоящему изобретению, включающий стадии:
- (i) анионообменной хроматографии;
- (ii) хроматографии на основе гидрофобных взаимодействий; и
- (iii) гель-хроматографии.
Еще один дополнительный аспект настоящего изобретения предусматривает способ очистки антитела против собачьего NGF согласно настоящему изобретению, включающий стадии:
- (i) аффинной хроматографии Captoadhere; и
- (ii) анионообменной хроматографии.
Еще один дополнительный аспект настоящего изобретения предусматривает способ получения канинизированного антитела против собачьего NGF согласно настоящему изобретению, на которых экспрессируют один или несколько из полинуклеотидов/нуклеиновых кислот или векторов согласно вышеизложенным аспектам настоящего изобретения, которые экспрессируют легкие и/или тяжелые цепи антитела согласно настоящему изобретению в подходящей клетке-хозяине, извлекают экспрессированные полипептиды, которые могут экспрессироваться вместе в клетке-хозяине, или отдельно в различных клетках-хозяевах, и выделяют антитела.
Еще один дополнительный аспект настоящего изобретения предусматривает способ лечения, ослабления или подавления боли у собаки, или лечения опухоли, пролиферацию в которой индуцирует NGF, включающий стадию, на которой вводят собаке эффективное количество полинуклеотида согласно любому из вышеизложенных аспектов настоящего изобретения.
Еще один дополнительный аспект настоящего изобретения предусматривает антитело или связывающий фрагмент антитела согласно любому из вышеизложенных аспектов настоящего изобретения, или фармацевтическую композицию согласно вышеизложенным аспектам настоящего изобретения, или нуклеиновую кислоту или вектор, содержащий ее, согласно любому из вышеизложенных аспектов настоящего изобретения для применения при лечении или предупреждении боли у собаки.
Согласно определенным вариантам осуществления боль представляет собой острую боль. Согласно определенным вариантам осуществления боль представляет собой хроническую боль. Более того, боль может представлять собой послеоперационную боль или боль, возникающую в результате любой операционной процедуры, которая у собак может включать без ограничения ортопедическую операцию, операцию на мягких тканях, процедуры овариогистерэктомии, процедуры кастрации и подобное. Согласно определенным дополнительным вариантам осуществления боль представляет собой хроническую боль, связанную с раком или раковым состоянием. Согласно определенным дополнительным вариантам осуществления боль связана с или возникает в результате ревматоидного артрита или остеоартрита. Согласно определенным вариантам осуществления боль представляет собой воспалительную боль или зудящую боль.
Еще один дополнительный аспект настоящего изобретения предусматривает антитело или связывающий фрагмент антитела согласно любому из вышеизложенных аспектов настоящего изобретения или фармацевтическую композицию согласно вышеизложенным аспектам настоящего изобретения, или нуклеиновую кислоту или вектор, содержащий ее, согласно любому из вышеизложенных аспектов настоящего изобретения для применения при лечении артрита, в частности, остеоартрита и/или ревматоидного артрита.
Еще один дополнительный аспект настоящего изобретения предусматривает антитело или связывающий фрагмент антитела согласно любому из вышеизложенных аспектов настоящего изобретения или фармацевтическую композицию согласно вышеизложенным аспектам настоящего изобретения, или нуклеиновую кислоту или вектор, содержащий ее, согласно любому из вышеизложенных аспектов настоящего изобретения для применения при лечении индуцируемой к пролиферации NGF опухоли у субъекта-собаки и состояний, связанных с ней, в частности, остеосаркомы. Согласно определенным вариантам осуществления опухоль индуцируется к пролиферации аутокринным или паракринным NGF.
Еще один дополнительный аспект настоящего изобретения предусматривает применение антитела или связывающего фрагмента антитела согласно любому из вышеизложенных аспектов настоящего изобретения или фармацевтической композиции согласно вышеизложенным аспектам настоящего изобретения, или нуклеиновой кислоты или вектора, содержащего ее, согласно любому из вышеизложенных аспектов настоящего изобретения при получении лекарственного препарата для лечения или предупреждения боли у собаки.
Как правило, боль представляет собой хроническую боль. Более того, боль может представлять собой послеоперационную боль или боль, возникающую в результате любой операционной процедуры, которая у собак может включать без ограничения ортопедическую операцию, операцию на мягких тканях, процедуры овариогистерэктомии, процедуры кастрации и подобное. Согласно определенным дополнительным вариантам осуществления боль представляет собой хроническую боль, связанную с раком или раковым состоянием. Согласно определенным дополнительным вариантам осуществления боль связана с или возникает в результате ревматоидного артрита или остеоартрита. Согласно определенным вариантам осуществления боль представляет собой воспалительную боль или зудящую боль.
Еще один дополнительный аспект настоящего изобретения предусматривает применение антитела или связывающего фрагмента антитела согласно любому из вышеизложенных аспектов настоящего изобретения, или фармацевтической композиции согласно вышеизложенным аспектам настоящего изобретения, или нуклеиновой кислоты или вектора, содержащего ее, согласно любому из вышеизложенных аспектов настоящего изобретения при получении лекарственного препарата для лечения, подавления, ослабления или предупреждения ревматоидного артрита или остеоартрита у собаки.
Еще один дополнительный аспект настоящего изобретения предусматривает применение антитела или связывающего фрагмента антитела согласно любому из вышеизложенных аспектов настоящего изобретения, или фармацевтической композиции согласно вышеизложенным аспектам настоящего изобретения, или нуклеиновой кислоты или вектора, содержащего ее, согласно любому из вышеизложенных аспектов настоящего изобретения при получении лекарственного препарата для лечения индуцируемой к пролиферации NGF опухоли у собаки и состояний, связанных с ней, в частности, остеосаркомы. Согласно определенным вариантам осуществления опухоль индуцируется к пролиферации аутокринным или паракринным NGF.
Согласно еще одному дополнительному аспекту предусматривается клеточная линия, или клетка, происходящая из нее или являющаяся ее потомком, которая вырабатывает нейтрализующие моноклональные антитела против собачьего NGF или их фрагменты согласно настоящему изобретению.
Еще один дополнительный аспект настоящего изобретения предусматривает набор для лечения боли у собак или для лечения состояния, связанного с болью, или для лечения, ослабления или подавления боли, связанной с остеоартритом, ревматоидным артритом или полиартритом, содержащий антитело против собачьего NGF или связывающий фрагмент согласно любому из вышеизложенных аспектов настоящего изобретения и инструкции к его применению.
Еще один дополнительный аспект настоящего изобретения предусматривает диагностический набор для выявления моноклонального антитела против собачьего NGF в жидкостях in vitro, ex vivo и in vivo для применения при определении концентрации указанного антитела. Набор может содержать любое из антител согласно настоящему изобретению или его связывающий фрагмент. Набор может содержать инструкции к его применению.
Краткое описание графических материалов
На фиг.1 представлен график, иллюстрирующий связывание канинизированных антител, полученных согласно настоящему изобретению, к мышиным NGF и собачьим NGF.
На фиг.2A-D показан ряд гелей, иллюстрирующих очистку с помощью белка А канинизированных антител согласно настоящему изобретению.
На фиг.3 показан гель, иллюстрирующий результаты очистки канинизированных антител методом SDS-PAGE.
На фиг.4 представлен график, иллюстрирующий ингибирование NGF-индуцированной пролиферации клеток TF-1 канинизированными антителами.
На фиг.5 представлен график, иллюстрирующий связывание комплемента, индуцированное связавшимися с антигеном канинизированными антителами.
На фиг.6 показана аминокислотная последовательность вариабельного домена легкой цепи канинизированного антитела против NGF (SEQ ID NO:1). Три области CDR, определенные в соответствии с нумерацией по Kabat, подчеркнуты. Звездочки над конкретным остатком указывают на различия последовательностей между канинизированной последовательностью и аминокислотной последовательностью крысиного моноклонального антитела против мышиного NGF альфаD11.
На фиг.7 представлена аминокислотная последовательность вариабельного домена тяжелой цепи канинизированного антитела против NGF (SEQ ID NO:2). Три области CDR, определенные в соответствии с нумерацией по Kabat, подчеркнуты. Звездочки над конкретным остатком указывают на различия последовательностей между канинизированной последовательностью и крысиным моноклональным антителом против мышиного NGF альфаD11.
На фиг.8 представлена аминокислотная последовательность (SEQ ID NO:5) вариабельного домена легкой цепи каппа канинизированного антитела против собачьего NGF (caN-kLC). Остатки вариабельного домена показаны жирным шрифтом.
На фиг.9 представлена аминокислотная последовательность (SEQ ID NO:6) вариабельного домена легкой цепи каппа канинизированного антитела IgG-A против собачьего NGF (caN-HCA). Остатки вариабельного домена показаны жирным шрифтом.
На фиг.10 представлена аминокислотная последовательность (SEQ ID NO:7) вариабельного домена легкой цепи каппа канинизированного антитела IgG-B против собачьего NGF (caN-HCB). Остатки вариабельного домена показаны жирным шрифтом.
На фиг.11 представлена аминокислотная последовательность (SEQ ID NO:8) вариабельного домена легкой цепи каппа канинизированного антитела IgG-C против собачьего NGF (caN-HCC). Остатки вариабельного домена показаны жирным шрифтом.
На фиг.12 представлена аминокислотная последовательность (SEQ ID NO:9) вариабельного домена легкой цепи каппа канинизированного антитела IgG-D против собачьего NGF (caN-HCD). Остатки вариабельного домена показаны жирным шрифтом.
На фиг.13 А представлен график, иллюстрирующий сравнение связывания с NGF моноклонального антитела против собачьего NGF с использованием варьирующихся разведении SEQ ID NO:5 и 7 и SEQ ID NO:10 и 11. На фиг.13 В представлен график, иллюстрирующий связывание комплемента в супернатантах с фиг.13А.
На фиг.14А представлен график, иллюстрирующий сравнение связывания с NGF N-гликозилированного и агликозилированного вариантов моноклонального антитела против собачьего NGF с тяжелыми цепями изотипов НСВ и НСС. На фиг.14В представлен график, иллюстрирующий связывание комплемента в супернатантах с фиг.14А.
Фиг.15А и В иллюстрируют количественную очистку антитела против собачьего NGF согласно настоящему изобретению с использованием трехстадийного способа (Способа I), предусматривающего (1) анионообменную хроматографию, (2) хроматографию на основе гидрофобных взаимодействий и (3) гель-хроматографию. На фиг.15А показаны результаты фракционирования методом эксклюзионной ВЭЖХ. На фиг.15В показан восстанавливающий гель SDS-PAGE фракций после каждой стадии. На фиг.15С и D проиллюстрирована количественная очистка антитела против собачьего NGF согласно настоящему изобретению с использованием двухстадийного способа (Способа II), предусматривающего хроматографию Captoadhere и анионообменную хроматографию. Фиг.15С: Анализ SDS-PAGE в невосстанавливающих и восстанавливающих условиях. Дорожка 1 содержит MWS, дорожка 2 содержит 2 мкг/мл образца 3450 и 0 мкл восстановителя, дорожка 3 содержит 4 мкг/мл образца 3450 и 0 мкл восстановителя, дорожка 4 содержит 6 мкг/мл образца 3450 и 0 мкл восстановителя, дорожка 5 содержит MWS, дорожка 6 содержит 2 мкг/мл образца 3450 и 3 мкл восстановителя, дорожка 7 содержит 4 мкг/мл образца 3450 и 3 мкл восстановителя, дорожка 8 содержит 6 мкг/мл образца 3450 и 3 мкл восстановителя, а дорожка 9 содержит MWS. Фиг.15D: эксклюзионная хроматография.
На фиг.16 проиллюстрировано сравнение моноклонального антитела против собачьего NGF, очищенного способами I и II. Фиг.16А: сравнение невосстанавливающего и восстанавливающего SDS-PAGE. Фиг.16 В: сравнение антител против NGF методом ELISA.
На фиг.17 показано, что масса (верхняя панель) и температура (нижняя панель) тела стабильны после внутривенного введения собакам антитела против собачьего NGF.
На фиг.18 проиллюстрирован кинетический анализ концентрации в плазме моноклонального антитела против собачьего NGF после внутривенного введения собаке. Собаке-биглю внутривенно вводили антитело против NGF в концентрации 2 мг/кг, образцы плазмы отбирали в указанных временных точках и моноклональное антитело против NGF детектировали методом ELISA NGF. Моноклональное антитело против собачьего NGF характеризовалось неожиданно длительной фазой полувыведения (бета), составлявшей приблизительно 9 суток.
На фиг. 19 показано, что моноклональные антитела против собачьего NGF ослабляют воспалительную боль у собак. Каолин инъецировали в подушечку стопы собаки породы бигль в сутки 1, антитело или контроль-носитель - в сутки 0, и хромоту измеряли по шкале визуальной оценки.
Подробное раскрытие настоящего изобретения
После обширных экспериментальных работ авторами настоящего изобретения была взята аминокислотная последовательность крысиного моноклонального антитела (MAb) αD11 против мышиного NGF, и ее неожиданно использовали для получения неиммуногенного антитела против собачьего NGF. Полученное неиммуногенное антитело, которое не получают с использованием стандартных методик CDR-прививки, как показано, проявляет связывание с высокой аффинностью с собачьим NGF. Антитело нейтрализует биологическую функцию собачьего NGF, наиболее конкретно путем подавления связывания NGF с клеточными рецепторами TrkA и р75. Более того, было также неожиданно обнаружено, что при введении собаке против них не вырабатываются нейтрализующие антитела. Соответственно, канинизированное антитело согласно настоящему изобретению является подходящим для длительного облегчения хронической боли у собак.
Способ создания вариабельных доменов тяжелой и легкой цепи для антител согласно настоящему изобретению, который был использован авторами настоящего изобретения, приводит в результате к замене конкретных крысиных (донорных) аминокислотных остатков, которые присутствуют в пределах каркасных участков вариабельных доменов легкой и тяжелой цепи на остатки, которые на основании анализа авторами настоящего изобретения будут сохранять конформацию участков CDR и, таким образом, сохранять специфичность связывания и авидность при снижении присутствия иммуногенных эпитопов, которые могут приводить в результате к образованию нейтрализующих антитела против антитела, если бы его вводили собакам в неизмененном виде. В частности, способ получения антител согласно настоящему изобретению (известный как PETisation) включает оценку последовательности каркасных участков донорного (например, крысиного) антитела в отношении пригодности для введения собаке путем сравнения последовательности каркасных участков донорного антитела с последовательностью антитела или пула антител, происходящих из собак. Хотя сравнение можно проводить между донорной последовательностью и единственным представителем целевой последовательности, будет очевидно, что сравнение с пулом целевых последовательностей является предпочтительным, поскольку оно будет расширять количество встречающихся в естественных условиях вариантов выбора в каждом положении по Kabat у целевого вида. Это не только будет повышать вероятность "совпадения" между донором и целью, но также будет расширять количество вариантов выбора для замены в случаях, когда совпадения не существует. В результате будет возможен выбор замены с характеристиками, максимально близкими донору. В случаях, когда донорная последовательность и собачья последовательность отличаются по любому номеру по Kabat или соответствующему положению, донорную последовательность модифицируют с замещением рассматриваемого аминокислотного остатка аминокислотным остатком, который, как известно, присутствует в этом положении у собак в естественных условиях.
В случаях, когда требуется замещение аминокислотного остатка, присутствующего в донорном каркасном участке иммуноглобулина, его, как правило, выполняют с использованием принципа консервативного замещения, при котором аминокислотный остаток заменяют аминокислотным остатком, который присутствует в этом положении по Kabat у собаки в естественных условиях и является максимально родственным в плане размера, заряда и гидрофобности подвергающейся замене аминокислоте в донорной последовательности. Смысл заключается в том, чтобы выбрать замену, которая не вызовет никакой или по меньшей мере вызовет лишь минимальную перестройку или нарушение в трехмерную структуру донорного антитела. В определенных ситуациях не будет явного варианта выбора, и каждый выбор будет характеризоваться преимуществами и недостатками. Окончательное решение может требовать моделирования трехмерной структуры или даже экспрессии различных альтернативных последовательностей. Однако, в целом, будет доступно явное предпочтение. В результате этой процедуры изменение в донорной последовательности будет выполнено только, когда этот остаток будет чужеродным в целевой последовательности, и заменяющая аминокислота является максимально родственной той, которую она заменяет. Следовательно, избегают создания чужеродных эпитопов, а общая трехмерная структура сохраняется, и в результате сохраняется также аффинность и специфичность.
Константные участки легкой и тяжелой цепи, как правило, получают из происходящих из собаки (целевых) антител. Константные домены тяжелой цепи выбирают или модифицируют так, чтобы они не опосредовали нисходящих эффекторных функций. Достаточно неожиданно, было обнаружено, что против антител, полученным согласно настоящему изобретению, не вырабатываются или вырабатываются минимальные количества нейтрализующих антител, причем было неожиданно обнаружено, что антитела обладают связанным с этим преимуществом в виде длительного периода полувыведения из кровотока и возможности повторного дозирования. Более того, поскольку замещение остатков каркасных участков осуществляют таким образом, что оно не оказывает отрицательного воздействия на трехмерную конформацию участков CDR, изменений в специфичности связывания с желаемой мишенью не будет.
Существуют четыре основных изотипа IgG у человека и мыши, и хотя их номенклатура подобна, они отличаются по характеристикам и функции, в том числе по аффинности в отношении бактериальных продуктов, таких как белок А и белок G, их способности к активации комплементопосредованного цитолиза (CDC) и их способности к индукции киллинга клеток-мишеней посредством антителозависимой клеточно-опосредованной цитотоксичности (ADCC). Выбор изотипов IgG с активными в отношении CDC и ADCC или "заряженными" константными доменами, как полагают, является клиническим преимуществом, когда антитела разрабатывают для устранения клеток-мишеней, несущих их когнатный антиген, как например, в онкологии или для борьбы с инфекциями (например, при медицинском применении у человека изотипы IgG1 человека являются предпочтительными для вышеуказанных целей). В отличие от этого, активация иммунной системы считается нежелательной в других условиях, как например, при облегчении воспаления, боли или аутоиммунных реакций, и, следовательно, предпочтительными являются изотипы IgG человека с минимальной CDC и ADCC активностью (например, при таком медицинском применении у человека часто являются предпочтительными изотипы IgG4). В иммунной системе собак было описано четыре различных изотипа константных доменов тяжелых цепей иммуноглобулина-гамма (IgG) (патент США №5,852,183, Tang L. et al. 2001. Veterinary Immunology and hnmunopathology, 80. 259-270) наряду с единственными последовательностями константных доменов каппа и лямбда. Четыре собачьих константных доменов тяжелых цепей А, В, С и D не были охарактеризованы с точки зрения опосредуемой ими функциональной активности. Несмотря на общую гомологию с семейством IgG белки, кодирующие собачий IgG, более родственны друг другу, чем членам семейства из других видов, таким образом, было невозможно только по гомологии определить, которые из указанных выше функций могут быть приписаны, если вообще могут, каждому из четырех собачьих изотипов. Выбор изотипов IgG с активными в отношении CDC и ADCC константными доменами считается преимущественным, когда антитела разрабатывают для устранения клеток-мишеней, несущих их когнатный антиген, как например, в онкологии или при борьбе с инфекциями, например, при медицинском применении у человека изотипы IgG1 человека являются предпочтительными. В отличие от этого, активация иммунной системы считается нежелательной в других условиях, как например, при облегчении воспаления, боли или аутоиммунных реакций, и, следовательно, предпочтительными являются изотипы IgG человека с минимальной CDC и ADCC активностью, например, например, при медицинском применении у человека будут выбирать изотипы IgG4.
Антитела согласно настоящему изобретению содержат происходящие из собаки константные домены тяжелой и легкой цепи. Более того, гипервариабельные участки происходят из крысиного антитела альфаD11 против мышиного NGF. Антитело αD11 было впервые описано Cattaneo и соавт. (Cattaneo A, Rapposelli В, Calissano P. (1988) "Three distinct types of monoclonal antibodies after long-term immunization of rats with mouse nerve growth factor". J Neurochem 50(4):1003-1010). Антитело альфаD11 было затем клонировано Ruberti и соавт. (Ruberti, F. et al. (1993) "Cloning and Expression of an Anti-Nerve Growth Factor (NGF) Antibody for Studies Using the Neuroantibody Approach". Cellular and Molecular Neurobiology. 13(5):559-568).
CDR-участки, происходящие из антитела aDIl, объединяют с последовательностями каркасных участков, которые были идентифицированы авторами настоящего изобретения как сохраняющие третичную структуру CDR и, следовательно, специфичность связывания, предотвращая выработку нейтрализующих антител против него при введении антитела собаке.
Каждый из вариабельных участков легкой и тяжелой цепей содержит четыре каркасных участка, называемые FR1-FR4. Для каждого из этих каркасных участков авторами настоящего изобретения был выявлен предпочтительный аминокислотный остаток (так называемый предпочтительный остаток) для каждого конкретного положения, и более того, в этом положении также могут быть предусмотрены альтернативные аминокислотные остатки. В таблицах 1-8 ниже иллюстрируются 4 каркасных участка для каждой из тяжелой и легкой цепей. В этих таблицах представлено положение аминокислоты в этом конкретном каркасном участке и, кроме того, в соответствии с системой нумерации по Kabat, используемой для указания положения конкретного остатка по длине полного вариабельного домена тяжелой или легкой цепи. Остаток или остатки, показанные как остатки группы 1, представляют собой предпочтительные остатки, тогда как остатки группы 2 представляют собой альтернативные остатки. Однако они в основном не будут предпочтительными относительно остатков, показанных в группе 1, в этом конкретном положении. Аминокислотные остатки указаны с использованием однобуквенной системы.
Канинизированное антитело согласно настоящему изобретению, таким образом, отличается, например, от химерного моноклонального антитела согласно настоящему изобретению, которое состоит из полного вариабельного участка, происходящего из первого вида, и константных доменов, происходящих из второго вида, или от канинизированного CDR-привитого антитела, в котором гипервариабельные участки (CDR) вариабельных участков тяжелой и легкой цепей содержат аминокислотные остатки, происходящие из донорного антитела и встроенные в каркасные участки (FR), и константные участки (CR), происходящие из целевого антитела или из собачьих последовательностей зародышевого типа.
Предпочтительно, чтобы канинизированное антитело, главным образом, сохраняло свойства связывания исходного (донорного) антитела, из которого происходят CDR. Это значит, что канинизированное антитело будет проявлять такую же или, главным образом, такую же связывающую способность и авидность в отношении антигена, что и донорное антитело, из которого происходят CDR. В идеальном случае аффинность канинизированного антитела будет составлять не менее 10% аффинности донорного антитела в отношении целевого эпитопа, более предпочтительно не менее приблизительно 30%, и наиболее предпочтительно аффинность будет составлять не менее 50% таковой исходного (донорного) антитела. Способы анализа связывающей способности в отношении антигена являются хорошо известными из уровня техники и включают анализы полумаксимального связывания, конкурентные анализы и анализ по методу Скэтчарда.
Как определено выше в настоящем документе, настоящее изобретение распространяется на связывающие элементы или антигенсвязывающие фрагменты, полученные из канинизированных антител согласно настоящему изобретению. Такие антигенсвязывающие фрагменты относятся к одному или нескольким фрагментам антитела, которые сохраняют способность к специфичному связыванию с собачьему NGF. Было показано, что антигенсвязывающая функция антитела может осуществляться фрагментами антитела полной длины. Согласно определенным вариантам осуществления связывающие элементы или антигенсвязывающие фрагменты могут быть выделенными связывающими элементами. Связывающий элемент или антигенсвязывающий фрагмент согласно настоящему изобретению может содержать фрагмент антител согласно настоящему изобретению, например, фрагмент полностью канинизированной молекулы антитела, такой как только тяжелая или легкая цепь или, например, вариабельный домен тяжелой и/или легкой цепи. Согласно определенным вариантам осуществления связывающий элемент, как правило, может содержать, состоять из или состоять, по существу, из VH и/или VL домена антитела. VH домены связывающих элементов также предусматриваются как часть настоящего изобретения. В пределах каждого из VH и VL доменов находятся 3 гипервариабельных участка ("CDR"), вместе с 4 связанными каркасными участками ("FR"), VH домен, как правило, содержит 3 HCDR (гипервариабельные участки тяжелой цепи), и VL домен, как правило, содержит 3 LCDR (гипервариабельные участки легкой цепи). Соответственно, связывающий элемент может содержать VH домен, содержащий последовательно участки CDR1 (или HCDR1), CDR2 (HCDR2) и CDR3 (HCDR3) VH вместе с несколькими связанными каркасными участками. Связывающий элемент может дополнительно или альтернативно содержать VL домен, содержащий домены CDR1, CDR2 и CDR3 VL вместе со связанными каркасными участками. VH или VL домены, как правило, содержат четыре каркасных участка, FR1, FR2, FR3 и FR4. Используемый в настоящем документе термин «каркасный участок» или «каркасная последовательность» относится к последовательностям вариабельного участка, остающимся после удаления CDR. Поскольку точное определение последовательности CDR может быть дано в соответствии с различными системами (Kabat, Chothia и т.д.), значение каркасной последовательности, соответственно, подвержено различным интерпретациям. Шесть CDR (VL-CDR1, CDR2 и CDR3 легкой цепи и VH-CDR1, CDR2 и CDR3 тяжелой цепи) разделяют каркасные участки легкой цепи и тяжелой цепи на четыре подучастка на каждой цепи, известных как FR1, FR2, FR3 и FR4.
На фиг.6 показана аминокислотная последовательность вариабельного домена легкой цепи антитела против NGF согласно настоящему изобретению. Участки CDR1, CDR2 и CDR3 выделены подчеркиванием. Как таковой, и как показано на фиг.6, VL-CDR1 расположен между каркасными участками FR1 и FR2, VL-CDR2 расположен между каркасными участками FR2 и FR3, a VL-CDR3 расположен между каркасными участками FR3 и FR4. На фиг.7 показана аминокислотная последовательность вариабельного домена тяжелой цепи антитела против NGF согласно настоящему изобретению. Участки CDR1, CDR2 и CDR3 выделены подчеркиванием. Как и в случае с вариабельным участком легкой цепи, показанным на фиг.6, VH-CDR1 расположен между каркасными участками FR1 и FR2, VH-CDR2 расположен между каркасными участками FR2 и FR3, a VH-CDR3 расположен между каркасными участками FR3 и FR4.
На фиг.6 и 7 остатки вариабельного домена легкой цепи (фиг.6) и вариабельного домена тяжелой цепи (фиг.7) стандартно пронумерованы в соответствии с системой нумерации, разработанной Kabat и соавт.(Kabat, E.A., Wu,T.T., Perry,H., Gottesman, K. and Foeller,C. (1991) Sequences of Proteins of bnmunological Interest, Fifth Edition. NIH Publication No.91-3242, Kabat et al. (1971) Ann. NY Acad, Sci. 190:382-391). Система нумерации по Kabat относится к системе нумерации аминокислотных остатков, которые являются более вариабельными (т.е. гипервариабельными), чем другие аминокислотные остатки в вариабельных участках тяжелой и легкой цепи антитела или его антигенсвязывающей части. Система нумерации по Kabat, таким образом, обычно используется, когда речь идет об остатке в вариабельном домене (примерно, остатки 1-104 легкой цепи и остатки 1-113 тяжелой цепи). Эта система нумерации может быть использована в настоящем описании там, где это указано. Обозначения остатка по Kabat не всегда прямо соответствуют линейной нумерации аминокислотных остатков вариабельных участков тяжелой и легкой цепей согласно настоящему изобретению, представленной в соответствующих последовательностях, приведенных в настоящем документе в перечне с соответствующим SEQ ID NO для этой последовательности. В частности, фактическая линейная аминокислотная последовательность может содержать меньшее количество или дополнительные аминокислоты, которые при точной нумерации по Kabat соответствуют укорочению или вставке в структурный компонент, либо каркасный участок, либо гипервариабельный участок (CDR), базовой структуры вариабельного домена тяжелой или легкой цепи. Верный номер остатков по Kabat можно определить для любого заданного антитела с помощью выравнивания остатков в последовательности антитела со стандартной последовательностью, к которой была применена нумерация по Kabat.
Кроме того, на фиг.7 показана аминокислотная последовательность вариабельного домена тяжелой цепи. Она также приведена в SEQ ID NO:2. Однако на фиг.7 нумерация учитывает аминокислотные остатки 80, 80А, SOB и 80С, тогда как в SEQ ID NO:2 нумерация продолжается последовательно, то есть 80, 81, 82 и 83. То же самое является верным для остатков 100, 100А, 100В, 100С, 100D, 100Е и 100F по Kabat на фиг.7.
Как описано выше в настоящем документе, связывающий фрагмент антитела можно выбрать из группы, содержащей без ограничения Fab фрагмент. Fab' фрагмент и scFv (одноцепочечный фрагмент вариабельного участка), или из пептидомиметика, диатела или родственного мультивалентного производного.
Согласно определенным вариантам осуществления связывающий фрагмент антитела представляет собой Fab или F(ab')2 фрагмент, который состоит из VL, VH, CL и СН1 доменов антитела. Согласно определенным вариантам осуществления VL домен характеризуется аминокислотной последовательностью SEQ ID NO:1 или SEQ ID NO:3, и VH домен характеризуется аминокислотной последовательностью SEQ ID NO:2 или SEQ ID NO:4. Согласно определенным вариантам осуществления CL и СН1 домены являются таковыми на основе аминокислотной последовательности CL и СН1 домена собачьего иммуноглобулина.
Методики, используемые для рекомбинантного получения Fab, Fab' и F(ab')2 фрагментов, являются хорошо известными специалисту в настоящей области техники и включают таковые, раскрытые в РСТ публикации международной патентной заявки № WO 92/22324 и у Sawai et al., "Direct Production of the Fab Fragment Derived From the Sperm Immobilizing Antibody Using Polymerase Chain Reaction and cDNA Expression Vectors", 1995, AJRI 34:26-34. Пример методик, которые можно использовать для получения scFv (одноцепочечные Fv фрагменты), раскрыты в Huston et al., "Protein Engineering of Single-Chain Fv Analogs and Fusion Proteins", Methods in Enzymology, vol.203:46-88 (1991), содержание которой включено в настоящий документ с помощью ссылки.
Согласно определенным вариантам осуществления фрагменты антитела можно получить из антител полной длины посредством протеолитического расщепления в соответствии со способом по Morimoto (Morimoto et al., "Single-step purification of F(ab')2 fragments of mouse monoclonal antibodies (immunoglobulins Gl) by hydrophobic interaction high performance liquid chromatography using TSKgel Phenyl-5PW" Journal of Biochemical and Biophysical Methods 24:107-117 (1992)). Фрагменты антитела также можно непосредственно получить с помощью клеток-хозяев (Carter et al., "High level Escherichia coli expression and production of a bivalent humanized antibody fragment" Bio/Technology 10:163-167 (1992)).
Помимо обеспечения канинизированного моноклонального антитела, которое характеризуется специфичностью связывания с собачьим NGF и которые оказывают антагонистическое воздействие на функцию собачьего NGF, настоящее изобретение дополнительно распространяется на связывающие элементы, отличные от антител, содержащие пару связывающих доменов на основе аминокислотной последовательности VL участка (вариабельного участка легкой цепи), которая определена в SEQ ID NO:1 или SEQ ID NO:3, и аминокислотной последовательности VH участка (вариабельного участка тяжелой цепи), которая определена в SEQ ID NO:2 или SEQ ID NO:4. В частности, настоящее изобретение распространяется на отдельные связывающие домены, в основе которых лежат либо VL, либо VH участок канинизированных антител согласно настоящему изобретению.
Соответственно, согласно определенным дополнительным вариантам осуществления настоящего изобретения предусматривается связывающий элемент, содержащий, состоящий из или состоящий, по существу, из отдельного связывающего домена, полученного из канинизированного антитела согласно настоящему изобретению. Согласно определенным вариантам осуществления отдельный связывающий домен получен из аминокислотной последовательности VH (вариабельного домена тяжелой цепи), который определен в SEQ ID NO:2 или SEQ ID NO:4. Такой связывающий домен можно использовать в качестве нацеливающего средства для собачьего NGF.
Согласно определенным вариантам осуществления дополнительные методики конструирования можно использовать для модификации антител согласно настоящему изобретению, например посредством включения модификаций в Fc участок, которые могут изменять время полувыведения из сыворотки крови, фиксация комплемента, связывание Fc с рецептором и/или антигензависимую клеточную цитотоксичность. Кроме того, согласно определенным вариантам осуществления можно получать антитела или фрагменты антитела, которые характеризуются измененными схемами гликозилирования. Согласно определенным вариантам осуществления антитело согласно настоящему изобретению является измененным с увеличением или уменьшением степени, в которой антитело является гликозилированным. Гликозилирование полипептидов, как правило, представляет собой либо N-гликозилирование, либо O-гликозилирование. N-гликозилирование относится к присоединению углеводного фрагмента к боковой цепи аспарагинового остатка. Последовательности-трипептиды аспарагин-Х-серин и аспарагин-Х-треонин, в которых Х представляет собой аминокислоту за исключением пролина, являются распознаваемыми последовательностями для ферментативного присоединения углеводного фрагмента к боковой цепи аспарагина. Следовательно, присутствие любой из этих последовательностей-трипептидов в полипептиде создает потенциальный сайт гликозилирования. O-гликозилирование относится к присоединению одного из Сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, зачастую серину или треонину, хотя также можно использовать 5-гидроксипролин или 5-гидроксилизин. Авторами настоящего изобретения были обеспечены агликозилированные собачьи константные домены, определенные в настоящем документе как SEQ ID NO:15, 16, 17, 18, 19, 20, 21 и 22.
Согласно определенным дополнительным вариантам осуществления антитела против собачьего NGF согласно настоящему изобретению можно подвергать ПЭГилированию посредством осуществления реакции антитела с производным полиэтиленгликоля (PEG). Согласно определенным вариантам осуществления антитело является дефукозилированным и, таким образом, не содержит фукозных остатков.
Согласно определенным вариантам осуществления модификации биологических свойств антитела можно выполнить посредством выбора замен, которые воздействуют на (а) структуру полипептидного остова в зоне замены, например, в виде листовой или спиральной конформации, (b) заряд или гидрофобность молекулы в целевом сайте или (с) величину боковой цепи. Аминокислоты можно сгруппировать в соответствии с подобием свойств их боковых цепей (A. L. Lehninger, in Biochemistry, 2nd Ed., 73-75, Worth Publishers, New York (1975)): (1) неполярные: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M); (2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (С), Tyr (Y), Asn (N), Gin (Q); (3) кислые: Asp (D), Glu (E); (4) основные: Lys (К), Arg (R), His (H). В качестве альтернативы, встречающиеся в естественных условиях остатки можно разделить на группы на основе общих свойств боковых цепей: (1) гидрофобные: норлейцин, Met, Ala, Val, Leu, He; (2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln; (3) кислые: Asp, Glu; (4) основные: His, Lys, Arg; (5) остатки, которые оказывают влияние на ориентацию цепей: Gly, Pro; (6) ароматические: Trp, Туг, Phe. Неконсервативные замены будут влечь за собой смену члена одного из этих классов на другой класс.Такие замещенные остатки также могут быть введены в сайты консервативных замен или в оставшиеся (например, неконсервативные) сайты.
Согласно различным дополнительным аспектам настоящее изобретение распространяется на иммуноконъюгат, содержащий антитело против собачьего NGF согласно настоящему изобретению или его антигенсвязывающую часть, связанную с молекулой-партнером. Согласно определенным вариантам осуществления такой конъюгат антитело-молекула-партнер получают с помощью химического линкера, такого как пептидильный линкер, гидразиновый линкер или дисульфидный линкер. Согласно определенным вариантам осуществления партнер по сочетанию представляет собой эффекторную молекулу, молекулу метки, лекарственного средства или носителя. Подходящие методики сочетания антител согласно настоящему изобретению как с пептидильными, так и с непептидильными партнерами по сочетанию будут известны специалистам в настоящей области техники. Примеры подходящих меток включают выявляемые метки, такие как радиоактивная метка, или метку-фермент, такую как пероксидаза хрена, или химические частицы, такие как биотин. В качестве альтернативы, метка может представлять собой функциональную метку, например рицин, или пролекарства, которые способны к превращению пролекарств в активные лекарственные средства в сайте связывания антитела.
Согласно различным дополнительным аспектам настоящее изобретение распространяется на полинуклеотиды и, в частности, выделенные полинуклеотиды, которые кодируют канинизированные антитела, фрагменты антител и связывающим элементы согласно настоящему изобретению. Как определено в настоящем документе, "полинуклеотид" включает любой полирибонуклеотид или полидезоксирибонуклеотид, который может представлять собой немодифицированную РНК или ДНК или модифицированную РНК или ДНК, в том числе без ограничения двухнитевую РНК, и РНК, которая представляет собой смесь одно- и двухнитевых участков. Полинуклеотид согласно настоящему изобретению, например, полинуклеотид, который кодирует полипептид или полипептиды согласно настоящему изобретению, включает его аллельные варианты и/или их комплементарные последовательности, в том числе полинуклеотид, который гибридизуется с такими нуклеотидными последовательностями в условиях умеренной или высокой жесткости.
Настоящее изобретение дополнительно распространяется на миметики антител, такие как доменные антитела, наноантитела (nanobodies), унитела (unibodies), версатела (versabodies) и дуокалины (duocalins), в основе которых лежат антитела против собачьего NGF согласно настоящему изобретению. Большое разнообразие технологий создания миметиков-антител известно специалисту в настоящей области техники. Например, так называемые доменные антитела (Domantis, Великобритания) представляют собой небольшие функциональные связывающиеся блоки антител, которые соответствуют вариабельным участкам либо легких, либо тяжелых цепей человеческих антител. Руководство для получения таких доменных антител можно найти в патенте США №6291158, патенте США №6582915 и патенте США №6593081. Наноантитела представляют собой терапевтические белки-производные антител, которые характеризуются уникальными структурными и функциональными свойствами встречающихся в естественных условиях антител, содержащих только тяжелые цепи, обнаруживаемых у верблюдов. Унитела также представляют собой фрагменты антител, полученные с помощью технологии, основанной на удалении шарнирного участка антител IgG4. Удаление шарнирного участка дает в результате молекулу, которая составляет примерно половину от размера традиционного антитела IgG4 и которая характеризуется моновалентным связывающим участком. Унитела сохраняют свойство антител IgG4 оставаться инертными и, таким образом, не вызывать иммунные реакции.
Дополнительные связывающие молекулы включают молекулы аффител (affibody) (патент США №5831012), ОАКРины (сконструированные молекулы белков на основе анкириновых повторов) (РСТ публикация международной заявки № WO 02/20565) и антикалины (anticalins) (патент США №7250297 и WO 99/16873). Версатела представляют собой молекулы, полученные согласно еще одной технологии получения миметиков антител. Версатела (Amunix, публикация заявки на патент США №2007/0191272) представляют собой небольшие белки, называемые микробелками, весом 3-5 кДа, содержащие более 15% цистеиновых остатков, которые образуют остов с высокой плотностью дисульфидных связей, который заменяет гидрофобную внутреннюю часть, которая, как правило, присутствует у белка.
Авимеры являются другим типом миметика антитела. Авимеры возникают в результате рекомбинации семейств человеческих сывороточных белков. Они представляют собой отдельные белковые цепи, состоящие из модульных связывающих доменов, каждый из которых предназначен для связывания с конкретным сайтом-мишенью. Авимеры могут связываться одновременно с сайтами на одном белке-мишени и/или сайтами на нескольких белках-мишенях. Известный как многоточечное присоединение или авидность, этот механизм связывания имитирует способ взаимодействия клеток и молекул в организме, помогает в создании антагонистов и агонистов и дает в результате лекарственные средства с несколькими функциями и сильной активностью. Библиотеки авимеров можно получить в соответствии с WO 2004/044011, включенной в настоящий документ посредством ссылки, и например, US 2005/0053973. Библиотеки авимеров также коммерчески доступны от Avidia Inc, Маунтин-Вью, Калифорния, США.
Получение антитела
Антитела и связывающие элементы согласно настоящему изобретению можно получить полностью или частично с помощью химического синтеза. Например, антитела и связывающие элементы согласно настоящему изобретению можно получить с помощью методик, которые хорошо известны специалисту в настоящей области техники, таких как стандартный жидкофазный пептидный синтез, или с помощью способов твердофазного пептидного синтеза. В качестве альтернативы, антитела и связывающие элементы можно получить в растворе с использованием методик жидкофазного пептидного синтеза или, кроме того, с помощью сочетания твердофазных, жидкофазных химических методов и химии растворов.
Настоящее изобретение дополнительно распространяется на получение антител или связывающих элементов согласно настоящему изобретению посредством экспрессии нуклеиновой кислоты, которая кодирует по меньшей мере одну аминокислотную последовательность, которая содержит антитело согласно настоящему изобретению, в подходящий экспрессионной системе так, чтобы необходимый пептид или полипептид мог кодироваться. Например, нуклеиновую кислоту, кодирующую аминокислотную последовательность легкой цепи, и вторую нуклеиновую кислоту, кодирующую аминокислотную последовательность тяжелой цепи, можно экспрессировать с получением антитела согласно настоящему изобретению.
Соответственно, в определенных дополнительных аспектах настоящего изобретения предусматриваются нуклеиновые кислоты, кодирующие аминокислотные последовательности, которые образуют антитела или связывающие элементы согласно настоящему изобретению.
Как правило, нуклеиновые кислоты, кодирующие аминокислотные последовательности, которые образуют антитела или связывающие элементы согласно настоящему изобретению могут быть обеспечены в выделенной или очищенной форме, или обеспечиваться в форме, которая, главным образом, не содержит материала, который может быть связан с ней в естественных условиях, за исключением одной или нескольких регуляторных последовательностей. Нуклеиновая кислота, которая экспрессирует антитело или связывающий элемент согласно настоящему изобретению, может быть целиком или частично синтетической и может включать без ограничения ДНК, кДНК и РНК.
Последовательности нуклеиновой кислоты, кодирующие антитела или связывающие элементы согласно настоящему изобретению, могут быть легко получены специалистом в настоящей области техники с использованием методик, которые хорошо известны специалисту в настоящей области техники, такие как описанные в Sambrook et al. "Molecular Cloning", A laboratory manual, cold Spring Harbor Laboratory Press, Volumes 1-3, 2001 (ISBN-0879695773), и Ausubel et al. Short Protocols in Molecular Biology. John Wiley and Sons, 4th Edition, 1999 (ISBN - 0471250929). Указанные методики включают (i) использование полимеразной цепной реакции (ПЦР) для амплификации образцов нуклеиновой кислоты, (ii) химический синтез или (iii) получение последовательностей кДНК. ДНК, кодирующую антитела или связывающие элементы согласно настоящему изобретению, можно получить и использовать любым подходящим способом, известным специалисту в настоящей области техники, включающим взятие кодирующей ДНК, определение подходящих сайтов узнавания рестрикционным ферментом с любой стороны от части, которую нужно экспрессировать, и вырезание указанной части из ДНК. Вырезанную часть можно затем функционально связать с подходящим промотором и экспрессировать в подходящей экспрессионной системе, такой как коммерчески доступная экспрессионная система. В качестве альтернативы, соответствующие части ДНК можно амплифицировать с использованием подходящих ПЦР праймеров. Модификации в последовательностях ДНК можно выполнить с использованием сайт-направленного мутагенеза.
Последовательности нуклеиновой кислоты, кодирующие антитела или связывающие элементы согласно настоящему изобретению могут быть обеспечены в виде конструктов в форме плазмиды, вектора, транскрипционной или экспрессионной кассеты, которая содержит по меньшей мере одну нуклеиновую кислоту, описанную выше. Конструкт может содержаться в рекомбинантной клетке-хозяине, которая содержит один или несколько конструктов, которые упомянуты выше. Экспрессию можно подходящим образом обеспечить с помощью культивирования в соответствующих условиях рекомбинантных клеток-хозяев, содержащих подходящие последовательности нуклеиновой кислоты. После экспрессии антитело или фрагменты антител можно выделить и/или очистить с использованием любой подходящей методики, после чего применять в соответствующих случаях.
Системы для клонирования и экспрессии полипептида в ряде различных клеток-хозяев являются хорошо известными. Подходящие клетки-хозяева включают системы на основе бактерий, клеток млекопитающих, дрожжей, насекомых и бакуловирусную систему экспрессии. Доступные из уровня техники линии клеток млекопитающих для экспрессии гетерологичного полипептида включают клетки яичника китайского хомячка (СНО), HeLa клетки, клетки почки новорожденного хомячка и NSO клетки миеломы мыши. Типичным преимущественным хозяином-бактерией является Е. coli. Экспрессия антител и фрагментов антитела в прокариотических клетках, таких как Е. coli, является хорошо известной из уровня техники. Экспрессия в эукариотических клетках в культуре также является доступной для специалиста в настоящей области техники как вариант для получения связывающего элемента.
Общие методики получения антител хорошо известны специалисту в настоящей области техники, причем такие способы обсуждаются, например, в Kohler and Milstein (1975) Nature 256: 495-497; патенте США №4376110; Harlow and Lane, Antibodies: a Laboratory Manual, (1988) Cold Spring Harbor. Методики получения рекомбинантных молекул антител описаны в вышеупомянутых источниках, а также, например, в Европейском патенте №0368684.
Согласно определенным вариантам осуществления согласно настоящему изобретению используются рекомбинантные нуклеиновые кислоты, содержащие вставку, кодирующую вариабельный домен тяжелой цепи и/или вариабельный домен легкой цепи антител или связывающих элементов. В сущности, такие нуклеиновые кислоты содержат кодирующие однонитевые нуклеиновые кислоты, двухнитевые нуклеиновые кислоты, состоящие из указанных кодирующих нуклеиновых кислот и комплементарных им нуклеиновых кислот, или эти комплементарные (однонитевые) нуклеиновые кислоты сами по себе.
Более того, нуклеиновые кислоты, кодирующие вариабельный домен тяжелой цепи и/или вариабельный домен легкой цепи антител, могут представлять собой ферментативно или химически синтезированные нуклеиновые кислоты, характеризующиеся аутентичной последовательностью, кодирующей встречающиеся в естественных условиях вариабельный домен тяжелой цепи и/или вариабельный домен легкой цепи, или их мутанта.
Антитело согласно настоящему изобретению можно получить посредством рекомбинантных методов не только непосредственно, но также в виде слитого полипептида с гетерологичным полипептидом, который предпочтительно представляет собой сигнальную последовательность, или другим полипептидом со специфическим сайтом расщепления на N-конце зрелого белка или полипептида. Выбранная гетерологичная сигнальная последовательность предпочтительно представляет собой таковую, которая узнается и подвергается процессингу (т.е. расщепляется сигнальной пептидазой) клеткой-хозяином. Для прокариотических клеток-хозяев, которые не узнают и не подвергают процессингу сигнальную последовательность нативного антитела, сигнальная последовательность замещается на прокариотическую сигнальную последовательность, выбранную, например, из группы лидерных последовательностей щелочной фосфатазы, пенициллиназы, 1рр или термостабильного энтеротоксина II.
Выражение "выделенный" при использовании в отношении канинизированных антител согласно настоящему изобретению, или связывающих элементов, полученных из них, или полипептидов, которые кодируют их, относится к состоянию, при котором указанные антитела, связывающие элементы или нуклеиновые кислоты (полинуклеотиды) обеспечиваются в выделенной и/или очищенной форме, то есть они были отделены от, выделены из или очищены от их естественного окружения и обеспечиваются, главным образом, в чистой или однородной форме или, в случае нуклеиновой кислоты, не содержат или, главным образом, не содержат нуклеиновой кислоты или генов другого происхождения, нежели последовательность, кодирующая полипептид с необходимой функцией. Соответственно, такие выделенные антитела, связывающие элементы и выделенные нуклеиновые кислоты не будут содержать или, главным образом, не будут содержать материала, с которым они связаны в естественных условиях, такого как другие полипептиды или нуклеиновые кислоты, с которыми они обнаруживаются в их естественном окружении или в среде, в которой их получают (например, клеточная культура), если такое получение выполняется с помощью технологии рекомбинантной ДНК, практически осуществляемой in vitro или in vivo.
Антитела, связывающие элементы и нуклеиновые кислоты могут быть составлены с разбавителями или вспомогательными веществами и при этом из практических соображений все еще считаться обеспеченными в выделенной форме. Например, антитела и связывающие элементы можно смешать с желатином или другими носителями при использовании для покрытия микротитровальных планшетов для применения в иммунологических анализах, или их будут смешивать с фармацевтически приемлемыми носителями или разбавителями при использовании в диагностике или терапии. Антитела или связывающие элементы могут быть гликозилированными либо с помощью естественных механизмов, либо с помощью систем гетерологичных эукариотических клеток (например, СНО или NSO клетки), либо они могут быть (например, при получении посредством экспрессии в прокариотической клетке) негликозилированными.
Неоднородные препараты, содержащие молекулы канинизированных антител против собачьего NGF, также составляют часть настоящего изобретения. Например, такие препараты могут представлять собой смеси антител с тяжелыми цепями полной длины и тяжелыми цепями, лишенными С-концевого лизина, с различными степенями гликозилирования и/или с аминокислотами, подвергнутыми дериватизации, такой как циклизация N-концевой глутаминовой кислоты с образованием остатка пироглутаминовой кислоты.
Очистка антител
Изотипы А, В, С и D MAb против собачьего NGF характеризуются равной эффективностью. Изотипы А и D собачьего IgG могут быть предпочтительны для использования согласно настоящему изобретению, поскольку эти изотипы характеризуются желаемым отсутствием связывания комплемента. Однако эти изотипы не связывают стафилококковый белок А иди стрептококковый белок G и, соответственно, не могут быть очищены с использованием этих традиционных инструментов. Авторы настоящего изобретения выявили два альтернативных способа, которые могут быть использованы для очистки изотипов А и/или D. Первый способ заключается в сочетании анионообменной хроматографии, хроматографии на основе гидрофобных взаимодействий и гель-хроматографии. Второй способ заключается в сочетании аффинной хроматографии captoadhere и анионообменной хроматографии.
Фармацевтические композиции
Как правило, фармацевтические композиции согласно настоящему изобретению составляют в виде жидкого состава, лиофилизированного состава, лиофилизированного состава, который восстанавливается в жидкость, или в виде аэрозольного состава. Согласно определенным вариантам осуществления антитело в составе находится в концентрации от приблизительно 0,5 мг/мл до приблизительно 250 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 45 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 100 мг/мл, от приблизительно 100 мг/мл до приблизительно 200 мг/мл или от приблизительно 50 мг/мл до приблизительно 250 мг/мл. Согласно определенным вариантам осуществления состав дополнительно содержит буфер. Как правило, рН состава составляет от приблизительно рН 5,5 до приблизительно рН 6,5. Согласно определенным вариантам осуществления буфер может содержать от приблизительно 4 мМ до приблизительно 60 мМ гистидинового буфера, от приблизительно 5 мМ до приблизительно 25 мМ сукцинатного буфера или от приблизительно 5 мМ до 25 мМ ацетатного буфера. Согласно определенным вариантам осуществления буфер содержит хлорид натрия в концентрации от приблизительно 10 мМ до 300 мМ, как правило в концентрации около 125 мМ, и цитрат натрия в концентрации от приблизительно 5 мМ до 50 мМ, как правило 25 мМ. Согласно определенным вариантам осуществления состав может дополнительно содержать поверхностно-активное вещество в концентрации от немного выше 0% до приблизительно 0,2%. Согласно определенным вариантам осуществления поверхностно-активное вещество выбрано из группы, состоящей без ограничения из: полисорбата-20, полисорбата-40, полисорбата-60, полисорбата-65, полисорбата-80, полисорбата-85 и их сочетаний. В предпочтительном варианте осуществления поверхностно-активное вещество представляет собой полисорбат-20 и может дополнительно содержать хлорид натрия в концентрации приблизительно 125 мМ и цитрат натрия в концентрации приблизительно 25 мМ.
Введение
Антитела или связывающие элементы согласно настоящему изобретению можно вводить сами по себе, но предпочтительно их будут вводить в виде фармацевтической композиции, которая обычно содержит подходящий фармацевтически приемлемый наполнитель, разбавитель или носитель, выбранные в зависимости от предполагаемого пути введения. Примеры подходящих фармацевтических носителей включают воду, глицерин, этанол и подобное.
Моноклональное антитело или связывающий элемент согласно настоящему изобретению можно вводить пациенту-собаке, нуждающейся в лечении, любым подходящим путем. Как правило, композицию можно вводить парентерально путем инъекции или инфузии. Примеры предпочтительных путей для парентерального введения включают без ограничения внутривенное, внутрисердечное, внутриартериальное, внутрибрюшинное, внутримышечное, внутриполостное, подкожное, чресслизистое, ингаляционное или чрескожное. Пути введения могут дополнительно включать местное и кишечное, например, мукозальное (в том числе легочное), пероральное, назальное, ректальное.
В вариантах осуществления в случаях, когда композиция доставляется в виде инъекционной композиции, например, при внутривенном, внутрикожном или подкожном применении, активный ингредиент может присутствовать в форме приемлемого для парентерального введения водного раствора, который является апирогенным и характеризуется подходящими рН, изотоничностью и стабильностью. Специалист в настоящей области техники способен приготовить подходящие растворы с использованием, например, изотоничных сред, таких как инъекционный раствор хлорида натрия, инъекционный раствор Рингера или инъекционный раствор Рингера с лактатом. Консерванты, стабилизаторы, буферы, антиоксиданты и/или другие добавки можно включить при необходимости.
Композицию также можно вводить с помощью микросфер, липосом, других систем доставки на основе микрочастиц или составов с замедленным высвобождением, помещаемых в определенные ткани, в том числе кровь.
Примеры методик и протоколов, упоминаемых выше, и другие методики и протоколы, которые можно использовать в соответствии с настоящим изобретением, можно найти в Remington's Pharmaceutical Sciences, 18th edition, Gennaro, A.R., Lippincott Williams & Wilkins; 20th edition ISBN 0-912734-04-3; и Pharmaceutical Dosage Forms and Drug Delivery Systems; Ansel, H.C. et al. 7th Edition ISBN 0-683305-72-7, полные раскрытия которых включены в настоящий документ с помощью ссылки.
Антитела и композиции согласно настоящему изобретению, как правило, вводят субъекту в "терапевтически эффективном количестве", оно представляет собой количество, достаточное для проявления благоприятного воздействия в отношении субъекта, которому вводят композицию. Фактическая вводимая доза и частота и длительность введения будут зависеть от и могут определяться с должным учетом природы и тяжести состояния, которое подлежит лечению, а также таких факторов, как возраст, пол и вес субъекта, которого лечат, а также пути введения. Также должное внимание следует уделить свойствам композиции, например, ее активности связывания и времени нахождения в плазме крови in-vivo, концентрации антитела или связывающего элемента в составе, а также пути, месту и скорости доставки.
Схемы приема могут включать однократное введение антитела или композиции согласно настоящему изобретению или введение нескольких доз антитела или композиции. Антитело или содержащие антитело композиции можно также вводить последовательно или раздельно с другими терапевтическими средствами и лекарственными препаратами, которые используют для лечения состояния, при котором для лечения вводят антитело или связывающий элемент согласно настоящему изобретению.
Примеры схем приема, которые можно назначать субъекту, можно выбрать из группы, содержащей без ограничения от 1 мкг/кг/сутки вплоть до 20 мг/кг/сутки, от 1 мкг/кг/сутки вплоть до 10 мг/кг/сутки, от 10 мкг/кг/сутки вплоть до 1 мг/кг/сутки. Согласно определенным вариантам осуществления доза будет такой, чтобы получить концентрацию антитела в плазме крови от 1 мкг/мл до 100 мкг/мл. Однако фактическая доза вводимой композиции и частота и длительность введения будут зависеть от природы и тяжести состояния, подлежащего лечению. Назначение лечения, например, выбор дозировки и т.д., в конечном счете, находится в пределах ответственности и осуществляется по усмотрению практикующих ветеринарных врачей и других врачей-ветеринаров, и для него, как правило, учитывается нарушение, подлежащее лечению, состояние конкретного пациента, место доставки, способ введения и другие факторы, известные практикующим врачам.
Определения
Если не определено иное, все технические и научные термины, используемые в настоящем документе, имеют значение обычно понятное лицу, которое является специалистом в области техники настоящего изобретения. Значение и объем терминов должен быть ясным, однако, в случае какой-либо двусмысленности определения, данные в настоящем документе, имеют преимущественное значение перед любым словарным или посторонним значением.
По всему описанию, если контекст не требует иного, термины "содержат" или "включают" или варианты, такие как "содержит" или "содержащий", "включает" или "включающий" следует понимать как предполагающие включение указанного целого или группы целых, а не исключение любого другого целого или группы целых.
Используемые в настоящем документе термины, приведенные в формах единственного числа включают соответствующие формы множественного числа, если контекст явно не требует иного. Таким образом, например, ссылка на "активное средство" или "фармацевтически активное средство" включает одно активное средство, а также два или более различных активных средств в сочетании, тогда как ссылки на "носитель" включают смеси двух или более носителей, а также один носитель и т.п.Кроме того, если контекст не требует иного, термины в единственном числе должны включать в себя множественное, а термины во множественном числе должны включать в себя единственное.
Как определено в настоящем документе, термин "боль" означает неприятное чувственное и эмоциональное переживание, связанное с фактическим или возможным повреждением ткани или описанное в отношении такого повреждения.
В отношении операционной или послеоперационной боли Акт о защите прав животных в США (US Animal Welfare Act) (Animal Welfare Act 2002. AWA regulations, CFR, Title 9 (Animals и Animal Products), Chapter 1 (Animal и Plant Health Inspection Service, Department of Agriculture). Subchapter A (Animal Welfare), Parts 1-4) определяет болезненную процедуру как любую процедуру, которая, как обосновано ожидается, вызовет быль сильнее незначительной или кратковременной боли или страдания у человека, в отношении которого применялась эта процедура, то есть, боль, превышающая таковую, вызванную инъекциями или другими несущественными процедурами. Таким образом, если собака подвергается болезненной хирургической процедуре, животное должно получить послеоперационные анальгезирующие средства.
В другом случае собака может испытывать значительную или хроническую боль в результате связанного медицинского состояния, такого как ревматоидный артрит, остеоартрит, воспаление или раковое или злокачественное состояние.
Термин "ноцицепция" относится к восприятию болевых стимулов. Как определено в настоящем документе, "нейропатическая боль" (также известная как невралгия) представляет собой боль, которая происходит от проблем с сигналами от нервов. Она может возникать как следствие повреждения или заболевания, поражающего соматосенсорную систему. Существуют причины нейропатической боли, и она может быть связана с ненормальными воспринимаемыми ощущениями, называемыми дисэстезией, которые возникают спонтанно. В качестве альтернативы, она может быть связана с аллодинией, которая проявляется при появлении боли, или, что хуже, при прикосновении или стимуле, который в норме не должен был вызывать боль. Например, легкое прикосновение к лицу может стать причиной возникновения боли при невралгии тройничного нерва, или давление постельного белья может стать причиной возникновения боли при диабетической нейропатии. Нейропатическая боль может также возникать в результате аллодинии при появлении боли, или, что хуже, при прикосновении или стимуле, который в норме не должен был вызывать боль. Например, легкое прикосновение к лицу может стать причиной возникновения боли при невралгии тройничного нерва. Нейропатическая боль, относящаяся к гипералгезии, означает, что сильная боль возникает в результате стимула или прикосновения, который в номе вызвал бы лишь незначительный дискомфорт, тогда как парестезия означает, что некомфортные или болезненные ощущения возникают даже при отсутствии контакта с областью чего либо, вызывающего боль, например, булавки и иглы. Другие формы нейропатической боли включают зуд или чесотку, которые могут быть связаны с аллергической или воспалительной реакциями на коже и воспалительной болью, возникающей в результате повреждения ткани и процессов заживления.
Как определено в настоящем документе, термин "нейтрализующее NGF антитело" или подобный описывает антитело, которое способно к нейтрализации биологической активации и передачи сигнала NGF. Нейтрализующее антитело, которое также можно назвать антагонистическим антителом или блокирующим антителом, специфично и предпочтительно селективно связывается с NGF и подавляет одну или несколько биологических активностей NGF. Например, нейтрализующее антитело может подавлять связывание NGF с его целевым лигандом, таким как связанные с клеточной мембраной рецепторы TrkA или р75.
Используемый в настоящем документе термин «биологическая активность» относится к одному или нескольким внутренне присущим биологическим свойствам молекулы (как присутствующей в природе в том виде, в котором она находится in vivo, так и обеспечиваемой или создаваемой рекомбинантными средствами). Биологические свойства включают в себя без ограничения связывание и/или активацию рецептора;
индукцию передачи клеточного сигнала или клеточной пролиферации, ингибирование клеточного роста, индукцию продукции цитокина, индукцию апоптоза и ферментативную активность.
Термин "гипервариабельный участок (CDR)", который используется в настоящем документе, относится к аминокислотным последовательностям, которые вместе определяют связывающую способность и специфичность природного Fv участка связывающего сайта нативного иммуноглобулина, которые определены Kabat и соавт. (Kabat, E.A., Wu, T.T., Perry, H., Gottesman, K. and Foeller, C. (1991) Sequences of Proteins of hnmunological Interest, Fifth Edition. NIH Publication No.91-3242). Термин "каркасный участок (FR)", который используется в настоящем документе, относится к аминокислотным последовательностям, расположенным между CDR. Эти части антитела служат для поддержания CDR в соответствующей ориентации (это дает возможность CDR связывать антиген).
Термин "константный участок (CR)", который используется в настоящем документе, относится к части молекулы антитела, которая предоставляет эффекторные функции. Согласно настоящему изобретению константные участки, как правило, означают собачьи константные участки, то есть такие константные участки рассматриваемых канинизированных антител, которые происходят из собачьих иммуноглобулинов. Константный участок тяжелой цепи может быть выбран из любого из четырех изотипов: А, В, С или D.
Термин "химерное антитело", который используется в настоящем документе, относится к антителу, содержащему последовательности, происходящие из двух различных антител, которые, как правило, принадлежат к различным видам. Наиболее типично, химерные антитела содержат вариабельные домены, происходящие из вида-донора, которые специфично связываются с целевым эпитопом, и константные домены, происходящие из антител, полученных из целевого вида, которому нужно вводить это антитело.
Термин "иммуногенность", который используется в настоящем документе, относится к мере способности нацеливающего белка или терапевтического фрагмента вызывать иммунный ответ (гуморальный или клеточный) при введении реципиенту. Настоящее изобретение относится к иммуногенности рассматриваемых канинизированных антител. Предпочтительно, антитела согласно настоящему изобретению не обладают иммуногенностью, то есть при введении собаке против них не будут вырабатываться нейтрализующие антитела и, кроме того, Fc участками антитела не будут опосредоваться эффекторные функции.
Термин "идентичность" или "идентичность последовательности", который используется в настоящем документе, означает, что в любом конкретном положении аминокислотного остатка в выравниваемой последовательности аминокислотный остаток является идентичным в выравниваемых последовательностях. Термин "сходство" или "сходство последовательности", который используется в настоящем документе, указывает на то, что в любом конкретном положении в выравниваемых последовательностях аминокислотный остаток в последовательностях представляет собой таковой подобного типа. Например, лейцин может быть замещен остатком изолейцина или валина. Это может относиться к консервативному замещению. Предпочтительно, когда аминокислотные последовательности согласно настоящему изобретению модифицированы посредством консервативного замещения любого из аминокислотных остатков, содержащихся в них, при этом эти изменения не оказывают воздействия на специфичность связывания или функциональную активность получаемого в результате антитела по сравнению с немодифицированным антителом.
Идентичность последовательности в отношении (нативного) полипептида согласно настоящему изобретению и его функциональных производных относится к проценту аминокислотных остатков в кандидатной последовательности, которые являются идентичными остаткам соответствующего нативного полипептида после выравнивания последовательностей и введения гэпов, если необходимо, для достижения максимальной процентной гомологии и без учета любых консервативных замен как части идентичности последовательности. Ни N- или С-концевые продолжения, ни вставки не должны рассматриваться как снижение идентичности последовательности или гомологии. Способы и компьютерные программы для проведения выравнивания двух или более аминокислотных последовательностей и определения их идентичности или гомологии последовательности являются хорошо известными специалисту в настоящей области техники. Например, процент идентичности или сходства 2 аминокислотных последовательностей можно легко рассчитать с использованием алгоритмов, например, BLAST (Altschul et al. 1990), FASTA (Pearson & Lipman 1988) или алгоритма Смита-Вассермана (Smith & Waterman 1981).
Используемая в настоящем документе ссылка на аминокислотный остаток с "наибольшей гомологией" со вторым аминокислотным остатком относится к аминокислотному остатку, большинство характеристик или свойств которого подобны второму аминокислотному остатку. При определении того, характеризуется ли аминокислотный остаток наибольшей гомологией со вторым аминокислотным остатком, как правило, можно оценивать такие факторы, как, без ограничения, заряд, полярность, гидрофобность, масса боковой цепи и размер боковой цепи.
Термин "соответствующее положение", который используется в настоящем документе в отношении аминокислотного остатка, который присутствует во второй последовательности в положении, соответствующем определенному аминокислотному остатку в первой последовательности, как предполагается, относится к положению во второй последовательности, которое является таким же, как и положение в первой последовательности, когда две последовательности выравнивают с обеспечением максимальной идентичности последовательности в двух последовательностях. Аминокислотные остатки в соответствующих положениях характеризуются одинаковыми номерами по Kabat.
Термин "состоит, по существу, из" или "состоящий, по существу, из", который используется в настоящем документе, означает, что полипептид может характеризоваться дополнительными признаками или элементами, помимо описанных, при условии, что такие дополнительные признаки или элементы не оказывают существенного влияния на способность антитела или фрагмента антитела обладать специфичностью связывания с собачьим NGF. То есть, антитело или фрагменты антитела, содержащие полипептиды могут характеризоваться дополнительными признаками или элементами, которые не препятствуют способности антитела или фрагментов антитела связываться с собачьим NGF и оказывать антагонистическое воздействие на функциональную активность собачьего NGF. Такие модификации можно ввести в аминокислотную последовательность с целью снижения иммуногенности антитела. Например, полипептид, состоящий, по существу, из определенной последовательности, может содержать одну, две, три, четыре, пять или более присоединенных, удаленных или замещенных аминокислот на любом из концов или на обоих концах последовательности при условии, что эти аминокислоты не препятствуют подавляющей, блокирующей или нарушающей роли антитела или фрагмента при связывании с собачьим NGF и ограничении его биологической функции. Подобным образом, молекулу полипептида, которая входит в состав антагонистических антител против собачьего NGF согласно настоящему изобретению, можно химически модифицировать одной или несколькими функциональными группами при условии, что такие функциональные группы не препятствуют способности антитела или фрагмент антитела связываться с собачьим NGF и оказывать антагонистическое воздействие на его функцию.
Используемый в настоящем документе термин "эффективное количество" или "терапевтически эффективное количество" означает количество средства, связывающего соединения, малой молекулы, слитого белка или пептидомиметика согласно настоящему изобретению, которое требуется для устранения связывания собачьего NGF с рецепторами р75 и/или TrkA.
Термины "полипептид", "пептид" или "белок" используются в настоящем документе взаимозаменяемо для обозначения линейного ряда аминокислотных остатков, соединенных друг с другом пептидными связями между альфа-амино- и карбокси-группами смежных остатков. Аминокислотные остатки обычно находятся в природной "L" изомерной форме. Однако, остатки в "D" изомерной форме могут замещать любой L-аминокислотный остаток при условии, что полипептидом сохраняется необходимое функциональное свойство.
Как определено в настоящем документе, "антитело" охватывает антигенсвязывающие белки, которые специфично связываются с представляющим интерес целевым антигеном, в этом случае собачьим фактором роста нервов, включающие один или несколько полипептидов, которые могут быть рекомбинантно полученными или которые являются генетически кодируемыми генами иммуноглобулинов или фрагментами генов иммуноглобулинов. Термин "антитело" охватывает моноклональные и химерные антитела, в частности канинизированные антитела, а также охватывает поликлональные антитела или антитела любого класса или подтипа. "Антитело", кроме того, распространяется на гибридные антитела, биспецифичные антитела, гетероантитела и на их функциональные фрагменты, которые сохраняют способность к связыванию антигена.
Фраза "специфично связывается с" относится к связыванию антитела со специфическим белком или мишенью, которые присутствуют в гетерогенной популяции белков. Следовательно, когда они присутствуют в конкретных условиях иммунологического анализа, антитела связываются с конкретным белком, в этом случае собачьим NGF, и не связываются в существенном количестве с другими белками, присутствующими в образце.
Как определено в настоящем документе, "собака" может также называться псом. Собак можно классифицировать как относящихся к подвиду с триномиальным названием Canis lupus familiaris (Canis familiaris domesticus) или Canis lupus dingo. Собаки включают любой вид псовых и включают домашние породы и разновидности домашней собаки, их также называют животными-компаньонами.
Настоящее изобретение будет далее описано со ссылкой на следующие примеры, которые обеспечены с целью иллюстрации, и не предполагается, что они будут рассматриваться как ограничивающие настоящее изобретение. Способы и методики согласно настоящему изобретению обычно осуществляют в соответствии с традиционными методами, хорошо известными из уровня техники и описанными в различных общих или более специальных источниках, которые процитированы и обсуждаются по всему настоящему описанию, если иное не указано особо.
ПРИМЕРЫ
Пример 1 - Продукция антител
Полноразмерные последовательности антител продуцировали путем комбинирования канинизированных последовательностей вариабельных доменов с С-концевыми последовательностями собачьих константных тяжелых или константных легких цепей. В иммунной системе собаки описаны константные домены тяжелой цепи четырех различных изотипов иммуноглобулина-гамма (IgG) (Tang L. et al. 2001. Veterinary Immunology and bnmunopathology, 80. 259-270) наряду с единственными последовательностями константных доменов каппа и лямбда.
Канинизированный VH домен αD11 комбинировали с каждым из четырех изотипов А, В, С и D тяжелой цепи IgG и канинизированным VL доменом αD11 с собачьим константным доменом легкой цепи каппа. Последовательности цепей полноразмерного зрелого антитела (caN) показаны в SEQ ID NO:5 (VL1 и собачий константный домен каппа), 6 (VH1 и тяжелая цепь изотипа А), 7 (VH1 и тяжелая цепь изотипа В), 8 (VH1 и тяжелая цепь изотипа С) и 9 (VH1 и тяжелая цепь изотипа D). Последовательность легкой цепи вариантного антитела (caN2) показана в SEQ ID NO:10 (вариант легкой цепи (VL2) и собачий константный домен каппа). Аминокислотные последовательности тяжелых цепей вариантного антитела (caN2) приведены в SEQ ID NO:11 (вариант НСА - VH2 и тяжелая цепь изотипа A), SEQ ID NO:12 (вариант НСВ - VH2 и тяжелая цепь изотипа В), SEQ ID NO:13 (вариант НСС - VH2 и тяжелая цепь изотипа С) и SEQ ID NO:14 (вариант HCD - VH2 и тяжелая цепь изотипа D).
Объединенные аминокислотные последовательности превращали в экспрессируемую в клетках млекопитающих форму с помощью оптимального выбора кодонов и химического синтеза полного гена и клонирования в вектор экспрессии в клетках млекопитающих pcDNA3.1+.
Полученными кДНК трансфицировали клетки СНО и супернатанты с тяжелыми цепями, характеризующимися последовательностями SEQ Ю NO:6-9, анализировали в примере 2. Антитела, характеризующиеся последовательностью легкой цепи SEQ ID NO:10 и последовательностью тяжелой цепи SEQ ID NO:11, очищали в примере 11.
Пример 2 - Определение связывания антитела с мышиным и собачьим NGF
Комбинациями кДНК канинизированных тяжелых и легких цепей трансфицировали клетки СНО, супернатанты собирали и обеспечивали их реакцию в формате ELISA либо с собачьим, либо с мышиным NGF. После стадий инкубирования и отмывки связанное собачье антитело выявляли по способности реагировать с козьим поликлональным антителом, специфичным к собачьему IgG, связанным с пероксидазой хрена (HRP), и проявляли с использованием ТМВ. Оптическую плотность полученного в результате продукта измеряли при 450 нм и сравнивали с таковой у имитирующего супернатанта с трансфекцией пустым вектором (обозначенным "имитация" на фиг.1).
Результаты показаны на графике на фиг.1. Связывание с мышиным NGF показано для 4 канинизированных антител. Каждое из этих антител содержит одну и ту же легкую цепь (caN-kLC-1), т.е. легкую цепь, содержащую собачий константный домен каппа. Каждое антитело содержит особый константный домен тяжелой цепи. Таким образом, конкретный вариабельный домен тяжелой цепи комбинировали с одним из 4 различных константных доменов (caN-HCA, caN-HCB, caN-HCC или caN-HCD). Во второй части графика показано связывание единственного антитела, состоящего из легкой цепи caN-kLC-1 и константной цепи caN-HCB с собачьим NGF.
Пример 3 - Очистка канинизированных антител
Супернатанты, полученные, как описано в примере 2, очищали с использованием колонки с белком А, разделяли методом SDS-PAGE и тестировали на предмет реактивности по отношению к конъюгату поликлонального антитела против собачьего IgG с HRP. Это поликлональное антитело преимущественно распознавало тяжелые цепи.
Результаты показаны на фиг.2A-D. Легенда: А - НСА представляет собой канинизированное антитело, содержащее тяжелую цепь caN-HCA и легкую цепь caN-kLC, HCB представляет собой канинизированное антитело, содержащее тяжелую цепь caN-HCB и легкую цепь caN-kLC, С - НСС представляет собой канинизированное антитело, содержащее тяжелую цепь caN-HCC и легкую цепь caN-kLC, D - HCD представляет собой канинизированное антитело, содержащее тяжелую цепь caN-HCA и легкую цепь caN-kLC. На каждой из фиг.2A-D, L означает нагрузку, W означает промывку, Р означает пиковую фракцию, a F означает проскок.
Можно видеть, что белок А преимущественно связывался с изотипом HCB (т.е. канинизированным антителом, содержащим тяжелую цепь caN-HCB), тогда как существенного удерживания вещества в случае изотипов НСА, НСС и HCD не происходило, и они легко смывались с белка А.
Пример 4 - Анализ очищенных канинизированных антител методом SDS-PAGE
Показательные фракции пиков из гелей, описанных в примере 2 (фигуры 2A-D), разделяли методом SDS-PAGE и окрашивали Кумасси синим.
Результаты показаны в геле, изображенном на фиг.3. Этот гель показал, что тяжелые и легкие цепи ясно визуализировались. Порядок дорожек слева направо: дорожка 1 - стандарты размеров, дорожка 2 - ПСА caN-HCA+caN-kLC1, дорожка 3 - НСВ caN-HCB+caN-kLC1, дорожка 4 - НСС caN-HCC+caN-kLC1, дорожка 5 - HCD caN-HCA+caN-kLC.
Пример 5 - Ингибирование индуцированной NGF пролиферации клеток TF-1 канинизированными антителами
Серийные разведения супернатантов трансфицированных клеток СНО из примера 2 («антагонист») инкубировали с клетками TF-1 в присутствии 0,3 нг/мл NGF. Полученную пролиферацию измеряли по включению тимидина.
Результаты показаны на фиг.4. 50% Ингибирование наблюдали при расчетной концентрации моноклонального антитела (MAb) 0,75-1,5 нг/мл.
Пример 6 - Связывание комплемента, индуцированное связавшимися с антигеном канинизированными антителами
Супернатанты от трансфицированных СНО клеток из примера 2 инкубировали в планшетах, покрытых 0,1 нг/мл NGF для захвата антител. Планшеты отмывали и затем инкубировали с человеческой сывороткой и связанный комплемент C1q измеряли по связыванию с поликлональным антителом против человеческого C1q с HRP и проявляли как описано выше.
Способ связывания комплемента
Планшеты покрывали 100 мкл/лунку мышиного NGF в концентрации 5 мкг/мл и блокировали 5% BSA/PBS (бычий сывороточный альбумин/фосфатный буферный раствор). Покрытые лунки инкубировали в течение 1 часа при комнатной температуре с супернатантами от клеточных культур, содержащими рекомбинантный канинизированный IgG против NGF, разводили PBS/1% BSA (100 мкл/лунка). Планшеты отмывали и инкубировали в течение 1 часа при комнатной температуре со 100 мкл/лунку человеческой сыворотки, разведенной 1/100 в стабилизированном вероналовым буфером солевом растворе, содержащем 0,5 мМ MgClz, 2 мМ CaCl2, 0,05% Tween-20, 0,1% желатин и 0,5% BSA. После отмывки планшеты инкубировали с 100 мкл овечьего антитела C1q-HRP (Serotec) при разведении 1/800 в PBS/1% BSA. После отмывки планшеты проявляли путем добавления 100 мкл субстрата ТМВ (Thermo Scientific). Проявку останавливали добавлением 100 мкл 2N H2S04 и поглощение считывали при 450 нм.
Результаты показаны на графике на фиг.5. Эти результаты свидетельствуют о связывании C1q с иммобилизованными канинизированными антителами типов НСВ и НСС и отсутствии связывания C1q с канинизированными антителами типов НСА и HCD. Таким образом, результаты неожиданно свидетельствуют о том, что различные происходящие от собаки тяжелые цепи проявляют различные характеристики связывания и активации комплемента и что было показано, что канинизированные антитела с тяжелыми цепями типов НСА и HCD неожиданно являются предпочтительными для применения в качестве антагониста собачьего NGF. Идентификация происходящих от собаки тяжелых цепей, которые не опосредуют связывание комплемента, является особенно важной находкой, поскольку NGF является растворимым медиатором.
Пример 7 - Сравнение связывания моноклонального антитела против собачьего NGF с NGF
Проводили сравнение связывания моноклонального антитела против собачьего NGF с NGF с использованием каркасов VL1 и VH1 (SEQ ID NO:1 и 2) против альтернативных каркасов VL2 и VH2 (SEQ ID NO:3 и 4). ДНК, кодирующую легкую и тяжелую цепи, представленные в SEQ ID NO:10 и SEQ ID NO:11, синтезировали и клонировали в pcDNA3,1+ правее от пептидов секреторной сигнальной последовательности. ДНК котрансфицировали клетки СНО и супернатант сравнивали методом ELISA связывания с мышиным NGF и супернатанта СНО, полученного в результате коэкспрессии SEQ ID NO:5 с SEQ ID NO:7.
Результаты показаны на фиг.13А. Дорожки A-D соответствуют супернатанту (неразбавленный, 1/10, 1/100, 1/1000, соответственно), полученному с использованием SEQ ID NO:5 и SEQ ID NO:7. Дорожки Е-Н соответствуют супернатанту (неразбавленный, 1/10, 1/100, 1/1000, соответственно), полученному с использованием SEQ ID NO:10 и SEQ ID NO:11. Дорожка I соответствует неразбавленному супернатанту, полученному с использованием отрицательного контроля.
Пример 8 - Связывание комплемента, индуцированное связавшимися с NGF канинизированными антителами
Супернатанты трансфицированных клеток СНО из примера 7 тестировали на их способность рекрутировать комплемент методом анализа Clq ELISA (в соответствии со способом, описанным на фиг.5).
Результаты показаны на фиг.13 В. Комбинация VL2 (в SEQ ID NO:10) и VH2 каркасов с константными доменами типа НСА (SEQ ID NO:11) была неактивна в рекрутировании комплемента несмотря на связывание с NGF, наблюдаемое на панели А, эквивалентное таковому тяжелой цепи типа НСВ в MAb (SEQ ID NO:5+7). MAb тестировали в сериях разведении 4, 2 и 1 мкг/мл. С использовали в качестве отрицательного контроля.
Пример 9 - Сравнение связывания с NGF N-гликозилированных и агликозилированных вариантов моноклональных антител против собачьего NGF с тяжелыми цепями изотипов НСВ и НСС
Проводили сравнение связывания с NGF N-гликозилированных и агликозилированных вариантов моноклональных антител против собачьего NGF с тяжелыми цепями изотипов НСВ и НСС. Экспрессирующими векторами, кодирующими пары легких и тяжелых цепей, представленных в SEQ ID NO:5 и SEQ ID NO:7 (НСВ), SEQ ID NO:5 и SEQ ID NO:16 (НСВ*), SEQ ID NO:5 и SEQ ID NO:8 (НСС), или SEQ ID NO:5 и SEQ ID NO:17 (НСС*), котрансфицировали клетки СНО и супернатанты сравнивали методом ELISA связывания с мышиным NGF.
Результаты показаны на фиг.14А. Белые боксы соответствуют неразбавленному супернатанту, закрашенные боксы соответствуют разведению 1/100, а С соответствует неразбавленному супернатанту отрицательного контроля. Наблюдали эквивалентное связывание с NGF.
Пример 10 - Связывание комплемента, индуцированное связавшимися с NGF канинизированными антителами
Супернатанты трансфицированных клеток СНО из примера 9 тестировали на их способность рекрутировать комплемент методом анализа C1q ELISA (в соответствии со способом, описанным на фиг.5).
Результаты показаны на фиг.14В. Способность рекрутировать комплемент C1q устранялась при удалении N-связанного участка гликозилирования из тяжелой цепи типа В (НСВ*) и ослаблялась сходной мутацией в тяжелой цепи типа С (НСС*).
Таким образом, в настоящем документе совершенно неожиданно показано, что если антитело согласно изобретению содержит происходящую от собаки тяжелую цепь подтипа НСА или HCD, связывание антитела с собачьим NGF не приводит к активации комплемента или иных нисходящих эффекторных функций, таких как ADCC. Таким образом, указанные антитела при антагонистическом воздействии на биологическую функциональную активность собачьего NGF путем предотвращения связывания собачьего NGF с мембраносвязанными рецепторами TrkA или р75 ингибируют ассоциированный каскад нисходящей внутриклеточной передачи сигнала. Кроме того, поскольку экспрессия NGF часто имеет место вблизи нервов и т.п., оказывающие антагонистическое действие в отношении или нейтрализующие NGF антитела согласно изобретению, которые содержат происходящую от собаки тяжелую цепь подтипа НСА или HCD, могут блокировать биологическую активность собачьего NGF без вовлечения более широкого иммунного ответа. Такие функциональные свойства являются хоть и неожиданными, но чрезвычайно желаемыми.
Пример 11: Очистка моноклональных антител против NGF после экспрессии в клетках СНО
Поскольку для моноклональных антител против собачьего NGF изотипов НСА и HCD характерно желаемое отсутствие связывания комплемента (фигура 5), но присуще слабое связывание со стафилококковым белком А (фигура 2), были разработаны альтернативные способы очистки. Моноклональные антитела против собачьего NGF, полученные с помощью экспрессирующих векторов, экспрессирующих SEQ ID NO:10 (вариант легкой цепи (VL2) и собачьего константного домена каппа) и SEQ ID NO:11 (вариант НСА - VH2 и тяжелая цепь изотипа А), экспрессировали в клетках СНО и по результатам обширных исследований было выявлено, что антитело против собачьего NGF может быть фракционировано до высокой чистоты двумя альтернативными способами очистки.
Согласно первому способу моноклональное антитело против собачьего NGF очищали методами анионообменной хроматографии, хроматографии на основе гидрофобных взаимодействий и гель-хроматографии (способ I - фигура 15А и В). Согласно второму способу антитело против NGF очищали методами аффинной хроматографии Captoadhere с последующей анионообменной хроматографией (способ II - фигура 15С и D).
Основной пик моноклонального антитела против NGF, очищенного любым из способов, соответствует молекулярной массе приблизительно 150 кДа. Сравнение методами SDS-PAGE и ELISA (фигура 16) свидетельствует о том, что способы I и II позволяют получать препараты антитела одинаковой чистоты и биологической активности. Очищенные моноклональные антитела против NGF, полученные этими способами, тестировали методом анализа нейтрализации NGF TF-1 (описанным на фигуре 4) и было показано, что они характеризуются высокой активностью (IC50 13 пМ антител против NGF нейтрализовали 37 пМ NGF; не показано).
Пример 12; Моноклональные антитела против собачьего NGF могут быть безопасно введены собакам внутривенным путем и не вызывают лихорадку
Моноклональные антитела против собачьего NGF, полученные с помощью экспрессирующих векторов, экспрессирующих SEQ ID NO:10 и SEQ ID NO:11 (собачья тяжелая цепь типа НСА), экспрессировали в клетках СНО и очищали комбинацией методов ионообменной хроматографии, хроматографии на основе гидрофобных взаимодействий и гель-хроматографии (способ I, фигура 15А и В) и буфер заменяли на фосфатно-солевой буфер. Антитела инъецировали внутривенно собакам породы бигль в концентрации 2 мг/кг массы тела и оценивали на предмет знаков токсичности методом визуального обследования ветеринаром, по изменению массы тела, температуры тела и биохимических показателей плазмы. Фигура 17 иллюстрирует измерения массы и температуры тела. Не наблюдалось изменений этих или любых других измеренных биохимических показателей плазмы (включая натрий, калий, хлорид, кальций, фосфат, мочевина, креатинин, глюкоза, холестерин, билирубин, аланинтрансаминаза, щелочная фосфатаза, амилаза, липаза, общий белок или альбумин: не показано).
Пример 13. Фармакокинетика моноклонального антитела против собачьего NGF в плазме in vivo свидетельствует о длительном времени полувыведения из сыворотки и отсутствии иммуногенности
Моноклональные антитела против собачьего NGF, полученные с помощью экспрессирующих векторов, экспрессирующих SEQ ID NO:10 и SEQ ID NO:11 (собачья тяжелая цепь типа НСА), экспрессировали в клетках СНО и очищали комбинацией методов ионообменной хроматографии, хроматографии на основе гидрофобных взаимодействий и гель-хроматографии (способ I, фигура 15А и В) и буфер заменяли на фосфатно-солевой буфер. Антитела инъецировали внутривенно собакам породы бигль в концентрации 2 мг/кг массы тела и образцы плазмы отбирали в различных временных точках в течение следующих 2 недель. Разбавленные образцы плазмы оценивали на предмет концентрации антитела против собачьего NGF методом ELISA с использованием в качестве мишени NGF и конъюгат поликлонального антитела против собачьего NGF с пероксидазой хрена в качестве вторичного реагента и проявляли в соответствии с фигурой 1. Результаты показаны на фигуре 18. Измеренные концентрации в плазме согласовывались с двухфазной кинетикой при времени полужизни в (альфа) фазе тканевого распределения приблизительно 33 часов и неожиданно длительной (бета) фазой элиминации приблизительно 9 суток.
Отсутствие резкого снижения концентрации антитела против собачьего NGF в плазме от 100 до 300 часов свидетельствует о том, что в крови собак нет ни предсуществующих нейтрализующих антител против рекомбинантных моноклональных антител против NGF, ни наработанных таковых нейтрализующих антител после введения. Для сравнения, рекомбинантные белки на основе иммуноглобулина человека нейтрализуются антителами в крови собак приблизительно за 200 часов после введения (Richter et al. Drag Metabolism and Disposition 27: 21, 1998). Эти результаты показывают, таким образом, что антитела против собачьего NGF согласно настоящему изобретению характеризуются длительным временем полувыведения из сыворотки (9 суток) in vivo после внутривенной инъекции и что нет ни предсуществующих антител, ни вновь наработанных антител, которые нейтрализовали бы со временем введенные антитела против NGF.
Пример 14 - Эффект моноклонального антитела против собачьего NGF по ослаблению воспалительной боли in vivo
Антителотерапия:
Моноклональные антитела против собачьего NGF, полученные с помощью экспрессирующих векторов, экспрессирующих SEQ ID NO:10 и SEQ ID NO:11 (собачья тяжелая цепь типа НСА), экспрессировали в клетках СНО и очищали комбинацией методов ионообменной хроматографии, хроматографии на основе гидрофобных взаимодействий и гель-хроматографии (способ I) и буфер заменяли на фосфатно-солевой буфер.
Собачья модель воспаления
Все эксперименты выполняли с предварительным утверждением ведомственного этического комитета (Institutional Ethics Committee) (CRL, Ирландия). Собакам породы бигль вводили инъекцией (=день -1) каолин в подушечку стопы задней конечности с целью создания саморазрешающегося воспаления, начинающегося примерно 24 часа спустя, и которое вызывает временную хромоту собак. В этой модели, как только первоначальная воспалительная реакция на каолин пойдет на убыль, собаки станут хромать все меньше в течение периода примерно 1-2 недели и затем полностью восстановятся.
Группам из 3 собак вводили инъекцией внутривенно либо моноклональные антитела против собачьего NGF в дозе 200 мкг/кг массы тела, либо фосфатно-солевой буферный раствор в качестве контроля средой (= день 0). Собак оценивали в отношении хромоты в течение 7 дней с помощью способа визуальной оценки (например, оценка 0, нет хромоты (полная нагрузка на ногу); оценка 1, легкая хромота (неполная нагрузка на ногу, но ходит нормально); оценка 2, умеренная хромота (незначительная нагрузка на ногу, и не ходит нормально); оценка 3, тяжелая хромота (без нагрузки на ногу)). Наблюдатели не были осведомлены относительно того, какую инъекцию получали те или иные собаки.
Результаты показаны на фиг.19. Оценки хромоты снижались у собак, получавших моноклональные антитела против NGF, к 3 дню после инъекции в сравнении с контролем средой, указывая на то, что моноклональные антитела против NGF оказывают воздействие на снижение боли у собак большее, нежели таковое, наблюдаемое только со средой самой по себе. Отложенная активность соответствует фармакокинетике в плазме крови для моноклональных антител против собачьего NGF, которые демонстрировали медленное распределение в тканях в ходе фазы (альфа), длящейся примерно 30 часов, и относительно слабую васкуляризацию области подушечки стопы. Результаты, показанные на фиг.19, показывают, что антитела против собачьего NGF согласно настоящему изобретению, снижают воспалительную боль у собак с вытекающим снижением хромоты.
Все документы, упоминаемые в настоящем описании, включены в настоящий документ с помощью ссылки. Различные модификации и изменения в описанных вариантах осуществления настоящих изобретений будут очевидны специалисту в настоящей области техники без отступления от объема настоящего изобретения. Хотя настоящее изобретение было описано в связи с конкретными предпочтительными вариантами осуществления, следует понимать, что заявленное изобретение не следует излишне ограничивать такими конкретными вариантами осуществления. В действительности, различные модификации описанных методов осуществления изобретения, которые являются очевидными для специалиста в настоящей области техники, как предполагается, охватываются настоящим изобретением.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ NGF И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2019 |
|
RU2838175C2 |
| ТЕРАПЕВТИЧЕСКИЕ СОБАЧЬИ ИММУНОГЛОБУЛИНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2627191C2 |
| ТЕРАПЕВТИЧЕСКИЕ СОБАЧЬИ ИММУНОГЛОБУЛИНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2626527C1 |
| АНТИТЕЛА ПРОТИВ ФАКТОРА РОСТА НЕРВОВ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2012 |
|
RU2640252C2 |
| АНТИТЕЛА ПРОТИВ ФАКТОРА РОСТА НЕРВОВ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2012 |
|
RU2640254C2 |
| АНТИТЕЛА К PD-1 СОБАК | 2014 |
|
RU2761663C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ПРОТИВ ИНТЕРЛЕЙКИНА-31 | 2012 |
|
RU2588462C2 |
| АНТИТЕЛА К АЛЬФА-РЕЦЕПТОРУ СОБАЧЬЕГО ИНТЕРЛЕЙКИНА-4 | 2016 |
|
RU2736732C2 |
| КАНИНИЗИРОВАННЫЕ МЫШИНЫЕ АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ PD-1 | 2014 |
|
RU2676158C1 |
| АНТИТЕЛА К PD-1 СОБАК | 2014 |
|
RU2732604C2 |








































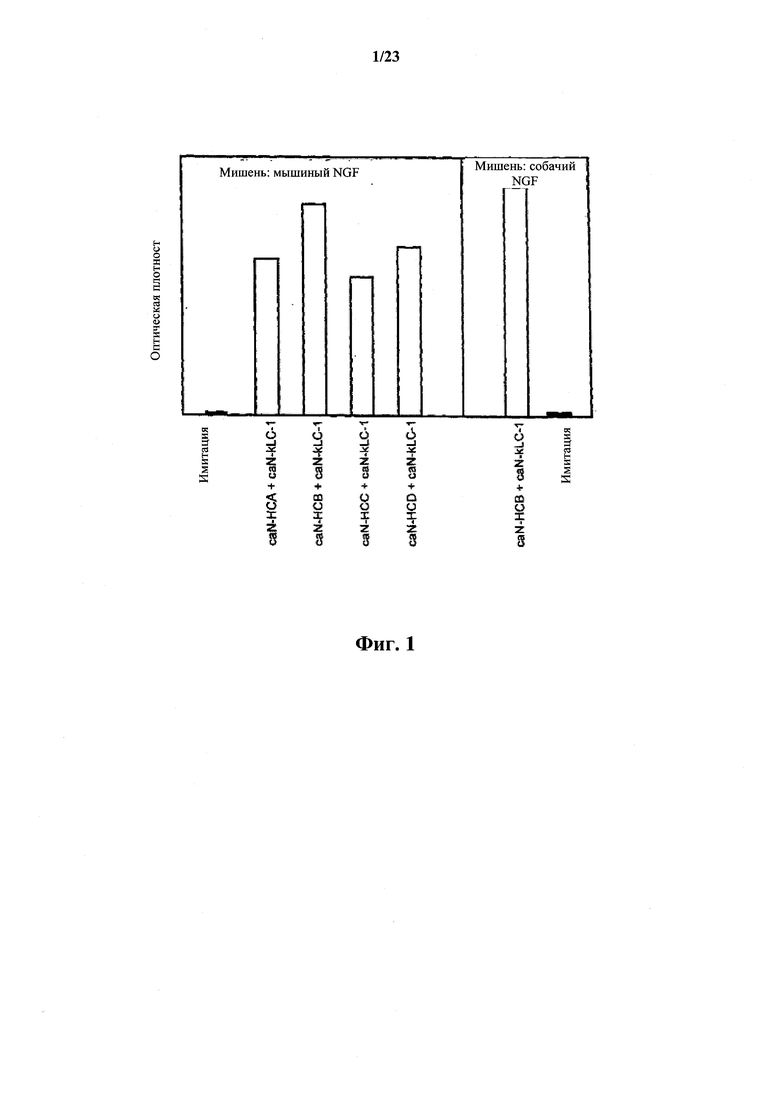

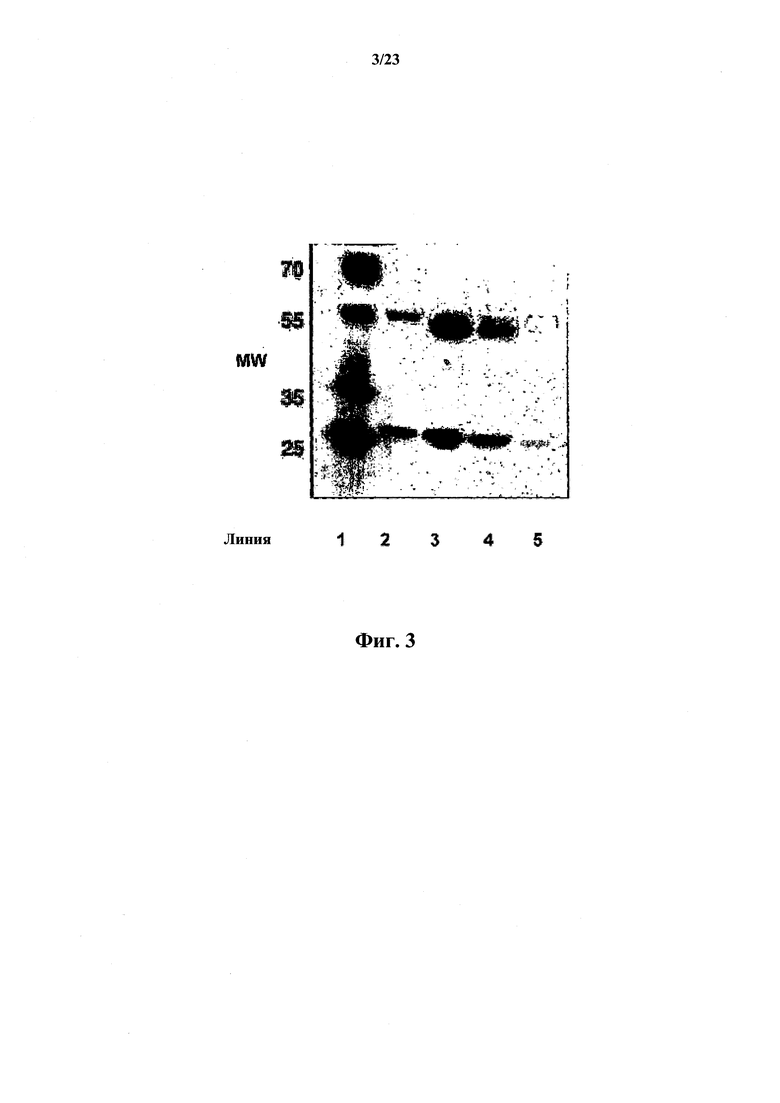
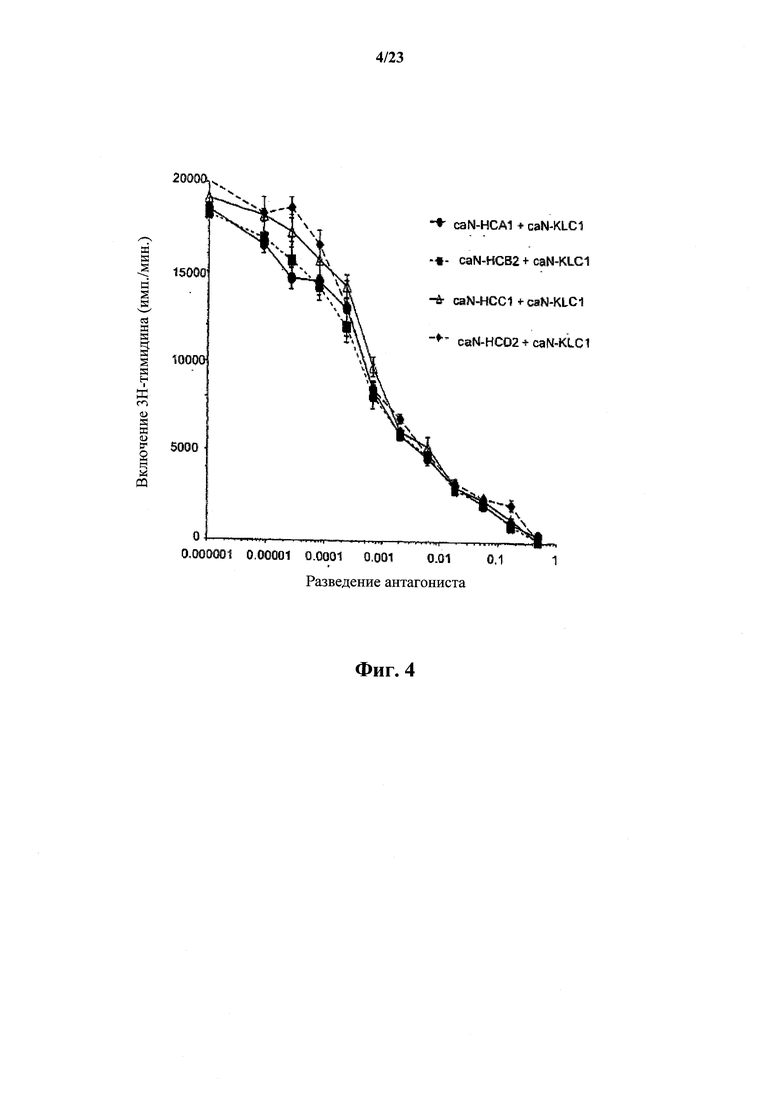
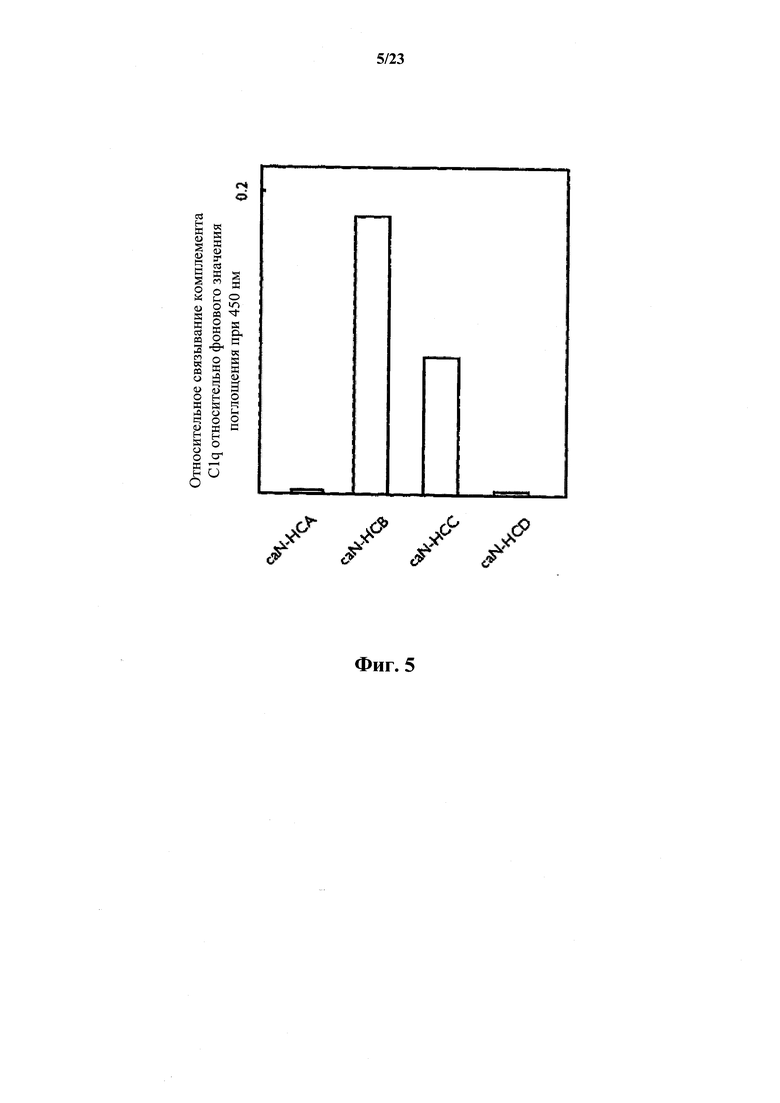







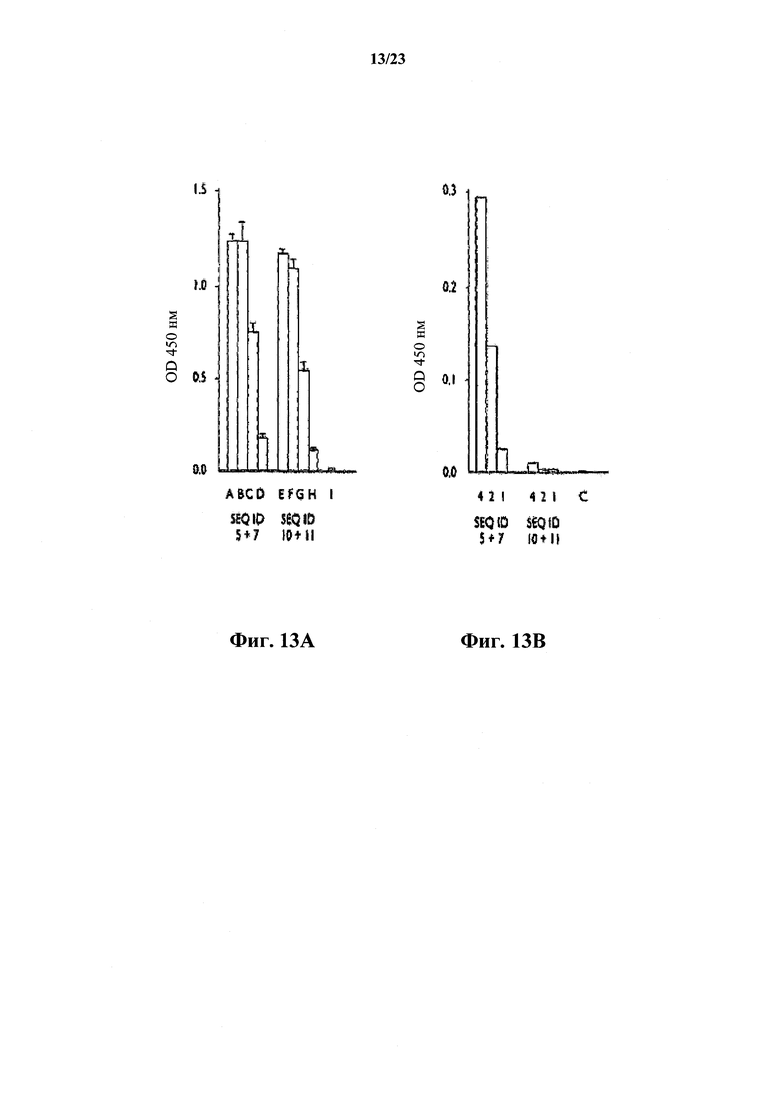
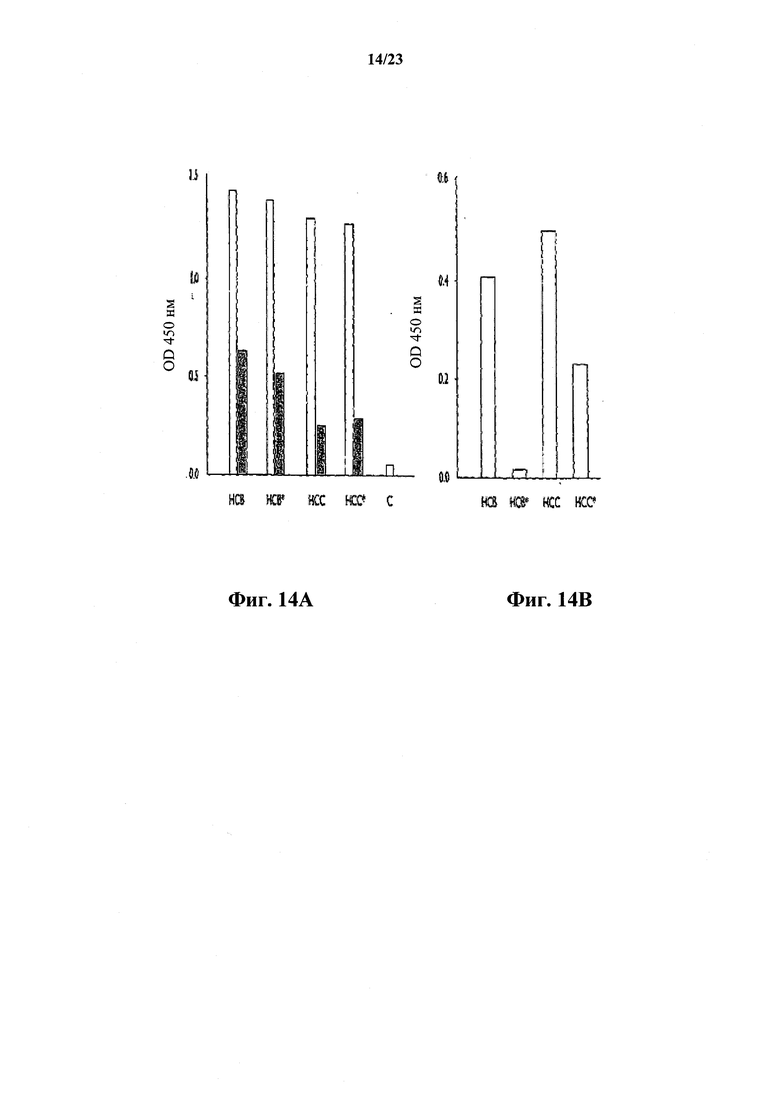
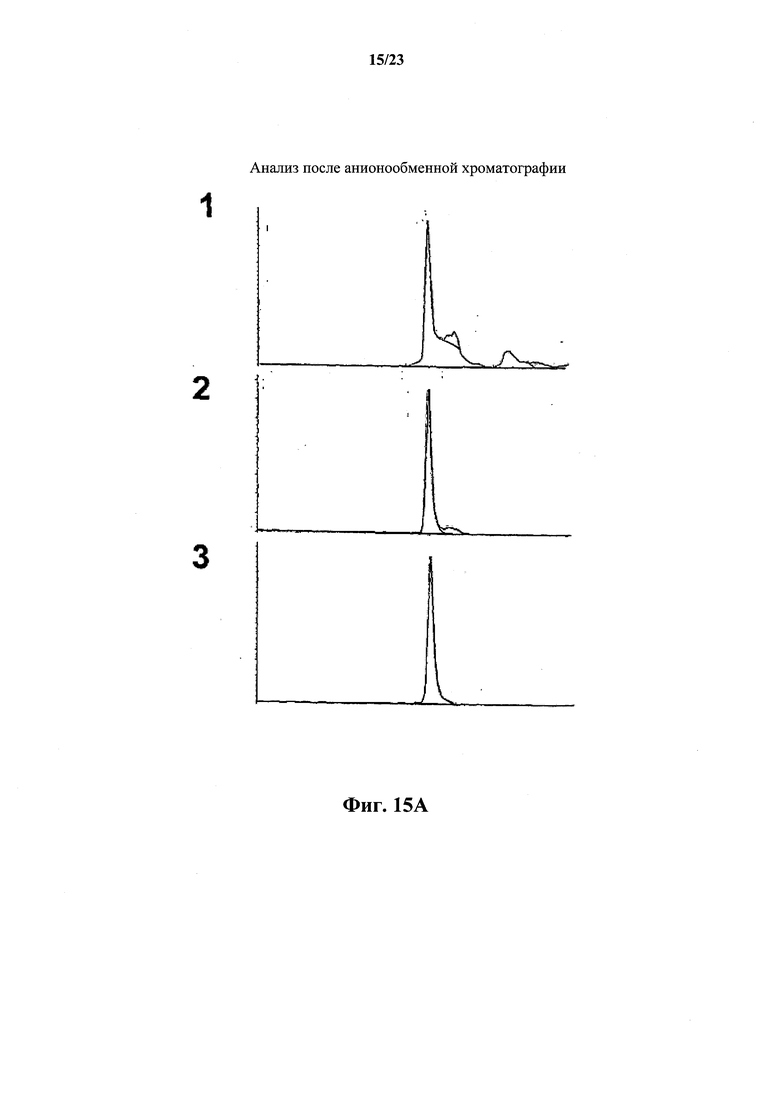
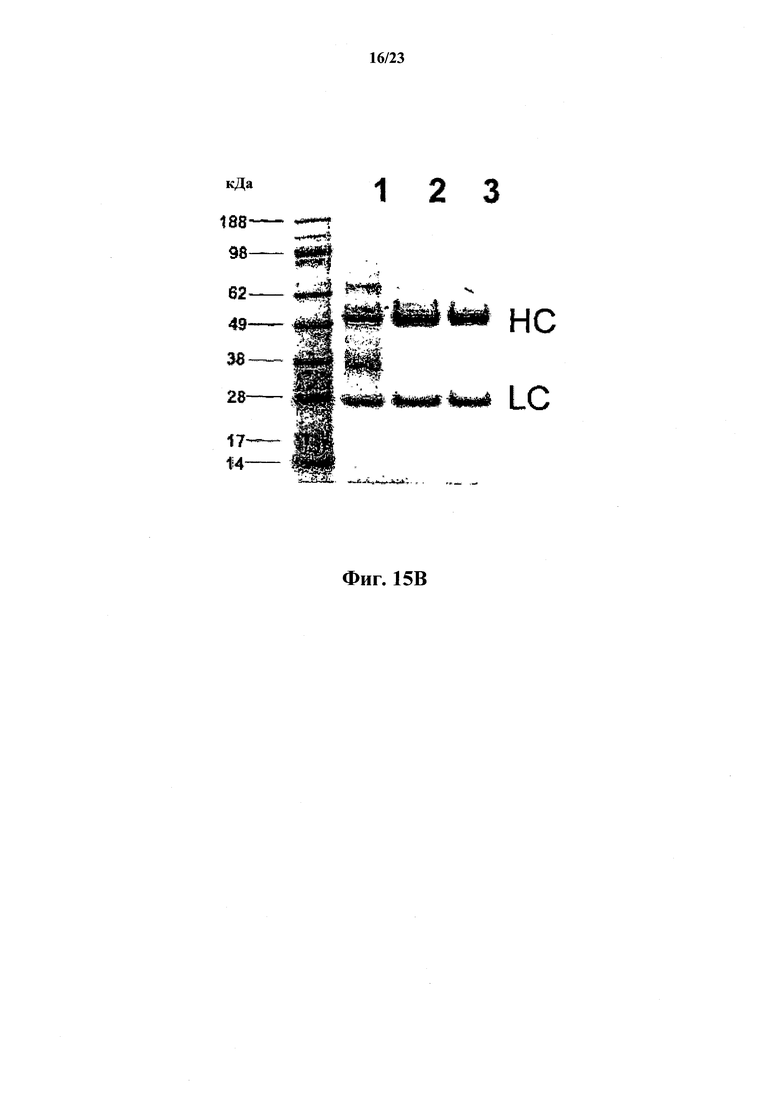
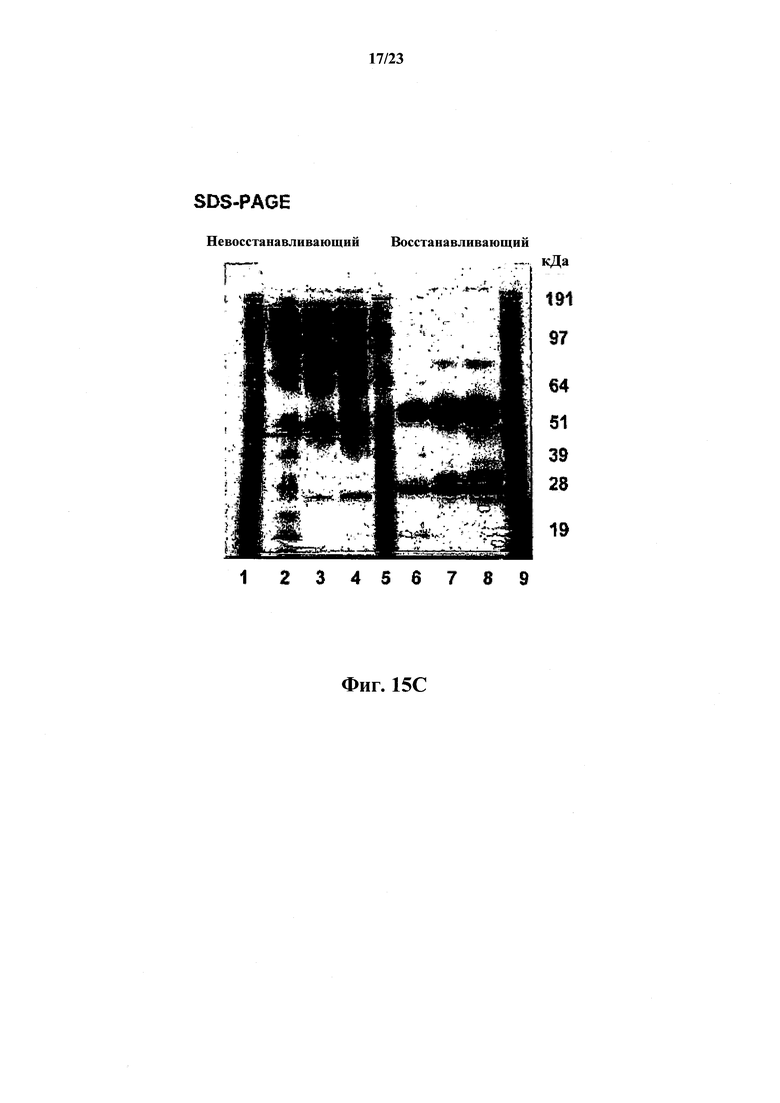

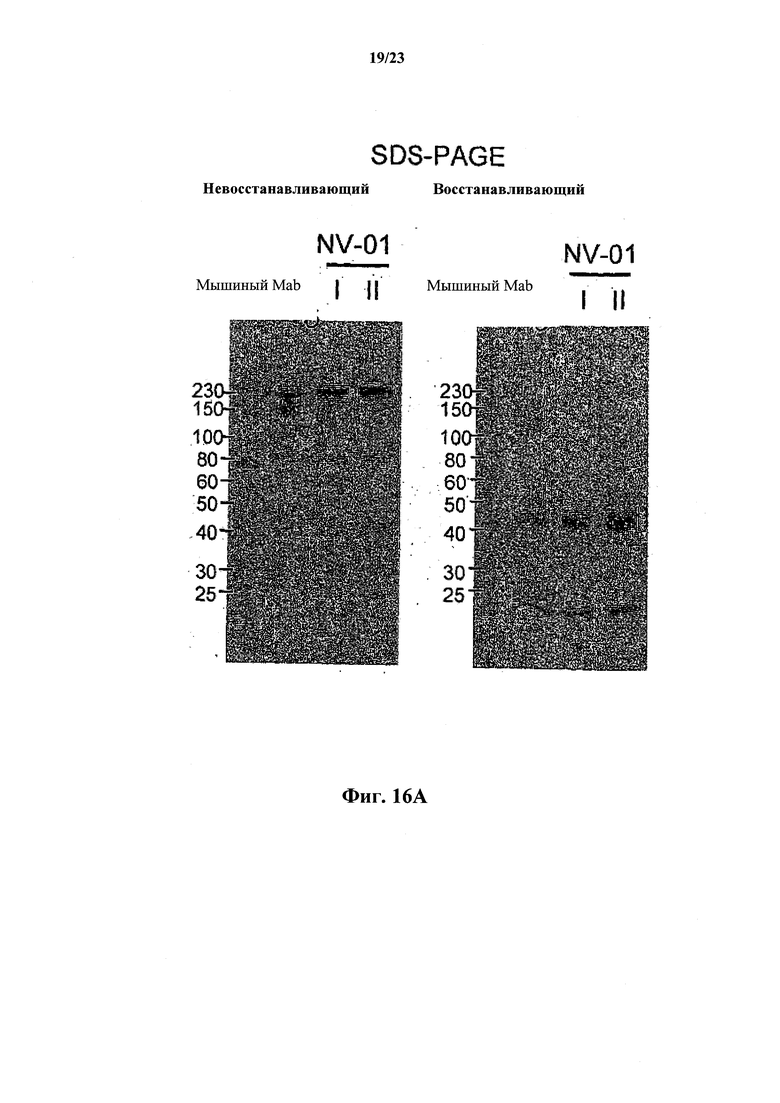

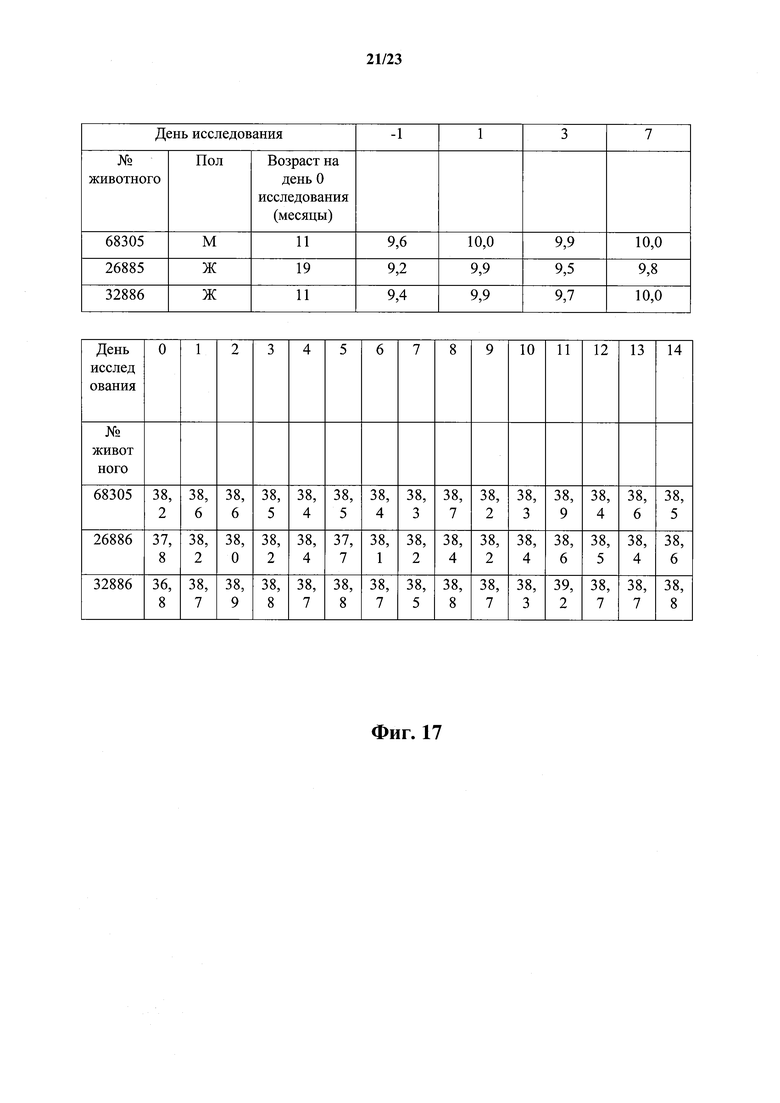
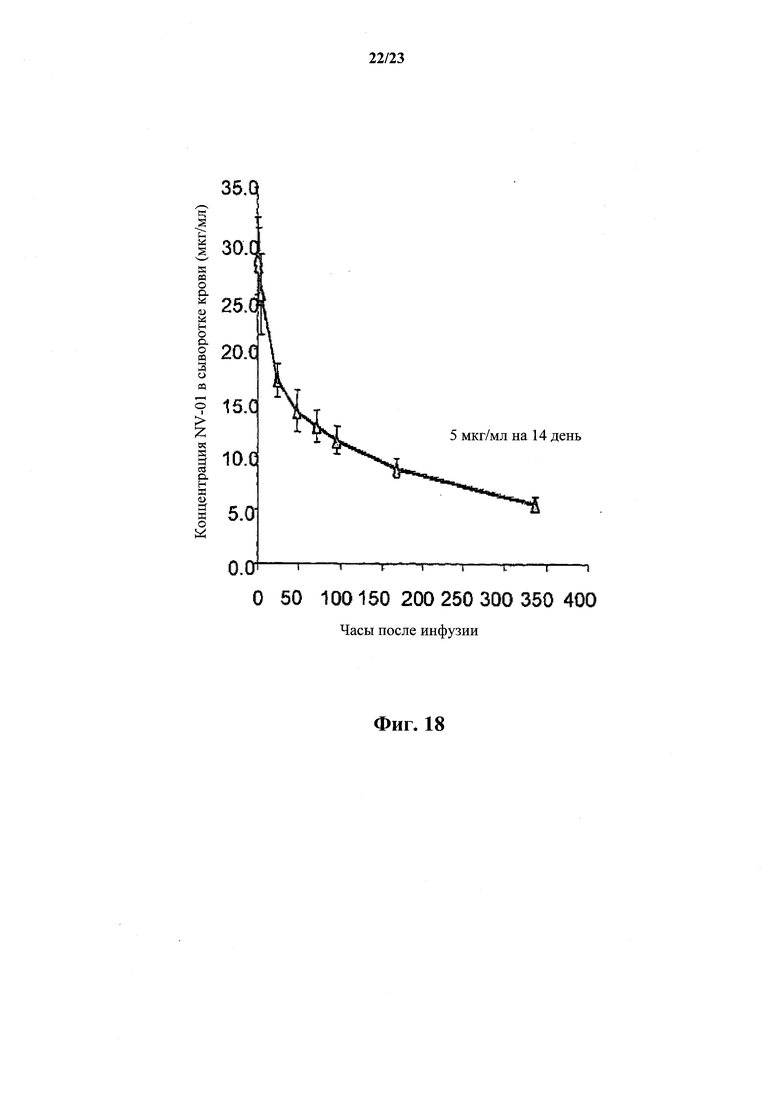
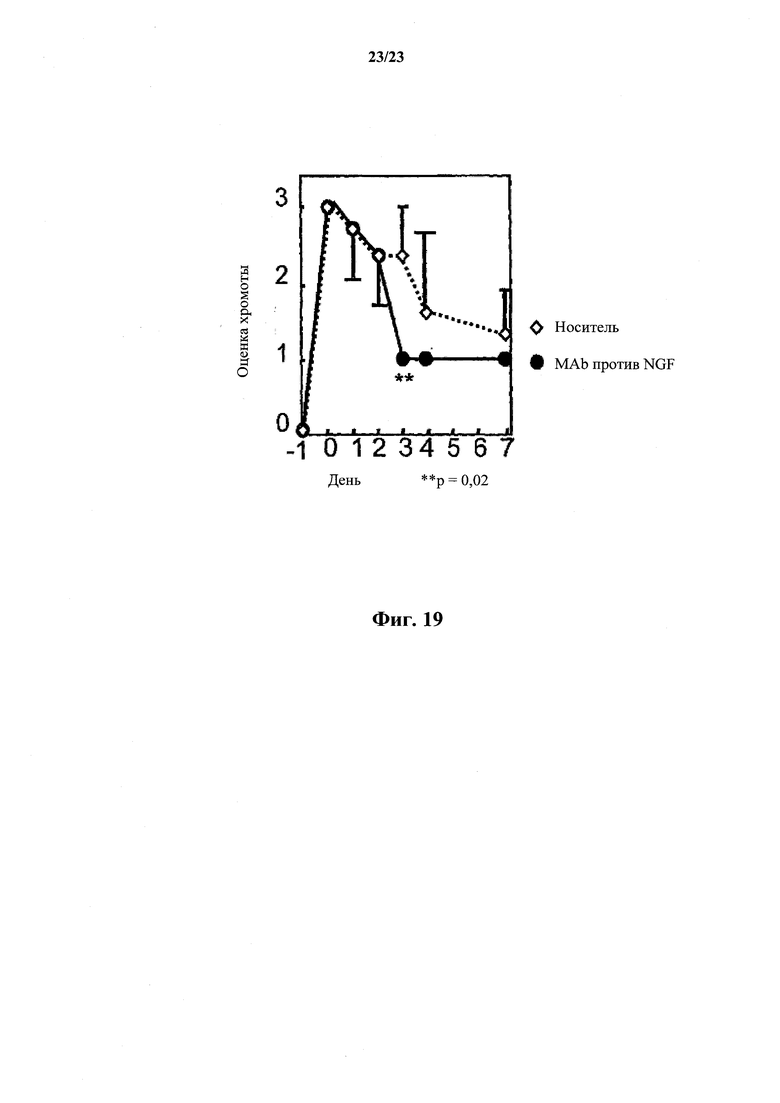
Настоящее изобретение относится к биотехнологии, в частности к способу получения антител, подходящих для применения у собаки, которые специфично связываются с собачьим фактором роста нервов (NGF) и нейтрализуют способность собачьего NGF связываться с рецептором собачьего NGF р75 или TrkA, и соответствующим антителам. Для осуществления указанного способа получают донорное антитело от вида, отличного от собаки, причем донорное антитело характеризуется специфичностью связывания в отношении целевого антигена, присутствующего у собак. Затем сравнивают каждый аминокислотный остаток в последовательности каркасных участков донорного антитела с каждым аминокислотным остатком, присутствующим в соответствующем положении в последовательности каркасных участков пула собачьих антител. После чего замещают идентифицированные аминокислотные остатки в донорном антителе аминокислотными остатками, присутствующими в соответствующем положении в пуле собачьих антител. Полученное антитело не содержит в любом положении в пределах каркасных участков какую-либо аминокислоту, которая будет чужеродной в соответствующем положении у собак. Настоящее изобретение также раскрывает фармацевтическую композицию и набор, содержащие указанные антитела, для лечения боли у собак, в частности боли, связанной с иммуноопосредованным полиартритом, остеоартритом или ревматоидным артритом. Настоящее изобретение позволяет избежать при получении собачьих антител снижения или потери антигенсвязывающей активности. 5 н. и 18 з.п. ф-лы, 19 ил., 8 табл., 14 пр.
1. Способ получения антитела, подходящего для применения у собаки, включающий стадии:
- получения донорного антитела от вида, отличного от собаки, причем донорное антитело характеризуется специфичностью связывания в отношении целевого антигена, присутствующего у собак;
- сравнения каждого аминокислотного остатка в аминокислотной последовательности каркасных участков донорного антитела с каждым аминокислотным остатком, присутствующим в соответствующем положении в аминокислотной последовательности каркасных участков пула собачьих антител, для идентификации одного или нескольких аминокислотных остатков в пределах аминокислотной последовательности каркасных участков донорного антитела, которые отличаются от одного или нескольких аминокислотных остатков в соответствующем положении в пределах аминокислотной последовательности каркасных участков пула собачьих антител; и
- замещения одного или нескольких идентифицированных аминокислотных остатков в донорном антителе одним или несколькими аминокислотными остатками, присутствующими в соответствующем положении в пуле собачьих антител для получения модифицированного антитела,
при этом модифицированное антитело не содержит в любом положении в пределах каркасных участков какую-либо аминокислоту, которая будет чужеродной в соответствующем положении у собак; и
при этом модифицированное антитело способно специфично связываться с собачьим фактором роста нервов (NGF) и ингибировать способность собачьего NGF связываться с рецептором собачьего NGF р75 или TrkA.
2. Антитело или его антигенсвязывающий фрагмент, которые способны специфично связываться с собачьим фактором роста нервов (NGF) и ингибировать способность собачьего NGF связываться с рецептором собачьего NGF р75 или TrkA, в которых антитело или его антигенсвязывающий фрагмент содержит вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 1 или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ней, и вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 2 или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ней;
при этом вариабельный участок легкой цепи содержит последовательность CDR1, включающую RASEDIYNALA (остатки 24-34 в SEQ ID NO: 1), последовательность CDR2, включающую NTDTLHT (остатки 50-56 в SEQ ID NO: 1), и последовательность CDR3, включающую QHYFHYPRT (остатки 89-97 в SEQ ID NO: 1), и
при этом вариабельный участок тяжелой цепи содержит последовательность CDR1, включающую NNNVN (остатки 31-35 в SEQ ID NO: 2), последовательность CDR2, включающую GVWAGGATDYNSALKS (остатки 50-65 в SEQ ID NO: 2), и последовательность CDR3, включающую DGGYSSSTLYAMDA (остатки 98-111 в SEQ ID NO: 2), и
при этом антитело или его антигенсвязывающий фрагмент не содержит в любом положении в пределах каркасных участков какую-либо аминокислоту, которая будет чужеродной в соответствующем положении у собак.
3. Антитело или его антигенсвязывающий фрагмент по п. 2, при этом антитело или его антигенсвязывающий фрагмент содержит вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 1, и вариабельный участок тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 2.
4. Антитело или его антигенсвязывающий фрагмент по п. 2, при этом антитело или его антигенсвязывающий фрагмент содержит вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 3, и вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 4.
5. Антитело или его антигенсвязывающий фрагмент по п. 2, при этом антитело или его антигенсвязывающий фрагмент содержит:
вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3 и дополнительно содержащий аминокислотные замены E16G, K18T, E70D и A100Q, и
вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 4 и дополнительно содержащий аминокислотные замены D10G, N13Q, T17S, T19R, V24A, L41P, R43K, L67F, T70S, T73N, S74A, S76N, T92V и L117S.
6. Антитело или его антигенсвязывающий фрагмент по п. 2, в которых легкая цепь содержит аминокислотную последовательность SEQ ID NO: 5 или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ней.
7. Антитело или его антигенсвязывающий фрагмент по п. 6, в которых легкая цепь содержит аминокислотную последовательность SEQ ID NO: 5.
8. Антитело или его антигенсвязывающий фрагмент по п. 6, в которых легкая цепь содержит аминокислотную последовательность SEQ ID NO: 10.
9. Антитело или его антигенсвязывающий фрагмент по п. 2, в которых тяжелая цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 9, или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ними.
10. Антитело или его антигенсвязывающий фрагмент по п. 2, в которых тяжелая цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 14, или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ними.
11. Антитело или его антигенсвязывающий фрагмент по п. 2, в которых тяжелая цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18, или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ними.
12. Антитело или его антигенсвязывающий фрагмент по п. 2, в которых тяжелая цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:19, SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22, или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ними.
13. Антитело или его антигенсвязывающий фрагмент по п. 2, в которых тяжелая цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 6, SEQ ID NO: 9, SEQ ID NO: 15 и SEQ ID NO: 22, или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ними.
14. Антитело или его антигенсвязывающий фрагмент по п. 2, в которых тяжелая цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 11, SEQ ID NO: 14, SEQ ID NO: 19 и SEQ ID NO: 22, или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ними.
15. Антитело или его антигенсвязывающий фрагмент, которые способны специфично связываться с собачьим фактором роста нервов (NGF) и ингибировать способность собачьего NGF связываться с рецептором собачьего NGF р75 или TrkA, в которых антитело или его антигенсвязывающий фрагмент содержит вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, при этом вариабельный участок легкой цепи содержит:
каркасный участок FR1, содержащий аминокислотную последовательность SEQ ID NO: 23 или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ней,
каркасный участок FR2, содержащий аминокислотную последовательность SEQ ID NO: 25 или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ней,
каркасный участок FR3, содержащий аминокислотную последовательность SEQ ID NO: 27 или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ней, и
каркасный участок FR4, содержащий аминокислотную последовательность SEQ ID NO: 28 или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ней,
при этом вариабельный участок легкой цепи содержит последовательность CDR1, включающую RASEDIYNALA (остатки 24-34 в SEQ ID NO: 1), последовательность CDR2, включающую NTDTLHT (остатки 50-56 в SEQ ID NO: 1), и последовательность CDR3, включающую QHYFHYPRT (остатки 89-97 в SEQ ID NO: 1),
и при этом вариабельный участок тяжелой цепи содержит:
каркасный участок FR1, содержащий аминокислотную последовательность SEQ ID NO: 29 или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ней,
каркасный участок FR2, содержащий аминокислотную последовательность SEQ ID NO: 30 или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ней,
каркасный участок FR3, содержащий аминокислотную последовательность SEQ ID NO: 32 или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ней,
каркасный участок FR4, содержащий аминокислотную последовательность SEQ ID NO: 33 или аминокислотную последовательность, которая характеризуется по меньшей мере 85% идентичностью с ней,
при этом вариабельный участок тяжелой цепи содержит последовательность CDR1, включающую NNNVN (остатки 31-35 в SEQ ID NO: 2), последовательность CDR2, включающую GVWAGGATDYNSALKS (остатки 50-65 в SEQ ID NO: 2), и последовательность CDR3, включающую DGGYSSSTLYAMDA (остатки 98-111 в SEQ ID NO: 2),
и при этом антитело или его антигенсвязывающий фрагмент не содержит в любом положении в пределах каркасных участков какую-либо аминокислоту, которая будет чужеродной в соответствующем положении у собак.
16. Антитело или его антигенсвязывающий фрагмент по п. 15, в котором вариабельный участок легкой цепи содержит:
каркасный участок FR1, содержащий аминокислотную последовательность SEQ ID NO: 23 или SEQ ID NO: 24,
каркасный участок FR2, содержащий аминокислотную последовательность SEQ ID NO: 25,
каркасный участок FR3, содержащий аминокислотную последовательность SEQ ID NO: 26 или SEQ ID NO: 27,
каркасный участок FR4, содержащий аминокислотную последовательность SEQ ID NO: 28,
и при этом вариабельный участок тяжелой цепи содержит:
каркасный участок FR1, содержащий аминокислотную последовательность SEQ ID NO: 29,
каркасный участок FR2, содержащий аминокислотную последовательность SEQ ID NO: 30,
каркасный участок FR3, содержащий аминокислотную последовательность SEQ ID NO: 31 и SEQ ID NO: 32, и
каркасный участок FR4, содержащий аминокислотную последовательность SEQ ID NO: 33.
17. Антитело или его антигенсвязывающий фрагмент по п. 15, в котором вариабельный участок легкой цепи содержит:
каркасный участок FR1, содержащий аминокислотную последовательность SEQ ID NO: 24 и дополнительно содержащий аминокислотную замену E16G и K18T,
каркасный участок FR2, содержащий аминокислотную последовательность SEQ ID NO: 25,
каркасный участок FR3, содержащий аминокислотную последовательность SEQ ID NO: 26 или SEQ ID NO: 27 и дополнительно содержащий аминокислотную замену E14D,
каркасный участок FR4, содержащий аминокислотную последовательность SEQ ID NO: 28 и дополнительно содержащий аминокислотную замену A3Q, и при этом вариабельный участок тяжелой цепи содержит:
каркасный участок FR1, содержащий аминокислотную последовательность SEQ ID NO: 29 и дополнительно содержащий аминокислотные замены D10G, N13Q, T17S, T19R и V24A,
каркасный участок FR2, содержащий аминокислотную последовательность SEQ ID NO: 30 и дополнительно содержащий аминокислотные замены L6P и R8K,
каркасный участок FR3, содержащий аминокислотную последовательность SEQ ID NO: 31 и SEQ ID NO: 32 и дополнительно содержащий аминокислотные замены L2F, T5S, T8N, S9A, S11N и T27V, и
каркасный участок FR4, содержащий аминокислотную последовательность SEQ ID NO: 33 и дополнительно содержащий аминокислотную замену L6S.
18. Антитело или его антигенсвязывающий фрагмент по п. 2 или п. 15, содержащие константный домен тяжелой цепи антитела, выбранные или модифицированные посредством замены или делеции аминокислоты так, чтобы константные домены не опосредовали последующих эффекторных функций.
19. Антитело или его антигенсвязывающий фрагмент по п. 18, содержащие константный домен собачьей тяжелой цепи агликозилированного типа НСВ, НСА или HCD.
20. Антитело или его антигенсвязывающий фрагмент по п. 18, содержащие константный домен собачьей тяжелой цепи агликозилированного типа НСВ или HCD.
21. Антитело или его антигенсвязывающий фрагмент по п. 2 или 15 для применения в лечении состояния, ассоциированного с болью, или для лечения, подавления или ослабления боли, связанной с иммуноопосредованным полиартритом, остеоартритом или ревматоидным артритом, или для лечения индуцируемой к пролиферации фактором роста нервов опухоли у собаки и ассоциированных с ней заболеваний.
22. Фармацевтическая композиция для лечения боли у собак, или для лечения состояния, ассоциированного с болью, или для лечения, подавления или ослабления боли, связанной с иммуноопосредованным полиартритом, остеоартритом или ревматоидным артритом, или для лечения индуцируемой к пролиферации фактором роста нервов (NGF) опухоли у собаки и ассоциированных с ней заболеваний, при этом композиция содержит антитело или его антигенсвязывающий фрагмент по любому из пп. 2-20 вместе с по меньшей мере одним фармацевтически приемлемым носителем, вспомогательным веществом или разбавителем.
23. Набор для лечения боли у собак, или для лечения состояния, ассоциированного с болью, или для лечения, подавления или ослабления боли, связанной с иммуноопосредованным полиартритом, остеоартритом или ревматоидным артритом, или для лечения индуцируемой к пролиферации фактором роста нервов (NGF) опухоли у собаки и ассоциированных с ней заболеваний, содержащий антитело или его антигенсвязывающий фрагмент по любому из пп. 2-20 и инструкцию к его применению.
| WO 2012024650 A2, 23.02.2012 | |||
| WO 2003060080 A2, 24.07.2003 | |||
| WO 2005061540 A2, 07.07.2005 | |||
| СПОСОБЫ ЛЕЧЕНИЯ БОЛИ, ОБУСЛОВЛЕННОЙ РАКОМ КОСТИ, ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА ФАКТОРА РОСТА НЕРВОВ | 2005 |
|
RU2389509C2 |
Авторы
Даты
2018-02-08—Публикация
2012-05-08—Подача