Область техники
Изобретение относится к области медицины, в частности к фармацевтической промышленности, и описывает жидкую пероральную лекарственную форму, выполненную в виде сиропа, включающую фенспирида гидрохлорид.
Уровень техники
Болезни органов дыхания составляют до 80% заболеваний, диагностируемых у детей и подростков [Опыт использования препарата фенспирид гидрохлорид при лечении острых респираторных заболеваний у детей в амбулаторной практике / Ю.В. Черненков, О.И. Гуменюк, И.Ю. Попова, Е.Е. Раскина, Н.Н. Добло // Педиатрия. - 2010. - Том 89 - №1. - С. 95-98]. Наряду с высоким уровнем заболеваемости, отмечается увеличение в общей популяции числа рецидивирующих и хронических форм болезней органов дыхания, нередко приводящих к инвалидизации [Механизмы бронхиальной обструкции и терапевтическая тактика при бронхитах у детей / Е.В. Середа, О.Ф. Лукина, Л.Р. Селимзянова // Педиатрия. - 2008. - №87 (6). - С. 146-149. Здоровье детей России (состояние и проблемы). Под ред. А.А. Баранова. М.: Союз педиатров России, 1999. Белая книга: Пульмонология / Чучалин А.Г. // Пульмонология. - 2004. - №1. - С. 7-34]. Наибольшую опасность эти заболевания представляют для ребенка в первые три года жизни [Фенспирида гидрохлорид: опыт применения в терапии ОРИ у детей // Информационно-аналитическая газета «Фармацевтический вестник». 27.10.2010].
При этом, по статистике, 20-25% детей в России могут быть отнесены к категории часто болеющих, т.е. переносящих от 6 до 12 эпизодов инфекций верхних дыхательных путей в год. Болезни органов дыхания детей первого года жизни приводят к летальному исходу в 7,8% случаев [Рациональная антибактериальная терапия в отделениях реанимации и интенсивной терапии / М.А. Георгянц, Ю.А. Винник, В.А. Корсунов // Клиническая антибиотикотерапия. - 2003. - №2. - С. 8].
Высокая распространенность инфекций верхних дыхательных путей отчасти объясняется неадекватным лечением, в т.ч. одновременным назначением неоправданно большого количества лекарственных средств в основном симптоматической терапии [Фенспирида гидрохлорид: опыт применения в терапии ОРИ у детей // Информационно-аналитическая газета «Фармацевтический вестник». - 27.10.2010].
В последние годы в качестве противовоспалительного препарата при острых, рецидивирующих и хронических заболеваниях органов дыхания успешно применяется фенспирида гидрохлорид (препарат Эреспал® сироп, «Лаборатории Сервье Индастри», Франция), обладающий выраженным противовоспалительным действием и тропностью к слизистой оболочке дыхательных путей [Механизмы бронхиальной обструкции и терапевтическая тактика при бронхитах у детей / Е.В. Середа, О.Ф. Лукина, Л.Р. Селимзянова // Педиатрия. - 2008. - №87 (6). - С. 146-149. Эффективность и безопасность применения фенспирида гидрохлорида (эреспала) в лечении детей и подростков в раннем реабилитационном периоде внебольничных пневмоний / Н.Д. Сорока, Е.В. Коршунова, С.П. Гомозова, Т.Г. Власова, В.Н. Котельникова // Педиатрия. - 2010. - Том 89. - №2. - С. 120 127].
Феспирид гидрохлорид - 8-(2-фенилэтил)-1-окса-3,8-диазаспиро (4,5)-декан-2-ОН является противовоспалительным средством, оказывающим антиэкссудативное действие, препятствующим развитию бронхоспазма. Проявляет антагонизм с медиаторами воспаления и аллергии: серотонином, гистамином (на уровне Н1-гистаминовых рецепторов), брадикинином {Противовоспалительный препарат фенспирид / А.А. Визелъ, И.Ю. Визелъ, И.Ю. Пронина // Пульмонология. - 2007. - №2. - С. 80-88].
Феспирид гидрохлорид (Эреспал сироп) хорошо себя зарекомендовал при лечении бронхиальной астмы у детей [Патогенетическое обоснование применения фенспирида (эреспала) при бронхиальной астме у детей / С.В. Лукьянов [и др.] // Пульмонология. - 2001. - №4. - С. 59-64], острой респираторной вирусной инфекции [Результаты многоцентрового исследования эффективности фенспирида гидрохлорида (эреспала) при лечении острой респираторной инфекции у детей / Г.А. Самсыгина, С.Б. Фитилев, A.M. Левин // Педиатрия. - 2003. - №2. - С. 81-85], хронического бронхита [Эффективность фенспирида у больных хроническим обструктивным бронхитом / Т.Д. Шорохова [и др.] // Клиническая медицина. - 2001. - №8. - С. 55-57], заболеваний бронхо-легочной системы и ЛОР-органов [Эреспал (фенспирид) в лечении заболеваний бронхо-легочной системы и ЛОР-органов / А.С. Соколов // Пульмонология. - 2003. - №5. - С. 122-127]. Имеются сообщения об эффективности фенспирида при хронической обструктивной болезни легких [Клинико-функциональное состояние и качество жизни больных хронической обструктивной болезнью легких до и после лечения фенспиридом в амбулаторных условиях / С.И. Буторов [и др.] // Терапевтический архив. - 2008. - Т. 80. - №3. - С. 24-28].
В настоящее время высокая клиническая эффективность фенспирида гидрохлорида доказана в лечении практически всех заболеваний верхних дыхательных путей, различных клинических вариантов бронхитов, обострений хронической обструктивной болезни легких.
Фенспирид входит в перечень жизненно необходимых и важнейших лекарственных средств (ЖНВЛС).
Применение фенспирида гидрохлорида в лечении острых респираторных инфекций (ОРИ) у детей первых месяцев жизни позволяет купировать основные симптомы ОРИ (ринит, фарингит, кашель). Кроме того, монототерапия фенспирида гидрохлоридом при лечении ОРИ позволяет избежать полипрагмазии (назначения больным детям нескольких препаратов одновременно - муколитиков, мукокинетиков, бронхолитиков и антигистаминных).
Наиболее высокие показатели заболеваемости гриппом и ОВРИ отмечаются у детей первых 6 лет жизни. Известно, что детский возраст, особенно ранний и дошкольный, характеризуется значительно более высокой чувствительностью организма ребенка к вирусным и вирусно-бактериальным агентам, проникающим в респираторный тракт, и, соответственно, значительно более высокой заболеваемостью ОРИ. Отсюда очевидно, что группой высокого риска по заболеваемости вирусными и вирусно-бактериальными инфекциями респираторного тракта являются дети первых лет жизни [Самсыгина Г.А. Противовоспалительная терапия острых респираторных инфекций у детей. Педиатрия - 2011. - Том 90. - №1. - С. 102-105].
Учитывая детский возраст пациентов, а также симптоматику ОРИ (воспаленность и отечность дыхательных путей), проблема затрудненного глотания лекарственных препаратов является актуальной. Дисфагия (затруднение глотания) широко распространена, особенно среди детей и пожилых людей, и по разным оценкам наблюдается примерно у 35% населения. В этой связи выпуск лекарственных препаратов фенспирида в жидкой форме представляется наиболее удобным и безопасным.
Препараты фенспирида представлены на рынке в виде таблеток покрытых пленочной оболочкой и сиропов.
Из предшествующего уровня техники широко известны и представлены на отечественном рынке следующие жидкие лекарственные формы фенспирида гидрохлорида:
- «Эриспирус®» в лекарственной форме сиропа в дозировке 2 мг/мл во флаконе 150 мл, производства фирмы Сандоз д.д. (Словения), регистрационное удостоверение №ЛП-002715 от 14.11.2014 г.
- «Сиресп» в лекарственной форме сиропа в дозировке 2 мг/мл во флаконе 150 мл, производства Фармацевтический завод «Польфарма» АО (Польша), регистрационное удостоверение №ЛП-002683 от 29.10.2014 г.
- «Эреспал®» в лекарственной форме сиропа в дозировке 2 мг/мл во флаконах по 150 и 250 мл, производства фирмы Лаборатории Сервье (Франция), регистрационное удостоверение №П N012547/02 от 28.06.2010 г.
Указанные препараты, помимо активного действующего вещества (фенспирида гидрохлорида) также содержат: антимикробные консерванты (метилпарагидроксибензоат, пропилпарагидроксибензоат, калия сорбат), гидрофильный растворитель (глицерин), корригенты вкуса (сахарин, солодки корней экстракт), красители и ароматизаторы, воду в качестве основного растворителя. Также в составе всех вышеуказанных препаратов содержится корригент вкуса одновременно выполняющий функцию загустителя - сахароза.
При этом, концентрация сахарозы в сиропах составляет около 60-65% или 600-650 мг/мл. Данное количество сахарозы является оптимальным т.к. сиропы с концентрацией сахара выше 66% при хранении и небольшом охлаждении засахариваются, образуя крупные трудно растворимые кристаллы сахарозы. В то же время, сиропы с концентрацией сахара ниже 60% подвергаются брожению и скисанию.
Вместе с тем, употребление сахарозы способствует развитию гипергликемии, усиленному выбросу инсулина в кровь, истощению инсулярного аппарата, что способствует развитию сахарного диабета. Пациентам с данным заболеванием, употребление сахарозы противопоказано либо допустимо в малых количествах с повышенной осторожностью. Увеличенное количество сахарозы, которое поступает в организм человека, не может полностью депонировать в виде гликогена и превращаться в триглицерид, что способствует развитию живой ткани, увеличению холестерина в крови и развитию на этом фоне ряда тяжелых сердечно-сосудистых заболеваний. Известно также о разрушительном влиянии сахарозы на зубную эмаль и о ее высоком кариесогенном действии.
В этой связи существует потребность в разработке качественных и доступных отечественных H1-антигистаминных средств, содержащих фенспирида гидрохлорид в виде жидких лекарственных форм, предпочтительно в виде сиропов, удобных для применения, стабильных при хранении и имеющих маскирующий сладкий вкус, и, кроме того, лишенных недостатков известных лекарственных препаратов, содержащих в своем составе сахарозу.
Наиболее близким аналогом, принятым в качестве прототипа, является широко распространенный и известный на рынке лекарственный препарат «Эреспал®» производства фирмы Лаборатории Сервье (Франция), в лекарственной форме сиропа в дозировке 2 мг/мл во флаконах по 150 и 250 мл (регистрационное удостоверение №П N012547/02 от 28.06.2010 г.).
Технической задачей настоящего изобретения является расширение перечня лекарственных средств отечественного производства.
Техническим результатом (целью) изобретения является создание жидкой лекарственной формы фенспирида, предпочтительно в форме сиропа, стабильной при получении и длительном хранении, фармацевтически эквивалентной прототипу, но исключающей при этом содержание сахарозы в своем составе.
Для достижения указанной цели авторами настоящего изобретения была предпринята попытка разработки препарата-аналога - «Фенспирид сироп» 2 мг/мл (разрабатываемый препарат), который по эффективности, безвредности и показателям качества не уступал бы инновационному препарату «Эреспал®» сироп 2 мг/мл («Лаборатории Сервье», Франция), (референтный препарат, препарат сравнения, прототип).
Раскрытие изобретения
Исходя из задачи исследования, авторы настоящего изобретения, попытались разработать препарат фармацевтически эквивалентный препарату «Эреспал®» сироп 2 мг/мл, имеющий сопоставимые с ним показатели качества и свойства, включая специфические виды действия и безвредность. При этом можно будет прогнозировать, что разработанный препарат будет также терапевтически эквивалентен препарату сравнения.
Лекарственные препараты являются фармацевтически эквивалентными, если они содержат одно и то же количество одного и того же действующего вещества (одних и тех же действующих веществ) в одних и тех же лекарственных формах, которые соответствуют требованиям одних и тех же или сопоставимых стандартов. Терапевтически эквивалентным другому препарату, является препарат, содержащий ту же активную субстанцию или ее терапевтически активную часть и клинически проявляющий такую же эффективность и безопасность, как и препарат, эффективность и безопасность которого установлена [CPMP/EWG/QWP/1401/98. Note for guidance on the investigation of bioavailability and bioequivalence. - London: CPMP/EMEA, 26 July 2001].
Требования к препарату в форме сиропа, содержащему фенспирида гидрохлорид, в ведущих фармакопеях не описаны. Общие требования к сиропам описаны в монографии «Liguid preparations for oral use» Европейской Фармакопеи [European Pharmacopoeia 7th Edition. - Strassbourg: European Directorate for the Quality of Medicines & Health Care (EDQM) - Council of Europe, 67075 Strasbourg Cedex, France 2010. - Vol. 1, Vol. 2. - 3536 p.], в монографии «Liguid preparations for oral use» Британской Фармакопеи [British Pharmacopoeia. - 2013, vol. III], в монографии «Pharmaceutical Dosage Forms: Solutions}) Фармакопеи США [The United States Pharmacopeia, 36 ed. (NF 31) / Rochiville: United States Pharmacopeia Convention Inc],
Референтный препарат «Эреспал®» сироп 2 мг/мл, содержит следующие компоненты г/100 мл:
Вспомогательные вещества в составе препарата «Эреспал®» сироп 2 мг/мл выполняют следующее функциональное назначение:
- солодки корней экстракт - корригент вкуса;
- настойка ванильная, ароматизирующий состав с медовыми оттенками - ароматизаторы;
- метилпарагидроксибензоат, пропилпарагидроксибензоат, калия сорбат - антимикробные консерванты;
- сахарин - корригент вкуса;
- сахароза - корригент вкуса, загуститель;
- глицерол - гидрофильный растворитель;
- краситель солнечный закат желтый (Сансет желтый S) - краситель;
- вода очищенная - растворитель.
План экспериментов по фармацевтической разработке препарата «Фенспирид сироп» 2 мг/мл основывался на фармакопейных и регуляторных требованиях. Предполагалась разработка препарата в форме сиропа, содержащего в качестве действующего вещества фенспирида гидрохлорида - ингибитора фосфолипазы А2 (ФЛА2), блокатора Н1-гистаминовых и α1-адренергических рецепторов.
Учитывая физико-химические свойства действующего и вспомогательных веществ, входящих в состав препарата, необходимо было выбрать их качественный и количественный состав по результатам физико-химических, микробиологических, технологических и аналитических исследований.
Сложность достижения технического результата заключается в исключении (или замене) сахарозы из состава препарата с одновременным сохранением его физико-химических, органолептических, фармацевтических и терапевтических свойств, при условии, что указанная сахароза в референтном препарате является не только корригентом вкуса, но и загустителем, а учитывая ее количество в составе сиропа, по сути, наряду с водой, является его основой.
С целью решения данной задачи, авторам удалось разработать рациональный состав препарата «Фенспирид сироп» 2 мг/мл с учетом состава и свойств референтного препарата «Эреспал®» сироп 2 мг/мл, а также свойств фенспирида гидрохлорида и вспомогательных веществ. При этом выбрать состав препарата таким образом, чтобы изменения в нем по отношению к референтному препарату можно было классифицировать как несущественные изменения I типа [The rules governing medicinal products in the European Union. - V. 2. - Notice to Applicants. - V. 2C. - Regulatory Guidelines. - Guideline on Dossier Requirements for Type IA and IB Notifications. - EC. - July 2003. Надлежащая производственная практика лекарственных средств / Под ред. Н.А. Ляпунова, В.А. Загория, В.П. Георгиевского, Е.П. Безуглой. - К: МОРИОН, 1999. - 896 с. The rules governing medicinal products in the European Union. - V. 2. - Notice to Applicants. - V. 2C. - Regulatory Guidelines. - Guideline on the Categorisation of new Applications (NA) versus Variations Applications (V). - European Comission. - January 2002. - 11 р.]. Разработку состава необходимо осуществлять так, чтобы разрабатываемый препарат можно квалифицировать как фармацевтически эквивалентный относительно референтного препарата, а также с учетом медико-биологических требований, предъявляемых к препаратам для системного лечения органов верхних дыхательных путей, для чего:
- препарат должен содержать фенспирида гидрохлорид в концентрации, соответствующей его содержанию в референтном препарате - 2 мг/мл;
- препарат должен иметь лекарственную форму «сироп» и обеспечивать терапевтическую эквивалентность относительно референтного препарата.
В этой связи критическими характеристиками для разрабатываемого препарата являются:
- физическая стабильность сиропа (в т.ч. аналогичный уровень рН);
- микробиологическая чистота, которая должна соответствовать фармакопейным требованиям [5.1.4. Microbiological guality non-sterile pharmaceutical preparations and substances for pharmaceutical use. - European Pharmacopoeia 8.0. - P. 559. Государственная фармакопея Российской Федерации. - М.: Издательство «Научный центр экспертизы средств медицинского применения», 2008. - 704 с.].
С целью достижения вышеуказанного технического результата авторами настоящего изобретения были проведены исследования по выбору корригентов вкуса, корригентов рН (буферных веществ), ароматизаторов и антимикробных консервантов разрабатываемого состава.
Для изготовления лабораторных образцов использовали мешалку «Polytron» фирмы «Kinematica» (Швейцария). Наработку опытных серий препарата осуществляли в вакуумном реакторе-гомогенизаторе РП 500 фирмы «Промвит» (Украина), моделирующем промышленное оборудование.
Для взвешивания использовали весы EUROPE-C500 и CRYSTAL 200 фирмы «Gibertini S.A.» (Италия).
рН сиропов определяли потенциометрически на рН-метре «744 рН Meter» фирмы «Metrohm» (Швейцария) с электродом типа «Porotrode» [European Pharmacopoeia 7th Edition. - Strassbourg: European Directorate for the Quality of Medicines & Health Care (EDQM) - Council of Europe, 67075 Strasbourg Cedex, France 2010. - Vol. 1, Vol. 2. - 3536 p.].
Определение структурной вязкости проводили методом ротационной вискозиметрии на ротационном вискозиметре с коаксиальными цилиндрами «Reolab-QC» фирмы «Anton Paar» (Австрия), при температуре (25,0±0,1)°С или при других температурах, указанных в тексте. Строили реограммы, отражающие зависимость касательного напряжения сдвига τr от градиента скорости сдвига Dr, по которым определяли тип течения системы, наличие тиксотропных свойств, нижний, верхний и экстраполированный пределы текучести. Структурную вязкость рассчитывали по формуле: η=τr/Dr [Государственная фармакопея Российской Федерации. - М.: Издательство «Научный центр экспертизы средств медицинского применения», 2008. - 704 с.].
Размер частиц определяли с помощью микроскопа MBL-2100 (« », Германия).
», Германия).
Кинетику абсорбции воды сиропами, характеризующую их осмотическую активность, определяли в опытах in vitro методом диализа через полупроницаемую мембрану из целлофана (ГОСТ 7730-89) при температуре (25,0±0,1)°С [Работы ГНЦЛС по созданию, внедрению и стандартизации мягких лекарственных средств и суппозиториев / Н.А. Ляпунов, Е.П. Безуглая, Н.Г. Козлова и др. // Фармаком. - 1999. - №3. - С. 61-64. Lugano A.S. Etude du transport de principles actifs incorpores dans des emulsions liquides de type huile dans eau: These doct. pharm. sci. - 1793. - Zurich, 1977. - 117 s. Методические рекомендации no экспериментальному (доклиническому) изучению лекарственных препаратов для местного лечения ран / Б.М. Даценко, С.В. Бирюкова, Т.И. Тамм и др. - М., МЗ СССР, 1989. - 47 с.].
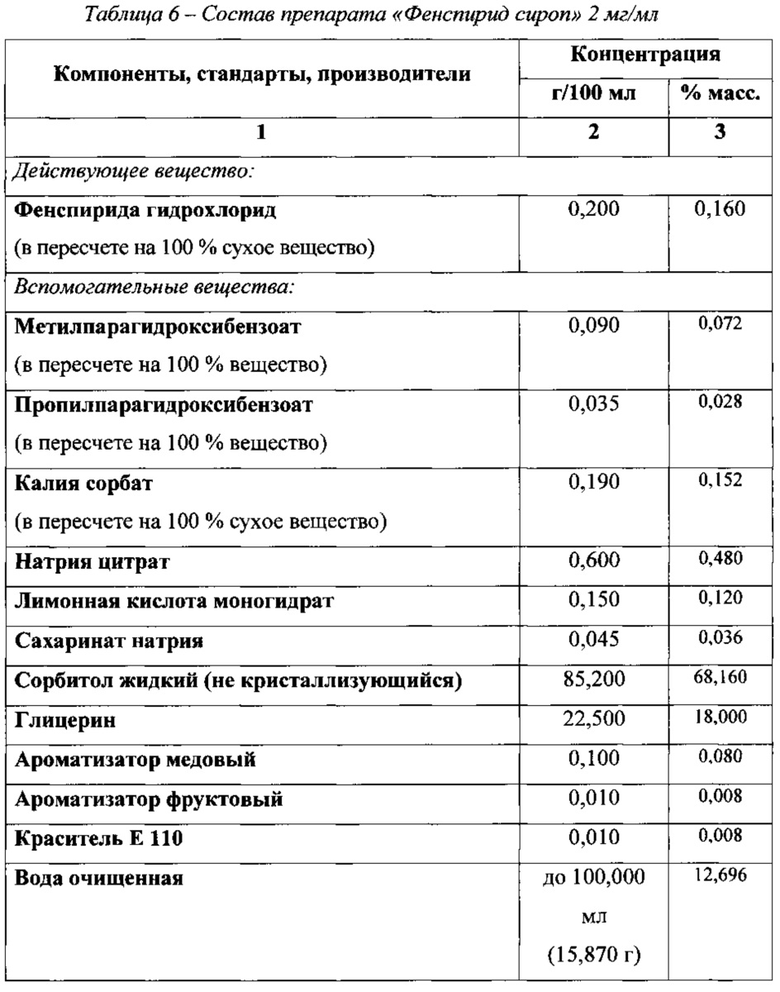
В качестве основного корригента вкуса в состав референтного препарата входит сахароза в концентрации 60,0 г/100 мл сиропа.
Для приготовления сиропов может быть использована либо сахароза в концентрации не менее 45 мас.%, либо другие полиспирты или подсластители.
В настоящее время в качестве подсластителя и загустителя сиропов также используется сорбитол.
Сорбитол обладает маскирующим сладким вкусом, в то же время он не является токсичным, не вызывает быстрых изменений количества сахара в крови и не провоцирует дополнительной выработки инсулина поджелудочной железой. Являясь калоригенным заменителем сахара, сорбитол всасывается из желудочно-кишечного тракта, практически не влияя на содержание глюкозы в крови, что позволяет применять препарат для лечения больных сахарным диабетом (Регистр лекарственных средств России, РЛС. Энциклопедия лекарств. - 14-й вып./ред. Г.Л. Вышковский. - М.: РЛС - 2006, 2005).
Сорбитол, как химическое вещество - это шестиатомный спирт с эмпирической формулой C5H14O6. Он является стереоизомером маннитола. Сорбитол используется как заменитель сахара [Справочник - Видаль.
Лекарственные препараты в России / М.: АстраФармСервис, 2010. Handbook of Pharmaceutical Excipients: 6-th Edition / Ed. by Anley Wade and Paul J. Weller. - Washington/London: Amer. Pharm. Association/The Pharm. Press, 2009. – 888 p.].
В качестве основного корригента вкуса в разрабатываемом препарате был выбран сорбитол жидкий некристаллизующийся.
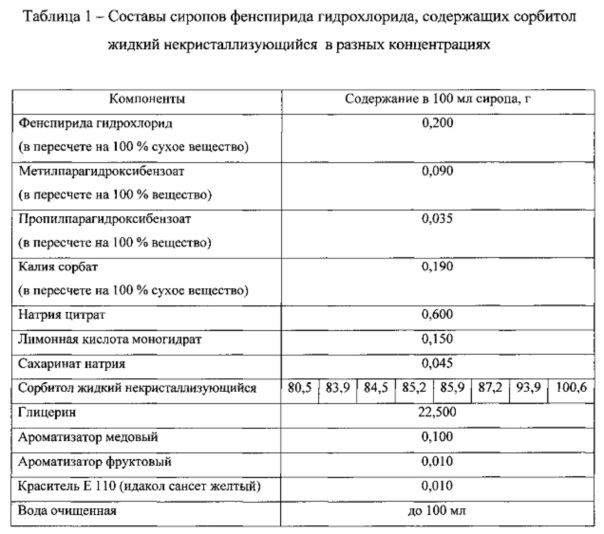
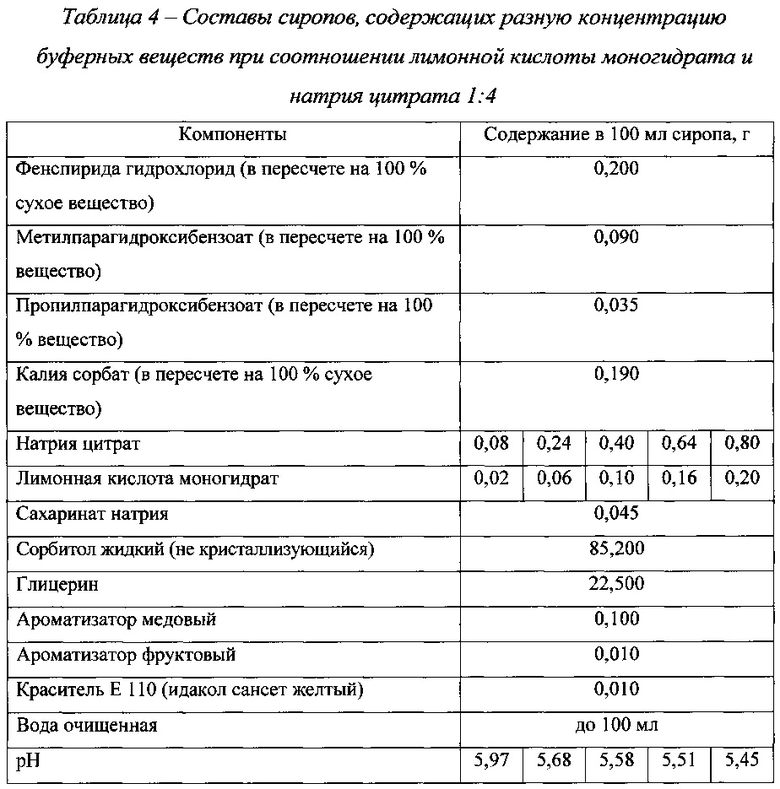
Поскольку реопараметры сиропов на основе сорбитола зависят от его концентрации, были проведены реологические исследования образцов сиропов в зависимости от концентрации сорбитола жидкого некристаллизующегося. Составы сиропов приведены в таблице 1.
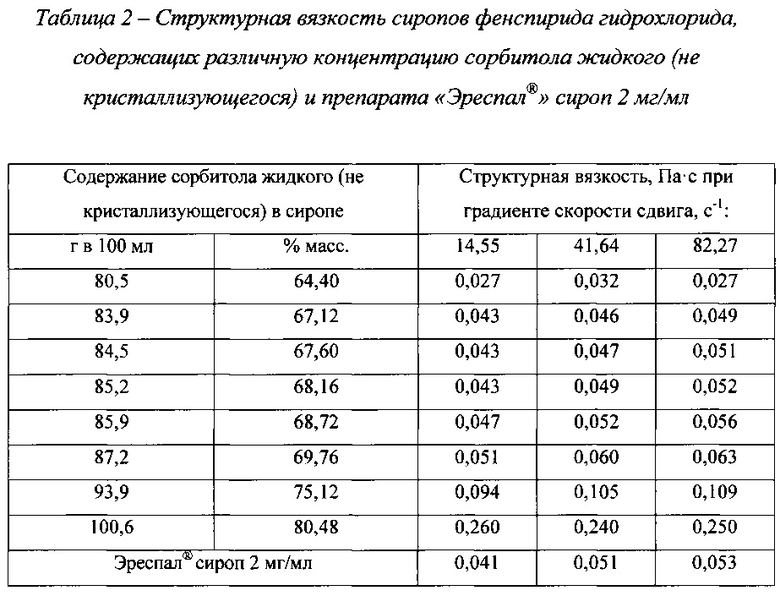
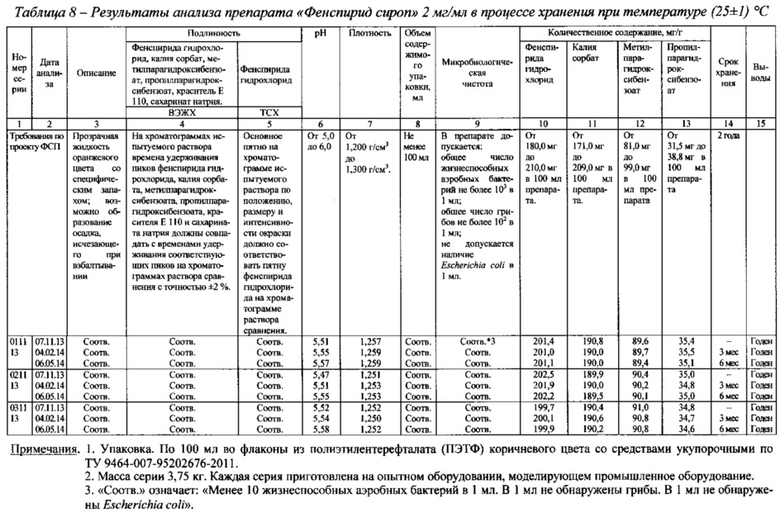
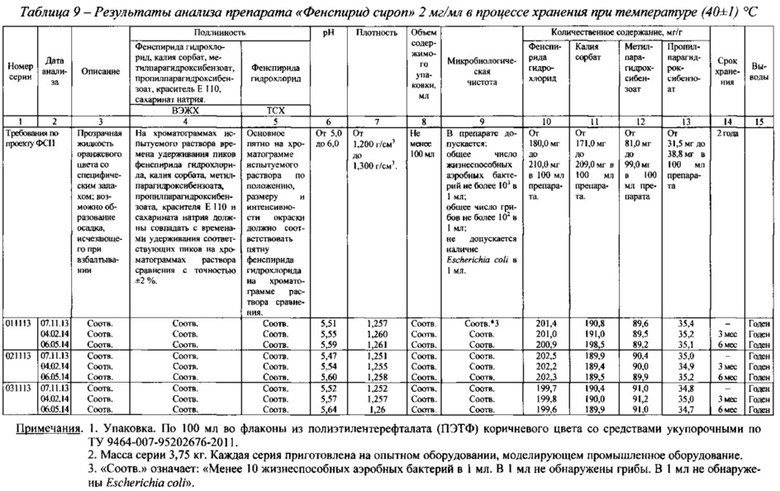
На Фиг. 1 представлены реограммы сиропов фенспирида гидрохлорида, содержащих сорбитол жидкий некристаллизующийся в разных концентрациях и реограмма препарата «Эреспал®» сироп 2 мг/мл. На Фиг. 2 представлен график зависимости структурной вязкости сиропов от концентрации сорбитола жидкого некристаллизующегося при градиенте скорости сдвига 41,64 с-1. В таблице 2 приведены значения структурной вязкости указанных сиропов при разных градиентах скорости сдвига в сравнении со структурной вязкостью референтного препарата.
Как видно из данных, представленных на фиг. 1, все сиропы имеют тип течения близкий к ньютоновскому, у них отсутствуют нижний предел текучести и тиксотропные свойства. Структурная вязкость сиропов увеличивается с увеличением концентрации сорбитола жидкого некристаллизующегося (фиг. 2). Наиболее близким по своим реологическим свойствам к референтному препарату является сироп, содержащий 85,2 г сорбитола жидкого некристализующегося в 100 мл (табл. 2).
При исследовании уровня рН референтного препарата, были установлены следующие значения рН: 5,03; 5,28 5,48; 5,50; 5,53; 5,89. Соответственно, для разрабатываемого препарата должны быть установлены пределы рН от 5,0 до 6,0.
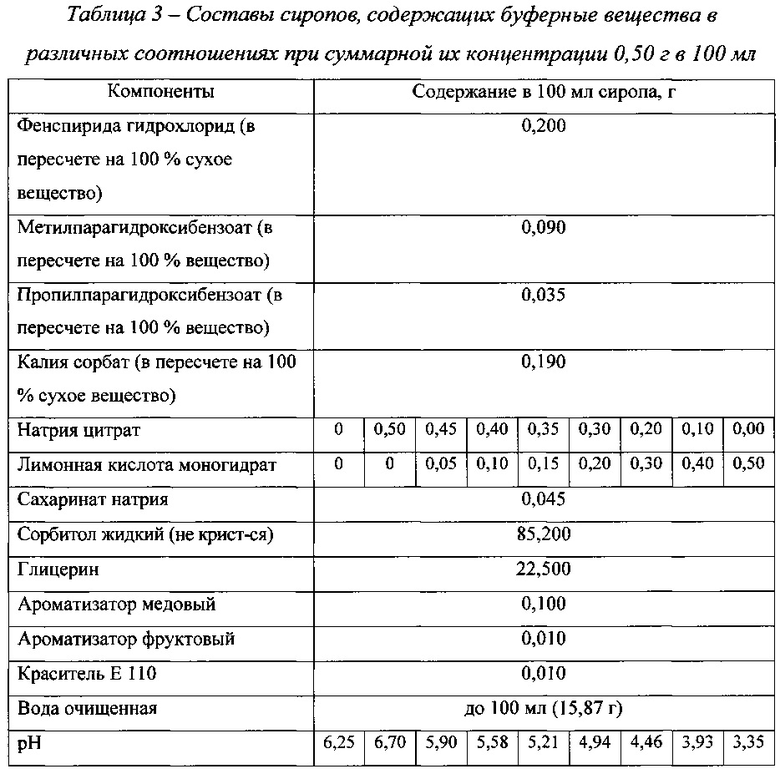
рН разрабатываемого сиропа, в состав которого не вводили корригенты рН (буферные вещества), составил 6,25. Для создания рН около 5,5 в состав сиропа были включены буферные вещества. Выбран нитратный буфер, состоящий из натрия цитрата и лимонной кислоты моногидрата.
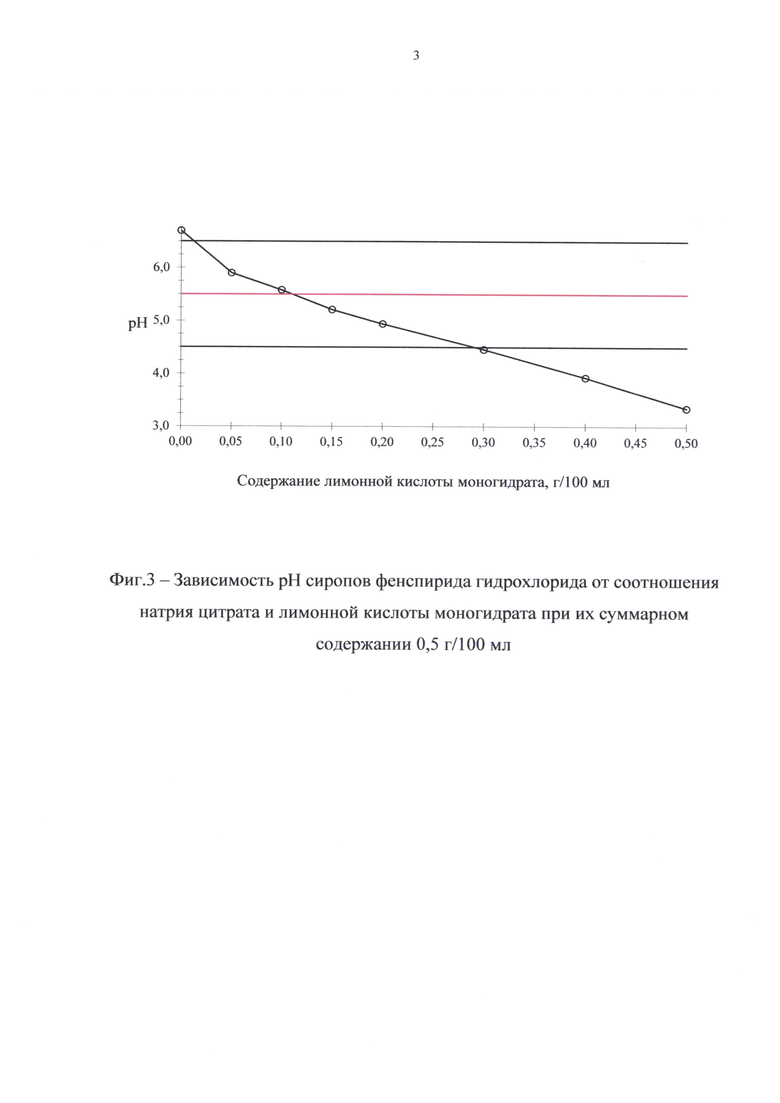
Были наработаны сиропы, содержащие буферные вещества в различных соотношениях при суммарной их концентрации 0,50 г в 100 мл, что соответствует 0,40 мас.% Составы этих сиропов представлены в табл. 3. На фиг. 3 представлена зависимость рН препарата от соотношения буферных веществ.
Как видно из данных, представленных на фиг. 3, с увеличением концентрации лимонной кислоты моногидрата и, соответственно, с уменьшением концентрации натрия цитрата рН сиропов уменьшается. Оптимальное значение рН 5,5 достигается при содержании в 100 мл сиропа лимонной кислоты моногидрата и натрия цитрата около 0,10 г и 0,40 г соответственно.
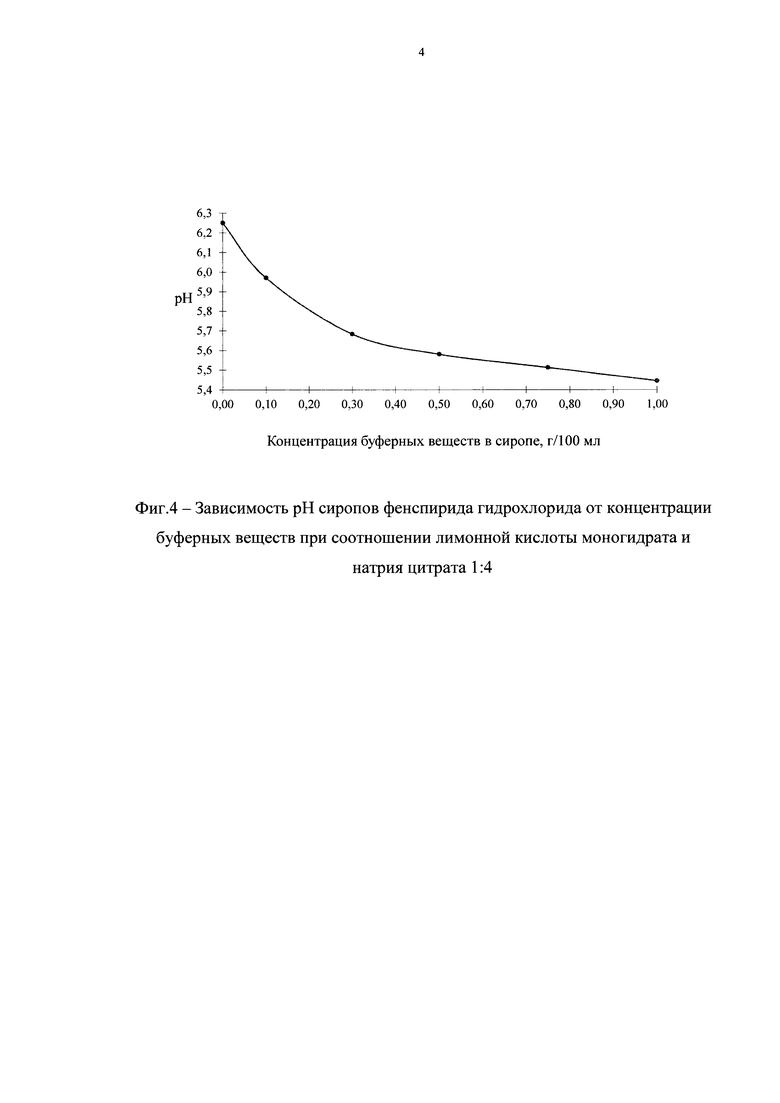
Дальнейшим этапом наших исследований было изучение зависимости рН сиропов от концентрации буферных веществ при выбранном соотношении лимонной кислоты моногидрата и натрия цитрата (1:4). В табл. 4 приведены составы исследуемых сиропов, а на фиг. 4 - результаты исследований.
Как видно из данных, представленных в табл. 4 и на фиг. 4, с увеличением концентрации буферных веществ при выбранном соотношении лимонной кислоты моногидрата и натрия цитрата рН сиропа уменьшается.
На основании полученных данных был выбран состав буферных веществ разрабатываемого препарата: лимонной кислоты моногидрат 0,15 г в 100 мл сиропа, что соответствует 0,12 мас.% и натрия цитрата 0,60 г в 100 мл сиропа, что соответствует 0,48 мас.%.
В состав референтного препарата «Эреспал» в качестве отдушек
входят ароматизирующий состав с оттенками медового запаха, настойка ванильная и солодки корней экстракт в концентрациях 0,5 г/100 мл, 0,4 г/100 мл и 0,2 г/100 мл соответственно.
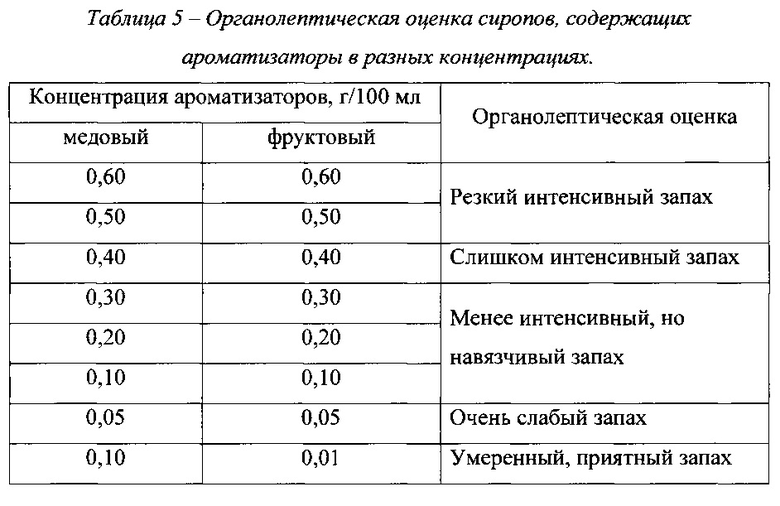
В состав разрабатываемого препарата в качестве отдушек были включены ароматизатор медовый и ароматизатор фруктовый. Были приготовлены сиропы, содержащие эти ароматизаторы в разных концентрациях. На добровольцах проведена органолептическая оценка каждого сиропа. Результаты представлены в таблице 5.
По результатам органолептических исследований в состав разрабатываемого препарата включены ароматизатор медовый в концентрация 0,10 г/100 мл и ароматизатор фруктовый в концентрация 0,01 г/100 мл, что соответствует 0,080 мас.% и 0,008 мас.%, соответственно.
В результате исследований по разработке препарата «Фенспирид сироп» 2 мг/мл, авторы настоящего изобретения пришли к следующим выводам относительно состава вспомогательных веществ, входящих в его состав:
1. Выбор корригентов вкуса. В качестве основного корригента вкуса выбран сорбитол жидкий некристаллизующийся. На основании экспериментальных данных и изучения физико-химических свойств сиропов, содержащих сорбитол жидкий некристаллизующийся в разных концентрациях (реологических свойств сиропов и их плотности) была выбрана его концентрация 85,2 г в 100 мл сиропа, что соответствует 68,16 мас.%.
2. Выбор корригентов рН (буферных веществ). Замена сахарозы, входящей в состав референтного препарата, на сорбитол жидкий некристаллизующийся повлекло за собой изменение рН препарата. В связи с этим в состав препарата был введен цитратный буфер, включающий натрия цитрат и лимонную кислоту моногидрат в концентрации 0,60 г/100 мл и 0,15 г/100 мл соответственно (0,48 мас.% и 0,12 мас.% соответственно).
Выбранный качественный и количественный состав буферных веществ обеспечивает рН препарата в установленных пределах от 5,0 до 6,0.
3. Выбор ароматизаторов. На основании результатов органолептических исследований в состав препарата были включены ароматизатор медовый в концентрации 0,1 г/100 мл и ароматизатор фруктовый в концентрации 0,01 г/100 мл, что соответствует 0,080 мас.% и 0,008 мас.%, соответственно.
4. Выбор антимикробных консервантов. В состав разрабатываемого препарата были включены метилпарагидроксибензоат (0,090 г/100 мл или 0,072 мас.%), пропилпарагидроксибензоат (0,035 г/100 мл или 0,028 мас.%) и калия сорбат (0,19 г/100 мл или 0,152 мас.%). Выбранный качественный и количественный состав консервантов обеспечивает антимикробное консервирующее действие, соответствующее требованиям ЕФ 8.0 (5.1.3) к лекарственным средствам для приема внутрь и требованиям ГФ РФ XII издания (статья 34) к лекарственным средствам категории 3.
Таким образом, на основании результатов проведенных исследований был обоснован состав препарата «Фенспирид сироп» 2 мг/мл, представленный в таблице 6
В результате проведенных комплексных исследований, экспериментальным путем, авторами настоящего изобретения была получена жидкая лекарственная форма фенспирида в виде сиропа, физико-химические и биологические свойства, а также показатели качества которой, подтверждают рациональность выбранного состава, для достижения цели настоящего изобретения и решения проблемы замещения сахарозы.
Ниже представлены сравнительные результаты анализа разработанного препарата «Фенспирид сироп» 2 мг/мл и препарата «Эреспал®» сироп 2 мг/мл, заявленного авторами настоящего изобретения в качестве прототипа.
Реологические свойства
Для определения условий хранения препарата было исследовано влияние колебаний температуры на реологические и физические свойства разрабатываемого препарата.
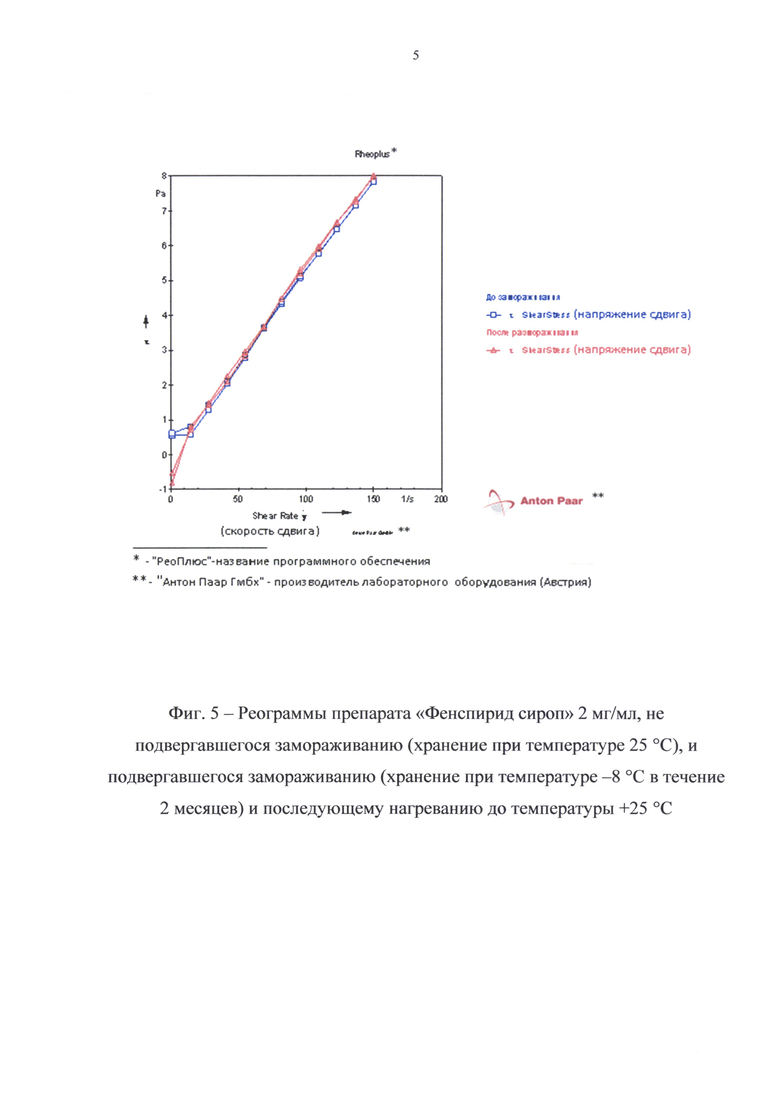
Препарат хранили в течение 2 мес. при температуре -8°С, после чего выдерживали при температуре 25°С до постоянной температуры препарата и снимали его реограмму, а также реограмму препарата этой же серии, хранившегося после наработки при температуре 25°С (фиг. 5). Кроме того, были сделаны фотографии указанных образцов препарата (фиг. 6).
Как видно по данным, представленным на фиг. 5 и 6, замораживание и последующее размораживание препарата не нарушает его физическую стабильность, все компоненты остаются в растворенном состоянии. Реограммы препаратов, подвергавшегося и не подвергавшегося замораживанию, практически совпадают, структурная вязкость при различных градиентах скорости сдвига практически не отличается.
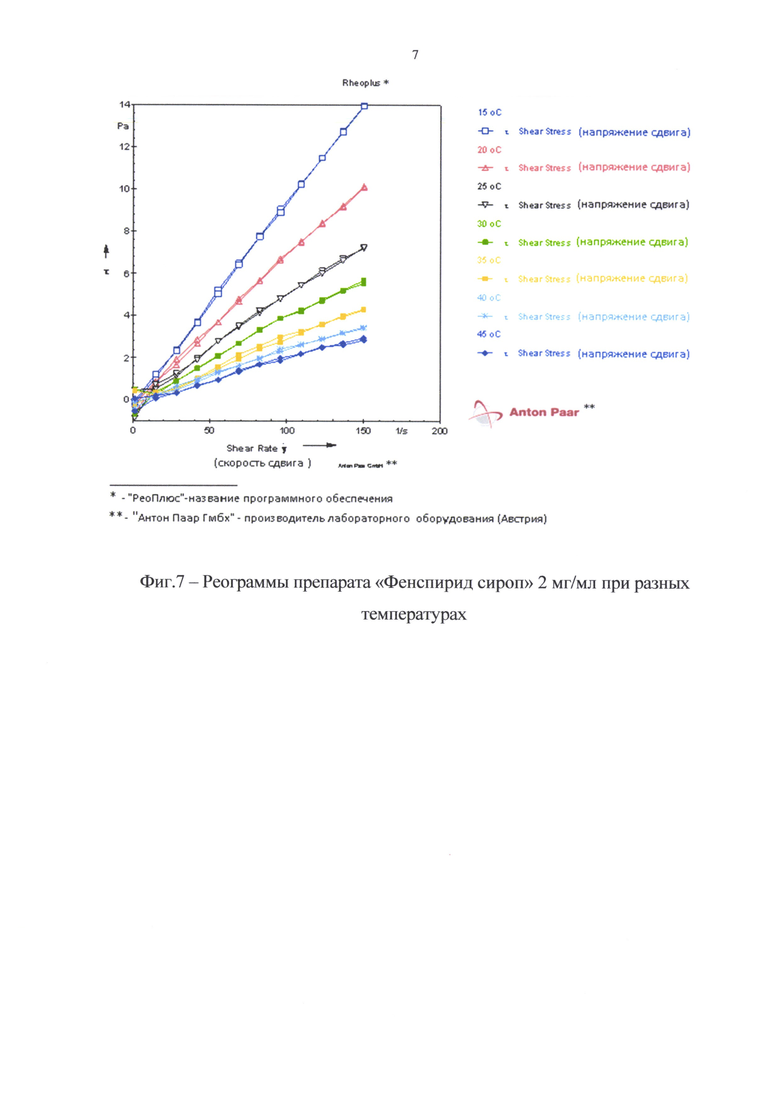
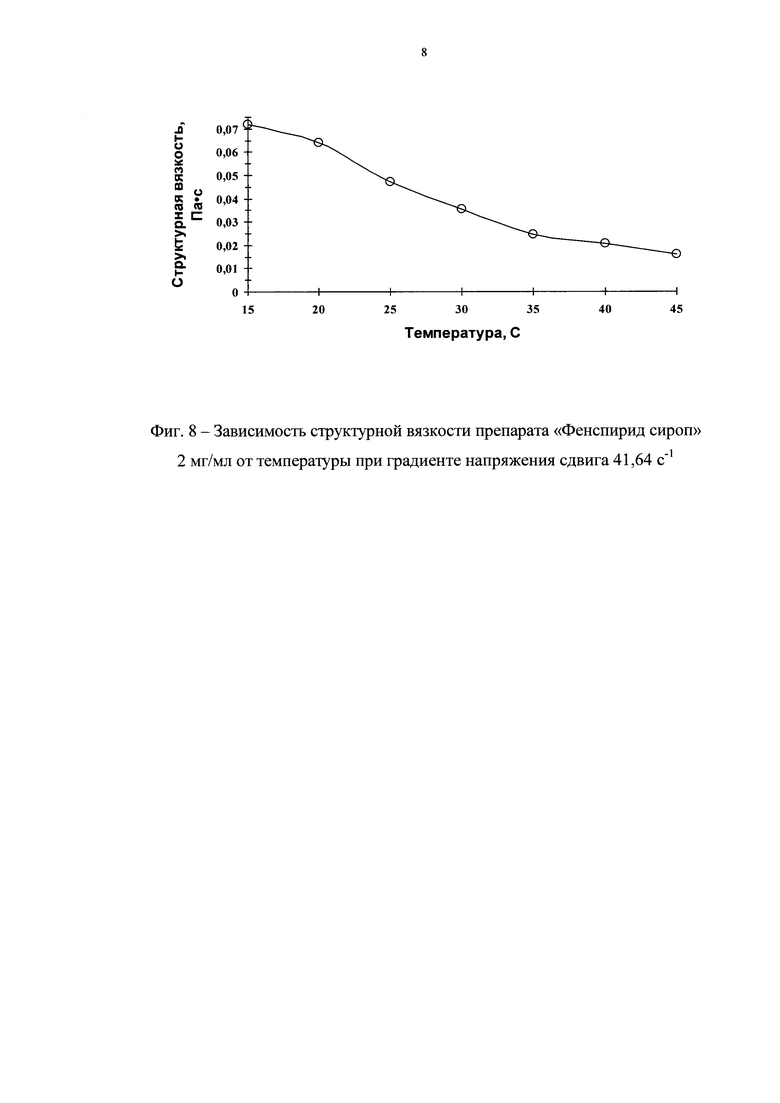
На фиг. 7 представлены реограммы препарата «Фенспирид сироп» 2 мг/мл при разных температурах, а на фиг. 8 - зависимость структурной вязкости сиропа от температуры.
Как видно из реограмм, приведенных на фиг. 7, препарат в интервале температур от 15 до 45°С имеет тип течения близкий к ньютоновскому, тиксотропные свойства у препарата при всех изученных температурах отсутствуют. Что касается структурной вязкости, то она уменьшается с увеличением температуры (фиг. 8). Так, при увеличении температуры с 15 до 45°С значения структурной вязкости уменьшаются на ~80%. Изменения реопараметров с изменением температуры обратимы.
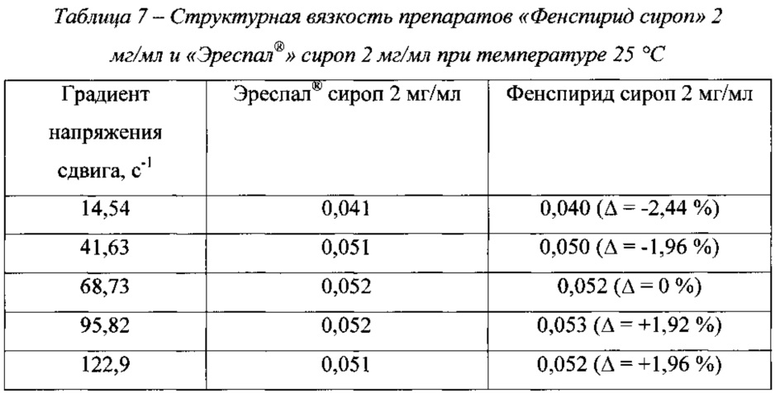
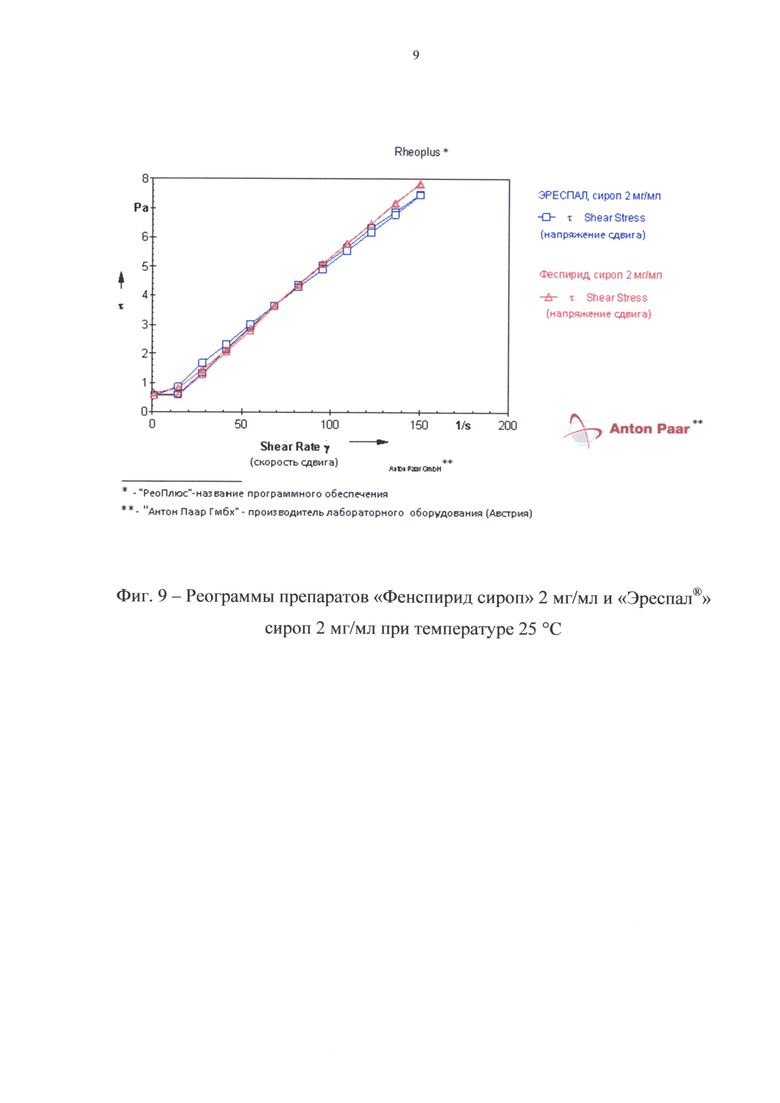
На фиг. 9 приведены реограммы разработанного и референтного препаратов, а в таблице 7 - значения их структурной вязкости при разных градиентах напряжения сдвига.
Как видно из данных, представленных на фиг. 9 и в табл. 7, реопараметры разработанного и референтного препаратов практически не отличаются.
Гиперосмолярные свойства
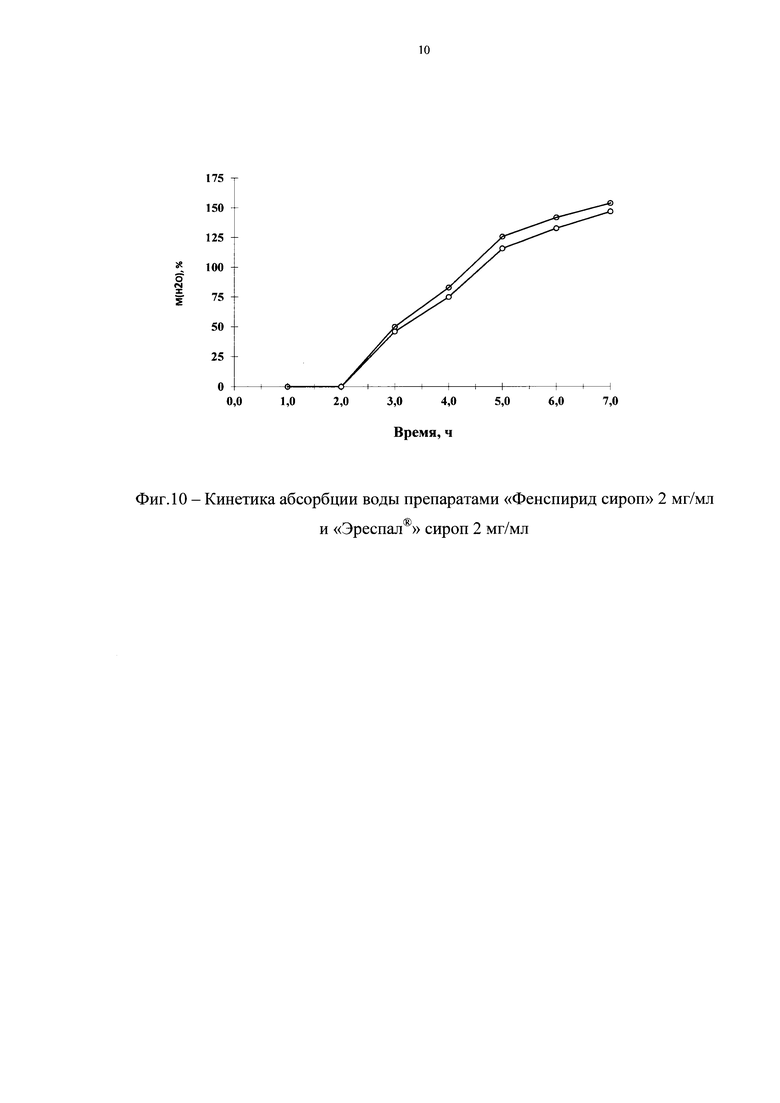
Были проведены сравнительные исследования кинетики абсорбции воды разработанным и референтным препаратами. Результаты исследований представлены на фиг. 10. Как видно из представленных данных осмотическая активность разрабатываемого и референтного препаратов практически не отличается.
Стабильность
Совместимость фенспирида гидрохлорида со вспомогательными веществами и его стабильность в разработанном препарате «Фенспирид сироп» 2 мг/мл подтверждены результатами исследования его стабильности, приведенными ниже.
Исследования были проведены на трех опытных сериях (011113, 021113 и 031113) препарата «Фенспирид сироп» 2 мг/мл. На хранение были заложены образцы опытных серий, изготовленные в реакторе-гомогенизаторе РП-500, моделирующем промышленное оборудование, и расфасованные во флаконы по 100 мл. Масса каждой серии нерасфасованной продукции составляла 3,75 кг (3,0 л).
Для указанных трех серий были проведены долгосрочные испытания при хранении образцов при температуре (25±1)°С и ускоренные испытания при хранении образцов при температуре (40±1)°С.
Долгосрочные и ускоренные испытания серий 011113, 021113 и 031113 были запланированы в соответствии с рекомендациями Руководства CPMP/ICH/2736/99 (ICH Topic Q1A (R2)) «Note for Guidance on Stability Testing: Stability Testing of New Drug Substances and Products)); протокол включал исходный анализ трех серий, анализ через 3 месяца в первый год хранения, через 6 месяцев во второй год хранения.
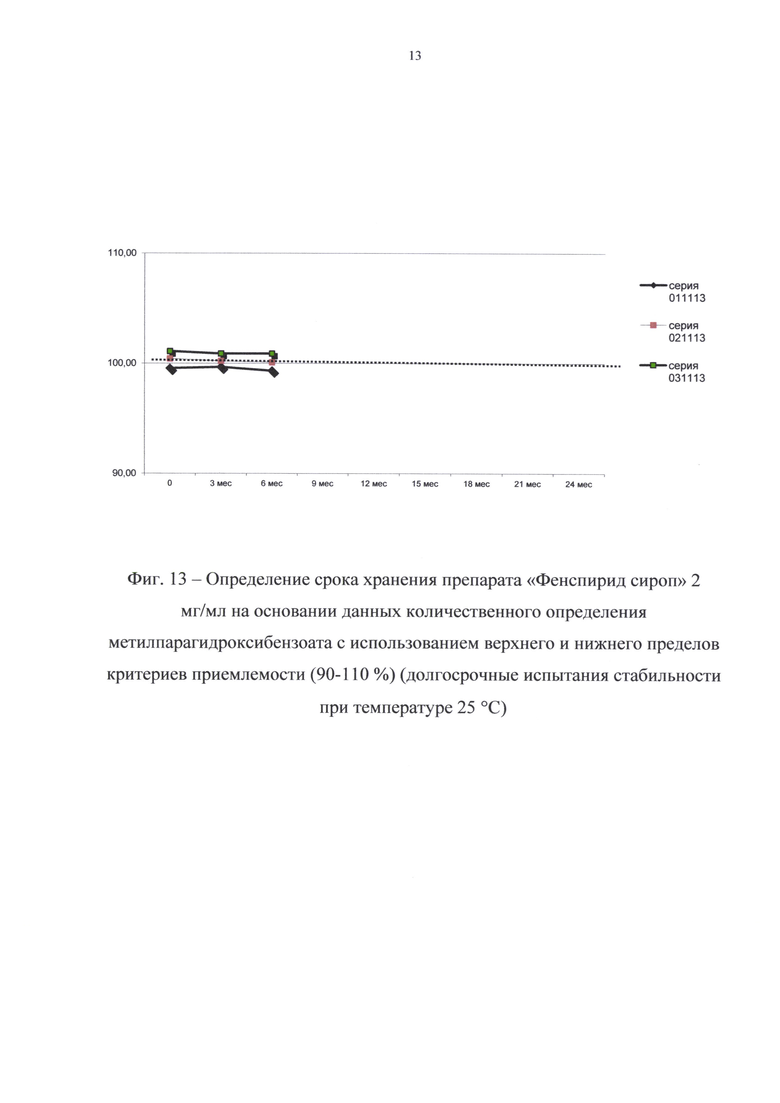
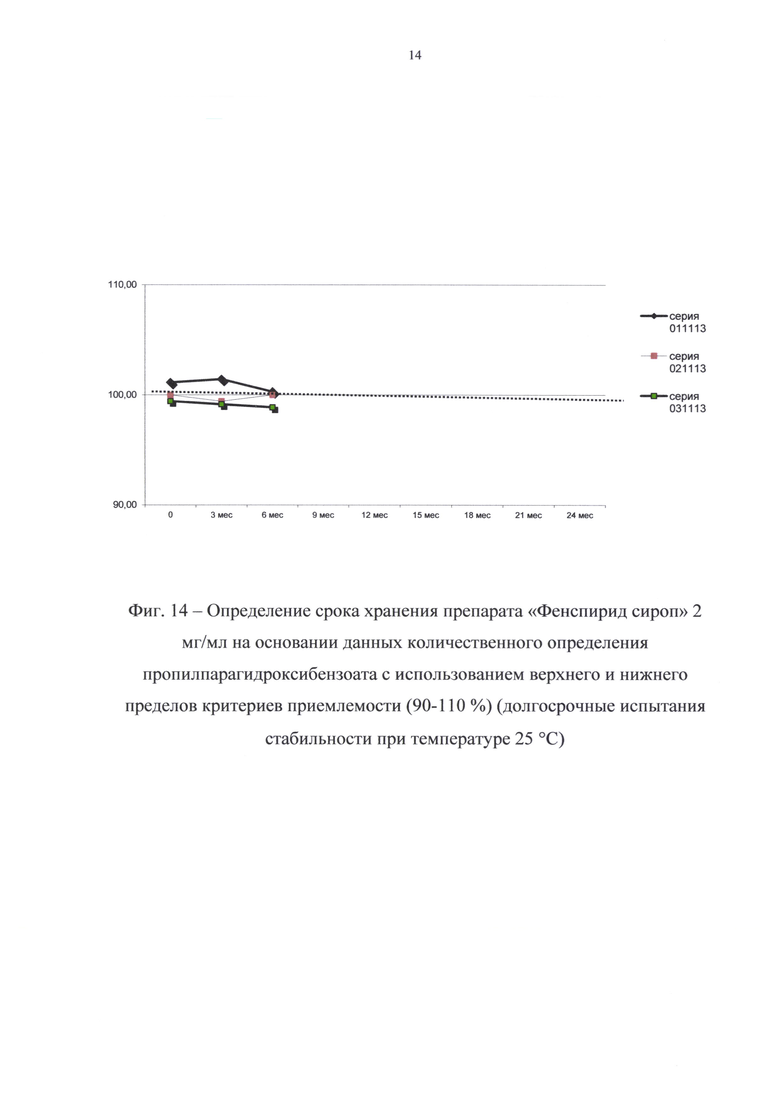
Данные о стабильности представлены в таблицах 8 и 9 и на фиг. 11-14.
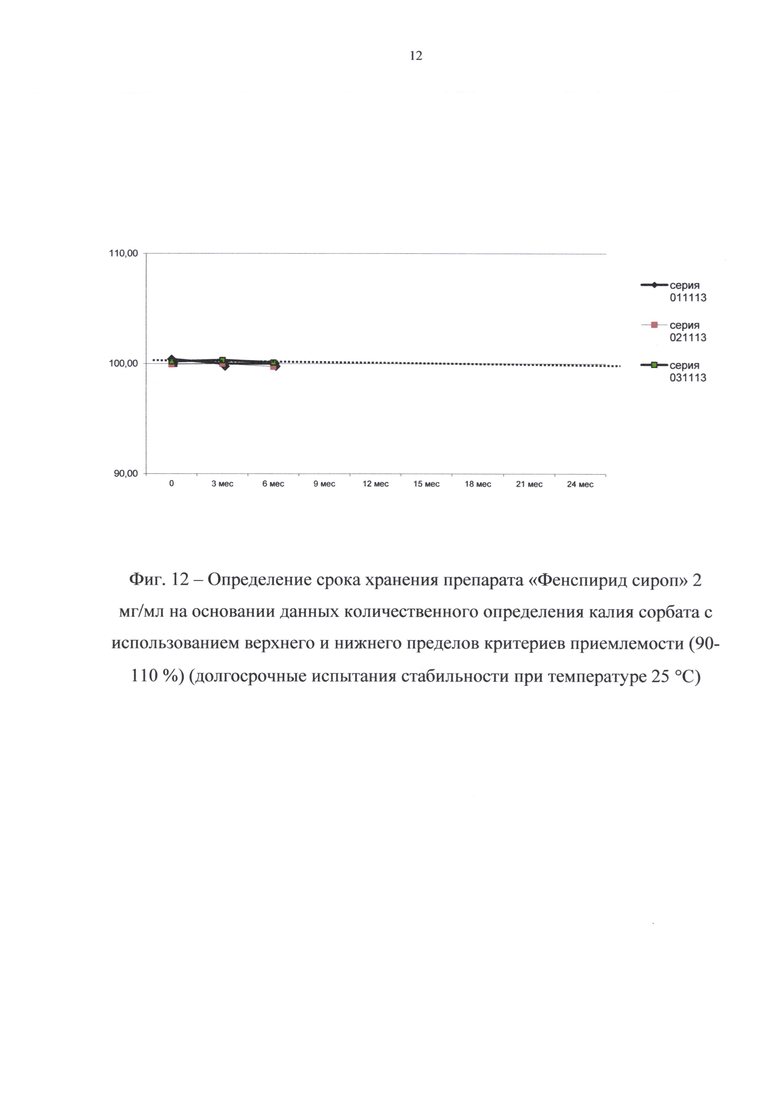
В результате долгосрочных испытаний стабильности при температуре 25°С в течение 6 месяцев (периода изучения стабильности) существенных изменений в показателях качества препарата не произошло; препарат выдерживал испытания по всем показателям спецификации.
Настоящее изобретение также относится к способу получения жидкой лекарственной формы фенспирида, который, учитывая свойства компонентов, входящих в его состав, включает следующие основные технологические процессы:
- приготовление раствора;
- растворение фенспирида гидрохлорида в воде очищенной;
- приготовление раствора буферных веществ, сахарината натрия и красителя в воде очищенной;
- введение приготовленных растворов и ароматизатора фруктового в сорбитол, гомогенизация и выгрузка нерасфасованного сиропа из реактора-гомогенизатора;
Согласно изобретению способ получения жидкой лекарственной формы фенспирида осуществляют следующим образом:
В емкость №1 загружают глицерин, нагревают, затем загружают предварительно отвешенные метилпарагидроксибензоат, пропилпарагидроксибензоат, калия сорбат и ароматизатор медовый и перемешивают до полного растворения компонентов; одновременно в емкость №2 загружают предварительно отвешенные часть воды очищенной и фенспирида гидрохлорид, который перемешивают до полного растворения; в емкость №3 загружают предварительно отвешенные часть воды очищенной, натрия цитрат, лимонную кислоту моногидрат, натрия сахаринат, краситель Е 110 и перемешивают смесь до полного растворения веществ; затем в реактор-гомогенизатор загружают предварительно отвешенный сорбитол жидкий некристаллизующийся и из емкости №3 количественно переносят раствор вспомогательных веществ, после чего перемешивают смесь в течение 5-10 мин при температуре 20-25°С до получения однородной массы; далее в реактор-гомогенизатор из емкости №1 количественно переносят раствор и перемешивают смесь в течение 5-10 мин при температуре 20-25 С до получения однородной массы; также в реактор-гомогенизатор из емкости №2 количественно переносят раствор фенспирида гидрохлорида и загружают предварительно отвешенный ароматизатор фруктовый, которые перемешивают смесь в течение 5-10 мин при температуре 20-25 С до получения однородного сиропа; в промежуточных емкостях сироп нерасфасованный транспортируют в помещение для дозирования и выгружают частями в бункер дозирующий машины, после чего сироп дозируют во флаконы, укупоривают крышками и упаковывают в пачки.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА В ВИДЕ СИРОПА С ПОВЫШЕННОЙ МИКРОБИОЛОГИЧЕСКОЙ УСТОЙЧИВОСТЬЮ | 2018 |
|
RU2713303C2 |
| ЖИДКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ОКСИЭТИЛАММОНИЯ МЕТИЛФЕНОКСИАЦЕТАТА | 2021 |
|
RU2783660C2 |
| ЖИДКАЯ ЛЕКАРСТВЕННАЯ ФОРМА РИСПЕРИДОНА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2016 |
|
RU2646812C1 |
| СТАБИЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ЛАМИВУДИНА | 2015 |
|
RU2587782C1 |
| ЖИДКАЯ ВОДНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ АМБРОКСОЛА И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ЕЕ ОСНОВЕ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ДЫХАТЕЛЬНЫХ ПУТЕЙ С ОБРАЗОВАНИЕМ ВЯЗКОЙ МОКРОТЫ (ВАРИАНТЫ) | 2010 |
|
RU2426531C1 |
| ЖИДКАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ, ОБЛАДАЮЩАЯ НООТРОПНОЙ АКТИВНОСТЬЮ | 2018 |
|
RU2703293C1 |
| АНТИГИСТАМИННАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2165255C1 |
| ЖИДКАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ГРИППА И ОРВИ | 2020 |
|
RU2770521C2 |
| ЖИДКАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ГРИППА И ОРВИ | 2018 |
|
RU2737086C2 |
| ЖИДКАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ГРИППА И ОРВИ | 2020 |
|
RU2744854C1 |


Изобретение относится к фармацевтической промышленности и представляет собой жидкую лекарственную форму фенспирида гидрохлорида, выполненную в виде сиропа, включающую фенспирида гидрохлорид, метилпарагидроксибензоат, пропилпарагидроксибензоат, калия сорбат, натрия цитрат, лимонной кислоты моногидрат, сахаринат натрия, сорбитол жидкий некристаллизующийся, глицерин, ароматизатор медовый, ароматизатор фруктовый, краситель Е 110 и воду очищенную, причем компоненты в лекарственной форме находятся в определенном соотношении в г/100 мл. Изобретение обеспечивает расширение арсенала лекарственных средств, представляющих собой жидкую лекарственную форму фенспирида гидрохлорида, стабильных при получении и длительном хранении без использования сахарозы. 2 н.п. ф-лы, 14 ил., 9 табл.
1. Жидкая лекарственная форма фенспирида гидрохлорида, выполненная в виде сиропа, включающая активное вещество и комбинацию вспомогательных веществ, имеющая следующий состав в г/100 мл:
2. Жидкая лекарственная форма фенспирида гидрохлорида по п. 1, для получения которой готовят раствор активного и вспомогательных веществ, для чего в емкость №1 загружают глицерин, затем загружают предварительно отвешенные метилпарагидроксибензоат, пропилпарагидроксибензоат, калия сорбат и ароматизатор медовый и перемешивают до полного растворения компонентов, а также в емкость №2 загружают предварительно отвешенные  часть воды очищенной и фенспирида гидрохлорид, который перемешивают до полного растворения, затем в емкость №3 загружают предварительно отвешенные
часть воды очищенной и фенспирида гидрохлорид, который перемешивают до полного растворения, затем в емкость №3 загружают предварительно отвешенные  часть воды очищенной, натрия цитрат, лимонную кислоту моногидрат, натрия сахаринат, краситель Е 110 и перемешивают смесь до полного растворения веществ, затем в реактор-гомогенизатор загружают предварительно отвешенный сорбитол жидкий некристаллизующийся и из емкости №3 количественно переносят раствор вспомогательных веществ, после чего перемешивают смесь до получения однородной массы, далее в реактор-гомогенизатор из емкости №1 количественно переносят раствор и перемешивают смесь до получения однородной массы; также в реактор-гомогенизатор из емкости №2 количественно переносят раствор фенспирида гидрохлорида и загружают предварительно отвешенный ароматизатор фруктовый, смесь перемешивают до получения однородного сиропа.
часть воды очищенной, натрия цитрат, лимонную кислоту моногидрат, натрия сахаринат, краситель Е 110 и перемешивают смесь до полного растворения веществ, затем в реактор-гомогенизатор загружают предварительно отвешенный сорбитол жидкий некристаллизующийся и из емкости №3 количественно переносят раствор вспомогательных веществ, после чего перемешивают смесь до получения однородной массы, далее в реактор-гомогенизатор из емкости №1 количественно переносят раствор и перемешивают смесь до получения однородной массы; также в реактор-гомогенизатор из емкости №2 количественно переносят раствор фенспирида гидрохлорида и загружают предварительно отвешенный ароматизатор фруктовый, смесь перемешивают до получения однородного сиропа.
| Инструкция по медицинскому применению лекарственного препарата Эреспал, дата регистрации 28.06.2010, найдно в Интернет на сайте: http://grls.rosminzdrav.ru/Grls_View_v2.aspx?idReg=141666&t=; | |||
| СИРОП АМБРОКСОЛА ДЛЯ ЛЕЧЕНИЯ БРОНХОПУЛЬМОНАЛЬНЫХ ЗАБОЛЕВАНИЙ | 2000 |
|
RU2169557C1 |
| US 5272137 А, 21.12.1993 | |||
| WO 2010107404 А1, 23.09.2010. | |||
Авторы
Даты
2017-01-11—Публикация
2015-08-26—Подача