Область изобретения
Настоящее изобретение относится к способу получения гидрогеля и к гидрогелю, получаемому указанным способом. Настоящее изобретение также относится к способу получения конъюгата гидрогель-спейсер, к конъюгату гидрогель-спейсер, получаемому указанным способом, к способу получения пролекарства, связанного с носителем, и к пролекарствам, связанным с носителем, получаемым указанным способом, в частности к пролекарствам, связанным с носителем, которые обеспечивают контролируемое и/или замедленное высвобождение лекарственного средства из носителя. Кроме того, изобретение относится к применению гидрогеля для получения пролекарства, связанного с носителем.
Уровень техники
Стандартные гидрогели представляют собой трехмерные гидрофильные или алифатические полимерные сети, способные включать большие количества воды. Эти сети могут состоять из различных полимеров и являются нерастворимыми из-за присутствия ковалентных химических и/или физических поперечных связей, таких как ионные, гидрофобные взаимосвязи или переплетения.
Многие стандартные гидрогели несколько ограничены в их применении. Некоторые гидрогели применяются для фармацевтических применений, таких как сшивание раны, тканевая инженерия или доставка лекарственного средства. Гидрогели для лигации раскрываются, например в WO 2008/125655 А1.
Кроме того, в WO 99/014259 А1 раскрываются поперечно-сшитые гидрогели на основе ПЭГ, в которых заключены молекулы лекарственного средства.
Высвобождение заключение молекул лекарственного средства из таких стандартных гидрогелей зависит от разложения гидрогеля и может привести к взрывному высвобождению, временно вызывающее слишком высокие уровни и сложности предсказания высвобождения лекарственно средства. Желательно контролировать и/или задерживать высвобождение лекарственно средства из гидрогеля. В WO 06/003014 А2 и WO 2011/012715 А1 описываются гидрогели в качестве носителей в пролекарствах, связанных с носителем, где биологически активные составляющие ковалентно связаны с гидрогелем через линкеры пролекарств. Такие гидрогель-связанные пролекарства высвобождают лекарственное средство контролируемым образом и с конкретным периодом полураспада.
Однако гидрогели, описанные в WO 2011/012715 А1, предпочтительно применяются для контролируемого и замедленного высвобождения более маленьких молекул лекарственного средства, и не могут обеспечить достаточный доступ для более больших молекул, таким образом, приводя к низкой загрузке лекарственного средства в такие гидрогели.
Подробное описание изобретения
Способ получения гидрогеля и гидрогель
Соответственно, существует потребность в гидрогелях, которые могут применяться в качестве носителей для пролекарств, связанных с носителем, которые подходят для контролируемого и замедленного высвобождения более больших молекул лекарственного средства.
Таким образом, задачей настоящего изобретения является преодоление по меньшей мере некоторых вышеуказанных недостатков и обеспечение гидрогеля, который может применяться в качестве носителя для пролекарств, связанных с носителем, который подходит для контролируемого и/или замедленного высвобождения более больших молекул лекарственного средства.
Одним объектом настоящего изобретения является способ получения гидрогеля, содержащий стадии:
(а) обеспечения смеси, содержащей
(a-i) по меньшей мере один реагент основной цепи, где по меньшей мере один реагент основной цепи имеет молекулярную массу в интервале от 1 до 100 кДа, и содержит по меньшей мере три амина (-NH2 и/или -NH-);
(a-ii) по меньшей мере один поперечно-сшивающий реагент, где по меньшей мере один поперечно-сшивающий реагент имеет молекулярную массу в интервале от 6 до 40 кДа, и где по меньшей мере один поперечно-сшивающий реагент содержит
(i) по меньшей мере две карбонилокси группы (-(С=O)-O- или -O-(C=O)-), и дополнительно
(ii) по меньшей мере две активированные функциональные концевые группы, выбранные из группы, состоящей из активированных сложноэфирных групп, активированных карбаматных групп, активированных карбонатных групп и активированных тиокарбонатных групп,
и является основанным на ПЭГ, содержащим по меньшей мере 70% ПЭГ; и
(a-iii) первый растворитель и по меньшей мере второй растворитель, где второй растворитель является несмешиваемым с первым растворителем,
в массовом отношении по меньшей мере одного реагента основной цепи к по меньшей мере одному поперечно-сшивающему реагенту в интервале от 1:99 до 99:1; и
(b) полимеризации смеси со стадии (а) путем суспензионной полимеризации в гидрогель.
В общем известно, что структура поперечно-сшивающих агентов влияет на размер пор гидрогеля, но ожидали, что чем длиннее поперечно-сшивающие агенты, тем более вероятно они образуют вторичные структуры, которые будут преграждать путь во внутреннее пространство гидрогеля. Ожидалось, что это будет мешать более большим белковым лекарственным средствам входить во внутреннее пространство гидрогеля, и присоединение таких молекул лекарственного средства будет ограничено прежде всего поверхностью и областями, близкими к поверхности гидрогеля. Неожиданно было обнаружено, что несмотря на эти ожидаемые ограничения, большие лекарственные средства, такие как белки, способны входить в гидрогели согласно настоящему изобретению в количествах, которые позволяют этим гидрогелям быть полезными в качестве носителей для пролекарств.
Применяемые в настоящей заявке термины имеют следующие значения
Как применяется в настоящей заявке, термин "гидрогель" означает гидрофильную или амфифильную полимерную сеть, состоящую из гомополимеров или сополимеров, которые являются нерастворимыми благодаря присутствию ковалентны благодаря присутствию ковалентных химических связей. Поперечно-сшивающие агенты обеспечивают структуру сети и механическую прочность. Гидрогели показывают термодинамическую совместимость с водой, что позволяет им разбухать в водной среде.
Как применяется в настоящей заявке, термин "реагент" означает химическое соединение, которое содержит по меньшей мере одну функциональную группу для реакции с функциональной группой другого реагента или составляющей.
Как применяется в настоящей заявке, термин "реагент основной цепи" означает реагент, который подходит в качестве исходного вещества для образования гидрогелей, как применяется в настоящей заявке, реагент основной цепи предпочтительно не содержит биоразлагаемые связи. Реагент основной цепи может содержать "разветвляющееся ядро", которое относится к атому или составляющей, к которой присоединено более одной других составляющих.
Как применяется в настоящей заявке, термин "поперечно-сшивающий реагент" означает линейный или разветвленный реагент, который подходит в качестве исходного вещества для сшивания реагентов основной цепи. Предпочтительно, поперечно-сшивающий реагент представляет собой линейное химическое соединение. Поперечно-сшивающий реагент содержит по меньшей мере две биоразлагаемые связи.
Как применяется в настоящей заявке, термин "составляющая" означает часть молекулы, у которой отсутствует один или более атомов по сравнению с соответствующим реагентом. Если, например, реагент формулы "Н-Х-Н" реагирует с другим реагентом и становится частью продукта реакции, соответствующая составляющая продукта реакции имеет структуру "Н-X-" или "-Х-", тогда как каждая "-" показывает присоединение к другой составляющей. Соответственно, биологически активная составляющая высвобождается из пролекарства в качестве лекарственного средства.
Соответственно, фраза "в связанной форме", как применяется, относится к соответствующей составляющей реагента, т.е. "лизин в связанной форме" относится к составляющей лизина, у которой отсутствует один или более атомов реагента лизина и которая является частью молекулы.
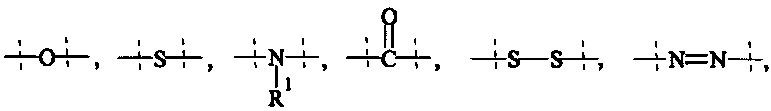
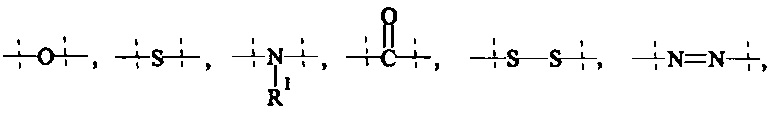
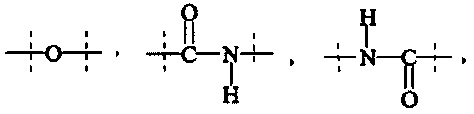
Как применяется в настоящей заявке, термин "функциональная группа" означает группу атомов, которая может реагировать с другими функциональными группами. Функциональные группы включают, но без ограничения к этому, следующие группы: карбоновая кислота (-(С=O)ОН), первичный или вторичный амин (-NH2, -NH-), малеимид, тиол (-SH), сульфоновая кислота (-(O=S=O)OH), карбонат, карбамат (-O(C=O)N<), гидрокси (-ОН), альдегид (-(С=O)Н), кетон (-(С=O)-), гидразин (>N-N<), изоцианат, изотиоцианат, фосфорная кислота (-O(Р=O)ОНОН), фосфоновая кислота (-O(Р=O)ОНН), галоацетил, алкилгалогенид, акрилоил, арилфторид, гидроксиламин, дисульфид, винилсульфон, винилкетон, диазоалкан, оксиран и азиридин.
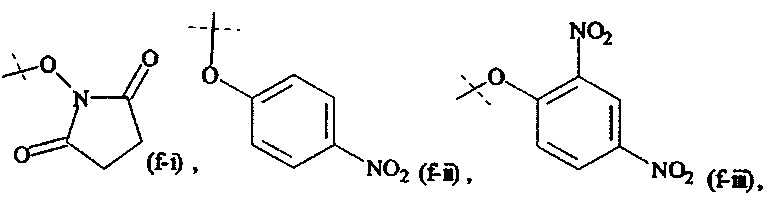
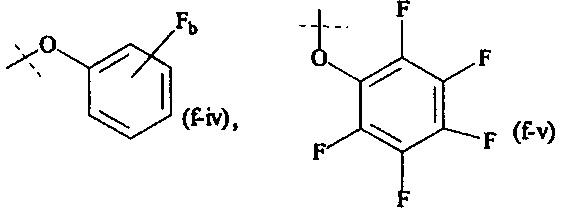
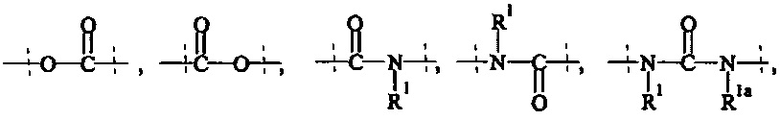
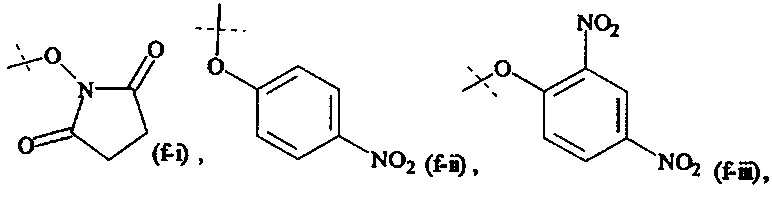
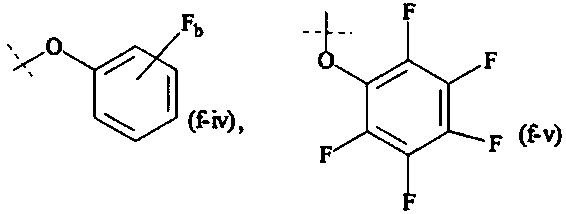
Как применяется в настоящей заявке, термин "активированная функциональная группа" означает функциональную группу, которая связана с активирующей группой, т.е. функциональную группу, прореагировавшую с активирующим реагентом. Предпочтительные активированные функциональные группы включают, но без ограничения к этому, активированные сложноэфирные группы, активированные карбаматные группы, активированные карбонатные группы и активированные тиокарбонатные группы. Предпочтительные активирующие группы выбираются из формул ((f-i) - (f-vi):
 или
или 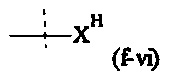
где пунктирные линии означают присоединение к остальной части молекулы;
b равно 1, 2, 3 или 4; и
XH представляет собой Cl, Br, I или F.
Соответственно, предпочтительный активированный сложный эфир имеет формулу
-(C=O)-XF,
где
XF выбирается из формул (f-i), (f-ii), (f-iii), (f-iv), (f-v) и (f-vi).
Соответственно, предпочтительный активированный карбамат имеет формулу
-N-(C=O)-XF,
где XF выбирается из формул (f-i), (f-ii), (f-iii), (f-iv), (f-v) и (f-vi).
Соответственно, предпочтительный активированный карбонат имеет формулу
-O-(C=O)-XF,
где XF выбирается из формул (f-i), (f-ii), (f-iii), (f-iv), (f-v) и (f-vi).
Соответственно, предпочтительный активированный сложный тиоэфир имеет формулу
-S-(C=O)-XF,
где
XF выбирается из формул (f-i), (f-ii), (f-iii), (f-iv), (f-v) и (f-vi).
Соответственно, "активированная концевая функциональная группа" представляет собой активированную функциональную группу, которая располагается в конце составляющей или молекулы, т.е. представляет собой терминальную активированную функциональную группу.
Как применяется в настоящей заявке, термин "блокирующая группа" означает составляющую, которая является необратимо, т.е. перманенто, связанной с функциональной группой, чтобы исключить возможность ее реакции с функциональной группой других реагентов или составляющих.
Как применяется в настоящей заявке, термин "защитная группа" означает составляющую, которая обратимо соединена с функциональной группой, предотвращая ее реакцию с, например, другой функциональной группой. Подходящим спиртовыми (-ОН) защитными группами являются, например, ацетил, бензоил, бензил, β-метоксиэтоксиметиловый простой эфир, диметокситритил, метоксиметиловый простой эфир, метокситритил, п-метоксибензиловый простой эфир, метилтиометиловый простой эфир, пивалоил, тетрагидропиранил, тритил, триметилсилил, трет.-бутилдиметилсилил, три-изо-пропилсилилоксиметил, триизопропилсилиловый простой эфир, метиловый простой эфир, и этоксиэтилиловый простой эфир. Подходящими аминными защитными группами являются, например, карбобензилокси, п-метоксибензил карбонил, трет.-бутилоксикарбонил, 9-фторенилметилоксикарбонил, ацетил, бензоил, бензил, карбамат, п-метоксибензил, 3,4-диметоксибензил, п-метоксифенил, и тозил. Подходящими карбонильными защитными группами являются, например, ацетали и кетали, ацилали и дитианы. Подходящие защитные группы карбоновых кислот представляют собой, например, метиловые сложные эфиры, бензиловые сложные эфиры, трет.-бутиловые сложные эфиры, 2,6-диметилфенол, 2,6-диизопропилфенол, 2,6.-ди-трет.-бутилфенол, силиловые сложные эфиры, сложные ортоэфиры и оксазолин. Подходящими фосфатными защитными группами являются, например, 2-цианоэтил и метил.
Как применяется в настоящей заявке, термины "обработка" и "обрабатывание" относится к ряду манипуляций, необходимых для выделения и очистки продукта (продуктов) химической реакции, в частности полимеризации.
Как применяется в настоящей заявке, термин "полимер" означает молекулу, содержащую повторяющиеся структурные единицы, т.е. мономеры, соединенные химическими связями линейным, кольцевым, разветвленным, попречно-сшитым или дендримерным путем или их комбинацией, которые могут быть синтетического или биологического происхождения или комбинацией обоих. Понятно, что полимер может также содержать, например, функциональные группы или защитные составляющие. Предпочтительно, полимер имеет молекулярную массу по меньшей мере 0.5 кДа, например, молекулярную массу по меньшей мере 1 кДа, молекулярную массу по меньшей мере 2 кДа, молекулярную массу по меньшей мере 3 кДа или молекулярную массу по меньшей мере 5 кДа.
Как применяется в настоящей заявке, термин "полимерный" означает реагент или составляющую, содержащую один или более полимеров.
Специалисту в данной области техники понятно, продукты полимеризации, полученные в результате реакции полимеризации, не имеют одинаковую молекулярную массу, а скорее показывают распределение молекулярной массы. Следовательно, диапазоны молекулярной массы, молекулярные массы, диапазоны числа мономеров в полимере и количества мономеров в полимере, как применяется в настоящей заявке, относятся среднечисловой молекулярной массе и среднему числу мономеров. Как применяется в настоящей заявке, термин "среднечисловая молекулярная масса" означает обычные арифметические значения молекулярных масс отдельных полимеров.
Как применяется в настоящей заявке, термин "полимеризация" или "полимеризующийся" означает процесс реакции мономерных или макромономерных реагентов в ходе химической реакции полимерных цепей или сетей, включая, но без ограничения к этому, гидрогели.
Как применяется в настоящей заявке, термин "макромономер" означает молекулу, которая была получена в ходе полимеризации мономерных реагентов.
Как применяется в настоящей заявке, термин "конденсационная полимеризация" или "реакция конденсации" означает химическую реакцию, в которой функциональные группы двух реагентов реагируют с образованием одной молекулы, т.е. продукта реакции, и низкомолекулярная молекула, например вода, выделяется.
Как применяется в настоящей заявке, термин "суспензионная полимеризация" означает гомогенную и/или двухфазную реакцию полимеризации, где мономерные реагенты растворяются в первом растворителе, образующем дисперсную фазу, которая эмульгируется во втором растворителе, образующем непрерывную фазу. Согласно настоящему изобретению мономерными реагентами являются по меньшей мере один реагент основной цепи и по меньшей мере один поперечно-сшивающий реагент. Как первый растворитель, так и мономерные реагенты являются не растворимыми во втором растворителе. Такая эмульсия образуется путем перемешивания, встряхивания, обработки ультразвуком или Microsieve™ эмульгирования, более предпочтительно путем перемешивания или Microsieve™ эмульгирования и более предпочтительно путем перемешивания. Эта эмульсия стабилизируется путем соответствующего эмульгатора. Эта полимеризация инициируется путем добавления основания в качестве инициатора, которое растворимо в первом растворителе. Подходящее общеизвестное основание, подходящее в качестве инициатора, может быть третичным основанием, таким как тетраметилэтилендиамин (TMEDA).
Как применяется в настоящей заявке, термин "не смешивающийся" означает свойство, когда два вещества не способны объединятся с образованием гомогенной смеси.
Как применяется в настоящей заявке, термин "полиамин" означает реагент или составляющую, содержащую более одного аминан (-NH- и/или -NH2), например, от 2 до 64 аминов, от 4 до 48 аминов, от 6 до 32 аминов, от 8 до 24 аминов или от 10 до 16 аминов. Особенно предпочтительные полиамины содержат от 2 до 32 аминов.
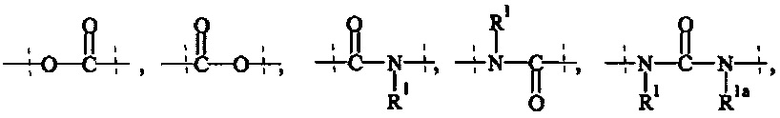
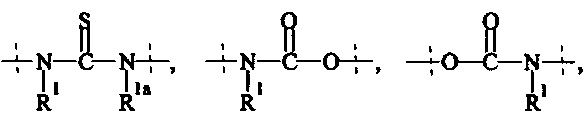
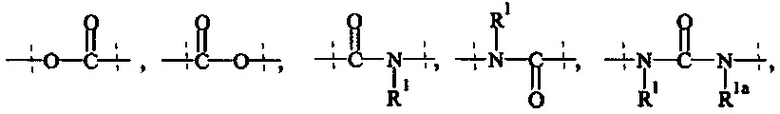
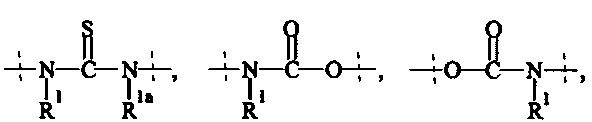
Как применяется в настоящей заявке, термин "ПЭГ-основные, содержащие по меньшей мере Х% ПЭГ" в отношении составляющей или реагента означает, что указанная составляющая или реагент содержит по меньшей мере Х% (мас./мас.) единиц этиленгликоля (-СН2СН2О-), где единицы этиленгликоля могут быть расположены блочным образом, чередующимся образом или могут быть расположены случайным образом внутри составляющей или реагента, и предпочтительно все единицы этиленгликоля указанной составляющей или реагента присутствуют в одном блоке; оставшимся массовым процентом ПЭГ-основной составляющей или реагента являются другие составляющие, особенно выбранные из следующих заместителей и связей:
- С1-50 алкила, С2-50 алкенила, С2-50 алкинила, С3-10 циклоалкила, 4-7-членного гетероциклила, 8-11-членного гетеробициклила, фенила; нафтила; инденила; инданила; и тетралинила; и
- связей, выбранных из группы, состоящей из
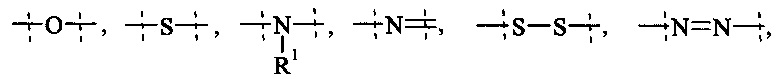
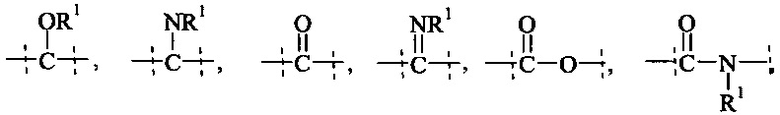
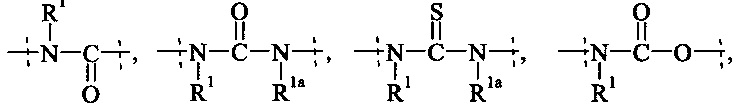
 , и
, и 
где
пунктирные линии означают присоединение к остальной части составляющей или реагента, и
R1 и Rla независимо друг от друга выбираются Н и С1-6 алкила.
Как применяется в настоящей заявке, термин "C1-4 алкил" сам по себе или в комбинации означает неразветвленную или разветвленную алкильную группу, имеющую от 1 до 4 атомов углерода. Если присутствует в конце молекулы, примеры неразветвленных и разветвленных С1-4 алкильных групп представляют собой метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор.-бутил и трет.-бутил. Когда две составляющие молекулы связаны С1-4 алкильной группой, тогда примерами таких См алкильных групп являются -СН2-, СН2СН2, -СН(СН3)-, -СН2-СН2-СН2-, СН(С2Н5)-, -С(СН3)2-, -СН2-СН2-СН2-СН2-, и СН2-СН2-СН2(СН3)-. Каждый атом водорода С1-4 алкильной группы может быть замещен заместителем, как указано далее.
Как применяется в настоящей заявке, термин "C1-6 алкил" сам по себе или в комбинации означает неразветвленную или разветвленную алкильную группу, имеющую от 1 до 6 атомов углерода. Если присутствует в конце молекулы, примеры неразветвленных и разветвленных C1-6 алкильных групп представляют собой метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор.-бутил, трет.-бутил, н-пентил, 2-метилбутил, 2,2-диметилпропил, н-гексил, 2-метилпентил, 3-метилпентил, 2,2-диметилбутил, 2,3-диметилбутил и 3,3-диметилпропил. Когда две составляющие молекулы связаны С1-6 алкильной группой, тогда примерами таких C1-6 алкильных групп являются -СН2-, -СН2-СН2-, -СН(СН3)-, -СН2-СН2-СН2-, -CH(C2H5)- и С(СН3)2-. Каждый атом водорода C1-6 алкильной группы может быть замещен заместителем, как указано далее.
Соответственно, как применяется в настоящей заявке,, термин "C1-20 алкила" сам по себе или в комбинации означает неразветвленную или разветвленную алкильную группу, имеющую от 1 до 20 атомов углерода. Термин "C8-18 алкил" сам по себе или в комбинации означает неразветвленную или разветвленную алкильную группу, имеющую от 8 до 18 атомов углерода. Соответственно, как применяется в настоящей заявке, термин "С1-50 алкил" сам по себе или в комбинации означает неразветвленную или разветвленную алкильную группу, имеющую от 1 до 50 атомов углерода. Каждый атом водорода С1-20 алкильной группы, C8-18 алкильной группы и С1-50 алкильной группы может быть замещен заместителем. В каждом случае алкильная группа может присутствовать в конце молекулы, или две составляющие молекулы могут быть связаны алкильной группой.
Как применяется в настоящей заявке, термин "С2-6 алкенил" сам по себе или в комбинации означает неразветвленную или разветвленную углеводородную составляющую, содержащую по меньшей мере одну углерод-углеродную двойную связь, имеющую от 2 до 6 атомов углерода. Если присутствует в конце молекулы, примерами являются -СН=СН2, -СН=СН-СН3, СН2-СН=СН2, СН=СНСН2-СН3 и -СН=СН-СН=СН2. Когда две составляющие молекулы связаны С2-6 алкенильной группой, тогда примером такого С2-6 алкенила является -СН=СН-. Каждый атом водорода С2-6 алкенильной группы может быть замещен заместителем, как указано далее. Необязательно, одна или более тройных связей могут встречаться.
Соответственно,, как применяется в настоящей заявке, термин "С2-20 алкенил" сам по себе или в комбинации означает неразветвленный или разветвленный углеводородный остаток, содержащий по меньшей мере одну углерод-углеродную двойную связь, имеющий от 2 до 20 атомов углерода. Термин "С2-50 алкенил" сам по себе или в комбинации означает неразветвленный или разветвленный углеводородный остаток, содержащий по меньшей мере одну углерод-углеродную двойную связь, имеющий от 2 до 50 атомов углерода. Если присутствует в конце молекулы, примерами являются СН=СН2, -СН=СН-СН3, -СН2-СН=СН2, СН=СНСН2-СН3 и СН=СН-СН=СН2. Когда две составляющие молекулы связаны алкенильной группой, тогда примером является, например, -СН=СН-. Каждый атом водорода С2-20 алкенильной или C2-50 алкенильной группы может быть замещен заместителем, как указано далее. Необязательно, одна или более тройных связей могут встречаться.
Как применяется в настоящей заявке, термин "С2-6 алкинил" сам по себе или в комбинации означает неразветвленный или разветвленный углеводородный остаток, содержащий по меньшей мере одну углерод-углеродную тройную связь, имеющий от 2 до 6 атомов углерода. Если присутствует в конце молекулы, примерами являются -С≡СН, -СН2-С≡СН, СН2СН2-С≡СН и СН2-С≡С-СН3. Когда две составляющие молекулы связаны алкинильной группой, тогда примером является: -С≡С-. Каждый атом водорода С2-6 алкинильной группы может быть замещен заместителем, как указано далее. Необязательно, одна или более двойных связей могут встречаться.
Соответственно,, как применяется в настоящей заявке,, термин "С2-20 алкинил" сам по себе или в комбинации означает неразветвленный или разветвленный углеводородный остаток, содержащий по меньшей мере одну углерод-углеродную тройную связь, имеющий от 2 до 20 атомов углерода, и "С2-50 алкинила" сам по себе или в комбинации означает неразветвленный или разветвленный углеводородный остаток, содержащий по меньшей мере одну углерод-углеродную тройную связь, имеющий от 2 до 50 атомов углерода. Если присутствует в конце молекулы, примерами являются -С≡СН, СН2-С≡СН, СН2-СН2-С≡СН и СН2-С≡С-СН3. Когда две составляющие молекулы связаны алкинильной группой, тогда примером является, -С≡С-. Каждый атом водорода С2-20 алкинильной или С2-50 алкинильной группы может быть замещен заместителем, как указано далее. Необязательно, одна или более двойных связей могут встречаться.
Как применяется в настоящей заявке, термины "С3-8 циклоалкил" или "С3-8 циклоалкильное кольцо" означает циклическую алкильную цепь, имеющую от 3 до 8 атомов углерода, которая может быть насыщенной или ненасыщенной, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, циклогептил, циклооктил. Каждый атом водорода циклоалкила может быть замещен заместителем, как указано далее. Термин "С3-8 циклоалкил" или "С3-8 циклоалкильное кольцо" также включает мостиковые бициклы подобные норборану или норбонену. Соответственно, "С3-5 циклоалкил" означает циклоалкил, имеющий от 3 до 5 атомов углерода, и "С3-10 циклоалкил" означает циклоалкил, имеющую от 3 до 10 атомов углерода.
Соответственно, как применяется в настоящей заявке, термин "С3-10 циклоалкил" означает карбоциклическую кольцевую систему, имеющую от 3 до 10 атомов углерода, которая может быть насыщенной или ненасыщенной, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, циклогептил, циклооктил, циклононил, циклодецил. Термин "С3-10 циклоалкил" также включает по меньшей мере частично насыщенные карбомоно- и -бициклы.
Как применяется в настоящей заявке, термин "галоген" означает фтор, хлор, бром или иод. Особенно предпочтительным является фтор или хлор.
Как применяется в настоящей заявке, термин "4-7-членный гетероциклил" или "4-7-членный гетероцикл" означает цикл, имеющий 4, 5, 6 или 7 атомов в цикле, который может содержать до максимального числа двойных связей (ароматическое или неароматическое кольцо, полностью, частично или ненасыщенное), где от по меньшей мере одного атома в цикле до 4 атомов в цикле заменены на гетероатом, выбранный из группы, состоящей из серы (включая -S(O)-, -S(O)2-), кислорода и азота (включая =N(O)-), и где цикл связан с остальной частью молекулы через атом углерода или азота. Примерами 4-7-членных гетероциклов являются азетидин, оксетан, тиетан, фуран, тиофен, пиррол, пирролин, имидазол, имидазолин, пиразол, пиразолин, оксазол, оксазолин, изоксазол, изоксазолин, тиазол, тиазолин, изотиазол, изотиазолин, тиадиазол, тиадиазолин, тетрагидрофуран, тетрагидротиофен, пирролидин, имидазолидин, пиразолидин, оксазолидин, изоксазолидин, тиазолидин, изотиазолидин, тиадиазолидин, сульфолан, пиран, дигидропиран, тетрагидропиран, имидазолидин, пиридин, пиридазин, пиразин, пиримидин, пиперазин, пиперидин, морфолин, тетразол, тризол, тризолидин, тетразолидин, диазепан, азепин или гомопиперазин. Каждый атом водорода 4-7-членного гетероциклила или 4-7-членной гетероциклической группы может быть замещен заместителем, как указано далее.
Как применяется в настоящей заявке, термин "8-11-членный гетеробициклил" или "8-11-членный гетеробицикл" означает гетероциклическую систему из двух циклов, содержащую от 8 до 11 атомов в цикле, в которой по меньшей мере один атом в цикле является общим для обоих циклов, и которая может содержать до максимального числа двойных связей (ароматическое или неароматическое кольцо, полностью, частично или ненасыщенное) где от по меньшей мере одного атома в цикле до 6 атомов в цикле заменены на гетероатом, выбранный из группы, состоящей из серы (включая -S(O)-, -S(O)2-), кислорода и азота (включая =N(O)-), и где цикл связан с остальной частью молекулы через атом углерода или азота. Примерами 8-11-членных гетеробициклов являются индол, индолин, бензофуран, бензотиофен, бензоксазол, бензизоксазол, бензотиазол, бензизотиазол, бензимидазол, бензимидазолин, хинолин, хиназолин, дигидрохиназолин, хинолин, дигидрохинолин, тетрагидрохинолин, декагидрохинолин, изохинолин, декагидроизохинолин, тетрагидроизохинолин, дигидроизохинолин, бензазепин, пурин или птеридин. Термин 8-11-членный гетеробицикл также включает спиро-структуры из двух циклов, такие как 1,4-диокса-8-азаспиро[4.5]декан или мостиковые гетероциклы, такие как 8-аза-бицикло[3.2.1]октан. Каждый атом водорода 8-11-членного гетеробициклила или 8-11-членного гетеробицикла может быть замещен заместителем, как указано далее.
Термин "замещенный" означает, что один или более -Н атомов молекулы или составляющей замещены другим атомом или группой атомов, которые обозначаются как "заместители". Подходящие заместители выбираются из группы, состоящей из галогена; CN; COOR9; OR9; C(O)R9; C(O)N(R9R9a); S(O)2N(R9R9a); S(O)N(R9R9a); S(O)2R9; S(O)R9; N(R9)S(O)2N(R9aR9b); SR9; N(R9R9a); NO2; OC(O)R9; N(R9)C(O)R9a; N(R9)S(O)2R9a; N(R9)S(O)R9a; N(R9)C(O)OR9a; N(R9)C(O)N(R9aR9b); OC(O)N(R9R9a); T; C1-50 алкила; C2-50 алкенила; или C2-50 алкинила, где T; С1-50 алкил; C2-50 алкенил; и C2-50 алкинил необязательно замещены одной или более группами R10, которые являются одинаковыми или различными, и где С1-50 алкил; С2-50 алкенил; и C2-50 алкинил необязательно прерываются одной или более группами, выбранными из группы, состоящей из Т, -С(O)O-; -О-; -С(О)-; -C(O)N(R11)-; -S(O)2N(R11)-; -S(O)N(R11)-; -S(O)2-; -S(O)-; -N(R11)S(O)2N(R11a)-; -S-; -N(R11)-; -OC(O)R11; -N(R11)C(O)-; -N(R11)S(O)2-; -N(R11)S(O)-; -N(R11)C(O)O-; -N(R11)C(O)N(R11a)-; и -OC(O)N(R11Rlla);
где
R9, R9a, R9b независимо выбираются из группы, состоящей из Н; Т; и С1-50 алкила; С2-50 алкенила; или C2-50 алкинила, где Т; С1-50 алкил; С2-50 алкенил; и С2-50 алкинил необязательно замещены одной или более группами R10, которые являются одинаковыми или различными, и где С1-50 алкил; C2-50 алкенил; и C2-50 алкинил необязательно прерываются одной или более группами, выбранными из группы, состоящей из Т, -С(O)O-; -О-; -C(O)-; -C(O)N(R11)-; S(O)2N(R11)-; -S(O)N(R11)-; -S(O)2-; -S(O)-; N(R11)S(O)2N(R11a)-; -S-; -N(R11)-; -OC(O)R11; -N(R11)C(O)-; -N(R11)S(O)2-; -N(R11)S(O)-; -N(R11)C(O)O-; N(R11)C(O)N(R11a)-; и -OC(O)N(R11R11a);
Т выбирается из группы, состоящей из фенила; нафтила; инденила; инданила; тетралинила; С3-10 циклоалкила; 4-7 членного гетероциклила; или 8-11-членного гетеробициклила, где Т необязательно замещен одной или более группами R10, которые являются одинаковыми или различными;
R10 представляет собой галоген; CN; оксо (=O); COOR12; OR12; C(O)R12; C(O)N(R12R12a); S(O)2N(R12R12a); S(O)N(R12R12a); S(O)2R12; S(O)R12; N(R12)S(O)2N(R12aR12b); SR12; N(R12R12a); NO2; OC(O)R12; N(R12)C(O)R12a; N(R12)S(O)2R12a; N(R12)S(O)R12a; N(R12)C(O)OR12a; N(R12)C(O)N(R12aR12b); OC(O)N(R12R12a); или C1-6 алкил, где C1-6 алкил необязательно замещен одной или более группами галогена, которые являются одинаковыми или различными;
R11, Rlla, R12, R12a, R12b независимо выбираются из группы, состоящей из Н; или С1-6 алкила, где С1-6 алкил необязательно замещен одной или более группами галогена, которые являются одинаковыми или различными.
В одном варианте выполнения настоящего изобретения R9, R9a, R9b могут независимо друг от друга представлять собой Н.
В одном варианте выполнения настоящего изобретения R10 представляет собой С1-6 алкил.
В одном варианте выполнения настоящего изобретения Т представляет собой фенил.
Предпочтительно, максимум 6 -Н атомов молекулы независимо замещены заместителем, например, 5 -Н атомов независимо замещены заместителем, 4 -Н атомов независимо замещены заместителем, 3 -Н атомов независимо замещены заместителем, 2 -Н атомов независимо замещены заместителем, или 1 -Н атом замещен заместителем.
Как применяется в настоящей заявке, термин "прерывается" означает, что между двумя атомами углерода или в конце углеродной цепи между соответствующим атомом углерода и атомом водорода вставлен один или более атомов.
Как применяется в настоящей заявке, термин "пролекарство" означает соединение, которое подвергается биотрансформации перед проявлением его фармакологических эффектов. Пролекарства могут, таким образом, рассматриваться как биологически активные составляющие, связанные с специализированными нетоксичными защитными группами, применяемыми временным образом, для изменения или уменьшения нежелательных свойств в родоначальной молекуле. К этому также относится усиление желательных свойств лекарственного средства и подавление нежелательных свойств.
Как применяется в настоящей заявке, термин "пролекарство, связанное с носителем" означает пролекарство, которое содержит временную связь биологически активной составляющей с временной группой носителя, которая обеспечивает улучшенные физио-химические или фармакокинитические свойства, и которая может быть легко удалена in vivo, как правило, путем гидролитического расщепления.
Как применяется в настоящей заявке, термин "составляющая обратимого линкера пролекарства" означает составляющую, которая на одном ее конце присоединена к биологически активной составляющей D через обратимую связь, и на другом ее конце присоединена через перманентную связь, которая согласно настоящему изобретению образуется путем реакции аминной функциональной группы составляющей основной цепи или Ax2 с Ay1, таким образом, связывая биологически активную составляющую с носителем-гидрогелем в пролекарстве, связанном с носителе, согласно настоящему изобретению. "Обратимая связь" представляет собой связь, которая является неферментативно гидролитически расщепляемой, т.е. расщепляемой, при физиологических условиях (водный буфер при рН 7.4, 37°C) с периодом полураспада в интервале от одного часа до двенадцати месяцев.
Напротив, "перманентная связь" является неферментативно гидролитически расщепляемой при физиологических условиях (водный буфер при рН 7.4, 37°C) с периодом полураспада боле двенадцати месяцев.
"Биорасщепляемая связь" представляет собой связь, которая является ферментативно и/или неферментативно гидролитически расщепляемой, т.е. расщепляемой, при физиологических условиях (водный буфер при рН 7.4, 37°C) с периодом полураспада в интервале от одного часа до двенадцати месяцев. Предпочтительно биорасщепляемая связь является неферментативно гидролитически расщепляемой при физиологических условиях.
Как применяется в настоящей заявке, термин "бесследный линкер пролекарства" означает обратимый линкер пролекарства, который при расщепление, высвобождает лекарственное средство в его свободной форме. Как применяется в настоящей заявке, термин "свободная форма" лекарственного средства означает лекарственное средство в его немодифицированной фармакологически активной форме.
Как применяется в настоящей заявке, термин "пептид" означает короткий полимер аминокислотных мономеров, связанных пептидными связями. Термин "полипептид" означает пептид, содержащий до и включающий 50 аминокислотных мономеров. Термин "белок" означает пептид из более чем 50 аминокислотных мономеров.
Как применяется в настоящей заявке, термин "олигонуклеотид" означает короткий полимер из нуклеиновых кислот из до 100 оснований.
Как применяется в настоящей заявке, термин "фармацевтическая композиция" означает один или более активных ингредиентов, и один или более инертных ингредиентов, а также любой продукт, который образуется из, непосредственно или косвенно, комбинации, комплексообразования или агрегации любых двух или более ингредиентов или из диссоциации одного или более ингредиентов или из других типов реакций или взаимодействий одного или более ингредиентов. Соответственно, фармацевтические композиции согласно настоящему изобретению охватывают любую композицию, полученную путем смешивания пролекарства, связанного с носителем, согласно настоящему изобретению и одного или более фармацевтически приемлемых эксципиентов.
Как применяется в настоящей заявке, термин "эксципиент" относится к разбавителю, вспомогательному средству или носителю, совместно с которым вводится терапевтическое средство. Такой фармацевтический наполнитель может представлять собой стерильную жидкость, такую как вода и масла, включая жидкости нефтяного, животного, растительного или синтетического происхождения, включая (но не ограничиваясь только ими) арахисовое масло, соевое масло, минеральное масло, сезамовое масло и т.п.. Вода является предпочтительным наполнителем, когда фармацевтическая композиция вводится перорально. Раствор поваренной соли и раствор декстрозы являются предпочтительными наполнителями, когда фармацевтическая композиция вводится внутривенно. Растворы соли и водные растворы декстрозы и глицерина предпочтительно применяются в качестве жидких наполнителей для инъецируемых растворов. Подходящие фармацевтические наполнители включают крахмал, глюкозу, лактозу, сахарозу, маннит, трегалозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, глицерин моностеарат, тальк, хлорид натрия, сухое молоко, глицерин, пропиленгликоль, воду, этанол и т.п.. Композиция при желании может содержать также небольшие количества увлажняющих или эмульгирующих средств, рН-буферных средств, таких как, например, ацетат, сукцинат, трис, карбонат, фосфат, HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфокислота), MES (2-(N-морфолин)этансульфокислота) или может содержать детергенты, такие как Tween, полоксамеры, полоксамины, CHAPS, Igepal, или аминокислоты, такие как, например, глицин, лизин или гистидин. Такие композиции могут иметь вид растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, препаратов с замедленным высвобождением и т.п. Композиция может иметь вид суппозитория, с традиционными связующими средствами и наполнителями, такими как триглицериды. Препарат для перорального введения может содержать стандартные наполнители, такие как фармацевтические категории маннита, лактозы, крахмала, стеарата магния, сахарина натрия, целлюлоза, карбонат магния и т.д. Примеры подходящих фармацевтических наполнителей описаны в "Reминутgton's Pharmaceutical Sciences" by E.W. Martin. Такие композиции содержат терапевтически эффективное количество терапевтического средства (лекарство или действующее вещество), предпочтительно в очищенной форме, вместе с подходящим количеством наполнителя, так чтобы получилась готовая форма для введения пациенту. Готовая форма должна соответствовать способу введения.
В общем, термин "содержит" или "содержащий" также охватывает "состоит из" или "состоящий из".
Некоторые реагенты основной цепи и поперечно-сшивающие реагенты, которые могут применяться в качестве исходного вещества на стадии (а) способа являются коммерчески доступными. Кроме того, реагенты основной цепи и поперечно-поперечно-сшивающие реагенты могут быть получены согласно способу, описанному в части «Примеры». Способ синтеза подходящего реагента основной цепи описывается в Примере 1 в WO 2011/012715 А1, которая включена в настоящую заявку в полном объеме. В Примере 2 в WO 2011/012715 А1 далее раскрываются способы синтеза поперечно-сшивающих реагентов с низкомолекулярной массой, которые могут модифицироваться с применением стандартных знаний в области химии, с получением поперечно-сшивающих реагентов, подходящих для настоящего изобретения. На основе этих способов специалист в данной области техники может применить стандартные знания в области химии для получения реагентов основной цепи и поперечно-сшивающих реагентов, применяемых в настоящем изобретении.
Смесь со стадии (а) содержит первый растворитель и по меньшей мере второй растворитель. Указанный первый растворитель предпочтительно выбирается из группы, состоящей из дихлорметана, хлороформа, тетрагидрофурана, этилацетата, диметилформамида, ацетонитрила, диметилсульфоксида, пропиленкарбоната, N-метилпирролидона, метанола, этанола, изопропанола и воды и их смесей.
По меньшей мере один реагент основной цепи и по меньшей мере один поперечно-сшивающий реагент растворяются в первом растворителе, т.е. дисперной фазе полимеризационной суспензии. В одном варианте выполнения настоящего изобретения реагент основной цепи и поперечно-сшивающий реагент растворяются по отдельности, т.е. в различных контейнерах, с применением либо одинаковых, либо различных растворителей, и предпочтительно с применением одного и того же растворителя для обоих реагентов. В другом варианте выполнения настоящего изобретения, реагент основной цепи и поперечно-сшивающий реагент растворяются вместе, т.е. в одном контейнере с применением одного и того же растворителя.
Подходящим растворителем для реагента основной цепи является органический растворитель. Предпочтительно, растворитель выбирается из группы, состоящей из дихлорметана, хлороформа, тетрагидрофурана, этилацетата, диметилформамида, ацетонитрила, диметилсульфоксида, пропиленкарбоната, N-метилпирролидона, метанола, этанола, изопропанола и воды и их смесей. Более предпочтительно, реагент основной цепи растворяется в растворителе, выбранном из группы, состоящей из ацетонитрила, диметилсульфоксида, метанола или их смесей. Наиболее предпочтительно, реагент основной цепи растворяется в диметилсульфоксиде.
В одном варианте выполнения настоящего изобретения реагент основной цепи растворяется в растворителе при концентрации в интервале от 1 до 300 мг/мл, более предпочтительно от 5 до 60 мг/мл и наиболее предпочтительно от 10 до 40 мг/мл.
Подходящим растворителем для поперечно-сшивающего реагента является органический растворитель. Предпочтительно, растворитель выбирается из группы, состоящей из дихлорметана, хлороформа, тетрагидрофурана, этилацетата, диметилформамида, ацетонитрила, диметилсульфоксида, пропиленкарбоната, N-метилпирролидона, метанола, этанола, изопропанола, воды или их смесей. Более предпочтительно, поперечно-сшивающий реагент растворяется в растворителе, выбранном из группы, состоящей из диметилформамида, ацетонитрила, диметилсульфоксида, метанола или их смесей. Наиболее предпочтительно, поперечно-сшивающий реагент растворяется в диметилсульфоксиде.
В одном варианте выполнения настоящего изобретения поперечно-сшивающий реагент растворяется в растворителе при концентрации в интервале от 5 до 500 мг/мл, более предпочтительно от 25 до 300 мг/мл и наиболее предпочтительно от 50 до 200 мг/мл.
По меньшей мере один реагент основной цепи и по меньшей мере один поперечно-сшивающий реагент смешиваются в массовом отношении в интервале от 1:99 до 99:1, например, в отношении в интервале от 2:98 до 90:10, в массовом отношении в интервале от 3:97 до 88:12, в массовом отношении в интервале от 3:96 до 85:15, в массовом отношении в интервале от 2:98 до 90:10 и в массовом отношении в интервале от 5:95 до 80:20; особенно предпочтительно в массовом отношении от 5:95 до 80:20, где первое число относится к реагенту основной цепи и второе число относится поперечно-сшивающему реагенту.
Предпочтительно, отношения выбираются таким образом, что смесь со стадии (а) содержит мольный избыток аминных групп из реагента основной цепи по сравнению с активированными функциональными концевыми группами сшивающего реагента. Соответственно, гидрогель, полученный способом согласно настоящему изобретению, имеет свободные аминные группы, которые могут применяться для связывания других составляющих с гидрогелем, такие как спейсеры, аффинные лиганды, хелаторы и/или составляющие обратимых линкеров пролекарства.
По меньшей мере один второй растворитель, т.е. непрерывная фаза полимеризационной суспензии, представляет собой предпочтительно органический растворитель, более предпочтительно органический растворитель, выбранный из группы, состоящей из линейных, разветвленных или циклических С5-30 алканов; линейных, разветвленных или циклических С5-30 алкенов; линейных, разветвленных или циклических С5-30 алкинов; линейных или циклических поли(диметилсилокеанов); ароматических С6-20 углеводородов; и их смесей. Даже более предпочтительно, по меньшей мере второй растворитель выбирается из группы, состоящей из линейных, разветвленных или циклических С5-16 алкенов; толуола; ксилола; мезитилена; гексаметилдисилоксана; или их смесей. Наиболее предпочтительно, по меньшей мере второй растворитель выбирается из группы, состоящей из линейных С7-11 алканов, таких как гептан, октан, нонан, декан и ундецен.
Предпочтительно, смесь со стадии (а) дополнительно содержит детергент. Предпочтительными детергентами являются Cithrol DPHS, Hypermer 70А, Hypermer В246, Hypermer 1599A, Hypermer 2296 или Hypermer 1083. Наиболее предпочтительным является Cithrol DPHS.
Предпочтительно, детергент имеет концентрацию от 0.1 г до 100 г на 1 л всей смеси, т.е. дисперсной фазы и непрерывной фазы вместе. Более предпочтительно, детергент имеет концентрацию от 0.5 г до 10 г на 1 л всей смеси, и наиболее предпочтительно, детергент имеет концентрацию от 0.5 г до 5 г на 1 л всей смеси.
Предпочтительно, смесь со стадии (а) представляет собой эмульсию.
Полимеризация на стадии (b) инициируется путем добавления основания. Предпочтительно, основание представляет собой ненуклеофильное основание, растворимое в алканах, более предпочтительно основание выбирается из N,N,N'N'-тетраметилэтилендиамина (TMEDA), 1,4-диметилпиперазина, 4-метилморфолина, 4-этилморфолина, 1,4-диазабицикло[2.2.2]октана, 1,1,4,7,10,10-гексаметилтриэтилентетрамина, 1,4,7-триметил-1,4,7-триазациклононана, трис[2-(диметиламино)этил]амина, триэтиламина, диизопропилэтиламина (DIPEA), триметиламина, N,N-диметилэтиламина, N,N,N',N'-тетраметил-1,6-гександиамина, N,N,N',Nʺ,Nʺ-пентаметилдиэтилентриамина, 1,8-диазабицикло[5.4.0]ундец-7-ена, 1,5-диазабицикло[4.3.0]нон-5-ена, и гексаметилентетрамина. Даже более предпочтительно, основание выбирается из TMEDA, 1,4-диметилпиперазина, 4-метилморфолина, 4-этилморфолина, 1,4-диазабицикло[2.2.2]октана, 1,1,4,7,10,10-гексаметилтриэтилентетрамина, 1,4,7-триметил-1,4,7-триазациклононана, трис[2-(диметиламино)этил]амина, 1,8-диазабицикло[5.4.0]ундец-7-ена, 1,5-диазабицикло[4.3.0]нон-5-ена, и гексаметилентетрамина. Наиболее предпочтительно, основанием является TMEDA.
Основание добавляется к смеси со стадии (а) в количестве 1-500 эквивалентов на активированную функциональную концевую группу в смеси, предпочтительно в количестве 5-50 эквивалентов, более предпочтительно в количестве 5-25 эквивалентов и наиболее предпочтительно в количестве 10 эквивалентов.
На стадии (b) способа, полимеризация гидрогеля согласно настоящему изобретению представляет собой реакцию конденсации, которая предпочтительно осуществляется в условиях перемешивания смеси со стадии (а). Предпочтительно, окружная скорость (окружная скорость = π × скорость вращения мешалки × диаметр мешалки) находится в интервале от 0.2 до 10 метров в секунду (м/с), более предпочтительно от 0.5 до 4 м/с и наиболее предпочтительно от 1 до 2 м/с.
В предпочтительном варианте выполнения стадии (b), реакция полимеризации осуществляется в цилиндрическом сосуде, оборудованном перегородками. Отношение диаметра к высоте сосуда может находиться в интервале от 4:1 до 1:2, более предпочтительно отношение диаметра к высоте сосуда находится в интервале от 2:1 до 1:1.
Предпочтительно, реакционный сосуд оборудован мешалкой с осевым потоком, выбранной из группы, состоящей из мешалки с наклонными лопастями, пропеллерной мешалки типа гребного винта или Lightnin А-310. Более предпочтительно, мешалка представляет собой мешалку с наклонными лопастями.
Стадия (b) может осуществляться при широком диапазоне температур, предпочтительно при температуре 10°C до 100°C, более предпочтительно при температуре от 0°C до 80°C, даже более предпочтительно при температуре от 10°C до 50°C и наиболее предпочтительно при температуре окружающей среды. "Температура окружающей среды" относится к стандартной температуре в лаборатории и предпочтительно означает температуру в интервале от 17 до 25°C.
Предпочтительно, гидрогель, полученный в результате полимеризации, представляет собой формованное изделие, такое как покрытие, ячейка, стент, наночастица или микрочастица. Более предпочтительно, гидрогель находится в форме шариков микрочастиц, имеющих диаметр от 1 до 500 микрометров, более предпочтительно с диаметром от 10 до 300 микрометров, даже более предпочтительно с диаметром от 20 до 150 микрометров и наиболее предпочтительно с диаметром от 30 до 130 микрометров. Вышеуказанные диаметры измеряются, когда микрочастицы гидрогель полностью гидратированы в воде.
В одном варианте выполнения настоящего изобретения, способ получения гидрогеля настоящего изобретения далее содержит стадию:
(с) обработки гидрогеля.
Стадия (с) содержит одну или более следующих стадий:
(c1) удаление избытка жидкости из реакции полимеризации,
(с2) промывка гидрогеля для удаления растворителей, применяемых в ходе полимеризации,
(с3) перенос гидрогеля в буферный раствор,
(с4) фракционирование/просеивание по размеру гидрогеля,
(с5) перенос гидрогеля в контейнер,
(с6) сушка гидрогеля,
(с7) перенос гидрогеля в конкретный растворитель, подходящий для стерилизации, и
(с8) стерилизация гидрогеля, предпочтительно путем гамма-облучения
Предпочтительно, стадия (с) содержит все следующие стадии
(c1) удаление избытка жидкости из реакции полимеризации,
(с2) промывка гидрогеля для удаления растворителей, применяемых в ходе полимеризации,
(с3) перенос гидрогеля в буферный раствор,
(с4) фракционирование/просеивание по размеру гидрогеля,
(с5) перенос гидрогеля в контейнер,
(с7) перенос гидрогеля в конкретный растворитель, подходящий для стерилизации, и
(с8) стерилизация гидрогеля, предпочтительно путем гамма-облучения.
Реагент основной цепи
По меньшей мере один реагент основной цепи имеет молекулярную массу в интервале от 1 до 100 кДа, предпочтительно от 2 до 50 кДа, более предпочтительно от 5 до 30 кДа, даже более предпочтительно от 5 до 25 кДа и наиболее предпочтительно от 5 до 15 кДа.
Предпочтительно, реагент основной цепи является основанным на ПЭГ, содержащим по меньшей мере 10% ПЭГ, более предпочтительно содержащим по меньшей мере 20% ПЭГ, даже более предпочтительно содержащим по меньшей мере 30% ПЭГ и наиболее предпочтительно содержащим по меньшей мере 40% ПЭГ.
В одном варианте выполнения настоящего изобретения реагент основной цепи присутствует в форме его кислотной соли, предпочтительно в форме кислотно-аддитивной соли. Подходящие кислотно-аддитивные соли образуются из кислот, которые образуют нетоксичные соли. Примеры включают, но без ограничения к этому, ацетат, аспартат, бензоат, бензилат, бикарбонат, карбонат, бисульфат, сульфат, борат, камсилат, цитрат, эдисилат, эсилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид, гидробромид, гидроиодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат, гидрофосфат, дигидрофосфат, сахарат, стеарат, сукцинат, тартрат и тозилат. Особенно предпочтительно реагент основной цепи присутствует в форме его гидрохлоридной соли.
В одном варианте выполнения настоящего изобретения, по меньшей мере один реагент основной цепи выбирается из группы, состоящей из
соединения формулы (I)
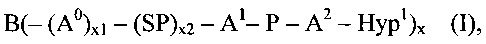
где
B представляет собой разветвляющееся ядро,
SP представляет собой спейсерную составляющую, выбранную из группы, состоящей из C1-6 алкила, С2-6 алкенила и С2-6 алкинила,
P представляет собой полимерную цепь, основанную на ПЭГ, содержащую по меньшей мере 80% ПЭГ, предпочтительно по меньшей мере 85% ПЭГ, более предпочтительно по меньшей мере 90% ПЭГ и наиболее предпочтительно по меньшей мере 95% ПЭГ,
Hyp1 представляет собой составляющую, содержащую амин (-NH2 и/или -NH-) или полиамин, содержащий по меньшей мере два амина (-NH2 и/или -NH-),
x равно целому числу от 3 до 16,
x1, x2 независимо друг от друга равны 0 или 1, при условии что x1 равно 0, если х2 равно 0,
А0, А1, А2 независимо друг от друга выбираются из группы, состоящей из
 и
и 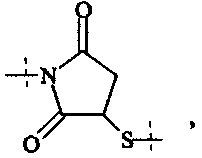
где R1 и Rla независимо друг от друга выбираются из Н и C1-6 алкила;
соединения формулы (II)
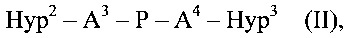
где
P определено выше для соединения формулы (I),
Hyp2, Hyp3 независимо друг от друга представляют собой полиамин, содержащий по меньшей мере два амина (-NH2 и/или -NH-), и
А3 и А4 независимо выбираются из группы, состоящей из
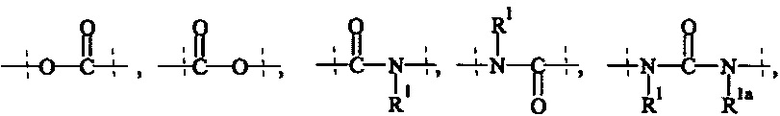
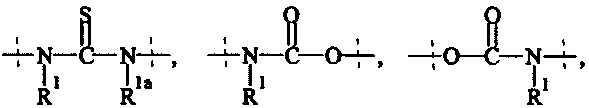
 и
и 
где R1 и Rla независимо друг от друга выбираются из Н и C1-6 алкила;
соединения формулы (III)

где
P1 представляет собой полимерную цепь, основанную на ПЭГ, содержащую по меньшей мере 80% ПЭГ, предпочтительно по меньшей мере 85% ПЭГ, более предпочтительно по меньшей мере 90% ПЭГ и наиболее предпочтительно по меньшей мере 95% ПЭГ,
Hyp4 представляет собой полиамин, содержащий по меньшей мере три амина (-NH2 и/или NH), и
А5 выбирается из группы, состоящей из
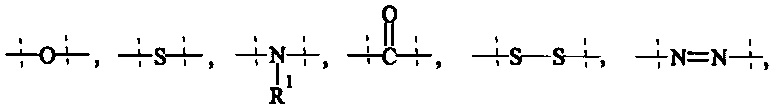
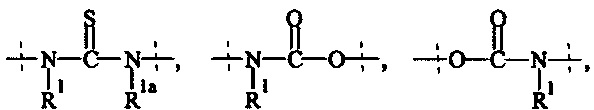
 и
и 
где R1 и Rla независимо друг от друга выбираются из Н и C1-6 алкила;
и
соединения формулы (IV),

где
Hyp5 представляет собой полиамин, содержащий по меньшей мере три амина (-NH2 и/или NH), и
А6 выбирается из группы, состоящей из
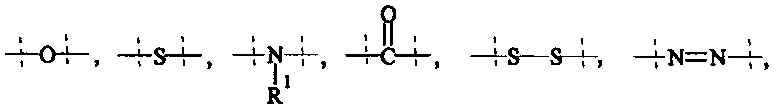
 и
и 
где R1 и Rla независимо друг от друга выбираются из Н и C1-6 алкила; и
Т1 выбирается из группы, состоящей из С1-50 алкила, С2-50 алкенила или С2-50 алкинила, фрагмент которых необязательно прерывается одной или более группами, выбранными из -NH-, -N(C1-4 алкила)-, -О-, -S-, -С(О)-, -C(O)NH-, -C(O)N(C1-4 алкила)-, -О-С(О)-, -S(O)-, -S(O)2-, 4-7-членного гетероциклила, фенила или нафтила.
В следующих частях термин "Hypx" относится к Hyp1, Hyp2, Hyp3, Hyp4 и Hyp5 в общем.
Предпочтительно, реагент основной цепи представляет собой соединение формулы (I), (II) или (III), более предпочтительно реагент основной цепи представляет собой соединение формулы (I) или (III), и наиболее предпочтительно реагент основной цепи представляет собой соединение формулы (I).
В предпочтительном варианте выполнения настоящего изобретения, в соединении формулы (I), х равно 4, 6 или 8. Предпочтительно, в соединении формулы (I) х равно 4 или 8, наиболее предпочтительно, х равно 4.
В предпочтительном варианте выполнения настоящего изобретения в соединениях формулы (I) - (IV), А0, А1, А2, А3, А4, А5 и А6 выбираются из группы, включающей
 и
и 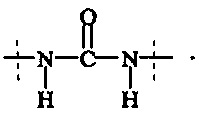
Предпочтительно, в соединении формулы (I), А0 представляет собой
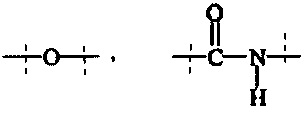 или
или 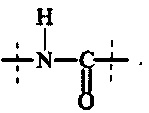
Предпочтительно, в соединении формулы (I), А1 представляет собой
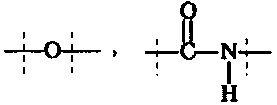 или
или 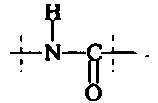
Предпочтительно, в соединении формулы (I), А2 представляет собой
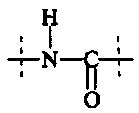 или
или 
Предпочтительно, в соединении формулы (II), А3 представляет собой
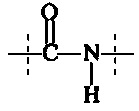 или
или 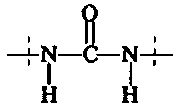
и А4 представляет собой
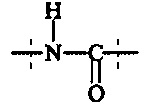 или
или 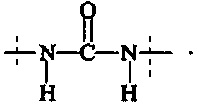
Предпочтительно, в соединении формулы (III), А5 представляет собой
 или
или 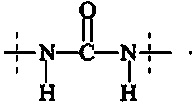
Предпочтительно, в соединении формулы (IV), А6 представляет собой
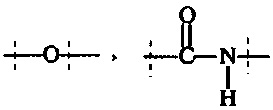 или
или 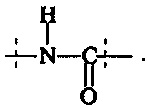
Предпочтительно, в соединении формулы (IV), Т1 выбирается из Н и C1-6 алкила.
В одном варианте выполнения настоящего изобретения, в соединении формулы (I), разветвляющееся ядро В выбирается из следующих структур:
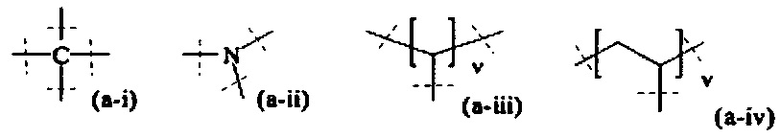
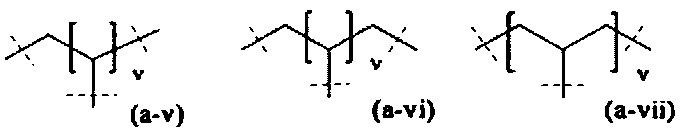
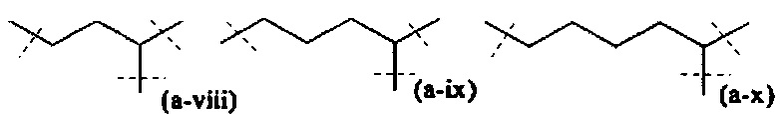

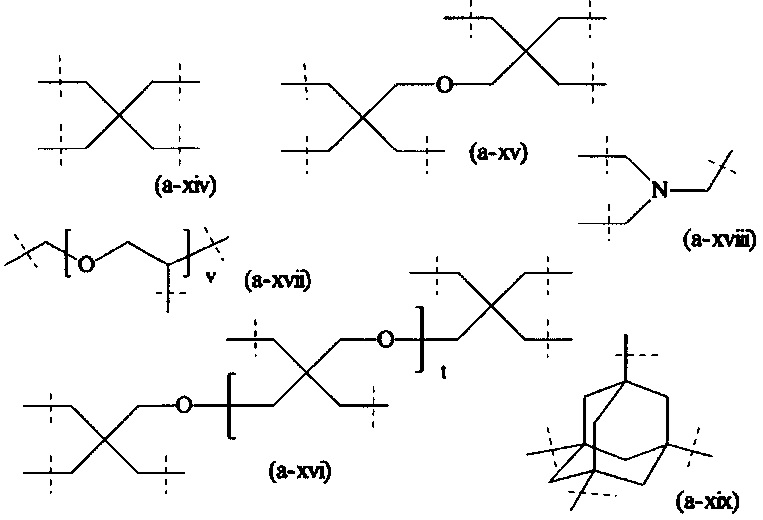
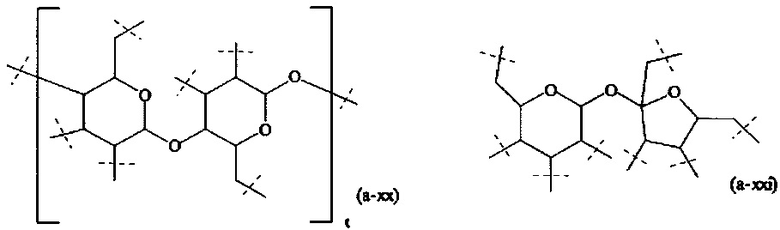
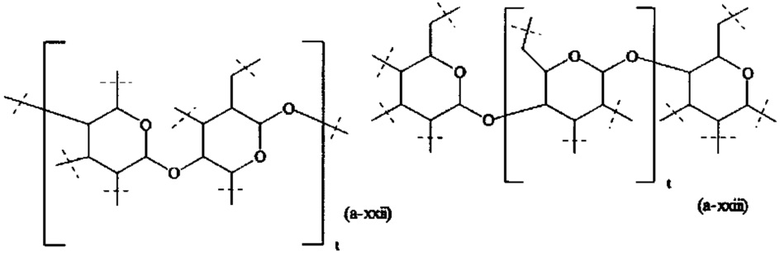
где
пунктирные линии означают присоединение к А0 или, если x1 и х2 оба равны 0, к А1,
t равно 1 или 2; предпочтительно t равно 1,
v равно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14; предпочтительно, v равно 2, 3, 4, 5, 6; более предпочтительно, v равно 2, 4 или 6; наиболее предпочтительно, v равно 2.
В предпочтительном варианте выполнения настоящего изобретения, В имеет структуру формулы (a-i), (a-ii), (a-iii), (a-iv), (a-v), (a-vi), (a-vii), (a-viii), (a-ix), (a-x), (a-xiv), (a-xv) или (a-xvi). Более предпочтительно, В имеет структуру формулы (а-iii), (a-iv), (a-v), (a-vi), (a-vii), (a-viii), (a-ix), (a-x) или (a-iv). Наиболее предпочтительно, В имеет структуру формулы (a-xiv).
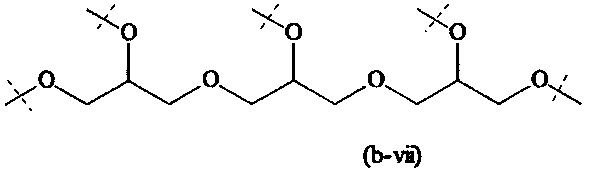
Предпочтительный вариант выполнения настоящего изобретения представляет собой комбинацию В и А0, или, если x1 и х2 оба равны 0, предпочтительный комбинацию В и A1, которая выбирается из следующих структур:
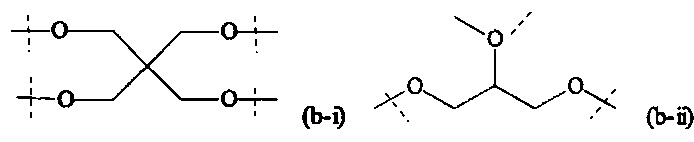

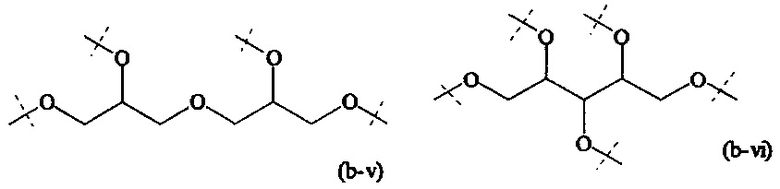
где
пунктирные линии означают присоединение к SP или, если x1 и х2 оба равны 0, к Р.
Более предпочтительно, комбинация В и А0 или, если x1 и х2 оба равны 0, комбинация В и А1, имеет структуру формулы (b-i), (b-iv), (b-vi) или (b-viii) и наиболее предпочтительно имеет структуру формулы (b-i).
В одном варианте выполнения настоящего изобретения, x1 и х2 в формуле (I) равны 0.
В одном варианте выполнения настоящего изобретения, полимерная цепь Р, основанная на ПЭГ, имеет молекулярную массу от 0.3 кДа до 40 кДа; например, от 0.4 до 35 кДа, от 0.6 до 38 кДа, от 0.8 до 30 кДа, от 1 до 25 кДа, от 1 до 15 кДа или от 1 до 10 кДа. Наиболее предпочтительно Р имеет молекулярную массу от 1 до 10 кДа.
В одном варианте выполнения настоящего изобретения, полимерная цепь Р1, основанная на ПЭГ, имеет молекулярную массу от 0.3 кДа до 40 кДа; например, от 0.4 до 35 кДа, от 0.6 до 38 кДа, от 0.8 до 30 кДа, от 1 до 25 кДа, от 1 до 15 кДа или от 1 до 10 кДа. Наиболее предпочтительно Р1 имеет молекулярную массу от 1 до 10 кДа.
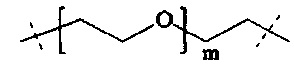
В одном варианте выполнения настоящего изобретения, в соединениях формулы (I) или (II), Р имеет структуру формулы (c-i):
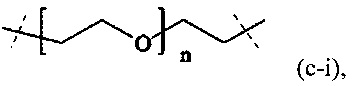
где n находится в интервале от 6 до 900, более предпочтительно n находится в интервале от 20 до 700 и наиболее предпочтительно n находится в интервале от 20 до 250.
В одном варианте выполнения настоящего изобретения, в соединениях формулы (III), Р1 имеет структуру формулы (c-ii):
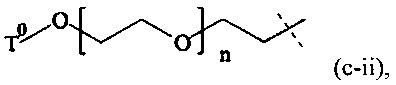
где
n находится в интервале от 6 до 900, более предпочтительно n находится в интервале от 20 до 700 и наиболее предпочтительно n находится в интервале от 20 до 250;
Т0 выбирается из группы, состоящей из C1-6 алкила, С2-6 алкенила и С2-6 алкинила, которые необязательно прерываются одной или более группами, выбранными из -NH-, -N(C1-4 алкила)-, -О-, -S-, -С(О)-, -C(O)NH-, -C(O)N(C1-4 алкила)-, -О-С(О)-, -S(O)- или S(O)2.
В одном варианте выполнения настоящего изобретения, в соединениях формулы (I)-(IV), составляющая Hypx представляет собой полиамин и предпочтительно содержит в связанной форме и, когда применяется, в R- и/или S-конфигурации, составляющую формул (d-i), (d-ii), (d-iii) и/или (d-iv):


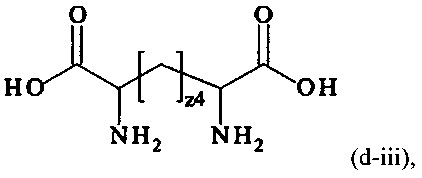
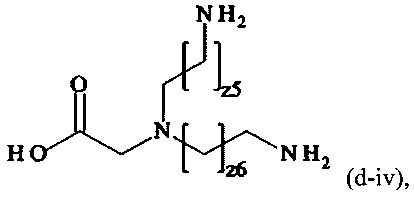
где
z1, z2, z3, z4, z5, z6 независимо друг от друга равны 1, 2, 3, 4, 5, 6, 7 или 8.
Более предпочтительно, Hypx содержит в связанной форме и в R- и/или S-конфигурации лизин, орнитин, диаминопропионовую кислоту и/или диаминомасляную кислоту. Наиболее предпочтительно, Hypx содержит в связанной форме и в R- и/или S-конфигурации лизин.
Hypx имеет молекулярную массу от 40 Да до 30 кДа, предпочтительно от 0.3 кДа до 25 кДа, более предпочтительно от 0.5 кДа до 20 кДа, даже более предпочтительно от 1 кДа до 20 кДа и наиболее предпочтительно от 2 кДа до 15 кДа.
Hypx предпочтительно выбирается из группы, состоящей из
составляющей формулы (e-i)
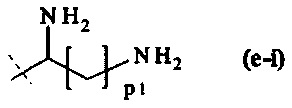
где
p1 равно целому числу от 1 до 5, предпочтительно p1 равно 4, и
пунктирная линия показывает присоединение к А2, если реагент основной цепи имеет структуру формулы (I), и к А3 или А4, если реагент основной цепи имеет структуру формулы (II);
составляющей формулы (e-ii)
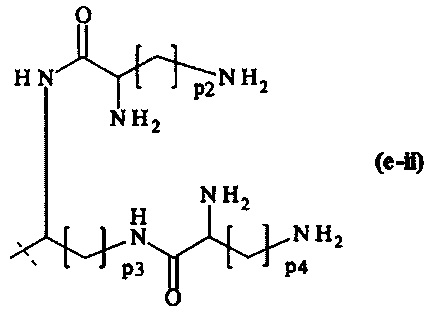
где
р2, р3 и р4 являются одинаковыми или различными и каждый независимо выбирается из целого числа от 1 до 5, предпочтительно р2, р3 и р4 равны 4, и
пунктирная линия показывает присоединение к А2, если реагент основной цепи имеет структуру формулы (I), к А3 или А4, если реагент основной цепи имеет структуру формулы (II), к А5, если реагент основной цепи имеет структуру формулы (III), и к А6, если реагент основной цепи имеет структуру формулы (IV);
составляющей формулы (e-iii)

где
p5-p11 являются одинаковыми или различными и каждый независимо выбирается из целого числа от 1 до 5, предпочтительно р5-p11 равны 4, и
пунктирная линия показывает присоединение к А2, если реагент основной цепи имеет формулу (I), к А3 или А4, если реагент основной цепи имеет формулу (II), к А5, если реагент основной цепи имеет формулу (III), и к А6, если реагент основной цепи имеет формулу (IV);
составляющей формулы (e-iv)
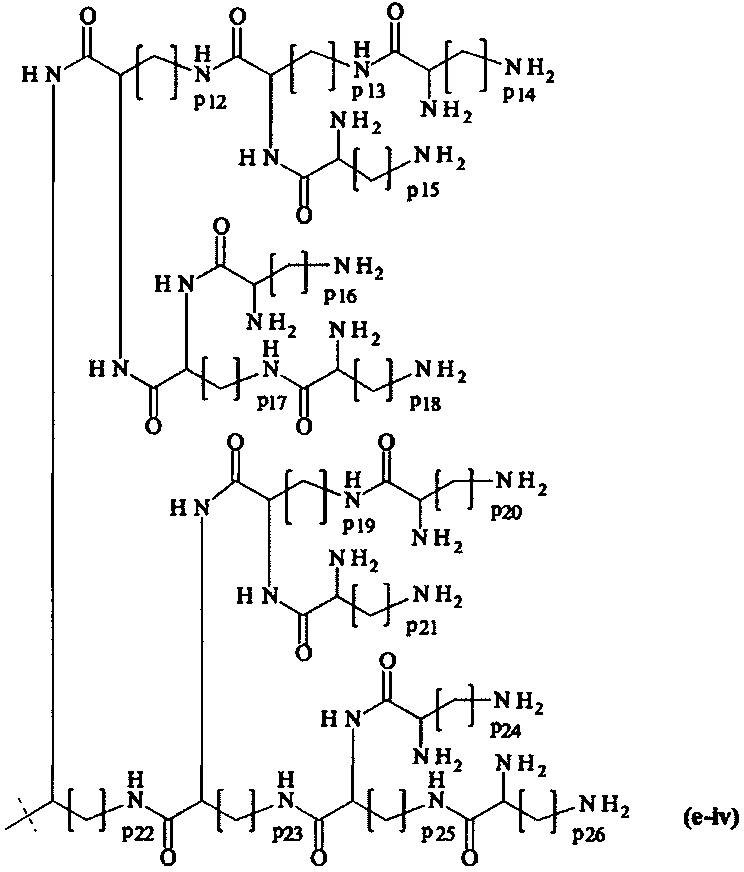
где
р12-р26 являются одинаковыми или различными и каждый независимо выбирается из целого числа от 1 до 5, предпочтительно р12-р26 равны 4, и
пунктирная линия показывает присоединение к А2, если реагент основной цепи имеет структуру формулы (I), к А3 или А4, если реагент основной цепи имеет структуру формулы (II), к А5, если реагент основной цепи имеет структуру формулы (III), и к А6, если реагент основной цепи имеет структуру формулы (IV);
составляющей формулы (e-v)
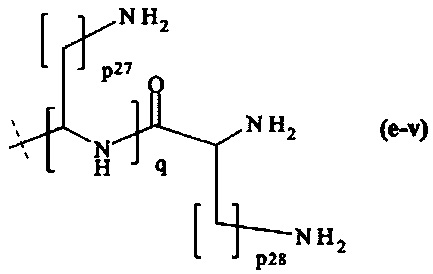
где
р27 и р28 являются одинаковыми или различными и каждый независимо представляет собой целое число от 1 до 5, предпочтительно р27 и р28 равны 4,
q равно целому числу от 1 до 8, предпочтительно q равно 2 или 6, и наиболее предпочтительно q равно 6, и
пунктирная линия показывает присоединение к А2, если реагент основной цепи имеет структуру формулы (I), к А3 или А4, если реагент основной цепи имеет структуру формулы (II), к А5, если реагент основной цепи имеет структуру формулы (III), и к А6, если реагент основной цепи имеет структуру формулы (IV);
составляющей формулы (e-vi)
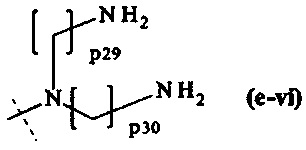
где
р29 и р30 являются одинаковыми или различными и каждый независимо представляет собой целое число от 2 до 5, предпочтительно р29 и р30 равны 3, и
пунктирная линия показывает присоединение к А2, если реагент основной цепи имеет структуру формулы (I), к А3 или А4, если реагент основной цепи имеет структуру формулы (II), к А5, если реагент основной цепи имеет структуру формулы (III), и к А6, если реагент основной цепи имеет структуру формулы (IV);
составляющей формулы (e-vii)
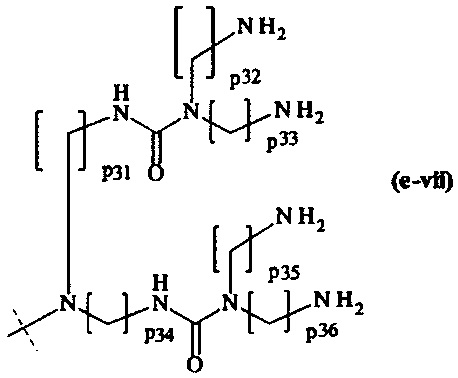
где
р31-р36 являются одинаковыми или различными и каждый независимо выбирается из целого числа от 2 до 5, предпочтительно р31-р36 равны 3, и
пунктирная линия показывает присоединение к А2, если реагент основной цепи имеет структуру формулы (I), к А3 или А4, если реагент основной цепи имеет структуру формулы (II), к А5, если реагент основной цепи имеет структуру формулы (III), и к А6, если реагент основной цепи имеет структуру формулы (IV);
составляющей формулы (e-viii)
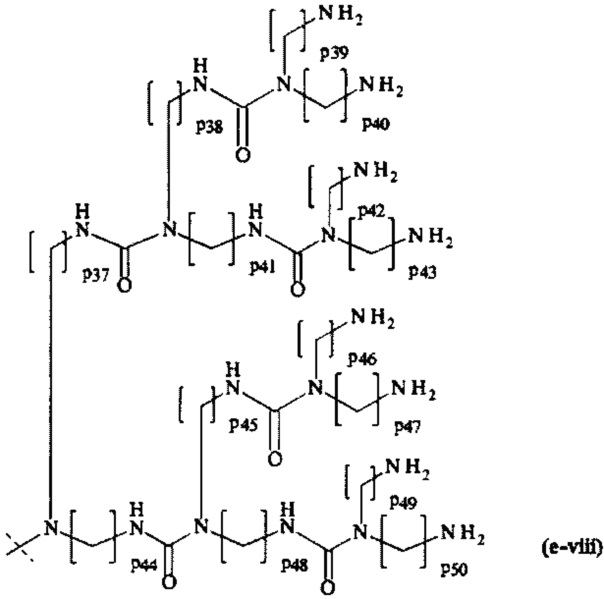
где
р37-р50 являются одинаковыми или различными и каждый независимо выбирается из целого числа от 2 до 5, предпочтительно р37-р50 равны 3, и
пунктирная линия показывает присоединение к А2, если реагент основной цепи имеет структуру формулы (I), к А3 или А4, если реагент основной цепи имеет структуру формулы (II), к А5, если реагент основной цепи имеет структуру формулы (III), и к А6, если реагент основной цепи имеет структуру формулы (IV); и
составляющей формулы (e-ix):

где
р51-р80 являются одинаковыми или различными и каждый независимо выбирается из целого числа от 2 до 5, предпочтительно р51-р80 равны 3, и
пунктирная линия показывает присоединение к А2, если реагент основной цепи имеет структуру формулы (I), к А3 или А4, если реагент основной цепи имеет структуру формулы (II), к А5, если реагент основной цепи имеет структуру формулы (III), и к А6, если реагент основной цепи имеет структуру формулы (IV); и
где составляющие (e-i) - (e-v) могут при каждом хиральном центре иметь R- или S-конфигурацию, предпочтительно, все хиральные центры составляющей (e-i)-(e-v) находятся в одинаковой конфигурации.
Предпочтительно, Hypx имеет структуру формулы (e-i), (e-ii), (e-iii), (e-iv), (e-vi), (e-vii), (e-viii) или (e-ix). Более предпочтительно, Hypx имеет структуру формулы (e-ii), (e-iii), (e-iv), (e-vii), (e-viii) или (e-ix), даже более предпочтительно Hypx имеет структуру формулы (e-ii), (e-iii), (e-vii) или (e-viii), и наиболее предпочтительно Hypx имеет структуру формулы (e-iii).
Если Hypx содержит в связанной форме лизин, он предпочтительно представляет собой D-лизин, так как неожиданно было обнаружено, что гидрогели, содержащие составляющие основной цепи, содержащие D-лизин - в отличие от тех, которые содержат L-лизин - являются более стабильными при введении пациенту.
Если реагент основной цепи имеет структуру формулы (I), предпочтительный составляющая - А2-Hyp1 представляет собой составляющую формулы
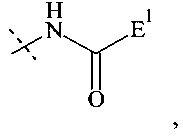
где
пунктирная линия показывает присоединение к Р; и
Е1 выбирается из формул (e-i) - (e-ix).
Если реагент основной цепи имеет структуру формулы (II), предпочтительная составляющая Hyp2-А3 - представляет собой составляющую формулы
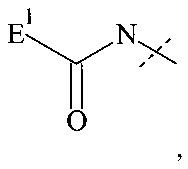
где
пунктирная линия показывает присоединение к Р; и
Е1 выбирается из формул (e-i) - (e-ix);
и предпочтительная составляющая - А4-Hyp3 представляет собой составляющую формулы
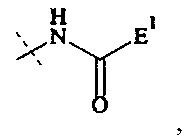
где
пунктирная линия показывает присоединение к Р; и
Е1 выбирается из формул (e-i) - (e-ix).
Если реагент основной цепи имеет структуру формулы (III), предпочтительная составляющая - А5-Hyp4 представляет собой составляющую формулы
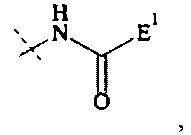
где
пунктирная линия показывает присоединение к Р1; и
Е1 выбирается из формул (e-i) - (e-ix).
Более предпочтительно, реагент основной цепи имеет структуру формулы (I), и В имеет структуру формулы (a-xiv).
Даже более предпочтительно, реагент основной цепи имеет структуру формулы (I), В имеет структуру формулы (a-xiv), x1 и х2 равны 0, и А1 представляет собой -О-.
Даже более предпочтительно, реагент основной цепи имеет структуру формулы (I), В имеет структуру формулы (a-xiv), А1 представляет собой -О-, и Р имеет структуру формулы (c-i).
Даже более предпочтительно, реагент основной цепи имеет формулу (I), В имеет формулу (a-xiv), x1 и х2 равны 0, А1 представляет собой -О-, и Р имеет формулу (c-i).
Даже более предпочтительно, реагент основной цепи имеет формулу (I), В имеет формулу (a-xiv), x1 и х2 равны 0, А1 представляет собой -О-, Р имеет формулу (с-i), А2 представляет собой -NH-(C=O)-, и Hyp1 имеет формулу (e-iii).
Наиболее предпочтительно, реагент основной цепи имеет следующую формулу:
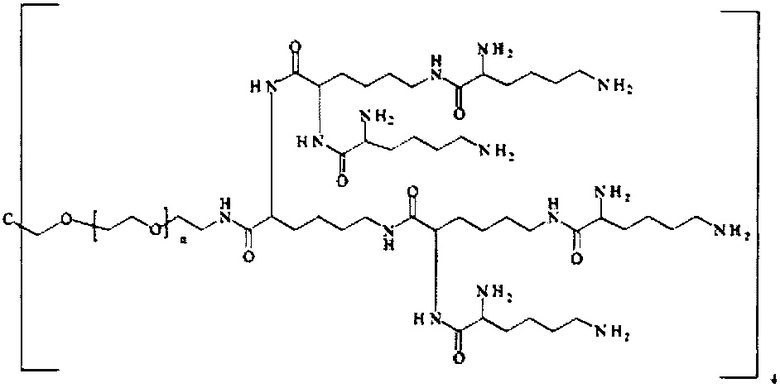
где
n находится в интервале от 10 до 40, предпочтительно от 10 до 30, более предпочтительно от 10 до 20.
В равной степени предпочтительно, n находится в интервале от 20 до 30 кДа, и наиболее предпочтительно n равно 28.
SP формулы (I) представляет собой спейсерную составляющую, выбранную из группы, состоящей из C1-6 алкила, С2-6 алкенила и С2-6 алкинила, предпочтительно SP представляет собой -СН2-, -СН2-СН2-, -СН(СН3)-, -СН2-СН2-СН2-, СН(С2Н5)-, С(СН3)2-, -СН=СН- или -СН=СН-, наиболее предпочтительно SP представляет собой -СН2-, -СН2-СН2- или -СН=СН-.
Поперечно-сшивающий реагент
По меньшей мере один поперечно-сшивающий реагент содержит по меньшей мере две карбонилокси группы (-(С=O)-O- или -O-(С=O)-), которые представляют собой биоразлагаемые связи. Эти биоразлагаемые связи необходимы для получения биоразлагаемого гидрогеля. Кроме того, по меньшей мере один поперечно-сшивающий реагент содержит по меньшей мере две активированные функциональные концевые группы, которые в ходе полимеризации на стадии (b) реагируют с аминами по меньшей мере одного реагента основной цепи.
Поперечно-сшивающий реагент имеет молекулярную массу в интервале от 6 до 40 кДа, более предпочтительно в интервале от 6 до 30 кДа, даже более предпочтительно в интервале от 6 до 20 кДа, даже более предпочтительно в интервале от 6 до 15 кДа и наиболее предпочтительно в интервале от 6 от 10 кДа.
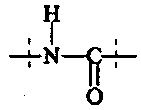
Поперечно-сшивающий реагент содержит по меньшей мере две активированные функциональные концевые группы, выбранные из группы, содержащей активированные сложноэфирные группы, активированные карбаматные группы, активированные карбонатные группы и активированные тиокарбонатные группы, которые в ходе полимеризации реагируют с аминными группами реагентов основной цепи, образую амидные связи, т.е. составляющая основной цепи и поперечно-сшивающая составляющая предпочтительно соединены амидной связью.
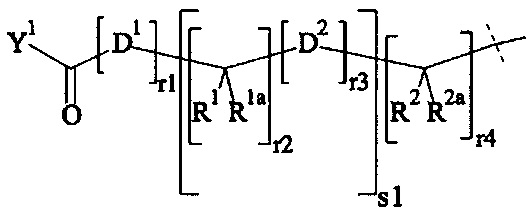
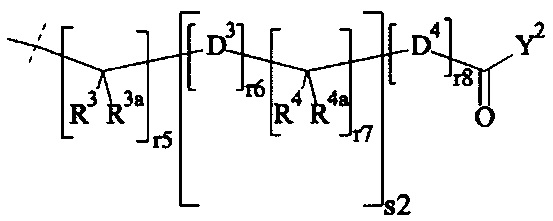
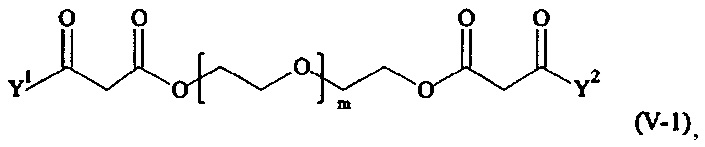
В одном предпочтительном варианте выполнения настоящего изобретения, поперечно-сшивающий реагент представляет собой соединение формулы (V-I):
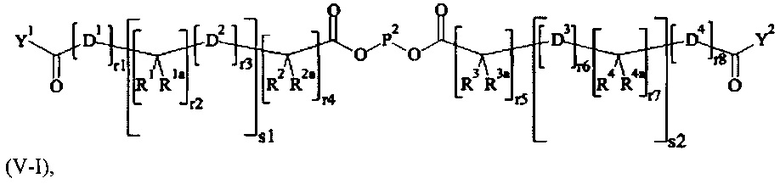
где
каждый D1, D2, D3 и D4 являются одинаковыми или различными, и каждый независимо друг от друга выбирается из группы, включающей -О-, -NR5-, -S- и CR6R6a-;
каждый R1, R1a, R2, R2a, R3, R3a, R4, R4a, R6 и R6a являются одинаковыми или различными, и каждый независимо друг от друга выбирается из группы, включающей -Н, OR7, -NR7R7a, -SR7 и C1-6 алкил; необязательно, каждая пара (пары) R1/R2, R3/R4, Rla/R2a и R3a/R4a может (могут) независимо образовывать химическую связь, и/или каждая из пар R1/R1a, R2/R2a, R3/R3a, R4/R4a, R6/R6a, R1/R2, R3/R4, R1a/R2a и R3a/R4a независимо друг от друга соединяется вместе с атомом, к которому она присоединена, с образованием С3-8 циклоалкила или с образованием кольца А, или соединяется вместе с атомом, к которому они присоединены, с образованием 4-7-членного гетероциклила или 8-11-членного гетеробициклила или адамантила;
каждый R5 независимо выбирается из -Н и С1-6 алкила; необязательно, каждая из пар R1/R5, R2/R5, R3/R5, R4/R5 и R5/R6 может независимо образовывать химическую связь и/или соединяется вместе с атомом, к которому она присоединена, с образованием 4-7-членного гетероциклила или 8-11-членного гетеробициклила;
каждый R7, R7a независимо выбирается из Н и C1-6 алкила;
А выбирается из группы, состоящей из инденила, инданила и тетралинила;
Р2 представляет собой
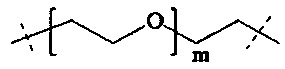
m находится в интервале от 120 до 920, предпочтительно от 120 до 460 и более предпочтительно от 120 до 230;
r1, r2, r7, r8 независимо равны 0 или 1;
r3, r6 независимо равны 0, 1, 2, 3 или 4;
r4, r5 независимо равны 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10;
s1, s2 независимо равны 1, 2, 3,4, 5 или 6;
Y1, Y2 являются одинаковыми или различными, и каждая независимо друг от друга выбирается из формул (f-i) - (f-vi):
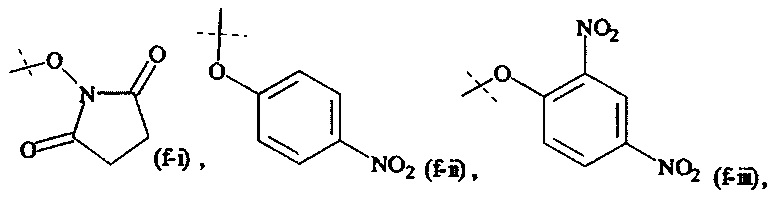
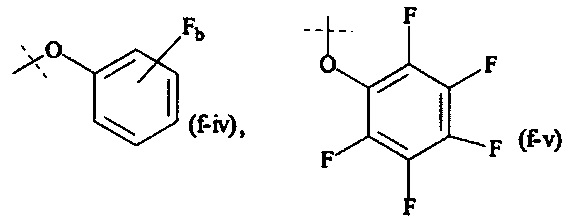 или
или 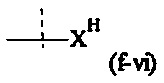
где
пунктирные линии означают присоединение к остальной части молекулы,
b равно 1, 2, 3 или 4
XH представляет собой Cl, Br, I или F.
Предпочтительно, поперечно-сшивающий реагент представляет собой соединение формулы (V-II):
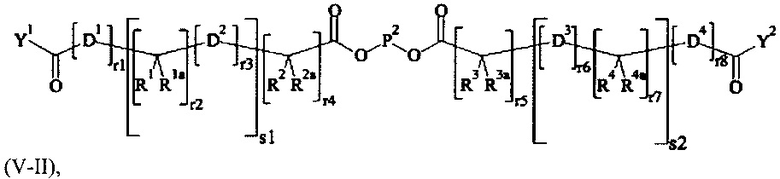
где
D1, D2, D3 и D4 являются одинаковыми или различными, и каждый независимо друг от друга выбирается из группы, включающей О, NR5, S и CR5R5a;
R1, Rla, R2, R2a, R3, R3a, R4, R4a, R5 и R5a являются одинаковыми или различными, и каждый независимо друг от друга выбирается из группы, включающей Н и C1-6 алкил; необязательно, одна или более пар R1/R1a, R2/R2a, R3/R3a, R4/R4a, R1/R2, R3/R4, R1a/R2a, и R3a/R4a образуют химическую связь или соединяются вместе с атомом, к которому они присоединены, с образованием С3-8 циклоалкила или с образоваием кольца А, или соединяются вместе с атомом, к которому они присоединены, с образованием 4-7-членного гетероциклила или 8-11-членного гетеробициклила или адамантил;
А выбирается из группы, состоящей из фенила, нафтила, инденила, инданила и тетралинила;
Р2 представляет собой
m находится в интервале от 120 до 920, предпочтительно от 120 до 460 и более предпочтительно от 120 до 230;
r1, r2, r7, r8 независимо равно 0 или 1;
r3, r6 независимо равно 0, 1, 2, 3 или 4;
r4, r5 независимо равно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10;
s1, s2 независимо равно 1, 2, 3, 4, 5 или 6;
Y1, Y2 являются одинаковыми или различными, и каждая независимо друг от друга выбирается из формул (f-i) - (f-vi):
 или
или 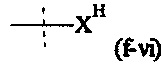
где
пунктирные линии означают присоединение к остальной части молекулы,
b равно 1, 2, 3 или 4
XH представляет собой Cl, Br, I или F.
Понимается, что составляющие
 и
и 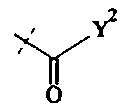
представляют собой по меньшей мере две активированные функциональные концевые группы.
Предпочтительно, Y1 и Y2 формулы (V-I) и (V-II) имеют структуру формулы (f-i), (f-ii) или (f-v). Более предпочтительно, Y1 и Y2 имеют структуру формулы (f-i) или (f-ii) и наиболее предпочтительно, Y1 и Y2 имеют структуру формулы (f-i).
Предпочтительно, обе составляющие Y1 и Y2 формулы (V-I) и (V-II) имеют одинаковую структуру. Более предпочтительно, обе составляющие Y1 и Y2 имеют структуру формулы (f-i).
Предпочтительно, r1 формулы (V-I) и (V-II) равно 0.
Предпочтительно, r1 и s1 формулы (V-I) и (V-II) оба равны 0.
Предпочтительно, одна или более пар R1/R1a, R2/R2a, R3/R3a, R4/R4a, R1/R2, R3/R4, R1a/R2a, и R3a/R4a формулы (V-I) и (V-II) образуют химическую связь или соединяются вместе с атомом, к которому они присоединены, с образованием С3-8 циклоалкила или кольца А.
Предпочтительно, одна или более пар R1/R2, R1a/R2a, R3/R4, R3a/R4a формулы (V-I) и (V-II) соединяются вместе с атомом, к которому они присоединены, с образованием 4-7-членного гетероциклила или 8-11-членного гетеробициклила.
Предпочтительно, поперечно-сшивающий реагент формулы (V-I) и (V-II) является симметричным, т.е. составляющая
имеет такую же структуру, что и составляющая
В одном предпочтительном варианте выполнения настоящего изобретения s1, s2, r1 и r8 формулы (V-I) и (V-II) равны 0.
В другом предпочтительном варианте выполнения настоящего изобретения s1, s2, r1 и r8 формулы (V-I) и (V-II) равны 0, и r4 формулы (V-I) и (V-II) и r5 равны 1.
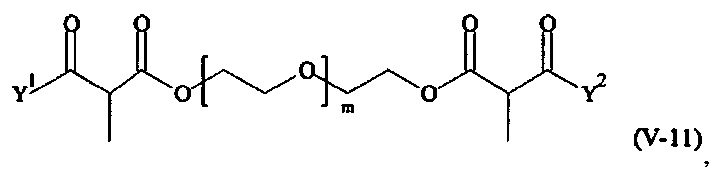
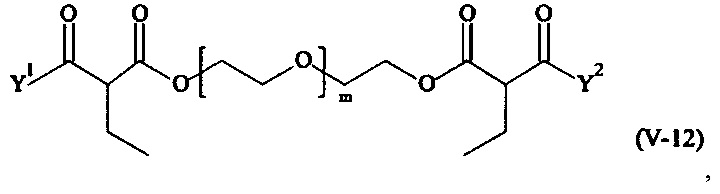
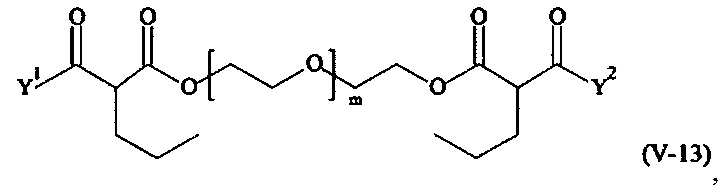
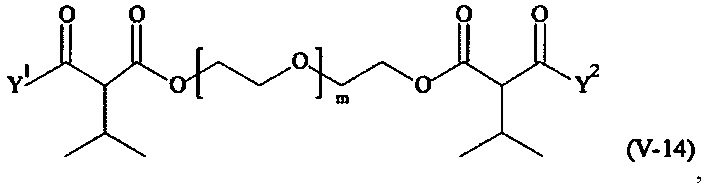
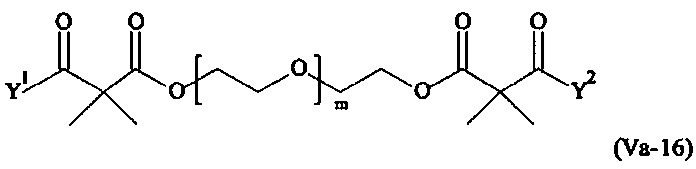
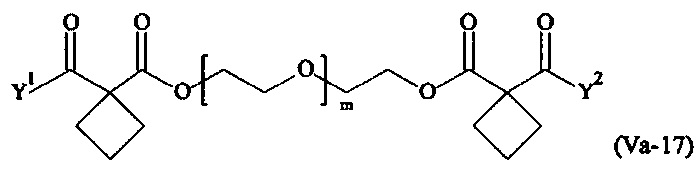
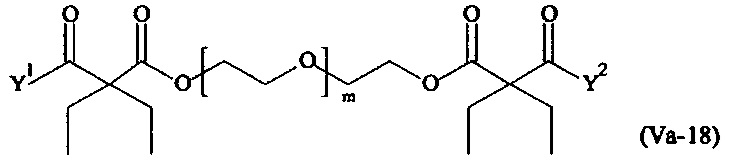
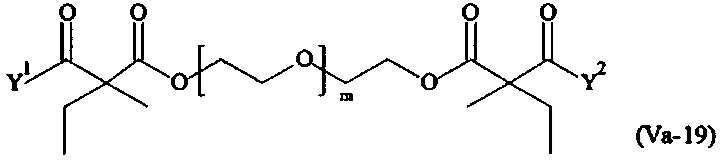
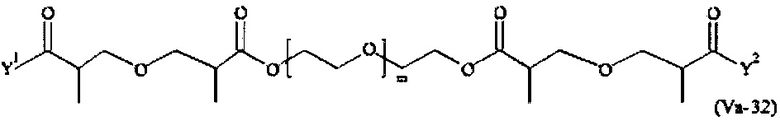
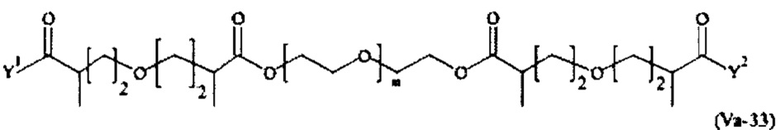
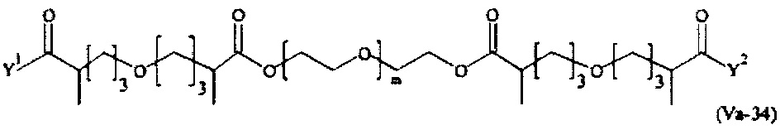
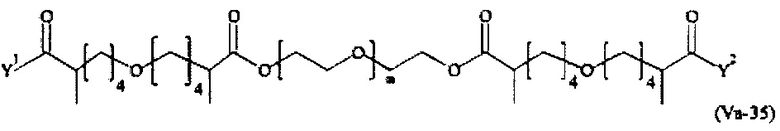
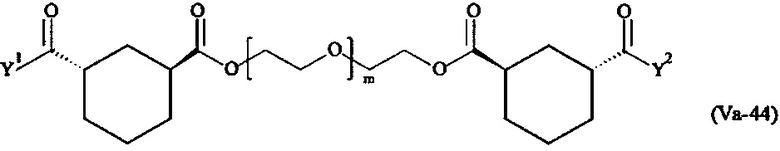
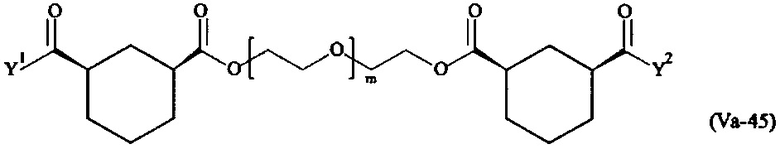
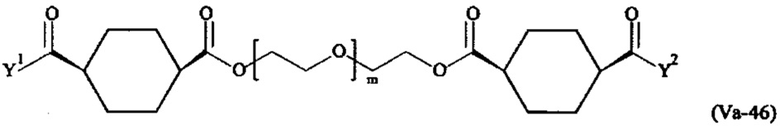
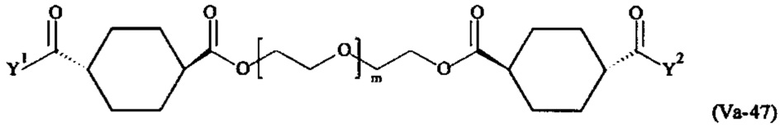
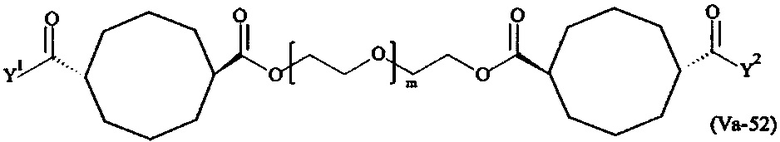
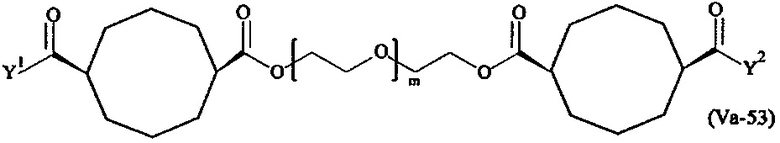
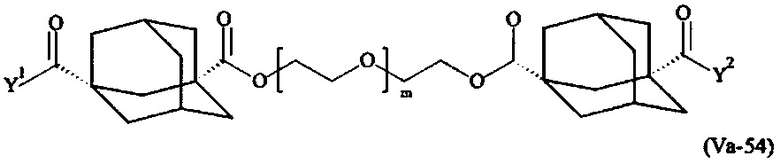
Предпочтительными поперечно-сшивающими реагентами являются поперечно-сшивающие реагенты формул (V-1) - (V-54):
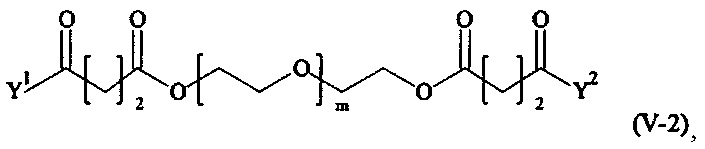
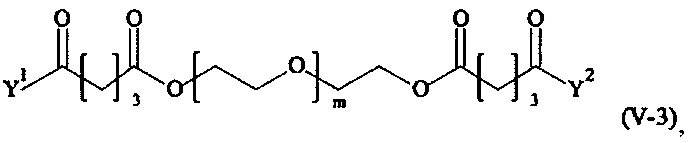
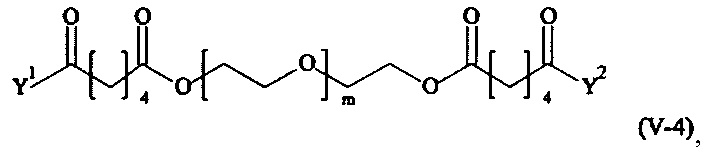
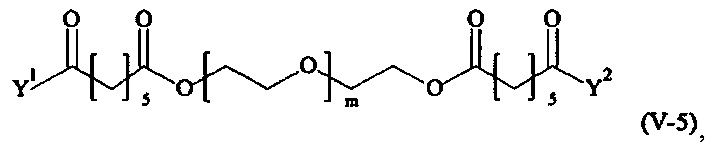
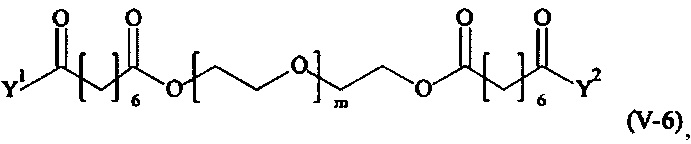
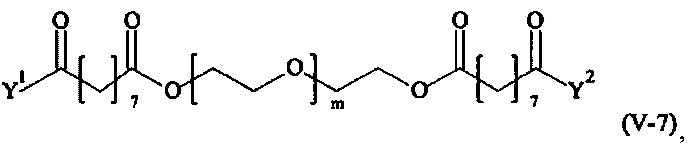
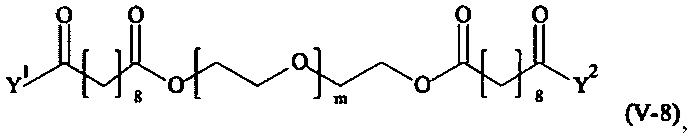
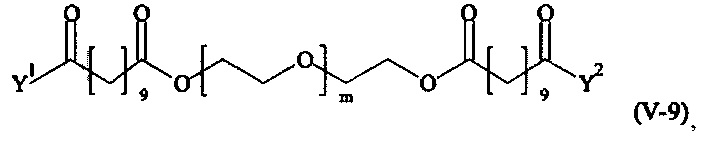

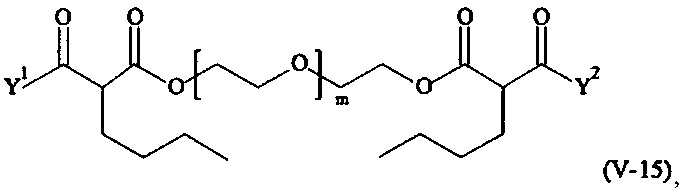
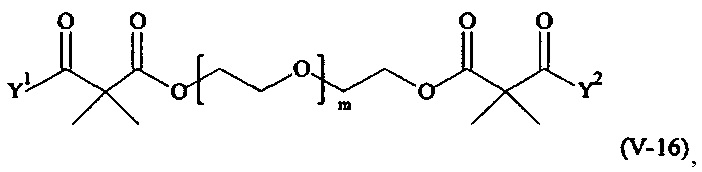

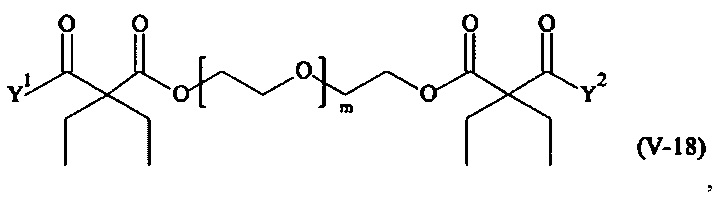
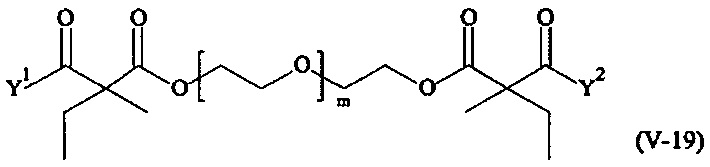

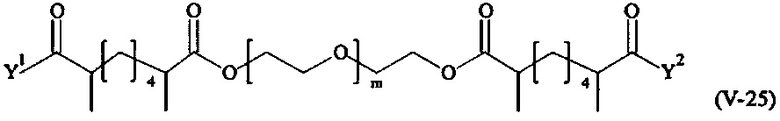
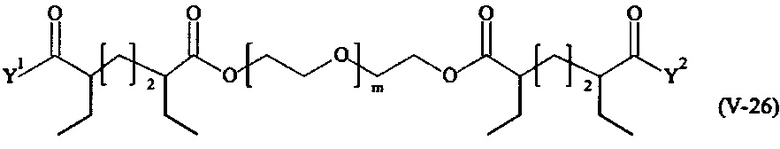
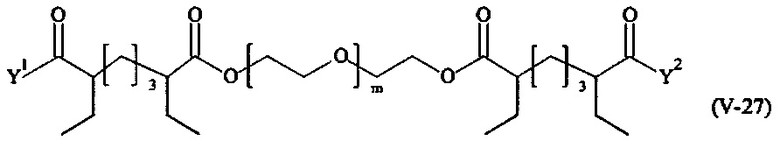
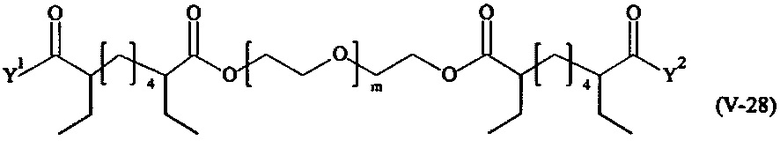
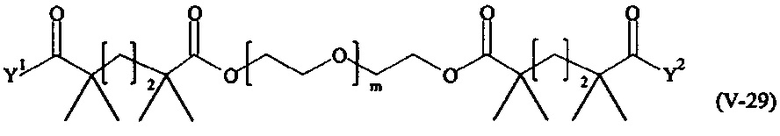
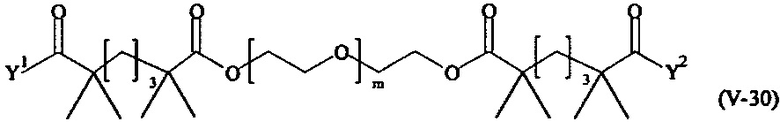
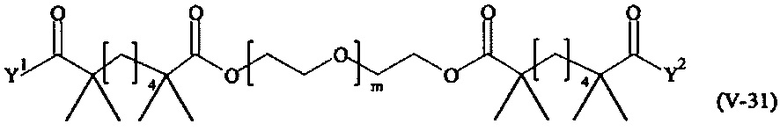

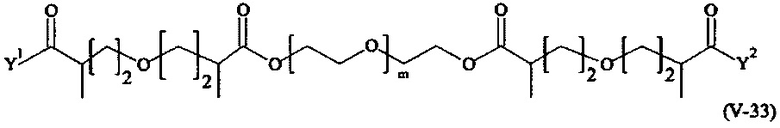
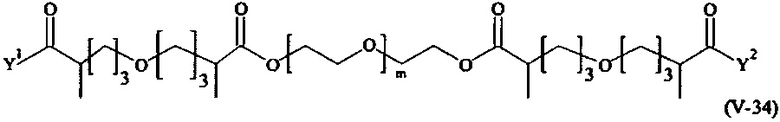
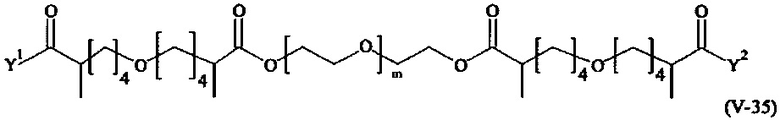
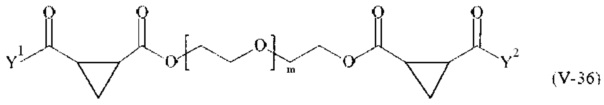

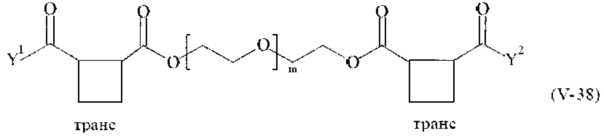
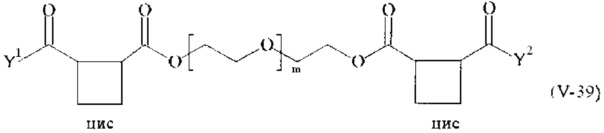
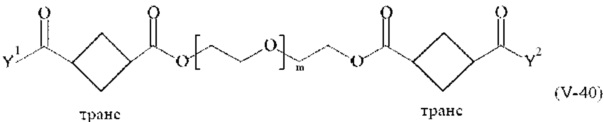
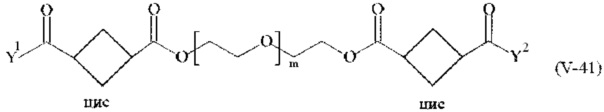
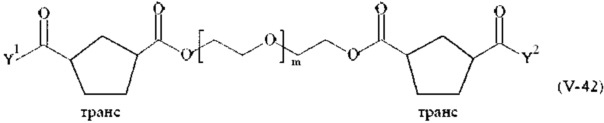
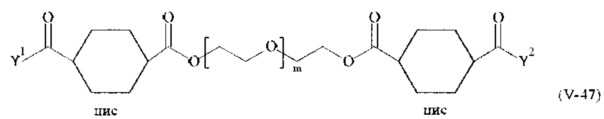
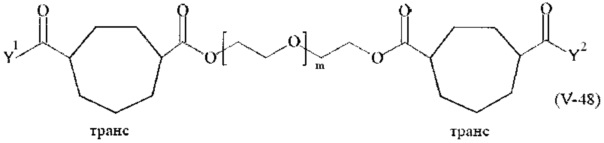

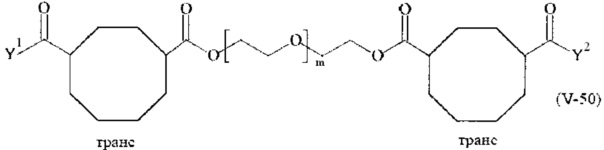
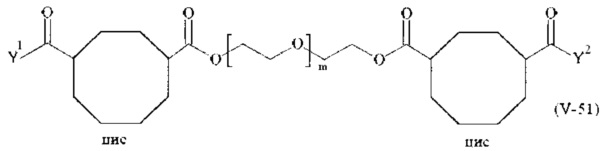
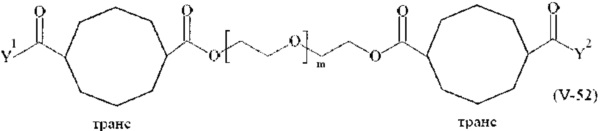
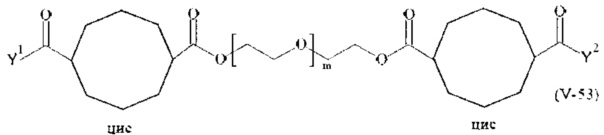
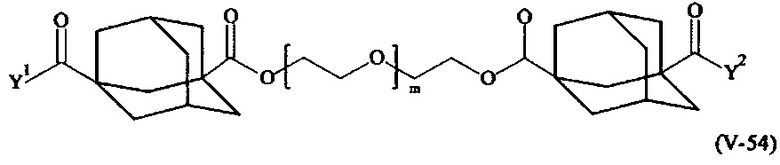
где
каждый поперечно-сшивающий реагент может быть в форме его рацемической смеси, если применяется; и
m, Y1 и Y2 определено выше.
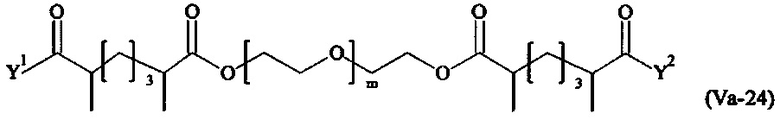
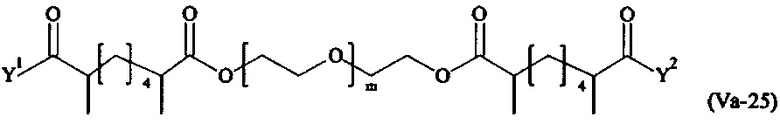
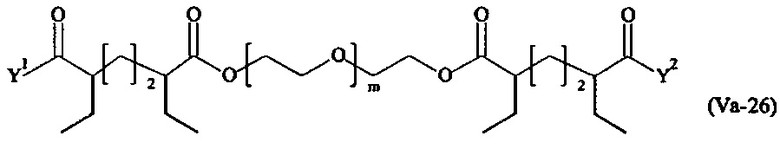
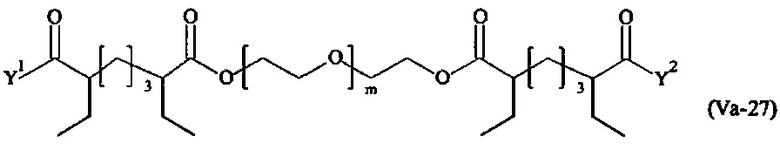
Даже более предпочтительными поперечно-сшивающими реагентами являются сшивающие реагенты формулы (Va-1) - (Va-54):
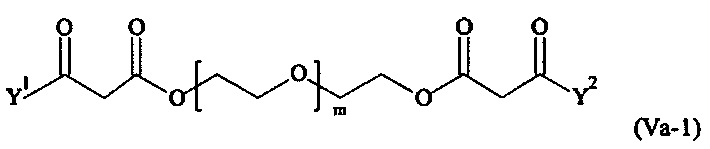
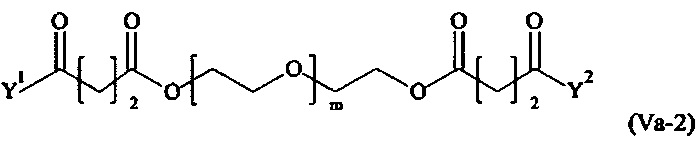
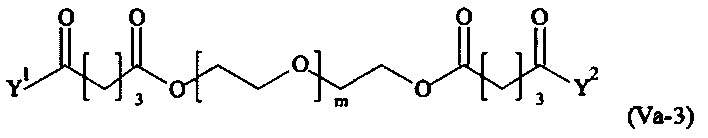
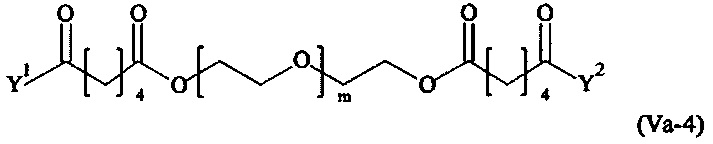
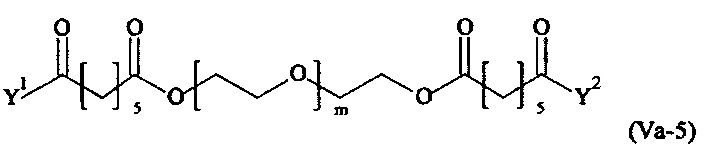
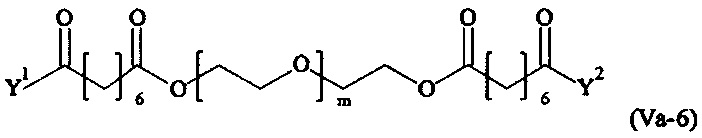

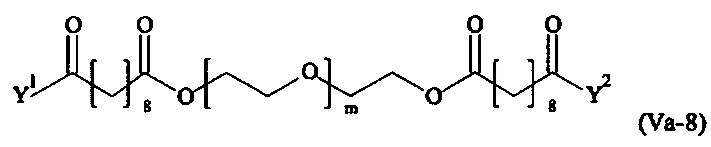
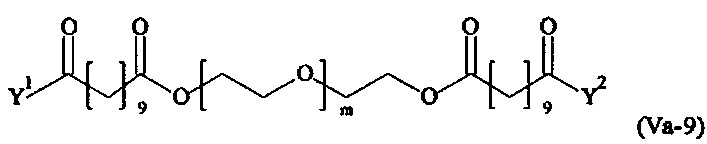
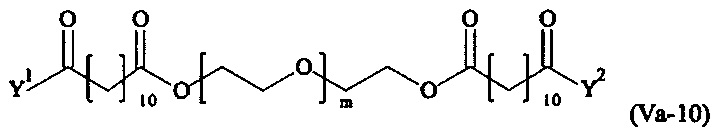
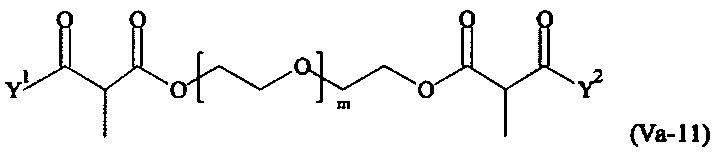
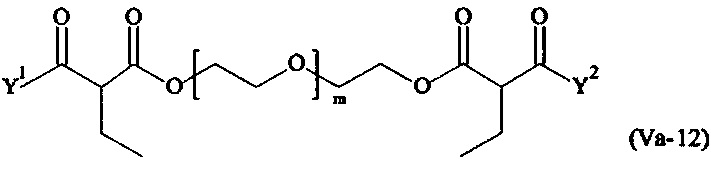

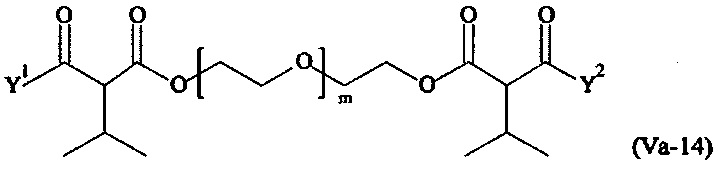
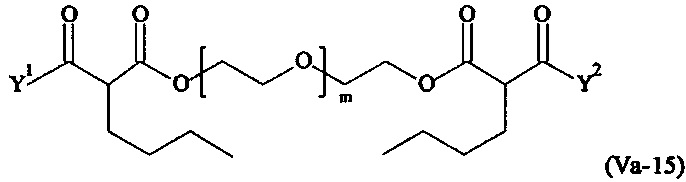
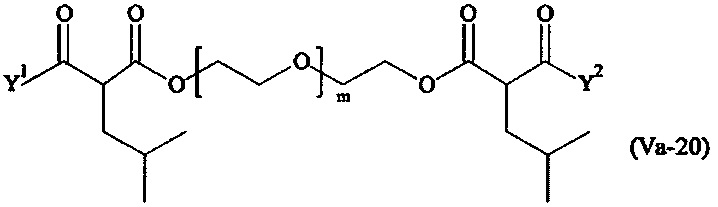
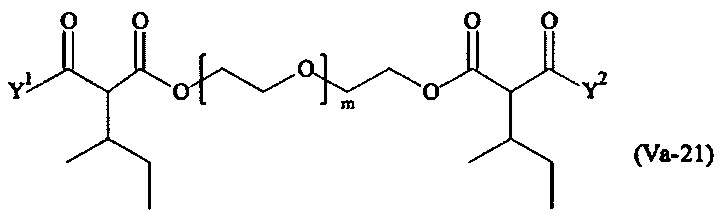
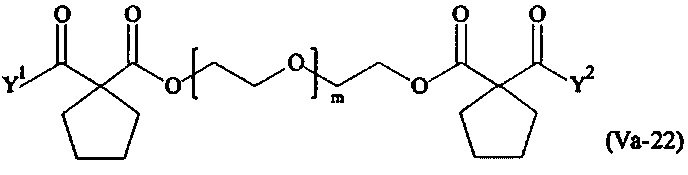
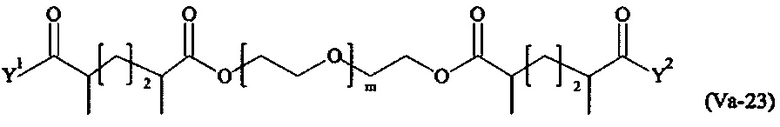
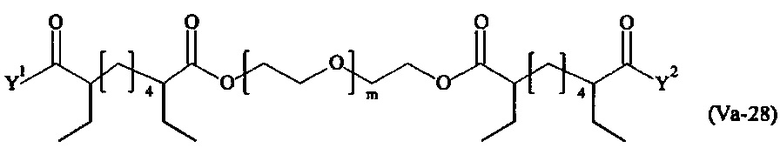
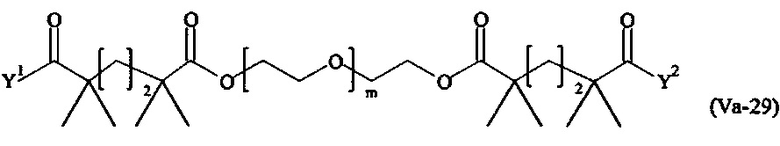
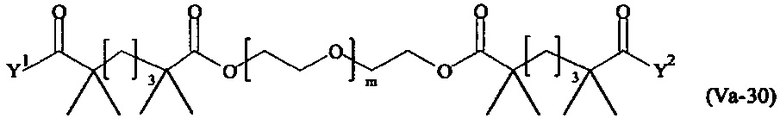
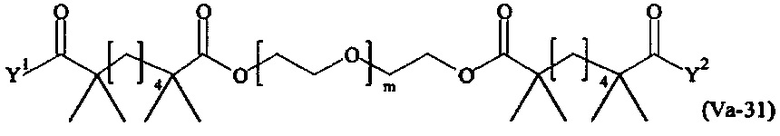
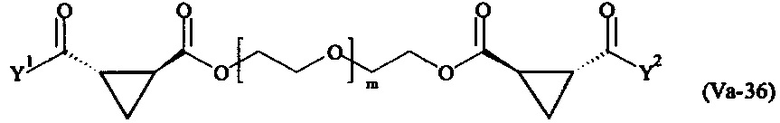
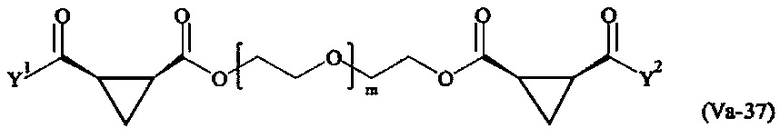
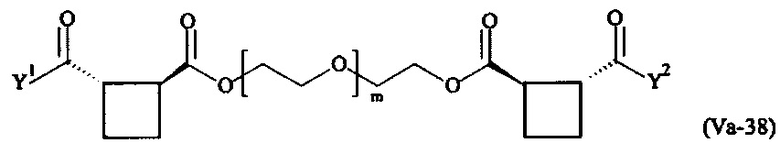
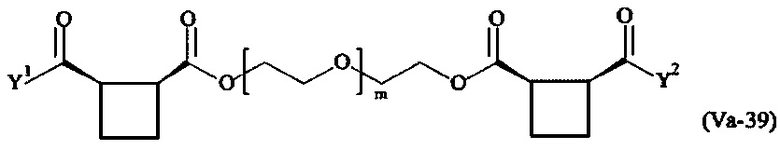
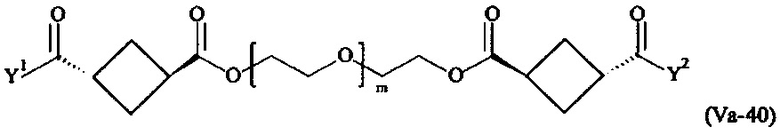
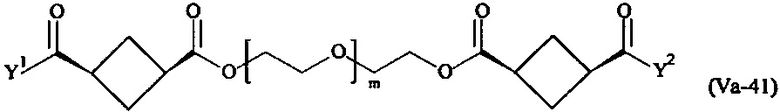
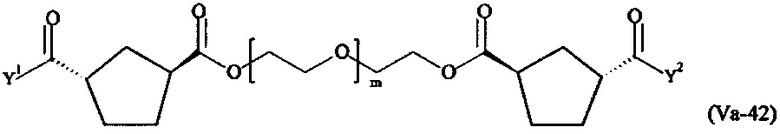
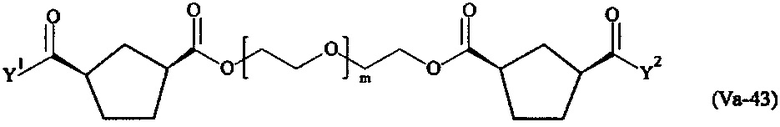
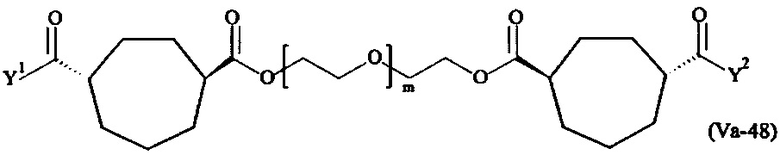
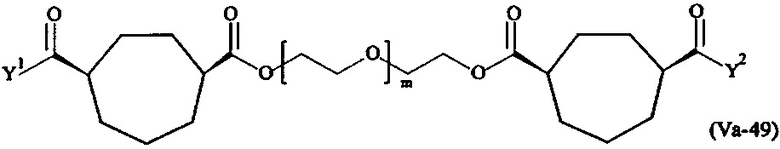
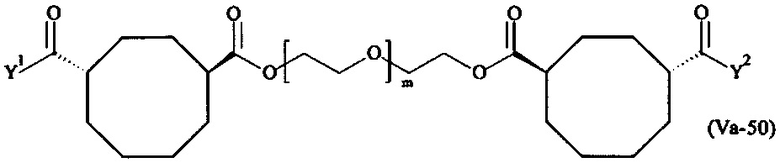
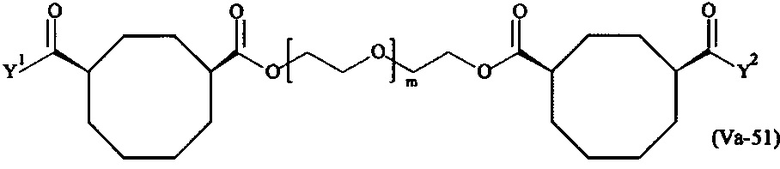
где
каждый поперечно-сшивающий реагент может быть в форме его рацемической смеси, если применяется; и
m, Y1 и Y2 определены выше.
Неожиданно было обнаружено, что применение поперечно-сшивающих реагентов с разветвителями, т.е. остатками, отличными от Н, при альфа атоме углерода карбонилокси группы, приводит к образованию гидрогелей, которые являются более устойчивыми к ферментативному расщеплению, такому как расщепление эстеразами.
Подобным образом, неожиданно было обнаружено, что чем меньше атомов присутствует между (C=O) карбонилокси группы и (C=O) соседнего активированного сложного эфира, активированного карбамата, активированного карбоната или активированного тиокарбамата, полученные гидрогели являются более устойчивыми к расщеплению, как например, более устойчивыми к расщеплению эстеразами.
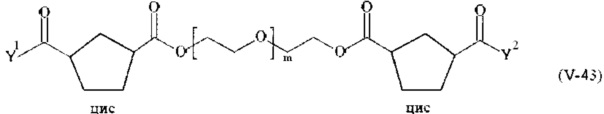
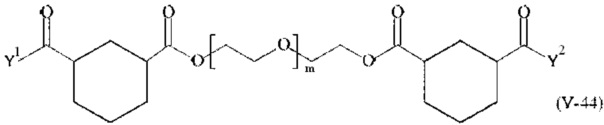
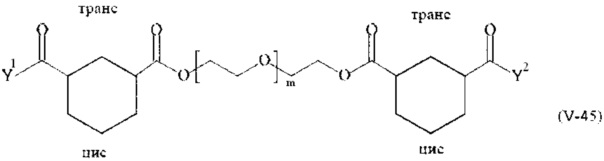
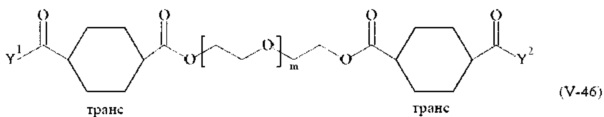
Соответственно, поперечно-сшивающие реагенты V-11 - V-54, V-1, V-2, Va-11 - Va-54, Va-1 и Va-2 являются предпочтительными поперечно-сшивающими реагентами. Поперечно-сшивающие реагенты Va-11 - Va-54, Va-1 и Va-2 являются наиболее предпочтительными поперечно-сшивающими реагентами. Наиболее предпочтительным является поперечно-сшивающий реагент Va-14.
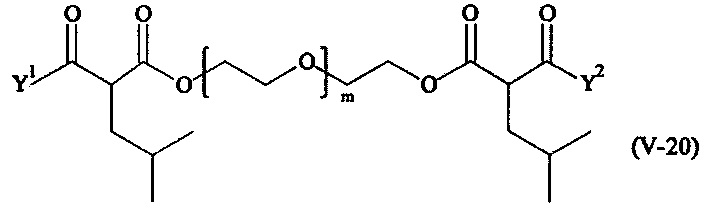
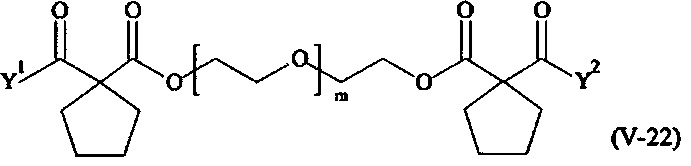
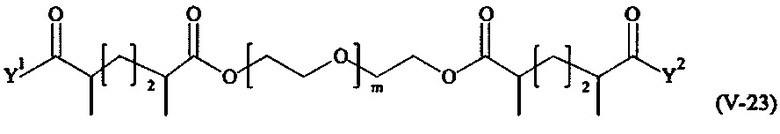
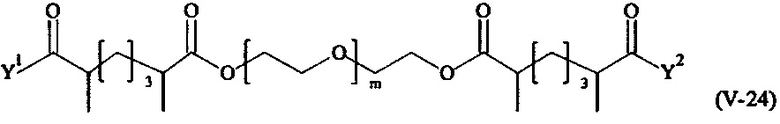
В другом варианте выполнения настоящего изобретения, поперечно-сшивающие реагенты V-1, V-2, V-5, V-6, V-7, V-8, V-9, V-10, V-11, V-12, V-13, V-14, V-15, V-16, V-17, V-18, V-19, V-20, V-21, V-22, V-23, V-24, V-25, V-26, V-27, V-28, V-29, V-30, V-31, V-32, V-33, V-34, V-35, V-36, V-37, V-38, V-39, V-40, V-41, V-42, V-43, V-44, V-45, V-46, V-47, V-48, V-49, V-50, V-51, V-52, V-53 и V-54 являются предпочтительными поперечно-сшивающими реагентами. Более предпочтительно, по меньшей мере один поперечно-сшивающий реагент имеет формулу V-5, V-6, V-7, V-8, V-9, V-10, V-14, V-22, V-23, V-43, V-44, V-45 или V-46, и наиболее предпочтительно, по меньшей мере один поперечно-сшивающий реагент имеет формулу V-5, V-6, V-9 или V-14.
В другом варианте выполнения настоящего изобретения, поперечно-сшивающие реагенты Va-1, Va-2, Va-5, Va-6, Va-7, Va-8, Va-9, Va-10, Va-11, Va-12, Va-13, Va-14, Va-15, Va-16, Va-17, Va-18, Va-19, Va-20, Va-21, Va-22, Va-23, Va-24, Va-25, Va-26, Va-27, Va-28, Va-29, Va-30, Va-31, Va-32, Va-33, Va-34, Va-35, Va-36, Va-37, Va-38, Va-39, Va-40, Va-41, Va-42, Va-43, Va-44, Va-45, Va-46, Va-47, Va-48, Va-49, Va-50, Va-51, Va-52, Va-53 и Va-54 являются даже более предпочтительными поперечно-сшивающими реагентами. Более предпочтительно, по меньшей мере один поперечно-сшивающий реагент имеет формулу Va-5, Va-6, Va-7, Va-8, Va-9, Va-10, Va-14, Va-22, Va-23, Va-43, Va-44, Va-45 или Va-46, и наиболее предпочтительно, по меньшей мере один поперечно-сшивающий реагент имеет формулу Va-5, Va-6, Va-9 или Va-14.
Предпочтительные варианты выполнения соединения формулы (V-I) и (V-II), как указано выше, относятся соответственно к предпочтительным соединениям формул (V-1) (V-54) и к более предпочтительным соединениям формул (Va-1) - (Va-54).
Другим объектом настоящего изобретения является гидрогель, полученный способом согласно настоящему изобретению, как описано выше.
Гидрогель содержит от 0.01 до 1 ммоль/г первичной аминной группы (-NH2), более предпочтительно, от 0.02 до 0.5 ммоль/г первичной аминной группы и наиболее предпочтительно от 0.05 до 0.3 ммоль/г первичной аминной группы. Термин "X ммоль/г первичной аминной группы" означает, что 1 г сухого гидрогеля содержит X ммоль первичной аминной группы. Измерение содержания амина в гидрогеле осуществляется согласно Gude et al. (Letters in Peptide Science, 2002, 9(4): 203-206, который включен посредством ссылки в полном объеме) и также подробно описано в части «Примеры».
Предпочтительно, термин "сухой", как применяется в настоящей заявке, означает остаточное содержание воды, равное максимум 10%, предпочтительно менее 5% и более предпочтительно менее 2% (определено согласно Karl Fischer). Предпочтительным способом сушки является лиофилизация.
Способ получения конъюгата гидрогель-спейсер
Другим объектом настоящего изобретения является способ получения конъюгата гидрогель-спейсер, включающий стадии:
(d) реакция гидрогеля со стадии (b) или (с) со спейсерным реагентом формулы (VI)
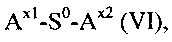
где
S0 выбирается из группы, состоящей из С1-50 алкила, С2-50 алкенила и С2-50 алкинила, фрагменты которых необязательно прерываются одной или более группами, выбранными из -NH-, -N(C1-4 алкила)-, -O-, -S, -C(O)-, -C(O)NH, -C(O)N(C1-4 алкила)-, -O-C(O)-, -S(O)-, -S(O)2-, 4-7-членного гетероциклила, фенила и нафтила;
Ax1 представляет собой функциональную группу для реакции с аминной группой гидрогеля; и
Ax2 представляет собой функциональную группу;
в присутствии растворителя с получением конъюгата гидрогель-спейсер.
Предпочтительно, Ах1 выбирается из группы, состоящей из активированной карбоновой кислоты; Cl-(C=O)-; NHS-(C=O)-, где NHS представляет собой N-гидроксисукцинимид; ClSO2-; R1(C=O)-; I-; Br-; Cl-; SCN-; и CN-,
где
R1 выбирается из группы, состоящей из Н, C1-6 алкила, алкенила, С2-6 алкинила, С3-8 циклоалкила, 4-7-членного гетероциклила, 8-11-членного гетеробициклила, фенила, нафтила, инденила, инданила и тетралинила.
Наиболее предпочтительно, Ax1 представляет собой активированную карбоновую кислоту.
Подходящие активирующие реагенты для получения активированной карбоновой кислоты представляют собой, например, N,N'-дициклогексил-карбодиимид (DCC), 1-этил-3-карбодиимид (EDC), бензотриазол-1-ил-окситрипирролидинфосфония гексафторфосфат (PyBOP), бромтрипирролидинфосфония гексафторфосфат (PyBrOP), 1-циано-2-этокси-2-оксоэтилиденаминоокси)диметиламино-морфолино-карбения гексафторфосфат (COMU), 1-гидроксибензотриазол (НОВТ), 1-гидрокси-7-азабензотриазол (HOAT), O-(6-хлорбензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HCTU), 1-Н-бензотриазолий (HBTU), (O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), и O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU). Эти реагенты являются коммерчески доступными и хорошо известны специалистам в данной области техники.
Предпочтительно, Ax2 выбирается из группы, состоящей из малеимида, SH, NH2, SeH, N3, С≡СН, CR1=CR1aR1b, ОН, (CH=X0)-R1, (C=O)-S-R1, (C=O)H, NH-NH2, О-NH2, Ar-X0, Ar-Sn(R1)(R1a)(R1b), Ar-B(OH)(OH),
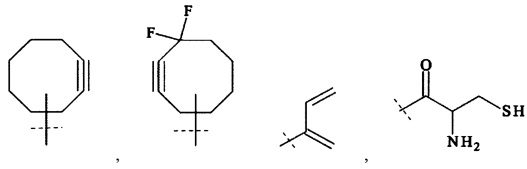
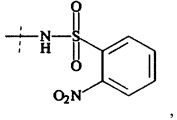 и
и  ; с необязательными защитными группами;
; с необязательными защитными группами;
где
X0 представляет собой -ОН, -NR1R1a, -SH, и -SeH,
Ar выбирается из фенила, нафтила, инденила, инданила и тетралинила, и
R1, Rla, Rlb независимо друг от друга выбираются из группы, состоящей из Н, С1-6 алкила, С2-6 алкенила, С2-6 алкинила, С3-8 циклоалкила, 4-7-членного гетероциклила, 8-11-членного гетеробициклила, фенила, нафтила, инденила, инданила и тетралинила.
Более предпочтительно, Ax2 выбирается из -NH2, малеимида и тиола, и наиболее предпочтительно Ax2 представляет собой малеимид. В равной степени предпочтительным является тиол (-SH).
Подходящие условия реакции описаны в части «Примеры» и известны специалистам в данной области техники.
Стадия (d) способа осуществляется в присутствии основания. Подходящие основания включают стандартные неорганические или органические основания. Они предпочтительно включают гидриды, гидроксиды, амиды, алкоксиды, ацетаты, карбонаты или бикарбонаты щелочноземельных или щелочных металлов, такие как, например, гидрид натрия, амид натрия, метоксид натрия, этоксид натрия, трет.-бутоксид натрия, гидроксид натрия, гидроксид калия, гидроксид аммония, ацетат натрия, ацетат калия, ацетат кальция, ацетат аммония, карбонат натрия, карбонат калия, бикарбонат калия, бикарбонат натрия или карбонат аммония, и третичные амины, такие как триметиламин, триэтиламин, трибутиламин, N,N-диметиланилин, N,N-диметилбензиламин, пиридин, N-метилпиперидин, N-метилморфолин, N,N-диметиламинопиридин, диазабициклооктан (DABCO), диазабициклононен (DBN), N,N-диизопропилэтиламин (DIPEA), диазабициклоундецен (DBU) или коллидин.
Стадия (d) способа осуществляется в присутствии растворителя. Подходящие растворители для осуществления стадии (d) способа согласно изобретению включают органические растворители. Они предпочтительно включают воду и алифатические, алициклические или ароматические углеводороды, такие как, например, петролейный эфир, гексан, гептан, циклогексан, метилциклогексан, бензол, толуол, ксилол или декалин; галогенированные углеводороды, такие как, например, хлорбензол, дихлорбензол, дихлорметан, хлороформ, четыреххлористый углерод, дихлорэтан или трихлорэтан; спирты, такие как метанол, этанол, н- или изо-пропанол, н-, изо-, втор- или трет-бутанол, этандиол, пропан-1,2-диол, этоксиэтанол, метоксиэтанол, диэтиленгликоля монометиловый простой эфир, диметиловый простой эфир, диэтиленгликоль; ацетонитрил, N-метил-2-пирролидон (NMP), диметилформамид (DMF), диметилсульфоксид (DMSO), N,N-диметилацетамид, нитрометан, нитробензол, гексаметилфосфорамид (НМРТ), 1,3-диметил-2-имидазолидинон (DMI), 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон (DMPU), этилацетат, ацетон, бутанон; сложные эфиры, такие как диэтиловый простой эфир, диизопропиловый простой эфир, метил-трет-бутиловый простой эфир, метил-трет-амиловый простой эфир, диоксан, тетрагидрофуран, 1,2-диметоксиэтан, 1,2-диэтоксиэтан или анизол; или их смеси. Предпочтительно, растворитель выбирается из воды, ацетонитрила или N-метил-2-пирролидона.
Другим объектом настоящего изобретения является конъюгат гидрогель-спейсер, полученный вышеописанным способом.
Способ получения пролекарства, связанного с носителем
Другим объектом настоящего изобретения является способ получения пролекарства, связанного с носителем, включающий стадию:
(е) реакцию гидрогеля со стадии (b) или (с) или конъюгата гидрогель-спейсер со стадии (d) с реагентом формулы (VII) линкер пролекарства-биологически активная составляющая
где
Ay1 представляет собой функциональную группу для реакции с амином гидрогеля со стадии (b) или (с) или для реакции с функциональной группой Ax2 конъюгата гидрогель-спейсер со стадии (d),
L представляет собой линкер пролекарства;
D представляет собой биологически активная составляющая;
в присутствии растворителя, с получением пролекарства, связанного с носителем.
Стадия (е) способа может осуществляться в присутствии растворителя. Подходящие растворители для осуществления стадии (е) растворителя согласно изобретению включают органические растворители. Они предпочтительно включают воду и алифатические, алициклические или ароматические углеводороды, такие как, например, петролейный эфир, гексан, гептан, циклогексан, метилциклогексан, бензол, толуол, ксилол или декалин; галогенированные углеводороды, такие как, например, хлорбензол, дихлорбензол, дихлорметан, хлороформ, четыреххлористый углерод, дихлорэтан или трихлорэтан; спирты, такие как метанол, этанол, н- или изо-пропанол, н-, изо-, втор- или трет-бутанол, этандиол, пропан-1,2-диол, этоксиэтанол, метоксиэтанол, диэтиленгликоля монометиловый простой эфир, диметиловый простой эфир, диэтиленгликоль; ацетонитрил, N-метил-2-пирролидон (NMP), диметилформамид (DMF), диметилсульфоксид (DMSO), N,N-диметилацетамид, нитрометан, нитробензол, гексаметилфосфорамид (НМРТ), 1,3-диметил-2-имидазолидинон (DMI), 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон (DMPU), этилацетат, ацетон, бутанон; сложные эфиры, такие как диэтиловый простой эфир, диизопропиловый простой эфир, метил-трет-бутиловый простой эфир, метил-трет-амиловый простой эфир, диоксан, тетрагидрофуран, 1,2-диметоксиэтан, 1,2-диэтоксиэтан или анизол; или их смеси. Предпочтительно, растворитель выбирается из воды, ацетонитрила или N-метил-2-пирролидона.
Если реагент формулы (VII) линкер пролекарства-биологически активная составляющая реагирует с амином гидрогеля со стадии (b) или (с), тогда Ay1 представляет собой малеимид или ОН-, предпочтительно малеимид.
Если реагент формулы (VII) линкер пролекарства-биологически активная составляющая реагирует с Ax2 конъюгата гидрогель-спейсер со стадии (d), структура Ay1 зависит от структуры Ax2, с которой Ay1 реагирует. Предпочтительные пары Ax2/Ay1 выбираются из следующих:
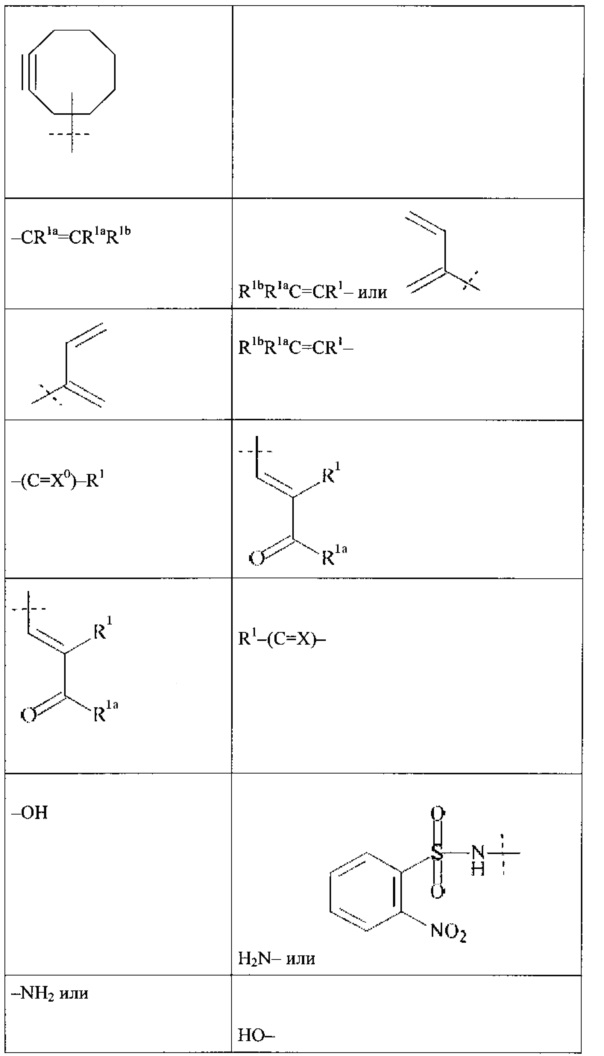
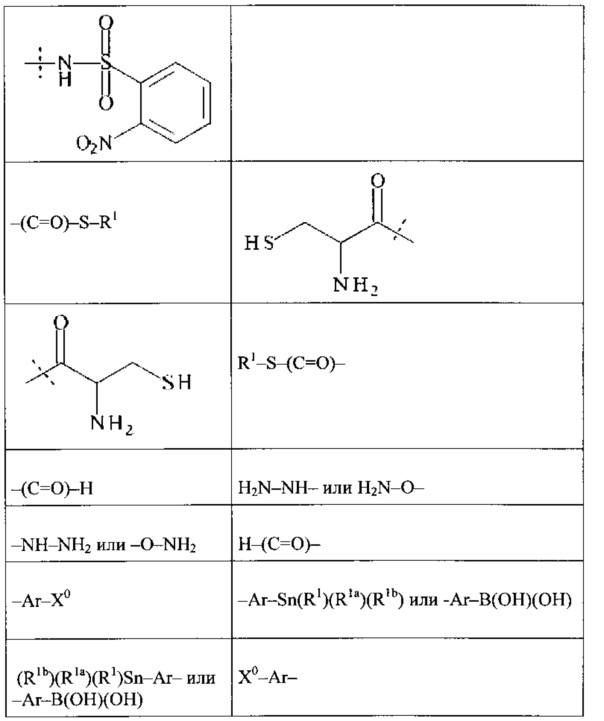
где
Х0 представляет собой -ОН, -NR1R1a, -SH, и -SeH;
R1, Rla, Rlb независимо друг от друга выбираются из группы, состоящей из Н, С1-6 алкила, С2-6 алкенила, C2-6 алкинила, С3-8 циклоалкила, 4-7-членного гетероциклила, 8-11-членного гетеробициклила, фенила, нафтила, инденила, инданила и тетралинила; и
Ar выбирается из фенила, нафтила, инденила, инданила и тетралинила.
Более предпочтительно, Ay1 выбирается из -SH или -малеимида, и наиболее предпочтительно Ay1 представляет собой -SH и, соответственно, предпочтительный Ax2 представляет собой -малеимид или -SH, и наиболее предпочтительный Ax2 представляет собой -малеимид.
В особенно предпочтительном варианте выполнения настоящего изобретения Ax2 представляет собой тиол, и Ay1 формулы (VII) имеет формулу (VIIa)
где
Т представляет собой Н или метку;
PG0 представляет собой сера-активирующую составляющую; и
S представляет собой серу.
В одном варианте выполнения настоящего изобретения PG0 формулы (VIIa) выбирается из группы, состоящей из
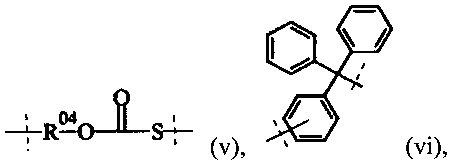 и
и 
где
пунктирные линии, отмеченные звездочками, показывают присоединение к Т формулы (VIIa), и непомеченные линии показывают присоединение к сере формулы (VIIa);
Ar представляет собой ароматическую составляющую, которая необязательно имеет заместители;
R01, R03, R04 независимо друг от друга представляют собой химическую связь или представляют собой C1-50 алкил; С2-50 алкенил; или С2-50 алкинил, где С1-50 алкил; С2-50 алкенил; и С2-50 алкинил необязательно замещены одной или более группами R3, которые являются одинаковыми или различными, и где С1-50 алкил; С2-50 алкенил; и С2-50 алкинил необязательно прерываются одной или более группами, выбиранными из группы, состоящей из -Q-, -С(O)O-; -О-; -С(О)-; -C(O)N(R4)-; S(O)2N(R4)-; S(O)N(R4)-; -S(O)2-; -S(O)-; -N(R4)S(O)2N(R4a)-; -S-; N(R4)-; OC(O)R4; -N(R4)C(O)-; -N(R4)S(O)2-; -N(R4)S(O)-; N(R4)C(O)O-; N(R4)C(O)N(R4a)-; и -OC(O)N(R4R4a);
R02 представляет собой H; С1-50 алкил; С2-50 алкенил; или С2-50 алкинил, где С1-50 алкил; С2-50 алкенил; и С2-50 алкинила необязательно замещены одной или более группами R3, которые являются одинаковыми или различными, и где С1-50 алкил; С2-50 алкенил; и С2-50 алкинил необязательно прерываются одной или более группами, выбранными из группы, состоящей из -Q-, -С(O)O-; -О-; -С(О)-; -C(O)N(R4)-; -S(O)2N(R4)-; -S(O)N(R4)-; -S(O)2-; -S(O)-; N(R4)S(O)2N(R4a)-; -S-; -N(R4)-; -OC(O)R4; -N(R4)C(O)-; N(R4)S(O)2-; -N(R4)S(O)-; -N(R4)C(O)O-; -N(R4)C(O)N(R4a)-; и OC(O)N(R4R4a);
Q выбирается из группы, состоящей из фенила; нафтила; инденила; инданила; тетралинила; C3-10 циклоалкила; 4-7-членного гетероциклила; и 8-11-членного гетеробициклила, где Т необязательно замещен одной или более группами R3, которые являются одинаковыми или различными;
R3 представляет собой галоген; CN; оксо (=O); COOR5; OR5; C(O)R5; C(O)N(R5R5a); S(O)2N(R5R5a); S(O)N(R5R5a); S(O)2R5; S(O)R5; N(R5)S(O)2N(R5aR5b); SR5; N(R5R5a); NO2; OC(O)R5; N(R5)C(O)R5a; N(R5)S(O)2R5a; N(R5)S(O)R5a; N(R5)C(O)OR5a; N(R5)C(O)N(R5aR5b); OC(O)N(R5R5a); или С1-6 алкил, где С1-6 алкил необязательно замещен одной или более группами галоген, которые являются одинаковыми или различными; и
R4, R4a, R5, R5a, R5b независимо выбираются из группы, состоящей из Н; или C16 алкила, где С1-6 алкил необязательно замещен одной или более группами галоген, которые являются одинаковыми или различными.
Предпочтительно, R01 представляет собой С1-6 алкил. Даже более предпочтительно, R01 выбирается из -СН2-, -СН2-СН2- и -СН2-СН2-СН2-.
Предпочтительно, R02 выбирается из Н и C1-6 алкила.
Предпочтительно, R03 представляет собой С1-6 алкила.
Предпочтительно, R04 представляет собой С1-6 алкила.
Предпочтительно, Ar выбирается из группы, состоящей из

 и
и 
где
пунктирные линии, помеченные звездочками, показывают присоединение к Т формулы (VIIa), и непомеченные пунктирные линии означают присоединение к остатку PG0 формулы (VIIa);
W представляет собой независимо друг от друга О, S или N;
W' представляет собой N; и
где Ar необязательно замещен одной или более группами заместителей, выбранных из группы, состоящей из NO2, Cl и F.
Более предпочтительно, PG0 формулы (VIIa) выбирается из группы, состоящей из
 и
и 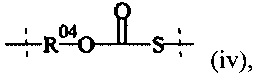
где
пунктирные линии, отмеченные звездочками, показывают присоединение к Т формулы (VIIa), и непомеченные линии показывают присоединение к сере формулы (VIIa); и
Ar, R01, R02, R03 и R04 описаны выше.
Более предпочтительно, PG0 формулы (VIIa) представляет собой
где
пунктирные линии, помеченные звездочками, показывают присоединение к Т формулы (VIIa), и непомеченные пунктирные линии показывают присоединение к сере формулы (VIIa).
Наиболее предпочтительно, PG0 формулы (VIIa) представляет собой
где
пунктирные линии, помеченные звездочками, показывают присоединение к Т формулы (VIIa), и непомеченные пунктирные линии показывают присоединение к сере формулы (VIIa).
В одном предпочтительном варианте выполнения настоящего изобретения Т формулы (VIIa) представляет собой Н.
В другом варианте выполнения настоящего изобретения, Т формулы (VIIa) содержит полимерную составляющую. Предпочтительно, Т формулы (VIIa) содержит полимер, выбранный из группы, состоящей из 2-метакрилоил-оксиэтил фосфоил холины, поли(акриловые кислоты), поли(акрилаты), поли(акриламиды), поли(акрилокси) полимеры, поли(амиды), поли(амидоамины), поли(аминокислоты), поли(ангидриды), поли(аспартамиды), поли(масляные кислоты), поли(гликолевые кислоты), полибутилен терефталаты, поли(капролактоны), поли(карбонаты), поли(цианоакрилаты), поли(диметилакриламиды), поли(сложные эфиры), поли(этилены), поли(алкиленгликоли), поли(этиленоксиды), поли(этилфосфаты), поли(этилоксазолины), поли(гликолиевые кислоты), поли(гидроксиэтилакрилаты), поли(гидроксиэтил-оксазолины), поли(гидроксиметакрилаты), поли(гидроксипропилметакриламиды), поли(гидроксипропилметакрилаты), поли(гидроксипропилоксазолины), поли(иминокарбонаты), поли(молочные кислоты), со(поли)меры молочные и гликолиевых кислот, поли(метакриламиды), поли(метакрилаты), поли(метилоксазолины), поли(органофосфазены), поли(сложные ортоэфиры), поли(оксазолины), поли(пропиленгликоли), поли(силоксаны), поли(уретаны), поли(виниловые спирты), поли(виниламин), поли(винилметиловые простые эфиры), поли(винилпирролидоны), силиконы, целлюлозы, карбометилцеллюлозы, гидроксипропилметилцеллюлозы, хитины, хитозаны, декстраны, декстрины, желатины, гиалуроновые кислоты и производные, функционализированные гиалуроновые кислоты, маннаны, пектины, рамногалактуронаны, крахмалы, гидроксиалкилакрахмалы, гидроксиэтилкрахмалы и другие полимеры на основе углеводов, ксиланы, и их сополимеры.
Если Т формулы (VIIa) представляет собой полимерную составляющую, Т предпочтительно имеет молекулярную массу по меньшей мере 1 кДа, предпочтительно по меньшей мере 3 кДа и наиболее предпочтительно по меньшей мере 5 кДа. Если Т формулы (VIIa) представляет собой полимерную составляющую, она предпочтительно имеет молекулярную массу самое большое 1000 кДа, например, самое большое 800 кДа, самое большое 500 кДа, самое большое 250 кДа, самое большое 200 кДа или самое большое 100 кДа.
В другом варианте выполнения настоящего изобретения, Т формулы (VIIa) содержит аффинный лиганд. Предпочтительно, Т формулы (VIIa) содержит, более предпочтительно Т представляет собой аффинную лигандную составляющую, выбранную из группы, включающей 4-аминобензамидин, 3-(2'-аминобензгидрилокси)тропан, ε-аминокапроил-р-хлорбензиламид, 1-амино-4-[3-(4,6-дихлортриазин-2-иламино)-4-сульфофениламино]антрахинон-2-сульфоновую кислоту, 2-(2'-амино-4'-метилфенилтио)-N,N-диметилбензиламин дигидрохлорид, ангиопоэтин-1, аптамеры, аротиноидную кислоту, авидин, биотин, кальмодулин, кокаэтилен, цитоспорон В, N,N-дигексил-2-(4-фторфенил)индол-3-ацетамид, N,N-дипропил-2-(4-хлорфенил)-6,8-дихлор-имидазо[1,2-а]пиридин-3-ацетамид, 5-фтор-2'-деоксиуридин 5'-(п-аминофенил) монофосфат, S-гексил-L-глутатион, (S,S)-4-фенил-α-(4-фенилоксазолидин-2-илиден)-2-оксазолин-2-ацетонитрил, Pro-Leu-Gly гидроксамат, 2-(4-(2-(трифторметил)фенил)пиперидин-1-карбоксамидо)бензойную кислоту, триметил(м-аминофенил)аммония хлорид, урокотин III, кофакторы, такие как аденозин трифосфат, s-аденозил метионин, аскорбиновую кислоту, кобаламин, коэнзим А, коэнзим В, коэнзим М, коэнзим Q, коэнзим F420, цитидинтрифосфат, фламин мононуклеотид, флавин аденин динуклеотид, глутатион, гем, липоамид, менахинон, метанофуран, метилкобаламин, молибдоптерин, NAD+, NADP+, нуклеотидные сахара, 3'-фосфоаденозин-5'-фосфосульфат, пиридоксалфосфат, полигистидины, пирролхинолин хинон, рибофлавин, стрептавидин, тетрагидробиоптерин, тетрагидрометаноптерин, тетрагидрофолиевую кислоту, белок-носитель биотинкарбоксила (ВССР), хитин-связывающий белок, FK506-связывающие белки, FLAG метку, зеленый флуорисцнтный белок, глутатион-S-трансфераза, гемагглятинин, мальтоза-связывающий белок, myc метку, NusA, эпитоп белка С, S-метку, strep-метку, тиоредоксины, триазины и фрагменты антител.
Если Т формулы (VIIa) содержит аффинный лиганд, аффинный лиганд предпочтительно представляет собой полигистидин.
В другом варианте выполнения настоящего изобретения, Т формулы (VIIa) содержит заряженную составляющую. Предпочтительно, Т формулы (VIIa) содержит по меньшей мере один положительный и/или отрицательный заряд. Понятно, что число положительных и отрицательных зарядов Т является неравным для получения заряженной молекулы Т.
Предпочтительно, Т формулы (VIIa) содержит по меньшей мере один положительный или отрицательный заряд, например, по меньшей мере два положительных или отрицательных заряда, по меньшей мере три положительных или отрицательных заряда, по меньшей мере четыре положительных или отрицательных заряда, по меньшей мере пять положительных или отрицательных зарядов, по меньшей мере шесть положительных или отрицательных зарядов, по меньшей мере семь положительных или отрицательных зарядов, по меньшей мере восемь положительных или отрицательных зарядов, по меньшей мере девять положительных или отрицательных зарядов, по меньшей мере десять положительных или отрицательных зарядов, по меньшей мере одиннадцать положительных или отрицательных зарядов, по меньшей мере двенадцать положительных или отрицательных зарядов, по меньшей мере тринадцать положительных или отрицательных зарядов, по меньшей мере четырнадцать положительных или отрицательных зарядов или по меньшей мере пятнадцать положительных или отрицательных зарядов.
Более предпочтительно, Т формулы (VIIa) содержит по меньшей мере один положительный заряд, как например один положительный заряд, два положительных заряда, три положительных заряда, четыре положительных заряда, пять положительных зарядов, шесть положительных зарядов, семь положительных зарядов, восемь положительных зарядов, девять положительных зарядов, десять положительных зарядов, одиннадцать положительных зарядов, двенадцать положительных зарядов, тринадцать положительных зарядов, четырнадцать положительных зарядов или пятнадцать положительных зарядов. Более предпочтительно, Т формулы (VIIa) содержит один положительный заряд, два положительных заряда, три положительных заряда, четыре положительных заряда, пять положительных зарядов, шесть положительных зарядов, семь положительных зарядов или восемь положительных зарядов. Более предпочтительно, Т формулы (VIIa) содержит два положительных заряда, три положительных заряда, четыре положительных заряда, пять положительных зарядов или шесть положительных зарядов.
Предпочтительно, по меньшей мере один положительный заряд Т формулы (VIIa) обеспечивается аммонием или фосфонием.
Предпочтительно, Т формулы (VIIa) содержит полиамид, содержащий по меньшей мере один остаток четвертичного аммония и/или по меньшей мере один пртонированный остаток аммония, необязательно содержащие другие функциональные группы. Предпочтительно, такие необязательные другие функциональные группы представляет собой аминные функциональные группы. Предпочтительно, Т формулы (VIIa) содержит по меньшей мере один остаток четвертичного аммония и/или по меньшей мере один пртонированный остаток аммония. Даже более предпочтительно, Т формулы (VIIa) содержит четыре остатка четвертичного аммония и/или четыре протонированных остатка аммония.
Предпочтительно, Т формулы (VIIa) содержит в связанной форме полиамин. Более предпочтительно, Т формулы (VIIa) содержит в связанной форме полиамин, выбранный из группы, состоящей из этилендиамина, 1,3-диаминопропана, гексаметилендиамина, кадаверина, путресцина, спермина, спермидина, норспермидина и тетраэтилметилендиамина.
Даже более предпочтительно, Т формулы (VIIa) содержит составляющую формулы (а):
где
пунктирная линия показывает присоединение к PG0;
R1, R1a, R1b, R2, R2a, R2b, R3, R3a, R3b, R4, R4a, R4b независимо друг от друга представляют собой Н или метил;
каждый m независимо друг от друга равен 1, 2, 3, 4, 5, 6, 7 или 8;
каждый n независимо друг от друга равен 1, 2, 3, 4, 5, 6, 7 или 8;
каждый x независимо друг от друга равен 1, 2, 3, 4, 5, 6, 7 или 8:
каждый y независимо друг от друга равен 0, 1, 2, 3, 4, 5, 6, 7 или 8; и
SP представляет собой спейсерную составляющую.
Предпочтительно, составляющая формулы (а) является симметричной, т.е. составляющая
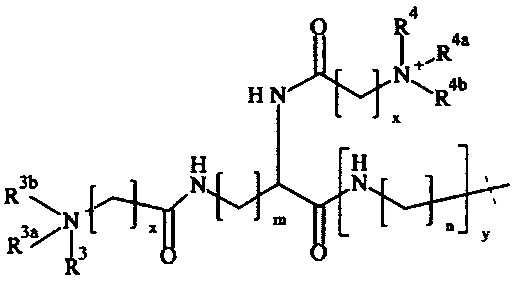
является такой же, как составляющая
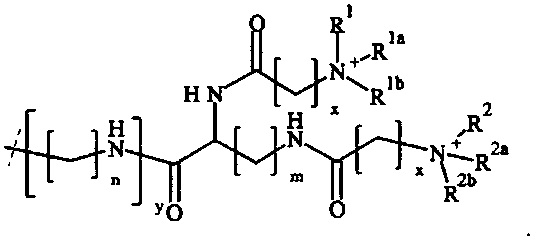
В одном варианте выполнения настоящего изобретения R1, Rla, Rlb формулы (а) все представляют собой метил.
В другом варианте выполнения настоящего изобретения R1 формулы (а) представляет собой Н, и Rla и R1b формулы (а) оба представляют собой метил.
В одном варианте выполнения настоящего изобретения R2, R2a, R2b формулы (а) все представляют собой метил.
В другом варианте выполнения настоящего изобретения R2 формулы (а) представляет собой Н, и R2a и R2b формулы (а) оба представляют собой метил.
В одном варианте выполнения настоящего изобретения R3, R3a, R3b формулы (а) все представляют собой метил.
В другом варианте выполнения настоящего изобретения R3 формулы (а) представляет собой Н, и R3a и R3b формулы (а) оба представляют собой метил.
В одном варианте выполнения настоящего изобретения R4, R4a, R4b формулы (а) все представляют собой метил.
В другом варианте выполнения настоящего изобретения R4 формулы (а) представляет собой Н, и R4a и R4b формулы (а) оба представляет собой метил.
Предпочтительно, m формулы (а) равно 1, 2, 3, 4, 5 или 6. Более предпочтительно, m формулы (а) равно 2, 3, 4 или 5, даже более предпочтительно, m формулы (а) равно 3, 4 или 5, и наиболее предпочтительно, m формулы (а) равно 4.
Предпочтительно, n формулы (а) равно 1, 2, 3, 4, 5 или 6. Более предпочтительно, n формулы (а) равно 2, 3, 4 или 5, даже более предпочтительно, n формулы (а) равно 2, 3 или 4, и наиболее предпочтительно, n формулы (а) равно 3.
Предпочтительно, x формулы (а) равно 1, 2, 3, 4, 5 или 6. Более предпочтительно, n формулы (а) равно 1, 2, 3 или 4, даже более предпочтительно, x формулы (а) равно 1, 2 или 3, и наиболее предпочтительно, x формулы (а) равно 1.
Предпочтительно, y формулы (а) равно 1, 2, 3, 4, 5 или 6. Более предпочтительно, y формулы (а) равно 1, 2, 3 или 4, даже более предпочтительно, y формулы (а) равно 1, 2 или 3, и наиболее предпочтительно, y формулы (а) равно 1.
В одном предпочтительном варианте выполнения настоящего изобретения, R1, Rla, Rlb, R2, R2a, R2b, R3, R3a, R3b, R4, R4a, R4b представляют собой метил; m равно 4; n равно 3; y равно 1, и x равно 1.
В другом предпочтительном варианте выполнения настоящего изобретения, R1, R2, R3, R4 представляют собой Н; Rla, Rlb, R2a, R2b, R3a, R3b, R4a, R4b представляют собой метил, m равно 4; n равно 3; y равно 1, и x равно 1.
Предпочтительными противоионами для Т формулы (I) являются Cl-, TFA- и  .
.
Если Ay1 имеет формулу (VIIa), и Т представляет собой метку, тогда Т может применяться для очистки реагента формулы (VII) линкер пролекарства-биологически активная составляющая, который имеет определенное количество составляющих Ayl-L на составляющую D, из смеси реагентов формулы (VII) линкер пролекарства-биологически активная составляющая, в которых каждый D связан с x составляющими Ay1-L, и где x представляет собой положительное целое число, такое как 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. Т может, таким образом, применяться для выделения моноконъюгатов реагента формулы (VII) линкер пролекарства-биологически активная составляющая.
Способ выделения моноконъюгатов линкер пролекарства-биологически активная составляющая зависит от метки Т формулы (VIIa).
Если Т формулы (VIIa) представляет собой полимерную составляющую с молекулярной массой по меньшей мере 10% (мас./мас.) для D формулы (VII), стадия выделения предпочтительно представляет собой эксклюзионную хроматографию по размерам.
Если Т формулы (VIIa) содержит аффинный лиганд, стадия предпочтительно представляет собой аффинную хроматографию.
Если Т формулы (VIIa) содержит заряженную составляющую, стадия выделения предпочтительно представляет собой ион-обменную хроматографию.
В предпочтительном варианте выполнения настоящего изобретения Т формулы (VIIa) представляет собой заряженную составляющую, и стадия выделения предпочтительно представляет собой ион-обменную хроматографию.
Предпочтительно, стадия (е) способа содержит стадию реакции конъюгата гидрогель-спейсер со стадии (d) с реагентом формулы (VII) пролекарство-биологически активная составляющая.
Подходящие условия реакции описаны в части «Примеры» и известны специалистам в данной области техники.
Соответственно, способ получения пролекарства, связанного с носителем, предпочтительно содержит стадии:
(d) реакция гидрогеля со стадии (b) или (с) со спейсерным реагентом формулы (VI)
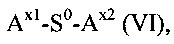
где
S0 выбирается из группы, состоящей из С1-50 алкила, С2-50 алкенила и С2-50 алкинила, фрагменты которых необязательно прерываются одной или более группами, выбранными из -NH-, -N(C1-4 алкила)-, -О-, -S, -С(О)-, -C(O)NH, -C(O)N(C1-4 алкила)-, -О-С(О)-, -S(O)-, -S(O)2-, 4-7-членного гетероциклила, фенила и нафтила;
Ax1 представляет собой функциональную группу для реакции с аминной группой гидрогеля, и
Ax2 представляет собой функциональную группу;
в присутствии растворителя с получением конъюгата гидрогель-спейсер; и
(е) реакцию конъюгата гидрогель-спейсер со стадии (d) с реагентом формулы (VII) линкер пролекарства-биологически активная составляющая
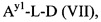
где
Ay1 представляет собой функциональную группу для реакции с функциональной группой Ax2 конъюгата гидрогель-спейсер со стадии (d),
L представляет собой линкер пролекарства;
D представляет собой биологически активную составляющую;
в присутствии растворителя, с получением пролекарства, связанного с носителем.
Предпочтительные комбинации Ax2 и Ay1 описаны выше.
Реагент линкера пролекарства и составляющая линкера пролекарства как часть реагента линкер пролекарства-биологически активная составляющая могут иметь структуру любой составляющей линкера пролекарства, известной в данной области техники.
Предпочтительный линкер пролекарства описывается в и может быть получен как описывается в WO 2005/099768 А2. Соответственно, предпочтительный реагент Ayl-L-D линкер пролекарства-биологически активная составляющая имеет структуру формулы (h-i) или (h-ii):
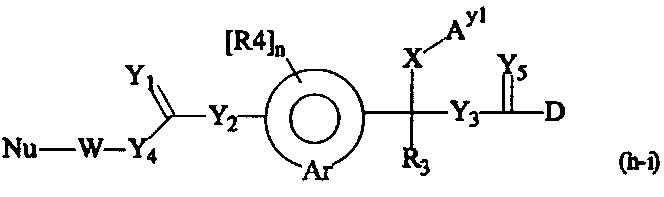
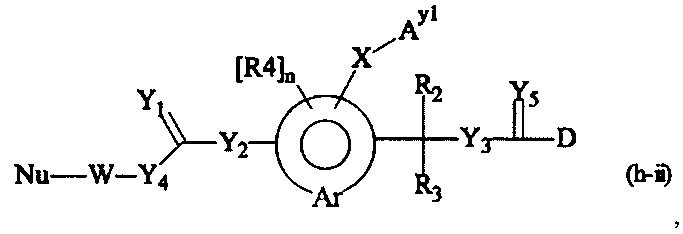
где
Ay1 представляет собой функциональную группу, как определено для стадии (е),
D представляет собой биологически активную составляющую, которая связана с L через аминную группу соответствующего лекарственного средства;
X представляет собой спейсерную составляющую, такую как R5-Y6,
Y1, Y2 независимо представляют собой О, S или NR6,
Y3, Y5 независимо представляют собой О или S,
Y4 представляет собой О, NR6 или C(R7)(R8)-,
Y6 представляет собой О, S, NR6, сукцинимид, малеимид, насыщенные углерод-углеродные связи или любой гетероатом, содержащую свободную электронную пару, или отсутствует,
R2, R3 независимо друг от друга выбираются из водорода, замещенного или незамещенного линейного, разветвленного или циклического алкила или гетероалкила, арилов, замещенных арилов, замещенного или незамещенного гетероарила, циано, нитро, галоген, карбокси, карбоксилалкила, алкилакарбонила или карбоксамидоалкила;
R4 выбирается из водорода, замещенного или незамещенного линейного, разветвленного или циклического алкила или гетероалкила, арила, замещенного арила, замещенного или незамещенного гетероарила, замещенного или незамещенного линейного, разветвленного или циклического алкокси, замещенного или незамещенного линейного, разветвленного или циклического гетероакрилокси, арилаокси или гетероарилаокси, циано, галогена,
R5 выбирается из замещенного или незамещенного линейного, разветвленного или циклического алкила или гетероалкила, арилов, замещенных арилов, замещенных или незамещенных гетероарилов,
R6 выбирается из водорода, замещенного или незамещенного линейного, разветвленного или циклического алкила или гетероалкила, арилов, замещенных или незамещенных гетероарилов,
R7, R8 независимо выбираются из водорода, замещенного или незамещенного линейного, разветвленного или циклического алкила или гетероалкила, арилов, замещенных арилов, замещенных или незамещенных гетероарилов, карбоксиалкила, алкилакарбонил, карбоксамидоалкила, циано или галоген,
W выбирается из замещенного или незамещенного линейного, разветвленного или циклического алкила, арилов, замещенных арилов, замещенного или незамещенного линейного, разветвленного или циклического гетероалкила, замещенных или незамещенных гетероарилов,
Nu представляет собой нуклеофил,
n равно нулю или целому положительному числу, и
Ar представляет собой многозамещенный ароматический углеводород или многозамещенный ароматический гетероцикл.
Необходимо понимать, что в формулах (h-i) и (h-ii) L соответствует составляющей, связывающей Ay1 и D.
Предпочтительно, R2, R3, R4, R5, R6, R7 и R8 в формулах (h-i) и (h-ii) независимо выбираются из Н, С1-6 алкила, С2-6 алкенила и С2-6 алкинила.
Предпочтительно, Y6 в формуле (h-i) и (h-ii) представляет собой C1-20 алкил, С2-20 алкенил или С2-20 алкинил.
Предпочтительно, Nu в формулах (h-i) и (h-ii) выбирается из группы нуклеофилов, состоящей из первичных, вторичных и третичных аминогрупп, тиола, карбоновой кислоты, гидроксиламина, гидразина и азот-содержащего гетероарила.
Предпочтительно, W в формулах (h-i) и (h-ii) представляет собой -(CR9R10)b-, где R9 и R10 независимо выбираются из Н, С1-6 алкила, С2-6 алкенила и С2-6 алкинила, и где b равно 1, 2, 3, 4 или 5.
Предпочтительно, n в формулах (h-i) и (h-ii) равно 0, 1 или 2, более предпочтительно, n равно 0 или 1, и наиболее предпочтительно n равно 0.
Предпочтительно, Ar в формулах (h-i) и (h-ii) выбирается из
Другие предпочтительные линкеры пролекарств раскрываются в и могут быть получены как описано в WO 2006/136586 А2. Соответственно, предпочтительный реагент линкер пролекарства-биологически активная составляющая Ay1-L-D имеет структуру формулы (h-iii), (h-iv) или (h-v):
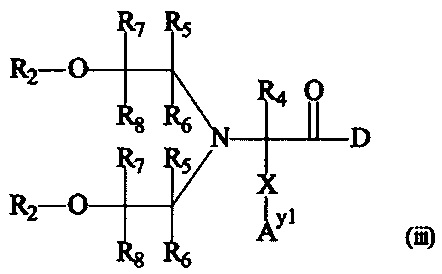
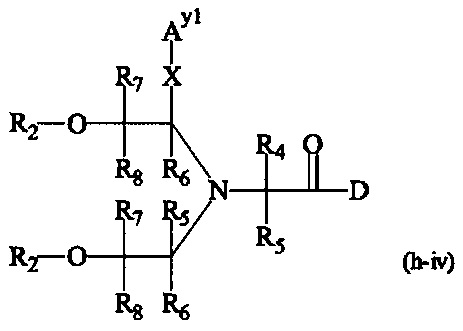
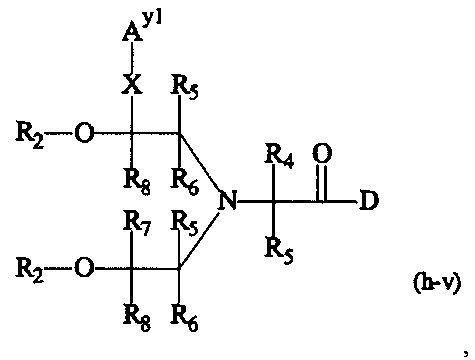
где
Ayl представляет собой функциональную группу, как определено для стадии (е);
D представляет собой биологически активную составляющую, которая связана с L через аминную группу соответствующего лекарственного средства, с образованием амидной связи;
X представляет собой спейсерную составляющую, такую как R13-Y1;
Y1 представляет собой О, S, NR6, сукцинимид, малеимид, насыщенные углерод-углеродные связи или любой гетероатом, содержащий свободную электронную пару, или отсутствует;
R13 выбирается из замещенного или незамещенного линейного, разветвленного или циклического алкила или гетероалкила, арилов, замещенных арилов, замещенных или незамещенных гетероарилов;
R2 и R3 независимо выбираются из водорода, ацильных групп или защитных групп для гидроксильных групп;
R4-R12 независимо выбираются из водорода, замещенного или незамещенного линейного, разветвленного или циклического алкила или гетероалкила, арилов, замещенных арилов, замещенных или незамещенных гетероарилов, циано, нитро, галогена, карбокси, карбоксамида.
Необходимо понимать, что в формулах (h-iii), (h-iv) и (h-v) L соответствует составляющей, связывающей Ay1 и D.
Предпочтительно, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 в формулах (h-iii), (h-iv) и (h-v) независимо выбираются из Н, C1-6 алкила, С2-6 алкенила и С2-6 алкинила.
Предпочтительно, в формулах (h-iii), (h-iv) и (h-v) Y1 представляет собой C1-20 алкил, С2-20 алкенил или С2-20 алкинил.
Другие предпочтительные линкеры пролекарств раскрываются в и могут быть получены как описано в WO 2009/095479 А2. Соответственно, предпочтительный реагент линкер пролекарства-биологически активная составляющая Ay1-L-D имеет структуру формулы (h-vi):

где
Ay1 представляет собой функциональную группу, как определено для стадии (е);
D представляет собой биологически активную составляющую, которая соединена с остатком молекулы через ароматический амин соответствующего лекарственного средства путем образования амидной связи;
X представляет собой C(R4R4a); N(R4); О; C(R4R4a)-C(R5R5a); C(R5R5a)-C(R4R4a); C(R4R4a)-N(R6); N(R6)-C(R4R4a); C(R4R4a)-O; или O-C(R4R4a);
X1 представляет собой С; или S(O);
X2 представляет собой C(R7, R7a); или C(R7, R7a)-C(R8, R8a);
R1, Rla, R2, R2a, R3, R3a, R4, R4a, R5, R5a, R6, R7, R7a, R8, R8a независимо выбираются из группы, состоящей из Н; и С1-4 алкила;
необязательно, одна или более пар Rla/R4a, R1a/R5a, R4a/R5a, R4a/R5a, R7a/R8a образуют химическую связь;
необязательно, одна или более пар R1/Rla, R2/R2a, R4/R4a, R5/R5a, R7/R7a, R8/R8a соединяются вместе с атомом, к которому они присоединены, с образованием С3-8 циклоалкила; или 4-7-членного гетероциклила;
необязательно, одна или более пар R1/R4, R1/R5, R1/R6, R4/R5, R7/R8, R2/R3 соединяются вместе с атомом, к которому они присоединены, с образованием кольца А;
необязательно, R3/R3a соединяются вместе с атомом, к которому они присоединены, с образованием 4-7-членного гетероцикла;
A выбирается из группы, состоящей из фенила; нафтила; инденила; инданила; тетралинила; С3-10 циклоалкила; 4-7-членного гетероциклила; и 8-11-членного гетеробициклила;
при условии, что один водород из R1, Rla, R2, R2a, R3, R3a, R4, R4a, R5, R5a, R6, R7, R7a, R8 или R8a замещен на Ay1.
Понятно, что в формуле (h-vi) L соответствует составляющей, связывающей Ay1 и D.
Другие предпочтительные линкеры пролекарств раскрываются в или могут быть получены как описано в WO 2011/012721 А1 и WO 2011/012722 А1. Соответственно, предпочтительный реагент линкер пролекарства-биологически активная составляющая Ayl-L-D имеет структуру формулы (h-vii):
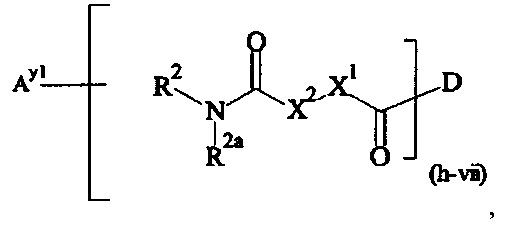
где
D представляет собой биологически активную составляющую, которая соединена с остатком молекулы через ароматический амин соответствующего лекарственного средства путем образования амидной связи;
Ay1 представляет собой функциональную группу, как определено для стадии (е);
X1 представляет собой C(R1Rla) или циклический фрагмент, выбранный из С3-8 циклоалкила, 4-7-членного гетероциклила, фенила, нафтила, инденила, инданила, тетралинила или 8-11-членного гетеробициклила,
где
если X1 представляет собой циклический фрагмент, указанный циклический фрагмент включен в L1 через два соседних кольцевых атома, и кольцевой атом X1, который является соседним с атомом углерода амидной связи, также представляет собой атом углерода;
X2 представляет собой химическую связь или выбирается из C(R3R3a), N(R3), О, C(R3R3a)-C(R4R4a), C(R3R3a)-N(R4), N(R3)-C(R4R4a), C(R3R3a)-O или O-C(R3R3a),
где
если X1 представляет собой циклический фрагмент, X2 представляет собой химическую связь, C(R3R3a), N(R3) или О;
необязательно, если X1 представляет собой циклический фрагмент, и X2 представляет собой C(R3R3a), порядок X1 фрагмента и X2 фрагмента внутри L1 может быть изменен, и циклический фрагмент включается в L1 через два соседних кольцевых атома;
R1, R3 и R4 независимо выбираются из группы, состоящей из Н, С1-4 алкила и -N(R5R5a);
Rla, R2, R3a, R4a и R5a независимо выбираются из группы, состоящей из Н, и С1-4 алкила;
R5 представляет собой C(O)R6;
R6 представляет собой С1-4 алкил;
необязательно, одна из пар Rla/R4a, R3a/R4a или Rla/R3a образует химическую связь;
при условии, что один водород из R1, Rla, R2, R2a, R3, R3a, R4, R4a, R5, R5a или R6 замещен на Ay1.
Понятно, что в формуле (h-vii) L соответствует составляющей, связывающей Ay1 и D.
Другие предпочтительные линкеры пролекарств раскрываются в или могут быть получены как описано в WO 2011/089214 А1. Соответственно, предпочтительный реагент линкер пролекарства-биологически активная составляющая Ayl-L-D имеет структуру формулы (h-viii):
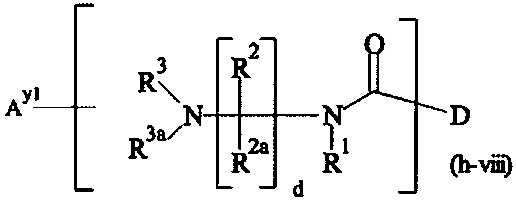
где
Ay1 представляет собой функциональную группу, как определено для стадии (е);
D представляет собой биологически активная составляющая, которая соединена с остатком молекулы через ароматический гидроксил (-ОН) соответствующего лекарственного средства путем образования карбаматной связи;
R1 выбирается из группы, состоящей из С1-4 алкила; гетероалкила; С3-8 циклоалкила; и
R2, R2a, R3 и R3a независимо выбираются из водорода, замещенного или незамещенного линейного, разветвленного или циклического С1-4 алкила или гетероалкила;
каждый d независимо равен 2, 3 или 4;
при условии, что один водород из R1, R2, R2a, R3 или R3a замещен на Ay1.
Понятно, что в формуле (h-viii) L соответствует составляющей, связывающей Ay1 и D.
Другие предпочтительные линкеры пролекарств раскрываются в или могут быть получены как описано в WO 2011/089216 А1. Соответственно, предпочтительный реагент линкер пролекарства-биологически активная составляющая Ay1-L-D имеет структуру формулы (h-ix):
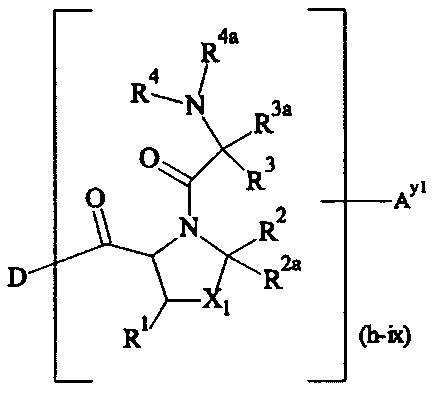
где
Ay1 представляет собой функциональную группу, как определено для стадии (е);
D представляет собой биологически активную составляющую, которая соединена с остатком молекулы через алифатический амин соответствующего лекарственного средства путем образования амидной связи;
X1 выбирается из О, S или CH-R1a;
R1 и Rla независимо выбираются из Н, ОН, CH3;
R2, R2a, R4 и R4a независимо выбираются из Н и С1-4 алкила,
R3 и R3a независимо выбираются из Н, С1-4 алкила, и R5;
R5 выбирается из
где
пунктирные линии означают присоединение к остальной части составляющей.
при условии, что один водород из R1, R1a, R2, R2a, R3, R3a, R4, R4a и R5 замещен на Ayl.
Понятно, что в формуле (h-ix) L соответствует составляющей, связывающей Ay1 и D.
Предпочтительно, R3 формулы (h-ix) представляет собой Н, и R3a формулы (h-ix) представляет собой R5.
Предпочтительно, один из R4/R4a формулы (h-ix) представляет собой Н.
Необязательно, одна или более пар R3/R3a, R4/R4a, R3/R4 формулы (h-ix) может независимо образовывать один или более циклические фрагменты, выбранные из С3-8 циклоалкила, 4-7-членного гетероциклила или 8-11-членного гетеробициклила.
Необязательно, R3, R3a, R4 и R4a формулы (h-ix) замещены С1-6 алкилом, С2-6 алкенилом, С2-6 алкинилом, фенилом, 4-7-членным гетероциклилом или галогеном.
Другие предпочтительные линкеры пролекарств раскрываются в или могут быть получены как описано в WO 2011/089215 А1. Соответственно, предпочтительный реагент линкер пролекарства-биологически активная составляющая Ayl-L-D имеет структуру формулы (h-x):
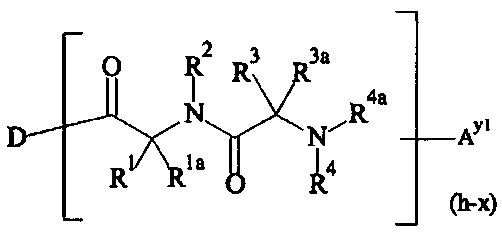
где
Ayl представляет собой функциональную группу, как определено для стадии (е);
D представляет собой биологически активную составляющую, которая соединена с остатком молекулы через ароматический амин соответствующего лекарственного средства путем образования амидной связи;
R1, Rla, R2, R3, R3a, R4 и R4a независимо выбираются из Н и C1-4 алкила;
необязательно, любые два из R1, Rla, R2, R3, R3a, R4 и R4a могут независимо образовывать один или более циклические фрагменты, выбранные из С3-8 циклоалкила, 4-7-членного гетероциклила, фенила, нафтила, инденила, инданила, тетралинила или 8-11-членного гетеробициклила;
необязательно, R1, Rla, R2, R3, R3a, R4 и R4a замещены заместителем, выбранным из группы, состоящей из С1-6 алкила, С2-6 алкенила, С2-6 алкинила, С38 циклоалкила, 4-7-членного гетероциклила, фенила, нафтила, инденила, инданила, тетралинила или 8-11-членного гетеробициклила;
при условии, что один водород из R1, Rla, R2, R3, R3a, R4 и R4a замещен на Ayl.
Понятно, что в формуле (h-x) L соответствует составляющей, связывающей Ay1 и D.
Другие предпочтительные линкеры пролекарств раскрываются в или могут быть получены как описано в РСТ/ЕР2012/065748. Соответственно, предпочтительный реагент линкер пролекарства-биологически активная составляющая Ayl-L-D имеет структуру формулы (h-xi):
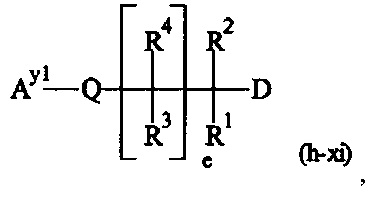
где
Ay1 представляет собой функциональную группу, как определено для стадии (е);
D представляет собой биологически активную составляющую, которая соединена с остатком молекулы через группу карбоновой кислоты (-(C=O)-OH) соответствующего лекарственного средства путем образования карбоксильной сложноэфирной связи;
R1 выбирается из группы из незамещенного алкила; замещенного алкила; незамещенного фенила; замещенного фенила; незамещенного нафтила; замещенного нафтила; незамещенного инденила; замещенного инденила; незамещенного инданила; замещенного инданила; незамещенного тетралинила; замещенного тетралинила; незамещенного С3-10 циклоалкила; замещенного С3-10 циклоалкила; незамещенного 4-7-членного гетероциклила; замещенного 4-7-членного гетероциклила; незамещенного 8-11-членного гетеробициклила; и замещенного 8-11-членного гетеробициклила;
R2 выбирается из Н, незамещенного алкила, и замещенного алкила
R3 и R4 независимо выбираются из группы, состоящей из Н, незамещенного алкила, и замещенного алкила;
e равно 0 или 1;
необязательно, R1 и R3 соединены вместе с атомом, к которому они присоединены, с образованием кольца А;
A выбирается из группы, состоящей из С3-10 циклоалкила; 4-7-членного алифатического гетероциклила; и 8-11-членного алифатического гетеробициклила, где A является незамещенным или замещенным;
Q выбирается из группы, состоящей из С1-50 алкила, С2-50 алкенила или С2-50 алкинила, фрагменты которых необязательно прерываются одной или более группами, выбранными из -NH-, -N(C1-4 алкила)-, -О-, -S-, -С(О)-, -C(O)NH-, -C(O)N(C1-4 алкила)-, -О-С(О)-, -S(O)-, -S(O)2-, 4-7-членного гетероциклила, фенила или нафтила.
Понятно, что в формуле (h-xi) L соответствует составляющей, связывающей Ay1 и D.
Другие предпочтительные линкеры пролекарств раскрываются в или могут быть получены как описано в ЕР 12165516. Соответственно, предпочтительный реагент линкер пролекарства-биологически активная составляющая Ayl-L-D имеет структуру формулы (h-xii):
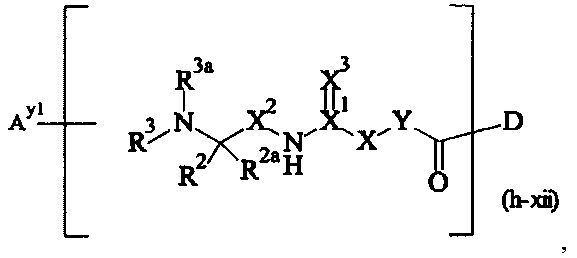
где
Ayl представляет собой функциональную группу, как определено для стадии (е);
D представляет собой биологически активную составляющую, которая соединена с остатком молекулы через гидроксильную группу соответствующего лекарственного средства путем образования сложноэфирной или карбаматной связи;
Y представляет собой -C(R1)R1a)-; или -N(R1)-;
X представляет собой -C(R4)(R4a)-; -N(R4)-; -О-; -C(R4)(R4a)-C(R5)R5a)-; -C(R4)R4a)-N(R6)-; N(R6)-C(R4)(R4a)-; -C(R4)(R4a)-O-; -O-C(R4)(R4a)-; -C(O)-N(R6)-; или N(R6)C(O);
X1 представляет собой 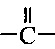 или;
или; 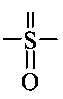
X2 представляет собой -C(R7)(R7a)-; или -C(R7)(R7a)-C(R8)(R8a)-;
X3 представляет собой =O; =S; или =N-CN;
R1, R1a, R2, R2a, R3, R3a, R4, R4a, R5, R5a, R6, R7, R7a, R8, R8a независимо выбираются из группы, состоящей из Н; C1-6 алкила, С2-6 алкенила, С2-6 алкинила, С1-20 гетероалкила и Y1-T; и независимо ни от чего, одна или более пар Rla/R4a, Rla/R5a, R4a/R5a, R7a/R8a отсутствуют, и соответствующие атомы углерода, к которым они присоединены, образуют цис-двойную связь;
Y1 представляет собой химическую связь или C1-6 алкил, С2-6 алкенил, С2-6 алкинил;
Т выбирается из группы, состоящей из фенила; нафтила; инденила; инданила; тетралинила; С3-10 циклоалкила; 4-7-членного гетероциклила; или 8-11-членного гетеробициклила, где Т необязательно замещен одной или более группами R9, которые являются одинаковыми или различными;
R9 представляет собой галоген; -CN; оксо (=O); -С(O)ОН; -ОН; S(O)2NH2; S(O)NH2; S(O)2OH; S(O)OH; SH; NH2; NO2; C1-6 алкил или С1-10 гетероалкил;
необязательно, одна или более из пар R1/Rla, R1/R4, R1/R6, R1/R5, R2/R2a, R2/R3, R4/R4a, R4/R5, R5/R5a, R7/R7a, R7/R8, R8/R8a соединяются вместе с атомом, к которому они присоединены, с образованием кольца Т;
необязательно, R3/R3a соединяются вместе с атомом, к которому они присоединены, с образованием 4-7-членного гетероцикла;
при условии, что один водород из R1, Rla, R2, R2a, R3, R3a, R4, R4a, R5, R5a, R6, R7, R7a, R8 или R8a замещен на Ayl.
Понятно, что в формуле (h-xii) L соответствует составляющей, связывающей Ay1 и D.
В предпочтительном варианте выполнения настоящего изобретения, реагент линкер пролекарства-биологически активная составляющая Ayl-L-D имеет формулу (h-i) или (h-ii).
В другом предпочтительном варианте выполнения настоящего изобретения, реагент линкер пролекарства-биологически активная составляющая Ay1-L-D имеет формулу (h-vi).
Любое лекарственное средство, которое содержит по меньшей мере одну функциональную группу, может быть коъюгировано с реагентом линкера пролекарства с получением реагента линкера пролекарства-биологически активная составляющая Ay1-L-D. Такое лекарственное средство выбирается из группы, состоящей из полипептидов, белков и олигонуклеотидов. Предпочтительно, лекарственное средство представляет собой белок.
Предпочтительно, D имеет молекулярную массу в интервале от 2 до 500 кДа, более предпочтительно от 5 до 250 кДа, более предпочтительно от 5 до 100 кДа и наиболее предпочтительно от 10 до 60 кДа.
В одном варианте выполнения настоящего изобретения лекарственное средство представляет собой белковое лекарственное средство. Предпочтительно, лекарственное средство представляет собой белковое лекарственное средство, которое модулирует активность одной или более биологических мишеней, выбранных из следующего: основной фактор роста фибробластов (bFGF), кислотный фактор роста фибробластов (aFGF), трансформирующие факторы роста альфа (TGFa), трансформирующие факторы роста бета (TGFβ), фактор роста тромбоцитов (PDGF), ангиогенин, фактор роста эндотелиальных клеток, полученных из тромбоцитов (PD-ECGF), интерлейкин-1 (IL-1) интерлейкин-8 (IL-8), интерлейкин-12, васкулярный эндотелиальный фактор роста (VEGF), ангиопоэтин-1, Del-I, фоллистатин, гранулоцитарный колониестимулирующий фактор (G-CSF), фактор роста гепатоцитов (HGF), лептин, мидкин, плацентный фактор роста, плеотрофин (PTN), програнулин, пролиферин, фактор некроза опухолей альфа (TNF-alpha), ангиоаррестин, ангиостатин (фрагмент плазминтогена), антиангиогенный анти-тромбин III, ингибитор, полученный из хряща (CDI), фрагмент комплимента CDS9, эндостатин (фрагмент коллагена XVIII), фрагмент фибронектина, gro-beta, гепариназы, гепарин гексасахаридный фрагмент, человеческий хорионический гонадотропин (hCG), интерферон альфа/бета/гамма, интерферон-индуцирующий белок (IP-IO), kringle S (фрагмент плазминтогена), ингибитора металлопротеиназ (TIMPs), 2-метоксиэстрадиол, ингибитор плацентарной рибонуклеазы, ингибитор активатора плазминтогена, тромбоцитарный фактор-4 (PF4), фрагмент пролактина 16 kD, пролиферин-связанный белок (PRP), ретиноиды, тетрагидрокортизол-S, тромбоспондин-1 (TSP-I), васкулостатин, и вакостатин (фрагмент калретикулина), простагландин, гормон роста, инсулин-подобный фактор роста-I (IGF-I), сфингозин-1-фосфат, фактор D, RTP801, ингибиторы комплимента, включая С1, С3 и С5, α2 адренергический агонист, mTOR, цилиарный нейротрофический фактор (CNTF), нейротрофический фактор головного мозга (BDNF), нейротрофический фактор, полученный из глиальных клеток (GDNF), фактор роста, выделяемый из эпителия (LEDGF), фактор жизнеспособности род полученных конус (RdCVF), фактор пигментного эпителия (PEDF).
Если лекарственное средство представляет белок, он предпочтительно выбираются из группы, включающей АСТН, аденозин деаминаза, агалзидаза, альбумин, альфа-1 антитрипсин (ААТ), альфа-1 протеиназы ингибитор (API), алглюкозидаза, алтеплаза, антистреплаза, анкрод серии протеаза, антитела (моноклональные или поликлональные и фрагменты или гибриды), антитромбин III, антитрипсины, апротинины, аспарагиназы, бифалин, костно-морфогенетические белки, кальцитонин (лосося), коллагеназа, DNаза, эндорфины, энфувиритид, энцефалины, эритропоетины, фактор Vila, фактор VIII, фактор Villa, фактор IX, фибринолизин, гибридные белки, фолликуло-стимулирующие гормоны, гранулоцитарный колониестимулирующий фактор (Г-КСФ), галактозидаза, глюкагон, глюкагоноподобные пептиды типа GLP-1, глюкоцереброзидаза, гранулоцитарный-моноцитарный колониестимулирующий фактор (GM-CSF), хорионический гонадотропин (hCG), гемоглобины, вакцины гепатита В, гирудин, гиалуронидазы, идурнонидаза, иммуноглобулины, вакцины против простуды, интерлейкины (1 альфа, 1 бета, 2, 3, 4, 6, 10, 11, 12), антагонист рецептора IL-1 (rhlL-1ra), инсулины, интерфероны (альфа 2а, альфа 2b, альфа 2с, бета 1a, бета 1b, гамма 1a, гамма 1b), фактор роста кератиноцитов (KGF), лактаза, левпролид, левотироксин, лютеинизирующий гормон, вакцина Лайма, натрийуретические пептиды, панкрелипазы, папаин, паращитовидный гормон, PDGF, пепсин, фосфолипаза-активирующий белок (PLAP), тромбоцит-активирующий фактор ацетилгидролаза (PAF-AH), пролактин, белок С, октреотид, секретин, серморелин, пероксидисмутаза (SOD), соматропины (гормон роста), соматостатин, стерптокиназа, сукраза, фрагмент тетанотоксина, тилактаза, тромбины, тимозин, тиреостимулирующий гормон, тиротропин, трансформирующие факторы роста, фактор некроза опухолей (TNF), TNF рецептор-lgG Fc, тканевой активатор плазминогена (tPA), трансферрин, TSH, уратоксидаза и урокиназа.
Если лекарственное средство представляет собой антитело, оно может быть моноклональным или поликлональным антителом или их фрагментом или слиянием. Предпочтительные фрагменты антител выбираются из группы, включающей Fab (фрагмент, антиген-связывающий), F(ab)2 фрагменты, Fc (фрагмент, кристаллизуемый), pFc' фрагмент, Fv (фрагмент, вариабельный), scFv (одноцепочечный вариабельный фрагмент), ди-scFv/диатела, биспецифичные Т-клеточные антитела, CDRs (области, определяющие комплементарность), одно-доменные антитела (sdABs/нанотела), тяжелые цепи (α, δ, ε, γ, μ) или фрагменты тяжелой цепи, легкие цепи (λ, κ) или фрагменты легкой цепи, VH фрагменты (вариабельная область тяжелой цепи), VL фрагменты (вариабельная область легкой цепи), VHH фрагменты и VNAR фрагменты.
Если лекарственное средство представляет собой аффинный каркасный белок, он предпочтительно выбирается из группы, состоящей из полученных из акул аффинных каркасных белков, Kunitz домен-происходящих аффинных каркасных белков, сентюрин-происходящих аффинных каркасных белков, убиквитин-происходящих аффинных каркасных белков, липокалин-происходящих аффинных каркасных белков, анкирин-происходящих аффинных каркасных белков, versabodies (дисульфид-богатых аффинных каркасных белков), фибронектин-происходящих аффинных каркасных белков, камелоид-происходящих фрагментов антител и аффинных каркасных белков, llama-происходящих фрагментов антител и аффинных каркасных белков, трансферрин-происходящих аффинных каркасных белков, и протеазных ингибиторов сквош-типа с цистеин-knot scaffold-происходящих аффинных каркасных белков.
Другим объектом настоящего изобретения является пролекарство, связанное с носителем, полученное способом получения пролекарства, связанного с носителем, согласно настоящему способу.
Такое пролекарство, связанное с носителем, высвобождает молекулы лекарственного средства с периодом полураспада в интервале от 1 часа до двенадцати месяцев, например, от 6 часов до двенадцати месяцев, от двенадцати часов до одиннадцати месяцев, от одного для до десяти месяцев, от трех дней до девяти месяцев, от шести дней до девяти месяцев, от одной недели до девяти месяцев, от двух недель до семи месяцев, от трех недель до восьми месяцев, от четырех недель до восьми месяцев, от шести недель до семи месяцев, от восьми недель до семи месяцев, от десяти недель до шести месяцев, от двенадцати недель до шести месяцев или от шестнадцати недель до пяти месяцев.
Другим объектом настоящего изобретения является фармацевтическая композиция, содержащая пролекарства, связанные с носителем, согласно настоящему изобретению или их фармацевтическую соль вместе с фармацевтически приемлемым эксципиентом.
Другим объектом настоящего изобретения является пролекарство, связанное с носителем, согласно настоящему изобретению или фармацевтическая композиция, содержащая пролекарство, связанное с носителем, согласно настоящему изобретению для применения в качестве медикамента.
Другим объектом настоящего изобретения является способ лечения, контроля, замедления или профилактики у млекопитающего пациента, предпочтительно у человека, нуждающегося в этом, одного или более состояний, включающий введение указанному пациенту терапевтически эффективного количества пролекарства, связанного с носителем, согласно настоящему изобретению или фармацевтической композиции, содержащей пролекарство, связанное с носителем, согласно настоящему изобретению или его фармацевтически приемлемой соли.
Примеры
Вещества и способы
Вещества:
Амино 4-arm ПЭГ5000 приобрели у JenKem Technology, Beijing, P.R. China. Cithrol™ DPHS приобрели у Croda International Pic, Cowick Hall, United Kingdom.
цис-1,4-циклогександикарбоновую кислоту приобрели у TCI EUROPE N.V., Boerenveldseweg 6 - Haven 1063, 2070 Zwijndrecht, Belgium.
Изопропилмалоновую кислоту приобрели у ABCR GmbH & Co. KG, 76187 Karlsruhe, Germany.
Монобензиловый сложный эфир глутаровой кислоты приобрели у IRIS Biotec GmbH, 95615 Marktredwitz, Germany.
N-(3-малеимидопропил)-21-амино-4,7,10,13,16,19-гексаокса-генэйкозановой кислоты сложный пентафторфениловый эфир (малеимид-NH-ПЭГ6-PFE) и N-(3-малеимидопропил)-39-амино-4,7,10,13,16,19,22,25,28,31,34,37-додекаокса-нонатриконтановой кислоты сложной пентафторфениловый сложный эфир (малеимид-NH-ПЭГ12-PFE) приобрели у Biomatrik Inc., Jiaxing, P.R. China.
Oxyma pure и Fmoc-L-Asp(OtBu)-OH приобрели у Merck Biosciences GmbH, Schwalbach/Ts, Germany.
(5-метил-2-оксо-1,3-диоксо-4-ил)-метил 4-нитрофенил карбонат приобрели у Chemzon Scientific Inc., Lachine, QC, Canada.
Все другие химические вещества приобрели у Sigma-ALDRICH Chemie GmbH, Taufkirchen, Germany.
Способы:
Обращенно-фазовую ВЭЖХ проводили на колонке 100×20 мм и 100×40 мм С18 ReproSil-Pur 300 ODS-3 5 мкм (Dr. Maisch, Аммербух, Германия), в составе ВЭЖХ-системы Waters 600 HPLC System и с детектором поглощения Waters 2487. Применяли линейный градиент раствора А (0.1% ТФУК в H2O) и раствора В (0.1% ТФУК в ацетонитриле). ВЭЖХ-фракции, содержащие продукт, собрали и лиофилизовали.
Флэш-хроматографические очистки осуществляли на системе Isolera One от Biotage АВ, Sweden, с применением картриджей силикагеля Biotage KP-Sil и н-гептана, этилацетата и метанола в качестве элюентов. Продукты обнаруживали при 254 нм. Для продуктов, не показывающих поглощение при длине волны 240 нм, фракции подвергали скринингу с помощью LC/MS.
Аналитическая ультра-эффективная LC (UPLC) осуществлялась на системе Waters Acquity, оборудованной колонкой Waters ВЕН300 С18 (2.1×50 мм, 1.7 мкм размер частиц), совмещенной с масс-спектометром LTQ Orbitrap Discovery от Thermo Scientific.
ВЭЖХ-масс-спектрометрия с ионизацией электрораспылением (HPLC-ESI-MS) осуществлялась на Waters Acquity UPLC с детектором Acquity PDA, совмещенным с Thermo LTQ Orbitrap Discovery масс-спектрометром высокого разрешения высокой точности, оборудованном колонкой Waters ACQUITY UPLC ВЕН300 С18 RP (2.1×50 мм, 300 Å, 1.7 мкм, скорость потока: 0.25 мл/минута; растворитель A: UP-H2O + 0.04% TFA, растворитель В: UP-ацетонитрил + 0.05% TFA.
MS спектр ПЭГ продуктов показал ряд (СН2СН2О)n составляющих благодаря полидисперсности исходных ПЭГ-материалов. Для более легкой интерпритации в примерах приводится только один представительный сигнал m/z.
Пример 1
Синтез реагента основной цепи 1a, 1g, и 1h:
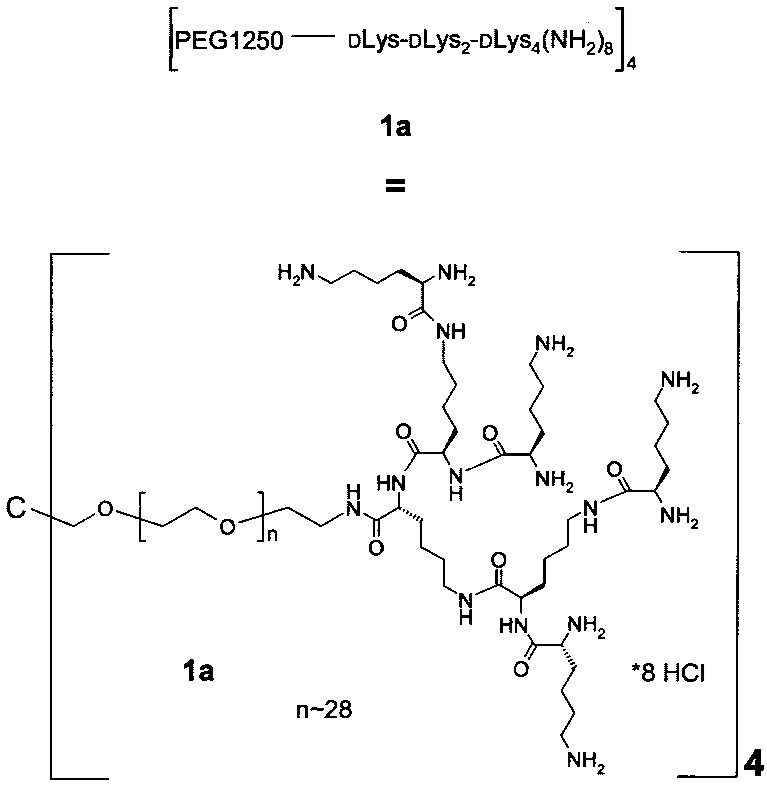
Реагент основной цепи 1а синтезировали как описано в примере 1 в WO 2011/012715 А1, за исключением применения Boc-DLys(Boc)-OH вместо Вос-LLys(Boc)-OH.
MS: m/z 888.50 = [М+10Н+]10+ (вычислено = 888.54)
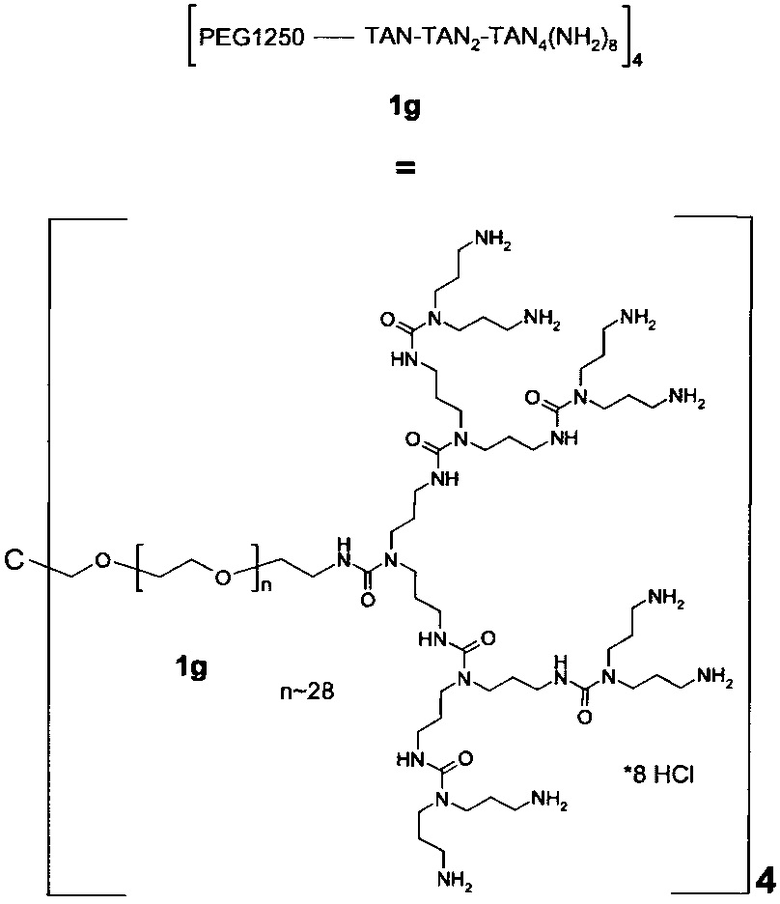
Реагент основной цепи 1g синтезировали из амино 4-arm ПЭГ5000 1b согласно следующей схеме:
Для синтеза соединения 1b, амино 4-arm ПЭГ5000 (MW около 5350 г/моль, 10.7 г, 2.00 ммоль, HCl соль) и бис(пентафторфенил)карбонат (4.73 г, 12.0 ммоль) растворили в 43 мл DCM (безводный), и DIPEA (3.10 г, 24.0 ммоль, 4.18 мл) добавили при комнатной температуре. Через 10 минут, 1,9-бис-boc-1,5,9-тиазанон (5.30 г, 16.0 ммоль) добавили, и смесь перемешивали в течение 15 минут. Затем дополнительный 1,9-бис-boc-1,5,9-тиазанон (0.33 г, 1.0 ммоль) добавили. После полного растворения, реакционную смесь отфильтровали, и растворитель выпарили при комнатной температуре.
Остаток растворили в 40 мл iPrOH и разбавили с применением 320 мл МТВЕ. Продукт осаждался всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 200 мл холодного МТВЕ (0°C). Продукт высушивали in vacuo всю ночь.
Выход 11.1 г (83%) твердое вещество белого цвета 1b.
MS: m/z 1112.86 = [М+6Н]6+ (вычислено = 1113.04).
Для синтеза соединения 1с, boc-защищенное соединение 1b (11.1 г, 1.66 ммоль) растворили в 40 мл 3 М HCl в МеОН и перемешивали в течение 20 минут при 45°C, затем в течение 10 минут при 55°C. Для осаждения, 10 мл МеОН и 200 мл МТВЕ добавили, и смесь хранили в течение 16 часов при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3 и промыли с применением 200 мл холодного МТВЕ (0°C). Продукт высушивали in vacuo всю ночь.
Выход 9.14 г (89%) порошок белого цвета 1c (HCl соль).
MS: m/z 979.45 = [M+6H]6+ (вычислено = 979.55).
Для синтеза соединения 1d, соединение 1с (9.06 г, 1.47 ммоль, HCl соль) и бис(пентафторфенил)карбонат (6.95 г, 17.6 ммоль) растворили в 50 мл DCM (безводный) и DIPEA (4.56 г, 35.3 ммоль, 6.15 мл) добавили при комнатной температуре. Через 10 минут, 1,9-бис-boc-1,5,9-тиазанон (7.80 г, 23.5 ммоль) добавили, и смесь перемешивали в течение 15 минут. Затем дополнительный 1,9-бис-boc-1,5,9-тиазанон (0.49 г, 1.5 ммоль) добавили. После полного растворения, растворитель выпарили при комнатной температуре.
Остаток растворили в 35 мл iPrOH при 40°C и разбавили с применением 200 мл МТВЕ. Продукт осаждался всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 200 мл холодного МТВЕ (0°C). Продукт высушивали in vacuo всю ночь с получением 1d в виде твердого вещества белого цвета.
Выход 11.6 г (90%) твердого вещества белого цвета 1d.
MS: m/z 1248.08 = [М+7Н]7+ (вычислено = 1248.27).
Для синтеза соединения 1е, boc-защищенное соединение 1d (11.4 г, 1.31 ммоль) растворили в 40 мл 3 М HCl в МеОН и перемешивали в течение 20 минут при 45°C, затем в течение 10 минут при 55°C. Для осаждения, 10 мл МеОН и 200 мл МТВЕ добавили, и смесь хранили в течение 16 часов при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3 и промыли с применением 200 мл холодного МТВЕ (0°C). Продукт высушивали in vacuo всю ночь с получением порошка белого цвета 1е.
Выход 7.60 г (75%) порошка белого цвета 1e (HCl соль).
MS: m/z 891.96 = [М+8Н]8+ (вычислено = 892.13).
Для синтеза соединения 1f, соединение 1е (7.56 г, 0.980 ммоль, HCl соль) и бис(пентафторфенил)карбонат (9.27 г, 23.0 ммоль) растворили в 250 мл DCM (безводный) и DIPEA (6.08 г, 47.0 ммоль, 8.19 мл) добавили при 35°C. Через 10 минут, 1,9-бис-boc-1,5,9-тиазанон (5.30 г, 16.0 ммоль) добавили, и смесь перемешивали в течение 15 минут. Затем дополнительный 1,9-бис-boc-1,5,9-тиазанон (0.33 г, 1.0 ммоль) добавили. После полного растворения, растворитель выпарили при комнатной температуре.
Остаток растворили в 250 мл iPrOH при 60°C и разбавили с применением 1350 мл МТВЕ. Продукт осаждался всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 400 мл холодного МТВЕ (0°C). Продукт высушивали in vacuo всю ночь с получением 1f в виде стекловидного твердого вещества.
Выход 11.1 г (83%) стекловидного твердого вещества 1f.
MS: m/z 1312.01 = [М+10Н]10+ (вычислено = 1312.21).
Для синтеза реагента основной цепи 1g, boc-защищенное соединение 1f (7.84 г, 0.610 ммоль) растворили в 16 мл МеОН при 37°C, и 55 мл предварительно охлажденный раствор 4 М HCl (4°C) в диоксане добавили при комнатной температуре. Смесь перемешивали без охлаждения в течение 20 минут. Через 20 минут 110 мл 3М HCl в МеОН добавили. Раствор распределили по 24 пробиркам фирмы Falcon (50 мл) и осаждали путем добавления 40 мл холодного МТВЕ (-20°C) в каждую пробирку фирмы Falcon. После центрифугирования при 3214 rcf в течение 1 минуты, супернатант отделили, и стекловидное твердое вещество растворили в 5 мл МеОН на пробирку фирмы Falcon и осадили путем добавления 40 мл холодного МТВЕ (-20°C) в каждую пробирку фирмы Falcon еще раз. Супернатант отделили, и оставшееся твердое вещество высушивали in vacuo всю ночь.
Выход 5.74 г (87%) стекловидного вещества белого цвета 1g (HCl соль).
MS: m/z 965.46 = [M+10H]10+ (вычислено = 965.45).
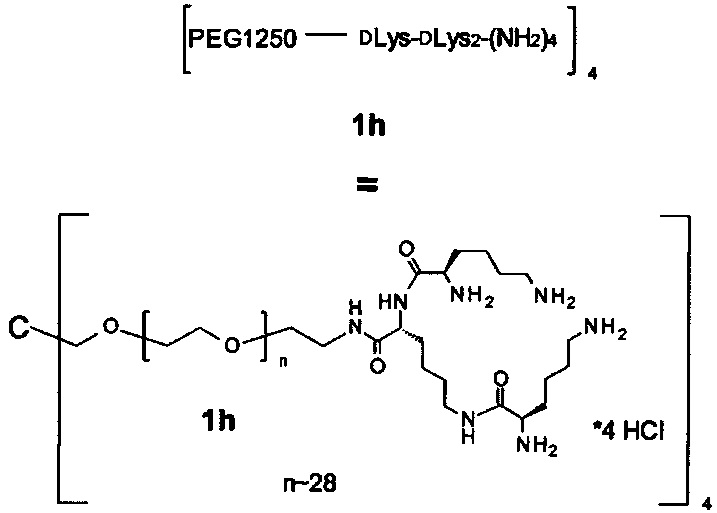
Реагент основной цепи 1h синтезировали как описано для соединения 1е в примере 1 в WO 2011/012715 А1, за исключением применения Boc-DLys(Boc)-OH вместо Boc-LLys(Boc)-OH.
MS: m/z 848.52 = [М+8Н+]8+ (вычислено = 848.57)
Пример 2
Синтез поперечно-сшивающих реагентов 2d, 2g, rac-2k, rac-2o, 2s, 2v, rac-2y, 2ac, 2ag и 2ak
Поперечно-сшивающий реагент 2e получили из азелаиновой кислоты сложного монобензилового эфира и ПЭГ 10000 согласно следующей схеме:
Для синтеза азелаиновой кислоты сложного монобензилового эфира 2а, смесь азелаиновой кислоты (37.6 г, 200 ммоль), бензилового спирта (21.6 г, 200 ммоль), п-толуолсульфоновой кислоты (0.80 г, 4.2 ммоль), и 240 мл толуола нагревали с отгонкой флегмы в течение 7 часов в устройстве Dean-Stark. После охлаждения, растворитель выпарили, и 300 мл насыщенного водного раствора NaHCO3 добавили. Эту смесь экстрагировали с применением 3×200 мл МТВЕ. Объединенные органические фазы высушили над Na2SO4; и растворитель выпарили. Продукт очистили на 2×340 г силикагеля с применением этил ацетат/гептан (10:90→25:75) в качестве элюента. Элюент выпарили, и остаток высушивали in vacuo всю ночь.
Выход 25.8 г (46%) бесцветного масла 2а.
MS: m/z 279.16 = [М+Н]+ (вычислено = 279.16).
Для синтеза соединения 2b, азелаиновой кислоты сложный монобензиловый эфир 2а (3.90 г, 14.0 ммоль) и ПЭГ 10000 (40.0 г, 4.00 ммоль) растворили в 64 мл дихлорметан и охладили на ледяной бане. Раствор DCC (2.89 г, 14.0 ммоль) и DMAP (0.024 г, 0.020 ммоль) в 32 мл дихлорметана добавили. Ледяную баню удалили, и смесь перемешивали при комнатной температуре всю ночь. Полученную суспензию охладили до 0°C, и твердое вещество отфильтровали. Растворитель выпарили in vacuo.
Остаток растворили в 65 мл дихлорметана и разбавили с применением 308 мл МТВЕ при комнатной температуре. Смесь хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 250 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 40.8 г (97%) порошка белого цвета 2b.
MS: m/z 835.50 = [М+14Н]14+ (вычислено = 835.56).
Для синтеза соединения 2с, соединение 2b (40.6 г, 3.86 ммоль) растворили в метил ацетате (250 мл), и 203 мг палладия на угле добавили. В атмосфере водорода при давлении окружающей среды, смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь отфильтровали через слой целита, и фильтрат выпарили и высушивали in vacuo всю ночь.
Выход 37.2 г (93%) стекловидного твердого вещества 2с.
MS: m/z 882.53 = [М+13Н]13+ (вычислено = 882.51).
Для синтеза соединения 2d, соединение 2с (32.0 г, 3.10 ммоль) и TSTU (3.73 г, 12.4 ммоль) растворили в 150 мл дихлорметана при комнатной температуре. Затем DIPEA (1.60 г, 12.4 ммоль) добавили, и смесь перемешивали в течение 1 часа. Полученную суспензию отфильтровали, и фильтрат разбавили с применением 170 мл дихлорметана, промыли с применением 140 мл раствора 750 г воды / 197 г NaCl / 3 г NaOH. Органическую фазу высушивали над MgSO4, и растворитель выпарили in vacuo.
Остаток растворили в 200 мл толуола, разбавили с применением 180 мл МТВЕ при комнатной температуре и хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 100 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 28.8 г (88%) порошка белого цвета 2d.
MS: m/z 795.47 = [М+15Н]15+ (вычислено = 795.54).
Поперечно-сшивающий реагент 2g получили из азелаиновой кислоты сложного монобензилового эфира и ПЭГ 6000 согласно следующей схеме:
Для синтеза соединения 2е, азелаиновой кислоты сложный монобензиловый эфир 2а (6.50 г, 23.3 ммоль) и ПЭГ 6000 (40.0 г, 6.67 ммоль) растворили в 140 мл дихлорметана и охладили на ледяной бане. Раствор DCC (4.81 г, 23.3 ммоль) и DMAP (0.040 г, 0.33 ммоль) в 40 мл дихлорметана добавили. Ледяную баню удалили, и смесь перемешивали при комнатной температуре всю ночь. Полученную суспензию охладили до 0°C и твердое вещество отфильтровали. Растворитель выпарили in vacuo.
Остаток растворили в 70 мл дихлорметана и разбавили с применением 300 мл МТВЕ при комнатной температуре. Смесь хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 500 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 41.2 г (95%) порошка белого цвета 2е.
MS: m/z 833.75 = [М+8Н]8+ (вычислено = 833.74).
Для синтеза соединения 2f, соединение 2е (41.2 г, 6.32 ммоль) растворили в метил ацетате (238 мл) и этаноле (40 мл), затем 400 мг палладия на угле добавили. В атмосфере водорода при давлении окружающей среды, смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь отфильтровали через слой целита и фильтрат выпарили и высушивали in vacuo всю ночь.
Выход 38.4 г (96%) стекловидного твердого вещества 2f.
MS: m/z 750.46 = [М+9Н]9+ (вычислено = 750.56).
Для синтеза соединения 2g, соединение 2f (38.2 г, 6.02 ммоль) и TSTU (7.25 г, ммоль) растворили в 130 мл дихлорметана при комнатной температуре. Затем DIPEA (3.11 г, 24.1 ммоль) добавили, и смесь перемешивали в течение 1 часа. Полученную суспензию отфильтровали, фильтрат разбавили с применением 100 мл дихлорметана и промыли с применением 200 мл раствора 750 г воды / 197 г NaCl / 3 г NaOH. Органическую фазу высушивали над MgSO4, и растворитель выпарили in vacuo.
Остаток растворили в 210 мл толуола, разбавили с применением 430 мл МТВЕ при комнатной температуре и хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 450 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 35.8 г (91%) порошка белого цвета 2g.
MS: m/z 857.51 = [М+8Н]8+ (вычислено = 857.51).
Поперечно-сшивающий реагент 2k получили из изопропилмалоновой кислоты сложного монобензилового эфира и ПЭГ 10000 согласно следующей схеме:
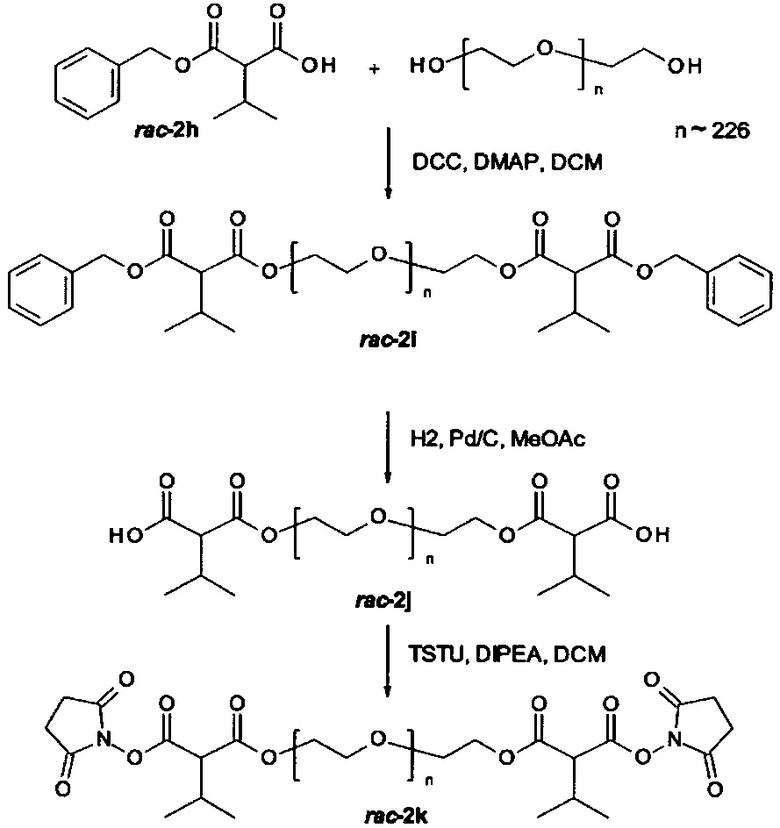
Для синтеза изопропилмалоновой кислоты сложного монобензилового эфира rac-2h, изопропилмалоновую кислоту (35.0 г, 239 ммоль), бензиловый спирт (23.3 г, 216 ммоль) и DMAP (1.46 г, 12.0 ммоль) растворили в 100 мл ацетонитрила. Смесь охладили до 0°C с применением ледяной бани. Раствор DCC (49.4 г, 239 ммоль) в 150 мл ацетонитрила добавили в течение 15 минут при 0°C. Ледяную баню удалили, и реакционную смесь перемешивали всю ночь при комнатной температуре, затем твердое вещество отфильтровали. Фильтрат выпарили при 40°C in vacuo, и остаток растворили в 300 мл МТВЕ. Этот раствор экстрагировали с применением 2×300 мл насыщенного водного раствора NaHCO3, затем объединенные водные фазы подкислили до рН=1-3 с применением 6 Н соляной кислоты. Оставшуюся эмульсию экстрагировали с применением 2×300 мл МТВЕ, и растворитель выпарили. Объединенные органические фазы промыли с применением 200 мл насыщенного водного раствора NaCl и высушивали над MgSO4. Продукт очистили на 340 г силикагеля с применением этил ацетат/гептан (10:90→20:80) в качестве элюента. Элюент выпарили, и остаток высушивали in vacuo всю ночь.
Выход 9.62 г (17%) бесцветного масла rac-2h.
MS: m/z 237.11 = [М+Н]+ (вычислено = 237.11).
Для синтеза соединения rac-2i, изопропилмалоновой кислоты сложный монобензиловый эфир rac-2h (945 г, 4.00 ммоль) и ПЭГ 10000 (10.0 г, 4.00 ммоль) растворили в 20 мл дихлорметана и охладили на ледяной бане. Раствор DCC (825 мг, 4.00 ммоль) и DMAP (6 мг, 0.05 ммоль) в 10 мл дихлорметане добавили. Ледяную баню удалили, и смесь перемешивали при комнатной температуре всю ночь. Полученную суспензию охладили до 0°C, и твердое вещество отфильтровали. Растворитель выпарили in vacuo.
Остаток растворили в 20 мл дихлорметана и разбавили с применением 150 мл МТВЕ при комнатной температуре. Смесь хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 500 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 9.63 г (92%) порошка белого цвета rac-2i.
MS: m/z 742.50 = [М+16Н]16+ (вычислено = 742.51).
Для синтеза соединения rac-2j, соединение rac-2i (3.38 г, 0.323 ммоль) растворили в метил ацетате (100 мл), и 105 мг палладия на угле добавили. В атмосфере водорода при давлении окружающей среды, смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь отфильтровали через слой целита и фильтрат выпарили и высушивали in vacuo всю ночь.
Выход 3.25 г (98%) стекловидного твердого вещества rac-2j.
MS: m/z 731.25 = [М+16Н]16+ (вычислено = 731.25).
Для синтеза соединения rac-2k, соединение rac-2j (3.10 г, 0.302 ммоль) и TSTU (0.364 г, 1.21 ммоль) растворили в 15 мл дихлорметана при комнатной температуре. Затем DIPEA (0.156 г, 1.21 ммоль) добавили, и смесь перемешивали в течение 45 минут. Полученную суспензию отфильтровали, и фильтрат промыли с применением 2×10 мл 0.5 М фосфатного буфера рН=6.5. Органическую фазу высушивали над MgSO4, и растворитель выпарили in vacuo. Остаток растворили в 20 мл толуола, разбавили с применением 10 мл МТВЕ при комнатной температуре и хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 250 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 2.66 г (84%) порошка белого цвета rac-2k.
MS: m/z 743.37 = [М+16Н]16+ (вычислено = 743.38).
Поперечно-сшивающий реагент rac-2о получили из цис-1,4-циклогександикарбоновой кислоты и ПЭГ 10000 согласно следующей схеме:
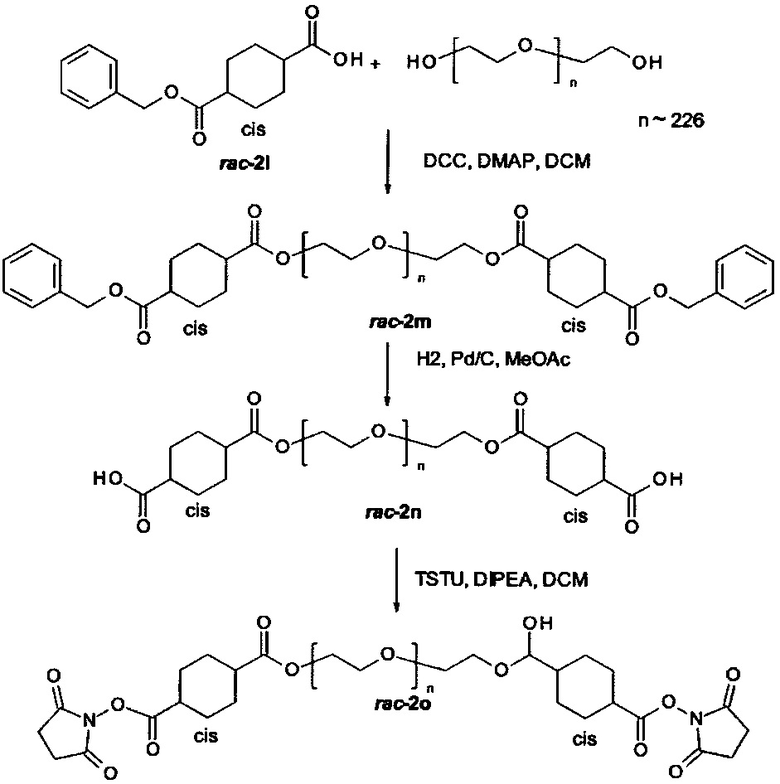
Для синтеза цис-1,4-циклогександикарбоновой кислоты сложного монобензилового эфира rac-21, цис-1,4-циклогександикарбоновую кислоту (20.0 г, 116 ммоль), бензиловый спирт (11.3 г, 105 ммоль) и DMAP (710 мг, 5.81 ммоль) растворили в 200 мл THF. Смесь охладили до 0°C с применением ледяной бани. Раствор DCC (49.4 г, 239 ммоль) в 100 мл THF добавили в течение 15 минут при 0°C. Ледяную баню удалили, и реакционную смесь перемешивали всю ночь при комнатной температуре, затем твердое вещество отфильтровали. Фильтрат выпарили при 40°C, и остаток растворили в 300 мл МТВЕ. Этот раствор экстрагировали с применением 2×300 мл насыщенного водного раствора NaHCO3, затем объединенные водные фазы подкислили до рН=1-3 с применением 6H соляной кислоты. Оставшуюся эмульсию экстрагировали с применением 2×300 мл МТВЕ, и растворитель выпарили. Объединенные органические фазы промыли с применением 200 мл насыщенного водного раствора NaCl и высушивали над MgSO4. Продукт очистили на 340 г силикагеля с применением этилацетат/гептан (10:90→20:80) в качестве элюента. Элюент выпарили, и остаток в виде бесцветного масла кристаллизовали в ходе сушки in vacuo всю ночь.
Выход 4.82 г (16%) бесцветных кристаллов rac-2l.
MS: m/z 263.13 = [М+Н]+ (вычислено = 263.13).
Для синтеза соединения rac-2m, цис-1,4-циклогександикарбоновой кислоты сложный монобензиловый эфир rac-2l (2.10 г, 8.00 ммоль) и ПЭГ 10000 (20.0 г, 10.0 ммоль) растворили в 50 мл дихлорметана и охладили на ледяной бане. Раствор DCC (1.65 г, 8.00 ммоль) и DMAP (0.012 г, 0.10 ммоль) в 25 мл дихлорметана добавили. Ледяную баню удалили, и смесь перемешивали при комнатной температуре всю ночь. Полученную суспензию охладили до 0°C, и твердое вещество отфильтровали. Растворитель выпарили in vacuo.
Остаток растворили в 55 мл дихлорметана и разбавили с применением 300 мл МТВЕ при комнатной температуре. Смесь хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 250 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 18.2 г (87%) порошка белого цвета rac-2m.
MS: m/z 745.76 = [М+16Н]16+ (вычислено = 745.77).
Для синтеза соединения rac-2n, соединение rac-2m (9.00 г, 0.857 ммоль) растворили в метил ацетате (100 мл), и 157 мг палладия на угле добавили. В атмосфере водорода при давлении окружающей среды, смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь отфильтровали через слой целита и фильтрат выпарили и высушивали in vacuo всю ночь.
Выход 8.83 г (100%) стекловидного твердого вещества rac-2n.
MS: m/z 734.50 = [М+16Н]16+ (вычислено = 734.50).
Для синтеза соединения rac-2о, соединение rac-2n (8.92 г, 0.864 ммоль) и TSTU (1.04 г, 3.64 ммоль) растворили в 35 мл дихлорметана при комнатной температуре. Затем DIPEA (0.447 г, 3.46 ммоль) добавили, и смесь перемешивали в течение 45 минут. Полученную суспензию отфильтровали, и фильтрат промыли с применением 2×10 мл 0.5 М фосфатного буфера рН=6.5. Органическую фазу высушивали над MgSO4, и растворитель выпарили in vacuo.
Остаток растворили в 50 мл толуола, разбавили с применением 25 мл МТВЕ при комнатной температуре и хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 400 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 7.62 г (84%) порошка белого цвета rac-2о.
MS: m/z 702.60 = [М+16Н]16+ (вычислено = 702.59).
Поперечно-сшивающий реагент 2s получили из пробковой кислоты сложного монобензилового эфира и ПЭГ 10000 соответственно согласно следующей схеме:
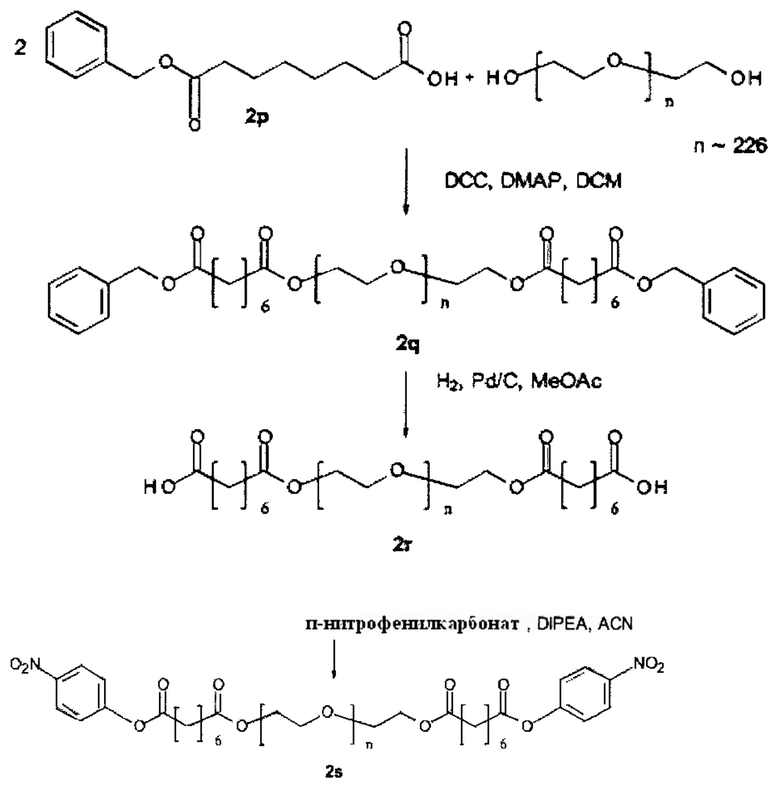
Пробковой кислоты сложный монобензиловый эфир 2р синтезировали из пробковой кислоты и бензилового спирта в соответствии с азелаиновой кислоты сложным монобензиловым эфиром 2а.
Соединение 2q синтезировали в соответствии с ПЭГ производной 2b из пробковой кислоты сложного монобензилового эфира 2р и ПЭГ 10000.
Соединение 2r синтезировали в соответствии с ПЭГ производной 2с из соединения 2q.
Для синтеза соединения 2s, соединение 2r (18.0 г, 1.74 ммоль) и п-нитрофенил карбонат (2.12 г, 6.76 ммоль) растворили в 70 мл ацетонитрила при комнатной температуре. Затем DIPEA (0.90 г, 6.76 ммоль) в 1.0 мл дихлорметана добавили, и смесь перемешивали в течение 17 часов. Смесь разбавили с применением 270 мл МТВЕ при комнатной температуре и хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 200 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 17.6 г (96%) порошка бледно-желтого цвета 2s.
MS: m/z 822.20 = [М+14Н]14+ (вычислено = 822.25).
Поперечно-сшивающий реагент 2v получили из пробковой кислоты сложного монобензилового эфира 2р и ПЭГ 6000 соответственно согласно следующей схеме:

Соединение 2t синтезировали в соответствии с ПЭГ производной 2b из пробковой кислоты сложного монобензилового эфира 2р и ПЭГ 6000.
Соединение 2u синтезировали в соответствии с ПЭГ производной 2с из соединения 2t.
Для синтеза соединения 2v, соединение 2u (2.40 г, 0.38 ммоль) и п-нитрофенил карбонат (4.61 г, 1.52 ммоль) растворили в 6 мл ацетонитрила при комнатной температуре. Затем DIPEA (0.20 г, 1.52 ммоль) в 0.14 мл дихлорметана добавили, и смесь перемешивали в течение 1 часа. Смесь разбавили с применением 26 мл МТВЕ при комнатной температуре и хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 100 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 2.37 г (95%) порошка бледно-желтого цвета 2v.
MS: m/z 774.34 = [М+9Н]9+ (вычислено = 774.34).
Поперечно-сшивающий реагент 2y получили из изопропилмалоновой кислоты сложного монобензилового эфира и ПЭГ 8000 согласно следующей схеме:
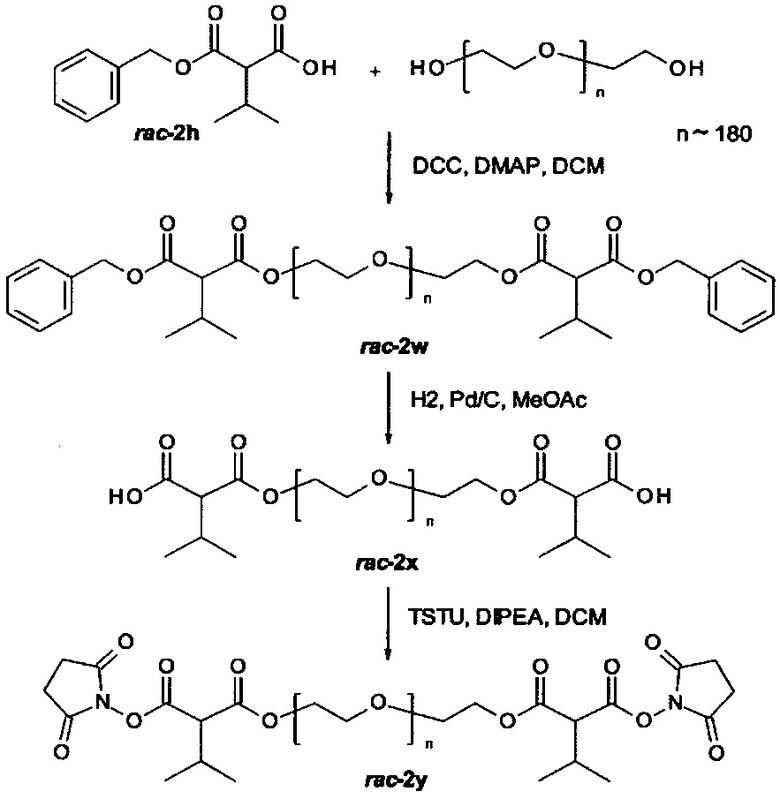
Для синтеза соединения rac-2w, изопропилмалоновой кислоты сложный монобензиловый эфир rac-2h (2.25 г, 9.50 ммоль) и ПЭГ 8000 (19.0 г, 2.38 ммоль) растворили в 100 мл дихлорметана и охладили на ледяной бане. Раствор DCC (1.96 г, 9.50 ммоль) и DMAP (14 мг, 0.12 ммоль) в 10 мл дихлорметана добавили. Ледяную баню удалили, и смесь перемешивали при комнатной температуре всю ночь. Полученную суспензию охладили до 0°C, и твердое вещество отфильтровали. Растворитель выпарили in vacuo.
Остаток растворили в 40 мл дихлорметана и разбавили с применением 270 мл МТВЕ при комнатной температуре. Смесь хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 500 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 18.5 г (92%) порошка белого цвета rac-2w.
MS: m/z 737.43 = [М+13Н]13+ (вычислено = 737.42).
Для синтеза соединения rac-2х, соединение rac-2w (18.4 г, 2.18 ммоль) растворили в метил ацетата (160 мл), и 254 мг палладия на угле добавили. В атмосфере водорода при давлении окружающей среды, смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь отфильтровали через слой целита, и фильтрат выпарили и высушивали in vacuo всю ночь.
Выход 17.7 г (98%) стекловидного твердого вещества rac-2x.
MS: m/z 723.51 = [М+13Н]13+ (вычислено = 723.55).
Для синтеза соединения rac-2y, соединение rac-2x (13.6 г, 1.65 ммоль) и TSTU (1.96 г, 6.60 ммоль) растворили в 60 мл дихлорметана при комнатной температуре. Затем DIPEA (852 мг, 6.60 ммоль) добавили, и смесь перемешивали в течение 45 минут.Полученную суспензию отфильтровали, фильтрат разбавили с применением 70 мл этил ацетата и промыли с применением 70 мл 0.5 М фосфатного буфера рН=6.5. Органическую фазу высушивали над MgSO4, и растворитель выпарили in vacuo. Остаток растворили в 80 мл толуола, оставшееся твердое вещество отфильтровали и промыли с применением 20 мл толуола. Объединенные фракции толуола разбавили с применением 35 мл МТВЕ при комнатной температуре и хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 600 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 12.1 г (87%) порошка белого цвета rac-2y.
MS: m/z 738.51 = [М+13Н]13+ (вычислено = 738.49).
Поперечно-сшивающий реагент 2ас получили из себациновой кислоты сложного монобензилового эфира и ПЭГ 10000 согласно следующей схеме:
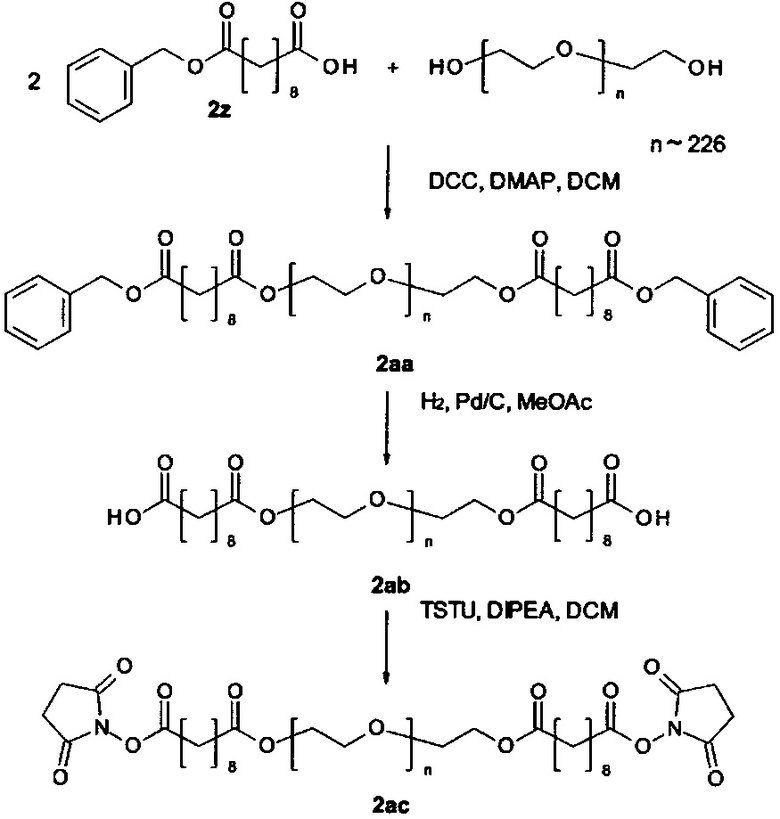
Для синтеза себациновой кислоты сложного монобензилового эфира 2z, смесь себациновой кислоты (20.2 г, 100 ммоль), бензилового спирта (10.8 г, 100 ммоль), п-толуолсульфоновой кислоты (0.40 г, 2.1 ммоль) и 120 мл толуол нагревали с отгонкой флегмы в течение 19 часов в устройстве Dean-Stark. После охлаждения, растворитель выпарили, и 150 мл насыщенного водного раствора NaHCO3 добавили. Эту смесь экстрагировали с применением 3×100 мл МТВЕ. Объединенные органические фазы высушили над Na2SO4 и растворитель выпарили. Продукт очистили на 340 г силикагеля с применением этил ацетат/гептан (10:90→25:75) в качестве элюента. Элюент выпарили, и остаток высушивали in vacuo всю ночь.
Выход 13.4 г (46%) бесцветного масла 2z.
MS: m/z 293.16 = [М+Н]+ (вычислено = 293.16).
Для синтеза соединения 2аа, себациновой кислоты сложный монобензиловый эфир 2z (1.02 г, 3.50 ммоль) и ПЭГ 10000 (10.0 г, 1.00 ммоль) растворили в 40 мл дихлорметана и охладили на ледяной бане. Раствор DCC (722 мг, 3.5 ммоль) и DMAP (6.1 мг, 0.05 ммоль) в 12 мл дихлорметана добавили. Ледяную баню удалили, и смесь перемешивали при комнатной температуре всю ночь. Полученную суспензию охладили до 0°C, и твердое вещество отфильтровали. Растворитель выпарили in vacuo.
Остаток растворили в 12 мл дихлорметана и разбавили с применением 45 мл МТВЕ при комнатной температуре. Смесь хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 250 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 9.92 г (94%) порошка белого цвета 2аа.
MS: m/z 793.48 = [М+15Н]15+ (вычислено = 793.56).
Для синтеза соединения 2ab, соединение 2аа (9.83 г, 0.93 ммоль) растворили в метил ацетате (100 мл), и 123 мг палладия на угле добавили. В атмосфере водорода при давлении окружающей среды, смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь отфильтровали через слой целита и фильтрат выпарили и высушивали in vacuo всю ночь.
Выход 9.14 г (95%) стекловидного твердого вещества 2ab.
MS: m/z 840.51 = [М+14Н]14+ (вычислено = 840.44).
Для синтеза соединения 2ас, соединение 2ab (9.00 г, 0.87 ммоль) и TSTU (1.05 г, 3.47 ммоль) растворили в 30 мл дихлорметана при комнатной температуре. Затем DIPEA (449 мг, 3.47 ммоль) добавили, и смесь перемешивали в течение 1 часа. Полученную суспензию отфильтровали, и фильтрат разбавили с применением 30 мл дихлорметана, промыли с применением 60 мл раствора 750 г воды / 197 г NaCl / 3 г NaOH. Органическую фазу высушивали над MgSO4, и растворитель выпарили in vacuo.
Остаток растворили в 45 мл толуола, разбавили с применением 35 мл МТВЕ при комнатной температуре и хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 350 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 8.29 г (90%) порошка белого цвета 2ас.
MS: m/z 794.47 = [М+15Н]15+ (вычислено = 794.48).
Поперечно-сшивающий реагент 2ag получили из уноктандикарбоновой кислоты сложного монобензилового эфира и ПЭГ 10000 согласно следующей схеме:
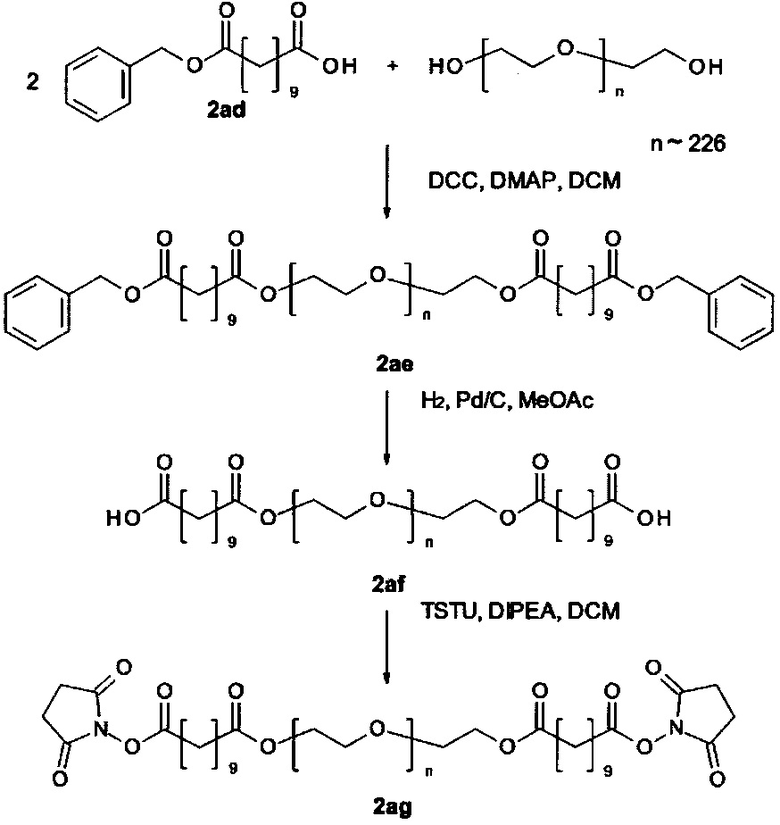
Для синтеза уноктандикарбоновой кислоты сложного монобензилового эфира 2ad, смесь уноктандикарбоновой кислоты (21.6 г, 100 ммоль), бензилового спирта (10.8 г, 100 ммоль), п-толуолсульфоновой кислоты (0.40 г, 2.1 ммоль) и 120 мл толуола нагревали с отгонкой флегмы в течение 19 часов в устройстве Dean-Stark. После охлаждения, растворитель выпарили, и 150 мл насыщенного водного раствора NaHCO3 добавили. Эту смесь экстрагировали с применением 3×100 мл МТВЕ. Объединенные органические фазы высушили над Na2SO4, и растворитель выпарили. Продукт очистили на 340 г силикагеля с применением этил ацетат/гептан (10:90→5:75) в качестве элюента. Элюент выпарили, и остаток высушивали in vacuo всю ночь.
Выход 14.8 г (48%) бесцветного масла 2ad.
MS: m/z 307.19 = [М+Н]+ (вычислено = 307.19).
Для синтеза соединения 2ае, уноктандикарбоновой кислоты сложный монобензиловый эфир 2ad (1.07 г, 3.50 ммоль) и ПЭГ 10000 (10.0 г, 1.00 ммоль) растворили в 40 мл дихлорметане и охладили на ледяной бане. Раствор DCC (722 мг, 3.5 ммоль) и DMAP (6.1 мг, 0.05 ммоль) в 12 мл дихлорметана добавили. Ледяную баню удалили, и смесь перемешивали при комнатной температуре всю ночь. Полученную суспензию охладили до 0°C, и твердое вещество отфильтровали. Растворитель выпарили in vacuo.
Остаток растворили в 13 мл дихлорметана и разбавили с применением 43 мл МТВЕ при комнатной температуре. Смесь хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 250 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 10.0 г (95%) порошка белого цвета 2ае.
MS: m/z 792.48 = [М+15Н]15+ (вычислено = 792.49).
Для синтеза соединения 2af соединение 2ае (9.83 г, 0.93 ммоль) растворили в метил ацетате (100 мл), и 103 мг палладия на угле добавили. В атмосфере водорода при давлении окружающей среды, смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь отфильтровали через слой целита и фильтрат выпарили и высушивали in vacuo всю ночь.
Выход 8.90 г (92%) стекловидного твердого вещества 2af.
MS: m/z 780.47 = [М+15Н]15+ (вычислено = 780.47).
Для синтеза соединения 2ag, соединение 2af (8.75 г, 0.84 ммоль) и TSTU (1.01 г, 3.37 ммоль) растворили в 30 мл дихлорметана при комнатной температуре. Затем DIPEA (435 мг, 3.37 ммоль) добавили, и смесь перемешивали в течение 1 часа. Полученную суспензию отфильтровали, и фильтрат разбавили с применением 30 мл дихлорметан, промыли с применением 60 мл раствора 750 г воды / 197 г NaCl / 3 г NaOH. Органическую фазу высушивали над MgSO4, и растворитель выпарили in vacuo.
Остаток растворили в 38 мл толуола, разбавили с применением 30 мл МТВЕ при комнатной температуре и хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 350 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 7.51 г (84%) порошка белого цвета 2ag.
MS: m/z 793.48 = [М+14Н]14+ (вычислено = 793.38).
Поперечно-сшивающий реагент 2ak получили из глутаровой кислоты сложного монобензилового эфира и ПЭГ 10000 согласно следующей схеме:
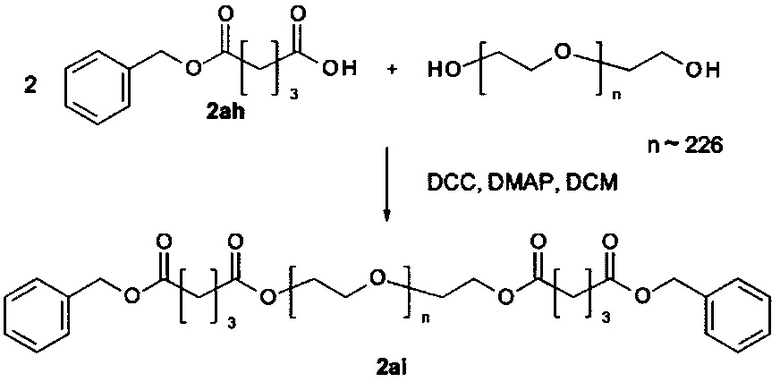
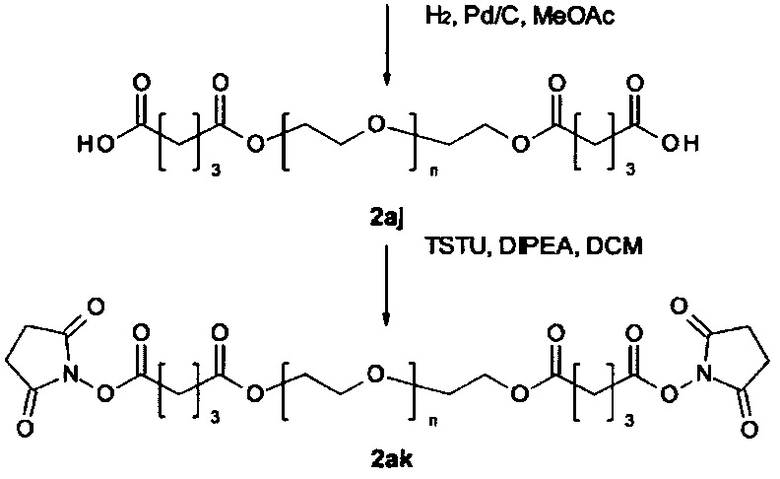
Для синтеза соединения 2ai, глутаровой кислоты сложный монобензиловый эфира 2ah (1.95 г, 8.78 ммоль) и ПЭГ 10000 (25.1 г, 2.51 ммоль) растворили в 70 мл дихлорметана и охладили на ледяной бане. Раствор DCC (1.81 г, 8.78 ммоль) и DMAP (15.3 мг, 0.13 ммоль) в 18 мл дихлорметана добавили. Ледяную баню удалили, и смесь перемешивали при комнатной температуре всю ночь. Полученную суспензию охладили до 0°C, и твердое вещество отфильтровали. Растворитель выпарили in vacuo.
Остаток растворили в 70 мл дихлорметана и разбавили с применением 360 мл МТВЕ при комнатной температуре. Смесь хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 500 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 24.9 г (95%) порошка белого цвета 2ai.
MS: m/z 740.76 = [М+16Н]16+ (вычислено = 740.76).
Для синтеза соединения 2aj соединение 2ai (24.9 г, 2.39 ммоль) растворили в метил ацетате (220 мл), и 302 мг палладия на угле добавили. В атмосфере водорода при давлении окружающей среды, смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь отфильтровали через слой целита и фильтрат выпарили и высушивали in vacuo всю ночь.
Выход 24.3 г (99%) стекловидного твердого вещества 2aj.
MS: m/z 729.50 = [М+16Н]16+ (вычислено = 729.49).
Для синтеза соединения 2ak, соединение 2aj (23.9 г, 2.33 ммоль) и TSTU (2.81 г, 9.33 ммоль) растворили в 100 мл дихлорметана при комнатной температуре. Затем DIPEA (1.21 г, 9.33 ммоль) добавили, и смесь перемешивали в течение 1 часа. Полученную суспензию отфильтровали, и фильтрат разбавили с применением 20 мл дихлорметана, промыли с применением 120 мл раствора 750 г воды / 197 г NaCl / 3 г NaOH. Органическую фазу высушивали над MgSO4, и растворитель выпарили in vacuo.
Остаток растворили в 125 мл толуола, разбавили с применением 100 мл МТВЕ при комнатной температуре и хранили всю ночь при -20°C. Остаток собрали путем фильтрации через стеклянный фильтр Por. 3, и промыли с применением 650 мл холодного МТВЕ (-20°C). Продукт высушивали in vacuo всю ночь.
Выход 22.5 г (92%) порошка белого цвета 2ak.
MS: m/z 741.63 = [М+16Н]16+ (вычислено = 741.63).
Пример 3
Получение шариков гидрогеля 3а, 3b, 3c, и 3d, содержащего свободные аминогруппы.
В цилиндрическом реакторе с объемом 250 мл и выходом на дне, диаметр 60 мм, оборудованном перегородками, эмульсию 218 мг Cithrol™ DPHS в 100 мл ундекана перемешивали с применением мешалки isojet, диаметр 50 мм при 580 оборотов в минуту, при температуре окружающей среды. Раствор 250 мг соединения 1а и 2205 мг соединения 2d в 22.1 г DMSO добавили и перемешивали в течение 10 минут при комнатной температуре с образованием суспензии. 1.1 мл TMEDA добавили для осуществления полимеризации. Смесь перемешивали в течение 16 часов. 1.7 мл уксусной кислоты добавили, и затем через 10 минут 100 мл 15 мас. % раствора хлорида натрия в воде добавили. Через 10 минут, мешалку остановили, и фазам дали разделиться. Через 2 часа водную фазу, содержащую гидрогель, выпустили.
Для фракционирования шариков по размеру, суспензию гидрогеля в воде разбавили с применением 40 мл этанола и просеяли во влажном состоянии на стальных ситах 125, 100, 75, 63, 50, 40 и 32 мкм с применением устройства, контролирующего просеивание, Retsch AS200 в течение 15 минут. Амплитуда просеивания составляла 1.5 мм, скорость течения воды 300 мл/минут. Фракции шариков, которые задерживались на ситах 63 и 75 мкм, объединили и промыли 3 раза с применением 0.1% АсОН, 10 раз с применением этанола, и высушивали в течение 16 часов при 0.1 мбар с получением 670 мг 3а в виде порошка белого цвета.
Содержание аминогрупп в гидрогеле в количестве 0.145 ммоль/г получили путем объединения fmoc-аминокислоты со свободными аминогруппами на гидрогеле и последующего определения fmoc.
3b получили, как описано для 3а, за исключением применения скорости мешалки 560 оборотов в минуту, применения 350 мг 1а, 2548 мг 2g, 26.1 г DMSO, 257 мг Cithrol™ DPHS, 1.5 мл TMEDA и 2.4 мл уксусной кислоты, с получением 550 мг 3b в виде порошка белого цвета, свободные аминогруппы - 0.120 ммоль/г.
3с получили, как описано для 3а, за исключением применения скорости мешалки 560 оборотов в минуту, применения 250 мг 1а, 3019 мг rac2k, 32.7 г DMSO, 290 мг Cithrol™ DPHS, 1.1 мл TMEDA, и 1.7 мл уксусной кислоты, с получением 770 мг 3с в виде порошка белого цвета, свободные аминогруппы - 0.126 ммоль/г.
3d получили, как описано для 3а, за исключением применения 250 мг 1а, 2258 мг rac2o, 22.6 г DMSO, 222 мг Cithrol™ DPHS, 1.1 мл TMEDA, и 1.7 мл уксусной кислоты, с получением 186 мг 3d в виде порошка белого цвета, свободные аминогруппы - 0.153 ммоль/г.
3е получили, как описано для 3а, за исключением применения 250 мг 1а, 2168 мг rac-2y, 21.8 г DMSO, 215 мг Cithrol™ DPHS, 1.1 мл TMEDA, 1.7 мл уксусной кислоты, с получением 710 мг 3е в виде порошка белого цвета, свободные аминогруппы - 0.154 ммоль/г.
3f получили, как описано для соединения 3а, за исключением применения скорости мешалки 400 оборотов в минуту, применения 290 мг реагента основной цепи, который описан в примере 1 в WO 2011/012715 А1 в качестве 1g, 2281 мг 2v, 15.8 г DMSO, 290 мг Cithrol™ DPHS, 2.2 мл TMEDA, 3.3 мл уксусной кислоты, просеивания через стальные сита 250, 180, 125, 90, и 63 мкм; продукт собрали на сите с размером 180 мкм. Обработка обеспечила 820 мг 3f в виде порошка бледно-желтого цвета, свободные аминогруппы - 0.108 ммоль/г.
3g получили, как описано для 3а, за исключением применения скорости мешалки 500 оборотов в минуту, применения 300 мг реагента основной цепи, который описан в пример 1 WO 2011/012715 А1 в качестве 1g, 2520 мг 2s, 32.4 г DMSO, 300 мг Cithrol™ DPHS, 2.2 мл TMEDA, 3.4 мл уксусной кислоты, с получением 770 мг 3g в виде порошка бледно-желтого цвета, свободные аминогруппы 0.175 - ммоль/г.
3h получили, как описано для 3а, за исключением применения 200 мг 1а, 1995 мг 2ас, 19.8 г DMSO, 195 мг Cithrol™ DPHS, 0.9 мл TMEDA, 1.4 мл уксусной кислоты, с получением 650 мг 3h в виде порошка белого цвета, свободные аминогруппы - 0.131 ммоль/г.
3i получили, как описано для 3а, за исключением применения 150 мг 1а, 1591 мг 2ag, 15.7 г DMSO, 154 мг Cithrol™ DPHS, 0.7 мл TMEDA, 1.0 мл уксусной кислоты, с получением 300 мг 3i в виде порошка белого цвета, свободные аминогруппы - 0.123 ммоль/г.
3j получили, как описано для 3а, за исключением применения скорости мешалки 570 оборотов в минуту, применения 360 мг 1h, 2567 мг 2ak, 26.3 г DMSO, 257 мг Cithrol™ DPHS, 2.2 мл TMEDA, 3.4 мл уксусной кислоты, с получением 744 мг 3j в виде порошка белого цвета, свободные аминогруппы - 0.097 ммоль/г.
Пример 4
Синтез линкерного реагента 4с
Линкерный реагент 4с синтезировали согласно следующей схеме:
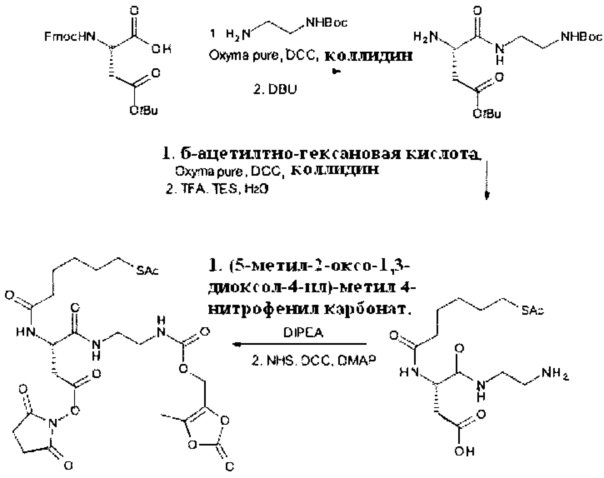
Синтез 4а:
Fmoc-L-Asp(OtBu)-OH (1.00 г, 2.43 ммоль) растворили с применением DCC (0.70 г, 3.33 ммоль) в DCM (25 мл). Oxyma pure (0.51 г, 3.58 ммоль) и колли дин (0.50 мл, 3.58 ммоль) добавили в виде одной части, и раствор N-Boc-этилендиамина (0.41 г, 2.56 ммоль) в DCM (15 мл) добавили медленно. После перемешивания смеси в течение 90 минут при комнатной температуре, образованный осадок отфильтровали, и фильтрат промыли с применением водной HCl (0.1 М, 50 мл). Водный слой экстрагировали с применением DCM (2×20 мл), и объединенные органические фракции промыли с применением насыщенного водного раствора NaHCO3 (3×25 мл) и солевого раствора (1×50 мл), высушивали над Na2SO4, отфильтровали и концентрировали in vacuo. Неочищенное твердое вещество очистили с помощью флэш-хроматографии. Промежуточное соединение N-boc-N'-(N-fmoc-4-трет.-бутил-L-аспартоил)-этилендиамин получили в виде твердого вещества белого цвета (0.98 г, 1.77 ммоль, 73%).
MS: m/z 554.29 = [М+Н]+, (вычислено = 554.29).
N-boc-N'-(N-fmoc-4-трет.-бутил-L-аспартоил)-этилендиамин (0.98 г, 1.77 ммоль) растворили в THF (15 мл), DBU (0.31 мл) добавили, и раствор перемешивали в течение 12 минут при комнатной температуре. Реакцию погасили с помощью АсОН (0.5 мл), концентрировали in vacuo, и остаток очистили с помощью флэш-хроматографии с получением 4а (0.61 г, 1.77 ммоль, 73% за 2 стадии) в виде твердого вещества белого цвета.
MS: m/z 332.38 = [М+Н]+, (вычислено = 332.22).
Синтез 4b:
6-Ацетилтиогексановую кислоту (0.37 г, 1.95 ммоль) растворили в DCM (19.5 мл), и Oxyma pure (0.35 г, 2.48 ммоль) и DCC (0.40 г, 1.95 ммоль) добавили в виде одной части. Раствор перемешивали в течение 30 минут при комнатной температуре, отфильтровали, и фильтрат добавили к раствору 4а (0.61 г, 1.77 ммоль) в DCM (10.5 мл). DIPEA (0.46 мл, 2.66 ммоль) добавили к раствору, и реакционную смесь перемешивали в течение 2 часов при комнатной температуре. Раствор промыли с применением водной H2SO4 (0.1 М, 2×30 мл), насыщенного водного раствора NaHCO3 (2×20 мл) и соляного раствора (1×20 мл). Органический слой высушивали над Na2SO4, отфильтровали и концентрировали in vacuo. Неочищенное вещество очистили с помощью флэш-хроматографии с получением N-boc-N'-(N-6-ацетилтиогексил-4-трет.-бутил-L-аспартоил)-этилендиамина (0.65 г, 1.30 ммоль, 73% за 2 стадии) в виде твердого вещества белого цвета.
MS: m/z 504.27 = [М+Н]+, (вычислено = 504.28).
N-boc-N'-(N-6-Ацетилтиогексил-4-трет.-бутил-L-аспартоил)-этилендиамин (0.60 г, 1.18 ммоль) растворили в TFA (5 мл) и TES (0.13 мл) и воду (0.13 мл) добавили. Смесь перемешивали в течение 30 минут при комнатной температуре. TFA удалили в потоке N2, и неочищенный 4b растворили в H2O/ACN 1:1 и очистили посредством обращенно-фазовой ВЭЖХ.
Выход: 0.39 г, 0.85 ммоль (TFA соль), 72%.
MS: m/z 348.25 = [М+Н]+, (вычислено = 348.16).
Синтез 4с:
4b (TFA соль, 0.38 г, 0.80 ммоль) растворили в DMF (5 мл), и (5-метил-2-оксо-1,3-диоксол-4-ил)-метил 4-нитрофенил карбонат (0.26 г, 0.88 ммоль) и DIPEA (0.28 мл, 1.6 ммоль) добавили. Полученную суспензию разбавили с применением DCM (5 мл) и перемешивали в течение 3 часов при комнатной температуре. Дополнительный DIPEA (0.28 мл 1.6 ммоль) добавили, и перемешивание продолжали в течение 2 часов. DCM концентрировали in vacuo, остаток разбавили с применением H2O/ACN 3:1 и очистили посредством обращенно-фазовой ВЭЖХ с получением N-(5-метил-2-оксо-1,3-диоксол-4-ил)-метил-оксокарбонил-N'-(N-6-ацетилтиогексил-L-аспартил)-этилендиамина (0.31 г, 0.62 ммоль, 77%) в виде бесцветного масла.
MS: m/z 504.16 = [М+Н]+, (вычислено = 504.17).
N-(5-метил-2-оксо-1,3-диоксол-4-ил)-метил оксокарбонил-N'-(N-6-ацетилтиогексил-L-аспартил)-этилеnе-диамин (150 мг, 0.30 ммоль) растворили в DCM (17.5 мл) и NHS (41 мг, 0.36 ммоль), DCC (74 мг, 0.36 ммоль) и DMAP (4 мг, 0.03 ммоль) добавили в виде одной части. Реакцию перемешивали в течение 1 часов при комнатной температуре, и полученную суспензию отфильтровали. Осадок промыли с применением небольшого количества DCM, и объединенные фильтраты концентрировали in vacuo. 4с очистили посредством обращенно-фазовой ВЭЖХ с получением бесцветного масла (144 мг, 0.24 ммоль, 80%).
MS: m/z 601.18 = [М+Н]+, (вычислено = 601.18).
Пример 5
Получение шариков малеимид-функционализированного гидрогеля 5а
259.3 мг сухих шариков гидрогеля 3а инкубировали в течение 15 минут в 10 мл 1% н-пропиламина в NMP и далее промыли два раза с применением 1% н-пропиламина в NMP и два раза с применением 2% DIPEA в NMP. 171 мг малеимид-NH-ПЭГ12-PFE растворили в 1 мл NMP и добавили к промытым шарикам гидрогеля 3а. Суспензию гидрогеля инкубировали в течение 2 часов при комнатной температуре. Полученные шарики малеимид-функционализированного гидрогеля 5а промыли пять раз, каждый раз с помощью NMP, 20 мМ сукцината, 1 мМ Na2EDTA, 0.01% Tween 20, рН 3.0, воды, и с 0.1% уксусной кислоты, 0.01% Tween 20.
Получение шариков малеимид-функционализированного гидрогеля 5b
117.7 мг сухих шариков гидрогеля 3а поместили для набухания в 5 мл NMP и промыли пять раз с помощью NMP и пять раз с помощью 2% DIPEA в NMP. 5 эквивалентов (56 мг) малеимид-NH-ПЭГ6-PFE (на основании содержания амина в шариках гидрогеля) растворили в 0.5 мл NMP и добавили к промытым шарикам гидрогеля 5b. Суспензию гидрогеля инкубировали в течение 2.5 часов при комнатной температуре. Полученные шарики малеимид-функционализированного гидрогеля промыли пять раз, каждый раз с помощью NMP и после всего с помощью 0.1% уксусной кислоты, 0.01% Tween 20.
Пример 6
Синтез пролкарства Lucentis-линкер-гидрогель 6с
4.6 мг Lucentis (показан на приведенной далее схеме как Lucentis-NH2) (460 мкл 10 мг/мл Lucentis в 10 мМ гистидина, 10wt% α,α-трегалоза, 0.01% Tween 20, рН 5.5) подвергли буферному обмену на 10 мМ фосфат натрия, 2.7 мМ хлорид калия, 140 мМ хлорид натрия, рН 7.4, и концентрацию Lucentis довели до 16.4 мг/мл. 6 мг линкерного реагента 4с растворили в 100 мкл DMSO с получением концентрации 100 мм. 1 мольный эквивалент линкерного реагента 4с относительно количества Lucentis добавили к раствору Lucentis. Реакционную смесь аккуратно смешали и инкубировали в течение 5 минут при комнатной температуре. Затем 2 дополнительных мольных эквивалента линкерного реагента 4с добавили к раствору Lucentis с шагом 1 мольный эквивалент, и после добавления каждого эквивалента реакционную смесь инкубировали в течение 5 минут при комнатной температуре с получением смеси немодифицированного Lucentis и моноконъюгата защищенный Lucentis-линкер 6а.
Значение рН реакционной смеси довели до рН 6.5 путем добавления 1 М цитрата натрия, рН 5.0 и Na2EDTA добавили до конечной концентрации 5 мм. Для удаления защитных групп 6а 0.5 М NH2OH (растворенный в 10 мМ цитрата натрия, 140 мМ хлорида натрия, 5 мМ Na2EDTA, рН 6.5) добавили до конечной концентрации 45 мм, и реакционную смесь без защитных групп инкубировали при комнатной температуре в течение 4 часов с получением моноконъюгата Lucentis-линкер 6b. Смесь Lucentis и моноконъюгата Lucentis-линкер 6b подвергли буферному обмену на 10 мМ фосфат натрия, 2.7 мМ хлорид калия, 140 мм хлорид натрия, 5 мм Na2EDTA, 0.01% Tween 20, рН 6.5, и общую концентрацию двух видов Lucentis довели до 11.8 мг/мл. Содержание моноконъюгата Lucentis-линкер 6b в смеси составило 20%, как определено путем ESI-MS.
4 мг смесь Lucentis/Lucentis-линкер моноконъюгат 6b в 10 мМ фосфата натрия, 2.7 мМ хлорида калия, 140 мМ хлорида натрия, 5 мМ Na2EDTA, 0.01% Tween 20, рН 6.5 добавили к 1 мг шариков малеимид-функционализированного гидрогеля 5а и инкубировали всю ночь при комнатной температуре с получением пролекарства Lucentis-линкер-гидрогель 6с.
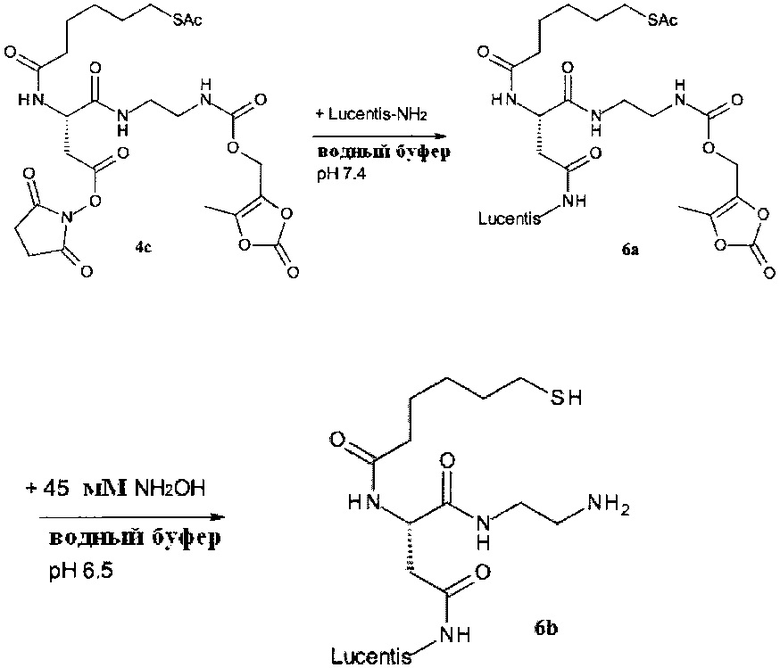
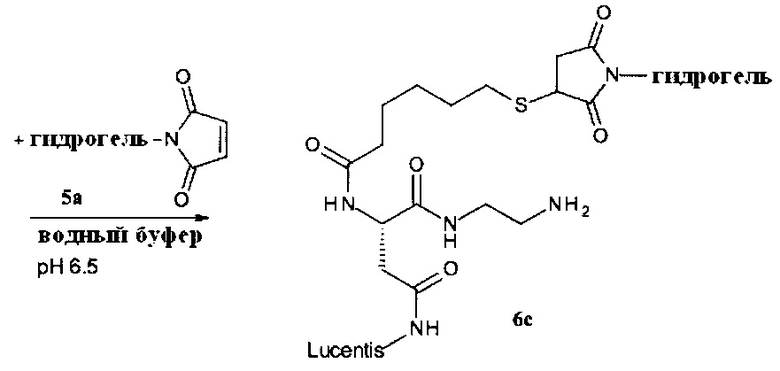
Пример 7
Кинетика In vitro высвобождения - определение периода полураспада in vitro
Пролекарство Lucentis-линкер-гидрогель 6с (содержащее около 1 мг Licentious) промыли пять раз с применением 60 мМ фосфата натрия, 3 мМ Na2EDTA, 0.01% Tween 20, рН 7.4 и наконец суспендировали в 1 мл вышеуказанного буфера. Суспензию инкубировали при 37°C. Буфер суспензии обменивали через различные интервалы времени и анализировали путем ВЭЖХ-SEC при 220 нм. Пики, соответствующие высвобожденному Lucentis, интегрировали, и составили графики отношения всего высвобожденного Lucentis к общему времени инкубации. Программные обеспечения для подбора кривой по точкам применялись для определения скоростей расщепления первого порядка.
Пример 8
Получение шариков гидрогеля 8а и 8b, содержащих свободные аминогруппы
8а получили, как описано для 3а, за исключением применения 400 мг [ПЭГ1250-LLys-LLys2-LLys4(NH2)8]4, 5082 мг 2s, 33.5 г DMSO, 400 мг Cithrol™ DPHS, 2.3 мл TMEDA, и 4.8 мл уксусной кислоты, с получением 1460 мг 8а в виде порошка белого цвета, свободные аминогруппы - 0.057 ммоль/г.
8b получили, как описано для 3а, за исключением применения 290 мг [ПЭГ1250-LLys-LLys2-LLys4(NH2)8]4, 2281 мг 2v, 26.1 г DMSO, 257 мг Cithrol™ DPHS, 1.7 мл TMEDA, и 3.5 мл уксусной кислоты, с получением 820 мг 8b в виде порошка белого цвета, свободные аминогруппы - 0.108 ммоль/г.
8с получили, как описано для 3а, за исключением применения 250 мг [ПЭГ1250-LLys-LLys2-LLys4(NH2)8]4, 2168 мг rac-2y, 21.8 г DMSO, 215 мг Cithrol™ DPHS, 1.1 мл TMEDA, и 1.7 мл уксусной кислоты, с получением 810 мг 8с в виде порошка белого цвета, свободные аминогруппы - 0.154 ммоль/г.
Пример 9
Получение биотин-конъюгированного гидрогеля 9а и 9b
11 мг 8а перенесли в шприц, оборудованный фильтровальной фриттой. Шарики гидрогеля 8а промыли три раза, каждый раз с применением NMP и с применением H2O/ACN/TFA (1/1/0.002; об./об./об.), соответственно. 1.14 мг биотинамидогексановой кислоты N-гидроксисукцинимидного сложного эфира (2.5 мкмоль) растворили в 250 мкл H2O/ACN/TFA (1/1/0.002; об./об./об.), добавили к промытым шарикам гидрогеля 8а и инкубировали в течение 5 минут при комнатной температуре при перемешивании (15 оборотов в минуту). 50 мкл 0.5 М фосфата натрия, рН 7.4 добавили, и реакционную смесь инкубировали в течение 60 минут при комнатной температуре при перемешивании (15 оборотов в минуту). Полученный биотин-конъюгированный гидрогель 9а промыли пять раз, каждый раз с помощью H2O/ACN/TFA (1/1/0.002; об./об./об.) и с помощью 10 мМ фосфата натрия, 2.7 мМ хлорида калия, 140 мМ хлорида натрия, 10% ACN, рН 7.4, соответственно.
9b получают согласно 9а, за исключением того, что применялись 11.3 мг шариков гидрогеля 8b и 2.2 мг биотинамидогексановой кислоты N-гидроксисукцинимидного сложного эфира (4.8 мкмоль).
Пример 10
Получение стрептавидин-биотин гидрогеля 10а и 10b
6 мг стрептавидина растворили в 10 мМ фосфате натрия, 2.7 мМ хлориде калия, 140 мМ хлориде натрия, 10% ACN, рН 7.4, добавили к биотин-конъюгированному гидрогелю 9а (полученному из 11 мг 8а) и инкубировали в течение 60 минут при комнатной температуре при перемешивании (15 оборотов в минуту) с получением стрептавидин-биотин гидрогеля 10а. 10а промыли два раза с применением 850 мкл 10 мМ фосфата натрия, 2.7 мМ хлорида калия, 140 мМ хлорида натрия, 10% ACN, рН 7.4, и объединили фракции промывки. Количество стрептавидина, связанного с биотин-конъюгированным гидрогелем, определили непосредственно путем фотометрического определения при 280 нм концентрации стрептавидина в объединенных фракциях промывки, и, как обнаружили, оно составило 2.6 мг.
10b получили согласно 10а, за исключением того, что применялись биотин-конъюгированный гидрогель 9b (полученный из 11.3 мг 8b) и 8.1 мг стрептавидина. Количество стрептавидина, связанного с биотин-конъюгированным гидрогелем 9b, как обнаружили, составляло 0.5 мг.
Пример 11
Шарики блокированного гидрогеля 11
Шарики гидрогеля синтезировали согласно методике, описанной в примере 3с, и функционализировали малеимидными группами согласно методике, описанной в примере 5b. После этого, 4 мл суспензии гидрогеля при 10 мг/мл перенесли в шприц, объемом 20 мл, оборудованный фриттой. Растворитель удалили, и гидрогель промыли 10 раз с пмощью 5 мл 10 мМ гистидин/10 мас. % α,α-трегалоза/0.01% Tween 20/pH 5.5. Растворитель удалили, и 5 мл 1 мМ β-меркаптоэтанола в 10 мМ гистидин/10 мас. % α,α-трегалоза/0.01% Tween 20/pH 5.5 втянули в шприц. Полученную суспензию инкубировали при температуре окружающей среды при мягком перемешивании в течении 5 минут. Растворитель удалили, и гидрогель обработали еще 9 раз с применением 5 мл 1 мМ β-меркаптоэтанола в 10 мМ гистидин/10 мас. % α,α-трегалоза/0.01% Tween 20/pH 5.5. Растворитель каждый удаляли. Шарики гидрогеля затем промыли 10 раз, каждый раз с применением 5 мл 10 мМ гистидин/10 мас. % α,α-трегалоза/0.01% Tween 20/pH 5.5, растворитель удаляли каждый раз. Шарики гидрогеля промыли 10 раз, каждый раз с применением 5 мл PBS-T/pH 7.4, растворитель удаляли каждый раз. Наконец, свежий PBS-T/pH 7.4 втянули в шприц, и суспензию перенесли в пробирку фирмы Falcon с получением 11.
Аббревиатуры:
Ac ацетил
ACN ацетонитрил
АсОН уксусная кислота
Asp аспартат
Boc трет.-бутилоксикарбонил
DBU 1,8-диазабицикло(5.4.0)ундец-7-ен
DCC дициклогексилкарбодиимид
DCM дихлорметан
DIPEA диизопропилэтиламин
DMAP диметиламинопиридин
DMF диметилформамид
DMSO диметилсульфоксид
Fmoc флуоренилметилоксикарбонил
HPLC высокоэффективная жидкостная хроматография
iPrOH изопропанол
Малеимид-NH-ПЭГ6-PFE N-(3-малеимидопропил)-21-амино-4,7,10,13,16,19-гексаокса-генэйкозановой кислоты пентафторфениловый сложный эфир
Малеимид-NH-ПЭГ12-PFE N-(3-малеимидопропил)-39-амино-4,7,10,13,16,19,22,25,28,31,34,37-додекаокса-нонатриконтановой кислоты пентафторфениловый сложный эфир
МеОАс метилацетат
МеОН метанол
MS масс-спектрометрия
МТВЕ метил-трет-бутиловый простой эфир
NHS N-гидроксисукцинимид
Оxyma Pure этил 2-циано-2-(гидроксиимино)ацетат
ПЭГ полиэтиленгликоль
RP-HPLC обращенно-фазовая высокоэффективная жидкостная хроматография
RT комнатная температура
tBu трет.-бутил
TAN 1,5,9-тиазанон
TES триэтилсилан
TFA трифторуксусная кислота
THF тетрагидрофуран
TMEDA N,N,N',N'-тетраметилэтилен диамин
TSTU O-(N-сукцинимидил)-N,N,N',N'-тетраметилурония тетрафторборат
| название | год | авторы | номер документа |
|---|---|---|---|
| VEGF-НЕЙТРАЛИЗУЮЩИЕ ПРОЛЕКАРСТВА ДЛЯ ЛЕЧЕНИЯ ОФТАЛЬМОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2673881C2 |
| ДИАГНОСТИКА, ПРОФИЛАКТИКА И ЛЕЧЕНИЕ БОЛЕЗНЕЙ СУСТАВОВ | 2013 |
|
RU2682676C2 |
| БИОРАЗЛАГАЕМЫЕ НЕРАСТВОРИМЫЕ В ВОДЕ ГИДРОГЕЛИ НА ОСНОВЕ ПОЛИЭТИЛЕНГЛИКОЛЯ | 2010 |
|
RU2554854C9 |
| ПРОЛЕКАРСТВА PTH | 2017 |
|
RU2747316C2 |
| CNP ПРОЛЕКАРСТВА | 2016 |
|
RU2824988C1 |
| ПРОЛЕКАРСТВА, СОДЕРЖАЩИЕ КОНЪЮГАТ ИНСУЛИНА И ЛИНКЕРА | 2010 |
|
RU2574667C2 |
| ПРОЛЕКАРСТВА, СОДЕРЖАЩИЕ КОНЪЮГАТ ЭКСЕНДИН-ЛИНКЕР | 2011 |
|
RU2593774C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ СВЯЗАННЫХ С ГОРМОНОМ РОСТА ЗАБОЛЕВАНИЙ У ЧЕЛОВЕКА | 2014 |
|
RU2689336C2 |
| ПРОЛЕКАРСТВО, СОДЕРЖАЩЕЕ САМОРАСЩЕПЛЯЕМЫЙ ЛИНКЕР | 2018 |
|
RU2798085C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ СВЯЗАННЫХ С ГОРМОНОМ РОСТА ЗАБОЛЕВАНИЙ У ЧЕЛОВЕКА | 2019 |
|
RU2802215C2 |
Изобретение относится к способу получения гидрогеля, включающему стадии: (а) обеспечения смеси, содержащей (a-i) реагент основной цепи, где реагент основной цепи имеет молекулярную массу в интервале от 1 до 100 кДа и представляет собой соединение такое, как определено в формуле изобретения, (a-ii) сшивающий реагент, где сшивающий реагент имеет молекулярную массу в интервале от 6 до 40 кДа и представляет собой соединение такое, как определено в формуле изобретения, и (a-iii) первый растворитель и по меньшей мере второй растворитель, где второй растворитель является несмешиваемым с первым растворителем, в массовом соотношении указанного по меньшей мере одного реагента основной цепи и указанного по меньшей мере одного сшивающего реагента в интервале от 1:99 до 99:1; и (b) полимеризации смеси со стадии (а) путем суспензионной полимеризации в гидрогель, причем полимеризацию на стадии (b) инициируют путем добавления основания. Также описаны гидрогель, получаемый указанным способом, способ получения конъюгата гидрогель-спейсер, конъюгат гидрогель-спейсер, получаемый указанным способом, способ получения конъюгата, связанного с носителем, конъюгат, связанный с носителем, получаемый указанным способом, а также фармацевтическая композиция для контролируемого и/или замедленного высвобождения лекарственного средства, содержащая указанный конъюгат, связанный с носителем. Технический результат – обеспечение гидрогеля, который может применяться в качестве носителя для конъюгатов, связанных с носителем, которые подходят для контролируемого и/или замедленного высвобождения более больших молекул лекарственных средств, например таких, как белки. 7 н. и 20 з.п. ф-лы, 11 пр.
1. Способ получения гидрогеля, включающий стадии:
(а) обеспечения смеси, содержащей
(a-i) реагент основной цепи, где реагент основной цепи имеет молекулярную массу в интервале от 1 до 100 кДа и представляет собой соединение формулы (I)

где В представляет собой разветвляющееся ядро, имеющее структуру (a-i)
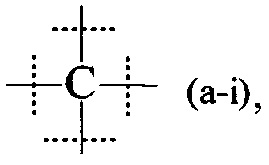
где пунктирные линии означают присоединение к А1,
Р представляет собой полимерную цепь, основанную на ПЭГ, содержащую по меньшей мере 80% ПЭГ,
х представляет собой целое число от 3 до 16,
х1, х2 равны 0,
А1 представляет собой фрагмент формулы  ,
,
А2 представляет собой фрагмент формулы 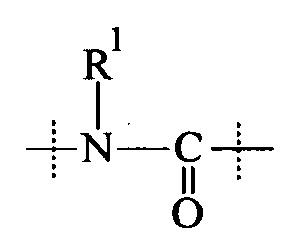 , где R1 означает Н,
, где R1 означает Н,
Hyp1 представляет собой фрагмент формулы (e-ii), (e-iii) и (e-viii):
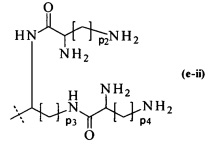
где р2, р3 и р4 являются одинаковыми или различными и каждый независимо от других представляет собой целое число от 1 до 5 и
пунктирная линия означает присоединение к А2,
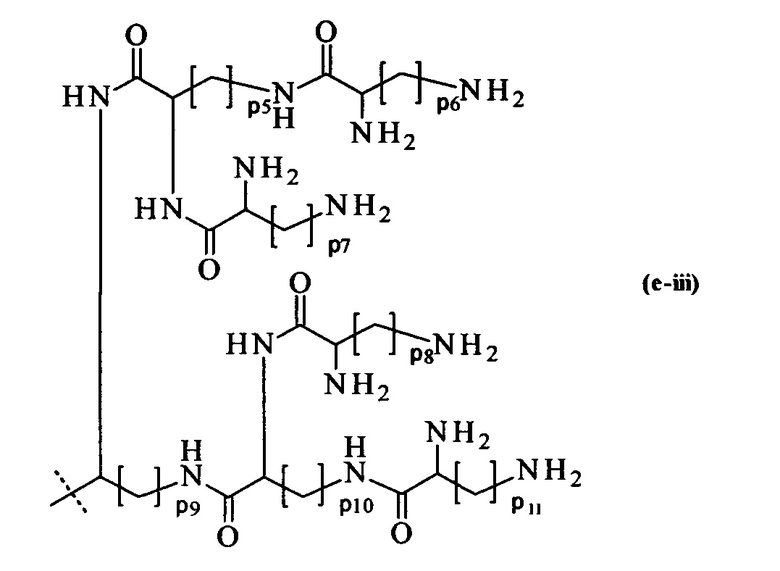
где р5-р11 являются одинаковыми или различными и каждый независимо от других представляет собой целое число от 1 до 5 и
пунктирная линия означает присоединение к А2,
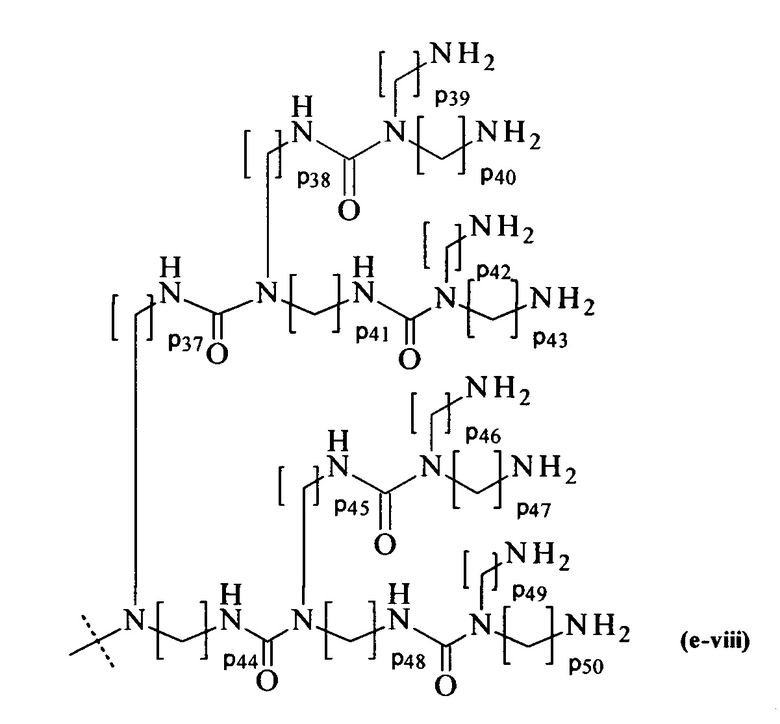
где р37-р50 являются одинаковыми или различными и каждый независимо от других представляет собой целое число от 2 до 5 и
пунктирная линия означает присоединение к А2,
причем фрагменты (e-ii), (e-iii) и (e-viii) могут при каждом хиральном центре иметь R- или S-конфигурацию,
(a-ii) сшивающий реагент, где сшивающий реагент имеет молекулярную массу в интервале от 6 до 40 кДа и представляет собой соединение формулы (V-II)
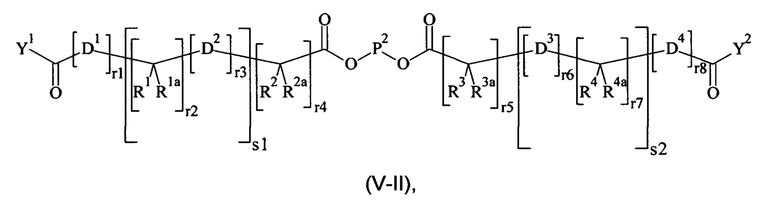
где P2 представляет собой  ,
,
m находится в интервале от 120 до 920,
R1, R1a, R2, R2a, R3, R3a, R4, R4a являются одинаковыми или различными и каждый независимо от других выбирают из группы, включающей Н и C1-6 алкил; необязательно, одна или более пар R1/R1a, R2/R2a, R3/R3a, R4/R4a, R1/R2, R3/R4, R1a/R2a и R3a/R4a образуют химическую связь или соединены вместе с атомом, к которому они присоединены, с образованием С3-8 циклоалкила,
r1 и r8 равны 0,
r2 и r7 независимо равны 0 или 1,
r3 и r6 равны 0,
r4 и r5 независимо равны 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10,
s1, s2 независимо равны 1, 2, 3, 4, 5 или 6,
Y1, Y2 являются одинаковыми или различными и каждую независимо друг от друга выбирают из формул (f-i) и (f-ii)
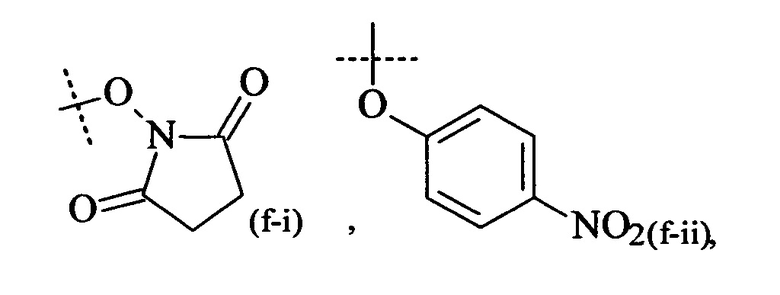
где пунктирные линии означают присоединение к остальной части молекулы, и
(a-iii) первый растворитель и по меньшей мере второй растворитель, где второй растворитель является несмешиваемым с первым растворителем,
в массовом соотношении указанного по меньшей мере одного реагента основной цепи и указанного по меньшей мере одного сшивающего реагента в интервале от 1:99 до 99:1; и
(b) полимеризации смеси со стадии (а) путем суспензионной полимеризации в гидрогель, причем полимеризацию на стадии (b) инициируют путем добавления основания.
2. Способ по п. 1, где Р содержит по меньшей мере 85% ПЭГ, предпочтительно по меньшей мере 90% ПЭГ и более предпочтительно по меньшей мере 95% ПЭГ.
3. Способ по п. 1, где р2, р3 и р4 равны 4.
4. Способ по п. 1, где р5-р11 равны 4.
5. Способ по п. 1, где р37-р50 равны 3.
6. Способ по п. 1, где все хиральные центры фрагментов (e-ii), (e-iii) и (e-viii) имеют одинаковую конфигурацию.
7. Способ по п. 1, где m находится в интервале от 120 до 460 и предпочтительно от 120 до 230.
8. Способ по п. 1, где смесь со стадии (а) дополнительно содержит детергент.
9. Способ по п. 8, где детергентом является Cithrol DPHS, Hypermer 70А, Hypermer В246, Hypermer 1599A, Hypermer 2296 или Hypermer 1083.
10. Способ по п. 1, где основание выбирают из N,N,N',N'-тетраметилэтилендиамина (TMEDA), 1,4-диметилпиперазина, 4-метилморфолина, 4-этилморфолина, 1,4-диазабицикло[2.2.2]октана, 1,1,4,7,10,10-гексаметилтриэтилентетрамина, 1,4,7-триметил-1,4,7-триазациклононана, трис[2-(диметиламино)этил]амина, триэтиламина, диизопропилэтиламина (DIPEA), триметиламина, N,N-диметилэтиламина, N,N,N',N'-тетраметил-1,6-гександиамина, N,N,N',N'',N''-пентаметилдиэтилентриамина, 1,8-диазабицикло[5.4.0]ундец-7-ена, 1,5-диазабицикло[4.3.0]нон-5-ена и гексаметилентетрамина.
11. Способ по п. 1 или 8, где смесь со стадии (а) представляет собой эмульсию.
12. Способ по п. 1 или 8, дополнительно включающий стадию
(с) обработки гидрогеля.
13. Способ по п. 1, где Р имеет структуру формулы (c-i)
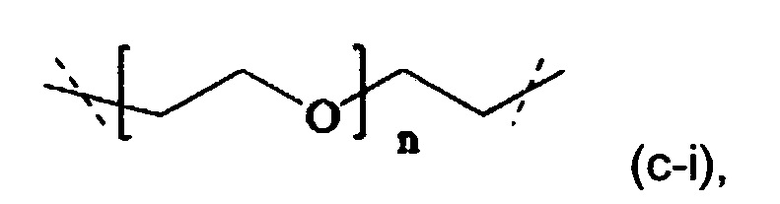
где n находится в интервале от 6 до 900, более предпочтительно от 20 до 700 и наиболее предпочтительно от 20 до 250.
14. Способ по п. 1, где реагент основной цепи имеет следующую формулу:
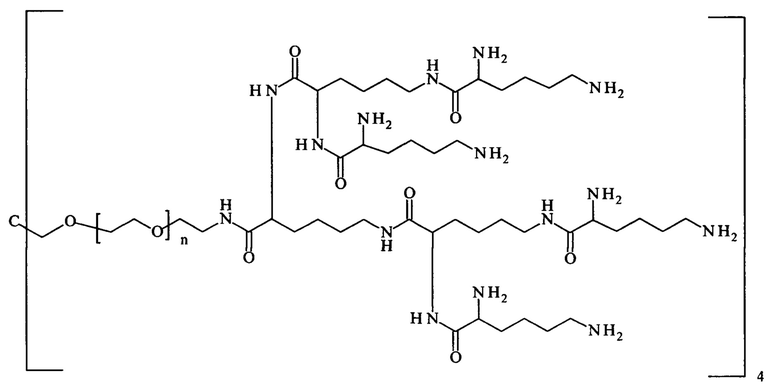
где n находится в интервале от 10 до 40, предпочтительно от 10 до 30, более предпочтительно от 10 до 20.
15. Способ по п. 14, где n находится в интервале от 20 до 30 и наиболее предпочтительно n равно 28.
16. Способ по п. 1 или 8, где реагент основной цепи присутствует в форме его кислотной соли.
17. Способ по п. 1 или 8, где сшивающий реагент имеет формулу (V-1)-(V-31) и (V-36)-(V-54):
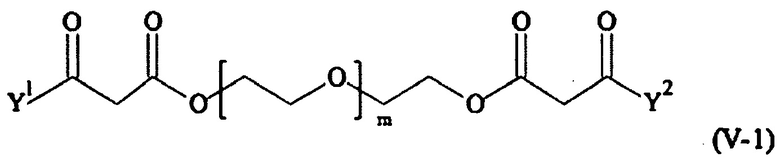
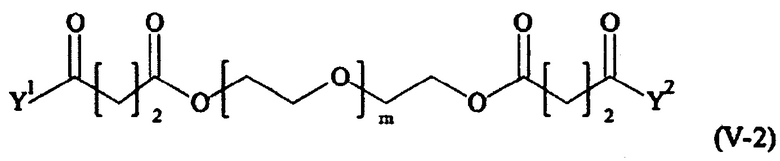
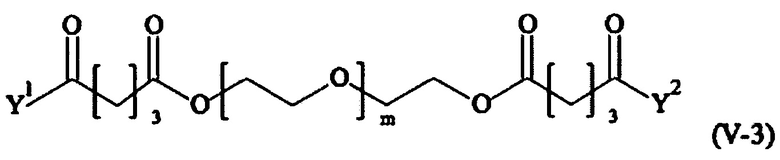
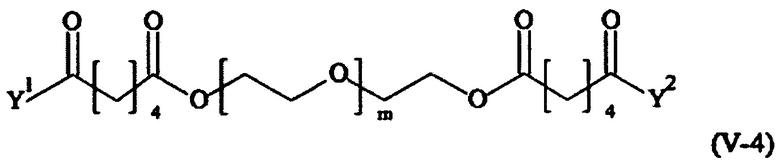
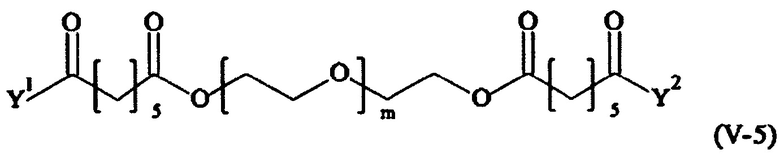
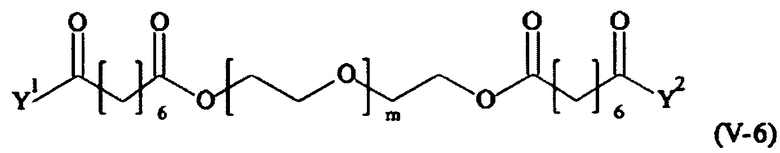
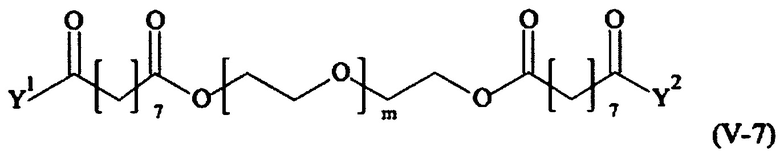
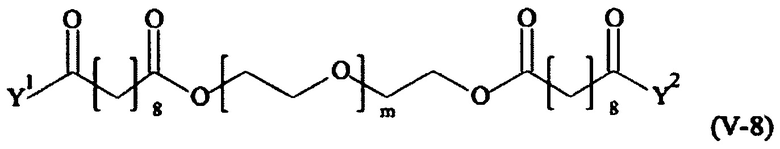

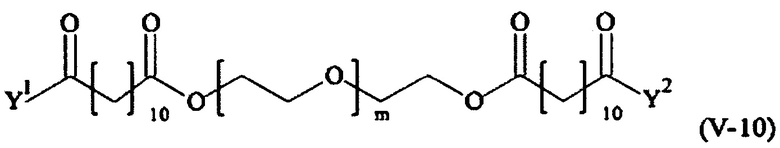
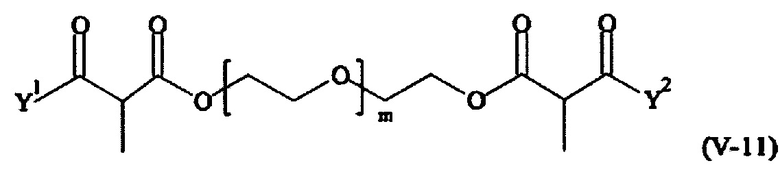
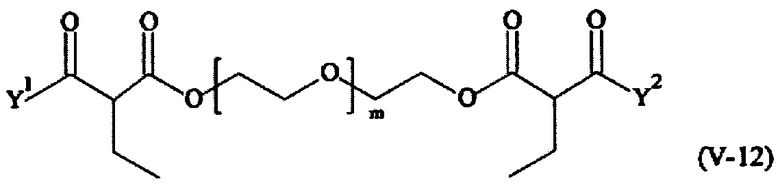


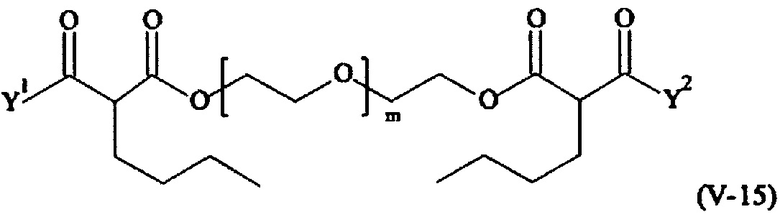
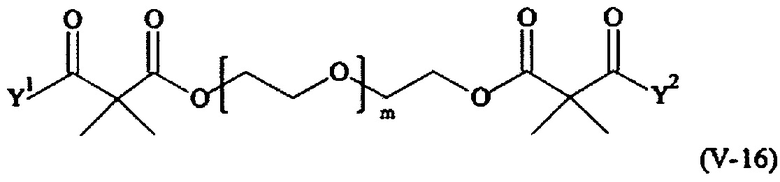
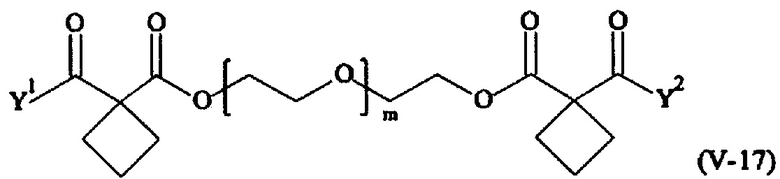
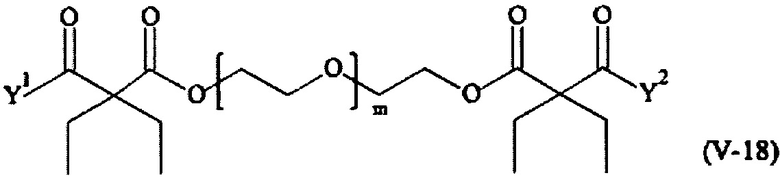

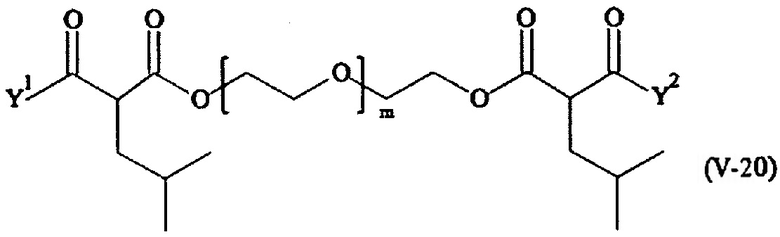
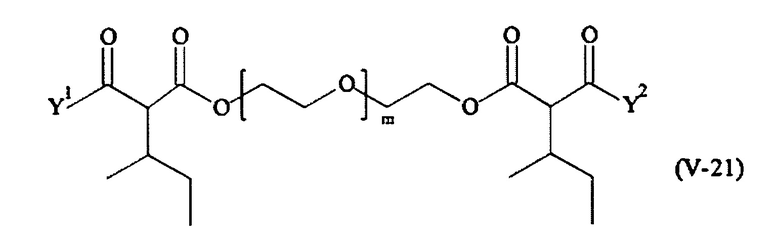
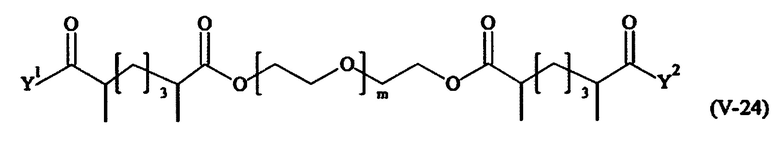
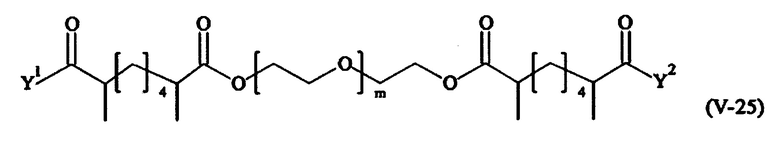
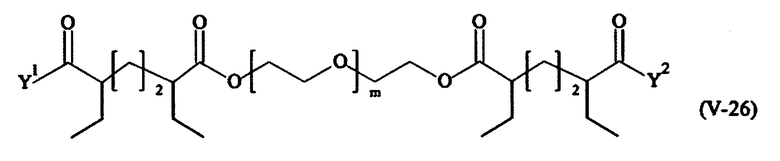
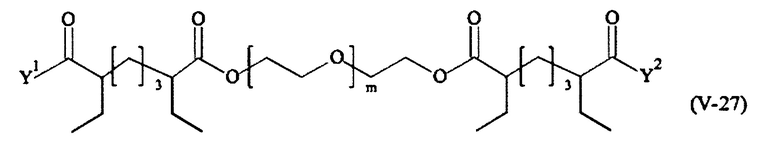

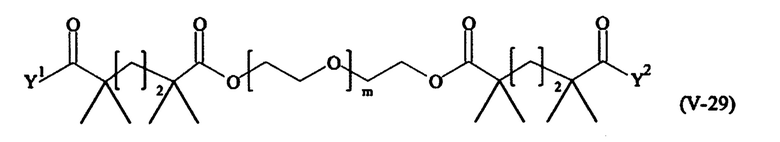
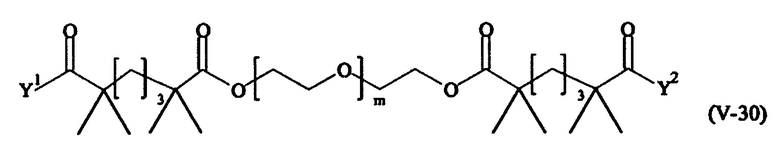
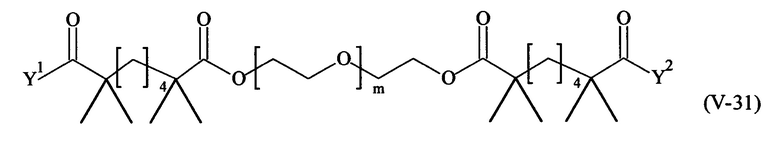
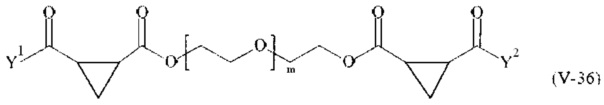
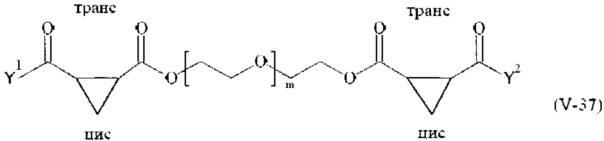
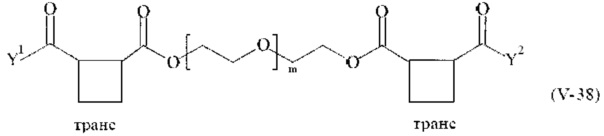
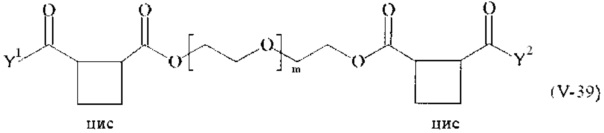

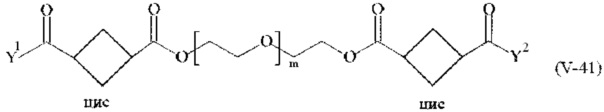

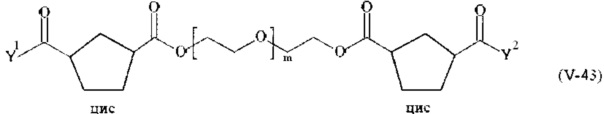

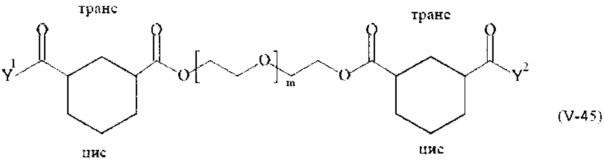
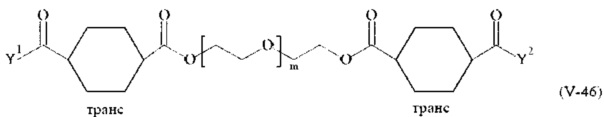
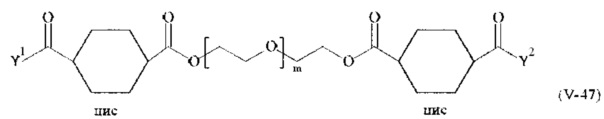
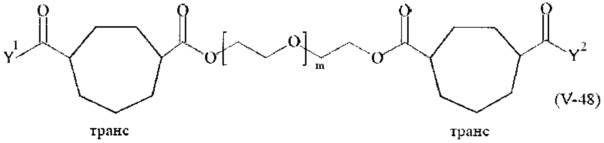
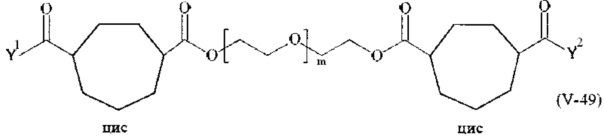
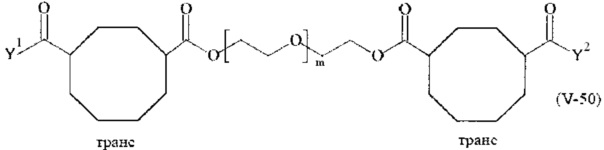
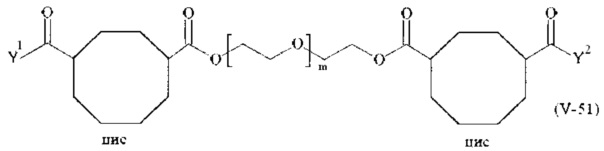
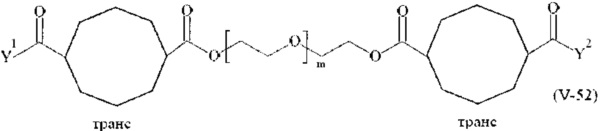
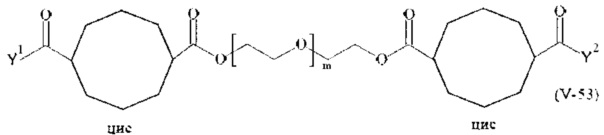

где при наличии каждый сшивающий реагент может быть в форме его рацемической смеси и
m находится в интервале от 120 до 920, предпочтительно от 120 до 460 и более предпочтительно от 120 до 230;
Y1, Y2 являются одинаковыми или различными и каждую независимо друг от друга выбирают из формул (f-i) и (f-ii)
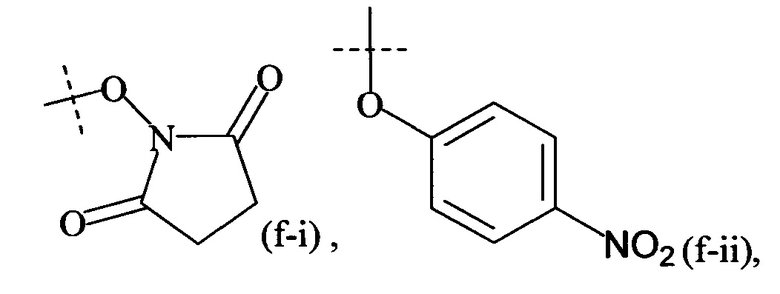
где пунктирные линии означают присоединение к остальной части молекулы.
18. Способ по п. 1, где гидрогель, полученный полимеризацией, представляет собой формованное изделие.
19. Способ по п. 18, где гидрогель находится в форме бисера микрочастиц, имеющих диаметр от 1 до 500 мкм.
20. Гидрогель, получаемый способом по п. 1.
21. Способ получения конъюгата гидрогель-спейсер, содержащий стадию
(d) реакции гидрогеля по п. 20 со спейсерным реагентом формулы (VI)
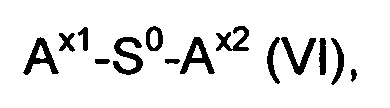
где S0 выбирают из группы, включающей С1-50 алкил, фрагмент которого необязательно прерван одной или более группами, выбранными из -NH-, -О-, -C(O)NH- и -О-С(О)-;
Ax1 представляет собой функциональную группу для реакции с аминной группой гидрогеля и выбрана из группы, состоящей из NHS-(C=O)- и R1(C=O)-, где NHS представляет собой N-гидроксисукцинимид и где R1 выбирают из группы, состоящей из 8-11-членного гетеробициклила, где 8-11-членный гетеробициклил означает гетероциклическую систему из двух циклов с 8-11 атомами в цикле, в которой по меньшей мере один атом в цикле является общим для обоих циклов и которая может содержать до максимального числа двойных связей, где от по меньшей мере одного атома в цикле до 6 атомов в цикле заменены на гетероатом, выбранным из группы, состоящей из серы, кислорода и азота, и где цикл связан с остальной частью молекулы через атом углерода или азота;
Ax2 представляет собой функциональную группу и представляет собой малеимид, SH, NH2;
в присутствии растворителя с получением конъюгата гидрогель-спейсер.
22. Конъюгат гидрогель-спейсер, получаемый способом по п. 21.
23. Способ получения конъюгата, связанного с носителем, включающий стадию
(е) реакции гидрогеля по п. 20 или конъюгата гидрогель-спейсер по п. 22 с реагентом линкер-биологически активный фрагмент формулы (VII)

где Ay1 представляет собой функциональную группу для реакции с амином гидрогеля со стадии (b) или (с) или для реакции с функциональной группой Ax2 конъюгата гидрогель-спейсер со стадии (d) и представляет собой SH или малеимид;
L представляет собой линкер;
D представляет собой биологически активный фрагмент;
в присутствии растворителя с получением конъюгата, связанного с носителем.
24. Способ по п. 23, где D имеет молекулярную массу в интервале от 2 до 500 кДа, более предпочтительно от 5 до 250 кДа, более предпочтительно от 5 до 100 кДа и наиболее предпочтительно от 10 до 60 кДа.
25. Конъюгат, связанный с носителем, получаемый способом получения конъюгата, связанного с носителем, по п. 23.
26. Фармацевтическая композиция для контролируемого и/или замедленного высвобождения лекарственного средства, содержащая конъюгат по п. 25 или его фармацевтическую соль вместе с фармацевтически приемлемым эксципиентом.
27. Конъюгат, связанный с носителем, по п. 25 или фармацевтическая композиция по п. 26 для применения в качестве медикамента.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| VINOGRADOV S ET AL: "Nanogel (TM) particles: Novel drug delivery system for antisense oligonucleotides", COLLOIDS AND SURFACES | |||
| B, BIOINTERFACES, ELSEVIER, AMSTERDAM, NL, том 16 | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| EA 200501863 A1, 30.06.2006 | |||
| Сырьевая смесь для приготовления огнезащитного покрытия | 1988 |
|
SU1625856A1 |
| US 5932462 A, 03.08.1999 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРНЫХ КОНЪЮГАТОВ | 2006 |
|
RU2401283C2 |
Авторы
Даты
2018-03-19—Публикация
2013-10-08—Подача