Область техники
Данное изобретение относится к области медицины, более конкретно к фармацевтической композиции и способу лечения связанных с гормоном роста заболеваний у человека.
Предшествующий уровень техники
Гормон роста (далее: ГР) представляет собой гормон, который стимулирует рост и репродукцию клеток у человека и других животных. Он представляет собой 191-аминокислоту, одноцепочечный полипептидный гормон, который синтезируется, хранится и выделяется в соматотрофных клетках в боковых крыльях передней доли гипофиза. Гормон также известен как соматотропин, если имеет отношение к гормону роста, полученному методом рекомбинантной ДНК, и обозначается как "рчГР". Гормон роста имеет множество функций в теле, наиболее значимой из которых является увеличение роста в детстве, и существует несколько заболеваний, которые могут быть вылечены с помощью терапевтического применения ГР. Эффект от дефицита гормона роста сильно варьируется в зависимости от возраста, в котором он возникает. У детей недостаток роста и низкорослость являются основными проявлениями дефицита ГР. Он также может вызывать половую недоразвитость. У взрослых эффект от дефицита выражен слабее и может включать дефицит силы, энергии и костной массы, а также повышенный сердечнососудистый риск. Существует множество причин дефицита ГР, включая мутации определенных генов, врожденный порок развития, включая гипоталамус, и/или переднюю долю гипофиза, и повреждения гипофиза при травмах, хирургическом вмешательстве или заболевании. Дефицит лечат введением внешнего ГР. Все применяемые в настоящее время ГР являются биосинтетической версией человеческого ГР, полученной методом рекомбинантной ДНК. ГР применяют в качестве заменяющей терапии у детей и взрослых, страдающих дефицитом ГР, возникшим либо в детстве (после завершения фазы роста), либо во взрослом состоянии (обычно в результате приобретенной опухоли гипофиза). У таких пациентов улучшения могут включать снижение массы жировой ткани, повышение массы нежировой ткани, улучшение плотности костей, улучшение липидного профиля, снижение факторов сердечнососудистого риска и улучшение психосоциального здоровья. Genentech Inc (US) первые клонировали рчГР и описали это в патенте ЕР-В 22242. По данным на 2006, синтетические гормоны роста, доступные в Соединенных Штатах и Европе (и их производители) включают Нутропин (Genentech), Хуматроп (Eli Lilly), Генотропин (Pfizer), Нордитропин (Novo Nordisk), Сайзен (Merck Serono) и Омнитроп (Sandoz).
Хотя методы молекулярной биологии значительно повышают доступность многих белков и/или полипептидов (далее обозначенных как белки), терапевтическое применение указанных белков часто тормозится другими факторами, такими как короткий период полувыведения плазмы из-за почечного и рецептор-опосредованного клиренса, агрегации, протеолитического разложения, плохой биодоступности и физических свойств, которые исключают эффективность составов.
Механизм улучшения доступности белков заключается в слиянии белка с соединениями, используемыми для получения производных, которые включают, но не ограничены ими, полиэтиленгликоль и полипропиленгликоль. Некоторые из этих признанных преимуществ включают: пониженную иммуногенность и антигенность, повышенную продолжительность действия и измененные фармакокинетические свойства. [Veronese, F.M. "Enzymes for Human Therapy: Surface Structure Modifications," Chimica Oggi, 7:53-56 (1989)] (Ссылка 5).
С помощью ПЭГилирования рчГР можно улучшить характеристики молекулы для медицинского применения через повышение периода полувыведения in vivo (что позволяет снизить дозу или частоту дозирования), улучшение ее стабильности и снижение ее антигенности, или их сочетание.
В общем, такой тип модификации молекулы хорошо известен в данной области техники, и существует множество патентов, доступных из литературных источников, которые описывают эту концепцию. Например, ПЭГилированный эритропоэтин (ЭПО) от Hofmann La Roche описан в ЕР-В 1196443, в котором заявляется специфический линкер, содержащий ПЭГ, ковалентно связанный с ЭПО, ПЭГилированный интерферон альфа, описанный в ЕР-В 975369, от компании Nektar/La Roche, и другой ПЭГилированный интерферон альфа в ЕР-В 1562634 от компании Hofmann La Roche.
Полагают, что in vivo клиренс рчГР происходит по двум представленным ниже механизмам. Первый представляет собой почечный клиренс, в котором рчГР выводится из кровотока почечной клубочковой фильтрацией. Почечный клиренс рчГР хорошо описан, и ПЭГилирование синтетического рчГР поэтому является очевидным выбором для решения этой проблемы. Почечный клиренс составляет 25-53% от общего клиренса рчГР (Girard, J. Mehls, O.J. Clin. Invest. 1994 March; 93(3): 1163-1171, ссылка 3).
Вторым механизмом является печеночный клиренс (в печени). Поглощение ГР печенью вызывается рецептор-опсредованным эндоцитозом с последующей лизосомной деградацией.
Третьим механизмом является рецептор-опосредованный клиренс в других тканях, таких как хондроциты хрящей. При снижении сродства связывания ГР с рецептором ГР путем ПЭГилирования рецептор-опосредованный клиренс снижается. Однако существуют определенные проблемы с введением рчГР. Одним из основных недостатков подкожного введения рчГР является возникновение липоатрофии у пациентов, получающих лечение.
Липоатрофия - это медицинский термин, применяемый для локализированной потери жировой ткани. Композиции для подкожного введения рчГР вызывают проблемы липоатрофии, которая, предположительно, вызывается высокой локальной концентрацией комплекса гормона роста в месте инъекции.
У  A. et al. в публикации в J. Pediatr. Endocrinol. Metab. 1999 Jan-Feb; 12(1):95-7 есть описание такой истории болезни (ссылка 1). Это отчет по пациенту с выделенным дефицитом ГР из-за делеции 6,7 т.п.н. гена, который получал высокую дозу рчГР, и у которого развивались локальные липоатрофии в местах инъекций без определения каких-либо антител через 6 лет после лечения. Этиология липоатрофии предположительно объясняется прямым липолитическим эффектом высоких доз рчГР.
A. et al. в публикации в J. Pediatr. Endocrinol. Metab. 1999 Jan-Feb; 12(1):95-7 есть описание такой истории болезни (ссылка 1). Это отчет по пациенту с выделенным дефицитом ГР из-за делеции 6,7 т.п.н. гена, который получал высокую дозу рчГР, и у которого развивались локальные липоатрофии в местах инъекций без определения каких-либо антител через 6 лет после лечения. Этиология липоатрофии предположительно объясняется прямым липолитическим эффектом высоких доз рчГР.
Полагают, что липоатрофия, связанная с введением рчГР, вызывается активностью самого рчГР, более высокими концентрациями и пролонгированным воздействием. Такие высокие концентрации возникают в месте инъекции.
Шанс того, что высокая активность гормона роста аккумулируется рядом с местом инъекции, становится даже более высоким, если рчГР ПЭГилирован, из-за увеличенного времени пребывания. При применении составов ПЭГилированного рчГР ткань подвергается продолжительному и усиленному воздействию гормона роста из-за того, что ПЭГилированный конъюгат обладает активностью, необходимой для фармакологического действия, а диффузия конъюгата ограничена из-за размера конъюгата. Результатом является повышенный липолиз в месте инъекции.
В WO-A 2005/079838 описан ПЭГилированный чГР, где фрагмент чГР присоединен к полиэтиленгликольному полимеру через функциональную аминогруппу, что может считаться прочной связью из-за стабильности аминогруппы. Примером такого соединения ПЭГилированного чГР, которое вызывает липоатрофию, является соединение РНА-794428. Соединение РНА-794428 является ПЭГилированным рчГР и также описано в WO-A 2005/079838 от компании Pharmacia (приобретена Pfizer), а также описано в Horm. Res. 2006; 65 (suppl. 4): 1-213, CF1-98 ГР/IGF Treatment в статье "First in-human study of PEGylated recombinant human growth hormone", Philip Harris et al. (ссылка 4).
Согласно информации по клиническим исследованиям, опубликованным на www.clinicaltrials.gov, исследования закончились 10 декабря 2007. Решение Pfizer's закончить программу было вызвано липоатрофией в месте инъекции, которая была отмечена на клинической Фазе 2 исследований после однократной инъекции РНА 794428.
В WO-A 2006/102659 (Nektar) также описываются и предлагаются конъюгаты рчГР-ПЭГ (линейного и разветвленного типа) через аминовую связь. Проблема, решаемая в WO-A 2006/102659, описана в параграфе [0005] на странице 2. Согласно заявителю, решаемой проблемой является пониженная частота дозирования. Так как терапия рчГР обычно требует ежедневных инъекций, пациентам, и в частности, педиатрическим пациентам, не нравится неудобство и дискомфорт, связанный с таким режимом. Решение, описанное в Nektar's WO-A, заключается в предоставлении новых конъюгатов ПЭГ-рчГР.
В таблице 6 [0257] WO-A можно увидеть, что конъюгаты ПЭГ-рчГР обладают достаточно низкой активностью in vitro по сравнению с природным гормоном роста без ПЭГ. Несмотря на низкую активность in vitro, конъюгаты ПЭГилированного рчГР активны in vivo. Более подробная информация дана в [0261]: "Хотя предварительные in vitro результаты позволяют предположить, что увеличение количества ПЭГ, присоединенного кчГР, снижает его способность стимулировать рецептор чГР, основываясь на предварительных in vivo результатах, судя по всему, снижение биодоступности более чем уравновешивается повышенным периодом полувыведения и/или доступностью в плазме, что позволяет сделать заключение, что представленные здесь конъюгаты обладают превосходным фармакодинамическим действием in vivo по сравнению с немодифицированным рчГР при идентичном режиме дозирования".
В WO-A 2006/102659 (Nektar) не описаны саморасщепляемые линкеры - т.е. просто отмечается, что конъюгаты ПЭГ-рчГР являются активными in vivo, хотя их in vitro активность значительно снижена. Проблема липоатрофии не рассматривается. Решением проблем с получением желаемых свойств пониженной липоатрофии и пониженной частоты инъекций у ПЭГилированного конъюгата чГР является применение пролекарства. Пролекарством является любое соединение, которое претерпевает биопревращение перед проявлением фармакологического эффекта. Пролекарства, таким образом, могут рассматриваться как лекарственные средства, содержащие специализированные нетоксичные защитные группы, применяемые в переходном состоянии для изменения или удаления нежелательных свойств в исходной молекуле. В этом случае полимерный носитель может временно снижать активность гормона роста и, следовательно, снижать вероятность липолиза тканей. Переходное конъюгирование с полимерным носителем будет в то же время увеличивать период полувыведения конъюгата и, следовательно, обеспечивать пролонгированную доставку чГР.
Множество макромолекулярных пролекарств описаны в литературе, в которых макромолекулярный носитель связан через лабильную сложноэфирную группу с лекарственным агентом (например, Y. Luo, MR Ziebell, GD Prestwich, "A Hyaluronic Acid - Taxol Antitumor Bioconjugate Targeted to Cancer Cells", Biomacromolecules 2000, 1, 208-218, J Cheng et al., Synthesis of Linear, beta-Cyclodextrin Based Polymers and Their Camptothecin Conjugates, Bioconjugate Chem. 2003, 14, 1007-1017, R. Bhatt et al., Synthesis and in Vivo Antitumor Activity of Poly(L-glutamic acid) Conjugates of 20(S)-Campththecin, J. Med. Chem. 2003, 46, 190-193; R.B. Greenwald, A. Pendri, C.D. Conover, H. Zhao, Y.H. Choe, A. Martinez, K. Shum, S. Guan, J. Med. Chem., 1999, 42, 3657-3667; B. Testa, J.M: Mayer in Hydrolysis in Drug and Prodrug Metabolism, Wiley-VCH, 2003, Chapter 8). В этих случаях конъюгированная функциональная группа биоактивного соединения является гидроксильной группой или карбоновой кислотой.
Особенно для биомакромолекул, но также для низкомолекулярных полимерных пролекарств, может быть желательно связывать макромолекулярный носитель с аминогруппами (т.е. N-концы или аминогруппы лизина белков) биоактивного вещества. Особенно это применимо, если маскировка биоактивности лекарственного средства требует конъюгирования определенной аминогруппы биоактивного вещества, например, аминогруппы, расположенной в активном центре, или области, или эпитопе, вовлеченных в связывание рецептора. Также во время получения пролекарства аминогруппы могут быть более хемоселективно адресованы и служат для лучшего управления конъюгированием носителя и лекарственного средства, благодаря их большей нуклеофильности по сравнению с гидроксильными или фенольными группами. Особенно это справедливо для белков, которые могут содержать огромное множество различных реакционноспособных функциональных групп. В этом случае неселективные реакции конъюгирования дают нежелательные смеси продуктов, которые требуют значительной харастеризации или очистки и могут снижать выход реакции и терапевтическую эффективность продукта.
Активация пролекарств может происходить либо ферментативным, либо не ферментативным расщеплением лабильного мостика между носителем и молекулой лекарственного средства, или последовательным сочетанием обоих методов, например, ферментативной стадии с последующей неферментативной перегруппировкой.
В WO-A 2005/099768 описаны ПЭГилированные линкерные молекулы с саморасщепляющимися линкерами для большой группы биомолекул, включая соматотропины (пункт 6). В WO-A 2005/099768 решаемой проблемой является межиндивидуальные колебания и непредсказуемое действие активации пролекарства при вовлечении ферментативных механизмов (страница 12, строки 17-30). В этой заявке в качестве решения описан ароматический линкер, который может быть на основе ПЭГ. Такой линкер-ПЭГ связывает лекарственное средство таким образом, что активность лекарственного средства значительно снижается. Оно активируется только при высвобождении лекарственного средства, которое инициируется гидролизом. Гидролиз может контролироваться химически. Никаких специальных акцентов не сделано относительно ГР и связанных с ним проблем, таких как липоатрофия, связанных с указанным решением.
Вкратце, ни в одном из указанных выше источников не описывается решение разрабатывать рчГР аролонгированного действия на основе конъюгата пролекарства, который может вводиться менее часто без повышения частоты липоатрофии.
Таким образом, объектом данного изобретения является предоставление такого пролекарства или фармацевтической композиции, содержащей указанное пролекарство, для снижения частоты введения рчГР с применением ПЭГ конъюгированного с рчГР без значительного возникновения липоатрофии.
Сущность изобретения
Следовательно, данное изобретение обеспечивает фармацевтическую композицию, содержащую подходящие фармацевтические наполнители, а также содержащую клинически эффективное для человека in vivo ПЭГилированного конъюгата пролекарства рекомбинантного человеческого гормона роста рчГР, где ПЭГ связан с рчГР через самогидролизуемый (саморасщепляющийся) временный линкер; где указанный конъюгат пролекарства отличается тем, что:
(1): конъюгат имеет ГР активность, которая менее 5% от природного гормона роста без ПЭГ; и
(2): скорость самогидролиза линкера такова, что период полувыведения in vivo составляет от 10 часов до 600 часов.
Свойство (1) обеспечивает низкое количество случаев липоатрофии при приеме пролекарства, несмотря на то, что оно имеет значительно более длительное время действия in vivo. Не ограничиваясь теорией, авторы данного изобретения полагают, что если пролекарство имеет большую активность ГР, этот продукт все равно будет вызывать липоатрофию гораздо чаще, чем представленные в настоящее время на рынке продукты рчГР.
Свойство (2) обеспечивает выделение рчГР (без ПЭГ) постепенно, в течение определенного времени, так, чтобы вводить фармацевтический продукт рчГР менее часто, чем человеческий гормон роста, например, только один раз в неделю или один раз в месяц вместо ежедневного введения, при этом сохраняя полную эффективность по сравнению с рчГР.
Предпочтительно, период полувыведения in vivo вплоть до в 5 раз меньше, например, в 2, 3, 4 или 5 раз меньше, чем соответствующий период полувыведения in vitro конъюгата ПЭГилированного пролекарства чГР. Более предпочтительно, период полувыведения in vivo вплоть до в 3 раза меньше, чем соответствующий период полувыведения in vitro конъюгата ПЭГилированного пролекарства чГР. Наиболее предпочтительно, период полувыведения in vivo вплоть до в 2 раза меньше, чем соответствующий период полувыведения in vitro t конъюгата ПЭГилированного пролекарства чГР.
Данное изобретение относится к ПЭГилированным пролекарствам рчГР, в частности, рчГР ПЭГилированным пролекарствам, связанным с носителем, включая касскадные пролекарства, связанные с носителем (cascade carrier prodrugs). Пролекарства могут быть определены как терапевтические агенты, которые являются неактивными сами по себе, но предсказуемо превращаются в активные метаболиты (см. В. Testa, J.M: Mayer в Hydrolysis in Drug and Prodrug Metabolism, Wiley-VCH, 2003, стр. 4). В системах пролекарств, связанных с носителем, многие медицинские агенты являются неактивными или показывают пониженную биологическую активность, когда полимер ковалентно конъюгирован с молекулой лекарственного средства. В таких случаях временную связь лекарственного средства и носителя применяют таким образом, что медицинский агент высвобождается из полимерного носителя in vivo, восстанавливая свою биологическую активность. Пониженная биологическая активность пролекарства, по сравнению с выделенным лекарственным средством, является преимуществом, если желаемо замедленное или контролируемое выделение лекарственного средства. В этом случае относительно большое количество пролекарства может быть введено без сопутствующих побочных эффектов и риска передозировки. Высвобождение лекарственного средства происходит в течение времени, тем самым снижая необходимость повторного и частого введения лекарственного средства.
В пролекарствах, связанных с полимерным носителем, биологически активные фрагменты часто связаны с фрагментом полимерного носителя лабильным мостиком, образованным между фрагментом носителем и функциональной группой молекулы лекарственного средства. Расщепление носителя пролекарства создает молекулярное соединение (лекарственное средство) с повышенной биоактивностью и по меньшей мере один побочный продукт, носитель. Этот побочный продукт может быть биологически инертен (например, ПЭГ). После расщепления биологически активное соединение открывает по меньшей мере одну ранее конъюгированную и таким образом замаскированную или защищенную функциональную группу, и присутствие этой группы обычно вносит вклад в биологическую активность. Активность ГР может быть измерена с применением методов, известных в данной области техники. В этом аспекте особенно внимание уделяется примеру 1. Основываясь на факте, что некоторые временные линкеры, применяемые в соответствии сданным изобретением, могут иметь период полувыведения in vitro менее 3000 ч, соответствующие измерения активности ГР проводят косвенно, через определение активности ГР соответствующего ПЭГ конъюгата, содержащего постоянный линкер вместо временного линкера. Это может быть проведено как описано в WO 2006102659 на странице 74, параграф 0240, биологическая активность рчГР и конъюгатов, описанных здесь, должна оцениваться in vitro с применением анализа пролиферации клетоклимфомы крыс NB2-II. Вкратце, клетки NB2-II, полученные из лимфомы крысы, инкубируют с рчГР, что приводит к связыванию молекулы рчГР с ее рецептором на поверхности клетки. Связывание с рецептором вызывает каскад сигнальной трансдукции, что дает пролиферацию клеток. Результаты анализа основаны на определенном содержании белка и 100% биологической активности немодифицированного рчГР.
Предпочтительно, для измерения активности ГР используют протокол, описанный в примере 24.
Период полувыведения in vitro может быть измерен с применением методов, известных в данной области техники. Здесь особое внимание уделяется примеру 2. Следовательно, второй аспект данного изобретения относится к клинически эффективному количеству фармацевтической композиции, содержащей ПЭГилированное пролекарство рчГР из первого аспекта, для применения в способе лечения заболеваний, связанных с ГР, у человека.
Этот второй аспект альтернативно может быть сформулирован как способ лечения связанного с ГР заболевания у человека, предусматривающий введение человеку клинически эффективного количества фармацевтической композиции, содержащей ПЭГилированное пролекарство рчГР из первого аспекта.
В ситуации, где остаточная активность пролекарства (как, например, при применении временно конъюгированного с ПЭГ рчГР) значительно снижена по сравнению с природным человеческим ГР, липолитические эффекты могут не возникать даже при длительном приеме.
Описанные здесь соединения, названные ПЭГилированными пролекарствами рчГР, являются конъюгатами, которые могут иметь значительно сниженную остаточную активность по сравнению с человеческим ГР. Для оказания терапевтически полезного действия необходимо высвободить рчГР из конъюгата пролекарства, для чего необходимо, чтобы описанные пролекарства прошли стадию активации (например, механизмы 1,6-выделения), названную здесь саморасщеплением, отщепляя группу ПЭГ от лекарственного средства. Механизм 1,6-выделения описан в WO-А 2005/099768. Не ограничиваясь теорией, авторы данного изобретения полагают, что описанные здесь временно ПЭГилированные конъюгаты рчГР значительно снижают липоатрофию благодаря низкой активности ПЭГилированных конъюгатов рчГР до того, как ПЭГ начинает постепенно отщепляться за счет самоотщепляющегося линкера. Это свойство обеспечивает то, что пролекарство не будет вызывать липоатрофию более часто, чем человеческий ГР или другие постоянно ПЭГилированные соединения рчГР, описанные выше.
Проблема, лежащая в основе данного изобретения, также решается фармацевтической композицией, содержащей подходящие фармацевтические наполнители, и также содержащей конъюгат пролекарства человеческого гормона роста (чГР) формулы (АА)

где
hGH-NH является остатком чГР;
La является функциональной группой, которая самогидролизуема (саморасщепляема) группой Ga, вызывающей саморасщепление; и
S0 является полимерной цепью, имеющей молекулярную массу по меньшей мере 5 кДа и содержащей по меньшей мере первую разветвляющую структуру BS1, и по меньшей мере первая разветвляющая структура BS1, содержит по меньшей мере вторую полимерную цепь S1, имеющую молекулярную массу по меньшей мере 4 кДа, где по меньшей мере одна из S0, BS1, S1 также содержит группу Ga, вызывающую саморасщепление, и где разветвляющая структура BS1 также содержит по меньшей мере третью полимерную цепь S2, имеющую молекулярную массу по меньшей мере 4 кДа, или по меньшей мере одна из S0, S1 содержит по меньшей мере вторую разветвляющую структуру BS2, содержащую по меньшей мере третью полимерную цепь S2, имеющую молекулярную массу по меньшей мере 4 кДа, и где молекулярная масса конъюгата пролекарства без чГР-NH составляет по меньшей мере 25 кДа и не более 1000 кДа, предпочтительно по меньшей мере 25 кДа и не более 500 кДа, даже более предпочтительно по меньшей мере 30 кДа и не более 250 кДа, даже более предпочтительно по меньшей мере 30 кДа и не более 120 кДа, даже более предпочтительно по меньшей мере 40 кДа и не более 100 кДа, даже более предпочтительно по меньшей мере 40 кДа и не более 90 кДа. Неожиданно было обнаружено, что остаточная активность пролекарства в соответствии сданным изобретением может быть эффективно понижена применением полимерного носителя, имеющего по меньшей мере 3 цепи определенной минимальной длины (что определено их молекулярной массой) и, таким образом, в сочетании с временным линкером, описанным здесь, решается проблема получения пролекарства чГР, которое может вводиться менее часто без увеличения риска липоатрофии. Пролекарство должно быть растворимо в воде. Для по меньшей мере бис-конъюгированных пролекарств проблема может быть решена фармацевтической композицией, содержащей подходящие фармацевтические наполнители, а также содержащей конъюгат пролекарства человеческого гормона роста (чГР) формулы (АВ)
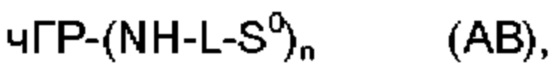
где
n равно 2, 3 или 4; предпочтительно 2;
чГР(-МН)n является остатком чГР;
каждый L независимо является постоянной функциональной группой Lp или функциональной группой La, которая является самогидролизуемой (саморасщепляемой) посредством группы Ga, вызывающей саморасщепление; и каждая S0 независимо является полимерной цепью, имеющей молекулярную массу по меньшей мере 5 кДа, где S0 при необходимости является разветвленной, так как она содержит по меньшей мере первую разветвляющую структуру BS1, где по меньшей мере первая разветвляющая структура BS1 содержит по меньшей мере вторую полимерную цепь S1, имеющую молекулярную массу по меньшей мере 4 кДа, где по меньшей мере одна из S0, BS1, S1 также содержит группу Ga, вызывающую саморасщепление, и где молекулярная масса конъюгата пролекарства без чГР-NH составляет по меньшей мере 25 кДа и не более 1000 кДа, предпочтительно по меньшей мере 25 кДа и не более 500 кДа, даже более предпочтительно по меньшей мере 30 кДа и не более 250 кДа, даже более предпочтительно по меньшей мере 30 кДа и не более 120 кДа, даже более предпочтительно по меньшей мере 40 кДа и не более 100 кДа, даже более предпочтительно по меньшей мере 40 кДа и не более 90 кДа. Еще один аспект данного изобретения относится к конъюгату пролекарства, определенному выше.
Предпочтительные варианты данного изобретения описаны ниже только в качестве примеров.
ОПРЕДЕЛЕНИЯ
Перед обсуждением подробных вариантов осуществления данного изобретения представлены описания определенных терминов, связанных с основными аспектами данного изобретения.
В общем, все специфические технические термины, применяемые здесь, должны пониматься так, как их понимают специалисты в данной области техники в данном техническом контексте.
рчГР, или чГР, или ГР, или чГР остаток относится к человеческому гормону роста. NH-чГР является остатком чГР, где -NH- из -NH-чГР является аминогруппой чГР. Термин «активность» понимается как способность гормона роста или его конъюгата вызывать биологическую реакцию в ответ при введении млекопитающему, например, в модели in vivo, или вызывать измеряемую реакцию в модели in vitro как описано в примерах.
В системе пролекарства измеряемая активность имеет две составляющих, одна из высвобожденного свободного лекарственного вещества, и одна из еще не расщепленного конъюгата пролекарства. Для разделения активности конъюгата пролекарства здесь применяют термин «остаточная активность», который означает часть измеренной активности пролекарства, которая может быть отнесена к конъюгату пролекарства.
Термин «саморасщепление» понимается как ограничивающее скорость гидролитическое расщепление связи между временным линкером и молекулой лекарственного средства рчГР в водном забуференном растворе в физиологических условиях рН 7,4 и 37°С. Саморасщепление не требует присутствия фермента. Такое саморасщепление или самогидролиз контролируется группой, вызывающей саморасщепление, которая является частью молекулы пролекарства. Такая группа, вызывающая саморасщепление может присутствовать как таковая или в замаскированной форме так, что требуется ее демаскирование до того, как сможет стартовать механизм самогидролиза.
Скорость самогидролиза линкера относится к скорости расщепления чГР-ПЭГилированного пролекарства in vivo. Ферментное или другое действие практически всегда приводит к тому, что гидролиз линкера пролекарства проходит быстрее in vivo, чем in vitro, и определено, что чГР ПЭГ пролекарство расщепляется аутогидролитическим путем, если период полувыведения пролекарства in vivo до 5 раз меньше, чем соответствующий период полувыведения конъюгата ПЭГилированного пролекарства чГР in vitro.
Термин «временная связь» или «временный линкер» описывает лабильность связи между ПЭГ и рчГР в ПЭГилированном пролекарстве рчГР. В таких временных связях рчГР выделяется из соответствующего пролекарства с in vivo периодом полувыведения линкера вплоть до 1200 часов.
Термин «конъюгат» понимается как одна или более молекул ПЭГ, ковалентно связанные с лекарственным средством, которым в данном случае является человеческий гормон роста.
Термин «временный конъюгат» относится к ПЭГилированным пролекарствам чГР, содержащим по меньшей мере одну временную связь.
Термин «постоянный конъюгат» относится к ПЭГилированным конъюгатам или пролекарствам чГР, где полимер ПЭГ связан с чГР с помощью связей, при этом период полувыведения in vitro составляет по меньшей мере 3000 часов. Период полувыведения in vitro или период полувыведения линкера in vitro равен высвобождению 50% чГР из чГР ПЭГилированного продукта в буфере при рН 7,4 и 37°С.
Термины «период полувыведения in vivo» или «период полувыведения линкера in vivo» понимают как интервал времени, при котором 50% исходной доли гормона роста высвобождается из ПЭГилированного пролекарства чГР после введения в тело человека, рассчитанный с учетом периода полувыведения соответствующего конъюгата соединения, как описано в примере 2.
Термин «период полувыведения конъюгата» понимается как интервал времени, за который 50% ПЭГилированного постоянного конъюгата чГР, определенного выше, выводится из кровотока.
Термин «липоатрофия» понимается как медицинский термин для местной потери жировой ткани. В данном контексте «липоатрофия» относится к липоатрофии в месте инъекции, что означает прохождение липолиза ткани вблизи места инъекции.
Термин «пролекарство» понимается как любое соединение, которое претерпевает превращение до проявления его полного фармакологического эффекта. Классификация систем пролекарства дана в определениях IUPAC (http://www.chem.qmul.ac.uk/iupac/medchem, в доступе с 8 марта 2004):
Пролекарство
Пролекарством является любое соединение, которое подвергается биотрансформации до демонстрации своего фармакологического действия. Пролекарства могут рассматриваться как лекарственные средства, содержащие специализированные нетоксичные защитные группы, применяемые временно, для изменения или удаления нежелательных свойств в исходной молекуле.
Двойное пролекарство (или про-пролекарство)
Двойное пролекарство является биологически неактивной молекулой, которая превращается in vivo в две стадии (ферментативно и/или химически) в активные виды.
Пролекарство, связанное с носителем (пролекарство на носителе)
Связанное с носителем пролекарство является пролекарством, которое содержит временную связь данного активного вещества с временной группой носителя, которая дает улучшенные физико-химические или фармакокинетические свойства, и которая может быть легко удалена in vivo, обычно гидролитическим расщеплением.
Каскадное пролекарство
Каскадное пролекарство является пролекарством, для которого отщепление группы носителя становится эффективным только после демаскирования активирующей группы.
Биотрансформация
Биотрансформация является химическим превращением веществ живыми организмами или ферментными препаратами.
Соответственно, группа, вызывающая каскадный самогидролиз, становится эффективной только после демаскирования определенных вызывающих самогидролиз структурных элементов. Может быть проведена одна или более каскадных демаскирующих стадий, требуемых для открывания вызывающих самогидролиз структурных элементов. По меньшей мере, одна из стадий демаскирования может быть основана на стадии биотрансформации. Термин «фармацевтическая композиция, содержащая клинически эффективное in vivo для человека количество ПЭГилированного пролекарства рекомбинантного человеческого гормона роста (рчГР)» означает количество, которое является достаточно высоким для того чтобы получить желаемый клинический эффект у человека после введения фармацевтической композиции человеку, например, желаемый клинический эффект в отношении лечения заболевания, связанного с ГР. В данном контексте специалист в данной области техники сможет скорректировать количество ПЭГилированного пролекарства рекомбинантного человеческого гормона роста (рчГР), вводимого для получения желаемого клинического эффекта. Термин «физиологическое состояние» понимается как любое in vitro или in vivo состояние, идентичное или похожее, на рН и температуру человеческого тела. Более конкретно, физиологическое состояние относится к состоянию с рН около рН 7,4 (рН 6,8 - рН 7,8) и температурой около 37°С (от 35°С до 40°С). Термин «линкер» часто применяют в публикациях в области биоконъюгирования, и он широко описывает химические структуры, применяемые для связывания двух молекулярных соединений. Такая связь может быть постоянной или временной. Временным линкером является линкер, при котором конъюгирование лекарственного средства с молекулой ПЭГ является обратимым. Это подразумевает, что отщепление линкера высвобождает лекарственное средство в его природной и активной форме. Структурная дифференциация структурной единицы временного линкера от полимерного носителя может быть сложной в случае пролекарств, связанных с носителем, особенно если полимер постоянно присоединен клинкеру, и, поэтому, продукты разложения линкера не выделяются в результате расщепления пролекарства. Структурное определение линкера становится даже более сложным, если линкер функционирует и как группа, вызывающая саморасщепление, и как разветвляющая структурная единица. Поэтому в контексте данного изобретения термин «линкер» может применяться как синоним для сочетания функциональной группы La и группы, вызывающей саморасщепление Ga. В случаях, где описаны пролекарства на носителе, в которых носителем является разветвленный ПЭГ, предпочтительно применять структурные описания на основе сочетаний La и Ga. В таком случае группа Ga, вызывающая расщепление, считается частью полимера носителя. Изменение химической природы Ga позволяет проектировать свойства саморасщепления соответствующего пролекарства, связанного с носителем, в значительной степени. Термин «постоянный линкер» относится к ПЭГ конъюгату с чГР-донированной первичной аминогруппой через образование алифатического амида или алифатического карбамата. Если применяются обычные реагенты для ПЭГилирования, полученные конъюгаты обычно являются очень устойчивыми к гидролизу, и скорость расщепления амидной или карбаматной связи будет слишком низкой для терапевтического применения системы пролекарства. Тем не менее, такой конъюгат с постоянным линкером применяют для исследования терапевтической применимости конъюгатов пролекарства, так как они позволяют оценить остаточную активность.
Если такие стабильные связи применяются в пролекарстве, расщепление функциональной группы не возможно в терапевтически полезный промежуток времени без ферментативного катализа.
Термин «растворимое в воде пролекарство» означает пролекарство, которое растворимо в воде в физиологических условиях. Обычно растворимое в воде пролекарство пропускает по меньшей мере 75%, более предпочтительно по меньшей мере 95% света, пропускаемого тем же раствором после фильтрации. По массе, растворимый в воде полимер является, предпочтительно, на по меньшей мере около 35% (по массе) растворимым в воде, еще более предпочтительно, на по меньшей мере около 50% (по массе), еще более предпочтительно, на по меньшей мере около 70% (по массе), еще более предпочтительно, на по меньшей мере около 85% (по массе), еще более предпочтительно, на по меньшей мере около 95% (по массе) или является полностью растворимым в воде.
Термин «ПЭГ» или «остаток пэгилирования» в данном описании применяется для подходящих растворимых в воде полимеров, характеризуемых повторяющимися единицами. Подходящие полимеры могут быть выбраны из группы, включающей полиалкилокси полимеры, гиалуроновую кислоту и ее производные, поливиниловые спирты, полиоксазолины, полиангидриды, сложные поли(ортоэфиры), поликарбонаты, полиуретаны, полиакриловые кислоты, полиакриламиды, полиакрилаты, полиметакрилаты, полиорганические фосфазены, полисилоксаны, поливинилпирролидон, полицианоакрилаты и сложные полиэфиры.
Цепи ПЭГ могут состоять из связующей группы, полимерной группы и концевой группы.
Для разветвленных моноконъюгатов ПЭГилированных пролекарств чГР критическое расстояние определяет кратчайшее расстояние между местом присоединения ПЭГ цепи S0 к La и первой разветвляющей структурой BS1, измеренное как соединенные атомы.
Термин "ПЭГ нагрузка" понимается как описание молекулярной массы полимерной цепи, состоящей из множества повторяющихся структурных единиц, присоединенных кчГР. Общая ПЭГ нагрузка означает общую молекулярную массу всех цепей полимерного носителя, присоединенных к чГР на молекулярной основе.
Подробное описание изобретения
Фармацевтическая композиция, содержащая подходящие фармацевтические наполнители
Как известно специалисту в данной области техники, фармацевтическая композиция содержит фармацевтически приемлемые наполнители и/или носители. «Фармацевтически приемлемые» включают любой наполнитель и/или добавку, которые не влияют на эффективность биологической активности активного ингредиента, и который не является токсичным для хозяина, которому его вводят. В предпочтительном варианте осуществления фармацевтической композицией является композиция для подкожного введения, внутримышечного введения или внутривенного введения. Данные способы введения являются примерами предпочтительных методов введения для лечения соответствующих расстройств/заболеваний, описанных здесь.
Фармацевтическая композиция может содержать другие активные ингредиенты, отличные от ПЭГилированного пролекарства рчГР, описанного здесь.
Рекомбинантный человеческий гормон роста (рчГР)
Так как рекомбинантный человеческий ГР идентичен по последовательности природному человеческому ГР, термин рекомбинантный человеческий гормон роста (рчГР) относится к так называемым эквивалентным биодженерикам. Таким образом, термины рчГР и чГР могут применяться как синонимы в данном изобретении. Термин «биодженерики» описывает генерические формы биофармацевтических веществ; молекул, полученных с применением биологических процессов, обычно методами современной биотехнологии. Генерические химические фармацевтические вещества могут быть определены как молекулы, которые, при сравнении с оригинальным продуктом, имеют практически такую же активность, практически химически идентичны зарегистрированным аналогам, являются биоэквивалентными, получают допуск на рынок через сокращенную методику после истечения срока действия патента.
Как известно специалисту в данной области техники, в настоящее время является рутинной процедурой проведение, например, незначительных аминокислотных замен в целевых биологических веществах (здесь ГР) без значительного влияния на активность биологических веществ.
Кроме рекомбинантного человеческого и биодженериков, термин рекомбинантный человеческий гормон роста (рчГР) относится ко всем возможным полипептидам рчГР.
Точное описание возможных полипептидов рчГР дано в WO-A 2005/079838 от Pharmacia Corporation, на странице 15, от параграфа 0043 до параграфа 0053. Термин «полипептид чГР или белок чГР» в данном описании охватывает все полипептиды чГР, предпочтительно, из млекопитающих, более предпочтительно, из человека и мышей, а также их варианты, аналоги, ортологи, гомологи и производные, и их фрагменты, которые характеризуются тем, что способствуют росту в фазе роста и при поддержании нормального телосложения, анаболизма и метаболизма жиров.
Термин «полипептид или белок чГР», предпочтительно, относится к 22 кДа полипептиду чГР, имеющему последовательность, описанную у A.L. Grigorian et al., Protein Science (2005), 14, 902-913, а также к его вариантам, гомологам и производным, обладающим практически той же биологической активностью (способствуют росту в фазе роста и при поддержании нормального телосложения, анаболизма и метаболизма жиров). Более предпочтительно, термин «полипептид или белок чГР» относится к полипептиду, имеющему точно указанную выше последовательность.
Производные чГР охватывают в частности конъюгаты пролекарства чГР, содержащие постоянно связанные полимеры, такие как ПЭГ, т.е. пролекарство в соответствии сданным изобретением может содержать, в дополнение к одному или более полимерным конъюгатам с временным линкером, другие полимерные конъюгаты с постоянным линкером.
Термин «варианты полипептида чГР» в данном описании относятся к полипептидам из того же вида, но отличающимся от ссылочного полипептида чГР. В общем, отличия ограничены так, чтобы последовательность аминокислот ссылки и варианта была практически одинаковой, и, в большинстве областей, идентичной.
Предпочтительно, полипептиды чГР являются на по меньшей мере 70%, 80%, 90%, 95%, 96%, 97%, 98% или 99% идентичными ссылочному полипептиду, предпочтительно полипептид чГР имеет последовательность, указанную у A.L. Grigorian et al., Protein Science (2005), 14, 902-913. Под полипептидом, имеющим последовательность аминокислот по меньшей мере например, на 95% «идентичную» запрашиваемой последовательности аминокислот, подразумевается, что последовательность аминокислот рассматриваемого полипептида идентична запрашиваемой последовательности за исключением того, что рассматриваемая последовательность полипептида может включать вплоть до пяти аминокислотных замен на каждые 100 аминокислот запрашиваемой последовательности аминокислот. Эти изменения ссылочной последовательности могут возникать в амино или карбокси концевых положениях ссылочной последовательности аминокислот или в любом месте между этими концевыми положениями, вставленные либо отдельно между остатками в ссылочной последовательности, или в виде одной или более соседних групп в ссылочной последовательности. Запрашиваемой последовательностью может быть полная последовательность аминокислот или любой фрагмент, определенный как здесь описано.
Такие варианты полипептида чГР могут быть природными вариантами, такими как природные аллельные варианты, кодированные одной или несколькими альтернативными формами чГР, занимающими данный локус на хромосоме организма, или изоформы, кодированные природными сплайс-вариантами, происходящими от единичного первичного транскрипта. Альтернативно, вариант полипептида чГР может быть вариантом, который неизвестен в природе, и который может быть получен с применением известных в данной области техники методов мутагенеза.
В данной области техники известно, что одна или более аминокислот могут быть делетированы из N-конца или С-конца биоактивного пептида или белка без значительной потери биологической функции (см., например, Ron et al., (1993), Biol Chem., 268 2984-2988, описание которого включено сюда путем ссылки полностью). Также специалисту в данной области техники будет понятно, что некоторые последовательности аминокислот полипептидов чГР могут быть изменены без значительного влияния на структуру или функции белка. Такие мутации включают делеции, вставки, инверсии, повторы и замещения, выбранные согласно общим правилам, известным в данной области техники, чтобы оказывать минимальное влияние на активность. Например, инструкции по получению фенотипически латентных замещений аминокислот представлены у Bowie et al. (1990), Science 247:1306-1310, включенной сюда путем ссылки, где авторы указывают, что существуют два основных подхода для изучения устойчивости аминокислотной последовательности к изменениям.
Первый способ относится к процессу эволюции, в котором мутации либо принимаются, либо отторгаются природным отбором. Во втором подходе применяется метод генной инженерии для введения аминокислотных замен в определенные положения клонированного чГР, и отбор или скрининг для идентификации последовательностей, которые сохранили функциональность. Эти исследования показали, что белки являются неожиданно устойчивыми к аминокислотным замещениям. Авторы также указывают, что аминокислотные замены вероятно являются пермиссивными в определенных положениях белка. Например, наиболее замаскированные остатки аминокислот требуют неполярных боковых цепей, принимая во внимание то, что некоторые характеристики поверхностных боковых цепей обычно сохраняются. Другие такие фенотипически «молчащие» замещения описаны у Bowie et al., (1990) выше, ссылки на которые даны здесь.
Обычно в качестве консервативных замещений рассматриваются замещения друг другом алифатических аминокислот Ala, Val, Leu и Phe, взаимозамена гидроксильных остатков Ser и Thr, замена кислых остатков Asp и Glu, замещение между амидными остатками Asn и Gln, замена основных остатков Lys и Arg и замены среди ароматических остатков Phe, Tyr. Кроме того, следующие группы аминокислот обычно представляют эквивалентные замены: (1) Ala, Pro, Gly, Glu, Asp, Gln, Asn, Ser, Thr; (2) Cys, Ser, Tyr, Thr; (3) Val, lle, Leu, Met, Ala, Phe; (4) Lys, Arg, His; (5) Phe, Tyr, Trp, His.
Термин полипептид чГР также охватывает все полипептиды чГР, кодированные аналогами, ортологами и/или видами гомологов чГР. В данном описании термин «аналоги чГР» относится к чГР различных и неродственных организмов, которые осуществляют одинаковые функции в каждом организме, но которые не происходят из анцестральной структуры, которая является общей для предков организмов. Вместо этого, аналогичные чГР происходят отдельно и затем эволюционируют для осуществления одной и той же функции (или подобных функций). Другими словами, аналогичными полипептидами чГР являются полипептиды с довольно разными последовательностями аминокислот, но которые обладают одинаковой биологической активностью, а именно способствуют росту в фазе роста и поддерживают нормальное телосложение, анаболизм и липидный метаболизм. В данном описании термин «ортологи чГР» относятся к чГР в двух различных видах, последовательности которых являются родственными друг другу через общий гомологический чГР в анцестральных видах, но которые эволюционировали таким образом, чтобы стать отличными друг от друга. В данном описании термин «гомологи чГР» относится кчГР различных организмов, которые осуществляют одни и те же функции в каждом организме, и которые происходят из анцестральной структуры, которая является общей для предков организма. Другими словами, гомологичные полипептиды чГР являются полипептидами с подобными последовательностями аминокислот, которые осуществляют одну и туже биологическую функцию, а именно способствуют росту в фазе роста и поддерживают нормальное телосложение, анаболизм и липидный метаболизм. Предпочтительно, гомологи полипептида чГР могут быть определены как полипептиды, имеющие по меньшей мере 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98% или 99% идентичностью со ссылочным полипептидом чГР, предпочтительно, полипептид чГР имеет указанную выше последовательность. Таким образом, полипептид чГР может быть, например: (i) таким, в котором один или более остатков аминокислот замещены консервативным или неконсервативным остатком аминокислоты (предпочтительно, консервативным остатком аминокислоты), и такой замещенный остаток аминокислоты может быть или не быть кодирован генетическим кодом: или (ii) таким, в котором один или более остатков аминокислот включает группу заместителя: или (iii) таким, в котором полипептид чГР соединен с другим соединением, таким как соединение, увеличивающее период полувыведения полипептида (например, полиэтиленгликоль): или (iv) таким, в котором дополнительные аминокислоты соединены с указанной выше формой полипептида, например, пептид, слитый с участком IgG Fc, или лидерная, или секреторная последовательности, или последовательность, которую применяют для очистки указанной выше формы полипептида или пробелковой последовательности. Полипептиды чГР могут быть мономерами или мультимерами. Мультимеры могут быть димерами, триммерами, тетрамерами или мультимерами, содержащими по меньшей мере пять мономерных полипептидных единиц. Мультимеры также могут быть гомодимерами или гетеродимерами. Мультимеры могут быть результатом гидрофобных, гидрофильных, ионных и/или ковалентных связей и/или могут быть косвенно связаны, например, образованием липосом. В одном примере ковалентные связи могут быть между гетерологическими последовательностями, содержащимися в слитом белке, содержащем полипептид чГР или его фрагмент (см., например, патент США 5478925, описание которого включено сюда путем ссылки полностью). В другом примере полипептид чГР или его фрагмент соединен с одним или более полипептидами, которые могут быть либо полипептидами чГР, либо гетерологическими полипептидами, через пептидные линкеры, такие как описаны в патенте США 5073627 (включенном сюда путем ссылки). Другим способом получения мультимера полипептидов чГР является применение полипептидов чГР, слитых с полипептидной последовательностью лейциновой застежки-молнии или изолейциновой застежки-молнии, которые, как известно, способствуют мультимеризации белков, в которых они обнаруживаются, при использовании методов, известных специалистам в данной области техники, включая методики, изложенные в WO 94/10308. В другом примере полипептиды чГР могут быть объединены взаимодействиями между полипептидной последовательностью Flag®, содержащейся в слитых полипептидах чГР, содержащих полипептидную последовательность Flag®. Мультимеры чГР также могут быть получены с применением химических методов, известных в данной области техники, таких как сшивка с применением линкерных молекул и методы оптимизации длины молекулы линкера, известных в данной области техники (см., например, US 5478925), известных в данной области техники методов получения одной или более межмолекулярных связей между цистеиновыми остатками, расположенными в последовательности полипептидов, присутствие которых желательно в мультимере (см., например, US 5478925, добавление цистеина или биотина к С-концу или N-концу полипептида чГР и методы получения триммеров, содержащих один или более из этих модифицированных полипептидов (см., например, US 5478925), или любого из 30 методов получения липосом, содержащих мультимеры чГР (см., например, патент США №5478925), описание которых включено сюда путем ссылки.
В данном описании термин «фрагмент полипептида чГР» относится к любому пептиду или полипептиду, содержащему сопредельный диапазон части последовательности аминокислот полипептида чГР, предпочтительно, полипептида, имеющего указанную выше последовательность.
ПЭГилированное пролекарство рчГР - предпочтительные ПЭГ, полимерные цепи
Как описано выше, ПЭГилированное пролекарство рчГР, описанное здесь, должно иметь относительно низкую активность.
Следовательно, в предпочтительном варианте осуществления общая нагрузка ПЭГ на молекулу гормона роста составляет по меньшей мере 25 кДа. В общем, общая нагрузка ПЭГ будет менее 1000 кДа. Предпочтительно, нагрузка ПЭГ составляет по меньшей мере 25 кДа и не более 500 кДа, даже более предпочтительно по меньшей мере 30 кДа и не более 250 кДа, даже более предпочтительно по меньшей мере 30 кДа и не более 120 кДа, даже более предпочтительно по меньшей мере 40 кДа и не более 100 кДа, даже более предпочтительно по меньшей мере 40 кДа и не более 90 кДа.
ПЭГ может быть присоединен к чГР через одну или более точек крепления. При наличии одной точки крепления соответствующий ПЭГ в моноконъюгате ПЭГ-чГР пролекарства будет разветвлен и содержит по меньшей мере 3 цепи. В случае наличия более одной точки крепления, например, как в бисконъюгате, соответствующий ПЭГ в чГР ПЭГ пролекарстве может быть разветвленным или линейным. Бисконъюгаты могут содержать одну или более временных связей, и ПЭГ может быть линейным или разветвленным или содержать смесь одной линейной и одной разветвленной цепи. Если бисконъюгат содержит одну временную связь и одну линейную и одну разветвленную цепь, временная связь может быть на любой цепи. Если применяется разветвленная цепь ПЭГ, может быть одна или более разветвляющихся структурных единиц.
Разветвленным ПЭГ является молекула ПЭГ, состоящая из точки разветвления, соединяющей две или более цепи ПЭГ, для получения молекулы с одной точкой прикрепления для присоединения к гормону роста. Это может быть две 20 кДа ПЭГ-цепи, объединенные с получением одной 40 кДа ПЭГ молекулы. В случае если молекула содержит две или более точки разветвления, молекула обозначается как 3- или 4-плечий ПЭГ, соответственно.
В кратком описании и с учетом указанных выше ограничений ПЭГ полимер не ограничен конкретной структурой, и может быть линейным, разветвленным или многоплечим (т.е. разветвленный ПЭГ или ПЭГ, присоединенный к полиольной сердцевине), древовидным или с расщепляющимися линкерами. Не ограничиваясь теорией, задачей нагрузки ПЭГ является обеспечение подходящей молекулярной массы для получения требуемой относительно низкой активности и недопущение слишком высокой молекулярной массы ПЭГ, которая может создать другие проблемы.
ПЭГилирование природного человеческого ГР происходит на некоторых лизиновых группах или на N-концевом амине (F1), как подробно описано у Clark et al. (ссылка 2 здесь) на странице 21973, таблица III. Высоко реакционноспособными являются положения F1 и LYS-140. Умеренно реакционноспособными положениями являются LYS-115, LYS-38 и LYS-70. Малореакционноспособными положениями являются LYS-172, LYS-41, LYS-158 и LYS-168.
В более общих терминах, ПЭГ, применяемый здесь в сочетании с временным линкером, может снижать риск липоатрофии подходящим выбором указанного полимера. Однако принципы данного изобретения также применяются к полимерам, отличным от ПЭГ. Таким образом, термин ПЭГ используется здесь только как пример для подходящих полимеров.
Таким образом, в предпочтительном варианте осуществления ПЭГ-пролекарством чГР является моноконъюгат, конъюгированный одной из его первичных аминогрупп с саморасщепляющейся функциональной группой La до полимерной цепи S0. Эта полимерная цепь S0 имеет молекулярную массу по меньшей мере 5 кДа, и содержит по меньшей мере одну разветвляющую структуру BS1. Разветвляющая структура BS1 содержит вторую полимерную цепь S1, которая имеет молекулярную массу по меньшей мере 4 кДа.
Как указано выше, требуется по меньшей мере третья полимерная цепь S2, имеющая молекулярную массу по меньшей мере 4 кДа. Полимерная цепь S2 может быть частью BS1 или может быть другим ответвлением S0 или S1, давая другую разветвляющую структуру BS2, которая содержит S2.
При необходимости более 3 полимерных цепей присутствует в конъюгате пролекарства в соответствии сданным изобретением, например, 4, 5, 6, 7 или 8. Однако каждая другая полимерная цепь имеет молекулярную массу по меньшей мере 4 кДа. Общее количество полимерных цепей ограничено общей массой конъюгата пролекарства, которая должна быть не более 1000 Да (без чГР-NH). Таким образом, предпочтительным вариантом осуществления данного изобретения является композиция, в которой по меньшей мере одна из разветвляющих структур BS1, BS2 содержит дополнительную четвертую полимерную цепь S3, имеющую молекулярную массу по меньшей мере 4 кДа, или одна из S0, S1, S2 содержит третью разветвляющую структуру BS3, содержащую по меньшей мере четвертую полимерную цепь S3, имеющую молекулярную массу по меньшей мере 4 кДа. Группа Ga, вызывающая саморасщепление, которая необходима для саморасщепления La, содержится в одной из разветвленных структур или полимерных цепей.
При необходимости, одна из разветвляющих структур служит в качестве группы Ga так, что разветвляющая структура состоит из Ga (вместо того, чтобы содержать указанную группу), что также охватывается термином «содержащая». Получение пролекарства конъюгата (АА) обычно дает смесь конъюгатов, где несколько первичных аминогрупп чГР конъюгированы с получением различных моноконъюгатов, различных биконъюгатов, различных триконъюгатов и.т.д. пролекарств. Соответствующие моноконъюгированные, бисконъюгированные или трисконъюгированные ПЭГ-пролекарства чГР могут быть разделены стандартными методами, известными в данной области техники, такими как хроматография на колонке и подобные.
В моноконъюгатах ПЭГ-пролекарств чГР по меньшей мере три полимерных цепи S0, S1, S2 содержат «полимерный фрагмент», который характеризуется одной или более повторяющимися структурными единицами, которые могут быть распределены произвольно, блоками или попеременно. Кроме того, по меньшей мере три полимерных цепи S0, S1, S2 демонстрируют концевую группу, которая обычно является атомом водорода или алкильной группой, имеющей от 1 до 6 атомов углерода, которая может быть разветвлена или не разветвлена, например, метильной группой, особенно для полимерных цепей на основе ПЭГ, с получением так называемых мПЭГ.
Указывается, что полимерные фрагменты в по меньшей мере трех полимерных цепях S0, S1, S2, могут иметь дополнительные цепеобразные заместители, получаемые из повторяющихся структурных единиц и образующие цепи, имеющие молекулярную массу менее 4 кДа, которые не считаются полимерными цепями S0, S1, S2 и т.д. Предпочтительно по меньшей мере три полимерные цепи S0, S1, S2 имеют заместители молекулярной массой менее 1000 Да.
Значимой структурной характеристикой S0 является ее критическое расстояние. Критическое расстояние определяет кратчайшее расстояние между местом присоединения S0 к La и первой разветвляющей структурой BS1, измеренной как соединенные атомы. Длина критического расстояния оказывает влияние на остаточную активность, как описано для соединения 33. Критическое расстояние составляет, предпочтительно, менее 50, более предпочтительно, менее 20, наиболее предпочтительно, менее 10.
По меньшей мере, обычно каждая из трех полимерных цепей S0, S1 и S2 содержит соединительный фрагмент. Ga присутствует в по меньшей мере одном из соединительных фрагментов. Для полимерных цепей, отличных от S0, соединительным фрагментом является структурный элемент, связывающий полимерный фрагмент, например, S1 с BS1, и полимерную группу S2 с BS2. Для S0 соединительным фрагментом является структурный элемент, соединяющий La и BS1.
Соединительные фрагменты могут состоять из C1-50 алкильных цепей, которые разветвлены или не разветвлены, и которые при необходимости прерываются или оканчиваются гетероатомами или функциональными группами, выбранными из группы, включающей -О-; -S-; N(R); С(О); C(O)N(R); N(R)C(O); одного или более карбоциклов или гетероциклов, где R является атомом водорода или C1-20 алкильными цепями, которые при необходимости прерываются или оканчиваются одним или более указанными выше атомами или группами, которые также имеют водород в качестве концевого атома; и где карбоциклом является фенил; нафтил; инденил; инданил; тетралинил; С3-10 циклоалкил; и где гетероциклом является 4-7-членный гетероциклил; или 9-11-членный гетеробициклил.
"С3-10 циклоалкил" или "С3-10 циклоалкильное кольцо" означает циклическую алкильную цепь, имеющую от 3 до 10 атомов углерода, которая может иметь двойные связи углерод-углерод, являющиеся по меньшей мере частично насыщенными, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, циклогептил, циклооктил, циклононил, циклодецил. Каждый атом водорода циклоалкильного углерода может быть замещен заместителем. Термин "С3-10 циклоалкил" или "С3-10циклоалкильное кольцо" также включает мостиковые бициклы, такие как норбонан или норбонен.
"4-7-членный гетероциклил" или "4-7-членный гетероцикл" означает кольцо с 4, 5, 6 или 7 атомами в кольце, которые могут содержать вплоть до максимального количества двойных связей (ароматических или не ароматических, которые полностью, частично или не насыщены), где по меньшей мере один атом в кольце и вплоть до 4 атомов в кольце замещены гетероатомом, выбранным из группы, включающей серу (включая -S(O)-, -S(O)2-), кислород и азот (включая =N(O)-), и где кольцо соединено с остальной молекулой через атом углерода или азота. Примеры 4-7-членных гетероциклов включают азетидин, оксетан, тиетан, фуран, тиофен, пиррол, пирролин, имидазол, имидазолин, пиразол, пиразолин, оксазол, оксазолин, изоксазол, изоксазолин, тиазол, тиазолин, изотиазол, изотиазолин, тиадиазол, тиадиазолин, тетрагидрофуран, тетрагидротиофен, пирролидин, имидазолидин, пиразолидин, оксазолидин, изоксазолидин, тиазолидин, изотиазолидин, тиадиазолидин, сульфолан, пиран, дигидропиран, тетрагидропиран, имидазолидин, пиридин, пиридазин, пиразин, пиримидин, пиперазин, пиперидин, морфолин, тетразол, триазол, триазолидин, тетразолидин, диазепан, азепин или гомопиперазин.
"9-11-членный гетеробициклил" или "9-11-членный гетеробицикл" означает гетероциклическую систему из двух колец с 9-11 атомами в кольце, где по меньшей мере один атом в кольце является общим для двух колец, и которая может содержать вплоть до максимального количества двойных связей (ароматическое или неароматическое кольцо, которое полностью насыщено, частично насыщено или ненасыщено), где по меньшей мере один атом в кольце, и вплоть до 6 атомов в кольце замещены гетероатомом, выбранным из группы, включающей серу (включая -S(O)-, -S(O)2-), кислород и азот (включая =N(O)-), и где кольцо связано с оставшейся молекулой через атом углерода или азота. Примеры 9-11-членного гетеробицикла включают индол, индолин, бензофуран, бензотиофен, бензоксазол, бензизоксазол, бензотиазол, бензизотиазол, бензимидазол, бензимидазолин, хинолин, хинадолин, дигидрохиназолин, хинолин, дигидрохинолин, тетрагидрохинолин, декагидрохинолин, изохинолин, декагидроизохинолин, тетрагидроизохинолин, дигидроизохинолин, бензазепин, пурин или птеридин. Термин 9-11-членный гетеробицикл также включает спироструктуры из двух колец, такие как 1,4-диокса-8-азаспиро[4.5]декан или мостиковые гетероциклы, такие как 8-азабицикпо[3.2.1]октан.
Карбоцикл, гетероцикл и гетеробицикл могут быть замещены C1-20 алкилом, при необходимости прерывающимся или оканчивающимся гетероатомами или функциональными группами, выбранными из группы, включающей -О-; -S-; N(R); С(О); C(O)N(R); N(R)C(O), где R является водородом или С1-10 алкильной цепью, которая при необходимости прерывается или оканчивается одним или более указанными выше атомами или группами, которые также имеют водород в качестве концевого атома.
Полимерный фрагмент из по меньшей мере трех цепей S0, S1, S2 образует основную часть цепей, предпочтительно по меньшей мере 90% молекулярной массы каждой цепи, более предпочтительно по меньшей мере 95%, даже более предпочтительно по меньшей мере 97,5%, даже более предпочтительно по меньшей мере 99%. Таким образом, основная часть цепей представлена полимерным фрагментом. Предпочтительно по меньшей мере три цепи S0, S1, S2 независимо основаны на полимере, выбранном из группы, включающей полиалкилокси полимеры, гиалуроновую кислоту и ее производные, поливиниловые спирты, полиоксазолины, полиангидриды, поли(ортоэфиры), поликарбонаты, полиуретаны, полиакриловые кислоты, полиакриламиды, полиакрилаты, полиметакрилаты, полиорганофосфазены, полисилоксаны, поливинилпирролидон, полицианоакрилаты и сложные полиэфиры.
Предпочтительно по меньшей мере три цепи S0, S1, S2 основаны на одинаковом полимере. Предпочтительно по меньшей мере три цепи S0, S1, S2 основаны на полиалкилокси полимерах. Даже более предпочтительно по меньшей мере три цепи S0, S1, S2 основаны на полиэтиленгликоле.
То же самое применяется для других цепей S3, S4, S5, и т.д.
Цепь S0 содержит разветвляющую структуру BS1, так что S1 соединен с S0. Для связи S2 может применяться разветвляющая структура BS1, или присутствует другая разветвляющая структура BS2, которая может быть частью S0 или S1.
Следовательно, могут присутствовать другие разветвляющие структуры, в которых присутствуют другие цепи. Например, если присутствует цепь S3, она может быть связана с BS1, BS2 или разветвляющей структурой BS3. Разветвляющая структура BS3, если присутствует, может быть частью S0, S1 или S2.
В общем, может применяться любое химическое вещество, которое позволяет разветвлять цепи. Предпочтительно, разветвляющие структуры независимо выбирают из группы, включающей по меньшей мере 3-кратно замещенный карбоцикл по меньшей мере 3-кратно замещенный гетероцикл, третичный атом углерода, четвертичный атом углерода и третичный атом азота, где термины карбоцикл и гетероцикл такие, как определены выше.
ПЭГилированное пролекарство рчГР - временные структуры линкеров, La, Ga
В публикациях из области саморасщепления вызывающие его группы иногда называют линкерами для отличия их структуры от носителя. Тем не менее, часто очень трудно четко разделить эти структурные характеристики. Поэтому в терминах данного изобретения группа Ga, вызывающая саморасщепление, считается частью носителя S, содержащего по меньшей мере S0, S1, S2, BS1 и при необходимости BS2. Изменение химической природы Ga позволяет создавать свойства саморасщепления соответствующего связанного с носителем пролекарства в значительной степени.
Как описано выше, ПЭГилированное пролекарство, где лекарством является, например, рчГР, как описано в заявке на патент WO-A 2005/099768, и имеет характеристики выделения, которые здесь описаны как 1,6 система расщепления без образования токсических ароматических соединений. В этом документе широко описаны множественные, родственные описанным здесь, подходящие структуры временных линкеров для получения соответствующего целевого профиля высвобождения. Другие структуры временных линкеров в общем/широко описаны в, например, других заявках от Complex Biosystems GmbH applications, таких как WO-А 2005/034909, WO-A 2005/099768, WO-A 2006/003014 и WO-A 2006/136586. Больше структур временных линкеров широко описано, например, в WO-A 99/30727 (Enzon Inc).
Для решения настоящих проблем с ГР, описанных выше, авторы данного изобретения выбрали предпочтительные структуры временных линкеров для получения описанных здесь соответствующих функциональных свойств ПЭГилированного пролекарства рчГР. На основе представленного здесь подробного описания предпочтительных линкерных структур специалист в данной области техники сможет получить другие подходящие предпочтительные временные линкерные структуры, которые будут давать ПЭГилированное пролекарство рчГР с описанными здесь соответствующими функциональными свойствами.
Для введения в S0 могут быть выбраны, предпочтительно, подходящие временные линкерные структуры, которые являются самогидролизуемыми (саморасщепляемыми). Выбираемые линкерные структуры подробно описаны ниже. В идеале, конъюгат в соответствии с данным изобретением обладает одной или более из следующих характеристик и/или преимуществ по сравнению с современными конъюгатами или композициями рчГР: может быть легко синтезирован с хорошим выходом, имеет период полувыведения в предпочтительном интервале, может быть очищен для получения гомогенных композиций конъюгатов, демонстрирует активность после саморасщепления, например, in vitro и in vivo активность, и имеет фармакодинамические эффекты, превосходящие немодифицированный рчГР и описанные ранее конъюгаты рчГР, и не вызывает липоатрофии. Описанные здесь структуры демонстрируют требуемые здесь свойства высвобождения.
В общем, связанные с носителем пролекарства требуют присутствия расщепляемых функциональных групп, связывающих лекарственное средство и носитель. В отсутствии групп, вызывающих самогидролиз, функциональные группы, которые включают донированные лекарственным средством аминогруппы, такие как алифатическим амид или карбаматные связи La, обычно являются очень устойчивыми к гидролизу, и скорость расщепления амидной связи является слишком низкой для терапевтического применения системы пролекарства. Если такие стабильные связи применяются в связанных с носителем пролекарствах, отщепление функциональной группы не является возможным в терапевтически полезный период времени без биотрансформации. В таких случаях линкер демонстрирует структурный мотив, который распознается как субстрат соответствующим эндогенным ферментом. В таком случае, отщепление функциональной связи La включает комплекс, содержащий фермент. Примеры включают пептидные линкеры, которые распознаются эндогенными протеазами и расщепляются ферментами.
Уровни ферментов могут значительно различаться между индивидуумами, что вызывает биологические вариации в активации пролекарства при ферментном расщеплении. Уровни ферментов также могут в значительной степени зависеть от места введения. Например, известно, что при подкожной инъекции определенные области тела дают более предсказуемый терапевтический эффект, чем другие. Такой высокий уровень межиндивидуальных колебаний нежелателен. Более того, трудно установить in vivo-in vitro корреляцию фармакокинетических свойств для таких пролекарств, связанных с зависимым от ферментов носителем. При отсутствии надежной in vivo-in vitro корреляции оптимизация профиля высвобождения становится трудоемкой задачей.
Для избежания межиндивидуальных колебаний и вариабельности места введения желательно применять пролекарства, связанные с носителем, которые имеют кинетику расщепления в терапевтически полезный период времени без дополнительного привлечения ферментов для расщепления. В частности, для носителей с высокой молекулярной массой, более конкретно, для разветвленных полимерных носителей, доступ к соединяющей функциональной группе La может быть ограничен для ферментов из-за пространственного группирования. Поэтому существует необходимость в создании пролекарств на носителях, которые обладают свойствами саморасщепления.
Кинетика саморасщепления, например, может быть измерена in vitro через запись скорости гидролиза в буферном растворе без ферментов.
Для введения гидролитической лабильности в функциональные группы L, такие как амиды или карбаматы, необходимо создать структурные химические компоненты в носитель для того, чтобы они действовали, например, как соседние группы рядом с функциональными группами. Такие вызывающие саморасщепление химические структуры, которые осуществляют контроль на расщепляемостью амидной связи пролекарства, называют группами Ga, вызывающими саморасщепление. Группы, вызывающие саморасщепление, могут оказывать сильное действие на скорость гидролиза данной функциональной группы La.
Предпочтительные La выбирают из группы, включающей С(O)-O- и С(О)-, которые образуют, вместе с первичной аминогруппой чГР, карбаматную или амидную группу. Таким образом, композиция в соответствии сданным изобретением является предпочтительной, где La выбирают из группы, включающей С(O)-O- и С(О)-, которые образуют, вместе с первичной аминогруппой чГР, карбаматную или амидную группу с получением формулы (АА1) или (АА2)
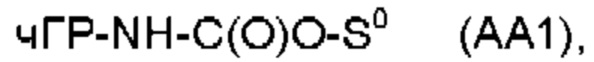
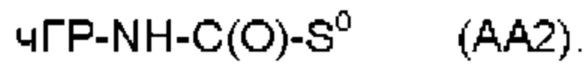
В следующем разделе перечислены различные структурные компоненты, которые могут функционировать как группы Ga, вызывающие саморасщепление. Группа Ga является группой, вызывающей саморасщепление. Ga могут присутствовать как таковые или как каскадные группы, вызывающие саморасщепление, которые раскрывают для активизации с помощью дополнительной стадии гидролитического или ферментативного расщепления. Если Ga присутствует как таковая, она управляет лимитирующим скорость самогидролизом La.
Примеры Ga:
A.J. Garman et al. (A.J. Garman, S.B. Kalindjan, FEBS Lett. 1987, 223 (2), 361-365 1987) применяют ПЭГ5000-малеиновый ангидрид для обратимой модификации аминогрупп в тканевом активаторе плазминогена и урокиназе. Регенерация функционального фермента из ПЭГ-uPA конъюгата при инкубировании при рН 7,4 в буфере путем расщепления связей малеаминовой кислоты дает кинетику первого порядка с периодом полувыведения 6,1 ч.
Простые ароматические фрагменты могут вызывать лабильность в присоединенной карбаматной связи (WO-A 01/47562). Например, замещенная или не замещенная флуоренилметильная группа применяется для лабилизации карбаматных связей в различных биоактивных агентах при применении пролекарства (Tsubery et al. J Biol Chem 279 (2004) 38118-24). Две цепи ПЭГ присоединяют к флуоренильной группе в WO-A 2007/075534.
Таким образом, Ga является ароматическим кольцом или флуоренилметилом, непосредственно присоединенным к карбаматной функциональной группе La. Следовательно, в соответствии сданным изобретением предпочтительна композиция, в которой Ga является ароматическим кольцом или флуоренил метилом, непосредственно присоединенным к карбаматной функциональной группе, образованной La и первичной аминогруппой чГР. Альтернативно, превращение Ga может вызывать молекулярную перегруппировку в S0, такую как 1,4 или 1,6-отщепление. Перегруппировка делает La настолько более лабильной, что вызывается ее расщепление. Превращение Ga представляет собой лимитирующую скорость стадию в каскадном механизме. Идеально, скорость расщепления временной связи идентична желаемой скорости высвобождения для молекулы лекарственного средства в данном терапевтическом сценарии. В такой каскадной системе на основе 1,6 отщепления желательно, чтобы расщепление La было практически немедленным после того, как ее лабильность была вызвана трансформацией Ga. В дополнение желательно, чтобы лимитирующая скорость кинетика расщепления проходила в терапевтически полезный период времени без необходимости привлечения дополнительных ферментов для избежания недостатков, связанных с преимущественно ферментным расщеплением, описанным выше.
В R.B. Greenwald, A. Pendri, C.D. Conover, Н. Zhao, Y.H. Choe, A. Martinez, K. Shum, S. Guan, J. Med. Chem., 1999, 42, 3657-3667 и патентной РСТ-заявке WO-A 99/30727 описан метод синтеза поли(этиленгликолевых) пролекарств аминосодержащих низкомолекулярных соединений на основе отщепления 1,4- или 1,6-бензила. В данном подходе аминогруппа молекулы лекарственного средства связана через карбаматную группу с ПЭГилированным бензильным фрагментом.
Поли(этиленгликоль) присоединяется к бензильной группе через сложный эфир, карбонат, карбамат или амид. Высвобождение ПЭГ из молекулы лекарственного средства возникает через сочетание самогидролиза и ферментного расщепления. Отщепление инициирующей высвобождение маскирующей группы, при данном подходе, сопровождается классическим и быстрым отщеплением 1,4- или 1,6-бензила. Эта линкерная система также применяется для высвобождаемых поли(этиленгликолевых) конъюгатов белков (S. Lee, R.B. Greenwald et al. Bioconj. Chem. 2001, 12 (2), 163-169). Лизозим применяют в качестве модели белка, так как он теряет активность, если ПЭГилирование проходит на эпсилон-аминогруппе лизиновых остатков. Различные количества ПЭГ линкера конъюгируют с белком. Регенерация нативного белка из ПЭГ конъюгатов проходит в плазме крысы или в нефизиологическом буфере с высоким рН. Смотри также F.M.H. DeGroot et al. (WO-A 2002/083180 и WO-A 2004/043493) и D. Shabat et al. (WO-A 2004/019993).
Таким образом, La является карбаматной функциональной группой, при этом расщепление указанной группы вызывается гидроксильной или аминогруппой Ga через отщепление 1,4- или 1,6 бензила S0, где Ga содержит сложноэфирные, карбонатные, карбаматные или амидные связи, которые подвергаются лимитирующему скорость превращению. На самом деле, Ga может отщепляться гидролизом.
Следовательно, предпочтительна композиция в соответствии сданным изобретением, в которой La образует, вместе с аминогруппой чГР, карбаматную функциональную группу, расщепление указанной группы вызывается гидроксильной или аминогруппой Ga через отщепление 1,4- или 1,6 бензила S0, где Ga содержит сложноэфирные, карбонатные, карбаматные или амидные связи, которые подвергаются лимитирующему скорость превращению.
Ga может содержать каскадную систему расщепления, которая запускается компонентами Ga, которые состоят из структурного сочетания, представляющего указанный выше предшественник. Предшественник Ga может содержать дополнительные временные связи, такие как амид, сложный эфир или карбамат. Стабильность или подверженность гидролизу временной связи предшественника (например, карбамата) может управляться самогидролитическими свойствами или может потребовать активности фермента.
Antczak et al. (Bioorg Med Chem 9 (2001) 2843-48) описывают реагент, который образует основу для макромолекулярной каскадной системы пролекарства для аминсодержащих молекул лекарственного средства. При таком подходе антитело служит в качестве носителя, стабильная связь связывает антитело с активирующей группой, несущей отщепляемую маскирующую группу. При удалении связанной со сложным эфиром маскирующей группы, La отщепляется и высвобождает лекарственное соединение.
D. Shabat et al. (Chem. Eur. 3. 2004, 10, 2626-2634) описывают полимерную систему пролекарства на основе активирующей группы миндальной кислоты. В этой системе маскирующая группа связана с активирующей группой карбаматной связью. Активирующая группа конъюгирована постоянно с полиакриламидным полимером через амидную связь. После активации маскирующей группы каталитическим антителом, маскирующая группа отщепляется циклизацией и лекарственное средство высвобождается. Активирующая группа все еще связана с полиакриламидным полимером после высвобождения лекарственного средства. M.-R. Lee et al. описывают (Angew. Chem. 2004, 116, 1707-17 10) подобную систему пролекарства на основе активирующей группы миндальной кислоты и связанной со сложным эфиром маскирующей группы. Тем не менее, в этих линкерах стадия 1,6 отщепления все еще дает высоко реакционноспособное ароматическое промежуточное соединение. Даже если ароматический фрагмент остается постоянно присоединенным к полимерному носителю, могут быть вызваны побочные реакции с потенциально токсическим или иммуногенным эффектом. Greenwald et al. опубликовали в 2000 систему доставки поли(этиленгликолевого) лекарственного средства для аминосодержащих пролекарств на основе лактонизацией с блокировкой триметила (R.B. Greenwald et al. J.Med.Chem. 2000, 43(3), 457-487; WO-A 02/089789). В такой системе пролекарств замещенная о-гидроксифенилдиметилпропионовая кислота сочетается с аминогруппами молекул лекарственного средства амидной связью. Гидроксигруппа связана с ПЭГ сложноэфирной, карбонатной или карбаматной группой. Стадией, определяющей скорость, при высвобождении лекарства является ферментативное отщепление этих функциональных групп с последующим быстрым расщеплением амида через лактонизацию, высвобождение ароматического побочного продукта лактона. Недавно R.B. Greenwald et al. (Greenwald et al. J. Med.Chem. 2004, 47, 726-734) описали систему ПЭГ-пролекарства на основе бис-(N-2-гидроксиэтил)глицинамидного (бицинамидного) линкера. В этой системе две молекулы ПЭГ связаны с молекулой бицина, соединенной с аминогруппой молекулы лекарственного средства. Две первых стадии в активации пролекарства включают ферментное расщепление обеих молекул ПЭГ. Описаны различные связи между ПЭГ и бицином, приводящие к различной кинетике активации пролекарства. Основным недостатком этой системы является медленная скорость гидролиза бицинамида, конъюгированного с молекулой лекарственного средства (t1/2=3 ч в фосфатном буфере), что дает высвобождение промежуточного соединения модифицированного бицином пролекарства, которое может демонстрировать фармакокинетические и фармакодинамические свойства, отличающиеся от свойств исходной молекулы лекарственного средства.
Более конкретно, предпочтительные группы La и Ga с определенными спейсерными фрагментами для S0 описаны ниже.
Предпочтительную структуру, согласно WO-A 2005/099768, выбирают из общей формулы (I) и (II):
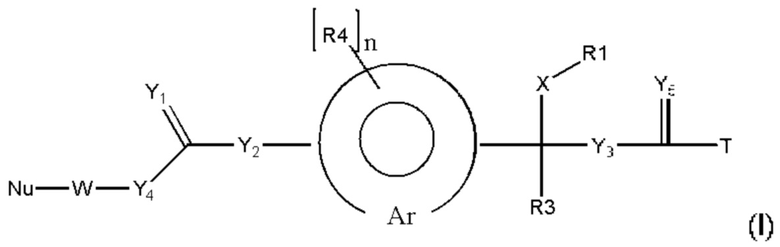
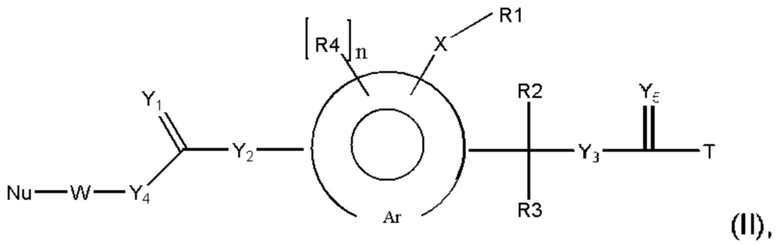
где Т является чГР-NH; X является спейсерным фрагментом; Y1 и Y2 каждый независимо является О, S или NR6; Y3 является О или S; Y4 является О, NR6 или -C(R7)(R8); R3 является фрагментом, выбранным из группы, включающей водород, замещенные или незамещенные линейные, разветвленные или циклические алкилы или гетероалкилы, арилы, замещенные арилы, замещенные или незамещенные гетероарилы, цианогруппы, нитрогруппы, галогены, карбоксигруппы, карбоксиалкильные группы, алкилкарбонильные группы или карбоксамидоалкильные группы; R4 является фрагментом, выбранным из группы, включающей водород, замещенные или незамещенные линейные, разветвленные или циклические алкилы или гетероалкилы, арилы, замещенные арилы, замещенные или незамещенные гетероарилы, замещенные или незамещенные линейные, разветвленные или циклические алкокси, замещенные или незамещенные линейные, разветвленные или циклические гетероалкилокси, арилокси или гетероарилокси, цианогруппы и галогены; R7 и R8 каждый независимо выбирают из группы, включающей водород, замещенные или не замещенные линейные, разветвленные или циклические алкилы или гетероалкилы, арилы, замещенные арилы, замещенные или незамещенные гетероарилы, карбоксиалкильные группы, алкилкарбонильные группы, карбоксамидоалкильные группы, цианогруппы и галогены; R6 является группой, выбранной из водорода, замещенных или незамещенных линейных, разветвленных или циклических алкилов или гетероалкилов, арилов, замещенных арилов, замещенных или незамещенные гетероарилов; R1 является остатком S0; W является группой, выбранной из замещенных или незамещенных линейных, разветвленных или циклических алкилов или гетероалкилов, арилов, замещенных арилов, замещенных или незамещенных линейных, разветвленных или циклических гетероалкилов, замещенных или незамещенных гетероарилов; Nu является нуклефилом; n равно нулю или положительному целому числу; и Ar является мультизамещенным ароматическим углеводородом или мультизамещенным ароматическим гетероциклом.
В терминах данного изобретения группа La представлена Y3-C(Y5)NH- (вместе с аминогруппой чГР), Ga представлена Nu-W-Y4-C(Y1)Y2 и Ar(R4)n-C(R3)XR1 является S0, которая также включает по меньшей мере S1, S2, BS1 и при необходимости BS2. В альтернативном варианте осуществления S1 присоединена через Ar или является R3. Затем атом углерода, соседний с Y3, замещенный XR1, является разветвляющей структурой BS1, S1 оканчивается Ar, содержащим Ga. Очевидно, что в этом варианте осуществления термины S0 и S1 являются взаимозаменяемыми.
Предпочтительно, в формуле (АА) или (АА1) S0 является формулой (ААА1)
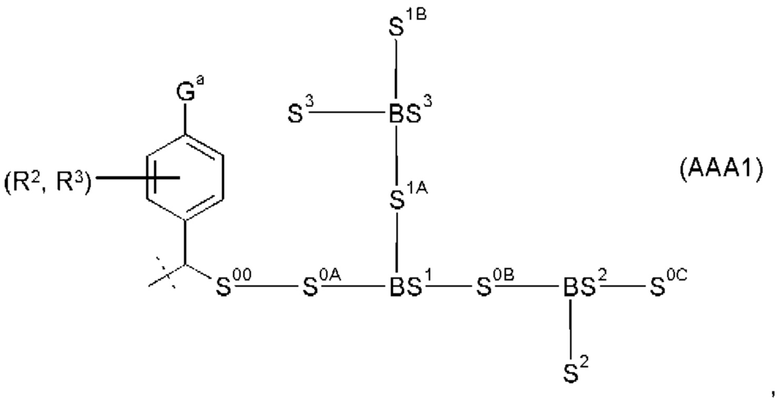
где
Ga имеет указанное выше значение;
S00 является СН2; или С(О);
S0A является алкиленовой цепью, содержащей от 1 до 20 атомов углерода, которая при необходимости прерывается или оканчивается одной или более группами, циклами или гетероатомами, выбранными из группы, состоящей из при необходимости замещенного гетероцикла; О; S; С(О); и NH;
BS1, BS2, BS3 независимо выбирают из группы, включающей N и СН.
S0B, S1A независимо являются алкиленовой цепью, содержащей от 1 до 200 атомов углерода, которая при необходимости прерывается или оканчивается одной или более группами, циклами или гетероатомами, выбранными из группы, состоящей из при необходимости замещенного гетероцикла; О; S; С(О); и NH;
S0C, S1B являются (С(O))n2(СН2)n1(ОСН2СН2)nOCH3, где каждый n независимо равен целому числу от 100 до 500, каждый n1 независимо равен 0, 1, 2, 3, 4, 5, 6, 7 или 8, и n2 равен 0 или 1.
S2, S3 независимо являются водородом или (С(O)n2(СН2)n1(ОСН2СН2)nOCH3, где каждый n независимо является целым числом от 100 до 500, каждый n1 независимо является 0, 1, 2, 3, 4, 5, 6, 7 или 8, и n2 является 0 или 1, при условии, что по меньшей мере один из S2, S3 отличен от водорода.
R2, R3 определены как в формуле (А) ниже.
Термин гетероцикл означает гетероцикл, такой как определен выше. Необязательными заместителями являются, например, оксо (=O), где кольцо является по меньшей мере частично насыщенным, разветвленным или неразветвленным алкилом, содержащим от одного до 6 атомов углерода, или галоген. Предпочтительным замещенным гетероциклом является сукцинимид.
Предпочтительно, Ga в формуле (ААА1) является OC(O)-R, и R является частичной структурой формулы (I), показанной ниже, где R1, R4, R5 и n такие, как определены ниже.
Другой предпочтительный вариант осуществления описан в WO 06136586 А2. Следовательно, предпочтительны следующие структуры:
где Т означает NH-чГР;
X является спейсерным фрагментом, таким как R13-Y1;
Y1 является О, S, NR6, сукцинимидом, малеимидом, ненасыщенными связями углерод-углерод или любым гетероатомом, содержащим свободную электронную пару, или отсутствует;
R13 выбирают из замещенного или незамещенного линейного, разветвленного или циклического алкила или гетероалкила, арилов, замещенных арилов, замещенных или незамещенных гетероарилов;
R2 и R3 независимо выбирают из водорода, ацильных групп или защитных групп для гидроксильных групп;
R4-R12 независимо выбирают из водорода, X-R1, замещенного или не замещенного линейного, разветвленного или циклического алкила или гетероалкила, арилов, замещенных арилов, замещенных или незамещенных гетероарилов, циано, нитро, галогена, карбокси, карбоксамида;
R1 является остатком S0, содержащим по меньшей мере S1, S2, BS1 и, при необходимости, BS2.
В этом варианте осуществления La является амидной группой, и Ga охватывает N-разветвленные структуры, несущие OR2/OR3.
В еще одном предпочтительном варианте осуществления предпочтительная структура представлена конъюгатом пролекарства D-L, где
- D является NH-чГР; и
- L является биологически неактивным линкерным фрагментом -L1, представленным формулой (I),
где пунктирная линия показывает присоединение к аминогруппе чГР через образование амидной связи;
X является C(R4R4a); N(R4); О; C(R4R4a)-C(R5R5a); C(R5R5a)-C(R4R4a); C(R4R4a)-N(R6); N(R6)-C(R4R4a); C(R4R4a)-O; или O-C(R4R4a);
X1 является С или S(O);
X2 является C(R7, R7a) или C(R7, R7a)-C(R8, R8a);
R1, R1a, R2, R2a, R3, R3a, R4, R4a, R5, R5a, R6, R7, R7a, R8, R8a независимо выбирают из группы, включающей Н и С1-4 алкил; или
при необходимости, одна или более из пар R1a/R4a, R1a/R5a, R4a/R5a, R4a/R5a, R7a/R8a образуют химическую связь;
при необходимости, один или более из пар R1/R1a, R2/R2a, R4/R4a, R5/R5a, R7/R7a, R8/R8a вместе с атомом, к которому они присоединены, образуют С3-7 циклоалкил;
или 4-7-членный гетероциклил;
при необходимости, одна или более из пар R1/R4, R1/R5, R1/R6, R4/R5, R7/R8, R2/R3 вместе с атомом, к которому они присоединены, образуют кольцо А;
при необходимости, R3/R3a вместе с атомом азота, к которому они присоединены, образуют 4-7-членный гетероцикл;
А выбирают из группы, состоящей из фенила; нафтила; инденила; инданила; тетралинила; С3-10 циклоалкила; 4-7-членного гетероциклила; и 9-11-членного гетеробициклила; и
где L1 замещена одной группой L2-Z и, при необходимости, замещена дополнительно, при условии, что водород, отмеченный звездочкой в формуле (I), не замещен заместителем; где
L2 является одинарной химической связью или разделителем; и
Z является остатком S0, содержащим по меньшей мере S1, S2, BS1 и, при необходимости, BS2.
В этом варианте осущствления La представлена амидной группой, и Ga представлена N(H*)X1(O) и цепью, связанной с N, включая заместители N.
Конъюгаты пролекарства этого типа описаны в заявке на европейский патент №08150973.9
Следовательно, предпочтительна композиция в соответствии сданным изобретением, где La-S0 представлена формулой (ААА2),
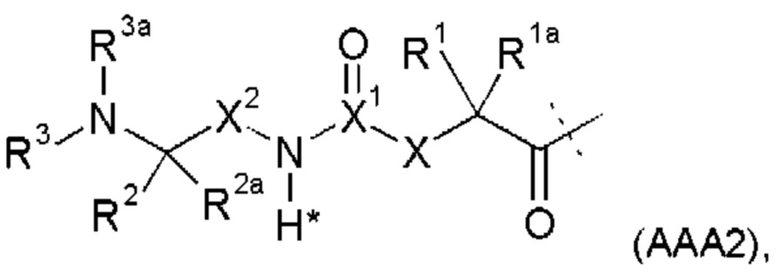
где пунктирная линия показывает присоединение к первичной аминогруппе чГР так, что La и аминогруппа образуют амидную связь;
X является C(R4R4a); N(R4); О; C(R4R4a)-C(R5R5a); C(R5R5a)-C(R4R4a); C(R4R4a)-N(R6); N(R6)-C(R4R4a); C(R4R4a)-O; или O-C(R4R4a);
X1 является С или S(O);
X2 является C(R7, R7a) или C(R7, R7a)-C(R8, R8a);
R1, R1a, R2, R2a, R3, R3a, R4, R4a, R5, R5a, R6, R7, R7a, R8, R8a независимо выбирают из группы, включающей Н и С1-4 алкил; или
при необходимости, одна или более из пар R1a/R4a, R1a/R5a, R4a/R5a, R4a/R5a, R7a/R8a образуют химическую связь;
при необходимости, одна или более из пар R1/R1a, R2/R2a, R4/R4a, R5/R5a, R7/R7a, R8/R8a объединены с атомом, к которому они присоединены, с получением С3-7 циклоалкила или 4-7-членного гетероциклила;
при необходимости, одна или более из пар R1/R4, R1/R5, R1/R6, R4/R5, R7/R8, R2/R3 объединены с атомом, к которому они присоединены, с получением кольца А;
при необходимости, R3/R3a объединены вместе с атомом азота, к которому они присоединены, с получением 4-7-членного гетероцикла;
А выбирают из группы, состоящей из фенила; нафтила; инденила; инданила; тетралинила; С3-10 циклоалкила; 4-7-членного гетероциклила; и 9-11-членного гетеробициклила; и
где S0 замещена одной группой L2-Z и, при необходимости, замещена дополнительно, при условии, что водород, отмеченный звездочкой в формуле (I), не замещен заместителем; где
L2 является одинарной химической связью или спейсер; и
Z является формулой (ААА2а)
где S00, S0A, S0B, S0C, S1A, S1B, S2, S3, BS1, BS2 и BS3 имеют значения, указанные для формулы (ААА1) выше.
"Алкил" означает прямую или разветвленную углеводородную цепь. Каждый водород алкила может быть замещен заместителем.
"C1-4 алкил" означает цепь, содержащую 1-4 атома углерода, например, если присутствует в конце молекулы: метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил трет-бутил, или, например, -СН2-, -СН2-СН2-, -СН(СН3)-, -СН2-СН2-СН2-, -СН(С2Н5)-, -С(СН3)2-, когда два фрагмента молекулы соединены алкильной группой. Каждый водород С1-4 алкила может быть замещен заместителем.
"C1-6 алкил" означает алкильную цепь, содержащую 1-6 атомов углерода, например, если присутствует в конце молекулы: C1-4 алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил; трет-бутил, н-пентил, н-гексил, или, например, -СН2-, -СН2-СН2-, -СН(СН3)-, -СН2-СН2-СН2-, -СН(С2Н5)-, -С(СН3)2-, когда два фрагмента молекулы связаны алкильной группой. Каждый водород C1-6 алкила может быть замещен заместителем.
Следовательно, "C1-18 алкил" означает алкильную цепь, содержащую 1-18 атомов углерода, и "С8-18 алкил" означает алкильную цепь, содержащую 8-18 атомов углерода. Следовательно, "С1-50 алкил" означает алкильную цепь, содержащую 1-50 атомов углерода.
"С2-50 алкенил" означает разветвленную или не разветвленную алкенильную цепь, содержащую от 2 до 50 атомов углерода, например, если присутствует в конце молекулы: -СН=СН2, -СН=СН-СН3, -СН2-СН=СН2, -СН=СН-СН2-СН3, -СН=СН-СН=СН2, или, например, -СН=СН-, когда два фрагмента молекулы связаны алкенильной группой. Каждый атом водорода С2-50 алкенила может быть замещен заместителем, определенным ниже. Следовательно, термин "алкенил" относится к углеродной цепи с по меньшей мере одной двойной связью углерод-углерод. При необходимости может присутствовать одна или более тройных связей.
"С2-50 алкинил" означает разветвленную или неразветвленную алкинильную цепь, содержащую от 2 до 50 атомов углерода, например, если присутствует в конце молекулы: -С≡СН, -СН2-С≡СН, СН2-СН2-С≡СН, СН2-С≡С-СН3, или, например, -С≡С-, когда два фрагмента молекулы связаны алкинильной группой. Каждый атом водорода С2-50 алкинила может быть замещен заместителем, определенным ниже. Следовательно, термин "алкинил" относится к углеродной цепи с по меньшей мере одной тройной связью углерод-углерод. При необходимости может присутствовать одна или более двойных связей.
"С3-7 циклоалкил" или "С3-7 циклоалкильное кольцо" означает циклическую алкильную цепь, содержащую от 3 до 7 атомов углерода, которая может содержать двойные связи углерод-углерод, являющиеся по меньшей мере частично насыщенными, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, циклогептил. Каждый водород циклоалкила может быть замещен заместителем. Термин "С3-7 циклоалкил" или "С3-7 циклоалкильное кольцо" также включает мостиковые бициклы, такие как норборнан или норборнен. Следовательно, "С3-5 циклоалкил" означает циклоалкил, содержащий от 3 до 5 атомов углерода.
Следовательно, "С3-10 циклоалкил" означает циклический алкил, содержащий от 3 до 10 атомов углерода, например, С3-7 циклоалкил; циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, циклогептил, циклооктил, циклононил, циклодецил. Термин "С3-10 циклоалкил" также включает по меньшей мере частично насыщенные карбомоно- и бициклы.
"Галоген" означает фтор, хлор, бром или йод. Обычно предпочтительно, чтобы галогеном являлся фтор или хлор.
"4-7-членный гетероцикл ил" или "4-7-членный гетероцикл" означает кольцо с 4, 5, 6 или 7 атомами в кольце, который может содержать вплоть до максимального количества двойных связей (ароматическое или не ароматическое кольцо, которое полностью насыщено, частично насыщено или ненасыщено), где по меньшей мере от одного атома до вплоть до 4 атомов в кольце замещены гетероатомом, выбранным из группы, включающей серу (включая -S(O)-, -S(O)2-), кислород и азот (включая =N(O)-), и где кольцо связано с остатком молекулы через атом углерода или азота. Примеры 4-7-членных гетероциклов включают азетидин, оксетан, тиетан, фуран, тиофен, пиррол, пирролин, имидазол, имидазолин, пиразол, пиразолин, оксазол, оксазолин, изоксазол, изоксазолин, тиазол, тиазолин, изотиазол, изотиазолин, тиадиазол, тиадиазолин, тетрагидрофуран, тетрагидротиофен, пирролидин, имидазолидин, пиразолидин, оксазолидин, изоксазолидин, тиазолидин, изотиазолидин, тиадиазолидин, сульфолан, пиран, дигидропиран, тетрагидропиран, имидазолидин, пиридин, пиридазин, пиразин, пиримидин, пиперазин, пиперидин, морфолин, тетразол, триазол, триазолидин, тетразолидин, диазепан, азепин или гомопиперазин.
"9-11-членный гетеробициклил" или "9-11-членный гетеробицикл" означает гетероциклическую систему из двух колец с 9-11 атомами в кольце, где по меньшей мере один атом в кольце является общим для обоих колец, и которая может содержать вплоть до максимального количества двойных связей (ароматическое или не ароматическое кольцо, которое полностью насыщено, частично насыщено или ненасыщено), где по меньшей мере от одного атома кольца вплоть до 6 атомов в кольце замещены гетероатомами, выбранным из группы, включающей серу (включая -S(O)-, -S(O)2-), кислород и азот (включая =N(O)-), и где кольцо связано с остатком молекулы через атом углерода или азота. Примеры 9-11-членного гетеробицикла включают индол, индолин, бензофуран, бензотиофен, бензоксазол, бензизоксазол, бензотиазол, бензизотиазол, бензимидазол, бензимидазолин, хинолин, хиназолин, дигидрохиназолин, хинолин,дигидрохинолин, тетрагидрохинолин, декагидрохинолин, изохинолин, декагидроизохинолин, тетрагидроизохинолин, дигидроизохинолин, бензазепин, путин или птеридин.
Термин 9-11-членный гетеробицикл также включает спироструктуры из двух колец, такие как 1,4-диокса-8-азаспиро[4.5]декан или мостиковые гетероциклы, такие как 8-азабицикпо[3.2.1]октан.
Предпочтительно, La-S0 выбирают из группы, состоящей из
где R является Н или C1-4 алкилом; Y является NH, О или S; и R1, R1a, R2, R2a, R3, R3a, R4, X, X1, X2 имеют значения, указанные выше.
Даже более предпочтительно, La-S0 выбирают из группы, состоящей из
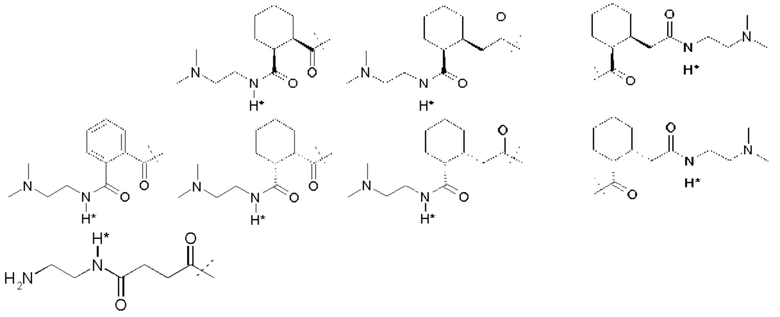
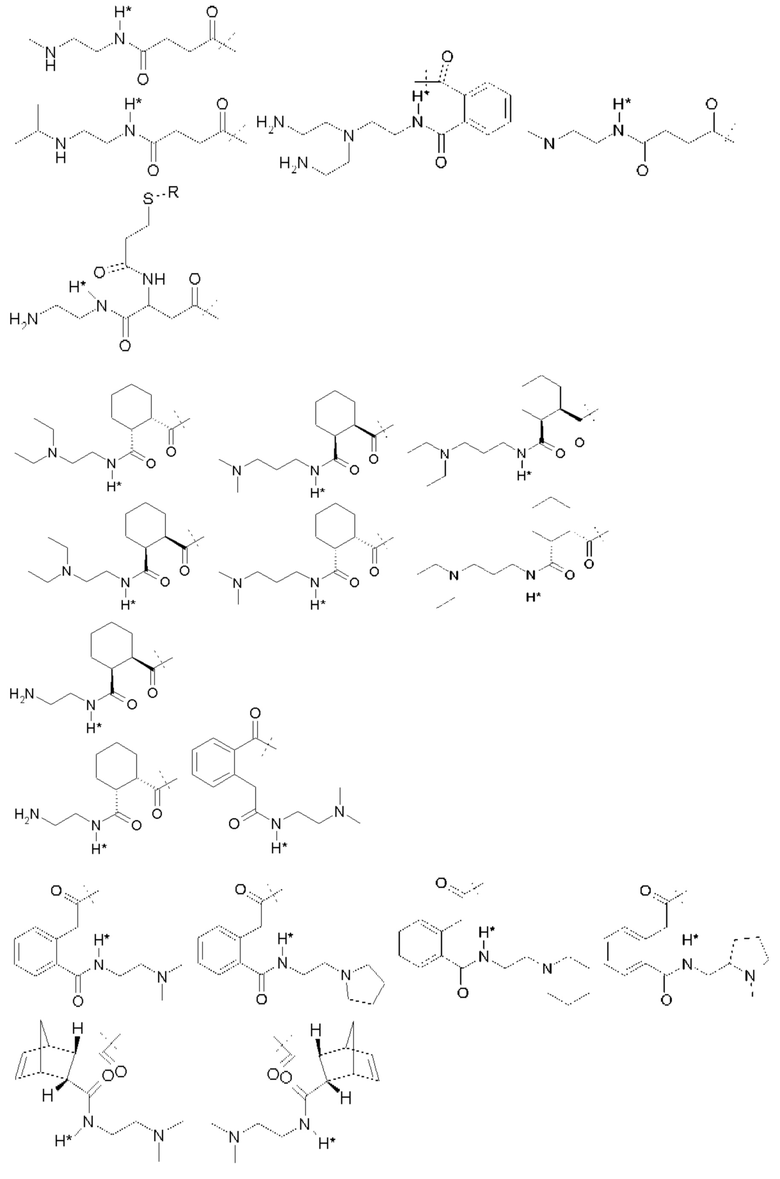
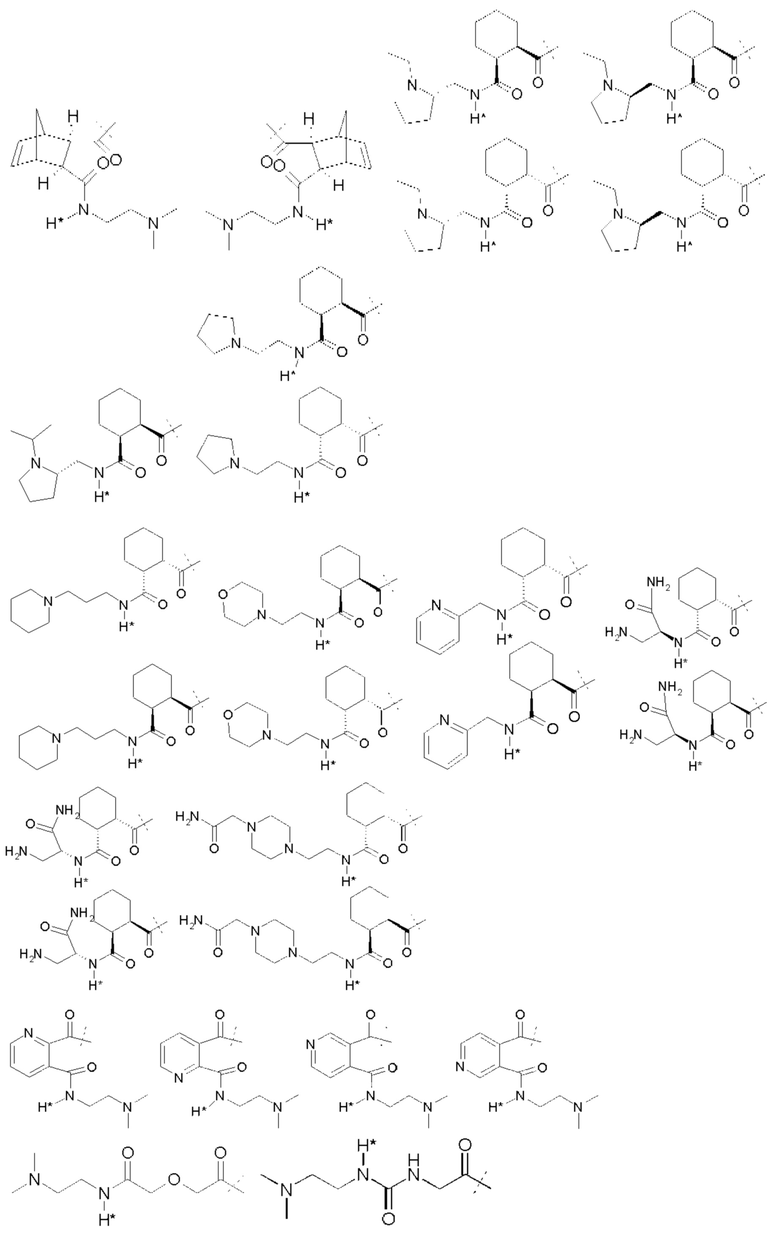
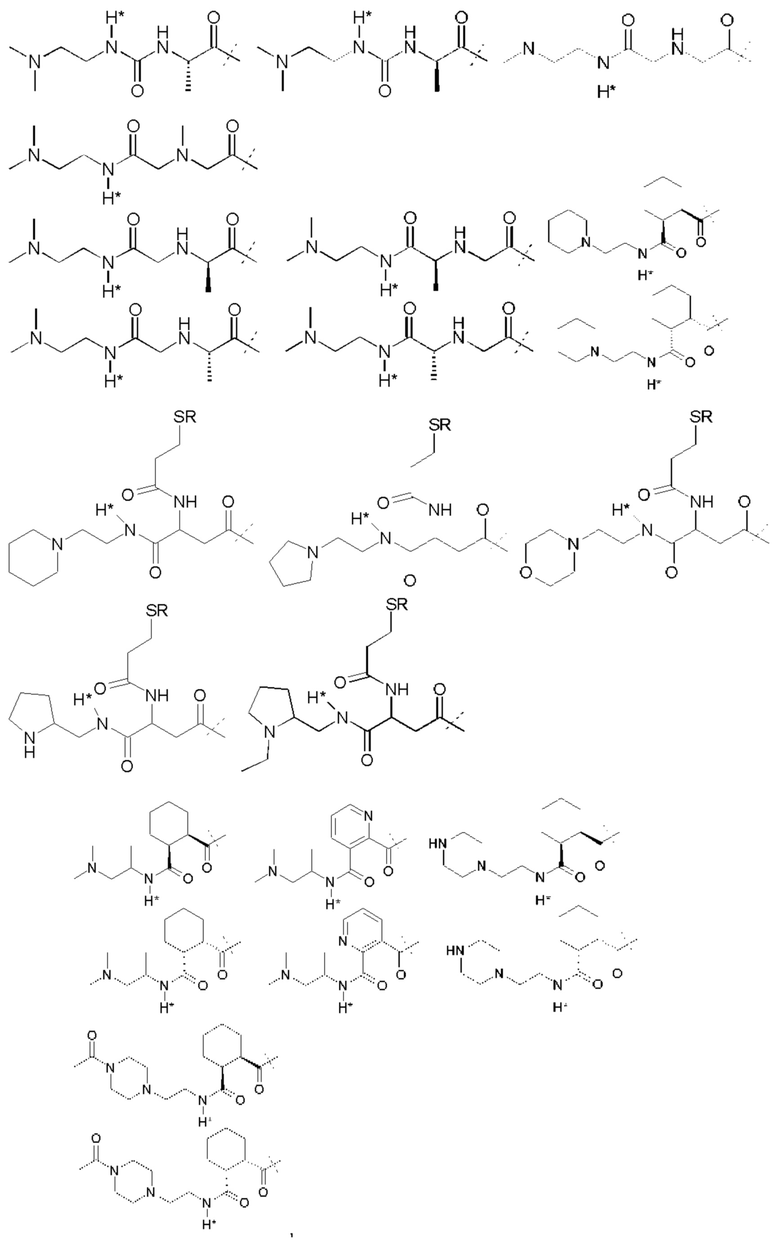
где R имеет указанное выше значение.
По меньшей мере один (вплоть до четырех) атомов водорода замещен группой L2-Z. Если присутствует более одной группы L2-Z, каждая L2 и каждая Z может быть выбрана независимо. Предпочтительно присутствует только одна группа L2-Z.
В общем, S0 может быть замещена L2-Z в любом положении, за исключением замещения атома водорода, отмеченного звездочкой, в указанной выше формуле. Предпочтительно, от одного до четырех атомов водорода в R, R1-R8 непосредственно, или в виде атома водорода С1-4 алкила или других групп, данных в определении R и R1-R8, замещены L2-Z.
Кроме того, S0 может быть при необходимости дополнительно замещена. В общем, может применяться любой заместитель, который не оказывает влияния на принцип расщепления.
Предпочтительно, один или более других необязательных заместителей независимо выбирают из группы, включающей галоген; CN; COOR9; OR9; C(O)R9; C(O)N(R9R9a); S(O)2N(R9R9a); S(O)N(R9R9a); S(O)2R9; S(O)R9; N(R9)S(O)2N(R9aR9b); SR9; N(R9R9a); NO2; OC(O)R9; N(R9)C(O)R9a; N(R9)S(O)2R9a; N(R9)S(O)R9a; N(R9)C(O)OR9a; N(R9)C(O)N(R9aR9b); OC(O)N(R9R9a); T; C1-50 алкил; C2-50 алкенил; или C2-50 алкинил, где T; C1-50 алкил; С2-50 алкенил; и С2-50 алкинил при необходимости замещены одним или более R10, которые являются одинаковыми или разными, и где C1-50 алкил; С2-50 алкенил; и С2-50 алкинил при необходимости прерываются одной или более группами, выбранными из группы, включающей Т, -С(O)O-; -О-; -С(О)-; -C(O)N(R11)-; -S(O)2N(R11)-; -S(O)N(R11)-; -S(O)2-; -S(O)-; -N(R11)S(O)2N(R11a)-; -S-; -N(R11)-; -OC(O)R11; -N(R11)C(O)-; -N(R11)S(O)2-; -N(R11)S(O)-; -N(R11)C(O)O-; -N(R11)C(O)N(R11a)- и -OC(O)N(R11R11a);
R9, R9a, R9b независимо выбирают из группы, включающей Н; Т; и C1-50 алкил; С2-50 алкенил; или С2-50 алкинил, где Т; C1-50 алкил; С2-50 алкенил; и С2-50 алкинил при необходимости замещены одним или более R10, которые являются одинаковыми или разными, и где C1-50 алкил; С2-50 алкенил; и С2-50 алкинил при необходимости прерываются одной или более группами, выбранными из группы, включающей Т, -С(O)O-; -О-; -С(О)-; -C(O)N(R11)-; -S(O)2N(R11)-; -S(O)N(R11)-; -S(O)2-; -S(O)-; -N(R11)S(O)2N(R11a)-; -S-; -N(R11)-; -OC(O)R11; -N(R11)C(O)-; -N(R11)S(O)2-; -N(R11)S(O)-; -N(R11)C(O)O-; -N(R11)C(O)N(R11a)- и -OC(O)N(R11R11a);
T выбирают из группы, включающей фенил; нафтил; инденил; инданил; тетралинил; С3-10 циклоалкил; 4-7-членный гетероциклил; или 9-11-членный гетеробициклил, где Т при необходимости замещен одним или более R10, которые являются одинаковыми или разными;
R10 является галогеном; CN; оксо (=O); COOR12; OR12; C(O)R12; C(O)N(R12R12a); S(O)2N(R12R12a); S(O)N(R12R12a); S(O)2R12; S(O)R12; N(R12)S(O)2N(R12aR12b); SR12; N(R12R12a); NO2; OC(O)R12; N(R12)C(O)R12a; N(R12)S(O)2R12a; N(R12)S(O)R12a; N(R12)C(O)OR12a; N(R12)C(O)N(R12aR12b); OC(O)N(R12R12a) или C1-6 алкилом, где C1-6 алкил при необходимости замещен одним или более галогенами, которые являются одинаковыми или разными;
R11, R11a, R12, R12a, R12b независимо выбирают из группы, включающей Н; или С1-6 алкил, где C1-6 алкил необязательно замещен одним или более галогенами, которые являются одинаковыми или разными.
Термин "прерывается" означает, что группа вставлена между двумя атомами углерода или на конце углеродной цепи между атомами углерода и водорода.
L2 является одинарной химической связью или спейсером. Если L2 является спейсером, она предпочтительно определена как один или более необязательных заместителей, определенных выше, при условии, что L2 замещена Z.
Следовательно, если L2 отлична от одинарной химической связи, L2-Z является COOR9; OR9; C(O)R9; C(O)N(R9R9a); S(O)2N(R9R9a); S(O)N(R9R9a); S(O)2R9; S(O)R9; N(R9)S(O)2N(R9aR9b); SR9; N(R9R9a); OC(O)R9; N(R9)C(O)R9a; N(R9)S(O)2R9a; N(R9)S(O)R9a; N(R9)C(O)OR9a; N(R9)C(O)N(R9aR9b); OC(O)N(R9R9a); T; С1-50 алкилом; C2-50 алкенилом или C2-50 алкинилом, где T; C1-50 алкил; С2-50 алкенил и С2-50 алкинил при необходимости замещены одним или более R10, которые являются одинаковыми или разными, и где C1-50 алкил; С2-50 алкенил; и С2-50 алкинил при необходимости прерываются одной или более группами, выбранными из группы, включающей -Т-, -С(O)O-; -О-; -С(О)-; -C(O)N(R11)-; -S(O)2N(R11)-; -S(O)N(R11)-; -S(O)2-; -S(O)-; -N(R11)S(O)2N(R11a)-; -S-; -N(R11)-; -OC(O)R11; -N(R11)C(O)-; -N(R11)S(O)2-; -N(R11)S(O)-; -N(R11)C(O)O-; -N(R11)C(O)N(R11a)- и -OC(O)N(R11R11a);
R9, R9a, R9b независимо выбирают из группы, включающей Н; Z; Т; и С1-50 алкила; С2-50 алкенила; или С2-50 алкинила, где Т; C1-50 алкил; С2-50 алкенил; и С2-50 алкинил при необходимости замещены одним или более R10, которые являются одинаковыми или разными, и где C1-50 алкил; С2-50 алкенил; и С2-50 алкинил при необходимости прерываются одной или более группами, выбранными из группы, включающей Т, -С(O)O-; -О-; -С(О)-; -C(O)N(R11)-; -S(O)2N(R11)-; -S(O)N(R11)-; -S(O)2-; -S(O)-; -N(R11)S(O)2N(R11a)-; -S-; -N(R11)-; -OC(O)R11; -N(R11)C(O)-; -N(R11)S(O)2-; -N(R11)S(O)-; -N(R11)C(O)O-; -N(R11)C(O)N(R11a)- и -OC(O)N(R11R11a);
T выбирают из группы, включающей фенил; нафтил; инденил; инданил; тетралинил; С3-10 циклоалкил; 4-7-членный гетероциклил; или 9-11-членный гетеробициклил, где t при необходимости замещен одним или более R10, которые являются одинаковыми или разными;
R10 является Z; галогеном; CN; оксо (=O); COOR12; OR12; C(O)R12; C(O)N(R12R12a); S(O)2N(R12R12a); S(O)N(R12R12a); S(O)2R12; S(O)R12; N(R12)S(O)2N(R12aR12b); SR12; N(R12R12a); NO2; OC(O)R12, N(R12)C(O)R12a; N(R12)S(O)2R12a; N(R12)S(O)R12a; N(R12)C(O)OR12a; N(R12)C(O)N(R12aR12b); OC(O)N(R12R12a) или С1-6 алкилом, где С1-6 алкил необязательно замещен одним или более галогенами, которые являются одинаковым или разными.
R11, R11a, R12, R12a, R12b независимо выбирают из группы, включающей Н, Z или С1-6 алкил, где С1-6 алкил при необходимости замещен одним или более галогенами, которые являются одинаковыми или разными,
при условии, что один из R9, R9a, R9b, R10, R11, R11a, R12, R12a, R12b является Z.
Даже более предпочтительные общие ароматические структуры перечислены ниже.
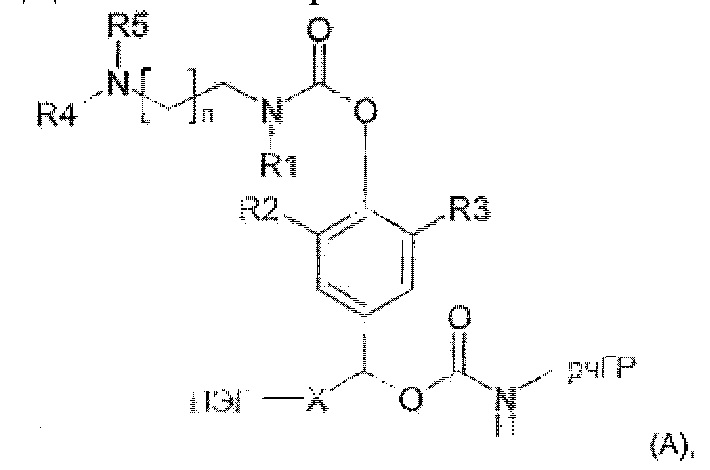 где
где
NH-рчГР является остатком рчНР, присоединенным к временному линкеру;
R1, R2, R3, R4, R5 независимо выбирают из водорода, метила, этила, пропила, изопропила, бутила, изобутила, третичного бутила,
ПЭГ является остатком ПЭГилирования, присоединенным к временному линкеру, и n=1 или 2, и
X выбирают из C1-C8 алкила или С1-С12 гетероалкила.
Термин "С1-С12 гетероалкил" означает алкильную цепь, содержащую от 1 до 12 атомов углерода, которые при необходимости прерываются гетероатомами, функциональными группами, карбоциклами или гетероциклами, как определено выше.
В предпочтительном вариПЭГ осуществления в формуле (А) La представлена карбаматной группой, присоединенной к рчГР, Ga представлена ароматической кислородной группой, карбонилом, присоединенным к ней, и заместителем, присоединенным к карбонилу, как показано в формуле I.
Более предпочтительные структуры описаны общей формулой I, которые является частью структуры (А) в общей структуре ароматического линкера, указанной выше:
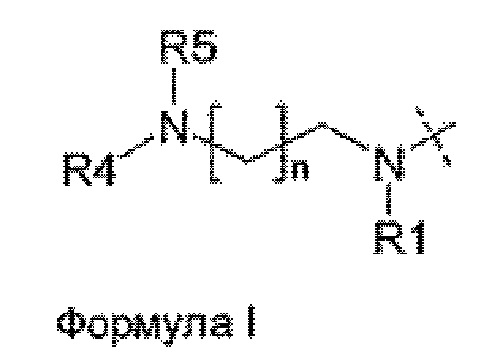
и где предпочтительные примеры формулы I содержат:
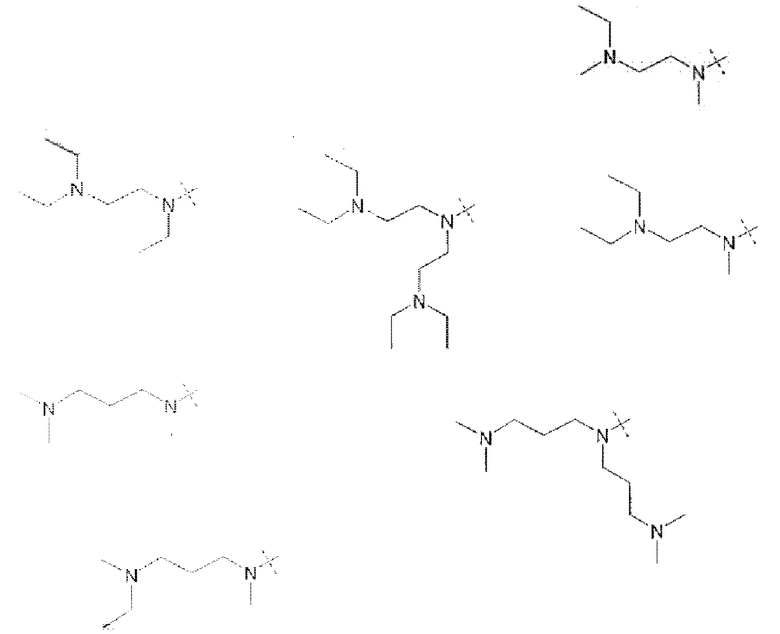
Более предпочтительны ароматические структуры формулы II, которые является частью структуры (А) в общей структуре ароматического линкера, указанной выше:
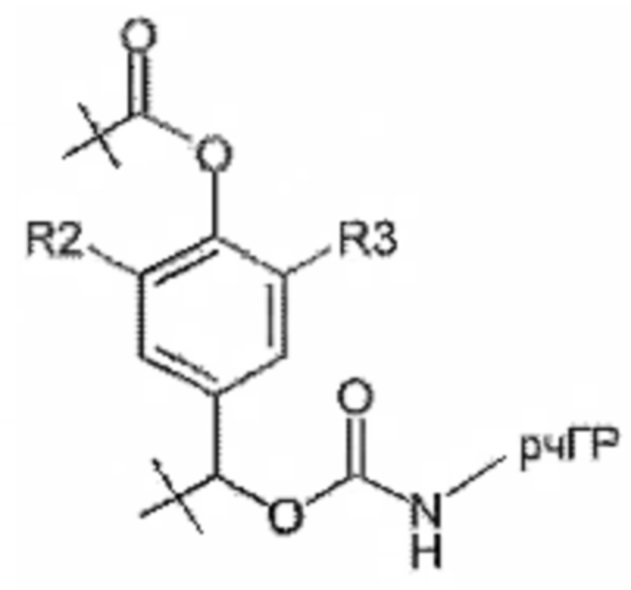
Формула II
и где предпочтительные примеры формулы II содержат:
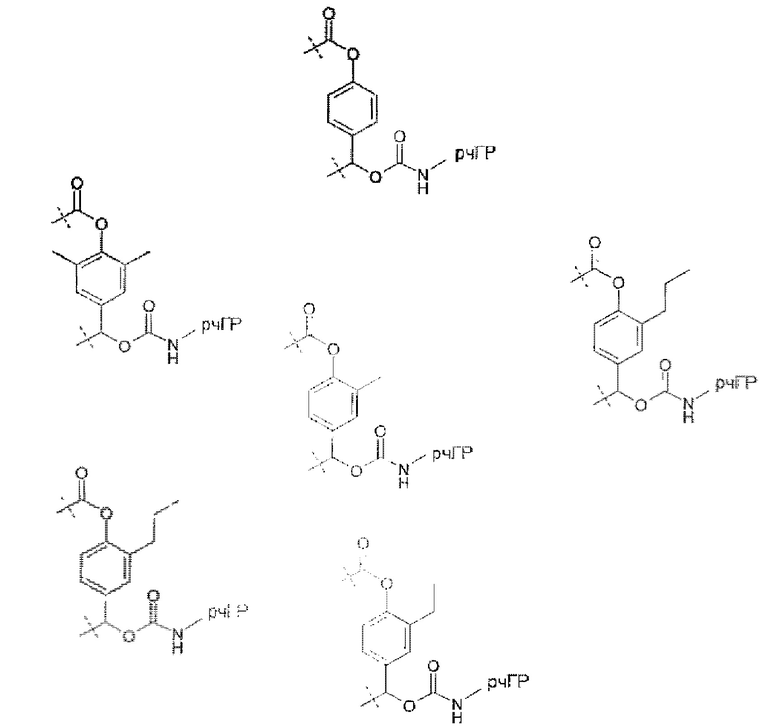
Более предпочтительны структуры формулы III, которые является частью структуры (А) в общей структуре ароматического линкера, указанной выше, где ПЭГ-Х является
Формула III
и ПЭГ-W включает следующие группы заместителей:
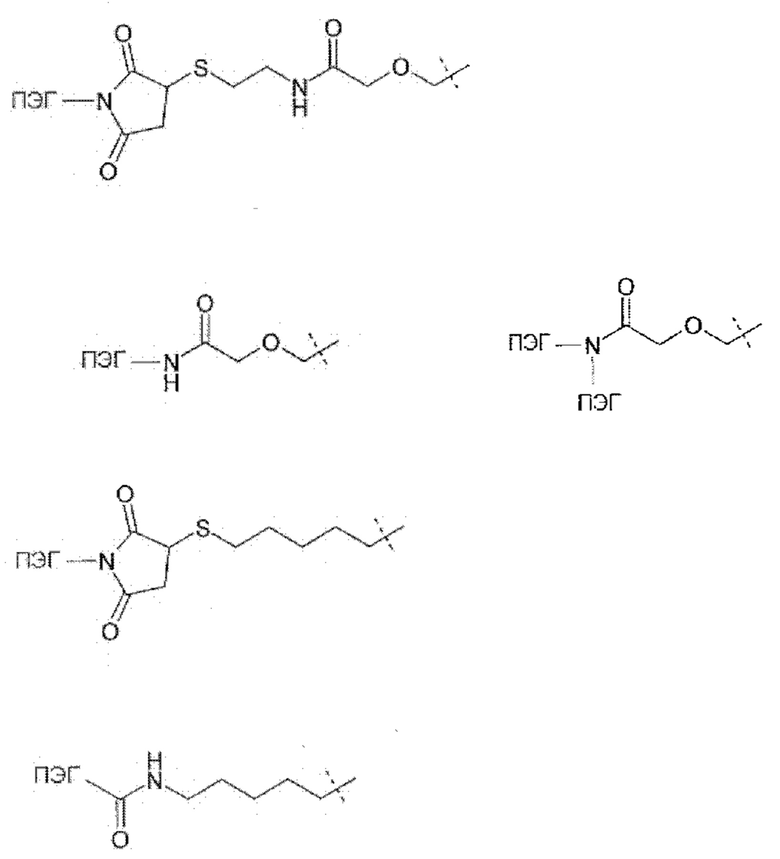
Некоторые примеры предпочтительных конъюгатов пролекарства показаны ниже:
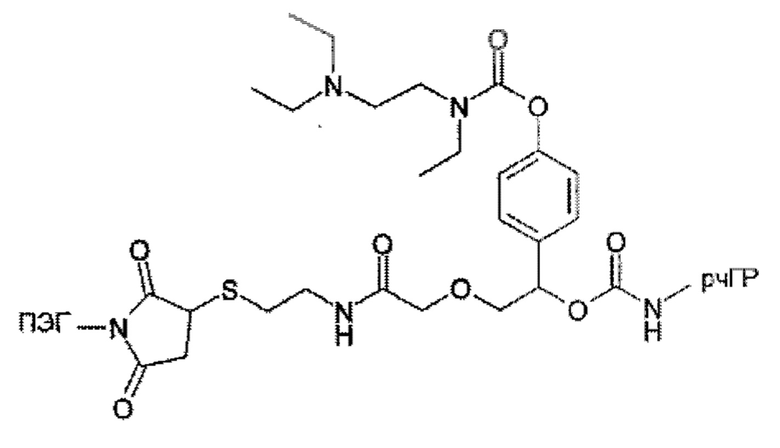
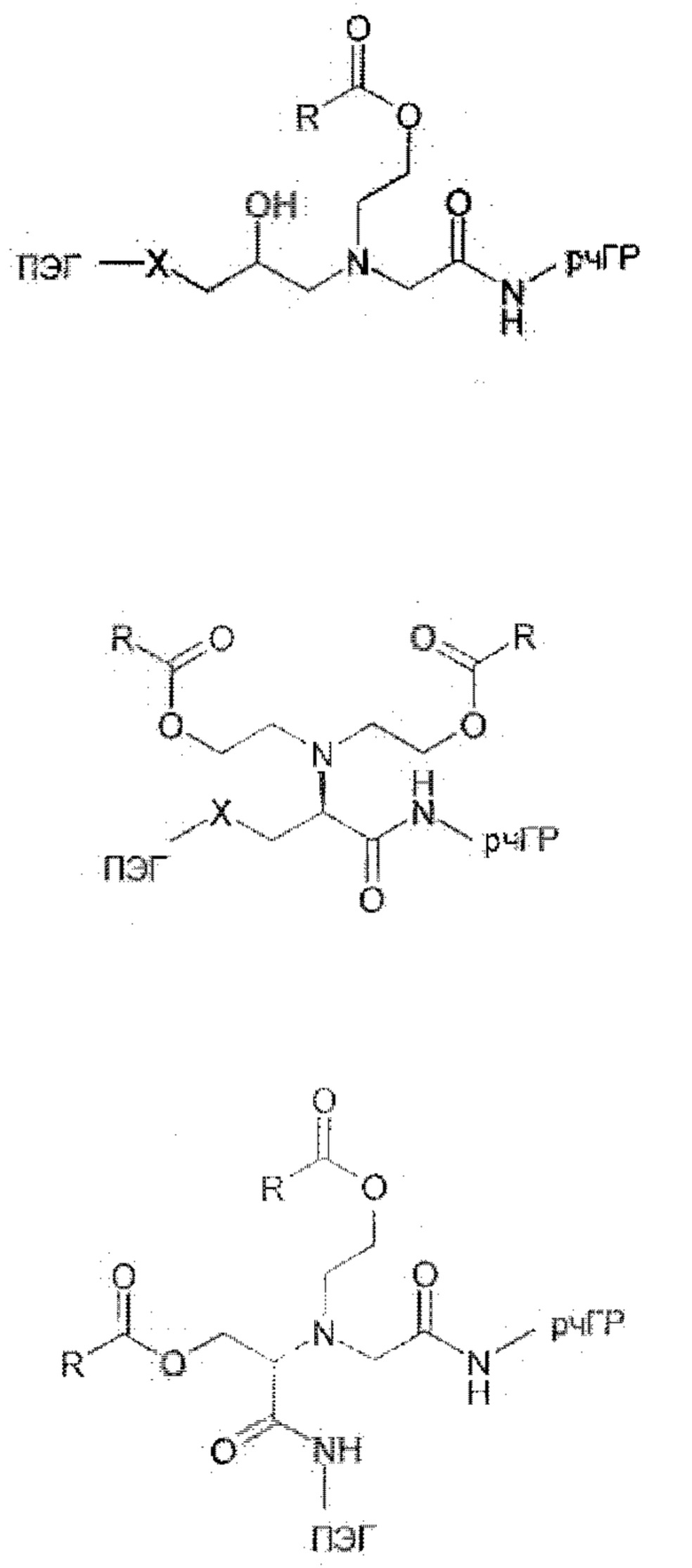
R выбирают из водорода, метила, этила, пропила и бутила,
X выбирают из С1-С8 алкила или С1-С12 гетероалкила.
Также, в предпочтительном и более предпочтительном вариантах осуществления ПЭГ означает, предпочтительно, остаток S0, содержащей по меньшей мере S1, S2, BS1 и при необходимости BS2.
В предпочтительном варианте пролекарства в соответствии с данным изобретением выбирают из группы, включающей
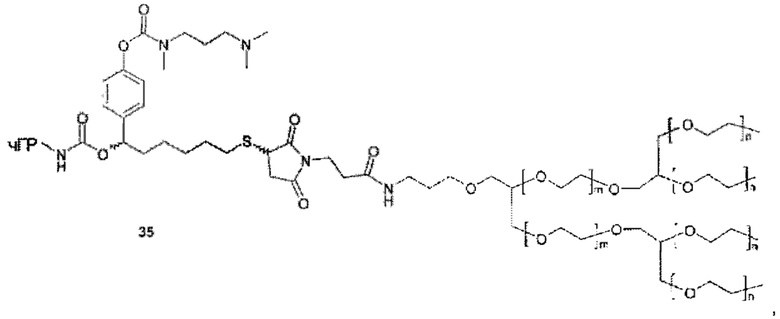
где m равно целому числу от 200 до 250, и n является целым числом от 100 до 125;
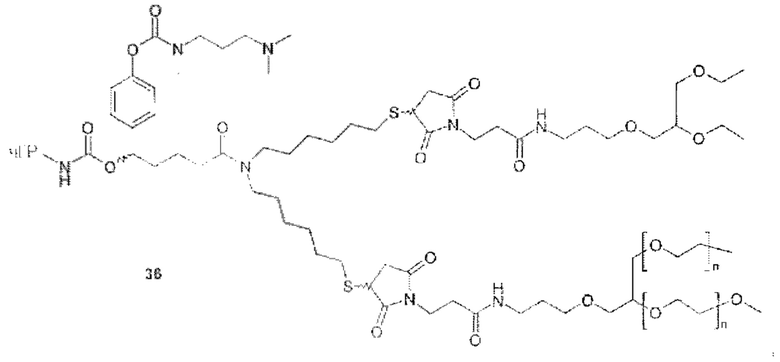
где n равно целому числу от 400 до 500;
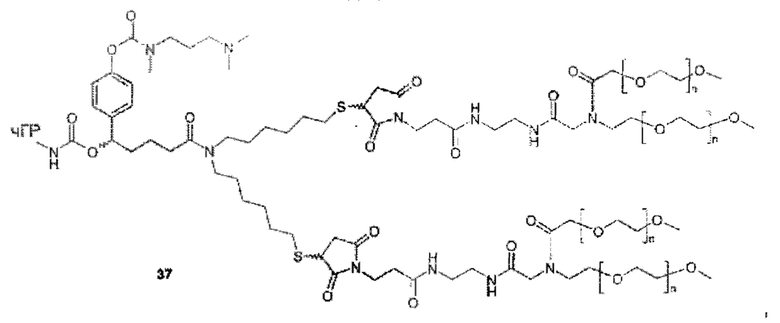
где n равно целому числу от 400 до 500; и
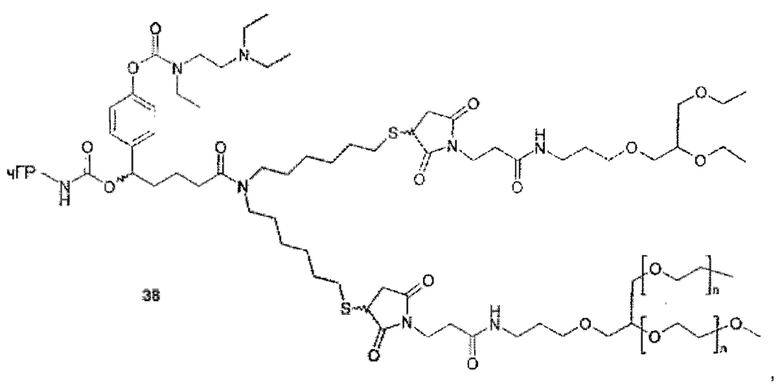
где n равно целому числу от 400 до 500.
методами, известными в данной области техники. Однако, особенно для соединений формулы (АА1), предпочтительно строить молекулу пролекарства конвергентным синтезом, обеспечивая первую молекулу предшественника, содержащую одну или более тиольных групп и активированную карбонатную группу, и вторую молекулу предшественника, содержащую малеимидную группу для взаимодействия в реакции присоединения с получением тиосукцинимидной группы, и для взаимодействия такой объединенной молекулы предшественника с чГР с получением соединения формулы (AA1).
Следовательно, другой аспект данного изобретения представляет собой способ получений соединения формулы чГР-NH-С(О)О-S0 (АА1), где S0 имеет указанное выше значение и содержит по меньшей мере одну группу
где способ содержит следующие стадии;
(а) взаимодействие соединения формулы ROC(O)O-S0-SH (АА1') с соединением формулы
 (АА2'), где R является подходящим остатком для активированной карбонатной группы, и где S0' и S0'' выбирают для получения S0, содержащей по меньшей мере одну группу
(АА2'), где R является подходящим остатком для активированной карбонатной группы, и где S0' и S0'' выбирают для получения S0, содержащей по меньшей мере одну группу
 с получением соединения формулы ROC(O)O-S0, и
с получением соединения формулы ROC(O)O-S0, и
(b) взаимодействие соединения формулы ROC(O)O-S0 с чГР-NH2, где чГР-NH2 является чГР с одной из его первичных аминогрупп, с получением соединения формулы (АА1).
Подходящие группы R для карбонатных функциональных групп включают замещенные алкильные, или карбоциклические, или гетероциклические группы, такие как арильные или циклоалкильные группы, такие группы, как пентафторфенил или NHS.
Анализы для определения функциональных свойства рчГР ПЭГилированного пролекарства
Активность и период полувыведения конъюгата
Для определения активности и периода полувыведения конъюгата пролекарства, описанного здесь, необходимо синтезировать «постоянный» конъюгат, которые не подвержен самогдролизу - то есть, постоянный конъюгат.
Это достигается синтезом молекулы, идентичной рчГР ПЭГилированному пролекарству, помимо модификации части линкерной структуры, которая инициирует саморасщепление. Такое соответствующее соединение будет иметь остаточную активность и циркулирующий период полувыведения конъюгата, идентичный рчГР ПЭГилированному пролекарству. В общем, для любых пролекарств, конъюгированных с самогидролизуемым (саморасщепляемым) временным линкером, можно предположить синтез молекулы, идентичной пролекарству, кроме способности к саморасщеплению, проведением незначительной модификации линкерной структуры.
Причиной применения соответствующих конъюгатов является то, что если самогидролизуемый (саморасщепляемый) временный линкер, описанный здесь, применяют в анализе, указанном в примере 1, очевидно, что конъюгат немедленно начнет высвобождать немодифицированное лекарственное средство, что повлияет на результаты анализа. Другими словами, невозможно измерить остаточную активность без получения постоянного конъюгата, так как неизмененное нативное лекарственное средство, например, рчГР, будет выделяться и участвовать в измеряемой активности. Это очевидно для специалиста в данной области техники. По этой причине, объясненной выше, остаточную активность пролекарств, конъюгированных с самогидролизуемым (саморасщепляемым) временным линкером, выражают как активность соответствующих постоянных конъюгатов.
Постоянные конъюгаты получают так же, как пролекарства, конъюгированные с самогидролизуемым (саморасщепляемым) временным линкером, (примеры 20-23), но с незначительной модификацией линкерной структуры так, чтобы линкер больше не мог саморасщепляться. Получение постоянных конъюгатов описано в примере 10 - примере 19.
Согласно одному варианту осуществления данного изобретения рчГР ПЭГилированные пролекарства, описанные здесь, характеризуются тем, что:
(1): если ПЭГ связан с рчГР в конъюгате пролекарства, пролекарство имеет ГР активность менее 5% по отношению к нативному гормону роста без ПЭГ, чтобы избежать липоатрофии в месте инъекции; и
(2): ПЭГ связан с рчГР через самогидролизуемый (саморасщепляемый) временный линкер, где скорость самогидролиза линкера такова, что in vivo период полувыведения составляет от 10 часов до 600 часов.
Анализ для определения свойства (1) подробно описан в рабочем примере 1 ниже.
На основании этих подробных инструкций специалист в данной области техники легко измерит эту остаточную активность пролекарства.
В предпочтительном варианте осуществления остаточная активность свойства (1) менее 5%, более предпочтительно, менее 3%, даже более предпочтительно, менее 1% и наиболее предпочтительно, практически отсутствует.
Анализ для определения свойства (2) подробно описан в рабочем примере 2 ниже. На основании этих подробных инструкций специалист в данной области техники легко измерит скорость саморасщепления временного линкера пролекарства. В предпочтительном варианте осуществления скорость саморасщепления in vivo такова, что период полувыведения in vivo составляет от 20 часов до 300 часов, более предпочтительно, от 20 часов до 150 часов, даже более предпочтительно, от 30 часов до 150 часов, даже более предпочтительно, от 30 часов до 100 часов, даже более предпочтительно, от 40 часов до 100 часов, даже более предпочтительно, от 50 до 75 часов, а также даже более предпочтительно, от 30 до 75 часов.
In vivo и in vitro корреляция
Известно из представленных выше заявок на патенты компании Ascendis Pharma (Complex Biosystems Company), что существует хорошая корреляция между in vitro и in vivo скоростью расщепления линкера. Кинетика высвобождения in vivo может быть легко предсказана из экспериментальных данных in vitro.
Липоатрофия
Как описано выше, липоатрофия представляет собой липолиз, возникающий вблизи места инъекции. Поэтому измерение in vitro липолиза гормона роста и конъюгатов гормона роста может применяться для оценки липоатрофического эффекта конъюгатов.
Для определения липолитического эффекта конъюгата пролекарства, описанного здесь, необходимо синтезировать «постоянный» конъюгат, который не подвержен самогидролизу - то есть постоянный конъюгат.
Анализ для определения липоатрофии описан здесь подробно в рабочем примере 3. На основании этих подробных инструкций специалист в данной области техники легко измерит липоатрофию.
В предпочтительном варианте осуществления конъюгат ПЭГилированного пролекарства рчГР, описанный здесь, обладает липоатрофическим эффектом, который сравним с человеческим гормоном роста, измеренным согласно анализу для определения липоатрофии из примера 3 и другим идентичным условиям режима дозирования.
Связанные с ГР заболевания
Термин "связанные с ГР" заболевания из второго аспекта относится к заболеваниям и состояниям, при которых человек может извлечь пользу из ГР.
Они включают, но не ограничены ими, дефицит гормона роста, дефицит гормона роста, возникающий во взрослом возрасте, синдром Тернера, синдром Прадера-Уилли, синдром короткой кишки, хроническая почечная недостаточность, низкую массу для данного гестационного возраста (НГВ), ВИЧ-синдром истощения, противодействие старению, ревматоидный артрит, идиопатическая низкорослость, гомеобокс-ген и соматопауза при маленьком росте. Также включены другие состояния, характеризующиеся маленьким ростом, которые включают синдром Ноонана, дисплазию скелета, синдром Дауна, маленький рост, связанный с продолжительным применением стероидов, синдром Аарскога, среди прочих. Также включены хронические заболевания почек, юношеский ревматоидный артрит; кистозный фиброз, ВИЧ инфекция у детей, получающих лечение ВАПРТ (высокоактивная противоретровирусная терапия) (ВИЧ/ВАСЛ (ВИЧ-ассоциированный синдром липодистрофии) дети); маленький рост у детей, рожденных с очень низкой массой тела (ОНМТР), но с малой массой тела при рождении для данного срока беременности (SGA); дисплазия скелета; гипохондроплазия; ахондроплазия; идиопатическая низкорослость (ISS); GHD (дефицит гормона роста) у взрослых; хрупкость в или длинных костей, таких как большая берцовая кость, малоберцовая кость, бедренная кость, плечевая кость, лучевая кость, локтевая кость, ключица, пясть, плюсна и пальцы; хрупкость в и губчатых костей, таких как череп, основание руки и основание ноги; пациенты после хирургических операций на сухожилиях или связках в, например, руках, колене или плече; дистракционный остеогенез; расстройства, возникающие при замене сустава или диска, восстановлении мениска, спинномозговом слиянии или фиксации протеза, например, в колене, бедре, плече, локте, запястье или челюсти; расстройства, возникающие при фиксации остеосинтетического материала, такого как ногти, винты и пластины; несоединение или неправильное соединение при переломах; расстройства, возникающие при остеатомии, например, в большой берцовой кости или 1-ом пальце; расстройства, возникающие при имплантации графта; дегенерация суставного хряща в колене, вызванная травмой или артритом; остеопороз у пациентов с синдромом Тернера; остеопороз у мужчин; взрослые пациенты на хроническим диализе (ВПХД); связанная с недоеданием сердечнососудистая болезнь у ВПХД; устранение кахексии у ВПХД; рак у ВПХД; хроническое обструктивное заболевание легких у ВПХД; ВИЧ у ВПХД; старение на фоне ВПХД; хроническая болезнь печени у ВПХД, синдром усталости у ВПХД; болезнь Крона; ухудшение функции печени; мужчины с ВИЧ инфекциями; синдром короткого кишечника; общее ожирение; ВИЧ-ассоциированный синдром липодистрофии (ВАСЛ); бесплодие у мужчин; пациенты после плановых хирургических операций, алкогольной/лекарственной детоксикации или неврологической травмы; старение; ослабленные пожилые; остеоартрит; травматическое повреждение хряща; эректильная дисфункция; фибромиалгия; расстройства памяти; депрессия; травматическое повреждение мозга; субарахноидальное кровоизлияние; очень низкая масса тела при рождении; метаболический синдром; глюкокортикоидная миопатия; и маленький рост из-за лечения глюкокортикоидами у детей.
Чертежи
На фигурах показано следующее.
На Фиг. 1 показан ДСН-ПААГ анализ очищенных постоянных ПЭГ-чГР конъюгатов, где дорожка 1: HiMark™ предварительно окрашенный белковый стандарт с высокой молекулярной массой; дорожка 2: соединение 23; дорожка 3: соединение 23; дорожка 4: соединение 25; дорожка 5: соединение 26, дорожка 6: соединение 33; дорожка 7: соединение 32; дорожка 8: соединение 28; дорожка 9: соединение 28; дорожка 10: соединение 28; дорожка 11: соединение 30; дорожка 12: соединение 34; дорожка 13: соединение 34; дорожка 14: соединение 27; дорожка 15: соединение 29.
На Фиг. 2 показана эксклюзионная хроматограмма погашенного реакционного раствора при синтезе конъюгата 28 и эксклюзионная хроматограмма очищенного 28.
На Фиг. 3 показана очистка катионообменной хроматографией конъюгата 35 и эксклюзионная хроматограмма очищенного 35.
На Фиг. 4 показана очистка катионообменной хроматографией конъюгата 36 и эксклюзионная хроматограмма очищенного 36.
На Фиг. 5 показана очистка катионообменной хроматографией конъюгата 37 и эксклюзионная хроматограмма очищенного 37.
На Фиг. 6 показаны эксклюзионная хроматограммы образцов конъюгата 35, инкубированного в буфере при рН 7,4 и 37°С в различные моменты времени.
На Фиг. 7-10 показаны предпочтительные конъюгаты пролекарства в соответствии с данным изобретением с указанием S0, S1, S2, La, Ga, BS1, BS2, BS3 и критического расстояния.
На Фиг. 11 показаны фармакодинамические кривые отклика (response curves) для конъюгата 36.
Подробно, на Фиг. 7 и 8 показаны примерные структуры 35 и 38 типа (АА1, ААА1), где по меньшей мере 5 кДа полимерная цепь S0, содержащая Ga, и BS1, и BS2 обозначена как S0; карбаматная группа, получаемая из La и первичной аминогруппы чГР, обозначена как La; BS1 содержит по меньшей мере 4 кДа полимерную цепь, обозначенную как S1, где S1 содержит BS3, которая содержит по меньшей мере 4 кДа полимерную цепь, обозначенную как S3. BS2 содержит по меньшей мере 4 кДа полимерную цепь, обозначенную как S2. Критические расстояния даны 18 атомами для Фиг. 7 и 4 атомами для Фиг. 8.
На Фиг. 9 и 10 представлены структуры типа (АА2, ААА2), где амидная группа, получаемая из La и первичной аминогруппы чГР, обозначена как La, и остаток, присоединенный к La, обозначен как S0, содержащая Ga и "ПЭГ", представляет собой остаток S0, содержащий по меньшей мере BS1, S1 и S2 (все не показано).
ПРИМЕРЫ
Способы
Аналитическая препаративная ОФ-ВЭЖХ
Аналитическую ОФ-ВЭЖХ/ИЭР-МС проводят на оборудовании Waters, состоящем из 2695 системы управления образцами, 2487 Детекторе Двойной Абсорбции и ZQ 4000 ИЭР инструмента, оборудованного 5 мкм колонками Reprosil Pur 300  ODS-3 (75×1,5 мм) (Dr. Maisch, Ammerbuch, Germany; скорость потока: 350 мкл/мин, типовой градиент: 10-90% ацетонитрил в воде, 0,05% ТФК в течение 5 мин). Для препаративной ОФ-ВЭЖХ применяют контроллер Waters 600 и детектор двойной абсорбции 2487, оборудованный следующими колонками (Reprosil Pur 300
ODS-3 (75×1,5 мм) (Dr. Maisch, Ammerbuch, Germany; скорость потока: 350 мкл/мин, типовой градиент: 10-90% ацетонитрил в воде, 0,05% ТФК в течение 5 мин). Для препаративной ОФ-ВЭЖХ применяют контроллер Waters 600 и детектор двойной абсорбции 2487, оборудованный следующими колонками (Reprosil Pur 300  ODS-3)
ODS-3)
А): 100×20 мм, скорость потока 10 мл/мин, типовой градиент: 10-90% ацетонитрил в воде, 0,1% ТФК в течение 11 мин
или
В): 100×40 мм (частицы 10 мкм), скорость потока 40 мл/мин, типовой градиент: 10-90% ацетонитрил в воде, 0,1% ТФК в течение 11 мин.
Катионообменная хроматография
Очистку конъюгатов катионообменной хроматографией проводят с применением системы  Explorer (GE Healthcare), оборудованной колонкой Macrocap SP. Соответствующий конъюгат в 20 мМ буфере на основе ацетата натрия рН 4 наносят на колонку, которая предварительно уравновешена в 20 мМ буфере на основе ацетата натрия рН 4 (буфер А). Колонку промывают тремя объемами колонки буфера А для удаления непрореагировавшего реагента ПЭГ. Конъюгаты элюируют с применением градиента 10-60% буфера В (20 мМ ацетат натрия, 1 М хлорид натрия, рН 4,5) в количестве 20 объемов колонки, или 0-40% буфером B в количестве 20 объемов колонки и затем 40-80% B в количестве трех объемов колонки. Скорость потока составляет 7 мл/мин, и элюент отслеживают определением при 280 нм.
Explorer (GE Healthcare), оборудованной колонкой Macrocap SP. Соответствующий конъюгат в 20 мМ буфере на основе ацетата натрия рН 4 наносят на колонку, которая предварительно уравновешена в 20 мМ буфере на основе ацетата натрия рН 4 (буфер А). Колонку промывают тремя объемами колонки буфера А для удаления непрореагировавшего реагента ПЭГ. Конъюгаты элюируют с применением градиента 10-60% буфера В (20 мМ ацетат натрия, 1 М хлорид натрия, рН 4,5) в количестве 20 объемов колонки, или 0-40% буфером B в количестве 20 объемов колонки и затем 40-80% B в количестве трех объемов колонки. Скорость потока составляет 7 мл/мин, и элюент отслеживают определением при 280 нм.
Анионообменная хроматография
Очистку конъюгатов анионообменной хроматографией проводят с применением системы  Explorer system (GE Healthcare) оборудованной колонкой Source Q. Соответствующий конъюгат в 20 мМ Tris/HCl буфере рН 7,5 (буфер С) наносят на колонку, которая предварительно уравновешена в буфере С. Колонку промывают тремя объемами колонки буфера С для удаления непрореагировавшего реагента ПЭГ. Конъюгаты элюируют с применением градиента 0-20% буфера D (20 мМ Tris/HCl, 1 М хлорид натрия, рН 7,5) в количестве 25 объемов колонки. Скорость потока составляет 5 мл/мин, и элюент отслеживают УФ определением при 280 нм. Альтернативно, применяют буферную систему 20 мМ бис-трис/HCl, рН 6,5 (буфер Е) и 20 мМ бис-трис/HCl, 1 М хлорид натрия, рН 6,5 (буфер F).
Explorer system (GE Healthcare) оборудованной колонкой Source Q. Соответствующий конъюгат в 20 мМ Tris/HCl буфере рН 7,5 (буфер С) наносят на колонку, которая предварительно уравновешена в буфере С. Колонку промывают тремя объемами колонки буфера С для удаления непрореагировавшего реагента ПЭГ. Конъюгаты элюируют с применением градиента 0-20% буфера D (20 мМ Tris/HCl, 1 М хлорид натрия, рН 7,5) в количестве 25 объемов колонки. Скорость потока составляет 5 мл/мин, и элюент отслеживают УФ определением при 280 нм. Альтернативно, применяют буферную систему 20 мМ бис-трис/HCl, рН 6,5 (буфер Е) и 20 мМ бис-трис/HCl, 1 М хлорид натрия, рН 6,5 (буфер F).
Аналитическая эксклюзионная хроматография
Аналитическую эксклюзионную хроматографию проводят на системе  Explorer (GE Healthcare). Образцы анализируют с применением колонки Superdex 200 или Sepharose 6 (10×300 мм) и в качестве подвижной фазы применяют 20 мМ фосфата натрия, 135 мМ хлорида натрия, рН 7,4. Скорость потока составляет 0,75 мл/мин, и элюированные чГР и полимер-чГР конъюгаты определяют при 215 нм и 280 нм.
Explorer (GE Healthcare). Образцы анализируют с применением колонки Superdex 200 или Sepharose 6 (10×300 мм) и в качестве подвижной фазы применяют 20 мМ фосфата натрия, 135 мМ хлорида натрия, рН 7,4. Скорость потока составляет 0,75 мл/мин, и элюированные чГР и полимер-чГР конъюгаты определяют при 215 нм и 280 нм.
Определение активности пфф-активированных мПЭГ-линкерных реагентов
Определенное количество пфф-активированного мПЭГ-линкерного реагента (3-5 мг) растворяют в 100 мкл воды. Добавляют 10 мкл 0,5 М NaOH, и реакционную смесь подвергают взаимодействию в течение 60 мин при 40°С. Добавляют 1,5 мкл ТФК и 10% этой смеси анализируют аналитической ОФ-ВЭЖХ. Хроматограммы записывают при 260 и 280 нм. Пик, соответствующий пентафторфенолу (пфф), интегрируют. Определенные значения сравнивают с подходящей калибровочной кривой, полученной при анализе определенных количеств пфп с применением аналитической ОФ-ВЭЖХ и интеграцией хроматограмм, записанных при 260 и 280 нм.
Анализ ДСН-ПААГ
Постоянные мПЭГ-чГР конъюгаты анализируют с применением гелей NuPAGE® Novex Tris-Acetate (1,5 мм толщиной, 15 дорожек), буфера NuPAGE Tris-Acetate SDS-Running Buffer, предварительно окрашенного белкового стандарта с высокой молекулярной массой HiMark™ и красителя Simply Blue™ SafeStain (Invitrogen). На каждую дорожку наносят 0,2-0,6 мкг конъюгата, и электрофорез и последующее окрашивание проводят согласно протоколу поставщика.
Пример 1: Анализ для измерения чГР ПЭГилироваого пролекарства и чГР активности
Биологическую активность чГР измеряют с применением стандартных анализов, известных специалистам в данной области техники. Как описано в ЕР 1715887 В1 и выше, биологическая активность, связанная с природным или модифицированным чГР (например, ПЭГилированным чГР), может быть измерена с применением стандартного анализа пролиферации клеток FDC-P1, (Clark et al., Journal of Biological Chemistry 271: 21969-21977) или анализа связывания рецепторов (US 5057417). В строке 8 (страница 14) патента ЕР 1715887 В1 описано, что предпочтительная in vitro активность должна быть настолько высока, насколько это возможно, наиболее предпочтительно, модифицированный чГР имеет равную или улучшенную in vitro биологическую активность. В данном изобретении биологическая активность должна быть, по-возможности, низкой по сравнению с природным чГР. Авторы данного изобретения делают абсолютно противоположное тому, что описано в ЕР 1715887 В1.
In vitro Анализ
Активность in vitro постоянного ПЭГ-чГР конъюгата, описанного в примерах ниже, определяют с применением одного или более стандартных анализов для оценки биологической активности in vitro. Стандартные анализы, которые могут применяться, включают анализы пролиферации клеток с применением, например, клеток FDC-PI (см., например, Clark et al., Journal of Biological Chemistry, 271: 21969-21977, 1996), или клеток Ba/F3-чГРR, которые экспрессируют рецепторы для чГР, чГР дельта 135-146, или клетки лимфомы крысы Nb2, которые пролиферируют в ответ на чГР через лактогенные рецепторы (см., например, Alam, K.S., et al., J. Biotech 2000, Feb. 28, 78(1), 49-59). Также могут применяться анализы на связывание рецепторов (см., например, патент США №5057417).
Nb2-11 является клоном колонии лимфомы крыс Nb-2, которая получена из трансплантата лимфомы, которая развивается в вилочковой железе/лимфоузле самца крысы линии Noble (Nb) после продолжительной обработки эстрогенами. Клетки происходят из пре-Т клеток, и их пролиферация зависит от лактогенов млекопитающих, таких как пролактин. Nb2-11 также могут быть мутогенетически стимулированы IL-2. Инъекция клеток Nb2 крысам Nb вызывает увеличение злокачественных опухолей, которые крайне чувствительности к лечению алкалоидами барвинка. Кариотипический анализ показал, что колония клеток имеет только пять хорошо развитых аномалий хромосомы. Клетки не экспрессируют поверхностный иммуноглобулин, и их зависимость от лактогенов подтверждается. Протоколы применения клеток Nb2-11 в биоанализах доступны от ЕСАСС по запросу.
Как описано в WO 2006102659 на странице 74, параграф 0240, пример 7, биологическую активность чГР и описанных здесь конъюгатов можно оценивать in vitro с применением анализа пролиферации клеток лимфомы крысы NB2-11. Кратко, клетки NB2-11, полученные из лимфомы крысы, инкубируют с чГР, что приводит к связыванию чГР молекулы с ее рецептором на поверхности клетки. Связывание рецептора вызывает каскад сигнальной трансдукции, что приводит к пролиферации клеток. Результаты анализа основаны на определенном содержании белка и 100% биоактивности немодифицированного чГР.
Заключение:
Основываясь на подробных инструкциях этого примера 1, специалист в данной области техники легко определит остаточную активность пролекарства.
Пример 2: Анализ для измерения скорости само расщепления временного линкера пролекарства
Определение in vitro периода полувыведения
Для определения in vitro скорости расщепления линкера ПЭГ-линкер-чГР конъюгатов соединения растворяют в буфере при рН 7,4 (например, 10 мМ фосфата натрия, 140 мМ NaCl, 3 мМ ЭДТК) и раствор фильтруют через 0,22 мкм фильтр и инкубируют при 37°С. Образцы берут с определенными интервалами времени и анализируют ОФ-ВЭЖХ или эксклюзионной хроматографией при 215 нм. Пики, соответствующие высвобожденному чГР, интегрируют и наносят на график по отношению к времени инкубирования. Программное обеспечение для построения кривых применяют для определения скоростей расщепления первого порядка.
Определение корреляции in vivo периода полувыведения и in vitrolin vivo периода полувыведения
Скорости расщепления линкера in vivo определяют сравнением фармакокинетики постоянных ПЭГ-чГР конъюгатов с соответствующим временным ПЭГ-линкер-чГР конъюгатом, имеющим тот же фрагмент ПЭГ после внутривенной инъекции крысе. Сначала, постоянный ПЭГ-чГР конъюгат вводят внутривенно крысам, и образцы крови отбирают в определенные интервалы времени, получают плазму и анализируют на чГР с применением ELISA (твердофазный иммуноферментный анализ).
Затем, временный ПЭГ-чГР конъюгат вводят внутривенно крысам, и образцы крови отбирают в определенные интервалы времени, получают плазму и анализируют на чГР с применением ELISA.
In vivo период полувыведения рассчитывают из соотношения концентрации чГР временного конъюгата, деленного на определенную концентрацию чГР постоянного конъюгата в соответствующие моменты времени, и строят кривую. Данные сравнивают с измерениями периода полувыведения in vitro.
Заключение
Основываясь на подробных инструкциях этого примера 2, специалист в данной области техники легко определит in vivo период полувыведения чГР-ПЭГилированного пролекарства.
Пример 3: Анализ для измерения липоатрофии
Как сказано выше, соединение РНА-794428 является ПЭГилированным-чГР и описано в патенте ЕР 1715887 компании Pharmacia. Согласно www.clinicaltrials.gov, анализ закончился 10 декабря 2007. Решение компании Pfizer (Pharmacia) закончить программу было вызвано случаями липоатрофии в месте инъекции, что было описано в исследованиях на клинической фазе 2 после одной инъекции РНА 794428. Липоатрофия является термином, описывающим локализованную потерю жировой ткани и видна на человеке как ямки в коже (видимые глазом).
Анализ
Существует несколько in vitro методов, описанных в данной области техники, для измерения липоатрофии. Одно из предложений описано в публикации J. Anim. Sci (1972), 35: 794-800 (L.J. Machlin) на странице 795. Другое описано в Int. J. Cancer; 80, 444-447 (1999).
В общем, липоатрофия может быть измерена как предложено ниже.
Липолитический эффект может быть определен с применением in vitro анализа, включающего изолированные адипоциты млекопитающих, предпочтительно мышиные адипоциты. Исследуемые образцы инкубируют при физиологически релевантных условиях с предопределенным числом адипоцитов в бикарбонатном буфере Кребса-Рингера, содержащем подходящие питательные вещества в течение вплоть до 6 часов. Концентрацию выделенного глицерина определяют стандартными методами, например, ферментным или радиометрическим определением. Контрольные образцы, содержащие только адипоциты, анализируют для определения спонтанного выделения глицерина.
Липолитический эффект нативного немодифицированного рекомбинантного человеческого гормона роста и постоянно ПЭГилированного рекомбинантного человеческого гормона роста сравнивают с эффектом временно ПЭГилированного рекомбинантного человеческого гормона роста.
Заключение
Основываясь на подробных инструкциях этого примера 3, специалист в данной области техники легко определит липоатрофическое действие.
Пример 4: Синтез постоянного линкерного реагента 12а и временных линкерных реагентов 12b и 12с
Синтез соединения 6
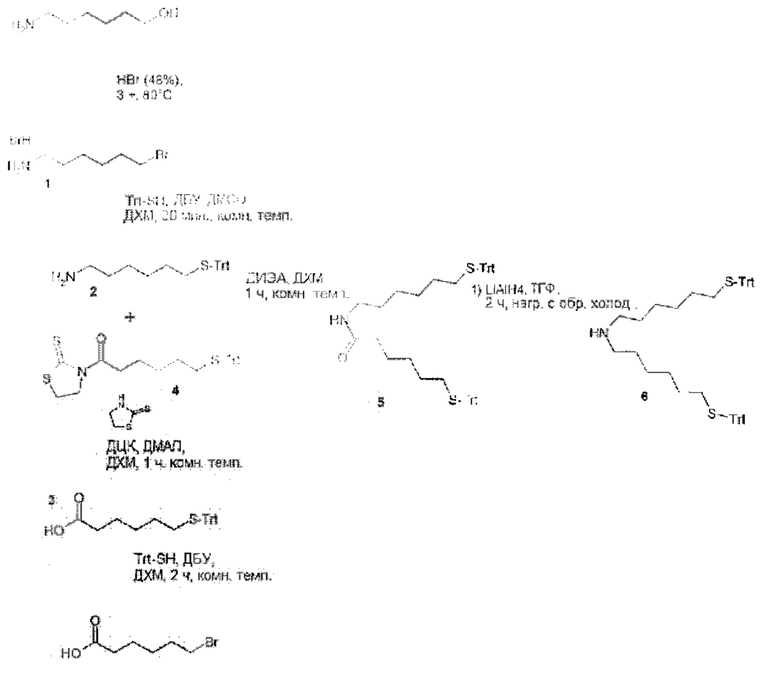
6-Аминогексан-1-ол (2,85 г, 24,3 ммоль) растворяют в водн. HBr (48%, 10 мл, 89 ммоль) и перемешивают при 80°С в течение 3 ч. Избыток HBr выпаривают при 50-65°С и 15 Торр, и остаток сушат в вакууме.
1: Выход 6,07 г (96%)
МС [М+Н]+=180,3 г/моль (MW+H рассчит. = 180,0 г/моль)
ДБУ (3,5 мл, 23,2 ммоль) добавляют к суспензии гидробромида 6-бромгексиламина 1 (3,03 г, 11,6 ммоль) и добавляют трифенилметантиол (2,14 г, 7,74 ммоль) в ДХМ (25 мл) и ДМСО (13 мл). Реакционную смесь перемешивают в течение 30 мин при комнатной температуре и разбавляют водой (150 мл).
Водный слой экстрагируют эфиром, и объединенную органическую фазу выпаривают. 2 очищают ОФ-ВЭЖХ.
2: Выход 1,17 г (40%)
МС [М+Н]+=376,7 г/моль (ММ+Н рассчит. = 376,2 г/моль)
ДБУ (4,56 мл, 30,0 ммоль) добавляют к 6-бромгексановой кислоте (3,90 г, 20,0 ммоль) и трифенилметантиолу (11,1 г, 40,0 ммоль) в ДХМ (40 мл). После перемешивания при комнатной температуре в течение 1 ч добавляют ледяную 1 М H2SO4 (50 мл), и смесь экстрагируют ДХМ. Объединенную органическую фазу сушат над Na2SO4 и концентрируют в вакууме. Соединение 3 очищают хроматографией на колонке с силикагелем (200 мл) с применением гептана/этилацетата (4/1, Rf=0,2) в качестве подвижной фазы.
3: Выход 5,83 г (75%)
ДМАП (37 мг, 0,31 ммоль) добавляют к 6-тритилсульфанилгексановой кислоте 3 (5,83 г, 14,9 ммоль), тиазолидин-2-ону (3,56 г, 29,9 ммоль) и дициклогексилкарбодиимиду (3,08, 14,9 ммоль) в ДХМ (100 мл). После перемешивания при комнатной температуре в течение 1 ч добавляют 1 М HCl (0,6 мл) и смесь фильтруют. Фильтрат концентрируют в вакууме и соединение 4 очищают хроматографией на колонке с силикагелем (180 мл) с применением гептана/этилацетата (1/1) в качестве подвижной фазы.
4: Выход 7,15 г (97%) в виде желтого масла
Раствор 1-(2-тиоксотиазолидин-3-ил)-6-тритилсульфанилгексан-1-она 4 (1,53 г, 3,11 ммоль) в THF (13 мл) добавляют в течение 2 мин к 6-тритилсульфанилгексиламину 2 (1,17 г, 3,11 ммоль) в ДМСО (1 мл) и ТГФ (5 мл). После добавления триэтиламина (435 мкл, 3,11 ммоль) реакционную смесь перемешивают в течение 90 мин при комнатной температуре. Добавляют простой эфир (200 мл) и воду (100 мл) и фазы разделяют. После экстрагирования водной фазы простым эфиром объединенные органические фазы сушат над Na2SO4 и концентрируют в вакууме. Соединение 5 очищают хроматографией на колонке с силикагелем (150 мл) с применением гептана/этилацетата (2/1, Rf=0,1) в качестве подвижной фазы.
5: Выход 1,23 г (53%)
МС [M+Na]+=770,6 г/моль (MM+Na рассчит. = 770,4 г/моль)
В атмосфере азота 1 М раствор LiAlH4 в ТГФ (1,.2 мл, 4,8 ммоль) помещают в сухую колбу, и раствор соединения 5 (509 мг, 0,680 ммоль) в 10 мл ТГФ добавляют в течение 4 мин. Смесь перемешивают при нагревании с обратным холодильником в течение 2 ч до полного превращения исходного материала, показанного тонкослойной хроматографией (гептан/этилацетат 1:1). Реакционную смесь осторожно гасят 10:1 суспензией воды в диэтиловом эфире до остановки выделения газа. Смесь выливают в 50 мл насыщенного раствора тартрата натрия калия и перемешивают в течение 90 мин. Добавляют 90 мл этилацетата и фазы разделяют. Водную фазу экстрагируют этилацетатом (4×20 мл), и объединенную органическую фазу промывают насыщенным раствором соли (30 мл), сушат над MgSO4, фильтруют и концентрируют с получением прозрачного масла. Соединение 6 адсорбируют на двуокиси кремния и очищают флэш-хроматографией (30 г двуокиси кремния, CH2Cl2/MeOH 20:1 (об./об.) + 0,1% NEt3). Продукт получают в виде грязнобелого вязкого масла.
6: Выход 270 мг (54%)
МС [М+Н]+=734,4 г/моль (ММ+Н рассчит. = 734,4 г/моль)
Rf=0,28 (CH2Cl2/MeOH 19:1)
Синтез соединения 9
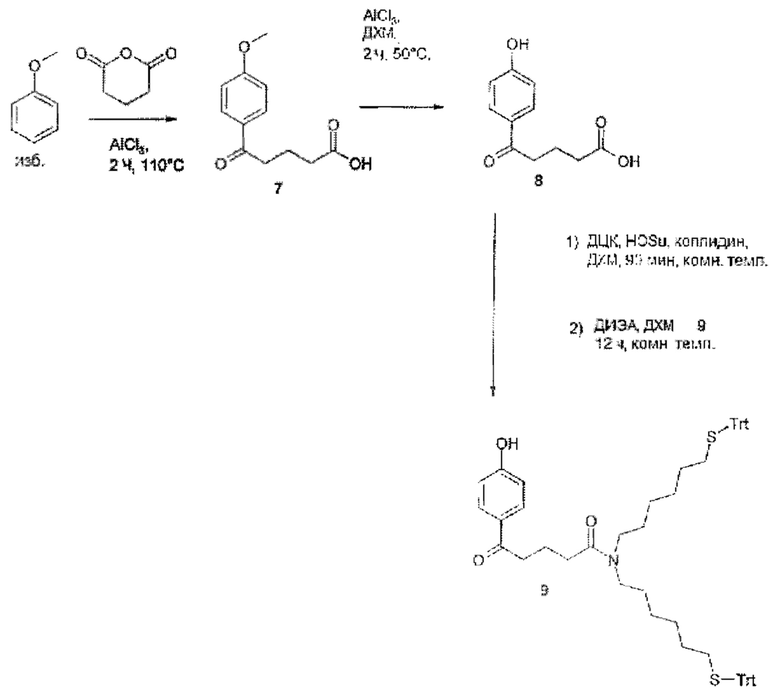
AlCl3 (23,0 г, 172,3 ммоль) добавляют к глутаровому ангидриду (10,0 г, 86,2 ммоль) в анизола (85 мл, 781 ммоль). Реакционную смесь нагревают до 110°C а течение 2 ч, охлаждают до комнатной температуры выливают на 3 н HCl/лед м экстрагируют дихлорметаном. Вещную фазу экстрагируют дихлорметаном (4×20 мл), и объединенные органические фракции промывают насыщенным раствором соли (30 мл), сушат над MgSO4, фильтруют и концентрируют с получением красного масла, которое перекристаллизовывают из толуола. Продукт 7 получают в виде грязнобелого твердого вещества.
7: Выход 5,2 г (48%)
МС [M+Na]+=245,8 (MM+Na рассчит. = 245,1 г/моль)
AlCl3 (9,0 мг, 68 ммоль) добавляют к соединению 7 (5,0 г, 23 ммоль) в 1,2-дихлорэтане. Реакционную смесь перемешивают в течение 14 ч при 85°С и затем охлаждают до комнатной температуры. Добавляют ледяную 1 н HCl (50 мл) и смесь экстрагируют этилацетатом (4×30 мл). Объединенные органические фракции сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением светло-красного твердого вещества, которое применяют на следующей стадии без дальнейшей очистки.
8: Выход 3 г (62%)
МС [М+Н]+=209,1 (ММ+Н рассчит. = 209,1 г/моль)
Дициклогексилкарбодиимид (532 мг, 2,6 ммоль), кислоту 8 (403 мг, 1,9 ммоль), HOSu (297 мг, 2,6 ммоль) и коллидин (1,0 мл, 7,8 ммоль) в ДХМ (10 мл) перемешивают в течение 90 мин при комнатной температуре. После удаления дициклогексилмочевины фильтрацией амин 6 (947 мг, 1,3 ммоль) в ДХМ (5 мл) и ДИЭА (450 мкл, 2,6 ммоль) добавляют к фильтрату, и смесь подвергают взаимодействию в течение 14 ч при комнатной температуре. Добавляют 1 н H2SO4 (2×50 мл) и фазы разделяют. Водную фазу экстрагируют этилацетатом (4×20 мл), и объединенные органические фазы промывают насыщенным раствором соли (30 мл), сушат над MgSO4, фильтруют и концентрируют в вакууме. Остатки очищают хроматографией на колонке с силикагелем (150 мл) с применением гептана/этилацетата (1/2, Rf=0,66) в качестве подвижной фазы.
9: Выход 819 мг (69%)
МС [M+Na]+=946,4 (MM+Na рассчит. = 946,.4 г/моль)
Синтез постоянного линкерного реагента 12а и временного линкерного реагента 12b и 12с
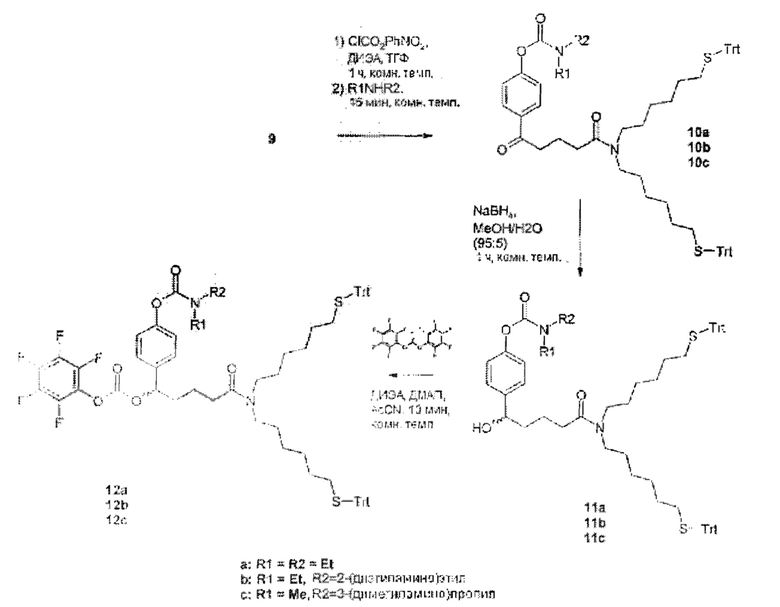
Соединение 9 (1 экв., 175 мг, 0,19 ммоль) растворяют в сухом ТГФ (1,5 мл), добавляют п-нитрофенилхлорформиат (1,1 экв, 42 мг, 0,21 ммоль) и ДИПЭА (2 экв., 66 мкл, 0,38 ммоль) и смесь перемешивают в течение 60 мин при комнатной температуре. Добавляют диэтиламин (R1=R2=Et, 2 экз., 39 мкл, 0,38 ммоль) и перемешивание продолжают в течение 15 мин. Растворитель удаляют в вакууме, добавляют 100 мкл АсОН и соединение 10а очищают ОФ-ВЭЖХ.
МС [M+Na]+=1045,9 (MM+Na рассчит. = 1045.5 г/моль)
NaBH4 (5 экв., 37 мг, 0,05 ммоль) добавляют к соединению 10а, содержащему ВЭЖХ фракцию (ацетонитрил/Н20 ~ 3/1 (об./об.) + 0,1% ТФК) и смесь реагирует в течение 10 мин при комнатной температуре. Добавляют дополнительную порцию NaBH4 (5 экв., 37 мг, 0,95 ммоль), и реакционную смесь перемешивают до полного превращения исходного материала, подтвержденного ЖХ/МС анализом (10 мин при комнатной температуре). Соединение 11а очищают ОФ-ВЭЖХ и лиофилизируют, 11а: Выход 95 мг (49% по отношению к соединению 9)
МС [M+Na+H]+=1047,7 (MM+Na рассчит. = 1047,5 г/моль)
Соединение 9 (1 экв., 175 мг, 0,19 ммоль) растворяют в сухом ТГФ (1,5 мл), добавляют п-нитрофенилхлорформиат (1,1 экв., 42 мг, 0,21 ммоль) и ДИПЭА (2 экв., 66 мкл, 0,38 ммоль) и смесь перемешивают 60 мин при комнатной температуре.
Добавляют N,N,N'-триэтилэтан-1,2-диамин (R1=Et, R2 = 2-(диэтиламино)этил, 2 экв., 68 мкл, 0,38 ммоль) и перемешивание продолжают в течение 15 мин. Добавляют 100 мкл АсОН, растворитель удаляют в вакууме и соединение 10b очищают ОФ-ВЭЖХ и лиофилизируют.
10b: Выход 147 мг в виде соли ТФК (65%)
МС [M+Na]+=1116,4 (MM+Na рассчит. = 1116,6 г/моль)
Соединение 10с синтезируют как описано выше с применением N,N,N'-триметилпропан-1,3-диамина (R1=Ме, R2 = 3-(диметиламино)пропил, 56 мкл, 0,38 ммоль) в виде диамина.
10с: Выход 134 мг в виде соли ТФК (59%)
МС [M+Na]+=1088,4 (MM+Na рассчит. = 1088,6 г/моль)
NaBH4 (46 мг, 1,2 ммоль) добавляют к соединению 10b (147 мг, 0,12 ммоль) в МеОН/воде = 95:5 (об./об.) (3 мл) двумя дозами, и смесь перемешивают течение 1 ч при комнатной температуре. После добавления АсОН (300 мкл) и концентрации продукт 11b очищают ОФ-ВЭЖХ и лиофилизируют.
11b: Выход 107 мг в виде соли ТФК (73%)
МС [M+Na]+=1118,4 (MM+Na рассчит. = 1118,6 г/моль)
Соединение 11с синтезируют по тому же протоколу.
11с: Выход 65 мг в виде соли ТФК (54%) из 134 мг исходного материала
МС [M+Na]+=1090,4 (MM+Na рассчит. = 1090,6 г/моль)
В атмосфере азота бис-пентафторфенилкарбонат (2,5 экв., 25 мг, 63 мкмоль), ДМАП (1 мг) и ДИЭА (5 экв., 22 мкл, 127 мкмоль) добавляют к соединению 11а (1 экв., 26 мг, 26 мкмоль) в сухом ацетонитриле (0,5 мл). Реакционную смесь перемешивают в течение 30 мин при комнатной температуре, охлаждают до 0°С и подкисляют АсОН (200 мкл). Продукт 12а очищают ОФ-ВЭЖХ и лиофилизируют.
12а: Выход 13 мг (42%)
МС [M+Na]+=1258,2 (MM+Na рассчит. = 1257,5 г/моль)
Соединения 12b и 12с получают согласно методикам получения соединения 11b (56 мг, 48 мкмоль) и соединения 11с (88 мг, 73 мкмоль), соответственно.
12b: Выход 63 мг в виде соли ТФК (93%)
МС [М+Н]+=1306,3 (ММ+Н рассчит. = 1306,6 г/моль)
12с: Выход 41 мг в виде соли ТФК (41%)
МС [М+Н]+=1278,4 (MM+Na рассчит. = 1278,5 г/моль)
Пример 5: Синтез постоянного литерного реагента 14а и временного линкерного реагента 14с
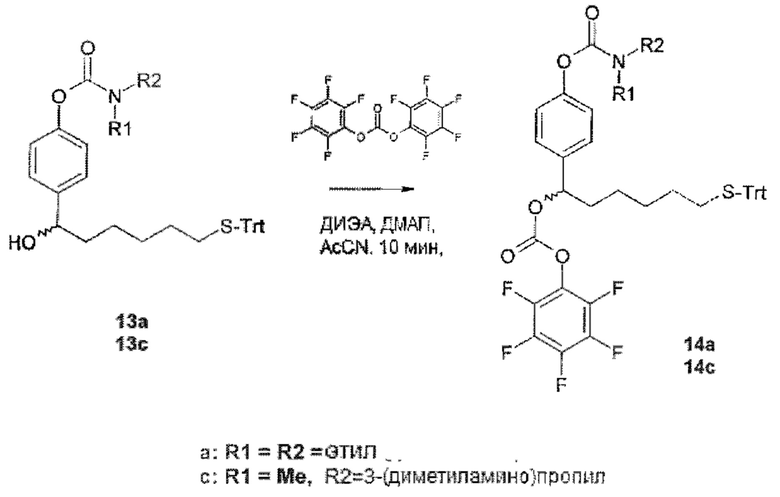
Соединения 13а и 13с синтезируют как описано в WO 2005/099768 A2.
В атмосфере азота биспентафторфенилкарбонат (631 мг, 1,6 ммоль), ДМАП (20 мг, 0,16 ммоль) и ДИЭА (556 мкл, 3,2 ммоль) добавляют к соединению 13а (364 мг, 0,64 ммоль) в сухом ацетонитриле (5 мл). Реакционную смесь перемешивают в течение 15 мин при комнатной температуре, охлаждают до 0°С и подкисляют уксусной кислотой (1 мл). Продукт 14а очищают ОФ-ВЭЖХ и лиофилизируют.
14а: Выход 379 мг (77%)
МС [M+Na]+=800,4 (MM+Na рассчитано = 800,3 г/моль)
Соединение 14с получают по методике получения соединения 13 с (97 мг, 130 мкмоль).
14с: Выход 114 мг в виде соли ТФК (94%)
MC [M+H]+=821,5 (ММ+Н рассчитано = 821,3 г/моль)
Пример 6: Синтез постоянного литерного реагента 15
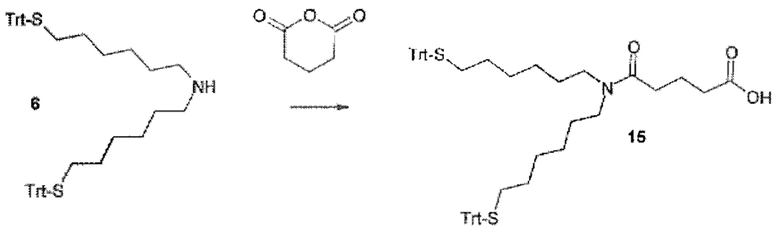
Глутаровый ангидрид (0,41 ммоль), амин 6 (200 мг, 0,27 ммоль), ДИПЭА (72 мкл, 0,41 ммоль) и ДМАП (11 мг, 0,09 ммоль) перемешивают в ацетонитриле (3 мл) в течение 2 ч при 80°С. Смесь охлаждают до комнатной температуры и добавляют уксусную кислоту (200 мкл). Продукт 15 очищают ОФ-ВЭЖХ и лиофилизируют.
15: Выход 130 мг (57%)
МС [M+Na]+=870,2 (MM+Na рассчитано = 870,4 г/моль)
Пример 7: Синтез активированных мПЭГ-линкерных реагентов мПЭГ-малеимидные исходные материалы:
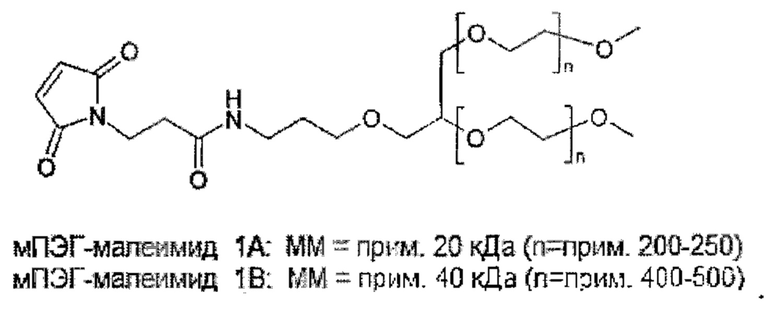
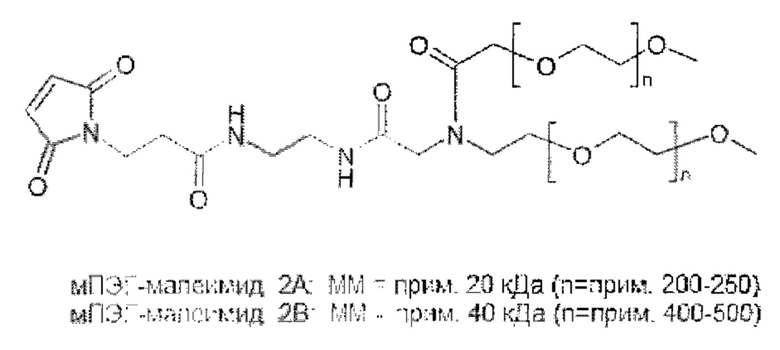
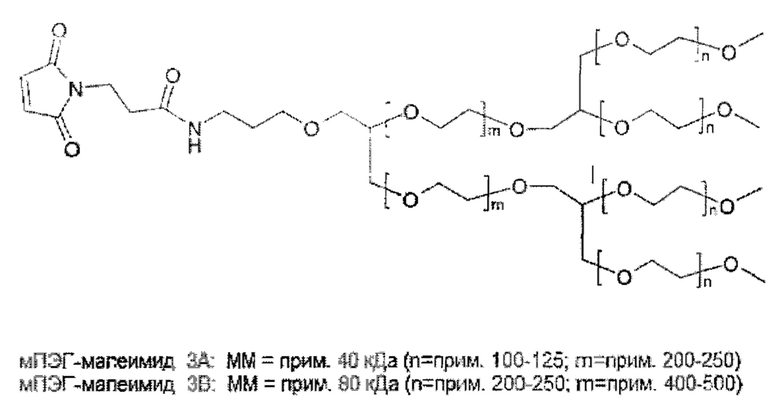
мПЭГ остатки после взаимодействия с тиольной группой (R3 в структурах ниже):
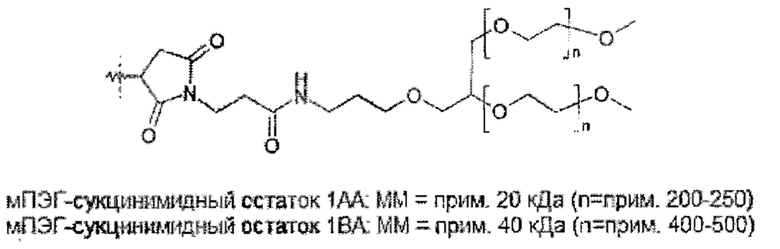
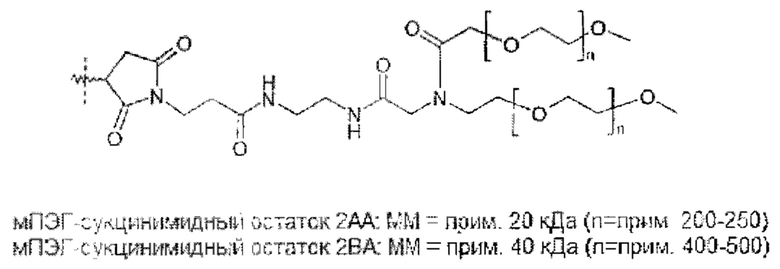
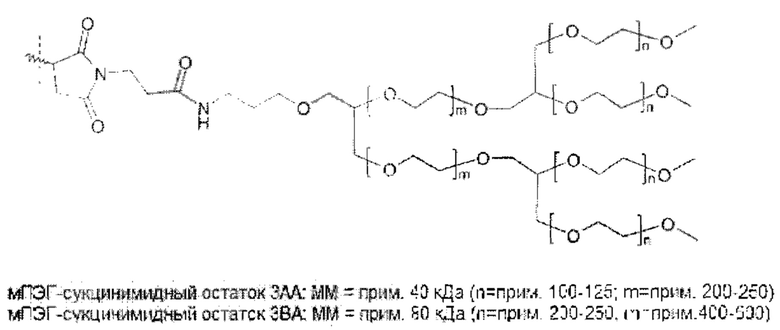
Вертикальная пунктирная линия означает место присоединения тиольной группы в соответствующей структуре
Синтез постоянных пфф-активированных мПЭГ-линкерных реагентов 17аа, 17ab, 17ас, 17ad и временных пфф-активированных мПЭГ-линкерных реагентов 17b, 17са и 17cb
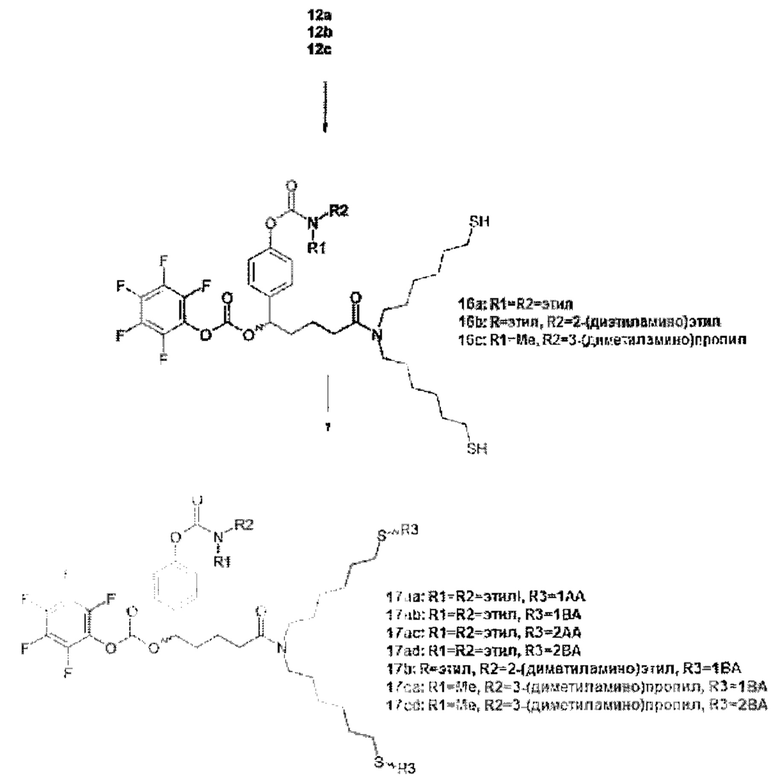
Карбонат 12а (13 мг, 10 мкмоль) перемешивают в 10 мкл АсОН, 700 мкл ГФИП, 1 мкл ТФК and 2 мкл ТЭС в течение 10 при комнатной температуре. Летучие компоненты удаляют в потоке азота и соединение 16а очищают ОФ-ВЭЖХ.
16а: Выход 3,8 мг (5 мкмоль)
МС [M+H]+=751,3 (ММ+H рассчит. = 751,3 г/моль)
Соединения 16b и 16с получают, соответственно, из соединений 12b (7,7 мг, 5,4 мкмоль) и 12с (2 мг, 1,5 мкмоль) в указанном порядке,
16b: Выход 2,5 мг (2,7 мкмоль)
МС [M+Na]+=845,1 (MM+Na рассчит. = 844,3 г/моль)
16с: Выход 0,5 мг (0,6 мкмоль)
МС [M+Na]+=816,6 (MM+Na рассчит. = 816,3 г/моль)
мПЭГ-малеимид 1В (NOF, Japan) (521 мг, 12,7 мкмоль) добавляют к 3,5 мг (3,9 мкмоль) соединения 16с в 4 мл 3/1 (об./об.) ацетонитриле/воде + 0,1% ТФК.
Добавляют 200 мкл 0,5 М фосфатного буфера рН 7,4, и смесь реагирует в течение 10 мин при комнатной температуре. Добавляют 1 мкл (13 мкмоль) меркаптоэтанола, и реакционную смесь подкисляют до рН 4-5 добавлением ТФК. Соединение 17са очищают ОФ-ВЭЖХ и лиофилизируют.
17са: Выход 220 мг (пфф-карбонат активность 82%)
Соединение 17cb синтезируют как описано для соединения 17са с применением соединения 16с (3,5 мг, 3,9 мкмоль) и мПЭГ-малеимида 2В (656 мг, 16 мкмоль).
17cb: Выход 130 мг (пфф-карбонат активность 85%)
184 мг (8,8 мкмоль) мПЭГ-малеимида 1А (NOF, Japan) добавляют к соединению 16а (2,0 мг, 2,7 мкмоль) в 4 мл 1/1 (об./об.) ацетонитриле/воде + 0,1% ТФК. Добавляют 200 мкл 0,5 М фосфатного буфера рН 7,4, и смесь реагирует в течение 10 мин при комнатной температуре. Добавляют 0,2 мкл (1,6 мкмоль) меркаптоэтанола, и реакционную смесь подкисляют до рН 2-3 добавлением ТФК. Соединение 17аа отделяют от непрореагировавшего ПЭГ с применением ОФ-ВЭЖХ и лиофилизируют.
17аа: Выход 90 мг (пфф-карбонат активность 88%)
Соединение 17ab синтезируют как описано выше, с применением соединения 16а (3,8 мг, 5,0 мкмоль) и 680 мг (16 мкмоль) мПЭГ-малеимида 1В (NOF, Japan).
17ab: Выход 250 мг (пфф-карбонат активность 83%)
Соединение 17ас синтезируют как описано выше с применением соединения 16а (2,5 мг, 3,3 мкмоль) и 200 мг (9,5 мкмоль) мПЭГ-малеимида 2А (Jenkem, PR China).
17ас: Выход 80 мг (пфф-карбонат активность 80%)
Соединение 17ad синтезируют как описано выше с применением соединения 16а и мПЭГ-малеимида 2В.
Соединение 17b синтезируют как описано для соединения 17cb с применением соединения 16b и мПЭГ-малеимида 1В.
Пример 8: Синтез пфф-активированных постоянных мПЭГ линкерных реагентов 19аа и 19ab и временного постоянного мПЭГ-линкерного реагента 19с
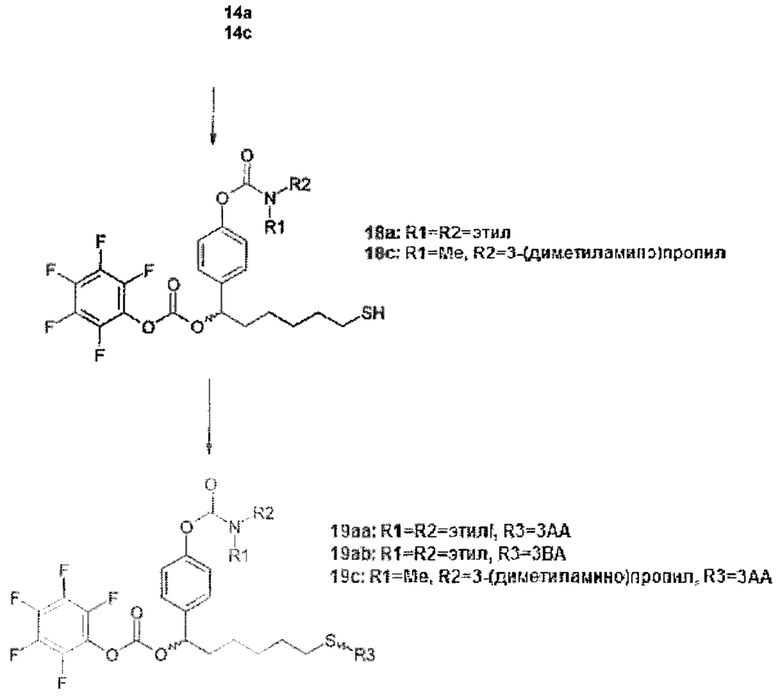
Карбонат 14с (20 мг, 21 мкмоль) перемешивают в 10 мкл АсОН, 400 мкл ГФИП и 5 мкл ТЭС в течение 10 мин при комнатной температуре и охлаждают до 0°С.
Добавляют ледяной ацетонитрил/воду = 9/1 (об./об.) и соединение 18с отделяют ОФ-ВЭЖХ и лиофилизируют.
18с: Выход 5,0 мг в виде соли ТФК (7,2 мкмоль)
МС [M+H]+=579,6 (ММ+Н рассчит. = 579.2 г/моль)
Соединение 18а синтезируют как описано выше с применением карбоната 14а (24 мг, 31 мкмоль).
18а: Выход 8,0 мг (15 мкмоль)
МС [M+H]+=536,2 (ММ+Н рассчит. = 536,5 г/моль)
205 мг (5 мкмоль) мПЭГ-малеимида 3А (NOF, Japan) добавляют к соединению 18а (4,0 мг, 7,5 мкмоль) в 2 мл 1/1 (об./об.) ацетонитриле/воде + 0.1% ТФК. Добавляют 100 мкл 0,5 М фосфатного буфера (рН 7,4) и смесь подвергают взаимодействию в течение 10 мин при комнатной температуре. Реакционную смесь подкисляют до рН 2-3 добавлением ТФК, и соединение 19аа отделяют от непрореагировавшего ПЭГ с применением ОФ-ВЭЖХ и лиофилизируют.
19аа: Выход 125 мг (пфф-карбонат активность 85%)
Соединение 19ab получают соответственно из 410 мг (5 мкмоль) mПЭГ-малеимида 3В (NOF, Japan) и соединения 18а (4,0 мг, 7,5 мкмоль).
19ab: Выход 265 мг (пфф-карбонат активность 87%)
Соединение 19с получают соответственно из 205 мг мПЭГ-малеимида 3А и соединения 18с (5 мг, 7,2 мкмоль)
19с: Выход 120 мг (пфф-карбонат активность 88%)
Пример 9: Синтез постоянного 4-разветвленного 80 кДа мПЭГ-NHS производного сложного эфира 22
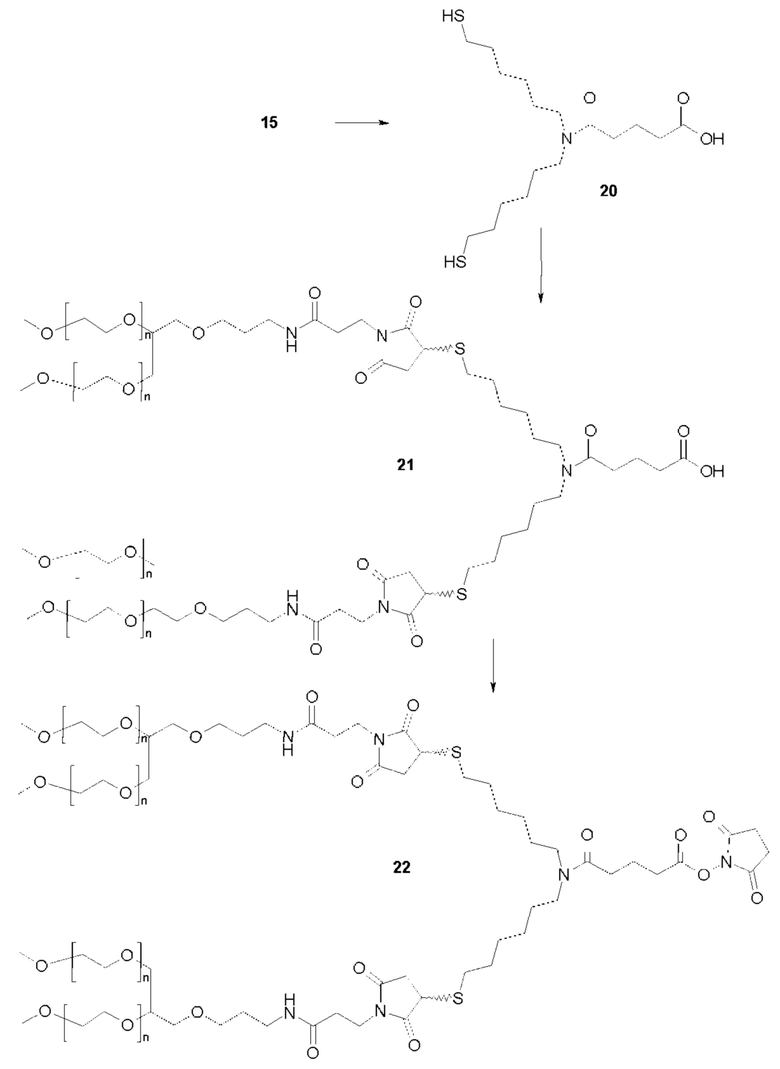
Кислоту 15 (12 мг, 14 мкмоль) перемешивают в 1 мл ТФК, 1 мл ДХМ и 10 мкл ТЭС в течение 10 мин при комнатной температуре. Летучие компоненты удаляют в потоке азота, и дитиол 20 очищают ОФ-ВЭЖХ.
20: Выход 2,9 мг (8 мкмоль)
МС [M+Na]+=386,8 (ММ+Na рассчит. = 386,2 г/моль)
Соединение 20 (1 мг, 2,8 мкмоль) в 170 мкл ацетонитрила добавляют к мПЭГ-малеимиду 1В (NOF, Japan) (380 мг, 9,2 мкмоль) в 4 мл 1/1 (об/об.) ацетонитрила/воды + 0,1% ТФК, Добавляют 200 мкл 0,5 М фосфатного буфера рН 7,4, и смесь реагирует в течение 10 мин при комнатной температуре. Добавляют 0,6 мкл (7,8 мкмоль) меркаптоэтанола, и реакционную смесь подкисляют до рН 4-5 добавлением ТФК. Буфер меняют на 0,005% HCl (колонка HiPREP Desalting, 26/10 GE Healthcare) и соединение 21 лиофилизируют без дальнейшей очистки.
21: Выход 320 мг
Соединение 21 растворяют в 50 мл толуола, и полимерный раствор азеотропно сушат в течение двух часов при нагревании с обратным холодильником с применением ловушки Дина-Старка. Полимерный раствор затем охлаждают до комнатной температуры. Высушенный мПЭГ-линкерный реагент 21 осаждают добавлением охлажденного простого эфира (60 мл).
Дициклогексилкарбодиимид (1,2 мг, 6 мкмоль) в ДХМ добавляют к раствору соединения 21 (240 мг, 3 мкмоль) и N-гидроксисукцинимида (0,7 мг, 6 мкмоль) в ДХМ (3 мл). Реакционную смесь перемешивают в течение 14 ч при комнатной температуре и соединение 22 осаждают добавлением холодного простого эфира (20 мл). Продукт 22 сушат з вакууме.
22: Выход 200 мг
Пример 10: Синтез постоянного амид-связанного мПЭГ-чГР моноконъюгата 23 и мПЭГ2-чГР бисконъюгата 24 с применением линейного производного 40 кДа мПЭГ-сукцинимидилгексаноата
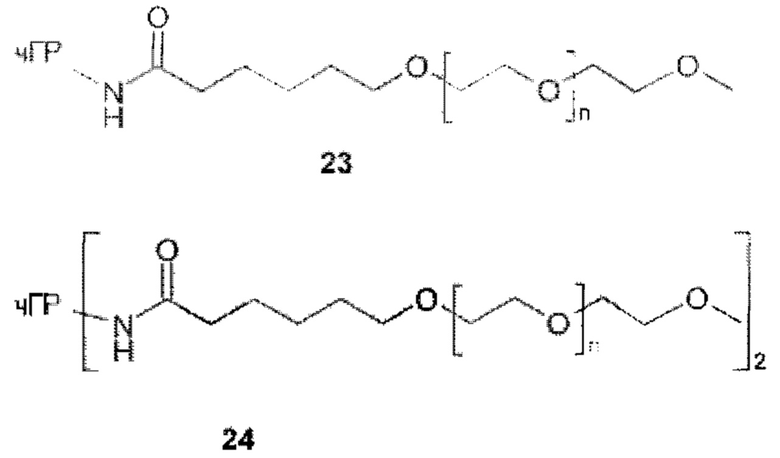
В чГР меняют буфер на 50 мМ бората натрия рН 8,5 (альтернативно может применяться борат натрия рН 8 или борат натрия рН 9). Концентрация чГР составляет приблизительно 2,5 мг/мл. Трехкратный молярный избыток 40 кДа производного мПЭГ-сукцинимидилгексаноата (NOF, Japan) по отношению к количеству чГР растворяют в воде с получением 20% (мас./об.) раствора реагента (альтернативно может применяться четырехкратный или пятикратный молярный избыток). Раствор реагента добавляют к раствору чГР и смешивают. Реакционную смесь инкубируют в течение 2 ч при комнатной температуре и гасят гидроксиламином при комнатной температуре и pH 7 в течение двух часов. Погашенную реакционную смесь анализируют эксклюзионной хроматографией. Моноконъюгат 23 и бисконъюгат 24 очищают катионообменной хроматографией. Альтернативно, для очистки может применяться анионообменная хроматография. Очищенные конъюгаты анализируют ДСН-ПААГ (Фиг. 1).
Пример 11: Синтез постоянного амид-связанного мПЭГ-чГР моноконъюгата 25 и мПЭГ-чГР бисконъюгата 26 с применением разветвленного производного 40 кДа мПЭГ-NHS сложного эфира
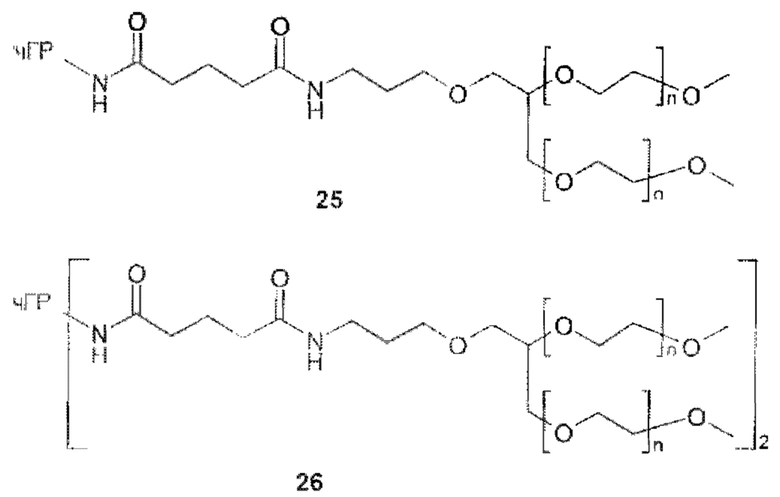
Постоянный мПЭГ-чГР моноконъюгат 25 и бисконъюгат 26 синтезируют по методике, описанной в примере 10 с применением разветвленного производного 40 кДа мПЭГ-NHS сложного эфира (NOF, Japan). Очищенный конъюгаты анализируют ДСН-ПААГ (Фиг. 1).
Пример 12: Синтез постоянного амид-связанного мПЭГ-чГР моноконъюгата 27 с применением 4-разветвленяого производного 80 кДа мПЭГ-NHS сложного эфира
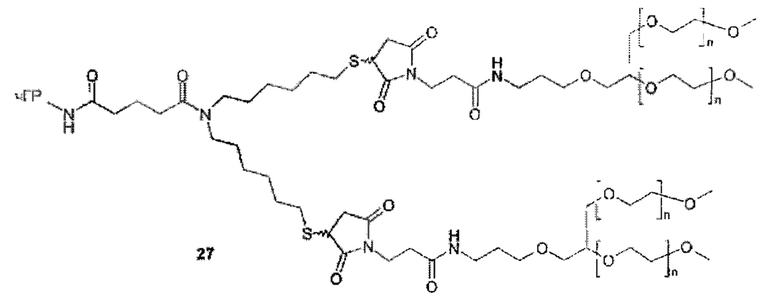
Постоянный мПЭГ-чГР моноконъюгат 27 получают по методике примера 10 с применением 4-разветэленвого производного 80 кДа мПЭГ-NHS сложного эфира 22.
Очищенное соединение 27 анализируют ДСН-ПААГ (Фиг. 1).
Пример 13: Синтез постоянного карбамат-связанного мПЭГ-чГР моноконъюгата 28 с применением 4-разветвпенного производного 40 кДа мПЭГ-пентафторфенилкарбоната 17аа
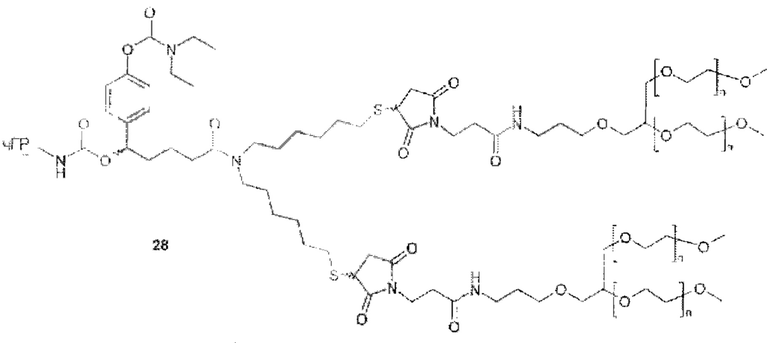
В чГР меняют буфер на 50 мМ борат натрия рН 9 (альтернативно может применяться борат натрия рН 8,5 или борат натрия рН 8). Концентрация чГР приблизительно составляет 2,5 мг/мл. Четырехкратный молярный избыток постоянного 4-разветвленного 40 кДа мПЭГ-линкерного реагента 17аа по отношению к количеству чГР растворяют в воде с получением 20% (мас./об.) раствора реагента. Раствор реагента добавляют к раствору чГР и смешивают. Реакционную смесь инкубируют в течение 1,5 ч при комнатной температуре и гасят инкубированием в 100 мМ гидроксиламина при рН 7 и комнатной температуре в течение 2 часов. Погашенную реакционную смесь анализируют эксклюзионной хроматографией (Фиг. 2 верх). Постоянный мПЭГ-линкер-чГР моноконъюгат 28 очищают анионообменной хроматографией при рН 7,5 и анализируют ДСН-ПААГ (Фиг. 1) и эксклюзионной хроматографией (Фиг. 2 снизу).
Пример 14: Синтез постоянного карбамат-связанного мПЭГ-чГР моноконъюгата 29 с применением 4-разветвленного производного 80 кДа мПЭГ-пентафторфенилкарбоната
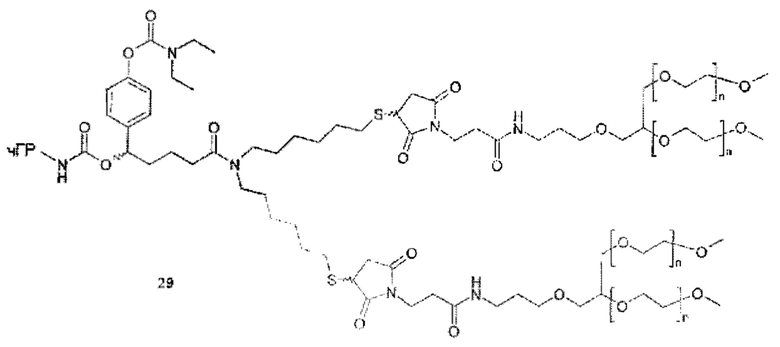
Постоянный карбамат-связанный мПЭГ-чГР моноконъюгат 29 синтезируют согласно примеру 13 с применением 4-разветвленного производного 80 кДа мПЭГ-пентафторфенилкарбоната 17ab. Очищенное соединение 29 анализируют ДСН-ПААГ (Фиг. 1).
Пример 15: Синтез постоянного карбамат-связанного мПЭГ-чГР моноконъюгата 30 с применением 4-развствленного производного 40 кДа мПЭГ-пентафторфенилкарбоната 17ас
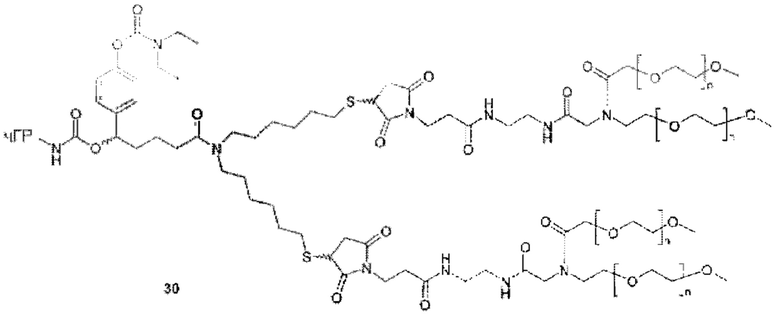
Постоянный чПЭГ-чГР моноконъюгат 30 синтезируют по методике примера 13 с применением 4-разветвленного производного 40 кДа мПЭГ-пентафторфенилкарбоната 17ас. Очищенное соединение 30 анализируют ДСН-ПААГ (Фиг. 1).
Пример 16: Синтез постоянного мПЭГ-чГР моноконъюгата 31 с применением 4-рвзветвленного производного 80 кДа мПЭГ-пентафторфенилкарбоната
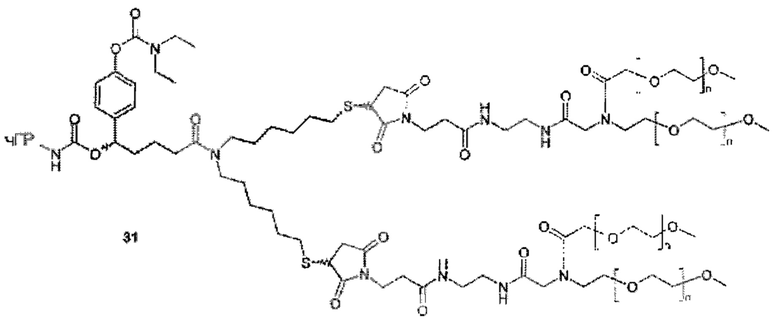
Постоянный мПЭГ-чГР моноконъюгат 31 может быть синтезирован согласно примеру 13 с применением 4-разветвленного производного 80 кДа мПЭГ-пентафторфенилкарбоната 17ad.
Пример 17: Синтез постоянного карбамат-связанного мПЭГ-чГР моноконъюгата 32 с применением 4-разветвненного производного 40 кДа мПЭГ-пентафторфенилкарбоната
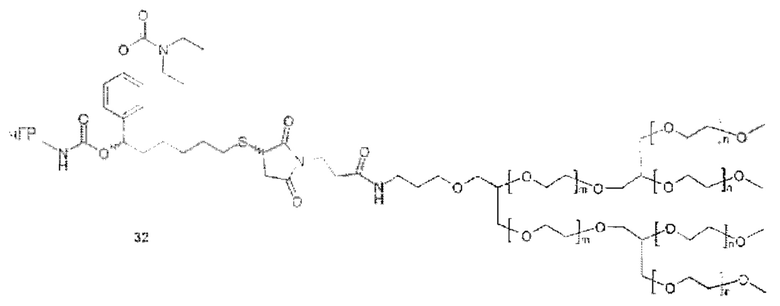
Постоянный карбамат-связанный мПЭГ-чГР моноконъюгат 32 синтезируют по методике примера 13 с применением 4-рззветвленного производного 40 кДа mПЭГ-пентафторфенилкарбоната 19аа. Очищенное соединение 32 анализируют ДСН-ПААГ (Фиг. 1).
Пример 18: Синтез постоянного карбамат-связанного мПЭГ-чГР моноконъюгата 33 с применением 4-разеетвленного производного 80 кДа мПЭГ-пентафторфенилкарбоната
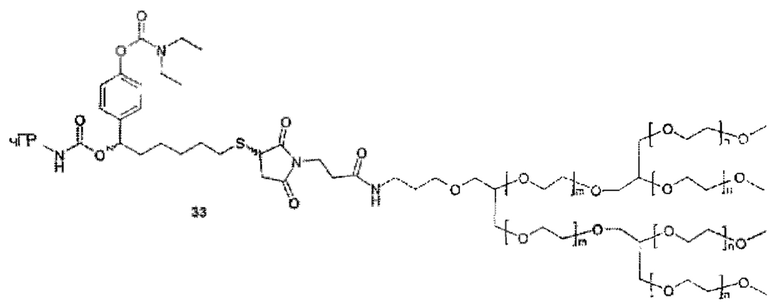
Постоянный мПЭГ-чГР моноконъюгат 33 синтезируют по методике примера 13 с применением 4-разветвленного производного 80 кДа мПЭГ-пентафторфенилкарбоната 19ab. Очищенное соединение 33 анализируют ДСН-ПААГ (Фиг. 1).
Пример 19: Синтез постоянного амин-связанного мПЭГ-чГР моноконъюгата 34 с применением разветвленного производного 40 кДа мПЭГ-пропиональдегида
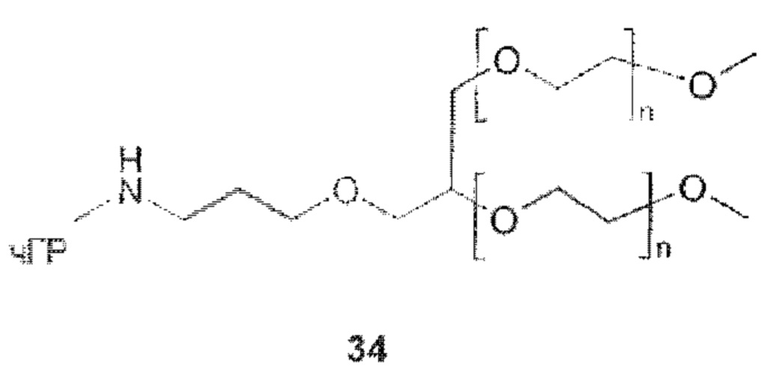
В чГР меняют буфер на 50 мМ MES буфер Н 6 (альтернативно может применяться HEPES буфер рН 7) и концентрацию чГР доводят до 1,5 мг/мл. Трехкратный молярный избыток 40 кДа мПЭГ-пропиональдегида (GL2-400AL3, NOF, Japan) по отношению к количеству чГР растворяют в воде с получением 25% (масс./об.) раствора реагента. Раствор реагента добавляют к раствору чГР и смешивают. Аликвоту 1 М исходного раствора цианоборгидрида натрия в воде добавляют с получением конечной концентрации 25 мМ в реакционной смеси. Раствор инкубируют в течение 18 ч при комнатной температуре в темноте. Реакцию гасят добавлением Tris буфера. Реакционную смесь анализируют эксклюзионной хроматографией конъюгат 34 очищают катионообменной хроматографией. Очищенный мПЭГ-чГР моноконъюгат 34 анализируют ДСН-ПААГ (Фиг. 1).
Пример 20: Синтез временного карбамат-связанного мПЭГ-чГР моноконъюгата 35 с применением временного 4-разветвленного производного 40 кДа мПЭГ-пентафторфенилкарбоната 19с
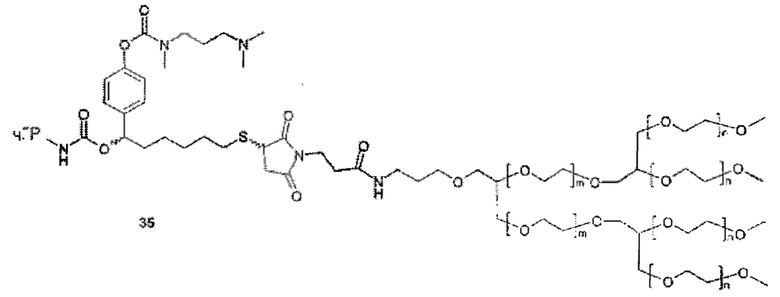
В чГР меняют буфер на 50 мМ борат натрия рН 9 (альтернативно может применяться борат натрия рН 8,5 или борат натрия рН 8) и концентрацию чГР доводят до 2,5 мг/мл. Четырехкратный избыток временного мПЭГ-линкерного реагента 19с по отношению к количеству чГР растворяют в воде с получением 20% (масс./об.) раствора реагента. Раствор реагента добавляют к раствору чГР и смешивают. Реакционную смесь инкубируют в течение 1 ч при комнатной температуре и гасят инкубированием в 100 мМ гидроксиламина при рН 7 и комнатной температуре в течение 2 ч. мПЭГ-линкер-чГР моноконъюгат очищают анионообменной хроматографией при рН 6,5 (Фиг. 3 вверху) и анализируют эксклюзионной хроматографией (Фиг. 3 внизу).
Пример 21: Синтез, временного мПЭГ-линкер-чГР моноконъюгата 36 с применением 4-разввтвленного производного 80 кДа чПЭГ-пентафторфенилкарбоната
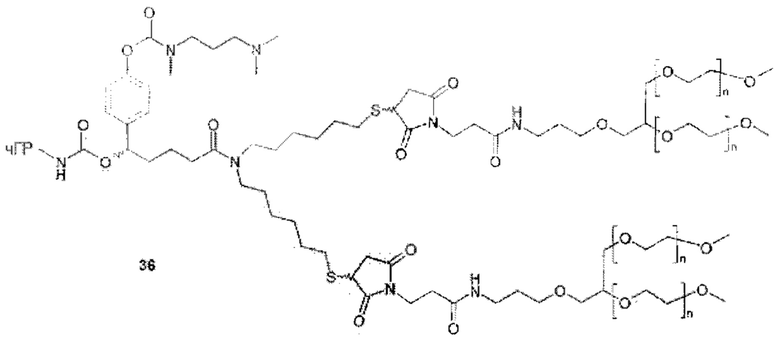
В чГР меняет буфер маг 100 мМ борат натрия рН 9 (альтернативно может применяться борат натрия рН 8,5 или борат натрия рН 8) и концентрацию чГР доводят до 10 мг/мл. Четырехкратный избыток временного 4-разветвленного 80 кДа мПЭГ-линкерного реагента 17са по отношению к количеству чГР растворяют в воде с получением 25% (масс./об.) раствора реагента. Раствор реагента добавляют к раствору чГР и смешивают. Реакционную смесь инкубируют в течение 45 мин при комнатной температуре и гасят инкубированием в 100 мМ гидроксиламина при рН 7 и комнатной температуре в течение 2 ч. мПЭГ-линкер-чГР моноконъюгат 36 очищают катионообменной хроматографией (Фиг. 4 вверху) и анализируют эксклюзионной хроматографией (Фиг. 4 внизу).
Пример 22: Синтез временного мПЭГ-чГР моноконъюгата 37 с применением 4-разветвленного производного 80 кДа мПЭГ-пентафторфенилкарбоната 17cb
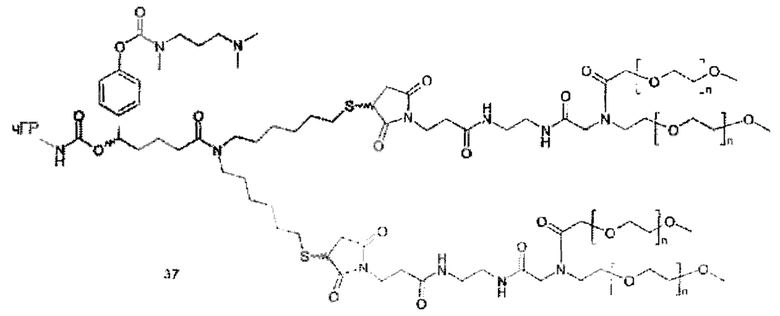
мПЭГ-линкер-чГР конъюгат 37 синтезируют как описано в примере 21 с применением активированного мПЭГ-линкерного реагента 17cb.
Катионообменная хроматограмма и аналитическая эксклюзионная хроматограмма показаны на Фиг. 5 вверху и внизу, соответственно.
Пример 23: Синтез временного карбамат-связанного мПЭГ-чГР моноконъюгата 38 с применением 4-разветеленного производного 80 кДа мПЭГ-пентафторфенилкарбоната 17b
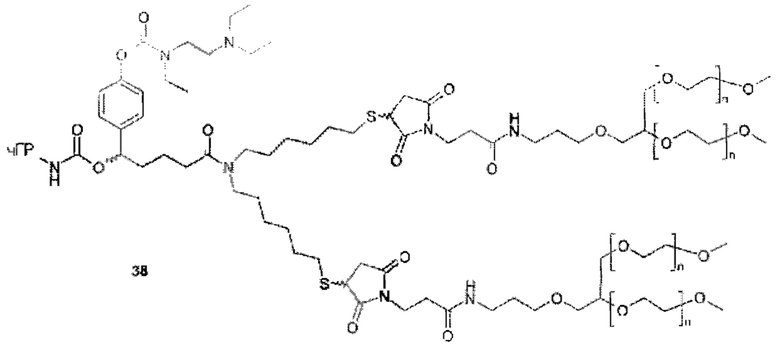
Временный карбаматсвязанный мПЭГ-линкер-чГР конъюгат 33 может быть синтезирован как описано в примере 21 с применением временного 4-разветвленного 80 кДа мПЭГ-линкерного реагента 17b.
Пример 24: Анализ для измерения активности ПЭГилированного продукта чГР и чГР
Специалист в данной области техники легко определит остаточную активность полимерного пролекарства, выраженную как активность соответствующего постоянного полимерного конъюгата с применением стандартных анализов, описанных в примере 1.
Более конкретно, клетки NB2-11 выращивают в среде, не содержащей сыворотки, с добавлением 100 нг/мл чГР. Для анализа пролиферации in vitro суспензию клеток, содержащую 2×105 клеток/мл, дважды промывают средой, не содержащей сыворотку и чГР, и распределяют в 96-луночный плоскодонный титровальный микропланшет (104 клеток/лунку). Соединения тестируют трижды с применением ряда стадий титрования (9 стадий, с применением 3-кратное разведение между стадиями). Клетки с растворами соединения инкубируют в течение 48 часов с последующим инкубированием в течение 2,5 часов с реагентом для пролиферации клеток WST-1. Пролиферацию NB2-11 определяют через оптическую плотность, считанную с применением ридера ELISA, и реакцию наносят на график как функцию от концентрации и определяют значения ЕС50. Результаты показаны как % остаточной in vitro биологической активности по отношению к немодифицированному чГР в таблице 1.
В описанных выше in vitro экспериментах нативный чГР (источник: Novo Nordisk, Дания) применяют в качестве ссылочного соединения. Такой метод получения чГР применяют для синтеза постоянных ПЭГ-чГР конъюгатов.
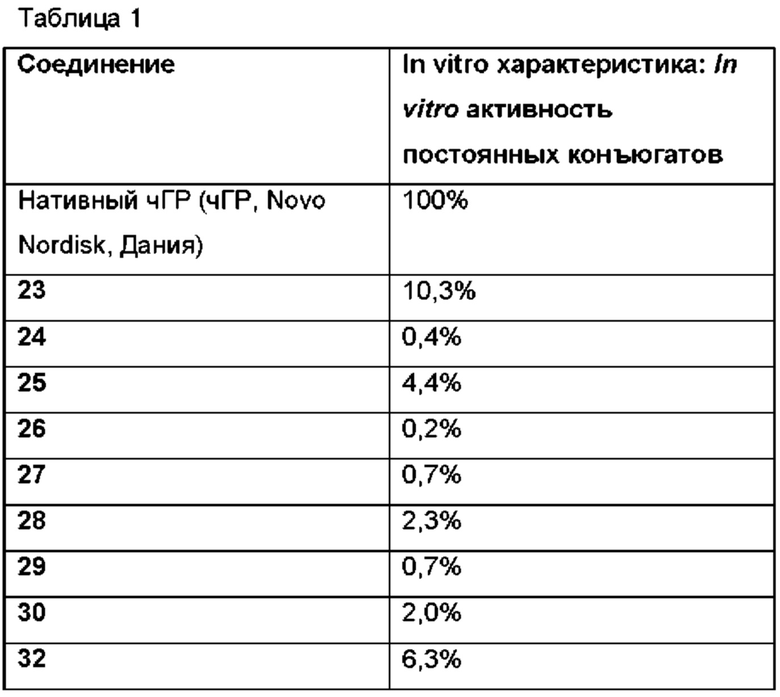
Таблица 1: In vitro биоактивность постоянно ПЭГилированных чГР конъюгатов по сравнению с нативным чГР (Norditropin, Novo Nordisk, Дания)
Заключение:
Как видно из таблицы 1, при конъюгировании подходящей молекулы ПЭГ с чГР in vitro активность ПЭГилированного чГР может быть снижена до менее чем 5% от активности нативного неконъюгированного чГР. Например, конъюгирование разветвленного ПЭГ 4×20 кДа с чГР снижает остаточную активность до 0,7% от неконъюгированного стандарта.
Далее, из этих результатов также неожиданно было обнаружено, что остаточная активность ПЭГилированного гормона роста связана не только с размером присоединенного ПЭГ, но также со степенью разветвления и расстояния между чГР и точками разветвления в структуре ПЭГ.
Линейный ПЭГ
Более конкретно, присоединение 40 кДа линейного ПЭГ к чГР дает in vitro активность 10,3% (соединение 23) по сравнению с нативным чГР.
Разветвленный ПЭГ
При присоединении разветвленного 2×20 кДа ПЭГ (соединение 25) in vitro активность далее снижается до 4,4% по сравнению с нативным чГР.
Далее, при присоединении 4×20 кДа ПЭГ с коротким расстоянием между чГР и точками разветвления в реагенте ПЭГ (соединение 27 и 29) in vitro активность еще больше снижается до, соответственно, 0,7% по сравнению с нативным чГР. Неожиданно, при присоединении 4×20 кДа ПЭГ с относительно длинным спейсером между человеческим гормоном роста и первой точной разветвления в реагенте ПЭГ (например, соединение 33), in vitro активность снижается в меньшей степени (2,2%), что указывает на важность спейсера между чГР функциональной группой и первой точкой разветвления в разветвленном реагенте ПЭГ.
Конъюгирование более одного фрагмента ПЭГ с чГР для получения бисПЭГ-конъюгатов снижает in vitro активность до ниже чем 0,5%. (например, соединение 24 и 26).
Пример 25: Определение in vitro скорости саморасщепления конъюгата 35, 36, 37 и 38
Скорость саморасщепление конъюгата 35, 36 и 37 при рН 7,4 и 37°С определяют как описано в примере 2. Для этих конъюгатов был определен период полувыведения при саморасщеплении, составляющий приблизительно 75 ч. На фиг. 6 показаны эксклюзионные хроматограммы образцов инкубированного 35, анализированного через 0 ч, 8 ч, 47 ч, 97 ч и 168 ч, показывающие медленное высвобождение чГР из конъюгата 35 в течение времени. Скорость саморасщепления конъюгата 38 может быть определена соответственно, и дает периоды полувыведения приблизительно 50 ч.
Пример 26: Анализ для измерения конечного in vivo периода полувыведения ПЭГилированных пролекарств чГР, который выражается через период полувыведения соответствующего постоянного конъюгата in vivo
Фармакокинетику постоянных конъюгатов определяют после внутривенной инъекции 0,25 мг (чГР эквиваленты) крысам. Для выбора конъюгата, подходящего для еженедельных инъекций человеку, желателен период полувыведения из плазмы, составляющий более 10 часов у крыс.
Однократную дозу 0,25 мг чГР или 0,25 мг постоянного ПЭГ-чГР конъюгата (доза основана на чГР) на крысу вводят внутривенно самцам крыс Wistar (200-250 г). Две группы из двух животных каждая применяют для каждого соединения. 200-300 мкл цельной крови берут подъязычно с получением 100 мкл Ca-Heparin плазмы на животное и момент времени. Образцы собирают через 0,5, 3, 24, 48, 72 и 96 ч на группу 1 и через 5, 8, 32, 56, 80 и 168 ч на группу 2. Образцы плазмы хранят при -80°С до анализа.
Концентрации чГР и ПЭГ-чГР конъюгата измеряют с применением набора чГР ELISA (DSL). Концентрации плазмы рассчитывают из калибровочной кривой соответствующего конъюгата или чГР и наносят на график по отношению к времени, и конечный период полувыведения (t1/2) рассчитывают с применением однокамерной модели. Результаты определения периода полувыведения представлены в таблице 2.
Для выбора конъюгата, подходящего для еженедельного введения человеку, проводят фармакокинетические исследования на крысах. Так как период полувыведения ПЭГилированных конъюгатов у крыс в 5 раз быстрее, чем у человека, период полувыведения ПЭГилированного чГР у крыс должен быть около 10 часов или больше. Для получения оценки периода полувыведения конъюгированного чГР ПЭГилированного пролекарства без расщепления линкера, постоянно конъюгированный соответствующий конъюгат вводят крысам. Результаты определения in vivo периода полувыведения представлены в таблице 2.

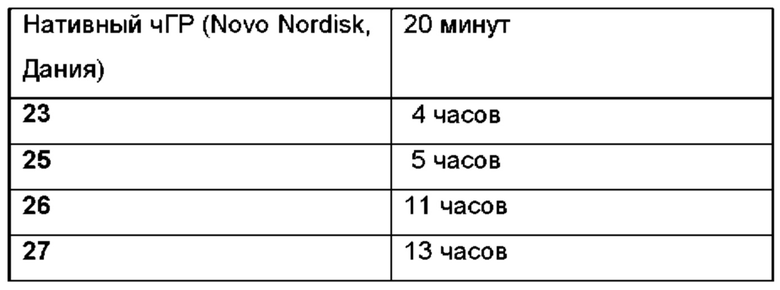
Таблица 2: Период полувыведения постоянных ПЭГ-чГР конъюгатов у крыс
Заключение:
Из таблицы 1 и таблицы 2 очевидно, что остаточная активность обратно коррелирует с периодом полувыведения, например, высокая степень остаточной активности вызывает более быстрое выведение. Это является типичным для конъюгатов, выводимых механизмами клиренса, медиированного рецептором. Более того, для получения чГР ПЭГилированного пролекарства, которое может вводиться один раз в неделю человеку, и с низкой остаточной активностью, предпочтительна молекула ПЭГ с одной или более точкой разветвления и молекулярной массой 40 кДа или выше. Альтернативно, конъюгирование ПЭГ с более чем одним местом в чГР с получением бисПЭГ-чГР конъюгатов, дает длинный конечный период полувыведения.
Пример 27: Фармакодинамическое исследование временного карбамат-связанного мПЭГ-линкер-чГР конъюгата 36 и человеческого гормона роста на яванских макаках
Объектом данного анализа является сравнение фармакодинамической реакции у яванских макак одной дозы временного карбамат-связанного мПЭГ-линкер-чГР конъюгата 36 с ежедневным дозированием гормона роста в течение одной недели.
Исследуют следующие группы дозирования:
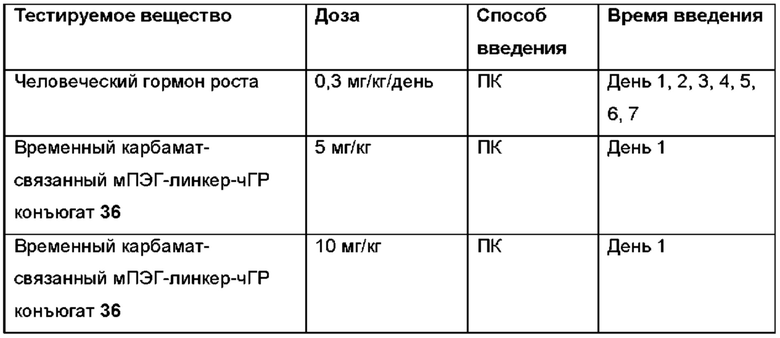
Так как временный карбамат-связанный мПЭГ-линкер-чГР конъюгат 36 временно ПЭГилирован с применением 80 кДа ПЭГ группы, количества чГР в группах дозирования 5 и 10 мг/кг временного карбамат-связанного мПЭГ-линкер-чГР конъюгата 36 составляют приблизительно 1 и 2 мг/кг, соответственно. Следовательно, количество чГР в 10 мг/кг группе временного карбамат-связанного мПЭГ-линкер-чГР конъюгата 36 эквивалентно суточной дозе 0,3 мг/кг чГР. Каждое тестируемое соединение вводят подкожно 2 яванским макакам (1 самец, 1 самка) в дозе 1 мг/кг. Возраст и масса животных составляют 2,5-3 года и 2,0-2,5 кг, соответственно.
Образцы крови собирают из бедренной артерии/вены для определения концентраций в сыворотке IGF-1, фармакодинамического маркера человеческого гормона роста. Образцы крови отбирают в следующие моменты времени: 0 (перед использованием препарата), 3, 6, 12, 24, 36, 48, 72, 96, 120 и 144 часов после дозирования в День 1.
Образцы крови собирают, свертывают и затем хранят на ледяном блоке или мокром льду до центрифугирования. После центрифугирования образцы сыворотки аликвотируют в предварительно помеченные пробирки и плотно закрывают. Пробирки хранят при -70°С после аликвотирования в пробирки. IGF-1 уровни в образцах сыворотки измеряют с применением набора Quantikine Human IGF-1 ELISA (R&D systems), который адаптирован и утвержден для применения в определении уровней IGF-1 в сыворотке яванских макаков. Фармакодинамическая реакция тестируемых веществ показана на Фиг. 11. Суточное введение чГР и однократное введение временного карбамат-связанного мПЭГ-линкер-чГР конъюгата 36 повышает уровни IGF-1 по сравнению с уровнями, измеренными в группе носителя. Однократное введение 5 мг/кг временного карбамат-связанного мПЭГ-линкера-чГР конъюгата 36 эквивалентно суточному введению чГР, в то время как однократное введение 10 мг/кг временного карбамат-связанного чПЭГ-линкера-чГР конъюгата 36 превосходит суточный чГР. Это ясно показывает, что еженедельная доза временного карбамат-связанного мПЭГ-линкера-чГР конъюгата 36 превосходит эквивалентную дозу чГР.
Аббревиатуры:
ДБУ - 1,3-диазабицикло[5.4.0]ундецен
ДХМ - дихлорметан
ДИЭА - диизопропилэтиламин
ДМАП - диметиламинопиридин
ДМФ - N,N-диметилформамид
ДМСО - диметилсульфоксид
экв. - стехиометрический эквивалент
fmoc - 9-флуоренилметоксикарбонил
ГФИП - гексафторизопропанол
HOSu - N-гидроксисукцинимид
ЖХМС - жидкостная хроматография в сочетании с масс-спектрометрией
Mal - малеимидопропионил
МС - масс-спектр
ММ - молекулярная масса
ПЭГ - полиэтиленгликоль
ОФ-ВЭЖХ - высокоэффективная жидкостная хроматография с обращенной фазой
Rf - коэффициент удержания
комн. темп. - комнатная температура
SEC - эксклюзионная хроматография
Suc - сукцинимидопропионил
ТЭС - триэтилсилан
ТФК - трифторуксусная кислота
ТГФ - тетрагидрофуран
Trt - тритил
ССЫЛКИ
1.  et al. J. Pediatr. Endocrinol. Metab. 1999 Jan-Feb; 12(1): 95-7.
et al. J. Pediatr. Endocrinol. Metab. 1999 Jan-Feb; 12(1): 95-7.
2. Clark et al., 1996, Journal of Biological Chemistry 271: 21969-21977.
3. Girard, J. Mehls, O., J. Clin Invest. 1994 March; 93(3): 1163-1171.
4. Philip Harris et al. Horm. Res. 2006; 65 (suppl. 4): 1-213, CF1-98 GH/IGF Treatment with title "First in-human study of PEGylated recombinant human growth factor".
5. Veronese, F.M. "Enzymes for Human Therapy: Surface Structure Modifications," Chimica Oggi, 7: 53-56 (1989).
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ СВЯЗАННЫХ С ГОРМОНОМ РОСТА ЗАБОЛЕВАНИЙ У ЧЕЛОВЕКА | 2014 |
|
RU2689336C2 |
| ПЭГИЛИРОВАННЫЕ СОЕДИНЕНИЯ РЕКОМБИНАНТНОГО ГОРМОНА РОСТА ЧЕЛОВЕКА | 2009 |
|
RU2530714C9 |
| НОВЫЕ ПОЛИМЕРНЫЕ hGH ПРОЛЕКАРСТВА | 2015 |
|
RU2718664C2 |
| СПОСОБ КОНЪЮГАЦИИ ПЕПТИДОВ, ОПОСРЕДОВАННОЙ ТРАНСГЛУТАМИНАЗОЙ | 2005 |
|
RU2385879C2 |
| ПРОЛЕКАРСТВА НА ОСНОВЕ ГИДРОГЕЛЯ | 2013 |
|
RU2647729C2 |
| VEGF-НЕЙТРАЛИЗУЮЩИЕ ПРОЛЕКАРСТВА ДЛЯ ЛЕЧЕНИЯ ОФТАЛЬМОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2673881C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ Fc-ОБЛАСТЬ ИММУНОГЛОБУЛИНА В КАЧЕСТВЕ НОСИТЕЛЯ | 2004 |
|
RU2352583C2 |
| ПРОЛЕКАРСТВА, СОДЕРЖАЩИЕ КОНЪЮГАТ ИНСУЛИНА И ЛИНКЕРА | 2010 |
|
RU2574667C2 |
| КОНЪЮГАТ ПОЛИЭТИЛЕНГЛИКОЛЯ-Г-КСФ | 2006 |
|
RU2423133C2 |
| СОДЕРЖАЩИЕ ПЭГ КОНЪЮГАТЫ HGF-NK4 | 2002 |
|
RU2293574C2 |
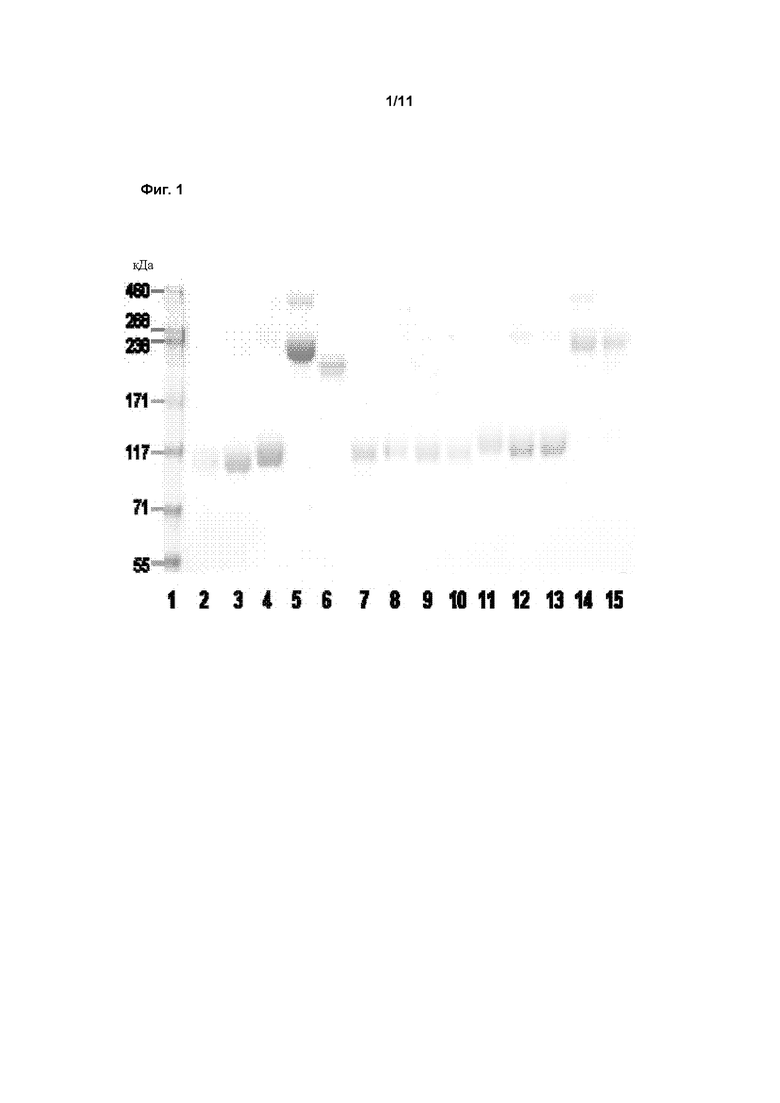
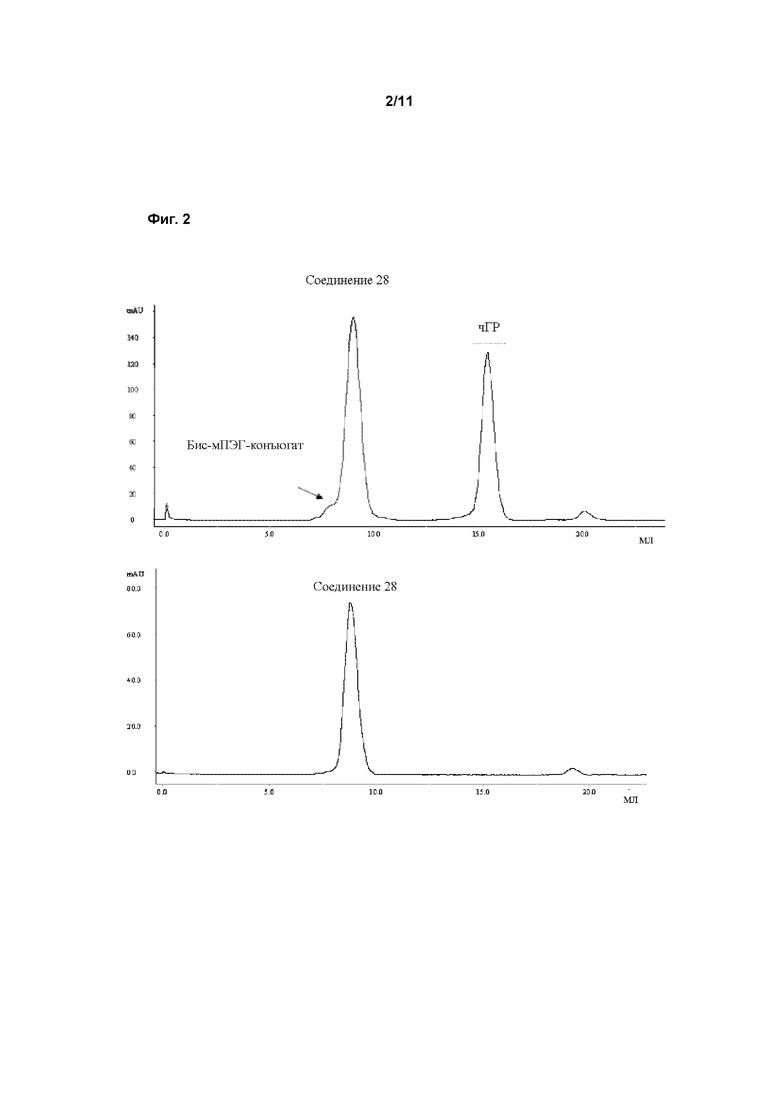
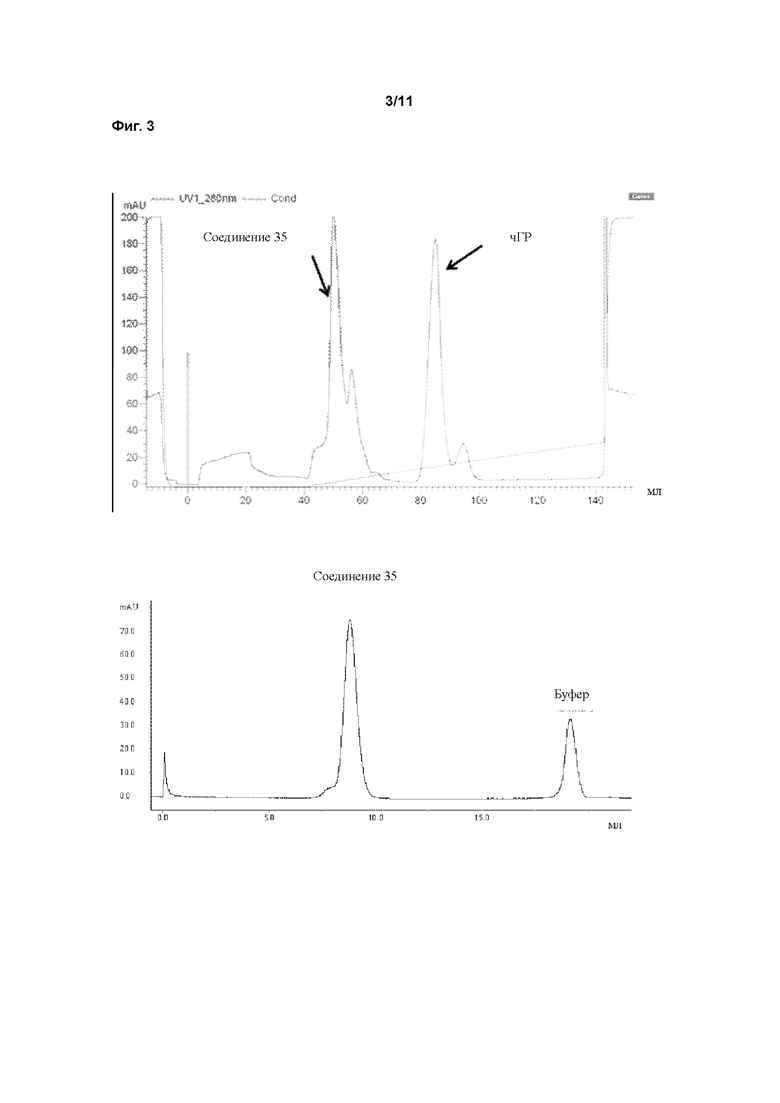
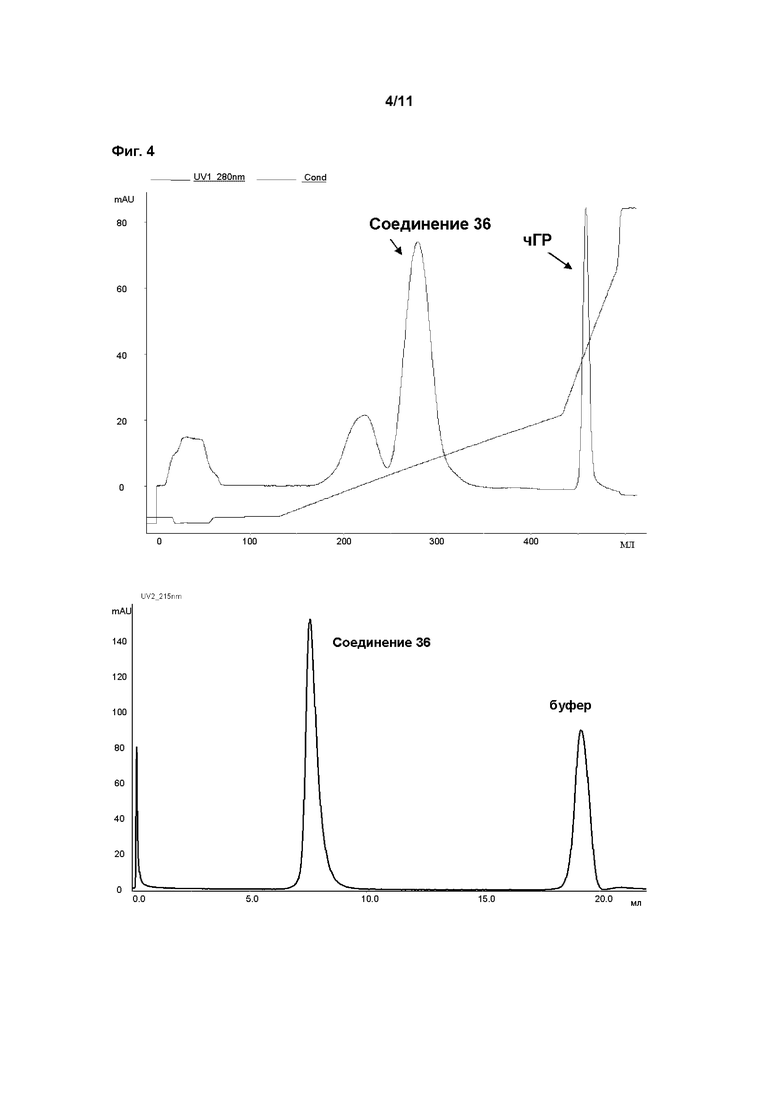
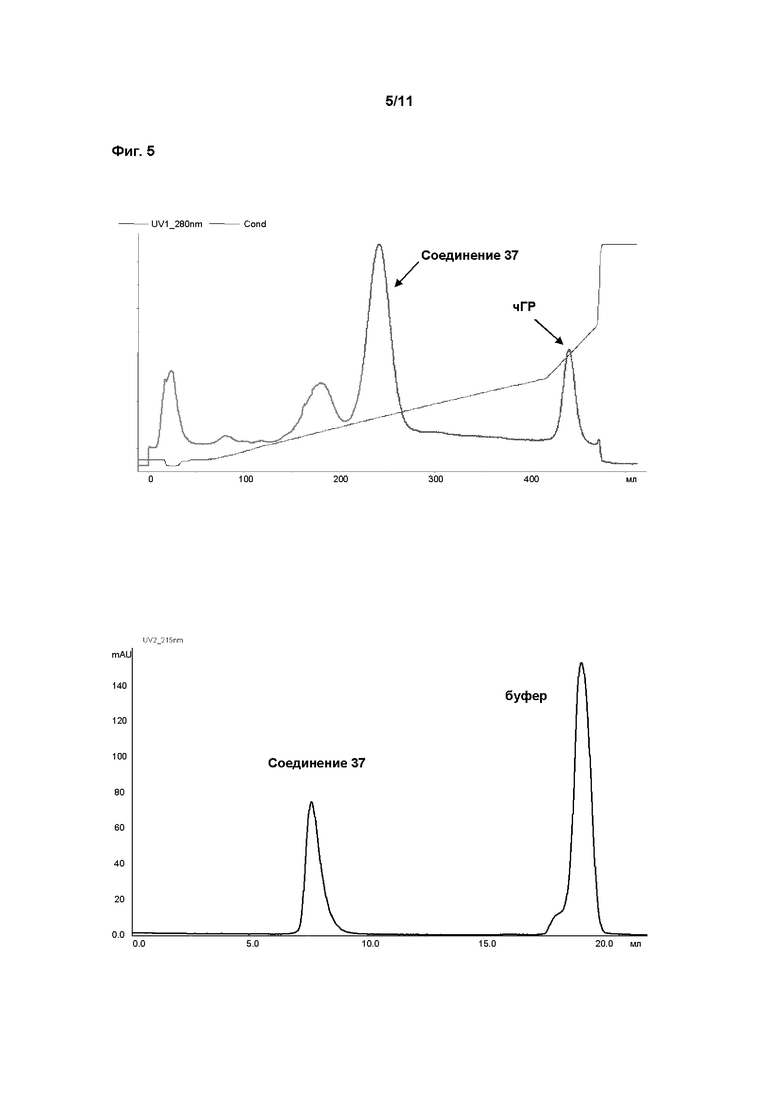
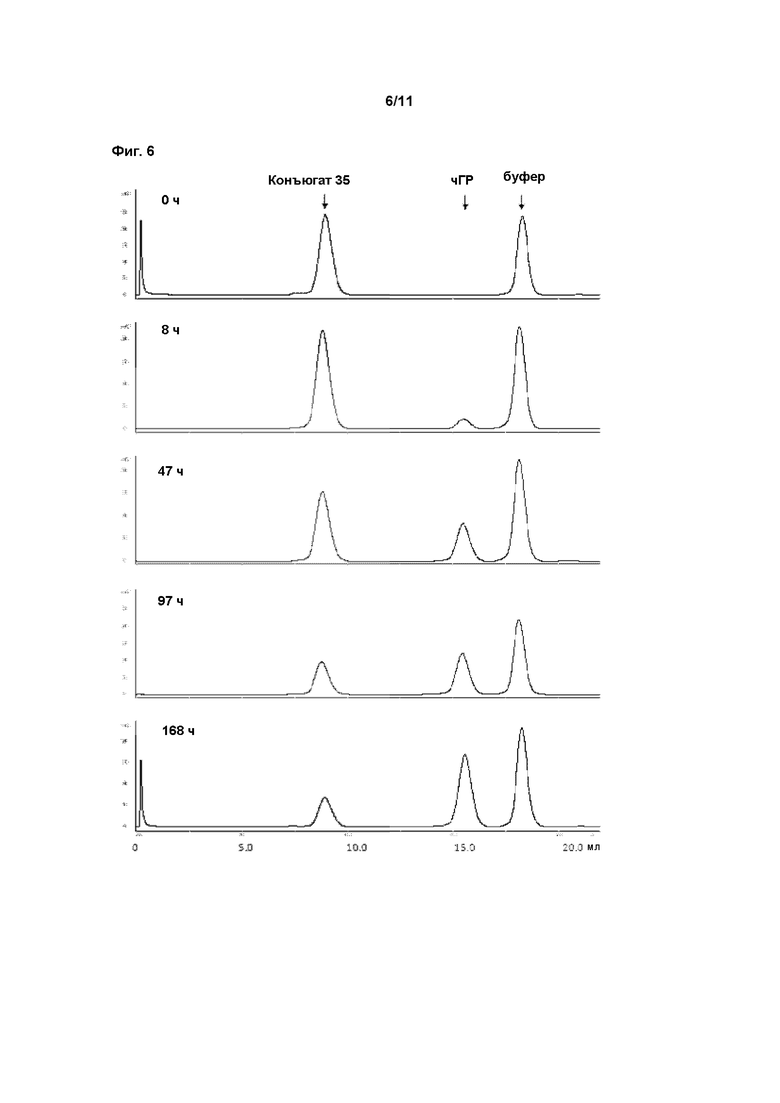
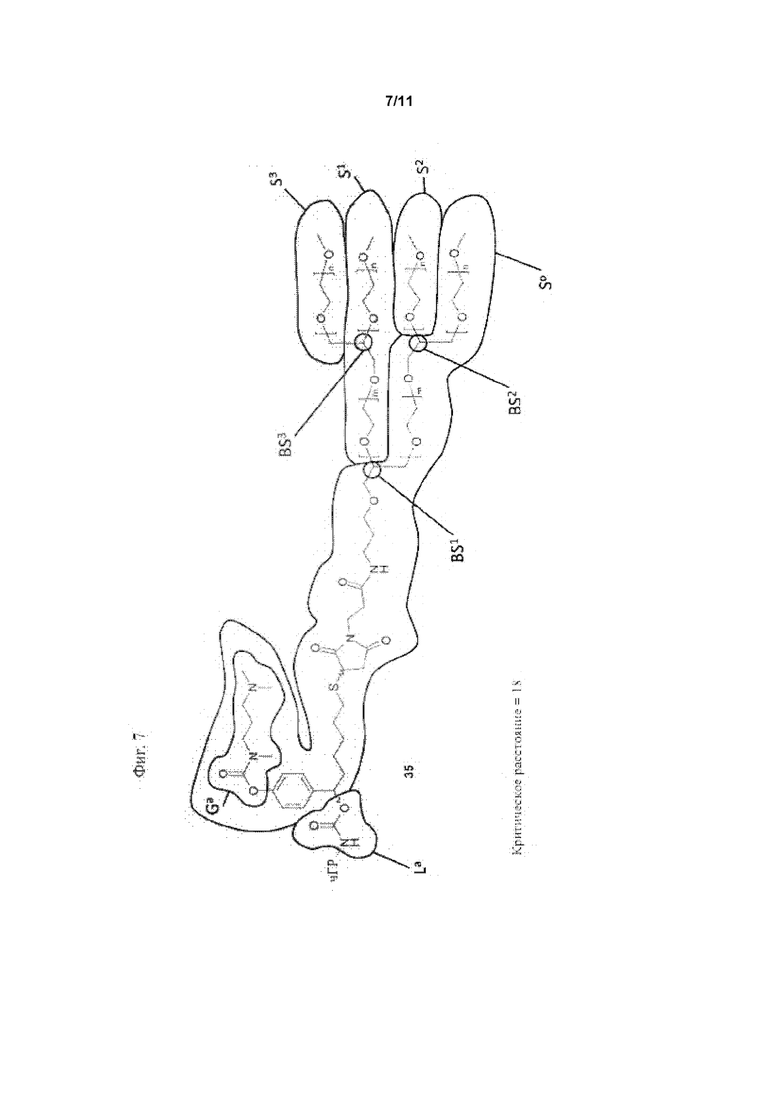
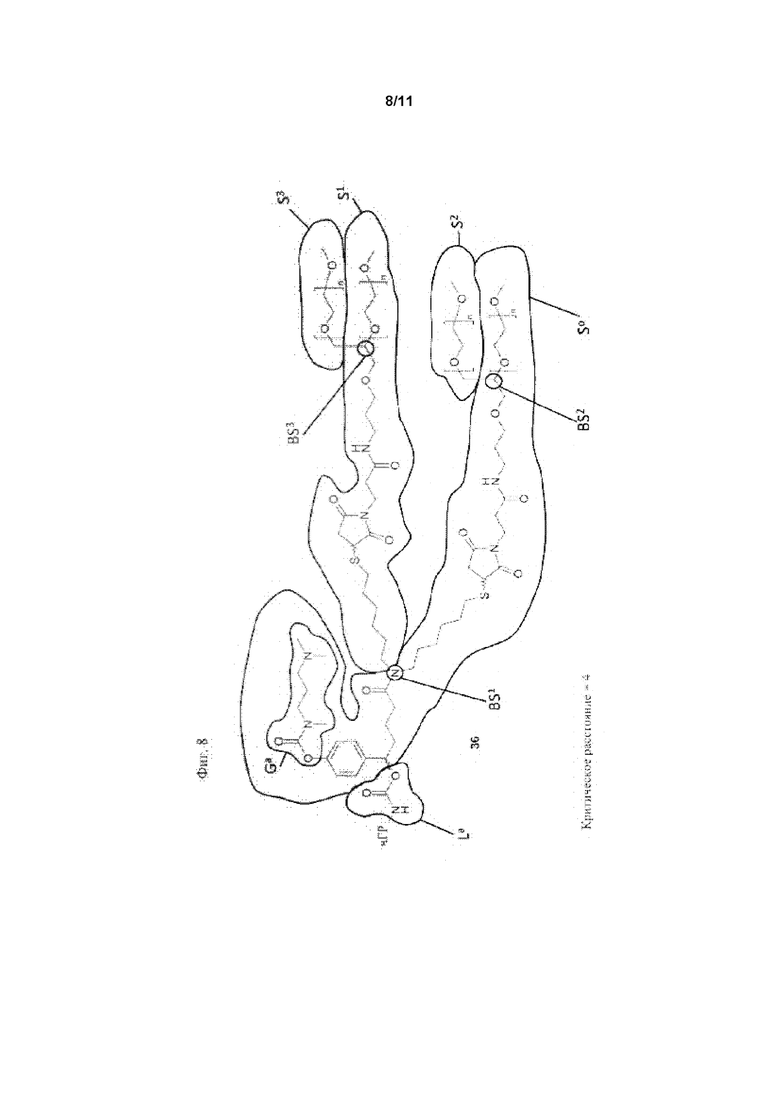
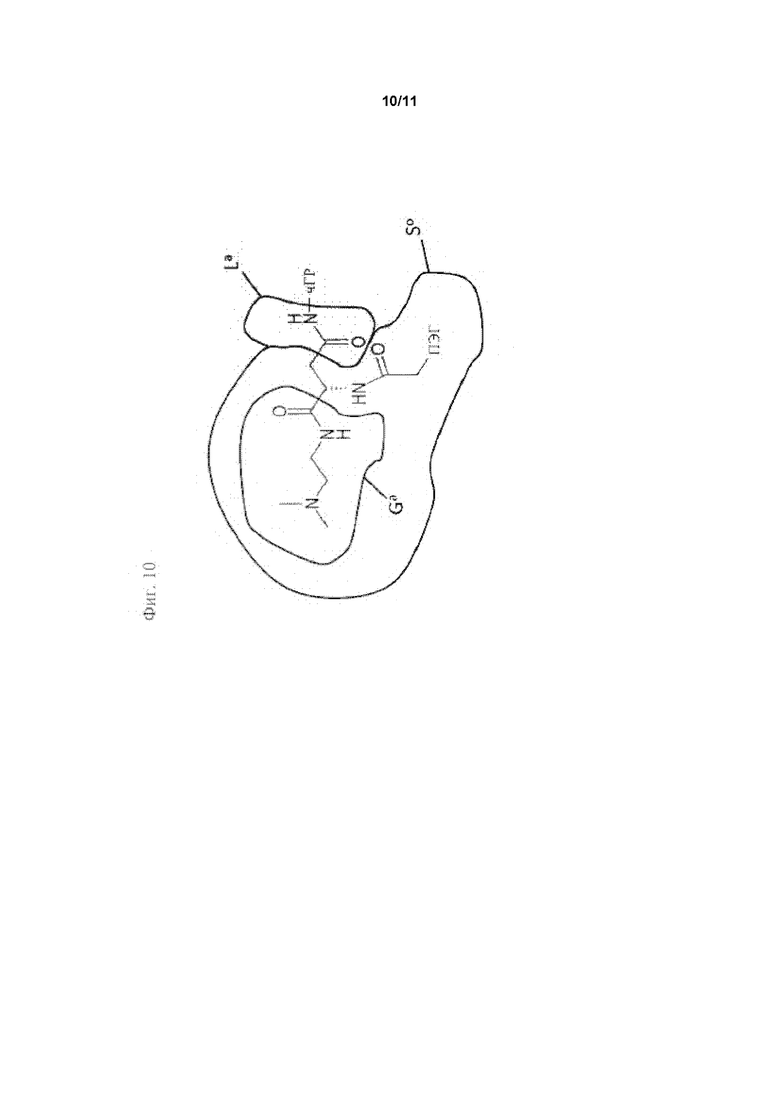
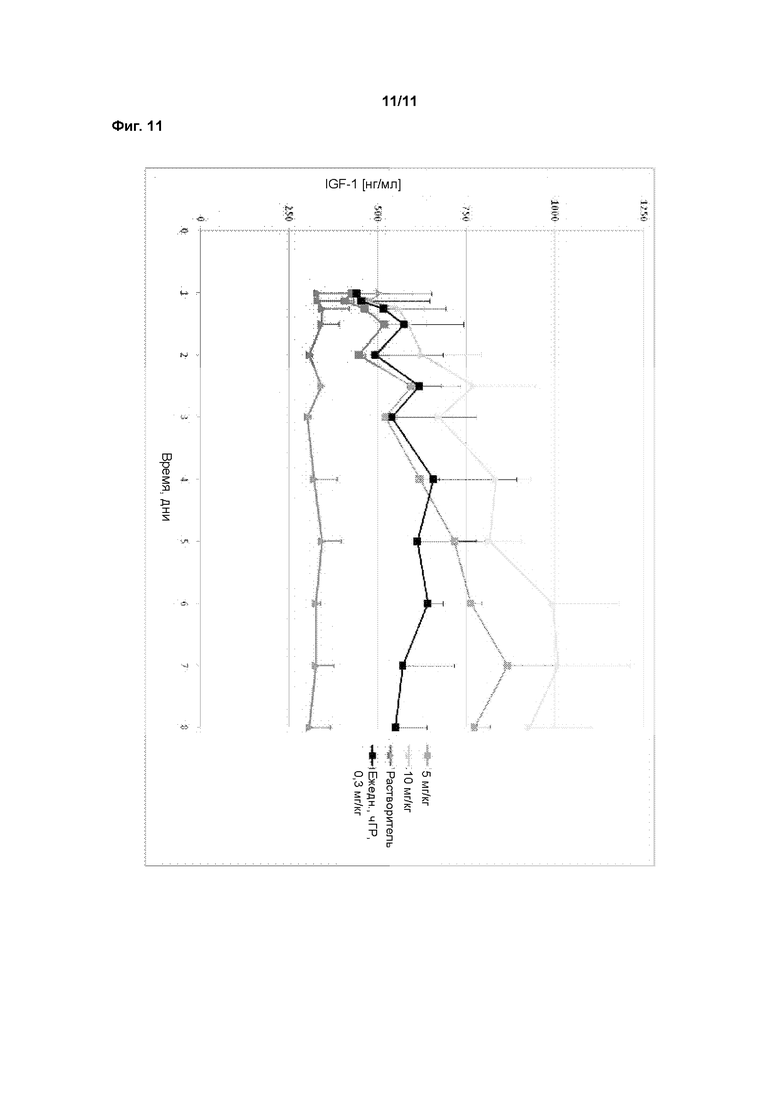
Изобретение относится к конъюгатам пролекарства рекомбинантного человеческого гормона роста (рчГР), где молекулярная масса пролекарства без чГР-NH составляет по меньшей мере 30 кДа и максимум 120 кДа. Также описывается способ лечения связанных с гормоном роста заболеваний у человека, в котором используют вышеописанные конъюгаты. 2 н. и 7 з.п. ф-лы, 11 ил., 27 пр., 2 табл.
1. Конъюгат пролекарства человеческого гормона роста (чГР) формулы (I):
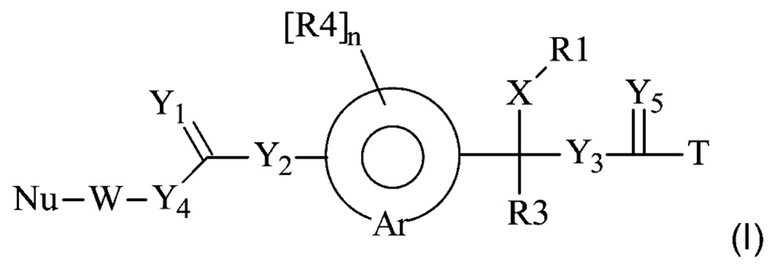
где
Т представляет собой чГР-NH;
X представляет собой спейсерный фрагмент;
фрагмент:
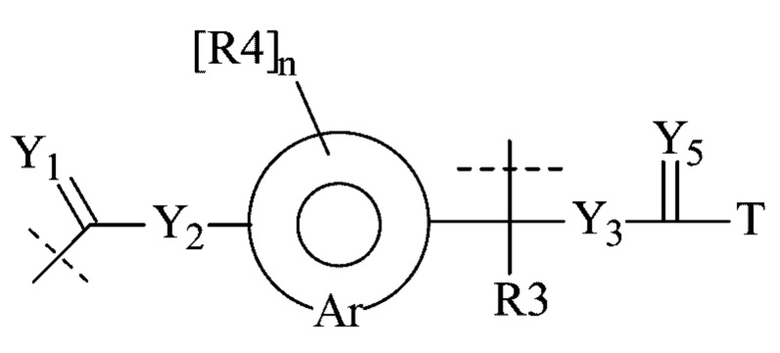
выбран из группы, состоящей из
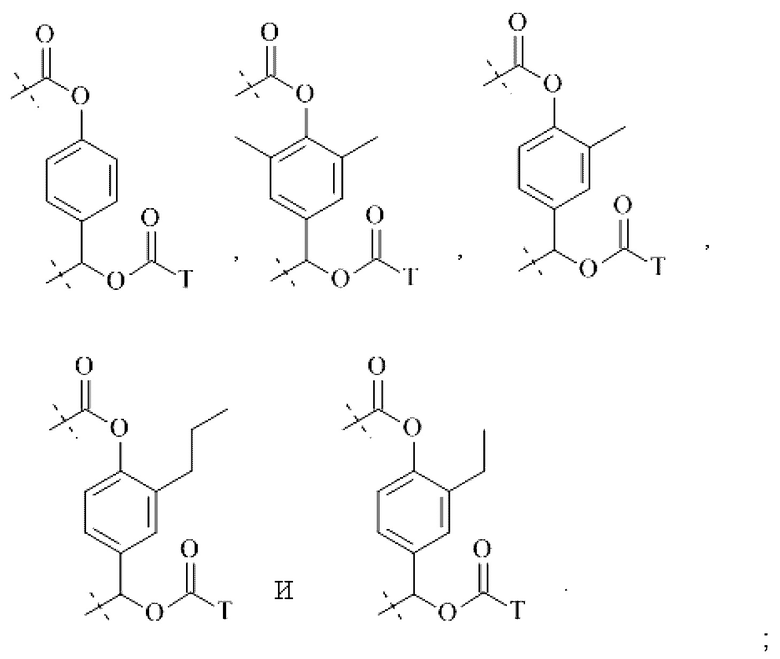
R1 представляет собой полимерный носитель, имеющий:
первую цепь;
вторую цепь; и
третью цепь,
где первая цепь содержит первую разветвляющую структуру BS1, выбранную из группы, состоящей из третичного атома углерода, четвертичного атома углерода и третичного атома азота; и
где критическое расстояние составляет менее 50 атомов, причем критическое расстояние представляет собой кратчайшее расстояние между первыми разветвляющими структурами BS1 и местом присоединения фрагмента
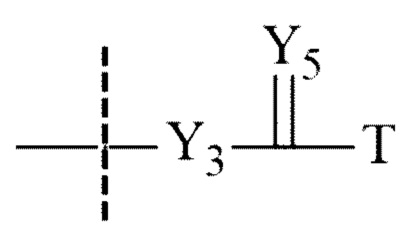
к остальной части конъюгата пролекарства, измеренное как связанные атомы;
фрагмент
 выбран из группы, состоящей из
выбран из группы, состоящей из
и
где молекулярная масса пролекарства без чГР-NH составляет по меньшей мере 30 кДа и максимум 120 кДа.
2. Пролекарство по п. 1, где критическое расстояние составляет менее 20 атомов.
3. Пролекарство по п. 1 или 2, где критическое расстояние составляет менее 10 атомов.
4. Пролекарство по п. 1 или 2, где молекулярная масса пролекарства без чГР-NH составляет по меньшей мере 40 кДа и максимум 100 кДа.
5. Пролекарство по п. 1 или 2, где молекулярная масса пролекарства без чГР-NH составляет по меньшей мере 40 кДа и максимум 90 кДа.
6. Пролекарство по п. 1 или 2, где первая, вторая и третья цепи независимо основаны на полимере, выбранном из группы, состоящей из полиалкилокси полимеров, гиалуроновой кислоты и ее производных, поливиниловых спиртов, полиоксазолинов, полиангидридов, поли(ортоэфиров), поликарбонатов, полиуретанов, полиакриловых кислот, полиакриламидов, полиакрилатов, полиметакрилатов, полиорганофосфазенов, полисилоксанов, поливинилпирролидонов, полицианоакрилатов и сложных полиэфиров.
7. Пролекарство по п. 1 или 2, где первая, вторая и третья цепи основаны на полиалкоксиполимере.
8. Пролекарство по п. 1 или 2, где первая, вторая и третья цепи основаны на полиэтиленгликоле.
9. Способ лечения связанного с гормоном роста заболевания у человека, предусматривающий введение человеку конъюгата пролекарства человеческого гормона роста по любому из пп. 1-8 в клинически эффективном количестве.
| WO 2005099768 A2, 27.10.2005 | |||
| WO 2006102659 A2, 2006.09.28 | |||
| Питатель для сыпучих материалов | 1988 |
|
SU1579873A1 |
| Фритта для металлизационной пасты | 1988 |
|
SU1625855A1 |
| Clark R | |||
| et al., Long-acting growth hormones produced by conjugation with polyethylene glycol, J | |||
| Biol | |||
| Chem., 1996, Vol | |||
| Искроудержатель для паровозов | 1920 |
|
SU271A1 |
Авторы
Даты
2023-08-23—Публикация
2019-05-14—Подача