ОБЛАСТЬ ТЕХНИКИ
Настоящее раскрытие относится к микроорганизму Corynebacterium с улучшенной способностью продуцировать L-лизин и способу получения L-лизина с его помощью.
УРОВЕНЬ ТЕХНИКИ
Микроорганизм рода Corynebacterium представляет собой грамположительную бактерию и широко используется в получении L-аминокислоты. L-аминокислота, в частности, L-лизин, используется в кормах для животных, лекарственных препаратах для людей, а также в областях, связанных с косметической отраслью, и его получают путем ферментации с применением штаммов Corynebacterium.
Было несколько попыток улучшить способ получения L-аминокислоты с применением штаммов Corynebacterium. В числе этих попыток было проведено исследование по улучшению штаммов Corynebacterium, продуцирующих L-аминокислоты, путем нарушения или подавления экспрессии специфичных генов с применением технологии рекомбинантных ДНК. Кроме того, проводят много исследований в отношении эффектов амплификации генов, связанных с биосинтезом каждой L-аминокислоты, на продуцирование L-аминокислоты и в отношении улучшения штаммов Corynebacterium, продуцирующих L-аминокислоты. Более того, можно даже встраивать экзогенные гены, полученные из других бактерий.
Однако, до сих пор существует необходимость в штаммах с улучшенной способностью продуцировать L-лизин за рамками общепринятых способов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
Один аспект предусматривает коринеформный микроорганизм с улучшенной способностью продуцировать L-лизин.
Другой аспект предусматривает способ получения L-лизина с применением коринеформного микроорганизма.
РЕШЕНИЕ ТЕХНИЧЕСКОЙ ЗАДАЧИ
Один аспект предусматривает коринеформный микроорганизм с улучшенной способностью продуцировать L-лизин, в котором инактивирован белок-инициатор формирования перегородки.
Термин "инициатор формирования перегородки", используемый в данном документе, относится к фактору, который необходим для инициации формирования перегородки, т.е. мембранной структуры, которая разделяет внутреннее пространство клетки в процессе клеточного деления коринеформного микроорганизма. Клеточное деление может происходить в присутствии инициатора формирования перегородки. В присутствии инициатора формирования перегородки перегородка может инвагинироваться на периферической части вокруг центра клетки, чтобы поделить цитоплазму надвое. Синтез внешней мембраны может происходить после этого, вслед за клеточным делением. Белок-инициатор формирования перегородки может быть одним из белков, выбранных из таблиц 1 и 2.
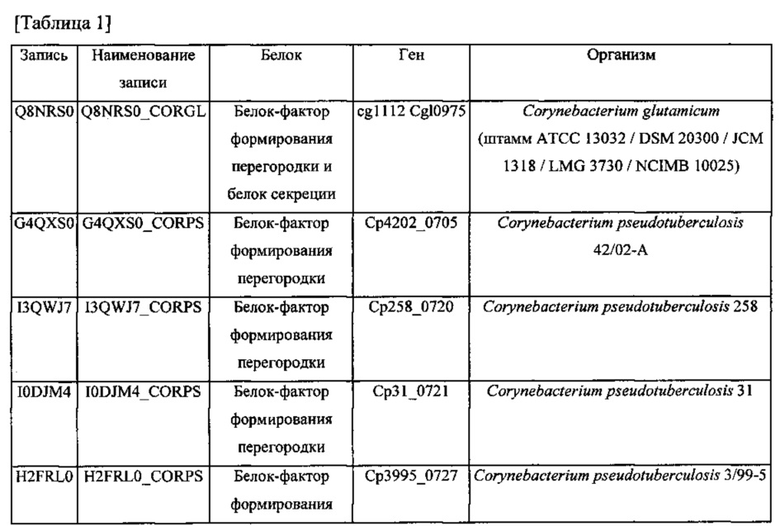
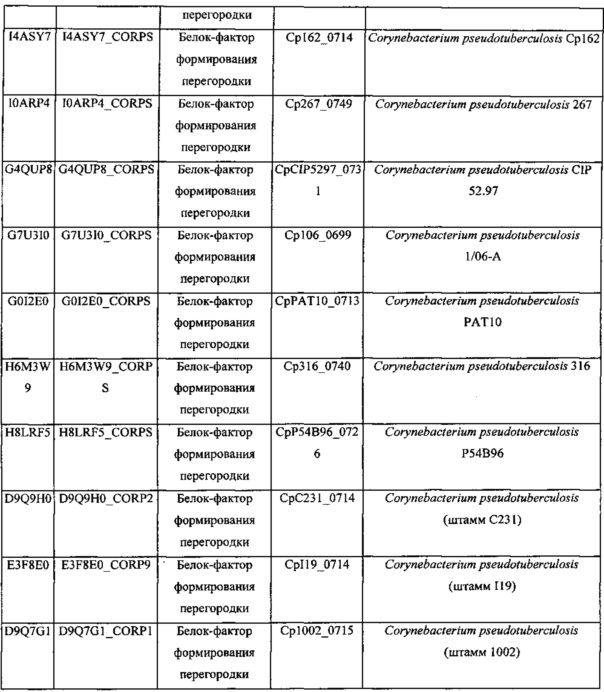

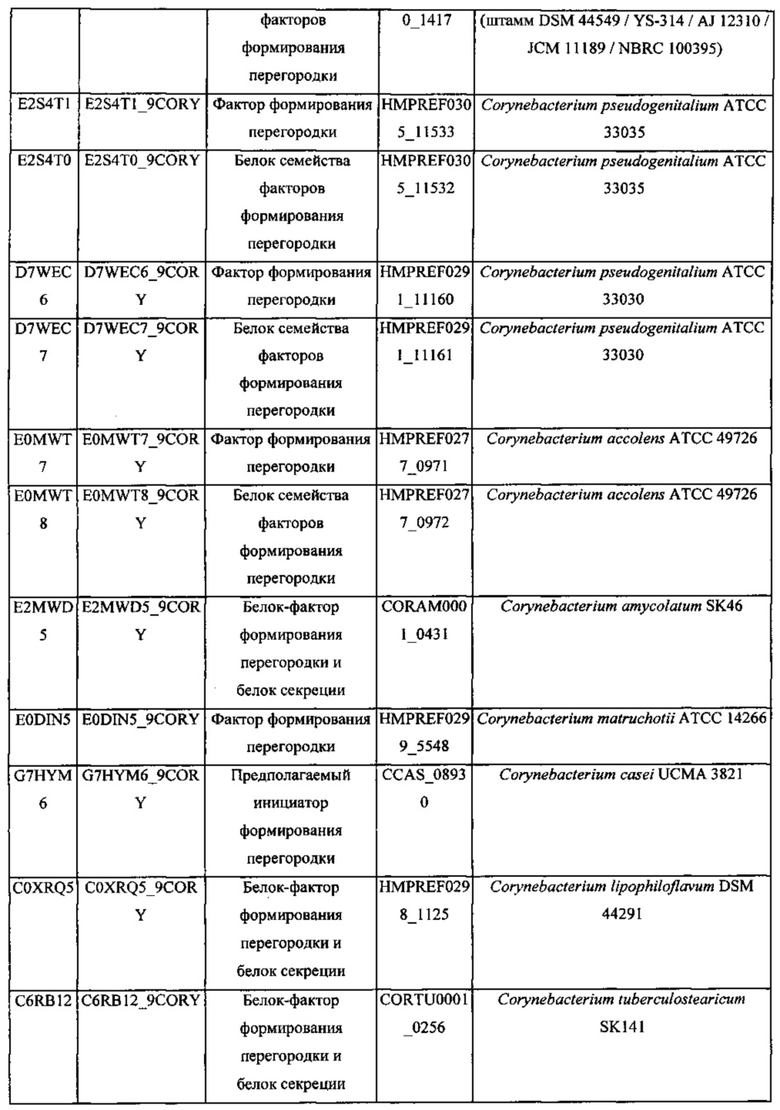

Инициатор формирования перегородки может включать филаментный чувствительный к температуре (Fts) белок. Fts-белок является белком, вовлеченным в формирование дивисомы, которая может быть необходима в процессе клеточного деления микроорганизма. Fts-белок может включать FtsB, FtsA, FtsZ, FtsEX, FtsK, FtsQ, FtsW, FtsI или их комбинацию, в частности, FtsB. FtsB может иметь аминокислотную последовательность SEQ ID NO: 1 или последовательность на 70% гомологичную ей, конкретно на 80% гомологичную ей, более конкретно на 90% гомологичную ей, наиболее конкретно на 95% гомологичную ей. Термин "гомология" относится к степени идентичности между двумя аминокислотными последовательностями, которые могут быть определены с применением способов, в которых используют BLAST 2.0 для подсчета параметра, такого как оценка в баллах, идентичность или схожесть, которые широко известны специалистам в данной области.
Ген, кодирующий Fts-белок, может быть нуклеиновой кислотой, кодирующей ftsA, ftsB, ftsZ, ftsEX, ftsK, ftsQ, ftsW, ftsI или их комбинацию.
Ген ftsB, вовлеченный в клеточное деление коринеформного микроорганизма, может формировать дивисому так же как ftsZ, ftsEX, ftsK, ftsQ, ftsW и высокомолекулярные (HMW) PBP класса В. Ген ftsB может быть нуклеиновой кислотой, кодирующей аминокислотную последовательность SEQ ID NO: 1. Ген ftsB может быть, например, геном с номером доступа NCBI NCg10936. Термин "ген с номером доступа NCBI NCg10936" относится к гену с нуклеотидной последовательностью SEQ ID NO: 2, которая получена из штаммов Corynebacterium glutamicum. Кроме того, этот ген может присутствовать в микроорганизмах рода Corynebacterium и продуцировать практически тот же продукт, который продуцирует ген с номером доступа NCBI NCg10936. Выражение "практически тот же", используемое в данном документе, означает ту же активность и механизм управления, как таковые для продукта гена с номером доступа NCBI NCg10936.
Термин "инактивация", используемый в данном документе, означает отсутствие проявления уровня активности клеток или ферментов, который можно измерить у клеток того же типа или исходных ферментов сравнимых с ними. Сравнимыми с ними клетками того же типа могут быть клетки не подверженные каким-либо манипуляциям, таким как рекомбинация или модификация. В микроорганизме, инактивация белка-инициатора формирования перегородки может относиться к устраненной активности полипептидов, которые кодируют инициатор формирования перегородки. Дополнительно, в микроорганизме белок-инициатор формирования перегородки может быть инактивирован до степени, достаточной для продуцирования L-лизина.
Инактивация может быть вызвана с помощью способа рекомбинации. Способ рекомбинации может включать способ гомологичной рекомбинации. Способ гомологичной рекомбинации может быть осуществлен путем трансформации вектора, содержащего часть последовательностей гена, в микроорганизм и культивированием микроорганизма в присутствии продукта селективного маркера и, таким образом, часть последовательностей гена и эндогенных генов в микроорганизме может подвергаться гомологичной рекомбинации. Вектором может быть вектор pDZ-ΔftsB W140*, содержащий фрагмент гена с номером доступа NCBI NCg10936, представленный под SEQ ID NO: 4, или вектор pDZ-ftsB W140*, содержащий фрагмент гена с номером доступа NCBI NCg10936, представленный под SEQ ID NO: 6. С помощью гомологичной рекомбинации эндогенные гены в микроорганизме могут подвергаться рекомбинации и из числа рекомбинированных генов, рекомбинанты, содержащие маркер, могут быть выбраны с помощью селективного маркера. С помощью способа гомологической рекомбинации может быть получен микроорганизм рода Corynebactërium, в котором эндогенный ген с номером доступа NCBI NCg10936 инактивирован.
Инактивация активности белка в микроорганизме может быть вызвана делецией, заменой, вставкой, инверсией, или их комбинацией, основания, нуклеозида или нуклеотид гена или их комбинации. В деталях, примерами способа инактивации активности белка могут быть подход с нокаутом гена, антисмысловая технология или технология RNAi. Способ инактивации активности белка может дополнительно включать делецию изначальной копии каждого гена, замену изначальной копии на мутантную или экспрессию изначальной копии под управлением слабого промотора. Кроме того, можно также использовать замену промотора гена, кодирующего белок, перенос мутации с помощью случайного или сайт-направленного мутагенеза или разрушение или нокаут гена. Более того, можно также применять способы вставки нестабильных элементов в мРНК или аберрации сайта связывания рибосом (RBS) на РНК путем модификации гена.
Инактивация генов может быть достигнута с помощью трансформации вектора, содержащего часть гена с номером доступа NCBI NCg10936 и селективный маркер, в микроорганизм рода Corynebacterium с последующим культивированием в присутствии антибиотиков и отбором.
Селективный маркер может использоваться для отбора клеток, трансформированных вектором. Селективным маркером может быть маркер, предоставляющий селектируемый фенотип, такой как устойчивость к лекарственным средствам, ауксотрфия, устойчивость к цитотоксическим лекарственным средствам или экспрессия поверхностных белков.
Коринеформный микроорганизм может быть выбран из группы, состоящей из Corynebacterium glutamicum, Corynebacterium ammoniagenes, Corynebacterium pseudotuberculosis, Corynebacterium efficiens, Corynebacterium pseudogenitalium, Corynebacterium genitalium, Corynebacterium accolens, Corynebacterium amycolatum, Corynebacterium matruchotii, Corynebacterium casei, Corynebacterium lipophiloflavum, Corynebacterium tuberculostearicum, Corynebacterium jeikeium, Corynebacterium paurometabolum и полученных из их дикого типа мутантов, продуцирующих L-лизин. В частности, коринеформным микроорганизмом может быть Corynebacterium glutamicum. Corynebacterium glutamicum может быть Corynebacterium glutamicum с номером доступа КССМ11016Р, КССМ10770Р, КССМ11347Р или CJ3P.
Термин "коринеформный микроорганизм", используемый в данном документе, относится к микроорганизму рода Corynebacterium со способностью продуцировать L-лизин. Примеры коринеформных микроорганизмов могут включать микроорганизмы рода Corynebacterium с улучшенной способностью продуцировать L-лизин, в которые были внесены мутации для инактивация гена, кодирующего белок-инициатор формирования перегородки, с целью улучшения способности продуцировать L-лизин. Выражение "со способностью продуцировать L-лизин" означает, что если микроорганизм культивируют в среде, то микроорганизм обладает способностью продуцировать и секретировать L-лизин в среду. Коринеформным микроорганизмом может быть микроорганизм, который может продуцировать и накапливать L-лизин в больших количествах в культуральной среде, по сравнению с его диким типом или материнским штаммом.
Согласно варианту осуществления в коринеформном микроорганизме инактивирован ген, кодирующий белок-инициатор формирования перегородки, например FtsB, таким образом, клеточное деление коринеформного микроорганизма может ингибироваться, в то время как способность продуцировать L-лизин соответственно может быть улучшена.
Другой аспект предусматривает способ получения L-лизина, при этом способ включает культивирование микроорганизма согласно настоящему изобретению таким образом, чтобы получить L-лизин в культуральной среде; и извлечение L-лизина из микроорганизма или культуральной среды. Микроорганизм такой же как описано выше.
Культивирование микроорганизма может осуществляться в подходящей среде при условиях культивирования, хорошо известных в уровне техники. Такой способ культивирования может быть просто отрегулирован в зависимости от выбранного микроорганизма. Способ культивирования может включать по меньшей мере один, выбранный из группы, состоящей из культивирования в периодической культуре, непрерывной культуре и культуре с подпиткой.
При использовании среды, которую применяют для культивирования, можно столкнуться с требованиями определенного микроорганизма. Среда может быть выбрана из группы, состоящей из источников углерода, источников азота, микроэлементов и их комбинации.
Источник углерода может быть выбран из группы, состоящей из углеводов, липидов, жирных кислот, спиртов, органических кислот и их комбинации. Углеводом может быть глюкоза, сахароза, лактоза, фруктоза, мальтоза, крахмал, целлюлоза или их комбинация. Липидом может быть соевое масло, подсолнечное масло, касторовое масло, кокосовое масло или их комбинация. Жирной кислотой может быть пальмитиновая кислота, стеариновая кислота, линолевая кислота или их комбинация. Спиртом может быть глицерин или этанол. Органическая кислота может включать уксусную кислоту.
Источник азота может включать источник органического азота, источник неорганического азота или их комбинацию. Источник органического азота может быть выбран из группы, состоящей из пептона, дрожжевого экстракта, мясного экстракта, экстракта солода, жидкого кукурузного экстракта (CSL), соевой муки и их комбинации. Источник неорганического азота может быть выбран из группы, состоящей из мочевины, сульфата аммония, хлорида аммония, фосфата аммония, карбоната аммония, нитрата аммония и их комбинации.
Среда может включать одно, выбранное из группы, состоящей из фосфора, солей металлов, аминокислот, витаминов, предшественников и их комбинации. Источник фосфора может включать дигидрофосфат калия, дикалий фосфат и натрийсодержащую соль, соответствующую ему. Соль металла может быть сульфатом магния и сульфатом железа.
Среду или отдельные компоненты можно добавлять в культуральную среду в режиме культивирования в периодической культуре, непрерывной культуре или культуре с подпиткой.
В способе культивирования рН культуры может быть отрегулирован. Регулирование рН можно осуществлять путем добавления к культуре гидроксида аммония, гидроксида калия, аммиака, фосфорной кислоты или серной кислоты. Дополнительно, способ культивирования может включать предотвращение образования воздушных пузырьков. Предотвращение образования воздушных пузырьков можно осуществлять путем применения противовспенивающего средства. Противовспенивающее средство может включать сложный полигликолевый эфир жирной кислоты. Дополнительно, способ культивирования может включать введение газа в культуру. Газ может включать любой газ, способный поддерживать аэробные условия в культуре. Газом может быть кислород или кислородсодержащий газ. Кислородсодержащий газ может включать воздух. При культивировании температура культуры может находиться в диапазоне от 20 до 45°С, например от 22 до 42°С или от 25 до 40°С. Культивирование может продолжаться до момента достижения желаемого уровня продуцирования L-лизина.
В способе согласно настоящему изобретению культивирование может быть непрерывным культивированием или периодическим культивированием, таким как культивирования в периодической культуре, культуре с подпиткой и многократной культуре с подпиткой. Такой способ культивирования хорошо известен в данной области, и может быть использован любой соответствующий способ. L-аминокислота может быть выделена и проанализирована с помощью анионообменной хроматографии и нингидриновой дериватизации.
ПРЕИМУЩЕСТВЕННЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Согласно микроорганизму, в котором ген, кодирующий белок-инициатор формирования перегородки, инактивирован, в соответствии с аспектом, способность микроорганизма продуцировать L-лизин можно улучшить.
Согласно способу получения L-лизина в соответствии с аспектом, L-лизин можно продуцировать с высокой эффективностью.
ПРИНЦИП ИЗОБРЕТЕНИЯ
Далее настоящее изобретение будет описано более подробно со ссылками на примеры. Однако, эти примеры приведены только в целях иллюстрации, и не подразумевается ограничение объема настоящего изобретения этими примерами.
Пример 1: получение рекомбинантного вектора с инактивированным путем делеции геном ftsB
Последовательность нуклеотидов гена ftsB (SEQ ID NO: 2) получали на основе базовой последовательности из GenBank Национального Института Здоровья США (NIH Genbank). Чтобы получить фрагмент гена, в котором открытая рамка считывания ftsB внутренне утеряна, на основе SEQ ID NO: 2, конструировали праймеры 0936F1, 09369R1, 0936F2 и 0936R2 и присваивали им SEQ ID NO: 7-10 соответственно.
Чтобы получить инактивированный рекомбинантный вектор вследствие делеции гена ftsB, использовали вектор pDZ (со ссылками на патент Кореи с регистрационным номером 10-0924065). Затем как описано выше молекулы нуклеиновой кислоты, сконструированные для инактивации, с модифицированной последовательностью гена ftsB, встраивали в сайт множественного клонирования вектора pDZ с получением, таким образом, вектора pDZ-ΔftsB, содержащего последовательность нуклеиновой кислоты SEQ ID NO: 4. Последовательность нуклеиновой кислоты SEQ ID NO: 4 кодирует аминокислоту с аминокислотной последовательностью SEQ ID NO: 3.
Проводили ПЦР с применением геномной ДНК Corynebacterium glutamicum АТСС 13032 в качестве матрицы и с применением праймеров 0936F1-0936R1 и 0936F2-0936R2. В качестве полимеразы использовали высокоточную ДНК полимеразу PfuUltra™ (Stratagene). Условия ПЦР были следующими: денатурация при 96°С в течение 30 секунд, отжиг при 58°С в течение 30 секунд, полимеризация при 72°С в течение 2 минут и 30 циклов.
В результате получили пару ДНК-фрагментов ftsB-A и ftsB-B, каждый из которых содержит ген ftsB в 74 п. о. и 95 п. о. соответственно. Амплифицированные продукты клонировали в вектор pDZ с применением набора Infusion cloning kit (Invitrogen), с получением в результате конструкции вектора pDZ-ΔftsB. Вектор pDZ-ΔftsB содержит как конец XbaI гена ftsB в 135 п. о., так и фрагмент ftsB без внутреннего участка в 408 п. о.
Пример 2: получение рекомбинантного вектора с инактивированным путем встраивания стоп-кодона геном ftsB
Чтобы получить рекомбинантный вектор с инактивированным путем встраивания стоп-кодона геном ftsB, использовали вектор pDZ и конструировали праймер для замены антикодона 140й аминокислоты в открытой рамке считывания гена ftsB, т.е. триптофана, стоп-кодоном. С применением пары праймеров 0936 F1 и 0936 R3 и пары праймеров 0936 F3 и 0936R2 проводили ПЦР для амплификации таким же образом как в примере 1, а амплифицированные продукты клонировали в вектор pDZ с получением в результате конструкции вектора pDZ-ftsB W140*. Последовательности пары праймеров 0936F3 и 0936R3 указаны под SEQ ID NO: 11 и 12 соответственно. Последовательность аминокислот гена fts, клонированного в сконструированный вектор, указана под SEQ ID NO: 5, а последовательность их нуклеиновых кислот указана под SEQ ID NO: 6 (нуклеотидная последовательность).
Пример 3: конструкция штамма с инактивированным геном ftsB
Штамм Corynebacterium glutamicum КССМ11016Р, продуцирующий L-лизин, ((старый) номер доступа KFCC10881, со ссылками на патенты Кореи с регистрационными номерами 10-0159812 и 10-0397322), трансформировали рекомбинантными векторами, сконструированными в примерах 1 и 2, способом электрического импульса (с применением способа трансформации, описанного в Appl. Microbiol. Biotechnol. (1999) 52:541-545). Затем, штамм с целевым геном, встроенным с помощью гомологии гена на хромосоме, отбирали из селективной среды, содержащей 25 мг/л канамицина. Успешное встраивание вектора в хромосому подтверждали с помощью наблюдения становилась ли колония голубой на твердой среде, содержащей X-gal (5-бром-4-хлор-3-индолил-β-D-галактозид). Штамм с первичной вставленной хромосомой культивировали со встряхиванием в питательной среде (при температуре 30°С в течение 8 часов), которую потом разводили от 10-4 до 10-10, с последующим размазыванием на твердую среду, содержащую X-gal. В то время как большинство колоний были голубыми, некоторые колонии были белыми. Те немногочисленные колонии белого цвета, выбирали для дальнейшего отбора штамма, в котором ген ftsB был инактивирован, с помощью вторичного кроссовера.
Чтобы отобрать штамм, в котором ген ftsB был инактивирован с помощью делеции, использовали пару ген-специфических праймеров, SEQ ID NO: 7 и SEQ ID NO: 10, 0936F1-0936R2 в качестве праймеров для проведения ПЦР. Основную последовательность анализировали в отношении целевого сайта для окончательного подтверждения с получением конструкции инактивированного штамма КССМ11016P-ΔftsB вследствие делеции гена ftsB. Чтобы отобрать штамм, в котором ген ftsB инактивирован вследствие перемещения модифицированного стоп-кодона, использовали пару праймеров, SEQ ID NO: 7 и SEQ ID NO: 10, 0936F1-0936R2 в качестве праймеров для проведения ПЦР. Основную последовательность анализировали в отношении целевого сайта для окончательного подтверждения с получением конструкции штамма КССМ11016P-ftsB W140* с инактивированным геном ftsB вследствие встраивания стоп-кодона.
Для изучения эффектов в других штаммах, принадлежащих роду Corynebacterium glutamicum, конструировали таким же образом как в вышеописанном способе штаммы с удаленным геном ftsB и штаммы со встроенным стоп-кодоном, т.е. KCCM10770P-ΔftsB, КССМ11016P-ftsB W140*, KCCM11347P-ΔftsB, KCCM11347P-ftsB W140*, CJ3P-ΔftsB, CJ3P-ftsB W140*, с применением KCCM10770P (со ссылками на патент Кореи с регистрационным номером 10-0924065), КССМ11347Р (со ссылками на патент Кореи с регистрационным номером 10-1994-0001307) и CJ3P (Binder et al. Genome Biology 2012,13:R40) в качестве материнских штаммов.
Пример 4: продуцирование L-лизина в штамме с инактивированным геном ftsB
Штаммы Corynebacterium glutamicum KCCM11016P-ΔftsB, KCCM11016P-ftsB W140*, KCCM10770P-ΔftsB, KCCM10770P-ftsB W140*, KCCM11347P-ΔftsB, KCCM11347P-ftsB W140, CJ3P-ΔftsB и CJ3P-ftsB W140*, продуцирующие L-лизин, сконструированные в примере 3, культивировали для получения L-лизина описанным ниже способом.
Материнский штамм Corynebacterium glutamicum и каждый из штаммов KCCM11016P-ΔftsB, KCCM11016P-ftsB W140*, KCCM10770P-ΔftsB, KCCM10770P-ftsB W140*, KCCM11347P-ΔftsB, KCCM11347P-ftsB W140*, CJ3P-ftsB и CJ3P-ftsB W140* инокулировали в колбу с угловыми перегородками объемом 250 мл, содержащую 25 мл культуральной среды для посева, с последующим культивированием со встряхиванием при 30°С в течение 20 часов при 200 оборотах в минуту (об./мин.). Затем, 1 мл каждой культуральной среды для посева инокулировали в колбу с угловыми перегородками объемом 250 мл, содержащую 24 мл среды для продуцирования, с последующим культивированием со встряхиванием при 30°С в течение 120 часов при 200 об./мин. Композиции культуральной среды для посева и среды для продуцирования были такими, как описаны ниже.
Культуральная среда для посева (рН 7,0).
20 г нерафинированного сахара, 10 г пептона, 5 г дрожжевого экстракта, 1,5 г мочевины, 4 г KH2PO4, 8 г K2HPO4, 0,5 г MgSO4 7H2O, 100 мкг биотина, 1000 мкг тиамина-HCl, 2000 мкг пантотената кальция, 2000 мкг никотинамида (в 1 л дистиллированной воды).
Среда для продуцирования (рН 7,0).
100 г глюкозы, 40 г (NH4)2SO4, 2,5 г соевого белка, 5 г твердых веществ кукурузного экстракта, 3 г мочевины, 1 г КН2РО4, 0,5 г MgSO4 7H2O, 100 мкг биотина, 1000 мкг тиамина гидрохлорида, 2000 мкг пантотената кальция, 3000 мкг никотинамида, 30 г СаСО3 (в 1 л дистиллированной воды).
После завершения культивирования измеряли степень продуцирования L-лизина с применением способа HPLC. Концентрации L-лизина в культуральных растворах материнского штамма Corynebacterium glutamicum и KCCM11016P-ΔftsB, KCCM11016P-ftsB W140*, KCCM10770P-ΔftsB, KCCM10770P-ftsB W140*, KCCM11347P-ΔftsB, KCCM11347P-ftsB W140, CJ3P-ΔftsB и CJ3P-ftsB W140* показаны в таблице 3. Результаты, показанные в таблице 3, являются усредненным значением повторных экспериментов.

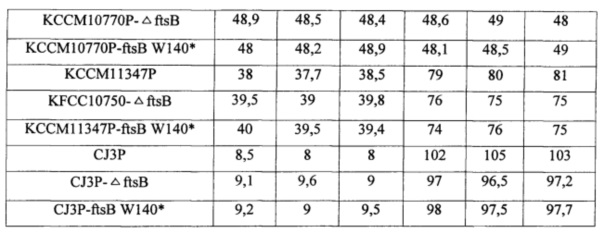
Как показано в таблице 3, если в материнском штамме КССМ11016Р удален ген ftsB или встроен стоп-кодон, то продукция L-лизина повышается приблизительно на 4% во всех них. Эти результаты демонстрируют, что концентрация лизина повышалась не за счет структурных изменений самого гена ftsB, а за счет делеции FtsB-белка, который является инициатором формирования перегородки. Кроме того, концентрации лизина в штаммах с инактивированным геном FtsB из других материнских штаммов, КССМ10770Р, КССМ11347Р и CJ3P, повышались приблизительно на 4% по сравнению с материнскими штаммами с активностью FtsB дикого типа. С другой стороны, клеточный объем штаммов с инактивированным геном FtsB уменьшался приблизительно на 5% по сравнению с материнскими штаммами. Этот результат подразумевает, что способность продуцировать лизин можно улучшить путем контроля количества штаммов вследствие супрессии клеточного деления штаммов, продуцирующих L-лизин. 27 сентября 2013 года штамм KCCM11016P-ftsB W140* (СА01-2274) передали на депонирование в Корейский центр культур микроорганизмов (Korean Culture Center of Microorganisms), расположенный по адресу Urim bd., Hongje-l-dong, Seodaemun-gu, Сэул, Корея, с номером доступа КССМ11454Р.
Депозитарний орган: Корейский центр культур микроорганизмов (международный).
Номер доступа: КССМ 11454Р.
Дата регистрации: 27 сентября 2013 года.





Предложены коринеформный микроорганизм с улучшенной способностью продуцировать L-лизин и способ получения L-лизина с использованием указанного микроорганизма. Указанный коринеформный микроорганизм представляет собой Corynebacterium glutamicum, в котором инактивирован белок-инициатор формирования перегородки, где указанный белок-инициатор формирования перегородки представляет собой филаментный чувствительный к температуре белок В (FtsB). Способ получения L-лизина предусматривает культивирование указанного микроорганизма в культуральной среде и извлечение L-лизина из микроорганизма или культуральной среды. Группа изобретений обеспечивает повышенную продукцию L-лизина. 2 н. и 1 з.п. ф-лы, 3 табл., 4 пр.
1. Коринеформный микроорганизм с улучшенной способностью продуцировать L-лизин, в котором инактивирован белок-инициатор формирования перегородки, где указанный белок-инициатор формирования перегородки представляет собой филаментный чувствительный к температуре белок В (FtsB), а указанный коринеформный микроорганизм представляет собой Corynebacterium glutamicum.
2. Микроорганизм по п.1, где белок-инициатор формирования перегородки обладает аминокислотной последовательностью SEQ ID NO: 1.
3. Способ получения L-лизина, при этом способ предусматривает:
культивирование микроорганизма по п.1 для получения L-лизина в культуральной среде; и
извлечение L-лизина из микроорганизма или культуральной среды.
| US 2002107377 A1, 08.08.2002 | |||
| NOENS E | |||
| Control of sporulation-specific cell division in Streptomyces coelicolor | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| FtsX en FtsE import autolytically produced peptidoglycan subunits during sporulation-specific cell division of Streptomyces coelicolor, abstract, с | |||
| Рогульчатое веретено | 1922 |
|
SU142A1 |
| Счетный диск для расчета водопроводных и канализационных труб | 1924 |
|
SU1887A1 |
| BLOMACH B | |||
| ET AL | |||
| Acetohydroxyacid Synthase, a Novel Target for Improvement of l-Lysine Production by Corynebacterium glutamicum // Appl Environ Microbiol | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| КОРИНЕФОРМНАЯ БАКТЕРИЯ, ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ | 2004 |
|
RU2333247C2 |
Авторы
Даты
2018-04-19—Публикация
2014-12-08—Подача