Область изобретения
Настоящее изобретение относится к микроорганизму, продуцирующему L-лизин, и способу получения L-лизина с использованием этого микроорганизма.
Предшествующий уровень техники
L-аминокислоты, в частности L-лизин, которые используют в кормах для животных, лекарственных средствах для человека или косметической промышленности, получают, главным образом, путем ферментации с использованием штамма рода Corynebacterium или штамма рода Escherichia. Соответственно, в настоящее время проводятся различные исследования для разработки штаммов, продуцирующих L-лизин с высоким выходом, и технологии их ферментации. Однако, исследования по контролю клеточного лизиса, который может вызывать снижение продуктивности на поздних стадиях ферментации, проведены недостаточно.
Между тем известно, что гидролазы клеточной стенки представляют собой ферменты, которые разрушают клеточные стенки бактерий и присутствуют во всех микроорганизмах, имеющих пептидогликан (Rice КС & Bayles KW. Microbiol Mol Biol Rev. 2008. 72:85-109). Хотя исследования таких гидролаз клеточной стенки проводили на различных бактериях, их точный механизм контроля пока еще не известен.
Модель механизма клеточного лизиса, происходящего во время культивирования микроорганизмов, недавно была предложена для Pneumococcus (Mellroth Р et al. J Biol Chem. 2012. 287:11018-29). Более конкретно, когда клетки подвергают различным типам стресса, активность гидролазы клеточной стенки, присутствующей на наружной стенке клеток, увеличивается, тем самым инициируя разрушение клеточной стенки. Когда клетки разрушаются под непрерывным действием такой гидролазы клеточной стенки, гидролаза клеточной стенки, присутствующая в цитоплазме, высвобождается наружу из клеток. Сообщалось, что окружающие клетки разрушаются, когда ряд процессов происходит непрерывно, так что количество гидролазы клеточной стенки снаружи клеток превышает пороговое значение. Однако, корреляция между клеточным лизисом, происходящим во время процесса ферментации культуры, и продуцированием аминокислот все еще неизвестна.
Техническая задача
Авторы настоящего изобретения предприняли попытки непрерывного поиска эффективного пути, способного увеличивать продуктивность по L-лизину у микроорганизма рода Corynebacterium, который представляет собой репрезентативный L-лизин-продуцирующий штамм. В результате авторы настоящего изобретения подтвердили, что продуктивность по L-лизину увеличивалась, когда имела место недостаточность по гену, кодирующему белок, вовлеченный в гидролиз клеточной стенки, и что увеличение продуктивности по лизину подвергалось воздействию, когда имела место недостаточность по дополнительному гену, кодирующему белок, обладающий похожей функцией, тем самым создав настоящее изобретение.
Техническое решение
Задача настоящего изобретения заключается в том, чтобы предложить микроорганизм рода Corynebacterium, продуцирующий L-лизин.
Другая задача настоящего изобретения заключается в том, чтобы предложить способ получения L-лизина с использованием микроорганизма рода Corynebacterium, продуцирующего L-лизин.
Полезные эффекты изобретения
Микроорганизм по настоящему изобретению представляет собой микроорганизм рода Corynebacterium, модифицированный таким образом, что активность белка, вовлеченного в гидролиз клеточной стенки, снижена или инактивирована по сравнению с его эндогенной активностью. То есть, микроорганизм по настоящему изобретению представляет собой новый штамм, который дает увеличение продуктивности на поздней стадии ферментации, и следовательно применим в качестве нового образца микроорганизма рода Corynebacterium, который продуцирует L-лизин, тем самым предоставляя микроорганизм, способный продуцировать L-лизин с высоким выходом. Соответственно, полученный L-лизин можно использовать не только в кормах для животных или добавках в корма для животных, но также в различных продуктах, таких как пищевые продукты для человека, пищевые добавки, лекарственные средства и так далее.
Наилучшее воплощение изобретения
Для решения вышеизложенных задач в одном аспекте настоящего изобретения предложен микроорганизм рода Corynebacterium, продуцирующий L-лизин, который модифицирован таким образом, что активность белка, вовлеченного в гидролиз клеточной стенки, инактивирована по сравнению с его эндогенной активностью.
Как его используют здесь, термин "белок, вовлеченный в гидролиз клеточной стенки" относится к релевантному белку, способному гидролизовать клеточную стенку в микроорганизме рода Corynebacterium. Белок, вовлеченный в гидролиз клеточной стенки, может представлять собой ассоциированную с клеточной стенкой гидролазу или N-ацетилмурамоил-L-аланин-амидазу, но не ограничиваясь этим.
Как описано здесь, при условии, что белок обладает активностью релевантного белка, способного гидролизовать клеточную стенку в микроорганизме, последовательности белка и гена могут быть взяты из известной базы данных. Дополнительно, Genbank от NCBI и другие можно использовать в качестве примеров известной базы данных, но не ограничиваясь этим.
Гидролаза, ассоциированная с клеточной стенкой, может представлять собой белок, кодируемый геном NCgl1480, белок, кодируемый геном NCgl2107, или белок, кодируемый геном NCgl2108, имеющий происхождение из микроорганизма рода Corynebacterium, в частности из Corynebacterium glutamicum, но не ограничиваясь этим. В качестве конкретного примера, гидролаза, ассоциированная с клеточной стенкой, может иметь аминокислотную последовательность SEQ ID NO: 1, 2 или 3, но может включать белковую последовательность, обладающую вышеуказанной активностью без ограничения. Дополнительно, любые нуклеотидные последовательности могут быть включены в данное изобретение без ограничения при условии, что они представляют собой нуклеотидную последовательность, кодирующую белок, обладающий активностью гидролазы, ассоциированной с клеточной стенкой. В качестве конкретного примера, он может представлять собой белок, кодируемый нуклеотидной последовательностью SEQ ID NO: 5, 6 или 7, но не ограничиваясь этим.
N-ацетилмурамоил-L-аланин-амидаза может представлять собой белок, кодируемый геном NCgl2986, имеющий происхождение из микроорганизма рода Corynebacterium, в частности из Corynebacterium glutamicum. В частности, N-ацетилмурамоил–L-аланин-амидаза может иметь аминокислотную последовательность SEQ ID NO: 4, но любые аминокислотные последовательности белка, обладающего вышеуказанной активностью, могут быть включены без ограничения. Дополнительно, любая нуклеотидная последовательность может быть включена без ограничения при условии, что эта нуклеотидная последовательность кодирует белок, обладающий активностью N-ацетилмурамоил-L-аланин-амидазы. Например, это может быть белок, кодируемый нуклеотидной последовательностью SEQ ID NO: 8, но не ограничиваясь этим.
Каждый из белков, описанных выше, дополнительно к аминокислотным последовательностям, представленным в SEQ ID NO, может включать без ограничения любую аминокислотную последовательность, которая имеет гомологию с вышеперечис ленными аминокислотными последовательностями 80% или больше, предпочтительно 90% или больше, более предпочтительно 95% или больше и еще более предпочтительно 97% или больше, при условии, что аминокислотные последовательности кодируют белки, обладающие по существу таким же действием, как каждый из этих белков, или соответствующим таковому. Кроме того, очевидно, что любой модифицированный белок, имеющий гомологию, описанную выше, может входить в объем настоящего изобретения, несмотря на то, что белок может иметь аминокислотную последовательность с частичной делецией, модификацией, заменой или вставкой в нее.
Дополнительно гены, кодирующие каждый из белков по настоящему изобретению, в дополнение к нуклеотидным последовательностям, представленным в SEQ ID NO, также могут включать без ограничения любую последовательность гена, кодирующую белки, имеющие гомологию с каждой из вышеперечисленных нуклеотидных последовательностей 80% или больше, предпочтительно 90% или больше, более предпочтительно 95% или больше, еще более предпочтительно 98% или больше, и наиболее предпочтительно 99% или больше, при условии, что последовательности генов кодируют белок, обладающий по существу таким же действием, как каждый из этих белков, или соответствующим таковому. Кроме того, очевидно, что любая нуклеотидная последовательность, имеющая вышеописанную гомологию, может входить в объем настоящего изобретения, несмотря на то, что последовательность может иметь частичную делецию, модификацию, замену или вставку в нее.
Как его используют здесь, термин "гомология" относится к сходству нуклеотидных последовательностей или аминокислотных последовательностей кодируемого геном белка. Когда гомология достаточно высока, продукты соответствующего гена могут быть одними и теми же или иметь похожую активность. То есть, это относится к проценту идентичности между двумя полинуклеотидными или полипептидными группировками. Соответствие последовательности одной группировки другой можно определить методикой, известной в данной области техники. Например, гомологию можно определить путем выравнивания информации о последовательностях двух полинуклеотидных молекул или двух полипептидных молекул непосредственно путем использования компьютерной программы, которая легкодоступна и способна выравнивать информацию о последовательностях. Компьютерная программа может представлять собой BLAST (NCBI), CLC Main Workbench (CLC bio), MegAlignTM (DNASTAR Inc) и так далее. Дополнительно гомологию можно определить путем гибридизации полинуклеотидов в условиях образования стабильной двойной цепи в гомологичных участках и затем переваривания гибридизованной цепи нуклеазой, специфичной к одинарной цепи, для определения размера расщепленного фрагмента.
Как его используют здесь, термин "эндогенная активность" относится к активности белка в состоянии до модификации микроорганизма или в его природном состоянии.
Как его используют здесь, термин "активность фермента, модифицированного с инактивацией, по сравнению с его эндогенной активностью" относится к активности, при которой ген, кодирующий фермент, совсем не экспрессируется по сравнению со штаммом дикого типа или штаммом до модификации или относится к снижению или устранению активности, даже если ген экспрессируется.
"Инактивация активности по сравнению с его эндогенной активностью" относится к снижению или устранению активности по сравнению с таковой, которой обладает микроорганизм в своем природном состоянии или состоянии до модификации. "Снижение активности" представляет собой понятие, относящееся к случаю, когда активность фермента снижена по сравнению с той, которой исходно обладает микроорганизм, вследствие модификации в гене, кодирующем фермент, к случаю, когда суммарный уровень экспрессии фермента ниже, чем таковой у штамма микроорганизма природного типа или штамма до модификации, или к их комбинации.
"Устранение активности" относится к случаю, когда ген, кодирующий фермент, совсем не экспрессируется по сравнению с таковым у штамма природного типа или штамма до модификации, и/или относится к случаю, когда ген экспрессируется, но не проявляет активность.
Способ модификации с инактивацией активности фермента может быть выполнен путем применения различных способов, хорошо известных в данной области техники. Примеры способов могут включать способ замены гена, кодирующего фермент, на хромосоме на мутированный ген таким образом, что активность фермента может быть снижена, включая случай, когда активность фермента устранена; способ введения модификации в последовательность регуляции экспрессии гена, кодирующего фермент на хромосоме; способ замены последовательности регуляции экспрессии гена, кодирующего фермент, на последовательность, обладающую слабой активностью или не обладающую активностью; способ делетирования части или целого гена, кодирующего фермент, на хромосоме; способ введения антисмыслового олигонуклеотида (например антисмысловой РНК), который ингибирует трансляцию с мРНК с образованием фермента через комплементарное связывание с транскриптом гена на хромосоме; способ, делающий присоединение рибосомы невозможным вследствие образования вторичной структуры путем искусственного добавления последовательности Шайна-Дальгарно (SD) и комплементарной ей последовательности на переднем конце последовательности SD гена, кодирующего фермент; способ с использованием технологии обратной транскрипции (RTE), при котором добавляют промотор таким образом, чтобы обеспечить обратную транскрипцию на 3'-конце открытой рамки считывания (ORF) соответствующей последовательности и так далее, и также включает их комбинацию, но не ограничиваясь этим.
В частности, способ делетирования части гена или целого гена, кодирующего фермент, может быть выполнен путем замены полинуклеотида, кодирующего эндогенный белок-мишень на хромосоме, с помощью вектора для вставки хромосомы в микроорганизм на полинуклеотид или маркер, где часть последовательности нуклеиновой кислоты делетирована. Например, можно использовать способ делетирования гена путем гомологичной рекомбинации.
Как его используют здесь, термин "часть", хотя он может варьировать в зависимости от типа полинуклеотида, может, в частности, относиться к последовательности длиной от 1 нуклеотида до 300 нуклеотидов, более конкретно от 1 нуклеотида до 100 нуклеотидов и еще более конкретно от 1 нуклеотида до 50 нуклеотидов, но не ограничиваясь этим.
Как его используют здесь, термин "гомологичная рекомбинация" относится к генетической рекомбинации, которая происходит путем кроссинговера по локусу генной цепи, имеющему взаимную гомологию.
Согласно одному примеру воплощения настоящего изобретения белки инактивировали путем гомологичной рекомбинации.
В частности, способ модифицирования последовательности регуляции экспрессии может быть выполнен путем индуцирования модификации в последовательности регуляции экспрессии посредством делеции, вставки, неконсервативной или консервативной замены последовательности нуклеиновой кислоты последовательности регуляции экспрессии или их комбинации; или может быть выполнен путем замены последовательности на более слабый промотор. Последовательность регуляции экспрессии включает промотор, операторную последовательность, последовательность, кодирующую сайт связывания с рибосомой, и последовательность для регуляции терминации транскрипции и трансляции.
Дополнительно, способ модификации последовательности гена на хромосоме может быть выполнен путем индуцирования модификации в последовательности путем делеции, вставки, неконсервативной или консервативной замены последовательности гена или их комбинации, так чтобы дополнительно снизить активность фермента; или путем замены последовательности на последовательность гена, улучшенную для дополнительного ослабления активности, или на последовательность гена, улучшенную с тем, чтобы не иметь активности.
Как его используют здесь, термин "микроорганизм, продуцирующий L-лизин" относится к штамму микроорганизма, способному продуцировать L-лизин путем ферментации. Например, он включает штамм, способный увеличивать продуктивность по L-лизину путем модифицирования последовательности с помощью манипуляции по настоящему изобретению, такой что активность белка, вовлеченного в гидролиз клеточной стенки, инактивирована по сравнению с его эндогенной активностью; и путем регуляции клеточного лизиса для продуцирования лизина, что происходит во время ферментации, но не ограничиваясь этим.
В настоящем изобретении микроорганизм, продуцирующий L-лизин, может включать все микроорганизмы рода Corynebacterium, которые могут быть модифицированы таким образом, что активность белка, вовлеченного в гидролиз клеточной стенки, инактивирована по сравнению с его эндогенной активностью. Например, можно использовать Corynebacterium glutamicum, Corynebacterium ammoniagenes, Corynebacterium thermoaminogenes, Brevibacterium flavum или Brevibacterium fermentum, но микроорганизм не ограничен этим. Например, Corynebacterium glutamicum можно использовать в качестве микроорганизма рода Corynebacterium. Модифицированный микроорганизм рода Corynebacterium характеризуется тем, что продуктивность по L-лизину усилена по сравнению с микроорганизмом, который не модифицирован таким образом, что активность белка, вовлеченного в гидролиз клеточной стенки, инактивирована по сравнению с его эндогенной активностью.
В другом аспекте настоящего изобретения предложен способ получения L-лизина, включающий: (1) культивирование микроорганизма рода Corynebacterium, который модифицирован таким образом, что активность белка, вовлеченного в гидролиз клеточной стенки, инактивирована по сравнению с его эндогенной активностью; и (2) выделение L-лизина из культуральной среды или из микроорганизма.
Микроорганизм рода Corynebacterium, у которого продуктивность по L-лизину увеличена, является таким как описано выше.
Как его используют здесь, термин "культура" относится к культивированию микроорганизма в искусственно контролируемых условиях окружающей среды. В настоящем изобретении способ получения L-лизина путем культивирования микроорганизма рода Corynebacterium можно выполнять с использованием методики, широко известной в данной области техники. В частности, примеры культивирования включают периодический процесс и периодический процесс с подпиткой или повторяющийся периодический процесс с подпиткой непрерывным способом, но не ограничиваясь этим.
Среда, используемая для культивирования, должна удовлетворять требованиям для конкретного штамма соответствующим образом (например, Manual of Methods for General Bacteriology. American Society for Bacteriology. Washington D.C., USA, 1981). Источники углерода, которые можно использовать в настоящем изобретении, могут включать сахара и углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, крахмал и целлюлоза; масла и жиры, такие как соевое масло, подсолнечное масло, касторовое масло и кокосовое масло; жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота; спирты, такие как глицерин и этанол; и органические кислоты, такие как глюконовая кислота, уксусная кислота и пировиноградная кислота, но не ограничиваясь этим. Эти вещества можно использовать по отдельности или в смеси. Источники азота, которые можно использовать в настоящем изобретении, могут включать пептон, дрожжевой экстракт, мясной экстракт, солодовый экстракт, жидкий кукурузный экстракт, обезжиренный соевый жмых и мочевину или неорганические соединения, такие как сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония, но не ограничиваясь этим. Эти источники азота также можно использовать по отдельности или в смеси. Источники фосфора, которые можно использовать в настоящем изобретении, могут включать однозамещенный фосфат калия, гидроортофосфат калия или соответствующие натрийсодержащие соли, но не ограничиваясь этим. Дополнительно, культуральная среда может содержать соль металла, такую как сульфат магния или сульфат железа, которые необходимы для роста. Наконец, дополнительно к вышеописанным веществам, можно использовать необходимые факторы роста, такие как аминокислоты и витамины. Дополнительно в культуральной среде можно использовать подходящие предшественники. Эти вещества можно добавлять в среду во время культивирования периодическим или непрерывным способом. Такие разнообразные способы культивирования раскрыты, например, в литературе ("Biochemical Engineering" by James M. Lee, Prentice-Hall International Editions, pp 138-176).
Основные соединения, такие как гидроксид натрия, гидроксид калия или аммиак, или кислотные соединения, такие как фосфорная кислота или серная кислота, можно добавлять в культуральную среду подходящим образом для подведения рН культуральной среды. Дополнительно, можно использовать пеногаситель, такой как полигликолевый эфир жирной кислоты, для подавления образования пузырьков. Для поддержания культуральной среды в аэробном состоянии в культуральную среду можно вводить кислород или кислородсодержащий газ (например воздух). Температура культуральной среды обычно может составлять от 20°С до 45°С, предпочтительно 25°С до 40°С, но может быть изменена в зависимости от условий. Культивирование можно продолжать до получения максимального количества желаемой L-аминокислоты, и обычно время культивирования может достигать от 10 часов до 160 часов. L-лизин может высвобождаться в культуральную среду или содержаться в клетках.
Способ по настоящему изобретению для получения L-лизина может включать стадию выделения лизина из микроорганизма или из среды. Методики, известные в данной области техники, такие как центрифугирование, фильтрование, анионообменная хроматография, кристаллизация, ВЭЖХ (высокоэффективная жидкостная хроматография) и так далее, можно использовать в качестве способа выделения L-лизина из микроорганизма или из культуры, но способ не ограничен этим. Стадия выделения может включать процесс очистки.
ПРИМЕРЫ
Далее настоящее изобретение будет описано более подробно с сопутствующими примерами воплощений. Однако примеры воплощений, раскрытые здесь, предназначены исключительно для иллюстративных целей, и их не следует рассматривать как ограничивающие объем настоящего изобретения.
Пример 1: Получение библиотеки случайных мутаций с использованием транспозона
Для получения генов, увеличивающих продуктивность по лизину, была получена векторная библиотека следующим способом. Проводили трансформацию плазмидой, полученной с использованием набора EZ-Tn5™<R6Kγori/KAN-2>Tnp Transposome™ (Epicentre), с использованием штамма KССМ11016Р (микроорганизм был обозначен как KFCC10881 и повторно депонирован в международном органе депонирования в соответствии с Будапештским договором, и затем получил депозитарный номер доступа KССМ11016Р; патент Кореи No. 10-0159812) в качестве родительского штамма, и затем распределяли по чашке с комплексной средой, содержащей канамицин (25 мг/л) с получением около 20000 колоний.
Планшет с комплексной средой (рН 7,0)
10 г глюкозы, 10 г пептона, 5 г мясного экстракта, 5 г дрожжевого экстракта, 18,5 г сердечно-мозговой вытяжки, 2,5 г NaCl, 2 г мочевины, 91 г сорбита, 20 г агара (в расчете на 1 л дистиллированной воды)
Пример 2: Скрининг библиотеки случайных мутаций с использованием транспозона
Каждую из 20000 колоний, полученных в Примере 1, инокулировали в селективную среду (300 мкл) и культивировали в 96-луночных планшетах с глубокими лунками при 32°С при 1000 об/мин в течение примерно 24 часов. Для анализа количества L-лизина, продуцированного в культуральной среде, использовали нингидриновый метод (Moore, S., Stein, W. Н., Photometric ninhydrin method for use in the chromatography of amino acids. J. Biol. Chem. 1948, 176, 367-388). После завершения культивирования проводили реакцию между культуральным супернатантом (10 мкл) и раствором для нингидриновой реакции (190 мкл) при 65°С в течение 30 минут. После этого измеряли поглощение при длине волны 570 нм с помощью спектрофотометра, и примерно 60 типов колоний были отобраны в качестве модифицированных штаммов, демонстрирующих высокое поглощение по сравнению с контролем, KССМ11016Р. Другие колонии демонстрировали сходное или пониженное поглощение по сравнению с таковым у контрольного штамма KССМ11016Р.
60 типов отобранных штаммов культивировали таким же образом, как описано выше, и нингидриновую реакцию проводили в повторах. В результате были отобраны 10 штаммов, обладающих повышенной продуктивностью по L-лизину по сравнению со штаммом КССМ11016Р.
Селективная среда (рН 8,0)
10 г глюкозы, 5,5 г сульфата аммония, 1,2 г MgSO4-7H2O, 0,8 г KН2РО4, 16,4 г K2НРO4, 100 мкг биотина, 1000 мкг тиамин-НСl, 2000 мкг пантотената кальция, 2000 мкг никотинамида (в расчете на 1 л дистиллированной воды).
Пример 3: Анализ продуктивности по L-лизину отобранных штаммов со случайными мутациями Для окончательного отбора штаммов, обладающих повышенной продуктивностью по L-лизину, проводили тест на воспроизводимость в колбе с использованием среды, описанной ниже, для 10 типов штаммов, выбранных в Примере 2. 10 типов штаммов и контроль инокулировали в колбе с угловыми перегородками (250 мл), содержащей посевную среду, описанную ниже (25 мл), и культивировали со встряхиванием при 30°С и 200 об/мин в течение 20 часов. Посевная среда и продукционная среда имели описанные ниже составы. При завершении культивирования концентрации L-лизина в культуральной среде анализировали посредством ВЭЖХ, и концентрации L-лизина каждого из мутатных штаммов показаны в Таблице 1 ниже.
Посевная среда (рН 7,0)
20 г глюкозы, 10 г пептона, 5 г дрожжевого экстракта, 1,5 г мочевины, 4 г KН2РО4, 8 г K2НРO4, 0,5 г MgSO4 7H2O, 100 мкг биотина, 1000 мкг тиамин-НСl, 2000 мкг пантотената кальция, 2000 мкг никотинамида (на основе 1 л дистиллированной воды).
Продукционная среда (рН 7,0)
100 г глюкозы, 40 г (NH4)2SO4, 2,5 г соевого белка, 5 г твердой фракции кукурузного экстракта, 3 г мочевины, 1 г KН2РО4, 0,5 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамин-НСl, 2000 мкг пантотената кальция, 3000 мкг никотинамида, 30 г СаСО3 (в расчете на 1 л дистиллированной воды).
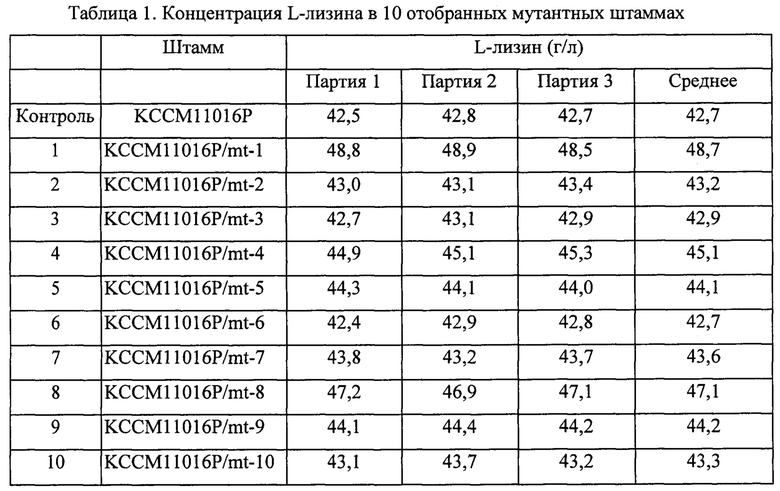
Среди 10 отобранных мутантных штаммов, перечисленных выше, KCCM11016P/mt-1 и KCCM11016P/mt-8 были окончательно отобраны как штаммы, обладающие значительно повышенной продуктивностью по L-лизину.
Пример 4: Подтверждение генов, вовлеченных в продуктивность по L-лизину, у окончательно отобранных штаммов и выбор дополнительных генов-кандидатов
В этом Примере проводили идентификацию генов, которые являются дефектными вследствие случайной вставки транспозона, у штаммов, окончательно отобранных в Примере 3. Геномную ДНК KCCM11016P/mt-1 и KCCM11016P/mt-8 экстрагировали и затем расщепляли. После этого, полученные в результате фрагменты лигировали, ими трансформировали Е. coli DH5a, и затем высевали на твердую среду LB, содержащую канамицин (25 мг/л). После отбора 20 типов трансформированных колоний были получены плазмиды, содержащие части неизвестных генов, и нуклеотидные последовательности анализировали с использованием последовательностей SEQ ID NO: 9 и SEQ ID NO: 10 в наборе EZ-Tn5™<R6Kγori/KAN-2>Tnp Transposome™ (Таблица 2). В результате было подтверждено, что у мутантных штаммов каждый из генов NCgl2108 и NCgl2986 был инактивирован.

Гены NCgl2108 и NCgl2986, идентифицированные как дефектные у мутантных штаммов, выбранных в Примере 3, эндогенно присутствовали в Corynebacterium, и таким образом продукты их экспрессии идентифицировали как белки, вовлеченные в гидролиз клеточной стенки.
На основании результатов отбора 2 типов белков, вовлеченных в гидролиз клеточной стенки, у штаммов со случайными мутациями с использованием транспозонов, посчитали, что недостаточность генов, вовлеченных в гидролиз клеточной стенки, будет эффективной в увеличении продуктивности по L-лизину. Соответственно, был проведен поиск в Национальном Центре Биотехнологической Информации (NCBI) генов, вовлеченных в гидролиз клеточной стенки, отличных от генов NCgl2108 и NCgl2986.
В результате поиска гены NCgl1480 и NCgl2107, которые эндогенно присутствуют у Corynebacterium, были дополнительно выбраны в качестве генов белков, вовлеченных в гидролиз клеточной стенки. Соответственно, для подтверждения того, влияет ли делеция генов NCgl1480 и NCgl2107 на продуктивность по L-лизину, эти гены были выбраны как дополнительные гены-кандидаты для делетирования.
Пример 5: Получение рекомбинантных плазмид для инактивации генов NCgl1480, NCgl2107. NCgl2108 и NCgl2986
В этом Примере для подтверждения того, будет ли инактивация генов NCgl1480, NCgl 2107, NCgl 2108 и NCgl 2986 влиять на продуктивность по L-лизину, были получены рекомбинантные плазмиды для делетирования генов NCgl1480, NCgl2107, NCgl2108 и NCgl2986, выбранных в Примере 4, в хромосомах L-лизин-продуцирующих штаммов Corynebacterium.
На основании нуклеотидных последовательностей, о которых сообщалось в GenBank Национального Института Здоровья США (NIH Genbank), были получены аминокислотные последовательности NCgl1480, NCgl2107, NCgl2108 и NCgl2986, представленные в SEQ ID NO: 1, 2, 3 и 4, а также нуклеотидные последовательности SEQ ID NO: 5, 6, 7 и 8, кодирующие их. Для получения фрагментов генов, в которых открытая рамка считывания каждого из NCgl1480, NCgl2107, NCgl2108 и NCgl2986 имеет внутреннюю делецию, на основании вышеупомянутых SEQ ID NO: 5, 6, 7 и 8 были получены праймеры SEQ ID NO: 11-14 для NCgl1480, 15-18 для NCgl2107, 19-22 для NCgl2108 и 23-26 для NCgl2986. Их последовательности показаны в Таблице 3 ниже.


ПЦР проводили с использованием геномной ДНК Corynebacterium glutamicum АТСС13032 в качестве матрицы наряду с парами нуклеотидных последовательностей SEQ ID NO: 11 и 12, 13 и 14, 15 и 16, 17 и 18, 19 и 20, 21 и 22, 23 и 24 и 25 и 26, в качестве праймеров (Sambrook et ah, Molecular Cloning, a Laboratory Manual (1989), Cold Spring Harbor Laboratories). ПЦР проводили в следующих условиях: 30 циклов, каждый из которых состоял из денатурации при 95°С в течение 30 секунд, отжига при 50°С в течение 30 секунд и элонгации при 72°С в течение 1 минуты.
В результате были получены две пары фрагментов ДНК 319 п.н. и 410 п.н. (NCgl1480-A и NCgl1480-B, соответственно), содержащих участки выше по ходу транскрипции и ниже по ходу транскрипции от гена NCgl1480; две пары фрагментов ДНК 324 п.н. и 300 п.н. (NCgl2107-A и NCgl2107-B, соответственно), содержащих участки выше по ходу транскрипции и ниже по ходу транскрипции от гена NCgl2107; две пары фрагментов ДНК 381 п.н. и 377 п.н. (NCgl2108-A и NCgl2108-B, соответственно), содержащих участки выше по ходу транскрипции и ниже по ходу транскрипции от гена NCgl2108; и два фрагмента ДНК фрагмента ДНК 356 п.н. и 374 п.н. (NCgl2986-A и NCgl2986-B, соответственно), содержащих участки выше по ходу транскрипции и ниже по ходу транскрипции от гена NCgl2986. Фрагменты ДНК, амплифицированные путем ПЦР, конъюгировали с плазмидой pDZ (патент Кореи No. 10-0924065) с помощью набора Infusion Cloning Kit (Invitrogen), трансформировали E.coli DH5α и затем высевали на твердую среду LB, содержащую канамицин (25 мг/л). После отбора колоний, трансформированных плазмидами, в которые желаемые гены были вставлены путем ПЦР,были получены плазмиды с использованием метода выделения плазмид, хорошо известного в данной области техники. Полученные таким образом плазмиды были обозначены как pDZ-ΔNCgl1480, pDZ-ΔNCgl2107, pDZ-ΔNCgl2108 и pDZ-ΔNCgl2986, соответственно. В pDZ-ΔNCgl1480 был делетирован фрагмент гена 1672 п.н. гена NCgl1480; в pDZ-ΔNCgl2107 был делетирован фрагмент гена 1026 п.н. гена NCgl2107; в pDZ-ΔNCgl2108 был делетирован фрагмент гена 576 п.н. гена NCgl2108; и в pDZ-ΔNCgl2986 был делетирован фрагмент гена 1092 п.н. гена NCgl2986.
Пример 6: Получение и оценка штамма с инактивированным геном белка, ассоциированного с гидролизом клеточной стенки, происходящего из лизин-продуцирующего штамма КССМ11016Р
На основе KССМ11016Р, репрезентативного L-лизин-продуцирующего штамма рода Corynebacterium, был получен штамм с инактивированным геном белка, ассоциированного с гидролизом клеточной стенки, выбранный из вышеперечисленных, и была проведена оценка его продуктивности по лизину.
Каждой из 4 рекомбинантных плазмид (pDZ-ΔNCgl1480, pDZ-ΔNCgl2107, pDZ-ΔNCgl2108 и pDZ-ΔNCgl2986), полученных в Примере 5, трансформировали Corynebacterium glutamicum КССМ11016Р, методом электрического импульса, и штаммы, у которых ген-мишень был инактивирован путем гомологичной рекомбинации, были получены, используя метод ПЦР. Полученные инактивированные штаммы были названы KCCM11016P::ΔNCgl1480, KCCM11016P::ΔNCgl2107, KCCM11016P::ΔNCgl2108 и КССМ11016P::ΔNCgl2986, соответственно.
Каждый из 4 штаммов и контрольный штамм инокулировали в колбе с угловыми перегородками (25 мл), содержащей 25 мл следующей посевной среды, и культивировали со встряхиванием при 30°С и 200 об/мин в течение 20 часов. После этого посевную культуру (1 мл) инокулировали в колбу с угловыми перегородками (1 мл), содержащую 24 мл следующей продукционной среды, и культивировали со встряхиванием при 37°С и 200 об/мин в течение 96 часов. Посевная среда и продукционная среда имели следующий состав.
Посевная среда (рН 7,0)
20 г глюкозы, 10 г (NH4)2SO4, 10 г пептона, 5 г дрожжевого экстракта, 1,5 г мочевины, 4 г KН2РO4, 8 г К2НРO4, 0,5 г MgSO4H2O, 100 мкг биотина, 1000 мкг тиамин-НСl, 2000 мкг кальций-пантотената, 2000 мкг никотинамида (в расчете на 1 л дистиллированной воды).
Продукционная среда (рН 7,0)
100 г глюкозы, 40 г (NH4)2SO4, 2,5 г соевого белка, 5 г твердой фракции кукурузного экстракта, 3 г мочевины, 1 г KН2РO4, 0,5 г MgSO4 H2O, 100 мкг биотина, 1000 мкг тиамин-НСl, 2000 мкг кальций-пантотената, 3000 мкг никотинамида, 30 г СаСО3 (в расчете на 1 л дистиллированной воды).
После завершения культивирования концентрации L-лизина анализировали посредством ВЭЖХ, и концентрации показаны в Таблице 4 ниже. Результаты, представленные в Таблице 4, представляют собой результаты трех повторных экспериментов, и продуктивность оценивали на основании средней величины.
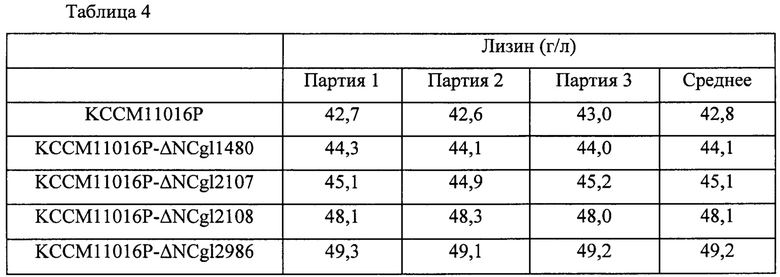
В результате, как показано в Таблице 4 выше, продуктивность по лизину у штамма, в котором каждый из генов NCgl1480, NCgl2107, NCgl2108 и NCgl2986 был инактивирован, увеличивалась на 3,2%, 5,4%, 13% и 15%, соответственно, по сравнению с таковой у родительского штамма KССМ11016Р.
Эти результаты подтверждают, что продуктивность по L-лизину можно повысить путем инактивации белков, вовлеченных в гидролиз клеточной стенки, который может вызывать слияние клеток у микроорганизма рода Corynebacterium.
Соответственно, были проведены эксперименты как описано ниже для определения того, могут или нет проявляться похожие эффекты в случае, когда белки, вовлеченные в гидролиз клеточной стенки, инактивированы у различных микроорганизмов рода Corynebacterium.
Пример 7: Получение и оценка штаммов с инактивированным белком, ассоциированным с гидролизом клеточной стенки, происходящих из L-лизин-продуцирующего штамма KССМ10770Р
Для изучения того, являются ли эффекты инактивации белков, ассоциированных с гидролизом клеточной стенки, у L-лизин-продуцирующего штамма Corynebacterium glutamicum KССМ10770Р (патент Кореи No. 10-0924065), имеющего усиленный путь биосинтеза лизина, подобными экспериментальным результатам, полученным в Примере 6, штаммы, в которых каждый из 4 белков, вовлеченных в гидролиз клеточной стенки, был инактивирован, получали таким же образом как описано в Примере 6. Полученные штаммы были названы KCCM10770P::ΔNCgl1480, KCM10770P::ΔNCgl2107, KCCM10770P::ΔNCgl2108 и KCM10770P::ΔNCgl2986. Сравнивали их продуктивность по L-лизину.
Для сравнения продуктивности по лизину вышеупомянутых штаммов, штаммы и контрольный штамм культивировали таким же образом как в Примере 6. Концентрации L-лизина, проанализированные посредством ВЭЖХ после завершения культивирования, представлены в Таблице 5 ниже. Результаты, представленные в Таблице 5, представляют собой результаты трех повторных экспериментов, и продуктивность оценивали на основании средней величины.

В результате, как показано в Таблице 5 выше, продуктивность по лизину у штамма, в котором каждый из генов NCgl1480, NCgl2107, NCgl2108 и NCgl2986 был инактивирован, повышалась на 2,2%, 4,3%, 12,1% и 14,2%, соответственно, по сравнению с таковой у родительского штамма KССМ10770Р.
Соответственно, было обнаружено, что у Corynebacterium glutamicum KССМ10770Р (патент Кореи No. 10-0924065) продуктивность по L-лизину также может быть улучшена путем инактивации белков, вовлеченных в гидролиз клеточной стенки, таким же образом как в Примере 6.
Пример 8: Получение и оценка штаммов с инактивированным белком, ассоциированным с гидролизом клеточной стенки, происходящих из L-лизин-продуцирующего штамма KССМ11347Р
Для изучения эффектов инактивации белков, ассоциированных с гидролизом клеточной стенки, у L-лизин-продуцирующего штамма Corynebacterium glutamicum KССМ11347Р (микроорганизм был обозначен как KFCC10750 и повторно депонирован в международном органе депонирования в соответствии с Будапештским договором, и затем ему был присвоен депозитарный номер доступа КССМ11347Р; патент Кореи No. 10-0073610), полученного путем искусственной модификации, штаммы, у которых каждый из 4 белков, вовлеченных в гидролиз клеточной стенки, был инактивирован, были получены таким же образом как описано в Примере 6. Полученные штаммы назвали KCCM11347P::ΔNCgl1480, KCCM11347P:ΔNCgl2107, KCCM11347P::ΔNCgl2108 и KССМ11347P:ΔNCgl2986. Сравнивали их продуктивность по L-лизину.
Для сравнения продуктивности по лизину у вышеупомянутых штаммов, эти штаммы и контрольный штамм культивировали таким же образом как в Примере 6. После завершения культивирования концентрации L-лизина анализировали посредством ВЭЖХ, и они представлены в Таблице 6 ниже. Результаты, представленные в Таблице 6, представляют собой результаты трех повторных экспериментов, и продуктивность оценивали на основании средней величины.
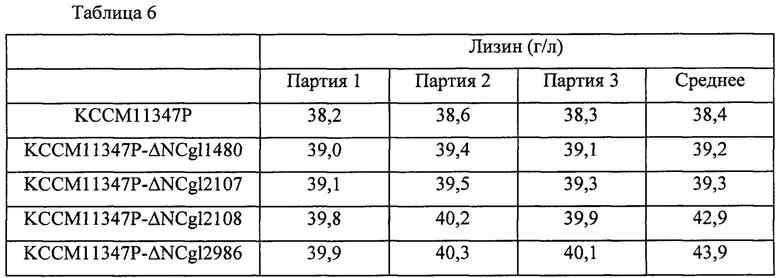
В результате, как показано в Таблице 6 выше, продуктивность по лизину у штамма, в котором каждый из генов NCgl1480, NCgl2107, NCgl2108 и NCgl2986 был инактивирован, увеличивалась на 2%, 2,4%, 11,7% и 14,4%, соответственно, по сравнению с таковой у родительского штамма KССМ11347Р.
Соответственно, было обнаружено, что у Corynebacterium glutamicum KССМ11347Р (патент Кореи No. 10-0073610) продуктивность по L-лизину также может быть улучшена путем инактивации белков, вовлеченных в гидролиз клеточной стенки, таким же образом как в Примерах 6 и 7.
Пример 9: Получение и оценка штаммов с инактивированным белком, ассоциированным с гидролизом клеточной стенки, происходящих из L - лизин-продуцирующего штамма CJ3P
Для изучения того, являются ли эффекты инактивации белков, ассоциированных с гидролизом клеточной стенки, у Corynebacterium glutamicum CJ3P (Binder et al. Genome Biology 2012, 13:R40), который продуцирует L-лизин путем введения 3 типов модификаций [pyc (P458S), hom(V59A) и lysC(T311I)] в Corynebacterium glutamicum дикого типа, подобными экспериментальным результатам, полученным в Примерах 6, 7 и 8, штаммы, в которых каждый из 4 белков, вовлеченных в гидролиз клеточной стенки, был инактивирован, получали таким же образом как описано в Примере 6. Полученные штаммы назвали CJ3P::ΔNCgl1480, CJ3P::ΔNCgl2107, CJ3P::ΔNCgl2108 и CJ3P::ΔNCgl2986. Сравнивали их продуктивность по L-лизину.
Для сравнения продуктивности по лизину у вышеперечисленных штаммов, эти штаммы и контрольный штамм культивировали таким же образом как в Примере 6. Концентрации L-лизина, проанализированные посредством ВЭЖХ после завершения культивирования, представлены в Таблице 7 ниже. Результаты, представленные в Таблице 7, представляют собой результаты трех независимых экспериментов, и продуктивность оценивали на основании средней величины.
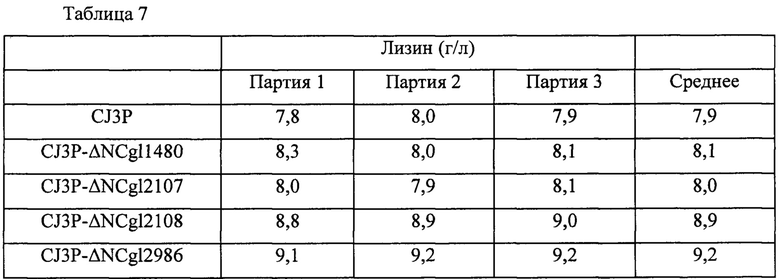
В результате, как показано в Таблице 7 выше, продуктивность по лизину у штамма, в котором каждый из генов NCgl1480, NCgl2107, NCgl2108 и NCgl2986 был инактивирован, увеличивалась на 3%, 1,3%, 12,7% и 16%, соответственно, по сравнению с таковой у родительского штамма CJ3P.
Соответственно, было обнаружено, что у Corynebacterium glutamicum CJ3P продуктивность по L-лизину также может быть улучшена путем инактивации белков, вовлеченных в гидролиз клеточной стенки, таким же образом как в Примерах 6, 7 и 8.
Пример 10; Получение и оценка штамма с одновременно инактивированными белками, ассоциированными с гидролизом клеточной стенки, происходящего из L-лизин-продуцирующего штамма KССМ11016Р
После подтверждения на основании приведенных выше Примеров того, что продуктивность по L-лизину увеличивалась, когда каждый из белков, вовлеченных в гидролиз клеточной стенки, был инактивирован в L-лизин-продуцирующем штамме Corynebacterium, предприняли попытку определить, будет ли также увеличиваться продуктивность по L-лизину при одновременной инактивации 2 релевантных белков.
Следовательно, был проведен следующий эксперимент для подтверждения эффекта одновременной инактивации белков, вовлеченных в гидролиз клеточной стенки, у L-лизин-продуцирующего штамма Corynebacterium. Штамм, у которого два типа генов белков (NCgl2108 и NCgl2986), вовлеченных в гидролиз клеточной стенки, которые являются высокоэффективными в усилении продуктивности по L-лизину, когда каждый из этих белков является дефектным, были одновременно инактивированы, был получен таким же образом как в Примере 6. Полученный штамм был обозначен как KССМ11016Р::ΔNCgl2108/ΔNCgl2986. Сравнивали продуктивность по L-лизину.
Для сравнения продуктивности по L-лизину вышеупомянутого штамма этот штамм и контрольный штамм культивировали таким же образом как в Примере 6. Концентрации L-лизина, проанализированные методом ВЭЖХ после завершения культивирования, показаны в Таблице 8 ниже. Результаты, представленные в Таблице 8, представляют собой результаты трех повторных экспериментов, и продуктивность оценивали на основании средней величины.
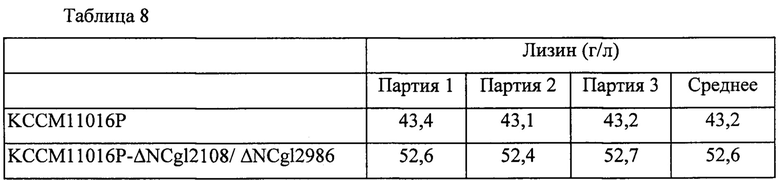
В результате, как показано в Таблице 8, продуктивность по лизину у штамма, в котором гены NCgl2108 и NCgl2986 были одновременно инактивированы, была увеличена на 21,6%, по сравнению с таковой у родительского штамма KССМ11016Р.
Такой результат подтверждает, что продуктивность по L-лизину может быть повышена даже в том случае, когда не только один белок, но также два или более белков, вовлеченных в гидролиз клеточной стенки, были одновременно инактивированы у микроорганизма рода Corynebacterium.
В этом отношении вышеупомянутый штамм KССМ11016P-ΔNCgl2986 получил название СА01-2292. СА01-2292 был депонирован в Корейском центре культур микроорганизмов (KССМ), международном органе депонирования, в соответствии с Будапештским договором, и затем ему был присвоен депозитарный номер доступа KССМ11627Р.
На основании этих результатов было подтверждено, что штаммы, продуцирующие L-лизин, обладают эффектом усиления продуктивности по L-лизину путем регулирования лизиса клеток во время ферментации, где белки, вовлеченные в гидролиз клеточной стенки, были инактивированы по сравнению с их эндогенной активностью. Также дополнительно было подтверждено, что продуктивность по L-лизину может быть повышена, когда не только один, но также два или более белков, вовлеченных в гидролиз клеточной стенки, были одновременно инактивированы, тем самым предоставив новый штамм, продуцирующий L-лизин.
Несмотря на то, что настоящее изобретение было описано со ссылкой на конкретные иллюстративные воплощения, специалист в области техники, к которой принадлежит данное изобретение, понимает, что настоящее изобретение может быть воплощено в других конкретных формах без отступления от технической идеи или существенных признаков настоящего изобретения. Следовательно, воплощения, раскрытые выше, во всех отношениях рассматриваются как иллюстративные и не предназначены ограничивать объем настоящего изобретения. Более того, объем настоящего изобретения определяется прилагаемой формулой изобретения, нежели подробным описанием, и следует понимать, что все модификации или вариации, выводимые из значений и объема настоящего изобретения, и их эквиваленты включены в объем прилагаемой формулы.
Группа изобретений относится к области биотехнологии. Предложен микроорганизм рода Corynebacterium, модифицированный таким образом, что активность белка, вовлеченного в гидролиз клеточной стенки, инактивирована по сравнению с его эндогенной активностью. Предложен способ получения L-лизина с использованием указанного микроорганизма. Группа изобретений позволяет повысить продуктивность по L-лизину в модифицированном микроорганизме по сравнению с родительским микроорганизмом. 2 н. и 2 з.п. ф-лы, 8 табл., 10 пр.
1. Микроорганизм рода Corynebacterium, обладающий повышенной продуктивностью по L-лизину по сравнению с немодифицированным микроорганизмом, модифицированный таким образом, что активность белка, вовлеченного в гидролиз клеточной стенки, инактивирована по сравнению с его эндогенной активностью.
2. Микроорганизм по п. 1, где белок, вовлеченный в гидролиз клеточной стенки, представляет собой по меньшей мере один белок, выбранный из группы, состоящей из белков, содержащих аминокислотные последовательности SEQ ID NO: 1-4.
3. Микроорганизм по п. 1, где микроорганизм рода Corynebacterium представляет собой Corynebacterium glutamicum.
4. Способ получения L-лизина, включающий:
(1) культивирование микроорганизма рода Corynebacterium по любому из пп. 1-3 в среде и
(2) выделение L-лизина из культуральной среды или из микроорганизма.
| JIANZHONG XU et al., Metabolic engineering Corynebacterium glutamicum for the L-lysine production by increasing the flux into L-lysine biosynthetic pathway, Amino Acids Vol | |||
| Способ изготовления звездочек для французской бороны-катка | 1922 |
|
SU46A1 |
| Способ разделения гафния и циркония | 1924 |
|
SU2165A1 |
| KR 100838035 B1, 12.06.2008 | |||
| US 2007254345 A1, 01.11.2007 | |||
| NAKAMURA J | |||
| et al., Mutations of the Corynebacterium glutamicum NCgl1221 Gene, Encoding a Mechanosensitive Channel Homolog, Induce L-Glutamic Acid Production, APPLIED AND ENVIRONMENTAL MICROBIOLOGY Vol | |||
| Способ подготовки рафинадного сахара к высушиванию | 0 |
|
SU73A1 |
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| КАТОДНЫЙ ГЕНЕРАТОР | 1926 |
|
SU4491A1 |
| NICK KENJI OLRICHS, Bugging the cell wall of bacteria: Novel insights into peptidoglycan biosynthesis and its inhibition, Utrecht University, pp | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| RU 2000117787 A, 27.12.2002. | |||
Авторы
Даты
2019-03-28—Публикация
2016-06-27—Подача