Изобретение относится к биотехнологии, ветеринарной вирусологии и микробиологии.
Иммуногенность и эффективность вакцин в значительной степени увеличивается с использованием в технологии их изготовления неспецифических стимуляторов иммунитета - адъювантов.
Известно, что при изготовлении средств специфической профилактики инфекционных болезней животных нашли применение, главным образом, два типа адъювантов: сорбционные (гидроксид алюминия, оксид кремния, алюмокалиевые квасцы) и масляные - для получения эмульсионных вакцин (адъювант Фрейнда и многочисленные его разновидности).
Преимущества эмульсионных вакцин перед сорбционными заключаются в пролонгировании действия антигена, лучшей его сохранности, возможности введения менее концентрированной антигенной части, позволяет не проводить дополнительную вакцинацию животных за счет адъювантных свойств.
Свойства масляных эмульсионных вакцин описываются положениями коллоидной химии и в соответствии с ними классифицируются по типу получаемой эмульсии: «вода в масле» или обратные эмульсии (антиген находится внутри мицелл и закрыт эмульгатором и маслом; «вода в масле в воде» или сложные эмульсии (антиген находится как внутри мицелл, так и в водной фазе), «масло в воде» или прямые эмульсии (антиген находится в водной фазе) [1, 2].
Процесс изготовления вакцины инактивированной эмульсионной против ящура состоит из следующих этапов:
- культивирование вирусного антигена в суспензионной культуре, преимущественно в культуре клеток ВНК-21,
- очистка вирусной суспензии от балластных примесей,
- инактивация вирусной суспензии,
- концентрирование полученного антигена вируса ящура,
- соединение концентрата антигена с масляным адъювантом (эмульгирование).
Известен способ изготовления вакцины против ящура и вакцина против ящура типа А [3], который заключается в том, что изготовление вакцины против ящура типа А включает репродукцию вирусного антигена в суспензионной культуре клеток ВНК-21, инактивацию вирусного антигена, очистку от балластных примесей и концентрирование антигена при помощи проточной ультрафильтрации или полиэтиленгликоля. Для изготовления эмульсионной вакцины используют антигенный материал с содержанием иммуногенных (146S+75S) компонентов вируса ящура, по меньшей мере, 2,0 мкг/см3.
Недостатком указанного способа является то, что предлагаемое количество иммуногенных компонентов не обеспечивает образования высокого уровня гуморального иммунитета. Количество иммуногенных компонентов повышают за счет увеличения прививной дозы для КРС.
Известен способ изготовления вакцины против ящура и вакцина против ящура типа О [4], который заключается в том, что изготовление вакцины против ящура типа О включает репродукцию вирусного антигена в суспензионной культуре клеток ВНК-21, инактивацию вирусного антигена, очистку от балластных примесей и концентрирование антигена при помощи проточной ультрафильтрации или полиэтиленгликоля. Для изготовления адсорбат и эмульсионной вакцины используют антигенный материал с содержанием иммуногенных (146S+75S) компонентов вируса ящура, по меньшей мере, 4,0 мкг/см3.
Недостатком указанного способа является то, что вакцина обладает выраженной иммуногенной активностью для КРС в дозе 5 см3.
Известна вакцина инактивированная эмульсионная против ящура типа А [5]. Вакцина содержит авирулентный и очищенный антигенный материал, полученный в перевиваемой культуре клеток ВНК-21.
Антигенный материал представляет собой суспензию, содержащую преимущественно 146S и 75S иммуногенные компоненты вируса ящура. Кроме того, вакцина содержит поддерживающую среду и масляный адъювант в эффективных соотношениях. В качестве поддерживающей среды используют раствор Эрла без сыворотки с добавлением ФГМС, ГБКС и антибиотиков при рН 7,4-7,6. Из масляных адъювантов вакцина содержит масляный адъювант ВНИИЗЖ или масляный адъювант марок Montanide ISA-70 или Montanide ISA-206 производства фирмы «Seppic» (Франция).
Недостатком указанного способа является то, что вакцина обладает иммуногенной активностью для КРС в дозе 5,0 см3.
Наиболее близким аналогом является способ изготовления и вакцина инактивированная эмульсионная против ящура типа А [5].
Проблема, на решение которой направлено настоящее изобретение - получить препарат, обладающий высокими иммуностимулирующими свойствами при использовании различных антигенных материалов вируса ящура разных типов.
Для этого был разработан новый способ изготовления вакцины инактивированной эмульсионной против ящура.
Решение проблемы в части способа, включающем культивирование вирусного антигена в суспензионной культуре клеток ВНК-21, очистку вирусной суспензии от балластных примесей, инактивацию, концентрирование полученного антигена вируса ящура и соединение концентрата антигена с масляным адъювантом, заключается в результате использования в качестве адъюванта масляного адъюванта Montanide ISA-61 VG (Seppic, Франция), разработки режимов, определения соотношения водной и масляной фаз и параметров производства противоящурной вакцины.
Montanide ISA-61 VG - адъювант на основе минерального масла, который был разработан для производства эмульсий вода в масле (В/М). Он содержит особое обогащенное светлое минеральное масло и высокоочищенное ПАВ, полученное из маннитола и очищенной олеиновой кислоты растительного происхождения. Montanide ISA-61 VG не содержит компонентов животного происхождения.
В результате разработки нами было установлено, что рецептуры вакцин против ящура с Montanide ISA 61 VG вызывают напряженный и продолжительный иммунный ответ. По сравнению с традиционными масляными эмульсиями, эмульсия с Montanide ISA 61 VG является более стабильной и обладает низкой вязкостью. Обеспечивая высокую и долговременную защиту, вакцина с этим адъювантом может содержать антиген вируса ящура в низких концентрациях.
Вирус ящура культивируют в суспензионной культуре клеток ВНК-21 в течение 10-18 ч при температуре 36-37°С. При достижении количества мертвых клеток 90-95% прекращают культивирование. Вируссодержащую суспензию контролируют на стерильность и содержание 146S иммуногенных компонентов. Сразу по окончании цикла репродукции вируса, не прекращая термостатирования, в вируссодержащую суспензию добавляют 15-20% раствор АЭЭИ, подкисленный ледяной уксусной кислотой до рН 8,0-8,5. Инактивацию инфекционности вируса проводят в течение 12-24 часов при 36-37°С и рН 7,2-7,6 с перемешиванием через 5-6 часов в течение 3-5 минут. Остаток АЭЭИ нейтрализуют добавлением тиосульфата натрия.
При температуре суспензии 36-37°С добавляют 10% раствор ПГМГ до концентрации 0,005-0,007% для флокуляции балластных примесей и инактивации возможных контаминантов. Флокулированные балластные примеси подвергают седиментации с последующей декантацией.
Полученный антиген контролируют на авирулентность в первично-трипсинизированной культуре клеток свиной почки, содержание вирусспецифического белка, 146S иммуногенных компонентов вируса и стерильность.
После контроля на авирулентность и стерильность вируссодержащую суспензию фильтруют через фильтр с порами 1,2 и 0,6 мкм для удаления оставшихся частиц с помощью фильтровальной установки.
Необходимое количество 146S иммуногенных компонентов в 1 см3 концентрата достигают с помощью проточной ультрафильтрации. Ультрафильтрацию проводят под давлением 1,5 атм.
В полученном концентрате проверяют количество растворимого балластного белка и прозрачность. При показании прозрачности ниже 90% или наличие растворимого балластного белка выше 10 мг/см3, полученный концентрат дополнительно фильтруют через фильтры с порами 0,45 мкм.
Адъювант Montanide ISA-61 VG стерилизуют через фильтр с порами 0,20 мкм при давлении 1,1-1,2 атм.
Эмульгирование (соединение концентрата антигена с адъювантом Montanide ISA-61 VG) проводят при помощи проточного смесителя в соотношении от 40÷60 до 50÷:50 по весу, при температуре 18-25°С.
При разработке способа изготовления особое внимание было уделено, способам концентрирования, очистки инактивированной суспензии и концентрата, определению наиболее оптимального соотношения масляной и водной фазы. Масляные адъюванты, предназначенные для получения эмульсии вода в масле, обычно используют в соотношении 70:30.
Обычно при изготовлении эмульсионной вакцины против ящура с типом эмульсии «вода в масле в воде» получают путем смешивания концентрата антигена и масляного адъюванта при температуре 30-33°С в соотношении 50:50 по весу.
При изготовлении эмульсионной вакцины с адъювантом Montanide ISA-61 VG антиген и масляный адъювант смешивают в соотношении от 40÷60 до 50÷:50 как по весу, так и по объему, что дает возможность увеличения количества 146S иммуногенных компонентов в прививном объеме препарата. Увеличение количества 146S иммуногенных компонентов позволяет повысить иммунный статус животных. Смешивание антигена и масляного адъюванта в равных пропорциях дает возможность концентрировать полуфабрикат примерно в 2 раза меньше.
При использовании адъюванта Montanide ISA-61 VG удалось избежать потерь вирусной суспензии вследствие щадящей очистки.
Соединение концентрата с масляным адъювантом Montanide ISA-61 VG проводят без предварительного подогрева вирусной суспензии и адъюванта. Подогрев антигена вируса ящура отрицательно влияет на иммуногенные компоненты. За счет этого еще дополнительно удалось увеличить количество 146S иммуногенных компонентов в прививном объеме препарата, что позволяет эффективно применять прививную дозу 2,0 см3 для КРС.
Способ изготовления вакцины интактивированной эмульсионной против ящура состоит из следующих этапов:
- в качестве вирусного антигена используют вирус ящура типа А и/или вирус ящура типа О, и/или вирус ящура типа Азия-1;
- для изготовления вакцины в качестве чувствительной биологической системы используют предпочтительно суспензионную культуру клеток ВНК-21, а в качестве поддерживающей среды раствор Эрла без сыворотки с добавлением ферментативных гидролизатов мышц сухого (ФГМС), гидролизатов белков крови сухого (ГБКС) и антибиотиков при рН 7,4-7,6;
- культивирование проводят в течение 10-18 ч при температуре 36-37°С;
- после окончания процесса культивирования вирусного антигена к нему добавляют хлороформ до конечной концентрации 0,2%;
- для инактивации вируса используют АЭЭИ, который добавляют в вируссодержащую суспензию до концентрации 0,025-0,05%. По окончании инактивации АЭЭИ нейтрализуют внесением в суспензию тиосульфата натрия [6].
- очистку вирусной суспензии осуществляют путем добавления полигексаметиленгуанидина гидрохлорида (ПГМГ), который вносят в суспензию до концентрации 0,005-0,007% [7];
- дополнительную очистку вируссодержащей суспензии проводят путем пропускания через фильтры с порами 1,2 и 0,6 мкм под давлением 1,5 атм;
- для изготовления эмульсионной вакцины антиген концентрируют проточной ультрафильтрацией под давлением 1,5 атм;
- при показании прозрачности ниже 90% или наличии растворимого балластного белка выше 10 мг/см3, полученный концентрат дополнительно очищают через фильтры с порами 0,45 мкм;
- для изготовления эмульсионной вакцины используют авирулентный и очищенный антигенный материал с содержанием иммуногенных (146S) компонентов вируса ящура не менее 6 мкг по каждому типу в 1 см3;
- масляный адъювант Montanide ISA-61 VG стерилизуют при помощи фильтровальной установки, пропуская масляный адъювант через фильтр с размером пор 0,2 мкм при давлении 1,1-1,2 атмосферы;
- эмульсионную вакцину получают путем диспергирования при помощи проточного смесителя концентрата ящурного антигена и масляного адъюванта Montanide ISA-61 VG в соотношении от 40÷60 до 50÷50 по массе при температуре 18-25°С.
При этом в части вакцины, полученной заявленным способом, содержащей авирулентный и очищенный антигенный материал вируса ящура типа А и/или вируса ящура типа О, и/или вируса ящура типа Азия-1 в эффективном количестве, содержащий преимущественно 146S иммуногенные компоненты и масляный адъювант Montanide ISA-61 VG названная проблема решается тем, что:
1. в качестве авирулентного очищенного антигенного материала вируса ящура типа А вакцина содержит авирулентный очищенный антигенный материал штамма вируса ящура типа А в количестве не менее 3,0 мкг 146S иммуногенных компонентов в 1 см3 готового препарата;
2. в качестве авирулентного очищенного антигенного материала вируса ящура типа А вакцина содержит авирулентный очищенный антигенный материал штамма А №2155/Забайкальский/2013 [8] в количестве не менее 3,0 мкг 146S иммуногенных компонентов в 1 см3 готового препарата;
3. в качестве авирулентного очищенного антигенного материала вируса ящура типа О вакцина содержит авирулентный очищенный антигенный материал штамма вируса ящура типа О в количестве не менее 3,0 мкг 146S иммуногенных компонентов в 1 см3 готового препарата;
4. в качестве авирулентного очищенного антигенного материала вируса ящура типа О вакцина содержит авирулентный очищенный антигенный материал штамма О №2123/Южная Осетия/2011 [9] в количестве не менее 3 мкг 146S иммуногенного компонента в 1 см3 готового препарата;
5. в качестве авирулентного очищенного антигенного материала вируса ящура типа Азия-1 вакцина содержит авирулентный очищенный антигенный материал штамма вируса ящура типа Азия-1 в количестве не менее 3,0 мкг 146S иммуногенных компонентов в 1 см3 готового препарата;
6. в качестве авирулентного очищенного антигенного материала вируса ящура типа Азия-1 вакцина содержит авирулентный очищенный антигенный материал штамма Азия-1 №1946/Шамир 3/89 [9] в количестве не менее 3 мкг 146S иммуногенного компонента в 1 см3 готового препарата;
7. вакцина содержит авирулентный очищенный антигенный материал вируса ящура и масляный адъювант Montanide ISA-61 VG в соотношении от 40÷60 до 50÷50 при следующем количестве, мкг в 1 см3 готового препарата:
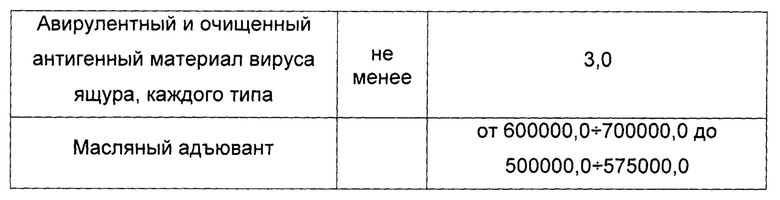
Технический результат группы изобретений заключается в повышении уровня гуморального иммунитета, изготовлении эмульсионной вакцины в разных пропорциях водной и масляной фазы, увеличении содержания иммуногенных компонентов в меньшем прививном объеме, уменьшении потерь компонентов при изготовлении эмульсионной вакцины в соотношении от 40÷60 до 50÷50, уменьшении кратности концентрирования для получения более эффективных, безопасных и экономически целесообразных противоящурных препаратов, повышении напряженности и продолжительности иммуногенной активности вакцин против ящура, снижении реактогенности, улучшении стабильности.
Технический результат от изобретения в части вакцины заключается в повышении напряженности и продолжительности иммуногенной активности вакцин против ящура, снижении реактогенности, улучшении стабильности препарата, а также в расширении арсенала имеющихся средств специфической профилактики ящура.
Основной технический результат заключается в уменьшении содержания антигенов в прививной дозе, за счет значительного снижения содержания иммуногенных компонентов в вирусной суспензии, которая используется для получения вакцины.
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают его объем.
Пример 1. Для изготовления вакцины используют вирус ящура А №2155/Забайкальский/2013, который культивируют в суспензионной культуре клеток ВНК-21 при температуре 36-37°С. Через 6-7 часов инкубирования проводят подсчет живых и мертвых клеток при окраске трипановым синим. При достижении количества мертвых клеток 90-95% культивирование прекращают и вируссодержащую суспензию контролируют на стерильность и содержание 146S компонентов. Количество 146S компонентов в суспензии не менее 0,5 мкг/см3. Сразу по окончании цикла репродукции вируса, не прекращая термостатирования, в вируссодержащую суспензию добавляют 15-20% раствор АЭЭИ, подкисленный ледяной уксусной кислотой до рН 8,0-8,5. Конечная концентрация АЭЭИ в вируссодержащей суспензии должна быть равной 0,025-0,05%. Инактивацию инфекционности вируса проводят в течение 12-24 часов при 36-37°С и рН 7,2-7,6 с перемешиванием через 5-6 часов в течение 3-5 минут. Остаток АЭЭИ нейтрализуют добавлением тиосульфата натрия.
При температуре суспензии 36-37°С добавляют 10% раствор ПГМГ до концентрации 0,005-0,007% для флокуляции балластных примесей и инактивации возможных контаминантов. Флокулированные балластные примеси подвергают седиментации с последующей декантацией.
Необходимое количество иммуногенных компонентов 146S достигают при помощи ультрафильтрации. Конечная концентрация 146S компонентов вируса ящура должна быть, не менее 3,0 мкг в 1 см3 готового препарата. Адъювант Montanide ISA-61 VG стерилизуют через фильтр с порами 0,2 мкм. Затем антиген смешивают с масляным адъювантом Montanide ISA-61 VG при температуре 18-25°С.
Приготовленную вакцину расфасовывают во флаконы и проверяют на стерильность, авирулентность, безвредность, иммуногенность и стабильность.
Пример 2. Для изготовления вакцины использовали вирус ящура О №2123/Южная Осетия/2011. Вакцину готовили так, как описано в примере 1.
Приготовленную вакцину расфасовывают во флаконы и проверяют на стерильность, авирулентность, безвредность, иммуногенность и стабильность.
Пример 3. Для изготовления вакцины используют вирус ящура Азия-1 №1946/Шамир 3/89. Вакцина изготавливалась так, как описано в примере 1.
Приготовленную вакцину расфасовывают во флаконы и проверяют на стерильность, авирулентность, безвредность, иммуногенность и стабильность.
Пример 4. Инактивированную эмульсионную вакцину против ящура типов А и О изготавливают из штаммов вируса ящура А №2155/Забайкальский/2013 и О №2123/Южная Осетия/2011. Штаммы вируса ящура культивируют в отдельных биореакторах. После этого штаммы концентрируют либо по отдельности и затем смешивают в зависимости от содержания иммуногенных компонентов, либо после смешивания также проводят концентрирование. После этого добавляют масляный адъювант Montanide ISA-61 VG.
Приготовленную вакцину расфасовывают во флаконы и проверяют на стерильность, авирулентность, безвредность, иммуногенность и стабильность.
Пример 5. Инактивированную эмульсионную вакцину против ящура типов А, О, Азия-1 изготавливают из штаммов вируса ящура А №2155/Забайкальский/2013, О №2123/Южная Осетия/2011 и Азия-1 №1946/Шамир 3/89. Штаммы вируса ящура культивируют в отдельных биореакторах. После этого штаммы концентрируют по отдельности и затем смешивают в зависимости от содержания иммуногенных компонентов. После этого добавляют масляный адъювант Montanide ISA-61 VG.
Приготовленную вакцину расфасовывают во флаконы и проверяют на стерильность, авирулентность, безвредность, иммуногенность и стабильность.
Пример 6. Проведены испытания иммуногенной активности инактивированной эмульсионной вакцины против ящура типа А №2155/Забайкальский/2013 на подсвинках с масляными адъювантами Montanide ISA-206 и Montanide ISA-61 VG, изготовленной так, как описано в примере 1, и содержащей, мкг в 2,0 см3:


Животных прививали внутримышечно в дозе 2,0 см3.
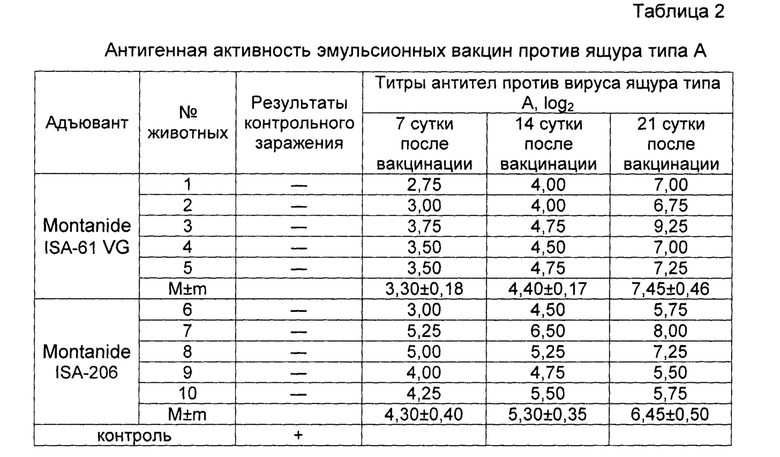
Результаты испытаний представлены в таблице 2. Из результатов, представленных в таблице видно, что титр антител на 21 сутки после иммунизации у животных привитых вакциной на основе масляного адъюванта Montanide ISA-61 VG был в 2 раза выше, чем у животных инокулированных вакциной с адъювантом Montanide ISA-206.
Пример 7. Проведены испытания иммуногенной активности инактивированной эмульсионной вакцины против ящура типа О №2123/Южная Осетия/2011 на КРС с масляными адъювантами Montanide ISA-206 и Montanide ISA-61 VG, изготовленной так, как описано в примере 2, и содержащей, мкг в 2,0 см3:


Животных вакцинировали внутримышечно в дозе 2,0 см3.
Результаты опыта отображены в таблице 3. Эмульсионная вакцина с Montanide ISA-61 VG стимулировала выработку вируснейтрализующих антител в 2 раза больше, чем с Montanide ISA-206.
Пример 8. Проведены испытания иммуногенной активности инактивированной эмульсионной вакцины против ящура типа Азия-1 №1946/Шамир 3/89 на КРС с масляными адъювантами Montanide ISA-70 и Montanide ISA-61 VG, изготовленной так, как описано в примере 3, и содержащей, мкг в 2,0 см3:


Животных вакцинировали внутримышечно в дозе 2,0 см3.
Результаты опыта показаны в таблице 4. Данные представленные в таблице показывают, что вакцина с Montanide ISA-61 VG индуцировала на 21 сутки титр антител на уровне 5,90±0,27 log2, вакцина с Montanide ISA-70 - 4,95±0,18 log2.
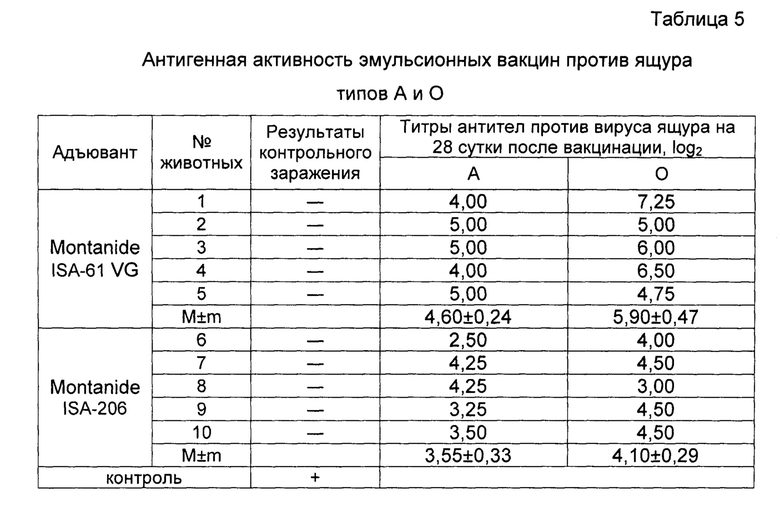
Пример 9. Проведены испытания иммуногенной активности инактивированных эмульсионных вакцин против ящура типов А №2155/Забайкальский/2013 и О №2123/Южная Осетия/2011 на КРС с масляными адъювантами Montanide ISA-206 и Montanide ISA-61 VG, изготовленных так, как описано в примере 4, и содержащей, мкг в 2,0 см3: 

Животных вакцинировали внутримышечно в дозе 2,0 см3.
Результаты опыта отображены в таблице 5. Из таблицы следует, что индукция антител против вируса ящура после инокуляции вакциной с масляным адъювантом Montanide ISA-61 VG по типу А была в 2,1 раза выше, а по типу О в 3,5 раза выше, чем у вакцины с масляным адъювантом Montanide ISA-206.
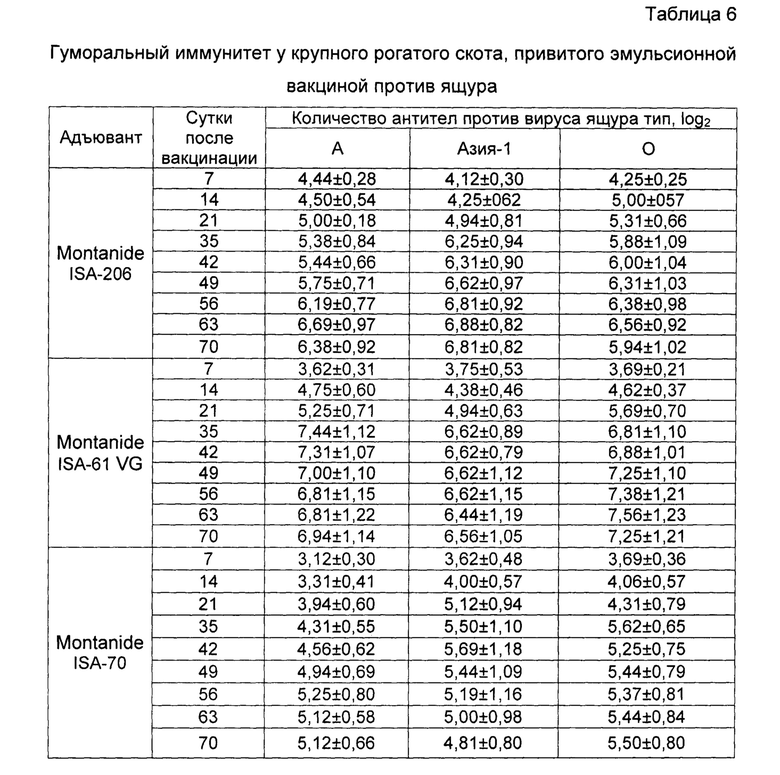
Пример 10. Проведены испытания иммуногенной активности инактивированной эмульсионной вакцины против ящура типов А №2155/Забайкальский/2013, О №2123/Южная Осетия/2011 и Азия-1 №1946/Шамир 3/89, изготовленной так, как описано в примере 5, и содержащей, мкг в 2,0 см3:

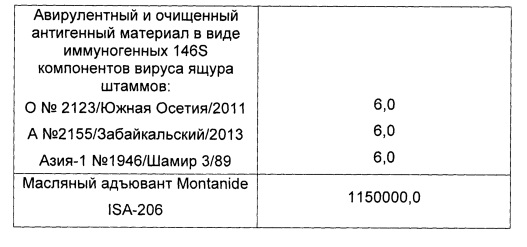
Животных вакцинировали внутримышечно в дозе 2,0 см3.
Результаты опыта показаны в таблице 6. По результатам испытаний можно сделать вывод, что уровень гуморального иммунитета у животных привитых вакциной с масляным адъювантом Montanide ISA-61 VG на 70 сутки превышал гуморальный иммунитет животных инокулированных вакцинами с масляным адъювантом Montanide ISA-70 и масляным адъювантом Montanide ISA-206 по типу А в 3,5 и в 1,5 раза, соответственно. Индуцирование вируснейтрализующих антител у животных привитых вакцинами с масляным адъювантом Montanide ISA-61 VG и масляным адъювантом Montanide ISA-206 по типу О не отличался. Выработка антител по типу О у животных иммунизированных вакциной с масляным адъювантом Montanide ISA-61 VG была в 3,4 раза выше, чем у животных привитых вакциной с масляным адъювантом Montanide ISA-70. По типу Азия-1 индуцирование гуморального иммунитета у животных привитых вакциной с масляным адъювантом Montanide ISA-61 VG в 2,5 раза и в 3,4 раза выше, чем у животных инокулированных вакцинами с масляным адъювантом Montanide ISA-206 и с масляным адъювантом Montanide ISA-70, соответственно.
Пример 11. Проведены испытания реактогенности инактивированной эмульсионной вакцины против ящура типов А №2155/Забайкальский/2013, О №2123/Южная Осетия/2011, Азия-1 №1946/Шамир 3/89. Результаты исследований представлены в таблице 7.
Исследования показали, что при введении эмульсионной вакцины с адъювантом Montanide ISA-61 VG гранулема на 7 сутки была только у одного животного, объем которой составил 0,006 см3 при внутримышечном введении, а при подкожном введении на 7 сутки гранулемы были объемом 39,9 и 177,4 см3. Тогда как после введения вакцины с адъювантом Montanide ISA-206 гранулемы на 7 сутки наблюдались у всех животных размером 0,5-3 см3 при внутримышечном введении. При подкожном введении объем гранулем составил 52 и 180,5 см3. При внутримышечном введении вакцины с адъювантом Montanide ISA-70 на 7 сутки гранулема наблюдалась у одного животного размером 0,05 см3, а при подкожном введении объем гранулем составил 54,81 и 1618,75 см3. На 14 сутки гранулемы не наблюдались ни у одного животного. Животные, привитые подкожно вакцинами с адъювантом Montanide ISA-61 VG и адъювантом Montanide ISA-206 на 35 сутки имели незначительные гранулемы объемом 1,00 и 1,04 см3. Тогда как животные, иммунизированные вакциной с адъювантом Montanide ISA-70, имели гранулемы 1,12 и 8,7 см3.
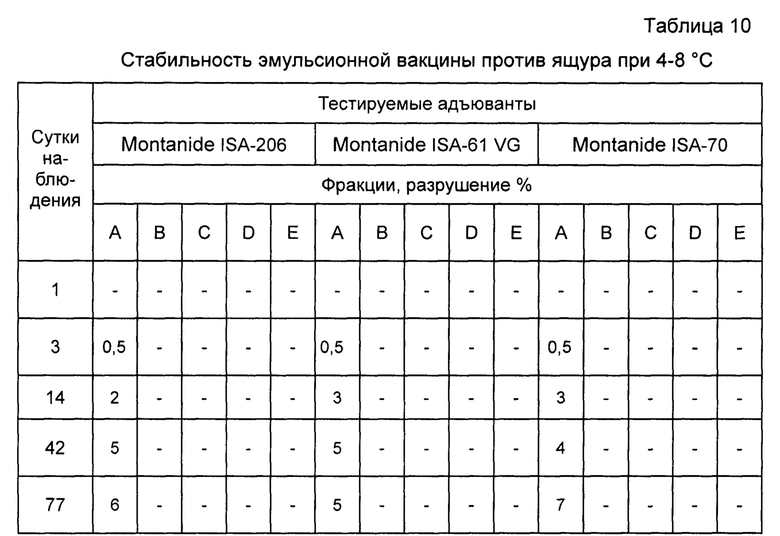
Пример 12. Проведены испытания стабильности инактивированной эмульсионной вакцины против ящура типов А, О, Азия-1. Результаты исследований отображены в таблицах 8, 9, 10.
Как видно из таблиц, вакцина, приготовленная на основе масляного адъюванта Montanide ISA-61 VG более стабильна при равных условиях испытаний.
Источники информации
1. Пат. РФ 2510845, МПК A61K 39/39, A61K 39/113, Адъювант, опубл. 10.04.2014 г.
2. Сумм Б.Д. Основы коллоидной химии. - 2007, М., 240 с.
3. Пат. РФ 2143921, МПК A61K 39/135, C07K 14/09, C12N 7/04, Вакцина против ящура типа А и способ ее изготовления, опубл. 10.01.2000 г.
4. Пат. РФ 2212895, МПК A61K 39/135, C12N 7/04, Вакцина против ящура типа О и способ ее изготовления, опубл. 27.09.2003 г.
5 Пат. РФ 2294759 A61K 39/135, А61Р 31/12, Вакцина инактивированная эмульсионная против ящура типа А, опубл. 10.03.2007 г.
6. А.С. 594771, А61K 39/12, C12N 7/04, Средство для инактивации вирусов при изготовлении противовирусных препаратов, опубл. 07.07.1993 г.
7. Пат. РФ 2054039, C12N 7/02, А61K 39/135, Способ очистки и стерилизации культурального вируса ящура, опубл. 10.02.1996 г.
8. Пат. РФ 2603255, A61K 39/135, C12N 7/04, Штамм А №2155/Забайкальский/2013 вируса ящура Aphtae epizooticae типа А для контроля антигенной и иммуногенной активности и для изготовления биопрепаратов для диагностики и специфической профилактики ящура типа А, опубл. 27.11.2016 г.
9. Пат. РФ 2593718, A61K 39/135, C12N 7/04, Вакцина инактивированная эмульсионная против ящура типов А, О, Азия-1, опубл. 10.08.2016 г.

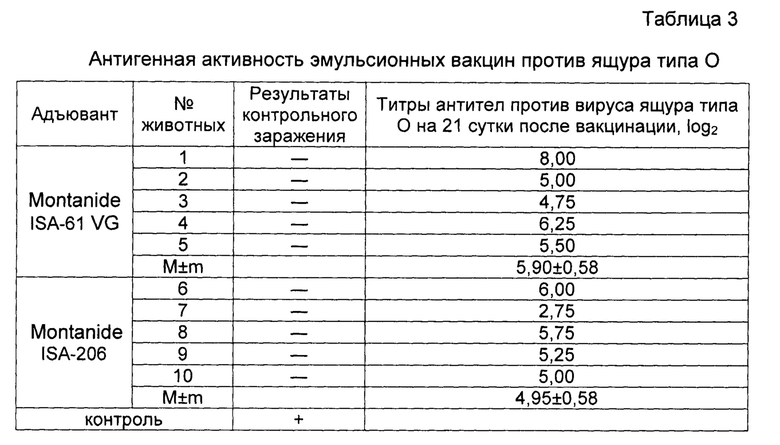
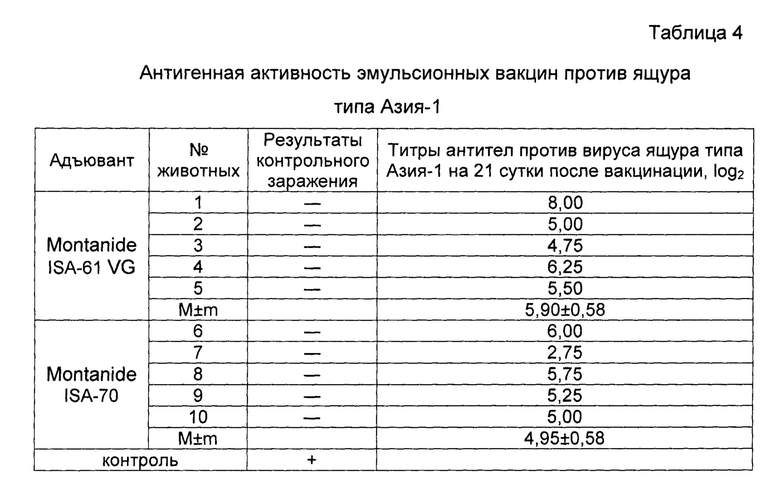
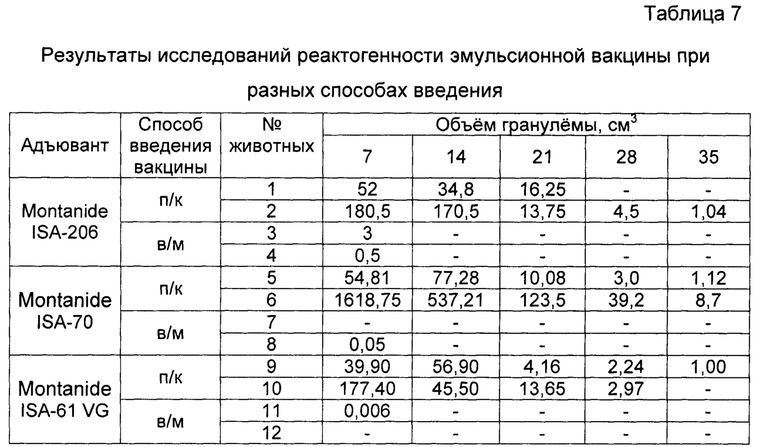
Примечание: п/к - подкожно, в/м - внутримышечно
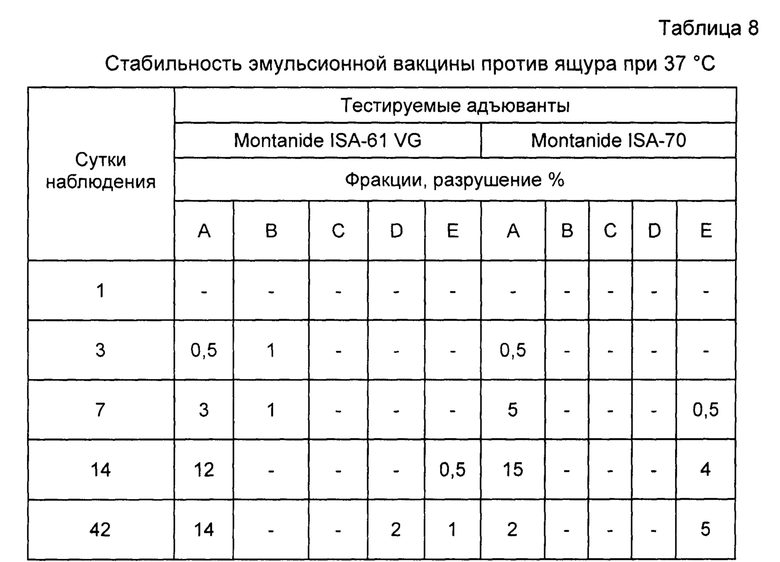
Примечание: А - прозрачное масло в верхней фракции; В - опалесцирующее масло; С - нормальное масло; D - плотная эмульсия (коалесцент); Е - водная фракция на дне пробирки.
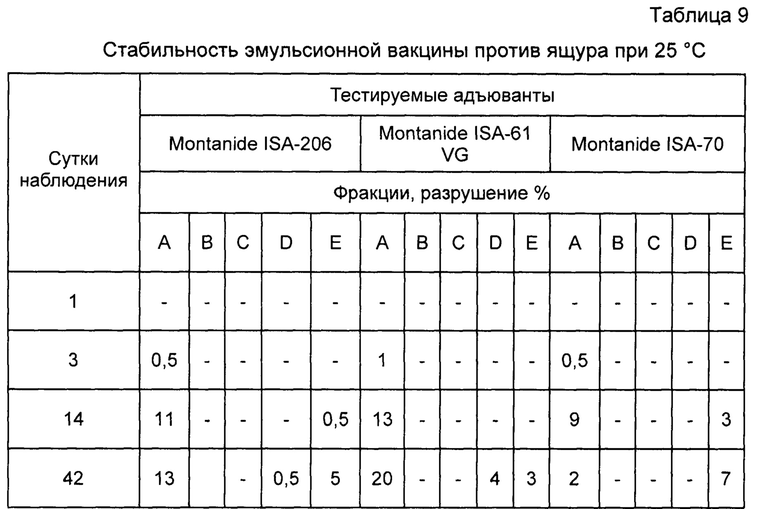
Примечание: А - прозрачное масло в верхней фракции; В - опалесцирующее масло; С - нормальное масло; D - плотная эмульсия (коалесцент); Е - водная фракция на дне пробирки.
Примечание: А - прозрачное масло в верхней фракции; В - опалесцирующее масло; С - нормальное масло; D - плотная эмульсия (коалесцент); Е - водная фракция на дне пробирки.
| название | год | авторы | номер документа |
|---|---|---|---|
| Вакцина инактивированная эмульсионная против ящура типа А | 2017 |
|
RU2665850C1 |
| Вакцина инактивированная эмульсионная против ящура типа О | 2017 |
|
RU2682876C1 |
| Вакцина инактивированная эмульсионная против ящура типа О | 2017 |
|
RU2665849C1 |
| Вакцина для ранней защиты против ящура типа О инактивированная эмульсионная | 2019 |
|
RU2699671C1 |
| ВАКЦИНА ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ ПРОТИВ ЯЩУРА ТИПОВ А, О, АЗИЯ-1 | 2015 |
|
RU2593718C1 |
| ВАКЦИНА ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ ПРОТИВ ЯЩУРА ТИПА А | 2005 |
|
RU2294759C2 |
| Вакцина для ранней защиты против ящура типа Азия-1 инактивированная эмульсионная | 2020 |
|
RU2741639C1 |
| Вакцина против ящура генотипа О/ЕА-3 из штамма "О N2241/Эфиопия/2011" культуральная инактивированная эмульсионная | 2023 |
|
RU2816264C1 |
| Вакцина против ящура генотипа A/AFRICA/G-VII культуральная инактивированная эмульсионная | 2024 |
|
RU2840148C1 |
| Вакцина против ящура генотипа O/ME-SA/Ind-2001e из штамма "О N2620/Оренбургский/2021" культуральная инактивированная эмульсионная | 2023 |
|
RU2815537C1 |
Изобретения относятся к области ветеринарной вирусологии и биотехнологии и касаются вакцины и способа ее получения. Способ изготовления вакцины включает в себя культивирование вирусного антигена в суспензионной культуре клеток ВНК-21, инактивацию, очистку вирусной суспензии от балластных примесей, концентрирование полученного антигена вируса ящура и соединение с адъювантом. В качестве адъюванта используется масляный адъювант Montanide ISA-61 VG (Seppic, Франция), который стерилизуют при помощи фильтров. При этом вируссодержащую суспензию очищают с помощью фильтрования, антигенный материал концентрируют проточной ультрафильтрацией. Изобретения позволяют получить более эффективные, безопасные и экономически целесообразные противоящурные препараты и обеспечивают повышение напряженности и продолжительности иммуногенной активности вакцины против ящура и снижение её реактогенности. 2 н. и 10 з.п. ф-лы, 10 табл., 12 пр.
1. Способ изготовления вакцины инактивированной эмульсионной против ящура, включающий культивирование вирусного антигена в суспензионной культуре клеток ВНК-21, инактивацию, очистку вирусной суспензии от балластных примесей, концентрирование полученного антигена вируса ящура и соединение концентрата антигена с адъювантом, отличающийся тем, что в качестве адъюванта используют масляный адъювант Montanide ISA-61 VG, культивирование вирусного антигена проводят в течение 10-18 ч при температуре 36-37°C до достижения количества мертвых клеток 90-95%, вируссодержащую суспензию фильтруют через фильтр с порами 1,2 и 0,6 мкм, антиген концентрируют проточной ультрафильтрацией под давлением 1,5 атм, адъювант Montanide ISA-61 VG стерилизуют через фильтр с порами 0,20 мкм при давлении 1,1-1,2 атм, соединение антигена вируса ящура с масляным адъювантом Montanide ISA-61 VG проводят при температуре 18-25°C.
2. Способ изготовления вакцины против ящура по п. 1, отличающийся тем, что антигенный материал концентрируют до достижения содержания иммуногенных (146S) компонентов вируса ящура не менее 6 мкг по каждому типу в 1 см3.
3. Способ изготовления вакцины против ящура по п. 1, отличающийся тем, что сконцентрированный антигенный материал дополнительно очищают при показании прозрачности ниже 90% или наличии растворимого балластного белка выше 10 мг/см3.
4. Способ изготовления вакцины против ящура по п. 3, отличающийся тем, что сконцентрированный антигенный материал фильтруют через фильтры с порами 0,45 мкм.
5. Вакцина против ящура, полученная по любому из пп. 1-4, содержащая антигенный материал вируса ящура типа А и/или вируса ящура типа О, и/или вируса ящура типа Азия-1 в эффективном количестве и масляный адъювант Montanide ISA-61 VG.
6. Вакцина против ящура по п. 5, полученная по любому из пп. 1-4, отличающаяся тем, что в качестве авирулентного очищенного антигенного материала вируса ящура типа А содержит авирулентный очищенный антигенный материал штамма вируса ящура типа А в количестве не менее 3,0 мкг 146S иммуногенных компонентов в 1 см3 готового препарата.
7. Вакцина против ящура по п. 6, полученная по любому из пп. 1-4, отличающаяся тем, что в качестве авирулентного очищенного антигенного материала вируса ящура типа А содержит авирулентный очищенный антигенный материал штамма А №2155/Забайкальский/2013 в количестве не менее 3 мкг 146S иммуногенных компонентов в 1 см3 готового препарата.
8. Вакцина против ящура по п. 5, полученная по любому из пп. 1-4, отличающаяся тем, что в качестве авирулентного очищенного антигенного материала вируса ящура типа О содержит авирулентный очищенный антигенный материал штамма вируса ящура типа О в количестве не менее 3,0 мкг 146S иммуногенных компонентов в 1 см3 готового препарата.
9. Вакцина против ящура по п. 8, полученная по любому из пп. 1-4, отличающаяся тем, что в качестве авирулентного очищенного антигенного материала вируса ящура типа О содержит авирулентный очищенный антигенный материал штамма О №2123/Южная Осетия/2011 в количестве не менее 3 мкг 146S иммуногенных компонентов в 1 см3 готового препарата.
10. Вакцина против ящура по п. 5, полученная по любому из пп. 1-4, отличающаяся тем, что в качестве авирулентного очищенного антигенного материала вируса ящура типа Азия-1 содержит авирулентный очищенный антигенный материал штамма вируса ящура типа Азия-1 в количестве не менее 3,0 мкг 146S иммуногенных компонентов в 1 см3 готового препарата.
11. Вакцина против ящура по п. 10, полученная по любому из пп. 1-4, отличающаяся тем, что в качестве авирулентного очищенного антигенного материала вируса ящура типа Азия-1 содержит авирулентный очищенный антигенный материал штамма Азия-1 №1946/Шамир 3/89 в количестве не менее 3 мкг 146S иммуногенных компонентов в 1 см3 готового препарата.
12. Вакцина по любому из пп. 5-11, полученная по любому из пп. 1-4, отличающаяся тем, что она содержит в качестве антигенного материала антигенный очищенный материал вируса ящура и масляный адъювант Montanide ISA-61 VG в соотношении от 40÷60 до 50÷50, мкг в 1 см3 готового препарата: авирулентный и очищенный антигенный материал в виде 146S иммуногенных компонентов вируса ящура, каждого типа не менее 3,0 и масляный адъювант Montanide ISA-61 VG от 600000,0÷700000,0 до 500000,0÷575000,0.
| ВАКЦИНА ИНАКТИВИРОВАННАЯ СОРБИРОВАННАЯ ПРОТИВ ЯЩУРА ТИПОВ А, О, АЗИЯ-1 | 2015 |
|
RU2603003C1 |
| ВАКЦИНА ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ ПРОТИВ ЯЩУРА ТИПА А | 2005 |
|
RU2294759C2 |
| ВАКЦИНА ПРОТИВ ЯЩУРА ТИПА АЗИЯ-1 И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 2002 |
|
RU2220744C1 |
| ВАКЦИНА ПРОТИВ ЯЩУРА ТИПА О И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 2001 |
|
RU2212895C2 |
| US 0009145548 B2, 29.09.2015. | |||
Авторы
Даты
2018-05-03—Публикация
2017-06-06—Подача