Данное изобретение относится к способу мокрого гашения оксидов кальция и магния от известково-магнезиальных соединений, предпочтительно содержащих по меньшей мере 10 масс.% MgO по отношению к общей массе указанного известково-магнезиального соединения, включающему следующие стадии:
подачу указанного известково-магнезиального соединения, содержащего MgO, в оборудование для гашения;
подачу водной фазы для гашения в указанное оборудование для гашения; и
гашение указанных оксидов кальция и магния указанного известково-магнезиального соединения, поданного в указанное оборудование для гашения, посредством указанной водной фазы для гашения, приводящее к образованию гашеных твердых частиц гидроксидов кальция и магния (например, общей формулы xCa(OH)2.yMg(OH)2).
Как правило, гашение MgO, чтобы образовать Mg(OH)2, по сравнению с обычным гашением CaO, чтобы образовать Ca(OH)2, является реакцией, трудно выполнимой рентабельным образом на промышленном уровне. Одним из возможных путей изготовления полностью гидратированных продуктов, а именно, в которых MgO и CaO полностью преобразованы в Mg(OH)2 и Ca(OH)2 соответственно, является гидратация при высоком давлении, во время которой подача тепла является иногда необходимой в зависимости от реакционной способности MgO. В некоторых случаях во время гашения в мокром процессе очень продолжительные времена реакции могут преодолевать эти недостатки. Однако, применение гидраторов высокого давления с подачей тепла или без нее или очень продолжительных времен пребывания создает множество затруднений, которые снижают уровень промышленного производства гидроксида магния из MgO, и предпочтение отдается химическому производству Mg(OH)2 из солей, обработанных щелочными растворами.
Точно так же, как в природе существуют отложения известняка (карбоната кальция формулы CaCO3), существуют, кроме того, отложения доломита (смешанного карбоната кальция и магния общей формулы xCaCO3.yMgCO3, где x и у являются молярными коэффициентами, такими, что x/y=0,8 до 1,2), и отложения других смешанных карбонатов общей формулы xCaCO3.yMgCO3, где 1,2≤x/y≤25) или любого другого смешанного карбоната кальция и магния. Таким же образом, как и в случае известняка, доломит или другие вышеуказанные смешанные карбонаты могут быть обожжены, посредством чего получают доломитовую негашеную известь формулы xCaO.yMgO или любой другой смешанный оксид кальция и магния. Аналогично негашеной извести, реакция гидратации инициируется, когда доломитовую негашеную известь или другой вышеуказанный смешанный оксид приводят в контактирование с водой. Однако, как указано выше, известно, что оксид магния имеет гораздо более низкую реакционную способность по отношению к воде, чем высококальциевая негашеная известь, которая является высокогидрофильной, и гидратация этих обожженных соединений становится тем самым гораздо более сложной, чем гидратация высококальциевой негашеной извести.
Как указано выше, для того, чтобы получить полностью гидратированный продукт посредством мокрого процесса, специалисты в данной области техники в настоящее время прибегают к помощи процесса гидротермической гидратации при применении водной фазы, предварительно нагретой до температуры, как правило, между 40 и 80°C, в течение увеличенного времени реакции (как правило, от 5 до 48 ч). Другим возможным процессом, к помощи которого могут прибегнуть специалисты, является процесс гидратации при высоком давлении. На промышленном уровне первый вариант является предпочтительным, хотя время пребывания и качество гидратированного продукта в высокой степени зависят от реакционной способности оксидов в первоначальном соединении.
Во всех случаях, эти процессы гашения являются сложными и дорогими и являются неблагоприятными для промышленной обработки этих MgO-содержащих соединений, чтобы получать соединения, содержащие Mg(OH)2, с тем риском, что часть MgO не будет гидратирована надлежащим образом.
FR2669327 A1 раскрывает применение химических агентов, таких как амины или гликоли, чтобы изготавливать гидратированную известь при регулируемой или контролируемой температуре, обладающую улучшенными пластическими свойствами и высокими величинами удельной поверхности.
WO9209528 также описывает применение добавок, выбранных из числа гликолей и/или аминов, чтобы изготавливать гидроксиды кальция и/или магния, имеющие высокие величины удельной поверхности.
US3120444 описывает добавление низкомолекулярных алифатических спиртов, чтобы получать гидратированную известь с улучшенными пластическими свойствами.
US1856763 описывает способ изготовления негашеной извести высокой чистоты с замедленной реакционной способностью для применения ее в известковых растворах.
Целью данного изобретения является преодоление недостатков предшествующего уровня техники посредством предоставления способа, делающего возможным простое, низкозатратное производство соединения посредством мокрого процесса, который может быть выполнен на промышленном уровне, данное соединение содержит гашеные твердые частицы Mg(OH)2 посредством чего гидратация ускоряется и/или посредством чего степень преобразования оксида MgO в гидроксид Mg(OH)2 увеличивается.
Для того, чтобы решить эту проблему, в соответствии с данным изобретением предоставлен способ, такой как указано выше, в котором указанное гашение выполняют в присутствии добавки, выбранной из группы, состоящей из водорастворимых гидроксидов металлов, в частности гидроксидов щелочных металлов (особенно гидроксидов Na, Li или К), водорастворимых силикатов металлов, в частности водорастворимых силикатов щелочных металлов или щелочноземельных металлов (особенно силикатов Na, Li, K, Ca или Mg), водорастворимых алюминатов, в частности алюминатов K, Na, Li или NH4 (особенно алюмината натрия), водорастворимых солей алюминия, в частности фторида, нитрата, хлорида или лактата алюминия (особенно нитрата и лактата алюминия), водорастворимых галогенидов металлов, в частности хлоридов, бромидов или фторидов, водорастворимых нитратов металлов, водорастворимых лактатов металлов, водорастворимых солей аммония, аммиака и их смесей.
В контексте данного изобретения, под терминами «водорастворимые» понимается то, что добавки являются по меньшей мере частично водорастворимыми. Степень растворимости добавок не обязательно должна быть высокой, добавки могут становиться растворимыми во время реакции гашения.
Добавки, выбранные из вышеуказанной группы, обладают тем преимуществом, что делают возможной ускоренную и/или улучшенную гидратацию MgO-содержащего соединения при давлении окружающей среды и при сравнительно коротких временах реакции. Поэтому реакция гашения в присутствии указанный добавок становится промышленно применимой и, следовательно, делает возможным изготовление соединений, содержащих большее количество гашеных твердых частиц простым низкозатратным образом.
Преимущественно указанные оксиды кальция и магния известково-магнезиального соединения имеют содержание оксида магния менее чем 50 масс.% по отношению к массе указанного известково-магнезиального соединения и предпочтительно имеют молярное соотношение кальций/магний между 0,8 и 1,2.
Более конкретно указанное известково-магнезиальное соединение выбрано из группы, состоящей из обожженного, полуобожженного или полугидратированного доломита, смешанных известково-магнезиальных соединений, в частности смешанных оксидов кальция и магния, имеющих достаточное содержание MgO, а именно, выше чем 10 масс.% по отношению к общей массе смешанного оксида, и их смесей.
Гидратация доломитовой негашеной извести и всех материалов, имеющих высокую долю MgO (а именно, по меньшей мере 10 масс.% по отношению к общей массе известково-магнезиального соединения, содержащего указанный MgO, или в некоторых вариантах осуществления по отношению к общей массе смешанного оксида) является недостаточной в обычных промышленных процессах и требует менее обожженного материала (мягкообожжженной доломитовой извести), чтобы получить приемлемые степени преобразования, или очень продолжительные времена реакции трудно адаптируются к промышленному процессу.
Эту низкую реакционную способность доли MgO часто объясняют присутствием пережженных продуктов вследствие способности к быстрому реагированию оксида магния во время операции обжига. Для доломитовых продуктов этот пережог является, как правило, результатом необходимости применения температур, делающих возможным, по меньшей мере отчасти, также обеспечение преобразования карбоната кальция (CaCO3) в оксид кальция (негашеную известь).
Это приводит поэтому в промышленной практике для гидратации обожженного доломита, доломитовой извести или магнезиальной извести, однако также и любого подобного продукта, содержащего значительные количества MgO, в зависимости от потери реакционной способности, обусловленной пережогом, к тому, что более низкие степени преобразования в Mg(OH)2 получают, когда выполняют гашение посредством мокрого процесса, или же к тому, что очень продолжительные времена реакции требуются, чтобы получить приемлемую степень преобразования.
В качестве варианта, применение экстремальных условий гашения может потребоваться, чтобы получить более полно гидратированный продукт, таких как применение высоких величин давления, времен реакции более чем 24 часа или гидратации паром в отношении степеней пережога для продуктов минерального происхождения.
Для мокрого гашения, степени преобразования MgO в Mg(OH)2 от 10 до 60% Mg могут быть получены в обычном оборудовании при применении типичных времен пребывания для гашения высококальциевой негашеной извести. Такое оборудование указано, например, в Boynton pp. 363, в частности, аппарат для гашения извести с задержкой со средним временем пребывания от 20 до 40 мин, аппарат для гашения извести в виде пасты со средним временем пребывания от 5 до 20 мин, шаровая мельница для гашения извести со средним временем пребывания от 10 до 20 мин, резервуар с непрерывным или периодическим перемешиванием со средним временем пребывания менее чем один час, шнековый аппарат для гашения извести со средним временем пребывания от 10 до 30 мин или барабанный аппарат для гашения извести со средним временем пребывания от 10 до 30 мин, в отношении реакционной способности оксидов кальция и магния исходного известково-магнезиального соединения. В таких случаях, увеличение времени пребывания до периода от 5 до 48 ч может увеличивать степень преобразования вплоть до полного преобразования. Однако, как указано выше, указанное увеличение времени пребывания будет являться затратным для выполнения, при том риске, что во многих случаях преобразование в гидроксид магния будет оставаться в значительной степени недостаточным.
Поэтому эти гидратированные продукты, как правило, содержат значительные количества непрореагировавшего MgO. Этот MgO может реагировать впоследствии, например, во время транспортировки, во время применения или даже в производных продуктах, полученных из этих гидратированных продуктов, создавая, как правило, многочисленные проблемы, начиная с расширения продукта во время более поздней гидратации.
В способе по данному изобретению, присутствие добавки делает возможным значительное увеличение в степенях преобразования при сравнительно коротких временах реакции по сравнению с обычными процессами гашения для соединений с низкой реакционной способностью, при давлении окружающей среды и в пределах приемлемых температурных интервалов для промышленного применения.
Преимущественно указанные гидроксиды щелочного металла выбирают из группы, состоящей из гидроксида натрия, гидроксида калия, гидроксида лития и их смесей.
Преимущественно указанные водорастворимые силикаты щелочных металлов или щелочноземельных металлов выбирают из группы, состоящей из силиката кальция, силиката магния, силиката натрия, силиката калия, силиката лития. Предпочтительно силикат является силикатом щелочного металла, преимущественно силикатом натрия.
Преимущественно указанные водорастворимые алюминаты выбирают из группы, состоящей из алюмината калия, алюмината натрия, алюмината лития, алюмината аммония и их смесей. Предпочтительно алюминат является алюминатом натрия.
Преимущественно указанные водорастворимые соли алюминия выбирают из группы, состоящей из фторида алюминия, нитрата алюминия, хлорида алюминия, лактата алюминия и их смесей. Предпочтительно соль алюминия является лактатом алюминия.
Преимущественно указанные водорастворимые галогениды металла выбирают из группы, состоящей из хлоридов металлов, бромидов металлов, фторидов металлов и их смесей.
Преимущественно указанные водорастворимые галогениды металлов выбирают из группы, состоящей из галогенидов щелочных металлов, в частности галогенидов натрия и лития, галогенидов щелочноземельных металлов, в частности галогенидов кальция и магния, и их смесей.
Преимущественно указанные водорастворимые нитраты металлов выбирают из группы, состоящей из нитратов щелочных металлов, нитратов щелочноземельных металлов и их смесей. Предпочтительно нитрат является нитратом натрия, лития, кальция или магния.
Предпочтительно указанные нитраты металлов, лактаты и галогениды содержат по меньшей мере один атом металла, выбранной из группы, состоящей из алюминия, кальция и магния, более предпочтительно из алюминия и магния.
В первом частном варианте осуществления способа по данному изобретению, указанную добавку добавляют к указанной водной фазе для гашения перед подачей указанной водной фазы для гашения, чтобы образовать водную фазу для гашения, содержащую добавку.
В одном из вариантов способа по данному изобретению указанную добавку добавляют к указанной водной фазе для гашения внутри указанного оборудования для гашения или в указанный узел подачи указанной водной фазы для гашения.
В другом варианте способа по данному изобретению указанную добавку добавляют к указанному MgO-содержащему известково-магнезиальному соединению или в указанный узел подачи указанного известково-магнезиального соединения.
В одном из предпочтительных вариантов осуществления способа по данному изобретению указанную добавку подают при содержании между 0,1 и 20%, предпочтительно между 1 и 10 масс.% по отношению к общей массе MgO.
В частном случае обожженных доломитов (xCaO.yMgO), они обычно характеризуются их химической чистотой и реакционной способностью.
Под высокой чистотой имеют в виду низкое процентное содержание примесей, т.е. в общем менее чем 5%, преимущественно менее чем 4 масс.% и предпочтительно менее чем 3%, даже менее чем 2%, по массе обычных примесей, первоначально содержащихся в доломите (SiO2, Al2O3, Fe2O3, SO3 ...), а также высокое содержание оксидов CaO+MgO. Это также предполагает ограничение всех других возможных форм кальция и магния, таких как необожженные материалы (CaCO3, MgCO3) или соединения типа силиката или алюмината кальция и/или магния. Обожженные доломиты, используемые в способе по данному изобретению содержат более чем 90 масс.%, преимущественно более чем 93%, предпочтительно более чем 97 масс.% CaCO3, Ca(OH)2, CaO, Mg(OH)2 и MgO и необязательно остатков MgCO3; CaO и MgO предпочтительно составляют основную часть.
Реакционная способность обожженного доломита может быть охарактеризована посредством испытания на реакционную способность, описанного в стандарте ASTM C110-02: 2002 §12. Однако в дополнение к характеристикам, описанным в стандарте, реакционная способность доломита характеризуется ее величиной t70, которая представляет собой время, требующееся для достижения реакционной средой 70°C, начиная от первоначальной температуры, установленной при 40°C. В данном изобретении принимают во внимание другой критерий, t60, который аналогичным образом представляет собой время, необходимое для достижения 60°C, начиная от 40°C, при нормализованных условиях для этого испытания на реакционную способность.
Известково-магнезиальные соединения, более конкретно те, которые выбраны из группы, состоящей из обожженного, полуобожженного или полугидратированного доломита, смешанных известково-магнезиальных соединений, в частности смешанных оксидов кальция и магния, имеющих достаточное содержание MgO, а именно, выше чем 10 масс.% по отношению к общей массе смешанного оксида, и их смесей, используемые в способе по данному изобретению, предпочтительно имеют величину t60, составляющую 5 минут или менее.
Для того, чтобы способ, являющийся предметом данного изобретения был эффективным, т.е. для того, чтобы добавки оказывали значительное влияние на уровень гидратации MgO, содержащегося в известково-магнезиальных продуктах, первоначальный известково-магнезиальный продукт перед гидратацией в соответствии со способом данного изобретения должен иметь минимальную реакционную способность.
В случае, когда известково-магнезиальные продукты, подлежащие гидратированию, являются почти не реакционноспособными, вследствие, например, значительного пережога исходного минерала, гидратация MgO, содержащегося в этих известково-магнезиальных соединениях, наиболее затруднена, и добавки, заявленные в данном изобретении, несмотря на то, что они могут улучшать процентную долю гидратации MgO, несомненно не смогут обеспечивать достижение увеличения гидратации 30%, предпочтительно 100%, более предпочтительно 150% и еще более предпочтительно 200%.
Для того, чтобы описать известково-магнезиальные соединения, пригодные для применения в способе по данному изобретению, было разработано очень простое испытание, которое описано ниже. В оставшейся части данного документа оно будет называться как упрощенное испытание для определения степени преобразования, которое измеряет степень реакционной способности известково-магнезиальных соединений, подлежащих гидратации.
Для этого испытания четыре литра деминерализованной воды предварительно нагретой до 70°C, помещали в мерный (полу-)цилиндрический стеклянный реактор с двойной рубашкой, имеющий рабочий объем 5 дм3 и внутренний диаметр примерно 15 см. Реактор открыт с верхней стороны, что делает возможным соединение лопастной мешалки с двигателем и размещение термопары в воде. Воду перемешивают при 500-600 об/мин. Воду при 73°C принуждают к циркулированию в двойной рубашке при применении термостатируемой циркуляционной ванны.
Когда достигнуто термическое равновесие, т.е. когда температура воды в реакторе стабилизируется при 70°C±1°C, 200 г известково-магнезиального продукта добавляют сразу же к воде при перемешивании. Перемешивание поддерживают в течение 30 минут, на протяжении которых температура реакционной среды должна оставаться между 70°C и 80°C. С продуктами, почти не обладающими реакционной способностью, эта температура будет оставаться близкой к 70°C. С более реакционноспособными продуктами, в частности такими, которые содержат CaO, температура будет ближе к 75, даже к 80°C. После реакционного времени 30 минут перемешивание прекращают и суспензию фильтруют через воронку Бюхнера. Образец 30 г твердого продукта, отобранного фильтрованием, сушат при 150°C в течение менее чем 30 минут при применении инфракрасных термовесов.
После сушки продукт подвергают термогравиметрическому анализу (TGA) и степень преобразования MgO вычисляют при применении метода, описанного ниже.
Преимущественно известково-магнезиальные продукты, которые, в соответствии с этим упрощенным испытанием для определения степени преобразования, проявляют степень преобразования MgO по меньшей мере 10%, предпочтительно выше чем 15% и более предпочтительно выше чем 20%, используют в способе по данному изобретению в присутствии по меньшей мере одной добавки.
Известково-магнезиальные продукты, описанные в данном изобретении, обычно характеризуют после и/или перед их гидратацией в соответствии со способом данного изобретения при применении метода термического анализа и более конкретно термогравиметрии. Это измерение выполняют посредством помещения от 50 мг до 2 г гидратированного образца в печь, снабженную весами.
Массу образца регистрируют во время повышения температуры от комнатной температуры вплоть до величины между 900 и 1000°C при скорости от 5 до 20°C/мин в потоке воздуха или азота. Образец сушат при 150°C перед этим термогравиметрическим измерением. Этот способ делает возможным количественное определение различных соединений, содержащихся в анализируемом образце, и в частности Mg(OH)2, Ca(OH)2 и CaCO3. Негидратированная или некарбонизированная фазы (например, CaO и MgO) не могут быть идентифицированы и количественно определены при применении этого термогравиметрического метода.
Перед их гидратацией в соответствии со способом, являющимся предметом данного изобретения, известково-магнезиальные продукты могут содержать Ca(OH)2, возможно являющийся i) гидроксидом кальция, который может быть сформирован, например, посредством реакции CaO с влагой в воздухе на этапах хранения или транспортировки (если известково-магнезиальные продукты содержат кальций в форме CaO), или ii) гидроксидом Ca, который может быть сформирован во время предшествующей стадии гидратации известково-магнезиального соединения, при применении способа, отличного от способа, являющего предметом данного изобретения, и не использующего добавку. Содержание Ca(OH)2 в известково-магнезиальных продуктах перед гидратацией в соответствии со способом данного изобретения находится между 1 и 65%, верхнее значение соответствует частному случаю полугидратированного доломита общей формулы Ca(OH)2.MgO (т.е. примерно 65% Ca(OH)2 и 35% MgO, если не учитывать примеси).
Поскольку MgO менее чувствителен к влажности, чем CaO, известково-магнезиальные продукты перед гидратацией в соответствии со способом данного изобретения обычно содержат менее чем 1,0%, предпочтительно менее чем 0,5% и в частности менее чем 0,2% Mg(OH)2.
В некоторых случаях, известково-магнезиальные продукты могут содержать CaCO3, возможно являющийся i) остаточным карбонатом кальция, производным от первичного минерала (например, доломита), который не был разложен во время стадии обжига минерала, или ii) карбонатом кальция, который мог быть сформирован, например, посредством реакции Ca(OH)2 с окружающим CO2 на этапах хранения или транспортировки. Содержание CaCO3 в известково-магнезиальных продуктах перед гидратацией может составлять между 1 и 72%, верхнее значение соответствует частному случаю полуобожженного доломита общей формулы MgO.CaCO3 (т.е. примерно 29% MgO и 71% CaCO3, если не учитывать примеси).
После гидратации в соответствии со способом данного изобретения известково-магнезиальные продукты могут все еще содержать CaCO3, поскольку это соединение невосприимчиво к гидратации. Они также содержат Ca(OH)2, который либо уже первоначально содержался в известково-магнезиальном продукте (например, полугидратированном доломите), либо является результатом гидратации CaO (если известково-магнезиальное соединение перед гидратацией содержит CaO). Они также содержат Mg(OH)2, образованный гидратацией MgO, содержащегося в известково-магнезиальном продукте перед гидратацией.
В случае известково-магнезиальных продуктов, содержащих Mg(OH)2, доля Mg(OH)2 может быть количественно определена посредством термогравиметрии, принимая во внимание потерю массы между 200 и 450°C, в частности между 220 и 420°C, более конкретно между 250 и 400°C, которая соответствует высвобождению воды вследствие дегидроксилирования Mg(OH)2; (Mg(OH)2, разлагается на MgO+H2O).
В случае известково-магнезиальных продуктов, содержащих Ca(OH)2, доля Ca(OH)2 может быть количественно определена посредством термогравиметрии, принимая во внимание потерю массы между 400 и 600°C, в частности между 420 и 580°C и более конкретно между 450 и 560°C, которая соответствует высвобождению воды вследствие дегидроксилирования Ca(OH)2; (Ca(OH)2, разлагается на CaO+H2O).
В случае известково-магнезиальных продуктов, содержащих CaCO3, доля CaCO3 может быть количественно определена посредством термогравиметрии, принимая во внимание потерю массы между 600 и 900°C, в частности между 620 и 850°C и более конкретно между 650 и 800°C, которая соответствует высвобождению CO2 вследствие декарбонизации CaCO3 (CaCO3 разлагается на CaO+CO2).
В контексте данного изобретения, под «степенью преобразования MgO» (обозначено как tcMgO (%)), понимается соотношение между числом молей магния во фракции Mg(OH)2 конечного гидратированного продукта и числом молей магния в MgO, первоначально содержащегося в известково-магнезиальном продукте перед гидратацией. Она может быть вычислена при применении формулы 1 ниже:
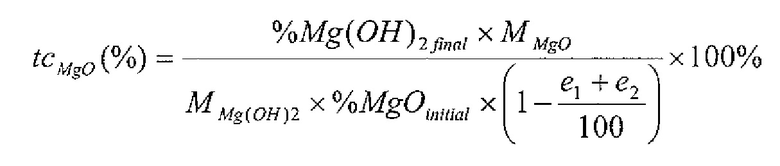
Формула 1
- % Mg(OH)2FINAL представляет собой массовую долю Mg(OH)2 в гидратированном продукте, такую, как определено после потери массы, соответствующей разложению Mg(OH)2, на термогравиметрической кривой;
- % MgOinitial представляет собой массовую долю MgO в продукте, подлежащем гидратированию, определенную рентгеновской люминесценцией;
- MMgO представляет собой молярную массу MgO (г/моль) (40,3 г/моль);
- MMg(OH)2 представляет собой молярную массу Mg(OH)2 (г/моль) (58,3 г/моль);
- e1 представляет собой воду, присоединенную к Mg(OH)2 в гидратированном продукте, и поэтому соответствует абсолютной величине первой потери массы на термогравиметрической кривой;
- e2 представляет собой воду, присоединенную к Ca(OH)2 в гидратированном продукте, и поэтому соответствует абсолютной величине второй потери массы на термогравиметрической кривой.
Преимущественно в соответствии с данным изобретением, степень преобразования MgO в Mg(OH)2 улучшена на 30%, предпочтительно на 100%, предпочтительно на 150% и еще более предпочтительно на 200% по сравнению со степенью преобразования, полученной при отсутствии добавки. Эту степень преобразования также предпочтительно получают при временах реакции менее чем 5 часов, предпочтительно менее чем 2 часа и более предпочтительно менее чем 1 час, в частности менее чем 30 минут и еще более предпочтительно менее чем 20 минут, наиболее короткое время, применяемое для непрерывных процессов; в некоторых случаях, время реакции 15 минут, даже 10 минут или менее будет достаточным.
Улучшенная степень преобразования MgO в Mg(OH)2 может быть вычислена при применении формулы 2 ниже:
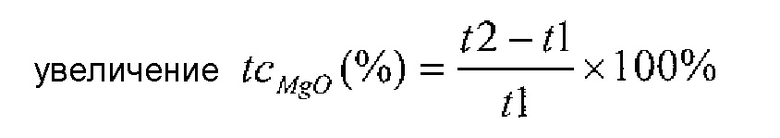
Формула 2
- t1 представляет собой степень преобразования MgO в Mg(OH)2, полученную при отсутствии добавки;
- t1 представляет собой степень преобразования MgO в Mg(OH)2, полученную после добавления добавки;
Эффективное время реакции может быть больше, чем время пребывания в гидраторе. Под «временем реакции» в контексте данного изобретения понимается время, прошедшее с момента контактирования указанного известково-магнезиального продукта с указанной водной фазой до получения вышеуказанной степени преобразования. Это время включает время пребывания продукта в реакторе, применяемом для выполнения гидратации, и может также включать дополнительное время, в течение которого водная фаза остается в контакте с известково-магнезиальным продуктом после фазы гидратации. Все время пока водная фаза не отделена от известково-магнезиального продукта (фильтрацией, пропусканием через сито ...), гидратирование последнего может продолжаться. Наблюдалось, что с добавками по данному изобретению дополнительное гашение, происходящее после времени пребывания в гидраторе, также ускоряется по сравнению с ситуацией без добавки.
Предпочтительное оборудование для гидратации для выполнения способа данного изобретения является обычным оборудованием для гидратации в мокром процессе. Таким оборудованием является аппарат для гашения извести с выдерживанием для мокрого процесса, например, аппарат для гашения извести в полужидком виде для мокрого процесса, шаровая мельница для гашения извести, резервуар с непрерывным или периодическим перемешиванием, шнековый аппарат для гашения извести или барабанный аппарат для гашения извести. В одном из предпочтительных вариантов осуществления данного изобретения указанное известково-магнезиальное соединение является порошковым соединением. В гидратор в таком случае подают порошковое соединение, содержащее MgO с размером частиц между 20 мкм и 10 мм, предпочтительно <5 мм, предпочтительно <2 мм.
В контексте данного изобретения, термин « мокрое гашение» означает гашение, которое не использует сухой процесс, который приводит к образованию порошкового продукта. Иными словам, «мокрый процесс» означает гашение, которое приводит к образованию пасты или суспензии твердых частиц. Предпочтительно указанные гашеные твердые частицы гидроксидов кальция и магния образуют суспензию или пасту из твердых частиц, содержащую по меньшей мере 30% воды. Мольное соотношение вода/MgO-содержащие твердые частицы составляет более чем 1,2, в частности более чем 1,5, при условии, что способ гашения использует мокрый процесс. Преимущественно способ в соответствии с данным изобретением также включает просеивание полученной суспензии и/или стадию деагломерации или измельчения в мельнице указанных гашеных твердых частиц Mg(OH)2.
Как правило, в одном из предпочтительных вариантов осуществления способа по данному изобретению, указанная водная фаза для гашения имеет температуру перед гашением между 35 и 90°C.
Другие варианты осуществления способа данного изобретения указаны в приложенной формуле изобретения.
Другие характеристики, подробности и преимущества данного изобретения станут очевидными из описания, представленного ниже, которое является неограничивающим и ссылается на добавленные Примеры и приложенные Фигуры.
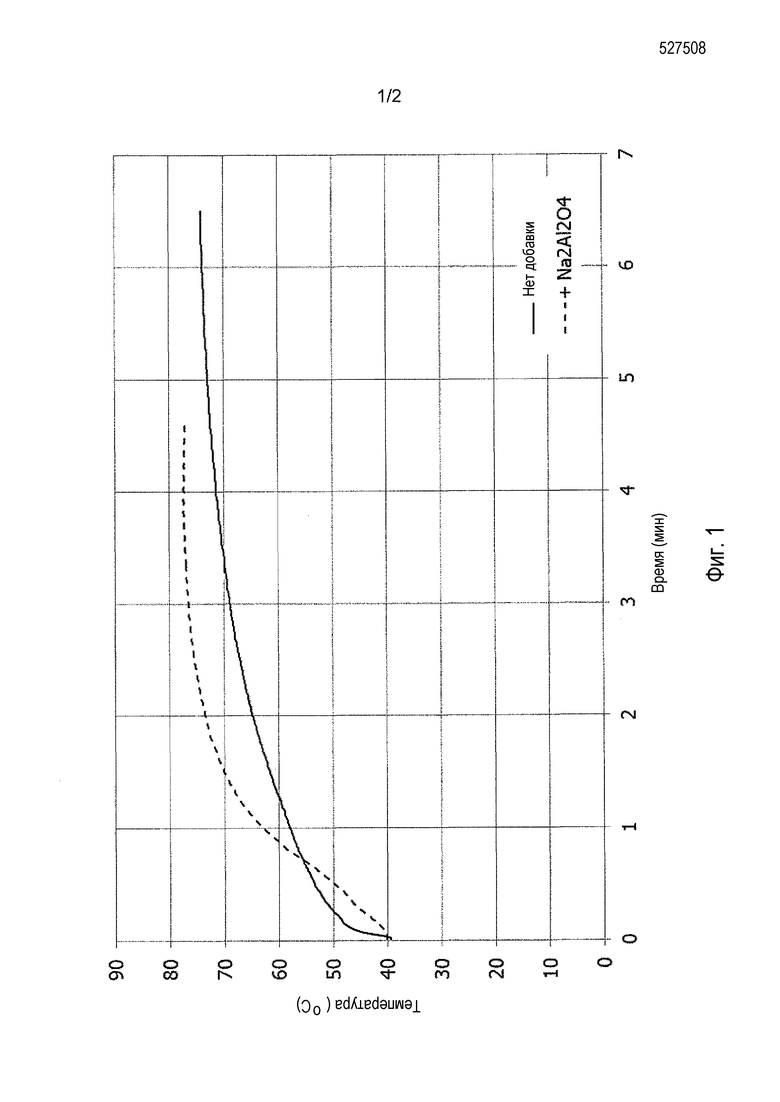
Фиг. 1 иллюстрирует влияние добавки в соответствии с данным изобретением, по сравнению со Сравнительным примером без добавки, на реакцию гашения обожженного доломита 1.
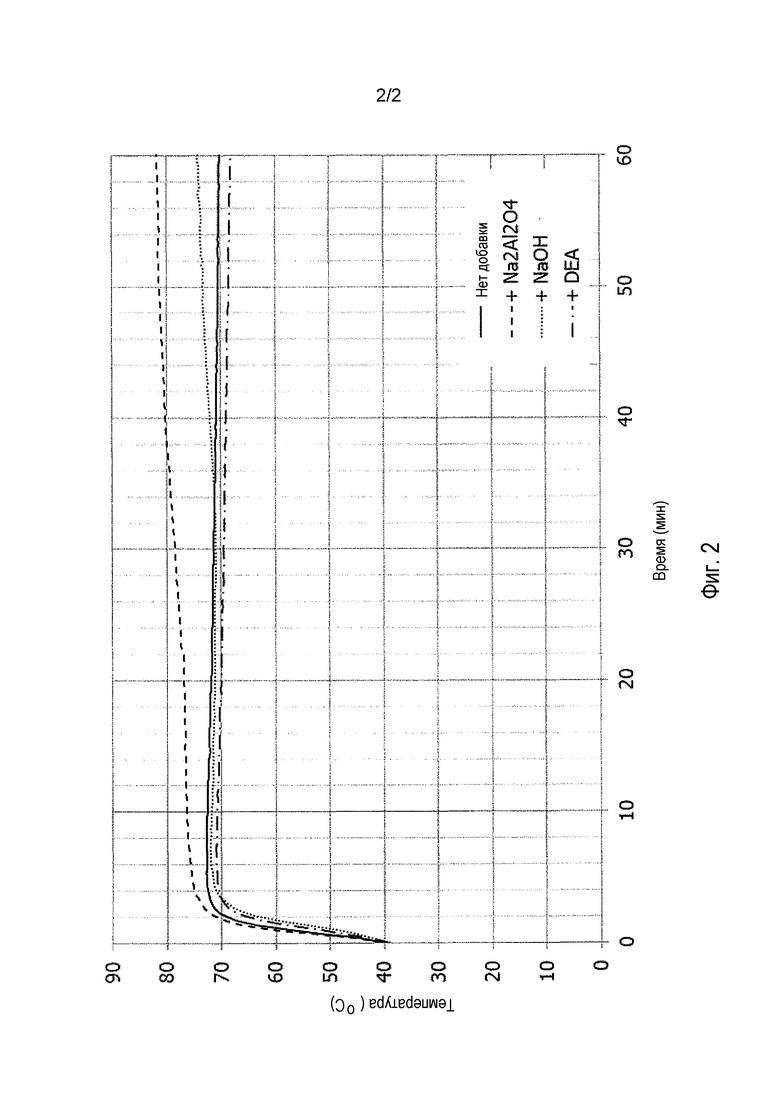
Фиг. 2 показывает влияние различных добавок (Na2Al2O4 и NaOH) в соответствии с данным изобретением по сравнению со сравнительными примерами без добавки или в присутствии диэтаноламина (DEA) на реакцию гашения обожженного доломита 2.
Способ данного изобретения поэтому использует гидратацию посредством мокрого процесса, который является контролируемым, быстрым и простым для, помимо прочего, обожженного доломита, доломитовой или магниевой извести или любого соединения, содержащего MgO, при высокой степени преобразования и вплоть до получения полностью гидратированных продуктов при применении стандартного оборудования для гидратации посредством применения добавки при предпочтительных пропорциях от 0,1 до 20%, предпочтительно от 1 до 10 масс.% по отношению к общей массе MgO.
Добавки по данному изобретению выбраны из группы, состоящей из водорастворимых гидроксидов металлов, в частности гидроксидов щелочных металлов (особенно гидроксидов Na, Li или К), водорастворимых силикатов металлов, в частности водорастворимых силикатов щелочных металлов или щелочноземельных металлов (особенно силикатов Na, Li, K, Ca или Mg), водорастворимых алюминатов, в частности алюминатов K, Na, Li или NH4 (особенно алюмината натрия), водорастворимых солей алюминия, в частности фторида, нитрата, хлорида или лактата алюминия (особенно нитрата и лактата алюминия), водорастворимых галогенидов металлов, в частности хлоридов, бромидов или фторидов, водорастворимых нитратов металлов, водорастворимых лактатов металлов, водорастворимых солей аммония, аммиака и их смесей.
Пример 1
Реакцию гашения выполняли в соответствии с типичной конфигурацией испытания на реакционную способность согласно стандарту ASTM C110-02: 2002 § 12. Поэтому, первоначально 120 г доломитовой негашеной извести 1 добавляли к 400 г воды для гашения при 40°C, не содержащей какой-либо добавки (противопоставленный материал). Затем другой образец 120 г этой доломитовой негашеной извести 1 добавляли к раствору алюмината натрия (формула Na2Al2O4) при 40°C, предварительно приготовленного посредством растворения 4 г алюмината натрия в 396 г деминерализованной воды. В обоих случаях реакционную смесь перемешивали при 250 об/мин. Образец доломитовой извести 1 являлся тонкой фракцией, имеющей размер частиц d98 3 мм или менее и изготовленной промышленным способом. Он содержал 39,7% MgO и 55,1% CaO (массовые доли, определенные посредством рентгеновской люминесценции), что соответствует молярному соотношению Ca/Mg (или x/y) 1,00, и его реакционная способность представлена в Таблице 1 и на Фиг. 1.
Эти реакции гашения выполняли в резервуаре типа DEWAR, имеющем емкость 665 см3, снабженным валом с четырьмя лопастями и с температурным датчиком для автоматического получения данных о температуре с течением времени (одно измерение каждую секунду). Из кривой, представленной на Фиг. 1, были определены следующие характеристики:
a) t60, представляет собой время, необходимое для реакционной среды, чтобы достигнуть 60°C от первоначальной температуры, установленной при 40°C;
b) t70, представляет собой время, необходимое для реакционной среды, чтобы достигнуть 70°C от первоначальной температуры, установленной при 40°C;
c) TTM представляет собой время до максимальной температуры реакционной среды, т.е., когда не наблюдается повышение температуры более чем 0,5°C на протяжении трех последовательных измерений.
Полученную суспензию (или молоко) доломита выдерживали при перемешивании до тех пор, пока не была достигнута величина TTM, после чего пропускали через сито с размером отверстий 250 мкм, удержанную фракцию сушили при 110°C и взвешивали. Массовое процентное содержание этих удержанных частиц затем рассчитывали по отношению к исходному количеству доломитовой негашеной извести в виде тонких частиц. Эти удержанные частицы называют «отходами» и указывают размер фракции грубых нежелательных частиц, полученных во время гашения. Эти данные представлены в Табл. 1 ниже.
Продукт, который был пропущен через сито, быстро сушили при 150°C и анализировали. Содержание Mg(OH)2 и Ca(OH)2 рассчитывали на основании измерения потери тепла при термогравиметрическом анализе (TGA), как описано выше. Степень преобразования MgO затем рассчитывали при применении формулы 1. Все результаты приведены в Таблице 1 и проиллюстрированы на Фиг. 1.
Na2Al2O4
(Пример 1)
Результаты оценки реакционной способности (Фиг. 1) показывают, что не только была значительно ускорена реакция (даже если первоначально наблюдалось менее быстрое увеличение по сравнению со сравнительным примером без добавки, используемом в качестве ссылки) в присутствии алюмината натрия по сравнению со ссылкой без добавки, но также конечная полученная температура была выше, указывая на более высокую степень преобразования.
Все результаты приведены в Таблице 1.
Для примера в соответствии с данным изобретением, в присутствии алюмината натрия, наблюдали практически полное преобразование (степень преобразования примерно 90%) несмотря на короткое время реакции порядка лишь 5 минут. В дополнение к этому, полученная суспензия в форме доломитового молока была гораздо более тонкая в присутствии алюмината натрия. Суспензия имела срединный диаметр d50 примерно 6 мкм, и лишь 1% был удален посредством пропускания через сито с размером отверстий 250 мкм по сравнению со случаем с использованием продукта без добавки (d50 примерно от 11 дo 13 мкм, и 5 масс.% удалено после пропускания через сито с размером отверстий 250 мкм).
Пример 2
Пример 2 был аналогичен Примеру 1 в том. что доломит гидратировали при тех же самых условиях и в присутствии алюмината натрия (3% по отношению к массе доломитовой негашеной извести). Различия между этим Примером 2 и Примером 1 были следующими:
- на этот раз гидратировали доломитовую негашеную известь 2, содержащую 39,5% MgO и 51,9% CaO (т.е. молярное соотношение x/y=0,94), имеющую реакционную способность, описанную в Таблице 2 и на Фиг. 2;
- время реакции составляло 1 час, суспензию доломита оставляли при перемешивании на 1 час в сосуде Дьюара перед фильтрованием, сушкой и анализом как в Примере 1;
- на этот раз доломитовую суспензию не пропускали через сито, и степень преобразования поэтому представлена твердым веществом в целом, в противоположность Примеру 1, в котором некоторое количество грубых частиц удаляли просеиванием через сито.
Как показано на Фиг. 2, добавление алюмината натрия во время реакции гидратации делает возможным увеличение температуры гидратации, и оно приводило к более высокой степени преобразования (Таблица 2).
Пример 3
Этот пример полностью аналогичен Примеру 2, только лишь алюминат натрия был заменен гидроксидом натрия (NaOH), при том, что все пропорции оставлены одинаковыми.
Фиг. 2 показывает, что эта добавка приводила ко второму увеличению в температуре по прохождении 30 минут, приводя в конечном счете к более высокой конечной температуре и в результате к улучшенной степени гидратации (Таблица 2). Время реакции более чем 1 час при тех же самых условиях (1 ч 30, например) должно приводить к еще более улучшенной степени гидратации.
Сравнительный пример
Этот сравнительный пример полностью аналогичен Примерам 2 и 3, однако на этот раз добавкой являлся диэтаноламин (DEA), также добавленный в доле 3% по отношению к массе первоначальной доломитовой негашеной извести. На этот раз добавка приводила к небольшой задержке в реакции гидратации и к небольшому уменьшению в температуре гидратации (Фиг. 2). В результате степень гидратации части MgO доломита 2 была уменьшена (Таблица 2).
Данное изобретение, несомненно, никоим образом не ограничивается вышеописанными вариантами осуществления, и многочисленные модификации могут быть сделаны в отношении них без отклонения от объема приложенной формулы изобретения.
Na2Al2O4
(Пример 2)
NaOH
(Пример 3)
диэтаноламин (DEA)
(Сравнительный пример 1)
(2) Удельная поверхность по БЭТ, измеренная на основе манометрического анализа адсорбции азота после времени дегазирования по меньшей мере 2 часа при 190°C.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СУХОГО ГАШЕНИЯ ОКСИДОВ КАЛЬЦИЯ И МАГНИЯ ИЗ КАЛЬЦИЕВО-МАГНИЕВЫХ СОЕДИНЕНИЙ | 2014 |
|
RU2668667C2 |
| МИНЕРАЛЬНАЯ КОМПОЗИЦИЯ НА ОСНОВЕ СМЕШАННОЙ ТВЕРДОЙ ФАЗЫ КАРБОНАТОВ КАЛЬЦИЯ И МАГНИЯ И СПОСОБ ПОЛУЧЕНИЯ ТАКОЙ КОМПОЗИЦИИ | 2014 |
|
RU2631818C2 |
| МИНЕРАЛЬНАЯ КОМПОЗИЦИЯ НА ОСНОВЕ СМЕШАННОЙ ТВЕРДОЙ ФАЗЫ КАРБОНАТОВ КАЛЬЦИЯ И МАГНИЯ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ЕЕ ПРИМЕНЕНИЕ | 2013 |
|
RU2599758C2 |
| СПОСОБ ОБРАБОТКИ СТАЛИ В СТАЛЕРАЗЛИВОЧНОМ КОВШЕ | 2009 |
|
RU2413006C1 |
| Способ приготовления шихты | 2016 |
|
RU2638195C1 |
| СПОСОБ ОБЕЗВОЖИВАНИЯ ШЛАМОВ, ШЛАМЫ, ПОЛУЧЕННЫЕ ЭТИМ СПОСОБОМ, И ИХ ПРИМЕНЕНИЕ | 2004 |
|
RU2326057C2 |
| СПОСОБ ПОДГОТОВКИ К ПЕРЕРАБОТКЕ СИДЕРИТОВОЙ ЖЕЛЕЗНОЙ РУДЫ (ВАРИАНТЫ) И ПОСЛЕДУЮЩИЙ СПОСОБ ЕЕ БЕЗОТХОДНОЙ ПЕРЕРАБОТКИ | 2011 |
|
RU2562016C1 |
| Шихта и способ получения флюса и огнеупорного материала для сталеплавильного производства (варианты) с ее использованием | 2020 |
|
RU2749446C1 |
| СИНТЕТИЧЕСКИЙ СЫРЬЕВОЙ МАТЕРИАЛ ДЛЯ ПРОИЗВОДСТВА СТЕКЛА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2305665C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОКСИДА МАГНИЯ ИЗ ПРИРОДНЫХ РАССОЛОВ | 2001 |
|
RU2211803C2 |
Изобретение может быть использовано в химической промышленности. Способ мокрого гашения оксидов кальция и магния известково-магнезиального соединения, содержащего по меньшей мере 10 масс.% MgO по отношению к общей массе известково-магнезиального соединения, включает подачу известково-магнезиального соединения и водной фазы в оборудование для гашения. Проводят гашение оксидов кальция и магния известково-магнезиального соединения, приводящее к образованию гашеных твердых частиц гидроксидов кальция и магния. Гашение выполняют в присутствии добавки, выбранной из группы, состоящей из водорастворимых гидроксидов металлов, водорастворимых силикатов металлов, водорастворимых алюминатов, водорастворимых солей алюминия, водорастворимых галогенидов металлов, водорастворимых нитратов металлов, водорастворимых лактатов металлов, водорастворимых солей аммония, аммиака и их смесей. Добавку подают при содержании между 0,1 и 20 масс.% по отношению к общей массе MgO. Оксиды кальция и магния известково-магнезиального соединения имеют содержание оксида магния менее чем 50 масс.% по отношению к массе известково-магнезиального соединения и молярное соотношение кальций/магний между 0,8 и 1,2. Изобретение позволяет ускорить гидратацию и/или увеличить степень преобразования MgO в Mg(OH)2 в процессе мокрого гашения оксидов кальция и магния известково-магнезиального соединения. 21 з.п. ф-лы, 2 ил., 2 табл., 3 пр.
1. Способ мокрого гашения оксидов кальция и магния известково-магнезиального соединения, содержащего по меньшей мере 10 масс.% MgO по отношению к общей массе указанного известково-магнезиального соединения, включающий следующие стадии:
- подачу известково-магнезиального соединения, содержащего MgO, в оборудование для гашения;
- подачу водной фазы для гашения в указанное оборудование для гашения; и
- гашение указанных оксидов кальция и магния указанного известково-магнезиального соединения, поданного в указанное оборудование для гашения, посредством указанной водной фазы для гашения, приводящее к образованию гашеных твердых частиц гидроксидов кальция и магния,
отличающийся тем, что указанное гашение выполняют в присутствии добавки, выбранной из группы, состоящей из водорастворимых гидроксидов металлов, выбранных из гидроксидов щелочных металлов и их смесей; водорастворимых силикатов металлов, выбранных из силикатов щелочных металлов, силикатов щелочноземельных металлов и их смесей; водорастворимых алюминатов, выбранных из алюмината калия, алюмината натрия, алюмината лития, алюмината аммония и их смесей; водорастворимых солей алюминия, выбранных из фторида алюминия, нитрата алюминия, хлорида алюминия, лактата алюминия и их смесей; водорастворимых галогенидов металлов, выбранных из хлоридов металлов, бромидов металлов, фторидов металлов и их смесей; водорастворимых нитратов металлов, выбранных из нитратов щелочных металлов, нитратов щелочноземельных металлов и их смесей; водорастворимых лактатов металлов; водорастворимых солей аммония; аммиака и их смесей, при этом указанную добавку подают при содержании между 0,1 и 20 масс.% по отношению к общей массе MgO, причем указанные оксиды кальция и магния известково-магнезиального соединения имеют содержание оксида магния менее чем 50 масс.% по отношению к массе указанного известково-магнезиального соединения и предпочтительно имеют молярное соотношение кальций/магний между 0,8 и 1,2.
2. Способ по п.1, в котором указанное известково-магнезиальное соединение выбрано из группы, состоящей из обожженного, полуобожженного или полугидратированного доломита, смешанных известково-магнезиальных соединений, в частности смешанных оксидов кальция и магния, имеющих достаточное содержание MgO, а именно выше чем 10 масс.% по отношению к общей массе смешанного оксида, и их смесей.
3. Способ по любому из пп.1 и 2, в котором указанные водорастворимые гидроксиды металлов выбирают из группы, состоящей из гидроксидов натрия, калия или лития и их смесей.
4. Способ по любому из пп.1 и 2, в котором указанные водорастворимые силикаты металлов выбирают из группы, состоящей из силикатов натрия и лития, силикатов кальция и магния и их смесей.
5. Способ по любому из пп.1 и 2, в котором указанный водорастворимый алюминат представляет собой алюминат натрия.
6. Способ по любому из пп.1 и 2, в котором указанные водорастворимые соли алюминия выбирают из группы, состоящей из нитрата алюминия и лактата алюминия.
7. Способ по любому из пп.1 и 2, в котором указанные водорастворимые нитраты металлов выбирают из группы, состоящей из нитратов натрия и лития, нитратов кальция и магния и их смесей.
8. Способ по любому из пп.1 и 2, в котором указанные водорастворимые галогениды металлов выбирают из группы, состоящей из галогенидов щелочных металлов, в частности галогенидов натрия и лития, галогенидов щелочноземельных металлов, в частности галогенидов кальция и магния и их смесей.
9. Способ по любому из пп.1 и 2, в котором указанные галогениды металлов, указанные нитраты металлов и указанные лактаты металлов содержат по меньшей мере один атом металлов, выбранных из группы, состоящей из алюминия, кальция и магния.
10. Способ по любому из пп.1 и 2, в котором указанные галогениды металлов, указанные нитраты металлов и указанные лактаты металлов содержат по меньшей мере один атом металлов, выбранных из группы, состоящей из алюминия и магния.
11. Способ по любому из пп.1 и 2, в котором указанную добавку добавляют к указанной водной фазе для гашения перед указанной подачей указанной водной фазы для гашения, чтобы образовать водную фазу для гашения, содержащую добавку.
12. Способ по любому из пп.1 и 2, в котором указанную добавку добавляют к указанной водной фазе для гашения внутри указанного оборудования для гашения или в узел подачи указанной водной фазы для гашения.
13. Способ по любому из пп.1 и 2, в котором указанную добавку добавляют к указанному MgO-содержащему соединению или в узел подачи указанного известково-магнезиального соединения.
14. Способ по любому из пп.1 и 2, в котором указанное известково-магнезиальное соединение имеет степень преобразования MgO в Mg(OH)2 по меньшей мере 10%, предпочтительно выше чем 15% и более предпочтительно выше чем 20% при измерении посредством упрощенного испытания для определения степени преобразования.
15. Способ по любому из пп.1 и 2, в котором указанное оборудование для гашения является обычным гидратором для мокрого процесса.
16. Способ по любому из пп.1 и 2, в котором степень преобразования MgO в Mg(OH)2 увеличена на 30%, предпочтительно на 100%, более предпочтительно на 150% и еще более предпочтительно на 200% по сравнению со степенью преобразования, полученной без добавки.
17. Способ по п.16, в котором время реакции составляет менее 5 часов, предпочтительно менее 2 часов, более предпочтительно менее 1 часа, и, в частности, оно составляет менее чем 30 минут и более конкретно менее чем 20 минут.
18. Способ по любому из пп.1 и 2, в котором указанное известково-магнезиальное соединение является порошковым соединением.
19. Способ по любому из пп.1 и 2, в котором указанные гашеные твердые частицы гидроксидов кальция и магния образуют суспензию или пасту из твердых частиц, содержащую по меньшей мере 30% воды.
20. Способ по любому из пп.1 и 2, дополнительно включающий стадию деагломерации или измельчения в мельнице указанных гашеных твердых частиц гидроксидов кальция и магния.
21. Способ гашения по п.19, дополнительно включающий стадию пропускания указанной суспензии через сито.
22. Способ гашения по любому из пп.1 и 2, в котором указанная водная фаза для гашения имеет температуру перед гашением между 35 и 90°C.
| WO 9851614 A1, 19.11.1998 | |||
| СПОСОБ ГАШЕНИЯ ИЗВЕСТИ | 0 |
|
SU297607A1 |
| ЖЕЛЕЗНОДОРОЖНАЯ ТОРМОЗНАЯ СИСТЕМА ДЛЯ ЖЕЛЕЗНОДОРОЖНОГО ТРАНСПОРТНОГО СРЕДСТВА И СПОСОБ ТОРМОЖЕНИЯ ЖЕЛЕЗНОДОРОЖНОГО ТРАНСПОРТНОГО СРЕДСТВА, СОДЕРЖАЩЕГО ТАКУЮ СИСТЕМУ | 2014 |
|
RU2669327C2 |
| US 3120444 A, 04.02.1964 | |||
| US 1856763 A, 03.05.1932 | |||
| WO 9209528 A1, 11.06.1992 | |||
| US 5502021 A, 26.03.1996. | |||
Авторы
Даты
2018-05-15—Публикация
2014-02-19—Подача