Настоящее изобретение предлагает способ сухого гашения оксидов кальция и магния из кальциево-магниевых соединений, предпочтительно содержащих, по меньшей мере, 10% масс. MgO по отношению к суммарной массе вышеупомянутого кальциево-магниевого соединения, включающий следующие стадии:
- загрузка кальциево-магниевого соединения, содержащего MgO, в оборудование для гашения;
- загрузка водной фазы для гашения в вышеупомянутое оборудование для гашения; и
- гашение вышеупомянутых оксидов кальция и магния из вышеупомянутого кальциево-магниевого соединения, загруженного в вышеупомянутое оборудование для гашения, вышеупомянутой водной фазой для гашения, которое приводит к образованию гашеных твердых частиц гидроксидов кальция и магния (например, имеющих общую формулу xCa(OH)2⋅yMg(OH)2).
Как правило, реакцию гашения MgO, из которого образуется гидроксид магния Mg(OH)2, по сравнению с традиционным гашением CaO, из которого образуется Ca(OH)2, трудно осуществлять экономичным образом на промышленном уровне. Один из возможных путей получения полностью гидратированных продуктов, то есть таких, в которых MgO и CaO полностью превращаются в Mg(OH)2 и Ca(OH)2, соответственно, представляет собой гидратацию при высоком давлении, в процессе которой иногда становится необходимой подача тепла в зависимости от реакционной способности MgO. В некоторых случаях использования процесса влажного гашения очень большая продолжительность реакции может преодолевать эти недостатки. Однако использование высокого давления в установках для гашения с подачей или без подачи тепла или большая продолжительность выдерживания представляют собой многочисленные затруднения, которые сокращают промышленное производство гидроксида магния из MgO, причем предпочтение отдается химическому производству Mg(OH)2 посредством обработки солей щелочными растворами.
Аналогично существованию месторождений известняка (карбонат кальция, имеющий формулу CaCO3), существуют также месторождения доломита (смешанный карбонат кальция и магния, имеющий общую формулу xCaCO3⋅yMgCO3, где x и y представляют собой такие молярные коэффициенты, что x/y составляет от 0,8 до 1,2), и месторождения других смешанных карбонатов, имеющих общую формулу xCaCO3⋅yMgCO3, где 1,2≤x/y≤25), или других смешанных карбонатов кальция и магния. Таким же образом, как в случае известняков, доломиты или другие вышеупомянутые смешанные карбонаты можно подвергать обжигу, и в результате этого получается доломитовая негашеная известь, имеющая формулу xCaO⋅yMgO, или какой-либо другой смешанный оксид кальция и магния. Аналогично негашеной извести, реакция гидратации инициируется, когда доломитовая негашеная известь или какой-либо другой вышеупомянутый смешанный оксид вступает в контакт с водой. Однако, как упомянуто выше, известно, что оксид магния имеет значительно меньшую реакционную способность по отношению к воде, чем имеющая высокое содержание кальция негашеная известь, которая имеет высокую гидрофильность, и в результате этого гидратация этих подвергнутых обжигу соединений становится значительно более сложной, чем гидратация имеющей высокое содержание кальция негашеной извести.
По этой причине в подавляющем большинстве случаев гидратированная доломитовая известь, или другой смешанный гидроксид кальция и магния, изготовленный в промышленном масштабе посредством сухого процесса, по существу, представляет собой полугидратированную доломитовую известь или другой вышеупомянутый смешанный гидроксид, содержащий в значительном количестве остаточный негидратированный MgO. Вышеупомянутая полугидратированная доломитовая известь, как правило, представляется формулами xCa(OH)2⋅yMgO или xCa(OH)2⋅(y-z)Mg(OH)2⋅zMgO в зависимости от уровня гидратации оксида магния (где x/y составляет от 0,8 до 1,2). Другие вышеупомянутые смешанные гидроксиды имеют формулы такого же типа, но другие молярные соотношения кальция и магния.
Чтобы преодолеть эту низкую реакционную способность по отношению к воде негашеной доломитовой извести или других вышеупомянутых подвергнутых обжигу соединений, в целях получения полностью гидратированных продуктов, имеющих общую формулу xCa(OH)2⋅yMg(OH)2, известно применение значительно большего количества воды, чем количество воды, которое используется для сухого гашения, и/или более высокой температуры, чем температура, которая преимущественно используется в стандартных реакциях гидратации негашеной извести, или измельчение доломитовой извести или другого вышеупомянутого подвергнутого обжигу соединения перед гидратацией, вплоть до гидротермальной реакции, т.е. гидратации под давлением при высокой температуре, когда давление водяного пара составляет от 7 до 13 бар (от 0,7 до 1,3 МПа), а температура составляет от 115 до 165°C (Boynton, «Химия и технология извести и известняка», второе издание, издательство Wiley Interscience, 1980 г., с. 325-326 и 374). Этот тип доломитового продукта, который является полностью гидратированным, является известным как тип S, в отличие от типа N, который представляет собой обычные доломитовые гидраты, т.е. частично гидратированные продукты (J. A. H. Oates, «Известь и известняк, издательство Wiley-VCH, Вайнхайм, 1998 г., с. 222-223).
Во всех случаях эти процессы гашения являются сложными и дорогостоящими, что сокращает промышленное использование этих содержащих MgO соединений.
Французский патент FR 2669327 A1 описывает использование химических реагентов, таких как амины или гликоли, для производства в условиях регулируемой или контролируемой температуры гашеной извести, имеющей улучшенные пластические свойства и высокую удельную поверхность.
Международная патентная заявка WO 9209528 также описывает использование добавок, в качестве которых выбираются гликоли и/или амины, для производства гидроксидов кальция и/или магния, имеющих высокую удельную поверхность.
Патент США US 3120444 описывает добавление низкомолекулярных алифатических спиртов для получения гашеной извести, имеющей улучшенные пластический свойства.
Патент США US 1856763 описывает способ производства негашеной извести, имеющей высокую чистоту и замедленную реакционную способность для использования в строительных растворах.
Задача настоящего изобретения заключается в том, чтобы преодолеть недостатки предшествующего уровня техники посредством предложения способа, который обеспечивает простое экономичное производство с использованием сухого процесса, который может осуществляться на промышленном уровне, соединения, которое содержит твердые частицы гашеного Mg(OH)2, где ускоряется гидратация, и/или где увеличивается степень превращения оксида магния MgO в гидроксид Mg(OH)2. Для решения этой задачи, как уже было упомянуто выше, настоящее изобретение предлагает способ, согласно которому вышеупомянутое гашение осуществляется в присутствии добавки, выбранной из группы, которую составляют растворимые в воде гидроксиды металлов, в частности, гидроксиды щелочных металлов (в частности, гидроксиды Na, Li или K и, более конкретно, NaOH), растворимые в воде силикаты металлов, в частности, растворимые в воде силикаты щелочных металлов или щелочноземельных металлов (в частности, силикаты щелочных металлов Na, Li или K, и более конкретно силикаты Na), растворимые в воде алюминаты, растворимые в воде галогениды металлов, в частности, хлориды, бромиды или фториды (в частности, хлориды металлов), растворимые в воде нитраты металлов, растворимые в воде соли аммония, аммиак, а также их смеси.
При использовании в настоящем изобретении термин «растворимый в воде» означает, что добавки являются, по меньшей мере, частично растворимыми в воде. Степень растворимости добавок не обязательно должна быть высокой; добавки должны лишь иметь способность солюбилизироваться в процессе реакции гашения.
Добавки, выбранные из вышеупомянутой группы, имеют преимущество обеспечения повышения скорости и/или степени гидратации содержащего MgO соединения при атмосферном давлении и относительно короткой продолжительности реакции. Таким образом, реакция гашения в присутствии вышеупомянутых добавок становится применимой в промышленных условиях и, следовательно, обеспечивает производство соединений, включающих гашеные твердые частицы, простым и экономичным способом.
Для вышеупомянутых оксидов кальция и магния в составе кальциево-магниевого соединения содержание оксида магния преимущественно составляет менее чем 50% масс. по отношению к массе вышеупомянутого кальциево-магниевого соединения, и предпочтительное молярное соотношение кальция и магния составляет от 0,8 до 1,2.
Более конкретно, вышеупомянутое кальциево-магниевое соединение выбирается из группы, которую составляют доломитовая известь, полуобожженный доломит или полугидратированная доломитовая известь, смешанные кальциево-магниевые соединения, в частности, смешанные оксиды кальция и магния, имеющие значительное содержание MgO, составляющее более чем 10% масс. по отношению к суммарной массе смешанного оксида, а также их смеси.
Гидратация доломитовой извести и всех материалов, имеющих высокое содержание MgO (составляющее, по меньшей мере, 10% масс. по отношению к суммарной массе кальциево-магниевого соединения или, согласно некоторым вариантам осуществления, по отношению к суммарной массе смешанного оксида) является неполной в традиционных промышленных процессах, и для нее требуются менее обожженные материалы (мягкообожженная доломитовая известь), чтобы получать приемлемые степени превращения, или продолжительность реакции является настолько большой, что оказывается неприемлемой для промышленного процесса.
Эта низкая реакционная способность части MgO обычно обусловлена присутствием чрезмерно обожженных продуктов вследствие чувствительности оксида магния в процессе операции обжига. Для доломитовых продуктов этот чрезмерный обжиг, как правило, является результатом необходимости применения температуры, которая обеспечивает также, по меньшей мере, частичное превращение карбоната кальция (CaCO3) в оксид кальция (негашеную известь).
Из этого следует, что при промышленном осуществлении гидратации доломитовой извести или магнезиальной извести, а также любого аналогичного продукта, содержащего значительные количества MgO, в зависимости от потери реакционной способности в результате чрезмерного обжига, наблюдается меньшая степень превращения в Mg(OH)2, когда осуществляется процесс сухого гашения.
В качестве альтернативы, для получения более гидратированного продукта могут потребоваться более жесткие применяемые условия гашения, такие как условия высокого давления, продолжительность реакции, составляющая более чем 24 часа, или гидратация водяным паром в зависимости от степени чрезмерного обжига продуктов минерального происхождения.
Действительно, хорошо известно (см. Boynton, с. 374-376), что являются относительно редкими доломиты, которые можно подвергать гидратации, осуществляя, главным образом, сухой процесс при атмосферном давлении, независимо от продолжительности гидратации. В остальных случаях реакция гашения осуществляется в бункере с избытком воды в течение периода времени, составляющего приблизительно от 10 до более чем 24 часов, что угрожает промышленной экономичности таких реакций гашения. Как правило, в большинстве случаев гидратированная доломитовая известь имеет низкое содержание Mg(OH)2 и обычно гидратируется лишь от 10 до 25% MgO, причем иногда гидратируется менее чем 10% или даже менее чем 5% MgO. Это является особенно актуальным в случае сухой гидратации, потому что в случае влажной гидратации могут быть получены более высокие степени гидратации MgO. Даже после выдерживания в бункере в течение неприемлемо продолжительного периода полное превращение наблюдается редко или даже никогда. В данном отношении Boynton пишет, что для получения более высокой степени превращения необходимо осуществлять гидратацию под давлением.
Таким образом, эти гидратированные продукты, как правило, содержат в значительных количествах непрореагировавший MgO. Этот MgO может впоследствии реагировать, например, в процессе транспортировки, в процессе использования или даже в составе производных продуктов, изготовленных из этих гидратированных продуктов, как правило, создавая многочисленные проблемы, начиная с расширения продукта в процессе последующей гидратации.
В способе согласно настоящему изобретению присутствие добавки обеспечивает значительное повышение степени превращения при относительно короткой продолжительности реакции по сравнению с традиционными процессами гашения имеющих низкую реакционную способность соединений при атмосферном давлении и в приемлемом интервале температур для промышленного применения.
Преимущественно вышеупомянутые гидроксиды щелочных металлов выбираются из группы, которую составляют гидроксид натрия, гидроксид калия, гидроксид лития, а также их смеси. Предпочтительным из гидроксидов щелочных металлов является гидроксид натрия.
Преимущественно вышеупомянутые растворимые в воде силикаты щелочных металлов или щелочноземельных металлов выбираются из группы, которую составляют силикат кальция, силикат магния, силикат натрия, силикат калия и силикат лития. Предпочтительными являются силикаты щелочных металлов, преимущественно силикат натрия.
Преимущественно вышеупомянутые растворимые в воде алюминаты выбираются из группы, которую составляют алюминат калия, алюминат натрия, алюминат лития, алюминат аммония, а также их смеси.
Преимущественно вышеупомянутые растворимые в воде галогениды металлов выбираются из группы, которую составляют хлориды металлов, бромиды металлов и фториды металлов. Предпочтительные галогениды представляют собой хлориды.
Предпочтительно вышеупомянутые нитраты и галогениды металлов включают, по меньшей мере, один атом металла, выбранный из группы, которую составляют алюминий, кальций и магний, предпочтительнее алюминий и магний.
В способе согласно первому конкретному варианту осуществления настоящего изобретения вышеупомянутая добавка добавляется в вышеупомянутую водную фазу для гашения перед загрузкой вышеупомянутой водной фазы для гашения в целях получения содержащей добавку водной фазы для гашения.
В способе согласно одному варианту осуществления настоящего изобретения вышеупомянутая добавка добавляется в вышеупомянутую водную фазу для гашения внутри вышеупомянутого оборудования для гашения или в процессе вышеупомянутой загрузкой вышеупомянутой водной фазы для гашения.
В способе согласно следующему варианту осуществления настоящего изобретения вышеупомянутая добавка добавляется в вышеупомянутое содержащее MgO кальциево-магниевое соединение или в процессе вышеупомянутой загрузки вышеупомянутого кальциево-магниевого соединения.
В способе согласно одному варианту осуществления настоящего изобретения вышеупомянутая добавка вводится при содержании, составляющем от 0,1 до 20% и предпочтительно от 1 до 10% масс. по отношению к суммарной массе MgO.
В конкретном случае доломитовая известь (xCaO⋅yMgO), как правило, отличается своей высокой химической чистотой и реакционной способностью.
Термин «высокая чистота» означает низкое процентное содержание примесей, которое составляет, как правило, менее чем 5%, преимущественно менее чем 4% масс., предпочтительно менее чем 3% и даже менее чем 2% масс., включая традиционные примеси, которые содержаться в исходном доломите (SiO2, Al2O3, Fe2O3, SO3 и т.д.), а также высокое суммарное содержание оксидов (CaO+MgO). Данный термин также предполагает ограничение всех других возможных форм кальция и магния, таких как необожженные материалы (CaCO3, MgCO3) или соединения кальция и/или магния типа силикатов или алюминатов. Доломитовая известь, которая используется в способе согласно настоящему изобретению, содержит более чем 90% масс., преимущественно более чем 93%, предпочтительно более чем 96% масс. и еще предпочтительнее более чем 97% масс. CaCO3, CaO, Ca(OH)2, Mg(OH)2 и MgO и необязательно остаточный MgCO3; CaO и MgO предпочтительно составляют основную массу.
Чтобы способ согласно настоящему изобретению был эффективным, т.е. чтобы добавки играли значительную роль в уровне гидратации MgO, который содержится в кальциево-магниевых продуктах, исходный кальциево-магниевый материал перед гидратацией с применением способа согласно настоящему изобретению должен иметь минимальную реакционную способность.
Если кальциево-магниевые продукты, которые подлежат гидратации, имеют чрезмерно низкую реакционную способность, например, главным образом, вследствие чрезмерного обжига исходного минерала, в частности, такого как доломит (в частном случае спеченный доломит), гидратация MgO, который содержится в этих кальциево-магниевое соединениях, оказывается наиболее затруднительной, и хотя добавки, заявленные согласно настоящему изобретению, могут повышать процентную степень гидратация MgO, они определенно не смогут повысить ее на 30%, предпочтительно на 100%, предпочтительнее на 150% и еще предпочтительнее на 200%.
Чтобы описать кальциево-магниевые соединения, которые можно использовать в способе согласно настоящему изобретению, было разработано очень простое исследование, которое описано ниже. В следующей части настоящего описания оно будет называться термином «упрощенное исследование для определения степени превращения», причем данная степень представляет собой меру реакционной способности кальциево-магниевых соединений, которые подлежат гидратации.
Для данного исследования 4 л деминерализованной воды, предварительно нагретой до 70°C, помещают в мерный, цилиндрический стеклянный реактор с двойной рубашкой, имеющий эффективный объем 5 л и внутренний диаметр, составляющий приблизительно 15 см. Данный реактор является открытым сверху, что позволяет помещать в воду лопасть смесителя, присоединенного к мотору, и термопару. Воду перемешивают со скоростью, составляющей от 500 до 600 об/мин. Вода при температуре 73°C принудительно циркулирует в двойной рубашке с использованием термостатируемой циркуляционной ванны.
Когда достигается тепловое равновесие, т.е. когда температура воды в реакторе стабилизируется на уровне 70°C, в воду единовременно добавляют при перемешивании 200 г кальциево-магниевого продукта. Перемешивание продолжают в течение 30 минут, причем в течение данного периода температура реакционной среды должна оставаться в интервале от 70°C до 80°C. В случае продуктов, имеющих низкую реакционную способность, данная температура должна оставаться близкой к 70°C. В случае продуктов, имеющих более высокую реакционную способность, в частности, продуктов, содержащих CaO, температура должна приближаться к 75°C и даже к 80°C. После проведения реакции в течение 30 минут перемешивание прекращают, и суспензию фильтруют через воронку Бюхнера (Büchner). Образец, содержащий 30 г твердого продукта, отделенного посредством фильтрования, высушивают при 150°C в течение менее чем 30 минут, используя инфракрасные термовесы.
После высушивания продукт подвергают термогравиметрическому анализу, и степень превращения MgO вычисляют с применением способа, который описан ниже.
Преимущественные кальциево-магниевые продукты, которые, согласно данному упрощенному исследованию для определения степени превращения, проявляют степень превращения MgO, составляющую, по меньшей мере, 10%, предпочтительно более чем 15% и предпочтительнее более чем 20%, можно использовать в способе согласно настоящему изобретению в присутствии, по меньшей мере, одной добавки.
В конкретном случае доломитовой извести, имеющей формулу xCaO⋅yMgO, где x/y составляет от 0,8 до 1,2, чтобы охарактеризовать реакционную способность доломитовой извести, можно использовать другое исследование, которое в последующей части настоящего документа называется термином «исследование реакционной способности». Для данного исследования, которое описывано в стандарте ASTM C110 под заголовком «скорость гашения», 400 г дистиллированной воды, предварительно нагретой до 40°C, помещают в изотермический реактор. Данную воду помещают при перемешивании с помощью лопастей смесителя, вращающихся со скоростью 400±50 об/мин, и после этого в воду единовременно добавляют 120 г доломитовой извести. Изменение температуры суспензии, полученной таким способом, регистрируют в зависимости от времени до тех пор, пока не будет достигнута постоянная температура. Сначала, перед тем, как доломитовая известь добавляется в воду, температура составляет 40°C, а после добавления доломитовой извести в воду начинается реакция гидратации, которая сопровождается повышением температуры, когда сначала происходит гидратация части CaO доломитовой извести, а затем гидратация части MgO.
Данное исследование реакционной способности стандартным образом применяется для определения реакционной способности доломитовой извести, причем доломитовая известь обычно характеризуется значением t70, которое представляет собой время, требуемое для повышения температуры от 40°C до 70°C при нормальных условиях данного исследования. Согласно настоящему изобретению, также используется еще один критерий t60, который аналогичным образом представляет собой время, требуемое для повышения температуры от 40°C до 60°C при нормальных условиях данного исследования реакционной способности. Преимущественно доломитовая известь согласно настоящему изобретению имеет значение t60, которое составляет 5 минут или менее.
Описанные кальциево-магниевые продукты согласно настоящему изобретению, как правило, исследуют после и/или до их гидратации, используя метод термического анализа согласно настоящему изобретению и, более конкретно, термогравиметрический метод. Данные измерения осуществляют, помещая гидратированный образец массой от 50 мг до 2 г в печь, оборудованную весами.
Масса образца регистрируется в процессе повышения температуры от комнатной температуры до уровня, составляющего от 900 до 1000°C, при скорости нагревания от 5 до 20°C/мин в потоке воздуха или азота. Перед данным термогравиметрическим измерением образец высушивают при 150°C. Данный способ обеспечивает количественное определение различных соединений, которые содержатся в анализируемом образце, и, в частности, Mg(OH)2, Ca(OH)2 и CaCO3. Негидратированные или некарбонатные фазы (например, CaO и MgO) невозможно идентифицировать и количественно определять с применением данного термогравиметрического метода.
Перед гидратацией с применением способа согласно настоящему изобретению кальциево-магниевые продукты могут содержать Ca(OH)2, который может представлять собой (i) гидроксид кальция, образующийся в результате реакции CaO с влагой, содержащейся в воздухе, например, в процессе стадий хранения или транспортировки (если кальциево-магниевые продукты содержат кальций в форме CaO), или (ii) гидроксид кальция, который может образовываться в процессе предшествующей стадии гидратации кальциево-магниевого соединения с применением способа, отличающегося от способа согласно настоящему изобретению, и без применения добавки. Содержание Ca(OH)2 в кальциево-магниевых продуктах до гидратации с применением способа согласно настоящему изобретению составляет от 1 до 65%, причем верхнее значение соответствует конкретному случаю полугидратированного доломита, имеющего общую формулу Ca(OH)2⋅MgO (т.е. приблизительно 65% Ca(OH)2 и 35% MgO, если не учитываются примеси).
Поскольку MgO является менее чувствительным по отношению к влаге, чем CaO, кальциево-магниевые продукты до гидратации с применением способа согласно настоящему изобретению, как правило, содержат менее чем 1,0%, предпочтительно менее чем 0,5% и в частности, менее чем 0,2% Mg(OH)2.
В некоторых случаях кальциево-магниевые продукты могут содержать CaCO3, который может представлять собой (i) остаточный карбонат кальция, источником которого является исходный минерал (например, доломит), не подвергнутый разложению в процессе стадии обжига минерала, или (ii) карбонат кальция, который может образовываться, например, в результате реакции Ca(OH)2 с атмосферным CO2 в процессе стадий хранения или транспортировки. Содержание CaCO3 в кальциево-магниевых продуктах до гидратации может составлять от 1 до 72%, причем верхнее значение соответствует конкретному случаю полуобожженного доломита, имеющего общую формулу MgO⋅CaCO3 (т.е. приблизительно 29% MgO и 71% CaCO3, если не учитываются примеси).
После гидратации с применением способа согласно настоящему изобретению кальциево-магниевые продукты могут снова содержать CaCO3, поскольку данное соединение не является чувствительным по отношению к гидратации. Они также содержат Ca(OH)2, в том числе исходно содержащийся в кальциево-магниевом продукте (например, полугидратированный доломит) или образующийся в результате гидратации CaO (если кальциево-магниевое соединение до гидратации содержит CaO). Они также содержат Mg(OH)2, образованный посредством гидратации MgO, который содержался в кальциево-магниевом продукте до гидратации.
Что касается кальциево-магниевых продуктов, содержащих Mg(OH)2, пропорцию Mg(OH)2 можно количественно определять термогравиметрическим методом, измеряя потерю массы при температуре, составляющей от 200 до 450°C, в частности, от 220 до 420°C и, более конкретно, от 250 до 400°C, которая соответствует высвобождению воды вследствие дегидратации Mg(OH)2 (Mg(OH)2 разлагается, образуя MgO и H2O).
Что касается кальциево-магниевых продуктов, содержащих Ca(OH)2, пропорцию Ca(OH)2 можно количественно определять термогравиметрическим методом, измеряя потерю массы при температуре, составляющей от 400 до 600°C, в частности, от 420 до 580°C и, более конкретно, от 450 до 560°C, которая соответствует высвобождению воды вследствие дегидратации Ca(OH)2 (Ca(OH)2 разлагается, образуя CaO и H2O).
Что касается кальциево-магниевых продуктов, содержащих CaCO3, пропорцию CaCO3 можно количественно определять термогравиметрическим методом, измеряя потерю массы при температуре, составляющей от 600 до 900°C, в частности, от 620 до 850°C и, более конкретно, от 650 до 800°C, которая соответствует высвобождению CO2 вследствие декарбонизации CaCO3 (CaCO3 разлагается, образуя CaO и CO2).
При использовании в настоящем изобретении термин «степень превращения MgO» (обозначается tcMgO (%)) представляет собой молярное соотношение содержания магния во фракции Mg(OH)2 конечного гидратированного продукта и содержания магния в MgO, который первоначально содержался в кальциево-магниевом продукте до гидратации. Эту величину можно вычислять, используя приведенную ниже формулу 1:
Формула 1
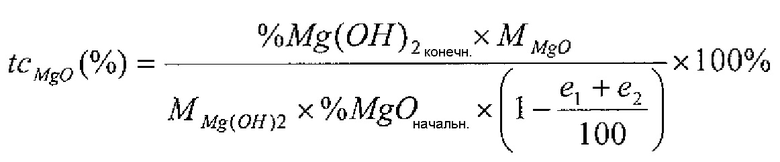
- % Mg(OH)2конечн представляет собой массовую пропорцию Mg(OH)2 в гидратированном продукте, которая определяется, например, по результатам потери массы, соответствующей разложению Mg(OH)2, на термогравиметрической кривой;
- % MgOначальн представляет собой массовую пропорцию Mg(OH)2 в продукте, подлежащем гидратации, которая определяется методом рентгеновской флуоресценции;
- MMgO представляет собой молярную массу MgO (г/моль) (40,3 г/моль);
- MMg(OH)2 представляет собой молярную массу Mg(OH)2 (г/моль) (58,3 г/моль);
- e1 представляет собой воду, присоединенную к Mg(OH)2 в гидратированном продукте и, таким образом, соответствует значению первой потери массы на термогравиметрической кривой;
- e2 представляет собой воду, присоединенную к Ca(OH)2 в гидратированном продукте и, таким образом, соответствует значению второй потери массы на термогравиметрической кривой.
Преимущественно, согласно настоящему изобретению, степень превращения MgO в Mg(OH)2 повышается на 30%, предпочтительно на 100%, предпочтительнее на 150% и еще предпочтительнее на 200% по сравнению со степенью превращения, получаемой при отсутствии добавки в таких же технологических условиях.
Повышенная степень превращения вычисляется в форме увеличения степени превращения согласно формуле ((t2-t1)/t1)⋅100, где t1 представляет собой степень превращения MgO в Mg(OH)2, получаемую при отсутствии добавки, и t2 представляет собой степень превращения MgO в Mg(OH)2, получаемую в присутствии добавки.
Данная степень превращения также предпочтительно получается, когда продолжительность реакции составляет менее чем 5 часов, предпочтительно менее чем 2 часа и предпочтительнее менее чем 1 час, в частности, менее чем 30 минут и, более конкретно, менее чем 20 минут, причем минимальные сроки применяются для непрерывных процессов; в некоторых случаях является достаточной продолжительность реакции, составляющая 15 минут и даже 10 минут или менее.
Эффективная продолжительность реакции может составлять более чем продолжительность выдерживания в установке для гашения. Термин «продолжительность реакции» при использовании согласно настоящему изобретению означает период времени, проходящий с момента вступления в контакт вышеупомянутого кальциево-магниевого продукта с вышеупомянутой водной фазой до момента получения вышеупомянутой степени превращения. Данный период времени включает продолжительность выдерживания продукта в реакторе, который используется для осуществления гидратации, и может также включать дополнительное время, соответствующее, например, хранению продукта в бункере или в контейнерах (таких как эластичные контейнеры, барабаны и т.д.) после того, как в реакторе осуществляется так называемая фаза гидратации. Если после фазы гидратации в продукте по-прежнему содержатся негидратированные оксиды (CaO и MgO) и свободная вода (влага), продукт может продолжать гидратироваться в процессе стадий, следующих после гидратации (таких как разделение, измельчение, хранение в бункере и т.д.). Как показывают наблюдения, при использовании добавок согласно настоящему изобретению дополнительное гашение, которое происходит после периода выдерживания в установке для гашения, также ускоряется по сравнению с ситуацией без добавки.
Предпочтительное оборудование для гидратации, в котором осуществляется способ согласно настоящему изобретению, представляет собой традиционное оборудование для сухого процесса гидратации, в качестве которого может присутствовать одноступенчатая установка для гашения, которую составляет единственный горизонтальный (полу)цилиндрический реактор, оборудованный центральным валом и лопастями, причем данному реактору может предшествовать другой горизонтальный цилиндр, используемый в качестве предварительного смесителя, или многоступенчатая установка для гашения, которую составляют, например, три последовательных реактора с возрастающим диаметром, в которые продукт поступает по мере протекания реакции гидратации, или, как правило, можно использовать любое другое оборудование, в котором может осуществляться сухая гидратация негашеной извести.
В способе согласно одному предпочтительному варианту осуществления настоящего изобретения вышеупомянутое кальциево-магниевое соединение представляет собой порошкообразный материал. В этом случае в установку для гашения поступает порошкообразный содержащий MgO материал, у которого размер частиц составляет от 20 мкм до 10 мм, предпочтительно менее чем 5 мм и предпочтительнее менее чем 2 мм.
Предпочтительно вышеупомянутые гашеные твердые частицы гидроксидов кальция и магния присутствуют в форме твердых частиц, содержащих менее чем 30% масс. воды. Массовое соотношение воды и кальциево-магниевого соединения, содержащего MgO, составляет менее чем 1,5, если в способе гашения используется сухой процесс.
В способе согласно одному конкретному варианту осуществления настоящего изобретения, в частности, в присутствии добавок типа гидроксидов щелочных металлов, продукты, производимые с применением способа гидратации согласно настоящему изобретению, имеют небольшую удельную поверхность, которая составляет преимущественно от 5 до 15 м2/г, предпочтительно менее чем 12 м2/г и предпочтительнее менее чем 10 м2/г.
При использовании согласно настоящему изобретению термин «сухое гашение» означает сухой процесс в строгом смысле или почти сухой процесс.
Согласно одному режиму сухого гашения, количество добавляемой воды ограничивается количеством, которое требуется для реакции гашения и увеличивается на количество потерь водяного пара вследствие экзотермической природы данной реакции. Когда полученный продукт выходит из установки для гашения, он представляет собой порошок и содержит, как правило, менее чем 2% остаточного негидратированного CaO и менее чем 2% влаги, причем максимальное содержание влаги составляет 5%. Следует отметить, что содержание остаточной влаги в данном продукте гидратации составляет, по меньшей мере, 0,3%, как правило, 0,5% или более и часто 1% или более. Кроме того, содержание остаточной влаги при выходе из установки для гашения может временно составлять более чем 5%, в частности, когда продолжительность реакции превышает продолжительность выдерживания в установке для гашения. Данное значение при выходе из установки для гашения можно наблюдать на уровне, составляющем вплоть до 10% или более (но менее чем 15%). Продукт можно упаковывать и продавать непосредственно после необязательной стадии регулирования размера частиц, но без необходимости какой-либо предварительной стадии высушивания и деагломерации. Массовое соотношение воды и кальциево-магниевого продукта, которое обеспечивает достижение этого низкого уровня влагосодержания, в высокой степени зависит от реакционной способности вышеупомянутого кальциево-магниевого соединения. В конкретном случае доломитов, имеющих формулу xCaO⋅yMgO, где соотношение x/y составляет от 0,8 до 1,2, массовое соотношение воды и доломитовой извести, которое обеспечивает изготовление продуктов, содержащих менее чем 5% влаги, как правило, составляет от 0,2 до 0,6 в зависимости от реакционной способности доломитовой извести. Как правило, для вышеупомянутой доломитовой извести данное соотношение составляет от 0,3 до 0,5.
Согласно одному варианту предшествующего способа гашения, гидратацию можно осуществлять, используя повышенный избыток воды, как описывает международная патентная заявка WO 97/14650. В данном случае, полученный продукт гидратации имеет содержание влаги, составляющее от 5 до 30% масс. и чаще от 15 до 30% масс., в частности, от 20 до 30% масс.
В некоторых случаях, данное содержание влаги не превышает 25% масс. За счет этой влаги, как правило, для гидроксидов требуется стадия высушивания и деагломерации перед хранением и транспортировкой. Данный способ гашения далее будет называться термином «почти сухое гашение». Для таких доломитов, которые описаны в приведенном выше параграфе, этосоответствующее массовое соотношение воды и доломитовой извести составляет, как правило, от 0,6 до 1,2 и, в частности, от 0,7 до 1,0 в зависимости от реакционной способности доломитовой извести.
Как правило, чем ниже реакционная способность доломитовой извести, тем ниже температура в процессе ее гидратации. Это приводит к уменьшению испарения воды, добавляемой для реакции гидратации и, следовательно, к увеличению количества жидкой воды и, в результате этого, к увеличению содержания влаги в гидратированном продукте. В случае имеющей низкую реакционную способность доломитовой извести количество воды, добавляемой для реакции гидратации, ограничивается содержанием влаги в продукте, который выходит из установки для гашения. Если уровень влагосодержания составляет более чем 25% и даже приближается к 30%, продукт в большей степени напоминает пасту, чем порошок. При таких уровнях влагосодержания возникают проблемы в установках для гашения, которые не приспособлены для обработки пасты. Таким образом, количество воды, добавляемой для гидратации имеющей низкую реакционную способность доломитовой извести, ограничивается тем, что оно остается в пределах приемлемого интервала влагосодержания. Однако посредством ограничения количества добавляемой воды эффективность реакции гидратации также оказывается ограниченной. Известно, что при увеличении количества воды улучшается склонность MgO к гидратации.
Преимущественный способ согласно настоящему изобретению дополнительно включает стадию деагломерации или измельчения вышеупомянутых гашеных твердых частиц Ca(OH)2 и Mg(OH)2.
Как правило, в способе согласно одному предпочтительному варианту осуществления настоящего изобретения вышеупомянутая водная фаза для гашения имеет перед гашением температуру, которая составляет менее чем 90°C.
Другие варианты осуществления способа согласно настоящему изобретению представлены в прилагаемой формуле изобретения.
Кроме того, настоящее изобретение предлагает кальциево-магниевое соединение, имеющее формулу xCa(OH)2⋅aMgO⋅bMg(OH)2⋅l, где x, a и b представляют собой такие молярные коэффициенты, что a+b=y, x/(a+b)=x/y составляет от 0,8 до 1,2, где b соответствует массовой пропорции Mg(OH)2, составляющей от 5 до 50%, и l представляет собой примеси, причем вышеупомянутое кальциево-магниевое соединение имеет удельную поверхность, измеренную манометрическим методом адсорбции азота и вычисленную с применением метода Брунауэра-Эммета-Теллера (BET), которая составляет 5 м2/г или более и 15 м2/г или менее.
Данное кальциево-магниевое соединение представляет собой, в частности, гидратированную доломитовуя известь, которая, помимо наличия высокого содержания Mg(OH)2 и низкой удельной поверхности по методу BET, получается с применением способа сухой гидратации согласно настоящему изобретению.
Согласно одному преимущественному варианту осуществления настоящего изобретения, кальциево-магниевое соединение представляет собой доломитовую известь, в частности, гидратированную или частично гидратированную доломитовую известь.
Предпочтительно в кальциево-магниевом соединении согласно настоящему изобретению молярный коэффициент b соответствует массовой пропорции Mg(OH)2, составляющей более чем 7%, предпочтительно более чем 10%, преимущественно более чем 15%, преимущественнее более чем 20% и еще преимущественнее более чем 30%.
Преимущественно в соединении согласно настоящему изобретению молярный коэффициент b соответствует массовой пропорции Mg(OH)2, составляющей менее чем 45% и даже менее чем 40%.
Согласно следующему преимущественному варианту осуществления настоящего изобретения, кальциево-магниевое соединение, которое предпочтительно получают с применением сухой гидратации доломита, имеет вышеупомянутую удельную поверхность, измеренную манометрическим методом адсорбции азота и вычисленную с применением метода BET, которая составляет 12 м2/г или менее и, в частности, 10 м2/г или менее.
Соединение согласно другим вариантам осуществления настоящего изобретения представлено в прилагаемой формуле изобретения.
Другие характеристики, отличительные особенности и преимущества настоящего изобретения становятся очевидными из представленного ниже описания, которое является неограничительным и приводится по отношению к прилагаемым примерам и чертежам.
Фиг. 1 иллюстрирует кривые реакционной способности доломитовой извести в примере 1.
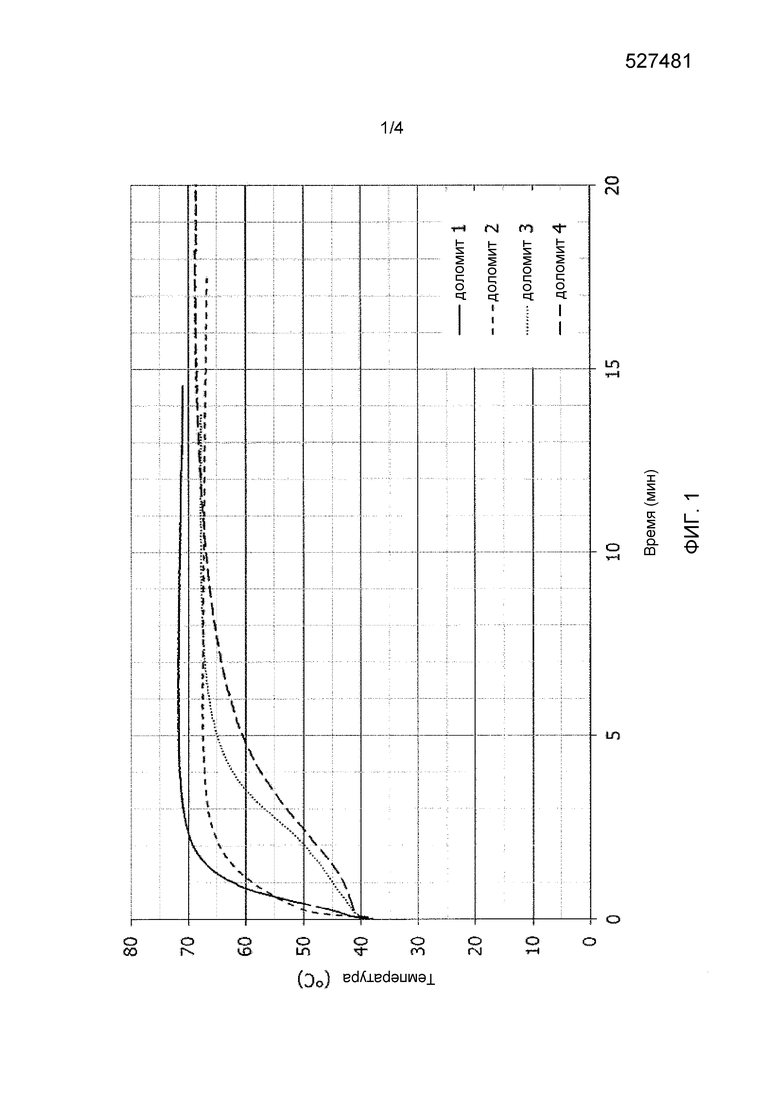
Фиг. 2 иллюстрирует влияние добавок на гидратацию часть MgO доломитовой извести в примере 2.
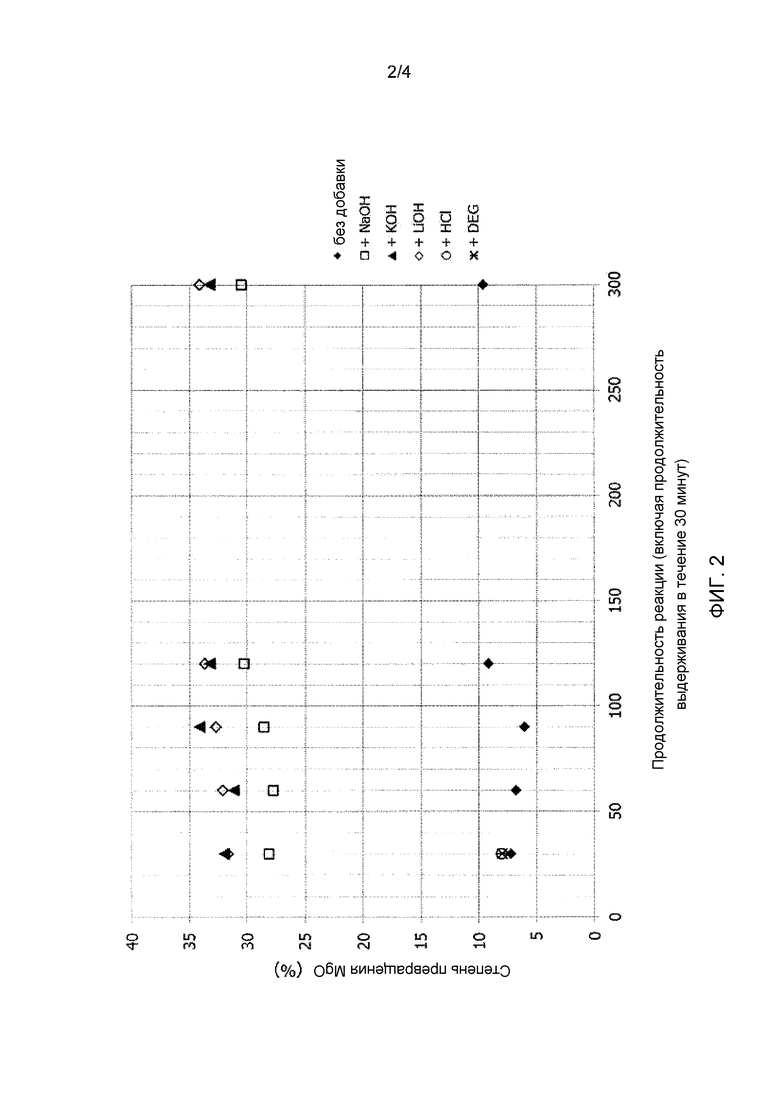
Фиг. 3 иллюстрирует кривую реакционной способности доломитовой извести в примере 3.
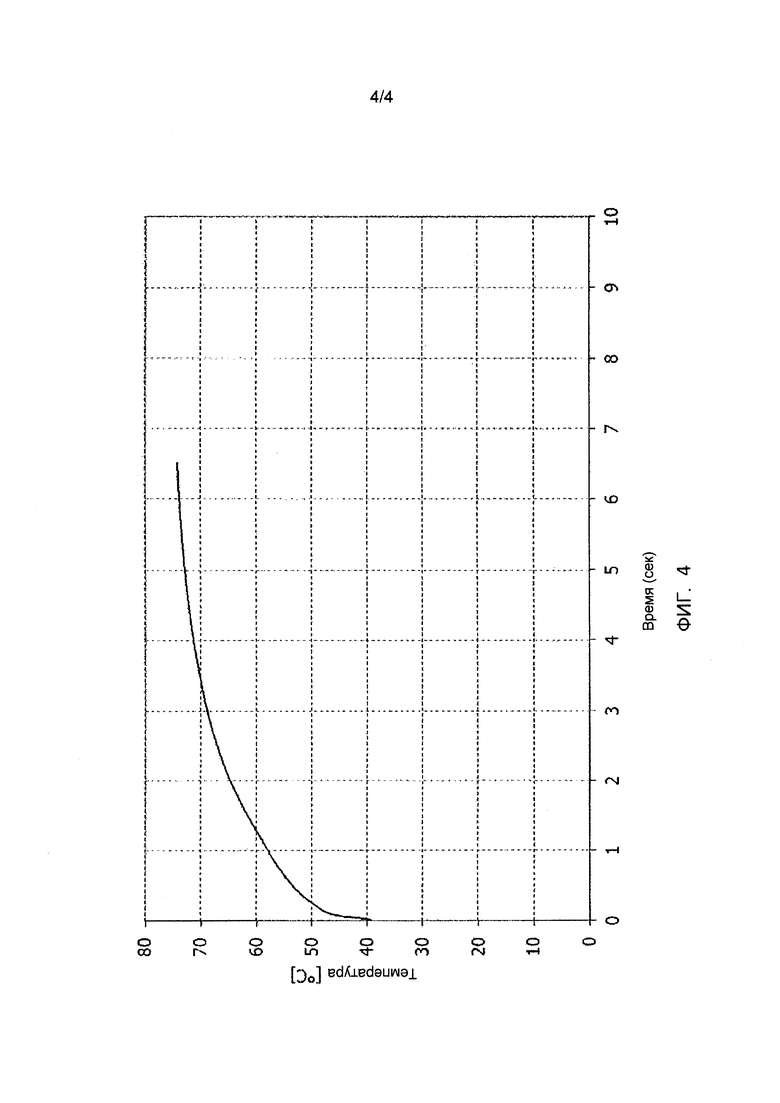
Фиг. 4 иллюстрирует кривую реакционной способности доломитовой извести в примере 7.
Таким образом, в способе согласно настоящему изобретению применяется регулируемая, быстрая и простая сухая или почти сухая гидратация доломитовой извести, доломитовой негашеной извести и магнезиальной извести, помимо прочих соединений, или любого соединения, содержащего, по меньшей мере, 10% масс. MgO, которая осуществляется с помощью стандартного оборудования для гидратации и посредством использования добавки в предпочтительных пропорциях, составляющих от 0,1 до 20% масс., предпочтительно от 1 до 10% масс. и особенно преимущественно от 2 до 5% масс. по отношению к суммарной массе MgO, и обеспечивает степень превращения MgO в получаемый Mg(OH)2, которая является значительно больше, чем степень превращения достигаемая в таких же условиях, но без добавки.
Добавки согласно настоящему изобретению выбираются из группы, которую составляют растворимые в воде гидроксиды металлов, в частности, гидроксиды щелочных металлов (гидроксиды Na, Li или K и, в частности, NaOH), растворимые в воде силикаты металлов, в частности, растворимые в воде силикаты щелочных металлов или щелочноземельных металлов (в частности, силикаты щелочных металлов Na, Li или K и, более конкретно, силикаты Na), растворимые в воде алюминаты, растворимые в воде галогениды металлов в частности, хлориды, бромиды или фториды, (в частности, хлориды металлов), растворимые в воде нитраты металлов, растворимые в воде соли аммония, аммиак, а также их смеси.
Пример 1
В данном примере исследовали доломиты четырех различных типов. Эти доломиты имели различные реакционные способности, такие как проиллюстрировано на фиг. 1, которая представляет температурные кривые эти доломитов, полученные в процессе исследования реакционной способности согласно стандарту ASTM C110. В условиях данного исследования все эти доломиты достигали 60°C, начиная с 40°C, в течение менее чем 5 минут.
Без учета примесей (например, следов CaCO3) доломитовая известь 1, согласно термогравиметрическим и рентгенофлуоресцентным анализам, имела массовое процентное содержание MgO, составляющее 39,5% масс., массовое процентное содержание CaO, составляющее 51,9% масс., и молярное соотношение Ca и Mg, т.е. x/y, составляющее 0,94. Доломитовая известь 2, согласно термогравиметрическим и рентгенофлуоресцентным анализам, имела массовое процентное содержание MgO, составляющее 36,8% масс., массовое процентное содержание CaO, составляющее 47,9 и молярное соотношение Ca и Mg, т.е. x/y, составляющее 0,93. Доломитовая известь 3, согласно термогравиметрическим и рентгенофлуоресцентным анализам, имела массовое процентное содержание MgO, составляющее 37% масс., массовое процентное содержание CaO, составляющее 56,9 и молярное соотношение Ca и Mg, т.е. x/y, составляющее 1,11. Доломитовая известь 4, согласно термогравиметрическим и рентгенофлуоресцентным анализам, имела массовое процентное содержание MgO, составляющее 40,8% масс., массовое процентное содержание CaO, составляющее 58,0 и молярное соотношение Ca и Mg, т.е. x/y, составляющее 1,02.
Все эти доломитовые извести подвергали гидратации, используя плужный смеситель типа Lödige, имеющий объем 5 л и действующий в качестве установки для гашения. Для данной гидратации 1 кг доломитовой извести постепенно добавляли в смеситель в условиях вращения, используя лабораторное устройство для дозирования порошка. Одновременно воду (деминерализованную воду) добавляли в смеситель, используя перистальтический насос, присоединенный к распылительному наконечнику. Поскольку не все доломитовые извести имели одинаковые размеры частиц и были более или менее сыпучими, оказалось невозможным применение устройства для дозирования с одинаковыми параметрами для всех доломитов. Таким образом, время, требуемое для полного добавления 1 кг доломита, имело большую или меньшую продолжительность для различных исследованных доломитов. Однако для каждого параметра дозирующего доломит устройства также регулировали водяной насос таким образом, что в любое время всю массу доломитовой извести и всю массу воды добавляли одновременно в течение одного и того же периода времени добавления, причем данное время составляло от 10 до 20 минут в зависимости от доломита. Массовое соотношение воды и доломитовой извести для всех доломитов находилось на уровне 0,4.
После этой фазы загрузки в смеситель, перемешивание продолжали в течение одного часа, и после этого продукт извлекали из установки для гашения, высушивали при 150°C и анализировали термогравиметрическим методом, чтобы определить степень превращения части MgO доломитовой извести каждого типа в эти условиях гидратации. Поскольку образцы анализировали немедленно после завершения гидратации в смесителе, продолжительность реакции в данном случае была сопоставимой с продолжительностью выдерживания продукта в смесителе, т.е. составляла 1 час (приблизительно 1 час, включая продолжительность добавления доломита и воды в установку для гашения).
Для доломитовой извести каждого из четырех исследованных типов гидратацию первоначально осуществляли без добавки, а затем с добавлением 3% гидроксида натрия (NaOH) по отношению к массе доломитовой извести. Когда добавка представляла собой NaOH, данную добавку помещали в воду для гидратации, по меньшей мере, за 1 час до начала гидратации доломитовой извести, таким образом, чтобы гарантировать полное растворение NaOH в воде и обеспечить возвращение к комнатной температуре раствора NaOH, изготовленного таким способом.
Все результаты представлены в таблице 1 и показывают значительное положительное воздействие использования NaOH в процессе реакции гидратации на степень гидратации части MgO этих доломитов. Использование NaOH обеспечивает увеличение степени превращения MgO на 200% вплоть до более чем 630% по сравнению со степенью превращения без добавки, причем данный эффект становится наиболее значительным и заметный после гидратации в течение лишь одного часа.
Пример 2
В данном примере исследовали доломитовую известь только одного типа. Она представляла собой доломит 1, уже использованный в примере 1. Этот доломит подвергали гидратации, осуществляя такие же операции, которые описаны в примере 1, поддерживая также массовое соотношение воды и доломитовой извести на уровне 0,4. С другой стороны, гидратацию осуществляли в данном случае в течение лишь 30 минут после окончания добавления доломитовой извести и воды в смеситель вместо одного часа, как в примере 1. После окончания этих 30 минут (t=30 минут) продукт извлекали из смесителя, отбирали первый образец, а остальную массу продукта помещали в закрытый пластмассовый контейнер. Затем другие образцы отбирали из данного контейнера в моменты времени t=60, 90, 200 и 500 минут, т.е. в каждом случае отбирали по пять образцов. Таким образом, в данном примере продолжительность реакции соответствует продолжительности выдерживания (30 минут), к которой добавляется продолжительность хранения в контейнере.
Доломит подвергали гидратации без добавки, а затем с добавкой 3% NaOH, как в примере 1, а затем добавляли KOH и LiOH. В случае KOH и LiOH массы KOH и LiOH вычисляли таким образом, чтобы добавлять в смеситель, в котором осуществляется гидратация, такое же молярное количество OH, как количество, добавленное в случае 3% NaOH. В конкретном случае LiOH используемая добавка представляла собой гидрат (LiOH⋅H2O). Эти добавки добавляли в воду для гидратации, осуществляя такую же процедуру, которая описана в примере 1. Все результаты представлены вместе в таблице 2. Эти значения четко показывают благоприятное воздействие различных исследованных добавок на уровень гидратации части MgO исследуемой доломитовой извести, причем данное воздействие становилось заметным уже через 30 минут, т.е. немедленно после того, как продукт извлекали из установки для гашения (фиг. 2).
b. по сравнению с продуктом, полученным в таких же условиях без добавки; c. фактически LiOH⋅H2O.
Помимо значительного воздействия на степень превращения MgO в Mg(OH)2, добавки, используемые в данном примере, также производили значительное воздействие на удельную поверхность и поровый объем гидратированных продуктов, как проиллюстрировано результатами в таблице 3.
b. объем пор, имеющих размеры от 17 до 1000 Å, полученный вычислением с применением метода BET на основе измерений адсорбции/десорбции азота для дегазированного образца;
c. фактически LiOH⋅H2O.
Пример 3
Описанные ниже исследования в примере 3 осуществляли, исходя из доломитовой извести 5, имеющей значение d98, составляющее 3 мм или менее, и содержащей 39,7% масс. MgO согласно анализу методом рентгенофлуоресцентной спектрометрии.
Доломит 5, используемый в данном примере (исключая примеси, такие как, например, CaCO3), согласно термогравиметрическому и рентгенофлуоресцентному анализу, имел массовое процентное содержание MgO, составляющее 39,7%, массовое процентное содержание CaO, составляющее 55,1, и молярное соотношение Ca и Mg, т.е. x/y, составляющее 1,00.
Этот доломит первоначально подвергали упрощенному исследованию для определения степени превращения при 70°C, как описано выше, и получали описание реакционной способности материалов, подлежащих гидратации. Для этого доломита степень превращения MgO в Mg(OH)2 в процессе данного исследования составляла 22,6%, как проиллюстрировано результатами, приведенными ниже в таблице, и вычислено с использованием формулы 1.
Кроме того, исследование реакционной способности, осуществленное согласно следующему описанию и стандарту ASTM C110, показало относительно высокую реакционную способность для этого доломита: t70 составляло 3,5 минуты, и потребовалось только 1,2 минуты для достижения 60°C, начиная с 40°C, как проиллюстрировано кривой зависимости реакционной способности на фиг. 3.
Эту доломитовую известь затем подвергали гидратации в лабораторной экспериментальной установке для гашения. Данная установка для гашения представляла собой одноступенчатую установку для гашения. Она имела форму горизонтального цилиндра, у которого длина составляла приблизительно 80 см, и диаметр составлял 25 см. Эти пропорции соответствуют пропорциям промышленных одноступенчатых установок для гашения, которые традиционно используются для гидратации негашеной извести или доломитовой извести при атмосферном давлении в сухом или почти сухом процессе. Эти размеры составляют в 6-7 раз меньше, чем размеры промышленных установок для гашения. Данный цилиндр был оборудован двойной рубашкой, которая позволяет регулировать температуру посредством циркуляции горячей или холодной текучей среды. Внутри установки для гашения находился вал, снабженный лопастями, которые использовали для гомогенизации продукта в процессе гидратации, а также для перемещения продукта от входного отверстия (на одном торце цилиндра) по направлению к выпускному отверстию (на другом торце цилиндра). Когда продукт проходил полную длину установки для гашения, он выходил из установки для гашения посредством простого перетекания. Как правило, уровень заполнения объема установки для гашения составлял приблизительно 50%, т.е. высота слоя продукта достигала приблизительно уровня вала.
Установку для гашения предварительно нагревали до 70-80°C посредством циркуляции воды при температуре 90°C внутри двойной рубашки. Это предварительное нагревание обеспечивает моделирование равновесного состояния, которое достигается в промышленных условиях в процессе непрерывной работы, и предотвращает конденсацию водяного пара, который образуется в реакции гидратации доломита, на стенках установки для гашения, если они являются холодными. Двойная рубашка осушается, когда в установке для гашения начинается реакция гидратации.
В данном примере доломит помещали в установку для гашения с использованием шнека, который предварительно калибровали, чтобы устанавливать скорость потока доломитовой извести на уровне 200 г/мин.
Доломит подвергали гидратации, используя массовое соотношение воды и доломитовой извести, составляющее 0,4, в присутствии 1% алюмината натрия, имеющего формулу NaAlO2, по отношению к массе доломитовой извести. Гидратацию осуществляли в непрерывном режиме, и средняя продолжительность выдерживания продукта гидратации в реакторе составляла приблизительно от 15 до 20 минут. В целом, продолжительность гидратации в этих условиях составляла 60 минут. Чтобы выполнить эти условия, раствор изготавливали перед гидратацией посредством перемешивания 5160 г деминерализованной воды и 120 г алюмината натрия, имеющего формулу NaAlO2. Данный раствор выдерживали в условиях непрерывного перемешивания. Когда начиналась операция добавления доломитовой извести в установку для гашения, также начиналось загрузка данного раствора. Данная загрузка в установку для гашения осуществляли через два отверстия, каждое из которых имело диаметр, составляющий приблизительно 5 мм, и находилось на крышке установки для гашения вблизи входного отверстия для доломитовой извести, с использованием распылительных наконечников. Скорость потока данного раствора составляла 88 г/мин.
Первые 40 минут гидратации соответствовали пуску установки для гашения. В течение следующих 20 минут образцы регулярно отбирали и высушивали на термовесах при 150°C в течение менее чем 30 минут. Определяли их влагосодержание. Эти высушенные образцы затем подвергали термогравиметрическому измерению, которое позволяло вычислять степень превращения MgO в Mg(OH)2. В данном примере, поскольку образцы отбирали непосредственно на выходе установки для гашения, продолжительность реакции можно было считать сопоставимой с продолжительностью выдерживания в установке для гашения.
Кроме того, такую же процедуру гидратации осуществляли с использованием данной доломитовой извести в точно одинаковых условиях, но без добавки (использовали 200 г/мин доломитовой извести и 86 г/мин водопроводной воды, т.е. соотношение воды и доломитовой извести составляло 0,43, как описано выше). Это позволяло сравнивать результаты, полученные с добавкой и без добавки алюмината натрия в аналогичных технологических условиях. Эти результаты сравниваются в таблице 5. Добавка обеспечивала значительное увеличение процентной степени гидратации MgO в условиях данного примера, причем данная процентная степень увеличивалась более чем в два раза в присутствии 1% алюмината натрия по отношению к массе доломита.
без добавки
Пример 4
Данный пример был очень похож на пример 3 в том, что одну и ту же доломитовую известь использовали и подвергали гидратации в одной и той же установке для гашения. Однако в данном случае доломитовую известь, снова добавляемую в установку для гашения при скорости 200 г/мин, подвергали гидратации при массовом соотношении воды и доломитовой извести, составляющей 0,8. Первоначально доломит подвергали гидратации деминерализованной водой без добавления добавки при скорости потока воды 160 г/мин. После этого вместо воды использовали раствор алюмината натрия, имеющего формулу NaAlO2, который предварительно изготавливали, перемешивая 9600 г водопроводной воды и 600 г алюмината натрия NaAlO2. В течение 60 минут гидратации (первые 40 минут для достижения равновесного состояния) данный раствор загружали в установку для гашения при скорости 170 г/мин. Результаты, полученные в этих новых условиях с добавкой и без добавки, сравниваются в таблице 6. В данном примере, как и в примере 3, продолжительность реакции можно считать сопоставимой с продолжительностью выдерживания в установке для гашения, поскольку образцы исследовали немедленно после того, как они выходили из установки для гашения.
Добавка обеспечивала весьма значительное увеличение процентной степени гидратации MgO в условиях данного примера, причем эта процентная степень увеличивалась более чем в три раза в присутствии 5% алюмината натрия по отношению к массе доломита. Значение 28,5%, достигнутое для степени превращения MgO в присутствии 5% алюмината натрия, представляет собой высокую степень превращения по сравнению со степенями превращения, обычно получаемыми без добавки в промышленных условиях гидратации доломита в сухом процессе, которые, как обычно считается, не могут превышать 25%.
без добавки
Пример 5
В данном примере доломитовую известь 2, описанную в примере 1, подвергали гидратации в лабораторной экспериментальной установке для гашения, уже использованной в описанных выше примерах 3 и 4. В данном случае скорость потока доломитовой извести составляла 150 г/мин, но все остальные параметры (предварительное нагревание, уровень заполнения и т.д.) оставались такими же, как в процедуре, описанной в примере 3.
Эту доломитовую известь сначала подвергали гидратации деминерализованной водой, предварительно нагретой до 70°C, и добавляли в установку для гашения при скорости 55 г/мин. Вместо этой воды затем использовали раствор гидроксида натрия (NaOH) при концентрации 10% масс., который также предварительно нагревали до 70°C и добавляли при скорости потока 85 г/мин. Это соответствует добавлению 5,7% NaOH по отношению к массе доломитовой извести.
Как описано выше в примере 3, средняя продолжительность выдерживания в установке для гашения составляла приблизительно от 20 до 30 минут. Немедленно после выхода из установки для гашения гидратированный продукт исследовали (продолжительность реакции и в этом случае была эквивалентна продолжительности выдерживания). Результаты представлены в таблице 7. В данном случае наблюдалось весьма выраженное воздействие использования гидроксида в процессе реакции гидратации доломитовой извести.
Продукт, полученный в присутствии гидроксида натрия и имеющий степень превращения, составляющую приблизительно 50%, проявлял удельную поверхность по методу BET, составляющую 11,0 м2/г.
Пример 6
В данном случае доломитовую известь 3, описанную в примере 1, подвергали гидратации в экспериментальной установке для гашения, которую уже использовали в примерах 3-5. Эту доломитовую известь загружали в установку для гашения при скорости 150 г/мин.
Данную доломитовую известь сначала подвергали гидратации деминерализованной водой, предварительно нагретой до 70°C, и загружали в установку для гашения при скорости 59 г/мин. Вместо этой воды затем использовали раствор гидроксида натрия (NaOH) при концентрации, составляющей 7,5% масс., который также предварительно нагревали до 70°C и загружали при скорости 71 г/мин. Это соответствует добавлению 3,5% NaOH по отношению к массе доломитовой извести.
Как описано выше в примере 5, средняя продолжительность выдерживания в установке для гашения составляла приблизительно от 20 до 30 минут. После выпуска из установки для гашения продукты помещали в контейнер для хранения в лаборатории. Первую серию образцов, изготовленных с добавкой и без добавки гидроксида натрия, отбирали непосредственно на выпуске установки для гашения (продолжительность реакции равнялась продолжительности выдерживания в установке для гашения). Вторую серию образцов, изготовленных с добавкой и без добавки гидроксида натрия, отбирали из контейнеров через 1 час после выпуска из установки для гашения (продолжительность реакции превышала продолжительности выдерживания на 1 час). Результаты представлены в таблице 8. Хотя гидроксид натрия уже обеспечивал удвоение степени превращения MgO в Mg(OH)2 в течение времени выдерживания в установке для гашения (когда продолжительность реакции равнялась продолжительности выдерживания), он производил значительно более сильное воздействие, когда продукты хранили в течение одного часа перед исследованием (когда продолжительность реакции превышала продолжительности выдерживания на 1 час). В присутствии гидроксида натрия степень превращения, составляющая приблизительно 76%, могла быть достигнута после хранения в течение лишь одного часа после выпуска из установки для гашения. С другой стороны, продукт, полученный без добавки, не реагировал в процессе этого часового хранения. Продукт, полученный в присутствии гидроксида натрия и имеющий степень превращения, составляющую приблизительно 76%, имел удельную поверхность по методу BET, составляющую 9,2 м2/г.
Пример 7
В данном примере исследовали доломитовую известь 6. В данном случае ее подвергали гидратации, используя эпициклический (планетарный) смеситель типа Hobart, имеющий объем 5 л.
Обожженный доломит 6, используемый в данном примере (исключая примеси, такие как CaCO3), согласно термогравиметрическим и рентгенофлуоресцентным анализам, имел массовое процентное содержание MgO, составляющее 40,9%, массовое процентное содержание CaO, составляющее 54,1 и молярное соотношение Ca и Mg, т.е. x/y, составляющее 0,95.
Основное различие данного смесителя и плужного смесителя в примерах 1 и 2 заключается в том, что данный смеситель является в значительной степени менее замкнутым, и в результате этого происходит высвобождение энергии реакции гидратации, и, следовательно, снижение температуры в процессе гидратации по сравнению с температурой, измеренной для такого же доломита и такого же соотношения воды и доломита в более замкнутом плужном смесителе. Однако воду и доломит добавляли точно таким же образом, как в примерах 1 и 2.
В данном случае 800 г доломитовой извести и 320 г деминерализованной воды (соотношение воды и доломита составляло 0,4) постепенно загружали в смеситель в течение периода, составляющего приблизительно 20 минут. После завершения этой фазы загрузки смесь выдерживали в условиях перемешивания для гидратации в течение 60 минут. Продукт затем извлекали из смесителя, высушивали при 150°C и анализировали, чтобы определить степень превращения MgO в Mg(OH)2 в этих условиях (продолжительность реакции равнялась продолжительность выдерживания).
В данном примере гидратацию сначала осуществляли, используя в качестве сравнения воду без добавки, а затем добавляли 3% силиката натрия по отношению к массе доломита. Силикат натрия использовали в форме растворимого стекла, т.е. в форме силиката натрия, имеющего молярное соотношение SiO2 и Na2O, составляющее 3,5, в водном растворе при концентрации 37%.
Результаты представлены в таблице 9. Они показывают низкую процентную степень гидратации доломита 6 без добавки по сравнению с процентными степенями гидратации, полученными без добавок для доломитов 1-6 в предшествующих примерах, вероятно, вследствие снижения температуры гидратации, как разъясняется выше. С другой стороны, гидратация с добавкой силиката натрия обеспечивала значительное повышение степени гидратации MgO, получаемой в одинаковых условиях.
Сравнительный пример 1
Данный сравнительный пример является аналогичным примеру 2, но в данном случае в качестве добавки для гидратации доломитовой извести 1 использовали не гидроксид щелочного металла, а хлористоводородную кислоту. Как и в примере 2, массовое соотношение воды и доломита сохранялось на уровне 0,4, и количество добавки составляло 3% по отношению к массе доломита. Для этой цели, осуществляя процедуру, описанную в примере 2, раствор, изготовленный с использованием 81 г 37% масс. хлористоводородной кислоты и 349 г деминерализованной воды, постепенно добавляли в расчете на 1 кг доломита. После выдерживания в течение 30 минут в смесителе, в котором происходила гидратация, продукт высушивали и исследовали (продолжительность реакции равнялась продолжительности выдерживания). Результаты данного исследования, которые представлены в таблице 10, показали незначительное воздействие хлористоводородной кислоты на процентную степень гидратации части MgO данного доломита (фиг. 2).
Сравнительный пример 2
Этот второй сравнительный пример является точно аналогичным сравнительному примеру 1, но в данном случае вместо хлористоводородной кислоты использовали диэтиленглиголь (DEG) в жидкой форме (1 кг доломитовой извести и 400 г деминерализованной воды предварительно смешивали с 30 г жидкого DEG). Результаты, которые представлены в таблице 10, снова показали незначительное воздействие DEG на степень превращения MgO для данного доломита (фиг. 2).
Очевидно, что настоящее изобретение никаким образом не ограничивается вариантами осуществления, которые представлены в приведенном выше описании, и можно производить его многочисленные модификации без выхода за пределы объема прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОКРОГО ГАШЕНИЯ ОКСИДОВ КАЛЬЦИЯ И МАГНИЯ ОТ ИЗВЕСТКОВО-МАГНЕЗИАЛЬНЫХ СОЕДИНЕНИЙ | 2014 |
|
RU2654010C2 |
| МИНЕРАЛЬНАЯ КОМПОЗИЦИЯ НА ОСНОВЕ СМЕШАННОЙ ТВЕРДОЙ ФАЗЫ КАРБОНАТОВ КАЛЬЦИЯ И МАГНИЯ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ЕЕ ПРИМЕНЕНИЕ | 2013 |
|
RU2599758C2 |
| МИНЕРАЛЬНАЯ КОМПОЗИЦИЯ НА ОСНОВЕ СМЕШАННОЙ ТВЕРДОЙ ФАЗЫ КАРБОНАТОВ КАЛЬЦИЯ И МАГНИЯ И СПОСОБ ПОЛУЧЕНИЯ ТАКОЙ КОМПОЗИЦИИ | 2014 |
|
RU2631818C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКАРБОАЛЮМИНАТОВ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ ИЗ ПРИРОДНОГО МАГНИЙСОДЕРЖАЩЕГО СЫРЬЯ | 2012 |
|
RU2540635C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОКСИДА МАГНИЯ ИЗ ПРИРОДНЫХ РАССОЛОВ | 2001 |
|
RU2211803C2 |
| КАРБОНАТНО-СИЛИКАТНЫЙ СИНТЕТИЧЕСКИЙ СЫРЬЕВОЙ МАТЕРИАЛ ДЛЯ ПРОИЗВОДСТВА СТЕКЛА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2007 |
|
RU2361827C1 |
| СОСТАВ ШИХТЫ ДЛЯ ПОЛУЧЕНИЯ ВСПЕНЕННОГО ТЕПЛОИЗОЛЯЦИОННОГО МАТЕРИАЛА | 2017 |
|
RU2655499C1 |
| Состав сырьевой смеси для получения магнезиального вяжущего | 2021 |
|
RU2768338C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАУСТИЧЕСКОГО ДОЛОМИТА | 1998 |
|
RU2158241C2 |
| СПОСОБ ПОДГОТОВКИ К ПЕРЕРАБОТКЕ СИДЕРИТОВОЙ ЖЕЛЕЗНОЙ РУДЫ (ВАРИАНТЫ) И ПОСЛЕДУЮЩИЙ СПОСОБ ЕЕ БЕЗОТХОДНОЙ ПЕРЕРАБОТКИ | 2011 |
|
RU2562016C1 |
Изобретение может быть использовано в химической промышленности. Способ сухого гашения оксидов кальция и магния из кальциево-магниевого соединения, содержащего, по меньшей мере, 10 мас.% MgO по отношению к суммарной массе вышеупомянутого кальциево-магниевого соединения включает загрузку кальциево-магниевого соединения, содержащего MgO, и водной фазы в оборудование для гашения. Оксиды кальция и магния кальциево-магниевого соединения содержат оксид магния в количестве менее чем 50% масс., молярное соотношение кальция и магния составляет 0,8-1,2. Проводят гашение оксидов кальция и магния с образованием гашеных твердых частиц гидроксидов кальция и магния. Гашение осуществляют в присутствии добавки, выбранной из группы, включающей растворимые в воде гидроксиды щелочных металлов, растворимые в воде силикаты щелочных металлов, алюминат калия, алюминат натрия, алюминат лития, алюминат аммония или их смеси, растворимые в воде хлориды металлов, бромиды металлов, фториды металлов или их смеси, растворимые в воде нитраты металлов, растворимые в воде соли аммония, аммиак или их смеси. Добавку вводят в количестве 0,1-20 мас.% по отношению к суммарной массе MgO. Изобретение позволяет повысить степень превращения оксида магния в гидроксид магния и ускорить процесс промышленного получения гидроксидов кальция и магния. 16 з.п. ф-лы, 4 ил., 10 табл., 7 пр.
1. Способ сухого гашения оксидов кальция и магния из кальциево-магниевого соединения, предпочтительно содержащего, по меньшей мере, 10 мас.% MgO по отношению к суммарной массе вышеупомянутого кальциево-магниевого соединения, включающий следующие стадии:
- загрузка кальциево-магниевого соединения, содержащего MgO, в оборудование для гашения;
- загрузка водной фазы для гашения в вышеупомянутое оборудование для гашения; и
- гашение вышеупомянутых оксидов кальция и магния из вышеупомянутого кальциево-магниевого соединения, загруженного в вышеупомянутое оборудование для гашения, вышеупомянутой водной фазой для гашения, приводящее к образованию гашеных твердых частиц гидроксидов кальция и магния,
отличающийся тем, что вышеупомянутое гашение осуществляется в присутствии добавки, выбранной из группы, включающей растворимые в воде гидроксиды щелочных металлов, растворимые в воде силикаты щелочных металлов, алюминат калия, алюминат натрия, алюминат лития, алюминат аммония или их смеси, растворимые в воде хлориды металлов, бромиды металлов, фториды металлов или их смеси, растворимые в воде нитраты металлов, растворимые в воде соли аммония, аммиак или их смеси;
где оксиды кальция и магния кальциево-магниевого соединения имеют содержание оксида магния, составляющее менее чем 50 мас.% по отношению к массе кальциево-магниевого соединения, и имеют молярное соотношение кальция и магния, составляющее от 0,8 до 1,2;
где добавка вводится при содержании, составляющем от 0,1 до 20 мас.% по отношению к суммарной массе MgO.
2. Способ гашения по п.1, в котором вышеупомянутое кальциево-магниевое соединение выбирается из группы, которую составляют доломитовая известь, полуобожженный доломит или полугидратированная доломитовая известь, смешанные кальциево-магниевые соединения, в частности, смешанные оксиды кальция и магния, имеющие значительное содержание MgO, составляющее более чем 10 мас.% по отношению к суммарной массе смешанного оксида, а также их смеси.
3. Способ гашения по п.1, в котором гидроксиды щелочных металлов выбирают из группы, состоящей из гидроксида натрия, калия или лития, а также их смеси.
4. Способ гашения по п.1, в котором силикаты щелочных металлов выбирают из группы, состоящей из силикатов натрия и лития, силикатов щелочноземельных металлов, в частности силикатов кальция и магния, а также их смеси.
5. Способ гашения по п.1, в котором нитраты металлов и галогениды металлов включают, по меньшей мере, один атом металла, выбранного из группы, включающей алюминий, кальций и магний.
6. Способ гашения по п.1, в котором нитраты металлов и галогениды металлов включают, по меньшей мере, один атом металла, выбранного из группы, включающей алюминий и магний.
7. Способ гашения по п.1, в котором вышеупомянутая добавка добавляется в вышеупомянутую водную фазу для гашения перед вышеупомянутой загрузкой вышеупомянутой водной фазы для гашения для образования содержащей добавку водной фазы для гашения.
8. Способ гашения по п.1, в котором вышеупомянутая добавка добавляется в вышеупомянутую водную фазу для гашения внутри вышеупомянутого оборудования для гашения или в процессе вышеупомянутой загрузки вышеупомянутой водной фазы для гашения.
9. Способ гашения по п.1, в котором вышеупомянутая добавка добавляется в вышеупомянутое содержащее MgO соединение или в процессе вышеупомянутой загрузки вышеупомянутого кальциево-магниевого соединения.
10. Способ гашения по п.1, в котором вышеупомянутая добавка вводится при содержании, составляющем от 1 до 10% масс. по отношению к суммарной массе MgO.
11. Способ гашения по п.1, в котором вышеупомянутое кальциево-магниевое соединение имеет степень превращения MgO в Mg(OH)2, составляющую, по меньшей мере, 10%, предпочтительно более чем 15% и предпочтительнее более чем 20% при измерении упрощенным методом определения степени превращения.
12. Способ гашения по п.1, в котором вышеупомянутое оборудование для гашения представляет собой установку для сухого процесса гашения.
13. Способ гашения по п.1, в котором степень превращения MgO в Mg(OH)2 повышается на 30%, предпочтительно на 100%, предпочтительнее на 150% и еще предпочтительнее на 200% по отношению к степени превращения, полученной без добавки.
14. Способ гашения по п.13, в котором продолжительность вышеупомянутой реакции составляет менее чем 5 часов, предпочтительно менее чем 2 часа, предпочтительнее менее чем 1 час, в частности, она составляет менее чем 30 минут и, более конкретно, менее чем 20 минут.
15. Способ гашения по п.1, в котором вышеупомянутое кальциево-магниевое соединение представляет собой порошкообразный материал.
16. Способ гашения по п.1, дополнительно включающий стадию деагломерации или измельчения вышеупомянутых гашеных твердых частиц.
17. Способ гашения по п.1, в котором вышеупомянутая водная фаза для гашения имеет температуру перед гашением, составляющую менее чем 90°C.
| WO 9209528 A1, 11.06.1992 | |||
| СПОСОБ ГАШЕНИЯ ИЗВЕСТИ | 0 |
|
SU297607A1 |
| WO 2005014483 A2, 17.02.2005 | |||
| WO 9851614 A1, 19.11.1998 | |||
| ЖЕЛЕЗНОДОРОЖНАЯ ТОРМОЗНАЯ СИСТЕМА ДЛЯ ЖЕЛЕЗНОДОРОЖНОГО ТРАНСПОРТНОГО СРЕДСТВА И СПОСОБ ТОРМОЖЕНИЯ ЖЕЛЕЗНОДОРОЖНОГО ТРАНСПОРТНОГО СРЕДСТВА, СОДЕРЖАЩЕГО ТАКУЮ СИСТЕМУ | 2014 |
|
RU2669327C2 |
| US 3120444 A, 04.02.1964 | |||
| US 1856763 A, 03.05.1932. | |||
Авторы
Даты
2018-10-02—Публикация
2014-02-18—Подача