РОДСТВЕННАЯ ЗАЯВКА
Настоящая заявка испрашивает приоритет на основании заявки на патент США №61/624215, поданной 13 апреля 2012 г., полное содержание которой полностью включено в данное описание путем ссылки.
УРОВЕНЬ ТЕХНИКИ
По оценкам, в 2012 г. более чем у 1,6 миллиона людей будет диагностирован рак. Например, самым распространенным типом рака у женщин является рак молочной железы, и это заболевание ответственно за один из самых высоких показателей смертности из всех форм рака, поражающих женщин. Современное лечение рака молочной железы ограничивается тотальной или частичной мастэктомией, лучевой терапией или химиотерапией. Почти 230000 случаев рака в 2012 г. будут относиться к раку молочной железы, что, по оценкам, приведет к 40000 смертельных исходов. См. Siegel et al., Ca Cancer J Clin 2012; 62: 10-29.
Ряд случаев смерти от рака вызван гематологическими видами рака, включая лейкозы, миеломы и лимфомы. В 2012 г. почти 80000 случаев рака будут представлять собой лимфомы, которые, по оценкам, приведут к 20000 случаев смерти.
Лучевая терапия, химиотерапия и хирургическое вмешательство являются первичными способами лечения рака. Однако эти способы лечения наиболее успешны только при выявлении рака на ранней стадии. После достижения раком инвазивных/метастатических стадий, линии внедряющихся клеток или метастазирующих клеток могут избежать выявления, приводя, таким образом, к рецидивам, что требует лечения, которое является высокотоксичным. В этот момент и раковые клетки, и непораженные клетки пациента подвергаются токсичной терапии, приводящей, наряду с другими осложнениями, к ослаблению иммунной системы.
В связи с этим, в данной области сохраняется потребность в новых способах лечения рака, такого как рак молочной железы или лимфомы, у пациента.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Соответственно, настоящее изобретение относится к гидробромиду N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамида:
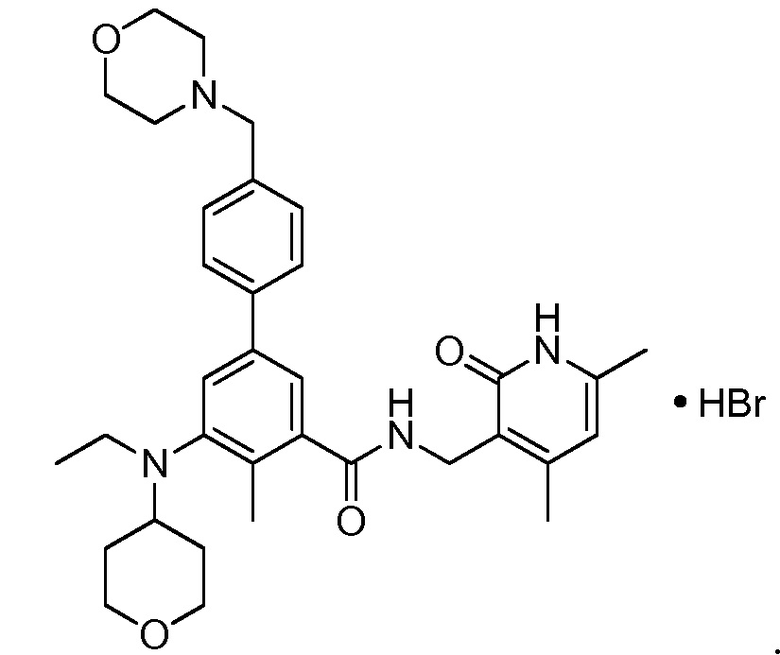
Изобретение также относится к определенной полиморфной форме гидробромида N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамида («полиморф A», или «полиморф A гидробромида N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамида»). Как указано в настоящей заявке, представленный здесь гидробромид, а также полиморф A проявляют физические свойства, которые можно использовать для получения новых фармакологических свойств, и которые можно использовать в лекарственном веществе и разработке лекарственного продукта.
В одном варианте осуществления гидробромид является кристаллическим. В другом варианте осуществления гидробромид по существу не содержит примеси. В другом варианте осуществления гидробромид представляет собой кристаллическое твердое вещество, по существу не содержащее аморфный гидробромид N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамида.
В другом аспекте изобретение относится к фармацевтической композиции, содержащей описанный выше гидробромид и фармацевтически приемлемый носитель или разбавитель.
В одном аспекте описанный выше гидробромид получают, используя способ, включающий объединение N-((4,6-диметил-2-оксо- 1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамида с бромистоводородной кислотой.
Полиморф A N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамида можно определить в соответствии с его профилем порошковой рентгеновской дифракции. Соответственно, в одном варианте осуществления полиморф характеризуется картиной порошковой рентгеновской дифракции, имеющей один или несколько характерных пиков, выраженных в градусах 2-тета, примерно при 3,9+/-0,3 градуса, примерно 17,5+/-0,3 градуса и примерно 22,0+/-0,3 градуса 2-тета. В другом варианте осуществления полиморф характеризуется картиной порошковой рентгеновской дифракции, имеющей характерные пики, выраженные в градусах 2-тета, примерно при 3,9+/-0,3 градуса, примерно 17,5+/-0,3 градуса и примерно 22,0+/-0,3 градуса 2-тета. В еще одном варианте осуществления полиморф характеризуется картиной порошковой рентгеновской дифракции, имеющей характерные пики, выраженные в градусах 2-тета, примерно при 3,9+/-0,3 градуса, 10,1+/-0,3 градуса, 14,3+/-0,3 градуса, 17,5+/-0,3 градуса, 18,7+/-0,3 градуса, 20,6+/-0,3 градуса, 20,9+/-0,3 градуса, 21,8+/-0,3 градуса, 22,0+/-0,3 градуса, 23,3+/-0,3 градуса и 23,6+/-0,3 градуса 2-тета. В еще одном варианте осуществления полиморф характеризуется картиной порошковой рентгеновской дифракции по существу в соответствии с фиг. 1. В другом варианте осуществления полиморф характеризуется картиной порошковой рентгеновской дифракции по существу в соответствии с таблицей 1.
Полиморф A можно также определить в соответствии с его термограммой, полученной дифференциальной сканирующей калориметрией. В одном варианте осуществления полиморф характеризуется термограммой, полученной дифференциальной сканирующей калориметрией, имеющую характерный пик, выраженный в единицах °C при температуре 255+/-5°C. В одном варианте осуществления полиморф характеризуется термограммой, полученной дифференциальной сканирующей калориметрией, по существу в соответствии с фиг. 3.
В одном аспекте полиморф A получают, используя способ, включающий объединение N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамида с бромистоводородной кислотой.
В другом аспекте изобретение относится к способу перекристаллизации полиморфа A, который включает следующие стадии: (a) растворение полиморфа A в первом растворителе и (b) добавление второго растворителя с тем, чтобы указанный полиморф перекристаллизовался. В одном варианте осуществления первый растворитель представляет собой этанол, и второй растворитель представляет собой MTBE (простой метил-трет-бутиловый эфир). В другом варианте осуществления способ включает (a) растворение полиморфа A в этаноле, (b) нагревание смеси, (c) добавление MTBE к смеси, образуя осадок, содержащий указанный полиморф и фильтрацию осадка с тем, чтобы указанный полиморф перекристаллизовался.
В еще одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей полиморф A и фармацевтически приемлемый носитель или разбавитель.
Изобретение также относится к способу лечения рака, включающему введение нуждающемуся в нем индивиду терапевтически эффективного количества описанного выше гидробромида соединения, полиморфа A или фармацевтической композиции, содержащей любое из этих соединений. Можно лечить разнообразные виды рака, включая неходжкинскую лимфому или рак молочной железы.
В другом аспекте изобретение относится к способу ингибирования активности гистон-метилтрансферазы EZH2 у нуждающегося в нем индивида, включающему введение индивиду эффективного количества описанного выше гидробромида соединения, полиморфа A или фармацевтической композиции, содержащей любое из этих соединений.
В еще одном аспекте настоящее изобретение относится к способу ингибирования активности гистон-метилтрансферазы EZH2 in vitro, включающему введение описанного выше гидробромида соединения или полиморфа A.
Изобретение также относится к применению описанного выше гидробромида соединения, полиморфа A или фармацевтической композиции, содержащей любое из этих соединений, для получения лекарственного препарата для лечения рака у нуждающегося в лечении индивида.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 изображен профиль порошковой рентгеновской дифракции полиморфа A (моногидробромида).
На фиг. 2 изображен профиль порошковой рентгеновской дифракции дигидробромида соединения I.
На фиг. 3 изображена полученная дифференциальной сканирующей калориметрией термограмма полиморфа A.
На фиг. 4 изображена динамическая сорбция пара полиморфа A, которая демонстрирует низкую гигроскопичность данного соединения.
На фиг. 5 изображен анализ с использованием ВЭЖХ полиморфа A в течение трех дней при повышенной температуре. Полиморф A в течение этого времени продуцировал минимальное количество примесей.
На фиг. 6 изображена динамическая сорбция пара натриевой соли соединения I, которая демонстрирует значительную гигроскопичность данного соединения.
На фиг. 7 изображена динамическая сорбция пара гемисульфата соединения I, которая демонстрирует, что данное соединение имеет умеренно высокую гигроскопичность.
На фиг. 8 показаны данные дифференциальной сканирующей калориметрии моногидрохлорида соединения I, которые указывают на то, что данное соединение является слабо кристаллическим.
На фиг. 9 изображен профиль порошковой рентгеновской дифракции синтетического промежуточного соединения 5.
На фиг. 10 изображен профиль порошковой рентгеновской дифракции полиморфа B.
На фиг. 11 изображен профиль порошковой рентгеновской дифракции моногидробромида соединения I.
На фиг. 12-14 показаны результаты исследований in vivo гидробромида соединения I в линии клеток лимфомы человека.
На фиг. 15-16 показан противораковый эффект гидробромида соединения I на модели ксенотрансплантата лимфомы мыши.
На фиг. 17 изображен профиль порошковой рентгеновской дифракции синтетического промежуточного соединения 2.
На фиг. 18A и B изображен (A) профиль порошковой рентгеновской дифракции тригидрохлорида соединения I и (B) динамическая сорбция пара моногидрохлорида соединения I, которая демонстрирует значительную гигроскопичность данного соединения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Форма соли HBr и полиморфная форма A
Настоящее изобретение относится к гидробромиду N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамида:
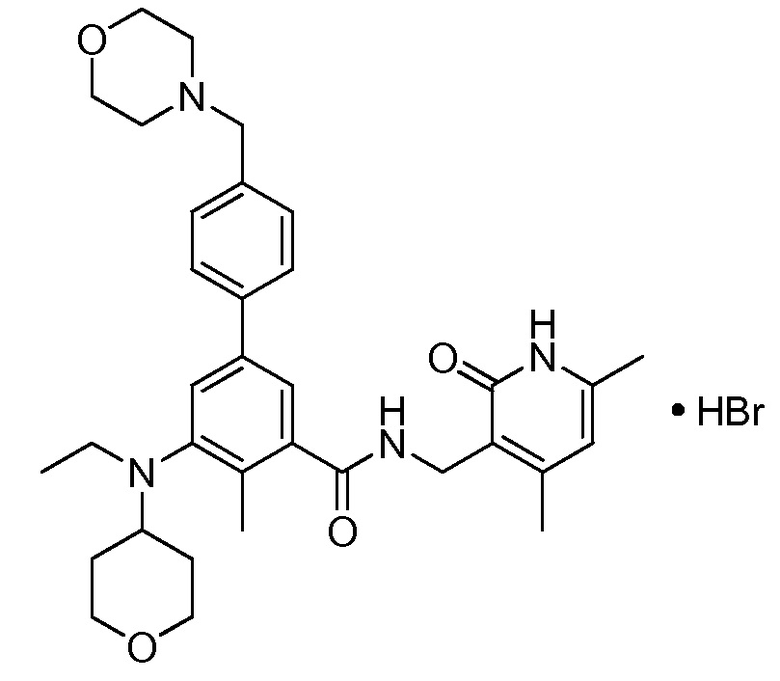
Используемый здесь термин «соединение I» относится к N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамиду. Гидробромид соединения I можно применять для ингибирования активности гистон-метилтрансферазы EZH2 или у индивида, или in vitro. Гидробромид соединения I можно также применять для лечения рака у нуждающегося в лечении индивида.
Соединение I может быть протонированным в одном или нескольких его оснόвных участках, таких как морфолиновая, дизамещенная анилиновая и/или пиридоновая части. Соответственно, в определенных вариантах осуществления изобретение относится к моногидробромиду, дигидробромиду или тригидробромиду соединения I. В одном варианте осуществления изобретение относится к моногидробромиду соединения I. Когда соединение представляет собой моногидробромид, то соединение может быть протонированным в любом оснόвном участке. В неограничивающем варианте осуществления соединение I протонировано у атома азота морфолинового заместителя, обеспечивая получение моногидробромида соединения I, имеющего следующую структуру:
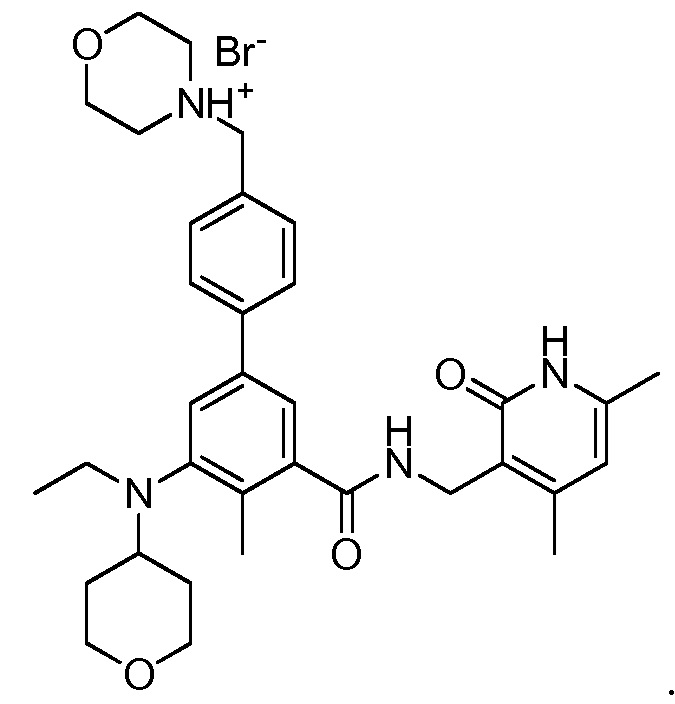
Этот конкретный моногидробромид может именоваться «бромидом 4-((3'-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5'-(этил(тетрагидро-2H-пиран-4-ил)амино)-4'-метил-[1,1'-бифенил]-4-ил)метил)морфолин-4-ия». На фиг. 11 изображена кристаллическая структура данной конкретной солевой формы, полученная рентгеновским структурным анализом.
Гидробромид соединения I имеет ряд преимущественных физических свойств относительно его формы свободного основания, а также других солей свободного основания. В частности, гидробромид соединения I имеет низкую гигроскопичность по сравнению с другими солевыми формами соединения I. Для эффективности соединения при лечении в целом требуется, чтобы соединение было минимально гигроскопичным. Лекарственные формы, которые являются высокогигроскопичными, могут быть неустойчивыми, поскольку скорость растворения лекарственной формы может изменяться при его хранении в окружающих условиях с меняющейся влажностью. Гигроскопичность может также воздействовать на крупномасштабное манипулирование и производство соединения, поскольку может быть трудным определение действительной массы гигроскопического активного агента при получении фармацевтической композиции, содержащей этот агент. Гидробромид соединения I имеет низкую гигроскопичность по сравнению с другими солевыми формами соединения I. В связи с этим, он может храниться в течение существенных периодов и не подвергаться повреждающим изменениям, например растворимости, плотности или даже химического состава.
В дополнение к указанным выше преимуществам, гидробромид соединения I может быть получен в высококристаллической форме, которую можно использовать при получении фармацевтических препаративных форм, и он улучшит общее обращение, манипулирование и хранение лекарственного соединения. В предпочтительном варианте осуществления кристаллическая форма гидробромида соединения I представлена в форме, именуемой «полиморф A».
Способность вещества существовать в нескольких кристаллических формах определяется как полиморфизм; различные кристаллические формы конкретного вещества именуются «полиморфами». В целом, на полиморфизм воздействует способность молекулы вещества изменять ее конформацию или образовывать различные межмолекулярные или внутримолекулярные взаимодействия, в частности водородные связи, что отражается в различном расположении атомов в кристаллических решетках различных полиморфов. Напротив, общая внешняя форма вещества известна как «морфология», которая относится к внешней форме кристалла и присутствующим плоскостям без ссылки на внутреннюю структуру. Кристаллы могут проявлять различную морфологию на основании различных условий, таких как, например, скорость роста, перемешивание и присутствие примесей.
Различные полиморфы вещества могут обладать различными энергиями кристаллической решетки и, таким образом, в твердом состоянии они могут демонстрировать различные физические свойства, такие как форма, плотность, температура плавления, цвет, устойчивость, растворимость, скорость растворения и т.д., которые, в свою очередь, могут воздействовать на устойчивость, скорость растворения и/или биодоступность данного полиморфа и его пригодность для применения в качестве фармацевтического средства и в фармацевтических композициях.
Полиморф A является высококристаллическим и проявляет низкую гигроскопичность. Также этот полиморф может быть получен воспроизводимо, и небольшие изменения условий кристаллизации не приводят к получению различных кристаллических форм.
Доступ к различным полиморфам гидробромида соединения I желателен по ряду причин. Одна такая причина состоит в том, что отдельные полиморфы могут после кристаллизации включать различные примеси или химические остатки. Например, примеси можно удалить во время процесса превращения соединения I в полиморф A.
Без связи с теорией, полиморфные формы, проявляющие компактные профили кристаллов, имеют преимущества с точки зрения легкости фильтрации и легкости текучести. Полиморф A демонстрирует компактную форму кристаллов и поэтому обладает данными преимуществами.
В определенных вариантах осуществления полиморф A можно идентифицировать на основании характерных пиков при анализе порошковой рентгеновской дифракции. Порошковая рентгеновская дифракция, также именуемая XRPD, представляет собой научную технологию с использованием дифракции рентгеновских лучей, нейтронов или электронов на порошковых, микрокристаллических или других твердых материалах для структурной характеристики материалов. В одном варианте осуществления полиморф A характеризуется картиной порошковой рентгеновской дифракции, имеющей один или несколько характерных пиков, выраженных в градусах 2-тета, примерно при 3,9+/-0,3 градуса, примерно 17,5+/-0,3 градуса и примерно 22,0+/-0,3 градуса 2-тета. В другом варианте осуществления полиморф характеризуется картиной порошковой рентгеновской дифракции, имеющей характерные пики, выраженные в градусах 2-тета, примерно при 3,9+/-0,3 градуса, примерно 17,5+/-0,3 градуса и примерно 22,0+/-0,3 градуса 2-тета.
В одном варианте осуществления полиморф A характеризуется картиной порошковой рентгеновской дифракции, имеющей по меньшей мере 5 характерных пиков, выраженных в градусах 2-тета, примерно при 3,9+/-0,3 градуса, 10,1+/-0,3 градуса, 14,3+/-0,3 градуса, 17,5+/-0,3 градуса, 18,7+/-0,3 градуса, 20,6+/-0,3 градуса, 20,9+/-0,3 градуса, 21,8+/-0,3 градуса, 22,0+/-0,3 градуса, 23,3+/-0,3 градуса и 23,6+/-0,3 градуса 2-тета. В другом варианте осуществления полиморф A характеризуется картиной порошковой рентгеновской дифракции, имеющей по меньшей мере 6 характерных пиков, выраженных в градусах 2-тета, примерно при 3,9+/-0,3 градуса, 10,1+/-0,3 градуса, 14,3+/-0,3 градуса, 17,5+/-0,3 градуса, 18,7+/-0,3 градуса, 20,6+/-0,3 градуса, 20,9+/-0,3 градуса, 21,8+/-0,3 градуса, 22,0+/-0,3 градуса, 23,3+/-0,3 градуса и 23,6+/-0,3 градуса 2-тета. В еще одном варианте осуществления полиморф A характеризуется картиной порошковой рентгеновской дифракции, имеющей по меньшей мере 7 характерных пиков, выраженных в градусах 2-тета, примерно при 3,9+/-0,3 градуса, 10,1+/-0,3 градуса, 14,3+/-0,3 градуса, 17,5+/-0,3 градуса, 18,7+/-0,3 градуса, 20,6+/-0,3 градуса, 20,9+/-0,3 градуса, 21,8+/-0,3 градуса, 22,0+/-0,3 градуса, 23,3+/-0,3 градуса и 23,6+/-0,3 градуса 2-тета. В другом варианте осуществления полиморф A характеризуется картиной порошковой рентгеновской дифракции, имеющей по меньшей мере 8 характерных пиков, выраженных в градусах 2-тета, примерно при 3,9+/-0,3 градуса, 10,1+/-0,3 градуса, 14,3+/-0,3 градуса, 17,5+/-0,3 градуса, 18,7+/-0,3 градуса, 20,6+/-0,3 градуса, 20,9+/-0,3 градуса, 21,8+/-0,3 градуса, 22,0+/-0,3 градуса, 23,3+/-0,3 градуса и 23,6+/-0,3 градуса 2-тета. В еще одном варианте осуществления полиморф A характеризуется картиной порошковой рентгеновской дифракции, имеющей по меньшей мере 9 характерных пиков, выраженных в градусах 2-тета, примерно при 3,9+/-0,3 градуса, 10,1+/-0,3 градуса, 14,3+/-0,3 градуса, 17,5+/-0,3 градуса, 18,7+/-0,3 градуса, 20,6+/-0,3 градуса, 20,9+/-0,3 градуса, 21,8+/-0,3 градуса, 22,0+/-0,3 градуса, 23,3+/-0,3 градуса и 23,6+/-0,3 градуса 2-тета. В еще одном варианте осуществления полиморф характеризуется картиной порошковой рентгеновской дифракции, имеющей по меньшей мере 10 характерных пиков, выраженных в градусах 2-тета, примерно при 3,9+/-0,3 градуса, 10,1+/-0,3 градуса, 14,3+/-0,3 градуса, 17,5+/-0,3 градуса, 18,7+/-0,3 градуса, 20,6+/-0,3 градуса, 20,9+/-0,3 градуса, 21,8+/-0,3 градуса, 22,0+/-0,3 градуса, 23,3+/-0,3 градуса и 23,6+/-0,3 градуса 2-тета.
В еще одном варианте осуществления полиморф характеризуется картиной порошковой рентгеновской дифракции, имеющей характерные пики, выраженные в градусах 2-тета, примерно при 3,9+/-0,3 градуса, примерно 14,3+/-0,3 градуса, примерно 18,7+/-0,3 градуса, примерно 23,3+/-0,3 градуса и примерно 23,6+/-0,3 градуса 2-тета.
В еще одном варианте осуществления полиморф характеризуется картиной порошковой рентгеновской дифракции, имеющей характерные пики, выраженные в градусах 2-тета, примерно при 3,9+/-0,3 градуса, примерно 10,1+/-0,3 градуса, примерно 14,3+/-0,3 градуса, примерно 17,5+/-0,3 градуса, примерно 18,7+/-0,3 градуса, примерно 20,6+/-0,3 градуса, примерно 20,9+/-0,3 градуса, примерно 21,8+/-0,3 градуса, примерно 22,0+/-0,3 градуса, примерно 23,3+/-0,3 градуса и примерно 23,6+/-0,3 градуса 2-тета. В еще одном варианте осуществления полиморф характеризуется картиной порошковой рентгеновской дифракции, по существу, в соответствии с фиг. 1. В другом варианте осуществления полиморф характеризуется картиной порошковой рентгеновской дифракции, по существу, в соответствии с величинами 2-тета, перечисленными в таблице 1.
Используемый здесь термин «примерно» при ссылке на величины градуса 2-тета относится к указанной величине +/-0,3 градуса 2-тета.
Фармацевтические композиции, содержащие полиморф A, можно идентифицировать сравнением профилей порошковой рентгеновской дифракции композиций с профилем порошковой рентгеновской дифракции полиморфа A. Следует понимать, что фармацевтические композиции, содержащие полиморф A, могут проявлять не идентичные профили порошковой рентгеновской дифракции по сравнению с профилем порошковой рентгеновской дифракции чистого полиморфа A.
В определенных вариантах осуществления полиморф A можно идентифицировать на основании характерного пика, наблюдаемого на термограмме, полученной с помощью дифференциальной сканирующей калориметрии. Дифференциальная сканирующая калориметрия, или DSC, представляет собой термоаналитическую технологию, при которой разность в количестве тепла, требуемого для увеличения температуры образца и эталона, измеряют как функцию температуры. В одном варианте осуществления полиморф A характеризуется термограммой, полученной с использованием дифференциальной сканирующей калориметрии, в единицах °C при температуре примерно 255+/-5°C. В другом варианте осуществления полиморф A характеризуется термограммой, полученной с использованием дифференциальной сканирующей калориметрии, имеющей один эндотермический пик, наблюдаемый в диапазоне температуры 250-255°C. В другом варианте осуществления полиморф A характеризуется термограммой, полученной с использованием дифференциальной сканирующей калориметрии, по существу, в соответствии с фиг. 3.
В определенных вариантах осуществления полиморф A может содержать примеси. Неограничивающие примеры примесей включают нежелательные полиморфные формы или остаточные органические и неорганические молекулы, такие как растворители, вода или соли. В одном варианте осуществления полиморф A, по существу, не содержит примесей. В другом варианте осуществления полиморф A содержит менее чем 10 мас.% общего количества примесей. В другом варианте осуществления полиморф A содержит менее чем 5 мас.% общего количества примесей. В другом варианте осуществления полиморф A содержит менее чем 1 мас.% общего количества примесей. В еще одном варианте осуществления полиморф A содержит менее чем 0,1 мас.% общего количества примесей.
В определенных вариантах осуществления полиморф A представляет собой кристаллическое твердое вещество, по существу, не содержащее аморфный гидробромид соединения I. Используемый здесь термин «по существу, не содержащее аморфный гидробромид соединения I» означает, что соединение не содержит значительное количество аморфного гидробромида соединения I. В определенных вариантах осуществления присутствует по меньшей мере примерно 95 мас.% кристаллического полиморфа A. В еще одних вариантах осуществления изобретения присутствует по меньшей мере примерно 99 мас.% кристаллического полиморфа A.
В другом варианте осуществления полиморф A по существу не содержит полиморфа B.
Соль по изобретению и его кристаллическую форму полиморф A можно обнаружить вместе с другими веществами или их можно выделить. В некоторых вариантах осуществления соль по изобретению или ее кристаллическая форма является по существу выделенной. Под фразой «по существу выделенная» подразумевается, что соль или ее кристаллическая форма, по меньшей мере частично, или по существу отделена от окружающей среды, в которой она была образована или выявлена. Частичное отделение может включать, например, композицию, обогащенную солью по изобретению. Существенное отделение может включать композиции, содержащие по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95%, по меньшей мере примерно 97% или по меньшей мере примерно 99 мас.% гидробромида соединения I и полиморфа A. Способы выделения соединений и их солей обычно используются в данной области.
И гидробромид соединения I, и полиморф A могут встречаться в виде любого целесообразного таутомера или смеси целесообразных таутомеров. Используемый здесь термин «таутомер» относится к одному из двух или более структурных изомеров, которые существуют в равновесии, и легко превращаются из одной изомерной формы в другую. Примеры включают кето-енольные таутомеры, такие как ацетон/пропен-2-ол, и тому подобные. Гидробромид соединения I и полиморф A могут иметь один или более таутомеров и поэтому включают различные изомеры, т.е. пиридин-2(1H)-он и соответствующий пиридин-2-ол. Все такие изомерные формы этих соединений специально включены в настоящее изобретение.
Получение формы в виде соли HBr и полиморфа A
Гидробромид соединения I, а также полиморф A, можно получить, используя известные технологии. Обычно солевую форму получают объединением в растворе соединения в форме свободного основания и кислоты, содержащей анион желаемой солевой формы, и затем выделением твердого солевого продукта из реакционного раствора (например, кристаллизацией, осаждением, выпариванием и т.д.). Можно использовать другие образующие соль технологии.
На демонстрируемой ниже схеме 1 представлен конкретный вариант осуществления для получения свободного основания соединения I, а также гидробромида соединения I. Вкратце, метил 3-амино-5-бром-2-метилбензоат (1) взаимодействует с дигидро-2H-пиран-4(3H)-оном в условиях восстановительного аминирования для образования метил 5-бром-2-метил-3-((тетрагидро-2H-пиран-4-ил)амино)бензоата (2) на стадии 1. На стадии 2 снова используют восстановительное аминирование для образования 5-бром-3-(этил(тетрагидро-2H-пиран-4-ил)амино)-2-метилбензоата (3). Затем это соединение взаимодействует в условиях реакции соединения Сузуки на стадии 3 для образования метил 5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксилата (4), который гидролизуется до соответствующей кислоты (5) на стадии 4. На стадии 5 кислота (5) взаимодействует в условиях реакции соединения амида с гидрохлоридом 3-(аминометил)-4,6-диметил-дигидро-пиридин-2(1H)-она для образования соединения I.
Как показано, соединение I может затем взаимодействовать с водной HBr для образования гидробромида соединения I.
Схема 1
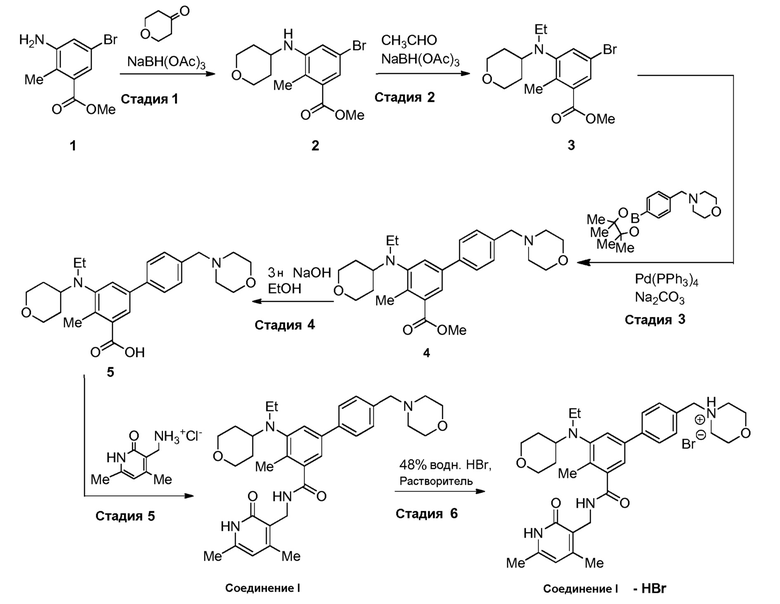
Описанный выше синтез имеет ряд преимуществ. Например, в нем используется ряд промежуточных соединений, которые можно получить в кристаллических формах, которые можно выделить. При использовании кристаллических промежуточных соединений необходимы технологии минимальной очистки (например, хроматография), приводя к общему улучшенному выходу конечного соединения I.
Соответственно, изобретение относится к промежуточному соединению 1 в кристаллической форме. В другом варианте осуществления изобретение относится к промежуточному соединению 2 в кристаллической форме. На фиг. 17 показан профиль порошковой рентгеновской дифракции кристаллического соединения 2. В еще одном варианте осуществления промежуточное соединение 5 является кристаллическим. На фиг. 9 показан профиль порошковой рентгеновской дифракции кристаллического соединения 5. В других вариантах осуществления соединения 2 и/или 5 получают по существу в чистой форме без использования хроматографии. Специалисту в данной области понятно, что кристаллизация промежуточных соединений необязательно протекает без усилий или эффективно.
Изобретение также относится к способу получения N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамида, включающему взаимодействие 5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоновой кислоты (5) с солью 3-(аминометил)-4,6-диметил-дигидро-пиридин-2(1H)-она. В одном варианте осуществления этого способа (5) представлена в кристаллической форме.
Соединение I может взаимодействовать с водной HBr в присутствии соответствующего растворителя для образования полиморфа A, конкретной кристаллической формы гидробромида. В одном варианте осуществления соединение I взаимодействует с водной HBr в присутствии этанола и этилацетата для образования полиморфа A.
После получения полиморфа он может быть перекристаллизован с использованием того же растворителя (или растворителей), которые использовались для получения полиморфа, или другого растворителя (или растворителей) для получения композиции, которая имеет увеличенную кристалличность. В целом, полиморф A можно перекристаллизовать растворением полиморфа в одном или нескольких растворителях, необязательно, с нагреванием, с последующей необязательной стадией охлаждения, и затем выделением кристаллической структуры посредством, например, стадии фильтрации. После первоначального растворения полиморфа в первом растворителе (или комбинации растворителей), дополнительный, другой растворитель можно добавить в любой точке процесса (до или после нагревания, до или после охлаждения и т.д.) для получения желаемой кристаллической структуры. Например, первый растворитель можно использовать для растворения полиморфного соединения, и затем второй растворитель (например, противорастворитель) можно добавлять для вызова осаждения полиморфа из раствора. В одном варианте осуществления воду добавляют к первому растворителю для содействия растворению полиморфа.
Неограничивающие примеры растворителей, которые можно использовать для перекристаллизации полиморфа A, следующие: метанол, этанол, этилацетат, простой метил-трет-бутиловый эфир, вода, изопропиловый спирт, тетрагидрофуран, ацетон, ацетонитрил, и 2-метилтетрагидрофуран, а также их комбинация. Неограничивающими примерами комбинаций растворителей, которые можно использовать для перекристаллизации полиморфа A, являются (растворитель и противорастворитель, где воду можно добавлять к первому растворителю для содействия растворению полиморфа): метанол/вода и этилацетат, изопропиловый спирт/вода и этилацетат, тетрагидрофуран/вода и этилацетат, ацетон и этилацетат, ацетонитрил/вода и этилацетат, этанол/вода и простой метил-трет-бутиловый эфир, изопропиловый спирт/вода и простой метил-трет-бутиловый эфир, этанол/вода и тетрагидрофуран, изопропиловый спирт/вода и ацетон и этанол/вода и этилацетат. В конкретных вариантах осуществления комбинациями растворителей являются метанол/вода и этилацетат, изопропиловый спирт/вода и этилацетат, этанол/вода и 2-метилтетрагидрофуран и метанол/2-метилтетрагидрофуран.
В одном аспекте полиморф A получают, используя способ, включающий объединение N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамида с бромистоводородной кислотой.
В другом аспекте изобретение относится к способу перекристаллизации полиморфа A, который включает следующие стадии: (a) растворение полиморфа A в первом растворителе и (b) добавление второго растворителя с тем, чтобы указанный полиморф перекристаллизовался. В одном варианте осуществления первый растворитель представляет собой этанол, а второй растворитель представляет собой MTBE. В другом варианте осуществления способ включает (a) растворение полиморфа A в этаноле, (b) нагревание смеси, (c) добавление MTBE к смеси, образуя осадок, содержащий указанный полиморф, и фильтрацию осадка с тем, чтобы указанный полиморф перекристаллизовался.
Фармацевтические композиции
В другом аспекте изобретение относится к фармацевтической композиции, содержащей гидробромид соединения I и фармацевтически приемлемый носитель или разбавитель. Изобретение также относится к фармацевтической композиции, содержащей полиморф A и фармацевтически приемлемый носитель или разбавитель.
Термин «фармацевтическая композиция» включает препараты, пригодные для введения млекопитающим, например людям. Когда соединения по настоящему изобретению вводятся в виде фармацевтических препаратов млекопитающим, например людям, то их можно вводить в чистом виде или в виде фармацевтической композиции, содержащей, например, от 0,1 до 99,9% (предпочтительнее, от 0,5 до 90%) активного ингредиента в комбинации с фармацевтически приемлемым носителем.
Описанные здесь соединения (т.е. гидробромид соединения I и полиморф A) можно комбинировать с фармацевтически приемлемым носителем в соответствии с обычными технологиями составления фармацевтических композиций. Используемый здесь термин «фармацевтически приемлемый носитель» может включать любой и все растворители, разбавители или другой жидкий носитель, дисперсию или вспомогательные суспендирующие материалы, поверхностно-активные средства, изотонические агенты, загустители или эмульгаторы, консерванты, твердые связывающие агенты, смазывающие вещества и тому подобные, в соответствии с конкретной желаемой лекарственной формой. В руководстве Remington's Pharmaceutical Sciences, Sixteenth Edition, E.W. Martin (Mack Publishing Co., Easton, Pa., 1980) описаны разнообразные носители, используемые при составлении фармацевтических композиций, и известные технологии для их получения. За исключением случаев, когда любая обычная среда носителя несовместима с соединениями по изобретению, например, в связи с оказанием нежелательного биологического эффекта или иным взаимодействием вредным образом с любым(и) другим(и) компонентом(ами) фармацевтической композиции, предусмотрено, что ее использование входит в пределы объема настоящего изобретения. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают без ограничения сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; эксципиенты, такие как масло какао и воски для суппозиторий; масла, такие как арахисовое масло, масло хлопковых семян; масло сафлора, кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли, такие как полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; забуферивающие агенты, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический солевой раствор; раствор Рингера; этиловый спирт и фосфатные буферные растворы, а также другие нетоксичные совместимые смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красящие агенты, высвобождающие агенты, покрывающие агенты, подсластители, ароматизирующие и дезодорирующие агенты, консерванты и антиоксиданты также могут присутствовать в композиции, в соответствии с суждением составителя композиции.
Кроме того, носитель может принимать широкое разнообразие форм, в зависимости от формы желаемого для введения препарата, например, перорального, назального, ректального, вагинального, парентерального (включая внутривенные инъекции или инфузии). При получении композиций для пероральной лекарственной формы можно использовать любую из обычных фармацевтических сред. Обычные фармацевтические среды включают, например, воду, гликоли, масла, спирты, ароматизирующие агенты, консерванты, красящие агенты и тому подобные в случае пероральных жидких препаратов (таких как, например, суспензии, растворы, эмульсии и эликсиры); аэрозоли или носители, такие как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие агенты, смазывающие вещества, связывающие агенты, разрыхлители и тому подобные, в случае пероральных твердых препаратов (таких как, например, порошки, капсулы и таблетки).
Смачивающие агенты, эмульгаторы и смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красящие агенты, подсластители, ароматизирующие и дезодорирующие агенты, консерванты и антиоксиданты также могут присутствовать в композициях.
Примеры фармацевтически приемлемых антиоксидантов включают растворимые в воде антиоксиданты, такие как аскорбиновая кислота, цистеин гидрохлорид, бисульфат натрия, метабисульфит натрия, сульфит натрия и тому подобные; растворимые в масле антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), лецитин, пропилгаллат, токоферолы и тому подобные; и хелатирующие металлы агенты, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, винная кислота, фосфорная кислота и тому подобные.
Фармацевтические композиции, содержащие соединения, можно составлять с содержанием любой желаемой их концентрации. В некоторых вариантах осуществления композицию составляют так, чтобы она содержала, по меньшей мере, терапевтически эффективное количество. В некоторых вариантах осуществления композицию составляют так, чтобы она содержала некоторое количество, которое не вызвало бы один или несколько нежелательных побочных эффектов.
Поскольку кристаллическая форма гидробромида соединения I легче поддерживается во время его получения, то твердые лекарственные формы представляют собой предпочтительную форму для фармацевтической композиции по изобретению. Особенно предпочтительны такие твердые лекарственные формы для перорального введения как капсулы, таблетки, пилюли, порошки и гранулы. При желании, таблетки могут быть покрыты с использованием технологий, известных специалистам в данной области.
Фармацевтические композиции включают те, которые пригодны для перорального, сублингвального, назального, ректального, вагинального, топического, буккального и парентерального (включающего подкожное, внутримышечное и внутривенное) введения, хотя самый подходящий путь будет зависеть от природы и тяжести подвергаемого лечению состояния. Композиции могут быть для удобства представлены в стандартной лекарственной форме и получены любым из способов, хорошо известных в области фармации. В определенных вариантах осуществления фармацевтическая композиция составляется для перорального введения в форме пилюли, капсулы, пастилки или таблетки. В других вариантах осуществления фармацевтическая композиция представлена в форме суспензии.
Соединения по изобретению пригодны в качестве активной субстанции в фармацевтических композициях, которые эффективны, в частности, для лечения связанных с EZH2 расстройств, в частности, рака. Фармацевтическая композиция в различных вариантах осуществления имеет фармацевтически эффективное количество гидробромида соединения I или полиморфа A, наряду с другими фармацевтически приемлемыми эксципиентами, носителями, наполнителями, разбавителями и тому подобными веществами.
Терапевтически или фармацевтически «эффективное количество» представляет собой количество соединения (гидробромида соединения I или полиморфа A), которое при введении пациенту облегчает симптом или состояние, например предотвращает различные морфологические и соматические симптомы рака. В примере эффективное количество гидробромида соединения I или полиморфа A представляет собой количество, достаточное для лечения рака у индивида. Это количество может варьироваться в зависимости от таких факторов как размер и масса тела индивида, тип заболевания или конкретное соединение по изобретению. Количество гидробромида соединения I или полиморфа A, которое составляет «эффективное количество», варьируется в зависимости от соединения, патологического состояния и его тяжести, возраста подлежащего лечению пациента и тому подобного. Средний специалист в данной области, обладающий запасом знаний и изучивший данное описание, может обычным образом определить эффективное количество.
Схема введения может воздействовать на то, что составляет фармацевтически эффективное количество. Гидробромид соединения I или полиморф A и композиции, содержащие любое из этих соединений, можно вводить индивиду или перед началом, или после начала заболевания. Кроме того, несколько дробных дозировок, а также отсроченное введение доз можно проводить ежедневно или последовательно, или дозу можно вводить непрерывной инфузией или в виде болюсной инъекции. Кроме того, дозировки можно пропорционально увеличивать или уменьшать по показаниям в соответствии с требованиями терапевтической или профилактической ситуации.
Способы лечения
Соединения по настоящему изобретению (т.е. гидробромид соединения I, а также полиморф A) ингибируют активность гистон-метилтрансферазы EZH2 или ее мутанта, и, соответственно, в одном аспекте изобретения определенные соединения, описанные здесь, являются кандидатами для применения с целью лечения или предотвращения определенных состояний и заболеваний. Настоящее изобретение относится к применению способов лечения и заболеваний, на течение которых можно повлиять модулированием статуса метилирования гистонов или других белков, причем указанный статус метилирования опосредуется, по меньшей мере частично, активностью EZH2. Модуляция статуса метилирования гистонов может, в свою очередь, влиять на уровень экспрессии генов-мишеней, активируемых метилированием, и/или генов-мишеней, подавляемых метилированием. Способ включает введение нуждающемуся в таком лечении индивиду терапевтически эффективного количества соединения по настоящему изобретению.
Расстройство, при котором играет роль опосредованное EZH2 метилирование белка, может представлять собой рак или предраковое состояние. Настоящее изобретение дополнительно относится к применению соединения по настоящему изобретению (т.е. гидробромида соединения I, а также полиморфа A) при лечении рака или предракового состояния, на течение которых можно повлиять модулированием опосредованного EZH2 метилирования белка, или для получения лекарственного препарата, применяемого для лечения такой формы рака или предракового состояния. Примерные виды рака, которые можно лечить, включают лимфомы, включая неходжкинскую лимфому, фолликулярную лимфому (FL) и диффузную крупноклеточную B-клеточную лимфому (DLBCL); меланому и лейкоз, включая CML (хронический миелоидный лейкоз). Иллюстративное предраковое состояние включает синдром миелодисплазии (MDS; ранее известный как предлейкозный синдром).
В еще одном варианте осуществления изобретение относится к способу лечения лимфомы, включающему введение нуждающемуся в нем индивиду эффективного количества гидробромида соединения I.
В еще одном варианте осуществления изобретение относится к способу лечения лимфомы, включающему введение нуждающемуся в нем индивиду эффективного количества полиморфа A.
Настоящее изобретение также относится к способам защиты против расстройства, при котором играет роль опосредованное EZH2 метилирование белка у нуждающегося в защите индивида, введением терапевтически эффективного количества соединения по настоящему изобретению (т.е. гидробромида соединения I, а также полиморфа A) нуждающемуся в таком лечении индивиду. Расстройство может представлять собой рак, например, рак, при котором играет роль опосредованное EZH2 метилирование белка. Настоящее изобретение также относится к применению соединения по настоящему изобретению (т.е. гидробромида соединения I, а также полиморфа A) для получения лекарственного препарата, применяемого для предотвращения клеточного пролиферативного расстройства, связанного, по меньшей мере частично, с опосредованным EZH2 метилированием белка.
Соединения по настоящему изобретению можно применять для модуляции метилирования белка (например, гистона), например, для модуляции ферментативной активности гистон-метилтрансферазы или гистон-деметилазы. По меньшей мере некоторые из соединений по изобретению можно применять in vivo или in vitro для модулирования метилирования белка. Сообщалось, что метилирование гистонов вовлечено в аберрантную экспрессию определенных генов при различных формах рака и в сайленсинг нейронных генов в не нейронных клетках. По меньшей мере некоторые соединения, описанные здесь, представляют собой подходящие кандидаты для лечения этих заболеваний, т.е. для уменьшения метилирования или восстановления метилирования примерно до его уровня в соответствующих нормальных клетках.
Соединения, которые представляют собой модуляторы метилирования, можно применять для модулирования пролиферации клеток. Например, в некоторых случаях избыточную пролиферацию можно снизить средствами, которые уменьшают метилирование, в то время как недостаточную пролиферацию можно стимулировать средствами, которые увеличивают метилирование. Соответственно, заболевания, которые можно лечить соединениями по изобретению, могут включать гиперпролиферативные заболевания, такие как рост доброкачественных клеток и рост злокачественных клеток.
Используемая здесь фраза «нуждающийся в нем индивид» относится к индивиду, имеющему расстройство, при котором играет роль опосредованное EZH2 метилирование белков, или индивиду, имеющему повышенный риск развития такого расстройства относительно популяции в целом. Нуждающийся в нем индивид может иметь предраковое состояние. Предпочтительно, нуждающийся в нем индивид страдает раком. «Индивид» включает млекопитающее. Млекопитающее может представлять собой, например, человека или соответствующее млекопитающее, кроме человека, такое как примат, мышь, крыса, собака, кошка, корова, лошадь, коза, верблюд, овца или свинья. Индивид может представлять собой также дикую или домашнюю птицу. В одном варианте осуществления млекопитающее представляет собой человека.
Используемый здесь термин «клеточное пролиферативное расстройство» относится к состояниям, при которых нерегулируемый или аномальный рост клеток или оба эти процесса могут привести к развитию нежелательного состояния или заболевания, которое может быть или не быть раковым. Иллюстративные клеточные пролиферативные расстройства, которые можно лечить соединениями по изобретению, охватывают разнообразные соединения, при которых происходит нарушение регуляции клеточного деления. Иллюстративные клеточные пролиферативные расстройства включают без ограничения новообразования, доброкачественные опухоли, злокачественные опухоли, предраковые состояния, опухоли in situ, инкапсулированные опухоли, метастатические опухоли, жидкие опухоли, сόлидные опухоли, иммунологические опухоли, гематологические опухоли, раковые опухоли, карциномы, лейкозы, лимфомы, саркомы и быстро делящиеся клетки. Используемый здесь термин «быстро делящиеся клетки» определяется как любая клетка, которая делится со скоростью, превышающей или большей, чем та, которая ожидается или наблюдается среди соседних или расположенных рядом клеток в пределах одной и той же ткани. Клеточное пролиферативное расстройство включает предрак или предраковое состояние. Клеточное пролиферативное расстройство включает рак. В одном аспекте способы по настоящему изобретению применяются для лечения или облегчения симптома рака или для идентификации подходящих кандидатов для таких целей. Термин «рак» включает сόлидные опухоли, а также гематологические опухоли и/или злокачественные заболевания. «Предраковая клетка» или «преканкрозная клетка» представляет собой клетку, проявляющую клеточное пролиферативное расстройство, которое представляет собой предрак или предраковое состояние. «Раковая клетка» или «канкрозная клетка» представляет собой клетку, проявляющую клеточное пролиферативное расстройство, которое представляет собой рак. Любое воспроизводимое средство измерения можно использовать для идентификации раковых клеток или преканкрозных клеток. Раковые клетки или преканкрозные клетки можно идентифицировать гистологическим типированием или градацией образца ткани (например, биоптата). Раковые клетки или преканкрозные клетки можно идентифицировать посредством использования соответствующих молекулярных маркеров.
Иллюстративные нераковые состояния или расстройства, которые можно лечить с применением одного или нескольких соединений по настоящему изобретению, включают без ограничения ревматоидный артрит; воспаление; аутоиммунное заболевание; лимфопролиферативные состояния; акромегалию; ревматоидный спондилит; остеоартрит; подагру, другие поражения суставов; сепсис; септический шок; эндотоксический шок; грамотрицательный сепсис; синдром токсического шока; астму; респираторный дистресс синдром взрослых; хроническое обструктивное легочное заболевание; хроническое легочное воспаление; воспалительное кишечное заболевание; болезнь Крона; псориаз; экзему; язвенный колит; фиброз поджелудочной железы; фиброз печени; острое и хроническое почечное заболевание; синдром раздраженной кишки; гипертермию; рестеноз; церебральную малярию; инсульт и ишемическое повреждение; невральную травму; болезнь Альцгеймера; болезнь Хантингтона; болезнь Паркинсона; острую и хроническую боль; аллергический ринит; аллергический конъюнктивит; хроническую сердечную недостаточность; острый коронарный синдром; кахексию; малярию; проказу; лейшманиоз; болезнь Лайма; синдром Рейтера; острый синовиит; мышечную дегенерацию, бурсит; тендонит; тендосиновиит; синдром грыжевого выпячивания, разрывов или пролабирования межпозвонковых дисков; остеопетроз; тромбоз; рестеноз; силикоз; легочный саркоидоз; заболевания с резорбцией костной ткани, такие как остеопороз; реакцию трансплантат-против-хозяина; рассеянный склероз; волчанку; фибромиалгию; СПИД и другие вирусные заболевания, такие как опоясывающий лишай, инфекция вирусом простого герпеса I или II, вирусом гриппа и цитомегаловирусом; и сахарный диабет.
Примерные виды рака, которые можно лечить, используя одно или несколько соединений по настоящему изобретению, включают без ограничения карциному коры надпочечников, формы рака, связанные со СПИД, связанную со СПИД лимфому, анальный рак, аноректальный рак, рак анального канала, рак аппендикса, мозжечковую астроцитому в детском возрасте, астроцитому мозга в детском возрасте, базальноклеточную карциному, рак кожи (кроме меланомы), рак желчевыводящих путей, рак внепеченочных желчных протоков, рак внутрипеченочных желчных протоков, рак желчного пузыря, рак мочевого пузыря, рак костей и суставов, остеосаркому и злокачественную фиброзную гистиоцитому, рак мозга, опухоль мозга, глиому ствола мозга, мозжечковую астроцитому, церебральную астроцитому/злокачественную глиому, эпендимому, медуллобластому, супратенториальные примитивные нейроэктодермальные опухоли, глиому зрительных путей и гипоталамуса, рак молочной железы, бронхиальные аденомы/карциноиды, карциноидную опухоль, опухоли желудочно-кишечного тракта, рак нервной системы, лимфому нервной системы, рак центральной нервной системы, лимфому центральной нервной системы, рак шейки матки, раковые опухоли у пациентов в детском возрасте, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз, хронические миелопролиферативные расстройства, рак ободочной кишки, колоректальный рак, кожную T-клеточную лимфому, лимфоидную неоплазму, грибковый микоз, синдром Сезари, рак эндометрия, рак пищевода, внечерепную зародышевоклеточную опухоль, внегонадную зародышевоклеточную опухоль, рак внепеченочных желчных протоков, рак глаз, внутриглазную меланому, ретинобластому, рак желчного пузыря, рак желудка, карциноидную опухоль желудочно-кишечного тракта, стромальную опухоль желудочно-кишечного тракта (GIST), зародышевоклеточную опухоль, зародышевоклеточную опухоль яичников, гестационную трофобластическую опухоль, глиому, рак головы и шеи, гепатоцеллюлярный рак (печени), лимфому Ходжкина, гипофарингеальный рак, внутриглазную меланому, глазной рак, островковоклеточные опухоли (эндокринной поджелудочной железы), саркому Капоши, рак почек, рак гортани, острый лимфобластический лейкоз, острый миелоидный лейкоз, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз, волосатоклеточный лейкоз, рак губ и ротовой полости, рак печени, рак легких, немелкоклеточный рак легких, мелкоклеточный рак легких, свзанную со СПИД лимфому, неходжкинскую лимфому, первичную лимфому центральной нервной системы, макроглобулинемию Вальденстрема, медуллобластому, меланому, внутриглазную меланому, карциному из клеток Меркеля, злокачественную мезотелиому, мезотелиому, метастатический плоскоклеточный рак шеи, рак ротовой полости, рак языка, синдром множественной эндокринной неоплазии, фунгоидный микоз, синдромы миелодисплазии, миелодиспластические/миелопролиферативные заболевания, хронический миелогенный лейкоз, острый миелогенный лейкоз, множественную миелому, хронические миелопролиферативные расстройства, рак носоглотки, нейробластому, рак ротовой полости, рак ротоглотки, рак яичников, эпителиальный рак яичников, опухоль яичников с низким злокачественным потенциалом, рак поджелудочной железы, островковоклеточный рак поджелудочной железы, рак околоносовых пазух и носовой полости, рак паращитовидной железы, рак пениса, рак глотки, феохромоцитому, пинеобластому и супратенториальные примитивные нейроэктодермальные опухоли, опухоль гипофиза, неоплазму из плазматических клеток/множественную миелому, плевропульмональную бластому, рак предстательной железы, ректальный рак, рак почечных лоханок и мочеточников, переходноклеточный рак, ретинобластому, рабдомиосаркому, рак слюнных желез, семейство опухолей саркомы Юинга, саркому Капоши, саркому мягких тканей, рак матки, саркому матки, рак кожи (кроме меланомы), рак кожи (меланому), карцинома кожи из клеток Меркеля, рак тонкого кишечника, саркому мягких тканей, плоскоклеточную карциному, рак желудка, супратенториальные примитивные нейроэктодермальные опухоли, рак яичек, рак горла, тимому, тимому и карциному тимуса, рак щитовидной железы, переходноклеточный рак почечной лоханки и мочеточника и других мочевыводящих органов, гестационную трофобластическую опухоль, рак уретры, рак эндометрия матки, саркому матки, рак тела матки, рак влагалища, рак вульвы и опухоль Вильмса.
«Клеточное пролиферативное расстройство гематологической системы» представляет собой клеточное пролиферативное расстройство, вовлекающее клетки гематологической системы. Клеточное пролиферативное расстройство гематологической системы может включать лимфому, лейкоз, миелоидные неоплазмы, неоплазмы из тучных клеток, миелодисплазию, доброкачественную моноклональную гаммапатию, лимфоматоидный грануломатоз, лимфоматоидный папулез, истинную полицитемию, хронический миелоцитарный лейкоз, идиопатическую миелоидную метаплазию и эссенциальную тромбоцитемию. Клеточное пролиферативное расстройство гематологической системы может включать гиперплазию, дисплазию и метаплазию клеток гематологической системы. В одном аспекте композиции по настоящему изобретению можно применять для лечения рака, выбранного из группы, состоящей из гематологического рака по настоящему изобретению или гематологических клеточных пролиферативных расстройств по настоящему изобретению, или применять для идентификации подходящих кандидатов для таких целей. Гематологический рак по настоящему изобретению может включать множественную миелому, лимфому (включая лимфому Ходжкина, неходжкинскую лимфому, лимфомы в детском возрасте и лимфомы лимфоцитарного и кожного происхождения), лейкоз (включая лейкоз в детском возрасте, волосатоклеточный лейкоз, острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, хронический лимфоцитарный лейкоз, хронический миелоцитарный лейкоз и тучноклеточный лейкоз), миелоидные неоплазмы и тучноклеточные неоплазмы.
«Клеточное пролиферативное расстройство легких» представляет собой клеточное пролиферативное расстройство, вовлекающее клетки легких. Клеточные пролиферативные расстройства легких могут включать все формы клеточных пролиферативных расстройств, поражающих легочные клетки. Клеточные пролиферативные расстройства легких могут включать рак легких, предрак или предраковое состояние легких, доброкачественные разрастания ткани или поражения легких, и злокачественные разрастания ткани или поражения легких, и метастатические поражения в тканях и органах в организме, иных, чем легкие. В одном аспекте композиции по настоящему изобретению можно применять для лечения рака легких или клеточных пролиферативных расстройств легких, или применять для идентификации подходящих кандидатов для таких целей. Рак легких может включать все формы рака легких. Рак легких может включать злокачественные новообразования легких, карциному in situ, типичные карциноидные опухоли и атипичные карциноидные опухоли. Рак легких может включать мелкоклеточный рак легких («SCLC»), немелкоклеточный рак легких («NSCLC»), плоскоклеточную карциному, аденокарциному, мелкоклеточную карциному, крупноклеточную карциному, аденоплоскоклеточную карциному и мезотелиому. Рак легких может включать «рубцовую карциному», бронхиоальвеолярную карциному, гигантоклеточную карциному, веретеноклеточную карциному и крупноклеточную нейроэндокринную карциному. Рак легких может включать легочные новообразования, имеющие гистологическую и ультраструктурную гетерогенность (например, смешанные клеточные типы).
Клеточные пролиферативные расстройства легких могут включать все формы клеточных пролиферативных расстройств, поражающих легочные клетки. Клеточные пролиферативные расстройства легких могут включать рак легких, предраковые состояния легких. Клеточные пролиферативные расстройства легких могут включать гиперплазию, метаплазию и дисплазию легких. Клеточные пролиферативные расстройства легких могут включать гиперплазию, вызванную асбестом, чешуйчатую метаплазию и доброкачественную реактивную мезотелиальную метаплазию. Клеточные пролиферативные расстройства легких могут включать замещение цилиндрического эпителия стратифицированным плоским эпителием и дисплазию слизистой оболочки. Индивиды, подверженные воздействию вдыхаемых вредных агентов окружающей среды, таких как сигаретный дым и асбест, могут иметь повышенный риск развития клеточных пролиферативных расстройств легких. Предшествующие легочные заболевания, которые могут предрасположить индивидов к развитию клеточных пролиферативных расстройств легких, могут включать хроническое интерстициальное легочное заболевание, некротизирующее легочное заболевание, склеродермию, ревматоидное заболевание, саркоидоз, интерстициальный пневмонит, туберкулез, повторные пневмонии, идиопатический легочный фиброз, гранулемы, асбестоз, фиброзирующий альвеолит и болезнь Ходжкина.
«Клеточное пролиферативное расстройство ободочной кишки» представляет собой клеточное пролиферативное расстройство, вовлекающее клетки ободочной кишки. Предпочтительно, клеточное пролиферативное расстройство ободочной кишки представляет собой рак ободочной кишки. В одном аспекте композиции по настоящему изобретению можно применять для лечения рака ободочной кишки или клеточных пролиферативных расстройств ободочной кишки, или применять для идентификации подходящих кандидатов для таких целей. Рак ободочной кишки может включать все формы рака ободочной кишки. Рак ободочной кишки может включать спорадический и наследственный рак ободочной кишки. Рак ободочной кишки может включать злокачественные новообразования ободочной кишки, карциному in situ, типичные карциноидные опухоли и атипичные карциноидные опухоли. Рак ободочной кишки может включать аденокарциному, плоскоклеточную карциному и аденоплоскоклеточную карциному. Рак ободочной кишки может быть связан с наследственным синдромом, выбранным из группы, состоящей из наследственного неполипозного колоректального рака, семейного аденоматозного полипоза, синдрома Гарднера, синдрома Пейтца-Джегерса, синдрома Туркота и ювенильного полипоза. Рак ободочной кишки может быть вызван наследственным синдромом, выбранным из группы, состоящей из наследственного неполипозного колоректального рака, семейного аденоматозного полипоза, синдрома Гарднера, синдрома Пейтца-Джегерса, синдрома Туркота и ювенильного полипоза.
Клеточные пролиферативные расстройства ободочной кишки могут включать все формы клеточных пролиферативных расстройств, поражающих клетки ободочной кишки. Клеточные пролиферативные расстройства ободочной кишки могут включать рак ободочной кишки, предраковые состояния ободочной кишки, аденоматозные полипы ободочной кишки и метахронные поражения ободочной кишки. Клеточное пролиферативное расстройство ободочной кишки может включать аденому. Клеточные пролиферативные расстройства ободочной кишки могут характеризоваться гиперплазией, метаплазией и дисплазией ободочной кишки. Предшествующие заболевания ободочной кишки, которые могут предрасположить индивидов к развитию клеточных пролиферативных расстройств ободочной кишки, могут включать предшествующий рак ободочной кишки. Текущие заболевания, которые могут предрасположить к развитию клеточных пролиферативных расстройств ободочной кишки, могут включать болезнь Крона и язвенный колит. Клеточные пролиферативные расстройства ободочной кишки могут быть связаны с мутацией в гене, выбранном из группы, состоящей из p53, ras, FAP и DCC. Индивид может иметь повышенный риск развития клеточных пролиферативных расстройств ободочной кишки вследствие присутствия мутации в гене, выбранном из группы, состоящей из p53, ras, FAP и DCC.
«Клеточное пролиферативное расстройство поджелудочной железы» представляет собой клеточное пролиферативное расстройство, вовлекающее клетки поджелудочной железы. Клеточные пролиферативные расстройства поджелудочной железы могут включать все формы клеточных пролиферативных расстройств, поражающих панкреатические клетки. Клеточные пролиферативные расстройства поджелудочной железы могут включать рак поджелудочной железы, предрак или предраковое состояние поджелудочной железы, гиперплазию поджелудочной железы и дисплазию поджелудочной железы, доброкачественные разрастания ткани или поражения поджелудочной железы, и злокачественные разрастания ткани или поражения поджелудочной железы, и метастатические поражения в ткани и органах в организме, отличных от поджелудочной железы. Рак поджелудочной железы включает все формы рака поджелудочной железы. Рак поджелудочной железы может включать аденокарциному протоков, аденочешуйчатую карциному, плеоморфную гигантоклеточную карциному, муцинозную аденокарциному, подобную остеокластам гигантоклеточную карциному, муцинозную цистаденокарциному, ацинарную карциному, неклассифицированную крупноклеточную карциному, мелкоклеточную карциному, панкреатобластому, папиллярную неоплазму, муцинозную цистаденому, папиллярную кистозную неоплазму и серозную цистаденому. Рак поджелудочной железы может также включать панкреатические неоплазмы, имеющие гистологическую и ультраструктурную гетерогенность (например, смешанные клеточные типы).
«Клеточное пролиферативное расстройство предстательной железы» представляет собой клеточное пролиферативное расстройство, вовлекающее клетки предстательной железы. Клеточные пролиферативные расстройства предстательной железы могут включать все формы клеточных пролиферативных расстройств, поражающих клетки предстательной железы. Клеточные пролиферативные расстройства предстательной железы могут включать рак предстательной железы, предрак или предраковое состояние предстательной железы, доброкачественные разрастания ткани или поражения предстательной железы, и злокачественные разрастания ткани или поражения предстательной железы, и метастатические поражения в ткани и органах в организме, отличных от предстательной железы. Клеточные пролиферативные расстройства предстательной железы могут включать гиперплазию, метаплазию и дисплазию предстательной железы.
«Клеточное пролиферативное расстройство кожи» представляет собой клеточное пролиферативное расстройство, вовлекающее клетки кожи. Клеточные пролиферативные расстройства кожи могут включать все формы клеточных пролиферативных расстройств, поражающих клетки кожи. Клеточные пролиферативные расстройства кожи могут включать предрак или предраковое состояние кожи, доброкачественные разрастания ткани или поражения кожи, меланому, злокачественную меланому и другие злокачественные разрастания ткани или поражения кожи и метастатические поражения в ткани и органах в организме, отличных от кожи. Клеточные пролиферативные расстройства кожи могут включать гиперплазию, метаплазию и дисплазию кожи.
«Клеточное пролиферативное расстройство яичников» представляет собой клеточное пролиферативное расстройство, вовлекающее клетки яичников. Клеточные пролиферативные расстройства яичников могут включать все формы клеточных пролиферативных расстройств, поражающих клетки яичников. Клеточные пролиферативные расстройства яичников могут включать предрак или предраковое состояние яичников, доброкачественные разрастания ткани или поражения яичников, рак яичников, злокачественные разрастания ткани или поражения яичников и метастатические поражения в ткани и органах в организме, отличных от яичников. Клеточные пролиферативные расстройства кожи могут включать гиперплазию, метаплазию и дисплазию клеток яичников.
«Клеточное пролиферативное расстройство молочной железы» представляет собой клеточное пролиферативное расстройство, вовлекающее клетки молочной железы. Клеточные пролиферативные расстройства молочной железы могут включать все формы клеточных пролиферативных расстройств, поражающих молочную железу. Клеточные пролиферативные расстройства молочной железы могут включать рак молочной железы, предрак или предраковое состояние молочной железы, доброкачественные разрастания ткани или поражения молочной железы и злокачественные разрастания ткани или поражения молочной железы и метастатические поражения в ткани и органах в организме, отличных от молочной железы. Клеточные пролиферативные расстройства молочной железы могут включать гиперплазию, метаплазию и дисплазию молочной железы.
Клеточное пролиферативное расстройство молочной железы может представлять собой предраковое состояние молочной железы. Композиции по настоящему изобретению можно применять для лечения предракового состояния молочной железы. Предраковое состояние молочной железы может включать атипичную гиперплазию молочной железы, карциному протоков in situ (DCIS), внутрипротоковую карциному, дольковую карциному in situ (LCIS), дольковую неоплазию и рост или поражение молочной железы 0-ой стадии или 0-ой степени (например, рак молочной железы 0-ой стадии или 0-ой степени или карцинома in situ). Стадию предракового состояния молочной железы можно определить в соответствии со схемой классификации TNM, принятой Американским Объединенным Комитетом по Раку (AJCC), где первичная опухоль (T) была отнесена к стадии T0 (отсутствие первичной опухоли) или Tis (первичная опухоль in situ), где поражение региональных лимфоузлов (N) было отнесено к стадии N0 (отсутствие поражения лимфоузлов) и где отдаленные метастазы (M) были отнесены к стадии M0 (отсутствие отдаленных метастазов).
Клеточное пролиферативное расстройство молочной железы может представлять собой рак молочной железы. В одном аспекте композиции по настоящему изобретению можно применять для лечения рака молочной железы, или применять для идентификации подходящих кандидатов для таких целей. Рак молочной железы может включать все формы рака молочной железы. Рак молочной железы может включать первичный эпителиальный рак молочной железы. Рак молочной железы может включать те формы рака, при которых молочная железа вовлечена в поражение другими опухолями, такими как лимфома, саркома или меланома. Рак молочной железы может включать карциному молочной железы, протоковую карциному молочной железы, дольковую карциному молочной железы, недифференцированную карциному молочной железы, листовидную цистосаркому молочной железы, ангиосаркому молочной железы и первичную лимфому молочной железы. Рак молочной железы может включать рак молочной железы I, II, IIIA, IIIB, IIIC и IV стадии. Протоковая карцинома молочной железы может включать инвазивную карциному, инвазивную карциному in situ с преобладающим внутрипротоковым компонентом, воспалительный рак молочной железы и протоковую карциному молочной железы с гистологическим типом, выбранным из группы, состоящей из угревого, слизистого (коллоидного), медуллярного, медуллярного с лимфоцитарным инфильтратом, папиллярного, циррозного и трубчатого. Дольковая карцинома молочной железы может включать инвазивную дольковую карциному с преобладающим компонентом in situ, инвазивную дольковую карциному и инфильтрирующую дольковую карциному. Рак молочной железы может включать болезнь Педжета, болезнь Педжета с внутрипротоковой карциномой и болезнь Педжета с инвазивной протоковой карциномой. Рак молочной железы может включать новообразования молочной железы, имеющие гистологическую и ультраструктурную гетерогенность (например, смешанные клеточные типы).
Соединения по настоящему изобретению можно применять для лечения рака молочной железы или применять для идентификации подходящих кандидатов для таких целей. Рак молочной железы, который подлежит лечению, может включать семейный рак молочной железы. Рак молочной железы, который подлежит лечению, может включать спорадический рак молочной железы. Рак молочной железы, который подлежит лечению, может возникнуть у индивида мужского пола. Рак молочной железы, который подлежит лечению, может возникнуть у индивида женского пола. Рак молочной железы, который подлежит лечению, может возникнуть у индивида женского пола в преклимактерическом или постклимактерическом периоде. Рак молочной железы, который подлежит лечению, может возникнуть у индивида в возрасте 30 лет или старше 30 лет или у индивида в возрасте моложе 30 лет. Рак молочной железы, который подлежит лечению, возник у индивида в возрасте 50 лет или старше 50 лет или у индивида в возрасте моложе 50 лет. Рак молочной железы, который подлежит лечению, может возникнуть у индивида в возрасте 70 лет или старше 70 лет или у индивида в возрасте моложе 70 лет.
Рак молочной железы, который подлежит лечению, можно типировать для идентификации семейной или спонтанной мутации в генах BRCA1, BRCA2 или p53. Рак молочной железы, который подлежит лечению, можно типировать как имеющий амплификацию гена HER2/neu, как проявляющий сверхэкспрессию HER2/neu или как имеющий низкий, промежуточный или высокий уровень экспрессии HER2/neu. Рак молочной железы, который подлежит лечению, можно типировать в отношении маркера, выбранного из группы, состоящей из эстрогеновых рецепторов (ER), прогестероновых рецепторов (PR), рецептора-2 человеческого эпидермального фактора роста, Ki-67, CA 15-3, CA 27-29 и c-Met. Рак молочной железы, который подлежит лечению, можно типировать как ER-неизвестный, ER-богатый или ER-бедный. Рак молочной железы, который подлежит лечению, можно типировать как ER-отрицательный или ER-положительный. ER-типирование рака молочной железы можно выполнять любым воспроизводимым средством. ER-типирование рака молочной железы можно выполнять, как изложено в публикации Onkologie 27: 175-179 (2004). Рак молочной железы, который подлежит лечению, можно типировать как PR-неизвестный, PR-богатый или PR-бедный. Рак молочной железы, который подлежит лечению, можно типировать как PR-отрицательный или PR-положительный. Рак молочной железы, который подлежит лечению, можно типировать как рецепторно-положительный или рецепторно-отрицательный. Рак молочной железы, который подлежит лечению, можно типировать как связанный с повышенными уровнями в крови CA 15-3 или CA 27-29 или их обоими.
Рак молочной железы, который подлежит лечению, может включать локализованную опухоль молочной железы. Рак молочной железы, который подлежит лечению, может включать опухоль молочной железы, которая связана с отрицательным результатом биопсии сигнального лимфоузла (SLN). Рак молочной железы, который подлежит лечению, может включать опухоль молочной железы, которая связана с положительным результатом биопсии сигнального лимфоузла (SLN). Рак молочной железы, который подлежит лечению, может включать опухоль молочной железы, которая связана с положительными результатами биопсии одного или нескольких подмышечных лимфоузлов, где стадия поражения подмышечных лимфоузлов была определена любым применимым способом. Рак молочной железы, который подлежит лечению, может включать опухоль молочной железы, которую типировали как имеющую негативный узловой статус (например, с отрицательными результатами биопсии лимфоузлов) или позитивный узловой статус (например, с положительными результатами биопсии лимфоузлов). Рак молочной железы, который подлежит лечению, может включать опухоль молочной железы, которая метастазировала в другие участки в организме. Рак молочной железы, который подлежит лечению, можно классифицировать как метастазировавший в участок, выбранный из группы, состоящей из кости, легких, печени или мозга. Рак молочной железы, который подлежит лечению, можно классифицировать в соответствии с характеристикой, выбранной из группы, состоящей из метастатического, локализованного, регионального, локально-регионального, локально запущенного, отдаленного, многоцентрового, двустороннего, одностороннего, контралатерального, вновь диагностированного, рецидивирующего или неоперабельного.
Соединение по настоящему изобретению можно применять для лечения или предотвращения клеточных пролиферативных расстройств молочной железы, или для лечения или профилактики рака молочной железы у индивида, имеющего повышенный риск развития рака молочной железы, относительно популяции в целом, или применять для идентификации подходящих кандидатов для таких целей. Индивид с повышенным риском развития рака молочной железы относительно популяции в целом представляет собой индивида женского пола с семейным анамнезом или личным анамнезом рака молочной железы. Индивид с повышенным риском развития рака молочной железы относительно популяции в целом представляет собой индивида женского пола, имеющей связанную с зародышевой линией или спонтанную мутацию в BRCA1 или BRCA2 или в них обоих. Индивид с повышенным риском развития рака молочной железы относительно популяции в целом представляет собой индивида женского пола с семейным анамнезом рака молочной железы и связанной с зародышевой линией или спонтанной мутацией в BRCA1 или BRCA2 или в них обоих. Индивид с повышенным риском развития рака молочной железы относительно популяции в целом представляет собой индивида женского пола в возрасте больше 30 лет, больше 40 лет, больше 50 лет, больше 60 лет, больше 70 лет, больше 80 лет или больше 90 лет. Индивид с повышенным риском развития рака молочной железы относительно популяции в целом представляет собой индивида с атипичной гиперплазией молочной железы, протоковой карциномой in situ (DCIS), внутрипротоковой карциномой, дольчатой карциномой in situ (LCIS), дольчатой неоплазией или 0-ой стадией роста или поражения молочной железы (например, раком молочной железы 0-ой стадии или 0-ой степени или карциономой in situ).
Рак молочной железы, который подлежит лечению, можно гистологически классифицировать по степени дифференциации в соответствии с системой Скарффа-Блума-Ричардсона, причем митозу клеток в опухоли молочной железы дают балльную оценку 1, 2 или 3; балльную оценку ядерного плейоморфизма 1, 2 или 3; балльную оценку образования трубочек 1, 2 или 3 и общую балльную оценку Скарффа-Блума-Ричардсона от 3 до 9. Рак молочной железы, который подлежит лечению, можно в соответствии с подходом Международной Экспертной Группы по Согласованию лечения Рака молочной железы классифицировать по степеням дифференциации, выбранным из группы, состоящей из степени 1, степени 1-2, степени 2, степени 2-3 или степени 3.
В одном варианте осуществления изобретение относится к способу лечения рака молочной железы, включающему введение нуждающемуся в лечении индивиду эффективного количества гидробромида соединения I.
В другом варианте осуществления изобретение относится к способу лечения рака молочной железы, включающему введение нуждающемуся в лечении индивиду эффективного количества полиморфа A.
Стадию рака, который подлежит лечению, можно определить в соответствии с системой классификации TNM Американского Объединенного Комитета по Раку (AJCC), в соответствии с которой (T) присваивается стадия TX, T1, T1mic, T1a, T1b, T1c, T2, T3, T4, T4a, T4b, T4c или T4d; и где региональным лимфоузлам (N) присваивается стадия NX, NO, N1, N2, N2a, N2b, N3, N3a, N3b или N3c; и где отдаленным метастазам (M) может быть присвоена стадия MX, MO или M1. Стадию рака, который подлежит лечению, можно определить в соответствии с классификацией Американского Объединенного Комитета по Раку (AJCC) как стадию I, стадию IIA, стадию IIB, стадию IIIA, стадию IIIB, стадию IIIC или стадию IV. Раку, который подлежит лечению, может быть в соответствии с классификацией AJCC присвоена степень GX (например, степень невозможно оценить), степень 1, степень 2, степень 3 или степень 4. Стадию рака, который подлежит лечению, можно установить в соответствии с патоморфологической классификацией AJCC (pN): pNX, pN0, PN0 (I-), PN0 (I+), PN0 (моль-), PN0 (моль+), PN1, PN1(mi), PN1a, PN1b, PN1c, pN2, pN2a, pN2b, pN3, pN3a, pN3b или pN3c.
Рак, который подлежит лечению, может включать опухоль, диаметр которой был определен как равный или меньший чем примерно 2 сантиметра. Рак, который подлежит лечению, может включать опухоль, диаметр которой был определен как составляющий от примерно 2 до примерно 5 сантиметров. Рак, который подлежит лечению, может включать опухоль, диаметр которой был определен как составляющий больше или равный 3 сантиметрам. Рак, который подлежит лечению, может включать опухоль, диаметр которой был определен как составляющий больше чем 5 сантиметров. Рак, который подлежит лечению, можно классифицировать по микроскопическому виду как высокодифференцированный, умеренно дифференцированный, низкодифференцированный или недифференцированный. Рак, который подлежит лечению, можно классифицировать по микроскопическому виду в отношении числа митозов (например, количества клеточных делений) или ядерного плейоморфизма (например, изменения клеток). Рак, который подлежит лечению, можно классифицировать по микроскопическому виду как связанный с областями некроза (например, областями умирающих или дегенерирующих клеток). Рак, который подлежит лечению, можно классифицировать как имеющий аномальный кариотип, имеющий аномальное число хромосом, или имеющий одну или несколько хромосом, которые являются аномальными по виду. Рак, который подлежит лечению, можно классифицировать как являющийся анеуплоидным, триплоидным, тетраплоидным, или как имеющий измененную плоидию. Рак, который подлежит лечению, можно классифицировать как имеющий хромосомную транслокацию или делецию или дупликацию всей хромосомы, или область делеции, дупликации или амплификации части хромосомы.
Рак, который подлежит лечению, можно оценить с использованием ДНК-цитометрии, проточной цитометрии или визуализирующей цитометрии. Рак, который подлежит лечению, можно типировать как имеющий 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% клеток на стадии синтеза ДНК клеточного деления (например, на фазе S клеточного деления). Рак, который подлежит лечению, можно типировать как имеющий низкую фракцию S-фазы или высокую фракцию S-фазы.
Используемый здесь термин «нормальная клетка» обозначает клетку, которую нельзя классифицировать как часть «клеточного пролиферативного расстройства». В нормальной клетке отсутствует нерегулируемый или аномальный рост или оба этих явления, которые могут привести к развитию нежелательного состояния или заболевания. Предпочтительно, нормальная клетка обладает нормально функционирующими механизмами регуляции контрольных точек клеточного цикла.
Используемый здесь термин «контакт с клеткой» относится к условию, при котором соединение или другая композиция вещества находится в непосредственном контакте с клеткой, или находится достаточно близко для вызова желаемого биологического эффекта в клетке.
Используемый здесь термин «соединение-кандидат» относится к соединению по настоящему изобретению (т.е. гидробромиду соединения I, а также полиморфу A), которое было или будет подвергнуто тестированию в одном или нескольких биологических анализах in vitro или in vivo, для определения вероятности того, что соединение вызовет желаемый биологический или медицинский ответ, искомый исследователем или клиницистом, в клетке, ткани, системе, у животного или человека. Соединение-кандидат представляет собой соединение по настоящему изобретению. Биологический или медицинский ответ может представлять собой лечение рака. Биологический или медицинский ответ может представлять собой лечение или профилактику клеточного пролиферативного расстройства. Биологический ответ или эффект может также включать изменение пролиферации или роста клеток, которое происходит in vitro, или на животной модели, а также другие биологические изменения, которые могут наблюдаться in vitro. Биологические анализы in vitro или in vivo могут включать без ограничения анализы ферментативной активности, анализы сдвига электрофоретической подвижности, анализы репортерных генов, анализы жизнеспособности клеток in vitro и анализы, описанные здесь.
Используемый здесь термин «монотерапия» относится к введению одного активного или терапевтического соединения нуждающемуся в лечении индивиду. Предпочтительно, монотерапия включает введение терапевтически эффективного количества активного соединения. Например, монотерапия рака одним из соединений по настоящему изобретению (т.е. гидробромидом соединения I, а также полиморфом A) включает введение его индивиду, нуждающемуся в лечении рака. Монотерапия может контрастировать с комбинированной терапией, при которой вводят комбинацию множества активных соединений, предпочтительно, с каждым компонентом комбинации, присутствующим в терапевтически эффективном количестве. В одном аспекте монотерапия соединением по настоящему изобретению более эффективна при индукции желаемого биологического эффекта, чем комбинированная терапия.
Используемые здесь термины «лечение» или «лечить» описывают ведение пациента и уход за ним с целью борьбы с заболеванием, состоянием или расстройством и включает введение соединения по настоящему изобретению (т.е. гидробромида соединения I, а также полиморфа A) для облегчения симптомов или осложнений заболевания, состояния или расстройства, или для устранения заболевания, состояния или расстройства. Термин «лечение» может также включать обработку клетки in vitro или животную модель.
Соединение по настоящему изобретению (т.е. гидробромид соединения I, а также полиморф A) можно также применять для предотвращения заболевания, состояния или расстройства или применять для идентификации подходящих кандидатов для таких целей. Используемый здесь термин «предотвращение» или «предотвращать» описывает уменьшение или устранение начала проявления симптомов или осложнений заболевания, состояния или расстройства.
Используемый здесь термин «облегчать» предназначен для описания способа, посредством которого уменьшается тяжесть признака или симптома расстройства. Важно, что признак или симптом можно облегчить без их устранения. В предпочтительном варианте осуществления введение фармацевтических композиций по изобретению ведет к устранению признака или симптома, однако их устранение не требуется. Ожидается, что эффективные дозировки уменьшат тяжесть признака или симптома. Например, признак или симптом такого расстройства как рак, который может возникнуть во множественных участках в организме, облегчается, если тяжесть течения рака уменьшается по меньшей мере в пределах одного из множественных участков в организме.
Используемый здесь термин «тяжесть» предназначен для описания вероятности трансформации в рак из предракового или доброкачественного состояния в злокачественное состояние. Альтернативно, или в дополнение, тяжесть предназначена для описания стадии рака, например, в соответствии с системой TNM (принятой Международным Противораковым Союзом (UICC) и Американским Объединенным Комитетом по Раку (AJCC)) или с другими признанными в данной области способами. Стадия рака относится к степени или тяжести рака на основании таких факторов как локализация первичной опухоли, размер опухоли, число опухолей и вовлечение лимфоузлов (распространение рака в лимфатические узлы). Альтернативно, или в дополнение, тяжесть предназначена для описания степени злокачественности опухоли признанными в данной области способами (см. National Cancer Institute (Национальный Институт Рака, www.cancer.gov). Степень злокачественности опухоли представляет собой систему, используемую для классификации раковых клеток с точки зрения того, насколько аномально они выглядят под микроскопом, и насколько вероятен быстрый рост и распространение опухоли. При определении степени злокачественности опухоли учитываются многие факторы, включая структуру и тип роста клеток. Определенные факторы, используемые для определения степени злокачественности опухоли, варьируются в зависимости от каждого типа рака. Тяжесть также описывает гистологическую степень злокачественности, также именуемую дифференциацией, которая относится к тому, насколько опухолевые клетки напоминают нормальные клетки того же типа ткани (см. National Cancer Institute, www.cancer.gov). Кроме того, тяжесть описывает степень полиморфизма ядер, которая относится к размеру и форме ядра в опухолевых клетках и процентной доле опухолевых клеток, которые делятся (см. National Cancer Institute, www.cancer.gov).
В другом аспекте изобретения тяжесть описывает степень, до которой опухоль секретировала факторы роста, разрушила внеклеточную матрицу, стала васкуляризированной, утратила адгезию к расположенным рядом тканям или метастазировала. Кроме того, тяжесть описывает число участков, в которые метастазировала первичная опухоль. Наконец, тяжесть включает трудность лечения опухолей различных типов и локализаций. Например, наиболее тяжелыми считаются неоперабельные опухоли, те злокачественные заболевания, которые имеют доступ к множеству систем организма (гематологические и иммунологические опухоли), и те, которые наиболее устойчивы к традиционным способам лечения. В этих ситуациях удлинение ожидаемой продолжительности жизни индивида и/или уменьшение болевого синдрома, уменьшение доли раковых клеток или ограничение присутствия клеток до пределов одной системы и снижение стадии рака/степени злокачественности опухоли/гистологической степени злокачественности/степени полиморфизма ядер считаются облегчением признака или симптома рака.
Используемый здесь термин «симптом» определяется как указание на заболевание, болезнь, повреждение или на то, что в организме что-то нарушено. Симптомы ощущаются или отмечаются индивидом, испытывающим симптом, но другим нелегко их заметить. Другие определяются как лица, не являющиеся медицинскими работниками.
Используемый здесь термин «признак» также определяется как указание на то, что в организме что-то нарушено. Но признаки определяются как проявления, которые может видеть врач, медсестра или другой медицинский работник.
Рак представляет собой группу заболеваний, которые могут вызвать почти любой признак или симптом. Признаки и симптомы зависят от локализации рака, размера раковой опухоли и того, насколько обширно поражение им соседних органов или структур. Если рак распространяется (метастазирует), то симптомы могут появляться в различных частях тела.
По мере роста раковой опухоли, она начинает сдавливать соседние органы, кровеносные сосуды и нервы. Это давление создает некоторые из признаков и симптомов рака. Если раковая опухоль находится в жизненно важной области, такой как определенные части мозга, то даже самая маленькая опухоль может вызвать ранние симптомы.
Но иногда раковые опухоли начинают развиваться в местах, где они не вызывают никаких симптомов до тех пор, пока опухоль ни вырастет до достаточно больших размеров. Например, раковые опухоли поджелудочной железы обычно не вырастают до достаточно больших размеров для возможности их пальпаторного выявления при наружном исследовании тела. Некоторые формы рака поджелудочной железы не вызывают симптомов до тех пор, пока они ни начинают расти вокруг желчного протока, что блокирует ток желчи и ведет к пожелтению кожи, известному как желтуха. Ко времени, когда рак поджелудочной железы вызывает эти признаки или симптомы, он обычно достигает поздней стадии.
Рак может также вызвать такие симптомы как лихорадка, усталость или потеря массы тела. Это может быть связано с тем, что раковые клетки используют бόльшую часть энергии, поступающей в организм, или высвобождают вещества, которые изменяют метаболизм организма. Или рак может вызвать реакции иммунной системы такими путями, которые вызывают эти симптомы.
Иногда раковые клетки высвобождают в циркулирующую кровь вещества, которые вызывают симптомы, обычно не считающиеся возникающими в результате рака. Например, некоторые формы рака поджелудочной железы могут высвобождать вещества, которые вызывают развитие тромбов в венах нижних конечностей. Некоторые формы рака легких вырабатывают подобные гормонам вещества, которые воздействуют на уровни кальция в крови, поражающие нервы и мышцы, вызывая слабость и головокружение.
Рак проявляется несколькими общими признаками или симптомами, которые возникают, когда присутствуют разнообразные подтипы раковых клеток. Большинство людей, страдающих раком, в некоторое время в ходе течения их заболевания теряют массу тела. Необъяснимая (непреднамеренная) потеря массы тела, составляющая 10 фунтов (~4,5 кг) или более, может представлять собой первый признак рака, в частности, рака поджелудочной железы, желудка, пищевода или легких.
Лихорадка очень часто встречается при раке, но чаще наблюдается при запущенном заболевании. Почти у всех пациентов, страдающих раком, в какое-то время будет лихорадка, особенно если рак или его лечение воздействует на иммунную систему и затрудняет борьбу организма с инфекцией. Реже, лихорадка может представлять собой ранний признак рака, как это бывает при лейкозе или лимфоме.
Усталость может представлять собой важный симптом по мере прогрессирования рака. Она может возникать рано, хотя она может наблюдаться при таких видах рака, как лейкоз, или если рак вызывает продолжающуюся потерю крови, как происходит при некоторых формах рака ободочной кишки или желудка.
Боль может представлять собой ранний симптом при некоторых видах рака, таких как рак костей или рак яичек. Но чаще всего боль является симптомом запущенного заболевания.
Наряду с раком кожи (см. следующий раздел), некоторые злокачественные новообразования внутренних органов могут вызвать видимые кожные признаки. Эти изменения внешнего вида кожи включают потемнение (гиперпигментацию), пожелтение (желтуху) или покраснение (эритему); зуд или избыточный рост волос.
Альтернативно, или в дополнение, подтипы рака проявляются специфическими признаками или симптомами. Изменения обычного ритма дефекации или функции мочевого пузыря могут указать на наличие рака. Длительный запор, диарея или изменение размера стула может быть признаком рака ободочной кишки. Боль при мочеиспускании, кровь в моче или изменение функции мочевого пузыря (такое как более частое или менее частое мочеиспускание) могут быть связаны с раком мочевого пузыря или предстательной железы.
Изменения состояния кожи или появление нового состояния кожи могут указать на наличие рака. Различные типы рака кожи могут вызывать выделения крови и иметь вид, подобный незаживающим ранкам. Длительно текущая язвочка в ротовой полости может представлять собой рак ротовой полости, в частности, у пациентов, которые курят, жуют табак или часто употребляют алкоголь. Ранки на пенисе или во влагалище могут быть признаками инфекции или ранней стадии рака.
Необычное кровотечение или выделение может указывать на наличие рака. Необычное кровотечение может возникать или на ранней стадии, или при запущенном раке. Кровь в мокроте (слизь) может быть признаком рака легких. Кровь в фекалиях (или темный или черный стул) может быть признаком рака ободочной или прямой кишки. Рак шейки матки или эндометрия (выстилки полости матки) может вызвать вагинальное кровотечение. Кровь в моче может быть признаком рака мочевого пузыря или почек. Кровянистое выделение из соска может быть признаком рака молочной железы.
Объемное образование в виде утолщения или уплотнения в молочной железе или других частях тела может указывать на присутствие рака. Многие формы рака можно ощутить через кожу при пальпации, главным образом, в молочной железе, яичке, лимфатических узлах (железах) и мягких тканях тела. Объемное образование в виде уплотнения или утолщения может представлять собой ранний или поздний признак рака. Любое объемное образование в виде уплотнения или утолщения может указывать на наличие рака, особенно если образование является новым или выросло в размере.
Нарушение пищеварения или глотания может указывать на наличие рака. Хотя эти симптомы обычно имеют другие причины, нарушения пищеварения или глотания могут быть признаком рака пищевода, желудка или глотки (горла).
Недавно возникшие изменения бородавки или родинки могут указывать на наличие рака. Любая бородавка, родинка или веснушка, которая меняется по цвету, размеру или форме или утрачивает свои четкие границы, указывает на возможное развитие рака. Например, поражение кожи может представлять собой меланому.
Стойкий кашель или охриплость могут указывать на наличие рака. Непреходящий кашель может представлять собой признак рака легких. Охриплость может представлять собой признак рака гортани (голосового аппарата) или щитовидной железы.
Хотя перечисленные выше признаки и симптомы являются более распространенными, наблюдаемыми при раке, существует много других, которые менее распространены и не перечислены в настоящем описании. Однако все признанные в данной области признаки и симптомы рака предусматриваются и охватываются настоящим изобретением.
Лечение рака может привести к уменьшению размера опухоли. Уменьшение размера опухоли может также именоваться «регрессией опухоли». Предпочтительно, размер опухоли после лечения уменьшается на 5% или больше относительно ее размера перед лечением; предпочтительнее, размер опухоли уменьшается на 10% или более; предпочтительнее, уменьшается на 20% или более; предпочтительнее, уменьшается на 30% или более; предпочтительнее, уменьшается на 40% или более; еще предпочтительнее, уменьшается на 50% или более; и наиболее предпочтительно, уменьшается более чем на 75% или более. Размер опухоли можно измерить любым воспроизводимым средством измерения. Размер опухоли можно измерить в виде диаметра опухоли.
Лечение рака может привести к уменьшению объема опухоли. Предпочтительно, объем опухоли после лечения уменьшается на 5% или более относительно ее объема перед лечением; предпочтительнее, объем опухоли уменьшается на 10% или более; предпочтительнее, уменьшается на 20% или более; предпочтительнее, уменьшается на 30% или более; предпочтительнее, уменьшается на 40% или более; еще предпочтительнее, уменьшается на 50% или более; и наиболее предпочтительно, уменьшается более чем на 75% или более. Объем опухоли можно измерить любым воспроизводимым средством измерения.
Лечение рака приводит к уменьшению числа опухолей. Предпочтительно, число опухолей после лечения уменьшается на 5% или более относительно их числа перед лечением; предпочтительнее, число опухолей уменьшается на 10% или более; предпочтительнее, уменьшается на 20% или более; предпочтительнее, уменьшается на 30% или более; предпочтительнее, уменьшается на 40% или более; еще предпочтительнее, уменьшается на 50% или более; и наиболее предпочтительно, уменьшается более чем на 75%. Число опухолей можно измерить любым воспроизводимым средством измерения. Число опухолей можно измерить подсчетом опухолей, видимых невооруженным глазом или при определенном увеличении. Предпочтительно, определенное увеличение составляет 2×, 3×, 4×, 5×, 10× или 50×.
Лечение рака может привести к уменьшению числа метастатических поражений в других тканях или органах, удаленных от участка первичной опухоли. Предпочтительно, число метастатических поражений после лечения уменьшается на 5% или более относительно их числа перед лечением; предпочтительнее, число метастатических поражений уменьшается на 10% или более; предпочтительнее, уменьшается на 20% или более; предпочтительнее, уменьшается на 30% или более; предпочтительнее, уменьшается на 40% или более; еще предпочтительнее, уменьшается на 50% или более; и наиболее предпочтительно, уменьшается более чем на 75%. Число метастатических поражений можно измерить любым воспроизводимым средством измерения. Число метастатических поражений можно измерить подсчетом метастатических поражений, видимых невооруженным глазом или при определенном увеличении. Предпочтительно, определенное увеличение составляет 2×, 3×, 4×, 5×, 10× или 50×.
Лечение рака может привести к увеличению среднего времени выживания популяции получавших лечение индивидов по сравнению с популяцией, получавшей один носитель. Предпочтительно, среднее время выживания увеличивается более чем на 30 дней; предпочтительнее, более чем на 60 дней; предпочтительнее, более чем на 90 дней; и наиболее предпочтительно, более чем на 120 дней. Увеличение среднего времени выживания популяции можно измерить любым воспроизводимым средством измерения. Увеличение среднего времени выживания популяции можно измерить, например, расчетом для популяции средней продолжительности выживания после начала лечения активным соединением. Увеличение среднего времени выживания популяции можно также измерить, например, расчетом для популяции средней продолжительности выживания после завершения первого курса лечения активным соединением.
Лечение рака может привести к увеличению среднего времени выживания популяции получавших лечение индивидов по сравнению с популяцией не получавших лечение индивидов. Предпочтительно, среднее время выживания увеличивается более чем на 30 дней; предпочтительнее, более чем на 60 дней; предпочтительнее, более чем на 90 дней и наиболее предпочтительно, более чем на 120 дней. Увеличение среднего времени выживания популяции можно измерить любым воспроизводимым средством. Увеличение среднего времени выживания популяции можно измерить, например, расчетом для популяции средней продолжительности выживания после начала лечения активным соединением. Увеличение среднего времени выживания популяции можно также измерить, например, расчетом для популяции средней продолжительности выживания после завершения первого курса лечения активным соединением.
Лечение рака может привести к увеличению среднего времени выживания популяции получавших лечение индивидов по сравнению с популяцией, получающей монотерапию лекарственным средством, которое не является соединением по настоящему изобретению. Предпочтительно, среднее время выживания увеличивается более чем на 30 дней; предпочтительнее, более чем на 60 дней; предпочтительнее, более чем на 90 дней; и наиболее предпочтительно, более чем на 120 дней. Увеличение среднего времени выживания популяции можно измерить любым воспроизводимым средством. Увеличение среднего времени выживания популяции можно измерить, например, расчетом для популяции средней продолжительности выживания после начала лечения активным соединением. Увеличение среднего времени выживания популяции можно также измерить, например, расчетом для популяции средней продолжительности выживания после завершения первого курса лечения активным соединением.
Лечение рака может привести к уменьшению смертности популяции получавших лечение индивидов по сравнению с популяцией, получающей один носитель. Лечение рака может привести к уменьшению смертности популяции получавших лечение индивидов по сравнению с не получавшей лечение популяцией. Лечение рака может привести к уменьшению смертности популяции получавших лечение индивидов по сравнению с популяцией, получавшей монотерапию лекарственным средством, которое не является соединением по настоящему изобретению. Предпочтительно, смертность уменьшается более чем на 2%; предпочтительнее, более чем на 5%; предпочтительнее, более чем на 10%; и наиболее предпочтительно, более чем на 25%. Уменьшение смертности популяции получавших лечение индивидов можно измерить любым воспроизводимым средством. Уменьшение смертности популяции можно измерить, например, расчетом для популяции среднего числа связанных с заболеванием случаев смерти на единицу времени после начала лечения активным соединением. Уменьшение смертности популяции можно измерить, например, расчетом для популяции среднего числа связанных с заболеванием случаев смерти на единицу времени после завершения первого курса лечения активным соединением.
Лечение рака может привести к уменьшению скорости роста опухоли. Предпочтительно, после лечения скорость роста опухоли снижается по меньшей мере на 5% относительно скорости перед лечением; предпочтительнее, скорость роста опухоли снижается по меньшей мере на 10%; предпочтительнее, уменьшается по меньшей мере на 20%; предпочтительнее, уменьшается по меньшей мере на 30%; предпочтительнее, уменьшается по меньшей мере на 40%; предпочтительнее, уменьшается по меньшей мере на 50%; еще предпочтительнее, уменьшается по меньшей мере на 50%, и наиболее предпочтительно, уменьшается по меньшей мере на 75%. Скорость роста опухоли можно измерить любым воспроизводимым средством измерения. Скорость роста опухоли можно измерить в соответствии с изменением диаметра опухоли на единицу времени.
Лечение рака может привести к уменьшению возобновления роста опухоли. Предпочтительно, возобновление роста опухоли после лечения составляет менее чем 5%; предпочтительнее, возобновление роста опухоли составляет менее чем 10%; предпочтительнее, менее чем 20%; предпочтительнее, менее чем 30%; предпочтительнее, менее чем 40%; предпочтительнее, менее чем 50%; еще предпочтительнее, менее чем 50%; и наиболее предпочтительно, менее чем 75%. Возобновление роста опухоли можно измерить любым воспроизводимым средством измерения. Возобновление роста опухоли определяется, например, измерением увеличения диаметра опухоли после предшествующего уменьшения размера опухоли после лечения. На уменьшение возобновления роста опухоли указывает отсутствие возобновления роста опухоли после прекращения лечения.
Лечение или профилактика клеточного пролиферативного расстройства может привести к снижению скорости клеточной пролиферации. Предпочтительно, скорость клеточной пролиферации после лечения снижается по меньшей мере на 5%; предпочтительнее, по меньшей мере на 10%; предпочтительнее, по меньшей мере на 20%; предпочтительнее, по меньшей мере на 30%; предпочтительнее, по меньшей мере на 40%; предпочтительнее, по меньшей мере на 50%; еще предпочтительнее, по меньшей мере на 50%; и наиболее предпочтительно, по меньшей мере на 75%. Скорость клеточной пролиферации можно измерить любым воспроизводимым средством измерения. Скорость клеточной пролиферации определяется, например, измерением числа делящихся клеток в образце ткани на единицу времени.
Лечение или профилактика клеточного пролиферативного расстройства может привести к уменьшению доли пролиферирующих клеток. Предпочтительно, доля пролиферирующих клеток после лечения уменьшается по меньшей мере на 5%; предпочтительнее, по меньшей мере на 10%; предпочтительнее, по меньшей мере на 20%; предпочтительнее, по меньшей мере на 30%; предпочтительнее, по меньшей мере на 40%; предпочтительнее, по меньшей мере на 50%; еще предпочтительнее, по меньшей мере на 50%; и наиболее предпочтительно, по меньшей мере на 75%. Долю пролиферирующих клеток можно измерить любым воспроизводимым средством измерения. Предпочтительно, доля пролиферирующих клеток измеряется, например, количественным определением числа делящихся клеток относительно числа не делящихся клеток в образце ткани. Доля пролиферирующих клеток может быть эквивалентна митотическому индексу.
Лечение или профилактика клеточного пролиферативного расстройства может привести к уменьшению размера области или зоны клеточной пролиферации. Предпочтительно, область или зона клеточной пролиферации после лечения уменьшается по меньшей мере на 5% относительно ее размера перед лечением; предпочтительнее, уменьшается по меньшей мере на 10%; предпочтительнее, уменьшается по меньшей мере на 20%; предпочтительнее, уменьшается по меньшей мере на 30%; предпочтительнее, уменьшается по меньшей мере на 40%; предпочтительнее, уменьшается по меньшей мере на 50%; еще предпочтительнее, уменьшается по меньшей мере на 50%; и наиболее предпочтительно, уменьшается по меньшей мере на 75%. Размер области или зоны клеточной пролиферации можно измерить любым воспроизводимым средством измерения. Размер области или зоны клеточной пролиферации можно измерить как диаметр или ширину области или зоны клеточной пролиферации.
Лечение или профилактика клеточного пролиферативного расстройства может привести к уменьшению числа или доли клеток, имеющих аномальный вид или морфологию. Предпочтительно, число клеток, имеющих аномальную морфологию, после лечения уменьшается по меньшей мере на 5% относительно его величины перед лечением; предпочтительнее, уменьшается по меньшей мере на 10%; предпочтительнее, уменьшается по меньшей мере на 20%; предпочтительнее, уменьшается по меньшей мере на 30%; предпочтительнее, уменьшается по меньшей мере на 40%; предпочтительнее, уменьшается по меньшей мере на 50%; еще предпочтительнее, уменьшается по меньшей мере на 50%; и наиболее предпочтительно, уменьшается по меньшей мере на 75%. Аномальный внешний вид или морфологию можно измерить любым воспроизводимым средством измерения. Аномальный вид или морфологию можно определить микроскопией, например, используя инвертированный микроскоп для исследования тканевых культур. Аномальная клеточная морфология может принимать форму ядерного плейоморфизма.
Используемый здесь термин «селективно» означает тенденцию возникновения у одной популяции с более высокой частотой, чем у другой популяции. Сравниваемые популяции могут представлять собой клеточные популяции. Предпочтительно, соединение по настоящему изобретению (т.е. гидробромид соединения I, а также полиморф A) селективно действует на раковую или предраковую клетку, но не на нормальную клетку. Предпочтительно, соединение по настоящему изобретению действует селективно для модуляции одной молекулярной мишени (например, мишени в виде протеин-метилтрансферазы), но существенно не модулирует другую молекулярную мишень (например, протеин-метилтрансферазу, не являющуюся мишенью). Изобретение также относится к способу селективного ингибирования активности фермента, такого как протеин-метилтрансфераза. Предпочтительно, явление селективно происходит в популяции A относительно популяции B, если оно происходит более чем в два раза чаще в популяции A по сравнению с популяцией B. Явление происходит селективно, если оно происходит более чем в пять раз чаще в популяции A. Явление происходит селективно, если оно происходит более чем в десять раз чаще в популяции A; предпочтительнее, больше чем в пятьдесят раз; еще предпочтительнее, больше чем в 100 раз; и наиболее предпочтительно, больше чем в 1000 раз чаще в популяции A по сравнению с популяцией B. Например, можно сказать, что гибель клеток селективно происходит в раковых клетках, если она происходит больше чем в два раза чаще в раковых клетках по сравнению с нормальными клетками.
Соединение по настоящему изобретению может модулировать активность молекулярной мишени (например, мишени в виде протеин-метилтрансферазы). Модулирование относится к стимуляции или ингибированию активности молекулярной мишени. Предпочтительно, соединение по настоящему изобретению модулирует активность молекулярной мишени, если оно стимулирует или ингибирует активность молекулярной мишени по меньшей мере в 2 раза относительно активности молекулярной мишени в таких же условиях, но только в отсутствие указанного соединения. Предпочтительнее, соединение по настоящему изобретению модулирует активность молекулярной мишени, если оно стимулирует или ингибирует активность молекулярной мишени, по меньшей мере в 5 раз, по меньшей мере в 10 раз, по меньшей мере в 20 раз, по меньшей мере в 50 раз, по меньшей мере в 100 раз относительно активности молекулярной мишени в таких же условиях, но только в отсутствие указанного соединения. Активность молекулярной мишени можно измерить любым воспроизводимым средством. Активность молекулярной мишени можно измерить in vitro или in vivo. Например, активность молекулярной мишени можно измерить in vitro анализом ферментативной активности или анализом связывания ДНК, или активность молекулярной мишени можно измерить in vivo анализом экспрессии репортерного гена.
Соединение по настоящему изобретению (т.е. гидробромид соединения I, а также полиморф A) значимо не модулирует активность молекулярной мишени, если добавление соединения не стимулирует или не ингибирует активность молекулярной мишени больше чем на 10% относительно активности молекулярной мишени в таких же условиях, но только в отсутствие указанного соединения.
Используемый здесь термин «изозим-селективное» означает предпочтительное ингибирование или стимуляцию первой изоформы фермента по сравнению со второй изоформой фермента (например, предпочтительное ингибирование или стимуляцию изозима протеин-метилтрансферазы альфа по сравнению с изозимом протеин-метилтрансферазы бета). Предпочтительно, соединение по настоящему изобретению демонстрирует минимум четырехкратную разность, предпочтительно, десятикратную разность, предпочтительнее, пятидесятикратную разность дозировки, требуемой для достижения биологического эффекта. Предпочтительно, соединение по настоящему изобретению демонстрирует эту разницу по диапазону ингибирования, и разность иллюстрируется при IC50, т.е. концентрации, обеспечивающей ингибирование на 50%, для представляющей интерес молекулярной мишени.
Введение соединения по настоящему изобретению в клетку или нуждающемуся в нем индивиду может привести к модуляции (т.е. стимуляции или ингибированию) активности представляющей интерес протеин-метилтрансферазы.
Лечение рака или клеточного пролиферативного расстройства может привести к гибели клеток, и, предпочтительно, гибель клеток приводит к уменьшению, по меньшей мере на 10% числа клеток в популяции. Предпочтительнее, гибель клеток означает уменьшение по меньшей мере на 20%; предпочтительнее, уменьшение по меньшей мере на 30%; предпочтительнее, уменьшение по меньшей мере на 40%; предпочтительнее, уменьшение по меньшей мере на 50%; наиболее предпочтительно, уменьшение по меньшей мере на 75%. Число клеток в популяции можно измерить любым воспроизводимым средством. Число клеток в популяции можно измерить сортировкой клеток с активированной флюоресценцией (FACS), иммунофлуоресцентной микроскопией и световой микроскопией. Способы измерения гибели клеток показаны в публикации Li et al., Proc Natl Acad Sci USA. 100(5): 2674-8, 2003. В одном аспекте гибель клеток происходит в результате апоптоза.
Предпочтительно, эффективное количество соединения по настоящему изобретению не оказывает значимое цитотоксическое действие на нормальные клетки. Терапевтически эффективное количество соединения не оказывает значимое цитотоксическое действие на нормальные клетки, если введение соединения в терапевтически эффективном количестве не вызывает гибель больше чем 10% нормальных клеток. Терапевтически эффективное количество соединения не оказывает значимое воздействие на жизнеспособные нормальные клетки, если введение соединения в терапевтически эффективном количестве не вызывает гибель больше чем 10% нормальных клеток. В одном аспекте гибель клеток происходит в результате апоптоза.
Контакт клетки с соединением по настоящему изобретению может селективно индуцировать или активировать гибель раковых клеток. Введение нуждающемуся индивиду соединения по настоящему изобретению может селективно индуцировать или активировать гибель раковых клеток. Контакт клетки с соединением по настоящему изобретению может селективно индуцировать гибель одной или нескольких клеток, пораженных клеточным пролиферативным расстройством. Предпочтительно, введение нуждающемуся индивиду соединения по настоящему изобретению селективно индуцирует гибель одной или нескольких клеток, пораженных клеточным пролиферативным расстройством.
Настоящее изобретение относится к способу лечения или профилактики рака (например, на течение которого можно влиять модулированием опосредованного EZH2 метилирования белка) введением соединения по настоящему изобретению (т.е. гидробромида соединения I, а также полиморфа A) нуждающемуся в нем индивиду, где введение соединения по настоящему изобретению приводит к одному или нескольким из следующих эффектов: предотвращение пролиферации раковых клеток накоплением клеток в одной или нескольких фазах клеточного цикла (например, G1, G1/S, G2/M), или индукция старения клеток, или стимуляция дифференциации опухолевых клеток; стимуляция гибели раковых клеток посредством цитотоксичности, некроза или апоптоза без значительного количества погибших нормальных клеток, противоопухолевая активность у животных при терапевтическом индексе по меньшей мере 2. Используемый здесь термин «терапевтический индекс» представляет собой максимальную переносимую дозу, деленную на эффективную дозу. Настоящее изобретение также относится к способу, используемому для идентификации подходящих кандидатов для лечения или профилактики рака.
За подробными описаниями известных методик, описанных здесь, или эквивалентных методик специалист в данной области может обратиться к общим руководствам. Эти руководства включают: Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Inc. (2005); Sambrook et al., Molecular Cloning, A Laboratory Manual (3rd edition), Cold Spring Harbor Press, Cold Spring Harbor, New York (2000); Coligan et al., Current Protocols in Immunology, John Wiley & Sons, N.Y.; Enna et al., Current Protocols in Pharmacology, John Wiley & Sons, N.Y.; Fingl et al., The Pharmacological Basis of Therapeutics (1975), Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA, 18th edition (1990). На эти руководства можно, конечно, также сослаться при осуществлении или использовании какого-либо аспекта изобретения.
Иллюстративные примеры
Материалы и методы
Порошковая рентгеновская дифракция
PXRD для всех образцов регистрировали на аппарате Rigaku MultiFlex (Мишень: Cu; Напряжение в трубке: 40 кВ; Ток в трубке: 30 мА).
Дифференциальная сканирующая калориметрия
DSC для всех образцов регистрировали на аппарате Mettler-Toledo DSC 1/700 (Условия рабочего цикла: Первоначальная температура 35°C, Конечная температура 325°C, Скорость нагревания 30°C/мин).
Рентгеновская кристаллография
Бесцветный пластинчатый кристалл с размерами 0,28×0,22×0,06 мм устанавливали на нейлоновую петлю, используя очень небольшое количество паратонового масла. Данные собирали, используя дифрактометр на основе устройства CCD (прибора с зарядовой связью) Bruker, оборудованного низкотемпературным аппаратом Oxford Cryostream, работающими при 173 K (-100°C). Данные измеряли, используя омега и фи сканы 0,5° на рамку в течение 45 с. Общее число изображений основывалось на результатах из программы COSMO, где ожидаемая избыточность данных составляла 4,0 и полнота до 100% до 0,83 Å. Клеточные параметры выбирали, используя программное обеспечение APEX II, и детализировали, используя программное обеспечение SAINT, на всех наблюдаемых отражениях. Сжатие данных выполняли, используя программное обеспечение SAINT, которое осуществляет коррекцию Lp (коррекцию Лоренца на поляризацию). Коррекцию на масштабирование и абсорбцию применяли, используя методику мультисканирования SADABS, поставляемую George Sheldrick. Структуры устанавливают прямым методом, используя программу SHELXS-97, и детализируют методом наименьших квадратов на F2, SHELXL-97, которые включены в программное обеспечение SHELXTL-PC V 6.10.
Структура, показанная на фиг. 11, была установлена в пространственной группе P21/c (# 14). Все неводородные атомы детализируются анизотропно. Атомы водорода рассчитывали геометрическими методами и детализировали в качестве «верховой» модели. Кристалл, использованный для исследования дифракции, не демонстрировал разрушение во время сбора данных. Все чертежи сделаны при 50% эллипсоидах.
Динамическая сорбция пара (DVS)
DVS измеряли на системе VTI Model SGA-100. Метод измерения: Относительную влажность (RH) изменяли регулируемым образом, шагами по 5% от 5,0% до 95,0%, затем назад до 5,0%, используя систему гравиметрической сорбции паров, и измеряли изменение процентной доли массы (мас.%) образца на каждой стадии.
ВЭЖХ
ВЭЖХ проводили на жидкостном хроматографе Agilent 1200, снабженном четвертичным насосом, обеспечивающим смешивание при низком давлении, и встроенным в магистраль дегазатором. Условия аналитического метода: образец 8 мкл (20 мг ER-581982-06, разбавленных 50 мл метанола, для обеспечения получения раствора с концентрацией приблизительно 0,4 мг/мл) инжектировали на колонку Agilent Zorbax Eclipse XDB-C18 (4,6×150 мм, 3,5 мкм). Условия хроматографии: подвижная фаза A, вода с 5 мМ формиата аммония; подвижная фаза B, 5 мМ формиата аммония в растворе 50/45/5 ацетонитрила/метанола/воды; скорость потока 1,5 мл/мин; градиент: изократический при 10% B от 0 до 3 мин; линейное увеличение до 70% B от 3 до 7 мин; изократический при 70% B от 7 до 12 мин; линейное увеличение до 100% B от 12 до 15 мин изократический при 100% B от 15 до 20 мин; температура колонки 35°C; выявление УФ 230 нм. Приблизительное время удерживания соединения I = 10,7 мин.
Синтез полиморфа A
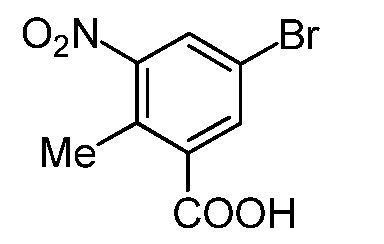
5-бром-2-метил-3-нитробензойная кислота
К перемешанному раствору 2-метил-3-нитробензойной кислоты (100 г, 552 ммоль) в концентрированной H2SO4 (400 мл) порциями добавляли 1,3-дибром-5,5-диметил-2,4-имидазолидиндион (88 г, 308 ммоль) и затем реакционную смесь перемешивали при комнатной температуре (к.т.) в течение 5 ч. Реакционную смесь выливали на ледяную воду, осажденное твердое вещество отфильтровывали, промывали водой и сушили в вакууме для получения желаемого соединения в виде твердого вещества (140 г, 98%). Выделенное соединение брали непосредственно на следующую стадию. 1H ЯМР (ДМСО-d6, 400 MГц) δ 8,31 (c, 1H), 8,17 (c, 1H), 2,43 (c, 3H).
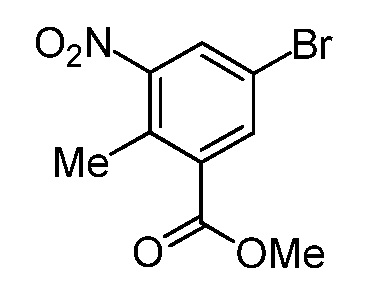
Метил 5-бром-2-метил-3-нитробензоат
К перемешанному раствору 5-бром-2-метил-3-нитробензойной кислоты (285 г, 1105 ммоль) в ДМФА (2,8 л) при комнатной температуре добавляли карбонат натрия (468 г, 4415 ммоль) с последующим добавлением метилиодида (626,6 г, 4415 ммоль). Полученную реакционную смесь нагревали при 60°C в течение 8 ч. После завершения реакции (по данным мониторинга ТСХ), реакционную смесь фильтровали (для удаления карбоната натрия) и промывали этилацетатом (1 л × 3). Объединенный фильтрат промывали водой (3 л × 5) и водную фазу обратно экстрагировали этилацетатом (1 л × 3). Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и концентрировали под пониженным давлением для получения указанного в заголовке соединения в виде твердого вещества (290 г, выход 97%). Выделенное соединение брали непосредственно на следующую стадию. 1H ЯМР (CDCl3, 400 MГц) δ 8,17 (с, 1H), 7,91 (с, 1H), 3,96 (с, 3H), 2,59 (с, 3H).
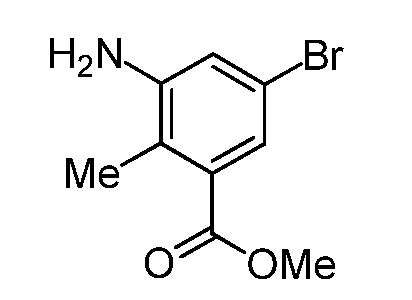
Метил 3-амино-5-бром-2-метилбензоат (1)
К перемешанному раствору метил 5-бром-2-метил-3-нитробензоата (290 г, 1058 ммоль) в этаноле (1,5 л) добавляли водный хлорид аммония (283 г, 5290 ммоль, растворенные в 1,5 л воды). Полученную смесь перемешивали при 80°C, к которой порциями добавляли железный порошок (472 г, 8451 ммоль). Полученную реакционную смесь нагревали при 80°C в течение 12 ч. После завершения реакции, определенного ТСХ, реакционную смесь подвергали горячему фильтрованию через целит®, и слой целлита промывали метанолом (5 л) с последующим промыванием 30% MeOH в ДХМ (5 л). Объединенный фильтрат концентрировали в вакууме, полученный остаток разбавляли водным раствором бикарбоната натрия (2 л) и экстрагировали этилацетатом (5 л × 3). Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и концентрировали под пониженным давлением для получения указанного в заголовке соединения в виде твердого вещества (220 г, 85%). Соединение непосредственно брали на следующую стадию. 1H ЯМР (CDCl3, 400 MГц) δ 7,37 (с, 1H), 6,92 (с, 1H), 3,94 (с, 3H), 3,80 (шир.с, 2H), 2,31 (с, 3H).
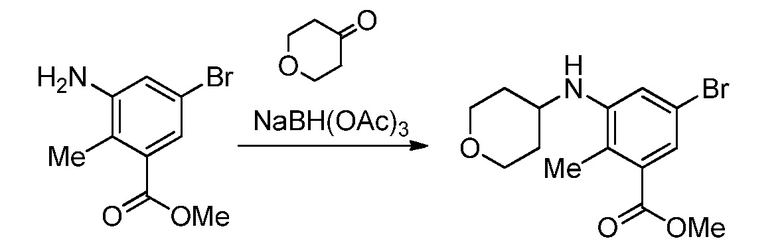
Метил 5-бром-2-метил-3-((тетрагидро-2H-пиран-4-ил)амино)бензоат (2)
Реактор загружали метил 3-амино-5-бром-2-метилбензоатом (455,8 г, 1,87 моль), 1,2-дихлорэтаном (4,56 л) и уксусной кислотой (535 мл, 9,34 моль). К смеси добавляли дигидро-2H-пиран-4(3H)-он (280 г, 2,80 моль) и триацетоксиборгидрид натрия (594 г, 2,80 моль), поддерживая внутреннюю температуру ниже 40°C. Смесь перемешивали при 25°C в течение 2,5 ч и затем реакцию гасили раствором гидроксида натрия (448 г, 11,20 моль) в воде (5,61 л). После перемешивания в течение 20 минут при окружающей температуре, органический слой отделяли и водный слой экстрагировали этилацетатом (3,65 л). Органические слои объединяли, промывали солевым раствором (1,5 л) и концентрировали в вакууме.
Остаток обрабатывали этилацетатом (1,8 л) и нагревали до 65-70°C. Смесь перемешивали при 65-70°C в течение 15 минут для получения прозрачного раствора и затем обрабатывали н-гептаном (7,3 л), поддерживая температуру от 60 до 70°C. После того как гептан полностью добавляли к раствору, смесь выдерживали при 65-70°C в течение 15 минут и затем давали возможность охладиться до 18-22°C в течение 3 ч. Полученную суспензию перемешивали при 18-22°C в течение 4 ч, охлаждали до 0-5°C в течение 1 ч и выдерживали при 0-5°C в течение 2 ч. Осадок фильтровали, дважды промывали н-гептаном (1,4 л) и сушили в вакууме для получения указанного в заголовке соединения (540 г, 88%). Профиль XRPD этого соединения показан на фиг. 17.

Метил 5-бром-3-(этил(тетрагидро-2H-пиран-4-ил)амино)-2-метилбензоат (3)
К перемешанному раствору метил 5-бром-2-метил-3-((тетрагидро-2H-пиран-4-ил)амино)бензоата (14 г, 42,7 ммоль) в дихлорэтане (150 мл) добавляли ацетальдегид (3,75 г, 85,2 ммоль) и уксусную кислоту (15,3 г, 256 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 15 минут. Смесь охлаждали до 0°C и добавляли триацетоксиборгидрид натрия (27 г, 128 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. После завершения реакции, по данным определения ТСХ, к реакционной смеси добавляли водный раствор бикарбоната натрия до тех пор, пока ни получали pH 7-8, органическую фазу отделяли и водную фазу экстрагировали этилацетатом. Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и концентрировали под пониженным давлением. Неочищенное соединение очищали колоночной хроматографией (силикагель 100-200 меш), элюируя этилацетатом:гексаном для получения желаемого соединения в виде вязкой жидкости (14 г, 93%). 1H ЯМР (ДМСО-d6, 400 MГц) δ 7,62 (с, 1H), 7,52 (с, 1H), 3,80 (шир.с, 5H), 3,31 (т, 2H), 2,97-3,05 (м, 2H), 2,87-2,96 (м, 1H), 2,38 (с, 3H), 1,52-1,61 (м, 2H), 1,37-1,50 (м, 2H), 0,87 (т, 3H, J=6,8 Гц).
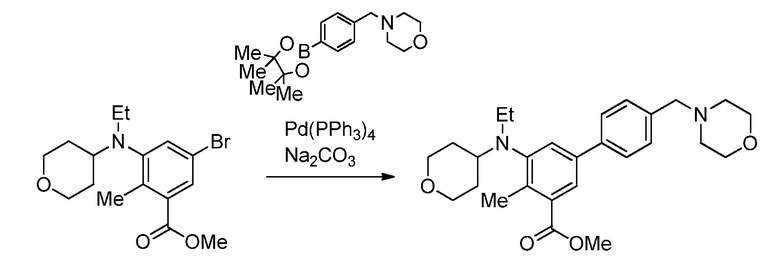
Метил 5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксилат (4)
Смесь метил 5-бром-3-(этил(тетрагидро-2H-пиран-4-ил)амино)-2-метилбензоата (580 г, 1,63 моль), 4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензил)морфолина (592 г, 1,95 моль), 1,4-диоксана (3,86 л), карбоната натрия (618 г, 5,83 моль) и воды (771 мл) дегазировали барботированием азота через смесь при 20°C в течение 20 минут и обрабатывали тетракис(трифенилфосфин)палладием(0) (14,11 г, 12,21 ммоль). Полученную смесь дегазировали в течение дополнительных 20 минут и затем нагревали до 87-89°C в течение 17 ч. После охлаждения до 20°C смесь разбавляли этилацетатом (5,80 л) и раствором (R)-2-амино-3-меркаптопропионовой кислоты (232 г) в воде (2,320 л). После перемешивания в течение 1 ч при 20°C, органический слой отделяли и снова промывали раствором (R)-2-амино-3-меркаптопропионовой кислоты (232 г) в воде (2,320 л). Водные слои объединяли и экстрагировали этилацетатом (5,80 л). Органические слои объединяли, промывали раствором гидроксида натрия (93 г) в воде (2,32 л) и концентрировали в вакууме при 35°C для получения указанного в заголовке соединения в виде оранжевого масла (1,21 кг, выход 164%).

5-(Этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоновая кислота (5)
Метил 5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксилат (69,0 г, 152,5 ммоль) (на основании теоретического выхода с предыдущей стадии) суспендировали в этаноле (380 мл) и обрабатывали раствором гидроксида натрия (24,84 г, 621,0 ммоль) в воде (207 мл). Смесь перемешивали при 40°C в течение 18 ч. После охлаждения до 0-5°C, смесь нейтрализовали до pH 6,5 1н хлористоводородной кислотой (580 мл), поддерживая температуру ниже 25°C. Затем смесь дважды экстрагировали смесью дихлорметана (690 мл) и метанола (69,0 мл). Органически слои объединяли и концентрировали в вакууме для получения неочищенного продукта в виде желтого твердого вещества (127 г).
Неочищенный продукт растворяли в 2-метилтетрагидрофуране (656 мл) при 70°C и затем обрабатывали IPA (изопропиловым спиртом) (828 мл). Смеси давали возможность охладиться до к.т. в течение 3-4 ч и затем перемешивали в течение ночи при к.т. Осадок фильтровали, дважды промывали IPA (207 мл) и сушили в вакууме для получения указанного в заголовке соединения в виде не совсем белого твердого вещества (53,54 г, 80%). Профиль XRPD данного соединения показан на фиг. 9.
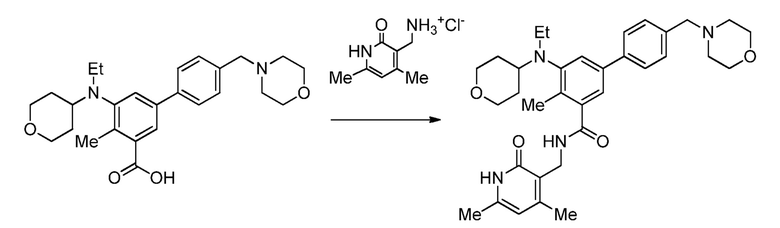
N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамид (соединение I)
Смесь 5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоновой кислоты (540 г, 1,23 моль) и гидрохлорида 3-(аминометил)-4,6-диметил-дигидро-пиридин-2(1H)-она (279 г, 1,48 моль) суспендировали в ДМСО (2,70 л) и обрабатывали триэтиламином (223 мл, 1,60 моль). Смесь перемешивали при 25°C в течение 30 мин и обрабатывали EDC-HCl (1-(3-диметиламинопропил)-3-этилкарбодиимидом гидрохлоридом) (354 г, 1,85 моль) и HOBT (1-гидроксибензотриазолом) гидратом (283 г, 1,85 моль). Реакционную смесь перемешивали при к.т. в течение 16 ч. После добавления триэтиламина (292 мл, 2,09 моль), смесь охлаждали до 15°C, разбавляли водой (10,1 л), поддерживая температуру ниже 30°C, и перемешивали при 19-25°C в течение 4 ч. Полученный осадок фильтровали, дважды промывали водой (2,70 л) и сушили в вакууме для получения неочищенного продукта (695 г, анализ масс.-масс. = 78%).
Для дополнительной очистки продукта проводили перекристаллизацию. Неочищенный продукт (20,00 г, 34,92 ммоль) суспендировали в смеси этанола (190 мл) и воды (10,00 мл) и нагревали до 75°C до тех пор, пока не получали прозрачный раствор. Раствору давали возможность охладиться до к.т. в течение ночи. Осадок фильтровали, дважды промывали смесью этанола (30,0 мл) и воды (30,0 мл) и сушили в вакууме при 35°C для получения указанного в заголовке соединения в виде не совсем белого твердого вещества (14,0 г, извлечение 70% из неочищенного продукта и выход 90% на основании анализа масс.-масс.).
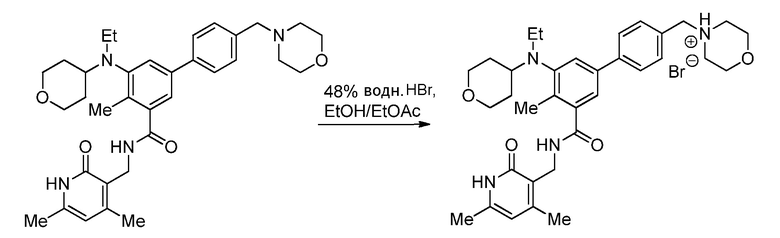
Бромид 4-((3'-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5'-(этил(тетрагидро-2H-пиран-4-ил)амино)-4'-метил-[1,1'-бифенил]-4-ил)метил)морфолин-4-ия (полиморф A)
Неочищенный N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамид (595 г, 464 г на основании анализа масс.-масс., 810,3 ммоль) суспендировали в этаноле (3,33 л). После нагревания до 70°C, смесь обрабатывали 48%-ным водным HBr (97 мл, 850,8 ммоль) и перемешивали при 70°C в течение 30 мин. Полученный раствор оранжево-красного цвета обрабатывали этилацетатом (3,33 л), поддерживая температуру выше 60°C. Смесь медленно охлаждали до к.т. в течение 18 ч. Смесь охлаждали до 0°C в течение 1 ч и перемешивали при этой температуре в течение 5,5 ч. Полученный осадок фильтровали, дважды промывали этилацетатом (1,39 л) и сушили в вакууме для получения указанного в заголовке соединения в виде не совсем белого твердого вещества (515 г, выход 97%).
Перекристаллизация полиморфа A: бромид 4-((3'-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5'-(этил(тетрагидро-2H-пиран-4-ил)амино)-4'-метил-[1,1'-бифенил]-4-ил)метил)морфолин-4-ия (0,50 г, 0,77 ммоль; чистота 95,6% по ВЭЖХ) суспендировали в этаноле (3,0 мл) и нагревали до 80°C до получения прозрачного раствора. К раствору медленно добавляли MTBE (5,0 мл). Полученному раствору давали возможность охладиться до 18-22°C в течение 3 ч и перемешивали при 18-22°C в течение 15 ч. Осадок фильтровали, дважды промывали MTBE (2 мл) и сушили в вакууме для получения 0,45 г указанного в заголовке соединения (извлечение 89%, чистота 96,6% по ВЭЖХ). Профиль порошковой рентгеновской дифракции полиморфа A (моногидробромида) показан на фиг. 1. Ниже в таблице 1 перечислены наиболее значимые пики.
Оценка гидробромида соединения I и полиморфа A
Получили и проводили скрининг ряда различных солевых форм соединения I, включая гидрохлорид, гидробромид, гемисульфат, соль натрия, фосфат, нитрат, малеат, малонат и L-тартрат. Среди них гидробромид (HBr) имел самые предпочтительные физико-химические свойства с точки зрения легкости получения и гигроскопичности.
Провели детальные исследования свободного основания соединения I, а также гидрохлорид этого соединения. По меньшей мере пять различных кристаллических форм были выявлены из свободной формы соединения I во время предварительного скрининга полиморфов с использованием XRD и DSC. Вследствие высокой степени вариабельности, наблюдавшейся во время кристаллизации свободной формы, осуществляли поиск кристаллических форм других солей. Из подвергнутых скринингу солей, моногидрохлорид, моногидробромид, гемисульфат, фосфат, малеат, L-тартрат и соль натрия были кристаллическими. Фосфат и малеат были гигроскопичными, и L-тартрат имел слабую кристалличность.
Было трудно получить высокую степень кристалличности из гидрохлорида соединения I. Смесь кристаллического и аморфного материала получали независимо от условий кристаллизации. Как показано на фиг. 8, данные DSC моногидрохлорида соединения I указывают на некоторую степень некристалличности с эндотермой при 190,5°C. Также были получены данные динамической сорбции паров (DVS) для моногидрохлорида соединения I, и было обнаружено, что он демонстрирует некоторую гигроскопичность: наблюдали прибавку массы от 4 до 6% при относительной влажности (RH) 75% при 25°C (фиг. 18B). Это можно отнести на счет определенного количества некристаллической природы моногидрохлорида. См., например, фиг. 18A, которая демонстрирует аморфный тригидрохлорид соединения I. Ввиду того, что уровень кристалличности не был регулируемым, то гидрохлорид не рассматривали для дальнейшей разработки.
Как показано на фиг. 6, анализ DVS натриевой соли соединения I продемонстрировал значительную гигроскопичность: прибавку массы приблизительно 15% наблюдали при относительной влажности (RH) 75% при 25°C. Как показано на фиг. 7, гемисульфат соединения I продемонстрировал умеренно высокую гигроскопичность: наблюдали прибавку массы от 9 до 11% при относительной влажности (RH) 75% при 25°C. Это можно отнести на счет высоконекристаллической природы соединения, поскольку данные DSC гемисульфата указывают на очень высокую степень некристалличности без четкой эндотермы.
Из этих кристаллических соединений, моногидробромид был наиболее кристаллическим и наименее гигроскопичным (см. фиг. 1, 3 и 4). Кроме того, моногидробромид является высокоустойчивым и противодействует генерированию примесей (на фиг. 5 изображен анализ ВЭЖХ полиморфа A в течение трех дней при повышенной температуре. Полиморф A продуцировал минимальное количество примесей в течение трех дней при 100°C). Интересно, что, как было обнаружено, дигидробромид соединения I является первично аморфным (фиг. 2).
Две различные кристаллические формы моногидробромида соединения I (полиморфы A и B) получали из различных систем растворителей и характеризовали, используя анализы XRD, DSC и TGA-DSC (термогравиметрический анализ-ДСК). Данные XRD и DSC по этим двум кристаллическим формам из репрезентативных партий соединения I показаны на фиг. 1, 3 и 10. Полиморф B характеризуется профилем порошковой XRD с пиками при 8,5, 10,9, 16,7, 17,4, 20,9, 22,1 и 25,7 ±0,2 градуса 2 тета (см. фиг. 10). Было обнаружено, что из этих двух полиморфов, полиморф A является более кристаллическим по природе. Исследования динамической адсорбции паров (DVS) показали, что полиморф A является негигроскопичным (фиг. 4). При термических анализах наблюдали один эндотермический пик с температурой начала приблизительно при 251°C. Кроме того, по анализу DSC было очевидно, что перекристаллизация полиморфа A значительно увеличивает кристалличность материала (см. фиг. 3).
При множественных прогонах в лабораторных масштабах, воспроизводимо получали полиморф A, и небольшие изменения условий кристаллизации не привели к получению различных кристаллических форм.
Анализы фермента PRC2 дикого типа и его мутанта
Общие материалы. S-аденозилметионин (SAM), S-аденозилгомоцистеин (SAH), бицин, KC1, Tween20, диметилсульфоксид (ДМСО) и желатин бычьей кожи (BSG) закупали у компании Sigma-Aldrich на самом высоком возможном уровне чистоты. Дитиотреитол (DTT) закупали у компании EMD. 3H-SAM закупали у компании American Radiolabeled Chemicals с удельной активностью 80 Ки/ммоль. 384-луночные стрептавидиновые флэш-планшеты Flashplates закупали у компании PerkinElmer.
Субстраты. Пептиды, репрезентативные для остатков 21-44 гистона H3 человека, содержащие или немодифицированный лизин 27 (H3K27me0), или диметилированный лизин 27 (H3K27me2) с C-концевым G(K-биотин) линкером - мотивом метки аффинитета и C-концевым амидным кэпом, были синтезированы в компании 21st Century Biochemicals. Пептиды очищали высокоэффективной жидкостной хроматографией (ВЭЖХ) до чистоты более чем 95%, что подтверждали жидкостной хроматографией - масс спектрометрией (LC-MS). Список последовательностей приведен ниже.
H3K27me0: ATKAARKSAPATGGVKKPHRYRPGGK(биотин)-амид (SEQ ID NO: 1)
H3K27me2: ATKAARK(me2)SAPATGGVKKPHRYRPGGK(биотин)-амид (SEQ ID NO: 2)
Олигонуклеосомы куриных эритроцитов очищали из куриной крови в соответствии с принятыми процедурами.
Комплексы рекомбинантного PRC2. Комплексы PRC2 человека очищали в виде 4-компонентных ферментных комплексов, коэкспрессируемых в клетках Spodoptera frugiperda (sf9), с использованием экспрессионной системы бакуловируса. Экспрессируемые субъединицы представляли собой EZH2 дикого типа (NM_004456) или мутанты EZH2 Y641F, N, H, S или C, генерированные из конструкта EZH2 дикого типа, EED (NM_003797), Suz12 (NM_015355) и RbAp48 (NM_005610). Субъединица EED содержала N-концевую метку FLAG, которую использовали для очистки всего 4-компонентного комплекса из лизатов клеток sf9. Чистота комплексов соответствовала или превышала 95%, по данным определения SDS-PAGE (электрофорезом в полиакриламидном геле с додецилсульфатом натрия) и анализом с использованием биоанализатора Agilent Bioanalyzer. Исходные концентрации фермента (в целом, 0,3-1,0 мг/мл) определяли, используя анализ Брэдфорда, относительно стандарта бычьего сывороточного альбумина (BSA).
Общая процедура для анализов фермента PRC2 на пептидных субстратах. Все анализы выполняли в буфере, состоящем из 20 мМ бицина (pH=7,6), 0,5 мМ DTT, 0,005% BSG и 0,002% Tween20, приготовленном в день использования. Соединения в 100% ДМСО (1 мкл) вносили в полипропиленовые 384-луночные планшеты с V-образным дном (Greiner), используя приспособление для пипетирования Platemate 2 Х 3, оснащенное 384-канальной пипеточной головкой (Thermo). ДМСО (1 мкл) добавляли в колонки 11, 12, 23, 24, ряды A-H для контроля максимального сигнала, и SAH, известный продукт и ингибитор PRC2 (1 мкл), добавляли в колонки 11, 12, 23, 24, ряды I-P для контроля минимального сигнала. Смесь (40 мкл), содержащую фермент PRC2 дикого типа и пептид H3K27me0, или любой из ферментов, мутантных по Y641, и пептид H3K27me2, добавляли капельницей Multidrop Combi (Thermo). Соединениям давали возможность инкубироваться с PRC2 в течение 30 мин при 25°C, затем добавляли состав (10 мкл), содержащий смесь нерадиоактивного и 3H-SAM для инициации реакции (конечный объем = 51 мкл). Во всех случаях конечные концентрации были следующими: концентрация фермента PRC2 дикого типа или мутанта составляла 4 нМ, концентрация SAH в лунках контроля минимального сигнала составляла 1 мМ и концентрация ДМСО составляла 1%. Конечные концентрации остальных компонентов указаны ниже в таблице 2. Анализы останавливали добавлением нерадиоактивного SAM (10 мкл) до конечной концентрации 600 мкМ, которая разбавляет 3H-SAM до уровня, при котором его включение в пептидный субстрат больше не выявляется. 50 мкл реакционной смеси в 384-луночном планшете затем переносили в 384-луночный флэш-планшет, и биотинилированным пептидам давали возможность связаться со стрептавидиновой поверхностью в течение по меньшей мере 1 ч перед трехразовым промыванием 0,1% Tween20 в мойке для планшетов Biotek ELx405. Затем планшеты считывали в устройстве для считывания планшетов PerkinElmer TopCount для измерения количества меченого 3H пептида, связанного с поверхностью планшета Flashplate, измеряемого в виде распадов в минуту, (dpm), или, альтернативно, именуемого импульсами в минуту (cpm).
Общая процедура для анализов фермента PRC2 дикого типа на олигонуклеосомальном субстрате. Анализы выполняли в буфере, состоящем из 20 мМ бицина (pH=7,6), 0,5 мМ DTT, 0,005% BSG, 100 мМ KCl и 0,002% Tween20, приготовленном в день использования. Соединения в 100% ДМСО (1 мкл) вносили в полипропиленовые 384-луночные планшеты с V-образным дном (Greiner), используя приспособление для пипетирования Platemate 2 X 3, оснащенное 384-канальной пипеточной головкой (Thermo). ДМСО (1 мкл) добавляли в колонки 11, 12, 23, 24, ряды A-H для контроля максимального сигнала, и SAH, известный продукт и ингибитор PRC2 (1 мкл), добавляли в колонки 11, 12, 23, 24, ряды I-P для контроля минимального сигнала. Смесь (40 мкл), содержащую фермент PRC2 дикого типа и олигонуклеосому куриных эритроцитов, добавляли капельницей Multidrop Combi (Thermo). Соединениям давали возможность инкубироваться с PRC2 в течение 30 мин при 25°C, затем добавляли состав (10 мкл), содержащий смесь нерадиоактивного и 3H-SAM для инициации реакции (конечный объем = 51 мкл). Конечные концентрации были следующими: концентрация фермента PRC2 дикого типа составляла 4 нМ, нерадиоактивного SAM составляла 430 нМ, 3H-SAM составляла 120 нМ, олигонуклеосомы куриных эритроцитов составляла 120 нМ, SAH в лунках контроля минимального сигнала составляла 1 мМ и концентрация ДМСО составляла 1%. Анализ останавливали добавлением нерадиоактивного SAM (10 мкл) до конечной концентрации 600 мкМ, которая разбавляет 3H-SAM до уровня, при котором его включение в олигонуклеосому куриных эритроцитов больше не выявляется. 50 мкл реакционной смеси в 384-луночном планшете затем переносили в 384-луночный флэш-планшет, и олигонуклеосомы куриных эритроцитов иммобилизировали к поверхности планшета, который затем промывали три раза 0,1% Tween20 в мойке для планшетов Biotek ELx405. Затем планшеты считывали в устройстве для считывания планшетов PerkinElmer TopCount для измерения количества меченой 3H олигонуклеосомы куриных эритроцитов, связанной с поверхностью планшета Flashplate, измеряемого в виде распадов в минуту, (dpm), или, альтернативно, именуемого импульсами в минуту (cpm).
Расчет % ингибирования
где dpm = распады в минуту, cmpd = сигнал в аналитической лунке, и min и max представляют собой соответственно контроли минимальных и максимальных сигналов.
Четырехпараметрическое соответствие IC50
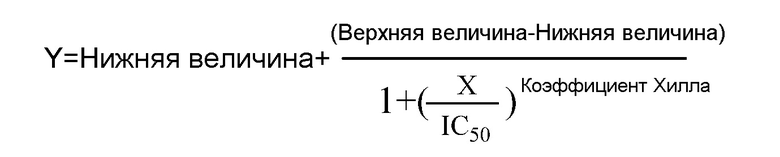
где в величинах top и bottom обычно допускается плавающая запятая, но они могут быть фиксированы соответственно на уровне 100 или 0 при 3-параметрическом соответствии. В величине коэффициента Хилла обычно допускается плавающая запятая, но она также может быть фиксирована на уровне 1 при 3-параметрическом соответствии. Y представляет собой % ингибирования, и X представляет собой концентрацию соединения.
Величины IC50 для анализов фермента PRC2 на пептидных субстратах (например, EZH2 дикого типа и мутанта по Y641F) представлены ниже в таблице 3.
Анализ метилирования WSU-DLCL2
Суспензию клеток WSU-DLCL2 закупали у компании DSMZ (Германской Коллекции Микроорганизмов и Клеточных Культур, Брауншвейг, Германия). Среду RPMI/Glutamax, пенициллин-стрептомицин, инактивированную нагреванием фетальную телячью сыворотку и D-PBS (фосфатно-солевой буферный раствор Дульбекко) закупали у компании Life Technologies, Grand Island, NY, USA. Экстракционный буфер и нейтрализационный буфер (5X) закупали у компании Active Motif, Carlsbad, CA, USA. Кроличье антитело к гистону H3 закупали у компании Abcam, Cambridge, MA, USA. Кроличье антитело к H3K27me3 и конъюгированный с HRP (пероксидазой хрена) анти-кроличий IgG закупали у компании Cell Signaling Technology, Danvers, MA, USA. Субстрат TMB «Super Sensitive» закупали у компании BioFX Laboratories, Owings Mills, MD, USA. Не содержащий IgG бычий сывороточный альбумин закупали у компании Jackson ImmunoResearch, West Grove, PA, USA. PBS с Tween (10X PBST) закупали у компании KPL, Gaithersburg, MD, USA. Серную кислоту закупали у компании Ricca Chemical, Arlington, TX, USA. Планшеты Immulon ELISA (для иммуноферментого анализа) закупали у компании Thermo, Rochester, NY, USA. Планшеты для клеточной культуры с V-образным дном закупали у компании Corning Inc., Corning, NY, USA. Полипропиленовые планшеты с V-образным дном закупали у компании Greiner Bio-One, Monroe, NC, USA.
Суспензию клеток WSU-DLCL2 поддерживали в ростовой среде (RPMI 1640 с добавлением 10% об./об. инактивированной нагреванием фетальной телячьей сыворотки и 100 Ед/мл пенициллина-стрептомицина) и культивировали при 37°C в атмосфере 5% CO2. В условиях анализа клетки инкубировали в аналитической среде (RPMI 1640 с добавлением 10% об./об. инактивированной нагреванием фетальной телячьей сыворотки и 100 Ед/мл пенициллина-стрептомицина) при 37°C в атмосфере 5% CO2 на планшетном шейкере.
Клетки WSU-DLCL2 высевали в аналитической среде в концентрации 50000 клеток на мл в 96-луночный планшет с V-образным дном с 200 мкл на лунку. Соединение (1 мкл) из 96-луночных исходных планшетов добавляли непосредственно в клеточный планшет с V-образным дном. Планшеты инкубировали на шейкере титровальных планшетов при 37°C в атмосфере 5% CO2 в течение 96 часов. После четырех дней инкубации планшеты центрифугировали при 241×g в течение пяти минут, и среду осторожно аспирировали из каждой лунки клеточного планшета, не повреждая клеточный осадок. Клеточный осадок ресуспендировали в 200 мкл DPBS, и планшеты снова центрифугировали при 241×g в течение пяти минут. Супернатант аспирировали и в каждую лунку добавляли холодный (4°C) экстракционный буфер (100 мкл). Планшеты инкубировали при 4°C на орбитальном шейкере в течение двух часов. Планшеты центрифугировали при 3427×g × 10 минут. Супернатант (80 мкл на лунку) переносили в его соответствующую лунку в 96-луночном полипропиленовом планшете с V-образным дном. Нейтрализационный буфер 5X (20 мкл на лунку) добавляли в полипропиленовый планшет с V-образным дном, содержащим супернатант. Полипропиленовые планшеты с V-образным дном, содержащие неочищенный препарат гистона (CHP), инкубировали на орбитальном шейкере в течение пяти минут. Неочищенные препараты гистона добавляли (2 мкл на лунку) в каждую соответствующую лунку из двух 96-луночных планшетов ELISA, содержащих 100 мкл покрывающего буфера (1X PBS + BSA 0,05% мас./об.). Планшеты герметично укупоривали и инкубировали в течение ночи при 4°C. На следующий день планшеты промывали три раза 300 мкл 1X PBST на лунку. Лунки блокировали в течение двух часов с 300 мкл разбавителя ELISA на лунку ((PBS (1X) BSA (2% мас./об.) и Tween20 (0,05% об./об.)). Планшеты промывали три раза 1X PBST. Для планшета выявления гистона H3 добавляли 100 мкл на лунку антитела к гистону H3 (Abcam, ab1791), разведенного 1:10000 в разбавителе ELISA. Для планшета выявления триметилирования H3K27, добавляли 100 мкл на лунку анти-H3K27me3, разбавленного 1:2000 в разбавителе ELISA. Планшеты инкубировали в течение 90 минут при комнатной температуре. Планшеты промывали три раза 300 мкл 1X PBST на лунку. Для выявления гистона H3, 100 мкл конъюгированного с HRP анти-кроличьего IgG антитела, разбавленного до 1:6000 в разбавителе ELISA, добавляли на лунку. Для выявления H3K27me3, 100 мкл конъюгированного с HRP анти-кроличьего IgG антитела, разбавленного до 1:4000 в разбавителе ELISA, добавляли на лунку. Планшеты инкубировали при комнатной температуре в течение 90 минут. Планшеты промывали четыре раза 300 мкл 1X PBST на лунку. Добавляли 100 мкл субстрата TMB на лунку. Планшеты гистона H3 инкубировали в течение пяти минут при комнатной температуре. Планшеты H3K27me3 инкубировали в течение 10 минут при комнатной температуре. Реакцию останавливали 1н серной кислотой (100 мкл на лунку). Спектральную поглощательную способность для каждого планшета считывали при 450 нм.
Сначала для каждой лунки определяли следующее отношение:

Каждый планшет включал восемь контрольных лунок с обработкой только ДМСО (минимальное ингибирование), а также восемь контрольных лунок для максимального ингибирования (фоновые лунки).
Рассчитывали среднюю величину отношения для каждого типа контроля и использовали для определения процента ингибирования для каждой тестовой лунки в планшете. Тестируемое соединение серийно разбавляли в три раза в ДМСО на общее число из десяти тестируемых концентраций, начиная на уровне 25 мкМ. Определяли процент ингибирования и строили кривые IC50, используя по две лунки на одну концентрацию соединения. Величины IC50 для этого анализа представлены ниже в таблице 3.

Анализ клеточной пролиферации
Суспензию клеток WSU-DLCL2 закупали в DSMZ (German Collection of Microorganisms and Cell Cultures, Braunschweig, Germany). Среду RPMI/Glutamax, пенициллин-стрептомицин, инактивированную нагреванием фетальную телячью сыворотку закупали у компании Life Technologies, Grand Island, NY, USA. Полипропиленовые 384-луночные планшеты с V-образным дном закупали у компании Greiner Bio-One, Monroe, NC, USA. 384-луночные белые матовые планшеты для клеточной культуры закупали у компании Perkin Elmer, Waltham, MA, USA. Прибор Cell-Titer Glo® закупали у компании Promega Corporation, Madison, WI, USA. Планшетный ридер SpectraMax M5 закупали у компании Molecular Devices LLC, Sunnyvale, CA, USA.
Суспензию клеток WSU-DLCL2 поддерживали в ростовой среде (RPMI 1640 с добавлением 10% об./об. инактивированной нагреванием фетальной телячьей сыворотки) и культивировали при 37°C в атмосфере 5% CO2. В условиях анализа клетки инкубировали в аналитической среде (RPMI 1640 с добавлением 10% об./об. инактивированной нагреванием фетальной телячьей сыворотки и 100 Ед/мл пенициллина-стрептомицина) при 37°C в атмосфере 5% CO2.
Для оценки воздействия соединения на пролиферацию линии клеток WSU-DLCL2, экспоненциально растущие клетки высевали в 384-луночные белые матовые планшеты при плотности 1250 клеток/мл в конечном объеме 50 мкл аналитической среды. Исходный планшет с соединением получали выполнением девятиточечных трехкратных серийных разведений в ДМСО в трех повторениях, начиная при 10 мМ (конечный верхний уровень концентрации соединения при анализе составил 20 мкМ и ДМСО составил 0,2%). Аликвоту 100 нл из планшета с соединением добавляли в его соответствующую лунку в клеточном планшете. Контроль ингибирования на 100% состоял из клеток, обработанных стауроспорином в конечной концентрации 200 нМ, и контроль ингибирования 0% состоял из клеток, обработанных ДМСО. После добавления соединения, аналитические планшеты инкубировали в течение 6 дней при 37°C, 5% CO2, относительной влажности >90% в течение 6 дней. Жизнеспособность клеток измеряли количественным определением АТФ, присутствующей в клеточных культурах, добавляя 35 мкл реагента Cell Titer Glo® в клеточные планшеты. Люминесценцию считывали на приборе SpectraMax M5. Концентрацию, ингибирующую жизнеспособность клеток на 50%, определяли, используя 4-параметрическую подгонку нормализованных кривых доза-ответ. Величины IC50 для данного анализа представлены ниже в таблице 3.
Исследование In Vivo - Линия клеток лимфомы человека SUDHL10
Мыши
Возраст самок мышей Fox Chase SCID® Mice (CB17/Icr-Prkdcsrid/IcrIcoCrl, Beijing Vitalriver Laboratory Animal Co., LTD) составлял 6-8 недель и масса тела (BW) находилась в диапазоне 16,0-21,1 г в 1-й день (Dl) исследования. Животные без ограничений получали воду (стерильную) и стерилизованный облучением гранулированный корм. Мышей содержали на подложке из кукурузных початков в статических микроизоляторах с 12-часовым световым циклом при 20-22°C (68-72°F) и влажности 40-60%. Все процедуры соответствуют рекомендациям Руководства по уходу и использованию лабораторных животных в отношении ограничения подвижности, рационального использования, хирургических процедур, регуляции потребления корма и жидкости и ветеринарного ухода.
Культура опухолевых клеток
Линию клеток лимфомы человека SUDHL10 получали из коллекции DSMZ и поддерживали в соответствии с требованиями CRO (Организации клинических исследований) в виде суспензионных культур в среде RPMI-1640, содержащей 100 Ед/мл натриевой соли пенициллина G, 100 г/мл стрептомицина и 10% фетальную телячью сыворотку. Клетки культивировали в колбах для культуры ткани в увлажненном инкубаторе при 37°C, в атмосфере 5% CO2 и 95% воздуха. Для имплантации использовали только культуры ниже пассажа 12.
Имплантация опухоли In Vivo
Линию клеток лимфомы человека SUDHL10 собирали во время среднелогарифмической фазы роста и ресуспендировали в PBS с 50% Matrigel™ (BD Biosciences). Каждая мышь получала 1×107 клеток (0,2 мл клеточной суспензии) подкожно в правый бок. Опухоли измеряли штангенциркулем в двух измерениях для мониторинга роста по мере того как средний объем приближался к желаемому диапазону 80-120 мм. Размер опухоли в мм3 рассчитывали по формуле
Объем опухоли = w2 × l/2,
где w = ширина и l = длина опухоли в мм. Массу опухоли можно оценить при допущении, что 1 мг эквивалентен 1 мм3 объема опухоли. Через 10 дней мышей с опухолями размером 72-256 мм3 распределяли на четыре группы (n=16 на группу) при средних объемах опухоли 173-179 мм3.
Тестируемые объекты
Гидробромид соединения I хранили при комнатной температуре и защищенным от света. В каждый день лечения готовили свежие составы соединения суспендированием порошка в 0,5% карбоксиметилцеллюлозе натрия (NaCMC) и 0,1% Tween® 80 в деионизированной воде. Носитель, 0,5% NaCMC и 0,1% Tween® 80 в деионизированной воде, использовали для лечения контрольной группы по такой же схеме. Перед введением препаративные формы хранили в защищенном от света месте при 4°C.
План лечения
Мышей лечили дозами гидробромида соединения I в диапазоне от 125 до 500 мг/кг и по схемам BID (два раза в день через каждые 12 ч) в течение 28 дней путем перорального принудительного введения. Каждую дозу доставляли в объеме 0,2 мл/мышь массой 20 г (10 мл/кг), и проводили коррекцию на последнюю зарегистрированную массу отдельных животных. На 25-й день 8 мышей с самыми маленькими опухолями на группу были выбраны для конечной точки задержки роста опухоли (наблюдение до 60 дней). Остающихся животных подвергали эвтаназии на 28-й день через 3 ч после введения последней дозы для забора опухоли.
Медиана объема опухоли (MTV) и анализ ингибирования роста опухоли (TGI)
Эффективность лечения определяли в последний день лечения. MTV(n), медиану объема опухоли для числа животных, n, оцениваемую в последний день, определяли для каждой группы. Процент ингибирования роста опухоли (%TGI) можно определить несколькими путями. Сначала разность между MTV(n) предназначенной контрольной группы и MTV(n) группы, получавшей лечение лекарственным средством, выражают в виде процентной доли MTV(n) контрольной группы
Другим путем расчета %TGI является учет изменения размера опухоли со дня 1 до дня n, причем n представляет собой последний день лечения.
Анализ задержки роста опухоли
Восемь мышей на группу держали живыми после последнего дня лечения для анализа задержки роста опухоли. Опухоли измеряли штангенциркулем два раза в неделю, и каждое тестируемое животное подвергали эвтаназии, когда его новообразование достигало конечного объема 2000 мм3, или в предварительно определенный последний день исследования, в зависимости от того, что из них происходило первым. Выполняли анализ выживания по методу Каплана-Мейера.
Токсичность
Животных ежедневно взвешивали в дни 1-5 и затем дважды в неделю до завершения исследования. Мышей часто обследовали для выявления скрытых признаков любых побочных связанных с лечением эффектов, которые документировали. Приемлемую токсичность для максимальной переносимой дозы (MTD) определяли как потерю групповой средней BW менее чем 20% во время испытания, и смертность не более чем 10% вследствие TR (связанных с лечением) случаев смерти. Случай смерти подлежал классификации как TR, если его можно было отнести на счет побочных эффектов лечения, по данным клинических признаков и/или вскрытия, или вследствие неизвестных причин в течение периода введения тестируемого средства. Случай смерти надлежало классифицировать как NTR (не связанный с лечением), если были доказательства того, что смерть не была связана с побочными эффектами лечения. Случаи смерти NTR в течение интервала между введением тестируемого средства обычно относят к категории NTRa (вследствие несчастного случая или ошибки человека) или NTRm (вследствие подтвержденной вскрытием диссеминации опухоли путем инвазии и/или метастазирования). Получавших пероральное лечение животных, которые умерли от неизвестных причин в течение периода введения тестируемого средства, можно классифицировать как NTRu, когда групповое поведение не подтверждает классификацию TR и данные вскрытия, то исключение ошибки введения невозможно.
Взятие образцов
На 28-й день у восьми мышей с самыми большими опухолями брали образцы предварительно определенным образом для оценки ингибирования мишени в опухолях. Забор опухолей у определенных мышей производили в условиях отсутствия РНАзы, и их разрезали пополам. Определяли общую массу опухоли. Замороженную ткань опухоли от каждого животного подвергали мгновенному замораживанию в жидком N2 и истирали в порошок ступкой и пестиком.
Статистические и графические анализы
Все статистические и графические анализы выполняли с использованием программного обеспечения Prism 3.03 (GraphPad) для Windows. Для тестирования статистической значимости различий между контрольной и получавшей лечение группами в течение всего периода лечения использовали повторные показатели ANOVA с последующим применением ретроспективного критерия множественного сравнения Даннета. Программа Prism представляет результаты как не значимые (ns) при P>0,05, значимые (обозначенные символом «*») при 0,01<P<0,05, очень значимые («**») при 0,001<P<0,01 и крайне значимые («***») при P<0,001. Для плеча исследования «задержка роста опухоли» динамику во времени процентной доли животных в каждой группе, остающихся в исследовании, представляли на графике выживания Каплана-Мейера.
Экстракция гистонов
Для выделения гистонов 60-90 мг опухолевой ткани гомогенизировали в 1,5 мл ядерного экстракционного буфера (10 мМ Tris-HCl, 10 мМ MgC12, 25 мМ KC1, 1% Triton X-100, 8,6% сахарозы, плюс таблетка ингибитора протеазы Roche 1836145) и инкубировали на льду в течение 5 минут. Ядра собирали центрифугированием при 600 g в течение 5 минут при 4°C и однократно промывали в PBS. Супернатант удаляли, и гистоны экстрагировали в течение одного часа при перемешивании в вихревой мешалке через каждые 15 минут с 0,4н холодной серной кислотой. Экстракты просветляли центрифугированием при 10000 g в течение 10 минут при 4°C и переносили в свежую центрифужную пробирку, содержащую 10x объем ледяного ацетона. Гистоны осаждали при -20°C в течение от 2 часов до всей ночи, осаждали центрифугированием при 10000 g в течение 10 минут и ресуспендировали в воде.
ELISA
Гистоны получали в эквивалентных концентрациях в покрывающем буфере (PBS+0,05% BSA), обеспечивая выход образца 0,5 нг/мкл, и 100 мкл образца или стандарта добавляли в двух повторениях в 2 96-луночные планшеты ELISA (Thermo Labsystems, Immulon 4HBX #3885). Планшеты герметично укупоривали и инкубировали в течение ночи при 4°C. На следующий день планшеты трижды промывали 300 мкл/лунку PBST (PBS+0,05% Tween 20; 10x PBST, KPL #51-14-02) на планшетной мойке Bio Tek. Планшеты блокировали 300 мкл/лунку разбавителя (PBS+2%BSA+0,05% Tween 20), инкубировали при к.т. в течение 2 часов и трижды промывали PBST. Все антитела разбавляли в разбавителе. В каждую лунку добавляли 100 мкл/лунку антитела к H3K27me3 (CST #9733, 50% маточный раствор глицерина 1:1000) или антитела ко всему H3 (Abcam abl791, 50% глицерин 1:10000). Планшеты инкубировали в течение 90 мин при к.т. и трижды промывали PBST. 100 мкл/лунку анти-Rb-IgG-HRP антитела (Cell Signaling Technology, 7074) добавляли в разведении 1:2000 в планшет H3K27Me3 и 1:6000 в планшет H3 и инкубировали в течение 90 мин при к.т. Планшеты промывали 4 раза PBST. Для выявления, добавляли 100 мкл/лунку субстрата TMB (BioFx Laboratories, #TMBS) и планшеты инкубировали в темноте при к.т. в течение 5 мин. Реакцию останавливали 100 мкл/лунку 1н H2SO4. Спектральную поглощательную способность при 450 нм считывали на ридере микропланшетов SpectaMax M5.
Результаты
Мышей, несущих ксенотранплантаты опухоли SUDHL10, лечили гидробромидом соединения I в максимальной переносимой дозе 500 мг/кг BID и фракциях MTD (½ и ¼ MTD). Все дозы были хорошо переносимы в течение 28 дней без какой-либо значимой потери массы тела. Наблюдали один случай смерти, не связанный с лечением в группе, получавшей дозу 500 мг/кг, на 15-й день вследствие ошибки дозировки. Все дозы приводили к ингибированию росту опухоли в 28-й день по сравнению с носителем (таблица 4), и в группах, получавших дозы 250 мг/кг и 500 мг/кг BID, они вызывали регрессию опухолей (TGI>100%).
Фиг. 12A демонстрирует динамику во времени роста ксенотрансплантатов опухолей SUDHL10 для различных групп лечения. Группа, получавшая 125 мг/кг BID, значимо не отличалась от группы носителя по повторным показателям ANOVA и ретроспективного критерия Даннета, но средний конечный размер опухоли в 28-й день был значительно меньше, чем размер в группе носителя (2-сторонний дисперсионный анализ с ретроспективным критерием Бонферрони, p<0,0001). Введение 250 мг/кг BID и 500 мг/кг BID гидробромида соединения I в течение 28 дней вызывало сравнимые ответы регрессии, поскольку конечные массы опухолей на 28-й день были одинаковыми для этих 2 групп (фиг. 12B).
Гистоны, выделенные из опухолей, забранных на 28-й день (через 3 ч после последней дозы), подвергали анализу ELISA для определения глобальных уровней H3K27me3. На фиг. 13 показана отчетливая дозозависимая понижающая регуляция метильной метки H3K27me3 лечением гидробромида соединения I. На этой фигуре показано глобальное метилирование H3K27me3 в опухолях SUDHL10 от мышей, получавших лечение гидробромидом соединения I в течение 28 дней.
На 25-й день восемь мышей на группу с самыми маленькими опухолями выбирали для исследования задержки роста опухоли для оценки возобновления роста опухолей после прекращения введения на 28-й день. Мышей подвергали эвтаназии, когда их опухоли достигали размера 2000 мм3 или на 60-й день (в зависимости от того, что наступит раньше). Эти данные использовали для выполнения анализа выживания Каплана-Мейера. На фиг. 14A показано, что возобновление роста опухоли было четко зависимым от дозы, и все мыши, получавшие лечение самой высокой дозой 500 мг/кг BID в течение 28 дней, выжили до 60-го дня. Только 2 мышей пришлось подвергнуть эвтаназии до 60-го дня в группе, получавшей дозу 250 мг/кг. У мышей из группы, получавшей дозу 125 мг/кг, имелось отчетливое увеличение выживания относительно мышей, получавших лечение носителем, с увеличением медианы выживания на 15,5 дней (фиг. 14B).
Противораковый эффект гидробромида соединения I на мышиной модели Пфейффера ксенотрансплантата диффузной крупноклеточной B-клеточной лимфомы человека
Моногидробромид соединения I тестировали в отношении его противораковой активности на мышиной модели Пфейффера ксенотрансплантата опухоли человека, которая представляет собой модель ксенотрансплантата диффузной крупноклеточной B-клеточной лимфомы человека. Самкам 5-недельных мышей NSG (Jackson Labs, Bar Harbor, Maine) подкожно имплантировали фрагменты опухолей от 20 до 25 мг. Лечение начинали приблизительно через 31 день после имплантации опухоли, когда средний размер опухолей достигал приблизительно 365 мм3. Схема лечения описана в таблице 5.
Объем опухоли контролировали в течение всего эксперимента. Объем опухоли измеряли два раза в неделю после начала лечения. Опухолевую нагрузку (мг = мм3) рассчитывали по данным измерения штангенциркулем по формуле для объема удлиненного эллипсоида (L×W)/2, где L и W представляют собой соответствующие ортогональные измерения длины и ширины (мм).
1-й день был днем первого лечения и 28-й день был днем последнего лечения. Данное исследование заканчивалось через 36 дней после введения последней дозы, поэтому 64-й день был днем окончания исследования. Первичными конечными точками, используемыми для оценки эффективности в настоящем исследовании, были полные регрессии опухоли (CR), размеры опухолей среди групп и процентная доля ингибирования опухоли в конце исследования. Полный ответ определяли как уменьшение размера опухоли до не выявляемого размера (<20 мм3) в конце исследования. Величины для процентного ингибирования опухоли рассчитывали по формуле
[1-(ΔT/ΔC)]×100,
где ΔT и ΔC представляют собой изменения среднего объема опухоли (Δ роста) для каждой леченой (T) группы и контрольной (C) группы носителя. T0 и C0 (за один день до первой дозы) использовали для исходного объема опухоли. Кроме того, объемы опухолей, которые регистрировали через один день после введения последней дозы (T29 и C29) использовали для расчета ΔT и ΔC. Когда величина составляла больше 100%, то ее в итоге регистрировали как 100%. Формула, использованная для расчета процентного ингибирования опухолей, показана ниже.

В течение периода лечения было обнаружено, что животные не могут переносить ежедневное лечение дозой гидробромида соединения I 1142 мг/кг, и трое животных в этой группе (группе E) потребовали применения эвтаназии после первой недели лечения вследствие потери более чем 20% исходной массы тела. Следовательно, введение препарата для этой группы прекращали после 12 доз. Все животные в других группах вводимых доз, за исключением одного животного в группе D (342 мг/кг гидробромида соединения I), хорошо переносили 28-дневное лечение при минимальной потере массы тела. График относительной массы тела мышей представлен на фиг. 15. Массу тела животных, полученную в 0-й день, использовали в качестве исходной массы тела на графике.
Гидробромид соединения I продемонстрировал высокую и длительную противораковую активность на модели Пфейффера со 100% частоты CR в трех из четырех групп введения (таблица 6). Кроме того, возобновление роста опухоли не наблюдали даже через 36 дней после прекращения лечения. Это свидетельствует о том, что все опухолевые клетки были уничтожены во время лечения. Хотя возобновление роста опухоли наблюдали в группе с самой низкой дозой (группа B, 34,2 мг/кг), отчетливую активность, вызывающую стаз опухоли, наблюдали во время периода лечения (фиг. 16). Опухоль начинала расти только после прекращения лечения (фиг. 16). Этот результат также свидетельствует о том, что активность, вызывающая стаз опухоли, наблюдавшаяся в группе B, действительно представляет собой активность, вызванную тестируемым соединением.
₤ 1 животное подвергли эвтаназии на 36-й день ввиду низкой массы тела.
¥ 3 животных подвергли эвтаназии на 7-й, 9-й и 11-й день, отдельно, ввиду низкой массы тела.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ, КОТОРЫЕ МОЖНО ИСПОЛЬЗОВАТЬ ДЛЯ ЛЕЧЕНИЯ ПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2015 |
|
RU2711500C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2699546C2 |
| ТЕТРАГИДРОПИРАНИЛ АМИНО-ПИРРОЛОПИРИМИДИНОН И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2020 |
|
RU2747991C1 |
| АРИЛ-ИЛИ ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ БЕНЗОЛЬНЫЕ СОЕДИНЕНИЯ | 2012 |
|
RU2632193C2 |
| ТЕТРАГИДРОПИРАНИЛ АМИНО-ПИРРОЛОПИРИМИДИНОН И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2015 |
|
RU2715421C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2827936C2 |
| ОЧИЩЕННЫЕ ПИРРОЛОХИНОЛИНИЛ-ПИРРОЛИДИН-2,5-ДИОНОВЫЕ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2010 |
|
RU2556205C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2677276C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ СОЕДИНЕНИЯ ТРИАЗОЛОПИРИМИДИНА | 2017 |
|
RU2754856C2 |
| СИНЕРГИЧЕСКИЕ КОМПОЗИЦИИ ИНГИБИТОРОВ PI3K И МЕК | 2012 |
|
RU2607944C2 |
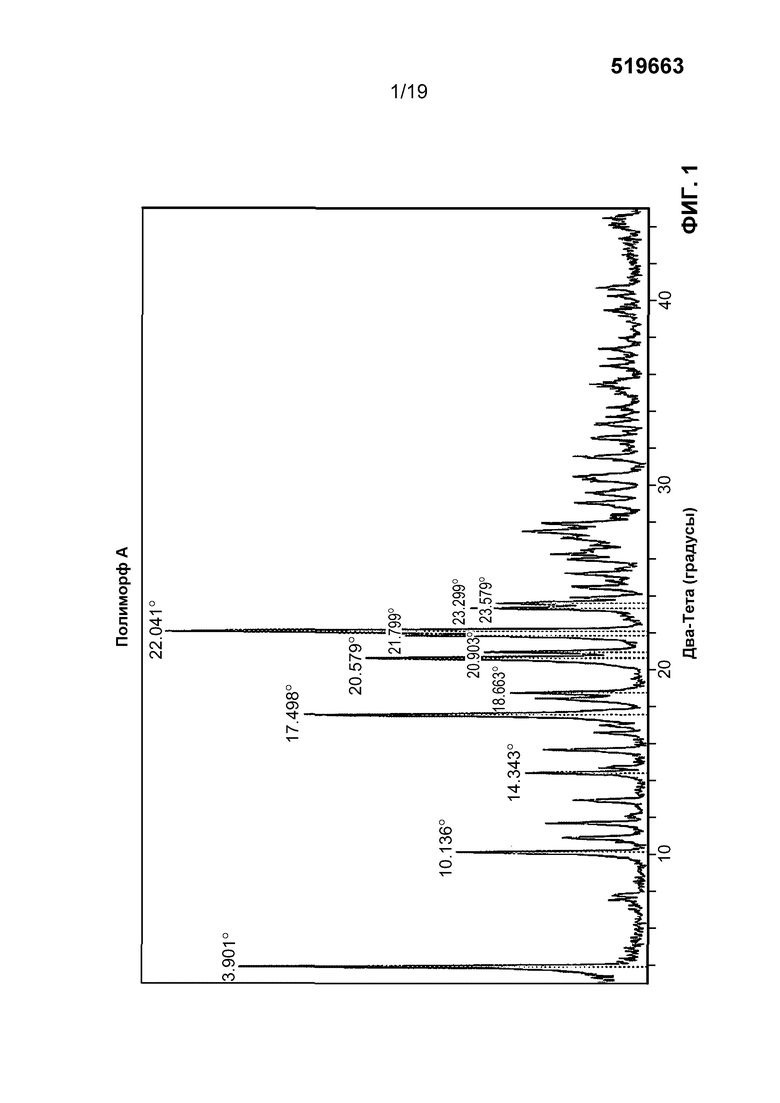

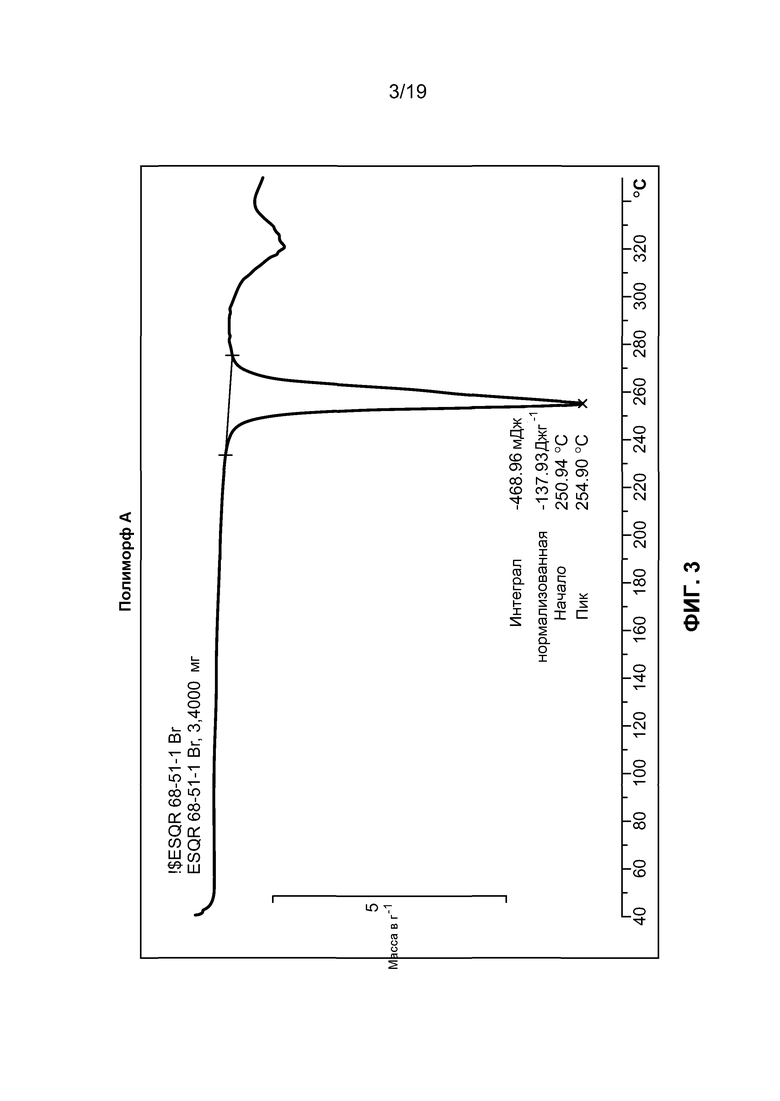


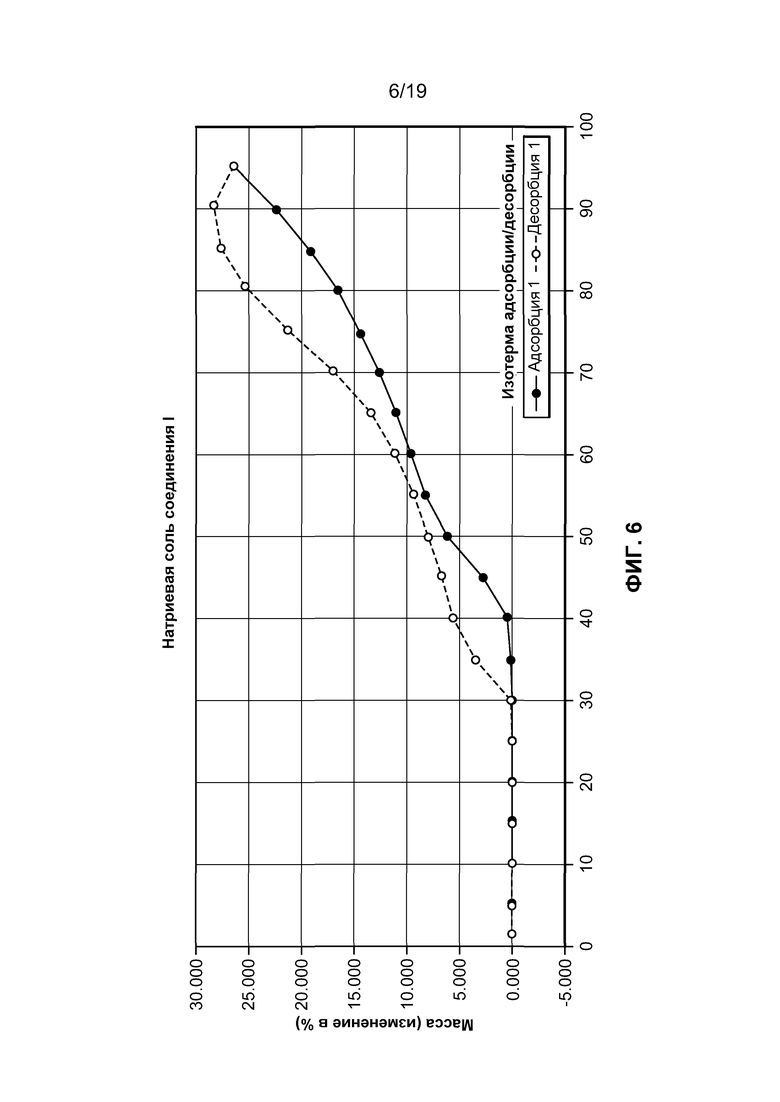
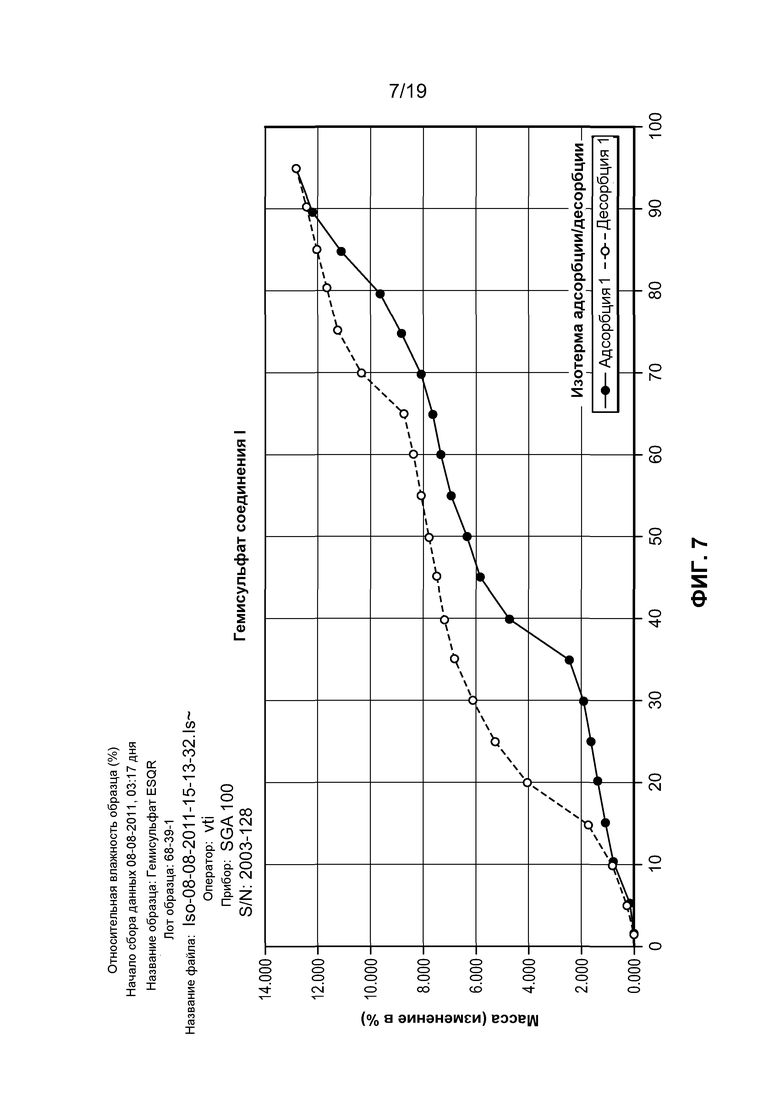

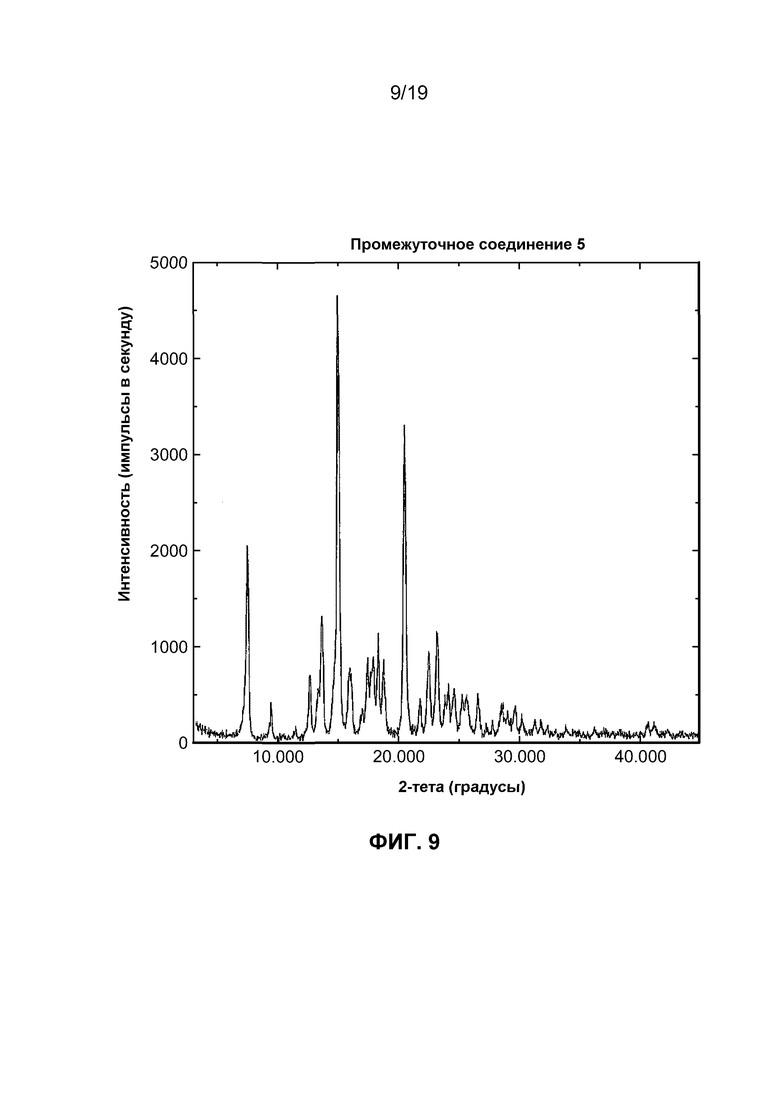
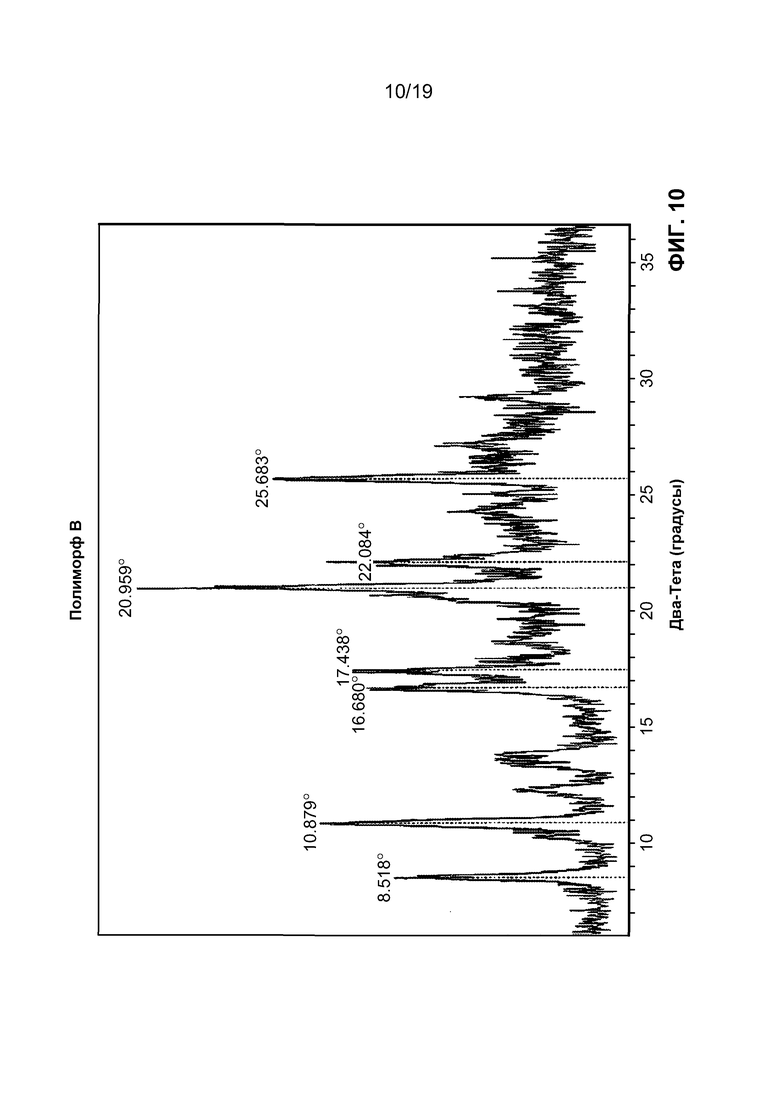

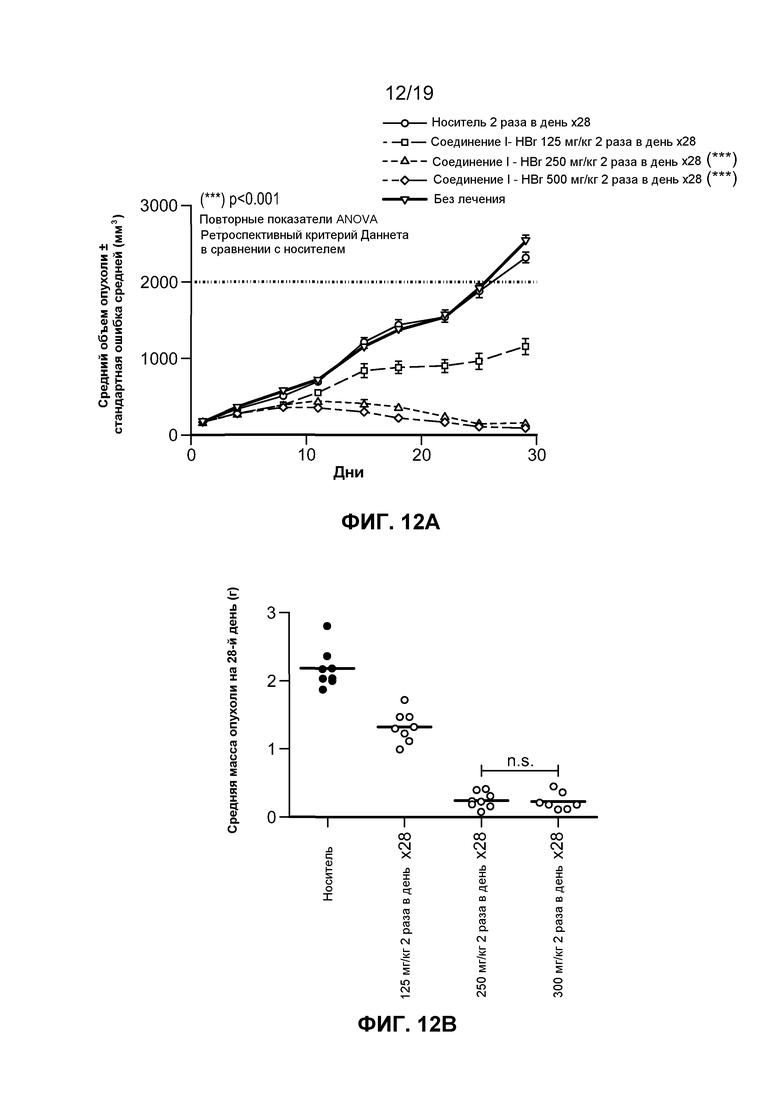
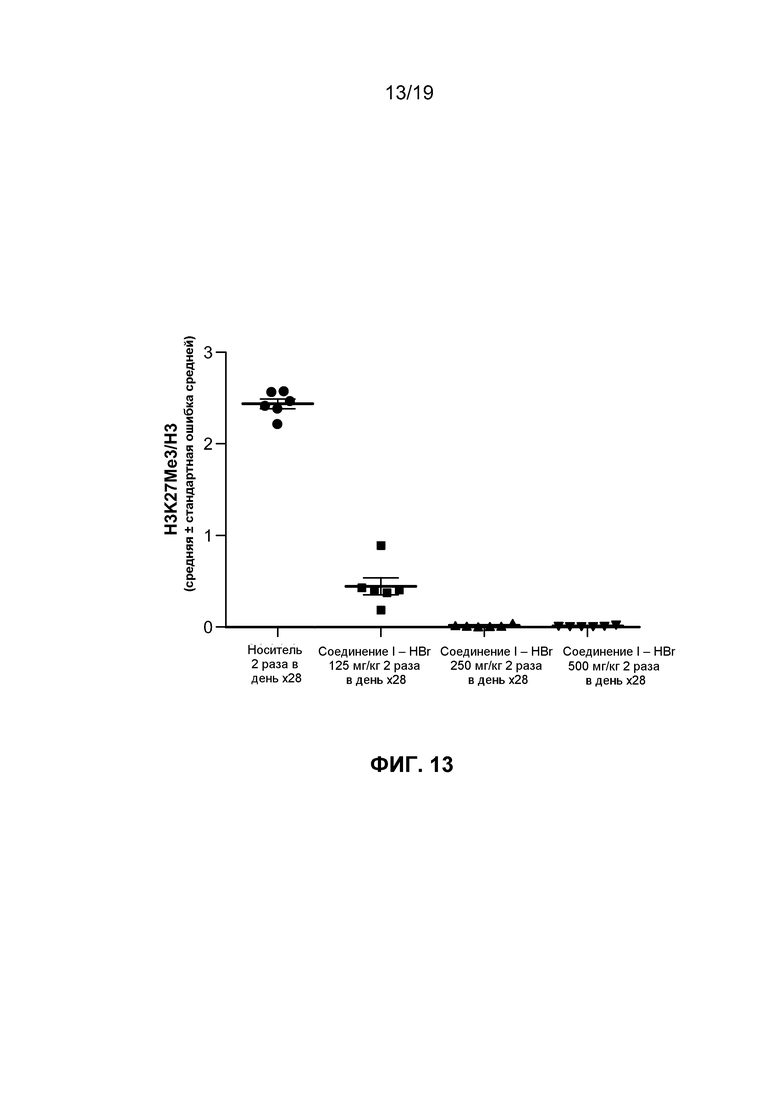
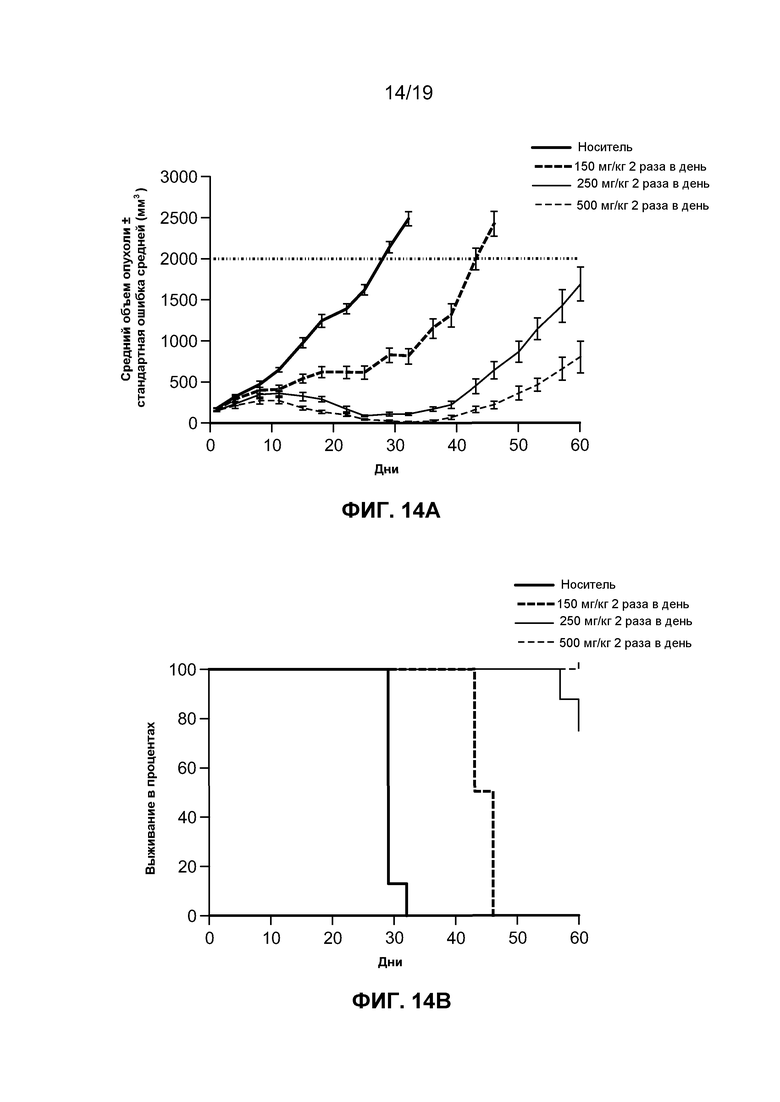



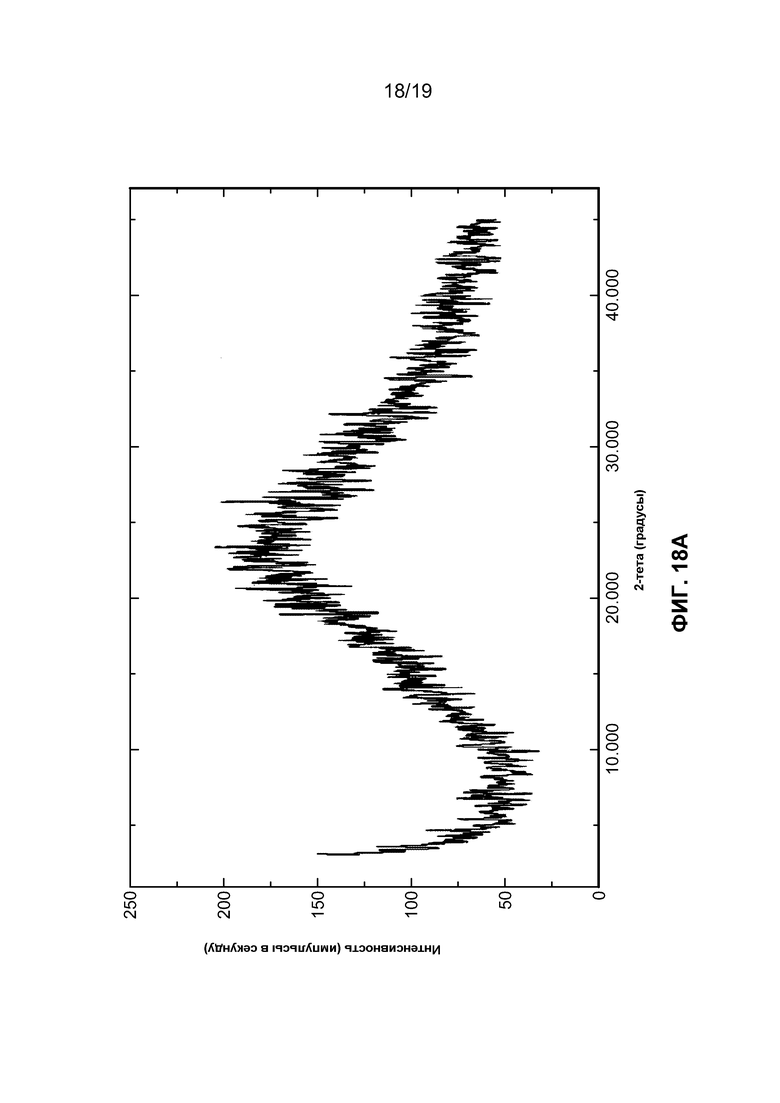
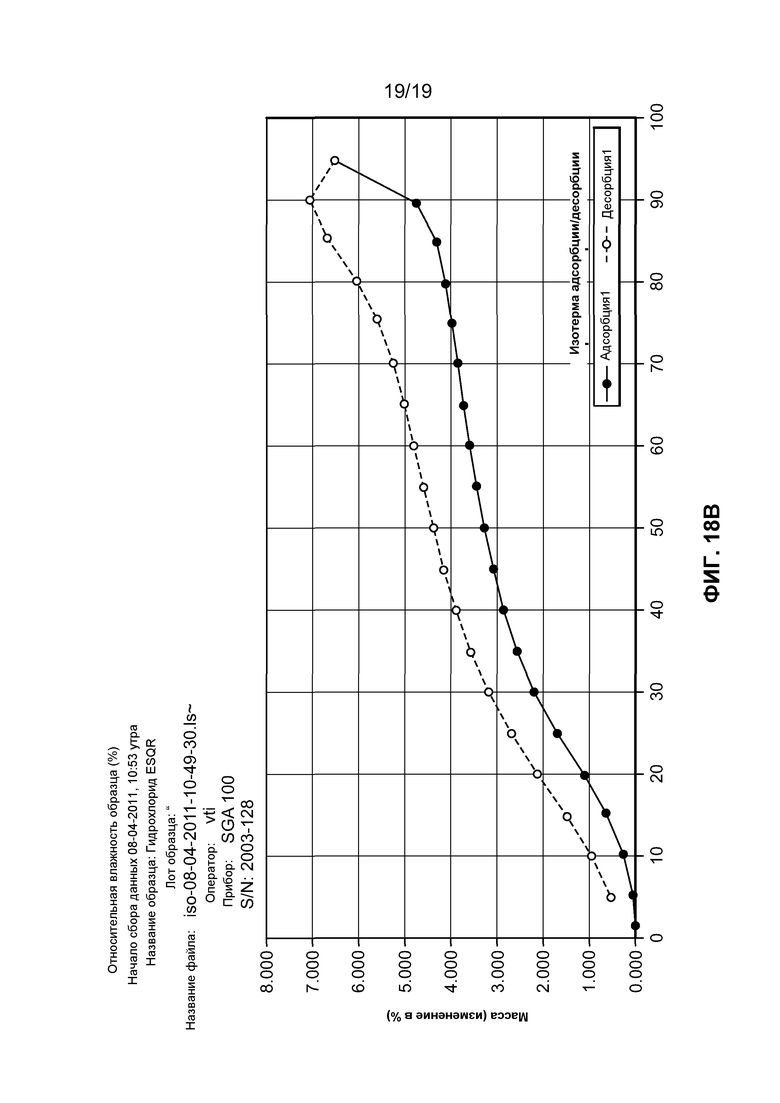
Изобретение относится к гидробромиду N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамида, а также его полиморфной форме. Технический результат: получен гидробромид N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамида, который обладает наибольшей кристалличностью и наименьшей гигроскопичностью, а кроме того, является высокоустойчивым и противодействует генерированию примесей. 13 н. и 20 з.п. ф-лы, 6 табл., 21 ил.
1. Гидробромид N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1’-бифенил]-3-карбоксамида.
2. Соединение по п.1, которое представляет собой моногидробромид.
3. Соединение по п.1 или 2, отличающееся тем, что указанное соединение является кристаллическим.
4. Соединение по п.3, отличающееся тем, что указанное соединение по существу не содержит примеси.
5. Соединение по п.4, отличающееся тем, что указанное соединение представляет собой кристаллическое твердое вещество, по существу, не содержащее аморфный гидробромид N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1’-бифенил]-3-карбоксамида.
6. Фармацевтическая композиция для ингибирования активности гистон-метилтрансферазы EZH2, содержащая терапевтически эффективное количество соединения по п.1, и фармацевтически приемлемый носитель или разбавитель.
7. Способ получения соединения по п.1, включающий объединение N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1’-бифенил]-3-карбоксамида с бромистоводородной кислотой.
8. Полиморф A гидробромида N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1’-бифенил]-3-карбоксамида.
9. Полиморф по п.8, характеризующийся картиной порошковой рентгеновской дифракции, имеющей характерные пики, выраженные в градусах 2-тета, примерно при 3,9±0,3 градуса, примерно 17,5±0,3 градуса и примерно 22,0±0,3 градуса 2-тета.
10. Полиморф по п.8, характеризующийся картиной порошковой рентгеновской дифракции, имеющей один или несколько характерных пиков, выраженных в градусах 2-тета, примерно при 3,9±0,3 градуса, примерно 14,3±0,3 градуса, примерно 18,7±0,3 градуса, примерно 23,3±0,3 градуса и примерно 23,6±0,3 градуса 2-тета.
11. Полиморф по п.8, характеризующийся картиной порошковой рентгеновской дифракции, имеющей по меньшей мере 5 характерных пиков, выраженных в градусах 2-тета, примерно при 3,9±0,3 градуса, 10,1±0,3 градуса, 14,3±0,3 градуса, 17,5±0,3 градуса, 18,7±0,3 градуса, 20,6±0,3 градуса, 20,9±0,3 градуса, 21,8±0,3 градуса, 22,0±0,3 градуса, 23,3±0,3 градуса и 23,6±0,3 градуса 2-тета.
12. Полиморф по п.8, характеризующийся картиной порошковой рентгеновской дифракции, имеющей по меньшей мере 6 характерных пиков, выраженных в градусах 2-тета, примерно при 3,9±0,3 градуса, 10,1±0,3 градуса, 14,3±0,3 градуса, 17,5±0,3 градуса, 18,7±0,3 градуса, 20,6±0,3 градуса, 20,9±0,3 градуса, 21,8±0,3 градуса, 22,0±0,3 градуса, 23,3±0,3 градуса и 23,6±0,3 градуса 2-тета.
13. Полиморф по п.8, характеризующийся картиной порошковой рентгеновской дифракции, имеющей по меньшей мере 7 характерных пиков, выраженных в градусах 2-тета, примерно при 3,9±0,3 градуса, 10,1±0,3 градуса, 14,3±0,3 градуса, 17,5±0,3 градуса, 18,7±0,3 градуса, 20,6±0,3 градуса, 20,9±0,3 градуса, 21,8±0,3 градуса, 22,0±0,3 градуса, 23,3±0,3 градуса и 23,6±0,3 градуса 2-тета.
14. Полиморф по п.8, характеризующийся картиной порошковой рентгеновской дифракции, имеющей по меньшей мере 8 характерных пиков, выраженных в градусах 2-тета, примерно при 3,9±0,3 градуса, 10,1±0,3 градуса, 14,3±0,3 градуса, 17,5±0,3 градуса, 18,7±0,3 градуса, 20,6±0,3 градуса, 20,9±0,3 градуса, 21,8±0,3 градуса, 22,0±0,3 градуса, 23,3±0,3 градуса и 23,6±0,3 градуса 2-тета.
15. Полиморф по п.8, характеризующийся картиной порошковой рентгеновской дифракции, имеющей по меньшей мере 9 характерных пиков, выраженных в градусах 2-тета, примерно при 3,9±0,3 градуса, 10,1±0,3 градуса, 14,3±0,3 градуса, 17,5±0,3 градуса, 18,7±0,3 градуса, 20,6±0,3 градуса, 20,9±0,3 градуса, 21,8±0,3 градуса, 22,0±0,3 градуса, 23,3±0,3 градуса и 23,6±0,3 градуса 2-тета.
16. Полиморф по п.8, характеризующийся картиной порошковой рентгеновской дифракции, имеющей по меньшей мере 10 характерных пиков, выраженных в градусах 2-тета, примерно при 3,9±0,3 градуса, 10,1±0,3 градуса, 14,3±0,3 градуса, 17,5±0,3 градуса, 18,7±0,3 градуса, 20,6±0,3 градуса, 20,9±0,3 градуса, 21,8±0,3 градуса, 22,0±0,3 градуса, 23,3±0,3 градуса и 23,6±0,3 градуса 2-тета.
17. Полиморф по п.8, характеризующийся картиной порошковой рентгеновской дифракции, имеющей характерные пики, выраженные в градусах 2-тета, примерно при 3,9±0,3 градуса, 10,1±0,3 градуса, 14,3±0,3 градуса, 17,5±0,3 градуса, 18,7±0,3 градуса, 20,6±0,3 градуса, 20,9±0,3 градуса, 21,8±0,3 градуса, 22,0±0,3 градуса, 23,3±0,3 градуса и 23,6±0,3 градуса 2-тета.
18. Полиморф по п.8, характеризующийся картиной порошковой рентгеновской дифракции, по существу, в соответствии с фиг.1.
19. Полиморф по п.8, характеризующийся термограммой, полученной с использованием дифференциальной сканирующей калориметрии, в единицах °C при температуре 255±5°C.
20. Полиморф по п.8, характеризующийся термограммой, полученной с использованием дифференциальной сканирующей калориметрии, по существу, в соответствии с фиг.3.
21. Способ получения полиморфа по любому из пп.8-20, включающий объединение N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1’-бифенил]-3-карбоксамида с бромистоводородной кислотой.
22. Способ перекристаллизации полиморфа по любому из пп.8-20, включающий следующие стадии: (a) растворение полиморфа A в первом растворителе и (b) добавление второго растворителя с тем, чтобы указанный полиморф перекристаллизовался, где первый растворитель выбран из метанола, этанола, изопропилового спирта, тетрагидрофурана и ацетона, и второй растворитель выбран из этилацетата, простого метил-трет-бутилового эфира (MTBE) и 2-метилтетрагидрофуран.
23. Способ перекристаллизации полиморфа по любому из пп.8-20, включающий следующие стадии: (a) растворение полиморфа A в первом растворителе и (b) добавление второго растворителя с тем, чтобы указанный полиморф перекристаллизовался, где первый растворитель выбран из метанола, этанола, изопропилового спирта и тетрагидрофурана, и второй растворитель выбран из этилацетата, простого метил-трет-бутилового эфира (MTBE), 2-метилтетрагидрофуран и ацетона.
24. Способ по п.22 или 23, отличающийся тем, что первый растворитель представляет собой этанол, а второй растворитель представляет собой MTBE.
25. Способ по п.22 или 23, включающий (a) растворение полиморфа A в этаноле, (b) нагревание смеси, (c) добавление MTBE к смеси, образуя осадок, содержащий указанный полиморф, и фильтрацию осадка с тем, чтобы указанный полиморф перекристаллизовался.
26. Фармацевтическая композиция для ингибирования активности гистон-метилтрансферазы EZH2, содержащая терапевтически эффективное количество полиморфа по любому из пп.8-20, и фармацевтически приемлемый носитель или разбавитель.
27. Способ лечения рака, включающий введение нуждающемуся в лечении индивиду терапевтически эффективного количества соединения по п.1 или 2 или полиморфа по любому из пп.8-20.
28. Способ по п.27, отличающийся тем, что онкологическое заболевание представляет собой неходжкинскую лимфому или рак молочной железы.
29. Способ ингибирования активности гистон-метилтрансферазы EZH2 у нуждающегося в нем индивида, включающий введение индивиду эффективного количества соединения по 1 или 2 или полиморфа по любому из пп.8-20.
30. Способ ингибирования активности гистон-метилтрансферазы EZH2 in vitro, включающий введение соединения по 1 или 2 или полиморфа по любому из пп.8-20.
31. Применение соединения по 1 или 2 или полиморфа по любому из пп.8-20 для получения лекарственного препарата для лечения онкологического заболевания у нуждающегося в лечении индивида.
32. Способ получения N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1’-бифенил]-3-карбоксамида, включающий взаимодействие 5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1’-бифенил]-3-карбоновой кислоты (5) с солью 3-(аминометил)-4,6-диметил-дигидро-пиридин-2(1H)-она.
33. Способ по п.32, отличающийся тем, что кислота (5) представлена в кристаллической форме.
| WO 2011140325 A1, 10.11.2011 | |||
| RU 2004122114 A, 27.05.2005. |
Авторы
Даты
2018-06-26—Публикация
2013-04-11—Подача