ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрошен приоритет на основании предварительной заявки США 61/289563, поданной 23 декабря 2009 года. Указанная заявка включена в данное описание во всей полноте в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ ПО ИЗОБРЕТЕНИЮ
Рак представляет собой вторую основную причину смерти в Соединенных Штатах, уступая только заболеваниям сердца (Cancer Facts and Figures 2004, American Cancer Society, Inc.). Несмотря на последние успехи в диагностике и лечении рака, хирургия и лучевая терапия могут излечивать при раннем обнаружении рака, но современные лекарственные терапии метастазирующей опухоли по большей части являются паллиативными и редко обеспечивают долговременное излечение. Даже с новыми химиотерапевтическими средствами, выходящими на рынок, сохраняется необходимость в новых лекарственных препаратах эффективных в монотерапии или в комбинации с существующими средствами в качестве терапий первой линии и в качестве терапий второй и третьей линии при лечении резистентных опухолей.
Раковые клетки по определению представляют собой гетерогенные. Например, в одной ткани или одном типе клеток множественные мутационные «механизмы» могут приводить к развитию рака. Сама по себе гетерогенность часто существует между раковыми клетками, взятыми из опухолей одной и той же ткани и одного и того же типа, которая возникла у различных особей. Часто наблюдаемые мутационные «механизмы», связанные одними и теми же видами рака, могут отличаться между одним типом ткани и другим (например, часто наблюдаемые мутационные «механизмы», приводящие к раку толстой кишки, могут отличаться от часто наблюдаемых мутационных «механизмов», приводящих к лейкозам). Таким образом, часто сложно предсказать, будет ли конкретный рак отвечать на конкретное химиотерапевтическое средство. (Cancer Medicine, 5th Edition, Bast et al. eds., B.C. Decker Inc., Hamilton, Ontario)
Компоненты путей передачи клеточных сигналов, которые регулируют рост и дифференциацию нормальных клеток, могут в случае нарушения их регуляции приводить к нарушениям клеточной пролиферации и раку. Мутации в сигнальных белках клетки могут вызывать экспрессию или активацию таких белков в неприемлемых концентрациях или в неприемлемое время в ходе клеточного цикла, что, в свою очередь, может приводить к неконтролируемому клеточному росту или изменениям в адгезионных свойствах клетка-клетка. Например, нарушение регуляции рецепторных тирозинкиназ в результате мутации, перестройка гена, амплификация гена и гиперэкспрессия и рецептора, и лиганда были причастны к возникновению и развитию рака у человека.
c-Met тирозинкиназный рецептор представляет собой единственный высокоафинный рецептор фактора роста гепатоцитов (HGF), также известного как рассеивающий фактор. Связывание HGF с c-Met внеклеточным связывающим лиганд доменом приводит к мультимеризации рецептора и фосфорилированию множественных остатков тирозина в внутриклеточной части c-Met. Активация c-Met приводит к связыванию и фосфорилированию белков-посредников, таких как Gab-1, Grb-2, Shc и c-Cb1, и последовательной активации переносчиков сигнала, таких как PI3K, PLC-γ, STAT, ERK1 и 2 и FAK. c-Met и HGF экспрессируются во многих тканях, и их экспрессия обычно ограничивается клетками эпителиального и мезенхимального происхождения, соответственно. Регуляция c-Met и HGF нарушена при раке человека, и они могут участвовать в нарушении регуляции роста клеток, распространении раковых клеток и проникновении опухоли в ходе развития болезни и метастаза (см., например, Journal of Clinical Investigation 109: 863-867 (2002) и Cancer Cell pp 5-6 июль 2004). c-Met и HGF высоко экспрессированы при многочисленных раках по сравнению с окружающей тканью, и их экспрессия корреллирует с неблагоприятным прогнозом и отсутствием ответа на стандартное клиническое лечение (см., например, Journal of Cellular Biochemistry 86: 665-677 (2002); Int. J. Cancer (Pred. Oncol.) 74: 301-309 (1997); Clinical Cancer Research 9: 1480-1488 (2003) и Cancer Research 62: 589-596 (2002)). Без какой-либо связи с теорией, предполагается, что c-Met и HGF могут защищать опухоли от клеточной смерти, индуцируемой ДНК разрушающими агентами и, таким образом, может участвовать в устойчивости к химическому воздействию и устойчивости к лучевому воздействию опухолей. Без какой-либо связи с теорией полагают, что ингибиторы c-Met могут быть использованы в качестве терапевтических средств при лечении пролиферативных расстройств, включая рак груди (см., например, Cancer and Metastasis Reviews 22: 309-325 (2003)). Таким образом, необходимы новые соединения и способы для регулирования указанных факторов и лечения рака. Настоящее изобретение направлено на решение данных проблем.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает форму 1 полиморфа (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемого порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8 и 14,1 °2θ при использовании Cu Kα излучения. В некоторых вариантах осуществления полиморф может также быть охарактеризован порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8, 14,1, 15,5, 17,8, 19,9 и 25,6 °2θ при использовании Cu Kα излучения. В других вариантах осуществления полиморф может также характеризоваться порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8, 14,1, 14,9, 15,5, 17,1, 17,8, 19,4, 19,9, 21,1, 21,9, 23,0, 25,6 и 28,4 °2θ при использовании Cu Kα излучения.
Настоящее изобретение также обеспечивает форму 2 полиморфа (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемого порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9 и 12 °2θ при использовании Cu Kα излучения. В некоторых вариантах осуществления полиморф может также характеризоваться порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9, 12,0, 16,7, 20,1 и 22,8 °2θ при использовании Cu Kα излучения. В других вариантах осуществления полиморф может также характеризоваться порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9, 12,0, 13,2, 16,4, 16,7, 17,2, 20,1, 20,3, 20,8, 22,8, 23,7, 28,6 и 30,4 °2θ при использовании Cu Kα излучения.
Настоящее изобретение также обеспечивает (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диондихлорметан и композицию, включающую (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диондихлорметан. Композиция может включать более чем 90%, более чем 95% или более чем 99% (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диондихлорметана.
Настоящее изобретение также обеспечивает (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрин или композицию, включающую (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрин. Композиция может включать более чем 90%, более чем 95% или более чем 99% (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-·(1S,2S)-(+)-псевдоэфедрина. В некоторых вариантах осуществления изобретения композиция может включать менее чем 1%, менее чем 0,5% или менее чем 0,1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионпсевдоэфедрина.
Настоящее изобретение также обеспечивает хирально очищенный (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, включающий менее чем 1%, менее чем 0,7%, менее чем 0,5% или менее чем 0,1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Настоящее изобретение также обеспечивает способ получения (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, включающий: (а) смешивание (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона с (1S,2S)-(+)-псевдоэфедрином в первом растворителе с получением твердого вещества (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрина; (b) промывание твердого вещества (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрина, полученного на стадии (а) смесью воды с первым растворителем; (с) введение в реакцию (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрина со стадии (b) с кислотой в органическом растворителе и выделение органического слоя полученного раствора; (d) промывание органического слоя со стадии (с); (e) добавление второго растворителя к органическому слою; (f) концентрирование органического слоя до такой степени, чтобы концентрация второго растворителя в растворе была менее чем 5%; и (g) кристаллизацию из органического слоя стадии (f) и сушку полученного раствора (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона под вакуумом с получением (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Предпочтительно полученный (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион включает менее чем 1%, менее чем 0,7%, менее чем 0,5% или менее чем 0,1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Первый растворитель может представлять собой неводный растворитель. Предпочтительно первый неводный растворитель может представлять собой метанол, этанол, циклогексилэтиленамин, ацетонитрил или их смесь. Второй растворитель может представлять собой неводный растворитель. Предпочтительно второй неводный растворитель может представлять собой метанол, этанол, ацетонитрил или их смесь. В некоторых вариантах осуществления второй растворитель представляет собой такой же, как указанный первый растворитель. В других вариантах осуществления второй растворитель отличается от указанного первого растворителя. Органический растворитель на стадии (с) может представлять собой метилтетрагидрофуран. В некоторых вариантах осуществления органический слой промывают на стадии (d) раствором соли. Предпочтительно раствор соли представляет собой раствор хлорида натрия.
Способ может дополнительно включать промывание кристаллов (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона после стадии (g). В некоторых вариантах осуществления кристаллы (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона промывают спиртом. Предпочтительно спирт выбирают из этанола и метанола.
Настоящее изобретение также обеспечивает способ получения (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, включающий (а) смешивание (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрина и кислоты; (b) добавление спирта к смеси со стадии (а) с образованием суспензии; (с) нагревание и перемешивание суспензии, полученной на стадии (b); (d) охлаждение и выделение (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона; (e) промывание (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, выделенного на стадии (d) первым растворителем; (f) растворение (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона со стадии (e) во втором растворителе с получением раствора; (g) добавление третьего растворителя к раствору на стадии (f) и дистилляцию раствора до достижения содержания второго растворителя в растворе менее 5%; (h) кристаллизацию (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона из раствора со стадии (g); (i) необязательное добавление четвертого растворителя (предпочтительно воды) для созревания кристаллов на стадии (h); (j) выделение кристаллов со стадии (i) фильтрацией; (k) промывание кристаллов со стадии (j) смесью третьего растворителя и четвертого растворителя; и (l) сушку кристаллов со стадии (k) под вакуумом с получением (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Предпочтительно полученный (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион включает менее чем 1%, менее чем 0,7%, менее чем 0,5% или менее чем 0,1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Спирт может представлять собой метанол, этанол или их смесь. Первый растворитель может представлять собой неводный растворитель. Предпочтительно первый неводный растворитель представляет собой метанол, этанол или их смесь. Второй растворитель может представлять собой неводный растворитель. Предпочтительно второй неводный растворитель представляет собой тетрагидрофуран. Третий растворитель может представлять собой неводный растворитель. Предпочтительно третий неводный растворитель представляет собой метанол, этанол или их смесь.
Настоящее изобретение также обеспечивает способ получения (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, включающий (а) растворение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в дихлорметане и выделение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диондихлорметана; (b) растворение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диондихлорметана в первом растворителе; (с) дистилляцию раствора со стадии (b) до достижения концентрации дихлорметана в растворе менее 0,1% масс.; (d) разбавление раствора со стадии (с) во втором растворителе; (е) введение раствора со стадии (d) в систему мультиколоночной хроматографии, содержащую насадочный материал, пригодный для хирального разделения; (f) объединение полученного очищенного продукта, получаемого из системы на стадии (е); и (g) кристаллизацию очищенного продукта со стадии (f) и фильтрование полученного (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или выпаривание очищенного продукта со стадии (f) досуха, с получением, таким образом, (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Предпочтительно полученный (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион включает менее чем 1%, менее чем 0,7%, менее чем 0,5% или менее чем 0,1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Предпочтительно первый неводный растворитель может представлять собой метанол, этанол или их смесь. Второй растворитель может представлять собой неводный растворитель. Предпочтительно второй неводный растворитель представляет собой метанол, этанол, ацетонитрил или их смесь. Более предпочтительно второй неводный растворитель представляет собой смесь метанола и ацетонитрила.
Если не оговорено особо, все технические и научные термины, используемые в настоящем описании, имеют значение, понятное среднему специалисту в области техники, к которой относится настоящее изобретение. В спецификации форма единственного числа также включает множественное число, если контекст явно не подразумевает обратного. Хотя в практике или испытаниях настоящего изобретения могут быть использованы способы и материалы, сходные или эквивалентные описанным здесь, пригодные способы и материалы описаны ниже. Все публикации, заявки на патент, патенты и другие ссылки, упомянутые в настоящем описании, включены в качестве ссылки. Ссылки, цитированные в настоящем описании, не признаны имеющими приоритет перед заявленным изобретением. В случае конфликта, материалы, способы и примеры представлены только в качестве иллюстрирующих и не предполагаются в качестве ограничивающих.
Другие признаки и преимущества изобретения будут понятны из последующего подробного описания и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг.1 изображены химические структуры (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
На Фиг.2 показан эффект (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на выживание MDA-MB-231 или Paca-2 клеток in vitro.
На Фиг.3 показан эффект (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на выживание MDA-MB-231 клеток in vitro.
На Фиг.4 показан эффект (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на на активность протеинкиназы С in vitro.
На Фиг.5 на части А показано ингибирование c-Met автофосфорилирования (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом; на части B показано ингибирование индуцированного c-Met фосфорилирования (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом или (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом.
На Фиг.6 показан эффект (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на индукцию апоптоза в раковых клетках.
На Фиг.7 показан эффект (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на ингибирование метастатической инвазии раковых клеток.
На Фиг.8 показан эффект (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на ксенотрансплантат рака молочной железы.
На Фиг.9 показан эффект (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на ксенотрансплантат рака толстой кишки человека (часть А), на ксенотрансплантат рака поджелудочной железы человека (часть B), на ксенотрансплантат рака простаты человека (часть С) и на ксенотрансплантат рака желудка человека (часть D).
На Фиг.10 показана цитотоксическая чувствительность множества клеточных линий к (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диону.
На Фиг.11 показано уменьшение количества фосфорилированного c-Met в гистологических образцах, обработанных (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом, способом имуногистохимии (часть А) или вестерн-блоттинга (часть B).
На Фиг.12 в части А показана порошковая рентгенограмма формы 1 полиморфа (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона; в части B показаны типичные величины 2θ для порошковой рентгенограммы формы 1 полиморфа (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
На Фиг.13 в части А показана порошковая рентгенограмма формы 2 полиморфа (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона; в части B показаны типичные величины 2θ для порошковой рентгенограммы формы 2 полиморфа (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
На Фиг.14 показаны графики, сравнивающие порошковые рентгенограммы форм 1 и 2 полиморфов (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
На Фиг.15 части А и B графически показывают ИК спектры форм 1 и 2 полиморфов (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
На Фиг.16 графически показано термическое (плавление) поведение форм 1 и 2 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
На Фиг.17 части А и B графически показывают растворимость и характеристическое растворение форм 1 и 2, соответственно, (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соединения пирролохинолинилпирролидин-2,5-диона
Настоящее изобретение обеспечивает (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, имеющий хиральную чистоту более чем 99% по данным ВЭЖХ и содержащий менее 1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Настоящее изобретение обеспечивает композицию, включающую (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, имеющий хиральную чистоту более чем 99% по данным ВЭЖХ и содержащий менее 1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона. Композиция может содержать один или более фармацевтически приемлемых носителей и эксципиентов.
Предпочтительно (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион высокой чистоты, обеспечиваемый настоящим изобретением, имеет хиральную чистоту более чем 99,3%, более чем 99,5%, более чем 99,6%, более чем 99,7%, более чем 99,8% или более чем 99,9%. Предпочтительно композиция, содержащая (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион высокой чистоты, обеспечиваемый настоящим изобретением, содержит менее чем 0,7%, менее чем 0,5%, менее чем 0,4%, менее чем 0,3%, менее чем 0,2% или менее чем 0,1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Все формы соединений по настоящему изобретению предполагаются или в смеси, или в чистом виде, включая кристаллические формы рацемических смесей и кристаллические формы индивидуальных изомеров. Изобретение особенно конкретно охватывает выделенные оптические изомеры, обладающие указанной активностью. Рацемические формы можно разрешать физическими способами, как, например, разделение или кристаллизация диастереомерных производных, разделением хиральной колоночной хроматографией или сверхкритической хроматографией с подвижной фазой. Индивидуальные оптические изомеры могут быть получены из рацематов традиционными способами, такими как, например, образование соли с оптически активной кислотой или основанием с последующей кристаллизацией.
Определенные соединения по настоящему изобретению могут быть использованы в таутомерной форме. Все такие таутомерные формы соединений рассматриваются как входящие в объем настоящего изобретения, если не указано иначе.
Дополнительно, полиморфизм кристаллов может присутствовать, но не является ограничивающим, но любая кристаллическая форма может быть единой или смесью кристаллических форм, или безводной, или гидратированной кристаллической формой.
Термины «кристаллические полиморфы», или «полиморфы», или «кристаллические формы» означают кристаллические структуры, в которых соединение (или его соль или сольват) может кристаллизоваться в различные кристаллические упаковки, все из которых имеют один и тот же элементный состав. Различные кристаллические формы обычно имеют различные картины рентгеновской дифракции, инфракрасные спектры, точки плавления, плотность, форму кристаллов, оптические и электрические свойства, стабильность и растворимость. Растворитель кристаллизации, скорость кристаллизации, температура хранения и другие факторы могут приводить к доминированию одной кристаллической формы. Кристаллические полиморфы соединений могут быть получены кристаллизацией при различных условиях.
Настоящее изобретение обеспечивает два полиморфа (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Форма 1 полиморфа (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуется порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8 и 14,1 °2θ при использовании Cu Kα излучения. В некоторых вариантах осуществления полиморф также может быть охарактеризован порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8, 14,1, 15,5, 17,8, 19,9 и 25,6 °2θ при использовании Cu Kα излучения. В других вариантах осуществления полиморф также может быть охарактеризован порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8, 14,1, 14,9, 15,5, 17,1, 17,8, 19,4, 19,9, 21,1, 21,9, 23,0, 25,6 и 28,4 °2θ при использовании Cu Kα излучения.
Настоящее изобретение также обеспечивает форму 2 полиморфа (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемого порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9 и 12 °2θ при использовании Cu Kα излучения. В некоторых вариантах осуществления полиморф может также характеризоваться порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9, 12,0, 16,7, 20,1 и 22,8 °2θ при использовании Cu Kα излучения. В других вариантах осуществления полиморф может также характеризоваться порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9, 12,0, 13,2, 16,4, 16,7, 17,2, 20,1, 20,3, 20,8, 22,8, 23,7, 28,6 и 30,4 °2θ при использовании Cu Kα излучения.
Настоящее изобретение также обеспечивает композицию, включающую форму 1 полиморфа (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемого порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8 и 14,1 °2θ при использовании Cu Kα излучения. Композиция может включать один или несколько фармацевтически приемлемых носителей и эксципиентов.
Дополнительно, соединения по настоящему изобретению, например соли соединений, могут существовать в гидратированной или негидратированной (ангидрид) форме или в качестве сольватов с другими сольватными молекулами. Неограничивающие примеры гидратов включают моногидраты, дигидраты и т.д. Неограничивающие примеры сольватов включают сольваты с этанолом, сольваты с ацетоном и т.д.
Настоящее изобретение также обеспечивает (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрин. (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрин может включать менее чем 1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион псевдоэфедрина.
Настоящее изобретение также обеспечивает композицию, включающую (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрин, имеющий хиральную чистоту имеющий хиральную чистоту более чем 99% по данным ВЭЖХ и содержащий менее 1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион псевдоэфедрина. Композиция может включать один или несколько фармацевтически приемлемых носителей или эксципиентов.
Предпочтительно (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион псевдоэфедрин высокой чистоты, обеспечиваемый настоящим изобретением, имеет хиральную чистоту более чем 99,5%, более чем 99,6%, более чем 99,7%, более чем 99,8% или более чем 99,9%. Предпочтительно композиция, содержащая (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион псевдоэфедрин высокой чистоты, обеспечиваемый настоящим изобретением, содержит менее чем 0,5%, менее чем 0,4%, менее чем 0,3%, менее чем 0,2% или менее чем 0,1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион псевдоэфедрина.
«Сольваты» обозначают присоединенные формы растворителя, которые содержат стехиометрические или не стехиометрические количества растворителя. Некоторые соединения имеют тенденцию захватывать фиксированные молярные соотношения молекул растворителя в кристаллическом твердом состоянии, таким образом формируя сольват. Если растворитель представляет собой воду, то полученный сольват представляет собой гидрат, если растворитель представляет собой спирт, то полученный сольват представляет собой алкоголят. Гидраты, образованные комбинацией одной или нескольких молекул воды с одними или несколькими веществами, в которых вода остается в своей молекулярной форме H2O, такие комбинации способны образовывать один или несколько гидратов. Например, сольват может представлять собой дихлорметановый (DCM) сольват.
Настоящее изобретение также обеспечивает (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диондихлорметан и композицию, включающую (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диондихлорметан. Композиция может включать более чем 90%, более чем 95% или более чем 99% (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диондихлорметана. Композиция может включать один или несколько фармацевтически приемлемых носителей или эксципиентов.
Некоторые соединения по настоящему изобретению могут существовать в таутомерной форме, которая также, как предполагается, охвачена объемом настоящего изобретения. «Таутомеры» относится к соединениям, структуры которых значительно отличается по расположению атомов, но существуют в состоянии быстрого и легкого равновесия. Следует понимать, что соединения по изобретению могут быть отображены как различные таутомеры. Следует также понимать, что если соединения имеют таутомерные формы, все таутомерные формы предполагаются охваченными объемом настоящего изобретения и наименование соединений не исключает никаких таутомерных форм.
Соединения, соли и пролекарства по настоящему изобретению могут существовать в нескольких таутомерных формах, и такие таутомерные формы включены в объем настоящего изобретения. Таутомеры существуют как смеси таутомерного комплекса в растворе. В твердой форме обычно преобладает один из таутомеров. Даже если один таутомер может быть описан, настоящее изобретение включает все таутомеры настоящего соединения.
Как использовано в настоящем описании, термин «соль» представляет собой фармацевтически приемлемую соль и может включать кислые аддитивные соли, включая гидрохлориды, гидробромиды, фосфаты, сульфаты, гидросульфаты, алкилсульфонаты, арилсульфонаты, ацетаты, бензоаты, цитраты, малеаты, фумараты, сукцинаты, лактаты и тартраты; катионы щелочных металлов, такие как Na+, K+, Li+, соли щелочноземельных металлов, таких как Mg2+ Ca2+, или соли органических аминов.
Как использовано в настоящем описании, термин «метаболит» означает продукт метаболизма соединения по настоящему изобретению или фармацевтически приемлемой его соли, полиморфа или сольфата, который проявляет сходную активность in vivo по сравнению с указанным соединением по настоящему изобретению.
Как использовано в настоящем описании, термин «приготовление смеси» означает комбинирование, компаундирование, размешивание, встряхивание, круговое перемешивание или взбалтывание. Термин «перемешивание» означает смешивание, встряхивание, взбалтывание или круговое перемешивание.
Соединения по настоящему изобретению могут также быть получены в виде пролекарств, например, фармацевтически приемлемых пролекарств. Термины «про-лекарство» и «пролекарство» используют в настоящем описании взаимозаменяемо, и они относятся к любому соединению, которое высвобождает активное исходное лекарство in vivo. Поскольку известны свойства пролекарств улучшать многочисленные желаемые качества фармацевтических препаратов (например, растворимость, биодоступность, изготовление и т.д.), соединения по настоящему изобретению могут доставляться в виде пролекарственной формы. Таким образом, настоящее изобретение охватывает пролекарства заявляемых в настоящий момент соединений, способы их доставки и содержащие их композиции. Термин «пролекарства» включает соединение по настоящему изобретению, ковалентно связанное с одним или несколькими защитными группами, такими как аминокислотные группы или другие водорастворимые группы. Соединение по настоящему изобретению может освобождаться от защитной группы посредством гидролитических, окислительных и/или ферментных механизмов освобождения. В одном из вариантов осуществления композиция пролекарства по настоящему изобретению демонстрирует дополнительное преимущество повышенной растворимости в воде, улучшенную стабильность и улучшенные фармакинетические профили. Защитная группа может быть выбрана для получения заданных характеристик пролекарства. Например, защитная группа, например аминокислотная группа или другая группа, повышающая растворимость, такая как фосфат, может быть выбрана на основе растворимости, стабильности, биодоступности и/или доставки или поглощения in vivo. Термин «пролекарство» также предназначен для включения любого ковалентно связанного носителя, который высвобождает активный исходный лекарственный препарат по настоящему изобретению in vivo, при введении пациенту такого пролекарства. Пролекарства по настоящему изобретению получают модификацией функциональных групп, присутствующих в соединении, таким образом, что модификации расщепляются или при использовании обычных манипуляций, или in vivo, до исходного соединения. Пролекарства включают соединения по настоящему изобретению, в которых гидрокси-, амино-, сульфгидрил, карбокси или карбонильная группа связана с любой группой, так что может расщепляться in vivo с образованием свободной гидроксильной, свободной амино, свободной сульфгидрильной, свободной карбокси или свободной карбонильной группы, соответственно.
Примеры пролекарств включают, но не ограничиваются перечисленным, сложные эфиры (например, производные ацетатов, диалкиламиноацетатов, формиатов, фосфатов, сульфатов и бензоатов) и карбаматы (например, N,N-диметиламинокарбонил) гидрокси функциональных групп, сложноэфирные группы (например, этил сложные эфиры, морфолиноэтанол сложные эфиры) карбоксильных функциональных групп, N-ацил производные (например, N-ацетил) N-основания Манниха, Шиффовы основания и энаминоны аминофункциональных групп, оксимы, ацетали, кетали и еноловые сложные эфиры кетоновой и альдегидной функциональных групп в соединениях Формулы I и т.п, см. Bundegaard, H. "Design of Prodrugs" p1-92, Elesevier, New York-Oxford (1985).
Синтез соединений (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Стандартные синтетические способы и процедуры получения органических молекул и превращения функциональных групп и манипуляций с ними, включая использование защитных групп, могут быть получены из соответствующей научной литературы или из стандартных справочников в данной области. Хотя они и не ограничены одним или несколькими источниками, признанные справочники включают: Smith, M. B.; March, J. March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th ed.; John Wiley & Sons: New York, 2001; и Greene, T.W.; Wuts, P.G. M. Protective Groups in Organic Synthesis, 3rd; John Wiley & Sons: New York, 1999. Последующие описания способов синтеза предназначены для иллюстрации, но не для ограничения, общих процедур получения соединений по изобретению.
Настоящее изобретение также обеспечивает способ получения (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, включающий (a) смешивание (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона с (1S,2S)-(+)-псевдоэфедрином в первом растворителе с получением твердого вещества (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрина; (b) промывание твердого вещества (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрина, полученного на стадии (а) смесью воды с первым растворителем; (с) введение в реакцию (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрина со стадии (b) с кислотой в органическом растворителе и выделение органического слоя полученного раствора; (d) промывание органического слоя со стадии (с); (e) добавление второго растворителя к органическому слою; (f) концентрацию органического слоя до такой степени, чтобы концентрация второго растворителя в растворе была менее чем 5%; и (g) кристаллизацию из органического слоя стадии (f) и сушку полученного раствора (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона под вакуумом с получением (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона. Предпочтительно полученный (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион включает менее чем 1%, менее чем 0,7%, менее чем 0,5% или менее чем 0,1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Первый растворитель может представлять собой неводный растворитель. Предпочтительно первый неводный растворитель может представлять собой метанол, этанол, ацетонитрил или их смесь. Второй растворитель может представлять собой неводный растворитель. Предпочтительно второй неводный растворитель может представлять собой метанол, этанол, ацетонитрил или их смесь. В некоторых вариантах осуществления второй растворитель представляет собой такой же, как указанный первый растворитель. В других вариантах осуществления второй растворитель отличается от указанного первого растворителя. Органический растворитель на стадии (с) может представлять собой метилтетрагидрофуран. В некоторых вариантах осуществления органический слой промывают на стадии (d) раствором соли. Предпочтительно раствор соли представляет собой раствор хлорида натрия.
Способ может дополнительно включать промывание кристаллов (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион после стадии (g). В некоторых вариантах осуществления кристаллы (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона промывают спиртом. Предпочтительно спирт выбирают из этанола и метанола.
Настоящее изобретение также обеспечивает способ получения (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, включающий (а) смешивание (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрина и кислоты; (b) добавление спирта к смеси со стадии (а) с образованием суспензии; (с) нагревание и перемешивание суспензии, полученной в (b); (d) охлаждение и выделение (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона; (e) промывание (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, выделенного на стадии (d), первым растворителем; (f) растворение (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона со стадии (e) во втором растворителе с получением раствора; (g) добавление третьего растворителя к раствору в (f) и дистилляцию раствора до достижения содержания второго растворителя в растворе менее 5%; (h) кристаллизацию (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона из раствора со стадии (g); (i) необязательное добавление четвертого растворителя (предпочтительно воды) для созревания кристаллов на стадии (h); (j) выделение кристаллов со стадии (i) фильтрацией; (k) промывание кристаллов со стадии (j) смесью третьего растворителя и четвертого растворителя; и (l) сушку кристаллов со стадии (k) под вакуумом с получением (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Спирт может представлять собой метанол, этанол или их смесь. Первый растворитель может представлять собой неводный растворитель. Предпочтительно первый неводный растворитель представляет собой метанол, этанол или их смесь. Второй растворитель может представлять собой неводный растворитель. Предпочтительно второй неводный растворитель представляет собой тетрагидрофуран. Третий растворитель может представлять собой неводный растворитель. Предпочтительно третий неводный растворитель представляет собой метанол, этанол или их смесь. Предпочтительно четвертый растворитель представляет собой воду.
Настоящее изобретение также обеспечивает способ получения (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, включающий (а) растворение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в дихлорметане и выделение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диондихлорметана; (b) растворение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диондихлорметана в первом растворителе; (с) дистилляцию раствора со стадии (b) до достижения концентрации дихлорметана в растворе не станет менее 0,1% масс.; (d) разбавление раствора со стадии (с) во втором растворителе; (е) введение раствора со стадии (d) в систему мультиколоночной хроматографии, содержащую насадочный материал, пригодный для хирального разделения; (f) объединение полученного очищенного продукта, получаемого из системы на стадии (е); и (g) кристаллизацию очищенного продукта со стадии (f) и фильтрование полученного (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или выпаривание очищенного продукта со стадии (f) досуха, с получением, таким образом, (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона. Предпочтительно полученный (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион включает менее чем 1%, менее чем 0,7%, менее чем 0,5% или менее чем 0,1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Предпочтительно первый неводный растворитель может представлять собой метанол, этанол или их смесь. Второй растворитель может представлять собой неводный растворитель. Предпочтительно второй неводный растворитель представляет собой метанол, этанол, ацетонитрил или их смесь. Более предпочтительно второй неводный растворитель представляет собой смесь метанола и ацетонитрила.
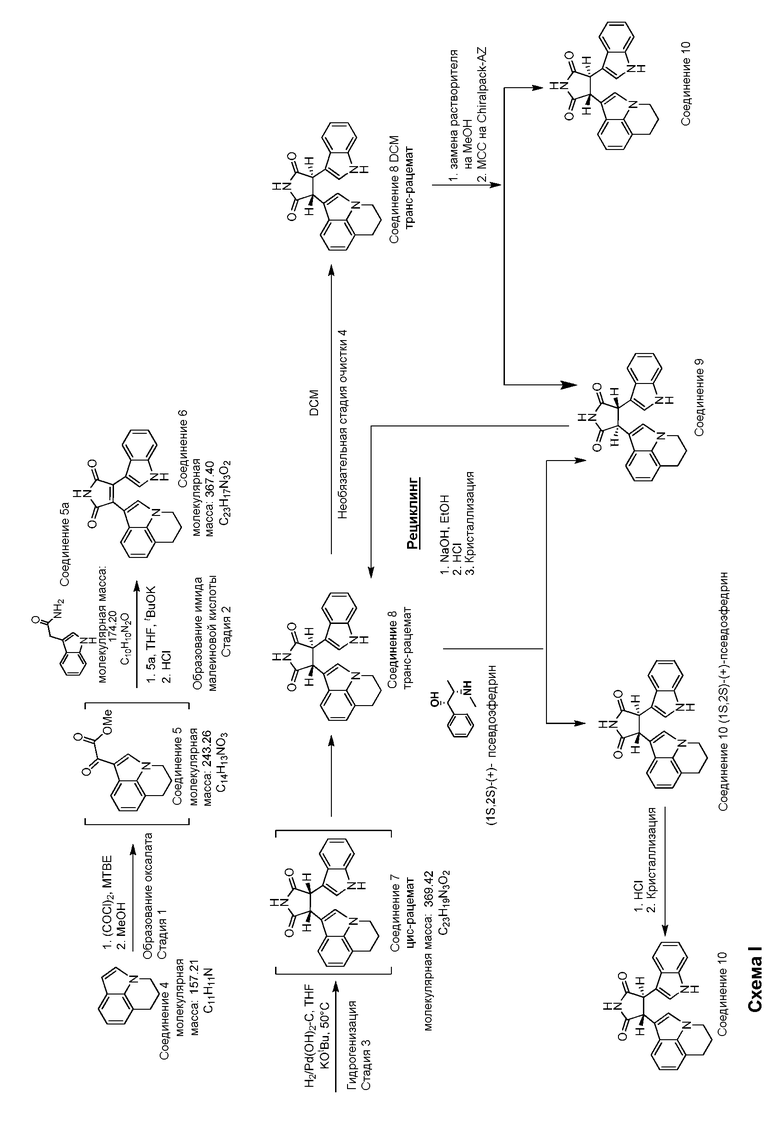
На схеме I представлено краткое изложение получения не требующей подготовки композиции, включающей высоко чистый (>99% хиральной чистоты) (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона с минимальными количествами (<1%) нежелательного энантиомера, (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона. Предпочтительно композиции включают (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, имеющий хиральную чистоту более чем 99,3%, более чем 99,5%, более чем 99,6%, более чем 99,7%, более чем 99,8% или более чем 99,9%. Предпочтительно композиции включают менее чем 0,7%, менее чем 0,5%, менее чем 0,4%, менее чем 0,3%, менее чем 0,2% или менее чем 0,1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Как показано на схеме I и описано подробно в последующих примерах, используют различные процедуры для получения и выделения указанных композиций, включающих (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона высокой хиральной чистоты, включая, но не ограничиваясь перечисленным, разрешение мультиколоночной хроматографией, диастереометрическое разрешение солей или динамическое кинетическое разрешение.
На стадии 1 на схеме I, лилолидин (Соединение 4) обрабатывали оксалилхлоридом с получением ацилхлорида в реакционном растворителе метил-трет-бутиловом простом эфире (МТБЭ). Добавление метанола было достаточным для обеспечения промежуточного сложного кетоэфира, метилового сложного эфира 5,6-дигидро-4H-пирроло[3,2,1-ij] хинолин-l-ил) оксоацетиловой кислоты (Соединение 5). На стадии 2 реакции Соединение 5 и индол-3-ацетамид (Соединение 5а) комбинируют с получением 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (Соединение 6). Как подробно описано в последующих примерах, нет необходимости в выделении промежуточного Соединения 5 для получения Соединения 6. Замещение растворителя с МТБЭ на тетрагидрофуран (ТГФ) было необходимым перед проведением стадии 2, поскольку и 5, и 5а обладают чрезвычайно слабой растворимостью в МТБЭ. После добавления Соединения 5а для поглощения Соединения 5 в ТГФ в присутствии основания добавляли HCl для завершения реакции для достижения неочищенного Соединения 6. Неочищенное Соединение 6 затем очищали от дихлорметана (DCM) и гептана с получением Соединения 6 достаточной чистоты для осуществления следующей стадии. Подробное описание указанного способа показано в Примере 1.
Соединение 6 гидрогенизировали гидроксидом палладия, ТГФ и трет-бутоксидом калия с получением транс-рацемата (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (Соединение 8). Как описано в примерах, получение соединения 8 не требует выделения неочищенного цис рацемата (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (Соединение 7). Предпочтительнее в ходе гидрогенизации Соединение 6 условия модифицировали таким образом, чтобы повлиять на изомеризацию полученного Соединения 7 in situ. Проистекающий способ обеспечивает механизмы контроля основных примесей в Соединении 8, в особенности Соединения 6. В частности, реакцию проводят в ТГФ растворителе и используемый катализатор представляет собой гидроксид палладия. Трет-бутоксид калия также добавляют к реакционной смеси, для содействия изомеризации. Подробное описание указанного способа показано в Примере 2.
Наиболее обычная примесь в Соединении 8 представляет собой Соединение 7. Поскольку Соединение 7 само по себе представляет собой хиральное, в особенности сложно предсказать эволюцию изомеров Соединения 7 из мультиколоночной хроматографии (МСС) при использовании Соединения 8 более низкой чистоты (<99%). Для того чтобы обеспечить продукт высокой чистоты, таким образом, необходимо увеличить чистоту рацемата Соединения 8 перед энантиомерным разрешением при помощи МСС. Было определено, что чистота Соединения 8 может быть улучшена путем селективной кристаллизации сольватов и различных растворителей. Один такой сольват, полученный из дихлорметана (DCM), приводит к Соединению 8 DCM высокой химической чистоты (>99%). Как показано на схеме I, Соединение 8 DCM было получено путем растворения неочищенного Соединения 8 в DCM и последующей затравки кристаллами DCM. После роста кристаллического слоя до критической массы добавляли гептан для завершения кристаллизации. После выделения фильтрацией и удаления массового избыточного растворителя под вакуумом Соединение 8 DCM обычно содержало 0,8-0,9 моль DCM по отношению к Соединению 8. Эта кристаллизация сольвата удаляла примеси, присутствующие в неочищенном (95-98%) Соединении 8 как следствие гидрогенации и изомеризации. Подпобное описание этого способа показано в Примере 3.
Настоящее изобретение обеспечивает хиральное разрешение двух энантиомеров Соединения 8 DCM при помощи МСС, как показано на схеме I. Способ разделения энантиомеров МСС обеспечивает преимущество по сравнению с разделением партии ВЭЖХ хроматографией тем, что она может обеспечить большую хиральную чистоту (>99%) при больших масштабах (>20 кг), по сравнению с полученными партиями. Разрешение МСС можно проводить или в метаноле, или смеси метанола и этанола (1:1 об.), или метанола и ацетонитрила (9:1 об.). Используемая хиральная неподвижная фаза (CSP) партии представляет собой или Chiralpak AD или AZ, доступные от Chiral Technologies, Inc. Концентрация загружаемого раствора рацемата находится в диапазоне 20-50 г/л. Предпочтительно установленная хиральная чистота для разделения составляет >99% (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (Соединение 10) и содержание <1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (Соединение 9).
Более определенно, разделения проводят получением загружаемого раствора рацемического Соединения 8 в выбранной подвижной фазе. Указанный раствор получают из Соединения 8 DCM путем изначального растворения вещества в метаноле. Хроматографические параметры оценивали перед получением и проводили конечную оптимизацию в ходе начальных часов или дней разделения загружаемого раствора. Если собранные начальные фракции не отвечали спецификации хиральной чистоты, материал рециркулировали в загружаемый раствор для повторения разрешения. Как только были установлены операционные параметры, удовлетворяющие спецификациям, условия использовали для разделения всего объема загружаемого раствора. В ходе операции Соединение 10 собирали как поток очищенного вещества, объединяли и концентрировали. Концентрированное очищенное вещество затем или концентрировали досуха (масштаб <5 кг) или концентрировали и вводили затравку для индукции кристаллизации Соединения 10 (масштаб >5 кг). Подробное описание указанного способа представлено в примере 4.
Дополнительно к разрешению МСС применяли классический подход к разрешению хиральных кислот или оснований посредством формирования диастереомерных солей. В случае Соединения 10 могли быть использованы или кислоты, или основания, поскольку молекула представляет собой амфотерную. После подробного отбора хиральных оснований было показано, что соли, образуемые из энантиомеров Соединения 8 с псевдоэфедрином, имеют в значительной степени различные профили растворимости в некоторых растворителях. Это отношение оптимизировали, чтобы дать возможность разрешения Соединения 8 при использовании (1S,2S)-(+)-псевдоэфедрин для селективного получения (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрин (Соединение 10 (1S,2S)-(+)-псевдоэфедрин). Подробное описание указанного способа приведено в Примере 6. Другой способ, обеспечиваемый настоящим изобретением, состоит в рацемизации нежелательного энантиомера, (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона Соединение 9) in situ при использовании динамического кинетического разрешения (DKR). Подробное описание указанного способа представлено в Примере 7.
И в разрешении МСС, и в классическом способе разрешения диастереомерных солей выделяли нежелательный энантиомер, Соединение 9. Указанный нежелательный энантиомер можно изомерировать с получением рацемического Соединения 8. Это осуществляют путем применения той же процедуры изомеризации цис-изомера, Соединения 7 с получением неочищенного транс-рацемата Соединения 8. Изомеризацию проводят или в метаноле, или этаноле при использовании гидроксида натрия в качестве основания. Подробное описание этого способа представлено в Примере 5.
Способы синтеза, описанные на схеме I представляют собой легко воспроизводимыми в больших масштабах, например, 10 кг, 20 кг, 30 кг, 40 кг, 50 кг и 60 кг и более, обеспечивая общий выход более 45% (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона ( Соединение 10), от индолацетамида в качестве ограничивающего реагента. Предпочтительно 1 кг лилолидина (Соединение 4) приводит к выходу примерно 1 кг (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (Соединения 10), имеющего чистоту >99%.
Настоящее соединение также обеспечивает способ получения плиморфов (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона. Неочищенное Соединение 10 растворяли в растворителе, например, ТГФ, путем нагревания полученной смеси до 50°С. Полученную смесь осветляли фильтрованием с последующим добавлением второго растворителя, такого как метанол и Формы 1 затравочного кристалла Соединения 10.
Использование затравочных кристаллов задает контроль полиморфов в способе кристаллизации. При отсутствии затравки или Форма 1, или Форма 2 могут спонтанно кристаллизоваться с высокой чистотой. Таким образом, для обеспечения Формы 1 или Формы 2 допускается спонтанная кристаллизация; и единожды образованный кристаллический продукт может быть охарактеризован количественным анализом при использовании порошковой рентгеновской дифракции для определения полученной кристаллической формы и ее полиморфной чистоты. После такой характеристики кристаллический продукт может быть использован в качестве «затравочных кристаллов» или «затравки» для контроля полиморфа, или Формы 1, или Формы 2, получаемого в ходе последующей кристаллизации, как описано здесь.
Раствор затем концентрировали азеотропно и при атмосферном давлении путем дистилляции для уменьшения объема растворителя, например, ТГФ. Температуру растворителя понижали до 50°С и перемешивали в течение 4 часов. Аликвоты забирали для подтверждения образования желаемого полиморфа. Если необходимо, полиморф мог быть повторно растворен в ТГФ (30% объема партии), осветлен фильтрованием, концентрирован, и в него вносили затравку для получения выхода желаемого полиморфа. После получения желаемой формы полиморфа добавляли 50% водный раствор метанола при 50°С и раствор взбалтывали в течение последующих 2-3 часов. Раствор затем охлаждали до температуры окружающей среды и выдерживали в течение по меньшей мере 2 часов, позволяя кристаллизоваться. После завершения кристаллы выделяли фильтрацией, промывали дополнительным водным 50% метанолом и сушили под вакуумом при 65°С в течение по меньшей мере 12 часов. Полиморфную Форму 1 Соединения 10 выделили в виде красно-коричневого твердого вещества.
Полиморф Формы 2 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона может быть также получен описанным выше способом, если затравочные кристаллы формы 1 заменить затравочными кристаллами Формы 2.
Способы лечения
Настоящее изобретение обеспечивает способы лечения нарушений клеточной пролиферации у пациента, нуждающегося в таком лечении, путем введения пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, включающей (а) (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, имеющий хиральную чистоту более чем 99%, как определено ВЭЖХ, и содержащий менее чем 1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и фармацевтически эффективный носитель; (b) полиморф формы 1 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8 и 14,1 °2θ при использовании Cu Kα излучения, и один или несколько фармацевтически приемлемых носителей или эксципиентов; или (с) полиморф формы 2 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9 и 12 °2θ при использовании Cu Kα излучения, и один или несколько фармацевтически приемлемых носителей или эксципиентов.
Нарушение деления клеток может представлять собой рак или предраковое состояние. Настоящее изобретение дополнительно обеспечивает использование композиции (а) (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, имеющего хиральную чистоту более чем 99%, как определено ВЭЖХ, и содержащего менее чем 1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и фармацевтически эффективный носитель; (b) полиморфа формы 1 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемого порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8 и 14,1 °2θ при использовании Cu Kα излучения, и одного или нескольких фармацевтически приемлемых носителей или эксципиентов; или (с) полиморфа формы 2 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемого порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9 и 12 °2θ при использовании Cu Kα излучения, и одного или нескольких фармацевтически приемлемых носителей или эксципиентов, для получения медицинского препарата, пригодного для лечения нарушения клеточной пролиферации.
Настоящее изобретение также обеспечивает способы защиты от нарушений клеточной пролиферации у пациента, нуждающегося в этом, путем введения терапевтически эффективного количества фармацевтической композиции, включающей (а) (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, имеющий хиральную чистоту более чем 99%, как определено ВЭЖХ, и содержащий менее чем 1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и фармацевтически эффективный носитель; (b) полиморф формы 1 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8 и 14,1 °2θ при использовании Cu Kα излучения, и один или несколько фармацевтически приемлемых носителей или эксципиентов; или (с) полиморф формы 2 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9 и 12,0 °2θ при использовании Cu Kα излучения, и один или несколько фармацевтически приемлемых носителей или эксципиентов, и один или несколько фармацевтически приемлемых носителей или эксципиентов пациенту, нуждающемуся в таком лечении. Нарушение клеточной пролиферации может представлять собой рак или предраковое состояние. Настоящее изобретение также обеспечивает использование композиции, (а) (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, имеющего хиральную чистоту более чем 99%, как определено ВЭЖХ, и содержащего менее чем 1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и фармацевтически эффективный носитель; (b) полиморфа формы 1 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемого порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8 и 14,1 °2θ при использовании Cu Kα излучения, и одного или нескольких фармацевтически приемлемых носителей или эксципиентов; или (с) полиморфа формы 2 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемого порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9 и 12,0 °2θ при использовании Cu Kα излучения, и одного или нескольких фармацевтически приемлемых носителей или эксципиентов для получения медицинского препарата, пригодного для лечения нарушения клеточной пролиферации.
Как использовано в настоящем описании, «пациент, нуждающийся в этом» представляет собой пациента, имеющего нарушение клеточной пролиферации, или пациента, имеющего повышенный риск развития нарушения клеточной пролиферации по отношению ко всей популяции. Пациент, который в этом нуждается, может находиться в предраковом состоянии. Предпочтительно пациент, который в этом нуждается, имеет рак. Термин «пациент» включает млекопитающее. Млекопитающее может представлять собой, например, любое млекопитающее, например, человека, примата, птицу, мышь, крысу, домашнюю птицу, собаку, кошку, корову, лошадь, козу, верблюда, овцу или свинью. Предпочтительно млекопитающее представляет собой человека.
Как используется в настоящем описании, термин «нарушение клеточной пролиферации» относится к состояниям, при которых нерегулярный или ненормальный рост клеток, или как тот, так и другой, может приводить к развитию нежелательного состояния или заболевания, которое может быть, а может не быть раковым. Примеры нарушений клеточной пролиферации по изобретению включают различные состояния, где клеточные деления разрегулированы. Примеры нарушения клеточной пролиферации включают, но не ограничиваются перечисленным, неоплазмы, доброкачественные опухоли, недоброкачественные опухоли, предраковые состояния, опухоли в месте образования, инкапсулированные опухоли, метастатические опухоли, жидкие опухоли, твердые опухоли, иммунологические опухоли, опухоли кровеносной системы, различные виды раков, карциномы, лейкозы, лимфомы, саркомы и быстро делящиеся клетки. Термин «быстро делящиеся клетки», как использовано в настоящем описании, определяется как любая клетка, которая делится со скоростью, которая превышает или больше, чем ожидалось или наблюдалось среди соседних или смежных клеток в той же самой ткани. Нарушение клеточной пролиферации включает предрак или предраковое состояние. Нарушение клеточной пролиферации включает рак. Предпочтительно способы, обеспечиваемые в настоящем описании, используют для лечения или облегчения симптомов рака. Термин «рак» включает твердые опухоли, а также опухоли кровеносной системы и/или злокачественные новообразования. «Предраковая клетка» или «преканцерогенная клетка» представляет собой клетку, демонстрирующую нарушение клеточной пролиферации, которое представляет собой предрак или предканцерогенное состояние. «Раковая клетка» или «канцерогенная клетка» представляет собой клетку, демонстрирующую нарушение клеточной пролиферации, которое представляет собой рак. Любые воспроизводимые способы измерений могут быть использованы для определения раковых или преканцерогенных клеток. Раковые клетки или преканцерогенные клетки могут быть идентифицированы по гистологическому определению или классификации образцов тканей (например, образцов биопсии). Раковые клетки или преканцерогенные клетки можно идентифицировать путем использования пригодных молекулярных маркеров.
Примеры неканцерогенных состояний или заболеваний включают, но не ограничиваются перечисленным, ревматоидный артрит, воспаление, аутоиммунное заболевание, лимфопролиферативное состояние, акромегалию, ревматоидный спондилит, остеоартрит, подагру, другие артритные состояния, сепсис, септический шок, эндотоксический шок, грам-отрицательный сепсис, синдром токсического шока, астму, синдром острой дыхательной недостаточности у взрослых, хроническую обструктивную болезнь легких, хроническое воспаление легких, воспалительные заболевания кишечника, болезнь Крона, псориаз, экзему, язвенный колит, фиброз поджелудочной железы, фиброз печени, острую и хроническую болезнь почек, синдром раздраженной толстой кишки, лихорадку, рестеноз, церебральную малярию, удар и ишемическое повреждение, мозговую травму, болезнь Альцгеймера, хорею Гентингтона, болезнь Паркинсона, острую и хроническую боль, аллергический ринит, аллергический конъюнктивит, хроническую сердечную недостаточность, острый коронарный синдром, кахексию, малярию, проказу, лейшманиоз, болезнь Лайма, синдром Рейтера, острый синовит, дегенерацию мышц, бурсит, тендонит, теносиновит, синдром грыжи, разрыв или выпадение межпозвоночного диска, болезнь Альберс-Шенберга, тромбоз, рестеноз, силикоз, патологическое разрастание мягких тканей легкого, болезни резорбции кости, такие как остеопороз, реакцию «трансплантат-против-хозяина», множественный склероз, волчанку, фибромиалгию, СПИД и другие вирусные заболевания, такие как герпес зостер, простой герпес I и II, вирус гриппа и цитомегаловирус и сахарные диабеты.
Примеры рака включают, но не ограничиваются перечисленным, адренокортикальную карциному, виды рака, сопутствующие СПИД, лимфому, сопутствующую СПИД, рак заднего прохода, аноректальный рак, рак анального канала, рак аппендикса, детскую астроцитому мозжечка, детскую астроцитому головного мозга, базально-клеточную карциному, рак кожи (немеланомный), рак печени, внепеченочный рак желчных протоков, внутрипеченочный рак желчных протоков, рак мочевого пузыря, рак мочепузырный, рак костей и суставов, остеосаркому и злокачественную фиброзную гистиоцитому, рак мозга, опухоль мозга, глиому ствола мозга, астроцитому мозжечка, церебральную астроцитому/злокачественную глиому, эпендимому, медуллобластому, супратенториальные примитивные нейроэктодермальные опухоли, глиому зрительного пути и гипоталамуса, рак груди, бронхиальные аденомы/карциноиды, карциноидные опухоли, желудочного тракта, рак нервной системы, лимфому нервной системы, рак центральной нервной системы, лимфому центральной нервной системы, рак шейки матки, детский рак, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз, хронические миелопролиферативные нарушения, рак толстой кишки, рак ободочной и прямой кишки, кожную Т-клеточную лимфому, лимфоидную неоплазму, грибовидную гранулему, синдром Сезари, рак эндометрия, рак пищевода, внечерепную опухоль зародышевых клеток, внегонадная опухоль зародышевых клеток, внепеченочный рак желчных протоков, рак глаза, внутриглазную меланому, ретинобластому, рак желчного пузыря, желудочный рак (рак желудка), карциноидную опухоль желудочно-кишечного тракта, желудочно-кишечная стромальная опухоль (GIST), эмбрионально-клеточная опухоль, опухоль зародышевых клеток яичника, гестационную трофобластическую опухолевую глиому, рак головы и шеи, гепатоклеточный (печеночный) рак, лимфому Ходжкина, гипофарингеальный рак, внутриклеточную меланому, рак глаза, опухоли островковых клеток (поджелудочной железы), саркому Капоши, рак почки, почечный рак, рак почки, рак гортани, острый лимфобластный лейкоз, острый миелоидный лейкоз, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз, лейкоз ворсистых клеток, рак губы и ротовой полости, рак печени, рак легких, немелкоклеточный рак легких, мелкоклеточный рак легких, лимфому, сопутствующую СПИД, неходжкинскую лимфому, первичную лимфому центральной нервной системы, макроглобулинемию Вальденстрема, медуллобластому, меланому, внутриглазную(глазную) меланому, карциному клеток Меркеля, злокачественную мезотелиому, мезотелиому, метастатический сквамозный рак шеи, рак рта, рак языка, синдром множественной эндокринной неоплазии, грибовидную гранулему, миелодиспластические синдромы, миедодиспластические/миелопролиферативные заболевания, хронический миелогенный лейкоз, острый миелоидный лейкоз, множественную миелому, хронические миелопролиферативные нарушения, рак носоглотки, нейробластому, оральный рак, рак ротовой полости, ротоглоточный рак, рак яичника, рак эпителиальных клеток яичника, потенциально злокачественную опухоль яичника, рак поджелудочной железы, рак островных клеток поджелудочной железы, рак параназального синуса и носовой камеры, рак паращитовидной железы, рак полового члена, рак глотки, феохромоцитому, пинеобластому и супратенториальные примитивные нейроэктодермальные опухоли, опухоль гипофиза, неоплазму плазматических клеток/множественную миелому, плевролегочную бластому, рак простаты, рак прямой кишки, почечной лоханки и уретры, переходный клеточный рак, ретинобластому, рабдомиосаркому, рак слюнной железы, семейство саркому Юинга, саркому Капоши, саркому мягких тканей, рак матки, саркому матки, рак кожи (немеланомный), рак кожи (меланома), карциному клеток Меркеля, рак тонкой кишки, саркому мягких тканей, сквамозную клеточную карциному, желудочный рак (рак желудка), супратенториальные примитивные нейроэктодермальные опухоли, рак яичек, рак горла, тимому, тимому и карциному тимуса, рак щитовидной железы, переходный клеточный рак почечной лоханки и уретры и других мочевых органов, гестационную трофобластную опухоль, рак уретры, рак эндометрия матки, саркому матки, рак тела матки, рак вагины, рак женских наружных половых органов и опухоль Вильмса.
«Нарушение клеточной пролиферации кроветворной системы» представляет собой нарушение клеточной пролиферации, вовлекающее клетки кроветворной системы. Нарушение клеточной пролиферации кроветворной системы может включать лимфому, лейкоз, миелоидные новообразования, новообразования тучных клеток, миелодисплазию, доброкачественную моноклональную гаммопатию, лимфоматоидный грануломатоз, лимфатоидный папулез, истинную палицитемию, хронический миелоцитарный лейкоз, агногенную миелоидную метаплазию и идиопатическую тромбоцитемию. Нарушение клеточной пролиферации кроветворной системы может включать гиперплазию, дисплазию и метаплазию клеток кроветворной системы. Предпочтительно композиции по настоящему изобретению могут быть использованы для лечения рака, выбранного из группы, состоящей из рака кровеносной системы по настоящему изобретению или нарушению клеточной пролиферации кроветворной системы по настоящему изобретению. Рак кроветворной системы по настоящему изобретению может включать множественную миелому, лимфому (включая лимфому Ходжкина, неходжкинскую лимфому, детские лимфомы и лимфомы лимфоцитарного и кожного происхождения), лейкоз (включая детский лейкоз, волосатоклеточный лейкоз, острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, хронический лимфоцитарный лейкоз, хронический миелоцитарный лейкоз, хронический миелогенный лейкоз и лейкоз тучных клеток), миелоидные новообразования и новообразования тучных клеток.
«Нарушение клеточной пролиферации легких» представляет собой нарушение клеточной пролиферации, вовлекающее клетки легкого. Нарушения клеточной пролиферации легких могут включать все формы нарушений клеточной пролиферации, воздействующие на клетки легкого. Нарушения клеточной пролиферации легких могут включать рак легких, предрак или предраковое состояние легких, доброкачественные опухоли или патологические изменения легких и злокачественные опухоли или патологические изменения легких, и метастатические изменения в тканях и органах, отличных от легких. Предпочтительно композиции по настоящему изобретению могут быть использованы для лечения рака легких или нарушений клеточной пролиферации легких. Рак легких может включать все формы рака легких. Рак легких может включать злокачественные новообразования легких, карциному in situ, типичные карциноидные опухоли и атипичные карциноидные опухоли. Рак легких может включать мелкоклеточный рак легких («SCLC»), немелкоклеточный рак легких («NSCLC»), несквамозный немелкоклеточный рак легких, сквамозный немелкоклеточный рак легких, плоскоклеточную карциному, неплоскоклеточную карциному, аденокарциному, мелкоклеточную карциному, крупноклеточную карциному, аденосквамозную карциному клетки и мезотелиому. Рак легких может включать «рубцовую карциному», бронхиоальвеолярную карциному, гигантоклеточную карциному, веретеноклеточную карциному и крупноклеточную нейроэндокринную карциному. Рак легких может включать новообразования, имеющие гистологическую или ультраструктурную неоднородность (например, смешанные клеточные типы).
Нарушения клеточной пролиферации легких могут включать все формы нарушения клеточной пролиферации, воздействующие на клетки легкого. Нарушения клеточной пролиферации легких могут включать рак легкого, предраковое состояние легкого. Нарушения клеточной пролиферации легких могут включать гиперплазию, дисплазию и метаплазию легких. Нарушения клеточной пролиферации легких могут включать асбест-индуцированную гиперплазию, плоскоклеточную метаплазию и доброкачественную реактивную мезоэпителиальную метаплазию. Нарушения клеточной пролиферации легких могут включать замену цилиндрического эпителия стратифицированным плоскоклеточным эпителием и дисплазию слизистой. Индивидуумы, подвергающиеся действию вдыхаемых повреждающих агентов, таких как сигаретный дым и асбест, могут быть подвержены риску развития нарушений клеточной пролиферации легких. Первоочередные заболевания легких, которые могут приводить к предрасположенности индивидуумов к развитию нарушений клеточной пролиферации легких, могут включать хроническую интерстициальную легочную болезнь, некротическую легочную болезнь, склеродермию, ревматоидный артрит, саркоидоз, интерстициальную пневмонию, туберкулез, многократные пневмонии, идиопатический фиброз легких, гранулематоз, асбестоз, фиброзирующий альвеолит и болезнь Ходжкина.
«Нарушение клеточной пролиферации толстой кишки» представляет собой нарушение клеточной пролиферации, затрагивающие клетки толстой кишки. Предпочтительно нарушение клеточной пролиферации толстой кишки представляет собой рак толстой кишки. Предпочтительно композиции по настоящему изобретению могут быть использованы для лечения рака толстой кишки или нарушений клеточной пролиферации толстой кишки. Рак толстой кишки включает все формы рака толстой кишки. Рак толстой кишки может включать единичные или наследственные случаи рака толстой кишки. Рак толстой кишки может включать злокачественные новообразования толстой кишки, местную карциному, типичные карциноидные опухоли и атипичные карциноидные опухоли. Рак толстой кишки может включать аденокарциному, плоскоклеточную карциному и аденосквамозную карциному клетки. Рак толстой кишки может быть связан с наследственным синдромом, выбранным из группы, состоящей из наследственного неполипозного рака ободочной и прямой кишки, семейного аденоматозного полипоза, синдрома Гардинера, синдрома Пейтца-Егерса, синдрома Турко и ювенильного полипоза. Рак толстой кишки может быть вызван наследственным синдромом, выбранным из группы, состоящей из наследственного неполипозного рака ободочной и прямой кишки, семейного аденоматозного полипоза, синдрома Гардинера, синдрома Пейтца-Егерса, синдрома Турко и ювенильного полипоза.
Нарушения клеточной пролиферации толстой кишки могут включать все формы нарушения клеточной пролиферации, воздействующие на клетки толстой кишки. Нарушения клеточной пролиферации толстой кишки могут включать рак толстой кишки, предраковые состояния толстой кишки, аденоматозные полипы толстой кишки и метахронные патологические изменения толстой кишки. Нарушения клеточной пролиферации толстой кишки могут включать аденому. Нарушения клеточной пролиферации толстой кишки могут быть характеризованы гиперплазией, метаплазией или дисплазией толстой кишки. Первоочередные заболевания толстой кишки, которые могут вести к предрасположенности индивидуумов к развитию нарушений клеточной пролиферации толстой кишки, могут включать первичный рак толстой кишки. Текущее заболевание, которое может приводить к предрасположенности индивидуума к развитию нарушений клеточной пролиферации толстой кишки, может включать болезнь Крона и язвенный колит. Нарушение клеточной пролиферации толстой кишки может быть связано с мутацией в гене, выбранном из группы, состоящей из p53, ras, FAP и DCC. Индивидуум может иметь повышенный риск развития нарушения клеточной пролиферации толстой кишки из-за присутствия мутации в гене, выбранном из группы, состоящей из p53, ras, FAP и DCC.
«Нарушение клеточной пролиферации простаты» представляет собой нарушение клеточной пролиферации, затрагивающее клетки простаты. Нарушения клеточной пролиферации простаты могут включать все формы нарушений клеточной пролиферации, влияющие на клетки простаты. Нарушения клеточной пролиферации простаты могут включать рак простаты, предрак или предраковое состояние простаты, доброкачественные разрастания или патологические изменения простаты и злокачественные разрастания или патологические изменения простаты, и метастатические патологические изменения в тканях и органах тела, отличных от простаты. Нарушения клеточной пролиферации простаты могут включать гиперплазию, метаплазию и дисплазию простаты.
«Нарушение клеточной пролиферации кожи» представляет собой нарушение клеточной пролиферации, затрагивающее клетки кожи. Нарушения клеточной пролиферации кожи могут включать все формы нарушений клеточной пролиферации, влияющие на клетки кожи. Нарушения клеточной пролиферации кожи могут включать предрак или предраковое состояние кожи, доброкачественные разрастания или патологические изменения кожи, меланому и другие злокачественные разрастания или патологические изменения кожи и метастатические патологические изменения в тканях и органах тела, отличных от кожи. Нарушения клеточной пролиферации кожи могут включать гиперплазию, метаплазию и дисплазию кожи.
«Нарушение клеточной пролиферации яичника» представляет собой нарушение клеточной пролиферации, затрагивающее клетки яичника. Нарушения клеточной пролиферации яичника могут включать все формы нарушений клеточной пролиферации, влияющие на клетки яичника. Нарушения клеточной пролиферации яичника могут включать предрак или предраковое состояние яичника, доброкачественные разрастания или патологические изменения яичника, рак яичника, злокачественные разрастания или патологические изменения яичника и метастатические патологические изменения в тканях и органах тела, отличных от яичника. Нарушения клеточной пролиферации яичника могут включать гиперплазию, метаплазию и дисплазию клеток яичника.
«Нарушение клеточной пролиферации молочной железы» представляет собой нарушение клеточной пролиферации, затрагивающее клетки молочной железы. Нарушения клеточной пролиферации молочной железы могут включать все формы нарушений клеточной пролиферации, влияющие на клетки молочной железы. Нарушения клеточной пролиферации молочной железы могут включать рак молочной железы, предрак или предраковое состояние молочной железы, доброкачественные разрастания или патологические изменения молочной железы, злокачественные разрастания или патологические изменения молочной железы и метастатические патологические изменения в тканях и органах тела, отличных от молочной железы. Нарушения клеточной пролиферации молочной железы могут включать гиперплазию, метаплазию и дисплазию молочной железы.
Нарушение клеточной пролиферации молочной железы может представлять собой предраковое состояние молочной железы. Композиции по настоящему изобретению могут быть использованы для лечения предракового состояния молочной железы. Предраковое состояние молочной железы может включать атипичную гиперплазию молочной железы, местную внутрипротоковую карциному (DCIS), интрадуктальную карциному, местную лобулярную карциному (LCIS), лобулярное новообразование и стадию 0 или степень 0 разрастания или патологического изменения молочной железы (например, стадия 0 или степень 0 рака груди или местной карциномы). Можно выделять стадии предракового состояния молочной железы, согласно TNM схеме классификации, как принято Американским объединенным онкологическим комитетом (American Joint Committee on Cancer) (AJCC), где первичную опухоль (T) относят к стадии T0 или Tis; и где местные лимфотические узлы (N) относят к стадии N0; и где отдаленные метастазы (M) относят к стадии M0.
Нарушение клеточной пролиферации молочной железы может представлять собой рак молочной железы. Предпочтительно композиции по настоящему изобретению могут быть использованы для лечения рака молочной железы. Рак молочной железы может включать первичные эпителиальные виды рака молочной железы. Рак молочной железы может включать виды рака, где молочная железа вовлекается другими опухолями, такими как лимфома, саркома или меланома. Рак молочной железы может включать карциному молочной железы, внутрипротоковую карциному молочной железы, лобулярную карциному молочной железы, недифференцированную карциному молочной железы, филлоидную цистосаркому молочной железы, ангиосаркому молочной железы и первичную лимфому молочной железы. Рак груди может включать стадию I, II, IIIA, IIIB, IIIC и IV рака груди. Внутрипротоковая карцинома молочной железы может включать инвазивную карциному, местную инвазивную карциному с преимущественным внутрипротоковым компонентом, отечно-инфильтративный рак молочной железы и внутрипротоковую карциному молочной железы с гистологическим типом, выбранную из группы, состоящей из узелковой, слизеобразующей, медуллярной, медуллярной с лимфотическим инфильтратом, папиллярной, скиррозной и тубулярной. Лобулярная карцинома молочной железы может включать инвазивную лобулярную карциному с доминирующим местным компонентом, инвазивную лобулярную карциному и инфильтрирующую инвазивную лобулярную карциному. Рак молочной железы может включать болезнь Педжета, болезнь Педжета с внутрипротоковой карциномой и болезнь Педжета с инвазивной внутрипротоковой карциномой. Рак молочной железы может включать новообразования молочной железы, имеющие гистологическую и ультраструктурную неоднородность (например, смешанные клеточные типы).
Предпочтительно соединение по настоящему изобретению может быть использовано для лечения рака молочной железы. Рак молочной железы, лечение которого будут проводить, может включать семейный рак молочной железы. Рак молочной железы, лечение которого будут проводить, может включать спорадический рак молочной железы. Рак молочной железы, лечение которого будут проводить, может возникать у пациента мужского пола. Рак молочной железы, лечение которого будут проводить, может возникать у пациента женского пола. Рак молочной железы, лечение которого будут проводить, может возникать у предклимактерического пациента женского пола или у постклимактерического пациента женского пола. Рак молочной железы, лечение которого будут проводить, может возникать у пациента, возраст которого более или равен 30 годам, или у пациента, возраст которого менее 30 лет. Рак молочной железы, лечение которого будут проводить, может возникать у пациента, возраст которого равен или более 50 лет, или у пациента, возраст которого менее 50 лет. Рак молочной железы, лечение которого будут проводить, может возникать у пациента, возраст которого равен или более 70 лет, или у пациента, возраст которого менее 70 лет.
Рак молочной железы, лечение которого будут проводить, может быть типирован для определения семейной или спонтанной мутации в BRCA1, BRCA2 или p53. Рак молочной железы, лечение которого будут проводить, может быть типирован как имеющий генную амплификацию HER2/neu, повышенную экспрессию HER2/neu или как имеющий низкий, промежуточный или высокий уровень экспрессии HER2/neu. Рак молочной железы, лечение которого будут проводить, может быть типирован по маркеру, выбранному из группы, состоящей из рецептора эстрогена (ER), рецептора прогестерона (PR), рецептора к фактору роста эпидермиса человека 2, Ki-67, CA15-3, CA 27-29 и c-Met. Рак молочной железы, лечение которого будут проводить, может быть типирован как с неизвестным уровнем ER, богатым ER или бедным ER. Рак молочной железы, лечение которого будут проводить, может быть типирован как ER-отрицательный или ER-положительный. ER-типирование рака молочной железы можно проводить любыми воспроизводимыми способами. ER-типирование рака молочной железы можно проводить, как изложено в Onkologie 27: 175-179 (2004). Рак молочной железы, лечение которого будут проводить, может быть типирован как с неизвестным уровнем PR, богатым PR или бедным PR. Рак молочной железы, лечение которого будут проводить, может быть типирован как PR-отрицательный или PR-положительный. Рак молочной железы, лечение которого будут проводить, может быть типирован как отрицательный по отношению к рецептору или положительный по отношению к рецептору. Рак молочной железы, лечение которого будут проводить, может быть типирован как ассоциированный с повышенным уровнем в крови CA 15-3, или CA 27-29, или обоих.
Рак молочной железы, лечение которого будут проводить, может включать локализованную опухоль молочной железы. Рак молочной железы, лечение которого будут проводить, может включать опухоль молочной железы, ассоциированную с негативной биопсией сигнального лимфатического узла (SLN). Рак молочной железы, лечение которого будут проводить, может включать опухоль молочной железы, ассоциированную с положительной биопсией сигнального лимфатического узла (SLN). Рак молочной железы, лечение которого будут проводить, может включать опухоль молочной железы, ассоциированную с одним или несколькими положительными подмышечными лимфатическими узлами, где была определена стадия подмышечных лимфатических узлов любым приемлемым способом. Рак молочной железы, лечение которого будут проводить, может включать опухоль молочной железы, которая была типирована как имеющая статус отсутствия поражения лимфатических узлов (например, без поражения лимфатических узлов) или имеющая статус наличия поражения лимфатических узлов (например, с поражением лимфатических узлов). Рак молочной железы, лечение которого будут проводить, может включать опухоль молочной железы, которая имеет метастазы в других отделах тела. Рак молочной железы, лечение которого будут проводить, классифицированный как имеющий метастазы в других отделах, выбранных из группы, состоящей из костей, легких, печени или головного мозга. Рак молочной железы, лечение которого будут проводить, классифицированный согласно характеристикам, выбранным из группы, состоящей из метастатического, локализованного, местного, местно-распространенного, локально-местного, локально-распространенного, отдаленного, многоочагового, билатерального, ипсилатерального, контралатерального, свеже-диагностированного, рецидивирующего и неоперабельного.
Соединение по настоящему изобретению может быть использовано при лечении нарушения клеточной пролиферации молочной железы или при лечении или предотвращении рака молочной железы у пациента, имеющего повышенный риск развития рака молочной железы по сравнению с популяцией в целом. Пациент с повышенным риском развития рака молочной железы по сравнению с популяцией в целом представляет пациента женского пола с семейной историей или персональной историей рака молочной железы. Пациент с повышенным риском развития рака молочной железы по сравнению с популяцией в целом представляет собой пациента женского пола, имеющего зародышевую линию или спонтанную мутацию в BRCA1 или BRCA2, или обоих. Пациент с повышенным риском развития рака молочной железы по сравнению с популяцией в целом представляет собой пациента женского пола с семейной историей рака молочной железы и имеющего зародышевую линию или спонтанную мутацию в BRCA1 или BRCA2, или обоих. Пациент с повышенным риском развития рака молочной железы по сравнению с популяцией в целом представляет собой пациента женского пола в возрасте более 30 лет, более 40 лет, более 50 лет, более 60 лет, более 70 лет, более 80 лет или более 90 лет. Пациент с повышенным риском развития рака молочной железы по сравнению с популяцией в целом представляет собой пациента с атипичной дисплазией молочной железы, местной внутрипротоковой карциномой (DCIS), интрадуктальным раком, местной лобулярной карциномой (LCIS), лобулярным новообразованием или стадией 0 разрастания или патологического изменения молочной железы (например, стадия 0 или степень 0 рака груди или местной карциномы).
Рак груди, лечение которого можно проводить, можно по гистологии разделить согласно системе Scarff-Bloom-Richardson, в которой опухоли молочной железы приписывают значение митоза 1, 2 или 3; значение ядерного плейоморфизма 1, 2 или 3; значение образования канальцев 1, 2 или 3; и общий результат по Scarff-Bloom-Richardson в диапазоне от 3 до 9. Можно определить степень развития рака груди, лечение которого можно проводить, по классификации опухолей согласно международной группе по согласованию лечения рака груди, выбранную из группы, состоящей из степени 1, степени 1-2, степени 2, степени 2-3 или степени 3.
Можно определить степень развития рака груди, лечение которого можно проводить, согласно TNM системе классификации Американского объединенного онкологического комитета (American Joint Committee on Cancer) (AJCC), где опухоли (T) назначена стадия TX, T1, T1mic, T1a, T1b, T1c, T2, T3, T4, T4a, T4b, T4c или T4d; и где региональным лимфатическим узлам (N) назначена стадия NX, N0, N1, N2, N2a, N2b, N3, N3a, N3b или N3c; и где отдаленному метастазу (M) может быть назначена стадия MX, M0 или M1. Стадия рака, лечение которого можно проводить, может представлять собой согласно системе классификации Американского объединенного онкологического комитета (American Joint Committee on Cancer) (AJCC) Стадию I, Стадию IIA, Стадию IIB, Стадию IIIA, Стадию IIIB, Стадию IIIC или Стадию IV. Рак, лечение которого можно проводить, можно отнести к стадии согласно классификации AJCC, к Стадии GX (например, стадия не может быть определена), Стадии 1, Стадии 2, Стадии 3 или Стадии 4. Рак, лечение которого можно проводить, можно отнести к стадии согласно патологической классификации (pN) AJCC как pNX, pN0, PN0 (I-), PN0 (I+), PN0 (mol-), PN0 (mol+), PN1, PN1(mi), PN1a, PN1b, PN1c, pN2, pN2a, pN2b, pN3, pN3a, pN3b или pN3c.
Рак, лечение которого предполагается проводить, может включать опухоль, которая была определена как менее чем или равная примерно 2 сантиметрам в диаметре. Рак, лечение которого предполагается проводить, может включать опухоль, которая была определена как от примерно 2 до примерно 5 сантиметров в диаметре. Рак, лечение которого предполагается проводить, может включать опухоль, которая была определена как более чем или равная примерно 3 сантиметрам в диаметре. Рак, лечение которого предполагается проводить, может включать опухоль, которая была определена как более чем примерно 5 сантиметров в диаметре. Рак, лечение которого предполагается проводить, может быть классифицирован по микроскопическому строению как хорошо развитый, умеренно развитый, слабо развитый или неразвитый. Рак, лечение которого предполагается проводить, может быть классифицирован по микроскопическому строению с точки зрения числа митоза (например, числа клеточных пролифераций) или ядерного плейоморфизма (например, изменение в клетках). Рак, лечение которого предполагается проводить, может быть классифицирован по микроскопическому строению как ассоциированный с областями некроза (например, областями умирающих или деградирующих клеток). Рак, лечение которого предполагается проводить, может быть классифицирован как имеющий аномальный кариотип, имеющий аномальное число хромосом или имеющий одну или несколько хромосом, которые представляют собой аномальные по внешнему виду. Рак, лечение которого предполагается проводить, может быть классифицирован как анеуплоидный, триплоидный, тетраплоидный или как имеющий измененную плоидию. Рак, лечение которого предполагается проводить, может быть классифицирован как имеющий хромосомную транслокацию или делецию, или дупликацию всей хромосомы или область делеции, дупликации или амплификации части хромосомы.
Рак, лечение которого предполагается проводить, может быть оценен ДНК цитометрией, проточной цитометрией или визуальной цитометрией. Рак, лечение которого предполагается проводить, может быть классифицирован как имеющий 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% клеток на стадии синтеза клеточной пролиферации (например, в S-фазе клеточной пролиферации). Рак, лечение которого предполагается проводить, может быть классифицирован как имеющий низкую S-фракцию или высокую S-фракцию.
Как использовано в настоящем описании, «нормальная клетка» представляет собой клетку, которая не может быть классифицирована как часть «нарушения клеточной пролиферации». В нормальной клетке отсутствует нерегулируемый или аномальный рост, или и тот, и другой, которые приводят к нежелательному состоянию или заболеванию. Предпочтительно нормальные клетки обладают нормально функционирующими контрольными регуляторными механизмами.
Как используется в настоящем описании, «контакт с клеткой» относится к состоянию, в котором соединение или другая композиция вещества находится в непосредственном контакте с клеткой или достаточно близко, чтобы вызвать в клетке желаемое биологическое действие.
Как используется в настоящем описании, «соединение-кандидат» относится к соединению по настоящему изобретению, которое было или будет тестировано в одном или нескольких in vitro или in vivo биологических испытаниях для определения, способно ли указанное соединение вызвать желаемый биологический или медицинский ответ в клетке, ткани, системе, животном или человеке, которого добивается исследователь или практикующий врач. Соединение-кандидат представляет собой фармацевтическую композицию, включающую (a) композицию, включающую (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, имеющий хиральную чистоту более чем 99%, как определено ВЭЖХ, и содержащую менее чем 1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и фармацевтически приемлемый носитель; (b) полиморф формы 1 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8 и 14,1 °2θ при использовании Cu Kα излучения, и один или несколько фармацевтически приемлемых носителей или эксципиентов; или (с) полиморф формы 2 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9 и 12 °2θ при использовании Cu Kα излучения, и один или несколько фармацевтически приемлемых носителей или эксципиентов. Биологический или медицинский ответ может представлять собой лечение рака. Биологический или медицинский ответ может представлять собой лечение или предотвращение нарушения клеточной пролиферации. Биологические испытания in vitro или in vivo могут включать, но не ограничиваются перечисленным, анализы ферментативной активности, методы сдвига электрофоретической подвижности, испытания жизнеспособности клеток in vitro и описанные здесь испытания.
Как использовано в настоящем описании, «монотерапия» относится к введению одного активного или терапевтического соединения пациенту, нуждающемуся в таком введении. Предпочтительно монотерапия будет подразумевать введение терапевтически эффективного количества активного соединения. Например, монотерапия рака одним из соединений по настоящему изобретению или его фармацевтически приемлемой солью, пролекарством, метаболитом, полиморфом или сольватом пациенту, нуждающемуся в лечении рака. Монотерапию можно противопоставлять комбинированному лечению, при котором вводят комбинацию нескольких активных соединений, предпочтительно с каждым компонентом комбинации, присутствующим в терапевтически эффективном количестве. В одном аспекте монотерапия соединением по настоящему изобретению представляет собой более эффективную по сравнению с комбинированным лечением для достижения желаемого биологического действия.
Как используется в настоящем описании, «терапия» или «лечение» описывает контролирование заболевания и уход за пациентом в целях борьбы с заболеванием, состоянием или нарушением и включает введение соединения по настоящему изобретению для облегчения симптомов или осложнений заболевания, состояния или нарушения или для излечения заболевания, состояния или нарушения.
Соединения по настоящему изобретению могут также быть использованы для предотвращения заболевания, состояния или нарушения. Как используется в настоящем описании, «предотвращение» или «предотвратить» описывает уменьшение или устранение возникновения симптомов или осложнений заболевания, состояния или нарушения.
Лечение рака может приводить к уменьшению опухоли в размерах. Уменьшение опухоли в размерах также можно обозначать как «регрессия опухоли». Предпочтительно после лечения размер опухоли уменьшается на 5% или больше по отношению к ее размеру перед лечением; более предпочтительно уменьшается на 10% или более; более предпочтительно уменьшается на 20% или более; более предпочтительно уменьшается на 30% или более; более предпочтительно уменьшается на 40% или более; еще более предпочтительно уменьшается на 50% или более; и наиболее предпочтительно уменьшается на 75% или более. Размер опухоли может быть измерен любым воспроизводимым способом. Размер опухоли может быть измерен как диаметр опухоли.
Лечение рака может приводить к уменьшению опухоли в объеме. Уменьшение опухоли в размерах также можно обозначать как «регрессия опухоли». Предпочтительно после лечения объем опухоли уменьшается на 5% или более по отношению к ее размеру перед лечением; более предпочтительно объем опухоли уменьшается на 10% или более; более предпочтительно уменьшается на 20% или более; более предпочтительно уменьшается на 30% или более; более предпочтительно уменьшается на 40% или более; еще более предпочтительно уменьшается на 50% или более; и наиболее предпочтительно уменьшается на 75% или более. Объем опухоли может быть измерен любым воспроизводимым способом измерения.
Лечение рака может приводить к уменьшению числа опухолей. Предпочтительно после лечения число опухолей уменьшается на 5% или больше по отношению к числу перед лечением; более предпочтительно число опухолей уменьшается на 10% или более; более предпочтительно уменьшается на 20% или более; более предпочтительно уменьшается на 30% или более; более предпочтительно уменьшается на 40% или более; еще более предпочтительно уменьшается на 50% или более; и наиболее предпочтительно уменьшается на 75% или более. Число опухолей может быть измерено любым воспроизводимым способом измерения. Число опухолей может быть измерено подсчетом опухолей, видимых невооруженным глазом, или при конкретном увеличении. Предпочтительно конкретное увеличение составляет 2×, 3×, 4×, 5×, l0× или 50×.
Лечение рака может приводить к уменьшению числа метастатических патологических изменений в других тканях или органах, отдаленных от места первичной опухоли. Предпочтительно после лечения число метастатических патологических изменений уменьшается на 5% или больше по отношению к числу перед лечением; более предпочтительно число метастатических патологических изменений уменьшается на 10% или более; более предпочтительно уменьшается на 20% или более; более предпочтительно уменьшается на 30% или более; более предпочтительно уменьшается на 40% или более; еще более предпочтительно уменьшается на 50% или более; и наиболее предпочтительно уменьшается на 75% или более. Число метастатических патологических изменений может быть измерено любым воспроизводимым способом измерения. Число опухолей может быть измерено подсчетом опухолей, видимых невооруженным глазом, или при конкретном увеличении. Предпочтительно конкретное увеличение составляет 2×, 3×, 4×, 5×, l0× или 50×.
Лечение рака может приводить к увеличению продолжительности жизни пациентов, подвергающихся лечению, по сравнению с получающими только носитель. Предпочтительно средняя продолжительность жизни увеличивается на более чем 30 дней; более предпочтительно на более чем 60 дней; более предпочтительно на более чем 90 дней и наиболее предпочтительно на более чем 120 дней. Увеличение средней продолжительности жизни популяции может быть измерено любыми воспроизводимыми способами. Увеличение средней продолжительности жизни популяции может быть измерено, например, расчетом для популяции средней продолжительности жизни после начала лечения активным соединением. Увеличение средней продолжительности жизни популяции можно также измерить, например, расчетом для популяции средней продолжительности жизни после завершения первого круга лечения активным соединением.
Лечение рака может приводить к увеличению продолжительности жизни у популяции пациентов с проведенным лечением по сравнению с популяцией пациентов, не получавшим терапии. Предпочтительно средняя продолжительность жизни увеличивается на более чем 30 дней; более предпочтительно на более чем 60 дней; более предпочтительно на более чем 90 дней и наиболее предпочтительно на более чем 120 дней. Увеличение средней продолжительности жизни популяции может быть измерено любыми воспроизводимыми способами. Увеличение средней продолжительности жизни популяции может быть измерено, например, расчетом для популяции средней продолжительности жизни после начала лечения активным соединением. Увеличение средней продолжительности жизни популяции можно также измерить, например, расчетом для популяции средней продолжительности жизни после завершения первого круга терапии активным соединением.
Лечение рака может приводить к увеличению средней продолжительности жизни у пациентов с проведенным лечением по сравнению с пациентами, получавшими монотерапию лекарственным средством, которое не представляет собой соединение по настоящему изобретению или его фармацевтически приемлемую соль, пролекарство, метаболит, полиморф или сольват. Предпочтительно средняя продолжительность жизни увеличивается на более чем 30 дней; более предпочтительно на более чем 60 дней; более предпочтительно на более чем 90 дней и наиболее предпочтительно на более чем 120 дней. Увеличение средней продолжительности жизни популяции может быть измерено любыми воспроизводимыми способами. Увеличение средней продолжительности жизни популяции может быть измерено, например, расчетом для популяции средней продолжительности жизни после начала терапии активным соединением. Увеличение средней продолжительности жизни популяции можно также измерить, например, расчетом для популяции средней продолжительности жизни после завершения первого круга терапии активным соединением.
Лечение рака может приводить к уменьшению процента смертности пациентов, подвергающихся лечению, по сравнению с получающими только носитель. Лечение рака может приводить к уменьшению процента смертности пациентов, подвергающихся терапии, по сравнению с не получавшими лечения. Лечение рака может приводить к уменьшению процента смертности пациентов, подвергающихся лечению, по сравнению с пациентами, получавшими монотерапию лекарственным средством, которое не представляет собой соединение по настоящему изобретению или его фармацевтически приемлемую соль, пролекарство, метаболит, полиморф или сольват. Предпочтительно процент смертности уменьшается на более чем 2%, более предпочтительно на более чем 5%, более предпочтительно на более чем 10% и наиболее предпочтительно на более чем 25%. Уменьшение коэффициента смертности популяции может быть измерено любыми воспроизводимыми способами. Уменьшение коэффициента смертности популяции может быть измерено, например, расчетом среднего числа смертей, связанных с заболеванием на единицу времени после начала лечения активным соединением. Уменьшение коэффициента смертности популяции может также быть измерено, например, расчетом для популяции среднего числа смертей, связанных с заболеванием, на единицу времени после завершения первого круга терапии активным соединением.
Лечение рака может приводить к уменьшению скорости роста опухоли. Предпочтительно после лечения рака скорость роста опухоли уменьшается по меньшей мере на 5% по сравнению со скоростью до терапии; более предпочтительно после лечения рака скорость роста опухоли уменьшается по меньшей мере на 10%; более предпочтительно уменьшается по меньшей мере на 20%; более предпочтительно уменьшается по меньшей мере на 30%; более предпочтительно уменьшается по меньшей мере на 40%; более предпочтительно уменьшается по меньшей мере на 50%; еще более предпочтительно уменьшается по меньшей мере на 50%; наиболее предпочтительно уменьшается по меньшей мере на 75%. Скорость роста опухоли может быть измерена любыми воспроизводимыми способами. Скорость роста опухоли может быть измерена по изменению диаметра опухоли с течением времени.
Лечение рака может приводить к уменьшению повторного роста опухоли. Предпочтительно после лечения рака возобновление роста опухоли меньше чем 5%; более предпочтительно возобновление роста опухоли меньше чем 10%; более предпочтительно меньше чем 20%; более предпочтительно меньше чем 30%; более предпочтительно меньше чем 40%; более предпочтительно меньше чем 50%; еще более предпочтительно менее чем 50%, наиболее предпочтительно возобновление роста опухоли меньше чем 75%. Возобновление роста опухоли может быть измерено любыми воспроизводимыми способами. Возобновление роста опухоли может быть измерено по увеличению диаметра опухоли после предыдущего уменьшения размеров после лечения. Уменьшение возобновления роста опухоли определяют по отсутствию повторного возникновения опухолей после прекращения лечения.
Терапия или предотвращение нарушения клеточного роста может приводить к уменьшению скорости клеточной пролиферации. Предпочтительно после терапии скорость клеточной пролиферации уменьшается по меньшей мере на 5%; более предпочтительно по меньшей мере на 10%; более предпочтительно по меньшей мере на 20%; более предпочтительно по меньшей мере на 30%; более предпочтительно по меньшей мере на 40%; более предпочтительно по меньшей мере на 50%; еще более предпочтительно менее чем 50%, наиболее предпочтительно по меньшей мере на 75%. Скорость клеточной пролиферации может быть измерена любыми воспроизводимыми способами. Скорость клеточной пролиферации может быть измерена, например, путем измерения числа делящихся клеток в образце ткани за единицу времени.
Лечение или предотвращение нарушения клеточного роста может приводить к уменьшению пропорции делящихся клеток. Предпочтительно после лечения пропорция делящихся клеток уменьшается по меньшей мере на 5%; более предпочтительно по меньшей мере на 10%; более предпочтительно по меньшей мере на 20%; более предпочтительно по меньшей мере на 30%; более предпочтительно по меньшей мере на 40%; более предпочтительно по меньшей мере на 50%; еще более предпочтительно по меньшей мере на 50%; и наиболее предпочтительно по меньшей мере на 75%. Пропорция делящихся клеток может быть измерена любыми воспроизводимыми способами. Предпочтительно пропорция делящихся клеток может быть измерена, например, количественным выражением числа делящихся клеток по отношению к числу неделящихся клеток в образце ткани. Пропорция делящихся клеток может быть эквивалентна митотическому индексу.
Лечение или предотвращение нарушения клеточного роста может приводить к уменьшению размера области или зоны клеточной пролиферации. Предпочтительно после терапии размер области или зоны клеточной пролиферации уменьшается по меньшей мере на 5% по отношению к размеру до терапии; более предпочтительно по меньшей мере на 10%; более предпочтительно уменьшается по меньшей мере на 20%; более предпочтительно уменьшается по меньшей мере на 30%; более предпочтительно уменьшается по меньшей мере на 40%; более предпочтительно уменьшается по меньшей мере на 50%; еще более предпочтительно уменьшается по меньшей мере на 50%; и наиболее предпочтительно уменьшается по меньшей мере на 75%. Размер области или зоны клеточной пролиферации может быть измерен любыми воспроизводимыми способами. Размер области или зоны клеточной пролиферации может быть измерен как диаметр или ширина области или зоны клеточной пролиферации.
Терапия или предотвращение нарушения клеточного роста может приводить к уменьшению числа или пропорции клеток, имеющих аномальный внешний вид или морфологию. Предпочтительно после терапии число клеток, имеющих аномальный внешний вид или морфологию, уменьшается по отношению к их размеру до терапии; более предпочтительно уменьшается по меньшей мере на 10%; более предпочтительно уменьшается по меньшей мере на 20%; более предпочтительно уменьшается по меньшей мере на 30%; более предпочтительно уменьшается по меньшей мере на 40%; более предпочтительно уменьшается, по меньшей мере на 50%; еще более предпочтительно уменьшается по меньшей мере на 50%; и наиболее предпочтительно уменьшается по меньшей мере на 75%. Аномальный внешний вид и морфология клеток могут быть измерены любыми воспроизводимыми способами. Аномальный внешний вид и морфология клеток могут быть измерены микроскопией, например при использовании инвертированного микроскопа для культуры тканей. Аномальный внешний вид и морфология клеток может принимать форму ядерного плейоморфизма.
Как используется здесь термин «выборочно» обозначает тенденцию к встречаемости с более высокой частотой в одной популяции, чем в другой популяции. Сравниваемые популяции могут представлять собой популяции клеток. Предпочтительно соединение по настоящему изобретению или его фармацевтически приемлемая соль, пролекарство, метаболит, полиморф или сольват действует избирательно на раковую или предраковую клетку, но не на нормальную клетку. Предпочтительно соединение по настоящему изобретению или его фармацевтически приемлемая соль, пролекарство, метаболит, полиморф или сольват действует избирательно, модулируя одну молекулярную мишень (например, c-met), но не модулируя в значительной степени другую молекулярную мишень (например, протеинкиназу С). Изобретение также обеспечивает способ селективного ингибирования активности фермента, такого как киназа. Предпочтительно событие происходит селективно в популяции A по сравнению с популяцией B, если оно происходит в два раза чаще в популяции A по сравнению с популяцией B. Событие происходит селективно, если оно происходит в пять раз чаще в популяции A по сравнению с популяцией B. Событие происходит селективно, если оно происходит более чем в десять раз чаще в популяции A по сравнению с популяцией B; более предпочтительно более чем в пятьдесят раз чаще в популяции A по сравнению с популяцией B; еще более предпочтительно более чем в 100 раз чаще в популяции A по сравнению с популяцией B и наиболее предпочтительно более чем в 1000 раз чаще в популяции A по сравнению с популяцией B. Например, о клеточной смертности будет сказано, что она происходит селективно в раковых клетках, если она происходит более чем в два раза чаще в раковых клетках по сравнению с нормальными клетками.
Соединение по настоящему изобретению или его фармацевтически приемлемая соль, пролекарство, метаболит, полиморф или сольват могут модулировать активность молекулярной мишени (например, c-met). Модулирование относится к стимуляции или ингибированию активности молекулярной мишени. Предпочтительно соединение по настоящему изобретению модулирует активность молекулярной мишени по меньшей мере в 2 раза по сравнению с активностью молекулярной мишени при тех же условиях, отличающихся только присутствием указанного соединения. Более предпочтительно модулирует активность молекулярной мишени, если оно стимулирует или ингибирует активность молекулярной мишени по меньшей мере в 5 раз, по меньшей мере в 10 раз, по меньшей мере в 20 раз, по меньшей мере в 50 раз, по меньшей мере в 100 раз, по сравнению с активностью молекулярной мишени при тех же условиях, отличающихся только присутствием указанного соединения. Активность молекулярной мишени может быть измерена любыми воспроизводимыми способами. Активность молекулярной мишени может быть измерена in vitro или in vivo. Например, активность молекулярной мишени может быть измерена in vitro путем анализа ферментативной активности или анализа ДНК связывания, или активность молекулярной мишени может быть измерена in vivo анализом на экспрессию оцениваемого гена.
Соединение по настоящему изобретению или его фармацевтически приемлемая соль, пролекарство, метаболит, полиморф или сольват не модулируют значительно активность молекулярной мишени, если добавление соединения не стимулирует или не ингибирует активность молекулярной мишени более чем на 10% по отношению к активности молекулярной мишени при тех же условиях, отличающихся только присутствием указанного соединения.
Как используется в настоящем описании, термин «изофермент селективный» означает предпочтительное ингибирование или стимуляцию первой изоформы фермента по сравнению со второй изоформой фермента (например, предпочтительное ингибирование или стимуляцию изофермента альфа-киназы по сравнению с изоферментом бета-киназой). Предпочтительно соединение по настоящему изобретению демонстрирует минимально четырехкратное отличие, предпочтительно десятикратное отличие, более предпочтительно пятидесятикратное отличие в дозе, требуемой для достижения биологического действия. Предпочтительно соединение по настоящему изобретению демонстрирует указанное отличие в диапазоне ингибирования и пример отличия представляет собой IC50, т.е. 50% ингибирование интересующей молекулярной мишени.
Введение соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, полиморфа или сольвата в клетку или нуждающемуся в этом пациенту может приводить к модуляции (т.е. стимуляции или ингибированию) активности интересующей киназы.
Изобретение обеспечивает способы оценки биологической активности композиции, включающей (a) (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, имеющий хиральную чистоту более чем 99%, как определено ВЭЖХ, и содержащий менее чем 1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и фармацевтически эффективный носитель; (b) полиморф формы 1 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8 и 14,1 °2θ при использовании Cu Kα излучения; или (с) полиморф формы 2 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9 и 12 °2θ при использовании Cu Kα излучения.
В одном из способов можно использовать анализ ферментативной активности. В одном конкретном анализе ферментативной активности ферментативная активность представляет собой киназную. Как используется в настоящем описании, «киназа» относится к большому классу ферментов, которые катализируют перенос γ-фосфат от АТФ к гидроксильной группе на боковой цепи Ser/Thr или Tyr в белках и пептидах и непосредственно участвуют в контроле различных важных функций клеток, возможно наиболее значительные: сигнальная трансдукция, дифференциация и пролиферация. Подсчитано, что существует примерно 2000 различных протеинкиназ в теле человека, и хотя каждая из них фосфорилирует определенные белковые/пептидные субстраты, они все связывают второй субстрат АТФ в высококонсервативной полости. Примерно 50% известных онкогенных продуктов представляют собой протеин-тирозин киназы (PTK) и, было показано, что их киназная активность ведет к образованию клеток. Предпочтительно анализируемая киназа представляет собой тирозинкиназу.
Изменение ферментативной активности, вызванное соединениями по настоящему изобретению, может быть измерено в описанных анализах. Изменение ферментативной активности можно характеризовать как изменение фосфорилирования определенных субстратов. Как использовано в настоящем описании, «фосфорилирование» относится к добавлению фосфатной группы к субстрату, включающему белки и органические молекулы, и играет важную роль в регуляции биологической активности белков. Предпочтительно анализируемое и измеряемое фосфорилирование включает добавление фосфатной группы к остаткам тирозина. Субстрат может представлять собой пептид или белок.
В некоторых анализах используют иммунологические реагенты, например, антитела и антигены. Флуоресценцию можно использовать при измерении ферментативной активности в некоторых анализах. Как использовано в настоящем описании, «флуоресценция» относится к процессу, в ходе которого молекула испускает фотон в результате поглощения самой молекулой входящего фотона с более высокой энергией.
Введение соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, полиморфа или сольвата в клетку или пациенту, который в этом нуждается, может приводить к модуляции (т.е. стимуляции или ингибированию) активности c-Met. Как используется в настоящем описании, активность c-Met относится к любой биологической функции или активности, которая осуществляется c-Met. Например, функция c-Met включает фосфорилирование белков-мишеней по каскаду пути. Другие функции c-Met включают автофосфорилирование, связывание адаптора белка, такого как Gab-1, Grb-2, Shc, SHP2 и c-Cb1, и активацию переносчиков сигнала, таких как Ras, Src, PI3K, PLC-γ, STAT, ERK1 и 2 и FAK.
Введение соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, полиморфа или сольвата в клетку или пациенту, который в этом нуждается, может приводить к модуляции (т.е. стимуляции или ингибированию) активности ERK 1 или ERK 2 или обоих. Как используется в настоящем описании, активность ERK 1 или ERK 2 относится к любой биологической функции или активности, которая осуществляется ERK 1 или ERK 2, например, функция ERK 1 или ERK 2 включает фосфорилирование белков-мишеней по каскаду пути.
Активация относится к помещению композиции вещества (например, белка или нуклеиновой кислоты) в состояние, пригодное для реализации желаемой биологической функции. Композиция вещества, которое может быть активировано, также имеет неактивированное состояние. Активированная композиция вещества может обладать ингибирующей или стимулирующей функцией или и той, и другой.
Повышение относится к увеличению желаемой биологической активности композиции вещества (например, белка или нуклеиновой кислоты). Повышение может происходить посредством увеличения концентрации композиции вещества.
Как использовано в настоящем описании, «путь контрольной точки клеточного цикла» относится к биохимическому пути, который включает модуляцию контрольной точки клеточного цикла. Путь контрольной точки клеточного цикла может иметь стимулирующее или ингибирующее действие, или и то, и другое на одну или несколько функций, включающих контрольную точку клеточного цикла. Путь контрольной точки клеточного цикла включает по меньшей мере две композиции вещества, предпочтительно белков, обе из которых влияют на модуляцию пути контрольной точки клеточного цикла. Предпочтительно путь контрольной точки клеточного цикла представляет собой биохимический сигнальный путь.
Как использовано в настоящем описании, «регулятор контрольной точки клеточного цикла» относится к композиции вещества, которое может участвовать, по меньшей мере частично, в модуляции контрольной точки клеточного цикла. Регулятор контрольной точки клеточного цикла может оказывать стимулирующее или ингибирующее действие, или и то и другое на одну или несколько функций, включающих контрольную точку клеточного цикла. Регулятор контрольной точки клеточного цикла может представлять собой белок или не белок.
Лечение рака или нарушения клеточного роста может приводить к гибели клеток и, предпочтительно гибель клеток приводит к уменьшению на по меньшей мере 10% клеток в популяции. Более предпочтительно гибель клеток приводит к уменьшению на по меньшей мере 20%, более предпочтительно уменьшению на по меньшей мере 30%, более предпочтительно уменьшению на по меньшей мере 40%, более предпочтительно уменьшению на по меньшей мере 50%, наиболее предпочтительно уменьшению на по меньшей мере 75%. Число клеток в популяции может быть измерено любыми воспроизводимыми способами. Число клеток в популяции может быть измерено сортировкой флуоресцентно-активированных клеток (FACS), иммунофлуоресцентной микроскопией и световой микроскопией. Способы измерения гибели клеток представляют собой такие, как показано в Li et al. (2003) Proc. Natl. Acad. Sci. USA. 100(5): 2674-8. В одном из аспектов гибель клеток происходит путем апоптоза.
Предпочтительно эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, полиморфа или сольвата не представляет собой в значительной степени цитотоксическое по отношению к нормальным клеткам. Терапевтически эффективное количество соединения не представляет собой в значительной степени цитотоксическое по отношению к нормальным клеткам, если введение соединения в терапевтически эффективном количестве не вызывает гибель клеток более 10% нормальных клеток. Терапевтически эффективное количество соединения не воздействует значительно на жизнеспособность нормальных клеток, если назначение соединения в терапевтически эффективном количестве не вызывает гибель клеток более 10% нормальных клеток. В одном из аспектов гибель клеток происходит путем апоптоза.
Контакт клетки с соединением по настоящему изобретению или его фармацевтически приемлемой солью, пролекарством, метаболитом, полиморфом или сольватом может вызывать активацию гибели клеток селективно в раковых клетках. Введение пациенту, который в этом нуждается, соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, полиморфа или сольвата может индуцировать или активировать гибель клеток селективно в раковых клетках. Контакт клетки с соединением по настоящему изобретению или его фармацевтически приемлемой солью, пролекарством, метаболитом, полиморфом или сольватом может вызывать активацию гибели клеток селективно в одной или нескольких клетках, затронутых нарушением деления клеток. Предпочтительно введение пациенту, который в этом нуждается, соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, полиморфа или сольвата может индуцировать или активировать гибель клеток селективно в одной или нескольких клетках, затронутых нарушением деления клеток.
Настоящее изобретение относится к способу лечения или предотвращения рака путем введения соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, полиморфа или сольвата пациенту, который в этом нуждается, где введение соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, полиморфа или сольвата приводит к одному или нескольким пунктам из следующих: аккумуляция в клетках в Gl и/или S фазе клеточного цикла, цитотоксичность посредством гибели клеток в раковых клетках без значительного количества гибели клеток в нормальных клетках, противоопухолевая активность у животных с терапевтическим индексом по меньшей мере 2 и активация контрольной точки клеточного цикла. Как используется в настоящем описании, «терапевтический индекс» представляет собой максимальную дозу, разделенную на эффективную дозу.
Специалист в данной области может обратиться к общим исходным текстам для подробного описания известных способов, обсуждаемых здесь, или эквивалентных технологических способов. Указанные тексты включают Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Inc. (2005); Sambrook et al., Molecular Cloning, A Laboratory Manual (3d ed.), Cold Spring Harbor Press, Cold Spring Harbor, New York (2000); Coligan et al. , Current Protocols in Immunology, John Wiley & Sons, N.Y.; Enna et al., Current Protocols in Pharmacology, John Wiley & Sons, N.Y.; Fingl et al., The Pharmacological Basis of Therapeutics (1975), Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA, 18th edition (1990). К указанным текстам можно, несомненно, обращаться при приготовлении и использовании аспекта по настоящему изобретению.
Как используется в настоящем описании, «комбинированное лечение», или «сотерапия» включает введение соединения по настоящему изобретению и по меньшей мере одного второго агента в качестве части специального режима лечения, предназначенного для обеспечения благоприятного эффекта от совместного действия указанных терапевтических средств. Благоприятный эффект от совместного действия указанных терапевтических средств включает, но не ограничивается перечисленным, фармакокинетическое или фармакодинамическое совместное действие, происходящее из-за комбинации терапевтических средств. Введение указанных терапевтических средств в комбинации обычно проводят в течение определенного периода времени (обычно минут, часов, дней или недель, в зависимости от выбранной комбинации). «Комбинированное лечение» может, но обычно не предполагает введение двух или более из указанных терапевтических средств в виде части отдельных режимов монотерапии, которые случайно и произвольно приводят к комбинации по настоящему изобретению.
«Комбинированное лечение» предназначено охватить введение всех указанных терапевтических средств последовательно, где каждое терапевтическое средство вводят в различное время, а также введение указанных терапевтических средств или по меньшей мере двух из терапевтических средств в значительной степени одновременно. В значительной степени одновременное введение может быть осуществлено, например, путем введения пациенту одной капсулы, имеющей заданное соотношение каждого терапевтического средства или нескольких единых капсул для каждого из терапевтических средств. Последовательное или в значительной степени одновременное введение каждого терапевтического средства можно производить любым приемлемым способом, включая, но не ограничиваясь перечисленным, пероральные способы, внутривенные способы, внутримышечные способы и прямую абсорбцию через слизистую мембрану тканей. Терапевтические средства можно вводить одинаковым способом или различными способами. Например, первое терапевтическое средство из выбранной комбинации можно вводить внутривенной инъекцией, тогда как второе терапевтическое средство комбинации можно вводить перорально. В качестве альтернативы, все терапевтические средства можно вводить перорально или все терапевтические средства можно вводить внутривенной инъекцией. Последовательность, в которой вводят терапевтические средства, не представляет собой узко критичную.
«Комбинированное лечение» также охватывает введение терапевтических средств. Как описано выше, в дополнительной комбинации с другими биологически активными ингредиентами и нелекарственными лечениями (например, хирургия или радиационная терапия). Если комбинированное лечение дополнительно включает нелекарственное лечение, нелекарственное лечение можно проводить в течение любого приемлемого времени, настолько долго пока достигается благоприятный эффект от совместного действия комбинации терапевтических средств и нелекарственного лечения. Например, в приемлемых случаях, положительное действие все еще достигается, если нелекарственное лечение временно прекращают при введении терапевтических средств, возможно на дни и даже недели.
Соединение по настоящему изобретению или его фармацевтически приемлемая соль, пролекарство, метаболит, полиморф или сольват можно вводить в комбинации со вторым химотерапевтическим средством. Второе химотерапевтическое средство может представлять собой таксан, ингибитор ароматазы, антрациклин, лекарственный препарат, нацеленный на микротрубочки, лекарственный препарат яд топоизомеразы, целевое моноклональное или поликлональное антитело, ингибитор молекулярной мишени или фермента (например, ингибитор киназы) или лекарственный препарат аналог цитидина. Предпочтительно химотерапевтическое средство может представлять собой, но не ограничивается перечисленным, тамоксифен, ралоксифен, анастрозол, экземестан, летрозол, HERCEPTIN® (трастузумаб), GLEEVEC® (иматаниб), TAXOL® (паклитаксел), циклофосфамид, ловастатин, минозин, araC, 5-фторурацил (5-FU), метотрексат (MTX), TAXOTERE® (доцетаксел), ZOLADEX® (госерелин), винкристин, винбластин, нокодазол, тенипозид, этопосид, GEMZAR® (гемцитабин), эпотилон, навелбин, камптотецин, даунонибицин, дактиномицин, митоксантрон, амсакрин, доксорубицин (адриамицин), эпирубицин или идарубицин. Второе химотерапевтическое средство может представлять собой цитокин, такой как G-CSF (гранулоцитарный колониестимулирующий фактор). Соединение по настоящему изобретению или его фармацевтически приемлемая соль, пролекарство, метаболит, полиморф или сольват можно вводить в комбинации с радиационной терапией. Соединение по настоящему изобретению или его фармацевтически приемлемая соль, пролекарство, метаболит, полиморф или сольват можно вводить в комбинации со стандартной комбинацией химиотерапии такой как, но не ограниченной перечисленным, CMF (циклофосфамид, метотрексат и 5-фторурацил), CAF (циклофосфамид, адриамицин и 5-фторурацил), AC (адриамицин и циклофосфамид), FEC (5-фторурацил, эпирубицин и циклофосфамид), ACT или ATC (адриамицин, циклофосфамид и паклитаксел) или CMFP (циклофосфамид, монотрексат, 5-фторурацил и преднизон).
Соединение по настоящему изобретению или его фармацевтически приемлемая соль, пролекарство, метаболит, полиморф или сольват можно вводить с ингибитором фермента, такого как рецепторная или нерецепторная киназа. Рецепторная или нерецепторная киназа по изобретению представляют собой, например, тирозинкиназы или серотонин/треонин киназы. Ингибиторы киназ по изобретению представляют собой небольшие молекулы, полинуклеиновые кислоты, белки или антитела.
Примеры тирозинкиназ включают, но не ограничены перечисленным, бевацизумаб (мишени VEGF), BIBW 2992 (мишени EGFR и Erb2), цетуксимаб/эрбитукс (мишени Erb1), иматиниб/гливек (мишени Bcr-Ab1), трастузумаб (мишени Erb2), гефитиниб/иресса (мишени EGFR), раниубизумаб (мишени VEGF), пегаптиниб (мишени VEGF), эрлотиниб/тарцева (мишени Erb1), нилотиниб (мишени Bcr-Ab1), лапатиниб (мишени Erb1 или Erb2/Her2), GW-572016/лапатиниб дитосилат (мишени HER2/Erb2), панитумумаб/вектибикс (мишени EGFR), вадентиниб (мишени RET/VEGFR), E7080 (множественные мишени, включая RET и VEGFR), герцептин (мишени HER2/Erb2), PKI-166 (мишени EGFR), канертиниб/CI-1033 (мишени EGFR), сунитиниб/SU-11464/сутент (мишени EGFR и FLT3), матуцумаб/Emd7200 (мишени EGFR), EKB-569 (мишени EGFR), Zd6474 (мишени EGFR и VEGFR), PKC-412 (мишени VEGR и FLT3), ваталаниб/Ptk787/ZK222584 (мишени VEGR), CEP-701 (мишени FLT3), SU5614 (мишени FLT3), MLN518 (мишени FLT3), XL999 (мишени FLT3), VX-322 (мишени FLT3), Azd0530 (мишени SRC), BMS-354825 (мишени SRC), SKI-606 (мишени SRC), CP-690 (мишени JAK), AG-490 (мишени JAK), WHI-P154 (мишени JAK), WHI-P131 (мишени JAK), сорафениб/нексавар (мишени RAF киназа, VEGFR-1, VEGFR-2, VEGFR-3, PDGFR-β, KIT, FLT-3 и RET), дазатиниб/спрайсел (BCR/ABL и Src), AC-220 (мишени Flt3), AC-480 (мишени все HER белки, "panHER"), мотезаниб дифосфат (мишени VEGF1-3, PDGFR и c-kit), деносумаб (мишени RANKL, ингибирует SRC), AMG888 (мишени HER3) и AP24534 (множественные мишени, включая Flt3).
Примеры серин/треонинкиназ включают, но не ограничиваются перечисленным, рапамун (мишени mTOR/FRAP1), дефоролимус (мишени mTOR), сертикан/эверолимус (мишени mTOR/FRAP1), AP23573 (мишени mTOR/FRAP1), эрил/фазудил гидрохлорид (мишени RHO), флавопиридол (мишени CDK), селициклиб/CYC202/росковитрин (мишени CDK), SNS-032/BMS-387032 (мишени CDK), рубоксистаурин (мишени PKC), Pkc412 (мишени PKC), бриостатин (мишени PKC), KAI-9803 (мишени PKC), SF1126 (мишени PI3K), VX-680 (мишени Aurora киназа), Azdl 152 (мишени Aurora киназа), Arry-142886/AZD-6244 (мишени MAP/MEK), SCIO-469 (мишени MAP/MEK), GW681323 (мишени MAP/MEK), CC-401 (мишени INK), CEP-1347 (мишени INK) и PD 332991 (мишени CDK).
Предпочтительное комбинированное лечение включает, но не ограничено перечисленным, (а) (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, имеющий хиральную чистоту более чем 99%, как определено ВЭЖХ, и содержащий менее чем 1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и фармацевтически эффективный носитель; (b) полиморф формы 1 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8 и 14,1 °2θ при использовании Cu Kα излучения, и один или несколько фармацевтически приемлемых носителей или эксципиентов; или (с) полиморф формы 2 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9 и 12 °2θ при использовании Cu Kα излучения, и один или несколько фармацевтически приемлемых носителей или эксципиентов, вводимые в комбинации с эрлонибом, (а) (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, имеющий хиральную чистоту более чем 99%, как определено ВЭЖХ, и содержащий менее чем 1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и фармацевтически эффективный носитель; (b) полиморф формы 1 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8 и 14,1 °2θ при использовании Cu Kα излучения, и один или несколько фармацевтически приемлемых носителей или эксципиентов; или (с) полиморф формы 2 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9 и 12 °2θ при использовании Cu Kα излучения, и один или несколько фармацевтически приемлемых носителей или эксципиентов, вводимые в комбинации с гемцитабином, и (а) (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, имеющий хиральную чистоту более чем 99%, как определено ВЭЖХ, и содержащий менее чем 1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и фармацевтически эффективный носитель; (b) полиморф формы 1 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8 и 14,1 °2θ при использовании Cu Kα излучения, и один или несколько фармацевтически приемлемых носителей или эксципиентов; или (с) полиморф формы 2 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9 и 12 °2θ при использовании Cu Kα излучения, и один или несколько фармацевтически приемлемых носителей или эксципиентов, вводимые в комбинации с сорафинибом. В определенных вариантах осуществления субъект или пациент получает комбинацию эрлотиниба, вводимого в количестве 150 мг раз в день, в комбинации с (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом, вводимым в количестве 360 мг дважды в день. В других вариантах осуществления субъект или пациент получает комбинацию гемицитабина, вводимого в количестве 1000 мг/м2 внутривенной инъекцией в течение 30 минут еженедельно, в комбинации с (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом, вводимым в количестве 360 мг перорально дважды в день или в количестве 120 мг перорально дважды в день. В другом варианте осуществления субъект или пациент получает комбинацию сорафиниба, вводимого в количестве 200 мг дважды в день, в комбинации с (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом, вводимым в количестве 360 мг дважды в день. Предпочитаемая форма дозировки для (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона включает, но не ограничена перечисленным, капсулу и таблетку.
Фармацевтические композиции
Настоящее изобретение также обеспечивает фармацевтические композиции, включающие (а) (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, имеющий хиральную чистоту более чем 99%, как определено ВЭЖХ, и содержащий менее чем 1% (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и фармацевтически эффективный носитель; (b) полиморф формы 1 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8 и 14,1 °2θ при использовании Cu Kα излучения, и один или несколько фармацевтически приемлемых носителей или эксципиентов; или (с) полиморф формы 2 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, характеризуемый порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9 и 12 °2θ при использовании Cu Kα излучения, и один или несколько фармацевтически приемлемых носителей или эксципиентов.
«Фармацевтическая композиция» представляет собой состав, содержащий соединения по настоящему изобретению в форме, пригодной для введения пациенту. В одном варианте осуществления фармацевтическая композиция представлена нерасфасованной или в форме однократной дозировки. Форма однократной дозировки представляет собой любую из разнообразия форм, включая, например, капсулу, пакет для внутривенного вливания, таблетку, одно нажатие на аэрозольный ингалятор или флакон. Количество активного ингредиента (например, состав описанного соединения или его соли, гидрата, сольвата или изомера) в однократной дозе представляет собой эффективное количество и изменяется, согласно конкретному используемому лечению. Специалист в данной области техники поймет, что иногда необходимо делать рутинные изменения дозы, в зависимости от возраста и состояния пациента. Доза будет также зависеть от способа введения. Предполагается разнообразие способов, включая пероральное, легочное, ректальное, парентеральное, чрескожное, подкожное, внутривенное, внутримышечное, внутрибрюшинное, ингаляционное, буккальное, подъязычное, внутриплевральное, субдуральное, интраназальное и т.п. Форма дозировки для местного или чрескожного введения соединения по настоящему изобретению включает порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и аэрозоли. В одном варианте осуществления активный компонент смешивают в стерильных условиях с фармацевтически пригодным носителем и с любыми требуемыми консервантами, буферами или пропеллентами.
Как используется в настоящем описании, фраза «фармацевтически приемлемый» относится к тем компонентам, материалам, композициям, носителям и/или лекарственным формам, которые в объеме результатов тщательной медицинской оценки пригодны для использования в контакте с тканями человеческого существа и животных без излишней токсичности, раздражения, аллергического ответа или других проблем, или осложнений, соизмеримы с допустимым соотношением польза/риск.
«Фармацевтически приемлемый эксципиент» обозначает эксципиент, который используют в получении фармацевтической композиции, который представляет собой в общем безопасный, нетоксичный и ни биологически, ни другим образом не являющийся нежелательным, и включает эксципиент, который пригоден для ветеринарного использования, а также для фармацевтического использования человеком. «Фармацевтически приемлемый эксципиент», как используется в спецификации и формуле изобретения, включает как один, так и несколько таких эксципиентов.
Фармацевтическая композиция по настоящему изобретению сформулирована, чтобы быть сопоставимой с предполагаемым способом введения. Примеры способов введения включают парентеральное (например, внутривенное, внутрикожное, подкожное), пероральное (например, ингаляция), чрескожное (местное) и чресслизистое введение. Растворы и суспензии, используемые для парентерального, внутрикожного или подкожного применения могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекции, физиологический раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для достижения тонуса, такие как хлорид натрия или декстроза. рН можно устанавливать при использовании кислот или оснований, таких как соляная кислота или гидрохлорид натрия. Парентеральный препарат может находиться в ампуле, одноразовом шприце или во флаконах с несколькими дозами, изготовленных из стекла или пластика.
Соединение или фармацевтическую композицию по изобретению можно вводить пациенту при использовании большого числа хорошо известных способов, используемых в настоящее время для химиотерапии. Например, для лечения различных видов рак, соединение по изобретению можно инъецировать непосредственно в опухоли, инъецировать в кровяное русло или полости тела или вводить перорально или наносить на кожу при использовании пластырей. Выбранная доза должна быть достаточной для того, чтобы лечение было эффективным, но не настолько высокой, чтобы вызывать неприемлемые побочные эффекты Состояние заболевания (например, рак, предрак и т.п) и здоровья пациента следует предпочтительно тщательно отслеживать в течение достаточного периода после лечения.
Термин «терапевтически эффективное количество», как используется в настоящем описании, относится к количеству фармацевтического агента для лечения, облегчения или предотвращения определенного заболевания или состояния, или для демонстрации определяемого терапевтического или ингибирующего действия. Действие может быть определено любым аналитическим способом, известным в данной области. Точное эффективное количество для пациента будет зависеть от массы тела, размера и здоровья пациента; природы и степени состояния; и терапевтических средств или комбинации терапевтических средств, выбранных для введения. Терапевтически эффективные количества для конкретной ситуации могут быть определены путем рутинного эксперимента, который входит в квалификацию и усмотрение врача-клинициста. В предпочтительном аспекте заболевание или состояние, подвергаемое лечению, представляет собой рак. В другом аспекте заболевание или состояние, подвергаемое лечению, представляет собой нарушение клеточной пролиферации.
Для любого соединения терапевтически эффективное количество может быть оценено изначально либо в анализах клеточной культуры, например клеток новообразования, либо на животной модели, обычно крысах, мышах, кроликах, собаках или свиньях. Животная модель может быть также использована для определения приемлемого диапазона концентрации и способа введения. Такая информация может быть затем использована для определения приемлемых доз и способов введения человеку. Терапевтическая/профилактическая эффективность и токсичность могут быть определены по стандартным фармацевтическим процедурам в клеточных культурах или на экспериментальных животных, например, ED50 (эффективная терапевтическая доза для 50% популяции) и LD50 (летальная доза для 50% популяции). Соотношение дозы между токсическим и терапевтическим действием представляет собой терапевтический индекс, и он может быть выражен как отношение LD50/ED50. Фармацевтические композиции, которые демонстрируют большие терапевтические индексы представляют собой предпочтительные. Дозировка может варьировать в этом соотношении в зависимости от используемой формы дозировки, чувствительности пациента и способа введения.
Дозу и введение устанавливают для обеспечения достаточных концентраций активного(ых) агента(ов) или для поддержания желаемого эффекта. Факторы, которые можно принимать во внимание, включают опасность состояния болезни, общее здоровье пациента, возраст, вес и пол пациента, диету, время и частоту введения, лекарственную(ые) комбинацию(и), реакционную чувствительность, толерантность/ответ на лечение. Действующие в течение длительного времени фармацевтические композиции можно вводить ежедневно, каждые от 3 до 4 дней, каждую неделю или раз в каждые две недели, в зависимости от периода полувыведения и скорости и почечного клиренса конкретного состава.
Фармацевтические композиции, содержащие активные соединения по настоящему изобретению, могут быть изготовлены хорошо известным способом, например, при помощи способов обычного смешивания, растворения, гранулирования, изготовления драже, растирания в порошок, эмульгирования, инкапсулирования, включения или лиофилизации. Фармацевтические композиции могут быть изготовлены хорошо известным способом при использовании одного или нескольких фармацевтически приемлемых носителей, включая эксципиенты и/или добавки, облегчающие переработку активных соединений в составы, которые могут быть использованы фармацевтически. Конечно, пригодные составы зависят от выбранного способа введения.
Фармацевтические композиции, пригодные для использования в виде инъекций, включают стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильного раствора или инъекции для немедленного введения. Для внутривенного введения пригодные носители включают физиологический солевой раствор, бактериостатическую воду, Cremophor EL™ (BASF, Parsippany, N.J.) или физиологический раствор с фосфатным буфером (PBS). Во всех случаях композиция должна быть стерильной и должна быть жидкой до такой степени, чтобы имелась возможность легкого введения через иглу шприца. Она должна быть стабильной при условиях изготовления и хранения и должна быть защищена от загрязняющего действия со стороны микроорганизмов, таких как бактерии и грибы. Носитель должен представлять собой растворитель или среду для дисперсии, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и пригодные их смеси. Может поддерживаться надлежащее жидкое состояние, например, путем использования покрытия, такого как лецитин, за счет поддержания размера частиц в случае дисперсии, и путем использования поверхностно-активных веществ. Предотвращение действия микроорганизмов может достигать путем различных антибактериальных и противогрибковых агентов, например, парабена, хлорбутанола, фенола, аскорбиновой кислоты, тимерозала и т.п. Во многих случаях будет предпочтительным включать в композицию изотонические агенты, например, сахара, полиспирты, такие как маннит, сорбит и/или гидроксид натрия. Длительная абсорбция инъецируемой композиции может быть осуществлена путем включения в композицию агента, который задерживает абсорбцию, например, моностеарата алюминия и желатина.
Стерильные растворы для инъекций могут быть получены путем включения активного соединения в требуемое количество пригодного растворителя с одним из или комбинацией ингредиентов, перечисленных выше, при необходимости, с последующей стерилизацией фильтрованием. Обычно дисперсии получают путем включения активного соединения в стерильный носитель, который содержит основную диспергирующую среду для дисперсии и требуемые другие ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных растворов для инъекций, способы получения представляют собой сушку под вакуумом и лиофилизацию, которые приводят к порошку активного ингредиента и, кроме того, любого дополнительного желаемого ингредиента из их предварительного раствора, стерилизованного фильтрованием.
Пероральные композиции обычно включают инертные разбавители или съедобные фармацевтически приемлемые носители. Они могут быть заключены в желатиновые капсулы или спрессованы в таблетки. В целях перорального терапевтического введения активное соединение может быть введено с эксципиентами и использовано в форме таблеток, пастилок или капсул. Пероральные композиции также могут быть получены при использовании жидкого носителя для использования в качестве ополаскивателя для рта, где соединение в жидком носителе применяют перорально и полоскают рот и выплевывают или проглатывают. Фармацевтически применимые связующие агенты и/или вспомогательные материалы могут быть включены как часть композиции. Таблетки, пилюли, капсулы, пастилки и т.п. могут содержать любой из следующих ингредиентов или компоненты сходной природы: связующее, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал, прежелатинизированный крахмал или лактоза, дезинтегрирующий агент, такой как натрий-кроскармелоза, натрий-крахмалгликолят, альгиновая кислота, примогель, кросповидон или кукурузный крахмал; лубрикант, такой как стеарат магния, стеариновая кислота, стеарилфумарат натрия или Sterotes; глидант, такой как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как мята, метилсалицилат или ароматизатор апельсин.
Для введения путем ингаляции соединения доставляют в форме аэрозольного спрея из контейнера под давлением или диспенсера, который содержит пригодный вытесняющий газ, например, гидрофторалканы, хлорфторуглероды, диоксид углерода, или распылителя.
Системное введение может также осуществляться как чресслизистое или чрескожное. Для чресслизистого или чрескожного введения в составе используют проникающие вещества, пригодные для барьера, через который осуществляется проникновение. Такие проникающие вещества обычно известны в данной области техники, например, для чресслизистого введения, детергенты, желчные соли и производные фусидовой кислоты. Чресслизистое введение может осуществляться посредством использования назальных спреев или суппозиториев. Для чрескожного введения активные компоненты составляют в виде мазей, бальзамов, гелей или кремов, как обычно известно в данной области техники.
Активные соединения могут быть получены с фармацевтически приемлемыми носителями, которые будут защищать соединение от быстрого вывода из тела, такими как составы контролируемого высвобождения, включая импланты и системы микроинкапсулированной доставки. Могут быть использованы биоразрушаемые, биологически совместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры, полимолочная кислота или их смеси, или сополимеры, или сложные полиэфиры. Способы для получения таких составов будут очевидны специалисту в данной области техники. Вещества могут также быть коммерчески доступны от Alza Corporation и Nova Pharmaceuticals, Inc. В качестве фармацевтически приемлемых носителей могут также быть использованы суспензии липосом (включая липосомы, мишенями которых являются инфицированные клетки с моноклональными антителами к вирусным ангигенам). Они могут быть получены согласно способам, известным специалистам в данной области, например, как описано в патенте США № 4522811.
В особенности предпочтительно формулировать пероральные или парентеральные композиции в стандартных лекарственных формах для облегчения введения и однородности дозировки. Стандартная лекарственная форма, как используется в настоящем описании, относится к физически дискретным единицам, пригодным для единичных доз для лечения пациентов; каждая единица, содержит предварительно определенное количество активного соединения, рассчитанного для получения желаемого терапевтического эффекта и требуемого фармацевтического носителя. Спецификация стандартных лекарственных форм по изобретению направлена и непосредственно зависит от уникальных характеристик активного соединения и конкретного терапевтического эффекта, которого необходимо достичь.
В терапевтических применениях дозы фармацевтических композиций, используемых в соответствии с изобретением, варьируют в зависимости от, среди других факторов, которые влияют на выбор дозировки, средства, возраста, веса и клинического состояния пациента, которого лечат, а также опыта и решения клинического или практического врача, назначающего лечение. Обычно доза должна быть достаточной для того, чтобы вызвать замедление и, предпочтительно регрессию, роста опухолей и также, предпочтительно, вызывая полную регрессию рака. Дозировки могут быть в диапазоне от примерно 0,1 мг/кг в день до примерно 5000 мг/кг в день. В предпочтительных аспектах дозировки могут быть в диапазоне от примерно 1 мг/кг в день до примерно 1000 мг/кг в день. В одном аспекте доза будет в диапазоне от примерно 0,1 мг/день до примерно 50 г/день; от примерно 0,1 мг/день до примерно 25 г/день; от примерно 0,1 мг/день до примерно 10 г/день; от примерно 0,1 мг/день до примерно 3 г/день или от примерно 0,1 мг/день до примерно 1 г/день в единой, разделенной или непрерывной дозах (указанную дозу можно регулировать для массы пациента в кг, площади поверхности тела в м2 и возраста в годах). В предпочтительных применениях дозировка может составлять примерно 400 миллиграммов два раза в день (b.i.d.). В конкретных применениях дозировка составляет 360 миллиграммов (мг) два раза в день (b.i.d.). Более предпочтительно форма дозировки представляет собой капсулу или таблетку и назначается как две или три капсулы или таблетки с комбинированной дозировкой 360 милиграммов (мг). Указанная форма дозировки вводится два раза в день с общей дозой 720 миллиграммов (мг). Эффективное количество фармацевтического средства представляет собой такое, которое обеспечивает объективно установленное улучшение, как видно клиническому врачу или другому квалифицированному наблюдателю. Например, регрессия опухоли у пациента может быть измерена со ссылкой на диаметр опухоли. Уменьшение диаметра опухоли указывает на регрессию. На регрессию также указывает неспособность опухоли рецидивировать после окончания лечения. Как используется в настоящем описании, термин «способ эффективной дозы» относится к количеству активного соединения для достижения желаемого биологического эффекта на пациента или клетку.
Фармацевтические композиции могут быть заключены в контейнер, упаковку или диспенсер вместе с инструкциями по введению.
Соединения по настоящему изобретению способны дополнительно образовывать соли. Все указанные формы также предполагаются в объеме заявленного изобретения.
Как используется в настоящем описании, «фармацевтически приемлемые соли» относятся к производным соединений по настоящему изобретению, где исходное соединение модифицировано получением его кислотных или основных солей. Примеры фармацевтически приемлемых солей включают, но не ограничиваются перечисленным, соли минеральных или органических кислот основных остатков, таких как амины, щелочные или органические соли кислых остатков, таких как карбоновые кислоты и т.п. Фармацевтически приемлемые соли включают традиционные нетоксичные соли или четвертичные аммониевые соли исходного соединения, полученные, например, из нетоксичных неорганических или органических кислот. Например, такие традиционные нетоксичные соли включают, но не ограничиваются перечисленным, соли, полученные из неорганических или органических кислот, выбранных из 2-ацетоксибензойной, 2-гидроксиэтансульфоновой, уксусной, аскорбиновой, бензолсульфоновой, бензойной, бикарбоновой, карбоновой, лимонной, этилендиаминтетрауксусной, этандисульфоновой, 1,2-этансульфоновой, фумаровой, глюкогептоновой, глюконовой, глутаминовой, гликолевой, гликолиларсалиновой, гексилрезорциновой, гидрабамовой, бромистоводородной, хлористоводородной, йодистоводородной, гидроксималеиновой, гидроксинафтойной, изэтионовой, молочной, лактобионовой, лаурилсульфоновой, малеиновой, яблочной, миндальной, метансульфоновой, нафтильной, азотной, щавелевой, памовой, пантотеновой, фенилуксусной, фосфорной, полигалактуроновой, пропионовой, салициловой, стеариновой, надуксусной, янтарной, сульфаминовой, сульфаниловой, серной, дубильной, винной, толуолсульфоновой и обычно встречающихся аминокислот, например глицина, аланина, фенилаланина, аргинина и т.д.
Другие примеры фармацевтически приемлемых солей включают гексановую кислоту, циклопентанпропионовую кислоту, пировиноградную кислоту, малоновую кислоту, 3-(4-гидроксибензоил)бензойную кислоту, коричную кислоту, 4-хлорбензолсульфоновую кислоту, 2-нафталинсульфоновую кислоту, 4-толуолсульфоновую кислоту, камфорсульфоновую кислоту, 4-метилбицикло[2.2.2]окт-2-ен-1-карбоновую кислоту, 3-фенилпропионовую кислоту, триметилуксусную кислоту, трет-бутилуксусную кислоту, муконовую кислоту и т.п. Настоящее изобретение также охватывает соли, образованные, когда кислый протон, присутствующий в исходном соединении, или замещается на ион металла, например ион щелочного металла, ион щелочноземельного металла или ион алюминия; или координируется органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и т.п.
Следует понимать, что все ссылки на фармацевтически приемлемые соли включают формы присоединения растворителя (сольваты) или кристаллические формы (полиморфы), как определено здесь, той же соли.
Соединения по настоящему изобретению могут быть также получены в форме сложных эфиров, например фармацевтически приемлемых сложных эфиров. Например, функциональная группа карбоксильной кислоты в соединении может быть превращена в его соответствующий сложный эфир, например метиловый, этиловый или другой сложный эфир. Также спиртовая группа в соединении может быть превращена в его соответствующий сложный эфир, например, ацетат, пропионат или другой сложный эфир.
Соединения по настоящему изобретению могут быть также получены в форме пролекарств, например, фармацевтически приемлемых пролекарств. Термины «про-лекарство» и «пролекарство» используют здесь взаимозаменяемо и относят к любому соединению, которое высвобождает активное исходное лекарственное средство in vivo. Поскольку известно, что пролекарства улучшают многочисленные желательные качества фармацевтических препаратов (например, растворимость, биодоступность, производство и т.д.), соединения по настоящему изобретению могут доставляться в форме пролекарства. Таким образом, изобретение предполагает охватить пролекарства заявляемых в настоящее время соединений, способы доставки указанных пролекарств и содержащие их композиции. «Пролекарства» предполагают включать любые ковалентно связанные носители, которые высвобождают активное исходное лекарственное средство по настоящему изобретению in vivo, если такое пролекарство вводят пациенту. Пролекарства по настоящему изобретению получают модификацией функциональных групп, присутствующих в соединении таким образом, что модификации расщепляются или при рутинных манипуляциях, или in vivo до исходного соединения. Пролекарства включают соединения по настоящему изобретению, в которых гидроксил, амино, сульфгидрил, карбокси или карбонильную группу связывают с любой группой, которая может отщепляться in vivo с образованием формы, не содержащей гидроксил, аминогруппу, сульфгидрил, карбоксигруппу или карбонильную группу, соответственно.
Примеры пролекарств включают, но не ограничиваются перечисленным, сложные эфиры (например, производные ацетата, диалкиламиноацетатов, гидрокси, фосфатов, сульфатов и бензоатов) и карбаматы (например, Ν,Ν-диметиламинокарбонил) гидроксильных функциональных групп, сложные эфиры (например, этиловые сложные эфиры, морфолиноэтанольные сложные эфиры) карбонильных функциональных групп, N-ацилпроизводные (например, N-ацетил) N-основания Манниха, Шиффовы основания и энаминоны аминофункциональных групп, оксимы, ацетали, кетали и еноловые сложные эфиры кетоновой и альдегидной функциональных групп в соединениях по изобретению и т.п., см. Bundegaard, H., Design of Prodrugs, p.1-92, Elesevier, New York-Oxford (1985).
Соединения или их фармацевтически приемлемые соли, сложные эфиры или пролекарства вводят перорально, назально, чрескожно, внутрилегочно, ингаляционно, буккально, подъязычно, внутрибрюшинно, подкожно, внутримышечно, внутривенно, ректально, внутриплеврально, субдурально и парентерально. В одном варианте осуществления соединение вводят перорально. Специалисту в данной области техники будут понятны преимущества определенных способов введения.
Схему приема, использующую соединение, выбирают в соответствии с многообразием факторов, включая тип, вид, возраст, массу, пол и медицинское состояние пациента; серьезность состояния, которое подвергают лечению, способ введения, почечную и печеночную функцию пациента, конкретные используемые соединение или его соль. Обычный специалист - врач или ветеринар могут легко определить и прописать эффективное количество лекарственного средства, требуемого для предотвращения, противостояния или остановки прогрессирования состояния.
Технологические способы составления и введения описанных соединений по изобретению могут быть найдены в Remington: the Science and Practice of Pharmacy, 19th edition, Mack Publishing Co., Easton, PA (1995). В одном варианте осуществления описанные здесь соединения и их фармацевтически приемлемые соли используют в фармацевтических препаратах в комбинации с фармацевтически приемлемым носителем или разбавителем. Пригодные фармацевтически приемлемые носители включают инертные твердые наполнители или разбавители и стерильные водные или органические растворы. Соединения будут представлены в таких фармацевтически приемлемых композициях в количествах, достаточных для обеспечения желаемой дозы в количестве в диапазоне, описанном здесь.
Все проценты и соотношения, используемые здесь, если не указано иначе, представлены по массе.
Другие особенности и преимущества настоящего изобретения понятны из различных примеров. Представленные примеры иллюстрируют различные компоненты и методологию, используемую в практике настоящего изобретения. Примеры не ограничивают заявленное изобретение. На основе представленного описания специалист в данной области может установить и применить другие компоненты и методологию, используемую в практике настоящего изобретения.
ПРИМЕРЫ
Пример 1
Настоящий пример описывает получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Лилолидин [CAS 102280-97-7] (70 кг) (Соединение 4 на схеме I) загружали в соответствующим образом очищенный и сухой реакционный сосуд и затем добавляли метил-трет-бутиловый простой эфир (МТБЭ) (375 кг). Литодидин может быть коммерчески приобретен или изготовлен, как описано в опубликованной заявке на патент США № 2006/0223760. Полученную партию взбалтывали в течение минимум 10 минут при 15-25°С. В отдельном сосуде получали раствор оксалилхлорида (56,6 кг) в МТБЭ (370 кг). Раствор лилолидина затем добавляли к раствору оксалилхлорида при такой скорости, чтобы поддерживать температуру ниже 32°С. Сосуд промывали дополнительным МТБЭ (162 кг) и добавляли к реакционной смеси. Партию перемешивали при 15-25°С в течение минимум двух часов перед ВЭЖХ анализом. Когда реакцию считали завершенной, добавляли метанол (90 кг) и партию перемешивали в течение по меньшей мере двух часов. Когда определяли завершение реакции при помощи ВЭЖХ, партию дистиллировали до примерно 80 галлонов. Не было необходимости в выделении промежуточного продукта, метилового сложного эфира 5,6-дигидро-4H-пирроло[3,2,1-ij] хинолин-l-ил) оксоацетиловой кислоты (Соединение 5 на Схеме I). К партии добавляли тетрагидрофуран (ТГФ) (840 кг) и опять уменьшали объем дистилляцией до примерно 80 галлонов. Указанный способ замены растворителя продолжали до достижения количества МТБЭ, присутствующего в партии, менее 1% масс. Новый сосуд загружали индол-3-ацетамидом [CAS 879-37-8] (61,3 кг) (Соединение 5a на Схеме I) и затем ТГФ (840 кг). Полученный раствор затем загружали в партию при такой скорости, чтобы температура поддерживалась при 15-25°С. Сосуд, содержащий раствор индол-3-ацетамида промывали ТГФ (140 кг) и смыв добавляли в партию. Пустой сосуд затем загружали раствором трет-бутоксида калия (1,6 M в ТГФ, 581 кг) и ТГФ (350 кг). Раствор также добавляли в партию и полученный раствор перемешивали при 20-32°С в течение минимум трех часов. Когда исходный материал был поглощен, что было подтверждено анализом ВЭЖХ, добавляли водный HCl (конц., 273 кг) при такой скорости, чтобы температура поддерживалась ниже 50°С. Партию перемешивали при 40-50°С в течение минимум 30 минут.
После того как было определено завершение реакции при помощи ВЭЖХ анализа, добавляли водный раствор гидроксида аммония (конц.), при этом поддерживая температуру реакции ниже 40°С, пока рН смеси не становилось 9-10. После добавления этилацетата (EtOAc) (462 кг) и перемешивания партии слои разделяли. Органический слой промывали рассолом (182 кг NaCl и 1022 кг воды). Полученный органический раствор дистиллировали до примерно одной трети исходного объема. Добавляли этанол (2B, 1120 кг) и продолжали дистилляцию до уменьшения объема партии до примерно 240 галлонов. Опять добавляли этанол (2B, 1120 кг) и объем уменьшали до 240 галлонов. Затем добавляли воду (1400 кг) к партии, чтобы вызвать осаждение продукта. Партию перемешивали в течение минимум двух часов и твердые вещества выделяли фильтрацией. Твердые вещества затем забирали дихлорметаном (DCM) (840 кг) и добавляли гептан (442 кг) для очистки продукта. После перемешивания партии в течение двух часов продукт выделяли фильтрацией. После кондиционирования на фильтре было получено примерно 115 кг (88%) of 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (Соединение 6 на Схеме I) в виде красного порошка. Это превращение Соединения 4 в Соединение 6 показано на Схеме II.
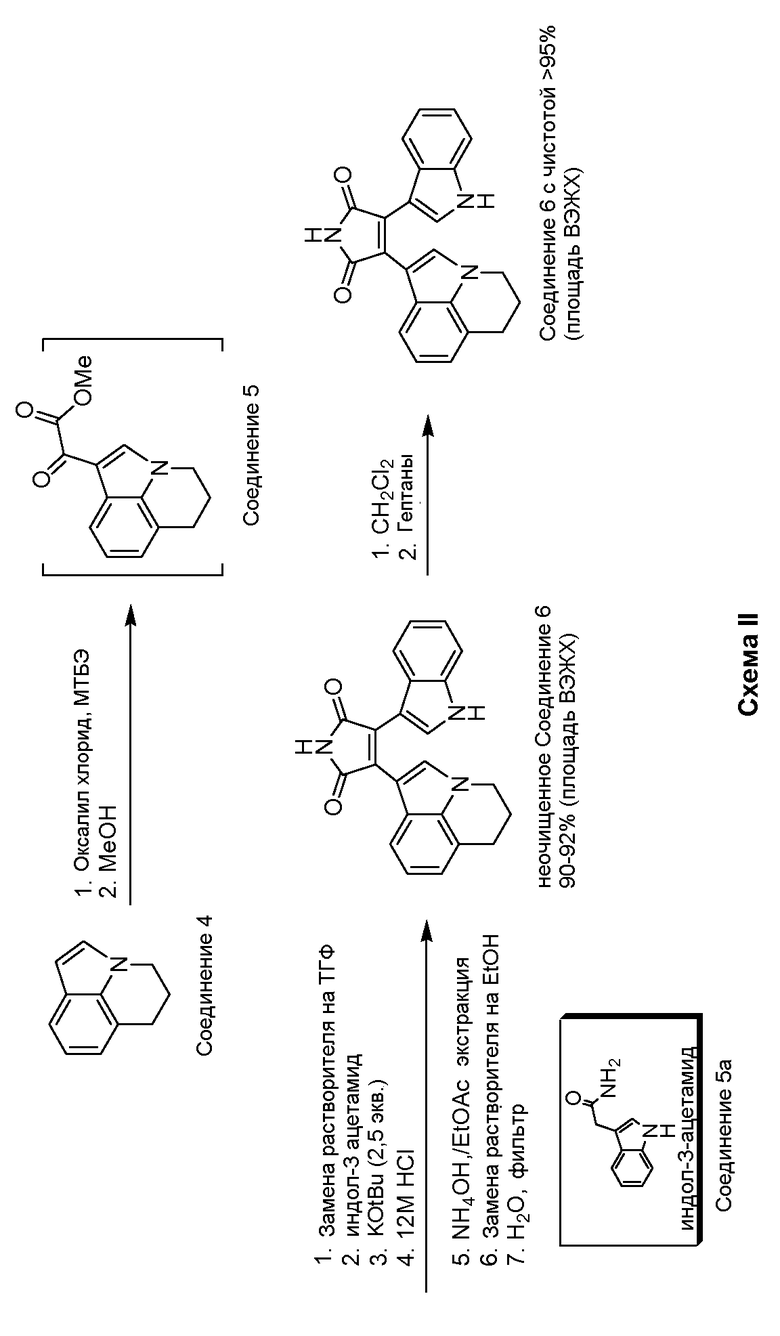
Пример 2
Настоящий пример описывает получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Гидроксид палладия (20% масс. Pd-на-углероде, 11,5 кг) загружали в надлежащим образом подготовленный реакционный сосуд. Добавляли ТГФ (340 кг) до получения суспензии и катализатор предварительно восстанавливали водородом (50-75 psi). Соединение 6 (115 кг) загружали в пустой сосуд с последующей загрузкой ТГФ (353 кг). Полученную смесь перемешивали до завершения растворения. Раствор Соединения 6 затем переносили в суспензию катализатора. Загружали в пустой реактор раствор трет-бутоксида натрия (1,6 M в ТГФ, 36 кг) с последующей загрузкой ТГФ (21 кг). Этот полученный раствор также переносили к реакционной смеси с последующим дополнительным промыванием ТГФ (340 кг). Партию затем нагревали до 45-55°С при 65-80 psi водорода. Нет необходимости выделять промежуточный цис-рацемат (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (Соединение 7 на Схеме I).
После определения завершения реакции при помощи ВЭЖХ анализа партию фильтровали через целит для удаления катализатора и разбавляли изопропилацетатом (iPrOAc) (810 кг). Органический раствор промывали водным HCl (28 кг конц. HCl, 290 кг воды). Указанный способ повторяли второй раз. Органический раствор затем промывали рассолом (580 кг) перед концентрированием до примерно 300 галлонов дистилляцией. Добавляли iPrOAc (1690 кг) и партию дистиллировали до примерно 400 галлонов. Способ дистилляции повторяли, добавляя iPrOAc (1000 кг), пока содержание ТГФ не становилось <2% масс. раствора. Гептаны (2000 кг) затем добавляли, чтобы вызвать осаждение продукта. Неочищенный (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (Соединение 8 на Схеме I) выделяли фильтрацией и кондиционировали с получением 111 кг (95%), имеющего ВЭЖХ чистоту ~96%. Указанный материал также содержал 1,7% iPrOAc и 6,3% гептана. Указанный материал было подтвержден по лабораторной шкале использования как имеющий достаточную чистоту для использования в получении (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диондихлорметана (DCM) и разрешения мультиколоночной хроматографией (MCC) или для непосредственного использования в кристаллизации диастереомерной соли, как описано подробнее в последующих примерах.
Пример 3
Настоящий пример описывает получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона DCM.
Предпочтительно провести химическую очистку Соединения 8 путем получения кристаллического (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона DCM (Соединение 8 DCM на Схеме I) перед способом разрешения энантиомеров при помощи MCC.
В одном примере в реакционный сосуд загружали метанол (125 кг) и Соединение 8 (52,5 кг) и полученную смесь нагревали до 55-65°С. В чистый реактор загружали DCM (557 кг). Раствор Соединения 8 затем переносили в реактор, содержащий DCM через встроенный фильтр. Реактор промывали DCM (134 кг), который тоже переносили через фильтр в реактор, содержащий реакционную смесь. Партию взбалтывали в течение минимум 30 минут, прежде чем вводили затравку Соединение 8 DCM (0,1 кг). Партию перемешивали в течение по меньшей мере четырех часов и затем отбирали образец для оценки степени кристаллизации. Если концентрация в фильтрате Соединения 8 DCM составляла ниже 65 мг/мл, добавляли гептаны (718 кг) и партию перемешивали в течение по меньшей мере одного часа. Партию затем охлаждали до 0-5°С и продукт выделяли фильтрацией. Твердые вещества кондиционировали на фильтре и сушили под вакуумом в полочной вакуумной сушилке при 45-55°С в течение по меньшей мере четырех часов. Выделяли Соединение 8 DCM (48,3 кг, 92%, ВЭЖХ 99,0%) в виде твердого вещества рыжевато-коричневого цвета. Превращение Соединения 6 в Соединение 8 DCM, описанное в примерах 2 и 3, показано на Схеме III.

Пример 4
Настоящий пример описывает хиральное разрешение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона DCM при помощи MCC и выделение (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Загружаемый раствор для мультиколоночной хроматографии (MCC) получали растворением Соединения 8 DCM в метаноле. Полученный сорастворитель DCM/метанол подвергали дистилляции, пока остаточная концентрация DCM в загрузочном растворе не достигала достаточного уровня, пригодного для контакта с хиральной стационарной фазой (CSP), т.е. <0,1% масс. Партию разбавляли в смеси метанол/ацетонитрил (9:1) до концентрации 50 мг/мл и вводили в хроматографическую систему. Может быть использована Chiralpak AZ (CSP). Проводили мониторинг очищенного продукта путем хирального ВЭЖХ анализа и регулировали параметры хроматографии для получения >99% хиральной чистоты (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (Соединение 10 на Схеме I). Очищенный продукт объединяли и периодически концентрировали по мере прохождения разделения. Собранный очищенный продукт был помещен в большой реактор, и уменьшали объем. Затем выделяли кристаллизацией Соединение 10.
Пример 5
Настоящий пример описывает периодическую генерацию (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона из нежелаемого энантиомера (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
В некоторых случаях, например когда разрешения достигают при использовании MCC, желательно периодически выделять и рацемизировать нежелательный энантиомер, (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион (Соединение 9 на Схеме I).
В одном из примеров способа получения неочищенного Соединения 8 из выделенного Соединения 9, нежелаемый энантиомер (6,46 кг) загружали в 100-л реактор. Загружали этанол (60 л) с последующим добавлением твердого NaOH (1,05 кг, 1,5 экв.). Полученную суспензию нагревали до 65°С с течение 13 часов и затем оставляли остывать до температуры окружающей среды в течение 4 часов. Смесь отбирали и анализировали хиральным ВЭЖХ, показывая соотношение энантиомеров 54/46. Химическую чистоту определяли 94,6% (AUC) при помощи ВЭЖХ. Суспензию затем осветляли фильтрованием через целит и собранное вещество промывали этанолом (13 л). Материал, который затем удаляли представлял собой коричневую пленку твердого вещества без крупных фрагментов. Раствор затем вновь загружали в 100-л реактор и добавляли 2 M HCl (13,1 л, 1,5 экв.) в течение 35 минут. В ходе добавления образовывалась тонкая суспензия. Смесь затем перемешивали при комнатной температуре (после 5 часов была получена плотная оранжевая суспензия). Затем добавляли воду (25 л) в течение 45 минут и смесь перемешивали в течение 2 часов. Удаляли аликвоту и фильтровали. Партию затем нагревали до 60°С и перемешивали в течение 8 часов и затем оставляли медленно охлаждаться для улучшения фильтрационных свойств твердых веществ. Было выделено неочищенное Соединение 8 [5,12 кг, 75,7% (рассчитано для 4,5% масс. этанола)] с химической чистотой 99,39% (AUC) согласно ВЭЖХ. В данном случае чистота была достаточной, чтобы далее обработать материал MCC. При необходимости чистота может быть улучшена через формирование DCM.
Хиральное разрешение Соединения 8 DCM до Соединения 10, описанное в Примере 4, и рециркуляция Соединения 9 в Соединение 8, описанная в Примере 5, показаны на Схеме IV.
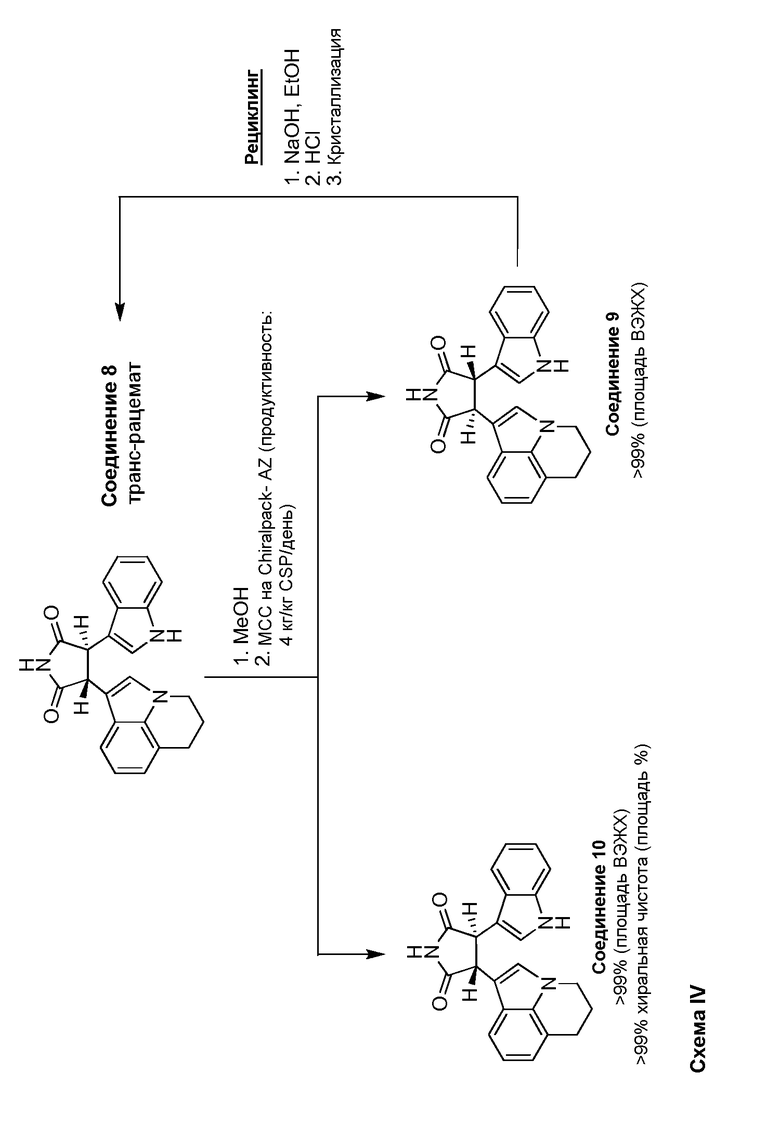
Пример 6
Настоящий пример описывает хиральное разрешение путем образования диастереомерной соли и выделения (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
В качестве альтернативы хирального разрешения МСС, разрешения энантиомеров, Соединения 10 и Соединения 9, также можно достичь путем предпочтительного образования диастереомерной соли Соединения 10.
В одном примере неочищенное Соединение 8 может быть превращено в (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрин (Соединение 10·(1S,2S)-(+)-псевдоэфедрин на Схеме I) при использовании следующей репрезентативной процедуры. (1S,2S)-(+)-псевдоэфедрин (601 г, 0,6 экв.) растворяли в ацетонитриле (CH3CN) (11,2 л, 5 об.) при примерно 50°С и перемешивали в течение примерно 30 минут после растворения. Неочищенное Соединение 8 [2,24 кг, 96,4% (AUC) по ВЭЖХ] растворяли в CH3CN (11,2 л, 5 об.) при примерно 50°С и затем осветляли фильтрованием через слой целита. Раствор Соединения 8 добавляли каплями из перевернутого бака к раствору (1S,2S)-(+)-псевдоэфедрин в течение 20-30 минут при примерно 50°С. После того как полученный раствор начинал кристаллизоваться, сразу после завершения добавления Соединения 8, смесь перемешивали, пока она медленно охлаждалась до температуры окружающей среды, затем перемешивание продолжали в течение ночи (примерно 11 ч общего охлаждения и перемешивания). Гранулированные твердые вещества бежевого цвета фильтровали через 18" нутч-фильтр из нержавеющей стали и промывали, повторно суспендировали при использовании CH3CN (7 л, 3,2 об.). Суспензию фильтровали и твердые вещества вновь суспендировали CH3CN (5 л, 2,3 об.). После сушки на нутч-фильтре в течение 1 часа образец анализировали ВЭЖХ. Если твердые вещества содержали больше, чем возможное количество нежелаемой диастереоизомерной соли, твердые вещества могли быть повторно суспендированы при использовании CH3CN и высушены перед повторным анализом. Твердые вещества затем сушили под горячим N2 (51°С) в течение ночи. Обычно анализ Соединение 10·(1S,2S)-(+)-псевдоэфедрин показывает общую химическую чистоту >99% (AUC) по ВЭЖХ и хиральную чистоту >99% Соединения 10. При использовании 1H ЯМР анализа оценивали, что типичный образец содержал <0,5% масс. CH3CN.
Соединение 10·(1S,2S)-(+)-псевдоэфедрин может быть затем превращено в Соединение 10 путем обработки кислотой и кристаллизацией из метанола или этанола. Репрезентативная процедура представляет собой следующую: Соединение 10·(1S,2S)-(+)-псевдоэфедрин (50 г) суспендируют в метилтетрагидрофуране (МеТГФ, MeTHF) (500 мл) и воде (250 мл). 1 M HCl (110 мл) добавляют к смеси для достижения конечного рН 1,6. Полученный раствор с небольшим количеством твердых веществ перемешивают в течение примерно одного часа для растворения твердых веществ. Органический и водный слои промывают раствором вода/рассол (1:1, 250 мл), разделяют и добавляют 2-B этанол (1000 мл). Раствор затем концентрируют до 200 мл и анализируют содержание МеТГФ (4,8% масс.). Раствор затем осветляют фильтрованием и добавляют затравку Соединения 10 (0,2 г) (T=25°C). Смесь перемешивают в течение примерно трех дней с периодически отбираемыми и анализируемыми образцами на оставшееся в маточном растворе Соединение 10. Полученную смесь фильтруют и твердые вещества промывают 2-B этанолом (70 мл). Твердые вещества сушат в течение примерно трех часов в вакуумной печи при примерно 60°C с получением Соединения 10 [28,84 г, 82,7%, 99,60% (AUC) согласно ВЭЖХ, 0,54% масс. этанола, 0,08% масс. МеТГФ] в виде бежевого твердого вещества.
Диастереомерное разрешение Соединения 8 в Соединение 10, описанное в примере 6, и рециклирование Соединения 9 в Соединение 8 описано в Примере 5 и показано на Схеме V.
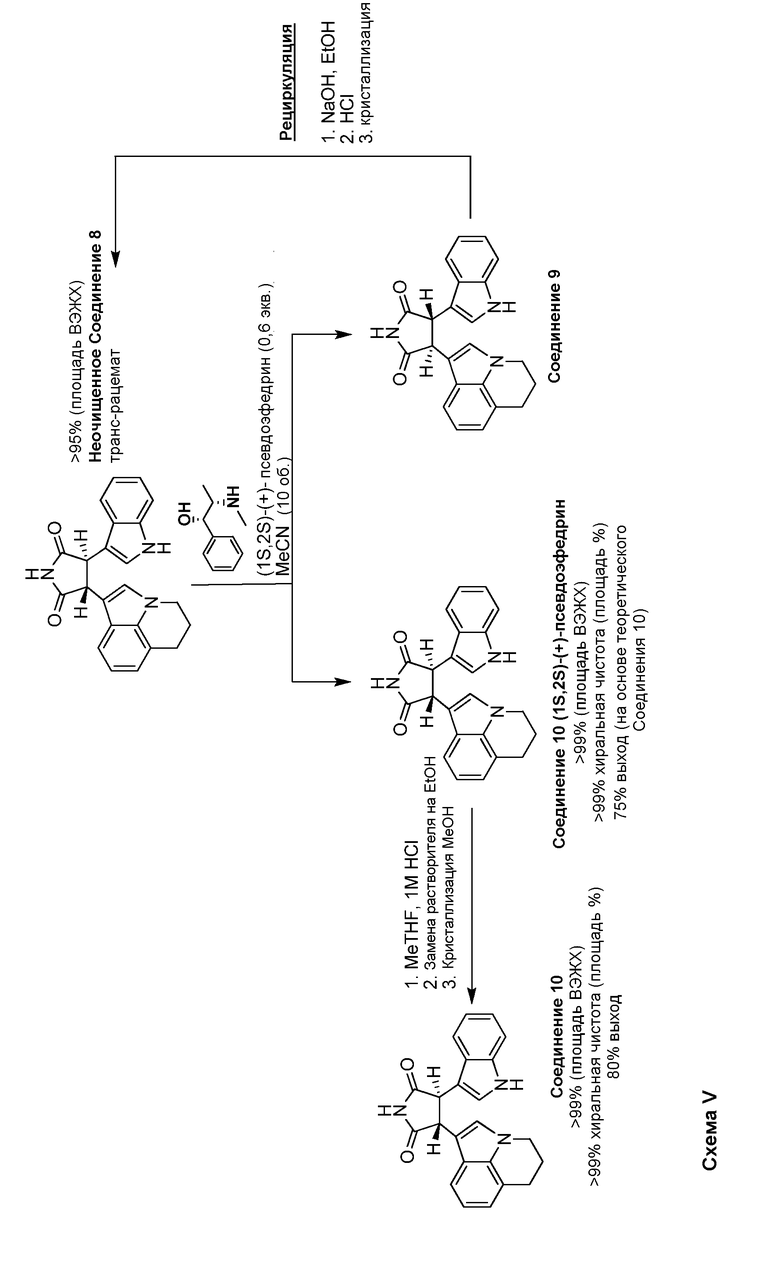
Пример 7
Настоящий пример описывает хиральное разделение при помощи динамического кинетического разрешения (DKR).
В качестве альтернативы хиральному разрешению при помощи MCC или традиционному кинетическому разрешению путем образования диастереомерной соли, можно также достичь динамического кинетического разрешения (DKR) энантиомеров Соединения 10 и Соединения 9 за счет преимущественного образования диастереомерной соли Соединения 10 с одновременной рацемизацией in situ Соединения 9.
В указанном способе неочищенное Соединение 8 можно превращать в Соединение·(1S,2S)-(+)-псевдоэфедрин при использовании следующей репрезентативной процедуры. Неочищенное Соединение 8 (1,25 кг, 96% AUC, 9,1% масс. содержание растворителя) и (1S,2S)-(+)-псевдоэфедрин (559 г, 1,0 экв.) переводили в суспензию в 2B-этаноле (11,25 л, 9 об.) и нагревали до 50°C в течение 3 часов. Суспензию обрабатывали 21% масс. NaOEt в метаноле или этаноле (110 г, 0,1 экв.) и нагревали до 50°C. Через 40 часов смесь гасили путем добавления 1 M HCl (338 мл, 0,1 экв.) в воде (786 мл, -10% по отношению к этанолу) в течение 5 минут. Смесь перемешивали при 50°C в течение 1 часа и затем оставляли охлаждаться до температуры окружающей среды в течение 0,5 часа. Суспензию перемешивали при комнатной температуре в течение еще 3 часов и затем фильтровали. Твердые вещества промывали 10% вода/2B-этанол (3,75 л, 3 об.) и сушили в вакуумной печи (50°C, 2 подноса) в течение 18 часов. Твердые вещества анализировали и показали, что Соединение 10·(1S,2S)- (+)-псевдоэфедрин [1,22 кг, 74%, 99,3% (AUC) согласно ВЭЖХС, 99,2% (AUC) согласно хиральной ВЭЖХ]. Указанный способ проводили на 20 кг Соединения 8 для получения Соединение 10·(1S,2S)-(+)-псевдоэфедрин [18,9 кг, 70%, 98,8% (AUC) согласно ВЭЖХ, 99,1% (AUC) согласно хиральной ВЭЖХ].
Динамическое кинетическое разрешение Соединения 8 в Соединение 10 через Соединение 10·(1S,2S)-(+)-псевдоэфедрин показано на Схеме VI.

Пример 8
Настоящий пример описывает хиральное разделение при помощи динамического кинетическоо разрешения (DKR).
В качестве альтернативы хиральному разрешению при помощи MCC или традиционному кинетическому разрешению путем образования диастереомерной соли можно также достичь динамического кинетического разрешения (DKR) энантиомеров Соединения 10 и Соединения 9 за счет преимущественного образования диастереомерной соли Соединения 10 с одновременной рацемизацией in situ Соединения 9.
В указанном способе неочищенное Соединение 8 (111,4 кг), Pd поглотительную смолу (PL-TMT-MP, 3,5 кг) и метанол (1507 л) добавляли в контейнер и нагревали до 45°C в течение по меньшей мере 16 часов. После завершения реакции смесь фильтровали для удаления Pd поглотительной смолы. Контейнер промывали метанолом (104 л). Объединенный фильтрат дистиллировали до ~600 л. (1S,2S)-(+)-псевдоэфедрин (51,4 кг) и метанол (416 л) добавляли к фильтрату. Полученный раствор нагревали при 45°C в течение 3-4 часов. Твердые вещества осаждали и анализировали ВЭЖХ для уверенности, что реакция протекала селективно. Затем добавляли раствор метоксида натрия в метаноле (21% масс., 6,1 кг) с последующим добавлением метанола (11 л) и полученную смесь нагревали при 45°C в течение дополнительных 18 часов. Реакционную смесь анализировали ВЭЖХ на завершение кристаллизации. После завершения кристаллизации реакционную смесь обрабатывали раствором HCl (3,5 кг) для нейтрализации основания. Полученную смесь охлаждали до температуры окружающей среды и взбалтывали в течение минимум 3 часов. Твердые вещества затем выделяли фильтрацией и остаток на фильтре промывали раствором метанола и воды (411 л к 46 л, соответственно). Остаток на фильтре был бесцветным (если в твердом веществе оставался значительный цвет, промывание повторяли для удаления цвета). Твердые вещества сушили в осушителе фильтра при 55°C под вакуумом в течение минимум 8 часов и высвобождали для использования на следующей стадии в виде Соединения 10·(1S,2S)-(+)-псевдоэфедрина (101 кг).
Пример 9
Настоящий пример описывает способ получения суспензии для получения (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона
Смешивали Соединение 10·(1S,2S)-(+)-псевдоэфедрин (100,7 кг) и раствор водной HCl (1M, 250 кг) и метанол (240 кг) и полученную суспензию нагревали до 50°C и перемешивали в течение по меньшей мере 2 часов. По завершении реакции, смесь охлаждали до температуры окружающей среды и перемешивали в течение минимум 1 часа. Твердые вещества выделяли фильтрацией, промывали 50% раствором водного метанола (200 л) и сушили под вакуумом при 65°C в течение по меньшей мере 6 часов. Неочищенное Соединение 10 растворяли в ТГФ (96 кг) путем нагревания смеси до 50°C. Полученный раствор осветляли фильтрацией с последующим добавлением метанола (200 кг). Раствор затем концентрировали азеотропно и при атмосферном давлении путем дистилляции для уменшения содержания ТГФ. Когда объем раствора уменьшался до 250 л, добавляли дополнительный метанол (200 л) и повторяли способ концентрации. Указанный способ повторяли, пока содержание ТГФ не уменьшалось до менее 5% (об./об.). В ходе добавления метанола также вводили один ил несколько кристаллов Соединения 10 (300 г) для облегчения кристаллизации. Кристаллы выделяли фильтрацией, промывали дополнительным 50% водным метанолом и сушили под вакуумом при 65°C в течение по меньшей мере 12 часов. Неочищенное Соединение 10 (60,6 кг) выделяли в виде красно-коричневого твердого вещества.
Пример 10
Настоящий пример описывает способ получения суспензии для получения полиморфа формы 1 (-)-транс-3-(5,6-дигидро-4H-пирроло [3,2,1-ij] хинолин-1-ил)-4-(lH-индол-3-ил)пирролидин-2,5-диона
Неочищенное Соединение 10 получали, как описано в Примере 9. Неочищенное Соединение 10 растворяли в ТГФ (96 кг) путем нагревания смеси до 50°C. Полученный раствор осветляли фильтрацией с последующим добавлением метанола (200 кг) и Формы 1 Соединения 10 в виде затравки для полиморфного контроля над способом кристаллизации. Затравки для полиморфного контроля отбирали из репрезентативных партий, в которых характеристические данные подтвердили, что кристаллический материал представлял собой желаемую полиморфную форму. Раствор затем концентрировали азеотропно и при атмосферном давлении путем дистилляции для уменьшения содержания ТГФ. Как только объем раствора уменьшали до 250 л, добавляли дополнительный метанол (200 л) и способ концентрации повторяли. Указанный способ повторяли, пока содержание ТГФ не уменьшалось до менее чем 5% (об./об.). Затем температуру раствора уменьшали до 50°C и перемешивали в течение по меньшей мере 4 часов. Аликвоты отбирали для подтверждения образования желаемого полиморфа. При необходимости полиморф может быть растворен в ТГФ (30% объема партии), осветлен фильтрацией, концентрирован и может быть внесена затравка для получения желаемого полиморфа. При получении желаемого полиморфа добавляли раствор 50% водного метанола при 50°C и раствор взбалтывали в течение дополнительных 2-3 часов. Раствор затем охлаждали до температуры окружающей среды и выдерживали в течение по меньшей мере 2 часа для кристаллизации. По завершении кристаллы выделяли фильтрацией, промывали дополнительным 50% водным метанолом и сушили под вакуумом при 65°С в течение по меньшей мере 12 часов. Полиморф Формы 1 Соединения 10 (60,6 кг) выделяли в виде красно-коричневого твердого вещества.
Полиморф Формы 2 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона может также быть получен описанным выше способом, если затравочные кристаллы Формы 1 заменить на затравочные кристаллы Формы 2.
Пример 11
Пример 11 описывает способ генерации XRPD рентгенограммы полиморфов (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Порошковую рентгеновскую дифрактограмму получали на Siemens D5000 дифрактометре при использовании Cu Kα излучения (40 кВ, 40 мА), θ-θ гониометра, дивергенции V20 и возвращающих щелей, графитового вторичного монохроматора и сцинциляционного счетчика. Рабочие характеристики прибора проверяли при использовании сертифицированного стандарта корунда (NIST 1976). Программное обеспечение, используемое для сбора данных, представляло собой Diffrac Plus XRD Commander v2.3.1, и данные анализировали и представляли при использовании Diffrac Plus EVA v 11,0.0.2 или v 13.0.0.2.
Образцы порошка получали в виде образцов плоских пластин. Примерно 35 мг образца аккуратно упаковывали в прорезную полость полированной с нулевой фоновой интенсивностью (510) кремниевой пластины. В ходе анализа образец вращали в его плоскости. Подробности сбора данных следующие:
Угловой диапазон: от 2 до 42 °2θ
Длина шага: 0,05 °2θ
Время сбора данных: 4 с/шаг
Пример 12
Пример 12 описывает способ генерации XRPD рентгенограммы полиморфов (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Порошковую рентгеновскую дифрактограмму высокого разрешения получали на Bruker D8 дифрактометре при использовании Cu Kα излучения (40 кВ, 40 мА), θ-2θ гониометра, дивергенции V4 и принимающих щелей, Ge-монохроматора и детектора Lynxeye. Рабочие характеристики прибора проверяли при использовании сертифицированного стандарта корунда (NIST 1976). Программное обеспечение, используемое для сбора данных, представляло собой Diffrac Plus XRD Commander v2.5.0, и данные анализировали и представляли при использовании Diffrac Plus EVA v 11,0.0.2 или v 13.0.0.2.
Образцы прогоняли при условиях окружающей среды в виде образцов плоских пластин при использовании порошка в том состоянии, как он был получен. Примерно 100 мг образца аккуратно упаковывали в кольцевую полость, прорезанную в полированной с нулевой фоновой интенсивностью (510) кремниевой пластине. В ходе анализа образец вращали в его собственной плоскости. Подробности сбора данных общей процедуры следующие:
Угловой диапазон: от 2 до 42 °2θ
Длина шага: 0,05 °2θ
Время сбора данных: 5 с/шаг
Пример 13
Пример 13 описывает XRPD рентгенограммы полиморфов (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Два несольватированных полиморфа (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона: Форма 1 и Форма 2 (см. Фиг.12 и 13).
Форма 1 показывает XRPD рентгенограмму, включающую 2θ величины в степени 8,2, 10,8 и 14,1 (см. Фиг.12 и Таблицу 1).
Форма 2 показывает XRPD рентгенограмму, включающую 2θ величины в степени 6,5, 9,9 и 12,0 (см. Фиг.13 и Таблицу 1).
Пример 14
Форма 1 представляет собой более термодинамически стабильную по сравнению с Формой 2, как определено в экспериментах по взаимному превращению. Форма 1 представляет собой орторомбическую и содержит четыре молекулы (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на элементарную ячейку. Форма 1 имеет точку плавления ~218°C, задокументированную в DSC (см. Фиг.16) экспериментах.
Форма 2 представляет собой двоякопреломляющий стержневидный кристалл. Никаких выраженных изменений в кристаллической форме или чистоте не было отмечено в ходе хранения многочисленных партий Формы 2 при 40°C/75% влажность в течение времени до шести месяцев и при 25°C/60% влажность в течение времени до 12 месяцев. Пространственная группа формы 2 представляла собой или P21 или P2: имеются две молекулы (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на элементарную ячейку (одна молекула в асимметрической ячейке), и нет избытка объема в элементарной ячейке, который занимает молекула растворителя. Форма 2 имеет точку плавления при ~216°C, задокументированную в DSC (см. Фиг.16).
При увеличении масштабов получения Соединения 10 до >5 кг в виде единой партии спонтанно выпадала Форма 1. Инфракрасная (ИК) рентгеновская порошковая дифракция (XRPD) была определена как эффективные аналитические инструменты для идентификации и различия этих двух форм (см. Фиг.14 и 15). Способ было легко контролировать посредством затравки, что показано в масштабах 7 кг.
Два полиморфа можно взаимопревращать, если для контроля способа кристаллизации используют правильные условия. Форму 2 можно получить при растворении Формы 1 в метаноле, затравки Формы 2 и испарения смеси досуха при роторном испарении. Успешное превращение было определено как Форма 2 путем ИК анализа и подтверждено XRPD анализом.
Пример 15
ИК спектр Формы 1 демонстрирует интенсивные вибрации центрированные при -3300 см-1, которые не наблюдались в Форме 2 (Фиг.15, панель A), тогда как ИК спектр Формы 2 показал относительно интенсивный пик, центрированный при -800 см-1, который не наблюдался в Форме 1 (Фиг.15, панель B).
Форма 1 и Форма 2 имеют различное уравнение растворимостей: Форма 2 = 0,61 мг/мл и Форма 1 = 0,51 мг/мл. На Фиг.17, панель A показана растворимость Форм 1 и 2 в метаноле от 0-70°С. На Фиг.17, панель B показана действительная растворимость Форм 1 и 2 в 50 мМ pH 6,8 фосфатном буфере/1% SLS.
Пример 16
Экспоненциально растущие MDA-MB-231 клетки или MIA PaCa-2 (также известные как PACA-2) клетки высевали при 1000 клеток на лунку в планшеты на шесть лунок и оставляли прикрепляться в течение 24 часов. MDA-MB-231 и MIA PaCa-2 клетки культивировали в DMEM с добавлением 10% (об./об.) фетальной бычьей сыворотки (FBS) и 5 мл пенициллина/стрептомицина при 37°C в 5% CO2. MDA-MB-231 и MIA PaCa-2 заложены в клеточных линиях эстроген рецептор-отрицательного рака молочной железы человека и панкреатической карциномы, соответственно. (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион каждый растворяли в концентрации 10 мМ в ДМСО и раздельно добавляли к клеткам в концентрации 0,1, 0,25, 0,5, 1 или 2 мкΜ. Контрольные планшеты получали только ДМСО, в том же процентном отношении к общему объему культуры, что и вводимое в сочетании с наибольшей концентрацией лекарственного препарата. Клеточные культуры наблюдали ежедневно в течение 10-15 дней, затем фиксировали и окрашивали модифицированной окраской по Райту-Гимзе (Sigma). Обработка (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом приводит к гибели клеток MDA-MB-231 или клеток Paca-2. См., например, Фиг.2. Было обнаружено, что IC50 для (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона составил 0,5 мкΜ. Было обнаружено, что величина IC50 для (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона составила 0,5 мкΜ.
Пример 17
MDA-MB-231 клетки (ATCC #HTB-26), выращенные на DMEM с добавлением 15% инактивированной нагреванием фетальной бычьей сыворотки с добавлением 10 мМ HEPES pH 7,5, помещали в 60-мм2 планшеты (2×105 лунок в планшете). Через два дня соединения-кандидаты в ДМСО при различных концентрациях разбавляли в среде и добавляли в индивидуальные планшеты так, чтобы конечная концентрация ДМСО в среде для выращивания культур клеток была 0,1%. Через два дня инкубации культуры трипсинизировали, клетки промывали средой, считали при использовании гемоцитометра и 500 клеток, включающих тела клеток, высевали в 100 мм2 планшеты в среду. Через две недели среду удаляли и колонии клеток фиксировали метанолом в течение 10 минут, красили 1% кристаллическим фиолетовым в течение 10 минут, промывали водой и сушили на воздухе. Колонии клеток подсчитывали визуально, если в колонии присутствовало более 50 клеток. Эффективность высева на планшет определяли как среднее число образованных колоний, деленное на 500. Выжившую фракцию определяли как эффективность высева на планшет соединения-кандидата, разделенную на эффективность высева на планшет ДМСО, умноженную на 100. Для титров соединений-кандидатов была определена величина IC50 путем подстановки уравнения y=AeBx к экспериментальным точкам и экстраполяции концентрации, где выжившая фракция составила 50. Лечение (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом или (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом приводит к гибели клеток MDA-MB-231. См., например, Фиг.3. Было обнаружено, что IC50 для (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона составляет 0,62 мкΜ. Было обнаружено, что IC50 для (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона составляет 4,1 мкΜ.
Пример 18
Рекомбинантную протеинкиназу С (Calbiochem) (100 нг) инкубировали с (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом при 0,05, 0,5 или 10 мкΜ в течение 15 минут при комнатной температуре. Затем к каждому образцу добавляли радиоактивный раствор для мечения в киназном буфере (20 мМ Tris-HCl pH 7,5, 10 мМ MgCl2), содержащем 20 мкΜ АТФ, 0,2 мкКи/мкл γ32Ρ-ΑΤΡ, 0,2 мкг/мл Гистона H1 (Upstate Biotechnology/Millipore, Bedford, MA). Киназную ракцию проводили в течение 5 минут при комнатной температуре. Продукты реакции анализировали 12% SDS-PAGE и авторадиографией.
Обработка рекомбинантной протеинкиназы С в течение 15 минут при комнатной температуре (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом при исследованных концентрациях не уменьшала киназную активность по сравнению с обработкой одним носителем. См., например, Фиг.4.
Пример 19
MDA-MB-231 клетки находились без сыворотки в течение ночи (16 часов) в отсутствие или в присутствии определенных концентраций отдельных энантиомеров (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона. Клетки обрабатывали 100 нг/мл рекомбинантным фактором роста гепатоцитов человека/рассеивающим фактором (HGF/SF) (R&D Systems #294-HG) в течение 10 минут. Все клеточные экстракты получали в лизирующем буфере (20 мМ Tris-HCl pH 7,5, 150 мМ NaCl, 1 мМ Na2EDTA, 1 мМ EGTA, 1% Triton X-100, 2,5 мМ пирофосфата натрия, 1 мМ бета-глицерофосфата, 1 мМ Na3VO4, 1 мкг/мл лейпептина, 1 мМ фенилметилсульфонилфторида) и разрушали клетки ультразвуком. Концентрацию протеина измеряли анализом Бредфорда при использовании реагента BioRad (BioRad, Hercules, CA), согласно указаниям производителя. Образцы (50 мкг белка) разрешали при использовании 8% SDS-PAGE при восстановительных условиях и переносили на PVDF мембрану (BioRad). Мембрану инкубировали в течение 1 часа в TBS-T (50 мМ Tris-HCl (pH=7,6), 200 мМ NaCl, 0,05% Tween 20) с 5% молока. Белки определяли инкубацией в течение ночи при 4°С в TBS-T с 5% молока и или поликлональным антителом к фосфорилированному c-Met (#3121), или моноклональным антителом к β-актину (A-5441) (Sigma), которые использовали в качестве контроля насыщения суммарного белка. После интенсивного промывания в TBS-T, на один час добавляли пероксидазу хрена, конъюгированную против кроличьего IgG (1:5000) или мышиного IgG (1:2000) (Amersham Biosciences), и визуализировали специфические белковые связи при использовании усовершенствованной хемилюминесцентной детекторной системы (Amersham Biosciences), согласно инструкции производителя. См., например, Фиг.5.
Обработка (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом ингибирует одновременно и базальное, и HGF-индуцированное автофосфорилирование c-Met при концентрации по меньшей мере 30 нМ. Напротив, (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион демонстрирует только минимальное ингибирующее действие на c-Met фосфорилирование при значительно больших концентрациях (20 мкΜ). См., например, Фиг.5.
Пример 20
A549 клетки рака легкого человека в планшете на 96 лунок (Costar 3603, 5000/лунка) были обработаны одним из A) ДМСО в качестве контроля; B) 1,2 мкΜ (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион в течение 38 часов перед добавлением 1:200 флуроресцентного аннексина V (зеленый) и 1:500 пропидиййодида (малиновый, конечная концентрация 1 мкг/мл). Процедуру мечения оставляли проводиться при 37°C в течение 20 минут с последующим получением изображения и анализом при использовании IC100 Image Cytometer (Beckman Coulter, Inc) с 10X амплификацией.
Чтобы определить, работает ли (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион в первую очередь по цитостатическому механизму или по механизму апоптоза, раковые клетки подвергали действию (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона при окраске флуоресцентно меченным аннексином V (зеленая флуоресценция) и пропидиййодидом (ярко-малиновая флуоресценция). Аннексин V представляет собой хорошо проверенный реагент, который специфично связывается с высокой избирательностью с внешним мембранным фосфатидилсерином, ранним маркером возникающего апоптоза, тогда как пропидиййодид представляет собой маркер погибших клеток. Инкубация клеток рака легкого человека (A549) с 1,2 мкΜ (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в течение 38 часов индуцировала апоптоз клеток, как доказано сильным окрашиванием аннексином V. Небольшой процент клеток (~10-20%), одновременно окрашенных и аннексином V и пропидиййодидом, показывает, что субпопуляция клеток, обработанных (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом уже были погибшими в течение 38 часов. Указанные данные согласуются с тем, что (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион вызывает гибель клеток главным образом посредством активации механизмов апоптоза (см. Фиг.6)
Пример 21
Клетки MDA-MB-231 были предварительно обработаны указанными концентрациями (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в течение 24 часов. 300 мкл каждой клеточной суспензии (при концентрации 0,5×106 клеток/мл в не содержащей сыворотки среде) помещали в индивидуальные вставки и инкубировали в течение 24 часов при 37°C. На дне лунок, в которых находились вставки, содержалось 500 мкл 10% FBS содержащей среды. Через 24 часа среду из каждой вставки отсасывали и клетки, которые не инвазировали, аккуратно удаляли из внутренней части вставки мазком с ватным кончиком. Каждую вставку затем переносили в чистую лунку, содержащую раствор для окраски клеток и инкубировали в течение 10 минут при комнатной температуре. Дно вставки обесцвечивали путем инкубирования в экстракционном растворе и измеряли OD при 560 нМ. (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион ингибировал миграцию через сообщающиеся пустоты у конфлюентных культур раковых клеток MDA-MB-231. Данные представляют среднее по двум независимым экспериментам (см. Фиг.7).
Заболеваемость и смертность от большинства видов рака представляет собой результат локальной инвазии и метастазов из первичных опухолей в другие ткани. Данный процесс главным образом зависит от подвижности и роста опухолевых клеток. Активация c-Met HGF индуцирует различные клеточные ответы, включая подвижность, инвазию, заживление ран и регенерацию тканей. Было установлено, что аберрантная активация c-Met играет критическую роль в развитии и прогрессе первичных опухолей и вторичных метастазов. HGF обладает способностью диссоциировать эпителиальные слои и стимулировать клеточную подвижность и инвазию через субстрат экстраклеточного матрикса, и продукция HGF коррелирует с метастазами опухоли in vivo.
Как показано выше, (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион ингибирует инвазивный фенотип MDA-MB-231 клеток рака молочной железы с установленной величиной IC50 примерно 500 нМ. Сходные результаты были получены для раковых клеток мозга и легкого. Таким образом, результаты показывают, что (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион ингибирует метастатическую инвазию раковых клеток.
Пример 22
(-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион показывает эффективность в ксенотрансплантате рака молочной железы человека. Клетки рака молочной железы человека MDA-MB-231 прививали подкожно самкам бестимусных мышей (8,0×l06 клеток/мышь) и оставляли до образования пальпируемых опухолей. Когда опухоли достигали примерно 60 мм3, животным вводили перорально (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион в дозе 200 мг/кг или контрольный носитель ежедневно (5 последовательных дней с последующими перерывом в приеме дозы на 2 дня). (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион составляли в PEG 400:20% Витамин E TPGS (60:40). Животные получали всего 20 доз (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или контрольного носителя. Опухоли измеряли в ходе лечения и посттерапевтического периода наблюдения. Каждая точка представляет среднее ± SEM для десяти опухолей. (см. Фиг.8).
Лечение (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом в качестве монотерапии была эффективна в замедлении роста опухолей. Ингибирование роста опухоли (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом рассчитывали как 79%, и оно было статистически значимым (p=0,009). Не было значительного изменения в массе тела в связи с пероральным введением носителя или (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в дозе 200 мг/кг.
Пример 23
В ксенотрансплантатной модели рака толстой кишки человека HT-29 клетки рака толстой кишки человека прививали подкожно самкам бестимусных мышей (5,0×106 клеток/мышь) и оставляли до образования пальпируемых опухолей. Когда опухоли достигали примерно 60 мм3, животным вводили перорально (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион в дозе 200 мг/кг или 300 мг/кг, или контрольный носитель ежедневно (5 последовательных дней с последующим перерывом в приеме дозы на 2 дня). (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион составляли в PEG 400:20% Витамин E TPGS (60:40). Животные получали всего 20 доз (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или контрольного носителя. Опухоли измеряли в ходе лечения и посттерапевтического периода наблюдения. Каждая точка представляет среднее ± SEM для десяти опухолей (см. Фиг.9, панель А).
В указанной высокоагрессивной ксенотрансплантатной модели рака толстой кишки человека, животные, получающие дозу или 200 мг/кг, или 300 мг/кг в качестве монотерапии, демонстрировали значительное ингибирование роста опухоли, с 300 мг/кг были более эффективными, чем 200 мг/кг. (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион в дозах 200 мг/кг показывал оптимальное ингибирование роста опухоли 39% (p=0,006), тогда как 300 мг/кг показывал оптимальное ингибирование роста опухоли 55% (p=0,00001). Не было значительного изменения в массе тела в связи с пероральным введением носителя или (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в дозе 200 мг/кг или 300 мг/кг.
Эффективность (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона также тестировали на ксенотрансплантатной модели с несколькими другими линиями клеток рака: рак поджелудочной железы человека MIA PaCa2 (Фиг.9, панель B), рак простаты человека PC3 (фиг.9, панель C) и рак желудка человека MKN45 (Фиг.9, панель D). Клетки обрабатывали также (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом в качестве монотерапии при указанных концентрациях. Во всех указанных моделях (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион значительно ингибировал рост опухолей.
Пример 24
(-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион показал значительную цитотоксичность по отношению к множественным клеточным раковым линиям. Различные клеточные раковые линии подвергали лечению (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом в указанных концентрациях в диапазоне от 0,03 до 30 мкΜ. Чувствительность указанных клеток к (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диону измеряли стандартным MTS анализом на цитотоксичность (Фиг.10). Клеточные линии рака человека, экспрессирующие c-Met и/или фосфо-c-Met, были чувствительными к (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диону. Напротив, клеточные линии рака человека без иммунодетектируемых c-Met или фосфо-c-Met (Фиг.10, SK-MEL-28, MCF-7 и NCI-H661) демонстрировали малую чувствительность.
Пример 25
(-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион анализировали с точки зрения его активности в ингибировании большой группы (n=230) киназ человека. Данные, представленные в таблице 2, показывают, что (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион ингибирует только c-Met до значительной степени и демонстрирует умеренную активность против небольшого числа других киназ. (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион демонстрирует константу ингибирования (Κi) при ~360 нМ по отношению к c-Met.
Пример 26
Была установлена ксенотрансплантатная модель рака толстой кишки человека с HT-29 клетками рака толстой кишки человека, как описано в примере 23. Мышей, имеющих опухоль, подвергали лечению одной дозой (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (300 мг/кг). Уменьшение фосфо-c-Met было зарегистрировано имунногистохимически через 24 часа. Значительное уменьшение количества фосфо-c-Met визуализировали при использовании иммунопероксидазной системы, применяющей диаминобензидин, который приводит к нерастворимому коричневому продукту реакции (Фиг.11, панель A). Вестерн-блоттинг образца опухоли на фосфо-c-Met подтвердил результаты иммуногистохимического анализа (Фиг.11, панель B).
Пример 27
Настоящий пример описывает ингибирование c-Met рецепторной тирозинкиназы при светлоклеточной саркоме и опухолях, ассоциированных с MiT (Микрофтальмический транскрипционный фактор). Соединения по изобретению также демонстрировали эффективность у пациента со светлоклеточной саркомой. Исследования, описанные в настоящем примере использовали (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, низкомолекулярный ингибитор c-Met рецепторной тирозинкиназы.
(-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион представляет соой селективный ингибитор c-Met рецепторной тирозинкиназы. При аномальной активации c-Met играет многочисленные роли в аспектах рака человека, включая рост раковых клеток, выживание, ангиогенез, инвазию и метастазы. Описанные выше данные демонстрируют, что (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион ингибирует активацию c-Met в широком диапазоне клеточных линий опухолей человека, включая светлоклеточную саркому, и демонстрирует противоопухолевую активность по отношению к нескольким ксенотрансплантатам опухолей человека. В клинических исследованиях лечение (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом хорошо переносилось и приводило к ответу со стороны опухоли и к продолжительному стабильному состоянию в широком диапазоне опухолей и доз.
(-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион вводили пациентам со светлоклеточной саркомой. В частности, (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион демонстрировал частичный ответ, как определено RECIST (Критерии оценки ответа солидных опухолей на лечение (Response Evaluation Criteria in Solid Tumors)), у пациента со светлоклеточной саркомой.
Объективный ответ на введение (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона было видно у группы пациенов, пораженных молекулярно-связанной группой опухолей типа саркомы, для которых не существует эффективного лечения. На основе указанного ответа (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион вводили в дозе 360 миллиграммов (мг) дважды в день (b.i.d.).
(-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион вводили пациентам с MiT (микрофтальмический транскрипционный фактор)-ассоциированными опухолями. MiT опухоли, которые могут включать светлоклеточную саркому (CCS), альвеолярную саркому мягких тканей (ASPS) и почечно-клеточную карциному, связанную с транслокацией (RCC), биологически связаны через общую хромосомную аномалию, которая ответственна за повышенную экспрессию c-Met, приводящую к развитию указанных опухолей. Опухоли с указанной аномалией резистентны к существующим способам лечения и в отсутствие успешного хирургического оперативного вмешательства неизменно летальны.
В ходе первой стадии исследования 23 пациента были зарегистрированы и им было проведено лечение 120 мг (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом b.i.d. Было показано, что четырнадцать из указанных пациентов были оценены на эффективность лечения. Дополнительно к пациенту с подтвержденным частичным ответом десять из оцененных пациентов продемонстрировали стабильное заболевание.
Объективный клинический ответ, демонстрируемый для (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, выстраивается вокруг данных, которые показывают, что выбивание MiT экспрессии путем shРНК подавляет c-Met экспрессию и препятствует росту клеток светлоклеточной саркомы человека in vitro и in vivo. Эта находка ведет к развитию клинического испытания на пациентах с MiT-ассоциированными опухолями при использовании (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, который показал противораковую активность, включая объективный ответ опухоли, также как и способность ингибировать c-Met белок в биопсиях опухолей от пациентов, получавших лечение этим лекарственным средством.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ РАКА | 2006 |
|
RU2409579C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ РАКА | 2006 |
|
RU2547148C2 |
| ЗАМЕЩЕННЫЕ ПИРРОЛЫ И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1990 |
|
RU2142460C1 |
| СОЕДИНЕНИЯ ДЛЯ ИНГИБИРОВАНИЯ КИНАЗЫ EGFR, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2020 |
|
RU2832925C2 |
| НОВЫЕ АЛКИЛИРУЮЩИЕ СРЕДСТВА | 2013 |
|
RU2632206C2 |
| ПРИМЕНЕНИЕ ЗАМЕЩЕННЫХ 2-(2-(4,4,6-ТРИМЕТИЛ-2-ОКСО-4Н-ПИРРОЛО[3,2,1-IJ]ХИНОЛИН-1(2Н)-ИЛИДЕН)ГИДРАЗИНИЛ)ТИАЗОЛ-4(5Н)-ОНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРОВ СВЕРТЫВАНИЯ КРОВИ XA И XIA И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2023 |
|
RU2819271C1 |
| ТРИЦИКЛИЧЕСКИЕ АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ И ПРОИЗВОДНЫЕ ТЕТРАГИДРОХИНОЛИНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1991 |
|
RU2023712C1 |
| 1,7-АНЕЛЛИРОВАННЫЕ ПРОИЗВОДНЫЕ 3-(ПИПЕРАЗИНОАЛКИЛ)-ИНДОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРОМЕЖУТОЧНЫЙ ПРОДУКТ ДЛЯ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2083580C1 |
| СОЕДИНЕНИЕ НА ОСНОВЕ ПИРРОЛАМИДОПИРИДОНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2809596C2 |
| ПРИМЕНЕНИЕ ГИДРИРОВАННЫХ ПРОИЗВОДНЫХ ПИРРОЛО[3,2,1-IJ]ХИНОЛИН-1-ИЛИДЕН-2-ТИОКСОТИАЗОЛИДИН-4-ОНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРОВ СВЕРТЫВАНИЯ КРОВИ XA И XIA | 2023 |
|
RU2819897C1 |

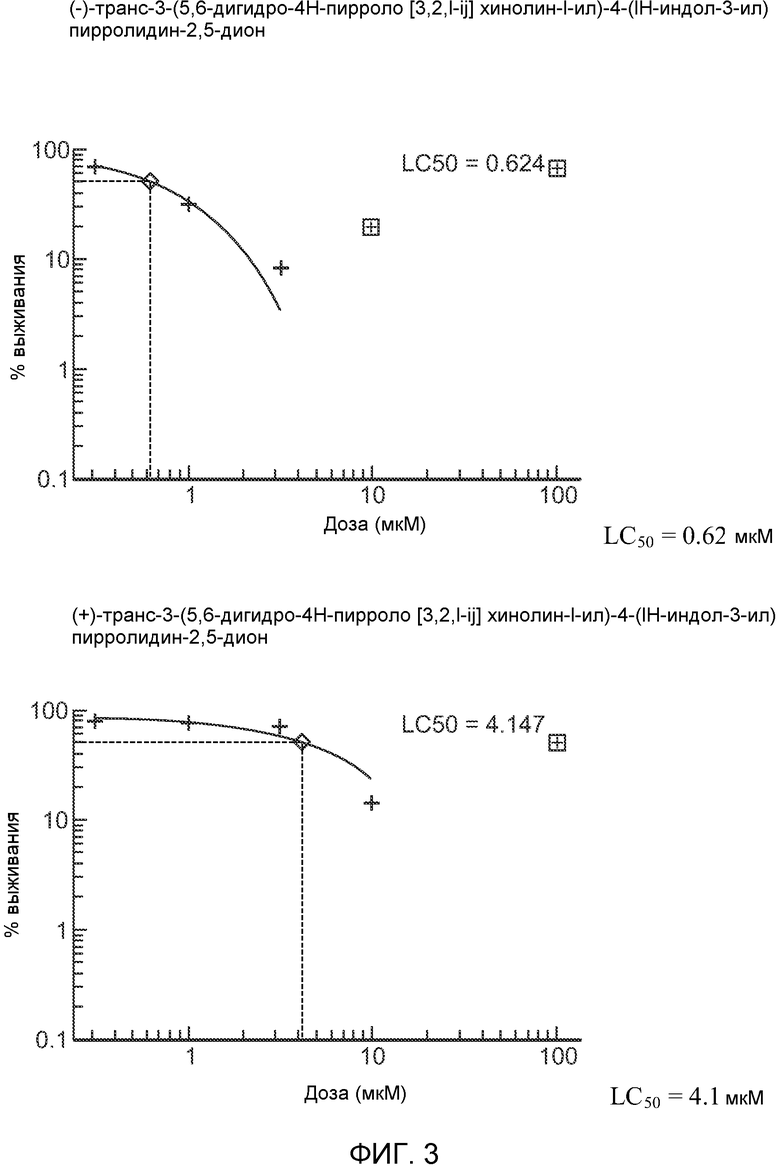


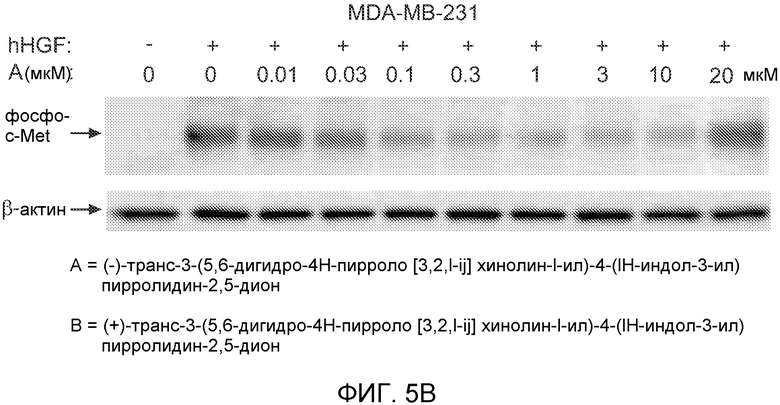
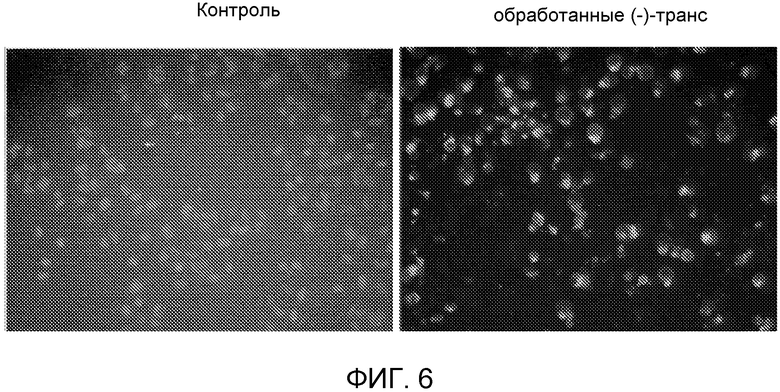

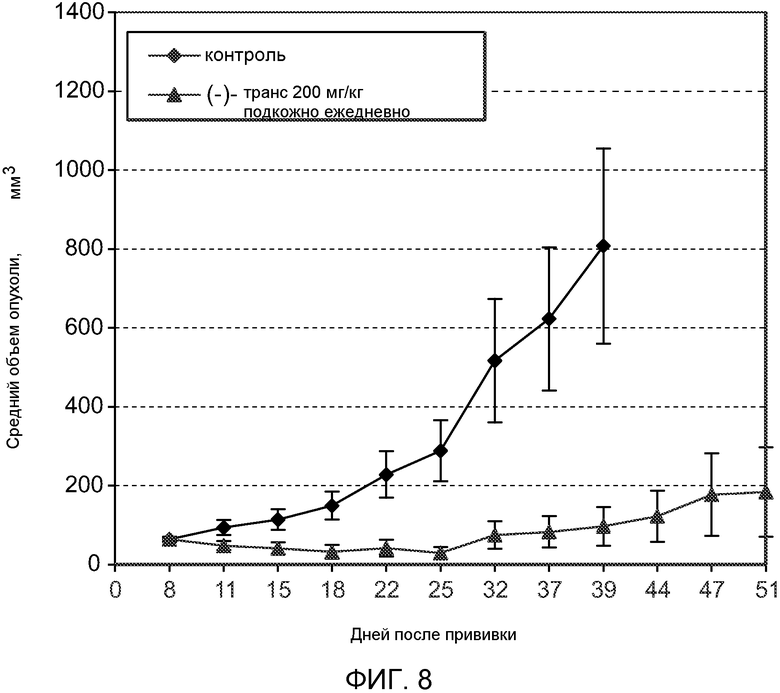


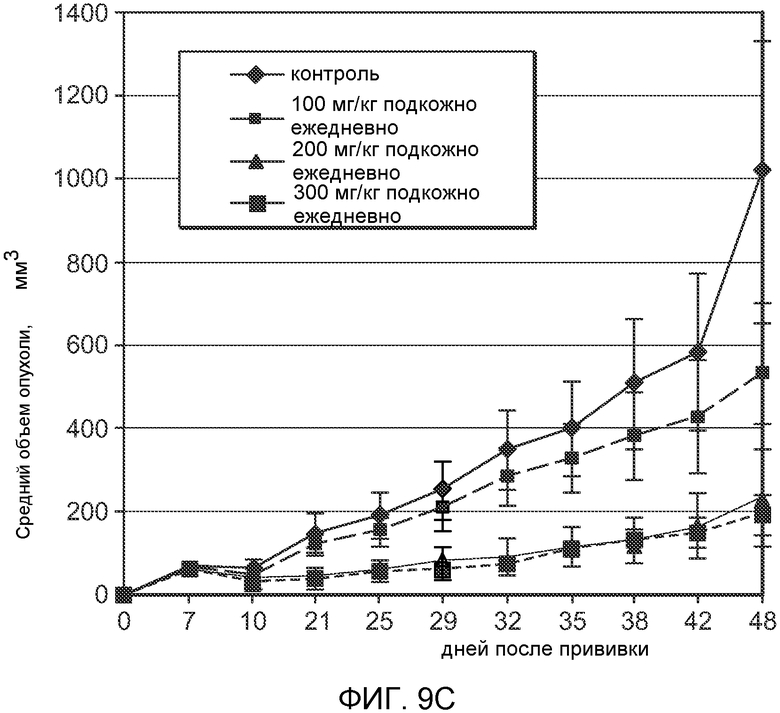
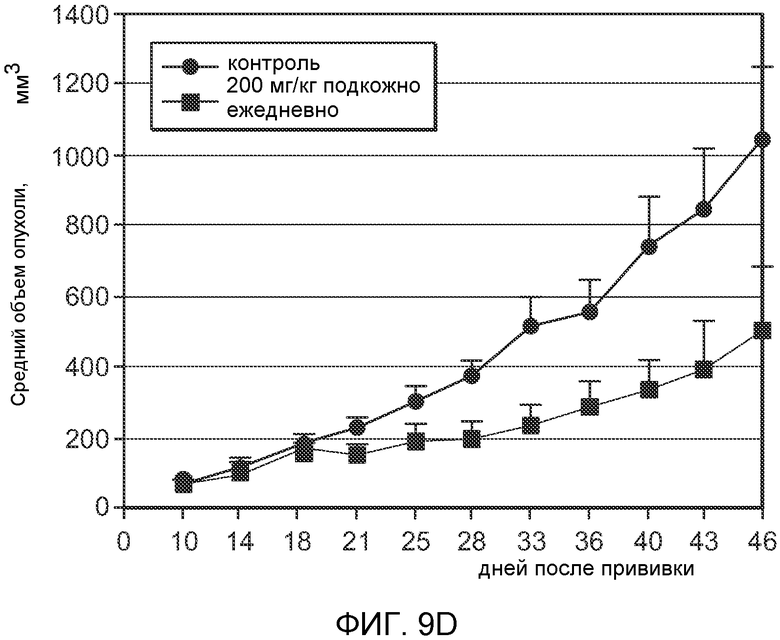

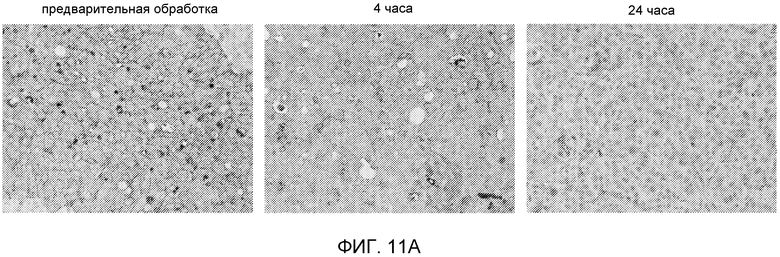
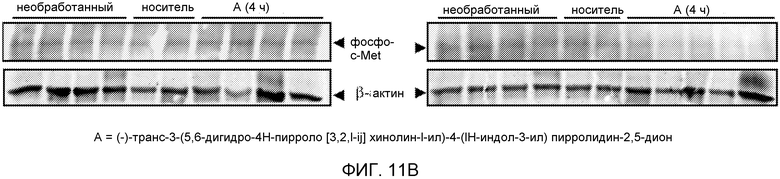




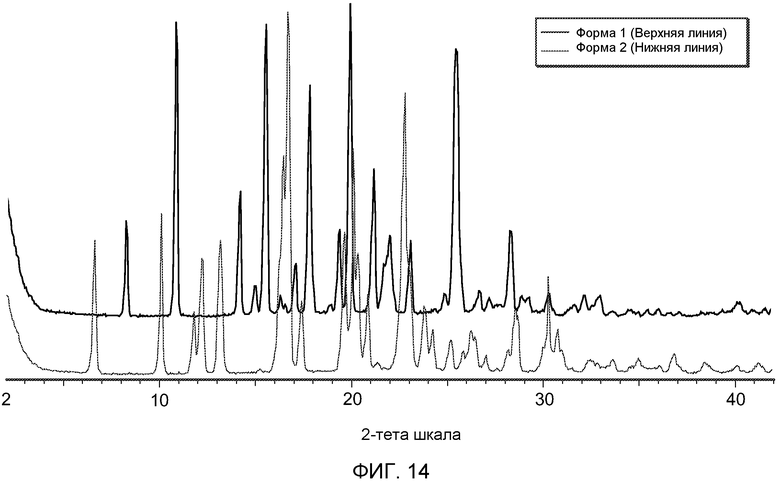
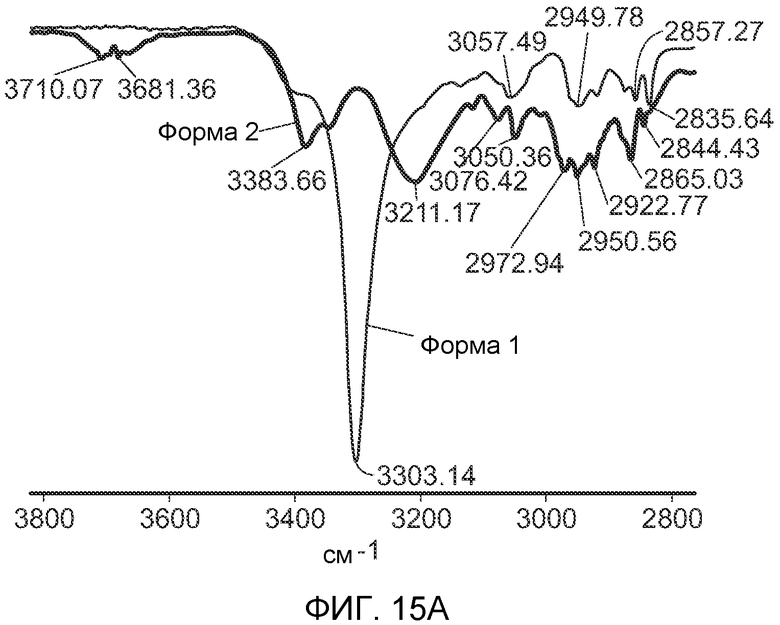
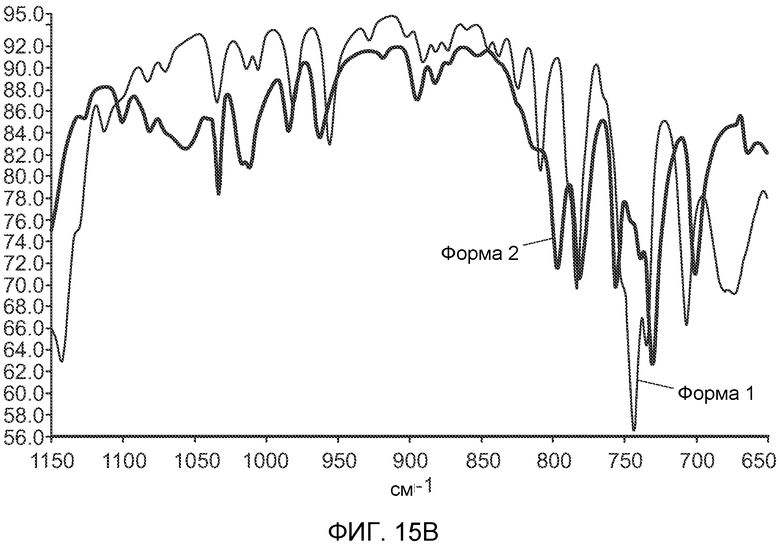

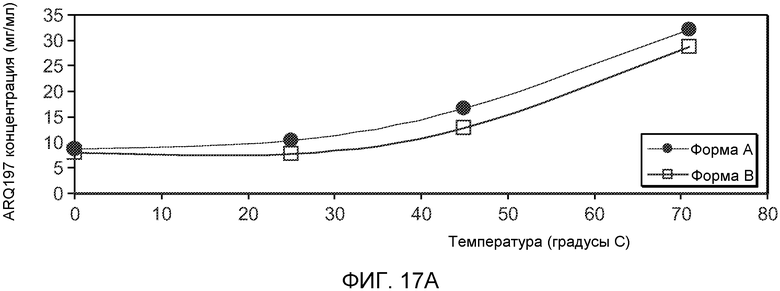

Изобретение относится к области органической химии, а именно к полиморфам формы 1 и формы 2 (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-l-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона. Также изобретение относится к способам получения указанных полиморфов и фармацевтической композиции на их основе. Технический результат: получены новые полиморфы (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-l-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, полезные при лечении рака. 10 н. и 13 з.п. ф-лы, 26 ил., 2 табл., 27 пр.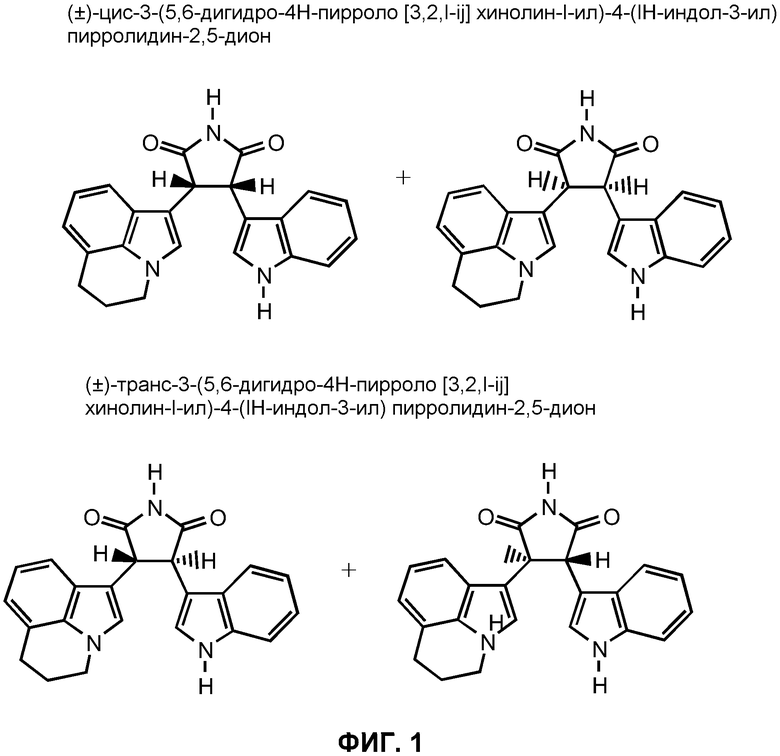
1. Полиморф (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(lH-индол-3-ил)пирролидин-2,5-диона, характеризующийся:
(i) порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8, 14,1 °2θ при использовании Cu Кα излучения; или
(ii) порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9, 12,0 °2θ при использовании Cu Кα излучения.
2. Полиморф по п.1, характеризующийся порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8, 14,1, 15,5, 17,8, 19,9 и 25,6 °2θ при использовании Cu Кα излучения.
3. Полиморф по п.1, характеризующийся порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 8,2, 10,8, 14,1, 14,9, 15,5, 17,1, 17,8, 19,4, 19,9, 21,1, 21,9, 23,0, 25,6 и 28,4 °2θ при использовании Cu Кα излучения.
4. Полиморф по п.1, характеризующийся порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9, 12,0, 16,7, 20,1 и 22,8 °2θ при использовании Cu Кα излучения.
5. Полиморф по п.1, характеризующийся порошковой рентгеновской дифрактограммой, включающей пики приблизительно в области 6,5, 9,9, 12,0, 13,2, 16,4, 16,7, 17,2, 20,1, 20,3, 20,8, 22,8, 23,7, 28,6 и 30,4 °2θ при использовании Cu Кα излучения.
6. (±)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диондихлорметан.
7. (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрин.
8. Способ получения (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона, включающий:
a) смешивание (±)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона с (1S,2S)-(+)-псевдоэфедрином в первом растворителе с получением твердого вещества (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрина;
b) промывание твердого вещества (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрина, полученного на стадии (а), смесью воды с первым растворителем;
c) взаимодействие (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрина со стадии (b) с кислотой в органическом растворителе и выделение органического слоя полученного раствора;
d) промывание органического слоя со стадии (с);
e) добавление второго растворителя к органическому слою;
f) концентрирование органического слоя до достижения концентрации второго растворителя в растворе менее чем 5%; и
g) кристаллизацию из органического слоя со стадии (f) и сушку полученного раствора (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона под вакуумом с получением (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона.
9. Способ получения (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона, включающий:
a) смешивание (±)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона с циклогексилэтиламином в первом растворителе с получением твердого вещества (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-дион циклогексилэтиламина;
b) промывание твердого вещества (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-дион циклогексилэтиламина, полученного на стадии (а), смесью воды с первым растворителем;
c) взаимодействие (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-дион циклогексилэтиламина со стадии (b) с кислотой в органическом растворителе и выделение органического слоя полученного раствора;
d) промывание органического слоя со стадии (с);
е) добавление второго растворителя к органическому слою;
f) концентрирование органического слоя до достижения концентрации второго растворителя в растворе менее чем 5%; и
g) кристаллизацию из органического слоя со стадии (f) и сушку полученного раствора (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона под вакуумом с получением (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
10. Способ по п.8 или 9, где указанный первый растворитель представляет собой неводный растворитель, который предпочтительно представляет собой ацетонитрил.
11. Способ по п.8 или 9, где указанный второй растворитель представляет собой такой же растворитель, как и первый растворитель; или указанный второй растворитель отличается от первого растворителя.
12. Способ по п.8 или 9, где указанный органический растворитель со стадии (с) представляет собой метилтетрагидрофуран.
13. Способ по п.8 или 9, где указанный органический слой промывают раствором соли на стадии (d), предпочтительно где указанный раствор соли представляет собой раствор хлорида натрия.
14. Способ по п.8 или 9, дополнительно включающий промывание кристаллов (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона после стадии (g), предпочтительно, где кристаллы (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона промывают спиртом, выбранным из этанола и метанола.
15. Способ получения (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4 -(1Н-индол-3-ил)пирролидин-2,5-диона, включающий:
a) смешивание (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-дион·(1S,2S)-(+)-псевдоэфедрина и кислоты;
b) добавление спирта к смеси со стадии (а) с образованием суспензии;
c) нагревание и перемешивание суспензии, полученной на стадии (b);
d) охлаждение и выделение (-)-транс-3-(5,6-дигидро-4Н-пирроло[[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона;
e) промывание (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, выделенного на стадии (d), первым растворителем;
f) растворение (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4 -(1H-индол-3-ил)пирролидин-2,5-диона со стадии (e) во втором растворителе с получением раствора;
g) добавление третьего растворителя к раствору со стадии (f) и дистилляцию раствора до достижения содержания второго растворителя в растворе менее 5%;
h) кристаллизацию (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона из раствора со стадии (g);
i) необязательное добавление четвертого растворителя для созревания кристаллов со стадии (h);
j) выделение кристаллов со стадии (i) фильтрацией;
k) промывание кристаллов со стадии (j) смесью третьего растворителя и четвертого растворителя; и
l) сушку кристаллов со стадии (k) под вакуумом с получением (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона;
где указанный спирт предпочтительно представляет собой метанол, этанол или их смесь.
16. Способ по п.15, где указанный второй растворитель представляет собой неводный растворитель, который предпочтительно представляет собой тетрагидрофуран;
где указанный третий растворитель представляет собой неводный растворитель, который предпочтительно представляет собой метанол, этанол или их смесь; или
где указанный четвертый растворитель представляет собой водный растворитель, который предпочтительно представляет собой воду.
17. Способ получения (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона, включающий:
a) растворение (±)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в дихлорметане и выделение (+)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-дион дихлорметана;
b) растворение (±)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-дион дихлорметана в первом растворителе;
c) дистилляцию раствора со стадии (b) до достижения концентрации дихлорметана в растворе менее 0,1% масс.;
d) разбавление раствора со стадии (с) во втором растворителе;
e) введение раствора со стадии (d) в систему мультиколоночной хромотографии, содержащую насадочный материал, пригодный для хирального разделения;
f) объединение полученного очищенного продукта, получаемого из системы со стадии (е); и
g) кристаллизацию очищенного продукта со стадии (f) и фильтрование полученного (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона с получением (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона.
18. Способ по пп.8, 15 или 17, где первый растворитель представляет собой неводный растворитель, который предпочтительно представляет собой метанол, этанол или их смесь.
19. Способ по п.8, 9 или 17, где второй растворитель представляет собой неводный растворитель, который предпочтительно представляет собой метанол, этанол, ацетонитрил или их смесь.
20. Способ по п.8, 9, 15 или 17, где полученный (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-дион содержит менее чем 1% (+)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона, предпочтительно содержит менее чем 0,7% (+)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона.
21. Способ получения (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона, включающий стадии (a-f) по п.14 и стадию g′, где стадия g′ включает испарение очищенного продукта со стадии (f) с получением (-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона.
22. Фармацевтическая композиция для лечения рака, включающая полиморф по любому из пп.1-5 и фармацевтически приемлемый носитель или эксципиент.
23. Полиморф по любому из пп.1-5, предназначенный для применения в способе лечения рака в сочетании с фармацевтически приемлемым носителем или эксципиентом, где рак необязательно выбирают из рака легкого, рака толстой кишки, рака молочной железы, рака поджелудочной железы, рака простаты, хронического миелогенного лейкоза, меланомы, рака яичника, почечной карциномы, гепатомы, рака головного мозга и множественной миеломы.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| 1,7-АНЕЛЛИРОВАННЫЕ ПРОИЗВОДНЫЕ 3-(ПИПЕРАЗИНОАЛКИЛ)-ИНДОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРОМЕЖУТОЧНЫЙ ПРОДУКТ ДЛЯ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2083580C1 |
| Прибор для механического отбирания средней пробы зерна | 1923 |
|
SU2907A1 |
Авторы
Даты
2015-07-10—Публикация
2010-12-21—Подача