ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет приоритет предварительной заявки на патент США №61/936267, поданной 5 февраля 2014 г., полное содержание которой настоящим включено во всей своей полноте посредством ссылки для любых целей.
1. ОБЛАСТЬ РАСКРЫТИЯ
Настоящее раскрытие относится к синтетическим замещенным гетероциклическим соединениям и фармацевтическим композициям, содержащим их, которые способны ингибировать виды протеинкиназной активности или проявлять антагонизм по отношению к ним. Кроме того, настоящее раскрытие касается применения таких соединений в лечении и/или предупреждении определенных типов рака, зуда, атопического дерматита, чесотки, питириаза, воспаления, рестеноза, атеросклероза, псориаза, тромбоза, болезни Альцгеймера, боли, заболевания, нарушения, поражения или дисфункции, связанных с дисмиелинизацией или демиелинизацией, или заболевания или нарушения, ассоциированного с аномальными видами активности протеинкиназ.
2. ПРЕДПОСЫЛКИ РАСКРЫТИЯ
Белки семейства Trk представляют собой рецепторные тирозинкиназы, представленные тремя членами семейства, TrkA, TrkB и TrkC. Они с высокой степенью сродства связываются с лигандами семейства нейротрофинов, прототипными членами которого являются фактор роста нервов (NGF), нейротрофический фактор головного мозга (BDNF) и нейротрофин 3-5 (NT 3-5), и опосредуют передачу сигнала, индуцируемую ими. Кроме того, был идентифицирован корецептор р75, не имеющий ферментативной активности, который связывается со всеми нейротрофинами (NT) с низкой степенью сродства и регулирует передачу сигналов с помощью нейротрофинов. Важнейшая роль Trk и их лигандов в процессе развития центральной и периферической нервной систем была установлена посредством исследования нарушения функции генов у мышей. В частности, было показано, что взаимодействие TrkA-NGF является необходимым условием выживания конкретных популяций периферических нейронов, участвующих в опосредовании передачи болевого сигнала. Было показано, что повышенная экспрессия TrkA также коррелирует с повышенным уровнем боли в случае рака поджелудочной железы (Zhu, et al, Journal of clinical oncology, 17:2419-2428 (1999)). Повышенная экспрессия NGF и TrkA также наблюдалась в хондроцитах человека при остеоартрите (Iannone et al, Rheumatology 41:1413-1418 (2002)).
TrkA (тропомиозин-рецепторная киназа А) представляет собой рецепторную киназу клеточной поверхности, содержащую внеклеточный, трансмембранный и цитоплазматический киназный домен. Связывание нейротрофина запускает олигомеризацию рецепторов, фосфорилирование тирозиновых остатков в киназном домене и активацию межклеточных сигнальных путей, в том числе каскада Ras/MAPK, PI3K/AKT и IP3-зависимого высвобождения Са2+. Тирозинкиназная активность является обязательным требованием для передачи сигнала посредством данного класса рецепторов. Рецепторы NGF также были обнаружены в различных типах клеток вне нервной системы. Например, TrkA также были обнаружены на моноцитах человека, Т- и В-лимфоцитах и мастоцитах.
Существует несколько примеров антител к TrkA либо антител к NGF, известных из уровня техники. Например, в публикациях по РСТ №№ WO 2006/131952, WO 2005/061540 и ЕР 1181318 раскрыто применение антител к TrkA в качестве эффективных обезболивающих средств в животных моделях воспалительной и нейропатической боли in vivo. В заявках согласно РСТ №№ WO 01/78698, WO 2004/058184 и WO 2005/019266 раскрыто применение антагониста NGF в предупреждении или лечении боли. В заявке согласно РСТ WO 2004/096122 описан способ лечения или предупреждения боли посредством совместного введения антитела к NGF и опиоидного обезболивающего средства. В заявке согласно РСТ WO 2006/137106 раскрыт способ лечения или предупреждения боли посредством совместного введения антитела к TrkA и опиоидного обезболивающего средства. Кроме того, благодаря использованию антитела к NGF было достигнуто глубокое ослабление, или значительное уменьшение, боли в костях, вызванной метастазами рака предстательной железы (Sevik, MA, et al, Pain 115:128-141 (2005)).
Мутации потери функции в TrkA (NTRK1) приводили к врожденному отсутствию чувствительности к боли с ангидрозом [Nat Genet 1996;13:485-8], и антитело к NGF танезумаб продемонстрировало клиническую эффективность в отношении боли при остеоартрите и диабетической нейропатической боли [N Engl J Med 2010;363:1521-31; Arthritis Rheum 2013;65:1795-803]. Кроме того, ингибиторы Trk демонстрируют превосходную эффективность в доклинических моделях боли [Mol Pain 2010;6:87-100]. Array недавно продемонстрировала эквивалентную эффективность с аллостерическими селективными ингибиторами TrkA в моделях боли, которые потенциально могут быть более безопасными, чем общие ингибиторы Trk, обсуждаемые ниже [веб-сайт Array, 2012. Доступно: http://www.arraybiopharma.com/_documents/Publication/PubAttachment587.pdf [последний доступ 22 января 2014 г].
Существует несколько свидетельств того, что ингибирование Trk может быть благоприятным при лечении болезни Альцгеймера. Уровни NGF и TrkA повышены в дыхательных путях страдающих астмой (при астме) [J Asthma 2013;50:712-17; Respirology (2009) 14, 60-68; и PLoS ONE 4(7): е6444. doi: 10.1371/journal.pone.0006444] и могут способствовать воспалению, гиперчувствительности и ремоделированию. Также было показано, что NGF и TrkA усиливают индуцируемое овальбумином воспаление дыхательных путей у грызунов [Exp Ther Med 2013;6:1251-8]. СТ327 представляет собой местный ингибитор TrkA, который клинически оценивали в Creabilis в отношении хронического зуда при таких заболеваниях, как атопический дерматит, псориаз и чесотка [http://clinicaltrials.gov/show/NCT01808157]. Ингибирование TrkA может быть полезным при лечении болезни Шагаса. Trypanosoma cruzi, возбудитель болезни Шагаса, использует Trk для внедрения в различные типы клеток человека-хозяина [Infect Immun 2009;77:1368-75; Infect Immun 2011;79:4081-7].
Селективное ингибирование TrkA-киназной активности также может быть полезным при лечении заболеваний уха [Laryngoscope 2011 Oct;121(10):2199-213], цирроза печени и гепатоцеллюлярной карциномы [World J Gastroenterol 2007 October 7; 13(37):4986-4995], воспалительных заболеваний легких [Immunology and Microbiology, "Inflammatory Diseases - A Modern Perspective", книга под редакцией Amit Nagal, ISBN 978-953-307-444-3, опубликовано: 16 декабря 2011 г., глава 5: Expression and Role of the TrkA Receptor in Pulmonary Inflammatory Diseases], фиброза [J Cell Commun Signal. Mar 2010; 4(1):15-23. Заявка на патент: PCT/GB2004/004795], птеригия [Int. J. Exp. Path. (2009), 90, 615-620], заболеваний легких [Expert Rev Respir Med. 2010 June; 4(3):395-411], легочного саркоидоза [Dagnell et al. Respiratory Research 2010, 11:156], дисфункции мочевого пузыря [Neurourology and Urodynamics 30:1227-1241 (2011); BJU International 111, 372-380; J Urol. 2013 August; 190(2): 757-764; Neurourology and Urodynamics 33:39-45 (2014)], дисфункции нижних мочевыводящих путей [International Journal of Urology (2013) 20, 13-20], болезни Паджета [J Cutan Pathol 2010: 37: 1150-1154], диабетической нефропатии [Diabetes. Sep 2012, Vol. 61 Issue 9, p 2280-2288.; Regulatory Peptides 135 (2006) 30-38.], синдрома раздраженного кишечника [Neurogastroenterol Motil (2013) 25, e740-e754], при радиационной защите [Radiother Oncol. 2012 June; 103(3):380-387].
Более того, боль, которая может быть вызвана самим заболеванием или лечением, является распространенной у людей с раком, хотя не все люди с раком будут ощущать боль. Примерно от 30% до 50% людей с раком ощущают боль, подвергаясь лечению, и от 70% до 90% людей с раком на поздней стадии ощущают боль [Lesage P. and Portenoy RK. Cancer Control; Journal of the Moffitt Cancer Center 1999;6(2):136-145]. Раковая боль является сложным изменяющимся со временем симптомом, который является конечным результатом смешанного механизма боли. Она включает воспалительный, нейропатический, ишемический и компрессионный механизмы во множестве участков [Pathophysiology of cancer pain and opioid tolerance. B: The British Pain Society's Cancer Pain Management. Веб-сайт Британского общества no изучению боли, www.britishpainsociety.org. Опубликовано в январе 2010 г. По состоянию на 29 января 2013 г]. Она представляет собой субъективное, неоднородное ощущение, которое модифицировано индивидуальными генетическими характеристиками, анамнезом, настроением, ожиданием и культурой. Синдромы раковой боли классифицируются как острый и хронический на основании начала и длительности. Острые болевые синдромы имеют внезапное четко определенное начало, определяемую причину (например, хирургическую операцию), подвергаются симпатическому выбросу (реакция борьбы или бегства) и, как ожидается, улучшаются при контроле. С другой стороны, хроническая боль имеет менее отчетливое начало, имеет длительное и нестабильное течение и в значительной степени обусловлена центральной сенсибилизацией и нейропластическими реакциями в результате острого поражения [Fornasari D. Pain mechanisms in patients with chronic pain. Clin Drug Investig 2012; 32(suppl 1):45-52; Latremoliere A, Woolf CJ. Central sensitization: a generator of pain hypersensitivity by central neural plasticity. J Pain 2009; 10:895-926]. Она часто характеризуется "вспышками боли", называемыми прорывной болью [Portenoy RK, Dhingra LK. Assessment of cancer pain. B: Drews RE, ed. UpToDate. Waltham, MA: UpToDate; 2013].
Терапевтические значения эффективного ингибитора Trk могут в значительной степени выходить за пределы терапии боли. Было определено, что полиморфизм TrkA ассоциирован с шизофренией [J Psychiatr Res. 2009 Oct;43(15):1195-9]. Также было документально зафиксировано разрушение данного рецептора и его сигнального пути в некоторых злокачественных опухолях. Потенциальная полезность ингибиторов Trk в онкологии рассматривалась ранее (для обзоров см. Expert Opin Ther Pat. 2014 Jul; 24(7):731-44; Nat Rev Cancer, 2004: 4:361-70; Clin Cancer Res, 2009; 15:5962-7). TrkA и/или Trk(B/C) вовлечены в выживание и метастазирование при раке предстательной железы [Expert Opin Investig Drugs, 2007;16:303-9; Prostate, 2000:45:140-8], молочной железы [Cytokine Growth Factor Rev, 2012;23;357-65], гепатоцеллюлярной карциноме (раке печени) и циррозе печени [World J Gastroenterol. 2007 Oct 7; 13(37):4986-95; Gastroenterology. 2002 Jun; 122(7):1978-86; Biochem Biophys Res Commun. 2011 Mar 4;406(1):89-95.; Digestive Diseases and Sciences, Vol. 55, No. 10, (October 2010), pp. 2744-55, ISSN 0163-2116], внутрипеченочной холангиокарциноме [World J Gastroenterol 2014 April 14; 20(14):4076-4084], фиброзе печени [Expert Rev Mol Med.; 11: e7. doi:10.1017/S1462399409000994], раке яичника [Gynecol Oncol. 2007 Jan; 104(1):168-75], видах рака поджелудочной железы [Clin Cancer Res., 2005; 11:440-9], раке полости рта [Dermatol Surg 2004;30:1009-1016] и боли при раке полости рта [J Dent Res 91(5):447-453, 2012], раке кожи [Am J Clin Pathol 2004;122:412-420], раке шейки матки [African Journal of Biotechnology Vol. 10(38), pp. 7503-7509, 25 July, 2011], раке костей [J Vet Intern Med 2008;22:118.1-1188]. Другие редкие виды рака, такие как врожденная аденосаркома почки, фибросаркома младенцев [Am J Pathol, 1998;153:1451-8] и секреторная карцинома молочной железы [Cancer Cell, 2002; 347-8], характеризуются перестройками генов Tel-TrkC. Соматические перестройки TrkA были обнаружены в небольшом, но непротиворечивом подмножестве папиллярных опухолей щитовидной железы [Cancer Lett 2006;232:90-8; Mol Cell Endocrinol 2010;321:44-9; Genomics. 1995 Jul 1;28(1):15-24; Int J Cancer. 1999 Mar 15;80(6):842-7].
В данной области недавно было открыто новое интересное направление с обнаружением онкогенных перестроек TrkA (NTRK1) у небольшого подмножества пациентов с раком легкого [Nat Med 2013;19:1469-72] и при колоректальном раке (в виде мутации слияния ТРМ3-TrkA) [Mol Oncol. 2014 Jun 12. pii: S1574-7891(14)00125-2]. Образцы опухолей от 3 из 91 пациентов с раком легкого без предварительного определения изменений генов продемонстрировали свидетельство наличия слияний гена TrkA (NTRK1). Данные мутации слияния генов соответствуют внутриклеточным онкогенным белкам, и они характеризуются конститутивно активированной внутриклеточной TrkA-киназной активностью и трансформацией фибробластов. Слияния TrkA (NTRK1), TrkB (NTRK2) или TrkC (NTRK3) также были идентифицированы в глиобластоме, опухолях Шпиц, шпицоидных меланомах, при остром миелогенном лейкозе и секреторном раке молочной железы [Greco A, et al. Mol Cell Endocrinol 2009; Alberti L, et al. J Cell Physiol 2003; Martin-Zanca D et al. Nature 1986; Wiesner T, et al. Nat Commun 2013; Vaishnavi A, et al, Nat Med 2013]. Идентификация данной перестройки генов или мутаций слияния может обеспечивать подход к стратификации пациентов, подобный тому, который эффективно использовался в Pfizer, обеспечивая быструю регистрацию и одобрение кризотиниба [Drugs 2013;73:2031-51].
Известно, что пациент с TrkA-положительным метастатическим колоректальным раком недавно подвергался клиническому лечению с помощью RXDX-101, общего ингибитора Trk, и достиг частичного ответа [Ignyta, Inc. News Release. May 31, 2014. Веб-сайт: http://finance.yahoo.com/news/ignyta-announces-interim-data-rxdx-190000889.html]. В ходе собственного поиска по общедоступным геномным базам данных о раке человека авторами настоящего изобретения было обнаружено, что множество типов рака человека характеризуются слияниями TrkA или мутациями слияния, например, рак молочной железы (например, CAL-51, САМА-1 и другие 3 линии клеток рака молочной железы человека от 5 пациентов), рак эндометрия (например, RK95-2 и другие 7 линий раковых клеток человека от 8 пациентов), рак крови (например, CML-T1 и другие 3 линии раковых клеток от 4 пациентов), рак печени (SNU-878 и другие 2 линии раковых клеток от 3 пациентов), колоректальный рак (например, SNU-C4 и другие 10 линий раковых клеток от 11 пациентов), рак поджелудочной железы (например, Panc 02.13 и Panc 03.27 от 2 пациентов) и рак кожи (например, LOX IMVI и другие 4 линии раковых клеток от 5 пациентов), при которых селективный ингибитор TrkA, подобно описанным в настоящем раскрытии или соединению по настоящему раскрытию, можно использовать для точной инактивации внутриклеточной TrkA-киназной активности конститутивно активированных внутриклеточных онкогенных белков, т.е. продуктов мутаций слияния TrkA, и, следовательно, в качестве эффективного средства лечебной терапии рака человека для типов рака человека, приведенных выше.
Считается, что тирозинкиназная активность Trk стимулирует нерегулируемую активацию механизма пролиферации клеток. Считается, что ингибиторы киназ TrkA, TrkB или TrkC, отдельно или в комбинации, имеют полезность в отношении некоторых из наиболее распространенных видов рака, таких как рак головного мозга, меланома, множественная миелома, плоскоклеточный рак, рак мочевого пузыря, рак желудка, рак поджелудочной железы, рак молочной железы, рак головы, рак шеи, рак пищевода, рак предстательной железы, колоректальный рак, рак легкого, рак почки, рак яичника, гинекологический рак, рак щитовидной железы и определенные типы гемобластоза. Лестауртиниб (СЕР-701, Cephalon), индолокарбазольный ингибитор некоторых тирозинкиназ, в том числе Flt-3 и TrkA, и СЕР-751, общий ингибитор Trk, вступили в клинические испытания фазы II относительно лечения острого миелогенного лейкоза (AML), рака поджелудочной железы и множественной миеломы (ММ) и/или рака предстательной железы.
Особенно следует отметить сообщения об аберрантной экспрессии NGF и рецепторной TrkA-киназы, которая вовлечена в развитие и прогрессирование карциномы предстательной железы человека и протоковой аденокарциномы поджелудочной железы, и активирующих хромосомных перестройках Trk при остром миелогенном лейкозе (AML), раке щитовидной железы и раке молочной железы, а также точечных мутациях рецепторов, которые предположительно являются конститутивно активирующими при опухолях толстого кишечника. Помимо данных механизмов активации, сообщалось о повышении уровня Trk рецептора и лиганда в различных типах опухолей, в том числе во множественной миеломе, меланоме, нейробластоме, карциноме яичника и поджелудочной железы. Было показано, что нейротрофины и их соответствующие подтипы Trk-рецепторов вызывают множество плейотропных эффектов в злокачественных клетках, в том числе повышение инвазивности опухоли и хемотаксиса, активацию апоптоза, стимуляцию клоногенного роста и изменение морфологических свойств клеток. Данные эффекты наблюдались в карциномах предстательной железы, молочной железы, щитовидной железы, толстого кишечника, злокачественных меланомах, карциномах легкого, глиобластомах, карциноидных опухолях поджелудочной железы и широком спектре детских и нейроэктодермальных опухолей, включающих опухоль Вильмса, нейробластомы и медуллобластомы. Нейротрофины и подтипы их рецепторов вовлечены в данные виды рака посредством аутокринного либо паракринного механизмов, в котором участвуют клетки карциномы и окружающие паренхимные и стромальные ткани. В целом онкогенные свойства сигнального пути Trk во множестве типов опухолей делает модулирование сигнального пути Trk-рецептора потенциально привлекательной точкой терапевтического воздействия в различных злокачественных опухолях.
Помимо антител, однако, известны несколько других ингибиторов TrkA, и лишь очень немногие из них (если таковые имеются) демонстрируют высокую селективность в отношении TrkA-киназы (в том числе ингибиторы TrkA СЕР-751 и CEP-701, являющиеся производными стауроспорина). В уровне техники редко упоминалось (если это вообще имело место), что синтетическую органическую молекулу или соединение применяли в качестве прямого ингибитора или антагониста TrkA или NGF, в частности, для лечения или предупреждения боли. Это может быть обусловлено главным образом фактами сложности идентификации сильнодействующих и особенно селективных низкомолекулярных органических соединений, противодействующих TrkA или противодействующих NGF, несмотря на то, что была установлена кристаллическая структура NGF в комплексе с TrkA-рецептором (Nature 401:184-188(1996) & 254:411 (1991)).
Терапевтические значения эффективного ингибитора Trk могут в значительной степени выходить за пределы терапии боли. Также было документально зафиксировано разрушение данного рецептора и его сигнального пути в некоторых злокачественных опухолях. Считается, что тирозинкиназная активность Trk стимулирует нерегулируемую активацию механизма пролиферации клеток. Считается, что ингибиторы киназ TrkA, TrkB или TrkC, отдельно или в комбинации, имеют полезность в отношении некоторых из наиболее распространенных видов рака, таких как рак головного мозга, меланома, множественная миелома, плоскоклеточный рак, рак мочевого пузыря, рак желудка, рак поджелудочной железы, рак молочной железы, рак головы, рак шеи, рак пищевода, рак предстательной железы, колоректальный рак, рак легкого, рак почки, рак яичника, гинекологический рак, рак щитовидной железы и определенные типы гемобластоза. Лестауртиниб (СЕР-701, Cephalon), индолокарбазольный ингибитор некоторых тирозинкиназ, в том числе Flt-3 и TrkA, и СЕР-751, общий ингибитор Trk, вступили в клинические испытания фазы II относительно лечения острого миелогенного лейкоза (AML), рака поджелудочной железы и множественной миеломы (ММ) и/или рака предстательной железы.
В связи с терапевтической перспективой, связанной с ингибированием TrkA, и относительным отсутствием сильнодействующих и селективных ингибиторов существует большая потребность в обнаружении сильнодействующих и особенно селективных для изоформ ингибиторов TrkA, в частности, активных при пероральном введении малых синтетических молекул для возможного лечения или предупреждения заболевания или нарушений, ассоциированных с активностью TrkA.
3. КРАТКОЕ ОПИСАНИЕ РАСКРЫТИЯ
Объектом настоящего раскрытия является применение малой синтетической молекулы и ее солей, или сольватов, или пролекарства, в качестве ингибиторов и/или антагонистов протеинкиназы, в частности, в качестве ингибитора и/или антагониста рецептора NGF TrkA, для получения лекарственного препарата для лечения и/или предупреждения заболеваний, ассоциированных непосредственно или опосредованно с ингибированием TrkA, которые включают определенный вид рака (например, рак поджелудочной железы, рак желудка, рак пищевода, рак желудочно-кишечного тракта, колоректальный рак, рак легкого (мелкоклеточный и немелкоклеточный), рак печени, гепатоцеллюлярную карциному, внутрипеченочную холангиокарциному, рак головного мозга или нейробластому, глиобластому и медуллобластому человека, ретинобластому, лейкоз, лимфому, меланому, злокачественную мезотелиому, рак молочной железы, рак мочевого пузыря, рак яичника, рак предстательной железы или метастазирование, рак щитовидной железы, плоскоклеточную карциному, опухоли Шпиц, шпицоидные меланомы, острый миелогенный лейкоз, рак эндометрия, рак кожи, рак полости рта, рак костей, меланому), зуд, атопический дерматит, чесотку, питириаз, воспалительное заболевание кишечника, воспалительный артрит, астму, заболевания дыхательных путей человека, респираторное заболевание, фиброзное заболевание, фиброз почки, фиброз печени, цирроз печени, рестеноз, атеросклероз, псориаз, тромбоз, болезнь Шагаса, паразитарные заболевания, болезнь Альцгеймера, боль (т.е. для уменьшения боли у субъекта, нуждающегося в этом, включающей острую боль, хроническую боль, воспалительную боль, нейропатическую боль, раковую боль и генерализованное болевое расстройство), воспалительные заболевания легких, легочный саркоидоз, дисфункцию мочевого пузыря или дисфункцию нижних мочевыводящих путей, болезнь Паджета, диабетическую нефропатию, синдром раздраженного кишечника, облучение, шизофрению, заболевание, нарушение, поражение или дисфункцию, связанные с дисмиелинизацией или демиелинизацией, или заболевание или нарушение, ассоциированные с аномальными видами активности протеинкиназ.
В одном аспекте в настоящем раскрытии представлены, помимо прочего, низкомолекулярные соединения и их соли, или сольваты, или пролекарства, в качестве ингибиторов и/или антагонистов рецептора NGF TrkA для получения лекарственного препарата для лечения и/или предупреждения заболеваний, ассоциированных непосредственно или опосредованно с модулированием активности или экспрессии протеинкиназы TrkA или активности в определенных популяциях пациентов со следующими типами рака с TrkA-положительными мутациями, слияниями или мутациями слияния или генетически аномальной TrkA-киназной активностью, которые могут быть клинически диагностированы с помощью доступных в настоящее время или в будущем инструментов для диагностики, например, раком поджелудочной железы, раком предстательной железы или метастазированием, раком молочной железы, гепатоцеллюлярной карциномой, внутрипеченочной холангиокарциномой, раком печени, раком яичника, раком щитовидной железы, раком легкого (мелкоклеточным и немелкоклеточным), колоректальным раком, глиобластомой, опухолями Шпиц, шпицоидными меланомами, острым миелогенным лейкозом, раком эндометрия, раком кожи, раком полости рта, раком костей, меланомой, раком желудка, раком пищевода, раком желудочно-кишечного тракта, раком головного мозга или нейробластомой, медуллобластомой человека, ретинобластомой, лейкозом, лимфомой, злокачественной мезотелиомой, раком мочевого пузыря, плоскоклеточными карциномами.
В одном аспекте в настоящем раскрытии представлены соединения, имеющие структурную формулу (I):
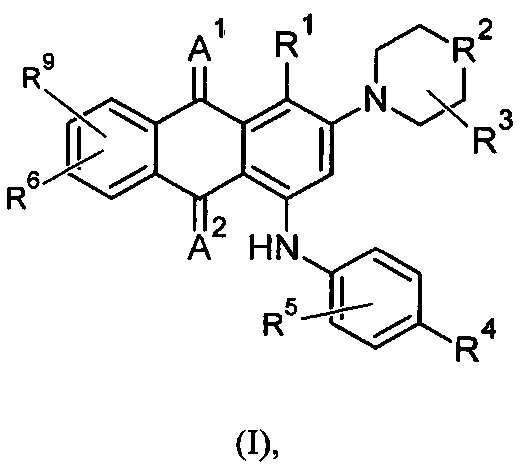
или их соль, сольват, сложный эфир или пролекарство;
где:
А1 и А2 независимо представляют собой кислород или серу;
R1 представляет собой NH2 или R7;
R2 представляет собой NR7 или CR7R10;
R3, R5, R6 и R9 независимо представляют собой R7;
или, в качестве альтернативы, R6 и R9, взятые вместе с атомом(атомами), к которому(которым) они присоединены, образуют 3-6-членную необязательно замещенную гетероциклическую группу, содержащую один или более гетероатомов, выбранных из группы, включающей азот, кислород и серу;
R4 представляет собой галоген, CN, NO2, CF3, -(CHR)nCOOR11, -(CHR)nSO2R11, С1-4галогеналкил, -ОС1-4-галогеналкил, С2-6алкил, С2-6алкенил, С2-6алкинил, -(CHR)nC6-10apил, -(CHR)nC5-8гетероцикл, -(CHR)nC3-8циклоалкил, -О-С6-10арил, -О-С5-10гетероцикл, -(CHR)nC(O)CF3, -(CHR)nC(OH)(CF3)2, -(СН2)nгалоген, -OR10, -NR11R12, -NRaCOR11, -NRaCOOR11, -NRaSO2R11, -NRaCONR11R12, -COR11, тетразол, -(CHR)nтетразол, -S-С1-6алкил или -CONR11R12, где каждый указанный алкил, алкенил, алкинил, арил, циклоалкил и гетероцикл необязательно независимо замещен 1 -2 группами R8;
или, в качестве альтернативы, R4 и R5, взятые вместе с атомом(атомами), к которому (которым) они присоединены, образуют 3-6-членную необязательно замещенную гетероциклическую группу, содержащую один или более гетероатомов, выбранных из группы, включающей азот, кислород и серу;
R7 и R10 независимо выбраны из группы, включающей водород, галоген, CN, NH2, NO2, С1-4галогеналкил, -ОС1-4галогеналкил, С1-6алкил, С2-6алкенил, С2-6алкинил, -(CHR)nC6-10арил, -(CHR)nC5-8гетероцикл, -(CHR)nC3-8циклоалкил, -О-С6-10арил, -O-С5-10гетероцикл, -C(O)CF3, -(СН2)nгалоген, -(CHR)n-(O)n-C(=O)R8, -(CHR)n-(S)n-C(=O)R8, -ORa, -NR11R12, -NRaCOR11, -NRaCOORa, -NRaSO2R, -NRaCONR11R12, -CORa, -(CHR)nCOORa, -S-С1-6алкил и -CONR11R12, где каждый указанный алкил, алкенил, алкинил, арил, циклоалкил и гетероцикл необязательно независимо замещен 1-2 группами R8;
R11 и R12 независимо выбраны из группы, включающей водород, N(Ra)C(=O)R, галоген, CN, NH2, NHRa, NO2, С1-4галогеналкил, -ОС1-4галогеналкил, С1-6алкил, С2-8алкенил, -S-C1-6алкил, -C(=O)-(O)n-Ra, -(CHR)n-(O)n-C(=O)R8, -(CHR)n-(S)n-C(=O)R8, -ORa, -(CHR)nC3-10циклоалкил, -(CHR)nC6-10арил, -(CHR)nC5-10гетероарил и -(CHR)nC5-10гетероцикл, где каждый указанный алкил, алкенил, циклоалкил, арил, гетероарил и гетероцикл необязательно независимо замещен 1-2 группами R8, и где один или более атомов углерода указанного алкила могут быть заменены одним или более гетероатомами, выбранными из группы, включающей азот, кислород и серу;
или, в качестве альтернативы, R11 и R12, взятые вместе с атомом(атомами), к которому(которым) они присоединены, образуют 3-6-членную необязательно замещенную гетероциклическую группу, содержащую один или более гетероатомов, выбранных из группы, включающей азот, кислород и серу; где необязательный заместитель представляет собой R8; и
каждый R независимо представляет собой водород, галоген, CN, NO2, NH2 или С1-6алкил;
каждый Ra независимо представляет собой водород или С1-6алкил;
каждый R8 независимо представляет собой С1-6алкил, галоген, CN, NO2, NH2, NHRa, SO2R11 или NRaSO2R11; и
n представляет собой целое число от 0 до 3;
при следующих условиях:
если R2 представляет собой СН2, то R4 не представляет собой Н или СН3;
если R2 представляет собой NCH2CH2OH, то (a) R4 не представляет собой Н или ОСН3 или (b) R5 не представляет собой ОСН3; и
если R2 представляет собой N(CH3), то R4 не представляет собой Н, СН3, ОСН3 или F.
В одном варианте осуществления формулы (I) R1 выбран из группы, включающей водород, -(СН2)nгалоген, -CN, -СН3, NH2, NHRa и -С1-3алкил.
В одном варианте осуществления формулы (I) R4 выбран из группы, включающей -C(O)OR11, -SO2NHC(=O)CH3, -C(CF3)(CF3)OH, -SO2NH2, -C(O)NR11R12, -CN, -CF3, -NO2, -C(O)CF3, -(СН2)nгалоген, 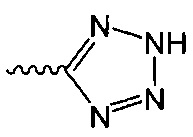
 и
и  .
.
В одном варианте осуществления формулы (I) R3, R5, R6 и R9 представляют собой водород.
В одном варианте осуществления формулы (I) R2 выбран из
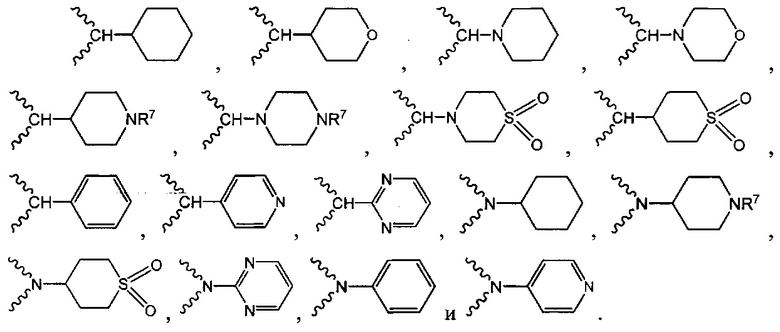
В другом аспекте в настоящем раскрытии представлены соединения, имеющие структурную формулу (II):
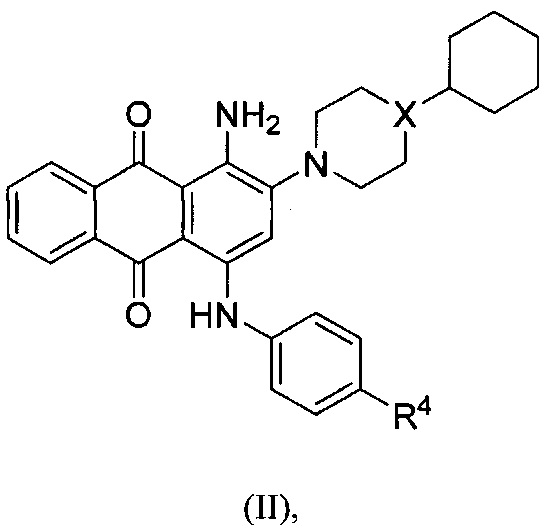
или их соль, сольват, сложный эфир или пролекарство; где:
X представляет собой N или СН;
R4 представляет собой биоизостер карбоксигруппы, выбранный из -(CHR)nCOOR11, -(CHR)nSO2R11, -(CHR)nC5-8гетероцикла или -(CHR)nC(OH)(CF3)2, где каждый указанный гетероцикл необязательно независимо замещен 1-2 группами R8;
R11 независимо выбран из группы, включающей водород, С1-6алкил, NH2, NHRa и NRaC(=O)R, где каждый указанный алкил необязательно независимо замещен 1-2 группами R8, и где один атом углерода указанного алкила может быть заменен одним гетероатомом, выбранным из группы, включающей азот, кислород и серу;
каждый R8 независимо представляет собой С1-6алкил, галоген, CN, NO2, NH2, NHRa, SO2R11 или NRaSO2R11;
каждый R независимо представляет собой водород, галоген, CN, NO2, NH2 или С1-6алкил;
каждый Ra независимо представляет собой водород или С1-6алкил; и
n равно 0.
В одном варианте осуществления формулы (II) X представляет собой N.
В одном варианте осуществления формулы (II) R4 представляет собой -COOR11, где R11 представляет собой водород. В одном варианте осуществления формулы (II) R4 представляет собой -COOR11, где R11 представляет собой С1-6алкил. В некоторых вариантах осуществления формулы (II) R4 представляет собой -COOR11, где R11 представляет собой С1-6алкил, где один атом углерода указанного С1-6алкила заменен одним атомом азота.
В одном варианте осуществления формулы (II) X представляет собой N, a R4 представляет собой -COOR11, где R11 представляет собой водород.
В другом варианте осуществления формулы (II) R4 представляет собой -SO2R11, где R11 представляет собой NH2 или NRaC(=O)R. В некоторых вариантах осуществления формулы (II) R4 представляет собой -SO2R11, где R11 представляет собой NHC(=O)R, и где R представляет собой С1-6алкил.
В одном варианте осуществления формулы (II) R4 представляет собой С5гетероцикл, где гетероцикл представляет собой тетразол.
В другом аспекте в настоящем раскрытии представлены фармацевтические композиции, содержащие одно или более соединений, описанных выше, или их соль, сольват, сложный эфир, пролекарство или физиологически функциональное производное; и фармацевтически приемлемое индифферентное вещество.
В еще одном аспекте в настоящем раскрытии представлены способы селективного ингибирования рецептора NGF TrkA или проявления антагонизма по отношению к нему для лечения и/или предупреждения определенного заболевания, нарушения, симптома или состояния, в том числе рака (например, рака поджелудочной железы, рака желудка, рака пищевода, рака желудочно-кишечного тракта, колоректального рака, рака легкого, рака печени, рака головного мозга или нейробластомы, глиобластомы и медуллобластомы человека, ретинобластомы, лейкоза, лимфомы, меланомы, злокачественной мезотелиомы, рака молочной железы, рака мочевого пузыря, рака яичника, рака предстательной железы, рака щитовидной железы, плоскоклеточных карцином, зуда, атопического дерматита, чесотки, питириаза, воспалительного заболевания кишечника, воспалительного артрита, астмы, заболеваний дыхательных путей человека, рестеноза, атеросклероза, псориаза, тромбоза, болезни Шагаса, паразитарных заболеваний, болезни Альцгеймера, боли, заболевания, нарушения, поражения или дисфункции, связанных с дисмиелинизацией или демиелинизацией, или заболевания или нарушения, ассоциированных с аномальными видами активности протеинкиназ, с помощью терапевтически эффективного количества соединения, описанного выше, или его соли, сольвата или физиологически функционального производного.
В еще одном аспекте в настоящем раскрытии представлены способы лечения и/или предупреждения определенного вида рака (например, рака поджелудочной железы, рака желудка, рака пищевода, рака желудочно-кишечного тракта, колоректального рака, рака легкого, рака печени, рака головного мозга или нейробластомы, глиобластомы и медуллобластомы человека, ретинобластомы, лейкоза, лимфомы, меланомы, злокачественной мезотелиомы, рака молочной железы, рака мочевого пузыря, рака яичника, рака предстательной железы, рака щитовидной железы, плоскоклеточных карцином, зуда, атопического дерматита, чесотки, питириаза, воспалительного заболевания кишечника, воспалительного артрита, астмы, заболеваний дыхательных путей человека, рестеноза, атеросклероза, псориаза, тромбоза, болезни Шагаса, паразитарных заболеваний, болезни Альцгеймера, боли, заболевания, нарушения, поражения или дисфункции, связанных с дисмиелинизацией или демиелинизацией, или заболевания или нарушения, ассоциированных с аномальными видами активности протеинкиназ, с помощью комбинации (а) терапевтически эффективного количества соединения, описанного выше, или его соли, сольвата или сложного эфира, пролекарства или физиологически функционального производного, и (b1) опиоидного обезболивающего средства или по меньшей мере одного обезболивающего средства, которое действует по механизму, отличному от антагонизма TrkA, либо (b2) существующего или утвержденного противоракового средства или по меньшей мере одного существующего или утвержденного противоракового средства.
Дополнительные варианты осуществления включают комбинацию любого из приведенных выше вариантов осуществления и одного или более фармацевтически приемлемых наполнителей. Другие варианты осуществления включают лекарственную форму, например, твердую или полужидкую лекарственную форму, содержащую любую из приведенных выше кристаллических форм, аморфных форм или их комбинаций. В еще нескольких вариантах осуществления лекарственная форма, содержащая любую из приведенных выше кристаллических форм, аморфных форм или их комбинаций, включает одно или более из таблетки, твердой капсулы, мягкой капсулы, порошка, суппозитория и геля или одно или более из инъекционной формы, трансдермального пластыря, распыляемой формы и имплантируемого депо-препарата.
Другие варианты осуществления представляют собой применение любого из приведенных выше вариантов осуществления в получении лекарственной формы для ингибирования рецептора NGF TrkA. Еще несколько вариантов осуществления представляют собой применение любого из приведенных выше вариантов осуществления для получения лекарственной формы для лечения нарушения, заболевания или состояния, выбранных из группы, включающей боль (т.е. для уменьшения боли у субъекта, нуждающегося в этом, включающей острую боль, хроническую боль, воспалительную боль, нейропатическую боль, раковую боль и генерализованное болевое расстройство), рак (например, рак поджелудочной железы, рак предстательной железы или метастазирование, рак молочной железы, гепатоцеллюлярную карциному, внутрипеченочную холангиокарциному, рак печени, рак яичника, рак щитовидной железы, рак легкого (мелкоклеточный и немелкоклеточный), колоректальный рак, глиобластому, опухоли Шпиц, шпицоидные меланомы, острый миелогенный лейкоз, рак эндометрия, рак кожи, рак полости рта, рак костей, меланому, рак желудка, рак пищевода, рак желудочно-кишечного тракта, рак головного мозга или нейробластому, медуллобластому человека, ретинобластому, лейкоз, лимфому, злокачественную мезотелиому, рак мочевого пузыря, плоскоклеточные карциномы), атопический дерматит, псориаз, заболевания кожи, зуд, фиброз печени, цирроз печени, чесотку, питириаз, воспалительное заболевание кишечника, воспалительный артрит, астму, заболевания дыхательных путей человека, болезнь Шагаса, паразитарные заболевания, болезнь Альцгеймера, рестеноз, атеросклероз, тромбоз, цирроз печени, фиброз печени, воспалительные заболевания легких, легочный саркоидоз, дисфункцию мочевого пузыря или дисфункцию нижних мочевыводящих путей, болезнь Паджета, диабетическую нефропатию, синдром раздраженного кишечника, облучение, шизофрению, или заболевание, нарушение или поражение, связанные с дисмиелинизацией или демиелинизацией, или заболевание или нарушение, ассоциированные с аномальными видами активности TrkA-протеинкиназ или слияниями или мутациями белка TrkA (NTRK1), с помощью терапевтически эффективного количества соединения, описанного выше, или его соли, сольвата или физиологически функционального производного.
В другом аспекте в настоящем раскрытии представлены фармацевтические композиции, содержащие соединение, описанное выше, и фармацевтически приемлемое индифферентное вещество.
В другом аспекте в настоящем раскрытии представлен способ применения соединения, имеющего структурную формулу (I) и/или формулу (II), в медицинском лечении и предупреждении.
В другом аспекте в настоящем раскрытии представлен способ применения соединения, имеющего структурную формулу (I) и/или формулу (II), в медицинском лечении и предупреждении боли (т.е. уменьшении боли у субъекта, нуждающегося в этом, включающей острую боль, хроническую боль, воспалительную боль, нейропатическую боль, раковую боль и генерализованное болевое расстройство), рака (например, рака поджелудочной железы, рака предстательной железы или метастазирования, рака молочной железы, гепатоцеллюлярной карциномы, внутрипеченочной холангиокарциномы, рака печени, рака яичника, рака щитовидной железы, рака легкого (мелкоклеточного или немелкоклеточного), колоректального рака, глиобластомы, опухолей Шпиц, шпицоидных меланом, острого миелогенного лейкоза, рака эндометрия, рака кожи, рака полости рта, рака костей, меланомы, рака желудка, рака пищевода, рака желудочно-кишечного тракта, рака головного мозга или нейробластомы, медуллобластомы человека, ретинобластомы, лейкоза, лимфомы, злокачественной мезотелиомы, рака мочевого пузыря, плоскоклеточных карцином), атопического дерматита, псориаза, заболеваний кожи, зуда, фиброза печени, цирроза печени, чесотки, питириаза, воспалительного заболевания кишечника, воспалительного артрита, астмы, заболеваний дыхательных путей человека, болезни Шагаса, паразитарных заболеваний, болезни Альцгеймера, рестеноза, атеросклероза, тромбоза, цирроза печени, фиброза печени, воспалительных заболеваний легких, легочного саркоидоза, дисфункции мочевого пузыря или дисфункции нижних мочевыводящих путей, болезни Паджета, диабетической нефропатии, синдрома раздраженного кишечника, облучения, шизофрении, или заболевания, нарушения или поражения, связанных с дисмиелинизацией или демиелинизацией, или заболевания или нарушения, ассоциированных с патологическими видами активности TrkA-протеинкиназ или слияниями или мутациями белка TrkA (NTRK1), с помощью комбинации (а) терапевтически эффективного количества соединения, описанного выше, или его соли, сольвата или сложного эфира, пролекарства или физиологически функционального производного, и (b1) опиоидного обезболивающего "средства или по меньшей мере одного обезболивающего средства, которое действует по механизму, отличному от антагонизма Trk, либо (b2) существующего или одобренного противоракового средства или химиотерапевтического средства или по меньшей мере одного существующего или одобренного противоракового средства.
В другом аспекте в настоящем раскрытии представлен способ получения соединения, имеющего структурную формулу (I) и/или формулу (II), описанные выше.
В другом аспекте в настоящем раскрытии представлен способ лечения заболевания, нарушения, симптома или состояния, ассоциированных с ненормальной активностью TrkA или со слиянием или мутацией белка TrkA или гена NTRK1, у пациента, страдающего от них, включающий введение пациенту фармацевтической композиции, содержащей терапевтически эффективное количество соединения, имеющего структурную формулу (I) и/или формулу (II), где фармацевтическая композиция составлена в единичную лекарственную форму, выбранную из группы, включающей единичную лекарственную форму для перорального введения (в том числе порошок, таблетки, пилюли, пеллеты, капсулы, порошки, пастилки, гранулы, растворы, суспензии, эмульсии, сиропы, эликсиры, составы с пролонгированным высвобождением, аэрозоли, распыляемые составы и капсуловидные таблетки), ингаляционную единичную лекарственную форму (в том числе распыляемый состав, аэрозоль, лекарственные формы для ингалятора, аэрозольного распылителя, образования дыма и испарителя), единичную лекарственную форму для парентерального введения (в том числе единичные лекарственные формы для внутрикожной, внутримышечной, внутрикостной, внутрибрюшинной, внутривенной, эпидуральной, внутрисердечной, внутриглазной, внутрисуставной, подкожной и интратекальной инъекции), единичную лекарственную форму для наружного применения (в том числе крем, гель, жидкую мазь или бальзам, лосьон или мазь, ушные капли, глазные капли, кожный пластырь и вагинальные кольца), единичную лекарственную форму для интраназального введения, суппозиторную единичную лекарственную форму (в том числе вагинальную, спринцевальную, маточную и ректальную), единичную лекарственную форму для эпидурального введения, подъязычную единичную лекарственную форму (в том числе пастилку и лепешку) и единичную лекарственную форму для внутримозгового введения.
В другом аспекте в настоящем раскрытии представлен способ лечения заболевания, нарушения, симптома или состояния, ассоциированных с ненормальной активностью TrkA или со слиянием или мутацией белка TrkA или гена NTRK1, у пациента, страдающего от них, включающий введение пациенту фармацевтической композиции, содержащей терапевтически эффективное количество соединения, имеющего структурную формулу (I) и/или формулу (II), где фармацевтическая композиция составлена в единичную лекарственную форму для перорального введения, содержащую от приблизительно 0,02 мг соединения на кг веса тела до приблизительно 60 мг соединения на кг веса тела.
В другом аспекте в настоящем раскрытии представлен способ лечения заболевания, нарушения, симптома или состояния, ассоциированных с ненормальной активностью TrkA или со слиянием или мутацией белка TrkA или гена NTRK1, у пациента, страдающего от них, включающий введение пациенту фармацевтической композиции, содержащей терапевтически эффективное количество соединения, имеющего структурную формулу (I) и/или формулу (II), где фармацевтическая композиция составлена в единичную лекарственную форму для внутривенного введения, содержащую от приблизительно 0,002 мг соединения на кг веса тела до приблизительно 60 мг соединения на кг веса тела.
В другом аспекте в настоящем раскрытии представлен способ лечения заболевания, нарушения, симптома или состояния, ассоциированных с ненормальной активностью TrkA или слиянием или мутацией белка TrkA или гена NTRK1, у пациента, страдающего от них, включающий введение пациенту фармацевтической композиции, содержащей терапевтически эффективное количество соединения, имеющего структурную формулу (I) и/или формулу (II), где фармацевтическая композиция составлена в единичную лекарственную форму для интраназального введения, содержащую от приблизительно 0,002 мг соединения на кг веса тела до приблизительно 6 мг соединения на кг веса тела.
В другом аспекте в настоящем раскрытии представлен способ лечения заболевания, нарушения, симптома или состояния, ассоциированных с ненормальной активностью TrkA или слиянием или мутацией белка TrkA или гена NTRK1, у пациента, страдающего от них, включающий введение пациенту фармацевтической композиции, содержащей терапевтически эффективное количество соединения, имеющего структурную формулу (I) и/или формулу (II), где фармацевтическая композиция составлена в суппозиторную единичную лекарственную форму, содержащую от приблизительно 0,001 мг соединения на кг веса тела до приблизительно 50 мг соединения на кг веса тела, и содержит активный ингредиент в диапазоне от приблизительно 0,5% до приблизительно 10% по весу.
В другом аспекте в настоящем раскрытии представлен способ лечения заболевания, нарушения, симптома или состояния, ассоциированных с ненормальной активностью TrkA или слиянием или мутацией белка TrkA или гена NTRK1, у пациента, страдающего от них, включающий введение пациенту фармацевтической композиции, содержащей терапевтически эффективное количество соединения, имеющего структурную формулу (I) и/или формулу (II), где фармацевтическая композиция составлена в единичную лекарственную форму, выбранную из группы, включающей единичную лекарственную форму для парентерального введения (в том числе единичные лекарственные формы для внутрикожной, внутримышечной, внутрикостной, внутрибрюшинной, внутривенной, эпидуральной, внутрисердечной, внутриглазной, внутрисуставной, подкожной и интратекальной инъекции), единичную лекарственную форму для наружного применения (в том числе крем, гель, жидкую мазь или бальзам, лосьон или мазь, ушные капли, глазные капли, кожный пластырь и вагинальные кольца), единичную лекарственную форму для интраназального введения, суппозиторную единичную лекарственную форму (в том числе вагинальную, спринцевальную, маточную и ректальную), единичную лекарственную форму для эпидурального введения, подъязычную единичную лекарственную форму (в том числе пастилку и лепешку) и единичную лекарственную форму для внутримозгового введения, единичную лекарственную форму для внутрикожного введения, единичную лекарственную форму для внутримышечного введения, единичную лекарственную форму для внутрибрюшинного введения, единичную лекарственную форму для подкожного введения, единичную лекарственную форму для эпидурального введения, подъязычную единичную лекарственную форму и единичную лекарственную форму для внутримозгового введения, где указанные единичные лекарственные формы содержат от приблизительно 0,001 мг соединения на кг веса тела до приблизительно 60 мг соединения на кг веса тела.
5. ПОДРОБНОЕ ОПИСАНИЕ РАСКРЫТИЯ
Настоящее раскрытие относится к новым синтетическим малым молекулам, которые действуют в качестве ингибиторов и/или антагонистов членов семейства протеинкиназ Trk, в частности, рецептора NGF TrkA.
5.1 ОПРЕДЕЛЕНИЯ
Термины, применяемые в формуле изобретения и описании, определены согласно изложенному ниже, если не указано иное.
Термин "соединение по настоящему раскрытию", "данное соединение по настоящему раскрытию", "соединения по настоящему раскрытию", или "настоящие соединения" относится к одному или более соединениям, охватываемым структурными формулами и/или любыми субродовыми формулами, раскрытыми в данном документе, и включает любые конкретные соединения с данной общей формулой, структура которых раскрыта в данном документе. Соединения по настоящему раскрытию могут содержать один или более хиральных центров и/или двойных связей и, следовательно, могут существовать в виде стереоизомеров, таких как изомеры по двойной связи (т.е. геометрические изомеры), рацемических смесей, энантиомеров или диастереомеров. Соответственно, химические структуры, представленные в данном документе, охватывают все возможные энантиомеры и стереоизомеры проиллюстрированных соединений, в том числе стереоизомерно чистую форму (например, геометрически чистую, энантиомерно чистую или диастереомерно чистую) и смеси энантиомеров и стереоизомеров. Соединения по настоящему раскрытию также могут существовать в нескольких таутомерных формах. Соответственно, химические структуры, представленные в данном документе, охватывают все возможные таутомерные формы проиллюстрированных соединений. Соединения также включают меченные изотопами соединения, где один или более атомов имеют атомную массу, отличную от атомной массы, обычно обнаруживаемой в природе. Примеры изотопов, которые могут быть введены в соединения, включают без ограничения 2Н, 3Н, 13С, 14С, 15N, 17O, 18O и т.д. Соединения могут существовать в несольватированных формах, а также в сольватированных„ формах, в том числе в гидратированных формах и в виде N-оксидов. В целом, соль, гидратированная, сольватированная и N-оксидная формы находятся в пределах объема настоящего раскрытия. Определенные соединения по настоящему раскрытию могут существовать в нескольких кристаллических формах или в аморфной форме. В целом, все физические формы эквивалентны путям применения, предусмотренным в настоящем раскрытии, и предназначены для включения в объем настоящего раскрытия.
Термин "физиологически функциональное(функциональные) производное(производные)". применяемый в данном документе, относится к любому физиологически переносимому производному соединения по настоящему раскрытию, например, к сложному эфиру или пролекарству, которое при введении млекопитающему, например, человеку, превращается непосредственно или опосредованно в соединение формулы (I) и/или формулы (II) или его активный метаболит. Физиологически функциональные производные включают пролекарства соединений по настоящему раскрытию. Примеры пролекарств описаны в Н. Okada et al., Chem. Pharm. Bull. 1994, 42, 57-61. Такие пролекарства могут преобразовываться in vivo в ходе метаболизма в соединение по настоящему раскрытию. Данные пролекарства сами по себе могут быть активными или неактивными.
"Алкил" сам по себе или в качестве части другого заместителя относится к насыщенному или ненасыщенному, разветвленному, имеющему прямую цепь или циклическому одновалентному углеводородному радикалу, полученному посредством удаления одного атома водорода от одного атома углерода исходного алкана, алкена или алкина. Термин "алкил" специально предназначен для включения групп, имеющих любые степень или уровень насыщения, т.е. групп, имеющих исключительно одинарные углерод-углеродные связи, групп, имеющих одну или более двойных углерод-углеродных связей, групп, имеющих одну или более тройных углерод-углеродных связей, и групп, имеющих комбинации одинарных, двойных и тройных углерод-углеродных связей. Если предполагается конкретный уровень насыщения, то применяют выражения "алканил", "алкенил" и "алкинил". В некоторых вариантах осуществления алкильная группа содержит от 1 до 20 атомов углерода (С1-С20алкил). В других вариантах осуществления алкильная группа содержит от 1 до 10 атомов углерода (С1-С10алкил). В еще нескольких вариантах осуществления алкильная группа содержит от 1 до 6 атомов углерода (С1-С6алкил). Типичные алкильные группы включают без ограничения метил; этилы, такие как этанил, этенил, этинил; пропилы, такие как пропан-1-ил, пропан-2-ил, циклопропан-1-ил, проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), циклопроп-1-ен-1-ил; циклопроп-2-ен-1-ил, проп-1-ин-1-ил, проп-2-ин-1-ил и т.д.; бутилы, такие как бутан-1-ил, бутан-2-ил, 2-метилпропан-1-ил, 2-метилпропан-2-ил, циклобутан-1-ил, бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метилпроп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил, бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.д.; и т.п.
"Алканил" сам по себе или в качестве части другого заместителя относится к насыщенному, разветвленному, имеющему прямую цепь или циклическому алкильному радикалу, полученному путем удаления одного атома водорода от одного атома углерода исходного алкана. Типичные алканильные группы включают без ограничения метанил; этанил; пропанилы, такие как пропан-1-ил, пропан-2-ил (изопропил), циклопропан-1-ил и т.д.; бутанилы, такие как бутан-1-ил, бутан-2-ил (втор-бутил), 2-метилпропан-1-ил (изобутил), 2-метилпропан-2-ил (трет-бутил), циклобутан-1-ил и т.д.; и т.п.
"Алкенил" сам по себе или в качестве части другого заместителя относится к ненасыщенному, разветвленному, имеющему прямую цепь или циклическому алкильному радикалу, имеющему по меньшей мере одну двойную углерод-углеродную связь, полученному путем удаления одного атома водорода от одного атома углерода исходного алкена. Группа может быть либо в цис-, либо в транс-конформации относительно двойной(двойных) связи(связей). Типичные алкенильные группы включают без ограничения этенил; пропенилы, такие как проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), проп-2-ен-2-ил, циклопроп-1-ен-1-ил; циклопроп-2-ен-1-ил; бутенилы, такие как бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метилпроп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил и т.д.; и т.п.
"Алкинил" сам по себе или в качестве части другого заместителя относится к ненасыщенному, разветвленному, имеющему прямую цепь или циклическому алкильному радикалу, имеющему по меньшей мере одну тройную углерод-углеродную связь, полученному путем удаления одного атома водорода от одного атома углерода исходного алкина. Типичные алкинильные группы включают без ограничения этинил; пропинилы, такие как проп-1-ин-1-ил, проп-2-ин-1-ил и т.д.; бутинилы, такие как бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.д.; и т.п.
"Алкилдиил" сам по себе или в качестве части другого заместителя относится к насыщенной или ненасыщенной, разветвленной, имеющей прямую цепь или циклической двухвалентной углеводородной группе, полученной путем удаления одного атома водорода от каждого из двух различных атомов углерода исходного алкана, алкена или алкина или путем удаления двух атомов водорода от одного атома углерода исходного алкана, алкена или алкина. Два одновалентных радикальных центра или двухвалентный радикальный центр по каждой единице валентности могут образовывать связи с одинаковыми или различными атомами. Типичные алкилдиильные группы включают без ограничения метандиил; этилдиилы, такие как этан-1,1-диил, этан-1,2-диил, этен-1,1-диил, этен-1,2-диил; пропилдиилы, такие как пропан-1,1-диил, пропан-1,2-диил, пропан-2,2-диил, пропан-1,3-диил, циклопропан-1,1-диил, циклопропан-1,2-диил, проп-1-ен-1,1-диил, проп-1-ен-1,2-диил, проп-2-ен-1,2-диил, проп-1-ен-1,3-диил, циклопроп-1-ен-1,2-диил, циклопроп-2-ен-1,2-диил, циклопроп-2-ен-1,1-диил, проп-1-ин-1,3-диил и т.д.; бутилдиилы, такие как бутан-1,1-диил, бутан-1,2-диил, бутан-1,3-диил, бутан-1,4-диил, бутан-2,2-диил, 2-метилпропан-1,1-диил, 2-метилпропан-1,2-диил, циклобутан-1,1-диил; циклобутан-1,2-диил, циклобутан-1,3-диил, бут-1-ен-1,1-диил, бут-1-ен-1,2-диил, бут-1-ен-1,3-диил, бут-1-ен-1,4-диил, 2-метилпроп-1-ен-1,1-диил, 2-метанилиденпропан-1,1-диил, бута-1,3-диен-1,1-диил, бута-1,3-диен-1,2-диил, бута-1,3-диен-1,3-диил, бута-1,3-диен-1,4-диил, циклобут-1-ен-1,2-диил, циклобут-1-ен-1,3-диил, циклобут-2-ен-1,2-диил, циклобута-1,3-диен-1,2-диил, циклобута-1,3-диен-1,3-диил, бут-1-ин-1,3-диил, бут-1-ин-1,4-диил, бута-1,3-диин-1,4-диил и т.д.; и т.п. Если предполагаются конкретные уровни насыщения, то применяют номенклатурные обозначения алканилдиил, алкенилдиил и/или алкинилдиил. В некоторых вариантах осуществления алкилдиильная группа представляет собой (С1-С20)алкилдиил, более предпочтительно (С1-С10)алкилдиил, наиболее предпочтительно (С1-С6)алкилдиил.
"Алкилено" сам по себе или в качестве части другого заместителя относится к имеющей прямую цепь алкилдиильной группе, имеющей два концевых одновалентных радикальных центра, полученной путем удаления одного атома водорода от каждого из двух концевых атомов углерода исходного алкана, алкена или алкина с прямой цепью. Типичные алкиленовые группы включают без ограничения метановую группу; этиленовые группы, такие как этановая, этеновая, этиновая; пропиленовые группы, такие как пропановая, проп[1]еновая, пропа[1,2]диеновая, проп[1]иновая и т.д.; бутиленовые группы, такие как бутановая, бут[1]еновая, бут[2]еновая, бута[1,3]диеновая, бут[1]иновая, бут[2]иновая, бута[1,3]дииновая и т.д.; и т.п. Если предполагаются конкретные уровни насыщения, то применяют номенклатурные обозначения алкано, алкено и/или алкино.
"Ацил" сам по себе или в качестве части другого заместителя относится к радикалу -C(O)R200, где R200 представляет собой водород, алкил, замещенный алкил, арил, замещенный арил, арилалкил, замещенный арилалкил, гетероалкил, замещенный гетероалкил, гетероарилалкил или замещенный гетероарилалкил, как определено в данном документе. Иллюстративные примеры включают без ограничения формил, ацетил, циклогексилкарбонил, циклогексилметилкарбонил, бензоил, бензилкарбонил и т.п.
"Амино" сам по себе или в качестве части другого заместителя относится к радикалу -NRaRb, где Ra и Rb независимо представляют собой водород, алкил, замещенный алкил, арил, замещенный арил, арилалкил, замещенный арилалкил, гетероалкил, замещенный гетероалкил, гетероарилалкил или замещенный гетероарилалкил, как определено в данном документе, или, в качестве альтернативы, Ra и Rb, взятые вместе с атомами, с которыми они связаны, образуют циклогетероалкильное кольцо. Иллюстративные примеры включают без ограничения -NH2, -NHCH3, -N(CH3)2, -NH-фенил, -NH-СН2-фенил, пирролидин и т.п.
"Арил" сам по себе или в качестве части другого заместителя относится к одновалентной ароматической углеводородной группе, полученной путем удаления одного атома водорода от одного атома углерода исходной ароматической кольцевой системы, как определено в данном документе. Типичные арильные группы включают без ограничения группы, полученные из ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, флуорена, гексацена, гексафена, гексалена, ассим-индацена, сим-индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плеядена, пирена, пирантрена, рубицена, трифенилена, тринафталина и т.п. В некоторых вариантах осуществления арильная группа содержит от 6 до 20 атомов углерода (С6-С20арил). В других вариантах осуществления арильная группа содержит от 6 до 15 атомов углерода (C6-С15арил). В других вариантах осуществления арильная группа содержит от 6 до 10 атомов углерода (С6-С10арил).
"Арилалкил" сам по себе или в качестве части другого заместителя относится к ациклической алкильной группе, в которой один из атомов водорода, связанных с атомом углерода, как правило, концевой или находящийся в состоянии sp3-гибридизации атом углерода, заменен арильной группой, как определено в данном документе. Типичные арилалкильные группы включают без ограничения бензил, 2-фенилэтан-1-ил, 2-фенилэтен-1-ил, нафтилметил, 2-нафтилэтан-1-ил, 2-нафтилэтен-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и т.п. Если предполагаются конкретные алкильные фрагменты, то применяют номенклатурные обозначения арилалканил, арилалкенил и/или арилалкинил. В некоторых вариантах осуществления арилалкильная группа представляет собой (С6-С30)арилалкил, например, алканильный, алкенильный или алкинильный фрагмент арилалкильной группы представляет собой (С1-С10)алкил, и арильный фрагмент представляет собой (С6-С20)арил. В других вариантах осуществления арилалкильная группа представляет собой (С6-С20)арилалкил, например, алканильный, алкенильный или алкинильный фрагмент арилалкильной группы представляет собой (С1-С8)алкил, и арильный фрагмент представляет собой (С6-С12)арил. В еще нескольких вариантах осуществления арилалкильная группа представляет собой (С6-С15)арилалкил, например, алканильный, алкенильный или алкинильный фрагмент арилалкильной группы представляет собой (С1-С5)алкил, и арильный фрагмент представляет собой (С6-С10)арил.
"Арилокси" сам по себе или в качестве части другого заместителя относится к радикалу формулы -O-R201, где R201 представляет собой арил, замещенный арил, арилалкил или замещенный арилалкил.
"Арилоксикарбонил" сам по себе или в качестве части другого заместителя относится к радикалу формулы -C(O)-O-R201, где R201 представляет собой арил, замещенный арил, арилалкил или замещенный арилалкил.
"Биоизостер карбоксигруппы" сам по себе или в качестве части другого заместителя, как применяется в данном документе, относится к фрагменту, который, как ожидается, при физиологическом рН проявляет химические или биологические свойства, сходные с таковыми для фрагмента карбоновой кислоты в том же положении соединения. В определенных вариантах осуществления биоизостер карбоксилатной группы представляет собой фрагмент, выбранный из группы, включающей -C(O)OR11, -SO2R11, -С5-8гетероцикл и -C(OH)(CF3)2; R11 независимо выбран из группы, включающей водород, С1-6алкил, NH2, NHRa и NRaC(=O)R, где каждый указанный алкил необязательно независимо замещен, и где один атом углерода указанного алкила может быть заменен одним гетероатомом, выбранным из группы, включающей азот, кислород и серу; каждый R независимо представляет собой водород, галоген, CN, NO2, NH2 или С1-6алкил; каждый Ra независимо представляет собой водород или С1-6алкил.
"Циклоалкил" или "карбоциклил" сам по себе или в качестве части другого заместителя относится к насыщенному или ненасыщенному циклическому алкильному радикалу, как определено в данном документе. Если предполагается конкретный уровень насыщения, то применяют номенклатурные обозначения "циклоалканил" или "циклоалкенил". Типичные циклоалкильные группы включают без ограничения группы, полученные из циклопропана, циклобутана, циклопентана, циклогексана и т.п. В некоторых вариантах осуществления циклоалкильная группа содержит от 3 до 10 атомов кольца (С3-С10циклоалкил). В других вариантах осуществления циклоалкильная группа содержит от 3 до 7 атомов кольца (С3-С7циклоалкил).
"Циклогетероалкил" или "гетероциклил" сам по себе или в качестве части другого заместителя относится к насыщенному или ненасыщенному циклическому алкильному радикалу, в котором один или более атомов углерода (и необязательно любые связанные атомы водорода) независимо заменены одинаковыми или различными гетероатомами. Типичные гетероатомы для замены атома(атомов) углерода включают без ограничения В, N, Р, О, S, Si и т.д. Если предполагается конкретный уровень насыщения, то применяют номенклатурные обозначения "циклогетероалканил" или "циклогетероалкенил". Типичные циклогетероалкильные группы включают без ограничения группы, полученные из эпоксидов, азиринов, тииранов, имидазолидина, морфолина, пиперазина, пиперидина, пиразолидина, пирролидона, хинуклидина, боролана, диоксаборолана и т.п. В некоторых вариантах осуществления циклогетероалкильная группа содержит от 3 до 10 атомов кольца (3-10-членный циклогетероалкил). В других вариантах осуществления циклоалкильная группа содержит от 5 до 7 атомов кольца (5-7-членный циклогетероалкил).
"Галоген" или "атом галогена" сам по себе или в качестве части другого заместителя относится к любому из таких элементов, как фтор, хлор, бром, йод и астат, расположенных в группе VIIA. (17) периодической таблицы.
Циклогетероалкильная группа может быть замещена у гетероатома, например, атома азота, (С1-С6)алкильной группой. В качестве конкретных примеров в определение "циклогетероалкила" включены N-метилимидазолидинил, N-метилморфолинил, N-метилпиперазинил, N-метилпиперидинил, N-метилпиразолидинил и N-метилпирролидинил. Циклогетероалкильная группа может быть присоединена к остальной части молекулы посредством атома углерода кольца или гетероатома кольца.
"Гетероалкил, гетероалканил, гетероалкенил, гетероалканил, гетероалкилдиил и гетероалкилено" сами по себе или в качестве части другого заместителя относятся соответственно к алкильной, алканильной, алкенильной, алкинильной, алкилдиильной и алкиленовой группам, в которых каждый из одного или более атомов углерода (и любых связанных атомов водорода) независимо заменены одинаковыми или различными гетероатомными группами. Типичные гетероатомные группы, которые могут быть включены в данные группы, включают без ограничения -О-, -S-, -О-О-, -S-S-, -O-S-, -NR203R204-, =N-N=, -N=N-, -N=N-NR205R206, -PR207-, -P(O)2-, -POR208-, -O-P(O)2-, -SO-, -SO2-, -SnR209R210-, -BR211R212, BOR213OR214 и т.п., где R203, R204, R205, R206, R207, R208, R209, R210, R211, R212, R213 и R214 независимо представляют собой водород, алкил, замещенный алкил, арил, замещенный арил, арилалкил, замещенный арилалкил, циклоалкил, замещенный циклоалкил, циклогетероалкил, замещенный циклогетероалкил, гетероалкил, замещенный гетероалкил, гетероарил, замещенный гетероарил, гетероарилалкил или замещенный гетероарилалкил.
"Гетероарил" сам по себе или в качестве части другого заместителя относится к одновалентному гетероароматическому радикалу, полученному путем удаления одного атома водорода от одного атома исходных гетероароматических кольцевых систем, как определено в данном документе. Типичные гетероарильные группы включают без ограничения группы, полученные из акридина, β-карболина, хромана, хромена, циннолина, фурана, имидазола, индазола, индола, индолина, индолизина, изобензофурана, изохромена, изоиндола, изоиндолина, изохинолина, изотиазола, изоксазола, нафтиридина, оксадиазола, оксазола, перимидина, фенантридина, фенантролина, феназина, фталазина, птеридина, пурина, пирана, пиразина, пиразола, пиридазина, пиридина, пиримидина, пиррола, пирролизина, хиназолина, хинолина, хинолизина, хиноксалина, тетразола, тиадиазола, тиазола, тиофена, триазола, ксантена, фуропиридина и т.п. В некоторых вариантах осуществления гетероарильная группа содержит от 5 до 20 атомов кольца (5-20-членный гетероарил). В других вариантах осуществления гетероарильная группа содержит от 5 до 10 атомов кольца (5-10-членный гетероарил). Иллюстративные гетероарильные группы включают группы, полученные из фурана, тиофена, пиррола, бензотиофена, бензофурана, бензимидазола, индола, пиридина, пиразола, хинолина, имидазола, оксазола, изоксазола и пиразина.
"Гетероарилалкил" сам по себе или в качестве части другого заместителя относится к ациклической алкильной группе, в которой один из атомов водорода, связанных с атомом углерода, как правило, концевой или находящийся в состоянии sp3-гибридизации атом углерода, заменен гетероарильной группой. Если предполагаются конкретные алкильные фрагменты, то применяют номенклатурные обозначения гетероарилалканил, гетероарилалкенил и/или гетероарилалкинил. В некоторых вариантах осуществления гетероарилалкильная группа представляет собой 6-21-членный гетероарилалкил, например, алканильный, алкенильный или алкинильный фрагмент гетероарилалкила представляет собой (С1-С6)алкил, и гетероарильный фрагмент представляет собой 5-15-членный гетероарил. В других вариантах осуществления гетероарилалкил представляет собой 6-13-членный гетероарилалкил, например, алканильный, алкенильный или алкинильный фрагмент представляет собой (С1-С3)алкил, и гетероарильный фрагмент представляет собой 5-10-членный гетероарил.
"Гетероарилокси" сам по себе или в качестве части другого заместителя относится к радикалу формулы -O-R201, где R201 представляет собой гетероарил, замещенный гетероарил, гетероарилалкил или замещенный гетероарилалкил.
"Гетероарилоксикарбонил" сам по себе или в качестве части другого заместителя относится к радикалу формулы -C(O)-O-R201, где R201 представляет собой гетероарил, замещенный гетероарил, гетероарилалкил или замещенный гетероарилалкил.
"Модулирование" относится к корректированию, регулированию или изменению. Как применяется в данном документе, модулирование кальциевых ионных каналов включает антагонизм, агонизм или частичный антагонизм. Иными словами, соединения по настоящему раскрытию могут выступать в качестве антагонистов, агонистов или частичных агонистов активности кальциевых ионных каналов.
"Исходная ароматическая кольцевая система" относится к ненасыщенной циклической или полициклической кольцевой системе, имеющей сопряженную π-электронную систему. В частности, в определение "исходной ароматической кольцевой системы" включены конденсированные кольцевые системы, в которых одно или более колец являются ароматическими и одно или более колец являются насыщенными или ненасыщенными, такие как, например, флуорен, индан, инден, фенален и т.д. Типичные исходные ароматические кольцевые системы включают без ограничения ацеантрилен, аценафтилен, ацефенантрилен, антрацен, азулен, бензол, хризен, коронен, флуорантен, флуорен, гексацен, гексафен, гексален, ассим-индацен, сим-индацен, индан, инден, нафталин, октацен, октафен, октален, овален, пента-2,4-диен, пентацен, пентален, пентафен, перилен, фенален, фенантрен, пицен, плеяден, пирен, пирантрен, рубицен, трифенилен, тринафталин и т.п.
"Исходная гетероароматическая кольцевая система" относится к исходной ароматической кольцевой системе, в которой каждый из одного или более атомов углерода (и необязательно любых связанных с ними атомов водорода) независимо заменены одинаковыми или различными гетероатомами. Типичные гетероатомы для замены атомов углерода включают без ограничения В, N, Р, О, S, Si и т.д. В частности, в определение "исходной гетероароматической кольцевой системы" включены конденсированные кольцевые системы, в которых одно или более колец являются ароматическими и одно или более колец являются насыщенными или ненасыщенными, такие как, например, бензодиоксан, бензофуран, хроман, хромен, индол, индолин, ксантен и т.д. Типичные исходные гетероароматические кольцевые системы включают без ограничения арсиндол, карбазол, β-карболин, хроман, хромен, циннолин, фуран, имидазол, индазол, индол, индолин, индолизин, изобензофуран, изохромен, изоиндол, изоиндолин, изохинолин, изотиазол, изоксазол, нафтиридин, оксадиазол, оксазол, перимидин, фенантридин, фенантролин, феназин, фталазин, птеридин, пурин, пиран, пиразин, пиразол, пиридазин, пиридин, пиримидин, пиррол, пирролизин, хиназолин, хинолин, хинолизин, хиноксалин, тетразол, тиадиазол, тиазол, тиофен, триазол, ксантен и т.п.
"Пациент" или "субъект" включает без ограничения животных, таких как, например, млекопитающие. Предпочтительно, пациентом является человек.
"Предупреждающий" или "предупреждение" относится к снижению риска приобретения заболевания или нарушения (т.е. действиям, обуславливающим отсутствие развития по меньшей мере одного из клинических симптомов заболевания у пациента, который может быть подвержен данному заболеванию или предрасположен к нему, но который еще не ощущает или у которого еще не проявляются симптомы данного заболевания).
"Защитная группа" относится к группировке атомов, которая при присоединении к реакционноспособной функциональной группе в молекуле скрывает, снижает реакционную способность функциональной группы или препятствует ей. Примеры защитных групп можно найти в Green et al., "Protective Groups in Organic Chemistry", (Wiley, 2nd ed. 1991) и Harrison et al., "Compendium of Synthetic Organic Methods", Vols. 1-8 (John Wiley and Sons, 1971-1996). Иллюстративные защитные группы для аминогруппы включают без ограничения формильную, ацетильную, трифторацетильную, бензильную, бензилоксикарбонильную ("CBZ"), трет-бутоксикарбонильную ("Вос"), триметилсилильную ("TMS"), 2-триметилсилилэтансульфонильную ("SES"), тритильную и замещенную тритильную группы, аллилоксикарбонил, 9-флуоренилметилоксикарбонил ("FMOC"), нитровератрилоксикарбонил ("NVOC") и т.п. Иллюстративные защитные группы для гидроксигруппы включают без ограничения группы, в случае применения которых гидроксигруппа является ацилированной либо алкилированной, такие как бензил, и тритиловые эфиры, а также алкиловые эфиры, тетрагидропираниловые эфиры, триалкилсилиловые эфиры и аллиловые эфиры.
"Соль" относится к соли соединения, которая обладает необходимой фармакологической активностью исходного соединения. Такие соли включают (1) соли присоединения кислоты, образованные неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.; или образованные органическими кислотами, такими как уксусная кислота, пропионовая кислота, капроновая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, третичная бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и т.п.; или (2) соли, образованные при замене кислого протона, присутствующего в исходном соединении, ионом металла, например, ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; или координационные соединения с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин и т.п.
"Сольват" означает соединение, образованное путем сольватации (объединения молекул растворителя с молекулами или ионами растворенного вещества, т.е. соединения по настоящему раскрытию), или агрегат, который содержит ион или молекулу растворенного вещества (соединения по настоящему раскрытию) с одной или более молекулами растворителя.
"Фармацевтически приемлемый" означает подходящий для применения в контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции и т.п., сопоставимый с разумным соотношением польза/риск и эффективный для своего предполагаемого применения по результатам тщательной медицинской оценки.
"Пролекарство или мягкое лекарство" относится к предшественнику фармацевтически активного соединения, где предшественник сам по себе может быть или может не быть фармацевтически активным, но при введении будет преобразован в ходе метаболизма либо иным образом в фармацевтически активное соединение или лекарственное средство, представляющее интерес. Например, пролекарство или мягкое лекарство представляет собой сложноэфирную или эфирную форму фармацевтически активного соединения. Было получено и раскрыто несколько пролекарств для различных фармацевтических препаратов. См., например, Bundgaard, Н. and Moss, J., J. Pharm. Sci. 78: 122-126 (1989). Таким образом, специалисту в данной области известно получение данных предшественников, пролекарств или мягких лекарств посредством обычно применяемых методик органического синтеза.
"Замещенный" при применении для модифицирования определенной группы или радикала означает, что каждый из одного или более атомов водорода определенной группы или радикала независимо друг от друга заменен одинаковыми или различными заместителями. Замещающие группы, применимые для замещения насыщенных атомов углерода в определенной группе или радикале, включают без ограничения -Ra, галоген, -О-, =O, -ORb, -SRb, -S-, =S, -NRcRc, =NRb, =N-ORb, тригалогенметил, -CF3, -CN, -OCN, -SCN, -NO, -NO2, =N2, -N3, -S(O)2Rb, -S(O)2NRb, -S(O)2O-, -S(O)2ORb, -OS(O)2Rb, -OS(O)2O-, -OS(O)2ORb, -P(O)(O-)2, -P(O)(ORb)(O-), -P(O)(ORb)(ORb), -C(O)Rb, -C(S)Rb, -C(NRb)Rb, -C(O)O-, -C(O)ORb, -C(S)ORb, -C(O)NRcRc, -C(NRb)NRcRc, -OC(O)Rb, -OC(S)Rb, -OC(O)O-, -OC(O)ORb, -OC(S)ORb, -NRbC(O)Rb, -NRbC(S)Rb, -NRbC(O)O-, -NRbC(O)ORb, -NRbC(S)ORb, -NRbC(O)NRcRc, -NRbC(NRb)Rb и -NRbC(NRb)NRcRc, где Ra выбран из группы, включающей алкил, замещенный алкил, арилалкил, алкилдиил, замещенный алкилдиил, арил, замещенный арил, арилалкил, замещенный арилалкил, гетероалкил, замещенный гетероалкил, гетероалкилдиил, замещенный гетероалкилдиил, гетероарил, замещенный гетероарил, гетероарилалкил, замещенный гетероарилалкил; каждый Rb независимо представляет собой водород или Ra; и каждый Rc независимо представляет собой Rb или, в качестве альтернативы, два Rc, взятые вместе с атомом азота, с которым они связаны, образуют циклогетероалкильное кольцо, которое может необязательно включать в себя от 1 до 4 одинаковых или различных дополнительных гетероатомов, выбранных из группы, включающей О, N и S. В качестве конкретных примеров, подразумевается, что -NRcRc включает -NH2, -NH-алкил, N-пирролидинил и N-морфолинил.
Подобным образом, замещающие группы, применимые для замещения ненасыщенных атомов углерода в определенной группе или радикале, включают без ограничения -Ra, галоген, -О-, -ORb, -SRb, -S-, -NRcRc, тригалогенметил, -CF3, -CN, -OCN, -SCN, -NO, -NO2, -N3, -S(O)2Rb, -S(O)2O-, -S(O)2ORb, -OS(O)2Rb, -OS(O)2O-, -OS(O)2ORb, -P(O)(O-)2, -P(O)(ORb)(O-), -P(O)(ORb)(ORb), -C(O)Rb, -C(S)Rb, -C(NRb)Rb, -C(O)O-, -C(O)ORb, -C(S)ORb, -C(O)NRcRc, -C(NRb)NRcRc, -OC(O)Rb, -OC(S)Rb, -OC(O)O-, -OC(O)ORb, -OC(S)ORb, -NRbC(O)Rb, -NRbC(S)Rb, -NRbC(O)O-, -NRbC(O)ORb, -NRbC(S)ORb, -NRbC(O)NRcRc, -NRbC(NRb)Rb и -NRbC(NRb)NRcRc, где Ra, Rb и Rc определены выше.
Замещающие группы, применимые для замещения атомов азота в гетероалкильных и циклогетероалкильных группах, включают без ограничения -Ra, -О-, -ORb, -SRb, -S-, -NRcRc, тригалогенметил, -CF3, -CN, -NO, -NO2, -S(O)2Rb, -S(O)2O-, -S(O)2ORb, -OS(O)2Rb, -OS(O)2O-, -OS(O)2ORb, -P(O)(O-)2, -P(O)(ORb)(O-), -P(O)(ORb)(ORb), -C(O)Rb, -C(S)Rb, -C(NRb)Rb, -C(O)ORb, -C(S)ORb, -C(O)NRcRc, -C(NRb)NRcRc, -OC(O)Rb, -OC(S)Rb, -OC(O)ORb, -OC(S)ORb, -NRbC(O)Rb, -NRbC(S)Rb, -NRbC(O)ORb, -NRbC(S)ORb, -NRbC(Q)NRcRc, -NRbC(NRb)Rb и -NRbC(NRb)NRcRc, где Ra, Rb и Rc определены выше.
Замещающие группы из приведенных выше списков, применимые для замещения других определенных групп или атомов, будут очевидны специалистам в данной области. Заместители, применяемые для замещения определенной группы, могут быть дополнительно замещены, как правило, одной или более из одинаковых или различных групп, выбранных из ряда групп, определенных выше. Термин "необязательно замещенный", применяемый в отношении конкретной группы, означает, что конкретная группа может быть замещенной или незамещенной. Например, необязательно замещенный алкил обозначает замещенный алкил или незамещенный алкил.
"Лечение", "лечить" или "способ лечения" любого заболевания или нарушения относится в некоторых вариантах осуществления к улучшению течения или предупреждению заболевания или нарушения (т.е. прекращению, предупреждению, сдерживанию или ослаблению развития заболевания или по меньшей мере одного из его клинических симптомов). В других вариантах осуществления "лечение", "лечить" или "способ лечения" относится к улучшению по меньшей мере одного физического параметра, который может не восприниматься пациентом. В еще нескольких вариантах осуществления "лечение", "лечить" или "способ лечения" относится к ингибированию, или сдерживанию, или предупреждению прогрессирования заболевания или нарушения физически (например, путем стабилизации воспринимаемого симптома), физиологически (например, путем стабилизации физического параметра) либо обоими способами. В еще нескольких вариантах осуществления "лечение", "лечить" или "способ лечения" относится к задерживанию начала заболевания или нарушения.
"Терапевтически эффективное количество" означает количество соединения, которое при введении пациенту для лечения заболевания является достаточным для осуществления такого лечения заболевания. "Терапевтически эффективное количество" будет варьировать в зависимости от соединения, заболевания и его тяжести и возраста, веса и т.д. пациента, подлежащего лечению.
"Индифферентное вещество" относится к разбавителю, вспомогательному средству, наполнителю или носителю, совместно с которым вводят соединение.
Рассмотрим теперь подробно предпочтительные варианты осуществления настоящего раскрытия. Хотя раскрытие будет описано в сочетании с предпочтительными вариантами осуществления, следует понимать, что ограничение раскрытия предпочтительными вариантами осуществления не предусмотрено. Тем не менее, предусматривается охват альтернатив, модификаций и эквивалентов, которые могут быть включены в сущность и объем настоящего раскрытия, определенные в прилагаемой формуле изобретения.
Термин "рецептор" относится к молекуле или комплексу молекул, как правило (хотя и не обязательно), белку(белкам), которые специфически связываются с одним или более конкретными лигандами. Рецептор считается рецептором для такого(таких) лиганда(лигандов). Связывание лиганда с рецептором во многих случаях вызывает одну или более биологических реакций. "Модулятор" полипептида является ингибитором либо усилителем действия или функции полипептида. Подобным образом, "модулятор" сигнального пути является ингибитором или усилителем по меньшей мере одной функции, опосредованной сигнальным путем. Аспекты модуляторов определены ниже в отношении полипептидов; однако, специалисты в данной области легко поймут, что данные определения также применимы к сигнальным путям.
"Неселективный" модулятор полипептида представляет собой средство, которое модулирует других членов того же семейства полипептидов в концентрациях, обычно используемых для модулирования конкретного полипептида.
"Селективный" модулятор полипептида в значительной степени модулирует конкретный полипептид при концентрации, при которой другие члены того же семейства полипептидов не подвергаются значительному модулированию.
Модулятор "воздействует непосредственно на" полипептид, если модулятор оказывает свое действие путем непосредственного взаимодействия с полипептидом.
Модулятор "воздействует опосредованно на" полипептид, если модулятор оказывает свое действие путем взаимодействия с молекулой, отличной от полипептида, при этом данное взаимодействие взывает модулирование действия или функции полипептида.
"Ингибитор" или "антагонист" полипептида представляет собой средство, которое ослабляет, посредством любого механизма, любое действие или функцию полипептида по сравнению с наблюдаемыми в отсутствии (или в присутствии меньшего количества) данного средства. Ингибитор полипептида может оказывать влияние на (1) экспрессию, стабильность мРНК, транспорт белка, модификацию (например, фосфорилирование) или разрушение полипептида, или (2) одно или более нормальных действий или функций полипептида. Ингибитор полипептида может быть неселективным или селективным. Предпочтительные ингибиторы (антагонисты) обычно представляют собой малые молекулы, которые воздействуют непосредственно на целевой полипептид и являются селективными по отношению к нему.
"Обратимый" ингибитор представляет собой такой ингибитор, эффекты которого можно устранить (т.е. ингибитор, который не инактивирует целевой полипептид необратимым образом).
"Конкурентный" ингибитор полипептида представляет собой такой ингибитор, который конкурирует за связывание с полипептидом с другим компонентом, необходимым для функционирования полипептида. Например, функционирование TrkA требует связывания с АТФ и субстратом. Соответственно, конкурентный ингибитор TrkA может действовать, например, путем связывания с участками связывания АТФ или субстрата. Данное ингибирование обычно можно устранить путем повышения концентрации АТФ или субстрата в реакционной смеси. Говорят, что такой ингибитор конкурентно ингибирует TrkA соответственно по отношению к АТФ или субстрату.
"Неконкурентный" ингибитор полипептида обычно связывается с полипептидом в участке, отличном от участка связывания для другого компонента, необходимого для функционирования полипептида. Данное ингибирование нельзя устранить путем повышения концентрации компонента(компонентов), необходимых для функционирования полипептида.
Как применяется в данном документе, "аллостерический модулятор" полипептида, как правило, фермент или рецептор, представляет собой модулятор, который связывается в положении, отличном от активного центра целевого полипептида, изменяя активность путем индукции аллостерического изменения формы целевого полипептида.
Термины "полипептид" и "белок" применяются в данном документе взаимозаменяемо для обозначения полимера из аминокислот и, если не ограничено иным образом, включают атипичные аминокислоты, которые могут функционировать аналогично встречающимся в природе аминокислотам.
Термин "специфическое связывание" определен в данном документе как предпочтительное связывание партнеров по связыванию друг с другом (например, двух полипептидов, полипептида и молекулы нуклеиновой кислоты или двух молекул нуклеиновой кислоты) в конкретных участках. Термин "специфически связывается" указывает на то, что предпочтение к связыванию (например, сродство) в отношении целевой молекулы/последовательности является по меньшей мере в 2 раза, более предпочтительно по меньшей мере в 5 раз и наиболее предпочтительно по меньшей мере в 10 или 20 раз большим по сравнению с неспецифической целевой молекулой (например, случайно образованной молекулой, не имеющей специфически распознаваемого(распознаваемых) участка(участков)).
Фразы "эффективное количество" и "количество, достаточное для" относятся к количествам биологически активного средства, которые проявляют предполагаемую биологическую активность.
Термин "совместно вводимый" или "совместное введение", применяемый по отношению к введению антагонистов Trk (т.е. TrkA) и других средств, указывает на то, что антагонист и другое(другие) средство(средства) вводят согласованно таким образом, что существует по меньшей мере некоторое хронологическое перекрывание их физиологической активности у субъекта. Таким образом, антагонист TrkA и другое средство можно вводить одновременно и/или последовательно. При последовательном введении может иметь место даже некоторая значительная задержка (например, минуты или даже часы или дни) перед введением второго средства, поскольку первое вводимое средство проявляет некоторый физиологический эффект в отношении организма, когда второе вводимое средство вводится или становится активным у субъекта.
Термин "уменьшение боли", применяемый в данном документе, относится к снижению уровня боли, которую испытывает субъект, относительно уровня боли, которую испытывал бы субъект без вмешательства. Если субъектом является человек, то уровень боли, которую испытывает человек, можно оценить, попросив его или ее описать боль или сравнить ее с другими болезненными ощущениями. В качестве альтернативы, уровни боли можно определить путем измерения физических реакций субъекта на боль, таких как высвобождение вызванных стрессом факторов или активность передающих боль нервов в периферической нервной системе или ЦНС. Уровни боли можно также определить путем измерения количества хорошо изученного обезболивающего средства, необходимого для того, чтобы человек сообщил об отсутствии боли, или для того, чтобы субъект перестал испытывать симптомы боли. Уменьшение боли также можно измерить как повышение порога, при котором субъект ощущает данный раздражитель как болезненный. В определенных вариантах осуществления уменьшения боли достигают путем снижения "гипералгезии", повышенной чувствительности к болевому раздражителю, и такое ингибирование может происходить без ухудшения "ноцицепции", нормальной чувствительности субъекта к "болевому" раздражителю. Термин "боль", применяемый в данном документе, также относится, например, к острой боли, хронической боли, воспалительной боли, нейропатической боли и генерализованному болевому расстройству.
Как применяется в отношении уменьшения боли, "субъект, нуждающийся в этом" относится к животному или человеку, предпочтительно человеку, который, как ожидается, будет ощущать боль в ближайшем будущем. Такое животное или человек может находиться в постоянном состоянии, которое вызывает боль в настоящее время и, вероятно, будет продолжаться, вызывая боль. В качестве альтернативы, животное или человек переносили, переносят или будут переносить процедуру или событие, которое обычно имеет болезненные последствия. Хронические болезненные состояния, такие как диабетическая нейропатическая гипералгезия и коллагеноз сосудов, являются примерами первого типа; лечение зубов, в частности, сопровождающееся воспалением или повреждением нерва, и воздействие токсинов (в том числе воздействие химиотерапевтических средств) являются примерами последнего типа.
"Воспалительная боль" относится к боли, возникающей вследствие воспаления. Воспалительная боль зачастую проявляется в виде повышенной чувствительности к механическим раздражителям (механическая гипералгезия или болезненность). Например, воспалительная боль обусловлена состоянием, выбранным из группы, включающей ожог, солнечный ожог, артрит, остеоартрит, колит, кардит, дерматит, миозит, неврит, мукозит, уретрит, цистит, гастрит, пневмонию и коллагеноз сосудов.
"Нейропатическая боль" относится к боли, возникающей вследствие состояний или событий, которые приводят к повреждению нерва. "Нейропатия" относится к болезненному процессу, который приводит к повреждению нервов. "Каузалгия" означает состояние хронической боли после поражения нерва. "Аллодиния" относится к состоянию, при котором человек ощущает боль в ответ на обычно неболезненный раздражитель, такой как легкое прикосновение. Например, нейропатическая боль обусловлена состоянием, выбранным из группы, включающей каузалгию, диабет, диабетическую периферическую нейропатию, коллагеноз сосудов, невралгию тройничного нерва, повреждение спинного мозга, повреждение ствола головного мозга, таламический синдром, комплексный регионарный болевой синдром I типа/рефлекторную симпатическую дистрофию, синдром Фабри, нейропатию мелких волокон, рак, химиотерапию рака, хронический алкоголизм, инсульт, абсцесс, демиелинизирующее заболевание, вирусную инфекцию, противовирусную терапию, СПИД и терапию СПИДа. Нейропатическая боль обусловлена причиной, выбранной из группы, включающей травму, хирургические вмешательство, ампутацию, действие токсина и химиотерапию.
Применяемый в данном документе термин "генерализованное болевое расстройство" относится к группе идиопатических болевых синдромов (например, фибромиалгии, синдрому раздраженного кишечника и височно-нижнечелюстным нарушениям), патогенный механизм которых в настоящее время неизвестен, которые характеризуются диффузной или генерализованной болью и для которых исключен диагноз воспаления или нейропатии в качестве непосредственной причины боли.
"Обезболивающее средство" относится к молекуле или комбинации молекул, которые вызывают уменьшение боли.
Разница между "острой" и "хронической" болью является временной разницей: острая боль ощущается вскоре (например, обычно в течение приблизительно 48 часов, чаще в течение приблизительно 24 часов и наиболее часто в течение приблизительно 12 часов) после наступления события (такого как воспаление или поражение нерва), которое привело к такой боли. В противоположность этому, существует значительная задержка по времени между ощущением хронической боли и наступлением, которое привело к такой боли. Такая задержка по времени обычно составляет по меньшей мере приблизительно 48 часов после такого события, чаще по меньшей мере приблизительно 96 часов после такого события и наиболее часто по меньшей мере приблизительно одну неделю после такого события.
Термин "неадаптивное употребление химического вещества" относится к употреблению любого химического вещества, которое приводит к нежелательным последствиям для пользователя, превосходящим любые преимущества, обуславливаемые химическим веществом. Химические вещества, употребляемые неадаптивным способом, обычно потребляют или вводят (как правило, самостоятельно вводят) в организм с помощью любого способа введения для обеспечения эффекта в отношении организма, который пользователь обычно ощущает как приятный. Химическое вещество может быть отдельным химическим веществом (например, кокаином) или типом химических веществ (например, продуктами питания в целом). Нежелательные последствия могут включать, например, нежелательные эффекты в отношении здоровья, способности заботиться о себе, способности формировать и поддерживать отношения между людьми и/или способности работать. Нежелательные последствия обычно являются достаточно значительными, так что пользователю хотелось бы контролировать, уменьшить или прекратить употребление химического вещества или, в качестве альтернативы, членам семьи и/или друзьям пользователя хотелось бы увидеть контроль, уменьшение или прекращение употребления пользователем химического вещества. Неадаптивное употребление химического вещества может включать неконтролируемое пристрастие к химическому веществу; зависимость от химического вещества, в том числе психологическую и/или физическую зависимость; и неадаптивное употребление химического вещества; а также любые из отдельных симптомов зависимости от химического вещества и/или злоупотребления им, приведенных ниже.
Термин "нейростероид" относится к классу стероидов, природные формы которых вырабатываются в клетках центральной или периферической нервной системы независимо от стероидогенной активности эндокринных желез. Нейростероиды являются производными холестерина, и примеры нейростероидов включают 3α,5α-тетрагидропрогестерон, 3α,5β-тетрагидропрогестерон и 3α,5α-тетрагидродезоксикортикостерон. Примерами являются ганаксалон и альфаксалон.
"Бензодиазепин" относится к средству, выбранному из группы, включающей алпразолам, хлордиазепоксид, гидрохлорид хлордиазепоксида, хлорметазон, клобазам, клоназепам, клоразепат дикалия, диазепам, дроперидол, этазолам, цитрат фентанила, гидрохлорид флуразепама, галазепам, лоразепам, гидрохлорид мидазолама, оксазепам, празепам, квазепам, темазепам и триазолам.
"Барбитурат" относится к средству, выбранному из группы, включающей амобарбитал, амобарбитал натрия, апробарбитал, бутабарбитал натрия, гексобарбитал натрия, мефобарбитал, метарбитал, метогекситал натрия, пентобарбитал, пентобарбитал натрия, фенобарбитал, фенобарбитал натрия, секобарбитал, секобарбитал натрия, талбутал, тиамилал натрия и тиопентал натрия.
Термин "композиция", применяемый в данном документе, предназначен для охвата продукта, содержащего определенные ингредиенты в определенных количествах, а также любого продукта, получаемого, непосредственно или опосредованно, в результате объединения определенных ингредиентов в определенных количествах. Такой термин в отношении фармацевтической композиции предназначен для охвата продукта, содержащего активный(активные) ингредиент(ингредиенты) и инертный(инертные) ингредиент(ингредиенты), которые образуют носитель, а также любого продукта, получаемого, непосредственно или опосредованно, в результате объединения, связывания с образованием комплекса или агрегации любых двух или более ингредиентов, или в результате диссоциации одного или более ингредиентов, или в результате других типов реакций или взаимодействий одного или более ингредиентов. Соответственно, фармацевтические композиции по настоящему раскрытию охватывают любую композицию, получаемую путем смешивания соединения по настоящему раскрытию и фармацевтически приемлемого носителя. Под "фармацевтически приемлемым" подразумевается, что носитель, разбавитель или наполнитель должны быть совместимыми с другими ингредиентами состава и не должны наносить вред пациенту, получающему их.
Термин "рак" относится к физиологическому состоянию у млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток, или описывает его. Примеры рака включают, например, лейкоз, лимфому, бластому, карциному и саркому. Более конкретные примеры таких видов рака включают хронический миелоидный лейкоз, острый лимфобластный лейкоз, лимфобластный лейкоз, положительный по филадельфийской хромосоме (Ph+ALL), плоскоклеточную карциному, рак легкого (например, мелкоклеточный рак легкого и немелкоклеточный рак легкого), глиому, рак желудочно-кишечного тракта, почечно-клеточный рак, рак яичника, рак печени (например, гепатоцеллюлярную карциному, фиброламеллярную карциному, холангиокарциному, ангиосаркому, гепатобластому, гемангиому, аденомы печени и фокальную нодулярную гиперплазию, а также метастатический рак печени), колоректальный рак, рак эндометрия, рак почки, рак предстательной железы, рак щитовидной железы, нейробластому, рак поджелудочной железы (например, аденокарциному, карциному островковых клеток, панкреатобластому, изолированные саркомы и лимфомы, псевдопапиллярные новообразования, ампулярный рак, экзокринные опухоли, нейроэндокринные опухоли и эндокринные опухоли), мультиморфную глиобластому, рак шейки матки, рак желудка, рак мочевого пузыря, гепатому, рак молочной железы, карциному толстого кишечника и рак головы и шеи, рак желудка, герминому, детскую саркому, синоназальную лимфбму из естественных клеток-киллеров, множественную миелому, метастазирование, острый миелогенный лейкоз (AML) и хронический лимфоцитарный лейкоз (CML).
Следует понимать, что настоящее раскрытие не ограничено конкретными способами, реагентами, соединениями, композициями или биологическими системами, которые, разумеется, могут варьировать. Также следует понимать, что терминология, применяемая в данном документе, предназначена для описания только конкретных аспектов и не предназначена для ограничения. Используемые в данном описании и прилагаемой формуле изобретения формы единственного числа включают ссылки на множественное число, если в содержании четко не указано иное. Таким образом, например, ссылка на "соединение" включает комбинацию двух или более соединений или молекул и т.п.
5.2 СОЕДИНЕНИЯ
В одном аспекте в настоящем раскрытии представлены соединения, имеющие структурную формулу (I),

или их соль, сольват, сложный эфир или пролекарство;
где:
А1 и А2 независимо представляют собой кислород или серу;
R1 представляет собой NH2 или R7;
R2 представляет собой NR7 или CR7R10;
R3, R5, R6 и R9 независимо представляют собой R7;
или, в качестве альтернативы, R6 и R9, взятые вместе с атомом(атомами), к которому (которым) они присоединены, образуют 3-6-членную необязательно замещенную гетероциклическую группу, содержащую один или более гетероатомов, выбранных из группы, включающей азот, кислород и серу;
R4 представляет собой галоген, CN, NO2, CF3, -(CHR)nCOOR11, -(CHR)nSO2R11, С1-4галогеналкил, -ОС1-4-галогеналкил, С2-6алкил, С2-6алкенил, С2-6алкинил, -(CHR)nC6-10арил, -(CHR)nC5-8гетероцикл, -(CHR)nC3-8циклоалкил, -О-С6-10арил, -О-С5-10гетероцикл, -(CHR)nC(O)CF3, -(CHR)nC(OH)(CF3)2, -(СН2)nгалоген, -OR10, -NR11R12, -NRaCOR11, -NRaCOOR11, -NRaSO2R11, -NRaCONR11R12, -COR11, тетразол, -(CHR)nтетразол, -S-С1-6алкил или -CONR11R12, где каждый указанный алкил, алкенил, алкинил, арил, циклоалкил и гетероцикл необязательно независимо замещен 1-2 группами R8;
или, в качестве альтернативы, R4 и R5, взятые вместе с атомом(атомами), к которому(которым) они присоединены, образуют 3-6-членную необязательно замещенную гетероциклическую группу, содержащую один или более гетероатомов, выбранных из группы, включающей азот, кислород и серу;
R7 и R10 независимо выбраны из группы, включающей водород, галоген, CN, NH2, NO2, С1-4галогеналкил, -ОС1-4галогеналкил, С1-6алкил, С2-6алкенил, С2-6алкинил, -(CHR)nC6-10арил, -(CHR)nC5-8гетероцикл, -(CHR)nC3-8циклоалкил, -О-С6-10арил, -О-С5-10гетероцикл, -C(O)CF3, -(СН2)nгалоген, -(CHR)n-(O)n-C(=O)R8, -(CHR)n-(S)n-C(=O)R8, -ORa, -NR11R12, -NRaCOR11, -NRaCOORa, -NRaSO2R, -NRaCONR11R12, -CORa, -(CHR)nCOORa, -S-С1-6алкил и -CONR11R12, где каждый указанный алкил, алкенил, алкинил, арил, циклоалкил и гетероцикл необязательно независимо замещен 1-2 группами R8;
R11 и R12 независимо выбраны из группы, включающей водород, NRaC(=O)R, галоген, CN, NH2, NHRa, NO2, С1-4галогеналкил, -ОС1-4галогеналкил, С1-6алкил, С2-8алкенил, -S-С1-6алкил, -C(=O)-(O)n-Ra, -(CHR)n-(O)n-C(=O)R8, -(CHR)n-(S)n-C(=O)R8, -ORa, -(CHR)nC3-10циклоалкил, -(CHR)nC6-10арил, -(CHR)nC5-10гетероарил и -(CHR)nC5-10гетероцикл, где каждый указанный алкил, алкенил, циклоалкил, арил, гетероарил и гетероцикл необязательно независимо замещен 1-2 группами R8, и где один или более атомов углерода указанного алкила могут быть заменены одним или более гетероатомами, выбранными из группы, включающей азот, кислород и серу;
или, в качестве альтернативы, R11 и R12, взятые вместе с атомом(атомами), к которому(которым) они присоединены, образуют 3-6-членную необязательно замещенную гетероциклическую группу, содержащую один или более гетероатомов, выбранных из группы, включающей азот, кислород и серу; где необязательный заместитель представляет собой R8; и
каждый R независимо представляет собой водород, галоген, CN, NO2, NH2 или C1-6алкил;
каждый Ra независимо представляет собой водород или С1-6алкил;
каждый R8 независимо представляет собой С1-6алкил, галоген, CN, NO2, NH2, NHRa, SO2R11 или NRaSO2R11; и
n представляет собой целое число от 0 до 3, т.е. 0, 1, 2 или 3;
при следующих условиях:
если R2 представляет собой СН2, то R4 не представляет собой Н или СН3;
если R2 представляет собой NCH2CH2OH, то (a) R4 не представляет собой Н или ОСН3 или (b) R5 не представляет собой ОСН3; и
если R2 представляет собой N(CH3), то R4 не представляет собой Н, СН3, ОСН3 или F.
В одном варианте осуществления формулы (I) R1 выбран из группы, включающей водород, -(СН2)nгалоген, -CN, -СН3, NH2, NHRa и -С1-3алкил.
В одном варианте осуществления формулы (I) R4 выбран из группы, включающей -C(O)OR11, -SO2NHC(=O)CH3, -C(CF3)(CF3)OH, -SO2NH2, -C(O)NR11R12, -CN, -CF3, -NO2, -C(O)CF3, -(СН2)nгалоген,  ,
,  и
и 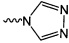 .
.
В одном варианте осуществления формулы (I) R3, R5, R6 и R9 представляют собой водород.
В одном варианте осуществления формулы (I) R2 выбран из группы, включающей
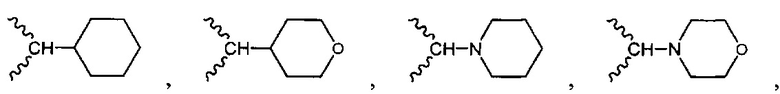
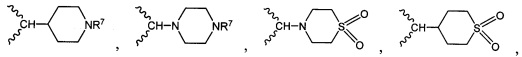
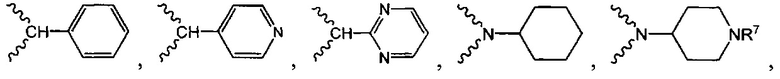
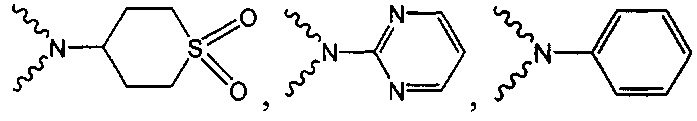 и
и 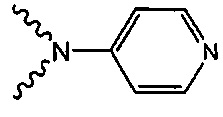 .
.
В одном варианте осуществления формулы (I) А1 и А2 представляют собой кислород; R1 представляет собой NH2; R2 представляет собой NR7 или CHR7; R3, R5, R6 и R9 представляют собой водород; R7 представляет собой С5-8гетероцикл или С3-8циклоалкил; и R4 выбран из группы, включающей -C(O)OR11, -SO2NHC(=O)CH3, -C(CF3)(CF3)OH, -SO2NH2, -C(O)NR11R12, -CN, -CF3, -NO2, -C(O)CF3, -(СН2)nгалоген, 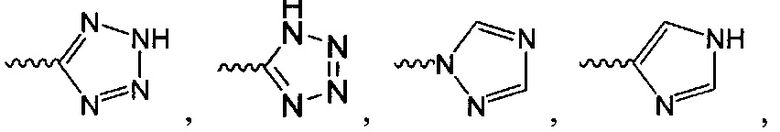
 и
и 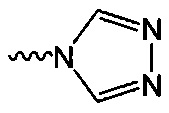 .
.
В одном варианте осуществления R2 выбран из группы, включающей
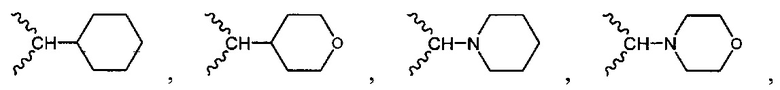
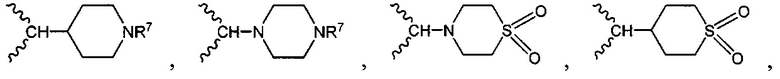

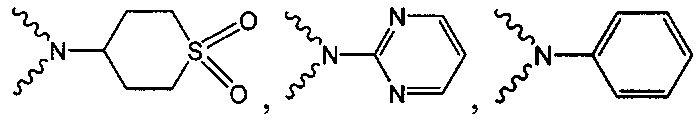 и
и
В другом аспекте в настоящем раскрытии представлены соединения, имеющие структурную формулу (II):
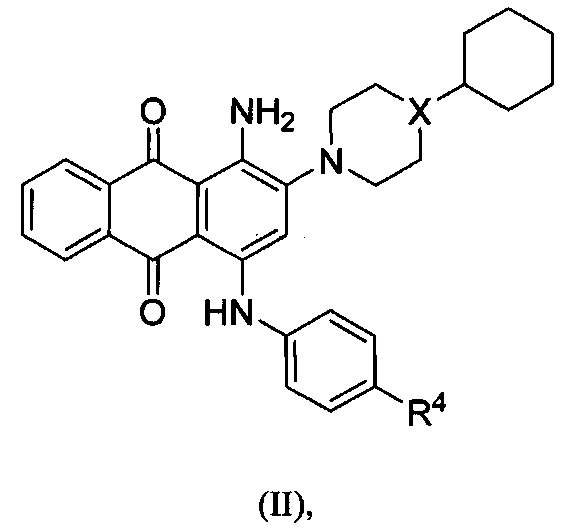
или их соль, сольват, сложный эфир или пролекарство;
где:
X представляет собой N или СН;
R4 представляет собой биоизостер карбоксигруппы, выбранный из -(CHR)nCOOR11, -(CHR)nSO2R11, -(CHR)nC5-8гетероцикла или -(CHR)nC(OH)(CF3)2, где каждый указанный гетероцикл необязательно независимо замещен 1-2 группами R8;
R11 независимо выбран из группы, включающей водород, С1-6алкил, NH2, NHRa и NRaC(=O)R, где каждый указанный алкил необязательно независимо замещен 1-2 группами R8, и где один атом углерода указанного алкила может быть заменен одним гетероатомом, выбранным из группы, включающей азот, кислород и серу;
каждый R8 независимо представляет собой С1-6алкил, галоген, CN, NO2, NH2, NHRa, SO2R11 или NRaSO2R11;
каждый R независимо представляет собой водород, галоген, CN, NO2, NH2 или С1-6алкил;
каждый Ra независимо представляет собой водород или С1-6алкил; и
n равно 0.
В одном варианте осуществления формулы (II) X представляет собой N.
В одном варианте осуществления формулы (II) R4 представляет собой -COOR11, где R11 представляет собой водород. В одном варианте осуществления формулы (II) R4 представляет собой -COOR11, где R11 представляет собой С1-6алкил. В некоторых вариантах осуществления формулы (II) R4 представляет собой -COOR11, где R11 представляет собой С1-6алкил, где один атом углерода указанного С1-6алкила заменен одним атомом азота.
В одном варианте осуществления формулы (II) X представляет собой N, a R4 представляет собой -COOR11, где R11 представляет собой водород.
В другом варианте осуществления формулы (II) R4 представляет собой -SO2R11, где R11 представляет собой NH2 или NRaC(=O)R. В некоторых вариантах осуществления формулы (II) R4 представляет собой -SO2R11, где R11 представляет собой NHC(=O)R, и где R представляет собой С1-6алкил.
В одном варианте осуществления формулы (II) R4 представляет собой С5гетероцикл, где гетероцикл представляет собой тетразол.
В некоторых конкретных вариантах осуществления соединения формулы (I) и/или формулы (II) выбраны из группы, включающей:
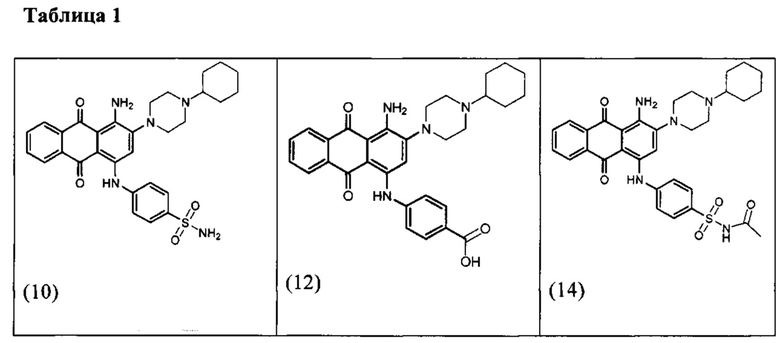
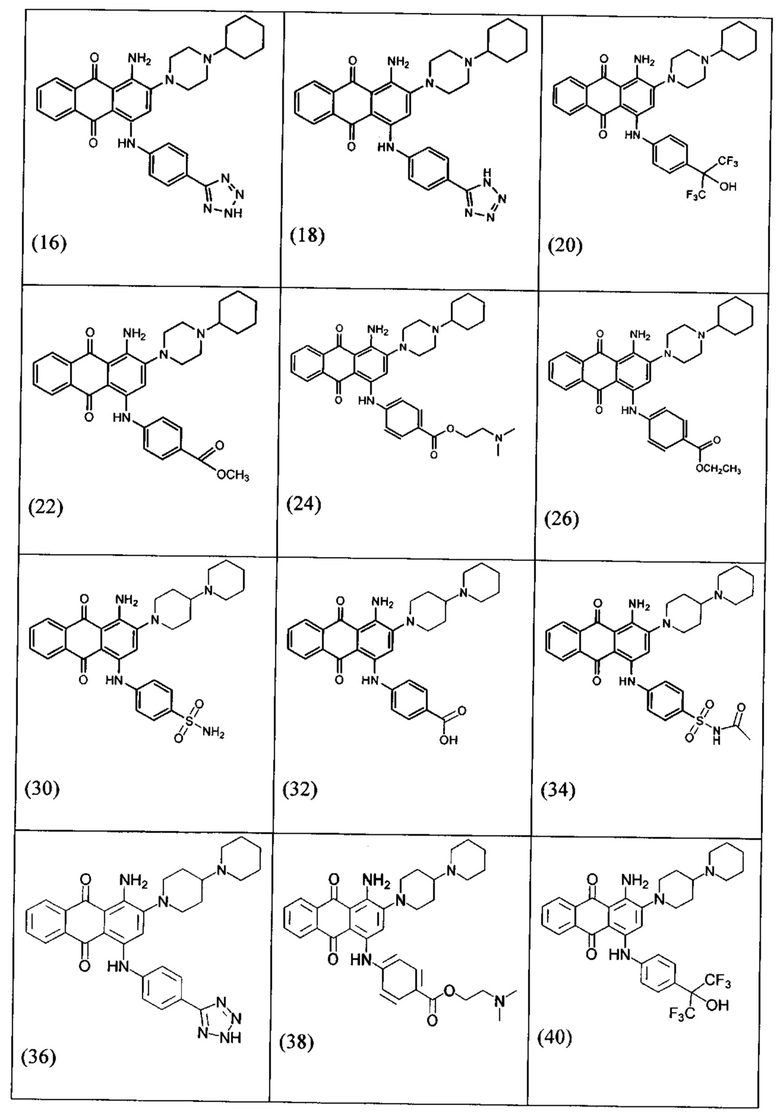
Соединения, приведенные в таблице 1, также могут быть представлены их химическими названиями, как указано далее:

 .
.
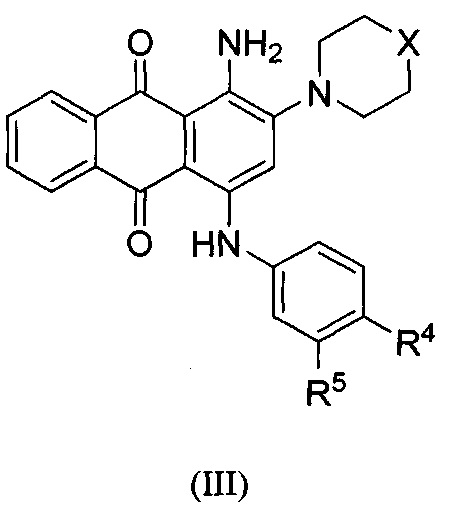
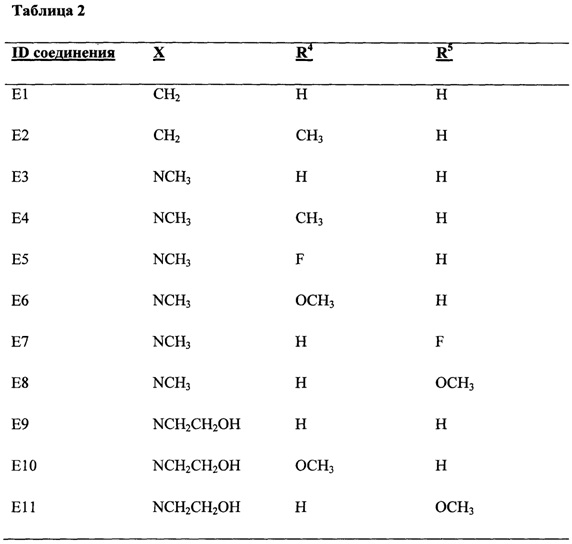
5.3 СИНТЕЗ СОЕДИНЕНИЙ
Несколько способов получения соединений по настоящему раскрытию проиллюстрированы в следующих схемах и примерах. Исходные материалы получают в соответствии с процедурами, известными в данной области техники, или согласно проиллюстрированному в данном документе. В данном документе используются следующие сокращения: Me: метил; Et: этил; t-Bu: трет-бутил; Ar: арил; Ph: фенил; Bn: бензил; BuLi: бутиллитий; Piv: пивалоил; Ас: ацетил; THF: тетрагидрофуран; DMSO: диметилсульфоксид; EDC: N-(3-диметиламинопропил)-N'-этилкарбодиимид; Boc: трет-бутилоксикарбонил; Et3N: триэтиламин; DCM: дихлорметан; DCE: дихлорэтан; DME: диметоксиэтан; DBA: диэтиламин; DAST: трифторид диэтиламиносеры; EtMgBr: бромид этилмагния; BSA: бычий сывороточный альбумин; TFA: трифторуксусная кислота; DMF: N,N-диметилформамид; SOCl2: тионилхлорид; CDI: карбонилдиимидазол; к.т.: комнатная температура; HPLC: высокоэффективная жидкостная хроматография; TLC: тонкослойная хроматография. Соединения, описанные в данном документе, могут быть получены различными способами, известными специалисту в данной области.
Процедуры, описанные в данном документе, для синтеза соединений по настоящему раскрытию могут включать одну или более стадий введения защитных групп и удаления защитных групп (например, образование и удаление ацетальных групп). Кроме того, процедуры синтеза, раскрытые ниже, могут включать различные способы очистки, такие как колоночная хроматография, флэш-хроматография, тонкослойная хроматография (TLC), перекристаллизация, дистилляция, жидкостная хроматография высокого давления (HPLC) и т.п. Кроме того, также можно применять различные методики, хорошо известные в области химии, для идентификации и количественной оценки продуктов химических реакций, такие как спектроскопия протонного магнитного резонанса и магнитного резонанса на ядрах углерода-13 (1Н- и 13С-ЯМР), инфракрасная и ультрафиолетовая спектроскопия (ИК и УФ), рентгеновская кристаллография, элементный анализ (ЕА), HPLC и масс-спектроскопия (MS). Способы введения защитных групп и удаления защитных групп, очистки, идентификации и количественной оценки хорошо известны в области химии.
Пример схемы синтеза соединений формулы (I) и/или формулы (II)
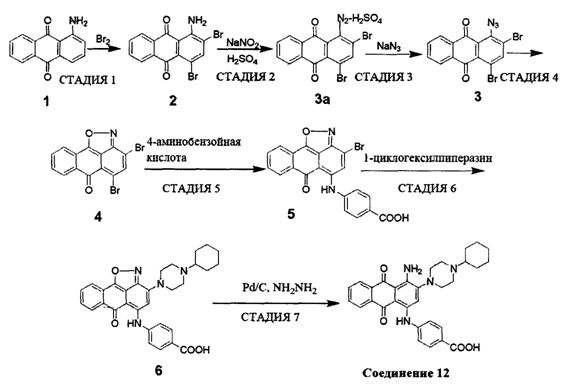
Получение промежуточного соединения 2. 30,0 кг 4-амино-10-гидроксиантрацен-9(10Н)-она (исходный материал 1) суспендировали в МеОН (70 л). К суспензии добавляли 53,7 кг брома при 60°С в течение приблизительно 1 ч. После добавления брома реакционную смесь перемешивали при 50-60°С в течение приблизительно 18-24 часов. Затем реакционную смесь охлаждали. Полученную в результате суспензию фильтровали, промывали с помощью МТВЕ. Твердое вещество красного цвета высушивали с получением промежуточного соединения 2 в виде твердого вещества красного цвета (~50,0 кг, выход 98%). Анализ посредством HPLC показал 96% чистоты. 1H-ЯМР (CDCl3, 300 Гц) δ 8,26 (m, 2Н), 8,09 (s, 1Н), 7,80 (m, 2H).
Получение промежуточного соединения 3а. 2,99 кг NaNO2 аккуратно добавляли к охлажденному раствору H2SO4 (27,8 л). Смесь перемешивали при 35°С в течение 1 ч. Затем к смеси добавляли промежуточное соединение 2 (15,0 кг) и перемешивали при 50-55°С в течение 4 ч. После охлаждения до комнатной температуры реакционную смесь выливали на дробленый лед. Твердое вещество желтого цвета отделяли осаждением. Твердое вещество собирали посредством фильтрации, промывали ледяной водой, а затем смесью 1:1 этанола/МТВЕ с получением влажного твердого вещества, которое высушивали. Получали 24,7 кг неочищенного отсырелого продукта. Продукт применяли на следующей стадии без дополнительной очистки.
Получение промежуточного соединения 3. В реактор с рубашкой на 100 л загружали раствор NaN3 (2,73 кг) в воде. Промежуточное соединение 3а добавляли при комнатной температуре, и смесь перемешивали при комнатной температуре в течение ночи. Затем к смеси медленно добавляли водный раствор NaOH (6 н.). Затем твердое вещество собирали посредством фильтрации и промывали водой. Отфильтрованный осадок суспендировали водой, фильтровали и промывали водой, а затем смесью ацетона/воды (9:1), высушивали на воздухе с получением неочищенного промежуточного соединения 3 (23,2 кг отсырелого твердого вещества). Анализ посредством HPLC показал 95% чистоты. 1Н-ЯМР (300 МГц, DMSO-d6) δ 8,51 (s, 1H), 8,11-8,15 (m, 2H), 7,91-7,94 (m, 2H).
Получение промежуточного соединения 4. 26,5 кг неочищенного промежуточного соединения 3 добавляли к толуолу при приблизительно 50-70°С. Затем смесь перемешивали при 50-70°С в течение ночи. После снижения температуры реакции до к.т. твердый продукт собирали. Отфильтрованный осадок промывали с помощью МеОН. Полученное твердое вещество ресуспендировали в МеОН и перемешивали при комнатной температуре в течение приблизительно 1-3 часов. После фильтрации 13,3 кг влажного продукта, представляющего собой промежуточное соединение 4, получали в виде твердого вещества желтого цвета. Анализ посредством HPLC показал 98,7% чистоты. 1Н-ЯМР (300 МГц, DMSO-d6): δ 8,27 (m, 2H), 8,13 (m, 1H), 7,91 (m, 1H), 7,78 (m, 1H).
Получение промежуточного соединения 5. Смешивали 4-аминобензойную кислоту и гидроксид лития в DMAc, затем к смеси добавляли 3,5-дибром-6Н-антра[1,9-cd]изоксазол-6-он при приблизительно 40-60°С. Реакционную смесь перемешивали в течение до 24 часов. К реакционной смеси добавляли МТВЕ. Твердое вещество фильтровали и высушивали с получением 4-((3-бром-6-оксо-6Н-антра[1,9-cd]изоксазол-5-ил)амино)бензойной кислоты (промежуточного соединения 5).
Получение промежуточного соединения 6. Растворяли промежуточное соединение 5 в DMSO, затем к раствору добавляли триэтиламин и 1-циклогексилпиперазин при температуре приблизительно 50-70°С. Добавляли МТВЕ и раствор МеОН. Выделяли влажный осадок и промывали с помощью МТВЕ и МеОН, а затем фильтровали с получением промежуточного соединения 6 в виде твердого вещества.
Получение соединения 12. В колбе смешивали промежуточное соединение 6, Pd/C и гидразин и нагревали в течение приблизительно 4 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали, и затем ее повторно растворяли в TFA/DMAc и активированном угле, а затем фильтровали через целит. Добавляли NaHCO3 для нейтрализации смеси, и твердое вещество собирали посредством фильтрации. Соединение 12 очищали и высушивали. Это давало приблизительно 99% чистоты (HPLC, % площади). Масс-спектры давали [М+1]=525,5. 1Н-ЯМР (300 МГц, DMSO-d6), ppm (δ): 12,36 (1Н, s), 8,27 (2H, d), 7,95 (2H, d), 7,85 (2H, t), 7,42 (2H, d), 7,25 (1Н, s), 2,96 (4H, m), 2,74 (4H, m), 2,27 (2H, m), 1,57-1,80 (6H, m), 1,06-1,23 (5H, m).
5.3 ВИДЫ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ
Ингибирование соединениями в радиометрическом анализе смешанных мицелл. В конечном реакционном объеме 25 мкл, TrkA (человеческую) (3 нм) инкубировали с реакционным буфером для киназ (20 мМ HEPES (рН 7,5), 10 мМ MgCl2, 1 мМ EGTA, 0,02% Brij 35, 0,02 мг/мл BSA, 0,1 мМ Na3VO4, 2 мМ DTT, 1% DMSO), 0,2 мг/мл субстрата поли-EY (4:1) и 2 нМ MnCl2, а также [33Р-АТФ] (удельная активность примерно 500 имп/мин/пмоль, концентрация в соответствии с требованиями). Реакцию начинали посредством добавления смеси на основе MgATP. После инкубирования в течение по меньшей мере 40 минут при комнатной температуре реакцию останавливали путем добавления 5 мкл 3% раствора фосфорной кислоты. Затем 10 мкл реакционной смеси наносили пятнами на плоский фильтр Р30 и промывали три раза в течение 5 минут в 75 мМ фосфорной кислоты и один раз в метаноле перед высушиванием и сцинтилляционными измерениями. TrkA: рекомбинантный цитоплазматический домен человека (аминокислоты 441-796), меченный гистидином, экспрессируемый в клетках насекомых. Активируется in vitro посредством аутофосфорилирования. Mw=42,8 кДа. Субстраты для киназ: поли-(EY) для TRKA; поли-(EY) (4:1) с 2 мМ MnCl2, средний Mw=16 кДа, стандартные условия (если не указано иное): 30 нМ TRKA, 0,2 мг/мл поли-(EY)+2 мМ MnCl2 и 10 мкМ ([γ-33P]) АТФ. С использованием аналогичных условий анализа с рекомбинантными цитоплазматическими доменами человека других киназ также можно измерить виды активности других киназ.
Антагонистическую активность соединения, которое можно применять в настоящем раскрытии, в отношении TrkA-киназы можно определить с помощью данных анализов. В частности, соединения из вышеупомянутых примеров по настоящему раскрытию, в том числе из таблицы 1, характеризовались активностью антагонизма в отношении TrkA-киназной активности в вышеупомянутых анализах, обычно при IC50, составляющей менее чем приблизительно 25 мкМ. Предпочтительные соединения в рамках настоящего раскрытия характеризовались активностью антагонизма в отношении TrkA-киназной активности в вышеупомянутых анализах при IC50, составляющей менее чем приблизительно 2,5 мкМ. Более предпочтительные соединения в рамках настоящего раскрытия характеризовались активностью антагонизма в отношении TrkA-киназной активности в вышеупомянутых анализах при IC50, составляющей менее чем приблизительно 0,25 мкМ. Наиболее предпочтительные соединения в рамках настоящего раскрытия характеризовались активностью антагонизма в отношении TrkA-киназной активности в вышеупомянутых анализах при IC50, составляющей менее чем приблизительно 0,1 мкМ. Например, соединение А по настоящему раскрытию характеризуется IC50, составляющей 0,085 мкМ; соединение 12 по настоящему раскрытию характеризуется приблизительно 99,6% ингибированием TrkA-киназы при концентрации 10 мкМ или IC50, составляющей приблизительно 50-150 нМ, и характеризуется значениями IC50 более 10 мкМ при антагонизме в отношении, например, следующих структурно родственных протеинкиназ и других более чем 400 киназ, включающих TrkB, TrkC, ABL1, AKT1, ALK5/TGFB-R1, ARAF, AXL, BMX, BTK, CDK1/циклин В, CDK2/циклин А, CDK2/циклин E, c-MET, c-Src, EPHA1, FES/FPS, FGFR1, FGR, FLT1, FLT3 (CD), FMS, FYN, IGF-1R, IR, ITK, JAK3, JNK3, LCK, LYN, MEK1, MEK2, MLK1/MAP3K9, MUSK, P38a/MAPK14, P38b/MAPK11, PDGFRa, PDGFRb, PKA, PKC-альфа, PKC-бета I, PKC-бета II, PKC-дельта, PKC-эпсилон, PKC-эта, PKC-гамма, PKC-йота, PKC-мю/PKD1, PKC-тета, PKC-дзета, PKD2/PRKD2, PKG1a, PKG1b, RAF1, RET, TEC, TGFbR2, TIE2/TEK, VEGFR2/KDR, VEGFR3/FLT4 (в двух повторностях, с общим ингибитором киназ стауроспорином или K-252а в качестве соединения для положительного контроля). Такой результат свидетельствует о собственной активности соединений, применяемых в качестве селективных для изоформ антагонистов TrkA-киназной активности.
Ингибирование соединениями в функциональном анализе с использованием живых цельных клеток. Существует несколько способов измерения активации TrkA полной длины, стимулируемой ее естественным лигандом или агонистом NGF в живых клетках. Примером являются технические средства анализа профиля PathHunter, предоставляемые DiscoverX (Фримонт, Калифорния). Технология PathHunter является адаптацией комплементации фрагментов ферментов, которая предлагает новый общий формат функционального клеточного анализа для выявления белок-белковых взаимодействий. В данном подходе к клеточному анализу с использованием клеточного окружения U2OS небольшой пептидный эпитоп (PK) экспрессируется рекомбинантным путем на внутриклеточном С-конце TrkA (человеческой, полной длины). Он экспрессируется совместно с большей последовательностью, называемой акцептором фермента (ЕА), которая присоединена к цитоплазматическому белку SHC1, который будет взаимодействовать с TrkA внутриклеточно. Индуцируемая NGF активация TrkA-рецептора вызывает гомо- либо гетеродимеризацию TrkA, обуславливающую перекрестное фосфорилирование. Затем белок слияния SHC1-EA связывается с фосфорилированным TrkA-рецептором, что ускоряет комплементацию фрагментов PK и ЕА. В ходе данного взаимодействия образуется активный фермент бета-галактозидаза, который выявляют с использованием хемилюминесцентного субстрата.
В таких клеточных функциональных анализах, например, соединение 12 по настоящему раскрытию ингибирует стимулируемую NGF активацию TrkA при низкой наномолярной концентрации (IC50 для клеток составляет приблизительно 50-150 нМ) и при этом практически не оказывает эффект в отношении стимулируемой BDNF активации TrkB либо стимулируемой NT3 активации TrkC (IC50>10 мкМ в обоих случаях, в трех повтори остях, с общим ингибитором киназ стауроспорином или K-252а в качестве соединения для положительного контроля, агонистом для внутреннего контроля и соединением для отрицательного контроля).
Способ ингибирования по отношению к АТФ. Анализы TrkA-киназы проводили при комнатной температуре. К смеси фермент/субстрат добавляли соединения в четырех концентрациях (0, 0,037, 0,11 и 0,33 мкМ) с использованием акустической технологии и инкубировали в течение 40 мин. для обеспечения уравновешивания и связывания с ферментом всех соединений. Затем добавляли АТФ в различных концентрациях (10, 100, 200, 350 и 500 мкМ АТФ с 0,2 мг/мл поли-(EY)) для начала реакции. Активность отслеживали с течением времени каждые 5-15 мин. Такой кинетический анализ демонстрирует, что соединение D, например, ингибирует TrkA неконкурентно по отношению к АТФ: на графиках двойной обратной зависимости Лайнуивера-Берка показаны различия в Vmax, но не в km, для 4 условий.
Способ ингибирования по отношению к субстрату. Анализы киназ проводили аналогично исследованию АТФ. К смеси фермент/субстрат добавляли соединения в различных концентрациях (0, 0,037, 0,11 и 0,33 мкМ) с использованием акустической технологии и инкубировали в течение 40 мин. для обеспечения уравновешивания и связывания с ферментом всех соединений. Затем добавляли 10 мкМ АТФ и субстрат в различных концентрациях (0,02, 0,05, 0,1, 0,2 и 0,5 мг/мл поли-(EY)) для начала реакции. Активность отслеживали с течением времени каждые 5-15 мин. Такой кинетический анализ демонстрирует, что соединение D, например, ингибирует TrkA неконкурентно по отношению к субстрату: на графиках двойной обратной зависимости Лайнуивера-Берка показаны различия в Vmax, но не в km, для 4 условий.
Анализы жизнеспособности и пролиферации клеток. Для оценки чувствительности опухолевых клеток к химиотерапии жизнеспособность клеток измеряют с помощью люминесцентного анализа жизнеспособности клеток CellTiter-Glo® (Promega; Висконсин, США) согласно инструкциям производителя. Вкратце, от 5×103 до 7×105 клеток/мл культивируют в стерильных 96-луночных планшетах в присутствии повышающихся концентраций лекарственных средств (тестируемый препарат, от 0 до 100 мкМ) или индифферентного вещества в среде RPMI. Затем планшеты инкубируют в течение 24-96 ч., а затем добавляют 100 мкл реагента CellTiter-Glo для лизиса клеток. После инкубирования в течение 10 минут при комнатной температуре люминесценцию регистрируют в люминометре при времени интегрирования 1 с на лунку. Сигналы люминесценции для обработанных лекарственным средством клеток нормализуют по сигналу люминесценции, полученному от клеток, обработанных индифферентным веществом. В качестве альтернативного способа количественной оценки жизнеспособности клеток применяют способ исключения красителя трипанового синего. Клетки, обработанные индифферентным веществом или лекарственным средством, анализируют путем добавления раствора трипанового синего (0,4% в фосфатно-солевом буферном растворе [PBS]) в культуральную среду. Через 3 мин. число мертвых клеток, в которых задерживается краситель, сравнивают с общим числом клеток для расчета жизнеспособности клеток. Программное обеспечение GraphPad Prism 5 применяют для расчета IC50 и построения кривой зависимости эффекта от дозы для лекарственных средств. Многопланшетный ридер: EnVision 2104 (PerkinElmer). % контрольной жизнеспособности = 100*[(Х(обработанные лекарственным средством) - L(исходный уровень))/(Н(контроль с индифферентным веществом) - L(исходный уровень))]. Такие анализы демонстрируют, что, например, соединение 12 характеризуется значениями IC50 приблизительно от 2 до 5 мкМ в раковых клетках поджелудочной железы человека (из АТСС) AsPC-1, MIA РаСа-2, ВхРС-3, Capan-1 и Panc-1; приблизительно 5 мкМ в раковых клетках печени человека SK-HEP-1 и HepG2 и приблизительно 7 мкМ в раковых клетках желудка человека NCI-N87 после 24-часового инкубирования. Таксол, эрлотиниб, сорафениб и гемцитабин применяют в качестве контролей, и соединения по настоящему раскрытию проявляют синергический или аддитивный эффект с гемцитабином в раковых клетках поджелудочной железы или проявляют синергический или аддитивный эффект с сорафенибом в клетках рака печени.
Значения фармакокинетических параметров и биодоступности после пероральной и внутрибрюшинной (i.p.) обработки у мышей CD-1. Определяли фармакокинетические параметры и биодоступность у мышей CD-1 после пероральной и i.p. обработки (n=4 на группу дозирования). Например, для соединения 12 биодоступность при пероральном введении у мышей CD-1 составляет приблизительно 100% после перорального дозирования 50 мг/кг лекарственного средства; биодоступность при i.p. введении составляет приблизительно 100% после i.p. дозирования 50 мг/кг лекарственного средства; период полувыведения соединения 12 составляет приблизительно 1 ч. после внутривенного дозирования, и приблизительно 3,5 ч. после i.p. дозирования, и приблизительно 4,5 ч. после перорального дозирования.
Модель нейропатической боли при хронической компрессии (CCD у крыс. Модель CCI является одной из наиболее широко применяемых моделей мононейропатической боли, впервые подробно описанной Bennett и Xie (Bennett GJ, Xie YK. Pain. 1988; 33(1):87-107). В ней имитируются важные клинические симптомы хронической боли, такие как механическая аллодиния и термическая гипералгезия. Хроническую компрессию седалищного нерва вызывали путем завязывания четырех свободных лигатур вокруг левого седалищного нерва в соответствии со способом Bennett и Xie. Данная процедура обуславливала тактильную аллодинию в левой задней лапе. Калиброванные нити фон Фрея применяли для определения наиболее низкого порога механической (тактильной) чувствительности, необходимого для того, чтобы вызвать оживленный рефлекс сгибания лапы в задних лапах крысы. Обеспечивали акклиматизацию крыс в клетках из проволочной сетки в течение 15-20 мин. перед тестированием по методу фон Фрея. Оценку порогов сгибания лапы (PWT) с использованием нитей фон Фрея осуществляли перед хирургическим вмешательством, вызывающим CCI (на исходном уровне перед хирургическим вмешательством в день 0). Перед дозированием лекарственного средства в день 14 для каждой крысы регистрировали исходный уровень перед дозированием. Крыс включали в исследование, только если они не демонстрировали двигательную дисфункцию (например, волочение или свисание лапы) и их PWT был ниже 4 г. Использовали ранее не подвергавшихся обработке лекарственным средством крыс с CCI (n=4-6 на группу). Индифферентное вещество для перорального введения представляло собой 0,5% CMC-Na/0,1% Tween 80 в дистиллированной воде. Габапентин в качестве положительного контроля растворяли в индифферентном веществе и вводили перорально при 100 мг/кг (посредством перорального зонда). Тестовое соединение суспендировали в индифферентном веществе и вводили перорально при 50 мг/кг и 100 мг/кг. Каждой крысе с CCI вводили разовую дозу тестового соединения, габапентина или индифферентного вещества в качестве контроля за 2 часа до оценки PWT. В такой крысиной модели нейропатической боли соединение 12, например, продемонстрировало приблизительно 48% относительный обезболивающий эффект при пероральной дозе 150 мг/кг по сравнению с обезболивающим эффектом, вызываемым морфином (HCl) при 3 мг/кг s.c.
Данные результаты продемонстрировали, что пероральное введение, например, соединения D по настоящему раскрытию значительно уменьшало механическую аллодинию у крыс с CCI в модели нейропатической боли дозозависимым образом. Кроме того, при той же пероральной дозе 100 мг/кг соединение D является приблизительно на 98% более эффективным в подавлении механической аллодинии в случае нейропатической боли при CCI по сравнению с габапентином, существующим в настоящее время золотым стандартом лекарственного препарата от нейропатической боли, и при этом даже 50 мг/кг перорально вводимого соединения D являются приблизительно на 28% более эффективными, чем 100 мг/кг перорально вводимого габапентина. Следует отметить, что крысы с CCI, которым дозировали габапентин, продемонстрировали сонливость или нарушение координации движений, что сопоставимо с известным побочным эффектом габапентина. Однако такой эффект или другая аномалия не наблюдались у крыс с CCI, которым дозировали соединение D.
Более того, статистически значимое различие между антиаллодиническими эффектами, измеренными в день 14 и в день 20 в одной и той же группе крыс с CCI, обработанных одной и той же разовой пероральной дозой соединения D 100 мг/кг, не наблюдалось, что указывало на отсутствие проблемы переносимости.
Модель мононейропатической боли при лигатуре спинального нерва (SNL) у крыс. Хирургическую процедуру осуществляют в соответствии со способом, впервые описанным Kim и Chung (Kim SH, Chung JM. Pain. 1992; 50(3):355-63). Данная процедура обуславливает тактильную аллодинию в левой задней лапе. Крыс включают в исследование, только если они не демонстрируют двигательную дисфункцию (например, волочение или свисание лапы) и их PWT ниже 4,0 г.
Дозозависимые антиаллодинические эффекты тестового соединения: в день 14 после хирургического вмешательства крыс обрабатывают тестовым соединением в одной из четырех доз, индифферентным веществом или положительным контролем посредством перорального зонда, и PWT определяют с помощью калиброванных нитей фон Фрея в моменты времени 0 (непосредственно перед дозированном лекарственного средства, исходный уровень перед дозированием), 0,5, 1, 2, 4 и 6 ч.
Эффекты переносимости: через 6 дней после тестирования в день 14, т.е. в день 20 после хирургического вмешательства, ту же процедуру, что и в день 14, повторяют в день 20 с той же группой крыс с CCI, обработанных той же (эффективной) дозой, что и в день 14. Результаты изучения антиаллодинических эффектов тестового соединения, тестируемых в день 14 и в день 20, сравнивают, чтобы увидеть, наблюдается ли какой-либо эффект переносимости тестового соединения у животных.
Антиаллодинические эффекты при повторном введении тестового соединения: введение тестового соединения начинают в день 7 после хирургического вмешательства и выполняют один раз в день в течение 7 дней. PWT определяют с помощью калиброванных нитей фон Фрея один раз в день через 2 часа после дозирования соединения. Через 7 дней дозирования измерение продолжают раз в два дня без дозирования соединения в течение следующих 7 дней. PWT определяют в моменты времени, указанные выше.
Эффекты термической гипералгезии. Термическую гипералгезию можно оценивать у крыс с SNL посредством плантарного теста с разовой дозой тестового соединения в моменты времени, указанные выше.
Модель индуцируемой стрептозотоцином диабетической полинейропатической боли. Диабетическая периферическая нейропатия представляет собой долгосрочное осложнение сахарного диабета. Крысы получают i.p. инъекции стрептозотоцина (STZ, 50 мг/кг, растворенного в цитратном буфере с рН 4,5 непосредственно перед инъекцией) в целях индуцирования инсулинозависимого сахарного диабета и вызывания тактильной аллодинии. Через одну неделю оценивают уровень глюкозы в крови в образцах, отобранных из хвостовой вены, с использованием стандартных тестовых полосок и колориметра. Только животных с уровнем глюкозы в крови >350 мг/дл считают страдающими диабетом и включают в тестирование. Типичные признаки нейропатической боли (тактильной аллодинии) развиваются в задних лапах, начиная примерно с 2-3 недели после инъекции STZ. Через 4 недели обычно достигают стабильного уровня аллодинии. В данный момент времени крыс с PWT ниже 4,5 г включают в исследование для тестирования соединения. Состояние аллодинии остается неизменным до 8й недели после инъекции STZ. Всех животных наблюдают каждый день и регулярно взвешивают в течение периода исследования. В данной модели нейропатической боли имитируются симптомы нейропатии у пациентов, страдающих диабетом (Lynch JJ, 3rd, et al Eur J Pharmacol. 1999; 364(2-3):141-6; Calcutt NA, J Neurol Sci. 2004; 220(1-2):137-9).
Дозозависимые антиаллодинические эффекты тестового соединения: в день 28 после инъекции STZ крыс обрабатывают тестовым соединением в одной из четырех доз или контролями (индифферентным веществом и положительным) посредством перорального зонда, и PWT определяют с помощью калиброванных нитей фон Фрея в моменты времени 0 (непосредственно перед дозированием лекарственного средства, исходный уровень перед дозированием), 0,5, 1, 2,4 и 6 ч.
Эффекты переносимости: через 6 дней после тестирования в день 28, т.е. в день 34 после инъекции STZ, ту же процедуру, что и в день 28, повторяют в день 34 с той же группой крыс, которым инъецировали STZ, обработанных той же (эффективной) дозой, что и в день 28. Два результата изучения антиаллодинических эффектов тестового соединения, определенные в день 28 и в день 34, сравнивают, чтобы увидеть, наблюдается ли какой-либо эффект переносимости тестового соединения у животных.
Антиаллодинические эффекты при повторном введении тестового соединения: введение (р.о.) тестового соединения начинают в день 21 после инъекции STZ и выполняют один раз в день в течение 7 дней. PWT определяют с помощью калиброванных нитей фон Фрея один раз в день через 1 час после дозирования соединения. Через 7 дней дозирования измерение продолжают раз в два дня без дозирования соединения в течение следующих 7 дней. PWT определяют в моменты времени, указанные выше. Оценку термической гипералгезии посредством плантарного теста можно осуществлять в моделях с STZ с разовой дозой, и PWL определяют в моменты времени, указанные выше.
Каррагинановая модель боли. Каррагинановая модель является быстрой надежной моделью, применяемой для оценки способности обезболивающих средств блокировать воспалительную боль. Обезболивающие эффекты комбинаций тестируемого препарата в отношении формирования боли оценивают с использованием модели индуцируемой каррагинаном боли у крыс. Взрослым самцам крыс Sprague-Dawley перорально вводят исследуемые лекарственные средства (индифферентное вещество, соединения по настоящему раскрытию) один раз в день в течение 2 дней (день -2 и день -1) и за 30 минут до инъекции каррагинана в день 0 (момент времени = 0). Для инъекции каррагинана животным производили легкую анестезию и инъецировали 0,1 мл 2% каррагинана в поверхность подошвы правой задней лапы. Индометацин в качестве положительного контроля (30 мг/кг, р.о.) вводят перорально непосредственно перед инъекцией каррагинана. Объемы лап (правой и левой) измеряют с использованием плетизмометра перед введением лекарственного средства в день -2, и они служат в качестве измерений исходного уровня. Объемы лап снова измеряют через два часа после инъекции каррагинана. Степень механической аллодинии измеряется наблюдателем в слепом для наблюдателя исследовании с использованием нитей фон Фрея, прикладываемых к поверхности подошв задних лап, в возрастающем числовом порядке. Каждая нить увеличивает силу, прикладываемую к лапе. Нити прикладывают до достижения сгибания лапы животного. Данную процедуру проводят перед введением лекарственного средства (день -2), в день -1 и в день 0 в моменты времени = 0, 20, 40, 60, 80 и 120 минут после введения каррагинана. Силу (выраженную в граммах), необходимую для сгибания лапы после инъекции каррагинана, вычитают из силы, необходимой для сгибания лапы перед инъекцией каррагинана. Результаты выражают как среднее изменение по сравнению с исходным уровнем по пяти моментам времени после инъекции каррагинана. В такой крысиной модели боли соединение 12, например, продемонстрировало приблизительно 85% относительный обезболивающий эффект при пероральной дозе 150 мг/кг по сравнению с приблизительно 100% обезболивающим эффектом, вызываемым индометацином (30 мг/кг, р.о.).
Оценивание противоопухолевой эффективности соединения формулы (I) и/или формулы (II) in vivo в мышиной модели подкожного ксенотрансплантата раковых клеток PANC-1 поджелудочной железы человека.
Осуществляли оценку терапевтической эффективности соединения формулы (I) и/или формулы (II) (тестируемый препарат) и его комбинации с гемцитабином in vivo в подкожных ксенотрансплантатах раковых клеток PANC-1 поджелудочной железы человека у самок бестимусных мышей BALB/c (с весом тела в диапазоне 18-23 грамма).
Содержание животных: животных содержали в помещениях с ламинарным потоком при постоянной температуре и влажности по 4 или 3 животных в каждой клетке. Температура: 22±3°С. Влажность: 50±20%. Световой цикл: 12 часов света и 12 часов темноты. Клетки: применяли поликарбонатные клетки размером 300 мм × 180 мм × 150 мм, оснащенные материалом на основе мягкой древесины. Подстилку меняли два раза в неделю. Рацион: животные имели свободный доступ к сертифицированному коммерческому лабораторному рациону. Концентрации загрязнителей в данном рационе анализировались производителями стандартным способом для удостоверения в том, что уровень загрязнителей находится ниже их допустимого максимума, и они, таким образом, не будут оказывать влияние на рост опухоли.
Вода: животные имели свободный доступ к стерильной питьевой воде. Идентификация клеток: идентификационные бирки для каждой клетки содержали следующую информацию: количество животных, пол, линию, дату получения, обработку, номер группы и дату начала обработки. Вкратце, линию клеток PANC-1 изначально приобретали у АТСС (CRL-1469), и первичную линию клеток PANC-1 получали из подкожных ксенотрансплантатных опухолей PANC-1. Первичные клетки PANC-1 выдерживали in vitro в виде монослойной культуры в среде DMEM, дополненной 10% термоинактивированной фетальной бычьей сывороткой, 100 ед./мл. пенициллина и 100 мкг/мл стрептомицина и L-глутамина (2 мМ) при 37°С в атмосфере воздуха, содержащего 5% CO2. Клетки, растущие в экспоненциальной фазе, собирали и подсчитывали для инокуляции опухоли.
Инокуляция опухолевых клеток и рандомизация. Каждому животному подкожно инокулировали в правый бок первичные опухолевые клетки PANC-1 (5×106/животное) в 0,1 мл PBS. Обеспечивали непрерывное развитие опухоли до тех пор, пока средний объем опухоли не достигал примерно 85 мм3. Затем животных рандомизировали в 6 групп, при этом каждая группа содержала 8 животных. Тестируемые препараты вводили животным-опухоленосителям в соответствии с заранее определенными схемами. Все процедуры, связанные с обращением с животными, уходом за ними и их обработкой в данном исследовании, осуществляли в соответствии с руководством, одобренным Институциональным комитетом по содержанию и использованию животных (IACUC), в лаборатории для тестирования согласно указаниям Ассоциации по оценке и аккредитации ухода за лабораторными животными (AAALAC). Во время систематического наблюдения животных проверяли на наличие каких-либо эффектов роста опухоли в отношении нормального поведения, как, например, подвижности, потребления пищи и воды (только путем осмотра), набора/потери веса тела (BW) (BW измеряли дважды в неделю), потускнения глаз/шерсти и любого другого аномального эффекта. Смерть и наблюдаемые клинические признаки регистрировали, исходя из количества животных в каждом подмножестве.
Измерение опухоли и конечные точки. Основной конечной точкой была оценка того, можно ли ингибировать рост опухоли Измерение опухоли проводили дважды в неделю с помощью штангенциркуля, и объем опухоли (мм3) вычисляли с использованием формулы: TV=a×b2/2, где а и b представляют собой соответственно длинный и короткий диаметры опухоли. Размеры опухолей затем применяли для получения значений Т/С и TGI (ингибирование роста опухоли), которые являются показателями противоопухолевой эффективности. Значение Т/С (в процентах) является показателем противоопухолевого эффекта. Т и С представляют собой соответственно средние объемы в обработанных и контрольных группах в определенный день. Изменение BW, выраженное в %, рассчитывают с использованием следующей формулы: Изменение BW (%)=(BW_день X/BW_день 0)×100, где BW_день Х представляет собой BW в определенный день, а BW_день 0 представляет собой BW в день 0 (инокуляция опухоли).
Сбор образцов опухоли. Два образца опухоли соответственно из группы 1, 2 и 3; шесть образцов опухоли из группы 4; пять образцов опухоли соответственно из группы 5 и 6 мгновенно замораживали в жидком азоте и выдерживали при -80°С. Всего собрали 22 образца опухоли.
Статистический анализ. Однофакторный ANOVA осуществляли для сравнения объемов опухолей между группами. Все данные анализировали с использованием программного обеспечения SPSS 17.0; результаты при p<0,05 считали статистически значимыми. Противоопухолевая эффективность соединения 12 in vivo в отдельности либо в комбинации с гемцитабином приведена в следующих двух таблицах.
Результаты указывают на то, что соединение 12 было эффективным в снижении темпов роста опухоли в отдельности либо в комбинации с существующим в настоящее время стандартом медицинского препарата гемцитабином, и комбинация соединения 12 и гемцитабина продемонстрировала значительные синергические действия и при этом характеризовалась более значительным уменьшением опухоли, чем соединение 12 либо гемцитабин в отдельности.
Средние объемы опухоли в различных группах

Примечание: а среднее значение ± SEM
Противоопухолевая активность соединения 12 и его комбинации с гемцитабином при обработке в мышиной модели подкожного ксенотрансплантата раковых клеток PANC-1 поджелудочной железы человека


Примечание: a среднее значение ± SEM; b по сравнению с контролем.
P-значения: G2 по сравнению с G3<0,001; G2 по равнению с G4=0,008; G2 по сравнению с G5<0,001; G2 по сравнению с G6<0,004;
G3 по сравнению cG4=0,094; G3 по сравнению с G5=0,134; G3 по сравнению с G6=0,062;
G4 по сравнению с G5<0,001; G4 по сравнению с G6<0,001;
G5 по сравнению с G6=0,998
5.4 ТЕРАПЕВТИЧЕСКИЕ ПУТИ ПРИМЕНЕНИЯ
В соответствии с настоящим раскрытием соединение по настоящему раскрытию или его соль, сольват, сложный эфир и/или пролекарство или фармацевтическую композицию, содержащую соединение или его соль, сольват, сложный эфир и/или пролекарство, вводят пациенту, предпочтительно человеку, страдающему различными нарушениями. Они включают виды рака, тревожность, генерализованное болевое расстройство, острую боль, хроническую боль, воспалительную боль и нейропатическую боль.
Несмотря на то, что настоящее раскрытие было описано и проиллюстрировано со ссылкой на определенные предпочтительные варианты осуществления, специалистам в данной области будет понятно, что в нем могут быть произведены различные изменения, модификации и замены без отступления от сущности и объема настоящего раскрытия.
5.5 ТЕРАПЕВТИЧЕСКОЕ/ПРОФИЛАКТИЧЕСКОЕ ВВЕДЕНИЕ
Соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства или фармацевтические композиции, содержащие соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства, можно успешно применять в медицине человека. Как было ранее описано выше в разделе 6.4, соединения по настоящему раскрытию применимы для лечения или предупреждения различных заболеваний.
При применении для лечения или предупреждения вышеупомянутых заболеваний или нарушений соединения по настоящему раскрытию можно вводить или применять в отдельности или в комбинации с другими активными средствами (например, с другими средствами от боли).
В настоящем раскрытии представлены способы лечения и профилактики путем введения пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества одного или более соединений по настоящему раскрытию или их солей, сольватов, сложных эфиров и/или пролекарств. Пациентом может быть животное, более предпочтительно млекопитающее и наиболее предпочтительно человек.
Соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства можно вводить перорально. Соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства также можно вводить посредством любого другого удобного способа, например, посредством инфузии или болюсной инъекции, посредством всасывания через эпителиальную или слизистую выстилку (например, слизистую оболочку полости рта, слизистую оболочку прямой кишки и кишечника и т.д.). Введение может быть системным или местным. Известны различные системы доставки (например, инкапсулирование в липосомах, микрочастицах, микрокапсулах, капсулах и т.д.), которые можно применять для введения соединения и/или фармацевтической композиции на его основе. Способы введения включают без ограничения внутрикожный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный, эпидуральный, пероральный, подъязычный, интраназальный, внутримозговый, интравагинальный, чрескожный, ректальный, посредством ингаляции или наружный, в частности, на уши, нос, глаза или кожу. Предпочтительный способ введения остается на усмотрение практикующего врача и будет зависеть отчасти от участка с медицинским состоянием. В большинстве случаев введение будет приводить к высвобождению соединений по настоящему раскрытию или их солей, сольватов, сложных эфиров и/или пролекарств в кровоток пациента.
В конкретных вариантах осуществления может быть желательно вводить одно или более соединений по настоящему раскрытию или их слей, сольватов, сложных эфиров и/или пролекарств местно в область, требующую лечения. Этого можно достигнуть, например, и не в качестве ограничения, посредством местной инфузии во время хирургического вмешательства, наружного применения, например, вместе с раневой повязкой после хирургического вмешательства, посредством инъекции, с помощью катетера, с помощью суппозитория или с помощью имплантата, при этом указанный имплантат изготовлен из пористого, непористого или гелеобразного материала, в том числе мембран, таких как мембраны Silastic, или волокон. В некоторых вариантах осуществления введение можно осуществлять путем прямой инъекции в участок (или прежний участок), пораженный раком или артритом.
В определенных вариантах осуществления может быть желательным введение одного или более соединений по настоящему раскрытию или их солей, сольватов, сложных эфиров и/или пролекарств в центральную нервную систему пациента с помощью любого подходящего способа, в том числе с помощью внутрижелудочковой, интратекальной и эпидуральной инъекции. Проведение внутрижелудочковой инъекции может обеспечивать внутрижелудочковый катетер, например, присоединенный к резервуару, такому как резервуар Оммайя.
Соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства также можно вводить непосредственно в легкое путем ингаляции. Для введения путем ингаляции соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства можно удобным способом доставлять в легкое с помощью ряда различных устройств. Например, можно применять ингалятор отмеренных доз ("MDI"), в котором используются емкости, которые содержат подходящий низкокипящий газ-вытеснитель (например, дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или любой другой подходящий газ), для доставки соединений по настоящему раскрытию непосредственно в легкое.
В качестве альтернативы, для введения соединений по настоящему раскрытию или их солей, сельватов, сложных эфиров и/или пролекарств в легкое можно применять устройство по типу ингалятора сухого порошка ("DPI"). В устройствах по типу DPI обычно применяют такой механизм, как выброс газа, для создания облака сухого порошка внутри контейнера, который затем может вдыхаться пациентом. Устройства по типу DPI также хорошо известны в данной области техники. Популярной разновидностью является многодозовая система DPI ("MDDPI"), которая обеспечивает доставку более чем одной терапевтической дозы. Например, капсулы и картриджи из желатина для применения в ингаляторе или инсуффляторе можно составить таким образом, чтобы они содержали порошкообразную смесь соединения по настоящему раскрытию и подходящей порошкообразной основы, такой как лактоза или крахмал, для данных систем.
Другим типом устройства, которое можно применять для доставки соединений по настоящему раскрытию или их солей, сольватов, сложных эфиров и/или пролекарств в легкое, является устройство для распыления жидкости, поставляемое, например, Aradigm Corporation, Хейворд, Калифорния. В системах распыления жидкости применяют форсунки с отверстиями чрезвычайно малого размера для перевода в аэрозольное состояние жидких составов лекарственных средств, которые затем можно непосредственно вдыхать в легкое.
В некоторых вариантах осуществления для доставки соединений по настоящему раскрытию или их солей, сольватов, сложных эфиров и/или пролекарств в легкое применяют аэрозольный распылитель. Аэрозольные распылители образуют аэрозоли из жидких составов лекарственных средств путем применения, например, ультразвуковой энергии для образования мелких частиц, которые можно легко вдохнуть (см., например, Verschoyle et al., British J. Cancer, 1999, 80, Suppl. 2, 96). Аэрозольные распылители являются доступными из ряда коммерческих источников, таких как Sheffield/Systemic Pulmonary Delivery Ltd., Aventis и Batelle Pulmonary Therapeutics.
В других вариантах осуществления для доставки соединений по настоящему раскрытию или их солей, сольватов, сложных эфиров и/или пролекарств в легкое применяют электрогидродинамическое ("EHD") аэрозольное устройство. В аэрозольных EHD-устройствах применяют электрическую энергию для перевода в аэрозольное состояние жидких растворов или суспензий лекарственных средств (см., например, Noakes et al., патент США №4765539). Электрохимические свойства состава могут представлять собой важные параметры для оптимизации при доставке соединений по настоящему раскрытию или их солей, сольватов, сложных эфиров и/или пролекарств в легкое с помощью аэрозольного EHD-устройства, и такая оптимизация осуществляется стандартным способом специалистом в данной области. Аэрозольные EHD-устройства могут более эффективно доставлять лекарственные средства в легкое, чем существующие технологии легочной доставки.
В других вариантах осуществления соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства могут быть доставлены в везикуле, в частности, липосоме (см. Langer, 1990, Science, 249:1527-1533; Treat et al., в "Liposomes in the Therapy of Infectious Disease and Cancer," Lopez-Berestein and Fidler (eds.), Liss, New York, pp. 353-365 (1989); см. в общих чертах "Liposomes in the Therapy of Infectious Disease and Cancer," Lopez-Berestein and Fidler (eds.), Liss, New York, pp. 353-365 (1989)).
В других вариантах осуществления соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства могут быть доставлены посредством систем с пролонгированным высвобождением. В еще нескольких вариантах осуществления система с пролонгированным высвобождением представляет собой систему с пролонгированным высвобождением для перорального введения. В еще нескольких вариантах осуществления можно применять насос (см. Langer, выше; Sefton, 1987, CRC Crit Ref Biomed Eng. 14:201; Saudek et al., 1989, N. Engl. J Med. 321:574).
В еще нескольких вариантах осуществления в фармацевтических композициях, содержащих соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства, можно применять полимерные материалы. (Касательно иллюстративных полимерных материалов см. "Medical Applications of Controlled Release", Langer and Wise (eds.), CRC Pres., Boca Raton, Florida (1974); "Controlled Drug Bioavailability," Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger and Peppas, 1983, J Macromol. Sci. Rev. Macromol Chem. 23:61; см. также Levy et al., 1985, Science 228: 190; During et al., 1989, Ann. Neurol. 25:351; Howard et al., 1989, J. Neurosurg. 71:105). В еще нескольких вариантах осуществления полимерные материалы применяют для доставки пероральных фармацевтических композиций с пролонгированным высвобождением. Иллюстративные полимеры включают без ограничения натрий-карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и гидроксиэтилцеллюлозу (наиболее предпочтительно гидроксипропилметилцеллюлозу). Были описаны другие эфиры целлюлозы (Alderman, Int. J. Pharm. Tech. & Prod. Mfr., 1984, 5(3) 1-9). Факторы, оказывающие влияние на высвобождение лекарственного средства, хорошо известны специалисту в данной области и были описаны в уровне техники (Bamba et al., Int. J. Pharm., 1979, 2, 307).
В других вариантах осуществления для перорального введения с пролонгированным высвобождением можно применять препараты, покрытые энтеросолюбильной оболочкой. Материалы покрытий включают без ограничения полимеры с рН-зависимой растворимостью (т.е. для рН-контролируемого высвобождения), полимеры с низкой или рН-зависимой скоростью набухания, растворения или размывания (т.е. для высвобождения, контролируемого по времени), полимеры, которые разрушаются под действием ферментов (т.е. для высвобождения, контролируемого ферментами), и полимеры, которые образуют твердые слои, разрушающиеся при повышении давления (т.е. для высвобождения, контролируемого давлением).
В еще нескольких вариантах осуществления для перорального введения с пролонгированным высвобождением применяют осмотические системы доставки (Verma et al., Drug Dev. Ind. Pharm., 2000, 26:695-708). В еще нескольких вариантах осуществления в качестве устройств пероральной доставки с пролонгированным высвобождением применяют осмотические устройства OROS™ (Theeuwes et al., патент США №3845770; Theeuwes et al., патент США №3916899).
В еще нескольких вариантах осуществления систему с контролируемым высвобождением можно разместить рядом с мишенью для соединений по настоящему раскрытию или их солей, сольватов, сложных эфиров и/или пролекарств, в каковом случае, таким образом, требуется только часть системной дозы (см., например, Goodson, в "Medical Applications of Controlled Release," выше, vol. 2, pp. 115-138 (1984)). Также можно применять другие системы с контролируемым высвобождением, обсуждаемые в Langer, 1990, Science 249:1527-1533.
5.6 ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ПО НАСТОЯЩЕМУ РАСКРЫТИЮ
В одном аспекте в настоящем раскрытии представлены фармацевтические композиции, содержащие одно или более соединений по настоящему раскрытию, в том числе соединения, имеющие структурную формулу (I) и/или формулу (II), и любые из их субродовых групп и конкретных вариантов осуществления, описанных выше в разделе 5.2.
Фармацевтические композиции по настоящему раскрытию содержат терапевтически эффективное количество одного или более соединений по настоящему раскрытию или их солей, сольватов, сложных эфиров и/или пролекарств, предпочтительно в очищенной форме, вместе с подходящим количеством фармацевтически приемлемого индифферентного вещества с целью получения формы для надлежащего введения пациенту. При введении пациенту соединения по настоящему раскрытию и фармацевтически приемлемые индифферентные вещества предпочтительно являются стерильными. Вода является предпочтительным индифферентным веществом, если соединение вводят внутривенно. Солевые растворы и водные растворы декстрозы и глицерина также можно использовать в качестве жидких индифферентных веществ, в частности, для инъецируемых растворов. Подходящие фармацевтические индифферентные вещества также включают наполнители, такие как крахмал, глюкоза, лактоза, сахароза, желатин, солод, рис, мука, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропилен, гликоль, вода, этанол и т.п. Фармацевтические композиции по настоящему раскрытию при необходимости также могут содержать незначительные количества смачивающих или эмульгирующих средств или буферных средств для поддержания рН. Кроме того, можно применять вспомогательные, стабилизирующие, загущающие, смазывающие и красящие средства.
Фармацевтические композиции можно получать посредством способов традиционного смешивания, растворения, гранулирования, получения драже, растирания в порошок, эмульгирования, инкапсулирования, улавливания или лиофилизации. Фармацевтические композиции можно составлять традиционным способом с использованием одного или более физиологически приемлемых носителей, разбавителей, наполнителей или вспомогательных средств, которые облегчают переработку соединений по настоящему раскрытию в препараты, которые можно применять фармацевтически. Надлежащий состав зависит от выбранного способа введения.
Фармацевтические композиции по настоящему раскрытию могут принимать форму растворов, суспензий, эмульсий, таблеток, пилюль, пеллет, капсул, капсул, содержащих жидкости, порошков, составов с пролонгированным высвобождением, суппозиториев, эмульсий, аэрозолей, распыляемых составов, суспензий или любой другой формы, подходящей для применения. В некоторых вариантах осуществления фармацевтически приемлемое индифферентное вещество представлено в виде капсулы (см., например, Grosswald et al., патент США №5698155). Другие примеры подходящих фармацевтических индифферентных веществ были описаны в уровне техники (см. Remington: The Science and Practice of Pharmacy, Philadelphia College of Pharmacy and Science, 20th Edition, 2000).
Для наружного применения соединение можно составить в виде растворов, гелей, мазей, кремов, суспензий и т.д., как хорошо известно в данной области техники.
Системные составы включают составы, предназначенные для введения путем инъекции, например, для подкожной, внутривенной, внутримышечной, интратекальной или внутрибрюшинной инъекции, а также составы, предназначенные для чрескожного, чресслизистого, перорального или легочного введения. Системные составы можно получать в комбинации с дополнительным активным средством, таким как другое противораковое средство.
В некоторых вариантах осуществления соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства составлены в соответствии со стандартными процедурами в виде фармацевтической композиции, приспособленной для внутривенного введения людям. Как правило, соединения для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. Для инъекции соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства можно составить в водные растворы, предпочтительно в физиологически совместимых буферах, такие как раствор Хэнкса, раствор Рингера или физиологический солевой буфер. Раствор может содержать средства для образования состава, такие как суспендирующие, стабилизирующие и/или диспергирующие средства. При необходимости фармацевтические композиции также могут содержать солюбилизирующее средство. Фармацевтические композиции для внутривенного введения могут необязательно содержать местный анестетик, такой как лигнокаин, для облегчения боли в месте инъекции. Обычно ингредиенты поставляют раздельно либо смешанными между собой в единичную лекарственную форму, например, в виде лиофилизированного порошка или не содержащего воды концентрата в герметично закрытом контейнере, таком как ампула или пакет-саше, на котором указано количество активного средства. Если соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства вводят путем инфузии, их можно дозировать, например, с помощью инфузионного флакона, содержащего стерильные воду или солевой раствор фармацевтической степени чистоты. Если соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства вводят путем инъекции, может быть предоставлена ампула со стерильной водой для инъекции или солевым раствором, так что ингредиенты можно смешивать перед введением.
Для чресслизистого введения в составе применяют проникающие средства, соответствующие барьеру, через который необходимо пройти. Такие проникающие средства обычно известны в данной области техники.
Фармацевтические композиции для пероральной доставки могут быть, например, в форме таблеток, пастилок, водных или масляных суспензий, гранул, порошков, эмульсий, капсул, сиропов или эликсиров. Вводимые перорально фармацевтические композиции могут содержать одно или более необязательных средств, например, подсластителей, таких как фруктоза, аспартам или сахарин; ароматизаторов, таких как масло мяты перечной, масло грушанки или вишневый ароматизатор; красителей и консервантов для получения фармацевтического препарата с привлекательным вкусом. Более того, в форме таблетки или пилюли композиции могут иметь покрытие для замедления разложения и всасывания в желудочно-кишечном тракте, что обеспечивает, таким образом, пролонгированное действие в течение длительного периода времени. Мембраны с селективной проницаемостью, окружающие осмотически активное движущее соединение, также подходят для вводимых перорально соединений по настоящему раскрытию. В этих последних платформах жидкость из среды, окружающей капсулу, поглощается движущим соединением, которое набухает, вытесняя средство или композицию средств через отверстие. Данные платформы для доставки могут обеспечивать профиль доставки по сути нулевого порядка в отличие от пикообразного профиля составов с немедленным высвобождением. Также можно применять материал для задержки по времени, такой как моностеарат глицерина или стеарат глицерина. Композиции для перорального введения могут содержать стандартные индифферентные вещества, такие как маннит, лактоза, крахмал, стеарат магния, сахаринат натрия, целлюлоза, карбонат магния и т.д. Такие индифферентные вещества предпочтительно имеют фармацевтическую степень чистоты.
В случае жидких препаратов для перорального введения, таких как, например, суспензии, эликсиры и растворы, подходящие носители, наполнители или разбавители включают воду, солевой раствор, алкиленгликоли (например, пропиленгликоль), полиалкиленгликоли (например, полиэтиленгликоль), масла, спирты, слабокислые буферы от рН 4 до рН 6 (например, ацетатный, нитратный, аскорбатный от приблизительно 5,0 мМ до приблизительно 50,0 мМ) и т.д. Кроме того, можно добавлять ароматизаторы, консерванты, красители, соли желчных кислот, ацилкарнитины и т.п.
Для трансбуккального введения фармацевтические композиции могут принимать форму таблеток, пастилок и т.д., составленных традиционным способом.
Жидкие составы лекарственных средств, подходящие для применения с аэрозольными распылителями и устройствами для распыления жидкостей, а также аэрозольными EHD-устройствами, как правило, будут содержать соединение по настоящему раскрытию с фармацевтически приемлемым индифферентным веществом. В некоторых вариантах осуществления фармацевтически приемлемое индифферентное вещество представляет собой жидкость, такую как спирт, вода, полиэтиленгликоль или перфторуглерод. Необязательно можно добавлять другой материал для изменения аэрозольных свойств раствора или суспензии соединений, раскрытых в данном документе. Данный материал предпочтительно представляет собой жидкость, такую как спирт, гликоль, полигликоль или жирная кислота. Другие способы составления жидких растворов или суспензий лекарственных средств, подходящих для применения в аэрозольных устройствах, известны специалистам в данной области (см., например, Biesalski, патент США №5112598; Biesalski, патент США №5556611).
Соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства также можно составить в ректальные или вагинальные фармацевтические композиции, такие как суппозитории или удерживающие клизмы, например, содержащие традиционные основы для суппозиториев, такие как масло какао или другие глицериды.
В дополнение к составам, описанным ранее, соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства также можно составить в виде депо-препарата. Такие составы длительного действия можно вводить путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Таким образом, например, соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства можно составить с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле), или ионообменными смолами или в виде умеренно растворимых производных, например, в виде умеренно растворимой соли.
5.7 ТЕРАПЕВТИЧЕСКИЕ ДОЗЫ
Представленные соединения по настоящему раскрытию или их соль, пролекарство или мягкое лекарство, соль пролекарства или мягкого лекарства, сольват или гидрат и фармацевтически приемлемое индифферентное вещество обычно применяются в количестве, эффективном для достижения предполагаемой цели. Для применения в лечении или предупреждении заболеваний или нарушений, характеризующихся подавлением апоптоза, соединения и/или фармацевтические композиции на их основе вводят или применяют в терапевтически эффективном количестве.
Количество соединений по настоящему раскрытию или их солей, сольватов, сложных эфиров и/или пролекарств, которое будет эффективным для лечения конкретного нарушения или состояния, раскрытого в данном документе, будет зависеть от природы нарушения или состояния и может быть определено посредством стандартных клинических методик, известных в данной области техники. Кроме того, анализы in vitro или in vivo можно необязательно использовать для облегчения определения оптимальных диапазонов доз. Количество вводимых соединений по настоящему раскрытию или их солей, сольватов, сложных эфиров и/или пролекарств, разумеется, будет зависеть, наряду с другими факторами, от субъекта, подлежащего лечению, веса субъекта, тяжести болезни, способа введения и решения лечащего врача.
Например, дозу можно доставить в фармацевтической композиции путем однократного введения, путем многократного применения или контролируемого высвобождения. В некоторых вариантах осуществления соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства доставляют путем перорального введения с пролонгированным высвобождением. Дозирование можно повторять периодически, можно производить в отдельности или в комбинации с другими лекарственными средствами и можно продолжать до тех пор, пока это требуется для эффективного лечения болезненного состояния или нарушения.
Подходящие диапазоны доз для перорального введения (единичная лекарственная форма для перорального введения) пациенту, нуждающемуся в этом, зависит от активности соединений по настоящему раскрытию, но обычно составляют от приблизительно 0,001 мг до приблизительно 200 мг соединения по настоящему раскрытию на килограмм веса тела; более предпочтительно от приблизительно 0,01 мг до приблизительно 50 мг соединения по настоящему раскрытию на килограмм веса тела; еще более предпочтительно от приблизительно 0,05 мг до приблизительно 20 мг соединения по настоящему раскрытию на килограмм веса тела; и пациентом является животное; более предпочтительно млекопитающее и наиболее предпочтительно человек. Диапазоны доз можно легко определить с помощью способов, известных среднему специалисту в данной области.
Подходящие диапазоны доз для внутривенного (i.v.) введения пациенту, нуждающемуся в этом, составляют от приблизительно 0,001 мг до приблизительно 100 мг на килограмм веса тела; более предпочтительно от приблизительно 0,01 мг до приблизительно 20 мг соединения по настоящему раскрытию на килограмм веса тела; и пациентом является животное; более предпочтительно млекопитающее и наиболее предпочтительно человек. Подходящие диапазоны доз для интраназального введения пациенту, нуждающемуся в этом, обычно составляют от приблизительно 0,001 мг/кг веса тела до приблизительно 10 мг/кг веса тела; более предпочтительно от приблизительно 0,01 мг до приблизительно 1 мг соединения по настоящему раскрытию на килограмм веса тела; и пациентом является животное; более предпочтительно млекопитающее и наиболее предпочтительно человек. Суппозитории обычно содержат от приблизительно 0,01 миллиграмма до приблизительно 50 миллиграммов соединения по настоящему раскрытию на килограмм веса тела и содержат активный ингредиент в диапазоне от приблизительно 0,5% до приблизительно 10% по весу. Рекомендованные дозы для внутрикожного, внутримышечного, внутрибрюшинного, подкожного, эпидурального, подъязычного или внутримозгового введения пациенту, нуждающемуся в этом, находятся в диапазоне от приблизительно 0,001 мг до приблизительно 200 мг на килограмм веса тела; и пациентом является животное; более предпочтительно млекопитающее и наиболее предпочтительно человек. Эффективные дозы можно экстраполировать из кривых зависимости эффекта от дозы, полученных в тестовых системах in vitro или в животных моделях. Такие животные модели и системы хорошо известны в данной области техники.
Соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства предпочтительно анализируют in vitro и in vivo в отношении желаемой терапевтической или профилактической активности перед применением у людей. Например, анализы in vitro можно применять для определения того, является ли введение конкретного соединения по настоящему раскрытию или комбинации соединений предпочтительным для индуцирования апоптоза или передачи сигналов в клетках, которые сверхэкспрессируют белки Bcl-2 или протеинкиназы. Соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства могут также демонстрировать эффективность и безопасность при использовании модельных систем на животных.
Терапевтически эффективная доза соединений по настоящему раскрытию или их солей, сольватов, сложных эфиров и/или пролекарств предпочтительно будет обеспечивать терапевтическую выгоду, не вызывая значительной токсичности. Токсичность соединений по настоящему раскрытию или их солей, сольватов, сложных эфиров и/или пролекарств может быть определена с использованием стандартных фармацевтических процедур и может быть легко установлена специалистом в данной области. Соотношение доз между токсичным и терапевтическим эффектом является терапевтическим индексом. Соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства обычно демонстрируют особенно высокие терапевтические индексы при лечении ассоциированных с апоптозом заболеваний и нарушений. Доза соединений по настоящему раскрытию или их солей, сольватов, сложных эфиров и/или пролекарств предпочтительно будет находиться в диапазоне концентраций в кровотоке, который включает эффективную дозу с небольшой или отсутствующей токсичностью.
5.8 КОМБИНИРОВАННАЯ ТЕРАПИЯ
В определенных вариантах осуществления настоящего раскрытия соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства можно применять в комбинированной терапии по меньшей мере с одним дополнительным активным или терапевтическим средством. Соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства и по меньшей мере одно дополнительное активное или терапевтическое средство могут действовать аддитивно или, более предпочтительно, синергично. В некоторых вариантах осуществления соединения по настоящему раскрытию или их соли, сольваты, сложные эфиры и/или пролекарства вводят одновременно, последовательно или раздельно с введением другого терапевтического средства. Иллюстративные активные или химиотерапевтические средства включают без ограничения ацеглатон, акларубицин, алтретамин, аминоглутетимид; 5-аминолевулиновую кислоту, амсакрин, анастрозол, гидрохлорид анцитабина, антитело к 17-1а, антилимфоцитарные иммуноглобулины, антинеопластон а10, аспарагиназу, пэгаспаргазу, азацитидин, азатиоприн, батимастат, производное бензопорфирина, бикалутамид, гидрохлорид бисантрена, сульфат блеомицина, бреквинар натрия, броксуридин, бусульфан, кампат-1H, карацемид, карбетимер, карбоплатин, карбоквон, кармофур, кармустин, хлорамбуцил, хлорозотоцин, хромомицин, цисплатин, кладрибин, Corynebacterium parvum, циклофосфамид, циклоспорин, цитарабин, дакарбазин, дактиномицин, гидрохлорид даунорубицина, децитабин, диазиквон, дихлордиэтилсульфид, дидемнин В, доцетаксел, доксифлуридин, гидрохлорид доксорубицина, дролоксифен, эхиномицин, эдатрексат, эллиптиний, элмустин, энлоплатин, эноцитабин, гидрохлорид эпирубицина, эрлотиниб, натриевую соль фосфата эстрамустина, этанидазол, этоглюцид, этопозид, гидрохлорид фадрозола, фазарабин, фентретинид, флоксуридин, фосфат флударабина, фторурацил, флутамид, форместан, фотемустин, нитрат галлия, гемцитабин, гусперимус, гомогаррингтонин, гидроксимочевину, гидрохлорид идарубицина, ифосфамид, илмофозин, тозилат импросульфана, инолимомаб, интерлейкин-2; иринотекан, JM-216, летрозол, гамоленат лития, лобаплатин, ломустин, лонидамин, мафосфамид, мелфалан, меногарил, меркаптопурин, метотрексат, метотрексат натрия, мибоплатин, милтефозин, мисонидазол, митобронитол, дигидрохлорид митогуазона, митолактол, митомицин, митотан, гидрохлорид митозанетрона, мизорибин, мопидамол, муитлаихилпептид, муромонаб-CD3, гидрохлорид мустина, микофеноловую кислоту, мофетил микофенолата, недаплатин, нилутамид, гидрохлорид нимустина, оксалиплатин, паклитаксел, PCNU, пеностатин, сульфат пепломицина, пипоброман, пирарубицин, изетионат пиритрексима, гидрохлорид пироксантрона, пликамицин, порфимер натрия, преднимустин, гидрохлорид прокарбазина, ралтитрексед, ранимустин, разоксан, роглетимид, роквинимекс, себриплатин, семустин, сиролимус, сизофиран, собузоксан, бромебрат натрия, сорафениб, спарфозовую кислоту, спарфозат натрия, стрептозоцин, сулофенур, такролимус, тамоксифен, тегафур, гидрохлорид телоксантрона, темозоломид, тенипозид, тестолактон, тетранатрий-мезотетрафенилпорфинсульфонат, тиогуанин, тиоинозин, тиотепу, топотекан, торемифен, треосульфан, триметрексат, трофосфамид, фактор некроза опухоли, убенимекс, урамустин, сульфат винбластина, сульфат винкристина, сульфат виндезина, винорелбина тартрат, ворозол, зиностатин, золимомаб-аритокс и гидрохлорид зорубицина и т.п., отдельно либо в любой комбинации, ингибитор протеинкиназы А (PKA), ингибитор передачи сигналов с помощью цАМФ, ингибитор протеинкиназы PKC (эпсилон, или альфа, или бета), ингибитор Bcl-2 (Bcl-2, или MCL-1, или Bcl-xL), нестероидные противовоспалительные лекарственные средства, ингибитор синтеза простагландинов, местный анестетик, противосудорожное средство, антидепрессант, агонист опиоидных рецепторов и нейролептическое средство, бензодиазепин, барбитурат, нейростероид и ингаляционный анестетик, анестетик и другое болеутоляющее средство.
Вышеизложенное подробное описание было приведено только для ясности понимания, и на основании этого не должны подразумеваться никакие ненужные ограничения, поскольку модификации будут очевидны специалистам в данной области: Это не является признанием того, что любая информация, представленная в данном документе, является частью предшествующего уровня техники или относится к заявленным к настоящему времени раскрытиям, или что любая прямо или косвенно упоминаемая публикация является частью предшествующего уровня техники.
В данном документе описаны варианты осуществления настоящего раскрытия, в том числе наилучший способ, известный авторам настоящего изобретения, для осуществления настоящего раскрытия. Вариации таких предпочтительных вариантов осуществления могут стать очевидными для средних специалистов в данной области при прочтении вышеизложенного описания. Авторы настоящего изобретения ожидают, что специалисты в данной области будут использовать такие вариации при необходимости, и авторы настоящего изобретения предусматривают, что настоящее раскрытие будет осуществлено на практике иным образом, нежели конкретно описано в данном документе. Соответственно, настоящее раскрытие включает все модификации и эквиваленты объекта изобретения, приведенного в формуле изобретения, прилагаемой к данному документу, в рамках применимого законодательства. Более того, любая комбинация описанных выше элементов во всех их возможных вариациях охвачена настоящим раскрытием, если в данном документе не указано иное или иное явно не вытекает из контекста.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
Все ссылки, статьи, публикации, патенты, публикации патентов и заявки на патент, приведенные в данном документе, включены во всей своей полноте посредством ссылки для любых целей.
Однако упоминание любой ссылки, статьи, публикации, патента, публикации патента и заявки на патент, цитируемых в данном документе, не рассматривается и не должно рассматриваться в качестве признания или любой формы предположения, что они составляют действительный предшествующий уровень техники или образуют часть общедоступных известных сведений в любой стране мира.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ ИНГИБИТОРОВ ТИРОЗИНКИНАЗНЫХ РЕЦЕПТОРОВ БЕЛКОВ | 2009 |
|
RU2586212C2 |
| СОЕДИНЕНИЯ ПИРАЗИНО[1,2-а]ИНДОЛА, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В ЛЕКАРСТВЕННЫХ СРЕДСТВАХ | 2014 |
|
RU2660417C2 |
| СПОСОБЫ И КОМПОЗИЦИИ С ПРИМЕНЕНИЕМ ИММУНОМОДУЛИРУЮЩИХ СОЕДИНЕНИЙ ПРИ КОМБИНИРОВАННОМ ЛЕЧЕНИИ | 2007 |
|
RU2426542C2 |
| ЗАМЕЩЕННОЕ АРОМАТИЧЕСКОЕ ПРОИЗВОДНОЕ С КОНДЕНСИРОВАННЫМИ КОЛЬЦАМИ И КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ЕГО, И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2811484C1 |
| ПРИМЕНЕНИЕ ИНГИБИТОРА IBAT ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ЗАПОРА | 2008 |
|
RU2482850C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ И СОСТОЯНИЙ | 2015 |
|
RU2713886C2 |
| 1,5-БЕНЗОТИАЗЕПИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТИГИПЕРЛИПИДЕМИЧЕСКИХ СРЕДСТВ | 2001 |
|
RU2302414C2 |
| ПРИМЕНЕНИЕ ИНГИБИТОРА IBAT ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ЗАПОРА | 2004 |
|
RU2342928C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ КАК ИНГИБИТОРЫ TRK | 2019 |
|
RU2803817C2 |
| КЛАСС КОНДЕНСИРОВАННЫХ КОЛЬЦЕВЫХ СОЕДИНЕНИЙ И ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2021 |
|
RU2831125C1 |
Изобретение относится к соединениям, имеющим структурную формулу (I):
 ,
,
или его соль, или сольват; где А1 и А2 независимо представляют собой кислород; R1 выбран из группы, включающей водород, NH2; R2 выбран из группы, включающей: 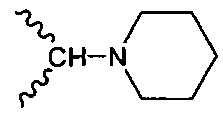 ,
, 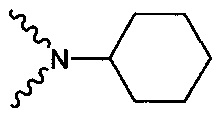 ,
,
R3, R5, R6 и R9 независимо представляют собой R7; R4 выбран из группы, включающей С1-4галогеналкил, -(CHR)nC(OH)(CF3)2, -C(O)OR11, -SO2NHC(=O)CH3, -SO2NH2,
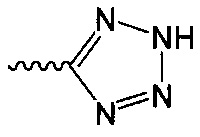 ,
, 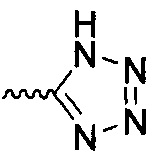 ,
, 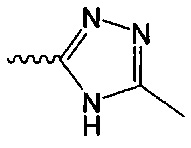 ;
;
R7 представляет собой водород; R11 независимо выбран из группы, включающей водород, С1-2алкил или (CH2)2N(CH3)2; и n равно 0;
соединениям, имеющим структурную формулу (II):
 ,
,
где X представляет собой N или СН; R4 выбран из группы, включающей -C(O)OR11, -C(CF3)(CF3)OH, -(CHR)nC(OH)(CF3)2,  ,
,  ,
, 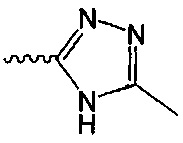 ;
;
R11 выбран из группы, включающей водород, С1-2алкил или (CH2)2N(CH3)2; и n равно 0; фармацевтическим композициям, содержащим их и к применению таких соединений в лечении и/или предупреждении определенных типов рака, боли, воспаления, рестеноза, атеросклероза, псориаза, тромбоза, болезни Альцгеймера, или дисфункции, связанных с дисмиелинизацией или демиелинизацией. 7 н. и 13 з.п. ф-лы, 4 табл.
1. Соединение, имеющее структурную формулу (I):
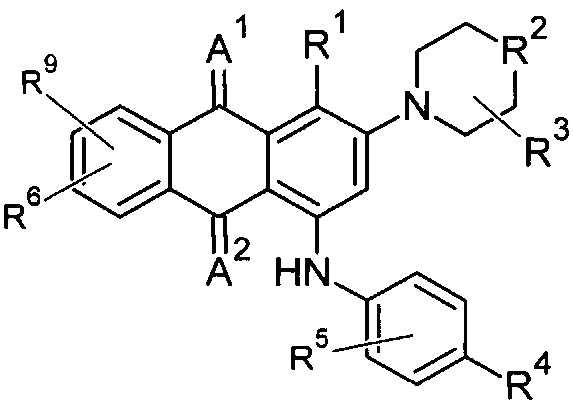 ,
,
или его соль, или сольват;
где:
А1 и А2 независимо представляют собой кислород;
R1 выбран из группы, включающей водород, NH2;
R2 выбран из группы, включающей:
 ,
,  ,
,
R3, R5, R6 и R9 независимо представляют собой R7;
R4 выбран из группы, включающей С1-4галогеналкил, -(CHR)nC(OH)(CF3)2, -C(O)OR11, -SO2NHC(=O)CH3, -SO2NH2,
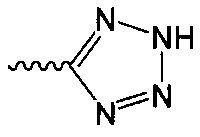 ,
, 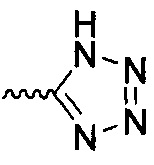 ,
, 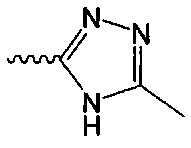 ;
;
R7 представляет собой водород;
R11 независимо выбран из группы, включающей водород, С1-2алкил или (CH2)2N(CH3)2;
и
n равно 0.
2. Соединение по п. 1, выбранное из группы, включающей:
4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензолсульфонамид;
4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензойную кислоту;
N-[(4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}фенил)сульфонил]ацетамид;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(2Н-тетразол-5-ил)фенил]амино}антрацен-9,10-дион;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(1Н-тетразол-5-ил)фенил]амино}антрацен-9,10-дион;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)фенил]амино}антрацен-9,10-дион;
метил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат;
2-(диметиламино)этил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат;
этил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат;
4-{[4-амино-3-(1,4'-бипиперидин-1'-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензолсульфонамид;
4-{[4-амино-3-(1,4'-бипиперидин-1'-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензойную кислоту;
N-[(4-{[4-амино-3-(1,4'-бипиперидин-1'-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}фенил)сульфонил]ацетамид;
1-амино-2-(1,4'-бипиперидин-1'-ил)-4-{[4-(2Н-тетразол-5-ил)фенил]амино}антрацен-9,10-дион;
2-(диметиламино)этил-4-{[4-амино-3-(1,4'-бипиперидин-1'-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат и
1-амино-2-(1,4'-бипиперидин-1'-ил)-4-{[4-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)фенил]амино}антрацен-9,10-дион,
или его соль, или сольват.
3. Соединение по п. 1, представляющее собой
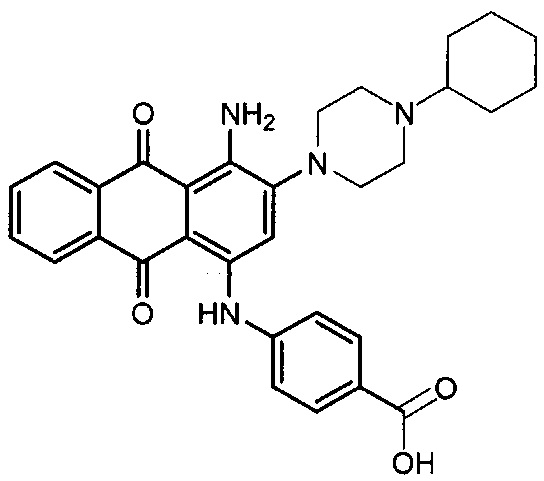 .
.
4. Соединение, имеющее структурную формулу (II):
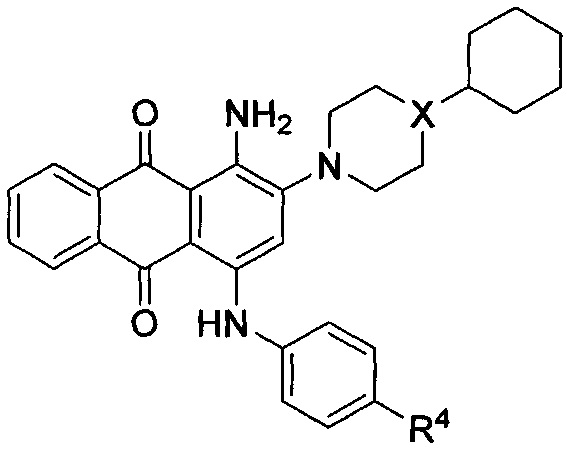 ,
,
или его соль, или сольват;
где:
X представляет собой N или СН;
R4 выбран из группы, включающей -C(O)OR11, -C(CF3)(CF3)OH, -(CHR)nC(OH)(CF3)2, 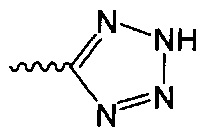 ,
, 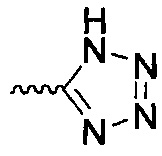 ,
, 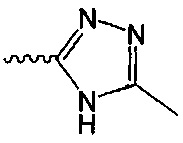 ;
;
R11 выбран из группы, включающей водород, С1-2алкил или (CH2)2N(CH3)2; и
n равно 0.
5. Соединение по п. 4, выбранное из группы, включающей:
4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензолсульфонамид;
4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензойную кислоту;
N-[(4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}фенил)сульфонил]ацетамид;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(2Н-тетразол-5-ил)фенил]амино}антрацен-9,10-дион;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(1Н-тетразол-5-ил)фенил]амино}антрацен-9,10-дион;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)фенил]амино}антрацен-9,10-дион;
метил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат;
2-(диметиламино)этил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат и
этил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат;
или его соль, или сольват.
6. Фармацевтическая композиция для лечения или предупреждения заболеваний, ассоциированных с ингибированием TrkA, содержащая:
a) терапевтически эффективное количество соединения по п. 1, или его соли, или сольвата и
b) фармацевтически приемлемые индифферентное вещество или носитель.
7. Фармацевтическая композиция по п. 6, где соединение выбрано из группы, включающей:
4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензолсульфонамид;
4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензойную кислоту;
N-[(4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}фенил)сульфонил]ацетамид;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(2Н-тетразол-5-ил)фенил]амино}антрацен-9,10-дион;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(1Н-тетразол-5-ил)фенил]амино}антрацен-9,10-дион;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)фенил]амино}антрацен-9,10-дион;
метил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат;
2-(диметиламино)этил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат;
этил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат;
4-{[4-амино-3-(1,4'-бипиперидин-1'-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензолсульфонамид;
4-{[4-амино-3-(1,4'-бипиперидин-1'-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензойную кислоту;
N-[(4-{[4-амино-3-(1,4'-бипиперидин-1'-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}фенил)сульфонил]ацетамид;
1-амино-2-(1,4'-бипиперидин-1'-ил)-4-{[4-(2Н-тетразол-5-ил)фенил]амино}антрацен-9,10-дион;
2-(диметиламино)этил-4-{[4-амино-3-(1,4'-бипиперидин-1'-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат и
1-амино-2-(1,4'-бипиперидин-1'-ил)-4-{[4-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)фенил]амино}антрацен-9,10-дион,
или их соль, или сольват.
8. Фармацевтическая композиция по п. 6, где соединение представляет собой
 .
.
9. Фармацевтическая композиция по п. 6, где указанная фармацевтическая композиция составлена в единичную лекарственную форму, выбранную из группы, включающей единичную лекарственную форму для перорального введения, инъекционную единичную лекарственную форму, единичную лекарственную форму в виде трансдермального пластыря или единичную лекарственную форму в виде имплантируемого депо-состава.
10. Фармацевтическая композиция для лечения или предупреждения заболеваний, ассоциированных с ингибированием TrkA, содержащая:
a) терапевтически эффективное количество соединения по п. 4, или его соли, или сольвата и
b) фармацевтически приемлемые индифферентное вещество или носитель.
11. Фармацевтическая композиция по п. 10, где соединение выбрано из группы, включающей:
4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензолсульфонамид;
4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензойную кислоту;
N-[(4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}фенил)сульфонил]ацетамид;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(2Н-тетразол-5-ил)фенил]амино}антрацен-9,10-дион;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(1Н-тетразол-5-ил)фенил]амино}антрацен-9,10-дион;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)фенил]амино}антрацен-9,10-дион;
метил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат;
2-(диметиламино)этил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат и
этил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат,
или их соль, или сольват.
12. Фармацевтическая композиция по п. 10, где указанная фармацевтическая композиция составлена в единичную лекарственную форму, выбранную из группы, включающей единичную лекарственную форму для перорального введения, инъекционную единичную лекарственную форму, единичную лекарственную форму в виде трансдермального пластыря или единичную лекарственную форму в виде имплантируемого депо-состава.
13. Фармацевтическая композиция по п. 12, где соединение представляет собой
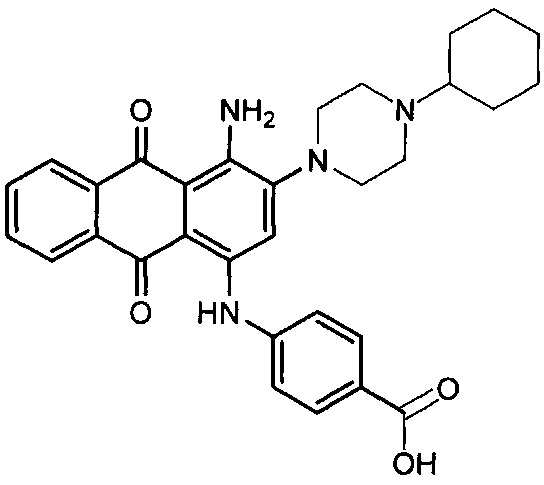 .
.
14. Способ облегчения боли у пациента, страдающего от нее, включающий:
а) введение пациенту терапевтически эффективного количества соединения по п. 1, или его фармацевтически приемлемой соли, или сольвата,
где боль выбрана из группы, включающей острую боль, хроническую боль, воспалительную боль, нейропатическую боль, тоническую боль, постоянную боль, послеоперационную боль, боль при остеоартрите, диабетическую нейропатическую боль, боль, вызванную воздействием химических веществ, боль, вызванную химиотерапией, раковую боль, боль, вызванную приемом лекарственных средств, боль в костях, боль, ассоциированную с гипералгезией, вызванной употреблением алкоголя, генерализованное болевое расстройство и их комбинации.
15. Способ по п. 14, где вводимое соединение выбрано из группы, включающей:
4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензолсульфонамид;
4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензойную кислоту;
N-[(4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}фенил)сульфонил]ацетамид;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(2Н-тетразол-5-ил)фенил]амино}антрацен-9,10-дион;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(1Н-тетразол-5-ил)фенил]амино}антрацен-9,10-дион;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)фенил]амино}антрацен-9,10-дион;
метил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат;
2-(диметиламино)этил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат;
этил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат;
4-{[4-амино-3-(1,4'-бипиперидин-1'-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензолсульфонамид;
4-{[4-амино-3-(1,4'-бипиперидин-1'-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензойную кислоту;
N-[(4-{[4-амино-3-(1,4'-бипиперидин-1'-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}фенил)сульфонил]ацетамид;
1-амино-2-(1,4'-бипиперидин-1'-ил)-4-{[4-(2Н-тетразол-5-ил)фенил]амино}антрацен-9,10-дион;
2-(диметиламино)этил-4-{[4-амино-3-(1,4'-бипиперидин-1'-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат и
1-амино-2-(1,4'-бипиперидин-1'-ил)-4-{[4-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)фенил]амино}антрацен-9,10-дион,
или их соль, или сольват.
16. Способ по п. 14, где вводимое соединение представляет собой
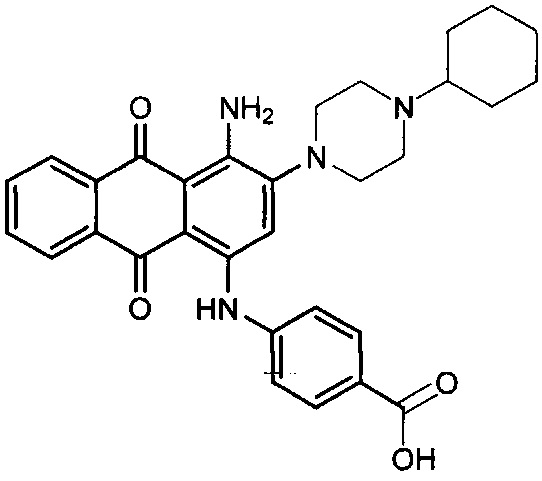 .
.
17. Способ облегчения острой или хронической боли у пациента, страдающего от нее, включающий:
а) введение пациенту терапевтически эффективного количества соединения по п. 4, или его фармацевтически приемлемой соли, или сольвата.
18. Способ по п. 17, где вводимое соединение выбрано из группы, включающей:
4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензолсульфонамид;
4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензойную кислоту;
N-[(4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}фенил)сульфонил]ацетамид;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(2Н-тетразол-5-ил)фенил]амино}антрацен-9,10-дион;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(1Н-тетразол-5-ил)фенил]амино}антрацен-9,10-дион;
1-амино-2-(4-циклогексилпиперазин-1-ил)-4-{[4-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)фенил]амино}антрацен-9,10-дион;
метил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат;
2-(диметиламино)этил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат и
этил-4-{[4-амино-3-(4-циклогексилпиперазин-1-ил)-9,10-диоксо-9,10-дигидроантрацен-1-ил]амино}бензоат,
или их соль, или сольват.
19. Способ по п. 17, где вводимое соединение представляет собой
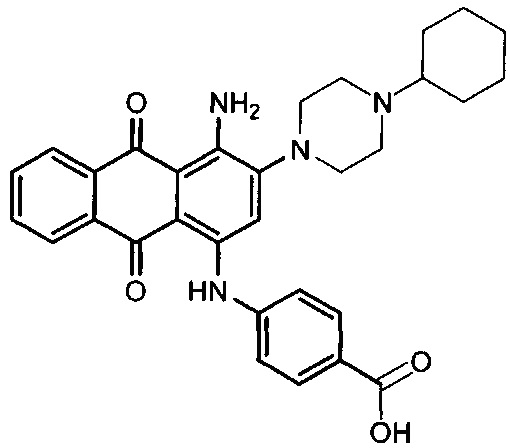 .
.
20. Синергический способ снижения темпов роста опухоли при раке поджелудочной железы у пациента, страдающего от него, включающий:
а) введение пациенту терапевтически эффективного количества гемцитабина и b) введение пациенту терапевтически эффективного количества соединения, имеющего следующую структуру:
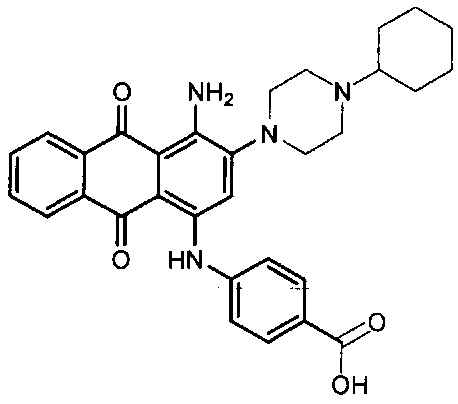 ,
,
или его фармацевтически приемлемой соли, или сольвата,
где комбинация гемцитабина и вышеупомянутого соединения проявляет синергический эффект в отношении уменьшения опухоли.
| Younis Baqi et all | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Med | |||
| Chem | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ИХ ПРОИЗВОДНЫЕ, ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ КАК УСИЛИТЕЛИ И МЕТОД ЛЕЧЕНИЯ НАРУШЕНИЯ МЫСЛИТЕЛЬНОЙ ДЕЯТЕЛЬНОСТИ | 1994 |
|
RU2152944C1 |
Авторы
Даты
2018-06-28—Публикация
2015-02-05—Подача