Область техники, к которой относится изобретение
Данное изобретение относится к пептидам, которые можно использовать для прогнозирования, диагностики или лечения сердечно-сосудистых заболеваний.
Уровень техники
Среди липопротеинов высокой плотности (HDL), концентрация которых в крови, как известно, находится в отрицательной корреляции с риском сердечно-сосудистой патологии, наиболее многочисленным белком, на долю которого приходится 70% HDL, является аполипопротеин A-I (ApoA-I). Аполипопротеин A-I в составе HDL играет ключевую роль в поддержании гомеостаза холестерина, участвуя в регуляции обратного транспорта холестерина и доставки его в печень (Yancey et аl., 2003, Arterioscler. Thromb. Vasc. Biol. 23:712-719). Аполипопротеин A-I в составе HDL также обладает противовоспалительными и антиоксидантными свойствами.
Обнаружено, что при аутоиммунном заболевании, называемом системной красной волчанкой (SLE), с которым ассоциирован высокий риск ишемической болезни сердца, имеет место высокий уровень аутоантител против аполипопротеина Α-I - имуноглобулинов класса G (анти-ApoA-I IgG) (Dinu et al., 1998, Lupus 7:355-360,). Аутоантитела класса IgG против аполипопротеина A-I присутствуют у лиц других групп с высоким риском сердечно-сосудистой патологии, включая пациентов, перенесших инфаркт миокарда (Vuilleumier et al., 2010а, Eur. Heart J. 31:815-823), больных ревматоидным артритом (Vuilleumier et al., 2010b, Arthritis Rheum. 62:2640-2650,), пациентов с острой болью в груди (Keller et al., 2012, J. Intern. Med. 271:451-462) и с тяжелым стенозом сонной артерии (Montecucco et al., 2011, Eur. Heart J. 32:412-421). В случаях инфаркта миокарда и ревматоидного артрита также показано, что аутоантитела класса IgG против аполипопротеина A-I IgG ассоциированы с повышенным риском ишемической болезни сердца в группах с высоким риском сердечно-сосудистой патологии (Vuilleumier et al., 2010a,b см. выше; Keller et al., 2012, см. выше), а у больных с тяжелым стенозом сонной артерии эти антитела ассоциированы с повышенной подверженностью образованию атеросклеротических бляшек (Montecucco et al., 2011, Eur. Heart J. 32:412-421). Наконец, в недавно проведенном прямом сравнительном исследовании было показано, что аутоантитела класса IgG против аполипопротеина A-I являются наилучшим гуморальным аутоиммунным маркером для прогнозирования ишемической болезни сердца после инфаркта миокарда (Vuilleumier, 2011, J. Clinic. Experiment. Cardiology. 2:69), и единственным биологическим маркером, позволяющим делать поэтапное прогнозирование в отношении традиционных факторов риска сердечнососудистой патологии для выделения групп риска ишемической болезни сердца у больных ревматоидным артритом (Finckh et al., 2012, Arthritis Care Res (Hoboken) 64:817-825).
С патофизиологической точки зрения аутоантитела IgG против аполипопротеина Α-I являются, как было показано в экспериментах на мышах с дефицитом аполипопротеина Е, потенциальными посредниками в процессе атерогенеза и связанных с ним осложнений, увеличивая размеры атеросклеротических повреждений и подверженность им (Montecucco et al., 2011, см. выше). Хотя эти способствующие атерогенезу эффекты не вполне понятны, имеются данные, свидетельствующие об их синергизме на нескольких различных уровнях. Установлено, что аутоантитела IgG против аполипопротеина A-I (i) ослабляют защитное для сосудов действие липопротеинов высокой плотности (Batuca et al., 2009, Rheumatology (Oxford) 48:26-31,), (ii) способствуют стерильному воспалению с участием комплекса Toll-подобных рецепторов-2/CD4 (Pagano et al., 2012, J Intern Med. 1365-2796,), (iii) действуют как проаритмогенные факторы, участвуя в активации кальциевых каналов L-типа рецепторами минералокортикоидов в направлении от первичного сигнала к внутриклеточной мишени (Rossier et al., 2012, Endocrinology 153:1269-1278), и (iv) способствуют хемотаксису нейтрофилов (Montecucco et al., 2011, см. выше)
Разработаны методы прогнозирования/диагностирования сердечно-сосудистых расстройств, основанные на определении присутствия аутоантител против аполипопротеина Α-I у пациента. Однако эти методы, как правило, предполагают иммунологическую реакцию между указанными антителами и цельным (то есть всей длины полипептидной цепи) аполипопротеином Α-I (Dinu et al., 1998, см. выше; Vuilleumier et al., 2010a, см. выше; Keller et al., 2012, см. выше, Montecucco et al., 2011, см. выше; Batuca et al., 2009, см. выше). Основные ограничения использования в таком иммунологическом анализе цельного аполипопротеина Α-I связаны с дороговизной получения цельного белка в большом количестве и с его нестабильностью, что нивелирует эффективность анализа. С целью решения этой проблемы данным изобретением предлагается новый диагностический способ иммунологического анализа, основанный на использовании пептидов, которые дешевле получать, которые более стабильны, чем цельный белок, и которые специфично связываются с аутоантителами против аполипопротеина Α-I, присутствующими у индивидов с сердечно-сосудистыми заболеваниями. Способы по данному изобретению полезны, в частности, для индивидуального выбора адекватного лечения, отвечающего потребностям конкретного больного, а также для проведения мероприятий с целью предотвращать развитие сердечно-сосудистых расстройств, не допускать первичные и рецидивные сердечнососудистые инциденты в группах населения с повышенным риском сердечно-сосудистой патологии.
Раскрытие изобретения
В первом аспекте данного изобретения его целью являются пептиды, имитирующие эпитоп аполипопротеина Α-I (пептидомиметики), в которых имеются:
(a) аминокислотная последовательность длиной 15-80 аминокислотных остатков,
(b) аминокислотная последовательность, содержащая какую-либо из последовательностей:
(i) SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24; или их вариантов, или
(ii) аминокислотную последовательность, идентичную какой-либо из последовательностей, перечисленных в пункте (i), за тем исключением, что 1, 2, 3, 4, 5 или 6 аминокислотных остатков указанной последовательности из пункта (i) заменены, делетированы, вставлены и/или химически модифицированы, причем это не ликвидирует способности указанного пептидомиметика специфично связываться с антителами против аполипопротеина Α-I, или
(iii) какую-либо комбинацию двух аминокислотных последовательностей из пункта (i) и/или (ii); и
(c) внутримолекулярные поперечные сшивки между по меньшей мере двумя не смежными аминокислотными остатками аминокислотной последовательности по пункту b);
причем указанный пептидомиметик способен специфично связываться с антителами против аполипопротеина A-I.
Во втором аспекте данного изобретения его целью являются пептиды, имитирующие эпитоп (пептидомиметики) аполипопротеина Α-I, в которых имеются:
(a) аминокислотная последовательность длиной 15-80 аминокислотных остатков,
(b) аминокислотная последовательность, содержащая какую-либо из последовательностей:
(i) SEQ ID NO: 5, SEQ ID NO: 21, SEQ ID NO: 23; или их вариантов, или
(ii) SEQ ID NO: 8, SEQ ID NO: 9 или SEQ ID NO: 25; или их вариантов, или
(iii) аминокислотную последовательность, идентичную какой-либо из последовательностей, перечисленных в пункте (i) и/или (ii), за тем исключением, что 1, 2, 3, 4, 5 или 6 аминокислотных остатков указанной последовательности из пункта (iii) заменены, делегированы, вставлены и/или химически модифицированы, причем это не ликвидирует способности указанного пептидомиметика специфично связываться с антителами против аполипопротеина Α-I, или
(iii) какую-либо комбинацию двух аминокислотных последовательностей из пункта (i), (ii) и/или (iii);
причем указанный пептидомиметик способен специфически связываться с антителами против аполипопротеина A-I.
В третьем своем аспекте данное изобретение касается изолированного полинуклеотида, кодирующего указанный пептидомиметик, рекомбинантного вектора, содержащего указанный полинуклеотид, клеток-хозяев, несущих указанный рекомбинангаый вектор, а также способа получения указанного пептидомиметика, включающего этапы культивирования указанных клеток-хозяев в культуральной среде и выделения указанного пептида из этой культуральной среды или из лизата клеток-хозяев после их лизиса, и при необходимости создание поперечных сшивок между двумя не смежными аминокислотными остатками этого пептида посредством дисульфидного мостика, лактамного мостика или углеводородной сшивки.
В четвертом своем аспекте данное изобретение относится к диагностическим композициям, препаратам или планшетам для иммунологического анализа, содержащим по меньшей мере один пептидомиметик по данному изобретению.
В пятом аспекте данного изобретения предлагается фармацевтическая композиция, содержащая по меньшей мере один пептидомиметик по данному изобретению.
В шестом своем аспекте данное изобретение касается набора для выявления антител против аполипопротеина Α-I, играющих роль биологического маркера сердечнососудистого заболевания в образцах биологических жидкостей; указанный набор включает по меньшей мере один петидомиметик по данному изобретению или комбинацию таких пептидов.
В седьмом своем аспекте данное изобретение относится к способу выявления эндогенных антител против аполипопротеина Α-I в образцах биологических жидкостей млекопитающих, включающему следующие этапы:
(а) забор образца биологической жидкости у млекопитающего;
(b) обеспечение контактирования указанного образца биологической жидкости с твердой подложкой, несущей по меньшей мере один связанный пептидомиметик по данному изобретению, причем это контактирование осуществляется в условиях, достаточных для связывания антител против аполипопротеина Α-I, присутствующих в указанном образце биологической жидкости, с по меньшей мере одним указанным пептидомиметиком по типу взаимодействия антиген-антитело;
(c) удаление не связанных антител с поверхности указанной твердой подложки;
(d) выявление присутствия комплексов антиген-антитело, связанных с указанной твердой подложкой;
при этом присутствие указанных комплексов свидетельствует о том, что данный образец биологической жидкости содержит эндогенные антитела против аполипопротеина A-I.
В восьмом своем аспекте данное изобретение касается способа выявления сердечно-сосудистых заболеваний или определения их профиля риска по образцам биологических жидкостей млекопитающих, включающего следующие этапы:
(a) забор образца биологической жидкости у млекопитающего;
(b) обеспечение контактирования указанного образца биологической жидкости с твердой подложкой, несущей по меньшей мере один связанный пептидомиметик по данному изобретению, причем это контактирование осуществляется в условиях, достаточных для связывания антител против аполипопротеина Α-I, присутствующих в указанном образце биологической жидкости, с по меньшей мере одним указанным пептидомиметиком по типу взаимодействия антиген-антитело;
(c) удаление не связанных антител с поверхности указанной твердой подложки;
(d) выявление присутствия комплексов антиген-антитело, связанных с указанной твердой подложкой;
при этом присутствие указанных комплексов свидетельствует о том, что данный образец биологической жидкости содержит одно или более аутоантител против аполипопротеина Α-I, ассоциированных с сердечно-сосудистым заболеванием.
В девятом своем аспекте данное изобретение относится к способу предотвращения и/или лечения сердечно-сосудистого заболевания у нуждающегося в том индивида, включающему введение указанному индивиду указанного пептидомиметика, содержащей его фармацевтической композиции или аналога указанного пептидомиметика по пространственной структуре.
В десятом своем аспекте данное изобретение касается способа предотвращения и/или лечения сердечно-сосудистого заболевания у индивида, страдающего от острой боли в груди, острого коронарного синдрома, ревматоидного артрита, системной красной волчанки, тяжелого стеноза сонной артерии, терминальной стадии почечной недостаточности или периодонтита, причем этот способ включает следующие этапы:
(a) выявление эндогенных антител против аполипопротеина Α-I в образце биологической жидкости млекопитающего способом по данному изобретению; и
(b) введение пациенту по меньшей мере одного агента, выбираемого из: (i) пептидомиметика по данному изобретению или содержащей его фармацевтической композиции, (ii) структурного аналога указанного пептидомиметика по любому из пунктов 1-5 формулы изобретения, (iii) фармацевтической композиции, содержащей аполипопротеин Α-I, и (iv) агента, подходящего для предотвращения и/или лечения сердечно-сосудистого заболевания.
Другие признаки и преимущества данного изобретения явствуют из приведенного ниже описания осуществления изобретения.
Описание фигур
Фиг. 1. Химическая реакция для создания дисульфидного мостика в молекуле пептида по данному изобретению в растворе (А), углеводородной сшивки в молекуле пептида по данному изобретению при твердофазном пептидном синтезе по Fmoc-стратегии (В) или лактамного мостика в молекуле пептида по данному изобретению на твердой фазе (С). DMSO - диметилсульфоксид; РуВОР - бензотриазол-1-ил-окситрипирроллидинофосфонийгексафторфосфат; DIEA - Ν,Ν-диизопропилэтиламин; аллильная группа описывается структурной формулой Н2С=СН-СН2-; alloc - аллилоксикарбонильная группа. Буквы m, k и l возле скобок относятся к положениям аминокислотных остатков в последовательности пептида.
Фиг. 2. Развернутые химические формулы примеров поперечных сшивок в молекулах пептидов по данному изобретению: дисульфидный мостик (А), углеводородная сшивка (В), лактамный мостик (С). В формуле (А): k равно 3 или 6, R представляет боковую цепь аминокислоты; в формуле (В): для поперечной сшивки между аминокислотными остатками в положениях n и n+4 k=3, n=1, *=(S)-2-(4'-пентенил)-аланин; для поперечной сшивки между аминокислотными остатками в положениях n и n+7 k=6, n=4, *=(R)-2-(7'-октенил)-аланин); R представляет боковую цепь аминокислоты; в формуле (С): если X=-CO-NH-, то n=2, p=4, k=3; если Χ=-NH-CO-, то n=4, p=2, k=3; R представляет боковую цепь аминокислоты. Буквы m, k и l возле скобок относятся к положениям аминокислотных остатков в последовательности пептида.
Фиг. 3. Данные спектроскопии кругового дихроизма для пептидомиметиков F3L1 и F3S2A (F3S2A=F3S2) (A), F3S1B и F4S2B (В), F3L1 и F4L1 (С) показывают большее содержание альфа-спиральных участков по сравнению с контрольным пептидом F3, в котором нет поперечных сшивок..
Фиг. 4. Данные конкурентного твердофазного иммуноферментного анализа (ELISA) показывают, что пептидомиметик F3L1 эффективно конкурирует с интактным аполипопротеином Α-I за связывание с антителами против аполипопротеина Α-I. Образцы сыворотки крови, взятые у индивидов, у которых было установлено наличие антител против аполипопротеина Α-I, преинкубировали с пептидомиметиком F3L1 в указанных концентрациях, а затем наносили на планшеты для ELISA, покрытые интактным аполипопротеином Α-I, и проводили последующие этапы анализа согласно стандартному протоколу (А). Для сравнения такой же опыт выполняли с аполипопротеином Α-I в качестве конкурента (В).
Фиг. 5. Данные конкурентного твердофазного иммуноферментного анализа (ELISA) показывают, что пептидомиметик F3L1 эффективно конкурирует с интактным аполипопротеином Α-I за связывание с антителами против аполипопротеина A-I.. Образцы сыворотки крови, взятые у трех индивидов, у которых было установлено наличие антител против аполипопротеина A-I (+), преинкубировали с пептидомиметиком F3L1 (А), пептидом F3 (В) или рандомизированным пептидом F3 (С), в указанных концентрациях, а затем наносили на планшеты для ELISA, покрытые интактным аполипопротеином Α-I и проводили последующие этапы анализа согласно стандартному протоколу. Контролем служили образцы сыворотки крови, взятые у трех индивидов, у которых не выявлялись антитела против аполипопротеина A-I (-).
Фиг. 6. Пептидомиметик F3L1 подавляет провоспалительную реакцию, связанную с иммуноглобулинами G против аполипопротеина Α-I. Изменение продукции фактора некроза опухолей (TNF-α) макрофагами, вызванное IgG против аполипопротеина Α-I (А) или объединенными иммуноглобулинами G от индивидов, у которых было установлено наличие антител против аполипопротеина Α-I (В).
Фиг. 7. Пептидомиметик F3L1 подавляет хронотропный эффект, связанный с иммуноглобулинами G против аполипопротеина A-I.
Фиг. 8. Идентификация эпитопа аполипопротеина Α-I использованием расщепления полипептидной цепи по остаткам лизина (К). Показана иммунореактивность каждой фракции с сывороткой крови от индивидов, у которых имеются аутоантитела (А), и от тех, у которых их не выявлено (В).
Фиг. 9. Идентификация эпитопа аполипопротеина Α-I использованием расщепления полипептидной цепи по остаткам аргинина (R). Показана иммунореактивность каждой фракции с сывороткой крови от индивидов, у которых имеются аутоантитела (А), и от тех, у которых их не выявлено (В).
Осуществление изобретения
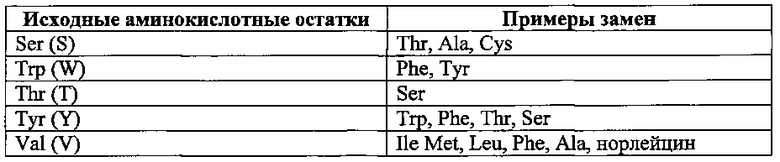
Аполипопротеин А-1, обозначаемый в настоящем документе также АроА-I и АроА-1, - это белок, кодируемый у человека геном APOA1 Человеческий АроА-I имеет молекулярную массу 28 кДа (регистрационный номер UniProt Р02647). Зрелый человеческий белок АРО-А1 содержит 243 аминокислотных остатка (SEQ ID NO: 1). Аполипопротеин A-I играет особую роль в липидном обмене. Он является основным белковым компонентом липопротеинов высокой плотности (HDL) в плазме крови. Аполипопротеин Α-I способствует переходу холестерина из тканей в печень для последующего выведения из организма. Он является кофактором для лецитин-холестерин-ацилтрансферазы (LCAT), которая обеспечивает образование большинства эфиров холестерина, содержащихся в плазме крови. Аполипопротеин Α-I был также идентифицирован как стабилизирующий фактор для простациклина (PGI2) и, таким образом, он обладает противосвертывающим действием. Дефекты гена, кодирующего аполипопротеин Α-I, связаны с состояниями, обусловленными дефицитом HDL, включая болезнь Танжера, и с системным не нейропатическим амилоидозом. Белок Аро А-I конформационно изменчив и динамичен, переходя из одной конформации в другую, которых существует по меньшей мере две существенно различных - без липидов и со связанными липидами. В исследованиях структуры интактного аполипопротеина А-1 без липидов в этом конформере было выявлено наличие шести α-спиральных участков, а именно: α-спиральный участок А от остатка аргинина в положении 10 до остатка глицина в положении 39 последовательности SEQ ID NO: 1; α-спиральный участок В от остатка аспарагина в положении 48 до остатка глутамина в положении 84 последовательности SEQ ID NO: 1; α-спиральный участок С от остатка лизина в положении 94 до остатка глутаминовой кислоты в положении 136 последовательности SEQ ID NO: 1; α-спиральный участок D от остатка глутаминовой кислоты в положении 146 до остатка аланина в положении 187 последовательности of SEQ ID NO: 1; α-спиральный участок Ε от остатка аланина в положении 196 до остатка глутаминовой кислоты в положении 212 последовательности SEQ ID NO: 1; α-спиральный участок F от остатка пролина в положении 220 до остатка глутамина в положении 243 последовательности SEQ ID NO: 1.
Термины «пептидомиметик эпитопа» или «мимотоп» в настоящем документе относятся к пептидам, имитирующим эпитоп белка-мишени. Пептидомиметик достаточно похож на природный эпитоп белка-мишени, чтобы его распознавали антитела, специфичные к природному эпитопу (таким образом, пептидомиметик обладает свойствами антигена) и, по всей вероятности, также вызывает иммунологическую реакцию, специфичную для природного эпитопа (таким образом, обладает свойствами иммуногена). Более конкретно, термин «пептидомиметик эпитопа АроА-I" относится к пептиду, имитирующему антигенную детерминанту аполипопротеина Α-I, который поэтому распознается антителами, специфично связьшающимися с аполипопротеином ΑΙ, называемыми также антителами против аполипопротеина Α-Ι.
Термин «эпитоп», в настоящем документе также называемый «антигенная детерминанта» - это часть антигена, распознаваемая иммунной системой, а именно антителами, В- либо Т-клетками.
Термин «антигенность» относится к антигенным свойствам эпитопа и обозначает способность эпитопа соединяться с конечными продуктами иммунного ответа, например с секретированными антителами и/или рецепторами на поверхности Т-клеток. Термин «иммуногенность» относится к иммуногенным свойствам эпитопа и обозначает способность эпитопа вызывать гуморальный и/или клеточно-опосредованный иммунный ответ. Все эпитопы, обладающие иммуногенностью, имеют также и антигенность, но не все антигенные эпитопы иммуногенны.
Выражение «две не смежных аминокислоты»/«два не смежных аминокислотных остатка» применительно к аминокислотной последовательности в настоящем документе относится к двум не соседним остаткам аминокислот, то есть расположенным не непосредственно рядом друг с другом в первичной структуре пептида, имеющего указанную аминокислотную последовательность.
Термин «антитело против АроА-I» или «антитело к АроА-I» в настоящем документе относится к любому антителу или его варианту/форме, включая (но не ограничиваясь перечисленным здесь) фрагмент антитела, доменное антитело или одноцепочечное антитело, способные избирательно (специфично) связываться с белком АроА-I, например с безлипидной формой аполипопротеина Α-I или ее фрагментом. В частности, антитела против АроА-I включают антитела, способные связываться с эпитопами аполипопротеина Α-I млекопитающих, а именно человека, в частности белка АроА-I с аминокислотной последовательностью SEQ ID NO: 1, или с любым эпитопом, расположенным в пределах области, состоящей из какой-либо из аминокислотных последовательностей SEQ ID NO: 2-9 или SEQ ID NO: 23. Антитела против ApoA-I включают мышиные, химерные, гуманизированные или полностью человеческие антитела, полученные путем генетической инженерии, или биспецифичные, или полиспецифичные антитела, а также их фрагменты, например одноцепочечные антитела (scFv) или доменные антитела против белка Аро Α-I или их фрагменты и т.п. Антитела против АроА-I могут быть моноклональными или поликлональными антителами, их фрагментами или производными, обладающими в основном такой же антигенной специфичностью. В частности, антитела против АроА-I могут быть аутоантителами (называемыми также эндогенными антителами), образующимися у индивидов, для которых высок риск сердечно-сосудистых расстройств, в том числе у лиц с острой болью в груди, острым коронарным синдромом, ревматоидным артритом, системной красной волчанкой, тяжелым стенозом сонной артерии, терминальной стадией почечной недостаточности и периодонтитом. Термин «избирательно/специфично» указывает, что данные антитела распознают предпочтительно полипептид-мишень или определенный эпитоп и/или связываются с ним, то есть проявляют к ним более высокое сродство связывания, чем в отношении любого другого антигена или эпитопа и поэтому связывание с полипептидом-мишенью можно отличить от неспецифичного связывания с другими антигенами. Определить сродство связывания для того или иного антитела, например путем анализа по Скатчарду (Scatchard et al., 1949, Ann. N.Y. Acad. 1949. 51, 660-672), не составит особого труда для рядового специалиста в данной области техники.
Термин «фармацевтически приемлемый» относится к носителям, состоящим из материалов, не являющихся нежелательными с биологической или иных точек зрения.
Термин «носитель» относится к любому присутствующему в фармацевтической композиции компоненту, отличному от активного агента, и, таким образом, включает разбавители, связующие вещества, агенты, улучшающие скольжение, дезинтегрирующие агенты, наполнители, красители, увлажняющие или эмульгирующие агенты, забуферивающие агенты, консерванты и т.п.
Термин «лечение» и его синонимы в настоящем документе, как правило, означают получение желаемого фармакологического или физиологического эффекта. Этот эффект может быть профилактическим в том смысле, что заболевание, симптом или состояние полностью или частично предотвращается, и/или терапевтическим в том смысле, что заболевание, состояние, симптом или негативный эффект, относимые к данному заболеванию, полностью или частично излечиваются. Термин «лечение» в настоящем документе охватывает всякое лечение заболевания у млекопитающих, в частности у людей, и включает: (а) предотвращение возникновения заболевания у предрасположенного к нему индивида, у которого оно еще не диагностировано, например при наличии данного с заболевания в семейном анамнезе; (b) подавление заболевания, то есть остановка его развития, или ослабление заболевания, например регрессирование заболевания и/или его симптомов, например улучшение состояния индивида или репарация поражений.
В частности, лечение сердечно-сосудистых заболеваний включает предотвращение, ослабление или даже ликвидацию симптомов заболевания или расстройства, например снижения числа случаев и частоты инфаркта миокарда или поражения периферических артерий среди населения в целом (первичная профилактика) или у индивидов, у которых уже имели место такие заболевания или расстройства (вторичная профилактика).
Термин «сердечно-сосудистые заболевания» в настоящем документе относится к заболеваниям или расстройствам, затрагивающим сердце или кровеносные сосуды. Примеры сердечно-сосудистых заболеваний, не имеющие ограничительного характера, включают в основном острые и хронические проявления артериосклероза, например острый коронарный синдром, инсульт, транзиторную ишемическую атаку, аритмии, сердечную недостаточность и поражение периферических кровеносных сосудов.
Термины «риск сердечно-сосудистых заболеваний» или «сердечно-сосудистый риск» в настоящем документе определяются как вероятность развития какого-либо сердечно-сосудистого заболевания у индивидов, у которых пока нет значительных атеросклеротических поражений. Эта вероятность обычно оценивается на основании наблюдения различных типичных факторов сердечно-сосудистого риска, например половой принадлежности, возраста, семейного анамнеза, табакокурения, диабета, повышенного кровяного давления (гипертензии), высокого уровня холестерина в крови (дислипидемии), избыточной массы тела, недостаточной физической активности и нездорового питания; эти факторы обычно объединяют в специальных таблицах для расчета риска, например по шкале SCORE или по Фрамингемской шкале. (D'Agostino et al., 2008, Circulation 117:743-53). Индивид считается имеющим высокий сердечнососудистый риск, если вероятность развития сердечно-сосудистого заболевания в ближайшие 10 лет больше 10% по Фрамингемской шкале суммарного сердечнососудистого риска (D'Agostino, et al., 2008, Circulation 117:743-53).
Термины «индивид/пациент/больной» в настоящем документе относятся к млекопитающим. Например, млекопитающие, к которым относится данное изобретение, включают человека, приматов, домашних животных (например, крупный рогатый скот, овец, свиней, лошадей, лабораторных грызунов и проч.).
Термин «образец биологической жидкости» относится к клиническим образцам жидкостей тела (слюны, крови, мочи и др.), взятым у млекопитающего для анализа, например образцом биологической жидкости является образец сыворотки крови, взятый у человека.
Термин «контрольный образец» относится к образцу, служащему положительным либо отрицательным контролем. Образцы для отрицательного контроля включают образцы жидкостей тела, взятые у индивида того же или родственного вида, что и индивид, у которого определяют наличие аутоантител против аполипопротеина A-I, причем об индивиде - источнике контрольного образца известно, что его биологическое состояние нормальное, то есть у него нет детектируемых аутоантител против аполипопротеина Α-I; или же отрицательным контролем служит раствор, не содержащий антител, иммунологически взаимодействующих с аполипопротеином Α-I. Образцы для положительного контроля включают образцы жидкостей тела, взятые у индивида того же или родственного вида, что и индивид, у которого определяют наличие аутоантител против аполипопротеина Α-I, причем об индивиде - источнике контрольного образца известно, что у него имеются детектируемые аутоантитела против аполипопротеина A-I; или же положительным контролем служит раствор, содержащий антитела, иммунологически взаимодействующие с аполипопротеином A-I.
Термин «вариант» применительно к пептиду или полипептиду в настоящем документе означает пептид или полипептид, в основном гомологичный исходному или референсному полипептиду, с которым проводят сравнение, но имеющий аминокислотную последовательность, отличающуюся от исходной или референсной одной или более делецией, инсерцией и/или заменой аминокислотных остатков. Выражение «в основном гомологичный» означает, что аминокислотная последовательность пептида/полипептида - варианта идентична аминокислотной последовательности исходного/референсного пептида/полипептида, за исключением делеции, инсерции и/или замены 1, 2, 3, 4, 5 или 6 аминокислотных остатков. Идентичность двух аминокислотных последовательностей можно установить на глаз и/или путем математических расчетов, или же путем сравнения информации о последовательностях с помощью известных компьютерных программ, используемых для сравнения последовательностей, например пакета программ Clustal (версия 1.83). Вариант пептида/полипептида может иметь аминокислотную последовательность с по меньшей мере одной консервативной заменой аминокислотного остатка, то есть в данном положении аминокислотной последовательности находится остаток другой, чем в исходном пептиде/полипептиде, аминокислоты, но с близкими физико-химическими свойствами. Как правило, замены одного или более аминокислотных остатков в исходном полипептиде должны быть консервативными. Примеры консервативных замен включают замену одного алифатического аминокислотного остатка на другой, например в пределах группы, состоящей из валина, лейцина, изолейцина и аланина, или замену одного полярного аминокислотного остатка на другой, например лизина на аргинин (или наоборот), аспарагина на глутамин (или наоборот), аспарагиновой кислоты на глутаминовую (или наоборот). Хорошо известны и другие консервативные замены, например замены целой области полипептидной цепи на область со сходной гидрофобностью (Kyte, et al., 1982, J. MoI. Biol., 157: 105-131). Например, «консервативная аминокислотная замена может включать такую замену остатка природной аминокислоты на остаток неприродной аминокислоты, которая не влияет или мало влияет на полярность или заряд в данном положении полипептидной цепи. Желательные аминокислотные замены (будь то консервативные замены или не консервативные) специалист в данной области техники может определить тогда, когда это потребуется. Примеры аминокислотных замен представлены в таблице 1, приведенной ниже. Термин «вариант» применительно к пептиду или полипептиду включает также пептид или полипептид, в основном гомологичный исходному (референсному) пептиду/полипептиду, но имеющий аминокислотную последовательность, отличающуюся от исходной (референсной) последовательности тем, что один или более аминокислотных остатков химически модифицированы или заменены на свои аналоги. Например, могут быть химически модифицированы 1, 2, 3, 4, 5 или 6 аминокислотных остатков. Химические модификации одного или более аминокислотных остатков включают создание углеводородной сшивки, например превращение какого-либо аминокислотного остатка в (S)-2-(4'-пентенил)-аланин или (R)-2-(7'-октенил)-аланин. Таким образом, в настоящем документе термин «вариант» применительно к пептиду или полипептиду также включает исходную (референсную) полипептидную цепь, в которой один или более аминокислотных остатков заменены на (S)-2-(4'-пентенил)-аланин или (R)-2-(7'-октенил)-аланин для создания углеводородной сшивки.

Варианты также включают пептидомиметики по данному изобретению, содержащие α,α-диалкилированные аминокислотные остатки, например 2-аминоизомасляную кислоту для стабилизации α-спиральных структур. Для добавления α,α-диалкилированных аминокислотных остатков предпочтительны положения аминокислотной последовательности, занимаемые аминокислотными остатками, которым не присуща способность к формированию спиральной структуры или эта способность не выражена, например остатками пролина, глицина или валина, причем последней из перечисленных аминокислот присуща способность стабилизировать структуру типа «складчатый слой» β-лист). К этой группе соединений принадлежат также (S)-2-(4'-пентенил)-аланин и (R)-2-(7'-октенил)-аланин, которые можно использовать для создания описанных в настоящем документе углеводородных сшивок. Такие аминокислотные остатки можно также включать в те положения полипептидной цепи, которые склонны к протеолитическому расщеплению пептида, если указанному пептиду есть какое-либо терапевтическое применение. Примеры положений аминокислотной последовательности аполипопротеина A-I, в которые можно добавлять α,α-диалкилированные аминокислотные остатки, включают положения в α-спиральной области F, а именно, например, пролин-229, валин-220, фенилаланин-221, лизин-225, валин-226 или фенилаланин-228 (положения указаны по аминокислотной последовательности зрелого белка ApoA-I SEQ ID NO: 1.
Термин «твердая подложка» включает любую твердофазную основу для проведения иммунологического анализа или для осуществления способа по данному изобретению. Он включает шарики, микрочастицы, наночастицы, стенки пробирки, материалы типа ткани или планшеты, пленки, пластинки, лунки, сделанные или имеющие покрытие из стекла, полистирола, полипропилена, нитроцеллюлозы, кварца, керамики, декстрана или иных материалов. Например твердой подложкой могут служить лунки титрационного микропланшета, например 96-луночного титрационного микропланшета.
Термин «набор» подразумевает по меньшей мере один пептидомиметик по данному изобретению или его вариант, или их комбинацию, описанные в настоящем документе, присоединенные или подлежащие присоединению к твердой подложке, и при необходимости инструкции по применению.
Термин «эффективность» применительно к лечению или способу по данному изобретению подразумевает оценку на основании изменений в течение заболевания или состояния в ответ на применение способа по данному изобретению. Например, эффективность лечения или способа по данному изобретению может быть измерена по влиянию указанного лечения или способа на i) различные клинические результаты (например, на общую смертность, смертность от сердечно-сосудистых заболеваний, рецидивирование острого коронарного синдрома или инсульта, госпитализацию…) и/или ii) суррогатные маркеры, например действие терапевтических агентов у различных животных или в системах in vitro.
Термин «эффективное количество» в настоящем документе относится к количеству по меньшей мере одного пептидомиметика по данному изобретению или содержащей его фармацевтической композиции, которое вызывает детектируемое ослабление симптомов сердечно-сосудистых заболеваний у индивидов, которым вводят указанный пептидомиметик; эти симптомы включают, например, общую смертность, смертность от сердечно-сосудистых заболеваний, рецидивирование острого коронарного синдрома или инсульта, госпитализацию в связи с сердечно-сосудистой патологией.
Пептидомиметики эпитопов аполипопротеина A-I
В одном из своих аспектов данное изобретение относится к пептидомиметикам - пептидам, имитирующим эпитоп (эпитопы) аполипопротеина А-1 в не связанной с липидами форме и способным специфично связываться с аутоантителами к аполипопротеину Α-I, присутствующими у индивидов с сердечно-сосудистыми заболеваниями или расстройствами.
В первом аспекте данного изобретения в пептидомиметиках имеются внутримолекулярные поперечные сшивки.
Одно из воплощений данного изобретения относится к пептидомиметикам эпитопа АроА-I, которые имеют:
(a) аминокислотную последовательность длиной 15-80 аминокислотных остатков;
(b) аминокислотную последовательность, содержащую какую-либо из последовательностей
(i) SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 25, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24; или какой-либо из их вариантов;
(ii) аминокислотную последовательность, идентичную какой-либо из последовательностей, перечисленных в пункте (i), за тем исключением, что 1, 2, 3, 4, 5 или 6 аминокислотных остатков указанной последовательности из пункта (i) заменены, делетированы, вставлены и/или химически модифицированы, при этом не уничтожая способности указанного пептидомиметика специфично связываться с антителами против аполипопротеина А-I;
(iii) какую-либо комбинацию двух аминокислотных последовательностей из пункта (i) и/или (ii); и
(с) внутримолекулярные поперечные сшивки между по меньшей мере двумя не смежными аминокислотными остатками аминокислотной последовательности по пункту b);
при этом указанный пептидомиметик способен специфично связываться с антителами против аполипопротеина А-I.
В одном из воплощений данного изобретения описанные выше пептидомиметики состоят из 20-55, предпочтительно 25-55, более предпочтительно 25-40 аминокислотных остатков.
В другом воплощении данного изобретения описанные выше пептидомиметики состоят из 20-40; 21-40; 22-40; 23-40; 24-40; 25-40; 26-40; 27-40; 28-40 или 30-40 аминокислотных остатков.
В другом воплощении данного изобретения описанные выше пептидомиметики состоят из 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 50, 55, 60, 65, 70, 75 или 80 аминокислотных остатков. В частности, пептидомиметики по данному изобретению состоят из 17, 18, 22, 26, 28, 32, 37, 38, 39, 40, 42, 44 или 55 аминокислотных остатков.
В одном из воплощений данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит (i) какую-либо из последовательностей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 9 или какой-либо из их вариантов, или (ii) комбинацию двух последовательностей, выбираемых из SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 9 или их вариантов.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит (i) какую-либо из последовательностей SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24 и SEQ ID NO: 18 или какой-либо из их вариантов, или (ii) комбинацию двух последовательностей, выбираемых из SEQ ID NO: 10, SEQ OD NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24 или их вариантов.
В одном из воплощений данного изобретения аминокислотная последовательность предлагаемого пептидомиметика состоит из (i) какой-либо из последовательностей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 9 или какой-либо из их вариантов или (ii) комбинации двух последовательностей, выбираемых из последовательностей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 9 или их вариантов.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика состоит из (i) какой-либо из последовательностей SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24 и SEQ ID NO: 18 или какой-либо из их вариантов или (ii) комбинации двух последовательностей, выбираемых из последовательностей SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 22 и SEQ ID NO: 24 или их вариантов.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит какую-либо из последовательностей SEQ ID NO: 8 или SEQ ID NO: 9 или какой-либо из их вариантов.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 25 или ее вариант.
В другом частном случае осуществления данного изобретения аминокислотная последовательность предлагаемого пептидомиметика состоит из какой-либо из последовательностей SEQ ID NO: 8 или SEQ ID NO: 9 или какой-либо из их вариантов.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика состоит из последовательности SEQ ID NO: 25 или ее варианта.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 5 или ее вариант.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 5, в которой делетированы два последних аминокислотных остатка Ε и N в С-концевой части последовательности SEQ ID NO: 5.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 21 или ее вариант.
В другом частном случае воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика состоит из последовательности SEQ ID NO: 5 или ее варианта.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика состоит из последовательности SEQ ID NO: 5, в которой делетированы два последних аминокислотных остатка Ε и N в С-концевой части последовательности SEQ ID NO: 5.
В другом частном случае воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика состоит из последовательности SEQ ID NO: 21 или ее варианта.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 23 или состоит из нее, или состоит из последовательности SEQ ID NO: 23 с добавлением 1, 2, 3, 4, 5 или 6 аминокислотных остатков, в частности 5 аминокислотных остатков.
В еще одном воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит какую-либо из последовательностей SEQ ID NO: 15, SEQ ID NO 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20 или какой-либо из их вариантов.
В еще одном воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 19 или ее вариант.
В другом частном случае воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика состоит из какой-либо из последовательностей SEQ ID NO: 15, SEQ ID NO 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20 или какого-либо из их вариантов.
В другом частном случае воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика состоит из последовательности SEQ ID NO: 19 или ее варианта.
В еще одном воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 13, SEQ ID NO: 22 или SEQ ID NO: 24 или какой-либо из их вариантов.
В другом частном случае воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика состоит из последовательностей SEQ ID NO: 13, SEQ ID NO: 22 или SEQ ID NO: 24, или какого-либо из их вариантов.
В еще одном воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 13 или состоит из нее.
В одном из частных случаев воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 18 или ее вариант.
В другом частном случае воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика состоит из последовательности SEQ ID NO: 18 или ее варианта.
В другом воплощении данного изобретения предлагаемый пептид имеет такую аминокислотную последовательность, какие указаны выше, за тем исключением, что 1, 2, 3, 4, 5 или 6 аминокислотных остатков указанной последовательности заменены, делетированы и/или добавлены без негативного влияния на способность указанного пептидомиметика специфично связываться с антителами против аполипопротеина A-I.
В одном из частных случаев воплощения данного изобретения 1, 2, 3, 4, 5 или 6 аминокислотных остатков указанной последовательности заменены на аминокислотные остатки, подходящие для создания внутримолекулярной поперечной сшивки, например на остаток глутаминовой кислоты (Е), и/или на остаток лизина (К) для создания лактамного мостика, или на остаток цистеина (С) для создания дисульфидного мостика.
При необходимости 2, 4 или 6 аминокислотных остатков, содержащихся в аминокислотной последовательности пептидомиметика по данному изобретению, химически модифицируют для создания внутримолекулярной поперечной сшивки без негативного влияния на способность указанного пептидомиметика специфично связываться с антителами против аполипопротеина Α-I. Например, в одном из частных случаев воплощения данного изобретения по меньшей мере два, например 2-4 аминокислотных остатка, например остаток фенилаланина (F), лейцина (L), метионина (М), валина (V), лизина (К) и тирозина (Y), содержащиеся в аминокислотной последовательности пептида по данному изобретению, заменены на остатки аланина и указанные остатки аланина химически модифицированы с образованием (S)-2-(4'-пентенил)-аланина или (R)-2-(7'-октенил)-аланина, так что создается углеводородная сшивка между двумя химически модифицированными остатками аланина.
В другом воплощении данного изобретения N-концевой и/или С-концевой аминокислотные остатки предлагаемого пептидомиметика модифицируют, чтобы ликвидировать электрический заряд свободных концевых амино- и/или карбоксильной группы, соответственно. В одном из частных случаев воплощения данного изобретения к свободной аминогруппе на N-конце указанного пептида ковалентно присоединяется ацильная группа (например, ацетил, пропионил, пальмитоил и проч.). В другом воплощении данного изобретения свободная карбоксильная группа на С-конце указанного пептида амидирована. В еще одном воплощении данного изобретения модифицированы как С-, так и N-концевые аминокислотные остатки пептидомиметика, в частности к свободной аминогруппе на N-конце указанного пептида ковалентно присоединена ацильная группа (например, ацетил, пропионил, пальмитоил и проч.), а свободная карбоксильная группа на С-конце указанного пептида амидирована.
В другом воплощении данного изобретения внутримолекулярная поперечная сшивка между двумя не смежными аминокислотными остатками, содержащимися в аминокислотной последовательности описанного выше пептидомиметика, создается образованием ковалентной связи, например лактамным мостиком, углеводородной сшивкой, дисульфидным мостиком или любой другой жесткой линкерной структурой между указанным двумя не смежными аминокислотными остатками, например как при стабилизации альфа-спиральной структуры ковалентными связями вместо водородных (Chapman et al., J Am Chem Soc, 2004, 126: 12252-12253) или как изображено на фиг. 1 и 2.
В одном из воплощений данного изобретения аминокислотные остатки предлагаемого пептида, между которыми имеется поперечная сшивка, находятся в положениях n и n+3, n+4, n+5, n+6, n+7, n+8, n+9, n+10, n+11, соответственно. Ясно, что эти положения относятся к первичной структуре (аминокислотной последовательности) пептида, то есть к соответствующим положениям аминокислотных остатков в первичной структуре пептида и что "n" указывает положение одного из аминокислотных остатков в аминокислотной последовательности пептидомиметика, "n+3" указывает, что другой аминокислотный остаток расположен через 3 аминокислотных остатка от положения n, "n+4" указывает, что другой аминокислотный остаток расположен через 4 аминокислотных остатка от положения n, "n+5" указывает, что другой аминокислотный остаток расположен через 5 аминокислотных остатка от положения n в аминокислотной последовательности указанного пептида, и т.д.
В одном из частных случаев воплощения данного изобретения создается дисульфидный мостик между остатком цистеина (С), занимающим положение n в аминокислотной последовательности предлагаемого пептида, и другим остатком цистеина (С), занимающим положение n+3 в указанной последовательности. Химическая реакция для создания дисульфидного мостика в молекуле пептида в растворе представлена на фиг. 1А. Этот дисульфидный мостик в молекуле пептида изображен на фиг. 2А.
В другом частном случае воплощения данного изобретения создается углеводородная сшивка между химически модифицированным остатком аланина (А), занимающим положение n в аминокислотной последовательности предлагаемого пептида, и другим химически модифицированным остатком аланина (А), занимающим положение n+4 или n+7 в указанной последовательности. В частности, углеводородная сшивка создается между модифицированными остатками аланина, которые включают аминокислоты с двузамещенным α-атомом углерода, например 2-аминоизомасляную кислоту, (S)-2-(4'-пентенил)-аланин и (R)-2-(7'-октенил)-аланин. В другом воплощении данного изобретения внутримолекулярная поперечная сшивка представляет собой углеводородную сшивку между одним остатком (S)-2-(4'-пентенил)-аланина и одним остатком (R)-2-(7'-октенил)-аланина. В другом воплощении данного изобретения внутримолекулярная поперечная сшивка представляет собой углеводородную сшивку между двумя остатками (S)-2-(4'-пентенил)-аланина. В альтернативном воплощении данного изобретения углеводородная сшивка создается между химически модифицированным остатком аланина (А), занимающим положение n в аминокислотной последовательности предлагаемого пептида, и другим химически модифицированным остатком аланина (А), занимающим положение n+3 в указанной аминокислотной последовательности.
Химическая реакция для создания углеводородной сшивки в молекуле пептида путем твердофазного пептидного синтеза с использованием защитной группы Fmoc изображена на фиг. 1В. Углеводородная сшивка в молекуле пептида изображена на фиг. 2В.
Примеры углеводородных сшивок, которые можно использовать по данному изобретению, включают структуры, изображенные на фиг. 2В. Например, углеводородная сшивка может связывать два аминокислотных остатка Хаа в положениях n и n+7, где Хаа в положении n является модифицированным аланином, имеющим формулу (I): -ΝΗ-С(СН3)(R)-С(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединенную к другому остатку Хаа в положении n+7, и где Хаа в положении n+7 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении n, как описано выше. В другом примере углеводородная сшивка может соединять два аминокислотных остатка в положениях n и n+4, где Хаа в положении n представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)3-СН=СН-(СН2)3-, присоединенную к другому Хаа в положении n+4, и где Хаа в положении n+4 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении n, как описано выше.
В одном из частных случаев воплощения данного изобретения создается лактамный мостик между остатком глутаминовой кислоты (Е) в положении n в аминокислотной последовательности предлагаемого пептида и остатком лизина (К) в положении n+4 или n+7, предпочтительно в положении n+4, указанной аминокислотной последовательности.
В другом воплощении данного изобретения создается лактамный мостик между остатком лизина (К) в положении n в аминокислотной последовательности предлагаемого пептида и остатком глутаминовой кислоты (Е) в положении n+4 или n+7, предпочтительно в положении n+4, указанной аминокислотной последовательности.
Химическая реакция для создания лактамного мостика в молекуле пептида на твердой фазе изображена на фиг. 1С. Лактамный мостик в молекуле пептида изображен на фиг. 2С.
Примеры лактамных мостиков, которые можно использовать по данному изобретению, включают структуры, изображенные на фиг. 2С. Например, лактамный мостик образуется между двумя аминокислотными остатками Хаа в положениях n и n+4 аминокислотной последовательности предлагаемого пептида, где Хаа в положении n является модифицированным аминокислотным остатком, имеющим формулу (I): -ΝΗ-C(H)(R)-C(O)-, где R представляет лактамный мостик -(CH2)2-CO-NH-(CH2)4-, присоединенный к другому аминокислотному остатку в положении n+4, и где Хаа в положении n+4 представляет модифицированный аминокислотный остаток, имеющий формулу (I): -NH-C(H)(R')-C(O)-, где R' представляет одинарную связь к лактамному мостику от Хаа в положении n, как описано выше. В другом примере лактамный мостик образуется между двумя аминокислотными остатками в положениях n и n+4 аминокислотной последовательности предлагаемого пептида, где Хаа в положении n представляет модифицированный аминокислотный остаток, имеющий формулу (I): -ΝΗ-C(H)(R)-C(O)-, где R' представляет лактамный мостик -(CH2)4-NH-CO-(CH2)2-, присоединенный к другому остатку Хаа в положении n+4, и где Хаа в положении n+4 представляет модифицированный аминокислотный остаток, имеющий формулу (I): -NH-C(H)(R')-C(O)-, где R' представляет одинарную связь к лактамному мостику от Хаа в положении n, описанным выше.
В другом воплощении данного изобретения пептидомиметик выбирают из пептидов, представленных в таблице 2 ниже, в которых внутримолекулярные поперечные сшивки созданы посредством лактамного мостика между подчеркнутыми остатками глутаминовой кислоты (Е) и лизина (К) либо посредством углеводородной сшивки между R8 и S5, где R8 соответствует (R)-2-(7'-октенил)-аланину и S5 соответствует (S)-2-(4'-пентенил)-аланину.
Таблица 2. Примеры пептидомиметиков по данному изобретению и их аминокислотные последовательности.
R8 соответствует (R)-2-(7'-октенил)-аланину и S5 соответствует (S)-2-(4'-пентенил)-аланину, участвующим в образовании углеводородной сшивки, как показано на фиг. 2В. Подчеркнутые буквы Е и К обозначают аминокислотные остатки, участвующие в образовании лактамного мостика, как показано на фиг. 2С. При необходимости в пептидах по данному изобретению свободная аминогруппа на N-конце ацетилирована, а свободная карбоксильная группа на С-конце амидирована.




В одном из частных случаев воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 8 или SEQ ID NO: 9; или какой-либо из их вариантов.
В одном из частных случаев воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 25 или какой-либо из ее вариантов.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 5 или какой-либо из ее вариантов.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 5, в которой делегированы последние два аминокислотных остатка Е и N ее С-концевой части.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 21 или SEQ ID NO: 23, или какой-либо из их вариантов.
В другом частном случае воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19 или SEQ ID NO: 20, или какой-либо из их вариантов.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 15, в которой свободная аминогруппа на N-конце ацетилирована и/или свободная карбоксильная группа на С-конце амидирована, в частности свободная аминогруппа на N-конце ацетилирована и свободная карбоксильная группа на С-конце амидирована.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 16, в которой свободная аминогруппа на N-конце ацетилирована и/или свободная карбоксильная группа на С-конце амидирована, в частности свободная аминогруппа на N-конце ацетилирована и свободная карбоксильная группа на С-конце амидирована.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 17, в которой свободная аминогруппа на N-конце ацетилирована и/или свободная карбоксильная группа на С-конце амидирована, в частности свободная аминогруппа на N-конце ацетилирована и свободная карбоксильная группа на С-конце амидирована.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 19, в которой свободная аминогруппа на N-конце ацетилирована и/или свободная карбоксильная группа на С-конце амидирована, в частности свободная аминогруппа на N-конце ацетилирована и свободная карбоксильная группа на С-конце амидирована.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 20, в которой свободная аминогруппа на N-конце ацетилирована и/или свободная карбоксильная группа на С-конце амидирована, в частности свободная аминогруппа на N-конце ацетилирована и свободная карбоксильная группа на С-конце амидирована.
В другом воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 13, SEQ ID NO: 22 или SEQ ID NO: 24.
В одном из частных случаев воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 13 в которой свободная аминогруппа на N-конце ацетилирована и/или свободная карбоксильная группа на С-конце амидирована, в частности свободная аминогруппа на N-конце ацетилирована и свободная карбоксильная группа на С-конце амидирована.
В другом частном случае воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 22, в которой свободная аминогруппа на N-конце ацетилирована и/или свободная карбоксильная группа на С-конце амидирована, в частности свободная аминогруппа на N-конце ацетилирована и свободная карбоксильная группа на С-конце амидирована.
В одном из частных случаев воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит последовательность SEQ ID NO: 24, в которой свободная аминогруппа на N-конце ацетилирована и/или свободная карбоксильная группа на С-конце амидирована, в частности свободная аминогруппа на N-конце ацетилирована и свободная карбоксильная группа на С-конце амидирована.
В еще одном воплощении данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит какую-либо из последовательностей:
(i) SEQ ID NO: 19 с лактамным мостиком, изображенным на фиг. 2С, соединяющим остаток Ε в положении 19 и остаток К в положении 23;
(ii) SEQ ID NO: 15 с углеводородной сшивкой, изображенной на фиг. 2В, соединяющей (R)-2-(7'-октенил)-аланин в положении 16 и (S)-2-(4'-пентенил)-аланин в положении 23;
(iii) SEQ ID NO: 16 с углеводородной сшивкой, изображенной на фиг. 2В, соединяющей (S)-2-(4'-пентенил)-аланин в положении 13 и (S)-2-(4'-пентенил)-аланин в положении 17;
(iv) SEQ ID NO: 17 с углеводородной сшивкой, изображенной на фиг. 2В, соединяющей (R)-2-(7'-октенил)-аланин в положении 9 и (S)-2-(4'-пентенил)-аланин в положении 16.
В другом частном случае воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит какую-либо из последовательностей SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19 или SEQ ID NO: 20, или какой-либо из их вариантов.
В другом частном случае воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика содержит какую-либо из последовательностей SEQ ID NO: 13, SEQ ID NO: 22 или SEQ ID NO: 24, или какой-либо из их вариантов.
В еще одном частном случае воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика состоит из какой-либо из последовательностей:
(i) SEQ ID NO: 19 с лактамным мостиком, изображенным на фиг. 2С, соединяющим остаток Ε в положении 19 и остаток К в положении 23;
(ii) SEQ ID NO: 15 с углеводородной сшивкой, изображенной на фиг. 2В, соединяющей (R)-2-(7'-октенил)-аланин в положении 16 и (S)-2-(4'-пентенил)-аланин в положении 23;
(iii) SEQ ID NO: 16 с углеводородной сшивкой, изображенной на фиг. 2В, соединяющей (S)-2-(4'-пентенил)-аланин в положении 13 и (S)-2-(4'-пентенил)-аланин в положении 17;
(iv) SEQ ID NO: 17 с углеводородной сшивкой, изображенной на фиг. 2В, соединяющей (R)-2-(7'-октенил)-аланин в положении 9 и (S)-2-(4'-пентенил)-аланин в положении 16.
В другом частном случае воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика состоит из какой-либо из последовательностей SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19 или SEQ ID NO: 20, или какого-либо из их вариантов.
В еще одном частном случае воплощения данного изобретения аминокислотная последовательность предлагаемого пептидомиметика состоит из какой-либо из последовательностей SEQ ID NO: 13, SEQ ID NO: 22 или SEQ ID NO: 24, или какого-либо из их вариантов.
В другом варианте данного изобретения в предлагаемых пептидомиметиках нет внутримолекулярных поперечных сшивок.
В одном из своих воплощений данное изобретение относится к пептидам, имитирующим (пептидомиметикам) эпитопы аполипопротеина Α-I (АроА-I), причем указанные пептидомиметики имеют:
(a) аминокислотную последовательность длиной 15-80 аминокислотных остатков;
(b) аминокислотную последовательность, содержащую какую-либо из последовательностей:
(i) SEQ ID NO: 5, SEQ ID NO: 21, SEQ ID NO: 23, или какой-либо из их вариантов; или
(ii) SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 25, или какой-либо из их вариантов; или
(iii) аминокислотную последовательность, идентичную какой-либо из последовательностей по пункту (i) или (ii) за тем исключением, что 1, 2, 3, 4, 5 или 6 аминокислотных остатков указанной последовательности по пункту (i) или (ii) заменены, делегированы, вставлены и/или химически модифицированы без негативного влияния на способность указанного пептидомиметика специфично связываться с антителами против аполипопротеина Α-I, или
(iv) любую комбинацию двух аминокислотных последовательностей по пункту (i), (ii) и/или (iii);
причем указанный пептидомиметик способен специфично связываться с антителами против аполипопротеина A-I.
В одном из воплощений данного изобретения описанные выше пептидомиметики состоят из 20-55, в частности 25-55, в том числе 25-40 аминокислотных остатков.
В другом воплощении данного изобретения описанные выше пептидомиметики состоят из 20-40; 21-40; 22-40; 23-40; 24-40; 25-40; 26-40; 27-40; 28-40 или 30-40 аминокислотных остатков.
В другом воплощении данного изобретения описанные выше пептидомиметики состоят из 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 50, 55, 60, 65, 70, 75 или 80 аминокислотных остатков. В частности, пептидомиметики по данному изобретению состоят из 17, 18, 22, 26, 28, 32, 37, 38, 39, 40, 42, 44 или 55 аминокислотных остатков.
В другом воплощении данного изобретения N-концевой и/или С-концевой участки предлагаемого пептидомиметика модифицированы для ликвидации возможного электрического заряда, обусловленного наличием свободной аминогруппы и/или свободной карбоксильной группы, соответственно. В одном из частных случаев воплощения данного изобретения свободная аминогруппа на N-конце указанного пептида ковалентно связана с ацильной группой (например, с ацетилом, пропионилом, пальмитоилом и др.). В другом воплощении данного изобретения свободная карбоксильная группа на С-конце указанного пептида амидирована. В еще одном воплощении данного изобретения модифицированы как N-, так и С-конец предлагаемого пептидомиметика, в частности свободная аминогруппа на N-конце указанного пептида ковалентно связана с ацильной группой (например, с ацетилом, пропионилом, пальмитоилом и др.) и свободная карбоксильная группа на С-конце указанного пептида амидирована.
В одном из частных случаев воплощения данного изобретения указанный пептидомиметик содержит последовательность SEQ ID NO: 5, SEQ ID NO: 21 или SEQ ID NO: 23.
В другом воплощении данного изобретения указанный пептидомиметик содержит последовательность SEQ ID NO: 5, в которой делетированы два последних аминокислотных остатка Ε и N в С-концевом участке.
В одном из частных случаев воплощения данного изобретения предлагаемый пептидомиметик содержит последовательность SEQ ID NO: 5 или ее вариант, в которых свободная аминогруппа на N-конце ацетилирована и/или свободная карбоксильная группа на С-конце амидирована, в частности свободная аминогруппа на N-конце ацетилирована и свободная карбоксильная группа на С-конце амидирована.
В одном из частных случаев воплощения данного изобретения предлагаемый пептидомиметик содержит последовательность SEQ ID NO: 21 или ее вариант, в которых свободная аминогруппа на N-конце ацетилирована и/или свободная карбоксильная группа на С-конце амидирована, в частности свободная аминогруппа на N-конце ацетилирована и свободная карбоксильная группа на С-конце амидирована.
В одном из частных случаев воплощения данного изобретения предлагаемый пептидомиметик содержит последовательность SEQ ID NO: 23 или ее вариант, в которых свободная аминогруппа на N-конце ацетилирована и/или свободная карбоксильная группа на С-конце амидирована, в частности свободная аминогруппа на N-конце ацетилирована и свободная карбоксильная группа на С-конце амидирована.
В одном из частных случаев воплощения данного изобретения указанный пептидомиметик содержит последовательность SEQ ID NO: 8, SEQ ID NO: 9 или SEQ ID NO: 25.
В другом частном случае воплощения данного изобретения предлагаемый пептидомиметика содержит последовательность SEQ ID NO: 8 или ее вариант, в которых свободная аминогруппа на N-конце ацетилирована и/или свободная карбоксильная группа на С-конце амидирована, в частности свободная аминогруппа на N-конце ацетилирована и свободная карбоксильная группа на С-конце амидирована.
В другом частном случае воплощения данного изобретения предлагаемый пептидомиметик содержит последовательность SEQ ID NO: 9 или ее вариант, в которых свободная аминогруппа на N-конце ацетилирована и/или свободная карбоксильная группа на С-конце амидирована, в частности свободная аминогруппа на N-конце ацетилирована и свободная карбоксильная группа на С-конце амидирована.
В другом частном случае воплощения данного изобретения предлагаемый пептидомиметик содержит последовательность SEQ ID NO: 25 или ее вариант, в которых свободная аминогруппа на N-конце ацетилирована и/или свободная карбоксильная группа на С-конце амидирована, в частности свободная аминогруппа на N-конце ацетилирована и свободная карбоксильная группа на С-конце амидирована.
В другом аспекте данного изобретения предлагаются пептидомиметики для использования в качестве диагностических композиций.
В частности, данным изобретением предлагаются пептидомиметики для использования при диагностировании и/или прогнозировании сердечно-сосудистых заболеваний.
В другом воплощении данного изобретения предлагаются пептидомиметики для использования в качестве медикамента.
В другом воплощении данного изобретения предлагаются пептидомиметики для использования при лечении сердечно-сосудистых заболеваний.
По другому воплощению данного изобретения предлагается препарат для иммунологического анализа, который можно использовать для выявления антител против аполипопротеина Α-I, играющих роль биологических маркеров сердечно-сосудистых заболеваний, в образцах биологических жидкостей; этот препарат содержит по меньшей мере один пептидомиметик по данному изобретению или его вариант.
По еще одному воплощению данного изобретения предлагается препарат для иммунологического анализа, который можно использовать для выявления антител против аполипопротеина Α-I, играющих роль биологических маркеров сердечно-сосудистых заболеваний, в образцах биологических жидкостей; этот препарат содержит по меньшей мере один пептидомиметик по данному изобретению или его вариант.
По другому воплощению данного изобретения предлагается применение такого препарата для иммунологического анализа в качестве покрытия твердой подложки для проведения иммунологического анализа.
По еще одному воплощению данного изобретения предлагается планшет для иммунологического анализа, используемый для выявления антител против аполипопротеина Α-I, играющих роль биологических маркеров сердечно-сосудистых заболеваний, в образцах биологических жидкостей; этот планшет содержит по меньшей мере один пептидомиметик по данному изобретению или его вариант, связанный с твердой подложкой и/или покрывающий ее.
Полинуклеотиды, кодирующие пептидомиметики по данному изобретению
В другом своем аспекте данное изобретение относится к изолированным полинуклеотидам, кодирующим пептидомиметики по данному изобретению.
В одном из частных случаев воплощения данного изобретения оно относится к изолированным полинуклеотидам, кодирующим пептидомиметики по данному изобретению, в которых внутримолекулярные поперечные сшивки представляют собой дисульфидные мостики между двумя остатками цистеина, не смежными в аминокислотной последовательности указанного пептидомиметика.
Получение и очистка пептидов по данному изобретению
В другом аспекте данного изобретения предлагается рекомбинантный вектор, содержащий полинуклеотид по данному изобретению.
Для целей данного изобретения можно использовать многие экспрессионные системы, включая (но не ограничиваясь перечисленным здесь) хромосомы, эписомы и производные вирусов. В частности, используемые по данному изобретению рекомбинантные векторы могут быть производными бактериальных плазмид, транспозонов, эписом дрожжей, инсерционных элементов, хромосомных элементов дрожжей, вирусов (например, бакуловирусов, папилломавирусов, SV40, вируса осповакцины, аденовирусов, поксвирусов, вирусов псевдобешенства, ретровирусов).
Рекомбинантиные векторы по данному изобретению могут быть также производными космид или фагмид. Нужные нуклеотидные последовательности встраивают в рекомбинантный экспрессионный вектор с помощью методов, хорошо известных специалистам в данной области техники, например описанных в работе MOLECULAR CLONING: A LABORATORY MANUAL, Sambrook et al., 4th Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 2001.
Рекомбинантный вектор по данному изобретению может содержать нуклеотидные последовательности для регуляции экспрессии полинуклеотида по данному изобретению, а также последовательности, обеспечивающие эту экспрессию и транскрипцию указанного полинуклеотида и его трансляцию с образованием полипептида по данному изобретению, причем эти последовательности выбирают соответственно используемым клеткам-хозяевам.
Например, в рекомбинантный вектор можно интегрировать нужный сигнал секреции, так что полипептид, кодируемый полинуклеотидом по данному изобретению, будет направляться в просвет эндоплазматического ретикулума, в периплазматическое пространство, на мембрану или во внеклеточную среду. Подбор подходящего сигнала секреции способствует последующей очистке нужного белка.
В другом воплощении данного изобретения предлагаются клетки-хозяева, несущие рекомбинантный вектор по данному изобретению.
Введение рекомбинантного вектора по настоящему изобретению в клетки-хозяева осуществляется методами, хорошо известными специалистам в данной области техники, например описанными в работе BASIC METHODS IN MOLECULAR BIOLOGY, Davis et al., 2nd ed., McGraw-Hill Professional Publishing, 1995, and MOLECULAR CLONING: A LABORATORY MANUAL (см. выше), например, путем трансфекции с использованием фосфата кальция, трансфекции с использованием DEAE-декстрана, трансфекции, микроинъекции, трансфекции с помощью катионных липидов, электропорации, трансдукции или инфекции.
Клетками-хозяевами по данному изобретению могут служить, например, бактериальные клетки (например, Е. coli), клетки грибов (например, дрожжей или Aspergillus), клетки актиномицет (например, Streptomyces), клетки насекомых, клетки яичника китайского хомячка (СНО), мышиные клетки линии С127, клетки сирийского хомячка линии ВНК, эмбриональные почечные клетки человека 293 (НЕК 293).
Эти клетки-хозяева могут использоваться, например, для экспрессии пептидомиметиков по данному изобретению. После очистки стандартными методами пептиды по данному изобретению можно использовать в способах, описанных далее в настоящем документе.
В другом воплощении данного изобретения предлагается способ получения пептидов по данному изобретению, включающий культивирование указанных выше клеток-хозяев в культуральной среде и выделение указанных пептидов из культуральной среды или из лизата клеток-хозяев после их лизиса. В тех случаях, когда в пептиде по данному изобретению имеются внутримолекулярные поперечные сшивки между двумя не смежными аминокислотными остатками, представляющие собой дисульфидные мостики, образованные остатками цистеина, создание этих поперечных сшивок может осуществляться в ходе этапов синтеза и очистки указанных пептидов или же на последующем независимом этапе.
В тех случаях, когда в пептиде по данному изобретению имеются внутримолекулярные поперечные сшивки между двумя не смежными аминокислотными остатками, представляющие собой лактамные мостики или углеводородные сшивки, и этот пептид получен по технологии рекомбинантной ДНК, как описано выше, при получении пептидомиметика по данному изобретению может требоваться дополнительный этап, в ходе которого создаются указанные внутримолекулярные поперечные сшивки, описанные в настоящем документе.
Или же пептидомиметик по данному изобретению может быть получен методами химического синтеза, например твердофазного пептидного синтеза. Очистка таких пептидов может осуществляться любым известным в данной области техники методом, подходящим для очистки белков/пептидов. Примеры этих методов включают ионообменную хроматографию, хроматографию с использованием гидрофобных взаимодействий и методы, основанные на иммунологической аффинности.
Внутримолекулярные поперечные сшивки в пептидах по данному изобретению могут создаваться путем образования лактамного мостика между имеющимися в аминокислотной последовательности пептида остатками глутаминовой кислоты и лизина с использованием ортогональных наборов защитных групп (O-Fm и Fmoc) при твердофазном синтезе по Вос-методу и формирования лактамного мостика на смоле после отщепления защитных групп (флуоренилметиловый эфир/карбамат) 20%-ным пиперидином в течение 1 часа. При синтезе по Fmoc-методу ортогональные защитные группы О-аллил и Aloc отщепляли на смоле путем обработки трехкратным избытком тетракис(трифенилфосфин)палладия(O) в смеси хлороформ/уксусная кислота/N-метилморфолин в течение 2 часов. Лактамная циклизация пептида может осуществляться с 3 эквивалентами реагента Pyclock и 9 эквивалентами диизопропилэтиламина (DIEA) в течение 2 суток с контролем при помощи нингидриновой реакции по Кайзеру (Kaiser et al., 1970, Anal Biochem 34:595-598).
В другом воплощении данного изобретения внутримолекулярные поперечные сшивки в пептидах по данному изобретению создаются путем образования углеводородной сшивки с применением реакции метатезиса с замыканием цикла (RCM) в пептидах, в которых при твердофазном синтезе в ходе удлинения пептидной цепи в нее включены две α-метил, α-алкенил аминокислотных остатка. RCM-реакция осуществляется применительно к пептидам с Fmoc-защитой на амидной 4-метилбензгидриламиновой смоле (MBHA-Rink) с дихлор-(о-изопропоксифенилметилен)(трициклогексилфосфин)рутением(II) в качестве катализатора, как описано в работе Kim et al., 2011 (Nat Protoc 6: 761-771). Конечное снятие защиты (и ацетилирование) и последующее отщепление пептидомиметика по данному изобретению от смолы осуществляется по протоколу, описанному в разделе «Примеры».
Композиции и наборы по данному изобретению
Данным изобретением предлагаются композиции, содержащие пептидомиметики по данному изобретению.
По одному из воплощений данного изобретения предлагаются композиции, содержащие пептидомиметики по данному изобретению для применения в диагностических целях или в качестве препарата для иммунологического анализа.
В частности, настоящим изобретением предлагаются композиции, содержащие пептидомиметики по данному изобретению для применения при диагностировании и/или прогнозировании сердечнососудистых заболеваний.
В другом воплощении данного изобретения предлагаются композиции, в частности фармацевтические композиции, содержащие пептидомиметики по данному изобретению для применения в качестве медикамента.
Настоящим изобретением также предлагаются композиции, содержащие пептидомиметики по данному изобретению для применения при лечении сердечнососудистых заболеваний.
В другом аспекте данного изобретения предлагается набор для выявления антител против аполипопротеина Α-I, играющих роль биологических маркеров сердечнососудистых заболеваний, в образцах биологических жидкостей, причем этот набор содержит по меньшей мере один пептидомиметик по данному изобретению или его вариант, или их комбинацию.
В одном из частных случаев воплощения данного изобретения предлагаемый набор включает по меньшей мере один пептидомиметик, аминокислотная последовательность которого содержит какую-либо из последовательностей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24 и SEQ ID NO: 18 или их вариантов.
В другом воплощении данного изобретения предлагаемый набор включает по меньшей мере один пептидомиметик, аминокислотная последовательность которого содержит какую-либо из последовательностей SEQ ID NO: 8, SEQ ID NO: 9 или их вариантов.
В другом воплощении данного изобретения предлагаемый набор включает по меньшей мере один пептидомиметик, аминокислотная последовательность которого содержит последовательность SEQ ID NO: 25.
В другом воплощении данного изобретения предлагаемый набор включает по меньшей мере один пептидомиметик, аминокислотная последовательность которого содержит последовательность SEQ ID NO: 5 или ее вариант.
В частности, аминокислотная последовательность указанного по меньшей мере одного пептидомиметика содержит последовательность SEQ ID NO: 5, в которой делегированы два последних аминокислотных остатка Ε и N в С-концевом участке последовательности SEQ ID NO: 5.
В другом частном случае воплощения данного изобретения предлагаемый набор включает по меньшей мере один пептидомиметик, аминокислотная последовательность которого содержит последовательность SEQ ID NO: 21.
В другом частном случае воплощения данного изобретения предлагаемый набор включает по меньшей мере один пептидомиметик, аминокислотная последовательность которого содержит последовательность SEQ ID NO: 23.
В еще одном воплощении данного изобретения предлагаемый набор включает по меньшей мере один пептидомиметик, выбираемый из:
(i) пептидомиметика, аминокислотная последовательность которого содержит последовательность SEQ ID NO: 19 и внутримолекулярную сшивку, представляющую собой лактамный мостик, изображенный на фиг. 2С, который связывает, остаток глутаминовой кислоты (Е) в положении 19 и остаток лизина (К) в положении 23;
(ii) пептидомиметика, аминокислотная последовательность которого содержит последовательность SEQ ID NO: 15 и внутримолекулярную сшивку, представляющую собой углеводородную сшивку, изображенную на фиг. 2В, которая связывает остаток (R)-2-(7'-октенил)-аланина в положении 16 и остаток (S)-2-(4'-пентенил)-аланина в положении 23;
(iii) пептидомиметика, аминокислотная последовательность которого содержит последовательность SEQ ID NO: 16 и внутримолекулярную сшивку, представляющую собой углеводородную сшивку, изображенную на фиг. 2В, которая связывает остаток (S)-2-(4'-пентенил)-аланина в положении 13 и остаток (S)-2-(4'-пентенил)-аланина в положении 17;
(iv) пептидомиметика, аминокислотная последовательность которого содержит последовательность SEQ ID NO: 17 и внутримолекулярную сшивку, представляющую собой углеводородную сшивку, изображенную на фиг. 2В, которая связывает остаток (R)-2-(7'-октенил)-аланина в положении 9 и остаток (S)-2-(4'-пентенил)-аланина в положении 16.
В еще одном воплощении данного изобретения предлагаемый набор включает по меньшей мере один пептидомиметик, выбираемый из:
(i) пептидомиметиков, аминокислотная последовательность которых содержит последовательность SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19 или SEQ ID NO: 20;
(ii) пептидомиметиков, аминокислотная последовательность которых содержит последовательность SEQ ID NO: 13, SEQ ID NO: 22 или SEQ ID NO: 24.
В другом своем аспекте данное изобретение относится к набору для осуществления способа по данному изобретению.
Этот набор по данному изобретению включает по меньшей мере один пептидомиметик по данному изобретению, его вариант или комбинацию таких пептидов для присоединения к твердому материалу, называемому в настоящем документе твердофазной подложкой.
По данному изобретению можно использовать различные твердые материалы в качестве подложки, включая (но не ограничиваясь перечисленным здесь) стекло, полистирол, полипропилен, нитроцеллюлозу, кварц, керамику, декстран или иные материалы. По форме подходящие твердые подложки включают шарики, микрочастицы, наночастицы, стенки пробирки, тканый или листовой материла, пленки, пластинки, лунки, образованные указанными материалами или покрытые ими. Обычно твердая подложка включает лунки, как в 96-луночном планшете для микротитрования.
Связывание или иммобилизация пептидомиметиков по данному изобретению на твердый материал в наборе по данному изобретению осуществляется путем адсорбции или химического присоединения к твердофазной подложке. Можно использовать любые известные в данной области техники средства иммобилизации белков или пептидов на твердой подложке. Пептиды по данному изобретению могут быть ковалентно или не ковалентно связаны с материалом твердой подложки путем таких методов, как ковалентное присоединение через амидную или эфирную связь либо адсорбция. Пептиды можно связывать, используя такие пары связывающихся друг с другом веществ, как биотин-авидин или антитело-антиген. После того, как пептид иммобилизован на твердой подложке, ее можно инкубировать с блокирующим раствором (содержащим блокирующий белок, например бычий сывороточный альбумин), чтобы сократить неспецифичную адсорбцию антител, содержащихся в анализируемом образце, на поверхности подложки. В одном из вариантов данного изобретения пептидомиметики можно синтезировать прямо на твердой подложке, входящей в набор по данному изобретению.
В одном из воплощений данного изобретения в тех случаях, когда предлагаемый набор включает по меньшей мере один пептидомиметик по данному изобретению или его вариант, или комбинацию таких пептидов для присоединения к твердому материалу, служащему твердофазной подложкой, указанный набор при необходимости также включает реагенты для этого присоединения и/или соответствующий материал твердой подложки для осуществления иммунологического анализа.
В другом воплощении данного изобретения предлагаемый набор также включает по меньшей мере один реагент для промывания, чтобы удалять не связавшиеся вещества перед проведением собственно определения искомого агента, чтобы избежать при этом излишнего фона/шума. Типичные реагенты для промывания включают стандартные буферные растворы, известные в данной области техники.
В другом воплощении данного изобретения предлагаемый набор также включает по меньшей мере один контрольный образец и при необходимости информацию по калибровке для количественного определения выявляемых антител против аполипопротеина A-I.
В другом воплощении данного изобретения предлагается планшет для иммунологического анализа, несущий по меньшей мере один пептидомиметик по данному изобретению, его вариант или их комбинацию, связанные с твердым материалом, служащим твердофазной подложкой.
Применения и способы по данному изобретению
В одном из аспектов данного изобретения предлагается способ выявления эндогенных антител против аполипопротеина Α-I в образцах биологических жидкостей млекопитающих, включающий этапы:
(a) забор образца биологической жидкости у млекопитающего;
(b) контактирование указанного образца биологической жидкости с твердой подложкой, несущей по меньшей мере один пептидомиметик по данному изобретению, причем это контактирование происходит в условиях, достаточных для связывания антител против аполипопротеина Α-I, присутствующих в указанном образце биологической жидкости, с указанным по меньшей мере одним пептидомиметиком путем взаимодействий антиген-антитело;
(c) удаление не связавшихся антител с поверхности указанной твердой подложки;
(d) выявление присутствия комплексов антиген-антитело, связанных с указанной твердой подложкой;
при этом присутствие указанных комплексов является свидетельством того, что данный образец биологической жидкости содержит эндогенные антитела против аполипопротеина Α-I.
В другом аспекте данного изобретения предлагается способ выявления сердечнососудистых заболеваний по образцу биологической жидкости млекопитающего, включающий этапы:
(a) забор образца биологической жидкости у млекопитающего;
(b) контактирование указанного образца биологической жидкости с твердой подложкой, несущей по меньшей мере один пептидомиметик по данному изобретению, причем это контактирование происходит в условиях, достаточных для связывания антител против аполипопротеина Α-I, присутствующих в указанном образце биологической жидкости, с указанным по меньшей мере одним пептидомиметиком путем взаимодействий антиген-антитело;
(c) удаление не связавшихся антител с поверхности указанной твердой подложки;
(d) выявление присутствия комплексов антиген-антитело, связанных с указанной твердой подложкой;
при этом присутствие указанных комплексов является свидетельством того, что у источник данного образца биологической жидкости имеется одно или более сердечнососудистых заболеваний, ассоциированных с антителами против аполипопротеина Α-I.
В другом воплощении данного изобретения предлагается способ, в котором аминокислотная последовательность указанного по меньшей мере одного пептидомиметика содержит аминокислотную последовательность, выбираемую из последовательностей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24 и SEQ ID NO: 18 и любых их вариантов.
В одном из частных случаев воплощения данного изобретения предлагается способ, в котором аминокислотная последовательность указанного по меньшей мере одного пептидомиметика содержит аминокислотную последовательность, выбираемую из последовательностей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9 и любых их вариантов.
В одном из частных случаев воплощения данного изобретения предлагается способ, в котором аминокислотная последовательность указанного по меньшей мере одного пептидомиметика содержит аминокислотную последовательность, выбираемую из последовательностей SEQ ID NO: 8, SEQ ID NO: 9 и любых их вариантов.
В одном из частных случаев воплощения данного изобретения предлагается способ, в котором аминокислотная последовательность указанного по меньшей мере одного пептидомиметика содержит последовательность SEQ ID NO: 25.
В другом частном случае воплощения данного изобретения предлагается способ, в котором аминокислотная последовательность указанного по меньшей мере одного пептидомиметика содержит аминокислотную последовательность SEQ ID NO: 5 или какой-либо ее вариант, в частности вариант, содержащий последовательность SEQ ID NO: 5, в которой делегированы два последних аминокислотных остатка Ε и N в С-концевом участке последовательности SEQ ID NO: 5.
В одном из частных случаев воплощения данного изобретения предлагается способ, в котором аминокислотная последовательность указанного по меньшей мере одного пептидомиметика содержит последовательность SEQ ID NO: 21.
В одном из частных случаев воплощения данного изобретения предлагается способ, в котором аминокислотная последовательность указанного по меньшей мере одного пептидомиметика содержит последовательность SEQ ID NO: 23.
В другом частном случае воплощения данного изобретения предлагается способ, в котором аминокислотная последовательность указанного по меньшей мере одного пептидомиметика содержит аминокислотную последовательность, выбираемую из последовательностей SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24 и SEQ ID NO: 18 и любых их вариантов.
В другом воплощении данного изобретения предлагается способ, в котором аминокислотная последовательность указанного по меньшей мере одного пептидомиметика содержит аминокислотную последовательность, выбираемую из последовательностей SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20 и любых их вариантов.
В другом воплощении данного изобретения предлагается способ, в котором аминокислотная последовательность указанного по меньшей мере одного пептидомиметика содержит аминокислотную последовательность, выбираемую из последовательностей SEQ ID NO: 13, SEQ ID NO: 22 или SEQ ID NO: 24 и любых их вариантов.
В еще одном воплощении данного изобретения предлагается способ, в котором указанный по меньшей мере один пептидомиметик содержит что-либо из следующего:
(i) аминокислотную последовательность SEQ ID NO: 19 с лактамным мостиком, изображенным на фиг. 2С, связующим аминокислотный остаток Ε в положении 19 с остатком К в положении 23 указанной последовательности;
(ii) аминокислотную последовательность SEQ ID NO: 15 с углеводородной сшивкой, изображенной на фиг. 2В и связующей остаток (R)-2-(7'-октенил)-аланина в положении 16 и (S)-2-(4'-пентенил)-аланина в положении 23 указанной последовательности;
(iii) аминокислотную последовательность SEQ ID NO: 16 и внутримолекулярную сшивку по пункту с), являющуюся углеводородной сшивкой, изображенной на фиг. 2В и связующей остаток (S)-2-(4'-пентенил)-аланина в положении 13 и (S)-2-(4'-пентенил)-аланина в положении 17 указанной последовательности;
(iv) аминокислотную последовательность SEQ ID NO: 17 и внутримолекулярную сшивку по пункту с), являющуюся углеводородной сшивкой, изображенной на фиг. 2В и связующей остаток (R)-2-(7'-октенил)-аланина в положении 9 and (S)-2-(4'- пентенил)-аланина в положении 16 указанной последовательности.
В еще одном воплощении данного изобретения предлагается способ, в котором указанный по меньшей мере один пептидомиметик содержит что-либо из следующего:
(i) аминокислотную последовательность SEQ ID NO: 13, SEQ ID NO: 22 или SEQ ID NO: 24;
(ii) аминокислотную последовательность SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19 или SEQ ID NO: 20.
В другом воплощении данного изобретения предлагается способ, в котором указанный по меньшей мере один пептидомиметик содержит что-либо из следующего:
(i) аминокислотную последовательность SEQ ID NO: 19 с лактамным мостиком, изображенным на фиг. 2С, связующим аминокислотный остаток Ε в положении 19 с остатком К в положении 23 указанной последовательности;
(ii) аминокислотную последовательность SEQ ID NO: 15 с углеводородной сшивкой, изображенной на фиг. 2В и связующей остаток (R)-2-(7'-октенил)-аланина в положении 16 и (S)-2-(4'-пентенил)-аланина в положении 23 указанной последовательности;
(iii) аминокислотную последовательность по пункту b), содержащую последовательность SEQ ID NO: 16 и внутримолекулярную сшивку по пункту с), являющуюся углеводородной сшивкой, изображенной на фиг. 2В и связующей остаток (S)-2-(4'-пентенил)-аланина в положении 13 и (S)-2-(4'-пентенил)-аланина в положении 17 указанной последовательности;
(iv) аминокислотную последовательность по пункту b), содержащую последовательность SEQ ID NO: 17 и внутримолекулярную сшивку по пункту с), являющуюся углеводородной сшивкой, изображенной на фиг. 2В и связующей остаток (R)-2-(7'-октенил)-аланина в положении 9 и (S)-2-(4'-пентенил)-аланина в положении 16 указанной последовательности.
В еще одном воплощении данного изобретения предлагается способ, в котором указанный по меньшей мере один пептидомиметик состоит из какой-либо последовательности из следующих:
(i) аминокислотной последовательности SEQ ID NO: 13, SEQ ID NO: 22, SEQ ID NO: 24 или какого-либо из их вариантов;
(ii) аминокислотной последовательности SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20 или какого-либо из их вариантов.
В другом воплощении данного изобретения предлагается способ, в котором указанный образец биологической жидкости контактирует с указанной твердой подложкой (см. этап b), с которой связан по меньшей мере один пептидомиметик или его вариант.
В другом воплощении данного изобретения предлагается способ, который включает также этап сравнения сигнала, полученного на этапе выявления (см. этап d) с аналогичным сигналом, полученным для по меньшей мере одного контрольного образца, причем сигнал для указанного по меньшей мере одного контрольного образца регистрируют до либо после этапа выявления (d) для указанного образца биологической жидкости, либо одновременно с ним.
Выявление захваченных/связанных антител на этапе (d) можно осуществлять любым подходящим методом для выявления захваченных на поверхности антител или белков, известным в данной области техники, например путем оптической детекции (например, методом твердофазного иммуноферментного анализа ELISA), путем детекции изменений, связанных с изменениями массы (например, методом поверхностного плазмонного резонанса, масс-спектрометрии), путем электрической детекции (например, методом импедансной спектрометрии, электрохимическими методами).
Результаты такого анализа могут быть качественными или количественными. Количество захваченных/связанных антител на твердой подложке можно сравнивать с данными, полученными для положительных и отрицательных контролей. Обычно определение в контролях проводят параллельно с определениями в исследуемых образцах. Положительным контролем может служить сыворотка крови или раствор, содержащие антитела, проявляющие иммунореактивность в отношении аполипопротеина Α-I. Отрицательным контролем может служить сыворотка крови или раствор, не содержащие антител, проявляющих иммунореактивность в отношении аполипопротеина Α-I. Для количественной оценки получают калибровочную кривую, используя известные количества антител против аполипопротеина Α-I, и/или применяют ее. Антитела для положительных контролей можно получить, используя целую аминокислотную последовательность аполипопротеина Α-I или же ее фрагменты.
Сравнение с образцами нормальных (взятых у здоровых индивидов) биологических жидкостей можно проводить различными методами. В одном из воплощений данного изобретения оно включает контрольную реакцию с образцом крови от здорового индивида. В другом воплощении данного изобретения оно осуществляется с использованием величин, полученных для концентрации эндогенных антител против аполипопротеина Α-I в типическом образце биологической жидкости, взятом у здорового индивида. Обычно уровень эндогенных антител против аполипопротеина Α-I в исследуемом образце сравнивают со значениями, полученными при каждой процедуре анализа, или с предварительно определенным значением. Предварительное определение можно проводить для данной аналитической процедуры в целом или же можно брать значение только для конкретного набора аналитических реагентов. Например, референсное значение можно брать для только для конкретного межповерочного интервала или же определять его повторно после калибровки для данной аналитической процедуры.
Способы, наборы и применения по данному изобретению могут быть пригодны для скрининговых задач, а также для диагностических целей, причем их можно использовать как для первичной диагностики, так и для отслеживания течения заболевания в ходе или после лечения.
В частности, способы, наборы и применения по данному изобретению могут быть пригодны для:
i) диагностических целей применительно к индивидам с острой болью в груди для исключения (или наоборот) ишемии миокарда и, таким образом, для диагностирования острого коронарного синдрома;
ii) прогнозирования и возможного лечения применительно к индивидам с острой болью в груди, острым коронарным синдромом, ревматоидным артритом, системной красной волчанкой, тяжелым стенозом сонной артерии, терминальной стадией почечной недостаточности или периодонтитом, поскольку данное изобретение позволяет идентифицировать среди пациентов подгруппы тех, для кого высок риск сердечнососудистых заболеваний, и, таким образом, идентифицировать подгруппы больных, которым может помочь описанная в настоящем документе специфическая терапия, нацеленная на ликвидацию негативных эффектов антител против аполипопротеина A-I.
Указанные выше диагностические, прогностические и терапевтические задачи актуальны как в первичной, так и во вторичной профилактике.
Способы, наборы и применения по данному изобретению могут быть пригодны, в частности, также для определения того, могут ли такие превентивные или лечебные мероприятия по поводу сердечно-сосудистых заболеваний, как способы, включающие введение по меньшей мере одного пептидомиметика по данному изобретению, принести пользу пациентам с острой болью в груди, острым коронарным синдромом, ревматоидным артритом, системной красной волчанкой, тяжелым стенозом сонной артерии, терминальной стадией почечной недостаточности или периодонтитом, у которых не отмечаются обычные факторы риска сердечно-сосудистых заболеваний (включая табакокурение, потребление алкогольных напитков, высокое кровяное давление, высокий уровень холестерина в крови, избыточную массу тела, недостаточную физическую активность, нездоровое питание).
Описанные в настоящем документе прогностические и/или диагностические способы анализа можно использовать для того, чтобы определить, принесет ли пользу данному индивиду введение агента (например, лекарственного препарата) для предотвращения и/или лечения сердечно-сосудистого заболевания. Например, такие аналитические способы можно применять для того, чтобы определить, принесет ли пользу данному индивиду введение терапевтического агента, пригодного для лечения сердечнососудистых заболеваний, например аполипопротеина Α-I, пептидомиметика по данному изобретению, внутривенно вводимых иммуноглобулинов (IVIG) или эплеренона.
Внутривенные иммуноглобулины (IVIG) - это вводимый внутривенно кровепродукт.Он содержит объединенные поливалентные иммуноглобулины IgG, выделенные из плазмы крови более чем тысячи доноров. Обычно дозировка IVIG зависит от медицинских показаний. В случаях первичной дисфункции иммунной системы применяется дозировка 100-400 мг/кг массы тела каждые 3-4 недели. В случаях неврологических и аутоиммунных заболеваний применяется дозировка 2 г/кг массы тела за 5-дневный курс, проводимый раз в месяц на протяжении 3-6 месяцев. Затем назначается поддерживающая терапия: 100-400 мг/кг массы тела каждые 3-4 недели.
Эплеренон (систематическое название согласно номенклатуре IUPAC прегн-4-ен-7,21-дикарбоновая кислота, 9,11-эпокси-17-гидрокси-3-оксо, γ-лактон, метиловый эфир (7α, 11α, 17α)) является антагонистом альдостерона; этот препарат используется как дополнительный при лечении хронической сердечной недостаточности. Он предназначен специально для снижения сердечно-сосудистого риска у больных, перенесших инфаркт миокарда.
Таким образом, одним из аспектов данного изобретения является способ определять, принесет ли пользу введение терапевтического агента для предотвращения и/или лечения сердечно-сосудистого заболевания данному индивиду, в частности пациенту с острой болью в груди, острым коронарным синдромом, ревматоидным артритом, системной красной волчанкой, тяжелым стенозом сонной артерии, терминальной стадией почечной недостаточности или периодонтитом.
Другим аспектом данного изобретения является способ отслеживать течение сердечно-сосудистого заболевания у пациента в ходе или после лечения. С этой целью выявляют антитела против аполипопротеина Α-I в биологических образцах, взятых у данного индивида до, в течение или после проведения лечения. Снижение количества антител против аполипопротеина Α-I, выявленных после лечения, указывает на то, что данному пациенту можно и дальше проводить такое лечение. Отсутствие антител против аполипопротеина Α-I после лечения указывает на то, что лечение можно прекратить или продолжить с меньшей интенсивностью (снизить частоту введения терапевтического агента и/или его дозу).
Информация, получаемая при применении описанных выше способов на практике полезна для прогнозирования и определения прогрессирования заболеваний, а также других патологических состояний, влияющих на здоровье индивида, и для клинического ведения пациентов с этими заболеваниями или состояниями. Конкретнее, эта информация помогает врачам назначать терапевтические и другие лечебные мероприятия в случаях сердечно-сосудистых заболеваний, в частности у индивидов с острой болью в груди, острым коронарным синдромом, ревматоидным артритом, системной красной волчанкой, тяжелым стенозом сонной артерии, терминальной стадией почечной недостаточности или периодонтитом.
В другом аспекте данного изобретения предлагается способ предотвращения и/или лечения сердечно-сосудистых заболеваний или состояний у нуждающихся в том индивидов, включающий введение пациенту пептидомиметика по данному изобретению или включающей его фармацевтической композиции.
В другом аспекте данного изобретения предлагается способ предотвращения и/или лечения сердечно-сосудистых заболеваний или состояний у нуждающихся в том индивидов, включающий введение пациенту структурного (по пространственной структуре) аналога пептидомиметика по данному изобретению.
В контексте данного изобретения структурный аналог пептидомиметика может быть каким-либо химическим веществом (в частности, какой-либо небольшой молекулой), которое найдено в библиотеке химических соединений либо сконструировано таким образом, что обладает пространственной структурой, сходной с таковой указанного пептидомиметика.
В одном из частных случаев воплощения данного изобретения предлагается способ предотвращения и/или лечения сердечно-сосудистых заболеваний, включающий введение индивиду, у которого способом по данному изобретению выявлено наличие эндогенных антител против аполипропротеина Α-I, по меньшей мере одного из следующего: (i) пептидомиметика по данному изобретению или включающей его фармацевтической композиции, (ii) структурного (по пространственной структуре) аналога пептидомиметика по данному изобретению, (iii) фармацевтической композиции, содержащей аполипопротеин Α-I, и (iv) агента, пригодного для предотвращения и/или лечения сердечно-сосудистого заболевания, например внутривенных иммуноглобулинов или эплеренона.
В одном из частных случаев воплощения данного изобретения предлагаемый способ применяется в отношении индивидов с острой болью в груди, острым коронарным синдромом, ревматоидным артритом, системной красной волчанкой, тяжелым стенозом сонной артерии, терминальной стадией почечной недостаточности или периодонтитом.
В другом воплощении данного изобретения предлагаемый способ для предотвращения и/или лечения сердечно-сосудистых заболеваний применяется к индивидам с острой болью в груди, острым коронарным синдромом, ревматоидным артритом, системной красной волчанкой, тяжелым стенозом сонной артерии, терминальной стадией почечной недостаточности или периодонтитом, у которых с помощью способа выявления антител к аполипопротеину Α-I по данному изобретению, диагностировано наличие эндогенных антител к аполипопротеину A-I.
В еще одном воплощении данного изобретения указанные индивиды не имеют таких обычно наблюдаемых факторов сердечно-сосудистого риска, как табакокурение, потребление алкоголя, высокое кровяное давление, высокий уровень холестерина в крови, избыточная масса тела, недостаточная физическая активность, нездоровое питание.
В другом аспекте данного изобретения предлагается применение пептидомиметиков по данному изобретению для получения медикаментозного средства, в частности для получения медикамента для предотвращения и/или лечения сердечнососудистых заболеваний. В другом аспекте данного изобретения предлагается применение пептидомиметиков по данному изобретению для получения диагностической композиции или препарата для иммунологического анализа, в частности для диагностирования сердечно-сосудистых заболеваний.
Способ введения
Вещества, композиции, в частности фармацевтические композиции, по данному изобретению и включающие их препараты можно вводить пациенту любым путем, включая пероральный, парентеральный, внутривенный, подкожный, ректальный или их сочетания. Парентеральное введение включает (но не ограничивается перечисленным здесь) внутривенное, интраартериальное, внутрибрюшинное, подкожное, интрадермальное и внутримышечное введение. Композиции по данному изобретению можно вводить в организм пациента в форме имплантата, обеспечивающего медленное высвобождение композиции, а также путем медленной регулируемой внутривенной инфузии.
В частности, вещества, композиции, в том числе фармацевтические композиции, по данному изобретению и включающие их препараты вводят пациенту подкожно.
В одном из воплощений данного изобретения введение предлагаемых композиций предполагает множественные последовательные инъекции.
В одном из частных случаев воплощения данного изобретения предлагаемую фармацевтическую композицию можно вводить повторно либо непрерывно. Фармацевтическую композицию по данному изобретению можно вводить повторно или непрерывно на протяжении по меньшей мере 1, 2, 3 или 4 недель; 2, 3, 4, 5, 6, 8, 10 или 12 месяцев; или 2, 3, 4 или 5 лет.
Комбинации
Пептидомиметики по данному изобретению или содержащие их фармацевтические композиции можно вводить пациентам сами по себе или же в сочетании с сопутствующими агентами, полезными для предотвращения и/или лечения сердечнососудистых заболеваний.
В другом воплощении данного изобретения предлагаемую фармацевтическую композицию вводят с другим терапевтическим агентом, полезным для предотвращения и/или лечения сердечно-сосудистых заболеваний, например с аспирином, бета-блокаторами, ингибитором ангиотензин-превращающего фермента и статинами.
В данное изобретение входит такое введение индивиду предлагаемых пептидомиметиков, когда оно осуществляется до или после применения (или одновременно с ним) других терапевтических схем лечения или сопутствующих агентов, полезных для предотвращения и/или лечения сердечно-сосудистых заболеваний (например, в схемах комбинированного лекарственного лечения), в терапевтически эффективных количествах. Пептидомиметики по данному изобретению, вводимые одновременно с указанными сопутствующими агентами, можно вводить в составе тех же либо других композиций и теми же либо другими путями введения.
Пациенты
В одном из воплощений данного изобретения пациентами являются индивиды с сердечно-сосудистыми заболеваниям или с подозрением на наличие у них таких заболеваний.
В одном из частных случаев воплощения данного изобретения пациентами являются индивиды, экстренно госпитализированные с острой болью в груди.
В другом воплощении данного изобретения пациентами являются индивиды, экстренно госпитализированные с острой болью в груди, у которых было диагностировано сердечно-сосудистое заболевание после проведения прогностического и/или диагностического анализа по данному изобретению.
В еще одном воплощении данного изобретения пациентами являются индивиды с острой болью в груди, острым коронарным синдромом, ревматоидным артритом, системной красной волчанкой, тяжелым стенозом сонной артерии, терминальной стадией почечной недостаточности или периодонтитом.
В еще одном воплощении данного изобретения у пациентов отсутствуют такие обычно наблюдаемые факторы сердечно-сосудистого риска, как табакокурение, потребление алкоголя, высокое кровяное давление, высокий уровень холестерина в крови, избыточная масса тела, недостаточная физическая активность, нездоровое питание.
В другом воплощении данного изобретения пациентами являются индивиды с острой болью в груди, острым коронарным синдромом, ревматоидным артритом, системной красной волчанкой, тяжелым стенозом сонной артерии, терминальной стадией почечной недостаточности или периодонтитом, у которых было диагностировано сердечно-сосудистое заболевание после проведения прогностического и/или диагностического анализа по данному изобретению.
Цитируемые в настоящем документе литературные источники полностью включаются в него путем отсылки. Данное изобретение не ограничивается объемом конкретных его воплощений, описанных в настоящем документе, которые предназначены лишь для иллюстрации отдельных аспектов данного изобретения, и в его объем входят функционально эквивалентные способы и компоненты. Собственно, из приведенного ниже описания и прилагаемых иллюстраций специалистам в данной области техники должны быть очевидны различные модификации данного изобретения помимо тех, что представлены и описаны в настоящем документе. Подразумевается, что такие модификации входят в объем прилагаемой формулы изобретения.
В свете приведенного в настоящем документе описания данного изобретения нижеследующие примеры представлены в качестве иллюстративного материала и не имеют ограничительного характера.
Примеры
Приводимые здесь сокращения относятся соответственно к определениям, представленным ниже.
аа (аминокислота); AUC (площадь под кривой), ч (час), мкл (микролитр), мкМ (микромолярный), мМ (миллимолярный), мг (миллиграм), мин (минута), нм (нанометр), BSA (бычий сывороточный альбумин), CI (доверительный интервал), CH2Cl2 (дихлорметан), DIPEA (диизопропилэтиламин), DMF (диметилформамид), EDTA (этилендиаминтетрауксусная кислота), HCTU (2-(6-хлор-1-Н-бензотриазол-1-ил)-1,1,3,3-тетраметил-аминийгексафтор-фосфат), HoBt (N-гидрокси-бензотриазол), OR (отношение шансов), PBS (забуференный фосфатом физиологический раствор), РуВОР (бензотриазол-1-ил-окси-трис-пирролидино-фосфоний гексафтор-фосфат), PyClock (6-хлор-бензотриазол-1-ил-окси-трис-пирролидино-фосфоний гексафторфосфат), TFA (трифторуксусная кислота), TIS (триизопропилсилан).
Материалы и методы
Пептидный синтез
Линейные пептиды, производные с С-концевой тиоэфирной группой для нативного химического лигирования (Dawson et al., 1994, Science 266:776-779) и некоторые аналоги с лактамными мостиками (F3L1) получали путем твердофазного синтеза по Меррифилду с Вос-защитой на синтезаторе ABI 433А, приспособленным для Вос-стратегии (Wilken and Kent, 1998, Curr Opin Biotechnol 9:412-426). Отщепление от смолы осуществляли с помощью фтористого водорода.
Чтобы создать лактамные мостики, использовали ортогональные наборы защитных групп (O-Fm и Fmoc) для, соответственно, глутаминовой кислоты (Glu) и лизина (Lys); лактамный мостик образовывался на смоле после отщепления защитных групп (флуоренилметилкарбамата) с использованием 20%-ного пиперидина в течение 1 часа.
Лактамную циклизацию осуществляли с 3 эквивалентами реагента Pyclock и 9 эквивалентами DIEA в течение 2 суток и отслеживали с помощью нингидриновой реакции по Кайзеру (Kaiser et al., 1970, Anal Biochem 34:595-598.
Длина пептидов EF (Ala190-Thr242 ApoA-I, т.е. 53 аминокислотных остатка) вызывала необходимость синтезировать два фрагмента (Ala190-Arg215 и Gln216-Thr242), которые потом соединяли путем нативного химического лигирования (метод NCL) (Dawson et al., 1994, Science 266:776-779). Поскольку для реализации метода NCL нужно наличие остатка цистеина на N-конце С-концевого фрагмента, в аминокислотной последовательности аполипопротеина Α-I приходилось заменять Gln216 на остаток Cys. Этот остаток алкилировали с помощью иодацетамида после стадии лигирования с образованием аналога глутамина (боковая цепь не СН2-СН2-CONH2, a CH2-S-CH2-CONH2). Также, поскольку концы пептиды замыкались в кольцо дисульфидным мостиком, к N-концу фрагмента Ala190-Arg215 и к С-концу фрагмента Gln216-Thr242 добавляли остатки Cys(Acm). Депротекция происходила с помощью HgOAc после алкилирования продукта лигирования и окисления под действием Н2О2. Наилучшие результаты циклизации получались, когда брали 20 эквивалентов Н2О2 и реакцию проводили в течение 30 минут при рН 7,0, после чего сразу же осуществляли очистку путем высокоэффективной жидкостной хроматографии с обращенной фазой (RP-HPLC).
Для создания некоторых линейных пептидов с лактамными мостиками применяли также твердофазный синтез с Fmoc-защитой. В этом случае использовали пару ортогональных защитных групп (аллил/аллилоксикарбонил) для остатков глутаминовой кислоты и лизина. Эти защитные группы удаляли с помощью 3 эквивалентов Pd(PPh3)4 в смеси CHCl3-АсОН-N-метилморфолин (37:2:1) в течение 2 часов по методике, описанной в работе Kates et al. (30), до циклизации пептида.
Все пептиды с углеводородными сшивками синтезировали на амидной МВНА-смоле Rink (нагрузка 0,56 ммоль/г), используя стандартные протоколы твердофазного синтеза по Fmoc-стратегии в масштабе 100 мкмоль с помощью пептидного синтезатора Prelude (Protein Technologies Inc., Таксон, США). Один цикл удлинения пептида состоял из следующих этапов: (i) нагруженную смолу сначала промывали DMF (3 раза по 30 секунд) концевую защитную группу Fmoc удаляли смесью 20%-ного пиперидина с DMF (2 раза по 10 минут); (ii) смолу после депротекции промывали DMF (6 раз по 30 с) и обрабатывали в течение 30 мин раствором, содержащим 5 эквивалентов соответствующей Fmoc-аминокислоты, 5 экв. HCTU и 10 экв. DIPEA; (iii) затем смолу промывали NMP (3 раза по 30 с), не прореагировавшие аминогруппы ацетилировали 10%-ным (объем/объем) раствором уксусного ангидрида в DMF (1 раз в течение 10 мин) и промывали смолу DMF (6 раз по 30 с). Эти этапы повторяли до тех пор, пока не завершалось образование желаемой аминокислотной последовательности пептида.
Присоединение α-метил,α-алкенилглицина осуществляли «вручную», как было описано в работе (Kim et al., 2011, Nat Protoc 6:761-771) с небольшими изменениями. После депротекции смолу обрабатывали в течение 2 часов раствором, содержащим 2 экв. аминокислоты, 2 экв. реагента Pyclock и 4 экв. DIPEA. Если нужно было двойное присоединение, этот этап повторяли. Следующую по аминокислотной последовательности аминокислоту присоединяли также «вручную» на этапе двойного присоединения в течение 2 часов с раствором, содержащим 5 экв. аминокислоты, 5 экв. реагента PyClock и 15 экв. DIEA.
Когда удалялась последняя защитная группа Fmoc, смолу обрабатывали раствором 10% (объем/объем) уксусного ангидрида и 1% (объем/объем) DIPEA в DMF (1 раз в течение 10 мин) для ацетилирования N-концов. Затем смолу промывали DMF (5×30 с) и CH2Cl2 (5 раз по 30 с), высушивали в вакууме в течение 20 мин, после чего обрабатывали в течение 90 мин раствором для отщепления, содержащим 2,5% (объем/объем) воды, 2,5% (объем/объем) триизопропилсилана и 5% фенола в TFA.
Реакция метатезиса с замыканием цикла (RCM)
Реакцию метатезиса с замыканием цикла (RCM) применительно ко всем пептидам, содержащим алкенилированные (олефиновые) производные аминокислот, осуществляли с Fmoc-защитой на амидной МВНА-смоле Rink с дихлор(о-изопропоксифенилметилен)(трициклогексилфосфин)рутением(II) в качестве катализатора, как описано в работе Kim et al., 2011, Nat Protoc 6:761-771). Смолу промывали последовательно DCM и DCE, затем обрабатывали 6 мМ раствором катализатора Граббса первого поколения в DCE (4,9 мг/мл, 0,2 экв. с учетом степени замещения смолы) в течение 2 часов, при этом раствор непрерывно барботировали азотом (не интенсивно). Реакцию метатезиса с замыканием цикла повторяли дважды. За ходом реакции следили с помощью высокоэффективной жидкостной хроматографии (HPLC) и масс-спектрометрии с ионизацией электрораспылением (ESI-MS), отделяя небольшие образцы смолы. Окончательную депротекцию (и ацетилирование) и последующее отщепление пептида от смолы осуществляли по описанному выше протоколу.
Очистка и анализ пептидов
Масс-спектрометрический анализ осуществляли с помощью масс-спектрометра Micromass-Platform LCZ. Аналитическую высокоэффективную жидкостную хроматографию (HPLC) с обращенной фазой осуществляли с помощью сепарационного модуля Waters 2795 с ультрафиолетовым детектором (214 нм); при этом использовали колонку Phenomenex-Aeris Widepore (3,6 мкм; XB С8; 4,6 мм × 150 мм). Препаративную HPLC осуществляли с помощью модуля Delta 600 с ультрафиолетовым детектором 2487; при этом использовали колонку Vydac С8 (внутренний диаметр 250×22; размер частиц 10 мкм). Для элюирования использовали 0,1%-ный водный раствор TFA и 0,1%-ный раствор TFA в смеси ацетонитрил:вода (9:1, объем/объем).
Выход каждого акта синтеза оценивали путем высокоэффективной жидкостной хроматографии (HPLC) и масс-спектрометрии с ионизацией электрораспылением (ESI-MS) неочищенной реакционной смеси. Затем пептиды очищали до гомогенного состояния путем HPLC с обращенной фазой. Идентичность и чистоту очищенных пептидов определяли путем аналитической HPLC и масс-спектрометрического анализа.
Скрининг по образцам сыворотки крови индивидов с острой болью в груди, имеющих и не имеющих аутоантител против аполипопротеина A-I
Использовали такие образцы сыворотки крови, какие описаны в ранее опубликованном исследовании, охватывавшем 138 пациентов, поступивших в отделение неотложной помощи с острой болью в груди (Keller et al., 2012, J Intern Med 271:451-462). Целью этого исследования было определение точности диагностирования по иммунореактивности IgG против аполипопротеина Α-I в самых первых образцах крови, взятых в отделении неотложной помощи при (i) инфаркте миокарда без подъема сегмента ST (NSTEMI) и (ii) последующем повышении уровня тропонина I. Подробное описание забора и обработки образцов, клинические результаты и критерии включения/исключения описаны в работе Keller et al (2012, J Intern Med 271:451-462). Поскольку от шести пациентов материала было недостаточно, анализ пептидов проводили на образцах от остальных 132 индивидов.
Твердофазный иммуноферментный анализ (ELISA) образцов сыворотки крови
Иммунореактивность в образцах сыворотки крови определяли методом твердофазного иммуноферментного анализа (ELISA), как описано ранее (Vuilleumier et al., 2010, Eur Heart J 31:815-823,). Вкратце, проделывали следующее. На планшеты Maxisorp (Nunc™, Роскилле, Дания) покрывали очищенным человеческим аполипопротеином A-I без липидов (20 мкг/мл; 50 мкл на лунку) либо синтетическими пептидами из аминокислотной последовательности аполипопротеина A-I (20 мкг/мл; 50 мкл на лунку) и инкубировали в течение 1 часа при температуре 37°С. Затем лунки промывали и блокировали в течение 1 часа PBS, содержащим 2% BSA, при температуре 37°С. После этого в лунки вносили образцы сыворотки крови в двух повторах, разбавленные 1/50, и инкубировали в течение 1 часа. Образцы сыворотки вносили также в лунки без аполипопротеина Α-I либо пептидов, чтобы определить неспецифичное связывание. Затем промывали шесть раз и вносили в лунки по 50 мкл раствора античеловеческих IgG, конъюгированных со щелочной фосфатазой, (Sigma-Aldrich, Сент-Луис, шт. Миссури, США), разведенных 1/1000 в растворе PBS/BSA, и инкубировали в течение 1 часа при температуре 37°С. Опять промывали шесть раз и проявляли, добавляя в качестве субстрата щелочной фосфатазы папа-нитрофенилфосфат (Sigma-Aldrich), растворенный в диэтаноламиновом буферном растворе (рН 9,8). Инкубировали в течение 20 минут при температуре 37°С, после чего определяли поглощение при 405 нм (OD405 nm) при помощи планшетного ридера (Molecular Devices Versa Max™; Molecular Device, Саннивэйл, шт. Калифорния, США). Для каждого образца из среднего значения поглощения вычитали соответствующую величину, обусловленную неспецифичным связыванием.
Проводили также конкурентный твердофазный иммуноферментный анализ для выборочных синтетических пептидов. Синтетические пептиды (растворенные в PBS, содержащем 2% BSA) в различных концентрациях инкубировали с образцами сыворотки крови от пациентов, содержащими высокие уровни IgG против аполипопротеина Α-I, в течение 2 часов при комнатной температуре, затем прибавляли в лунки, покрытые очищенным человеческим аполипопротеином Α-I без липидов (см. выше) и затем проводили анализ, как описано выше.
Статистический анализ
Статистический анализ проводили с помощью пакета программ Statistica™ (StatSoft, Талса, шт. Оклахома, США)). При необходимости использовали двусторонний точный критерий Фишера и U-критерий Манна-Уитни. Взаимосвязи между иммунореактивностью к различным пептидам и клиническими результатами исследования представляли как отношение шансов (OR) и соответствующий 95%-ный доверительный интервал. Для оценки связей между переменными использовали мультивариантный анализ с логистической регрессией. В этой модели клинические результаты были зависимыми переменными, и оценка риска инфаркта миокарда без подъема сегмента ST (NSTEMI) по шкале TIMI (Antman et al., 2000, JAMA 284:835-842; (позволявшая учесть основные сердечно-сосудистые факторы, определяющие результаты лечения пациента за 14 дней, в одной непрерывной переменной) была единственным вмешивающимся фактором из-за ограниченного объема выборки. ROC-анализ осуществляли с использованием пакета программ Analyse-it™ для Excel (Microsoft, Редмонд, шт. Вашингтон, США). Сравнение по площади под кривой (AUC) проводили, используя непараметрический тест Делонга (DeLong et al. 1988, Biometrics 44:837-845).
Эксперименты с использованием клеток: провоспалительная реакция, связанная с IgG против аполипопротеина A-I
Человеческие макрофаги, происходящие из моноцитов крови (HMDM), получали путем обработки человеческих моноцитов гамма-интерфероном (IFN-γ) в течение 24 часов, как описано ранее (Pagano et al., 2012, J Intern Med). Затем на клетки HMDM в 96-луночном планшете воздействовали в течение 24 часов в возрастающей концентрации (5-40 мкг/мл) поликлональными антителами против человеческого аполипопротеина A-I (Academy Bio-Medical Company, Хьюстон, шт. Техас, США) либо контрольными антителами (Meridian Life Science, Сакко, шт. Мэн, США), либо объединенными иммуноглобулинами G от индивидов, у которых имелись антитела против аполипопротеина A-I (pool+) или же не имелось таковых (pool-) (500 мкг/мл). На этой модели было показано, что IgG против аполипопротеина Α-I без липополисахарида (LPS) способствует продукции фактора некроза опухолей (TNF-α) и интерлейкина-6 (IL-6) зависимым от дозы образом, причем оптимальная стимуляция наблюдалась при концентрации 40 мкг/мл (Pagano et al., 2012, J Intern Med).
Для экспериментов по конкурентному ингибированию синтетические пептиды инкубировали с поликлональными IgG против аполипопротеина Α-I, взятыми в концентрации 40 мкг/мл, в течение 2 часов при комнатной температуре, после чего их добавляли к клеткам HMDMs в 96-луночных планшетах и затем определяли уровни IL-6 и TNF-α в супернатантах от клеток, применяя технологию Luminex MAP™. Для этих экспериментов брали кровь от трех разных доноров.
Эксперименты с использованием клеток: хронотропный эффект, связанный с IgG против аполипопротеина A-I
Желудочковые кардиомиоциты неонатальных крыс (NRVC) выделяли из желудочков сердца крыс линии Wistar возрастом 1-2 сут путем обработки трипсином-EDTA и коллагеназой типа 2. Животных умерщвляли путем декапитации без какой-либо анестезии, анальгезии или введения агентов, блокирующих нервно-мышечную передачу, согласно «Руководству по содержанию и использованию лабораторных животных», опубликованному Национальными институтами здоровья США (публикация 85-23), и с разрешения (1012/ 3134/0-R) местной ветеринарной службы. Только что выделенные клетки сразу помещали в пластиковые флаконы, чтобы произошла избирательная адгезия сердечных фибробластов. После этого кардиомиоциты сливали из флаконов и помещали в чашки Петри (90 мм), покрытые ламинином.
Клетки культивировали в течение 1-2 суток, затем через определенные промежутки времени инкубировали с подходящей концентрацией моноклональных иммуноглобулинов G против аполипопротеина A-I (Abcam, Ноттингем, Великобритания) или с носителем в бессывороточной среде DMEM. Определяли частоту спонтанных сокращений монослоев мелких клеток в момент окончания периода преинкубации (t=0) и в разные моменты времени после добавления различных веществ. Определение частоты сокращений выполнялось с помощью светового микроскопа путем подсчета числа сокращений в единицу времени в трех различных участках чашки Петри сотрудником, которому были не известны условия эксперимента. Предварительно определяли регулярность клеточных сокращений по изменениям уровня свободного кальция в цитозоле с помощью флуоресцентного индикатора кальция (Maturana et al., 2009, Endocrinology 150:3726-3734). Поскольку ранее было показано, что наибольший хронотропный эффект иммуноглобулинов G против аполипопротеина A-I IgG достигается при концентрации антител 10 мкг/мл (Vuilleumier et al., 2010, Eur Heart J 31:815-823), эту их концентрацию и брали во всех опытах. Эксперименты по конкурентному ингибированию с синтетическими пептидами проводили в тех же условиях. Синтетические пептиды инкубировали с моноклональными антителами против аполипопротеина A-I (Abcam, Ноттингем, Великобритания), взятыми в концентрации 10 мкг/мл, в течение 2 часов при комнатной температуре, затем их добавляли к клеткам NRVC в чашках Петри и определяли частоту сокращений, как описано выше.
Спектроскопия кругового дихроизма для определения содержания альфа-спиральных участков
Спектры кругового дихроизма (CD) от 185 нм до 240 нм регистрировали с помощью спектрополяриметра J-810 (Jasco, Япония) при температуре 20°С. Для получения образца, как правило, растворяли лиофилизованный пептид в 25%-ном водном растворе трифторэтанола до концентрации 2 мМ, затем разводили этот раствор в 20 раз водой и помещали в кварцевую кювету (длина оптического пути 0,2 см). Из опытных спектров CD вычитали спектр для 1,25%-ного водного раствора трифторэтанола. Полученные данные нормализовали, рассчитывая среднюю остаточную эллиптичность при длине волны 222 нм (θ)mrw,λ.
Пример 1. Примеры пептидомиметиков по данному изобретению
Пептидомиметики, представленные в приведенной ниже таблице 3, синтезировали, как описано выше в разделе «Материалы и методы» и характеризовали путем масс-спектрометрии.



Пептидомиметик EFL1 помимо лактамного мостика, описанного выше, содержал также дисульфидный мостик для того, чтобы тесно сблизить две области, происходящие из спиральных участков Е и F полипептидной цепи аполипопротеина AI. Циклизация пептида посредством дисульфидного мостика в случае EFL1 была подтверждена уменьшением молекулярной массы на 2 Да, а также сдвигом пика на хроматограмме при аналитической HPLC. Так же подтверждалось образование лактамного мостика и метатезис с замыканием кольца, что сопровождается уменьшением молекулярной массы на 18 Да (потеря Н2О) и 28 Да (потеря этилена), соответственно. В ходе реакции метатезиса с замыканием кольца в случае фрагмента C1S2, были получены два изомера с ожидаемой молекулярной массой, но с разной подвижностью при HPLC с обращенной фазой; их очистку и исследование проводили независимо.
В качестве контроля выбрали пептид F3, происходящий из спирального участка F полипептидной цепи аполипопротеина AI. Пептид F3 имеет аминокислотную последовательность, представленную SEQ ID NO: 9, с ацетилированной свободной аминогруппой на N-конце и амидированной свободной карбоксильной группой на С-конце и не содержит внутримолекулярных поперечных сшивок.
SEQ ID NO: 9: GLLPVLESFKVSFLSALEEYTKKLNT
Пример 2. Содержание альфа-спиральных участков в пептидомиметиках по данному изобретению
Содержание альфа-спиральных участков в пептидомиметиках F3L1, F3S2A, F3S1B, F4S2B и F4L1 (см. таблицу 3) определяли путем спектрометрии кругового дихроизма, как описано выше в разделе «Материалы и методы». Результаты, представленные на фиг. 3 показывают, что в содержащем углеводородную сшивку F3S2A и в содержащем лактамный мостик F3L1 и F4L1, а также в содержащих углеводородную сшивку F3S1B и F4S2B имеется больше спиральных участков (характерные минимумы при 208 нм и 222 нм) по сравнению с контрольным пептидом F3, в котором нет внутримолекулярных поперечных сшивок.
Пример 3. Антигенный и диагностический потенциал пептидомиметиков по данному изобретению
Для пептидомиметиков F3L1, F3S2A, F3S1B и F4S2B (см. таблицу 3) определяли реактивность с образцами сыворотки крови пациентов с острой болью в груди из когорты, включавшей 132 индивида, методом ELISA, как описано выше, и полученные данные подвергали статистическому анализу. Результаты этого исследования, представленные в таблице 4, ясно указывают на увеличение диагностической точности, обусловленное использованием пептидомиметиков F3S2A, F3S1B, F4S2B, содержащих углеводородные сшивки, и F3L1, содержащим лактамный мостик, по сравнению с пептидом, не содержащим внутримолекулярных поперечных сшивок (F3). Фактически, статистические показатели для этих пептидомиметиков, в особенности для F3L1, сравнимы с таковыми копептина и приближаются к соответствующим показателям, получаемым с интактным аполипопротеином А-1. Копептин является внутренним контролем, подтверждающим тот факт, что взятая когорта пациентов с острой болью в груди действительно репрезентативна (Reichelin, et al., 2009, J Am Coll Cardiol. 54(1):60-8). Копептин представляет собой С-концевой участок полипептидной цепи провазопрессина - предшественника вазопрессина, являющегося ключевым гормоном в регуляции водного гомеостаза; показано, что уровень копептина в кровотоке обладает веским прогностическим значением в отношении острого коронарного синдрома (Lippi et al., 2012, Clin Chem Lab Med. 50(2):243-5).
Таблица 4. Диагностические свойства петидомиметиков по данному изобретению в отношении диагностирования инфаркта миокарда без подъема сегмента ST (NSTEMI) и с последующим повышением уровня сердечного тропонина I у 132 пациентов с острой болью в груди, по данным исследования сыворотки крови методом твердофазного иммуноферментного анализа
Результаты для интактного аполипопротеина Α-I и копептина, включены для сравнения; они получены в экспериментах, осуществлявшихся в тот же период времени. Статистически значимые результаты (р<0,05) выделены жирным шрифтом. *С учетом оценки риска NSTEMI по шкале TIMI; при оценке риска порог отсечения для копептина <9 пмоль/л (Reichlin et al., 2009, JACC); **расчетный порог отсечения и позиция по 80-му процентилю. AUC - площадь под кривой. OR- отношение шансов. CI - доверительный интервал.

В экспериментах с применением конкурентного твердофазного иммуноферментного анализа сыворотку крови индивидов, у которых было установлено наличие антител против аполипопротеина A-I, преинкубировали с пептидом F3L1 в различных концентрациях (см. фиг. 3), после чего наносили на планшеты, покрытые интактным аполипопротеином A-I, и далее действовали по стандартному протоколу такого рода анализа. Полученные результаты показывают, что пептидомиметик F3L1 способен конкурентно ингибировать связывание интактного аполипопротеина A-I с иммуноглобулинами G, содержащимися в сыворотке крови индивидов, у которых имеются антитела против аполипопротеина A-I, причем этот эффект зависит от дозы (см. фиг. 4).
Результаты, полученные в экспериментах с применением конкурентного твердофазного иммуноферментного анализа, для F3, рандомизированного F3 и F3L1 (см. фиг. 5) демонстрируют отсутствие зависимого от дозы ингибирования в случае рандомизированного пептида, что подкрепляет специфичность эффекта, наблюдаемого в случае F3L1 и соответствующего пептида без лактамного мостика. В более широком смысле это подчеркивает важность должной вторичной структуры соответственной области, происходящей из альфа-спирального участка F.
Рандомизированный F3: Ac-KELYLLKFTVESKVGSTELPLNFSLA-NH2 соответствует аминокислотной последовательности, представленной SEQ ID NO: 26, с ацетилированной свободной аминогруппой на N-конце и амидированной свободной карбоксильной группой на С-конце.
Пример 4. Пептидомиметик F3L1 по данному изобретению подавляет провоспалительную реакцию, связанную с IgG против аполипопротеина A-I
Поликлональные иммуноглобулины G против аполипопротеина A-I (Academy Bio-Medical Company; Хьюстон, шт. Техас, США), взятые в оптимальной концентрации 40 мкг/мл, вызывали значительное повышение продукции TNF-α макрофагами, происходящими из моноцитов человека (см. фиг. 6А). Этого эффекта не было, если иммуноглобулины G против аполипопротеина Α-I перед внесением в среду, где росли клетки, преинкубировали с пептидом F3L1 в течение 2 часов при комнатной температуре. То же наблюдалось во втором эксперименте, в котором использовали объединенные IgG, полученные от индивидов, у которых было установлено наличие антител против аполипопротеина Α-I (см. фиг. 6В); правда, уровень продукции TNF-α под действием объединенных IgG был значительно ниже, нежели под действием поликлональных IgG против аполипопротеина A-I.
Эти результаты показывают, что пептидомиметик F3L1 подавляет провоспалительную реакцию, связанную с IgG против аполипопротеина A-I.
Пример 5. Пептидомиметик F3L1 подавляет хронотропный эффект, связанный с IgG против аполипопротеина A-I.
В культуре крысиных кардиомиоцитов добавление антител против аполипопротеина Α-I вызывало сильный хронотропный эффект (первая слева группа столбиков на фиг. 7). Такая реакция совершенно отсутствовала, если перед добавлением к культивируемым клеткам эти антитела преинкубировали с пептидомиметиком F3L1 (75 мкг/мл) в течение 2 часов при комнатной температуре (вторая слева группа столбиков на фиг. 7). Когда же к клеткам добавляли пептид F3L1 сам по себе, то частота сокращений, - ни изначальная, ни в присутствии альдостерона (10 нМ) - не изменялась (самая правая группа столбиков на фиг. 7), откуда следует, что способность пептида F3L1 подавлять хронотропный эффект, связанный с иммуноглобулинами G против аполипопротеина A-I, имеет непосредственное отношение к способности данного пептида взаимодействовать с антителами против аполипопротеина A-I.
Эти результаты показывают, что пептидомиметик F3L1 подавляет хронотропный эффект, связанный с IgG против аполипопротеина A-I.
Результаты, описанные в примерах 3 и 4, указывают на то, что F3L1 может быть полезен для лечения сердечно-сосудистых заболеваний.
Пример 6. Масс-спектрометрическая идентификация эпитопов аполипопротеина Α-I, взаимодействующих с антителами против него
Чтобы идентифицировать специфичные эндогенные эпитопы аполипопротеина A-I, очищенный аполипопротеин Α-I подвергали ферментативному расщеплению: происходил гидролиз белка по пептидным связям, образованным карбоксильными группами лизина или аргинина, затем пептиды разделяли и очищали путем высокоэффективной жидкостной хроматографии с обращенной фазой, после чего проводили масс-спектрометрический анализ. Иммунореактивность в отношении расщепленного белка в каждой полученной фракции проверяли путем твердофазного иммуноферментного анализа (ELISA), используя сыворотку крови от трех пациентов с высокими титрами аутоантител и от трех пациентов с низкими их титрами.
В случае расщепления аполипопротеина Α-I по остаткам лизина использовали эндопротеиназу Lys-C (Roche Applied Science); при этом фермент брали в соотношении к белку 1:50 (масса/масса), инкубировали в течение 18 часов при температуре 37°С и рН 8,5). Расщепление аполипопротеина Α-I ферментом Lys-C позволило идентифицировать фракции 70 и 71 (фиг. 8), содержавшие ранее не известный иммунореактивный эпитоп - пептид с аминокислотной последовательностью, соответствующей аминокислотным остаткам с 141-го по 182-й аминокислотной последовательности зрелого аполипопротеина A-I (SEQ ID NO: 1), содержащий область из альфа-спирального участка D последовательности SEQ ID NO: 5, в которой делетированы два последних аминокислотных остатка SEQ ID NO: 5. Аминокислотная последовательность этого эпитопа представлена SEQ ID NO: 21.
Чтобы получить пептидные фрагменты, отщепляемые по остаткам аргинина, нужно было бы использовать эндопротеиназу Arg-C. Однако известно, что фермент Arg-C не обладает достаточной специфичностью и получающиеся триптические пептиды не проявляли иммунореактивности. Чтобы преодолеть эту проблему, прежде чем проводить расщепление аполипопротеина A1, в нем обратимо блокировали остатки лизина малеиновым ангидридом; в итоге полипептидная цепь расщеплялась по остаткам аргинина (Butler et al., 1967, Biochemical Journal., 103(3): 78P-79P; Butler et al., Biochemical Journal, 112(5): 679-689). Этот подход позволил идентифицировать фракции 74 и 80 (фиг. 9), содержавшие другой иммунореактивный эпитоп - пептид с аминокислотной последовательностью, соответствующей аминокислотным остаткам с 216-го по 243-й аминокислотной последовательности зрелого аполипопротеина A-I (SEQ ID NO: 1), содержащий область 1 из альфа-спирального участка F последовательности SEQ ID NO: 8. Аминокислотная последовательность этого эпитопа представлена SEQ ID NO: 25.
Результаты, описанные в примере 6, указывают, что специфичные эпитопы. идентифицированные в этом примере, и - в более общем смысле - область из альфа-спирального участка D последовательности SEQ ID NO: 5, а также области 1 и 2 из альфа-спирального участка F последовательностей SEQ ID NO: 8 и SEQ ID NO: 9, соответственно, обладают большей иммунореактивностью в отношении антител против аполипопротеина A-I, чем другие фрагменты аполипопротеина A-I, содержащие другие спиральные участки, в частности альфа-спиральный участок Е, содержащийся в пептиде, соответствующем аминокислотным остаткам с 189-го по 215-й аминокислотной последовательности зрелого аполипопротеина A-I (SEQ ID NO: 1), который проявлял меньшую иммунореактивность. Таким образом, пептиды, аминокислотная последовательность которых содержит по меньшей мере одну из этих областей, можно предпочтительно использовать для выявления аутоантител против аполипопротеина А-I.
Эксперименты, подобные описанным в примерах 4 и 5, были повторены с большим числом образцов (n=9), что подтвердило результаты, представленные в указанных примерах.
Перечень последовательностей
Человеческий аполипопротеин A-I: SEQ ID NO: 1

Область, происходящая из альфа-спирального участка A: SEQ ID NO: 2: 
Область, происходящая из альфа-спирального участка В: SEQ ID NO: 3: 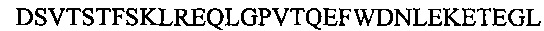 Область, происходящая из альфа-спирального участка С: SEQ ID NO: 4:
Область, происходящая из альфа-спирального участка С: SEQ ID NO: 4: 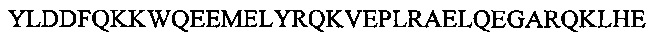
Область, происходящая из альфа-спирального участка D: SEQ ID NO: 5: 
Область 1, происходящая из альфа-спирального участка Е: SEQ ID NO: 6:
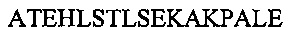
Область 2, происходящая из альфа-спирального участка Е: SEQ ID NO: 7: 
Область 1, происходящая из альфа-спирального участка F: SEQ ID NO: 8: 
Область 2, происходящая из альфа-спирального участка F: SEQ ID NO: 9: 
A1S2 без ацетилирования и амидирования:
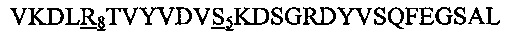
с углеводородной сшивкой, соединяющей R8 в положении 5 и S5 в положении 12 указанной последовательности, представленной:
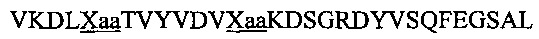 (SEQ ID NO: 10, где Хаа в положении 5 заменен на модифицированный аланин, имеющий формулу (I): -NH-С(СН3)(R)-С(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 12, и где Хаа в положении 12 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 5, как описано выше)
(SEQ ID NO: 10, где Хаа в положении 5 заменен на модифицированный аланин, имеющий формулу (I): -NH-С(СН3)(R)-С(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 12, и где Хаа в положении 12 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 5, как описано выше)
B1S2 без ацетилирования и амидирования:
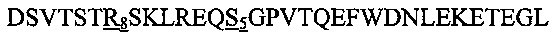
с углеводородной сшивкой, соединяющей R8 в положении 7 и S5 в положении 14 указанной последовательности, представленной:
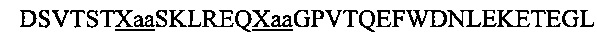 (SEQ ID NO: 11, где Хаа в положении 7 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 14, и где Хаа в положении 14 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 7, как описано выше)
(SEQ ID NO: 11, где Хаа в положении 7 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 14, и где Хаа в положении 14 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 7, как описано выше)
C1S2 без ацетилирования и амидирования:
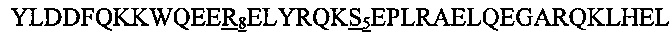
с углеводородной сшивкой, соединяющей R8 в положении 13 и S5 в положении 20 указанной последовательности, представленной:
 (SEQ ID NO: 12,
(SEQ ID NO: 12,
где Хаа в положении 13 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 20, и где Хаа в положении 20 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 13, как описано выше)
D1S2A без ацетилирования и амидирования:
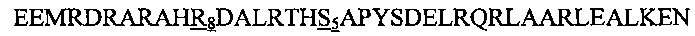
с углеводородной сшивкой, соединяющей R8 в положении 11 и S5 в положении 18 указанной последовательности, представленной:
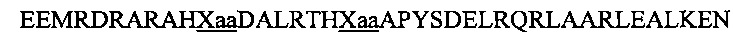 (SEQ ID NO: 13, где Хаа в положении 11 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 18, и где Хаа в положении 18 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 11, как описано выше)
(SEQ ID NO: 13, где Хаа в положении 11 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 18, и где Хаа в положении 18 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 11, как описано выше)
E1S2 без ацетилирования и амидирования:
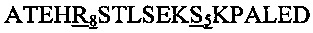
с углеводородной сшивкой, соединяющей R8 в положении 5 и S5 в положении 12 указанной последовательности, представленной:
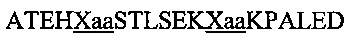 (SEQ ID NO: 14, где Хаа в положении 5 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 12, и где Хаа в положении 12 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 5, как описано выше) F3L1 без ацетилирования и амидирования:
(SEQ ID NO: 14, где Хаа в положении 5 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 12, и где Хаа в положении 12 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 5, как описано выше) F3L1 без ацетилирования и амидирования:
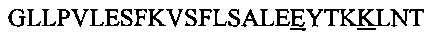
с лактамным мостиком, соединяющим Е в положении 19 и К в положении 23 указанной последовательности, представленной:
 (SEQ ID NO: 19, где Хаа в положении 19 представляет модифицированный аминокислотный остаток, имеющий формулу (I): -NH-C(H)(R)-C(O)-, где R представляет лактамный мостик -(CH2)2-CO-NH-(CH2)4-, присоединенный к другому Хаа в положении 23, и где Хаа в положении 23 представляет модифицированный аминокислотный остаток, имеющий формулу (I): -NH-C(H)(R')-C(O)-, где R' представляет одинарную связь к лактамному мостику от Хаа в положении 19, как описано выше)
(SEQ ID NO: 19, где Хаа в положении 19 представляет модифицированный аминокислотный остаток, имеющий формулу (I): -NH-C(H)(R)-C(O)-, где R представляет лактамный мостик -(CH2)2-CO-NH-(CH2)4-, присоединенный к другому Хаа в положении 23, и где Хаа в положении 23 представляет модифицированный аминокислотный остаток, имеющий формулу (I): -NH-C(H)(R')-C(O)-, где R' представляет одинарную связь к лактамному мостику от Хаа в положении 19, как описано выше)
F3S2A без ацетилирования и амидирования:
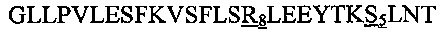
с углеводородной сшивкой, соединяющей R8 в положении 16 и S5 в положении 23 указанной последовательности, представленной:
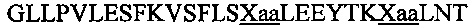 (SEQ ID NO: 15, где Хаа в положении 16 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 23, и где Хаа в положении 23 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 16, как описано выше)
(SEQ ID NO: 15, где Хаа в положении 16 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 23, и где Хаа в положении 23 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 16, как описано выше)
F3S1B без ацетилирования и амидирования:
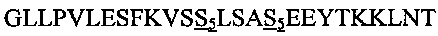
с углеводородной сшивкой, соединяющей S5 в положении 13 и S5 в положении 17 указанной последовательности, представленной:
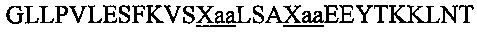 (SEQ ID NO: 16, где Хаа в положении 13 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 17, и где Хаа в положении 17 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 13, как описано выше)
(SEQ ID NO: 16, где Хаа в положении 13 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 17, и где Хаа в положении 17 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 13, как описано выше)
F4S2B без ацетилирования и амидирования:

с углеводородной сшивкой, соединяющей R8 в положении 9 и S5 в положении 16 указанной последовательности, представленной:
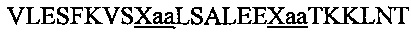 (SEQ ID NO: 17, где Хаа в положении 9 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 16, и где Хаа в положении 16 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 9, как описано выше)
(SEQ ID NO: 17, где Хаа в положении 9 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 16, и где Хаа в положении 16 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 9, как описано выше)
Линейный EFL1 без амидирования:
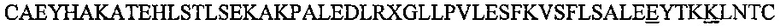 содержит X - аналог глутамина в положении 28 (боковая цепь CH2-S-CH2-CONH2 вместо CH2-CH2-CONH2) и лактамный мостик, соединяющий Е в положении 47 и К в положении 51 указанной последовательности, представленной:
содержит X - аналог глутамина в положении 28 (боковая цепь CH2-S-CH2-CONH2 вместо CH2-CH2-CONH2) и лактамный мостик, соединяющий Е в положении 47 и К в положении 51 указанной последовательности, представленной:

 (SEQ ID NO: 18, где Хаа в положении 28 представляет аналог глутамина с боковой цепью CH2-S-CH2-CONH2, а Хаа в положении 47 представляет модифицированный аминокислотный остаток, имеющий формулу (I): -NH-C(H)(R)-C(O)-, где R представляет лактамный мостик -(СН2)2-СО-NH-(СН2)4-, присоединяющий другой Хаа в положении 51, и где Хаа в положении 51 представляет модифицированный аминокислотный остаток, имеющий формулу (I): -NH-C(H)(R')-C(O)-, где R' представляет одинарную связь к лактамному мостику от остатка Хаа в положении 47, как описано выше)
(SEQ ID NO: 18, где Хаа в положении 28 представляет аналог глутамина с боковой цепью CH2-S-CH2-CONH2, а Хаа в положении 47 представляет модифицированный аминокислотный остаток, имеющий формулу (I): -NH-C(H)(R)-C(O)-, где R представляет лактамный мостик -(СН2)2-СО-NH-(СН2)4-, присоединяющий другой Хаа в положении 51, и где Хаа в положении 51 представляет модифицированный аминокислотный остаток, имеющий формулу (I): -NH-C(H)(R')-C(O)-, где R' представляет одинарную связь к лактамному мостику от остатка Хаа в положении 47, как описано выше)
F4L1 без ацетилирования и амидирования: SEQ ID NO: 20:
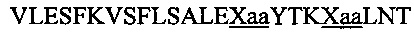
где Хаа в положении 15 представляет модифицированный аминокислотный остаток, имеющий формулу (I): -NH-C(H)(R)-C(O)-, где R представляет лактамный мостик -(CH2)2-CO-NH-(CH2)4-, присоединяющий другой Хаа в положении 19, и где Хаа в положении 19 представляет модифицированный аминокислотный остаток, имеющий формулу (I): -NH-C(H)(R')-C(O)-, где R' представляет одинарную связь к лактамному мостику от остатка Хаа в положении 15, как описано выше)
D2(aa 141-182): SEQ ID NO:21:
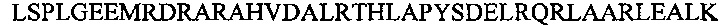
D2S2A: SEQ ID NO: 22:

где Хаа в положении 16 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 23, и где Хаа в положении 23 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 16, как описано выше)
D3: SEQIDNO: 23:

D3S2A: SEQ ID NO: 24:

где Хаа в положении 11 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R)-C(O)-, где R представляет углеводородную сшивку -(СН2)6-СН=СН-(СН2)3-, присоединяющую другой Хаа в положении 18, и где Хаа в положении 18 представляет модифицированный аланин, имеющий формулу (I): -NH-C(СН3)(R')-C(O)-, где R' представляет одинарную связь к углеводородной сшивке от Хаа в положении 11, как описано выше)
F5: SEQIDNO: 25:
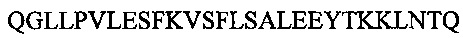
Рандомизированный F3 без ацетилирования и амидирования: SEQ ID NO: 26:
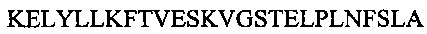
В данном перечне последовательностей R8 соответствует (R)-2-(7'-октенил)-аланину и S5 соответствует (S)-2-(4'-пентенил)-аланину.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ АПОПТОЗА И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2582247C2 |
| РЕКОМБИНАНТНЫЙ АДЕНОАССОЦИИРОВАННЫЙ ВИРУС, ЯВЛЯЮЩИЙСЯ ГИБРИДОМ СЕРОТИПОВ AAV9 И AAVrh74, С ПОНИЖЕННЫМ ТРОПИЗМОМ К ПЕЧЕНОЧНОЙ ТКАНИ | 2019 |
|
RU2812279C2 |
| Терапевтическое применение глюкагона и включающей его комбинации | 2019 |
|
RU2838895C2 |
| КОМПОЗИЦИИ ДЛЯ ПРЕДУПРЕЖДЕНИЯ И/ИЛИ ЛЕЧЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ ВИРУСОМ ВИЧ-1 | 2012 |
|
RU2603262C2 |
| ПЕПТИДЫ НАПРАВЛЕННОГО ДЕЙСТВИЯ НА VEGFR-1/NRP-1 | 2008 |
|
RU2488592C2 |
| АНТИТЕЛА, ОБЛАДАЮЩИЕ СПЕЦИФИЧНОСТЬЮ К BTN2, И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2794996C2 |
| НОВЫЕ ПРОНИКАЮЩИЕ В КЛЕТКУ ПЕПТИДЫ | 2013 |
|
RU2670488C2 |
| КОМПОЗИЦИИ, ОТНОСЯЩИЕСЯ К МУТАНТНОМУ ТОКСИНУ CLOSTRIDIUM DIFFICILE, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2592686C2 |
| КОНЪЮГАТЫ ДЛЯ ВВЕДЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ | 2009 |
|
RU2567667C2 |
| НОВЫЙ ЭПИТОП BNP (1-32) И АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ УКАЗАННОГО ЭПИТОПА | 2008 |
|
RU2511033C2 |












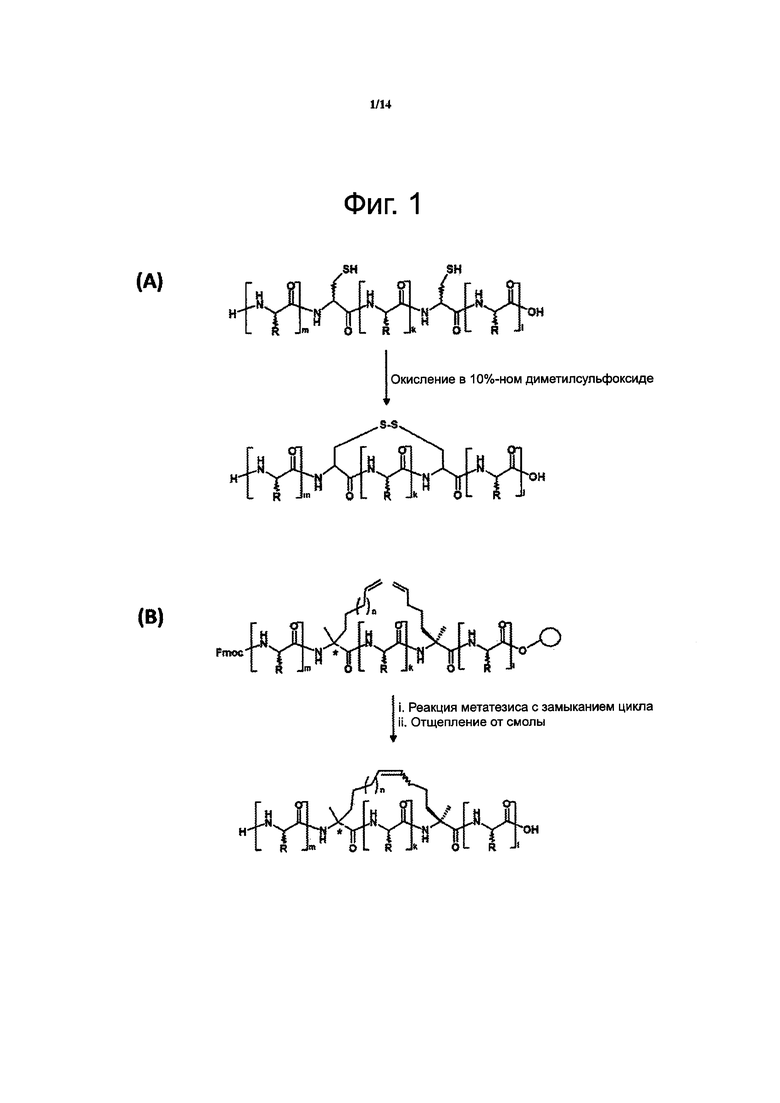
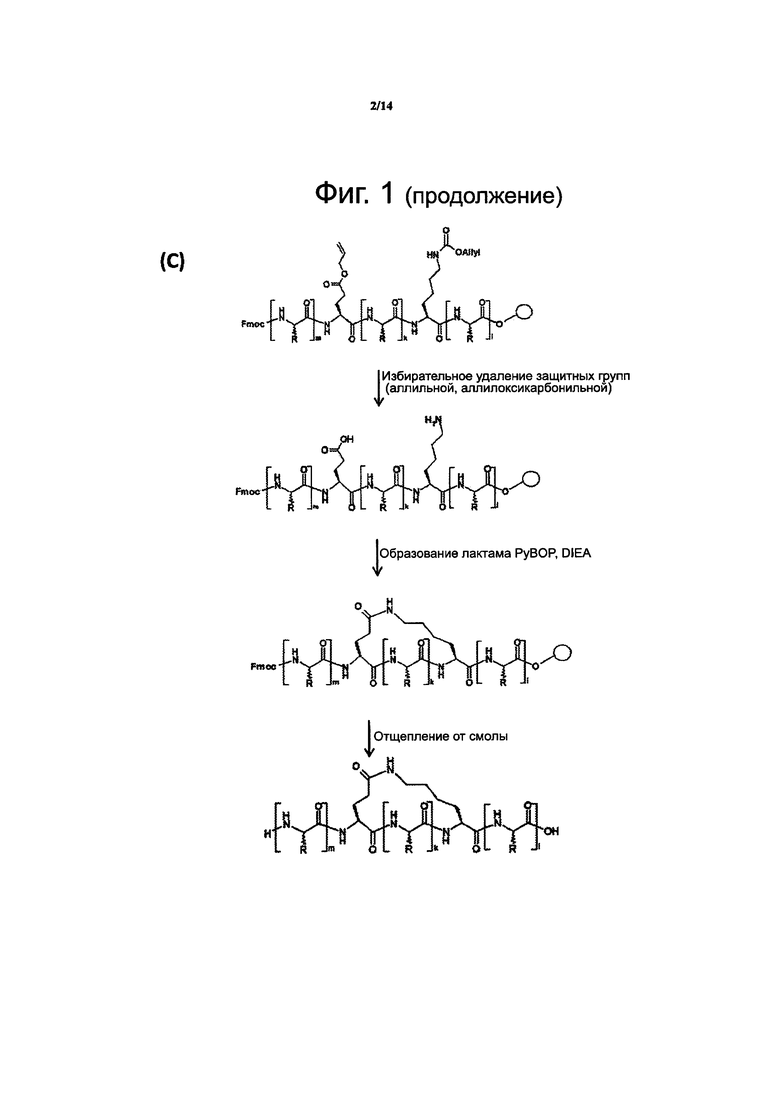
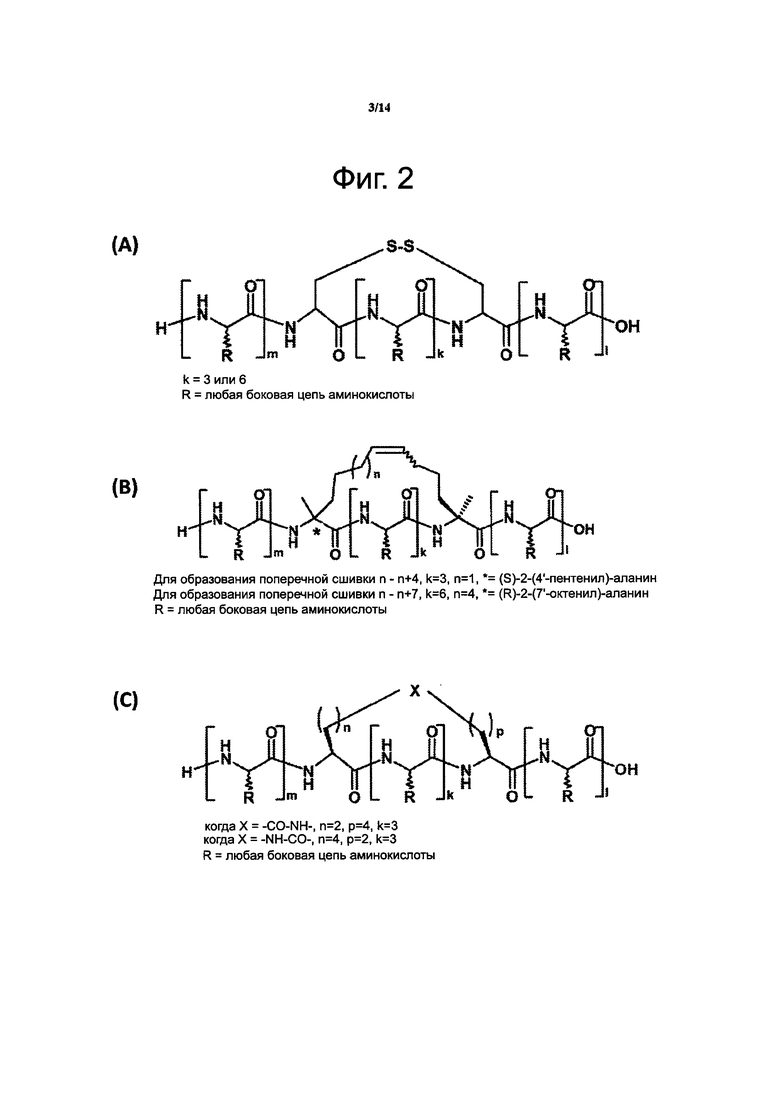
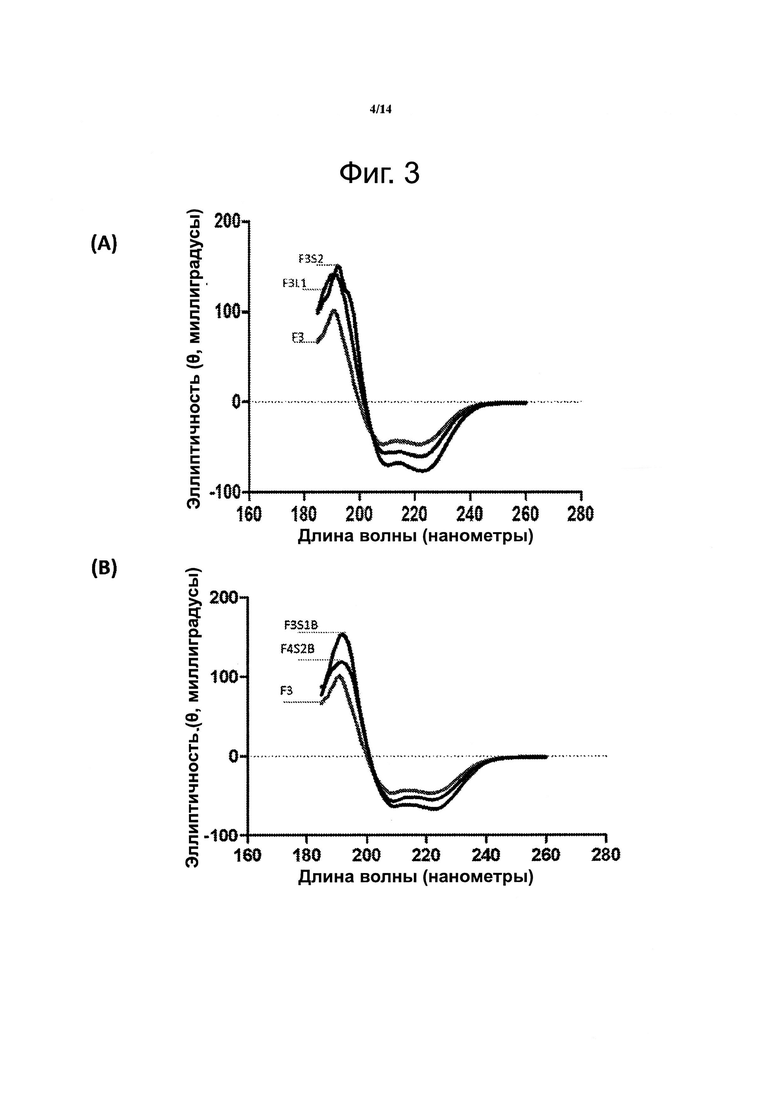
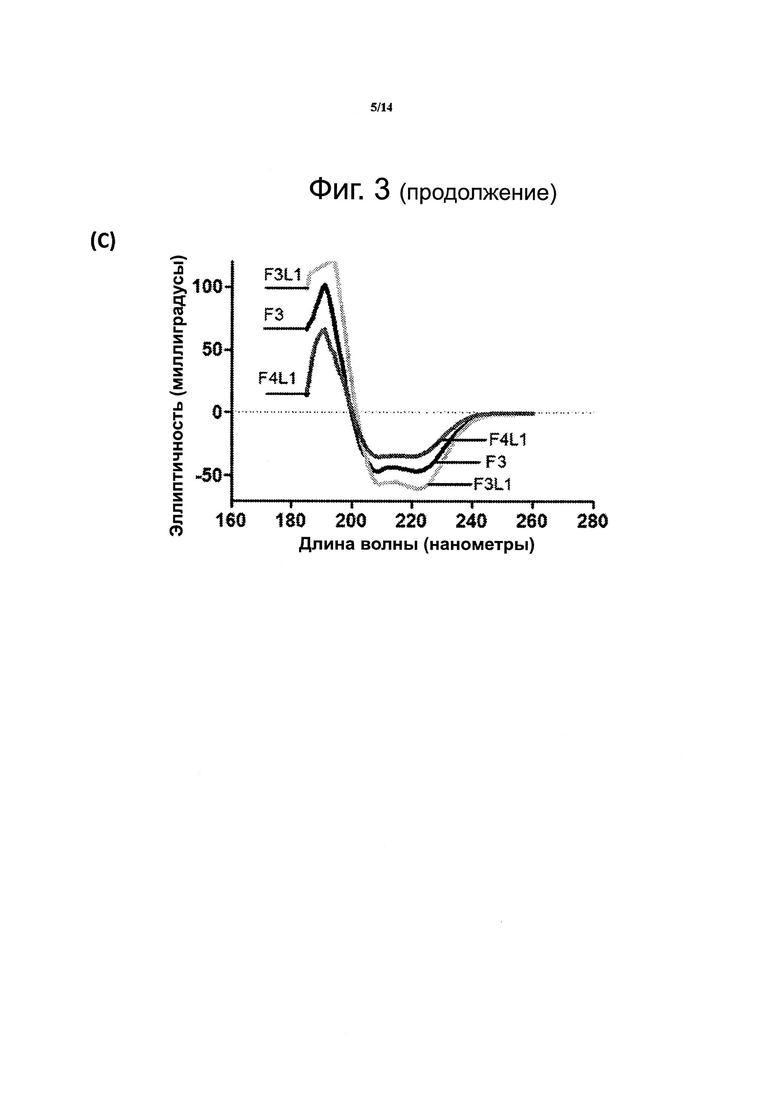
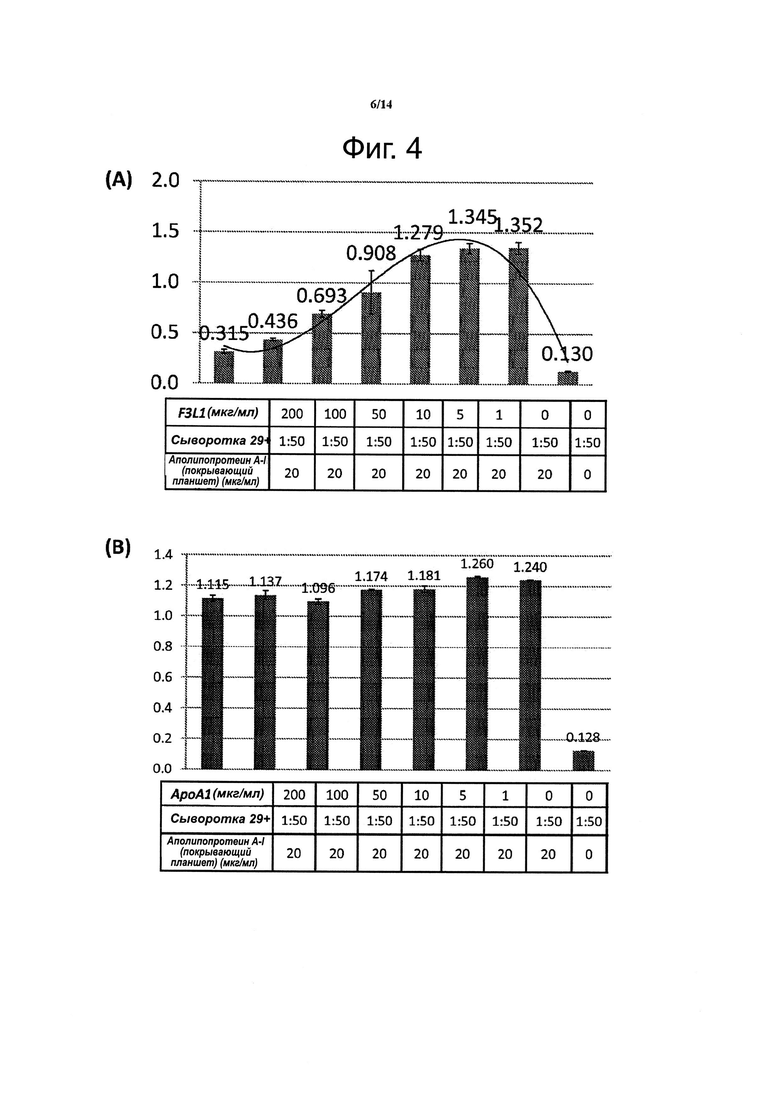

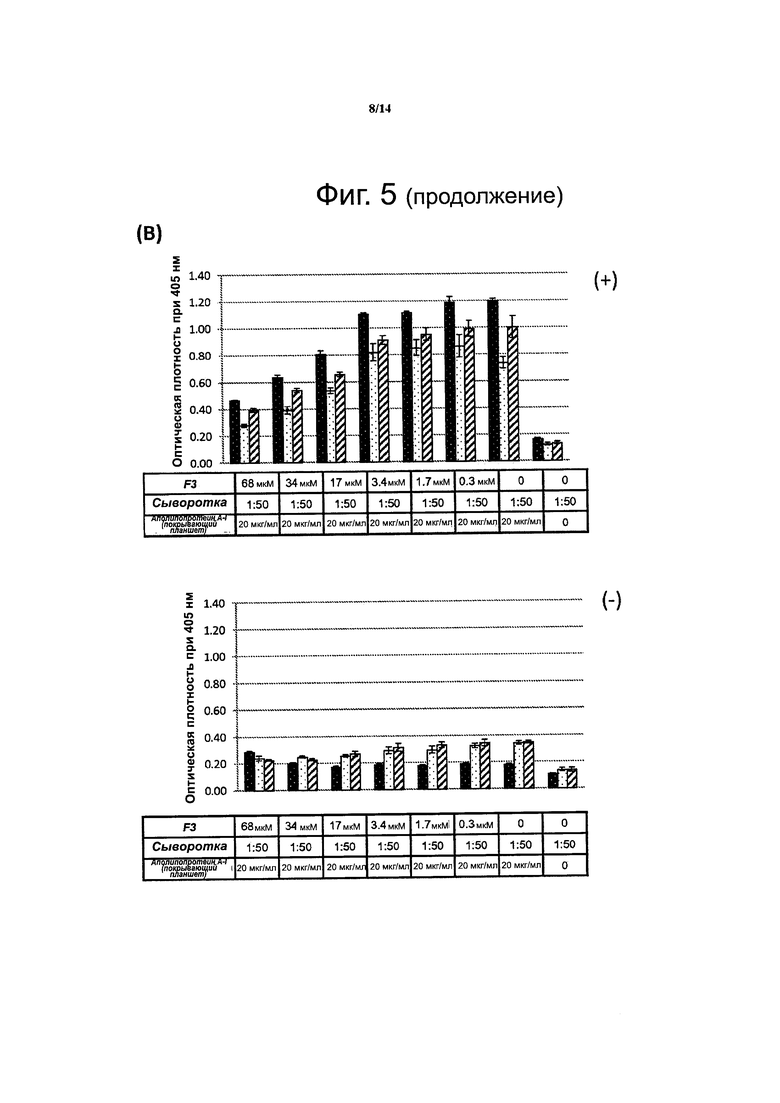
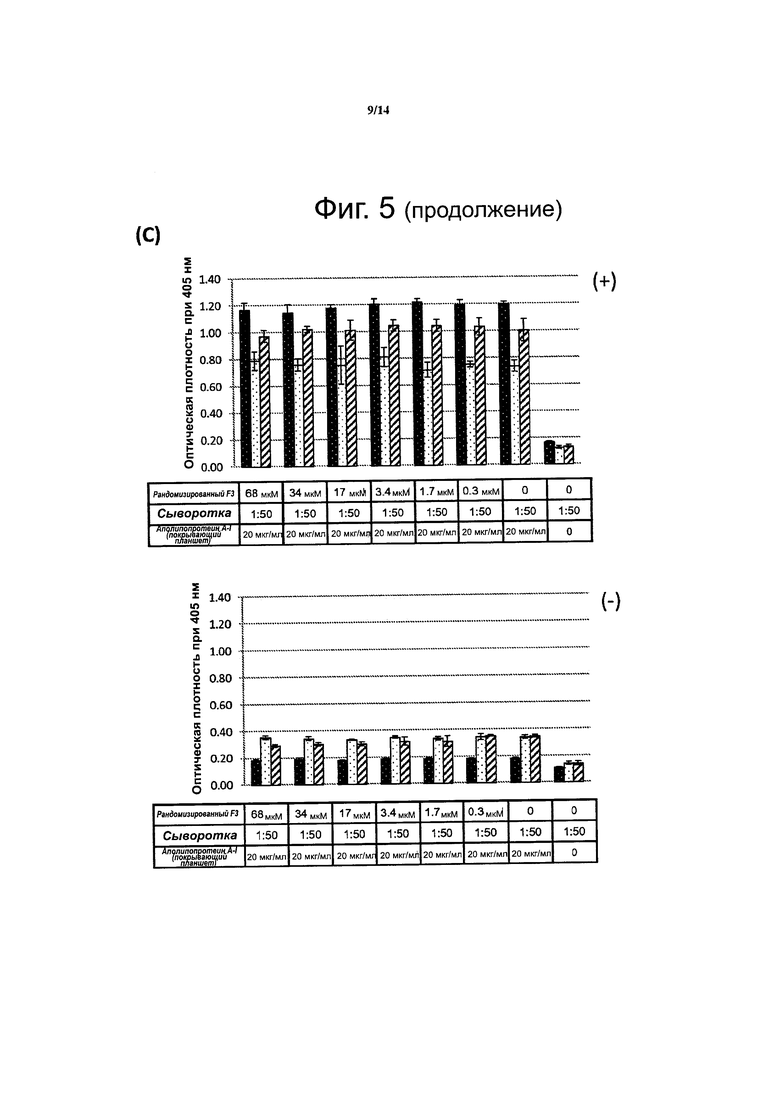
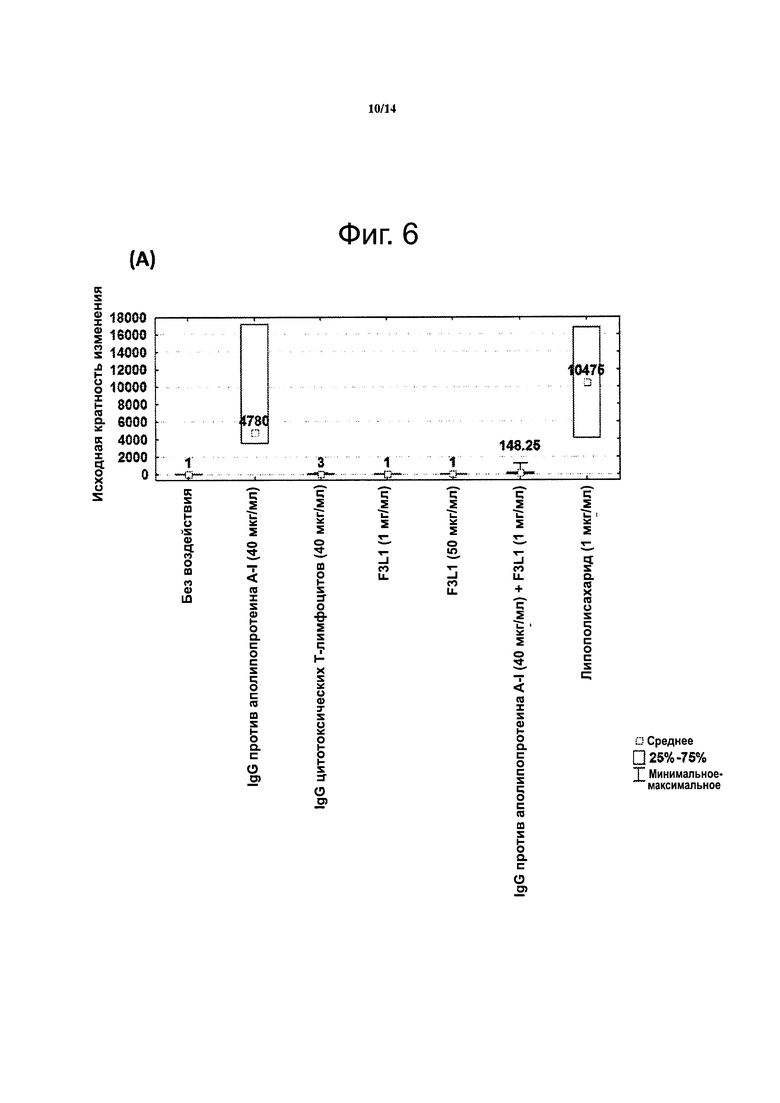

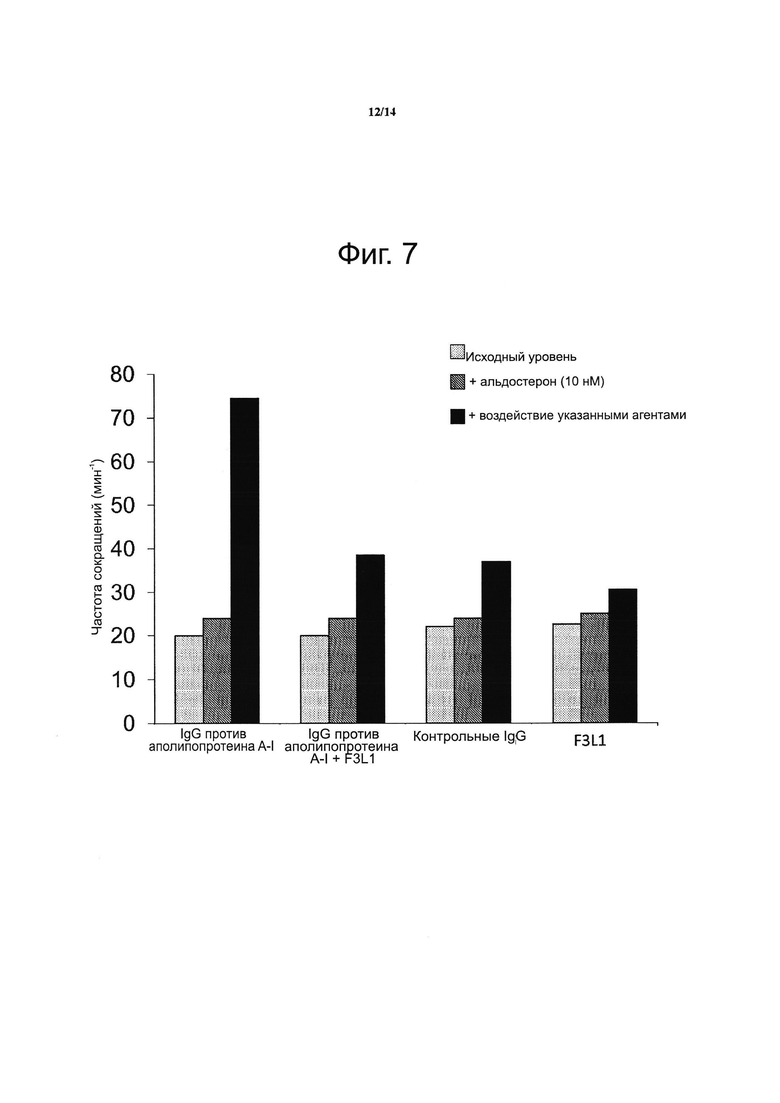


Настоящее изобретение относится к области биотехнологии, конкретно к пептидомиметикам эпитопа аполипопротеина А-I, и может быть использовано в медицине. Пептидомиметик эпитопа аполипопротеина А-I, способный специфично связываться с антителами против аполипопротеина А-I, используется в диагностическом иммунологическом методе анализа и позволяет выявить ряд сердечно-сосудистых заболеваний по образцу биологической жидкости. Пептидомиметик эпитопа аполипопротеина А-I также может быть применим в способе лечения таких сердечно-сосудистых заболеваний. 9 н. и 17 з.п. ф-лы, 9 ил., 3 табл., 6 пр.
1. Способ выявления эндогенных анти-ApoA-I антител в образце биологической жидкости из субъекта-млекопитающего, включающий стадии:
(а) получение образца биологической жидкости, выбираемого из образца слюны, крови или мочи, от субъекта-млекопитающего;
(b) приведение в контакт указанного образца биологической жидкости с твердой подложкой, несущей по меньшей мере один связанный пептидомиметик эпитопа аполипопротеина A-I (ApoA-I), где указанный пептидомиметик состоит из последовательности SEQ ID NO: 8 или ее варианта, SEQ ID NO: 9 или ее варианта, SEQ ID NO: 15 или ее варианта, SEQ ID NO: 16 или ее варианта, SEQ ID NO: 17 или ее варианта, SEQ ID NO: 19 или ее варианта, SEQ ID NO: 20 или ее варианта или SEQ ID NO: 25 или ее варианта, где указанный вариант пептидомиметика имеет аминокислотную последовательность, идентичную указанному пептидомиметику, за исключением того, что 1, 2, 3, 4, 5 или 6 аминокислот указанной последовательности замещены, удалены и/или химически модифицированы, не влияя при этом негативно на способность указанного пептидомиметика к специфическому связыванию с анти-ApoA-I антителом в образце, где приведение в контакт производится в условиях, подходящих для связывания анти-ApoA-I антитела, присутствующего в указанном образце биологической жидкости, с указанным по меньшей мере одним пептидомиметиком путем взаимодействия по типу антиген-антитело, где в последовательности указанного по меньшей мере одного пептидомиметика имеется внутримолекулярная поперечная сшивка между по меньшей мере двумя несмежными аминокислотами;
(c) удаление любых несвязанных антител с поверхности указанной твердой матрицы;
(d) выявление присутствия комплексов антиген-антитело, связанных с указанной твердой подложкой;
при этом присутствие указанных комплексов свидетельствует о том, что данный образец биологической жидкости содержит эндогенные антитела против аполипопротеина A-I.
2. Способ по п. 1, где присутствие комплексов антиген-антитело свидетельствует о том, что субъект страдает от сердечно-сосудистого заболевания.
3. Способ по п. 1, где указанный субъект страдает от по меньшей мере одного расстройства, выбранного из острой боли в груди, острого коронарного синдрома, ревматоидного артрита, системной красной волчанки, тяжелого стеноза сонной артерии, терминальной стадии почечной недостаточности или периодонтита.
4. Пептидомиметик эпитопа аполипопротеина A-I (ApoA-I), причем указанный пептидомиметик:
(а) состоит из аминокислотной последовательности, представленной одной из:
(i) SEQ ID NO: 25, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20, или
(ii) варианта аминокислотной последовательности SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20, где указанный вариант состоит из аминокислотной последовательности, которая
(а’) идентична какой-либо из последовательностей SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20, за тем исключением, что 1, 2, 3, 4, 5 или 6 аминокислотных остатков в указанной последовательности заменены и/или химически модифицированы, не влияя при этом негативно на способность указанного пептидомиметика специфично связываться с антителами против аполипопротеина A-I, или
(b’) идентична какой-либо из последовательностей SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 20, за тем исключением, что 1, 2 или 3 аминокислотных остатка в указанной последовательности делетированы, не влияя при этом негативно на способность указанного пептидомиметика специфично связываться с антителами против аполипопротеина A-I, или
(iii) любую комбинацию двух аминокислотных последовательностей по п. (i) и/или по п. (ii); и
(c) внутримолекулярную поперечную сшивку, соединяющую два не смежных аминокислотных остатка аминокислотной последовательности по п. (a);
причем указанный пептидомиметик способен специфично связываться с антителами против аполипопротеина A-I.
5. Пептидомиметик по п. 4, в котором аминокислотную последовательность по п. (а) выбирают из последовательностей SEQ ID NO: 8 или SEQ ID NO: 9 или из указанных их вариантов.
6. Пептидомиметик по п. 4, в котором внутримолекулярная поперечная сшивка по п. (b) представляет собой лактамный мостик между двумя аминокислотными остатками Хаа в положениях n и n+4 аминокислотной последовательности указанного пептида, где Xaa в положении n является модифицированным аминокислотным остатком, имеющим формулу (I): -NH-C(H)(R)-C(O)-, где R представляет собой лактамный мостик -(CH2)2-CO-NH-(CH2)4-, присоединенный к другому остатку в положении n+4, и где Xaa в положении n+4 является модифицированным аминокислотным остатком, имеющим формулу (I): -NH-C(H)(R’)-C(O)-, где R’ представляет собой одинарную связь к лактамному мостику от указанного Хаа в положении n.
7. Пептидомиметик по п. 4, в котором внутримолекулярная поперечная сшивка по п. (b) представляет собой углеводородную сшивку, связывающую два аминокислотных остатка Хаа в положениях n и n+7 аминокислотной последовательности указанного пептида, где Xaa в положении n является модифицированным аланином, имеющим формулу (I): -NH-C(CH3)(R)-C(O)-, где R представляет собой углеводородную сшивку -(CH2)6-CH=CH-(CH2)3-, присоединенную к другому остатку Хаа в положении n+7, и где Xaa в положении n+7 представляет собой модифицированный аланин, имеющий формулу (I): -NH-C(CH3)(R’)-C(O)-, где R’ представляет собой одинарную связь к углеводородной сшивке от указанного Хаа в положении n.
8. Пептидомиметик по п. 4, в котором внутримолекулярная поперечная сшивка по п. (b) представляет собой углеводородную сшивку, связывающую два аминокислотных остатка Хаа в положениях n и n+4 аминокислотной последовательности указанного пептида, где Xaa в положении n является модифицированным аланином, имеющим формулу (I): -NH-C(CH3)(R)-C(O)-, где R представляет собой углеводородную сшивку -(CH2)6-CH=CH-(CH2)3-, присоединенную к другому остатку Хаа в положении n+4, и где Xaa в положении n+4 представляет собой модифицированный аланин, имеющий формулу (I): -NH-C(CH3)(R’)-C(O)-, где R’ представляет собой одинарную связь к углеводородной сшивке от указанного Хаа в положении n.
9. Пептидомиметик по п.4, в котором:
(i) аминокислотная последовательность по п. (а) состоит из последовательности SEQ ID NO: 19, и внутримолекулярная поперечная сшивка по п. (b) представляет собой лактамный мостик, связывающий остаток глутаминовой кислоты (E) в положении 19 и остаток лизина (K) в положении 23, причем указанные положения относятся к аминокислотной последовательности по п. (а); или
(ii) аминокислотная последовательность по п. (а) состоит из последовательности SEQ ID NO: 15, и внутримолекулярная поперечная сшивка по п. (b) представляет собой углеводородную сшивку, связывающую (R)-2-(7’-октенил)-аланин в положении 16 и (S)-2-(4’-пентенил)-аланин в положении 23, причем указанные положения относятся к аминокислотной последовательности по п. (a); или
(iii) аминокислотная последовательность по п. (a) состоит из последовательности SEQ ID NO: 16, и внутримолекулярная поперечная сшивка по п. (b) представляет собой углеводородную сшивку, связывающую (S)-2-(4’-пентенил)-аланин в положении 13 и (S)-2-(4’-пентенил)-аланин в положении 17, причем указанные положения относятся к аминокислотной последовательности по п. (a);
(iv) аминокислотная последовательность по п. (a) состоит из последовательности SEQ ID NO: 17, и внутримолекулярная поперечная сшивка по п. (b) представляет собой углеводородную сшивку, связывающую (R)-2-(7’-октенил)-аланин в положении 9 и (S)-2-(4’-пентенил)-аланин в положении 16, причем указанные положения относятся к аминокислотной последовательности по п. (a).
10. Пептидомиметик по п.4, где аминокислотная последовательность (а) выбрана из SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 19 и SEQ ID NO: 20.
11. Пептидомиметик по п.4, причем указанный пептидомиметик:
(а) состоит из аминокислотной последовательности, представленной любой из:
(i) SEQ ID NO: 8, SEQ ID NO: 9 или
(ii) SEQ ID NO: 25; или
(iii) аминокислотной последовательности, идентичной любой из последовательностей по п. (i), за тем исключением, что 1, 2 или 3 аминокислотных остатка указанной последовательности по п. (i) делетированы, не влияя при этом негативно на способность указанного пептидомиметика специфично связываться с антителами против аполипопротеина A-I, или
(iv) аминокислотной последовательности, идентичной любой из последовательностей по п. (i), за тем исключением, что 1, 2, 3, 4, 5 или 6 аминокислотных остатков указанной последовательности по п. (i) заменены и/или химически модифицированы, не влияя при этом негативно на способность указанного пептидомиметика специфично связываться с антителами против аполипопротеина A-I, или
(v) любую комбинацию из двух аминокислотных последовательностей по п. (i), (ii), (iii) и/или (iv);
причем указанный пептидомиметик способен специфично связываться с антителами против аполипопротеина A-I.
12. Пептидомиметик по п. 11, в котором аминокислотная последовательность по п. (i) содержит последовательность SEQ ID NO: 8.
13. Пептидомиметик по п. 11, в котором аминокислотная последовательность по п. (i) содержит последовательность SEQ ID NO: 19.
14. Пептидомиметик по любому из пп. 4 или 11, в котором свободная N-концевая аминогруппа ацетилирована и свободная С-концевая карбоксильная группа амидирована.
15. Препарат, представляющий собой диагностический препарат или препарат для иммунологического анализа, для выявления анти-ApoA-I антител в образце биологической жидкости в качестве биологических маркеров сердечно-сосудистого заболевания, содержащий эффективное количество пептидомиметика по любому из пп. 4-14, где образец биологической жидкости выбран из образца слюны, крови или мочи от субъекта-млекопитающего.
16. Фармацевтическая композиция для профилактики или лечении сердечно-сосудистого заболевания, содержащая эффективное количество пептидомиметика по любому из пп. 4-14.
17. Набор для выявления антител против аполипопротеина A-I в образце биологической жидкости, выбираемый из образца слюны, крови или мочи от субъекта-млекопитающего, включающий пептидомиметик по любому из пп. 4-14 или их комбинацию.
18. Способ выявления эндогенных антител против аполипопротеина A-I в образце биологической жидкости, взятом у млекопитающего, включающий этапы:
(a) получение образца биологической жидкости, выбираемого из образца слюны, крови или мочи, от субъекта-млекопитающего;
(b) контактирование указанного образца биологической жидкости с твердой подложкой, с которой связан по меньшей мере один пептидомиметик по любому из пп. 4-14, причем это контактирование происходит в условиях, подходящих для связывания антител против аполипопротеина A-I, присутствующих в указанном образце биологической жидкости, с указанным по меньшей мере одним пептидомиметиком путем взаимодействий по типу антиген-антитело;
(c) удаление любых не связанных антител с поверхности указанной твердой подложки;
(d) выявление присутствия комплексов антиген-антитело, связанных с указанной твердой подложкой;
при этом наличие указанных комплексов свидетельствует о том, что в данном образце биологической жидкости содержатся эндогенные антитела против аполипопротеина A-I.
19. Способ обнаружения сердечно-сосудистого заболевания по образцу биологической жидкости, взятому у субъекта-млекопитающего, включающий этапы:
(a) получение образца биологической жидкости, выбираемого из образца слюны, крови или мочи, от субъекта-млекопитающего;
(b) контактирование указанного образца биологической жидкости с твердой подложкой, с которой связан по меньшей мере один пептидомиметик по любому из пп. 4-14, причем это контактирование происходит в условиях, подходящих для связывания антител против аполипопротеина A-I, присутствующих в указанном образце биологической жидкости, с указанным по меньшей мере одним пептидомиметиком путем взаимодействий по типу антиген-антитело;
(c) удаление любых не связанных антител с поверхности указанной твердой подложки;
(d) выявление присутствия комплексов антиген-антитело, связанных с указанной твердой подложкой;
при этом наличие указанных комплексов свидетельствует о том, что в данном образце биологической жидкости содержатся антитела против аполипопротеина A-I, ассоциированные с одним или более сердечно-сосудистыми заболеваниями.
20. Способ по п. 18 или 19, в котором индивид страдает от острой боли в груди, острого коронарного синдрома, ревматоидного артрита, системной красной волчанки, тяжелого стеноза сонной артерии, терминальной стадии почечной недостаточности или периодонтита.
21. Способ предотвращения или лечения сердечно-сосудистого заболевания у нуждающегося в этом субъекта, включающий введение указанному субъекту пептидомиметика по любому из пп. 4-14 или фармацевтической композиции по п. 16.
22. Способ по п. 21, в котором субъект страдает от острой боли в груди, острого коронарного синдрома, ревматоидного артрита, системной красной волчанки, тяжелого стеноза сонной артерии, терминальной стадии почечной недостаточности или периодонтита и наличие у него сердечно-сосудистого заболевания выявлено способом по п. 19.
23. Способ по любому из пп. 1-3, где пептидомиметик представлен пептидомиметиком по любому из пп. 4-14.
24. Способ предотвращения или лечения сердечно-сосудистого заболевания у индивида, страдающего от острой боли в груди, острого коронарного синдрома, ревматоидного артрита, системной красной волчанки, тяжелого стеноза сонной артерии, терминальной стадии почечной недостаточности или периодонтита, включающий этапы:
(a) выявление эндогенных антител против аполипопротеина A-I в образце биологической жидкости, взятом у индивида, являющегося млекопитающим, способом по п. 20; и
(b) введение указанному индивиду по меньшей мере одного агента, выбираемого из: (i) пептидомиметика по любому из пп. 4-14 или содержащей его фармацевтической композиции, (ii) фармацевтической композиции, содержащей аполипопротеин A-I, и (iii) агента, пригодного для предотвращения или лечения сердечно-сосудистого заболевания.
25. Способ по п. 24, в котором агент на этапе (b) является пептидомиметиком по любому из пп. 4-14.
26. Фармацевтическая композиция по п.16 для профилактики сердечно-сосудистого заболевания у субъекта, имеющего острую боль в груди, острый коронарный синдром, ревматоидный артрит, системную красную волчанку, тяжелый стеноз сонной артерии, терминальную стадию почечной недостаточности или периодонтит.
| SVIRIDOV D | |||
| et al., Helix stabilization of amphipathic peptides by hydrocarbon stapling increases cholesterol efflux by the ABCA1 transporter, BIOCHEM | |||
| & BIOPHYS.RES.COMM., 2011, v | |||
| Устройство анодов катодных ламп | 1923 |
|
SU410A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Способ пропитывания дерева | 1921 |
|
SU446A1 |
| WO 2012149563 A1, 01.11.2012 | |||
| WO 2005058938 A2, 30.06.2005 | |||
| Шарошка с механическим приводом для чистки трубок конденсаторов | 1927 |
|
SU9528A1 |
Авторы
Даты
2018-07-31—Публикация
2013-11-06—Подача