Настоящее изобретение относится к шаттлу для гематоэнцефалического барьера, который связывается с рецепторами на гематоэнцефалическом барьере (R/ГЭБ), и к способам его применения.
Предпосылки создания изобретения
Проникновение в головной мозг лекарственных средств для лечения неврологических нарушений, таких, например, как крупные биотерапевтические лекарственные средства и низкомолекулярные лекарственные средства, обладающие низкой способностью к проникновению в головной мозг, очень сильно ограничивается обширным и непроницаемым гематоэнцефалическим барьером (ГЭБ) наряду с другим клеточным компонентом в нейроваскулярной единице (НВЕ). Был протестирован целый ряд стратегий, предназначенных для преодоления указанного препятствия, одна из них заключается в использовании путей трансцитоза, опосредуемых эндогенными рецепторами, которые экспрессируются на эндотелии капилляров головного мозга. Были сконструированы рекомбинантные белки, такие как моноклональные антитела или пептиды, направленные к указанных рецепторам, для того, чтобы обеспечивать опосредуемую рецепторами доставку биотерапевтических лекарственных средств в головной мозг. Однако остаются неизученными стратегии, позволяющие максимизировать поглощение головным мозгом при минимизации ошибочной сортировки в эндотелиальных клетках головного мозга (ВЕС) и степень накопления в конкретных органеллах (прежде всего в органеллах, в которых происходит расщепление биотерапевтических лекарственных средств) в ВЕС.
Моноклональные антитела и другие биотерапевтические лекарственные средства обладают очень большим терапевтическим потенциалом в отношении лечения патологии центральной нервной системы (ЦНС). Однако ГЭБ препятствует их проникновению в головной мозг. В проведенных ранее исследованиях было продемонстрировано, что в компартмент ЦНС может проникать лишь очень низкий процент (примерно 0,1%) IgG, инъецированного в кровоток (Felgenhauer, Klin. Wschr. 52, 1974, сс. 1158-1164). Очевидно, что этот факт должен ограничивать любое фармакологическое действие вследствие низкой концентрации антитела в ЦНС.
Таким образом, существует необходимость в системах доставки лекарственных средств, предназначенных для лечения неврологических заболеваний, через ГЭБ, позволяющих эффективно транспортировать лекарственные средства в головной мозг.
Краткое изложение сущности изобретения
Первым объектом настоящего изобретения является шаттл, предназначенный для проникновения через гематоэнцефалический барьер (шаттл для гематоэнцефалического барьера), содержащий обладающий эффекторной функцией в отношении головного мозга элемент (эффекторный элемент для головного мозга), линкер и один одновалентный связывающий элемент, который связывается с рецептором гематоэнцефалического барьера, где линкер соединяет эффекторный элемент с одновалентным связывающим элементом, который связывается с рецептором гематоэнцефалического барьера.
В конкретном варианте шаттла для гематоэнцефалического барьера одновалентный связывающий элемент, который связывается с рецептором гематоэнцефалического барьера, выбран из группы, состоящей из белков, полипептидов и пептидов.
В конкретном варианте шаттла для гематоэнцефалического барьера одновалентный связывающий элемент, который связывается с рецептором гематоэнцефалического барьера, содержит молекулу, выбранную из группы, которая состоит из лиганда рецептора гематоэнцефалического барьера, scFv, Fv, sFab, VHH, предпочтительно sFab.
В конкретном варианте шаттла для гематоэнцефалического барьера рецептор гематоэнцефалического барьера выбран из группы, включающей рецептор трансферрина, рецептор инсулина, рецептор инсулинподобного фактора роста, белок 8, родственный рецептору липопротеинов низкой плотности, белок 1, родственный рецептору липопротеинов низкой плотности, и фактор роста, подобный гепаринсвязывающему эпидермальному фактору роста, предпочтительно он представляет собой рецептор трансферрина.
В конкретном варианте шаттла для гематоэнцефалического барьера одновалентный связывающий элемент, который связывается с рецептором гематоэнцефалического барьера, содержит один scFab, мишенью которого является рецептор трансферрина, более конкретно, scFab, который распознает эпитоп в рецепторе трансферрина, содержащийся в аминокислотной последовательности SEQ ID NO: 14, 15 или 16.
В конкретном варианте шаттла для гематоэнцефалического барьера эффекторный элемент для головного мозга выбирают из группы, включающей лекарственные средства для лечения неврологических нарушений, нейротропные факторы, факторы роста, ферменты, цитотоксические агенты, антитела, направленные к мишени в головном мозге, моноклональные антитела, направленные к мишени в головном мозге, пептиды, направленные к мишени в головном мозге.
В конкретном варианте шаттла для гематоэнцефалического барьера, мишень в головном мозге, выбрана из группы, состоящей из β-секретазы 1, Аβ, эпидермального фактора роста, рецептора эпидермального фактора роста 2, Tau, фосфорилированного Tau, аполипопротеина Е4, альфа-синуклеина, олигомерных фрагментов альфа-синуклеина, CD20, хантингтина, белка приона, содержащей богатый лейцином повтор киназы 2, паркина, пресенилина 2, гамма-секретазы, рецептора смерти 6, белка-предшественника амилоида, рецептора нейтрофина р75 и каспазы 6.
В конкретном варианте шаттла для гематоэнцефалического барьера эффекторный элемент для головного мозга выбирают из группы, состоящей из белков, полипептидов и пептидов.
В конкретном варианте шаттла для гематоэнцефалического барьера одновалентный связывающий элемент, который связывается с рецептором гематоэнцефалического барьера, выбран из группы, состоящей из белков, полипептидов и пептидов, и указанный одновалентный связывающий элемент соединен с С-концом эффекторного элемента для головного мозга с помощью линкера.
В конкретном варианте шаттла для гематоэнцефалического барьера эффекторный элемент для головного мозга содержит полноразмерное антитело, направленное к мишени в головном мозге, предпочтительно полноразмерный IgG.
В конкретном варианте шаттла для гематоэнцефалического барьера шаттл для гематоэнцефалического барьера содержит полноразмерное антитело IgG-типа в качестве эффекторного элемента для головного мозга, линкер и один scFab в качестве одновалентного связывающего элемента, который связывается с рецептором гематоэнцефалического барьера, где scFab соединен с помощью линкера с С-концом Fc-фрагмента одной из тяжелых цепей антитела IgG-типа.
В конкретном варианте шаттла для гематоэнцефалического барьера эффекторный элемент для головного мозга представляет собой полноразмерное антитело, направленное к Аβ.
В конкретном варианте шаттла для гематоэнцефалического барьера антитело, направленное к Аβ, содержит (a) H-CDR1, содержащий аминокислотную последовательность SEQ ID NO: 5, (б) H-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 6, (в) H-CDR3, содержащий аминокислотную последовательность SEQ ID NO: 7, (г) L-CDR1, содержащий аминокислотную последовательность SEQ ID NO: 8, (д) L-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 9, и (е) L-CDR3, содержащий аминокислотную последовательность SEQ ID NO: 10.
В конкретном варианте шаттла для гематоэнцефалического барьера антитело, направленное к Абета содержит VH-домен, содержащий аминокислотную последовательность SEQ ID NO: 11, и VL-домен, содержащий аминокислотную последовательность SEQ ID NO: 12.
В конкретном варианте шаттла для гематоэнцефалического барьера эффекторный элемент представляет собой полноразмерное антитело, направленное к Аβ, и одновалентный связывающий элемент представляет собой scFab, направленный к рецептору трансферрина, более конкретно scFab, распознающий эпитоп в рецепторе трансферрина, содержащийся в аминокислотной последовательности SEQ ID NO: 14, 15 или 16.
В конкретном варианте шаттла для гематоэнцефалического барьера первая тяжелая цепь антитела, направленного к мишени в головном мозге, присутствующего в шаттле для проникновения через гематоэнцефалический барьер, содержит первый модуль димеризации, а вторая тяжелая цепь антитела, направленного к мишени в головном мозге, присутствующего в шаттле для гематоэнцефалического барьера, содержит второй модуль димеризации, что позволяет осуществлять гетеродимеризацию двух тяжелых цепей.
В конкретном варианте шаттла для гематоэнцефалического барьера первый модуль димеризации в первой тяжелой цепи антитела, направленного к мишени в головном мозге, которое присутствует в шаттле для гематоэнцефалического барьера, содержит «выступы», а модуль димеризации во второй тяжелой цепи антитела, направленного к мишени в головном мозге, которое присутствует в шаттле для гематоэнцефалического барьера, содержит «впадины» в соответствии со стратегией «knobs-into holes».
В конкретном варианте шаттла для гематоэнцефалического барьера эффекторный элемент представляет собой полноразмерное антитело, направленное к фосфорилированному Tau, и одновалентный связывающий элемент представляет собой один scFab, направленный к рецептору трансферрина.
В конкретном варианте шаттла для гематоэнцефалического барьера эффекторный элемент представляет собой полноразмерное антитело, направленное к альфа-синуклеину, и одновалентный связывающий элемент представляет собой один scFab, направленный к рецептору трансферрина.
В конкретном варианте шаттла для гематоэнцефалического барьера линкер представляет собой пептидный линкер, предпочтительно пептид, имеющий аминокислотную последовательность длиной по меньшей мере 25 аминокислот, более предпочтительно длиной от 30 до 50 аминокислот, указанный линкер представляет собой, прежде всего (G4S)6G2 или (G4S)4.
Представленные ниже три варианта осуществления изобретения относятся к шаттлу для гематоэнцефалического барьера, в котором эффекторный элемент для головного мозга представляет собой белок, полипептид или пептид при условии, что эффекторный элемент для головного мозга не представляет собой полноразмерное антитело, прежде всего полноразмерный IgG.
В конкретном варианте шаттла для гематоэнцефалического барьера одновалентный связывающий элемент, который связывается с рецептором гематоэнцефалического барьера, содержит СН2-СН3-домен Ig и один sFab, который связывается с рецептором гематоэнцефалического барьера, где sFab соединен с С-концом СН2-СН3-домена Ig с помощью второго линкера.
В конкретном варианте шаттла для гематоэнцефалического барьера шаттл для гематоэнцефалического барьера содержит эффекторный элемент для головного мозга, линкер, домен СН2-СН3 Ig, второй линкер и один sFab, который связывается с рецептором гематоэнцефалического барьера, где эффекторный элемент для головного мозга соединен с помощью первого линкера с N-концом СН2-СН3-домена Ig и sFab соединен с С-концом СН2-СН3-домена Ig с помощью второго линкер.
В конкретном варианте шаттла для гематоэнцефалического барьера СН2-СН3-домен Ig представляет собой СН2-СН3-домен IgG.
Кроме того, настоящее изобретение относится к выделенной нуклеиновой кислоте, кодирующей шаттл для гематоэнцефалического барьера, клетке-хозяину, содержащей выделенную нуклеиновую кислоту, кодирующую шаттл для гематоэнцефалического барьера, и фармацевтической композиции, содержащей шаттл для гематоэнцефалического барьера.
Шаттл для гематоэнцефалического барьера, предлагаемый в настоящем изобретении, можно применять в качестве лекарственного средства, прежде всего его можно применять для лечения неврологического нарушения, такого, например, как болезнь Альцгеймера.
Шаттл для гематоэнцефалического барьера, предлагаемый в настоящем изобретении, можно применять для того, чтобы транспортировать эффекторный элемент для головного мозга через гематоэнцефалический барьер.
В конкретном варианте осуществления изобретения тяжелая цепь антитела IgG-типа в шаттле для гематоэнцефалического барьера, предлагаемом в настоящем изобретении, соединенная на С-конце его Fc-фрагмента с scFab в качестве одновалентного связывающего элемента, который связывается с рецептором гематоэнцефалического барьера, имеет следующую структуру:
- тяжелая цепь IgG,
- линкер, соединяющий С-конец Fc-фрагмента тяжелой цепи IgG с N-концом VL-домена scFab,
- вариабельный домен легкой цепи (VL) и домен легкой С-каппа-цепи scFab,
- линкер, соединяющий С-конец домена легкой С-каппа цепи scFab с N-концом VH-домена scFab,
- вариабельный домен тяжелой цепи (VH) антитела в виде scFab и СН3-домен тяжелой цепи IgG.
Вторым объектом настоящего изобретения является слитый белок, предназначенный для транспортирования эффекторного элемента для головного мозга через гематоэнцефалический барьер, содержащий СН2-СН3-домен Ig, линкер и один sFab, мишенью которого является рецептор гематоэнцефалического барьера, в котором sFab соединен с С-концом СН2-СН3-домена Ig с помощью линкера.
В конкретном варианте слитого белка, предлагаемого в настоящем изобретении, слитый белок, предлагаемый в настоящем изобретении, дополнительно содержит линкер на N-конце СН2-СН3-домена Ig для соединения эффекторного элемента для головного мозга с N-концом СН2-СН3-домена Ig.
В конкретном варианте слитого белка, предлагаемого в настоящем изобретении, эффекторный элемент для головного мозга выбирают из группы, состоящей из лекарственного средства для лечения неврологического нарушения, нейротропных факторов, факторов роста, ферментов, цитотоксических агентов, фрагментов антитела или пептидов, направленных к мишени в головном мозге, которые выбраны из группы, состоящей из scFv, Fv, scFab, Fab, VHH, F(ab')2.
В конкретном варианте слитого белка, предлагаемого в настоящем изобретении, sFab, направленный к рецептору гематоэнцефалического барьера, представляет собой sFab, направленный к рецептору трансферрина, предпочтительно scFab, распознающий эпитоп в рецепторе трансферрина, который содержится в аминокислотной последовательности SEQ ID NO: 14, 15 или 16.
В конкретном варианте слитого белка, предлагаемого в настоящем изобретении, линкер представляет собой пептидный линкер, прежде всего пептид, имеющий аминокислотную последовательность длиной по меньшей мере 15 аминокислот, более предпочтительно длиной от 20 до 50 аминокислот, наиболее предпочтительно указанный линкер имеет аминокислотную последовательность (G4S)6G2 (SEQ ID NO: 13) или (G4S)4 (SEQ ID NO: 17).
В конкретном варианте слитого белка, предлагаемого в настоящем изобретении, СН2-СН3-домен Ig представляет собой СН2-СН3-домен IgG.
Кроме того, в настоящем изобретении предложена нуклеиновая кислота, кодирующая слитый белок, предлагаемый в настоящем изобретении, и клетка-хозяин, содержащая нуклеиновую кислоту, кодирующую слитый белок, предлагаемый в настоящем изобретении.
Третьим объектом настоящего изобретения является конъюгат, содержащий слитый белок, предлагаемый в настоящем изобретении, и эффекторный элемент для головного мозга, соединенный с N-концом СН2-СН3-домена Ig слитого белка, предлагаемого в настоящем изобретении, с помощью линкера.
В конкретном варианте конъюгата, предлагаемого в настоящем изобретении, эффекторный элемент для головного мозга представляет собой нейротропный фактор, а линкер, соединяющий нейротропный фактор с N-концом СН2-СН3-домена Ig, представляет собой пептидный линкер.
Кроме того, в настоящем изобретении предложена фармацевтическая композиция, содержащая конъюгат, предлагаемый в настоящем изобретении, и фармацевтический носитель, применение конъюгата в качестве лекарственного средства, прежде всего, применение конъюгата для лечения нейродегенеративного нарушения, прежде всего болезни Альцгеймера.
Краткое описание чертежей
На чертежах показано:
на фиг. 1 - различные форматы шаттлов (слитых белков) для гематоэнцефалического барьера, использованных в примерах. 1А: конструкция, содержащая IgG, направленный к Аβ (mAb31). 1Б: конструкция, содержащая один Fab (sFab), направленный к TfR, который соединен с Fc-фрагментом IgG, направленным к Аβ (mAb31). 1В: конструкция, содержащая два Fab (dFab), направленных к TfR, которые соединены с Fc-фрагментом IgG, направленным к Аβ (mAb31). Структура scFab слита с С-концом тяжелой цепи антитела IgG-типа;
на фиг. 2 - данные, характеризующие способность слитых белков к связыванию с Aβ-структурами. Аффинность связывания оценивали с использованием системы для ELISA, результаты свидетельствуют о том, что содержащие Fab конструкции сохраняли способность связываться с Aβ. Связывание конструкций mAb31-8D3 с фибриллами Абета. В то время как антитело 8D3 (незакрашенные квадраты) не связывалось с иммобилизованными фибриллами Абета, для mAb31-8D3-dFab (закрашенные квадраты), mAb31-8D3-sFab (незакрашенные треугольники) и mAb31 (закрашенные треугольники) такое связывание имело место и оно характеризовалось сопоставимыми величинами аффинности;
на фиг. 3 - данные, характеризующие способность конструкций к связыванию с рецептором трансферрина (TfR). Аффинность связывания оценивали с использованием системы для ELISA, результаты свидетельствуют о том, что только содержащие Fab конструкции связывались с рецептором трансферрина (TfR) и конструкция, содержащая двойной Fab, обладала немного более высокой кажущейся аффинностью, обусловленной двухвалентным форматом связывания. Связывание конструкций mAb31-8D3 с mTfR. В то время как mAb31 (закрашенные треугольники) не связывалось с иммобилизованным mTfR, аффинность связывания mAb31-8D3-dFab (закрашенные квадраты) была сопоставима с аффинностью родительского антитела 8D3 (незакрашенные квадраты). Одновалентная конструкция mAb31-8D3-sFab (незакрашенные треугольники) характеризовалась промежуточной величиной аффинности;
на фиг. 4 - результаты «декорирования» (окрашивания) бляшек моноклональным антителом к Аβ mAb31 (фиг. 4А), конструкцией «один Fab mAb31» (один Fab-фрагмент, слитый с С-концом mAb31) (фиг. 4Б) и конструкцией «два Fab mAb31» (два Fab-фрагмента, слитых с С-концом mAb31) (фиг. 4В). Конструкции инъецировали мышам линии PS2APP (n=3/конструкцию), вводя внутривенно однократную дозу 10 мг/кг, и затем осуществляли перфузию головного мозга в течение 8 ч после введения дозы. Анализ включал исследование связывания с бляшками с помощью иммуногистохимии и конфокальной микроскопии. Результаты свидетельствуют о том, что только конструкция «один Fab-mAb31» обладала способностью пересекать ГЭБ и связываться с бляшками. На чертеже представлена только одна репрезентативная область головного мозга для всех животных;
на фиг. 5 - результаты количественной оценки конструкции «два Fab-mAb31». Осуществляли количественную оценку окрашивания бляшек и капилляров в трех различных областях для всех трех обработанных животных (в общей сложности по 9 областей для каждой конструкции). Результаты свидетельствуют о том, что только в капиллярах имело место увеличение уровней конструкции «два Fab-mAb31» по сравнению с mAb31. В бляшках (внутри головного мозга) не было обнаружено повышения уровней конструкции «два Fab-mAb31». Представлено сравнение результатов количественной оценки mAb31 (HEK-клетки в качестве контроля) с конструкцией «два Fab-mAb3», 10 мг/кг, через 8 ч после введения дозы;
на фиг. 6 - результаты количественной оценки конструкции «один Fab-mAb31». Осуществляли количественную оценку окрашивания бляшек и капилляров в трех различных областях для всех трех обработанных животных (в общей сложности по 9 областей для каждой конструкции). Результаты свидетельствуют о том, что в бляшках имело место очень значительное увеличение уровня конструкции «один Fab-mAb31» по сравнению с mAb31. Количественная оценка флуоресцентного сигнала выявила более чем 50-кратное увеличение уровня конструкции «один Fab-mAb31» по сравнению с конструкцией mAb31. Имело место также кратковременное окрашивание конструкцией «один Fab-mAb31», сопоставимое с mAb31, в капиллярах, свидетельствующее о пересечении ГЭБ. Представлено сравнение результатов количественной оценки mab31 (HEK-клетки в качестве контроля) с конструкцией «один Fab-mab3», 10 мг/кг, через 8 ч после введения дозы и 25 мг/кг через 24 ч после введения дозы;
на фиг. 7 - окрашивание бляшек моноклональным антителом к Аβ mAb31, взятым в двух различных дозах, и конструкцией «один Fab-mAb31» (один Fab-фрагмент, слитый с С-концом mAb31), взятой в очень низкой дозе. Конструкцию инъецировали мышам линии PS2APP (n=3/конструкцию) путем однократного внутривенного введения дозы, и затем осуществляли перфузию головного мозга в различные моменты времени после введения дозы. Анализ включал исследование связывания с бляшками с помощью иммуногистохимии и конфокальной микроскопии. Результаты свидетельствуют о том, что только конструкция «один Fab-mAb31» обладала способностью пересекать ГЭБ и связываться с бляшками. В случае конструкции «один Fab-mAb31» экспозиция в головном мозге была очень быстрой, и окрашивание бляшек сохранялась по меньшей мере в течение одной недели после однократного введения;
на фиг. 8 - результаты количественной оценки экспрессии на клеточной поверхности TfR после обработки конструкциями «один Fab-mAb31» или «два Fab-mAb31». Проиллюстрирована понижающая регуляция рецептора трансферрина (TfR) на клеточной поверхности конструкцией «два Fab-mAb31». Эндотелиальные клетки головного мозга, экспрессирующие TfR, инкубировали в течение 24 ч в присутствии либо конструкции «один Fab-mAb31» (фиг. 8А), либо конструкции «два Fab-mAb31» (фиг. 8Б). Продемонстрировано, что только конструкция «два Fab-mAb31» снижала уровень экспрессированного на клеточной поверхности TfR;
на фиг. 9 - результаты оценки in vivo клеточного трафика TfR после обработки конструкциями «один Fab-mab31» или «два Fab-mAb31». Представлены результаты исследования окрашивания капилляров и бляшек in vivo в первые моменты времени. Как sFab-MAb31 (фиг. 9А), так и dFab-MAb31 (фиг. 9Б), окрашивали сосудистую сеть головного мозга через 15 мин после инъекции, при этом не выявлено различий в их распределении. Через 8 ч после инъекции конструкция sFab-MAb31 достигала паренхимы и окрашивала амилоидные бляшки (стрелки, фиг. 9В), в то время как конструкция dFab-MAb31 оставалась внутри сосудистой сети головного мозга, при этом картина была сходной с той, которая была установлена в момент времени 15 мин (фиг. 9Г). В амилоидных бляшках, присутствующих в паренхиме конструкция dFab-MAb31 не обнаружена;
на фиг. 10 - результаты оценки in vivo клеточного трафика TfR после обработки конструкциями «один Fab-mab31» или «два Fab-mAb31». Для контроля целостности всех конструкций, применявшихся в исследовании, осуществляли окрашивание криосрезов головного мозга трансгенных по АРР мышей возрастом 18 месяцев с использованием mAb31 (фиг. 10А), sFab-mAb31 (фиг. 10Б) или dFab-mAB31 (фиг. 10В). На фиг. 10Г представлены результаты, полученные для контроля. Результаты свидетельствуют о том, что все 3 конструкции обнаружены в амилоидных бляшках головного мозга трансгенных мышей;
на фиг. 11 - результаты оценки in vivo клеточного трафика TfR после обработки конструкцией «один Fab-mab31». Исследование с помощью конфокальной микроскопии высокого разрешения, проведенное на обработанных in vivo образцах, продемонстрировало, что конструкция sFab-MAb31 не окрашивала обращенную в просвет сторону капилляров, но она содержались в везикулоподобных структурах, пересекающих обращенную в просвет мембрану эндотелиальных клеток, и в цитозоле эндотелиальных клеток. Стрелками на фиг. 11 указаны везикулы, содержащие конструкции sFab-MAb31 на внепросветной стороне ядер эпителиальных клеток. Указанные данные позволяют предположить, что sFab-MAb31 может, как проникать в эндотелиальные клетки головного мозга, так и пересекать сосудистую сеть и достигать амилоидных бляшек в паренхимальном пространстве головного мозга (ср. с фиг. 9А и 9В);
на фиг. 12 - результаты оценки in vivo клеточного трафика TfR, обработанного конструкцией «два Fab-mab31». Исследование, проведенное с помощью конфокальной микроскопии высокого разрешения на обработанных in vivo образцах, продемонстрировало, что конструкция dFab-MAb31 не окрашивала обращенную в просвет сторону капилляров, но она содержалась в везикулоподобных структурах, пересекающих обращенную в просвет мембрану эндотелиальных клеток, и в цитозоле эндотелиальных клеток. Стрелками на фиг. 12 указаны везикулы, содержащие конструкции dFab-MAb31 на внепросветной стороне ядер эпителиальных клеток. Указанные данные позволяют предположить, что конструкция dFab-MAb31 может проникать в эндотелиальные клетки головного мозга, но она захватывается и не может пересекать сосудистую сеть и, следовательно, достигать амилоидных бляшек в паренхимальном пространстве головного мозга (ср. с фиг. 9Б и 9Г);
на фиг. 13 - экспозиция головного мозга и результаты окрашивания бляшек после i.v.-введения. На фиг. 13А: конструкции mAb31, dFab и sFab вводили путем внутривенной инъекции трансгенным животным линии PS2APP в дозе 10 мг/кг, животных подвергали перфузии и умерщвляли через 8 ч после инъекции. Не обнаружено значительного увеличения окрашивания бляшек при использовании dFab по сравнению с mAb31. На основе измерений при 555 нм интенсивности флуоресценции от идентифицирующего антитела установлено, что при использовании конструкции sFab имело место в 55 раз более высокое окрашивание бляшек, чем при использовании родительского mAb31. Представлены репрезентативные результаты иммуногистохимического окрашивания в коре головного мозга с использованием mAb31 (фиг. 13Б), dFab (фиг. 13В) и sFab (фиг. 13Г) через 8 ч после инъекции. dFab-конструкция приводила только к окрашиванию микрососудов, в то время как sFab-конструкция интенсивно окрашивала бляшки амилоида-β. На фиг. 13Д продемонстрировано, что sFab-конструкция при ее введении в низкой дозе (2,66 мг/кг) быстро и в значительном количестве достигал бляшек в головном мозге в отличие от mAb31 при его введении как в дозе 2 мг/кг, так и в дозе 10 мг/кг. Включение sFab-конструкции в мишень сохранялось в течение по меньшей мере одной недели после инъекции. С помощью иммуногистохимического окрашивания выявлено окрашивание бляшек через 7 дней после инъекции при использовании mAb31 в дозе 2 мг/кг (фиг. 13Е) и sFab в дозе 2,66 мг/кг (фиг. 13Ж);
на фиг. 14 - результаты оценки эффективности in vivo, полученные в долгосрочном исследовании на несущих бляшки мышах линии PS2APP, которых обрабатывали путем 14 еженедельных i.v.-инъекций. На фиг. 14А-Г представлено связывание с бляшками-мишенями введенных конструкций, связанных с оставшимися бляшками по окончании исследования, после введения mAb31 в низкой дозе, введения mAb31 в средней дозе, введения sFab в низкой дозе и вводимого sFab в средней дозе соответственно. Представлены результаты количественного морфометрического анализа после иммуногистохимического окрашивания бляшек в коре головного мозга и гиппокампе (фиг. 14Д). Загрузка бляшками, выявленная у необработанных животных, которых умерщвляли в возрасте 4,5 месяцев, представлена в качестве исходного уровня амилоидоза при начале исследования. Четко видно значимое снижение количества бляшек после обработки sFab в средней дозе по сравнению с прогрессирующим образованием бляшек у обработанных наполнителем животных; тенденция к снижению образования бляшек проявлялась даже при введении sFab в низкой дозе. Таким образом, конструкция sFab значимо снижала количество бляшек, как в коре головного мозга, так и в гиппокампе. Анализ размеров бляшек позволил установить, что снижение количества бляшек наиболее выражено для бляшек малого размера: *р≤0,05, **р≤0,01, ***р≤0,001;
на фиг. 15 - данные, демонстрирующие, что антитела с мультимерными scFab-фрагментами к TfR, слитые с С-концом Fc, не индуцируют ADCC. NK92-опосредованное уничтожение эритролейкозных клеток мышей линии BA/F3 количественно оценивали на основе измерения высвобождения LDH. Только мультимерные конструкции, в которых TfR-связывающий Fab-фрагмент находился в «канонической» «N-концевой относительно Fc» ориентации, индуцировали значительную ADCC, в то время как имеющие обратную ориентацию шаттл-конструкции для головного мозга не обладали активностью;
на фиг. 16 - данные, демонстрирующие, что конструкция scFab 8D3, мишенью которой является рецептор трансферрина, связывается с тремя различными пептидами во внеклеточном домене мышиного рецептора трансферрина. Связывание антитела 8D3 с 15-мерными пептидами, перекрывающимся на три аминокислоты, выявляли путем хемилюминисцентного обнаружения антитела, инкубированного на предметном стекле CelluSpot, несущем иммобилизованные mTfR-пептиды. Контур: пептиды №№373, 374 и 376, связанные 8D3 (SEQ ID NO: 14, 15 и 16).
Подробное описание предпочтительных вариантов осуществления изобретения
Определения
Понятие «гематоэнцефалический барьер» или «ГЭБ» относится к физиологическому барьеру между периферическим кровотоком и головным мозгом и спинным мозгом, который формируется в результате плотных контактов в эндотелиальных плазматических мембранах капилляров головного мозга, создающих плотный барьер, который ограничивает транспорт молекул в головной мозг, даже очень малых молекул, таких как мочевина (60 Да). ГЭБ в головном мозге, барьер между кровью и спинным мозгом в спинном мозге и гематоретинальный барьер в сетчатке представляют собой непрерывные капиллярные барьеры в ЦНС и в настоящем описании они в целом обозначены как гематоэнцефалический барьер или ГЭБ. ГЭБ включает также барьер между кровью и СМЖ (хороидальное сплетение), в котором барьер содержит эпендимальные клетки, а не капиллярные эндотелиальные клетки.
Модули димеризации по типу «knobs into holes» и их применение для конструирования антител описаны у Carter P., Ridgway J.B.B., Presta L.G., Immunotechnology, том 2, номер 1, февраль 1996 г., сс. 73-73(1).
Понятие «ЦНС» или «центральная нервная система» относится к комплексу нервных тканей, которые контролируют функцию организма, и включают головной мозг и спинной мозг.
«Рецептор гематоэнцефалического барьера» (в настоящем описании сокращенно обозначен как «R/ГЭБ») представляет собой внеклеточный сцепленный с мембраной рецепторный белок, экспрессируемый на эндотелиальных клетках головного мозга, который обладает способностью транспортировать молекулы через ГЭБ или который можно использовать для транспорта экзогенных вводимых молекул. В контексте настоящего описания примерами R/ГЭБ являются: рецептор трансферрина (TfR), рецептор инсулина, рецептор инсулинподобного фактора роста (IGF-R), рецепторы липопротеинов низкой плотности, включая (но, не ограничиваясь только ими) белок 1 родственный рецептору липопротеинов низкой плотности (LRP1), белок 8, родственный рецептору липопротеинов низкой плотности (LRP8), и фактор роста, подобный гепаринсвязывающему эпидермальному фактору роста (НВ-EGF). В контексте настоящего описания примером R/ГЭБ является рецептор трансферрина (TfR).
Понятие «эффекторный элемент для головного мозга» относится к молекуле, предназначенной для транспортировки в головной мозг через ГЭБ. Как правило, эффекторный элемент обладает характерной терапевтической активностью, которую требуется реализовать в головном мозге. К эффекторным элементам относятся лекарственные средства для лечения неврологических нарушений и цитотоксические агенты, такие, например, как пептиды, белки и антитела, прежде всего моноклональные антитела или их фрагменты, направленные к мишени в головном мозге.
Понятие «одновалентный связывающий элемент» относится к молекуле, обладающей способностью к специфическому связыванию и к связыванию в одновалентном формате с R/ГЭБ. Шаттл и/или конъюгат для гематоэнцефалического барьера, предлагаемый в настоящем изобретении, отличаются наличием одной единицы одновалентного связывающего элемента, т.е. шаттл и/или конъюгат для гематоэнцефалического барьера, предлагаемый в настоящем изобретении, содержат одну единицу одновалентного связывающего элемента. К одновалентным связывающим элементам относятся (но, не ограничиваясь только ими) белки, полипептиды, пептиды и фрагменты антител, включая Fab, Fab', Fv-фрагменты, молекулы одноцепочечных антител, такие, например, как одноцепочечный Fab, scFv. Одновалентный связывающий элемент может представлять собой, например, каркасный белок, сконструированный с помощью известных в данной области технологий, таких как фаговый дисплей или иммунизация. Одновалентный связывающий элемент может представлять собой также пептид. В конкретных вариантах осуществления изобретения одновалентный связывающий элемент содержит СН2-СН3-домен Ig и один Fab (sFab), мишенью которого является рецептор гематоэнцефалического барьера. sFab соединен с С-концом СН2-СН3-домена Ig с помощью линкера. В конкретных вариантах осуществления изобретения мишенью sFab является рецептор трансферрина.
Понятие «одновалентный формат связывания» относится к специфическому связыванию с R/ГЭБ, при котором взаимодействие между одновалентным связывающим элементом и R/ГЭБ осуществляется через один единичный эпитоп. Одновалентный формат связывания предупреждает любую димеризацию/мультимеризацию R/ГЭБ вследствие того, что точка взаимодействия представляет собой один эпитоп. Одновалентный формат связывания предупреждает изменение внутриклеточной сортировки R/ГЭБ.
Понятие «эпитоп» включает любую полипептидную детерминанту, обладающую способностью к специфическому связыванию с антителом. В конкретных вариантах осуществления изобретения, эпитопная детерминанта включает химически активную поверхностную группировку молекул, таких как аминокислоты, боковые цепи Сахаров, фосфорил или сульфонил, и, в конкретных вариантах осуществления изобретения, она может иметь специфические трехмерные структурные характеристики и/или специфические характеристики заряда. Эпитоп представляет собой область антигена, с которой связывается антитело.
«Рецептор трансферрина» («TfR») представляет собой трансмембранный гликопротеин (с молекулярной массой примерно 180000), состоящий из двух связанных дисульфидом субъединиц (каждая имеет молекулярную массу примерно 90000), который участвует в поглощении железа у позвоночных. В контексте настоящего описания в одном из вариантов осуществления изобретения TfR представляет собой человеческий TfR, который содержит, например, аминокислотную последовательность, представленную у Schneider и др., Nature 311, 1984, сс. 675-678.
В контексте настоящего описания понятие «неврологическое нарушение» относится к заболеванию или нарушению, которое поражает ЦНС и/или этиология которого связана с ЦНС. Примерами заболеваний или нарушений ЦНС являются (но, не ограничиваясь только ими) невропатия, амилоидоз, рак, глазное заболевание или нарушение, вирусная или микробная инфекция, воспаление, ишемия, нейродегенеративное заболевание, эпилептический припадок, нарушения поведения и лизосомная болезнь накопления. Для целей настоящей заявки следует иметь в виду, что ЦНС включает глаз, который, в норме отделен от остальной части организма гематоретинальным барьером. Конкретными примерами неврологических нарушений являются (но, не ограничиваясь только ими) нейродегенеративные заболевания (включая, но, не ограничиваясь только ими, болезнь (диффузных) телец Леви, постмиелитический синдром, синдром Шая-Дрейджера, оливопонтоцеребеллярную атрофию, болезнь Паркинсона, мультисистемную атрофию, стриатонигральную дегенерацию), тауопатии (включая, но, не ограничиваясь только ими, болезнь Альцгеймера и супрануклеарный паралич), прионные заболевания (включая, но, не ограничиваясь только ими, бычью спонгиформную энцефалопатию, скрепи, синдром Крейтцфельдта-Якоба, куру, болезнь Герстманна-Штросслера-Шейнкера, хроническую изнуряющую болезнь и фатальную семейную бессонницу), бульварный паралич, болезнь двигательных нейронов и гетеродегенеративные нарушения нервной системы (включая, но, не ограничиваясь только ими, болезнь Канавана, болезнь Гентингтона, нейронный цероидный липофусциноз, болезнь Александера, синдром Туретта, синдром курчавых волос Менкеса, синдром Коккейна, синдром Галлервордена-Шпатца, болезнь Лафоры, синдром Ретта, гепатолентикулярную дегенерацию, синдром Леша-Найхана и синдром Унферрихта-Лундборга), деменцию (включая, но не ограничиваясь только ими, болезнь Пика и спиноцеребеллярную атаксию), рак (например, рак ЦНС и/или головного мозга, включая метастазы в головной мозг, образующиеся от рака в какой-либо области организма).
«Лекарственное средство для лечения неврологических нарушений» Представляет собой лекарственное средство или терапевтический агент, которым лечат одно или несколько неврологическое(их) нарушение(й). К Лекарственные средства для лечения неврологических нарушений, предлагаемые в изобретении, включают (но, не ограничиваясь только ими) низкомолекулярные соединения, антитела, пептиды, белки, встречающиеся в естественных условиях лиганды для одной или нескольких мишени(ей) в ЦНС, модифицированные версии встречающихся в естественных условиях лигандов для одной или нескольких мишени(ей) в ЦНС, аптамеры, ингибирующие нуклеиновые кислоты (т.е. малые ингибирующие РНК (siRNA) и короткие образующие шпильку РНК (shRNA)), рибозимы и малые молекулы, или активные фрагменты любой из указанных выше субстанций. Примеры лекарственных средств для лечения неврологических нарушений, предлагаемых в изобретении, представлены в настоящем описании и включают (но, не ограничиваясь только ими): антитела, аптамеры, белки, пептиды, ингибирующие нуклеиновые кислоты и малые молекулы, и активные фрагменты любой из указанных выше субстанций, которые или сами специфически распознают и/или воздействуют (т.е. ингибируют, активируют или обнаруживают) на антиген в ЦНС или молекулу-мишень, такую как (но, не ограничиваясь только ими) белок-предшественник амилоида или его фрагмент, амилоид бета, бета-секретазу, гамма-секретазу, tau, альфа-синуклеин, паркин, хантингтин, DR6, пресенилин, АроЕ, маркеры глиомы или другого рака ЦНС и нейротрофины. Примерами лекарственных средств для лечения неврологических нарушений и соответствующих нарушений, для лечения которых их можно применять, являются (но, не ограничиваясь только ими) нейротропный фактор головного мозга (BDNF) - хроническое повреждение головного мозга (нейрогенез), фактор роста фибробластов-2 (FGF-2), антитело к рецептору эпидермального фактора роста - рак головного мозга, (EGFR)-антитело, выведенный из линии глиальных клеток нейральный фактор (GDNF) -болезнь Паркинсона, нейротропный фактор головного мозга (BDNF) - амиотрофический боковой склероз, депрессия, лизосомальный фермент лизосомные болезни накопления в головном мозге, цилиарный нейротропный фактор (CNTF) - амиотрофический боковой склероз, неурегулин-1 - шизофрения, антитело к HER2 (например, трастузумаб) - метастазы в головной мозг при HER2-позитивном раке.
«Визуализирующий агент» представляет собой соединение, обладающее одним или несколькими свойствами, которые дают возможность обнаруживать прямо или косвенно его присутствие и/или локализацию. Примерами таких визуализирующих агентов являются белки и низкомолекулярные соединения, содержащие меченый элемент, дающий возможность обнаружения.
«ЦНС-антиген» или «мишень в головном мозге» представляет собой антиген и/или молекулу, который/которая экспрессируется в ЦНС, включая головной мозг, который/которая может служить мишенью для антитела или малой молекулы. Примеры таких антигенов и/или молекул включают (но, не ограничиваясь только ими) бета-секретазу 1 (ВАСЕ1), амилоид бета (Абета), рецептор эпидермального фактора роста (EGFR), человеческий рецептор эпидермального фактора роста 2 (HER2), Tau, аполипопротеин Е4 (АроЕ4), альфа-синуклеин, CD20, хантингтин, белок прион (PrP), содержащую богатый лейцином повтор киназу 2 (LRRK2), паркин, пресенилин 1, пресенилин 2, гамма-секретазу, рецептор смерти 6 (DR6), белок-предшественник амилоида (АРР), р75 рецептор нейротрофина (p75NTR) и каспазу 6. В одном из вариантов осуществления изобретения антиген представляет собой ВАСЕl.
В контексте настоящего изобретения понятие «нативная последовательность» белка относится к белку, содержащему аминокислотную последовательность встречающегося в естественных условиях белка, включая встречающиеся в естественных условиях варианты белка. В контексте настоящего описания понятие включает как белок, выделенный из природного источника, так и полученный методами рекомбинации.
В контексте настоящего описания понятие «антитело» применяют в его наиболее широком смысле и оно включает, в частности, моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), образованные по меньшей мере из двух интактных антител, и фрагменты антитела при условии, что они обладают требуемой биологической активностью.
В контексте настоящего описания «фрагменты антител» содержат часть интактного антитела, которая сохраняет способность связываться с антигеном. Примерами фрагментов антител являются Fab, Fab', F(ab')2 и Fv-фрагменты; димерные антитела (диабоди); линейные антитела; одноцепочечные молекулы антител, такие, например, как одноцепочечные Fab, scFv и мультиспецифические антитела, образованные из фрагментов антител. Формат «одноцепочечного Fab» описан у Hust М. и др., ВМС Biotechnol. 7, 8 марта 2007 г., с. 14.
Понятие «моноклональное антитело» в контексте настоящего описания относится к антителу, полученному из популяции практически гомогенных антител, т.е. индивидуальные антитела, образующие популяцию, являются идентичными и/или связываются с одним и тем же эпитопом за исключением возможных вариантов, которые могут возникать в процессе получения моноклонального антитела, такие варианты, как правило, присутствуют в минорных количествах. В отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела к различным детерминантам (эпитопам), мишенью каждого моноклонального антитела является одна детерминанта на антигене. Помимо их специфичности, преимуществом моноклональных антител является то, что они не загрязнены другими иммуноглобулинами. Прилагательное «моноклональный» указывает на характер антитела, т.е. на тот факт, что оно получено из практически гомогенной популяции антител, а не сконструировано для его производства каким-либо конкретным методом. Например, моноклональные антитела, которые можно применять согласно настоящему изобретению, можно получать с помощью метода гибридом, впервые описанного Kohler и др., Nature, 256, 1975, с. 495, или можно получать методами рекомбинантной ДНК (см., например, US 4816567). «Моноклональные антитела» можно выделять также из фаговых библиотек антител с помощью методов, описанных, например, у Clackson и др., Nature, 352, 1991, сс. 624-628 и у Marks и др., J. Mol. Biol., 222, 1991, сс. 581-597. Конкретными примерами моноклональных антител являются химерные антитела, гуманизированные антитела и человеческие антитела, включая их антигенсвязывающие фрагменты. В контексте настоящего описания моноклональные антитела включают, в частности, «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, выведенных из конкретного вида или относящихся к определенному классу или подклассу антител, в то время как остальная часть цепи(ей) идентична или гомологична соответствующим последовательностям антител, выведенных из других видов или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, если они обладают требуемой биологической активностью (патент США №4816567; Morrison и др., Proc. Natl. Acad. Sci. USA, 81, 1984, сс. 6851-6855). Химерные антитела, представляющие интерес в контексте настоящего описания, включают «приматизированные» антитела, которые содержат антигенсвязывающие последовательности вариабельного домена, выведенные из примата кроме человека (например, обезьяны Старого Света, такой как бабуин, макак-резус или обезьяна циномолгус) и последовательности человеческой константной области (патент США №5693780).
«Гуманизированные» формы нечеловеческих (например, мышиных) антител представляют собой химерные антитела, которые содержат минимальную последовательность, выведенную из нечеловеческого иммуноглобулина. В основном, гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентные антитела), в которых остатки из гипервариабельной области реципиента заменены на остатки из гипервариабельной области видов кроме человека (донорские антитела), таких как мыши, крысы, кролики или приматы кроме человека, обладающие требуемой специфичностью, аффинностью и эффективностью. В некоторых случаях остатки каркасного участка (FR) человеческого иммуноглобулина заменяют на соответствующие остатки нечеловеческого антитела. Кроме того, гуманизированные антитела могут содержать остатки, которые не присутствуют в реципиентном антителе или донорском антителе. Такие модификации осуществляют для дополнительного улучшения характеристик антитела. В целом, гуманизированное антитело должно содержать практически полностью по меньшей мере один и, как правило, два вариабельных домена, в которых все или практически все гипервариабельные участки соответствуют гипервариабельным участкам нечеловеческого иммуноглобулина и все или практически все FR представляют собой FR последовательности человеческого иммуноглобулина за исключением указанной(ых) выше замены(замен) FR. Гуманизированное антитело необязательно может содержать также по меньшей мере часть константной области иммуноглобулина, как правило, человеческого иммуноглобулина. Более подробно данный вопрос обсужден у Jones и др., Nature 321, 1986, сс. 522-525; Riechmann и др., Nature 332, 1988, сс. 323-329; и Presta, Curr. Op. Struct. Biol 2, 1992, сс. 593-596.
В контексте настоящего описания «человеческое антитело» представляет собой антитело, структура аминокислотной последовательности которого соответствует структуре аминокислотной последовательности антитела, которое можно получать из человеческой В-клетки, и которое включает антигенсвязывающие фрагменты человеческих антител. Такие антитела можно идентифицировать или создавать различными методами, включая (но, не ограничиваясь только ими) получение в трансгенных животных (например, мышах), которые могут после иммунизации продуцировать человеческие антитела при отсутствии производства эндогенного иммуноглобулина (см., например, у Jakobovits и др., Proc. Natl Acad. Sci. USA, 90, 1993, с. 2551; Jakobovits и др., Nature, 362, 1993, сс. 255-258; Bruggermann и др., Year in Immuno., 7, 1993, с. 33; и US №№5591669, 5589369 и 5545807); отбор из фаговых дисплейных библиотек, экспрессирующих человеческие антитела или фрагменты человеческих антител (см., например, McCafferty и др., Nature 348, 1990, сс. 552-553; Johnson и др., Current Opinion in Structural Biology 3, 1993, cc. 564-571; Clackson и др., Nature, 352, 1991, cc. 624-628; Marks и др., J. Mol. Biol. 222, 1991, cc. 581-597; Griffith и др., EMBO J. 12, 1993, cc. 725-734;US №№5565332 и 5573905); создание с использованием активированных in vitro В-клеток (см. US №№5567610 и 5229275); и выделение из продуцирующих человеческое антитело гибридом.
В контексте настоящего описания «мультиспецифическое антитело» представляет собой антитело, обладающее связывающими специфичностями в отношении по меньшей мере двух различных эпитопов. Например, мультиспецифические антитела могут связываться и с R/ГЭБ, и с антигеном головного мозга. Мультиспецифические антитела можно получать в виде полноразмерных антител или в виде фрагментов антител (например, биспецифические антитела в формате F(ab')2). Можно рассматривать также сконструированные антитела с двумя, тремя или большим количеством (например, четырьмя) функциональными антигенсвязывающими центрами (см., например заявку на патент США US 2002/0004587 А1 на имя Miller и др.). Мультиспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител.
В контексте настоящего описания антитела включают «варианты аминокислотной последовательности» с измененной антигенсвязывающей или биологической активностью. Примеры таких аминокислотных изменений включают антитела с повышенной аффинностью к антигену (например, антитела «с созревшей аффинностью») и антитела с измененной Fc-областью, если она присутствует, например, с измененной (повышенной или сниженной) антитело-обусловленной клеточнозависимой цитотоксичностью (ADCC) и/или комплементзависимой цитотоксичностью (CDC) (см., например, WO 00/42072, на имя Presta L. и WO 99/51642 на имя Iduosogie и др.); и/или увеличенным или уменьшенным временем полужизни в сыворотке (см., например, WO 00/42072, на имя Presta L.).
«Вариант с модифицированной аффинностью» имеет один или несколько замененных остатков гипервариабельного участка или каркасного участка родительского антитело (например, родительского химерного, гуманизированного или человеческого антитела), что приводит к изменению (повышению или снижению) аффинности. Согласно настоящему изобретению в одном из вариантов осуществления изобретения полученный(ые) в результате вариант(ы), отобранный(е) для дальнейшего усовершенствования, должен(ны) обладать пониженной аффинностью к R/ГЭБ. Как правило, для создания таких замещенных вариантов применяют метод фагового дисплея. В целом, метод состоит в следующем: подвергают мутации несколько сайтов (например, 6-7 сайтов) в гипервариабельном участке, осуществляя все возможные аминокислотные замены в каждом сайте. Созданные таким образом варианты антител экспонируются в одновалентном формате на частицах нитчатых фагов в виде слияний с продуктом гена III фага М13, упакованного в каждую частицу. Варианты, полученные с помощью фагового дисплея, затем подвергают скринингу в отношении их биологической активности (например, аффинности связывания). Для идентификации сайтов гипервариабельной области, являющихся кандидатами для модификации, можно осуществлять аланинсканирующий мутагенез с целью выявления остатков в гипервариабельном участке, оказывающих значительное влияние на связывание с антигеном. Может оказаться предпочтительным альтернативно этому или дополнительно проанализировать кристаллическую структуру комплекса антиген-антитело с целью идентификации точек контакта между антителом и его мишенью. Такие контактирующие остатки и соседние остатки являются кандидатами для замещения согласно методам, представленным в настоящем описании. После создания таких вариантов осуществляют скрининг панели вариантов и антитела с измененной аффинностью можно отбирать для дальнейшего усовершенствования.
В контексте настоящего описания антитело может представлять собой «гликозилированный вариант», в котором изменен какой-либо углевод, присоединенный к Fc-области, если она присутствует. Например, в заявке на патент США 2003/0157108 (на имя Presta L.) описаны антитела с созревшей углеводной структурой, в которой отсутствует присоединенная к Fc-области фукоза. См. также US 2004/0093621 (на имя Kyowa Hakko Kogyo Co., Ltd). Антитела, содержащие бисекционирующий N-ацетилгюкозамин (GlcNAc) в углеводе, присоединенном к Fc-области, описаны в WO 2003/011878 на имя Jean-Mairet и др., и в US 6602684 на имя Umana и др. Антитела, содержащие по меньшей мере один галактозный остаток в олигосахариде, присоединенном к Fc области, описаны в WO 1997/30087 на имя Patel и др. См. также WO 1998/58964 (на имя Raju S.) и WO 1999/22764 (на имя Raju S.), в которых описаны антитела с измененным углеводом, присоединенным к их Fc-области. См. также US 2005/0123546 (на имя Umana и др.), в котором описаны антитела с модифицированным гликозилированием. Употребляемое в настоящем описании понятие «гипервариабельный участок» относится к аминокислотным остаткам антитела, ответственным за связывание с антигеном. Гипервариабельный участок содержит аминокислотные остатки из «определяющих комплементарность участков» или «CDR» (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (Н2) и 95-102 (Н3) в вариабельном домене тяжелой цепи, см. Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD., 1991), и/или остатки из «гипервариабельной петли» (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (Н2) and 96-101 (Н3) в вариабельном домене тяжелой цепи, см. Chothia и Lesk J. Mol. Biol. 196, 1987, cc. 901-917). Остатки «каркасного участка» или «FR» представляют собой остатки в вариабельном домене, отличные от остатков гипервариабельного участка, определение которого приведено в настоящем описании.
«Полноразмерное антитело» представляет собой антитело, которое содержит антигенсвязывающую вариабельную область, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи, CH1, СН2 и СН3. Константные домены могут представлять собой константные домены, имеющие нативную последовательность (например, человеческие константные домены, имеющие нативную последовательность), или варианты их аминокислотной последовательности.
«Оголенное антитело» представляет собой антитело (как оно определено в настоящем описании), не конъюгированное с гетерологичной молекулой, такой как цитотоксический агент, полимер или радиоактивная метка.
Понятие «эффекторные функции» антитела относится к видам биологической активности, присущим Fc-области (нативной последовательности Fc-области или варианту аминокислотной последовательности Fc-области) антитела. Примерами эффекторных функций антитела являются C1q-связывание, комплементзависимая цитотоксичность (CDC), связывание с Fc-рецептором, антитело-обусловленная клеточнозависимая цитотоксичность (ADCC) и т.д. В одном из вариантов осуществления изобретения антитело, представленное в настоящем описании, практически не обладает эффекторной функцией.
Понятие « антитело-обусловленная клеточнозависимая цитотоксичность (ADCC)» относится к лизису человеческих клеток-мишеней антителом в присутствии эффекторных клеток. Понятие «комплементзависимая цитотоксичность (CDC)» обозначает процесс, который инициируется связыванием фактора комплемента C1q с Fc-фрагментом большинства антител IgG-подклассов. Связывание C1q с антителом обусловлено определенными белок-белковыми взаимодействиями в так называемом сайте связывания. Такие сайты связывания Fc-фрагмента известны из существующего уровня техники. Такие сайты связывания Fc-фрагмента характеризуются, например, присутствием аминокислот L234, L235, D270, N297, Е318, K320, K322, Р331 и Р329 (нумерация согласно EU-индексу Кэбота). Антитела подклассов IgG1, IgG2 и IgG3, как правило, обладают способностью активировать комплемент, включая связывание с C1q и С3, в то время как IgG4 не активирует систему комплемента и не связывается с C1q и/или С3.
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей полноразмерные антитела могут быть отнесены к различным «классам». Существует пять основных классов полноразмерных антител: IgA, IgD, IgE, IgG и IgM, и, кроме того, некоторые из них можно подразделять на «подклассы» (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам антител, обозначают как альфа, дельта, эпсилон, гамма и мю соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны. В контексте настоящего описания понятие «рекомбинантное антитело» относится к антителу (например, к химерному, гуманизированному или человеческому антителу или его антигенсвязывающему фрагменту), которое экспрессируется рекомбинантной клеткой-хозяином, содержащей нуклеиновую кислоту, кодирующую антитело. Примерами «клеток-хозяев», используемых для продуцирования рекомбинантных антител, служат: (1) клетки млекопитающих, например, клетки яичника китайского хомячка (СНО), COS, клетки миеломы (включая Y0- и NSO-клетки), клетки почки детеныша хомяка (BHK), Hela- и Vero-клетки; (2) клетки насекомых, например, sf9, sf21 и Tn5; (3) клетки растений, например, растений, относящихся к роду Nicotiana (например, Nicotiana tabacum); (4) клетки дрожжей, например, относящихся к роду Saccharomyces (например, Saccharomyces cerevisiae) или роду Aspergillus (например, Aspergillus niger); (5) клетки бактерий, например, клетки Escherichia coli или клетки Bacillus subtilis, и т.д.
В контексте настоящего описания понятие «специфическое связывание» или «специфически связывается с» относится к антителу, которое избирательно или преимущественно связывается с антигеном. Аффинность связывания, как правило, определяют с помощью стандартного анализа, такого как анализ Скэтчарда, или с помощью метода поверхностного плазмонного резонанса (например, с использованием BIACORE®).
Фраза «антитело, которое связывается с тем же самым эпитопом», что и референс-антитело, относится к антителу, которое блокирует связывание референс-антитела с его антигеном по данным анализа в условиях конкуренции более чем на 50% или более, и наоборот, референс-антитело блокирует связывание антитела с его антигеном по данным анализа в условиях конкуренции более чем на 50% или более.
В контексте настоящего описания понятие «цитотоксический агент» относится к субстанции, которая ингибирует или предупреждает клеточную функцию и/или вызывает гибель или разрушение клетки. К цитотоксическим агентам относятся (но, не ограничиваясь только ими) радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические агенты или лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); ингибирующие рост агенты; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или обладающие ферментативной активностью токсины бактериального, грибного, растительного или животного происхождения, включая их фрагменты и/или варианты.
Понятие «эффективное количество» агента, например, фармацевтической композиции, относится к количеству, которое является эффективным в дозах и в течение периодов времени, необходимых для достижения требуемого терапевтического или профилактического результата.
В контексте настоящего описания понятие «Fc-область» применяют для обозначения С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Fc-область содержит СН2- и СН3-домены иммуноглобулина. Понятие включает имеющие нативные последовательности Fc-области и варианты Fc-областей. В одном из вариантов осуществления изобретения Fc-область тяжелой цепи человеческого IgG простирается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако С-концевой остаток лизина (Lys447) Fc-области может присутствовать или отсутствовать. Если специально не указано иное, то нумерацию аминокислотных остатков в Fc-области или константной области осуществляют согласно системе нумерации EU, которую называют также EU-индексом, как описано у Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991. Понятие «каркасный участок» или «FR» относится к остатками вариабельного домена, отличным от остатков гипервариабельного участка (HVR). FR вариабельного домена, как правило, состоит из четырех FR-доменов: FR1, FR2, FR3 и FR4. Таким образом, последовательности HVR и FR, как правило, располагаются в VH (или VL) в следующем порядке: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
В контексте настоящего описания понятие «СН2-СН3-домен Ig» относится к белковому элементу, выведенному из СН2- или СН3-доменов иммуноглобулина. «СН2-СН3-домен Ig» содержит два полипептида «СН2-СН3», образующих димер. Иммуноглобулин может относиться к IgG-, IgA-, IgD-, IgE-или IgM-классу. В одном из вариантов осуществления изобретения СН2-СН3-домен Ig выведен из иммуноглобулина IgG-класса и обозначен в настоящем описании как «СН2-СН3-домен IgG». Понятие включает имеющие нативную последовательность СН2-СН3-домены и варианты СН2-СН3-доменов. В одном из вариантов осуществления изобретения СН2-СН3-домен Ig выведен из СН2-СН3-домена тяжелой цепи человеческого IgG, который простирается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако С-концевой остаток лизина (Lys447) в Fc-области может присутствовать или отсутствовать. Если специально не указано иное, то нумерацию аминокислотных остатков в области СН2-СН3-домена или константной области осуществляют согласно системе нумерации EU, которую называют также EU-индексом, как описано у Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
«Конъюгат» представляет собой слитый белок, предлагаемый в настоящем изобретении, конъюгированный с одной или несколькими гетерологичной(ыми) молекулой(ами), включая (но, не ограничиваясь только ими) метку, лекарственное средство для лечения неврологических нарушений или цитотоксический агент.
В контексте настоящего описания понятие «линкер» относится к химическому линкеру или одноцепочечному пептидному линкеру, который ковалентно соединяет различные элементы шаттла для гематоэнцефалического барьера и/или слитого белка, и/или конъюгата, предлагаемого в настоящем изобретении. Линкер соединяет, например, эффекторный элемент для головного мозга с одновалентным связывающим элементом. Например, если одновалентный связывающий элемент содержит СН2-СН3-домен Ig и sFab, мишенью которого является рецептор гематоэнцефалического барьера, то линкер соединяет sFab с С-концом СН3-СН2-домена Ig. Линкер, соединяющий эффекторный элемент для головного мозга с одновалентным связывающим элементом (первый линкер) и линкер, соединяющий sFab с С-концом СН2-СН3-домена Ig (второй линкер), могут быть одинаковыми или различными.
Можно применять одноцепочечные пептидные линкеры, содержащие от одной до двадцати аминокислот, сцепленных пептидными связями. В конкретных вариантах осуществления изобретения аминокислоты выбирают из двадцати встречающихся в естественных условиях аминокислот. В других конкретных вариантах осуществления изобретения одну или несколько аминокислот выбирают из глицина, аланина, пролина, аспарагина, глутамина и лизина. В других вариантах осуществления изобретения линкер представляет собой химический линкер. В конкретных вариантах осуществления изобретения указанный линкер представляет собой одноцепочечный пептид, аминокислотная последовательность которого состоит по меньшей мере из 25 аминокислот, предпочтительно из 32-50 аминокислот. В одном из вариантов осуществления изобретения указанный линкер представляет собой (G×S)n, где G обозначает глицин, S обозначает серии, (х=3, n=8, 9 или 10 и m=0, 1, 2 или 3) или (х=4 и n=6, 7 или 8 и m=0, 1, 2 или 3), предпочтительно х=4, n=6 или 7 и m=0, 1, 2 или 3, более предпочтительно х=4, n=7 и m=2. В одном из вариантов осуществления изобретения указанный линкер представляет собой (G4S)4 (SEQ ID NO: 17). В одном из вариантов осуществления изобретения указанный линкер представляет собой (G4S)6G2 (SEQ ID NO: 13).
Конъюгацию можно осуществлять с использованием разнообразных химических линкеров. Например, одновалентный связывающий элемент или слитый белок и эффекторный элемент для головного мозга можно конъюгировать с использованием разнообразных бифункциональных связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональных производных сложных имидоэфиров (таких как диметиладипимидат⋅HCl), активных сложных эфиров (таких как дисукцинимидилсуберат), альдегидов (таких как глутаровый альдегид), бисазидосоединений (таких как бис(пара-азидобензоил)гександиамин), производных бисдиазония (таких как бис(пара-диазонийбензоил)этилендиамин), диизоцианатов (таких как толуол-2,6-диизоцианат) и бис-активных соединений фтора (таких как 1,5-дифтор-2,4-динитробензол). Линкер может представлять собой «расщепляемый линкер», который облегчает высвобождение эффекторного элемента после введения в головной мозг. Например, можно применять неустойчивый в кислой среде линкер, чувствительный к действию пептидаз линкер, фотолабильный линкер, диметильный линкер или содержащий дисульфид линкер (Chari и др., Cancer Res. 52, 1992, сс. 127-131; US 5208020).
Ковалентную конъюгацию можно осуществлять либо непосредственно, либо с использованием линкера. В конкретных вариантах осуществления изобретения непосредственную конъюгацию осуществляют путем создания белкового слияния (т.е. путем генетического слияния двух генов, кодирующих одновалентный связывающий R/ГЭБ элемент и эффекторный элемент, и экспрессии продукта в виде единого белка). В конкретных вариантах осуществления изобретения непосредственную конъюгацию осуществляют путем формирования ковалентной связи между реакционноспособной группой на одном из двух фрагментов одновалентного связывающего элемента, мишенью которого является R/ГЭБ, и соответствующей группой или акцептором на эффекторном элементе для головного мозга. В конкретных вариантах осуществления изобретения непосредственную конъюгацию осуществляют путем модификации (т.е. генетической модификации) одной из двух предназначенных для конъюгации молекул с целью включения реакционноспособной группы (например, но, не ограничиваясь только ими, сульфгидрильной группы или карбоксильной группы), что позволяет осуществлять ковалентное присоединение к другой предназначенной для конъюгации молекуле в пригодных условиях. Например, но, не ограничиваясь только этим, молекулу (т.е. аминокислоту), имеющую требуемую реакционноспособную группу (т.е. остаток цистеина), можно встраивать, например, в одновалентный связывающий элемент антитела к R/ГЭБ и создавать дисульфидную связь с лекарством для лечения неврологических нарушений. В данной области известны также методы осуществления ковалентной конъюгации нуклеиновых кислот с белками (т.е. фотохимическое сшивание, см., например, Zatsepin и др., Russ. Chem. Rev. 74, 2005, сс. 77-95). Конъюгацию можно осуществлять с использованием разнообразных химических линкеров. Например, одновалентный связывающий элемент и эффекторный элемент для головного мозга можно конъюгировать с использованием разнообразных бифункциональных связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональных производных сложных имидоэфиров (таких как диметиладипимидат⋅HCl), активных сложных эфиров (таких как дисукцинимидилсуберат), альдегидов (таких как глутаровый альдегид), бисазидосоединений (таких как бис(пара-азидобензоил)гександиамин), производных бисдиазония (таких как бис(пара-диазонийбензоил)этилендиамин), диизоцианатов (таких как толуол-2,6-диизоцианат) и бис-активных соединений фтора (таких как 1,5-дифтор-2,4-динитробензол). Можно применять также пептидные линкеры, содержащие от одной до двадцати аминокислот, соединенных пептидными связями. В таких конкретных вариантах осуществления изобретения одну или несколько аминокислот выбирают из глицина, аланина, пролина, аспарагина, глутамина и лизина. Линкер может представлять собой «расщепляемый ликер», который облегчает высвобождение цитотоксического лекарственного средства в клетке. Например, можно применять неустойчивый в кислой среде линкер, чувствительный к действию пептидаз линкер, фотолабильный линкер, диметильный линкер или содержащий дисульфид линкер (Chari и др., Cancer Res. 52, 1992, сс. 127-131; US 5208020).
В контексте настоящего описания «метка» представляет собой маркер, сшитый со слитым белком, и ее применяют для обнаружения или визуализации.
Примерами таких меток являются: радиоактивная метка, флуорофор, хромофор или аффинная метка. В одном из вариантов осуществления изобретения метка представляет собой радиоактивную метку, используемую для медицинской визуализации, например, tc99m или I123, или спин-метку для визуализации методом ядерного магнитного резонанса (ЯМР) (который называют также магнитно-резонансной томографией, МРТ), например, йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо и т.д. «Индивидуум» или «субъект» представляет собой млекопитающее. Млекопитающие включают (но, не ограничиваясь только ими), одомашненных животных (например, коров, овец, кошек, собак и лошадей), приматов (например, человека и приматов кроме человека, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В конкретных вариантах осуществления изобретения индивидуум или субъект представляет собой человека.
«Выделенное» антитело представляет собой антитело, которое отделено от компонента его естественного окружения. В некоторых вариантах осуществления изобретения антитело очищают до более чем 95%- или 99%-ной чистоты по данным, например, электрофоретического анализа (например, ДСН-ПААГ, изоэлектрического фокусирования (ИЭФ), капиллярного электрофореза) или хроматографического анализа (например, ионообменной хроматографии или ЖХВР с обращенной фазой). Обзор методов оценки чистоты антител представлен, например, у Flatman и др., J. Chromatogr. В 848, 2007, сс. 79-87.
Понятие «листовка-вкладыш в упаковку» в контексте настоящего описания относится к инструкциям, которые обычно помещают в поступающие в продажу упаковки терапевтических продуктов и которые содержат информацию о показаниях, применении, дозе, пути введения, комбинированной терапии, противопоказаниях и/или мерах предосторожности при применении указанных терапевтических продуктов.
Понятие «фармацевтическая композиция» относится к препарату, находящемуся в такой форме, которая обеспечивает эффективное проявление биологической активности содержащегося в нем действующего вещества, и которая не содержит дополнительных компонентов, обладающих неприемлемой токсичностью для субъекта, которому следует вводить композицию.
Понятие «фармацевтически приемлемый носитель» относится к ингредиенту фармацевтической композиции, отличному от действующего вещества, который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает (но, не ограничиваясь только ими) буфер, эксципиент, стабилизатор или консервант.
В контексте настоящего описания понятие «лечение» (и его грамматические вариации, такие как «лечить» или «процесс лечения») относится к клиническому вмешательству с целью изменения естественного течения болезни у индивидуума, подлежащего лечению, и его можно осуществлять либо для профилактики или в процессе развития клинической патологии. Требуемыми действиями лечения являются (но, не ограничиваясь только ими) предупреждение возникновения или рецидива болезни, облегчение симптомов, уменьшение любых прямых или косвенных патологических последствий болезни, предупреждение метастазов, снижение скорости развития болезни, облегчение или временное ослабление болезненного состояния и ремиссия или улучшение прогноза. В некоторых вариантах осуществления изобретения антитела, предлагаемые в изобретении, применяют для задержки развития болезни или замедления прогрессирования болезни.
Композиции и способы
В способах и изделиях, предлагаемых в настоящем изобретении, применяют или они включают шаттл для гематоэнцефалического барьера и/или слитый белок, который связывается с R/ГЭБ. Антиген R/ГЭБ, предназначенный для получения или скрининга одновалентного связывающего элемента, может представлять собой, например, растворимую форму или его часть (например, внеклеточный домен), содержащую требуемый эпитоп. Альтернативно этому или дополнительно для создания или скрининга одновалентного связывающего элемента можно применять клетки, экспрессирующие ГЭБ-R на своей клеточной поверхности. Специалистам в данной области должны быть очевидны и другие формы R/ГЭБ, пригодные для создания одновалентного связывающего элемента. В контексте настоящего описания примерами R/ГЭБ могут служить рецептор трансферрина (TfR), рецептор инсулина, рецептор инсулинподобного фактора роста (IGF-R), белок 1, родственный рецептору липопротеинов низкой плотности (LRP1), и LRP8, и фактор роста, подобный гепаринсвязывающему эпидермальному фактору роста (HB-EGF).
Согласно настоящему изобретению «одновалентный связывающий элемент», мишенью которого является R/ГЭБ (например, одновалентный связывающий TfR элемент) выбирают на основе представленных в настоящем описании данных, демонстрирующих, что такой одновалентный связывающий элемент характеризуется улучшенной способностью к поглощению ЦНС (например, головным мозгом). Для идентификации такого связывающего элемента можно применять различные анализы, позволяющие оценивать одновалентный формат связывания, они включают (но, не ограничиваясь только ими) анализ Скэтчарда и метод поверхностного плазмонного резонанса (например, с использованием BIACORE®), и представленные в настоящем описании исследования in vivo.
Таким образом, в изобретении предложен способ получения одновалентного связывающего элемента, пригодного для транспортировки эффекторного элемента для головного мозга, такого, например, как лекарственное средство для лечения неврологического нарушения, через гематоэнцефалический барьер, заключающийся в том, что отбирают одновалентный связывающий элемент из панели одновалентных связывающих фрагментов, мишенью которых является R/ГЭБ, поскольку он характеризуется одновалентным форматом связывания с R/ГЭБ. Одновалентный формат связывания гарантирует эффективное пересечение ГЭБ для определенного R/ГЭБ, поскольку на него не оказывает влияния обычная внутриклеточная сортировка рецепторов.
В случае невропатического нарушения в качестве неврологического лекарственного средства можно выбирать: аналгетик, включая (но, не ограничиваясь только ими) наркотический/опиоидный аналгетик (т.е. морфин, фентанил, гидрокодон, меперидин, метадон, оксиморфон, пентазоцин, пропоксифен, трамадол, кодеин и оксикодон), нестероидное противовоспалительное лекарственное средство (НСПВС) (т.е. ибупрофен, напроксен, диклофенак, дифлунисал, этодолак, фенопрофен, флурбипрофен, индометацин, кеторолак, мефенамовая кислота, мелоксикам, набуметон, оксапрозин, пироксикам, сулиндак и толметин), кортикостероид (т.е. кортизон, преднизон, преднизолон, дексаметазон, метилпреднизолон и триамцинолон), противомигреневое средство (т.е. суматриптин, алмотриптан, фроватриптан, суматриптан, ризатриптан, элетриптан, золмитриптан, дигидроэрготамин, элетриптан и эрготамин), ацетаминофен, салицилат (т.е. аспирин, холина салицилат, магния салицилат, дифлунисал и салсалат), противоконвульсивное средство (т.е. карбамазепин, клоназепам, габапентин, ламотригин, прегабалин, тиагабин и топирамат), анестезирующее средство (т.е. изофуран, трихлорэтилен, галотан, севофлуран, бензокаин, хлорпрокаин, кокаин, циклометикаин, диметокаин, пропоксикаин, прокаин, новокаин, пропаракаин, тетракаин, артикаин, бупивакаин, картикаин, цинхокаин, этидокаин, левобупивакаин, лидокаин, мепивакаин, пиперокаин, прилокаин, ропивакаин, тримекаин, сакситоксин и тетродотоксин) и ингибитор сох-2 (т.е. целекоксиб, рофекоксиб и вальдекоксиб). В случае невропатического нарушения, сопровождающегося головокружением, в качестве неврологического лекарственного средства можно выбирать: средство против головокружения, включая (но, не ограничиваясь только ими) меклизин, дифенгидрамин, прометазин и диазепам. В случае невропатического нарушения, сопровождающегося тошнотой, в качестве неврологического лекарственного средства можно выбирать: средство против тошноты, включая (но, не ограничиваясь только ими) прометазин, хлорпромазин, прохлорперазин, триметобензамид и метоклопрамид. В случае нейродегенеративного заболевания в качестве неврологического лекарственного средства можно выбирать: гормон роста или нейротропный фактор; их примерами являются (но, не ограничиваясь только ими) нейротропный фактор головного мозга (BDNF), фактор роста нервной ткани (NGF), нейротрофин-4/5, фактор роста фибробластов (FGF)-2 и другие FGF, нейротрофин (NT)-3, эритропоэтин (ЕРО), фактор роста гепатоцитов (HGF), эпидермальный фактор роста (EGF), трансформирующий фактор роста (ТОР)-альфа, TGF-бета, сосудистый эндотелиальный фактор роста (VEGF), антагонист рецептора интерлейкина-1 (IL-lra), цилиарный нейротропный фактор (CNTF), глиальный нейротропный фактор (GDNF), неуртурин, тромбоцитарный фактор роста (PDGF), герегулин, неурегулин, артемин, персефин, интерлейкины, нейротропный фактор, происходящий из линии глиальных клеток (GFR), колониестимулирующий фактор (CSF) гранулоцитов, CSF гранулоцитов-макрофагов, нетрины, кардиотропин-1, белки hedgehog, лейкоз-ингибирующий фактор (LIF), мидкин, плейотропин, белки, участвующие в костном морфогенезе (BMP), сапозины, семафорины и фактор стволовых клеток (SCF). В случае рака в качестве неврологического лекарственного средства можно выбирать химиотерапевтическое средство. Примерами химиотерапевтических средств являются алкилирующие средства, такие как тиотепа и циклофосфамид (CYTOXAN™); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, такие как алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеланин; ацетогенины (прежде всего буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновая кислота; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), СРТ-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновая кислота; тенипозид; криптофицины (прежде всего криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая его синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкристатин; саркодиктин; спонгистатин; азотные аналоги горчичного газа, такие как хлорамбуцил, хлорнафазин, хлорофосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфанид, урациловый аналог горчичного газа; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как энедеиновые антибиотики (например, калихеамицин, прежде всего калихеамицин гамма и калихеамицин омега (Angew Chem. Intl. Ed. Engl. 33, 1994, cc. 183-186); динемицин, включая динемицин А; эсперамицин; также как хромофор неокарзиностатина и родственные хромофоры антибиотика хромопротеин энедиина), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-ФУ); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; антиадренальные средства, такие как аминоглутетимид, митотан, трилостан; пополнитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамида гликозид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; эллиптиния ацетат; эпотилон; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; майтансиноиды, такие как майтансин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитракрин; пентостатин; фенамет; пирарубицин; изоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (фирма JHS Natural Products, Эуген, шт. Орегон); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецены (прежде всего токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин (ELDESINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-С»); тиотепа; таксоиды, например, паклитаксел TAXOL™ (фирма Bristol-Myers Squibb Oncology, Принстон, шт. Нью-Джерси), не содержащий кремофор ABRAXANE™, препарат паклитаксела в виде частиц, связанных с альбумином (фирма American Pharmaceutical Partners, Шаумберг, шт. Иллинойс) и доцетаксел (TAXOTERE®, фирма Rhone-Poulenc Rorer, Антони, Франция); хлорамбуцил; гемцитабин (GEMZAR®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; леуковорин; винорелбин (NAVELBINE®); эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДМФО); ретиноиды, такие как ретиноевая кислота; капецитабин (XELODA®); фармацевтически приемлемые соли, кислоты или производные любого из представленных выше агентов; а также комбинации двух или большего количества указанных выше агентов, такие как CHOP (сокращенное название комбинированной терапии с использованием циклофосфамида, доксорубицина, винкристина и преднизолона) и FOLFOX (сокращенное название режима лечения с использованием оксалиплатина (ELOXATIN™) в комбинации с 5-ФУ и леуковорином).
Под указанное определение химиотерапевтических средств подпадают антигормональные средства, функция которых заключается в регулировании, снижении, блокировании или ингибировании воздействий гормонов, которые могут стимулировать рост рака и которые часто применяют в форме системного лечения или лечения всего организма. Они могут представлять собой сами гормоны. Примерами являются антиэстрогены и избирательные модуляторы рецептора эстрогена (SERM), включая, например, тамоксифен (включая тамоксифен NOLVADEX®), ралоксифен EVISTA®, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен FARESTON®; антипрогестероны; понижающие регуляторы рецептора экстрогена (ERD); средства, действие которых заключается в подавлении или «выключении» функции яичников, например, агонисты рилизинг-фактора лютеинизирующего гормона (LHRH), такие как LUPRON® и леупролида ацетат ELIGARD®, госерелина ацетат, бусерелина ацетат и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, ингибирующие фермент ароматазу, которая регулирует производство эстрогена в надпочечниках, такие, например, как 4(5)-имидазолы, аминоглутетимид, мегестрола ацетат MEGASE®, экземестан AROMASIN®, форместан, фадрозол, ворозол RIVISOR®, летрозол FEMARA® и анастрозол ARIMIDEX®. Кроме того, под указанное определение химиотерапевтических средств подпадают также бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат DIDROCAL®, NE-58095, золедроновая кислота/золедронат ZOMETA®, алендронат FOSAMAX®, памидронат AREDIA®, тилудронат SKELID® или ризедронат ACTONEL®; а также троксацитабин (аналог 1,3-диоксолан-нуклеотид-цитозина); антисмысловые олигонуклеотиды, прежде всего те, которые ингибируют экспрессию генов в путях передачи сигналов, участвующих в аберрантной пролиферации клеток, такие, например, как PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и вакцины для генной терапии, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 LURTOTECAN®; rmRH ABARELLX®; лапатиниба дитосиат (двойной низкомолекулярный ингибитор тирозинкиназ ErbB-2 и EGFR, известный также как GW572016); и фармацевтически приемлемые соли, кислоты и производные любого из указанных выше агентов.
К другой группе соединений, которые можно выбирать в качестве неврологических лекарственных средств при лечении или предупреждении рака, относятся противораковые иммуноглобулины (включая, но, не ограничиваясь только ими, трастузумаб, бевацизумаб, алемтуксумаб, цетуксимаб, гемтузумаба озогамицин, ибритумомаба тиуксетан, панитумумаба и ритуксимаб). В некоторых случаях для направленного воздействия на требуемые клетки (т.е. раковые клетки) и их уничтожения можно применять антитела, конъюгированные с токсичной меткой, включая (но, не ограничиваясь только им) тозитумомаб с радиоактичной меткой.
В случае глазного заболевания или нарушения в качестве неврологического лекарственного средства можно выбирать антиангиогенное офтальмологическое средство (т.е. бевацизумаб, ранибизумаб и пегаптаниб), офтальмологическое средство против глаукомы (т.е. карбахол, эпинефрин, демакария бромид, апраклоинидин, бримонидин, бринзоламид, левобунолол, тимолол, бетаксолол, дорзоламид, биматопрост, картеолол, метипранолол, дипивефрин, травопрост и латанопрост), ингибитор угольной ангидразы (т.е. метазоламид и ацетазоламид), офтальмологический антигистаминный препарат (т.е. нафазолин, фенилэфрин и тетрагидрозолин), офтальмологическое смазывающее средство, офтальмологическое стероидное средство (т.е. фторметолон, преднизолон, лотепреднол, дексаметазон, дифлупреднат, римексолон, флуоцинолон, медризон и триамцинолон), офтальмологическое анестезирующее средство (т.е. лидокаин, пропаракаин и тетракаин), офтальмологическое противоинфекционное средство (т.е. левофлоксцин, гатифлоксацин, ципрофлоксацин, моксифлоксацин, хлорамфеникол, бацитрацин/полимиксин, сульфацетамид, тобрамицин, азитромицин, безифлоксацин, норфлоксацин, сульфизоксазол, гентамицин, идоксуридин, эритромицин, натамицин, грамицидин, неомицин, офлоксацин, трифлуридин, ганцикловир, видарабин), офтальмологическое противовоспалительное средство (т.е. непафенак, кеторолак, флурбипрофен, супрофен, циклоспорин, триамцинолон, диклофенак и бромфенак), офтальмологическое антигистаминное или противозастойное средство (т.е. кетотифен, олопатадин, эпинастин, нафазолин, кромолин, тетрагидрозолин, пемироласт, бепотастин, нафазолин, фенилэфрин, недокромил, лодоксамид, фенилэфрин, эмедастин и азеластин). В случае нарушения, сопровождающегося эпилептическим припадком, в качестве неврологического лекарственного средства можно выбирать противосудорожное или антиэпилептическое средство, включая (но, не ограничиваясь только ими) барбитуратные противосудорожные средства (т.е. примидон, метарбитал, мефобарбитал, аллобарбитал, амобарбитал, апробарбитал, алфенал, барбитал, браллобарбитал и фенобарбитал), бензодиазепиновые противосудорожные средства (т.е. диазепам, клоназепам и лоразепам), карбаматные противосудорожные средства (т.е. фелбамат), противосудорожные средства на основе ингибитора угольной ангидразы (т.е. ацетазоламид, топирамат и зонизамид), дибензазепиновые противосудорожные средства (т.е. руфинамид, карбамазепин и окскарбазепин), противосудорожные средства на основе производных жирных кислот (т.е. дивалпроекс и валпроевая кислота), аналоги гамма-аминомасляной кислоты (т.е. прегабалин, габапентин и вигабатрин), ингибиторы обратного захвата гамма-аминомасляной кислоты (т.е. тиагабин), ингибиторы трансаминазы гамма-аминомасляной кислоты (т.е. вигабатрин), гидантоиновые противосудорожные средства (т.е. фенитоин, этотоин, фосфенитоин и мефенитоин), противосудорожные средства смешанного типа (т.е. лакозамид и магния сульфат), прогестины (т.е. прогестерон), оксазолидиндионовые противосудорожные средства (т.е. параметадион и триметадион), пирролидиновые противосудорожные средства (т.е. леветирацетам), сукцинимидные противосудорожные средства (т.е. этосукцимид и метсукцимид), триазиновые противосудорожные средства (т.е. ламотригин) и противосудорожные средства на основе мочевины (т.е. фенацетамид и фенетурид).
В случае лизосомной болезни накопления в качестве неврологического лекарственного средства можно выбирать средство, которое само обладает активностью фермента, статус которого нарушен при заболевании, или имитирует ее. Примерами рекомбинантных ферментов, пригодных для лечения лизосомного нарушения накопления, являются (но, не ограничиваясь только ими), например, ферменты, перечисленные в публикации заявки на патент США №2005/0142141 (т.е. альфа-L-идуронидаза, идуронат-2-сульфатаза, N-сульфатаза, альфа-N-ацетилглюкозаминидаза, N-ацетил-галактозамин-6-сульфатаза, бета-галактозидаза, арилсульфатаза В, бета-глюкуронидаза, кислая альфа-глюкозидаза, глюкоцереброзидаза, альфа-галактозидаза А, гексозаминидаза А, кислая сфингомиелиназа, бета-галактоцереброзидаза, бета-галактозидаза, арилсульфатаза А, кислая церамидаза, аспартоацилаза, пальмитоил-протеин-тиоэстераза 1 и трипептидиламинопептидаза 1).
В случае амилоидоза в качестве неврологического лекарственного средства можно выбирать (но, не ограничиваясь только ими) антитело или другую связывающую молекулу (включая, но, не ограничиваясь только ими, малую молекулу, пептид, аптамер или другую связывающую белок субстанцию), которая специфически связывается с мишенью, выбранной из таких мишеней, как: бета-секретаза, tau, пресенилин, белок-предшественник амилоида или его фрагментов, пептид амилоид-бета или его олигомеры или фибриллы, рецептор смерти 6 (DR6), рецептор конечных продуктов (глубокого) гликозилирования (RAGE), паркин и хантингтин; ингибитор холинэстеразы (т.е. галантамин, донепезил, ривастигмин и такрин); антагонист NMDA-рецептора (т.е. мемантин), средство, снижающее уровень моноаминов (т.е. тетрабеназин); эрголоида мезилат; антихолинергическое средство против болезни Паркинсона (т.е. процилидин, дифенгидрамин, тригексилфенидил, бензтропин, бипериден и тригексифенидил); допаминергическое средство против болезни Паркинсона (т.е. энтакапон, селегилин, прамипексол, бромокриптин, ротиготин, селегилин, ропинирол, разагилин, апоморфин, карбидопа, леводопа, перголид, толкапон и амантадин); тетрабеназин; противовоспалительное средство (включая, но, не ограничиваясь только ими, нестероидное противовоспалительное лекарственное средство (т.е. индометацин и другие перечисленные выше соединения); гормон (т.е. эстроген, прогестерон и леупролид); витамин (т.е. фолат и никотинамид); димеболин; гомотаурин (т.е. 3-аминопропансульфоновая кислота; 3 APS); модулятор активности рецептора серотонина (т.е. ксалипроден); интерферон и глюкокортикоид.
В случае вирусного или микробного заболевания в качестве неврологического лекарственного средства можно выбирать (но, не ограничиваясь только ими) противовирусное соединение (включая, но, не ограничиваясь только ими, противовирусное средство адамантанового ряда (т.е. римантадин и адамантин), противовирусный интерферон (т.е. пэгилированный интерферон альфа-2b), антагонист хемокинового рецептора (т.е. маравирок), ингибитор переноса цепи интегразы (т.е. ралтегравир), ингибитор нейраминидазы (т.е. озелтавир и занамивир), ненуклеозидный ингибитор обратной транскриптазы (т.е. эфавиренц, этравирин, делавирдин и невирапин), нуклеозидные ингибиторы обратной транскриптазы (тенофовир, абакавир, ламивудин, зидовудин, ставудин, энтекавир, эмтрицитабин, аделфовир, залцитабин, телбивудин и диданозин), ингибитор протеазы (т.е. дарунавир, атазанавир, фозампренавир, типранавир, ритонавир, нелфинавир, ампренавир, индинавир и саквинавир), пуриновый нуклеозид (т.е. валацикловир, фамцикловир, ацикловир, рибавирин, ганцикловир, валганцикловир и цидофовир) и противовирусное средство смешанного типа (т.е. энфувиртид, фоскарнет, паливизумаб и фомивирсен)), антибиотики (включая, но, не ограничиваясь только ими, аминопенициллин (т.е. амоксициллин, ампициллин, оксациллин, нафциллин, клоксациллин, диклоксациллин, флукоксациллин, темоциллин, азлоциллин, карбенициллин, тикарциллин, мезлоциллин, пиперациллин и бакампициллин), цефалоспорин (т.е. цефазолин, цефалексин, цефалотин, цефалмандол, цефтриаксон, цефотаксим, цефподоксим, цефтазидим, цефадоксил, цефрадин, лоракарбеф, цефотетан, цефуроксим, цефпрозил, цефаклор и цефокситин), карбапенем/пенем (т.е. имипенем, меропенем, эртапенем, фаропенем и дорипенем), монобактам (т.е. азтреонам, тигемонам, норкардицин А и табтоксинин-бета-лактам, ингибитор бета-лактамазы (т.е. клавулановая кислота, тазобактам и сулбактам) в сочетании с другим бета-лактамовым антибиотиком, аминогликозид (т.е. амикацин, гентамицин, канамицин, неомицин, нетилмицин, стрептомицин, тобрамицин и паромомицин), ансамицин (т.е. гелданамицин и гербимицин), карбацефем (т.е. лоракабеф), гликопептиды (т.е. теикопланин и ванкомицин), макролид (т.е. азитромицин, кларитромицин, диритромицин, эритромицин, рокситромицин, тролеандомицин, телитромицин и спектиномицин), монобактам (т.е. азтреонам), хинолон (т.е. ципрофлоксацин, эноксацин, гатифлоксацин, левофлоксацин, ломефлоксацин, моксифлоксацин, норфлоксацин, офлоксацин, тровафлоксацин, грепафлоксацин, спарфлоксацин и темафлоксацин), сульфонамид (т.е. мафенид, сульфонамидохризоидин, сульфацетамид, сульфадиазин, сульфаметизол, сульфаниламид, сульфасалазин, сульфизоксазол, триметоприм, триметоприм и сульфаметоксазол), тетрациклин (т.е. тетрациклин, демеклоциклин, доксициклин, миноциклин и окситетрациклин), антинеопластические или цитотоксические антибиотики (т.е. доксорубицин, митоксантрон, блеомицин, даунорубицин, дактиномицин, эпирубицин, идарубицин, пликамицин, митомицин, пентостатин и валрубицин) и антибактериальное соединение смешанного типа (т.е. бацитрацин, колистин и полимиксин В)), противогрибковое средство (т.е. метронидазол, нитазоксанид, имидазол, хлорокин, йодохинол и паромомицин) и противопаразитарное средство (включая, но, не ограничиваясь только ими, хинин, хлорохин, амодиахин, пириметамин, сульфадоксин, прогуанил, мефлохин, атоваквон, примахин, артемисинин, галофантрин, доксициклин, клидамицин, мебендазол, пирантела памоат, тиабендазол, диэтилкарбамазин, ивермектин, рифампин, амфотерицин В, меларзопрол, эфорнитин и албендазол). В случае ишемии в качестве неврологического лекарственного средства можно выбирать (но, не ограничиваясь только ими) тромболитическое средство (т.е. урокиназу, алтеплазу, ретеплазу и тенектеплазу), ингибитор агрегации тромбоцитов (т.е. аспирин, цилостазол, клопидогрел, празугрел и дипиридамол), статин (т.е. ловастатин, правастатин, фулвастатин, розувастатин, аторвастатин, симвастатин, церивастатин и питавастатин) и соединения, улучшающие кровоток или гибкость сосудов, включая, например, лекарственные средства для нормализации кровяного давления.
В случае нарушения поведения в качестве неврологического лекарственного средства можно выбирать: модифицирующее поведение соединение, включая (но, не ограничиваясь только ими) атипичное антипсихотическое средство (т.е. рисперидон, оланзапин, априпипразол, кветиапин, палиперидон, азенапин, клозапин, илоперидон и зипрасидон), антипсихотическое средство фенотиазинового ряда (т.е. прохлорперазин, хлорпромазин, флуфеназин, перфеназин, трифторперазин, тиоридазин и мезоридазин), тиоксантен (т.е. тиотиксен), антипсихотическое средство смешанного типа (т.е. пимозол, литий, молиндол, галоперидол и локсапин), избирательный ингибитор обратного захвата серотонина (т.е. циталопрам, эсциталопрам, пароксетин, флуоксетин и сертралин), ингибитор обратного захвата серотонина-норэпинефрина (т.е. дулоксетин, венлафаксин, десвенлафаксин), трициклический антидепрессант (т.е. доксепин, кломипрамин, амоксапин, нортриптилин, амитриптилин, тримипрамин, имипрамин, протриптилин и дезипрамин), тетрациклический антидепрессант (т.е. миртазапин и мапротилин), антидепрессант фенилпиперазинового ряда (т.е. тразодон и нефазодон), ингибитор моноаминоксидазы (т.е. изокарбоксазид, фенелзин, селегилин и транилципромин), бензодиазепин (т.е. алпразолам, эстазолам, флуразептам, клоназепам, лоразепам и диазепам), ингибитор обратного захвата норэпинефрина-допамина (т.е. бупропион), стимулятор ЦНС (т.е. фентармин, диэтилпропион, метамфетамин, декстроамфетамин, амфетамин, метилфенидат, дексметилфенидат, лиздексамфетамин, модафинил, пемолин, фендиметразин, бензфетамин, фендиметразин, армодафинил, диэтилпропион, кафеин, атомоксетин, доксапрам и мазиндол), анксиолитическое/седативное/снотворное средство (включая, но, не ограничиваясь только ими, барбитурат (т.е. секобарбитал, фенобарбитал и мефобарбитал), бензодиазепин (указанный выше), и анксиолитическое/седативное/снотворное средство смешанного типа (т.е. дифенгидрамин, натрия оксибат, залеплон, гидроксизин, хлоралгидрат, аолпидем, буспирон, доксепин, эсзопиклон, рамелтеон, мепробамат и этклорвинол)), секретин (см., например, Ratliff-Schaub и др., Autism 9, 2005, сс. 256-265), опиоидный пептид (см., например, Cowen и др., J. Neurochem. 89, 2004, сс. 273-285), и нейропептид (см., например, Hethwa и др., Am. J. Physiol. 289, 2005), сс. 301-305).
В случае воспаления ЦНС в качестве неврологического лекарственного средства можно выбирать средство, которое воздействует непосредственно на воспаление (т.е. нестероидное противовоспалительное средство, такое как ибупрофен или напроксен), или которое оказывает лечебное действие на причину, лежащую в основе воспаления (т.е. противовирусное или противораковое средство).
В другом варианте осуществления изобретения эффекторный элемент для головного мозга представляет собой интактное или полноразмерное антитело. В зависимости от аминокислотной последовательности константного домена их тяжелых цепей интактные антитела можно относить к различным классам. Существует пять основных классов интактных антител: IgA, IgD, IgE, IgG и IgM, и, кроме того, некоторые из них можно подразделять на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Константные домены тяжелой цепи, соответствующие различным классам антитела обозначают как α, δ, ε, γ и μ соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны. В одном из вариантов осуществления изобретения интактное антитело не обладает эффекторной функцией.
Методы создания антител являются известными и их примеры представлены выше в настоящем описании в разделе «Определения». В одном из вариантов осуществления изобретения антитело представляет собой химерное, гуманизированное или человеческое антитело или его антигенсвязывающий фрагмент.
Для определения связывания одновалентного связывающего элемента с R/ГЭБ можно применять различные методы. Одним из таких методов анализа является твердофазный иммуноферментный анализ (ELISA), позволяющий подтверждать способность связываться с человеческим R/ГЭБ (и антигеном головного мозга). Для осуществления этого анализа планшеты, сенсибилизированные антигеном (например, рекомбинантным sR/ГЭБ) инкубируют с образцом, содержащим одновалентный связывающий элемент, мишенью которого является R/ГЭБ, и определяют связывание одновалентного связывающего элемента с представляющим интерес антигеном.
Согласно одному из объектов изобретения одновалентный связывающий элемент, предлагаемый в изобретении, тестируют в отношении его активности связывания с антигеном, например, с помощью известных методов, таких как ELISA, вестерн-блоттинг и т.д.
Согласно одному из объектов изобретения одновалентный связывающий элемент, предлагаемый в изобретении, тестируют в отношении его антигенсвязывающей активности с одним R/ГЭБ с использованием картирования эпитопов на основе рентгенографического определения структуры.
Анализы для оценки поглощения системно вводимого шаттла и/или конъюгата для гематоэнцефалического барьера и другой биологической активности шаттла для гематоэнцефалического барьера и/или конъюгата можно осуществлять с помощью процедур, которые описаны в примерах, или которые являются известными для представляющего интерес шаттла для гематоэнцефалического барьера и/или конъюгата. Можно применять также измерение концентрации в паренхимальном пространстве ЦНС с использованием, например, микродиализа или метода капиллярного истощения в комбинации с ELISA или измерениями радиоактивности меченого шаттла и/или конъюгата для гематоэнцефалического барьера.
Фармацевтические композиции
Терапевтические композиции, которые содержат шаттл и/или конъюгат для гематоэнцефалического барьера, применяемые согласно настоящему изобретению, приготавливают с целью хранения путем смешения с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences, 16-е изд., под ред. Osol А., 1980) в форме лиофилизированных композиций или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях и они включают буферы, такие как фосфатный, цитратный буферы, а также буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол; бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и мета-крезол); полипептиды с низкой молекулярной массой (содержащие менее приблизительно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поли(винилпирролидон); аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТК; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; содержащие металл комплексы (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (ПЭГ).
Композиция, представленная в настоящем описании, при необходимости может содержать также более одного действующего вещества, необязательно вещества с дополнительными видами активности, которые не оказывают отрицательного воздействия друг на друга. Тип и эффективные количества таких лекарственных средств зависят, например, от количества шаттла и/или конъюгата для гематоэнцефалического барьера, присутствующего в композиции, и клинических параметров субъектов. Ниже описаны примеры таких лекарственных средств.
Действующие вещества можно включать также в микрокапсулы, например, полученные с помощью методов коацервации или межфазной полимеризации, например в гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы введения лекарственного средства (например, в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы описаны в Remington's Pharmaceutical Sciences, 16-е изд., под ред. A. Osol, 1980.
Можно приготавливать препараты с замедленным высвобождением. Приемлемыми примерами препаратов с замедленным высвобождением являются полупроницаемые матрицы из твердых гидрофобных полимеров, включающие антитело, такие матрицы представляют собой изделия определенной формы, например, пленки или микрокапсулы. Примерами матриц, обеспечивающих замедленное высвобождение, могут служить сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (U.S. №3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, нерасщепляемый этилен-винилацетат, расщепляемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (предназначенные для инъекции микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и леупролида ацетата), и поли-D-(-)-3-гидроксимасляная кислота.
Композиции, предназначенные для применения in vivo должны быть стерильными. Стерильность можно легко обеспечивать, например, путем фильтрации через стерильные фильтрующие мембраны. В одном из вариантов осуществления изобретения композиция является изотонической.
Шаттл и/или конъюгат для гематоэнцефалического барьера, предлагаемый в изобретении, можно применять в различных методах in vivo. Например, в изобретении предложен способ транспортировки терапевтического соединения через ГЭБ, заключающийся в том, что приводят в контакт шаттл и/или конъюгат для гематоэнцефалического барьера с ГЭБ, в результате чего одновалентный связывающий элемент транспортирует связанное с ним терапевтическое соединение через ГЭБ. Другим примером является предлагаемый в изобретении способ транспортирования лекарственного средства для лечения неврологического нарушения через ГЭБ, заключающийся в том, что приводят в контакт шаттл и/или конъюгат для гематоэнцефалического барьера с ГЭБ, в результате чего одновалентный связывающий элемент транспортирует связанное с ним лекарственное средство для лечения невротического нарушения через ГЭБ. В одном из вариантов осуществления изобретения указанный ГЭБ представляет собой ГЭБ млекопитающего (например, человека), например, имеющего неврологическое нарушение, включая (но неограничиваясь только ими): болезнь Альцгеймера (AD), «удар», деменцию, мышечную дистрофию (MD), рассеянный склероз (MS), амиотрофический боковой склероз (ALS), муковисцидоз, синдром Ангельмана, синдром Лиддла, болезнь Паркинсона, болезнь Пика, болезнь Педжета, рак, травматическое повреждение головного мозга и т.д.
В одном из вариантов осуществления изобретения неврологическое нарушение выбирают из: невропатии, амилоидоза, рака (например, затрагивающего ЦНС или головной мозг), глазного заболевания или нарушения, вирусной или микробной инфекции, воспаления (например, воспаления ЦНС или головного мозга), ишемии, нейродегенеративного заболевания, эпилептического припадка, нарушения поведения, лизосомной болезни накопления и т.д.
Невропатические нарушения представляют собой заболевания или патологии нервной системы, характеризующиеся несоответствующей или неконтролируемой передачей нервных сигналов или ее отсутствием, и они включают (но, не ограничиваясь только ими) хроническую боль (включая ноцицептивную боль), боль, вызываемую повреждением тканей организма, включая связанную с раком боль, невропатическую боль (боль, вызываемую патологиями в нервах, спинном мозге или головном мозге), и психогенную боль (полностью или частично связанную с психологическим нарушением), головную боль, мигрень, невропатию и синдромы, которые часто сопровождают указанные невропатические нарушения, такие как головокружение или тошнота.
Амилоидозы представляют собой группу заболеваний и нарушений, ассоциированных с внеклеточными белковыми отложениями в ЦНС, включая (но, не ограничиваясь только ими) вторичный амилоидоз, возрастной амилоидоз, болезнь Альцгеймера (AD), умеренное когнитивное нарушение (MCI), Деменция с тельцами Леви, синдром Дауна, наследственная церебральная геморрагия с амилоидозом (датский тип); Гуамский комплекс болезнь Паркинсона-деменция, церебральная амилоидная ангиопатия, болезнь Гентингтона, прогрессирующий супрануклеарный паралич, рассеянный склероз; болезнь Крейцфельда-Якоба, болезнь Паркинсона, трансмиссивная спонгиоформная энцефалопатия, ВИЧ-ассоциированная деменция, амиотрофический боковой склероз (ALS), миозит с тельцами включения (IBM) и глазные заболевания, связанные с отложением бета-амилоида (т.е. дегенерация желтого пятна, связанная с друзами оптическая невропатия и катаракта).
Различные типы рака ЦНС характеризуются аномальной пролиферацией одной или нескольких клеток ЦНС (т.е. нервных клеток) и включают (но, не ограничиваясь только ими) глиому, мультиформную глиобластому, менингиому, астроцитому, акустическую неврому, хондрому, олигодендроглиому, медуллобластомы, ганглиому, шванному, нейрофиброму, нейробластому и экстрадуральные, интрамедуллярные или интрадуральные опухоли.
Вирусные или микробные инфекции ЦНС включают (но, не ограничиваясь только ими) инфекции, вызываемые вирусами (т.е. вирусом гриппа, ВИЧ, полиовирусом, вирусом краснухи), бактериями (т.е. Neisseria sp., Streptococcus sp., Pseudomonas sp., Proteus sp., E.coli, S.aureus, Pneumococcus sp., Meningococcus sp., Haemophilus sp. и Mycobacterium tuberculosis) и другими микроорганизмами, такими как грибы (т.е. дрожжами, Cryptococcus neoformans), паразитами (т.е. Toxoplasma gondii) или амебами, которые приводят к патофизиологиям в ЦНС, включая (но не ограничиваясь только ими) менингит, энцефалит, миелит, васкулит и абсцесс, который может быть острым или хроническим. Воспаление ЦНС представляет собой воспаление, вызываемое повреждением ЦНС, которое может представлять собой физическое повреждение (т.е. обусловленное несчастным случаем, хирургическим вмешательством, травмой головного мозга, повреждением спинного мозга, контузией) или повреждение, обусловленное или связанное с одним или несколькими другими заболеваниями или нарушениями ЦНС (т.е. абсцессом, раком, вирусной или микробной инфекцией).
В контексте настоящего описания ишемия ЦНС относится к группе нарушений, связанных с аномальным кровотоком или состоянием сосудов в головном мозге или обусловливающими их причинами, и включает (но, не ограничиваясь только ими): очаговую ишемию головного мозга, глобальную ишемию головного мозга, «удар» (т.е. субарахноидное кровоизлияние и внутримозговое кровоизлияние) и аневризму.
Нейродегенеративные заболевания представляют собой группу заболеваний и нарушений, ассоциированных с потерей функции или гибелью нервных клеток в ЦНС, и включают (но, не ограничиваясь только ими): адренолейкодистрофию, болезнь Александера, болезнь Альперса, амиотрофический боковой склероз, атаксию-телеангиэктазию, болезнь Баттена, синдром Коккейна, кортикобазальную дегенерацию, дегенерацию, вызываемую или ассоциированную с амилоидозом, атаксию Фридрейха, фронтотемпоральную дольковую дегенерацию, болезнь Кеннеди, мультисистемную атрофию, рассеянный склероз, первичный боковой склероз, прогрессирующий супрануклеарный паралич, спинальную мышечную атрофию, поперечный миелит, болезнь Рефсума и спиноцеребральную атаксию.
Вызывающие эпилептический припадок заболевания и нарушения ЦНС связаны с несоответствующей и/или аномальной электрической проводимостью в ЦНС и включают (но, не ограничиваясь только ими): эпилепсию (т.е. приступы без видимых судорог, атонические припадки, доброкачественную роландову эпилепсию, детскую абсанс-эпилепсию, клонические эпилептические припадки, припадки эпилептические психомоторные, лобнодолевую эпилепсию, фебрильные эпилептические припадки, детские спазмы, юношескую миоклоническую эпилепсию, юношескую абсанс-эпилепсию, синдром Леннокса-Гасто, синдром Ландау-Клеффнера, синдром Драветса, синдром Отахара, синдром Веста, миоклонические эпилептические припадки, митохондриальные нарушения, прогрессирующие миоклонические эпилептические припадки, психогенные эпилептические припадки, рефлекторную эпилепсию, синдром Расмуссена, простые парциальные эпилептические припадки, вторичные генерализованные эпилептические припадки, височно-долевую эпилепсию, тониклонические эпилептические припадки, тонические эпилептические припадки, психомоторные эпилептические припадки, лимбическую эпилепсию, парциальные эпилептические припадки, генерализованные (большие) эпилептические припадки, эпилептический статус, абдоминальную эпилепсию, акинетические эпилептические припадки, автономные эпилептические припадки, массивную двухстороннюю миоклонию, катамениальную эпилепсию, эпилептические дроп-припадки, эмоциональные эпилептические припадки, фокальные эпилептические припадки, геластические эпилептические припадки, эпилепсию Джексона-Марча, болезнь Лафоры, моторные эпилептические припадки, мультифокальные эпилептические припадки, ночные эпилептические припадки, светочувствительные эпилептические припадки, псевдоэпилептические припадки, сенсорные эпилептические припадки, абортивные эпилептические припадки, сильвановы эпилептические припадки, эпилептические припадки, связанные с отменой лекарственного средства, и зрительные рефлекторные эпилептические припадки).
Нарушения поведения представляют собой нарушения ЦНС, характеризующиеся аномальным частично нарушенным поведением пораженного заболеванием субъекта и включают (но, не ограничиваясь только ими): нарушения сна (т.е. бессонницу, парасомнию, ночные кошмары, нарушения циркадного ритма сна и нарколепсию), нарушения настроения (т.е. депрессию, суицидальную депрессию, чувство страха, хронические аффективные нарушения, фобии, приступы паники, обсессивно-компульсивное расстройство, синдром нарушения внимания с гиперактивностью (ADHD), синдром нарушения внимания (ADD), синдром хронической усталости, агорафобию, посттравматическое стрессовое расстройство, биполярное нарушение), нарушения питания (т.е. анорексия или булимия), психозы, нарушения развития-поведения (т.е. аутизм, синдром Ретта, синдром Аспбергера), личностные нарушения и психотические нарушения (т.е. шизофрения, бредовые нарушения и т.п.).
Лизосомные нарушения накопления представляют собой метаболические нарушения, которые в некоторых случаях ассоциированы с ЦНС или имеют ЦНС-специфические симптомы; такие нарушения включают (но, не ограничиваясь только ими): болезнь Тэя-Сакса, болезнь Гоше, болезнь Фабри, мукополисахаридоз (I, II, III, IV, V, VI и VII типов), болезнь накопления гликогена, GM1-ганглиозидоз, метахроматическую лейкодистрофию, болезнь Фарбера, лейкодистрофию Канавана и нейронный цероидный липофусциноз типов 1 и 2, болезнь Нимана-Пика, болезнь Помбе и болезнь Краббе.
Один из объектов изобретения относится к шаттлу и/или конъюгату для гематоэнцефалического барьера, предлагаемому в изобретении, предназначенному для применения в качестве лекарственного средства. Другие объекты изобретения относятся к шаттлу и/или конъюгату для гематоэнцефалического барьера, предлагаемому в изобретении, предназначенному для применения при лечении неврологического заболевания или нарушения (например, болезни Альцгеймера). Конкретные варианты осуществления изобретения относятся к шаттлу и/или конъюгату для гематоэнцефалического барьера, предлагаемому в изобретении, предназначенному для применения в способе лечения. Конкретные варианты осуществления изобретения относятся к шаттлу и/или конъюгату для гематоэнцефалического барьера, предлагаемому в изобретении, предназначенному для применения в способе лечения индивидуума, который имеет неврологическое заболевание или нарушение, заключающемся в том, что вводят индивидууму в эффективном количестве шаттл и/или конъюгат для гематоэнцефалического барьера, предлагаемый в изобретении. Согласно любому из указанных выше вариантов осуществления изобретения «индивидуум» необязательно представляет собой человека.
Шаттл и/или конъюгат для гематоэнцефалического барьера, предлагаемый в изобретении, можно применять в терапии либо индивидуально, либо в комбинации с другими средствами. Например, шаттл и/или конъюгат для гематоэнцефалического барьера, предлагаемый в изобретении, можно вводить совместно по меньшей мере с одним дополнительным терапевтическим средством. В конкретных вариантах осуществления изобретения дополнительное терапевтическое средство представляет собой терапевтическое средство, эффективное в отношении лечения того же самого неврологического нарушения, для которого применяют шаттл и/или конъюгат для гематоэнцефалического барьера, предлагаемый в изобретении, или другого неврологического нарушения. Примерами дополнительных терапевтических средств являются (но, не ограничиваясь только ими): различные описанные выше неврологические лекарственные средства, ингибиторы холинэстеразы (такие как донепезил, галантамин, ровастигмин и такрин), антагонисты NMDA-рецептора (такие как мемантин), ингибиторы агрегации пептида амилоида бета, антиоксиданты, модуляторы γ-секретазы, имитаторы фактора роста нервной ткани (NGF) или агенты для генной терапии NGF, агонисты PPARy, ингибиторы HMS-CoA-редуктазы (статины), ампакины, блокаторы кальциевого канала, антагонисты ГАМК-рецептора, ингибиторы киназы-гликогенсинтазы, иммуноглобулин, предназначенный для внутривенного введения, агонисты мускаринового рецептора, модуляторы никотинового рецептора, средства активной или пассивной иммунизации против пептида амилоид бета, ингибиторы фосфодиэстеразы, антагонисты рецептора серотонина и антитела к пептиду амилоиду бета. В конкретных вариантах осуществления изобретения по меньшей мере одно дополнительное терапевтическое средство выбирают на основе его способности уменьшать одно или несколько побочных действий неврологического лекарственного средства.
Такие указанные выше комбинированные терапии включают совместное введение (когда два или большее количество терапевтических средств включают в одну и ту же или в различные композиции) и раздельное введение, в этом случае введение шаттла и/или конъюгата для гематоэнцефалического барьера, предлагаемого в изобретении, можно осуществлять до, одновременно и/или после введения дополнительного терапевтического средства и/или адъюванта. Шаттлы и/или конъюгаты для гематоэнцефалического барьера, предлагаемые в изобретении, можно применять также в комбинации с другими интервенционными терапиями, такими как (но, не ограничиваясь только ими) лучевая терапия, терапией поведения или другими терапиями, известными в данной области и пригодными для подлежащего лечению или предупреждению неврологического нарушения. Шаттл и/или конъюгат для гематоэнцефалического барьера, предлагаемый в изобретении, (или любое дополнительное терапевтическое средство) можно вводить любыми пригодными путями, включая парентеральное, внутрилегочное и интраназальное введение, и, если это требуется для местной обработки, путем введения в область повреждения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение.
Введение доз можно осуществлять любым пригодным путем, например, путем инъекций, таких как внутривенные или подкожные инъекции, что зависит, в частности, от того, является ли введение кратковременным или длительным. В контексте настоящего описания можно рассматривать различные схемы введения доз, включая (но, не ограничиваясь только ими) одноразовые или многократные введения в различные моменты времени, болюсное введение и пульсирующую инфузию.
Шаттл и/или конъюгаты для гематоэнцефалического барьера, предлагаемые в изобретении, можно включать в препаративную форму, дозировать и вводить в соответствии с надлежащей медицинской практикой. Факторы, которые необходимо учитывать в этом контексте, включают конкретное подлежащее лечению нарушение, конкретное подлежащее лечению млекопитающее, клиническое состояние конкретного пациента, причину нарушения, область введения средства, метод введения, схему введения и другие факторы, известные практикующим медицинским работникам. Шаттл и/или конъюгаты для гематоэнцефалического барьера, предлагаемые в изобретении, необязательно, но можно включать в препаративную форму вместе с одним или несколькими средствами, которые в настоящее время применяют для предупреждения или лечения рассматриваемого нарушения. Эффективное количество таких других средств зависит от количества шаттла и/или конъюгата для гематоэнцефалического барьера, предлагаемого в изобретении, которое присутствует в композиции, типа нарушения или лечения и от других указанных выше факторов. Как правило, их применяют в тех дозах и с использованием тех путей введения, которые представлены в настоящем описании, или в количестве, составляющем примерно от 1 до 99% от доз, указанных в настоящем описании, или в любой дозе и с использованием любого пути введения, которые с эмпирической/клинической точки зрения считаются пригодными.
Доза шаттла и/или конъюгата для гематоэнцефалического барьера, предлагаемого в изобретении, (применяемого индивидуально или в комбинации с одним или несколькими дополнительными терапевтическими средствами) пригодная для предупреждения или лечения заболевания, должна зависеть от типа подлежащего лечению заболевания, типа шаттла и/или конъюгата для гематоэнцефалического барьера, серьезности и протекания заболевания, от того, вводят антитело в профилактических или терапевтических целях, от предшествующей терапии, клинической истории пациента и ответа на шаттл для гематоэнцефалического барьера и/или конъюгат, и от решения лечащего врача. Шаттл и/или конъюгат для гематоэнцефалического барьера можно вводить пациенту однократно или в виде серий обработок. В зависимости от типа и серьезности заболевания доза, составляющая примерно от 1 мкг/кг до 15 мг/кг (например, 0,5-10 мг/кг) шаттла и/или конъюгата для гематоэнцефалического барьера может представлять собой начальную возможную дозу для введения пациенту, например, с помощью одной или нескольких отдельных обработок или с помощью непрерывной инфузии. Одним из примеров типичных суточных доз может являться доза, составляющая от примерно 1 мкг/кг до 100 мг/кг или более в зависимости от указанных выше факторов. При использовании повторных введений в течение нескольких дней или более длительного периода времени, в зависимости от состояния, лечение, как правило, следует продолжать до достижения подавления симптомов заболевания. Одним из примеров доз шаттла и/или конъюгата для гематоэнцефалического барьера является доза, составляющая от примерно 0,05 до примерно 10 мг/кг. Так, пациенту можно вводить одну или несколько следующих доз: примерно 0,5, 2,0, 4,0 или 10 мг/кг (или любую их комбинацию). Указанные дозы можно вводить дробно, например, каждую неделю или каждые три недели (например, так, чтобы пациент получал от примерно двух до примерно двадцати, например, примерно шесть доз антитела). Можно применять начальную повышенную ударную дозу с последующим введением одной или нескольких более низких доз. Однако можно применять другие схемы введения доз. С помощью общепринятых методов и анализов можно легко осуществлять мониторинг действия указанной терапии.
Изделия
Другим объектом изобретения является изделие, которое содержит продукты, применяемые для лечения, предупреждения и/или диагностирования указанных выше нарушений. Изделие представляет собой контейнер и этикетку или листовку-вкладыш в упаковку, которые размещены на контейнере или вложены в него. Приемлемыми контейнерами являются, например банки, пузырьки, шприцы, пакеты для внутривенного раствора и т.д. Контейнеры можно изготавливать из различных материалов, таких как стекло или пластмасса. Контейнер содержит композицию, которая сама или в сочетании с другой композицией является эффективной для лечения, предупреждения и/или диагностирования состояния, и может иметь стерильный порт доступа (например, контейнер может представлять собой пакет для внутривенного раствора или пузырек, снабженный пробкой, которую можно прокалывать с помощью иглы для подкожных инъекций). По меньшей мере одно действующее вещество в композиции представляет собой шаттл и/или конъюгат для гематоэнцефалического барьера, предлагаемый в изобретении. На этикетке или листовке-вкладыше в упаковку указано, что композицию применяют для лечения выбранного состояния. Кроме того, изделие может включать (а) первый контейнер с находящейся в нем композицией, где композиция содержит шаттл и/или конъюгат для гематоэнцефалического барьера, предлагаемый в изобретении; и (б) второй контейнер с находящейся в нем композицией, где композиция содержит дополнительное цитотоксическое или иное терапевтическое средство. Согласно этому варианту осуществления изобретения изделие может содержать также листовку-вкладыш в упаковку, которая содержит информацию о том, что композиции можно использовать для лечения конкретного состояния. В альтернативном или дополнительном варианте изделие может дополнительно включать второй (или третий) контейнер с фармацевтически приемлемым буфером, таким как бактериостатическая вода для инъекций (БСВИ), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может включать другие продукты, необходимые с коммерческой точки зрения и с точки зрения потребителя, в частности, другие буферы, разбавители, фильтры, иглы и шприцы.
Изделие необязательно может дополнительно содержать листовку-вкладыш в упаковку с инструкциями по лечению неврологического нарушения у субъекта, где в инструкции указано, что путем обработки шаттлом и/или конъюгатом для гематоэнцефалического барьера, указанным в описании, осуществляют лечение неврологического нарушения, и необязательно указано, что шаттл и/или конъюгат для гематоэнцефалического барьера, обладают улучшенной способностью к поглощению через ГЭБ благодаря их одновалентному формату связывания с R/ГЭБ.
Примеры
Пример 1 Создание экспрессионных плазмид
Описание применяемой в качестве основы /стандартной экспрессионной плазмиды млекопитающих
Требуемые белки экспрессировали путем кратковременной трансфекции клеток почки человеческого эмбриона (HEK293). Для экспрессии требуемого гена/белка (например, мультимерного белка антитело-Fab) применяли транскрипционную единицу, содержащую следующие функциональные элементы:
- немедленно-ранний энхансер и промотор из человеческого цитомегаловируса (P-CMV), включая интрон А,
- 5'-нетранслируемая область (5'UTR) тяжелой цепи человеческого иммуноглобулина,
- сигнальная последовательность (SS) тяжелой цепи мышиного иммуноглобулина,
- ген/белок, подлежащий экспрессии (например, тяжелая цепь полноразмерного антитела), и
- последовательность полиаденилирования бычьего гормона роста (BGH рА).
Помимо экспрессионной единицы/кассеты, включающей требуемый подлежащий экспрессии ген, применяемая в качестве основы /стандартная экспрессионная плазмида млекопитающих содержала:
- сайт инициации репликации из вектора pUC 18, обеспечивающий репликацию указанной плазмилы в Е.coli, и
- ген бета-лактамазы, который обусловливает устойчивость Е.coli к ампициллину.
Конструировали экспрессионные плазмиды. кодирующие следующие слитые полипептиды/белки антитело-sFab:
Четырехвалентная конструкция Mab31-scFab(8D3) (фиг. 1В) (Mab31 - человеческое моноклональное антитело, распознающее Абета. INN (международное непатентованное название) Mab31 - гантенерумаб)
Тяжелая цепь (10132_рРМ284_Mab31(IgG1)-(G4S)4-VL-Ck-(G4S)6-GG-VH-CH1) (SEO ID NO: 1):
Состав тяжелой цепи слитого белка Mab31-scFab(8D3):
- тяжелая цепь человеческого IgG1 Mab31 без С-концевого Lys,
- глицин-сериновый линкер,
- вариабельный домен легкой цепи (VL) варианта (L596V и L598I) мышиного антитела к трансферрину 8D3 (Boado R.J., Zhang Y., Wang Y. и Pardridge W.M., Biotechnology and Bioengineering 102, 2009, cc. 1251-1258),
- человеческая легкая С-каппа цепь,
- глицин-сериновый линкер
- вариабельный домен тяжелой цепи (VH) мышиного антитела к трансферрину 8D3 (Boado R.J., Zhang Y., Wang Y. и Pardridge W.M., Biotechnology and Bioengineering 102, 2009, cc. 1251-1258),
- СН3-домен тяжелой цепи человеческого IgGl.
Легкая цепь (5170-VL-Mab31-BsmI-L2-Neo-BGHpA) (SEP ID NO: 2)
Состав легкой цепи Mab31
- человеческая легкая С-каппа-цепь Mab31.
Трехвалентный Mab31-scFab(8D3) (фиг. 1Б)
Содержащая «выступ» тяжелая цепь
(10134_pPM287_Mab31(IgG1)_knob_SS_-(G4S)4-VL-Ck-(G4S)6-GG-VH-CH1) (SEQ ID NO: 3).
Состав слитого белка Mab31-scFab(8D3), содержащего имеющую «выступ» тяжелую цепь
- тяжелая цепь человеческого IgG1 Mab31 без С-концевого Lys, содержащая в СН3 мутацию T366W, приводящую к образованию «выступа», и мутацию S354C, предназначенную для образования дополнительного дисульфидного мостика,
- глицин-сериновый линкер
- вариабельный домен легкой цепи (VL) варианта (L596V и L598I) мышиного антитела к трансферрину 8D3 (Boado R.J., Zhang Y., Wang Y. и Pardridge W.M., Biotechnology and Bioengineering 102, 2009, cc. 1251-1258),
- человеческая легкая С-каппа цепь,
- глицин-сериновый линкер,
- вариабельный домен тяжелой цепи (VH) мышиного антитела к трансферрину 8D3 (Boado R.J., Zhang Y., Wang Y. и Pardridge W.M., Biotechnology and Bioengineering 102, 2009, cc. 1251-1258),
- СН3-домен тяжелой цепи человеческого IgG1.
Содержащая «впадину» тяжелая цепь (0133_рРМ286_Mab31(IgG1)_hole_SS) (SEQ ID NO: 4)
Состав слитого белка Mab31, содержащего имеющую «впадину» тяжелую цепь
- тяжелая цепь человеческого IgG1 Mab31, содержащая в СН3 мутации T366S, Y407V и L368A, приводящие к образованию «впадины», и мутацию Y349C, предназначенную для образования дополнительного дисульфидного мостика.
Легкая цепь (5170-VL-Mab31-BsmI-L2-Neo-BGHpA) (SEQ ID NO: 2)
Состав легкой цепи Mab31
- человеческая легкая С-каппа-цепь Mab31.
Пример 2: Очистка одинарных и двойных конструкций Mab31-Fab
Цепи антитела создавали путем кратковременной трансфекции HEK293-клеток (полученных из линии 293 клеток почки человеческого эмбриона), которые культивировали в среде F17 (фирма Invitrogen Corp.). Для трансфекции применяли обеспечивающий трансфекцию реагент «293-фектин» (фирма Invitrogen). Цепи антитела экспрессировали из двух (четырехвалентная конструкция Mab31-scFab(8D3)) или трех (трехвалентная конструкция Mab31-scFab(8D3)) различных плазмид, которые кодировали тяжелую цепь четырехвалентной конструкции Mab31-scFab(8D3) и соответствующую легкую цепь Mab31, или содержащие «выступ» и «впадину» тяжелые цепи трехвалентной конструкции Mab31-scFab(8D3) и требуемую легкую цепь соответственно. Для трансфекции применяли две или три плазмиды, используя эквимолярное соотношение плазмид. Трансфекции осуществляли согласно инструкциям производителя. Супернатанты клеточных культур, содержащие слитые белки антитела, собирали через 7 дней после трансфекции. Супернатанты хранили в замороженном состоянии до очистки.
Белки очищали из профильтрованных супернатантов клеточных культур. Супернатанты вносили в колонку с белком А-сефарозой (фирма GE Healthcare) и промывали ЗФР, рН 7,4. Для элюции антител применяли 100 мМ нитратный буфер, рН 3,0, после чего образец сразу нейтрализовали до рН 6,5. После концентрирования агрегированный белок и другие побочные продукты отделяли от мономерных антител с помощью гель-фильтрации (Супердекс 200; фирма GE Healthcare) в буфере, содержащем 20 мМ гистидин, 140 мМ NaCl, рН 6,0. Каждую индивидуальную фракцию анализировали с помощью аналитической гель-фильтрации (ГФ) (TSK G3000SWXL) и системы для капиллярного электрофореза, основанной на применении чипа (ГФ-ДСН, LabChipGX, фирма Caliper) для количественной оценки неполностью собранных молекул и других побочных продуктов. Фракции мономерных антител без побочных продуктов объединяли. После концентрирования с помощью центрифужного концентратора MILLIPOREAmicon Ultra (с номинальным отсечением по молекулярной массе 30) белок хранили при -80°С. Аналитическую характеризацию конечного продукта осуществляли путем определения белка с помощью УФ, ГФ-ДСН, гель-фильтрации, масс-спектрометрии, а также путем определения эндотоксинов.
Пример 3: Данные, полученные с помощью ELISA, о связывании конструкций, содержащих один Fab и два Fab
Связывание конструкций mAb31-8D3 с мышиным рецептором трансферрина (mTfR) оценивали с помощью непрямого ELISA. Для этой цели рекомбинантным mTfR (внеклеточный домен; фирма Sino Biological) сенсибилизировали титрационный микропланшет Maxisorb (фирма Nunc), используя концентрацию 1 мкг/мл в ЗФР, при 4°С в течение ночи. После блокирования в 1% Crotein-C/ЗФР (блокирующий буфер; фирма Roche) в течение 1 ч при КТ и четырех промывок с помощью 0,1% Твин-20/ЗФР (промывочный буфер) в лунки добавляли конструкции mAb31-8D3 в концентрациях, составляющих от 0,01 до 150 нМ, в блокирующем буфере и инкубировали в течение 1 ч при КТ. После четырех стадий промывки конструкции выявляли, добавляя антитело к человеческому IgG, конъюгированное с HRP (анти-IgG-HRP) (фирма Jackson Immunoresearch), разведенное в соотношении 1:10000 в блокирующей буфере (1 ч, КТ), с последующими шестью стадиями промывки и инкубировали в среде ТМВ (фирма Sigma). Абсорбцию считывали при 450 нм после прекращения цветной реакции с помощью 1н. HCl.
На фиг. 3 продемонстрировано, что связывание двухвалентной конструкции mAb31-8D3-dFab с mTfR сопоставимо со связыванием IgG 8D3, в то время как одновалентная конструкция mAb31-8D3-sFab обладала пониженной аффинностью.
Функциональность mAb31 подтверждали с помощью ELISA. В целом, метод состоял в следующем: Абета(1-40) в концентрации 7 мкг/мл в ЗФР сенсибилизировали планшеты Maxisorp в течение 3 дней при 37°C с получением фибриллярного Абета, после чего осуществляли сушку в течение 3 ч при КТ. Планшеты блокировали с помощью 1% Crotein С и 0,1% RSA в ЗФР (блокирующий буфер) в течение 1 ч при КТ, затем однократно промывали промывочным буфером. Конструкции mAb31 добавляли в концентрациях вплоть до 100 нМ в блокирующем буфере и инкубировали при 4°С в течение ночи. После четырех стадий промывки конструкции выявляли согласно описанному выше методу.
На фиг. 4 продемонстрировано, что обе конструкции mAb31-8D3 (sFab и dFab) связывались с иммобилизованными фибриллами Абета с аффинностью, сопоставимой с аффинностью немодифицированного mAb31.
Пример 4: Только конструкции, содержащие один Fab, пересекают ГЭБ и декорируют (окрашивают) бляшки
Получение срезов головного мозга и иммуногистохимическое окрашивание:
После перфузии с использованием ЗФР получали головной мозг животных и приготавливали сагиттальные криосрезы между положениями ~ 1,92 и 1,68 мм в боковой плоскости согласно атласу головного мозга Paxinos и Franklin. Получали срезы головного мозга животных с номинальной толщиной 20 мкм при -15°С, используя криостат Leica СМ3050 S, и помещали на предварительно охлажденные предметные стекла (фирма Superfrost plus, Мензель, Германия). Для каждого головного мозга на одно предметное стекло помещали по три среза на расстоянии 80 мкм друг от друга.
Срезы дегидратировали в ЗФР в течение 5 мин, после чего погружали на 2 мин в 100%-ный ацетон, предварительно охлажденный до -20°С. Все дальнейшие стадии осуществляли при комнатной температуре. Предметные стекла со срезами головного мозга промывали ЗФР, рН 7,4 и блокировали сайты неспецифического связывания путем последующей инкубации в Ultra V block (фирма LabVision) в течение 5 мин, после чего осуществляли промывку с помощью ЗФР и инкубацию в блокирующем растворе Power Block (фирма BioGenex), содержащем 2% сыворотки здоровой козы в ЗФР в течение 20 мин. Предметные стекла непосредственно инкубировали в течение 1 ч с вторичным антителом, очищенным с помощью аффинной хроматографии козьим античеловеческим IgG (специфическим в отношении тяжелой и легкой цепи), конъюгированным с красителем Alexa Fluor 555 (№ А-21433, лот 54699А, фирма Molecular Probes), в концентрации 20 мкг/мл в 2% сыворотки здоровой козы в ЗФР, рН 7,4. После интенсивной отмывки с помощью ЗФР оценивали локализацию бляшек посредством двойного мечения бляшек Абета путем инкубации с ВАР-2, представляющим собой созданное на фирме Roche мышиное моноклональное антитело к Абета, конъюгированное с красителем Alexa Fluor 488, в концентрации 0,5 мкг/мл в течение 1 ч в ЗФР с блокирующим раствором Power block (фирма BioGenex) и 10% сыворотки здоровой овцы. После отмывки с помощью ЗФР снижали автофлуоресценцию липофусцина путем гашения посредством инкубации в течение 30 мин в 4 мМ CuSO4 в 50 мМ ацетате аммония, рН 5. После промывки предметных стекол дважды дистиллированной водой предметные стекла заливали средой Confocal Matrix (фирма Micro Tech Lab, Австрия).
Конфокальная микроскопия
Получали по три изображения для каждого среза головного мозга каждой PS2APP-мыши с содержащими бляшки областями в фронтальном кортексе (область первичного моторного кортекса). Изображения регистрировали с помощью конфокальной системы Leica TCS SP5 при установке точечной диафрагмы на величину 1 Эйри.
Бляшки, иммунномеченные красителями Alexa Fluor 488, захватывали в одних и тех же спектральных условиях (при длине волны возбуждения 488 нм и полосе пропускания волн испускания 500-554 нм) при настроенном потенциале усиления и сдвиге фотоумножителя (РМТ) (как правило, 770 В и -0% соответственно) при 30%-ной мощности лазера.
Связанные вторичные меченные Alexa Fluor 555 антитела на доступной поверхности срезов ткани регистрировали при длине волны возбуждения 561 нм лазерного пучка с использованием «окна» от 570 до 725 нм, охватывающего диапазон длин волн испускания от применяемого идентифицирующего антитела. Параметры настройки инструмента, прежде всего мощность лазера, скорость сканирования, коэффициент усиления и сдвиг, в процессе регистрирования изображений сохраняли постоянными для того, чтобы иметь возможность осуществлять сравнительные измерения для тестируемых антител к человеческому Аβ. Мощность лазера устанавливали на уровне 30%, а параметры настройки РМТ, как правило, были следующими: потенциал усиления 850 В и номинальный сдвиг 0%. Это позволяло осуществлять визуализацию как слабо, так и сильно окрашенных бляшек при одних и тех же параметрах настройки. Частота сбора составляла 400 Гц.
Конфокальные сканированные изображения регистрировали в виде одиночных оптических слоев с помощью иммерсионного (IMM) УФ-объектива НСХ PL АРО 20×0,7 в воде при разрешении 512×512 пикселей и оптическую глубину измерения по вертикальной оси контролировали в интерактивном режиме для обеспечения визуализации внутри среза ткани. Осуществляли визуализацию амилоид-β=-бляшек, локализованных в слоях 2-5 фронтального кортекса, и количественно оценивали интенсивности флуоресценции.
Статистический анализ
Иммунопозитивные области визуализировали в виде изображений в формате TIFF (теговый формат файла для хранения графических образов) и обрабатывали для количественной оценки интенсивности флуоресценции и площади (измеряемой в пикселях) с помощью программы ImageJ, версия 1.45 (фирма NIH). При осуществлении количественной оценки для каждого изображения вычитали фоновые интенсивности 5 и отфильтровывали позитивные области размером менее 5 квадратных пикселей. Общую интенсивность флуоресценции выбранных изоповерхностей определяли как сумму интенсивностей одиночных индивидуальных позитивных областей и среднюю пиксельную интенсивность рассчитывали путем деления общей интенсивности на количество проанализированных пикселей.
Средние значения и стандартные отклонения рассчитывали с помощью программы Microsoft Excel (фирма Redmond, шт.Виргиния, США) для всех измеренных изоповерхностей, полученных из девяти изображений трех различных срезов для каждого животного. Статистический анализ осуществляли с использованием t-критерия Стьюдента для сравнений групп или критерия Манна-Уитни.
Мышам инъецировали i.v. в хвост по 10 мг/мл mAb31 (конструкция, изображенная на фиг. 1А), 13,3 мг/кг sFab-mAb31 (конструкция, изображенная на фиг. 1Б) и 16,7 мг/кг dFAb-mAb31 (конструкция, изображенная на фиг. 1В) и через 8 ч осуществляли перфузию головного мозга с использованием ЗФР. Срезы приготавливали согласно описанной выше процедуре и окрашивали козьим античеловеческим IgG. Для конструкции mAb31 специфический сигнал практически отсутствовал (фиг. 4А). Для sFab-mAb31 было обнаружено выраженное окрашивание, как бляшек, так и капилляров (фиг. 4Б), в то время как для dFab-mAb31 было обнаружено окрашивание только капилляров (фиг. 4В). Эти результаты убедительно демонстрируют, что одновалентный формат связывания (sFab-mAb31) с рецептором трансферрина обеспечивает намного более эффективную доставку конструкции через эндотелиальные клетки головного мозга в ГЭБ. Результаты количественной оценки для двухвалентной связывающей молекулы (dFab-mAb31) представлены на фиг. 5. Данные демонстрируют, что в случае конструкции dFab-mAb31 не происходило увеличение окрашивания бляшек, имело место лишь увеличение общей интенсивности вследствие накопления конструкции в капиллярах.
Пример 5: Количественная оценка экспозиции в головном мозге содержащей один Fab конструкции
Экспериментальная процедура описана в примере 4. Результаты количественной оценки экспозиции в головном мозге конструкции sFab-mAb31 представлены на фиг. 6, где приведены данные для mAb31 (конструкция, изображенная на фиг. 1А), которую вводили в дозе 10 мг/мл, и для sFab-mAb31 (конструкция, изображенная на фиг. 1Б), которую вводили в дозе 13,2 мг/кг. Уже через 8 ч после инъекции конструкции sFab-mAb31 имело место ее интенсивное поглощение по сравнению с mAb31 (увеличение примерно в 55 раз). Сходные результаты были получены через 24 ч после введения mAb31 (конструкция, изображенная на фиг. 1А) в дозе 25 мг/мл и sFab-mAb31 (конструкция, изображенная на фиг. 1Б) в дозе 33,3 мг/кг. На фиг. 6 продемонстрировано также кратковременное окрашивание капилляров sFab-mAb31, иллюстрирующее зависимость направленного воздействия и пересечения ГЭБ от времени. Как продемонстрировано на фиг. 6, все эти данные являются статистически высоко значимыми.
На фиг. 7 представлены данные для mAb31 (конструкция, изображенная на фиг. 1А) и конструкции sFab-mAb31 (конструкция, изображенная на фиг. 1Б) при их применении в низкой дозе. И в этом случае также только конструкция sFab-mAb31 оказалась способной пересекать эндотелиальные клетки головного мозга и окрашивать бляшки в головном мозге. Максимальный эффект достигался уже через 8 ч после введения дозы. Для конструкции mAb31 только при ее введении в более высокой дозе (10 мг/кг) и по истечении относительно продолжительного периода времени (7 дней) была выявлена тенденция к увеличению сигнала, характеризующего связывание с бляшками Абета в головном мозге (фиг. 7). Как продемонстрировано на фиг. 76, все эти данные являются статистически высоко значимыми.
Пример 6: Специфическая понижающая регуляция расположенного на клеточной поверхности TfR с помощью конструкции с двумя Fab
Экспериментальные детали: клетки линии bEnd3 культивировали в формате 6-луночного планшета. Через 2-3 дня после достижения конфлюэнтности осуществляли обработку в течение 24 ч dFab-mAb31, sFab-mAb31 или клетки оставляли необработанными (контроль). Затем среду удаляли/аспирировали и клетки промывали дважды охлажденным на льду ЗФР (-MgCl2)(-CaCl2) (фирма Gibco, 14190-094), используя по 5 мл/лунку. Добавляли 1 мл трипсина/ЭДТК (фирма Lonza, СС-5012)/лунку, инкубировали при 37°С в течение 15 мин до отделения всех клеток. Реакцию прекращали, добавляя 1 мл трипсинового нейтрализующего раствора (охлажденного на льду) (фирма Lonza, СС-5002). 2 мл фракции, полученной с помощью трипсина/ЭДТК + нейтрализующий раствор, собирали в 50-миллилитровую фальконовскую пробирку и хранили на льду. Центрифугировали клетки при 4°С при 1400 об/мин в течение 10 мин. Дебрис ресуспендировали в 50 мл охлажденной на льду среды для клеток bEnd3 (DMEM-12 (фирма Gibco 31331) + 10% FBS). Центрифугировали клетки при 4°С при 1400 об/мин в течение 10 мин. Дебрис ресуспендировали в 3 мл охлажденного на льду FACS-буфера (фирма BD, 554656). После подсчета клеток установлено: а) пробирка с sFab (2,5×105 клеток/мл), жизнеспособность: 47%, б) пробирка с dFab (3,18×105 клеток/мл), жизнеспособность: 55%, в) контрольная пробирка (4,6×105 клеток/мл), жизнеспособность: 57%. Осуществляли FACS-окрашивание, распределяли 1×105 клеток/пробирку Эппендорфа и центрифугировали (4°С, 10 мин, 1500 об/мин). Супернатант отсасывали; a) CD71-РЕ (клон моноклонального антитела R17217- IgG2a) (фирма Santa Cruz, sc-52504), 20 мкл антитела/дебрис (объем для окрашивания 100 мкл), доводили до объема 100 мкл с помощью охлажденного на льду FACS-буфера (фирма BD, 554656); б) CD31-APC (фирма BD, 551262) (крысиный антимышиный IgG2a (200 мкг/мл)), 5 мкг антитела/дебрис (объем для окрашивания 100 мкл), доводили до объема 100 мкл с помощью охлажденного на льду FACS-буфера (фирма BD, 554656); в) 8D3-Alexa488 (1:50) (объем для окрашивания 100 мкл), разводили с помощью охлажденного на льду FACS-буфера (фирма BD, 554656); г) контроль изотипа для Alexa488, АРС и РЕ (все фирмы BD). Инкубировали в темноте на льду в течение 1 ч. Доводили объем до 1,5 мл с помощью охлажденного на льду FACS-буфера и центрифугировали (4°С, 10 мин, 1500 об/мин). Дебрис промывали дважды с помощью 1,5 мл охлажденного на льду FACS-буфера и, наконец, ресуспендировали дебрис в 500 мкл ЗФР. FACS-измерения осуществляли с помощью устройства для проточной цитометрии Guava. Данные продемонстрировали, что двойная конструкция (dFab) (фиг. 8Б) обеспечивала понижающую регуляцию рецептора трансферрина на клеточной поверхности. Это не удалось обнаружить при использовании указанного формата анализа для одинарной конструкции (sFab) (фиг. 8А), что свидетельствует о том, что формат одновалентного связывания не оказывает непосредственного воздействия на клеточный трафик и рециклинг при определении количества рецепторов трансферрина на клеточной поверхности эндотелиальных клеток головного мозга.
Пример 7: Внутриклеточная сортировка in vivo конструкции с одним и двумя Fab
Трансгенным мышам APPswe/PS2 инъецировали i.v (инъекции в хвост) следующие конструкции: MAb31 (10 мг/кг), sFab-MAb31 (13,3 мг/кг) или dFab-MAb31 (17,44 мг/кг). Инъецированная доза отражала молекулярный размер, при этом MAb31 применяли в качестве референс-молекулы. Через 15 мин или 8 ч после инъекции мышей умерщвляли с помощью СО2 и подвергали следующей обработке. Вскрывали полость правого предсердия сердца так, чтобы могли вытекать кровь и раствор для перфузии. Разрезали левый желудочек сердца и в аорту вводили зонд для принудительного кормления №10. Инъецировали примерно 20 мл ЗФР (~10 мл/мин, комнатная температура), а затем 30 мл 2% PFA в ЗФР. Изымали головной мозг и инкубировали в течение еще 7,00 ч в том же самом перфузате. Устройство Vibratome (тип микротома) применяли для получения свободно плавающих срезов толщиной 100 мкм, которые использовали для иммунофлуоресцентного окрашивания. Сначала повышали проницаемость срезов, а затем блокировали с использованием ЗФР-0,3% Тритон Х-100-10% ослиной сыворотки. Затем срезы инкубировали в течение ночи с указанными первичными антителами, разведенными в ЗФР-5% ослиной сыворотки. Молекулярные зонды, представляющие собой вторичные антитела, применяли согласно рекомендациям производителя. Изображения получали с помощью конфокального микроскопа Leica SP5, для обработки изображений и реконструкции в 3D-формате применяли программу Imaris.
Указанные данные иллюстрируют поглощение sFab-MAb31 и dFab-MAb31 эндотелиальными клетками головного мозга при их периферическом введении. MAb31, sFab-MAb31 и dFab-MAb31 выявляли, используя козье античеловеческое антитело, конъюгированное в Alexa 555. Как продемонстрировано на фиг. 9, как sFab-MAb31 (фиг. 9А), так и dFab-MAb31 (фиг. 9Б) «декорировали» сосудистую сеть головного мозга через 15 мин после инъекции, при этом не обнаружено различий в их распределении. Через 8,00 ч после инъекции конструкция sFab-MAb31 достигала паренхимы и окрашивала амилоидные бляшки (фиг. 9В, стрелки), в то время как конструкция dFab-MAb31 (фиг. 9Г) оставалась внутри сосудистой сети головного мозга, при этом картина была сходной с той, которая была обнаружена через 15 мин после инъекции. С помощью dFab-MAb31 в паренхиме не выявлено никаких амилоидных бляшек.
Фиг. 10: Для контроля целостности всех конструкций, применявшихся в исследовании, осуществляли окрашивание криосрезов головного мозга мышей возрастом 18 месяцев с использованием MAb31 (фиг. 10А), sFab-MAb31 (фиг. 10Б) или dFab-MAB31 (фиг. 10В). Результаты свидетельствуют о том, что все 3 конструкции позволяли выявлять амилоидные бляшки в головном мозге трансгенных мышей.
Фиг. 11-12: С помощью конфокальной микроскопии высокого разрешения продемонстрировано, что sFab (фиг. 11) и dFab-MAb31 (фиг. 12) не окрашивали обращенную в просвет сторону капилляров головного мозга, но они содержались в везикулоподобных структурах, пересекающих обращенную в просвет мембрану эндотелиальных клеток и в цитозоле эндотелиальных клеток. Стрелками на фиг. 11 и фиг. 12 указаны везикулы, содержащие конструкции sFab-MAb31 на внепросветной стороне ядер эпителиальных клеток. Хотя эти данные позволяют предположить, что и sFab-MAb31, и dFab-MAb31 могут проникать в эндотелиальные клетки, но только sFab-MAb31 может пересекать сосудистую сеть и достигать амилоидных бляшек.
Способы и композиции, предлагаемые в изобретении, обеспечивают резкое увеличение пропорции антител, которые распределяются в ЦНС и поэтому более эффективно достигают терапевтической концентрации в ЦНС. Способы и композиции, предлагаемые в изобретении, являются новыми и существенно повышают эффективность прохождения через различные органеллы в ВЕС, используя оптимальный и беспрепятственный внутриклеточный путь/сортировку для достижения внеполостной стороны.
Пример 8: Одновалентный формат связывания рецептора имеет решающее значение для пересечения ГЭБ
Моноклональное антитело к Аβ mAb31 является высокоспецифическим и эффективным связывающим агентом Аβ-бляшек, разработанным при создании изобретения, что позволяет с его помощью количественно оценивать целенаправленное включение в паренхиму головного мозга. При создании изобретения в качестве модели амилоидоза применяли дважды трансгенных мышей линии PS2APP для изучения уровня экспозиции головного мозга двумя шаттл-конструкциями для головного мозга в сравнении с родительским антителом mAb31. Три варианта инъецировали внутривенно из расчета 10 мг/кг и уровень экспозиции определяли путем определения количества антитела, присутствующего в бляшках через 8 ч после инъекции. При применении dFab-конструкции не обнаружено никакого существенного увеличения окрашивания бляшек по сравнению с mAb31 (фиг. 13А). Однако при применении sFab-конструкции выявлено очень значительное увеличение окрашивания бляшек по сравнению с родительским антителом mAb31. Целенаправленное включение в амилоидные бляшки повышалось более чем в 50 раз при применении sFab-конструкции при количественной оценке на основе интенсивности флуоресценции с использованием меченого вторичного антитела. В то время как при применении sFab обнаружено интенсивное окрашивание бляшек (фиг. 13Г), dFab-конструкцию удалось обнаружить только в микрососудах (фиг. 13В), что свидетельствует о том, что dFab-конструкция «нацеливается» и проникает в микрососуды головного мозга, но не может выделяться на внеполостную сторону. При создании изобретения изучали способность к целенаправленному включению sFab-конструкции при ее применении в низкой дозе 2,66 мг/кг и пролонгированной экспозиции in vivo в течение вплоть до 7 дней. Максимальное окрашивание бляшек достигалось в течение 8 ч, после чего обнаружено постоянное связывание с бляшками в течение по меньшей мере одной недели после однократной инъекции (фиг. 13Д).
В предыдущем исследовании для родительского антитела mAb31 было установлено, что связывание с бляшками достигало максимума через 7 дней после инъекции. Количественная оценка окрашивания структур микрососудов продемонстрировала, что локализация sFab-конструкции в ГЭБ была очень кратковременной, это свидетельствует о относительно быстрой скорости, с которой конструкция пересекала барьер. Репрезентативные изображения окрашивания бляшек родительским антителом mAb31 в дозе 2 мг/кг через 7 дней после инъекции (фиг. 13Е) и применяемой в эквимолярной концентрации sFab-конструкцией (фиг. 13Ж) проиллюстрировали повышение связывания бляшек, достигаемое при применении шаттл-конструкции для головного мозга sFab. Для sFab-конструкции обнаружено лишь очень незначительная колокализация в лизосомальном компартменте, что, вероятно, характерно для нормального трафика TfR в лизосому. Проведенные при создании изобретения опыты in vitro продемонстрировали также рециклинг и трансцитоз sFab-конструкции. В сочетании, эти данные позволяют предположить, что sFab-конструкция не оказывает воздействия на нормальный трафик TfR. В противоположность этому, для dFab-конструкции продемонстрирована колокализация в лизосомальном компартмете, но отсутствие трансцитозной активности как in vitro, так и in vivo.
Пример 9: Повышенное проникновение антитела через ГЭБ транслируется в повышенную эффективность in vivo
В следующей серии экспериментов, проведенной при создании изобретения, решался вопрос о том, может ли значительное повышение экспозиции в головном мозге при применении одновалентного механизма связывания повышать эффективность in vivo антитела к Аβ в продолжительном эксперименте. Для этой цели инъецировали sFab-конструкцию и контрольное родительское антитело mAb31 еженедельно в течение трех месяцев. В проведенном ранее 5-месячном исследовании было установлено, что терапевтическое антитело mAb31 при применении в дозе 20 мг/кг снижало загрузку бляшками. Основываясь на данных, представленных на фиг. 14, при создании изобретения были выбраны две низкие дозы для решения вопроса о том, может ли повышенная экспозиция в головном мозге приводить к повышенной эффективности in vivo. Связывание с бляшками-мишенями в конце эксперимента продемонстрировало, что при применении в обеих дозах имело место более сильное целенаправленное включение sFab-конструкции по сравнению с родительским антителом mAb31 (фиг. 14 А-Г). Уровень амилоидоза оценивали количественно у дважды трансгенных мышей линии PS2APP на исходном уровне и после обработки наполнителем, применяемым в низкой дозе родительским mAb31 и применяемой в низкой дозе sFab-конструкцией. При применении в указанных низких дозах не выявлено никакого действия in vivo у родительского моноклонального антитела mAb31 (фиг. 14Д), что было ожидаемым с учетом результатов проведенного ранее долговременного 5-месячного опыта. В противоположность этому, существенное уменьшение количества бляшек, как в коре головного мозга, так и в гиппокампе обнаружено при применении sFab-конструкции в низкой дозе 2,67 мг/кг. Даже при применении в существенно более низкой дозе 0,53 мг/кг (фиг. 14Д), обнаружена тенденция к более предпочтительному действию sFab-конструкции, особенно в коре головного мозга, хотя различие не достигало статистической значимости. Вторичный анализ размеров бляшек подтвердил более выраженное снижение количества бляшек в случае небольших бляшек, что согласуется с механизмом действия mAb31. Указанные данные свидетельствуют о том, что повышенная способность проникать в головной мозг, чему способствует одновалентный формат связывания TfR, приводит к существенному повышению эффективности терапевтического антитела на животной модели хронической патологии, связанной с болезнью Альцгеймера.
Пример 10: Эффекторная функция различных содержащих антитело слитых белков на клетках линии TfR+-BaF3 in vitro (ADCC)
В качестве клеток-мишеней в экспериментах по изучению антитело-обусловленной клеточнозависимой токсичности (ADCC), индуцируемой различными содержащими антитело слитыми молекулами, применяли экспрессирующие рецептор трансферрина клетки линии BaF3 (DSMZ, № CLPZ04004) (TfR+).
В целом, метод состоял в следующем: 1×104 клеток линии BaF3 высевали в круглодонный 96-луночный планшет и необязательно совместно культивировали с человеческими эффекторными клетками линии NK92 (обладающий высокой аффинностью к CD16 клон 7A2F3; фирма Roche GlycArt) при соотношении эффекторные клетки/клетки-мишени 3:1 в присутствии содержащих антитело слитых белков или без них. После инкубации в течение четырех часов (37°С, 5% СО2) оценивали цитотоксичность путем измерения высвобождения лактатдегидрогеназы (LDH) из мертвых/погибающих клеток. Для этого клетки центрифугировали в течение 5 мин при 250×g и 50 мкл супернатанта переносили в плоскодооный планшет. Добавляли 50 мкл реакционной смеси для LDH (реакционная смесь фирмы Roche для LDH, каталожный номер 11644793001; фирма Roche Diagnostics GmbH) и реакционную смесь инкубировали в течение 20 мин при 37°С, 5% СО2. После этого измеряли абсорбцию с помощью ридера Tecan Sunrise Reader при длинах волн 492/620 нм.
Все образцы тестировали в трех повторностях и рассчитывали результаты с использованием следующих контролей:
- только клетки-мишени (+среда)
- максимальное высвобождение LDH: клетки-мишени + 3% Тритон-Х
- спонтанное высвобождение: клетки-мишени + NK-клетки (Е : Т = 3:1) % специфического ADCC/лизиса рассчитывали с использованием следующей формулы:

На фиг. 15 продемонстрировано, что слияние антитела с scFab-фрагментами к TfR, слитыми с С-концом Fc, не индуцировало ADCC. Опосредуемое NK92-клетками уничтожение эритролейкозных клеток мышей линии BA/F3 оценивали количественно путем измерения высвобождения LDH. Только слитые конструкции, содержащие TfR-связывающий Fab-фрагмент в «канонической» «N-концевой по отношению к Fc» ориентации, индуцировали значительную ADCC, в то время как конструкции шаттла для головного мозга с обратной ориентацией оказались «молчащими». Применяли следующие конструкции: 8D3-IgG (полноразмерный 8D3 IgG), OA - 8D3 (одна тяжелая цепь 8D3 IgG), mAb31 (антитело, изображенное на фиг. 1А), mAb31-8D3 sFab (конструкция, изображенная на фиг. 1Б), mAb31-8D3-dFab (конструкция, изображенная на фиг. 1В).
Пример 11: Эпитопное картирование антитела 8D3 к mTfR
Эпитопное картирование моноклонального антитела 8D3 осуществляли с использованием библиотеки перекрывающихся иммобилизованных пептидных фрагментов (длина: 15 аминокислот, сдвиг: 3 аминокислоты), соответствующих последовательности внеклеточного домена мышиного рецептора трансферрина-1 (90-763). Для получения массива пептидов применяли технологию CelluSpots™ фирмы Intavis. При таком подходе пептиды синтезировали с использованием автоматического синтезатора (MultiPep RS фирмы Intavis) на модифицированных целлюлозных дисках, которые растворяли после осуществления синтеза. Затем растворы индивидуальных пептидов, которые оставались ковалентно связанными с макромолекулярной целлюлозой, наносили в виде пятен на сенсибилизированные предметные стекла для микроскопа. CelluSpots™-синтез осуществляли постадийно с применением 9-флуоренилметоксикарбонил (Fmoc)-химии на амино-модифицированных целлюлозных дисках в 384-луночном планшете для синтеза. В каждом цикле сочетания осуществляли активацию соответствующих аминокислот раствором DIC/HOBt в ДМФ. Между стадиями сочетания непрореагировавшие аминогруппы кэпировали с помощью смеси уксусного ангидрида, диизопропилэтиламина и 1-гидроксибензотриазола. После завершения синтеза целлюлозные диски переносили в 96-луночный планшет и обрабатывали смесью трифторуксусной кислоты (ТФК), дихлорметана, триизопропилсилана (ТИС) и воды для удаления защитных групп с боковых цепей. После удаления раствора для отщепления, связанные с целлюлозой пептиды растворяли в смеси ТФК, TFMSA, ТИС и воды, осаждали с помощью простого диизопропилового эфира и ресуспендировали в ДМСО. После этого растворы пептидов наносили в виде пятен на предметные стекла CelluSpots™ фирмы Intavis с использованием робота для нанесения пятен на предметные стекла фирмы Intavis.
Для эпитопного анализа подготовленные предметные стекла отмывали этанолом и затем забуференным Трис соляным раствором (TBS; 50 мМ Трис, 137 мМ NaCl, 2,7 мМ KCl, рН 8), после чего осуществляли стадию блокирования в течение 16 ч при 4°C с использованием 5 мл 1 Ох реагента Western Blocking (фирма Roche Applied Science), 2,5 г сахарозы в TBS, 0,1% Твин 20. После отмывки (TBS + 0,1% Твин 20) предметные стекла инкубировали в течение 2 ч с раствором (1 мкг/мл) антитела 8D3 в TBS + 0,1% Твин 20 при температуре окружающей среды. После отмывки предметные стекла инкубировали с целью обнаружения с вторичным антимышиным антителом, конъюгированным с HRP (разведение 1:20000 в TBS-T), после чего осуществляли инкубацию с хемилюминисцентным субстратом люминолом и визуализировали с помощью LumiImager (фирма Roche Applied Science). Количественно оценивали позитивные по данным ELISA пятна и идентифицировали связывающие антитело эпитопы путем соотнесения их с соответствующими пептидными последовательностям.
На фиг. 16 продемонстрировано, что 8D3 связывается с тремя различными пептидами во внеклеточном домене мышиного рецептора трансферрина. Связывание антитела 8D3 с 15-мерными пептидами, перекрывающимися на три аминокислоты, выявляли путем хемилюминисцентного обнаружения антитела, инкубированного на предметном стекле CelluSpot, несущем иммобилизованные mTfR-пептиды. Контур: пептиды №№373, 374 и 376, связанные 8D3. 
В настоящем описании представлена группа биотерапевтических конструкций, мишенью которых является рецептор гематоэнцефалического барьера, в частности, рецептор трансферрина (TfR), которые обладают способностью транспортировать через ГЭБ терапевтические субстанции, включая антитела, белки, пептиды и малые молекулы, в пригодных для терапии дозах. Перераспределение сконструированных определенным образом биотерапевтических конструкций из цереброваскулярного пространства в паренхимальное пространство происходит в течение нескольких часов после инъекции, это свидетельствует о том, что указанные конкретные конструкции позволяют реализовать оптимальный путь транспортирования через ГЭБ, дающий возможность биотерапевтическим субстанциям в значительном количестве проникать посредством трансцитоза через ГЭБ и достигать паренхимы. Уровень поглощения биотерапевтических конструкций и их распределение в ЦНС полностью определяется одновалентным форматом связывания с рецептором гематоэнцефалического барьера, в частности, TfR. Если в результате связывания биотерапевтической конструкции с R/ГЭБ происходит димеризация TfR, то ее уровень в паренхимальном пространстве находится ниже предела обнаружения. Системное введение одной дозы содержащей один Fab моноклональной конструкции к Абета, созданной с применением способа, предлагаемого в изобретении, приводит не только к значительному повышению поглощения антитела в головном мозге, то также и к резкому повышению окрашивания патологических амилоидных бляшек связывающейся с ними моноклональной конструкцией к Абета. Однако при использовании содержащей два Fab связывающейся конструкции к R/ГЭБ, не было обнаружено ее выявляемого уровня в ЦНС. Представленные в настоящем описании результаты и эксперименты иллюстрируют имеющие решающее значение для этого механизмы, лежащие в основе повышенного поглощения биотерапевтических субстанций (таких как антитела) в ЦНС, в случае одновалентного формата связывания с R/ГЭБ. Во-первых, двойной (или мультимерный) формат связывания с R/ГЭБ ограничивает поглощение головным мозгом в результате понижающей регуляции R/ГЭБ на поверхности клеток, обращенной в сторону просвета, снижая тем самым общее количество анти-R/ГЭБ конструкций, которые могут проникать в сосудистую сеть, что представляет собой первую стадию для эффективного пересечения ГЭБ. Во-вторых, двойной (или мультимерный) формат связывания с R/ГЭБ индуцирует выраженный внутриклеточную неправильную сортировку в ВЕС, что препятствует достижению конструкциями внепросветной стороны. Важно, что одновалентное связывание с R/ГЭБ повышает поглощение и распределение в головном мозге, при этом имеет место полный сдвиг локализации из сосудистой сети к амилоидным бляшкам в ЦНС. Во-вторых, сконструированный одновалентный формат связывания биотерапевтических конструкций с R/ГЭБ обеспечивает рециклинг R/ГЭБ на обращенную к просвету сторону, что позволяет осуществлять поглощение дополнительных слитых полипептидных конструкций и их транспортирование на внепросветную сторону и в паренхиму. В-третьих, обладающую одновалентным форматом связывания биотерапевтическую конструкцию создают на С-конце Fc-фрагмента IgG, это сохраняет исходный формат терапевтического моноклонального антитела, что в большинстве случаев имеет решающее значение с точки зрения эффективности in vivo. Это можно осуществлять также путем сцепления с другой частью IgG, как представлено в настоящем описании. Это является предпочтительным, поскольку уже разработанные моноклональные антитела в виде IgG, обладающие установленной в доклинических и клинических опытах эффективностью, можно встраивать в указанную транспортную систему без ухудшения уже имеющейся функции и эффективности. Кроме того, технология одновалентного нацеливания на рецептор R/ГЭБ, основанная на опосредуемом рецептором транспорте (RMT), открывает путь для разработки широкого спектра возможных терапевтических средств для лечения заболеваний ЦНС. В изобретении предложены способы конструирования проникающих через ГЭБ терапевтических средств, сохраняющих существующие IgG-форматы, обладающие проверенной терапевтической активностью, которые существенно улучшают транспорт терапевтических средств через ГЭБ и их распределение в ЦНС.
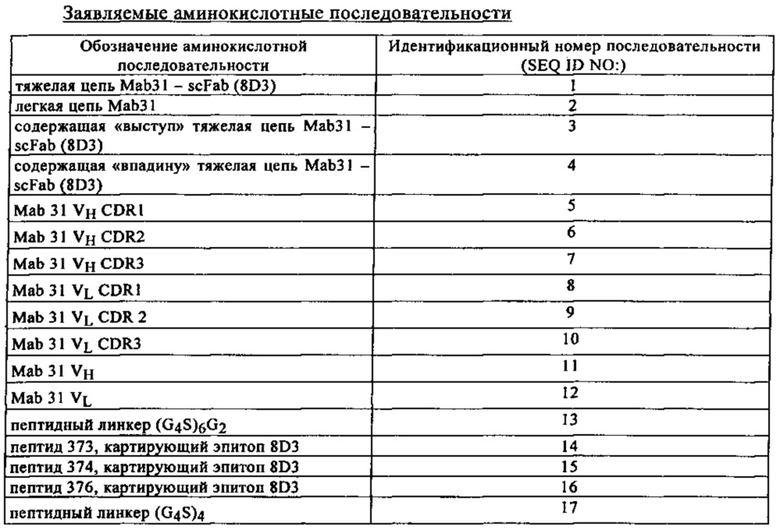
| название | год | авторы | номер документа |
|---|---|---|---|
| ШАТТЛ ДЛЯ ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА | 2013 |
|
RU2711552C2 |
| ШАТТЛ ДЛЯ ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА | 2019 |
|
RU2754794C2 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2694659C2 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИТИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2799436C1 |
| АНТИТЕЛА К АЛЬФА-СИНУКЛЕИНУ И СПОСОБЫ ПРИМЕНЕНИЯ | 2014 |
|
RU2718990C1 |
| АНТИТЕЛА К АЛЬФА-СИНУКЛЕИНУ И СПОСОБЫ ПРИМЕНЕНИЯ | 2014 |
|
RU2697098C1 |
| АНТИТЕЛА ПРОТИВ ТРАНСФЕРРИНОВОГО РЕЦЕПТОРА, ОБЛАДАЮЩИЕ ИНДИВИДУАЛИЗИРОВАННОЙ АФФИННОСТЬЮ | 2016 |
|
RU2729416C2 |
| АНТИТЕЛА ПРОТИВ ТРАНСФЕРРИНОВОГО РЕЦЕПТОРА, ОБЛАДАЮЩИЕ ИНДИВИДУАЛИЗИРОВАННОЙ АФФИННОСТЬЮ | 2016 |
|
RU2831724C2 |
| БИСПЕЦИФИЧНЫЕ АНТИТЕЛА ПРОТИВ ГАПТЕНА/ПРОТИВ РЕЦЕПТОРА ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА, ИХ КОМПЛЕКСЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЧЕЛНОКОВ ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА | 2014 |
|
RU2693438C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CD19 ЧЕЛОВЕКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2731156C1 |





















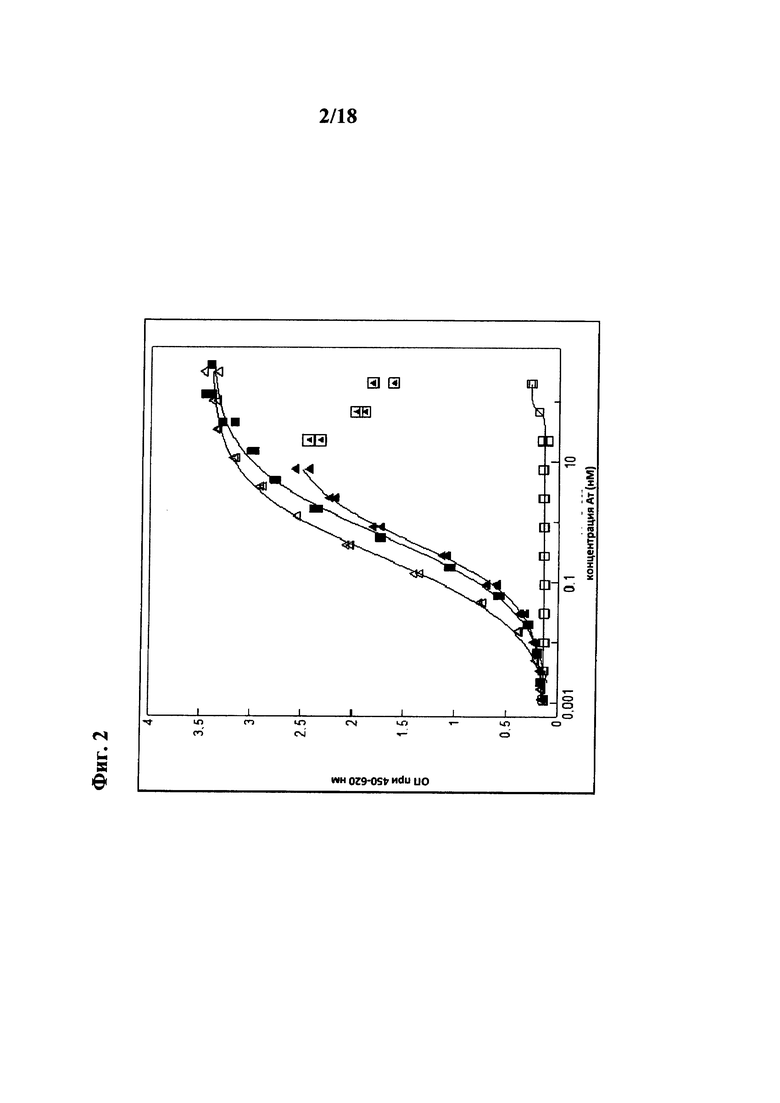

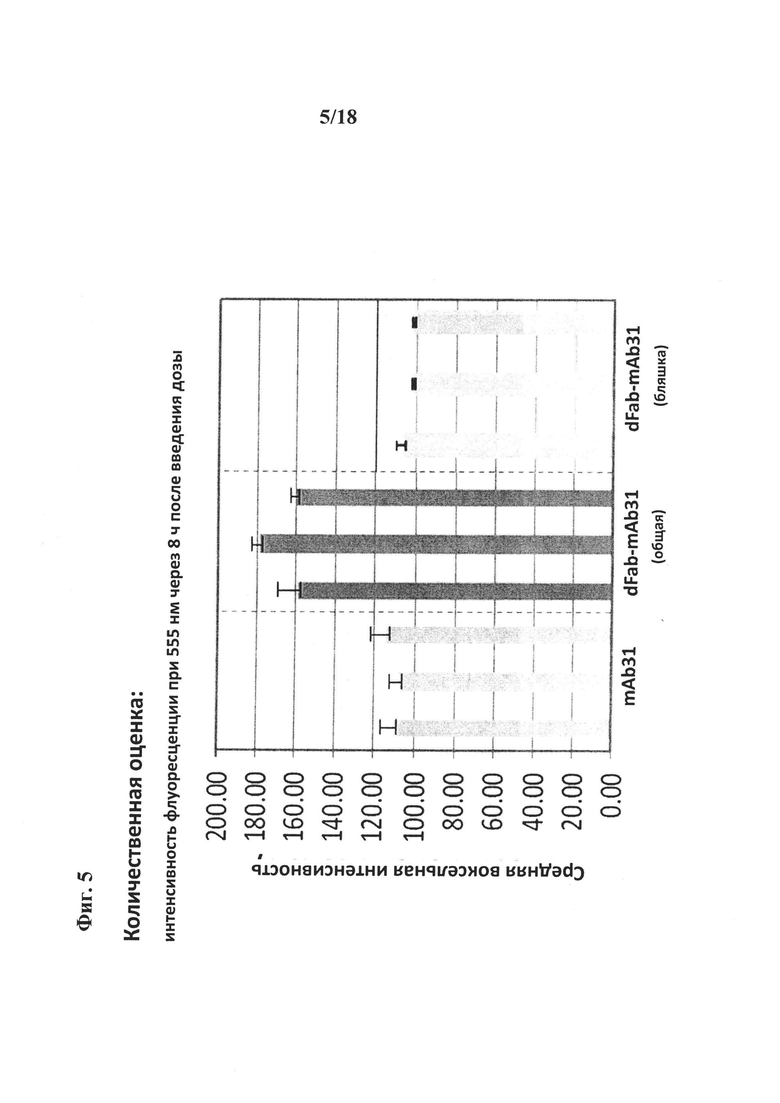
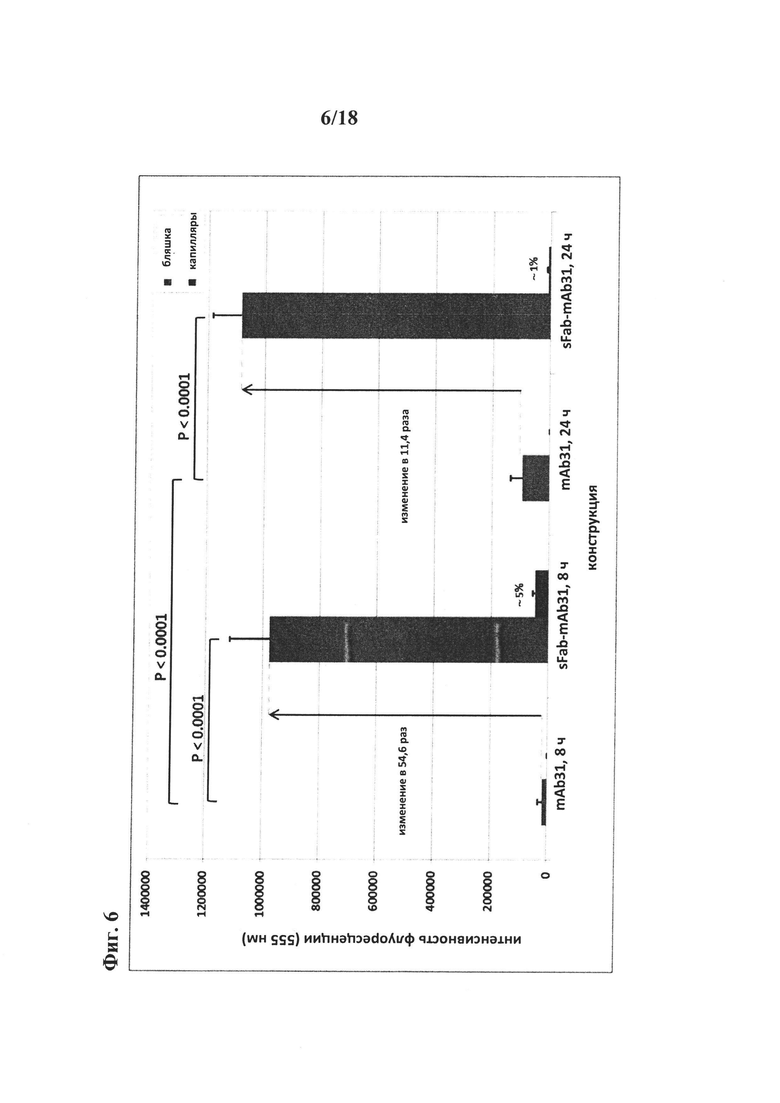

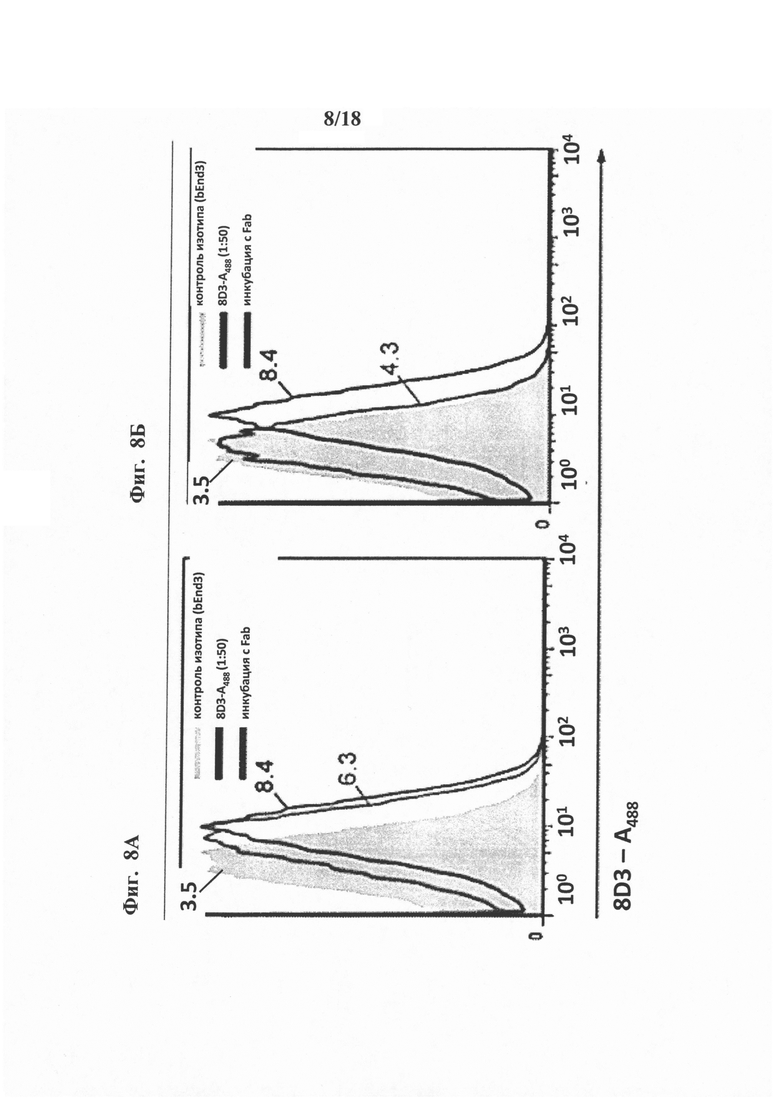

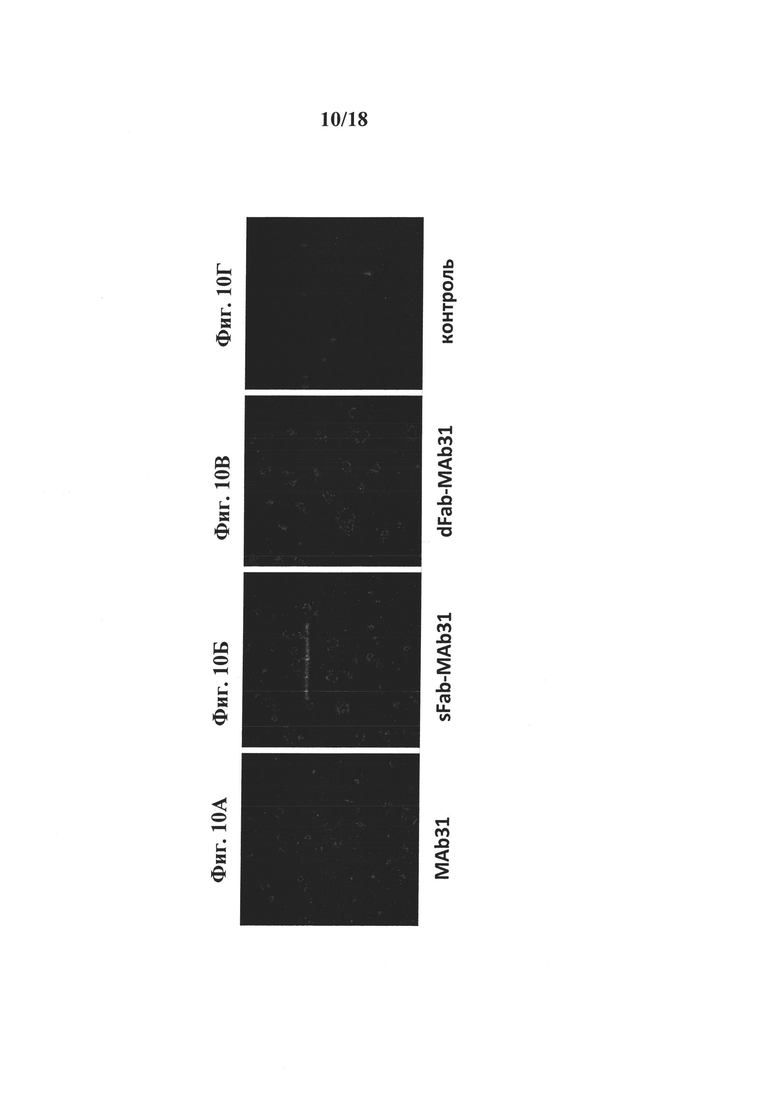
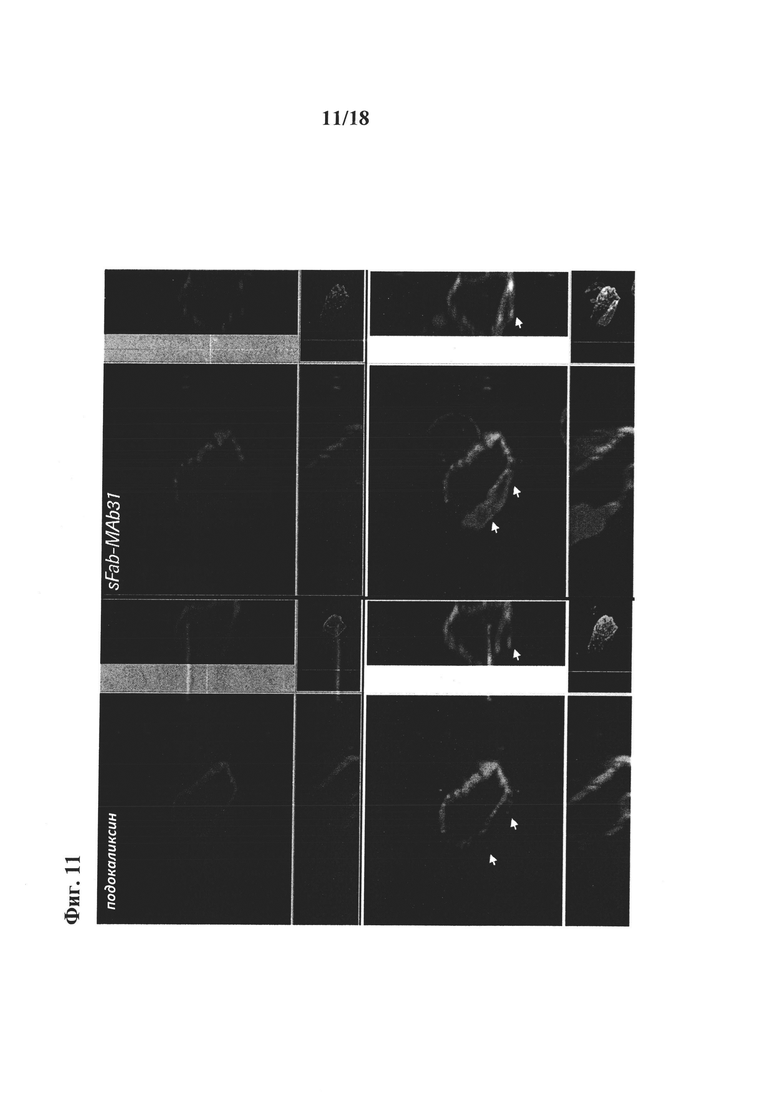

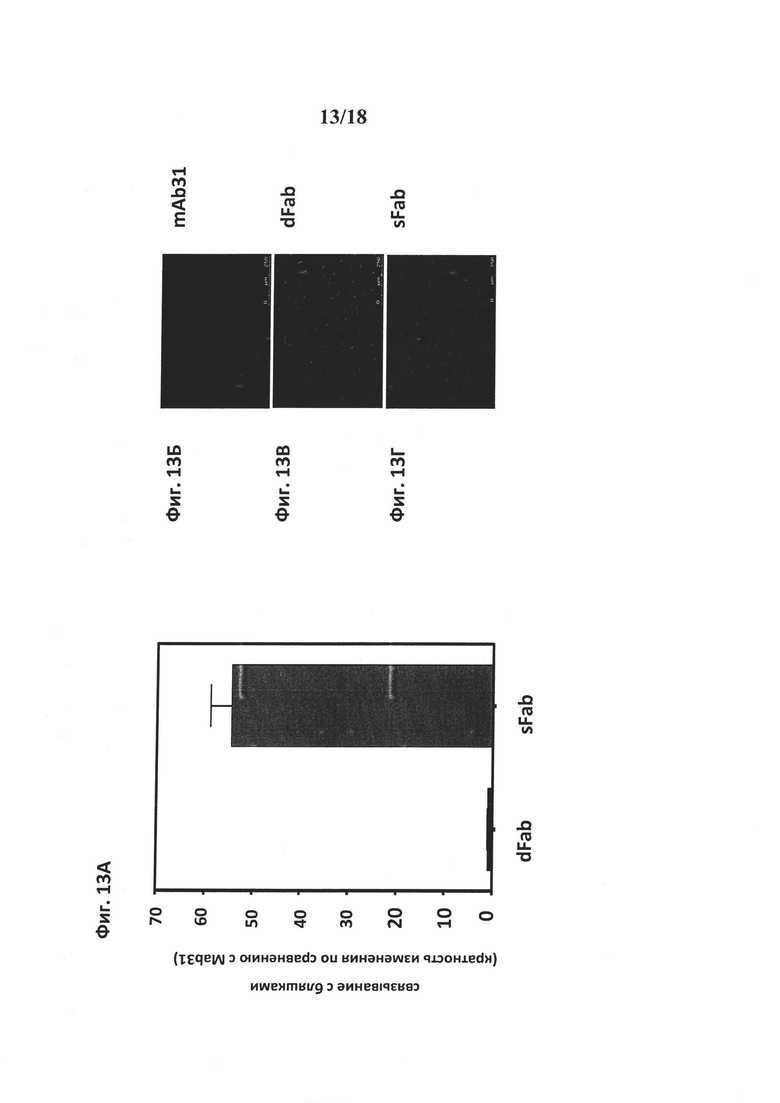
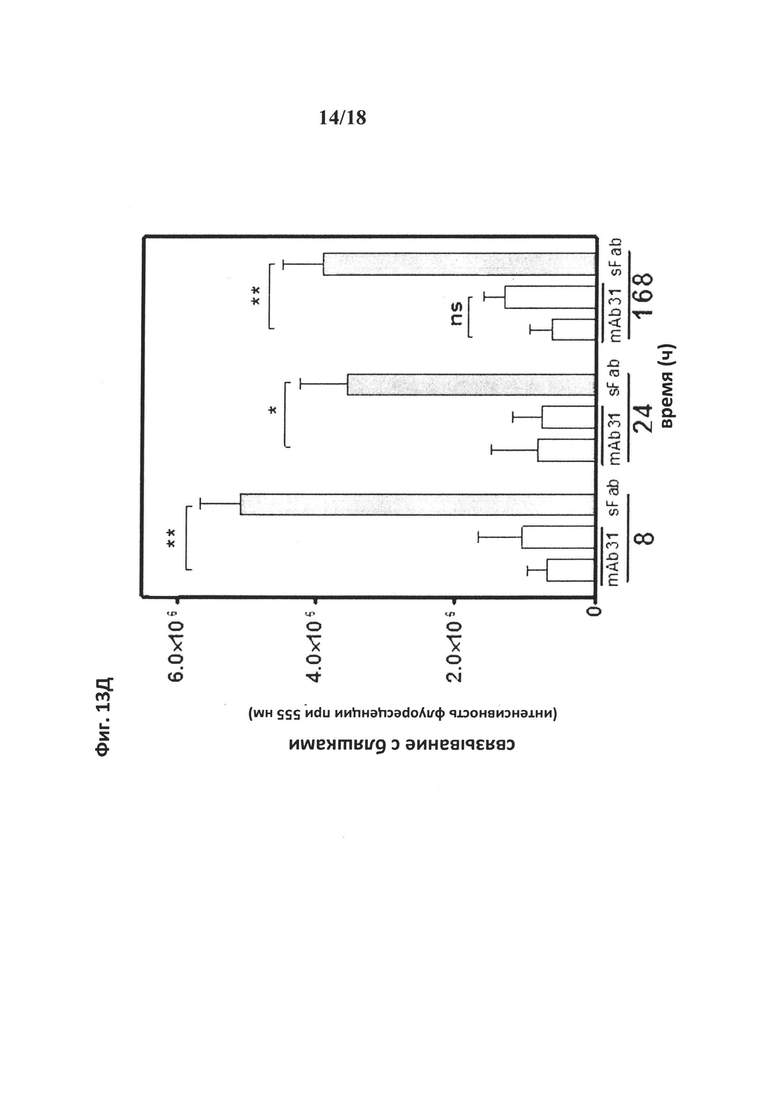


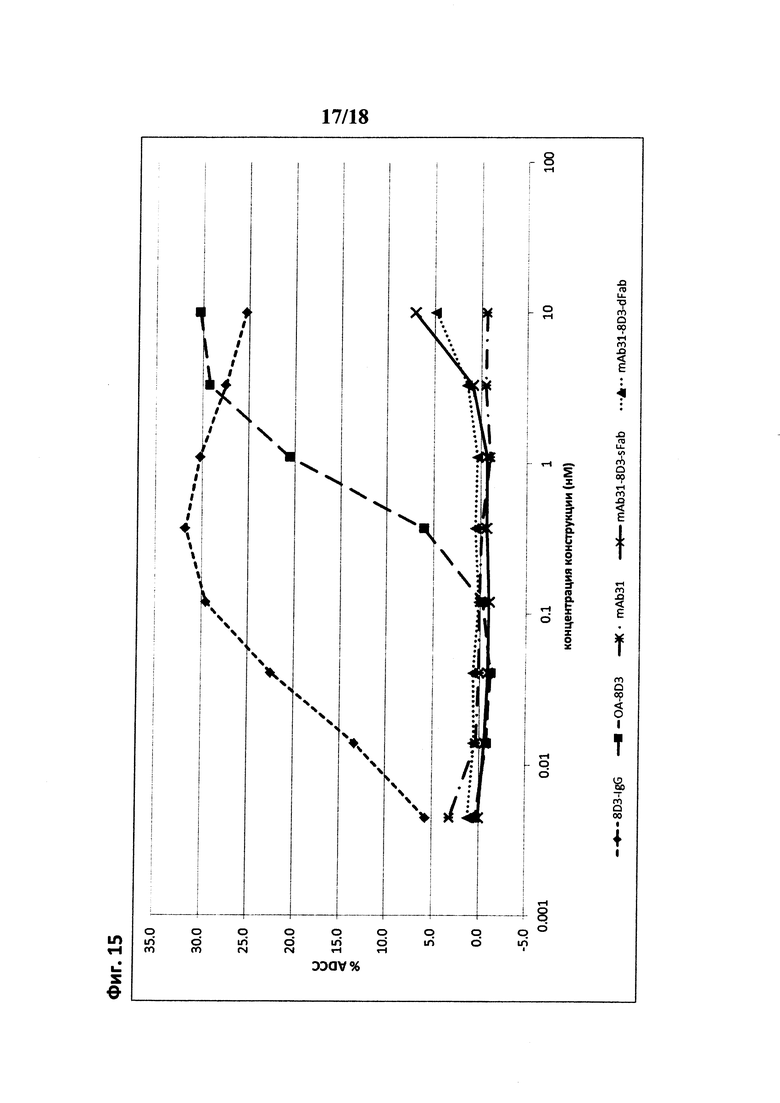
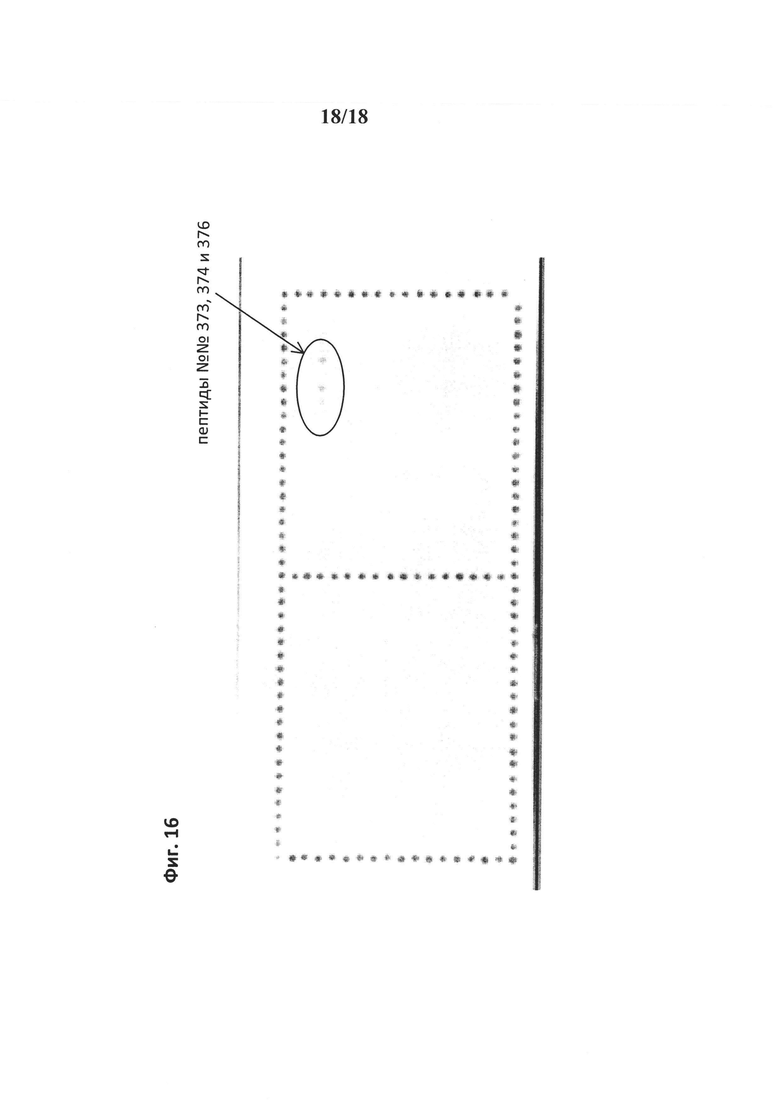
Изобретение относится к области биотехнологии, конкретно к шаттлам для гематоэнцефалического барьера, что может быть использовано в медицине. Получают шаттл для гематоэнцефалического барьера, который связывается с рецептором трансферрина, содержит специфичный к нему scFab, линкер и эффекторный элемент для головного мозга, что используют в фармацевтических композициях для транспорта эффекторного элемента для головного мозга через гематоэнцефалический барьер. Изобретение позволяет эффективно использовать различные терапевтические средства для лечения нейродегенеративных нарушений, предпочтительно болезни Альцгеймера. 4 н. и 16 з.п. ф-лы, 16 ил., 2 табл., 11 пр.
1. Шаттл для гематоэнцефалического барьера, содержащий эффекторный элемент для головного мозга, линкер и один одновалентный связывающий элемент, который связывается с рецептором трансферрина, в котором линкер соединяет эффекторный элемент с одновалентным связывающим элементом, который связывается с рецептором трансферрина, где одновалентный связывающий элемент, который связывается с рецептором трансферрина, содержит один scFab, мишенью которого является рецептор трансферрина, распознающий эпитоп в рецепторе трансферрина, который содержится в аминокислотной последовательности SEQ ID NO: 14, 15 или 16.
2. Шаттл для гематоэнцефалического барьера по п. 1, в котором эффекторный элемент для головного мозга выбран из группы, состоящей из лекарственных средств для лечения неврологического нарушения, нейротропных факторов, факторов роста, ферментов, цитотоксических агентов, антител, направленных к мишени в головном мозге, моноклональных антител, направленных к мишени в головном мозге, пептидов, направленных к мишени в головном мозге.
3. Шаттл для гематоэнцефалического барьера по п. 2, в котором мишень в головном мозге выбрана из группы, состоящей из β-секретазы 1, Аβ, эпидермального фактора роста, рецептора эпидермального фактора роста-2, Tau, фосфорилированного Tau, аполипопротеина Е4, альфа-синуклеина, олигомерных фрагментов альфа-синуклеина, CD20, хантингтина, белка приона, содержащей богатый лейцином повтор киназы 2, паркина, пресенилина 2, гамма-секретазы, рецептора смерти 6, белка-предшественника амилоида, рецептора нейротрофина р75 и каспазы 6.
4. Шаттл для гематоэнцефалического барьера по пп. 1-3, в котором эффекторный элемент для головного мозга выбран из группы, состоящей из белков, полипептидов и пептидов.
5. Шаттл для гематоэнцефалического барьера по п. 4, в котором одновалентный связывающий элемент, который связывается с рецептором трансферрина, содержащим один scFab, мишенью которого является рецептор трансферрина, распознающий эпитоп в рецепторе трансферрина, который содержится в аминокислотной последовательности SEQ ID NO: 14, 15 или 16, соединен с С-концом эффекторного элемента для головного мозга с помощью линкера.
6. Шаттл для гематоэнцефалического барьера по пп. 1-5, в котором эффекторный элемент для головного мозга содержит полноразмерное антитело, направленное к мишени в головном мозге, предпочтительно полноразмерный IgG.
7. Шаттл для гематоэнцефалического барьера по п. 6, содержащий полноразмерное антитело IgG-типа в качестве эффекторного элемента для головного мозга, линкер и один scFab, мишенью которого является рецептор трансферрина, распознающий эпитоп в рецепторе трансферрина, который содержится в аминокислотной последовательности SEQ ID NO: 14, 15 или 16, в котором scFab соединен с помощью линкера с С-концом Fc-фрагмента одной из тяжелых цепей антитела IgG-типа.
8. Шаттл для гематоэнцефалического барьера по п. 6 или 7, в котором эффекторный элемент представляет собой полноразмерное антитело, направленное к Аβ.
9. Шаттл для гематоэнцефалического барьера по п. 8, в котором антитело, направленное к Аβ, содержит (a) H-CDR1, содержащий аминокислотную последовательность SEQ ID NO: 5, (б) H-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 6, (в) H-CDR3, содержащий аминокислотную последовательность SEQ ID NO: 7, (г) L-CDR1, содержащий аминокислотную последовательность SEQ ID NO: 8, (д) L-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 9, и (е) L-CDR3, содержащий аминокислотную последовательность SEQ ID NO: 10.
10. Шаттл для гематоэнцефалического барьера по п. 9, в котором антитело, направленное к Аβ, содержит VH-домен, содержащий аминокислотную последовательность SEQ ID NO: 11, и VL-домен, содержащий аминокислотную последовательность SEQ ID NO: 12.
11. Шаттл для гематоэнцефалического барьера по п. 6 или 7, в котором эффекторный элемент представляет собой полноразмерное антитело, направленное к фосфорилированному Tau.
12. Шаттл для гематоэнцефалического барьера по п. 6 или 7, в котором эффекторный элемент представляет собой полноразмерное антитело, направленное к альфа-синуклеину.
13. Шаттл для гематоэнцефалического барьера по пп. 1-12, в котором линкер представляет собой пептидный линкер, предпочтительно пептид, который имеет аминокислотную последовательность длиной по меньшей мере 20 аминокислот, более предпочтительно длиной от 25 до 50 аминокислот.
14. Шаттл для гематоэнцефалического барьера по п. 1 или 2, в котором одновалентный связывающий элемент, который связывается с рецептором трансферрина, содержит СН2-СН3-домен Ig и один scFab, мишенью которого является рецептор трансферрина, распознающий эпитоп в рецепторе трансферрина, который содержится в аминокислотной последовательности SEQ ID NO: 14, 15 или 16, где scFab соединен с С-концом СН2-СН3-домена Ig с помощью второго линкера.
15. Шаттл для гематоэнцефалического барьера по п. 14, содержащий эффекторный элемент для головного мозга, линкер, СН2-СН3-домен Ig, второй линкер и один sFab, мишенью которого является рецептор трансферрина, распознающий эпитоп в рецепторе трансферрина, который содержится в аминокислотной последовательности SEQ ID NO: 14, 15 или 16, в котором эффекторный элемент для головного мозга соединен с помощью первого линкера с N-концом СН2-СН3-домена Ig и sFab соединен с С-концом СН2-СН3-домена Ig с помощью второго линкера.
16. Шаттл для гематоэнцефалического барьера по п. 14 или 15, в котором СН2-СН3-домен Ig представляет собой СН2-СН3-домен IgG.
17. Выделенная нуклеиновая кислота, кодирующая шаттл для гематоэнцефалического барьера по пп. 1-16.
18. Клетка-хозяин для экспрессии шатлла по п. 1, содержащая нуклеиновую кислоту по п. 17.
19. Фармацевтическая композиция для транспорта эффекторного элемента для головного мозга через гематоэнцефалический барьер, содержащая шаттл для гематоэнцефалического барьера по пп. 1-16 в эффективном количестве и фармацевтический носитель.
20. Шаттл для гематоэнцефалического барьера по пп. 1-16 для лечения нейродегенеративного нарушения, предпочтительно болезни Альцгеймера.
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| KONTERMANN R., Dual targeting strategies with bispecific antibodies, mAbs, 2012, v.4, is.2, p.182-197 | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| ПОЛИЛАКТИДНЫЕ НАНОЧАСТИЦЫ | 2007 |
|
RU2423104C2 |
Авторы
Даты
2018-08-01—Публикация
2013-08-26—Подача