Настоящее изобретение относится к композиции, содержащей смесь галактоолигосахаридов (GOS) для профилактики или лечения когнитивной дисфункции и/или эмоциональных расстройств, проявляющихся при психоневрологических заболеваниях или нарушениях, а также в процессе старения человека. Оно также относится к способу профилактики или лечения когнитивной дисфункции и/или эмоциональных расстройств, происходящих при психоневрологических заболеваниях или нарушениях, а также в процессе старения, путем перорального введения пациенту терапевтически эффективного количества композиции, содержащей смесь галактоолигосахаридов.
Предотвращение заболевания относится к способности фармацевтической композиции или лечения не только предотвращать возникновение заболевания, например, уменьшая факторы риска заболевания, но и подавлять развитие заболевания и уменьшать его последствия после диагностирования (по материалам «Glossary of Terms used in Health for All Series», Всемирная организация здравоохранения, Женева, 1984).
Первичное предотвращение заболевания направлено на предотвращение первоначального возникновения нарушения, в то время как вторичное и третичное предотвращение заболевания направлены на подавление или замедление развития заболевания и уменьшение частоты появления рецидивов, а также на предотвращение формирования хронического характера заболевания.
Когнитивная дисфункция относится к потере интеллектуальных функций, таких как мышление, запоминание и рассуждение, достаточно значимых, чтобы повлиять на повседневную деятельность индивида. Она может встречаться у пожилых и страдающих слабоумием пациентов, особенно у страдающих болезнью Альцгеймера. Ухудшение когнитивной функции может влиять на способность мыслить, сосредотачиваться, формулировать мысли, рассуждать и запоминать.
Психоневрологические заболевания или нарушения относятся к органическим нарушениям мозга или неврологическим нарушениям, приводящим к психиатрическим симптомам. Симптомы включают в себя тревожные расстройства и депрессивные состояния, обычно встречающиеся у пожилых пациентов.
В обзоре Gryan, J. F. and Dinan, T. G., Nature Review/Neuroscience; 13; 701-712; (2012) описывается, как изучение влияния пробиотических бактерий или антибиотиков на стерильных животных и животных, подвергнувшихся патогенным бактериальным инфекциям, наводит на мысль о роли микрофлоры кишечника в регуляции тревоги, настроения, когнитивных функций и боли.
Пробиотическими бактериями называются живые бактерии, которые могут приносить пользу здоровью хозяина при приеме их внутрь.
Bravo, J. A. et al. продемонстрировали антидепрессивные и анксиолитические свойства пробиотическоого штамма Lactobacillus rhamnosus при введении их внутрь мышей (см. Proc. Nath. Acad. Sci. USA; 108; 16050-16055; (2011)).
Burnet, P. W. J. предположил, что будущие исследования с использованием селективных противомикробных препаратов и пребиотиков, увеличивающих штаммы родственных кишечнику лактобактерий и бифидобактерий, могут показать их влияние на поведение и нейрофизиологические реакции животных и человека (Proc. Natl. Acad. Sci. USA; E175; (2012)).
Пребиотиками называются неперевариваемые компоненты пищи, которые избирательно стимулируют рост и/или активность одного или ограниченного количества видов бактерий в прямой кишке, что приводит к улучшению состояния здоровья хозяина. Галактоолигосахариды (GOS) и фруктоолигосахариды (FOS) являются примерами пребиотиков, которые устойчивы к пищеварительным ферментам желудочно-кишечного тракта млекопитающих, но расщепляются определенными видами бактерий в прямой кишке.
Было обнаружено, что пероральное введение млекопитающему, например, человеку, композиции, содержащей смесь галактоолигосахаридов, может привести к прямому взаимодействию с нейронами, расположенными в желудочно-кишечном тракте, что, в свою очередь, может привести к неожиданному увеличению уровня рецепторов N-метил-D-аспартата (рецепторов NMDA). В частности, было найдено повышение уровня протеинов NMDA-NRI и/или мРНК как в коре головного мозга, так и в гиппокампе, а также уровня протеинов NMDA-NR2A в гиппокампе. Это позволило предположить, что композиции, содержащие такого рода смеси, могут быть полезными для предотвращения или лечения когнитивной дисфункции и/или эмоциональных расстройств, возникающих при психоневрологических заболеваниях или нарушениях, или при старении.
Также было обнаружено, что пероральное введение композиции галактоолигосахаридов (GOS) снижает секрецию кортизола. Так как кортизол выделяется в ответ на стресс, то это говорит о том, что данная композиция может снизить избыточную секрецию кортизола, являющуюся симптомом тревожных расстройств и депрессивных состояний.
Смесь галактоолигосахаридов включает дисахариды Gal (β1-3)-Glc; Gal (β1-3)-Gal; Gal (β1-6)-Gal; Gal (α1-6)-Gal; трисахариды Gal (β1-6)-Gal (β1-4)-Glc; Gal (β1-3)-Gal (β1-4)-Glc; тетрасахарид Gal (β1-6)-Gal (β1-6)-Gal (β1-4)-Glc и пентасахарид Gal (β1-6)-Gal (β1-6)-Gal (β1-6)-Gal (β1-4)-Glc.
Эта смесь галактоолигосахаридов раскрыта в ЕР 1644482, в котором описывается новый штамм Bifidobacterium bifidum, продуцирующий фермент галактозидазу, превращающий лактозу в данную новую смесь галактоолигосахаридов. Как было показано, эта новая смесь в кишечнике обладает пребиотическими и противовоспалительными свойствами.
Эта смесь галактоолигосахаридов коммерциализирована на рынке под названием Bimuno (зарегистрированная торговая марка) и доступна от компании Clasado Ltd (Милтон Кейнс, Великобритания).
Согласно одному аспекту, настоящее изобретение относится к композиции, содержащей определенную выше смесь галактоолигосахаридов, для применения в профилактике или лечении когнитивной дисфункции и/или эмоциональных расстройств, проявляющихся при психоневрологических заболеваниях или нарушениях, а также в процессе старения.
В соответствии со вторым аспектом, настоящее изобретение относится к применению определенной выше смеси галактоолигосахаридов в получении лекарственного средства для профилактики или лечения когнитивной дисфункции и/или эмоциональных расстройств, проявляющихся при психоневрологических заболеваниях или нарушениях, а также в процессе старения.
Когнитивной дисфункцией может быть снижение или нарушение когнитивных способностей в результате старения, деменции или шизофрении. Психоневрологической болезнью могут быть депрессивные или тревожные расстройства. Тревожные расстройства охватывают различные формы обычных психиатрических нарушений, характеризующихся руминацией, беспокойством, напряжением, опасением и страхом неопределенности будущего, основанных или на реальных, или на вымышленных событиях, которые могут повлиять и на физическое, и на психологическое здоровье.
Согласно еще одному аспекту, настоящее изобретение относится к способу предотвращения или лечения когнитивной дисфункции и/или эмоциональных расстройств, проявляющихся при психоневрологических заболеваниях или в процессе старения, включающий введение индивидууму, например человеку, терапевтически эффективного количества композиции, содержащей определенную выше смесь галактоолигосахаридов. Терапевтически эффективное количество композиции галактоолигосахаридов предпочтительно вводить ежедневно в виде единственной дозы или, альтернативно, в виде двух отдельных доз с интервалом в несколько часов, например от 4 до 12 часов, предпочтительно от 6 до 10 часов, наиболее предпочтительно 8 часов между дозами.
Предпочтительно, смесь или композиция галактоолигосахаридов вводят перорально согласно ежедневной схеме приема в виде лиофилизированного порошка, таблетки, капсулы, жидкой лекарственной формы, такой как сироп, или мягкой пастилки.
Продукт, известный под названием Bimuno, содержит по меньшей мере 49% сухого вещества в виде смеси галактоолигосахаридов. Остальная часть композиции может содержать неактивные компоненты, такие как глюкоза, галактоза, лактоза, аравийская камедь, мальтодекстрин и лимонная кислота.
Порошкообразная композиция предпочтительно содержит от 1,35 г до 9,6 г галактоолигосахарида в порошке массой от 1,65 г до 20 г, предпочтительно от 1,96 г до 4,9 г галактоолигосахарида в порошке массой от 2,5 г до 10 г, наиболее предпочтительно 2,7 г галактоолигосахарида в композиции массой от 3,0 г до 5,5 г. Эта композиция также может быть добавлена в напиток, предпочтительно горячий напиток, или может быть насыпана на пищевой продукт, например, на сухой завтрак. Композиция также может быть добавлена в качестве ингредиента в различные пищевые продукты и напитки, такие как фруктовые соки, фруктовые напитки, вода, кофе, йогурт, крупы, хлеб, торты, печенье и тому подобное.
Альтернативно, галактоолигосахариды могут быть представлены в виде сиропа или пастилы (обезвоженного сиропа), в которых неактивные компоненты могут содержать глюкозу, галактозу, лактозу и лимонную кислоту. Суточная доза сиропа может содержать от 1,35 г до 9,6 г галактоолигосахаридной смеси в сиропообразной композиции массой от 2,1 г до 25,29 г, предпочтительно от 4,9 г до 1,96 г галактоолигосахаридов в массе сиропа от 3,0 г до 12,9 г, наиболее предпочтительно от 2,7 г до 2,75 г галактоолигосахаридов в массе сиропа от 4,1 г до 7,25 г.
Композиция согласно настоящему изобретению обладает анксиолитическими свойствами, уменьшает активность гипоталамо-гипофизарной системы (секрецию гормона стресса), а также уменьшает воспалительные реакции в головном мозге. Таким образом, галактоолигосахариды (GOS) Bimuno (торговая марка) могут успешно применяться для лечения или профилактики тревожных расстройств (например, беспокойство, бессонница), депрессивных состояний, воспаления головного мозга, вызванного бактериальным менингитом, энцефалита, вызванного вирусом простого герпеса (Herpes Simplex), или расстройств, наблюдающихся при болезни Альцгеймера. Галактоолигосахариды (GOS) Bimuno (торговая марка) могут также ослаблять нарушения когнитивных функций при старении, деменции и шизофрении. Кроме того, композиция галактоолигосахаридов (GOS) может снижать вредное влияние материнской инфекции на развитие головного мозга плода.
Далее настоящее изобретение будет описано посредством приведенных ниже примеров и чертежей.
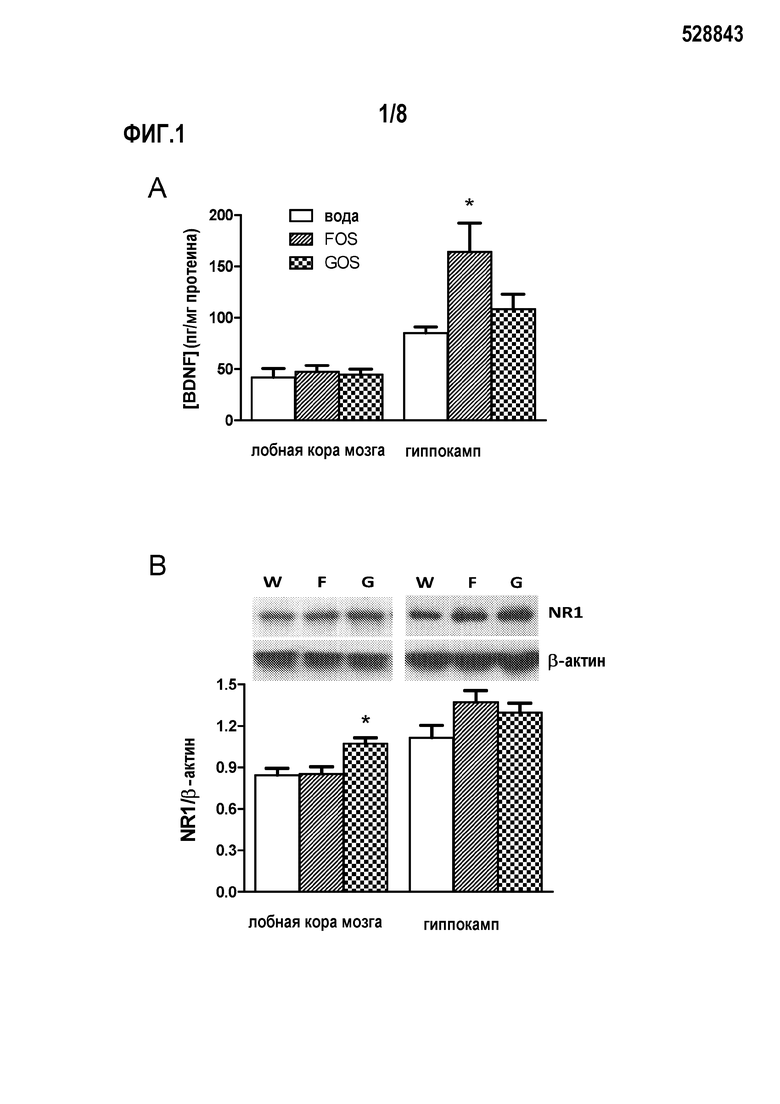
На фигуре 1А показано влияние галактоолигосахаридов (GOS) и фруктоолигосахаридов (FOS) на уровень протеина BDNF в экстрактах лобной коры мозга и гиппокампа крыс.
Фигура 1В показывает влияние галактоолигосахаридов (GOS) и фруктоолигосахаридов (FOS) на уровень субъединиц NRI в экстрактах лобной коры мозга и гиппокампа крыс. Изображены результаты Вестерн-блоттинга протеиновых экстрактов на NRI и β-актин с использованием иммунореактивности.
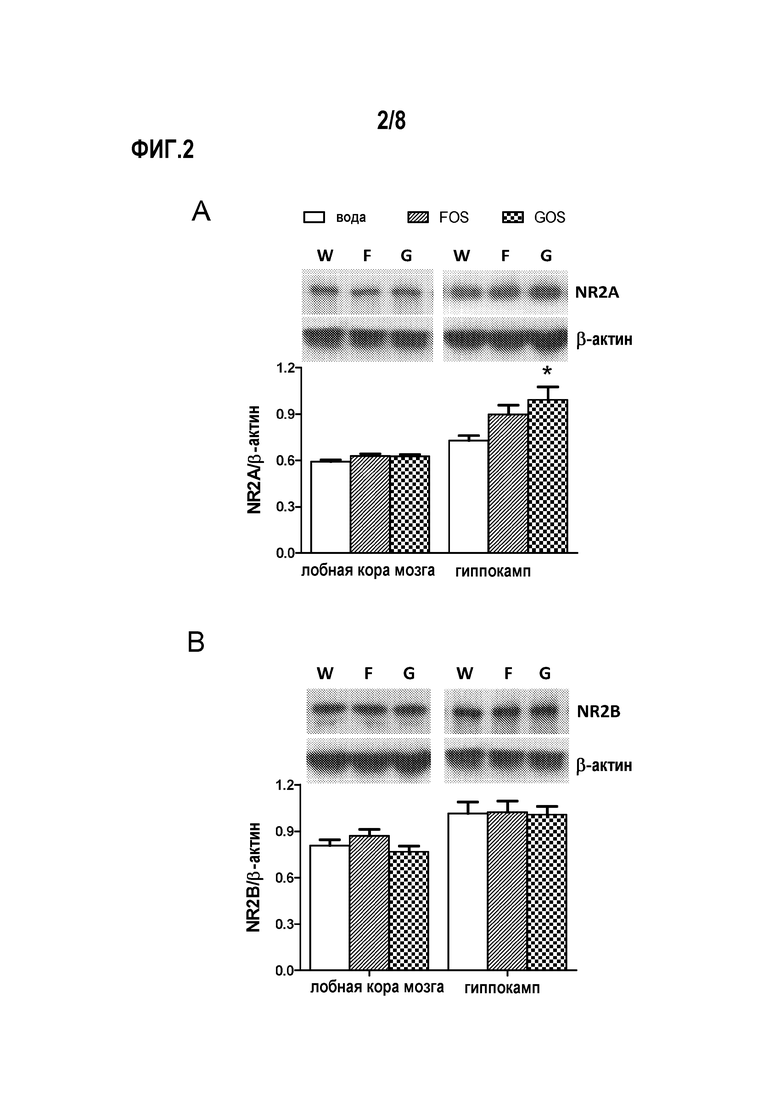
На фигуре 2А представлено влияние галактоолигосахаридов (GOS) и фруктоолигосахаридов (FOS) на уровень субъединиц NR2A в экстрактах лобной коры мозга и гиппокампа крыс. Изображены результаты Вестерн-блоттинга протеиновых экстрактов на NR2A и β-актин с использованием иммунореактивности.
Фигура 2В показывает влияние галактоолигосахаридов (GOS) и фруктоолигосахаридов (FOS) на уровень субъединиц NR2B в экстрактах лобной коры мозга и гиппокампа крыс. Изображены результаты Вестерн-блоттинга протеиновых экстрактов на NR2B и β-актин с использованием иммунореактивности.
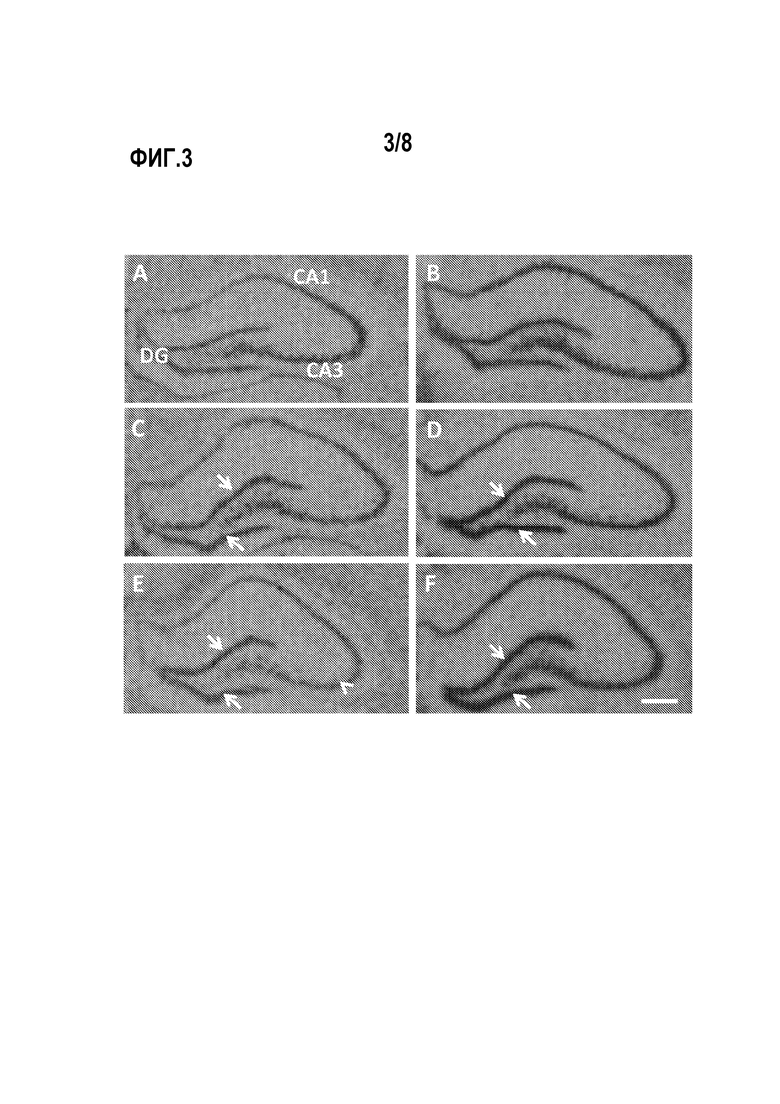
На фигурах 3A-3F представлены авторадиограммы субъединиц BDNF (А, С, Е) и субъединиц NRI (В, D, F) с использованием экспрессии мРНК в гиппокампе крыс после перорального введения воды (А, В), фруктоолигосахаридов (С, D) или галактоолигосахаридов (Е, F). Стрелками отмечена повышенная экспрессия, а клином отмечена пониженная экспрессия. DG = зубчатая извилина, СА1 и СА3 = подобласти Cornu Ammons гиппокампа. Масштабная метка = 200 мкМ (микрометров).
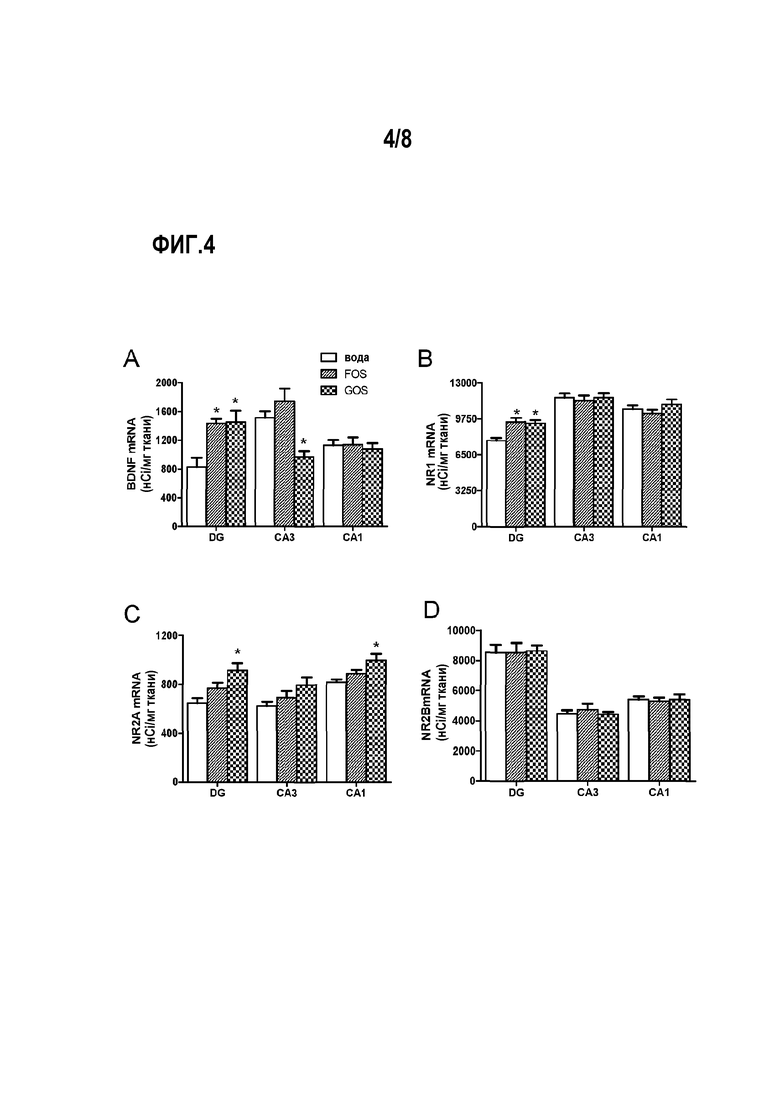
Фигуры 4A-4D показывают влияние галактоолигосахаридов (GOS) и фруктоолигосахаридов (FOS) на уровень BDNF, NRI, NR2A и NR2B мРНК в зубчатой извилине (DG) и СА1 и СА3 (Cornu Ammons) подобласти гиппокампа.
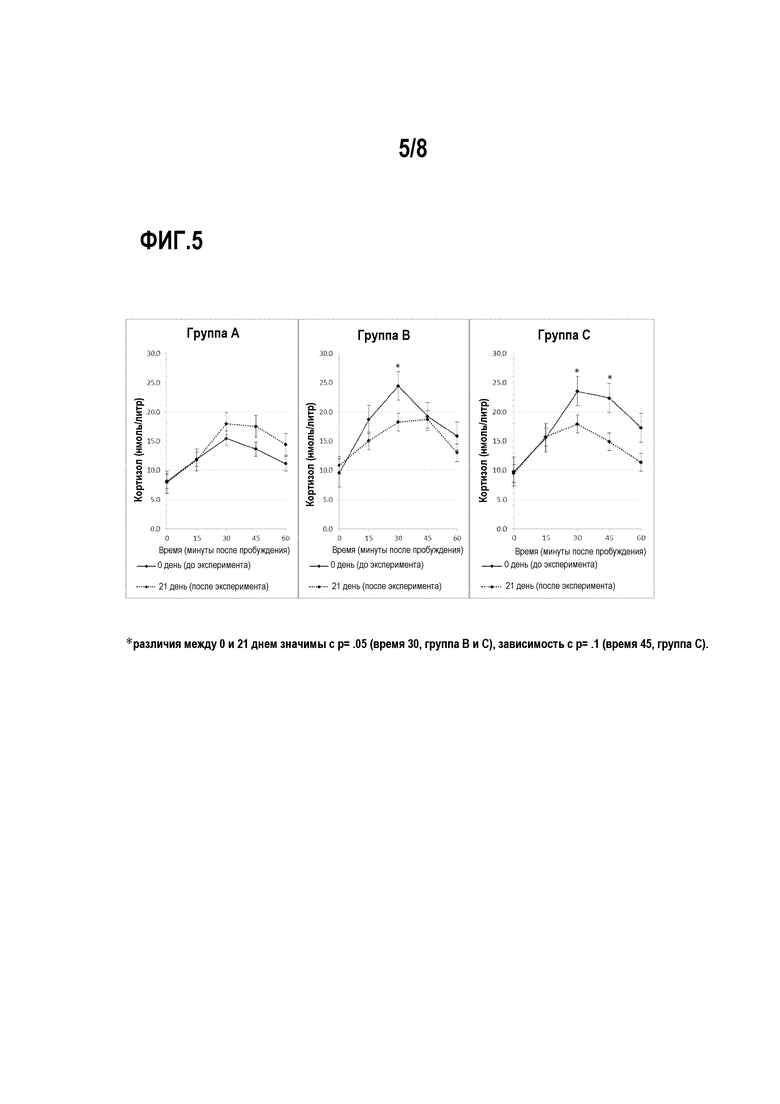
На фигуре 5 представлено влияние приема внутрь фруктоолигосахаридов (группа А), галактоолигосахаридов (группа C) и плацебо (группа B) на секрецию кортизола у здоровых взрослых людей.
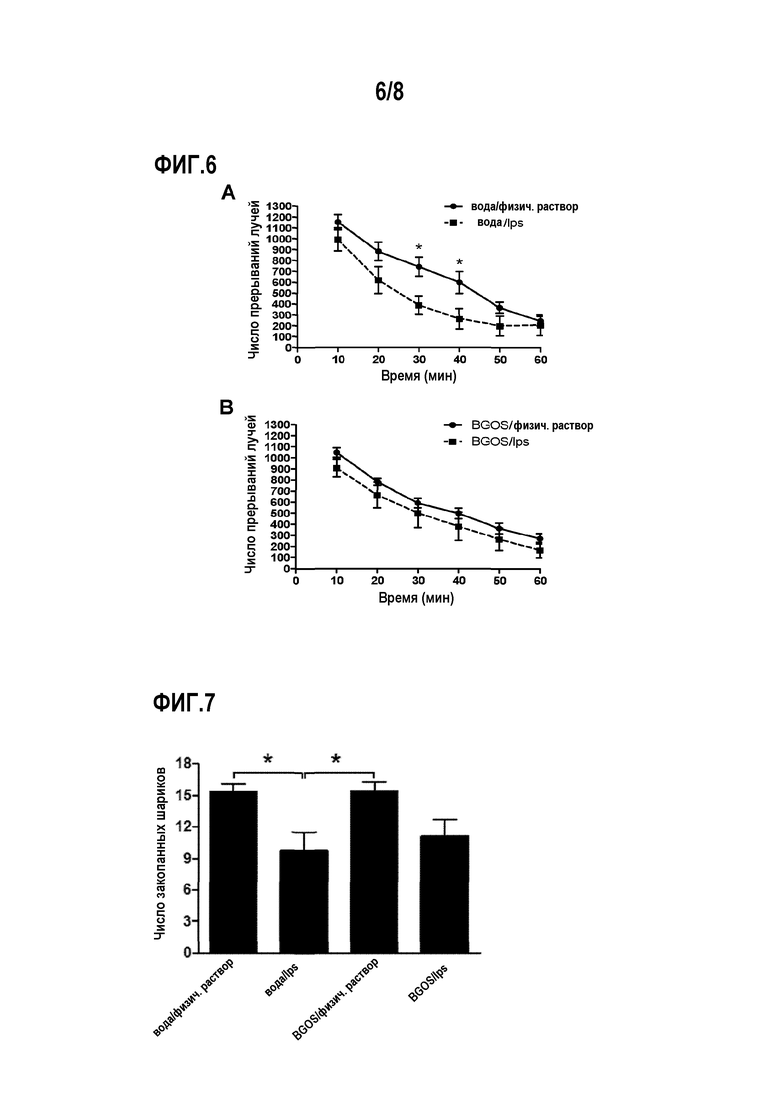
Фигура 6А показывает влияние на двигательную активность мышей, которых поили водой, последующего введения липополисахарида (LPS).
Фигура 6В показывает, что введение галактоолигосахаридов устраняет воздействие липополисахарида на двигательную активность.
На фигуре 7 представлено влияние липополисахаридов на естественное копательное поведение мышей, полученное в соответствии с результатами теста «закапывание шариков».
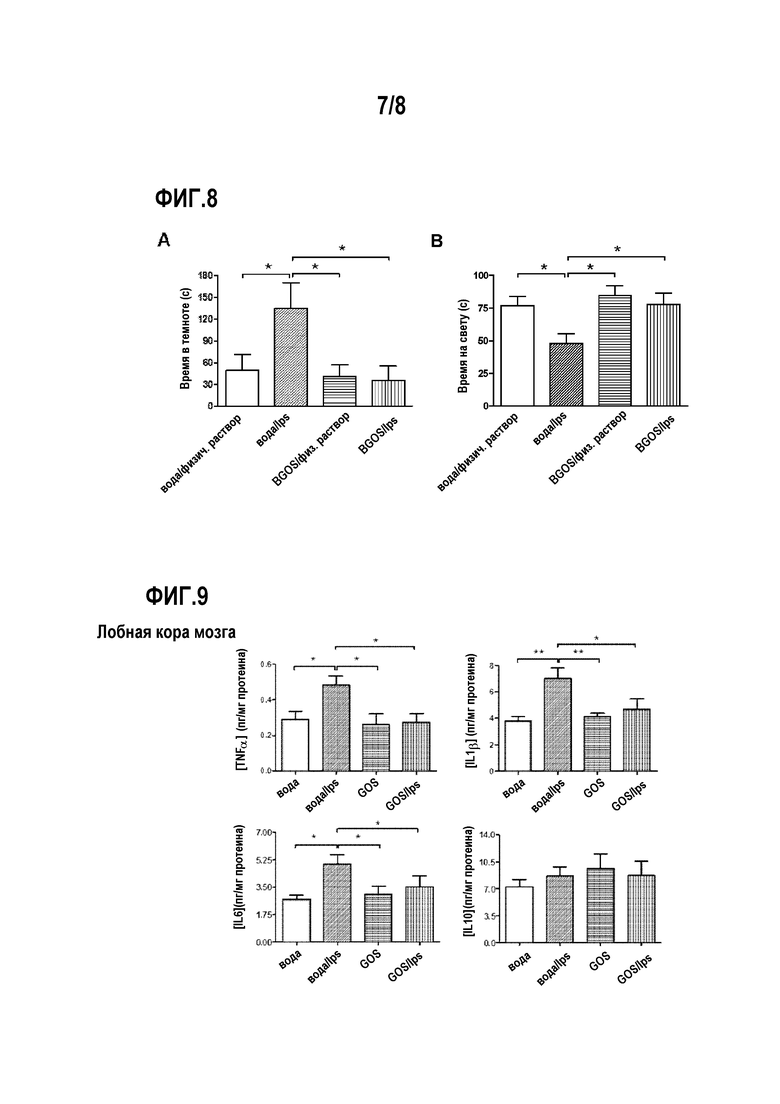
Фигура 8 показывает влияние введения липополисахаридов на тревожное поведение у мышей. Задержка (А) = время, необходимое для перемещения из темных (менее стрессовых) в освещенные (более стрессовые) области. Большая задержка = более стрессовое/менее исследовательское поведение. Время на свету (B) = время, проведенное в освещенной области. Большее время = меньшая тревожность.
На фигуре 9 представлено влияние липополисахаридов на уровни цитокинов в лобной коре мозга мышей спустя 24 ч после их введения.
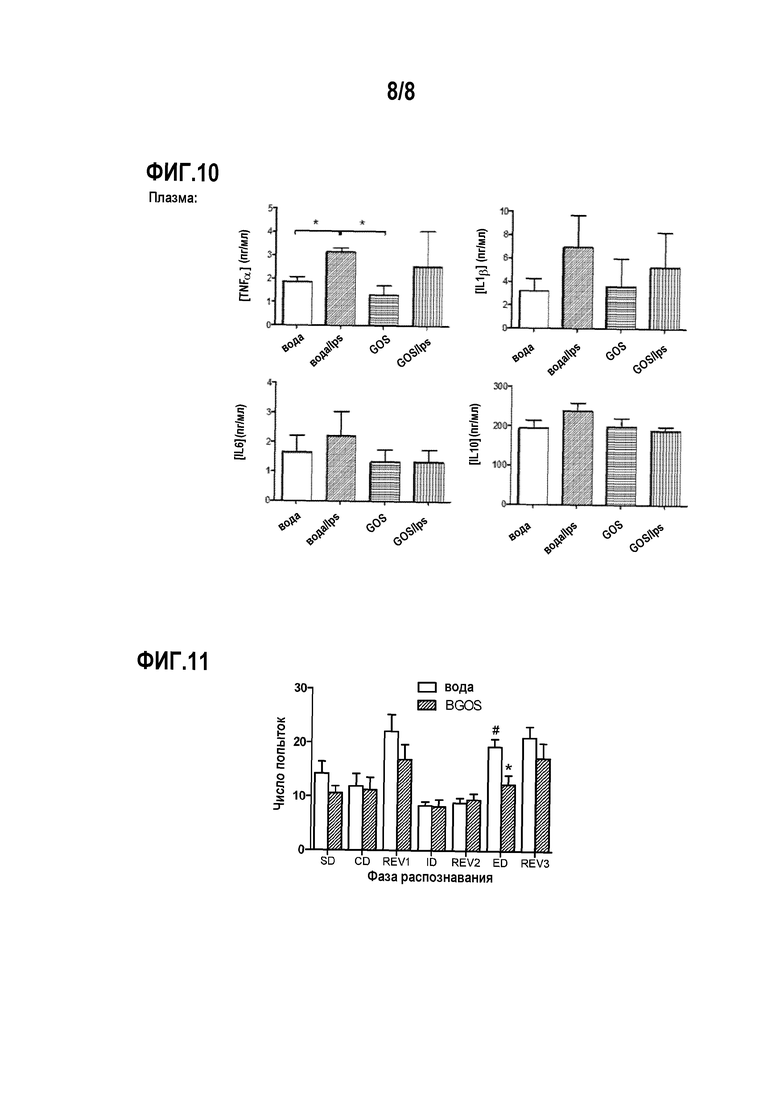
На фигуре 10 показано влияние липополисахаридов на уровни цитокинов в плазме мышей через 24 ч после их введения.
На фигуре 11 показано влияние BGOS на познавательную способность у здоровых крыс.
Пример 1
Лиофилизированная порошкообразная композиция, упакованная в индивидуальную упаковку, и содержащая в 5,5 г готового препарата:
Пример 2
Сиропообразная композиция, содержащая в 7,25 г готового препарата:
Пример 3
Изучение in vivo влияния добавления в пищу пребиотиков на нейротрофический фактор головного мозга (BDNF) и рецепторные субъединицы N-метил-D-аспартата (NMDA).
МАТЕРИАЛЫ И МЕТОДЫ
Введение пребиотика
Все эксперименты с крысами были выполнены в соответствии с инструкциями UK Home Office guide, Великобритания, и в рамках одобренных лицензий. Самцам крыс линии Sprague Dawley (225-250 г) ежедневно перорально вводили через зонд либо воду, либо фруктоолигосахарид (4 г/кг), либо галактоолигосахарид [Bimuno] (4 г/кг), в течение 5 недель (n=8/группа). Такой режим дозирования был основан на результатах предыдущих исследований (Anthony и др; Food Chem. Toxicol.; 44 (6); 819-826 (2006)) и предварительные результаты показывают, что данные оптимальные дозировки пребиотиков обеспечивает максимальное развитее микрофлоры (не показано). Все животные были умерщвлены, кровь туловища собрана, а мозг их удален спустя двадцать четыре часа после последнего принудительного кормления. Для получения плазмы кровь центрифугировали, из половины извлеченного мозга вырезали лобную кору и гиппокамп. Целые мозги и вырезанные области подвергались мгновенной заморозке в изопентане с сухим льдом и хранились в плазме при -80°С до их использования.
Анализ BDNF
Ткани коры мозга и гиппокампа из всех групп гомогенизировали в RIPA (радиоиммунопреципитация) буфере (1 к 10 (мас./объем), Sigma Aldrich, Великобритания), содержащем ингибиторы протеазы ("Complete-Mini", Roche). Концентрацию белка определяли с использованием реагента Брэдфорда (Sigma, UK). Перед выполнением анализа с использованием коммерчески доступного набора ELISA BDNF (иммуноанализаторная система BDNF Emax, Promega, Великобритания), образцы белковых экстрактов разбавляли деионизированной водой 1 к 5 (об./об.).
Вестерн-блоттинг (Western blotting)
Одинаковые концентрации белковых экстрактов коры мозга, гиппокампа или мозжечка (20 мкг) от групп, получавших пребиотики, и контрольной группы, смешивали с загруженным буфером (50 мМ 1,4-дитиотреитола и 0,025% бромфенольного синего) и разделяли с маркером молекулярного веса (GE Healthcare, Бакингемшир, Великобритания) методом электрофореза с использованием готового геля 7,5% SDS/полиакриламид (Biorad, Великобритания), пятна переносили на поливинилиденфторидные (PVDF) мембраны (Immobilon-P, Millipore, Уотфорд, Великобритания).
Мембраны блокировали 5% (мас./объем) раствором обезжиренного молока в PBS (фосфатно-солевом буфере), содержащем 0,1% Tween (PBST) в течение 45 мин, а затем инкубировали в течение 1 ч при комнатной температуре в инкубационном буфере (PBST и 2% (мас./объем) молока), содержащем первичные антитела (разбавленные 1 к 1000) специфичные к одной из трех субъединиц NMDA: NR1 (АВ9864, Millipore, Великобритания), NR2A (АВ1555, Millipore, Великобритания) и NR2B (АВ15362, Millipore, Великобритания) и β-актину (Sigma-Aldrich, Великобритания, разбавляли 1 к 50000). Далее мембраны промывали три раза в течение десяти минут буфером PBST и инкубировали в течение 30 минут в блокирующем буфере, содержащем связанные с HRP (пероксидазой хрена) вторичные антитела. Иммунореактивные полосы визуализировали хемилюминесценценцией с использованием набора ECL-Plus (GE Healthcare, Бакингемшир, Великобритания), и мембраны соединяли с рентгеновской пленкой (пленки Kodak BioMax АР). Все антитела дают одну полосу ожидаемой молекулярной массы. Оптические плотности (ОП) полос измеряли с помощью Alphalmager 3400, и результаты представляли в виде отношения оптических плотностей фосфорилированная/общая субъединица NMDAR или общая субъединица NMDAR/β-актин.
Гибридизационная гистохимия in situ (ISHH)
Замороженные полушарии головного мозга крыс подвергали коронарному рассечению (14 мкм) в криостате, помещали на предметное стекло Superfrost-plus (Fisher Scientific) и хранили при -80°С. Содержащие лобную кору мозга срезы предварительно обрабатывали, как было описано ранее (Burnet и др.; Mol. Cell. Neurosci.; 46; 167-175; (2011)).
Коммерчески синтезированные (MWG, Великобритания) олигодезоксирибонуклеотиды, комплементарные мишеням: BDNF (нуклеотиды 883-927, NM001270630.1), NR1 (нуклеотиды 746-780, NM008169.1), NR2A (нуклеотиды 1642-1676, NM008170.2) или NR2B (нуклеотиды 1758-1792, NM010350.2) использовались в установленном методе ISHH (Eastwood и др.; J. Psychopharmacol.; 21; 635-644; (2007)). По концевому положению 3'-олигодезоксирибонуклеотидные пробы были помечены [35S]-dATP (дАТФ) с использованием терминальной дезоксинуклеотидилтрансферазы (Promega, Великобритания). Пробы разбавляли гибридизационным буфером, переносили при помощи пипетки на срезы тканей (1×106 cpm/срез), помещали под покровное стекло и затем инкубировали в течение >16 ч при 34°С, закрывали кюветой из оргстекла, выложенной фильтровальной бумагой, смоченной смесью 4х SSC (солевой раствор цитрата натрия)/50% формамид.
Пост-гибридизационные промывки включали: промывание при комнатной температуре 2х SSC для удаления покровных пленок; 0,5х SSC, 20 мин (х3) при 55°С; 0,5х SSC 30 мин (х2) при комнатной температуре. Предметные стекла промывали водой, сушили и соединяли с рентгеновской пленкой (Kodak, Биомакс МС) на 7-28 дней с микрошкалой 14С. Средние плотности серого по всей глубине лобной коры серого вещества измеряли для каждой из мРНК с использованием компьютерного анализа изображения, и переводили в нCi/мг ткани с использованием метки микрошкалы 14C.
Анализ ВЭЖХ
Небольшие фрагменты тканей коры мозга (50 мг) по отдельности гомогенизировали в охлажденном льдом метаноле (1:10 мас./объем) и микроцентрифугировали при 13200 оборотах в минуту в течение 10 минут при 4°С. Надосадочную жидкость (10 микролитров) вводили в жидкостной хроматограф Hewlett-Packard 1100 (Agilent Technologies, Palo Alto, Калифорния) и подвергали проточной химической модификации, предшествующей попаданию в колонку, как было описано ранее (Grant и др.; J. Chromatogr. В Analit. Technol. Biomed. Life Sci.; 844; 278-282 (2006)). Вкратце, пробы (10 микролитров) подвергали взаимодействию с равным объемом модифицирующего реагента [o-фталевый диальдегид (2 мг) и Вос-L-цистеин (2 мг) в 0,2 мл метанола и 0,8 мл 0,4М натрий-боратного буфера (рН=9)], в течение 5 мин перед разделением на колонке. Разделение осуществляли с использованием термостатируемой при 30°С колонки Agilent Zorbax Eclipse, XDB-C18 (4,6×150 мм, 5 микрометров) и методики разделения, аналогичной описанной ранее (Morikawa и др.; J. Chromatogr. B Biomed. Sci. Appl.; 757; 119-125 (2001)). Подвижные фазы, состоящие из ацетонитрила (фаза А) и 100 мМ натрий-ацетатного буфера с рН=6 (фаза В), прокачивали через колонку со скоростью 1,4 мл/мин. Использовалась следующая градиентная система (мин/% фазы B): 0/91, 35/84, 65/84. Детектирование модифицированных аминокислот осуществлялось методом флуоресценции (испускание: 443 нм; поглощение: 344 нм). Калибровочные зависимости для D- и L-аминокислот (Sigma Aldrich, Великобритания) были построены по восьми точкам с использованием аутентичных стандартов (от 0,5 до 1000 пмоль) и в каждом случае, как было найдено, оказались линейными с коэффициентами корреляции >0,995.
Анализ данных
Все данные выражены в виде среднего значения ±стандартная погрешность среднего значения (SEM). Статистические сравнения между группами проводили односторонним методом ANOVA (дисперсионный анализ) с последующим post hoc анализом (Tukey HSD).
РЕЗУЛЬТАТЫ
Бифидобактерии в фекальных пеллетах крыс, которым вводили пробиотик, и в контрольной группе
Число бифидобактерий в фекальных пеллетах крыс (выраженное в loglO/г), которым вводили с пищей фруктоолигосахариды, было значительно больше, чем в контрольной группе (9,498±0,025 против 9,354±0,055, р<0,05), в то время как относительное содержание бифидобактерий в пеллетах крыс, которым вводили с пищей галактоолигосахариды, было значительно больше по сравнению и с контрольной группой (9,624±0,05 против 9,354±0,055, р<0,01), и с крысами, которым вводили с пищей фруктоолигосахариды (9,624±0,05 против 9,498±0,025, р<0,05).
Влияние пребиотиков на BDNF и NRL в лобной коре мозга крыс и гиппокампа
Уровни BDNF протеинов в экстрактах лобной коры мозга не различались между группами (фиг. 1А). Однако уровень BDNF в экстрактах гиппокампа крыс, которым вводили фруктоолигосахариды, значительно выше, чем у контрольной группы и у животных, которым вводили с пищей галактоолигосахариды. Результаты Вестерн-блоттинга показывают, что у крыс, которым вводили с пищей галактоолигосахариды, содержались значительно более высокие уровни иммунореактивности NR1 в лобной коре мозга по сравнению с контрольной группой и животными, которым вводили фруктоолигосахариды (фиг. 1B). Анализ гиппокампа, однако, показывает, что у крыс, которым вводили фруктоолигосахариды, содержание субъединиц NR1 значительно выше, чем в других группах, хотя тенденция к увеличению (р=0,055) наблюдалась и у животных, которым вводили галактоолигосахариды, по сравнению с контрольной группой.
Влияние пребиотиков на субъединицы NR2A и NR2B в лобной коре мозга крыс и гиппокампа
В соответствии с результатами Вестерн-блоттинга, в экстрактах гиппокампа, но не коры головного мозга, животных, которым вводили фруктоолигосахариды, обнаруживается значительно больше иммунореактивности NR2A по сравнению с двумя другими группами (фиг. 2). На уровень NR2B в лобной коре мозга и гиппокампе введение пребиотиков с пищей не влияет.
Влияние пребиотиков на субъединицы BDNF и NR мРНК в гиппокампе
Введение пребиотика увеличивает относительное содержание BDNF (фиг. 3А, С, Е и фиг. 4А) и NR1 (фиг. 3В, D, F) мРНК в зубчатой извилине гиппокампа по сравнению с контрольной группой. Также наблюдается снижение BDNF мРНК в подобласти CA3 крыс, которым вводили с пищей галактоолигосахариды (фиг. 3C).
Денситометрия подтверждает значительно большую экспрессию BDNF и NRL в зубчатой извилине крыс, которым вводили пребиотики, (фиг. 4А, В). Введение галактоолигосахаридов приводит к повышению уровня NR2A (фиг. 4С), но не NR2B (фиг. 4D), мРНК в зубчатой извилине и подобласти СА1 относительно контрольной группы и животных, которым вводили с пищей фруктоолигосахариды.
Концентрации аминокислот в фекалиях, плазме и головном мозге после введения пребиотиков
В данном исследовании было проверено, повышает ли увеличение микрофлоры кишечника концентрацию D-аланина внутри организма за счет увеличения содержания этой D-аминокислоты в кишечнике и кровотоке. В фекальных пеллетах крыс, которым вводили с пищей галактоолигосахариды, концентрация свободного D-аланина была значительно выше, чем в контрольной группе и у животных, которым вводили фруктоолигосахариды, при этом введение фруктоолигосахаридов приводит к промежуточным уровням этой D-аминокислоты (таблица 1). Оба пребиотика или только галактоолигосахарид повышают содержание и других аминокислот, включая D-серин и глутамат. Уровни D-аланина в плазме были значительно выше у крыс, которым вводили с пищей галактоолигосахариды, по сравнению с контрольными животными (таблица 1), также небольшое, хотя и не значимое (р=0,086), увеличение уровня наблюдалось у крыс, которым вводили фруктоолигосахариды. Введение пребиотика не изменяет концентрации других аминокислот, находящихся в кровообращении (таблица 1). У крыс, которым вводили с пищей галактоолигосахариды, были значительно более высокие концентрации D-серина в лобной коре мозга по сравнению с контрольной группой (таблица 2), хотя уровни всех других аминокислот, как в коре мозга, так и гиппокампе, после введения в пищу пребиотика не изменились. Существовала общая значимая корреляция между уровнями D-серина и протеина NR1 в коре мозга (коэффициент Пирсона r=0,684, р=0,01). Индивидуальный анализ групп показал, что эта корреляция была единственно значимой после введения в пищу галактоолигосахарида (GOS: r=0,96, р=0,04; FOS: r=0,68, р=0,32; вода: r=0,01, р=0,989).
Концентрации аминокислот в плазме и фекальных пеллетах крыс после повторного перорального введения воды или пребиотика. *р<0,05 по сравнению с водой; +р<0,05 по сравнению с FOS
Концентрации аминокислот в коре мозга и гиппокампе крыс после повторного перорального введения воды или пребиотика. *р<0,05 по сравнению с водой
ОБСУЖДЕНИЕ
Мы отметили: 1) более высокие уровни BDNF в гиппокампе крыс, которым вводили с пищей фруктоолигосахариды, по сравнению с крысами, которым вводили с пищей галактоолигосахариды, и контрольными животными, хотя уровень BDNF мРНК был увеличен в зубчатой извилине и крыс, которым вводили с пищей галактоолигосахариды, и крыс, которым вводили с пищей фруктоолигосахариды 2) увеличение содержания протеина NR1 в лобной коре мозга крыс, которым вводили с пищей галактоолигосахариды, и в гиппокампе животных, которым вводили с пищей пребиотики; 3) более высокие уровни протеина NR2A и кодирующей мРНК в гиппокампе крыс, которым вводили с пищей галактоолигосахариды, по сравнению с другими группами. Исходя из приведенной выше общей картины эффекта ясно, что влияние галактоолигосахаридов не основано на их пребиотических свойствах, а, скорее всего, связано с химической структурой сахаров в смеси галактоолигосахаридов.
Увеличение уровня BDNF в гиппокампе крыс под действием пребиотиков
Повышенная экспрессия BDNF и кодируемого белка у крыс, которым вводили с пищей фруктоолигосахариды, согласуется с влиянием пробиотических бифидобактерий (Bercik др.; Neurogastroenterol Motil.; 23; 1132-1139 (2011b); O'Sullivan и др.; Benef. Microbes; 2(3); 199-207 (2011)) и селективным разрастанием таких бактерий под действием противомикробных препаратов (Bercik др.; Gastroenterology; 141; 599-609 (2011a)). Таким образом, введение фруктоолигосахаридов могло усилить колонизацию B.breve, B.longum и/или аналогичными психотропными штаммами, в пределах общего увеличения относительного содержания бифидобактерий, по сравнению с крысами, которым вводили с пищей галактоолигосахариды (см. результаты). На основании данных наблюдений удивительно, что галактоолигосахариды не изменили уровни протеина BDNF в гиппокампе, тем более на величину, большую, чем фруктоолигосахариды. Мы показали, что введение с пищей галактоолигосахаридов привело к рецепторным изменениям BDNF мРНК в зубчатой извилине и в области СА3 гиппокампа. Увеличение экспрессии гена BDNF в зубчатой извилине было связано с антидепрессивным действием (Kerman, I. A.; Am. J. Psychiatry; 169; 1137-1140 (2012)). Следовательно, аналогичное повышение BDNF мРНК после введения галактоолигосахаридов соответствует потенциальному антидепрессивному/анксиолитическому свойству микрофлоры кишечника (Bercik и др. 2011a).
Увеличение уровня субъединиц NR1 в коре мозга крыс при введении галактоолигосахаридов
Увеличение белка NR1 у крыс, которым вводили с пищей галактоолигосахариды, по сравнению с контрольными животными и животными, которым вводили фруктоолигосахариды, совпадает или аналогично эффекту антидепрессанта флуоксетина, который является ингибитором обратного захвата серотонина. Последние клинические исследования показывают, что блокирование рецепторов NMDAR приводит к антидепрессивному эффекту (Autry и др.; Nature; 475; 91-95; (2011)). На основании этих данных понятно, что для повышения уровня субъединиц NR1 в коре мозга требуется увеличение в несколько раз количества бифидобактерий, происходящее без изменений уровней субъединиц NR2A и NR2B.
В целом, как оказалось, введение крысам галактоолигосахаридов оказывает более сильное влияние на субъединицы NMDA, чем введение фруктоолигосахаридов. То есть, галактоолигосахариды повышают уровень протеина NR1 и/или соответствующей мРНК и в коре мозга, и в гиппокампе, а NR2A в гиппокампе, в то время как фруктоолигосахариды повышают только уровень NR1 в гиппокампе.
Пример 4
Исследования с участием людей
Сорок пять здоровых добровольцев в течение 3 недель получали или один из двух пребиотиков (фруктоолигосахариды [FOS] (группа А) или галактоолигосахариды [GOS] (Группа C)), или плацебо (группа B) (мальтодекстрин). Образцы слюны на утренний кортизол отбирали при пробуждении до и после курса исследования. В последний день участники проходили серию компьютеризированных тестов для оценки обработки ими эмоционально окрашенной информации (the Emotional Test Battery, ETB; Harmer и др.; Am. J. Psychiatry; 161; 1256-1263; (2004)).
Уровни утреннего кортизола в слюне существенно не отличались между группами в базовой линии, но были значительно ниже после курса галактоолигосахаридов по сравнению с плацебо и фруктоолигосахаридами (существенное взаимодействия между группой лечения/днем отбора пробы/временной точкой пробы при повторных измерениях ANOVA [F(8,164)=1,20, р= ,05]). Анализ поведенческих данных показал снижение настороженности внимания к негативной информации по отношению к позитивной информации после курса галактоолигосахаридов по сравнению с курсом плацебо (группа/эмоции/маскирующие состояния, [F(2,41)=3,14, р=0,05). Группа, получавшая фруктоолигосахариды, не выполнила тест «проба с точкой» отлично от группы, получавшей плацебо. Не было выявлено существенных эффектов пребиотиков и на остальные тесты ETB.
Наше исследование показывает, что употребление галактоолигосахаридов снижает секрецию кортизола у здоровых добровольцев. Кроме того, как показало определение настороженности внимания, галактоолигосахариды изменяют обработку позитивной информации относительно негативной информации что, как полагают, играет ключевую роль в тревоге и ее модуляции транквилизаторами (например, Browning и др.; J. Psychopharmacol.; 21; 684-690;. Murphy и др.; Int. J. Neuropsychopharmacol.; 12; 169-179; (2008)).
Пример 5
Влияние смеси галактоолигосахаридов на индуцированные липополисахаридом (LPS) нездоровое поведения, тревоги после перенесенных заболеваний и на измененные уровни цитокинов у мышей.
Материалы и методы
Животные, введение пребиотиков и инъекции LPS
Эксперименты с крысами были выполнены в соответствии с UK Home Office Animals (научные процедуры) Act (1986) и рекомендациями Home Office. Самцов мышей линии CD1 (25-30 г, 6-8 недельного возраста, Harlan Orlac, Великобритания), размещали в 3 клетках (клетки из оргстекла, 33×15×13 см, длина/ширина/высота) и выдерживали в стандартных контролируемых лабораторных условиях (12 ч цикл свет/темнота, включение света в 7 утра, 21±1°С, влажность 50±5%). После 4-5 дней привыкания к оборудованию, мышей кормили стандартным кормом для мышей ab libitium, и обеспечивали в течение 3 недель (по весу, псевдослучайным образом), либо раствором пребиотика, содержащем 1,3% мас./объем смеси галактоолигосахаридов, коммерчески доступной под названием Bimuno от компании Clasado Ltd. (Великобритания), далее именуемое BGOS, или только водой для питья. Предварительные исследования подтвердили, что данный режим дозирования BGOS оптимально увеличивает содержание бифидобактерий и лактобактерий в кишечнике мыши (Clasado Ltd, Великобритания). Для того, чтобы избежать возможного перекрестного загрязнения групп, 2 группы, получавшие разные корма, держали изолированно друг от друга. После 3 недель все животные получали питьевую воду в течение 24 часов перед инъекцией LPS и поведенческими тестами. Однократную инъекцию мышам LPS (0,75 мг/кг) в физиологическом растворе (0,9% соли), либо только физиологического раствора выполняли интраперитонеально (внутрибрюшинная инъекция), за 4 ч до проведения поведенческих тестов. Таким образом, были протестированы четыре группы (n=15 мышей в группе, 5 различных клеток на один курс): 1) пьющие воду/подвергшиеся инъекции физиологическим раствором; 2) пьющие воду/подвергшиеся инъекции LPS; 3) питающиеся BGOS/подвергшиеся инъекции физиологическим раствором; и 4) питающиеся BGOS/подвергшиеся инъекции LPS. Данный эксперимент был повторен так, чтобы для проведения анализа обеспечить в общей сложности 30 мышей в опытной группе.
Двигательная активность (LMA)
Двигательная активность снижается после введения LPS (Skelly и др. (2013) PLOS One8: e69123) что, соответственно, было использовано в качестве эталона нездорового поведения. Данный тест проводился спустя 4 ч после инъекции LPS или физиологического раствора. Оборудование состояло из прозрачной коробки из оргстекла (48×27×21 см, длина/ширина/высота, Photo Beam Activity Hardware and Software, Open Field San Diego Instruments), содержащей тонкий слой подстилки из опилок, и накрытой прозрачной крышкой из оргстекла (перфорированной для обеспечения дыхания). Освещенность коробки составляла около 60 люкс. Каждое животное аккуратно помещалось в угол коробки и оставлялось на 2 ч для свободного изучения пространства. Двигательную активность регистрировали с помощью фотодатчиков, размещенных вдоль коробки, и выражали в виде числа прерываний лучей фотодатчиков, совершенных животными с течением времени. Число фекальных пеллетов подсчитывалось исследователем по окончании тестирования, а животные возвращались в свои клетки для отдыха перед следующим поведенческим тестированием.
Закапывание шариков
Этот тест, который используют для выявления анксиолитических и антидепрессивных лекарственных препаратов, а также оценки тревожного и обсессивно-компульсивного поведения, основан на врожденной особенности мышей закапывать объекты в стрессовой ситуации; тестирование проводилось в соответствии с описанным ранее (Deacon R.M.; Nat. Protoc; (2006); 1(1); 122-124, Nicolas и др.; Eur. J. Pharmacol.; (2006); 547; 106-115). Введение LPS и вызванное LPS нездоровое поведение приводит к уменьшению числа шариков, закопанных мышами (Njung'e & Handley; Pharmacol. Biochem. Behav.; (1991); 38 (1); 63-67). Тест «закапывание шариков» проводился спустя 7 ч после инъекции LPS/физиологического раствора. Двадцать шариков помещали на поверхность подстилки из опилок толщиной 5 см в прозрачной пластиковой клетке (44×28×12 см, длина/ширинах/высота), шарики располагали в 5 строк на расстоянии 4,2 см друг от друга, и 2 см от края клетки. Тестирование проводили при нормальном комнатном освещении, (~100 люкс на высоте 1 м над полом), как было описано ранее (Jacobson, L. et al.; Pharmacol. Biochem. Behav.; (2007); 15 (4); 619-626)) и используя рекомендации (Deacon, R., 2006). Каждое животное осторожно помещали в клетку с шариками на 30 мин, после чего считали число шариков, закопанных не менее чем на 2/3 их поверхности.
Темно-светлая камера
Данный тест также используется для оценки тревожного поведения и основан на противоречии между влечением к новизне и страхом ярких открытых пространств у мышей (Bourin, М. и Hascoet, М.; Eur J. Pharmacol (2003); 463 (1-3); 55-65; O'Leary, T. P. и др.; J. Neuroscience Methods; (2012); 203; 315-324 doi:. S0165-0270 (11) 00594-21). Мыши, находящиеся в менее тревожном состоянии, проводят больше времени в пугающей области, то есть в светлой части камеры; мыши, находящиеся в более тревожном состоянии, проводят больше времени в безопасной темной части камеры. Введение LPS, как было показано, усиливает тревожное поведение в этом тесте (Bassi et al; Basic Clin. Pharmacol. Toxicol.; (2012); 110 (4); 359-369). Тестирование проводилось спустя 24 ч после инъекции LPS/физиологического раствора.
Оборудование состояло из 2 окрашенных деревянных камер, маленькой черной камеры (21×16×16 см, длина/ширина/высота, с небольшим отверстием для доступа к светлой части, 3×2,7 см, длина/ширина) и большой освещенной камерой (46,5×21×21 см, длина/ширина/высота). Тестирование проводилось при немного приглушенном освещении в 50 люкс внутри освещенного отсека камеры в соответствии с описанным ранее (Strekalova T. и др.; Neuropsychopharmacology; (2004); 29; 2007-2017). Каждое животное аккуратно помещалось в темную часть светло-темной камеры, и оставлялось на 5 мин для свободного изучения всей камеры. Измерялась задержка перед выходом из темной части, число переходов между темной и освещенной частью и время, проведенное в светлой части. Критерием входа в любую часть было нахождение в ней 4 лап. После окончания процедуры мышей помещали обратно в их домашнюю клетку с соседями по клетке. После каждого животного камеру протирали тканью, слегка смоченной 10%-ным спиртовым раствором, для удаления сигнальных запахов без создания явного запаха спирта. В комнате не было фонового шума и экспериментатор оставался в помещении для получения результатов непосредственно на месте. Животные считались более тревожными и, таким образом, более подвергшимися воздействию инъекции LPS, если они демонстрировали более высокую задержку перед выходом в освещенную часть, осуществляли меньшее количество переходов между частями и проводили меньшее время в освещенной части.
Отбор тканей
Животных умерщвляли между 12 и 13 часами, спустя 3 ч после проведения поведенческого тестирования. Весь мозг немедленно извлекали и подвергали мгновенной заморозке в изопентане с сухим льдом (Sigma-Aldrich, Великобритания) и хранили при -80°С до проведения дальнейшего молекулярного анализа. Кровь из тела собирали в пробирки с калиевой солью ЭДТА (этилендиаминтетрауксусная кислота) и центрифугировали в течение 15 мин при 5000 оборотах в минуту. Плазму выделяли и хранили при -80°С до проведения дальнейшего анализа на кортикостерон. Фекальные пеллеты собирали из каждой клетки на протяжении всего исследования и хранили в 70% глицерине с PBS (фосфатно-солевой буфер) при -20°С для дальнейшего определения количества бактерий.
Анализ данных
Данные анализировали с использованием программного обеспечения SPSS (19 версия). Нормальность данных была проверена с помощью теста Колмогорова-Смирнова. Двигательную активность оценивали 2-сторонним методом ANOVA, и все другие данные - односторонним методом ANOVA (или анализом Краскала-Уоллиса для непараметрических данных) с последующим post hoc анализом Tukey (Тьюки). Все данные представлены в виде среднего ±стандартная ошибка среднего (SEM), а порог статистической значимости был принят р<0,05.
Результаты
Влияние BGOS на непосредственно индуцированное LPS нездоровое поведение: двигательная активность и закапывание шариков
Животные, которых поили простой водой, продемонстрировали более низкую двигательную активность после инъекций LPS по сравнению с введением физиологического раствора (фиг. 6A, время эффекта, F(5,260)=142,12, p<0,0001; эффект инъекции LPS (F(1,52)=3,61, р=0,063; корреляция время/инъекция LPS F(5,260)=5,12, р<0,001). Post-hoc тест показал, что на 30- и 40-минутной временной точке животные, получавшие воду и LPS, проходили значительно меньшее расстояние, чем аналогичные животные, получавшие физиологический раствор (для обеих групп р<0,05). Введение BGOS отменяло влияние LPS на двигательную активность (фиг. 6B), так как сохранялась зависимость от времени (F(5,260)=113,01, р<0,0001), но не было эффекта от инъекции LPS (F(1,52)=1,12, р=0,3), также нет корреляции время/инъекция LPS (Р(5,260)=0,12, р=0,99). Добавление BGOS не приводит к различиям в двигательной активности животных, получавших физиологический раствор, по сравнению с группой, получавшей воду и физиологический раствор.
В тесте по закапыванию шариков (фиг. 7), LPS оказал значительное влияние на поведение мышей (Н(df=3)=13,79, р<0,01), которое не отменялось введением BGOS, так как и животные, которым вводили воду (р<0,05) и животные, которым вводили BGOS (р<0,05), после получения LPS закапывали меньше шариков, чем аналогичные животные, которые получали физиологический раствор. Введение BGOS не приводит к различию в числе закопанных шариков животных, получавших физиологический раствор, и группы, получавшей воду и физиологический раствор.
Влияние BGOS на позднее тревожное поведение, вызванное LPS: светло-темная камера
LPS усиливает тревожное поведение животных, которых поили водой (фиг. 8). Введение BGOS устраняет этот эффект, если судить по задержке перед выходом в освещенное пространство (фиг. 8A, Н(DF=3)=12,17, р<0,01) и времени, проведенном в освещенной части (фиг. 8B, F(3,106)=4,71, р<0,01). Действительно, post-hoc анализ показывает, что животные, получавшие воду и LPS, показали значительную, в 2 раза большую, задержку перед выходом в освещенное пространство, по сравнению с животными, получавшими физиологический раствор (р<0,01), а также по сравнению и с животными, получавшими физиологический раствор, и с животными, получавшими BGOS и LPS (в обоих случаях р<0,05). Животные, получавшие воду и LPS, также проводили значительно меньшее время в освещенной части, по сравнению со всеми другими группами (р<0,05, вода и LPS против всех групп). Тем не менее, не было никакой статистической разницы между группами по числу переходов между темными и светлыми частями (фиг. 3C, F(3,110)=1,7, р=0,17). Введение только BGOS не приводит к различиям по любому из параметров у контрольных мышей, то есть мышей, получавших физиологический раствор, по сравнению с животными, получавшими воду и физиологический раствор.
Влияние BGOS на иммунные параметры спустя 24 ч после введения LPS: уровни цитокинов в лобной коре мозга и плазме
Введение LPS приводит к изменениям в лобной коре мозга у животных, получавших воду, но не у животных, получавших BGOS, (фиг. 9), уровней TNF-α, IL-1β и IL-6, но не IL-10. Post-hoc анализ показал, что у животных, получавших воду и LPS, обнаруживаются более высокие уровни TNF-α, чем всех других групп (р<0,05), более высокие уровни IL-Ιβ (р<0,01, относительно животных, получавших физиологический раствор, и р<0,05 относительно животных, получавших LPS и BGOS) и более высокие уровни IL-6 (р<0,05 относительно животных, получавших физиологический раствор и воду). Таким образом, уровни цитокинов у животных, получавших BGOS и которым вводили или физиологический раствор, или инъекцию LPS, в обоих случаях аналогичны уровням у контрольных животных, которым вводили воду и физиологический раствор.
Введение LPS приводит к существенным изменениям в плазме животных, получавших воду, но не у животных, получавших BGOS, (фиг. 10), уровней TNF-α, однако статистически значимого различия между группами в уровне IL-6 и IL-10, а также в уровне IL-Ιβ не наблюдалось, хотя в последнем случае введение LPS приводит к незначимому 2-кратному увеличению у животных, получавшим воду, по сравнению с животными, получавшим физиологический раствор.
Обсуждение
В настоящем исследовании было протестировано влияние употребления пребиотика (BGOS) на вызванное LPS нездоровое поведение, тревожность, а также экспрессию цитокинов у мышей; в основе исследования лежало предположение, что BGOS (Bimuno) влияет на функции мозга через воздействие на иммунную систему. Нашими двумя основными находками были: 1) мыши, получавшие с пищей BGOS, не проявляли дефицита двигательной активности (LMA) и беспокойства после однократной инъекции LPS, по сравнению с контрольной группой; и 2) вызванное LPS высвобождение медиаторов воспаления в плазме (гранулоцитарный колониестимулирующий фактор (G-CSF); хемокин (подсемейство C-C) лиганда 2 (CCL2); индуцируемый IFNγ монокин, хемокин (подсемейство С-Х-С) лиганда 9 (IG)) и головном мозге (TNFa), подавляется пероральным введением BGOS. В целом, наши данные подтверждают современные представления о том, что BGOS (Bimuno) играет важную роль в поддержании здоровья головного мозга, и что изменение, вызванное внешними вызовами иммунной системы, может укреплять данный эффект.
Пример 6
Влияние BGOS на когнитивные функции здоровых крыс
Материалы и методы
Нормальным крысам линии Sprague Dawley давали воду или пребиотический раствор, содержащий 1,3% масс./объем смеси BGOS, в течение 3 недель, а затем тестировали на выполнение задания «концентрация и смещение внимания» (ASST) (см. Bissonette, G.B. и др.; Behavioural Brain Research; (2013); 250; 91-101), используя стандартный протокол.
Результаты
На фиг. 11 показано, что крысы, получавшие в течение 3 недель BGOS, демонстрируют более высокие способности в экстра-пространственном (ED) компоненте ASST, что является мерой гибкости обучения. Выполнение элемента ED настолько легко, насколько и внутри-пространственной фазы (ID/ED-сдвиг) свидетельствует о повышенной когнитивной гибкости, характеристики, которая нарушается у пожилых людей. На фиг. 11 #p<0,05 по сравнению с контрольным ID и *р<0,05 по сравнению с контрольными ED.
Вывод
Крысы, получавшие BGOS, демонстрируют улучшенные познавательные способности при выполнении задач, зависящих от медиальной префронтальной коры мозга, которая обычно повреждается при психических расстройствах и старении.
Группа изобретений относится к медицине. Предложены: применение композиции галактоолигосахаридов, содержащей дисахариды Gal (β1-3)-Glc; Gal (β1-3)-Gal; Gal (β1-6)-Gal; Gal (α1-6)-Gal; трисахариды Gal (β1-6)-Gal (β1-4)-Glc; Gal (β1-3)-Gal (β1-4)-Glc; тетрасахарид Gal (β1-6)-Gal (β1-6)-Gal (β1-4)-Glc и пентасахарид Gal (β1-6)-Gal (β1-6)-Gal (β1-6)-Gal (β1-4)-Glc, для профилактики или лечения эмоциональных расстройств при психоневрологических заболеваниях или старении и соответствующий способ профилактики или лечения. Технический результат: композиция может снизить избыточную секрецию кортизола, являющуюся симптомом тревожных расстройств и депрессивных состояний. 2 н. и 11 з.п. ф-лы, 11 ил., 2 табл., 6 пр.
1. Применение композиции галактоолигосахаридов, содержащей дисахариды Gal (β1-3)-Glc; Gal (β1-3)-Gal; Gal (β1-6)-Gal; Gal (α1-6)-Gal; трисахариды Gal (β1-6)-Gal (β1-4)-Glc; Gal (β1-3)-Gal (β1-4)-Glc; тетрасахарид Gal (β1-6)-Gal (β1-6)-Gal (β1-4)-Glc и пентасахарид Gal (β1-6)-Gal (β1-6)-Gal (β1-6)-Gal (β1-4)-Glc, для профилактики или лечения эмоциональных расстройств при психоневрологических заболеваниях или старении.
2. Применение композиции по п.1, в котором психоневрологическими заболеваниями являются депрессивные или тревожные расстройства.
3. Применение композиции по п.1 или 2, которая представляет собой порошкообразную форму, таблетку, капсулу, жидкую терапевтическую форму, такую как сироп, или мягкую пастилку.
4. Применение композиции по п.3, в которой порошкообразная форма содержит от 1,35 г до 9,6 г галактоолигосахаридов в порошкообразной композиции массой от 1,65 г до 20 г, предпочтительно от 1,96 г до 4,9 г галактоолигосахаридов в порошке массой от 2,5 г до 10 г, наиболее предпочтительно от 2,7 г до 2,75 г галактоолигосахаридов в порошке массой от 3,0 г до 5,5 г.
5. Применение композиции по п.3, в которой сиропообразная форма содержит от 1,35 г до 9,6 г галактоолигосахаридов в сиропообразной композиции массой от 2,1 г до 25,29 г, предпочтительно от 1,96 г до 4,9 г галактоолигосахаридов в сиропе массой от 3,0 г до 12,9 г, наиболее предпочтительно от 2,7 г до 2,75 г галактоолигосахаридов в сиропе массой от 4,1 г до 7,25 г.
6. Способ профилактики или лечения эмоциональных расстройств при психоневрологических заболеваниях или старении, включающий введение индивидууму терапевтически эффективного количества композиции галактоолигосахаридов, содержащей дисахариды Gal (β1-3)-Glc; Gal (β1-3)-Gal; Gal (β1-6)-Gal; Gal (α1-6)-Gal; трисахариды Gal (β1-6)-Gal (β1-4)-Glc; Gal (β1-3)-Gal (β1-4)-Glc; тетрасахарид Gal (β1-6)-Gal (β1-6)-Gal (β1-4)-Glc и пентасахарид Gal (β1-6)-Gal (β1-6)-Gal (β1-6)-Gal (β1-4)-Glc.
7. Способ по п.6, в котором индивидуумом является человек.
8. Способ по п.6, в котором композицию вводят перорально.
9. Способ по п.6, в котором терапевтически эффективное количество композиции галактоолигосахаридов вводят ежедневно за один прием.
10. Способ по п.6, в котором терапевтически эффективное количество композиции галактоолигосахаридов вводят ежедневно за два приема, с интервалом между приемами от 4 до 12 часов, предпочтительно от 6 до 10 часов между приемами, наиболее предпочтительно 8 часов между приемами.
11. Способ по п.6, в котором композиция представляет собой порошкообразную форму, таблетку, капсулу, жидкую терапевтическую форму, такую как сироп, или мягкую пастилку.
12. Способ по п.11, в котором композиция представляет собой порошкообразную форму, содержащую от 1,35 г до 9,6 г галактоолигосахаридов в порошкообразной композиции массой от 1,65 г до 20 г, предпочтительно от 1,96 г до 4,9 г галактоолигосахаридов в порошке массой от 2,5 г до 10 г, предпочтительно от 2,7 г до 2,75 г галактоолигосахаридов в порошке массой от 3,0 г до 5,5 г.
13. Способ по п.11, в котором композиция представляет собой сиропообразную форму, содержащую от 1,35 г до 9,6 г галактоолигосахаридов в сиропообразной композиции массой от 2,1 г до 25,29 г, предпочтительно от 1,96 г до 4,9 г галактоолигосахаридов в сиропе массой от 3,0 г до 12,9 г, наиболее предпочтительно от 2,7 г до 2,75 г галактоолигосахаридов в сиропе массой от 4,1 г до 7,25 г.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| SEARLE LE et al | |||
| Purified galactooligosaccharide, derived from a mixture produced by the enzymic activity by Bifidobacterium bifidum, reduces Salmonella enterica serovar Typhimurium adhesion and invasion in vitro and in vivo | |||
| J.Med.Microbiol | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| SILK DB et al | |||
| Clinical trial: the effects of a trans-galacooligosaccharide prebviotic on faecal microbiota and symptoms in irritable bowel syndrome | |||
| Aliment.Pharmacol.Ther | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| ПРОИЗВОДНЫЕ 5БЕТА-САПОГЕНИНА И ПСЕВДОСАПОГЕНИНА И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ДЕМЕНЦИИ | 2000 |
|
RU2325396C2 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2018-08-08—Публикация
2014-03-17—Подача