ОБЛАСТЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области смесей для младенцев и детей младшего возраста и улучшению здоровья кишечника.
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Грудное молоко является предпочтительной пищей для младенцев. Грудное молоко содержит несколько биологически активных факторов, которые приносят пользу относительно незрелой иммунной системе и здоровью кишечника новорожденных в раннем возрасте. Младенцы, вскармливаемые грудным молоком, имеют меньшую заболеваемость инфекциями, чем младенцы, вскармливаемые смесями. Многие компоненты грудного молока, включая иммуноглобулины (такие как sIgA), интерлейкин (IL)-1, IL-6, IL-8, IL-10, интерферон-γ (IFN-γ), иммунокомпетентные клетки, трансформирующий фактор роста-β (TGF-β), лактоферрин, нуклеотиды и олигосахариды грудного молока (HMO), как полагают, играют роль в защите от инфекции патогенами. Кроме того, оптимальным считается созревание кишечника и развитие микробиоты у младенцев, вскармливаемых грудным молоком.
Однако кормить грудью младенца не всегда возможно или желательно. В данных случаях хорошей альтернативой являются детские смеси или смеси второго уровня. Данные смеси должны иметь оптимальный состав, чтобы как можно точнее имитировать благотворное влияние грудного молока.
WO 2005/122790 описывает способ стимуляции целостности барьера введением композиции, содержащей эйкозапентаеновую кислоту (EPA), докозагексаеновую кислоту (DHA) и арахидоновую кислоту (ARA) и, по меньшей мере, два различных олигосахарида. Олигосахариды действуют опосредованно, ферментируясь до короткоцепочечных жирных кислот (SCFA) кишечной микробиотой.
WO 2016/013935 описывает применение неперевариваемого олигосахарида в получении композиции для обеспечения питания младенца, страдающего повышенным риском пищевой аллергии. Младенец предпочтительно подвергается повышенному риску воздействия трихотеценовых микотоксинов, например, при употреблении большого количества злаков. В примерах VivinalGOS является источником галактоолигосахаридов.
WO 2006/115412 относится к жидкой пищевой композиции для улучшения барьерной функции кишечника и для предотвращения аллергии. Композиция содержит липиды с короткоцепочечными жирными ацильными цепями и неперевариваемые ферментируемые сахариды.
WO 2004/112509 описывает композицию для индукции модели созревания кишечного барьера, аналогичной наблюдаемой при грудном вскармливании. Композиция помогает улучшить созревание кишечного барьера, например, во время неонатального стресса. Выявлено, что разлучение с матерью у крыс увеличивает кишечную проницаемость и что смесь, содержащая LC-PUFA, Lactobacillus paracasei и неперевариваемые олигосахариды, может восстанавливать кишечную проницаемость до нормального уровня.
Тем не менее, существует потребность в улучшении детских смесей и композиций для детей младшего возраста, чтобы они приблизились к грудному молоку по структуре и функциям.
СУЩНОСТЬ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Авторы изобретения обнаружили, что комбинация питательных ингредиентов 2’-FL и диетической масляной кислоты оказывает положительное влияние на барьерную функцию кишечника. Также было обнаружено, что реакция иммунной системы и микробиоты является различной, когда присутствуют как 2’-FL, так и пищевая масляная кислота, по сравнению с тем случаем, когда присутствует только один из данных ингредиентов. Было показано, что смесь 2’-FL и пищевой масляной кислоты оказывает положительное влияние на экспрессию щелочной фосфатазы, что свидетельствует об улучшенном созревании функции кишечного барьера и улучшенной защите от кишечных патогенных бактерий. Данные эффекты были дополнительно улучшены присутствием 3’-GL. Следовательно, пищевая композиция, содержащая как пищевую масляную кислоту, так и 2’-FL, и предпочтительно дополнительно 3’-GL, будет иметь улучшенное воздействие на здоровье младенцев и детей младшего возраста.
СПИСОК ВАРИАНТОВ ОСУЩЕСВТЛЕНИЯ
1 Пищевая композиция для младенцев или детей младшего возраста, содержащая:
2’фукозиллактозу, и
пищевой бутират.
2 Пищевая композиция согласно варианту осуществления 1, дополнительно содержащая 3’галактозиллактозу.
3 Пищевая композиция по любому из предшествующих вариантов осуществления, где композиция, по меньшей мере, частично ферментирована бактериями, продуцирующими молочную кислоту, и содержит 0,1-1,5% по весу в сумме молочной кислоты и лактата относительно сухой массы пищевой композиции, и где, по меньшей мере, 90% по весу в сумме молочной кислоты и лактата представляет собой L-молочную кислоту и L-лактат.
4 Пищевая композиция по любому из предшествующих вариантов осуществления, где композиция дополнительно содержит LC-PUFA, выбранные из группы DHA, ARA и EPA, предпочтительно DHA и EPA, предпочтительно DHA, EPA и ARA, где пищевая композиция предпочтительно содержит, по меньшей мере, 1% по весу суммы DHA, ARA и EPA относительно всех жирных кислот.
5 Пищевая композиция по любому из предшествующих вариантов осуществления, где смесь дополнительно содержит галактоолигосахариды и/или фруктоолигосахариды.
6 Пищевая композиция по любому из предшествующих вариантов осуществления, где пищевая композиция выбрана из группы, состоящей из детской смеси, смеси второго уровня или смеси для детей младшего возраста, предпочтительно детской смеси.
7 Пищевая композиция по любому из предшествующих вариантов осуществления, где композиция содержит (i) 0,02-1 г 2’-FL на 100 мл пищевой композиции; (ii) 0,15-7,5% по весу относительно сухой массы; и/или (iii) 0,03-1,5 г на 100 ккал.
8 Пищевая композиция по любому из предшествующих вариантов осуществления, где пищевая композиция содержит (i) 0,010-0,250 г 3’-GL на 100 мл; (ii) 0,075-2% по весу относительно сухой массы; и/или (iii) 0,015-0,4 г на 100 ккал.
9 Пищевая композиция по любому из предшествующих вариантов осуществления, где пищевая композиция содержит (i) 0,3-5% по весу пищевой масляной кислоты относительно всех жирных кислот; (ii) 10 мг-175 мг на 100 мл; (iii) 15-250 мг на 100 ккал; и/или (iv) 0,075-1,3% по весу относительно сухой массы пищевой композиции.
10 Пищевая композиция по любому из предшествующих вариантов осуществления, где пищевая композиция содержит (i) 0,2-5 г суммы галактоолигосахаридов и фруктоолигосахаридов на 100 мл; и/или (ii) 0,3-7,5 г на 100 ккал, 1,5-35% по весу относительно сухой массы.
11 Пищевая композиция по любому из предшествующих вариантов осуществления, для применения в улучшении функции кишечного барьера и/или для применения в улучшении иммунной системы и/или для применения в улучшении кишечной микробиоты и/или для применения в лечении или предотвращении инфекций.
12 Пищевая композиция по любому из предшествующих вариантов осуществления, для применения в лечении или предотвращении аллергии, предпочтительно для применения в индукции пероральной толерантности к аллергенам.
13 Пищевая композиция для применения согласно варианту осуществления 11 или 12, где пищевую композицию вводят младенцам или детям младшего возраста, предпочтительно младенцам.
14 Пищевая композиция по любому из вариантов осуществления 1-10 или пищевая композиция для применения по любому из вариантов осуществления 11-13, для применения в обеспечении питания младенцев.
ПОДРОБНОЕ ОПИСАНИЕ:
Настоящее изобретение относится к пищевой композиции для младенцев или детей младшего возраста, содержащей:
2’фукозиллактозу, и
пищевой бутират.
В предпочтительном варианте осуществления пищевая композиция дополнительно содержит 3’галактозиллактозу.
В другом или следующем варианте осуществления пищевая композиция, по меньшей мере, частично ферментирована бактериями, продуцирующими молочную кислоту, и содержит 0,1-1,5% по весу в сумме молочной кислоты и лактата относительно сухой массы пищевой композиции, и где, по меньшей мере, 90% по весу в сумме молочной кислоты и лактата представляет собой L-молочную кислоту и L-лактат.
Настоящее изобретение дополнительно относится к указанной пищевой композиции для применения в качестве лекарственного средства, предпочтительно для лечения, предотвращения и/или облегчения заболевания и/или расстройства. Пищевая композиция предназначена предпочтительно для применения в улучшении барьерной функции кишечника, для применения в улучшении иммунной системы, для применения в улучшении кишечной микробиоты, для применения в лечении или предотвращении инфекций, в частности кишечных инфекций, и/или для применения в лечении или предотвращении аллергии, предпочтительно для применения в индукции пероральной толерантности к аллергенам.
Данный аспект настоящего изобретения можно также сформулировать как применение указанной пищевой композиции в получении лекарственного средства для лечения, предотвращения и/или облегчения заболевания и/или расстройства, предпочтительно для лечения заболевания. Применение пищевой композиции предпочтительно предназначено для улучшения барьерной функции кишечника, для улучшения кишечной микробиоты, для лечения или предотвращения инфекций, в частности кишечных инфекций, и/или для применения в лечении или предотвращении аллергии, предпочтительно для применения в индукции пероральной толерантности к аллергенам.
Данный аспект настоящего изобретения можно также сформулировать как применение указанной пищевой композиции для лечения, предотвращения и/или облегчения заболевания и/или расстройства. Применение пищевой композиции предпочтительно предназначено для улучшения барьерной функции кишечника, для улучшения кишечной микробиоты, для лечения или предотвращения инфекций, в частности кишечных инфекций, и/или для применения в лечении или предотвращении аллергии, предпочтительно для применения в индукции пероральной толерантности к аллергенам.
Данный аспект настоящего изобретения можно также сформулировать как способ лечения, предотвращения и/или облегчения заболевания и/или расстройства, включающий введение указанной композиции нуждающемуся субъекту. Способ предпочтительно предназначен для улучшения барьерной функции кишечника, для улучшения кишечной микробиоты, для лечения или предотвращения инфекций, в частности кишечных инфекций, и/или для применения в лечении или предотвращении аллергии, предпочтительно для применения в индукции пероральной толерантности к аллергенам.
Определения
В контексте настоящего изобретения термин “предотвращение” обозначает «снижение риска (возникновения)» или «снижение степени тяжести». Термин «предотвращение определенного состояния» также включает «лечение лица с (повышенным) риском указанного состояния».
В данном документе и в формуле изобретения глагол «содержать» и его спряжения применяют в неограничивающем смысле для обозначения того, что элементы, следующие за словом, включены, но элементы, не упомянутые специально, не исключаются. Кроме того, ссылка на элемент неопределенным артиклем «a» или «an» не исключает возможности наличия более одного элемента, если только контекст явно не требует наличия одного и только одного из элементов. Таким образом, неопределенный артикль «a» или «an» обычно означает «по меньшей мере, один».
2’-Фукозиллактоза
Пищевая композиция настоящего изобретения содержит 2’-фукозиллактозу (2-‘FL). Было обнаружено, что 2’-FL улучшает барьерную функцию кишечника. Также было обнаружено, что 2’-FL улучшает иммунную систему. Фукозиллактоза (FL) представляет собой неперевариваемый олигосахарид, присутствующий в материнском молоке. Его нет в коровьем молоке. Он состоит из трех монозных звеньев, фукозы, галактозы и глюкозы, соединенных вместе. Лактоза представляет собой звено галактозы, соединенное со звеном глюкозы через бета 1,4 связь. Звено фукозы соединено со звеном галактозы молекулы лактозы через альфа-1,2-связь (2'-фукозиллактоза, 2'-FL) или через альфа-1,3-связь со звеном глюкозы лактозы (3-фукозиллактоза, 3-FL).
2’-FL, предпочтительно α-L-Fuc-(1→2)-β-D-Gal-(1→4)-D-Glc, имеются в продаже, например, у Sigma-Aldrich. Альтернативно, ее можно выделить из грудного молока, например, как описано в Andersson & Donald, 1981, J Chromatogr. 211:170-1744, или получить генетически модифицированными микроорганизмами, например, как описано в Albermann et al, 2001, Carbohydrate Res. 334:97-103.
Предпочтительно, пищевая композиция настоящего изобретения содержит 10 мг-1 г 2’-FL на 100 мл, более предпочтительно 20 мг-0,5 г, даже более предпочтительно 40 мг-0,2 г 2’-FL на 100 мл. Относительно сухой массы, настоящая пищевая композиция предпочтительно содержит 0,075% по весу-7,5% по весу 2’-FL, более предпочтительно 0,15% по весу-3,75% по весу 2’-FL, даже более предпочтительно 0,3% по весу-1,5% по весу 2’-FL. Относительно энергии, настоящая пищевая композиция предпочтительно содержит 0,015-1,5 г 2’-FL на 100 ккал, более предпочтительно 0,03-0,075 г 2’-FL на 100 ккал, даже более предпочтительно 0,06-0,3 г 2’-FL на 100 ккал. Меньшее количество фукозиллактозы будет менее эффективным в стимулировании иммунной системы или улучшении барьерной функции кишечника, тогда как слишком большое количество приведет к излишне высокой стоимости продукта.
Пищевой бутират
Настоящая пищевая композиция содержит пищевой бутират. Было обнаружено, что бутират улучшает барьерную функцию кишечника. Пищевая композиция предпочтительно содержит 0,3-5% по весу масляной кислоты относительно веса всех жирных ацильных цепей, предпочтительно 0,6-5% по весу, даже более предпочтительно 1-5% по весу. Настоящая пищевая композиция предпочтительно содержит трибутирин (т.е. триглицерид с 3 цепями масляной кислоты, соединенные с глицериновым остовом через сложноэфирные связи).
Предпочтительно пищевая композиция содержит 0,075-1,3% по весу бутирата относительно сухой массы композиции, предпочтительно 0,1-1,3% по весу и более предпочтительно 0,25-1,3% по весу. Альтернативно пищевая композиция содержит 0,015-0,25 г бутирата на 100 ккал, предпочтительно 0,03-0,25 г бутирата на 100 ккал, и более предпочтительно 0,05-0,25 г бутирата на 100 ккал. Когда пищевая композиция представляет собой жидкость, композиция предпочтительно содержит 0,01-0,175 г бутирата на 100 мл, более предпочтительно 0,02-0,175 г бутирата на 100 мл, и более предпочтительно 0,035-0,175 г бутирата на 100 мл. Известно, что грудное молоко содержит очень низкий уровень бутирата, в частности <0,1% по весу относительно всех жирных кислот.
Пищевой бутират можно обеспечивать из любого подходящего источника, известного в данной области техники. Неограничивающие источники пищевого бутирата включают жиры животного происхождения и продукты их переработки, такие как, но не ограничиваясь, молоко, молочный жир, сливочный жир, сливочное масло, масло, пахта, масляная сыворотка, сливки; продукты, полученные при микробной ферментации, такие как, но не ограничиваясь, йогурт и ферментированная пахта; и продукты масла семян растительного происхождения, такие как ананас и/или ананасовое масло, абрикос и/или абрикосовое масло, ячмень, овес, коричневый рис, отруби, стручковая фасоль, бобовые, листовая зелень, яблоки, киви, апельсины. В некоторых вариантах осуществления пищевой бутират получают синтетическим способом. Предпочтительным источником пищевого бутирата является молочный жир жвачных животных, предпочтительно жир из коровьего молока.
В вариантах осуществления, где пищевой бутират получают синтетически, химическую структуру пищевого бутират можно модифицировать, при необходимости. Кроме того, пищевой бутират, полученный синтетически, можно очищать любыми способами, известными в данной области техники, для получения очищенной добавки пищевого бутирата, которую можно включать в пищевые композиции, описанные в настоящем изобретении. Пищевой бутират может быть обеспечен молочными липидами и/или формами бутирата, соединенными с триглицеридом.
В некоторых вариантах осуществления, пищевой бутират может содержать бутиратные соли, например, бутират натрия, бутират калия, бутират кальция, бутират магния и их комбинации. В определенных вариантах осуществления, пищевой бутират содержит подходящую бутиратную соль, которая покрыта одним или более жирами или липидами. В определенных вариантах осуществления, где пищевой бутират включает покрытую жирами бутиратную соль, пищевая композиция может представлять собой сухую порошкообразную композицию, в которую вводят пищевой бутират. Предпочтительно пищевой бутират поставляется в составе триглицерида. Это выгодно, потому что бутират является летучим (и имеет неприятный запах) в свободной или солевой форме. В триглицеридной форме бутират будет выделяться в желудке и после него в результате действия липаз.
В предпочтительном варианте осуществления, весовое соотношение 2’-FL к пищевому бутирату находится в диапазоне 10:1-1:10, предпочтительно 5:1-1:5, более предпочтительно 3:1-1:3.
3’галактозиллактоза
Пищевая композиция настоящего изобретения предпочтительно содержит 3’-галактозиллактозу. Предпочтительно 3’-галактозиллактоза представляет собой трисахарид Gal-(бета 1,3)-Gal-(бета 1,4)-Glc. В контексте настоящего изобретения, все упоминания 3-‘GL относятся к бета 1,3’-галактозиллактозе или бета 3’-GL, если специально не указано, что это не так. Данный трисахарид можно вводить в подходящей матрице или в пищевой композиции. Трисахарид может быть, например, частью смеси галактоолигосахаридов (GOS), предпочтительно бета-галактоолигосахаридов (бетаGOS). Было обнаружено, что бета3’-GL улучшает барьерную функцию кишечника.
Пищевая композиция настоящего изобретения предпочтительно содержит 0,07-3,75% по весу Gal (бета 1-3)-Gal (бета 1-4)-Glc относительно сухой массы пищевой композиции. В предпочтительном варианте осуществления, пищевая композиция содержит 0,07-0,375% по весу Gal (бета 1-3)-Gal (бета 1-4)-Glc относительно сухой массы пищевой композиции. В другом предпочтительном варианте осуществления, пищевая композиция содержит 1,125-1,725% по весу Gal (бета 1-3)-Gal (бета 1-4)-Glc относительно сухой массы пищевой композиции.
Пищевая композиция настоящего изобретения предпочтительно содержит 15-750 мг Gal (бета 1-3)-Gal (бета 1-4)-Glc на 100 ккал пищевой композиции. В предпочтительном варианте осуществления, пищевая композиция содержит 15-75 мг Gal (бета 1-3)-Gal (бета 1-4)-Glc на 100 ккал пищевой композиции. В другом предпочтительном варианте осуществления, пищевая композиция содержит 225-375 мг Gal (бета 1-3)-Gal (бета 1-4)-Glc на 100 ккал пищевой композиции.
Пищевая композиция настоящего изобретения предпочтительно содержит 10-500 мг Gal (бета 1-3)-Gal (бета 1-4)-Glc на 100 мл пищевой композиции. В предпочтительном варианте осуществления, пищевая композиция содержит 10-50 мг Gal (бета 1-3)-Gal (бета 1-4)-Glc на 100 мл пищевой композиции. В другом предпочтительном варианте осуществления, пищевая композиция содержит 150-250 мг Gal (бета 1-3)-Gal (бета 1-4)-Glc на 100 мл пищевой композиции. Известно, что грудное молоко содержит низкие концентрации 3’-GL, в частности в среднем не превышающие 5 мг/100 мл.
Комбинация 2’-FL, бутирата и 3’-GL будет обладать дополнительным улучшенным эффектом на здоровье, в частности, на улучшение барьерной функции кишечника, на улучшение иммунной системы, на улучшение кишечной микробиоты и/или на лечение или предотвращение инфекций, в частности, кишечных инфекций.
В предпочтительном варианте осуществления, весовое соотношение 2’-FL к 3’-GL находится в диапазоне 10:1-1:10, предпочтительно 5:1-1:5, более предпочтительно 3:1-1:3.
Другие олигосахариды
Если она присутствует, бета1,3’-галактозиллактоза может быть частью смеси галактоолигосахаридов (GOS), предпочтительно бета-галактоолигосахаридов (BGOS). Предпочтительно добавлять GOS к настоящей пищевой композиции, в добавление специально к бета1,3’-галактозиллактозе (бета3’-GL). Смесь GOS с разными размерами и связями будет иметь повышенный положительный эффект на микробиоту и улучшенное производство короткоцепочечных жирных кислот, которые, в свою очередь, будут иметь дополнительный улучшающий эффект на иммунную систему и/или на лечение или профилактику инфекций, в частности кишечных инфекций. Присутствие GOS, отличного от бета3’-GL, будет, в частности, иметь дополнительный эффект на барьерную функцию кишечника в толстой кишке и конце тонкой кишки, тогда как бета3’-GL будет также и в основном эффективна в тонкой кишке. Следовательно, добавление 3’-GL и GOS будет иметь дополнительный улучшенный эффект на здоровье, в частности на улучшение барьерной функции кишечника, на улучшение иммунной системы, на улучшение кишечной микробиоты и/или на лечение или предотвращение инфекций, в частности кишечных инфекций.
В контексте настоящего изобретения, подходящим способом образования GOS является обработка лактозы бета-галактозидазами. В зависимости от специфичности применяемого фермента, звено галактозы гидролизуется из лактозы и соединяется с другим звеном лактозы через бета-связь с образованием трисахарида. Звено галактозы также может быть соединено с другим одним звеном галактозы, образуя дисахарид. Последующие звенья галактозы присоединяются, образуя олигосахариды. Большинство данных образованных олигосахаридов имеют степень полимеризации (DP) 7 или ниже. В зависимости от фермента данные связи между остатками галактозы могут быть преимущественно бета1,4’, бета1,6’ или бета1,3’.
Подходящий способ получения бета1,6’ и/или бета1,4’ GOS заключается в применении бета-галактозидазы из Bacillus circulans. Имеющийся в продаже источник BGOS представляет собой Vivinal-GOS от FrieslandCampina Domo (Amersfoort, The Netherlands). Vivinal-GOS содержит BGOS, в основном с DP2-8 (пик при DP3) и в основном с бета1,4’ и бета1,6’ связями, причем бета1,4’ связи являются преобладающими. Бета1,4’- и бета1,6’-галактозиллактозу можно обогатить или очистить из данных смесей GOS, как известно в данной области техники, например, эксклюзионной хроматографией. Другой имеющийся в продаже источник BGOS с преимущественно бета1,4’ и/или бета 1,6’ связями представляет собой Oligomate 55 и 50 от Yakult, и Cup Oligo от Nissin Sugar. Альтернативно бета1,4’- и бета1,6’-галактозиллактозы коммерчески доступны как отдельные компоненты (Carbosynth).
Подходящий способ получения бета1,3’ GOS заключается в применении бета-галактозидазы из S. thermophilus. Особенно пригодным является применение бета-галактозидазы из штамма CNCM I-1470 и/или CNCM I-1620 в способе, как описано в примере 4 FR2723960 или примере 6 EP0778885. S. thermophilus CNCM I-1620 депонирован в соответствии с Будапештским договором от 23 августа 1995 г в Национальной коллекции культур микроорганизмов Института Пастера, Париж, Франция Compagnie Gervais Danone. Штамм S. thermophilus CNCM I-1620 также называют штамм S. thermophilus ST065. S. thermophilus CNCM I-1470 депонирован в соответствии с Будапештским договором от 23 августа 1995 г в Национальной коллекции культур микроорганизмов Института Пастера, Париж, Франция Compagnie Gervais Danone. Композиция данного GOS также описана более подробно в LeForestier et. al., 2009 Eur J Nutr, 48:457-464. Оба штамма также опубликованы в WO 96/06924. Другая коммерчески доступная GOS, богатая бета1,3 и бета1,6 галактоолигосахаридами, представляет собой Bimuno от Clasado, или Purimune от GTC Nutrition. Бета1,6’- и бета1,3’-галактозиллактозу модно обогащать или очищать из данных смесей GOS, как известно в данной области техники, например, эксклюзионной хроматографией. Альтернативно, чистая бета1,3’-галактозиллактоза является коммерчески доступной (Carbosynth).
GOS, включая BGOS, являются неперевариваемыми. Пищеварительные ферменты человека (включая человеческую лактазу) не способны гидролизовать GOS. Таким образом, GOS при потреблении достигает толстого кишечника в неизменном виде и доступен для ферментации кишечной микробиотой.
Предпочтительно пищевая композиция содержит, по меньшей мере, 250 мг GOS на 100 мл, более предпочтительно, по меньшей мере, 400 даже более предпочтительно, по меньшей мере, 600 мг на 100 мл. Предпочтительно пищевая композиция не содержит более чем 2500 мг GOS на 100 мл, предпочтительно не более чем 1500 мг, более предпочтительно не более чем 1000 мг. Более предпочтительно, пищевая композиция настоящего изобретения содержит GOS в количестве 250-2500 мг/100 мл, даже более предпочтительно в количестве 400-1500 мг/100 мл, даже более предпочтительно в количестве 600-1000 мг/100 мл.
Предпочтительно пищевая композиция содержит, по меньшей мере, 1,75% по весу GOS относительно сухой массы всей композиции, более предпочтительно, по меньшей мере, 2,8% по весу, даже более предпочтительно, по меньшей мере, 4,2% по весу, все относительно сухой массы всей композиции. Предпочтительно пищевая композиция не содержит более чем 17,5% по весу GOS относительно сухой массы всей композиции, более предпочтительно не более чем 10,5% по весу, даже более предпочтительно не более чем 7% по весу. Пищевая композиция настоящего изобретения предпочтительно содержит GOS в количестве 1,75-17,5% по весу, более предпочтительно в количестве 2,8-10,5% по весу, самое предпочтительное в количестве 4,2-7% по весу, все относительно сухой массы всей композиции.
Предпочтительно пищевая композиция настоящего изобретения содержит, по меньшей мере, 0,35 г GOS на 100 ккал, более предпочтительно, по меньшей мере, 0,6 г, даже более предпочтительно, по меньшей мере, 0,8 г на 100 ккал. Предпочтительно пищевая композиция не содержит более чем 3,7 г GOS на 100 ккал, предпочтительно не более чем 2,5 г на 100 ккал, более предпочтительно не более чем 1,5 г на 100 ккал. Более предпочтительно, пищевая композиция настоящего изобретения содержит GOS в количестве 0,35-3,7 г на 100 ккал, даже более предпочтительно в количестве 0,6-2,5 г на 100 мл, даже более предпочтительно в количестве 0,8-1,5 г на 100 мл.
Более низкие количества приводят к менее эффективной композиции, тогда как присутствие более высоких количеств GOS может приводить к побочным эффектам, таким как осмотические нарушения, боль в животе, вздутие живота, газообразование и/или метеоризм.
Суммарное количество GOS, как определено для настоящей пищевой композиции, включает количество бета1,3’-галактозиллактозы.
В предпочтительном варианте осуществления, пищевая композиция содержит 0,25-2,5 г галактоолигосахаридов на 100 мл, где 10 мг-500 мг на 100 мл галактоолигосахаридов составляет Gal (бета 1-3)-Gal (бета 1-4)-Glc. В другом предпочтительном варианте осуществления, пищевая композиция содержит 0,25-2,5 г галактоолигосахаридов на 100 мл, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет более чем 20% по весу относительно всех галактоолигосахаридов. В другом предпочтительном варианте осуществления, пищевая композиция содержит 0,25-2,5 г галактоолигосахаридов на 100 мл, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет 10-500 мг на 100 мл. В другом предпочтительном варианте осуществления, пищевая композиция содержит 0,25-2,5 г галактоолигосахаридов на 100 мл, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет более чем 20% по весу относительно всех галактоолигосахаридов и где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет 150 мг-250 мг на 100 мл.
В другом предпочтительном варианте осуществления, пищевая композиция содержит 0,25-2,5 г галактоолигосахаридов на 100 мл, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет 10 мг-50 мг на 100 мл.
Количество бета1,3’-галактозиллактозы в данном препарате GOS предпочтительно находится в диапазоне 60-65% по весу, относительно всех галактоолигосахаридов (исключая лактозу, галактозу и глюкозу). Другие предпочтительные источники бета1,3’-галактозиллактозы включают Bimuno (Clasado) или Purimune (GTC Nutrition).
Предпочтительно, как описано ниже, пищевая композиция настоящего изобретения также содержит фруктоолигосахариды (FOS).
Ферментированная композиция
Настоящая пищевая композиция предпочтительно, по меньшей мере, частично ферментирована. Частично ферментированная пищевая композиция содержит, по меньшей мере, часть композиции, которая ферментирована бактериями, продуцирующими молочную кислоту. Показано, что частично ферментированная смесь оказывает защитное действие на поддержание проницаемости кишечника при физическом или психологическом стрессе.
Ферментацию предпочтительно проводят при получении пищевой композиции. Предпочтительно, пищевая композиция не содержит значительных количеств жизнеспособных бактерий в конечном продукте, и это может быть достигнуто тепловой инактивацией после ферментации или инактивацией другими способами. Предпочтительно ферментированная композиция представляет собой продукт на основе молока, который представляет собой молочный субстрат, который ферментирован бактериями, продуцирующими молочными кислотами, где молочный субстрат содержит, по меньшей мере, одно, выбранное из группы, состоящей из молока, сыворотки, сывороточного белка, гидролизата сывороточного белка, казеина, гидролизата казеина или их смесей. Соответственно, пищевая композиция, содержащая ферментированные композиции и неперевариваемый олигосахарид, и способ их получения описаны в WO 2009/151330, WO 2009/151331 и WO 2013/187764.
Ферментированная композиция предпочтительно содержит фрагменты бактериальных клеток, такие как гликопротеины, гликолипиды, пептидогликан, липотейхоевую кислоту (LTA), липопротеины, нуклеотиды и/или капсульные полисахариды. Предпочтительно применять ферментированную композицию, содержащую инактивированные бактерии и/или клеточные фрагменты, непосредственно как часть конечного пищевого продукта, поскольку это приведет к более высокой концентрации фрагментов бактериальных клеток. Когда применяют коммерческие препараты бактерий, продуцирующих молочную кислоту, их обычно промывают, и материал отделяют от водной ростовой среды, содержащей фрагменты бактериальных клеток, тем самым уменьшая или устраняя присутствие фрагментов бактериальных клеток. Кроме того, при ферментации и/или других взаимодействиях бактерий, продуцирующих молочную кислоту, с молочным субстратом могут образовываться дополнительные биоактивные соединения, такие как короткоцепочечные жирные кислоты, биоактивные пептиды и/или олигосахариды и другие метаболиты, которые также могут приводить к функционированию кишечной микробиоты, более сходной с функционированием кишечной микробиоты младенцев, вскармливаемых грудью. Данные биоактивные соединения, которые образуются во время ферментации бактериями, продуцирующими молочными кислотами, также можно назвать постбиотиками. Предполагается, что композиция, содержащая данные постбиотики, преимущественно ближе к грудному молоку, поскольку грудное молоко не является чистой синтетической смесью, а содержит метаболиты, бактериальные клетки, клеточные фрагменты и подобные. Следовательно, считают, что ферментированная композиция, в частности, продукт, полученный из ферментированного молока, имеет улучшенный эффект по сравнению с продуктом, полученным из неферментированного молока, без или с добавлением бактерий, продуцирующих молочную кислоту, на предотвращение преждевременного созревания кишечника у младенца, и индуцирует у младенца паттерн созревания кишечника, который больше похож на паттерн созревания кишечника, наблюдаемый у младенцев, вскармливаемых грудным молоком.
Предпочтительно конечная пищевая композиция содержит 5-97,5% по весу ферментированной композиции относительно сухой массы, более предпочтительно 10-90% по весу, более предпочтительно 20-80% по весу, даже более предпочтительно 25-60% по весу. Как способ указать, что конечная пищевая композиция содержит, по меньшей мере, частично ферментированную композицию, и указать степень ферментации, можно брать концентрацию в сумме молочной кислоты и лактата в конечной пищевой композиции, поскольку они представляют собой метаболический конечный продукт, продуцируемый бактериями, продуцирующими молочную кислоту, после ферментации. Настоящая конечная пищевая композиция предпочтительно содержит 0,1-1,5% по весу в сумме молочной кислоты и лактата относительно сухой массы композиции, более предпочтительно 0,15-1,0% по весу, даже более предпочтительно 0,2-0,5% по весу. Альтернативно пищевая композиция содержит 0,02-0,3 г в сумме молочной кислоты и лактата на 100 ккал, предпочтительно 0,03-0,2 в сумме молочной кислоты и лактата на 100 ккал, предпочтительно 0,04-0,1 в сумме молочной кислоты и лактата на 100 ккал. Альтернативно, когда композиция представляет собой жидкость, сумма молочная кислота и лактат составляет 0,0125-0,2 г на 100 мл, предпочтительно 0,02-0,125 г на 100 мл, предпочтительно 0,03-0,07 г на 100 мл.
Предпочтительно, по меньшей мере, 50% по весу, даже более предпочтительно, по меньшей мере, 90% по весу, в сумме молочной кислоты и лактата находится в форме L(+)-изомера. Таким образом, в одном варианте осуществления сумма L(+)-молочной кислоты и L(+)-лактата составляет более чем 50% по весу, более предпочтительно более чем 90% по весу, относительно суммы молочной кислоты и лактата. В настоящем изобретении L(+)-лактат и L(+)-молочную кислоту также называют L-лактат и L-молочная кислота.
Комбинация 2’-FL, бутирата, необязательного 3’-GL и частично ферментированной смеси будет иметь дополнительный улучшенный эффект на здоровье, в частности на улучшение барьерной функции кишечника, на улучшение иммунной системы, на улучшение кишечной микробиоты и/или на лечение или предотвращение инфекций, в частности кишечных инфекций.
LC-PUFA
Настоящая пищевая композиция предпочтительно содержит длинноцепочечные полиненасыщенные жирные кислоты (LC-PUFA). LC-PUFA представляют собой жирные кислоты или жирные ацильные цепи с длиной 20-24 атомов углерода, предпочтительно 20 или 22 атомов углерода, содержащие две или более ненасыщенных связей. Предпочтительно пищевая композиция содержит, по меньшей мере, одну, предпочтительно две, более предпочтительно три LC-PUFA, выбранные из докозагексаеновой кислоты (DHA), эйкозапентаеновой кислоты (EPA) и арахидоновой кислоты (ARA) . Было обнаружено, что данные LC-PUFA улучшают барьерную функцию кишечника и поэтому особенно выгодно комбинировать с 2-‘FL, бутиратом и необязательным 3’-GL для дополнительного улучшения кишечного барьера. Данная комбинация имеет неожиданные выгодные эффекты и предпочтительно работает синергетически. Предпочтительно пищевая композиция содержит повышенное количество данных LC-PUFA. Текущие детские смеси, в случае, если они содержат данные LC-PUFA, обычно содержат суммарное количество DHA, ARA и EPA от 0,4 до 0,9% по весу относительно всех жирных кислот. В пищевой композиции настоящего изобретения, предпочтительно количество данных LC-PUFA составляет более 1% по весу, предпочтительно более 1,1% по весу, относительно всех жирных кислот. Предпочтительно количество данных LC-PUFA составляет не более чем 15% по весу, предпочтительно не более чем 5% по весу, относительно всех жирных кислот, предпочтительно не более чем 2,5 по весу относительно всех жирных кислот. Особенно предпочтительно, когда количество данных LC-PUFA находится в диапазоне 1-15% по весу, предпочтительно 1,1-5% по весу, более предпочтительно 1,5-2,5% по весу относительно всех жирных кислот. Данный диапазон считается наиболее оптимальным для применения в детской смеси для улучшения барьерной функции кишечника.
Предпочтительно количество DHA составляет, по меньшей мере, 0,4, предпочтительно, по меньшей мере, 0,5% по весу, относительно всех жирных кислот. Предпочтительно количество DHA составляет не более чем 1% по весу, предпочтительно не более чем 0,7% по весу, относительно всех жирных кислот. Предпочтительно пищевая композиция содержит количество DHA, по меньшей мере, 0,5% по весу, предпочтительно, по меньшей мере, 0,7% по весу, более предпочтительно, по меньшей мере, 1% по весу, относительно всех жирных кислот. Предпочтительно пищевая композиция содержит количество DHA 0,4-1% по весу, более предпочтительно 0,5-0,7% по весу.
Предпочтительно пищевая композиция содержит количество EPA, по меньшей мере, 0,09% по весу, предпочтительно, по меньшей мере, 0,1% по весу, относительно всех жирных кислот, и предпочтительно не более чем 0,4% по весу, более предпочтительно не более чем 0,1% по весу. Предпочтительно пищевая композиция содержит количество EPA 0,09-0,4% по весу, более предпочтительно 0,1-0,2% по весу.
Предпочтительно пищевая композиция содержит количество ARA, по меньшей мере, 0,25% по весу относительно всех жирных кислот, более предпочтительно, по меньшей мере, 0,5% по весу и предпочтительно не более чем 1% по весу. Предпочтительно пищевая композиция содержит количество ARA 0,4-1% по весу, более предпочтительно 0,5-0,7% по весу.
Предпочтительно пищевая композиция содержит DHA в количестве 0,4-1,0% по весу относительно всех жирных кислот, и EPA в количестве 0,09-0,4% по весу относительно всех жирных кислот. Более предпочтительно, пищевая композиция содержит DHA в количестве 0,5-0,7% по весу относительно всех жирных кислот, и EPA в количестве 0,1-0,2% по весу относительно всех жирных кислот. Особенно предпочтительно, когда пищевая композиция содержит DHA в количестве более чем 0,5% по весу относительно всех жирных кислот, и EPA в количестве более чем 0,1% по весу относительно всех жирных кислот. Предпочтительно пищевая композиция содержит DHA, EPA и ARA в количестве 0,4-1,0% по весу, 0,09-0,4% по весу, и 0,25-1,0% по весу относительно всех жирных кислот, соответственно. Более предпочтительно пищевая композиция содержит DHA, EPA и ARA в количестве 0,5-0,7% по весу, 0,1-0,2% по весу, и 0,5-0,7% по весу относительно всех жирных кислот, соответственно.
Предпочтительно пищевая композиция содержит DHA в количестве 20-50 мг/100 ккал и EPA в количестве 4,3-10,8 мг/100 ккал. Более предпочтительно пищевая композиция содержит DHA в количестве 25-33,5 мг/100 ккал и EPA в количестве 5,4-7,2 мг/100 ккал. Самое предпочтительное пищевая композиция содержит DHA в количестве приблизительно 25 мг/100 ккал и EPA в количестве приблизительно 5,4 мг/100 ккал. В данных вариантах осуществления наличие ARA является необязательным. Если она присутствует, количество ARA предпочтительно составляет 12,5-50 мг, более предпочтительно 25-33,5 мг и самое предпочтительное приблизительно 25 мг на 100 ккал. Предпочтительно весовое соотношение DHA/ARA составляет 0,9-2.
Предпочтительно весовое соотношение DHA/EPA/ARA составляет 1:(0,19-0,7):(0,9-2,0). Данные количества и/или соотношения DHA, EPA и ARA являются оптимальными для дополнительного улучшения барьерной функции кишечника, для дополнительного улучшения кишечных микробиотов и/или для лечения или предотвращения инфекций, в частности кишечных инфекций. LC-PUFA могут быть представлены в виде свободных жирных кислот, в форме триглицеридов, в форме диглицеридов, в форме моноглицеридов, в форме фосфолипидов или в виде смеси одного или нескольких из вышеперечисленных. Подходящими источниками данных LC-PUFA являются, например, рыбий жир и масло из Mortierella alpina.
Предпочтительно пищевая композиция настоящего изобретения содержит липид, где липид включает LC-PUFA, выбранные из группы, состоящей из DHA, EPA и ARA, и где сумма DHA, ARA и EPA составляет, по меньшей мере, 1% по весу относительно всех жирных кислот, и где липид содержит DHA в количестве 0,4-1,0% по весу относительно всех жирных кислот, EPA в количестве 0,09-0,4% по весу относительно всех жирных кислот и ARA в количестве 0,25-1% по весу относительно всех жирных кислот. В данном варианте осуществления особенно предпочтительно, когда липид содержит DHA в количестве 0,5-0,7% по весу относительно всех жирных кислот, EPA в количестве 0,1-0,2% по весу относительно всех жирных кислот и ARA в количестве 0,5-0,7% по весу относительно всех жирных кислот. Более предпочтительно липид содержит DHA в количестве, по меньшей мере, 0,5% по весу, EPA в количестве, по меньшей мере, 0,1% по весу и ARA в количестве, по меньшей мере, 0,5% по весу, все относительно всех жирных кислот.
Комбинация 2’-FL, бутирата, необязательной 3’-GL и LC-PUFA, в частности EPA, DHA и/или ARA, будет иметь дополнительный улучшенный эффект на здоровье, в частности на улучшение барьерной функции кишечника, на улучшение иммунной системы, на улучшение кишечной микробиоты и/или на лечение или предотвращение инфекций, в частности кишечных инфекций.
Пищевая композиция
Пищевая композиция настоящего изобретения не является грудным молоком.
Пищевая композиция настоящего изобретения предназначена для применения на младенцах или детях младшего возраста.
Настоящая пищевая композиция предпочтительно содержит липид, белок и углевод и предпочтительно вводят в жидкой форме. Настоящая пищевая композиция может также быть в виде сухой пищи, предпочтительно в виде порошка, который сопровождается инструкциями, как смешивать указанную сухую пищу, предпочтительно порошок, с подходящей жидкостью, предпочтительно водой. Таким образом, настоящая пищевая композиция может быть в виде порошка, пригодного для растворения в воде, получая готовую питьевую пищевую композицию, предпочтительно готовую питьевую детскую смесь, смесь второго уровня или смесь для детей младшего возраста, более предпочтительно готовую питьевую детскую смесь или смесь второго уровня. Пищевая композиция настоящего изобретения предпочтительно содержит другие фракции, такие как витамины, минералы, микроэлементы и другие питательные микроэлементы, чтобы сделать ее полноценной пищевой композицией. Предпочтительно детская смесь и смесь второго уровня содержат витамины, минералы, микроэлементы и другие питательные микровещества в соответствии с международными директивами.
Настоящая пищевая композиция предпочтительно содержит липид, белок и легкоусвояемый углевод, где липид обеспечивает 25-65% суммарных калорий, белок обеспечивает 6,5-16% суммарных калорий, и легкоусвояемый углевод обеспечивает 20-80% суммарных калорий. Предпочтительно, в настоящей пищевой композиции липид обеспечивает 30-55% суммарных калорий, белок обеспечивает 7-9% суммарных калорий, и легкоусвояемый углевод обеспечивает 35-60% суммарных калорий. Для расчета % от общего количества калорий для белка необходимо учитывать общую энергию, обеспечиваемую белками, пептидами и аминокислотами.
Предпочтительно липид обеспечивает 3-7 г липида на 100 ккал, предпочтительно 3,5-6 г на 100 ккал, белок обеспечивает 1,6-4 г на 100 ккал, предпочтительно 1,7-2,3 г на 100 ккал, и легкоусвояемый углевод обеспечивает 5-20 г на 100 ккал, предпочтительно 8-15 г на 100 ккал пищевой композиции. Предпочтительно настоящая пищевая композиция содержит липид, обеспечивающий 3,5-6 г на 100 ккал, белок, обеспечивающий 1,7-2,3 г на 100 ккал, и легкоусвояемый углевод, обеспечивающий 8-15 г на 100 ккал пищевой композиции.
Предпочтительно липид обеспечивает 2,5-6,5 г липида на 100 мл, предпочтительно 2,5-4 г на 100 мл, белок обеспечивает 1-3 г на 100 мл, предпочтительно 1-1,5 г на 100 мл, и легкоусвояемый углевод обеспечивает 3-13 г на 100 мл, предпочтительно 5-10 г на 100 мл пищевой композиции. Предпочтительно настоящая пищевая композиция содержит липид, обеспечивающий 2,0-6,5 г на 100 мл, белок, обеспечивающий 1-3 г на 100 мл, и легкоусвояемый углевод, обеспечивающий 5-10 г на 100 мл пищевой композиции.
Предпочтительно липид обеспечивает 15-45% по весу, предпочтительно 20-30% по весу, относительно сухой массы композиции, белок обеспечивает 8-20% по весу, предпочтительно 8,5-11,5% по весу, относительно сухой массы композиции, и легкоусвояемый углевод включает 25-90% по весу, предпочтительно 40-75% по весу, относительно сухой массы композиции. Предпочтительно настоящая пищевая композиция содержит липид, обеспечивающий 20-30% по весу, белок, обеспечивающий 8,5-11,5% по весу, и легкоусвояемый углевод, обеспечивающий 40-75% по весу, все относительно сухой массы композиции.
Настоящая композиция предпочтительно содержит липиды. Предпочтительно настоящая композиция содержит, по меньшей мере, один липид, выбранный из группы, состоящей из растительных липидов. Предпочтительно настоящая композиция содержит комбинацию растительных липидов и, по меньшей мере, одно масло, выбранное из группы, состоящей из рыбьего жира, масла водорослей, грибкового масла и бактериального масла. Липид настоящей пищевой композиции предпочтительно обеспечивает 3-7 г на 100 ккал пищевой композиции, предпочтительно липид обеспечивает 3,5-6 г на 100 ккал. Когда она в жидкой форме, например, в виде готовой для кормления жидкости, пищевая композиция предпочтительно содержит 2,0-6,5 г липида на 100 мл, более предпочтительно 2,5-4,0 г на 100 мл. Относительно сухой массы настоящая пищевая композиция предпочтительно содержит 15-45% по весу липида, более предпочтительно 20-30 по весу. Предпочтительно настоящая пищевая композиция включает, по меньшей мере, один, предпочтительно, по меньшей мере, два источника липидов, выбранные из группы, состоящей из рапсового масла (например, сурепного масла, рапсового масла с низким содержанием эруковой кислоты и масла канолы), высокоолеинового подсолнечного масла, высокоолеинового сафлорового масла, оливкового масла, масел морских организмов, микробных масел, кокосового масла, пальмоядрового масла.
Настоящая пищевая композиция предпочтительно содержит белок. Белок, применяемый в пищевой композиции, предпочтительно выбран из группы, состоящей из белок животных, отличных от человека, предпочтительно молочных белков, растительных белков, таких как предпочтительно соевый белок и/или рисовый белок, и их смесей. Настоящая пищевая композиция предпочтительно содержит казеин, и/или сывороточный белок, более предпочтительно бычьи сывороточные белки и/или бычий казеин. Таким образом, в одном варианте осуществления белок в настоящей пищевой композиции содержит белок, выбранный из группы, состоящей из сывороточного белка и казеина, предпочтительно сывороточной белка и казеина, предпочтительно сывороточной белок и/или казеин получены из коровьего молока. Предпочтительно белок содержит меньше чем 5% по весу относительно суммарного белка свободных аминокислот, дипептидов, трипептидов или гидролизованного белка. Настоящая пищевая композиция предпочтительно содержит казеин и сывороточные белки в весовом соотношении казеин:сывороточный белок 10:90-90:10, более предпочтительно 20:80-80:20, даже более предпочтительно 35:65-55:45.
В одном варианте осуществления, белок, применяемый в пищевой композиции, содержит гидролизованный белок, предпочтительно белок, применяемый в пищевой композиции, представляет собой гидролизованный белок или, другими словами, состоит из гидролизованного белка. Гидролизованный белок может также содержать свободные аминокислоты. Предпочтительно гидролизованный белок содержит гирдолизованный сывороточный белок. В одном варианте осуществления, белок, применяемый в пищевой композиции, представляет собой свободные аминокислоты или, другими словами, состоит из свободных аминокислот. Таким образом, в предпочтительном варианте осуществления, пищевая композиция настоящего изобретения, содержащая 2’-FL и пищевой бутират и необязательно также 3’GL, дополнительно содержит гидролизованный белок и/или свободные аминокислоты. Данные композиции предпочтительно применяют для предотвращения или лечения аллергии, более предпочтительно для предотвращения или лечении аллергии на белок коровьего молока.
% по весу белка относительно сухой массы настоящей пищевой композиции рассчитывают по способу Кьельдаля измерением общего количества азота, применяя коэффициент преобразования 6,38 в случае казеина или коэффициент преобразования 6,25 для других белков, кроме казеина. Термин «белок» или «белковый компонент», как применяют в контексте настоящего изобретения, относится к сумме белков, пептидов и свободных аминокислот.
Настоящая пищевая композиция предпочтительно содержит белок, обеспечивающий 1,6-4,0 г белка на 100 ккал пищевой композиции, предпочтительно обеспечивающий 11,7-2,3 г на 100 ккал пищевой композиции. Слишком низкое содержание белка по отношению к общему количеству калорий приведет к менее адекватному росту и развитию младенцев и детей младшего возраста. Слишком большое количество вызовет метаболическую нагрузку, например, на почки младенцев и детей младшего возраста. В жидком виде, как жидкость, готовая к употреблению, пищевая композиция предпочтительно содержит 1,0-3,0 г, более предпочтительно 1,0-1,5 г белка на 100 мл. Относительно сухой массы настоящая пищевая композиция предпочтительно содержит 8-20% по весу белка, более предпочтительно 8,5-11,5% по весу, относительно сухой массы всей пищевой композиции.
Настоящая пищевая композиция предпочтительно содержит легкоусвояемый углевод, обеспечивающий 5-20 г на 100 ккал, предпочтительно 8-15 г на 100 ккал. Предпочтительно количество легкоусвояемого углевода в настоящей пищевой композиции составляет 25-90% по весу, более предпочтительно 8,5-11,5% по весу, относительно суммарного сухого веса композиции. Предпочтительные легкоусвояемые углеводы представляют собой лактозу, глюкозу, сахарозу, фруктозу, галактозу, мальтозу, крахмал и мальтодекстрин. Лактоза представляет собой основной легкоусвояемый углевод, присутствующий в грудном молоке. Настоящая пищевая композиция предпочтительно содержит лактозу. Предпочтительно настоящая пищевая композиция не содержит больших количеств углеводов, отличных от лактозы. По сравнению с легкоусвояемыми углеводами, такими как мальтодекстрин, сахароза, глюкоза, мальтоза и другие легкоусвояемые углеводы с высоким гликемическим индексом, лактоза имеет низкий гликемический индекс и, следовательно, является предпочтительной. Настоящая пищевая композиция предпочтительно содержит легкоусвояемый углевод, где, по меньшей мере, 35% по весу, более предпочтительно, по меньшей мере, 50% по весу, более предпочтительно, по меньшей мере, 60% по весу, более предпочтительно, по меньшей мере, 75% по весу, даже более предпочтительно, по меньшей мере, 90% по весу, самое предпочтительное, по меньшей мере, 95% по весу легкоусвояемого углевода представляет собой лактоза. Относительно сухой массы настоящая пищевая композиция предпочтительно содержит, по меньшей мере, 25% по весу лактоза, предпочтительно, по меньшей мере, 40% по весу, более предпочтительно, по меньшей мере, 50% по весу лактозы.
Настоящая пищевая композиция предпочтительно содержит трудноусваиваемые олигосахариды (NDO). Термин “олигосахариды”, как применяют в настоящем изобретении, относится к сахаридам со степенью полимеризации (DP) 2-250, предпочтительно DP 2-100, более предпочтительно 2-60, даже более предпочтительно 2-10. Если олигосахарид с DP 2-100 включен в настоящую пищевую композицию, это дает в результате композиции, которые могут содержать олигосахариды с DP 2-5, DP 50-70 и/или DP 7-60. Термин “трудноусваиваемые олигосахариды” (NDO), как применяют в настоящем изобретении, относится к олигосахаридам, которые не перевариваются в кишечнике под действием кислот или пищеварительных ферментов, присутствующих в верхних отделах пищеварительного тракта человека, например, тонком кишечнике и желудке, но которые предпочтительно ферментируются кишечной микробиотой человека. Например, сахароза, лактоза, мальтоза и мальтодекстрины считаются легкоусвояемыми.
Предпочтительно настоящие трудноусваиваемые олигосахариды являются растворимыми. Термин "растворимый", как применяют в настоящем изобретении, когда речь идет о полисахаридах, волокнах или олигосахаридах, означает, что вещество является, по меньшей мере, растворимым в соответствии со способом, описанным L. Prosky et al., J. Assoc. Off. Anal. Chem. 71, 1017-1023 (1988).
Бета1,3’-галактозиллактоза может присутствовать в пищевой композиции настоящего изобретения как есть или как часть смеси галактоолигосахаридов (GOS), предпочтительно бета-галактоолигосахаридов (BGOS). В предпочтительном варианте осуществления бета1,3’-галактозиллактоза присутствует как часть смеси галактоолигосахаридов. В одном варианте осуществления, количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет более чем 20% по весу относительно всех галактоолигосахаридов.
Предпочтительно настоящая пищевая композиция также содержит фруктоолигосахариды (FOS). Термин “фруктоолигосахариды”, как применяют в настоящем изобретении, относится к углеводам, состоящим более чем на 50%, предпочтительно более чем на 65% из фруктозных звеньев в качестве мономерных звеньев, в которых, по меньшей мере, 50%, более предпочтительно, по меньшей мере, 75%, даже более предпочтительно, по меньшей мере, 90%, фруктозных звеньев соединены вместе бета-гликозидной связью, предпочтительно бета-2,1 гликозидной связью. Глюкозное звено может присутствовать на восстанавливающемся конце цепи фруктозных звеньев. Предпочтительно фруктоолигосахариды имеют DP или средний DP в диапазоне 2-250, более предпочтительно 2-100, даже более предпочтительно 10-60. Термин «фруктоолигосахариды» включает леван, гидролизованный леван, инулин, гидролизованный инулин и синтезированные фруктоолигосахариды. Предпочтительно препарат содержит короткоцепочечные фруктоолигосахариды со средней степенью полимеризации (DP) 3-6, более предпочтительно гидролизованный инулин или синтетический фруктоолигосахарид. Предпочтительно препарат содержит длинноцепочечные фруктоолигосахариды со средней DP выше 20. Предпочтительно препарат содержит как короткоцепочечные, так и длинноцепочечные фруктоолигосахариды. Фруктоолигосахарид, подходящий для применения в композиции настоящего изобретения, также является легко коммерчески доступным, например, RaftilineHP (Orafti). Предпочтительно пищевая композиция настоящего изобретения содержит, по меньшей мере, 25 мг FOS на 100 мл, более предпочтительно, по меньшей мере, 40 даже более предпочтительно, по меньшей мере, 60 мг. Предпочтительно композиция не содержит более чем 250 мг FOS на 100 мл, более предпочтительно не более чем 150 мг на 100 мл и самое предпочтительное не более чем 100 мг на 100 мл. Количество FOS предпочтительно составляет 2-250 г фруктоолигосахаридов на 100 мл, предпочтительно 40-150 г на 100 мл, более предпочтительно 60-100 г на 100 мл. Предпочтительно пищевая композиция настоящего изобретения содержит, по меньшей мере, 0,15% по весу FOS относительно сухой массы, более предпочтительно, по меньшей мере, 0,25% по весу, даже более предпочтительно, по меньшей мере, 0,4% по весу. Предпочтительно композиция не содержит более чем 1,5% по весу FOS относительно сухой массы всей композиции, более предпочтительно не более чем 2% по весу. Присутствие FOS демонстрирует дополнительный улучшенный эффект на микробиоту и производство SCFA.
Предпочтительно настоящая пищевая композиция содержит смесь галактоолигосахаридов (включая бета1,3’-галактозиллактозу) и фруктоолигосахаридов. Предпочтительно смесь галактоолигосахаридов и фруктоолигосахаридов присутствует в весовом соотношении 1/99-99/1, более предпочтительно 1/19-19/1, более предпочтительно 1/1-19/1, более предпочтительно 2/1-15/1, более предпочтительно 5/1-12/1, даже более предпочтительно 8/1-10/1, даже более предпочтительно в соотношении приблизительно 9/1. Данное весовое соотношение является особенно предпочтительным, когда галактоолигосахариды имеют низкую среднюю DP, и фруктоолигосахариды имеют относительно высокую DP. Самой предпочтительной является смесь галактоолигосахаридов со средней DP ниже 10, предпочтительно ниже 6, и фруктоолигосахаридов со средней DP выше 7, предпочтительно выше 11, даже более предпочтительно выше 20.
В предпочтительном варианте осуществления настоящая пищевая композиция содержит смесь короткоцепочечных (кц) фруктоолигосахаридов и длинноцепочечных (дц) фруктоолигосахаридов. Предпочтительно смесь короткоцепочечных фруктоолигосахаридов и длинноцепочечных фруктоолигосахаридов присутствует в весовом соотношении 1/99-99/1, более предпочтительно 1/19-19/1, даже более предпочтительно 1/10-19/1, более предпочтительно 1/5-15/1, более предпочтительно 1/1-10/1. Предпочтительной является смесь короткоцепочечных фруктоолигосахаридов со средней DP ниже 10, предпочтительно ниже 6, и фруктоолигосахаридов со средней DP выше 7, предпочтительно выше 11, даже более предпочтительно выше 20.
В другом предпочтительном варианте осуществления настоящая пищевая композиция содержит смесь короткоцепочечных (sc) фруктоолигосахаридов и длинноцепочечных (sc) галактоолигосахаридов. Предпочтительно смесь короткоцепочечных фруктоолигосахаридов и длинноцепочечных галактоолигосахаридов присутствует в весовом соотношении 1/99-99/1, более предпочтительно 1/19-19/1, даже более предпочтительно 1/10-19/1, более предпочтительно 1/5-15/1, более предпочтительно 1/1-10/1. Предпочтительной является смесь короткоцепочечных фруктоолигосахаридов и длинноцепочечных галактоолигосахаридов со средней DP ниже 10, предпочтительно ниже 6.
Настоящая пищевая композиция предпочтительно содержит 1,75-17,5% по весу всех трудноусваиваемых олигосахаридов, более предпочтительно 2,8-10,5% по весу, самое предпочтительное 4,2-7% по весу, относительно сухой массы пищевой композиции. Исходя из 100 мл настоящая пищевая композиция предпочтительно содержит 0,25-2,5 г всех трудноусваиваемых олигосахаридов, более предпочтительно 0,4-1,5 г, самое предпочтительное 0,6-1 г, исходя из 100 мл пищевой композиции. Меньшее количество трудноусваемых олигосахаридов будет менее эффективным в улучшении барьерной функции кишечника, тогда как слишком большое количество приведет к побочным эффектам в виде вздутия живота и дискомфорта в животе. Суммарное количество трудноусваиваемые олигосахариды включает галактоолигосахариды, включая бета3’-GL, фруктоолигосахариды и любые дополнительные трудноусваиваемые олигосахариды, которые могут дополнительно присутствовать в композиции.
Также важно, чтобы пищевая композиция настоящего изобретения не имела чрезмерной калорийности, но все же обеспечивала достаточное количество калорий для кормления субъекта. Следовательно, жидкая пища предпочтительно имеет калорийность 0,1-2,5 ккал/мл, более предпочтительно калорийность 0,5-1,5 ккал/мл, даже более предпочтительно 0,6-0,8 ккал/мл, и самое предпочтительное 0,65-0,7 ккал/мл.
Применение
Настоящая пищевая композиция предпочтительно представляет собой детскую смесь, смесь второго уровня или смесь для детей младшего возраста. Примеры смеси для детей младшего возраста представляет собой молоко третьего уровня, смесь третьего уровня и молочную смесь для детей 1-3 лет. Более предпочтительно пищевая композиция представляет собой детскую смесь или смесь второго уровня. Настоящую пищевую композицию можно успешно применять в качестве полноценного питания младенцам. Детская смесь определяется как смесь для применения на младенцах и может, например, быть молочной смесью первого уровня, предназначенной для младенцев от 0 до 6 или от 0 до 4 месяцев. Смесь второго уровня предназначена для младенцев от 4 или 6 месяцев до 12 месяцев. В этом возрасте младенцев начинают отлучать и переводить на другую пищу. Смесь для детей младшего возраста или смесь третьего уровня или смесь для детей 1-3 лет предназначена для детей от 12 до 36 месяцев. Предпочтительно настоящая пищевая композиция представляет собой детскую смесь.
Детская смесь, смесь второго уровня или смесь для детей младшего возраста может быть в виде жидкости, предпочтительно жидкости, готовой для применения, или в виде порошка. В одном варианте осуществления детская смесь, смесь второго уровня или смесь для детей младшего возраста находится в виде порошка, подходящего для растворения водой, давая готовую к применению детскую смесь, смесь второго уровня или смесь для детей младшего возраста. Ясно, что когда детская смесь, смесь второго уровня или смесь для детей младшего возраста настоящего изобретения находится в виде порошка, количества всех ингредиентов, включая трудноусваиваемые олигосахариды, 2’-FL и 3’-GL в указанной смеси, определяют как количества, которые будут присутствовать после разведения порошка водой, т.е. количества определяются в мг на 100 мл смеси, готовой к употреблению.
Пищевая композиция настоящего изобретения предназначена для применения в обеспечении питания младенца или маленького ребенка, предпочтительно младенца, предпочтительно возраста вплоть до 12 месяцев.
Детская смесь, смесь второго уровня или смесь для детей младшего возраста настоящего изобретения предназначена для применения в обеспечении питания младенца или маленького ребенка, предпочтительно младенца, предпочтительно возраста вплоть до 12 месяцев.
Предпочтительные варианты осуществления, описанные выше для детской смеси, смеси второго уровня и смеси для детей младшего возраста настоящего изобретения, также применимы к настоящей детской смеси для применения, смеси второго уровня для применения и смеси для детей младшего возраста для применения.
Настоящее изобретение дополнительно относится к композиции, содержащей 2-‘FL, пищевой бутират и необязательно 3-‘GL, или композиции настоящего изобретения для применения в качестве лекарственного средства. Предпочтительно указанная композиция предназначена для применения в улучшении здоровья кишечника младенцев, в частности барьерной функции кишечника и созревания кишечника, для применения в улучшении физиологии кишечника, для применения в улучшении барьерной функции кишечника, для применения в улучшении кишечной микробиоты, в частности для применения для уменьшения кишечных патогенных бактерий, для применения в лечении или предотвращении инфекций, в частности кишечных инфекций и/или для применения в лечении и/или предотвращения аллергии, и/или для применения в индукции пероральной толерантности к аллергенам.
Предпочтительно указанная композиция предназначена для применения в улучшении иммунной системы, предпочтительно для применения в снижении Th2 реакции.
Поскольку пищевая композиция настоящего изобретения обладает улучшенным эффектом на барьерную функцию кишечника, она будет уменьшать перемещение аллергенов, токсинов и/или патогенов, и тем самым предотвращать и/или лечить аллергию и/или предотвращать или вылечить инфекции. Поскольку также было обнаружено улучшенное действие на активность кишечной щелочной фосфатазы, пищевая композиция будет снижать количество кишечных патогенов, тем самым предотвращая и/или вылечивая инфекции, в частности кишечные инфекции. Улучшение созревания лактазы и пролиферации кишечных клеток также свидетельствует об улучшении созревания кишечного барьера. Наблюдалось улучшение микробиоты, увеличение количества бифидобактерий, усиленное закисление ферментацией и уменьшение количества патогенов. Улучшение кишечной микробиоты и/или иммунной системы, кроме того, полезно для предотвращения и/или лечения аллергии и инфекций, в частности кишечных инфекций. Воздействие на иммунную систему будет оказывать влияние на индукцию пероральной толерантности к аллергенам.
Эффекты как на количества IL-10, так и на CCL20, указывали на неожиданное улучшение модуляции реакции PBMC человека в присутствии комбинации 2’-FL и бутирата, которая еще больше улучшается, когда присутствует 3’-GL.
Поскольку пищевая композиция настоящего изобретения обладает улучшенным эффектом на снижение Th2 реакции, она посредством этого будет предотвращать и/или лечить аллергию.
Пищевая композиция настоящего изобретения предпочтительно предназначена для применения в обеспечении питания младенца или маленького ребенка, предпочтительно младенца, который страдает от аллергии или имеет повышенный риск заболеть аллергией.
Настоящее изобретение также относится к применению пищевой композиции настоящего изобретения для обеспечения питания младенцев или детей младшего возраста, предпочтительно для обеспечения питания младенцев.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Рисунок 1:
Влияние различных галактозиллактоз (GL) на DON-индуцированное нарушение целостности монослоя клеток Caco-2. На рисунках 1A и 1B показано трансэпителиальное электрическое сопротивление (TEER) для разных GL. На рисунках 1C и 1D показана транслокация желтого люцифера (LYF) в базолатеральный компартмент. TEER выражали в процентах от начального значения, и LYF выражали в нг/м2 x ч, т.е., в нг/мл. альфа3’-GL представляет собой Gal (альфа 1-3)-Gal (бета 1-4)-Glc; бета3’-GL представляет собой Gal (бета 1-3)-Gal (бета 1-4)-Glc; бета4’-GL представляет собой Gal (бета 1-4)-Gal (бета 1-4)-Glc’; бета6’-GL представляет собой Gal (бета 1-6)-Gal (бета 1-4)-Glc. Данные представляют собой среднее ± s.e. *: p<0,05 по сравнению с контролем, **: p<0,01 по сравнению с контролем, ***: p<0,001 по сравнению с контролем, ^: p<0,05 по сравнению с контролем DON, ^^ p<0,01 сравнению с контролем DON, ^^^ p<0,001 сравнению с контролем DON.
Рисунок 2:
Различные эффекты GL на вызванное DON повышение высвобождения IL8 Caco-2 клетками. IL-8 секреция выражена как пг/мл в виде среднего±s.e. альфа3’-GL представляет собой Gal (альфа 1-3)-Gal (бета 1-4)-Glc; бета3’-GL представляет собой Gal (бета 1-3)-Gal (бета 1-4)-Glc, бета4’-GL представляет собой Gal (бета 1-4)-Gal (бета 1-4)-Glc, бета6’-GL представляет собой Gal (бета 1-6)-Gal (бета 1-4)-Glc. Данные представляют сбой среднее±s.e. *: p<0,05 по сравнению с контролем, **: p<0,01 по сравнению с контролем, ***: p<0,001 по сравнению с контролем, ^: p<0,05 сравнению с контролем DON , ^^ p< 0,01 сравнению с контролем DON, ^^^ p< 0,001 сравнению с контролем DON.
ПРИМЕРЫ
Пример 1: детская смесь с 2’-FL и пищевым бутиратом повышает экспрессию кишечной щелочной фосфатазы
Две детские смеси подвергали стадии расщепления in vitro, и после стадии расщепления in vitro исследовали влияние на созревание кишечного барьера, в частности, на созревание щелочного фосфата (AP). AP представляет собой кишечный фермент, который экспрессируется и секретируется энтероцитами и применяется в качестве маркера дифференцировки. AP играет ключевую роль в гомеостазе кишечника и врожденной иммунной защите, дефосфорилируя вредные вещества, такие как липополисахарид микробного лиганда (эндотоксин).
Контрольная детская смесь представляла собой неферментированную детскую смесь с добавлением трудноусваиваемых олигосахаридов (scGos/lcFOS) в количестве 0,8 мг/100 мл в готовой к употреблению форме. ScGOS получают из Vivinal GOS, и lcFOS получают из RaftilineHP. Жирным компонентом являются в основном растительные масла, рыбий жир и микробное масло (источник арахидоновой кислоты). Количество масляной кислоты было ниже 0,05% по весу относительно общего количества жир.
Активная детская смесь представляла собой частично ферментированную детскую смесь, аналогичную примеру 8, т.е., дополнительно содержащую 0,1 г 2’-FL, липидный компонент, содержащий приблизительно 50% по весу жира из коровьего молока, и содержащую 1,5% по весу масляной кислоты относительно всех жирных кислот, приблизительно 3,4 г жира на 100 мл, приблизительно 0,28% по весу молочной кислоты относительно сухой массы и приблизительно 25 мг 3’-GL на 100 мл, когда она находится в форме, готовой для употребления.
In vitro расщепление:
Детские смеси получали при 13,7% (вес/об) в воде MiliQ, и 35 мл переносили в биореакторы в управляемой компьютером полудинамической модели желудочно-кишечного тракта, имитирующей состояние младенца. Каждый реактор был оборудован pH-электродом и четырьмя дозирующими линиями. Каждая дозирующая линия соединялась с насосом, добавляющим; а) соляную кислоту 0,25 М и б) бикарбонат натрия 0,5 М для контроля pH или в) искусственный желудочный сок (SGF), г) искусственный кишечный сок (SIF). Уровень pH контролировали путем стандартизации до 6,8 в начале пищеварения, затем постепенно снижая pH в течение 2-часовой желудочной фазы до 4,3. В кишечной фазе пищеварения pH постепенно повышается с 6,5 до 7,2 в течение 2 часов. В момент времени t=0 (начало пищеварения) 5,8 мл искуственной слюнной жидкости (100 мМ NaCl, 30 мМ KCl, 1,4 мМ CaCl2, 14 мМ NaHCO2, 0,6 мг/мл α-амилазы из Aspergillus oryzae (SIGMA, A9857)) добавляли в виде болюса. Начиная с t=0 и далее 12,25 мл SGF (100 мМ NaCl, 30 мМ KCl, 1,4 мМ CaCl2, 50 мМ ацетат натрия, 0,125 мг/мл пепсина из слизистой оболочки желудка свиньи (SIGMA, P7012) и 0,05 мг/мл липазы из Rhizopus oryzae, Amano) постепенно добавляли до t=120 (конец желудочной фазы). Последующая кишечная фаза начиналась с повышения pH до 6,5 и постепенного добавления 31,5 мл SIF (100 мМ NaCl, 10 мМ KCl, 1,7 мМ CaCl2, 0,17 мг/мл трипсина из поджелудочной железы крупного рогатого скота. (SIGMA, T9201), 0,18 мг/мл химотрипсина из поджелудочной железы крупного рогатого скота (SIGMA, C4129), 0,09 мг/мл липазы поджелудочной железы из поджелудочной железы свиньи (SIGMA, L0382), 1,42 мг/мл таурохолата (SIGMA, 86339) и 0,6 мг/мл тауроурсодезоксихолата (SIGMA, T0266)). В конце моделирования желудочно-кишечного пищеварения отбирали образец объемом 5 мл, смешивали с 5 мл буфера для ингибитора ферментов (0,1 М фосфат натрия, pH 5,5, 0,58 мг/мл ингибитора трипсин-химотрипсина из Glycine max (SIGMA, T9777), 34,5 мкг/мл орлистата (SIGMA, O4139)), быстро замораживали и хранили при -20°C до дальнейшего применения.
Клеточная дифференциация
Клетки из энтероцитоподобной и экспрессирующей щеточную кайму линии клеток кишечника человека C2BBe1 (ATCC® CRL-2102 ™) высевали из расчета 5000 клеток/лунка в 96-луночные планшеты Nunc™ Edge и выращивали до слияния в среде Игла, модифицированной Дульбекко (Каталог № 30-2002) с 10% фетальной телячьей сывороткой, 1% пенициллина/стрептомицина и 0,01 мг/мл человеческого трансферрина. После достижения слияния культуральную среду заменяли предварительно переваренной детской смесью, разведенной в культуральной среде без фетальной телячьей сыворотки до конечных концентраций 0,34%, 0,17% и 0,08,5% (вес/об) в четырех повторностях и инкубировали при 37°C, 5% CO2 в течение 96 часов, освежая разбавленной предварительно переваренной детской смесью через 48 часов. В конце периода инкубации на лунку собирали по 50 мкл культуральной среды, четыре экземпляра объединяли и хранили при -20°C до измерения активности AP. Затем все лунки промывали ледяным фосфатно-солевым буфером и в каждую лунку добавляли 100 мкл 50 мМ трис-HCl, 150 мМ NaCl, 0,5% тритон-100 при pH 7,0. После 30-минутной инкубации на льду собирали лизаты клеток и определяли содержание белка, применяя набор для анализа белков Thermo Fischer, Pierce BCA Protein Assay Kit в соответствии с инструкциями производителя. Активность АP определяли с помощью набора для колориметрического анализа активности щелочной фосфатазы Biovision в соответствии с инструкциями производителя. Активность АР выражали в единицах/мг белка.
Результаты
Активность АР была статистически значимо увеличена (p<0,05, t-тест) в энтероцитах, которые обрабатывали предварительно переваренной детской смесью настоящего изобретения, по сравнению с энтероцитами, обработанными предварительно переваренной контрольной смесью. Данный эффект был дозозависимым и значительно отличался при всех испытанных концентрациях. Увеличение внеклеточной активности АP по сравнению с контрольной формулой составило 43%, 36% и 32% при концентрациях детской смеси 0,34, 0,17 и 0,085% (вес/об), соответственно, смотри таблицу 1. Данное увеличение внеклеточной активности АP свидетельствует об улучшенном созревании барьерной функции кишечника и улучшенной защите от кишечных патогенных бактерий.
Таблица 1: активность AP кишечных энтероцитов, подвергшихся воздействию предварительно переваренного контрольной или экспериментальной формулы, в мЕд/мг белка.
* p значение, определенное с помощью t-критерия, двусторонней, двухвыборочной равной дисперсии
Пример 2 Детская смесь с 2’-FL и пищевым бутиратом улучшает экспрессию кишечной лактазы и пролиферацию клеток
Пищевые композиции примера 1 тестировали в аналогичном эксперименте, как в примере 1. Вместо 13,7 применяли 13,6% (вес/об) смеси. Вместо липазы из Rhizopus oryzae применяли липазу кролика в концентрации 16,6 мг/мл (Germ, REG, 340) в желудочной фазе. Во время кишечной фазы применяли 0,06 мг/мл липазы поджелудочной железы свиньи (SIGMA, L0382) и 3,5 мг/мл липазы поджелудочной железы свиньи (SIGMA L0126) вместо 0,09 мг/мл липазы поджелудочной железы из поджелудочной железы свиньи (SIGMA, L0382).
Активность лактазы измеряли смешиванием 30 мкл клеточного лизата с 30 мкл буфера для анализа (малеиновая кислота 0,625 M, лактоза 0,12 M, pH 6,0) и инкубировали при 37°C в течение 4 часов, полученную глюкозу определяли количественно. Активность лактазы выражали в мкмоль глюкоза/мин/мг.
Было обнаружено, что активность лактазы значительно увеличивалась, когда клетки обрабатывали предварительно переваренной экспериментальной тестовой детской смесью по сравнению с предварительно переваренной контрольной смесью, смотри таблицу 2.
Таблица 2: лактазная активность кишечных энтероцитов, подвергшихся воздействию предварительно переваренной контрольной или экспериментальной формулы, в мЕд/мг белка.
* p значение, определенное с помощью t-критерия, двусторонней, двухвыборочной равной дисперсии.
Активность лактазы увеличивается в дифференцирующихся энтероцитах с последующим увеличением активности сахаразы, после чего активность лактазы щеточной каймы начинает снижаться. Поскольку клетки не проявляли активности сахаразы во время измерения (данные не показаны), повышенная активность лактазы, таким образом, свидетельствует о более дифференцированном состоянии клеток.
Тест на клеточную пролиферацию
Криптоподобные клетки карциномы толстой кишки человека HT-29 высевали по 5·104 в 96-луночные планшеты Nunc™ Edge в DMEM с 10% FCS, 1% пенициллина/стрептомицина и 1 г/л галактозы. Клеткам давали возможность прикрепиться в течение 30 часов, после чего среду заменяли расщепленным IF, разведенным в культуральной среде без фетальной телячьей сыворотки до конечных концентраций 0,23%, 0,17% и 0,085% (вес/об) в трех повторностях. Различная скорость пролиферации клеток привела к разному содержанию клеточного белка после 72 часов инкубации, что было измерено лизированием клеток, с последующим определением содержания белка с помощью набора для анализа белка BCA Thermo Fischer, Pierce в соответствии с инструкциями производителя.
Клеточная пролиферация значительно увеливалась, о чем свидетельствует повышенное содержание клеточного белка в клетках, обработанных предварительно переваренной экспериментальной тестовой смесью, по сравнению с предварительно переваренной контрольной смесью (таблица 3).
Таблица 3: пролиферация (клеточный белок мкг/лунка) кишечных энтероцитов, подвергшихся воздействию предварительно переваренной контрольной или экспериментальной смеси в мЕ/мг белка.
* p значение, определенное с помощью t-критерия, двусторонней, двухвыборочной равной дисперсии.
Чтобы выполнять свою функцию барьера для внешней среды, эпителий кишечника должен постоянно обновляться. Рост и обновление эпителиальных клеток кишечника зависит от пролиферирующих клеток в криптах кишечника. Ожидается, что стимуляция скорости пролиферации клеток, таким образом, будет поддерживать барьерную функцию кишечника.
Пример 3: 3’-GL и 2’-FL защищают от нарушения кишечного барьера и предотвращают повышение проницаемости.
Бета1,3’-галактозиллактозу (бета3’-GL), бета1,4′-галактозиллактозу (бета4’-GL) и бета1,6′-галактозиллактозу (бета6’-GL) получали у Carbosynth (Berkshire, UK). Альфа1,3’-галактозиллактозу (альфа3’-GL) получали у Elicityl (Crolles, France). Очищенный дезоксидиваленол (DON) (D0156; Sigma Aldrich, St Luis, MO, USA) растворяли в чистом этаноле и хранили при -20°C. Клетки эпителиальной колоректальной аденокарциномы человека (Caco-2) получали из Американской коллекции типовых тканей (код HTB-37) (Manasse, VA, USA, пассаж 90-102).
Caco-2 клетки применяли в соответствии с установленными способами. Вкратце: клетки культивировали в среде Игла, модифицированной Дульбекко (DMEM), и высевали при плотности 0,3×105 клеток во вставки с высокой плотностью пор 0,3 см2 (0,4 мкм) с полиэтилентерефталатной мембраной (BD Biosciences, Franklin Lakes, NJ, USA), помещенные в 24-луночный планшет. Caco-2 клетки поддерживали во влажной атмосфере 95% воздуха и 5% CO2 при 37°C. После 17-19 дней культивирования получали слившийся монослой со средним трансэпителиальным электрическим сопротивлением (TEER), превышающим 400 Ω см2, измеренным вольтомметром системы электросопротивления Millicell (Millipore, Temecula, CA, USA).
Таким образом, монослои клеток Caco-2 выращивали в системе трансвел, которая представляет собой модель барьерной функции кишечника. Монослои предварительно обрабатывали в течение 24 часов различными GL, включая бета3'-GL, альфа3'-GL, бета4'-GL и бета6'-GL в концентрации 0,75% по весу GL, перед воздействием грибковый токсином дезоксиниваленол (DON), который представляет собой триггер и модельное соединение для нарушения кишечного барьера. DON разбавляли до конечной концентрации 4,2 мкМ в полной клеточной среде и добавляли к апикальной стороне, а также к базолатеральной стороне трансвелл вставок. Данная концентрация DON не влияла на жизнеспособность клеток Caco-2. Инкубация с DON составляла 24 часа.
Для исследования целостности барьера проводили измерения трансэпителиального электрического сопротивления (TEER) и проницаемости для люцифера желтого (LY). Для измерений TEER применяли вольтметр Millicel-ERS, соединенный с парой электродов в виде палочек для еды для измерения значений TEER. Результаты выражали в процентах от начального значения. Для анализа парацеллюлярного потока меченного соединения непроницаемый для мембран люцифер желтый (LY) (Sigma, Сент-Луис, Миссури, США) добавляли в концентрации 16 мкг/мл в апикальный отсек в трансвелл планшете на 4 часа, и парацеллюлярный поток определяли измерением интенсивности флуоресценции в базолатеральном компартменте с помощью спектрофотофлуориметра (FLUOstar Optima, BMG Labtech, Оффенбург, Германия), настроенного на длины волн возбуждения и излучения 410 и 520 нм, соответственно. Высвобождение интерлейкина-8 (IL-8 или CXCL8), который представляет собой типичный маркер воспаления, количественно определяли в среде апикальной стороны и базолатеральной стороны трансвелл вставок Caco-2 в ответ на обработку. Концентрации CXCL8 измеряли с помощью ELISA-анализа человеческого IL-8 (BD Biosciences, Pharmingem, Сан Диего, CA, США) в соответствии с инструкциями производителя. Подробнее о материалах и методах смотри Akbari et al, 2016, Eur J Nutr. 56 (5): 1919-1930.
Результаты показаны на рисунке 1A, B, C и D и на рисунке 2. На рисунке 1 показаны эффекты различных галактозиллактоз (GL) на вызванное DON нарушение целостности монослоя клеток Caco-2. На рисунках 1A и 1B показано трансэпителиальное электрическое сопротивление (TEER) для разных GL. На рисунках 1C и 1D показана транслокация люцифера желтого (LYF) в базолатеральный компартмент. TEER выражали в процентах от начального значения, и LYF выражали в нг/см2·ч. альфа3’-GL представляет собой Gal (альфа 1-3)-Gal(бета 1-4)-Glc; бета3’-GL представляет собой Gal(бета 1-3)-Gal(бета 1-4)-Glc; бета4’-GL представляет собой Gal(бета 1-4)-Gal(бета 1-4)-Glc; бета6’-GL представляет собой Gal(бета 1-6)-Gal (бета1-4)-Glc. Данные представляют собой среднее значение ± s.e. *: p <0,05 по сравнению с контролем, **: p <0,01 по сравнению с контролем, ***: p <0,001 по сравнению с контролем, ^: p <0,05 по сравнению с контролем DON, ^^ p <0,01 по сравнению с контролем DON, ^^^ p <0,001 по сравнению с контролем DON.
Как видно из рисунков 1A-D, присутствие DON нарушает барьерную функцию, как показано уменьшением значения TEER и увеличением потока LY для DON-контрольных образцов. Кроме того, присутствие DON увеличивало высвобождение CXCL8 (IL-8), как показано на рисунке 2. Рисунки 1A-D дополнительно показывают, что присутствие бета3'-GL предотвращает вызванную DON потерю целостности эпителиального барьера, как измерено повышенными значениями TEER и снижением потока LY, вызванного DON, через монослой кишечного эпителия. бета4'-GL и бета6'-GL не показали значительного влияния на барьерную функцию кишечного эпителия. Интересно, что бета3’-GL, т.е., галактозиллактоза с гликозидной связью β1-3, была эффективна в защите барьерной функции кишечника, тогда как альфа3’-GL, т.е., галактозиллактоза с гликозидной связью α1-3, не предотвращала вызванного DON нарушения кишечного барьера. Напротив, все галактозиллактоза были способны снижать вызванное DON высвобождение IL-8, как показано на рисунке 2.
Данные результаты указывают на специфический эффект бета3'-GL (в настоящем изобретении также называют бета1,3'-галактозиллактоза или Gal(бета 1-3)-Gal (бета 1-4)-Glc), на защиту функции кишечного эпителиального барьера, в частности, в условиях стимуляции, который выходит за рамки и/или не зависит от эффекта на предотвращение воспалительной реакции и/или от воздействия на или через микробиоту. Таким образом, данные результаты указывают на эффект, который бета3’-GL оказывает на улучшение барьерной функции кишечника и/или на предотвращение и/или лечение нарушения кишечного барьера. Кроме того, данные результаты указывают на влияние бета3'-GL на лечение, предотвращение и/или облегчение состояния, связанного с воздействием токсинов, у субъекта, в частности, когда токсин представляет собой токсин трикоцецен, и более конкретно, когда токсин представляет собой дезоксиниваленол.
В отдельном эксперименте влияние 2’фукозиллактозы на TEER и поток LYF определяли в той же модели. 2'-FL тестировали в концентрации 1 мг/мл, и было обнаружено, что он статистически значимо предотвращает вызванное DON снижение TEER и увеличение LYF, смотри таблицу 4. Это указывает на положительный эффект 2'-FL на барьерная функция кишечника. Таким образом, данный пример свидетельствует о дополнительном улучшенном эффекте на барьерную функцию кишечника в композиции при сочетании 2’-FL и бета3’-GL.
Таблица 4: Эффект 2’-FL на вызванное DON нарушение целостности монослоя клеток Caco-2.
среднее (s.e.)
*** p<0,001 по сравнению с контролем без DON.
^^ p<0,01 по сравнению с контролем с DON, ^p<0,05 по сравнению с контролем с DON
Пример 4: Бутират улучшает барьерную функцию кишечника
Исследовали эффект бутирата на барьерную функцию кишечника
Способы
Эпителиальные клетки кишечника человека T84 обычно применяют для изучения целостности кишечного барьера in vitro. Клетки Т84 (ATCC, США) культивировали на 12 мм трансвел вставках (0,4 мкм, Corning Costrar, США) в глутамаксе DMEM-F12 с пенициллин-стрептомицином (100 МЕ/мл) с добавлением 5% FBS-HI. Клетки Т84 применяли через 14 дней после достижения слияния. Монослои Т84, культивированные на трансвел фильтрах, предварительно инкубировали в течение 48 ч с или без бутирата. Затем данные образцы инкубировали дополнительные 48 ч в присутствии IL-4 (25 нг/мл). ИЛ-4 добавляли в базолатеральный компартмент; среду и добавки заменяли каждые 24 часа.
Целостность эпителиального барьера оценивали измерением трансэпителиального сопротивления (TEER; Ω x см2) эпителиальным вольтомметром (EVOM; World Precision Instruments, Германия).
Результаты показаны в таблице 5, где представлены относительные значения TEER. Столбцы 48h и 96h представляют собой увеличение TEER относительно значения t=0. Обработка IL-4 нарушало барьерную функцию кишечника; однако в присутствии бутирата это нарушение сглаживалось.
Таблица 5: Эффект бутирата на барьерную функцию кишечника.
Следовательно, данный пример указывает на дополнительный улучшенный эффект на барьерную функцию кишечника композиции, при смешении 2’-FL и пищевого бутирата и необязательно бета3’-GL.
Пример 5: 2’-FL и (3’-GL и/или бутират) влияют различно на иммунную систему
Активацию и реакции иммунных клеток определяли культивированием мононуклеарных клеток периферической крови (PBMC) человека в присутствии или в отсутствие 2’-FL, 3’-GL и масляной кислоты с или без T-клеточной специфической стимуляцией.
Материалы и способы
Выделение PBMC от здоровых доноров. Мононуклеарные клетки периферической крови человека (PBMC) от здоровых доноров выделяли из лейкоцитной пленки (Sanquin, Амстердам, Нидерланды). РВМС получали центрифугированием, применяя пробирки Leuosisp (Greiner Bio-One). PBMC собирали и промывали PBS (Gibco, Thermo Fisher Technologies)+2% термоинактивированной FCS (Invitrogen), с последующим гипотоническим лизисом эритроцитов стерильным буфером для лизиса (0,15 M NH4Cl, 0,01 M KHCO3 и 0,1 мМ ЭДТА, pH 7,4 при 4°C, все от Merck, Дармштадт, Германия). После лизиса PBMC суспендировали в замораживающей среде (70% среда RPMI 1640 (Gibco, Thermo Fisher Technologies) с добавлением 10% термоинактивированной FCS и 100 ед/мл пенициллин-стрептомицина, 20% термоинактивированной FCS и 10% DMSO (Sigma)) и криоконсервировали.
Модель активации PBMC: PBMC (0,2⋅106 клеток/лунка) культивировали в 96-луночных планшетах с плоским дном (Corning). В течение 24 часов клетки предварительно инкубировали с 2'-FL (Jennewein), 3'-GL (0-0,3% вес/об; Carbosynth) или бутиратом натрия (0,2 мМ; Sigma Aldrich) и их комбинациями. Впоследствии, клетки активировали CD3/CD28 (Pelicluster CD3 и Pelicluster CD28, Sanquin) в течение дополнительных 24 часов. После инкубации IFNγ измеряли ELISA в супернатантах (смотри ниже). Для определения активности клеток после стимуляции PBMC инкубировали с реагентом для пролиферации клеток WST-1 (10 мкл; Roche) и/или 10% Triton (5 мкл; отрицательный контроль). Через 3 часа оптическую плотность измеряли при OD 450 нм и OD 650 нм, и рассчитывали активность клеток в соответствии с инструкциями производителя.
Продуцирование IFNγ PBMC: PBMC инкубировали с указанными реагентами, и после инкубации собирали супернатанты, и уровни медиатора измеряли, применяя набор для ELISA IFNγ человека (R&D Systems Europe Ltd.) в соответствии с инструкциями производителя.
Продукция цитокинов PBMC: PBMC инкубировали с указанными реагентами. После инкубации, собирали супернатанты, и уровни IL2, IL6, IL10, IL13, IL21, TNFα, IFNγ, MIF, CCL1, CCL13, CCL17, CCL20, CCL22 и CXCL8-11 измеряли проведением ратифицированного мультиплексного иммуноанализа на основе технологии Luminex (xMAP, Luminex Austin, TX USA). Сбор данных проводили с помощью Biorad FlexMAP3D (Biorad laboratories, Hercules, США) в сочетании с программным обеспечением xPONENT версии 4.2 (Luminex). Данные анализировали подбором 5-параметрической кривой, применяя программное обеспечение Bio-Plex Manager, версия 6.1.1 (Biorad).
После стимуляции РВМС, собирали супернатанты клеточных культур, после чего измеряли цитокиновые ответы, чтобы проверить иммунную реакцию клеток. Уровни цитокинов, измеренные в стимулированных условиях, корректировали на (низкие) уровни цитокинов, измеренные в нестимулированных условиях. Кроме того, поскольку каждый донор по-своему эффективно реагирует на Т-клеточный стимул, мы рассчитали индивидуальный показатель цитокинового ответа, разделив ответ, индуцированный вмешательством, на базальный стимулированный ответ.
Обычно считается, что IL2, IL6, TNF-альфа, CCL1, CCL17 и CCL20 связаны с воспалением и/или пролиферацией. IFN-гамма, CXCL9, CXCL10 и CXCL11 считаются связанными с Th1 ответом. Считается, что IL13, CCL13 и CCL22 связаны с Th2 ответом. Считается, что IL10 и галектин-9 связаны с эффектом Treg, а IL21 связан с B-клеточным эффектом.
Статистический анализ: сравнение между стимулированными и контрольными CD3/CD28 проводили, применяя парный односторонний t-критерий (Wilcoxon), p <0,05 считали значимым различием.
Относительное среднее значение±стандартная ошибка среднего от измеренных и вычисленных значений в стимулированных условиях статистически проверяли, применяя парный двусторонний (Wilcoxon) t-критерий, p <0,05 считали значимым различием. Расчетные значения комбинированного действия отдельных ингредиентов основывались на измеренных значениях для каждого донора.
Активность иммунных клеток, измеренная с помощью WST, значительно увеличивалась через 24 часа при добавлении 2'-FL, тогда как при добавлении 3'-GL было обнаружено снижение активации. Добавление бутирата не влияло на метаболическую активность иммунных клеток ни в условиях без стимуляции, ни в условиях стимуляции Т-клетками (CD3/CD28).
Добавление 2’-FL изменяло ответ цитокинов, тогда как добавление 3’-GL не приводило к таким же изменениям. Интересно, что добавление 3’-GL к 2’-FL значительно повысило эффективность 2’-FL. Более того, разница, которую обнаружили между ответом, вызванным 3’-GL и 2’-FL и бутиратом, на метаболическую активность клеток по сравнению с продуцированием IFN-гамма, указывает на необходимость учитывать другие иммунные реакции.
В целом можно сделать вывод, что общий пул выделенных PBMC человека представляет собой разнообразный пул иммунных клеток, которые напрямую и по-разному реагируют на предоставленные HMO. Хотя клетки становятся более метаболически активными, продукция цитокинов в присутствии 2’-FL не равна продукции цитокинов в присутствии 3’-GL, что свидетельствует о дифференциальных иммунных реакциях. То же самое наблюдалось при взаимодействии с 2’-FL и бутиратом.
Результаты для 2’-FL и масляной кислоты
Интерлейкин-10 (IL10) не является цитокином, специфичным для определенного типа клеток, но широко экспрессируется многими иммунными клетками. Индукция IL10 часто происходит вместе с другими провоспалительными цитокинами, хотя пути, которые стимулируют IL10, могут отрицательно регулировать данные провоспалительные цитокины. IL10 играет центральную роль в инфекции, ограничивая/регулируя иммунный ответ на патогены и, тем самым, предотвращая повреждение хозяина. Следовательно, IL10 обычно рассматривают как регуляторный цитокин. Уровни IL 10 измеряли в культурах мононуклеарных клеток периферической крови (PBMC) от 10 доноров, являющихся людьми.
Таблица 6: уровни IL10 в PBMC в нестимулированных условиях, показаны как относительные (нормализованные) значения по сравнению с контролем без добавления, тем самым корректируя вариацию доноров
Наблюдаемая величина
Рассчитанная величина
*: парный двусторонний t-критерий (Wilcoxon), p <0,05 по сравнению с рассчитанным значением.
В человеческих PBMC, совместно культивируемых с 0,2% 2’-FL, обнаруживали значительно (p <0,05) повышенный уровень IL10 по сравнению с контролем без добавления, тогда как добавление бутирата не оказало влияния на уровни IL10. Комбинация 0,2% 2’-FL и 0,2 мМ бутирата достоверно увеличивала уровни IL10 по сравнению с контролем без добавления и с 0,2 мМ бутиратом. Интересно, что комбинация 2'-FL и бутирата повышала уровень IL10 до более высоких уровней, чем теоретически можно было ожидать, исходя из индивидуальных компонентов, смотри таблицу 6. Это свидетельствует о неожиданном, полезном увеличении регуляторной способности PBMC человека в присутствии комбинации. 2'-FL и бутирата по сравнению с отдельными ингредиентами.
В общем, CCL20 и CCR6 играют роль в рекрутировании незрелых DC и их предшественников в сайты потенциального проникновения антигена. В зависимости от тканевого микроокружения (например, местного присутствия TGF-бета, IL10 или IL15) иммунные клетки могут приобретать функциональный CCR6 и, следовательно, мигрировать к участкам продукции CCL20. Показано, что CCL20 быстро индуцирует прочную адгезию субпопуляций свежевыделенных Т-лимфоцитов к фактору межклеточной адгезии 1. Следовательно, регуляцию можно получить путем модуляции CCL20 в нестимулированных условиях.
Таблица 7. Уровни CCL-20 в нестимулированных условиях, показанные в виде относительных значений, тем самым корректируя вариацию доноров
Наблюдаемая величина
Наблюдаемая величина
Рассчитанная величина
Рассчитанная величина
парный двусторонний t-критерий (Wilcoxon): * p<0,05, ** p <0,01 по сравнению с рассчитанным значением.
В человеческих PBMC, подвергнутых воздействию 2’-FL, обнаруживали повышенный уровень CCL20 по сравнению с контролем без добавления, тогда как добавление только бутирата или 3’-GL не оказало статистически значимого эффекта на уровни CCL20. Инкубация PBMC человека с комбинацией 2’-FL и бутирата индуцировала значительно более высокие уровни CCL20 по сравнению с контролем без добавления и только бутиратом. Дополнительное присутствие 3’-GL в этой комбинации 2’-FL и бутирата еще больше повысило уровни CCL20. Неожиданно наблюдаемые уровни комбинации 2’-FL и бутирата были значительно выше, чем можно рассчитать на основе отдельных ингредиентов. Это также имело место, когда наблюдаемое значение комбинации 2’-FL, бутирата и 3’-GL сравнивали с теоретически рассчитанным значением на основе отдельных ингредиентов. Смотри таблицу 7.
Эти данные показывают, что добавление 2’-FL и бутирата влияет на иммунную реактивность PBMC человека. Дополнительное присутствие 3’-GL дополнительно улучшает иммунный ответ. Общий пул выделенных PBMC человека представляет собой разнообразный пул иммунных клеток, которые напрямую и по-разному реагируют на предоставленные HMO. Изменения, обнаруженные как в уровнях IL-10, так и в уровнях CCL20, наводят на мысль о неожиданной улучшенной модуляции реактивности PBMC человека в присутствии комбинации 2'FL и бутирата, которая еще больше улучшается, когда присутствует 3'GL.
Результаты для 2-’FL, 3’-GL и их комбинации
Изучено влияние сокультивирования с 2’FL и 3’GL и их комбинацией на культуры PBMC от 10 доноров, являющихся людьми. Сначала был определен эффект Т-клеточной специфической стимуляции через CD3/CD28.
После стимуляции человеческих РВМС собирали супернатанты клеточных культур, после чего измеряли цитокиновые ответы, чтобы проверить иммунную реакцию клеток. После Т-клеточной специфической стимуляции с помощью CD3/CD28 несколько цитокинов обнаруживали в супернатантах клеток, применяя технологию Luminex. Цитокины типа Th2 IL-4 и IL-13, хемокины CCL17 были значительно увеличены, показывая устойчивую Т-клеточную стимуляцию (Таблица 8).
Таблица 8. Уровни цитокина IL-4, IL-13 и хемокина CCL17 (пг/мл), как измерено в супернатантах клеточных культур PBMC после стимуляции CD3/CD28 по сравнению с нестимулированными условиями.
среднее (s.e.)
среднее (s.e.)
Парный односторонний t-критерий (Wilcoxon) * p <0,05, ** p <0,01, *** p <0,001, **** p <0,0001 стимулированные относительно нестимулированных
Впоследствии, чтобы проверить прямое влияние конкретных соединений на активность РВМС, клетки активировали CD3/CD28 в течение 24 часов после предварительной инкубации в течение 24 часов с 2’-FL, 3’-GL и их комбинациями. Кроме того, поскольку каждый донор по-своему эффективно реагирует на Т-клеточный стимул, индивидуальный показатель цитокинового ответа рассчитывали путем деления ответа, вызванного вмешательством, на базальный стимулированный ответ (контроль без стимуляции устанавливали на 1). Таким образом, было изучено вмешательство для 10 разных доноров.
IL-4 и IL-13 представляют собой близкородственные цитокины, которые, как известно, регулируют многие аспекты аллергического воспаления. Они играют важную роль в регулировании ответов лимфоцитов, миелоидных клеток и негематопоэтических клеток. Например; в Т-клетках IL-4 индуцирует дифференцировку наивных CD4 Т-клеток в Т-клетки типа Th2, в В клетках IL-4 запускает переключение класса иммуноглобулинов (Ig) на IgG1 и IgE, и в макрофагах IL-4 и IL-13 вызывает альтернативную активацию макрофагов.
Таблица 9: Относительный уровень IL-4, IL-13 и CCL17 в слимулированных CD3/CD28 условиях с 2’-FL и 3’-GL, или комбинацией.
Наблюдаемый эффект
рассчитанный эффект
* парный односторонний t-критерий (Wilcoxon) p <0,05 по сравнению с рассчитанным эффектом 2’-FL+3’-GL.
Т-клеточная стимуляция PBMC человека приводила к значительному увеличению IL-4 и IL-13. Предварительная инкубация клеток с 2’-FL не влияла на уровни IL-4 и IL-13 по сравнению с контролями. Однако по сравнению с контролем было обнаружено снижение в присутствии 3’-GL. Более того, комбинация 2’-FL и 3’-GL индуцировала значительно более низкие уровни IL-4 и IL-13 по сравнению с контролем и 2’-FL. Интересно, что данные сниженные уровни IL-4 и IL-13 были значительно ниже, чем можно было ожидать, исходя из расчетов индивидуальных эффектов 2’-FL и 3’-GL, смотри таблицу 9.
Эти данные показывают неожиданную сниженную реакцию Th2-типа на Т-клеточную стимуляцию в общей популяции PBMC, когда клетки находятся в присутствии комбинации 2'-FL и 3'-GL, по сравнению 3'-GL или 2'FL по отдельности.
Цитокины регулируют клеточные ответы на уровне транскрипции, в то время как хемокины играют роль в привлечении воспалительных клеток к участкам воспаления. Хемокин CCL17 (хемокин, регулируемый тимусом и активацией) представляет собой мощный хемоаттрактант для лимфоцитов Th2 и, как полагают, играет важную роль в воспалительных заболеваниях, таких как аллергия. Например, сывороточные уровни CCL17 четко отражают активность атопического дерматита, который считается Th2-доминантным воспалительным заболеванием кожи, особенно в острой фазе.
Стимуляция человеческими Т-клетками привела к значительному увеличению CCL17, смотри таблицу 9. Хотя предварительная инкубация с 2'-FL или 3'-GL не оказала значительного влияния на уровни CCL17 в стимулированных Т-клетками PBMC, значительное снижение уровня CCL17 обнаруживали, когда активированные РВМС были предварительно инкубированы как с 2'-FL, так и с 3'-GL, по сравнению с 2'-FL и 3'-GL по отдельности. На основе изменений, вызванных отдельными компонентами по сравнению с контрольными уровнями, можно рассчитать ожидаемое изменение при комбинировании вмешательств. Интересно, что когда стимулированные Т-клетками PBMC культивировали в присутствии комбинации 2’-FL и 3’-GL, индуцировались более низкие уровни CCL17, чем ожидалось. Изменения уровней CCL17 указывают на неожиданное дополнительное снижение реакции типа Th2 при Т-клеточной стимуляции в общей популяции PBMC, когда клетки находятся в присутствии комбинации 2’-FL и 3’-GL. Эти данные CCL17 соответствуют данным IL-4 и IL-13.
Общий пул выделенных PBMC человека представляет собой разнообразный пул иммунных клеток, которые могут реагировать напрямую и по-разному на предоставленные HMO. Хотя клетки становятся более метаболически активными, на уровни Th2 медиаторов IL-4, IL-13 и CCL17 не оказывало значительного влияния однократное воздействие 2’-FL, в то время как однократное воздействие 3’-GL приводило к снижению уровней данных медиаторов. Интересно, что одновременное воздействие 2’-FL и 3’-GL статистически значимо снижало уровни IL-4, IL-13 и CCL17, тем самым уменьшая реакцию типа Th2. Эти данные показывают, что добавление 3’-GL к 2’-FL может снизить развитие аллергии.
Пример 6: 2’-FL увеличивает образование бутирата микробиотой, в частности если также присутствует GOS
Образец кала от 3-месячного здорового младенца, рожденного посредством кесарева сечения, находящегося на исключительно грудном вскармливании без истории применения антибиотиков, применяли в качестве инокулята для моделирования кишечной микробиоты младенца в отделах толстой кишки квадро-SHIME® - динамической модели желудочно-кишечный тракт человека, содержащей 4 блока SHIME®, работающих параллельно, и каждый блок SHIME® состоит из 3 реакторов, имитирующих желудок и тонкий кишечник, проксимальный и дистальный отделы толстой кишки.
Профили SCFA показали, что ацетат представляет собой наиболее распространенный в дистальном отделе толстой кишки, за ним следует пропионат (таблица 10). Концентрации ацетата и пропионата были выше в присутствии scGOS/lcFOS и scGOS/lcFOS/2’-FL, чем в контрольном блоке и блоке с добавлением 2’-FL. Аналогичные наблюдения делали и в проксимальном отделе толстой кишки (данные не показаны). Интересно, что бутират генерировался раньше в дистальном отделе толстой кишки и в более высокой концентрации в присутствии 2’-FL и scGOS/lcFOS/2’-FL по сравнению с контрольной и scGOS/lcFOS группами. Уровень изобутирата, разветвленного SCFA, образующегося в результате протеолитической ферментации, снижался в дистальном отделе толстой кишки в присутствии scGOS/lcFOS/2’-FL и scGOS/lcFOS.
Таблица 10: Короткоцепочечные жирные кислоты, продуцируемые в дистальных отделах толстой кишки блока SHIME® без добавок (контроль) и с добавками в период с 1 по 3 (D1-D3), с 4 по 11 день (D4-D11) и с 12 по 15 день (D12-D15).
(Среднее ± SD)
± 3,77
± 2,32
± 5,43
± 17,67
± 9,8
± 3,35
± 10,25
± 0,97
± 1,04
± 9,26
± 6,8
± 9,20
(среднее ± SD)
± 1
± 0,58
± 1,08
± 3,4
± 3,5
± 1,03
± 3,01
± 0,49
± 0,63
± 1,04
± 2,36
± 2,55
(среднее ± SD)
± 0
± 0,12
± 0,15
± 0
± 0,1
± 0,08
± 0
± 0,49
± 0,09
± 0
± 0,32
± 0,15
(среднее ± SD)
± 0
± 0,93
± 0,28
± 0
± 0,49
± 0,23
± 0
± 0,75
± 0,21
± 0
± 0,19
± 0
Данные гликопрофиля показали, что 2’-FL не метаболизируется при добавлении отдельно, а утилизируется только в присутствии scGOS/lcFOS, где он медленно метаболизируется в проксимальных и дистальных отделах толстой кишки. Все другие углеводы, включая scGOS, были истощены в течение первого часа в проксимальном отделе толстой кишки.
Показано, что 2’-FL ферментировался только в присутствии других GOS, в частности GOS/lcFOS, что приводило к микробной экосистеме, которая, как предполагается, приносит пользу для здоровья.
scGOS/lcFOS/2’-FL усиливало продукцию бутирата, важного SCFA для барьерной функции кишечника. scGOS/lcFOS/2’-FL приводил к неожиданно более низкому уровню изобутирата, что свидетельствует о меньшей протеолитической активности в толстой кишке.
Пример 7: ингибирование патогенов в микробиоте 2’-FL, 3’-GL и бутиратом
Анаэробную ферментацию образцов фекальной суспензии тестировали в микрофлюидном минимультиферменторе BioLector Pro. Образцы фекальной суспензии отбирали у младенцев на грудном вскармливании и у младенцев на искусственном вскармливании. Данные образцы фекальной суспензии обрабатывали, добавляя 0,6 грамма фекалий в 40 мл среды Baby Reichardt V.6+слизь+сульфат аммония+лактат и ацетат. Полученные растворы помещали в микрофлюидный минимультиферментор BioLector Pro. В тестовые эксперименты добавляли 3-GL, 2’-FL, 3-GL+2’-FL и GOS/FOS. В контрольный эксперимент добавляли стерильную воду.
Кроме того, в тестовые эксперименты добавляли Clostridium difficile C153 (агар с диффициле), Salmonella enteriditis S29 (агар XLD), Cronobacter sakasakii E71 (хромогенный агар) или Klebsiella pneumonia K2 (цитратинозитольный агар Саймонса). Для каждого NDO и для контроля также готовили культуру, свободную от патогенов.
После ферментации ферментированные растворы тестировали на содержание SCFA (в частности, уксусную кислоту, пропионовую кислоту, масляную кислоту и изомасляную кислоту), содержание аммиака, содержание лактата и концентрацию патогенов. Также для определения состава микробиоты было выполнено выделение ДНК+идентификация и 16s секвенирование.
Применяли 32-луночный планшет, который может работать с низким pH. Лунки данного планшета заполняли фекальным раствором. 2,5% (вес/об) различных стерильных растворов углеводов (3'-GL, 2'-FL, 2'-FL/3'-GL (2,0+0,5%) и глюкозу добавляли к фекальной суспензии по шаблону.
Эксперимент начинали, и заданное значение pH составляло либо 5,5 (инокулят от младенца 1, рожденного естественным путем, вскармливаемого грудью, 5 месячного возраста) или pH 6,0 (инокулят от младенца 2, рожденного естественным путем, вскармливаемого грудью, 5 месячного возраста) с постоянным регулированием pH, температурой 37°C, влажностью 85%, контролем OD. Через 4, 8 и 24 часа отбирали образец для определения КОЕ на TOS-пропионатном MUP-агаре (общие бифидобактерии), XLD-агаре для Salmonella enteriditis S29 и цитратинозитольном агаре Саймонса на Klebsiella pneumonia K2 и для SCFA, анализ D- и L-лактата и аммиака. Фекальный осадок применяли для 16s ДНК секвенирования.
Для обоих инокулятов степень ферментации, измеренная по потреблению NaOH, т.е., образование кислоты, была самой высокой при комбинации 3’-GL/2’-FL по сравнению с только 3’-GL или 2’-FL. Скорость начального закисления была высокой для 3’-GL и 3’-GL/2’-FL. Обычно 2’-FL в отдельности приводил к более медленному и меньшему закислению. Поскольку количество углеводов, которые можно ферментировать, является одинаковым в реакционных сосудах, более высокое общее закисление с комбинацией указывает на неожиданный синергетический эффект комбинации 2’-FL и 3’-GL. SCFA, которые были получены, большей частью представляли собой уксусную кислоту. Также продуцировалась L-молочная кислота.
Рост бифидобактерий наблюдали с 3’-GL, 2’-FL и смесью 2’-FL/3’-GL, и стимуляция роста в целом была очень похожей. Однако через 24 часа самый высокий уровень наблюдали для смеси 3'-GL/2'-FL для ребенка 1. Также наблюдали рост Enterobacteriaceae, и он был очень похож в тестируемых условиях, но был самым низким через 8 часов для комбинации 2'-FL/3'-GL для инокулята ребенка 1. Данные 16s секвенирования микробиоты в данный момент времени показали относительное снижение уровня Proteobacteria (основным источником является род Escherichia). В конце ферментации, когда углеводы были истощены, микробиота, питавшаяся 2’FL/3’GL, была способна сохранять более положительную композицию микробиоты, чем контроли (глюкоза и без добавок). Для инокулята ребенка 2 эффект на бифидобактерии был самым высоким в присутствии 3’-GL, и эффект снижения роста на энтеробактерии был лучшим, когда применяли комбинацию 3’GL/2’FL.
В условиях, когда в сосуды добавляли смесь патогенных микроорганизмов, в целом наблюдалось немного сниженное закисления по сравнению с условиями, в которых не было добавок патогенов. Однако влияние 2'-FL, 3'-GL и 2'-FL/3'-GL на закисление, определяемое по потреблению NaOH, не было затронуто, и снова было самым высоким с 3'-GL/2'-FL для обоих инокулятов. Для инокулята ребенка 1 рост сальмонелл наиболее ограничивался 2’-FL, тогда как рост клебсиелл наиболее ингибировался комбинацией 3’-GL/2-’FL. Для инокулята ребенка 2 рост сальмонелл был наиболее ограничен 2’-FL, тогда как рост клебсиелл наиболее ингибировался 3’-GL или комбинацией 3’-GL/2’-FL. Для обоих посевов рост C. difficile был ограничен при всех условиях.
Данные результаты указывают на улучшенный эффект на функцию кишечной микробиоты и на то, что композиция 2’-FL и 3’-GL обладает эффектом, выходящую за рамки эффектов 2’-FL или 3’-GL по отдельности. Это указывает на то, что композиция с пищевым бутиратом и 2’FL будет иметь дополнительно улучшенный эффект на микробиоту, когда присутствует дополнительная 3’GL.
Пример 8: Детская смесь
Детская смесь, предназначенная для младенцев 0-6 месяцев, содержащая на 100 мл, после растворения 13,7 г порошка до конечного объема 100 мл:
66 ккал,
1,3 г белка (весовое соотношение сывороточный белок/казеин 1/1),
7,3 г легкоусвояемых углеводов (в основном была лактоза),
3,4 грамм жира (из которых приблизительно 50% по весу жир коровьего молока, причем остальное представляет собой растительные масла, рыбий жир и микробное масло). Относительно всех жирных кислот количество масляной кислоты составляет 1,48% по весу, количество арахидоновой кислоты составляет 0,52% по весу, количество эйкозапентаеновой кислоты составляет 0,11% по весу, количество докозагексаеновой кислоты составляет 0,52% по весу,
0,9 г трудноусваиваемых олигосахаридов, из которых 0,1 г 2’-FL (источник Jennewein), 0,08 г длинноцепочечных фруктоолигосахаридов (источник RaftilineHP), 0,72 г галактоолигосахаридов (из которых приблизительно 25 мг 3’галактозиллактозы, полученной ферментацией, причем остаток представляет собой галактоолигосахариды из Vivinal GOS),
Минералы, витамины, микроэлементы и другие питательные микровещества в соответствии с директивами для детской смеси,
Часть смеси, приблизительно 26% по весу относительно сухой массы, получают из продукта Lactofidus, ферментированного штаммами S. thermophilus и B. breve, давая в результате приблизительно 0,28% по весу молочной кислоты относительно сухой массы композиции, из которых более чем 95% по весу находится в L-форме.
Пример 9: Молочная смесь второго уровня
Молочная смесь второго уровня, предназначенная для младенцев старше 6 месяцев, содержащая на 100 мл, после растворения 14,55 г порошка до конечного объема 100 мл:
68 ккал,
1,36 г белка (весовое соотношение сывороточный белок/казеин 4/6),
8,1 г легкоусвояемых углеводов (в основном была лактоза),
3,2 г жира (из которых приблизительно 50% по весу жир коровьего молока, причем остаток представляет собой растительное масло, рыбий жир и микробное масло). Относительно всех жирных кислот количество масляной кислоты составляет 1,47% по весу, количество арахидоновой кислоты составляет 0,29% по весу, количество эйкозапентаеновой кислоты составляет 0,12% по весу, количество докозагексаеновой кислоты составляет 0,56% по весу
0,85 г трудноусваиваемых олигосахаридов, из которых 0,05 г 2’-FL (источник Jennewein, название?), 0,08 г длинноцепочечных фруктоолигосахаридов (источник RaftilineHP), 0,72 г галактоолигосахаридов (из которых приблизительно 25 мг 3’галактозиллактозы, полученной ферментацией, причем остаток составляют галактоолигосахариды из Vivinal GOS),
Минералы, витамины, микроэлементы и другие питательные микровещества в соответствии с директивами для детской смеси,
Часть смеси, приблизительно 26% по весу относительно сухой массы, получают из продукта Lactofidus, ферментированного штаммами S. thermophilus и B. breve, давая в результате приблизительно 0,28% по весу молочной кислоты относительно сухой массы композиции, из которых более чем 95% по весу находится в L-форме.
Пример 10: Смесь для детей младшего возраста
Молочная смесь второго уровня, предназначенная для детей младшего возраста от 12 месяцев вплоть до 36 месяцев, содержащей на 100 мл, после растворения 15,07 г порошка до конечного объема 100 мл:
65 ккал,
1,3 г белка (весовое соотношение сывороточный белок/казеин 4/6),
8,7 г легкоусвояемых углеводов (в основном была лактоза),
2,6 г жира (из которых приблизительно 10% по весу жира коровьего молока, причем остаток представляет собой растительное масло, рыбий жир). Относительно всех жирных кислот количество масляной кислоты составляет приблизительно 0,35% по весу, количество эйкозапентаеновой кислоты составляет 0,42% по весу, количество докозагексаеновой кислоты составляет 0,63% по весу).
1,22 г трудноусваиваемых олигосахаридов, из которых 0,02 г 2’-FL (источник Jennewein, название), 0,12 г длинноцепочечных фруктоолигосахаридов (источник RaftilineHP), 1,08 г галактоолигосахаридов (из которых приблизительно 17 мг 3’галактозиллактозы, полученной ферментацией, причем остаток представляет собой галактоолигосахариды из Vivinal GOS),
Минералы, витамины, микроэлементы и другие питательные микровещества в соответствии с директивами для детской смеси,
Часть смеси, приблизительно 18% по весу относительно сухой массы, получают из продукта Lactofidus, ферментированного штаммами S. thermophilus и B. breve, давая в результате приблизительно 0,2% по весу молочной кислоты относительно сухой массы композиции, из которых более чем 95% по весу находится в L-форме.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИТАТЕЛЬНАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ 2'ФУКОЗИЛЛАКТОЗУ И 3'ГАЛАКТОЗИЛЛАКТОЗУ | 2020 |
|
RU2818570C2 |
| БЕТА-1,3'-ГАЛАКТОЗИЛЛАКТОЗА ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ БАРЬЕРНОЙ ФУНКЦИИ КИШЕЧНИКА | 2020 |
|
RU2818918C2 |
| ПИТАТЕЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ ПОВЫШЕНИЯ ЦЕЛОСТНОСТИ КИШЕЧНОГО БАРЬЕРА, ПОЛУЧЕНИЕ КОМПОЗИЦИИ И СПОСОБ ЛЕЧЕНИЯ | 2018 |
|
RU2788854C2 |
| СМЕСЬ, СОДЕРЖАЩАЯ ГАЛАКТОМАННАНОВУЮ КАМЕДЬ И НЕУСВАИВАЕМЫЕ ОЛИГОСАХАРИДЫ | 2021 |
|
RU2830980C1 |
| ПРИМЕНЕНИЕ СФИНГОМИЕЛИНА И НЕПЕРЕВАРИВАЕМЫХ УГЛЕВОДОВ ДЛЯ НОРМАЛИЗАЦИИ МИКРОБИОТЫ КИШЕЧНИКА | 2008 |
|
RU2478309C2 |
| ПИЩЕВАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ МОЧЕВИНУ И НЕПЕРЕВАРИВАЕМЫЕ ОЛИГОСАХАРИДЫ | 2019 |
|
RU2804305C2 |
| ПРИМЕНЕНИЕ СФИНГОМИЕЛИНА И НЕПЕРЕВАРИВАЕМЫХ УГЛЕВОДОВ ДЛЯ НОРМАЛИЗАЦИИ МИКРОБИОТЫ КИШЕЧНИКА | 2012 |
|
RU2608215C2 |
| СМЕСЬ ДЛЯ КОРМЛЕНИЯ НЕДОНОШЕННЫХ ДЕТЕЙ | 2007 |
|
RU2444911C2 |
| ПЕДИАТРИЧЕСКАЯ СМЕСЬ ПИЩЕВЫХ ВОЛОКОН | 2008 |
|
RU2471375C2 |
| НЕПЕРЕВАРИВАЕМЫЕ ОЛИГОСАХАРИДЫ ДЛЯ СНИЖЕНИЯ ТОЛСТОКИШЕЧНОЙ ФЕРМЕНТАЦИИ БЕЛКА | 2020 |
|
RU2816647C2 |
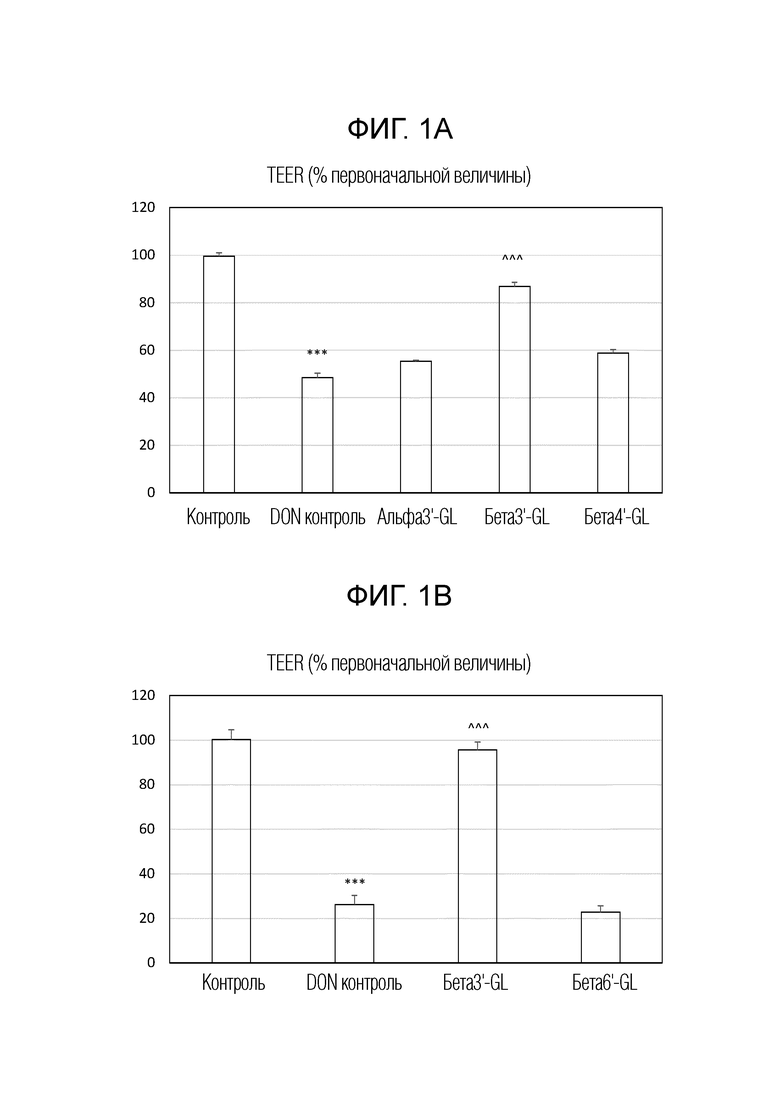
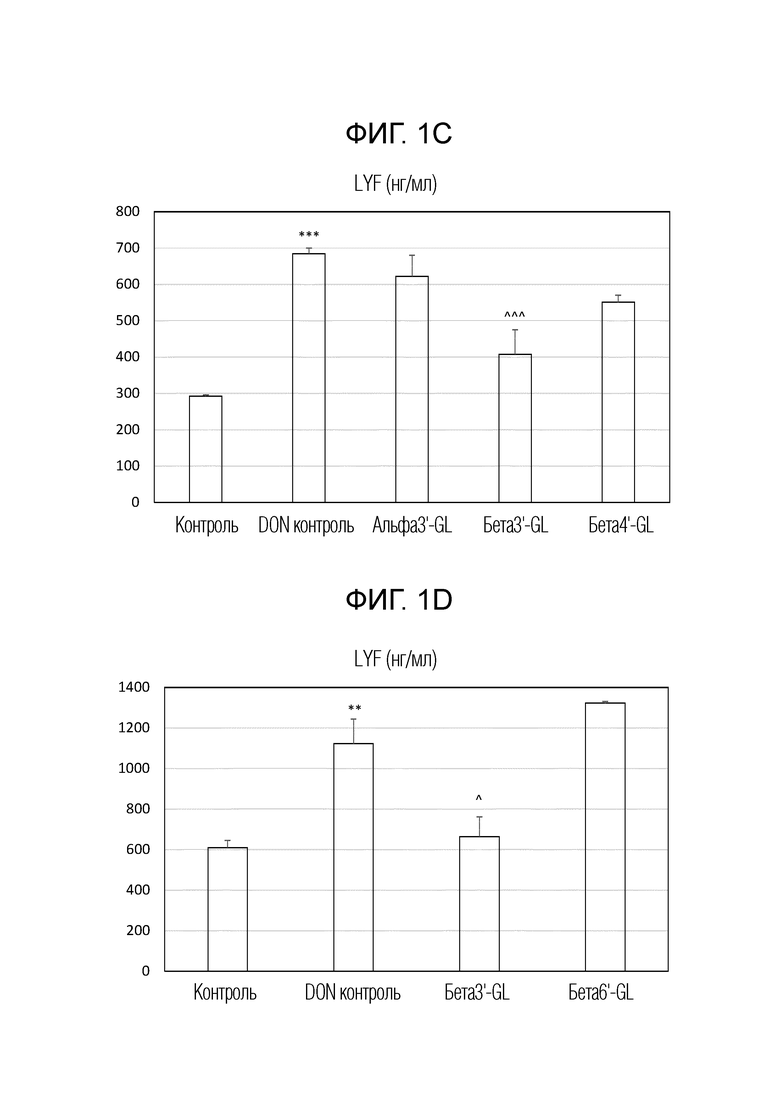
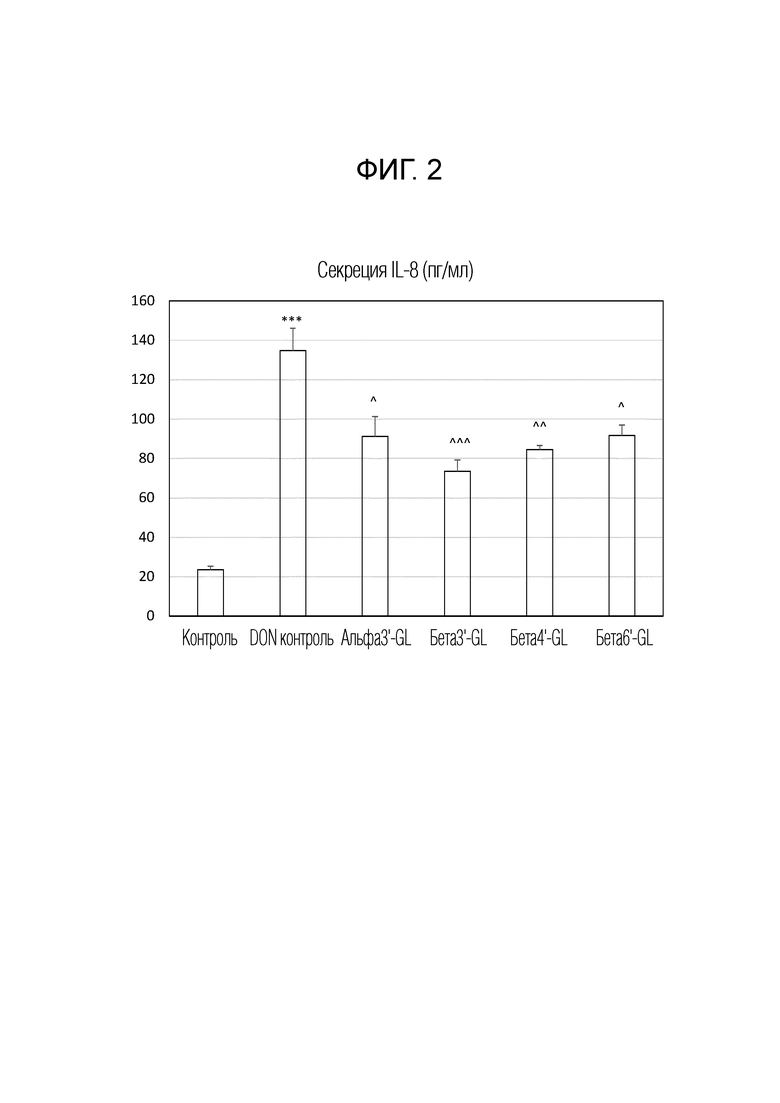
Изобретение относится к пищевой композиции для младенцев или детей младшего возраста. Пищевая композиция для младенцев или детей младшего возраста, которая не является грудным молоком, содержит 2’фукозиллактозу (2’-FL) в количестве (i) от 0,02 до 1 г 2’-FL на 100 мл пищевой композиции; (ii) от 0,15 до 7,5% по весу в расчете на сухую массу; и/или (iii) от 0,03 до 1,5 г на 100 ккал и пищевой бутират в количестве (i) от 10 мг до 175 мг на 100 мл; (ii) от 15 до 250 мг на 100 ккал; и/или (iii) от 0,075 до 1,3% по весу в расчете на сухую массу пищевой композиции. Изобретение позволяет получить пищевую композицию для обеспечения питания младенцев с целью улучшения барьерной функции кишечника, иммунной системы, кишечной микробиоты, а также для предотвращения инфекций. 3 н. и 10 з.п. ф-лы, 5 ил., 10 табл., 10 пр.
1. Пищевая композиция для младенцев или детей младшего возраста, которая не является грудным молоком, содержащая:
2’фукозиллактозу (2’-FL) в количестве (i) от 0,02 до 1 г 2’-FL на 100 мл пищевой композиции; (ii) от 0,15 до 7,5% по весу в расчете на сухую массу и/или (iii) от 0,03 до 1,5 г на 100 ккал, и
пищевой бутират в количестве (i) от 10 мг до 175 мг на 100 мл; (ii) от 15 до 250 мг на 100 ккал и/или (iii) от 0,075 до 1,3% по весу в расчете на сухую массу пищевой композиции.
2. Пищевая композиция по п. 1, дополнительно содержащая бета-3’-галактозиллактозу.
3. Пищевая композиция по любому из предшествующих пунктов, где композиция по меньшей мере частично ферментирована бактериями, продуцирующими молочную кислоту, и содержит 0,1-1,5% по весу в сумме молочной кислоты и лактата относительно сухой массы пищевой композиции и где по меньшей мере 90% по весу в сумме молочной кислоты и лактата представляет собой L-молочную кислоту и L-лактат.
4. Пищевая композиция по любому из предшествующих пунктов, где композиция дополнительно содержит длинноцепочечные полиненасыщенные жирные кислоты (LC-PUFA), выбранные из группы докозагексаеновой кислоты (DHA), арахидоновой кислоты (ARA) и эйкозапентаеновой кислоты (EPA), предпочтительно DHA и EPA, предпочтительно DHA, EPA и ARA, где пищевая композиция предпочтительно содержит по меньшей мере 1% по весу в сумме DHA, ARA и EPA относительно всех жирных кислот.
5. Пищевая композиция по любому из предшествующих пунктов, где смесь дополнительно содержит галактоолигосахариды и/или фруктоолигосахариды.
6. Пищевая композиция по любому из предшествующих пунктов, где пищевая композиция выбрана из группы, состоящей из детской смеси, смеси второго уровня или смеси для детей младшего возраста, предпочтительно детская смесь.
7. Пищевая композиция по любому из предшествующих пунктов, где композиция содержит 2’-фукозиллактозу в количестве (i) от 40 мг до 0,2 г на 100 мл пищевой композиции; (ii) от 0,3 до 1,5% по весу относительно сухой массы и/или (iii) от 0,06 до 0,3 г на 100 ккал.
8. Пищевая композиция по любому из пп. 2-7, где пищевая композиция содержит бета-3’-галактозиллактозу в количестве (i) 0,010-0,250 г на 100 мл; (ii) 0,075-2% по весу относительно сухой массы и/или (iii) 0,015-0,4 г на 100 ккал.
9. Пищевая композиция по любому из предшествующих пунктов, где пищевая композиция содержит пищевой бутират в количестве (i) от 0,035 г до 0,175 мг на 100 мл; (ii) от 0,05 до 0,25 г на 100 ккал и/или (iii) от 0,25 до 1,3% по весу относительно сухой массы пищевой композиции.
10. Пищевая композиция по любому из пп. 5-9, где пищевая композиция содержит (i) 0,2-5 г в сумме галактоолигосахаридов и фруктоолигосахаридов на 100 мл; и/или (ii) 0,3-7,5 г суммы галактоолигосахаридов и фруктоолигосахаридов на 100 ккал, 1,5-35% по весу суммы галактоолигосахаридов и фруктоолигосахаридов относительно сухой массы.
11. Применение пищевой композиции по любому одному из пп. 1-10 для улучшения барьерной функции кишечника, улучшения иммунной системы, улучшения кишечной микробиоты и для лечения или предотвращения инфекций, аллергии и в целях индукции толерантности к аллергенам.
12. Применение по п. 11, где пищевую композицию вводят младенцам или детям младшего возраста, предпочтительно младенцам.
13. Применение пищевой композиции по любому из пп. 1-10 для обеспечения питания младенцев или детей младшего возраста, предпочтительно для обеспечения питания младенцев.
| US 20120129935 A1, 24.05.2012 | |||
| US 20190029306 A1, 31.01.2019 | |||
| US 20150064220 A1, 05.03.2015 | |||
| US 20170157242 A1, 08.06.2017 | |||
| CN 107736614 A, 27.02.2018 | |||
| US 20070104700 A1, 10.05.2007 | |||
| КОМПОЗИЦИЯ ПРЕБИОТИКОВ ДЛЯ НОРМАЛИЗАЦИИ МИКРОФЛОРЫ ОРГАНИЗМА | 2011 |
|
RU2473347C1 |
Авторы
Даты
2024-05-31—Публикация
2020-06-04—Подача