Область техники
В данной заявке испрашивается приоритет и преимущество по отношению к Корейской патентной заявке №10-2016-0004383, поданной в Корейское ведомство по интеллектуальной собственности 13 января 2016 г., раскрытие которой включается в данный документ посредством ссылки.
Согласно настоящему изобретению предложена композиция для профилактики или лечения разных заболеваний, вызванных митохондриальной дисфункцией из-за пониженной экспрессии PGC-1α (коактиватор 1-альфа-рецептора, активируемого пролифераторами пероксисом).
Предшествующий уровень техники
Судьба клетки регулируется балансом и комбинацией факторов для поддержания выживания клетки и факторов для индуцирования гибели клетки. Сигнализация факторов, стимулирующих гибель клетки, начинает процессы гибели клетки посредством разных заданных путей, и ее показательным процессом является апоптоз. Процесс гибели клетки - апоптоз, который характеризуется отличительными изменениями в формах конденсации хроматина и деления ядра - происходит посредством активности ферментов каспаз из-за факторов, стимулирующих гибель клетки, во внутренней митохондриальной мембране, и данный процесс происходит с трансдукцией через наружную митохондриальную мембрану (Galluzzi et al., 2007; Kroemer et al., 2009)[1] (Chipuk et al., 2010; Youle and Strasser, 2008)[2]. Такой апоптоз посредством митохондрий начинается посредством разных стимуляций, таких как программы развития, повреждение ДНК, недостаточность факторов роста и питательных веществ, вирусная инфекция и окислительный стресс (Youle and Strasser, 2008)[3]. Однако ненормальная индукция апоптоза является очевидной причиной заболеваний. Ненормальная индукция апоптоза вызывает, например, нейродегенерацию, ишемическое реперфузионное повреждение, аутоиммунные заболевания и тому подобное (Fadeel and Orrenius, 2005)[4]. Результаты недавних исследований подтвердили, что разные заболевания могут быть вызваны функциями PGC-1α и дисрегуляцией PGC-1α при гибели и выживании клетки.
1. Нейродегенеративные заболевания
Нейродегенеративные заболевания, такие как болезнь Альцгеймера (AD), болезнь Паркинсона (PD), болезнь Гентингтона (HD) и боковой амиотрофический склероз (ALS), вызываются постепенно развивающимися дисфункциями и апоптозом нервных клеток (Jones et al., 2012)[5]. Общие признаки данных заболеваний возникают из-за потери нервных клеток в специфических частях. Можно наблюдать то, что PGC-1α непосредственно ассоциирован с такими нейродегенеративными заболеваниями на основе гиперактивности, вызванной нейродегенерацией, и поражений, проявляющихся в стриарной области мозга, в отличие от менее многочисленных поражений в коре мозга, которые можно наблюдать у нокаутированных по PGC-1α мышей (Lin et al., 2004)[6]. Наряду с этими данными можно наблюдать, что PGC-1α играет важную роль в поддержании функций нервных клеток посредством подтверждения вакуолярных поражений, показанных в центральной нервной системе нокаутированных по PGC-1α мышей (Leone et al., 2005)[7].
Патофизиологические проявления AD, такие как митохондриальная окислительная дисфункция, деградация митохондриальной продукции и мозговая дисфункция в мозгу пациентов с AD, обуславливаются митохондриальной дисфункцией (Chaturvedi & Flint, 2013)[8] - особенно снижения экспрессии PGC-1α в мозгу пациента с болезнью Альцгеймера, которые приводят к апоптозу нервных клеток из-за пониженных образования и функций митохондрий и повышенного окислительного стресса (Katsouri et al., 2011; Qin et al., 2009)[9, 10]. Пониженная экспрессия PGC-1α увеличивает экспрессию BACE1, который разрушает и расщепляет белок-предшественник амилоида, вызывающий AD, с образованием β-амилоида, увеличивая, посредством этого, количество β-амилоида, вызывая митохондриальную дисфункцию и апоптоз (Wang et al., 2013)[11].
Однонуклеотидные полиморфизмы гена PGC-1α (PPARGC1A) значимо ассоциированы с повышенными рисками PD и HD (Clark et al., 2011; Weydt et al., 2009)[12, 13]. Экспрессия гена PGC-1α снижается у пациентов с AD, PD и HD, а также в мышиных моделях HD (Cui et al., 2006; Qin et al., 2009; Ranganathan et al., 2009; Weydt et al., 2006; Xiang et al., 2011; Zheng et al., 2010)[14-19]. Таким образом, искусственная экспрессия PGC-1α в клеточной культуре - модели HD значимо снижает апоптоз нервных клеток (Chaturvedi et al., 2009)[20]. Кроме того, сверхэкспрессия PGC-1α улучшает моторную эффективность посредством моторных нейронов мышиной модели ALS (Zhao et al., 2011)[21]. Из-за таких функций PGC-1α, тесно ассоциированных с нейродегенеративными заболеваниями, появляются механизмы фармакологической активации PGC-1α в качестве новых способов излечения разных нейродегенеративных заболеваний.
2. Феномен старения посредством активных форм кислорода (ROS) PGC-1α играет ключевую роль в инициации защитных механизмов в ситуациях вызванного PGC1 окислительного стресса (Chaturvedi & Flint, 2013)[22]. Это взаимосвязано с функциями в нейродегенеративных заболеваниях, и количества митохондриальных связанных с дыханием комплексов и разобщающего белка (UCP) возрастают посредством сверхэкспрессии PGC-1α (St-Pierre et al., 2003)[23]. Данные увеличения происходят с увеличениями экспрессии групп белков, которые детоксифицируют активные формы кислорода (ROS) в митохондриях и цитоплазме (Cowell et al., 2009)[24]. В первом исследовании, выявляющем роль PGC-1α в метаболизме ROS, описано то, что эктопическая экспрессия PGC-1α в мышечных клетках увеличивает экспрессию супероксиддисмутазы 2 (SOD2), утилизирующей супероксид, и глутатионпероксидазы (GPX1), утилизирующей пероксид водорода (St-Pierre et al., 2003)[23]. С данного момента посредством расширенного поиска было исследовано, что все типы ферментов детоксификации ROS, присутствующих в разных внутриклеточных органеллах, таких как митохондрии, цитоплазма и пероксисомы, регулируются PGC-1α (St-Pierre et al., 2006; Valle et al., 2005)[25, 26]. Данные исследования также установили физиологическое значение ROS в метаболических программах, регулируемых PGC-1α. Можно видеть то, что PGC-1α выполняет цитопротекторные функции в ситуациях окислительного стресса, так как подавление экспрессии PGC-1α предотвращает увеличение групп белков детоксификации ROS (St-Pierre et al., 2006) [25].
Кроме того, связанные со старением хронические заболевания, например, дегенеративные заболевания мозга, метаболические заболевания и сердечно-сосудистые заболевания предшествуют старению клетки или старению организма. Данные заболевания увеличивают стресс, вызванный активными формами кислорода, асептическое воспаление, митохондриальную дисфункцию, повреждение ДНК и дисфункцию и укорочение теломеров. До настоящего времени понимание общих механизмов данных явлений было неполным, но недавно была представлена статья о том, что удаление PGC-1α укорачивает теломеры и индуцирует повреждения ДНК, вызывая старение сосудов и атеросклероз (Xiong, S 2015)[27]. Согласно данной статье удаление PGC-1α уменьшало активность и экспрессию обратной транскриптазы теломеров (TERT), которая поддерживает длину теломеров, и увеличивало активность и экспрессию р53. Данное исследование показывает, что PGC-1α играет ключевую роль в ослаблении старения и хронических заболеваний, вызывающих старение.
3. То, что касается сосудистых заболеваний или заболеваний миокарда Противоокислительные функции PGC-1α ассоциированы с защитой эндотелиальных клеток сосудов. Подобно моделям нейронов, увеличение экспрессии PGC-1α в человеческих эндотелиальных клетках сосудов продуцирует митохондрии и увеличивает группы ферментов детоксификации ROS (Valle et al., 2005) [26]. Приложение ROS к коровьим эндотелиальным клеткам увеличивает уровень PGC-1α и внутриклеточные антиокислительные функции (Borniquel et al., 2006) [28]. Применение искусственного окислительного стресса после сверхэкспрессии PGC-1α в человеческих эндотелиальных клетках сосудов уменьшает увеличение межклеточных ROS и препятствует активности каспазы 3 (Valle et al., 2005)[26]. Главной причиной смерти в мышиных двойных нокаутированных по PGC-1α и PGC-1β моделях является сердечная недостаточность (Lai et al., 2008)[29], и снижение уровня PGC-1α ассоциировано со стрессовой сердечной недостаточностью и гибелью клеток миокарда в мышиных моделях застойной сердечной недостаточности (Gamier et al., 2003)[30]. PGC-1α, как таковой, играет важную роль в метаболизме и росте клеток миокарда.
4. Мышечная дистрофия и родственные заболевания
Антиокислительные функции PGC-1α ассоциированы с функциями поддержания и усиления мышц. Пониженная мышечная масса и деградировавшие мышечные функции (сенильная мышечная дистрофия, саркопения или мышечная дисфункция) имеют широкий диапазон вредных эффектов на спектр заболеваний от связанных с гормонами до поддержания внутриклеточного гомеостаза. В нескольких исследованиях было выявлено то, что повышенная экспрессия PGC-1α (моторная функция или экспрессия гена) в мышечных клетках может решить проблему митохондриальной дисфункции, которая вызывает мышечную дистрофию, с поддержанием мышц [31-38].
5. Удаление жира и поддержание температуры тела
У нулевых по PGC-1α мышей экспрессия митохондриальных генов, которые содержат разные гены, действующие в качестве компонентов электронотранспортной системы (ETC), была снижена с уменьшением интенсивности дыхания (Lin et al., 2004; Leone et al., 2005)[6, 7]. Эти ослабленные митохондриальные функции повреждали физиологические процессы, зависимые от митохондриальных метаболических процессов. Действительно, дефицитные по PGC-1α мыши не могли увеличивать экспрессию UCP1, экспрессия которого увеличивается воздействием холода, и демонстрировали чувствительность к холоду (Lin et al., 2004; Leone et al., 2005)[6, 7]. Данные мыши имели пониженные моторные способности по сравнению с нормальными мышами (Leone et al., 2005) [7]. У трансгенных мышей, сверхэкспрессирующих PGC-1α в сердце и мышцах, была увеличена продукция митохондрий и была повышена экспрессия митохондриальных генов, в отличие от мышей, не имеющих PGC-1α (Lehman et al., 2000; Lin et al., 2002b; Wende et al., 2007). Данные исследования показывают то, что присутствие или отсутствие PGC-1α in vivo имеет важное влияние на физиологию митохондрий. Повышенный уровень PGC-1α в бурых или светлых преадипоцитах индуцирует дифференциацию бурых или светлых адипоцитов в коричневые адипоциты для окисления жирных кислот, увеличивая способность выделять из организма тепло вместо продуцирования АТФ. Кроме того, PGC-1α также удаляет жир [39-42].
Как хорошо известно, подкожный жир состоит из гранулярных слоев, окруженных целлюлитом. Этот подкожный жир плохо распадается посредством физических упражнений. Причиной является то, что липолитические ферменты в организме блокируются целлюлитом. Традиционно преобладающей является процедура физического отсоса адипоцитов посредством вставки катетера, именуемого акупунктурной иглой, и такая процедура причиняет боль пациенту, подвергающемуся данной процедуре, и, таким образом, данной процедуре обычно предшествует общая анестезия. Однако нельзя исключать того, что общая анестезия может действовать в качестве фактора риска для пациента, подвергающегося данной процедуре, и вставка катетера неизбежно вызывает внутреннее кровотечение и увеличивает время выздоровления ткани из-за этого.
При липолизе с использованием инъекции (инъекционный липолиз) лекарственное средство, способное к липолизу, непосредственно подкожно инъецируется в жировой сайт для растворения и выделения жира, и репрезентативные продукты, следовательно, включают липостабил®, липодиссолв, липо-зап и флаб-джаб, которые известны в качестве инъекции РРС (фосфатидилхолин). Данные инъекции РРС состоят из фосфатидилхолина и дезоксихолевой кислоты для поддержания фосфатидилхолина в жидком состоянии, и являются специальными лекарственными средствами, которые были впервые одобрены в качестве помощи для лечения печеночной комы для пациентов, впадающих в кому, вызванную циррозом. Однако инъекции РРС неправильно использовали в качестве неразрешенных средств для удаления жира, так как известно то, что инъекции РРС деградируют адипоциты с потерей массы при инъекции в жировую область. Фосфатидилхолины представляют собой главные вещества, составляющие клеточные мембраны, и полагали то, что фосфатидилхолины обеспечивают хорошее растворение жировых компонентов в крови, и что они растворяют адипоциты жировых тканей с выделением жира в адипоцитах из адипоцитов. Теоретически инъекции РРС можно использовать для удаления маленького количества подкожного жира и целлюлита, которые ограничиваются местным применением, но инъекция РРС, как таковая, не удаляет жир. Механизмы действия инъекций РРС не были выявлены. Большинство исследований по инъекциям РРС зависят от субъективной оценки пациентов, и отсутствуют результаты исследований, объективно показывающие изменения подкожной жировой массы. FDA США (Управление США по контролю качества пищевых продуктов и лекарственных средств) не одобряет применение фосфатидилхолинов для уменьшения подкожного жира из-за отсутствия данных по эффективности и безопасности инъекций РРС, и опасений относительно их неизбирательного применения. Кроме того, имеется литература, описывающая вредные эффекты на стеатогепатит, кожу и дыхательную систему.
Следовательно, авторы настоящего изобретения стремились разработать вещества, способные безопасно деградировать жиры организма для того, чтобы преодолеть побочные эффекты лекарственных средств и проблемы хронических заболеваний.
6. То, что касается старения
Старение представляет собой сложное и гетерогенное состояние, включающее несколько изменений, происходящих с течением времени. В самом деле, в случаях невозможности удовлетворения энергетических потребностей, дисфункция в некоторых физиологических процессах и повышенный стресс способствуют состоянию старения. В течение длительного периода времени митохондрии рассматривались в центре старения, так как митохондриальные функции обычно уменьшаются со старением (Quinlan et al., 2011)[43]. Например, митохондриальные функции, наряду с PGC-1α и PGC1b ослабевают во время дисфункции теломеров, и эта ситуация ассоциирована со старением (Sahin et al., 2011)[44].
В исследованиях старения наиболее заметной гипотезой является «свободнорадикальная теория старения», в которой увеличенная митохондриями продукция ROS и формирующееся в результате окислительное повреждение являются факторами, определяющими старение (Quinlan et al., 2011) [43]. В частности, полагают, что мутации митохондриальной ДНК (мтДНК) играют ключевую роль в неправильном функционировании митохондрий, ассоциированном со старением. Мышиные модели митохондриальной полимеразы с (POLG) (Kujoth et al., 2005; Trifunovic et al., 2004) [45, 46] помогли пролить свет на важность митохондрий в старении. POLG представляет собой ДНК-полимеразу, локализованную в митохондриях, и она участвует в репликации митохондриальной ДНК и репарации ДНК. Мыши с мутациями в POLG имеют большее число мутаций митохондриальной ДНК, демонстрируют алопецию (потерю шерсти) и имеют остеопороз и кардиомиопатию, и данные симптомы ассоциированы со старением (Kujoth et al., 2005; Trifunovic et al., 2004)[45, 46]. Для того чтобы проанализировать, могло ли улучшать внешние фенотипы мышей POLG увеличение числа митохондрий через экспрессию PGC-1α, данных мышей скрещивали с мышами MCK-PGC-1α Tg (Lin et al., 2002b)[47]. У мышей, экспрессирующих мутантный POLG и PGC-1α, возрастала митохондриальная активность в сердце и скелетной мышце, что приводило к улучшениям функций данных тканей по сравнению с мышами, экспрессирующими только мутантный GOLG (Dillon et al., 2012)[48]. Эти данные подчеркнули то, что повышенные митохондриальные функции имеют полезные эффекты, независимо от мутаций митохондриальной ДНК. Важно то, что повышенная экспрессия PGC-1α на протяжении времени жизни задерживает начало симптомов, ассоциированных со старением, таких как потеря мышечной массы (саркопения) (Wenz et al., 2009)[49]. Эти улучшенные функции приписываются уменьшению накопления окислительного повреждения посредством возраста и неправильных функций митохондрий (Wenz et al., 2009)[49]. В совокупности данные исследования показывают то, что PGC-1α задерживает начало симптомов, связанных со старением, и смягчает эффекты окислительного повреждения, которое произошло.
Подробное описание изобретения
Техническая проблема
Авторы настоящего изобретения намереваются предложить композицию для профилактики или лечения разных заболеваний, связанных с митохондриальной дисфункцией, вызванных понижением экспрессии PGC-1α, причем данная композиция содержит активный ингредиент, представленный общей формулой I:
Общая формула I: S-(MS)p-(MS)q
В данной общей формуле S представляет собой сиаловую кислоту; а каждый из (MS)p и (MS)q независимо представляет собой моносахаридный остаток.
Одним аспектом настоящего изобретения является предложение композиции для лечения и/или ухода при состоянии, расстройстве и/или заболевании, включающем нейродегенеративные заболевания, метаболические заболевания, местное удаление жира и заболевания, связанные с метаболизмом липидов, старение и заболевания, вызванные старением, мышечную дистрофию (саркопения, кахексия) и заболевание, вызванное мышечной дистрофией, которые предупреждаются, облегчаются и лечатся увеличением активности и продукцией ферментов, связанных с митохондриями, таких как PGC-1α, в конечном счете, увеличивая активность и продукцию митохондрий.
На протяжении всего данного описания изобретения дается ссылка на многие патентные документы и приводятся их цитирования. Раскрытия процитированных патентных документов целиком включаются в настоящее описание изобретения посредством ссылки, и более понятно объясняются уровень технической области, в пределы которой попадает настоящее изобретение, и подробности настоящего изобретения.
Техническое решение
Согласно одному аспекту настоящего изобретения предложена композиция для профилактики или лечения заболевания или симптома, ассоциированного с понижением экспрессии коактиватора 1-альфа-рецептора, активируемого пролифераторами пероксисом (PGC-1α), причем данная композиция содержит, в качестве активного ингредиента, соединение, представленное общей формулой I, или его соль, гидрат или сольват:
Общая формула I: S-(MS)p-(MS)q
В данной общей формуле S представляет собой сиаловую кислоту; а каждый из (MS)p и (MS)q независимо представляет собой моносахаридный остаток.
Согласно одному аспекту настоящего изобретения предложена композиция для лечения или лечения состояния, расстройства и/или заболевания, включающего нейродегенеративные заболевания, метаболические заболевания, местное удаление жира и заболевания, связанные с липидным метаболизмом, старение и заболевания, вызванные старением, мышечную дистрофию (саркопения, кахексия) и заболевание, вызванное мышечной дистрофией, которые предупреждаются, облегчаются и лечатся посредством увеличения экспрессии коактиватора 1-альфа-рецептора, активируемого пролифераторами пероксисом (PGC-1α), в качестве транскрипционного коактиватора, и которые вызваны митохондриальной дисфункцией, вызванной уменьшением экспрессии PGC-1α, причем данная композиция содержит, в качестве активного ингредиента, соединение, представленное общей формулой I.
Композиция для профилактики или лечения разных заболеваний, вызванных митохондриальной дисфункцией, согласно настоящему изобретению содержит для достижения таких целей в качестве активного ингредиента соединение, представленное общей формулой I:
Общая формула I: S-(MS)p-(MS)q
В данной общей формуле S представляет собой сиаловую кислоту; и каждый из (MS)p и (MS)q независимо представляет собой моносахаридный остаток.
Авторы настоящего изобретения старались разработать вещества, предотвращающие уменьшение экспрессии PGC-1α и формирующуюся в результате митохондриальную дисфункцию, которые являются причинами разных заболеваний. В результате было подтверждено, что в мышиных моделях нейродегенеративных заболеваний сиалоолигосахариды индуцируют увеличения экспрессии PGC-1α и митохондриальных функций и, таким образом, могут улучшать характер протекания нейродегенеративных заболеваний и могут предупреждать или лечить нейродегенеративные заболевания, вызванные понижением экспрессии PGC-1α и митохондриальной дисфункцией, мышечную дистрофию и формирующиеся в результате заболевания, сосудистые заболевания, старение и заболевание, вызванное старением.
В композиции по настоящему изобретению активный ингредиент представляет собой соединение общей формулы I или его соль, гидрат или сольват. В общей формуле I S представляет собой сиаловую кислоту. Сиаловая кислота может быть связана с (MS)p разными способами, но связывается с моносахаридным соединением (MS)p через α2,3-связь или α2,6-связь. В S может располагаться модифицированная сиаловая кислота, вместо сиаловой кислоты. Например, в S может располагаться модификация, в которой Н группы -ОН на углероде №4 сиаловой кислоты замещен другим заместителем, или ее ОН замещен другим заместителем. Данное замещение может представлять собой замещение в котором, например, Н заменен С1-С4-алкильной группой. С1-С4-алкильная группа может представлять собой метильную, этильную, пропильную или бутильную. Наиболее предпочтительно в S расположена немодифицированная сиаловая кислота.
Моносахаридные соединения, соответствующие (MS)p и (MS)q также могут соответствовать любому моносахаридному соединению, и их примеры включают тетрозы (например, эритроза и треоза), пентозы (например, рибоза, арабиноза, ксилоза и ликсоза) и гексозы (аллоза, алтроза, глюкоза, манноза, гулоза, идоза, галактоза и талоза). Моносахаридные соединения, расположенные в (MS)p и (MS)q, предпочтительно представляют собой пентозы или гексозы, более предпочтительно гексозы, еще более предпочтительно глюкозу, маннозу или галактозу и наиболее предпочтительно - глюкозу или галактозу. Моносахаридное соединение, соответствующее (MS)p и (MS)q, может представлять собой D- или L-стереоизомеры и наиболее предпочтительно - D-стереоизомеры.
В (MS)p и (MS)q могут быть расположены одинаковые или разные моносахардные соединения, предпочтительно - разные моносахардные соединения.
Согласно предпочтительному воплощению настоящего изобретения (MS)p представляет собой галактозу или глюкозу, и (MS)q представляет собой глюкозу или галактозу, и, наиболее предпочтительно, (MS)p представляет собой галактозу, a (MS)q представляет собой глюкозу. Когда (MS)p представляет собой галактозу, а (MS)q представляет собой глюкозу, получается дисахаридное соединение лактоза.
Моносахаридные соединения, соответствующие (MS)P или (MS)q, могут быть модифицированными или немодифицированными. Например, модифицированным моносахардным соединением может быть соединение, в котором Н группы -ОН может быть замещен ацетильной группой, и его ОН может быть замещен N-ацетильной группой. Предпочтительно моносахаридные соединения, соответствующие (MS)P или (MS)q, могут быть немодифицированными моносахаридными соединениями.
Согласно предпочтительному воплощению настоящего изобретения соединение общей формулы I, используемое в качестве активного ингредиента, представляет собой сиалиллактозу. Сиалиллактоза, которая используется в качестве активного ингредиента в настоящем изобретении, представляет собой соединение, образованное последовательным связыванием галактозы и глюкозы с сиаловой кислотой.
Сиаловая кислота может быть связана с галактозой разными способами, например, посредством α-2,3 или α-2,6 связи. Сиаловая кислота может быть модифицирована, и, например, в S может располагаться модификация, в которой Н группы -ОН на углероде №4 сиаловой кислоты замещен другим заместителем, или его ОН замещен другим заместителем. Данным замещением может быть замещение, при котором, например, Н замещен С1-С4-алкильной группой. С1-С4-алкильная группа может быть метильной, этильной, пропильной или бутильной.
Галактоза и глюкоза сиалиллактозы могут иметь D- или L-стереоизомеры и, наиболее предпочтительно - D-стереоизомеры. Галактоза и глюкоза сиалиллактозы являются модифицированными или немодифицированными. Например, модифицированным моносахаридным соединением может быть соединение, в котором Н группы -ОН может быть замещен ацетильной группой, и его ОН может быть замещен N-ацетильной группой. Предпочтительно галактоза и глюкоза сиалиллактозы являются немодифицированными моносахаридными соединениями.
Согласно предпочтительному воплощению настоящего изобретения сиалиллактоза, используемая в качестве активного ингредиента в настоящем изобретении, представляет собой α-NeuNAc-(2→3)-β-D-Gal-(1→4)-D-Glc или α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc [NeuNAc: N-ацетилнейраминил, Са1:галактоза, Glc: глюкоза]. α-NeuNAc-(2→3)-β-D-Gal-(1→4)-D-Glc представляет собой вещество, обнаруженное в ганглиозиде GM3, a α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc представляет собой изомер данного вещества.
Более предпочтительно сиалиллактоза, используемая в качестве активного ингредиента в настоящем изобретении, представляет собой α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc. Как подтверждено в примерах, приведенных ниже, α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc имеет превосходящую эффективность относительно α-NeuNAc-(2→3)-β-D-Gal-(1→4)-D-Glc.
Соединение, которое используется в качестве активного ингредиента в композиции по настоящему изобретению, может представлять собой его фармацевтически приемлемую соль, гидрат или сольват.
Термин «фармацевтически приемлемая соль» относится к соли соединения, которая дает желательные фармакологические эффекты, то есть, усиление экспрессии PGC-1α и митохондриальных функций. Примеры данной соли образуются посредством применения неорганических кислот, таких как гидрохлорид, гидробромид и гидройодид, и органических кислот, таких как ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, лара-толуолсульфонат, бисульфат, сульфамат, сульфат, нафтилат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, 2-гидроксиэтансульфат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, тозилат и ундеканоат.
Термин «фармацевтически приемлемый гидрат» относится к гидрату соединения, которое имеет желательные фармакологические эффекты. Термин «фармацевтически приемлемый сольват» относится к сольвату соединения, которое имеет желательные фармакологические эффекты. Данные гидрат и сольват также могут быть получены с использованием кислот.
Композиция по настоящему изобретению, содержащая в качестве активного ингредиента вышеупомянутое соединение общей формулы 1 или его фармацевтически приемлемую соль, гидрат или сольват, индуцирует повышение экспрессии PGC-1α и митохондриальных функций, в конечном счете демонстрируя профилактику или лечение нейродегенеративных заболеваний, сосудистых заболеваний и старения.
Термин «нейродегенеративное заболевание» в том виде, в котором он используется в данном документе, относится к общему термину для заболеваний, при которых определенные группы клеток мозга и спинного мозга постепенно теряют их функции, и число клеток мозга уменьшается. Нервные клетки мозга и спинного мозга имеют широкий спектр функций, в зависимости от их положения, и, таким образом, демонстрируют огромное разнообразие клинических аспектов, в зависимости от того, в каком положении нервные клетки сначала повреждаются и утрачивают функционирование, и в зависимости от того, в какой форме развивается такая дисфункция.
В одном воплощении настоящего изобретения нейродегенеративное заболевание представляет собой любое заболевание, выбранное из группы, состоящей из следующих: болезнь Альцгеймера (AD), боковой амиотрофический склероз (ALS, болезнь Лу Герига), мышечная дистрофия Дюшенна, болезнь Паркинсона (PD), болезнь Гентингтона (HD), болезнь Пика, болезнь Куфса, синдром Мор-Транебьерга, болезнь Уилсона, спорадическая болезнь Альцгеймера, спорадический боковой амиотрофический склероз, спорадическая болезнь Паркинсона, автономное изменение функции, расстройство сна, нейропсихиатрическое расстройство, депрессия, шизофрения, шизоаффективое расстройство, психоз Корсакова, мания, тревожное расстройство, фобическое расстройство, ухудшение способности к обучению или памяти, амнезия или связанная с возрастом потеря памяти, расстройство, связанное с недостатком внимания, депрессивное расстройство настроения, большое депрессивное расстройство, ананкастное расстройство личности, расстройство, связанное с употреблением психоактивных веществ, паническое расстройство, биполярное аффективное расстройство, мигрень, гиперактивное расстройство и дискинезия.
Более конкретно, нейродегенеративные заболевания включают острые, подострые или хронические нейродегенеративные заболевания.
Острые нейродегенеративные заболевания по настоящему изобретению включают инсульт, церебральный инфаркт, кровоизлияние в мозг, травму головы или травму спинного мозга, а подострые нейродегенеративные заболевания включают демиелинизирующие заболевания, неврологический паранеопластический синдром, подострую комбинированную дегенерацию, подострый некротизирующий энцефалит или подострый склерозирующий энцефалит. Хронические нейродегенеративные заболевания по настоящему изобретению включают потерю памяти (включающую сенильную деменцию, сосудистую деменцию, диффузное заболевание белого вещества (болезнь Бинсвангера), деменцию эндокринного или метаболического происхождения, деменцию, связанную с травмой головы и диффузным повреждением мозга, деменцию боксеров и деменцию фронтальной доли), болезнь Альцгеймера, болезнь Пика, болезнь диффузных телец Леви, прогрессирующий супрануклеарный паралич (синдром Стила-Ричардсона), множественную системную дегенерацию, хронические эпилептические состояния, ассоциированные с нейродегенерацией, заболевания моторных нейронов (включающие боковой амиотрофический склероз, дегенеративные атаксии, кортикобазальную дегенерацию, комплекс ALS-болезни Паркинсона-деменции Гуама, подострый склерозирующий панэнцефалит, болезнь Гентингтона, болезнь Паркинсона, синуклеинопатии, первичную прогрессирующую афазию, стриатонигральную дегенерацию, болезнь Мачадо-Йозефа/спинально-церебеллярную атаксию и оливопонтоцеребеллярные дегенерации), болезнь Жилль де ля Туретта, бульбарный и псевдобульбарный паралич, спинальную и спинобульбарную мышечную атрофию (болезнь Кеннеди), рассеянный склероз, первичный боковой склероз, семейную спастическую параплегию, болезнь Верднига-Хоффмана, болезнь Кугельберга-Веландера, болезнь Тэя-Сакса, болезнь Сандхоффа, семейную спастическую болезнь, болезнь Вольфарта-Кугельберга-Веландера, спастический парапарез, прогрессирующую мультифокальную лейкоэнцефалопатию, семейную дистонию (синдром Райли-Дея) и прионные заболевания (включающие болезнь Крейцфельда-Якоба, болезнь Герстманна-Штраусслера-Шейнкера, куру и смертельную семейную бессонницу).
Метаболические заболевания, заболевания, связанные с метаболизмом липидов, старение и заболевания, вызванные старением, мышечная дистрофия (саркопения, кахексия) и заболевания, вызванные мышечной дистрофией, по настоящему изобретению выбраны из группы, состоящей из следующих: изменения глюконеогенеза, целлюлит, гинекомастия, псевдогинекомастия, липоатрофия, старение, фотостарение, кожные травмы, реэпителиализация ран, дегидратация кожи, ксероз, кератинизационные расстройства, мозоли, уплотненная кожа, псориаз, поражения кожи, ассоциированные с волчанкой, себорейный дерматит, сенильный дерматит, перхоть, гнейс, себорея, гиперсеборея при угревой сыпи, солнечный дерматит, себорейный кератоз, сенильный кератоз, актинический кератоз, фотоиндуцированный кератоз, фолликулярный кератоз, угри, невус, изменение функции фибробластов, узелковый фасцит, склеродермия, контрактура Дюпюитрена, расстройство сальных желез, розацеа, полиморфные угри, комедоны, полиморфные, розовые, узелково-кистозные угри, конглобатные угри, сенильные угри, ихтиоз, болезнь Дарье, ладонно-подошвенная кератодермия, лейкоплакия, лишай слизистой, лишай кожи, экзема, обыкновенные бородавки, плоские бородавки, бородавчатая эпидермодисплазия, папилломатоз рта, красная волчанка, буллезные заболевания, пузырчатка, склеродермия, нарушения пигментации, витилиго, круговая алопеция, болезнь телец Леви, нейрофибриллярные клубки, волокна Розенталя, тельца Меллори, тяжелая миастения, синдром Жилль де ла Туретта, рассеянный склероз, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, эпилепсия, болезнь Крейцфельда-Якоба, синдром глухоты с дистонией, болезнь Лея, наследственная оптическая нейропатия Лебера, дистония, заболевание моторных нейронов, нейропатический синдром, атаксия и пигментная дегенерация сетчатки, болезнь Лея, наследуемая по материнской линии, наследственная атаксия Фридрейха и наследственная спастическая параплегия.
В одном воплощении настоящего изобретения композиция по настоящему изобретению выбрана из группы, состоящей из суспензий, сиропов, эмульсий, липосом, экстрактов, порошков, гранул, таблеток, препаратов с замедленным высвобождением и капсул.
В одном воплощении настоящего изобретения композиция по настоящему изобретению представляет собой композицию для перорального введения, и она находится в лекарственной форме системы доставки лекарственного средства, содержащей липосомы или препарат с замедленным высвобождением.
В одном воплощении настоящего изобретения, когда композиция по настоящему изобретению представляет собой композицию для парентерального введения, данная композиция может находится в лекарственной форме системы доставки лекарственного средства, содержащей липосомы и эхоконтрастный агент или препарат с замедленным высвобождением.
Композиция по настоящему изобретению может быть приготовлена в виде фармацевтической композиции, косметической композиции, нутрицевтической композиции или пищевой композиции.
Согласно предпочтительному воплощению настоящего изобретения композиция по настоящему изобретению содержит: (а) фармацевтически эффективное количество вышеупомянутого соединения общей формулы I по настоящему изобретению; и (б) фармацевтически приемлемый носитель.
Термин «фармацевтически эффективное количество» в том виде, в котором он используется в данном документе, относится к достаточному количеству для достижения эффективности или активности вышеупомянутого соединения общей формулы I.
В случаях, когда композицию по настоящему изобретению готовят в виде фармацевтической композиции, фармацевтическая композиция по настоящему изобретению содержит фармацевтически приемлемый носитель. Фармацевтически приемлемый носитель, содержащийся в фармацевтической композиции по настоящему изобретению, обычно используется во время приготовления препарата, и его примеры могут включать лактозу, декстрозу, сахарозу, сорбит, маннит, крахмал, аравийскую камедь, фосфат кальция, альгинат, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп, метилцеллюлозу, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния и минеральное масло, но не ограничиваются ими.
Фармацевтическая композиция по настоящему изобретению может дополнительно содержать смазывающее вещество, смачивающий агент, подсластитель, корригент, эмульгатор, суспендирующий агент, консервант и тому подобное, помимо приведенных выше ингредиентов. Подходящие фармацевтически приемлемые носители и агенты подробно описываются в Remington's Pharmaceutical Sciences (19-е изд., 1995).
Фармацевтическая композиция по настоящему изобретению может вводиться перорально или парентерально. Примеры парентерального введения могут включать внутривенную инъекцию, подкожную инъекцию, внутримышечную инъекцию, внутрибрюшинную инъекцию, чрескожную инъекцию, введение на слизистую, введение в виде глазных капель и тому подобное.
Правильная доза фармацевтической композиции по настоящему изобретению может варьировать, в зависимости от разных факторов, таких как способ приготовления, способ введения, возраст пациента, масса тела, пол, тяжесть заболевания и рацион, время введения, скорость выделения и чувствительность ответа. Предпочтительно доза фармацевтической композиции по настоящему изобретению составляет 0,0001-1000 мг/кг (массы тела), например, 0,001-800 мг/кг (массы тела) или 0,001-600 мг/кг (массы тела) в сутки у взрослых. Кроме того, данная фармацевтическая композиция может вводиться один или несколько раз в сутки в заданный интервал времени согласно решению врача или фармацевта.
Фармацевтическая композиция по настоящему изобретению может быть приготовлена в стандартной лекарственной форме или может быть приготовлена в многодозовом контейнере посредством применения фармацевтически приемлемого носителя и/или эксципиента согласно способу, легко осуществляемому человеком, имеющим обычную квалификацию в области, к которой относится настоящее изобретение.
Согласно предпочтительному воплощению настоящего изобретения лекарственной формой композиции по настоящему изобретению могут быть растворы, суспензии, сиропы, эмульсии, липосомы, экстракты, порошки, гранулы, таблетки, препараты с замедленным высвобождением и капсулы, и композиция по настоящему изобретению может дополнительно содержать диспергирующий агент или стабилизатор.
В частности, согласно пути введения, твердая лекарственная форма для перорального введения включает капсулы, таблетки, пилюли, порошки и гранулы. В данных твердых лекарственных формах активные соединения могут быть смешаны с по меньшей мере одним инертным фармацевтически приемлемым эксципиентом или носителем (например, цитрат натрия или дикальция фосфат) и/или а) наполнителями или расширителями (например, крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота), б) связующими агентами (например, карбоксиметилцеллюлоза, альгинат, желатин, поливинилпирролидон, сахароза и аравийская камедь, в) увлажнителями (например, глицерин), г) разрыхлителями (например, агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, силикат с заданными свойствами и карбонат натрия), д) агентами, задерживающими растворение (например, парафин), е) ускорителями поглощения (например, соединения четвертичного аммония), ж) смачивающими агентами (например, цетиловый спирт и глицеринмоностеарат), з) абсорбентами (например, каолин и бентонитовая глина) и и) смазками (например, тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси). В случае капсул, таблеток и пилюль, их лекарственная форма также может содержать буферы.
Кроме того, активные соединения могут использоваться в качестве эксципиентов, как, например, лактоза или молочный сахар, а также наполнителей в мягких и твердых желатиновых капсулах с использованием высокомолекулярных полиэтиленгликолей и тому подобного.
Твердые формы для введения - таблетки, покрытые сахаром таблетки, капсулы, пилюли и гранулы - могут быть получены с использованием покрытий и оболочек, таких как энтеросолюбильные покрытия и другие покрытия, хорошо известные в фармацевтической области. Они возможно могут содержать замутнитель, и они могут быть приготовлены таким образом, что в конкретном месте в желудочно-кишечном тракте замедленно или предпочтительно высвобождается только активный ингредиент. Также, если необходимо, активные соединения могут быть приготовлены в микрокапсулах, наряду с по меньшей мере одним из эксципиентов.
Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворители, суспензии, сиропы и эликсиры. Помимо активных соединений, жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области, такие как вода или другие растворители, солюбилизаторы и эмульгаторы (например, этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид), масла (в частности, хлопковое масло, арахисовое, кукурузное масло, масло из зародыша, оливковое масло, касторовое масло или кунжутное масло), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоль и сложный эфир жирной кислоты и сорбитана, и их смеси. Помимо инертных разбавителей, данная пероральная композиция также может содержать вспомогательные вещества, такие как смачивающий агент, эмульгатор, суспендирующий агент, подсластитель, корригент и ароматизатор.
Лекарственная форма для ректального или вагинального введения предпочтительно представляет собой суппозиторий, который может быть получен смешиванием соединения по настоящему изобретению с подходящим нераздражающим вспомогательным веществом или носителем (например, масло какао, полиэтиленгликоль или воск для суппозитория), который является твердым при комнатной температуре, но жидким при температуре тела и, следовательно, плавится в прямой кишке или вагинальной полости с высвобождением активного соединения.
Подходящая лекарственная форма для парентеральной инъекции может содержать физиологически приемлемый стерильный водный или неводный раствор, дисперсию, суспензию или эмульсию и стерильный порошок, который может быть переконфигурирован в стерильный инъецируемый раствор или дисперсию. Подходящие примеры водного или неводного носителя, разбавителя, растворителя или носителя включают воду, этанол, полиолы (пропиленгликоль, полиэтиленгликоль, глицерин и т.д.), растительные масла (оливковое масло), инъецируемые органические сложные эфиры (например, этилолеат) и их адекватные смеси.
Кроме того, композиция по настоящему изобретению может содержать вспомогательное вещество, такое как консервант, смачивающий агент, эмульгатор и диспергирующее средство. Действия микроорганизмов могут подавляться разными антибактериальными и противогрибковыми агентами (например, парабеном, хлорбутанолом, фенолом, сорбиновой кислотой и т.д.). Кроме того, композиция по настоящему изобретению может предпочтительно содержать осморегуляторы, такие как сахар и хлорид натрия. Длительное поглощение инъецируемого препарата может достигаться с использованием агентов, замедляющих поглощение (например, моностеарата алюминия и желатина).
Суспензия, помимо активных соединений, может содержать суспендирующий агент (например, этоксилированный изостеариловый спирт, полиоксиэтиленсорбитол и сложный эфир сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар, трагакант или их смеси).
В некоторых случаях для того, чтобы продлить эффекты лекарственного средства, желательно замедлить поглощение лекарственных средств из подкожной или внутримышечной инъекции. Это может достигаться применением жидкой суспензии кристаллического или аморфного вещества, имеющего плохую растворимость в воде. Здесь скорость поглощения лекарственного средства зависит от скорости растворения, которая может зависеть от размера кристаллов и кристаллической формы. Тем временем, замедленное поглощение введенной парентерально лекарственной формы осуществляется растворением или суспендированием лекарственного средства в масляном носителе.
Форма инъецируемого депо получается образованием матриц с микроинкапсулированным лекарственным средством в биодеградируемых полимерах, таких как полилактид-полигликолид. Скорость высвобождения лекарственного средства может контролироваться, в зависимости от отношения лекарственного средства к полимеру и свойств конкретного использованного полимера.
Другие примеры биодеградируемого полимера включают поли(ортоэфир) и поли(ангидрид). Кроме того, инъецируемую лекарственную форму в виде депо готовят посредством инкапсулирования лекарственного средства в липосомах или микроэмульсиях, которые являются совместимыми с тканями организма.
Инъецируемая лекарственная форма может стерилизоваться, например, посредством фильтрования через фильтр, задерживающий бактерии, или посредством включения стерилизующего агента в виде стерильной твердой композиции, которая может растворяться или диспергироваться в стерильной воде или некоторой другой стерильной инъецируемой среде немедленно перед применением.
Согласно предпочтительному воплощению настоящего изобретения композиция по настоящему изобретению представляет собой композицию для перорального введения, которая представляет собой липосомы или препарат с замедленным высвобождением.
Согласно другому предпочтительному воплощению настоящего изобретения композиция по настоящему изобретению представляет собой композицию для парентерального введения, и она находится в лекарственной форме липосом или препарата с замедленным высвобождением.
При приготовлении фармацевтической композиции по настоящему изобретению в лекарственной форме для перорального введения, а также в виде лекарственной формы для парентерального введения (предпочтительно, внутривенного введения), данная фармацевтическая композиция находится в лекарственной форме липосом или препарата с замедленным высвобождением.
Фармацевтическая композиция по настоящему изобретению может быть инкапсулирована в липосому с предоставлением стабильности лекарственной формы для доставки лекарственного средства. Липосомы, используемые в настоящем изобретении, могут быть приготовлены посредством смесей, содержащих полиолы, поверхностно-активные вещества, фосфолипиды, жирные кислоты и воду (Prescott, Ed., Methods in Cell Biology, (XIV), p.33et seq.(1976)).
Полиолы, используемые в липосомах, не являются особенно ограниченными, и их предпочтительные примеры включают пропиленгликоль, дипропиленгликоль, 1,3-бутиленгликоль, глицерин, метилпропандиол, изопренгликоль, пентиленгликоль, эритрит, ксилит и сорбит, наиболее предпочтительно - пропиленгликоль.
Поверхностно-активным веществом, используемым в получении липосом, может быть любое поверхностно-активное вещество, известное в данной области, и его примеры включают анионное поверхностно-активное вещество, катионное поверхностно-активное вещество, амфотерное поверхностно-активное вещество и неионное поверхностно-активное вещество, предпочтительно анионное поверхностно-активное вещество и неионное поверхностно-активное вещество. Конкретные примеры анионного поверхностно-активного вещества включают алкилацилглутаматы, алкилфосфаты, алкиллактаты, диалкилфосфаты и триалкилфосфаты. Конкретные примеры неионного поверхностно-активного вещества включают алкоксилированные простые алкиловые эфиры, алкоксилированные сложные алкиловые эфиры, алкилполигликозиды, полиглицериловые сложные эфиры и сложные эфиры сахаров. Наиболее предпочтительно используются полисорбаты, принадлежащие к неионным поверхностно-активным веществам.
Фосфолипид, который является другим компонентом, используемым при получении липосом, представляет собой амфотерный липид, и его примеры включают природные фосфолипиды (например, лецитин яичного желтка, соевый лецитин или сфингомиелин) и синтетические фосфолипиды (например, дипальмитоилфосфатидилхолин или гидрогенизированный лецитин), и его предпочтительным примером является лецитин. Более предпочтительно, лецитин представляет собой встречающийся в природе ненасыщенный лецитин или насыщенный лецитин, экстрагированный из соевых бобов или яичных желтков. В общем, встречающийся в природе лецитин содержит 23-95% фосфатидилхолинов и 20% или более фосфатидилэтаноламинов.
Жирные кислоты, используемые при получении липосом, представляют собой высшие жирные кислоты, и их предпочтительные примеры включают насыщенные или ненасыщенные жирные кислоты из С12-22 алкильных цепей, например, лауриновую кислоту, миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, олеиновую кислоту и линолевую кислоту. В общем, вода, используемая при получении липосом, представляет собой деионизированную дистиллированную воду.
Липосомы можно получать разными способами, известными в данной области, но наиболее предпочтительно они могут быть получены нанесением смеси, содержащей ингредиенты, в гомогенизатор с высоким давлением.
Полученные таким образом системы липосом имеют преимущество в том, что данные системы могут максимизировать доставку лекарственного средства посредством растворения разных плохо растворимых веществ и стабилизации нестабильных веществ.
Фармацевтическая композиция по настоящему изобретению может быть приготовлена в виде препарата с замедленным высвобождением для непрерывного поддержания эффективного уровня в крови эффективного ингредиента, уменьшая, посредством этого, число приемов лекарственных средств для улучшения соблюдения схемы и режима лечения лекарственным средством.
Препараты с замедленным высвобождением готовят так, чтобы они содержали носитель для замедленного высвобождения и другие вспомогательные вещества, помимо активного ингредиента по настоящему изобретению. Носитель для замедленного высвобождения, используемый в настоящем изобретении, может включать разные носители для замедленного высвобождения, известные в данной области, и, предпочтительно, полиэтиленоксид.
Кроме того, фармацевтическая композиция по настоящему изобретению может содержать, в качестве другого вспомогательного вещества, разбавляющий носитель, который является обычным в области фармации. Примеры разбавляющего носителя, используемого с этой целью, включают лактозу, декстрин, крахмал, микрокристаллическую целлюлозу, гидрофосфат кальция, карбонат кальция, сахар и диоксид кремния. Кроме того, фармацевтическая композиция по настоящему изобретению может содержать скользящее вещество для улучшения текучести, такое как стеарат цинка или стеарат магния, и другое вспомогательное вещество, которое можно использовать в области фармации.
Фармацевтическую композицию по настоящему изобретению можно использовать одну, но она может дополнительно содержать типичные активные ингредиенты, которые используются для неврологических заболеваний, сосудистых заболеваний, при старении и мышечной дистрофии, которые были упомянуты в настоящей методике, и в данных случаях фармацевтическую композицию по настоящему изобретению можно использовать в качестве более эффективной композиции посредством синергетических эффектов.
Композицию по настоящему изобретению можно готовить в виде косметической композиции. Косметическая композиция по настоящему изобретению может быть приготовлена в любой дозированной форме, которую традиционно получают, и ее примеры могут включать растворы, суспензии, эмульсии, пасты, гели, кремы, лосьоны, порошки, мыла, очищающие средства, содержащие поверхностно-активное вещество, масла, тональные крем-пудры, тональные крема на основе эмульсии, тональные крема на основе воска и спреи, но не ограничиваются ими. Более конкретно косметическая композиция по настоящему изобретению может быть приготовлена в дозированной форме смягчающего лосьона, питательного лосьона, питательного крема, массажного крема, эссенции, глазного крема, очищающего крема, очищающей пенки, очищающей воды, маски, спрея или порошка.
В случаях, когда дозированной формой по настоящему изобретению является паста, крем, лосьон или гель, в качестве ингредиента-носителя могут использоваться животное масло, растительное масло, воск, парафин, крахмал, трагакант, производное целлюлозы, полиэтиленгликоль, силикон, бентонит, диоксид кремния, тальк или оксид цинка.
Лактозу, тальк, диоксид кремния, гидроксид алюминия, силикат кальция или полиамидный порошок можно использовать в качестве ингредиента-носителя в случаях, когда дозированная форма по настоящему изобретению представляет собой порошок или спрей. В особенности, в случаях, когда дозированная форма по настоящему изобретению представляет собой спрей, данный спрей может дополнительно содержать пропеллент, такой как хлорфторуглеводород, пропан/бутан или диметиловый эфир.
Растворитель, солюбилизатор или эмульгатор можно использовать в качестве компонента-носителя в случаях, когда дозированная форма по настоящему изобретению представляет собой раствор или эмульсию, и его примеры включают воду, этанол, изопропанол, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутилгликолевое масло, алифатический сложный эфир глицерина, полиэтиленгликоль или сложный эфир жирной кислоты и сорбитана.
Жидкий растворитель (такой как вода, этанол или пропиленгликоль), суспендирующий агент (такой как этоксилированный изостеариловый спирт, сложный эфир полиоксиэтилена и сорбита или сложный эфир полиоксиэтилена и сорбитана), микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар или трагакант можно использовать в качестве ингредиента-носителя в случаях, когда лекарственная форма по настоящему изобретению представляет собой суспензию.
Сульфат алифатического спирта, сульфат простого эфира алифатического спирта, простой эфир сульфосукцината, изэтионат, производные имидазолия, метилтаурат, саркозинат, сульфат простого эфира амида жирной кислоты, алкиламидобетаин, алифатический спирт, глицерид жирной кислоты, диэтаноламид жирной кислоты, растительное масло, производные ланолина или сложный эфир этоксилированного глицерина и жирной кислоты можно использовать в качестве ингредиента-носителя в случаях, когда дозированная форма по настоящему изобретению представляет собой очищающее средство, содержащее поверхностно-активное вещество.
Ингредиенты, содержащиеся в косметической композиции по настоящему изобретению, включают ингредиенты, которые обычно используются в косметической композиции, помимо активного ингредиента и ингредиентов-носителей, и, например, могут включать обычные вспомогательные вещества, такие как антиоксиданты, стабилизаторы, солюбилизаторы, витамины, пигменты и корригенты.
В случаях, когда композицию по настоящему изобретению готовят в виде пищевой композиции (или нутрицевтической композиции), данная пищевая композиция содержит соединение общей формулы I в качестве активного ингредиента и ингредиенты, которые обычно добавляют во время изготовления пищевого продукта, и их примеры могут включать белки, углеводы, жиры, питательные вещества, приправы и корригенты. Примеры углевода включают моносахариды, например, глюкозу, фруктозу и т.д.; дисахариды, например, мальтозу, сахарозу, олигосахариды и т.д.; дисахариды, например, мальтозу, сахарозу, олигосахариды и т.д.; полисахариды, такие как сахара (например, декстрин, циклодекстрин и т.д.) и многоатомные спирты (например, ксилит, сорбит, эритрит и т.д.). Примеры корригента могут включать природные корригенты (тауматин и экстракт посконника крапиволистного (например, ребаудиозид А, глициризин и т.д.)) и синтетические корригенты (сахарин, аспартам и т.д.).
Например, при приготовлении пищевой композиции по настоящему изобретению в виде напитка, данная пищевая композиция может дополнительно содержать, помимо соединения общей формулы I по настоящему изобретению, лимонную кислоту, доведенную до жидкого состояния фруктозу, сахар, глюкозу, уксусную кислоту, яблочную кислоту, фруктовый сок, экстракт Eucommia ulmoides, экстракт ююбы и экстракт лакрицы.
В одном воплощении настоящего изобретения композиция по настоящему изобретению включена в онтологическую, косметическую или фармацевтическую систему доставки, или систему с замедленным высвобождением, выбранную из группы, состоящей из липосом, смешанных липосом, олеосом, ниосом, этосом, милликапсул, микрокапсул, нанокапсул, наноструктурированных жидких сред, губок, циклодекстринов, везикул, мицелл, смешанных мицелл поверхностно-активных веществ, смешанных мицелл поверхностно-активного вещества-фосфолипида, миллисфер, микросфер, наносфер, липосфер, микроэмульсий, наноэмульсий, миничастиц, милличастиц, микрочастиц, наночастиц и твердых липидных наночастиц.
В одном воплощении настоящего изобретения нанокапсулы по настоящему изобретению содержат микроэмульсии.
В одном воплощении настоящего изобретения композиция по настоящему изобретению предназначена для применения посредством местного применения, перорального или парентерального введения. В частности, например, местное применение по настоящему изобретению включает накожное введение.
Местное применение по настоящему изобретению, в частности, например, накожное введение, может осуществляться посредством ионофореза, ультрасонофореза, электропорации, механического давления, градиента осмотического давления, окклюзионного средства, микроинъекции, безыгольной инъекции посредством давления, применения микроэлектропластырей, применения масок на лицо или их любой комбинации, но не ограничивается ими.
В одном воплощении настоящего изобретения композиция по настоящему изобретению повышает экспрессию PGC-1α. Следовательно, композицию по настоящему изобретению можно использовать в профилактике, облегчении или лечении симптома или заболевания, ассоциированного с уменьшением уровня PGC-1α.
В одном воплощении настоящего изобретения композиция по настоящему изобретению предназначена для применения для лечения и/или излечения кожи. Более конкретно, лечение и/или излечения кожи представляет собой уменьшение, задержку и/или профилактику симптомов старения и/или фотостарения.
В одном воплощении настоящего изобретения композиция по настоящему изобретению предназначена для применения в уменьшении объема жировой ткани.
В одном воплощении настоящего изобретения композиция по настоящему изобретению предназначена для применения в уменьшении содержания триглицеридов в жировой ткани.
Более конкретно, например, жировая ткань представляет собой подкожную жировую ткань.
В одном воплощении настоящего изобретения подкожная жировая ткань по настоящему изобретению представляет собой подкожную жировую ткань области бедра, груди, нижней части шеи, линии шеи, ягодиц, лица, губ, щек, век и/или рук.
Согласно еще одному другому воплощению настоящего изобретения жировая ткань по настоящему изобретению представляет собой любую жировую ткань, которая может образоваться в организме, включая жировую ткань, образованную жировой эмболией.
В одном воплощении настоящего изобретения композиция по настоящему изобретению предназначена для применения в увеличении температуры кожи.
Согласно другому аспекту настоящего изобретения предложена ситологическая, косметическая или фармацевтическая композиция, содержащая ситологически, косметически или фармацевтически эффективное количество по меньшей мере одного соединения общей формулы I или приемлемой соли согласно другим аспектам настоящего изобретения и по меньшей мере один ситологически, косметически или фармацевтически приемлемый эксципиент или вспомогательное вещество.
Согласно одному воплощению настоящего изобретения соединение общей формулы I по настоящему изобретению, его смесь и/или его ситологически, косметически или фармацевтически приемлемая соль закреплены в состоянии адсорбции на ситологически, косметически или фармацевтически приемлемом твердом органическом полимере или твердой минеральной подложке, которая образуется тальком, бентонитом, диоксидом кремния, крахмалом и мальтодекстрином.
В одном воплощении настоящего изобретения композиция по настоящему изобретению предоставлена в дозированной форме, выбранной из группы, состоящей из кремов, множественных эмульсий, безводных композиций, водных дисперсий, масел, разных видов молочка, бальзамов, пен, лосьонов, гелей, кремовых гелей, водно-спиртовых растворов, водно-гликолевых растворов, жидких мазей, сывороток, мыл, шампуней, кондиционеров, сывороток, мазей, муссов, помад, порошков, кусков, карандашей, спреев, аэрозолей, капсул, желатиновых капсул, мягких капсул, твердых капсул, таблеток, таблеток, покрытых сахаром, гранул, жевательной резинки, растворов, суспензий, эмульсий, сиропов, эликсиров, полисахаридных пленок, желе и желатинов.
В одном воплощении настоящего изобретения композиция по настоящему изобретению закреплена в состоянии включения в продукт, выбранный из группы, состоящей из подглазных маскирующих карандашей, основ под макияж, лосьонов для удаления макияжа, молочка для удаления макияжа, теней для глаз, губной помады, блеска для губ, гигиенической губной помады и порошков.
В одном воплощении настоящего изобретения соединение общей формулы I, его смесь и/или его ситологически, косметически или фармацевтически приемлемая соль включаются в ткани, нетканые материалы или медицинские устройства.
В одном воплощении настоящего изобретения ткани, нетканые материалы или медицинские устройства по настоящему изобретению выбраны из группы, состоящей из перевязочных материалов, марли, футболок, колготок, носков, нижнего белья, поясов, перчаток, подгузников, гигиенических салфеток, повязок, покрывал, салфеток для протирания, клейких пластырей, неклейких пластырей, окклюзионных пластырей, микроэлектрических пластырей и масок для лица.
В одном воплощении настоящего изобретения композиция по настоящему изобретению дополнительно содержит ситологически, косметически или фармацевтически эффективное количество по меньшей мере одного вспомогательного вещества, выбранного из группы, состоящей из следующих: другие регуляторы PGC-1α, другие регуляторы PPARγ, препараты для уменьшения уровня тригриглицеридов адипоцитов, препараты для задержки дифференциации адипоцитов, липолитические агенты или стимуляторы липолиза, противоцеллюлитные агенты, образующие жировую ткань агенты, ингибиторы кластеризации рецептора ацетилхолина, ингибиторы мышечного сокращения, антихолинергические агенты, ингибиторы эластазы, ингибиторы металлопротеиназ матрикса, стимуляторы синтеза меланина или ингибиторы депигментирующих агентов, пропигментирующие агенты, агенты для искусственного загара, агенты против старения, ингибиторы NO-синтазы, ингибиторы 5α-редуктазы, ингибиторы лизил-гидроксилазы и/или пролил-гидроксилазы, антиоксиданты, ловушки свободных радикалов и/или агенты против атмосферного загрязнения, ловушки активных форм карбонила, агенты против гликирования, антигистаминные агенты, противовирусные агенты, противопаразитарные агенты, эмульгаторы, мягчители, органические растворители, жидкие пропелленты, кондиционеры для кожи, смачивающие агенты, вещества, удерживающие влагу, α- и β-гидроксикислоты, увлажнители, гидролазы кожи, витамины, аминокислоты, белки, пигменты или красители, красители, биополимеры, гелеобразующие полимеры, агенты, увеличивающие вязкость, поверхностно-активные вещества, смягчители, связующие вещества, консерванты, средства против морщин, агенты, способные уменьшать или лечить мешки под глазами, отшелушивающие агенты, десквамирующие агенты, кератолитические агенты, антибактериальные агенты, противогрибковые агенты, фунгистатики, бактерицидные агенты, бактериостатические агенты, кожные или стимуляторы, стимуляторы синтеза эластина, стимуляторы синтеза декорина, стимуляторы синтеза ламинина, стимуляторы дефенсина, стимуляторы шаперонов, стимуляторы синтеза цАМФ (циклический аденозинмонофосфат), белки теплового шока, стимуляторы синтеза HSP70 (белок теплового шока 70), стимуляторы синтеза белков теплового шока, стимуляторы синтеза аквапоринов, стимуляторы синтеза гиалуроновой кислоты, стимуляторы синтеза фибронектина, стимуляторы синтеза сиртуина, агенты, стимулирующие синтез компонентов рогового слоя и липидов, церамиды, жирные кислоты, ингибиторы деградации коллагена, ингибиторы деградации эластина, ингибиторы сериновых протеаз, стимуляторы пролиферации фибробластов, стимуляторы пролиферации кератиноцитов, стимуляторы пролиферации меланоцитов, стимуляторы дифференциации кератиноцитов, ингибиторы ацетилхолинэстеразы, релаксанты кожи, стимуляторы синтеза гликозаминогликана, ингибиторы гиперкератоза, противоугревые агенты, агенты репарации ДНК, агенты, защищающие ДНК, стабилизаторы, противозудные агенты, агенты для лечения и/или ухода за чувствительной кожей, отвердители, агенты, восстанавливающие плотность, реструктурирующие агенты, агенты против растяжек, регуляторы продукции кожного сала, противопотогенные средства, стимуляторы заживления, вспомогательные заживляющие агенты, стимуляторы реэпителизации, вспомогательные стимуляторы реэпителизации, цитокиновые факторы роста, седативные агенты, противовоспалительные агенты, анестетики, агенты, действующие на кровообращение в капиллярах и/или на микроциркуляцию, ингибиторы проницаемости сосудов, венотонизирующие средства, агенты, действующие на клеточный метаболизм, агенты для улучшения дермо-эпидермального соединения, индукторы или замедлители роста волос, корригенты, хелаторы, растительные экстракты, незаменимые масла, экстракты из морских водорослей, агенты, полученные от процессов биологической ферментации, минеральные соли, клеточные экстракты, солнцезащитные кремы и органические или неорганические солнцезащитные средства, имеющие активность против УФ (ультрафиолет) А и/или УФ В, и их смеси.
В одном воплощении настоящего изобретения вспомогательное вещество по настоящему изобретению имеет синтетическое происхождение, происходит из растительных экстрактов, процессов биологической ферментации или в результате комбинации синтеза или биотехнологических процессов.
В одном воплощении настоящего изобретения композиция по настоящему изобретению дополнительно содержит фармацевтически эффективное количество по меньшей мере одного противодиабетического средства.
В одном воплощении настоящего изобретения вспомогательное вещество по настоящему изобретению выбрано из группы, состоящей из агентов для повышения или снижения содержания триглицеридов в жировой ткани, агентов для усиления или задержки дифференциации адипоцитов, липолитических агентов и/или венотонизирующих средств.
В одном воплощении настоящего изобретения агенты для увеличения или уменьшения содержания триглицеридов в жировой ткани, агенты для задержки дифференциации адипоцитов, противоцеллюлитные агенты, липолитические агенты и/или венотонизирующие агенты по настоящему изобретению выбраны из группы, состоящей из следующих: форсколин, кофеин, эсцин, карнитин, кофермент А, липаза, глауцин, эскулин, виснадин, сарсасапогенин, экстракты Coffea arabica, экстракты Coleus forskohlii, экстракты Anemarrhena apshodeloides и смесь воды, глицерина, лецитина, кофеина, экстракта иглицы понтийской (Ruscus aculeatus), мальтодекстрина, диоксида кремния, триэтаноламина гидройодида, пропиленгликоля, экстрактов плюща (Hedera helix), карнитина, эсцина, трипепида-1, ксантановой камеди, каррагенана (Chondrus crispus) и динатрия EDTA (этилендиаминтетрауксусная кислота).
В одном воплощении настоящего изобретения вспомогательное вещество по настоящему изобретению выбрано из группы, состоящей из отвердителей, агентов, восстанавливающих плотность, и реструктурирующих агентов.
В одном воплощении настоящего изобретения отвердители, агенты, восстанавливающие плотность, и реструктурирующие агенты по настоящему изобретению выбраны из группы, состоящей из следующих: экстракты, ферментированные Pseudoalteromonas, трипептид-10 цитруллин, ацетилларгинил-триптофилдифенилглицин, гексапептид-10 и смесь экстрактов ферментации Pseudoalteromonas, гидролизованных белков пшеницы, гидролизованных соевых белков, трипептид-10 цитруллина и трипептида-1.
В одном воплощении настоящего изобретения вспомогательное вещество по настоящему изобретению выбрано из агентов против растяжек. Более конкретно, например, агенты против растяжек по настоящему изобретению выраны из группы, состоящей из следующих: экстракты Centella Asiatica, экстракты Rosa canina, экстракты Rosa moschata, экстракты Rosa rubiginosa и смесь воды, каприлилового/каприлового гликозида, лецитина, глицерина, экстракта ферментации Pseudoalteromonas, ацетилтрипептид-30 цитруллина, пентапептида-18, ксантановой камеди и каприлилгликоля.
В одном воплощении настоящего изобретения вспомогательное вещество по настоящему изобретению выбрано из средств против морщин или средств против старения.
В одном воплощении настоящего изобретения средства против морщин или средства против старения по настоящему изобретению выбраны из группы, состоящей из следующих: ацетилгептапептид-8; ацетилгептапептид-4; ацетилоктапептид-3; пентапептид-18; ацетилгексапептид-30; смесь гидролизованных белков пшеницы, гидролизованных соевых белков и трипептида-1; смесь диаминопропионилтрипептида-33, трипептид-10 цитруллина, экстракта ферментации Pseudoalteromonas, гидролизованных белков пшеницы, гидролизованных соевых белков, трипептид-10 цитруллина и трипептида-1; смесь ацетилтетрапептида-5, ацетилтрипептида-30 цитруллина, ацетиларгинилтрифенилдифенилглицина, ацетилтетрапептида-22, диметилметоксихроманола, диметилметоксихроманилпальмитата, экстракта ферментации Pseudoalteromonas, лизин-HCl, лецитина и трипептид-9 цитруллина; и смесь лизин-HCl, лецитина и трипептид-10 цитруллина.
Согласно другому аспекту настоящего изобретения предложен способ получения соединения, представленного общей формулой I, приведенной ниже, его ситологически, косметически или фармацевтически приемлемой соли, или их смеси, включающий проведение реакции в твердой фазе или в растворе:
Общая формула I: S-(MS)p-(MS)q
В данной общей формуле S представляет собой сиаловую кислоту; и каждый из (MS)p и (MS)q независимо представляет собой моносахаридный остаток.
Согласно другому аспекту настоящего изобретения предложена композиция для деградации жира в организме, содержащая, в качестве активного ингредиента, соединение, представленное общей формулой I, приведенной ниже:
Общая формула I: S-(MS)p-(MS)q
В общей формуле I S представляет собой сиаловую кислоту; и каждый из (MS)p и (MS)q независимо представляет собой моносахаридный остаток.
В одном воплощении настоящего изобретения в общей формуле I по настоящему изобретению (MS)p представляет собой галактозу, и (MS)q представляет собой глюкозу.
В одном воплощении настоящего изобретения соединение общей формулы I по настоящему изобретению представляет собой сиалиллактозу.
В одном воплощении настоящего изобретения сиалиллактоза по настоящему изобретению представляет собой α-NeuNAc-(2→3)-β-D-Gal-(1→4)-D-Glc или α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc.
В одном воплощении настоящего изобретения сиалиллактоза по настоящему изобретению представляет собой α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc.
В одном воплощении настоящего изобретения композиция по настоящему изобретению представляет собой фармацевтическую композицию.
В одном воплощении настоящего изобретения композиция по настоящему изобретению представляет собой лекарственную форму, выбранную из группы, состоящей из растворов, суспензий, сиропов, эмульсий, липосом, порошков, гранул, таблеток, препаратов с замедленным высвобождением и капсул.
В одном воплощении настоящего изобретения композиция по настоящему изобретению представляет собой композицию для парентерального введения, и она находится в лекарственной форме липосомы или препарата с замедленным высвобождением.
В одном воплощении настоящего изобретения композиция по настоящему изобретению представляет собой композицию для перорального введения, и она находится в лекарственной форме липосомы или препарата с замедленным высвобождением.
В одном воплощении настоящего изобретения композиция по настоящему изобретению представляет собой нутрицевтическую композицию или пищевую композицию.
Согласно другому аспекту настоящего изобретения в настоящем изобретении предложен способ профилактики или лечения заболевания или симптома, связанного с уменьшением экспрессии PGC-1α у субъекта, причем данный способ включает введение композиции по любому из других воплощений настоящего изобретения субъекту, нуждающемуся в этом. Заболевание или симптом, ассоциированные с уменьшением экспрессии PGC-1α, являются такими, как описано в других аспектах настоящего изобретения.
В одном воплощении настоящего изобретения способ лечения по настоящему изобретению дополнительно включает, перед этапом введения, измерение уровня экспрессии PGC-1α в клетках из образца, выделенного у субъекта. Уровень экспрессии PGC-1α по настоящему изобретению можно измерять с использованием любого способа, известного в данной области, без ограничения. Образец по настоящему изобретению, выделенный у субъекта, относится к образцу, выделенному у субъекта, имеющего клетки, экспрессирующие PGC-1α, но не является особенно ограниченным.
В одном воплощении настоящего изобретения наблюдается уменьшается ли или не уменьшается уровень экспрессии PGC-1α по настоящему изобретению по сравнению с нормальной контрольной группой, и тогда, при снижении, осуществляется стадия введения субъекту.
В одном воплощении настоящего изобретения нормальная контрольная группа по настоящему изобретению соответствует клеткам, полученным от здорового человека или субъекта, не демонстрирующего заболевание или симптом, ассоциированный с понижением экспрессии PGC-1α.
В одном воплощении настоящего изобретения образец по настоящему изобретению получают из конкретной ткани или органа. Конкретная ткань или орган по настоящему изобретению означает ткань или орган, связанные с заболеванием или симптомом, ассоциированным с уменьшением уровня экспрессии PGC-1α, и может быть соответствующим заболеванием или симптомом.
В одном воплощении настоящего изобретения введение по настоящему изобретению представляет собой местное применение по отношению к конкретной ткани, в которой измеренный уровень экспрессии PGC-1α снижается по сравнению с контрольной группой.
Согласно другому аспекту настоящего изобретения предложен способ деградации жира в организме, включающий введение композиции по любому другому аспекту настоящего изобретения субъекту, нуждающемуся в этом.
В одном воплощении настоящего изобретения данный способ дополнительно включает, перед стадией введения, измерение уровня экспрессии PGC-1α в клетках из образца, выделенного у субъекта. Уровень экспрессии PGC-1α по настоящему изобретению можно измерять с использованием любого способа, известного в данной области, без ограничения. Образец, выделенный у субъекта по настоящему изобретению, относится к образцу, выделенному у субъекта, имеющего клетки, экспрессирующие PGC-1α, но особенно не ограничивается.
В одном воплощении настоящего изобретения наблюдается снижается ли или нет уровень экспрессии PGC-1α по сравнению со средним уровнем экспрессии PGC-1α в группе со средней массой тела, и тогда, при снижении, осуществляется стадия введения субъекту.
В одном воплощении настоящего изобретения группа со средней массой тела по настоящему изобретению означает набор популяций, имеющих такую же массу, что и средняя масса в популяциях, которые имеют такой же рост, что и целевой объект. Группа выборки для измерения массы тела группы со средней массой тела может быть случайным образом выбрана из популяций, принадлежащих к той же самой расе или имеющих такую же этническую принадлежность, что и субъект, и включает по меньшей мере 10 или более, предпочтительно 50 или более и более предпочтительно 100 или более человек, средняя масса тела которых измеряется и может быть использована в качестве средней массы тела для выбора группы со средней массой тела. В качестве альтернативы, можно использовать традиционно известные статистические значения.
В одном воплощении настоящего изобретения клетки по настоящему изобретению получают от субъекта, принадлежащего к вышеупомянутой группе со средней массой тела.
В одном воплощении настоящего изобретения образец по настоящему изобретению получают из конкретных тканей или органов. Подходящие ткани или органы по настоящему изобретению могут быть надлежащим образом выбраны из сайтов с более высоким содержанием жира по сравнению со средним типом организма группы со средней массой тела.
В одном воплощении настоящего изобретения введение по настоящему изобретению представляет собой местное применение по отношению к конкретной ткани, в которой измеренный уровень экспрессии PGC-1α снижается по сравнению с контрольной группой.
Полезные эффекты
Композиция по настоящему изобретению не демонстрирует токсичности у животных, используемых в соответствующих моделях заболеваний. Кроме того, композиция по настоящему изобретению увеличивает экспрессию PGC-1α, который относится к митохондриальным функциям, и других связанных генов (домен фибронектина типа III, содержащий 5 (Fndc5), альфа-рецептор, связанный с эстрогеном (Erra), разобщающий белок 1 (UCP-1), мозговой нейтротрофический фактор (BDNF), супероксиддисмутаза 2 (SOD2) и глутатионпероксидаза 1 (GPX1)), более примечательно, по сравнению с контрольной группой, в разных органах, включающих мозг и гиппокамп, при инъекции композиции тестируемым группам животной модели и тестируемым группам нормальных животных для разных заболеваний мозга (AD, PD, HD и тому подобные), инсульта, стимуляции старения и анализов кожи. Кроме того, композиция по настоящему изобретению демонстрирует улучшенное поведение в основных поведенческих тестах для разных заболеваний мозга (AD, PD, HD и тому подобные). Следовательно, композицию по настоящему изобретению можно преимущественно использовать в качестве фармацевтической композиции для профилактики или лечения состояния, расстройства и/или заболевания, включающего связанные с PGC-1α нейродегенераивные заболевания, метаболические заболевания, удаление местного жира и заболевания, связанные с метаболизмом липидов, старение и заболевания, вызванные старением, и мышечную дистрофию (саркопения, кахексия) и заболевания, вызванные мышечной дистрофией.
Краткое описание графических материалов
На ФИГ. 1а, 1б и 1в показаны изменения экспрессии генов в органах (ФИГ. 1а), скелетных мышцах (ФИГ. 1б) и брюшном жире (ФИГ. 1в) посредством обработки 6'-сиалиллактоазой (SL) в нормальных мышиных моделях. На ФИГ. 1г, 1д и 1е показаны изменения экспрессии генов в органах (ФИГ. 1г), скелетных мышцах (ФИГ. 1д) и брюшном жире (ФИГ. 1е) посредством обработки 3'-SL в нормальных мышиных моделях.
На ФИГ. 2а и 2б показаны числовые значения (ФИГ. 2а) и вестерн-блоты (ФИГ. 2б) изменений экспрессии белка PGC-1α в мозге и гиппокампе.
На ФИГ. 3 показаны изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в нервных клетках.
На ФИГ. 4 показаны изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в незрелых мышечных клетках С2С12.
На ФИГ. 5а и 5б показаны числовые значения (уровень экспрессии генов группы (модель болезни Альцгеймера)/уровень экспрессии генов контрольной группы), (уровень экспрессии генов группы (модель болезни Альцгеймера плюс 3'-SL)/уровень экспрессии генов контрольной группы) и (уровень экспрессии генов группы (модель болезни Альцгеймера плюс 6'-SL)/уровень экспрессии генов контрольной группы) в соответствующих органах по отношению к изменениям относительной экспрессии генов в мозге и гиппокампе по сравнению с контрольной группой.
На ФИГ. 6 показано числовое значение времени убегания в тесте познавательных способностей при подвергании контрольной группы, группы (модель болезни Альцгеймера), группы (модель болезни Альцгеймера плюс 3'-SL) и группы (модель болезни Альцгеймера плюс 6'-SL) тесту познавательных способностей (водный лабиринт Морриса) в течение 7 суток.
На ФИГ. 7а и 7б показаны изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в моделях болезни Паркинсона.
На ФИГ. 8 показаны результаты поведенческого теста в животных моделях болезни Паркинсона.
На ФИГ. 9а и 9б показаны изменения экспрессии генов посредством обработки композициями SL в моделях эпилептических/конвульсивных мозговых заболеваний.
На ФИГ. 10а и 10б показаны изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в моделях болезни Гентингтона.
На ФИГ. 11 показаны результаты теста поездки на вращающемся цилиндре в моделях болезни Гентингтона.
На ФИГ. 12 показаны результаты наблюдения ишемического объема в ишемических моделях.
На ФИГ. 13 показаны изменения балла теста MLPT посредством обработки SL (3'-SL и 6'-SL) после индукции ICH.
На ФИГ. 14 показаны изменения экспрессии генов посредством обработки композициями SL в мышиных моделях.
На ФИГ. 15 показаны эффекты уменьшения уровня подкожного жира при местном применении композиций SL (3'-SL и 6'-SL) в мышиные модели.
На ФИГ. 16а и 16б показаны изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в моделях стимуляции старения.
На ФИГ. 17а и 17б показаны результаты измерения внутриклеточного уровня H2O2 (значения ROS) (ФИГ. 17а) и результаты измерения образования митохондриального супероксида (ФИГ. 17б).
На ФИГ. 18а и 18б показаны результаты измерения теломеразной активности посредством введения композиций SL (3'-SL и 6'-SL).
На ФИГ. 19а и 19б показаны результаты измерения внутриклеточного уровня H2O2 (значения ROS) (ФИГ. 19а) и результаты измерения образования митохондриального супероксида (ФИГ. 19б).
На ФИГ. 20а и 20б показаны результаты анализа теломеразной активности посредством обработки моделей артериосклероза (АроЕ-/-; ФИГ. 20а) и MASM (ФИГ. 20б) SL (3'-SL и 6'-SL).
На ФИГ. 21а и 21б показаны изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в моделях анализов кожи.
На ФИГ. 22а и 22б показаны изменения уровня внутриклеточного жира при введении 6'-сиалиллактозы (ФИГ. 22а) и 3'-сиалиллактозы (ФИГ. 22б) в дифференцированные адипоциты.
На ФИГ. 23а и 23б показаны полученные оптической микроскопией изображения клеток, демонстрирующие изменения уровня внутриклеточного жира при введении 6'-сиалиллактозы (ФИГ. 23а) и 3'-сиалиллактозы (ФИГ. 23б) в дифференцированные адипоциты.
На ФИГ. 24 показан эффект 6'-сиалиллактозы на жизнеспособность клеток в дифференцированных адипоцитах.
На ФИГ. 25 показаны изменения секреции глицерина посредством сиалиллактозы в дифференцированных адипоцитах.
На ФИГ. 26а и 26б показаны изменения кожи у мышей на высокожировой диете посредством перемежающейся инъекции сиалиллактозы.
Способ осуществления изобретения
Настоящее изобретение будет далее подробно описано со ссылкой на примеры. Данные примеры предназначены только для более конкретного иллюстрирования настоящего изобретения, и для специалистов в данной области будет очевидно то, что объем настоящего изобретения не ограничивается данными примерами.
Пример 1: оценка стимуляции экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в нормальных мышиных моделях.
Для того чтобы исследовать изменения относительной экспрессии генов органами по сравнению с экспрессией до введения SL (3'-SL и 6'-SL), приобретали 4-недельных мышей C57BL/6 у Dooyeul Biotech (Корея). Вода была свободно доступна, а имеющийся в продаже гранулированный корм (Dooyeul Biotech, Корея) давали в течение двух недель. В возрасте 6 недель мышей (исходная средняя масса тела 21,4 плюс/минус 1,1 г) случайным образом делили на три группы (состоящие из восьми мышей для каждой группы), описанные ниже, и рационы сохраняли в течение 10 недель (всего 24 животных):
- контрольная группа: группа мышей с нормальным рационом;
- группа с введением 3'-SL: отдельное введение 3'-сиалиллактозы (3'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо нормального рациона;
- группа с введением 6'-SL: отдельное введение 6'-сиалиллактозы (6'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо нормального рациона.
Ежесуточно перорально вводили сиалиллактозу или деионизированную воду. Мышей содержали в помещениях для животных в течение 10 недель, подвергали голоданию в течение 12 часов и умерщвляли. Каждые 5 суток измеряли потребление пищи и изменение массы тела. 3'-Сиалиллактозу (3'-N-ацетилнейраминил-D-лактоза, 3'-сиалил-D-лактоза или α-NeuNAc-(2→3)-β-D-Gal-(1→4)-D-Glc) или 6'-сиалиллактозу (6'-N-ацетилнейраминил-лактоза, 6'-сиалил-D-лактоза или α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc) приобратали у Sigma-Aldrich.
Изменения экспрессии генов посредством введения композиций SL (3'-SL и 6'-SL) количественно сравнивали для восьми главных органов (сердце, гиппокамп, мозг, спинной мозг, легкое, печень, селезенка и почка), трех скелетных мышц (камбаловидная мышца, четырехглавая мышца бедра и икроножная мышца) и брюшного жира. РНК экстрагировали агентом TRIzol (Invitrogen). кДНК синтезировали с использованием РНК, которая была выделена, как описано выше, и количественно измерена, и системы обратной транскрипции (Promega, США). Картины экспрессии PGC-1α и связанных генов измеряли с использованием предварительно разработанных праймеров и зондов (Applied Biosystems; PGC-1α, Mm00447181_m1, GAPDH (глицеральдегид-3-фосфатдегидрогеназа) и Mm99999915_q1) для синтезированной кДНК и мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, SOD2 и GPX1). Для ПЦР-реакции и анализа использовали систему Rotor-Gene 3000 (Corbett Research, Сидней, Австралия), и результаты показаны на ФИГ. 1.
На ФИГ. 1 изменения относительной экспрессии генов органами по сравнению с моментом до введения SL (3'-SL и 6'-SL) были выражены значениями (уровни экспрессии генов групп с введением SL) / (уровень экспрессии генов контрольной группы). В том, что касается 6'-SL, как можно видеть от большинства органов (ФИГ. 1а), скелетных мышц (ФИГ. 1б) и брюшного жира (ФИГ. 1в), группы с введением 6'-SL имели более высокий уровень, чем группа негативного контроля, учитывая уровни экспрессии нескольких мишеней анализа (Fndc5, PGC-1α, Erra, и UCP1), включая PGC-1α, в нескольких частях тела. То есть, могло быть подтверждено, что 6'-SL стимулировала экспрессию PGC-1α и связанных генов в нескольких органах, мышцах и жировой ткани нормальных мышей. В том, что касается 3'-SL, как можно видеть от большинства органов (ФИГ. 1г), скелетных мышц (ФИГ. 1д) и брюшного жира (ФИГ. 1е), группы с введением 3'-SL имели более высокий уровень, чем группа негативного контроля, учитывая уровни экспрессии нескольких мишеней анализа в нескольких частях тела, но были менее эффективными, чем группы с введением 6'-SL.
На ФИГ. 1а, 1б и 1в показаны изменения экспрессии генов в органах (ФИГ. 1а), скелетных мышцах (ФИГ. 1б) и брюшном жире (ФИГ. 1в) посредством обработки 6'-SL в нормальных мышиных моделях. На ФИГ. 1г, 1д и 1е показаны изменения экспрессии генов в органах (ФИГ. 1г), скелетных мышцах (ФИГ. 1д) и брюшном жире (ФИГ. 1е) посредством обработки 3'-SL в нормальных мышиных моделях. На ФИГ. 1а-1е по ординатам отложено отношение относительной экспрессии генов по сравнению с контрольной группой.
Пример 2: оценка стимуляции экспрессии белка PGC-1α посредством обработки композициями SL (3'-SL и 6'-SL) в мозге и гиппокампе старых мышиных моделей.
Для того чтобы исследовать относительную экспрессию белка в мозге по сравнению с экспрессией до введения SL (3'-SL и 6'-SL), приобретали 4-недельных мышей ICR в Central Lab Animal (Корея). Вода была свободно доступна, а имеющийся в продаже гранулированный корм (Dooyeul Biotech, Корея) давали в течение двух недель. В возрасте 6 недель мышей (исходная средняя масса тела 20,3 плюс/минус 1,5 г) случайным образом делили на три группы (состоящие из восьми мышей для каждой группы), описанные ниже, и рационы сохраняли в течение 42 недель (всего 24 животных).
- Контрольная группа: группа мышей с нормальным рационом;
- Группа с введением 3'-SL: обработка 3'-сиалиллактозой (3'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо нормального рациона;
- Группа с введением 6'-SL: обработка 6'-сиалиллактозой (6'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо нормального рациона.
Ежесуточно перорально вводили сиалиллактозу или DW (деионизированная вода). Мышей содержали в помещениях для животных в течение 42 недель, подвергали голоданию в течение 12 часов и умерщвляли. Каждые 5 суток измеряли потребление пищи и изменение массы тела. 3'-Сиалиллактозу (3'-N-ацетилнейраминил-D-лактоза, 3'-сиалил-D-лактоза или α-NeuNAc-(2→3)-β-D-Gal-(1→4)-D-Glc) или 6'-сиалиллактозу (6'-N-ацетилнейраминил-лактоза, 6'-сиалил-D-лактоза или α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc) приобретали у Sigma-Aldrich.
На ФИГ. 2 показаны числовые значения (ФИГ. 2а) и вестерн-блоты (ФИГ. 2б) изменений экспрессии белка PGC-1α в мозге и гиппокампе. На ФИГ. 2б ВВ1 6' представляет 6'-SL. В каждом сайте количественно измеряли «уровень экспрессии белка PGC-1α» и «уровень экспрессии белка GAPDH», и отношение относительных значений (уровень экспрессии белка PGC-1α) / (уровень экспрессии белка GAPDH) численно выражали для контрольной группы, группы обработки 3'-SL и группы обработки 6'-SL. Уровень экспрессии PGC-1α был значительно большим в группе с введением 6'-SL, чем в группе негативного контроля как в мозге, так и в гиппокампе. То есть, могло быть подтверждено то, что 6'-SL стимулировал экспрессию белка PGC-1α в нескольких участках мозга нормальных мышей.
На ФИГ. 2 показаны изменения экспрессии белка PGC-1α в мозге и гиппокампе посредством введения композиций SL в моделях старых мышей. 6-недельных самцов мышей ICR группировали в контрольную группу и группу с введением 6'-SL (8 животных на группу), которые затем подвергали анализу с контролируемым рационом в течение 42 недель. Мышей умерщвляли, и затем выделяли мозг и гиппокамп. Из мозга выделяли кору мозга. Изменения экспрессии белка PGC-1α в выделенном мозге и гиппокампе были выражены посредством числовых значений (ФИГ. 2а) и вестерн-блотов (ФИГ. 2б).
Пример 3: оценка стимуляции экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в анализе нервных клеток.
Для того чтобы исследовать имеет ли SL (3'-SL и 6'-SL) также и эффект стимулирования экспрессии гена PGC-1α и связанных генов в нервных клетках, был проведен следующий анализ.
Нейробласты (Neuro-2a, Американская коллекция типовых культур, США) культивировали в DMEM (среда Игла, модифицированная по Дульбекко), дополненной 10% фетальной телячьей сыворотки, 100 U (единиц) пенициллина и 0,1 мг/мл стрептомицина, в каждой лунке 6-луночных планшетов при 37°С в условиях 5% CO2/95% атмоферы. Клетки Neuro-2a соответствуют линии клеток быстрорастущей мышиной нейробластомы. После посева клеток Neuro-2a в плотности 6000 клеток на лунку добавляли SL в концентрации 0,1 мг/мл в лунки, демонстрирующие конфлюентность примерно 5×106 клеток/мл, с последующей инкубацией в течение 24 часов при таких же условиях. Вещества SL (3'-SL и 6'-SL) были такими же, что и вещества, описанные в Примере 1. Если не утверждается иное, понятно то, что SL (3'-SL и 6'-SL) и ее использованные концентрации являются такими же, что и описанные в Примере 1. Группу негативного контроля обрабатывали физиологическим раствором с 1/1000 объема среды. Клетки, обработанные каждым образцом, инкубировали при 37°С в течение 24 ч и затем дважды промывали холодным физиологическим раствором, и выделяли РНК с использованием агента TRIzol (Invitrogen). Картины экспрессии PGC-1α и связанных генов измеряли с использованием предварительно разработанных праймеров и зондов (Applied Biosystems; PGC-1α, Mm00447181_m1, GAPDH и Mm99999915_q1) для синтезированной кДНК и мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, BDNF, SOD2 и GPX1). Для ПЦР-реакции и анализа использовали систему Rotor-Gene 3000 (Corbett Research, Сидней, Австралия), и результаты показаны на ФИГ. 3.
На ФИГ. 3 показаны изменения экспрессии генов посредством обработки композицией SL (3'-SL и 6'-SL) в нервных клетках. Как показано на ФИГ. 3, в результате сравнения групп введения, при котором клетки Neuro-2 обрабатывали SL (3'-SL и 6'-SL) в течение 24 часов, а контрольную группу оставляли без обработки, группы с введением SL (3'-SL и 6'-SL) демонстрировали значимые увеличения уровней экспрессии нескольких мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, BDNF, SOD2 и GPX1), включая PGC-1α, по сравнению с группой негативного контроля. Могло быть подтверждено то, что 6'-SL стимулировала экспрессию PGC-1α и связанных генов в нервных клетках, и что стимулирующий эффект 3'-SL был ниже, чем эффект 6'-SL.
Пример 4: оценка стимуляции экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в анализе мышечных клеток.
Для того чтобы исследовать, имеет ли действительно SL влияние на стимулирование экспрессии гена PGC-1α в мышечных клетках, провели следующий анализ.
Незрелые мышечные клетки С2С12 получали из приобретенных в Американской коллекции культур тканей (АТСС, США). Клетки культивировали в среде Игла, модифицированной по Дульбекко (DMEM, Gibco, США), дополненной 10% фетальной телячьей сыворотки (FBS, США), в инкубаторе с 5% CO2 при 37°С, пока клетки не вырастали до конфлюентности 70%, в то время как среду заменяли каждые двое суток. Дифференциацию в мышечные клетки индуцировали культивированием в среде, содержащей 2% лошадиной сыворотки (HS, Gibco, США). Мышечные клетки, культивированные в среде, содержащей 2% HS, в течение 4 суток, обрабатывали SL в разных концентрациях. Группу негативного контроля обрабатывали физиологическим раствором с 1/1000 объема среды. Клетки, обработанные каждым образцом, инкубировали при 37°С в течение 24 ч и затем дважды промывали холодным физиологическим раствором, и выделяли РНК с использованием агента TRIzol (Invitrogen). кДНК синтезировали с использованием 1 мкг/мл РНК, которая была выделена, как описано выше, и количественно измерена, и системы обратной транскрипции (Promega, США).
Картины экспрессии PGC-1α и связанных генов измеряли с использованием предварительно разработанных праймеров и зондов (Applied Biosystems; PGC-1α, Mm00447181_m1, GAPDH и Mm99999915_q1) для синтезированной кДНК и мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, SOD2 и GPX1). Для ПЦР-реакции и анализа использовали систему Rotor-Gene 3000 (Corbett Research, Сидней, Австралия), и результаты показаны на ФИГ. 4.
На ФИГ. 4 показаны изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в незрелых мышечных клетках С2С12. Как показано на ФИГ. 4, в результате сравнения групп введения, при котором незрелые мышечные клетки С2С12 обрабатывали SL (3'-SL и 6'-SL) в течение 24 часов, а контрольную группу оставляли без обработки, группы с введением SL (3'-SL и 6'-SL) демонстрировали значимые увеличения уровней экспрессии нескольких мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, BDNF, SOD2 и GPX1), включая PGC-1α, по сравнению с группой негативного контроля. Могло быть подтверждено то, что 6'-SL стимулировала экспрессию PGC-1α и связанных генов в незрелых мышечных клетках С2С12, и что эффект стимуляции 3'-SL был ниже, чем эффект 6'-SL.
Пример 5: оценки стимуляции экспрессии генов и улучшения познавательных способностей посредством обработки композициями SL (3'-SL и 6'-SL) в моделях заболевания мозга - болезни Альцгеймера.
Для того чтобы исследовать изменения экспрессии генов и познавательных способностей посредством обработки композициями SL (3'-SL и 6'-SL) в моделях заболевания мозга - болезни Альцгеймера, 6-недельных мышей приобретали в Central Lab Animal (Корея). Вода была свободно доступна, а имеющийся в продаже гранулированный корм (Dooyeul Biotech, Корея) давали в течение двух недель. В возрасте 8 недель мышей делили на три группы (состоящие из восьми мышей для каждой группы): восемь 8-недельных самцов мышей C57/BL6 (нормальные мыши; исходная средняя масса тела 35,6 плюс/минус 3,3 г), получавших нормальный рацион, использовали в качестве контрольной группы. 8-недельных самцов мышиной модели с болезнью Альцгеймера (3×Tg; исходная средняя масса тела 33,9 плюс/минус 2,8 г) случайным образом делили на три группы с получением разного рациона (по восемь мышей на группу), и данные рационы сохраняли в течение 10 недель (всего 32 животных):
- контрольная группа: нормальные мыши, которых кормили нормальным рационом без введения SL (8 животных);
- группа (модель болезни Альцгеймера): модели болезни Альцгеймера, которых кормили нормальным рационом без введения SL (8 животных);
- группа (модель болезни Альцгеймера плюс 3'-SL): модели болезни Альцгеймера, которым отдельно вводили 3'-сиалиллактозу (3'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо нормального рациона (8 животных);
- группа (модель болезни Альцгеймера плюс 6'-SL): модели болезни Альцгеймера, которым отдельно вводили 6'-сиалиллактозу (6'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо нормального рациона (8 животных).
Ежесуточно перорально вводили сиалиллактозу или DW. Мышей содержали в помещениях для животных в течение 10 недель, подвергали голоданию в течение 12 часов и умерщвляли. Каждые 5 суток измеряли потребление пищи и изменение массы тела. 3'-Сиалиллактозу (3'-N-ацетилнейраминил-D-лактоза, 3'-сиалил-D-лактоза или α-NeuNAc-(2→3)-β-D-Gal-(1→4)-D-Glc) или 6'-сиалиллактозу (6'-N-ацетилнейраминил-лактоза, 6'-сиалил-D-лактоза или α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc) приобретали у Sigma-Aldrich.
Изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) количественно сравнивали в двух главных органах (мозге и гиппокампе), ассоциированных с мозговыми заболеваниями. Кору мозга использовали для мозга. РНК выделяли агентом TRIzol (Invitrogen). кДНК синтезировали с использованием РНК, которая была выделена, как описано выше, и количественно измерена, и системы обратной транскрипции (Promega, США). Картины экспрессии PGC-1α и связанных генов измеряли с использованием предварительно разработанных праймеров и зондов (Applied Biosystems; PGC-1α, Mm00447181_m1, GAPDH и Mm99999915_q1) для синтезированной кДНК и мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, BDNF, SOD2 и GPX1). Для ПЦР-реакции и анализа использовали систему Rotor-Gene 3000 (Corbett Research, Сидней, Австралия), и результаты показаны на ФИГ. 5.
На ФИГ. 5 показаны изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в моделях болезни Альцгеймера. На ФИГ. 5 показаны числовые значения (уровень экспрессии генов группы (модель болезни Альцгеймера) / уровень экспрессии генов контрольной группы), (уровень экспрессии генов группы (модель болезни Альцгеймера плюс 3'-SL) / уровень экспрессии генов контрольной группы) и (уровень экспрессии генов группы (модель болезни Альцгеймера плюс 6'-SL) / уровень экспрессии генов контрольной группы) в соответствующих органах по отношению к изменениям относительной экспрессии генов в мозге и гиппокампе по сравнению с контрольной группой. 8-недельных самцов мышей модели болезни Альцгеймера (3×Tg) группировали в группы с введением SL и в группу без введения SL (8 животных на группу), затем подвергали анализу с контролем рациона в течение 10 недель, и уровни экспрессии генов в опытных группах сравнивали с уровнями у нормальных мышей (C57/BL6) с нормальным рационом. Как показано на ФИГ. 5, на основе контрольной группы нормальных мышей с нормальным рационом, уровни экспрессии нескольких мишеней анализа (Fndc5, Erra, UCP1, BDNF, SOD2 и GPX1), включая PGC-1α, в мозге (ФИГ. 5а) и гиппокампе (ФИГ. 5б) были в некоторой степени ниже в группе с введением 6'-SL (модель болезни Альцгеймера плюс 6'-SL) по сравнению с нормальной контрольной группой, но были очень высокими в группе с введением 6'-SL (модель болезни Альцгеймера плюс 6'-SL) по сравнению с группой без введения SL (модель болезни Альцгеймера). Можно было видеть то, что 3'-SL имел относительно низкий эффект по сравнению с 6'-SL, учитывая эффекты стимуляции экспрессии связанных генов. То есть, 6'-SL демонстрировала значительные увеличения уровней экспрессии PGC-1α и связанных генов (Fndc5, PGC-1α, Erra, UCP1, BDNF, SOD2 и GPX1) в мозге и гиппокампе мышиных моделей болезни Альцгеймера.
На ФИГ. 6 показаны числовые значения времени убегания в тесте познавательных способностей при подвергании контрольной группы, группы (модель болезни Альцгеймера), группы (модель болезни Альцгеймера плюс 3'-SL) и группы (модель болезни Альцгеймера плюс 6'-SL) тесту познавательных способностей (водный лабиринт Морриса) в течение 7 суток. Можно было видеть то, что время убегания в тесте познавательных способностей было почти постоянным без улучшения даже после истечения времени теста в группе без введения SL (модель болезни Альцгеймера), но время убегания в тесте в группе с введением 6'-SL (модель болезни Альцгеймера плюс 6'-SL) было определенно коротким, но в некоторой степени худшим по сравнению с контрольной группой нормальных мышей с нормальным рационом. Можно было видеть то, что 3'-SL имел относительно низкий эффект по сравнению с 6'-SL, учитывая эффекты улучшения познавательных способностей. То есть, можно было подтвердить то, что 6'-SL лучше всего улучшал познавательные способности у мышиных моделей болезни Альцгеймера.
Пример 6: оценки стимуляции экспрессии генов и улучшения поведения посредством обработки композициями SL (3'-SL и 6'-SL) в моделях заболевания мозга - болезни Паркинсона.
Для того чтобы исследовать изменения экспрессии генов и улучшение поведения посредством обработки композициями SL (3'-SL и 6'-SL) в моделях заболевания мозга - болезни Паркинсона, 13-недельных нормальных крыс SD (крыса линии Спрег-Доули) и моделей заболевания мозга - болезни Паркинсона приобретали в Central Lab Animal (Корея). Вода была свободно доступна, а имеющийся в продаже гранулированный корм (Dooyeul Biotech, Корея) давали в течение одной недели. В возрасте 14 недель крыс SD делили на четыре группы (состоящих из 8 животных на группу): восемь 14-недельных самцов крыс SD (нормальные крысы; исходная средняя масса тела 355,6 плюс/минус 32,3 г), получавших нормальный рацион, использовали в качестве контрольной группы. Модели болезни Паркинсона - крысы SD, индуцированные 6-OHDA, которым в возрасте 8 недель вводили 6-гидроксидофамин (6-OHDA), и которые были поставлены в возрасте 13 недель, случайным образом делили на три группы с получением разного рациона, описанные ниже (8 животных на группу), и данные рационы сохраняли с 14-недельного возраста в течение 10 недель (всего 32 животных):
- контрольная группа: нормальные крысы, которых кормили нормальным рационом без введения SL (8 животных);
- группа (модель болезни Паркинсона): модели болезни Паркинсона, которых кормили нормальным рационом без введения SL (8 животных);
- группа (модель болезни Паркинсона плюс 3'-SL): модели болезни Паркинсона, которых обрабатывали 3'-сиалиллактозой (3'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела крысы в сутки), помимо нормального рациона (8 животных);
- группа (модель болезни Паркинсона плюс 6'-SL): модели болезни Паркинсона, которых обрабатывали 6'-сиалиллактозой (6'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела крысы в сутки), помимо нормального рациона (8 животных).
Ежесуточно перорально вводили сиалиллактозу или DW. Крыс содержали в помещениях для животных в течение 10 недель, подвергали голоданию в течение 12 часов и умерщвляли. Каждые 5 суток измеряли потребление пищи и изменение массы тела. 3'-Сиалиллактозу (3'-N-ацетилнейраминил-D-лактоза, 3'-сиалил-D-лактоза или α-NeuNAc-(2→3)-β-D-Gal-(1→4)-D-Glc) или 6'-сиалиллактозу (6-N-ацетилнейраминил-лактоза, 6'-сиалил-D-лактоза или α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc) приобретали у Sigma-Aldrich.
Изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) количественно сравнивали в двух главных органах (мозге и гиппокампе), ассоциированных с мозговыми заболеваниями. РНК выделяли агентом TRIzol (Invitrogen). кДНК синтезировали с использованием РНК, которая была выделена, как описано выше, и количественно измерена, и системы обратной транскрипции (Promega, США). Картины экспрессии PGC-1α и связанных генов измеряли с использованием предварительно разработанных праймеров и зондов (Applied Biosystems; PGC-1α, Mm00447181_m1, GAPDH и Mm99999915_q1) для синтезированной кДНК и мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, BDNF, SOD2 и GPX1). Для ПЦР-реакции и анализа использовали систему Rotor-Gene 3000 (Corbett Research, Сидней, Австралия), и результаты показаны на ФИГ. 7а и 7б.
На ФИГ. 7а и 7б показаны изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в моделях болезни Паркинсона. Модели болезни Паркинсона - крысы SD, индуцированные 6-OHDA, которым в возрасте 8 недель вводили 6-OHDA, и которые были поставлены в возрасте 13 недель, группировали на группы введения SL (3'-SL и 6'-SL) и группу без введения SL (8 животных на группу) и затем подвергали анализу с контролем рациона в течение 8 недель, и уровни экспрессии генов опытных групп сравнивали с уровнями экспрессии в контрольной группе, в которой 13-недельных самцов крыс SD (нормальных) кормили нормальным рационом. На ФИГ. 7а и 7б показаны числовые значения (уровень экспрессии генов группы (модель болезни Паркинсона) / уровень экспрессии генов контрольной группы), (уровень экспрессии генов группы (модель болезни Паркинсона плюс 3'-SL) / уровень экспрессии генов контрольной группы) и (уровень экспрессии генов группы (модель болезни Паркинсона плюс 6'-SL) / уровень экспрессии генов контрольной группы) в соответствующих органах по отношению к изменениям экспрессии генов в мозге и гиппокампе по сравнению с нормальными крысами. В результате, как показано на ФИГ. 7а и 7б, на основе контрольной группы нормальных крыс с нормальным рационом, уровни экспрессии нескольких мишеней анализа (Fndc5, Erra, UCP1, BDNF, SOD2 и GPX1), включая PGC-1α, в мозге (ФИГ. 7а) и гиппокампе (ФИГ. 7б) были в некоторой степени ниже в группе с введением 6'-SL (модель болезни Паркинсона плюс 6'-SL) по сравнению с нормальной контрольной группой, но были очень высокими в группе с введением 6'-SL по сравнению с группой без введения SL (модель болезни Паркинсона). Можно было видеть то, что 3'-SL имел относительно низкий эффект по сравнению с 6'-SL, учитывая эффекты стимуляции экспрессии генов. То есть, 6'-SL демонстрировала значительные увеличения уровней экспрессии PGC-1α и связанных генов в мозге и гиппокампе крысиных моделей болезни Паркинсона.
На ФИГ. 8 показаны результаты поведенческого теста на моделях болезни Паркинсона. На ФИГ. 8 ордината представляет время осуществления поворота и время спускания в результате проведения тестов поведенческих способностей (огибание угла и спускание) с использованием вертикального решетчатого устройства на контрольной группе, группе (модель болезни Паркинсона), группе (модель болезни Паркинсона плюс 3'-SL) и группе (модель болезни Паркинсона плюс 6'-SL). Вертикальное решетчатое устройство находилось в виде открытой коробки с размерами 5 см × 55 см × 8 см, и передняя поверхность была сделана из проволочной сетки 0,8 см × 0,8 см, а другие поверхности были сделаны из черного плексигласа. Днище было сделано на 5 см длиннее для безопасности. В данном тесте мышей размещали головой вверх на расстоянии 3 см от верха устройства, и им давали привыкать к устройству три раза в течение двух суток до тестирования. Описанную выше процедуру повторяли, если крыса не могла спуститься вниз в пределах 60 секунд. Время осуществления поворота представляет собой время, которое крыса, смотрящая вверх, тратит для поворота вниз, и время спускания представляет собой время, полученное вычитанием времени осуществления поворота из общего времени тестирования, в течение которого крыса осуществляет поворот и спускается на дно.
Как показано на ФИГ. 8, время осуществления поворота и время спускания в группе без введения SL (модель болезни Паркинсона) были в два или три раза продолжительнее, чем данное время в контрольной группе нормальных крыс с нормальным рационом, и время осуществления поворота и время спускания в группе с введением 6'-SL (модель болезни Паркинсона плюс 6'-SL) было почти аналогичным данному времени в контрольной группе. То есть, могло быть подтверждено то, что 6'-SL улучшал поведенческие способности (осуществление поворота или спускание) у крысиных моделей болезни Паркинсона. Можно было увидеть то, что 3'-SL имела относительно низкий эффект по сравнению с 6'-SL, учитывая эффекты улучшения поведенческих способностей.
Пример 7: оценка стимуляции экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в моделях эпилептического/конвульсивного заболевания мозга
Для того чтобы исследовать изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в моделях эпилептического/конвульсивного заболевания мозга, 4-недельных нормальных крыс SD и моделей эпилептического/конвульсивного заболевания мозга (эпилептические крысы Noda, NER) приобретали в Central Lab Animal (Корея). Вода была свободно доступна, а имеющийся в продаже гранулированный корм (Dooyeul Biotech, Корея) давали в течение двух недель. В возрасте 6 недель крыс SD делили на четыре группы (состоящие из 8 животных на группу): восемь 6-недельных самцов крыс SD (нормальные крысы; исходная средняя масса тела 176,3 плюс/минус 13,3 г), получавших нормальный рацион, использовали в качестве контрольной группы. 6-недельных самцов - моделей эпилептического/конвульсивного заболевания мозга (исходная средняя масса тела 181,8 плюс/минус 11,3 г) случайным образом делили на три группы с получением разного рациона (8 животных на группу), описанные ниже, и данные рационы сохраняли с 6-недельного возраста в течение 10 недель (всего 32 животных):
- контрольная группа: нормальные крысы, которых кормили нормальным рационом без введения SL (8 животных);
- группа (модель эпилептического/конвульсивного заболевания мозга): модели эпилептического/конвульсивного заболевания мозга, которых кормили нормальным рационом без введения SL (8 животных);
- группа (модель эпилептического/конвульсивного заболевания мозга плюс 3'-SL): модели эпилептического/конвульсивного заболевания мозга, которых обрабатывали 3'-сиалиллактозой (3'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела крысы в сутки), помимо нормального рациона (8 животных);
- группа (модель эпилептического/конвульсивного заболевания мозга плюс 6'-SL): модели эпилептического/конвульсивного заболевания мозга, которых обрабатывали 6'-сиалиллактозой (6'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела крысы в сутки), помимо нормального рациона (8 животных).
Ежесуточно перорально вводили сиалиллактозу или DW. Крыс содержали в помещениях для животных в течение 10 недель, подвергали голоданию в течение 12 часов и умерщвляли. Каждые 5 суток измеряли потребление пищи и изменение массы тела. 3'-Сиалиллактозу (3'-N-ацетилнейраминил-D-лактоза, 3'-сиалил-D-лактоза или α-NeuNAc-(2→3)-β-D-Gal-(1→4)-D-Glc) или 6'-сиалиллактозу (6'-N-ацетилнейраминил-лактоза, 6'-сиалил-D-лактоза или α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc) приобретали у Sigma-Aldrich.
Изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) количественно сравнивали в двух главных органах (мозге и гиппокампе), ассоциированных с мозговыми заболеваниями. РНК выделяли агентом TRIzol (Invitrogen). кДНК синтезировали с использованием РНК, которая была выделена, как описано выше, и количественно измерена, и системы обратной транскрипции (Promega, США). Картины экспрессии PGC-1α и связанных генов измеряли с использованием предварительно разработанных праймеров и зондов (Applied Biosystems; PGC-1α, Mm00447181_m1, 999915_q1) для синтезированной кДНК и мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, BDNF, SOD2 и GPX1). Для ПЦР-реакции и анализа использовали систему Rotor-Gene 3000 (Corbett Research, Сидней, Австралия), и результаты показаны на ФИГ. 9.
На ФИГ. 9а и 9б показаны изменения экспрессии генов посредством обработки композициями SL в моделях эпилептического/конвульсивного заболевания мозга. На ФИГ. 9а и 9б по ординатам отложены числовые значения (уровень экспрессии генов группы (модель эпилептического/конвульсивного заболевания мозга) / уровень экспрессии генов контрольной группы), (уровень экспрессии генов группы (модель эпилептического/конвульсивного заболевания мозга плюс 3'-SL) / уровень экспрессии генов контрольной группы) и (уровень экспрессии генов группы (модель эпилептического/конвульсивного заболевания мозга плюс 6'-SL) / уровень экспрессии генов контрольной группы) в соответствующих органах по отношению к изменениям относительной экспрессии генов в мозге или гиппокампе по сравнению с контрольной группой. 6-недельных моделей эпилептического/конвульсивного заболевания мозга группировали в группы с введением SL и группу без введения SL (8 животных на группу) и затем подвергали анализу с контролем рациона в течение 10 недель, и уровни экспрессии генов в опытных группах сравнивали в уровнем в контрольной группе, в которой 6-недельных самцов крыс SD (нормальных) кормили нормальным рационом. В результате, как показано на ФИГ. 9а и 9б, на основе контрольной группы нормальных крыс с нормальным рационом, уровни экспрессии нескольких мишеней анализа (Fndc5, Erra, UCP1, BDNF, SOD2 и GPX1), включая PGC-1α, в мозге (ФИГ. 9а) и гиппокампе (ФИГ. 9б) были в некоторой степени ниже в группах с введением SL (модель эпилептического/конвульсивного заболевания мозга плюс SL) по сравнению с нормальной контрольной группой, но были очень высокими в группах с введением SL по сравнению с группой без введения SL (модель эпилептического/конвульсивного заболевания мозга). То есть, 6'-SL демонстрировал значительные повышения уровней экспрессии PGC-1α и связанных генов в мозге и гиппокампе крысиных моделей эпилептического/конвульсивного заболевания мозга. Можно было видеть то, что 3'-SL имел относительно низкий эффект по сравнению с 6'-SL, учитывая эффекты стимуляции экспрессии генов.
Пример 8: оценки стимуляции экспрессии генов и улучшения времени поездки на вращающемся цилиндре посредством обработки композициями SL (3'-SL и 6'-SL) в моделях заболевания мозга - болезни Гентингтона
Для того чтобы исследовать изменения экспрессии генов и познавательных способностей посредством обработки композициями SL (3'-SL и 6'-SL) в моделях заболевания мозга - болезни Гентингтона, 4-недельных мышей приобретали в Central Lab Animal (Корея). Вода была свободно доступна, а имеющийся в продаже гранулированный корм (Dooyeul Biotech, Корея) давали в течение одной недели. В возрасте 5 недель мышей делили на три группы (состоящие из восьми мышей для каждой группы): восемь 5-недельных самцов мышей C57/BL6 (нормальные мыши; исходная средняя масса тела 25,3 плюс/минус 4,3 г), получавших нормальный рацион, использовали в качестве контрольной группы. 5-недельных самцов мышиной модели болезни Гентингтона (серия R6/2 (B6CBATg(HDexon1)62Gpb/3J, 111 CAGs) трансгенных мышей HD; исходная средняя масса тела 26,9 плюс/минус 4,8 г) случайным образом делили на три группы с получением разного рациона (по восемь мышей на группу), и данные рационы сохраняли в течение 10 недель (всего 32 животных):
- контрольная группа: нормальные мыши, которых кормили нормальным рационом без введения SL (8 животных);
- группа (модель болезни Гентингтона): модели болезни Гентингтона, которых кормили нормальным рационом без введения SL (8 животных);
- группа (модель болезни Гентингтона плюс 3'-SL): модели болезни Гентингтона, обработанные 3'-сиалиллактозой (3'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо нормального рациона (8 животных);
- группа (модель болезни Гентингтона плюс 6'-SL): модели болезни Гентингтона, обработанные 6'-сиалиллактозой (6'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо нормального рациона (8 животных).
Ежесуточно перорально вводили сиалиллактозу или DW. Мышей содержали в помещениях для животных в течение 10 недель, подвергали голоданию в течение 12 часов и умерщвляли. Каждые 5 суток измеряли потребление пищи и изменение массы тела. 3'-Сиалиллактозу (3'-N-ацетилнейраминил-D-лактоза, 3'-сиалил-D-лактоза или α-NeuNAc-(2→3)-β-D-Gal-(1→4)-D-Glc) или 6'-сиалиллактозу (6'-N-ацетилнейраминил-лактоза, 6'-сиалил-D-лактоза или α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc) приобретали у Sigma-Aldrich.
Изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) количественно сравнивали в двух главных органах (мозге и гиппокампе), ассоциированных с мозговыми заболеваниями. РНК выделяли агентом TRIzol (Invitrogen). кДНК синтезировали с использованием РНК, которая была выделена, как описано выше, и количественно измерена, и системы обратной транскрипции (Promega, США). Картины экспрессии PGC-1α и связанных генов измеряли с использованием предварительно разработанных праймеров и зондов (Applied Biosystems; PGC-1α, Mm00447181_m1, GAPDH и Mm99999915_q1) для синтезированной кДНК и мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, BDNF, SOD2 и GPX1). Для ПЦР-реакции и анализа использовали систему Rotor-Gene 3000 (Corbett Research, Сидней, Австралия), и результаты показаны на ФИГ. 10.
На ФИГ. 10а и 10б показаны изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в моделях болезни Гентингтона. На ФИГ. 10а и 10б показаны числовые значения (уровень экспрессии генов группы (модель болезни Гентингтона) / уровень экспрессии генов контрольной группы), (уровень экспрессии генов группы (модель болезни Гентингтона плюс 3'-SL) / уровень экспрессии генов контрольной группы) и (уровень экспрессии генов группы (модель болезни Гентингтона плюс 6'-SL) / уровень экспрессии генов контрольной группы) в соответствующих органах по отношению к изменениям экспрессии генов в мозге и гиппокампе по сравнению с контрольной группой нормальных мышей. 5-недельных самцов мышиной модели болезни Гентингтона группировали в группы с введением SL (3'-SL и 6'-SL) и группу без введения SL (8 животных на группу), затем подвергали анализу с контролем рациона в течение 10 недель, и уровни экспрессии генов в опытных группах сравнивали с уровнями экспрессии у нормальных мышей (C57/BL6) с нормальным рационом. В результате, как показано на ФИГ. 10а и 10б, на основе контрольной группы нормальных мышей с нормальным рационом, уровни экспрессии нескольких мишеней анализа (Fndc5, Erra, UCP1, BDNF, SOD2 и GPX1), включая PGC-1α, в мозге (ФИГ. 10а) и гиппокампе (ФИГ. 10б) были в некоторой степени ниже в группе с введением 6'-SL (модель болезни Гентингтона плюс 6'-SL) по сравнению с нормальной контрольной группой, но были превосходными в группе с введением 6'-SL по сравнению с группой без введения SL (модели болезни Гентингтона). То есть, 6'-SL демонстрировала значительные увеличения уровней экспрессии PGC-1α и связанных генов в мозге и гиппокампе мышиных моделей болезни Гентингтона. Можно было видеть то, что 3'-SL имел относительно низкий эффект по сравнению с 6'-SL, учитывая эффекты стимуляции экспрессии генов.
Кроме того, улучшение поведения оценивали посредством изменений времени поездки на вращающемся цилиндре группы (модель болезни Гентингтона), группы (модель болезни Гентингтона плюс 3'-SL) и группы (модель болезни Гентингтона плюс 6'-SL) по сравнению с нормальными мышами с нормальным рационом. Тест поездки на вращающемся цилиндре предназначен для исследования изменений числовых значений (время поездки на вращающемся цилиндре группы (модель болезни Гентингтона) / время поездки на вращающемся цилиндре контрольной группы), (время поездки на вращающемся цилиндре группы (модель болезни Гентингтона плюс 3'-SL) / время поездки на вращающемся цилиндре контрольной группы) и (время поездки на вращающемся цилиндре группы (модель болезни Гентингтона плюс 6'-SL) / время поездки на вращающемся цилиндре контрольной группы). Время поездки на вращающемся цилиндре измеряли посредством устройства с вращающимся цилиндром (цилиндр, ускоряющийся со скоростью вращения 4-40 об./мин на протяжении 3 минут, Jungdo Instruments, Корея). После практики 4-недельных мышей в тесте на вращающемся цилиндре, проводили тест на вращающемся цилиндре с 5-недельного возраста, и измеряли среднее время до падения.
На ФИГ. 11 показаны результаты теста поездки на вращающемся цилиндре в моделях болезни Гентингтона. На ФИГ. 11 по ординате отложены числовые значения (время поездки на вращающемся цилиндре группы (модель болезни Гентингтона) / время поездки на вращающемся цилиндре контрольной группы), (время поездки на вращающемся цилиндре группы (модель болезни Гентингтона плюс 3'-SL) / время поездки на вращающемся цилиндре контрольной группы) и (время поездки на вращающемся цилиндре группы (модель болезни Гентингтона плюс 6'-SL) / время поездки на вращающемся цилиндре контрольной группы). В результате, как показано на ФИГ. 11, при сравнении тестов поездки на вращающемся цилиндре для группы (модель болезни Гентингтона), группы (модель болезни Гентингтона плюс 3'-SL) и группы (модель болезни Гентингтона плюс 6'-SL) с контрольной группой нормальных мышей с нормальным рационом время поездки на вращающемся цилиндре возрастало в группе с введением 6'-SL (модель болезни Гентингтона плюс 6'-SL) по сравнению с группой без введения SL-группой (модель болезни Гентингтона), а эффект увеличения времени поездки 3'-SL был меньше, чем эффект 6'-SL. То есть, можно было подтвердить то, что 6'-SL наилучшим образом стимулировал улучшение поведения в моделях болезни Гентингтона.
Пример 9: изменения ишемического объема и балла MLPT посредством обработки композициями SL (3'-SL и 6'-SL) в моделях инсульта
Для того чтобы исследовать изменения ишемического объема и балла модифицированного теста на определение реакции конечностей (MLPT) посредством обработки композициями SL (3'-SL и 6'-SL) в моделях инсульта, 4-недельных мышей приобретали в Central Lab Animal (Корея). Вода была свободно доступна, а имеющийся в продаже гранулированный корм (Dooyeul Biotech, Корея) давали в течение одной недели. Модели инсульта, включающие временную и постоянную окклюзию средней мозговой артерии (МСА) и кровоизлияние в мозг (ICH), получали с использованием 6-недельных самцов крыс Sprague-Dawley (средняя масса тела 185,3 плюс/минус 15,8 г) и самцов мышей BALB/c (средняя масса тела 24,6 плюс/минус 3,8 г). Для сравнения эффектов введения SL, мышей случайным образом группировали, через один час после индукции инсульта, в три разные группы с внутрибрюшинным введением (8 животных на группу, всего 24 животных), описанные ниже, и затем им внутрибрюшинно вводили:
- контрольная группа: контрольная группа с внутрибрюшинным введением среды на основе лизисного буфера (8 животных);
- обработка 3'-SL: группа с внутрибрюшинным введением среды на основе лизисного буфера с 3'-SL (8 животных);
- обработка 6'-SL: группа с внутрибрюшинным введением среды на основе лизисного буфера с 6'-SL (8 животных).
В качестве дополнительных моделей церебрального инфаркта использовали мышиные модели местного церебрального инфаркта, и в данных моделях внутрибрюшинно вводили SL (3'-SL и 6'-SL) через 3 часа после индукции церебрального инфаркта:
- контрольная группа: контрольная группа с внутрибрюшинным введением среды на основе лизисного буфера (8 животных);
- обработка 3'-SL: группа с внутрибрюшинным введением среды на основе лизисного буфера с 3'-SL (8 животных);
- обработка 6'-SL: группа с внутрибрюшинным введением среды на основе лизисного буфера с 6'-SL (8 животных).
Измерение ишемического объема проводили через 24 часа после ишемической индукции посредством измерения объема ишемической области (инфаркт и его пограничная зона) с использованием 2,3,7-трифенилтетразолия хлорида (ТТС) следующим образом. После извлечения мозга получали срезы фронтальной оконечности толщиной 1 мм и погружали в раствор 2% ТСС. Окрашенные срезы затем фиксировали PBS (фосфатно-солевой буферный раствор) - 4% параформальдегида, и место ишемии и область полушария каждого среза измеряли с использованием системы анализа изображений. Значения, обусловленные отеком мозга, корректировали следующим образом: исправленное значение ишемического объема: измеренная площадь ишемии × 1 - {[площадь ипсилатерального полушария - площадь контралатерального полушария) / площадь контралатерального полушария]}. Ишемический объем был выражен в виде процентной доли общего объема полушария.
На ФИГ. 12 показан результат наблюдения ишемического объема в ишемических моделях. На ФИГ. 12 показаны результаты наблюдения защитных эффектов SL в отношении ишемического повреждения нервной ткани in vivo при обработке мышиных моделей с временной и постоянной окклюзией средней мозговой артерии (МСА) 3'- или 6'-SL. Как показано на ФИГ. 12, уменьшение ишемического объема посредством обработки 6'-SL составляло примерно 50% во всех моделях местной мозжечковой постоянной ишемии (50%), моделях местной мозжечковой временной ишемии (50%) и моделях местной мозжечковой постоянной окклюзии (40%). Можно было видеть то, что 3'-SL имела относительно слабый эффект по сравнению с 6'-SL, учитывая защитные эффекты на ишемическое повреждение нервной ткани.
Кроме того, для того, чтобы исследовать ингибирование нейродегенерации посредством SL (3'-SL и 6'-SL) в моделях ICH, провели MLPT тест. MLPT тест проводили за одни сутки до, через одни сутки после и через трое суток после индукции ICH. Модель подвешивали на высоте 10 см над столом, и протягивание передних лап к столу подвергали бальной оценке (0 баллов за нормальное протягивание и 1 балл за ненормальное сгибание). Затем давали передним лапам модели двигаться через край, и каждую переднюю лапу аккуратно опускали вниз, и проверяли отведение и помещение (передняя лапа - вторая задача; задняя лапа -третья задача). Наконец, крысу помещали обратно к краю стола для проверки латерального размещения передних лап. Осуществляли бальную оценку результатов трех задач следующим образом: 0 баллов за нормальное выполнение, 1 балл за выполнение с задержкой (по меньшей мере 2 секунды) или неполное выполнение и 2 балла за невыполнение. Общий балл семь показывает максимальную неврологическую недостаточность, и бальная оценка в 0 баллов показывает нормальное функционирование.
На ФИГ. 13 показаны изменения баллов MLPT теста посредством обработки SL (3'-SL и 6'-SL) после индукции ICH. Как показано на ФИГ. 13, как можно видеть из результатов первых суток и третьих суток после индукции модели IHC, балл MLPT теста был ниже при обработке моделей ICH 6'-SL по сравнению с контрольной группой. То есть, наблюдались ингибирующие эффекты на нейродегенерацию посредством обработки 6'-SL. Можно было видеть то, что 3'-SL оказывала относительно слабый эффект по сравнению с 6'-SL, учитывая ингибирующие эффекты на нейродегенерацию.
Пример 10: оценка изменений экспрессии генов в брюшном жире и местного удаления жира посредством обработки композициями SL (3'-SL и 6'-SL)
Для того чтобы исследовать эффекты обработки композициями SL (3'-SL и 6'-SL) на изменения экспрессии генов и местное удаление жира в мышиных моделях, 4-недельных самцов мышиных моделей ob (C57BL/6J-ob/ob) приобретали в Central Lab Animal (Корея). Вода была свободно доступна, а рацион с высоким содержанием жира (рацион для грызунов с 60 ккал% жира) давали в течение двух недель. 6-недельных самцов мышиных моделей ob (C57BL/6J-ob/ob) (исходная средняя масса тела 34,2 плюс/минус 3,7 г) случайным образом группировали на три группы с получением разного рациона (8 животных на группу), описанные ниже, и данные рационы сохраняли в течение 10 недель (всего 24 животных):
- контрольная группа: модели, которых кормили рационом с высоким содержанием жира (рацион для грызунов с 60 ккал% жира) без обработки SL (8 животных);
- группа с введением 3'-SL: модели, обработанные 3'-сиалиллактозой (3'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо рациона с высоким содержанием жира (8 животных);
- группа с введением 6'-SL: модели, обработанные 6'-сиалиллактозой (6'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо рациона с высоким содержанием жира (8 животных).
Ежесуточно перорально вводили сиалиллактозу или DW. Мышей содержали в помещениях для животных в течение 10 недель, подвергали голоданию в течение 12 часов и умерщвляли. Каждые 5 суток измеряли потребление пищи и изменение массы тела. 3'-Сиалиллактозу (3'-N-ацетилнейраминил-D-лактоза, 3'-сиалил-D-лактоза или α-NeuNAc-(2→3)-β-D-Gal-(1→4)-D-Glc) или 6'-сиалиллактозу (6'-N-ацетилнейраминил-лактоза, 6'-сиалил-D-лактоза или α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc) приобретали у Sigma-Aldrich.
Изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) количественно сравнивали в брюшной части. РНК выделяли агентом TRIzol (Invitrogen). кДНК синтезировали с использованием РНК, которая была выделена, как описано выше, и количественно измерена, и системы обратной транскрипции (Promega, США). Картины экспрессии PGC-1α и связанных генов измеряли с использованием предварительно разработанных праймеров и зондов (Applied Biosystems; PGC-1α, Mm00447181_m1, GAPDH и Mm99999915_q1) для синтезированной кДНК и мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, SOD2 и GPX1). Для ПЦР-реакции и анализа использовали систему Rotor-Gene 3000 (Corbett Research, Сидней, Австралия), и результаты показаны на ФИГ. 14.
На ФИГ. 14 показаны изменения экспрессии генов посредством обработки композициями SL в мышиных моделях. На ФИГ. 14 по ординате представлено отношение экспрессии генов в брюшном жире в моделях, которых кормили рационом с высоким содержанием жира, по сравнению с введением SL, которое показывает числовые значения (уровень экспрессии генов группы с введением 3'-SL / уровень экспрессии генов контрольной группы) и (уровень экспрессии генов группы с введением 6'-SL / уровень экспрессии генов контрольной группы) в брюшном жире. 6-недельных самцов мышей делили на контрольную группу и группы с введением SL (8 животных на группу), которые подвергали анализу с контролируемой высокожировой диетой в течение 10 недель. В результате, как показано на ФИГ. 14, группа с введением 6'-SL демонстрировала примерно двукратные значимые увеличения уровней экспрессии нескольких мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, SOD2 и GPX1) по сравнению с группой негативного контроля. Можно было видеть то, что 3'-SL имела относительно низкий эффект по сравнению с 6'-SL, учитывая эффекты стимулирования экспрессии PGC-1α и связанных генов.
Кроме того, в мышиных моделях ob (C57BL/6J-ob/ob), которых кормили рационом с высоким содержанием жира без обработки SL, исследовали эффект местного удаления жира посредством введения SL (3'-SL и 6'-SL) с использованием мезороллера (0,5 мм, INTO MR, Intomedi Inc.). В частности, сбривали волосы на спинной стороне крысы, наносили на кожу 0,1 М SL в буфере на основе физиологического раствора и абсорбировали в кожу посредством втирания с использованием мезороллера. Контрольную группу тестировали таким же способом, за исключением того, что буфер использовали без SL. Результаты показаны на ФИГ. 15. На ФИГ. 15 показаны изменения экспрессии генов при местном применении композиций SL (3'-SL и 6'-SL) мышиным моделям. На ФИГ. 15 3'-SL, 6'-SL и CTL представляют группу с введением 3'-SL, группу с введением 6'-SL и контрольную группу соответственно. После кормления рационом с высоким содержанием жира в течение 10 недель, местно вводили композиции SL (3'-SL и 6'-SL) в сутки 0 и сутки 4 с использованием мезороллера, и затем проводили наблюдение дермоскопией в сутки 7. Показаны результаты наблюдения.
В результате, как показано на ФИГ. 15, можно было подтвердить то, что местный жир был удален в части, в которую была введена 6'-SL с использованием мезороллера, по сравнению с частью негативного контроля. Можно было видеть то, что 3'-SL имела относительно слабый эффект по сравнению с 6'-SL, учитывая эффекты местного удаления жира.
Пример 11: изменения экспрессии генов частями организма и эффект профилактики хронического заболевания, связанного со старением, через контроль функций теломеров и ROS посредством обработки композициями SL (3'-SL и 6'-SL) в моделях стимуляции старения.
Для того чтобы исследовать изменения экспрессии генов частями организма посредством обработки композициями SL (3'-SL и 6'-SL) в моделях стимуляции старения, приобретали 4-недельных самцов мышиной модели стимуляции старения (SAM P1/Sku Slc) у Central Lab Animal (Корея). Вода была свободно доступна, а имеющийся в продаже гранулированный корм (Dooyeul Biotech, Корея) давали в течение одной недели. 6-недельных самцов мышиной модели стимуляции старения (исходная средняя масса тела 28,8 плюс/минус 2,3 г) случайным образом группировали на три группы с разным рационом (8 животных на группу), описанные ниже, и данные рационы сохраняли в течение 12 недель (всего 24 животных):
- контрольная группа: нормальные мыши, которых кормили нормальным рационом без введения SL (8 животных);
- группа с введением 3'-SL: модели стимуляции старения, обработанные 3'-сиалиллактозой (3'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо нормального рациона (8 животных);
- группа с введением 6'-SL: модели стимуляции старения, обработанные 6'-сиалиллактозой (6'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо нормального рациона (8 животных).
Ежесуточно перорально вводили сиалиллактозу или DW. Мышей содержали в помещениях для животных в течение 14 недель, подвергали голоданию в течение 12 часов и умерщвляли. Каждые 5 суток измеряли потребление пищи и изменение массы тела. 3'-Сиалиллактозу (3'-N-ацетилнейраминил-D-лактоза, 3'-сиалил-D-лактоза или α-NeuNAc-(2→3)-β-D-Gal-(1→4)-D-Glc) или 6'-сиалиллактозу (6'-N-ацетилнейраминил-лактоза, 6'-сиалил-D-лактоза или α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc) приобретали у Sigma-Aldrich.
Изменения экспрессии генов посредством введения композиций SL (3'-SL и 6'-SL) количественно сравнивали для восьми главных органов (сердце, гиппокамп, мозг, спинной мозг, легкое, печень, селезенка и почка), трех скелетных мышц (камбаловидная мышца, четырехглавая мышца бедра и икроножная мышца) и тому подобного. РНК выделяли агентом TRIzol (Invitrogen). кДНК синтезировали с использованием РНК, которая была выделена, как описано выше, и количественно измерена, и системы обратной транскрипции (Promega, США). Картины экспрессии PGC-1α и родственных генов измеряли с использованием предварительно разработанных праймеров и зондов (Applied Biosystems; PGC-1α, Mm00447181_m1, GAPDH и Mm99999915_q1) для синтезированной кДНК и мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, SOD2 и GPX1). Для ПЦР-реакции и анализа использовали систему Rotor-Gene 3000 (Corbett Research, Сидней, Австралия), и результаты показаны на ФИГ. 16.
На ФИГ. 16а и 16б показаны изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в моделях стимуляции старения. 6-недельные самцы мышиной модели стимуляции старения (SAM P1/Sku Slc) группировали в контрольную группу, группу с введением 3'-SL и группу с введением 6'-SL (8 животных на группу) и затем подвергали анализу с контролируемой диетой в течение 12 недель. На ФИГ. 16а и 16б по ординатам представлены изменения относительной экспрессии генов частями организма по сравнению с моментом до введения SL (3'-SL и 6'-SL), которые показывают числовые значения следующего: (уровень экспрессии генов группы с введением 3'-SL / уровень экспрессии генов контрольной группы) и (уровень экспрессии генов группы с введением 6'-SL / уровень экспрессии генов контрольной группы) в соответствующих частях организма. В результате, как показано на ФИГ. 16а и 16б, и 3'-SL (ФИГ. 16а) и 6'-SL (ФИГ. 16б) демонстрировали значимые увеличения уровеней экспрессии нескольких мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, SOD2 и GPX1) в большинстве органов и скелетных мышц, и 3'-SL имел относительно низкий эффект по сравнению с 6'-SL, учитывая эффекты стимуляции экспрессии генов мишеней анализа.
Кроме того, для анализов на уровне клеток были выделены гладкомышечные клетки мышиной аорты (MASM) из контрольной группы, которую кормили рационом с высоким содержанием жира (рацион для грызунов с 60 ккал% жира) без введения SL (Griendling et al., 1991), и композиции SL (3'-SL и 6'-SL) добавляли в культуральную жидкость с последующей инкубацией. Для измерения внутриклеточного H2O2 (значения ROS) клетки культивировали в 12-луночных культуральных планшетах с погружением в 0,1%-ную телячью коровью сыворотку. Значения уровня внутриклеточных ROS измеряли с использованием H2DCFDA. Для анализа клетки культивировали совместно с H2DCFDA в буфере HBSS (сбалансированный солевой раствор Хэнкса) в течение 30 минут. Клетки трипсинизировали, промывали и лизировали в HBSS. Немедленно измеряли значения флуоресценции посредством планшет-ридера CytoFluor (ФИГ. 17а).
Для измерения образования митохондриального супероксида, митохондриальные ROS измеряли с использованием MitoSOX Red (флуоресцентный маркер митохондриального супероксида). MASM выделяли и инкубировали с MitoSOX (4 мкМ) в темном помещении при 37°С в течение 20 минут. Флуоресценцию MitoSOX количественно измеряли посредством считывания интенсивности флуоресценции клеток с использованием флуоресцентного планшет-ридера (возбуждение 480 нм / испускание 580 нм) (ФИГ. 17б).
На ФИГ. 17а и 17б MASM были выделены из контрольной группы мышиной модели стимуляции старения, а композиции SL (3'-SL и 6'-SL) были добавлены в культуральную жидкость для проведения сравнения. Для измерения внутриклеточного H2O2 (значения ROS) клетки культивировали совместно с H2DCFDA (ФИГ. 17а), и для измерения митохондриальных ROS клетки культивировали совместно с MitoSOX Red (флуоресцентный маркер митохондриального супероксида) (ФИГ. 17а). Внутриклеточный H2O2 и образование митохондриального супероксида количественно измеряли посредством флуоресцентного планшет-ридера. Можно было видеть то, что композиции снижали значения ROS и ингибировали образование митохондриального супероксида.
На ФИГ. 17а и 17б показаны результаты измерения внутриклеточного H2O2 (значения ROS) (ФИГ. 17а) и результаты измерения образования митохондриального супероксида (ФИГ. 17б). MASM выделяли из мышиной модели стимуляции старения (SAM P1/Sku Slc), а композиции SL (3'-SL и 6'-SL) были добавлены в культуральную жидкость для проведения сравнения. Для измерения внутриклеточного H2O2 клетки культивировали совместно с H2DCFDA (ФИГ. 17а), и для измерения митохондриальных ROS клетки культивировали совместно с MitoSOX Red (флуоресцентный маркер митохондриального супероксида) (ФИГ. 17а). Внутриклеточный H2O2 и образование митохондриального супероксида количественно измеряли посредством флуоресцентного планшет-ридера. Можно было видеть то, что композиции SL (3'-SL и 6'-SL) снижали значения ROS и ингибировали образование митохондриального супероксида.
На ФИГ. 18а и 18б была измерена теломеразная активность с использованием протокола TRAP (Wright et al., 1995). Вкратце, клеточные осадки лизировали в лизирующем растворителе CHAPS (содержащем ингибитор рибонуклеазы), с последующей инкубацией при 40°С в течение 30 минут. Клеточные экстракты (1 мг) помещали в реакционную смесь TRAPeze (праймер субстрата теломеразы (TS), флуоресцентно меченый RP (обратный) праймер, матрица контрольного стандарта и меченный сульфородамином стандартный праймер K2). TS праймер подвергался элонгации при 30°С в течение 30 минут, и затем была проведена ПЦР. Флуоресценцию полученного таким образом продукта TRAP измеряли с использованием флуоресцентного планшет-ридера для количественного измерения теломеразной активности. Относительную теломеразную активность нормировали посредством отношения природного фторурацила к сульфородамину (внутренний контрольный стандарт) и выражали в процентах. Флуоресцеин (М0250) приобретали у Marker Gene Technologies, Inc. Н2-дихлорфлуоресцеина диацетат (DCFDA) приобретали у Molecular Probes. MitoSOXTM Red, MitoTracker Green FM и MitoTracker® Orange CMTMRos (MTO) приобретали у Invitrogen. 10000х краситель на основе золота SYBR® приобретали у Molecular Probes, Inc. Набор для фракционирования ядра/цитозоля (K266-100) приобретали у BioVision. Набор для выявления теломеразы TRAPeze® XL (S7707) приобретали у MILLIPORE. Набор для FISH (флуоресцентная гибридизация in situ) PNA (пептидная нуклеиновая кислота) теломера / Су3 (K5326) приобретали у Dako.
На ФИГ. 18а и 18б показаны результаты измерения теломеразной активности посредством введения композиций SL (3'-SL и 6'-SL). Посредством данных значений могла быть выведена активация TERT и пути элемента нервов, отвечающего на антиоксиданты/электрофилы (ARE/ERE) (Xiong et al., 2015, Cell Reports 12, 1391-1399). Модели стимуляции старения (ФИГ. 18а) и MASM (ФИГ. 18б) обрабатывали SL (3'-SL и 6'-SL) для анализа теломеразной активности. На ФИГ. 18а показаны данные анализа теломеразной активности in vivo в образце аорты, выделенном у контрольной группы, группы с введением 3'-SL и группы с введением 6'-SL. На ФИГ. 18б показаны данные анализа теломеразной активности in vitro при выделении гладкомышечных клеток контрольной группы (Griendling et al., 1991), и MASM культивировали в течение 1 суток в 12-луночных культуральных планшетах при обработке SL (3'-SL и 6'-SL). Результаты анализа показали то, что введение композиций SL (3'-SL и 6'-SL) увеличивало теломеразную активность. Данные результаты свидетельствуют о том, что композиции SL (3'-SL и 6'-SL) могут быть ассоциированы с восстановлением от дисфункции TERT и восстановлением повреждения ДНК (повышенная теломеразная активность - экспрессия TERT) через увеличение уровня PGC-1α.
Пример 12: эффект профилактики хронического заболевания, связанного со старением, через контроль функций теломеров и ROS посредством обработки композициями SL (3'-SL и 6'-SL) в моделях артериосклероза.
Недавно описали то, что удаление гена PGC-1α приводит к старению сосудов, атеросклерозу, дисфункции и уменьшению длины теломеров, повреждению ДНК, пониженной экспрессии и активности обратной транскриптазы теломеразы (TERT) и повышенному уровню р53 (Xiong et al., 2015, Cell Reports 12, 1391-1399).
В общем, у мышей АроЕ-/- повышена чувствительность к окислительному стрессу и воспалению, и быстро развиваются атеросклерозные поражения, наблюдаемые у субъектов, и, таким образом, данных мышей использовали в качестве репрезентативных моделей артериосклероза (Weiss et al., 2001). Следовательно, в Jackson Laboratory приобретали мышей АроЕ-/- (на основе C57BL/6). Генотип идентифицировали посредством ПЦР с использованием ДНК хвоста.
Для того чтобы исследовать эффект профилактики хронического заболевания, связанного со старением, через контроль функций теломеразы и повреждения ДНК посредством обработки композициями SL (3'-SL и 6'-SL) в моделях артериосклероза, два типа 24-недельных самцов мышиных моделей (PGC-1α+/+ApoE-/-) случайным образом группировали в три группы с разным рационом (8 животных на группу), описанные ниже, и данные рационы сохраняли в течение 6 недель (всего 24 животных):
- контрольная группа: модели артериосклероза, которых кормили рационом с высоким содержанием жира (рацион для грызунов с 60 ккал% жира) (8 животных);
- группа с введением 3'-SL: модели артериосклероза, обработанные 3'-сиалиллактозой (3'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо рациона с высоким содержанием жира (8 животных);
- группа с введением 6'-SL: модели артериосклероза, обработанные 6'-сиалиллактозой (6'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо рациона с высоким содержанием жира (8 животных).
Для анализов на уровне клеток были выделены гладкомышечные клетки мышиной аорты (MASM) из контрольной группы, которую кормили рационом с высоким содержанием жира (рацион для грызунов с 60 ккал% жира) без введения SL (Griendling et al., 1991), и композиции SL (3'-SL и 6'-SL) добавляли в культуральную среду, с последующим сравнением. Для измерения внутриклеточного H2O2 (значения ROS) клетки культивировали в 12-луночных культуральных планшетах с погружением в 0,1%-ную телячью сыворотку. Значения внутриклеточного уровня ROS измеряли с использованием H2DCFDA. Для анализа клетки культивировали совместно с H2DCFDA в буфере HBSS в течение 30 минут. Клетки трипсинизировали, промывали и лизировали в HBSS. Немедленно измеряли значения флуоресценции посредством планшет-ридера CytoFluor (ФИГ. 19а).
Для измерения образования митохондриального супероксида, митохондриальные ROS измеряли с использованием MitoSOX Red (флуоресцентный маркер митохондриального супероксида). MASM выделяли и инкубировали с MitoSOX (4 мкМ) в темном помещении при 37° в течение 20 минут. Флуоресценцию MitoSOX количественно измеряли посредством считывания интенсивности флуоресценции клеток с использованием флуоресцентного планшет-ридера (возбуждение 480 нм / испускание 580 нм) (ФИГ. 19б).
На ФИГ. 19а и 19б MASM были выделены из контрольной группы мышиной модели (PGC-1a+/+ApoE-/-), а композиции SL (3'-SL и 6'-SL) были добавлены в культуральную жидкость для проведения сравнения. Для измерения внутриклеточного H2O2 (значения ROS) клетки культивировали совместно с H2DCFDA (ФИГ. 19а), и для измерения митохондриальных ROS клетки культивировали совместно с MitoSOX Red (флуоресцентный маркер митохондриального супероксида) (ФИГ. 19а). Внутриклеточный H2O2 и образование митохондриального супероксида количественно измеряли посредством флуоресцентного планшет-ридера. Можно было видеть то, что композиции снижали значения ROS и ингибировали образование митохондриального супероксида.
На ФИГ. 19а и 19б показаны результаты измерения внутриклеточного H2O2 (значения ROS) (ФИГ. 19а) и результаты измерения образования митохондриального супероксида (ФИГ. 19б). MASM выделяли из мышиной модели (PGC-1α+/+ApoE-/-), а композиции SL (3'-SL и 6'-SL) были добавлены в культуральную жидкость для проведения сравнения. Для измерения внутриклеточного H2O2 клетки культивировали совместно с H2DCFDA (ФИГ. 19а), и для измерения митохондриальных ROS клетки культивировали совместно с MitoSOX Red (флуоресцентный маркер митохондриального супероксида) (ФИГ. 19а). Внутриклеточный H2O2 и образование митохондриального супероксида количественно измеряли посредством флуоресцентного планшет-ридера. Можно было видеть то, что композиции SL (3'-SL и 6'-SL) снижали значения ROS и ингибировали образование митохондриального супероксида.
На ФИГ. 20 была измерена активность теломеразы с использованием протокола TRAP (Wright et al., 1995). Вкратце, клеточные осадки лизировали в лизирующем растворителе CHAPS (содержащем ингибитор рибонуклеазы), с последующей инкубацией при 40°С в течение 30 минут. Клеточные экстракты (1 мг) помещали в реакционную смесь TRAPeze (праймер субстрата теломеразы (TS), флуоресцентно меченый RP (обратный) праймер, матрица контрольного стандарта и меченный сульфородамином стандартный праймер K2). TS праймер подвергался элонгации при 30°С в течение 30 минут, и затем была проведена ПЦР. Флуоресценцию полученного таким образом продукта TRAP измеряли с использованием флуоресцентного планшет-ридера для количественного измерения теломеразной активности. Относительную теломеразную активность нормировали посредством отношения природного фторурацила к сульфородамину (внутренний контрольный стандарт) и выражали в процентах. Флуоресцеин (М0250) приобретали у Marker Gene Technologies, Inc. Н2-дихлорфлуоресцеина диацетат (DCFDA) приобретали у Molecular Probes. MitoSOXTM Red, MitoTracker Green FM и MitoTracker® Orange CMTMRos (MTO) приобретали у Invitrogen. 10000 × краситель на основе золота SYBR® приобретали у Molecular Probes, Inc.. Набор для фракционирования ядра/цитозоля (K266-100) приобретали у BioVision. Набор для выявления теломеразы TRAPeze® XL (S7707) приобретали у MILLIPORE. Набор для FISH PNA теломера /Су3 (K5326) приобретали у Dako.
На ФИГ. 20а и 20б показаны результаты измерения теломеразной активности посредством введения композиций SL (3'-SL и 6'-SL). Посредством данных значений могла быть выведена активация TERT и пути элемента нервов, отвечающего на антиоксидант/электрофил (ARE/ERE) (Xiong et al., 2015, Cell Reports 12, 1391-1399).
На ФИГ. 20a и 20б показаны результаты анализа теломеразной активности посредством обработки моделей артериосклероза (АроЕ-/-; ФИГ. 20а) и MASM (ФИГ. 20б) SL (3'-SL и 6'-SL). На ФИГ. 20а показаны данные анализа теломеразной активности in vivo в образце аорты, выделенном у контрольной группы, группы с введением 3'-SL и группы с введением 6'-SL. На ФИГ. 20б показаны данные анализа теломеразной активности in vitro при выделении гладкомышечных клеток контрольной группы (Griendling et al., 1991) и культивировании MASM в течение 1 суток в 12-луночных культуральных планшетах при обработке SL (3'-SL и 6'-SL). Результаты анализа показали то, что введение композиций SL (3'-SL и 6'-SL) увеличивало теломеразную активность. Данные результаты свидетельствуют о том, что композиции SL (3'-SL и 6'-SL) могут быть ассоциированы с дисфункцией TERT и восстановлением повреждения ДНК (повышенная теломеразная активность - экспрессия TERT) через поаышенный уровень PGC-1α.
Пример 13: изменения экспрессии генов частями организма посредством обработки композициями SL (3'-SL и 6'-SL) в анализе кожи
Для того чтобы исследовать изменения экспрессии генов частями организма посредством обработки композициями SL (3'-SL и 6'-SL) в моделях анализа кожи, 6-недельных самцов мышиной модели анализа кожи (HRM2) (безволосый внешний вид с содержанием меланина) случайным образом группировали в три группы с разным рационом (8 животных на группу, всего 24 животных), описанные ниже, и рационы (AIN-76A, Dyets, США) сохраняли в течение 10 недель. Анализ воздействия облучением УФ (ультрафиолет) (анализ темных пятен, морщин), анализ чувствительности кожи, анализ раздражения кожи, анализ подкожного поглощения или тому подобное проводили с использованием переносного измерителя различий цвета (CR-10, Minolta, Япония):
- Контрольная группа: группа, которую кормили нормальным рационом (8 животных);
- Группа с введением 3'-SL: модели, обработанные 3'-сиалиллактозой (3'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо нормального рациона (8 животных);
- Группа с введением 6'-SL: модели, обработанные 6'-сиалиллактозой (6'-SL, Sigma) (пероральное введение 0,1 мг на кг массы тела мыши в сутки), помимо нормального рациона (8 животных).
Можно было видеть то, что группы с введением SL (3'-SL и 6'-SL) демонстрировали значительно улучшенную кожу по сравнению с контрольной группой, учитывая воздействие облучением УФ (анализ темных пятен, морщин), анализ чувствительности кожи, анализ раздражения кожи, анализ подкожного поглощения или тому подобное. Изменения экспрессии генов посредством введения композиций SL (3'-SL и 6'-SL) количественно сравнивали для восьми главных органов (сердце, гиппокамп, мозг, спинной мозг, легкое, печень, селезенка и почка), трех скелетных мышц (камбаловидная мышца, четырехглавая мышца бедра и икроножная мышца) и тому подобное. РНК выделяли агентом TRIzol (Invitrogen). кДНК синтезировали с использованием РНК, которая была выделена, как описано выше, и количественно измерена, и системы обратной транскрипции (Promega, США). Картины экспрессии PGC-1α и родственных генов измеряли с использованием предварительно разработанных праймеров и зондов (Applied Biosystems; PGC-1α, Mm00447181_m1, GAPDH и Mm99999915_q1) для синтезированной кДНК и мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, SOD2 и GPX1). Для ПЦР-реакции и анализа использовали систему Rotor-Gene 3000 (Corbett Research, Сидней, Австралия), и результаты показаны на ФИГ. 21а и 21б.
На ФИГ. 21а и 21б изменения относительной экспрессии генов частями тела по сравнению с моментом до введения SL (3'-SL и 6'-SL) были численно выражены посредством следующего: (уровень экспрессии генов группы с введением 3'-SL / уровень экспрессии генов контрольной группы) и (уровень экспрессии генов группы с введением 6'-SL / уровень экспрессии генов контрольной группы) в соответствующих частях организма. Уровень экспрессии нескольких мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, SOD2 и GPX1), включая PGC-1α, в нескольких частях организма был превосходным в группе с введением 6'-SL по сравнению с группой негативного котнроля. То есть, могло быть подтверждено то, что 6'-SL стимулировала экспрессию PGC-1α и связанных генов в нескольких органах и мышцах нормальных мышей. Можно было видеть то, что 3'-SL имела относительно низкий эффект по сравнению с 6'-SL, учитывая эффекты стимуляции экспрессии генов мишеней анализа.
На ФИГ. 21а и 21б показаны изменения экспрессии генов посредством обработки композициями SL (3'-SL и 6'-SL) в моделях анализа кожи. 6-недельных самцов мышиной модели анализа кожи (HRM2) случайным образом группировали в контрольную группу и группы с введением SL (3'-SL и 6'-SL) (8 животных на группу) и подвергали анализу с контролируемой диетой в течение 10 недель. Изменения относительной экспрессии генов, которые сравнивали с моментом до введения SL (3'-SL и 6'-SL), численно выражали посредством следующих: (уровень экспрессии генов группы с введением 3'-SL/ уровень экспрессии генов контрольной группы) и (уровень экспрессии генов группы с введением 6'-SL/ уровень экспрессии генов контрольной группы), которые представляют собой относительные отношения значений, полученных посредством количественного измерения «уровня экспрессии генов группы с введением SL» и «уровня экспрессии генов контрольной группы» в каждой части организма. Значимые увеличения уровней экспрессии нескольких мишеней анализа (Fndc5, PGC-1α, Erra, UCP1, SOD2 и GPX1) наблюдали в большинстве органов и скелетных мышц. Можно было видеть то, что 3'-SL (ФИГ. 21а) имела относительно низкий эффект по сравнению с 6'-SL (ФИГ. 21б), учитывая эффекты стимуляции экспрессии генов мишеней анализа.
Пример 14: эффекты композиции сиалиллактозы (3'-SL и 6'-SL) на дифференцированные адипоциты
(1) Культура клеток 3T3-L1 и дифференциация
Адипоциты 3T3-L1 приобретали в Корейском банке клеточных линий. Для культивирования и поддержания адипоцитов 3T3-L1 клетки субкультивировали в среде Игла, модифицированной по Дульбекко (DMEM, Welgene, Корея), дополненной 10% коровьей телячей сыворотки (FCS, Welgene, Корея), в инкубаторе с 5% CO2 при 37°С. Адипоциты 3T3-L1 делили на шесть групп следующим образом: NT; группа нормальных дифференцированных клеток (контрольная группа), опытная группа с сиалиллактозой: опытные группы, обработанные 1, 10, 100, 1000 и 10000 мкМ сиалиллактозы (SL, Sigma-Aldrich, США). Для дифференциации клеток клетки распределяли в 6-луночные планшеты при плотности 2×105 клеток на лунку и выращивали до 100%-ной конфлюентности. Через 2 суток опытные группы обрабатывали средой DMEM, содержащей 10% телячей коровьей сыворотки (FBS, Welgene, Корея), раствор MDI (0,5 мМ изобутилметилксантин (IBMX, Sigma-Aldrich, США), 1 мкМ дексаметазон (Sigma-Aldrich, США) и 1 мкг/мл инсулина (Sigma-Aldrich, США), и вновь обрабатывали DMEM, содержащей 10% FBS и 1 мкг/мл инсулина. Затем клетки дифференцировались в адипоциты, в то время как среду заменяли на DMEM, дополненную 10% FBS, каждые двое суток. В конце дифференциации среду DMEM, дополненную 10% FBS, обрабатывали 3'-сиалиллактозой или 6'-сиалиллактозой в концентрации 0; 0,01; 0,1; 1 и 10 мМ в течение 10 суток.
(2) Окрашивание масляным красным О
После дифференциации в 6-луночных планшетах адипоциты 3T3-L1, обработанные 3'-сиалиллактозой или 6'-сиалиллактозой, два раза промывали PBS и затем добавляли к ним 2 мл 10%-ного формалина (Sigma-Aldrich, США) для фиксации адипоцитов при комнатной температуре в течение 10 минут. После сушки зафиксированных клеток клетки обрабатывали 1 мл красителя масляный красный О (Sigma-Aldrich, США) в течение 20 минут и затем в достаточной степени промывали четыре раза дистиллированной водой для удаления красителя масляный красный О. Затем добавляли 1 мл 100%-ного изопропанола (Sigma-Aldrich, США) для растекания окрашенных адипоцитов, и затем количество накопившегося жира измеряли с использованием поглощения при 500 нм.
(3) Измерение свободного глицерина
Среду, полученную посредством обработки адипоцитов 3T3-L1, дифференцировавшихся в 6-луночных планшетах с использованием 6'-сиалиллактозы в концентрациях 0; 0,01; 0,1; 1 и 10 мкМ и культивирования данных адипоцитов в течение 10 суток, отбирали в пробирку Эппендорфа, с последующим анализом свободного глицерина с использованием набора для анализа глицерина на основе клеток (cayman, 10011725, США). 100 мкл реактива для анализа свободного глицерина добавляли в 25 мкл среды, с последующей инкубацией при комнатной температуре в течение 15 минут, и затем измеряли поглощение при 540 нм.
(4) Измерение жизнеспособности клеток
После дифференциации адипоциты 3T3-L1, обработанные 6'-сиалиллактозой, измеряли на жизнеспособность клеток с использованием набора-8 для подсчета клеток (Dojindo Molecular Technologies, Inc. США). После обработки лекарственным средством добавляли 10 мкл реактива ССК-8, с последующей инкубацией в течение 2 часов, и измеряли поглощение при 450 нм.
Как может быть подтверждено из ФИГ. 22 и 23, уровень внутриклеточного жира был снижен посредством добавления сиалиллактозы в дифференцированные адипоциты, и, в особенности, уровень внутриклеточного жира сильно уменьшался в опытных группах с добавлением 6'-сиалиллактозы.
На ФИГ. 22а и 22б показаны изменения уровня внутриклеточного жира при введении 6'-сиалиллактозы (ФИГ. 22а) и 3'-сиалиллактозы (ФИГ. 22б) в дифференцированные адипоциты. NT представляет контрольную группу, и 0,01; 0,1; 1 и 10 мМ представляют опытные группы, обработанные 0,01; 0,1; 1 и 10 мМ 6'-сиалиллактозы (ФИГ. 22а) и 3'-сиалиллактозы (ФИГ. 22б) соответственно.
ФИГ. 23а и 23б представляют собой полученные оптической микроскопией изображения клеток (анализ с масляным красным О), показывающие изменения внутриклеточного жира при введении в дифференцированные адипоциты 6'-сиалиллактозы (ФИГ. 23а) и 3'-сиалиллактозы (ФИГ. 23б). На ФИГ. NT представляет контрольную группу, и 0,01; 0,1; 1 и 10 мМ представляют опытные группы, обработанные 0,01; 0,1; 1 и 10 мМ 6'-сиалиллактозы (ФИГ. 23а) и 3'-сиалиллактозы (ФИГ. 23б) соответственно.
Как можно подтвердить из ФИГ. 24, сиалиллактозы не влияли на жизнеспособность клеток в концентрациях вплоть до 10 мМ в дифференцированных адипоцитах.
На ФИГ. 24 показан эффект 6'-сиалиллактозы на жизнеспособность клеток в дифференцированных адипоцитах. NT представляет контрольную группу, и 0,01; 0,1; 1; 10 и 100 мМ представляют опытные группы, обработанные 0,01; 0,1; 1, 10 и 100 мМ 6'-сиалиллактозы соответственно.
Кроме того, как можно подтвердить из ФИГ. 25, сиалиллактозы уменьшали содержание внутриклеточного жира посредством дозозависимого увеличения секреции глицерина в адипоцитах.
Сиалиллактозы стимулировали секрецию в дифференцированных адипоцитах независимо от жизнеспособности клеток, и особенно 6'-сиалиллактоза значимо снижала содержание внутриклеточного жира.
На ФИГ. 25 показаны изменения секреции глицерина посредством сиалиллактозы в дифференцированных адипоцитах. На ФИГ. NT представляет контрольную группу, и 0,01; 0,1; 1 и 10 мМ представляют опытные группы с 0,01; 0,1; 1 и 10 мМ 3'-сиалиллактозы соответственно.
Пример 15: изменения подкожного жира мышей на диете с высоким содержанием жира посредством подкожной инъекции композиций сиалиллактозы (3'-SL и 6'-SL)
(1) Мыши на высокопитательной диете
4-недельных мышей C56BL/6 приобретали у Dooyeul Biotech (Корея). Вода была свободно доступна, а имеющийся в продаже гранулированный корм (Dooyeul Biotech, Корея) давали в течение одной недели. Высокопитательный рацион (60% жира), приобретенный у Research Diets (New Brunswick, США), давали в течение 28 суток для получения мышей с накоплением жира.
(2) Подкожная инъекция сиалиллактозы
0,5 мл 100 мМ 3'-сиалиллактозы или 6'-сиалиллактозы, растворенных в фосфатном буфере, два раза подкожно инъецировали (сутки 0 и сутки 4) в четыре-пять мест спинной области мыши, имеющей накопление жира, индуцированное рационом с высоким содержанием жира. В сутки 4 и 7 наблюдали кожу посредством невооруженного глаза и дерматоскопии. Обработку фосфатным буфером использовали в качестве контрольной группы (CTL).
Как можно подтвердить из ФИГ. 26а и 26б, подкожная инъекция сиалиллактоз уменьшала уровень подкожного жира у мышей на высокожировой диете, индуцируя, посредством этого, морщины на поверхности кожи. В особенности, сильно уменьшала подкожный жир 6'-сиалиллактоза.
На ФИГ. 26а и 26б показаны изменения кожи мышей на высокожировой диете посредством подкожной инъекции сиалиллактоз. Изменения кожи были подтверждены невооруженным глазом и дерматоскопией (ФИГ. 26а и 26б). CTL представляет контрольную группу, а 3'-сиалиллактоза (3'-SL) и 6'-сиалиллактоза (6'-SL) представляют опытные группы.
Ссылки
1. Galluzzi, L., Maiuri, М.С., Vitale, I., Zischka, H., Castedo, M., Zitvogel, L., Kroemer, G., 2007. Cell death modalities: classification and pathophysiological implications. Cell Death Differ. 14, 1237-1243.
2. Chipuk, J.E., Moldoveanu, Т., Llambi, F., Parsons, M.J., Green, D.R., 2010. The BCL-2 family reunion. Mol. Cell 37, 299-310.
3. Youle, R.J., Strasser, A., 2008. The BCL-2 protein family: opposing activities that mediate cell death. Nat. Rev. Mol. Cell Biol. 9, 47-59.
4. Fadeel, В., Orrenius, S., 2005. Apoptosis: a basic biological phenomenon with wide ranging implications in human disease. J. Intern. Med. 258, 479-517.
5. Aleck W.E. Jones, Zhi Yao, Jose Miguel Vicencio, Agnieszka Karkucinska-Wieckowska, Gyorgy Szabadkai, 2012. PGC-1 family coactivators and cell fate: Roles in cancer, neurodegeneration, cardiovascular disease and retrograde mitochondria-nucleus signaling. Mitochondrion. 12, 86-99.
6. Lin, J. et al. Spiegelman, B.M., 2004. Defects in adaptive energy metabolism with CNS-linked hyperactivity in PGC-1alpha null mice. Cell 119, 121-135.
7. Leone, T.C., Lehman, J.J., Finck, B.N., Schaeffer, P.J., Wende, A.R., Boudina, S., Courtois, M., Wozniak, D.F., Sambandam, N., Bernal-Mizrachi, C, Chen, Z., Holloszy, J.O., Medeiros, D.M., Schmidt, R.E., Saffitz, J.E., Abel, E.D., Semenkovich, C.F., Kelly, D.P., 2005. PGC-1 alpha deficiency causes multi-system energy metabolic derangements: muscle dysfunction, abnormal weight control and hepatic steatosis. PLoS Biol. 3, e101.
8. Chaturvedi RK & Flint Beal M (2013) Mitochondrial diseases of the brain. Free Radic Biol Med 63, 1-29.
9. Katsouri L, Parr C, Bogdanovic N, Willem M & Sastre M (2011) PPARgamma co-activator-1alpha (PGC-1 alpha) reduces amyloid-beta generation through a PPARgamma-dependent mechanism. J Alzheimers Dis 25, 151-162.
10. Qin W, Haroutunian V, Katsel P, Cardozo CP, Ho L, Buxbaum JD & Pasinetti GM (2009) PGC-1 alpha expression decreases in the Alzheimer disease brain as a function of dementia. Arch Neurol 66, 352-361.
11. Wang R, Li JJ, Diao S, Kwak YD, Liu L, Zhi L, Bueler H, Bhat NR, Williams RW, Park EA et al. (2013) Metabolic stress modulates Alzheimer's beta secretase gene transcription via SIRT1-PPARgamma-PGC-1 in neurons. Cell Metab 17, 685-694.
12. Clark, J., Reddy, S., Zheng, K., Betensky, R., Simon, D., 2011. Association of PGC-1 alpha polymorphisms with age of onset and risk of Parkinson's disease. BMC Med. Genet. 12, 69.
13. Weydt, P., Soyal, S., Gellera, C, DiDonato, S., Weidinger, C, Oberkofler, H., Landwehrmeyer, G.B., Patsch, W., 2009. The gene coding for PGC-1 alpha modifies age at onset in Huntington's Disease. Mol. Neurodegener. 4, 3.
14. Cui, L., Jeong, H., Borovecki, F., Parkhurst, C.N., Tanese, N., Krainc, D., 2006. Transcriptional repression of PGC-1 alpha by mutant huntingtin leads to mitochondrial dysfunction and neurodegeneration. Cell 127, 59-69.
15. Qin W, Haroutunian V, Katsel P, Cardozo CP, Ho L, Buxbaum JD & Pasinetti GM (2009) PGC-1 alpha expression decreases in the Alzheimer disease brain as a function of dementia. Arch Neurol 66, 352-361.
16. Ranganathan, S., Harmison, G.G., Meyertholen, K., Pennuto, M., Burnett, B.G., Fischbeck, K.H., 2009. Mitochondrial abnormalities in spinal and bulbar muscular atrophy. Hum. Mol. Genet. 18, 27-42.
17. Weydt, P., Pineda, V.V., Torrence, A.E., Libby, R.T., Satterfield, T.F., Lazarowski, E.R., Gilbert, M.L., Morton, G.J., Bammler, Т.K., Strand, A.D., Cui, L., Beyer, R.P., Easley, C.N., Smith, A.C., Krainc, D., Luquet, S., Sweet, I.R., Schwartz, M.W., La Spada, A.R., 2006. Thermoregulatory and metabolic defects in Huntington's disease transgenic mice implicate PGC-1 alpha in Huntington's disease neurodegeneration. Cell Metab. 4, 349-362.
18. Xiang, Z., Valenza, M., Cui, L, Leoni, V., Jeong, H.-K., Brilli, E., Zhang, J., Peng, Q., Duan, W., Reeves, S.A., Cattaneo, E., Krainc, D., 2011. Peroxisome-proliferator-activated receptor gamma coactivator 1a contributes to dysmyelination in experimental models of Huntington's disease. J. Neurosci. 31, 9544-9553.
19. Zheng, В., Liao, Z., Locascio, J. J., Lesniak, K. A., Roderick, S. S., Watt, M. L, Eklund, A. C, Zhang-James, Y., Kim, P. D., Hauser, M. A. et al. (2010). PGC-1a, a potential therapeutic target for early intervention in Parkinson's disease. Sci. Transl. Med. 2, 52ra73.
20. Chaturvedi, R.K., Adhihetty, P., Shukla, S., Hennessy, Т., Calingasan, N., Yang, L, Starkov, A., Kiaei, M., Cannella, M., Sassone, J., Ciammola, A., Squitieri, F., Beal, M.F., 2009. Impaired PGC-1 alpha function in muscle in Huntington's disease. Hum. Mol. Genet. 18, 3048-3065.
21. Zhao, W., Varghese, M., Yemul, S., Pan, Y., Cheng, A., Marano, P., Hassan, S., Vempati, P., Chen, F., Qian, X., Pasinetti, G., 2011. Peroxisome proliferator activator receptor gamma coactivator-1alpha (PGC-1 alpha) improves motor performance and survival in a mouse model of amyotrophic lateral sclerosis. Mol. Neurodegener. 6, 51.
22. Chaturvedi RK & Flint Beal M (2013) Mitochondrial diseases of the brain. Free Radic Biol Med 63, 1-29.
23. St-Pierre, J., Lin, J., Krauss, S., Tarr, P.T., Yang, R., Newgard, C.B., Spiegelman, B.M., 2003. Bioenergetic analysis of peroxisome proliferator-activated receptor gamma coactivators 1alpha and 1beta (PGC-1 alpha and PGC-1beta) in muscle cells. J. Biol.Chem. 278, 26597-26603.
24. Cowell, R.M., Talati, P., Blake, K.R., Meador-Woodruff, J.H., Russell, J.W., 2009. Identification of novel targets for PGC-1 alpha and histone deacetylase inhibitors in neuroblastoma cells. Biochem. Biophys. Res. Commun. 379, 578-582.
25. St-Pierre, J., Drori, S., Uldry, M., Silvaggi, J.M., Rhee, J., Jager, S., Handschin, C, Zheng, K., Lin, J., Yang, W., Simon, D.K., Bachoo, R., Spiegelman, B.M., 2006. Suppression of reactive oxygen species and neurodegeneration by the PGC-1 transcriptional coactivators. Cell 127, 397-408.
26. Valle, I., Alvarez-Barrientos, A., Arza, E., Lamas, S., Monsalve, M., 2005. PGC-1 alpha regulates the mitochondrial antioxidant defense system in vascular endothelial cells. Cardiovasc. Res. 66, 562-573.
27. Xiong, S., Patrushev N., Forouuzandeh, F., Hilenski, L., Alexander, R.W., 2015. PGC-1 a modulates telomere function and DNA damage inprotecting against age-related chronic diseases. Cell Report 12,1391-1399.
28. Borniquel, S., Valle, I., Cadenas, S., Lamas, S., Monsalve, M., 2006. Nitric oxide regulates mitochondrial oxidative stress protection via the transcriptional coactivator PGC-1 alpha. The FASEB journal: Official Publication of the Federation of American Societies for Experimental Biology, 20, pp.1889-1891.
29. Lai, L, Leone, T.C., Zechner, C, Schaeffer, P.J., Kelly, S.M., Flanagan, D.P., Medeiros, D.M., Kovacs, A., Kelly, D.P., 2008. Transcriptional coactivators PGC-1alpha and PGC-1beta control overlapping programs required for perinatal maturation of the heart. Genes Dev. 22,1948-1961.
30. Gamier, A., Fortin, D., Delomenie, C, Momken, I., Veksler, V., Ventura-Clapier, R., 2003. Depressed mitochondrial transcription factors and oxidative capacity in rat failing cardiac and skeletal muscles. J. Physiol. 551, 491-501.
31. Ljubicic V, Joseph A, Saleem A, et al: Transcriptional and post-transcriptional regulation of mitochondrial biogenesis in skeletal muscle: effects of exercise and aging. Biochim Biophys Acta 2010;1800:223-234.
32. Gouspillou G, Picard M, Godin R, Burelle Y, Hepple R: Role of peroxisome proliferative activated receptor gamma coactivator 1-alpha (PGC-1α) in denervation-induced atrophy in aged muscle: facts and hypotheses. Longev Healthspan 2013;2:13.
33. Johnson ML, Robinson MM, Nair KS: Skeletal muscle aging and the mitochondrion. Trends Endocrin Met 2013;24:247-256.
34. Marzetti E, Calvani R, Cesari M, et al: Mitochondrial dysfunction and sarcopenia of aging: from signaling pathways to clinical trials. Int J Biochem Cell Biol 2013;45:2288-2301.
35. Calvani R, Joseph A, Adhihetty PJ, et al: Mitochondrial pathways in sarcopenia of aging and disuse muscle atrophy. Biol Chem 2013; 394:393-414.
36. Wallace DC: A mitochondrial paradigm of metabolic and degenerative diseases, aging, and cancer: a dawn for evolutionary medicine. Annu Rev Genet 2005;39:359.
37. Finck BN, Kelly DP: PGC-1 coactivators: inducible regulators of energy metabolism in health and disease. J Clin Invest 2006; 116: 615-622.
38. Tina Wenz, Susana G. Rossi, Richard L. Rotundo, Bruce M. Spiegelman, and Carlos T. Moraes. 2009, Increased muscle PGC-1a expression protects from sarcopenia and metabolic disease during aging, PNAS106, 20405-20410.
39. Rolfe, D. F. and Brown, G. C. (1997). Cellular energy utilization and molecular origin of standard metabolic rate in mammals. Physiol. Rev. 77, 731-758.
40. Jastroch, M., Divakaruni, A. S., Mookerjee, S., Treberg, J. R. and Brand, M. D. (2010). Mitochondrial proton and electron leaks. Essays Biochem. 47, 53-67.
41. Fukui Y, Masui S, Osada S, Umesono K, Motojima K. 2000. A new thiazolidinedione, NC-2100, which is a weak PPAR-g activator, exhibits potent antidiabetic effects and induces uncoupling protein 1 in white adipose tissue of KKAy obese mice. Diabetes 49: 759-767.
42. Wilson-Fritch L, Nicoloro S, Chouinard M, Lazar MA, Chui PC, Leszyk J, Straubhaar J, Czech MP, Corvera S. 2004. Mitochondrial remodeling in adipose tissue associated with obesity and treatment with rosiglitazone. J Clin Invest 114: 1281-1289.
43. Quinlan, C. L, Treberg, J. R. and Brand, M. D. (2011). Mechanisms of mitochondrial free radical production and their relationship to the aging process. In Handbook of the Biology of Aging (Seventh Edition) (ed. J. M. Edward and N. A. Steven), pp.47-61. San Diego, CA: Academic Press.
44. Sahin, E., Colla, S., Liesa, M., Moslehi, J., Müller F. L, Guo, M., Cooper, M., Kotton, D., Fabian, A. J., Walkey, C. et al. (2011). Telomere dysfunction induces metabolic and mitochondrial compromise. Nature 470, 359-365.
45. Kujoth, G. C, Hiona, A., Pugh, T. D., Someya, S., Panzer, K., Wohlgemuth, S. E., Hofer, Т., Seo, A. Y., Sullivan, R., Jobling, W. A. et al. (2005). Mitochondrial DNA mutations, oxidative stress, and apoptosis in mammalian aging. Science 309, 481-484.
46. Trifunovic, A., Wredenberg, A., Falkenberg, M., Spelbrink, J. N., Rovio, А. Т., Bruder, С.E., Bohlooly-Y, M., Gidlöf S., Oldfors, A., Wibom, R. et al. (2004). Premature ageing in mice expressing defective mitochondrial DNA polymerase. Nature 429, 417-423.
47. Lin, J., Wu, H., Tarr, P. Т., Zhang, C. Y., Wu, Z., Boss, O., Michael, L. F., Puigserver, P., Isotani, E., Olson, E. N. et al. (2002b). Transcriptional co-activator PGC-1 alpha drives the formation of slow-twitch muscle fibres. Nature 418, 797-801.
48. Dillon, L. M., Williams, S. L, Hida, A., Peacock, J. D., Prolla, T. A., Lincoln, J. and Moraes, С.T. (2012). Increased mitochondrial biogenesis in muscle improves aging phenotypes in the mtDNA mutator mouse. Hum. Mol. Genet. 21, 2288-2297.
49. Wenz, Т., Rossi, S. G., Rotundo, R. L., Spiegelman, В. M. and Moraes, С.T. (2009). Increased muscle PGC-1 alpha expression protects from sarcopenia and metabolic disease during aging. Proc. Natl. Acad. Sci. USA 106, 20405-20410.

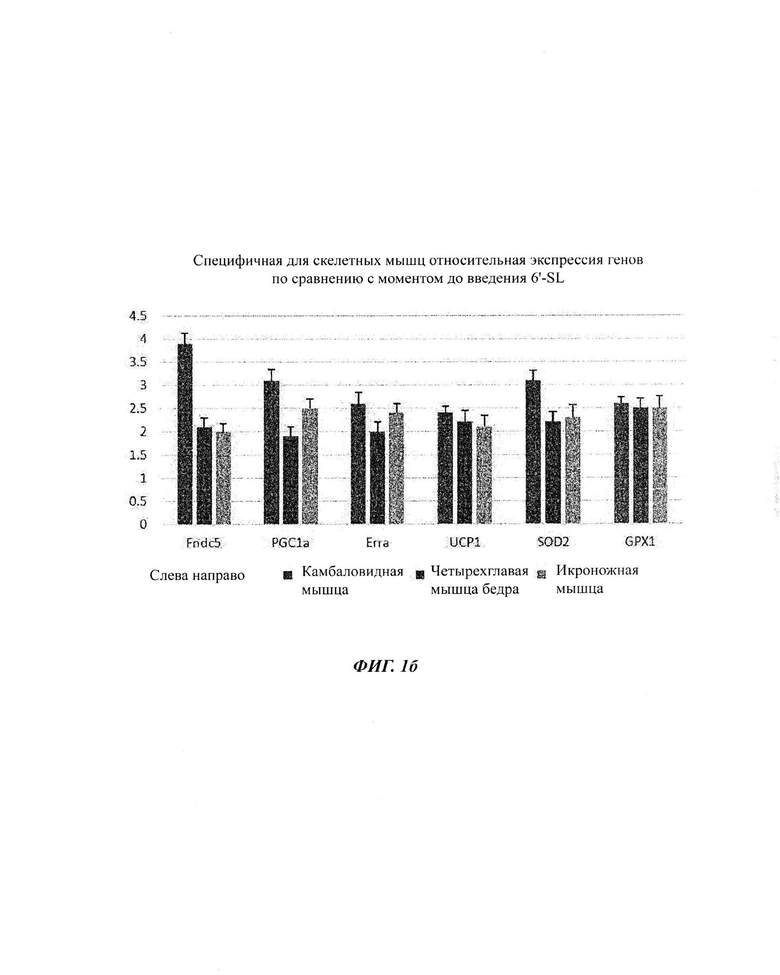
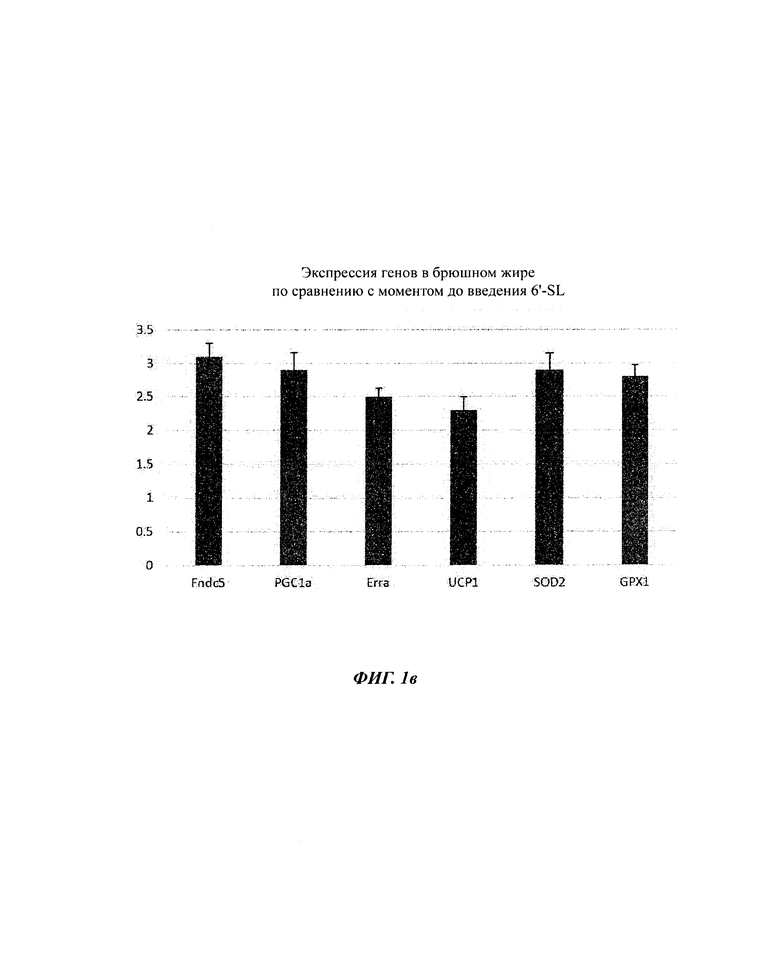



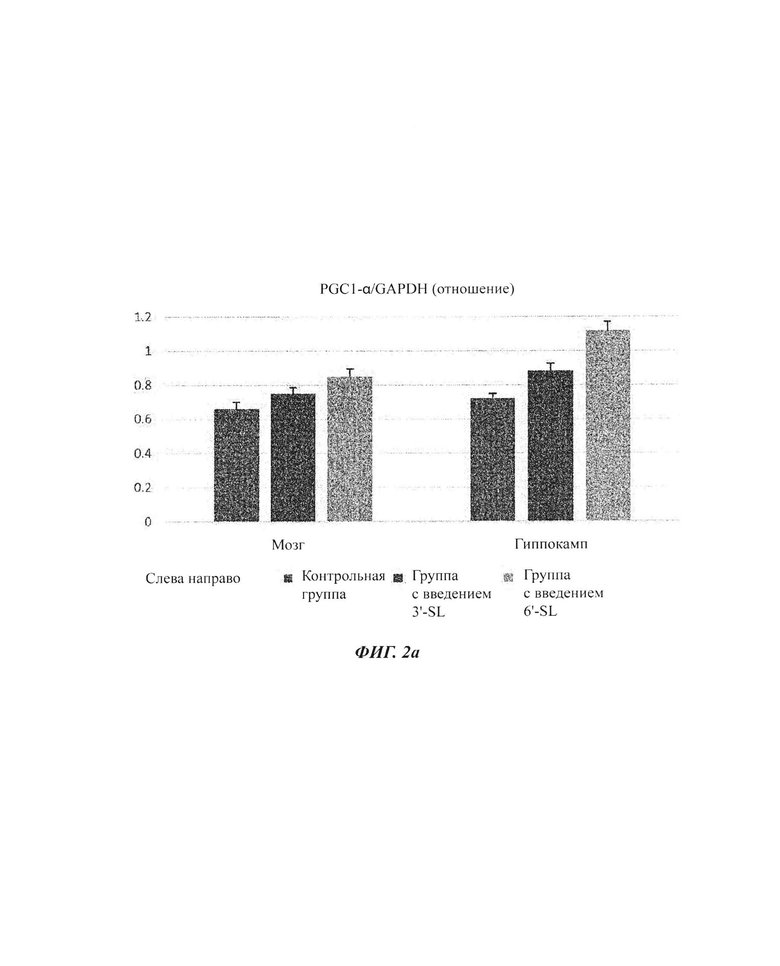

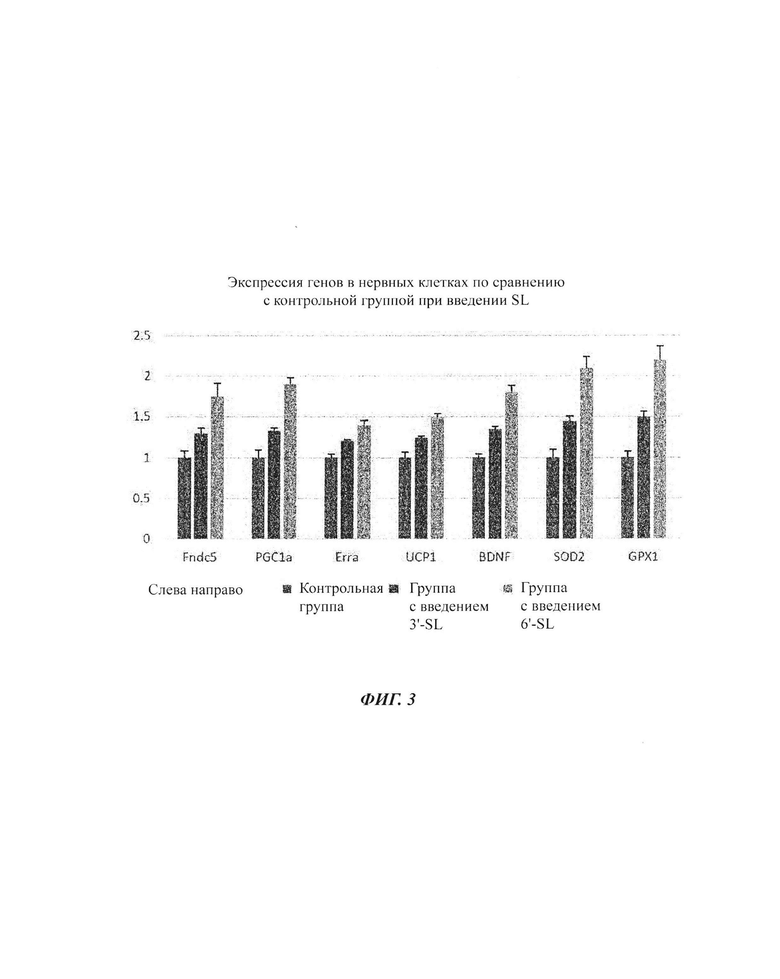
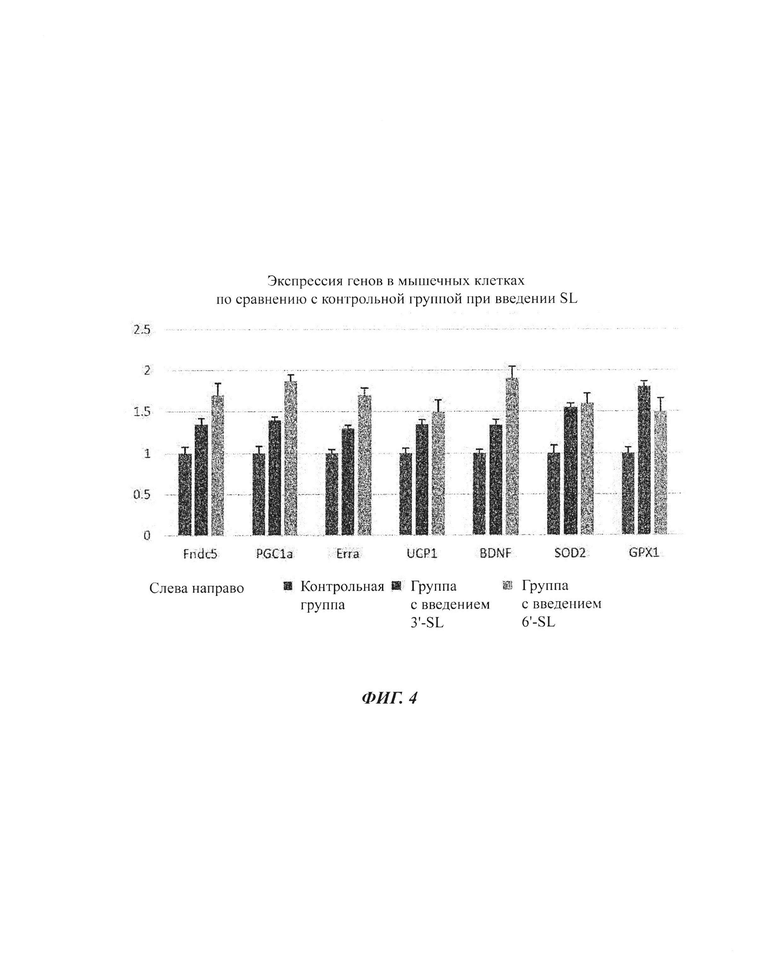


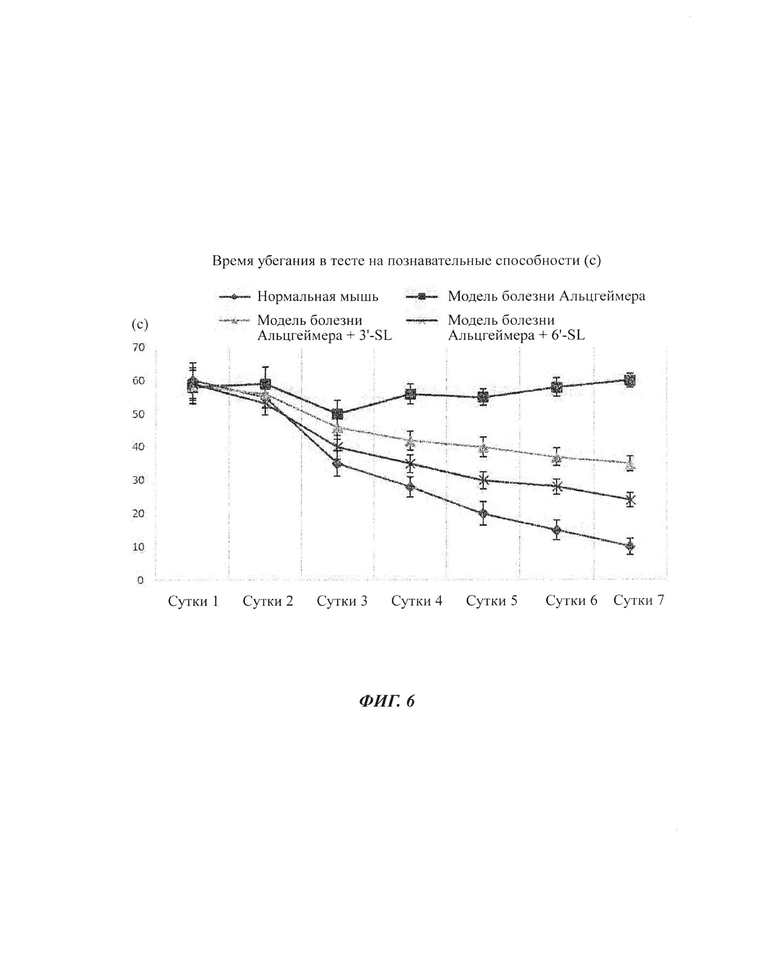
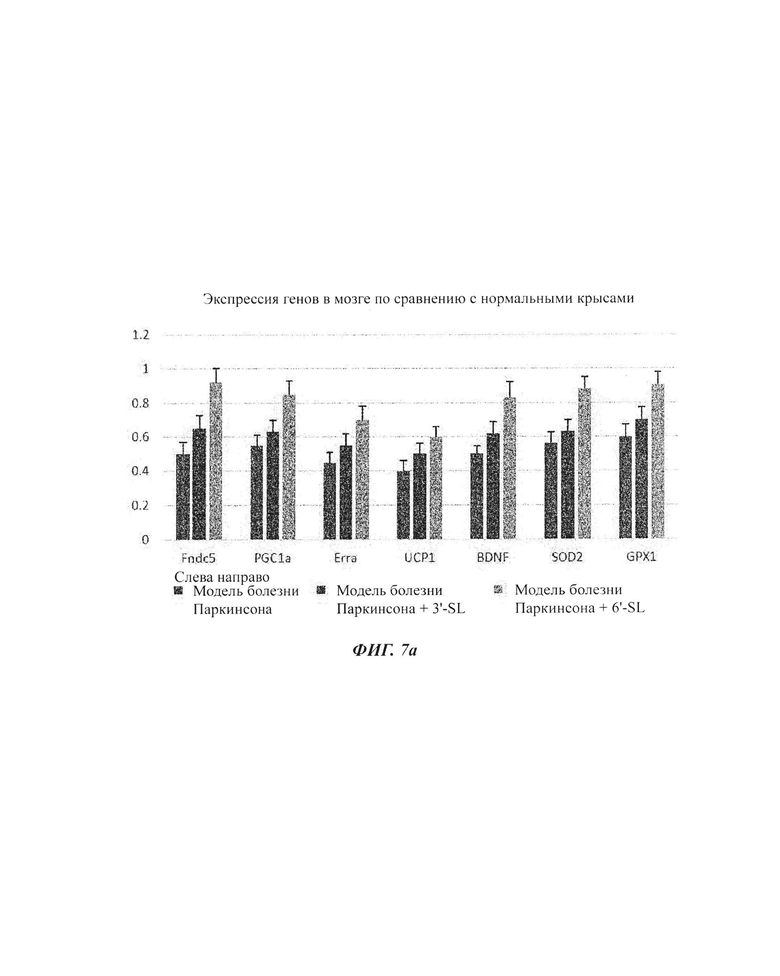

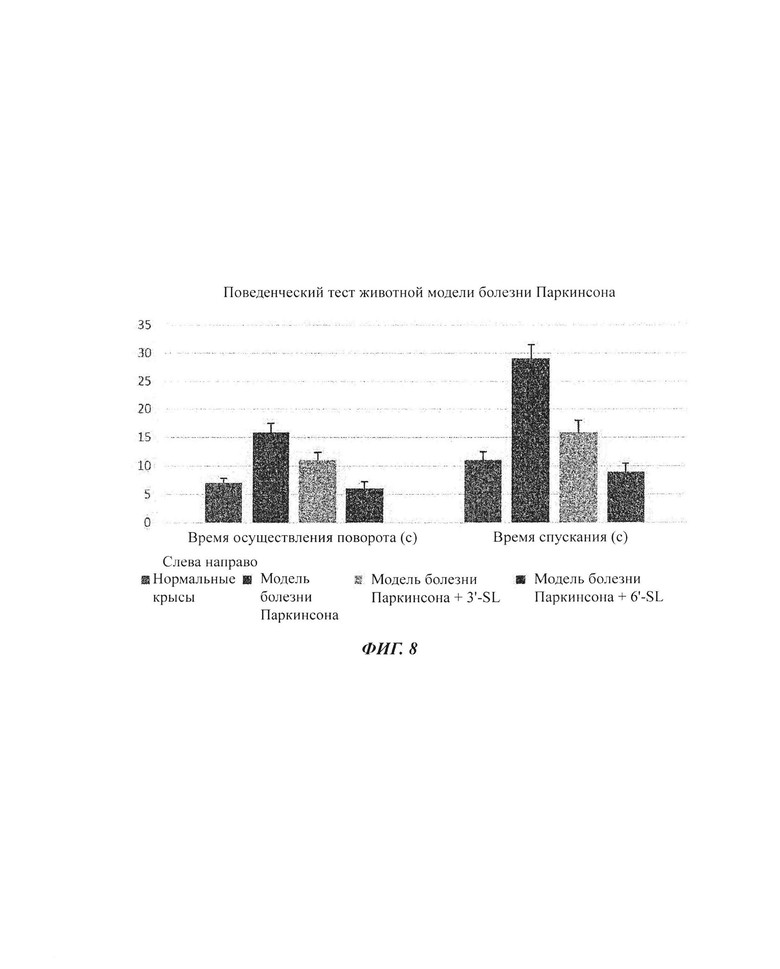
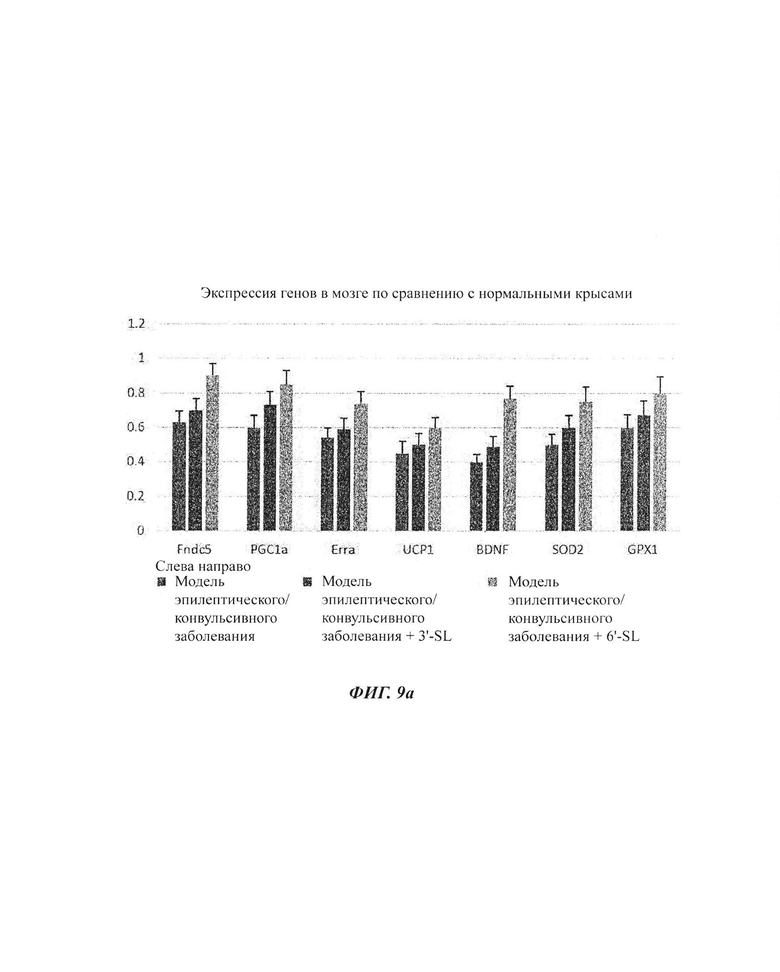

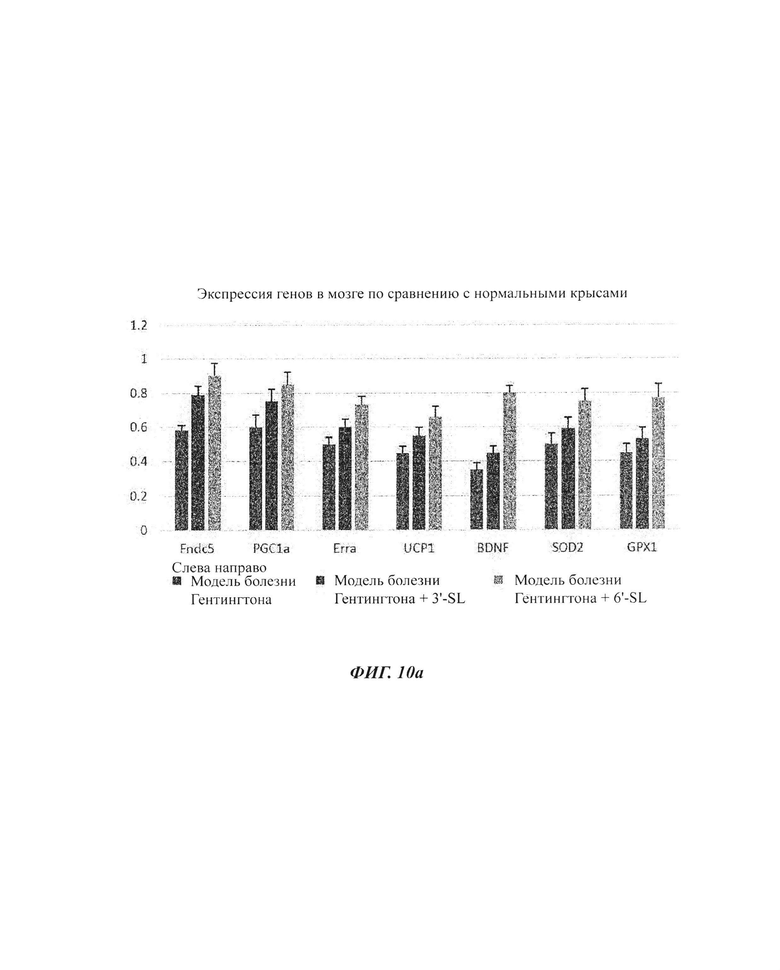
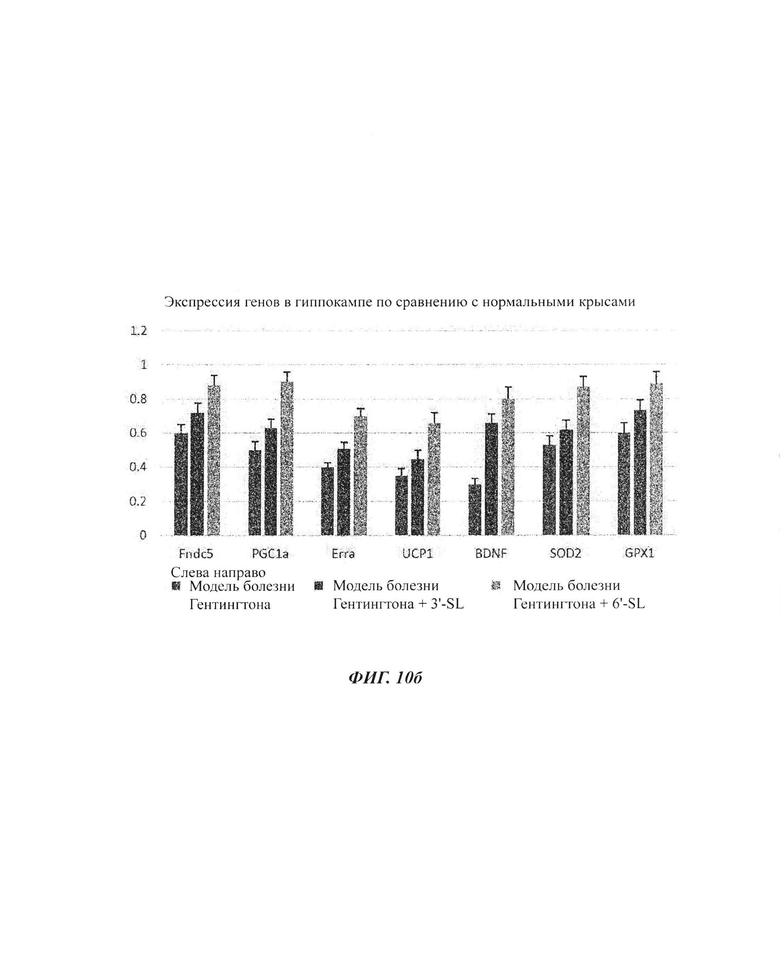


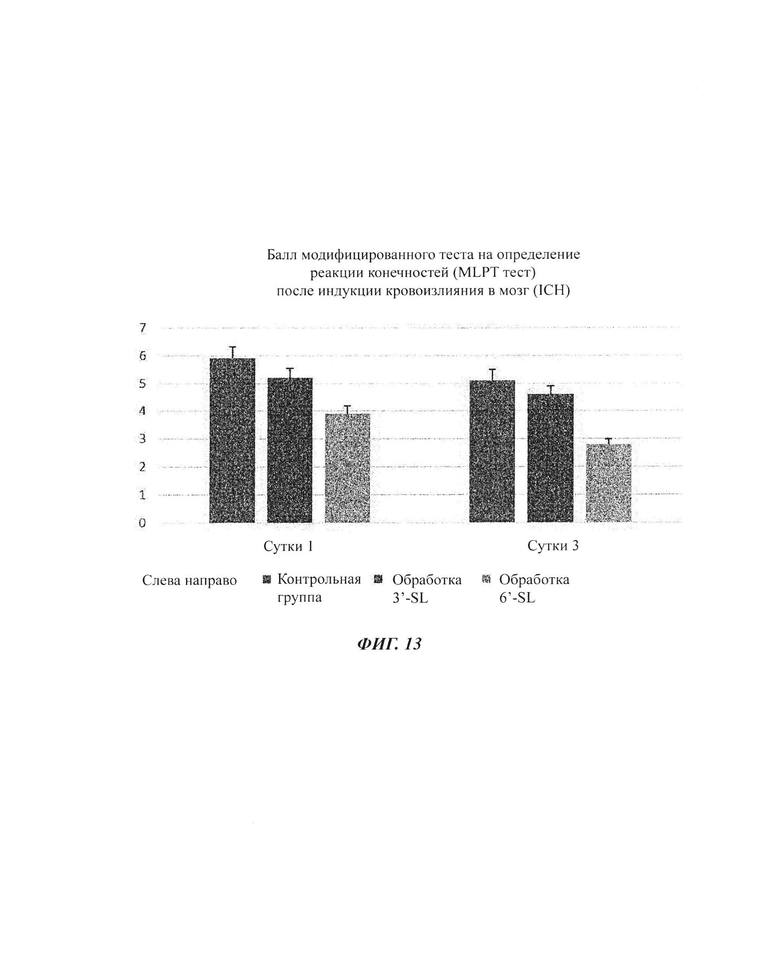
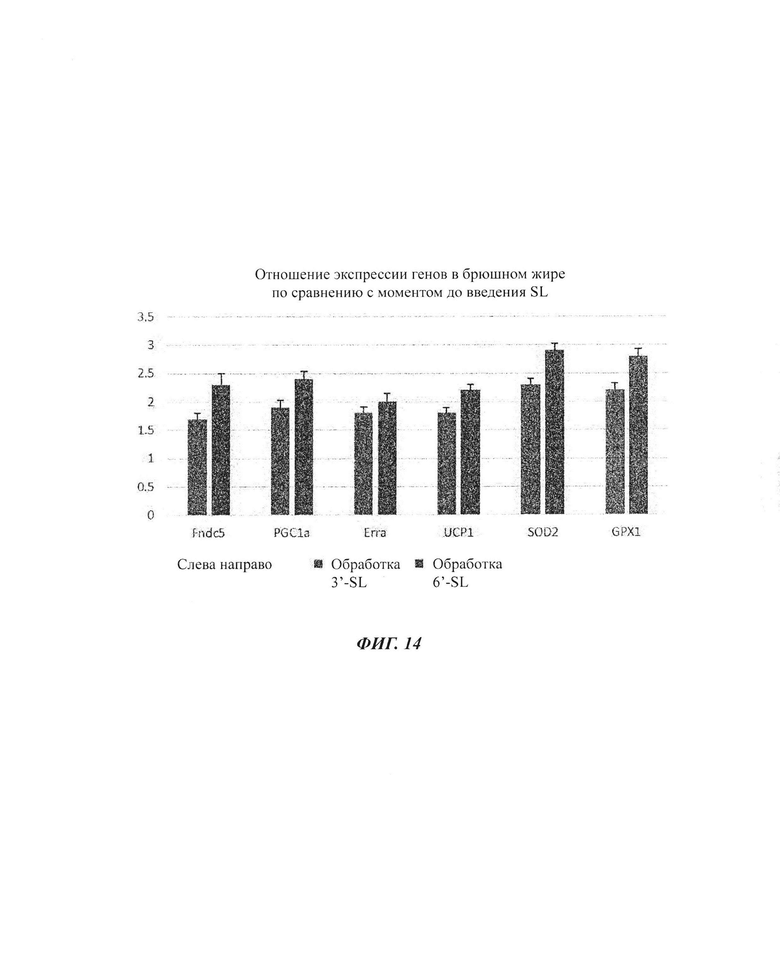

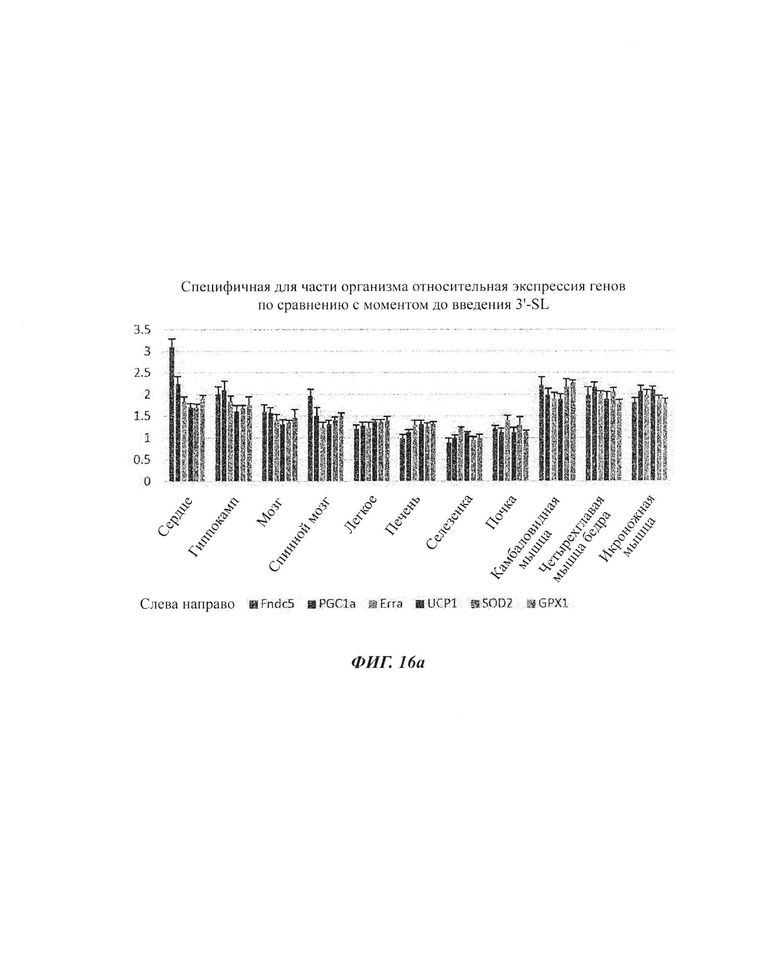
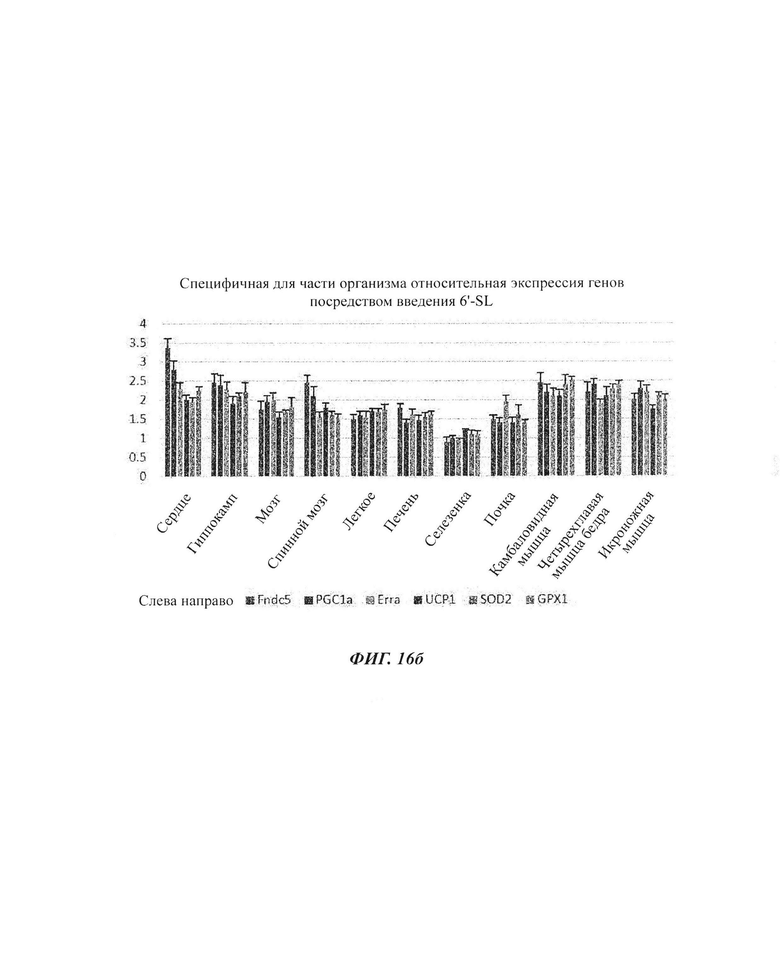
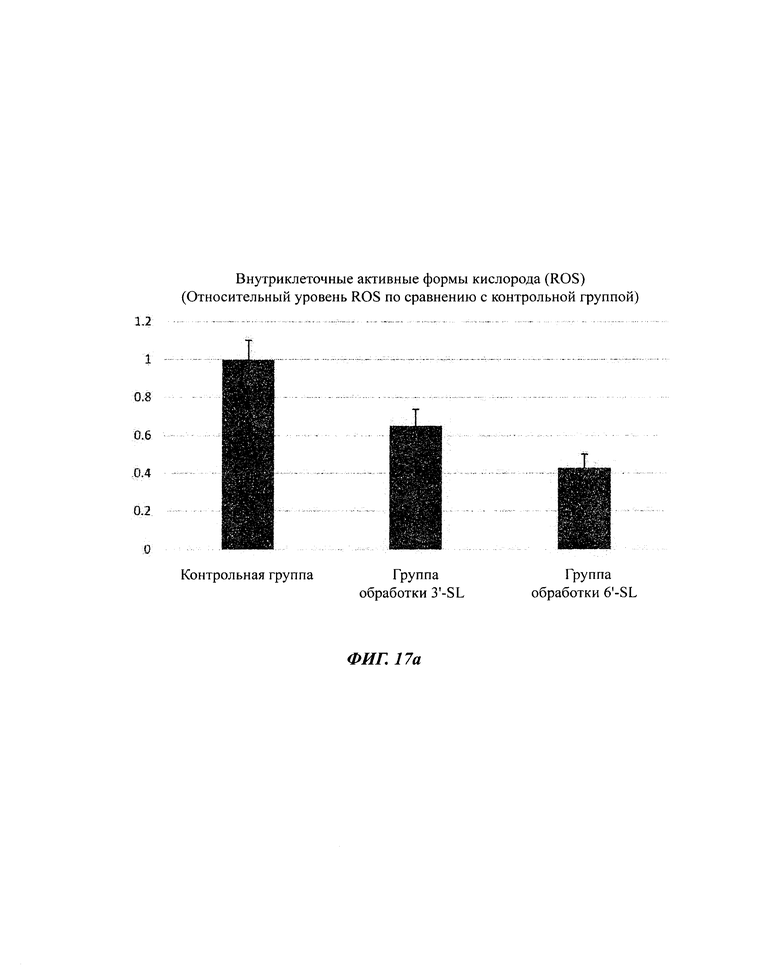
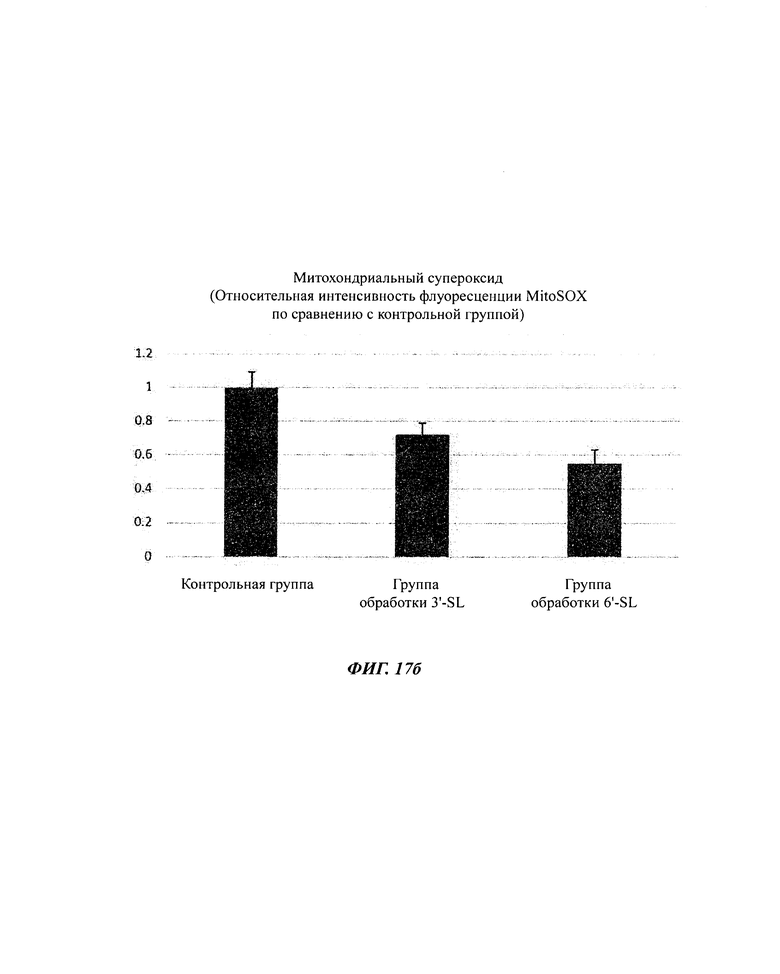
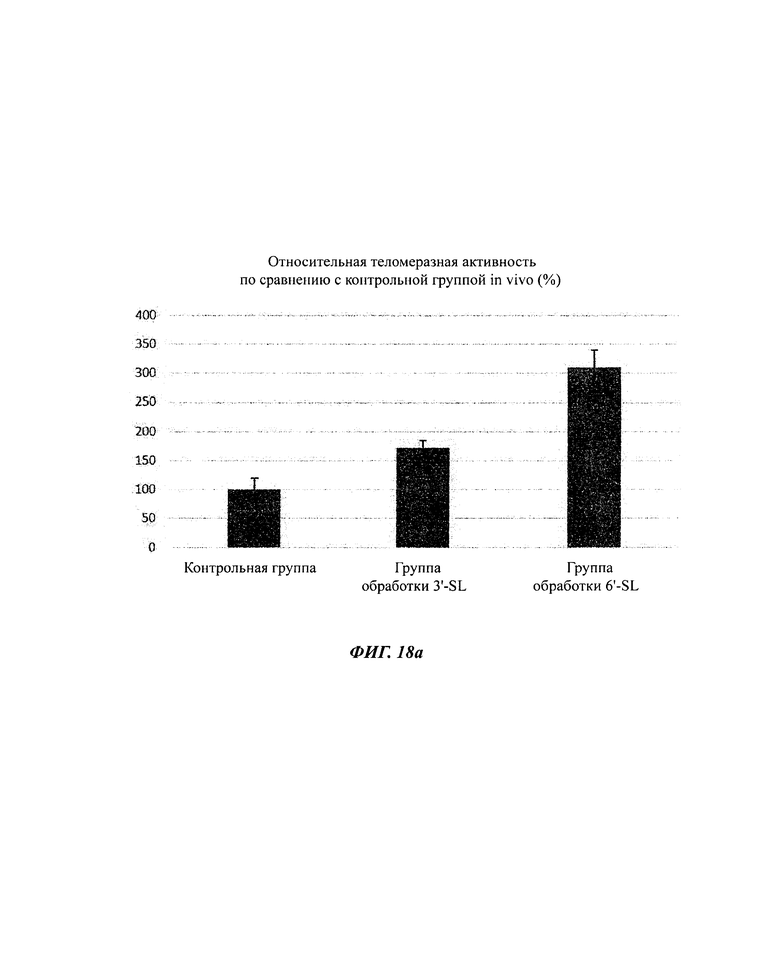
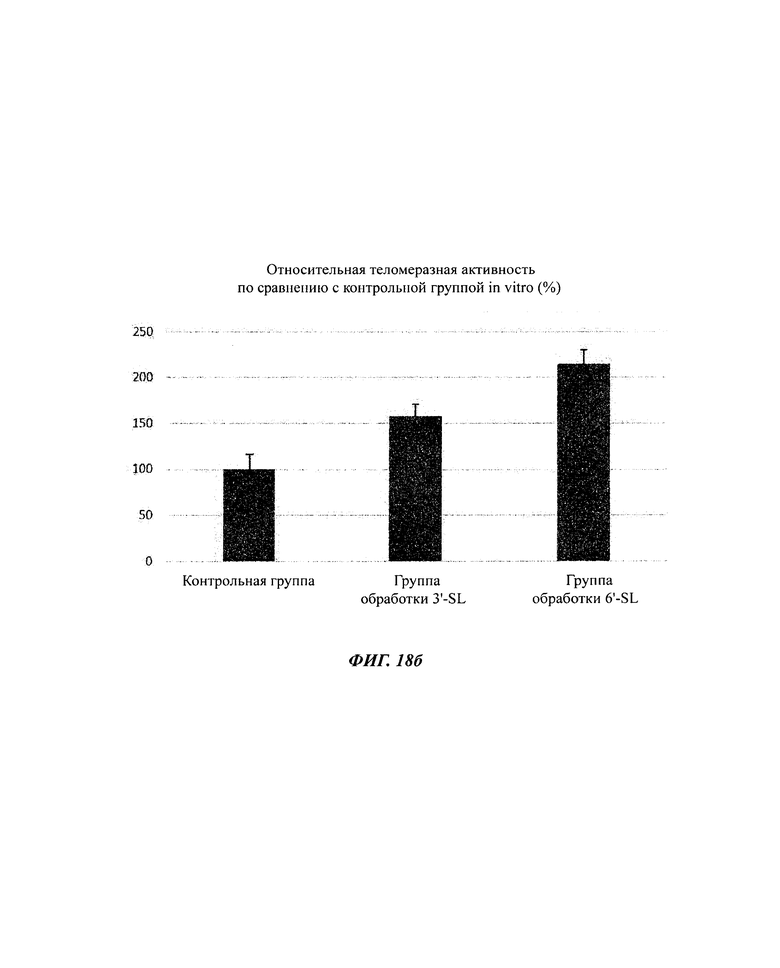
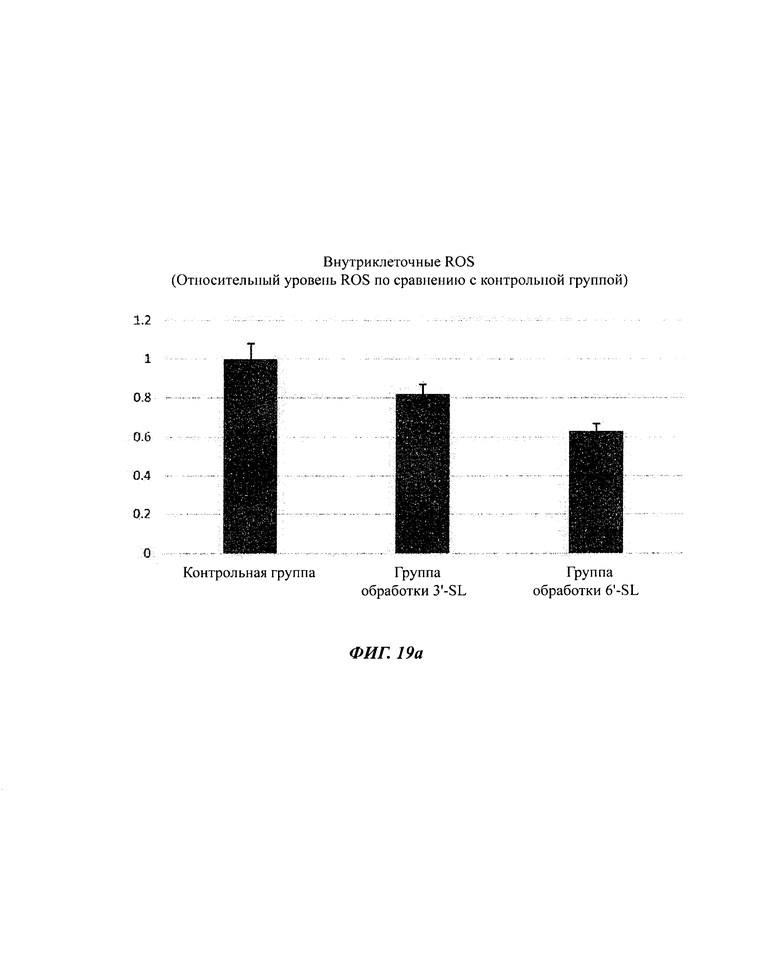
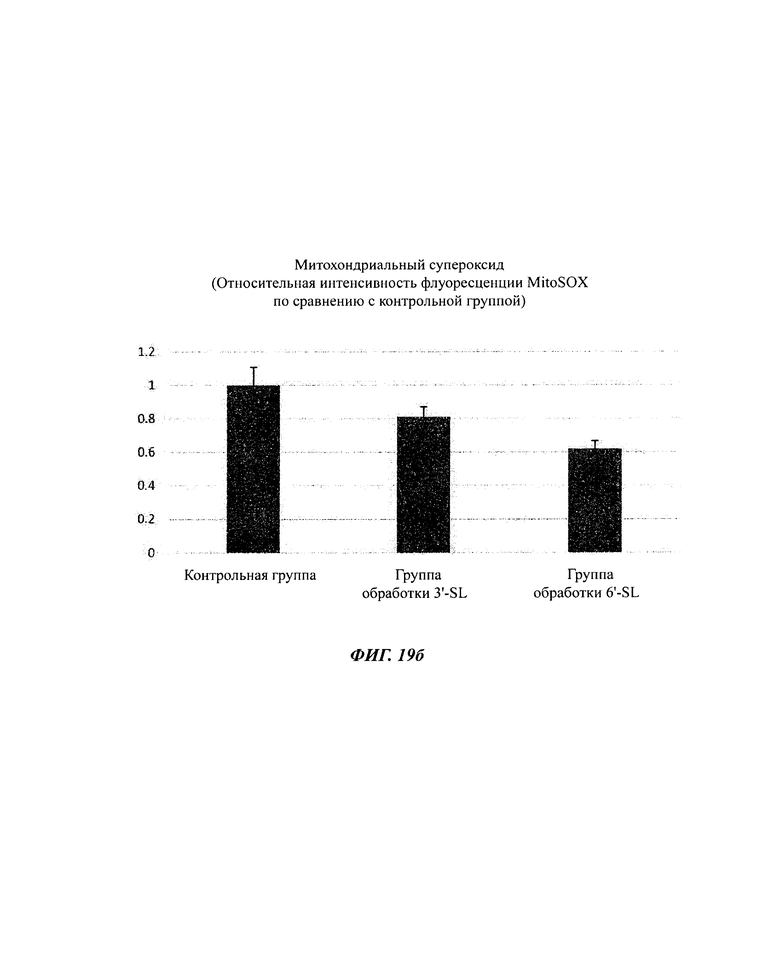


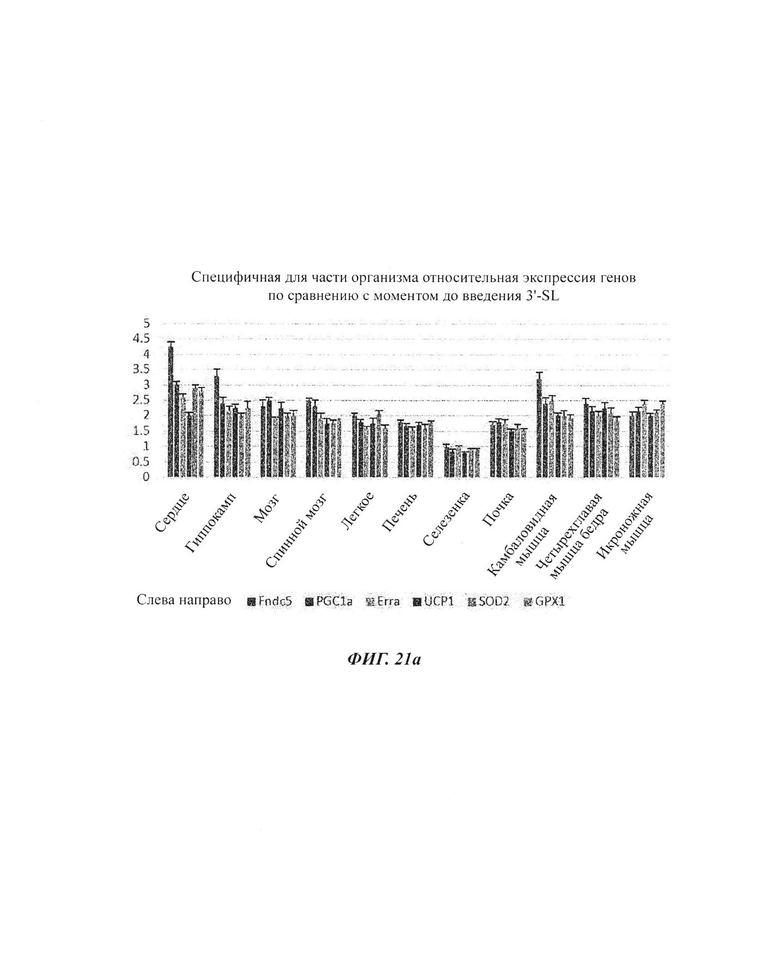
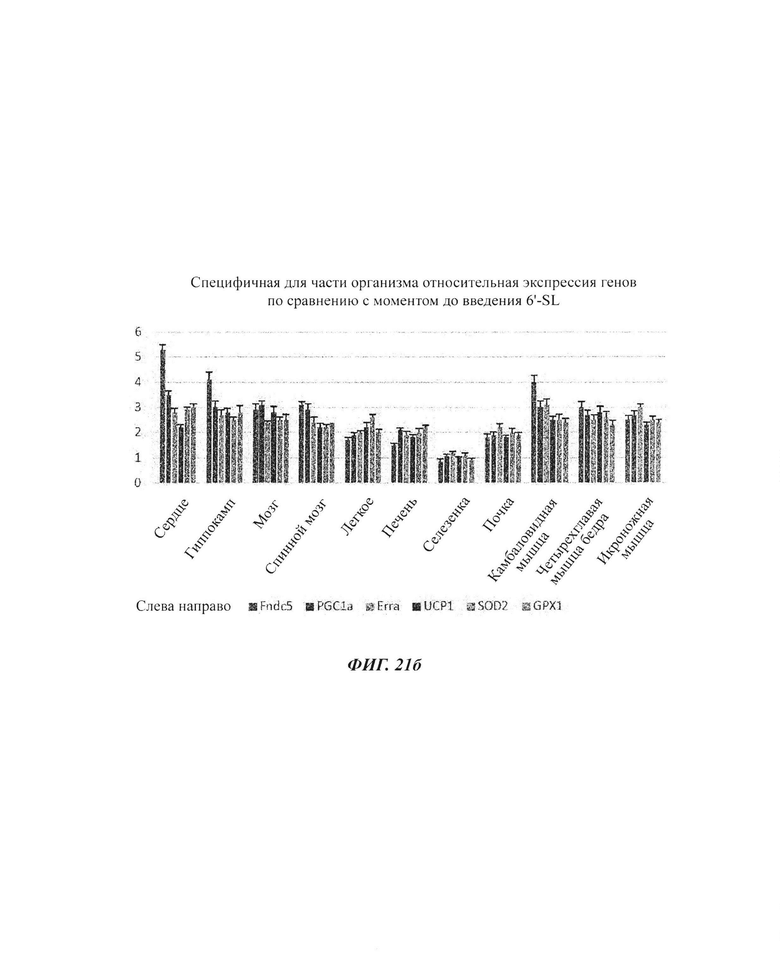
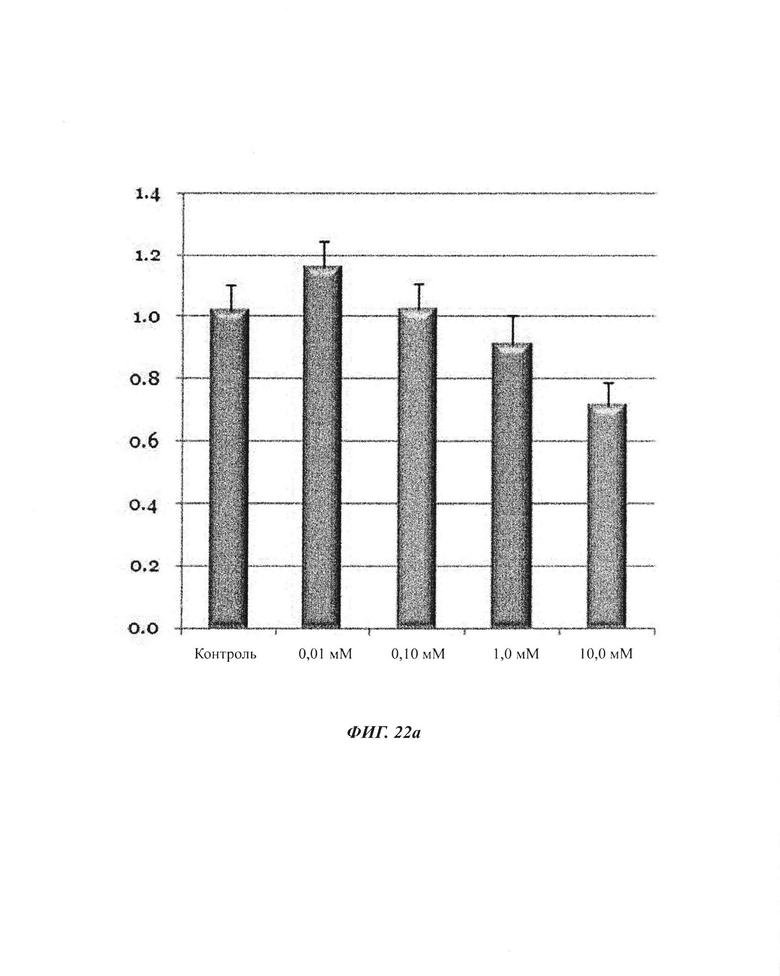



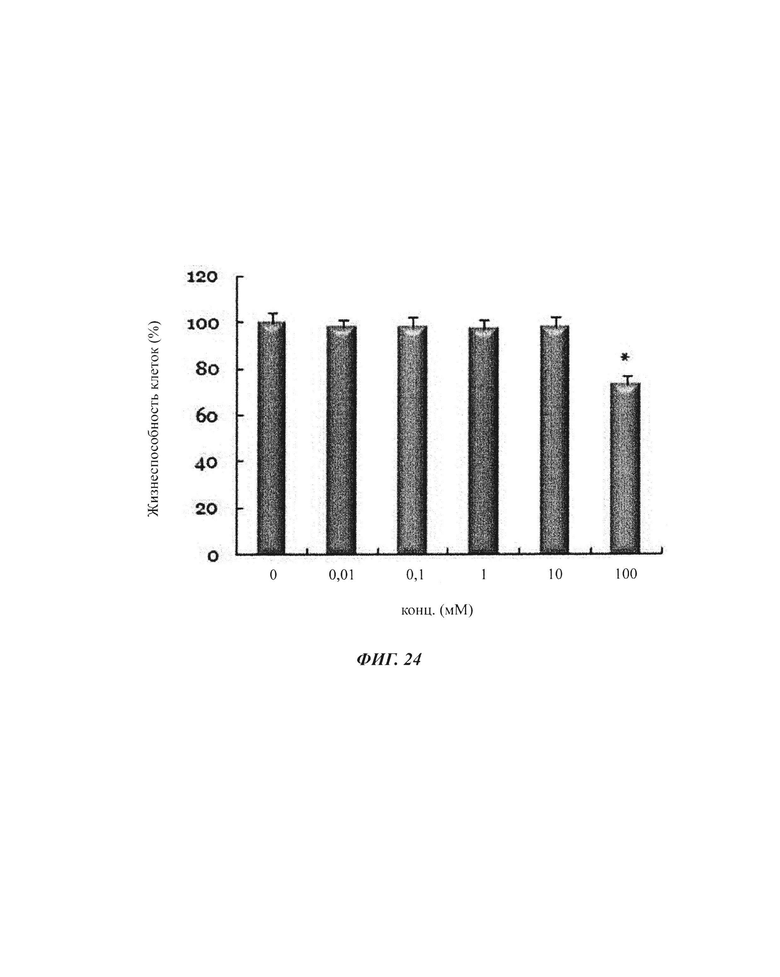


Изобретение относится к области фармацевтики и медицины, а именно к способу профилактики или лечения заболевания или симптома, ассоциированного с понижением экспрессии коактиватора 1-альфа-рецептора, активируемого пролифераторами пероксисом (PGC-1α), у субъекта, включающему введение композиции, содержащей α-NeuNAc-(2→3)-β-D-Gal-(1→4)-D-Glc и/или α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc, субъекту, нуждающемуся в этом, где NeuNAc означает N-ацетилнейраминил, Gal означает галактозу, Glc означает глюкозу, или его фармацевтически приемлемую соль, и фармацевтически приемлемый эксципиент, где указанное заболевание или симптом, ассоциированный с понижением экспрессии PGC-1α, выбраны из болезни Паркинсона (PD), болезни Гентингтона (HD), саркопении и кахексии. Технический результат заключается в повышении экспрессии PGC-1α. 7 з.п. ф-лы, 26 ил., 15 пр.
1. Способ профилактики или лечения заболевания или симптома, ассоциированного с понижением экспрессии коактиватора 1-альфа-рецептора, активируемого пролифераторами пероксисом (PGC-1α), у субъекта, включающий введение композиции, содержащей α-NeuNAc-(2→3)-β-D-Gal-(1→4)-D-Glc и/или α-NeuNAc-(2→6)-β-D-Gal-(1→4)-D-Glc, субъекту, нуждающемуся в этом, где NeuNAc означает N-ацетилнейраминил, Gal означает галактозу, Glc означает глюкозу, или его фармацевтически приемлемую соль, и фармацевтически приемлемый эксципиент,
где указанное заболевание или симптом, ассоциированный с понижением экспрессии PGC-1α, выбраны из группы, состоящей из следующих: болезнь Паркинсона (PD), болезнь Гентингтона (HD), саркопения и кахексия.
2. Способ по п. 1, где данное соединение представляет собой α-NeuNAc- (2→6)-β-D-Gal-(1→4)-D-Glc.
3. Способ по п. 1, где данная композиция находится в лекарственной форме, выбранной из группы, состоящей из растворов, суспензий, сиропов, эмульсий, липосом, порошков, гранул, таблеток, препаратов с замедленным высвобождением и капсул.
4. Способ по п. 3, где данная композиция представляет собой композицию для перорального введения и находится в лекарственной форме системы доставки лекарственного средства, содержащей липосомы или препарат с замедленным высвобождением.
5. Способ по п. 3, где данная композиция представляет собой композицию для парентерального введения и находится в лекарственной форме системы доставки лекарственного средства, содержащей липосомы и эхоконтрастный агент или препарат с замедленным высвобождением.
6. Способ по п. 1, где данная композиция включена в фармацевтическую систему доставки, или систему с замедленным высвобождением, выбранную из группы, состоящей из липосом, смешанных липосом, олеосом, ниосом, этосом, милликапсул, микрокапсул, нанокапсул, наноструктурированных липидных сред, губок, циклодекстринов, везикул, мицелл, смешанных мицелл поверхностно-активных веществ, смешанных мицелл поверхностно-активного вещества - фосфолипида, миллисфер, микросфер, наносфер, липосфер, микроэмульсий, наноэмульсий, мини-частиц, милличастиц, микрочастиц, наночастиц и твердых липидных наночастиц.
7. Способ по п. 6, где данная композиция предназначена для применения посредством местного применения, перорального или парентерального введения.
8. Способ по п. 1, где данная композиция повышает экспрессию PGC-1α.
| ОПОРА БУРОВОГО ШАРОШЕЧНОГО ДОЛОТА | 2006 |
|
RU2332552C2 |
| ESTALL J.L | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
| Приспособление для регулирования подачи горючей жидкости | 1924 |
|
SU1499A1 |
| CRUNKHORN S | |||
Авторы
Даты
2024-03-01—Публикация
2017-01-13—Подача