Предлагаемое изобретение относится к области органической химии, в частности, к способу получения 6-циклоалкил-1,11-диокса-4,8-дитиа-6-азациклотридеканов общей формулы (1):
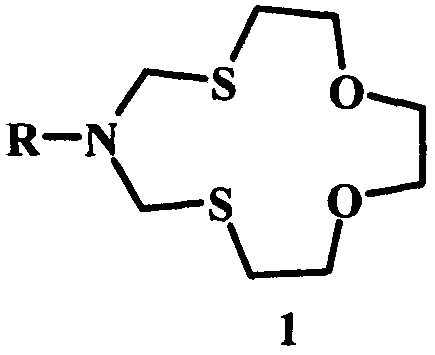
где R - цикло-C3H5, цикло-C5H9, цикло-C6H11, цикло-C5H9O, цикло-C7H13, цикло-C8H15, норборнил-.
O,S,N-содержащие макрогетероциклы находят применение в качестве селективных комплексообразователей [Tian М., Ihmels Н. Chem. Commun., 2009, 3175], ионофоров [Granzhan A., Ihmels Н., Tian М. Arkivoc, 2015, vi, 494], эффективных сорбентов для выделения и очистки драгоценных металлов [Хираока М. Краун-соединения: свойства и применение. М.: Мир, 1986; Akhmetova V.R., Rakhimova Е.В., Vagapov R.A., Minnebaev A.B., Kopylova E.V., Buslaeva T.M., Kunakova R.V. Trends in Heterocycl. Chem., 2011, 15, 9, 33], перспективны в качестве селективных лигандов при экстракции и разделении катионов металлов [Yordanov А.Т., Roundhill D.M. Coordination Chemistry Reviews, 1998, 170, 1, 93-124; Gloe K., Graubaum H., Wust M., Rambusch Т., Seichter W. Coordination Chemistry Reviews, 2001, 222, 1, 103], используются для транспорта ионов через мембраны [Bushlmann Р., Pretsch Е., Bakker Е. Chemical Reviews, 1998, 98, 4, 1593] и в фоточувствительных системах [Valeur В., Leray I. Coordination Chemistry Reviews, 2000, 205, 1, 3], выступают в роли межфазных катализаторов, моделирующих ферментативную активность [Feiters М.С. In comprehensive Supramolecular Chemistry. Pergamon Press, Oxford, 1996, 267].
Известен способ [Tanaka M., Nakamura M., Ikeda Т., Ikeda K., Ando H., Shibutani Y., Yajima S., Kimura K. The Journal of Organic Chemistry, 2001, 66, 21, 7008] получения N-(2-нитрофенил)-1,4-диокса-7,13-дитиа-10-азациклопентадекана (2) взаимодействием 2-фторнитробензола с 1,4-диокса-7,13-дитиа-10-азациклопентадеканом в присутствии карбоната цезия.
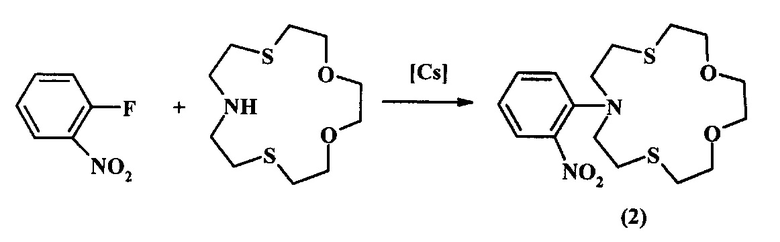
Известным способом не могут быть получены 6-циклоалкил-1,11-диокса-4,8-дитиа-6-азациклотридеканы общей формулы (1).
Известен способ [ Т.,
Т.,  D.,
D., 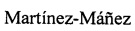 R., Ros-Lis J.V., Royo S.,
R., Ros-Lis J.V., Royo S.,  F., Soto J., Costero A.M., Gil S., Parra M. Tetrahedron Letters, 2009, 3885] получения 10-фенил-1,4-диокса-7,13-дитиа-10-азациклопентадекана (3) реакцией дигалогенпроизводного с 3,6-диокса-1,8-октандитиолом в присутствии катализатора на основе цезия.
F., Soto J., Costero A.M., Gil S., Parra M. Tetrahedron Letters, 2009, 3885] получения 10-фенил-1,4-диокса-7,13-дитиа-10-азациклопентадекана (3) реакцией дигалогенпроизводного с 3,6-диокса-1,8-октандитиолом в присутствии катализатора на основе цезия.
Известным способом не могут быть получены 6-циклоалкил-1,11-диокса-4,8-дитиа-6-азациклотридеканы общей формулы (1).
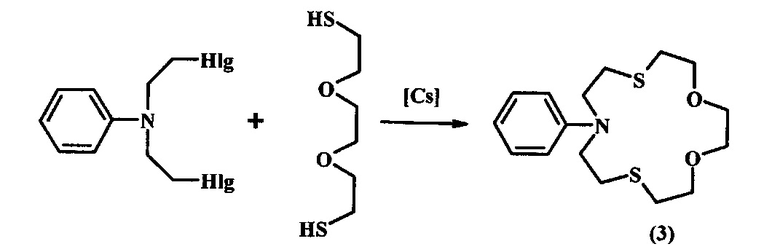
Известен способ [N.N. Makhmudiyarova, L.V. Mudarisova, E.S. Meshcheryakova, A.G. Ibragimov, U.M. Dzhemilev. Tetrahedron, 2015, 259] получения 6-(галогенфенил)-1,11-диокса-4,8-дитиа-6-азациклотридеканов (4) реакцией N,N-бис(метоксиметил)-N-галогенфениламинов с 3,6-диокса-1,8-октандитиолом в присутствии катализатора на основе меди.
Известным способом не могут быть получены 6-циклоалкил-1,11-диокса-4,8-дитиа-6-азациклотридеканы общей формулы (1).
Таким образом, в литературе отсутствуют сведения по получению 6-циклоалкил-1,11-диокса-4,8-дитиа-6-азациклотридеканов общей формулы (1).
Предлагается новый способ получения 6-циклоалкил-1,11-диокса-4,8-дитиа-6-азациклотридеканов общей формулы (1).
Сущность способа заключается во взаимодействии циклоалкиламина (циклопропил-амин, или циклопентил-амин, или циклогексил-амин, или тетрагидропиранил-амин, или циклогептил-амин, или циклооктил-амин, или норборнил-амин) с 1,6,9-триокса-3,12-дитиациклотридеканом в присутствии катализатора SmCl3⋅6H2O, взятыми в мольном соотношении циклоалкиламин: 1,6,9-триокса-3,12-дитиациклотридекан: 8 SmCl3⋅6H2O = 1:1:(0.03-0.07), предпочтительно 1:1:0.05, при комнатной температуре (~20°С) и атмосферном давлении в среде растворителей этанол-хлороформ (1:1, объемное соотношение) в течение 2.5-3.5 ч. Выход 6-циклоалкил-1,11-диокса-4,8-дитиа-6-азациклотридеканов (1) составляет 77-96%. Реакция протекает по схеме:
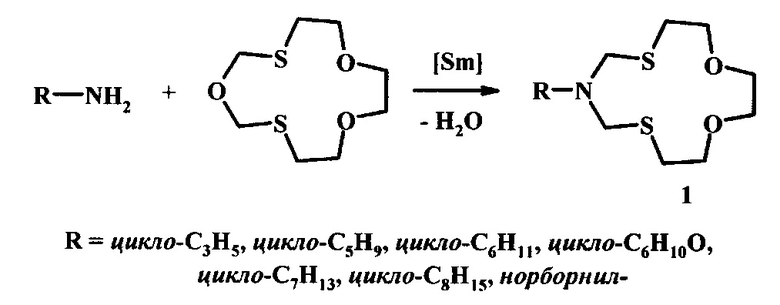
6-Циклоалкил-1,11-диокса-4,8-дитиа-6-азациклотридеканы общей формулы (1) образуются только лишь с участием циклоалкиламина и 1,6,9-триокса-3,12-дитиациклотридекана, взятых в стехиометрических количествах. При другом соотношении исходных реагентов снижается селективность реакции. Без катализатора SmCl3⋅6H2O реакция идет с выходом, не превышающим 30%. Проведение реакции в присутствии катализатора SmCl3⋅6H2O больше 7 мол. % не приводит к существенному увеличению выхода целевого продукта (1). Использование в реакции катализатора SmCl3⋅6H2O менее 3 мол. % снижает выход (1), что связано с уменьшением каталитически активных центров в реакционной массе. Реакции проводили при комнатной температуре ~20°С. При более высокой температуре (например, 60°С) увеличиваются энергозатраты, при меньшей температуре (например, 0°С) снижается скорость реакции. Опыты проводили в среде растворителей этанол-хлороформ (1:1, объемное соотношение), т.к. в них хорошо растворяются исходные реагенты и целевые продукты.
Существенные отличия предлагаемого способа
В известном способе реакция идет с участием в качестве исходных реагентов N,N-бис(метоксиметил)-N-галогенфениламинов и 3,6-диокса-1,8-октандитиола в присутствии катализатора CuCl с образованием 6-(галогенфенил)-1,11-диокса-4,8-дитиа-6-азациклотридеканов (4). Известный способ не позволяет получать 6-циклоалкил-1,11-диокса-4,8-дитиа-6-азациклотридеканы общей формулы (1).
В предлагаемом способе в качестве исходных реагентов применяются циклоалкиламины и 1,6,9-триокса-3,12-дитиациклотридекан. Реакция осуществляется в присутствии катализатора SmCl3⋅6H2O.
Предлагаемый способ обладает следующими преимуществами
Способ позволяет получать с высокой селективностью индивидуальные 6-циклоалкил-1,11-диокса-4,8-дитиа-6-азациклотридеканы общей формулы (1), синтез которых в литературе не описан.
Способ поясняется следующими примерами
ПРИМЕР 1. Синтез 1,6,9-триокса-3,12-дитиациклотридекана: смесь 6 мл 37% водного раствора формалина и 3.2 мл 3,6-диокса-1,8-октандитиола перемешивают 3 ч при 20°С, экстрагируют CHCl3, упаривают и выделяют 1,6,9-триокса-3,12-дитиациклотридекан.
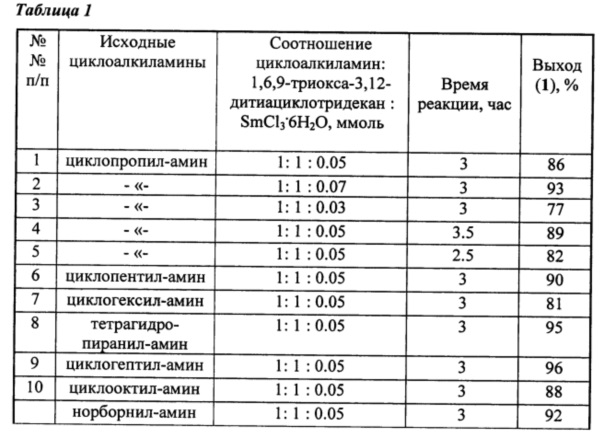
ПРИМЕР 2. В круглодонную колбу, установленную на магнитной мешалке, помещают 57 мг (1 ммоль) циклопропиламина в 5 мл этанола, 18 мг (0.05 ммоль) SmCl3⋅6H2O и 224 мг (1 ммоль) 1,6,9-триокса-3,12-дитиациклотридекана в 5 мл хлороформа. Реакционную смесь перемешивают при температуре ~20°С в течение 3 ч, колоночной хроматографией на SiO2 выделяют 6-циклопропил-1,11-диокса-4,8-дитиа-6-азациклотридекан с выходом 86%.
Другие примеры, подтверждающие способ, приведены в таблице 1.
Все опыты проводили при комнатной температуре (~20°С) в среде растворителей этанол-хлороформ (1:1, объемное соотношение), т.к. в них растворяются исходные и целевые продукты.
Спектральные характеристики
6-циклопропил-1,11-диокса-4,8-дитиа-6-азациклотридекана1(1Контроль реакции осуществляли методом ТСХ на пластинах Sorbfil (ПТСХ-АФ-В) проявляли парами I2. Для колоночной хроматографии использовали силикагель КСК (100-200 мкм). Спектры ЯМР 1D (1Н, 13С) и 2D (COSY, HSQC, НМВС) сняты на спектрометре Bruker Avance 400 (100.62 МГц для 13С и 400.13 МГц для 1Н) по стандартным методикам фирмы Bruker, внутренний стандарт Me4Si, растворитель - CDCl3.)
Элюент толуол-этилацетат-ацетон 4:1:1, Rf 0.7, nD18 1.5548.
Спектр ЯМР 1H (CDCl3, δ, м.д.): 0.38 уш.с (2Н, СН2, На-15,16), 0.51 уш.с (2Н, СН2, Hb-15,16), 2.16 уш.с (1Н, СН, Н-14), 2.68 уш.с (4Н, СН2, Н-3,9), 3.56 уш.с (8Н, СН2, Н-2,10,12,13), 4.08 уш.с (4Н, СН2, Н-5,7).
Спектр ЯМР 13С (CDCl3, δ, м.д.): 7.80 (С-15, С-16), 31.37 (С-3, С-9), 33.86 (С-14), 56.33 (С-5, С-7), 70.24 (С-2, С-10), 71.22 (С-12, С-13).
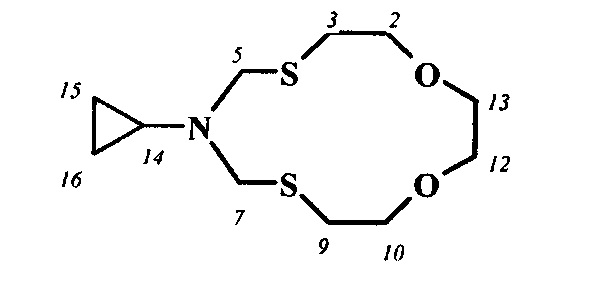
Спектральные характеристики 6-циклопентил-1,11-диокса-4,8-дитиа-6-азациклотридекана
Элюент хлороформ-ацетон 1:2, Rf 0.7, nD18 1.5323.
Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.32-1.38 м (2Н, СН2, На-15,18), 1.50-1.57 м (2Н, СН2, На-16,17), 1.62-1.70 м (2Н, СН2, Hb-16,17), 1.82-1.88 м (2Н, СН2, Hb-15,18), 2.71 т (4Н, СН2, Н-3,9; J 14 и 7 Гц), 3.06-3.09 м (1Н, СН, Н-14), 3.59-3.66 м (8Н, СН2, Н-2,10,12,13), 4.12 уш.с (4Н, СН2, Н-5,7).
Спектр ЯМР 13С (CDCl3, δ, м.д.): 23.57 (С-16, С-17), 30.99 (С-15, С-18), 31.07 (С-3, С-9), 55.41 (С-5, С-7), 61.83 (С-14), 70.26 (С-2, С-10), 71.39 (С-12, С-13).
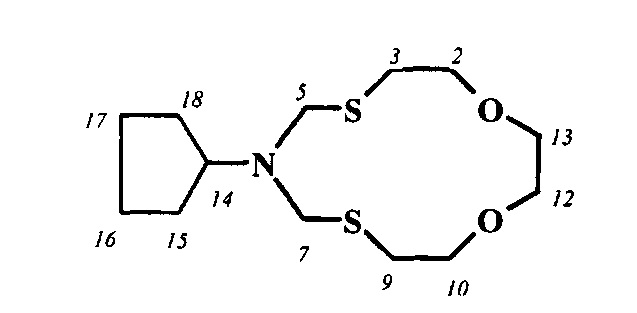
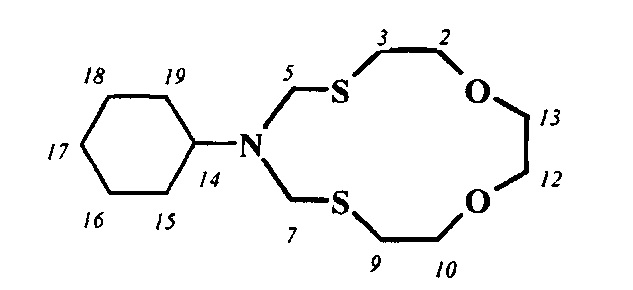
Спектральные характеристики 6-циклогексил-1,11-диокса-4,8-дитиа-6-азациклотридекана:
Элюент толуол-этилацетат-ацетон 4:1:1, Rf 0.65, nD18 1.5288. Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.08-1.13 м (1Н, СН2, На-17), 1.25-1.35 м (4Н, СН2, На-15,16,18,19), 1.58-1.63 м (1Н, СН2, Hb-17), 1.75-1.85 м (4Н, СН2, Hb-15,16,18,19), 2.64 т (4Н, СН2, Н-3,9; J 10 и 5 Гц), 2.70-2.75 м (1Н, СН, Н-14), 3.65 уш. с (4Н, СН2, Н-12,13), 3.80 т (4Н, СН2, Н-2,10; J 10 и 5 Гц), 4.52 уш. с (4Н, СН2, Н-5,7).
Спектр ЯМР 13С (CDCl3, δ, м.д.): 25.95 (С-16, С-17, С-18), 29.46 (С-3, С-9), 31.54 (С-15, С-19), 56.66 (С-5, С-7), 58.86 (С-14), 70.30 (С-12, С-13), 73.94 (С-2, С-10).
Спектральные характеристики 6-тетрагидро-2Н-пиран-4-ил-1,11-диокса-4,8-дитиа-6-азациклотридекана:
Элюент гексан-бензол-этанол 1:1:1, Rf 0.8, nD18 1.4530.
Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.64-1.78 м (4Н, СН2, Н-15,19), 2.65 т (4Н, СН2, Н-3,9; J 10 и 5 Гц), 2.95-3.02 м (1H, СН, Н-14), 3.37-3.42 м (2Н, СН2, На-16,18), 3.65 уш. с (4Н, СН2, Н-12,13), 3.81 т (4Н, СН2, Н-2,10; J 10 и 5 Гц), 3.98-4.03 м (2Н, СН2, Hb-16,18), 4.53 уш.с (4Н, СН2, Н-5,7). Спектр ЯМР 13С (CDCl3, δ, м.д.): 29.51 (С-3, С-9), 31.71 (С-15, С-19), 56.38 (С-14), 56.44 (С-5, С-7), 67.45 (С-16, С-18), 70.28 (С-12, С-13), 73.98 (С-2, С-10).
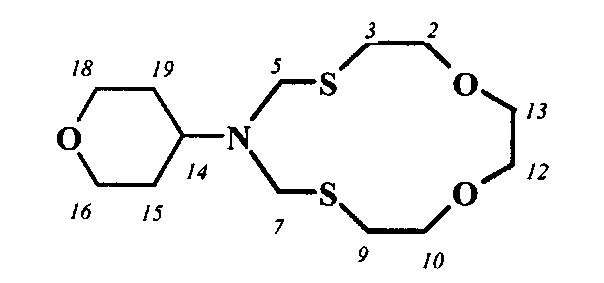
Спектральные характеристики 6-циклогептил-1,11-диокса-4,8-дитиа-6-азациклотридекана:
Элюент хлороформ-ацетон 1:2, Rf 0.8, nD18 1.4015.
Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.37-1.45 м (2Н, СН2, На-16,19), 1.47-1.58 м (4Н, СН2, Н-17,18; 2Н, СН2, На-15,20), 1.65-1.75 м (2Н, СН2, Hb-16,19), 1.78-1.88 м (2Н, СН2, Hb-15,20), 2.63 т (4Н, СН2, Н-3,9; J 10 и 5 Гц), 2.90-2.98 м (1Н, СН, Н-14), 3.64 уш.с (4Н, СН2, Н-12,13), 3.79 т (4Н, СН2, Н-2,10; J 10 и 5 Гц), 4.45 уш.с (4Н, СН2, Н-5,7).
Спектр ЯМР 13С (CDCl3, δ, м.д.): 25.11 (С-16, С-19), 27.65 (С-17, С-18), 29.55 (С-3, С-9), 33.16 (С-15, С-20), 56.55 (С-5, С-7), 60.74 (С-14), 70.32 (С-12, С-13), 73.69 (С-2, С-10).
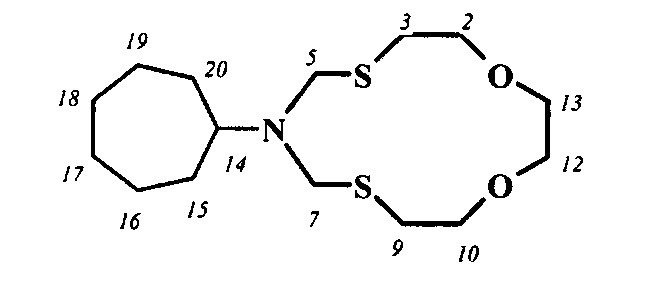
Спектральные характеристики 6-циклооктил-1,11-диокса-4,8-дитиа-6-азациклотридекана:
Элюент хлороформ-ацетон 1:2, Rf 0.7, nD18 1.4079.
Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.46-1.53 м (5Н, СН2, На-16,17,18,19,20), 1.57-1.66 м (5Н, СН2, Hb-16,18,20; На-15,21), 1.69-1.78 м (4Н, СН2, Hb-15,17,19,21), 2.64 т (4Н, СН2, Н-3,9; J 10 и 5 Гц), 3.02-3.07 м (1Н, СН, Н-14), 3.65 уш.с (4Н, СН2, Н-12,13), 3.80 т (4Н, СН2, Н-2,10; J 10 и 5 Гц), 4.45 уш.с (4Н, СН2, Н-5,7).
Спектр ЯМР 13С (CDCl3, δ, м.д.): 25.11 (С-17, С-19), 26.06 (С-18), 26.69 (С-16, С-20), 29.63 (С-3, С-9), 31.87 (С-15, С-21), 56.63 (С-5, С-7), 59.15 (С-14), 70.37 (С-12, С-13), 73.58 (С-2, С-10).
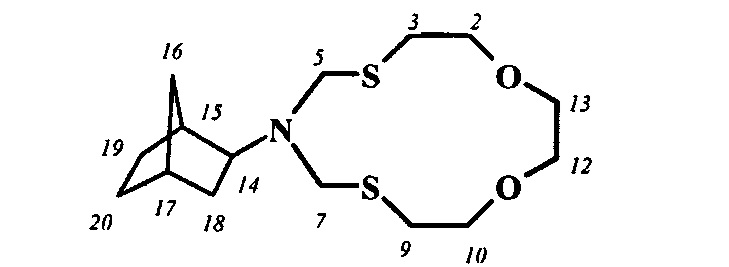
Спектральные характеристики 6-бицикло[2.2.1]гепт-2-ил-1,11-диокса-4,8-дитиа-6-азациклотридекана:
Элюент гексан-бензол-этанол 1:1:1, Rf 0.65, nD18 1.4622.
Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.07-1.14 м (3Н, СН2, На-16,19,20), 1.41-1.50 м (2Н, СН2, На-18; Hb-20), 1.52-1.63 м (3Н, СН2, Hb-16,18,19), 2.26 уш.с (1Н, СН, Н-17), 2.43 уш.с (1Н, СН, Н-15), 2.63-2.68 м (4Н, СН2, Н-3,9; 1H, СН, Н-14), 3.65 уш.с (4Н, СН2, Н-12,13), 3.78-3.82 м (4Н, СН2, Н-2,10), 4.45 д (2Н, СН2, На-5,7; J 14 Гц), 4.48 д (2Н, СН2, Hb-5,7; J 14 Гц).
Спектр ЯМР 13С (CDCl3, δ, м.д.): 27.53 (С-19), 28.64 (С-20), 29.65 (С-3, С-9), 35.25 (С-16), 36.43 (С-17), 37.21 (С-18), 39.58 (С-15), 57.81 (С-5, С-7), 64.45 (С-14), 70.38 (С-12, С-13), 73.85 (С-2, С-10).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛ 2-(1,11-ДИОКСА-4,8-ДИТИА-6-АЗАЦИКЛОТРИДЕКАН-6-ИЛ)АЛКАНОАТОВ | 2016 |
|
RU2632670C2 |
| СПОСОБ ПОЛУЧЕНИЯ 6-[4-ГИДРОКСИ(ТИО,КАРБОКСИ)ФЕНИЛ]-1,11-ДИОКСА-4,8-ДИТИА-6-АЗАЦИКЛОТРИДЕКАНОВ | 2016 |
|
RU2640211C2 |
| СПОСОБ ПОЛУЧЕНИЯ (1,11-ДИОКСА-4,8-ДИТИА-6-АЗАЦИКЛОТРИДЕКАН-6-ИЛ)-ХИНОЛИНОВ | 2016 |
|
RU2632673C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-(м,n-ГАЛОГЕНФЕНИЛ)-1,11-ДИОКСА-4,8-ДИТИА-6-АЗАЦИКЛОТРИДЕКАНОВ | 2014 |
|
RU2565786C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-ЦИКЛОАЛКИЛ-1,5,8-ТРИТИА-3-АЗАЦИКЛОДЕКАНОВ | 2017 |
|
RU2664655C2 |
| СПОСОБ ПОЛУЧЕНИЯ 12-ЦИКЛОАЛКИЛ-12,13,13b,13c-ТЕТРАГИДРО-6Н,11Н,14Н-4b,5a,10b,12,13a-ПЕНТААЗАДИБЕНЗО[a,h]ЦИКЛОГЕПТА[1,2,3,4-def]ФЛУОРЕНОВ | 2020 |
|
RU2735740C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-АДАМАНТИЛ-1,5,3-ДИТИАЗЕПАНОВ | 2015 |
|
RU2605447C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ЦИКЛОАЛКИЛЗАМЕЩЕННЫХ 1, 5, 3-ДИТИАЗЕПАНОВ | 2015 |
|
RU2601313C1 |
| СПОСОБ ПОЛУЧЕНИЯ N,N-БИС-[(1,5,3-ДИТИАЗЕПАН-3-ИЛ)АЛКИЛ]АМИНОВ | 2014 |
|
RU2591196C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-ЦИКЛОАЛКИЛЗАМЕЩЕННЫХ 1,5,3-ДИТИАЗЕПАНОВ | 2017 |
|
RU2664654C2 |
Изобретение относится к способу получения 6-циклоалкил-1,11-диокса-4,8-дитиа-6-азациклотридеканов общей формулы (1):
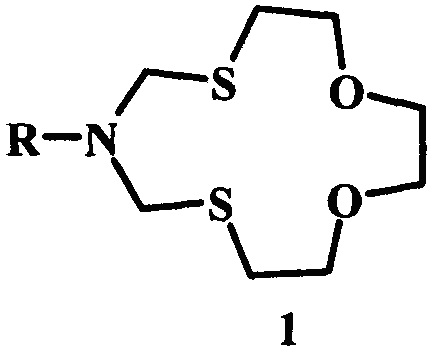
где R - цикло-C3H5, цикло-C5H9, цикло-C6H11, цикло-C5H9O, цикло-C7H13, цикло-C8H15, норборнил-, в котором циклоалкиламин (циклопропил-амин, или циклопентил-амин, или циклогексил-амин, или тетрагидропиранил-амин, или циклогептил-амин, или циклооктил-амин, или норборнил-амин) подвергают взаимодействию с 1,6,9-триокса-3,12-дитиациклотридеканом в присутствии катализатора SmCl3⋅6H2O при мольном соотношении циклоалкиламин : 1,6,9-триокса-3,12-дитиациклотридекан : SmCl3⋅6H2O = 1:1:(0.03-0.07) при комнатной температуре (~20°С) в среде растворителей этанол-хлороформ (1:1, объемное соотношение) в течение 2.5-3.5 ч. Технический результат: предложен способ получения 6-циклоалкил-1,11-диокса-4,8-дитиа-6-азациклотридеканов общей формулы (1) с высоким выходом. 1 табл., 2 пр.
Способ получения 6-циклоалкил-1,11-диокса-4,8-дитиа-6-азациклотридеканов общей формулы (1):
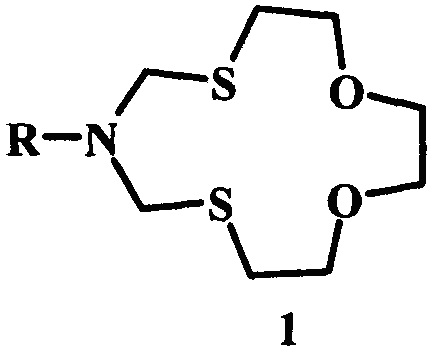
где R - цикло-C3H5, цикло-C5H9, цикло-C6H11, цикло-C5H9O, цикло-C7H13, цикло-C8H15, норборнил-,
отличающийся тем, что циклоалкиламин (циклопропил-амин, или циклопентил-амин, или циклогексил-амин, или тетрагидропиранил-амин, или циклогептил-амин, или циклооктил-амин, или норборнил-амин) подвергают взаимодействию с 1,6,9-триокса-3,12-дитиациклотридеканом в присутствии катализатора SmCl3⋅6H2O при мольном соотношении циклоалкиламин : 1,6,9-триокса-3,12-дитиациклотридекан : SmCl3⋅6H2O = 1:1:(0.03-0.07) при комнатной температуре (~20°С) в среде растворителей этанол-хлороформ (1:1, объемное соотношение) в течение 2.5-3.5 ч.
| Е | |||
| Б | |||
| Рахимова и др | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Журнал органической химии, т.52, вып.4, 2016, 584-588 | |||
| G | |||
| R | |||
| Khabibulina et al | |||
| Synthesis of dithiaza- and dioxadithiazacycloalkanes by cyclothiomethylation of arylamines with formaldehyde and α,ω-dithiols | |||
| Устройство для устранения мешающего действия зажигательной электрической системы двигателей внутреннего сгорания на радиоприем | 1922 |
|
SU52A1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-(м,n-ГАЛОГЕНФЕНИЛ)-1,11-ДИОКСА-4,8-ДИТИА-6-АЗАЦИКЛОТРИДЕКАНОВ | 2014 |
|
RU2565786C1 |
Авторы
Даты
2018-08-21—Публикация
2017-02-20—Подача