ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к ингибиторам пан-генотипического ВГС и к способам их использования для лечения ВГС инфекции.
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
[0002] Вирус гепатита С (ВГС) представляет собой РНК вирус, принадлежащий к роду Hepacivirus семейства Flaviviridae. Вирион оболочкового ВГС содержит геном РНК с позитивными цепями, кодирующий все известные вирус-специфические белки в единой, непрерывной, открытой считывающей рамке. Такая открытая считывающая рамка включает приблизительно 9500 нуклеотидов и кодирует один крупный полипротеин, содержащий около 3000 аминокислот. Указанный полипротеин состоит из капсидного белка, оболочковых белков E1 и E2, связанных с мембранными белками p7, и не-структурных белков NS2, NS3, NS4A, NS4B, NS5A и NS5B.
[0003] ВГС инфекция связана с прогрессирующим патологиями печени, включая цирроз и гепатоклеточную карциному. Хронический гепатит C можно лечить пэгинтерфероном-альфа в комбинации с рибавирином. При этом остаются существенные ограничения по эффективности и толерантности, так как многие пациенты страдают от побочных эффектов, и удаление вируса из организма часто оказывается несоответствующим требованиям. Поэтому существует необходимость в создании новых лекарственных средств для лечения инфекции ВГС.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
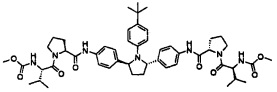
[0004] Неожиданно было обнаружено, что метил {(2S,3R)-1-[(2S)-2-{5-[(2R,5R)-1-{3,5-дифтор-4-[4-(4-фторфенил)пиперидин-1-ил]фенил}-5-(6-фтор-2-{(2S)-1-N-(метоксикарбонил)-O-метил-L-треонил]пирролидин-2-ил}-1H-бензимидазол-5-ил)пирролидин-2-ил)-6-фтор-1H-бензимидазол-2-ил}пирролидин-1-ил]-3-метокси-1-оксобутан-2-ил}карбамат (здесь и далее "соединение 1") и его фармацевтически приемлемые соли являются ингибиторами пан-генотипического ВГС. Указанные соединения являются эффективными в отношении ингибирования широкого круга ВГС генотипов и вариантов, таких как ВГС генотипы 1, 2, 3, 4, 5 и 6.
[0005] Соответственно, первый аспект настоящего изобретения отличается тем, что предложены способы лечения ВГС. Такие способы включают введение пациенту эффективного количества соединения 1 или его фармацевтически приемлемой соли пациенту с ВГС, независимо от специфического генотипа (генотипов) ВГС, который присутствует у этого пациента. Поэтому, такого пациента предпочтительно не генотипируют до лечения, и лечение можно начинать без предварительного скринирования пациента на специфические генотипы ВГС.
[0006] В одном варианте указанного аспекта настоящего изобретения, указанный пациент инфицирован генотипом 2, таким как генотип 2a или 2b. В другом варианте указанного аспекта настоящего изобретения, указанный пациент инфицирован генотипом 3, таким как генотип 3a. В другом варианте указанного аспекта настоящего изобретения, указанный пациент инфицирован генотипом 4, таким как генотип 4a. В еще одном варианте указанного аспекта настоящего изобретения, указанный пациент инфицирован генотипом 5, таким как генотип 5a. И в еще одном варианте указанного аспекта настоящего изобретения, указанный пациент инфицирован генотипом 6, таким как генотип 6a.
[0007] В другом варианте указанного аспекта настоящего изобретения, соединение 1 или его соль комбинируют или совместно вводят с другим анти-ВГС агентом. Нелимитирующие примеры указанных других анти-ВГС агентов включают ингибиторы ВГС полимеразы, ингибиторы ВГС протеазы, другие ингибиторы ВГС NS5A, CD81 ингибиторы, ингибиторы циклофилина или ингибиторы участка внутренней посадки рибосомы (IRES). В одном из примеров указанный пациент инфицирован генотипом 2, таким как генотип 2a или 2b. В другом примере указанный пациент инфицирован генотипом 3, таким как генотип 3a. В другом примере указанный пациент инфицирован генотипом 4, таким как генотип 4a. В еще одном примере указанный пациент инфицирован генотипом 5, таким как генотип 5a. И в еще одном примере указанный пациент инфицирован генотипом 6, таким как генотип 6a.
[0008] В еще одном варианте указанного аспекта настоящего изобретения, соединение 1 или его соль комбинируют или совместно вводят с ингибитором протеазы ВГС или с ингибитором полимеразы ВГС. В одном из примеров, указанный пациент инфицирован генотипом 2, таким как генотип 2a или 2b. В другом примере указанный пациент инфицирован генотипом 3, таким как генотип 3a. В другом примере указанный пациент инфицирован генотипом 4, таким как генотип 4a. В еще одном примере указанный пациент инфицирован генотипом 5, таким как генотип 5a. И в еще одном примере указанный пациент инфицирован генотипом 6, таким как генотип 6a.
[0009] В другом варианте указанного аспекта настоящего изобретения, соединение 1 или его соль комбинируют или совместно вводят с ингибитором протеазы ВГС. В одном из примеров, указанный пациент инфицирован генотипом 2, таким как генотип 2a или 2b. В другом примере указанный пациент инфицирован генотипом 3, таким как генотип 3a. В другом примере указанный пациент инфицирован генотипом 4, таким как генотип 4a. В еще одном примере указанный пациент инфицирован генотипом 5, таким как генотип 5a. И в еще одном примере указанный пациент инфицирован генотипом 6, таким как генотип 6a.
[0010] В другом варианте указанного аспекта настоящего изобретения, соединение 1 или его соль комбинируют или совместно вводят с ингибитором полимеразы ВГС. В одном из примеров, указанный пациент инфицирован генотипом 2, таким как генотип 2a или 2b. В другом примере указанный пациент инфицирован генотипом 3, таким как генотип 3a. В другом примере указанный пациент инфицирован генотипом 4, таким как генотип 4a. В еще одном примере указанный пациент инфицирован генотипом 5, таким как генотип 5a. И в еще одном примере указанный пациент инфицирован генотипом 6, таким как генотип 6a.
[0011] В другом варианте указанного аспекта настоящего изобретения, соединение 1 или его соль комбинируют или совместно вводят с ингибитором протеазы ВГС и ингибитором полимеразы ВГС. В одном из примеров, указанный пациент инфицирован генотипом 2, инфицирован генотипом 3, таким как генотип 3a. В другом примере указанный пациент инфицирован генотипом 4, таким как генотип 4a. В еще одном примере указанный пациент инфицирован генотипом 5, таким как генотип 5a. И в еще одном примере указанный пациент инфицирован генотипом 6, таким как генотип 6a.
[0012] В рассматриваемом аспекте настоящего изобретения, также как в каждом и любом варианте и примере, раскрытом здесь и далее, лечение предпочтительно длится меньше чем 24 недели и не включает введения интерферона указанному пациенту. Такое лечение может, например, включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли вместе с ингибитором протеазы ВГС или ингибитором полимеразы ВГС или с комбинацией ингибитора протеазы ВГС и ингибитора полимеразы ВГС. Например, лечение может включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли вместе с ингибитором протеазы ВГС. В другом примере лечение может включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли вместе с ингибитором полимеразы ВГС. В еще другом примере лечение может включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли вместе с комбинацией ингибитора протеазы ВГС и ингибитора полимеразы ВГС.
[0013] В рассматриваемом аспекте настоящего изобретения, также как в каждом и в любом варианте и примере, раскрытом здесь и далее, лечение предпочтительно длится не больше, чем 12 недель (например, лечение длится 8, 9, 10, 11 или 12 недель; предпочтительно, лечение длится 12 недель), и не включает введения интерферона указанному пациенту. Такое лечение может, например, включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли, вместе с ингибитором протеазы ВГС, или ингибитором полимеразы ВГС, или с комбинацией ингибитора протеазы ВГС и ингибитора полимеразы ВГС. Например, лечение может включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли вместе с ингибитором протеазы ВГС. В другом примере лечение может включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли вместе с ингибитором полимеразы ВГС. В еще другом примере лечение может включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли вместе с комбинацией ингибитора протеазы ВГС и ингибитора полимеразы ВГС.
[0014] В рассматриваемом аспекте настоящего изобретения, также как в каждом и в любом варианте и примере, раскрытом здесь и далее, лечение может включать или может не включать введение указанному пациенту рибавирина; например, лечение может включать введение указанному пациенту рибавирина.
[0015] Во втором аспекте настоящее изобретение отличается способами лечения ВГС. Такие способы включают введение пациенту с ВГС эффективного количества соединения 1 или его фармацевтически приемлемой соли, где указанный пациент инфицирован генотипом 2, 3, 4, 5 или 6 ВГС.
[0016] В одном варианте указанного аспекта настоящего изобретения, указанный пациент инфицирован генотипом 2, таким как генотип 2a или 2b. В другом варианте указанного аспекта настоящего изобретения, указанный пациент инфицирован генотипом 3, таким как генотип 3a. В другом варианте указанного аспекта настоящего изобретения, указанный пациент инфицирован генотипом 4, таким как генотип 4a. В еще одном варианте указанного аспекта настоящего изобретения, указанный пациент инфицирован генотипом 5, таким как генотип 5a. И в еще одном варианте указанного аспекта настоящего изобретения, указанный пациент инфицирован генотипом 6, таким как генотип 6a.
[0017] В другом варианте указанного аспекта настоящего изобретения, соединение 1 или его соль комбинируют или совместно вводят с другим анти-ВГС агентом. Нелимитирующие примеры указанных других анти-ВГС агентов включают ингибиторы полимеразы ВГС, ингибиторы протеазы ВГС, другие ингибиторы NS5A ВГС, ингибиторы CD81, ингибиторы циклофилина, или ингибиторы участка внутренней посадки рибосомы (IRES). В одном из примеров, указанный пациент инфицирован генотипом 2, таким как генотип 2a или 2b. В другом примере указанный пациент инфицирован генотипом 3, таким как генотип 3a. В другом примере указанный пациент инфицирован генотипом 4, таким как генотип 4a. В еще одном примере указанный пациент инфицирован генотипом 5, таким как генотип 5a. И в еще одном примере указанный пациент инфицирован генотипом 6, таким как генотип 6a.
[0018] В еще одном варианте указанного аспекта настоящего изобретения, соединение 1 или его соль комбинируют или совместно вводят с ингибитором протеазы ВГС или с ингибитором полимеразы ВГС. В одном из примеров, указанный пациент инфицирован генотипом 2, таким как генотип 2a или 2b. В другом примере указанный пациент инфицирован генотипом 3, таким как генотип 3a. В другом примере указанный пациент инфицирован генотипом 4, таким как генотип 4a. В еще одном примере указанный пациент инфицирован генотипом 5, таким как генотип 5a. И в еще одном примере указанный пациент инфицирован генотипом 6, таким как генотип 6a.
[0019] В другом варианте указанного аспекта настоящего изобретения, соединение 1 или его соль комбинируют или совместно вводят с ингибитором протеазы ВГС. В одном из примеров, указанный пациент инфицирован генотипом 2, таким как генотип 2a или 2b. В другом примере указанный пациент инфицирован генотипом 3, таким как генотип 3a. В другом примере указанный пациент инфицирован генотипом 4, таким как генотип 4a. В еще одном примере указанный пациент инфицирован генотипом 5, таким как генотип 5a. И в еще одном примере указанный пациент инфицирован генотипом 6, таким как генотип 6a.
[0020] В другом варианте указанного аспекта настоящего изобретения, соединение 1 или его соль комбинируют или совместно вводят с ингибитором полимеразы ВГС. В одном из примеров, указанный пациент инфицирован генотипом 2, таким как генотип 2a или 2b. В другом примере указанный пациент инфицирован генотипом 3, таким как генотип 3a. В другом примере указанный пациент инфицирован генотипом 4, таким как генотип 4a. В еще одном примере указанный пациент инфицирован генотипом 5, таким как генотип 5a. И в еще одном примере указанный пациент инфицирован генотипом 6, таким как генотип 6a.
[0021] В другом варианте указанного аспекта настоящего изобретения, соединение 1 или его соль комбинируют или совместно вводят с ингибитором протеазы ВГС и ингибитором полимеразы ВГС. В одном из примеров, указанный пациент инфицирован генотипом 2, таким как генотип 2a или 2b. В другом примере указанный пациент инфицирован генотипом 3, таким как генотип 3a. В другом примере указанный пациент инфицирован генотипом 4, таким как генотип 4a. В еще одном примере указанный пациент инфицирован генотипом 5, таким как генотип 5a. И в еще одном примере указанный пациент инфицирован генотипом 6, таким как генотип 6a.
[0022] В рассматриваемом аспекте настоящего изобретения, также как в каждом и любом варианте и примере, раскрытом здесь и далее, лечение предпочтительно длится меньше чем 24 недели и не включает введения интерферона указанному пациенту. Такое лечение может, например, включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли вместе с ингибитором протеазы ВГС или ингибитором полимеразы ВГС или с комбинацией ингибитора протеазы ВГС и ингибитора полимеразы ВГС. Например, лечение может включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли вместе с ингибитором протеазы ВГС. В другом примере лечение может включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли вместе с ингибитором полимеразы ВГС. В еще другом примере лечение может включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли вместе с комбинацией ингибитора протеазы ВГС и ингибитора полимеразы ВГС.
[0023] В рассматриваемом аспекте настоящего изобретения, также как в каждом и любом варианте и примере, раскрытом здесь и далее, лечение предпочтительно длится не больше, чем 12 недель (например, лечение длится 8, 9, 10, 11 или 12 недель; предпочтительно, лечение длится 12 недель), и не включает введения интерферона указанному пациенту. Такое лечение может, например, включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли вместе с ингибитором протеазы ВГС или ингибитором полимеразы ВГС или с комбинацией ингибитора протеазы ингибитора полимеразы ВГС. Например, лечение может включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли вместе с ингибитором протеазы ВГС. В другом примере лечение может включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли вместе с ингибитором полимеразы ВГС. В еще другом примере лечение может включать введение указанному пациенту соединения 1 или его фармацевтически приемлемой соли вместе с комбинацией ингибитора протеазы ВГС и ингибитора полимеразы ВГС.
[0024] В рассматриваемом аспекте настоящего изобретения, также как в каждом и в любом варианте и примере, раскрытом здесь и далее, лечение может включать или может не включать введение указанному пациенту рибавирина; например, лечение включает введение указанному пациенту рибавирина.
[0025] Настоящее изобретение также отличается тем, что Соединение 1 или его фармацевтически приемлемая соль предназначены для использования для лечения пациента с ВГС независимо от специфического генотипа (генотипов) ВГС, который имеется у пациента. Такие способы использования проиллюстрированы в раскрытом выше первом аспекте настоящего изобретения, включая каждый и любой вариант и пример, раскрытые здесь и далее.
[0026] Настоящее изобретение далее отличается тем, что Соединение 1 или его фармацевтически приемлемую соль для использования для лечения пациента, инфицированного ВГС генотипа 2, 3, 4, 5, или 6. Такие применения проиллюстрированы в раскрытом выше втором аспекте настоящего изобретения, включая каждый и любой вариант и пример, раскрытые здесь и далее.
[0027] Другие особенности, цели и преимущества настоящего изобретения очевидны с учетом приводимого далее описания. Однако, следует понимать, что подробное описание, хотя и относится к предпочтительным вариантам настоящего изобретения, представлено только с целью иллюстрации, но не ограничения. Различные изменения и модификации в объеме настоящего изобретения станут очевидны специалистам в данной области из подробного описания.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА ОСУЩЕСТВЛЕНИЯ
НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0028] Соединение 1, также известное как метил {(2S,3R)-1-[(2S)-2-{5-[(2R,5R)-1-{3,5-дифтор-4-[4-(4-фторфенил)пиперидин-1 -ил]фенил}-5-(6-фтор-2-{(2S)-1-N-(метоксикарбонил)-O-метил-L-треонил]пирролидин-2-ил}-1H-бензимидазол-5-ил)пирролидин-2-ил]-6-фтор-1H-бензимидазол-2-ил}пирролидин-1-ил]-3-метокси-1-оксобутан-2-ил}карбамат, раскрыто в опубликованной патентной заявке США No. 2012/0004196, полное содержание которой включено в описание по ссылке.
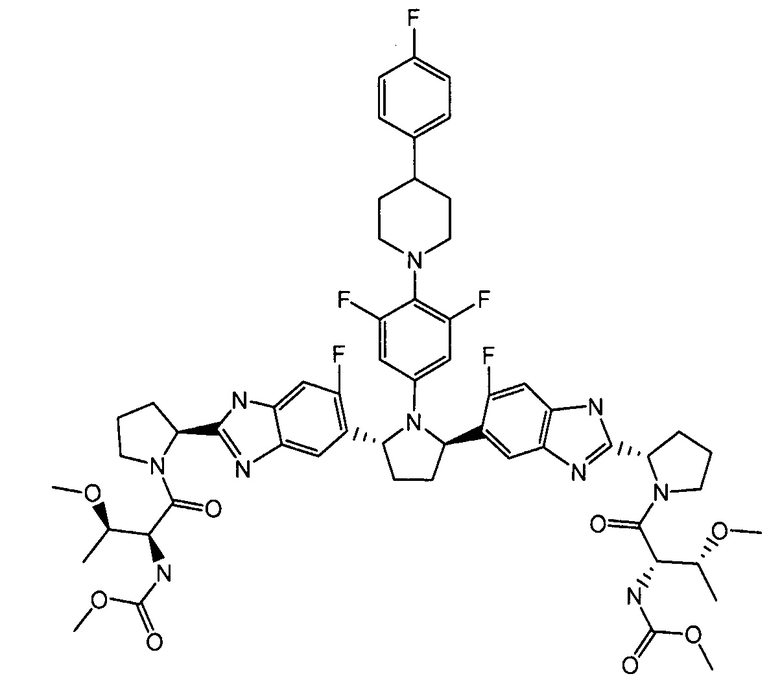
Соединение 1
[0029] Было обнаружено, что соединение 1 имеет значения EC50 меньше, чем 10 пМ против стабильных субгеномных репликонов с NS5A, полученных из широкого круга клинически релевантных генотипов ВГС, таких как генотипы ВГС 1a, 1b, 2a, 2b, 3a, 4a, 5a и 6a. В анализах временной экспрессии субгеномного репликона было обнаружено, что соединение 1 имеет значение EC50 меньше, чем 5 пМ, против многих вариантов ВГС, которые устойчивы к другим ингибиторам NS5A, таким как вариант T24A генотипа 2a, варианты L28F и L31V генотипа 2b, варианты M28T и Y93H генотипа 3a, варианты L28V и L30H генотипа 4a, варианты L28I, L31F и L31V генотипа 5a, и варианты L31V, T58N и T58A генотипа 6a. Значения EC50 определяют в присутствии 5% фетальной телячьей сыворотки, но в отсутствии человеческой плазмы в соответствии с раскрытыми далее процедурами.
[0030] Настоящее изобретение отличается использованием соединения 1 или его фармацевтически приемлемой соли для лечения ВГС, как раскрыто в описании выше. В любом раскрытом здесь способе использования, соединение 1 или его фармацевтически приемлемую соль можно приготовить в подходящей жидкой или твердой лекарственной форме. Предпочтительно, соединение 1 или его соль приготавливают в виде твердой композиции, включающей соединение 1 (или его фармацевтически приемлемую соль) в аморфной форме, фармацевтически приемлемый гидрофильный полимер и необязательно фармацевтически приемлемое поверхностно-активное вещество.
[0031] Нелимитирующий способ получения аморфной формы соединения 1 (или его фармацевтически приемлемой соли) происходит путем создания твердых дисперсий с полимерным носителем. В том смысле, как здесь использован, термин "твердая дисперсия" определяет систему в твердом состоянии (в противоположность жидкому или газообразному состоянию), включающую по меньшей мере два компонента, в которой один компонент диспергирован в другом компоненте или компонентах. Например, активный ингредиент или комбинацию активных ингредиентов можно диспергировать в матрице, состоящей из фармацевтически приемлемого гидрофильного полимера (полимеров) и фармацевтически приемлемого поверхностно-активного вещества (веществ). Термин "твердая дисперсия" охватывает системы, содержащие маленькие частицы одной фазы, диспергированные в другой фазе. Размеры таких частиц часто бывают меньше, чем 400 мкм, например, меньше чем 100, 10 или 1 мкм. Если твердая дисперсия, состоящая из компонент, такова, что указанная система химически и физически однородна, или гомогенна по всему объему, или состоит из одной фазы (как определено термодинамически), такую твердую дисперсию называют "твердым раствором". Стекловидный раствор представляет собой твердый раствор, в котором растворенное вещество растворено в стекловидном растворителе.
[0032] В любом из раскрытых в описании способов можно использовать твердую композицию, которая включает (1) соединение 1 (или его фармацевтически приемлемую соль) в аморфной форме, (2) фармацевтически приемлемый гидрофильный полимер и (3) фармацевтически приемлемое поверхностно-активное вещество. Соединение 1 (или его соль) и полимер предпочтительно приготавливают в виде твердой дисперсии. Поверхностно-активное вещество может быть также включено в ту же самую твердую дисперсию; или указанное поверхностно-активное вещество можно отдельно скомбинировать или смешать с твердой дисперсией.
[0033] Гидрофильный полимер может, например, и без ограничений, иметь Tg по меньшей мере 50°C, более предпочтительно по меньшей мере 60°C, и наиболее предпочтительно по меньшей мере 80°C, включая, но ими не ограничиваясь, от 80°C до 180°C, или от 100°C до 150°C. Предпочтительно, если гидрофильный полимер является водорастворимым полимером. Нелимитирующие примеры подходящих гидрофильных полимеров включают, но ими не ограничиваются, гомополимеры или сополимеры N-виниллактамов, такие как гомополимеры или сополимеры N-винилпирролидона (например, поливинилпирролидон (ПВП), или сополимеры N-винилпирролидона и винилацетата или винилпропионата); сложные эфиры целлюлозы или простые эфиры целлюлозы, такие как алкилцеллюлозы (например, метилцеллюлоза или этилцеллюлоза), гидроксиалкилцеллюлозы (например, гидроксипропилцеллюлоза), гидроксиалкилалкилцеллюлозы (например, гидроксипропилметилцеллюлоза), и фталаты целлюлозы или сукцинаты (например, ацетат-фталат целлюлозы и фталат гидроксипропилметилцеллюлозы, сукцинат гидроксипропилметилцеллюлозы, или ацетат-сукцинат гидроксипропилметилцеллюлозы); высокомолекулярные оксиды полиалкилена, такие как полиэтиленоксид, полипропиленоксид, и сополимеры этиленоксида и пропиленоксида; полиакрилаты или полиметакрилаты, такие как сополимеры метакриловая кислота/этилакрилат, сополимеры метакриловая кислота/метилметакрилат, сополимеры бутилметакрилат/2-диметиламиноэтилметакрилат, поли(гидроксиалкилакрилаты), и поли(гидроксиалкилметакрилаты); полиакриламиды; полимеры винилацетата, такие как сополимеры винилацетата и кротоновой кислоты, и частично гидролизованный поливинилацетат (также именуемый как частично омыленный "поливиниловый спирт"); поливиниловый спирт; олиго- или полисахариды, такие как каррагенаны, галактоманнаны и ксантановая камедь; полигидроксиалкилакрилаты; полигидроксиалкилметакрилаты; сополимеры метилметакрилата и акриловой кислоты; полиэтиленгликоли (ПЭГи); или любые их смеси.
[0034] Нелимитирующие примеры предпочтительных гидрофильных полимеров включают поливинилпирролидон (ПВП) K17, ПВП K25, ПВП K30, ПВП K90, гидроксипропилметилцеллюлозу (ГПМЦ) E3, ГПМЦ E5, ГПМЦ E6, ГПМЦ E15, ГПМЦ K3, ГПМЦ A4, ГПМЦ A15, ГПМЦ ацетат-сукцинат (AS) LF, ГПМЦ AS MF, ГПМЦ AS HF, ГПМЦ AS LG, ГПМЦ AS МГ, ГПМЦ AS HG, ГПМЦ фталат (P) 50, ГПМЦ P 55, Ethocel 4, Ethocel 7, Ethocel 10, Ethocel 14, Ethocel 20, коповидон (сополимер винилпирролидон-винилацетат 60/40), поливинилацетат, сополимер метакрилат/метакриловая кислота (Eudragit) L100-55, Eudragit L100, Eudragit S100, полиэтиленгликоль (ПЭГ) 400, ПЭГ 600, ПЭГ 1450, ПЭГ 3350, ПЭГ 4000, ПЭГ 6000, ПЭГ 8000, полоксамер 124, полоксамер 188, полоксамер 237, полоксамер 338, и полоксамер 407.
[0035] Из них предпочтительны гомополимеры или сополимеры N-винилпирролидона, такие как сополимеры N-винилпирролидона и винилацетата. Нелимитирующий пример предпочтительного полимера представляет собой сополимер 60 масс. % N-винилпирролидона и 40 масс. % винилацетата. Другие предпочтительные полимеры включают, без ограничений, гидроксипропилметилцеллюлозу (ГПМЦ, также известную как гипромеллоза в USP), такие как гидроксипропилметилцеллюлоза степени чистоты E5 (ГПМЦ-E5); и ацетат-сукцинат гидроксипропилметилцеллюлозы (ГПМЦ-AS).
[0036] Используемое фармацевтически приемлемое поверхностно-активное вещество может быть неионным поверхностно-активным веществом.
Предпочтительно, поверхностно-активное вещество имеет значение HLB (показатель гидрофильно-липофильного баланса) порядка 2-20. Твердые композиции, используемые в настоящем изобретении, могут также включать смесь фармацевтически приемлемых поверхностно-активных веществ, с по меньшей мере одним поверхностно-активным веществом со значением HLB по меньшей мере 10, и по меньшей мере другим поверхностно-активным веществом, со значением HLB ниже 10.
[0037] Нелимитирующие примеры подходящих фармацевтически приемлемых поверхностно-активных веществ включают производные полиоксиэтиленированного касторового масла, например, полиоксиэтиленглицерин тририцинолеат или полиоксил 35 касторовое масло (кремофор® EL; BASF Corp.), или полиоксиэтиленглицерин оксистеарат, такой как полиэтиленгликоль 40 гидрированное касторовое масло (кремофор® RH 40, также известное как полиоксил 40 гидрированное касторовое масло, или макроголглицерин гидроксистеарат), или полиэтиленгликоль 60 гидрированное касторовое масло (кремофор® RH 60 или моноэфир жирной кислоты полиоксиэтиленсорбитана), такие как моноэфир жирной кислоты полиоксиэтилен (20) сорбитана, например, полиоксиэтилен (20) сорбитан моноолеат (Tween® 80), полиоксиэтилен (20) сорбитан моностеарат (Tween® 60), полиоксиэтилен (20) сорбитан монопальмитат (Tween® 40), или полиоксиэтилен (20) сорбитан монолаурат (Tween® 20). Другие нелимитирующие примеры подходящих поверхностно-активных веществ включают полиоксиэтиленалкиловые простые эфиры, например, полиоксиэтилен (3) лауриловый простой эфир, полиоксиэтилен (5) цетиловый простой эфир, полиоксиэтилен (2) стеариловый простой эфир, полиоксиэтилен (5) стеариловый простой эфир; полиоксиэтиленалкилариловые простые эфиры, например, полиоксиэтилен (2) нонилфениловый простой эфир, полиоксиэтилен (3) нонилфениловый простой эфир, полиоксиэтилен (4) нонилфениловый простой эфир, полиоксиэтилен (3) октилфениловый простой эфир; сложные эфиры жирных кислот полиэтиленгликоля, например, ПЭГ-200 монолаурат, ПЭГ-200 дилаурат, ПЭГ-300 дилаурат, ПЭГ-400 дилаурат, ПЭГ-300 дистеарат, ПЭГ-300 диолеат; моноэфиры жирной кислоты алкиленгликоля, например, пропиленгликоль монолаурат (лаурогликоль®); сложные эфиры жирных кислот сахарозы, например, моностеарат сахарозы, дистеарат сахарозы, монолаурат сахарозы, дилаурат сахарозы; сложные моноэфиры жирных кислот сорбитана, такие как (Span® 20), сорбитан моноолеат, сорбитан монопальмитат (Span® 40), или сорбитан стеарат. Другие подходящие поверхностно-активные вещества включают, но ими не ограничиваются, блоксополимеры этиленоксида и пропиленоксида, также известные как блоксополимеры полиоксиэтилен-полиоксипропилена или полиоксиэтилен-полипропиленгликоля, такие как Полоксамер® 124, Полоксамер® 188, Полоксамер® 237, Полоксамер® 388 или Полоксамер® 407 (BASF Wyandotte Corp.). Как раскрыто выше, смесь поверхностно-активных веществ можно использовать в твердой композиции, используемой в настоящем изобретении.
[0038] Нелимитирующие примеры предпочтительных поверхностно-активных веществ включают полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 80, кремофор RH 40, кремофор EL, Gelucire 44/14, Gelucire 50/13, D-альфа-токоферил полиэтиленгликоль 1000 сукцинат (витамин E TPGS), пропиленгликоль лаурат, натрийлаурилсульфвт и сорбитан монолаурат.
[0039] Твердая дисперсия, которую используют в настоящем изобретении, предпочтительно, представляет собой твердый раствор, и более предпочтительно стекловидный раствор.
[0040] В одном варианте твердые композиции, используемые в настоящем изобретении, включают аморфную твердую дисперсию или твердый раствор, который включает соединение 1 (или его фармацевтически приемлемую соль) и фармацевтически приемлемый гидрофильный полимер. Твердая композиция также включает фармацевтически приемлемое поверхностно-активное вещество, которое, предпочтительно, приготавливают в форме аморфной твердой дисперсии или в виде твердого раствора. Гидрофильный полимер можно выбрать, например, из группы, состоящей из гомополимера N-виниллактама, сополимера N-виниллактама, сложного эфира целлюлозы, простого эфира целлюлозы, полиалкиленоксида, полиакрилата, полиметакрилата, полиакриламида, поливинилового спирта, полимера винилацетата, олигосахарида и полисахарида. В качестве нелимитирующего примера, гидрофильный полимер выбирают из группы, состоящей из гомополимера N-винилпирролидона, сополимера N-винилпирролидона, сополимера N-винилпирролидона и винилацетата, сополимера N-винилпирролидона и винилпропионата, поливинилпирролидона, метилцеллюлозы, этилцеллюлозы, гидроксиалкилцеллюлозы, гидроксипропилцеллюлозы, гидроксиалкилалкилцеллюлозы, гидроксипропилметилцеллюлозы, фталата целлюлозы, сукцината целлюлозы, ацетата-фталата целлюлозы, фталата гидроксипропилметилцеллюлозы, сукцината гидроксипропилметилцеллюлозы, ацетат-сукцината гидроксипропилметилцеллюлозы, полиэтиленоксида, полипропиленоксида, сополимера этиленоксида и пропиленоксида, сополимера метакриловая кислота/этилакрилат, сополимера метакриловая кислота/метилметакрилат, сополимера бутилметакрилат/2-диметиламиноэтилметакрилат, поли(гидроксиалкилакрилата), поли(гидроксиалкилметакрилата), сополимера винилацетата и кротоновой кислоты, частично гидролизованного поливинилацетата, каррагенана, галактоманнана и ксантановой камеди. Предпочтительно, гидрофильный полимер выбирают из поливинилпирролидона (ПВП) K17, ПВП K25, ПВП K30, ПВП K90, гидроксипропилметилцеллюлозы (ГПМЦ) E3, ГПМЦ E5, ГПМЦ E6, ГПМЦ E15, ГПМЦ K3, ГПМЦ A4, ГПМЦ A15, ГПМЦ ацетат сукцината (AS) LF, ГПМЦ AS MF, ГПМЦ AS HF, ГПМЦ AS LG, ГПМЦ AS МГ, ГПМЦ AS HG, ГПМЦ фталата (P) 50, ГПМЦ P 55, Ethocel 4, Ethocel 7, Ethocel 10, Ethocel 14, Ethocel 20, коповидона (сополимера винилпирролидон-винилацетата 60/40), поливинилацетата, сополимера метакрилат/метакриловая кислота (Eudragit) L100-55, Eudragit L100, Eudragit S100, полиэтиленгликолей (ПЭГ) 400, ПЭГ 600, ПЭГ 1450, ПЭГ 3350, ПЭГ 4000, ПЭГ 6000, ПЭГ 8000, полоксамера 124, полоксамера 188, полоксамера 237, полоксамера 338 или полоксамера 407. Более предпочтительно, гидрофильный полимер выбирают из гомополимеров винилпирролидона (например, ПВП со значениями К по Фикентшеру от 12 до 100, или ПВП со значениями К по Фикентшеру от 17 до 30), или сополимеров 30-70 масс .% N-винилпирролидона (ВП) и 70-30 масс. % винилацетата (ВА) (например, сополимер 60 масс. % ВП и 40 масс. % ВА). Поверхностно-активное вещество можно выбрать, например, из группы, состоящей из полиоксиэтиленглицерин тририцинолеата или полиоксила 35 касторового масла (кремофор® EL; BASF Corp.) или полиоксиэтиленглицерин оксистеарата, моноэфира жирной кислоты полиоксиэтилен сорбитана, алкилового простого эфира полиоксиэтилена, алкиларилового простого эфира полиоксиэтилена, сложного эфира жирной кислоты полиэтиленгликоля, сложного моноэфира жирной кислоты алкиленгликоля, сложного эфира жирной кислоты сахарозы, и сложного моноэфира жирной кислоты сорбитана. В качестве нелимитирующих примеров, поверхностно-активное вещество выбирают из группы, состоящей из полиэтиленгликоль 40 гидрированного касторового масла (кремофор® RH 40, также известное как полиоксил 40 гидрированное касторовое масло или макрогол глицерин гидроксистеарат), полиэтиленгликоль 60 гидрированного касторового масла (кремофор® RH 60), сложного моноэфира жирной кислоты полиоксиэтилен (20) сорбитана (например, полиоксиэтилен (20) сорбитан моноолеата (Tween® 80), полиоксиэтилен (20) сорбитан моностеарата (Tween® 60), полиоксиэтилен (20) сорбитан монопальмитата (Tween® 40) или полиоксиэтилен (20) сорбитан монолаурата (Tween® 20)), полиоксиэтилен (3) лаурилового простого эфира, полиоксиэтилен (5) цетилового простого эфира, полиоксиэтилен (2) стеарилового простого эфира, полиоксиэтилен (5) стеарилового простого эфира, полиоксиэтилен (2) нонилфенилового простого эфира, полиоксиэтилен (3) нонилфенилового простого эфира, полиоксиэтилен (4) нонилфенилового простого эфира, полиоксиэтилен (3) октилфенилового простого эфира, ПЭГ-200 монолаурата, ПЭГ-200 дилаурата, ПЭГ-300 дилаурата, ПЭГ-400 дилаурата, ПЭГ-300 дистеарата, ПЭГ-300 диолеата, пропиленгликоль монолаурата, моностеарата сахарозы, дистеарата сахарозы, монолаурата сахарозы, дилаурата сахарозы, сорбитан монолаурата, сорбитан моноолеата, сорбитан монопальмитата и сорбитан стеарата. Предпочтительно, поверхностно-активное вещество выбирают из полисорбата 20, полисорбата 40, полисорбата 60, полисорбата 80, кремофора RH 40, кремофора EL, Gelucire 44/14, Gelucire 50/13, D-альфа-токоферил полиэтиленгликоль 1000 сукцината (витамина E TPGS), пропиленгликоль лаурата, лаурилсульфата натрия, или сорбитан монолаурата. Более предпочтительно, поверхностно-активное вещество выбирают из сорбитан монолаурата или D-альфа-токоферил полиэтиленгликоль 1000 сукцината.
[0041] Используемая в настоящем изобретении твердая дисперсия, предпочтительно, включает или состоит из одной фазы (определяется термодинамически), в которой соединение 1, или комбинацию соединения 1 и другого анти-ВГС агента, молекулярно диспергируют в матрице, содержащей фармацевтически приемлемый гидрофильный полимер (полимеры). В таких случаях, термический анализ твердой дисперсии с помощью дифференциальной сканирующей калориметрии (DSC) обычно демонстрирует только один пик Tg, и такая твердая дисперсия не содержит детектируемого кристаллического соединения 1 по данным рентгеновской порошковой дифракционной спектроскопии.
[0042] Твердую композицию, используемую в настоящем изобретении, можно получить различными способами, такими как, без ограничений, экструзия расплава, сушка распылением, совместное осаждение, сушка вымораживанием, или другими способами удаления растворителя, причем предпочтительны экструзия расплава и сушка распылением. Процесс экструзии расплава обычно включает стадии приготовления расплава, который включает активный ингредиент (ингредиенты), гидрофильный полимер (полимеры) и предпочтительно поверхностно-активное вещество (вещества), и затем охлаждение расплава до его отверждения. "Плавление" означает переход в жидкое или резиноподобное состояние, в котором можно один компонент внедрить, предпочтительно внедрить гомогенно, в другой компонент или компоненты. Во многих случаях, полимерный компонент (компоненты) расплавится и другие компоненты, включая активный ингредиент (ингредиенты) и поверхностно-активное вещество (вещества), растворяться в расплаве, образуя при этом раствор. Плавление обычно включает нагревание выше точки размягчения полимера (полимеров). Получение расплава можно осуществить различными способами. Смешивание компонентов можно осуществить до, во время или после образования расплава. Например, компоненты можно смешать вначале, и затем расплавить, или одновременно смешать и расплавить. Расплав также можно гомогенизировать для более эффективного диспергирования активного ингредиента (ингредиентов). Кроме того, может оказаться удобным вначале расплавить полимер (полимеры) и затем добавить его и гомогенизировать активный ингредиент (ингредиенты). В одном из примеров все материалы, за исключением поверхностно-активного вещества (веществ), смешивают и подают в экструдер, тогда как поверхностно-активное вещество (вещества) расплавляют отдельно и подают под давлением во время экструзии.
[0043] Чтобы начать процесс экструзии расплава, активный ингредиент (ингредиенты) (например, соединение 1, или комбинацию соединения 1 и по меньшей мере другого анти-ВГС агента) можно использовать в их твердых формах, таких как соответствующие им кристаллические формы. Активный ингредиент (ингредиенты) можно также использовать в виде раствора или дисперсии в подходящем жидком растворителе, таком как спирты, алифатические углеводороды, сложные эфиры и, в некоторых случаях, жидкий диоксид углерода. Растворитель можно удалить, например, испаряя его после получения расплава.
[0044] Различные добавки также можно включить в расплав, например, регуляторы текучести (например, коллоидная двуокись кремния), связующие, смазывающие вещества, наполнители, разрыхлители, пластификаторы, красители или стабилизаторы (например, антиокислители, светостабилизаторы, акцепторы радикалов и стабилизаторы против активности микроорганизмов).
[0045] Плавление и/или смешивание можно осуществлять в аппаратах, которые обычно используют для такой цели. Особенно подходящие представляют собой экструдеры или месильные машины. Подходящие экструдеры включают одношнековые экструдеры, или экструдеры со шнеками, находящимися в зацеплении, или многошнековые экструдеры, предпочтительно, двухшнековые экструдеры, которые могут быть с одинаковым направлением вращения или с вращением в противоположном направлении, и которые, необязательно, могут быть снабжены замесочными дисками. Следует понимать, что рабочие температуры будут определяться типом экструдера или типом конфигурации внутри используемого экструдера. Часть энергии, необходимой для получения расплава, смешивания и растворения компонентов в экструдере можно обеспечить нагревательными элементами. Однако, трение и сдвиг материала в экструдере также могут обеспечить достаточное количество энергии для указанной смеси и могут способствовать образованию гомогенного расплава компонентов.
[0046] Расплав может быть от тонкого до пастообразного и до вязкого. Формирование экструдата обычно осуществляют в каландре с двумя вращающимися в противоположные стороны роллерами с соответствующими друг другу углублениями на их поверхностях. Полученный экструдат можно охладить и оставить отверждаться. Такой экструдат также можно нарезать на кусочки, или до (горячая нарезка), или после отверждения (холодная нарезка).
[0047] Отвержденный экструзионный продукт можно далее размолоть, измельчить, или каким-либо другим образом уменьшить до размера гранул. Отвержденный экструдат, также как каждая полученная гранула, включает твердую дисперсию, предпочтительно, твердый раствор активного ингредиента (ингредиентов) в матрице, состоящей из гидрофильного полимера (полимеров) и необязательно фармацевтически приемлемого поверхностно-активного вещества (веществ). Если г8ранулы не содержат никаких поверхностно-активных веществ, раскрытое выше фармацевтически приемлемое поверхностно-активное вещество можно добавить и смешать с гранулами. Экструзионный продукт также можно смешать с другим активным ингредиентом (ингредиентами) и/или добавкой (добавками) перед размалыванием или измельчением в гранулы. Полученные гранулы можно в результате дальнейшей обработки превратить в подходящие твердые лекарственные формы для перорального приема.
[0048] Испарение растворителя за счет сушки распылением обеспечивает преимущество технологичности при низких температурах, при необходимости, и позволяет осуществлять модификации процесса для дальнейшего улучшения характеристик порошка. Высушенный распылением порошок можно далее формировать при необходимости, и конечную лекарственную форму можно получать в зависимости от желания в виде капсул, таблеток или любых других твердых лекарственных форм.
[0049] Примеры процессов сушки распылением и оборудования для сушки распылением раскрыты в K.Masters, SPRAY DRYING HANDBOOK (Halstead Press, New York, 4th ed., 1985). Нелимитирующие примеры устройств для сушки распылением, которые пригодны для настоящего изобретения, включают распылительные сушилки производства Niro Inc. или GEA Process Engineering Inc., Buchi Labortechnik AG, и Spray Drying Systems, Inc. Процесс сушки распылением обычно включает разрушение жидкой смеси на мелкие капельки и быстрое удаление растворителя из капелек в контейнере (аппарате для сушки распылением), в котором существует сильная движущая сила для испарения растворителя из капелек. Методика измельчения включают, например, двухпоточные форсунки или пневмораспылители, или центробежные распылители. Сильную движущую силу для испарения растворителя можно обеспечить, например, поддерживая парциальное давление растворителя в распылительной сушилке значительно ниже, чем давление паров растворителя при температуре высыхающих капелек. Это можно осуществить или (1) поддерживая давление в центробежном распылителе соответствующим частичному вакууму; или (2) осуществляя смешивание жидких капелек с теплым осушающим газом (например, нагретым азотом); или (3) и тем и другим одновременно.
[0050] Температуру и скорость потока осушающего газа, также как и конструкцию распылительной сушилки, можно выбрать таким образом, чтобы капельки были достаточно сухими к моменту, когда они достигают стенок аппарата. Это позволяет высушенным капелькам стать практически твердыми, и можно получить тонкий порошок, который не прилипает к стенкам аппарата. Такой высушенный распылением продукт можно собрать, удаляя его вручную, пневматически, механически или другими подходящими средствами. Реальный промежуток времени для достижения предпочтительного уровня сухости зависит от размеров капелек, состава композиции и работы распылительной сушилки. После отверждения твердый порошок может оставаться в камере распылительной сушилки в течение дополнительного промежутка времени (например, 5-60 секунд) для дополнительного испарения растворителя из твердого порошка. Конечное содержание растворителя в твердой дисперсии, как она существует в сушилке, находится, предпочтительно, на достаточно низком уровне, что улучшает стабильность конечного продукта. Например, содержание остаточного растворителя в высушенном распылением порошке может быть меньше чем 2% по массе. Особенно предпочтительно, если содержание остаточного растворителя находится в пределах, указанных в материалах международной конференции по гармонизации (ICH) Guidelines. Кроме того, может оказаться полезным подвергнуть высушенную распылением композицию дальнейшей сушке, чтобы уменьшить содержание остаточного растворителя до еще более низких уровней. Способы дальнейшего снижения уровней содержания растворителя включают, но ими не ограничиваются, сушку в псевдоожиженном слое, инфракрасную сушку, сушку во вращающемся барабане, вакуумную сушку и комбинации их и других процессов.
[0051] Подобно раскрытому выше твердому экструдату, высушенный распылением продукт содержит твердую дисперсию, предпочтительно твердый раствор, активного ингредиента (ингредиентов) в матрице, состоящей из гидрофильного полимера (полимеров), и необязательно фармацевтически приемлемого поверхностно-активного вещества (веществ). Если высушенный распылением продукт не содержит никаких поверхностно-активных веществ, раскрытое выше фармацевтически приемлемое поверхностно-активное вещество можно добавить и смешать с высушенным распылением продуктом перед дальнейшей обработкой.
[0052] Перед подачей в распылительную сушилку активный ингредиент (ингредиенты) (например, соединение 1, или комбинацию соединения 1 и по меньшей мере другого анти-ВГС агента), гидрофильный полимер (полимеры), также как другие необязательные активные ингредиенты или эксципиенты, такие как фармацевтически приемлемое поверхностно-активное вещество (вещества), можно растворить в растворителе. Подходящие растворители включают, но ими не ограничиваются, алканолы (например, метанол, этанол, 1-пропанол, 2-пропанол или их смеси), ацетон, смеси ацетон/вода, алканол/вода (например, смеси этанол/вода) или их комбинации. Раствор также можно предварительно нагреть перед тем, как его подадут в распылительную сушилку.
[0053] Твердую дисперсию, полученную экструзией из расплава, сушкой распылением или другими способами можно получить в любых подходящих твердых лекарственных формах для перорального приема. В одном варианте, твердую дисперсию, полученную экструзией из расплава, сушкой распылением или другими способами можно спрессовать в виде таблеток. Полученную твердую дисперсию можно или непосредственно спрессовать, или размолоть или измельчить до гранул или порошков перед прессованием. Прессование можно осуществить в прессах для таблетирования, в таких как, стальной штамп между двумя пуансонами. Если твердая композиция настоящего изобретения включает соединение 1 и другой анти-ВГС агент, можно отдельно получить твердые дисперсии с каждым индивидуальным активным ингредиентом и затем смешать необязательно размолотую или измельченную твердую дисперсию перед компактированием. Соединение 1 и другой активный ингредиент (ингредиенты) также можно получить в той же самой твердой дисперсии, необязательно измельченной и/или смешанной с другими добавками, и затем прессовать в таблетки.
[0054] По меньшей мере одну добавку, выбранную из регуляторов текучести, связующих, смазывающих веществ, наполнителей, разрыхлителей или пластификаторов можно использовать при прессовании полученной твердой дисперсии. Такие добавки можно смешать с измельченной или размолотой твердой дисперсией перед компактированием. Различные другие добавки также можно использовать при получении твердой композиции настоящего изобретения, например красители, такие как азокрасители, органические или неорганические пигменты, такие как оксид алюминия или диоксид титана, или красители природного происхождения; стабилизаторы, такие как антиокислители, светостабилизаторы, акцепторы радикалов, стабилизаторы против активности микроорганизмов.
[0055] В любом аспекте, варианте и примере, раскрытом в описании, соединение 1 (или его фармацевтически приемлемую соль) можно вводить ВГС пациенту в комбинации с другим анти-ВГС агентом. Предпочтительно, такое лечение не включает использование интерферона на протяжении режима лечения. Режим лечения может длиться, например и без ограничений, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9 или 8 недель. Предпочтительно, режим лечения длится, например, и без ограничений, 12 недель. Режим лечения может также длиться меньше, чем 12 недель, например 11, 10, 9 или 8 недель.
[0056] Подходящие анти-ВГС агенты, которые можно комбинировать с соединением 1 (или его фармацевтически приемлемой солью) включают, но ими не ограничиваются, ингибиторы ВГС полимеразы (например, ингибиторы нуклеозид полимеразы или ингибиторы не-нуклеозид полимеразы), ингибиторы ВГС протеазы, ингибиторы ВГС геликазы, другие ингибиторы ВГС NS5A, ингибиторы проникновения ВГС, ингибиторы циклофилина, ингибиторы CD81, ингибиторы участка внутренней посадки рибосомы, или любые их комбинации. Например, указанный другой анти-ВГС агент может быть ингибитором ВГС полимеразы. В качестве другого примера, указанный другой анти-ВГС агент может быть ингибитором ВГС протеазы.
[0057] Указанный другой анти-ВГС агент может также включать два или более ВГС ингибитора. Например, анти-ВГС агент может быть комбинацией ингибитора ВГС полимеразы и ингибитора ВГС протеазы. В других случаях, указанный другой анти-ВГС агент может быть комбинацией двух различных ингибиторов ВГС протеазы. В другом случае указанный другой анти-ВГС агент может быть комбинацией двух различных ингибиторов ВГС полимеразы (например, один представляет собой ингибитор нуклеозид или нуклеотид полимеразы, и другой представляет собой ингибитор не-нуклеозид полимеразы; или оба представляют собой ингибиторы нуклеозид или нуклеотид полимеразы; или оба представляют собой ингибиторы не-нуклеозид полимеразы). В еще одном примере указанный другой анти-ВГС агент может быть комбинацией другого ингибитора ВГС NS5A и ингибитора полимеразы ВГС. В еще одном примере указанный другой анти-ВГС агент может быть комбинацией другого ингибитора ВГС NS5A и ингибитора ВГС протеазы. В еще одном варианте, указанный другой анти-ВГС агент может быть комбинацией двух других ингибиторов ВГС NS5A.
[0058] Конкретные примеры анти-ВГС агентов, которые подходят для комбинирования с соединением 1 (или его фармацевтически приемлемой солью) в любом аспекте, варианте или примере, раскрытом в описании, включают, но ими не ограничиваются, PSI-7977 (Pharmasset/Gilead), PSI-7851 (Pharmasset/Gilead), PSI-938 (Pharmasset/Gilead), PF-00868554, ANA-598, IDX184, IDX102, IDX375, GS-9190, VCH-759, VCH-916, MK-3281, BCX-4678, MK-3281, VBY708, ANA598, GL59728, GL60667, BMS-790052, BMS-791325, BMS-650032, BMS-824393, GS-9132, ACH-1095, AP-H005, A-831 (Arrow Therapeutics), A-689 (Arrow Therapeutics), INX08189 (Inhibitex), AZD2836, телапревир, боцепревир, ITMN-191 (Intermune/Roche), BI-201335, VBY-376, VX-500 (Vertex), PHX-B, ACH-1625, IDX136, IDX316, VX-813 (Vertex), SCH 900518 (Schering-Plough), TMC-435 (Tibotec), ITMN-191 (Intermune, Roche), MK-7009 (Merck), IDX-PI (Novartis), BI-201335 (Boehringer Ingelheim), R7128 (Roche), MK-3281 (Merck), MK-0608 (Merck), PF-868554 (Pfizer), PF-4878691 (Pfizer), IDX-184 (Novartis), IDX-375, PPI-461 (Presidio), BILB-1941 (Boehringer Ingelheim), GS-9190 (Gilead), BMS-790052 (BMS), CTS-1027 (Conatus), GS-9620 (Gilead), PF-4878691 (Pfizer), RO5303253 (Roche), ALS-2200 (Alios BioPharma/Vertex), ALS-2158 (Alios BioPharma/Vertex), GSK62336805 (Glaxo SmithKline), или любые их комбинации.
[0059] Нелимитирующие примеры ингибиторов ВГС протеазы, которые пригодны для создания композиций с соединением 1 (или его фармацевтически приемлемой солью) в любом аспекте, варианте или примере, раскрытом в описании, включают ACH-1095 (Achillion), ACH-1625 (Achillion), ACH-2684 (Achillion), AVL-181 (Avila), AVL-192 (Avila), BI-201335 (Boehringer Ingelheim), BMS-650032 (BMS), боцепревир, данопревир, GS-9132 (Gilead), GS-9256 (Gilead), GS-9451 (Gilead), IDX-136 (Idenix), IDX-316 (Idenix), IDX-320 (Idenix), MK-5172 (Merck), нарлапревир, PHX-1766 (Phenomix), телапревир, TMC-435 (Tibotec), ванепревир, VBY708 (Virobay), VX-500 (Vertex), VX-813 (Vertex), VX-985 (Vertex), или любые их комбинации. Нелимитирующие примеры ингибиторов ВГС полимеразы, которые пригодны для создания композиций с соединением 1 (или его фармацевтически приемлемой солью) в любом аспекте, варианте или примере, раскрытом в описании, включают ANA-598 (Anadys), BI-207127 (Boehringer Ingelheim), BILB-1941 (Boehringer Ingelheim), BMS-791325 (BMS), filibuvir, GL59728 (Glaxo), GL60667 (Glaxo), GS-9669 (Gilead), IDX-375 (Idenix), MK-3281 (Merck), тегобувир, TMC-647055 (Tibotec), VCH-759 (Vertex & ViraChem), VCH-916 (ViraChem), VX-222 (VCH-222) (Vertex & ViraChem), VX-759 (Vertex), GS-6620 (Gilead), IDX-102 (Idenix), IDX-184 (Idenix), INX-189 (Inhibitex), MK-0608 (Merck), PSI-7977 (Pharmasset/Gilead), PSI-938 (Pharmasset/Gilead), RG7128 (Roche), TMC64912 (Medivir), GSK625433 (GlaxoSmithKline), BCX-4678 (BioCryst), ALS-2200 (Alios BioPharma/Vertex), ALS-2158 (Alios BioPharma/Vertex), или любые их комбинации. Ингибиторами полимеразы могут быть ингибиторы нуклеотид полимеразы, такие как GS-6620 (Gilead), IDX-102 (Idenix), IDX-184 (Idenix), INX-189 (Inhibitex), MK-0608 (Merck), PSI-7977 (Pharmasset/Gilead), PSI-938 (Pharmasset/Gilead), RG7128 (Roche), TMC64912 (Medivir), ALS-2200 (Alios BioPharma/Vertex), ALS-2158 (Alios BioPharma/Vertex), или любые их комбинации. Ингибиторами полимеразы могут также быть ингибиторы не-нуклеозид полимеразы, такие как ANA-598 (Anadys), BI-207127 (Boehringer Ingelheim), BILB-1941 (Boehringer Ingelheim), BMS-791325 (BMS), филибувир, GL59728 (Glaxo), GL60667 (Glaxo), GS-9669 (Gilead), IDX-375 (Idenix), MK-3281 (Merck), тегобувир, TMC-647055 (Tibotec), VCH-759 (Vertex & ViraChem), VCH-916 (ViraChem), VX-222 (VCH-222) (Vertex & ViraChem), VX-759 (Vertex), или любые их комбинации. Нелимитирующие примеры ингибиторов NS5A, которые пригодны для создания композиций с соединением 1 (или его фармацевтически приемлемой солью) в любом аспекте, варианте или примере, раскрытом в описании, включают GSK62336805 (GlaxoSmithKline), ACH-2928 (Achillion), ACH-3102 (Achillion), AZD2836 (Astra-Zeneca), AZD7295 (Astra-Zeneca), BMS-790052 (BMS), BMS-824393 (BMS), EDP-239 (Enanta/Novartis), GS-5885 (Gilead), IDX-719 (Idenix), MK-8742 (Merck), PPI-1301 (Presidio), PPI-461 (Presidio), или любые их комбинации. Нелимитирующие примеры циклофилиновых ингибиторов, которые пригодны для создания композиций с соединением 1 (или его фармацевтически приемлемой солью) в любом аспекте, варианте или примере, раскрытом в описании, включают алиспоровир (Novartis & Debiopharm), NM-81 1 (Novartis), SCY-635 (Scynexis), или любые их комбинации. Нелимитирующие примеры ингибиторов вхождения ВГС, которые пригодны для создания композиций с соединением 1 (или с его фармацевтически приемлемой солью) в любом аспекте, варианте или примере, раскрытом в описании, включают ITX-4520 (iTherx), ITX-5061 (iTherx), или их комбинации.
[0060] В любом аспекте, варианте или примере, раскрытом в описании, соединение 1 (или его фармацевтически приемлемую соль) можно вводить, например, и без ограничений, одновременно с указанным другим анти-ВГС агентом. Соединение 1 (или его фармацевтически приемлемую соль) также можно вводить, например, и без ограничений, с указанным другим анти-ВГС агентом. Например, соединение 1 (или его фармацевтически приемлемую соль) можно вводить немедленно до или после введения указанного другого анти-ВГС агента. Частота введения может быть такой же или может отличаться. Например, соединение 1 (или его фармацевтически приемлемую соль) и указанный другой анти-ВГС агент можно вводить один раз в день. В другом примере соединение 1 (или его фармацевтически приемлемую соль) можно вводить один раз в день, и указанный другой анти-ВГС агент можно вводить два раза в день.
[0061] В любом аспекте, варианте или примере, раскрытом в описании, соединение 1 (или его фармацевтически приемлемую соль) можно совместно приготовить с указанным другим анти-ВГС агентом в единой лекарственной форме. Нелимитирующие примеры подходящих лекарственных форм включают жидкие или твердые лекарственные формы. Предпочтительно, чтобы лекарственная форма представляла собой твердую лекарственную форму. Более предпочтительно, чтобы лекарственная форма представляла собой твердую лекарственную форму, в которой соединение 1 (или его фармацевтически приемлемая соль) находится в аморфной форме, или наиболее предпочтительно, молекулярно диспергирована в матрице, которая включает фармацевтически приемлемый водорастворимый полимер и фармацевтически приемлемое поверхностно-активное вещество. Указанный другой анти-ВГС агент также может быть в аморфной форме, или может быть молекулярно диспергирован в той же самой матрице или в отличающейся матрице, которая включает фармацевтически приемлемый водорастворимый полимер и фармацевтически приемлемое поверхностно-активное вещество. Указанный другой анти-ВГС агент также можно приготовить в различной форме (формах) (например, в кристаллической форме).
[0062] В качестве нелимитирующей альтернативы, соединение 1 (или его фармацевтически приемлемую соль) и указанный другой анти-ВГС агент можно приготовить в различных лекарственных формах. Например, соединение 1 (или его фармацевтически приемлемую соль) и указанный другой анти-ВГС агент можно приготовить в различных соответствующих твердых лекарственных формах.
[0063] В любом аспекте, варианте или примере, раскрытом в описании, соединение 1 или его фармацевтически приемлемые соли можно вводить в подходящих количествах, таких как, например, в дозах от около 0,1 мг/кг до около 200 мг/кг массы тела, или от около 0,25 мг/кг до около 100 мг/кг, или от около 0,3 мг/кг до около 30 мг/кг. В качестве другого нелимитирующего примера соединение 1 (или его фармацевтически приемлемую соль) можно вводить в количестве полной дневной дозы от около 5 мг до около 300 мг, или от около 25 мг до около 200 мг, или от около 25 мг до около 50 мг или в любых количествах между указанными значениями. Составы однократной дозы могут содержать такие количества или их дольные единицы, чтобы составлять дневную дозу.
[0064] Следует понимать, однако, что специфический уровень доз для каждого конкретного пациента будет зависеть от различных факторов, включая активность конкретно используемого соединения, возраст пациента, массу тела, общее состояние здоровья, секс, питание, время введения, способ введения, скорость выведения, комбинацию лекарственных средств и тяжесть подлежащего лечению заболевания. Следует также понимать, что полную дневную дозу соединений и композиций, подлежащих введению, должен определять лечащий врач на основании объема своих медицинских знаний.
[0065] В следующей таблице перечислены нелимитирующие примеры комбинаций соединения 1 (или его фармацевтически приемлемой соли) и другого анти-ВГС агента, которые можно использовать в любом аспекте, варианте или примере, раскрытом в описании. В каждом случае применения соединение 1 (или его фармацевтически приемлемую соль) и указанный другой анти-ВГС агент можно вводить ВГС пациенту ежедневно. Каждый случай применения может быть без интерферона. В каждую схему может быть включено введение рибавирина. Однако настоящее изобретение предполагает, что каждая схема лечения может обходиться как без интерферона, так и без рибавирина. Кроме того, при необходимости интерферон и/или рибавирин могут быть включены в каждую схему лечения. Каждая схема лечения может также необязательно включать введение пациенту одного или более из других анти-ВГС агентов. Длительность каждой схемы лечения может составлять, например и без ограничений, 8-48 недель, в зависимости от реакции пациента. В любой конкретной схеме лечения, представленной в таблице 1, лекарственные средства можно, например и без ограничений, совместно приготовить в одной твердой лекарственной форме. Например, все лекарственные средства, используемые в схемах лечения, можно совместно приготовить в аморфных формах или молекулярно диспергировать в матрице, включающей фармацевтически приемлемый водорастворимый полимер и необязательно фармацевтически приемлемое поверхностно-активное вещество; в другом случае соединение 1 приготавливают в аморфной форме или молекулярно диспергируют в матрице, включающей фармацевтически приемлемый водорастворимый полимер и необязательно фармацевтически приемлемое поверхностно-активное вещество, и другое лекарственное средство находится в кристаллической форме (формах) и скомбинировано с аморфным соединением 1 в одной твердой лекарственной форме. В качестве еще одного варианта, соединение 1 приготавливают в лекарственной форме, отличающейся от формы другого лекарственного средства.

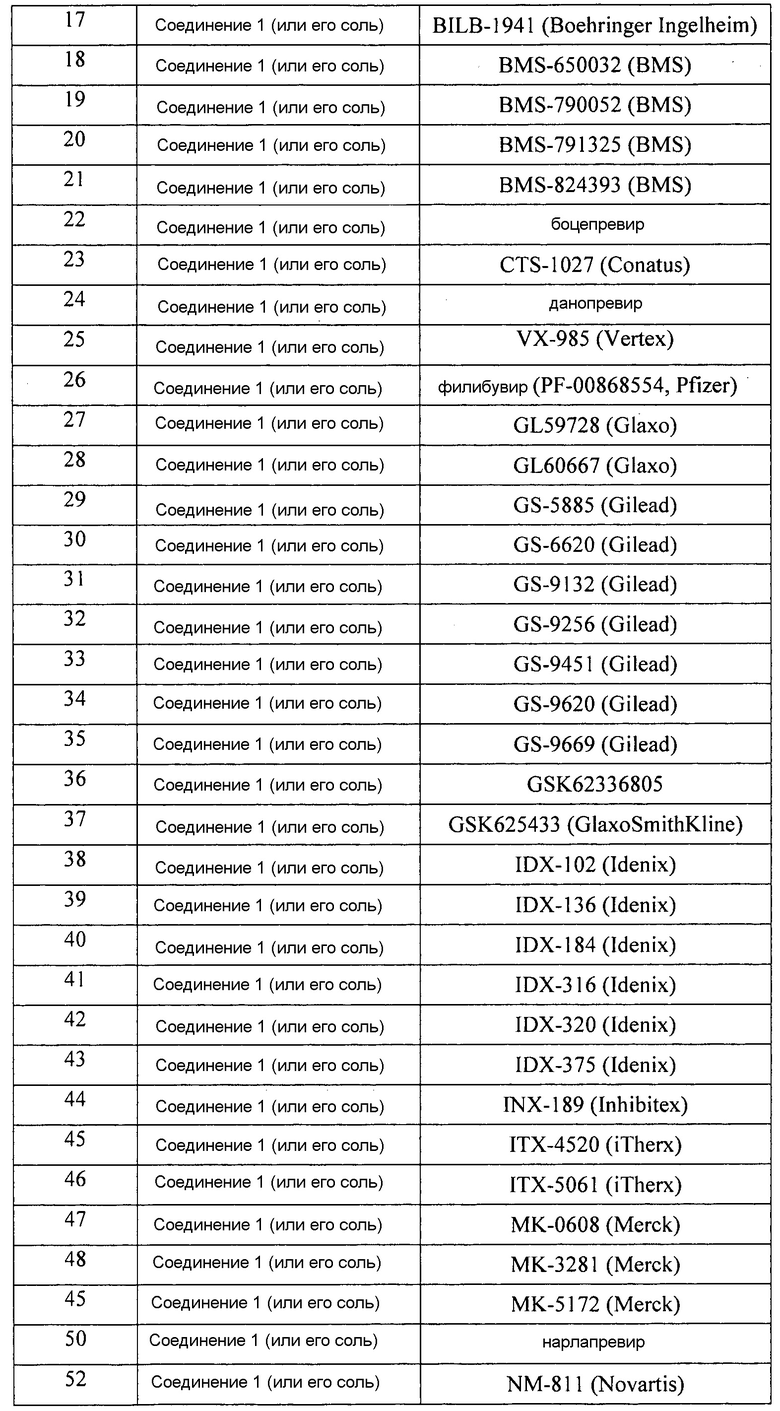
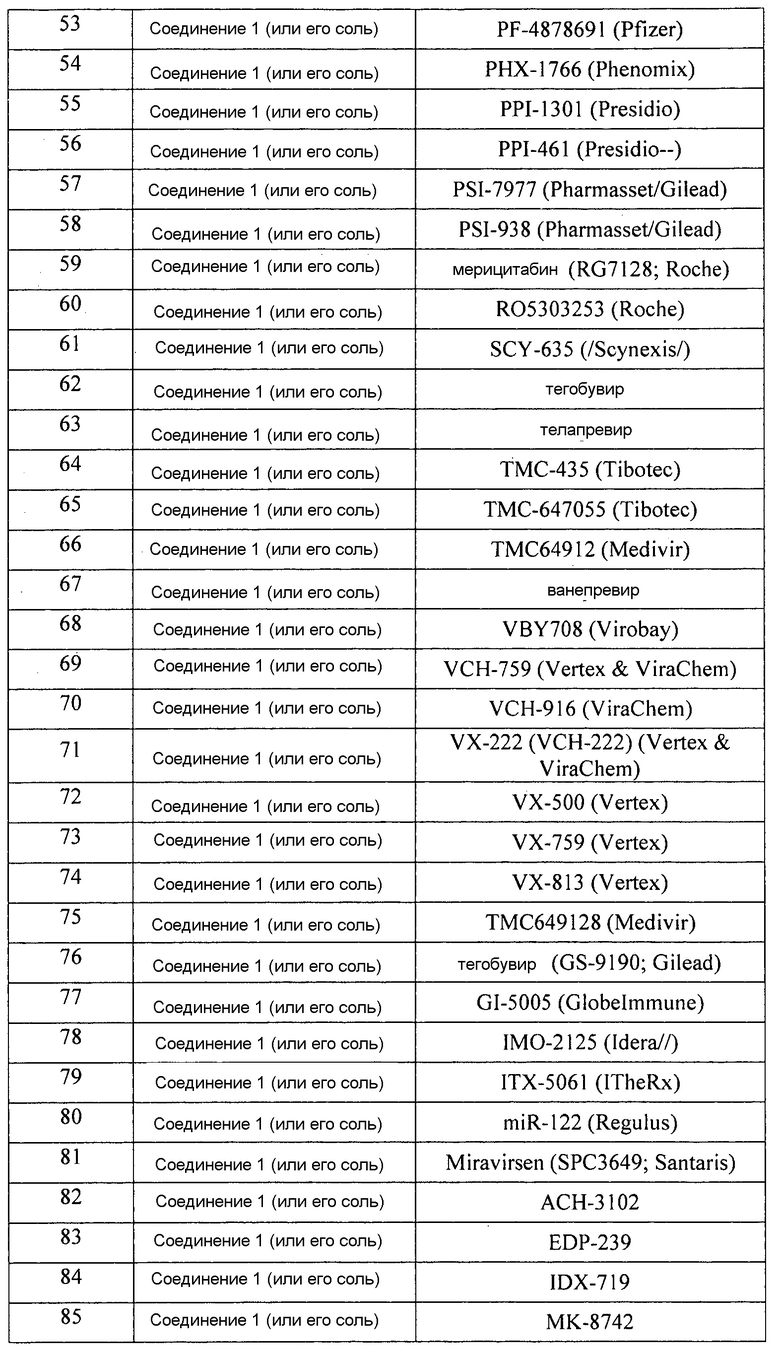
[0066] Следует понимать, что вышеперечисленные варианты и следующие примеры представлены только в качестве иллюстраций, но не ограничений. Различные изменения и модификации в объеме настоящего изобретения будут очевидны специалистам в данной области из представленного описания.
Пример 1. Противовирусная активность соединения 1 в анализах клеточной культуры репликона ВГС
[0067] Ингибирующие активности соединения 1 можно оценить, используя следующий протокол. Две клеточные линии стабильного субгеномного репликона генотипа 1 можно использовать для характеризации соединений в клеточной культуре: одну получают из генотипа la-H77, и другую получают из генотипа lb-Conl. Конструкции репликонов могут быть бицистронными субгеномными репликонами. Конструкция репликона генотипа la содержит NS3-NS5B кодирующий участок, полученный из H77 штамма ВГС (1a-H77). Указанный репликон также содержит репортер люциферазы светлячков и (Neo) селектируемый маркер неомицин фосфотрансферазы. Указанные два кодирующих участка, разделенные FMDV 2a протеазой, включают вначале цистрон бицистронной конструкции репликона, со вторым цистроном, содержащим NS3-NS5B кодирующий участок, с добавлением адаптивных мутаций E1202G, K1691R, K2040R и S2204I. lb-Conl, конструкция репликона идентична конструкции la-H77 репликона, за исключением того, что ВГС 5'UTR, 3'UTR, и NS3-NS5B кодирующие участки, получены из lb-Conl штамма, и адаптивные мутации представляют собой K1609E, K1846T и Y3005C. Кроме того, lb-Conl конструкция репликона содержит полиовирус IRES между IRES ВГС и геномом люциферазы. Клеточную линию репликона можно поддерживать в Дюльбекко модифицированной среде Игла (DMEM), содержащей 10% (об/об) фетальной телячьей сыворотки (FBS), 100 иммунизующих ед./мл пенициллина, 100 мг/мл стрептомицина (Invitrogen), и 200 мг/мл G418 (Invitrogen). Ингибирующие эффекты соединения 1 в отношении ВГС репликации можно определить, измеряя активность репортера люциферазы. Например, репликон-содержащие клетки можно высевать в 96-луночные планшеты при плотности 5000 клеток на лунку в 100 мкл DMEM, содержащую 5% FBS. На следующий день соединение 1 можно разбавить диметилсульфоксидом (ДМСО), получая 200 x исходный раствор в восьми сериях полулогарифмических разбавлений. Затем полученные серии разбавлений можно разбавить далее 100-кратно в среде, содержащей 5% FBS. Среду с ингибитором добавляют в планшеты с клеточной культурой, выдержанной в течение ночи, уже содержащей 100 мкл DMEM с 5% FBS. Полученные клетки можно инкубировать в течение трех дней в инкубаторах для тканевых культур, после чего в каждую лунку добавляют 30 мкл пассивного лизисного буфера (Promega), и затем планшеты инкубируют в течение 30-45 минут со встряхиванием для лизиса клеток. В каждую лунку добавляют раствор люциферина (100 мкл, Promega), и активность люциферазы можно измерить, используя люминометр Victor II (Perkin-Elmer). Процент ингибирования репликации РНК ВГС можно рассчитать для каждой концентрации соединения, и рассчитать значение EC50, используя кривую нелинейной регрессии, удовлетворяющую 4-параметрическому логистическому уравнению, и программное обеспечение GraphPad Prism 4.
[0068] Способность соединения 1 ингибировать NS5A из ВГС не-генотипа 1 можно оценить следующим образом. Создают число стабильных клеточных линий субгенома lb-Conl репликона, содержащих часть NS5A из генотипов 2a, 2b, 3a, 4a, 5a или 6a ВГС. Конструкция репликона содержит Notl рестрикционный сайт в прямом направлении от NS5A, и Blpl рестрикционный сайт сразу после NS5A аминокислоты 214. Выделяют РНК ВГС от инфицированных субъектов (см. Middleton et al., J VlROL METHODS 145: 137-145 (2007), и Tripathi et al, ANTIVIRAL RES 73:40-49 (2007)), и RT-PCR осуществляют на РНК для создания ДНК фрагмента, кодирующего ВГС NS5A аминокислоты 1-214. Полученный PCR фрагмент включает Notl и Blpl совместимые концы, и указанный фрагмент лигируют в плазмиду, содержащую b-Conl репликон. Стабильные клеточные линии, содержащие указанные химерические репликоны создают путем введения указанных конструкций в Huh-7 клетки. Ингибирующий эффект соединения 1 в отношении ВГС репликации в указанных репликонах можно определить, измеряя активность репортерного гена люциферазы, как раскрыто выше.
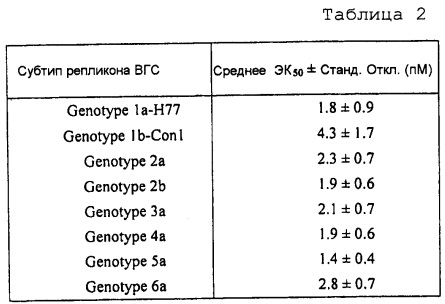
[0069] Используя вышеописанный анализ или аналогичные анализы репликонов на основе клеточных линий, показано, что соединение 1 демонстрирует значительные ингибирующие активности против репликации репликонов ВГС с NS5A из генотипов 1-6 (Таблица 2).
Пример 2. Противовирусная эффективность соединения 1 против ВГС не-генотипа 1 дикого типа и вариантов по сравнению с другими ингибиторами ВГС NS5A
[0070] Соединение 1 тестируют против мутантов, устойчивых в отношении других NS5A ингибиторов, включая сравнительное соединение, представленное в таблице 3. В lb-Conl теневом генотипе были сконструированы временно реплицирующие химерические репликоны, содержащие NS5A из генотипов 2-6 диких типов или репликоны, содержащей варианты внутри NS5A. Указанные репликоны также содержат репортерный ген светлячковой люциферазы. Варианты вводят путем сайт-направленного мутагенеза, используя набор для сайт-направленного мутагенеза множественных мутаций (Change-IT Multiple Mutation Site Directed Mutagenesis Kit (USB). Затем мутагенез подтверждают, используя анализ последовательностей, плазмиды линеаризируют морским рестрикционным ферментом. Транскрипционный набор с высоким выходом (Transcript Aid T7 High Yield (Fermentas)) используют для транскрибирования субгеномной РНК ВГС из плазмид. РНК транскрибируют путем электропорации в клеточную линию Huh-7, полученную как раскрыто выше (см. Middleton et al. и Tripathi et al., supra) за исключением того, что 3×106 клеток электропорируют с 15 мкг матричной РНК, и 96-луночные планшеты засевают 7,5×103 клеток на лунку. Через четыре часа после трансфектирования лунки с одного планшета собирают для измерения люциферазы. Этот планшет предоставляет данные о количестве транслируемого вклада РНК, и следовательно, об эффективности трансфекции. В лунки оставшихся планшетов добавляют, серии полу-логарифмических разбавлений тестируемого соединения в культуральной среде (0,5% ДМСО, конечная концентрация), и планшеты инкубируют при 37°C, 5% CO2 во влажной камере в течение 4 дней. После указанного периода среду удаляют, и планшеты промывают физиологическим раствором с фосфатным буфером по 100 мкл на лунку. Раствор люциферина (50 мкл, Promega) добавляют в каждую лунку, и люциферазную активность измеряют с помощью люминометра Victor II (Perkin-Elmer). Процент ингибирования репликации РНК ВГС рассчитывают для каждой концентрации соединения, величину EC50 рассчитывают, используя кривую нелинейной регрессии согласующуюся с 4-параметрическим логистическим уравнением, и программное обеспечению GraphPad Prism 4.
[0071] Используя вышеописанные анализы или аналогичные анализы репликонов в клеточной культуре, показано, что соединение 1 обладает значительной ингибирующей активностью против репликации репликонов ВГС, содержащих не-генотип 1 дикого типа NS5A, также как NS5A с устойчивыми вариантами (Таблица 3).
[0072] Изложенное выше описание настоящего изобретения представляет иллюстрацию и описание, но оно не предназначено для того, чтобы исчерпать или ограничить настоящее изобретение только тем, что конкретно раскрыто. Модификации и варианты возможны в свете раскрытых выше способов, или их можно почерпнуть из практики настоящего изобретения. Таким образом, следует понимать, что объем настоящего изобретения определяется пунктами формулы изобретения и их эквивалентами.
Группа изобретений относится к медицине и предназначена для лечения вируса гепатита С. Используют пан-генотипические ингибиторы ВГС, в частности метил {(2S,3R)-1-[(2S)-2-{5-[(2R,5R)-1-{3,5-дифтор-4-[4-(4-фторфенил)пиперидин-1-ил]фенил}-5-(6-фтор-2-{(2S)-1-N-(метоксикарбонил)-O-метил-L-треонил]пирролидин-2-ил}-1H-бензимидазол-5-ил)пирролидин-2-ил)-6-фтор-1H-бензимидазол-2-ил}пирролидин-1-ил]-3-метокси-1-оксобутан-2-ил}карбамат совместно с ингибитором протеазы HCV или полимеразы HCV. При этом пациента не генотипируют для указанного лечения, лечение длится не менее 24 недель и не включает введения интерферона. Группа изобретений позволяет повысить эффективность лечения. 2 н. и 11 з.п. ф-лы, 3 табл., 2 пр.
1. Способ лечения вируса гепатита С (HCV), включающий введение эффективного количества метил {(2S,3R)-1-[(2S)-2-{5-[(2R,5R)-1-{3,5-дифтор-4-[4-(4-фторфенил)пиперидин-1-ил]фенил}-5-(6-фтор-2-{(2S)-1-N-(метоксикарбонил)-O-метил-L-треонил]пирролидин-2-ил}-1H-бензимидазол-5-ил)пирролидин-2-ил)-6-фтор-1H-бензимидазол-2-ил}пирролидин-1-ил]-3-метокси-1-оксобутан-2-ил}карбамата (соединение 1) или его фармацевтически приемлемой соли HCV пациенту, где указанного пациента не генотипируют для указанного лечения и указанное соединение 1 вводится совместно с ингибитором протеазы HCV или ингибитором полимеразы HCV и где указанное лечение длится менее 24 недель и не включает введение интерферона указанному пациенту.
2. Способ по п.1, где указанный пациент инфицирован HCV генотипа 1, 2, 3, 4, 5 или 6.
3. Способ по п.1, где указанный пациент инфицирован HCV генотипа 2.
4. Способ по п.1, где указанный пациент инфицирован HCV генотипа 3.
5. Способ по п.1, где указанный пациент инфицирован HCV генотипа 4.
6. Способ по п.1, где указанный пациент инфицирован HCV генотипа 5.
7. Способ по п.1, где указанный пациент инфицирован HCV генотипа 6.
8. Способ по любому одному из пп.1-7, где указанное соединение 1 или его соль вводят совместно с другим анти-HCV агентом.
9. Способ по п.1, где указанное соединение 1 вводят совместно с ингибитором протеазы HCV и ингибитором полимеразы HCV.
10. Способ по п.1, где указанное лечение длится не больше чем 12 недель и не включает введения интерферона указанному пациенту.
11. Способ по п.1, где указанное соединение 1 вводят совместно с ингибитором протеазы HCV или с комбинацией ингибитора протеазы HCV и ингибитора полимеразы HCV и где указанное лечение длится меньше чем 24 недели и не включает введения интерферона указанному пациенту.
12. Способ по п.1, где указанное соединение 1 вводят совместно с ингибитором протеазы HCV или с комбинацией ингибитора протеазы HCV и ингибитора полимеразы HCV и где указанное лечение длится не больше чем 12 недель и не включает введения интерферона указанному пациенту.
13. Способ лечения инфекции, вызванной вирусом гепатита С (HCV), включающий введение эффективного количества метил {(2S,3R)-1-[(2S)-2-{5-[(2R,5R)-1-{3,5-дифтор-4-[4-(4-фторфенил)пиперидин-1-ил]фенил}-5-(6-фтор-2-{(2S)-1-N-(метоксикарбонил)-O-метил-L-треонил]пирролидин-2-ил}-1H-бензимидазол-5-ил)пирролидин-2-ил)-6-фтор-1H-бензимидазол-2-ил}пирролидин-1-ил]-3-метокси-1-оксобутан-2-ил}карбамата (соединение 1) или его фармацевтически приемлемой соли пациенту с HCV, где указанный пациент не генотипирован для указанного лечения и указанное соединение 1 вводится совместно с ингибитором протеазы HCV или ингибитором полимеразы HCV, где указанное лечение длится менее 24 недель и не включает введение интерферона указанному пациенту и где указанный пациент инфицирован HCV генотипа 1, 2, 3, 4, 5 или 6.
| US 2012004196 A1, 05.01.2012 | |||
| Клапанное парораспределение для паровозов | 1924 |
|
SU2318A1 |
| ГРИГОРЬЕВ П.Я | |||
| и др | |||
| Справочное руководство по гастроэнтерологии | |||
| Москва, МИА-2003, с | |||
| Кулиса для фотографических трансформаторов и увеличительных аппаратов | 1921 |
|
SU213A1 |
| TRAHTENHERTS A et al, Inhibition of hepatitis C virus RNA replicons by peptide aptamers., Antiviral Res | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Регулятор давления для автоматических тормозов с сжатым воздухом | 1921 |
|
SU195A1 |
Авторы
Даты
2018-08-29—Публикация
2013-09-17—Подача