ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к оптически чистому (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диону, или к его соли, а также относится к фармацевтическому средству, включающему его в свой состав в качестве активного ингредиента, который характеризуется наличием ингибирующего действия по отношению к ферменту, расщепляющему фактор-альфа некроза опухоли (ФНО-альфа) (ТАСЕ).
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
ФНО-альфа представляет собой один из цитокинов, секретируемых макрофагами, моноцитами и т. п., которые активируются экзогенными и эндогенными факторами. ФНО-альфа принимает активное участие в промотировании секреции различных цитокинов и в защите от инфекций. Тем не менее, устойчивое и избыточное продуцирование и секреции ФНО-альфа является причиной перепроизводства воспалительных цитокинов, апоптоза клеток и нарушения при передаче внутриклеточных сигналов и т. п., в результате чего возникали первичные и вторичные повреждения тканей, и что в конечном итоге становится фактором, ответственным за этиологию и обострение различных заболеваний (см. Непатентную Литературу 1). Таким образом, в целях лечения патологического состояния, которое, как полагают, может быть вызвано избыточным продуцированием и секрецией ФНО-альфа, является важным подавление продуцирования и секреции ФНО-альфа или подавление действия ФНО-альфа.
Примерами подобных заболеваний, в которых участвует ФНО-альфа, являются ревматоидный артрит, системная красная волчанка (СКВ), болезни Крона, болезнь Бехчета, множественный склероз, атеросклероз, миастения, сахарный диабет, сепсис, острые инфекционные заболевания, астма, атопический дерматит, контактный дерматит, псориаз, акне, лихорадка, анемия и тому подобные.
Фермент, расщепляющий фактор некроза опухоли-альфа (ТАСЕ) (также называемый ADAM 17), который по классификации относится к семейству ADAM (дезинтегрин и металлопротеиназа), представляет собой мембраносвязанную протеиназу, включающую цинк в структуру ее каталитического сайта, и таким образом, ТАСЕ продуцирует растворимый ФНО-альфа путем отщепления связанного с мембраной ФНО-альфа (про-ФНО-альфа). Таким образом, соединения, которые ингибируют действие фермента ТАСЕ вероятнее всего подавляют образование растворимого ФНО-альфа, таким образом, служат в качестве терапевтического агента для выше описываемых различных условий заболеваний, вызываемых действием ФНО-альфа. Основываясь на этом, активно проводятся исследования соединений, характеризующихся ингибирующим действием по отношению к ТАСЕ (см. Непатентную Литературу 2 и 3).
С другой стороны, матричная металлопротеиназа (также называемая матриксин) (ММП) представляет собой протеиназу, включающую цинк в структуру ее каталитического сайта и характеризуется способностью разложения внеклеточного матрикса. Известно приблизительно 20 подтипов ММП.
Соединение, которое ингибирует некоторые виды ММП, согласно сообщениям, также ингибирует продуцирование ФНО-альфа (см. Непатентную Литературу 4). Кроме того, поскольку ТАСЕ и ММП представляют собой ферменты, включающие цинк в структуру их каталитического сайта, а также характеризуются сходной трехмерной структурой, также сообщается о соединениях, которые ингибируют действие как ММП, так и ТАСЕ (см. Непатентную Литературу5). Тем не менее, согласно сообщениям, крысы, которым непрерывно вводят агент, который ингибирует действие многих видов ММП, в то же время страдают гипертрофической дегенерацией хрящевых пластин роста (см. Непатентную Литературу 6), и согласно наблюдениям, у мышей с заблокированным геном МТ1-MMП (MMП-14) проявляются симптомы артрита (см. Непатентную Литературу 7). Существуют опасения в отношении различных побочных эффектов, которые имеют место вследствие ингибирования ММП исходя из данных представленных сообщений. Кроме того, поскольку большая часть ММП задействуется при поддержании и гомеостазе внеклеточной матрицы, которая образует основную структуру живого тела, неизбирательное ингибирование каталитической активности многих видов ММП может вызывать серьезные побочные эффекты в живом организме. Таким образом, является предпочтительным, чтобы соединение, направленное на ингибирование продуцирования ФНО-альфа, основанное на ингибировании TACE, по существу не характеризовалось ингибирующим действием в отношении ММП.
В Патентной литературе 1, Непатентной Литературе 8 и Непатентной Литературе 9 содержатся отчеты о соединениях, которые селективно ингибируют TACE. Кроме того, в Патентной литературе 2-10 содержатся отчеты о соединениях-ингибиторах ТАСЕ, характеризующихся гидантоиновой структурой.
Список библиографических ссылок
Патентная Литература
[Патентная Литература 1] WO 03/022801 пояснительная записка
[Патентная Литература 2] WO 10/054278 пояснительная записка
[Патентная Литература 3] WO 10/036640 пояснительная записка
[Патентная Литература 4] WO 07/084455 пояснительная записка
[Патентная Литература 5] WO 07/084415 пояснительная записка
[Патентная Литература 6] WO 06/019768 пояснительная записка
[Патентная Литература 7] WO 05/085232 пояснительная записка
[Патентная Литература 8] WO 04/024721 пояснительная записка
[Патентная Литература 9] WO 04/033632 пояснительная записка
[Патентная Литература 10] WO 04/108086 пояснительная записка
Непатентная литература
[Непатентная Литература 1] статья авторов Aggarwall B.B., Puri R.K., eds. 1995. Human Cytokines: Their Role in W7059 Disease and Therapy. Издательство Cambridge, Mass, USA: Blackwell Sci.
[Непатентная Литература 2] статья авторов Nelson, F.C. и сотр., Exp. Opin. Invest. Drugs 1999, 8, стр. 383-392.
[Непатентная Литература 3] статья авторов Murumkar, P.R. и сотр., Exp. Opin. Ther. Patents 2010, 20, стр.31-57
[Непатентная Литература 4] статья авторов Mohler, К. M. и сотр., Nature 1994, 370, стр.218-220
[Непатентная Литература 5] статья авторов DasGupta, S. и сотр., Bioorg. Med. Chem., 2009, 17, стр.444-459
[Непатентная Литература 6] статья авторов Nakajima, М., The Bone 2001, 15, стр.161-166
[Непатентная Литература 7] статья авторов Holmbeck, K. и сотр., Cell 1999, 99, стр.81-92
[Непатентная Литература 8] статья авторов Yu, W. и сотр., Bioorg. Med. Chem. Lett., 2010, 20, стр.1877-1880
[Непатентная Литература 9] статья авторов Yu, W. и сотр., Bioorg. Med. Chem. Lett., 2010, 20, стр.5286-5289
Сущность технической проблемы, к которой относится изобретение
Ввиду подобных обстоятельств, существует постоянная потребность в ингибиторах продуцирования ФНО-альфа, действие которых основано на ингибировании TACE. И представляется желательной разработка нового соединения, обладающего ингибирующим действием по отношению к ТАСЕ. В соответствии с описываемым выше, с точки зрения безопасности считается, что новое соединение, направленное на ингибирование продуцирования ФНО-альфа, действие которого основано на ингибировании TACE, едва ли должно обладать ингибирующим действием в отношении ММП, а именно, что соединение должно являться селективным в отношении ММП. С другой стороны, с точки зрения полезности такого соединения, может представляться более желательным, чтобы соединение характеризовалось наличием еще одного полезного свойства.
Настоящее изобретение выполнено с целью лечения и профилактики подобных связанных с ФНО-альфа заболеваний. А именно, настоящее изобретение направлено на разработку нового соединения, или его соли, который характеризуется селективным ингибирующим действием по отношению к ТАСЕ (т. е. характеризуется слабым ингибирующим действием по отношению к ММП), а также направлено на разработку фармацевтических средств, содержащих в своем составе подобное соединение в качестве активного ингредиента.
В результате кропотливых исследований по вышеуказанным проблемам авторами настоящего изобретения произведено неожиданное открытие, что (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион характеризуется превосходной селективной ингибирующей активностью по отношению к ТАСЕ и благоприятной растворимостью в основании. Авторами настоящего изобретения продолжаются их исследования в целях завершения настоящего изобретения на основе данного открытия.
В частности, настоящее изобретение относится, по меньшей мере, к следующим соответствующим им аспектам.
(1) (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион или его соль.
(2) Фармацевтическое средство, содержащее в своем составе в качестве активного ингредиента соединение в соответствии с пунктом (1) или его соль.
(3) Фармацевтическое средство в соответствии с пунктом (2), по существу, не содержащее в своем составе (-)-изомер.
(4) Фармацевтическое средство в соответствии с пунктом (2) или (3), в котором 95% по массе или более от общего количества 5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона или его соли в составе фармацевтического средства, представляет собой (+)-изомер.
(5) Фармацевтическое средство в соответствии с пунктом (4), в котором 98% по массе или более от общего количества 5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона или его соли в составе фармацевтического средства представляет собой (+)-изомер.
(6) Фармацевтическое средство в соответствии с пунктом (5), в котором 99,5% по массе или более от общего количества 5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона или его сои в составе фармацевтического средства представляет собой (+)-изомер.
(7) Фармацевтическое средство в соответствии с любым из пунктов (2) и (6), в котором фармацевтическое средство представляет собой средство наружного применения.
(8) Фармацевтическое средство в соответствии с пунктом (7), в котором средство наружного применения выбирают из группы, состоящей из лосьона, крема, мази и жидкости.
(9) Фармацевтическое средство в соответствии с пунктом (7) или (8), содержащее в своем составе фармацевтически приемлемые гликоли.
(10) Фармацевтическое средство в соответствии с пунктом (9), в котором фармацевтически приемлемыми гликолями являются пропиленгликоль или бутиленгликоль.
(11) Фармацевтическое средство в соответствии с любым из пунктов (7)-(10), включающее в состав рецептуры воду.
(12) Фармацевтическое средство в соответствии с любым из пунктов (7)-(11), включающее в свой состав в качестве активного ингредиента 1% по массе или более (+)-5-(3,4-дифторфенил)-5-[(3- метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона или его соли.
(13) Фармацевтическое средство соответствии с пунктом (12), включающий в свой состав в качестве активного ингредиента 3% по массе или более (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона или его соли.
(14) Фармацевтическое средство в соответствии с любым из пунктов (2) и (13), который наносят трансдермально.
(15) Фармацевтическое средство в соответствии с любым из пунктов (2)-(14), в котором фармацевтическое средство является профилактическим или лечебным средством при кожных заболеваниях.
(16) Фармацевтическое средство в соответствии с пунктом (15), отличающееся тем, что кожное заболевание представляет собой одно или более веществ, выбираемых из группы, состоящей из локализованной склеродермии, атопического дерматита, контактного дерматита, псориаза, и акне.
(17) Способ изготовления (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона, включающий в себя оптическое разделение рацемата(±)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона посредством хроматографии с использованием колонки для оптического разделения.
(18) (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион получают путем оптического разделения рацемической смеси (±)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона посредством хроматографии с использованием колонки для оптического разделения.
(19) Смесь (+)- и (-)-изомеров 5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона, в которой (+)-изомер присутствует в количестве 90% ее или более относительно (-)-изомера.
(20) Смесь в соответствии с пунктом (19), в которой (+)-изомер присутствует в количестве 96% ее или более относительно (-)-изомера.
(21) Смесь в соответствии с пунктом (19) или пунктом (20), в которой (+)-изомер присутствует в количестве 99% ее или более относительно (-)-изомера.
Положительный эффект, обусловленный действием изобретения
Соединение (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион или его соль в соответствии с настоящим изобретением характеризуется превосходным избирательным ингибирующим действием по отношению к ТАСЕ и является эффективным при использовании в качестве профилактического или терапевтического агента применительно к ассоциированным с ФНО-альфа заболеваниям.
Описание вариантов осуществления
Далее приводится более подробное описание настоящего изобретения.
Во-первых, соль (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона в соответствии с настоящим изобретением не ограничивается специфическим образом, пока данная является фармакологически приемлемой солью. Подобные соли включают в себя, например, соль с неорганическим основанием, соль с органическим основанием и тому подобные. Примеры соли с неорганическим основанием включают в себя соли щелочного металла и соли щелочноземельного металла, такие как соль лития, соль натрия, соль калия, соль магния, соль кальция, и соль бария. Примеры соли с органическим основанием включают в себя соль триэтиламина, соль пиридина, соль этаноламина, соль циклогексиламина, соль дициклогексиламина, соль дибензолэтаноламина, соль бензоламина, соль 2-метилбензоламина, соль метилбензоламина, соль бруцина, соли хинина, соль хинидина, соль цинхонина, соль цинхонидина, соль аргинина и тому подобные.
Далее, в соответствии с настоящим изобретением описывается способ изготовления (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона в соответствии с настоящим изобретением (именуемого далее как «(+)-(I)»). Данное соединение может быть изготовлено различными способами. Например, соединение может быть эффективным образом изготовлено на основе способа изготовления, указываемого ниже.
Конкретные примеры «защитной группы», используемой в рамках следующего способа изготовления, включают в себя гидроксильную группу или карбоксильную группу, трет-бутильную группу, бензильную группу, О-метилбензильную группу, п-нитробензильную группу, п-метоксибензильную группу, о-хлорбензильную группу, 2,4-дихлорбензильную группу, п-бромбензильную группу, аллильную группу, трет-бутоксикарбонильную группу, бензилоксикарбонильную группу, о-метилбензилоксикарбонильную группу, п-нитробензилоксикарбонильную группу, п-метоксибензилоксикарбонильную группу, о-хлорбензилоксикарбонильную группу, 2,4-дихлорбензилоксикарбонильную группу, п-бромбензилоксикарбонильную группу, аллилоксикарбонильную группу, метоксиметильную группу, тетрагидропиранильную группу и тому подобные. Касаемо использования карбонильной защитной группы, примеры включают в себя защитную группу, получаемую из этандиола, пропандиола, меркаптоэтанола, меркаптопропанола, этандитиола, пропандитиола и тому подобные.
Способ изготовления 1 (Способ изготовления с использованием хиральной колонки)
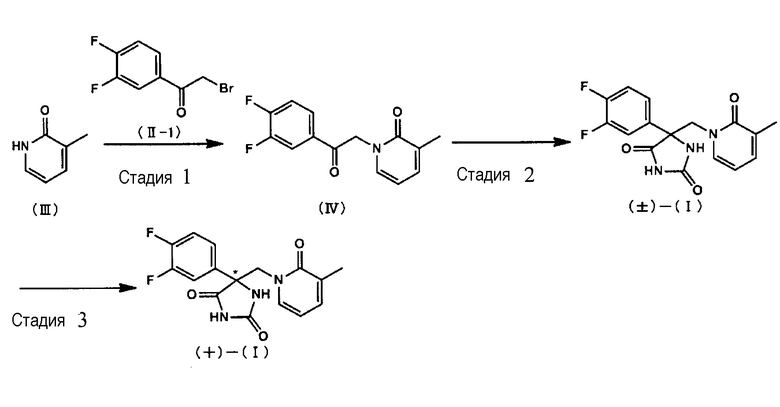
Соединение (+)-(I) может быть изготовлено, например, на основе способа, показываемого на следующей Схеме 1 (от Стадии 1 к Стадии 3).
[Формула 1]
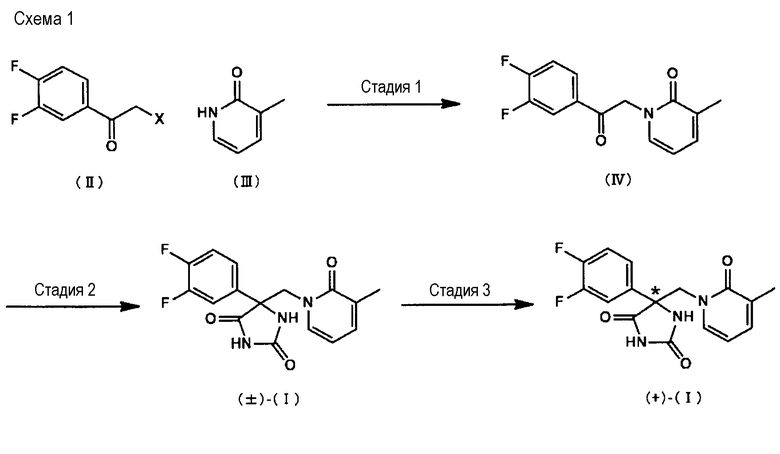
(в которой Х представляет собой атом хлора, атом брома или атом йода. Звездочка (*) обозначает оптически чистую форму.)
<Стадия 1>
В ходе Стадии 1 проводят взаимодействие соединения, описываемого общей структурной формулой (II), и соединения (III), в присутствии основания с получением соединения (IV).
[Формула 2]
Вместо соединения (III), соединение (V), которое представляет собой таутомерную форму соединения (III), может быть использовано. Примеры предпочтительных оснований включают в себя карбонат калия, карбонат натрия, карбонат цезия, гидрид натрия и тому подобные. Кроме того, в целях промотирования данной реакции могут быть добавлены добавки. Примеры подобных добавок включают в себя йодид калия, иодид натрия, тетрабутиламмоний иодид, бромид калия, бромид натрия, тетрабутиламмоний бромид и тому подобные. Растворитель для проведения реакции не является специфическим образом ограниченным, пока не приводит к существенному ингибированию реакции. Примеры предпочтительных растворителей для проведения реакции включают в себя, например, N,N-диметилформамид, диметилсульфоксид, ацетон, ацетонитрил, метанол, этанол, тетрагидрофуран, 1,4-диоксан, 2-метоксиэтанол, смеси данных растворителей и тому подобные. Кроме того, вода может быть добавлена к растворителю для проведения реакции. В случае, когда добавляют воду, хотя количество добавляемой воды не является специфическим образом ограниченным, оно, предпочтительно, составляет 10% или менее от объема растворителя для проведения реакции, например. Хотя температура проведения реакции также не является специфическим образом ограниченной, например, является предпочтительным диапазон от комнатной температуры до 60°С. Время проведения реакции, предпочтительно, составляет от 1 часа до 2 дней.
<Стадия 2>
В ходе Стадии 2 соединение (±)-(I), его рацемическую смесь получают путем проведения взаимодействия соединения (IV) с цианидом в присутствии соли. Примеры предпочтительных солей включают в себя карбонат аммония, бикарбонат аммония и тому подобные. Примеры предпочтительных цианидов включают в себя цианид калия, цианид натрия и тому подобные. Растворитель для проведения реакции не является специфическим образом ограниченным, пока не приводит к существенному ингибированию реакции. Примеры предпочтительных растворителей для проведения реакции включают в себя, например, воду, водный раствор аммиака, метанол, этанол, тетрагидрофуран, 1,4-диоксан, N,N-диметилформамид, смеси данных растворителей и тому подобные. Температура проведения реакции не является специфическим образом ограниченной. Например, является предпочтительным диапазон от 50°С до 120°С. Время проведения реакции, предпочтительно, составляет от 1 часа до 10 дней. Соединение (±)-(I), которое получают в ходе данной Стадии, может быть также получено в форме его соли в зависимости от процедуры обработки данной реакции.
<Стадия 3>
В ходе Стадии 3 соединение (±)-(I) оптически разделяют с использованием хиральной колонки с получением соединения (+)-(I). Оптическое разделение с использованием хиральной колонки может быть проведено в соответствии со способом, известным специалисту в данной области техники; см., например, работу «Separation of Optical W7059 Isomers» (автор Kikan Kagaku Sosetsu, No. 6, 1989, Издание The Chemical Society of Japan, Scientific Societies Press). Различные хиральные колонки, которые могут быть использованы, являются коммерчески доступными и может быть подобрана одна конкретная. Колонка CHIRALPAK AD (изготовитель Daicel Corporation) является предпочтительной с точки зрения благоприятной разделяющей способности обоих оптических изомеров.
Указываемое выше соединение (IV) может быть также получено по Схеме 2 ниже (Стадия 4 - Стадия 8).
[Формула 3]
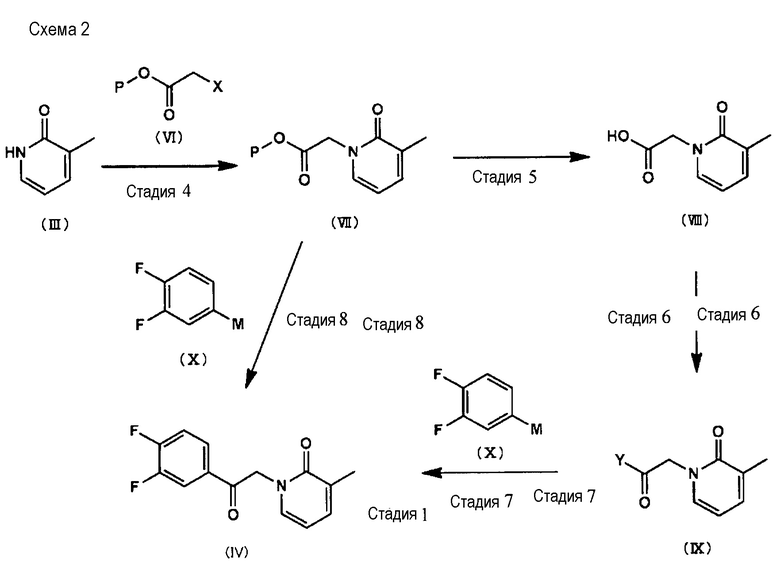
(в которой Х представляет собой атом хлора, атом брома или атом йода, Y представляет собой аминогруппу, получаемую, как показано ниже;
[Формула 4]
Р представляет собой защитную группу; М представляет собой MgBr, MgCl, Li, ZnBr или ZnCl.
<Стадия 4>
В ходе Стадии 4 соединение (III) и соединение, описываемое общей структурной формулой (VI), подвергают взаимодействию в присутствии основания с получением соединения, описываемого общей структурной формулой (VII).
[Формула 5]
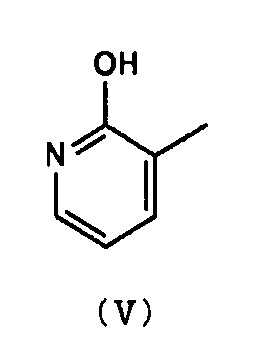
Вместо соединения (III), соединение (V), которое представляет собой таутомерноую форму соединения (III), может быть использовано. Примеры предпочтительных оснований включают в себя карбонат калия, карбонат натрия, карбонат цезия, гидрид натрия и тому подобные. Кроме того, в целях промотирования данной реакции могут быть добавлены добавки. Примеры подобных добавок включают в себя йодид калия, иодид натрия, тетрабутиламмоний иодид, бромид калия, бромид натрия, тетрабутиламмоний бромид и тому подобные. Растворитель для проведения реакции не является специфическим образом ограниченным, пока не приводит к существенному ингибированию реакции. Примеры предпочтительных растворителей для проведения реакции включают в себя, например, N,N-диметилформамид, диметилсульфоксид, ацетон, ацетонитрил, метанол, этанол, тетрагидрофуран, 1,4-диоксан, 2-метоксиэтанол, смеси данных растворителей и тому подобные. Хотя температура проведения реакции также не является специфическим образом ограниченной, например, является предпочтительным диапазон от комнатной температуры до 60°С. Время проведения реакции предпочтительно составляет от 1 часа до 2 дней.
<Стадия 5>
В ходе Стадии 5 соединение, описываемое общей структурной формулой (VII), подвергают гидролизу в среде водного неорганического основания с получением соединения (VIII). Примеры предпочтительных водных неорганических оснований включают в себя водный гидроксид натрия, водный гидроксид калия, водный гидроксид лития и тому подобные. Растворитель для проведения реакции не является специфическим образом ограниченным, пока не приводит к существенному ингибированию реакции. Примеры предпочтительных растворителей для проведения реакции включают в себя, например, воду, метанол, этанол, тетрагидрофуран, 1,4-диоксан, смеси данных растворителей и тому подобные. Хотя температура проведения реакции также не является специфическим образом ограниченной, например, является предпочтительным диапазон от комнатной температуры до 60°С. Время проведения реакции, предпочтительно, составляет от 1 до 96 часов. Соединение (VIII) получают в виде карбоновой кислоты, карбоксилата натрия, карбоксилата калия, карбоксилата лития, смеси карбоновой кислоты с неорганической солью (хлорид натрия, хлорид лития или хлорид калия) или подобных.
<Стадия 6>
В ходе Стадии 6 соединение (VIII), получаемое в ходе Стадии 5, преобразуют в активированное производное карбоновой кислоты и затем подвергают взаимодействию с амином или с его солью с получением соединения (IX). Примеры активированного производного карбоновой кислоты включают в себя галогенангидрид кислоты, получаемый обработкой соединения (VIII) тионилхлоридом, оксихлоридом фосфора, фосфорным ангидридом, оксалилхлоридом, тионилбромидом или тому подобными; активированный сложный эфир, получаемый по реакции конденсации соединения (VIII) с конденсирующим агентом, таким как 1-этил-3'-(3'-диметиламинопропил)карбодиимид или дициклогексилкарбодиимид; а также смешанный ангидрид, получаемый при взаимодействии соединения (VIII) с этилхлорформиатом, пивалоилхлоридом, изобутиловым эфиром хлормуравьиной кислотой или тому подобным. Кроме того, в данную реакцию может быть добавлено основание, при необходимости. Примеры подобных оснований включают в себя органические амины, такие как триэтиламин, трет-бутиламин, пиридин и N-метилморфолин. Триэтиламин, пиридин или N-метилморфолин являются предпочтительными. Растворитель для проведения реакции не является специфическим образом ограниченным, пока не приводит к существенному ингибированию реакции. Примеры предпочтительных растворителей для проведения реакции включают в себя, например, N,N-диметилформамид, тетрагидрофуран, дихлорметан, хлороформ и тому подобные. Хотя температура проведения реакции также не является специфическим образом ограниченной, например, является предпочтительным диапазон от комнатной температуры до 60°С. Время проведения реакции, предпочтительно, составляет от 1 до 96 часов.
<Стадия 7>
В ходе Стадии 7 получают соединение (IV) путем проведения взаимодействия соединения (IX), получаемого в ходе Стадии 6, и соединения, описываемого общей структурной формулой (X). В качестве указанного соединения (Х) может быть использовано соединение, представленное общей формулой (XI)
[Формула 6]
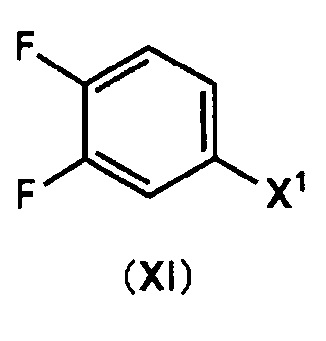
(где X1 представляет собой атом хлора, атом брома или атом йода)
в качестве материала могут быть использованы литий-содержащий реагент, изготовляемый по реакции обмена галоген-металл с использованием такого основания, как н-бутиллитий, втор-бутиллитий, трет-бутиллитий; реактив Гриньяра, изготовляемый с использованием магния, изопропилмагний бромида, изопропилмагний хлорида или тому подобного; цинк-содержащий реагент, изготовляемый с использованием активированного цинка, бромида цинка, хлорида цинка или тому подобного. Растворитель для проведения реакции не является специфическим образом ограниченным, пока не приводит к существенному ингибированию реакции. Примеры предпочтительных растворителей для проведения реакции включают в себя, например, тетрагидрофуран, диэтиловый эфир, 1,4-диоксан или диметоксиэтан. Хотя температура проведения реакции также не является специфическим образом ограниченной, например, является предпочтительным диапазон от -100°С до комнатной температуры. Время проведения реакции, предпочтительно, составляет от 1 до 24 часов.
<Стадия 8>
В ходе Стадии 8 таким же образом, как в ходе Стадии 7, соединение (IV) получают путем проведения взаимодействия соединения, описываемого общей структурной формулой (VII), с соединением, описываемым общей структурной формулой (X).
Кроме того, указываемое выше соединение (II) может быть изготовлено, как указывается ниже, по способу, описание которого приводится на Схеме 3 (от Стадии 9 до Стадии 11).
[Формула 7]
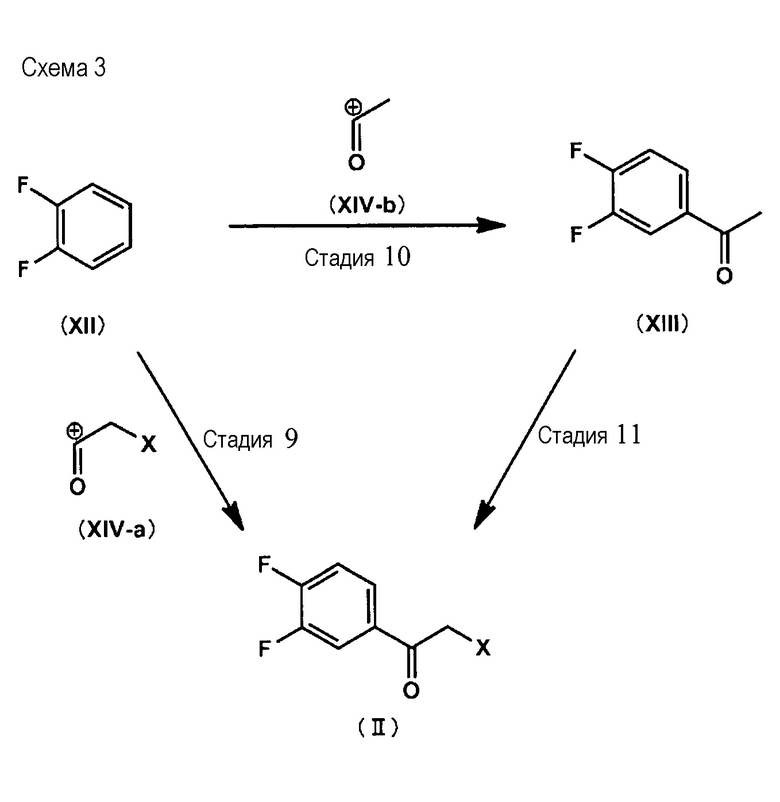
(где Х представляет собой атом хлора, атом брома или атом йода).
<Стадия 9>
В ходе Стадии 9 соединение (II) получают путем проведения взаимодействия соединения (XII) с промежуточным описываемым общей структурной формулой (XIV-а) соединением. Примеры промежуточного соединения (XIV-а) включают в себя активное промежуточное соединение, получаемое из галогенангидрида и кислоты Льюиса; активное промежуточное соединение, получаемое из ангидрида кислоты и кислоты Льюиса; а также активное промежуточное соединение, получаемое из карбоновой кислоты и дегидратирующего агента. Примеры галогенангидрида включают в себя хлорацетил хлорид, хлорацетил бромид, бромацетил бромид, бромацетил хлорид, иодацетил хлорид и тому подобные. Примеры ангидридорв кислот включают в себя хлоруксусный ангидрид, бромуксусный ангидрид, йодуксусный ангидрид и тому подобные. Примеры карбоновых кислот включают в себя хлоруксусную кислоту, бромуксусную кислоту, иодуксусную кислоту и тому подобные. Примеры кислот Льюиса включают в себя алюминий хлорид, хлорид цинка и тому подобные. Примеры дегидратирующих агентов включают в себя фосфорный ангидрид и тому подобные. Растворитель для проведения реакции не является специфическим образом ограниченным, пока не приводит к существенному ингибированию реакции. Примеры предпочтительных растворителей для проведения реакции включают в себя, например, дихлорметан, дихлорэтан и тому подобные. В дальнейшем, растворитель для проведения реакции может не использоваться. Хотя температура проведения реакции также не является специфическим образом ограниченной, например, является предпочтительным диапазон от 0 °C до 100 °C. Время проведения реакции, предпочтительно, составляет от 1 до 24 часов.
<Стадия> 10
В ходе Стадии 10 соединение (XIII) изготовляют путем проведения взаимодействия соединения (XII) с промежуточным соединением, описываемым общей структурной формулой (XIV-b). Примеры промежуточного соединения (XIV-b) включают в себя активное промежуточное соединение, получаемое из ацетилгалогенида и кислоты Льюиса; активное промежуточное соединение, получаемое из ацетилангидрида и кислоты Льюиса; а также активное промежуточное соединение, получаемое из уксусной кислоты и дегидратирующего агента. Примеры ацетилгалогенида включают в себя ацетилхлорид, ацетилбромид, ацетилиодид. Примеры кислот Льюиса включают в себя алюминия хлорид, хлорид цинка и тому подобные. Примеры дегидратирующих агентов включают в себя фосфорный ангидрид и тому подобные. Растворитель для проведения реакции не является специфическим образом ограниченным, пока не приводит к существенному ингибированию реакции. Примеры предпочтительных растворителей для проведения реакции включают в себя, например, дихлорметан, дихлорэтан и тому подобные. В дальнейшем, растворитель для проведения реакции может не использоваться. Хотя температура проведения реакции также не является специфическим образом ограниченной, например, является предпочтительным диапазон от 0°C до 100°C. Время проведения реакции, предпочтительно, составляет от 1 до 24 часов.
<Стадия 11>
В ходе Стадии 11 соединение (II) изготовляют путем проведения взаимодействия соединения (XIII) с галогенирующим агентом. Примеры галогенирующего агента включают в себя N-хлорсукцинимид, N-бромсукцинимид, N-йодсукцинимид, бензолтриметиламмонийтрибромид и тому подобные. Данная реакция может быть ускорена при использовании удовлетворяющей требованиям кислоты. Растворитель для проведения реакции не является специфическим образом ограниченным, пока не приводит к существенному ингибированию реакции. Примеры предпочтительных растворителей для проведения реакции включают в себя, например, тетрагидрофуран, дихлорметан, дихлорэтан и тому подобные. Хотя температура проведения реакции также не является специфическим образом ограниченной, например, является предпочтительным диапазон от 0°C до 100°C. Время проведения реакции, предпочтительно, составляет от 1 до 72 часов.
Способ изготовления 2 (Способ изготовления с использованием асимметричного элемента)
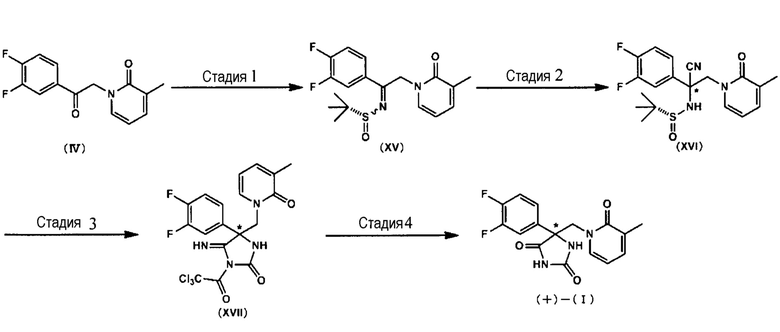
Соединение (+)-(I) может быть также изготовлено по способу, описываемому на Схеме 4, приводимой ниже (от Стадии 12 до Стадии 15).
[Формула 8]
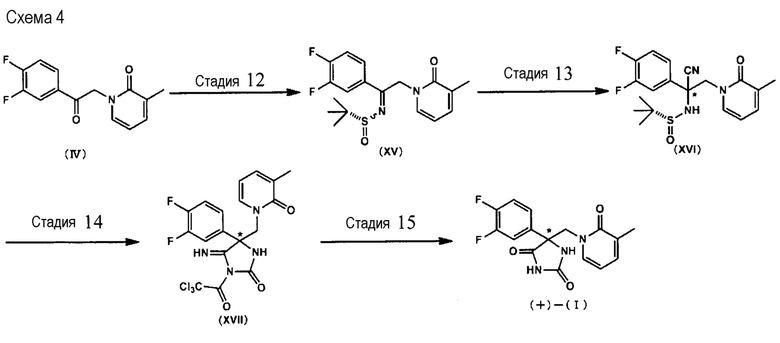
(где звездочкой (*) обозначается оптически чистая форма).
<Стадия 12>
В ходе Стадии 12 соединение (IV) подвергают взаимодействию с (R)-трет-бутансульфамидом в целях изготовления соединения (XV). Данная реакция может быть ускорена при использовании удовлетворяющей требованиям кислоты. В качестве кислот приводятся тетраизопропоксидтитан, тетраэтоксидтитан, тетрабутоксидтитан, п-толуолсульфоновая кислота и т. п. Растворитель для проведения реакции не является специфическим образом ограниченным, пока не приводит к существенному ингибированию реакции. Примеры предпочтительных растворителей для проведения реакции включают в себя, например, толуол, ксилол, бензол, тетрагидрофуран, диметоксиэтан, 1,4-диоксан и тому подобные. Температура проведения реакции не является специфическим образом ограниченной. Например, является предпочтительным диапазон от 0°C до 130°C. Время проведения реакции, предпочтительно, составляет от 1 часа до 72 часов. Соединение (XV), получаемое в ходе указываемой Стадии выделяют в виде Е-формы, Z-форме или в виде их смеси.
<Стадия 13>
В ходе Стадии 13 соединение (XV) подвергают взаимодействию с цианирующим агентом с получением соединения (XVI). В качестве цианирующего агента приводятся цианид натрия, цианид калия, триметилсилилцианид и т. п. Данная реакция может быть промотирована с использованием кислоты Льюиса или катион-захватного агента. В качестве кислоты Льюиса приводятся триметилалюминий и т. п. В качестве катион-захватного агента приводятся краун-эфир (15-краун-5, 18-краун-6 и тому подобные), гексаметилфосфорный триамид, N,N'-диметилпропиленмочевина и т. п. Растворитель для проведения реакции не является специфическим образом ограниченным, пока не приводит к существенному ингибированию реакции. Примеры предпочтительных растворителей для проведения реакции включают в себя, например, толуол, ксилол, бензол, тетрагидрофуран, диметоксиэтан, 1,4-диоксан и тому подобные. Температура проведения реакции не является специфическим образом ограниченной. Например, является предпочтительным диапазон от -40°C до 60°C. Время проведения реакции, предпочтительно, составляет от 1 часа до 120 часов.
При необходимости, участок от Стадии 12 до Стадии 13 может быть без проведения какой-либо специфической обработки по окончании реакции проведен одностадийным способом.
<Стадия 14>
В ходе Стадии 14 соединение (XVI) подвергают взаимодействию после удаления трет-бутилсульфинильной группы с использованием кислоты, с трихлорацетиловым сложным эфиром изоциановой кислоты с последующей обработкой триэтиламином до получения соединения (XVII). В качестве кислот приводятся соляная кислота, серная кислота, трифторуксусная кислота и т. п. Растворитель для проведения реакции не является специфическим образом ограниченным, пока не приводит к существенному ингибированию реакции. Примеры предпочтительных растворителей для проведения реакции включают в себя, например, хлористый метилен, хлороформ, толуол, ксилол, бензол, тетрагидрофуран, диметоксиэтан, 1,4-диоксан и тому подобные. Температура проведения реакции не является специфическим образом ограниченной. Например, является предпочтительным диапазон от 0°С до 60°С. Время проведения реакции, предпочтительно, составляет от 1 часа до 72 часов.
<Стадия> 15
В ходе Стадии 15 соединение (XVII) гидролизуют с использованием кислоты с получением соединения (+)-(I). В качестве кислоты приводятся соляная кислота, серная кислота, бромистоводородная кислота и т. п. Растворитель для проведения реакции не является специфическим образом ограниченным, пока не приводит к существенному ингибированию реакции. Примеры предпочтительных растворителей для проведения реакции включают в себя, например, хлористый метилен, хлороформ, толуол, ксилол, бензол, тетрагидрофуран, диметоксиэтан, 1,4-диоксан, воду и тому подобные; данная Стадия может быть осуществлена в отсутствии растворителя. Температура проведения реакции не является специфическим образом ограниченной. Например, является предпочтительным диапазон от 0°C до 120°C. Время проведения реакции, предпочтительно, составляет от 1 часа до 72 часов.
Соединение (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион (может упоминаться как «соединения в соответствии с изобретением»), изготовляемое на основе выше описываемых способов, выделяют и очищают в виде свободного соединения, его соли, гидрата, различных сольватов, такого как этанольный сольват, полиморфные кристаллические продукты или тому подобные. Фармацевтически приемлемая соль соединения в соответствии с изобретением может быть получена по стандартной солеобразующей реакции. Выделение и очистка может быть осуществлена с использованием химических процедур, таких как фракционная экстракция, кристаллизация и хроматография на фракции.
Соединение (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион или его соль в соответствии с настоящим изобретением проявляет превосходное селективное ингибирующее действие по отношению к ТАСЕ и может быть использовано в качестве активного ингредиента в составе фармацевтического средства. Таким образом, с учетом того, что настоящее изобретение также относится к фармацевтическому средству, которое включает в свой состав в качестве активного ингредиента (+)-5-(3,4-дифторфенил)-5-[(3-метил-2- оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион или его соль, действие которого основано на ингибирующем действии по отношению к ТАСЕ описываемого выше (+)-5-(3,4-дифторфенил)-5-[( 3-метил-2-оксопиридин- 1(2H)-ил)метил]имидазолидин-2,4-диона или его соли, фармацевтическое средство в соответствии с настоящим изобретением в особенности может быть использовано в качестве растворимого ингибитора продуцирования ФНО-альфа и также в особенности может быть использовано в качестве профилактического или терапевтического агента при различных видах ассоциированных с ФНО-альфа заболеваний. Примеры подобных заболеваний включают в себя ревматоидный артрит, псориатический артрит, системную красную волчанку (СКВ), люпус-нефрит, системную склеродермию, ограниченную склеродермию, синдром Шегрена, полимиозит, дерматомиозит, язвенный колит, болезнь Крона, болезнь Бехчета, множественный склероз, атеросклероз, миастению Gravis, анкилозирующий спондилит, диабет, сепсис, острые инфекционные заболевания, астму, хроническое обструктивное заболевание легких (ХОБЛ), атопический дерматит, контактный дерматит, псориаз, акне, остеопороз, ожоги, начальное отторжение, связанное с трансплантацией органов или тканей, лихорадку, анемию, рак, заболевание пародонта, глаукому, диабетические осложнения, увеит и тому подобные. В дополнение к этому, так как (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион или его соль в соответствии с настоящим изобретением обладает превосходным фармакологическим действием и трансдермальной абсорбцией даже при местном введении, как показано в описываемых ниже Примерах Испытаний 3 и 4 по отношению к связанным с ФНО-альфа заболеваниям, фармацевтическое средство в соответствии с настоящим изобретением в особенности может быть использовано в качестве профилактического или терапевтического агента при заболеваниях, при которых симптомы появляются на коже (т. е. при кожных заболеваниях). Примеры подобных заболеваний включают в себя кожную ограниченную склеродермию, атопический дерматит, контактный дерматит, псориаз, акне и тому подобные.
Фармацевтическое средство, содержащее в своем составе (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион или его соль в соответствии с настоящим изобретением, может вводиться системно или локально, перорально, трансдермально, назально, через дыхательные органы, через легкие, офтальмологическим путем, путем внутривенных инъекций, путем подкожных инъекций, ректальным способом введения и тому подобное. Кроме того, лекарственная форма данного фармацевтического средства может быть удовлетворяющим требованиям образом выбрана в соответствии с путем его введения. Примеры подобных лекарственных форм включают в себя таблетки, пастилки, подъязычные таблетки, покрытые сахаром таблетки, капсулы, пилюли, порошки, гранулы, жидкости, эмульсии, крема, мази, лосьоны, гели, желе, суспензии, сиропы, глазные капли, носовые капли, препараты для ингаляции, суппозитории, адгезионные материалы (например, ленты, пленки и т. п.), глазные мази, вагинальные таблетки, инъекции и тому подобные.
Кроме того, Фармацевтическое средство в соответствии с настоящим изобретением может содержать в своем составе удовлетворяющей требованиям компонент, помимо активного ингредиента ((+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)- 20 ил )метил]имидазолидин-2,4-диона или его соли), т. е. фармацевтически приемлемые жидкие или твердые добавки в составе рецептур (например, наполнитель, связующее вещество, разбавитель, утяжелитель, дезинтегратор, стабилизатор, консервант, буферное вещество, эмульгатор, ароматизатор, краситель, подсластитель, загуститель, модификатор, солюбилизирующий агент или т.п.) и может быть изготовлено в соответствии со стандартным способом в данной области техники.
Кроме того, (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион в соответствии с настоящим изобретением, о чем свидетельствуют Примеры Испытаний 5 и 6, приводимые ниже, характеризуется отличной растворимостью во внешнем основании, таким образом, что соединение в соответствии с настоящим изобретением в качестве активного ингредиента может содержаться при высокой концентрации (например, при концентрации 1% по массе или более) в составе легко приготовляемой рецептуры в соответствии с настоящим изобретением для целей приготовления Фармацевтического средства в соответствии с настоящим изобретением, представленного помимо указываемых выше различных лекарственных форм, в форме препаратов для наружного применения для трансдермального введения. Помимо данных внешних рецептур, лосьон, крем, жидкость или мазь являются предпочтительными.
Рецептуры, представленные в форме для внешнего введения (внешние рецептуры), такие как жидкость, эмульсия, крем, мазь, лосьон, гель и тому подобные, могут быть получены стандартным способом в настоящей области техники. В качестве оснований, используемых для получения внешних рецептур, без конкретного ограничения их фармацевтически приемлемых, могут быть перечислены водорастворимое основание, маслянистое основание, эмульсионное основание. Одно, два или более из данных оснований используются в зависимости от необходимости.
В качестве водорастворимого основания, например, приводятся полиэтиленгликоль (макрогол), этанол, глицерин, фармацевтически приемлемые гликоли (например, пропиленгликоль, бутиленгликоль и тому подобные). Среди них, с точки зрения благоприятной растворимости соединения в соответствии с настоящим изобретением являются предпочтительными фармацевтически приемлемые гликоли.
В качестве маслянистого основания, например, приводятся вазелин и парафин, которые выделяют из минерального сырья, пластичное основание, которое представляет собой гелеобразный полиэтилен в сочетании с жидким парафином, пчелиный воск, который получают из живых организмов, и тому подобные.
В качестве эмульсионного основания, например, приводятся ланолин, стеариловый спирт и тому подобные. В случае, когда используют эмульсионное основание, является предпочтительным дальнейшее добавление эмульгатора; в качестве данных эмульгаторов, например, могут быть перечислены гидрогенизированное полиоксиэтиленом касторовое масло, моностеарат глицерина и тому подобные.
Кроме того, в случае необходимости, в состав могу быть включены различные добавки. В качестве различных добавок, которые не являются специфическим образом ограниченными, пока таковые являются фармацевтически приемлемыми, например, могут быть перечислены пленкообразователь, такой как алкилметакрилатный сополимер, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, метилцеллюлоза, этилцеллюлоза, поливиниловый спирт и тому подобные; растворитель, такой как вода, этилацетат, бутилацетат, метилэтилкетон, изопропиловый сложный эфир адипиновой кислоты, диэтилсебацинат, триацетин и тому подобные; а также метилпарагидроксибензоат (консервант), пара-гидроксибензойная кислота (консервант) и т. п.
Дозировка фармацевтического средства, содержащего в своем составе (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион или его соль в соответствии с настоящим изобретением может удовлетворяющим требованиям образом определена в зависимости от таких условий, как цель введения, способы введения, симптоматика и тому подобные. Например, при пероральном введении взрослому пациенту, соединение в соответствии с изобретением, которое является активным ингредиентом, как правило, может быть введено в диапазоне приблизительно, составляющем приблизительно 0,01-100 мг/кг на дозу, и предпочтительно, может быть введено в диапазоне приблизительно, составляющем приблизительно 0,1-10 мг/кг, и предпочтительно, при введении от 1 до 3 раз в день. Кроме того, например, в случае применения к коже взрослого пациента в качестве местного агента, соединение в соответствии с изобретением, которое является активным ингредиентом, как правило, может быть введено в диапазоне приблизительно, составляющем 1-100,000 мкг/см2 в день, предпочтительно, может быть введено в диапазоне приблизительно, составляющем 10-10,000 мкг/см2, и более предпочтительно, может быть введено в диапазоне приблизительно, составляющем 10 - приблизительно 2,500 (мкг/см2, и предпочтительно, при введении один раз в день или при разделении на несколько приемов в течение одного дня.
В дополнение к этому, в составе фармацевтического средства, включающего в свой состав (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион или его соль в соответствии с настоящим изобретением в качестве активного ингредиента, является предпочтительным содержание (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона (который может ниже упоминаться как «(+)-изомер») или его соли в эффективном количестве, при этом данный, по существу, не содержит (-)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион (который может ниже упоминаться как «(-)-изомер») или его соль. В данном контексте, выражение «по существу не содержит (-)-изомер» означает, что (-)-изомер не обнаруживается или содержится в таком количестве, что он не оказывает какого-либо лекарственного действия в естественных условиях. Настоящее изобретение также относится к смеси (композиции), состоящей из (+)-изомера и (-)-изомера; указываемая смесь (композиция), предпочтительно, представляет собой смесь (композицию), в составе которой 95% ее или более составляет (+)-изомер и 5% ее или менее составляет (-)-изомер. Указываемая смесь (композиция) представляет собой, в более предпочтительном варианте, смесь (композицию), в составе которой 98% ее или более составляет (+)-изомера и 2% ее или менее составляет (-)-изомер, и еще более предпочтительно, смесь (композиция), в составе которой 99,5% ее или более составляет (+)-изомер и 0,5% ее или менее составляет (-)-изомер.
Более того, в составе фармацевтического средства, включающего в свой состав (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион или его соль в соответствии с настоящим изобретением, в общем объеме 5-(3,4-дифторфенил)-5-[( 3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона или его соли (+)-изомер, предпочтительно, присутствует в количестве, составляющем 95% ее или более (а именно, (+)-изомер присутствует в количестве, составляющем 90% ее или более), более предпочтительным, представляет собой соединение, в составе которого (+)-изомер присутствует в количестве, составляющем 98% ее или более (а именно, (+)-изомер присутствует в количестве, составляющем 96% ее или более), и еще более предпочтительным является соединение, в составе которого (+)-изомер присутствует в количестве, составляющем 99,5% ее или более (а именно, (+)-изомер присутствует в количестве, составляющем 99% ее или более).
Примеры
Ключевые особенности настоящего изобретения описываются более подробно со ссылкой на следующие рабочие Примеры и Примеры Испытаний. В следующих примерах и примерах испытаний материалы, их количества при использовании и соотношениях, обработка, процедуры или подобное могут быть в удовлетворяющей требованиям степени модифицированы, пока подобные модификации не выходят за рамки объема изобретения. Таким образом, объем настоящего изобретения не следует истолковывать как ограничиваемый конкретными примерами, приводимыми ниже.
ЯМР-спектры, приводимые ниже, измеряют с использованием спектрометра модели JNM-ECA 400 (400 МГц, изготовленного компанией JEOL Ltd.) с использованием дейтерированного хлороформа (CDCl3) или дейтерированного диметилсульфоксида (ДМСО-d6) в качестве растворителя и тетраметилсилана (TMS) в качестве внутреннего стандарта.
В результатах измерения химических сдвигов значения представляют в м. д., а константу связывания J измеряют в Гц. Аббревиатура s обозначает синглет, d обозначает дублет, t обозначает триплет, m обозначает мультиплет и br обозначает широкий. Для измерений методом масс-спектрометрии (с ионизационным электрораспылением: ESI-MS) используют прибор модели Exactive производства компании Thermo Fisher Scientific. Для измерения специфического вращения, используют поляриметр модели SEPA-300 производства компании HORIBA, Ltd.
Пример 1
Изготовление (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона (соединение (+)-(I))
Изготовление по Способу изготовления 1 (Способ изготовления с использованием хиральной колонки)
[Формула 9]
(где звездочкой (*) обозначается оптически чистая форма)
Стадия 1
Карбонат цезия (436 мг, 1,3 ммоль) и 3',4'-дифторфенилацилбромид (II-1) (300 мг, 1,3 ммоль) добавляют к раствору соединения (III), (133 мг, 1,2 ммоль) в N,N-диметилформамиде (10 мл), и полученную смесь перемешивают в течение 3 часов при комнатной температуре. Реакционный раствор разбавляют водой. Осаждаемое твердое вещество собирают фильтрованием и промывают водой с получением соединения (IV) (в количестве 206 мг, выход 64%) в виде желтого твердого вещества.
Стадия 2
Воду (0,8 мл) добавляют к суспензии соединения (IV) (206 мг, 0,78 ммоль), цианида калия (61 мг, 0,94 ммоль) и карбоната аммония (301 мг, 3,13 ммоль) в этаноле (0,8 мл), полученную смесь герметично закрывают и перемешивают в течение 67 часов при 100°С. После охлаждения реакционный раствор разбавляют водой и смесь экстрагируют этилацетатом. Полученный продукт сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении. Хлороформ добавляют к остатку и выпадающее в осадок твердое вещество собирают фильтрованием с получением соединения (±)-(I) (в количестве 119 мг, выход 46%) в виде бесцветного твердого вещества. Физические характеристики приводятся ниже.
1H-ЯМР (ДМСО-d6): δ 1,98 (3H, с), 4,46 (1Н, д, J=13,7 Гц), 4,61 (1H, д, J=13,7 Гц), 6,13 (1H, т, J=6,9 Гц), 7,22-7,33 (2H, м), 7,45-7,58 (2H, м), 7,69 (1H, ддд, J=2,3, 7,8, 12,4 Гц), 8,66 (1H, с), 10,99 (1H, с).
MS (ESI-FTMS): m/z 334 [M+H]+.
Соединение (±)-(I), получаемое путем проведения Стадия 2 более 1 раза, объединяют в целях успешного проведения Стадии 3.
Стадия 3
Высокоэффективная жидкостная хроматография (LaChrom Elite, Hitachi High Technologies Corporation) проводится с использованием разделяющей колонки (Chiralpak AD), и смеси н-гексан - этанол (30:70) пропускали через колонку при температуре 40°С со скоростью протока 8 мл/мин в течение одного часа в целях эквилибровки. Раствор соединения (±)-(I) (14 мг) в смеси н-гексан - этанол (30:70,2 мл) вводят и под наблюдением на УФ-детектора регистрируют первый пик (от приблизительно 12,5 мин до 15,5 мин) и второй пик (от приблизительно 18 мин до 23 мин). После того, как подобную процедуру повторяют, из каждой фракции выпаривают растворитель при пониженном давлении. В качестве соединения, показывающего первый пик, получают соединение в соответствии с настоящим изобретением (+)-5-(3,4-дифторфенил)-5-[(3-метил-2- оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион (выход 86 мг, оптическая чистота >99,9% по массе). В качестве соединения, показывающего второй пик, получают энантиомерное соединение в соответствии с настоящим изобретением (-)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион (выход 84 мг, оптическая чистота >99,8% по массе).
Физические характеристики соединения (+)-(I) показаны ниже:
Время удерживания по ВЭЖХ составляет 14,4 минут (аналитические условия, колонка: CHIRALPAK AD-H 4,6φx250 мм, подвижная фаза: н-гексан:этанол=40, скорость протока: 0,5 мл/мин, температура колонки: 30°С, длина волны детекции: 254 нм)
[а]D26,7=+229,9° (с 1,0, CHCl3)
1H-ЯМР (ДМСО-d6): δ 1,98 (3H, с), 4,46 (1H, д, J=13,3 Гц), 4,60 (1H, д, J=13,3 Гц), 6,12 (1H, т, J=6,9 Гц), 7,25 (1H, д, J=6,9 Гц), 7,29 (1H, д, J=6,0 Гц), 7,45-7,58 (2H, м), 7,65-7,73 (1H, м), 8,63 (1H, с), 10,98 (1H, с).
MS (ESI-FTMS): m/z 334 [M+H]+.
Физические характеристики энантиомерного соединения (-)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона в соответствии с настоящим изобретением, приводятся ниже:
Время удерживания по ВЭЖХ составляет 33,8 минут (аналитические условия, колонка: CHIRALPAK AD-H 4,6φx250 мм, подвижная фаза: н-гексан:этанол=40, скорость протока: 0,5 мл/мин, температура колонки: 30°С, длина волны детекции: 254 нм)
[а]D27=-196,73° (с 1,0, CHCl3)
1H-ЯМР (ДМСО-d6): δ 1,98 (3H, с), 4.46 (1H, д, J=13,7 Гц), 4,60 (1H, д, J=13,7 Гц), 6,12 (1H, т, J=6,7 Гц), 7,25 (1H, д, J=6,9 Гц), 7,29 (1H, д, J=6,4 Гц), 7,45-7,58 (2H, м), 7,69 (1H, ддд, J=2,3, 7,8, 12,4 Гц), 8,62 (1H, с), 10,98 (1H, с).
Изготовление по Способу изготовления 2 (Способу изготовления с использованием асимметричного элемента)
[Формула 10]
(где звездочка (*) обозначает оптически чистую форму. В дополнение к этому, цифры на каждой Стадии эквивалентны цифрам на каждой Стадии в настоящем примере).
Стадия 1
К раствору соединения (IV) (500 мг, 1,89 ммоль) и (R)-трет-бутансульфамида (345 мг, 2,85 ммоль) в толуоле (1,9 мл), добавляют тетраизопропоксид титана (596 мкл, 2,85 ммоль) и перемешивают при 100°C в течение 16 часов. После охлаждения до комнатной температуры добавляют насыщенный водный раствор хлорида аммония и перемешивают. Осажденное твердое вещество отфильтровывают путем фильтрации через целит и промывают этилацетатом. Органический слой отделяют и промывают насыщенным водным раствором хлорида натрия; сушат над безводным сульфатом натрия и растворитель выпаривают при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (силикагель) в целях получения соединения (XV) (в количестве 447 мг, выход 64%).
Стадия 2
При охлаждении до -20°С к раствору соединения (XV) (244 мг, 0,67 ммоль) в толуоле (1,3 мл) добавляют раствор в толуоле (1,8 моль/л, 556 мкл, 1,00 ммоль) триметилалюминия и триметилсилилцианида (126 мкл, 1,00 ммоль) и перемешивают при -20°C в течение 2 часов. Добавляют насыщенный водный раствор хлорида аммония и осаждаемое твердое вещество отфильтровывают через целит и промывают этилацетатом. Органический слой отделяют и промывают насыщенным водным раствором хлорида натрия; сушат над безводным сульфатом натрия и растворитель выпаривают при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (силикагель) в целях получения соединения (XVI) (в количестве 145 мг, выход 55%).
1H-ЯМР (400 MГц, CDCl3): δ 1,27 (9H, c), 2,18 (3H, c), 4,02 (1H, д, J=13,7 Гц), 4,80 (1H, д, J=13,7 Гц), 6,21 (1H, т, J=6,9 Гц), 7,04 (1H, м), 7,30 (1H, м), 7,40-7,50 (2H, м).
Стадия 3
При охлаждении льдом к раствору соединения (XVI) (130 мг, 0,337 ммоль) в этилацетате(3,3 мл) добавляют раствор гидрохлорида-этилацетата (1,5 мл) и перемешивают в течение 30 минут. Реакционный раствор концентрируют при пониженном давлении и растворяют в метиленхлориде (3,3 мл). К раствору добавляют трихлорацетиловый сложный эфир изоциановой кислоты (47 мкл, 0,40 ммоль) и раствор перемешивают при комнатной температуре в течение 40 минут. К реакционной смеси добавляют триэтиламин (46 мкл, 0,33 ммоль) и перемешивают при комнатной температуре в течение 2 ч. Реакционный раствор концентрируют при пониженном давлении и остаток очищают с помощью колоночной хроматографии (силикагель) в целях получения соединения (XVII) (в количестве 142 мг, выход 90%).
1H-ЯМР (400 MГц, CDCl3): δ 2,23 (3H, с), 4,00 (1H, д, J=14,2 Гц), 5,07 (1H, д, J=14,2 Гц), 6,20 (1H, т, J=6,9 Гц), 7,16 (1H, м), 7,22-7,33 (2H, м), 7,37-7,51 (2H, м), 8,75 (1H, с), 10,17 (1H, с).
Стадия 4
К соединению (XVII) (125 мг, 0,26 ммоль) добавляют 6 моль/л гидрохлорида (5,2 мл) и перемешивают при 100°C в течение 16 часов. После охлаждения до комнатной температуры реакционный раствор разбавляют водой и экстрагируют дважды этилацетатом. Органические слои объединяют, промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и растворитель выпаривают при пониженном давлении. Остаток очищают с использованием колоночной хроматографии (силикагель) в целях получения соединения (+)-(I) (в количестве 80 мг, выход 92%, оптическая чистота 97,6% по массе) в виде бесцветного твердого вещества.
[а]D26,7=+229,6° (с 0,05, CHCl3)
1H-ЯМР (ДМСО-d6): δ 1,98 (3H, с), 4,46 (1H, д, J=13,7 Гц), 4,58 (1H, д, J=13,7 Гц), 6,12 (1H, т, J=6,9 Гц), 7,22-7,33 (2H, м), 7,45-7,58 (2H, м), 7,69 (1H, ддд, J=2,3, 7,8, 12,4 Гц), 8,51 (1H, с), 10,99 (1H, с).
Пример испытания 1
Испытание на ингибирование ТАСЕ (in vitro)
Нуклеотидная последовательность ТАСЕ приводится автором Moss и сотр. (Moss, M.L. и сотр., Nature 1997, 385, стр. 733-736). Соответственно, кДНК ТАСЕ получают в соответствии с установленным способом из клеток ТНР-1 или подобных им, а затем инкоропорируют кДНК в вектор экспрессии. Далее, данный вектор трансформируют в клетки млекопитающих или клетки насекомых и получают выражение для ТАСЕ.
Испытание на ингибирование активности ТАСЕ проводят путем измерения активности TACE в присутствии и в отсутствие тестируемого вещества с помощью получаемого таким образом ТАСЕ в качестве фермента, а также флуоресцентного синтетического субстрата Nma (N-метилантраниловая кислота)-Leu-Ala-Gln-Ala-Val-Arg-Ser-Lys Ser-(DNP(динитрофенил))-D-Arg-NH2, включающего последовательность расщепленного действием TACE связанного с мембраной ФНО, в качестве субстрата. Испытание на ингибирование активности ТАСЕ демонстрируется ниже.
А именно, 90 мкл ферментного раствора, получаемого с использованием испытательного буфера А (50 мМ буферный раствор трис - хлористоводородной кислоты (рН 7,5) в том числе 200 мМ хлористого натрия, 5 мМ хлорида кальция, 10 мкМ сульфата цинка и 2 мг/мл бычьего сывороточного альбумина) и 90 мкл флуоресцентного синтетического субстрата, получаемого с использованием испытательного буфера В (50 мМ буферный раствор трис - хлористоводородной кислоты (рН 7,5) в том числе 200 мМ хлористого натрия, 5 мМ хлорида кальция, 10 мкМ сульфата цинка и 0,05% продукта под торговым наименованием PLURONIC F-68), смешивают вместе и подвергают взаимодействию при 37°С в течение 1,5 часов. Активность фермента затем определяется путем измерения с помощью измерителя интенсивности флуоресценции (модель Labsystems, Fluoroskan Ascent) при длине волны возбуждения 355 нм и длине волны детекции 460 нм.
Из измерения ферментативной активности в присутствии или в отсутствие тестируемого вещества определяют степень ингибирования и рассчитывают 50% концентрацию ингибирования (IC50) испытуемого вещества.
В соответствии с результатом, настоящее изобретательской (+)-5-(3,4-дифторфенил)-5-[(3-метил-2- оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион демонстрирует ингибирующую активность в отношении ТАСЕ, составляющую 100 нм или менее от значения IC50.
Пример испытания 2
Испытание на ингибирование MMП
Испытание на ингибирование MMП может быть осуществлено, например, с использованием флуоресцентного синтетического субстрата на основании методик, описываемых автором Bickett и сотр. (статья D. Mark Bickett и сотр., Anal. Biochem., 1993, 212, стр. 58-64), а также Nagase и сотр. (статья H. Nagase и сотр., J. Biol. Chem., 1994, 269, стр. 20952-20957) Методика для каждого испытания на ингибирование ММП демонстрируется ниже.
Испытание на ингибирование ММП-1
180 мкл (100 нг) ММП-1 человека (производства компании Calbiochem, партия номер # 444208) смешивают с 20 мкл 10 мМ п-аминофенилацетата ртути (АФРА) и активируют проведением реакции при 37°С в течение 1 часа. 20 µл получаемого раствора фермента разбавляют до 90 мкл испытательного буфера А. Смесь добавляют к 90 мкл из 20 мкМ флуоресцентного субстрата (DNP-Pro-Cha((3-циклогексилаланил)-Gly-Cys(Me)-His-Ala-Lys(Nma)-NH2), получаемого с использованием испытательного буфера В, и подвергают взаимодействию при 37°С в течение 5 часов. Активность фермента затем определяется путем измерения с помощью измерителя интенсивности флуоресценции (модель Labsystems, Fluoroskan Ascent) при длине волны возбуждения 355 нм и длине волны детекции 460 нм.
Из измерения ферментативной активности в присутствии или в отсутствие тестируемого вещества определяют степень ингибирования и рассчитывают 50% концентрацию ингибирования (IC50) испытуемого вещества.
Испытание на ингибирование ММП-2
90 мкл (5 нг) ММП-2 человека (производства компании Calbiochem, партия номер # 444213) смешивают с 10 мкл 10 мМ АФРА и активируют проведением реакции при 37°С в течение 1 часа. 10 мкл получаемого раствора фермента разбавляют до 90 мкл испытательного буфера А. Смесь добавляют к 90 мкл из 20 мкМ флуоресцентного субстрата (MOCAc((7-метоксикумарин-4-ил)ацетил)-Pro-Leu-Gly-Leu-A2pr(DNP)-Ala-Arg-NH2, производства компании Peptide Institute Inc., партия номер #3163-v, получаемого с использованием испытательного буфера В, и подвергают взаимодействию при 37°С в течение 5 часов. Активность фермента затем определяется путем измерения с помощью измерителя интенсивности флуоресценции (модель Labsystems, Fluoroskan Ascent) при длине волны возбуждения 320 нм и длине волны детекции 405 нм.
Из измерения ферментативной активности в присутствии или в отсутствие тестируемого вещества определяют степень ингибирования и рассчитывают 50% концентрацию ингибирования (IC50) испытуемого вещества.
Испытание на ингибирование ММП-3
90 мкл (1,5 нг) ММП-3 человека (производства компании Calbiochem, партия номер #444217), получаемого с использованием испытательного буфера А, добавляют к 90 мкл из 20 мкМ флуоресцентного м субстрата NFF-3 (MOCAc((7-метоксикумарин-4-ил)ацетил)-Arg-Pro-Lys-Pro-Val-Glu-Trp-Nva-аргинин-лизин(DNP)-NH2, производства компании Peptide Institute Inc., партия номер 3168 #-V) получаемого с использованием испытательного буфера В, и подвергают взаимодействию при 37°С в течение 4 часов. Активность фермента затем определяется путем измерения с помощью измерителя интенсивности флуоресценции (модель Labsystems, Fluoroskan Ascent) при длине волны возбуждения 320 нм и длине волны детекции 405 нм.
Из измерения ферментативной активности в присутствии или в отсутствие тестируемого вещества определяют степень ингибирования и рассчитывают 50% концентрацию ингибирования (IC50) испытуемого вещества.
Испытание на ингибирование ММП-8
90 мкл (29 нг) ММП-8 человека (производства компании Calbiochem, партия номер #444229) смешивают с 10 мкл 10 мМ АФРА и активируют проведением реакции при 37°С в течение 1 часа. 10 мкл получаемого раствора фермента разбавляют до 90 мкл испытательного буфера А. Смесь добавляют к 90 мкл из 20 мкМ флуоресцентного субстрата (MOCAc-Pro-Leu-Gly-Leu-A2pr(DNP)-Ala-Arg-NH2, производства компании Peptide Institute Inc., партия номер 3163 #-V), получаемого с использованием испытательного буфера В, и подвергают взаимодействию при 37°С в течение 5 часов. Активность фермента затем определяется путем измерения с помощью измерителя интенсивности флуоресценции (модель Labsystems, Fluoroskan Ascent) при длине волны возбуждения 320 нм и длине волны детекции 405 нм.
Из измерения ферментативной активности в присутствии или в отсутствие тестируемого вещества определяют степень ингибирования и рассчитывают 50% концентрацию ингибирования (IC50) испытуемого вещества.
Испытание на ингибирование ММП-9
90 мкл (11 нг) ММП-9 человека (производства компании Calbiochem, партия номер #444231) смешивают с 10 мкл 10 мМ АФРА и активируют проведением реакции при 37°С в течение 2 часов. 10 мкл получаемого раствора фермента разбавляют до 90 мкл испытательного буфера А. Смесь добавляют к 90 мкл из 20 мкМ флуоресцентного субстрата (DNP-Pro-Cha-Gly-Cys(Me)-His-Ala-Lys(Nma)-NH2) получаемого с использованием испытательного буфера В, и подвергают взаимодействию при 37°С в течение 4 часов. Активность фермента затем определяется путем измерения с помощью измерителя интенсивности флуоресценции (модель Labsystems, Fluoroskan Ascent) при длине волны возбуждения 355 нм и длине волны детекции 460 нм.
Из измерения ферментативной активности в присутствии или в отсутствие тестируемого вещества определяют степень ингибирования и рассчитывают 50% концентрацию ингибирования (IC50) испытуемого вещества.
Испытание на ингибирование ММП-13
90 мкл (130 нг) ММП-13 человека (производства компании Calbiochem, партия номер #444287) смешивают с 10 мкл 10 мМ АФРА и активируют проведением реакции при 37°С в течение 2 часов. 10 мкл получаемого раствора фермента разбавляют до 90 мкл испытательного буфера А. Смесь добавляют к 90 мкл из 20 мкМ флуоресцентного субстрата (DNP-Pro-Cha-Gly-Cys(Me)-His-Ala-Lys(Nma)-NH2), получаемого с использованием испытательного буфера В, и подвергают взаимодействию при 37°С в течение 4 часов. Активность фермента затем определяется путем измерения с помощью измерителя интенсивности флуоресценции (модель Labsystems, Fluoroskan Ascent) при длине волны возбуждения 355 нм и длине волны детекции 460 нм.
Из измерения ферментативной активности в присутствии или в отсутствие тестируемого вещества определяют степень ингибирования и рассчитывают 50% концентрацию ингибирования (IC50) испытуемого вещества.
Испытание на ингибирование ММП-14
90 мкл (1,9 нг) ММП-14 человека (производства компании Calbiochem, партия номер # 475935), получаемого с использованием испытательного буфера А, добавляют к 90 мкл из 20 мкМ флуоресцентного субстрата (Dnp-Pro-Cha-Gly-Cys(Me)-His-Ala-Lys(Nma)-NH2), получаемого с использованием испытательного буфера В, и подвергают взаимодействию при 37°С в течение 5 часов. Активность фермента затем определяется путем измерения с помощью измерителя интенсивности флуоресценции (модель Labsystems, Fluoroskan Ascent) при длине волны возбуждения 355 нм и длине волны детекции 460 нм.
Из измерения ферментативной активности в присутствии или в отсутствие тестируемого вещества определяют степень ингибирования и рассчитывают 50% концентрацию ингибирования (IC50) испытуемого вещества.
Испытание на ингибирование ММП-17
90 мкл (5,8 нг) ММП-17 человека (производства компании Calbiochem, # партия номер 475940), получаемого с использованием испытательного буфера А, добавляют к 90 мкл из 20 мкМ флуоресцентного субстрата (MOCAc-Pro-Leu-Gly-Leu-A2pr(Dnp)-Ala-Arg-NH2, производства компании Peptide Institute Inc., партия номер 3163 #-V), получаемого с использованием испытательного буфера В, и подвергают взаимодействию при комнатной температуре в течение 5 часов. Активность фермента затем определяется путем измерения с помощью измерителя интенсивности флуоресценции (модель Labsystems, Fluoroskan Ascent) при длине волны возбуждения 320 нм и длине волны детекции 405 нм. Из измерения ферментативной активности в присутствии или в отсутствие тестируемого вещества определяют степень ингибирования и рассчитывают 50% концентрацию ингибирования (IC50) испытуемого вещества.
Получаемые в ходе данных испытаний значения 50% концентрации ингибирования ММП настоящего соединения (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион в соответствии с изобретением приводятся в Таблице 1.
Пример испытания 3
Испытание на ингибирование ушного отека, вызываемого однократного применения ТПА (12-О-тетрадеканоилфорбол-13-ацетата) у мышей (испытание in vivo эффективности на основании связанного с ФНО-альфа кожного воспаления)
Ушной отек индуцируют путем нанесения 54 мкМ/л ТПА - ацетонового раствора на обе внутреннюю и наружную стороны левого уха мышей породы BALB/с (наносимый объем 54 мкМ/л ТПА - ацетонового раствора составляет по 10 мкл на каждую сторону левого уха (т.е. 1,08 мкмоль ТПА/ушная раковина)). Для неиндуциированной группы аналогично наносят ацетон вместо 54 мкМ/л ТПА - ацетонового раствора. Исследуемое вещество растворяют и получают в 1 масса/объем% раствор ацетона, содержащего 10% по объему ДМСО (транспорт местного введения), затем испытуемый раствор наносят на обе внутреннюю и внешнюю стороны левого уха мышей (наносимый объем данного испытуемого раствора 10 мкл на каждую сторону левого уха) за 1 час перед нанесением ТПА. Для контрольной группы аналогично применяется местное нанесение транспорта вместо раствора испытуемого вещества. Для этанерцептной группы вводят внутривенно 0,2 мл 5 мг/мл раствора препарата этанерцепт (1 мг/мышь) в день перед нанесением ТПА и за 1,5 часа перед нанесением ТПА. Для группы человеческого IgG (hlgG) (контрольная группа) вводят внутривенно 0,2 мл 5 мг/мл раствора hlgG (1 мг/мышь). Толщину ушной раковины измеряют под эфирным наркозом в день перед нанесением ТПА и через 6 часов после нанесения ТПА в целях оценки ингибирования эффекта ушного отека тестируемого вещества на основании увеличения толщины ушной раковины в качестве показателя.
Скорость ингибирования ушного отека (%) испытуемого вещества рассчитывают по следующей формуле, используя (A) среднее значение увеличения толщины ушной раковины группы, которой вводят испытуемого вещество, (B) среднее значение увеличения толщины ушной раковины не индуцированной группы, и (С) среднее значение увеличения толщины ушной раковины контрольной группы. Скорость ингибирования ушного отека (%) испытуемого вещества=(C-A)/(C-B)×l00
(А): Среднее значение увеличения толщины ушной раковины в группе, в которой вводят испытуемое вещество
(В): Среднее значение увеличения толщины ушной раковины в не индуцированной группе
(С): Среднее значение увеличения толщины ушной раковины в контрольной группе
Скорость ингибирования ушного отека (%) этанерцепта рассчитывают по следующей формуле, используя (B) среднее значение увеличения толщины ушной раковины не индуцированной группы, (D) среднее значение увеличения толщины ушной раковины в этанерцептной группе, и (E) среднее значение увеличения толщины ушной раковины в группе hlgG. Скорость ингибирования ушного отека (%) этанерцептом=(E-D)/(E-B)×l00
(D): Среднее значение увеличения толщины ушной раковины в этанерцептной группе
(Е): Среднее значение увеличения толщины ушной раковины в группе hlgG
Кроме того, рассчитывают этанерцептное отношение на основании следующей формулы путем одновременного сравнения скорости ингибирования ушного отека (%) испытуемого вещества со скоростью ингибирования ушного отека (%) этанерсептом (используемого в качестве положительного контроля).
«Этанерцептное Отношение»=Скорость ингибирования ушного отека (%) каждого испытуемого вещества/Скорость ингибирования ушного отека (%) этанерцептом.
Скорость ингибирования ушного отека (%) (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дионом в соответствии с настоящим изобретением составляет 62%, а Этанерцептное Отношение составляет 3,4. Соединение в соответствии с настоящим изобретением демонстрируют превосходное действие путем местного нанесения, чем путем внутривенного введения этанерцепта, который является коммерчески доступным препаратом для связанных с ФНО-альфа заболеваний.
Пример испытания 4
Фармакокинетические исследования после внутривенного и подкожного введения бесшерстным мышам
Внутривенное введение
Испытуемые вещества (в количестве в интервале 0,1-0,5 мг/5 мл/кг) вводят инъекционно ударной дозой в хвостовую вену бесшерстным мышам под анестезией
Подкожное введение
4 см2 сайт для нанесения (2 см × 2 см) отмечают на коже спины бесшерстных мышей под наркозом (подается) с использованием маркера на масляной основе. Испытуемые вещества наносят на сайт в количестве, составляющем 50 мкл/животное (1 масса/объем% раствора продукта под торговым наименованием Macrogol 400). Марлю (торговая марка BEMCOT®) размером приблизительно 2 см × 2 см в диаметре фиксируют с помощью двусторонней клейкой ленты на полиэтиленовой пленке размером примерно 4 см × 4 см и марлю лицевой стороной помещают на наносимое испытуемое вещество. Адгезионный эластичный бинт (торговая марка Elastopore, приблизительно 10 см) крепят на марлю в целях фиксации и защиты лицевой стороны, к которой прилагают испытуемое вещество. Затем мышей возвращают в клетку. Через двадцать четыре часа после нанесения, окклюзионное приложение подтверждают как должным образом выполненное.
Сбор крови
Хвостовую вену мышей разрезают бритвой, и кровь собирают из хвостовой вены с помощью микропипетки. Образцы крови собирают через 5, 15, 30 минут, 1, 3 и 6 часов после внутривенного введения и через 30 минут, 1, 3, 6 и 24 часа после подкожного введения, соответственно. Количество крови, собираемое в каждой точке, составляет в интервале приблизительно 30-50 мкл. Кровь переносят в пробирку, содержащую гепарин натрий, и плазму получают путем центрифугирования (при 4°С, 19,200 × g, в течение 10 мин). Плазму криоконсервируют в морозильной камере с температурой, заданной на -30°С.
Способ измерения концентрации в плазме испытуемого вещества
Криоконсервированную плазму, получаемую вышеуказанным способом, оттаивают при комнатной температуре. После удаления белка с использованием метанола измеряют концентрацию испытуемого вещества в плазме. Инструменты, используемые при измерении концентрации в плазме состоят из автоматического пробоотборника HTC PAL производства компании CTC Analytics, и ВЭЖХ Accela, а также прибора TSQ Quantum Ultra производства компании Thermo Fisher Scientific.
Расчет скорости трансдермального поглощения
Скорости трансдермального поглощения рассчитывают по следующей формуле, вычисляя ПКК (площадь под концентрационной кривой в плазме) от концентрации в плазме испытуемого вещества, измеряемой по способу, описываемому выше.
Скорость трансдермального поглощения (%)=((Div × AUCpc)/(Dpc × AUCiv)) ×100
Div: доза тестируемого вещества в течение внутривенного введения
DPC: доза тестируемого вещества в течение чрезкожного введения
AUCiv: площадь под концентрационной кривой в плазме испытуемого вещества после внутривенного введения
AUCpc: площадь под концентрационной кривой в плазме испытуемого вещества после подкожного введения
Подтверждено, что соединение в соответствии с настоящим изобретением характеризуется хорошей трансдермальной всасываемостью после его подкожного введения. Таким образом, делается вывод о том, что соединение в соответствии с настоящим изобретением также характеризуется хорошей кожной проницаемостью.
Пример испытания 5
Испытание растворимости во 2-ой жидкости для испытания распадаемости для Японской Фармакопеи
Получение раствора образца для калибровочной кривой
Тестируемые вещества (10,0 мг) правильно взвешивают и добавляют к ним метанол в целях доведения до 10 мл. Раствор разбавляют в 10 раз в целях приготовления 100 мкг/мл раствора.
Получение раствора образца для измерения растворимости
в центрифужной пробирке взвешивают 5,0 мг испытуемого вещества, добавляют 5 мл 2-ой жидкости из испытания на распадаемость для Японской Фармакопеи, ультрафугируют в течение 3 минут и после этого встряхивают в течение 2 часов. Данный раствор фильтруют через мембранный фильтр (0,2 мкм), отмеряют 500 мкл фильтрата, добавляют 500 мкл ацетонитрила и полностью перемешивают в целях получения раствора образца.
Приготовление 2-ой жидкости для испытания распадаемости для Японской Фармакопеи (pH 6,8)
К 250 мл 0,2 Моль/л водного раствора дигидрофосфата калия добавляют 118 мл водного 0,2 моль/л раствора гидроксида натрия и воды в целях доведения до 1,000 мл.
Способ измерения растворимости 2й жидкости для испытания распадаемости для Японской Фармакопеи
С использованием высокоэффективной жидкостной хроматографии каждый из образцов растворов для калибровочной кривой и образцов растворов для измерения растворимости измеряют дважды в целях вычисления средней площади каждого из них.
Способ расчета растворимости 2й жидкости для испытания распадаемости для Японской Фармакопеи
На основании величины средней площади, получаемой в выше упоминаемом способе, с помощью приводимого ниже уравнения для расчета растворимости.
Растворимость 2й жидкости для испытания распадаемости для Японской Фармакопеи ((мкг/мл)=((P×2)/S) ×l00
S: Средняя площадь для образца раствора для калибровочной кривой
P: Средняя площадь для образца раствора для измерения растворимости
Растворимость (мкг/мл) 2-ой жидкости для испытания распадаемости для Японской Фармакопеи, получаемые в ходе испытания для (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона в соответствии с настоящим изобретением и эталонного соединения(±)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона демонстрируются в Таблице 2.
По результатам испытаний, соединение в соответствии с настоящим изобретением характеризуется, по сравнению с его рацематом, на удивление высокой растворимостью 2-ой жидкости для испытания распадаемости для Японской Фармакопеи. Соединения в соответствии с настоящим изобретением, следовательно, очевидно, характеризуется наличием предпочтительной ключевой особенности для получения рецептуры.
Пример испытания 6
Испытание растворимости в органических растворителях
В условиях комнатной температуры, в 0,5 мл полипропиленовой пробирке предварительно готовят удовлетворяющее требованиям отмеряемое количество (+)-5-(3,4-дифторфенил 25)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона и(±)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона, соответственно. В каждую пробирку, добавляют растворитель (пропиленгликоль (ПГ) или бутиленгликоль (БГ)) в различном количестве, например, в 10-кратном, 20-кратном или 100-кратном количестве от количества испытуемого соединения и перемешивают с использованием миксера. В настольном ультразвуковом промывном устройстве, установленном на 37°С, производят обработку ультразвуком в течение 10 минут; после прогрева в течение часа в камере термостата, каждый выдерживают в течение 24 часов при комнатной температуре. Испытуемые растворы оценивают на глаз в целях определения состояния в соответствии с приводимым ниже критерием определения.
Критерий Определение растворимости в растворителях
Критерий Определение состоит из следующих двух категорий:
«Растворимый»: испытуемое соединение растворяется; не имеется нерастворенных веществ, не подтверждаемых путем визуального наблюдения. «Нерастворимый»: испытуемое соединение остается нерастворимым; имеются нерастворенные вещества, подтверждаемые путем визуального наблюдения.
В Таблице 3 демонстрируются результаты испытания растворимости (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона в соответствии с настоящим изобретением и эталонного соединения (±)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона.
По результатам выше упоминаемого испытания, подтверждено, что соединение в соответствии с настоящим изобретением характеризуется более высокой растворимостью в гликоле по сравнению с его рацематом. Соединения в соответствии с настоящим изобретением, следовательно, очевидно, характеризуется наличием предпочтительной ключевой особенности для получения композиции с использованием водорастворимого основания.
Результаты, получаемые в Примерах Испытаний 5 и 6 четко демонстрируют, что соединение в соответствии с настоящим изобретением характеризуется поразительно высокой растворимостью в водорастворимом основании или в воде, широко использующейся в общем случае в качестве основания. Соединения в соответствии с настоящим изобретением, характеризующиеся такой высокой растворимостью, достигают очень легкого изготовления препаратов для наружного применения при высоких концентрациях, таких как содержание 1% по массе или более указываемого соединения в качестве активного ингредиента.
Ниже дается объяснение Примеров Составления Рецептур фармацевтических средств, содержащих в своем составе в качестве активного ингредиента соединения в соответствии с настоящим изобретением, с конкретными примерами. Материалы, их количество и соотношение при использовании, способы, процедуры и подобные в нижеследующих Примерах Составления Рецептур могут быть модифицированы при сохранении цели настоящего изобретения. Объем настоящего изобретения не должны быть истолкован, следовательно, ограничительным образом со ссылкой на следующие конкретные примеры.
Пример Составления Рецептур 1 (1% по массе мазь)
Дозировка в 1 г мази
(1) Соединение (+)-(I) 10 мг
(2) Белый вазелин 990 мг
Компоненты (1) и (2) смешивают в расплаве при нагревании на воде (80°С), и перемешивают равномерно при охлаждении до затвердевания в целях изготовления.
Пример Составления Рецептур 2 (3% по массе мазь)
Дозировка в 1 г мази
(1) Соединение (+)-(I) 30 мг
(2) белый вазелин 970 мг
Компоненты (1) и (2) смешивают в расплаве при нагревании на воде (80°С), и перемешивают равномерно при охлаждении до затвердевания в целях изготовления.
Пример Составления Рецептур 3 (1% по массе мазь)
Дозировка в 1 г мази
(1) Соединение (+)-(I), 10 мг
(2) Белый вазелин, 250 мг
(3) Стеариловый спирт, 200 мг
(4) Пропиленгликоль, 120 мг
(5) Гидрированное полиоксиэтиленом касторовое масло, 40 мг
(6) Моностеарат глицерина, 10 мг
(7) Метилпараоксибензоат, 1 мг
(8) Пропилпараоксибензоат, 1 мг
(9) Очищенная вода, удовлетворяющее требованиям количество
Компоненты (1)-(3) смешивают в расплаве при нагревании на воде (при 80°С), добавляют раствор, нагретый до 80°С, в котором компоненты (4)-(8) растворяют в заранее в очищенной воде, и перемешивают равномерно при охлаждении до затвердевания в целях изготовления.
Пример Составления Рецептур 4 (3% по массе мазь)
Дозировка в 1 г мази
(1) Соединение (+)-(I), 30 мг
(2) Белый вазелин, 250 мг
(3) Стеариловый спирт, 200 мг
(4) Пропиленгликоль, 120 мг
(5) Гидрированное полиоксиэтиленом касторовое масло, 40 мг
(6) Моностеарат глицерина, 10 мг
(7) Метилпараоксибензоат, 1 мг
(8) Пропилпараоксибензоат, 1 мг
(9) Очищенная вода, удовлетворяющее требованиям количество
Компоненты (1)-(3) смешивают в расплаве при нагревании на воде (при 80°С), добавляют раствор, нагретый до 80°С, в котором компоненты (4)-(8) растворяют в заранее в очищенной воде, и перемешивают равномерно при охлаждении до затвердевания в целях изготовления.
Пример Составления Рецептур 5 (таблетка)
Дозировка в 1 г таблетки
(1) Соединение (+)-(I), 100 мг
(2) Лактоза, 308 мг
(3) Кальций карбоксиметилцеллюлоза, 30 мг
(4) Гидроксиметилцеллюлоза, 7 мг
(5) Стеарат магния, 5 мг
(6) Микрокристаллическая целлюлоза, 50 мг
Компоненты (1)-(4) и (6) перемешивают до однородного состояния и проводят гранулирование и просеивание. Компонент (5) добавляют и смешивают вместе и спрессовывают все вместе в целях изготовления.
Пример Составления Рецептур 6 (1% по массе жидкости)
Дозировка в 1 г жидкости
(1) Соединение (+)-(I), 10 мг
(2) Этанол , 500 мкг
(3) Глицерин, 200 мкг
(4) Пропиленгликоль, 200 мкг
(5) Очищенная вода, удовлетворяющее требованиям количество
Перемешивают компоненты (1)-(5) в целях изготовления.
Пример Составления Рецептур 7 (3% по массе жидкость)
Дозировка в 1 г жидкости
(1) Соединение (+)-(I), 30 мг
(2) Этанол, 500 мкг
(3) Глицерин, 200 мкг
(4) Пропиленгликоль, 200 мкг
(5) Очищенная вода, удовлетворяющее требованиям количество
Перемешивают компоненты (1)-(5) в целях изготовления.
Пример Составления Рецептур 8 (1% по массе эмульсионный лосьон)
Дозировка в 1 г лосьона
(1) Соединение (+)-(I), 10 мг
(2) Белый вазелин, 250 мг
(3) Стеариловый спирт, 50 мг
(4) Пропиленгликоль, 120 мг
(5) Гидрированное полиоксиэтиленом касторовое масло, 40 мг
(6) Моностеарат глицерина, 10 мг
(7) Метилпараоксобензоат, 1 мг
(8) Пропилпараоксобензоат, 1 мг
(9) Очищенная вода, удовлетворяющее требованиям количество
Компоненты (1)-(3) смешивают в расплаве при нагревании на воде (при 80°С), добавляют раствор, нагретый до 80°С, в котором компоненты (4)-(8) растворяют в заранее очищенной воде, и перемешивают равномерно при охлаждении до затвердевания в целях изготовления.
Пример Составления Рецептур 9 (3% по массе эмульсионного лосьона)
Дозировка в 1 г лосьона
(1) Соединение (+)-(I), 30 мг
(2) Белый вазелин, 250 мг
(3) Стеариловый спирт, 50 мг
(4) Пропиленгликоль, 120 мг
(5) Гидрированное полиоксиэтиленом касторовое масло, 40 мг
(6) Моностеарат глицерина, 10 мг
(7) Метилпараоксобензоат, 1 мг
(8) Пропилпараоксобензоат, 1 мг
(9) Очищенная вода, удовлетворяющее требованиям количество
Компоненты (1)-(3) смешивают в расплаве при нагревании на воде (при 80°С), добавляют раствор, нагретый до 80°С, в котором компоненты (4)-(8) растворяют в заранее очищенной воде, и перемешивают равномерно при охлаждении до затвердевания в целях изготовления.
[Промышленная применимость]
(+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион или его соль обладает превосходной селективной функцией ингибирования TACE, таким образом оно может быть успешно использовано в качестве активного ингредиента в составе фармацевтического средства для лечения и профилактики связанных с ФНО-альфа заболеваний.
Изобретение относится к (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диону или к его соли. Также предлагается лекарственное средство с ингибирующей активностью по отношению к ферменту, расщепляющему фактор-альфа некроза опухоли (ФНО-альфа) (TACE), включающее в качестве активного ингредиента (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион или его соль. Технический результат – получено новое соединение и фармацевтическое средство на его основе, которые могут найти применение в медицине для лечения псориаза. 5 н. и 15 з.п. ф-лы, 3 табл., 1 пр.
1. (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион или его соль.
2. Фармацевтическое средство с ингибирующей активностью по отношению к ферменту, расщепляющему фактор-альфа некроза опухоли (ФНО-альфа) (ТАСЕ), содержащее в качестве активного ингредиента соединение по п. 1 или его соль.
3. Фармацевтическое средство по п. 2, по существу не содержащее в своем составе (-)-изомер.
4. Фармацевтическое средство по п. 2 или 3, в котором 95% по массе или более от общего количества 5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона или его соли в фармацевтическом средстве представляет собой (+)-изомер.
5. Фармацевтическое средство по п. 4, в котором 98% по массе или более от общего количества 5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона или его соли в фармацевтическом средстве представляет собой (+)-изомер.
6. Фармацевтическое средство по п. 5, в котором 99,5% по массе или более от общего количества 5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона или его соли в фармацевтическом средстве представляет собой (+)-изомер.
7. Фармацевтическое средство по п. 2, где фармацевтическое средство представляет собой препарат наружного применения.
8. Фармацевтическое средство по п. 7, в котором препарат наружного применения выбран из группы, состоящей из лосьона, крема, жидкости и мази.
9. Фармацевтическое средство по п. 7 или 8, содержащее фармацевтически приемлемые гликоли.
10. Фармацевтическое средство по п. 9, в котором фармацевтически приемлемыми гликолями являются пропиленгликоль или бутиленгликоль.
11. Фармацевтическое средство по п. 7, включающее в свой состав воду.
12. Фармацевтическое средство по п. 7, включающее в качестве активного ингредиента 1% по массе или более (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона или его соли.
13. Фармацевтическое средство по п. 12, включающее в качестве активного ингредиента 3% по массе или более (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона или его соли.
14. Фармацевтическое средство по п. 2, которое наносят трансдермально.
15. Фармацевтическое средство по п. 2, в котором фармацевтическое средство является профилактическим или лечебным средством при кожных заболеваниях, где кожное заболевание представляет собой псориаз.
16. Способ изготовления (+)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона, включающий оптическое разделение рацемата(±)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона посредством хроматографии с использованием колонки для оптического разделения.
17. (+)-5-(3,4-Дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-дион, получаемый путем оптического разделения рацемической смеси (±)-5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона посредством хроматографии с использованием колонки для оптического разделения.
18. Смесь (+)- и (-)-изомеров 5-(3,4-дифторфенил)-5-[(3-метил-2-оксопиридин-1(2H)-ил)метил]имидазолидин-2,4-диона, в которой (+)-изомер присутствует в количестве 90% ее или более относительно (-)-изомера.
19. Смесь по п. 18, в которой (+)-изомер присутствует в количестве 96% ее или более относительно (-)-изомера.
20. Смесь по п. 18 или 19, в которой (+)-изомер присутствует в количестве 99% ее или более относительно (-)-изомера.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| RU 2003127732 A, 20.03.2005. | |||
Авторы
Даты
2018-09-27—Публикация
2014-06-06—Подача