ПЕРЕКРЕСТНАЯ ССЫЛКА НА СМЕЖНУЮ ЗАЯВКУ
Настоящая заявка испрашивает преимущество по предварительной заявке на патент США с серийным номером 61/643684, поданной 7 мая 2012 г., которая полностью включена в настоящий документ путем ссылки для любых целей.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области дифференцирования клеток. В частности, настоящее изобретение описывает диапазоны плотностей посева плюрипотентных клеток и/или клеток человека, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, подходящих для последующей эффективной генерации клеток, экспрессирующих маркеры, указывающие на панкреатическую энтодерму, и клеток, экспрессирующих маркеры, указывающие на эндокринную часть поджелудочной железы.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Последние достижения в области заместительной клеточной терапии для лечения сахарного диабета 1 типа и нехватка островков Лангерганса для трансплантации заставили обратить внимание на разработку источников инсулинпродуцирующих клеток или β-клеток, подходящих для приживления трансплантата. Одним из подходов является формирование функциональных β-клеток из плюрипотентных стволовых клеток, таких как, например, эмбриональные стволовые клетки.
При эмбриональном развитии позвоночных плюрипотентные клетки дают начало группе клеток, содержащих три зародышевых листка (эктодерму, мезодерму и энтодерму) в ходе процесса, именуемого гаструляцией. Ткани, такие как ткань щитовидной железы, вилочковой железы, поджелудочной железы, кишечника и печени, будут развиваться из энтодермы через промежуточную стадию. Промежуточной стадией данного способа является образование дефинитивной энтодермы. Клетки дефинитивной энтодермы экспрессируют некоторое число маркеров, таких как HNF3 бета, GATA4, MIXL1, CXCR4 и SOX17.
К концу гаструляции энтодерма разделяется на передний и задний домены, которые могут быть распознаны по экспрессии целого ряда факторов, однозначно выделяющих переднюю, среднюю и заднюю области энтодермы. Например, Hhex и Sox2 идентифицируют переднюю область, в то время как Cdx1, 2 и 4 идентифицируют заднюю половину энтодермы.
Миграция ткани энтодермы приводит энтодерму в непосредственную близость к различным мезодермальным тканям, которые способствуют регионализации кишечной трубки. Это достигается за счет целого ряда секретируемых факторов, таких как FGFs, Wnts, TGF-Bs, ретиноевой кислоты (RA), лигандов BMP и их антагонистов. Например, FGF4 и BMP способствуют экспрессии Cdx2 в предполагаемой энтодерме задней кишки и подавляют экспрессию передних генов Hhex и SOX2 (Development 2000 г., 127:1563-1567). Было продемонстрировано, что сигнализация WNT также действует параллельно с сигнализацией FGF, способствуя развитию задней кишки и препятствуя зачаткам передней кишки (Development 2007 г., 134:2207-2217). Наконец, ретиноевая кислота, секретируемая мезенхимой, регулирует границу между передней и задней кишкой (Curr Biol 2002 г., 12:1215-1220).
Уровень экспрессии специфических факторов транскрипции можно применять для определения типа ткани. Во время преобразования дефинитивной энтодермы в примитивную кишечную трубку кишечная трубка становится разделенной на широкие домены, которые можно наблюдать на молекулярном уровне с помощью ограниченных паттернов экспрессии генов. Например, регионализованный домен поджелудочной железы в кишечной трубке демонстрирует очень высокую экспрессию PDX-1 и очень низкую экспрессию CDX2 и SOX2. Аналогично наличие высоких уровней Foxe1 свидетельствует о ткани пищевода; в легочной ткани высок уровень экспрессии NKX2.1; в ткани желудка высок уровень экспрессии SOX2/Odd1 (OSR1); уровень экспрессии PROX1/Hhex/AFP высок в ткани печени; SOX17 имеет высокий уровень экспрессии в тканях желчного тракта; высок уровень экспрессии PDX1, NKX6.1/PTf1a и NKX2.2 в ткани поджелудочной железы; а уровень экспрессии CDX2 высок в ткани кишечника. Сводка, приведенная выше, взята из Dev Dyn 2009 г., 238:29-42 и Annu Rev Cell Dev Biol 2009 г., 25:221-251.
Формирование поджелудочной железы происходит в результате дифференцирования дефинитивной энтодермы в панкреатическую энтодерму (Annu Rev Cell Dev Biol 2009 г., 25:221-251; Dev Dyn 2009 г., 238:29-42). Дорсальный и вентральный домены поджелудочной железы формируются из эпителия передней кишки. Передняя кишка также дает начало формированию пищевода, трахеи, легких, щитовидной железы, желудка, печени, поджелудочной железы и системы желчных протоков.
Клетки панкреатической энтодермы экспрессируют панкреодуоденальный, содержащий гомеобокс, ген PDX1. В отсутствие PDX1 развитие поджелудочной железы не идет дальше формирования вентрального и дорсального зачатков. Таким образом, экспрессия PDX1 характеризует критическую стадию органогенеза поджелудочной железы. Зрелая поджелудочная железа содержит, помимо других типов клеток, экзокринную ткань и эндокринную ткань. Экзокринная и эндокринная ткани образуются при дифференцировании панкреатической энтодермы.
D’Amour et al. описывают производство обогащенных культур дефинитивной энтодермы, полученной из эмбриональных стволовых (ЭС) клеток человека при наличии высокой концентрации активина и низкой концентрации сыворотки (Nature Biotechnol 2005 г., 23:1534-1541; патент США № 7704738). Трансплантация этих клеток под капсулу почки у мышей приводила к дифференцированию в более зрелые клетки с характеристиками ткани энтодермы (патент США № 7704738). Клетки дефинитивной энтодермы, полученные из эмбриональных стволовых клеток человека, могут быть далее дифференцированы в PDX1-позитивные клетки после добавления FGF-10 и ретиноевой кислоты (патентная публикация США № 2005/0266554A1). Последующая трансплантация таких клеток-предшественников панкреатических клеток в жировое тело иммунодефицитных мышей привела к образованию функциональных панкреатических эндокринных клеток с последующей 3-4-месячной стадией матурации (патент США № 7993920 и патент США № 7534608).
Fisk et al. сообщают о системе получения клеток панкреатических островков из эмбриональных стволовых клеток человека (патент США № 7033831). В данном случае процесс дифференцирования был разделен на три стадии. Эмбриональные стволовые клетки человека сначала были дифференцированы в энтодерму при помощи комбинации бутирата натрия и активина A (патент США № 7326572). Затем клетки культивировали с антагонистами BMP, такими как Ноггин, в комбинации с EGF или бета-целлюлином для генерации PDX1-позитивных клеток. Окончательное дифференцирование запускали никотинамидом.
Ингибиторы в виде небольших молекул также применяли для индуцирования клеток-предшественников панкреатических эндокринных клеток. Например, ингибиторы в виде небольших молекул рецепторов TGF-B и рецепторов BMP (Development 2011 г., 138:861-871; Diabetes 2011 г., 60:239-247) применяли для значительного увеличения числа получаемых панкреатических эндокринных клеток. Кроме того, активирующие молекулы небольших размеров также применяли для генерирования клеток дефинитивной энтодермы или клеток-предшественников панкреатических клеток (Curr Opin Cell Biol 2009 г., 21:727-732; Nature Chem Biol 2009 г., 5:258-265).
Несмотря на значительные продвижения в совершенствовании протоколов генерации клеток поджелудочной железы из плюрипотентных стволовых клеток человека, существует значительная степень вариабельности в результатах, представляемых различными группами, в части эффективности генерации клеток поджелудочной железы из ЭС-клеток. Такую вариабельность связывали с различными факторами, например, с различиями в линиях ЭС-клеток, продолжительностью протокола, в том числе набором примененных реагентов, а также выбором адгезивных или суспензионных культур. В настоящем документе мы показываем, что несмотря на незначительную зависимость эффективности регулирования дифференцирования ЭС-клеток в дефинитивную энтодерму от плотности клеток эффективность генерации панкреатической энтодермы в значительной мере определяется исходной плотностью посева ЭС-клеток. В частности, исходные плотности посева клеток в диапазоне 0,8-2⋅105 клеток/см2 приводят к наибольшей экспрессии маркеров панкреатической энтодермы и эндокринной части поджелудочной железы.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном из вариантов осуществления настоящее изобретение относится к способу культивирования плюрипотентных стволовых клеток, включающему высевание плюрипотентных стволовых клеток на поверхности, причем упомянутые плюрипотентные стволовые клетки высевают с плотностью от приблизительно 0,8⋅105 клеток/см2 до приблизительно 3,0⋅105 клеток/см2. В некоторых вариантах осуществления культивируемые плюрипотентные стволовые клетки являются эмбриональными стволовыми клетками. В некоторых вариантах осуществления культивируемые плюрипотентные стволовые клетки являются эмбриональными стволовыми клетками человека. В некоторых вариантах осуществления поверхность, на которую высевают плюрипотентные стволовые клетки, содержит Matrigel™.
В одном из вариантов осуществления настоящее изобретение относится к способу дифференцирования плюрипотентных стволовых клеток, включающему высевание плюрипотентных стволовых клеток с плотностью от приблизительно 0,8⋅105 клеток/см2 до приблизительно 3,0⋅105 клеток/см2 на поверхности и дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму. В некоторых вариантах осуществления дифференцируемые плюрипотентные стволовые клетки являются эмбриональными стволовыми клетками. В некоторых вариантах осуществления дифференцируемые плюрипотентные стволовые клетки являются эмбриональными стволовыми клетками человека. В некоторых вариантах осуществления поверхность, на которую высевают плюрипотентные стволовые клетки, содержит Matrigel™. В некоторых вариантах осуществления клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, являются клетками человека.
В одном из вариантов осуществления настоящее изобретение относится к способу получения клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, включающему дифференцирование плюрипотентных стволовых клеток, высеваемых на поверхность с плотностью посева от приблизительно 0,8⋅105 клеток/см2 до приблизительно 3,0⋅105 клеток/см2. В некоторых вариантах осуществления плюрипотентные стволовые клетки, которые применяют в способе получения клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, являются эмбриональными стволовыми клетками. В некоторых вариантах осуществления эмбриональные стволовые клетки, которые применяют в способе получения клеток, экспрессирующих маркеры, характерные для дефинитивной энтодермы, являются эмбриональными стволовыми клетками человека. В некоторых вариантах осуществления плюрипотентные стволовые клетки высевают на поверхность, которая содержит Matrigel™. В некоторых вариантах осуществления клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, являются клетками человека.
В одном варианте осуществления настоящее изобретение относится к способу дифференцирования клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, включающему дифференцирование плюрипотентных стволовых клеток, которые высевают на первую поверхность с плотностью посева, достаточной для максимальной эффективности дифференцирования плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, и дифференцирование клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на панкреатическую энтодерму, посредством высевания клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, на вторую поверхность с плотностью посева, достаточной для максимальной эффективности дифференцирования клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, характерные для панкреатической энтодермы. В некоторых аспектах настоящего изобретения плотность посева, достаточная для максимальной эффективности дифференцирования плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, меняется в пределах от приблизительно 0,8⋅105 клеток/см2 до приблизительно 3,0⋅105 клеток/см2. В некоторых аспектах настоящего изобретения плотность посева, достаточная для максимальной эффективности дифференцирования клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, характерные для панкреатической энтодермы, меняется от приблизительно 1,5⋅105 клеток/см2 до приблизительно 5,0⋅105 клеток/см2. В некоторых вариантах осуществления плюрипотентные стволовые клетки, применяемые в способе дифференцирования клеток, являются эмбриональными стволовыми клетками. В некоторых вариантах осуществления настоящего изобретения эмбриональные стволовые клетки, применяемые в способе дифференцирования клеток, являются эмбриональными стволовыми клетками человека. В некоторых вариантах осуществления настоящего изобретения первая поверхность, на которую высевают плюрипотентные стволовые клетки, содержит Matrigel™. В некоторых вариантах осуществления настоящего изобретения вторая поверхность, на которую высевают клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, содержат Matrigel™. В некоторых вариантах осуществления настоящего изобретения клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, являются клетками человека. В некоторых вариантах осуществления настоящего изобретения клетки, экспрессирующие маркеры, указывающие на панкреатическую энтодерму, являются клетками человека.
В одном из вариантов осуществления настоящее изобретение относится к способу дифференцирования клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на эндокринную часть поджелудочной железы, включающему дифференцирование плюрипотентных стволовых клеток, которые высевают на поверхность с плотностью посева от приблизительно 0,8⋅105 клеток/см2 до приблизительно 3,0⋅105 клеток/см2, в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, и дифференцирование клеток, экспрессирующих маркеры дефинитивной энтодермы, в клетки, экспрессирующие маркеры, указывающие на эндокринную часть поджелудочной железы. В некоторых аспектах настоящего изобретения плюрипотентные стволовые клетки, которые применяют для дифференцирования в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, являются эмбриональными стволовыми клетками. В некоторых вариантах осуществления настоящего изобретения эмбриональные стволовые клетки, применяемые для дифференцирования в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, являются эмбриональными стволовыми клетками человека. В некоторых вариантах осуществления плюрипотентные стволовые клетки, которые применяют для дифференцирования в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, высевают на поверхность, которая содержит Matrigel™.
В одном из вариантов осуществления настоящее изобретение относится к способу получения клеток, экспрессирующих маркеры, указывающие на панкреатическую энтодерму, включающему высевание плюрипотентных стволовых клеток на поверхность, дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, высевание клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, на поверхность и дифференцирование клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на панкреатическую энтодерму. В некоторых аспектах настоящего изобретения плюрипотентные стволовые клетки, которые применяют в способе получения клеток, экспрессирующих маркеры, указывающие на панкреатическую энтодерму, высевают на поверхность с плотностью от приблизительно 0,8⋅105 клеток/см2 до приблизительно 3,0⋅105 клеток/см2. В некоторых аспектах настоящего изобретения клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, высевают на поверхность с плотностью от приблизительно 1,5⋅105 клеток/см2 до приблизительно 5,0⋅105 клеток/см2. В некоторых аспектах настоящего изобретения плюрипотентные стволовые клетки, дифференцируемые в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, являются эмбриональными стволовыми клетками. В некоторых аспектах настоящего изобретения эмбриональные стволовые клетки, дифференцируемые в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, являются эмбриональными стволовыми клетками человека. В некоторых аспектах настоящего изобретения плюрипотентные стволовые клетки высевают на поверхность, содержащую Matrigel™. В некоторых аспектах настоящего изобретения клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, высевают на поверхность, содержащую Matrigel™.
В одном из вариантов осуществления настоящее изобретение относится к способу получения клеток, экспрессирующих маркеры, указывающие на эндокринную часть поджелудочной железы, включающему высевание плюрипотентных стволовых клеток на поверхность; дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму; и дифференцирование клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на эндокринную часть поджелудочной железы. В некоторых аспектах настоящего изобретения плюрипотентные стволовые клетки, которые применяют в способе получения клеток, экспрессирующих маркеры, указывающие на панкреатическую энтодерму, высевают на поверхность с плотностью от приблизительно 0,8⋅105 клеток/см2 до приблизительно 3,0⋅105 клеток/см2. В некоторых аспектах настоящего изобретения клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, высевают на поверхность с плотностью от приблизительно 1,5⋅105 клеток/см2 до приблизительно 5,0⋅105 клеток/см2. В некоторых аспектах настоящего изобретения плюрипотентные стволовые клетки, дифференцируемые в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, являются эмбриональными стволовыми клетками. В некоторых аспектах настоящего изобретения эмбриональные стволовые клетки, дифференцируемые в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, являются эмбриональными стволовыми клетками человека. В некоторых аспектах настоящего изобретения плюрипотентные стволовые клетки высевают на поверхность, содержащую Matrigel™. В некоторых аспектах настоящего изобретения клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, высевают на поверхность, содержащую Matrigel™.
В одном из вариантов осуществления настоящее изобретение относится к способу дифференцирования клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, включающему высевание клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, на поверхность с плотностью посева от приблизительно 1,5⋅105 клеток/см2 до приблизительно 5,0⋅105 клеток/см2 и дифференцирование клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на панкреатическую энтодерму. В некоторых аспектах настоящего изобретения клетки являются клетками человека.
Настоящее изобретение относится к популяции клеток, экспрессирующих маркеры, указывающие на линию панкреатической энтодермы, получаемую in vitro постадийным дифференцированием от 0,8⋅105 плюрипотентных клеток/см2 до 3⋅105 плюрипотентных клеток/см2.
В одном из вариантов осуществления настоящего изобретения клетки, экспрессирующие маркеры, указывающие на линию панкреатических эндокринных клеток, получают in vitro постадийным дифференцированием от 0,8⋅105 плюрипотентных клеток/см2 до 3⋅105 плюрипотентных клеток/см2.
В одном из вариантов осуществления настоящего изобретения клетки, экспрессирующие маркеры, указывающие на линию панкреатической энтодермы, получают in vitro постадийным дифференцированием клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, высеваемых на поверхность с плотностью от 1,5⋅105 клеток/см2 до 5⋅105 клеток/см2.
В одном из вариантов осуществления настоящего изобретения клетки, экспрессирующие маркеры, указывающие на линию панкреатических эндокринных клеток, получают in vitro постадийным дифференцированием клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, высеваемых на поверхность с плотностью от 1,5⋅105 до 5⋅105 клеток/см2.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
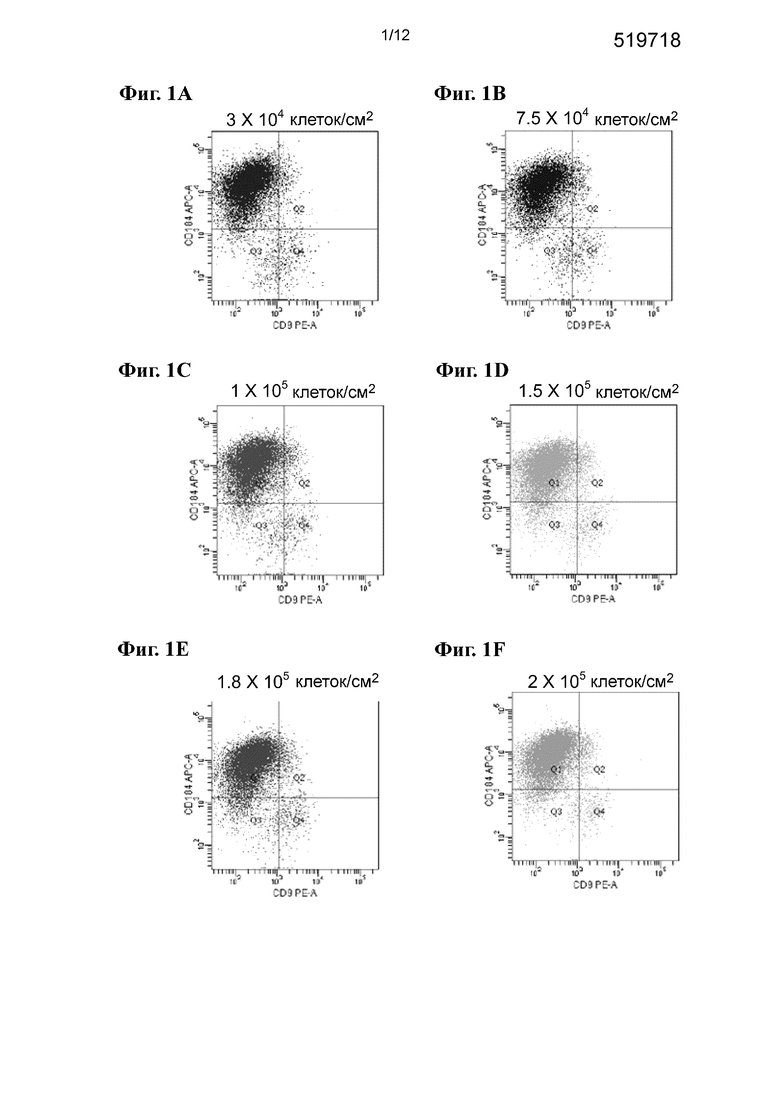
На фиг. 1А-1F приведена FACS-гистограмма профилей экспрессии CXCR4 (ось Y, маркер ДЭ) и CD-9 (ось X, маркер недифференцированных ЭС-клеток) для клеток H1, высеваемых с плотностью 0,3⋅105 клеток/см2 (фиг. 1A), 0,75⋅105 клеток/см2 (фиг. 1B), 1⋅105 клеток/см2 (фиг. 1C), 1,5⋅105 клеток/см2 (фиг. 1D), 1,8⋅105 клеток/см2 (фиг. 1E) и 2⋅105 клеток/см2 (фиг. 1F).
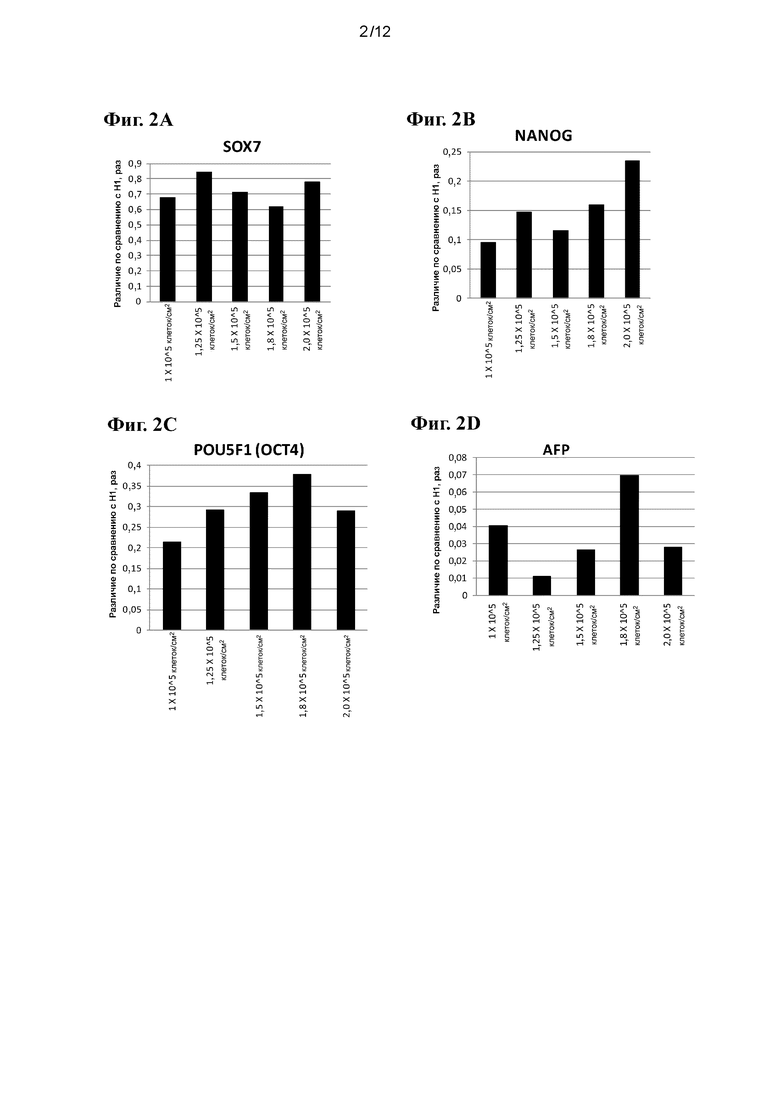
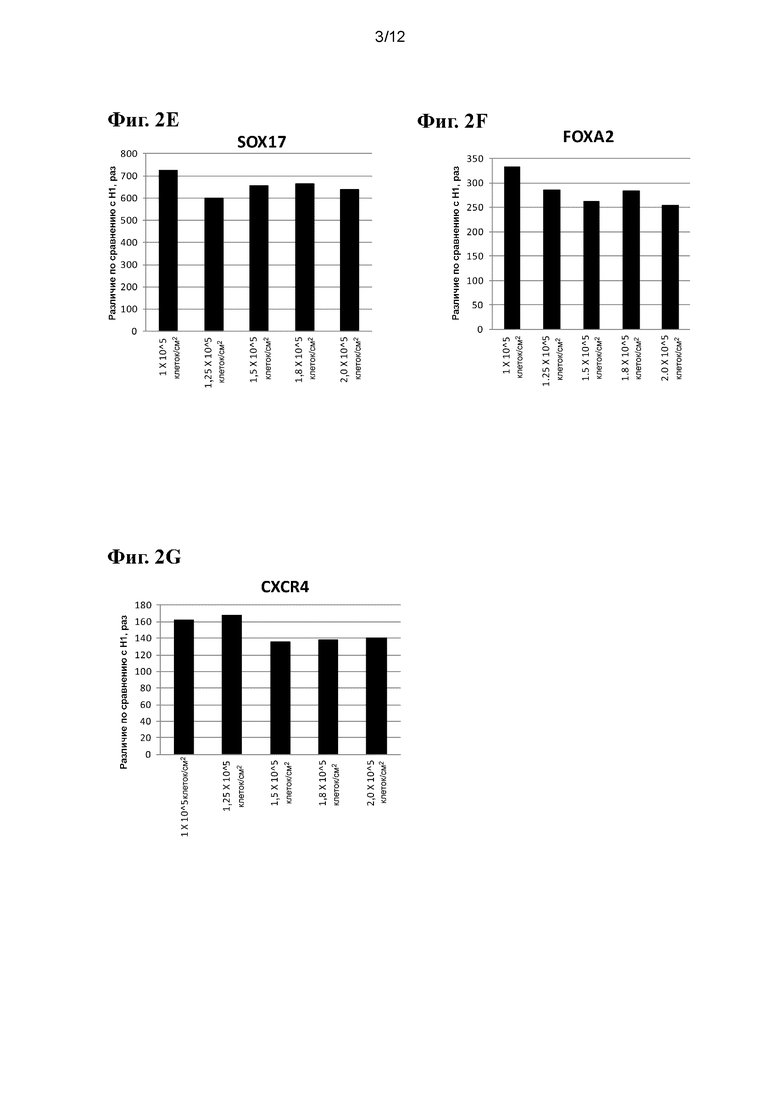
На фиг. 2A-2G приведены данные ПЦР в реальном времени при анализе экспрессии следующих генов в эмбриональных стволовых клетках человека линии Н1, высеваемых с различными плотностями и затем дифференцированных в ДЭ, как показано в примере 1: SOX7 (фиг. 2A), NANOG (фиг. 2B), OCT4 (фиг. 2C), AFP (фиг. 2D), SOX17 (фиг. 2E), FOXA2 (фиг. 2F) и CXCR4 (фиг. 2G).
На фиг. 3A-3H приведены фазоконтрастные изображения культур до индукции ДЭ, которые высевали с различными плотностями клеток: 0,3⋅105 клеток/см2 (фиг. 3A), 0,5⋅105 клеток/см2 (фиг. 3B), 0,75⋅105 клеток/см2 (фиг. 3C), 0,9⋅105 клеток/см2 (фиг. 3D), 1⋅105 клеток/см2 (фиг. 3E), 1,1⋅105 клеток/см2 (фиг. 3F), 1,2⋅105 клеток/см2 (фиг. 3G) и 1,5⋅105 клеток/см2 (фиг. 3H).
На фиг. 4A-4G приведены фазоконтрастные изображения культур ДЭ на день 4, которые первоначально высевали ЭС-клетками с различной плотностью клеток: 0,3⋅105 клеток/см2 (фиг. 4A), 0,5⋅105 клеток/см2 (фиг. 4B), 0,75⋅105 клеток/см2 (фиг. 4C), 1⋅105 клеток/см2 (фиг. 4D), 1,1⋅105 клеток/см2 (фиг. 4E), 1,2⋅105 клеток/см2 (фиг. 4F) и 1,5⋅105 клеток/см2 (фиг. 4G).
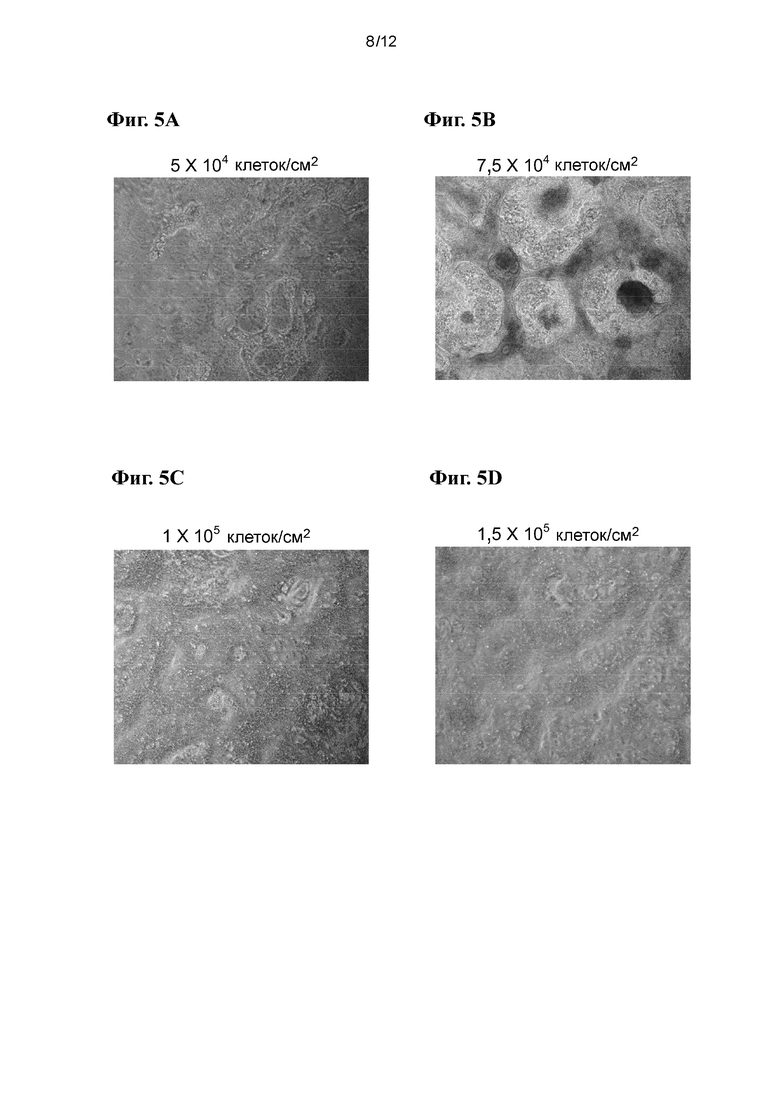
На фиг. 5A-5F приведены фазоконтрастные изображения культур на стадии 5, которые первоначально высевали ЭС-клетками с различной плотностью клеток: 5⋅104 клеток/см2 (фиг. 5A), 7,5⋅104 клеток/см2 (фиг. 5B), 1⋅105 клеток/см2 (фиг. 5C), 1,5⋅105 клеток/см2 (фиг. 5D), 1,8⋅105 клеток/см2 (фиг. 5E) и 2,0⋅105 клеток/см2 (фиг. 5F).
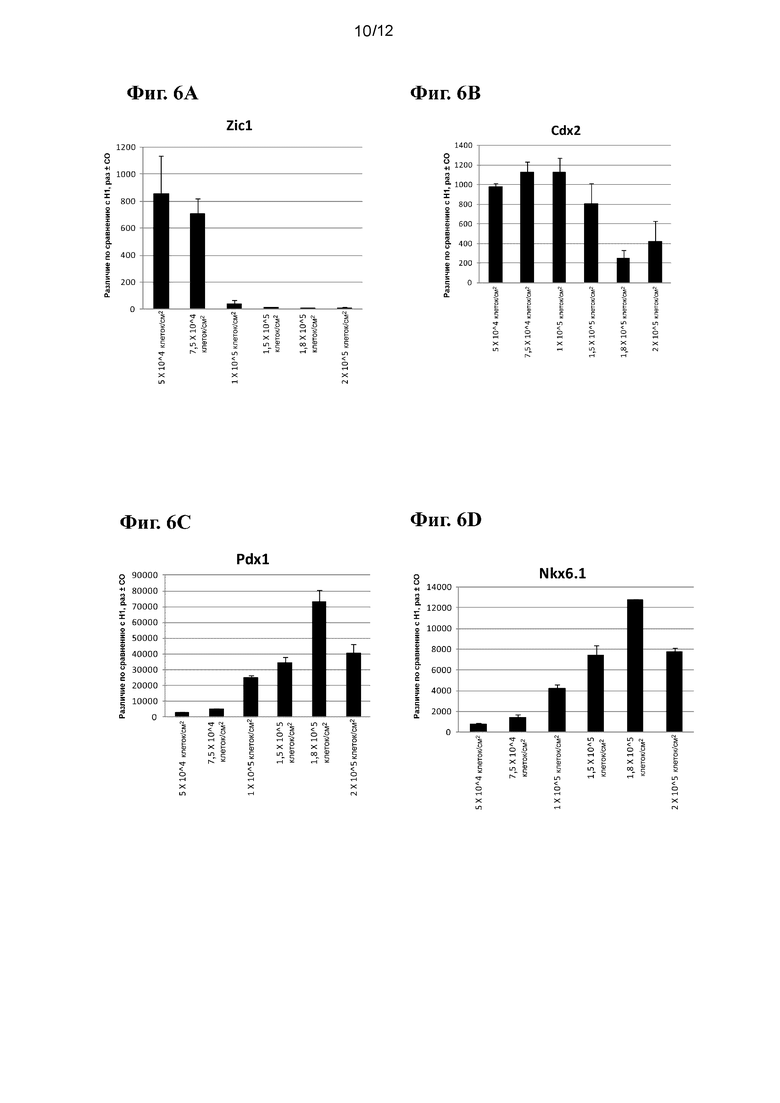
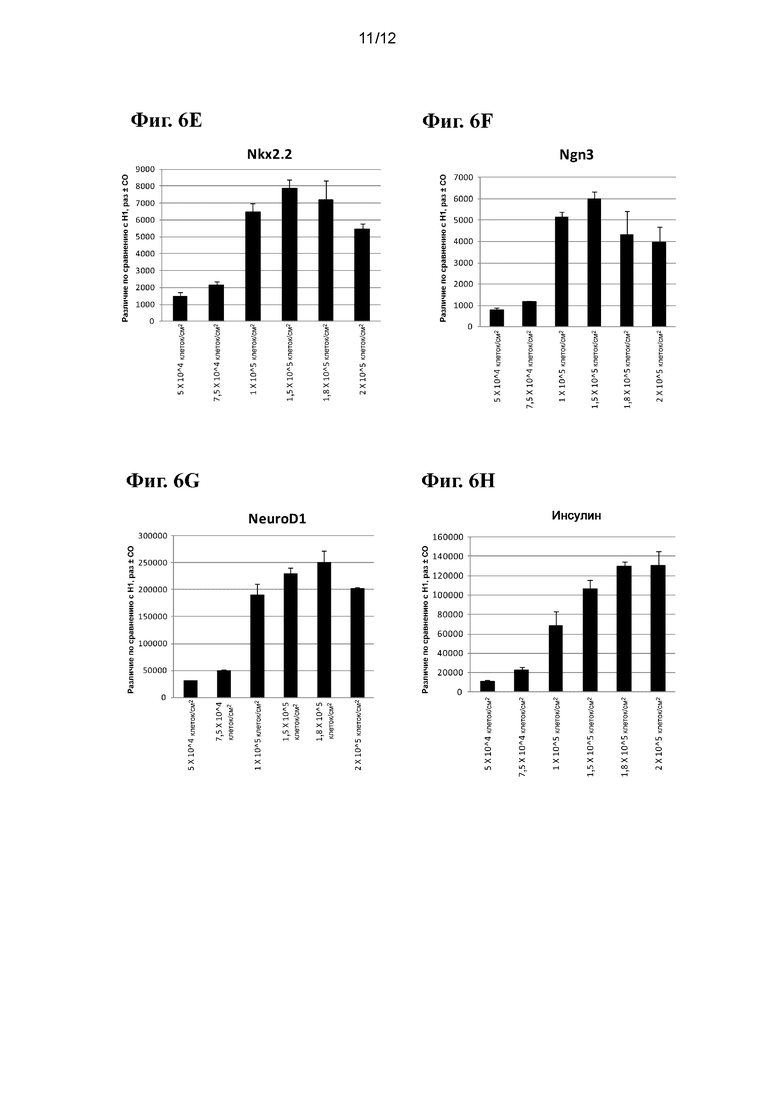
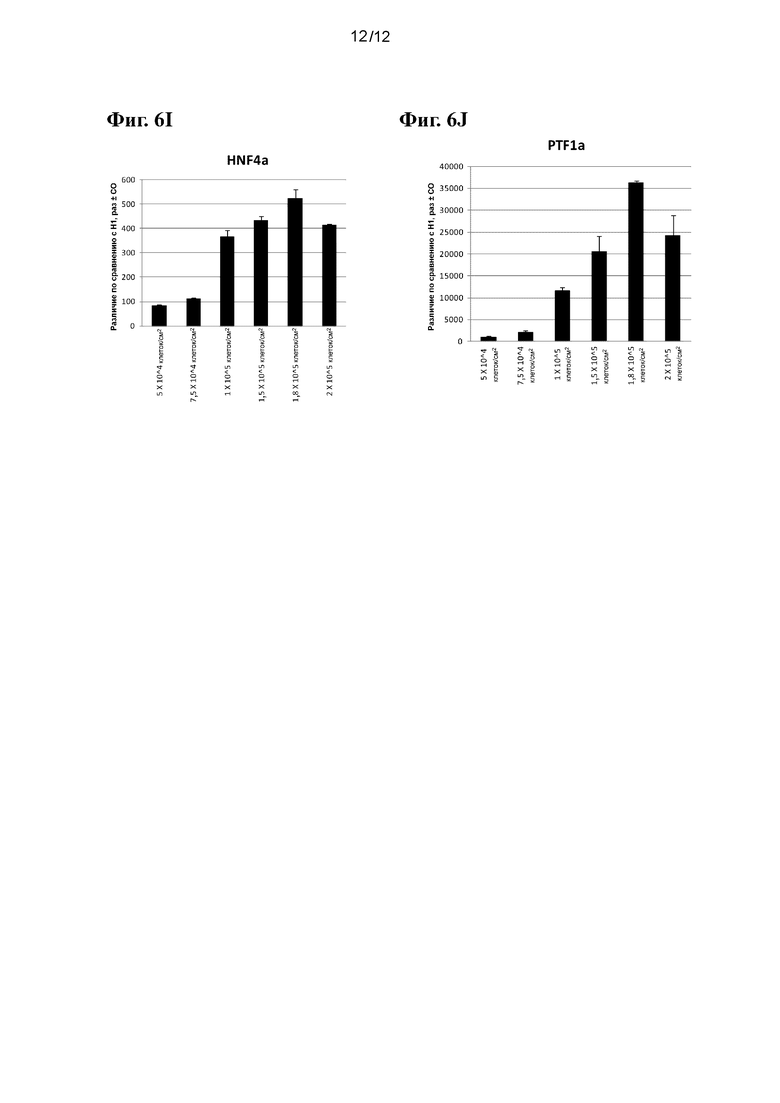
На фиг. 6А-6J приведены данные ПЦР в реальном времени при анализе экспрессии следующих генов в эмбриональных стволовых клетках человека линии Н1, высеваемых с различными плотностями и затем дифференцированных в стадию 5, как показано в примере 2: ZIC1 (фиг. 6A), CDX2 (фиг. 6B), PDX-1 (фиг. 6C), NKX6.1 (фиг. 6D), NKX2.2 (фиг. 6E), NGN3 (фиг. 6F), NEUROD (фиг. 6G), инсулин (фиг. 6H), HNF4a (фиг. 6I) и PTF1a (фиг. 6J).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для четкости описания, а не для ограничения настоящего изобретения, подробное описание настоящего изобретения разделено на следующие подразделы, описывающие или иллюстрирующие определенные особенности, варианты осуществления или области применения настоящего изобретения.
Определения
Стволовые клетки представляют собой недифференцированные клетки, определяемые как обладающие способностью на одноклеточном уровне к самообновлению и дифференциации. Стволовые клетки могут производить клетки-потомки, включая самообновляющиеся прогениторные клетки, необновляющиеся прогениторные клетки и окончательно дифференцированные клетки. Стволовые клетки также характеризуются своей способностью дифференцироваться in vitro в функциональные клетки различных линий дифференцирования из множества зародышевых листков (энтодермы, мезодермы и эктодермы). Стволовые клетки также дают начало тканям множества зародышевых листков после трансплантации и по существу вносят значительный вклад в образование большинства, если не всех, тканей после инъекции в бластоцисты.
По потенциалу развития стволовые клетки разделяют на: (1) тотипотентные, т.е. способные преобразоваться в любой из эмбриональных и внеэмбриональных типов клеток; (2) плюрипотентные, т.е. способные преобразоваться во все типы эмбриональных клеток; (3) мультипотентные, т.е. способные преобразоваться во множество клеточных линий дифференцирования, но в рамках одной ткани, органа или физиологической системы (например, гемопоэтические стволовые клетки (ГСК) могут порождать клетки-потомки, которые включают в себя ГСК (самообновление), олигопотентные ограниченные прогениторные клетки крови и все типы клеток и клеточные элементы (например, тромбоциты), являющиеся стандартными компонентами крови); (4) олигопотентные, т.е. способные преобразоваться в более ограниченное подмножество клеточных линий дифференцирования, чем мультипотентные стволовые клетки; и (5) унипотентные, т.е. способные преобразоваться в единственную клеточную линию дифференцирования (например, сперматогенные стволовые клетки).
Дифференцирование представляет собой процесс, посредством которого неспециализированная («некоммитированная») или менее специализированная клетка приобретает свойства специализированной клетки, например нервной клетки или мышечной клетки. Дифференцированная клетка, или клетка с индуцированным дифференцированием, представляет собой клетку, взятую на более специализированной («коммитированной») стадии клеточной линии дифференцирования. Термин «коммитированный» в применении к способу дифференцирования относится к клетке, которая прошла по пути дифференцирования до той стадии, на которой при нормальных условиях она продолжит дифференцироваться в клетку заданного типа или подмножества типов клеток и при этом не может в нормальных условиях дифференцироваться в клетку другого типа или возвратиться к клетке менее дифференцированного типа. «Дедифференцирование» относится к способу, посредством которого клетка возвращается на менее специализированную (или коммитированную) стадию клеточной линии дифференцирования. В настоящем документе термин «клеточная линия дифференцирования» определяет наследственность клетки, т.е. определяет, из какой клетки произошла данная клетка и каким клеткам она может дать начало. В клеточной линии дифференцирования клетку помещают в наследственную схему развития и дифференцирования. Маркером, специфичным для линии дифференцирования, называется характерная особенность, специфически ассоциированная с фенотипом клеток исследуемой линии дифференцирования, которую можно применять для оценки дифференцирования некоммитированных клеток в клетки исследуемой линии дифференцирования.
В настоящем документе термин «маркеры» означает молекулы нуклеиновых кислот или полипептидов с дифференциальной экспрессией в исследуемых клетках. В данном контексте под дифференциальной экспрессией понимают повышенный уровень положительного маркера и пониженный уровень отрицательного маркера по сравнению с недифференцированной клеткой. Поддающийся обнаружению уровень маркерной нуклеиновой кислоты или полипептида в исследуемых клетках оказывается значительно выше или ниже по сравнению с другими клетками, что позволяет идентифицировать исследуемую клетку и отличить ее от других клеток с помощью любого из множества известных в данной области способов.
В настоящем документе клетка «положительна по» заданному маркеру или «положительна», если заданный маркер обнаруживается в клетке. Аналогично клетка «отрицательна по» заданному маркеру или «отрицательна», если заданный маркер не обнаруживают в клетке.
В настоящем документе термины «плотность клеток» и «плотность посева» применяют взаимозаменяемо и относят к числу клеток, высеваемых на единицу поверхности плоского или искривленного субстрата.
В настоящем документе термины «стадия 1» и «S1» применяют взаимозаменяемо для обозначения клеток, экспрессирующих маркеры, характерные для дефинитивной энтодермы (ДЭ).
В настоящем документе термин «дефинитивная энтодерма» относится к клеткам, которые несут в себе характеристики клеток, появившихся из эпибласта во время гаструляции, и которые формируют желудочно-кишечный тракт и его производные. Клетки дефинитивной энтодермы экспрессируют по меньшей мере один из следующих маркеров: HNF3 бета, GATA4, SOX17, CXCR4, Cerberus, OTX2, goosecoid, C-Kit, CD99 и MIXL1.
В настоящем документе термин «кишечная трубка» относится к клеткам, полученным из дефинитивной энтодермы, экспрессирующим по меньшей мере один из следующих маркеров: HNF3 бета, HNF1 бета или HNF4 альфа. Клетки кишечной трубки могут дать начало всем энтодермальным органам, таким как легкие, печень, поджелудочная железа, желудок и кишечник.
В настоящем документе термины «стадия 2» и «S2» применяют взаимозаменяемо для обозначения клеток, экспрессирующих маркеры, характерные для примитивной кишечной трубки.
«Энтодерма передней кишки» относится к клеткам энтодермы, которые дают начало пищеводу, легким, желудку, печени, поджелудочной железе, желчному пузырю и части двенадцатиперстной кишки.
«Задняя часть передней кишки» относится к клеткам энтодермы, которые могут дать начало задней части желудка, поджелудочной железе, печени и части двенадцатиперстной кишки.
«Энтодерма средней кишки» относится к клеткам энтодермы, которые могут дать начало кишечнику, частям двенадцатиперстной кишки, аппендиксу и восходящей ободочной кишке.
«Энтодерма задней кишки» относится к клеткам энтодермы, которые могут дать начало дистальной трети поперечной ободочной кишки, нисходящей ободочной кишке, сигмовидной кишке и прямой кишке.
Термины «стадия 3» и «S3» применяют взаимозаменяемо для обозначения клеток, экспрессирующих маркеры, характерные для энтодермы передней кишки. В настоящем документе «клетки, экспрессирующие маркеры, характерные для линии дифференцирования передней кишки», относятся к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: PDX-1, FOXA2, CDX2, SOX2 и HNF4 альфа.
В настоящем документе термины «стадия 4» и «S4» применяют взаимозаменяемо для обозначения клеток, экспрессирующих маркеры, характерные для предшественников панкреатических клеток из передней кишки. В настоящем документе термин «клетки, экспрессирующие маркеры, характерные для линии предшественника панкреатической клетки из передней кишки» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: PDX-1, NKX6.1, HNF6, FOXA2, PTF1a, Prox1 и HNF4 альфа.
В настоящем документе термины «стадия 5» и «S5» применяют взаимозаменяемо для обозначения клеток, экспрессирующих маркеры, характерные для клеток панкреатической энтодермы и клеток-предшественников панкреатических эндокринных клеток. В настоящем документе термин «клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: PDX1, NKX6.1, HNF1 бета, PTF1 альфа, HNF6, HNF4 альфа, SOX9, HB9 или PROX1. Клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, по существу не экспрессируют CDX2 или SOX2.
В настоящем документе термины «панкреатическая эндокринная клетка», или «клетка, экспрессирующая гормон поджелудочной железы», или «клетка, экспрессирующая маркеры, характерные для линии панкреатических эндокринных клеток» относятся к клетке, способной экспрессировать по меньшей мере один из следующих гормонов: инсулин, глюкагон, соматостатин, грелин и полипептид поджелудочной железы.
«Клетка-предшественник панкреатической эндокринной клетки» или «прогениторная клетка панкреатической эндокринной клетки» относится к клеткам панкреатической энтодермы, обладающим возможностью стать панкреатической клеткой, экспрессирующей гормон. Такая клетка может экспрессировать по меньшей мере один из следующих маркеров: NGN3, NKX2.2, NeuroD, ISL-1, Pax4, Pax6 или ARX.
В настоящем документе взаимозаменяемо применяют «d1», «d 1» и «день 1»; «d2», «d 2» и «день 2»; «d3», «d 3» и «день 3» и так далее. Эти комбинации цифр и букв указывают день инкубации на различных стадиях во время постадийного протокола дифференцирования по данной заявке.
В настоящем документе термины «глюкоза» и «D-глюкоза» применяют взаимозаменяемо, и они относятся к декстрозе, сахару, обычно встречающемуся в природе.
В настоящем документе термины «NeuroD» и «NeuroD1» применяют взаимозаменяемо для обозначения белка, экспрессируемого в прогениторных клетках панкреатических эндокринных клеток, и гена, кодирующего его.
В настоящем документе термины «LDN» и «LDN-193189» применяют взаимозаменяемо для обозначения ингибитора рецептора BMP, выпускаемого Stemgent, штат Калифорния, США.
Выделение, размножение и культивирование плюрипотентных стволовых клеток
Плюрипотентные стволовые клетки могут экспрессировать один или более стадиеспецифический эмбриональный антиген (SSEA) 3 и 4, а также маркеры, определяемые антителами, обозначаемыми как Tra-1-60 и Tra-1-81 (Thomson et al., 1998 г. Science 282:1145-1147). Дифференцирование плюрипотентных стволовых клеток in vitro приводит к потере экспрессии SSEA-4, Tra-1-60 и Tra-1-81. Недифференцированные плюрипотентные стволовые клетки, как правило, имеют щелочнофосфатазную активность, которую можно обнаружить путем обработки клеток 4%-м раствором параформальдегида, а затем выращивая с Vector Red в качестве субстрата, как описано производителем (Vector Laboratories, штат Калифорния, США). Недифференцированные плюрипотентные стволовые клетки также, как правило, экспрессируют OCT4 и TERT, как обнаружено с помощью ОТ-ПЦР.
Другим желательным фенотипическим свойством выращенных плюрипотентных клеток является потенциал дифференцирования в клетки всех трех зародышевых листков: в энтодермальные, мезодермальные и эктодермальные ткани. Плюрипотентность стволовых клеток может быть подтверждена, например, путем инъекции клеток мышам с тяжелым комбинированным иммунодефицитом (SCID), обработкой всех образующихся тератом 4%-м раствором параформальдегида, а затем гистологическим исследованием на наличие типов клеток из трех зародышевых листков. Альтернативно плюрипотентность можно определить по созданию эмбриоидных телец и их анализу на предмет наличия маркеров, ассоциированных с тремя зародышевыми листками.
Выращенные линии плюрипотентных стволовых клеток могут быть кариотипированы с применением стандартного способа окрашивания красителем Гимзы (G-banding) и сравнены с опубликованными кариотипами соответствующих видов приматов. Желательно получить клетки, имеющие «нормальный кариотип», т.е. эуплоидные клетки, в которых все хромосомы человека присутствуют и не имеют видимых изменений. Плюрипотентные клетки можно легко размножить в культуре путем применения различных питательных слоев или с помощью сосудов, покрытых матриксными белками. Альтернативно химически определенные поверхности в комбинации со средами определенного состава, такими как среды mTeSR®1 (StemCell Technologies, г. Ванкувер, Канада), можно применять для обычного размножения клеток. Плюрипотентные клетки можно легко удалить из планшетов с культурой посредством ферментативной, механической обработки или с применением различных кальцийхелатирующих агентов, таких как EDTA (этилендиаминтетрауксусная кислота). Альтернативно плюрипотентные клетки можно размножить в суспензии в отсутствие каких-либо матриксных белков или питательного слоя.
Источники плюрипотентных стволовых клеток
Типы плюрипотентных стволовых клеток, которые можно применять, могут включать в себя устойчивые линии плюрипотентных клеток, полученных из тканей, образованных после беременности, в том числе преэмбриональной ткани (такой как, например, бластоцист), эмбриональной ткани или ткани плода, взятой в любой момент во время беременности, как правило, но не обязательно перед сроком приблизительно от 10 до 12 недель беременности. Не имеющими ограничительного характера примерами являются устойчивые линии эмбриональных стволовых клеток человека (hESC) или эмбриональные зародышевые клетки человека, такие как, например, эмбриональные стволовые клетки человека линий H1, H7 и H9 (WiCell Research Institute, г. Мэдисон, штат Висконсин, США). Также подходящими для целей настоящего изобретения являются клетки, взятые из популяции плюрипотентных стволовых клеток, уже культивированных в отсутствие питающих клеток. Также подходящими являются индуцибельные плюрипотентные клетки (IPS) или перепрограммированные плюрипотентные клетки, которые могут быть получены из взрослых соматических клеток с помощью принудительной экспрессии ряда факторов, относящихся к плюрипотентным транскрипционным факторам, таким как OCT4, Nanog, Sox2, KLF4 и ZFP42 (Annu Rev Genomics Hum Genet 2011 г., 12:165-185). Эмбриональные стволовые клетки человека, применяемые в способах настоящего изобретения, также могут быть подготовлены, как описано в работе Thomson et al. (патент США № 5843780; Science, 1998 г., 282:1145-1147; Curr Top Dev Biol 1998 г., 38:133-165; Proc Natl Acad Sci U.S.A. 1995 г., 92:7844-7848).
Формирование клеток, экспрессирующих маркеры, характерные для линии дифференцирования панкреатической энтодермы, из плюрипотентных стволовых клеток
Характеристики плюрипотентных стволовых клеток хорошо известны специалистам в данной области, и продолжается выявление дополнительных характеристик плюрипотентных стволовых клеток. Маркеры плюрипотентных стволовых клеток включают в себя, например, экспрессию одного или более из следующих маркеров: ABCG2, cripto, FOXD3, коннексин 43, коннексин 45, OCT4, SOX2, NANOG, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, Tra 1-60, Tra 1-81.
Плюрипотентные стволовые клетки, подходящие для применения в настоящем изобретении, включают в себя, например, эмбриональные стволовые клетки человека линии H9 (код NIH: WA09), эмбриональные стволовые клетки человека линии H1 (код NIH: WA01), эмбриональные стволовые клетки человека линии H7 (код NIH: WA07) и эмбриональные стволовые клетки человека линии SA002 (Cellartis, Швеция). Также подходящими для применения в рамках настоящего изобретения являются клетки, экспрессирующие по меньшей мере один из следующих маркеров, характерных для плюрипотентных клеток: ABCG2, cripto, CD9, FOXD3, коннексин 43, коннексин 45, OCT4, SOX2, NANOG, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, Tra 1-60 и Tra 1-81.
Маркеры, характерные для линии дифференцирования дефинитивной энтодермы, выбраны из группы, состоящей из SOX17, GATA4, HNF3 бета, GSC, CER1, Nodal, FGF8, Brachyury, Mix-подобного гомеобоксного белка, FGF4, CD48, эомезодермина (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 и Otx2. Подходящими для применения в рамках настоящего изобретения являются клетки с экспрессией по меньшей мере одного из маркеров, характерных для линии дифференцирования дефинитивной энтодермы. В одном из аспектов настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии дифференцирования дефинитивной энтодермы, представляет собой клетку-предшественника первичной полоски. В другом аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии дифференцирования дефинитивной энтодермы, представляет собой мезэнтодермальную клетку. В другом аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии дифференцирования дефинитивной энтодермы, представляет собой клетку дефинитивной энтодермы.
Маркеры, характерные для линии панкреатической энтодермы, выбирают из группы, состоящей из PDX1, NKX6.1, HNF1 бета, PTF1 альфа, HNF6, HNF4 альфа, SOX9, HB9 и PROX1. Подходящими для применения в рамках настоящего изобретения являются клетки с экспрессией по меньшей мере одного из маркеров, характерных для линии панкреатической энтодермы. В одном из аспектов настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, представляют собой клетки панкреатической энтодермы, в которых экспрессия PDX-1 и NKX6.1 по существу превышает экспрессию CDX2 и SOX2.
Маркеры, характерные для линии панкреатических эндокринных клеток, выбирают из группы, состоящей из NGN3, NEUROD, ISL1, PDX1, NKX6.1, PAX4, ARX, NKX2.2 и PAX6. В одном варианте осуществления настоящего изобретения панкреатическая эндокринная клетка способна к экспрессии по меньшей мере одного из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид. Подходящей для применения в рамках настоящего изобретения является клетка, экспрессирующая по меньшей мере один из маркеров, характерных для линии панкреатических эндокринных клеток. В одном из аспектов настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии панкреатических эндокринных клеток, представляет собой панкреатическую эндокринную клетку. Упомянутая панкреатическая эндокринная клетка может представлять собой панкреатическую клетку, экспрессирующую гормоны. Альтернативно упомянутая панкреатическая эндокринная клетка может представлять собой панкреатическую клетку, секретирующую гормоны.
В одном аспекте настоящего изобретения панкреатическая эндокринная клетка представляет собой клетку с экспрессией маркеров, характерных для линии дифференцирования β-клеток. Клетка с экспрессией маркеров, характерных для линии дифференцирования β-клеток, экспрессирует PDX1 и по меньшей мере один из следующих транскрипционных факторов: NKX2.2, NKX6.1, NEUROD, ISL1, HNF3 бета, MAFA, PAX4 и PAX6. В одном аспекте настоящего изобретения клетка с экспрессией маркеров, характерных для линии дифференцирования β-клеток, представляет собой β-клетку.
В настоящем изобретении изложен способ культивирования плюрипотентных стволовых клеток человека, включающий высевание плюрипотентных стволовых клеток человека на поверхность с плотностью от приблизительно 0,8⋅105 клеток/см2 до приблизительно 3,0⋅105 клеток/см2. В одном аспекте настоящего изобретения плюрипотентные стволовые клетки человека являются эмбриональными стволовыми клетками человека. В некоторых аспектах настоящего изобретения поверхность, на которую высевают клетки, содержит Matrigel™.
В одном из аспектов настоящее изобретение относится к способу дифференцирования плюрипотентных стволовых клеток. Такой способ включает высевание плюрипотентных стволовых клеток с плотностью от приблизительно 0,8⋅105 клеток/см2 до приблизительно 3,0⋅105 клеток/см2 на поверхности, а затем дифференцирование плюрипотентных клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму. В некоторых аспектах настоящего изобретения плюрипотентные клетки являются эмбриональными стволовыми клетками. В некоторых аспектах настоящего изобретения эмбриональные стволовые клетки являются эмбриональными стволовыми клетками человека. В некоторых аспектах настоящего изобретения поверхность, на которую высевают клетки, содержит Matrigel™.
Настоящее изобретение относится к способу получения клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, посредством дифференцирования эмбриональных плюрипотентных стволовых клеток человека, которые высевают на поверхность с плотностью посева от приблизительно 0,8⋅105 клеток/см2 до приблизительно 3,0⋅105 клеток/см2. В некоторых аспектах настоящего изобретения поверхность, на которую высевают клетки, содержит Matrigel™.
В одном аспекте настоящее изобретение относится к способу дифференцирования клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму человека, включающему дифференцирование эмбриональных плюрипотентных стволовых клеток человека, которые высевали на первую поверхность с плотностью посева, достаточной для максимального дифференцирования плюрипотентных клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму; и дифференцирование клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, высеваемых на вторую поверхность с плотностью посева, достаточной для максимальной эффективности дифференцирования в клетки, экспрессирующие маркеры, указывающие на панкреатическую энтодерму. В некоторых вариантах осуществления плюрипотентные стволовые клетки высевают с плотностью посева от приблизительно 0,8⋅105 клеток/см2 до приблизительно 3,0⋅105 клеток/см2. В некоторых вариантах осуществления клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, высевают на поверхность с плотностью посева от приблизительно 1,5⋅105 клеток/см2 до приблизительно 5,0⋅105 клеток/см2. В некоторых аспектах плюрипотентные клетки в способе дифференцирования клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму человека, содержат применение эмбриональных стволовых клеток. В некоторых аспектах настоящего изобретения эмбриональные стволовые клетки являются эмбриональными стволовыми клетками человека. В некоторых аспектах настоящего изобретения поверхности, на которые высевают клетки, содержат Matrigel™.
Настоящее изобретение относится к способу получения клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, которые были получены дифференцированием плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на эндокринную часть поджелудочной железы. При этом плюрипотентные стволовые клетки высевали на поверхность с плотностью посева от приблизительно 0,8⋅105 клеток/см2 до приблизительно 3,0⋅105 клеток/см2. В некоторых аспектах настоящего изобретения применяемые плюрипотентные стволовые клетки являются эмбриональными стволовыми клетками. В некоторых аспектах настоящего изобретения применяемые эмбриональные стволовые клетки являются эмбриональными стволовыми клетками человека. В некоторых аспектах настоящего изобретения поверхности, на которые высевают клетки, содержат Matrigel™.
В одном из аспектов настоящее изобретение относится к способу получения клеток, экспрессирующих маркеры, указывающие на панкреатическую энтодерму, включающему высевание плюрипотентных стволовых клеток на поверхность; дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму; и дифференцирование клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на панкреатическую энтодерму. В некоторых аспектах настоящего изобретения плюрипотентные стволовые клетки высевают с плотностью от приблизительно 0,8⋅105 клеток/см2 до приблизительно 3,0⋅105 клеток/см2. В некоторых аспектах настоящего изобретения клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, высевают с плотностью от приблизительно 1,5⋅105 клеток/см2 до приблизительно 5,0⋅105 клеток/см2. В некоторых аспектах настоящего изобретения плюрипотентные стволовые клетки являются эмбриональными стволовыми клетками. В некоторых аспектах настоящего изобретения эмбриональные стволовые клетки являются эмбриональными стволовыми клетками человека. В некоторых аспектах настоящего изобретения поверхности, на которые высевают клетки, содержат Matrigel™.
В одном из аспектов настоящее изобретение относится к способу получения клеток, экспрессирующих маркеры, указывающие на линию панкреатических эндокринных клеток, включающему высевание плюрипотентных стволовых клеток на поверхность; дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму; и дифференцирование клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на эндокринную часть поджелудочной железы. В некоторых аспектах настоящего изобретения плюрипотентные стволовые клетки, которые применяют в способе получения клеток, экспрессирующих маркеры, указывающие на линию панкреатических эндокринных клеток, высевают на поверхность с плотностью от приблизительно 0,8⋅105 клеток/см2 до приблизительно 3,0⋅105 клеток/см2. В некоторых аспектах настоящего изобретения клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, высевают с плотностью от приблизительно 1,5⋅105 клеток/см2 до приблизительно 5,0⋅105 клеток/см2. В некоторых аспектах настоящего изобретения плюрипотентные стволовые клетки являются эмбриональными стволовыми клетками. В некоторых аспектах настоящего изобретения эмбриональные стволовые клетки являются эмбриональными стволовыми клетками человека. В некоторых аспектах настоящего изобретения поверхности, на которые высевают клетки, содержат Matrigel™.
В одном из аспектов настоящее изобретение относится к способу дифференцирования клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, включающему высевание клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, на поверхность с плотностью посева от приблизительно 1,5⋅105 клеток/см2 до приблизительно 5,0⋅105 клеток/см2, а затем дифференцирование клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на панкреатическую энтодерму. В некоторых аспектах настоящего изобретения клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, которые применяют в данном способе, являются клетками человека, экспрессирующими маркеры, указывающие на дефинитивную энтодерму. В некоторых аспектах настоящего изобретения клетки, экспрессирующие маркеры, указывающие на панкреатическую энтодерму, являются клетками человека.
В одном из аспектов настоящее изобретение относится к способу дифференцирования клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, высеваемых на поверхность с плотностью посева от приблизительно 1,5⋅105 клеток/см2 до приблизительно 5,0⋅105 клеток/см2, а затем дифференцирование клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на эндокринную часть поджелудочной железы. В некоторых аспектах клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, являются клетками человека. В некоторых аспектах клетки, экспрессирующие маркеры, указывающие на эндокринную часть поджелудочной железы, являются клетками человека.
В настоящем изобретении описывается диапазон плотностей ЭС-клеток, которые можно эффективно дифференцировать в линии панкреатической энтодермы и панкреатических эндокринных клеток.
В другом аспекте настоящего изобретения описывается диапазон плотностей ДЭ-клеток, которые можно эффективно дифференцировать в линии панкреатической энтодермы и панкреатических эндокринных клеток.
Публикации, цитируемые в настоящем документе, включены в настоящий документ путем ссылки. Настоящее изобретение дополнительно иллюстрируется, среди прочего, следующими примерами.
ПРИМЕРЫ
Пример 1
Плотность посева эмбриональных стволовых клеток не оказывает существенного влияния на экспрессию маркеров дефинитивной энтодермы
Настоящий пример выполняли для того, чтобы выяснить, будет ли исходная плотность посева ЭС-клеток существенно влиять на продукцию клеток линии дифференцирования дефинитивной энтодермы.
Клетки эмбриональных стволовых клеток человека линии H1 (hESC H1) были собраны после нескольких пассажей (пассажи 40-52) и были посеяны как единичные клетки при следующих значениях плотности: 0,3⋅105 клеток/см2, 0,5⋅105 клеток/см2, 0,75⋅105 клеток/см2, 0,9⋅105 клеток/см2, 1⋅105 клеток/см2, 1,25⋅105 клеток/см2, 1,5⋅105 клеток/см2, 1,8⋅105 клеток/см2 и 2⋅105 клеток/см2 на чашках для культивирования, покрытых Matrigel™ (разведение 1:30; BD Biosciences, г. Франклин-Лейкс, штат Нью-Джерси), в среде mTeSR®1 (StemCell Technologies, г. Ванкувер, Канада) или MEF-CM (кондиционированные среды) с добавкой 10 мкМ Y27632 (Rock inhibitor, № по каталогу Y0503, SigmaAldrich, г. Сент-Луис, штат Миссури). Спустя сорок восемь часов после высевания культуры были промыты и инкубированы в неполном солевом растворе PBS (фосфатно-солевом буферном растворе без Mg или Ca) в течение приблизительно 30 секунд. Культуры дифференцировали в линию дифференцирования дефинитивной энтодермы (ДЭ) следующим образом.
Стадия 1 (дефинитивная энтодерма (ДЭ)-4 дня). Клетки были культивированы на протяжении одного дня в среде стадии 1: среда MCDB-131 (№ по каталогу 10372-019, Invitrogen, г. Карлсбад, штат Калифорния) с добавкой 2%-го БСА без жирных кислот (№ по каталогу 68700, Proliant, г. Энкени, штат Айова), 0,0012 г/мл бикарбоната натрия (№ по каталогу S3187, SigmaAldrich), 1 х GlutaMax™ (№ по каталогу 35050-079, Invitrogen), 2,5 мM D-глюкозы (№ по каталогу G8769, SigmaAldrich), 1:50000 х ITS-X (Invitrogen), 100 нг/мл GDF8 (R&D Systems, г. Миннеаполис, штат Миннесота) и 2,5 мкМ композиции MCX (ингибитор GSK3B, 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазотетрацикло [19.3.1.1~2,6~0,1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-он, публикация заявки на патент США № 2010-0015711; включено в настоящий документ путем ссылки в полном объеме). Затем клетки дополнительно культивировали на протяжении трех дней в среде MCDB-131 с добавкой 2%-го БСА без жирных кислот, 0,0012 г/мл бикарбоната натрия, 1 х GlutaMax™, 2,5 мM D-глюкозы, 100 нг/мл GDF8 и 1:50000 х ITS-X.
В конце стадии ДЭ образцы собирали и анализировали с помощью ПЦР в реальном времени и флуоресцентно-активированной сортировки клеток (FACS). Клетки, полученные из клеток hESC, готовили в форме одноклеточной суспензии инкубацией в TrypLE Express (Invitrogen, № по каталогу 12604) при 37°C в течение 3-5 минут, а затем параллельно считали с помощью гемоцитометра. Затем клетки дважды промывали в буферном растворе для окрашивания (PBS, содержащий 0,2%-й БСА) (BD Biosciences, № по каталогу 554657). Для окрашивания маркера клеточной поверхности от 1⋅105 до 1⋅106 клеток ресуспендировали в 100 мкл блокирующего буферного раствора (0,5%-го человеческого гамма-глобулина, разбавленного 1:4 в буферном растворе для окрашивания). Непосредственно конъюгированные первичные антитела CD184 APC (аллофикоцианин, BD Biosciences, № по каталогу 555976) и CD9 PE (BD Biosciences, № по каталогу 555372) добавляли к клеткам при конечном разбавлении 1:20 и инкубировали в течение 30 минут при 4°C. Окрашенные клетки дважды отмывали в буферном растворе для окрашивания BD, ресуспендировали в 200 мкл буферного раствора для окрашивания с последующей инкубацией в 15 мкл 7AAD для дискриминации живых и мертвых клеток до проведения анализа с помощью BD FACS Canto.
Суммарную РНК экстрагировали с помощью набора RNeasy Mini Kit (Qiagen, г. Валенсия, штат Калифорния) и обратно транскрибировали с помощью набора High Capacity cDNA Reverse Transcription Kit (Applied Biosystems, г. Фостер-Сити, штат Калифорния) в соответствии с инструкциями изготовителя. кДНК амплифицировали с помощью систем Taqman Universal Master Mix и Taqman Gene Expression Assays, которые предварительно наносили на специализированные чипы Taqman Arrays (Applied Biosystems). Данные анализировали с помощью программного обеспечения Sequence Detection Software (Applied Biosystems) и нормализовали для недифференцированных эмбриональных стволовых клеток человека (hES) с применением способа ΔΔCt. Все праймеры приобретали в Applied Biosystems.
На фиг. 1А-1F приведена FACS-гистограмма профилей экспрессии CXCR4 (ось Y, маркер ДЭ) и CD-9 (ось X, маркер недифференцированных ЭС-клеток) для клеток H1 с плотностью посева 0,3⋅105 клеток/см2 (фиг. 1A), 0,75⋅105 клеток/см2 (фиг. 1B), 1⋅105 клеток/см2 (фиг. 1C), 1,5⋅105 клеток/см2 (фиг. 1D), 1,8⋅105 клеток/см2 (фиг. 1E) и 2⋅105 клеток/см2 (фиг. 1F). Данные по проценту экспрессии CXCR4 и CD9 приведены в таблице I. Как видно из фиг. 1 и таблицы I, исходная плотность посева недифференцированных ЭС-клеток не оказывает существенного воздействия на последующее дифференцирование в дефинитивную энтодерму, что измеряют по повышению экспрессии CXCR4 и снижению экспрессии CD9.
Влияние плотности посева ЭС-клеток на экспрессию маркера CXCR4 дефинитивной энтодермы
Плотность клеток (клеток/см2)
Плотность клеток (клеток/см2)
На фиг. 2A-2G приведены данные ПЦР в реальном времени при анализе экспрессии следующих генов в эмбриональных стволовых клетках человека линии Н1, высеваемых с различными плотностями и затем дифференцированных в ДЭ, как показано в примере 1: SOX7 (фиг. 2A), NANOG (фиг. 2B), OCT4 (фиг. 2C), AFP (фиг. 2D), SOX17 (фиг. 2E), FOXA2 (фиг. 2F) и CXCR4 (фиг. 2G). Согласно данным FACS, не наблюдалось заметных различий между генами, которые обычно экспрессируются на стадии ДЭ (CXCR4, SOX17, FOXA2), для клеток H1, высеваемых с различными плотностями на поверхностях, покрытых Matrigel™. Более того, исходная плотность посева не оказывает существенного воздействия на гены, ассоциирующиеся с дополнительной эмбриональной энтодермой (AFP, SOX7), и на гены, связанные с плюрипотентностью (OCT4, Nanog).
На фиг. 3 и 4 приведены фазоконтрастные изображения культур до индукции ДЭ (фиг. 3A-3G) и через 4 дня после инициации дифференцирования в ДЭ (фиг. 4A-4G) для клеток Н1, высеваемых с различными плотностями посева: 3⋅104 клеток/см2 (фиг. 3A и фиг. 4A); 5⋅104 клеток/см2 (фиг. 4A и фиг. 4B); 7,5⋅104 клеток/см2 (фиг. 4A и фиг. 4C); 1⋅105 клеток/см2, фиг. 4D; фиг. 4E; 1,1⋅105 клеток/см2; фиг. 4F; 1,2⋅105 клеток/см2; фиг. 4G, 1,5⋅105 клеток/см2. Из фиг. 4 очевидно, что существуют заметные морфологические различия между культурами, высеваемыми при <1⋅105 клеток/см2 по сравнению с культурами, высеваемыми при более высоких плотностях клеток. Однако такие различия не трансформируются в заметные расхождения между генами/белками, которые ассоциированы с ДЭ. Данные настоящего примера указывают на то, что исходная плотность посева не оказывает существенного воздействия на экспрессию маркеров, которые ассоциированы с ДЭ. Культуры ЭС-клеток, высеваемые с плотностями в диапазоне 0,3-2⋅105 клеток/см2, демонстрировали сходную эффективность дифференцирования в ДЭ.
Пример 2
Плотность посева эмбриональных стволовых клеток существенно влияет на экспрессию маркеров панкреатической энтодермы и эндокринной части поджелудочной железы
Настоящий пример выполняли для того, чтобы выяснить, будет ли исходная плотность посева ЭС-клеток существенно влиять на генерацию культур панкреатической энтодермы/эндокринной части поджелудочной железы.
Клетки эмбриональных стволовых клеток человека линии H1 (hESC H1) были собраны после нескольких пассажей (пассажи 40-52) и были посеяны как единичные клетки при следующих значениях плотности: 0,5⋅105 клеток/см2, 0,75⋅105 клеток/см2, 1⋅105 клеток/см2, 1,5⋅105 клеток/см2, 1,8⋅105 клеток/см2 и 2⋅105 клеток/см2 на чашках для культивирования, покрытых MATRIGEL™ (разведение 1:30; BD Biosciences, штат Нью-Джерси), в MEF-CM (кондиционированные среды) с добавлением 10 мкМ Y27632. Спустя сорок восемь часов после высевания культуры были промыты и инкубированы в неполном солевом растворе PBS (фосфатно-солевом буферном растворе без Mg или Ca) в течение приблизительно 30 секунд.
Культуры дифференцировали в линии панкреатической энтодермы/панкреатических эндокринных клеток следующим образом.
a) Стадия 1 (дефинитивная энтодерма (ДЭ) - 4 дня). Клетки были культивированы на протяжении одного дня в среде стадии 1: среда MCDB-131 (Invitrogen, № по каталогу 10372-019) с добавкой 2%-го БСА без жирных кислот (Proliant, № по каталогу 68700), 0,0012 г/мл бикарбоната натрия (SigmaAldrich, № по каталогу S3187), 1 х GlutaMax™ (Invitrogen, № по каталогу 35050-079), 2,5 мM D-глюкозы (SigmaAldrich, № по каталогу G8769), 1:50000 х ITS-X (Invitrogen), 100 нг/мл GDF8 (R&D Systems) и композиции 2,5 мкМ MCX. Затем клетки дополнительно культивировали на протяжении трех дней в среде MCDB-131 с добавкой 2%-го БСА без жирных кислот, 0,0012 г/мл бикарбоната натрия, 1 х GlutaMax™, 2,5 мM D-глюкозы, 100 нг/мл GDF8 и 1:50000 х ITS-X.
b) Стадия 2 (первичная кишечная трубка - 2 дня). Клетки обрабатывали два дня в среде MCDB-131 с добавкой 1:50000 х ITS-X, 0,1%-го ALBUMAX BSA (Invitrogen); 0,0012 г/мл бикарбоната натрия; 1 х GlutaMax™; 2,5 мМ D-глюкозы; и 50 нг/мл FGF7, затем
c) Стадия 3 (передняя кишка - 3 дня). Клетки обрабатывали средой MCDB-131, обогащенной 1:200 раствором ITS-X; 20 мМ глюкозой; 1 х GlutaMax™; 0,0015 г/мл бикарбонатом натрия; 0,1%-м ALBUMAX БСА; 0,25 мкM SANT-1; 20 нг/мл Activin-A; 2 мкM RA; 50 нг/мл FGF7; и 200 нM LDN (ингибитор рецептора BMP; № по каталогу 04-0019; Stemgent, штат Калифорния) в течение трех дней.
d) Стадия 4 (предшественник панкреатической клетки из передней кишки - 3 дня). Клетки обрабатывали средой MCDB-131, обогащенной 1:200 раствором ITS-X; 20 мМ глюкозой; 1 х GlutaMax™; 0,0015 г/мл бикарбонатом натрия; 0,1%-м ALBUMAX БСА; 0,25 мкM SANT-1; 50 нM TPB (активатор PKC; № по каталогу 565740; EMD Chemicals, г. Джибстаун, штат Нью-Джерси); 200 нM LDN-193189; 2 мкM ингибитором ALk5 (SD-208, приводится в Molecular Pharmacology 2007 г., 72:152-161); и 100 нM ингибитором CYP26A (N-{4-[2-этил-1-(1H-1, 2, 4-триазол-1-ил)бутил]фенил}-1, 3-бензотиазол-2-амином, Janssen, Бельгия) в течение трех дней.
e) Стадия 5 (панкреатическая энтодерма/эндокринная часть поджелудочной железы - 3 дня). Клетки стадии 4 обрабатывали средой MCDB-131, обогащенной 1:200 раствором ITS-X; 20 мМ глюкозой; 1 х GlutaMax™; 0,0015 г/мл бикарбонатом натрия; 0,1%-м ALBUMAX БСА; 200 нM LDN-193189; 100 нM ингибитором CYP26A и 2 мкM ALk5 в течение трех дней.
По завершении стадии 5 регистрировали фазоконтрастные изображения для всех тестируемых плотностей клеток, а также мРНК для анализа ПЦР соответствующих генов панкреатической энтодермы. На фиг. 5A-5F приведены фазоконтрастные изображения культур на стадии 5, которые первоначально высевали ЭС-клетками с различной плотностью клеток: 5⋅104 клеток/см2 (фиг. 5A), 7,5⋅104 клеток/см2 (фиг. 5B), 1⋅105 клеток/см2 (фиг. 5C), 1,5⋅105 клеток/см2 (фиг. 5D), 1,8⋅105 клеток/см2 (фиг. 5E) и 2,0⋅105 клеток/см2 (фиг. 5F). Заметная гетерогенность культур, дифференцированных из культур, высеваемых с плотностями менее 1⋅105 клеток/см2, показывает, что исходная плотность клеток для ЭС-клеток оказывает существенное воздействие на морфологию культур более поздних стадий. В частности, клетки, дифференцированные из культур, исходно высеваемых с плотностью выше 1,5⋅105 клеток/см2, демонстрировали однородную морфологию на всей площади поверхности чашки для культивирования.
На фиг. 6А-6J приведены данные ПЦР в реальном времени при анализе экспрессии следующих генов в эмбриональных стволовых клетках человека линии Н1, высеваемых с различными плотностями и затем дифференцированных в стадию 5, как показано в примере 2: ZIC1 (фиг. 6A), CDX2 (фиг. 6B), PDX-1 (фиг. 6C), NKX6.1 (фиг. 6D), NKX2.2 (фиг. 6E), NGN3 (фиг. 6F), NEUROD (фиг. 6G), инсулин (фиг. 6H) HNF4a (фиг. 6I) и PTF1a (фиг. 6J). В отличие от эффектов, наблюдаемых в примере 1, исходная плотность посева оказывает заметное влияние на экспрессию маркеров панкреатической энтодермы/эндокринной части поджелудочной железы. В частности, клетки, дифференцированные из культур с исходной плотностью посева менее 1-1,5⋅105 клеток/см2, демонстрировали значительное снижение экспрессии PDX-1, NKX6.1, NGN3, NKX2.2, NeuroD и инсулина, одновременно проявляя повышенную экспрессию маркера эктодермы ZIC1 и маркера задней кишки CDX2. Полученные данные в совокупности с данными примера 1 наглядно показывают, что повышенная экспрессия CXCR4 и других связанных с ДЭ генов не предсказывает продукции генов панкреатической энтодермы/эндокринной части поджелудочной железы. Исходная плотность посева, очевидно, является важной переменной для контроля эффективности клеток панкреатической энтодермы/панкреатических эндокринных клеток.





Изобретение относится к области клеточной биологии и биотехнологии, в частности к способу дифференцирования плюрипотентных стволовых клеток, способу получения клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, способам дифференцирования клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, способу получения клеток, экспрессирующих маркеры, указывающие на панкреатическую энтодерму, способу получения клеток, экспрессирующих маркеры, указывающие на эндокринную часть поджелудочной железы. Способ включает высевание плюрипотентных стволовых клеток, которые не являются эмбриональными стволовыми клетками человека, на поверхность с плотностью от приблизительно 0,75⋅105 клеток/см2 до приблизительно 2,0⋅105 клеток/см2, обработку посеянных плюрипотентных стволовых клеток ингибитором ROCK, дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму. Далее клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, дифференцируют в клетки, экспрессирующие маркеры, указывающие на панкреатическую энтодерму, или в клетки, экспрессирующие маркеры, указывающие на эндокринную часть поджелудочной железы. Изобретение позволяет улучшить дифференцировку плюрипотентных стволовых клеток, которые не являются эмбриональными стволовыми клетками человека. 8 н. и 30 з.п. ф-лы, 6 ил., 1 табл., 2 пр.
1. Способ дифференцирования плюрипотентных стволовых клеток, включающий:
высевание плюрипотентных стволовых клеток на поверхность с плотностью от приблизительно 0,75⋅105 клеток/см2 до приблизительно 2,0⋅105 клеток/см2;
обработку посеянных плюрипотентных стволовых клеток ингибитором ROCK; и
дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, где плюрипотентные стволовые клетки не являются эмбриональными стволовыми клетками человека.
2. Способ по п. 1, в котором плюрипотентные стволовые клетки представляют собой эмбриональные стволовые клетки, которые не происходят из человека.
3. Способ по п. 1, в котором плюрипотентные стволовые клетки представляют собой плюрипотентные стволовые клетки человека и где плюрипотентные стволовые клетки человека выбирают из индуцибельных плюрипотентных стволовых клеток человека, перепрограммированных плюрипотентных стволовых клеток человека или неэмбриональных плюрипотентных стволовых человека, которые экспрессируют по меньшей мере один из следующих маркеров, характерных для плюрипотентных клеток: ABCG2, cripto, CD9, FOXD3, коннексин 43, коннексин 45, OCT4, SOX2, NANOG, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, Tra 1-60 и Tra 1-81.
4. Способ по п. 1, в котором поверхность, на которую высевают плюрипотентные стволовые клетки, содержит Matrigel™.
5. Способ по п. 1, где стадия обработки включает культивирование плюрипотентных стволовых клеток в среде с добавлением ингибитора ROCK или в кондиционированной среде c добавлением ингибитора ROCK.
6. Способ по п. 1, где стадия дифференцирования плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, включает обработку плюрипотентных стволовых клеток GDF-8 и 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-оном.
7. Способ получения клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, включающий дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, в котором плюрипотентные стволовые клетки высевали на поверхность с плотностью посева от приблизительно 0,75⋅105 клеток/см2 до приблизительно 2,0⋅105 клеток/см2 и обрабатывали ингибитором ROCK, где плюрипотентные стволовые клетки не являются эмбриональными стволовыми клетками человека.
8. Способ по п. 7, в котором плюрипотентные стволовые клетки представляют собой плюрипотентные стволовые клетки человека и где плюрипотентные стволовые клетки человека выбирают из индуцибельных плюрипотентных стволовых клеток человека, перепрограммированных плюрипотентных стволовых клеток человека или неэмбриональных плюрипотентных стволовых человека, которые экспрессируют по меньшей мере один из следующих маркеров, характерных для плюрипотентных клеток: ABCG2, cripto, CD9, FOXD3, коннексин 43, коннексин 45, OCT4, SOX2, NANOG, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, Tra 1-60 и Tra 1-81.
9. Способ по п. 7, в котором поверхность, на которую высевают плюрипотентные стволовые клетки, содержит Matrigel™.
10. Способ по п. 7, где плюрипотентные стволовые клетки дифференцируются в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, путем обработки плюрипотентных стволовых клеток GDF-8 и 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-оном.
11. Способ дифференцирования клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, включающий:
высевание плюрипотентных стволовых клеток на первую поверхность с плотностью посева от приблизительно 0,75⋅105 клеток/см2 до приблизительно 2,0⋅105 клеток/см2;
обработку ингибитором ROCK;
дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, путем обработки плюрипотентных стволовых клеток GDF-8 и 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-оном;
высевание клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, с плотностью посева, достаточной для максимальной эффективности дифференцирования клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму; и
дифференцирование клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на панкреатическую энтодерму, где плюрипотентные стволовые клетки не являются эмбриональными стволовыми клетками человека.
12. Способ по п. 11, в котором клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, высевают на поверхность с плотностью посева от приблизительно 1,5⋅105 клеток/см2 до приблизительно 5,0⋅105 клеток/см2.
13. Способ по п. 11, в котором плюрипотентные стволовые клетки представляют собой эмбриональные стволовые клетки, которые не происходят из человека.
14. Способ по п. 11, в котором плюрипотентные стволовые клетки представляют собой плюрипотентные стволовые клетки человека и где плюрипотентные стволовые клетки человека выбирают из индуцибельных плюрипотентных стволовых клеток человека, перепрограммированных плюрипотентных стволовых клеток человека или неэмбриональных плюрипотентных стволовых человека, которые экспрессируют по меньшей мере один из следующих маркеров, характерных для плюрипотентных клеток: ABCG2, cripto, CD9, FOXD3, коннексин 43, коннексин 45, OCT4, SOX2, NANOG, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, Tra 1-60 и Tra 1-81.
15. Способ по п. 11, в котором первая поверхность содержит Matrigel™.
16. Способ по п. 11, в котором вторая поверхность содержит Matrigel™.
17. Способ по п. 11, в котором первая поверхность и вторая поверхность представляют собой одну и ту же поверхность.
18. Способ по п. 12, где стадия обработки включает культивирование плюрипотентных стволовых клеток в среде с добавлением ингибитора ROCK или в кондиционированной среде c добавлением ингибитора ROCK.
19. Способ дифференцирования клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, включающий дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму; и дифференцирование клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на панкреатическую энтодерму; при этом плюрипотентные стволовые клетки высевали на поверхность с плотностью посева от приблизительно 0,75⋅105 клеток/см2 до приблизительно 2,0⋅105 клеток/см2 и обрабатывали ингибитором ROCK, где плюрипотентные стволовые клетки не являются эмбриональными стволовыми клетками человека.
20. Способ по п. 19, в котором плюрипотентные стволовые клетки представляют собой эмбриональные стволовые клетки, которые не происходят из человека.
21. Способ по п. 19, в котором плюрипотентные стволовые клетки представляют собой плюрипотентные стволовые клетки человека и где плюрипотентные стволовые клетки человека выбирают из индуцибельных плюрипотентных стволовых клеток человека, перепрограммированных плюрипотентных стволовых клеток человека или неэмбриональных плюрипотентных стволовых человека, которые экспрессируют по меньшей мере один из следующих маркеров, характерных для плюрипотентных клеток: ABCG2, cripto, CD9, FOXD3, коннексин 43, коннексин 45, OCT4, SOX2, NANOG, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, Tra 1-60 и Tra 1-81.
22. Способ по п. 19, в котором поверхность содержит Matrigel™.
23. Способ по п. 19, где плюрипотентные стволовые клетки дифференцируются в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму, путем обработки плюрипотентных стволовых клеток GDF-8 и 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-оном.
24. Способ получения клеток, экспрессирующих маркеры, указывающие на панкреатическую энтодерму, включающий:
a) высевание плюрипотентных стволовых клеток на поверхность с плотностью посева от приблизительно 0,75⋅105 клеток/см2 до приблизительно 2,0⋅105 клеток/см2;
b) обработку плюрипотентных стволовых клеток ингибитором ROCK;
c) дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму; и
d) дифференцирование клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на панкреатическую энтодерму,
где плюрипотентные стволовые клетки не являются эмбриональными стволовыми клетками человека.
25. Способ по п. 24, дополнительно включающий стадию высевания клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, на поверхность с плотностью посева от приблизительно 1,5⋅105 клеток/см2 до приблизительно 5,0⋅105 клеток/см2.
26. Способ по п. 24, в котором плюрипотентные стволовые клетки представляют собой эмбриональные стволовые клетки, которые не происходят из человека.
27. Способ по п. 24, в котором плюрипотентные стволовые клетки представляют собой плюрипотентные стволовые клетки человека и где плюрипотентные стволовые клетки человека выбирают из индуцибельных плюрипотентных стволовых клеток человека, перепрограммированных плюрипотентных стволовых клеток человека или неэмбриональных плюрипотентных стволовых человека, которые экспрессируют по меньшей мере один из следующих маркеров, характерных для плюрипотентных клеток: ABCG2, cripto, CD9, FOXD3, коннексин 43, коннексин 45, OCT4, SOX2, NANOG, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, Tra 1-60 и Tra 1-81.
28. Способ по п. 24, в котором поверхность содержит Matrigel™.
29. Способ по п. 24, где стадия обработки включает культивирование плюрипотентных стволовых клеток в среде с добавлением ингибитора ROCK или в кондиционированной среде c добавлением ингибитора ROCK.
30. Способ получения клеток, экспрессирующих маркеры, указывающие на эндокринную часть поджелудочной железы, включающий:
a) высевание плюрипотентных стволовых клеток на поверхность с плотностью посева от приблизительно 0,75⋅105 клеток/см2 до приблизительно 2,0⋅105 клеток/см2;
b) обработку плюрипотентных стволовых клеток ингибитором ROCK;
c) дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, указывающие на дефинитивную энтодерму; и
d) дифференцирование клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на эндокринную часть поджелудочной железы, где плюрипотентные стволовые клетки не являются эмбриональными стволовыми клетками человека.
31. Способ по п. 30, дополнительно включающий стадию высевания клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, на поверхность с плотностью посева от приблизительно 1,5⋅105 клеток/см2 до приблизительно 5,0⋅105 клеток/см2.
32. Способ по п. 30, в котором плюрипотентные стволовые клетки представляют собой эмбриональные стволовые клетки, которые не происходят из человека.
33. Способ по п. 30, в котором плюрипотентные стволовые клетки представляют собой плюрипотентные стволовые клетки человека и где плюрипотентные стволовые клетки человека выбирают из индуцибельных плюрипотентных стволовых клеток человека, перепрограммированных плюрипотентных стволовых клеток человека или неэмбриональных плюрипотентных стволовых человека, которые экспрессируют по меньшей мере один из следующих маркеров, характерных для плюрипотентных клеток: ABCG2, cripto, CD9, FOXD3, коннексин 43, коннексин 45, OCT4, SOX2, NANOG, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, Tra 1-60 и Tra 1-81.
34. Способ по п. 30, в котором поверхность содержит Matrigel™.
35. Способ по п. 30, где стадия обработки включает культивирование плюрипотентных стволовых клеток в среде с добавлением ингибитора ROCK или в кондиционированной среде c добавлением ингибитора ROCK.
36. Способ дифференцирования клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, включающий высевание клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, c плотностью посева от приблизительно 1,5⋅105 клеток/см2 до приблизительно 5,0⋅105 клеток/см2; и дифференцирование клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на панкреатическую энтодерму, где клетки получают из плюрипотентных стволовых клеток, посеянных на поверхность с плотностью посева от приблизительно 0,75⋅105 клеток/см2 до приблизительно 2,0⋅105 клеток/см2, и обрабатывают ингибитором ROCK, где плюрипотентные стволовые клетки не являются эмбриональными стволовыми клетками человека.
37. Способ дифференцирования клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на эндокринную часть поджелудочной железы, включающий высевание клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, на поверхность с плотностью посева от приблизительно 1,5⋅105 клеток/см2 до приблизительно 5,0⋅105 клеток/см2; и дифференцирование клеток, экспрессирующих маркеры, указывающие на дефинитивную энтодерму, в клетки, экспрессирующие маркеры, указывающие на эндокринную часть поджелудочной железы, где клетки получают из плюрипотентных стволовых клеток, посеянных на поверхность с плотностью посева от приблизительно 0,75⋅105 клеток/см2 до приблизительно 2,0⋅105 клеток/см2, и обрабатывают ингибитором ROCK, где плюрипотентные стволовые клетки не являются эмбриональными стволовыми клетками человека.
38. Способ по любому из пп. 1, 7, 11, 19, 24, 30, 36 и 37, где клетки являются дифференцируемыми в среде MCDB-131.
| US 20070254359 A1, 01.11.2007 | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Устройство для снятия жира с кишек | 1929 |
|
SU18625A1 |
| Видоизменение способа получения генераторного газа | 1929 |
|
SU17567A1 |
| ВАКУУМНАЯ ЭЛЕКТРОННО-ЛУЧЕВАЯ ТРУБКА | 2011 |
|
RU2562248C2 |
Авторы
Даты
2018-10-02—Публикация
2013-05-07—Подача