Изобретение относится к экспериментальной медицине и может быть использовано для ускорения восстановления количества эритроцитов и гемоглобина у крыс после кровопотери, являющейся моделью постгеморрагической анемии. Изобретение также может быть использовано в клинике для разработки метода лечения постгеморрагической анемии и железодефицитной анемии.
Анемией называется клинико-гематологический синдром, характеризующийся снижением уровня гемоглобина и количества эритроцитов в единице объема крови [2].
По данным ВОЗ, в 1993-2005 гг. анемиям были подвержены 24,8% населения планеты [24]. Не только в развивающихся странах [42, 44], но и в развитых странах [27, 30, 32, 33] отмечают большое количество случаев анемии, не имеющее тенденции к снижению. В России, по данным разных авторов, частота встречаемости анемии также высокая, на 2004 год анемия была зарегистрирована у 6-40% детского населения [1, 12].
Причинами анемии могут быть дефицит железа, возникающий в результате кровопотери, недостаточного поступления железа с пищей, повышенной потребности (детский и подростковый возраст, беременность, лактация), нарушения всасывания железа в кишечнике [38]. Железодефицитная анемия (ЖДА) составляет до 90% от всех анемий в детском возрасте и до 80% от всех анемий у взрослых [5, 13, 16].
Анемия нередко встречается при хронических заболеваниях и системных воспалительных процессах. При воспалении активация иммунной системы посредством действия гормона гепсидина изменяет направление транспорта железа от костного мозга к мононуклеарным фагоцитам в печени и селезенке, что сопровождается ограничением эритропоэза и развитием анемии [38].
Железо является необходимым элементом для жизнедеятельности организма. Геминовое железо входит в состав гемоглобина, миоглобина, содержится в качестве кофермента в таких ферментах, как цитохромы, каталаза, пероксидаза [45]. Негеминовое железо участвует в ряде окислительно-восстановительных реакций, в частности, является кофактором в реакциях окисления аминокислот, необходимых для синтеза коллагена, адреналина, норадреналина, дофамина, меланина. Железо (III), содержащееся в пищевых продуктах, высвобождается из его комплекса с белками или аминокислотами под действием соляной кислоты желудочного сока, восстанавливается аскорбиновой кислотой или тиолами до Fe(II) в просвете тонкого кишечника, поступает в энтероциты, высвобождается из энтероцитов в плазму крови в комплексе с трансферрином в виде трехзарядного иона Fe(III). Из плазмы крови Fe(III) транспортируется преимущественно в костный мозг для синтеза гема гемоглобина и в печень для синтеза гема цитохромов. В тканях железо вновь восстанавливается до Fe(II), образуя в комплексе с белками ферритин и гемосидерин [45].
Поскольку железо является необходимым элементом в жизненно важных реакциях, его дефицит вызывает существенные нарушения как в развивающемся, так и в зрелом организме.
Железо в составе гемоглобина эритроцитов осуществляет транспорт кислорода, а в составе цитохромов дыхательной электронтранспортной цепи в митохондриях участвует в процессе окислительного фосфорилирования, поэтому его дефицит сопровождается развитием гипоксии и гипоэнергетического состояния. Вследствие этих нарушений метаболизма при ЖДА снижается физическая работоспособность, эффективность обучения, концентрация внимания [14, 15, 18]. Известно, что гипоксия и дефицит энергии АТФ вызывают нарушения внутриутробного развития плода, уменьшение веса новорожденных, нарушение когнитивных функций, а также задержку развития речи и двигательных навыков у детей младшего и подросткового возраста [18, 20, 44].
Было показано, что дефицит железа сопровождается уменьшением содержания IgG, IL-6 в плазме крови и фагоцитарной активности лейкоцитов [27]. Снижение иммунологической реактивности при ЖДА приводит к увеличению подверженности инфекционным заболеваниям в любом возрасте [15, 44].
К другим нарушениям развития, обнаруженным у детей с ЖДА относятся задержка созревания костной ткани и твердых тканей зубов [30].
Таким образом, группу риска по развитию анемии составляют дети раннего возраста, беременные женщины, небеременные женщины репродуктивного возраста и пациенты с хроническими заболеваниями [21, 32, 40, 44].
Независимо от причины железодефицитной анемии (недостаточное потребление железа с пищей, маточные кровотечения, беременность, воспалительные заболевания) основной метод ее лечения - устранение дефицита железа. С этой целью применяют препараты железа, которые назначают перорально или парентерально (преимущественно внутривенно, реже внутримышечно) [6,19].
Для профилактики дефицита железа применяют пищевые продукты, обогащенные железом: печенье [31, 43], сироп [34] и пищевые добавки [44].
Всасывание в кишечнике железа из лекарственного препарата зависит от степени окисления железа и образования комплекса с органическими веществами. Для перорального применения используют препараты, содержащие Fe(II), иногда с добавкой аскорбиновой кислоты, способствующей поддержанию восстановленной формы железа, так как Fe(III) не усваивается. В то же время Fe(II), участвуя в реакции Фентона, способствует образованию активных форм кислорода, которые вызывают локальный оксидативный стресс в слизистой кишечника [25]. По этой причине курс лечения пероральными препаратами длительный, может продолжаться 6-10 недель и более [39]. Форсированное лечение с применением повышенных доз может сопровождаться диспептическими явлениями и повреждением слизистой кишечника вплоть до некроза.
Солевые препараты железа в просвете кишечника взаимодействуют с компонентами пищи и с другими лекарствами, что затрудняет абсорбцию железа, а употребление их натощак может вызвать воспаление слизистой кишечника.
Облегчается усвоение железа при образовании комплекса с каким-либо хелатирующим веществом (аланином) или с углеводами, в этом случае железо может быть в виде трехзарядного иона [46]. Тем не менее, даже современный препарат, такой как железа изомальтозат, может вызывать побочное действие в виде аллергии, гипертермии и диспепсии при пероральном введении [23]. Хотя пероральные препараты удобнее парентеральных, они оказывают медленное действие, неэффективны при нарушении всасывания в кишечнике и часто вызывают нежелательные реакции со стороны желудочно-кишечного тракта у 10-40% пациентов [22, 28].
Парентеральное введение препаратов железа применяют при нарушении всасывания в кишечнике, для достижения более быстрого эффекта (при тяжелой форме анемии), при плохой переносимости пероральных препаратов [22, 28]. Для внутривенного введения используют карбоксимальтозат, сахарат, глюконат и декстран железа, которые представляют собой сферические коллоиды. Многоядерные центры железа (III) гидроксида окружены снаружи множеством нековалентно связанных молекул полимальтозы, сахарозы или декстрана. Углеводная оболочка придает комплексу стабильность, замедляет высвобождение железа. Препараты с меньшей молекулярной массой (глюконат и сахарат железа) менее стабильны, и высвобождающийся ион железа может катализировать образование активных форм кислорода. Препараты с более высокой молекулярной массой (декстран железа) обладают большей стабильностью, но их недостатком является повышенный риск аллергических реакций [26]. Считают, что карбоксимальтозат железа лишен этих негативных свойств, проявляет более высокую переносимость и эффективность, применение этого препарата снижает частоту желудочно-кишечных расстройств [26, 35]. Карбосимальтозат железа можно вводить в больших дозах за один прием - 1000 мг и более [29]. Так, назначение беременным с ЖДА карбоксимальтозата железа в количестве 1000 мг позволило увеличить содержание гемоглобина с 8,5 г/дл до 11 г/дл [17]. Недостатком углеводных коллоидов является необходимость их медленного, капельного введения. Например, длительность инфузии декстрана железа достигает 6 часов [6].
Поскольку распространение анемии не снижается на протяжении последних лет, а применяемые препараты не всегда оказываются эффективными и проявляют нежелательное побочное действие, существует необходимость поиска новых лекарственных форм для коррекции дефицита железа.
Технической проблемой парентерального введения препаратов железа является усиление свободнорадикального окисления при введении солевых препаратов железа (И), риск аллергической реакции и необходимость медленного капельного введения препаратов железа (III), содержащегося в комплексе с полисахаридами.
Для преодоления этих проблем предлагается внутримышечное введение соединений железа (III), содержащихся в составе неорганических наночастиц.
Технический результат достигается за счет применения нанокластерного железо-молибденового полиоксометаллата кеплератного типа в водном растворе.
Для решения поставленной задачи предлагается способ коррекции постгеморрагической анемии у крыс, основанный на введении лекарственного препарата, содержащего неорганические активные ингредиенты железо и его соединения, отличающийся тем, что в качестве соединения железа выбран нанокластерный железо-молибденовый полиоксометаллат (ПОМ) кеплератного типа
[Mo72Fe30O252(CH3COO)12{Mo2O7(H2O)}2{H2Mo2O8(H2O)}(H2O)91]⋅150H2O,
сокращенно Mo72Fe30, причем достаточно введения инъекций ПОМа, которые производятся внутримышечно семикратно 1 раз в день в любое время дня, однократная доза составляет 0,15 мг/100 г.
Сущность изобретения поясняется следующими фигурами:
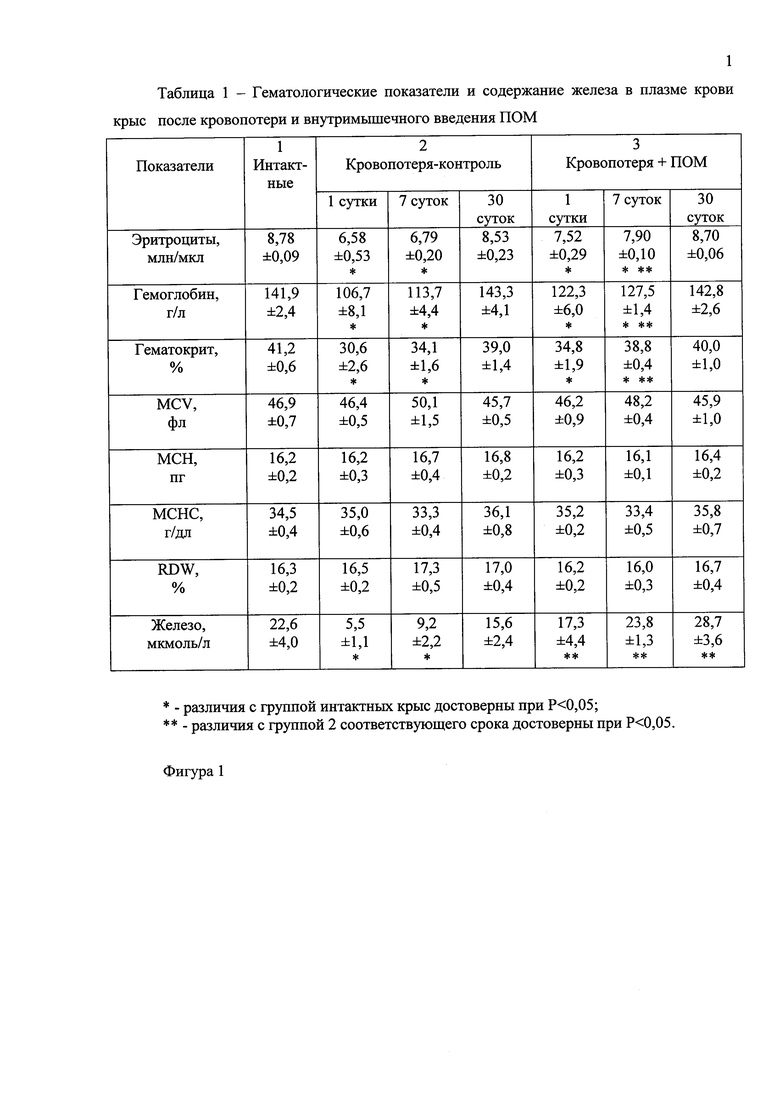
Фигура 1 - Таблица 1 - Гематологические показатели и содержание железа в плазме крови крыс после кровопотери и внутримышечного введения ПОМ;
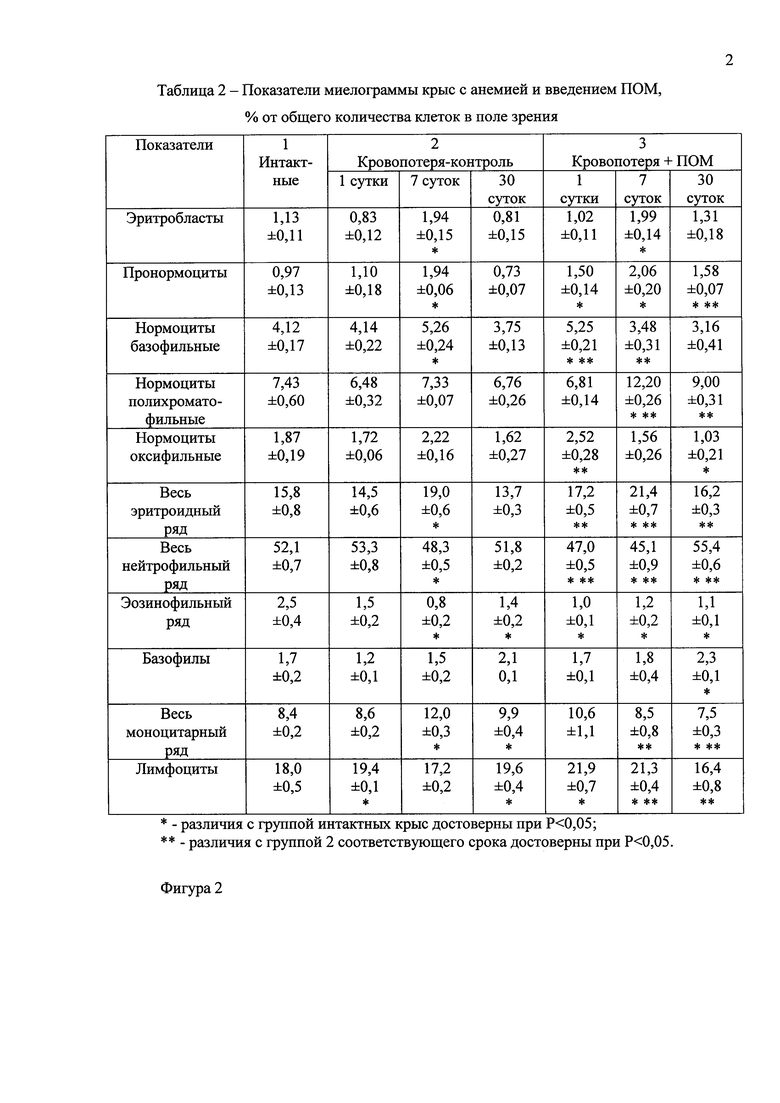
Фигура 2 - Таблица 2 - Показатели миелограммы крыс с анемией и введением ПОМ, % от общего количества клеток в поле зрения.
Цель предлагаемого изобретения - ускорить естественную регенерацию эритроцитов при экспериментальной постгеморрагической анемии путем направленной доставки железа, содержащегося в железо-молибденовых полиоксометаллатах.
Структура железо-молибденового ПОМ сходна с букиболами или фуллеренами [36, 37]. Впервые это соединение синтезировано под руководством профессора А. Мюллера (Университет Билефельда, Германия), получение данного соединения не представляет технической трудности. Кристаллографический размер такого полиоксометаллата составляет около 2,5 нм. Он растворим в воде, и образует в растворах многозарядные ионы, которые транспортируются под действием электрического поля [10]. Для полиоксометаллатов характерна постепенная деструкция в разбавленных растворах [10, 11], при этом образующиеся более простые соединения молибдена и железа в дальнейшем могут включаться в естественные для организма процессы метаболизма. В ранее проведенных экспериментах было показано, что при различных способах введения и сроках экспозиции железо-молибденовых ПОМ, отсутствуют как кумуляции железа и молибдена в различных органах крыс, так и выраженное токсическое действие [7-9, 41]. Тридцатикратное внутримышечное введение ПОМ, однократная доза которого составляла 0,15 мг/100 г, не вызывало признаков воспаления [3]. При исследовании влиянии железо-молибденовых ПОМ на гематологические показатели крыс нами было обнаружено увеличение количества эритроцитов и содержания гемоглобина после 7-кратного и 30-кратного внутримышечного введения этого препарата [4]. В этом же эксперименте однократная доза букиболов, во избежание токсического действия молибдена, была рассчитана таким образом, чтобы количество молибдена в одной инъекции раствора ПОМ соответствовало верхней границе нормы его суточного потребления. В этом случае количество железа было в 21,5 раз меньше суточной нормы железа. Полученный эффект от действия содержащегося в ПОМ малого количества железа, обнаруженный на здоровых животных, позволил сделать предположение, что данные наночастицы будут также эффективны при коррекции содержания гемоглобина и эритроцитов при анемии.
Материалы и методы
Моделирование анемии на крысах, по нашему мнению, является наиболее обоснованным, так как эти лабораторные животные имеют сходные с человеком пищеварительную систему и обмен веществ, также питаются тканями органического происхождения. Схожее течение физиологических и патологических процессов у крыс и человека позволяет использовать результаты исследований на животных для создания новых методов лечения этого заболевания у человека.
Синтез полиоксометаллата Mo72Fe30 осуществляли по методике, опубликованной в работе [37]. Аттестация синтезированного нанокластера Mo72Fe30 комплексом физико-химических методов показала соответствие его химического состава и структуры данным литературы [37], а также высокую степень его чистоты.
Эксперимент проводили на 40 крысах-самцах Wistar массой 250-300 г. Условия содержания и обращение с используемыми в эксперименте животными соответствовали рекомендациям международных этических комитетов (Директива Совета EC 2010/63/EU). В качестве модели постгеморрагической анемии была выбрана модель с кровопотерей в количестве 1,5% от массы тела крысы. Первую группу составили интактные животные (10 крыс). Во 2 и 3 группах (по 15 крыс) под эфирным наркозом осуществляли кровопотерю, забирая кровь из хвостовой вены. Вторая группа служила контролем для 3 группы. Животные 3 группы получали внутримышечные инъекции раствора ПОМ 1 мг/мл однократно, 7-кратно и 30-кратно. Крыс групп 2 и 3 групп выводили из эксперимента на 1, 7 и 30 сутки после кровопотери (по 5 животных на каждый срок). Однократная доза ПОМ составила 0,15 мг/100 г массы тела крысы и соответствовала предполагаемой терапевтической дозе наночастиц. Количество железа в ПОМ составляет 9%, то есть 0,0135 мг/100 г массы крысы в однократной инъекции.
У животных всех групп анализ крови, взятой из хвостовой вены, проводили на автоматизированном гематологическом анализаторе Celly 70 Biocode Hycel, предназначенном для исследования крови животных в экспериментах и ветеринарии.
Содержание железа в плазме крови определяли с использованием стандартных наборов реактивов фирмы «Витал Диагностикс» (СПб). Оптическую плотность измеряли на спектрофотометре DU-800 фирмы «Beckman» (США).
Крыс выводили из эксперимента передозировкой эфира для наркоза, костный мозг извлекали из бедренной кости. Миелограмму определяли общепринятым методом: мазок костного мозга фиксировали по Май-Грюнвальду, окрашивали по Романовскому-Гимза. В мазках костного мозга подсчитывали общее количество миелокариоцитов и осуществляли расчет миелограммы. Микроскопическое исследование проводили на микроскопе Leica DM 2500.
Статистический анализ материала проводили с помощью программ Statistica 6.0 (Stat. Soft. Inc.) и программы Microsoft Exel 2003. Данные представлены в виде: среднее ± ошибка среднего. Оценку статистической значимости различий, полученных данных в сравниваемых выборках осуществляли с использованием непараметрического критерия (U) Манна-Уитни. При проверке статистических гипотез использовался уровень значимости 5% (Р<0,05).
Результаты наблюдений и выводы
В контрольной группе животных №2 обнаружено достоверное уменьшение количества эритроцитов, гемоглобина и величины гематокрита на 1 и 7 сутки после кровопотери по сравнению с теми же показателями интактных животных (фигура 1). К 30 суткам гематологические показатели в контрольной группе крыс с кровопотерей нормализовались.
У крыс, получавших инъекции ПОМ на фоне кровопотери (группа 3), на 1 и 7 сутки эксперимента содержание эритроцитов, гемоглобина и гематокрит также достоверно снизились по сравнению с аналогичными показателями интактных животных (фигура 1). В то же время после семикратного введения ПОМ эти показатели стали достоверно выше, чем у контрольных животных группы 2 (фигура 1). Исследование характеристик эритроцитов в группах 2 и 3 не выявило достоверных отклонений от тех же тестов интактной группы для таких показателей, как объем эритроцитов (MCV), содержание гемоглобина в отдельном эритроците (МСН), концентрация гемоглобина в отдельном эритроците (МСНС) и показатель неоднородности эритроцитов (RDW) (фигура 1).
Кровопотеря сопровождалась значительным снижением содержания железа в плазме крови по сравнению с показателем интактных крыс: почти в 4 раза на 1 сутки, почти в 2 раза на 2 сутки, только к 30 суткам после кровопотери содержание железа приблизилось к уровню показателя интактных животных (фигура 1). Содержание железа в плазме крови крыс, получавших инъекции ПОМ после кровопотери, оставалось на уровне этого показателя интактных животных и было достоверно выше, чем у контрольных крыс с кровопотерей.
При сравнении фракций миелоидных клеток крыс 1 и 2 группы обнаружено, что в соответствии с моделью постгеморрагической анемии к 7 суткам после кровопотери достоверно увеличилось количество ряда предшественников эритроцитов (эритробластов, пронормоцитов, базофильных нормоцитов), а также суммарное количество клеток эритроидного ряда. Увеличение количества клеток эритроидного ростка на 7 сутки постгеморрагической анемии сопровождалось компенсаторным уменьшением предшественников лейкоцитов нейтрофильного и эозинофильного ряда (фигура 2). К 30 суткам постгеморрагической анемии количество эритроидных клеток и предшественников лейкоцитов не имело существенных отличий от тех же показателей интактных крыс.
У животных, получавших инъекции ПОМ, содержание пронормоцитов, нормоцитов базофильных, нормоцитов оксифильных и всех клеток эритроидного ряда стало больше, чем у интактных крыс уже на 1 сутки после кровопотери, а количество нормоцитов базофильных, оксифильных и всех эритроидных клеток достоверно превышало те же показатели контрольной группы (фигура 2). На 7 сутки после кровопотери и семи инъекций ПОМ были обнаружены в большем количестве, чем у интактных животных эритробласты, пронормоциты, нормоциты полихроматофильных и сумма эритроидных клеток. В то же время нормоциты полихроматофильные и все эритроидные предшественники у крыс после семи инъекций ПОМ были выявлены в большем количестве, чем те же группы клеток у контрольных животных после кровопотери (фигура 2). К 30 суткам после кровопотери и экспозиции ПОМ уровень части предшественников эритроцитов (пронормоцитов и нормоцитов оксифильных) еще оставался повышенным относительно показателей интактных крыс. В группе 3 к 30 суткам эксперимента уровень пронормоцитов, нормоцитов полихроматофильных и всех клеток эритроидного ряда достоверно превышал количество этих показателей миелограммы крыс, не получавших после кровопотери инъекций ПОМ.
У животных после инъекций ПОМ также наблюдалось компенсаторное уменьшение количества предшественников лейкоцитов нейтрофильного и эозинофильного ряда, и эти показатели снижались уже на 1 сутки после кровопотери, а уменьшение доли нейтрофилов в миелограмме было более выражено по сравнению с показателями контрольной группы.
Таким образом, в результате проведенного исследования было выявлено:
1. Снижение содержания эритроцитов, гемоглобина, гематокрита и железа в крови крыс на 1 и 7 сутки после кровопотери в количестве 1,5% от массы тела подтверждает моделирование геморрагической анемии, которая самопроизвольно компенсируется к 30 суткам.
2. Действие ПОМ на фоне кровопотери способствует более ранней и более эффективной коррекции характерных для геморрагической анемии гематологических показателей, уровня железа в плазме крови и предшественников эритроцитов в костном мозге по сравнению с их самопроизвольной нормализацией.
3. При введении ПОМ увеличение количества эритроцитов не сопровождалось отклонением от нормы размеров эритроцитов и содержания гемоглобина в каждом отдельном эритроците.
Предлагаемый способ прост и эффективен, поэтому в силу своей доступности может найти применение в разработке метода лечения геморрагической анемии и железодефицитной анемии у человека.
Литература
1. Анемии у детей: диагностика, дифференциальная диагностика, лечение. Под ред. А.Г. Румянцева и Ю.Н. Токарева. 2-е изд. доп.и перераб. М.: МАКС Пресс; 2004.216 с.
2. Воробьёв П.А. Анемический синдром в клинической практике. М.: Ньюдиамед, 2001. 168 с.
3. Гетте И.Ф., Данилова И.Г., Остроушко А.А. Содержание гистоновых белков в лимфоцитах крови и проявление воспалительного процесса // Российский иммунологический журнал. 2015. №2(1). 9(18). С. 444-445.
4. Данилова И.Г., Гетте И.Ф., Медведева С.Ю., Белоусова А.В., Тонкушина М.О., Остроушко А.А. Влияние железо-молибденовых нанокластерных полиоксометаллатов на апоптоз лейкоцитов крови и уровень белков теплового шока в клетках тимуса и селезенки крыс // Российские нанотехнологии. 2016. 11 (9). С.653-662. Doi 10.1134/с1995078016050049
5. Малова Н.Е. Клинико-патогенетические основы дифференцированной терапии и профилактики железодефицитной анемии у детей раннего возраста. Автореф. дисс. канд. мед. наук. М., 2003. 25 с.
6. Моисеев С.В. Железа карбоксимальтозат (Феринжект) - новый внутривенный препарат для лечения железодефицитной анемии // Клиническая фармакология и терапия. 2012, №21 (2). С. 2-7.
7. Остроушко А.А., Гетте И.Ф., Данилова И.Г., Мухлынина Е.А., Тонкушина М.О., Гржегоржевский К.В. Исследование возможности введения железо-молибденовых букиболов в организм методом электрофореза // Российские нанотехнологии. 2014. №9 - 10(9). С. 101-105.
8. Остроушко А.А., Гетте И.Ф., Медведева С.Ю., Данилова И.Г., Мухлынина Е.А., Тонкушина М.О., Морозова М.В. Исследование острого и подострого действия железо-молибденовых нанокластерных полиоксометаллатов // Российские нанотехнологии, 2013, №9-10. С. 67-71.
9. Остроушко А.А., Гетте И.Ф., Медведева С.Ю., Тонкушина М.О., Данилова И.Г., Прокофьева А.В., Морозова М.В. Оценка безопасности железо-молибденовых нанокластерных полиоксометаллатов, предназначенных для адресной доставки лекарственных веществ // Вестник уральской медицинской академической науки. 2011. №2. Т. 34. С. 107-110.
10. Остроушко А.А., Тонкушина М.О., Коротаев В.Ю., Прокофьева А.В., Кутяшев И.Б., Важенин В.А., Данилова И.Г., Меньшиков С.Ю. Стабильность полиоксометаллата Mo72Fe30 со структурой типа букибола в растворах // Журн. неорганической химии. 2012. Т. 57. №9. С. 1292-1295.
11. Остроушко А.А., Тонкушина М.О. Деструкция нанокластерных полиоксометаллатов на основе молибдена в водных растворах // Журн. физической химии. 2015. Т. 89. №3. С. 440-443.
12. Родионов В.А., Агандеева М.С. Распространенность анемий у детей города Чебоксары. Вестник Чувашского университета. 2013. №3. С. 491-496.
13. Руководство по гематологии. Под ред. А.И. Воробьева, издание 3-е, том 3. М.: Ньюдиамед; 2005. 409 с.
14. Румянцев А.Г., Захарова И.Н., Чернов В.М., И.С. Тарасова И.С., Защитников А.Л., Коровина Н.А., Боровик Т.Э., Звонкова Н.Г., Мачнева Е.Б., Лазарева С.И., Васильева Т.М. Распространенность железодефицитных состояний // Медицинский совет. 2015, №6. С. 62-66.
15. Тарасова И.С. Железодефицитная анемия у детей и подростков // Вопросы современной педиатрии. 2011. №10 (2). С. 40-48.
16. Хертл М. Дифференциальная диагностика в педиатрии. Пер. с нем. Том 2. М.: Медицина; 1990. 510 с.
17. Aporta Rodriguez R,  Montero M, Lorente Aporta JP, Gallego Luque C,
Montero M, Lorente Aporta JP, Gallego Luque C,  Mayor A,
Mayor A,  Ruiz J, Torres
Ruiz J, Torres  V,
V,  Jimenez C, Sanchez Sanchez G. Retrospective Case Reports of Anemic Pregnant Women Receiving Intravenous Ferric Carboxymaltose: Experience from a Tertiary Hospital in Spain. Obstet Gynecol Int. 2016; 2016: 5060252.
Jimenez C, Sanchez Sanchez G. Retrospective Case Reports of Anemic Pregnant Women Receiving Intravenous Ferric Carboxymaltose: Experience from a Tertiary Hospital in Spain. Obstet Gynecol Int. 2016; 2016: 5060252.
18. Arcanjo FP, Arcanjo CP, Santos PR. Schoolchildren with Learning Difficulties Have Low Iron Status and High Anemia Prevalence. J Nutr Metab. 2016; 2016: 7357136.
19. Auerbach M, Deloughery T. Single-dose intravenous iron for iron deficiency: a new paradigm. Hematology Am. Soc. Hematol. Educ. Program. 2016(1): 57-66.
20. Bastian TW, von Hohenberg WC, Mickelson DJ, Lanier LM, Georgieff MK. Iron Deficiency Impairs Developing Hippocampal Neuron Gene Expression, Energy Metabolism, and Dendrite Complexity. Dev Neurosci. 2016; 38(4): 264-276.
21. Coyne D. Hepcidin: clinical utility as a diagnostic tool and therapeutic target. Kidney Int., 2011. 80 (3): 240-244.
22. Crichton R, Danielson B, Geisser P. Iron therapy with special emphasis on intravenous administration. 4th edition. London, Boston: International Medical Publishers; 2008.
23. Dahlerup JF, Jacobsen BA, van der Woude J, Bark  , Thomsen LL, Lindgren S. High-dose fast infusion of parenteral iron isomaltoside is efficacious in inflammatory bowel disease patients with iron-deficiency anaemia without profound changes in phosphate or fibroblast growth factor 23. Scand J Gastroenterol. 2016; 51(11): 1332-8. doi: 10.1080/00365521.2016.1196496.
, Thomsen LL, Lindgren S. High-dose fast infusion of parenteral iron isomaltoside is efficacious in inflammatory bowel disease patients with iron-deficiency anaemia without profound changes in phosphate or fibroblast growth factor 23. Scand J Gastroenterol. 2016; 51(11): 1332-8. doi: 10.1080/00365521.2016.1196496.
24. De Benoist В., McLean E., Egli I., Cogswell M. Worldwide prevalence of anaemia 1993-2005: WHO global database on anaemia. Geneva: World Health Organization, 2008. 48 p.
25. Gasche C, Berstad A., Befrits R. et al. Guidelines on the diagnosis and management of iron deficiency and anemia in inflammatory bowel diseases. Inflamm. Bowel Dis., 2007, 13 (12): 1545-53.
26. Geisser P. The pharmacology and safety profile of ferric carboxymaltose (Ferinject®): structure/reactivity relationships of iron preparations. Port. J. Nephrol. Hypert. 2009, 23 (1): 11-16.
27. Hassan TH, Badr MA, Karam NA, Zkaria M, E1 Saadany HF, Abdel Rahman DM, Shahbah DA, A1 Morshedy SM, Fathy M, Esh AM, Selim AM, Impact of iron deficiency anemia on the function of the immune system in children.
28. Huch R., Schaefer R. Iron deficiency and iron deficiency anemia. New York: Thieme Medical Publishers; 2006.
29. Kalra PA, Bhandari S. Efficacy and safety of iron isomaltoside (Monofer(®)) in the management of patients with iron deficiency anemia. Int J Nephrol Renovasc Dis. 2016; 9:53-64. doi: 10.2147/IJNRD.S89704. eCollection 2016.
30. Kumar V, Haridas H, Hunsigi P, Farooq U, Erugula SR, Ealla KK. Evaluation of dental and bone age in iron-deficient anemic children of South India. J Int Soc Prev Community Dent. 2016; 6(5): 430-435.
31. Landim LA, Pessoa ML,  AC, Morgano MA, Marcos
AC, Morgano MA, Marcos  de Mota
de Mota  MA, Rocha MM,
MA, Rocha MM,  JA,
JA,  RS. Impact of the two different iron fortified cookies on treatment of anemia in preschool children in Brazil. Nutr Hosp. 2016; 33(5): 579. doi: 10.20960/nh.579
RS. Impact of the two different iron fortified cookies on treatment of anemia in preschool children in Brazil. Nutr Hosp. 2016; 33(5): 579. doi: 10.20960/nh.579
32. Le CH. The Prevalence of Anemia and Moderate-Severe Anemia in the US Population (NHANES 2003-2012). PLoS One. 2016 Nov 15; 11(11): e0166635. doi: 10.1371/journal.pone.0166635. eCollection 2016.
33. Levi M, Rosselli M, Simonetti M, Brignoli O, Cancian M, Masotti A, Pegoraro V, Cataldo N, Heiman F, Chelo M, Cricelli I, Cricelli C, Lapi F. Epidemiology of iron deficiency anaemia in four European countries: a population-based study in primary care. Eur J Haematol. 2016; 97(6):583-593. doi: 10.1111/ejh.12776. Epub 2016 Jun 8.
34. Mohamed Ali MF, Swar MO, Osman AM. Treatment of iron deficiency anaemia with the natural hematinic Carbaodeim. Sudan J Paediatr. 2016; 16(l): 37-44.
35. Moore R, Gaskell H, Rose P, Allan J. Meta-analysis of efficacy and safety of intravenous ferric carboxymaltose (Ferinject) from clinical trial reports and published trial data. BMC Blood Disord., 2011, 1:4.
36.  A., Krickemeyer E.,
A., Krickemeyer E.,  H., Schidtmann M., Peters F. // Organizational forms of matter: an inorganic superfullerene and keplerate based on molybdenum oxide. Angew Chem Int. 1998. V. 37. №24. P. 3360-3363.
H., Schidtmann M., Peters F. // Organizational forms of matter: an inorganic superfullerene and keplerate based on molybdenum oxide. Angew Chem Int. 1998. V. 37. №24. P. 3360-3363.
37.  A., Sarkar S., Nazir Shah S.Q.,
A., Sarkar S., Nazir Shah S.Q., H., Schmidtmann M., Sarkar Shatarupa,
H., Schmidtmann M., Sarkar Shatarupa,  P., Hauptfleisch В., Trautwein A. X.,
P., Hauptfleisch В., Trautwein A. X.,  V. // Archimedian Synthesis and Magic Numbers: "Sizing" Giant Molybdenum - Oxide Based Molecular Spheres of the Keplerate Type. Angew. Chem. Int. Ed. Engl. 1999. V. 38. P. 3238-3241.
V. // Archimedian Synthesis and Magic Numbers: "Sizing" Giant Molybdenum - Oxide Based Molecular Spheres of the Keplerate Type. Angew. Chem. Int. Ed. Engl. 1999. V. 38. P. 3238-3241.
38. Nairz M, Theurl I, Wolf D, Weiss G. Iron deficiency or anemia of inflammation?: Differential diagnosis and mechanisms of anemia of inflammation. Wien Med Wochenschr. 2016; 166(13-14): 411-423.
39. Nielsen P, Kongi R, Fischer R. Efficacy of an iron retard preparation in patients with iron deficiency anemia. MMW Fortschr Med. 2016;158(Suppl 6): 17-23.
40. Osendarp SJ, Murray-Kolb LE, Black MM. Case study on iron mental development - in memory of John Beard (1947-2009). Nutr Rev. 2010; 68 (1): 48-52.
41. Ostroushko A.A., Danilova I.G., Gette I.F., Medvedeva S.Yu., Tonkushina M.O., Prokofieva A.V., Morozova M.V. Study of safety of Molybdenum and Iron-Molybdenum Nanocluster Polyoxometalates Intended for Targeter Delivery of Drugs // Journal of Biomaterials and Nanobiotechnology. 2011. №2. P. 557-560.
42. Pasricha SR, Drakesmith H. Iron Deficiency Anemia: Problems in Diagnosis and Prevention at the Population Level. Hematol Oncol Clin North Am. 2016; 30(2): 309-25. doi: 10.1016/j.hoc.2015.11.003.
43.  AG,
AG,  G, Pozo JP,
G, Pozo JP,  J. Heme Iron Concentrate and Iron Sulfate Added to Chocolate Biscuits: Effects on Hematological Indices of Mexican Schoolchildren. J Am Coll Nutr. 2016; 35(6): 544-551.
J. Heme Iron Concentrate and Iron Sulfate Added to Chocolate Biscuits: Effects on Hematological Indices of Mexican Schoolchildren. J Am Coll Nutr. 2016; 35(6): 544-551.
44. UNICEF, United Nations University, WHO. Iron deficiency anemia: assessment, prevention and control. A guide for programme managers. Geneva: World Health Organization; 2001 (WHO/NHD/01.3). - 114 p. Available at:http://www.who.int/nutrition/publications/micronutrients / anaemia_iron_deficiency / WHO_NHD 01.3/en.
45. Wang J, Pantopoulos K. Regulation of cellular iron metabolism. Biochem J. 2011 Mar 15; 434(3): 365-81. doi: 10.1042/BJ20101825.
46. Zargaran M, Saadat E, Dinarvand R, Sharifzadeh M, Dorkoosh F. Preparation and Bioavailability Analysis of Ferrous Bis Alanine Chelate as a New Micronutrient for Treatment of Iron Deficiency Anemia. Adv. Pharm. Bull. 2016; 6(3):407-413.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ АНЕМИИ ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЙ И ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИИ У ПАЦИЕНТОВ СО ЗЛОКАЧЕСТВЕННЫМИ ОПУХОЛЯМИ | 2024 |
|
RU2840857C1 |
| Средство для коррекции нарушений в эритроидном ростке кроветворения, вызванных цитостатическим воздействием | 2016 |
|
RU2634572C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ АНЕМИИ ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЙ И ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИИ У ПАЦИЕНТОВ С ВОСПАЛИТЕЛЬНЫМИ ЗАБОЛЕВАНИЯМИ СУСТАВОВ | 2024 |
|
RU2825523C1 |
| СПОСОБ ДИАГНОСТИКИ АНЕМИИ ХРОНИЧЕСКОГО ЗАБОЛЕВАНИЯ У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ | 2021 |
|
RU2783248C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ АНЕМИИ ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЙ И ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИИ У ПАЦИЕНТОВ С ВИЧ-ИНФЕКЦИЕЙ | 2024 |
|
RU2828550C1 |
| Фармакологическая композиция на основе водорастворимых полиметаллокомплексов полигалактуроновой кислоты, стимулирующая процесс кроветворения | 2019 |
|
RU2704033C1 |
| СПОСОБ ЛЕЧЕНИЯ АНЕМИИ У БЕРЕМЕННЫХ | 2013 |
|
RU2532387C1 |
| СПОСОБ ЛЕЧЕНИЯ АНЕМИИ ВО ВРЕМЯ БЕРЕМЕННОСТИ | 2006 |
|
RU2319489C2 |
| Средство для стимуляции пролиферативной активности клеток костного мозга | 2023 |
|
RU2811901C1 |
| Готовая к применению инъекционная композиция для профилактики и лечения железодефицитной анемии | 2016 |
|
RU2720512C1 |
Изобретение относится к экспериментальной медицине и может быть использовано для ускорения восстановления количества эритроцитов и гемоглобина у крыс после кровопотери, являющейся моделью постгеморрагической анемии. Для этого животным вводят внутримышечно Mo72Fe30 - нанокластерный железо-молибденовый полиоксометаллат (ПОМ) кеплератного типа [Mo72Fe30O252(CH3COO)12{Mo2O7(H2O)}2{H2Mo2O8(H2O)}(H2O)9l]⋅150H2O. Введение осуществляют в дозе 0,15 мг/100 г семикратно 1 раз в день. Способ обеспечивает ускорение естественной регенерации эритроцитов путем направленной доставки железа, содержащегося в железо-молибденовых полиоксометаллатах. 2 ил.
Способ коррекции постгеморрагической анемии у крыс, отличающийся тем, что животным вводят внутримышечно Mo72Fe30 - нанокластерный железо-молибденовый полиоксометаллат (ПОМ) кеплератного типа [Mo72Fe30O252(CH3COO)12{Mo2O7(H2O)}2{H2Mo2O8(H2O)}(H2O)9l]⋅150H2O в дозе 0,15 мг/100 г, причем введение осуществляют семикратно 1 раз в день.
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ ПОСТГЕМОРРАГИЧЕСКОЙ ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИИ У ПАЦИЕНТОК С МАТОЧНЫМИ КРОВОТЕЧЕНИЯМИ ПУБЕРТАТНОГО ПЕРИОДА | 2006 |
|
RU2318524C2 |
| CN 104822391 A, 05.08.2015 | |||
| US 20120177700 A1, 12.07.2012 | |||
| ЛИТВИНЕНКО А | |||
| П | |||
| и др | |||
| Влияние перорального введения субстанции наночастиц железа на функциональное состояние органов репродуктивной системы самок мышей с экспериментальной железодефицитной анемией: (обзор) | |||
| Проблемы репродукции, 2015, т | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| ОСТРОУШКО А.А | |||
| и др | |||
| Исследование острого и подострого действия железо-молибденовых нанокластерных полиоксометаллатов | |||
| Российские нанотехнологии, 2013, т | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Торфодобывающая машина с вращающимся измельчающим орудием | 1922 |
|
SU87A1 |
| MULLER A | |||
| et al | |||
| Archimedian Synthesis and Magic Numbers: "Sizing" Giant Molybdenum - Oxide Based Molecular Spheres of the Keplerate Type | |||
| Angew | |||
| Chem | |||
| Int | |||
| Ed | |||
| Engl | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| V | |||
| Способ сужения чугунных изделий | 1922 |
|
SU38A1 |
| P | |||
| СЧЕТНЫЙ ЛОГАРИФМИЧЕСКИЙ ДИСК | 1923 |
|
SU3238A1 |
Авторы
Даты
2018-10-29—Публикация
2017-07-07—Подача