Настоящее изобретение относится к гидролизату коллагена нового типа.
Кроме того, изобретение относится к применению этого нового гидролизата коллагена в качестве действующего вещества для поддержания и/или улучшения здорового состояния костей, в особенности для предотвращения и/или лечения остеопороза. Помимо этого изобретение относится к биологически активной добавке, содержащей гидролизат коллагена.
Кости позвоночных животных и тем самым также и людей своей высокой прочностью и механической стабильностью обязаны особой структуре костной матрицы, которая синтезируется из остеобластов (костных клеток). Оба существенных компонента костной матрицы с одной стороны представляют собой каркас из сшитого коллагена, причем в случае костной матрицы в особенности речь идет о коллагене I типа. Образование его поперечных связей осуществляется главным образом посредством аминокислот лизин и гидроксилизин. Второй компонент представляет собой гидроксилапатит (также обозначают как апатит-(СаОН)), который включен в костную матрицу (минерализация костей). Такая структура кости примерно сопоставима со структурой железобетона, в которой друг друга дополняют свойства стального каркаса (соответствующего коллагену) и бетона (соответствующего гидроксилапатиту) равным образом с образованием предельно прочной структуры.
В отличие от многих других типов ткани кость обладает относительно высокой способностью к регенерации, т.е. внеклеточная костная матрица непрерывно формируется и снова подвергается разрушению. При нарушении этого равновесия, следовательно, недостаточного формирования новой костной матрицы, доходит до атрофии кости. Такое уменьшение плотности кости обозначают как остеопороз, и может иметь разные причины. Как правило, остеопороз возникает с увеличением возраста (большей частью начиная с пятого десятилетия жизни), особенно часто у женщин после менопаузы (постменопаузальный остеопороз).
С некоторых пор известно, что благодаря пероральному приему гидролизатов коллагена можно противодействовать потере плотности костей при остеопорозе. Гидролизаты коллагена, полученные в результате ферментативного гидролиза животного коллагена, соответственно содержат смесь из пептидов с различной длиной цепи или молекулярным весом. Например, в Европейском патенте ЕР 0777491 В1 раскрыто применение гидролизата коллагена со средним молекулярным весом от 1.000 до 40.000 Да, который получают посредством ферментативного гидролиза коллагена кожи, для лечения постменопаузального остеопороза. Считается, что такое благоприятное воздействие гидролизата коллагена на здоровое состояние костей основывается на стимуляции биосинтеза коллагена I типа и других матричных белков посредством остеобластов, подобно тому, как это уже может быть подтверждено in vitro для хондроцитов (см. S. Oesser und J. Seiffert (2003), Cell Tissue Research (311) 393-399).
Различные гидролизаты коллагена отличаются относительно распределения молекулярного веса содержащихся пептидов, их последовательностью аминокислот и другими параметрами, в зависимости от исходного материала и способа получения. В основе настоящего изобретения лежит задача, предоставить гидролизат коллагена, обладающий особенно высокой эффективностью применительно к поддержанию и/или улучшению здорового состояния костей.
Согласно изобретению эта задача решается благодаря гидролизату коллагена, который получают ферментативным гидролизом костного желатина типа В, причем гидролизат коллагена образован из пептидов, из которых по меньшей мере 50 мас. % имеют молекулярный вес от 1.500 до 13.500 Да, и их средний молекулярный вес находится в пределах от 4.000 до 8.000 Да.
Проведенные изобретателями исследования стимуляции синтеза матричных белков остеобластами in vitro, которые ниже описаны более подробно, неожиданным образом показали, что гидролизат коллагена подобного вида по сравнению с различными другими гидролизатами обладает значительно более высоким стимулирующим действием, в особенности на синтез коллагена I типа. В особенности благоприятным оказался гидролизат коллагена, у которого по меньшей мере 70 мас. % пептидов имеют молекулярный вес от 1.500 до 13.500 Да и/или их средний молекулярный вес находится в пределах от 4.500 до 6.000 Да.
Особенно интересной в этом результате является высокая эффективность гидролизата коллагена в частности из костного желатина, тем более что из предшествующего уровня техники уже известно применение гидролизатов из коллагена или желатина из шкуры животных (прежде всего из свиных шкур с остатками жира, а также из кожи рыб). В общем, желатин в виде денатурированной, растворимой формы коллагена представляет собой хорошо пригодный исходный материал для ферментативного гидролиза. Костный желатин, применяемый в контексте изобретения в качестве исходного материала для гидролизата, является желатином типа В, который предпочтительно получают посредством обработки щелочью коллагена из костей позвоночных животных, в особенности из оссеина. Оссеин представляет собой обезжиренные и деминерализованные кости. Наиболее выгодно используют оссеин из костей крупного рогатого скота.
Изоэлектрическая точка (ИЭТ) применяемого в качестве исходного материала костного желатина находится преимущественно ниже 5,5. В отличие от этого, желатины типа А, который получают путем кислотной обработки коллагена, обладает изоэлектрической точкой выше 7.
В гидролизате коллагена в соответствии с изобретением пептиды предпочтительно имеют степень амидирования остатков глутамина соответственно глутаминовой кислоты и остатков аспарагина соответственно аспарагиновой кислоты в совокупности менее чем 15%, в особенности менее чем 10%. Вследствие этого степень амидирования подсчитывают делением молярной доли глутаминовых и аспарагиновых остатков на молярную долю остатков глутамина, глутаминовой кислоты, аспарагина и аспарагиновой кислоты в пептидах. Упомянутое последним значение получается из природного аминокислотного состава коллагена и обычно составляет прибл. 1,12 ммоль/г. Молярная доля остатков глутамина и аспарагина может быть определена посредством кислотного гидролиза амидов и определения образованного при этом аммиака. Низкая степень амидирования пептидов может быть в частности достигнута благодаря обработке щелочью применяемого желатина (тип В).
Исследования стимуляции матричного синтеза белков остеобластами интересным образом также показали, что гидролизат коллагена в соответствии с изобретением с предпочтительным средним молекулярным весом от 4.600 до 6.000 Да обладает более высокой эффективностью, чем различные низкомолекулярные гидролизаты. С молекулярным весом содержащихся пептидов также коррелирует вязкость гидролизата коллагена. Что касается этого, то предпочтительно, если 20 мас. %-ый водный раствор гидролизата коллагена при 25°C имеет вязкость более чем 5 мПа⋅с, в особенности более чем 6 мПа⋅с.
Гидролизат коллагена в соответствии с изобретением имеет преимущественно содержание аммония, сульфата и фосфата в каждом случае менее чем 300 част, на млн., в особенности менее чем 100 част, на млн. Соответственно низкое содержание солей можно поддерживать уже при получении костного желатина, используемого для гидролиза.
Для ферментативного получения гидролизата коллагена можно применять различные протеазы, в особенности микробного происхождения, причем их различающиеся специфичности для определенных аминокислот оказывают непосредственное влияние на молекулярную структуру получаемых пептидов и тем самым также на их эффективность. Было обнаружено, что принимая во внимание стимуляцию остеобластов, особенно эффективный гидролизат коллагена предпочтительно получают посредством гидролиза желатина нейтральной эндопротеазой из Bacillus subtilis.
В соответствии с одним предпочтительным вариантом осуществления изобретения гидролизат коллагена получают воздействием эндопротеазы при температуре от 40 до 60°C, в особенности прибл. 50°C, в течение промежутка времени от 20 до 40 мин., в особенности прибл. 30 мин.
Также настоящее изобретение, наряду с описанным выше гидролизатом коллагена как таковым, в частности относится к его применению в качестве действующего вещества для поддержания и/или улучшения здорового состояния костей, в особенности для предотвращения и/или лечения остеопороза. В связи с выраженным стимулирующим действием гидролизата коллагена в соответствии с изобретением на синтез матричных белков остеобластами, которое подтверждено опытами in vitro, благодаря пероральному введению гидролизата коллагена можно целенаправленно противодействовать нарушению равновесия между формированием и разрушением костей.
Важный аспект изобретения относится к применению гидролизата коллагена в качестве действующего вещества для предотвращения и/или лечения постменопаузального остеопороза. По оценкам, от этой формы атрофии костной ткани страдают примерно 50% женщин в возрасте старше 50 лет, причем в первые пять лет после наступления менопаузы можно лишиться до 20% костного вещества.
Таким образом, настоящее изобретение также относится к способу предотвращения и/или лечения остеопороза, в особенности постменопаузального остеопороза, причем способ включает пероральное применение пациентом гидролизата коллагена в соответствии с изобретением, в особенности пациенткой в возрасте старше 50 лет.
Так как для гидролизатов из животных или растительных белков не требуется разрешение на применение в качестве лекарственного средства, то гидролизат коллагена в соответствии с изобретением может быть благоприятным образом приготовлен в виде биологически активной добавки. Гидролизат коллагена может быть представлен, например, в виде порошка, гранулята, раствора или суспензии, или в виде таблеток, капсул, капсет или саше, при необходимости в комбинации с приемлемыми добавками или вспомогательными веществами. В качестве альтернативы, гидролизат коллагена также можно добавлять непосредственно в пищевой продукт.
Суточный пероральный прием преимущественно находится в пределах от 1 до 15 г гидролизата коллагена, предпочтительно от 2 до 10 г, более предпочтительно от 2 до 7 г, и в особенности в пределах от 2,5 до 5 г. Соответствующее количество благоприятно может быть приготовлено в виде однократной суточной дозы.
Другой предпочтительный вариант осуществления изобретения относится к биологически активной добавке, которая наряду с гидролизатом коллагена в соответствии с изобретением содержит один или несколько пребиотиков. Комбинация гидролизата коллагена с одним или несколькими пребиотиками основывается на соображении, что не только биосинтез коллагена и других матричных белков, но и образование и включение гидроксилапатита в достаточном количестве может способствовать особенно эффективной регенерации костного вещества.
При этом ограничивающим фактором является снабжение костной матрицы кальцием, причем проблему составляет не достаточный прием кальция с пищей (как правило, это обеспечивается сбалансированной диетой), а удовлетворительное всасывание принимаемого кальция в кишечнике, которое весьма ограничено, в особенности исходя из образования труднорастворимых кальциевых солей.
Было обнаружено, что всасывание кальция и тем самым минерализация костей можно улучшить благодаря применению пребиотиков. В общем, пребиотики представляют собой неперевариваемые компоненты пищевых продуктов, которые целенаправленно стимулируют рост и/или активность определенных микроорганизмов микрофлоры кишечника и благодаря этому оказывают положительное влияние на здоровье. Хотя точный механизм, с помощью которого этот эффект пребиотиков оказывает благоприятное воздействие на всасывание кальция, все еще остается полностью не выясненным, однако указанный выше положительный эффект был подтвержден, например, для применения фруктанов у детей в возрасте прибл. 12 лет (см. S. Abrams et al. (2005), American Journal of Clinical Nutrition (82) 471-476).
Таким образом, благодаря совместному приему гидролизата коллагена и пребиотиков можно стимулировать образование обеих важных составных частей костной матрицы и тем самым добиться синергетического эффекта в отношении здорового состояния костей, в особенности принимая во внимание профилактику и/или лечение остеопороза.
В принципе, биологически активная добавка в соответствии с изобретением может содержать любое весовое соотношение гидролизата коллагена и пребиотика или пребиотиков. Чтобы обеспечить достаточное обеспечение обоими компонентами, однако предпочтительно, если доля гидролизата коллагена и пребиотика или пребиотиков каждый раз составляет прибл. от 20 до прибл. 80 мас. %, более предпочтительно каждый раз прибл. от 40 до прибл. 60 мас. %. В частности биологически активная добавка может содержать смесь из обоих компонентов в весовом соотношении примерно 1:1.
Пребиотик или пребиотики, применяемые в биологически активной добавке в соответствии с изобретением, предпочтительно выбирают из олигосахаридов и/или полисахаридов. Олигосахариды и полисахариды составляют большинство известных пребиотически действующих веществ, причем вследствие применения подобных веществ получают дополнительный благоприятный эффект, заключающийся в том, что существенно улучшается вкус биологически активной добавки по сравнению с чистым гидролизатом коллагена. Несмотря на то, что с помощью соответствующего способа можно получить гидролизаты коллагена, которые обычно обозначают как не имеющие вкуса, многие потребители все же ощущают вкусовой дискомфорт, называемый "клейким". Удивительным образом плохие вкусовые компоненты гидролизата коллагена могут быть устранены почти полностью благодаря сочетанию с пребиотическими олиго- и/или полисахаридами.
Пребиотик или пребиотики предпочтительно выбирают из инулина, фруктанов, галакто-олигосахаридов (ГОС), фрукто-олигосахаридов (ФОС), резистентных мальтодекстринов, полидекстрозы и их смесей. Они включают как встречающиеся в природе, так и полученные синтетическим путем сахариды. Инулин представляет собой фруктан, содержащий до 100 единиц фруктозы, а также концевую единицу глюкозы. Фрукто-олигосахариды и галакто-олигосахариды содержат исключительно единицы фруктозы или галактозы (как правило, до 10), и полидекстроза представляет собой синтетический полисахарид из единиц глюкозы, сорбита и лимонной кислоты.
Кроме того, предпочтительно, если биологически активная добавка в качестве другой составной части содержит по меньшей мере одну растворимую кальциевую соль. Таким образом, обеспечивается одновременно достаточное снабжение потребителя кальцием, независимо от его других пищевых привычек.
В принципе принимают в расчет все растворимые кальциевые соли, которые не являются токсичными или не имеют других вредных воздействий. Преимущественно, по меньшей мере одну растворимую кальциевую соль выбирают из цитрата кальция, лактата кальция, глюконата кальция, кальция лактат глюконата, лактобионата кальция и их смесей.
Биологически активная добавка в соответствии с изобретением в качестве комбинированного препарата также может содержать и еще другие компоненты, оказывающие положительный эффект на здоровое состояние костей или которые в общем, полезны в качестве пищевой добавки. Особенно благоприятно, например, когда помимо этого биологически активная добавка содержит один или несколько витаминов, которые выбирают из витамина С, витамина D, витамина D3, витамина Е, витамина К и их метаболитов.
Далее к биологически активной добавке в соответствии с изобретением также могут быть добавлены различные минеральные вещества, такие как в частности соли фтора, калия и магния. Кроме того, всасыванию таких минералов через стенку кишечника можно способствовать посредством короткоцепочечных кислот жирного ряда.
Другой предпочтительной добавкой являются омега-3 жирные кислоты, которые могут привести к повышению содержания кальцитонина в костях. Кроме того, им приписывают противовоспалительное действие.
Также вероятно положительным эффектом на плотность костной ткани обладают изофлавоны сои и могут быть использованы в биологически активной добавке в соответствии с изобретением.
В заключение следует еще назвать пряности или их ингредиенты, такие как, например, куркумин и чили, которые с их противовоспалительным и иммуномодулирующим действием могут способствовать благоприятным эффектам биологически активной добавки в соответствии с изобретением.
Благодаря положительному действию гидролизата коллагена в соответствии с изобретением на здоровое состояние костной ткани его применение в качестве биологически активной добавки при определенных обстоятельствах способствуют отказу от или по меньшей мере снижению дозы лекарственных средств, которые в противном случае применяют с этой целью, в особенности для предотвращения и/или лечения постменопаузального остеопороза. Примерами таких фармацевтических действующих веществ, применение которых является отчасти проблематичным, являются селективные модуляторы эстрогенового рецептора (СМЭР), паратгормон и его аналог терипаратид, другие гормоны (в особенности эстрогены и гормоны роста), бифосфонат и моноклональные антитела.
Другим объектом изобретения является способ получения гидролизата коллагена в соответствии с изобретением, включающий стадии:
- получения водного раствора костного желатина типа В с концентрацией от 5 до 20 мас. %, в особенности прибл. 10 мас. %;
- добавления нейтральной эндопротеазы из Bacillus subtilis в количестве от 1 до 4 мас. %, в особенности прибл. 2 мас. %, в пересчете на количество желатина;
- воздействия эндопротеазы на желатин при температуре от 40 до 60°C, в особенности прибл. 50°C, и значении рН от 5,5 до 6,5, в особенности прибл. 6, в течение промежутка времени от 20 до 40 мин., в особенности прибл. 30 мин.; и
- термической инактивации эндопротеазы.
Особые преимущества и предпочтительные варианты осуществления способа в соответствии с изобретением были уже пояснены в связи с гидролизатом коллагена в соответствии с изобретением.
Нижеследующие примеры со ссылкой на фигуры служат для более подробного пояснения изобретения.
Показано подробно:
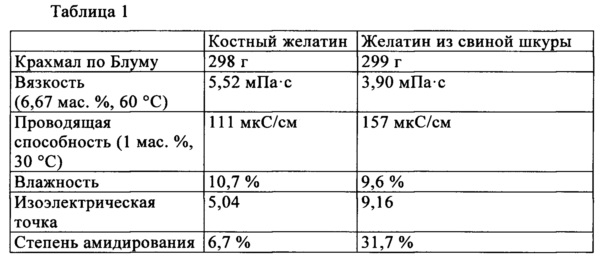
Фигура 1: гель-проникающая хроматограмма с распределением молекулярного веса гидролизата коллагена в соответствии с изобретением и сравнительного гидролизата;
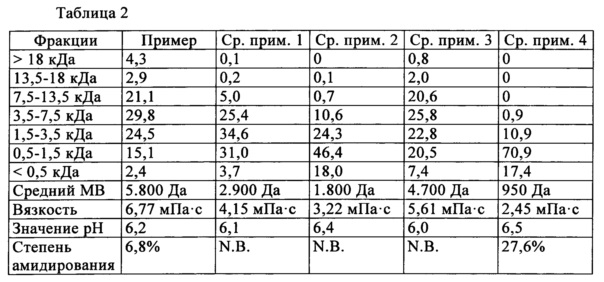
Фигура 2: диаграмма, соответствующая стимуляции синтеза коллагена I типа и остеокальцина гидролизатом коллагена в соответствии с изобретением и сравнительным гидролизатом; и
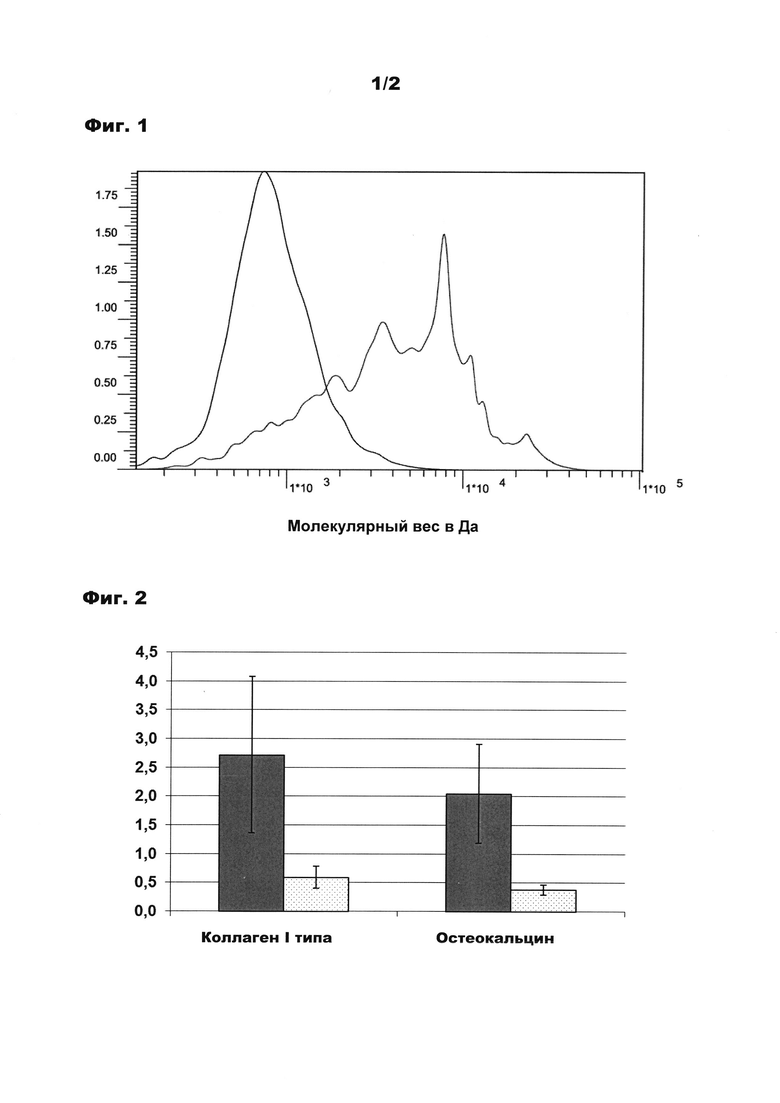
Фигура 3: диаграмма, соответствующая стимуляции синтеза различных матричных белков и ферментов гидролизатом коллагена в соответствии с изобретением и четырьмя различными сравнительными гидролизатами.
Получение гидролизатов коллагена
В дальнейшем описано получение гидролизата коллагена, предлагаемого в настоящем изобретении (пример), а также четырех гидролизатов коллагена, которые не соответствуют изобретению (сравнительные примеры от 1 до 4).
В качестве исходных материалов применяли два различных желатина, а именно желатин типа В из костей крупного рогатого скота (в дальнейшем обозначен как костный желатин) и желатин из свиных шкур типа А. Их существенные параметры представлены в таблице 1.
Пример
200 г костного желатина замачивали в 1800 г дистиллированной воды в течение 30 мин. при комнатной температуре. При перемешивании предварительно набухший желатин нагревали до 58±2°C и растворяли. Значение рН при помощи натрового щелока устанавливали 6,0±0,2. После этого добавляли 2 мас. % (в пересчете на желатин) нейтральной эндопротеазы из Bacillus subtilis. Через 30 мин. длительности гидролиза раствор для ферментативной инактивации нагревали до 85°C. Для получения образованного гидролизата коллагена раствор высушивали.
Сравнительный пример 1
200 г костного желатина замачивали в 1800 г дистиллированной воды в течение 30 мин. при комнатной температуре. При перемешивании предварительно набухший желатин нагревали до 49±2°C и растворяли, после чего добавляли 1,64 г CaCl2⋅2Н2О. Значение рН при помощи натрового щелока устанавливали 6,0±0,2. После этого добавляли 0,6 мас. % (в пересчете на желатин) нейтральной эндопротеазы из Bacillus subtilis. Через 30 мин. длительности гидролиза добавляли 0,2 мас. % (в пересчете на желатин) нейтральной эндопротеазы из Bacillus amyloliquefaciens. Через в совокупности 180 мин. длительности гидролиза раствор для ферментативной инактивации нагревали до 85°C и после чего высушивали.
Сравнительный пример 2
200 г костного желатина замачивали в 1800 г дистиллированной воды в течение 30 мин. при комнатной температуре. При перемешивании предварительно набухший желатин нагревали до 49±2°C и растворяли, после чего добавляли 0,4 г CaCl2⋅Н2О. Значение рН при помощи натрового щелока устанавливали 6,5±0,2. После этого добавляли 0,6 мас. % (в пересчете на желатин) нейтральной эндопротеазы из Bacillus subtilis. Через 60 мин. длительности гидролиза добавляли 0,2 мас. % (в пересчете на желатин) экзопротеазы из Aspergillus sojae. Через в совокупности 7 ч. длительности гидролиза раствор для ферментативной инактивации нагревали до 85°C и после чего высушивали.
Сравнительный пример 3
200 г желатина из свиных шкур замачивали в 1800 г дистиллированной воды в течение 30 мин. при комнатной температуре. При перемешивании предварительно набухший желатин нагревали до 57±2°C и растворяли. Значение рН при помощи натрового щелока устанавливали 6,0±0,2. После этого добавляли 0,3 мас. % (в пересчете на желатин) нейтральной эндопротеазы из Bacillus subtilis. Через 180 мин. раствор для ферментативной инактивации нагревали до 85°C и после чего высушивали.
Сравнительный пример 4
200 г желатина из свиных шкур замачивали в 1800 г дистиллированной воды в течение 30 мин. при комнатной температуре. При перемешивании предварительно набухший желатин нагревали до 58±2°C и растворяли. Значение рН при помощи натрового щелока устанавливали 7,0±0,2. После этого добавляли 2 мас. % (в пересчете на желатин) щелочной эндопротеазы из Bacillus licheniformis. Через 180 мин. раствор для ферментативной инактивации нагревали до 85°C и после чего высушивали.
Определение распределения молекулярного веса
Распределение молекулярного веса пептидов разных гидролизатов коллагена определяли при помощи гель-проникающей хроматографии с применением следующих параметров:
Обнаружение: УФ детектор Knauer К-2501 при 214 нм
В таблице 2 в каждом случае указаны распределение молекулярного веса в соответствии с заданными весовыми фракциями, средний молекулярный вес, вязкость и значение рН (в каждом случае при 20 мас. % и 25°C), а также степень амидирования различных гидролизатов коллагена.
На фигуре 1 показана гель-проникающая хроматограмма с распределением молекулярного веса гидролизата коллагена в соответствии с изобретением согласно примеру и гидролизата коллагена согласно сравнительному примеру 4. Молекулярный вес представлен по оси абсцисс с логарифмической шкалой.
Стимуляция синтеза матричных белков и ферментов in vitro
В качестве доказательства особой эффективности гидролизата коллагена в соответствии с изобретением было исследовано in vitro его стимулирующее действие на синтез матричных белков и ферментов, которые играют роль в построении и минерализации матрицы остеобластами. Это осуществляли путем определения экспрессии соответствующей мРНК при помощи ПЦР в реальном времени и полуколичественного анализа.
Остеобласты человека выделяли из коленных суставов тем, что костную ткань инкубировали при интенсивном перемешивании при 37°C в течение 1 ч. в растворе Хенкса, к ним добавляли 7 мг/мл гиалуронидазы тип I и III-S и 5 мг/мл проназы. Затем варку продолжали при 37°C в течение 3-5 ч. в растворе Хенкса, добавляли 16 мг/мл коллагеназы тип CLS IV. После ферментативной варки первичные остеобласты выращивали в среде HAMs F12, добавляли 10% фетальную телячью сыворотку, 20 ед/мл пенициллин-стрептомицина, 50 мкг/мл партрицина, 0,05 мг/мл аскорбиновой кислоты и 0,15 мг/мл глутамина.
Для фактического исследования однослойные клеточные культуры остеобластов человека в течение промежутка времени 24 ч. инкубировали в среде, которую добавляли посредством 0,5 мг/мл соответствующего гидролизата коллагена (согласно примеру или одному из сравнительных примеров). Контроль в каждом случае инкубировали в среде без гидролизата. После чего осуществляли определение соответствующей экспрессии мРНК, как описано выше.
Результаты стимуляции синтеза коллагена I типа и остеокальцина представлены в виде колоночной диаграммы на фигуре 2, причем левая колонка в каждом случае означает пример в соответствии с изобретением и правая колонка в каждом случае означает сравнительный пример 4. По оси ординат представлена экспрессия мРНК по отношению к контролю (=1) (среднее значение и отклонение от стандарта из по меньшей мере 12 независимых опытов). В то время как коллаген I типа с отрывом представляет собой важнейший матричный белок костной ткани, остеокальцин является ферментом, участвующим в дифференцировке матрицы, усиленная экспрессия которого равным образом благоприятствует формированию матрицы.
В обоих случаях проявляется явное стимулирующее действие гидролизата в соответствии с изобретением, а именно повышение экспрессии коллаген-мРНК в среднем на фактор прибл. 2,7 и экспрессии остеокальцин-мРНК в среднем на фактор прибл. 2,0. Интересным образом гидролизат в соответствии со сравнительным примером 4, который получают из другого исходного материала и имеет более низкий средний молекулярный вес, в противоположность этому приводит даже к уменьшению экспрессии обоих мРНК, что показывает высокую специфичность гидролизата коллагена в соответствии с изобретением.
Соответствующие результаты стимуляции синтеза коллагена I типа, бигликана, версикана и щелочной фосфатазы представлены в виде колоночной диаграммы на фигуре 3, причем колонки слева направо в каждом случае означают пример в соответствии с изобретением и сравнительные примеры 1, 2 и 3 (среднее значение и отклонение от стандарта из по меньшей мере 12 независимых опытов). Бигликан и версикан представляют собой протеогликаны, имеющие важное значение для структурной организации костной матрицы. Щелочная фосфатаза - наряду с другими функциями - подобно остеокальцину принимает участие в дифференцировке костной матрицы.
Также в данном контексте для всех четырех белков обнаруживается, что гидролизат коллагена в соответствии с изобретением обладает лучшим действием, нежели все сравнительные примеры. Из последнего, только сравнительный пример 3 обладает легким стимулирующим действием на синтез коллагена I типа (фактор прибл. 1,3), во всех других случаях никакое действие не проявляется или проявляется даже отрицательное действие, т.е. уменьшение синтеза мРНК. Хотя у бигликана, версикана и щелочной фосфатазы также действие гидролизата коллагена в соответствии с изобретением проявляется относительно слабо, тем не менее, в каждом случае оно все же более положительное, чем действие других гидролизатов.
Улучшенная эффективность гидролизата коллагена в соответствии с изобретением по сравнению с различными другими гидролизатами также подтверждается в отношении всех исследованных матричных белков и ферментов, усиленная экспрессия которых способствует формированию костной матрицы.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГИДРОЛИЗАТ КОЛЛАГЕНА И ЕГО ПРИМЕНЕНИЕ | 2012 |
|
RU2635995C2 |
| ГИДРОЛИЗАТ КОЛЛАГЕНА, ПРИМЕНЯЕМЫЙ ДЛЯ УЛУЧШЕНИЯ ЗДОРОВЬЯ КОЖИ, ВОЛОС И/ИЛИ НОГТЕЙ ЧЕЛОВЕКА | 2011 |
|
RU2577699C2 |
| Способ получения композиции на основе гидролизованного коллагена (варианты) | 2024 |
|
RU2827228C1 |
| СПОСОБ ГИДРОЛИЗА МОЛОЧНЫХ БЕЛКОВ | 2002 |
|
RU2292155C2 |
| МОЛОЧНЫЙ ПЕПТИДНЫЙ СОУС | 2023 |
|
RU2821540C1 |
| Композиция на основе коллагена из соединительной ткани якутской лошади и глюконата кальция | 2019 |
|
RU2723584C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ФУНКЦИОНАЛЬНЫХ РЫБОРАСТИТЕЛЬНЫХ СНЕКОВ ОСТЕОТРОПНОЙ НАПРАВЛЕННОСТИ НА ОСНОВЕ МЯСОКОСТНОГО РЫБНОГО СЫРЬЯ | 2020 |
|
RU2747096C1 |
| СУХОЙ КОНЦЕНТРАТ НАПИТКА ДЛЯ ВОССТАНОВЛЕНИЯ КОСТНОЙ ТКАНИ | 2023 |
|
RU2817886C1 |
| Средство для лечения ран и ожогов | 2021 |
|
RU2793318C1 |
| ДЕЙСТВУЮЩЕЕ ВЕЩЕСТВО ДЛЯ ЛЕЧЕНИЯ САРКОПЕНИИ | 2014 |
|
RU2679802C2 |
Изобретение относится к гидролизату коллагена. Гидролизат коллагена для изготовления в качестве биологически активной добавки, полученный ферментативным гидролизом костного желатина типа В, состоящий из пептидов, имеющих молекулярный вес от 1.500 до 13.500 Да, средний молекулярный вес которых находится в пределах от 4.500 до 6.000 Да. Биологически активная добавка, содержащая гидролизат коллагена. Способ получения гидролизата коллагена, включающий стадии: получение водного раствора костного желатина типа В, добавление нейтральной эндопротеазы из Bacillus subtilis, воздействие эндопротеазы на желатин, нагревание раствора, высушивание указанного раствора для получения гидролизата коллагена при определенных условиях. Вышеописанный гидролизат коллагена обладает высоким стимулирующим действием, в особенности на синтез коллагена I типа. 3 н. и 15 з.п. ф-лы, 3 ил., 2 табл., 7 пр.
1. Гидролизат коллагена для изготовления биологически активной добавки, полученный ферментативным гидролизом костного желатина типа В, причем гидролизат коллагена образован из пептидов, из которых по меньшей мере 50 мас. %, в особенности по меньшей мере 70 мас. %, имеют молекулярный вес от 1.500 до 13.500 Да, средний молекулярный вес которых находится в пределах от 4.500 до 6.000 Да.
2. Гидролизат коллагена по п. 1, причем костный желатин получают посредством обработки щелочью коллагена из костей позвоночных животных, в особенности из оссеина.
3. Гидролизат коллагена по одному из предыдущих пунктов, причем костный желатин имеет изоэлектрическую точку менее 5,5.
4. Гидролизат коллагена по п. 1 или 2, причем пептиды имеют степень амидирования остатков глутамина, соответственно глутаминовой кислоты, и остатков аспарагина, соответственно аспарагиновой кислоты, в совокупности менее чем 15%, в особенности менее чем 10%.
5. Гидролизат коллагена по п. 1 или 2, причем 20 мас. %-ный водный раствор гидролизата коллагена при 25°С имеет вязкость более чем 5 мПа⋅с, в особенности более чем 6 мПа⋅с.
6. Гидролизат коллагена по п. 1 или 2, причем гидролизат коллагена имеет содержание аммония, сульфата и фосфата в каждом случае менее чем 300 част./млн, в особенности менее чем 100 част./млн.
7. Гидролизат коллагена по п. 1 или 2, причем гидролизат коллагена получают посредством гидролиза желатина с нейтральной эндопротеазой из Bacillus subtilis.
8. Гидролизат коллагена по п. 7, причем гидролизат коллагена получают воздействием эндопротеазы при температуре от 40 до 60°С, в особенности приблизительно 50°С, в течение промежутка времени от 20 до 40 мин, в особенности приблизительно 30 мин.
9. Гидролизат коллагена по одному из пп. 1, 2 или 8 в качестве действующего вещества для поддержания и/или улучшения здорового состояния костей, в особенности для предотвращения и/или лечения остеопороза.
10. Гидролизат коллагена по п. 9 в качестве действующего вещества для предотвращения и/или лечения постменопаузального остеопороза.
11. Гидролизат коллагена по п. 10, причем гидролизат коллагена приготавливают в виде биологически активной добавки, в особенности в виде порошка, гранулята, раствора или суспензии, или в виде таблеток, капсул, капсет или саше.
12. Гидролизат коллагена по п. 11, причем предусматривают суточный пероральный прием от 1 до 15 г гидролизата коллагена, предпочтительно от 2 до 10 г, более предпочтительно от 2 до 7 г, в особенности от 2,5 до 5 г.
13. Биологически активная добавка, содержащая гидролизат коллагена по одному из предыдущих пунктов и один или несколько пребиотиков.
14. Биологически активная добавка по п. 13, причем пребиотик или пребиотики выбирают из олиго- и/или полисахаридов, в особенности из инулина, фруктанов, галакто-олигосахаридов (ГОС), фрукто-олигосахаридов (ФОС), резистентных мальтодекстринов, полидекстрозы и их смесей.
15. Биологически активная добавка по п. 13 или 14, кроме того, содержащая одну или несколько растворимых кальциевых солей, которые в особенности выбирают из цитрата кальция, лактата кальция, глюконата кальция, кальция лактат глюконат, лактобионат кальция и их смеси.
16. Биологически активная добавка по п. 13 или 14, кроме того, содержащая один или несколько витаминов, которые выбирают из витамина С, витамина D, витамина D3, витамина Е, витамина K и их метаболитов.
17. Биологически активная добавка по п. 13 или 14, кроме того, содержащая одно или несколько минеральных веществ, которые выбирают из солей фтора, калия и магния.
18. Способ получения гидролизата коллагена по одному из пп. 1-12, включающий стадии:
- получения водного раствора костного желатина типа В с концентрацией 10 мас. %;
- добавления нейтральной эндопротеазы из Bacillus subtilis в количестве 2 мас. % в пересчете на количество желатина;
- воздействия эндопротеазы на желатин при температуре от 40 до 60°С и значении рН 6,0±0,2 в течение 30 мин;
- нагревания раствора для ферментативной инактивации до 85°С, и
- высушивания указанного раствора для получения гидролизата коллагена.
| WO 2010149596 A1, 29.12.2010 | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| DE 10201100097 А1, 06.09.2012. | |||
Авторы
Даты
2018-10-31—Публикация
2013-11-04—Подача