Область техники
Настоящее изобретение относится к улучшенным применениям глюкагоноподобных пептидов-1 (GLP-1) при пероральной терапии.
Предшествующий уровень техники
Пероральный способ введения является, вне всяких сомнений, наиболее широко используемым путем введения лекарственных средств. Однако при введении белков и пептидов, таких как пептиды GLP-1, зачастую ограничиваются парентеральными способами вместо предпочтительного перорального приема, что объясняется несколькими лимитирующими факторами, такими как ферментативное разложение в желудочно-кишечном тракте и слизистой оболочке кишки, недостаточная абсорбция из слизистой оболочки кишки, а также пресистемный метаболизм в печени.
Патентный документ WO 2007/024700 относится к способам снижения массы тела и к лечению диабета за счет использования эксендиновых пептидов.
Таким образом, существует потребность в улучшенном способе введения или применении пептидов GLP-1 путем перорального приема, при котором допускается вариабельность концентрации в плазме.
Краткое описание сущности изобретения
Согласно некоторым вариантам осуществления, настоящее изобретение относится к твердой композиции, имеющей в своем составе пептид GLP-1 и усилитель, предназначенной для применения в качестве лекарственного препарата путем перорального введения, где указанный пептид имеет период полувыведения из плазмы в организме человека, составляющий по меньшей мере 60 часов, где указанную композицию вводят по меньшей мере 3 раза, и где а) указанную композицию вводят через день или чаще; или b) указанную композицию вводят таким образом, чтобы соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанной композиции, выраженным в днях, составляло более чем 2:1.
Согласно некоторым вариантам осуществления, настоящее изобретение относится к способу медицинского лечения, включающему пероральное введение пациенту, нуждающемуся в этом, твердой композиции, включающей пептид GLP-1 и усилитель, где указанный пептид имеет период полувыведения из плазмы в организме человека, составляющий по меньшей мере 60 часов, где указанную композицию вводят по меньшей мере 3 раза, и где a) указанную композицию вводят через день или чаще; или b) указанную композицию вводят таким образом, чтобы соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанной композиции, выраженным в днях, составляло более чем 2:1.
Изобретение может также позволить разрешить и другие проблемы, которые будут очевидны из раскрытия примеров осуществления.
Способ или применение согласно изобретению включает в себя введение пептида GLP-1, например, субъекту, нуждающемуся в этом. Согласно некоторым вариантам осуществления, пептид GLP-1 вводят в количестве от 0,5 до 100 мг, в частности, от 0,5 до 50 мг или от 0,5 до 25 мг. Согласно некоторым вариантам осуществления, пептид GLP-1 вводят в количестве от 1 до 25 мг или от 5 до 50 мг. Согласно некоторым вариантам осуществления, пептид GLP-1 вводят в количестве от 0,5 до 10 мг или от 0,5 до 5 мг. Согласно некоторым вариантам осуществления, пептид GLP-1 вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 1 до 1000 нМ (от 10-9 до 0,000001 моль/л), например, от 1 до 300 нМ (от 10-9 до 3×10-7 моль/л) или от 10 до 100 нМ (от 10-8 до 10-7 моль/л).
Описание изобретения
Настоящее изобретение относится к способам (таким как режимы дозирования) перорального введения пептида GLP-1, имеющего период полувыведения из плазмы в организме человека, составляющий по меньшей мере 60 часов, или, другими словами, к улучшенному применению указанного пептида GLP-1 при терапии для лечения, например, диабета 2-го типа. Пептид GLP-1 может вводиться в твердой дозированной лекарственной форме, такой как таблетка.
Можно ожидать, что в случае пептидов GLP-1 с периодом полувыведения из плазмы в организме человека, составляющим по меньшей мере 60 часов, предпочтительным будет режим перорального приема с низкой кратностью введения, например, при введении раз в неделю; такой режим дозирования используют, например, для подкожного введения раз в неделю пептида GLP-1 семаглутида. Например, семаглутид может вводиться путем инъекции, такой как подкожная инъекция, в форме водной композиции, содержащей 1,34 мг/мл семаглутида, 1,42 мг/мл дигидрата гидрофосфата натрия, 14,0 мг/мл пропиленгликоля, 5,50 мг/мл фенола, pH 7,4; где величину pH регулируют с помощью соляной кислоты и/или гидроксида натрия. Или же семаглутид может вводиться путем инъекции, такой как подкожная инъекция, в форме водной композиции, содержащей 4,1 мг/мл семаглутида, 1,42 мг/мл дигидрата гидрофосфата натрия, 14,0 мг/мл пропиленгликоля, 5,50 мг/мл фенола, pH 7,4; где величину pH регулируют с помощью соляной кислоты и/или гидроксида натрия.
Однако авторы изобретения неожиданно обнаружили, что вариабельность концентрации пептида GLP-1 в плазме будет ниже в случае дозирования пептида GLP-1 в соответствии со способами или применениями изобретения. Настоящее изобретение можно рассматривать как режим дозирования при пероральном введении пептида GLP-1, имеющего период полувыведения из плазмы в организме человека, составляющий по меньшей мере 60 часов, включающий в себя пероральное введение указанного пептида GLP-1 чаще, чем это предполагает период полувыведения указанного пептида GLP-1, где указанный пептид GLP-1 может вводиться в твердой дозированной лекарственной форме, такой как таблетка.
Следующий неограничивающий пример дополнительно иллюстрирует один из аспектов изобретения: пероральный прием один раз в день таблетки, содержащей пептид GLP-1 семаглутид, обеспечивает неожиданно меньшую вариабельность концентрации в плазме указанного пептида при введении лекарства в течение некоторого периода времени (например, в течение месяца) по сравнению с пероральным введением указанного пептида с использованием альтернативного режима дозирования в течение такого же периода времени (например, режим дозирования, при котором препарат принимают раз в неделю). Примеры 1-3, приведенные в данном контексте, показывают, что, к удивлению, ежедневный пероральный прием таблетки, содержащей пептид GLP-1, обеспечивает пониженную вариабельность концентрации в плазме. Можно предположить, что режим дозирования, при котором пептид GLP-1 вводят раз в неделю, будет приводить к вариабельности концентрации пептида GLP-1 в плазме в таком же диапазоне, что и при однократном введении дозы.
Таким образом, при измерении концентрации пептида GLP-1 в плазме после каждой дозы для группы пациентов и сравнении результатов измерений в случае использования пептида GLP-1 согласно способу или применению изобретения вариабельность концентрации пептида GLP-1 в плазме неожиданно оказывается ниже, чем при аналогичных измерениях после альтернативного режима дозирования.
Согласно некоторым вариантам осуществления, изобретение относится к некоторым режимам перорального приема пептидов GLP-1, обеспечивающим улучшение вариабельности концентрации указанного пептида GLP-1 в плазме. Согласно некоторым вариантам осуществления, пептид GLP-1 вводят в соответствии с режимом дозирования, обеспечивающим улучшенную вариабельность по сравнению с введением согласно альтернативной схеме применения.
Снижение вариабельности концентрации в плазме и, вследствие этого, меньшее различие между минимальной и максимальной концентрациями в плазме в группе пациентов и/или у пациента будет приводить к меньшим побочным эффектам, связанным с GLP-1 (таким как тошнота и рвота), и к большей эффективности терапевтического лечения (такой как уменьшение глюкозы в крови и снижение массы тела).
Согласно некоторым вариантам осуществления, изобретение относится к твердой композиции, имеющей в своем составе пептид GLP-1 и усилитель, предназначенной для применения в качестве лекарственного препарата путем перорального введения, где указанный пептид имеет период полувыведения из плазмы в организме человека, составляющий по меньшей мере 60 часов, где указанную композицию вводят по меньшей мере 3 раза, и где указанную композицию вводят через день или чаще. Согласно некоторым вариантам осуществления, настоящее изобретение относится к способу медицинского лечения, включающему в себя пероральное введение пациенту, нуждающемуся в этом, твердой композиции, имеющей в своем составе пептид GLP-1 и усилитель, где указанный пептид имеет период полувыведения из плазмы в организме человека, составляющий по меньшей мере 60 часов, где указанную композицию вводят по меньшей мере 3 раза, и где указанную композицию вводят через день или чаще.
Согласно некоторым вариантам осуществления, способ или применение согласно изобретению включает в себя введение два раза в день, один раз в день или через день. Согласно некоторым вариантам осуществления, способ или применение согласно изобретению включает в себя введение по меньшей мере через день (то есть введение через день или чаще), по меньшей мере один раз в день или по меньшей мере два раза в день.
Как ожидается, уменьшение изменения не произойдет после нескольких введений при использовании режима дозирования согласно изобретению. Соответственно, согласно некоторым вариантам осуществления, способ или применение согласно изобретению выполняют в течение некоторого временного периода, например, при введении по меньшей мере 3 раза. Согласно некоторым вариантам осуществления, способ или применение включает в себя введение по меньшей мере 5 раз или по меньшей мере 7 раз. Согласно некоторым вариантам осуществления, способ или применение включает в себя введение по меньшей мере 10 раз, по меньшей мере 14 раз или по меньшей мере 21 раз. Согласно некоторым вариантам осуществления, способ или применение осуществляют в течение по меньшей мере 2 недель, по меньшей мере 3 недель или по меньшей мере 4 недель.
Вариабельность оценивают, сравнивая уровень концентрации в плазме (то есть Сmax, ППК (англ. AUC, Area Under the Curve - площадь под кривой) или Ссредн.) в пределах интервала дозирования (то есть от одного перорального приема до следующего перорального приема). Согласно некоторым вариантам осуществления, термин "вариабельность" в данном контексте при использовании применительно к концентрации пептида GLP-1 в плазме означает выраженный в % средний CV (англ. coefficient of variation - коэффициент вариации) уровня концентрации пептида GLP-1 в плазме (то есть Сmax, ППК или Сaverage) в пределах интервала дозирования. Согласно некоторым вариантам осуществления, термин "вариабельность" в данном контексте при использовании применительно к концентрации пептида GLP-1 в плазме означает средний CV в % или относительное стандартное отклонение (RSD) в % (англ. relative standard deviation) уровня концентрации пептида GLP-1 в плазме (то есть Cmax, ППК или Caverage) после каждого дозирования для группы пациентов.
Согласно некоторым вариантам осуществления, способы и применения изобретения особенно подходят для перорального введения пептида GLP-1, биодоступность которого является низкой. Низкая биодоступность может быть биодоступностью менее 10%. При использовании в данном контексте, термин "биодоступность" соединения относится к концентрации в плазме указанного соединения, введенного перорально, относительно концентрации в плазме такого же количества указанного соединения, введенного внутривенно.
Согласно некоторым вариантам осуществления, изобретение относится к способу или применению перорального введения фармацевтически активного пептида GLP-1 субъекту, где указанный пептид имеет период полувыведения из плазмы в организме человека, составляющий по меньшей мере 60 часов, и где указанный способ включает в себя стадию введения указанного пептида через день или чаще в терапевтически эффективном количестве. Согласно некоторым вариантам осуществления изобретения, период полувыведения из плазмы пептида GLP-1 в организме человека составляет приблизительно 70 часов, при этом указанный способ включает в себя стадию введения указанного пептида через день или чаще в терапевтически эффективном количестве. Согласно некоторым вариантам осуществления, период полувыведения из плазмы пептида GLP-1 в организме человека составляет по меньшей мере 100 часов, и указанный способ включает в себя стадию введения указанного пептида через день или чаще в терапевтически эффективном количестве. Согласно некоторым вариантам осуществления, период полувыведения из плазмы пептида GLP-1 в организме человека составляет по меньшей мере 120 часов, и указанный способ включает в себя стадию введения указанного пептида через день или чаще в терапевтически эффективном количестве. Согласно некоторым вариантам осуществления, период полувыведения из плазмы пептида GLP-1 в организме человека составляет по меньшей мере 160 часов, и указанный способ включает в себя стадию введения указанного пептида через день или чаще в терапевтически эффективном количестве.
Согласно некоторым вариантам осуществления, изобретение относится к пептиду GLP-1 для применения в качестве перорального фармацевтического препарата через день или чаще при лечении диабета, где указанный пептид имеет период полувыведения из плазмы в организме человека, составляющий по меньшей мере 60 часов. Согласно некоторым вариантам осуществления, изобретение относится к пептиду GLP-1 для применения в качестве перорального фармацевтического препарата через день или чаще при лечении диабета, где указанный пептид имеет период полувыведения из плазмы в организме человека, составляющий по меньшей мере 70 часов. Согласно некоторым вариантам осуществления, изобретение относится к пептиду GLP-1 для применения в качестве перорального фармацевтического препарата через день или чаще при лечении диабета, где указанный пептид имеет период полувыведения из плазмы в организме человека, составляющий по меньшей мере 100 часов. Согласно некоторым вариантам осуществления, изобретение относится к пептиду GLP-1 для применения в качестве перорального фармацевтического препарата через день или чаще при лечении диабета, где указанный пептид имеет период полувыведения из плазмы в организме человека, составляющий по меньшей мере 120 часов. Согласно некоторым вариантам осуществления, изобретение относится к пептиду GLP-1 для применения в качестве перорального фармацевтического препарата через день или чаще при лечении диабета, где указанный пептид имеет период полувыведения из плазмы в организме человека, составляющий по меньшей мере 160 часов.
Под "периодом полувыведения из плазмы" в данном контексте понимается промежуток времени, который требуется после введения (в/в (внутривенно) или п/о (перорально)) для уменьшения вдвое концентрации в плазме, измеренной после фазы начального распределения.
Согласно некоторым вариантам осуществления, "эффективное количество" пептида GLP-1 при применении в данном контексте означает количество, достаточное для устранения, облегчения или частичного купирования клинических проявлений данного заболевания или состояния и его осложнений. Количество, достаточное для этого, определяют как "эффективное количество". Эффективные количества в каждом случае будут зависеть от серьезности заболевания или повреждения, а также от массы тела и общего состояния субъекта. Следует понимать, что определение соответствующей дозы может быть осуществлено при помощи рутинного исследования, путем создания матрицы величин и проверки различных точек в матрице, что полностью входит в компетенцию обычных профессиональных навыков квалифицированного терапевта или ветеринара.
Согласно некоторым вариантам осуществления, термин "лечение" или "терапия" при использовании в данном контексте означает контроль течения заболевания и заботу о пациенте с целью противодействия состоянию, такому как заболевание или расстройство. Согласно некоторым вариантам осуществления, термин "лечение" или "терапия" включает в себя полный спектр терапий для данного состояния, от которого страдает пациент, например, введение активного пептида GLP-1 для облегчения симптомов или осложнений; для замедления развития заболевания, расстройства или состояния; для ослабления или облегчения симптомов и осложнений; и/или для устранения или ликвидации заболевания, расстройства или состояния, а также для предупреждения возникновения патологического состояния. Согласно некоторым вариантам осуществления, предупреждение следует понимать как контроль течения заболевания и заботу о пациенте с целью противодействия заболеванию, состоянию или расстройству, при этом оно включает в себя введение активного пептида GLP-1 для предупреждения наступления симптомов или осложнений.
Согласно некоторым вариантам осуществления, вариабельность составляет менее 100%, то есть концентрация в плазме изменяется от одного дозирования до другого менее чем на 100%. Согласно некоторым вариантам осуществления, вариабельность концентрации в плазме составляет 90% или меньше, или же 80% или меньше, или же 70% или меньше по сравнению с концентрацией в плазме GLP-1 от одного дозирования до другого. Согласно некоторым вариантам осуществления, вариабельность концентрации в плазме составляет 60% или меньше, или же 50% или меньше, или же 40% или меньше по сравнению с концентрацией в плазме GLP-1 от одного дозирования до другого. Согласно некоторым вариантам осуществления, вариабельность определяют для группы пациентов, состоящей из по меньшей мере 5 субъектов, в том числе, по меньшей мере из 10 субъектов.
Выражение "альтернативный режим дозирования" в данном контексте означает режим дозирования выходящий за пределы заявленного способа. Согласно некоторым вариантам осуществления, термин "альтернативный режим дозирования" при использовании в данном контексте означает режим дозирования (то есть способ или применение), включающий в себя интервал дозирования, выбранный из группы, состоящей из однократного введения, введения раз в неделю или реже или введения каждую вторую неделю или реже.
Согласно некоторым вариантам осуществления, изобретение относится к твердой композиции, имеющей в своем составе пептид GLP-1 и усилитель, предназначенной для применения в качестве лекарственного препарата путем перорального введения, где указанный пептид имеет период полувыведения из плазмы в организме человека, составляет по меньшей мере 60 часов, где указанную композицию вводят по меньшей мере 3 раза, и где указанную композицию вводят таким образом, чтобы соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанной композиции, выраженным в днях, составляло более чем 2:1. Согласно некоторым вариантам осуществления, настоящее изобретение относится к способу медицинского лечения, включающему в себя пероральное введение пациенту, нуждающемуся в этом, твердой композиции, имеющей в своем составе пептид GLP-1 и усилитель, где указанный пептид имеет период полувыведения из плазмы в организме человека, составляющий по меньшей мере 60 часов, где указанную композицию вводят по меньшей мере 3 раза, и где указанную композицию вводят таким образом, чтобы соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанной композиции, выраженным в днях, составляло более чем 2:1.
Согласно некоторым вариантам осуществления, изобретение относится к способу или применению перорального введения пептида GLP-1 с низким клиренсом субъекту, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет 2:1 или больше, например, 3:1 или больше, либо 4:1 или больше. Согласно некоторым вариантам осуществления, соотношение между периодом полувыведения пептида GLP-1 из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 5:1 или более чем 6:1. Согласно некоторым вариантам осуществления, соотношение между периодом полувыведения пептида GLP-1 из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 7:1 или более чем 14:1. Согласно некоторым вариантам осуществления изобретения, описан способ или применение перорального введения, где пептид GLP-1 с низким клиренсом вводят в терапевтически эффективной дозе субъекту, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет 2:1 или больше. Таким образом, когда период полувыведения из плазмы указанного пептида GLP-1 в организме человека составляет, например, 2 дня, интервал дозирования в днях указанного пептида соответствует 1 дню или меньше, то есть пептид дозируют по меньшей мере раз в день; когда период полувыведения из плазмы указанного пептида GLP-1 в организме человека составляет, например, 4 дня, интервал дозирования в днях указанного пептида составляет 2 дня или меньше, то есть пептид дозируют по меньшей мере раз в два дня; и так далее. Согласно некоторым вариантам осуществления, описано изобретение, относящееся к способу или применению перорального введения, где пептид GLP-1 с низким клиренсом в терапевтически эффективной дозе вводят субъекту, так что соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет 2:1 или больше. Согласно некоторым вариантам осуществления, термин "терапевтически эффективная доза" относится к введению терапевтически эффективного количества пептида GLP-1.
При использовании в данном контексте под термином "пептид GLP-1 с низким клиренсом" или "GLP-1 с низким клиренсом" понимают пептид GLP-1, имеющий большой период полувыведения из плазмы на стандартных моделях фармакокинетики (например, фармакокинетика у собак породы бигль, у свиней или в организме человека) по сравнению с пептидом GLP-1 «лираглутидом». Согласно некоторым вариантам осуществления, термин "большой период полувыведения из плазмы" относится к периоду полувыведения, большему, чем период полувыведения лираглутида, где период полувыведения может быть определен в соответствии с описанием, приведенным в разделе данного документа "Способ определения периода полувыведения из плазмы". Согласно некоторым вариантам осуществления, термин "большой период полувыведения из плазмы" относится к периоду полувыведения в организме человека, составляющему по меньшей мере 60 часов, по меньшей мере 70 часов или по меньшей мере 80 часов.
Согласно некоторым вариантам осуществления, способ или применение перорального введения согласно изобретению приводит к уменьшению побочных эффектов по сравнению с использованием альтернативного режима дозирования. Согласно некоторым вариантам осуществления, способ перорального введения согласно изобретению приводит к уменьшению тошноты и/или рвоты по сравнению с использованием альтернативного режима дозирования. Согласно некоторым вариантам осуществления, способ перорального введения согласно изобретению приводит к уменьшению тошноты по сравнению с использованием альтернативного режима дозирования. Согласно некоторым вариантам осуществления, способ перорального введения согласно изобретению приводит к уменьшению рвоты по сравнению с использованием альтернативного режима дозирования.
Способ определения периода полувыведения из плазмы
Для определения периода полувыведения из плазмы пептидов GLP-1 после в/в или п/о введения человеку или животным (таким как, например, собаки породы бигль) может быть проведено фармакокинетическое исследование. Согласно некоторым вариантам осуществления, период полувыведения из плазмы пептида GLP-1 определяют в организме человека после в/в введения. Согласно некоторым вариантам осуществления, период полувыведения из плазмы пептида GLP-1 определяют в организме человека после п/о введения.
При таком исследовании субъектам обычно вводят в/в или п/о однократную дозу пептида GLP-1 в соответствующей композиции. В определенные моменты времени после дозирования отбирают образцы крови и определяют в них концентрацию пептида GLP-1 с помощью соответствующего количественного анализа. На основании этих измерений строят графическую зависимость изменения концентрации в плазме с течением времени и выполняют так называемый фармакокинетический анализ данных без компартментализации.
Для большинства активных ингредиентов при построении в виде полулогарифмической зависимости терминальная часть профилей концентрации в плазме будет линейной, указывая на то, что после первоначальной абсорбции и распределения лекарственное средство удаляется из организма с постоянной фракционной скоростью. Скорость (лямбда Z или λz) равна отрицательному угловому коэффициенту терминальной части графика. На основании этой скорости также может быть вычислен период полувыведения из плазмы как  (см., например, Johan Gabrielsson and Daniel Weiner: Pharmacokinetics and Pharmacodynamic Data Analysis. Concepts & Applications, 3е изд., Swedish Pharmaceutical Press, Стокгольм (2000)).
(см., например, Johan Gabrielsson and Daniel Weiner: Pharmacokinetics and Pharmacodynamic Data Analysis. Concepts & Applications, 3е изд., Swedish Pharmaceutical Press, Стокгольм (2000)).
Концентрация пептидов GLP-1 в плазме может быть определена с помощью любого подходящего метода. Концентрация пептидов GLP-1 в плазме для способа или применения согласно изобретению может быть определена с помощью любого подходящего метода. Например, может быть использован метод ЖХ-МС (жидкостная хроматография с масс-спектрометрией, от англ. Liquid Chromatography Mass Spectroscopy) или иммунологические анализы, такие как RIA (радиоиммунологический анализ, от англ. Radio immuno assay), ELISA (иммуноферментный анализ, от англ. Enzyme Linked Immuno Sorbent Assay) и LOCI (иммунологический анализ люминесценции кислородных каналов, от англ. Luminescence Oxygen Channeling Immunoassay). Общие протоколы подходящих RIA и ELISA анализов содержатся, например, в патентном документе WO 2009/030738 на страницах с 116 по 118. Концентрация пептидов GLP-1 в плазме может быть определена с помощью метода LOCI, описанного в данной работе в экспериментальной части под названием "Анализ образцов плазмы с помощью LOCI". Концентрация пептидов GLP-1 в плазме может быть определена с помощью метода ЖХ-МС, описанного в данной работе в экспериментальной части под названием "Альтернативный анализ образцов плазмы с помощью ЖХ-МС".
Способ определения вариабельности концентрации в плазме
Для определения периода полувыведения из плазмы пептида GLP-1 после в/в или п/о введения человеку или животным (таким как, например, собаки породы бигль) может быть проведено фармакокинетическое исследование. При таком исследовании субъектам обычно вводят п/о однократную или многократную дозу пептида GLP-1 в соответствующей композиции. В определенные моменты времени после дозирования берут образцы крови и определяют в них концентрацию активных ингредиентов с помощью соответствующего количественного анализа. На основании этих измерений строят график изменения концентрации в плазме в зависимости от времени и проводят так называемый фармакокинетический анализ данных без компартментализации. Вариабельность концентрации в плазме может быть определена как CV в % или как относительное стандартное отклонение в % для Сmax или Cсредн. или ППК. Например, вариабельность концентрации в плазме может быть определена как CV в % для Сmax или Ссредн. или ППК.
Пептид GLP-1
Способ или применение согласно настоящему изобретению включает в себя пептид GLP-1 с периодом полувыведения из плазмы в организме человека по меньшей мере 60 часов. Термины "пептид GLP-1" и "активный пептид GLP-1" при использовании в данном контексте означают пептид, являющийся либо GLP-1 человека, либо его аналогом или производным с GLP-1 активностью.
Термин "GLP-1 человека" или "нативный GLP-1" при использовании в данном контексте означает гормон GLP-1 человека, чьи структура и свойства хорошо известны. GLP-1 человека также обозначают GLP-1 (7-37), он содержит 31 аминокислоту и образуется в результате избирательного расщепления молекулы проглукагона.
Пептиды GLP-1 согласно изобретению обладают GLP-1 активностью. Этот термин относится к способности связываться с рецептором GLP-1 и инициировать путь трансдукции сигнала, что приводит к инсулинотропному действию или другим физиологическим воздействиям, как известно в данной области техники. Например, аналоги и производные изобретения могут быть проверены на наличие GLP-1 активности с помощью стандартного испытания GLP-1 активности.
Термин "аналог GLP-1" при использовании в данном контексте означает модифицированный GLP-1 человека, в котором один или более аминокислотный остаток GLP-1 человека замещен другими аминокислотными остатками, и/или в котором один или более аминокислотный остаток удален из GLP-1 человека, и/или в котором один или более аминокислотный остаток присоединен и/или вставлен в GLP-1 человека.
Согласно некоторым вариантам осуществления, пептид GLP-1 имеет период полувыведения из плазмы в организме человека, составляющий по меньшей мере 60 часов, например, по меньшей мере приблизительно 70 часов, по меньшей мере 90 часов, по меньшей мере 100 часов или, например, по меньшей мере 120 часов, по меньшей мере 140 часов или по меньшей мере 160 часов. Согласно некоторым вариантам осуществления, пептид GLP-1 имеет период полувыведения из плазмы в организме человека, составляющий по меньшей мере 60 часов, по меньшей мере 70 часов или по меньшей мере 90 часов. Согласно некоторым вариантам осуществления, пептид GLP-1 имеет период полувыведения из плазмы в организме человека, составляющий по меньшей мере 100 часов или, например, по меньшей мере 120 часов, по меньшей мере 140 часов или по меньшей мере 160 часов. Согласно некоторым вариантам осуществления, пептид GLP-1 имеет период полувыведения из плазмы в организме человека, составляющий по меньшей мере 1 день, по меньшей мере 36 часов или по меньшей мере 2 дня.
Согласно некоторым вариантам осуществления, аналог GLP-1 содержит 10 аминокислотных модификаций (замены, делеции, присоединения (включая вставки) и любые их комбинации) или меньше, по сравнению с GLP-1 человека, или же 9, 8, 7, 6, 5, 4, 3 или 2 модификации или меньше, или же 1 модификацию по сравнению с GLP-1 человека. Согласно некоторым вариантам осуществления, аналог GLP-1 содержит 5 аминокислотных модификаций (замены, делеции, присоединения (включая вставки) и любые их комбинации) или меньше по сравнению с GLP-1 человека.
Модификации в молекуле GLP-1 обозначаются указанием позиции и одно- или трехбуквенного кода аминокислотного остатка, замещающего остаток нативной аминокислоты.
При использовании перечня последовательности первому аминокислотному остатку последовательности присваивают номер 1. Однако в дальнейшем, в соответствии с общепринятой практикой применительно к пептидам GLP-1, этот первый остаток называют - номер 7 и последующие аминокислотные остатки нумеруют соответственно, заканчивая номером 37. Таким образом, в большинстве случаев любая ссылка в данной работе на номер аминокислотного остатка или порядковый номер последовательности GLP-1 (7-37) предполагает последовательность, начинающуюся с His (гистидина) в положении 7 и заканчивающуюся Gly (глицином) в положении 37. При использовании для обозначения аминокислот однобуквенных кодов термины, такие как 34Е, 34Q или 34R, означают, что аминокислота в положении 34 является Е, Q и R, соответственно. При использовании для обозначения аминокислот трехбуквенных кодов соответствующие выражения имеют вид 34Glu (глутаминовая кислота), 34Gln (глутамин) и 34Arg (аргинин), соответственно.
"des7" или "(или Des7)" означает нативный GLP-1, в котором отсутствует N-концевая аминокислота, гистидин. Таким образом, например, des7GLP-1 (7-37) является аналогом GLP-1 человека, у которого аминокислота в положении 7 исключена. Такой аналог также может обозначаться как GLP-1 (8-37). Точно так же (des7+des8); (des7, des8); (des7-8); или (Des7, Des8) в отношении аналога GLP-1 (7-37), где может подразумеваться ссылка на GLP-1 (7-37), относится к аналогу, в котором аминокислоты, соответствующие двум N-концевым аминокислотам нативного GLP-1, гистидину и аланину, исключены. Этот аналог также может быть обозначен как GLP-1 (9-37).
Неограничивающим примером аналога изобретения является [Aib8, Arg34]GLP-1 (7-37), обозначающий аналог GLP-1 (7-37), в котором аланин в положении 8 замещен α-аминоизомасляной кислотой (Aib), а лизин в положении 34 замещен аргинином. Этот аналог также может быть обозначен как (8Aib, R34) GLP-1 (7-37).
Термин "производное GLP-1" при использовании в данном контексте означает химически модифицированный исходный GLP-1 (7-37) или его аналог, где модификация (модификации) имеет форму присоединения амидов, углеводов, алкильных групп, ацильных групп, сложных эфиров, пегилирования, их комбинаций и тому подобное.
Согласно некоторым вариантам осуществления изобретения, модификация (модификации) включает в себя прикрепление боковой цепи к GLP-1 (7-37) или его аналогу. Согласно частному аспекту, боковая цепь способна образовывать нековалентные агрегаты с альбумином, что способствует циркуляции производного с током крови, а также обеспечивает эффект увеличения времени действия производного благодаря тому факту, что агрегат GLP-1-производного и альбумина лишь медленно распадается, высвобождая активный фармацевтический ингредиент. Таким образом, заместитель, или боковая цепь, как целое, предпочтительно называется альбумин-связывающей группировкой. Согласно частным аспектам, боковая цепь содержит по меньшей мере 10 атомов углерода, или по меньшей мере 12, 14, 16, 18, 20, 22, или по меньшей мере 24 атома углерода. Согласно другим частным аспектам, боковая цепь может также содержать по меньшей мере 5 гетероатомов, в частности, О и N, например, по меньшей мере 7, 9, 10, 12, 15, 17 или по меньшей мере 20 гетероатомов, например, по меньшей мере 1, 2 или 3 N-атома и/или по меньшей мере 3, 6, 9, 12 или 15 О-атомов. Согласно некоторым вариантам осуществления, пептид GLP-1 является ацилированным пептидом GLP-1.
Согласно некоторым вариантам осуществления, альбумин-связывающая группировка включает в себя часть, которая особенно подходит для связывания альбумина и, тем самым, для пролонгирования, и соответственно, может быть названа "пролонгирующей группировкой". Пролонгирующая группировка может находиться на противоположном конце альбумин-связывающей группировки относительно точки его прикрепления к пептиду или вблизи этого конца.
Согласно некоторым вариантам осуществления, альбумин-связывающая группировка включает в себя часть между пролонгирующей группировкой и точкой прикрепления к пептиду, такая часть может быть названа "линкером", "линкерной группировкой", "спейсером" или тому подобным. Линкер может быть необязательными, следовательно, в этом случае альбумин-связывающая группировка может быть идентичной пролонгирующей группировке.
Согласно некоторым вариантам осуществления, альбумин-связывающая группировка и/или пролонгирующая группировка является липофильной и/или отрицательно заряженной при физиологическом значении рН (7,4).
Альбумин-связывающая группировка, пролонгирующая группировка или линкер могут быть, например, ковалентно связаны с лизиновым остатком пептида GLP-1 путем ацилирования. Согласно предпочтительному аспекту, активный сложный эфир альбумин-связывающей группировки, предпочтительно включающей в себя замедляющую (пролонгирующую) группировку и линкер, ковалентно связан с аминогруппой лизинового остатка, предпочтительно, с его эпсилон-аминогруппой, с образованием амидной связи (этот процесс именуется ацилированием).
Если не указано иное, при упоминании об ацилировании лизинового остатка следует понимать, что оно происходит по его эпсилон-аминогруппе.
В данном случае термины "альбумин-связывающая группировка", "пролонгирующая группировка" и "линкер" могут включать в себя как непрореагировавшие, так и прореагировавшие формы этих молекул. Какая именно форма имеется в виду, становится ясным из контекста, в котором этот термин употреблен.
Для прикрепления к пептиду GLP-1 кислотная группа жирной кислоты или одна из кислотных групп двухосновной жирной кислоты образует амидную связь с эпсилон-аминогруппой лизинового остатка в пептиде GLP-1, предпочтительно, через линкер.
Термин "двухосновная жирная кислота" относится к жирным кислотам, таким как определены выше, но содержащим дополнительную карбоксильную группу в омега-положении. Таким образом, двухосновные жирные кислоты являются дикарбоновыми кислотами.
Каждый из двух линкеров производного изобретения может включать в себя следующий первый линкерный элемент:
Соед. I:

где k представляет собой целое число в диапазоне от 1 до 5, а n представляет собой целое число в диапазоне от 1 до 5.
Согласно частному аспекту, если k равно 1 и n равно 1, этот линкерный элемент может быть обозначен как OEG или дирадикал 8-амино-3,6-диоксаоктановой кислоты, и/или он может быть представлен следующей формулой:
Соед. II:
NH-(CH2)2-O-(CH2)2-O-CH2-CO-*.
Согласно другому частному аспекту, каждый линкер производного согласно изобретению может также независимо включать в себя второй линкерный элемент, предпочтительно, дирадикал Glu, такой как Соед. III и/или Соед. IV:
Соед. III:

Соед. IV:

где дирадикал Glu может быть включен р раз, где р представляет собой целое число в диапазоне от 1 до 3.
Соед. III может также называться гамма-Glu или сокращенно yGlu в связи с тем, что в этом случае для соединения с другим линкерным элементом или с эпсилон-аминогруппой лизина используется гамма-карбоксильная группа аминокислоты глутаминовой кислоты. Как было описано выше, другой линкерный элемент может, например, быть другим остатком Glu или молекулой OEG. Аминогруппа Glu, в свою очередь, образует амидную связь с карбоксильной группой пролонгирующей группировки или с карбоксильной группой, например, молекулы OEG, если она присутствует, или с гамма-карбоксильной группой, например, другого Glu, если он присутствует.
Соед. IV может также называться альфа-Glu или сокращенно aGlu или просто Glu, поскольку в этом случае для соединения с другим линкерным элементом или с эпсилон-аминогруппой лизина используется альфа-карбоксильная группа аминокислоты глутаминовой кислоты.
Приведенные выше структуры Соед. III и Соед. IV покрывают L-форму и D-форму Glu. Согласно частным аспектам, Соед. III и/или Соед. IV является/являются независимо друг от друга а) L-формой или b) D-формой.
Согласно другим конкретным аспектам, линкер содержит а) от 5 до 41 атомов углерода; и/или b) от 4 до 28 гетероатомов.
Концентрация в плазме производного GLP-1 согласно изобретению может быть определена с помощью любого подходящего метода. Например, может быть использован метод ЖХ-МС (англ. LC-MS, жидкостная хроматография с масс-спектрометрией) или иммунологические анализы, такие как RIA (радиоиммунологический анализ, от англ. Radio immuno assay), ELISA (иммуноферментный анализ) и LOCI (иммунологический анализ люминесценции кислородных каналов). Общие протоколы подходящих анализов RIA и ELISA можно найти, например, в патентном документе WO 09/030738 на стр. с 116 по 118.
Конъюгирование аналога GLP-1 и активированной боковой цепи осуществляют при помощи любого стандартного метода, например, как описано в следующей ссылочной литературе (в которой также описаны подходящие методы активации полимерных молекул): R.F. Taylor, (1991), "Protein immobilisation. Fundamental and applications (Иммобилизация белка. Основные принципы и области применения)", Marcel Dekker, N.Y.; S.S. Wong, (1992), "Chemistry of Protein Conjugation and Crosslinking (Химия конъюгирования и сшивки белка)", CRC Press, Boca Raton; G.Т. Hermanson et al., (1993), "Immobilized Affinity Ligand Techniques (Методы иммобилизованных аффинных лигандов)", Academic Press, N.Y.). Специалисту известно, что используемые активационный метод и/или конъюгационная химия будут зависеть от присоединенной группы (групп) полипептида (примеры которых также приведены выше) и от функциональных групп полимера (например, представляющих собой амин, гидроксил, карбоксил, альдегид, сульфидрил, сукцинимидил, малеимид, винилсульфон или галогенацетат).
Согласно некоторым вариантам осуществления изобретения, пептид GLP-1 представляет собой N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси][Aib8,Arg34]GLP-1-(7-37) (альтернативное название Nε26-{18-[N-(17-карбоксигептадеканоил)-L-γ-глутамил]-10-оксо-3,6,12,15-тетраокса-9,18-диазаоктдеканоил}-[8-(2-амино-2-пропановая кислота),34-L-аргинин] глюкагоноподобный пептид человека 1(7-37)) или Nε26{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}, Nε37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}-[Aib8,Arg34,Lys37]GLP-1(7-37)-ОН.
Согласно некоторым вариантам осуществления изобретения, пептид GLP-1 представляет собой N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Аib8,Arg34]GLP-1-(7-37).
Согласно некоторым вариантам осуществления изобретения, пептид GLP-1 представляет собой Nε26{2-[2-(2-{2-[2-(2-{(5)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетил-амино}этокси)этокси]ацетил}, Nε37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этoкcи]aцeтил}-[Aib8,Arg34,Lys37]GLP-1(7-37)-OH.
Усилитель
Способ или применение согласно настоящему изобретению может включать усилитель. Согласно некоторым вариантам осуществления, усилитель является водорастворимым. Согласно некоторым вариантам осуществления, термин "усилитель" относится к соединению, увеличивающему биодоступность пептида GLP-1 в композиции после перорального введения. Соответственно, согласно некоторым вариантам осуществления, усилитель является усилителем биодоступности. Согласно некоторым вариантам осуществления, массовая доля усилителя составляет по меньшей мере 60 масс. %, например, по меньшей мере 70 масс. % или по меньшей мере 75 масс. %, от общей массы композиции.
Усилитель может быть среднецепочечной жирной кислотой или ее солью и иметь длину углеродной цепи приблизительно от 4 до 20 атомов углерода. Согласно некоторым вариантам осуществления, усилитель является солью каприновой кислоты, такой как капрат натрия. Согласно некоторым вариантам осуществления, массовая доля указанной среднецепочечной жирной кислоты, такой как соль каприновой кислоты (например, капрат натрия), составляет по меньшей мере 60 масс. %, например, по меньшей мере 70 масс. % или по меньшей мере 75 масс. %, от общей массы композиции. Согласно некоторым вариантам осуществления, количество указанной среднецепочечной жирной кислотой, такой как соль каприновой кислоты (например, капрат натрия), в композиции составляет по меньшей мере 2,0 ммоль, например, по меньшей мере 2,5 ммоль или по меньшей мере 3,5 ммоль, в одной единице дозирования. Согласно некоторым вариантам осуществления, количество соли каприновой кислоты, такой как капрат натрия, в композиции составляет по меньшей мере 300 мг, по меньшей мере 400 мг или по меньшей мере 500 мг.
Согласно некоторым вариантам осуществления, усилитель является солью N-(8-(2-гидроксибензоил)амино)каприловой кислоты. Согласно некоторым вариантам осуществления, усилитель является усилителем абсорбции. Структурная формула N-(8-(2-гидроксибензоил)амино)каприлата представлена формулой (I)

Согласно некоторым вариантам осуществления, соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты имеет форму каприловой кислоты и/или форму каприлата. Согласно некоторым вариантам осуществления, соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты включает в себя один одновалентный катион, два одновалентных катиона или один двухвалентный катион. Согласно некоторым вариантам осуществления, соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты выбирают из группы, состоящей из натриевой соли, калиевой соли и кальциевой соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты. Соли N-(8-(2-гидроксибензоил)амино)каприлата могут быть получены с помощью способа, описанного, например, в патентных документах WO 96/030036, WO 00/046182, WO 01/092206 или WO 2008/028859. Соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты может быть кристаллической и/или аморфной. Согласно некоторым вариантам осуществления, усилитель включает в себя ангидрид, моногидрат, дигидрат, тригидрат, сольват или треть гидрата соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты, а также их комбинации. Согласно некоторым вариантам осуществления, усилитель является солью N-(8-(2-гидроксибензоил)амино)каприловой кислоты, такой как описана в патентном документе WO 2007/121318. Согласно некоторым вариантам осуществления, усилитель является М-(8-(2-гидроксибензоил)амино)каприлатом натрия (именуемым здесь "SNAC"), также известным как 8-(салицилоиламино)октаноат натрия. Согласно некоторым вариантам осуществления, массовая доля соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты, такой как SNAC, составляет по меньшей мере 60 масс. %, например, по меньшей мере 70 масс. % или по меньшей мере 75 масс. %, от общей массы композиции. Согласно некоторым вариантам осуществления, массовая доля соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты, такой как SNAC, составляет от 50 до 90 масс. % от общей массы композиции. Согласно некоторым вариантам осуществления, количество соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты в композиции лежит в диапазоне от 0,6 до 3,5 ммоль. Согласно некоторым вариантам осуществления, количество соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты в композиции составляет по меньшей мере 0,6 ммоль. Согласно некоторым вариантам осуществления, количество SNAC в композиции лежит в диапазоне от 100 до 1000 мг. Согласно некоторым вариантам осуществления, количество SNAC составляет от 100 до 500 мг, например, от 200 до 400 мг или 300 мг. Согласно некоторым вариантам осуществления, молярное соотношение между пептидом GLP-1 и усилителем в композиции составляет менее 10, например, менее 5 или менее 1.
Композиция
Способ или применение согласно изобретению включает в себя композицию, имеющую в своем составе пептид GLP-1 и необязательно усилитель. Согласно некоторым вариантам осуществления, композиция имеет форму твердой дозированной лекарственной формы. Согласно некоторым вариантам осуществления, композиция имеет форму таблетки. Согласно некоторым вариантам осуществления, композиция имеет форму капсулы. Согласно некоторым вариантам осуществления, композиция имеет форму саше. Согласно некоторым вариантам осуществления, композиция включает в себя гранулы, полученные при помощи сухого гранулирования. Согласно некоторым вариантам осуществления, композиция включает в себя гранулы, полученные при помощи вальцевания. Согласно некоторым вариантам осуществления, формованные изделия после процесса вальцевания измельчают с получением гранул. Согласно некоторым вариантам осуществления, термин "гранулят" относится к одной или более гранулам. Согласно некоторым вариантам осуществления, термин "гранула" относится к частицам, соединенным в частицы большего размера.
Согласно некоторым вариантам осуществления, термин "композиция" при использовании в данном контексте относится к одной единице дозирования.
Согласно некоторым вариантам осуществления, композиция или гранула включает в себя по меньшей мере один фармацевтически приемлемый носитель. Термин "носитель" при использовании в данном контексте в широком смысле означает любой компонент, отличный от активного терапевтического ингредиента (ингредиентов). Вспомогательное вещество может быть инертным веществом, которое инертно в том смысле, что само по себе (per se) по существу не оказывает никакого терапевтического и/или профилактического воздействия. Вспомогательное вещество может служить различным целям, например, выступать в качестве усилителя, усилителя абсорбции, основы (носителя), заполнителя (также известного как разбавитель), связующего, смазывающего вещества, скользящего вещества, разрыхлителя, ингибиторов кристаллизации, подкисляющего агента, подщелачивающего агента, консерванта, антиокислителя, буферного агента, хелатирующего агента, комплексообразователя, поверхностно-активного вещества, эмульгаторов и/или растворителей, подсластителей, увлажняющих агентов, стабилизатора, красителя, вкусовых и ароматизирующих добавок, и/или служить для улучшения введения и/или абсорбции активного вещества. Специалист в данной области может выбрать один или более из упомянутых выше вспомогательных веществ, с учетом конкретных требуемых свойств твердой пероральной лекарственной формы, при помощи стандартных исследований и без излишних сложностей. Количество каждого используемого вспомогательного вещества может варьировать в пределах диапазонов, стандартных для данной области техники. Способы и вспомогательные вещества, которые могут быть использованы для приготовления пероральных лекарственных форм, описаны в справочниках Handbook of Pharmaceutical Excipients, 6th edition, Rowe et al., Eds., American Pharmaceuticals Association and the Pharmaceutical Press, публикациях издательского отдела Королевского фармацевтического общества Великобритании Royal Pharmaceutical Society of Great Britain (2009); и справочнике Remington: the Science and Practice of Pharmacy, 21th edition, Gennaro, Ed., Lippincott Williams & Wilkins (2005).
Согласно некоторым вариантам осуществления, композиция или гранула включает в себя заполнитель, такой как лактоза (например, высушенная распылением лактоза, α-лактоза, β-лактоза, Таблетоза®, различные марки Фарматозы®, Микротоза® или Фаст-Флок®), микрокристаллическая целлюлоза (различные марки Авицел®, Эльцема®, Вивацел®, Минг Тай® или Солка-Флок®), другие производные целлюлозы, сахароза, сорбит, маннит, декстрины, декстраны, мальтодекстрины, декстроза, фруктоза, каолин, маннит, сорбит, сахароза, сахар, крахмалы или модифицированные крахмалы (в том числе картофельный крахмал, кукурузный крахмал и рисовый крахмал), фосфат кальция (например, основной фосфат кальция, гидрофосфат кальция, гидрат кальция фосфорнокислого двузамещенного), сульфат кальция, карбонат кальция или альгинат натрия. Согласно некоторым вариантам осуществления, заполнитель является микрокристаллической целлюлозой, такой как Авицел РН 101.
Согласно некоторым вариантам осуществления, композиция или гранула включает в себя связующее, такое как лактоза (например, высушенная распылением лактоза, α-лактоза, β-лактоза, Таблетоза®, различные марки Фарматозы®, Микротоза® или Фаст-Флок®), микрокристаллическая целлюлоза (различные марки Авицел®, Эльцема®, Вивацел®, Минг Тай® или Солка-Флок®), гидроксипропилцеллюлоза, L-гидроксипропилцеллюлоза (с низкой степенью замещения), гипромеллоза (англ. НРМС) (например, Метоцел Е, F и K, Метолоза SH из Shin-Etsu, Ltd, такая как, например, сорта Метоцела Е и Метолозы 60 SH с вязкостью 4000 сП, сорта Метоцела Е и Метолозы 65 SH с вязкостью 4000 сП, сорта Метоцела К с вязкостью 4000, 15000 и 100000 сП; и сорта Метолозы 90 SH 4000, 15000, 39000 и 100000), полимеры метилцеллюлозы (такие как, например, Метоцел А, Метоцел А4С, Метоцел А15С, Метоцел А4М), гидроксиэтилцеллюлоза, этилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, другие производные целлюлозы, сахароза, декстрины, мальтодекстрины, крахмалы или модифицированные крахмалы (в том числе картофельный крахмал, кукурузный крахмал и рисовый крахмал), лактат кальция, карбонат кальция, аравийская камедь, альгинат натрия, агар, каррагинан, желатин, гуаровая камедь, пектин, ПЭГ или повидон. Согласно некоторым вариантам осуществления, связующее является повидоном, таким как повидон K 90.
Согласно некоторым вариантам осуществления, композиция или гранула включает в себя разрыхлитель, такой как альгиновая кислота, альгинаты, микрокристаллическая целлюлоза, гидроксипропилцеллюлоза, другие производные целлюлозы, кроскармеллоза натрия, кросповидон, полакрилин калия, натриевая соль карбоксиметилкрахмала, крахмал, прежелатинизированный крахмал или карбоксиметилкрахмал (например, Примогель® и Эксплотаб®).
Согласно некоторым вариантам осуществления, композиция или гранула включает в себя смазывающее вещество, такое как стеариновая кислота, стеарат магния, стеарат кальция или стеарат другого металла, тальк, воски, глицериды, легкое минеральное масло, глицерилбегенат, гидрогенизированные растительные масла, стеарилфумарат натрия, полиэтиленгликоли, алкилсульфаты или бензоат натрия. Согласно некоторым вариантам осуществления, композиция или гранула включает в себя смазывающее вещество, такое как силикат магния, тальк или коллоидный диоксид кремния. Согласно некоторым вариантам осуществления, смазывающим веществом является стеарат магния.
Согласно некоторым вариантам осуществления, композиция или гранула включает в себя одно или более вспомогательное вещество, выбранное из ингибиторов кристаллизации, таких как повидон и т.д.; растворителей (также известных как поверхностно-активные вещества), таких как анионные поверхностно-активные вещества (например, плюроник или повидон), катионные поверхностно-активные вещества, неионные поверхностно-активные вещества и/или цвиттер-ионные поверхностно-активные вещества; красящих веществ, в том числе красителей и пигментов, таких как оксиды железа красный или желтый, диоксид титана, и/или тальк; и/или регуляторов pH, таких как лимонная кислота, винная кислота, фумаровая кислота, цитрат натрия, двухосновный фосфат кальция и/или двухосновный фосфат натрия.
Согласно некоторым вариантам осуществления, композиция включает в себя по меньшей мере 60 масс. % усилителя, менее 10 масс. % связующего, от 5 до 40 масс. % заполнителя и менее 10 масс. % смазывающего вещества. Согласно некоторым вариантам осуществления, усилитель является солью N-(8-(2-гидроксибензоил)амино)каприловой кислоты, и композиция включает в себя первую гранулу, содержащую пептид GLP-1 и не содержащую соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, и вторую гранулу, содержащую соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и не содержащую пептид GLP-1.
Согласно некоторым вариантам осуществления, масса таблетки составляет от 150 мг до 1000 мг, например, от 300 до 600 мг или, например, от 300 до 500 мг.
Композиция может включать в себя одно или более покрытие, которое может быть получено с помощью известных способов.
Способы приготовления композиций
Композиция для применения в настоящем изобретении может быть приготовлена известными в данной области техники способами. Согласно некоторым вариантам осуществления, композиция может быть гранулирована перед прессованием с получением таблеток. Согласно некоторым вариантам осуществления, гранулы изобретения получают при помощи сухого гранулирования, например, при помощи вальцевания. Согласно некоторым вариантам осуществления, формованные изделия после процесса вальцевания измельчают с получением гранул. Композиция может включать в себя одну или более внутригранулярные части и внегранулярную часть, где внутригранулярные части гранулируют, а внегранулярную часть добавляют после гранулирования. Первая внутригранулярная часть может включать в себя пептид GLP-1 и одно или более вспомогательное вещество, а вторая внутригранулярная часть может включать в себя усилитель и необязательно одно или более вспомогательное вещество. Первая внутригранулярная часть может включать в себя пептид GLP-1, заполнитель и/или связующее, а вторая внутригранулярная часть может включать в себя усилитель, смазывающее вещество и/или заполнитель. Согласно некоторым вариантам осуществления, первая внутригранулярная часть включает в себя пептид GLP-1, микрокристаллическую целлюлозу и/или повидон, а вторая внутригранулярная часть включает в себя усилитель, стеарат магния и/или микрокристаллическую целлюлозу. Внегранулярная часть может включать в себя смазывающее вещество. Согласно некоторым вариантам осуществления, внегранулярная часть включает в себя стеарат магния.
Для приготовления сухой смеси материала для производства таблеток компоненты взвешивают, необязательно растирают и затем объединяют. Перемешивание компонентов может осуществляться до получения гомогенной смеси.
Согласно некоторым вариантам осуществления, по меньшей мере часть композиции подвергают сухой или влажной грануляции. Гранулят может быть получен при помощи способа, известного специалисту в данной области, например, с использованием технологии сухого гранулирования, при которой фармацевтически активный агент и/или усилители прессуют вместе с вспомогательными веществами с образованием относительно больших формованных продуктов, например, брусков или полос, которые тонко измельчают путем растирания, и измельченный материал служит в качестве материала для изготовления таблеток, подлежащего впоследствии прессованию с получением таблеток. Подходящее оборудование для сухого гранулирования включает, не ограничиваясь перечнем, оборудование для вальцевания компании Gerteis, такое как Gerteis MINI-PACTOR. Согласно некоторым вариантам осуществления, гранулят получают при помощи вальцевания. Согласно некоторым вариантам осуществления, формованные изделия после процесса вальцевания измельчают с получением гранул. Или же, гранулят может быть получен при помощи влажного гранулирования, которое может осуществляться путем перемешивания фармацевтически активного агента, растворенного в воде, с сухой смесью усилителей и необязательно одного или более вспомогательного вещества с последующей сушкой гранулята.
Для прессования материала для изготовления таблеток с получением твердой пероральной лекарственной формы, например таблетки, может использоваться таблеточный пресс. На таблеточном прессе материал для изготовления таблеток загружают (например, с принудительной подачей или самотеком) в полость матрицы. После этого материал для изготовления таблеток сжимают при помощи пуансона под давлением. Затем полученный прессованный продукт или таблетка выталкивается из таблеточного пресса. Упомянутый выше процесс таблетирования далее в настоящем документе именуют "процессом таблетирования". Подходящие таблеточные прессы включают, не ограничиваясь перечнем, роторные таблеточные прессы и эксцентриковые таблеточные прессы. Примеры таблеточных прессов включают, не ограничиваясь перечнем, Fette 102i (Fette GmbH), Korsch XL100, Korsch PH 106 роторный таблеточный пресс (Korsch AG, Германия), Korsch EK-0 эксцентриковый таблеточный пресс (Korsch AG, Германия) и пресс Manesty F-Press (Manesty Machines Ltd., Соединенное Королевство). Согласно некоторым вариантам осуществления, таблетку получают, прилагая сжимающее усилие в диапазоне от 5 до 25 кН.
Показания к применению
Композиция для использования в настоящем изобретении предназначена для применения в качестве лекарственного средства. Согласно некоторым вариантам осуществления, композиция предназначена для использования при лечении или профилактике диабета и/или ожирения.
Следует понимать, что композиция или пептид GLP-1 для применения в качестве перорального фармацевтического препарата (то есть лекарственного средства) может рассматриваться как способ введения или, в качестве альтернативы, как применение композиции при производстве перорального фармацевтического препарата. Следует понимать, что способ введения, описанный в данной работе, может в качестве альтернативы рассматриваться как композиция для применения в качестве перорального фармацевтического препарата, или же как применение композиции при производстве перорального фармацевтического препарата. Способ введения, описанный в данной работе, может в качестве альтернативы рассматриваться как пептид GLP-1 для применения в качестве перорального фармацевтического препарата или же как применение пептида GLP-1 при производстве перорального фармацевтического препарата. Аналогично, применение пептида GLP-1, описанного в данной работе, может в качестве альтернативы рассматриваться как способ введения или применение пептида GLP-1 при производстве перорального фармацевтического препарата. Согласно некоторым вариантам осуществления, термины "режим дозирования" и "способ введения" в данном контексте употребляются как синонимы. При этом, согласно некоторым вариантам осуществления, термин "применение" включает в себя композицию для применения, например, "применение в медицине" включает в себя "композицию для применения в медицине". Согласно некоторым вариантам осуществления, термин "способ" при использовании в данном контексте включает в себя способ введения, например, способ перорального введения.
Способ введения согласно изобретению включает в себя пероральную терапию. Согласно некоторым вариантам осуществления, способ включает в себя лечение или профилактику диабета и/или ожирения.
Согласно некоторым вариантам осуществления, способ или применение включает в себя (например, пептид GLP-1 согласно изобретению может быть использован для следующего медицинского лечения):
(i) профилактику и/или лечение всех форм диабета, таких как гипергликемия, диабет 2-го типа, нарушенная толерантность к глюкозе, диабет 1 типа, инсулинонезависимый диабет, MODY (диабет взрослого типа у молодых), гистационный диабет, и/или использование для снижения HbA1c;
(ii) замедление или предупреждение прогрессирования диабетического заболевания, такого как прогрессирование диабета 2-го типа, замедление прогрессирования нарушенной толерантности к глюкозе (IGT) для инсулинозависимого диабета 2-го типа и/или замедление прогрессирования инсулинонезависимого диабета 2-го типа для инсулинозависимого диабета 2-го типа;
(iii) профилактику и/или лечение нарушений пищевого поведения, таких как ожирение, например, за счет снижения потребления пищи, уменьшения массы тела, подавления аппетита, включая насыщение; лечение или профилактику компульсивного переедания, нейрогенной булимии и/или ожирения, вызванного приемом антипсихотического средства или стероидного гормона; снижение двигательной функции желудка; и/или замедление эвакуации желудочного содержимого.
Согласно некоторым вариантам осуществления, показанием является пункт (i). Согласно некоторым вариантам осуществления, показанием является пункт (ii). Согласно еще одному частному аспекту, показанием является пункт (iii). Согласно некоторым вариантам осуществления, показанием является диабет 2-го типа и/или ожирение.
Согласно некоторым вариантам осуществления, способ или применение включает в себя профилактику, лечение, ослабление и/или вызывание одного или более заболеваний или состояний, описанных в данном контексте. Согласно некоторым вариантам осуществления, показанием являются пункты (i) и (iii). Согласно некоторым вариантам осуществления, показанием являются пункты (ii) и (iii). Согласно некоторым вариантам осуществления, способ включает в себя профилактику, лечение, ослабление и/или вызывание одного или более заболеваний или состояний, выбранных из a) и b), a) и c), b) и c) или a), b) и c), как описано в п. 1 формулы изобретения.
Согласно некоторым вариантам осуществления, изобретение включает в себя введение эффективного количества пептида GLP-1. Согласно некоторым вариантам осуществления, изобретение относится к введению эффективного количества пептида GLP-1.
Согласно некоторым вариантам осуществления, при использовании в данном контексте конкретные величины, приведенные в виде числовых значений или диапазонов можно рассматривать как конкретное значение либо как приблизительное конкретное значение.
Описание вариантов осуществления изобретения
Ниже представлены неограничивающие варианты осуществления изобретения:
1. Твердая композиция, включающая в себя пептид GLP-1 и усилитель, для использования в качестве лекарственного препарата путем перорального введения, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 60 часов, где указанную композицию вводят по меньшей мере 3 раза, и где
а) указанную композицию вводят через день или чаще; или
b) указанную композицию вводят таким образом, чтобы соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанной композиции, выраженным в днях, составляло более чем 2:1.
2. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция имеет форму таблетки.
3. Композиция по любому из предшествующих вариантов осуществления, где указанную композицию вводят два раза в день, один раз в день или через день.
4. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид вводят по меньшей мере через день.
5. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид вводят по меньшей мере один раз в день.
6. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид вводят по меньшей мере два раза в день.
7. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой пептид GLP-1.
8. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой ацилированный пептид GLP-1.
9. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Аib8,Arg34]GLР-1-(7-37) или Nε26{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}, Nε37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}-[Aib8,Arg34,Lys37]GLP-1(7-37)-OH.
10. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Аib8,Arg34]GLP-1-(7-37).
11. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой Nε26{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}, Nε37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}[Аib8,Arg34,Lys37]GLР-1(7-37)-ОН.
12. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид вводят в композиции, также содержащей одно или более фармацевтически приемлемое вспомогательное вещество.
13. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция имеет форму таблетки или капсулы.
14. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 1 до 1000 нМ (от 10-9 до 0,000001 моль/л).
15. GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 1 до 300 нМ (от 10-9 до 3×10-7 моль/л).
16. GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 10 до 100 нМ (от 10-8 до 10-7 моль/л).
17. Композиция по любому из предшествующих вариантов осуществления, где указанное лечение включает в себя профилактику и/или лечение диабета 2-го типа или ожирения.
18. Композиция по любому из предшествующих вариантов осуществления, где указанный усилитель является солью N-(8-(2-гидроксибензоил)амино)каприловой кислоты, такой как SNAC.
19. Композиция по любому из предшествующих вариантов осуществления, где массовая доля соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты, такой как SNAC, составляет по меньшей мере 50 масс. % от указанной композиции.
20. Композиция по любому из предшествующих вариантов осуществления, где количество SNAC составляет от 100 до 500 мг SNAC, например, от 200 до 400 мг или 300 мг SNAC.
21. Композиция по любому из предшествующих вариантов осуществления, где указанный усилитель является солью каприновой кислоты, такой как капрат натрия.
22. Композиция по любому из предшествующих вариантов осуществления, где количество указанной соли каприновой кислоты, такой как капрат натрия, составляет по меньшей мере 300 мг.
23. Композиция по любому из предшествующих вариантов осуществления, где массовая доля указанной соли каприновой кислоты, такой как капрат натрия, составляет по меньшей мере 50 масс. % от указанной композиции.
24. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция включает в себя покрытие.
25. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 70 часов.
26. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,01 до 100 мг, например, от 2 до 60 мг или, например, по меньшей мере 5 мг или по меньшей мере 10 мг.
27. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 100 мг.
28. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 50 мг.
29. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 25 мг.
30. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 1 до 25 мг.
31. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 5 до 50 мг.
32. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 10 мг.
33. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 5 мг.
34. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг пептида GLP-1 и от 100 до 500 мг или от 50 до 90 масс. % SNAC.
35. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид является семаглутидом.
36. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг семаглутида и от 100 до 500 мг или от 50 до 90 масс. % SNAC.
37. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 2 до 40 мг семаглутида и от 200 до 400 мг (например, 300 мг) или от 50 до 90 масс. % SNAC.
38. Композиция по любому из предшествующих вариантов осуществления, где указанный пептид входит в состав фармацевтической композиции, также содержащей одно или более фармацевтически приемлемое вспомогательное вещество.
39. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция содержит пептид GLP-1, SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
40. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг пептида GLP-1, от 100 до 500 мг SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
41. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг пептида GLP-1, от 50 до 90 масс. % SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
44. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг пептида GLP-1, от 100 до 500 мг или от 50 до 90 масс. % SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
45. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг пептида GLP-1, от 100 до 500 мг или от 50 до 90 масс. % SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
46. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг пептида GLP-1, от 200 до 400 мг (например, 300 мг) или от 50 до 90 масс. % SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
47. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг семаглутида, от 200 до 400 мг (например, 300 мг) или от 50 до 90 масс. % SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
48. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 2 до 60 мг семаглутида, от 200 до 400 мг (например, 300 мг) или от 50 до 90 масс. % SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
49. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 5 до 40 мг семаглутида, от 200 до 400 мг (например, 300 мг) или от 50 до 90 масс. % SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
50. Композиция по любому из предшествующих вариантов осуществления, где указанную композицию вводят по меньшей мере 5 раз, например, по меньшей мере 7 раз или по меньшей мере 10 раз.
51. Композиция по любому из предшествующих вариантов осуществления, где указанную композицию вводят по меньшей мере 14 раз или по меньшей мере 21 раз.
52. Композиция по любому из предшествующих вариантов осуществления, где указанную композицию вводят в течение по меньшей мере 2 недель, в течение по меньшей мере 3 недель или в течение по меньшей мере 4 недель.
53. Композиция по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 3:1.
54. Композиция по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 4:1.
55. Композиция по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 5:1.
56. Композиция по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 6:1.
57. Композиция по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 7:1.
58. Композиция по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 14:1.
59. Композиция по любому из предшествующих вариантов осуществления, где период полувыведения из плазмы определяют после в/в введения.
60. Композиция по любому из предшествующих вариантов осуществления, где период полувыведения из плазмы определяют после п/о введения.
61. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция предназначена для применения при лечении или профилактике диабета и/или ожирения.
62. Композиция по любому из предшествующих вариантов осуществления, где указанная композиция предназначена для применения при следующем лечении:
(i) для профилактики и/или лечения всех форм диабета, таких как гипергликемия, диабет 2-го типа, нарушенная толерантность к глюкозе, диабет 1 типа, инсулинонезависимый диабет, MODY (диабет взрослого типа у молодых), гистационный диабет, и/или для снижения НbА1с;
(ii) для замедления или предупреждения прогрессирования диабетического заболевания, такого как прогрессирование диабета 2-го типа, для замедления прогрессирования нарушенной толерантности к глюкозе (IGT) для инсулинозависимого диабета 2-го типа и/или для замедлени] прогрессирования инсулинонезависимого диабета 2-го типа для инсулинозависимого диабета 2-го типа; и/или
(iii) для профилактики и/или лечения нарушений пищевого поведения, таких как ожирение, например, за счет снижения потребления пищи, уменьшения массы тела, подавления аппетита, включая насыщение; для лечения или профилактики компульсивного переедания, нейрогенной булимии и/или ожирения, вызванного приемом антипсихотического средства или стероидного гормона; для снижения двигательной функции желудка; и/или замедления эвакуации желудочного содержимого.
63. Способ перорального введения фармацевтически активного пептида GLP-1 субъекту, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 60 часов, и где указанный способ включает в себя стадию введения указанного пептида через день или чаще в терапевтически эффективном количестве.
64. Способ перорального введения твердой композиции, имеющей в своем составе пептид GLP-1 и усилитель, субъекту, нуждающемуся в этом, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 60 часов, где указанную композицию вводят по меньшей мере 3 раза, и где а) указанную композицию вводят через день или чаще; или b) указанную композицию вводят таким образом, чтобы соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанной композиции, выраженным в днях, составляло более чем 2:1.
65. Способ перорального введения твердой композиции, имеющей в своем составе пептид GLP-1 и усилитель, субъекту, нуждающемуся в этом, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 60 часов, где указанную композицию вводят по меньшей мере 3 раза, и где указанную композицию вводят через день или чаще.
66. Способ перорального введения твердой композиции, имеющей в своем составе пептид GLP-1 и усилитель, субъекту, нуждающемуся в этом, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 60 часов, где указанную композицию вводят по меньшей мере 3 раза, и где указанную композицию вводят таким образом, чтобы соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанной композиции, выраженным в днях, составляло более чем 2:1.
67. Способ по любому из предшествующих вариантов осуществления, где указанная композиция имеет форму таблетки.
68. Способ по любому из предшествующих вариантов осуществления, где указанную композицию вводят два раза в день, один раз в день или через день.
69. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят по меньшей мере через день.
70. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят по меньшей мере один раз в день.
71. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят по меньшей мере два раза в день.
72. Способ по любому из предшествующих вариантов осуществления, где указанный пептид является пептидом GLP-1.
73. Способ по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой ацилированный пептид GLP-1.
74. Способ по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Аib8,Arg34]GLР-1-(7-37) или Nε26{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}, Nε37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)-деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}-[Aib8,Arg34,Lys37]GLP-1(7-37)-OH.
75. Способ по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Аib8,Arg34]GLР-1-(7-37).
11. Способ по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой Nε26{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}-этокси)этокси]ацетиламино}этокси)этокси]ацетил}, Nε37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)-деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}-[Aib8,Arg34,Lys37]GLP-1(7-37)-OH.
76. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в композиции, также содержащей одно или более фармацевтически приемлемое вспомогательное вещество.
77. Способ по любому из предшествующих вариантов осуществления, где указанная композиция имеет форму таблетки или капсулы.
78. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 1 до 1000 нМ (от 10-9 до 0,000001 моль/л).
79. GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 1 до 300 нМ (от 10-9 до 3×10-7 моль/л).
80. GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 10 до 100 нМ (от 10-8 до 10-7 моль/л).
81. Способ по любому из предшествующих вариантов осуществления, где указанное лечение включает в себя профилактику и/или лечение диабета 2-го типа или ожирения.
82. Способ по любому из предшествующих вариантов осуществления, где указанный усилитель является солью N-(8-(2-гидроксибензоил)амино)каприловой кислоты, такой как SNAC.
83. Способ по любому из предшествующих вариантов осуществления, где массовая доля соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты, такой как SNAC, составляет по меньшей мере 50 масс. % от указанной композиции.
84. Способ по любому из предшествующих вариантов осуществления, где количество SNAC составляет от 100 до 500 мг SNAC, например, от 200 до 400 мг или 300 мг SNAC.
85. Способ по любому из предшествующих вариантов осуществления, где указанный усилитель является солью каприновой кислоты, такой как капрат натрия.
86. Способ по любому из предшествующих вариантов осуществления, где количество указанной соли каприновой кислоты, такой как капрат натрия, составляет по меньшей мере 300 мг.
87. Способ по любому из предшествующих вариантов осуществления, где массовая доля указанной соли каприновой кислоты, такой как капрат натрия, составляет по меньшей мере 50 масс. % от указанной композиции.
88. Способ по любому из предшествующих вариантов осуществления, где указанная композиция включает в себя покрытие.
89. Способ по любому из предшествующих вариантов осуществления, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 70 часов.
90. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,01 до 100 мг, например, от 2 до 60 мг или, например, по меньшей мере 5 мг или по меньшей мере 10 мг.
91. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 100 мг.
92. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 50 мг.
93. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 25 мг.
94. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 1 до 25 мг.
95. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 5 до 50 мг.
96. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 10 мг.
97. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 5 мг.
98. Способ по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг пептида GLP-1 и от 100 до 500 мг или от 50 до 90 масс. % SNAC.
99. Способ по любому из предшествующих вариантов осуществления, где указанный пептид является семаглутидом.
100. Способ по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг семаглутида и от 100 до 500 мг или от 50 до 90 масс. % SNAC.
101. Способ по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 2 до 40 мг семаглутида и от 200 до 400 мг (например, 300 мг) или от 50 до 90 масс. % SNAC.
102. Способ по любому из предшествующих вариантов осуществления, где указанный пептид входит в состав фармацевтической композиции, также содержащей одно или более фармацевтически приемлемое вспомогательное вещество.
103. Способ по любому из предшествующих вариантов осуществления, где указанная композиция содержит пептид GLP-1, SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
104. Способ по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг пептида GLP-1, от 100 до 500 мг SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
105. Способ по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг пептида GLP-1, от 50 до 90 масс. % SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
106. Способ по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг пептида GLP-1, от 100 до 500 мг или от 50 до 90 масс. % SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
107. Способ по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг пептида GLP-1, от 100 до 500 мг или от 50 до 90 масс. % SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
108. Способ по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг пептида GLP-1, от 200 до 400 мг (например, 300 мг) или от 50 до 90 масс. % SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
109. Способ по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 1 до 100 мг семаглутида, от 200 до 400 мг (например, 300 мг) или от 50 до 90 масс. % SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
110. Способ по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 2 до 60 мг семаглутида, от 200 до 400 мг (например, 300 мг) или от 50 до 90 масс. % SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
111. Способ по любому из предшествующих вариантов осуществления, где указанная композиция содержит от 5 до 40 мг семаглутида, от 200 до 400 мг (например, 300 мг) или от 50 до 90 масс. % SNAC, микрокристаллическую целлюлозу, повидон и стеарат магния.
112. Способ по любому из предшествующих вариантов осуществления, где указанную композицию вводят по меньшей мере 5 раз, например, по меньшей мере 7 раз или по меньшей мере 10 раз.
113. Способ по любому из предшествующих вариантов осуществления, где указанную композицию вводят по меньшей мере 14 раз или по меньшей мере 21 раз.
114. Способ по любому из предшествующих вариантов осуществления, где указанную композицию вводят в течение по меньшей мере 2 недель, в течение по меньшей мере 3 недель или в течение по меньшей мере 4 недель.
115. Способ по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, в организме человека и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 3:1.
116. Способ по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, в организме человека и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 4:1.
117. Способ по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, в организме человека и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 5:1.
118. Способ по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, в организме человека и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 6:1.
119. Способ по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, в организме человека и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 7:1.
120. Способ по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, в организме человека и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 14:1.
121. Способ по любому из предшествующих вариантов осуществления, где период полувыведения из плазмы определяют после в/в введения.
122. Способ по любому из предшествующих вариантов осуществления, где период полувыведения из плазмы определяют после п/о введения.
123. Способ по любому из предшествующих вариантов осуществления, где указанная композиция предназначена для применения при лечении или профилактике диабета и/или ожирения.
124. Способ по любому из предшествующих вариантов осуществления, где указанная композиция предназначена для применения при следующем лечении:
(i) для профилактики и/или лечения всех форм диабета, такого как гипергликемия, диабет 2-го типа, нарушенная толерантность к глюкозе, диабет 1 типа, инсулинонезависимый диабет, MODY (диабет взрослого типа у молодых), гистационный диабет, и/или для снижения НbА1с;
(ii) для замедления или предупреждения прогрессирования диабетического заболевания, такого как прогрессирование диабета 2-го типа, для замедления прогрессирования нарушенной толерантности к глюкозе (IGT) для инсулинозависимого диабета 2-го типа, и/или для замедления прогрессирования инсулинонезависимого диабета 2-го типа для инсулинозависимого диабета 2-го типа; и/или
(iii) для профилактики и/или лечения нарушений пищевого поведения, такого как ожирение, например, за счет снижения потребления пищи, уменьшения массы тела, подавления аппетита, включая насыщение; для лечения или профилактики компульсивного переедания, нейрогенной булимии, и/или ожирения, вызванного приемом антипсихотического средства или стероидного гормона; для снижения двигательной функции желудка; и/или для замедления эвакуации желудочного содержимого.
125. Применение пептида GLP-1 при производстве лекарственного средства для перорального введения при лечении заболевания или состояния, такого как диабет, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 60 часов, где указанную композицию вводят по меньшей мере 3 раза и а) указанную композицию вводят через день или чаще; или b) указанную композицию вводят таким образом, чтобы соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанной композиции, выраженным в днях, составляло более чем 2:1.
126. Применение твердой композиции, имеющей в своем составе пептид GLP-1 и усилитель, при производстве лекарственного средства для перорального введения при лечении заболевания или состояния, такого как диабет, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 60 часов, где указанную композицию вводят по меньшей мере 3 раза, и где указанную композицию вводят через день или чаще.
127. Применение твердой композиции, имеющей в своем составе пептид GLP-1 и усилитель, при производстве лекарственного средства для перорального введения при лечении заболевания или состояния, такого как диабет, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 60 часов, где указанную композицию вводят по меньшей мере 3 раза, и где указанную композицию вводят таким образом, чтобы соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанной композиции, выраженным в днях, составляло более чем 2:1.
128. Применение по любому из вариантов осуществления со 125 по 127, где указанный пептид GLP-1 и/или указанная композиция являются такими, как определены по любой комбинации предшествующих вариантов осуществления.
Дополнительные частные варианты осуществления
Далее представлены частные неограничивающие варианты осуществления изобретения:
1. Пептид GLP-1 для применения при лечении в качестве перорального фармацевтического препарата через день или чаще, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 60 часов.
2. Пептид GLP-1, представляющий собой пептид GLP-1 с низким клиренсом, для применения при лечении в качестве перорального фармацевтического препарата с таким режимом дозирования, что соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 2:1.
3. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 3:1.
4. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 4:1.
5. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 5:1.
6. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 6:1.
7. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 7:1.
8. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 14:1.
9. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где период полувыведения из плазмы определяют после в/в введения.
10. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где период полувыведения из плазмы определяют после п/о введения.
11. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 1 день.
12. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 36 часов.
13. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 2 дня.
14. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 60 часов.
15. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят по меньшей мере через день.
16. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят по меньшей мере один раз в день.
17. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят по меньшей мере два раза в день.
18. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 100 мг.
19. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 50 мг.
20. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 25 мг.
21. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 1 до 25 мг.
22. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 5 до 50 мг.
23. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 10 мг.
24. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 5 мг.
25. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид является пептидом GLP-1.
26. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой ацилированный пептид GLP-1.
27. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Аib8,Arg34]GLP-1-(7-37) или Nε26{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}, Nε37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил-[Aib8,Arg34,Lys37]GLP-1(7-37)-OH.
28. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Аib8,Arg34]GLP-1-(7-37).
29. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой Nε26{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}-этокси)этокси]ацетиламино}этокси)этокси]ацетил}, Nε37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)-деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}-[Aib8,Arg34,Lys37]GLP-1(7-37)-OH.
30. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят в композиции, также содержащей одно или более фармацевтически приемлемое вспомогательное вещество.
31. Пептид GLP-1 по варианту осуществления 22, где указанная композиция имеет форму твердой дозированной лекарственной формы, такой как таблетка или капсула.
32. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 1 до 1000 нМ (от 10-9 до 0,000001 моль/л).
33. GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 1 до 300 нМ (от 10-9 до 3×10-7 моль/л).
34. GLP-1 по любому из предшествующих вариантов осуществления, где указанный пептид вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 10 до 100 нМ (от 10-8 до 10-7 моль/л).
35. Пептид GLP-1 по любому из предшествующих вариантов осуществления, где указанное лечение включает в себя профилактику и/или лечение диабета 2-го типа или ожирения.
36. Способ перорального введения фармацевтически активного пептида GLP-1 субъекту, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 60 часов, и где указанный способ включает в себя стадию введения указанного пептида через день или чаще в терапевтически эффективном количестве.
37. Способ перорального введения пептида GLP-1 с низким клиренсом в терапевтически эффективной дозе субъекту, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 2:1.
38. Способ по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 3:1.
39. Способ по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 4:1.
40. Способ по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 5:1.
41. Способ по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 6:1.
42. Способ по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 7:1.
43. Способ по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 14:1.
44. Способ по любому из предшествующих вариантов осуществления, где период полувыведения из плазмы определяют после в/в введения.
45. Способ по любому из предшествующих вариантов осуществления, где период полувыведения из плазмы определяют после п/о введения.
46. Способ по любому из предшествующих вариантов осуществления, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 1 день.
47. Способ по любому из предшествующих вариантов осуществления, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 36 часов.
48. Способ по любому из предшествующих вариантов осуществления, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 2 дня.
49. Способ по любому из предшествующих вариантов осуществления, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 60 часов.
50. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят по меньшей мере через день.
51. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят по меньшей мере один раз в день.
52. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят по меньшей мере два раза в день.
53. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 100 мг.
54. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 50 мг.
55. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 25 мг.
56. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 1 до 25 мг.
57 способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 5 до 50 мг.
58. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 10 мг.
59. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 5 мг.
60. Способ по любому из предшествующих вариантов осуществления, где указанный пептид является пептидом GLP-1.
61. Способ по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой ацилированный пептид GLP-1.
62. Способ по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Аib8,Arg34]GLP-1-(7-37) или Nε26{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}, Nε37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}-[Aib8,Arg34,Lys37]GLP-1(7-37)-OH.
63. Способ по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Аib8,Arg]GLP-1-(7-37).
64. Способ по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой Nε26{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}, Nε37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}-[Aib8,Arg34,Lys37]GLP-1(7-37)-OH.
65. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в композиции, также содержащей одно или более фармацевтически приемлемое вспомогательное вещество.
66. Способ по п. 22, где указанная композиция имеет форму твердой дозированной лекарственной формы, такой как таблетка или капсула.
67. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 1 до 1000 нМ (от 10-9 до 0,000001 моль/л).
68. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 1 до 300 нМ (от 10-9 до 3×10-7 моль/л).
69. Способ по любому из предшествующих вариантов осуществления, где указанный пептид вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 10 до 100 нМ (от 10-8 до 10-7 моль/л).
70. Способ по любому из предшествующих вариантов осуществления, где указанный способ включает в себя профилактику и/или лечение диабета 2-го типа или ожирения.
71. Применение пептида GLP-1 при производстве лекарственного средства для перорального введения при лечении диабета, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 60 часов, и где указанный способ включает в себя стадию введения указанного пептида через день или чаще в терапевтически эффективном количестве.
72. Применение пептида GLP-1 с низким клиренсом при производстве лекарственного средства для перорального введения при лечении диабета, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 2:1.
73. Применение по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 3:1.
74. Применение по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 4:1.
75. Применение по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 5:1.
76. Применение по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 6:1.
77. Применение по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 7:1.
78. Применение по любому из предшествующих вариантов осуществления, где соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанного пептида, выраженным в днях, составляет более чем 14:1.
79. Применение по любому из предшествующих вариантов осуществления, где период полувыведения из плазмы определяют после в/в введения.
80. Применение по любому из предшествующих вариантов осуществления, где период полувыведения из плазмы определяют после п/о введения.
81. Применение по любому из предшествующих вариантов осуществления, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 1 день.
82. Применение по любому из предшествующих вариантов осуществления, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 36 часов.
83. Применение по любому из предшествующих вариантов осуществления, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 2 дня.
84. Применение по любому из предшествующих вариантов осуществления, где указанный пептид имеет период полувыведения из плазмы в организме человека по меньшей мере 60 часов.
85. Применение по любому из предшествующих вариантов осуществления, где указанный пептид вводят по меньшей мере через день.
86. Применение по любому из предшествующих вариантов осуществления, где указанный пептид вводят по меньшей мере один раз в день.
87. Применение по любому из предшествующих вариантов осуществления, где указанный пептид вводят по меньшей мере два раза в день.
88. Применение по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 100 мг.
89. Применение по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 50 мг.
90. Применение по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 25 мг.
91. Применение по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 1 до 25 мг.
92. Применение по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 5 до 50 мг.
93. Применение по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 10 мг.
94. Применение по любому из предшествующих вариантов осуществления, где указанный пептид вводят в количестве от 0,5 до 5 мг.
95. Применение по любому из предшествующих вариантов осуществления, где указанный пептид является пептидом GLP-1.
96. Применение по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой ацилированный пептид GLP-1.
97. Применение по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1-(7-37) или Nε26{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}, Nε37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}-[Aib8,Arg34,Lys37]GLP-1(7-37)-OH.
98. Применение по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Аib8,Arg34]GLP-1-(7-37).
99. Способ по любому из предшествующих вариантов осуществления, где указанный пептид представляет собой Nε26{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}, Nε37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)-деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}-[Aib8,Arg34,Lys37]GLP-1(7-37)-OH.
100. Применение по любому из предшествующих вариантов осуществления, где указанный пептид вводят в композиции, также содержащей одно или более фармацевтически приемлемое вспомогательное вещество.
101. Применение по варианту осуществления 22, где указанная композиция имеет форму твердой дозированной лекарственной формы, такой как таблетка или капсула.
102. Применение по любому из предшествующих вариантов осуществления, где указанный пептид вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 1 до 1000 нМ (от 10-9 до 0,000001 моль/л).
103. Применение по любому из предшествующих вариантов осуществления, где указанный пептид вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 1 до 300 нМ (от 10-9 до 3×10-7 моль/л).
104. Применение по любому из предшествующих вариантов осуществления, где указанный пептид вводят в дозировке, обеспечивающей установившуюся среднюю концентрацию в плазме указанного пептида от 10 до 100 нМ (от 10-8 до 10-7 моль/л).
105. Применение по любому из предшествующих вариантов осуществления, где указанный способ включает в себя профилактику и/или лечение диабета 2-го типа или ожирения.
Описание примеров осуществления изобретения
Получение пептидов GLP-1:
Пептиды GLP-1 получают при помощи известных способов, например, как описано в примере 4 патентного документа WO 2006/097537 и в примере 2 патентного документа WO 2011/080103.
Как правило, пептиды GLP-1 могут быть получены путем рекомбинантной экспрессии, например, в клетках Е. coli или S. cerevisae (см., например, WO 2008/034881). Или же пептиды GLP-1 могут быть получены при помощи классического пептидного синтеза, например, при помощи твердофазного синтеза пептидов с использованием t-Boc или Fmoc или с помощью других общепринятых способов, см., например, работу Greene и Wuts, "Protective Groups in Organic Synthesis (Защитные группы в органическом синтезе)", John Wiley & Sons, 1999, либо при помощи жидкофазного синтеза. Кроме того, в качестве альтернативы, для получения пептидов GLP-1 может быть использована комбинация рекомбинантной экспрессии и химического синтеза (например, как описано в патентном документе WO 2009/083549). Химическая модификация пептидов GLP-1 может быть осуществлена с использованием стандартного способа ацилирования, например, как описано в патентном документе WO 2010/029159.
Приготовление композиций таблеток, содержащих GLP-1 и SNAC:
Композиции таблеток, содержащие пептид GLP-1 и SNAC (N-(8-(2-гидроксибензоил)амино)каприлат натрия), получают известными способами путем перемешивания пептида GLP-1, SNAC, микрокристаллической целлюлозы (Авицел РН 101), повидона K 90 (Kollidon 90F) и стеарата магния с последующим вальцеванием, например, как описано в патентных документах WO 2008/028859 (получение SNAC) и WO 2003/72195, Заявке согласно РСТ РСТ/ЕР2013/055362 и Заявке согласно РСТ РСТ/ЕР2013/055363 (способы получения композиций пептида GLP-1/SNAC).
Анализ образцов плазмы с помощью LOCI:
Анализ плазмы на активный пептидный ингредиент осуществляли при помощи иммунологического анализа люминесценции кислородных каналов (LOCI). При анализе методом LOCI используют покрытые стрептавидином донорные шарики и акцепторные шарики, конъюгированные с моноклональным антителом, связанным со среднемолекулярным участком активного пептидного ингредиента. Другое моноклональное антитело, специфичное для N-терминального эпитопа, было биотинилировано. При анализе три реагента объединяли с активным пептидным ингредиентом и формировали иммунный комплекс с двумя сайтами. При облучении комплекса из донорных шариков высвобождаются атомы синглетного кислорода, которые направляются в акцепторные шарики и вызывают хемилюминесценцию, измеряемую на планшетном ридере EnVision. Количество света было пропорционально концентрации активного пептидного ингредиента, при этом нижняя граница определяемых концентраций (англ. LLOQ) в плазме составила 100 пМ(10-10 моль/л).
Альтернативный анализ образцов плазмы с помощью ЖХ-МС:
Анализ плазмы на активный пептидный ингредиент осуществляли с помощью ЖХ-МС (англ. LC-MS), как известно специалистам в данной области. Система для ЖК-МС состояла из системы для сверхэффективной жидкостной хроматографии Waters Acquity UPLC (Waters), состоящей из автоматического пробоотборника (модель Acq-SM), насоса (модель Acq-BSM), термостата колонок (Model Acq-SM), детектора (Model Acq-TUV) и масс-анализатора LTQ Orbitrap XL (Thermo Fisher). Разделение методом высокоэффективной жидкостной хроматографии с обращенной фазой (анг. RP-HPLC) осуществляли при использовании линейного градиента ацетонитрила 0,1% в муравьиной кислоте на колонке CSH С18 (Waters, 1×150 мм) с расходом 0,1 мл/мин при температуре 45°С.
Пример 1
N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси)этокси)ацетил][Aib8,Arg34]GLP-1-(7-37) (пептид GLP-1 1) в композиции SNAC
Проводили фармакокинетическое исследование для определения периода полувыведения из плазмы пептидов GLP-1 после п/о введения человеку.
Субъектам перорально вводили пептид GLP-1 1 в композиции SNAC. Образцы крови отбирали в заданные моменты времени после дозирования, после чего образцы анализировали для определения концентрации пептида GLP-1. На основании этих измерений строили график зависимости концентрации в плазме от времени и выполняли фармакокинетический анализ данных без компартментализации. Вариабельность концентрации в плазме определяли как коэффициент вариации CV в % для Сmax и ППК. Количество SNAC в композиции таблетки составляло 300 мг. Результаты представлены в Таблице 1.
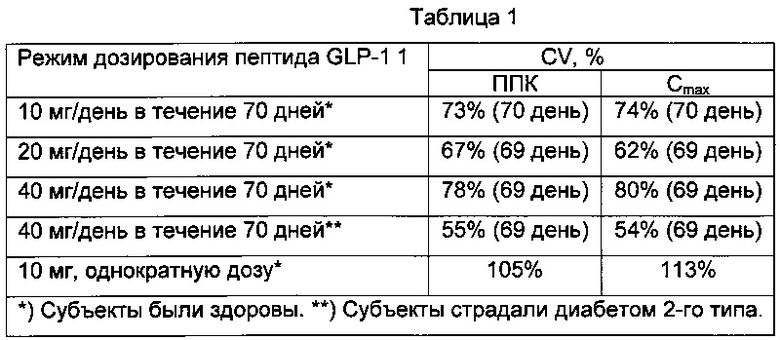
Результаты показывают, что вариабельность содержания в плазме пептида GLP-1 была в значительной степени снижена при ежедневном введении человеку в течение 70 дней 10, 20 или 40 мг пептида GLP-1 1 по сравнению с однократной дозой 10 мг пептида GLP-1 1.
Пример 2
N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси)этокси)ацетиламино]этокси]этокси)ацетил][Аib8,Arg34]GLP-1-(7-37) (пептид GLP-1 1) в композиции SNAC
Проводили фармакокинетическое исследование для определения периода полувыведения из плазмы пептидов GLP-1 после п/о введения собакам породы бигль.
Собакам вводили перорально пептид GLP-1 1 в композиции SNAC. Образцы крови отбирали в заданные моменты времени после дозирования, после чего образцы анализировали для определения концентрации пептида GLP-1. На основании этих измерений строили график зависимости концентрации в плазме от времени и проводили фармакокинетический анализ данных без компартментализации. Вариабельность концентрации пептида GLP-1 в плазме определяли как CV в % для ППК. Количество SNAC в композиции таблетки составляло 300 мг. Результаты представлены в Таблице 2.


Результаты показывают, что вариабельность содержания в плазме пептида GLP-1 была в значительной степени снижена при ежедневном введении в течение 7 дней 5 мг пептида GLP-1 1 по сравнению с однократной дозой 15 мг пептида GLP-1 1.
Пример 3
Nε26{2-[2-(2-{2-[2-(2-[(S)-4-карбокси-4-[10-(4-карбоксиФенокси)деканоиламино]бутириламино)этокси)этокси]ацетиламино)этокси)этокси]ацетил}, Nε37-{2-[2-(2-{2-[2-(2-((S)-4-карбокси-4-[10-(4-карбоксиФенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино)этокси)этокси]ацетил}-[Aib8,Arg34,Lys37]GLP-1(7-37)-OH (пептид GLP-1 2) в композиции SNAC
Проводили фармакокинетическое исследование для определения периода полувыведения из плазмы пептидов GLP-1 после п/о введения собакам породы бигль.
Собакам вводили перорально пептид GLP-1 2 в композиции SNAC. Образцы крови отбирали в заданные моменты времени после дозирования, после чего образцы анализировали для определения концентрации пептида GLP-1. На основании этих измерений строили график зависимости концентрации в плазме от времени и проводили фармакокинетический анализ данных без компартментализации. Вариабельность концентрации пептида GLP-1 в плазме определяли как CV в % для ППК. Количество SNAC в композиции таблетки составляло 300 мг. Результаты представлены в Таблице 3.

Результаты показывают, что вариабельность содержания в плазме пептида GLP-1 была в значительной степени снижена при ежедневном введении в течение 7 дней 10 мг пептида GLP-1 2 по сравнению с однократной дозой 10 мг пептида GLP-1 2.
Хотя в настоящей работе проиллюстрированы и описаны некоторые признаки изобретения, специалисты в данной области смогут реализовать многочисленные модификации, изменения, замены и эквиваленты. Вследствие этого следует понимать, что прилагаемая формула изобретения распространяется на все такие модификации и изменения, поскольку они подпадают под истинную сущность изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТВЕРДЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АГОНИСТ GLP-1 И СОЛЬ N-(8-(2-ГИДРОКСИБЕНЗОИЛ)АМИНО)КАПРИЛОВОЙ КИСЛОТЫ | 2019 |
|
RU2804318C2 |
| ТВЕРДЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АГОНИСТ GLP-1 И СОЛЬ N-(2-ГИДРОКСИБЕНЗОИЛ)АМИНО)КАПРИЛОВОЙ КИСЛОТЫ | 2011 |
|
RU2600440C2 |
| ТВЕРДЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АГОНИСТ GLP-1, СОЛЬ N-(8-(2-ГИДРОКСИБЕНЗОИЛ)АМИНО)КАПРИЛОВОЙ КИСЛОТЫ И СМАЗЫВАЮЩЕЕ ВЕЩЕСТВО | 2019 |
|
RU2807183C2 |
| КОМПОЗИЦИИ GLP-1 ПЕПТИДОВ И ИХ ПОЛУЧЕНИЕ | 2013 |
|
RU2641198C2 |
| ТВЕРДЫЕ КОМПОЗИЦИИ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ | 2018 |
|
RU2777206C2 |
| НОВЫЕ АНАЛОГИ ГЛЮКАГОНА | 2012 |
|
RU2610175C2 |
| ДВОЙНЫЕ АГОНИСТЫ GLP1/GIP ИЛИ ТРОЙНЫЕ АГОНИСТЫ GLP1/GIP/ГЛЮКАГОНА | 2013 |
|
RU2652783C2 |
| СХЕМЫ ДОЗИРОВАНИЯ ДЛЯ ВВЕДЕНИЯ АНАЛОГОВ ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА 2 (ГПП-2) | 2018 |
|
RU2785662C2 |
| СПОСОБ КОНЪЮГАЦИИ ПЕПТИДОВ, ОПОСРЕДОВАННОЙ ТРАНСГЛУТАМИНАЗОЙ | 2005 |
|
RU2385879C2 |
| ДВАЖДЫ АЦИЛИРОВАННЫЕ ПРОИЗВОДНЫЕ GLP-1 | 2010 |
|
RU2559540C2 |
Изобретение относится к медицине, а именно к эндокринологии, и может быть использовано для лечения диабета и/или ожирения. Способ включает введение терапевтически эффективного количества композиции в твердой пероральной лекарственной форме, содержащей глюкагоноподобный пептид-1 (пептид GLP-1), имеющий период полувыведения из плазмы в организме человека, составляющий по меньшей мере 60 часов, и усилитель, представляющий собой соль среднецепочечной жирной кислоты. Композицию вводят таким образом, чтобы соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанной композиции, выраженным в днях, составляло более чем 2:1. Использование изобретения позволяет повысить эффективность лечения и уменьшить количество побочных эффектов за счет снижения вариабельности концентрации пептида GLP-1 в плазме между приемами. 14 з.п. ф-лы, 3 табл., 3 пр.
1. Способ лечения диабета и/или ожирения у субъекта, нуждающегося в таком лечении, в котором указанному субъекту перорально вводят терапевтически эффективное количество композиции в твердой пероральной лекарственной форме, содержащей глюкагоноподобный пептид-1 (пептид GLP-1), имеющий период полувыведения из плазмы в организме человека, составляющий по меньшей мере 60 часов, и усилитель, представляющий собой соль среднецепочечной жирной кислоты, где указанную композицию вводят таким образом, чтобы соотношение между периодом полувыведения указанного пептида из плазмы в организме человека, выраженным в днях, и интервалом дозирования указанной композиции, выраженным в днях, составляло более чем 2:1.
2. Способ по п. 1, в котором указанный пептид GLP-1 представляет собой ацилированный аналог GLP-1, имеющий 3 аминокислотные замены или меньше по сравнению с GLP-1 (7-37).
3. Способ по п. 2, в котором указанный пептид GLP-1 выбран из семаглутида или Nε26{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}, Nε37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}-[Aib8,Arg34,Lys37]GLP-1(7-37)-OH.
4. Способ по п. 3, в котором указанный усилитель представляет собой соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты.
5. Способ по п. 4, в котором указанную композицию вводят через день или чаще.
6. Способ по п. 5, в котором указанную композицию вводят один раз в день.
7. Способ по п. 4, в котором указанная композиция имеет форму таблетки, капсулы, саше или гранул.
8. Способ по п. 7, в котором указанная композиция имеет форму таблетки.
9. Способ по п. 4, в котором указанный пептид GLP-1 представляет собой семаглутид.
10. Способ по п. 8, в котором усилитель представляет собой N-(8-(2-гидроксибензоил)амино)каприлат натрия (SNAC).
11. Способ по п. 9, в котором указанная композиция содержит 2-40 мг семаглутида и 200-400 мг SNAC.
12. Способ по п. 11, в котором указанную композицию вводят через день или чаще.
13. Способ по п. 12, в котором указанную композицию вводят один раз в день.
14. Способ по п. 11, в котором указанная композиция имеет форму таблетки, капсулы, саше или гранул.
15. Способ по п. 14, в котором указанная композиция имеет форму таблетки.
| WO 2008033888 A2, 20.03.2008 | |||
| US 20130053311 A1, 16.12.2009 | |||
| СПОСОБ ПОЛУЧЕНИЯ АКТИВНОГО УГЛЯ | 2014 |
|
RU2565202C1 |
Авторы
Даты
2018-10-31—Публикация
2014-05-02—Подача