Область техники, к которой относится изобретение
Настоящее изобретение относится к твердым композициям, содержащим агонист GLP-1 и соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, их способу получения и их применению в медицине.
Включение перечня последовательностей посредством ссылки
Перечень последовательностей, озаглавленный «ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ», имеет размер 4 килобайта и был создан 23 января 2017 года, и он включен в данный документ посредством ссылки.
Уровень техники
Человеческий GLP-1 и его аналоги характеризуются низкой биодоступностью при пероральном введении. После перорального введения экспозиция и биодоступность человеческого GLP-1 и его аналогов являются очень низкими. Таким образом, человеческий GLP-1 (и его аналоги) можно обнаруживать в плазме крови после перорального введения, только если он составлен с определенными усилителями всасывания в конкретном количестве.
Steinert и соавт. (Am J Clin Nutr, Oct 2010; 92: 810 - 817) раскрывают пероральное введение таблетки, содержащей GLP-1(7-36)-амид и 150 мг N-(8-(2-гидроксибензоил)амино)каприлата натрия (SNAC).
В WO 2010/020978 раскрыта пероральная фармацевтическая композиция, содержащая белок и N-(8-[2-гидроксибензоил)амино)каприлат (SNAC). Заявки на патенты, раскрывающие пероральные лекарственные формы на основе аналогов GLP-1, содержащие соль N-(8-(2-гидроксибензоил)-амино)каприлата, включают WO2012/080471, WO2013/189988, WO2013/139694, WO2013/139695 и WO2014/177683.
Несмотря на эти результаты, все еще возможно получение дополнительной оптимизированной фармацевтической композиции для перорального введения агониста GLP-1, такого как аналог GLP-1, содержащий заместитель.
Краткое описание
Настоящее изобретение относится к композиции, содержащей агонист GLP-1 и усилитель всасывания или средство доставки. В одном варианте осуществления композиция в соответствии с настоящим изобретением предусматривает очень высокое содержание средства доставки и минимальное содержание дополнительных вспомогательных веществ, описанных в данном документе ниже. Представленные композиции демонстрируют ускоренное всасывание, что обеспечивает возможность быстрого и эффективного поглощения активного фармацевтического ингредиента.
Пероральное введение терапевтических пептидов является сложным из-за быстрого разрушения таких пептидов в желудочно-кишечном тракте. В данном документе описаны фармацевтические композиции, обеспечивающие ускорение всасывания агониста GLP-1 в пределах 15-30 минут после введения и, тем самым, увеличение экспозиции агониста GLP-1 при пероральном введении. Авторы настоящего изобретения неожиданно обнаружили, что экспозиция агонистов GLP-1 в плазме крови повышается, когда получают композиции с очень высоким содержанием усилителя всасывания и минимальным содержанием любых дополнительных вспомогательных веществ.
В одном аспекте настоящее изобретение относится к композиции, где массовая доля средства доставки относительно композиции в целом или, в частности, относительно остальных вспомогательных веществ композиции, является очень высокой.
В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей агонист GLP-1, средство доставки и/или усилитель всасывания, как, например, SNAC, где средство доставки/усилитель всасывания составляют по меньшей мере 90%, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции.
В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей агонист GLP-1, средство доставки и/или усилитель всасывания, как, например, SNAC, где средство доставки/усилитель всасывания составляют по меньшей мере 90% вес/вес композиции.
В дополнительных вариантах осуществления композиция дополнительно содержит смазывающее вещество.
В одном аспекте настоящее изобретение относится к способу получения фармацевтической композиции, описанной в данном документе, как, например, способу, предусматривающему стадии:
a) гранулирования смеси, содержащей средство доставки, агонист GLP-1 и необязательно смазывающее вещество, и
b) прессования гранулята, полученного на стадии a), в таблетки и необязательно добавления дополнительного смазывающего вещества к грануляту перед прессованием.
В дополнительном аспекте настоящее изобретение относится к композиции или грануле, определенным в данном документе, для применения в медицине, как, например, для лечения сахарного диабета или ожирения, где указанную композицию вводят перорально.
В дополнительном аспекте настоящее изобретение относится к способу лечения сахарного диабета или ожирения, предусматривающему введение композиции, определенной в данном документе, пациенту, нуждающемуся в этом, где указанная композиция представляет собой таблетку, и ее вводят перорально.
Краткое описание графических материалов
На фиг. 1 показано быстрое растворение A1 по сравнению с эталоном A.
На фиг. 2 показано повышение скорректированной по дозе экспозиции аналогов A, B и C, составленных в соответствии с настоящим изобретением, после перорального введения таблетки собакам породы бигль. Данные приведены в виде среднего значения. Все из композиций A1, B1 и C1 демонстрируют повышенную скорректированную по дозе экспозицию по сравнению с эталонными композициями.
Описание
Аспект настоящего изобретения относится к композиции, содержащей агонист GLP-1 и усилитель всасывания или средство доставки. Композиция может находиться в форме, подходящей для перорального введения, такой как таблетка, саше или капсула. В одном варианте осуществления композиция представляет собой композицию для перорального применения или фармацевтическую композицию, такую как фармацевтическая композиция для перорального применения.
В одном варианте осуществления композиция в соответствии с настоящим изобретением предусматривает высокое содержание средства доставки и минимальное содержание дополнительных вспомогательных веществ, описанных в данном документе ниже. Представленные композиции демонстрируют ускоренное растворение и всасывание, что обеспечивает возможность быстрого и эффективного поглощения активного фармацевтического ингредиента.
GLP-1
Используемый в данном документе термин «агонист GLP-1» относится к соединению, которое полностью или частично активирует человеческий рецептор GLP-1. Таким образом, данный термин эквивалентен термину «агонист рецептора GLP-1», используемому в других документах. Подразумевается, что термин агонист GLP-1, а также конкретные агонисты GLP-1, описанные в данном документе, охватывает также их солевые формы.
Отсюда следует, что агонист GLP-1 должен проявлять «активность GLP-1», что означает способность соединения, т.е. аналога GLP-1 или соединения, содержащего аналог GLP-1, связываться с рецептором GLP-1 и инициировать путь передачи сигнала, приводящий к инсулинотропному действию или другим физиологическим эффектам, известным из уровня техники. В некоторых вариантах осуществления «агонист GLP-1» связывается с рецептором GLP-1, например, с константой аффинности (KD), или активирует рецептор с эффективностью (EC50), составляющими менее 1 мкМ, например, менее 100 нМ, как измерено с помощью способов, известных из уровня техники (см., например WO 98/08871), и проявляет инсулинотропную активность, где инсулинотропная активность может быть измерена в in vivo или in vitro анализах, известных средним специалистам в данной области техники. Например, агонист GLP-1 можно вводить животному с повышенным содержанием глюкозы в крови (например, полученному с применением внутривенного теста на толерантность к глюкозе (IVGTT). Специалист в данной области техники будет способен определить подходящую дозу глюкозы и подходящую схему сбора образцов крови для IVGTT, например, в зависимости от биологического вида животного) и измерять концентрацию инсулина в плазме крови с течением времени.
Подходящие анализы были описаны, например, в WO2015/155151.
Термин полумаксимальная эффективная концентрация (EC50) в целом относится к концентрации, которая индуцирует ответ, находящийся посередине между исходным уровнем и максимумом, исходя из кривой зависимости от дозы. EC50 применяют в качестве меры эффективности соединения, и она представляет собой концентрацию, при которой наблюдается 50% от его максимального эффекта. Вследствие альбумин-связывающих эффектов агонистов GLP-1, содержащих заместитель, описанных в данном документе, важно обратить внимание на то, включает ли анализ человеческий сывороточный альбумин или нет.
In vitro эффективность агониста GLP-1 можно определять, как описано в 2015/155151, пример 29 (анализ без HSA) и определенная EC50. Чем ниже значение EC50, тем выше эффективность. В одном варианте осуществления определенная эффективность (EC50) (анализ без HSA) составляет 5-1000 пМ, как, например, 10-750 пМ, 10-500 пМ или 10-200 пМ. В одном варианте осуществления EC50 (анализ без HSA) составляет не более 500 пМ, как, например, не более 300 пМ, как, например, не более 200 пМ.
В одном варианте осуществления EC50 (анализ без HSA) является сравнимой с таковой у человеческого GLP-1(7-37).
В одном варианте осуществления EC50 (анализ без HSA) составляет не более 50 пМ. В таком дополнительном варианте осуществления EC50 составляет не более 40 пМ, как, например, не более 30 пМ, как, например, не более 20 пМ, как, например, не более 10 пМ. В одном варианте осуществления EC50 составляет примерно 10 пМ.
При необходимости можно рассчитать кратное изменение относительно известного агониста рецептора GLP-1 в виде EC50 (тестируемого аналога)/EC50 (известного аналога), и, если данное соотношение составляет 0,5-1,5 или 0,8-1,2, считается, что эффективности являются эквивалентными.
В одном варианте осуществления эффективность, EC50 (анализ без HSA), эквивалентна эффективности лираглутида.
В одном варианте осуществления эффективность, EC50 (анализ без HSA), эквивалентна эффективности семаглутида.
В одном варианте осуществления эффективность, EC50 (анализ без HSA), эквивалентна эффективности соединения B.
В одном варианте осуществления эффективность, EC50 (анализ без HSA), эквивалентна эффективности соединения C.
В некоторых вариантах осуществления агонист GLP-1 представляет собой аналог GLP-1, необязательно содержащий один заместитель. Термин «аналог», используемый в данном документе в отношении пептида GLP-1 (далее в данном документе «пептид»), означает пептид, где по меньшей мере один аминокислотный остаток пептида был замещен другим аминокислотным остатком, и/или где по меньшей мере один аминокислотный остаток был удален из пептида, и/или где по меньшей мере один аминокислотный остаток был добавлен в пептид, и/или где по меньшей мере один аминокислотный остаток пептида был модифицирован. Такое добавление или удаление аминокислотных остатков может происходить на N-конце пептида и/или на C-конце пептида. В некоторых вариантах осуществления для описания агониста GLP-1 применяют простую номенклатуру, например, [Aib8]GLP-1(7-37) обозначает аналог GLP-1(7-37), в котором встречающийся в природе Ala в положении 8 был замещен Aib. В некоторых вариантах осуществления агонист GLP-1 содержит максимум двенадцать, как, например, максимум 10, 8 или 6 аминокислот, которые были изменены, например, путем замещения, делеции, вставки и/или модификации, например, по сравнению с GLP-1(7-37). В некоторых вариантах осуществления аналог содержит до 10 замещений, делеций, добавлений и/или вставок, как, например, до 9 замещений, делеций, добавлений и/или вставок, до 8 замещений, делеций, добавлений и/или вставок, до 7 замещений, делеций, добавлений и/или вставок, до 6 замещений, делеций, добавлений и/или вставок, до 5 замещений, делеций, добавлений и/или вставок, до 4 замещений, делеций, добавлений и/или вставок или до 3 замещений, делеций, добавлений и/или вставок, например, по сравнению с GLP-1(7-37). Если не указано иное, GLP-1 содержит только L-аминокислоты.
В некоторых вариантах осуществления используемый в данном документе термин «аналог GLP-1» или «аналог для GLP-1» относится к пептиду или соединению, которые представляют собой вариант человеческого глюкагоноподобного пептида-1 (GLP-1(7-37)). GLP-1(7-37) имеет последовательность HAEGTFTSDV SSYLEGQAAKEFIAWLVКGRG (SEQ ID No: 1). В некоторых вариантах осуществления термин «вариант» относится к соединению, которое содержит одно или более аминокислотных замещений, делеций, добавлений и/или вставок.
В одном варианте осуществления агонист GLP-1 характеризуется по меньшей мере 60%, 65%, 70%, 80% или 90% идентичностью последовательности с GLP-1(7-37) по всей длине GLP-1(7-37). В качестве примера способа для определения идентичности последовательности у двух аналогов два пептида [Aib8]GLP-1(7-37) и GLP-1(7-37) подвергают выравниванию. Идентичность последовательности [Aib8]GLP-1(7-37) относительно GLP-1(7-37) указывается как число выровненных идентичных остатков минус число отличающихся остатков, деленное на общее число остатков в GLP-1(7-37). Соответственно, в указанном примере идентичность последовательности составляет (31-1)/31.
В одном варианте осуществления на C-конце агониста GLP-1 находится амидная группа.
В некоторых вариантах осуществления агонист GLP-1 представляет собой GLP-1(7-37) или GLP-1(7-36)-амид. В некоторых вариантах осуществления агонист GLP-1 представляет собой эксендин-4, последовательность которого представляет собой HGEGTFITSDLSKQMEEEAVRLFIEWLKNGGPSSGAPPPS (SEQ ID No: 2).
Для продления эффекта агониста GLP-1 предпочтительно, чтобы агонист GLP-1 характеризовался увеличенным периодом полувыведения. Период полувыведения может быть определен с помощью способа, известного из уровня техники, и на подходящей модели, такой как самцы крыс Sprague Dawley или минисвиньи, как описано в WO2012/140117.
В одном варианте осуществления агонист GLP-1 в соответствии с настоящим изобретением характеризуется периодом полувыведения у минисвиньи, превышающим 24 часа. В одном варианте осуществления агонист GLP-1 в соответствии с настоящим изобретением характеризуется периодом полувыведения у минисвиньи, составляющим более 30 часов, как, например, более 36 часов, как, например, более 42 часов, как, например, более 48 часов, как, например, более 54 часов или как, например, более 60 часов.
В некоторых вариантах осуществления агонист GLP-1 содержит один заместитель, который ковалентно присоединен к пептиду. В некоторых вариантах осуществления заместитель предусматривает жирную кислоту или двухосновную жирную кислоту. В некоторых вариантах осуществления заместитель предусматривает жирную C16-, C18- или C20-кислоту. В некоторых вариантах осуществления заместитель предусматривает двухосновную жирную C16-, C18- или C20-кислоту.
В некоторых вариантах осуществления заместитель предусматривает формулу (X):
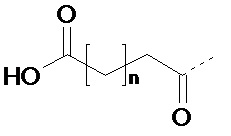 (X), где n составляет по меньшей мере 13, например, n составляет 13, 14, 15, 16, 17, 18 или 19. В некоторых вариантах осуществления заместитель предусматривает формулу (X), где n находится в диапазоне от 13 до 19, например в диапазоне от 13 до 17. В некоторых вариантах осуществления заместитель предусматривает формулу (X), где n составляет 13, 15 или 17. В некоторых вариантах осуществления заместитель предусматривает формулу (X), где n составляет 13. В некоторых вариантах осуществления заместитель предусматривает формулу (X), где n составляет 15. В некоторых вариантах осуществления заместитель предусматривает формулу (X), где n составляет 17.
(X), где n составляет по меньшей мере 13, например, n составляет 13, 14, 15, 16, 17, 18 или 19. В некоторых вариантах осуществления заместитель предусматривает формулу (X), где n находится в диапазоне от 13 до 19, например в диапазоне от 13 до 17. В некоторых вариантах осуществления заместитель предусматривает формулу (X), где n составляет 13, 15 или 17. В некоторых вариантах осуществления заместитель предусматривает формулу (X), где n составляет 13. В некоторых вариантах осуществления заместитель предусматривает формулу (X), где n составляет 15. В некоторых вариантах осуществления заместитель предусматривает формулу (X), где n составляет 17.
В некоторых вариантах осуществления заместитель предусматривает формулу (XIa):
HOOC-(C6H4)-O-(CH2)m-CO-* (XIa), где m составляет целое число в диапазоне 6-14.
В некоторых вариантах осуществления заместитель предусматривает формулу (XIb):
 (XIb), где карбокси-группа находится в положении 2, 3 или 4 группы (C6H4) и где m составляет целое число в диапазоне 8-11.
(XIb), где карбокси-группа находится в положении 2, 3 или 4 группы (C6H4) и где m составляет целое число в диапазоне 8-11.
В некоторых вариантах осуществления заместитель предусматривает формулу (XIa) или формулу (XIb), где m находится в диапазоне от 6 до 14, как, например, в диапазоне от 8 до 11. В некоторых вариантах осуществления заместитель предусматривает формулу (XIa) или формулу (XIb), где m составляет 8, 10 или 12. В некоторых вариантах осуществления заместитель предусматривает формулу (XIa) или формулу (XIb), где m составляет 9. В некоторых вариантах осуществления заместитель предусматривает формулу (XIa) или формулу (XIb), где m составляет 11.
В некоторых вариантах осуществления заместитель предусматривает одну или более 8-амино-3,6-диоксаоктановых кислот (OEG), как, например, две OEG.
В некоторых вариантах осуществления заместитель представляет собой [2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил].
В некоторых вариантах осуществления заместитель представляет собой [2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-({транс-4-[(19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил].
В некоторых вариантах осуществления агонист GLP-1 представляет собой семаглутид, также известный как N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1(7-37) (SEQ ID NO. 4), который может быть получен, как описано в WO2006/097537, пример 4, со следующей структурой:
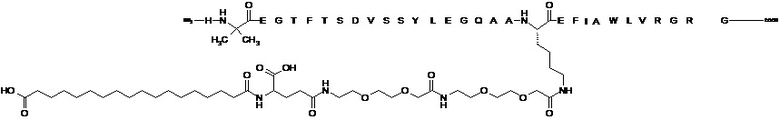 .
.
В одном варианте осуществления агонист GLP-1 представляет собой агонист GLP-1 B, который является диацилированным [Aib8,Arg34,Lys37]GLP-1(7-37) (SEQ ID NO. 5), показанным в примере 2 из WO2011/080103 и имеющим название Nε26{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}-этокси)этокси]ацетиламино}этокси)этокси]ацетил}, Nε37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]-ацетил}[Aib8,Arg34,Lys37]GLP-1(7-37)-пептид со следующей структурой: 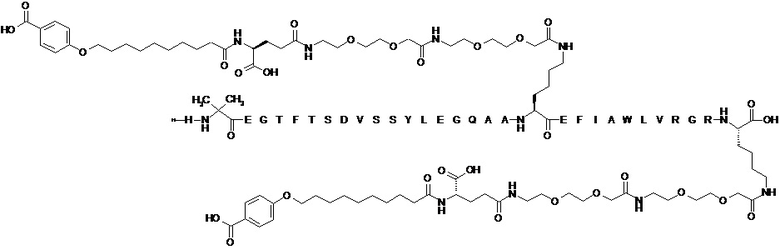 .
.
В одном варианте осуществления агонист GLP-1 представляет собой агонист GLP-1 C, который является диацилированным [Aib8,Glu22,Arg26,Lys27,Glu30,Arg34,Lys36]GLP-1(7-37)-пептидил-Glu-Gly (SEQ ID NO. 6), показанным в примере 31 из WO2012/140117 и имеющим название Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]-ацетил], Nε36-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил][Aib8,Glu22,Arg26,Lys27, Glu30,Arg34,Lys36]GLP-1(7-37)-пептидил-Glu-Gly со следующей структурой:
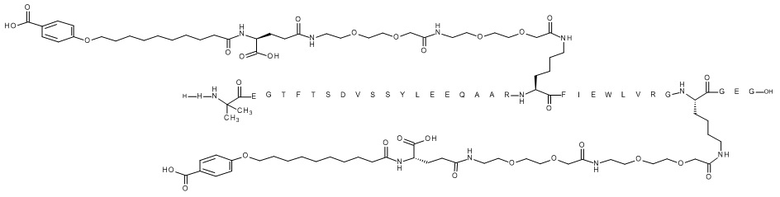 .
.
В целом, подразумевается, что термин агонист GLP-1 охватывает агонист GLP-1 и любую его фармацевтически приемлемую соль, амид или сложный эфир. В некоторых вариантах осуществления композиция содержит агонист GLP-1 или его фармацевтически приемлемую соль, амид или сложный эфир. В некоторых вариантах осуществления композиция содержит агонист GLP-1 и один или более фармацевтически приемлемых противоионов.
В некоторых вариантах осуществления агонист GLP-1 выбран из одного или более агонистов GLP-1, указанных в WO93/19175, WO96/29342, WO98/08871, WO99/43707, WO99/43706, WO99/43341, WO99/43708, WO2005/027978, WO2005/058954, WO2005/058958, WO2006/005667, WO2006/037810, WO2006/037811, WO2006/097537, WO2006/097538, WO2008/023050, WO2009/030738, WO2009/030771 и WO2009/030774.
В некоторых вариантах осуществления агонист GLP-1 выбран из группы, состоящей из
N-эпсилон37{2-[2-(2-{2-[2-((R)-3-карбокси-3-{[1-(19-карбоксинонадеканоил)пиперидин-4-карбонил]амино}пропиониламино)этокси]этокси}ацетиламино)этокси]этокси}ацетил[дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон26{2-[2-(2-{2-[2-((R)-3-карбокси-3-{[1-(19-карбоксинонадеканоил)пиперидин-4-карбонил]амино}пропиониламино)этокси]этокси}ацетиламино)этокси]этокси}ацетил[дезамино-His7,Arg34]GLP-1(7-37);
N-эпсилон37{2-[2-(2-{2-[2-((S)-3-карбокси-3-{[1-(19-карбокси-нонадеканоил)пиперидин-4-карбонил]амино}пропиониламино)этокси]этокси}ацетиламино)этокси]этокси}ацетил[Aib8,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-[2-(2-[2-(2-[2-(2-((R)-3-[1-(17-карбоксигептадеканоил)пиперидин-4-илкарбониламино]-3-карбоксипропиониламино)этокси)этокси]ацетиламино)этокси]этокси)ацетил][дезамино-His7,Glu22,Arg26,Arg 34,Phe(m-CF3)28]GLP-1(7-37)-амида;
N-эпсилон26-[(S)-4-карбокси-4-({транс-4-[(19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутирил][Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-{4-[(S)-4-карбокси-4-({транс-4-[(19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]бутирил}[Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-[2-(2-{2-[(S)-4-карбокси-4-({транс-4-[(19-карбокси-нонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-({транс-4-[(19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1(7-37)-амида;
N-эпсилон37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-({транс-4-[(19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Aib8,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-({транс-4-[(19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-({4-[(транс-19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][дезамино-His7,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-({транс-4-[(19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37);
N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-({4-[(19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил[Aib8,Lys26]GLP-1(7-37)-амида;
N-эпсилон26-[2-(2-[2-(2-[2-(2-((S)-2-[транс-4-((9-карбоксинонадеканоиламино]метил)циклогексилкарбониламино]-4-карбоксибутаноиламино)этокси)этокси]ацетиламино)этокси]этокси)ацетил][Aib8,Lys26]GLP-1(7-37)-амида;
N-эпсилон37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-({транс-4-[(19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][дезамино-His7,Arg26,Arg34,Lys37]GLP-1(7-37);
N-эпсилон37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-({транс-4-[(19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][дезамино-His7,Glu22,Arg26,Glu30,Arg34,Lys37]GLP-1(7-37);
N-эпсилон26-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{4-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]бутириламино}бутириламино)бутириламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{12-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]додеканоиламино}бутириламино)бутириламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{6-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]гексаноиламино}бутириламино)бутириламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{4-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]бутириламино}бутириламино)бутириламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1(7-34);
N-эпсилон26-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{12-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]додеканоиламино}бутириламино)бутириламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1(7-34);
N-эпсилон26-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{6-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]гексаноиламино}бутириламино)бутириламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1(7-34);
N-эпсилон26-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{12-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]додеканоиламино}бутириламино)бутириламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1(7-35);
N-эпсилон26-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{6-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]гексаноиламино}бутириламино)бутириламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1(7-35);
N-эпсилон26-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{6-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]гексаноиламино}бутириламино)бутириламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1(7-36)-амида;
N-эпсилон26-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{6-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]гексаноиламино}бутириламино)бутириламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1(7-35);
N-эпсилон26-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{12-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]додеканоиламино}бутириламино)бутириламино]этокси}этокси)ацетил][Aib8,Lys33,Arg34]GLP-1(7-34);
N-эпсилон26-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{12-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]додеканоиламино}бутириламино)бутириламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1(7-36)-амида;
N-эпсилон26-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{12-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]додеканоиламино}бутириламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетиламино]этокси}этокси)ацетиламино]этокси}этокси)ацетиламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Aib8,Lys26,Arg34]GLP-1(7-36)-амида;
N-эпсилон37-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{12-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]додеканоиламино}бутириламино)бутириламино]этокси}этокси)ацетил][Aib8,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{12-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]додеканоиламино}бутириламино)бутириламино]этокси}этокси)ацетил][дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-{2-[2-(2-{2-[2-((R)-3-карбокси-3-{[1-(19-карбокси-нонадеканоил)пиперидин-4-карбонил]амино}пропиониламино)этокси]этокси}ацетиламино)этокси]этокси}ацетил[дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-{2-[2-(2-{2-[2-((S)-3-карбокси-3-{[1-(19-карбоксинонадеканоил)пиперидин-4-карбонил]амино}пропиониламино)этокси]этокси}ацетиламино)этокси]этокси}ацетил[Aib8,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-[2-(2-[2-(2-[2-(2-((R)-3-[1-(17-карбоксигептадеканоил)пиперидин-4-илкарбониламино]3-карбокси-пропиониламино)этокси)этокси]ацетиламино)этокси]этокси)ацетил][дезамино-His7, Glu22,Arg26,Arg34,Phe(m-CF3)28]GLP-1(7-37)-амида;
N-эпсилон37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-({транс-4-[(19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Aib8,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-({транс-4-[(19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-({транс-4-[(19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37);
N-эпсилон37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-({транс-4-[(19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][дезамино-His7,Glu22,Arg26,Glu30,Arg34,Lys37]GLP-1(7-37);
N-эпсилон37-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{12-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]додеканоиламино}бутириламино)бутириламино]этокси}этокси)ацетил][Aib8,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-[2-(2-{2-[(S)-4-карбокси-4-((S)-4-карбокси-4-{12-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутириламино]додеканоиламино}бутириламино)бутириламино]этокси}этокси)ацетил][дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-(3-((2-(2-(2-(2-(2-гексадецилоксиэтокси)этокси)этокси)этокси)этокси))пропионил)[дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида; N-эпсилон37-{2-(2-(2-(2-[2-(2-(4-(гексадеканоиламино)-4-карбоксибутириламино)этокси)этокси]ацетил)этокси)этокси)ацетил)}[дезамино-His7,Glu22,Arg26,Glu30,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-{2-(2-(2-(2-[2-(2-(4-(гексадеканоиламино)-4-карбокси-бутирил-амино)этокси)этокси]ацетил)этокси)этокси)ацетил)}[дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-(2-(2-(2-(2-(2-(2-(2-(2-(2-(октадеканоиламино)этокси)этокси)ацетиламино)этокси)этокси)ацетиламино)этокси)этокси)ацетил)[дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-[4-(16-(1H-тетразол-5-ил)гексадеканоилсульфамоил)бутирил][дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37)-амида;
N-эпсилон37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37);
N-эпсилон37-(2-{2-[2-((S)-4-карбокси-4-{(S)-4-карбокси-4-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутириламино]бутириламино}бутириламино)этокси]этокси}ацетил)[дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37);
N-эпсилон37-{2-[2-(2-{(S)-4-[(S)-4-(12-{4-[16-(2-трет-бутил-2H-тетразол-5-ил)гексадеканоилсульфамоил]бутириламино}додеканоиламино)-4-карбоксибутириламино]-4-карбоксибутириламино}этокси)этокси]ацетил}[дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37);
N-эпсилон37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Aib8,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37);
N-альфа37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Aib8,Glu22,Arg26,Arg34,эпсилон-Lys37]GLP-1(7-37)-пептида;
N-эпсилон37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][дезамино-His7,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37);
N-эпсилон36-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(15-карбоксипентадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][дезамино-His7,Glu22,Arg26,Glu30,Arg34,Lys36]GLP-1(7-37)-Glu-Lys-пептида; N-эпсилон37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-({транс-4-[(19-карбоксинонадеканоиламино)метил]циклогексанкарбонил}амино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Aib8,Glu22,Arg26,Arg34,Lys37]GLP-1(7-37);
N-эпсилон37-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Aib8,Glu22,Arg26,Arg34,Aib35,Lys37]GLP-1(7-37);
N-эпсилон37-[(S)-4-карбокси-4-(2-{2-[2-(2-{2-[2-(17-карбоксигептадеканоиламино)этокси]этокси}ацетиламино)этокси]этокси}ацетиламино)бутирил][Aib8,Glu22,Arg26,34,Lys37]GLP-1(7-37);
N-эпсилон37-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(S)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил][ImPr7,Glu22,Arg26,34,Lys37]GLP-1(7-37);
N-эпсилон26-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетила};
N-эпсилон37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}[Aib8,Arg34,Lys37]GLP-1(7-37)-OH;
N-эпсилон26-(17-карбоксигептадеканоил)[Aib8,Arg34]GLP-1(7-37)-пептида;
N-эпсилон26-(19-карбоксинонадеканоил)[Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-(4-{[N-(2-карбоксиэтил)-N-(15-карбоксипентадеканоил)амино]метил}бензоил[Arg34]GLP-1-(7-37);
N-эпсилон26-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(S)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил][Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-[2-(2-[2-(2-[2-(2-[4-(19-карбоксинонадеканоиламино)-4(S)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил][Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(S)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил][3-(4-имидазолил)пропионил7,Arg34]GLP-1(7-37);
N-эпсилон26-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)(карбоксиметиламино)ацетиламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил][Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-3(S)-сульфопропиониламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил][Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(S)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил][Gly8,Arg34]GLP-1(7-37);
N-эпсилон26-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(S)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил][Aib8,Arg34]GLP-1(7-37)-амида;
N-эпсилон26-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(S)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил][Aib8,Arg34,Pro37]GLP-1(7-37)-амида, Aib8,Lys26-(N-эпсилон26-{2-(2-(2-(2-[2-(2-(4-(пентадеканоиламино)-4-карбоксибутириламино)этокси)этокси]ацетил)этокси)этокси)ацетил)})-Arg34)GLP-1-H(7-37)-OH;
N-эпсилон26-[2-(2-[2-(2-[2-(2-[4-{[N-(2-карбоксиэтил)-N-(17-карбоксигептадеканоил)амино]метил}бензоил)амино]этокси)этокси]ацетиламино)этокси]этокси)ацетил][Aib8,Arg34]GLP-1(7-37);
N-альфа-7-формил, N-эпсилон26-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(S)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил][Arg34]GLP-1(7-37);
N-эпсилон26-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(S)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил][Aib8,Glu22,Arg34]GLP-1(7-37);
N-эпсилон26-{3-[2-(2-{2-[2-(2-{2-[2-(2-[4-(15-(N-((S)-1,3-дикарбоксипропил)карбамоил)пентадеканоиламино)-(S)-4-карбоксибутириламино]этокси)этокси]этокси}этокси)этокси]этокси}этокси)этокси]пропионил}[Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-[2-(2-[2-(2-[2-(2-[4-{[N-(2-карбоксиэтил)-N-(17-карбоксигептадеканоил)амино]метил}бензоил)амино](4(S)-карбоксибутириламино)этокси)этокси]ацетиламино)этокси]этокси)ацетил][Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-{(S)-4-карбокси-4-((S)-4-карбокси-4-((S)-4-карбокси-4-((S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутириламино)бутириламино)бутириламино)бутириламино}[Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-4-(17-карбоксигептадеканоил-амино)-4(S)-карбоксибутирил[Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-{3-[2-(2-{2-[2-(2-{2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(S)-карбоксибутириламино]этокси)этокси]этокси}этокси)этокси]этокси}этокси)этокси]пропионил}[Aib8,Arg34]GLP-1(7-37);
N-эпсилон26-{2-(2-(2-(2-[2-(2-(4-(17-карбоксигептадеканоиламино)-4-карбоксибутириламино)этокси)этокси]ацетил)этокси)этокси)ацетил)}[Aib8,22,27,30,35,Arg34,Pro37,Lys26]GLP-1(7-37)-амида;
N-эпсилон26-[2-(2-[2-[4-(21-карбоксиунейкозаноиламино)-4(S)-карбоксибутириламино]этокси]этокси)ацетил][Aib8,Arg34]GLP-1(7-37) и
N-эпсилон26-[2-(2-[2-(2-[2-(2-[4-(21-карбоксиунейкозаноиламино)-4(S)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил][Aib8,Arg34]GLP-1(7-37).
Средство доставки
Соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты
Средство доставки, используемое в настоящем изобретении, представляет собой соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC). Структурная формула N-(8-(2-гидроксибензоил)амино)каприлата показана в виде формулы (I).
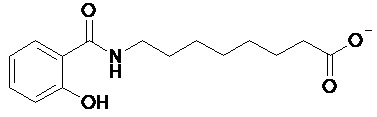 (I).
(I).
В некоторых вариантах осуществления соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты содержит один одновалентный катион, два одновалентных катиона или один двухвалентный катион. В некоторых вариантах осуществления соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты выбрана из группы, состоящей из натриевой соли, калиевой соли и/или кальциевой соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты. В одном варианте осуществления соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты выбрана из группы, состоящей из натриевой соли, калиевой соли и/или аммониевой соли. В одном варианте осуществления соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты представляет собой натриевую соль или калиевую соль. N-(8-(2-гидроксибензоил)амино)каприлатные соли можно получать с помощью способа, описанного, например, в WO96/030036, WO00/046182, WO01/092206 или WO2008/028859.
Соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты может быть кристаллической и/или аморфной. В некоторых вариантах осуществления средство доставки предусматривает ангидрат, моногидрат, дигидрат, тригидрат, сольват или гидрат соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты в количестве одной трети, а также их комбинации. В некоторых вариантах осуществления средство доставки представляет собой соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, описанную в WO2007/121318.
В некоторых вариантах осуществления средство доставки представляет собой N-(8-(2-гидроксибензоил)амино)каприлат натрия (называемый в данном документе «SNAC»), также известный как 8-(салицилоиламино)октаноат натрия.
Композиция
Композиция или фармацевтическая композиция по настоящему изобретению представляет собой твердую или сухую композицию, подходящую для введения с помощью перорального пути введения, как дополнительно описано в данном документе ниже.
В некоторых вариантах осуществления композиция содержит по меньшей мере одно фармацевтически приемлемое вспомогательное вещество. Используемый в данном документе термин «вспомогательное вещество» в широком смысле относится к любому компоненту, отличному от активного(-ых) терапевтического(-их) ингредиента(-ов) или активного(-ых) фармацевтического(-их) ингредиента(-ов) (API). Вспомогательное вещество может представлять собой фармацевтически инертное вещество, неактивное вещество и/или вещество, неактивное с терапевтической или медицинской точки зрения.
Вспомогательные вещества могут служить для различных целей, например, в качестве носителя, среды-носителя, наполнителя, связующего, смазывающего вещества, вещества, способствующего скольжению, разрыхлителя, средства контроля потока, ингибиторов кристаллизации, солюбилизатора, стабилизатора, красящего средства, ароматизатора, поверхностно-активного вещества, эмульгатора или их комбинаций, и/или для улучшения введения и/или всасывания терапевтически активного(-ых) вещества(веществ) или активного(-ых) фармацевтического(-их) ингредиента(-ов). Количество каждого используемого вспомогательного вещества может варьироваться в диапазонах, традиционных в данной области техники. Методики и вспомогательные вещества, которые можно использовать для составления лекарственных форм для перорального применения, описаны в Handbook of Pharmaceutical Excipients, 8th edition, Sheskey et al., Eds., American Pharmaceuticals Association and the Pharmaceutical Press, publications department of the Royal Pharmaceutical Society of Great Britain (2017); и Remington: the Science and Practice of Pharmacy, 22nd edition, Remington and Allen, Eds., Pharmaceutical Press (2013).
В некоторых вариантах осуществления вспомогательные вещества могут быть выбраны из связующих, таких как поливинилпирролидон (повидон) и т.д.; наполнителей, таких как порошок целлюлозы, микрокристаллическая целлюлоза, производные целлюлозы, как, например, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза, двухосновный фосфат кальция, кукурузный крахмал, прежелатинизированный крахмал и т.д.; смазывающих веществ и/или веществ, способствующих скольжению, таких как стеариновая кислота, стеарат магния, стеарилфумарат натрия, глицеринтрибегенат и т.д.; средств контроля потока, таких как коллоидный диоксид кремния, тальк и т.д.; ингибиторов кристаллизации, таких как повидон и т.д.; солюбилизаторов, таких как плюроник, повидон и т.д.; красящих средств, включая красители и пигменты, такие как оксид железа красный или желтый, диоксид титана, тальк и т.д.; средств контроля pH, таких как лимонная кислота, винная кислота, фумаровая кислота, цитрат натрия, двухосновный фосфат кальция, двухосновный фосфат натрия и т.д.; поверхностно-активных веществ и эмульгаторов, таких как плюроник, полиэтиленгликоли, карбоксиметилцеллюлоза натрия, полиэтоксилированное и гидрогенизированное касторовое масло и т.д.; и смесей двух или более таких вспомогательных веществ и/или адъювантов.
Композиция может содержать связующее, такое как повидон; разновидности крахмала; разновидности целлюлозы и их производные, такие как микрокристаллическая целлюлоза, например, Avicel PH от FMC (Филадельфия, Пенсильвания), гидроксипропилцеллюлоза, гидроксилэтилцеллюлоза и гидроксилпропилметилцеллюлоза METHOCEL от Dow Chemical Corp. (Мидленд, Мичиган); сахароза; декстроза; кукурузная патока; полисахариды и желатин. Связующее может быть выбрано из группы, состоящей из сухих связующих и/или связующих для влажной грануляции. Подходящие сухие связующие представляют собой, например, порошок целлюлозы и микрокристаллическую целлюлозу, такую как Avicel PH 102 и Avicel PH 200. В некоторых вариантах осуществления композиция содержит Avicel, такую как Avicel PH 102. Подходящие связующие для влажной грануляция или сухой грануляции представляют собой кукурузный крахмал, поливинилпирролидон (повидон), сополимер винилпирролидона-винилацетата (коповидон) и производные целлюлозы, такие как гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и гидроксилпропилметилцеллюлоза. В некоторых вариантах осуществления композиция содержит повидон.
В некоторых вариантах осуществления композиция содержит наполнитель, который может быть выбран из лактозы, маннита, эритритола, сахарозы, сорбита, фосфата кальция, такого как гидрофосфат кальция, микрокристаллической целлюлозы, порошкообразной целлюлозы, кондитерского сахара, прессованного сахара, декстратов, декстрина и декстрозы. В некоторых вариантах осуществления композиция содержит микрокристаллическую целлюлозу, такую как Avicel PH 102 или Avicel PH 200.
В некоторых вариантах осуществления композиция содержит смазывающее вещество и/или вещество, способствующее скольжению. В некоторых вариантах осуществления композиция содержит смазывающее вещество и/или вещество, способствующее скольжению, такие как тальк, стеарат магния, стеарат кальция, стеарат цинка, глицерилбегенат, глицерилдибегенат, бегеноилполиоксил-8-глицериды, полимеры полиэтиленоксида, лаурилсульфат натрия, лаурилсульфат магния, олеат натрия, стеарилфумарат натрия, стеариновая кислота, гидрогенизированные растительные масла, диоксид кремния и/или полиэтиленгликоль и т.д. В некоторых вариантах осуществления композиция содержит стеарат магния или глицерилдибегенат (такой как продукт Compritol® 888 ATO, который состоит из сложных моно-, ди- и триэфиров бегеновой кислоты (C22), при этом преобладает фракция сложных диэфиров).
В некоторых вариантах осуществления композиция содержит разрыхлитель, такой как крахмалгликолят натрия, полакрилин калия, крахмалгликолят натрия, кросповидон, кроскармеллоза, карбоксиметилцеллюлоза натрия или высушенный кукурузный крахмал.
Композиция может содержать одно или более поверхностно-активных веществ, например, поверхностно-активное вещество, по меньшей мере одно поверхностно-активное вещество или два различных поверхностно-активных вещества. Термин «поверхностно-активное вещество» относится к любым молекулам или ионам, которые содержат водорастворимую (гидрофильную) часть и жирорастворимую (липофильную) часть. Например, поверхностно-активное вещество может быть выбрано из группы, состоящей из анионных поверхностно-активных веществ, катионных поверхностно-активных веществ, неионогенных поверхностно-активных веществ и/или цвиттер-ионных поверхностно-активных веществ.
Как показано в примерах в данном документе, композиции по настоящему изобретению характеризуются очень высоким содержанием средства доставки. Такое очень высокое содержание может быть определено относительно полного содержания таблетки с включением также активного фармацевтического ингредиента (т.е. агониста GLP-1) или, в качестве альтернативы, относительно общего содержания вспомогательных веществ с исключением активного фармацевтического ингредиента. Описание, приведенное ниже, также относится к композициям, состоящим из конкретных ингредиентов, агониста GLP-1 и вспомогательных веществ, при этом термин «состоящий» следует понимать как все же охватывающий следовые количества любого вещества, не оказывающего эффект на функцию композиции, что может также обозначаться как «состоящий фактически из». Такие вещества могут представлять собой примеси, остающиеся при получении агониста GLP-1 или получении соли NAC, или минимальные количества (менее 1%) любого фармацевтически приемлемого вспомогательного вещества, которое не воздействует на качество или всасывание состава.
В одном варианте осуществления фармацевтическая композиция содержит:
a. агонист GLP-1 и
b. соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC),
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) составляет по меньшей мере 90% вес/вес композиции или более.
В таких дополнительных вариантах осуществления соль NAC составляет более 91%, как, например, более 92%, как, например, более 93, как, например, более 94%, как, например, более 95% вес/вес указанной композиции.
В таких дополнительных вариантах осуществления соль NAC составляет по меньшей мере 91% вес/вес, как, например, по меньшей мере 92% вес/вес, как, например, по меньшей мере 93% вес/вес, как, например, по меньшей мере 94% вес/вес, как, например по меньшей мере 95% вес/вес указанной композиции.
В одном варианте осуществления фармацевтическая композиция содержит:
a) агонист GLP-1 и
b) соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC),
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) составляет по меньшей мере 90% вес/вес вспомогательных веществ композиции.
В одном варианте осуществления фармацевтическая композиция состоит из:
a) агониста GLP-1 и
b) вспомогательных веществ, где вспомогательные вещества представляют собой:
i. соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) и
ii. одно или более дополнительных вспомогательных веществ;
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) составляет по меньшей мере 90% вес/вес вспомогательных веществ композиции.
В таких дополнительных вариантах осуществления соль NAC составляет по меньшей мере 91% вес/вес, как, например по меньшей мере 92% вес/вес, как, например по меньшей мере 93% вес/вес, как, например по меньшей мере 94% вес/вес, как, например по меньшей мере 95% вес/вес вспомогательных веществ композиции.
В одном варианте осуществления фармацевтическая композиция содержит:
a) агонист GLP-1 и
b) соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC),
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) составляет по меньшей мере 95% вес/вес вспомогательных веществ композиции.
В одном варианте осуществления фармацевтическая композиция состоит из:
a) агониста GLP-1 и
b) вспомогательных веществ, где вспомогательные вещества представляют собой:
i. соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) и
ii. одно или более дополнительных вспомогательных веществ;
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) составляет по меньшей мере 95% вес/вес вспомогательных веществ композиции.
В таких дополнительных вариантах осуществления соль NAC составляет более 95% вес/вес, как, например, более 96% вес/вес, как, например, более 97% вес/вес или как, например, более 98% вес/вес композиции.
В таких дополнительных вариантах осуществления соль NAC составляет по меньшей мере 95% вес/вес, как, например, по меньшей мере 96% вес/вес, как, например, по меньшей мере 97% вес/вес или как, например, по меньшей мере 98% вес/вес вспомогательных веществ композиции.
Как указано выше, в соответствии с настоящим изобретением содержание вспомогательных веществ, кроме средства доставки, предпочтительно является минимальным. В одном варианте осуществления фармацевтическая композиция содержит по меньшей мере одно смазывающее вещество.
В одном варианте осуществления фармацевтическая композиция содержит или состоит из:
a) агониста GLP-1,
b) соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) и
c) по меньшей мере одного смазывающего вещества.
В таких вариантах осуществления смазывающее вещество может представлять собой стеарат магния или глицерилдибегенат. В одном варианте осуществления смазывающее вещество представляет собой стеарат магния. В одном варианте осуществления смазывающее вещество представляет собой глицерилдибегенат.
Композиция, описанная выше, где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) составляет по меньшей мере 95% вес/вес вспомогательных веществ композиции, дополнительно может представлять собой композицию, где указанная соль составляет по меньшей мере 90% вес/вес композиции или больше.
Подобно композициям, описанным выше, где указанная соль составляет по меньшей мере 90% вес/вес или больше, композиция дополнительно может представлять собой композицию, где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) составляет по меньшей мере 95% вес/вес вспомогательных веществ композиции.
Фармацевтическая композиция дополнительно может представлять собой композицию, где соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) выбрана из группы, состоящей из натриевой соли, калиевой соли и/или кальциевой соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) или, в качестве альтернативы, из группы, состоящей только из натриевой соли и калиевой соли. В одном варианте осуществления соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) представляет собой N-(8-(2-гидроксибензоил)амино)каприлат натрия.
В вариантах осуществления, где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) составляет по меньшей мере 90% вес/вес вспомогательных веществ композиции, композиция содержит не более 10% вес/вес любых дополнительных вспомогательных веществ, таких как связующее, наполнитель и/или смазывающее вещество/вещество, способствующее скольжению. В некоторых вариантах осуществления композиция содержит по меньшей мере 90% вес/вес или больше средства доставки и менее 5% вес/вес любых дополнительных вспомогательных веществ, таких как связующее, наполнитель и/или смазывающее вещество/вещество, способствующее скольжению. В одном варианте осуществления фармацевтическая композиция содержит по меньшей мере 90% вес/вес средства доставки и менее 5% вес/вес смазывающего вещества. В одном варианте осуществления фармацевтическая композиция содержит по меньшей мере 90% вес/вес средства доставки и менее 3% вес/вес смазывающего вещества.
В некоторых вариантах осуществления композиция содержит по меньшей мере 90% вес/вес или больше средства доставки и 0,1-5% вес/вес, как, например, 0,5-4% вес/вес или 1-3% вес/вес, смазывающего вещества. В таких дополнительных вариантах осуществления композиция содержит 2-2,5% вес/вес смазывающего вещества.
В вариантах осуществления, где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) составляет по меньшей мере 95% вес/вес вспомогательных веществ композиции, композиция содержит не более 5% вес/вес любых дополнительных вспомогательных веществ, таких как связующее, наполнитель и/или смазывающее вещество/вещество, способствующее скольжению. В некоторых вариантах осуществления композиция содержит по меньшей мере 95% вес/вес средства доставки и менее 5% вес/вес смазывающего вещества. В одном варианте осуществления фармацевтическая композиция содержит по меньшей мере 95% вес/вес средства доставки и менее 3% вес/вес смазывающего вещества.
В некоторых вариантах осуществления композиция содержит по меньшей мере 95% вес/вес средства доставки и 0,1-5% вес/вес, как, например, 0,5-4% вес/вес или 1-3% вес/вес, смазывающего вещества. В таких дополнительных вариантах осуществления композиция содержит 2-2,5% вес/вес смазывающего вещества.
Фармацевтическую композицию в соответствии с настоящим изобретением предпочтительно получают в виде лекарственной формы, подходящей для перорального введения, как описано в данном документе ниже. Далее приведены абсолютные количества ингредиентов композиции по настоящему изобретению со ссылкой на содержание в единице дозирования, т.е. на таблетку, капсулу или саше.
В дополнительном варианте осуществления фармацевтические композиции по настоящему изобретению могут содержать не более 1000 мг указанной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты на единицу дозы. В одном варианте осуществления настоящее изобретение относится к композиции, где единица дозы содержит не более 500 мг указанной соли.
В некоторых вариантах осуществления количество соли N-(8-(2-гидроксибензоил) амино)каприловой кислоты на единицу дозы составляет по меньшей мере 0,05 ммоль, как, например, по меньшей мере 0,075 ммоль, как, например, по меньшей мере 0,1 ммоль, как, например, по меньшей мере 0,125 ммоль, как, например, по меньшей мере 0,15 ммоль, как, например, по меньшей мере 0,20 ммоль, по меньшей мере 0,25 ммоль, по меньшей мере 0,30 ммоль, по меньшей мере 0,35 ммоль, по меньшей мере 0,40 ммоль, по меньшей мере 0,45 ммоль, по меньшей мере 0,50 ммоль, по меньшей мере 0,55 ммоль или по меньшей мере 0,60 ммоль.
В некоторых вариантах осуществления количество соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты на единицу дозирования композиции составляет не более 3 ммоль, как, например, не более 2,75 ммоль, как, например, не более 2,5 ммоль, как, например, не более 2,25 ммоль, как, например, 2 ммоль, как, например, не более 1,5 ммоль, не более 1 ммоль, не более 0,75 ммоль, не более 0,6 ммоль, не более 0.5 ммоль, не более 0,4 ммоль, не более 0,3 ммоль и не более 0,2 ммоль.
В некоторых вариантах осуществления количество соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты на единицу дозы композиции находится в диапазоне 0,05-3 ммоль, 0,10-2,5 ммоль, 0,15-2,0 ммоль, 0,20-1,5 ммоль, 0,25-1,0 ммоль, 0,30-0,75 ммоль или как, например, 0,45-0,65 ммоль.
В некоторых вариантах осуществления, где соль NAC представляет собой SNAC, количество SNAC в композиции составляет по меньшей мере 20 мг, как, например, по меньшей мере 25 мг, как, например, по меньшей мере 50 мг, как, например, по меньшей мере 75 мг, по меньшей мере 100 мг, по меньшей мере 125 мг, по меньшей мере 150 мг, по меньшей мере 175 мг, по меньшей мере 200 мг, по меньшей мере 225 мг, по меньшей мере 250 мг, по меньшей мере 275 мг и по меньшей мере 300 мг на единицу дозы.
В некоторых вариантах осуществления, где соль NAC представляет собой SNAC, количество SNAC в композиции составляет не более 800 мг, как, например, не более 600 мг, как, например, не более 575 мг, как, например, не более 550 мг, не более 525 мг, не более 500 мг, не более 475 мг, не более 450 мг, не более 425 мг, не более 400 мг, не более 375 мг, не более 350 мг, не более 325 мг на единицу дозы или не более 300 мг на единицу дозы.
В некоторых вариантах осуществления, где соль NAC представляет собой SNAC, количество SNAC в композиции находится в диапазоне 20-800 мг, как, например, 25-600 мг, как, например, 50-500 мг, как, например, 50-400 мг, как, например, 75-400 мг, как, например, 80-350 мг или как, например, от примерно 100 до примерно 300 мг на единицу дозы.
В одном варианте осуществления, где соль NAC представляет собой SNAC, количество SNAC находится в диапазоне 20-200 мг, как, например, 25-175 мг, как, например, 75-150 мг, как, например, 80-120 мг, как, например, примерно 100 мг на единицу дозы.
В одном варианте осуществления, где соль NAC представляет собой SNAC, количество SNAC находится в диапазоне 200-800 мг, как, например, 250-400 мг, как, например, 250-350 мг, как, например, 275-325 мг, как, например, примерно 300 мг на единицу дозы.
В одном варианте осуществления единица дозы фармацевтических композиций по настоящему изобретению содержит 0,1-100 мг или от 0,2 до 100 мг агониста GLP-1.
В некоторых вариантах осуществления единица дозы композиции содержит количество агониста GLP-1, которое находится в диапазоне от 0,2 до 50 мг или от 1 до 40 мг.
В некоторых вариантах осуществления единица дозы содержит 0,5-5 мг агониста GLP-1, как, например, 0,75-4,5 мг, как, например, 1, 1,5, 2, 2,5 или 3 мг или 3,5, 4, 4,5 мг, как, например, 1-3 или 3-5 мг агониста GLP-1 на единицу дозы.
В некоторых вариантах осуществления единица дозы содержит от 2 до 20 мг агониста GLP-1, как, например, 2-15 мг, как, например, 2, 3, 4, 5, 6 или 7 мг, как, например, 2, 3, 4 или 5 мг или как, например, 8, 10, 12 или 14 мг, как, например, 15 мг или как, например, 20 мг агониста GLP-1 на единицу дозы.
В некоторых вариантах осуществления единица дозы содержит от 5 до 50 мг агониста GLP-1, как, например, 10-45 мг, как, например, 20, 30 или 40 мг, или как, например, 25, 35 или 45 мг, или как, например, 30-50 мг, или как, например, 20-40 мг агониста GLP-1 на единицу дозы.
Количество агониста GLP-1 может варьироваться в зависимости от природы агониста GLP-1 и необходимого эффекта, т.е. более высокое содержание может быть целесообразным при лечении ожирения в отличие от лечения сахарного диабета.
В предпочтительном варианте осуществления однократная доза композиции содержит 0,5-25 мг стеарата магния, как, например, 1-10 мг, как, например, 2-8 мг или как, например, 2-5 мг стеарата магния.
В предпочтительном варианте осуществления количество стеарата магния определяют относительно количества соли NAC, такой как SNAC, так что однократная доза композиции содержит 1-8 мг стеарата магния, или как, например, 2-5 мг стеарата магния, или 2-3 мг стеарата магния на 100 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты, например SNAC.
В предпочтительном варианте осуществления однократная доза композиции содержит 80-120 мг SNAC, 0,5-5 мг агониста GLP-1 и 2-3 мг смазывающего вещества.
В предпочтительном варианте осуществления однократная доза композиции содержит 80-120 мг SNAC, 1,5-10 мг агониста GLP-1 и 2-3 мг смазывающего вещества.
В предпочтительном варианте осуществления однократная доза композиции содержит 80-120 мг SNAC, 5-50 мг агониста GLP-1 и 2-3 мг смазывающего вещества.
В предпочтительном варианте осуществления однократная доза композиции содержит 250-350 мг SNAC, 0,5-5 мг агониста GLP-1 и 3-10 мг смазывающего вещества.
В предпочтительном варианте осуществления однократная доза композиции содержит 250-350 мг SNAC, 1,5-10 мг агониста GLP-1 и 3-10 мг смазывающего вещества.
В предпочтительном варианте осуществления однократная доза композиции содержит 250-350 мг SNAC, 5-50 мг агониста GLP-1 и 3-10 мг смазывающего вещества.
В одном варианте осуществления фармацевтическая композиция по настоящему изобретению характеризуется быстрым высвобождением in vitro. Высвобождение или растворение можно испытывать, как известно из уровня техники и как описано в данном документе в анализе I. Высвобождение можно выражать как количество агониста GLP-1, измеренное в растворе после указанного периода, относительно общего содержания агониста GLP-1 композиции. Относительное количество может быть указано в процентах. В одном варианте осуществления высвобождение агониста GLP-1 из фармацевтической композиции по настоящему изобретению составляет по меньшей мере 85% в пределах 15 минут или по меньшей мере 95% в пределах 30 минут. В одном таком варианте осуществления высвобождение измеряют при pH 6,8.
В одном варианте осуществления фармацевтическая композиция содержит:
a) агонист GLP-1 и
b) соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где высвобождение агониста GLP-1 достигает 85% в пределах 15 минут или 95% в пределах 30 минут. В одном варианте осуществления высвобождение измеряют при pH 6,8.
В одном варианте осуществления фармацевтическая композиция по настоящему изобретению обеспечивает раннюю экспозицию in vivo. В одном варианте осуществления фармацевтическая композиция по настоящему изобретению обеспечивает повышенную экспозицию in vivo. В одном варианте осуществления фармацевтическая композиция по настоящему изобретению обеспечивает повышенную раннюю экспозицию in vivo. Такую in vivo экспозицию можно тестировать на соответствующей модели, такой как анализ III, описанный в данном документе. Как показано в таблице 3.1, композиции, раскрытые в данном документе, демонстрируют повышенную раннюю скорректированную по дозе экспозицию у собак породы бигль в пределах первых 30 минут после перорального введения дозы. Экспозицию также можно измерять на протяжении предварительно определенного периода времени и рассчитывать кумулятивную скорректированную по дозе экспозицию (AUC), например в течение t=0-30 минут, также представленную в таблице 3.1 для композиций, описанных в данном документе.
В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, где скорректированная по дозе экспозиция в t=30 мин. является повышенной относительно композиции, описанной в WO2013/139694, которая содержит дополнительные вспомогательные вещества, микрокристаллическую целлюлозу и повидон. Эталонную композицию для указанного агониста GLP-1 предпочтительно следует получать с помощью двух гранул, раскрытых как тип F и H в WO2013/139694, и получать путем замещения семаглутида/соединения A на представляющий интерес агонист GLP-1.
В одном варианте осуществления фармацевтическая композиция содержит:
a) агонист GLP-1 и
b) соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где скорректированная по дозе экспозиция в t=30 мин. является повышенной относительно композиции типа F/H из WO2013/139694.
В одном варианте осуществления фармацевтическая композиция содержит:
a) агонист GLP-1 и
b) соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где скорректированная по дозе экспозиция (AUC) в течение t=0-30 мин. является повышенной относительно композиции типа F/H из WO2013/139694.
В одном варианте осуществления скорректированная по дозе экспозиция (AUC) в течение t=0-30 мин. является повышенной в по меньшей мере 1,5 раза, например 2 раза, по сравнению с композицией типа F/H из WO2013/139694.
Лекарственная форма
Композицию можно вводить в виде нескольких лекарственных форм, например, как таблетку; покрытую таблетку; саше или капсулу, такую как капсулы из твердого или мягкого желатина.
Композиция дополнительно может быть составлена с носителем лекарственного средства или системой доставки лекарственного средства, например для увеличения стабильности и/или растворимости или дополнительного увеличения биодоступности. Композиция может представлять собой лиофилизированную или высушенную распылением композицию.
Композиция может быть в форме единицы дозы, такой как таблетка. В некоторых вариантах осуществления масса однократной дозы находится в диапазоне oт 50 мг до 1000 мг, как, например, в диапазоне 50-750 мг или как, например, в диапазоне 100-500 мг.
В некоторых вариантах осуществления масса единицы дозы находится в диапазоне от 75 мг до 350 мг, как, например, в диапазоне 100-300 мг или как, например, в диапазоне 200-350 мг.
В некоторых вариантах осуществления масса единицы дозы находится в диапазоне от 100 мг до 400 мг, как, например, в диапазоне 50-300 мг или как, например, в диапазоне 200-400 мг.
В некоторых вариантах осуществления композицию можно гранулировать перед уплотнением. Композиция может содержать внутригранулярную часть и/или внегранулярную часть, при этом внутригранулярная часть была подвернута грануляции, а внегранулярная часть была добавлена после грануляции.
Внутригранулярная часть может содержать агонист GLP-1, средство доставки и/или вспомогательное вещество, такое как смазывающее вещество и/или вещество, способствующее скольжению. В некоторых вариантах осуществления внутригранулярная часть содержит средство доставки и смазывающее вещество и/или вещество, способствующее скольжению.
Внегранулярная часть может содержать агонист GLP-1, и/или смазывающее вещество, и/или вещество, способствующее скольжению, такое как стеарат магния. В некоторых вариантах осуществления внегранулярная часть содержит агонист GLP-1. В некоторых вариантах осуществления внегранулярныая часть содержит вспомогательное вещество, такое как смазывающее вещество и/или вещество, способствующее скольжению, такое как стеарат магния.
В дополнительных вариантах осуществления внутригранулярная часть содержит агонист GLP-1, средство доставки и смазывающее вещество и/или вещество, способствующее скольжению. В таких вариантах осуществления гранулят можно непосредственно прессовать в таблетки, и данные таблетки не имеют внегранулярной части.
Получение композиции
Получение композиции в соответствии с настоящим изобретением можно осуществлять в соответствии со способами, известными из уровня техники.
Для получения сухой смеси материала для таблетирования, различные компоненты взвешивают, необязательно протирают или просеивают, а затем объединяют. Смешивание компонентов можно осуществлять до тех пор, пока не будет получена однородная смесь.
Если в материале для таблетирования следует использовать гранулы, гранулы можно получать способом, известным специалисту в данной области техники, например с применением способов влажной грануляции, известных для получения «агломерированных» гранул или «измельчаемых» гранул. Способы формирования агломерированных гранул могут выполняться непрерывно и предусматривают, например, одновременное распыление массы для грануляции с раствором для грануляции и высушивание, например в барабанном грануляторе, в тарельчатых грануляторах, в дисковых грануляторах, в псевдоожиженном слое, путем распылительной сушки, распылительной грануляции или отверждения методом распылительной сушки, или выполняться с перерывами, например, в псевдоожиженном слое, в ротационном псевдоожиженном слое, в порционном смесителе, таком как смеситель с высоким сдвиговым усилием или смеситель с низким сдвиговым усилием, или в барабане для распылительной сушки. Способы получения измельчаемых гранул, которые могут проводиться с перерывами и в которых масса для грануляции вначале образует влажный агрегат с раствором для грануляции, который в дальнейшем измельчают или другими способами формируют в гранулы необходимого размера, и затем гранулы можно подвергать сушке. Подходящим оборудованием для стадии влажной грануляции являются планетарные смесители, смесители с низким сдвиговым усилием, смесители с высоким сдвиговым усилием, экструдеры и сферонизаторы, такие как устройство от компаний Loedige, Glatt, Diosna, Fielder, Collette, Aeschbach, Alexanderwerk, Ytron, Wyss & Probst, Werner & Pfleiderer, HKD, Loser, Fuji, Nica, Caleva и Gabler. Гранулы также могут формировать посредством методик сухой грануляции, в которых одно или более вспомогательных веществ и/или активный фармацевтический ингредиент прессуют с образованием относительно крупных прессованных образований, например брусков или лент, которые измельчают путем дробления, и раздробленный материал служит в качестве материала для таблетирования, подлежащего дальнейшему уплотнению. Подходящим оборудованием для сухой грануляции без ограничения является установка для вальцевания от Gerteis, такая как Gerteis MICRO-PACTOR, MINI-PACTOR и MACRO-PACTOR.
Термины «гранулят» и «гранулы» используются в данном документе взаимозаменяемо для обозначения частиц композиционного материала, которые могут быть получены, как описано выше.
Чтобы уплотнить материал для таблетирования в твердую пероральную лекарственную форму, например таблетку, может применяться таблеточный пресс. В таблеточном прессе материалом для таблетирования заполняют (например, с помощью принудительной подачи или подачи самотеком) полость матрицы. Затем материал для таблетирования уплотняют с помощью набора пуансонов, прилагая давление. В дальнейшем полученное прессованное изделие или таблетку извлекают из таблеточного пресса. Вышеупомянутый способ таблетирования в дальнейшем обозначается в данном документе как "способ уплотнения". Подходящие таблеточные прессы включают без ограничения роторные таблеточные прессы и эксцентриковые таблеточные прессы. Примеры таблеточных прессов включают без ограничения Fette 102i (Fette GmbH), Korsch XL100, роторный таблеточный пресс Korsch PH 106 (Korsch AG, Германия), эксцентриковый таблетирующий пресс Korsch EK-O (Korsch AG, Германия) и Manesty F-Press (Manesty Machines Ltd., Великобритания).
В одном варианте осуществления композиция содержит по меньшей мере один гранулят. В одном варианте осуществления композиция содержит один тип гранулята. В качестве альтернативы композиция может содержать два типа гранулятов.
В некоторых вариантах осуществления способ получения таблетки предусматривает: a) гранулирование смеси, содержащей средство доставки и необязательно смазывающее вещество; b) смешивание гранулята из a) с агонистом GLP-1 и необязательно дополнительным смазывающим веществом, и затем c) прессование смеси из b) в таблетки.
В некоторых вариантах осуществления способ получения таблетки предусматривает: a) гранулирование смеси, содержащей средство доставки, агонист GLP-1 и необязательно смазывающее вещество, и b) прессование гранулята из a) в таблетки и необязательно с включением дополнительного смазывающего вещества.
В целом, грануляты можно получать с помощью влажной грануляции, грануляции из расплава или сухой грануляции, предпочтительно сухой грануляции.
Показания к применению фармацевтического препарата
Настоящее изобретение также относится к композиции по настоящему изобретению для применения в качестве лекарственного препарата. В конкретных вариантах осуществления композицию по настоящему изобретению можно применять в следующих терапевтических способах лечения, предпочтительно все из них так или иначе связаны с сахарным диабетом и/или ожирением:
(i) предупреждение и/или лечение всех форм сахарного диабета, таких как гипергликемия, сахарный диабет 2 типа, нарушение толерантности к глюкозе, сахарный диабет 1 типа, инсулинонезависимый сахарный диабет, MODY (сахарный диабет зрелого типа у молодых), гестационный сахарный диабет и/или снижение уровня HbA1C;
(ii) задержка или предупреждение прогрессирования диабетического заболевания, например прогрессирования сахарного диабета 2 типа, задержка прогрессирования нарушения толерантности к глюкозе (IGT) до инсулинозависимого сахарного диабета 2 типа и/или задержка прогрессирования инсулинонезависимого сахарного диабета 2 типа до инсулинозависимого сахарного диабета 2 типа;
(iii) улучшение функции β-клеток, например, уменьшение уровня апоптоза β-клеток, повышение функции β-клеток и/или массы β-клеток, и/или восстановление чувствительности β-клеток к глюкозе;
(iv) предупреждение и/или лечение когнитивных нарушений;
(v) предупреждение и/или лечение расстройств пищевого поведения, таких как ожирение, например, путем уменьшения потребления пищи, снижения массы тела, подавления аппетита, вызывания чувства сытости; лечения или предупреждения компульсивного переедания, нервной булимии и/или ожирения, вызванного введением антипсихотического средства или стероида; снижения перистальтики желудка и/или задержки опорожнения желудка.
(vi) предупреждение и/или лечение осложнений диабета, таких как нейропатия, включая периферическую нейропатию; нефропатия или ретинопатия;
(vii) улучшение показателей липидного обмена, например, предупреждение и/или лечение дислипидемии, снижение общего содержания липидов в сыворотке крови; снижение содержания HDL; снижение содержания малых плотных LDL; снижение содержания VLDL; снижение содержания триглицеридов; снижение содержания холестерина; повышения HDL, снижения уровней липопротеина a (Lp(a)) в плазме крови человека; ингибирование образования аполипротеина a (apo(A)) in vitro и/или in vivo;
(iix) предупреждение и/или лечение сердечно-сосудистых заболеваний, таких как синдром X; атеросклероз; инфаркт миокарда; коронарное заболевание сердца; инсульт, ишемия головного мозга; ранняя стадия заболевания сердца или ранняя стадия сердечно-сосудистого заболевания, например гипертрофия левого желудочка; ишемическая болезнь сердца; эссенциальная гипертензия; острый гипертонический криз; кардиомиопатия; сердечная недостаточность; переносимость физической нагрузки; хроническая сердечная недостаточность; аритмия; нарушение сердечного ритма; обморок; атеросклероз; умеренная хроническая сердечная недостаточность; стенокардия; реокклюзия стента после шунтирования; динамическое нарушение кровообращения (atheroschlerosis oblitterens); диастолическая дисфункция и/или систолическая дисфункция;
(ix) предупреждение и/или лечение заболеваний желудочно-кишечного тракта, таких как синдром воспаленного кишечника; синдром короткой кишки или болезнь Крона; диспепсия и/или язва желудка;
(x) предупреждение и/или лечение критического состояния, например, лечение пациента в критическом состоянии, пациента с полинейропатией критических состояний (CIPNP) и/или пациента с потенциальной CIPNP; предупреждение развития критического состояния или CIPNP; предупреждение, лечение и/или излечение синдрома системного воспалительного ответа (SIRS) у пациента и/или для предупреждения или снижения вероятности развития у пациента бактериемии, септицемии и/или септического шока во время госпитализации; и/или
(xi) предупреждение и/или лечение синдрома поликистоза яичников (PCOS).
В конкретном варианте осуществления показание выбрано из группы, состоящей из (i)-(iii) и (v)-(iix), как, например, показаний (i), (ii) и/или (iii); или показания (v), показания (vi), показания (vii) и/или показания (iix). В другом конкретном варианте осуществления показание представляет собой (i). В дополнительном конкретном варианте осуществления показание представляет собой (v). В еще одном дополнительном конкретном варианте осуществления показание представляет собой (iix). В некоторых вариантах осуществления показания представляют собой сахарный диабет 2 типа и/или ожирение.
Способ лечения
Настоящее изобретение дополнительно относится к способу лечения субъекта, нуждающегося в этом, предусматривающему введение указанному субъекту терапевтически эффективного количества композиции в соответствии с настоящим изобретением. В одном варианте осуществления способ лечения предназначен для лечения сахарного диабета или ожирения и/или дополнительных показаний, указанных выше.
В некоторых вариантах осуществления описан способ лечения сахарного диабета, предусматривающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтической композиции, содержащей агонист GLP-1, соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) и необязательно смазывающее вещество.
В некоторых вариантах осуществления описан способ лечения сахарного диабета, предусматривающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтической композиции, содержащей 0,5-50 мг агониста GLP-1, 50-500 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) и 1-10 мг смазывающего вещества. В предпочтительном варианте осуществления соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% (вес/вес) композиции.
В предпочтительном варианте осуществления соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 95% (вес/вес) вспомогательных веществ композиции.
В альтернативном варианте осуществления описан способ лечения сахарного диабета, предусматривающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтической композиции, содержащей приблизительно 1-14 мг агониста GLP-1, приблизительно 100-300 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) и приблизительно 2-8 мг стеарата магния.
В некоторых вариантах осуществления агонист GLP-1 представляет собой семаглутид с формулой N-эпсилон26-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил][Aib8,Arg34]GLP-1(7-37), и соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (NAC) представляет собой натриевую соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты (SNAC). Описаны различные примеры смазывающего вещества, включая стеарат магния. Композицию вводят перорально, и она находится в форме таблетки, капсулы или саше.
В таких дополнительных вариантах осуществления одну или более единиц дозы можно вводить указанному субъекту, нуждающемуся в этом.
Комбинированное лечение
Лечение с помощью композиции в соответствии с настоящим изобретением также можно комбинировать с одним или более дополнительными активными фармацевтическими ингредиентами, например, выбранными из противодиабетических средств, средств против ожирения, средств, регулирующих аппетит, антигипертензивных средств, средств для лечения и/или предупреждения осложнений, возникающих в результате сахарного диабета или ассоциированных с ним, и средств для лечения и/или предупреждения осложнений и расстройств, возникающих в результате ожирения или ассоциированных с ним. Примерами этих биологически активных веществ являются: инсулин, сульфонилмочевины, бигуаниды, меглитиниды, ингибиторы глюкозидазы, антагонисты глюкагона, ингибиторы DPP-IV (дипептидилпептидазы-IV), ингибиторы натрий-глюкозного котранспортера 2 (SGLT2); канаглифлозин, дапаглифлозин, эмпаглифлозин, эртуглифлозин, ипраглифлозин, тофоглифлозин, лузеоглифлозин, бексаглифлозин, ремоглифлозин этабонат и сотаглифлозин, в частности, дапаглифлозин и эмпаглифлозин, ингибиторы ферментов печени, вовлеченных в стимуляцию глюконеогенеза и/или гликогенолиза, модуляторы поглощения глюкозы, соединения, модифицирующие метаболизм липидов, такие как антигиперлипидемические средства, как ингибиторы HMG CoA (статины), желудочные ингибиторные полипептиды (аналоги GIP), соединения, снижающие поглощение пищи, агонисты RXR и средства, действующие на ATP-зависимый калиевый канал β-клеток; холестирамин, колестипол, клофибрат, гемфиброзил, ловастатин, правастатин, симвастатин, пробукол, декстротироксин, нетеглинид, репаглинид; β-блокаторы, такие как алпренолол, атенолол, тимолол, pиндолол, пропранолол и метопролол, ингибиторы ACE (ангиотензинпревращающего фермента), такие как беназеприл, каптоприл, эналаприл, фозиноприл, лизиноприл, алатриоприл, хинаприл и рамиприл, блокаторы кальциевых каналов, такие как нифедипин, фелодипин, никардипин, исрадипин, нимодипин, дилтиазем и верапамил, и α-блокаторы, такие как доксазозин, урапидил, празозин и теразозин; агонисты CART (кокаин-амфетамин-регулируемый транскрипт), антагонисты NPY (нейропептида Y), агонисты PYY, агонисты Y2-рецептора, агонисты Y4-рецептора, агонисты смешанного Y2/Y4-рецептора, агонисты MC4 (меланокортина 4), антагонисты орексина, агонисты TNF (фактора некроза опухоли), агонисты CRF (кортикотропин-рилизинг фактора), антагонисты CRF BP (белка, связывающего кортикотропин-рилизинг фактор), агонисты урокортина, β3-агонисты, оксинтомодулин и аналоги, агонисты MSH (меланоцит-стимулирующего гормона), антагонисты MCH (меланоцит-концентрирующего гормона), агонисты CCK (холецистокинина), ингибиторы обратного захвата серотонина, ингибиторы обратного захвата серотонина и норадреналина, смешанные серотонин- и норадренергические соединения, агонисты 5HT (серотонина), агонисты бомбезина, антагонисты галанина, гормон роста, рилизинг-соединения гормона роста, агонисты TRH (тиреотропин-рилизинг гормона), модуляторы UCP 2 или 3 (разобщающего белка 2 или 3), агонисты лептина, агонисты DA (бромкриптин, допрексин), ингибиторы липазы/амилазы, модуляторы RXR (ретиноид X рецептор), агонисты TR β; антагонисты гистаминового H3-рецептора, агонисты или антагонисты желудочного ингибиторного полипептида (аналоги GIP), гастрин и аналоги гастрина.
Настоящее изобретение, описанное в данном документе, без ограничения этим дополнительно определено описанными ниже вариантами осуществления и формулой изобретения в данном документе.
Варианты осуществления
1. Фармацевтическая композиция, содержащая:
a) агонист GLP-1 и
b) соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес композиции.
2. Фармацевтическая композиция, содержащая:
a) агонист GLP-1 и
b) соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции.
3. Фармацевтическая композиция, состоящая из:
a) агониста GLP-1 и
b) вспомогательных веществ, где вспомогательные вещества представляют собой:
i. соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и
ii. одно или более дополнительных вспомогательных веществ;
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции.
4. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления 1-3, где композиция содержит по меньшей мере одно смазывающее вещество.
5. Фармацевтическая композиция, состоящая из:
a) агониста GLP-1,
b) соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты и
c) по меньшей мере одного смазывающего вещества.
6. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления 4 и 5, где смазывающее вещество представляет собой стеарат магния.
7. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где композиция содержит 1-8 мг, как, например, 2-5 мг или как, например, 2-3 мг, стеарата магния на 100 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты.
8. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления 2-7, где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес композиции.
9. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления 1, 5-8, где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 95% вес/вес вспомогательных веществ композиции.
10. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты выбрана из группы, состоящей из натриевой соли, калиевой соли и/или кальциевой соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты.
11. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты представляет собой N-(8-(2-гидроксибензоил)амино)каприлат натрия (SNAC).
12. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где единица дозы содержит не более 1000 мг указанной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты.
13. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где единица дозы содержит 0,5-50 мг агониста GLP-1.
14. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где агонист GLP-1 характеризуется T½ у минисвиней, составляющим по меньшей мере 24 часа.
15. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где агонист GLP-1 характеризуется EC50 (анализ без HSA), составляющей не более 100 пМ, как, например, не более 50.
16. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где агонист GLP-1 выбран из группы, состоящей из лираглутида, семаглутида, агониста GLP-1 B и агониста GLP-1 C.
17. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где агонист GLP-1 выбран из группы, состоящей из семаглутида и агониста GLP-1 C.
18. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где композиция содержит по меньшей мере один гранулят.
19. Фармацевтическая композиция в соответствии с предыдущим вариантом осуществления 18, где по меньшей мере один гранулят содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты.
20. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления 18-19, где по меньшей мере один гранулят дополнительно содержит смазывающее вещество, такое как стеарат магния.
21. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления 18-20, где по меньшей мере один гранулят дополнительно содержит агонист GLP-1.
22. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления 18-21, где по меньшей мере один гранулят получен путем сухой грануляции, как, например, путем вальцевания.
23. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления 18-22, где композиция содержит внегранулярную часть.
24. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления 18-23, где внегранулярная часть композиции содержит смазывающее вещество или вещество, способствующее скольжению, такое как стеарат магния, и/или агонист GLP-1.
25. Фармацевтическая композиция, содержащая:
a) 0,5-50 мг агониста GLP-1 и
b) 20-800 мг, как, например, 25-600, как, например, 50-500 мг, соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции, и где агонист GLP-1 представляет собой семаглутид.
26. Фармацевтическая композиция, содержащая:
a) 1-25 мг агониста GLP-1 и
b) 50-400 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции, и где агонист GLP-1 представляет собой семаглутид.
27. Фармацевтическая композиция, содержащая:
a) 1-15 мг агониста GLP-1 и
b) 75-150 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции, и где агонист GLP-1 представляет собой семаглутид.
28. Фармацевтическая композиция, содержащая:
a) 1-15 мг агониста GLP-1 и
b) 75-125 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции, и где агонист GLP-1 представляет собой семаглутид.
29. Фармацевтическая композиция, содержащая:
a) 1-15 мг агониста GLP-1 и
b) 80-120 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции, и где агонист GLP-1 представляет собой семаглутид.
30. Фармацевтическая композиция, содержащая:
a) 1-15 мг агониста GLP-1 и
b) 200-400 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции, и где агонист GLP-1 представляет собой семаглутид.
31. Фармацевтическая композиция, содержащая:
a) 1-15 мг агониста GLP-1 и
b) 250-350 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции, и где агонист GLP-1 представляет собой семаглутид.
32. Фармацевтическая композиция, содержащая:
a) 0,1-25 мг агониста GLP-1 и
b) 20-800 мг, как, например, 25-600, 50-500 мг, соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции, и где агонист GLP-1 представляет собой агонист GLP-1 C.
33. Фармацевтическая композиция, содержащая:
a) 1-25 мг агониста GLP-1 и
b) 50-400 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции, и где агонист GLP-1 представляет собой агонист GLP-1 C.
34. Фармацевтическая композиция, содержащая:
a) 1-15 мг агониста GLP-1 и
b) 75-150 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции, и где агонист GLP-1 представляет собой агонист GLP-1 C.
35. Фармацевтическая композиция, содержащая:
c) 1-15 мг агониста GLP-1 и
d) 75-125 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции, и где агонист GLP-1 представляет собой агонист GLP-1 C.
36. Фармацевтическая композиция, содержащая:
c) 1-15 мг агониста GLP-1 и
d) 80-120 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции, и где агонист GLP-1 представляет собой агонист GLP-1 C.
37. Фармацевтическая композиция, содержащая:
a) 1-15 мг агониста GLP-1 и
b) 200-400 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 90% вес/вес, как, например, по меньшей мере 95% вес/вес вспомогательных веществ композиции, и где агонист GLP-1 представляет собой агонист GLP-1 C.
38. Фармацевтическая композиция, содержащая:
a) 1-15 мг агониста GLP-1 и
b) 250-350 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 95% вес/вес вспомогательных веществ композиции, и где агонист GLP-1 представляет собой агонист GLP-1 C.
39. Фармацевтическая композиция в соответствии с любым из вариантов осуществления 25-38, дополнительно содержащая 1-10 мг смазывающего вещества, такого как стеарат магния.
40. Фармацевтическая композиция в соответствии с любым из вариантов осуществления 25-38, дополнительно содержащая 1-8 мг, как, например, 2-5 мг или как, например, 2-3 мг, стеарата магния на 100 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты.
41. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где композиция предназначена для перорального введения.
42. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где композиция представляет собой твердую композицию.
43. Фармацевтическая композиция в соответствии с предыдущими вариантами осуществления, где композиция представляет собой твердую композицию, такую как таблетка, капсула или саше.
44. Фармацевтическая композиция, содержащая:
a) агонист GLP-1 и
b) соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где высвобождение агониста GLP-1 достигает 85% в пределах 15 минут или 95% в пределах 30 минут.
45. Фармацевтическая композиция, содержащая:
a) агонист GLP-1 и
b) соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где скорректированная по дозе экспозиция в t=30 мин. является повышенной относительно эталонной композиции типа F/H из WO2013/139694.
46. Фармацевтическая композиция, содержащая:
a) агонист GLP-1 и
b) соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где скорректированная по дозе экспозиция (AUC) в течение t=0-30 мин. является повышенной относительно эталонной композиции типа F/H из WO2013/139694.
47. Фармацевтическая композиция в соответствии с предыдущим вариантом осуществления 46, где скорректированная по дозе экспозиция (AUC) в течение T=0-30 мин. является повышенной в по меньшей мере 1,5 раза, как, например, в по меньшей мере 2 раза.
48. Фармацевтическая композиция в соответствии с любым из вариантов осуществления 25-40, дополнительно определяемая с помощью признаков из одного или более из вариантов осуществления 8, 10, 11, 18-24 и 41-47.
49. Фармацевтическая композиция в соответствии с вариантами осуществления 44, 45, 46 или 47, дополнительно определяемая с помощью признаков одного или более из вариантов осуществления 4, 6-24 и 41-43.
50. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления для применения в медицине.
51. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления для применения в способе лечения сахарного диабета и/или ожирения.
52. Способ лечения субъекта, нуждающегося в этом, где способ предусматривает введение указанному субъекту терапевтически активного количества композиции в соответствии с любым из предыдущих вариантов осуществления.
Дополнительные варианты осуществления
1. Фармацевтическая композиция, содержащая:
a) агонист GLP-1 и
b) соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 95% вес/вес вспомогательных веществ композиции.
2. Фармацевтическая композиция в соответствии с вариантом осуществления 1, дополнительно содержащая по меньшей мере одно смазывающее вещество.
3. Фармацевтическая композиция, состоящая из:
a) агониста GLP-1,
b) соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты и
c) по меньшей мере одного смазывающего вещества.
4. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет более 90% вес/вес композиции.
5. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления 2-4, где смазывающее вещество представляет собой стеарат магния.
6. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где единица дозы содержит:
a) 0,5-50 мг агониста GLP-1 и/или
b) 50-500 мг указанной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты.
7. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где единица дозы содержит:
a) 0,5-50 мг агониста GLP-1,
b) 50-500 мг указанной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты и
c) 1-10 мг смазывающего вещества, такого как стеарат магния.
8. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где агонист GLP-1 выбран из группы, состоящей из лираглутида, семаглутида, агониста GLP-1 B и агониста GLP-1 C.
9. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления, где композиция представляет собой твердую композицию, такую как таблетка для перорального введения.
10. Фармацевтическая композиция, содержащая:
a) агонист GLP-1 и
b) соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты,
где
i. высвобождение агониста GLP-1 достигает 85% в пределах 15 минут, и/или
ii. скорректированная по дозе экспозиция (AUC) в течение t=0-30 мин. является повышенной относительно эталонной композиции типа F/H из WO2013/139694, и/или
iii. скорректированная по дозе экспозиция в 30 мин. (AUC) является повышенной относительно эталонной композиции типа F/H из WO2013/139694.
11. Фармацевтическая композиция в соответствии с вариантом осуществления 10, где композиция характеризуется одним или более признаками любого из вариантов осуществления 1-9.
12. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления для применения в медицине.
13. Фармацевтическая композиция в соответствии с любым из предыдущих вариантов осуществления для применения в способе лечения сахарного диабета и/или ожирения.
14. Способ лечения индивидуума, нуждающегося в этом, предусматривающий введение указанному индивидууму терапевтически активного количества композиции в соответствии с любым из предыдущих вариантов осуществления.
Способы и примеры
Общие способы обнаружения и определения характеристик
Анализ I. Испытание на растворимость
Испытание на растворимость проводят в соответствующем устройстве для определения растворимости, например, в устройстве для определения растворимости USP 2, и стандартное испытание на растворимость в соответствии с Европейской Фармакопеей (Ph Eur 2.9.3) можно осуществлять для измерения высвобождения агониста GLP-1 и SNAC in vitro.
Данные, описанные в данном документе, получают с применением устройства 2 в соответствии с Фармакопеей США 35 с применением скорости вращения лопасти-мешалки, составляющей 50 об./мин. Для проведения испытания при pH 6,8 используют 500 мл среды для растворения, представляющей собой 0,05 M фосфатный буфер, при температуре, составляющей 37±0,5°C. Среда для растворения содержит 0,1% Brij®35. Образцы извлекают через соответствующие промежутки времени. Содержание веществ в образце определяют с применением способа RP-HPLC для двойного обнаружения SNAC и агониста GLP-1. Содержание веществ в образце рассчитывают на основе площади пика для пиков SNAC и агониста GLP-1 на хроматограмме в сравнении со значениями площади пика для эталонов SNAC и агониста GLP-1 соответственно. Высвобожденное количество SNAC и агониста GLP-1 рассчитывают как процент от фактического содержания веществ в таблетках, т.е. 100/200/300 мг SNAC/таблетка и 3/5/4 мг агониста GLP-1/таблетка (например аналога A, B или C). Фактическое содержание веществ в таблетках определяют с применением анализа (II). Высвобожденное количество агониста GLP-1 приведено как среднее значение для 3 таблеток.
Анализ II. Анализ количества агониста GLP-1 и SNAC
Таблетки взвешивают перед экстракцией агониста GLP-1 и SNAC. Таблетки растворяют в соответствующем количестве 0,05 M фосфатного буфера, pH 7,4, с 20% ацетонитрила. Используют время экстракции, составляющее два часа. Образцы центрифугируют и подходящий объем переносят во флакон для HPLC. Стандарты соответствующего агониста GLP-1 и SNAC готовят с применением того же разбавителя, что используется для образцов. Для определения содержания агониста GLP-1 и SNAC используют HPLC с УФ-детектором. Содержание веществ в образце рассчитывают на основе площади пика для пиков SNAC и агониста GLP-1 на хроматограмме в сравнении со значениями площади пика для эталонов SNAC и агониста GLP-1 соответственно.
Содержание приводится как среднее значение для 3 таблеток.
Анализ III. Фармакокинетические исследования на собаках породы бигль
Проводят фармакокинетические (PK) исследования на собаках породы бигль для определения экспозиции агонистов GLP-1 после перорального введения разных лекарственных форм.
Для фармакокинетических исследований используют кобелей породы бигль, возрастом 1-5 лет и весом примерно 10-12 кг в начале исследования. Собак содержат группами в манежах (цикл 12 часов света : 12 часов темноты) и кормят индивидуально и строго один раз в день кормом для взрослых собак средних размеров Royal Canin (Royal Canin Products, филиал в Китае, или Brogaarden A/S, Дания). По мере возможности ежедневно допускается физическая активность и социальное общение в группах. Собак используют для повторных фармакокинетических исследовании с применением подходящего периода отмывки между последовательными введениями дозы. Перед началом первого фармакокинетического исследования обеспечивают соответствующий период акклиматизации. Все операции по обращению, введению дозы и сбору образцов крови животных осуществляет обученный и квалифицированный персонал. Перед проведением исследований собакам не дают пищу в течение ночи и от 0 до 4 ч после введения дозы. Кроме того, собакам ограничивали доступ к воде в период за 1 час до введения дозы и вплоть до 4 часов после введения дозы, но при этом обеспечивают ad libitum доступ к воде в течение всего остального периода.
Таблетки с агонистом GLP-1, используемые для p.o. исследований, описанных в данном документе, представляют собой таблетки с немедленным высвобождением на основе SNAC, вводимые перорально.
Таблетки, содержащие агонист GLP-1, вводят следующим образом: за 10 мин. перед введением таблетки собакам подкожно вводят примерно 3 нмоль/кг SEQ ID NO: 3). Таблетки с GLP-1 помещают в заднюю часть ротовой полости собаки, чтобы предотвратить разжевывание. Затем ротовую полость закрывают и с помощью шприца или зонда вводят 10 мл или 50 мл водопроводной воды для облегчения проглатывания таблетки.
Сбор образцов крови
Образцы крови собирают в предварительно определенные моменты времени вплоть до 10 ч после введения, чтобы адекватным образом охватить полный профиль всасывания, зависимость концентрации в плазме крови от времени, для агониста GLP-1.
В каждый момент времени сбора образца крови в 1,5-мл пробирку, покрытую EDTA, собирают примерно 0,8 мл цельной крови и пробирку аккуратно прокручивают для обеспечения перемешивания образца с EDTA. Образцы крови (например, 0,8 мл) собирают в буфер EDTA (8 мМ), а затем центрифугируют при 4°C и 2000G в течение 10 минут. Плазму крови пипеткой переносят в пробирки Micronic на сухой лед и держат при -20°C до проведения анализа.
Образцы крови собирают в зависимости от обстоятельств, например из venflon, установленного в подкожной вене предплечья на передней лапе, в течение первых 2 часов и затем с помощью шприца из яремной вены в остальные моменты времени (спускают первые несколько капель из venflon, чтобы удалить солевой раствор гепарина из образов, полученных из venflon).
Общие способы получения таблеток
Способ 1. Сухая грануляция
Сухую грануляцию проводят путем вальцевания на Gerteis MICRO-PACTOR. Скорость валика устанавливают на 1 об./мин., а интенсивность уплотнения на 6 кН/см, при этом глубина заполнения составляет 8 мм. После сухой грануляции проводят ручное просеивание лент с получением гранул с применением проволочного сита с размером ячеек 0,8 мм. Необязательно, чтобы удалить мелкозернистые частицы, применяют вторую стадию просеивания на вибрационном сите Retch, сите с размером ячеек 90 мкм.
Способ 2. Получение таблеток
Таблетки получают на Kilian Style One или Fette 102I, оснащенных одним или четырьмя наборами пуансонов, которые дают 4 мм округлые, 7 мм округлые или 5,75 × 10 мм, 7,2 × 12 мм, 7,5 × 12 мм, 7,5 × 12,5 мм или 9 × 18 мм овальные таблетки. Размер пуансона выбирают в соответствии с общей массой таблетки. В случае Kilian Style One скорость пресса устанавливают на 10%, а в случае Fette 102I скорость пресса устанавливают на 20 об./мин. Регулируют объем заполнения, чтобы получить таблетки с целевыми значениями массы от 28,6 мг до 823,5 мг. Применяют значения силы прессования от примерно 2 до 15 кН, чтобы получать таблетки с прочностью на раздавливание, составляющей примерно 20-160 Н, в соответствии с размером таблетки.
Примеры
Пример 1. Получение композиций
Получали таблетки с разными количествами агониста GLP-1, SNAC и дополнительных вспомогательных веществ. Содержание веществ в полученных композициях представлено в таблице 1 (таблица 1.1, таблица 1.2 и таблица 1.3). Агонист GLP-1 A представляет собой семаглутид, агонист GLP-1 B представляет собой диацилированный [Aib8,Arg34,Lys37]GLP-1(7-37) (пример 2 из WO2011/080103), и агонист GLP-1 C представляет собой диацилированный-[Aib8,Glu22,Arg26,Lys27,Glu30,Arg34,Lys36]GLP-1(7-37)-пептидил-Glu-Gly (пример 31 из WO2012/140117). Семаглутид может быть получен в соответствии со способом, описанным в WO2006/097537, пример 4. Агонисты GLP-1 B и C могут быть получены, как описано в WO2011/080103 и WO2012/140117 соответственно. SNAC получали в соответствии со способом, описанным в WO2008/028859.
Эталонные композиции A, B и C в целом получали, как описано в WO2013/139694. Тестируемые композиции (A1, A2, B1-B4, C1 и C2) в целом получали, как описано в способе 1 и 2 выше, с незначительными вариациями способа перед вальцеванием и получением таблеток, как указано ниже.
Таблица 1. Композиции таблеток, выраженные в виде мг на таблетку
Таблица 1.1. Обзор композиций с агонистом GLP-1 A
Таблица 1.2. Обзор композиций с агонистом GLP-1 B
Таблица 1.3. Обзор композиций с агонистом GLP-1 C
Для получения тестируемых композиций A1, A2, B1, B3, C1 и C2 следовали следующей процедуре: стеарат магния для гранул пропускали через сито с размером ячеек 355 мкм или меньше. Взвешивали правильное количество стеарата магния и SNAC. Стеарат магния вручную смешивали со SNAC в соответствии с принципом геометрического смешивания. Применяли два цикла геометрического разбавления. Остальное количество SNAC переносили в контейнер для смешивания и перемешивали с премиксом SNAC и стеарата магния в течение 30 мин. при 25 об./мин. в смесителе Turbula. Смесь подвергали вальцеванию, как описано в способе 1.
Взвешивали правильное количество агониста GLP-1 и гранул из SNAC и стеарата магния. Гранулы из SNAC и стеарата магния добавляли в контейнер для смешивания и вручную смешивали с агонистом GLP-1 в соответствии с принципом геометрического смешивания. Применяли два цикла геометрического разбавления. Остальное количество гранул из SNAC и стеарата магния переносили в контейнер для смешивания. Окончательное перемешивание агониста GLP-1 и гранул выполняли в течение 7 мин. при 25 об./мин. или в течение 20 мин. при 25 об./мин. в смесителе Turbula. Таблетки получали из данной композиции в соответствии со способом 2.
B2 получали следующим образом: гранулы стеарата магния и SNAC получали, как описано для предыдущих тестируемых композиций. Взвешивали правильное количество гранул из SNAC и стеарата магния и агониста GLP-1. 1/3 гранул из SNAC и стеарата магния смешивали с агонистом GLP-1 путем добавления гранул в контейнер для смешивания в соответствии с принципом геометрического смешивания. Применяли перемешивание в течение 7 мин. при 25 об./мин. в смесителе Turbula. Применяли два цикла геометрического разбавления. Остальное количество гранул из SNAC и стеарата магния переносили в контейнер для смешивания и смешивали в соответствии с принципом геометрического смешивания. Окончательное перемешивание агониста GLP-1 и гранул выполняли в течение 7 мин. при 25 об./мин. в смесителе Turbula. Таблетки получали из данной композиции в соответствии со способом 2.
B4 получали следующим образом: гранулы из SNAC (без стеарата магния) получали, как описано для предыдущих тестируемых композиций и в способе 1. Взвешивали правильное количество агониста GLP-1 и гранул из SNAC. Гранулы из SNAC добавляли в контейнер для смешивания и смешивали с агонистом GLP-1 в соответствии с принципом геометрического смешивания. Применяли два цикла геометрического разбавления. Остальное количество гранул из SNAC добавляли в контейнер для смешивания. Механическое перемешивание агониста GLP-1 и гранул выполняли в течение 7 мин. при 25 об./мин. в смесителе Turbula. Глицерилдибегенат (Compritol 888 ATO) пропускали через сито с размером ячеек 350 мкм или меньше. Взвешивали правильное количество глицерилдибегената. Глицерилдибегенат вручную смешивали со смесью гранул из SNAC и агониста GLP-1 в соответствии с принципом геометрического смешивания. Применяли три цикла геометрического разбавления. Полученную смесь переносили в контейнер для смешивания с остальной смесью гранул из SNAC и агониста GLP-1. Окончательное перемешивание с Compritol 888 ATO выполняли в течение 2 мин. при 25 об./мин. в смесителе Turbula. Таблетки получали из данной композиции в соответствии со способом 2.
Пример 2. Испытание на растворимость
Цель настоящего исследования заключалась в оценке растворимости серии композиций таблеток, описанных в примере 1.
Растворимость измеряли в соответствии с анализом I. В таблице 2 показаны результаты для таблеток, полученных в соответствии с примером 1 выше, где высвобождение представлено как «агонист GLP-1 в растворе (%)», описывающее количество агониста GLP-1 в растворе после 15, 30 и 60 мин. в сравнении с общим количеством агониста GLP-1 в таблетке в начале эксперимента. Общее количество агониста GLP-1 и SNAC в таблетках определяли в соответствии с анализом II.
Таблица 2. Агонист GLP-1 в растворе (%)
Полученные результаты показывают, что тестируемые композиции проявляют более быстрое высвобождение агониста GLP-1 по сравнению с таковым, наблюдаемым для эталонных композиций. Значительно более быстрое высвобождение агониста GLP-1 наблюдают в более ранние моменты времени, т.е. в 15 и 30 минут. Отличие в высвобождении является менее значимым после 60 минут. Количество SNAC в таблетках не влияло на высвобождение агониста GLP-1, т.е. таблетки, содержащие 100 мг SNAC растворяются с такой же скоростью, что и таблетки, содержащие 300 мг SNAC, при измерении после 15 минут или позже.
Дополнительные данные, полученные после 5, 10, 15, 20, 30, 45 и 60 минут для композиции A1 и эталона A, показаны на фигуре 1, демонстрирующей повышенное высвобождение в каждый момент времени.
Пример 3. Экспозиция при пероральном введении
Цель настоящего исследования заключалась в оценке экспозиции серии композиций, описанных в примере 1 выше, при пероральном введении собакам породы бигль с применением 10 мл воды для введения дозы собакам. Число тестов, выполненных для каждого состава, указано с помощью n.
Анализ и результаты
Концентрацию соответствующего агониста GLP-1 в плазме крови анализировали с применением ELISA или анализа на основании аналогичных антител, такого как LOCI. Индивидуальные профили зависимости концентрации в плазме крови от времени анализировали с помощью некомпартментной модели в WinNonlin v. 5.0 или Phoenix v. 6.2 или 6.3 (Pharsight Inc., Маунтин-Вью, Калифорния, США) или другого подходящего программного обеспечения для PK-анализа.
Экспозицию соединения, измеренную при t=30 мин., определяли и нормализовали как доза/кг массы тела.
Рассчитывали площадь под кривой зависимости концентрации в плазме крови от времени в течение первых 30 мин. (AUC, [время x концентрация]) (с помощью программы Pharsight) после перорального введения и нормализовали как ((доза/кг массы тела)*100) для получения скорректированной по дозе экспозиции. Полученные средние значения представлены в таблице 3.1.
Средняя скорректированная по дозе экспозиция аналогов A, B и C для t=0,5, 10, 15, 20 и 30 мин., полученная для составов A1, эталон A, B1 и эталон B, C1 и эталон C, показана на фигуре 2.
Поскольку отдельные агонисты GLP-1 ведут себя по-разному, т.е. могут характеризоваться более высокой или более низкой общей биодоступностью, также может быть уместным сравнение относительной экспозиции, чтобы понять эффект конкретной лекарственной формы/единицы дозы в сравнении с эффектом другой лекарственной формы/единицы дозы, содержащей тот же агонист GLP-1. Такие результаты включены в таблицу 3.2, где показано, что в случае каждого агониста GLP-1 получали 2-кратное увеличение экспозиции в течение первых 30 минут при применении лекарственной формы, раскрытой в данном документе, по сравнению с эталонной лекарственной формой.
Таблица 3.1. Скорректированная по дозе экспозиция - средние значения
лекарственная форма
Таблица 3.2. Скорректированная по дозе экспозиция - относительная экспозиция
Пример 4. Экспозиция при пероральном введении таблеток с 25-800 мг SNAC
Дополнительные таблетки с уменьшенными и увеличенными количествами SNAC изготавливали, как описано выше для A1 и A2.
A5 имела такой же состав, что и A2 выше. В данном случае гранулы изготавливали путем сухой грануляции с применением MINI-PACTOR® с последующим удалением мелкозернистых частиц с применением ситовой сетки с размером ячеек 90 мкм. Перед проведением сухой грануляции SNAC и стеарат магния перемешивали в течение 50 мин. при 25 об./мин. в смесителе V-shell. Гранулы из SNAC и стеарата магния перемешивали с агонистом GLP-1 в течение 10 мин. при 25 об./мин. в смесителе V-shell перед прессованием таблеток в соответствии со способом 2. В случае композиции A7 агонист GLP-1 A подвергали сухой грануляции вместе со SNAC и стеаратом магния с применением MINI-PACTOR® с последующим удалением мелкозернистых частиц с применением ситовой сетки с размером ячеек 90 мкм. SNAC и стеарат магния перемешивали в течение 50 мин. при 25 об./мин. в смесителе V-shell, а затем добавляли GLP-1 и перемешивали в течение 20 мин. при 25 об./мин. перед проведением сухой грануляции. Гранулы в дальнейшем прессовали в таблетки в соответствии со способом 2. MINI-PACTOR эксплуатировали при интенсивности уплотнения 6 кН/см, зазоре 1 мм, скорости валика 3 об./мин. и с применением проволочного сита с размером ячеек 0,63 мкм в случае обеих композиций A5 и A7.
Таблица 4.1. Композиции таблеток, выраженные в виде мг на таблетку
Цель настоящего исследования заключалась в оценке экспозиции серии композиций, описанных в таблице 4, при пероральном введении собакам породы бигль. Экспозицию при пероральном введении оценивали на собаках породы бигль, как описано в примере 1 выше, с применением 50 мл воды для введения дозы собакам. Число тестов, выполненных для каждого состава, указано с помощью n.
Результаты анализировали, как описано в примере 3, и полученные средние значения представлены в таблице 4.2, а относительные значения представлены в таблице 4.3 ниже.
Таблица 4.2. Скорректированная по дозе экспозиция - средние значения
лекарственная форма
Таблица 4.3. Скорректированная по дозе экспозиция - относительная экспозиция
лекарственная форма
Данные подтверждали, что повышение экспозиции в течение первых 30 минут наблюдали при применении лекарственной формы, раскрытой в данном документе, по сравнению с эталонной лекарственной формой
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Novo Nordisk A/S
<120> ТВЕРДЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АГОНИСТ GLP-1 И СОЛЬ N-(8-(2-ГИДРОКСИБЕНЗОИЛ)АМИНО)КАПРИЛОВОЙ КИСЛОТЫ
<130> 170097WO01
<160> 6
<170> PatentIn версии 3.5
<210> 1
<211> 31
<212> БЕЛОК
<213> Homo sapiens
<400> 1
His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly
20 25 30
<210> 2
<211> 40
<212> БЕЛОК
<213> Heloderma suspectum
<400> 2
His Gly Glu Gly Thr Phe Ile Thr Ser Asp Leu Ser Lys Gln Met Glu
1 5 10 15
Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro
20 25 30
Ser Ser Gly Ala Pro Pro Pro Ser
35 40
<210> 3
<211> 29
<212> БЕЛОК
<213> Homo sapiens
<400> 3
His Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Ser
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr
20 25
<210> 4
<211> 31
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> MOD_RES
<222> (2)..(2)
<223> Aib
<220>
<221> MOD_RES
<222> (20)..(20)
<223> Аминокислотный остаток модифицирован с помощью заместителя.
<400> 4
His Xaa Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Gly
20 25 30
<210> 5
<211> 31
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> MOD_RES
<222> (2)..(2)
<223> Aib
<220>
<221> MOD_RES
<222> (20)..(20)
<223> Аминокислотный остаток модифицирован с помощью заместителя.
<220>
<221> MOD_RES
<222> (31)..(31)
<223> Аминокислотный остаток модифицирован с помощью заместителя.
<400> 5
His Xaa Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Lys
20 25 30
<210> 6
<211> 33
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> MOD_RES
<222> (2)..(2)
<223> Aib
<220>
<221> MOD_RES
<222> (21)..(21)
<223> Аминокислотный остаток модифицирован с помощью заместителя
<220>
<221> MOD_RES
<222> (30)..(30)
<223> Аминокислотный остаток модифицирован с помощью заместителя
<400> 6
His Xaa Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Gln Ala Ala Arg Lys Phe Ile Glu Trp Leu Val Arg Gly Lys Gly Glu
20 25 30
Gly
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ТВЕРДЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АГОНИСТ GLP-1 И СОЛЬ N-(8-(2-ГИДРОКСИБЕНЗОИЛ)АМИНО)КАПРИЛОВОЙ КИСЛОТЫ | 2019 |
|
RU2804318C2 |
| ТВЕРДЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АГОНИСТ GLP-1 И СОЛЬ N-(2-ГИДРОКСИБЕНЗОИЛ)АМИНО)КАПРИЛОВОЙ КИСЛОТЫ | 2011 |
|
RU2600440C2 |
| КОМПОЗИЦИИ GLP-1 ПЕПТИДОВ И ИХ ПОЛУЧЕНИЕ | 2013 |
|
RU2641198C2 |
| ПЕРОРАЛЬНАЯ ДОЗИРОВАННАЯ ФОРМА СОЕДИНЕНИЙ ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА-1 | 2014 |
|
RU2671406C2 |
| ТВЕРДЫЕ КОМПОЗИЦИИ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ | 2018 |
|
RU2777206C2 |
| НОВЫЕ АНАЛОГИ ГЛЮКАГОНА | 2012 |
|
RU2610175C2 |
| ДВАЖДЫ АЦИЛИРОВАННЫЕ ПРОИЗВОДНЫЕ GLP-1 | 2010 |
|
RU2559540C2 |
| АЦИЛИРОВАННЫЕ GLP-1 СОЕДИНЕНИЯ | 2006 |
|
RU2434019C2 |
| ДИПЕПТИД, СОДЕРЖАЩИЙ НЕПРОТЕИНОГЕННУЮ АМИНОКИСЛОТУ | 2012 |
|
RU2643515C2 |
| СТАБИЛЬНЫЕ СОВМЕСТНЫЕ АГОНИСТЫ РЕЦЕПТОРА ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА-1/ГЛЮКАГОНА ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ | 2014 |
|
RU2683039C2 |
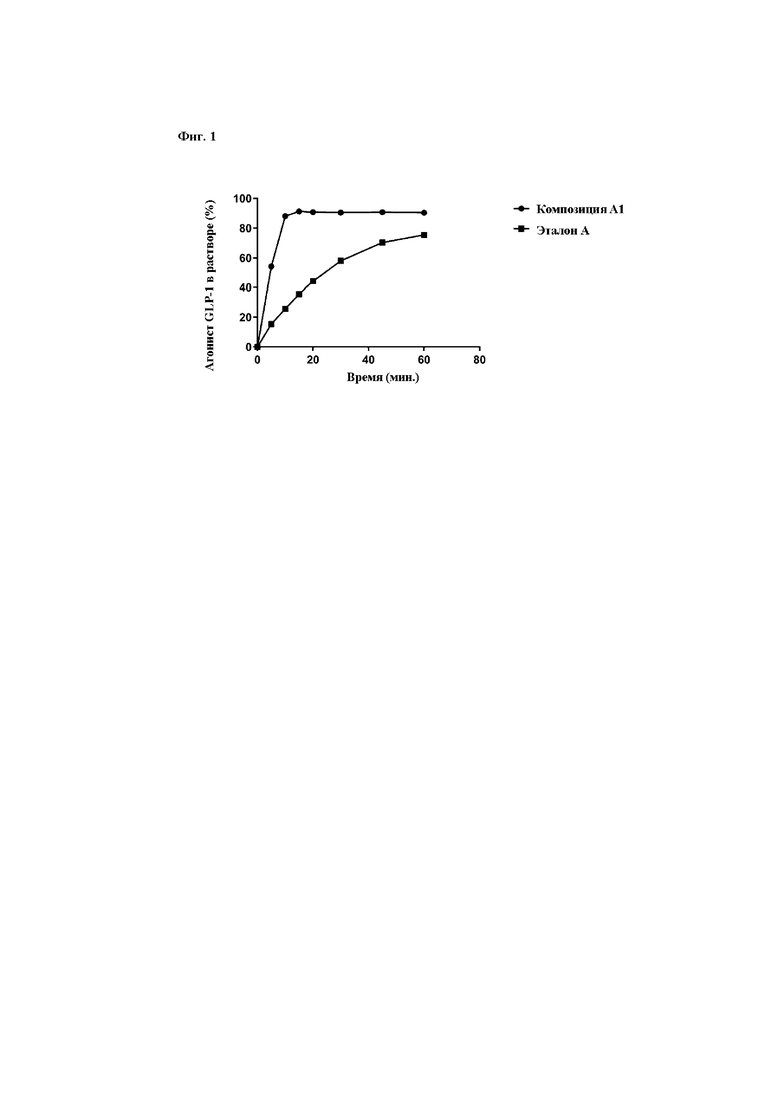
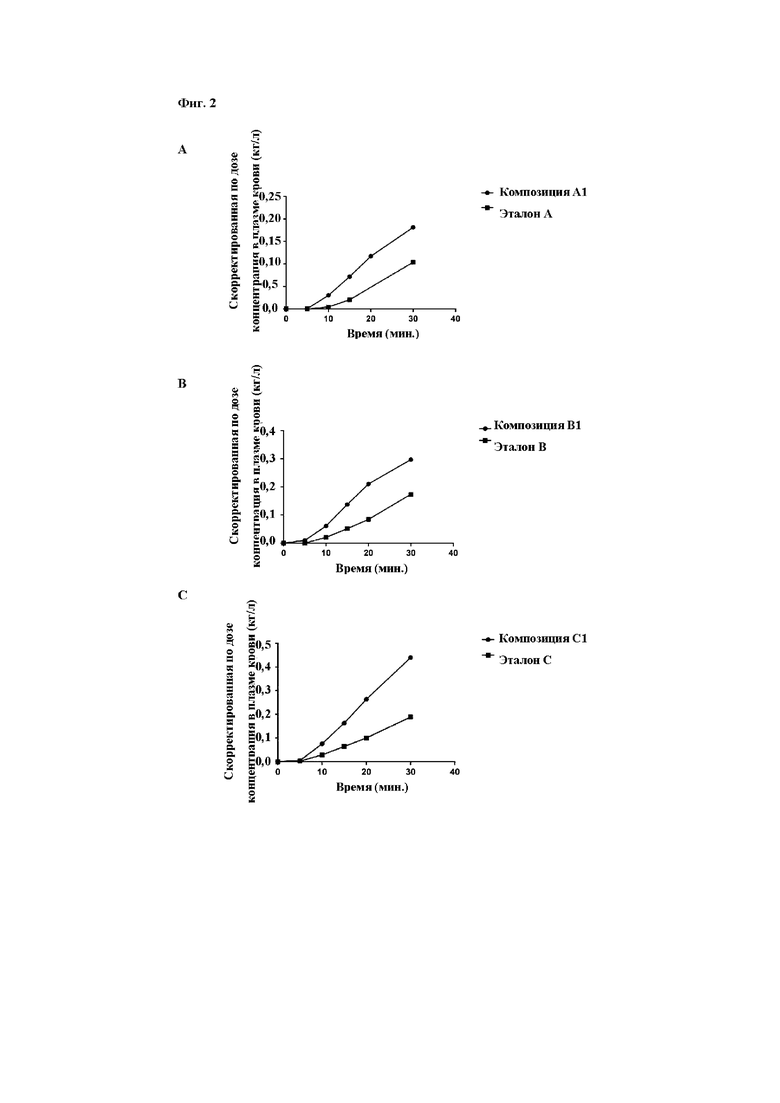
Настоящее изобретение относится к фармацевтическим композициям, содержащим пептид, такой как пептид GLP-1, и соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты. Настоящее изобретение дополнительно относится к способу лечения сахарного диабета и/или ожирения у субъекта. 2 н. и 8 з.п. ф-лы, 4 пр., 8 табл., 2 ил.
1. Фармацевтическая композиция, обладающая активностью GLP-1, содержащая:
a) 0,5-50 мг агониста GLP-1,
b) 20-800 мг соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты и
c) 1-10 мг смазывающего вещества,
где указанное смазывающее вещество представляет собой стеарат магния или глицерилдибегенат;
где указанная соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты составляет по меньшей мере 95% вес./вес. вспомогательных веществ композиции,
где агонист GLP-1 представляет собой семаглутид.
2. Фармацевтическая композиция по п. 1, где смазывающее вещество представляет собой стеарат магния.
3. Фармацевтическая композиция по п. 1 или 2, состоящая из:
a) семаглутида,
b) соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты и
c) стеарата магния.
4. Фармацевтическая композиция по любому из предыдущих пунктов, где композиция содержит 1-8 мг, как, например, 2-5 мг или как, например, 2-3 мг, cтеарата магния на 100 мг указанной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты.
5. Фармацевтическая композиция по любому из предыдущих пунктов, где соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты представляет собой N-(8-(2-гидроксибензоил)амино)каприлат натрия (SNAC).
6. Фармацевтическая композиция по любому из предыдущих пунктов, где единица дозы содержит:
a) 0,5-20 мг семаглутида,
b) 50-400 мг SNAC и
c) 1-10 мг стеарата магния.
7. Фармацевтическая композиция по любому из предыдущих пунктов, где единица дозы содержит:
a) 1-10 мг семаглутида,
b) 50-300 мг SNAC и
c) 1-10 мг стеарата магния.
8. Фармацевтическая композиция по любому из предыдущих пунктов, где композиция представляет собой твердую композицию, такую как таблетка для перорального введения.
9. Фармацевтическая композиция по любому из предыдущих пунктов для применения в способе лечения сахарного диабета и/или ожирения.
10. Способ лечения сахарного диабета и/или ожирения у субъекта, нуждающегося в этом, где способ предусматривает введение указанному субъекту терапевтически активного количества композиции по любому из предыдущих пунктов.
| US 2015031606 A1, 2015.01.29 | |||
| WO 2014177683 A1, 2014.11.06 | |||
| ТВЕРДЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АГОНИСТ GLP-1 И СОЛЬ N-(2-ГИДРОКСИБЕНЗОИЛ)АМИНО)КАПРИЛОВОЙ КИСЛОТЫ | 2011 |
|
RU2600440C2 |
| WO 2017060500 A1, 2017.04.13 | |||
| MELANIE DAVIES et al., "Effect of Oral Semaglutide Compared With Placebo and Subcutaneous Semaglutide on Glycemic Control in Patients With Type 2 Diabetes: A Randomized Clinical Trial", JAMA THE JOURNAL OF THE AMERICAN MEDICAL | |||
Авторы
Даты
2023-11-10—Публикация
2019-02-01—Подача