Настоящее изобретение относится к твердым композициям для перорального введения.
Предпосылки изобретения
Пептиды GLP-1 обладают низкой биодоступностью при пероральном введении. Пептиды GLP-1 могут быть выявлены в плазме крови после перорального введения только в том случае, если они составлены с определенными усилителями всасывания. Существует потребность в дальнейшем улучшении фармацевтической композиции для перорального введения пептидов GLP-1.
Краткое описание изобретения
В некоторых вариантах осуществления настоящее изобретение относится к твердой композиции для перорального введения, содержащей (i) производное GLP-1 и дапаглифлозин или (ii) производное GLP-1 и соль NAC в комбинации с ингибитором натрийзависимого переносчика глюкозы 2 типа (SGLT2).
Описание
Авторы настоящего изобретения неожиданно обнаружили, что композиции, содержащие дапаглифлозин в комбинации с производным GLP-1 или SNAC, обеспечивают улучшенную способность указанного производного GLP-1 к проникновению через клеточную мембрану. В некоторых вариантах осуществления композиция по настоящему изобретению обеспечивает улучшенную биодоступность пептида GLP-1 или его производного. В некоторых вариантах осуществления настоящее изобретение относится к твердой композиции для перорального введения, содержащей производное GLP-1 и дапаглифлозин. Кроме того, авторы настоящего изобретения неожиданно обнаружили, что композиции, содержащие дапаглифлозин в комбинации с производным GLP-1 или SNAC, обеспечивают улучшенную способность дапаглифлозина и/или пептида GLP-1 или его производного к проникновению через клеточную мембрану. В некоторых вариантах осуществления композиция по настоящему изобретению обеспечивает улучшенную биодоступность дапаглифлозина и/или пептида GLP-1 или его производного.
Авторы настоящего изобретения также неожиданно обнаружили, что композиции, содержащие эмпаглифлозин в комбинации с производным GLP-1 и SNAC, обеспечивают улучшенную способность указанного производного GLP-1 к проникновению через клеточную мембрану. В некоторых вариантах осуществления настоящее изобретение относится к твердой композиции для перорального введения, содержащей производное GLP-1 и соль NAC в комбинации с ингибитором SGLT2. В некоторых вариантах осуществления настоящее изобретение относится к твердой композиции для перорального введения, содержащей производное GLP-1, соль NAC (например, SNAC) и эмпаглифлозин.
В некоторых вариантах осуществления настоящее изобретение относится к твердой композиции, содержащей производное GLP-1 и дапаглифлозин. В некоторых вариантах осуществления указанная композиция предназначена для перорального введения. В некоторых вариантах осуществления указанное производное GLP-1 выбрано из группы, состоящей из семаглутида, соединения A, соединения B, соединения C, соединения D и соединения E. В некоторых вариантах осуществления указанная композиция дополнительно содержит усилитель всасывания. В некоторых вариантах указанный усилитель всасывания представляет собой соль NAC, такую как SNAC. В некоторых вариантах осуществления настоящее изобретение относится к твердой композиции, содержащей дапаглифлозин и SNAC, где указанная композиция необязательно дополнительно содержит пептид GLP-1 или его производное. В некоторых вариантах осуществления настоящее изобретение относится к твердой композиции для перорального введения, содержащей производное GLP-1 и второй активный ингредиент, где указанный второй активный ингредиент ингибирует обратный захват глюкозы посредством рецептора SGLT2 и увеличивает способность указанного производного GLP-1 к проникновению через клеточный монослой.
Твердая композиция для перорального введения, содержащая производное GLP-1 и дапаглифлозин, дополнительно обеспечивает удобство для пациента.
В некоторых вариантах осуществления композицию вводят один раз в день. В некоторых вариантах осуществления композицию вводят в дозе в диапазоне 100-1500 мг, как, например, 200-1000 мг. В некоторых вариантах осуществления вес таблетки находится в диапазоне от 150 мг до 1000 мг, как, например, в диапазоне 300-600 мг или, например, 300-500 мг.
В некоторых вариантах осуществления композиция содержит пептид GLP-1 или производное GLP-1 в количестве 0,1-100 мг, как, например, 0,2-60 мг. В некоторых вариантах осуществления композиция содержит пептид GLP-1 или производное GLP-1 в количестве 1-30 мг, как, например, 2-20 мг. В некоторых вариантах осуществления композиция содержит 0,5-300 мг, как, например, 5-100 мг, ингибитора SGLT2. В некоторых вариантах осуществления композиция содержит 3-50 мг, как, например, 5-30 мг, ингибитора SGLT2. В некоторых вариантах осуществления композиция содержит 5-300 мг ингибитора SGLT2, 0,1-100 мг производного GLP-1 и 20-800 мг соли NAC, такой как SNAC. В некоторых вариантах осуществления композиция содержит 0,5-50 мг дапаглифлозина, как, например, 2-15 мг дапаглифлозина. В некоторых вариантах осуществления композиция содержит 5 или 10 мг дапаглифлозина. В некоторых вариантах осуществления композиция содержит 0,5-50 мг дапаглифлозина и 0,1-100 мг производного GLP-1. В некоторых вариантах осуществления композиция содержит от 0,5 до 50 мг эмпаглифлозина. В некоторых вариантах осуществления композиция содержит 5-30 мг эмпаглифлозина, как, например, 10 или 25 мг эмпаглифлозина. В некоторых вариантах осуществления композиция содержит 20-800 мг соли NAC, такой как SNAC. В некоторых вариантах осуществления композиция содержит 20-1000 мг, как, например, 50-800 мг или 100-600 мг, соли NAC. В некоторых вариантах осуществления композиция содержит 100-500 мг, как, например, 200-400 мг или 300 мг, соли NAC. В некоторых вариантах осуществления композиция содержит 0,5-300 мг ингибитора SGLT2, 0,1-100 мг производного GLP-1 и 20-800 мг соли NAC, такой как SNAC. В некоторых вариантах осуществления соотношение между ингибитором SGLT2 и производным GLP-1 составляет от 0,1 до 100 по весу.
В некоторых вариантах осуществления доза указанного пептида GLP-1 или указанного производного GLP-1 составляет от 0,1 до 100 мг в день, как, например, от 0,1 до 60 мг в день. В некоторых вариантах осуществления доза дапаглифлозина составляет от 0,5 до 50 мг в день. В некоторых вариантах осуществления доза указанного дапаглифлозина составляет 0,5-50 мг в день, и доза указанного производного GLP-1 составляет 0,1-100 мг в день. В некоторых вариантах осуществления доза указанной соли NAC, такой как SNAC, составляет от 20 до 800 мг в день. В некоторых вариантах осуществления доза эмпаглифлозина составляет от 0,5 до 50 мг в день.
Пептиды GLP-1
В некоторых вариантах осуществления композиция по настоящему изобретению содержит пептид GLP-1. Термин «пептид GLP-1» относится к пептиду, который является вариантом GLP-1 человека с активностью GLP-1. Используемый в данном документе термин «GLP-1 человека» означает гормон GLP-1 человека, структура и свойства которого хорошо известны. GLP-1 человека также обозначается как GLP-1(7-37), он имеет 31 аминокислоту и является результатом избирательного расщепления молекулы проглюкагона. Аминокислотная последовательность GLP-1 человека представляет собой HAEGTFTSDVSSYLEGQAAKEFIAWLVKGRG (SEQ ID NO: 1).
В некоторых вариантах осуществления пептид GLP-1 содержит не более 10 замен, делеций и/или добавлений аминокислот по сравнению с GLP-1 человека или эксендином-4. В частности, пептид GLP-1 содержит не более 8, как, например, не более 6, не более 5 или не более 4, замен, делеций и/или добавлений аминокислот по сравнению с GLP-1 человека. Пептид GLP-1 может содержать не более 8 замен, делеций и/или добавлений аминокислот по сравнению с GLP-1 человека.
Пептиды GLP-1 по настоящему изобретению являются агонистами рецепторов GLP-1 (это также может называться «активностью GLP-1»). Агонист рецептора можно определить как соединение, которое связывается с рецептором и вызывает ответ, типичный для природного лиганда. Полный агонист можно определить как агонист, который вызывает ответ той же величины, что и природный лиганд (см., например, «Principles of Biochemistry», AL Lehninger, DL Nelson, MM Cox, Second Edition, Worth Publishers, 1993, page 763). Таким образом, например, «агонист рецептора GLP-1» (также называемый в данном документе «агонистом GLP-1») можно определить как соединение, которое способно связываться с рецептором GLP-1 и способно активировать его. А «полный» агонист рецептора GLP-1 можно определить как агонист рецептора GLP-1, который способен вызывать ответ рецептора GLP-1, аналогичный по величине ответу GLP-1 человека. В некоторых вариантах осуществления агонист GLP-1 представляет собой полный агонист рецептора GLP-1. Например, пептиды GLP-1 по настоящему изобретению можно тестировать в отношении активности GLP-1 с использованием стандартного анализа активности GLP-1.
В перечне последовательностей первому аминокислотному остатку в SEQ ID NO: 1 (гистидин) назначен №1. Однако в дальнейшем, в соответствии с установившейся практикой в данной области техники, этот гистидиновый остаток обозначается как №7, и последующие аминокислотные остатки пронумерованы соответствующим образом и оканчиваются глицином под №37. Поэтому, как правило, любая ссылка в данном документе на номер аминокислотного остатка или номер положения в последовательности GLP-1(7-37) относится к последовательности, начинающейся с His в положении 7 и заканчивающейся Gly в положении 37.
Пептиды GLP-1 по настоящему изобретению могут быть описаны со ссылкой на i) номер аминокислотного остатка в GLP-1(7-37) человека, который соответствует измененному аминокислотному остатку (т.е. соответствующее положение в GLP-1 человека), и на ii) фактическое изменение.
Другими словами, пептид GLP-1 представляет собой GLP-1(7-37) человека, в котором ряд аминокислотных остатков был изменен по сравнению с GLP-1(7-37) человека (SEQ ID NO: 1). Эти изменения могут независимо представлять собой одну или более аминокислотных замен, добавлений и/или делеций.
Ниже приведены неограничивающие примеры подходящей номенклатуры.
Пептиды GLP-1, «содержащие» определенные указанные изменения, могут содержать дополнительные изменения по сравнению с SEQ ID NO: 1. В некоторых вариантах осуществления пептид GLP-1 «имеет» указанные изменения.
Как видно из приведенных выше примеров, аминокислотные остатки можно идентифицировать по их полному названию, их однобуквенному коду и/или их трехбуквенному коду. Эти три способа полностью эквивалентны.
Выражения «положение, соответствующее» или «соответствующее положение» могут использоваться для описания характеристик сайта изменения в последовательности варианта GLP-1(7-37) со ссылкой на GLP-1(7-37) человека (SEQ ID NO: 1). Эквивалентные или соответствующие положения, а также количество изменений легко устанавливаются, например, при простой записи и визуальном осмотре; и/или можно использовать стандартную программу для выравнивания белков или пептидов, такую как «Align», которая основана на алгоритме Нидлмана-Вунша. Этот алгоритм описан в Needleman, S.B. and Wunsch, C.D., (1970), Journal of Molecular Biology, 48: 443-453, а программа Align - в Myers and W. Miller, «Optimal Alignments in Linear Space», CABIOS (Computer Applications in the Biosciences) (1988), 4:11-17. Для выравнивания можно использовать весовую матрицу BLOSUM62 с параметрами по умолчанию и матрицу идентичности с параметрами по умолчанию, и можно установить штраф за первый остаток в гэпе равным -12 или предпочтительно -10, а штрафы за дополнительные остатки в гэпе равными -2 или предпочтительно -0,5.
В случае, если в последовательность включены неприродные аминокислоты, такие как Imp и/или Aib, их можно для целей выравнивания заменить, например, на X. При желании X можно позднее скорректировать вручную.
Термин «пептид», используемый, например, применительно к пептидам GLP-1 по настоящему изобретению, относится к соединению, которое содержит ряд аминокислот, соединенных между собой амидными (или пептидными) связями. Пептиды по настоящему изобретению содержат по меньшей мере пять аминокислот-компонентов, соединенных пептидными связями. В конкретных вариантах осуществления пептид содержит по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25 или наиболее предпочтительно по меньшей мере 28 аминокислот. В конкретных вариантах осуществления пептид образован по меньшей мере пятью аминокислотами-компонентами, предпочтительно образован по меньшей мере 10, по меньшей мере 15, по меньшей мере 20, по меньшей мере 25 или наиболее предпочтительно образован по меньшей мере 28 аминокислотами. В дополнительных конкретных вариантах осуществления пептид a) образован 29-33 аминокислотами или b) состоит из них. В некоторых вариантах осуществления пептид состоит из 29, 30 или 31 аминокислоты. В некоторых вариантах осуществления пептид состоит из 32, 33 или 34 аминокислот. В еще одном конкретном варианте осуществления пептид состоит из аминокислот, соединенных между собой пептидными связями.
Аминокислоты представляют собой молекулы, содержащие аминогруппу и группу карбоновой кислоты и необязательно одну или более дополнительных групп, часто называемых боковой цепью.
Термин «аминокислота» включает протеиногенные (или природные) аминокислоты (среди них 20 стандартных аминокислот), а также непротеиногенные (или неприродные) аминокислоты. Протеиногенными являются те аминокислоты, которые в естественных условиях входят в состав белков. Стандартными являются те аминокислоты, которые кодируются генетическим кодом. Непротеиногенные аминокислоты не обнаруживаются в белках либо не вырабатываются с помощью стандартного клеточного аппарата (например, они могут быть подвергнуты посттрансляционной модификации). Неограничивающими примерами непротеиногенных аминокислот являются Aib (α-аминоизомасляная кислота), дезаминогистидин (альтернативное название имидазопропионовая кислота, сокращенно Imp), а также D-изомеры протеиногенных аминокислот. В дальнейшем следует понимать, что все аминокислоты пептида GLP-1, для которых оптический изомер не указан, означают L-изомер (если не указано иное).
В некоторых вариантах осуществления пептид GLP-1 содержит соединение формулы I:
Формула I: Xaa7-Xaa8-Glu-Gly-Thr-Xaa12-Thr-Ser-Asp-Xaa16-Ser-Xaa18-Xaa19-Xaa20-Glu-Xaa22-Xaa23-Xaa24-Xaa25-Xaa26-Lys-Phe-Ile-Xaa30-Xaa31-Leu-Val-Xaa34-Xaa35-Xaa36-Xaa37-Xaa38-Xaa39 (SEQ ID NO: 2), где
Xaa7 представляет собой L-гистидин, имидазопропионил, α-гидроксигистидин, D-гистидин, дезаминогистидин, 2-аминогистидин, β-гидроксигистидин, гомогистидин, Nα-ацетилгистидин, Nα-формилгистидин, α-фторметилгистидин, α-метилгистидин, 3-пиридилаланин, 2-пиридилаланин или 4-пиридилаланин;
Xaa8 представляет собой Ala, Gly, Val, Leu, Ile, Thr, Ser, Lys, Aib, (1-аминоциклопропил)карбоновую кислоту, (1-аминоциклобутил)карбоновую кислоту, (1-аминоциклопентил)карбоновую кислоту, (1-аминоциклогексил)карбоновую кислоту, (1-аминоциклогептил)карбоновую кислоту или (1-аминоциклооктил)карбоновую кислоту;
Xaa12 представляет собой Lys или Phe;
Xaa16 представляет собой Val или Leu;
Xaa18 представляет собой Ser, Arg, Asn, Gln или Glu;
Xaa19 представляет собой Tyr или Gln;
Xaa20 представляет собой Leu, Lys или Met;
Xaa22 представляет собой Gly, Glu, Lys или Aib;
Xaa23 представляет собой Gln, Glu или Arg;
Xaa24 представляет собой Ala или Lys;
Xaa25 представляет собой Ala или Val;
Xaa26 представляет собой Val, His, Lys или Arg;
Xaa30 представляет собой Ala, Glu или Arg;
Xaa31 представляет собой Trp или His;
Xaa34 представляет собой Glu, Asn, Gly, Gln или Arg;
Xaa35 представляет собой Gly, Aib или отсутствует;
Xaa36 представляет собой Arg, Gly, Lys или отсутствует;
Xaa37 представляет собой Gly, Ala, Glu, Pro, Lys, Arg или отсутствует;
Xaa38 представляет собой Ser, Gly, Ala, Glu, Gln, Pro, Arg или отсутствует; и
Xaa39 представляет собой Gly или отсутствует.
В некоторых вариантах осуществления пептид GLP-1 содержит соединение формулы I или состоит из него. Если Xaa38 в формуле I отсутствует, то Xaa39 в формуле I также может отсутствовать. Если Xaa37 в формуле I отсутствует, то Xaa38 и Xaa39 в формуле I также могут отсутствовать. Если Xaa36 в формуле I отсутствует, то Xaa37, Xaa38 и Xaa39 в формуле I также могут отсутствовать. Если Xaa35 в формуле I отсутствует, то Xaa36, Xaa37, Xaa38 и Xaa39 в формуле I также могут отсутствовать.
В некоторых вариантах осуществления пептид GLP-1 содержит соединение формулы I, где Xaa7 представляет собой His; Xaa8 представляет собой Ala или Aib; Xaa12 представляет собой Lys или Phe; Xaa16 представляет собой Val; Xaa18 представляет собой Ser; Xaa19 представляет собой Tyr; Xaa20 представляет собой Leu или Lys; Xaa22 представляет собой Glu, Gly или Lys; Xaa23 представляет собой Glu или Gln; Xaa24 представляет собой Ala или Lys; Xaa25 представляет собой Ala или Val; Xaa26 представляет собой Lys или Arg; Xaa30 представляет собой Ala или Glu; Xaa31 представляет собой Trp или His; Xaa34 представляет собой Gly, Gln или Arg; Xaa35 представляет собой Gly или отсутствует; Xaa36 представляет собой Arg, Lys или отсутствует; Xaa37 представляет собой Gly, Lys или отсутствует; Xaa38 представляет собой Glu, Gln или отсутствует; и Xaa39 представляет собой Gly или отсутствует.
В некоторых вариантах осуществления пептид GLP-1 содержит соединение формулы I, где Xaa7 представляет собой His; Xaa8 представляет собой Aib; Xaa12 представляет собой Phe; Xaa16 представляет собой Val; Xaa18 представляет собой Ser; Xaa19 представляет собой Tyr; Xaa20 представляет собой Leu; Xaa22 представляет собой Glu или Gly; Xaa23 представляет собой Gln; Xaa24 представляет собой Ala; Xaa25 представляет собой Ala; Xaa26 представляет собой Lys или Arg; Xaa30 представляет собой Ala или Glu; Xaa31 представляет собой Trp; Xaa34 представляет собой Arg; Xaa35 представляет собой Gly; Xaa36 представляет собой Arg или Lys; Xaa37 представляет собой Gly или Lys; Xaa38 представляет собой Glu или отсутствует; и Xaa39 представляет собой Gly или отсутствует.
Производные GLP-1
В некоторых вариантах осуществления пептид GLP-1 представляет собой производное пептида GLP-1 (также называемое в данном документе «производным GLP-1»). Используемый в данном документе термин «производное» применительно к пептиду GLP-1 означает химически модифицированный пептид GLP-1, в котором один или более заместителей были ковалентно присоединены к пептиду-компоненту. Заместитель также может называться боковой цепью. Таким образом, используемый в данном документе термин «производное» применительно к пептиду GLP-1 означает химически модифицированный пептид GLP-1, в котором один или более заместителей были ковалентно присоединены к пептиду. Производное GLP-1 может содержать пептид GLP-1, к которому путем ацилирования ковалентно присоединен заместитель, где указанный заместитель содержит липофильный фрагмент и необязательно дистальную кислотную (например, группу карбоновой кислоты) или ароматическую группу (например, 4-карбоксифенокси).
В некоторых вариантах осуществления указанный пептид GLP-1 или указанное производное GLP-1 имеет размер не более 12 кДа, как, например, не более 10 кДа, не более 7 кДа или не более 4 кДа. В некоторых вариантах осуществления указанный пептид GLP-1 или указанное производное GLP-1 имеет размер (т.е. молекулярную массу) 2-12 кДа, как, например, 3-6 кДа.
В некоторых вариантах осуществления боковая цепь способна образовывать нековалентные агрегаты с альбумином, что таким образом способствует циркуляции производного по кровотоку, а также оказывает эффект продления времени действия производного ввиду того, что агрегат производного GLP-1 и альбумина очень медленно распадается с высвобождением лекарственного вещества. Таким образом, данный заместитель или боковую цепь в целом предпочтительно называют альбуминсвязывающим фрагментом.
В конкретных вариантах осуществления боковая цепь имеет по меньшей мере 10 атомов углерода или по меньшей мере 15, 20, 25, 30, 35 или по меньшей мере 40 атомов углерода. В дополнительных конкретных вариантах осуществления боковая цепь может дополнительно включать в себя по меньшей мере 5 гетероатомов, в частности, O и N, например, по меньшей мере 7, 9, 10, 12, 15, 17 или по меньшей мере 20 гетероатомов, как, например, по меньшей мере 1, 2 или 3 атома N и/или по меньшей мере 3, 6, 9, 12 или 15 атомов O.
В другом конкретном варианте осуществления альбуминсвязывающий фрагмент содержит участок, который особенно важен для связывания альбумина и, следовательно, продления действия, и данный участок может соответственно называться фрагментом, продлевающим действие. Фрагмент, продлевающий действие, может находиться вблизи терминального (или дистального, или свободного) конца альбуминсвязывающего фрагмента относительно его точки присоединения к пептиду, предпочтительно на самом этом конце.
В еще одном конкретном варианте осуществления альбуминсвязывающий фрагмент содержит участок между фрагментом, продлевающим действие, и точкой присоединения к пептиду, и данный участок может называться линкером, линкерным фрагментом, спейсером и т.п. Линкер может быть необязательным, и, следовательно, в этом случае альбуминсвязывающий фрагмент может быть идентичным фрагменту, продлевающему действие.
В конкретных вариантах осуществления альбуминсвязывающий фрагмент и/или фрагмент, продлевающий действие, является липофильным и/или отрицательно заряженным при физиологическом значении pH (7,4).
Альбуминсвязывающий фрагмент, фрагмент, продлевающий действие, или линкер могут быть ковалентно присоединены к лизиновому остатку пептида-компонента (например, пептида GLP-1) путем ацилирования, т.е. посредством амидной связи, образованной между группой карбоновой кислоты (альбуминсвязывающего фрагмента, фрагмента, продлевающего действие или линкера) и аминогруппой лизинового остатка. Дополнительные или альтернативные химические реакции конъюгирования включают алкилирование, образование сложного эфира или образование амида или связывание с цистеиновым остатком, как, например, путем реакции связывания малеимида или галогенацетамида (такого как бром-/фтор-/йодацетамид).
В некоторых вариантах осуществления активный сложный эфир альбуминсвязывающего фрагмента, предпочтительно содержащий фрагмент, продлевающий действие, и линкер, ковалентно связан с аминогруппой лизинового остатка, предпочтительно с его эпсилон-аминогруппой, с образованием амидной связи, как поясняется выше.
Если не указано иное, когда делается ссылка на ацилирование лизинового остатка, подразумевается его эпсилон-аминогруппа.
Термин «жирная кислота» относится к алифатическим монокарбоновым кислотам, имеющим от 4 до 28 атомов углерода, которые предпочтительно имеют неразветвленную цепь и которые могут быть насыщенными или ненасыщенными.
Термин «жирная двухосновная кислота» относится к жирным кислотам, определенным выше, с дополнительной группой карбоновой кислоты в омега-положении. Таким образом, жирные двухосновные кислоты являются дикарбоновыми кислотами. Жирная двухосновная кислота может содержать 14-22 атома углерода.
Каждый из двух линкеров производного по настоящему изобретению может содержать следующий первый линкерный элемент:
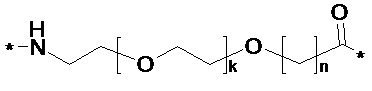 (химическое соединение A1a),
(химическое соединение A1a),
где k представляет собой целое число в диапазоне 1-5, и n представляет собой целое число в диапазоне 1-5.
В некоторых вариантах осуществления, если k = 1 и n = 1, этот линкерный элемент может быть обозначен как OEG или бирадикал 8-амино-3,6-диоксаоктановой кислоты, и/или он может быть представлен следующей формулой:
*-NH-(CH2)2-O-(CH2)2-O-CH2-CO-* (химическое соединение A2).
В некоторых вариантах осуществления каждый линкер производного по настоящему изобретению может дополнительно независимо содержать второй линкерный элемент, предпочтительно бирадикал Glu, такой как химическое соединение B1:
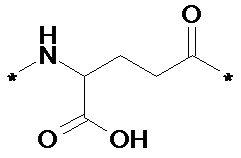 (химическое соединение B1),
(химическое соединение B1),
где бирадикал Glu может быть включен p раз, где p представляет собой целое число в диапазоне 1-3. Химическое соединение В1 также может называться гамма-Glu или кратко gGlu ввиду того, что именно гамма-карбоксигруппа аминокислоты глутаминовой кислоты используется в данном случае для соединения с другим линкерным элементом или с эпсилон-аминогруппой лизина. Как поясняется выше, другим линкерным элементом может быть, например, другой остаток Glu или молекула OEG. Аминогруппа Glu, в свою очередь, образует амидную связь с карбоксигруппой фрагмента, продлевающего действие, или с карбоксигруппой, например, молекулы OEG, если она имеется, или с гамма-карбоксигруппой, например, другого Glu, если он имеется.
Как поясняется выше, производные GLP-1 могут быть подвергнуты двойному ацилированию, т.е. к пептиду-компоненту (например, пептиду GLP-1) ковалентно присоединяются два альбуминсвязывающих фрагмента.
В некоторых вариантах осуществления два альбуминсвязывающих фрагмента (т.е. полные боковые цепи) являются сходными, предпочтительно практически идентичными или наиболее предпочтительно идентичными.
В некоторых вариантах осуществления два фрагмента, продлевающих действие, являются сходными, предпочтительно практически идентичными или наиболее предпочтительно идентичными.
В некоторых вариантах осуществления два линкера являются сходными, предпочтительно практически идентичными или наиболее предпочтительно идентичными.
Термин «практически идентичный» включает отличия от идентичности, которые обусловлены образованием одной или более солей, сложных эфиров и/или амидов; предпочтительно образованием одной или более солей, метиловых сложных эфиров и простых амидов; более предпочтительно образованием не более чем двух солей, метиловых сложных эфиров и/или простых амидов; еще более предпочтительно образованием не более чем одной соли, метилового сложного эфира и/или простого амида или наиболее предпочтительно образованием не более чем одной соли.
Применительно к химическим соединениям, таким как альбуминсвязывающие фрагменты, фрагменты, продлевающие действие, и линкеры, сходство и/или идентичность можно определить с использованием любой подходящей компьютерной программы и/или алгоритма, известных из уровня техники.
Например, сходство двух фрагментов, продлевающих действие, двух линкеров и/или двух полных боковых цепей можно подходящим образом определить с помощью молекулярных «отпечатков». «Отпечатки» являются математическим способом представления химической структуры (см., например, Chemoinformatics: A textbook, Johann Gasteiger and Thomas Engel (Eds), Wiley-VCH Verlag, 2003).
Примеры подходящих «отпечатков» включают без ограничения «отпечатки» UNITY, «отпечатки» MDL и/или «отпечатки» ECFP, такие как «отпечатки» ECFP_6 (ECFP обозначает «отпечатки» с расширенной связностью).
В конкретных вариантах осуществления два фрагмента, продлевающих действие, два линкера и/или две полные боковые цепи представлены в виде a) «отпечатков» ECFP_6; b) «отпечатков» UNITY и/или c) «отпечатков» MDL. Для расчета сходства двух «отпечатков», независимо от того, используются ли a), b) или c), предпочтительно используют коэффициент Танимото. В конкретных вариантах осуществления, независимо от того, используются ли a), b) или c), два фрагмента, продлевающих действие, два линкера и/или две полные боковые цепи соответственно имеют сходство, составляющее по меньшей мере 0,5 (50%); предпочтительно по меньшей мере 0,6 (60%); более предпочтительно по меньшей мере 0,7 (70%) или по меньшей мере 0,8 (80%); еще более предпочтительно по меньшей мере 0,9 (90%) или наиболее предпочтительно по меньшей мере 0,99 (99%), как, например, сходство, составляющее 1,0 (100%).
Расчеты для «отпечатков» UNITY можно производить с помощью программы SYBYL (доступной от Tripos, 1699 South Hanley Road, Сент-Луис, Миссури 63144-2319, США). Расчеты для «отпечатков» ECFP_6 и MDL можно производить с помощью программы Pipeline Pilot (доступной от Accelrys Inc., 10188 Telesis Court, Suite 100, Сан-Диего, Калифорния 92121, США).
Для более подробной информации см., например, J. Chem. Inf. Model. 2008, 48, 542-549; J. Chem. Inf. Comput. Sci. 2004, 44, 170-178; J. Med. Chem. 2004, 47, 2743-2749; J. Chem. Inf. Model. 2010, 50, 742-754; а также SciTegic Pipeline Pilot Chemistry Collection: Basic Chemistry User Guide, March 2008, SciTegic Pipeline Pilot Data Modeling Collection, 2008 - оба от Accelrys Software Inc., Сан-Диего, США, и руководства http://www.tripos.com/tripos_resources/fileroot/pdfs/Unity_111408.pdf и http://www.tripos.com/data/SYBYL/SYBYL_072505.pdf.
Ниже приведен пример расчета сходства, в котором известную полную боковую цепь известного производного GLP-1 сравнивали с ее метиловым сложным эфиром:
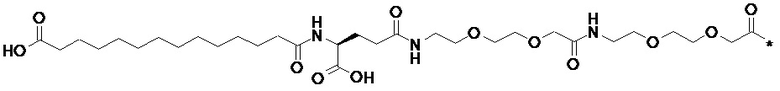
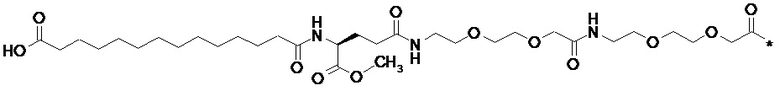
При использовании a) «отпечатков» ECFP_6 сходство составляет 0,798, при использовании b) «отпечатков» UNITY сходство составляет 0,957, и при использовании «отпечатков» MDL сходство составляет 0,905.
В случае двух идентичных боковых цепей (альбуминсвязывающих фрагментов) производное может быть обозначено как симметричное.
В конкретных вариантах осуществления коэффициент сходства составляет по меньшей мере 0,80, предпочтительно по меньшей мере 0,85, более предпочтительно по меньшей мере 0,90, еще более предпочтительно по меньшей мере 0,95 или наиболее предпочтительно по меньшей мере 0,99.
В некоторых вариантах осуществления производное GLP-1 содержит пептид GLP-1, где пептид GLP-1 содержит первый остаток K и второй остаток K, выбранные из группы, состоящей из i) первого остатка K в положении, соответствующем положению 26 в GLP-1(7-37) (SEQ ID NO: 1), и второго остатка K в положении, соответствующем положению 37 в GLP-1(7-37); и ii) первого остатка K в положении, соответствующем положению 27 в GLP-1(7-37) (SEQ ID NO: 1), и второго остатка K в положении, соответствующем положению T в GLP-1(7-37), где Т представляет собой целое число в диапазоне 7-37; где первый остаток K обозначен как KF, а второй остаток K обозначен как KT;
где пептид GLP-1 содержит не более десяти изменений аминокислот по сравнению с GLP-1(7-37);
где производное GLP-1 содержит первый и второй фрагменты, продлевающие действие, присоединенные к KF и KT соответственно посредством первого и второго линкера соответственно, где
первый и второй фрагменты, продлевающие действие, выбраны из химического соединения C1 и химического соединения C2:
Химическое соединение C1: HOOC-(CH2)x-CO-*
Химическое соединение C2: HOOC-C6H4-O-(CH2)y-CO-*,
в которых x представляет собой целое число в диапазоне 6-16, y представляет собой целое число в диапазоне 3-17; и первый и второй линкеры содержат химическое соединение D5:
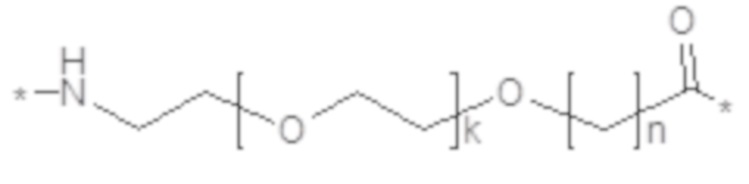
Химическое соединение D5
где k представляет собой целое число в диапазоне 1-5, и n представляет собой целое число в диапазоне 1-5; или его фармацевтически приемлемую соль, амид или сложный эфир. В некоторых вариантах осуществления производное GLP-1 содержит пептид GLP-1, где пептид GLP-1 содержит первый остаток K и второй остаток K, выбранные из группы, состоящей из i) первого остатка K в положении, соответствующем положению 26 в GLP-1(7-37) (SEQ ID NO: 1), и второго остатка K в положении, соответствующем положению 37 в GLP-1(7-37); и ii) первого остатка K в положении, соответствующем положению 27 в GLP-1(7-37) (SEQ ID NO: 1), и второго остатка K в положении, соответствующем положению Т в GLP-1(7-37), где Т представляет собой целое число в диапазоне 7-37; где первый остаток K обозначен как KF, и второй остаток K обозначен как KT; где пептид GLP-1 содержит не более десяти изменений аминокислот по сравнению с GLP-1(7-37); где производное GLP-1 содержит первый и второй фрагменты, продлевающие действие, присоединенные к KF и KT соответственно посредством первого и второго линкера соответственно, где первый и второй фрагменты, продлевающие действие, выбраны из химического соединения 1 и химического соединения 2:
Химическое соединение C1: HOOC-(CH2)x-CO-*
Химическое соединение C2: HOOC-C6H4-O-(CH2)y-CO-*,
в которых x представляет собой целое число в диапазоне 6-16, y представляет собой целое число в диапазоне 3-17; и первый и второй линкеры содержат химическое соединение D5:

Химическое соединение D5
где k представляет собой целое число в диапазоне 1-5, и n представляет собой целое число в диапазоне 1-5; или его фармацевтически приемлемую соль, амид или сложный эфир.
В некоторых вариантах осуществления (KF,KT) находятся в положениях, соответствующих положениям (26,37) в GLP-1(7-37) (SEQ ID NO: 1). В некоторых вариантах осуществления (KF,KT) находятся в положениях, соответствующих положениям (27,36) в GLP-1(7-37) (SEQ ID NO: 1).
В некоторых вариантах осуществления производное GLP-1 содержит фрагмент, продлевающий действие, представляющий собой химическое соединение C2. В некоторых вариантах осуществления химическое соединение C2 представлено химическим соединением C2a:
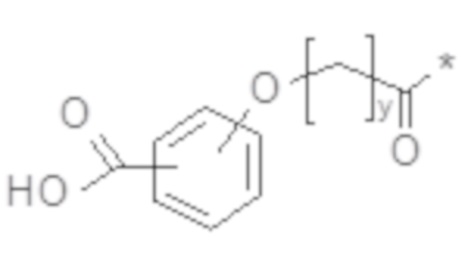
Химическое соединение C2a
В некоторых вариантах осуществления y в химическом соединении C2 или химическом соединении C2a представляет собой нечетное число. В некоторых вариантах осуществления y в химическом соединении 2 или химическом соединении 2a представляет собой целое число в диапазоне 9-11, такое как 9, 10 или 11. В некоторых вариантах осуществления химическое соединение C2 представлено химическим соединением C2b или химическим соединением C2c:
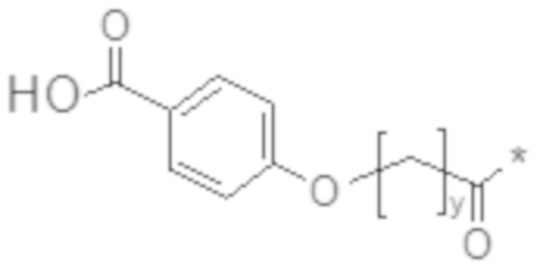
Химическое соединение C2b
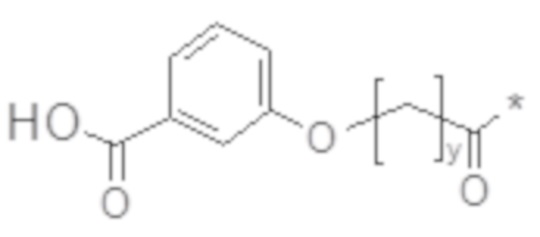
или химическое соединение C2c
В некоторых вариантах осуществления химическое соединение D5 представляет собой первый линкерный элемент. В некоторых вариантах осуществления химическое соединение 5 представляет собой первый линкерный элемент. В некоторых вариантах осуществления k в химическом соединении D5 равняется 1. В некоторых вариантах осуществления n в химическом соединении D5 равняется 1. В некоторых вариантах осуществления химическое соединение D5 включено m раз, где m представляет собой целое число в диапазоне 1-10. В некоторых вариантах осуществления m равняется 2. Если m не равняется 1, то элементы, представляющие собой химическое соединение D5, могут быть соединены между собой посредством амидной(амидных) связи(связей).
В некоторых вариантах осуществления производное GLP-1 дополнительно содержит второй линкерный элемент. В некоторых вариантах осуществления второй линкерный элемент представляет собой бирадикал Glu. В некоторых вариантах осуществления второй линкерный элемент выбран из химического соединения E6 и/или химического соединения E7:
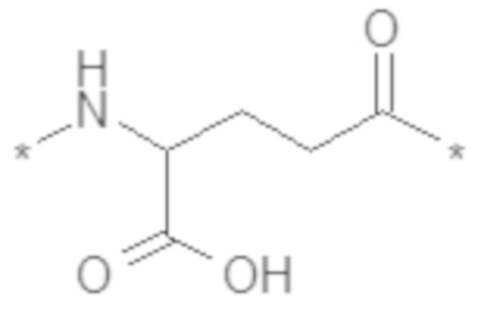
и/или химическое соединение E7
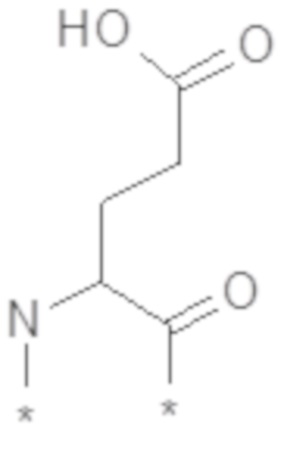
В некоторых вариантах осуществления второй линкерный элемент представляет собой химическое соединение E6. В некоторых вариантах осуществления бирадикал Glu включен p раз, где p представляет собой целое число в диапазоне 1-2, такое как 1 или 2. В некоторых вариантах осуществления второй линкерный элемент содержит бирадикал Glu, который представляет собой радикал L-Glu. В некоторых вариантах осуществления второй линкерный элемент содержит один или более бирадикалов Glu, и один или более элементов, представляющих собой химическое соединение D5, соединены между собой посредством амидной(амидных) связи(связей). В некоторых вариантах осуществления линкер состоит из m звеньев химического соединения D5 и p звеньев бирадикала Glu. В некоторых вариантах осуществления (m,p) равняется (2,2) или (2,1). В некоторых вариантах осуществления (m,p) равняется (2,1). В некоторых вариантах осуществления m элементов, представляющих собой химическое соединение D5, и p бирадикалов Glu соединены между собой посредством амидных связей.
В некоторых вариантах осуществления линкер и фрагмент, продлевающий действие, соединены между собой амидной связью. В некоторых вариантах осуществления линкер и пептид GLP-1 соединены между собой амидной связью. В некоторых вариантах осуществления линкер присоединен к эпсилон-аминогруппе первого или второго остатка K.
В некоторых вариантах осуществления производное GLP-1 представляет собой семаглутид. Семаглутид можно получать согласно раскрытому в WO2006/097537, например, в примере 4. Семаглутид может называться N-ε26-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(S)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил][Aib8,Arg34]-GLP-1(7-37)-пептидом. В качестве альтернативы, семаглутид может называться N6.26-{18-[N-(17-карбоксигептадеканоил)-L-γ-глутамил]-10-оксо-3,6,12,15-тетраокса-9,18-диазаоктадеканоил}-[8-(2-амино-2-пропановая кислота),34-L-аргинин]глюкагоноподобным пептидом 1(7-37) человека (WHO Drug Information Vol. 24, No. 1, 2010).
В некоторых вариантах осуществления производным GLP-1 является соединение A, которое представляет собой Nε26{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил},Nε37-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутириламино}этокси)этокси]ацетиламино}этокси)этокси]ацетил}-[Aib8,Arg34,Lys37]-GLP-1(7-37)-пептид и имеет следующую структуру:

(аминокислотная последовательность которого, т.е. [Aib8,Arg34,Lys37]GLP-1(7-37)-пептид, показана под SEQ ID NO: 3). Соединение A можно получать согласно раскрытому в WO 2011/080103, например, в примере 2.
В некоторых вариантах осуществления производным GLP-1 является соединение B, которое представляет собой Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил],Nε36-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Aib8,Glu22,Arg26,Lys27,Glu30,Arg34,Lys36]-GLP-1(7-37)-пептидил-Glu-Gly и имеет следующую структуру:
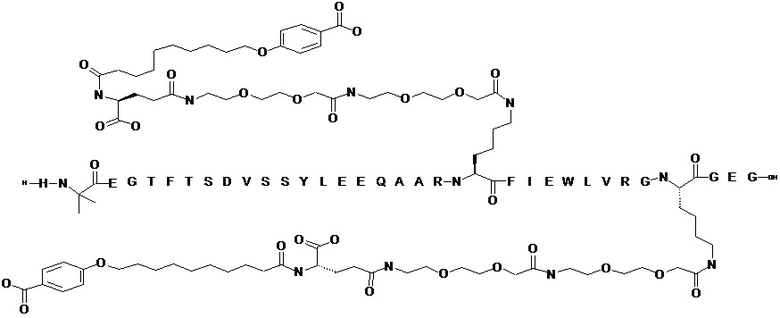
(аминокислотная последовательность которого показана под SEQ ID NO: 4). Соединение B можно получать согласно раскрытому в WO2012/140117, например, в примере 31. Соединение B также можно проиллюстрировать следующим образом:

(аминокислотная последовательность которого показана под SEQ ID NO: 4).
В некоторых вариантах осуществления агонист GLP-1 представляет собой производное GLP-1 (например, производное пептида GLP-1), ацилированное боковой цепью по эпсилон-аминогруппе лизина в каждом из положений 36 и 37;
где каждая боковая цепь в отдельности содержит фрагмент, продлевающий действие, следующей формулы:
Химическое соединение 1: HOOC-C6H4-O-(CH2)y-CO-*,
где у представляет собой целое число в диапазоне 8-11, который присоединен к эпсилон-аминогруппе лизина в положениях 36 и 37; и где фрагмент, продлевающий действие, присоединен к эпсилон-аминогруппе посредством линкера, содержащего:
i) gGlu следующей формулы:
Химическое соединение 3:*-NH-CH(COOH)-(CH2)2-CO-*
и
ii) фрагмент следующей формулы:
Химическое соединение 5: * NH-(CH2)2-[O-(CH2)2]k-O-[CH2]n-CO-*,
где k представляет собой целое число в диапазоне 1-5, и n представляет собой целое число в диапазоне 1-5;
или их фармацевтически приемлемую соль, амид или сложный эфир.
В некоторых вариантах осуществления в производном GLP-1 по настоящему изобретению линкер, фрагмент, продлевающий действие, и пептид соединены посредством амидных связей в положении *. В некоторых вариантах осуществления gGlu линкера соединен с фрагментом, продлевающим действие, посредством амидных связей в положении *. В некоторых вариантах осуществления gGlu линкера соединен с фрагментом, представляющим собой химическое соединение 5, посредством амидных связей в положении *. В некоторых вариантах осуществления фрагмент линкера, представляющий собой химическое соединение 5, соединен с пептидом посредством амидных связей в положении *. В некоторых вариантах осуществления фрагмент, имеющий формулу, определяемую химическим соединением 5, представляет собой «OEG», т.e. n = k = 1. В некоторых вариантах осуществления линкер представляет собой «*-gGlu-OEG-OEG-**», соединенный с фрагментом, продлевающим действие, в положении * и соединенный с пептидом в положении **. В некоторых вариантах осуществления фрагмент, продлевающий действие, имеет у = 10 и находится в пара-конфигурации. В некоторых вариантах осуществления фрагмент, продлевающий действие, имеет у = 9 и находится в пара-конфигурации. В некоторых вариантах осуществления фрагмент, продлевающий действие, имеет y = 9 или y = 10 и находится в мета-конфигурации.
В некоторых вариантах осуществления производное GLP-1 содержит соединение формулы II (SEQ ID NO: 7):
Формула II: Xaa7-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Xaa16-Ser-Xaa18-Xaa19-Xaa20-Glu-Xaa22-Xaa23-Ala-Xaa25-Xaa26-Xaa27-Phe-Ile-Xaa30-Xaa31-Leu-Xaa33-Xaa34-Xaa35-Lys36-Lys37 (SEQ ID NO: 5), где:
Xaa7 представляет собой L-гистидин, (S)-2-гидрокси-3-(1H-имидазол-4-ил)-пропионовую кислоту, D-гистидин, дезаминогистидин (desH), Nα-ацетилгистидин или Nα-формилгистидин;
Xaa8 представляет собой Ala, Ser, Aib, (1-аминоциклопропил)-карбоновую кислоту или (1-аминоциклобутил)-карбоновую кислоту;
Xaa16 представляет собой Val или Leu;
Xaa18 представляет собой Ser или Arg;
Xaa19 представляет собой Tyr или Gln;
Xaa20 представляет собой Leu или Met;
Xaa22 представляет собой Gly или Glu;
Xaa23 представляет собой Gln, Glu или Arg;
Xaa25 представляет собой Ala или Val;
Xaa26 представляет собой Arg или Lys;
Xaa27 представляет собой Glu или Leu;
Xaa30 представляет собой Ala или Glu;
Xaa31 представляет собой Trp или His;
Xaa33 представляет собой Val или Arg;
Xaa34 представляет собой Arg, Lys, His, Asn или Gln; и
Xaa35 представляет собой Gly или Aib.
В некоторых вариантах осуществления производное GLP-1 представляет собой производное GLP-1 формулы II (SEQ ID NO: 7), где Xaa7 представляет собой His; Xaa8 представляет собой Aib; Xaa16 представляет собой Val; Xaa18 представляет собой Ser; Xaa19 представляет собой Tyr; Xaa20 представляет собой Leu; Xaa22 представляет собой Gly или Glu; Xaa23 представляет собой Gln; Xaa25 представляет собой Ala; Xaa26 представляет собой Arg; Xaa27 представляет собой Glu; Xaa30 представляет собой Ala или Glu; Xaa31 представляет собой Trp; Xaa33 представляет собой Val; Xaa34 представляет собой Arg или Gln; и Xaa35 представляет собой Gly.
В некоторых вариантах осуществления производное GLP-1 представляет собой производное GLP-1 формулы II (SEQ ID NO: 7), где Xaa7 представляет собой His; Xaa8 представляет собой Aib; Xaa16 представляет собой Val; Xaa18 представляет собой Ser; Xaa19 представляет собой Tyr; Xaa20 представляет собой Leu; Xaa22 представляет собой Glu; Xaa23 представляет собой Gln; Xaa25 представляет собой Ala; Xaa26 представляет собой Arg; Xaa27 представляет собой Glu; Xaa30 представляет собой Ala; Xaa31 представляет собой Trp; Xaa33 представляет собой Val; Xaa34 представляет собой Arg; и Xaa35 представляет собой Gly.
В некоторых вариантах осуществления производным GLP-1 является соединение C, которое представляет собой N{эпсилон-36}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[11-(4-карбоксифенокси)ундеканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил],N{эпсилон-37}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[11-(4-карбоксифенокси)ундеканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Aib8,Glu22,Arg26,Arg34,Lys36,Lys37]-GLP-1-(7-37)-пептид и имеет следующую структуру:
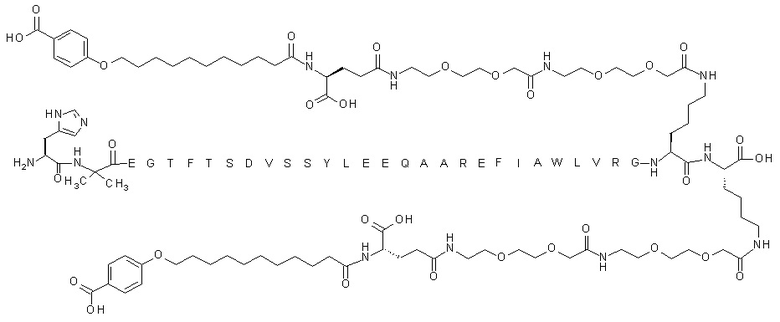
(аминокислотная последовательность которого показана под SEQ ID NO: 6). Соединение C можно получать согласно раскрытому в примере 1 в WO2015/155151.
В некоторых вариантах осуществления производным GLP-1 является соединение D, которое представляет собой N{эпсилон-36}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[11-(4-карбоксифенокси)ундеканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил],N{эпсилон-37}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[11-(4-карбоксифенокси)ундеканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Aib8,Arg26,Arg34,Lys36,Lys37]-GLP-1(7-37)-пептид и имеет следующую структуру:
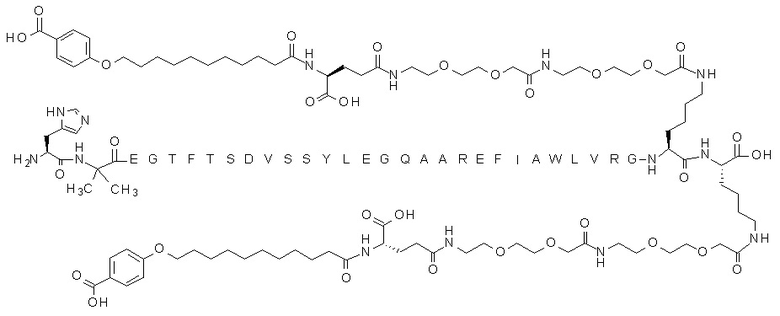
(аминокислотная последовательность которого показана под SEQ ID NO: 7). Соединение D можно получать согласно раскрытому в примере 2 в WO2015/155151. В некоторых вариантах осуществления соединение C и соединение D можно получать в соответствии с другими способами, известными специалисту в данной области.
В некоторых вариантах осуществления производным GLP-1 является соединение E, которое представляет собой N{эпсилон-36}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(3-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил],N{эпсилон-37}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(3-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Aib8,Glu22,Arg26,Arg34,Lys36,Lys37]-GLP-1(7-37)-пептид
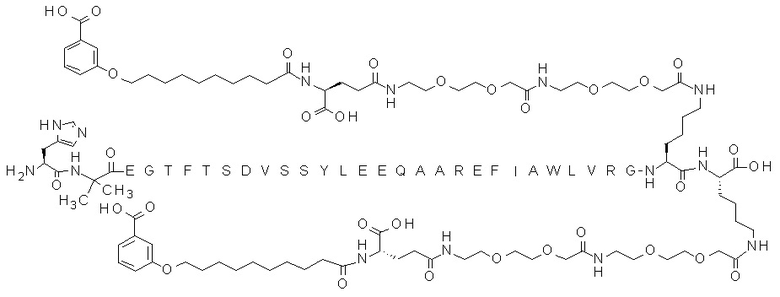
(аминокислотная последовательность которого показана под SEQ ID NO: 8). Соединение E можно получать согласно раскрытому, например, в WO2012/140117 или в примере 35 в WO2015/155151.
В некоторых вариантах осуществления производное GLP-1 выбрано из группы, состоящей из семаглутида, соединения A, соединения B, соединения C, соединения D и соединения E. В некоторых вариантах осуществления производное GLP-1 выбрано из группы, состоящей из семаглутида, соединения A, соединения B и соединения E.
Производные GLP-1 могут существовать в различных стереоизомерных формах, имеющих одинаковую молекулярную формулу и последовательность связанных атомов, но отличающихся только трехмерной ориентацией их атомов в пространстве. Стереоизомерия приведенных в качестве примера производных по настоящему изобретению указана в разделе экспериментов, в названиях, а также в структурах с использованием стандартной номенклатуры. Если не указано иное, настоящее изобретение относится ко всем стереоизомерным формам заявленного производного.
Концентрацию производных GLP-1 в плазме крови можно определить с помощью любого подходящего способа. Например, можно применять LC-MS (жидкостную хроматографию с масс-спектроскопией) или иммунологические анализы, такие как RIA (радиоиммунологический анализ), ELISA (твердофазный иммуноферментный анализ) и LOCI (люминесцентный иммунологический анализ с каналированием кислорода). Общие протоколы для подходящих анализов RIA и ELISA можно найти, например, в WO 2009/030738 на стр. 116-118.
В некоторых вариантах осуществления пептид GLP-1 или его производное представлены в форме их соли, сложного эфира или амида.
Неограничивающий список примеров пептидов GLP-1 или их производных для применения в настоящем изобретении можно найти в WO 2006/097537, WO 2011/080103, WO2012/140117 и/или PCT/EP2015/057442. Способы получения пептидов GLP-1 по настоящему изобретению можно найти, например, в WO2006/097537, WO2011/080103, WO2012/140117 или PCT/EP2015/057442. Способы получения таких пептидов GLP-1, а также анализы для определения характеристик таких пептидов GLP-1, как, например, физической и химической стабильности, а также активности и T1/2, представлены в WO2006/097537, WO2011/080103, WO2012/140117 и PCT/EP2015/057442. Соединение E можно получать согласно раскрытому, например, в WO2012/140117 или в примере 2 в PCT/EP2015/057442.
В некоторых вариантах осуществления пептид GLP-1 или его производное характеризуется периодом полужизни в плазме крови человека, составляющим по меньшей мере 60 часов. В некоторых вариантах осуществления пептид GLP-1 или его производное характеризуется периодом полужизни в плазме крови человека, составляющим по меньшей мере 60 часов, как, например, по меньшей мере 100 часов или по меньшей мере 160 часов. В некоторых вариантах осуществления пептид GLP-1 или его производное характеризуется периодом полужизни в плазме крови человека, составляющим по меньшей мере 1 день, по меньшей мере 36 часов или по меньшей мере 2 дня.
Ингибиторы SGLT2
В некоторых вариантах осуществления композиции по настоящему изобретению содержат ингибитор SGLT2. В некоторых вариантах осуществления ингибитор SGLT2 также является ингибитором SGLT1. Ингибиторы SGLT2 и SGLT1 представляют собой соединения, способные ингибировать натрийзависимый переносчик глюкозы. В некоторых вариантах осуществления ингибитор SGLT2 представляет собой глюкопиранозилзамещенное производное бензола. В некоторых вариантах осуществления ингибитор SGLT2 выбран из группы, состоящей из дапаглифлозина, эмпаглифлозина, канаглифлозина, эртуглифлозина, сотаглифлозина, ипраглифлозина, тофоглифлозина, лузеоглифлозина, бексаглифлозина и ремоглифлозина. В некоторых вариантах осуществления ингибитор SGLT2 представляет собой дапаглифлозин. В некоторых вариантах осуществления ингибитор SGLT2 представляет собой эмпаглифлозин. В некоторых вариантах осуществления ингибитор SGLT2 представляет собой канаглифлозин. В некоторых вариантах осуществления ингибитор SGLT2 представляет собой эртуглифлозин. В некоторых вариантах осуществления ингибитор SGLT2 представляет собой сотаглифлозин. В некоторых вариантах осуществления ингибитор SGLT2 представляет собой ипраглифлозин. В некоторых вариантах осуществления ингибитор SGLT2 представляет собой тофоглифлозин. В некоторых вариантах осуществления ингибитор SGLT2 представляет собой лузеоглифлозин. В некоторых вариантах осуществления ингибитор SGLT2 представляет собой бексаглифлозин. В некоторых вариантах осуществления ингибитор SGLT2 представляет собой ремоглифлозин. Ингибиторы SGLT2 можно получать в соответствии со способами, известными из уровня техники, например, показанными в WO 2006/120208, WO 2007/031548 или WO2008/002824.
Используемый в данном документе термин «ингибитор SGLT2» относится к соединению, которое оказывает ингибирующий эффект в отношении натрийзависимого переносчика глюкозы 2 типа (SGLT2), такого как SGLT2 человека. В некоторых вариантах осуществления ингибирующий эффект в отношении SGLT2 человека, измеренный по IC50, для ингибитора SGLT2 составляет ниже 1000 нМ, как, например, ниже 100 нМ или ниже 50 нМ. В некоторых вариантах осуществления значения IC50 для ингибитора SGLT2 составляют по меньшей мере 0,01 нМ, как, например, по меньшей мере 0,1 нМ. Способы определения ингибирующего эффекта в отношении SGLT2 человека известны из уровня техники, например, из стр. 23-24 WO2007/093610. В некоторых вариантах осуществления ингибитор SGLT2 представлен в форме его фармацевтически приемлемой соли, гидрата и/или сольвата. В некоторых вариантах осуществления ингибитор SGLT2 находится в аморфной форме. В некоторых вариантах осуществления ингибитор SGLT2 находится в кристаллической форме, например, в форме его фармацевтически приемлемой соли, гидрата и/или сольвата.
Дапаглифлозин
В некоторых вариантах осуществления композиции по настоящему изобретению содержат ингибитор SGLT2 дапаглифлозин. В некоторых вариантах осуществления дапаглифлозин имеет структуру, показанную формулой (II):
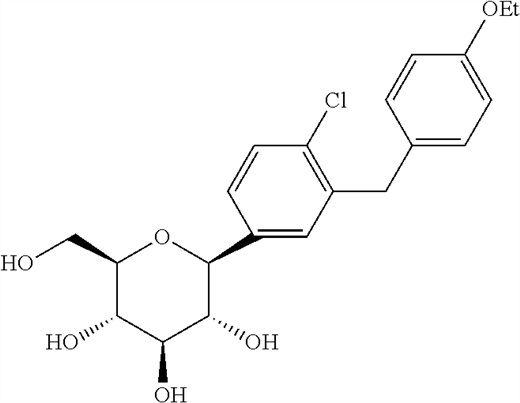
(II), или ее стереоизомерную форму. В некоторых вариантах осуществления дапаглифлозин представлен в форме его фармацевтически приемлемой соли, сложного эфира или сольвата. Сложный эфир может представлять собой сложный эфир дапаглифлозина в виде пролекарства, такой как сложный эфир, расщепляемый in vivo. Фармацевтически приемлемый сложный эфир может расщепляться в организме человека или животного с получением исходной кислотной группы (например, если указанный сложный эфир является метоксиметиловым) или гидроксигруппы (например, если указанный сложный эфир является ацетиловым сложным эфиром). Сольват может содержать пропиленгликолевый сольват дапаглифлозина, такой как дапаглифлозин-пропиленгликоль (1:1), или состоять из него. В некоторых вариантах осуществления дапаглифлозин представлен в форме его пропиленгликолевого сольвата/гидрата (1:1:1). В некоторых вариантах осуществления пропиленгликоль находится в (S)-форме, (R)-форме или их смеси. В некоторых вариантах осуществления пропиленгликоль находится в (S)-форме. В некоторых вариантах осуществления дапаглифлозин вводят в дозе от 0,5 до 200 мг/день, как, например, 3-20 мг/день, 5 мг/день или 10 мг/день.
Эмпаглифлозин
В некоторых вариантах осуществления композиции по настоящему изобретению содержат ингибитор SGLT2 эмпаглифлозин. В некоторых вариантах осуществления эмпаглифлозин имеет структуру, показанную формулой (III):
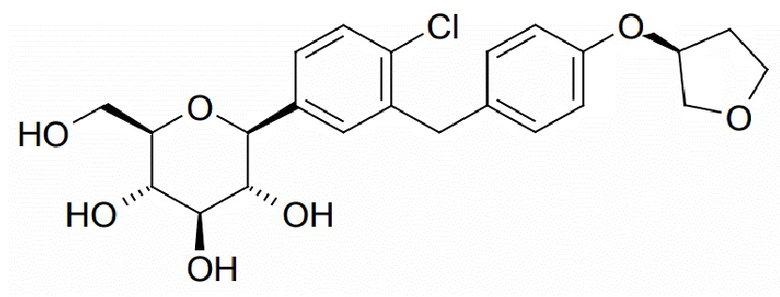
(III), или ее стереоизомерную форму. В некоторых вариантах осуществления эмпаглифлозин представлен в форме его фармацевтически приемлемой соли, сложного эфира или сольвата. Сложный эфир может представлять собой сложный эфир эмпаглифлозина в виде пролекарства, такой как сложный эфир, расщепляемый in vivo. Фармацевтически приемлемый сложный эфир может расщепляться в организме человека или животного с получением исходной кислотной группы (например, если указанный сложный эфир является метоксиметиловым) или гидроксигруппы (например, если указанный сложный эфир является ацетиловым сложным эфиром). В некоторых вариантах осуществления композиция содержит эмпаглифлозин в количестве 0,5-200 мг, как, например, 5-50 мг. В некоторых вариантах осуществления композиция содержит эмпаглифлозин в количестве 10 мг или 25 мг. В некоторых вариантах осуществления эмпаглифлозин вводят в дозе 0,5-200 мг/день, как, например, 5-50 мг/день. В некоторых вариантах осуществления эмпаглифлозин вводят в дозе 10 мг/день или 25 мг/день.
Усилитель всасывания
Способ или применение по настоящему изобретению могут предусматривать усилитель. В некоторых вариантах осуществления усилитель является водорастворимым. В некоторых вариантах осуществления термин «усилитель» относится к соединению, которое увеличивает биодоступность пептида GLP-1 в композиции после перорального введения. Соответственно, в некоторых вариантах осуществления усилитель представляет собой усилитель биодоступности. В некоторых вариантах осуществления весовая процентная доля усилителя составляет по меньшей мере 60% (вес/вес), как, например, по меньшей мере 70% (вес/вес) или по меньшей мере 75% (вес/вес), от общего веса композиции.
В некоторых вариантах осуществления усилитель представляет собой среднецепочечную жирную кислоту или ее соль и имеет длину углеродной цепи от приблизительно 4 до приблизительно 20 атомов углерода. В некоторых вариантах осуществления усилитель представляет собой соль каприновой кислоты, такую как капрат натрия. В некоторых вариантах осуществления весовая процентная доля указанной среднецепочечной жирной кислоты, такой как соль каприновой кислоты (например, капрата натрия), составляет по меньшей мере 60% (вес/вес), как, например, по меньшей мере 70% (вес/вес) или по меньшей мере 75% (вес/вес), от общего веса композиции. В некоторых вариантах осуществления количество указанной среднецепочечной жирной кислоты, такой как соль каприновой кислоты (например, капрата натрия), в композиции составляет по меньшей мере 2,0 ммоль, как, например, по меньшей мере 2,5 ммоль или по меньшей мере 3,5 ммоль, в одной единице дозирования. В некоторых вариантах осуществления количество соли каприновой кислоты, такой как капрат натрия, в композиции составляет по меньшей мере 300 мг, по меньшей мере 400 мг или по меньшей мере 500 мг.
В некоторых вариантах осуществления усилитель представляет собой соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты. В некоторых вариантах осуществления усилитель представляет собой усилитель всасывания. Структурная формула N-(8-(2-гидроксибензоил)амино)каприлата показана формулой (I):
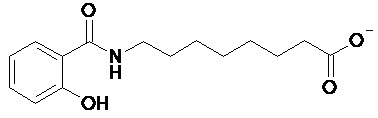 (I)
(I)
В некоторых вариантах осуществления соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты представлена в форме каприловой кислоты и/или в форме каприлата. В некоторых вариантах осуществления соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты содержит один одновалентный катион, два одновалентных катиона или один двухвалентный катион. В некоторых вариантах осуществления соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты выбрана из группы, состоящей из натриевой соли, калиевой соли и кальциевой соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты. N-(8-(2-гидроксибензоил)амино)каприлатные соли можно получать с помощью способа, описанного, например, в WO96/030036, WO00/046182, WO01/092206 или WO2008/028859. Соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты может быть кристаллической и/или аморфной. В некоторых вариантах осуществления усилитель содержит ангидрат, моногидрат, дигидрат, тригидрат, сольват или гидрат соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты в количестве одной трети, а также их комбинации. В некоторых вариантах осуществления усилитель представляет собой соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, описанную в WO2007/121318. В некоторых вариантах осуществления усилитель представляет собой N-(8-(2-гидроксибензоил)амино)каприлат натрия (называемый в данном документе «SNAC»), также известный как 8-(салицилоиламино)октаноат натрия. В некоторых вариантах осуществления весовая процентная доля соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты, такой как SNAC, составляет по меньшей мере 60% (вес/вес), как, например, по меньшей мере 70% (вес/вес) или по меньшей мере 75% (вес/вес), от общего веса композиции. В некоторых вариантах осуществления весовая процентная доля соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты, такой как SNAC, составляет 50-90% (вес/вес) от общего веса композиции. В некоторых вариантах осуществления количество соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты в композиции находится в диапазоне 0,2-5 ммоль, как, например, 0,6-3,5 ммоль. В некоторых вариантах осуществления количество соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты в композиции составляет по меньшей мере 0,6 ммоль. В некоторых вариантах осуществления количество SNAC в композиции находится в диапазоне 20-1000 мг, как, например, 50-800 мг или 100-600 мг. В некоторых вариантах осуществления количество SNAC составляет 100-500 мг, как, например, 200-400 мг или 300 мг. В некоторых вариантах осуществления молярное соотношение между пептидом GLP-1 и усилителем в композиции составляет менее 10, например, менее 5 или менее 1.
Твердые композиции
Способ или применение по настоящему изобретению предусматривают композицию, содержащую пептид GLP-1 и необязательно усилитель. В некоторых вариантах осуществления композиция находится в виде твердой лекарственной формы. Твердая лекарственная форма для перорального введения может быть выбрана из группы, состоящей из капсул, таблеток, порошков и/или гранул. В некоторых вариантах осуществления композиция представлена в форме таблетки. В некоторых вариантах осуществления композиция представлена в форме капсулы. В некоторых вариантах осуществления композиция представлена в форме саше. В некоторых вариантах осуществления композиция содержит гранулы, которые были изготовлены путем сухой грануляции или влажной грануляции. В некоторых вариантах осуществления композиция содержит гранулы, которые были изготовлены путем вальцевания. В некоторых вариантах осуществления формованные изделия после процесса вальцевания измельчают до гранул. В некоторых вариантах осуществления термин «гранулят» относится к одной или более гранулам. В некоторых вариантах осуществления термин «гранула» относится к частицам, собранным в более крупные частицы.
В некоторых вариантах осуществления термин «композиция», используемый в данном документе, относится к одной единице дозирования.
В некоторых вариантах осуществления композиция или гранула содержит одно или более фармацевтически приемлемых вспомогательных веществ. Используемый в данном документе термин «вспомогательное вещество» в широком смысле относится к любому компоненту, отличному от активного(активных) терапевтического(терапевтических) ингредиента(ингредиентов) (также называемых в данной области техники лекарственным веществом или активным(активными) фармацевтическим(фармацевтическими) ингредиентом(ингредиентами)). Вспомогательное вещество может представлять собой инертное вещество, которое является инертным в том смысле, что оно само по себе практически не имеет какого-либо терапевтического и/или профилактического эффекта. Вспомогательное вещество может служить для различных целей, например, в качестве усилителя, усилителя всасывания, среды-носителя, наполнителя (также известного как разбавители), связующего вещества, смазывающего вещества, вещества, способствующего скольжению, разрыхлителя, замедлителей кристаллизации, подкисляющего средства, подщелачивающего средства, консерванта, антиоксиданта, буферного средства, хелатообразующего средства, комплексообразующих средств, поверхностно-активного вещества, эмульгирующих и/или солюбилизирующих средств, подслащивающих средств, смачивающих средств, стабилизирующего средства, окрашивающего вещества, ароматизатора, и/или для улучшения введения и/или всасывания действующего вещества. Специалист в данной области может выбрать одно или более из вышеупомянутых вспомогательных веществ с учетом конкретных требуемых свойств твердой лекарственной формы для перорального введения путем проведения обычных экспериментов и без чрезмерной нагрузки. Количество каждого используемого вспомогательного вещества может варьироваться в диапазонах, традиционных в данной области техники. Методики и вспомогательные вещества, которые можно использовать для составления лекарственных форм для перорального введения, описаны в Handbook of Pharmaceutical Excipients, 6th edition, Rowe et al., Eds., American Pharmaceuticals Association and the Pharmaceutical Press, publications department of the Royal Pharmaceutical Society of Great Britain (2009) и Remington: the Science and Practice of Pharmacy, 21th edition, Gennaro, Ed., Lippincott Williams & Wilkins (2005).
В некоторых вариантах осуществления композиция или гранула содержит наполнитель, такой как лактоза (например, лактоза, высушенная распылением, α-лактоза, β-лактоза, Tabletose®, различные марки Pharmatose®, Microtose® или Fast-FloC®), микрокристаллическая целлюлоза (различные марки Avicel®, Elcema®, Vivacel®, Ming Tai® или Solka-Floc®), другие производные целлюлозы, сахароза, сорбит, маннит, декстрины, декстраны, мальтодекстрины, декстроза, фруктоза, каолин, маннит, сорбит, сахароза, сахар, крахмалы или модифицированные крахмалы (в том числе картофельный крахмал, маисовый крахмал и рисовый крахмал), фосфат кальция (например, основный фосфат кальция, гидрофосфат кальция, гидрат фосфата дикальция), сульфат кальция, карбонат кальция или альгинат натрия. В некоторых вариантах осуществления наполнитель представляет собой микрокристаллическую целлюлозу, такую как Avicel PH 101.
В некоторых вариантах осуществления композиция или гранула содержит связующее вещество, такое как лактоза (например, лактоза, высушенная распылением, α-лактоза, β-лактоза, Tabletose®, различные марки Pharmatose®, Microtose® или Fast-FloC®), микрокристаллическая целлюлоза (различные марки Avicel®, Elcema®, Vivacel®, Ming Tai® или Solka-Floc®), гидроксипропилцеллюлоза, L-гидроксипропилцеллюлоза (с низкой степенью замещения), гипромеллоза (HPMC) (например, Methocel E, F и K, Metolose SH от Shin-Etsu, Ltd, такие как, например, марки Methocel E и Metolose 60 SH вязкостью 4000 сП, марки Methocel F и Metolose 65 SH вязкостью 4000 сП, марки Methocel K вязкостью 4000, 15000 и 100000 сП и марки Metolose 90 SH вязкостью 4000, 15000, 39000 и 100000 сП), полимеры на основе метилцеллюлозы (такие как, например, Methocel A, Methocel A4C, Methocel A15C, Methocel A4M), гидроксиэтилцеллюлоза, этилцеллюлоза, натрий-карбоксиметилцеллюлоза, другие производные целлюлозы, сахароза, декстрины, мальтодекстрины, крахмалы или модифицированные крахмалы (в том числе картофельный крахмал, маисовый крахмал и рисовый крахмал), лактат кальция, карбонат кальция, аравийская камедь, альгинат натрия, агар, каррагинан, желатин, гуаровая камедь, пектин, PEG или повидон. В некоторых вариантах осуществления связующее вещество представляет собой повидон, такой как повидон K 90.
В некоторых вариантах осуществления композиция или гранула содержит разрыхлитель, такой как альгиновая кислота, альгинаты, микрокристаллическая целлюлоза, гидроксипропилцеллюлоза, другие производные целлюлозы, кроскармеллоза натрия, кросповидон, полакрилин калия, крахмалгликолят натрия, крахмал, прежелатинизированный крахмал или карбоксиметилированный крахмал (например, Primogel® и Explotab®).
В некоторых вариантах осуществления композиция или гранула содержит смазывающее вещество, такое как стеариновая кислота, стеарат магния, стеарат кальция или стеарат другого металла, тальк, воски, глицериды, легкое минеральное масло, глицерилбегенат, гидрогенизированные растительные масла, стеарилфумарат натрия, полиэтиленгликоли, алкилсульфаты или бензоат натрия. В некоторых вариантах осуществления композиция или гранула содержит смазывающее вещество, такое как силикат магния, тальк или коллоидный диоксид кремния. В некоторых вариантах осуществления смазывающее вещество представляет собой стеарат магния.
В некоторых вариантах осуществления композиция или гранула содержит одно или более вспомогательных веществ, выбранных из замедлителей кристаллизации, таких как повидон и т.д.; солюбилизирующих средств (также известных как поверхностно-активные вещества), таких как анионные поверхностно-активные вещества (например, плюроник или повидон), катионные поверхностно-активные вещества, неионогенные поверхностно-активные вещества и/или цвиттерионные поверхностно-активные вещества; окрашивающих веществ, в том числе красителей и пигментов, таких как оксид железа красный или желтый, диоксид титана и/или тальк; и/или регуляторов pH, таких как лимонная кислота, винная кислота, фумаровая кислота, цитрат натрия, двухосновный фосфат кальция и/или двухосновный фосфат натрия.
В некоторых вариантах осуществления композиция содержит по меньшей мере 60% (вес/вес) усилителя, менее 10% (вес/вес) связующего вещества, 5-40% (вес/вес) наполнителя и менее 10% (вес/вес) смазывающего вещества. В некоторых вариантах осуществления усилитель представляет собой соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, и композиция содержит первую гранулу, содержащую пептид GLP-1 и не содержащую соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, и вторую гранулу, содержащую соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и не содержащую пептид GLP-1.
Композиция может содержать один или более материалов покрытия, которые могут быть получены в соответствии со способами, хорошо известными из уровня техники.
Изготовление
Композицию для применения в настоящем изобретении можно получать так, как это известно из уровня техники. В некоторых вариантах осуществления композицию можно гранулировать перед прессованием в таблетки. В некоторых вариантах осуществления гранулы изготавливают путем сухой грануляции, как, например, путем вальцевания. В некоторых вариантах осуществления формованные изделия после процесса вальцевания измельчают до гранул. Композиция может содержать одну или более внутригранулярных частей и внегранулярную часть, где внутригранулярные части были гранулированы, и где внегранулярная часть была добавлена после грануляции. Первая внутригранулярная часть может содержать пептид GLP-1 и одно или более вспомогательных веществ, а вторая внутригранулярная часть может содержать усилитель и необязательно одно или более вспомогательных веществ. Первая внутригранулярная часть может содержать пептид GLP-1, наполнитель и/или связующее вещество, а вторая внутригранулярная часть может содержать усилитель, смазывающее вещество и/или наполнитель. В некоторых вариантах осуществления первая внутригранулярная часть содержит пептид GLP-1, микрокристаллическую целлюлозу и/или повидон, а вторая внутригранулярная часть содержит усилитель, стеарат магния и/или микрокристаллическую целлюлозу. Внегранулярная часть может содержать смазывающее вещество. В некоторых вариантах осуществления внегранулярная часть содержит стеарат магния.
Для получения сухой смеси материала для таблетирования различные компоненты взвешивают, необязательно протирают и затем объединяют. Смешивание компонентов можно осуществлять до тех пор, пока не будет получена однородная смесь.
В некоторых вариантах осуществления по меньшей мере часть композиции подвергают сухой грануляции или влажной грануляции. Гранулят можно получать способом, известным специалисту в данной области, например, с помощью методик сухой грануляции, в которых фармацевтически активное средство и/или усилители спрессовывают со вспомогательными веществами с образованием относительно крупных формованных изделий, например, брусков или лент, которые измельчают путем дробления, и дробленый материал служит материалом для таблетирования, который подлежит дальнейшему прессованию в таблетки. Подходящее оборудование для сухой грануляции включает без ограничения оборудование для вальцевания от Gerteis, такое как MINI-PACTOR Gerteis. В некоторых вариантах осуществления гранулят получают путем вальцевания. В некоторых вариантах осуществления формованные изделия после процесса вальцевания измельчают до гранул. В качестве альтернативы, гранулят можно получать посредством влажной грануляции, которую можно осуществлять путем смешивания фармацевтически активного средства, растворенного в воде, с сухой смесью усилителей и необязательно одного или более вспомогательных веществ с последующим высушиванием гранулята.
Для прессования материала для таблетирования в твердую лекарственную форму для перорального введения, например, в таблетку, можно использовать таблеточный пресс. В таблеточном прессе материалом для таблетирования заполняют (например, с принудительной подачей или с подачей самотеком) полость матрицы. Затем материал для таблетирования прессуют пуансоном под давлением. После этого полученное прессованное изделие или таблетку извлекают из таблеточного пресса. Вышеупомянутый процесс прессования в дальнейшем называется в данном документе «процессом прессования». Подходящие таблеточные прессы включают без ограничения роторные таблеточные прессы и эксцентриковые таблеточные прессы. Примеры таблеточных прессов включают без ограничения Fette 102i (Fette GmbH), Korsch XL100, роторный таблеточный пресс Korsch PH 106 (Korsch AG, Германия), эксцентриковый таблеточный пресс Korsch EK-O (Korsch AG, Германия) и пресс Manesty F (Manesty Machines Ltd., Великобритания). В некоторых вариантах осуществления таблетку получают путем приложения усилия прессования в диапазоне 3-20 кН или 5-25 кН.
Функциональные признаки
Биодоступность при пероральном введении
В некоторых вариантах осуществления твердые фармацевтические композиции по настоящему изобретению обеспечивают улучшенную биодоступность агониста GLP-1 и/или дапаглифлозина при пероральном введении. Как правило, термин «биодоступность» относится к доле введенной дозы лекарственного вещества (такого как пептид GLP-1 или его производное), которая достигает системного кровотока без изменений. По определению, если лекарственное вещество вводят внутривенно, его биодоступность составляет 100%. Однако, если лекарственное вещество вводят другими путями (как, например, перорально), его биодоступность уменьшается (из-за разрушения и/или неполного всасывания и пресистемного метаболизма). Знания о биодоступности важны при расчете доз для путей введения лекарственного вещества, отличных от внутривенного. График зависимости концентрации в плазме крови от времени составляют как после перорального, так и после внутривенного введения. Абсолютная биодоступность рассчитывается как (AUC при пероральном введении, деленная на дозу), разделенная на (AUC при внутривенном введении, деленная на дозу).
Показания
Композиция для применения в настоящем изобретении предназначена для применения в качестве лекарственного препарата. В некоторых вариантах осуществления композиция предназначена для применения в лечении или предупреждении сахарного диабета и/или ожирения.
Будет понятно, что композиция или пептид GLP-1 для применения в качестве фармацевтического препарата для перорального введения (т.е. лекарственного препарата) могут быть описаны как способ введения или, в качестве альтернативы, могут быть описаны как применение композиции в изготовлении фармацевтического препарата для перорального введения. Будет понятно, что описанный в данном документе способ введения может в качестве альтернативы быть описан как композиция для применения в качестве фармацевтического препарата для перорального введения или, в качестве альтернативы, как применение композиции в изготовлении фармацевтического препарата для перорального введения. Способ введения, описанный в данном документе, может в качестве альтернативы быть описан как пептид GLP-1 для применения в качестве фармацевтического препарата для перорального введения или, в качестве альтернативы, как применение пептида GLP-1 в изготовлении фармацевтического препарата для перорального введения. Аналогично, применение пептида GLP-1, описанного в данном документе, в качестве альтернативы может быть описано как способ введения или применение пептида GLP-1 в изготовлении фармацевтического препарата для перорального введения. В некоторых вариантах осуществления термины «режим дозирования» и «способ введения» используются в данном документе взаимозаменяемо. В данном документе в некоторых вариантах осуществления термин «применение» включает композицию для применения, например, «применение в медицине» включает «композицию для применения в медицине». В некоторых вариантах осуществления термин «способ», используемый в данном документе, включает способ введения, например, способ перорального введения.
Способ введения по настоящему изобретению включает пероральную терапию. В некоторых вариантах осуществления способ включает лечение или предупреждение сахарного диабета и/или ожирения.
В некоторых вариантах осуществления способ или применение включают (например, пептид GLP-1 по настоящему изобретению можно применять для следующих видов медицинского лечения):
(i) предупреждение и/или лечение всех форм сахарного диабета, таких как гипергликемия, сахарный диабет 2 типа, нарушение толерантности к глюкозе, сахарный диабет 1 типа, инсулинонезависимый сахарный диабет, MODY (сахарный диабет взрослого типа у молодых), гестационный сахарный диабет, и/или снижение уровня HbA1c;
(ii) задержку или предупреждение прогрессирования диабетического заболевания, такого как прогрессирование сахарного диабета 2 типа, задержку прогрессирования нарушения толерантности к глюкозе (IGT) до сахарного диабета 2 типа, требующего введения инсулина, и/или задержку прогрессирования сахарного диабета 2 типа, не требующего введения инсулина, до сахарного диабета 2 типа, требующего введения инсулина;
(iii) предупреждение и/или лечение расстройств приема пищи, таких как ожирение, например, путем уменьшения потребления пищи, снижения массы тела, подавления аппетита, вызывания чувства сытости; лечение или предупреждение компульсивного переедания, нервной булимии и/или ожирения, вызванного введением антипсихотического средства или стероида; снижение перистальтики желудка и/или задержку опорожнения желудка.
В некоторых вариантах осуществления показание представляет собой (i). В некоторых вариантах осуществления показание представляет собой (ii). В еще одном конкретном аспекте показание представляет собой (iii). В некоторых вариантах осуществления показание представляет собой сахарный диабет 2 типа и/или ожирение.
В некоторых вариантах осуществления способ или применение включает предупреждение, лечение, уменьшение интенсивности и/или индуцирование при одном или более заболеваниях или состояниях, определенных в данном документе. В некоторых вариантах осуществления показание представляет собой (i) и (iii). В некоторых вариантах осуществления показание представляет собой (ii) и (iii). В некоторых вариантах осуществления настоящее изобретение включает введение эффективного количества пептида GLP-1. В некоторых вариантах осуществления настоящее изобретение относится к введению эффективного количества пептида GLP-1.
В некоторых вариантах осуществления, как используется в данном документе, конкретные значения, данные в отношении чисел или интервалов, могут пониматься как конкретное значение или как приблизительно конкретное значение. В некоторых вариантах осуществления термин «приблизительно» при использовании в данном документе в отношении числа относится к указанному числу ± 10%.
Варианты осуществления настоящего изобретения
Ниже приведены неограничивающие варианты осуществления настоящего изобретения.
1. Твердая композиция для перорального введения, содержащая:
(i) производное GLP-1 и дапаглифлозин или
(ii) производное GLP-1 и соль NAC в комбинации с ингибитором SGLT2.
2. Композиция по любому из предыдущих вариантов осуществления, где указанный ингибитор SGLT2 представляет собой эмпаглифлозин.
3. Твердая композиция, содержащая производное GLP-1 и дапаглифлозин.
4. Композиция по любому из предыдущих вариантов осуществления, где указанная композиция предназначена для перорального введения.
5. Твердая композиция для перорального введения, содержащая производное GLP-1 и второй активный ингредиент, где указанный второй активный ингредиент ингибирует обратный захват глюкозы посредством рецептора SGLT2 и увеличивает способность указанного производного GLP-1 к проникновению через клеточный монослой.
6. Композиция по любому из предыдущих вариантов осуществления, где указанная композиция дополнительно содержит усилитель всасывания.
7. Композиция по любому из предыдущих вариантов осуществления, где указанный усилитель всасывания представляет собой соль NAC, такую как SNAC.
8. Композиция по любому из предыдущих вариантов осуществления, где указанное производное GLP-1 выбрано из группы, состоящей из семаглутида, соединения A, соединения B, соединения C, соединения D и соединения E.
9. Твердая композиция, содержащая дапаглифлозин и SNAC.
10. Композиция по любому из предыдущих вариантов осуществления, где указанная композиция дополнительно содержит пептид GLP-1.
11. Композиция по предыдущему варианту осуществления, где указанный пептид GLP-1 представляет собой производное GLP-1, такое как производное, выбранное из группы, состоящей из семаглутида, соединения A, соединения B, соединения C, соединения D и соединения E.
12. Композиция по любому из предыдущих вариантов осуществления, где указанный пептид GLP-1 или указанное производное GLP-1 имеет размер не более 12 кДа.
13. Композиция по любому из предыдущих вариантов осуществления, где указанный пептид GLP-1 или указанное производное GLP-1 содержит 10 аминокислотных модификаций или меньше по сравнению с GLP-1 человека.
14. Композиция по любому из предыдущих вариантов осуществления, где указанный пептид GLP-1 или указанное производное GLP-1 содержит 10 аминокислотных замен или меньше по сравнению с GLP-1 человека.
15. Композиция по любому из предыдущих вариантов осуществления, где указанный пептид GLP-1 или указанное производное GLP-1 характеризуется периодом полужизни в плазме крови человека, составляющим по меньшей мере 60 часов.
16. Композиция по любому из предыдущих вариантов осуществления, где указанный пептид GLP-1, производное GLP-1 и/или дапаглифлозин представлены в форме их фармацевтически приемлемой соли, сложного эфира или сольвата.
17. Композиция по любому из предыдущих вариантов осуществления, где указанный пептид GLP-1 или указанное производное GLP-1 представлены в форме их фармацевтически приемлемой соли или сложного эфира.
18. Композиция по любому из предыдущих вариантов осуществления, где указанный ингибитор SGLT2 представлен в форме его фармацевтически приемлемой соли, сложного эфира или сольвата.
19. Композиция по любому из предыдущих вариантов осуществления, где указанный дапаглифлозин представлен в форме его фармацевтически приемлемой соли, сложного эфира или сольвата.
20. Композиция по любому из предыдущих вариантов осуществления, где указанный дапаглифлозин представлен в форме пропиленгликолевого сольвата дапаглифлозина.
21. Композиция по любому из предыдущих вариантов осуществления, где указанный дапаглифлозин представлен в форме пропиленгликолевого сольвата/гидрата дапаглифлозина (1:1:1).
22. Композиция по любому из предыдущих вариантов осуществления, где указанный пропиленгликоль представлен в форме (R)- или (S)-стереоизомера или их смеси.
23. Композиция по любому из предыдущих вариантов осуществления, где указанная композиция содержит одно или более дополнительных фармацевтически приемлемых вспомогательных веществ.
24. Композиция по любому из предыдущих вариантов осуществления, где указанная композиция представлена в форме таблетки, капсулы или саше.
25. Композиция по любому из предыдущих вариантов осуществления, где вводимая доза указанной композиции находится в диапазоне 10-1500 мг или 200-1000 мг.
26. Композиция по любому из предыдущих вариантов осуществления, где доза дапаглифлозина составляет от 0,5 до 50 мг в день.
27. Композиция по любому из предыдущих вариантов осуществления, где доза указанного пептида GLP-1 или указанного производного GLP-1 составляет от 0,1 до 100 мг в день, как, например, от 0,1 до 60 мг в день.
28. Композиция по любому из предыдущих вариантов осуществления, где доза указанной соли NAC, такой как SNAC, составляет 20-800 мг в день.
29. Композиция по любому из предыдущих вариантов осуществления, где указанная композиция вводится один раз в день.
30. Композиция по любому из предыдущих вариантов осуществления, где указанное производное GLP-1 представляет собой семаглутид.
31. Композиция по любому из предыдущих вариантов осуществления, где указанное производное GLP-1 представляет собой соединение A.
32. Композиция по любому из предыдущих вариантов осуществления, где указанное производное GLP-1 представляет собой соединение B.
33. Композиция по любому из предыдущих вариантов осуществления, где указанное производное GLP-1 представляет собой соединение C.
34. Композиция по любому из предыдущих вариантов осуществления, где указанное производное GLP-1 представляет собой соединение D.
35. Композиция по любому из предыдущих вариантов осуществления, где указанное производное GLP-1 представляет собой соединение E.
36. Композиция, определенная в любом из предыдущих вариантов осуществления, для применения в медицине.
37. Композиция, определенная в любом из предыдущих вариантов осуществления, для применения в предупреждении или лечении сахарного диабета или ожирения.
38. Способ предупреждения или лечения сахарного диабета или ожирения, включающий введение терапевтически эффективного количества композиции, определенной в любом из предыдущих вариантов осуществления, субъекту, нуждающемуся в этом.
Примеры
Перечень сокращений
FD4: Флуоресцеинизотиоцианат-декстран, 4 кДа
Материалы и способы
Анализ (I): монослойная культура эпителиальных клеток и тест на способность к проникновению
Культивирование клеток
Клетки Caco-2 и NCI-N87 были получены из Американской коллекции типовых культур (ATCC) (Манассас, Виргиния). Клетки Caco-2 высевали в колбы для культивирования и пассировали в среде Игла в модификации Дульбекко (DMEM), дополненной 10% фетальной бычьей сывороткой крови, 1% пенициллином/стрептомицином (100 ед./мл и 100 мкг/мл соответственно), 1% L-глутамином и 1% заменимыми аминокислотами. Клетки Caco-2 высевали на поликарбонатные фильтры, обработанные для культивирования тканей, в 12-луночные планшеты Corning Transwell (1,13 см2, размер пор 0,4 мкм) при плотности 105 клеток/лунка.
Клетки NCI-N87 культивировали в среде Мемориального института Розуэлла Парка (RPMI) 1640, дополненной 10% фетальной бычьей сывороткой крови, 1% пенициллином/стрептомицином (100 ед./мл и 100 мкг/мл соответственно). Клетки N87 высевали на полиэфирные фильтры, обработанные для культивирования тканей, в 12-луночные планшеты Corning Transwell (1,13 см2, размер пор 0,4 мкм) при плотности 105 клеток/лунка.
Клеточные монослои выращивали в атмосфере 5% CO2-95% O2 при 37°C, заменяя среду для роста раз в два дня. Эксперимент проводили в дни 14-16 после посева клеток.
Трансэпителиальный транспорт
Количество тестируемого соединения, транспортируемого из донорной камеры (апикальная сторона) в приемную камеру (базолатеральная сторона), измеряли, как описано в [1] для монослоев Caco-2 и в [2] для монослоев клеток NCI-N87, в атмосфере 5% CO2-95% O2 при 37°C на встряхиваемом планшете (30 об./мин). Перед экспериментом клеточные монослои уравновешивали в течение 60 мин буфером для транспорта с обеих сторон эпителия. Буфер для транспорта состоял из сбалансированного солевого раствора Хэнкса, содержащего 0,1% овальбумин (вес/объем), 0,005% Tween-20 (вес/вес) и 10 мМ HEPES, доведенного до pH 7,4. Транспорт [3H]маннита (PerkinElmer) измеряли для проверки целостности эпителия.
В случае с клетками Caco-2 исследование транспорта начинали с добавления 400 мкл раствора тестируемого(тестируемых) соединения(соединений) (буфера для транспорта, содержащего тестируемое(тестируемые) соединение(соединения) и 0,8 мкКи/мл [3H]маннита; например, содержащего одно или более из 100 мкМ пептида GLP-1, 540 мкМ FD4 (Sigma Aldrich, артикул № 46944), 0-80 мМ SNAC, 0-2 мМ эмпаглифлозина и 0-3 мМ дапаглифлозина) в донорную камеру и 1 мл буфера для транспорта в приемную камеру, и образцы из приемной камеры (200 мкл) отбирали каждые 15 мин в течение 1 ч. В случае с клетками NCI-N87 после уравновешивания буфером клеточные монослои предварительно инкубировали в течение 15 мин с 400 мкл раствора тестируемого соединения (0-80 мM SNAC и/или 0-3 мM дапаглифлозина), которые заменяли на 400 мкл раствора тестируемого соединения (водного раствора, содержащего 0,8 мкКи/мл [3H]маннита и 100 мкМ пептида GLP-1 или 540 мкМ FD4), и образцы из приемной камеры (200 мкл) отбирали каждые 15 мин в течение 1 ч.
Перемещение данного соединения через клеточные слои выражается как кажущаяся способность к проникновению (Papp), определяемая как:
Уравнение (1):
 ,
,
где dQ/dt представляет собой поток в стационарном состоянии через клеточный слой (пмоль/с), A представляет собой площадь поверхности (1,12 см2), и C0 представляет собой исходную концентрацию образца.
До и после эксперимента отслеживали трансэпителиальное электрическое сопротивление (TEER) клеточных монослоев. После экспериментов клетки дважды промывали буфером, и среду пополняли для восстановления TEER в течение 24 ч. с целью обеспечения того, что клеточные монослои были жизнеспособными, а эффекты усилителя были временными. TEER измеряли с помощью эпителиального вольтомметра EVOM™, соединенного с палочковыми электродами. Для монослоев Caco-2 начальное TEER обычно составляло около 1000 Ω⋅см2, а для монослоев N87 оно составляло около 1600 Ω⋅см2.
Концентрацию дапаглифлозина и эмпаглифлозина в исходных растворах подтверждали с помощью UPLC.
Литературные источники
[1] I. Hubatsch, E.G.E. Ragnarsson, P. Artursson, Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nat. Protoc. (2007) 2, 2111-9.
[2] M. Lemieux, F. Bouchard, P. Gosselin, J. Paquin, M.A. Mateescu, The NCI-N87 cell line as a gastric epithelial barrier model for drug permeability assay. Biochem Biophys Res Commun. (2011); 412(3):429-34.
Общие способы
Концентрацию семаглутида и соединения B определяли с помощью анализа LOCI с применением принципа, подобного ELISA. Концентрацию дапаглифлозина и эмпаглифлозина в исходных растворах измеряли с помощью UPLC. Концентрацию FD4 измеряли во флуоресцентном планшет-ридере. Концентрацию [3H]маннита измеряли в сцинтилляционном счетчике.
Пример 1. Дапаглифлозин усиливает всасывание GLP-1 при пероральном введении
Способность семаглутида к проникновению через клеточный слой тестировали в анализе модельной системы in vitro (I), описанном в данном документе; этот анализ представляет собой модель всасывания соединений в желудочно-кишечном тракте, т.е. биодоступности при пероральном введении. Способность к проникновению оценивали как в широко используемой линии клеток кишечника Caco-2, так и в относительно недавно описанной линии клеток желудка N87, чтобы охватить различные желудочно-кишечные состояния, которые могут иметь отношение к всасыванию семаглутида. Результаты показаны в таблицах 1-4.
Таблица 1. Способность семаглутида к проникновению через монослои клеток Caco-2 в отдельности или в присутствии SNAC или дапаглифлозина; по 3 отдельным экспериментам.
(Papp (см/с), 10-8)
SNAC и дапаглифлозин вызывали временное уменьшение TEER в клеточном монослое (дозозависимым образом для дапаглифлозина) до ~25% от начальных значений с восстановлением через 24 ч. в свежей среде. При > 2,7 мМ дапаглифлозина наблюдалось отсутствие восстановления TEER, и значения способности к проникновению для них не включены.
На удивление, результаты этого эксперимента (таблица 1) показали, что дапаглифлозин действует как усилитель способности семаглутида к проникновению через клеточный монослой для тестируемого соединения, т.е. они указывают на то, что биодоступность семаглутида при пероральном введении будет увеличиваться в присутствии дапаглифлозина.
Таблица 2. Способность соединения В к проникновению через монослои клеток Caco-2 в отдельности или в присутствии SNAC или дапаглифлозина; по 2 отдельным экспериментам.
(Papp (см/с), 10-8)
SNAC и дапаглифлозин вызывали временное уменьшение TEER в клеточном монослое (дозозависимым образом для дапаглифлозина) до ~25% от начальных значений с восстановлением через 24 ч. в свежей среде. При > 2,7 мМ дапаглифлозина наблюдалось отсутствие восстановления TEER, и значения способности к проникновению для них не включены.
На удивление, результаты этого эксперимента (таблица 2) показали, что дапаглифлозин действует как усилитель способности соединения B GLP-1 к проникновению через клеточный монослой для тестируемого соединения, т.е. они указывают на то, что биодоступность соединения B при пероральном введении будет увеличиваться в присутствии дапаглифлозина.
Используемый сольват дапаглифлозина содержит пропиленгликоль (1:1), который протестировали отдельно, чтобы удостовериться в том, что наблюдаемые эффекты усилителя вызваны дапаглифлозином. Пропиленгликоль в концентрации до 3,2 мМ не приводил ни к уменьшению TEER в монослое, ни к усилению способности к проникновению.
Таблица 3. Способность семаглутида к проникновению через монослои клеток NCI-N87 в отдельности или в присутствии SNAC или дапаглифлозина.
(Papp (см/с), 10-8)
SNAC и дапаглифлозин вызывали временное уменьшение TEER в клеточном монослое до ~20% от начальных значений с восстановлением через 24 ч. в свежей среде. При ≥ 2,6 мМ дапаглифлозина наблюдалось отсутствие восстановления TEER, и значения способности к проникновению для них не включены.
Данные в таблице 3 показывают, что дапаглифлозин эффективно усиливает способность семаглутида к проникновению через монослой клеток желудка.
Таблица 4. Способность FD4 к проникновению через монослои клеток NCI-N87 в отдельности или в присутствии SNAC или дапаглифлозина; по 2 отдельным экспериментам.
(Papp (см/с), 10-8)
SNAC и дапаглифлозин вызывали временное уменьшение TEER в клеточном монослое до ~25% от начальных значений с восстановлением через 24 ч. в свежей среде. При > 2,6 мМ дапаглифлозина наблюдалось отсутствие восстановления TEER, и значения способности к проникновению для них не включены.
Результаты в таблице 4 показывают, что способность FD4 к проникновению увеличивалась дозозависимым образом с помощью дапаглифлозина.
В совокупности вышеприведенные данные неожиданно показали, что дапаглифлозин действует как усилитель способности семаглутида, соединения B и FD4 к проникновению через клеточный монослой для тестируемого соединения, т.е. они указывают на то, что биодоступность семаглутида и соединения B при пероральном введении будет увеличиваться в присутствии дапаглифлозина.
Пример 2. Комбинация дапаглифлозина и SNAC оказывает синергический эффект в отношении всасывания при пероральном введении
Способность FD4 или семаглутида к проникновению через клеточный слой тестировали в анализе модельной системы in vitro (I), описанном в данном документе; этот анализ представляет собой модель всасывания соединений в желудочно-кишечном тракте, т.е. биодоступности при пероральном введении. Результаты показаны в таблицах 5-8.
Таблица 5. Способность FD4 к проникновению через монослои клеток Caco-2 в отдельности или в присутствии SNAC, дапаглифлозина или их комбинации.
(Papp (см/с), 10-8)
SNAC, дапаглифлозин и их комбинации вызывали временное уменьшение TEER в клеточном монослое до ~35% от начальных значений с восстановлением через 24 ч. в свежей среде. При 3 мM дапаглифлозина и 60 мM SNAC + 2 мM дапаглифлозина наблюдалось отсутствие восстановления TEER, и значения способности к проникновению для них не включены.
На удивление, результаты этого эксперимента (таблица 5) показали, что комбинация дапаглифлозина и SNAC оказывала синергический эффект в отношении способности FD4 к проникновению через клеточный монослой, т.е. они указывают на то, что биодоступность при пероральном введении будет больше, чем сумма значений биодоступности при пероральном введении с дапаглифлозином в отдельности или SNAC в отдельности. Синергический эффект для семаглутида был подтвержден в клеточных слоях как Caco-2 (таблицы 6-7), так и NCI-N87 (таблица 8).
Таблица 6. Способность семаглутида к проникновению через монослои клеток Caco-2 в отдельности или в присутствии SNAC, дапаглифлозина или их комбинации.
(Papp (см/с), 10-8)
Смеси SNAC и дапаглифлозина вызывали временное уменьшение TEER в клеточном монослое до ~35% от начальных значений с восстановлением через 24 ч. в свежей среде. При 70 мМ SNAC + 2 мM дапаглифлозина и 80 мM SNAC + 1,5 мM дапаглифлозина наблюдалось отсутствие восстановления TEER, и значения способности к проникновению для них не включены.
Ранее было показано, что 0,5-1,5 мМ дапаглифлозина в отдельности оказывают незначительный эффект в отношении способности семаглутида к проникновению через монослои клеток Caco-2.
Таблица 7. Способность соединения B к проникновению через монослои клеток Caco-2 в отдельности или в присутствии SNAC, дапаглифлозина или их комбинации.
(Papp (см/с), 10-8)
Смеси SNAC и дапаглифлозина вызывали временное уменьшение TEER в клеточном монослое до ~35% от начальных значений с восстановлением через 24 ч. в свежей среде. Ранее было показано, что 0,5-2,0 мМ дапаглифлозина в отдельности оказывают незначительный эффект в отношении способности соединения B к проникновению через монослои клеток Caco-2.
Таблица 8. Способность семаглутида к проникновению через монослои клеток NCI-N87 в отдельности или в присутствии SNAC, дапаглифлозина или их комбинации.
(Papp (см/с), 10-8)
Смеси SNAC и дапаглифлозина вызывали временное уменьшение TEER в клеточном монослое до ~15% от начальных значений с восстановлением через 24 ч. в свежей среде. При 60 мМ SNAC + 2 мМ дапаглифлозина наблюдалось отсутствие восстановления TEER, и значения способности к проникновению для них не включены.
Ранее было показано, что 1-1,5 мМ дапаглифлозина в отдельности оказывают незначительный эффект в отношении способности семаглутида к проникновению через монослои клеток NCI-N87.
На удивление, результаты этих экспериментов (таблицы 5-8) показали, что комбинация дапаглифлозина и SNAC оказывала синергический эффект в отношении способности семаглутида, соединения B и FD4 к проникновению через клеточный монослой Caco-2 или NCI-87, т.е. они указывают на то, что биодоступность пептидов, таких как семаглутид и соединение B, при пероральном введении будет больше, чем сумма значений их биодоступности при пероральном введении с дапаглифлозином в отдельности или SNAC в отдельности.
Пример 3. Комбинация эмпаглифлозина и SNAC оказывает синергический эффект в отношении всасывания при пероральном введении
Способность семаглутида или FD4 к проникновению через клеточный слой тестировали в анализе модельной системы in vitro (I), описанном в данном документе; этот анализ представляет собой модель всасывания соединений в желудочно-кишечном тракте, т.е. биодоступности при пероральном введении. Результаты показаны в таблицах 9-10.
Таблица 9. Способность семаглутида к проникновению через монослои клеток Caco-2 в отдельности или в присутствии SNAC или комбинации SNAC и эмпаглифлозина.
(Papp (см/с), 10-8)
N.A.: данные отсутствуют
Таблица 10. Способность FD4 к проникновению через монослои клеток Caco-2 в отдельности или в присутствии SNAC, эмпаглифлозина или их комбинации; по 2 отдельным экспериментам.
(Papp (см/с), 10-8)
SNAC, эмпаглифлозин и их комбинации вызывали временное уменьшение TEER в клеточном монослое до ~35% от начальных значений с восстановлением через 24 ч. в свежей среде.
На удивление, результаты этих экспериментов (таблицы 9-10) показали, что комбинация эмпаглифлозина и SNAC оказывала синергический эффект в отношении способности семаглутида и FD4 к проникновению через клеточный монослой Caco-2, т.е. они указывают на то, что биодоступность пептидов, таких как семаглутид, при пероральном введении будет больше, чем сумма значений их биодоступности при пероральном введении с дапаглифлозином в отдельности или SNAC в отдельности.
Исследование составов с семаглутидом и дапаглифлозином в сравнении с семаглутидом повторяли in vivo со сравнимыми результатами.
Хотя определенные признаки настоящего изобретения были проиллюстрированы и описаны в данном документе, средним специалистам в данной области теперь придут на ум многие модификации, замены, изменения и эквиваленты. Следовательно, следует понимать, что прилагаемая формула изобретения предназначена для охвата всех таких модификаций и изменений, которые находятся в пределах истинной сущности настоящего изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Novo Nordisk A/S
<120> SOLID COMPOSITIONS FOR ORAL ADMINISTRATION
<130> 170046WO01
<160> 8
<170> PatentIn version 3.5
<210> 1
<211> 31
<212> PRT
<213> Homo sapiens
<400> 1
His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly
20 25 30
<210> 2
<211> 33
<212> PRT
<213> ARTIFICIAL
<220>
<223> Based on human GLP-1
<220>
<221> SITE
<222> (1)..(1)
<223> This residue is L-His, imidazopropionyl, alpha-hydroxy-histidine,
D-His, desamino-His, 2-amino-His, beta-hydroxy-His, homo-His,
N-alpha-acetyl-His, N-alpha-formyl-His, alpha-fluoromethyl-His,
alpha-methyl-His, 3-pyridyl-Ala, 2-pyridyl-Ala, or 4-pyridyl-Ala
<220>
<221> SITE
<222> (2)..(2)
<223> This residue is Ala, Gly, Val, Leu, Ile, Thr, Ser, Lys, Aib,
(1-aminocyclopropyl) carboxylic acid, (1-aminocyclobutyl)
carboxylic acid (CA), (1-aminocyclopentyl) CA,
(1-aminocyclohexyl) CA, (1-aminocycloheptyl) CA, or
<220>
<221> SITE
<222> (6)..(6)
<223> This residue is Lys or Phe
<220>
<221> SITE
<222> (10)..(10)
<223> This residue is Val or Leu
<220>
<221> SITE
<222> (12)..(12)
<223> This residue is Ser, Arg, Asn, Gln, or Glu
<220>
<221> SITE
<222> (13)..(13)
<223> This residue is Tyr or Gln
<220>
<221> SITE
<222> (14)..(14)
<223> This residue is Leu, Lys, or Met
<220>
<221> SITE
<222> (16)..(16)
<223> This residue is Gly, Glu, Lys, or Aib
<220>
<221> SITE
<222> (17)..(17)
<223> This residue is Gln, Glu, or Arg
<220>
<221> SITE
<222> (18)..(18)
<223> This residue is Ala or Lys
<220>
<221> SITE
<222> (19)..(19)
<223> This residue is Ala or Val
<220>
<221> SITE
<222> (20)..(20)
<223> This residue is Val, His, Lys or Arg
<220>
<221> SITE
<222> (24)..(24)
<223> This residue is Ala, Glu, or Arg
<220>
<221> SITE
<222> (25)..(25)
<223> This residue is Trp or His
<220>
<221> SITE
<222> (28)..(28)
<223> This residue is Glu, Asn, Gly, Gln, or Arg
<220>
<221> SITE
<222> (29)..(29)
<223> This residue is Gly, Aib, or absent
<220>
<221> SITE
<222> (30)..(30)
<223> This residue is Arg, Gly, Lys, or absent
<220>
<221> SITE
<222> (31)..(31)
<223> This residue is Gly, Ala, Glu, Pro, Lys, Arg, or absent
<220>
<221> SITE
<222> (32)..(32)
<223> This residue is Ser, Gly, Ala, Glu, Gln, Pro, Arg, or absent
<220>
<221> SITE
<222> (33)..(33)
<223> This residue is Gly or absent
<400> 2
Xaa Xaa Glu Gly Thr Xaa Thr Ser Asp Xaa Ser Xaa Xaa Xaa Glu Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Lys Phe Ile Xaa Xaa Leu Val Xaa Xaa Xaa Xaa Xaa
20 25 30
Xaa
<210> 3
<211> 31
<212> PRT
<213> ARTIFICIAL
<220>
<223> Based on human GLP-1
<220>
<221> SITE
<222> (2)..(2)
<223> This amino acid residue is Aib
<220>
<221> SITE
<222> (20)..(20)
<223> This amino acid residue is covalently attached to a substituent
<220>
<221> SITE
<222> (31)..(31)
<223> This amino acid residue is covalently attached to a substituent
<400> 3
His Xaa Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Lys
20 25 30
<210> 4
<211> 33
<212> PRT
<213> ARTIFICIAL
<220>
<223> Based on human GLP-1
<220>
<221> SITE
<222> (2)..(2)
<223> This amino acid residue is Aib
<220>
<221> SITE
<222> (21)..(21)
<223> This amino acid residue is covalently attached to a substituent
<220>
<221> SITE
<222> (30)..(30)
<223> This amino acid residue is covalently attached to a substituent
<400> 4
His Xaa Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Gln Ala Ala Arg Lys Phe Ile Gly Trp Leu Val Arg Gly Lys Gly Glu
20 25 30
Gly
<210> 5
<211> 31
<212> PRT
<213> ARTIFICIAL
<220>
<223> Based on human GLP-1
<220>
<221> SITE
<222> (1)..(1)
<223> This residue (Xaa7) is L-His,
(S)-2-Hydroxy-3-(1H-imidazol-4-yl)-propionic acid, D-His,
desamino-His, Nalpha-acetyl-His, or Nalpha-formyl-His
<220>
<221> SITE
<222> (2)..(2)
<223> This residue (Xaa8) is Ala, Ser, Aib, (1-aminocyclopropyl)
carboxylic acid, or (1-aminocyclobutyl) carboxylic acid
<220>
<221> SITE
<222> (10)..(10)
<223> This residue (Xaa16) is Val or Leu
<220>
<221> SITE
<222> (12)..(12)
<223> This residue (Xaa18) is Ser or Arg
<220>
<221> SITE
<222> (13)..(13)
<223> This residue (Xaa19) is Tyr or Gln
<220>
<221> SITE
<222> (14)..(14)
<223> This residue (Xaa20) is Leu or Met
<220>
<221> SITE
<222> (16)..(16)
<223> This residue (Xaa22) is Gly or Glu
<220>
<221> SITE
<222> (17)..(17)
<223> This residue (Xaa23) is Gln, Glu, or Arg
<220>
<221> SITE
<222> (19)..(19)
<223> This residue (Xaa25) is Ala or Val
<220>
<221> SITE
<222> (20)..(20)
<223> This residue (Xaa26) is Arg or Lys
<220>
<221> SITE
<222> (21)..(21)
<223> This residue (Xaa27) is Glu or Leu
<220>
<221> SITE
<222> (24)..(24)
<223> This residue (Xaa30) is Ala or Glu
<220>
<221> SITE
<222> (25)..(25)
<223> This residue (Xaa31) is Trp or His
<220>
<221> SITE
<222> (27)..(27)
<223> This residue (Xaa33) is Val or Arg
<220>
<221> SITE
<222> (28)..(28)
<223> This residue (Xaa34) is Arg, Lys, His, Asn, or Gln
<220>
<221> SITE
<222> (29)..(29)
<223> This residue (Xaa35) is Gly or Aib
<400> 5
Xaa Xaa Glu Gly Thr Phe Thr Ser Asp Xaa Ser Xaa Xaa Xaa Glu Xaa
1 5 10 15
Xaa Ala Xaa Xaa Xaa Phe Ile Xaa Xaa Leu Xaa Xaa Xaa Lys Lys
20 25 30
<210> 6
<211> 31
<212> PRT
<213> ARTIFICIAL
<220>
<223> Based on human GLP-1
<220>
<221> SITE
<222> (2)..(2)
<223> This amino acid residue is Aib
<220>
<221> SITE
<222> (30)..(30)
<223> This amino acid residue is covalently attached to a substituent
<220>
<221> SITE
<222> (31)..(31)
<223> This amino acid residue is covalently attached to a substituent
<400> 6
His Xaa Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Gln Ala Ala Arg Glu Phe Ile Ala Trp Leu Val Arg Gly Lys Lys
20 25 30
<210> 7
<211> 31
<212> PRT
<213> ARTIFICIAL
<220>
<223> Based on human GLP-1
<220>
<221> SITE
<222> (2)..(2)
<223> This amino acid residue is Aib
<220>
<221> SITE
<222> (30)..(30)
<223> This amino acid residue is covalently attached to a substituent
<220>
<221> SITE
<222> (31)..(31)
<223> This amino acid residue is covalently attached to a substituent
<400> 7
His Xaa Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Arg Glu Phe Ile Ala Trp Leu Val Arg Gly Lys Lys
20 25 30
<210> 8
<211> 31
<212> PRT
<213> ARTIFICIAL
<220>
<223> GLP-1 agonist based on from human GLP-1
<220>
<221> SITE
<222> (2)..(2)
<223> Aib
<220>
<221> SITE
<222> (30)..(30)
<223> This amino acid residue is covalently attached to a substituent
<220>
<221> SITE
<222> (31)..(31)
<223> This amino acid residue is covalently attached to a substituent
<400> 8
His Xaa Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Gln Ala Ala Arg Glu Phe Ile Ala Trp Leu Val Arg Gly Lys Lys
20 25 30
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ТВЕРДЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АГОНИСТ GLP-1, СОЛЬ N-(8-(2-ГИДРОКСИБЕНЗОИЛ)АМИНО)КАПРИЛОВОЙ КИСЛОТЫ И СМАЗЫВАЮЩЕЕ ВЕЩЕСТВО | 2019 |
|
RU2807183C2 |
| Терапевтическое применение глюкагона и включающей его комбинации | 2019 |
|
RU2838895C2 |
| Ацилированное производное GLP-1 | 2019 |
|
RU2773242C2 |
| ПЕПТИДНЫЙ АНАЛОГ АЦИЛИРОВАННОГО ОКСИНТОМОДУЛИНА | 2018 |
|
RU2752787C1 |
| СОЕДИНЕНИЯ-АГОНИСТЫ GIP И СПОСОБЫ | 2015 |
|
RU2716985C2 |
| МУЛЬТИАГОНИСТЫ И ИХ ПРИМЕНЕНИЕ | 2022 |
|
RU2833609C2 |
| Новые производные оксинтомодулина и содержащая их фармацевтическая композиция для лечения ожирения | 2012 |
|
RU2739209C2 |
| МУЛЬТИРЕЦЕПТОРНЫЙ АГОНИСТ И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2816492C2 |
| АЦИЛИРОВАННЫЙ АНАЛОГ ГЛЮКАГОНА, ЕГО ПРИМЕНЕНИЕ И СПОСОБЫ ПОЛУЧЕНИЯ | 2016 |
|
RU2735762C2 |
| УЛУЧШЕННЫЕ ПЕПТИДНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ NASH И ДРУГИХ РАССТРОЙСТВ | 2019 |
|
RU2790209C2 |
Изобретение относится к области медицины и фармацевтики, а именно к твердой композиции для перорального введения для лечения сахарного диабета и/или ожирения, содержащей эффективное количество семаглутида или его фармацевтически приемлемой соли или сольвата и эффективное количество дапаглифлозина или его фармацевтически приемлемой соли или сольвата. Предпотительно композиция дополнительно содержит усилитель всасывания натрия N-(8-(2-гидроксибензоил)амино)каприлат (SNAC). Изобретение обеспечивает композиции с улучшенным проникновением пептидов GLP-1 через клеточную мембрану, что необходимо для повышения их биодоступности при пероральном введении. 6 з.п. ф-лы, 10 табл., 3 пр.
1. Твердая композиция для перорального введения для лечения сахарного диабета и/или ожирения, содержащая эффективное количество семаглутида или его фармацевтически приемлемой соли или сольвата и эффективное количество дапаглифлозина или его фармацевтически приемлемой соли или сольвата.
2. Композиция по п. 1, где указанная композиция дополнительно содержит усилитель всасывания.
3. Композиция по п. 2, где указанный усилитель всасывания представляет собой соль N-(8-(2-гидроксибензоил)амино)каприлата (NAC).
4. Композиция по любому из пп. 2, 3, где указанный усилитель всасывания представляет собой натрия N-(8-(2-гидроксибензоил)амино)каприлат (SNAC).
5. Композиция по любому из предыдущих пунктов, где указанная композиция содержит 5-300 мг дапаглифлозина, 20-800 мг соли NAC, такой как SNAC, и 0,1-100 мг семаглутида.
6. Композиция по любому из предыдущих пунктов, где указанная композиция содержит одно или более ее дополнительных фармацевтически приемлемых вспомогательных веществ.
7. Композиция по любому из предыдущих пунктов, где указанная композиция представлена в форме таблетки, капсулы или саше.
| US 2015150811 A1, 04.06.2016 | |||
| WO 2017004623 A1, 05.01.2017 | |||
| GORGOJO-MARTINEZ J.J | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Vol | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| P | |||
| Способ применения резонанс конденсатора, подключенного известным уже образом параллельно к обмотке трансформатора, дающего напряжение на анод генераторных ламп | 1922 |
|
SU129A1 |
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
Авторы
Даты
2022-08-01—Публикация
2018-06-11—Подача