Область техники
[0001] Настоящее изобретение относится к контейнеру, используемому для введения, хранения или культивирования клеток млекопитающих, причем поверхность контейнера, соприкасающаяся с клетками млекопитающих, образована из фторкаучука с одной или более концевыми группами -CF3, или фторкаучука с общим числом не содержащих фтор концевых групп и концевых групп -CF2H во фторкаучуке не более 70×106 атомов углерода.
Уровень техники
[0002] Плюрипотентные стволовые клетки (ПСК), такие как эмбриональные стволовые клетки (ЭСК) и индуцированные плюрипотентные стволовые клетки (ИПСК) являются клетками с неограниченными способностями пролиферации и мультипотентностью, по отношению к клеткам различных тканей. Ожидается, что человеческие ПСК будут применяться в регенеративной медицине, причем человеческие ПСК индуцируются дифференцированием in-vitro в клетки, обладающие различными типами функций, которые затем вводятся пациентам с целью получения предположительного эффекта от такого введения. Кроме того, ожидается, что соматические стволовые клетки (ССК), такие как мезенхимальные стволовые клетки (МСК), проявляют терапевтический эффект, получаемый за счет выброса трофических факторов и цитокинов, и эффект самонаведения на поврежденные участки тканей с последующим дифференцированием в составные клетки и дополнением / восстановлением участков, и потому попытки клинических исследований этих явлений были предприняты. Для достижения этого требуется стабильное культивирование или хранение большого количества высококачественных клеток, а также введения при сохранении качества.
[0003] В качестве контейнера для культивирования плавающих клеток разработан контейнер для культивирования в форме мешка (далее - мешок) (патентный документ 1). Такой мешок состоит из полимерного сплава, в котором смесь полимеров, состоящая из блок-сополимера поли(этиленбутилен)полистирола с полипропиленом, смешана с сополимером этилена и акриловой кислоты, который обладает превосходными свойствами в части прозрачности и газопроницаемости. С другой стороны, разработаны мешки для культивирования адгезивных клеток (патентные документы 2, 3). Мешок, раскрытый в патентном документе 2, представляет собой усовершенствованный мешок, в котором клетки с легкостью прикрепляются к его внутренней поверхности за счет улучшенной гидрофильности, создаваемой посредством обработки поверхности коронным разрядом. Кроме того, мешок, раскрытый в патентном документе 3, состоит из листа синтетического каучука с заранее заданной жесткостью при изгибе, чтобы исключить легкую деформацию мешка во время культивирования, также он обладает отличительной характеристикой, состоящей в предотвращении отслаивания и смерти клеток из-за деформации контейнера при его перемещении.
Далее, на рынке известны и имеются в наличии мешки, например, CultiLife® Spin (производитель «Takara Рас Ltd.»), изготовленные из сополимера этилена (Э) и винилацетата (ВА) - ЭВА; VueLife FEP Bag 32-С (производитель «American Fluoroseal Corp.») из сополимера тетрафторэтилена (ТФЭ) и гексафторпропилена (ГФП) - ФЭП, т.е. из фторкаучука; и культуральный мешок A-1000NL (производитель «Nipro Corp.»).
Однако, все эти мешки не предотвращают адгезию адгезивных клеток к внутренней поверхности мешка и не поддерживают культивируемые клетки в плавающем состоянии.
[0004] В то же время известно, что поверхности бытовых приборов, используемых для разогрева и приготовления пищи, покрываются фторкаучуковой пленкой, в которой нестабильные концевые группы сополимера ТФЭ и перфторалкил-винилового эфира (ПФАВЭ) - ПФА - фторированы для удаления нестабильных концевых групп, улучшается возможность избежать пригорания (патентный документ 4). Однако адгезионные свойства клетки, проявляемые по отношению к фторкаучуку, концевые группы которого фторированы, не известны.
Документы уровня техники
Патентные документы
[0005]
Патентный документ 1: Японская нерассмотренная патентная заявка, публикация №03-65177
Патентный документ 2: Японская нерассмотренная патентная заявка, публикация №06-98756
Патентный документ 3: Японская нерассмотренная патентная заявка, публикация №2008-17839
Патентный документ 4: Патент Японии №3962153
Сущность изобретения
Проблема, которую должно решить изобретение
[0006] Цель настоящего изобретения состоит в том, чтобы предложить контейнер, пригодный для введения, хранения или приготовления раствора, содержащего клетки млекопитающих, с высокой концентрацией и с высокой долей живых клеток.
Средства решения указанных проблем
[0007] В результате исчерпывающего исследования, направленного на поиск решения проблемы, авторы настоящего изобретения обнаружили, что когда введение клеток млекопитающих осуществляется с использованием контейнера, поверхность которого, соприкасающаяся с клетками млекопитающих, образована из фторкаучука с одной или более концевыми группами -CF3 или фторкаучука, имеющего общее число нефторированных концевых групп и концевых групп -CF2H в фторкаучуке не более 70 на 1×106 атомов углерода, и в таком контейнере хранятся или культивируются клетки млекопитающих, адгезия клеток к внутренней поверхности контейнера эффективно предотвращается, и коэффициент выживаемости клеток повышается; контейнеры могут использоваться для введения, хранения или приготовления раствора, содержащего клетки млекопитающих с высокой концентрацией и с высокой долей живых клеток. Этот результат привел к совершению настоящего изобретения.
[0008] Настоящее изобретение состоит в следующем.
(1) Контейнер для введения, хранения или культивирования клеток млекопитающих, в котором поверхность контейнера, соприкасающаяся с клетками млекопитающих, образована из фторкаучука с общим числом нефторированных концевых групп и концевых групп -CF2H в фторкаучуке не более 70 на 1×106 атомов углерода.
(2) Контейнер для введения, хранения или культивирования клеток млекопитающих, в котором поверхность контейнера, соприкасающаяся с клетками млекопитающих, образована из фторкаучука с одной или более концевыми группами -CF3.
(3) Контейнер для введения, хранения или культивирования клеток млекопитающих по п. (2), в котором поверхность контейнера, соприкасающаяся с клетками млекопитающих, образована из фторкаучука с числом нефторированных концевых групп не более 70 на 1×106 атомов углерода.
(4) Контейнер для введения, хранения или культивирования клеток млекопитающих по любому из п. (1)-(3), в котором фторкаучук представляет собой один из фторкаучуков, выбранных из следующей группы: сополимер на основе тетрафторэтилена и гексафторпропилена, сополимер на основе тетрафторэтилена и перфторалкил-винилового эфира.
(5) Контейнер для введения, хранения или культивирования клеток млекопитающих по любому из п. (1)-(4), при этом контейнер представляет собой мешок.
(6) Контейнер для введения, хранения или культивирования клеток млекопитающих по любому из п. (1)-(5), при этом клетки млекопитающих представляют собой адгезивные клетки.
(7) Контейнер для введения, хранения или культивирования клеток млекопитающих по любому из п. (1)-(6), при этом клетки млекопитающих представляют собой мезенхимальные стволовые клетки.
Технический результат изобретения
[0009] Когда при использовании контейнера для введения, хранения и культивирования в соответствии с настоящим изобретением выполняется введение или хранение жидкой среды, содержащей клетки млекопитающих, или осуществляется культивирование клеток млекопитающих, поскольку возможно эффективное предотвращение адгезии к внутренней поверхности контейнера и повышение коэффициента выживаемости клеток, обеспечивается введение, хранение или приготовление среды, содержащей клетки млекопитающих, с высокой концентрацией и высокой долей живых клеток, что способствует регенеративной медицине с использованием жидкой среды, содержащей клетки млекопитающих (суспензии).
Осуществление изобретения
[0010] Контейнер для введения, хранения или культивирования в соответствии с настоящим изобретением (далее в некоторых случаях «контейнер в соответствии с настоящим изобретением») не ограничен, при условии, что в контейнере для введения, хранения или культивирования клеток млекопитающих поверхность, соприкасающаяся с клетками млекопитающих (жидкой средой, содержащей клетки млекопитающих), образована из фторкаучука с одной или более концевыми группами -CF3 или фторкаучука с общим числом нефторированных концевых групп и концевых групп -CF2H в фторкаучуке не более 70 на 1×106 атомов углерода (далее - «предлагаемый фторкаучук»); и контейнер в целом в некоторых случаях образован из предлагаемого фторкаучука. Контейнер в соответствии с настоящим изобретением обладает отличительной характеристикой, состоящей в том, что поверхность контейнера, соприкасающаяся с клетками млекопитающих, образована из предлагаемого фторкаучука. Когда выполняется введение или хранение жидкой среды, содержащей клетки млекопитающих, или культивирование клеток млекопитающих с использованием контейнера с такими признаками, поскольку клеточная адгезия эффективно предотвращена и коэффициент выживаемости клеток эффективно повышается, контейнер в соответствии с настоящим изобретением пригоден для использования для введения и/или хранения жидкой среды, содержащей плавающие клетки, и культивирования плавающих клеток, а также для введения и/или хранения жидкой среды, содержащей адгезивные клетки, и для плавающего культивирования адгезивных клеток. В случае с использованием для введения и/или хранения среды, содержащей клетки, и плавающего культивирования клеток, в предпочтительном варианте контейнер представляет собой контейнер, в котором внутренняя поверхность не покрыта веществом, демонстрирующим адгезивные свойства к клеткам, таким как матригель, энтактин, фибронектин, полимер, реагирующий на температуру (ПИПАА и т.д.), поликатион (полилизин и т.д.), желатин, лектин, полисахариды (гиалуроновая кислота и т.д.), полимолочная кислота, полигликолевая кислота, ε-аминокапролактон, коллаген I типа, коллаген IV типа, хитозан и ламинин. В данном случае, в настоящем изобретении «хранение» включает в себя хранение во время транспортировки.
[0011] Плавающие клетки включают в себя такие клетки, как красные кровяные тельца (эритроциты) и (получаемые из периферической крови) белые кровяные тельца (нейтрофильные лейкоциты, мононуклеарные лейкоциты (моноциты и лимфоциты), макрофаги и т.д.).
[0012] Примеры адгезивных клеток включают: стволовые клетки, в том числе плюрипотентные стволовые клетки, такие как эмбриональные стволовые клетки (ЭСК), эмбриональные половые клетки (ЭПК), зародышевые стволовые клетки (ЗСК) и индуцированные плюрипотентные стволовые клетки (ИПСК); мультипотентные стволовые клетки, такие как мезенхимальные стволовые клетки, гемопоэтические стволовые клетки и нервные стволовые клетки, и унипотентные стволовые клетки (клетки-предшественники), такие как клетки - предшественники миокарда, клетки - предшественники эндотелия сосудов, нейрональные клетки - предшественники; клетки - предшественники жировых клеток, фибробласты кожи, миобласты скелетной мускулатуры, остеобласты и одонтобласты; и зрелые клетки, такие как клетки миокарда, васкулярные эндотелиальные клетки, нервные клетки, жировые клетки, кожные фиброциты, скелетные миоциты, остеоциты, гепатоциты (клетки печени), эндотелиальные клетки пупочной вены; лимфатические эндотелиальные клетки кожных микроструктур, кератиноциты, бронхиальные эпителиальные клетки, меланоциты, гладкомышечные клетки и клетки зубов. В предпочтительном варианте имеются ввиду мезенхимальные стволовые клетки.
[0013] Предлагаемый фторкаучук предпочтительно представляет собой каучук, не содержащий концевых групп -CF2H, с общим числом нефторированных концевых групп в каучуке (например, функциональных групп типа -COF, -СООН, связанная с водой -СООН, -СН2ОН, -CONH2 и -COOCH3) и концевых групп -CF2H не более 70 на 1×106 атомов углерода, и в более предпочтительном варианте не более 35 на 1×106 атомов углерода. Далее, в еще более предпочтительном варианте их число составляет не более 20 на 1×106 атомов углерода, и в наиболее предпочтительном варианте не более 10 на 1×106 атомов углерода.
Т.е. один из объектов настоящего изобретения представляет собой контейнер для введения, хранения или культивирования клеток млекопитающих, в котором поверхность, соприкасающаяся с клетками млекопитающих, образована из фторкаучука с общим числом нефторированных концевых групп и концевых групп -CF2H во фторкаучуке не более 70 на 1×106 атомов углерода.
[0014] Число групп -COF, -СООН, связанная с водой -СООН, -СН2ОН, -CONH2, -СООСН3 и -CF2H на 1×106 атомов углерода может быть рассчитано посредством инфракрасной спектроскопии на основе преобразования Фурье.
[0015] Кроме того, предлагаемый фторкаучук достаточен, если он содержит одну или более концевых групп -CF3 имеет более стабилизированную концевую структуру; и предлагаемый фторкаучук включает в себя фторкаучук, в котором часть нефторированных концевых групп фторирована и имеют -CF3.
[0016] Анализ концевой группы -CF3 может быть выполнен посредством высокотемпературных измерений ядер 19F путем ядерно-магнитного резонанса (ЯМР).
[0017] В настоящем изобретении «нефторированная концевая группа» означает концевой элемент, обладающий некоторой степенью реакционной способности и, как правило, называемый «нестабильным концевым элементом», и в частности содержащий такие функциональные группы как -COF, -СООН, связанная с водой -СООН, -СН2ОН, -CONH2 и -СООСН3.
[0018] Общее число нефторированных концевых групп (например функциональных групп, таких, как -COF, -СООН, связанная с водой -СООН, -СН2ОН, -CONH2 и -СООСН3) в предлагаемом фторкаучуке в предпочтительном варианте составляет не более 70 на 1×106 атомов углерода, в более предпочтительном варианте не более 50 на 1×106 атомов углерода, в еще более предпочтительном варианте не более 35 на 1×106 атомов углерода, в еще более предпочтительном варианте не более 15 на 1×106 атомов углерода, в еще более предпочтительном варианте не более 10 на 1×106 атомов углерода, в еще более предпочтительном варианте не более 5 на 1×106 атомов углерода, в наиболее предпочтительном варианте не более 2 на 1×106 атомов углерода.
Т.е. один из объектов настоящего изобретения представляет собой контейнер для введения, хранения или культивирования клеток млекопитающих, в котором поверхность, соприкасающаяся с клетками млекопитающих, образована из фторкаучука с одной или более концевыми группами -CF3, в котором число нефторированных концевых групп не более 70 на 1×106 атомов углерода.
[0019] Предлагаемый фторкаучук, в частности, включает в себя политетрафторэтилен (ПТФЭ), сополимер (ФЭП - сополимер фтор-этилен-пропилена) на основе тетрафторэтилена (ТФЭ) и гексафторпропилена (ГФП) и перфторалкокси сополимер (ПФА) на основе ТФЭ-перфторалкилвинилового эфира (ПФАВЭ); среди них ФЭП и ПФА могут быть использованы в предпочтительном примере, и ФЭП в менее предпочтительном примере.
[0020] «Сополимер на основе ТФЭ-ГФП» означает сополимер, содержащий по меньшей мере ТФЭ и ГФП. Т.е. «сополимер на основе ТФЭ-ГФП» содержит, в дополнение к двухкомпонентному сополимеру (сополимер ТФЭ / ГФП; ФЭП) ТФЭ и ГФП и к трехкомпонентному сополимеру, такому, как сополимер на основе ТФЭ, ГФП и винилфторида (ВФ) (сополимер ТФЭ/ГФП/ВФ), сополимер на основе ТФЭ, ГФП и винилиденфторида (ВДФ) (сополимер ТФЭ / ГФП / ВДФ) и сополимер на основе ТФЭ, ГФП и перфторалкил-винилового эфира (ПФАВЭ) (сополимер ТФЭ / ГФП / ПФАВЭ), а также к четырехкомпонентному сополимеру, такому как сополимер на основе ТФЭ, ГФП, ВФ и ВДФ (сополимер ТФЭ / ГФП / ВФ / ВДФ), сополимер на основе ТФЭ, ГФП, ВФ и ПФАВЭ (сополимер ТФЭ / ГФП / ВФ / ПФАВЭ) и к пятикомпонентному сополимеру, такому, как сополимер на основе ТФЭ, ГФП, ВФ, ВДФ и ПФАВЭ (сополимер ТФЭ / ГФП / ВФ / ВДФ / ПФАВЭ).
[0021] В предпочтительном варианте сополимер на основе ТФЭ и ГФП представляет собой сополимер ТФЭ / ГФП или сополимер ТФЭ / ГФП / ПФАВЭ. Соотношение масс ТФЭ и ГФП в таком сополимере ТФЭ / ГФП в предпочтительном варианте составляет от 80 до 97 / от 3 до 20, в более предпочтительном варианте от 84 до 92 / от 8 до 16. Далее, соотношение масс ТФЭ, ГФП и ПФАВЭ в сополимере ТФЭ / ГФП / ПФАВЭ в предпочтительном варианте составляет от 70 до 97 / от 3 до 20 / от 0,1 до 10, в более предпочтительном варианте от 81 до 92 / от 5 до 16 / от 0,3 до 5.
[0022] «Сополимер на основе ТФЭ-ПФАВЭ» означает сополимер, содержащий по меньшей мере ТФЭ и ПФАВЭ. Т.е. понятие «сополимер на основе ТФЭ-ПФАВЭ» охватывает, в дополнение к двухкомпонентному сополимеру ТФЭ и ПФАВЭ (сополимер ТФЭ/ПФАВЭ; ПФА), также и трехкомпонентный сополимер, такой как сополимер на основе ТФЭ, ПФАВЭ и гексафторпропилена (ГФП) (сополимер ТФЭ / ПФАВЭ / ГФП), сополимер на основе ТФЭ, ПФАВЭ и винилиденфторида (ВДФ) (сополимер ТФЭ / ПФАВЭ / ВДФ) и сополимер на основе ТФЭ, ПФАВЭ и хлортрифторэтилена (ХТФЭ) (сополимер ТФЭ / ПФАВЭ / ХТФЭ), четырехкомпонентный сополимер, такой, как сополимер на основе ТФЭ, ПФАВЭ, ГФП и ВДФ (сополимер ТФЭ / ПФАВЭ / ГФП / ВДФ), сополимер на основе ТФЭ, ПФАВЭ, ГФП и ХТФЭ (сополимер ТФЭ / ПФАВЭ / ГФП / ХТФЭ) и сополимер на основе ТФЭ, ПФАВЭ, ВДФ и ХТФЭ (сополимер ТФЭ / ПФАВЭ / ВДФ / ХТФЭ), и пятикомпонентный сополимер, такой как сополимер на основе ТФЭ, ПФАВЭ, ГФП, ВДФ и ХТФЭ (сополимер ТФЭ / ПФАВЭ / ГФП / ВДФ / ХТФЭ).
[0023] ПФАВЭ, представляющий собой фрагмент ПФАВЭ, не ограничен, и его примеры могут включать в себя перфтор(метилвиниловый эфир) (ПФМВЭ), перфтор(этилвиниловый эфир) (ПФЭВЭ), перфтор(пропилвиниловый эфир) (ПФПВЭ), перфтор(бутилвиниловый эфир), перфтор(пентилвиниловый эфир), перфтор(гексилвиниловый эфир) и перфтор(гептилвиниловый эфир).
[0024] Соотношение масс ТФЭ и ПФАВЭ в сополимере на основе ТФЭ-ПФАВЭ предпочтительно составляет от 90 до 98 / от 2 до 10, и в более предпочтительном варианте от 92 до 97 / от 3 до 8.
[0025] Предлагаемый фторкаучук может быть изготовлен посредством фторирования концевых групп фторкаучука, синтезированного в соответствии с обычным способом суспензионной полимеризации, эмульсионной полимеризации и т.д., используя известный способ, такой как способ фторирования, в котором перед тем, как фторкаучук экструдируют в расплаве, фторкаучук и фторсодержащее соединение (например, источник фтор-радикалов) контактируют друг с другом для выполнения стабилизационной обработки, и способ, в котором гранулы фторкаучука, полученные после того, как экструдированный в расплаве фторкаучук, и фторсодержащее соединение контактируют друг с другом для выполнения фторирования. Далее, предлагаемый фторкаучук также может быть получен с использованием агента передачи цепи и катализатора полимеризации, способного контролировать концевые группы, вместе с мономером фтора в производстве (реакция полимеризации) фторкаучука. Далее, в качестве предлагаемого фторкаучука могут быть использованы продукты, доступные на рынке. Фторирование также может быть выполнено посредством введения фторсодержащего вещества в контакт с отливками из фторкаучука, например, пленки, отлитые из расплава фторкаучука, контейнеры из пленок, контейнеры, отлитые из фторкаучука. Далее, возможно сочетание этих способов обработки.
Т.е. не требуется, чтобы общее число нефторированных концевых групп и общее число нефторированных концевых групп и концевых групп -CF2H было не более 70 на 1×106 атомов углерода на каждом этапе использования фторкаучуков, гранул или пленок в качестве сырья; достаточно, чтобы на поверхности готового контейнера, соприкасающейся с клетками, общее их число не превышало 70 на 1×106 атомов углерода. Кроме того, в случае с фторкаучуком с одной или более концевыми группами -CF3, отсутствует необходимость в том, чтобы число концевых групп -CF3 составляло один или более на каждом этапе использования фторкаучуков, гранул и пленок в качестве сырья; достаточно, чтобы на поверхности готового контейнера, соприкасающейся с клетками, фторкаучук содержал одну или более концевых групп -CF3.
[0026] Источник фтор-радикалов конкретно не ограничен, но примеры могут включать в себя фторгалогенид, такой как IF5, ClF3, газообразный F2, CoF3, AgF2, UF6, OF2, N2F2 и CF3OF. Газообразный F2 в некоторых случаях может быть использован в концентрации 100%, но из соображений безопасности используется в смеси с инертным газом и разбавляется до диапазона от 5 до 50 масс. %, предпочтительно от 15 до 30 масс. %. Примеры инертного газа включают в себя азот, гелий, аргон, но с точки зрения экономической эффективности предпочтительно использование азота.
[0027] Фторирование выполняют при температуре предпочтительно от 20 до 220°C, и более предпочтительно от 100 до 200°C. Фторирование выполняют предпочтительно в течение от 5 до 30 ч, и более предпочтительно - от 10 до 20 ч.
[0028] Контейнер, полученный в соответствии с настоящим изобретением, представляет собой, как вариант, контейнер, в котором контролируются среднеарифметическая шероховатость (Ra) поверхности, среднеквадратическая шероховатость (RMS) поверхности и свободная энергия поверхности. Примеры контейнера включают в себя контейнеры с шероховатостью Ra внутренней поверхности контейнера от 3,5 до 6,5 нм, шероховатостью RMS поверхности от 4,5 до 8,0 нм, свободной энергией поверхности от 16,5 до 18,5 мДж/м2.
[0029] Примеры форм контейнера в соответствии с настоящим изобретением включают в себя чашку, луночный планшет, мешок, бутыль, центрифужную пробирку, колбу, шприц, трубку; при этом если контейнер, в соответствии с настоящим изобретением, представляет собой контейнер для введения клеток, то он предпочтительно представляет собой шприц, мешок (для капельницы), бутыль (для капельницы) и трубка; если контейнер, в соответствии с настоящим изобретением, представляет собой контейнер для хранения клеток, то он предпочтительно представляет собой чашку, луночный планшет, мешок, бутыль, центрифужную пробирку и колбу; если контейнер, в соответствии с настоящим изобретением, представляет собой контейнер для культивирования клеток, то он предпочтительно представляет собой планшет, луночный планшет, мешок и бутыль. В частности, контейнер в соответствии с настоящим изобретением, в форме мешка можно привести в качестве примера, поскольку он может применяться для любой области: введение, хранение и культивирование.
[0030] Чашка, луночный планшет, мешок, бутыль, центрифужная пробирка, колба, шприц, трубка и т.д. могут быть изготовлены способами формования, в том числе литье под давлением, экструзия, трансферное прессование, прессование, литье с раздувом, инжекционное литье, центробежное литье, экструзия пенопласта в сочетании со средствами уплотнения, такими как заварка, запайка, ультразвуковая сварка.
[0031] В частности, мешок может быть изготовлен складыванием пленок (листов) из предлагаемого фторкаучука и нагревом краев с использованием машину для импульсной сварки.
[0032] В качестве пленки, используемой для изготовления мешка, может быть использована однослойная пленка или многослойная пленка, состоящая из двух или более слоев; при этом если пленка состоит из нескольких слоев, достаточно изготовить мешок так, чтобы, по меньшей мере, внутренняя поверхность, соприкасающаяся с клетками млекопитающих, была слоем из предлагаемого фторкаучука, при этом остальные пленочные слои могут быть изготовлены из материала, отличного от предлагаемого фторкаучука (например, из полиолефинового каучука). Склеивание слоев выполняется с использованием таких способов, как способ горячего ламинирования, способ горячего прессования, способ высокочастотного нагрева, формование окунанием в раствор, ламинирование способом экструзии.
[0033] Кроме того, контейнер в соответствии с настоящим изобретением также может быть получен посредством обработки базового материала, такого как чашка, луночный планшет, мешок, бутыль, центрифужная пробирка, колба, шприц и трубка из стекла, металла, каучука и т.д. с нанесением покрытия, состоящего из предлагаемого фторкаучука. Любые способы могут быть применены в зависимости от формы базового материала. Примеры обработки с нанесением покрытия включают в себя нанесение покрытия методом центрифугирования, напыление, нанесение покрытия с удалением излишков с помощью планки, нанесение покрытий валиком, окунание, нанесение покрытия кистью, ротационная футеровка и электростатическое нанесение покрытия. На базовый материал наносится покрытие из фторкаучукового покрывающего агента, после этого выполняется сушка и высокотемпературная обработка для получения слоя покрытия. Толщина слоя подбирается по необходимости, с возможностью нанесения фторкаучукового покрытия из настоящего фторкаучука в два слоя.
[0034] Контейнер в соответствии с настоящим изобретением может быть использован, например, для криоконсервации жидкой среды, содержащей клетки млекопитающих, при этом среда, содержащая клетки млекопитающих, хранится (по меньшей мере 6 ч) при температуре, при которой жидкая среда на замерзает (обычно в диапазоне от 0 до 37°C, предпочтительно от 0 до 25°C (комнатная температура)), для производства культуры плавающих или адгезивных клеток млекопитающих в больших количествах посредством способа суспензионной культивации, или для ввода (трансплантации) жидкой среды, содержащей клетки млекопитающих, без перемещения в другой контейнер после ее хранения при температуре, при которой жидкая среда не замерзает.
[0035] Далее настоящее изобретение будет раскрыто более подробно на примерах, однако объем настоящего изобретения не ограничен этими примерами.
Пример 1
[0036] 1. Изготовление культуральных мешков
Три вида пленки размером 16 см × 15 см, толщиной 100 мкм запаивают посредством машины для импульсной сварки в условиях выдержки в течение 50 с, давления 0,2 МПа, с шириной свариваемой области 5 мм, чтобы получить 12 видов культуральных мешков (мешки от А до С (образцы сравнительных примеров 1-3), мешки от D до G (образцы примеров 1-4), мешок Н (образец сравнительного примера 4), мешки от I до K (образцы примеров 5-7) и мешок L (образец сравнительного примера 5)) (см. таблицу 2). В данном случае для культурального мешка М (образец сравнительного примера 6) используется культуральный мешок из поливинилхлорида (полученный посредством обработки квадратного мешка АСР-АМР Kawasumi, изготовленного компанией «Kawasumi Laboratories, Inc.») (см. таблицу 2).
[0037] 1.1. Измерение числа нефторированных концевых групп и числа концевых групп -CF2H
Образцы соответствующих каучуков толщиной около 250-300 мкм были изготовлены и проанализированы инфракрасной спектроскопией с использованием преобразования Фурье на спектрометре 1760Х (изготовлен компанией «PerkinElmer, Inc.»).
Образцы соответствующих каучуков толщиной около 250-300 мкм изготовлены посредством «раскатывания» гранул в гидравлическом прессе. Измерения были выполнены с использованием пленок (изготовленных из гранул посредством формования из расплава), представляющих собой культуральные мешки как они есть, если при этом толщина оказывалась недостаточной, то пленки накладывались друг на друга в несколько слоев.
[0038] Получены дифференциальные спектры стандартных образцов (образцов, фторированных достаточно до тех пор, пока по существу не исчезнет разность спектров); зафиксированы поглощения каждого пика; и рассчитано число нефторированных концевых групп и число концевых групп -CF2H на 1×106 атомов углерода для каждого образца с использованием следующего уравнения. Число нефторированных концевых групп и число концевых групп -CF2H в каждом культуральном мешке А-М показано в таблице 2.
[0039] Число нефторированных концевых групп и концевых групп -CF2H (на 1×106 атомов углерода) = 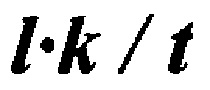 ,
,
где 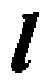 : поглощение,
: поглощение,
k: поправочный коэффициент (см. таблицу 1),
t: толщина образца (мм).

Столбец «До изготовления культурального мешка» в таблице означает, что образцы получены посредством «раскатывания» фторкаучуковых гранул, используемых для изготовления культурального мешка.
Столбец «После изготовления культурального мешка» в таблице означает, что образцы получены из пленок (изготовленных посредством формования из расплава из гранул), образующих культуральные мешки.
[0042] 1.2. Измерение наличия / отсутствия концевой группы -CF3
Соответствующие каучуковые пленки были расплавлены при температуре 370°C, и из них изготовили нити; затем их спектры были измерены посредством высокотемпературного ядерно-магнитного резонанса на ядрах 19F на ЯМР-спектрометре AVANCE 300WB (изготовлен компанией «Bruker Corp.»).
[0043] Получены разностные спектры от нитей, изготовленных посредством расплава каучуков с тем же самым составным соотношением, как и у соответствующих смол, и в которых отсутствуют концевые группы -CF3; когда пик наблюдался при δ=-82 ppm, принималось решение о присутствии концевых групп -CF3, и когда пик не наблюдался при δ=-82 ppm, принималось решение об отсутствии концевых групп -CF3. Наличие / отсутствие концевых групп -CF3 в каждом из культуральных мешков А-М показано в таблице 3.

Пример 2
[0045] 2. Хранение в культуральном мешке человеческих костномозговых мезенхимальных стволовых клеток (чМСК)
В случае хранения клеток в культуральном мешке, изготовленном по примеру 1, было проанализировано, происходит ли предотвращение адгезии, чтобы обеспечить возможность хранения клеток в плавающем состоянии.
[0046] 2.1. Способ
2.1.1. Приготовление жидкой среды для хранения клеток
Инъекция Lactec®, содержащая 6,0 масс. / об. % трегалозу (изготовлена компанией «Otsuka Pharmaceutical Factory, Inc.») и инъекция низкомолекулярного декстрана L (инъекция Lactec, содержащая 10 масс. / об. % декстрана) (изготовлена компанией «Otsuka Pharmaceutical Factory, Inc.») были смешаны в соотношении 1:1 для приготовления жидкой среды для хранения клеток.
[0047] 2.1.2. Приготовление клеток млекопитающих
[1] 4×105 чМСК (изготовлены компанией «Lonza Ltd.», РТ-2501) были культивированы в присутствии культуральной среды мультипотентных мезенхимальных стромальных клеток (МСК) (изготовлена компанией Lonza Ltd.», РТ-3001) в колбе 75 см2, в инкубаторе при температуре 37°C в 5% CO2, и субкультивированы с конфлюэнтностью ок. 90% обычным способом.
[2] Культуральную среду для субкультивированных чМСК (клетки субкультивированы три раза, конфлюэнтность ок. 100%) был удален аспиратором; чМСК промыли фосфатно-солевым буферным раствором (ФСБР, изготовлен компанией «Invitrogen Corp.») в количестве 8 мл на колбу.
[3] ФСБР был удален аспиратором; и был добавлен трипсин-ЭДТА (изготовлен компанией «Lonza Ltd.», СС-3232) в количестве 3,75 мл на колбу и выдержан при комнатной температуре в течение 5 мин.
[4] Полученное было медленно встряхивали, пока ок. 90% чМСК не было очищено под наблюдением под микроскопом.
[5] Культуральная среда МСК в количестве 3,75 мл на колбу была добавлена, чтобы остановить реакцию с трипсином; чМСК извлекли капельно и перенесли в центрифужную пробирку объемом 50 мл.
[6] Полученное было подвергнуто центрифугированию при 600×g в течение 5 мин. при температуре 25°C.
[7] Надосадочную жидкость была удаена аспиратором; добавлена жидкая среда для хранения клеток в количестве 3 мл на колбу, и осадочные чМСК были суспензиронаны.
[8] Было отобрано 10 мкл жидкой суспензии чМСК-КМ; количество клеток было измерено с использованием пластины для подсчета клеток; жидкая среда для хранения клеток была добавлена так, что количество клеток доведено до 5×105 клеток/мл, затем полученное было охлаждено льдом.
[0048] 2.1.3. Хранение клеток млекопитающих
[1] Был выполнен посев 3 мл жидкой среды для хранения клеток, содержащей 5×105 клеток чМСК / мл в каждый из 13 типов культуральных мешков А-М.
[2] После успокоения клеточной суспензионной массы и выдержки в течение 6 ч в инкубаторе (25°C, 5% CO2) (изготовлен компанией «As One Co., Ltd.», PIC 100), часть ее (20 мкл) была извлечена и смешана с 20 мкл 0,4% трипанового синего (изготовлен компанией «Gibco»); концентрацию клеток и число живых клеток в клеточной суспензии измерили под микроскопом (ECLIPSE TS100, изготовлен компанией «Nikon Corp.») с использованием пластин для подсчета клеток; рассчитали соответствующие коэффициент извлечения клеток (см. таблицу 4, 7 и 10) и коэффициент выживаемости клеток (см. таблицу 5, 8 и 11). Затем часть мешка была разрезана ножницами и положена на 6-луночный планшет; и было выполнено наблюдение за адгезией клеток к мешку под микроскопом (IX-70, изготовлен компанией «Olympus Corp.»). В данном случае результаты, представленные в таблицах 4-6, 7-9 и 10-12, были получены в результате независимых экспериментов (с различным временем приготовления чМСК).

Коэффициент извлечения клеток (%) обозначает отношение общего числа клеток в суспензии после хранения и общего числа клеток в суспензии сразу после начала хранения («До») ([общее число клеток в суспензии после хранения / общее число клеток в суспензии сразу после начала хранения («До») × 100]) (среднее значение ± стандартное отклонение, n=3). В данном случае в этой таблице значки «**» и «***» указывают на статистически значимое расхождение (р<0,01 и р<0,001 соответственно) от культурального мешка L (образец сравнительного примера 5) по методу Даннетта.

Коэффициент выживаемости клеток (%) указан как отношение числа живых клеток и общего числа клеток в клеточной суспензии ([число живых клеток в клеточной суспензии / общее число клеток в клеточной суспензии × 100]) (среднее значение ± стандартное отклонение, n=3). В данном случае в этой таблице значок «*» указывает на статистически значимое расхождение (р<0,05) от культурального мешка L (образец сравнительного примера 5) по методу Даннетта.

Коэффициент извлечения живых клеток указан как значение коэффициента извлечения клеток, умноженное на значение коэффициента выживаемости клеток (среднее значение ± стандартное отклонение, n=3). В данном случае в этой таблице значки «**» и «***» указывают на статистически значимое расхождение (р<0,01 и р<0,001 соответственно) от культурального мешка L (образец сравнительного примера 5) по методу Даннетта.
[0052] 2.2. Результаты
Коэффициент извлечения чМСК после хранения, как показано в таблице 4, в случае с использованием культуральных мешков А, В, С, Н, L и М (образцы сравнительных примеров 1, 2, 3, 4, 5 и 6), составил 39%, 43%, 34%, 40%, 38%) и 36% соответственно, а при использовании культуральных мешков D, F, G, J и K (образцы примеров 1, 3, 4, 6 и 7) соответственно 50%, 69%, 99%, 70% и 80%.
[0053] Далее, коэффициент выживаемости чМСК после хранения, как показано в таблице 5, в случае использования культуральных мешков D, F, G, J и K (образцы примеров 1, 3, 4, 6 и 7), составил соответственно 93%, 96%, 93%, 95% и 96%, в любом случае показатель достиг значения 90% и выше.
[0054] Следовательно, коэффициенты извлечения (коэффициент выживаемости клеток × коэффициент извлечения клеток) чМСК после хранения, как показано в таблице 6, оказались выше (46%, 66%, 92%, 66% и 77% соответственно) при хранении в культуральных мешках D, F, G, J и K (примерные образцы 1, 3, 4, 6 и 7) по сравнению с (34%, 37%, 31%, 37%, 31% и 32% соответственно) хранением в культуральных мешках А, В, С, Н, L и М (образец сравнительного примера 1, 2, 3, 4, 5 и 6).

Коэффициент извлечения клеток (%) указан как отношение общего числа клеток в клеточной суспензии после хранения и общего числа клеток в суспензии сразу после начала хранения («До») ([общее число клеток в клеточной суспензии после хранения / общее число клеток в суспензии сразу после начала хранения («До») × 100]) (среднее значение ± стандартное отклонение, n=3). В данном случае в этой таблице значок «***» указывает на статистически значимое расхождение (р<0,001) относительно культурального мешка L (образец сравнительного примера 5) по методу Даннетта.

Коэффициент выживаемости клеток (%) указан как отношение числа живых клеток и общего числа клеток в клеточной суспензии ([число живых клеток в клеточной суспензии / общее число клеток в клеточной суспензии × 100]) (среднее значение ± стандартное отклонение, n=3).

Коэффициент извлечения живых клеток указан как значение коэффициента извлечения клеток, умноженное на значение коэффициента выживаемости (среднее значение ± стандартное отклонение, n=3). В данном случае в этой таблице значок «***» указывает на статистически значимое расхождение (р<0,001) относительно культурального мешка L (образец сравнительного примера 5) по методу Даннетта.
[0058] 2.3. Результаты
Коэффициент извлечения чМСК после хранения, как показано в таблице 7, составил в случае использования культуральных мешков В и L (образцы сравнительных примеров 2 и 5) 30% и 25% соответственно, а при использовании культурального мешка G (образец примера 4) - 80%.
[0059] Кроме того, коэффициент выживаемости чМСК после хранения, как показано в таблице 8, при использовании культурального мешка G (образец примера 4) составил 95%.
[0060] Следовательно, коэффициенты извлечения (коэффициент выживаемости клеток × коэффициент извлечения клеток) чМСК, выживших после хранения, как показано в таблице 9, оказались выше (76%) при хранении в культуральном мешке G (образец примера 4), чем при хранении в культуральном мешке В и L (27% × 22% соответственно) (образцы сравнительных примеров 2 и 5).

Коэффициент извлечения клеток (%) указан как отношение общего числа клеток в клеточной суспензии после хранения к общему числу клеток в клеточной суспензии сразу после начала хранения («До») (общее число клеток в клеточной суспензии после хранения / общее число клеток в клеточной суспензии сразу после начала хранения («До») × 100) (среднее значение ± стандартное отклонение, n=3). В данном случае в таблице «*» указывает на статистически значимое расхождение (р<0,05) относительно культурального мешка В (образец сравнительного примера 2) по методу Даннетта.

Коэффициент выживаемости клеток (%) указан как отношение числа живых клеток и общего числа клеток в клеточной суспензии (число живых клеток в клеточной суспензии / общее число клеток в клеточной суспензии × 100) (среднее значение ± стандартное отклонение, n=3).

Коэффициент извлечения живых клеток указан как значение коэффициента извлечения клеток, умноженное на значение коэффициента выживаемости клеток (среднее значение ± стандартное отклонение, n=3). В данном случае в таблице «*» указывает на статистически значимое расхождение (р<0,05) относительно культурального мешка В (образец сравнительного примера 2) по методу Даннетта.
[0064] 2-4 Результаты
Коэффициент извлечения чМСК после хранения, как показано в таблице 10, при использовании культурального мешка В (образец сравнительного примера 2), составил 49%, а при использовании культуральных мешков Е, F, I и K (образцы примеров 2, 3, 5 и 7) - 83%, 75%, 84% и 67% соответственно.
[0065] Кроме того, коэффициенты выживаемости чМСК после хранения, как показано в таблице 11, в случае использования культуральных мешков Е, F, I и K (образцы примеров 2, 3, 5 и 7), были равны 93%, 93%, 91% и 92% соответственно, в любом случае показатель достиг значения 90% и выше.
[0066] Следовательно, коэффициенты извлечения (коэффициент выживаемости клеток × коэффициент извлечения клеток) чМСК, выживших после хранения, как показано в таблице 12, оказались выше (77%, 69%, 76% и 61% соответственно) при хранении в культуральных мешках Е, F, I и K (образцы примеров 2, 3, 5 и 7), чем при хранении в культуральном мешке В (45%) (образец сравнительного примера 2).
[0067] Кроме того, чМСК после хранения прилипают к внутренней поверхности культуральных мешков А-С, Н, L и М (образцы сравнительных примеров 1-3, 4, 5 и 6), и, наоборот, адгезивность к внутренней поверхности культуральных мешков D-G и I-K предотвращена (образцы примеров 1-4, 5-7); в частности, чМСК практически не прилипали к внутренней поверхности культуральных мешков Е-G и I-K (образцы примеров 2-4 и 5-7).
Результаты показывают, что адгезивность живых клеток в значительной степени снижена при хранении клеток в культуральных мешках D-G и I-K (образцы примеров 1-4 и 5-7) по сравнению с хранением клеток в культуральных мешках А-С, Н, L и М (образцы сравнительных примеров 1-3, 4, 5 и 6).
Пример 3
[0068] 3. Культивирование клеток 10Т1/2, полученных из мезенхимальных стволовых клеток мышей, с использованием культурального мешка
При выполнении культивирования клеток с использованием культуральных мешков, изготовленных по примеру 1, проанализирована возможность предотвращения адгезии, чтобы обеспечить культивирование клеток в плавающем состоянии.
[0069] 3.1. Способ
[1] Клетки 10Т1/2, полученные из мезенхимальных стволовых клеток мышей, взвесили в культуральной среде DMEM (изготовлена компанией «Nacalai Tesque, Inc.», 08458-45), содержащей 10% FBS (изготовлено компанией technologies Corp.» по стандарту компании «Gibco»), с доведением концентрации до уровня 1,0×105 клеток / мл; выполнили посев 3 мл суспензии в два вида культуральных мешков: В (образец сравнительного примера 2) и G (образец примера 4).
[2] Культивирование выполняли в инкубаторе (37°C, 5% CO2); часть (10 мкл) каждой клеточной суспензии извлекли через 4 ч, 1, 2, 3 и 6 дней и смешали с 10 мкл 0,4%-го трипанового синего (изготовлен компанией «Gibco»); число живых клеток измерили с использованием пластины для подсчета клеток, рассчитали коэффициент выживаемости клеток. Далее, наблюдение за клетками, прилипшими к культуральным мешкам, выполняли через оптический микроскоп (изготовлен компанией «Nikon Corp.»).
[0070] 3.2. Результаты
Коэффициент выживаемости клеток 10Т1/2 после культивирования составил 70% и выше в обоих случаях с использованием культурального мешка G (образец примера 4) и культурального мешка В (образец сравнительного примера 2). А доля клеток 10Т1/2, прилипших к внутренней поверхности мешка после культивирования, оказалась ниже при использовании культурального мешка G по сравнению с культуральным мешком В.
Результат показывает, что адгезивность живых клеток может быть значительно снижена при культивировании клеток в культуральном мешке G (образец примера 4) по сравнению с культивированием клеток в культуральном мешке В (образец сравнительного примера 2).
[0071] Результаты примеров 1-3 показывают, что при введении, хранении или культивировании с использованием культуральных мешков D-G и I-K (образцы примеров 1-7) клеточная адгезия к внутренней поверхности контейнера может быть эффективно предотвращена, и коэффициент выживаемости клеток может быть эффективно улучшен, при этом возможно введение, хранение или приготовление среды, содержащей клетки, с высокой концентрацией клеток и с высокой долей живых клеток.
Промышленная применимость
[0072] В соответствии с настоящим изобретением возможно введение, хранение или приготовление среды, содержащей высокую концентрацию клеток и высокую долю живых клеток, что способствует регенеративной медицине с использованием сред (суспензий), содержащих клетки млекопитающих.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ (СО)ПОЛИМЕРИЗАЦИИ ФТОРИРОВАННЫХ ОЛЕФИНОВЫХ МОНОМЕРОВ | 1994 |
|
RU2128667C1 |
| КОМПОЗИЦИЯ ДЛЯ ЭЛЕКТРОХИМИЧЕСКОГО УСТРОЙСТВА, СМЕСЬ ПОЛОЖИТЕЛЬНОГО ЭЛЕКТРОДА, КОНСТРУКЦИЯ ПОЛОЖИТЕЛЬНОГО ЭЛЕКТРОДА И АККУМУЛЯТОРНАЯ БАТАРЕЯ | 2020 |
|
RU2787681C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭЛАСТОМЕРНЫХ ФТОРИРОВАННЫХ СОПОЛИМЕРОВ | 1990 |
|
RU2086565C1 |
| ФТОРИРОВАННЫЕ ТЕРМОПЛАСТИЧНЫЕ ЭЛАСТОМЕРЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2158273C2 |
| ФТОРИРОВАННЫЙ ЭЛАСТОМЕРНЫЙ ЛАТЕКС, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФТОРИРОВАННЫЙ ЭЛАСТОМЕР И ФОРМОВАННЫЙ ПРОДУКТ ИЗ ФТОРКАУЧУКА | 2005 |
|
RU2398796C2 |
| ФТОРОПЛАСТОВАЯ ПОРООБРАЗУЮЩАЯ КОМПОЗИЦИЯ И СПОСОБ ПОЛУЧЕНИЯ ФТОРОПЛАСТОВОЙ ПОРООБРАЗУЮЩЕЙ КОМПОЗИЦИИ | 2014 |
|
RU2554886C1 |
| СПОСОБ ПОЛУЧЕНИЯ МОДИФИЦИРОВАННЫХ СОПОЛИМЕРОВ ТЕТРАФТОРЭТИЛЕНА С ЭТИЛЕНОМ | 1999 |
|
RU2156776C1 |
| ФТОРЭЛАСТОМЕР | 1994 |
|
RU2136702C1 |
| СОПОЛИМЕРЫ НА ОСНОВЕ ВИНИЛИДЕНФТОРИДА ДЛЯ ТЕРМОАГРЕССИВОСТОЙКИХ МАТЕРИАЛОВ | 2013 |
|
RU2522590C1 |
| БРОМСОДЕРЖАЩИЕ СОПОЛИМЕРЫ НА ОСНОВЕ ВИНИЛИДЕНФТОРИДА ДЛЯ ТЕРМОАГРЕССИВОСТОЙКИХ МАТЕРИАЛОВ | 2009 |
|
RU2407753C2 |
Изобретение относится к области биохимии. Предложен контейнер для введения, хранения или культивирования клеток млекопитающих. Контейнер имеет образованную из фторкаучука с общим числом нефторированных концевых групп и концевых групп -CF2H во фторкаучуке не более 70 на 1×106 атомов углерода соприкасающуюся с клетками млекопитающих поверхность. Изобретение обеспечивает эффективное предотвращение адгезии клеток и повышение коэффициента выживаемости клеток. 4 з.п. ф-лы, 12 табл.
1. Контейнер для введения, хранения или культивирования клеток млекопитающих, в котором поверхность контейнера, соприкасающаяся с клетками млекопитающих, образована из фторкаучука с общим числом нефторированных концевых групп и концевых групп -CF2H во фторкаучуке не более 70 на 1×106 атомов углерода.
2. Контейнер для введения, хранения или культивирования клеток млекопитающих по п. 1, в котором фторкаучук представляет собой один из фторкаучуков, выбранных из следующей группы: сополимер на основе тетрафторэтилена и гексафторпропилена, сополимер на основе тетрафторэтилена и перфторалкил-винилового эфира.
3. Контейнер для введения, хранения или культивирования клеток млекопитающих по п. 1 или 2, причем контейнер представляет собой мешок.
4. Контейнер для введения, хранения или культивирования клеток млекопитающих по п. 3, причем клетки млекопитающих представляют собой адгезивные клетки.
5. Контейнер для введения, хранения или культивирования клеток млекопитающих по п. 3, причем клетки млекопитающих представляют собой мезенхимальные стволовые клетки.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| БЕЙДЕР Э.Я., ДОНСКОЙ А.А | |||
| и др., Опыт применения фторполимерных материалов в авиационной технике // Российский химический журнал, т | |||
| LII, N 3, 2008, стр.1-44 | |||
| ЕВСЮКОВА Н.В., Влияние технологических факторов и структуры модификаторов на гидрофобные свойства волокнистых материалов и изделий легкой промышленности // АВТОРЕФЕРАТ, Москва, 2010, стр.1-24. | |||
Авторы
Даты
2018-10-31—Публикация
2016-07-14—Подача