Область техники
Настоящее изобретение относится к области медицины, в частности, к онкологии и молекулярной биологии, и может быть использовано для оценки риска рецидива рака молочной железы после хирургического удаления опухоли.
Изобретение основано на оценке уровня экспрессии 3 генов, мРНК которых могут быть получены из образца опухолевой ткани пациента. При этом уровень экспрессии может быть измерен как известными способами, так и способом, описанным в настоящем изобретении.
Предшествующий уровень техники
Рак молочной железы (РМЖ) - это злокачественная опухоль железистой ткани молочной железы. В мире это наиболее частая форма рака среди женщин, поражающая в течение жизни от 1:13 до 1:9 женщин в возрасте от 13 до 90 лет. Это также второе по частоте после рака легких онкологическое заболевание в популяции в целом (считая и мужское население). Количество случаев рака молочной железы в развитых странах резко увеличилось после 1970-х годов. За этот феномен считают частично ответственным изменившийся стиль жизни населения развитых стран (в частности, то, что в семьях стало меньше детей и сроки грудного вскармливания сократились) [Мерабишвили В.М. (2011). Рак молочной железы: заболеваемость, смертность, выживаемость (популяционное исследование). Вопросы онкологии, 5, 609-615].
Новым шагом в лечении онкологических заболеваний является так называемый «индивидуальный подбор лечения». Известно, что важное место в схеме лечения больных РМЖ занимает химиотерапия. Ранее пациентки со схожими по клеточному строению типами опухолей проходили химиотерапию по одной и той же схеме. Детальные исследования транскриптома РМЖ позволили установить, что каждая опухоль обладает собственными, присущими только ей характеристиками. То есть при схожих клинических проявлениях и клеточном строении разные опухоли могут проявлять себя различным образом, в том числе, по-разному реагировать на проводимую медикаментозную терапию. Это определяется молекулярно-генетическими особенностями опухоли, в том числе, особенностями экспрессии определенных генов в опухолевых клетках.
В настоящее время выделяют несколько молекулярно-генетических классов РМЖ. Данная классификация предполагает деление первичных опухолей и метастазов в зависимости от наличия и плотности на поверхности раковых клеток рецепторов к биологически активным веществам-регуляторам (гормонам). Иммуногистохимическое типирование позволяет выделить группу пациентов, которым показано лечение противоопухолевыми эндокринными препаратами (препаратами, блокирующими определенные рецепторы раковых клеток, что приводит к снижению их пролиферативного потенциала).
Проблемы метастазирования и рецидива рака молочной железы являются одними из сложнейших в плане прогнозирования в онкологической практике и требующими разработки комплексного подхода для раннего выявления риска появления метастаз.
Из уровня техники известны различные методы построения подобных прогнозов, в том числе основанных на оценке уровня экспрессии мРНК генов. В частности, при построении прогнозов известно использование метода, основанного на полимеразной цепной реакции в реальном времени (ПЦР-РВ), который отличается от традиционных качественных и полуколичественных методов тем, что позволяет быстро и точно определить количество копий ДНК или кДНК в широком диапазоне концентраций [Aerts, J., Wynendaele, W., Paridaens, R., Christiaens, M.R., Van Den Bogaert, W., Van Oosterom, A. Т., & Vandekerckhove, F. (2001). A real-time quantitative reverse transcriptase polymerase chain reaction (RT-PCR) to detect breast carcinoma cells in peripheral blood. Annals of oncology official journal of the European Society for Medical Oncology ESMO (Vol. 12, pp. 39-46).]. Метод широко используют в мире, как для научных, так и клинических целей, благодаря высокой производительности: обычно проводят 96 реакций в одном опыте, а в последних моделях приборов - 384 реакции. В отличие от обычной полимеразной цепной реакции, когда количество продуктов определяют на конечной стадии реакции, ПЦР-РВ позволяет следить за накоплением продуктов в экспоненциальной фазе реакции. В этой системе наряду с праймерами используют зонд (пробу), меченный флуоресцентным красителем. Зонд является олигонуклеотидом, который гибридизуется с последовательностью ДНК/кДНК между двумя фланкирующими праймерами. ПЦР-РВ состоит из двух основных этапов: 1) гибридизации исследуемой матрицы с зондом и 2) ПЦР, катализируемой Таq ДНК-полимеразой, обладающей 5'-экзонуклеазной активностью, расщепляющей зонд, что приводит к появлению и нарастанию флуоресцентного сигнала. Обычно реакция продолжается около 2 часов (40 циклов), в приборах нового поколения - всего 40 мин. Результаты анализа становятся доступными сразу после завершения реакции.
Существующие тест-системы позволяют уточнить диагноз, предсказать риск метастазирования и рецидива и эффективность разных видов терапии. Однако в работе Thomassen et al. (Thomassen M, Tan Q, Eiriksdottir F, Bak M, Cold S, Kruse ТА. Prediction of metastasis from low-malignant breast cancer by gene expression profiling. Int J Cancer. 2007 Mar 1; 120(5):1070-5) показано, что наборы генов в профилях практически не пересекаются. Кроме того, они применимы для анализа определенных разновидностей рака молочной железы (LNN, чувствительных к эстроген-рецептору (ER+)) или для прогнозирования развития заболевания у пациентов, принимающих адъювантную терапию.
Группа van't Veer et al. (van't Veer LJ, Dai H, van de Vijver MJ, He YD, Hart AAM, Mao M, et al. Gene expression profiling predicts clinical outcome of breast cancer. Nature [Internet]. Nature Publishing Group; 2002 Jan 31; 415(6871):530-6) использовала чип Rosetta с 60-мерными олигонуклеотидами и разработала 70-генный профиль, с помощью которого можно предсказывать образование метастаз в течение пяти лет у пациентов с РМЖ типа LNN (lymph node-negative) с большей точностью, чем с помощью классического клинико-патологического подхода. Предложенный генный профиль описан в патенте US 7514209 В2 (MammaPrint).
В заявке на патент US 2011/0145176 A1 (РАМ50) описан метод, набор реагентов и микрочипов для диагностики заболевания РМЖ и прогнозирования эффективности терапии на основании измерений уровней экспрессии 50 генов-маркеров.
Набор из праймеров к 14 генам и реагенты для определения их экспрессии методом ПЦР-РВ, а также алгоритм интерпретации экспрессии этих генов, предложены в патенте US 7695915 В2 для прогнозирования образования метастазов при люминальной форме РМЖ.
Метод и набор реагентов для прогнозирования развития заболевания РМЖ с помощью шести наборов генов-маркеров описаны в заявке на патент US 2010/0035240 A1. Метод основан на оценке уровня экспрессии 135 генов методом количественной полимеразной цепной реакции в реальном времени в свежезамороженных образцах РМЖ. Метод позволяет оценить общую десятилетнюю выживаемость, вероятность появления отдаленных метастазов и поражения лимфатических узлов.
В патенте US 7622251 В2 (Oncotype DX™) предложены численные молекулярные индикаторы для предсказания вероятности успешного отклика на антиэстрогенный агент (тамоксифен) и химиотерапию пациентов с заболеванием РМЖ (ER+, LNN) без адъювантной терапии.
Наиболее близким по достигаемому техническому результату является диагностический тест Oncotype DX Breast Cancer Assay, применяемый для оценки риска возникновения рецидива рака молочной железы. С помощью данного теста можно получать дополнительную информацию и принимать решение о дальнейшем лечении. По результатам исследования определяется агрессивность опухоли, а также оценивается риск возникновения рецидива и необходимость химиотерапевтического лечения. Исследуя экспрессию 21-го гена (16 генов-маркеров - Ki-67, STK15, Survivin, Cyclin B1, MYBL2, Stromelysin 3, Cathepsin L2, ER, PR, Bcl-2, SCUBE2, GRB7, HER2, GSTM1, Cd68, BAG1, и 5 нормировочных генов - Beta-actin, GAPDH, RPLPO, GUS, TFRC), специалисты устанавливают вероятность рецидива в течение 10 лет. Сам показатель выражен числом от 0 до 100. При этом для проведения теста используются фрагменты опухолевой ткани, стабилизированные в формалине и зафиксированные в парафине. Дополнительная стадия подготовки пробы приводит к увеличению времени проведения теста и дополнительным затратам. Также к недостаткам можно отнести необходимость в осуществлении микродиссекции образца опухолевой ткани, что требует привлечения высококвалифицированных специалистов.
Анализ патентной документации свидетельствует о том, что поиск эффективных решений, направленных на построение прогнозов общей и безрецидивной выживаемости с учетом индивидуальных молекулярно-генетических особенностей рака молочной железы, является крайне актуальной задачей.
Раскрытие изобретения
Задачей предлагаемого технического решения является разработка новых диагностических маркеров РМЖ, позволяющих достоверно оценить риск развития рецидива после хирургического лечения, и наборов реагентов на их основе для оценки экспрессии генов-маркеров при проведении ПЦР. При этом проводить оценку риска рецидива РМЖ с помощью заявляемого набора реагентов можно с помощью известных из уровня техники методов, а также с помощью описанного ниже способа, являющегося, простым, чувствительным, надежным, применимым в условиях клинических или поликлинических медицинских учреждений.
Заявляемое изобретение расширяет арсенал диагностических тестов посредством получения новых диагностических маркеров РМЖ, позволяющих при сопоставимой достоверности и специфичности оценить риск развития рецидива после хирургического лечения.
Поставленная задача решается за счет создания набора реагентов для определения риска возникновения рецидива онкологических заболеваний молочной железы, содержащего реагенты для оценки экспрессии генов-маркеров при проведении ПЦР, включающие праймеры - прямые и обратные, и зонды, специфичные по отношению к генам-маркерам - ELOVL5, IGFBP6, TXNDC9, представленные в лиофилизированном виде или водном растворе.
В одном из вариантов осуществления изобретения набор реагентов включает, по крайней мере, 3 пары праймеров с последовательностями SEQ ID NO: 1-3 и SEQ ID NO: 4-6 - прямые и обратные, соответственно, и зонды с последовательностями SEQ ID NO: 7-9, специфичные по отношению к генам-маркерам ELOVL5, IGFBP6, TXNDC9.
Набор реагентов может дополнительно содержать праймеры и зонды, специфичные по отношению к генам FBXO42, GUSB, HCFC1, RPLP0 и ТРТ1, используемые для нормирования результатов ПЦР. В качестве таких праймеров и зондов могут быть использованы праймеры с последовательностями SEQ ID NO: 10-19 и зонды с последовательностями SEQ ID NO: 20-24 соответственно.
Для определения риска возникновения рецидива онкологических заболеваний молочной железы набор реагентов, помимо реагентов для оценки экспрессии генов-маркеров при проведении ПЦР, может содержать реагенты для выделения и очистки РНК из образца опухолевой ткани; реагенты для синтеза одноцепочечной кДНК на мРНК с использованием олигонуклеотидных праймеров; буферы для проведения ПЦР.
Изобретение также относится к планшету с набором реагентов для проведения ПЦР реакции при определении риска возникновения рецидива онкологических заболеваний молочной железы у человека, содержащему нанесенные на его лунки праймеры и зонды, специфичные по отношению к генам-маркерам - ELOVL5, ITGBP6, TXNDC9. В одном из вариантов осуществления изобретения на лунки планшета нанесены геноспецифические олигонуклеотидные праймеры прямые и обратные с последовательностями SEQ ID NO: 1-3 и SEQ ID NO: 4-6, соответственно, в лиофилизированном виде, и флуоресцентные зонды с последовательностями SEQ ID NO: 7-9. Праймеры могут содержаться в концентрации 250 нМоль. Зонд может содержать краситель FAM с параметрами возбуждения на длине волны 485 нм и эмиссии на длине волны 520 нм, взятый в концентрации 250 нМоль.
При определении риска возникновения рецидива онкологических заболеваний молочной железы у пациента с помощью заявляемых набора или планшета измеряют уровень экспрессии (количественной оценки представленности) генов-маркеров ELOVL5, IGFBP6, TXNDC9 или взвешенной суммы уровней экспрессии указанных генов-маркеров в образце опухолевой ткани пациента с последующей оценкой риска рецидива путем сравнения уровней экспрессии генов-маркеров с предопределенными пороговыми значениями.
В качестве образцов опухолевой ткани пациента могут быть использованы свежезамороженные клетки ткани, или клетки биопсии, или зафиксированные в парафине клетки. Измерение экспрессии генов-маркеров осуществляется методом ПЦР-РВ. Для измерения методом ПЦР-РВ предпочтительно использовать одноцепочечные кДНК, синтезированные на выделенных и очищенных из образца опухолевой ткани пациента мРНК. Синтез кДНК может быть осуществлен с использованием олигонуклеотидных неспецифических праймеров со случайной последовательностью нуклеотидов и с парами праймеров - прямыми и обратными, и зондами, специфичными по отношению к генам-маркерам, а также с парами праймеров и зондами, специфичными по отношению к генам FBXO42, GUSB, HCFC1, RPLP0 и ТРТ1 для нормирования результатов ПЦР, с получением для каждого из генов-маркеров ненормированных оценок уровней их экспрессии Q(g), последующим их нормированием и получением значений Qnorm(g) для каждого гена-маркера, вычислением на основе Qnorm (g) риска рецидива SR. с использованием формулы:
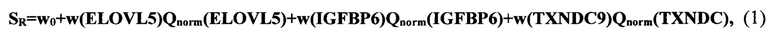
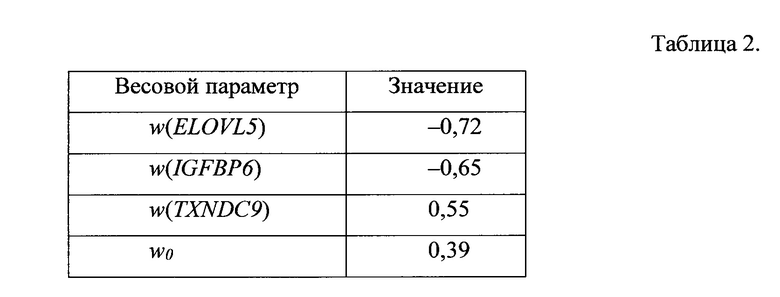
где w(ELOVL5)=-0,72, w(IGFBP6)=-0,65, w(TXNDC9)=0,55, w0=0,39;
Qnorm(ELOVL5), Qnorm(IGFBP6), Qnorm(TXNDC9) - нормированные уровни экспрессии генов-маркеров (или нормированные количественные оценки представленности генов), В качестве пороговых значений предпочтительно использовать, по крайней мере, два значения, при получении SR выше верхнего порогового значения делают вывод о высоком риске рецидива, при получении SR. ниже нижнего порогового значения - делают вывод о низком риске рецидива, при получении SR. из интервала значений, находящихся между указанными пороговыми значениями - делают вывод о неопределенном риске.
При использовании для нормирования результатов ПЦР в качестве праймеров SEQ ID NO: 10-19 и зондов SEQ ID NO: 20-24, специфичных по отношению к генам FBXO42, GUSB, HCFC1, RPLP0 и ТРТ1, при получении значения SR больше 0,2 - делают вывод о высоком риске возникновения рецидива, при значении SR меньше минус 0,2 - делают вывод о низком риске возникновения рецидива, при получении значения SR в интервале значений от минус 0,2 до 0,2 - считают риск неопределенным.
Краткое описание чертежей
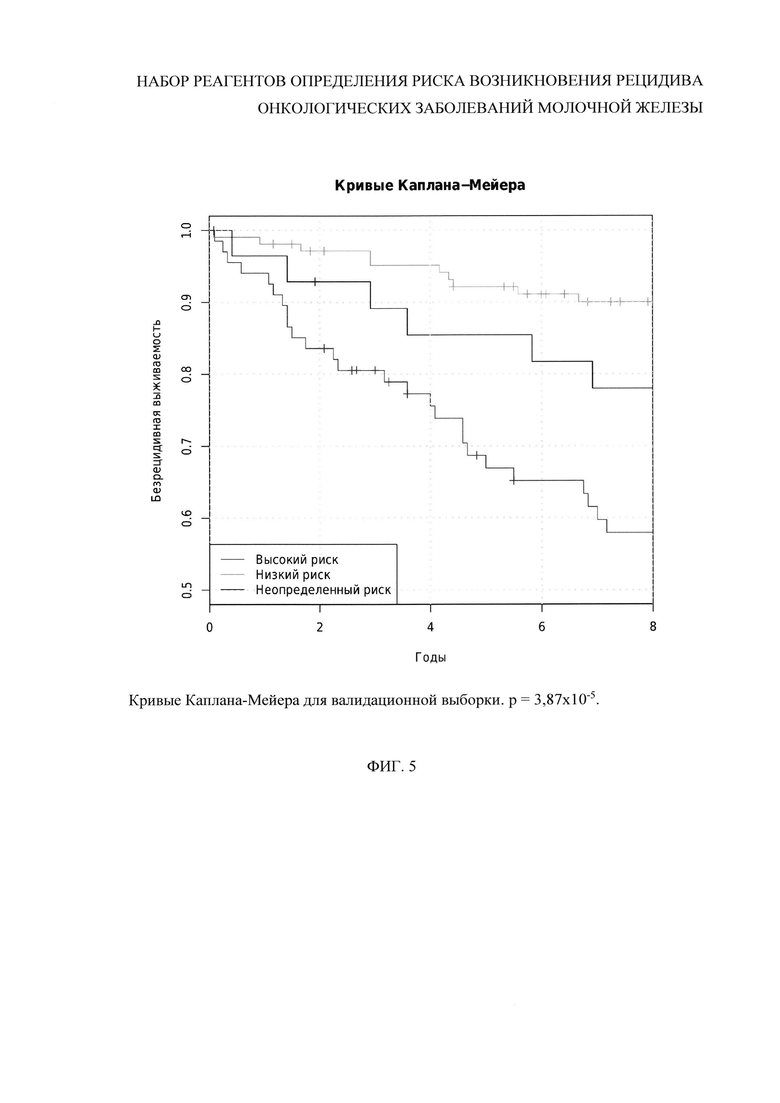
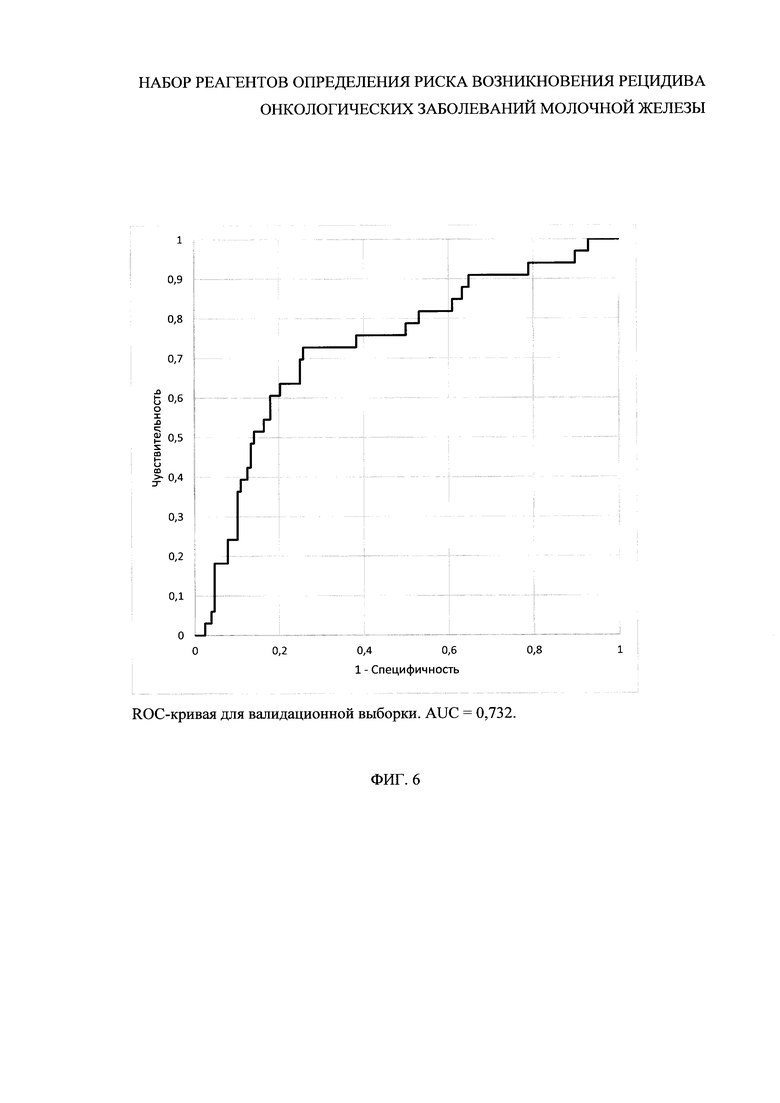
На фиг. 1 представлен пример последовательности прямых и обратных геноспецифических праймеров (последовательности SEQ ID NO: 1-3 и SEQ ID NO: 4-6). На фиг. 2 представлен пример последовательности зондов (SEQ ID NO: 7-9). На фиг. 3 - последовательности геноспецифических праймеров для нормирования результатов ПЦР (SEQ ID NO: 10-19) и зондами (SEQ ID NO: 20-24). На фиг. 4 представлена схема лунок планшета. На фиг. 5 и 6 представлены кривые Каплана-Мейера и ROC-кривая, построенные по валидационной выборке, подтверждающие работоспособность заявленного метода.
Осуществление изобретения
В изобретении представлены новые молекулярно-генетические маркеры для прогноза безрецидивной выживаемости после хирургического удаления первичной опухоли люминальной формы рака молочной железы, основанного на определении количественных оценок представленности мРНК 3 генов: ELOVL5, IGFBP6, TXNDC9. Это простой, надежный способ прогноза безрецидивной выживаемости на разных стадиях развития злокачественной трансформации, включая начальные. Функционал экспрессии 3 генов позволяет с высокой степенью достоверности оценить риск развития рецидива в первые пять лет после хирургического удаления первичной опухоли люминальной формы РМЖ.
В качестве образцов для проведения анализа могут быть использованы биоптаты, в том числе материал, полученный при игольчатой биопсии опухоли молочной железы.
В одном из вариантов осуществления изобретения при использовании для измерения экспрессии генов-маркеров метода ПЦР-РВ, может быть использована следующая последовательность действий:
- получение образца опухолевой ткани;
- выделение и очистка мРНК из образца;
- синтез одноцепочечных кДНК на мРНК с использованием олигонуклеотидных неспецифических праймеров со случайной последовательностью нуклеотидов;
- проведение ПЦР одноцепочечных кДНК с прямыми и обратными геноспецифическими праймерами и зондами, специфичными по отношению к исследуемым генам (генам-маркерам) - ELOVL5, IGFBP6, TXNDC9, и с парами геноспецифических праймеров и зондами для нормирования результатов ПЦР, например, специфичными по отношению к генам FBXO42, GUSB, HCFC1, RPLP0 и ТРТ1 с получением для каждого из перечисленных генов-маркеров их ненормированных количественных оценок представленности Q(g), последующим их нормированием и получением нормированных количественных оценок представленности Qnorm(g), вычислением риска рецидива (SR) по формуле (1), и при получении значения SR больше 0,2 - делают вывод о высоком риске возникновения рецидива, при значении SR меньше - 0,2 - делают вывод и низком риске возникновения рецидива, при получении значения SR в интервале от - 0,2 до 0,2 - считают риск неопределенным.
Способы выделения суммарной РНК из образцов тканей млекопитающих хорошо известны специалистам и, как правило, включают следующие стадии: измельчение в жидком азоте образцов опухолевых и нормальных тканей, лизис клеток, выделение РНК и ее очистку, проверку качества РНК электрофорезом в 1%-ном агарозном геле в присутствии красителя бромида этидия или в денатурирующем полиакриламидном геле, а также спектрофотометрическое определение количества РНК. Гомогенизацию кусочков тканей проводят вручную, растирая пестиком в керамической ступке, или с помощью механических гомогенизаторов, например, Omni Mixer или Micro-Dismembrator U фирмы Sartorius (Германия). Для выделения РНК используют различные протоколы, широко известные специалистам в данной области. В классических методах выделения РНК используют сильные хаотропные агенты, такие как гуанидинхлорид и гуанидинизотиоцианат, растворяющие белки, и последовательные экстракции фенолом и хлороформом для денатурации и удаления белков [Sambrook J., Fritsch E.F., Maniatis Т., Molecular Cloning. A laboratory Manual 2nd Edition ed. 1989, Cold Spring Harbour: CSHL Press]. Широко используют также метод с применением реагента Trizol [GIBCO/Life Technologies]. Для предотвращения разрушения РНК РНКазами используют ингибиторы, такие как игибитор RNAsin плацентарного или рекомбинантного происхождения, или, например, ванадил-рибозидный комплекс - неспецифический ингибитор РНКаз широкого спектра действия.
Быстрое и качественное выделение РНК проводят с использованием ряда коммерчески доступных наборов (Клоноген, Санкт-Петербург; RNeasy kits (Qiagen); SV Total RNA Isolation System, Promega (США) и т.д.). Использование различных приборов, например, QuickGene-810 (Life Science, Япония), позволяет исключить работу с агрессивными агентами, ускорить и упростить выделение РНК. Для экстракции РНК в этом приборе используют 80 мкм пористую мембрану, которая в 12,5 раз тоньше обычно используемого в таких приборах стеклянного фильтра (1000 мкм), что позволяет уменьшить деградацию РНК и увеличить ее выход.
Реакцию обратной транскрипции, в результате которой на РНК-матрице синтезируют одноцепочечную цепь ДНК, проводят с использованием коммерчески доступных препаратов обратных транскриптаз, таких как обратная транскриптаза вируса лейкоза мышей Молони (M-MLV), вируса миелобластоза птиц (AMV), PowerScript (точечная мутация M-MLV-RT), С. Therm Polymerase и др., с помощью которых можно получать продукты амплификации длиною до нескольких тысяч и даже несколько десятков тысяч пар нуклеотидов (т.п.н.). Может быть использована термостабильная ДНК-полимераза Thermus thermophilus (Tth), обладающая обратной транскриптазной активностью в присутствии ионов Mn2+.
Для обратной транскрипции могут быть использованы различные праймеры, например:
1) Олиго(с1Т)-содержащие праймеры связываются с эндогенным полиА-хвостом на 3'-конце мРНК. Эти праймеры наиболее часто используют для получения полноразмерных кДНК. К олиго(dT)-последовательности часто добавляют на 3'-конце нуклеотиды А, С или G, чтобы «заякорить» праймер на границу транскрипта и поли-А тракта;
2) Случайные гексануклеотидные праймеры (статистические затравки) гибридизуются с РНК в многочисленных участках. При обратной транскрипции с этими праймерами получают короткие кДНК. Случайные гексамеры используют для преодоления трудностей, связанных со вторичной структурой РНК, они более эффективны при обратной транскрипции 5'-областей мРНК;
3) Гексамеры или другие короткие олигонуклеотиды (10-12 нуклеотидов) случайного состава могут быть также использованы в комбинации с олигоГГ-содержащими праймерами;
4) Специфические олигонуклеотидные праймеры используют для транскрипции участка мРНК, представляющего интерес для исследования. Эти праймеры успешно применяют для диагностических целей.
Выбор специфических праймеров и зондов осуществляют способом, хорошо известным специалистам в данной области, для чего используют имеющиеся программы, многие из которых находятся в свободном доступе в Интернете, например, Genome Browser Gateway, BLAST, Primer3 и др.
Высокая специфичность ПЦР-РВ обеспечивается за счет использования зонда, содержащего на 5'-конце флуорофор или флуоресцентный краситель (в данном случае, FAM-6-carboxy-fluoroscein), а на 3'-конце - т.н. гаситель (в данном случае - RTQ1). В процессе ПЦР их взаимодействие нарушается за счет расщепления зонда Taq ДНК полимеразой благодаря ее 5'-экзонуклеазной активности, при этом происходит эмиссия флуоресценции. Подбор зондов для проведения ПЦР-РВ осуществляется в соответствии со стандартными рекомендациями и требованиями метода.
В одном из вариантов осуществления изобретения предложено использовать праймеры и зонды SEQ ID NO: 1-24 (фиг. 1, 2 и 3).
При оценке уровня мРНК генов на вход поступает соответствующий результатам одного ПЦР-исследования биологического образца набор значений пороговых циклов Ср (p=1,2,…,24), где значение порогового цикла Ср соответствует пробе (лунке Планшета) р, пробы 1-3 соответствуют гену ELOVL5, пробы 4-6 - гену IGFBP6, пробы 7-9 - гену TXNDC9, пробы 10-12 - гену FBXO42, пробы 13-15 - гену GUSB, пробы 16-18 - гену HCFC1, пробы 19-21 - гену RPLP0 и пробы 22-24 - гену ТРТ1. При этом известными считаются соответствующие используемым праймерам эффективности ПЦР: E(ELOVL5), E(IGFBP6), E(TXNDC9), E(FBXO42), E(GUSB), E(HCFC1), E(RPLP0) и E(TPT1). Для праймеров SEQ ID NO: 1-6, 10-19 эти значения эффективностей ПЦР равны соответственно 1,842, 1,914, 1,807, 1,885, 1,870, 1,904, 1,889 и 1,765.
Сначала по значениям пороговых циклов определяют количество соответствующих транскриптов в отдельности по каждой пробе, соответствующей одному из генов-маркеров ELOVL5, IGFBP6, TXNDC9. Для этого для каждой из проб p=1,2,3 вычисляют величину 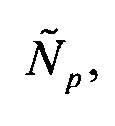 пропорциональную количеству мРНК ELOVL5 в исследуемом образце, по формуле
пропорциональную количеству мРНК ELOVL5 в исследуемом образце, по формуле
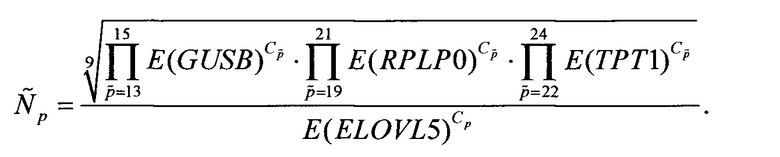
Аналогичным образом для каждой из проб p=4,5,6 вычисляют величину 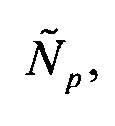 пропорциональную количеству мРНК IGFBP6 в исследуемом образце по формуле
пропорциональную количеству мРНК IGFBP6 в исследуемом образце по формуле
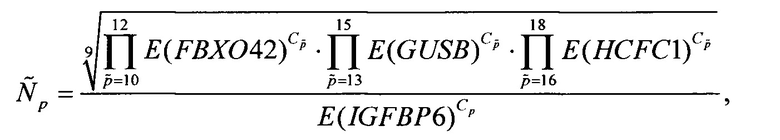
а для каждой из проб p=7,8,9 вычисляют величину  пропорциональную количеству мРНК TXNDC9 в исследуемом образце по формуле
пропорциональную количеству мРНК TXNDC9 в исследуемом образце по формуле
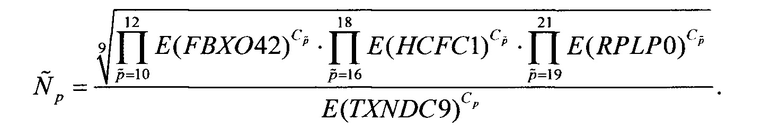
В приведенных формулах нормировка основывается на подходе, связанном с усреднением, использующим среднее геометрическое [Д.В. Ребриков, Г.А. Саматов, Д.Ю. Трофимов, П.А. Семенов, A.M. Савилова, И.А. Кофиади, Д.Д. Абрамов ПЦР «в реальном времени» - Москва: БИНОМ. Лаборатория знаний, 2009, п. 8.4; J. Vandesompele, K. De Preter, F. Pattyn, В. Poppe, N. Van Roy, A. De Paepe, F. Speleman Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes // Genome Biol., 2002, 3 (7): RESEARCH0034]. При этом для нормировки проб, ассоциированных с каждым из генов-маркеров, используется поднабор нормировочных генов с количеством мРНК по порядку наиболее близким к среднему количеству мРНК соответствующего гена-маркера.
Повторно используя усреднение, основывающееся на среднем геометрическом, в качестве ненормированной количественной оценки представленности гена-маркера ELOVL5 в образце биологического материала, берут среднее геометрическое по всем пробам, соответствующим этому гену:
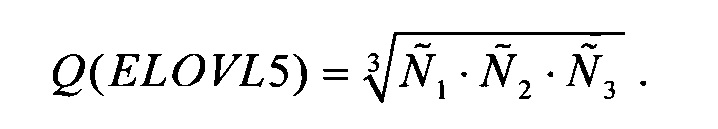
Аналогично в качестве ненормированной количественной оценки представленности гена-маркера IGFBP6 в образце биологического материала, берут среднее геометрическое по всем пробам, соответствующим этому гену:
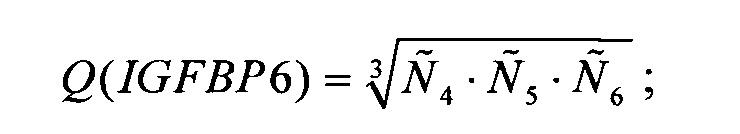
в качестве ненормированной количественной оценки представленности гена-маркера TXNDC9 в образце биологического материала, берут среднее геометрическое по всем пробам, соответствующим этому гену:
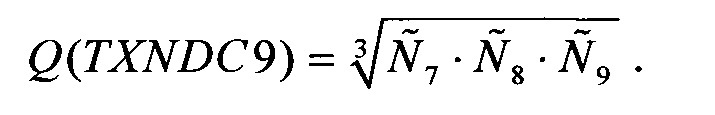
Для уменьшения вычислительных погрешностей вычисления 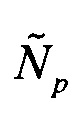 и Q(ELOVL5), Q(IGFBP6), Q(TXNDC9) могут осуществляться с использованием перехода в логарифмическую шкалу.
и Q(ELOVL5), Q(IGFBP6), Q(TXNDC9) могут осуществляться с использованием перехода в логарифмическую шкалу.
После того, как в рамках исследования образца биологического материала вычислены значения ненормированных количественных оценок представленности Q(ELOVL5), Q(IGFBP6), Q(TXNDC9), прогнозирование риска рецидива осуществляется применением линейного классификатора. На первом шаге осуществляется переход в логарифмическую шкалу и линейная нормировка: вычисляются нормированные количественные оценки представленности
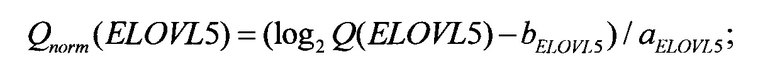
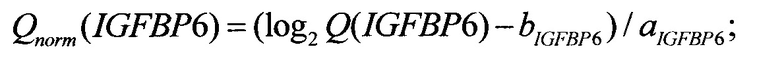
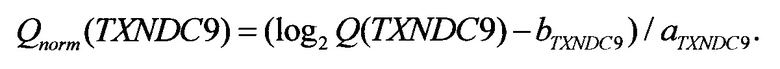
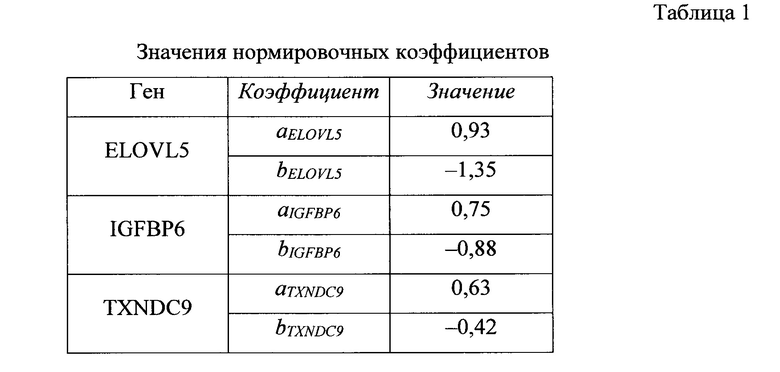
Нормировочные коэффициенты а и b выбираются на стадии калибровки системы таким образом, что для каждого гена-маркера ELOVL5, IGFBP6, TXNDC9 эмпирическое среднее величины Qnorm равно нулю, а эмпирическое среднеквадратическое отклонение - единице. Значения нормировочных коэффициентов могут зависеть от оборудования, используемого при проведении ПЦР-РВ, и коллекции образцов, по которой вычислялись эмпирические среднее и среднеквадратичное отклонения. Возможные значения нормировочных коэффициентов приведены в табл. 1.
Далее осуществляют вычисление значения риска рецидива РМЖ SR:
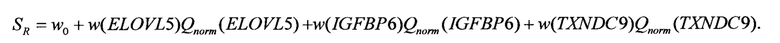
Значения весовых параметров w0, w(ELOVL5), w(IGFBP6), w(TXNDC9) приведены в табл. 2.
По значению SR осуществляют окончательное построение прогноза риска рецидива R: при значении больше 0,2 делают вывод о высоком риске рецидива, при значении меньше -0,2 делают вывод о низком риске рецидива, при значении между -0,2 и 0,2 считают риск неопределенным.
Формально, оба шага, осуществляемых при переходе от ненормированных количественных оценок представленности Q(ELOVL5), Q(IGFBP6), Q(TXNDC9) к значению риска рецидива SR, могут быть объединены в один, заключающийся в вычислении линейной комбинации логарифмов этих величин. Однако разбиение на два шага позволяет в рамках рассматриваемой системы при изменении используемого оборудования или даже используемого метода оценки количественной представленности генов-маркеров осуществлять пересчет только нормировочных параметров ag и bg, сохраняя значения весовых параметров w0 и w(ELOVL5), w(IGFBP6), w(TXNDC9).
Следует отметить, что отбор транскриптов, используемых непосредственно для формирования прогноза, осуществлялся на основе анализа данных о полногеномном транскриптоме более чем 400 пациентов, для которых имелась информация о возникновении и времени диагностирования рецидива (наборы данных GSE6532, GSE12093, GSE17705), а также собственных данных полногеномного транскриптомного анализа более чем 250 образцов тканей, пораженных РМЖ. В основе отбора лежало построение бинарного (двухклассового) классификатора, различающего пациентов, у которых был диагностирован рецидив, и пациентов, у которых рецидив диагностирован не был. При этом при построении обучающей выборки из рассмотрения была исключена так называемая «серая зона»: в первый класс были включены лишь пациенты, у которых рецидив был диагностирован в течение первых пяти лет после оперативного лечения, а во второй пациенты, у которых продолжительность безрецидивного периода составляла не менее семи лет.
При фиксированном наборе транскриптов для автоматизированного построения классификатора, использующего в точности этот набор транскриптов, применялся метод опорных векторов (SVM Supprot Vector Machine, см. С. Cortes, V. Vapnik Support-vector networks // Machine Learning, Vol. 20 (1995), 273-297) с линейным ядром и различными штрафами за ошибки разного рода.
Формирование итогового набора транскриптов осуществлялось автоматизированно с использованием полного перебора пар транскриптов и последующего достроения наиболее информативных пар до троек; достроение проводилось с использованием так называемого «жадного подхода», включающего добавление одного транскрипта к паре и последующей покомпонентной оптимизации (Galatenko V.V. и др. Highly informative marker sets consisting of genes with low individual degree of differential expression // Sci. Rep. 2015. T. 5. C. 14967; Галатенко В.В. и др. О построении медицинских тест-систем с использованием жадного алгоритма и метода опорных векторов // Бюллетень экспериментальной биологии и медицины. 2013. Т. 156. №11. С. 654-60).
Валидация итогового набора транскриптов и соответствующего этому набору классификатора осуществлялась на валидационной выборке, образцы которой не использовались ни при отборе транскриптов, ни при настройке классификатора: обучающие и валидационная выборки не пересекались не только по пациентам, но и по клиникам, в которых осуществлялся забор биоматериала, и по лабораториям, в которых проводились исследования этого биоматериала.
Осуществление изобретения
Изобретение поясняется следующими примерами осуществления.
Пример 1.
В примере представлена реализация способа оценки риска возникновения рецидива рака молочной у пациентки Инны У. на основе ПЦР-РВ. Выделение РНК:
а) брали образец биопсии опухолевой ткани молочной железы, законсервированный Реагентом для стабилизации мРНК;
б) анализируемый фрагмент биопсии опухолевой ткани молочной железы извлекали пинцетом из Реагента для стабилизации мРНК в предварительно подготовленную охлажденную фарфоровую ступку. Повторно охлаждали ступку и пестик жидким азотом до состояния, когда азот уже почти не испаряется;
в) осуществляли механическое дробление/перетирание образца в ступке;
г) добавляли в ступку 700 мкл Буфера А и 20 мл жидкого азота. Перетирали до получения однородной розоватой пудры. По завершению давали возможность ступке нагреться до комнатной температуры, а образцу растаять;
д) переносили все содержимое ступки в чистую пробирку на 1,5 мл и доводили объем гомогената до 1 мл, добавив 300 мкл Буфера А.
е) проводили стадию дополнительной гомогенизации. Для этого переносили 500 мкл гомогената на колонку QIAAshredder (Qiagen) или аналогичную. Центрифугировали 2 минуты при скорости >10000 об/мин. Раствор, прошедший через колонку, аккуратно отбирали в чистую пробирку. Повторяли процедуру для оставшегося образца. Объединяли гомогенизированные фракции;
ж) добавляли к образцу 200 мкл хлороформа и тщательно перемешивали на вортексе 15 сек. Инкубировали при комнатной температуре 2-3 мин;
и) центрифугировали при 4°С в течение 15 минут при 12000 об/мин;
к) переносили водную фазу (верхняя, неокрашенная) в чистую пробирку на 1.5-2 мл и определяли ее объем;
л) добавляли 1,5 объема от перенесенной водной фазы 100% этанола. Хорошо перемешивали с помощью пипетки;
м) переносили 500 мкл образца, включая осадок, если он выпал, на колонку RNeasy mini spin или аналогичную. Центрифугировали 15 сек при скорости >10000 об/мин. Удаляли раствор, прошедший через колонку;
н) повторяли предыдущий шаг для оставшегося раствора (с использованием той же самой колонки);
п) наносили на колонку 350 мкл Буфера В и центрифугировали 15 сек при скорости >10000 об/мин. Удаляли раствор, прошедший через колонку;
р) обрабатывали DNaseI. Переносили 80 мкл приготовленного раствора DNaseI на колонку RNeasy mini spin или аналогичную и инкубировали 15 мин при 20-30°С;
с) повторяли пункт п);
т) наносили на колонку 500 мкл Буфера Б, центрифугировали 15 сек при скорости >10000 об/мин. Удаляли раствор, прошедший через колонку;
у) добавляли 500 мкл Буфера Б на колонку и центрифугировали 2 мин при скорости >10000 об/мин;
ф) осторожно переносили колонку в чистую пробирку на 1,5 мл и центрифугировали еще 1 мин., чтобы полностью удалить остатки Буфера В;
х) переносили колонку в чистую пробирку на 1,5 мл для элюции образца. Аккуратно наносили 40 мкл воды деионизованной непосредственно на мембрану колонки. Центрифугировали 1 мин. при скорости >10000 об/мин;
ц) собирали элюированный раствор и снова наносили его на мембрану той же колонки RNeasy mini spin или аналогичную. Центрифугировали 1 мин при скорости >10000 об/мин;
ш) собранный элюированный раствор перемешивали, осаждали коротким центрифугированием и разделяли на 2 аликвоты. Держали полученный раствор РНК на льду;
щ) измеряли концентрацию выделенной тотальной РНК с помощью спектрофотометра NanoDrop или аналога;
э) Оценивали целостность выделенной тотальной РНК с помощью аппаратно-программной платформы Agilent 210 Bioanalyzer или аналога.
Проведение обратной транскрипции (ОТ):
а) пробирки с Буфером для проведения ОТ, смесью праймеров для проведения ОТ и водой деионизированной размораживали при комнатной температуре. Пробирку с Транскриптазой обратной помещали в лед;
б) приготавливали две пробирки, содержащие по 2 мкг выделенной РНК, и добавляли в каждую воды деионизированной до конечного объема 12 мкл;
в) инкубировали 5 мин. при 65°С. Переносили в лед;
г) смешивали 11 мкл Буфера для проведения ОТ, 1 мкл смеси праймеров для проведения ОТ, 1 мкл транскриптазы обратной. Перемешивали и добавляли по 13 мкл к 2 мкг РНК;
д) проводили синтез кДНК в программируемом автоматическом термоциклере по программе, представленной в табл.3

е) смешивали в одной пробирке полученные две пробы кДНК. Держали на льду. Проведение ПЦР-РВ
а) готовили разбавленные в 10 раз растворы кДНК исследуемого образца, Образца РНК клеток мозга контрольного и образца универсальной человеческой РНК контрольного. В табл.4 приведен расчет компонентов реакционной смеси для нанесения на Планшет с нанесенными реагентами.
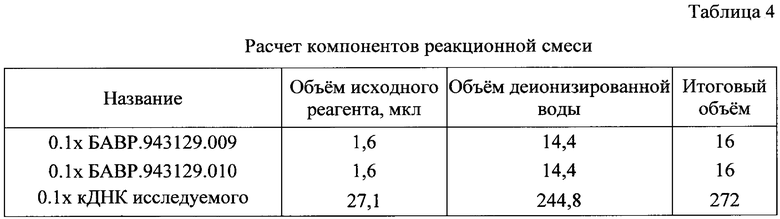
б) реакционные смеси для проведения ПЦР-РВ готовили в соответствии со схемой, представленной в табл.5 (приведен расчет для проведения ПЦР-РВ в одном из 384-луночных планшетов, состав смесей аналогичен).
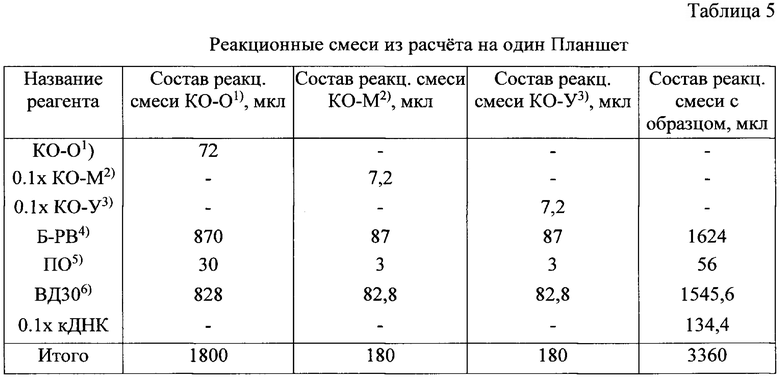
1)Контроль без примесей ДНК и РНК отрицательный
2)Образец РНК клеток мозга контрольный
3)Образец универсальной человеческой РНК контрольный
4)Буфер для проведения ПЦР-РВ (БАВР.943129.020)
5)Полимераза для проведения ПЦР-РВ (БАВР.943129.022)
6)Вода деионизированная (БАВР.943129.021)
в) добавляли по 12 мкл реакционной смеси в соответствующие лунки Планшета (схема лунок планшета на фиг. 4);
г) заклеивали заполненный планшет пленкой прозрачной для использования планшета. Встряхивали планшет на вортексе. Коротко центрифугировали планшет в центрифуге для осаждения капель со стенок и пленки на дно пробирок;
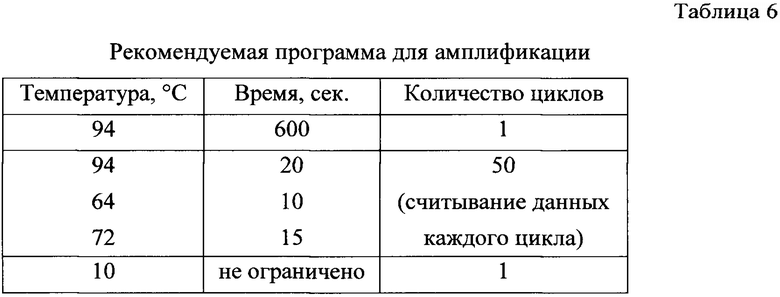
д) планшет ставили в амплификатор для ПЦР-РВ на 384 лунки. Рекомендуемая программа для амплификации представлена в табл.6
После проведения ПЦР-РВ биопсии пациентки Инны У. получены значения пороговых циклов, приведенные в табл.7.
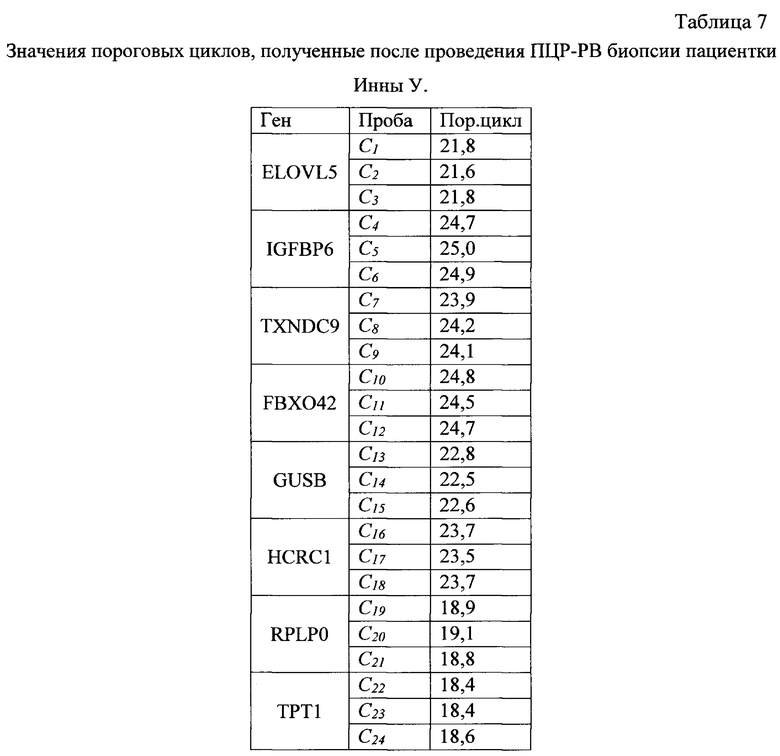
Осуществление вычисления в логарифмической шкале и учет значений
эффективностей ПЦР E(ELOVL5)=1,842, E(IGFBP6)=1,914, E(TXNDC9)=1,807, E(FBXO42)=1,885, E(GUSB)=1,870, E(HCFC1)=1,904, E(RPLP0)=1,889 и E(TPT1)=1,765, приводят к значениям
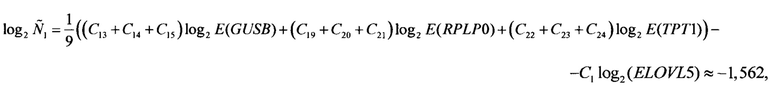
и, аналогично, 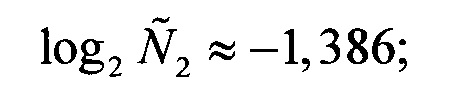
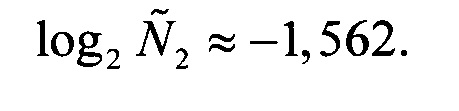 Соответственно,
Соответственно, 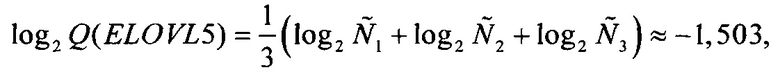 откуда
откуда 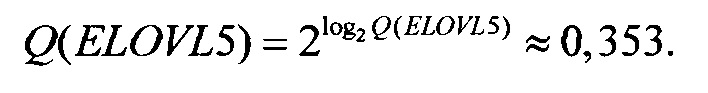
Следует отметить, что значение Q(ELOVL5) приведено исключительно для полноты изложения, так как на следующем шаге (при вычислении Qnorm(ELOVL5)) используется значение именно log2 Q(ELOVL5), а не самой Q(ELOVL5).
Аналогичные вычисления дают
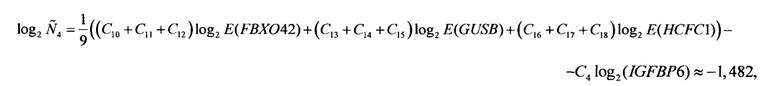
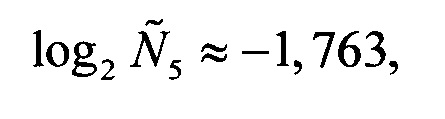
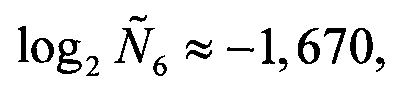
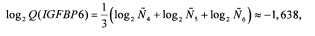
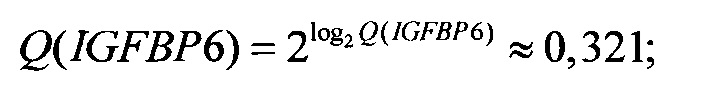
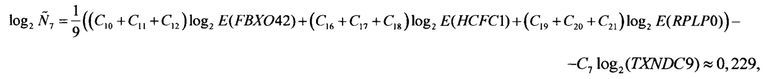
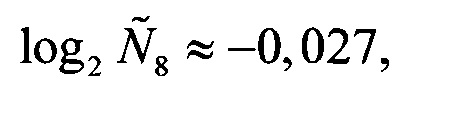
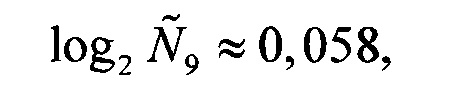
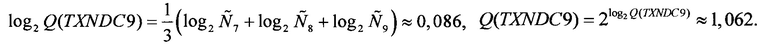
Далее вычисляются нормированные количественные оценки представленности генов-маркеров (см. Таблицу 1):
Qnorm(ELOVL5)=(log2 Q(ELOVL5)-(-1,351)) / 0,934 ≈ -0,163;
Qnorm(IGFBP6)=(log2 Q(IGFBP6)-(-0,876)) / 0,752 ≈ -1,014;
Qnorm(TXNDC9)=(log2 Q(TXNDC9)-(-0,417)) / 0,629 ≈ 0,800.
По нормированным количественным оценкам представленности генов-маркеров вычисляется коэффициент риска рецидива Sr (см. Таблицу 2):
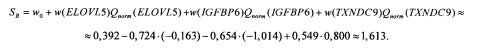
Так как полученное значение SR больше чем 0,2, сделан вывод о высоком риске рецидива РМЖ.
Пример 2.
В примере представлена реализация способа оценки риска возникновения рецидива рака молочной. Этап интерпретации нормированных количественных оценок экспрессии генов Qnorm. Представлены случаи с высоким и низким риском рецидива.
Вычисление ненормированных количественных оценок представленности генов по значениям пороговых циклов, полученных при ПЦР-РВ анализе образца.
Оценка риска возникновения рецидива по нормированным количественным оценкам представленности генов Qnorm.
2.1. После проведения ПЦР-РВ образца биопсии пациентки Екатерины А. и вычисления нормированных количественных оценок представленности генов получены следующие результаты: Qnorm(ELOVL5) = 0,418; Qnorm(IGFBP6) = 1,096; Qnorm(TXNDC) = -0,602. В этом случае значение коэффициента риска рецидива SR составило (см. Таблицу 2)
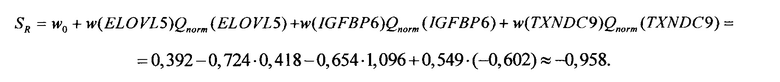
Так как полученное значение SR меньше чем -0,2, делается вывод о низком риске возникновении рецидива.
2.2. После проведения ПЦР-РВ образца биопсии пациентки Александры П. и вычисления нормированных количественных оценок представленности генов получены следующие результаты: Qnorm(ELOVL5) = -0,545; Qnorm(IGFBP6) = 0,199; Qnorm(TXNDC) = 0,438. В этом случае значение коэффициента риска рецидива SR составило (см. Таблицу 2)
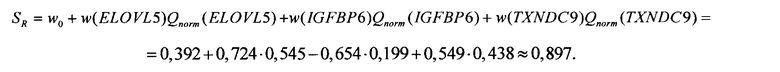
Так как полученное значение SR больше чем 0,2, сделан вывод о высоком риске возникновении рецидива РМЖ.
Валидация достоверности методики
Валидация достоверности описанной методики проведена на собственной коллекции данных, к которым применялся ПЦР-РВ анализ, а также на наборе GSE3494 микрочиповых данных (Miller L.D. et al. An expression signature for p53 status in human breast cancer predicts mutation status, transcriptional effects, and patient survival // Proc Natl Acad Sci USA. 2005. T. 102, №38. C. 13550-13555), не использовавшихся ни при выборе используемых генов-маркеров, ни при настройке классификатора. Валидация подтвердила высокую достоверность методики.
Так, кривые Каплана-Мейера и ROC-кривая, соответствующие микрочиповой валидации (201 образец, включая 33 образца, соответствующих возникновению рецидива в течение пяти лет, и 128 образцов, соответствующих безрецидивной выживаемости не менее 7 лет), приведены на Фиг. 5.
Оцененные по этой выборке частоты возникновения рецидивов у пациентов с низким, неопределенным и высоким риском развития рецидива составили соответственно 0,094 (9,4%), 0,160 (16,0%) и 0,412 (41,2%). Доля пациентов в классе с неопределенным риском составила всего 0,155 (15,5%). Значения чувствительности и специфичности составили соответственно 0,756 (75,6%) и 0,602 (60,2%) в случае объединения неопределенного риска с высоким, и соответственно 0,636 (63,6%) и 0,766 (76,6%) в случае объединения неопределенного риска с низким. При исключении из рассмотрения образцов с неопределенным риском чувствительность и специфичность составили соответственно 0,724 (72,4%) и 0,720 (72,0%).
Таким образом, экспериментальные данные показывают, что применение заявленного способа позволяет с высокой чувствительностью и специфичностью оценить риск развития рецидива после хирургического лечения с помощью новых диагностических маркеров РМЖ, а также разработать на их основе простой, чувствительный, надежный способ прогноза безрецидивной выживаемости.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ РИСКА ВОЗНИКНОВЕНИЯ РЕЦИДИВА ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2015 |
|
RU2626603C2 |
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДОВ ДЛЯ ОПРЕДЕЛЕНИЯ УРОВНЕЙ ЭКСПРЕССИИ ГЕНА PDLIM4 | 2015 |
|
RU2612139C1 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЧЕВОГО ПУЗЫРЯ (ВАРИАНТЫ) И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2011 |
|
RU2469323C2 |
| СПОСОБ СКРИНИНГА И МОНИТОРИНГА ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ (ВАРИАНТЫ) | 2012 |
|
RU2537263C2 |
| СПОСОБ ДИАГНОСТИКИ СВЕТЛОКЛЕТОЧНОЙ ПОЧЕЧНОКЛЕТОЧНОЙ КАРЦИНОМЫ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2545998C2 |
| СПОСОБ ДИАГНОСТИКИ ПЛОСКОКЛЕТОЧНОГО РАКА ЛЕГКОГО И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2014 |
|
RU2586779C2 |
| СПОСОБЫ И НАБОРЫ ДЛЯ МОЛЕКУЛЯРНОГО СУБТИПИРОВАНИЯ ОПУХОЛЕЙ | 2014 |
|
RU2690241C2 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ТЕРАПИИ РАКА МОЧЕВОГО ПУЗЫРЯ ЧЕЛОВЕКА МЕТОДОМ ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2011 |
|
RU2469098C2 |
| Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для определения экспрессии генов SOCS2, CD34, FAM30A, GPR56, DNMT3B, SPINK2 с последующим определением уровня относительной экспрессии относительно референс-гена ABL1, амплифицирумых в ПЦР-РВ, используемых для прогнозирования риска раннего рецидива у детей с острым миелоидным лейкозом после аллогенной трансплантации гемопоэтических стволовых клеток | 2022 |
|
RU2783950C1 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЧЕВОГО ПУЗЫРЯ С ПОМОЩЬЮ ОНКОМАРКЕРА TFDP1 (ВАРИАНТЫ) И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2011 |
|
RU2463354C1 |



Предложенная группа изобретений относится к области медицины, в частности, к онкологии и молекулярной биологии. Предложены набор реагентов и планшет для определения риска возникновения рецидива онкологических заболеваний молочной железы, включающие праймеры и зонды, специфичные по отношению к генам-маркерам ELOVL5, IGFBP6, TXNDC9. Предложенная группа изобретений обеспечивает получение новых диагностических маркеров РМЖ, позволяющих при сопоставимой достоверности и специфичности оценить риск развития рецидива после хирургического лечения. 2 н. и 8 з.п. ф-лы, 6 ил., 7 табл., 2 пр.
1. Набор реагентов для определения риска возникновения рецидива онкологических заболеваний молочной железы, характеризующийся тем, что он включает, по меньшей мере, реагенты для измерения уровня экспрессии генов-маркеров, в качестве которых использованы праймеры и зонды, специфичные по отношению к генам-маркерам ELOVL5, IGFBP6, TXNDC9.
2. Набор по п. 1, характеризующийся тем, что реагенты представлены в лиофилизированном виде или в виде водного раствора.
3. Набор по п. 1, характеризующийся тем, что в качестве праймеров и зондов, специфичных по отношению к генам-маркерам, использованы праймеры с последовательностями SEQ ID NO: 1-3 и SEQ ID NO: 4-6, и зонды с последовательностями SEQ ID NO: 7-9, соответственно.
4. Набор по п. 1, характеризующийся тем, что он дополнительно содержит праймеры и зонды, специфичные по отношению к генам FBXO42, GUSB, HCFC1, RPLP0 и ТРТ1, используемые для нормирования результатов ПЦР.
5. Набор по п. 4, характеризующийся тем, что в качестве праймеров и зондов, специфичных по отношению к генам FBXO42, GUSB, HCFC1, RPLP0 и ТРТ1, использованы праймеры с последовательностями SEQ ID NO: 10-19 и зонды с последовательностями SEQ ID NO: 20-24, соответственно.
6. Набор по п. 1, характеризующийся тем, что он дополнительно содержит один или несколько реагентов, выбранных из группы: реагенты для выделения и очистки РНК из образца опухолевой ткани; реагенты для синтеза одноцепочечной кДНК на мРНК с использованием олигонуклеотидных праймеров; буферы для проведения ПЦР.
7. Планшет для определения риска возникновения рецидива онкологических заболеваний молочной железы, включающий нанесенные на лунки реагенты из набора по п. 1 в лиофилизированном виде - праймеры и зонды, специфичные по отношению к генам-маркерам - ELOVL5, ITGBP6, TXNDC9.
8. Планшет по п. 7, характеризующийся тем, что в качестве праймеров и зондов, специфичных по отношению к генам-маркерам, использованы праймеры с последовательностями SEQ ID NO: 1-3 и SEQ ID NO: 4-6, и зонды с последовательностями SEQ ID NO: 7-9, соответственно.
9. Планшет по п. 7, характеризующийся тем, что праймеры содержатся в концентрации 250 нМоль.
10. Планшет по п. 7, характеризующийся тем, что зонд содержит краситель FAM с параметрами возбуждения на длине волны 485 нм и эмиссии на длине волны 520 нм, взятый в концентрации 250 нМоль.
| CN 101195825 A, 11.06.2008 | |||
| RU 2012146343 A, 10.05.2014 | |||
| CRONIN M | |||
| et al | |||
| Analytical Validation of the Oncotype DX Genomic Diagnostic Test for Recurrence Prognosis and Therapeutic Response Prediction in Node-Negative, Estrogen Receptor-Positive Breast Cancer | |||
| Clin Chem | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Integrated Solutions — Real-Time PCR Applications | |||
| Critical Factors for Successful Real-Time PCR | |||
| QIAGEN | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Найдено из Интернет: URL: http://jornades.uab.cat/workshopmrama/sites/jornades.uab.cat.workshopmrama/files/Critical_factors_successful_real_time_PCR.pdf. | |||
Авторы
Даты
2018-11-02—Публикация
2017-07-10—Подача