Изобретение относится к биотехнологии и медицине, а именно к онкогематологии и может быть использовано для выявления уровня экспрессии генов, характерных для лейкемических стволовых клеток (ЛСК) острого миелоидного лейкоза (ОМЛ) у детей методом полимеразной цепной реакции в реальном времени (ПЦР-РВ) перед аллогенной трансплантацией костного мозга с целью прогнозирования риска раннего посттрансплантационного рецидива.
Острые лейкозы наиболее частая форма детских злокачественных новообразований, и их частота возрастает. И хотя ОМЛ составляет только 20% детских лейкозов, ОМЛ превосходит острые лимфобластные лейкозы как лидирующая причина детской смертности [1].
Несмотря на современные достижения химиотерапии и таргетной терапии гемобластозов, алло-ТГСК остается актуальным и эффективным методом закрепления ремиссии для пациентов с ОМЛ высокой группы риска. И хотя выполнение алло-ТГСК снижает риск рецидива на 20-40% по сравнению с больными, которые получили интенсивную постремиссионную химотерапию, возврат заболевания ОМЛ после алло-ТГСК остается лидирующей причиной неудач терапии [2]. Определение риска посттрансплантационного рецидива может быть использовано для коррекции терапевтической тактики и раннего назначения профилактической терапии.
Известно, что ремиссионный статус и минимальная определяемая болезнь (МОБ), оцениваемая методом проточной цитометрии и ПЦР, имеют прогностическую значимость в отношении риска возврата ОМЛ после алло-ТГСК. Определение МОБ с помощью проточной цитометрии может быть применено для всех пациентов с ОМЛ, но имеет недостатки, связанные с более низкой разрешающей способностью по сравнению с ПЦР. В то же время, определение значимых молекулярных маркеров с помощью ПЦР возможно только у половины пациентов с ОМЛ из-за молекулярной гетерогенности и нестабильности генетических изменений [3].
Одной из основных причин развития рецидива ОМЛ и резистентности заболевания к проводимой терапии является персистенция клона ЛСК [4]. Таким образом, существует неудовлетворенная и настоятельная потребность в выявлении и количественной оценке ЛСК как универсального маркера для определения прогноза и улучшения стратификации риска при ОМЛ.
CD34 является маркером гемопоэтических стволовых клеток человека, и вся колониеобразующая активность клеток костного мозга детектируется во фракции CD34+.
Острый миелодиный лейкоз относится к CD34+ позитивным неоплазиям. Внутри CD34-позитивных лейкозов, которые составляют около трех четвертей всех ОМЛ, было показано, что ЛСК преимущественно находятся во фракции клеток CD34+38-[7].
Известно, что высокая экспрессия гена SOCS2 (супрессор передачи сигнала цитокинов 2) связана с прогрессией ОМЛ и может отражать свойства, связанные со стволовыми клетками опухоли, особенно в совокупности с другими молекулярными маркерами [6]. На мышиных моделях нокаутирование гена SOCS2 приводит к снижению пролиферативной активности ЛСК [5]. По данным некоторых исследований, FAM30A опосредует дифференцировку и химиорезистентность ЛСК при ОМЛ. Высокий уровень экспрессии FAM30A ассоциирован с неблагоприятными цитогенетическими поломками и резистентным течением лейкоза [8].
Относительно недавно, GPR56 был определен в качестве стабильного маркера ЛСК ОМЛ. Гиперэкспрессия GPR56 связана с наличием генетических аномалий высокого риска и неблагоприятным прогнозом. Анализ GPR56 в сочетании с экспрессией CD34 выявил потенциал приживления клеток GPR56+ как во фракциях CD34-, так и во фракциях CD34+, тем самым определяя дополнительный компартмент ЛСК, независимый от фенотипа CD34+CD38-ЛСК [9].
Гиперэкспрессия ДНК-метилтрансфераз (DNMT) ассоциирована с неблагоприятным прогнозом злокачественных заболеваний, а дерегуляция метилирования остается одной из характеристик, определяющих ОМЛ [10]. По результатам исследования S. Hayette и соавт. гиперэкспрессия DNMT3b является независимым предиктором неблагоприятного исхода ОМЛ.
SPINK2 является членом семейства ингибиторов сериновой протеиназы типа Kazal, которые ингибируют трипсин/акрозий. Недавно было показано, что экспрессия SPINK2 ассоциирована с более высокими рисками неблагоприятного исхода у педиатрических пациентов с ОМЛ [11]
Недавние исследования экспрессии генов ЛСК в дебюте заболевания показали независимую прогностическую значимость для детей с ОМЛ, которые получали стандартную химиотерапию, что послужило основой для создания шкалы pLCS6, состоящей из 6 генов с высокой предиктивной способностью [12].
Несмотря на то, что уровень pLCS6, определенный в дебюте заболевания связан с худшим прогнозом даже у реципиентов аллоТГСК, до настоящего момента не была доказана прогностическая значимость pLCS6, определенной у пациентов до алло-ТГСК.
Техническим результатом заявленного изобретения является разработка олигонуклеотидных праймеров и флуоресцентно-меченых зондов, которые в совокупности с ДНК-калибраторами представляют собой комплексное решение для молекулярно-генетической диагностики при ОМЛ, повышая ее информативность.
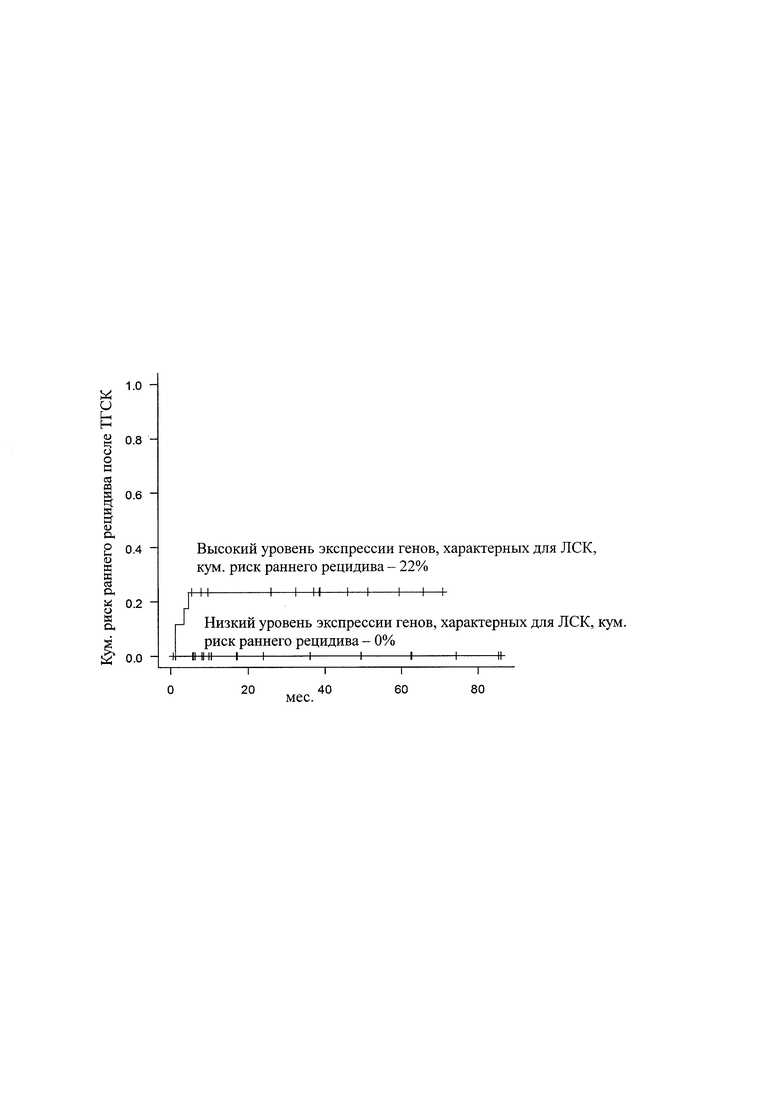
Указанный технический результат обеспечивается использованием набора олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для определения экспрессии генов SOCS2, CD34, FAM30A, GPR56, DNMT3B, SPINK2 с последующим определением уровня относительной экспрессии относительно референс-гена ABL1, амплифицируемых в ПЦР-РВ.
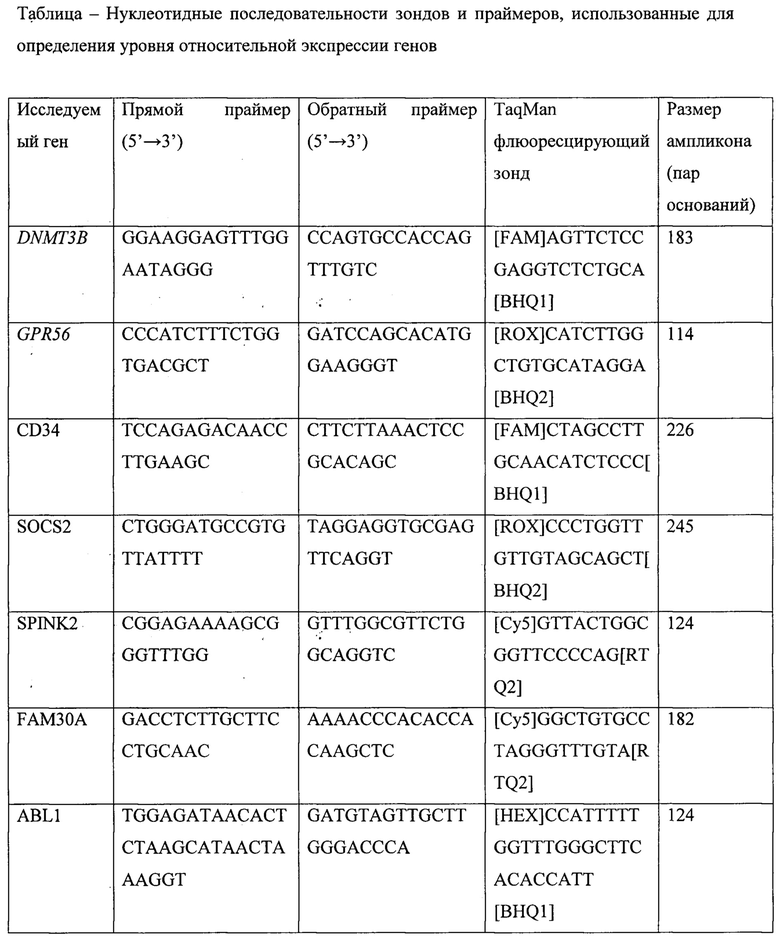
На фиг. представлен кумулятивный риск раннего рецидива после алло-ТГСК у детей с ОМЛ в зависимости от уровня экспрессии генов, характерных для ЛСК.
Для определения уровня экспрессии исследуемых генов проводился следующий алгоритм действий
1) Тотальная мРНК была выделена из ядросодержащих клеток костного мозга с применением метода гуанидин-фенол-хлороформной экстракции с помощью TriZ Reagent (Inogene, Russia) согласно протоколу, включающего следующие основные этапы:
 Гомогенизация пробы в 1 мл TriZ Reagent (Inogene, Russia) с добавлением 10^7 ядросодержащих клеток костного мозга.
Гомогенизация пробы в 1 мл TriZ Reagent (Inogene, Russia) с добавлением 10^7 ядросодержащих клеток костного мозга.
 Разделение фаз - к гомогенизированному раствору добавлялось 0,2 мл Хлороформа.
Разделение фаз - к гомогенизированному раствору добавлялось 0,2 мл Хлороформа.
 Выделение РНК из водной фазы с добавлением 0,5 мл Изопропанола и 1 мкл. гликогена.
Выделение РНК из водной фазы с добавлением 0,5 мл Изопропанола и 1 мкл. гликогена.
 Очищение РНК - с применением 70% Этанола
Очищение РНК - с применением 70% Этанола
 Элюция РНК - при помощи воды свободной от РНКаз
Элюция РНК - при помощи воды свободной от РНКаз
 Пробы, после выделения ДНК хранились при -80°С с использованием стандартных рабочих процедур.
Пробы, после выделения ДНК хранились при -80°С с использованием стандартных рабочих процедур.
2) Синтез кДНК осуществляли с использованием набора Обратная транскриптаза M-MuLV RH (BioLab mix, Россия). Протокол синтеза кДНК был следующим:
 10 мкл. экстрагированной тотальной РНК смешивали с 2 мкл. случайных гексамерных праймеров, вортексировали, а затем осаждали. Далее инкубировали в течение 2 минут при, 70°С. После завершения процесса инкубации пробирки помещали на лед (штатив -20°С). На льду в пробирки добавляли 8 мкл реакционной смеси, состоящей из:
10 мкл. экстрагированной тотальной РНК смешивали с 2 мкл. случайных гексамерных праймеров, вортексировали, а затем осаждали. Далее инкубировали в течение 2 минут при, 70°С. После завершения процесса инкубации пробирки помещали на лед (штатив -20°С). На льду в пробирки добавляли 8 мкл реакционной смеси, состоящей из:
- 7 мкл. ОТ-буффер mix;
- 1 мкл. M-MuLV-RH ревертаза
Полученные пробы помещали в амплификатор со следующей программой:
- 25°С - 10 мин;
- 42°С - 60 мин;
- 70°С - 10 мин.
С каждой пробой РНК выполнялось по 2 реакции обратной транскрипции.
После окончания процесса амплификации все пробы хранились при -20°С до проведения ПЦР в реальном времени.
Для каждой пробы кДНК была выполнена мультиплексная ПЦР в режиме реального времени для генов: SOCS2, CD34, FAM30A, GPR56, DNMT3B, SPINK2 с последующим определением уровня относительной экспрессии относительно референс-гена. ABL1 с использованием приборов CFX96 и iQ5 (Bio-Rad, США).
В качестве набора реагентов для амплификации использовался М-428 (Синтол, Россия), со следующими условиями реакции: 10 мкл. реакционной смеси для ПЦР, содержащей dNTP смесь по 2,5 мМ каждого, 10×ПЦР буфер, 5 Ед Taq-ДНК полимеразы и 2.5 μl 25 мМ MgCl2, с добавлением 7 пмоль каждого из ген-специфичных праймеров, 5 пмоль TaqMan зондов. Последовательности праймеров и TaqMan-зондов для ПЦР в реальном времени представлены в Таблице 1. Применялся следующий режим амплификации: начальная инкубация при 95°С - 10 мин, затем 45 циклов с условиями 95°С - 15 сек, 60°С - 1 мин. Флуоресцентный сигнал определяли при 60°С с использованием каналов FAM, HEX, ROX, Су5. Относительный уровень экспрессии гена рассчитывали по формуле:
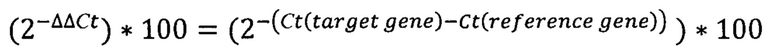
где:
Ct(target gene):
Ct(SOCS2/CD34/FAM30A/GPR56/DNMT3B/SPINK) Ct(reference gene): Ct (ABU)
Измерение уровня экспрессии генов, характерных для ЛСК было апробировано в когорте 37 детей с ОМЛ, получивших алло-ТТСК в ремиссии основного заболевания. Медиана возраста составила 6 (от 1 до 18) лет. Для каждого пациента полученные результаты суммировались по следующей формуле (CD34×0.0171)+(SOCS2×0.141)+(DNMT3b×0.189)+(GPR56×0.054)+(FAM30A×0.0516)+(SPINK2×0.109).
В общей сложности, по нашим данным, 18/37 (49%) пациентов имели высокий уровень экспрессии генов характерных для ЛСК до трансплантации. Только 6/18 пациентов с высоким уровнем экспрессии были МОБ-положительными (по данным проточной цитометрии или ПЦР). Линейный регрессионный анализ, включающий как пациентов в ремиссии заболевания, так и 13 детей с ОМЛ вне ремиссии, не показал связи между количеством бластов/МОБ и уровнем экспрессии генов, характерных для ЛСК (OR 1,002; 95% CI: 0,979, 1,025). Примечательно, что у пациентов с высоким уровнем экспрессии исследуемых генов кумулятивный риск раннего посттрансплантационного рецидива (конкурирующие риски по методу Fine-Grey) составил 22% против 0% для детей с ОМЛ, имеющих низкий уровень экспрессии генов ЛСК (р=0,03) (фиг.)
Таким образом, совокупный уровень экспрессии генов, характерных для ЛСК может использоваться в качестве независимого предиктора развития раннего рецидива ОМЛ у детей после алло-ТТСК с целью принятия решения о необходимости своевременных профилактических вмешательств.
Список литературы
1. Linabery, A.M. and Ross, J.A. (2008) Trends in Childhood Cancer Incidence in the US (1992-2004). Cancer, 112, 416-432. http://dx.doi.org/10.1002/cncr.23169
2. Hyakuna N. et. al. Retrospective analysis of children with high-risk acute myeloid leukemia who underwent allogeneic hematopoietic stem cell transplantation following complete remission with initial induction chemotherapy in the AML-05 clinical trial. Pediatr Blood Cancer. 2019 Oct;66(10):e27875. doi: 10.1002/pbc.27875. Epub 2019 Jul 16. PMID: 31309713.
3. Buccisano F, Maurillo L, Del Principe MI, et al. Prognostic and therapeutic implications of minimal residual disease detection in acute myeloid leukemia. Blood 2012;119:332-341
4. Terwijn M, Zeijlemaker W, Kelder A, Rutten AP, Snel AN, Scholten WJ, et al. Leukemic stem cell frequency: a strong biomarker for clinical outcome in acute myeloid leukemia. PLoS One. 2014;9(9):e107587.
5. Grandits AM, Wieser R. Gene expression changes contribute to sternness and therapy resistance of relapsed acute myeloid leukemia: roles of SOCS2, CALCRL, MTSS1, and KDM6A. Exp Hematol. 2021;99:1-11. doi:10.1016/j.exphem.2021.05.004
6. Nguyen, C.H., Glüxam, Т., Schlerka, A. et al. SOCS2 is part of a highly prognostic 4-gene signature in AML and promotes disease aggressiveness. Sci Rep 9, 9139 (2019). https://doi.org/10.1038/s41598-019-45579-0
7. Blair A, Hogge DE, Sutherland HJ. Most acute myeloid leukemia progenitor cells with long-term proliferative ability in vitro and in vivo have the phenotype CD34(+)/CD71(-)/HLA-DR-. Blood. 1998;92:4325-4335.
8. Jaime Calvo Sánchez, Marcel Köhn, Lutz Müller. Long non-coding RNA FAM30A as a novel regulator of leukemic stem cell fate in acute myeloid leukemia. EHA Library. Calvo Sánchez J. 06/09/21; 325163; EP409
9. Pabst C, Bergeron A, Lavallée VP, Yeh J, Gendron P, Norddahl GL, Krosl J, Boivin I, Deneault E, Simard J, Imren S, Boucher G, Eppert K, Herold T, Bohlander SK, Humphries K, Lemieux S, Hébert J, Sauvageau G, Barabé F. GPR56 identifies primary human acute myeloid leukemia cells with high repopulating potential in vivo. Blood. 2016 Apr 21;127(16):2018-27. doi: 10.1182/blood-2015-11-683649. Epub 2016 Feb 1. PMID: 26834243.
10. Hayette S, Thomas X, Jallades L, et al. High DNA methyltransferase DNMT3B levels: a poor prognostic marker in acute myeloid leukemia. PLoS One. 2012;7(12):e51527.doi:10.137l/journal.pone.0051527
11. Chen T, Lee TR, Liang WG, et al. Identification of trypsin-inhibitory site and structure determination of human SPINK2 serine proteinase inhibitor. Proteins 2009;77:20919.
12. Elsayed AH, Rafiee R, Cao X, Raimondi S, Downing JR, Ribeiro R, Fan Y, Gruber ТА, Baker S, Klco J, Rubnitz JE, Pounds S, Lamba JK. A six-gene leukemic stem cell score identifies high risk pediatric acute myeloid leukemia. Leukemia. 2020 Mar;34(3):735-745. doi: 10.1038/s41375-019-0604-8. Epub 2019 Oct 23. Erratum in:Leukemia. 2020 Apr 16;: PMID: 31645648; PMCID: PMC7135934
Изобретение относится к биотехнологии и медицине, а именно к онкогематологии для прогнозирования риска рецидива острого миелоидного лейкоза у детей после аллогенной трансплантации гемопоэтических стволовых клеток. Изобретение может быть использовано для выявления уровня экспрессии генов, характерных для лейкемических стволовых клеток (ЛСК) острого миелоидного лейкоза (ОМЛ) у детей методом полимеразной цепной реакции в реальном времени (ПЦР-РВ) перед аллогенной трансплантацией костного мозга с целью прогнозирования риска раннего посттрансплантационного рецидива. Разработан набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для определения экспрессии генов CD34, FAM30A, SOCS2, GPR56, DNMT3B, SPINK2 с последующим определением уровня относительной экспрессии относительно референс-гена ABL1. В совокупности уровень экспрессии вышеперечисленных генов может использоваться в качестве предиктора развития раннего рецидива ОМЛ у детей после аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК). 1 табл., 1 ил.
Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для определения экспрессии генов SOCS2, CD34, FAM30A, GPR56, DNMT3B, SPINK2 с последующим определением уровня относительной экспрессии относительно референс-гена ABL1, амплифицируемых в ПЦР-РВ, используемых для прогнозирования риска раннего рецидива у детей с острым миелоидным лейкозом после аллогенной трансплантации гемопоэтических стволовых клеток
DNMT3B-Fw
ggaaggagtt tggaataggg (SEQ ID NO: 1)
DNMT3B-Rv
ccagtgccac cagtttgtc (SEQ ID NO: 2)
DNMT3B-Pr
(FAM)agttctccga ggtctctgca(BHQ1) (SEQ ID NO: 3)
GPR56-Fw
cccatctttc tggtgacgct (SEQ ID NO: 4)
GPR56-Rv
gatccagcac atggaagggt (SEQ ID NO: 5)
GPR56-Pr
(ROX)catcttggct gtgcatagga(BHQ2) (SEQ ID NO: 6)
CD34-Fw
tccagagaca accttgaagc (SEQ ID NO: 7)
CD34-Rv
cttcttaaac tccgcacagc (SEQ ID NO: 8)
CD34-Pr
(FAM)ctagccttgc aacatctccc(BHQ1) (SEQ ID NO: 9)
SOCS2-Fw
ctgggatgcc gtgttatttt (SEQ ID NO: 10)
SOCS2-Rv
taggaggtgc gagttcaggt (SEQ ID NO: 11)
SOCS2-Pr
(ROX)ccctggttgt tgtagcagct(BHQ2) (SEQ ID NO: 12)
SPINK2-Fw
cggagaaaag cgggtttgg (SEQ ID NO: 13)
SPINK2-Rv
gtttggcgtt ctggcaggtc (SEQ ID NO: 14)
SPINK2-Pr
(Cy5)gttactggcg gttccccag(RTQ2) (SEQ ID NO: 15)
FAM30A-Fw
gacctcttgc ttcctgcaac (SEQ ID NO: 16)
FAM30A-Rv
aaaacccaca ccacaagctc (SEQ ID NO: 17)
FAM30A-Pr
(Cy5)ggctgtgcct agggtttgta(RTQ2) (SEQ ID NO: 18)
ABL1-Fw
tggagataac actctaagca taactaaagg t (SEQ ID NO: 19)
ABL1-Rv
gatgtagttg cttgggaccc a (SEQ ID NO: 20)
ABL1-Pr
(HEX)ccatttttgg tttgggcttc acaccatt(BHQ1) (SEQ ID NO: 21).
| ELSAYED A.H | |||
| et al., A six-gene leukemic stem cell score identifies high risk pediatric acute myeloid leukemia | |||
| Leukemia | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| PALLADINA A.D., Detection and monitoring of | |||
Авторы
Даты
2022-11-22—Публикация
2022-04-05—Подача