ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новой безводной кристаллической форме Кабазитаксела, к способу ее получения и ее фармацевтическим композициям.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Кабазитаксел является полусинтетическим производным природного таксана 10-диацетилбаккатина III, производимым серийно как ацетоновый сольват. Он стабилизирует микротрубочки, приводя в итоге к задержке пролиферующих клеток в митозе. Он одобрен в США для второочередного лечения гормонрезистентного рака предстательной железы вслед за лечением на основе доцетаксела.
Кабазитаксел имеет следующую формулу (I):
Его химическое наименование 4α-ацетокси-2α-бензоилокси-5β,20-эпокси-1β-гидрокси-7β,10β-диметокси-9-оксо-11-таксен-13α-ил (2R,3S)-3-трет-бутоксикарбониламино-2-гидрокси-3-фенилпропионат.
Кабазитаксел и способы его получения описаны в WO96/30355 и в WO99/25704.
WO2005/028462 описывает ацетоновый сольват Кабазитаксела, иногда именуемый формой A. Несмотря на тот факт, что кристаллизация ацетонового сольвата является весьма эффективным способом удаления примесей, лучшей фармацевтической формой будет чистый Кабазитаксел без какого-либо растворителя для кристаллизации.
Дополнительные формы кристаллосольватов Кабазитаксела, именуемые формой I (сольват толуола), формой II (сольват простого метил трет-бутилового эфира), формой III (сольват 2-пропанола), формой IV (сольват 1-бутанола), формой V (сольват 1-пропанола) и аморфной формой Кабазитаксела в порошковой, непенообразной форме, описаны в WO2012/142117 (Teva). Сольваты редко используют в фармацевтических препаратах, поскольку растворители легко испаряются, что затрудняет сохранение растворителя в кристалле. Десольвация активного фармацевтического ингредиента вследствие влияния условий хранения или по другим причинам, может приводить к образованию множества полиморфных форм вещества с различными физическими свойствами. Дополнительно, аморфные твердые вещества метастабильны, что может приводить со временем к образованию отличающихся полиморфных форм вещества с отличающимися физическими свойствами.
WO2009/115655 (Sanofi) раскрывает пять безводных форм соединения, именуемых как формы B, C, D, E и F; три формы сольватов с этанолом, именуемых, как этанолат формы B, D, E; этанол-вода гетеросольват форму F; а также моногидратную, не содержащую растворителя форму C, и дигидратную, не содержащую растворителя, форму C. Достижение высокой степени чистоты с данными формами возможно только в случае предварительной очистки активного фармацевтического ингредиента с помощью других технологий, таких, например, как пропуск через ацетоновый сольват (как описано в заявке). Вместе с тем введение дополнительной технологии очистки снижает эффективность производственного процесса вследствие удлинения времени изготовления и малого выхода продукции.
WO 2013/134534 раскрывает кристаллические сольваты Кабазитаксела с:
- алкиловыми ацетатами, такими как сольваты с этилацетатом (Форма VII), изопропилацетатом (Форма VIII), метилацетатом (Форма XVII), бутилацетатом (Форма XVIII) и изобутилацетатом (Форма XXI);
- кетонами, такими как сольваты с метилэтилкетоном (Форма IX) и метилизобутилкетоном(Форма X);
- спиртами, такими как сольваты с 2-бутанолом (Форма XI), изобутанолом (Форма XII) и амиловым спиртом (Форма XIII).
WO 2013/134534 также описывает сольваты с диоксоланом (Форма XIV), 1,4-диоксаном (Форма XV), 1,2-пропандиолом (Форма XIX), глицеролом (Форма XX) и 1,3-диметил-2-имидазолидиноном (Форма XXII). Так же раскрыта кристаллическая форма Кабазитаксела, указанная как Форма XVI, которая может быть безводной.
Кристаллический этилацетатный сольват Кабазитаксела также раскрыт в WO 2013/088335.
WO2009/115655 раскрывает две гидратдные формы соединения в частности моно- и дигидрат, обе гидратные формы получены из безводной формы C воздействием влаги. Безводную форму C высокой степени очистки, как описано выше, получают только пропусканием через ацетоновый сольват.
Кристаллическая форма Кабазитаксела, получаемая из ацетона/воды описана в CN 102675257 A.
Кристаллические формы, включая ангидратную форму Кабазитаксела, называемые Формами C1, C2, C3, C4, C5, C6, C7, C8, C8b, C9 и C9p, описаны в WO2013/034979.
Наконец, 13 кристаллических форм, именуемых как Форма-1, Форма-2, Форма-3, Форма-4, Форма-5, Форма-6, Форма-7, Форма-8, Форма-9, Форма-10, Форма-11, Форма-12 и Форма-13 раскрыты в WO2013/0109870.
Требуется найти новые кристаллические формы, способные решить вышеупомянутые проблемы.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Объектом настоящего изобретения является создание новой безводной кристаллической формы Кабазитаксела, названной формой H. Дополнительным объектом настоящего изобретения является создание способов получения упомянутой выше кристаллической формы и ее фармацевтических композиций.
В настоящем изобретении термин “безводный” относится к кристаллической форме Кабазитаксела, содержащей менее 1% адсорбированной влаги, что устанавливают методом Карла Фишера.
Форма H является безводной кристаллической формой Кабазитаксела, полученной кристаллизацией Кабазитаксела из смеси деканоил- и октаноилтриглицеридов (CAS number 52622-27-2), известной под торговым названием Miglyol® 812, или из глицеролтриоктаноата.
КРАТКОЕ ОПИСАНИЕ ФИГУР
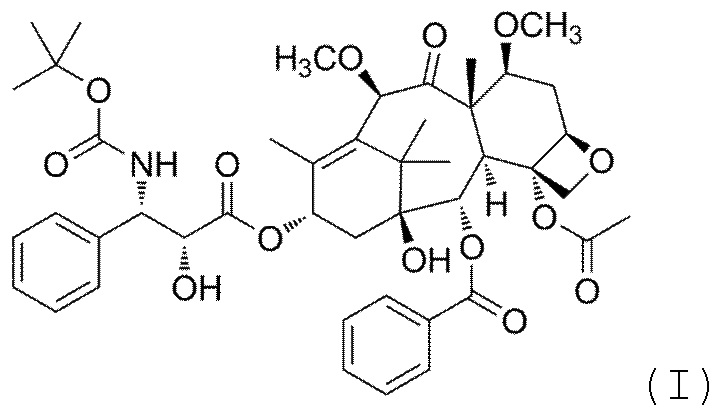
Фиг. 1 рентгенограмма X-RPD кристаллической формы H Кабазитаксела
Фиг. 2 спектр FTIR безводной кристаллической формы H Кабазитаксела в спектральном диапазоне 4000-550 см-1
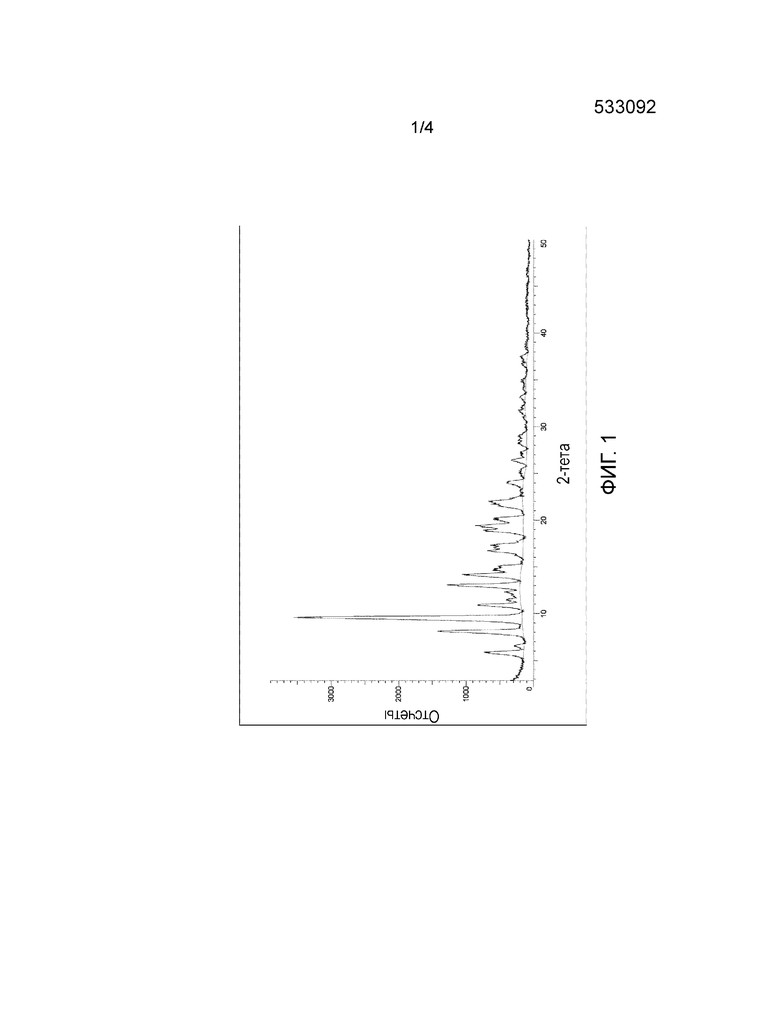
Фиг. 3 профили TG и DTA безводной кристаллической формы H Кабазитаксела
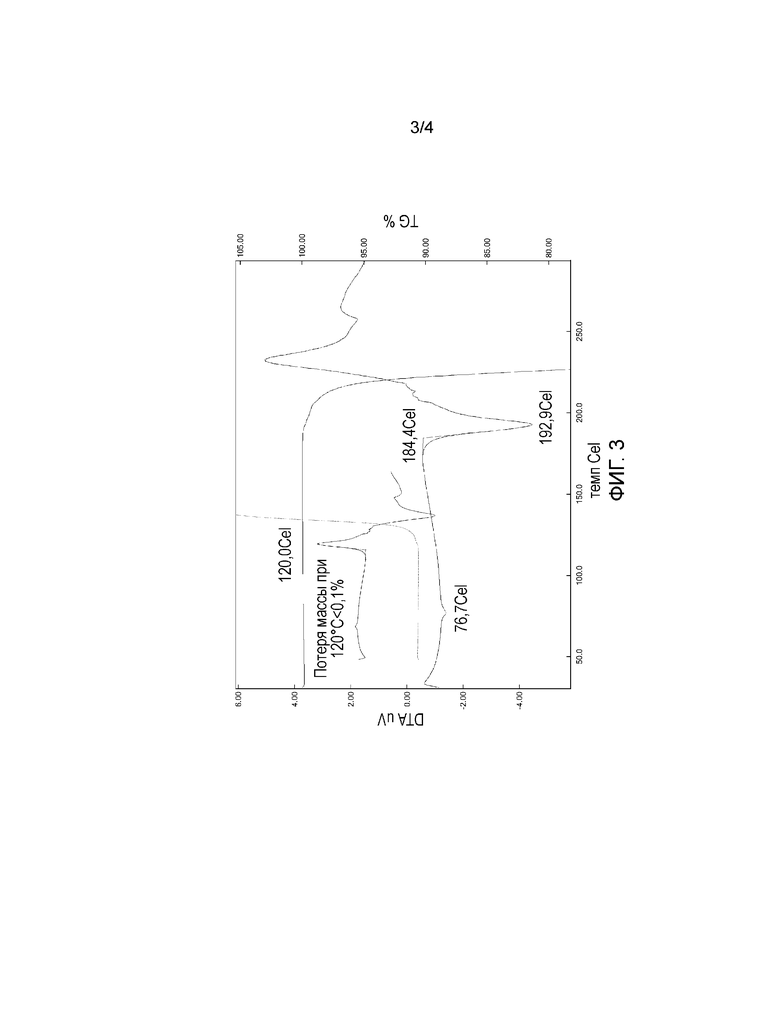
Фиг. 4 профиль DSC безводной кристаллической формы H Кабазитаксела
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Форма H Кабазитаксела согласно настоящему изобретению характеризуется рентгенограммой рентгеновской порошковой дифрактометрии (X-RPD), полученной с использованием длины λ1 и λ2 волн спектра меди, равных 1,54056 Å и 1,54439 Å, соответственно, по-существу, как показано на Фиг. 1. Рентгенограмма X-RPD показывает кристаллическую структуру и содержит отличительные отражения, выраженные как значения 2-тета градусов при 5,8, 6,5, 8,1, 9,5, 10,9, 11,5, 12,2, 13,0, 14,1, 14,8, 16,8, 17,2, 19,0, 19,4, 20,1, 21,9 и 24,0±0,2.
Рентгенограмма X-RPD, показанная на Фиг. 1, индексирована TOPAS с ромбической элементарной ячейкой и возможной пространственной группой P212121. Оптимизация по Pawley сходилась к Rwp=7,065% со следующими параметрами ячеек: a=18,693(4) Å, b=27,461(5) Å, c=8,587(1) Å, α=β=γ=90°, V=4408(1) Å3 и пространственной группой P212121, когерентной с присутствием 4 молекул в ячейке.
Форму H можно дополнительно характеризовать спектром инфракрасной спектроскопии с преобразованием Фурье (FTIR) в спектральном диапазоне 4000-550 см-1 в режиме НПВО, по существу, как показано на Фиг. 2. Спектр FTIR формы H содержит частоты собственного поглощения при 3615, 3449, 3060, 2982, 2939, 2893, 2826, 1742, 1711, 1489, 1450, 1390, 1368, 1315, 1273, 1263, 1247, 1172, 1098, 1071, 1027, 989, 947, 919, 883, 832, 802, 781, 718, 704, 675 и 637+4 см-1.
Форма H может дополнительно характеризоваться профилями Термогравимерического (TG) и Дифференциально-термического анализа (DTA) как показано на Фиг. 3. Профиль DTA характеризуется пиком плавления с нарастанием около 184°C и максимумом при 192,9°C, за которым следует выраженный экзотермический пик вследствие разложения.
Отсутствие потери массы вплоть до плавления на профиле TG является когерентным с безводным продуктом, в котором отсутствуют остаточные растворители.
Форму H может дополнительно характеризовать профиль Дифференциальной сканирующей калориметрии (DSC), показанный на Фиг. 4. Профиль DSC является когерентным с DT сигналом и показывает температурную кривую, характеризующуюся пиком плавления с нарастанием при 187,4°C, максимумом при 192,5°C, и ΔH= -41,03 Дж/г, за которым следует разложение, имеющее место при температуре выше 200°C.
Когда кристаллическая форма Кабазитаксела по настоящему изобретению указана в данном документе, как отличающаяся графическими данными, по существу показанными на Фигуре, такими, например, как дифрактограмма X-RPD, профили TG/DTA, DSC и спектр FTIR, специалисту в данной области техники понятно, что на такие графические представления данных могут влиять небольшие вариации, которые могут быть вызваны изменчивостью экспериментов, воздействующей на реакцию контрольно-измерительных приборов и/или на концентрацию образцов и степень чистоты. Данные вариации хорошо известны специалистам в данной области техники, и не препятствуют сравнению графических данных на фигурах в данном документе с графическими данными, выработанными для неизвестной кристаллической формы и из оценки, того, характеризуют ли два набора графических данных одну и ту же кристаллическую форму или две различные кристаллические формы.
Безводную кристаллическую форму H Кабазитаксела настоящего изобретения можно получить, начиная с растворения Кабазитаксела в смеси деканоил- и октаноилтриглицеридов или в глицеролтриоктаноате, как описано в Примере 1 или 2, соответственно. Осаждение кристаллов безводной формы H возникает спонтанно и может завершаться добавлением антирастворителя, такого как гептан. Полученные кристаллы затем выделяют фильтрацией, промывают свежим антирастворителем и высушивают.
Следующим объектом изобретения, таким образом, является создание способа получения безводной кристаллической формы H Кабазитаксела, включающего следующие стадии:
a) растворение Кабазитаксела в смеси деканоил- и октаноилтриглицеридов или в глицеролтриоктаноате при 20-25°C;
б) перемешивание раствора, полученного на стадии a), где продукт начинает кристаллизоваться;
в) добавление гептана к суспензии, полученной на стадии б);
г) фильтрование и высушивание осадка, полученного на стадии в), для получения кристаллической формы H Кабазитаксела.
Безводную кристаллическую форму H изобретения можно получить со степенью чистоты выше 99% при получении согласно описанию в примерах 1-2.
Безводная кристаллическая форма изобретения наделена несколькими предпочтительными свойствами в сравнении с ранее раскрытыми формами Кабазитаксела по показателю, например, высокой степени чистоты, получаемой без дополнительной кристаллизации, устойчивости к преобразованию в другие полиморфные формы, улучшенного удобства в обращении и улучшенным возможностям переработки.
Принимая во внимание описанные выше преимущества, безводная кристаллическая форма H Кабазитаксела изобретения подходит для получения Кабазитаксела, солей Кабазитаксела и полиморфных форм в целом.
Кроме того, безводная кристаллическая форма H изобретения является особенно полезной, как лекарственное средство, особенно для лечения различных видов рака, в частности, рака предстательной железы, например, гормонрезистентного рака предстательной железы.
Вышеупомянутые варианты применения безводной кристаллической формы H Кабазитаксела представляют следующий объект изобретения.
Безводную кристаллическую форму H изобретения для использования в терапевтических целях, можно включать в обычные фармацевтические композиции, содержащие, по меньшей мере, один эксципиент, пригодный для фармацевтического применения, что представляет следующий объект изобретения.
Изобретение ниже проиллюстрировано примерами, в которых, необработанный Кабазитаксел использовался как исходный материал.
ПРИМЕР 1
Получение безводной кристаллической формы H Кабазитаксела посредством перекристаллизации неочищенного Кабазитаксела в расстворителе Miglyol® 812
Неочищенный Кабазитаксел (1 г) растворили в Miglyol® 812 (28 г) при комнатной температуре. Раствор оставили кристаллизоваться при добавлении гептана (112 мл). Осадок отфильтровали, промыли гептаном и высушили под вакуумом в течение 16 часов при около 60°C. Получили Кабазитаксел со степенью чистоты более чем 99%. Выход 85%.
ПРИМЕР 2
Получение безводной формы H Кабазитаксела посредством перекристаллизации неочищенного Кабазитаксела из глицеролтриоктаноата
Неочищенный Кабазитаксел (1 г) растворили в глицеролтриоктаноате (28 г) при комнатной температуре. Раствор оставили кристаллизоваться при добавлении гептана (112 мл). Осадок отфильтровали, промыли гептаном и высушили под вакуумом в течение 16 часов при коло 60°C. Получили Кабазитаксел со степенью чистоты более чем 99%. Выход 84%.
ПРИМЕР 3
Соединение, полученное согласно Примерам 1-2, характеризовали с применением описанных ниже способов.
Рентгеновская порошковая дифрактометрия (X-RPD) (Фиг. 1)
Рентгенограммы X-RPD получали на Bruker D2-Phaser Дифрактометре. Рентгеновским генератором управляли при 30 кВ и 10 мА, используя линию CuKα в качестве источника излучения. Образец заложили в специальный паз, и длина волны излучения составила 10 мм. Данные собрали между 2 и 50 град 2-тета с размером шага 0,02 град 2-тета и временем счета на 1 шаг в 3 сек.
ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ С ПРЕОБРАЗОВАНИЕМ ФУРЬЕ (FTIR) (ФИГ. 2)
Инфракрасный спектр записали в виде Нарушенного Полного Внутреннего отражения (НПВО), используя спектрометр с преобразованием Фурье Perkin Elmer Spectrum One, оборудованный аксессуаром Specac ATR Golden Gate. Спектр являлся результатом сбора и преобразования данных 16 совместно добавленных сканирований в спектральном диапазоне 4000-550 см-1 с разрешающей способностью 4 см-1.
ТЕРМОГРАВИМЕРИЧЕСКИЙ (TG) И ДИФФЕРЕНЦИАЛЬНО-ТЕРМИЧЕСКИЙ АНАЛИЗ (DTA) (ФИГ. 3)
Анализ выполнили, применяя совместную систему Seiko TG/DTA7200 с использованием открытых алюминиевых чашек (емкостью 40 мкл). TG/DT сигналы записывали при температуре от 30 до 300°C с линейной тепловой мощностью (10°C/мин) под струей азота 200 мл/мин. Для измерения использовали около 10 мг порошка.
ДИФФЕРЕНЦИАЛЬНАЯ СКАНИРУЮЩАЯ КАЛОРИМЕТРИЯ (DSC) (ФИГ. 4)
Анализ выполнили, используя систему Mettler DSC1. Тепловой поток записывали от 30 до 300°C с линейной тепловой мощностью (10°C/мин) под струей азота 50 мл/мин. Около 5 мг порошка использовали для измерения в закрытом алюминиевом тигле (емкостью 40 мкл) с микроотверстием.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТВЕРДЫЕ ФОРМЫ ОРТАТАКСЕЛА | 2009 |
|
RU2488586C2 |
| Аморфная форма производного тиоколхицина | 2015 |
|
RU2684925C2 |
| НОВЫЕ КРИСТАЛЛИЧЕСКИЕ ФОРМЫ НАТРИЕВОЙ СОЛИ(4-{ 4-[5-(6-ТРИФТОРМЕТИЛ-ПИРИДИН-3-ИЛАМИНО) ПИРИДИН-2-ИЛ] ФЕНИЛ} ЦИКЛОГЕКСИЛ) УКСУСНОЙ КИСЛОТЫ | 2011 |
|
RU2612556C2 |
| ТОЗИЛАТНАЯ СОЛЬ ТРАНС-N-ИЗОБУТИЛ-3-ФТОР-3-[3-ФТОР-4-(ПИРРОЛИДИН-1-ИЛМЕТИЛ)ФЕНИЛ]ЦИКЛОБУТАНКАРБОКСАМИДА | 2008 |
|
RU2451016C2 |
| НОВЫЕ ФОРМЫ ТИОТРОПИЯ БРОМИДА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2006 |
|
RU2453547C2 |
| СОКРИСТАЛЛИЧЕСКИЕ ФОРМЫ ТРАМАДОЛА И NSAID | 2009 |
|
RU2599717C2 |
| СОЛИ И ПОЛИМОРФЫ ЗАМЕЩЕННОГО ИМИДАЗОПИРИДИНИЛ-АМИНОПИРИДИНА | 2015 |
|
RU2732125C2 |
| ТРИАЗИНОВЫЕ ПРОИЗВОДНЫЕ, ИМЕЮЩИЕ ИНГИБИТОРНУЮ АКТИВНОСТЬ В ОТНОШЕНИИ РЕПЛИКАЦИИ ВИРУСА, И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2022 |
|
RU2806042C1 |
| СТАБИЛЬНАЯ КРИСТАЛЛИЧЕСКАЯ ФОРМА ТИПИРАЦИЛА ГИДРОХЛОРИДА И СПОСОБ ЕЕ КРИСТАЛЛИЗАЦИИ | 2014 |
|
RU2674441C1 |
| СОЛИ N-(4-ФТОРБЕНЗИЛ)-N-(1-МЕТИЛПИПЕРИДИН-4-ИЛ)-N`-(2-МЕТИЛПРОПИЛОКСИ)ФЕНИЛМЕТИЛ)КАРБАМИДА И ИХ ПРИГОТОВЛЕНИЕ | 2005 |
|
RU2387643C2 |

Настоящее изобретение относится к новой безводной кристаллической форме, называемой формой H, Кабазитаксела формулы (I)

Безводная кристаллическая форма имеет одно или несколько из следующего: рентгенограмму X-RPD, полученную с применением длин λ1 и λ2 волн спектра меди, равных 1,54056 Å и 1,54439 Å, соответственно, содержащую отличительные отражения, выраженные в виде значений угла рассеяния 2-тета градусов при 5,8, 6,5, 8,1, 9,5, 10,9, 11,5, 12,2, 13,0, 14,1, 14,8, 16,8, 17,2, 19,0, 19,4, 20,1, 21,9 и 24,0±0,2; рентгенограмму X-RPD, полученную с применением длин λ1 и λ2 волн спектра меди, равных 1,54056 Å и 1,54439 Å, соответственно, по существу, как показано на Фиг. 1; профили TG и DTA, полученные с линейной тепловой мощностью в 10°C/мин, по существу, как показано на Фиг. 3; профиль DSC, полученный с линейной тепловой мощностью в 10°C/мин, по существу, как показано на Фиг. 4. Также предложены фармацевтическая композиция для лечения рака и способ получения безводной кристаллической формы Н. Новая форма H Кабазитаксела обладает уменьшенной способностью к поглощению влаги и высокой степенью чистоты. 3 н. и 1 з.п. ф-лы, 4 ил., 3 пр.
1. Безводная кристаллическая форма, называемая формой H, Кабазитаксела формулы (I)
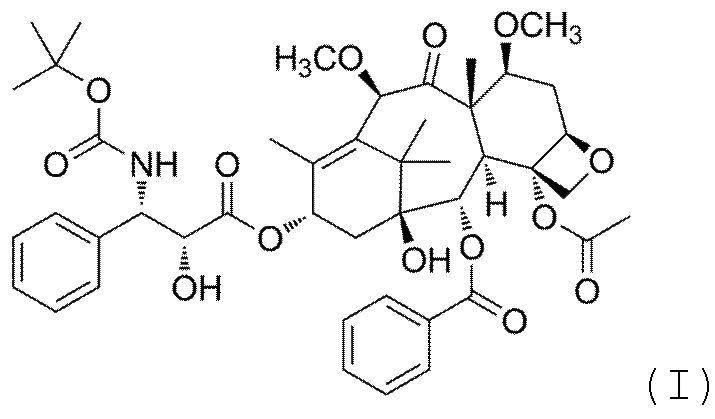
где безводная кристаллическая форма имеет одно или несколько из следующего:
- рентгенограмму X-RPD, полученную с применением длин λ1 и λ2 волн спектра меди, равных 1,54056 Å и 1,54439 Å, соответственно, содержащую отличительные отражения, выраженные в виде значений угла рассеяния 2-тета градусов при 5,8, 6,5, 8,1, 9,5, 10,9, 11,5, 12,2, 13,0, 14,1, 14,8, 16,8, 17,2, 19,0, 19,4, 20,1, 21,9 и 24,0±0,2;
- рентгенограмму X-RPD, полученную с применением длин λ1 и λ2 волн спектра меди, равных 1,54056 Å и 1,54439 Å, соответственно, по существу, как показано на Фиг. 1;
профили TG и DTA, полученные с линейной тепловой мощностью в 10°C/мин, по существу, как показано на Фиг. 3;
профиль DSC, полученный с линейной тепловой мощностью в 10°C/мин, по существу, как показано на Фиг. 4.
2. Кристаллическая форма Кабазитаксела по п. 1 для применения при получении Кабазитаксела, солей Кабазитаксела и их полиморфных форм.
3. Фармацевтическая композиция для лечения рака, содержащая безводную кристаллическую форму H по п. 1 в смеси по меньшей мере с одним эксципиентом, пригодным для фармацевтического применения.
4. Способ получения безводной кристаллической формы H по п. 1, включающий перекристаллизацию Кабазитаксела из смеси деканоил- и октаноилтриглицеридов или из глицеролтриоктаноата.
| US 20130178639 A1, 11.07.2013 | |||
| WO 2013034979 A2, 14.03.2013 | |||
| WO 1996030355 A1, 03.10.1996 | |||
| АЦЕТОНОВЫЙ СОЛЬВАТ ДИМЕТОКСИДОЦЕТАКСЕЛА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2004 |
|
RU2342373C2 |
Авторы
Даты
2018-11-12—Публикация
2014-10-09—Подача