ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к определению ответа пациентов, страдающих раком, на специфическую терапию. В частности настоящее изобретение относится к способу и конструкту ДНК для определения пациентов, отвечающих на терапию, включающую иммуноактивирующие конструкты ДНК, наряду с конструктом ДНК, предназначенным для лечения пациентов, страдающих раком, индивидуально характеризующихся как пациентов, потенциально отвечающих на лечение перед началом лечения с указанным конструктом.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ
[0002] Биомаркеры представляют вещества, находящиеся в крови или в других жидкостях организма, в тканях или в качестве рецепторов на клетках, которые сигнализуруют о присутствии или отсутствии состояния или заболевания, такого как, например, рак. Бимаркеры могут быть подразделены на предиктивные, прогностические и фармакодинамические бимаркеры.
[0003] Предиктивные биомаркеры используют для оценки возможности ответа пациента на лечение или положительного результата от конкретного лечения. Прогностические биомаркеры позволяют классифицировать опухоли по их агрессивному потенциалу для принятия решения о способе лечения или о степени агрессивности лечения. Фармакодинамические биомаркеры позволяют измерить краткосрочные эффекты лекарственного средства на опухоль и позволяют выбрать дозу во время клинических исследований нового противоракового лекарственного средства.
[0004] Таргетная терапия работает на молекулярном уровне для остановки роста или распространения рака. Во избежание лечения нецелесообразными способами, поскольку такая терапия, как правило, связанна с применением очень агрессивных лекарственных средств, продолжает существовать потребность в средствах, позволяющих определить, будет ли пациент отвечать на таргетную терапию или нет.
[0005] В виду того факта, что терапия становится все более и более узко направленной, повышается роль бимаркеров. Они помогут персонализировать терапевтические подходы и откроют путь к индивидуализированной онкологии. Также возможность определить, будет или не будет пациент отвечать на конкретную терапию, поможет предотвратить проведение пациенту нецелесообразного лечения.
[0006] Общеизвестным и хорошо зарекомендовавшим себя способом лечения рака является химиотерапия. Основным недостатком химиотерапии является применение очень агрессивных лекарственных средств, вызывающих тяжелые побочные эффекты. Для минимизации этих побочных эффектов предпринималось множество попыток, состоящих в минимизации дозировки химиотерапевтических лекарственных средств, такой как, например, комбинирование химиотерапии с иммуноактивирующими агентами. Одним из способов является применение иммуноактивирующей ДНК.
[0007] Так называемые неметилированные CG-последовательности продемонстрировали способность очень эффективно активировать иммунную систему (Krieg AM, Yi АK, Matson S, Waldschmidt TJ, Bishop GA, Teasdale R, Koretzky GA, Klinman DM; CpG motifs in bacterial DNA trigger direct B-cell activation; Nature 1995 Apr 6 374: 6522 546-9). Эти последовательности получают из бактерий. В ЕР 1196178 описывается ковалентнонепрерывная кольцевая ДНК с частично самокомплементарными последовательностями с получением в результате ДНК конструкта с двухцепочечным стеблем с одноцепочечными петлями на обоих концах, включающими неметилированные CG мотивы.
[0008] в ЕР 1776124 описывается комбинация гантелеобразных конструктов ДНК по ЕР 1196178 с химиотерапией для лечения раковых заболеваний. Пациенты, лечимые конструктами ДНК по ЕР 1196178, затем получали химеотерапию. Выявилось, что количество химиотерапевтического лекарственного средства может быть снижено при использовании указанной выше комбинации. Но в этом документе не приводится информации о средствах для определения, ответит ли вообще пациент на применяемую комбинированную терапию.
[0009] Объект настоящего изобретения относится к способу определения возможного ответа пациента, страдающего раком, на лечение иммуноактивирующей ДНК. Другой объект настоящего изобретения относится к иммуноактивирующей ДНК, которая может быть использована в таком способе, то есть, лечение пациента, определенного перед началом лечения, как отвечающего на лечение.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0010] Настоящее изобретение относится к способу прогнозирования или мониторинга ответа пациента, страдающего раком или аутоиммунным заболеванием, или ответа пациента на лечение агонистом TLR-9 за счет определения количества активированных натуральных килерных Т клеток (NKT). Для иммуннофенотипирования активированных NKT клеток предпочтительно определить дифференцировочный кластер или кластер дифференцировки (CD) молекул CD3+/CD56+/CD69+. Также может быть определено соотношение активированных NKT клеток от всей популяции NKT-клеток для оценки возможного ответа пациента на лечение TLR-9 агонистом.
[0011] Предполагается, что агонист TLR-9 представляет ДНК конструкт, содержащий по меньшей мере один мотив последовательности N1N2CGN3N4, где N1N2 и N3N4 представляет любую комбинацию А, С, Т, и G, а С представляет дезоксицитидин, G представляет дезоксигуанозин, А представляет дезоксиаденозин и Т представляет дезокситимидин
[0012] Пациент, отвечающий на лечение агонистом TLR-9, будет иметь по меньшей мере 3% активированных NKT-клеток от всей популяции NKT-клеток.
[0013] Дополнительно предполагается, что ранее перед этим может быть проведена индукционная терапия при использовании не ДНК лекарственного средства. Такая терапия включает химиотерапию с или без ингибитора ангиогенеза или с или без применения антител.
[0014] Другой объект настоящего изобретения относится к агонисту TLR-9 для применения в способе лечения рака, характеризующегося тем, что пациент имеет повышенные уровни активированных NKT-клеток.
[0015] Предполагается, что используемый агонист TLR-9 содержит по меньшей мере ДНК конструкт, включающий по меньшей мере один мотив последовательности N1N2CGN3N4, где N1N2 и N3N4 представляет любую комбинацию А, С, Т, и G, а С представляет дезоксицитидин, G представляет дезоксигуанозин, А представляет дезоксиаденозин и Т представляет дезокситимидин. Дополнительно агонист может быть охарактеризован N1N2, представляющим элемент, выбранный из группы, состоящей из GT, GG, GA, AT или АА; N3N4, представляющим элемент, выбранный из группы, состоящей из СТ или ТТ.
[0016] Агонист может содержать ДНК, которая представляет линейный с открытой цепью ДНК конструкт, содержащий одно или двухцепочечную ДНК, или линейный двухцепочечный ДНК конструкт, который содержит по меньшей мере на одном конце одноцепочечную петлю. Вместо использования петель для защиты концов линейных двойных цепочек в качестве части двойной цепочки ДНК может быть использован по меньшей мере один L-ДНК нуклеотид.
[0017] Мотив последовательности N1N2CGN3N4 будет расположен в одноцепочечной и/или двухцепочечной области последовательности ДНК. Дополнительно предполагается, что по меньшей мере один нуклеотид ДНК агониста TLR-9 модифицирован функциональной группой, выбранной из группы, состоящей из карбоксильной, амино, амидной, альдиминовой, кетальной, ацетальной, сложного эфира, простого эфира, дисульфидной, тиоловой и альдегидной групп.
[0018] Агонист, содержащий ДНК конструкт, может быть связан с соединением, выбранным из группы, состоящей из пептидов, белков, углеводов, антител, липидов, мицелл, везикул, синтетических молекул, полимеров, микрочастиц, металлических частиц, наночастиц или твердой фазы.
[0019] Дополнительно предполагается, что агонист, содержащий ДНК конструкт, может быть частью композиции лекарственного средства, где композиция лекарственного средства может представлять вакцину.
[0020] Другой объект настоящего изобретения относится к набору для прогнозирования или мониторинга ответа пациента, страдающего раком или аутоиммунным заболеванием, или ответа на лечение агонистом TLR-9, содержащему средства для определения и количественного определения активированных NKT-клеток из всей популяции NKT-клеток.
[0021] В наборе агонист TLR-9 может содержать ДНК конструкт, содержащий по меньшей мере один мотив последовательности N1N2CGN3N4, где N1N2 и N3N4 представляет любую комбинацию из А, С, Т, и G, а С представляет дезоксицитидин, G представляет дезоксигуанозин, А представляет дезоксиаденозин и Т представляет дезокситимидин.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0022] Фигура 1: ROC кривые активированных NKT-клеток у пациентов, получавших активный препарат.
[0023] Фигура 2: Активированные NKT-клетки в сравнении с чувствительностью и специфичностью.
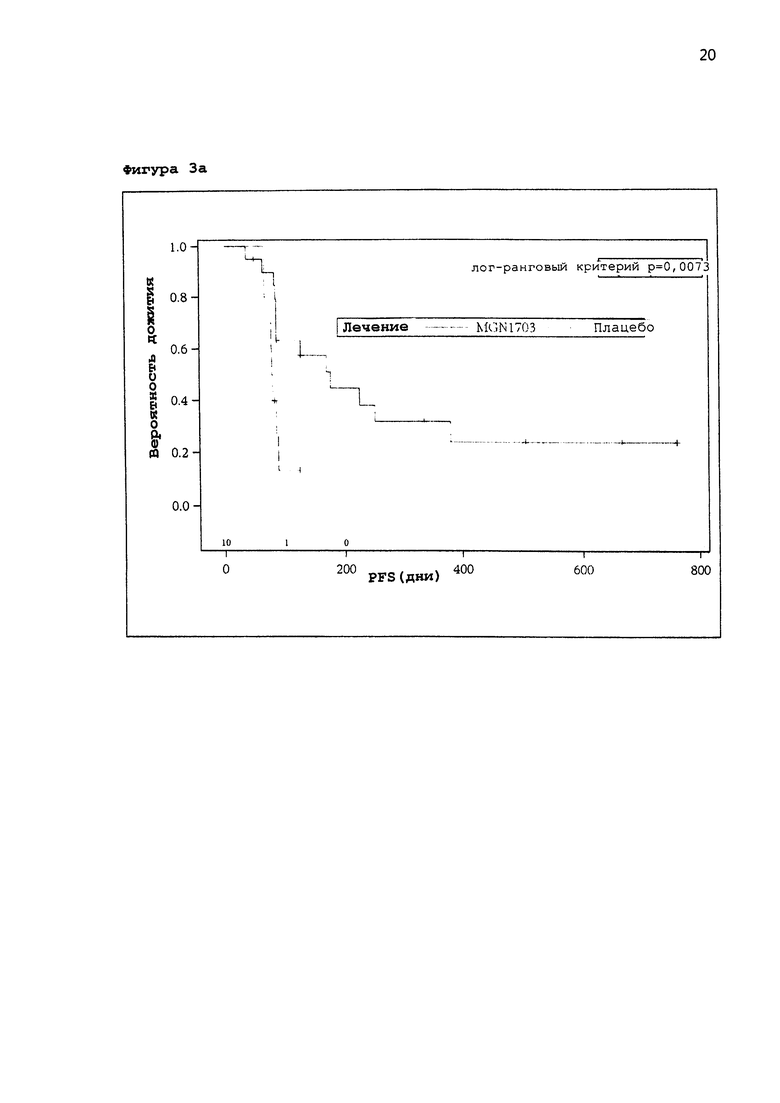
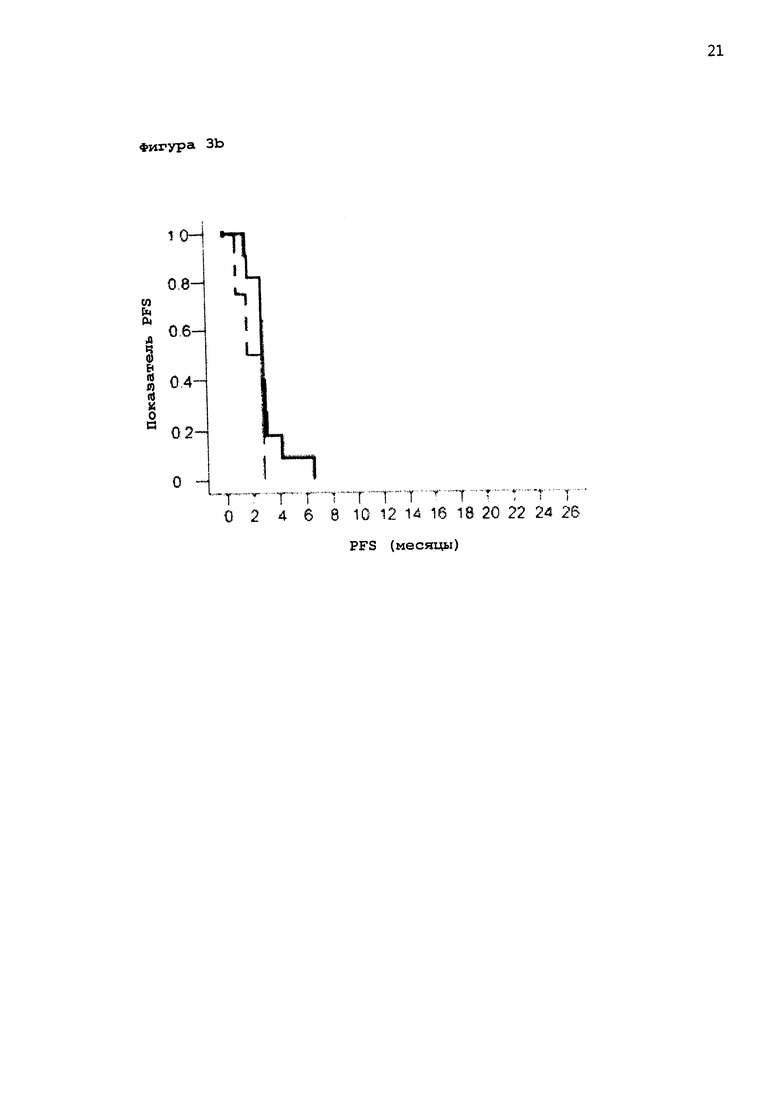
[0024] Фигура 3: а: График Каплана-Майера биомаркеров пациентов с положительным ответом для группы пациентов, получавших активный препарат и плацебо; b: кривая Каплана-Майера биомаркеров пациентов с отрицательным ответом для обоих случаев, для группы пациентов, получавших активный препарат, и группы пациентов, получавших плацебо.
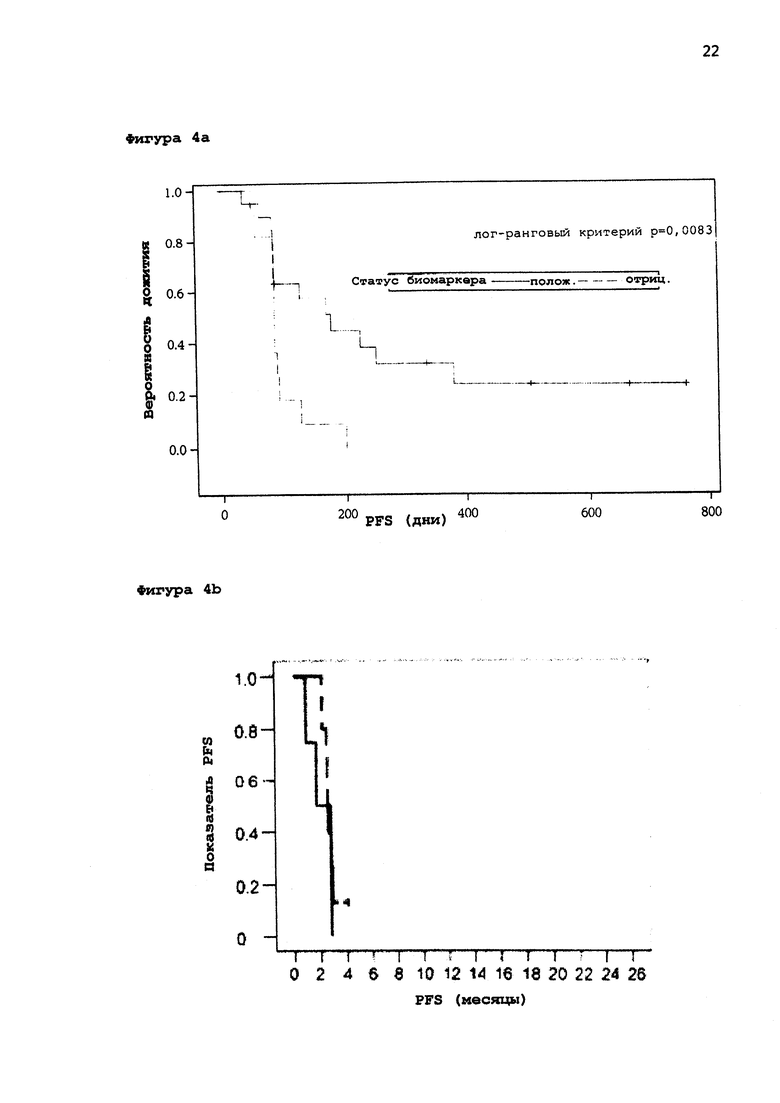
[0025] Фигура 4: а: График Каплана-Майера биомаркеров пациентов с положительным ответом по сравнению с пациентами с отрицательным ответом для группы пациентов, получавших активный препарат; b: График Каплана-Майера биомаркеров пациентов группы плацебо для пациентов с положительным ответом и для пациентов с отрицательным ответом.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0026] В контексте настоящего изобретения MGN1703 относится к ДНК конструкту из ковалентнонепрерывной кольцевой частично самокомплементарной цепочки ДНК, имеющей двухцепочечный стебель с одноцепочечными концевыми петлями, несущими неметилированные CG мотивы.
[0027] Используемый в описании настоящей патентной заявки термин «стебель» относится к двухцепочечной ДНК, образованной спариванием оснований в той же самой молекуле ДНК (которая тогда частично самокомплементарна) или в других молекулах ДНК (которые частично или полностью комплементарны). Внутримолекулярное спаривание оснований означает спаривание оснований в тех же самых молекулах, а спаривание оснований между другими молекулами ДНК определяется, как межмолекулярное спаривание оснований.
[0028] Используемый в описании настоящей патентной заявки термин «петля» относится к неспаренной, одноцепочечной области внутри или на конце структуры стебля. Используемый в описании настоящей патентной заявки термин «шпилька» относится к отличающейся комбинации стебля и петли, которая имеет место, когда две самокомлементарные области одной и той же молекулы ДНК гибридизуются с образованием стебля с неспаренной петлей.
[0029] Используемый в описании настоящей патентной заявки термин «гантелеобразная форма» относится к линейному конструкту ДНК со шпильками на обоих концах фланкирующи х областей стебля. Таким образом, «линейный конструкт ДНК» в контексте настоящего изобретения относится к линейному гантелеобразному конструкту ДНК, содержащему одноцепочечные петли на обоих концах двухцепочечной ДНК стебля.
[0030] Иммуномодуляция по настоящему изобретению относится к иммуноактивации и иммуносупрессии. Иммуноактивация предпочтительно означает, что клетки-эффекторы иммунной системы активированы для пролиферации, миграции, дифференцировки или проявления активности в любой другой форме. Пролиферация клеток, например, может быть индуцирована без костимулирующих сигналов при использовании иммуноактивирующих молекул ДНК, которые в норме требуют костимулирующего сигнала от хелперных Т-клеток.
[0031] С другой стороны, иммуносупрессию следует понимать, как снижение активности или эффективности иммунной системы. Иммуносупрессия специально индуцирована для профилактики, например, отторжения трансплантированных органов, лечения реакции трансплантант против хозяина после трансплантации костного мозга или для лечения аутоиммунных заболеваний, например, ревматоидных артритов или болезни Крона.
[0032] В этом контексте иммуностимуляция также может относиться к воздействию на природу или характер иммунной реакции, либо воздействию на иммунную реакцию, которая все еще развивается или созревает, или к модуляции характера устойчивой иммунной реакции.
[0033] Используемый в описании настоящей патентной заявки термин «вакцинация» относится к введению антигенного материала (вакцина) с получением иммунитета к заболеванию. Вакцины могут предотвратить или смягчить последствия инфицирования множеством патогенов, таких как вирусы, грибки, простейшие паразиты, бактерии, а также аллергические заболевания и астму, наряду с опухолями. Как правило, вакцины содержат один или более адъювант, например, иммуностимулирующие нуклеиновые кислоты, используемые для стимуляции иммунного ответа. Общепринято, что вакцины являются самым эффективным и самым экономичным способом профилактики инфекций и заболеваний.
[0034] Вводимый материал может, например, представлять живые, но ослабленные формы патогенов (бактерии или вирусы), убитые или инактивированные формы этих патогенов, очищенный материал, такой как белки, нуклеиновые кислоты, кодирующие антигены, или клетки, такие как клетки опухоли или дендритные клетки. В частности, недавно была разработана ДНК вакцинация. ДНК вакцинация работает за счет вставки (и экспрессии, запуска распознавания иммунной системой) ДНК, кодирующей антигены, в клетки человека или животного. Некоторые клетки иммунной системы, которые распознают экспрессированные белки, атакуют эти белки и экспрессирующие их клетки. Одним из преимуществ ДНК вакцин является простота их получения и хранения. Дополнительно, ДНК вакцины имеют множество преимуществ по сравнению с традиционными вакцинами, включая способность индуцировать широкий ряд типов иммунных ответов.
[0035] Вакцинация может быть использована в качестве профилактики, позволяющей создать иммунитет против антигена у вакцинированного здорового индивидуума при воздействии антигена. В качестве альтернативы, терапевтическая вакцинация может вызвать усиленный ответ иммунной системы вакцинированного больного индивидуума, направляя иммунную систему индивидуума против антигенов. Обе, и профилактическая и терапевтическая вакцинация, могут быть применены для людей и животных.
[0036] Используемый в описании настоящей патентной заявки термин «рак» относится к раковым заболеваниям или опухолям, лечимым или предотвращаемым, которые выбраны из группы, состоящей без ограничения из рака молочной железы, меланомы, неоплазии кожи, лимфомы, лейкимии, опухоли желудочно-кишечного тракта, включая, карциномы толстой кишки, карциномы желудка, карциномы поджелудочной железы, колоректальный рак, рак тонкой кишки, карциномы яичников, карциномы шейки матки, рака легких, рака простаты, почечно-клеточных карцином и/или метастаз в печени.
[0037] Аутоиммунные заболевания по настоящему изобретению включают ревматоидный артрит, болезнь Крона, системную красную волчанку (SLE), аутоиммунный тиреоидит, тиреоидит Хашимото, множественный склероз, диффузный токсический зоб, миастению гравис, целиакию и болезнь Аддисона.
[0038] Во время экспериментов с иммуноактивирующими гантелеобразными конструктами ДНК с немителированными CG-последовательностями в одноцепочечных концевых петлях было установлено, что к успешной терапии ДНК конструктами относятся увеличение количества клеток определенных типов иммунной активации и эффекторов пути.
[0039] У позвоночных частью врожденной иммунной системы являются так называемые «toll-подобные рецепторы» (TLRs). TLRs представляют семейство специализированных иммунных рецепторов, которые индуцируют защитные иммунные ответы, когда они определяют высококонсервативные патоген-ассоциированные молекулярные паттерны, такие как белки, липидные структуры, сахаридные структуры и определенные нуклеиновые кислоты. Для лечения рака были разработаны или разрабатываются синтетические агонисты для некоторых TLRs, включая TLR-3, TLR-4, TLR-7, TLR-8 и TLR-9, как правило, для активации иммунной системы в присутствии опухолей. TLR-9 распознает присутствие неметилированных, содержащих CG последовательностей ДНК, которые, как правило, встречаются в бактериях, но по существу никогда не встречаются в геномной ДНК человека. Следовательно, ДНК последовательности, содержащие неметилированные CG получены, как искусственные агонисты TLR-9. Воздействие таких содержащих неметилированные CG ДНК конструктов зависит от их взаимодействия с TLR-9, а взаимодействие ДНК-белок зависит от конформации обоих, и ДНК и белка. Экспериментальные данные показали, что гантелеобразные молекулы ДНК неожиданно подходят для индуцирования иммунного ответа.
[0040] Для определения средств для прогнозирования ответа пациента, страдающего раком, на применение агониста TLR-9 использовали гантелеобразный ДНК конструкт с неметилированными CG мотивами в одноцепочечных концевых петлях.
[0041] Для исследования было выбрано в общем 46 пациентов, страдающих метастатическим колоректальным раком, которые ранее получали в течение 4,5-6 месяцев комбинацию стандартной первой линии терапии с человеческими моноклональными антителами, ингибирующими фактор А роста эндотелия сосудов или без них. По прошествии около 1-6 недель периода отсутствия применения препарата провели рандомизацию пациентов, таким образом, что 32 пациента получали ДНК конструкт MGN1703 в дозировке 60 мг на дозу и 14 пациентов получали плацебо, каждому пациенту дважды в неделю делали подкожную инъекцию.
[0042] Через 12 недель лечения все пациенты прошли обследование на прогрессирование опухоли. Исходя из наличия или отсутствия прогрессирования опухоли, пациентов разделили на две группы, которые обозначили, как «PFS группы». Пациенты, у которых не наблюдалось прогрессирование опухоли, были обозначены, как пациенты без прогрессирования опухоли, и их кратко обозначили как «PFS1»; пациенты, у которых наблюдалось прогрессирование опухоли, были обозначены, как пациенты с прогрессированием опухоли, и их кратко обозначили как «PFS0». Очевидно, что отсутствие прогрессирования опухоли (PFS1) указывает на возможный ответ на лечение, в то время как рост опухоли (PFS2) указывает на отсутствие ответа. Лечение каждого пациента продолжали до момента обнаружения прогрессирования опухоли.
[0043] Результаты приведены в Таблице 1. Очевидно, что почти у всех пациентов, получавших ДНК конструкт, не наблюдалось прогрессии.

[0045] Перед первым применением MGN1703 или плацебо (исходный уровень) у всех пациентов взяли образцы крови. Были определены следующие иммунологические факторы, например, определяли часть от целой РВМС популяции и взаимосвязь активированных и не активированных субпопуляций. Выявили корреляцию соответствующих PFS групп после 12 недель и все иммунологические факторы на исходном уровне. Были определены следующие иммунологические факторы: моноциты, активированные моноциты 1, активированные моноциты 2, В-клетки, активированные В-клетки, Т-клетки, активированные Т-клетки, натуральные киллерные (КК)-клетки, активированные NK-клетки, NKT-клетки, активированные NKT-клетки, плазмоцитоидные дендритные клетки (pDCs), активированные pDCs, миелоидные дендритные клетки (mDCs), и активированные mDCs. В Таблице 2 приведены типы клеток, CDs и определенные количества.
[0047] Для оценки возможности использования в качестве соответствующего биомаркера одного из иммунологических факторов рассчитали каждый иммунологический фактор при использовании так называемой регрессии Кокса. Регрессия Кокса позволяет оценить влияние параметра(ов), не принимая во внимание функцию рисков. Полученное в результате из таких расчетов отношение пределов функции риска должно составлять менее 1, и связанный с ним значимый р показатель составляет менее 0,05. В противном случае наблюдаемый эффект не относится к примененному агонисту TLR-9. Эти критерии применяют только для активированных NKT-клеток, имеющих отношение пределов функции риска около 0,993 и р показатель 0,0309.
[0048] Неожиданно было обнаружено, что для прогнозирования успеха лечения в группе пациентов, принимающих активный препарат, может быть использован процент активированных NKT-клеток. В группе пациентов, принимавших активный препарат, исследовали взаимосвязь между процентом активированных NKT-клеток и статусом группы PFS при использовании передовых надежно отработанных статистических анализов.
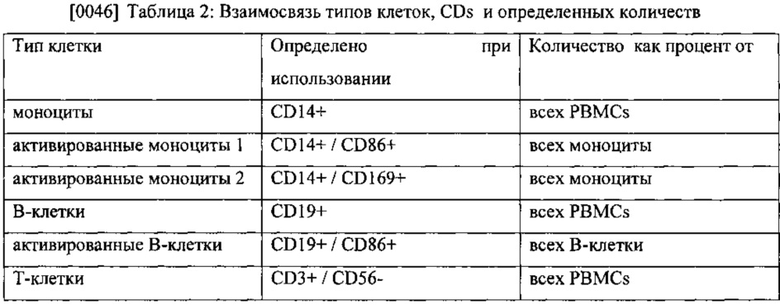
[0049] Рабочая характеристическая кривая (ROC) или просто ROC кривая, отображает эффективность бинарной классификационной системы, которая показывает, как варьирует порог разрешения. ROC кривые получают построением графиков долей объектов от общего количества носителей признака, верно классифицированных, как несущих признак, и долей объектов от общего количества объектов, не несущих признак, ошибочно классифицированных, как несущих признак при варьировании порога решающего правила. Верно классифицированные, как несущие признак, также обозначают, как чувствительность, а ошибочно классифицированные, как положительные, представляют «единица минус специфичность», или верно классифицированные, как отрицательный.
[0050] ROC анализ используют в медицине, радиологии, биометрии и других областях в течение многих десятилетий и все чаще используют в самообучении машин и глубинном анализе данных. В биомаркерах он может быть использован для исследования возможности использования потенциального биомаркера как имеющего клиническую ценность, то есть возможности его использования для прогнозирования. Диагностический тест или биомаркер будет считаться успешным, если кривая проходит выше диагонали, и диагностический тест, рассматривается, как неуспешный, если кривая зеркально отражает диагональ или проходит под ней. Следовательно, ROC кривая дает информацию об успешности или не успешности диагностического теста.
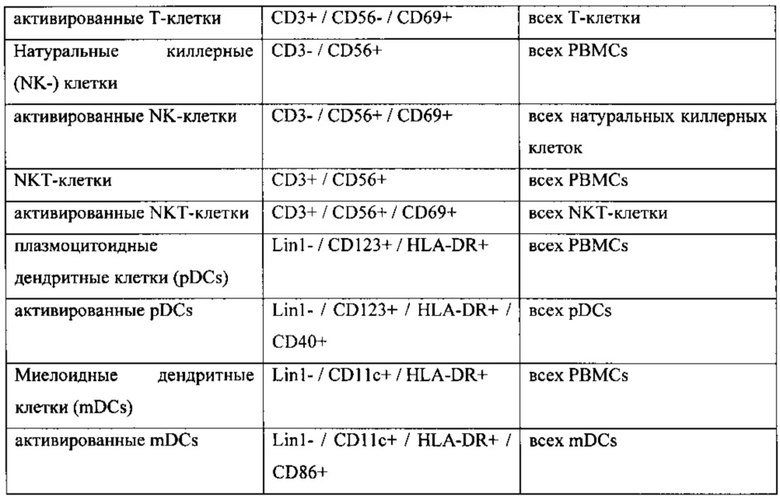
[0051] Получены ROC кривые для активированных NKT-клеток пациентов, получавших активный препарат (Фигура 1). Площадь под кривой была определена, как 0,71, что ясно указывает на достоверность биомаркера. Индекс Юдена, который может быть использован для определения оптимальной малозначимой величины для считывания показателей теста, показывает оптимальную малозначимую величину 3,08% для активированных NKT-клеток. На Фигуре 2 приведены активированные NKT-клетки по сравнению с чувствительностью и специфичностью.
[0052] Пациентов распредели по группам в зависимости от их уровня активированных NKT-клеток. У пациентов с уровнями клеток выше малозначимой величины 3,08% активированных NKT-клеток биомаркеры рассматриваются, как положительные, а у пациентов с уровнями клеток ниже малозначимой величины маркеры рассматриваются, как негативные.
[0053] На Фигуре 3а приведен график Каплана-Майера биомаркеров пациентов с положительным ответом для группы пациентов, получавших активный препарат, и плацебо (сплошная линия: пациенты, леченные MGN1703; пунктирная линия: пациенты, леченные плацебо). Очевидно, что вероятность дожития в группе с положительными биомаркерами неожиданно связана с применением агониста TLR-9.
[0054] На Фигуре 3b приведена кривая Каплана-Майера биомаркеров пациентов с отрицательным ответом для обоих случаев, для группы пациентов, получавших активный препарат, и группы пациентов, получавших плацебо. Очевидно, что время дожития без прогрессирования явно короче в группе пациентов, получавших активный препарат по сравнению с группой пациентов, получавших активный препарат с положительными маркерами (сравнение с Фигурой 3а).
[0055] На Фигуре 4а приведен график Каплана-Майера биомаркеров пациентов с положительным ответом по сравнению с пациентами с отрицательным ответом только для группы пациентов, получавших активный препарат (сплошная линия: пациенты с положительным биомаркером; пунктирная линия: пациенты с отрицательным маркером). Ясно, что пациенты с положительным биомаркером имеют значительное преимущество в вероятности дожития по сравнению с пациентами с негативными биомаркерами, даже, когда обе группы получают лечение активным препаратом MGN1703.
[0056] На Фигуре 4b приведен график Каплана-Майера биомаркеров пациентов группы плацебо для пациентов с положительным и для пациентов с отрицательным бимаркером (сплошная линия: пациенты с положительным биомаркером; пунктирная линия: пациенты с отрицательным маркером). Очевидно, что обе группы показали более или менее идентичную выживаемость без прогрессирования, поскольку они получали только плацебо. Ясно, что биомаркер подходит для оценки возможности пациента отвечать на лечение агонистом TLR-9 или нет. Дополнительно, плацебо группа показала, что биомаркер не связан с эффектами, вызванными общим состоянием здоровья пациента.
[0057] Настоящее изобретение обеспечивает новый предиктивный биомаркер для определения пациентов, отвечающих на лечение рака агонистами TLR-9, в частности ДНК конструктом из ковалентнонепрерывной кольцевой частично самокомплементарной цепочки ДНК, имеющей двухцепочечный стебель с одноцепочечными концевыми петлями, несущими неметилированные CG мотивы. Определение количества активированных NKT-клеток (CD3+/CD56+/Cd69+) на исходном уровне позволяет оценить ответа пациент на лечение ДНК конструктом. Важно отметить, что в группе пациентов, получавших плацебо, пациенты с характеристиками, подобными таковым у пациентов, отвечающих на лечение, ведут себя также, как пациенты, не отвечающие на лечение, показывая, что пролонгированное время дожития без прогрессирования у пациентов, получавших активный препарат с положительными маркерами имеет место по факту за счет применения биомаркеров для выбранной терапии, а не только за счет улучшения общего состояния здоровья или любого не специфического эффекта.
[0058] МАТЕРИАЛЫ И СПОСОБЫ
[0059] Обработка образца
[0060] Цельную кровь (10 мл) для FACS собрали в ВСТ пробирки Streck Cyto-Chex®. В течение 2 часов после сбора образов крови их отправили в контрольно-аналитическую лабораторию. Согласно установленному протоколу образцы хранили при комнатной температуре. Провели оценку количества и статус активирования плазмацитоидных дендритных клеток (pDC), миелоидных дендритных клеток (mDC), моноцитов, натуральных киллерных (NK) клеток, NKT-клеток, В клеток, Т клеток и других популяций клеток.
[0061] Аналитические методы
[0062] Согласно установленных принципов провели сортировку флуоресцентно-активированных клеток (FACS). Образцы цельной крови окрасили флуоресцентномеченными антителами и инкубировали. Провели фенотипический анализ иммунных клеток при использовании проточного цитометра FACScalibur (Becton Dickinson). Для каждого образца каждого пациента задокументировали количество соответствующих проанализированных популяций клеток.
[0063] Анализ человеческих РВМС (мононуклеарные клетки периферической крови) на активацию популяций специфических клеток.
[0064] CD40 экспрессия плазмацитоидных дендритных клеток (pDC).
[0065] Клетки окрасили следующей комбинацией моноклональных антител: противолинейные антитела, меченные ФИТЦ (Anti-Lineage marker-FITC), (коктейль из антител, содержащий антитела против CD3, CD14, CD16, CD19, CD20, CD56); анти-СD123-РЕ; анти-HLA-DR-PerCP; анти-СD40-АРС; PDC выделили, как: негативные к линейным клеткам, HLA-DR положительные, CD123 положительные. В популяции PDC в качестве маркера активации использовали CD40.
[0066] Активация NK-, NK-T и Т клеток при использовании маркера активации CD69.
[0067] Клетки окрасили следующей комбинацией моноклональных антител: анти CD3-FITC; анти CD56-PE; анти CD69-APC.
[0068] NK клетки выделили, как: CD3 негативные, CD56 положительные к клеткам.
[0069] NK-T клетки выделили, как: CD3 положительные, CD56 положительные к клеткам.
[0070] Т клетки выделили, как: CD3 положительные, CD56 негативные.
[0071] CD69 использовали в качестве маркера активации для всех 3 популяций.
[0072] CD86 экспрессия миелоидных дендритных клеток (MDC).
[0073] Клетки окрасили следующей комбинацией моноклональных антител: противолинейные антитела, меченные ФИТЦ, (коктейль антител, содержащий антитела против CD3, CD14, CD16, CD19, CD20, CD56); анти-CDllc-PE; анти-HLA-DR-PerCP; анти-CD86-APC.
[0074] MDC выделили, как: негативные к линейным клеткам, HLA-DR положительные, CD11c положительные к клеткам.
[0075] В MDC популяции в качестве маркера активации использовали CD86.
[0076] CD86 экспрессия В клеток и моноцитов; CD169 экспрессия моноцитов.
[0077] Клетки окрасили следующей комбинацией моноклональных антител: анти CD14-FITC; анти CD169-PE; анти CD19-PerCP; анти CD86-APC.
[0078] В клетки выделили, как CD19 положительные клетки. В популяции В клеток в качестве маркера активации использовали CD86.
[0079] Моноциты выделили, как CD14 положительные к клеткам. В популяции моноцитов в качестве маркеров активации использовали CD86 и CD169.
| название | год | авторы | номер документа |
|---|---|---|---|
| НЕКОДИРУЮЩИЙ ИММУНОМОДУЛИРУЮЩИЙ ДНК КОНСТРУКТ | 2011 |
|
RU2583291C2 |
| КОМБИНАЦИЯ, ВКЛЮЧАЮЩАЯ ИММУНОСТИМУЛИРУЮЩИЕ ОЛИГОНУКЛЕОТИДЫ | 2016 |
|
RU2766693C2 |
| НЕКОДИРУЮЩИЙ ИММУНОМОДУЛИРУЮЩИЙ КОНСТРУКТ ДНК С КОВАЛЕНТНО ЗАКРЫТОЙ СТРУКТУРОЙ | 2015 |
|
RU2668387C2 |
| АЛЛОГЕННОЕ ПРОТИВООПУХОЛЕВОЕ ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО | 2004 |
|
RU2354694C2 |
| КОНКАТЕМЕРЫ ДЛЯ ИММУНОМОДУЛЯЦИИ | 2010 |
|
RU2556119C2 |
| ПРИМЕНЕНИЕ КОНСТРУКЦИИ ДЛЯ ЭКСПРЕССИИ ДНК | 2011 |
|
RU2598713C2 |
| ДНК КОНСТРУКТ ДЛЯ ЭКСПРЕССИИ | 2011 |
|
RU2604186C2 |
| ПРОСТАТОАССОЦИИРОВАННЫЕ АНТИГЕНЫ И ИММУНОТЕРАПЕВТИЧЕСКИЕ СХЕМЫ НА ОСНОВЕ ВАКЦИН | 2013 |
|
RU2737765C2 |
| ПРОСТАТОАССОЦИИРОВАННЫЕ АНТИГЕНЫ И ИММУНОТЕРАПЕВТИЧЕСКИЕ СХЕМЫ НА ОСНОВЕ ВАКЦИН | 2013 |
|
RU2609651C2 |
| СПОСОБ ЛЕЧЕНИЯ ТРИЖДЫ НЕГАТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2017 |
|
RU2757905C2 |
Группа изобретений относится к медицине, а именно к прогнозированию или мониторингу будущего или текущего ответа пациента, страдающего раком, на лечение агонистом TLR-9. Для этого определяют количество активированных натуральных киллерных Т (NKT) клеток, где пациент, отвечающий на лечение агонистом TLR-9, имеет по меньшей мере 3% активированных NKT-клеток от всей популяции NKT-клеток. При этом у отвечающего на лечение пациента наблюдается пролонгированное время дожития без прогрессирования. Агонист TLR-9 представляет собой ДНК конструкт из ковалентнонепрерывной, частично самокомплементарной цепочки ДНК, имеющей двухцепочечный стебель с одноцепочечными концевыми петлями, несущими неметилированные CG мотивы, при этом ДНК конструкт содержит по меньшей мере один мотив последовательности N1N2CGN3N4, где N1N2 и N3N4 представляют любую комбинацию А, С, Т и G, и С представляет дезоксицитидин, G представляет дезоксигуанозин, А представляет дезоксиаденозин, а Т представляет дезокситимидин. Группа изобретений относится также к применению агониста TLR-9, представляющего ДНК конструкт, для лечения рака. Использование данной группы изобретений позволяет использовать активированные NKT-клетки в качестве биомаркера для пациентов, проходящих лечение агонистом TLR-9. 3 н. и 11 з.п. ф-лы, 2 табл., 4 ил.
1. Способ прогнозирования или мониторинга будущего или текущего ответа пациента, страдающего раком, на лечение агонистом TLR-9 определением количества активированных натуральных киллерньгх Т (NKT) клеток, где пациент, отвечающий на лечение агонистом TLR-9, имеет по меньшей мере 3% активированных NKT-клеток от всей популяции NKT-клеток, где у отвечающего на лечение пациента наблюдается пролонгированное время дожития без прогрессирования и где агонист TLR-9 представляет собой ДНК конструкт из ковалентнонепрерывной, частично самокомплементарной цепочки ДНК, имеющей двухцепочечный стебель с одноцепочечными концевыми петлями, несущими неметилированные CG мотивы, при этом ДНК конструкт содержит по меньшей мере один мотив последовательности N1N2CGN3N4, где N1N2 и N3N4 представляют любую комбинацию А, С, Т и G, и С представляет дезоксицитидин, G представляет дезоксигуанозин, А представляет дезоксиаденозин, а Т представляет дезокситимидин.
2. Способ по п. 1, где ранее проводилась индукционная терапия с не ДНК лекарственным средством.
3. Применение агониста TLR-9 для лечения рака, характеризующееся тем, что пациент имеет перед началом лечения по меньшей мере 3% активированных NKT-клеток от всей популяции NKT-клеток, где агонист TLR-9 включает по меньшей мере ДНК конструкт из ковалентнонепрерывной, частично самокомплементарной цепочки ДНК, имеющей двухцепочечный стебель с одноцепочечными концевыми петлями, несущими неметилированные CG мотивы, при этом ДНК конструкт содержит по меньшей мере один мотив последовательности N1N2CGN3N4, где N1N2 и N3N4 представляют любую комбинацию А, С, Т и G, и С представляет дезоксицитидин, G представляет дезоксигуанозин, А представляет дезоксиаденозин, а Т представляет дезокситимидин.
4. Применение по п. 3, где N1N2 представляет элемент, выбранный из группы, состоящей из GT, GG, GA, AT или АА, N3N4 представляет элемент, выбранный из группы, состоящей из СТ или ТТ.
5. Применение по любому из пп. 3 или 4, где агонист TLR-9 содержит по меньшей мере один L-ДНК нуклеотид.
6. Применение по любому из пп 3-5, где по меньшей мере один нуклеотид модифицирован функциональной группой, выбранной из группы, состоящей из карбоксильной, амино-, амидной, альдиминовой, кетальной, ацетальной, сложного эфира, простого эфира, дисульфидной, тиоловой и альдегидной групп.
7. Применение по любому из пп 3-5, где ДНК конструкт связан с соединением, выбранным из группы, состоящей из пептидов, белков, углеводов, антител, липидов, мицелл, везикул, синтетических молекул, полимеров, микрочастиц, металлических частиц или наночастиц.
8. Применение композиции лекарственного средства, включающей агонист TLR-9 для лечения рака, отличающееся тем, что до начала лечения пациент имеет по меньшей мере 3% активированных NKT-клеток от всей популяции NKT-клеток, при этом агонист TLR-9 включает по меньшей мере ДНК конструкт из ковалентнонепрерывной, частично самокомплементарной цепочки ДНК, имеющей двухцепочечный стебель с одноцепочечными концевыми петлями, несущими неметилированные CG мотивы, при этом ДНК конструкт содержит по меньшей мере один мотив последовательности N1N2CGN3N4, где N1N2 и N3N4 представляют любую комбинацию А, С, Т и G, и С представляет дезоксицитидин, G представляет дезоксигуанозин, А представляет дезоксиаденозин, а Т представляет дезокситимидин.
9. Применение по п. 8, где N1N2 представляет собой элемент, выбранный из группы, включающей GT, GG, GA, AT или АА, N3N4 представляет собой элемент, выбранный из группы, включающей СТ или ТТ.
10. Применение по любому из пп. 8 или 9, где агонист TLR-9 содержит по меньшей мере один L-ДНК нуклеотид.
11. Применение по любому из пп. 8-10, где по меньшей мере один нуклеотид модифицирован функциональной группой, выбранной из группы, включающей карбоксильную, аминную, амидную, альдиминовую, кетальную, ацетальную, сложного эфира, простого эфира, дисульфидную, тиоловую и альдегидную группы.
12. Применение по любому из пп. 8-10, где ДНК конструкт связан с соединением, выбранным из группы, включающей пептиды, белки, углеводы, антитела, липиды, мицеллы, везикулы, синтетические молекулы, полимеры, микрочастицы, металлические частицы или наночастицы.
13. Набор для прогнозирования или мониторинга будущего или текущего ответа пациента, страдающего раком, на лечение агонистом TLR-9, содержащий средства для количественного определения активированных NKT-клеток от всей популяции NKT-клеток, где пациент, отвечающий на лечение агонистом TLR-9, имеет по меньшей мере 3% активированных NKT-клеток от всей популяции NKT-клеток, где у отвечающего на лечение пациента наблюдается пролонгированное время дожития без прогрессирования и где агонист TLR-9 включает ДНК конструкт из ковалентнонепрерывной, частично самокомплементарной цепочки ДНК, имеющей двухцепочечный стебель с одноцепочечными концевыми петлями, несущими неметилированные CG мотивы, при этом ДНК конструкт содержит по меньшей мере один мотив последовательности N1N2CGN3N4, где N1N2 и N3N4 представляют любую комбинацию А, С, Т и G, и С представляет дезоксицитидин, G представляет дезоксигуанозин, А представляет дезоксиаденозин, а Т представляет дезокситимидин.
14. Способ по п. 1 или 2, где агонист TLR-9 содержит по меньшей мере один L-ДНК нуклеотид.
| VARGHESE B | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ZDRAZILOVA-DUBSKA L | |||
| et al | |||
| NKT-like cells are expanded in solid tumour patients // Klin Onkol | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| ZDRAZILOVA-DUBSKA L | |||
| et al | |||
| NKT-like cells are expanded in solid tumour patients // Klin Onkol | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| WO 2010055340 A1, 20.05.2010 | |||
| WO 2010055340 A1, 20.05.2010 | |||
| US 2009053250 A1, 26.02.2009 | |||
| US 2009220931 A1, 03.09.2009. | |||
Авторы
Даты
2018-11-14—Публикация
2014-05-15—Подача