Изобретение относится к полимерной некодирующей молекуле нуклеиновой кислоты для модуляции активности иммунной системы человека и животных, а также методу производства вышеперечисленного и вакцины, включающей полимерную некодирующую молекулу нуклеиновой кислоты, где под полимерными некодирующими молекулами нуклеиновой кислоты подразумевают некодирующие молекулы нуклеиновой кислоты, включающие, как минимум, четыре ковалентно связанные молекулы (тетрамер) вышеуказанных некодирующих молекул нуклеиновой кислоты.
В то время как адаптивный иммунный ответ начинается с задержкой (3-5 дней) после отбора специфических лимфоцитов для соответствующего патогена, их клональной экспансии и дифференцировки в эффекторные клетки, но затем обеспечивает длительную защиту от соответствующего патогена путем формирования иммунологической памяти, клетки врожденной иммунной системы узнают патоген посредством взаимодействия патоген-ассоциированных молекулярных паттернов (РАМР) с рецепторами, кодируемыми герминативными клетками, и реагируют моментально. Различные реакции принадлежат различным видам клеточных типов, как секреция цитокинов (напр., IL-1, IL-6, TNF-α) и хемокинов (напр., IL-8/CXCL8, MIP-1α/β, MCP-1), активация эффекторных механизмов (фагоцитоз, дыхательный взрыв, высвобождение бактерицидных или цитотоксических веществ или литических гранул), экспрессия костимулирующих молекул (CD80, CD86), а также повышенная экспрессия MHC-молекул. Таким образом, с одной стороны, эффекторные клетки рекрутированы и активированы, и способны элиминировать проникший патоген, с другой стороны, клетки адаптивной иммунной системы получают необходимые сигналы для их активации.
С целью улучшения иммунного ответа CpG-олигонуклеотиды (CpG-ODN) были использованы в качестве нового класса иммуномодулирующих молекул. Такие неметилированные CG-мотивы могут быть обнаружены в бактериальной ДНК и представляют собой «сигнал опасности» для иммунной системы. Как и патоген-ассоциированный молекулярный паттерн (РАМР), они вызывают неспецифическую активацию врожденной иммунной системы (Krieg, Nat. Med 2003; 9: 831-835). CpG-ODN индуцирует основанный на TH1 иммунный ответ посредством цитокинов: интерлейкина-12, интерферона-γ и фактора-α некроза опухолей.
Иммуностимулирующие нуклеиновые кислоты (ISS), включающие вышеуказанные CpG-ODN, имеют длину в несколько оснований и не включают открытой рамки считывания для экспрессии белков.
ISS представляют собой линейные молекулы нуклеиновой кислоты, концы которых свободны (свободные гидроксильные и фосфатные группы) или защищены синтетическими группами.
Стимуляция клеточного иммунного ответа позволяет влиять на обратные связи, что не приводит к приемлемой иммунной активности у пациента без воздействия.
Модификация CpG-ODN с помощью фосфотиоатного остова, который используется для стабилизации CpG-ДНК, имеет несколько серьезных недостатков. В частности, к ним относится замеченная токсичность (Heikenwalder 2004, Levin 1999), а также неспецифическое связывание с белками (Brown 1994).
В связи с этим был разработан новый класс ковалентно непрерывной иммуномодулирующей ДНК (WO 01/07055/EP 1196178). Эти ДНК-молекулы состоят из двух химическим способом синтезированных ДНК-ODN с самокомплементарной частью на 5'- и 3'-конце с палиндромными, перекрывающимися концами таким образом, что лигирование обеих ДНК-молекул приводит к образованию ковалентно непрерывной молекулы. Эти ДНК-молекулы с GC-мотивами в некомплементарной части демонстрируют активность, сходную с CpG-ODN (повышенная экспрессия поверхностных молекул CD80, CD40, MHC на В-клетках и секреция IL-6, IFN-γ, IFN-α, IL-12, TNFα мононуклеарными клетками периферической крови), но по сравнению с CpG-ODN с фосфоротиоатным остовом они демонстрируют отличия относительно паттерна экспрессии индуцированных цитокинов и отчетливо меньшую токсичность у мышей. Исходя из существующего уровня техники, иммуномодулирующая ДНК имеет ряд недостатков в отношении модуляции активности иммунной системы человека и животных. Невозможно модулировать активность активность иммунной системы человека и животных в необходимой степени, в частности, активировать ее. Молекулы согласно WO 01/07055, как показано в качестве примера на фигуре 1 или в пункте 11 формулы изобретения, состоят из нескольких дезоксирибонуклеотидных остатков, которые образуют частично одноцепочечную гантелеобразную и ковалентно непрерывную молекулу ДНК, которая сконструирована в виде димера в рамках настоящего изобретения. Согласно WO 01/07055 мономерные нуклеиновые кислоты, используемые в качестве исходного материала, были нагреты перед лигированием, получая однотипные молекулы нуклеиновых кислот, каждая из которых состоит из гантелеобразного димера (сравни с фигурой 1 WO 01/07055). Получаемая нуклеиновая кислота имеет вид гантели согласно чертежу 1 WO 01/07055. Мономер в рамках изобретения не означает структуру, состоящую, например, из одного основания, а означает нуклеиновую кислоту, которая сама по себе состоит из нескольких дезоксирибонуклеотидмонофосфатов (сравни с фигурой 1 или пунктом 11 формулы изобретения WO 01/07055), которые в совокупности формируют типичные для мономера свойства вследствие заданной последовательности оснований или заданной трехмерной конформации.
Исходя из этого уровня техники, целью настоящего изобретения является предоставление пригодных иммуномодулирующих молекул ДНК, которые инициируют улучшенный иммунный ответ, а также способ их изготовления, а также вакцин, включающих вышеуказанные иммуномодулирующие ДНК-молекулы.
В контексте настоящего изобретения иммуномодуляция означает, что медиаторные и эффекторные клетки иммунной системы, так, главным образом известные в настоящее время тимоциты с хелперной функцией и цитотоксические тимоциты, В-клетки и так называемые NK (естественные киллеры)-клетки, макрофаги и моноциты, а также дендритные клетки и их предшественники, а также клеточные популяции с функциями, на настоящий момент однозначно не идентифицированными, которые имеют функцию в пределах иммунной системы, подвергаются стимуляции путем использования молекул нуклеиновых кислот для пролиферации, миграции, дифференцировки или их активности. Иммуномодуляция означает, что наряду с основным улучшением иммунного ответа в определенном выше смысле также подвергнуты влиянию тип или характер иммунной реакции либо путем воздействия на начинающуюся или зреющую иммунную реакцию, либо путем изменения состоявшейся реакции в отношении ее характера.
Молекула с улучшенными иммуномодулирующими свойствами, заявленная в настоящем изобретении, полимерная некодирующая молекула нуклеиновой кислоты, сравнивается с димерными веществами из WO 01/07055. Под полимерной молекулой нуклеиновой кислоты следует понимать так называемый высокомолекулярный конкатемер. Полимерная молекула по изобретению может быть изготовлена способом, включающим нижеприведенные стадии:
- обеспечения 5'-фосфорилированной дезоксирибонуклеиновой кислоты,
- осаждения спиртом с последующим высушиванием осадка при 50°С или лиофилизацей молекулы ДНК при 50°С, в частности, в присутствии MgCl2 пока не будет получен сухой остаток с последующим ресуспендированием в буфере.
- добавления Т4-ДНК-лигазы, тем самым образуя реакционную смесь, и
- инкубации реакционной смеси при 37°С в течение, как минимум, 30 минут.
Конкатемеры состоят из ковалентно связанных мономерных единиц, которые полностью замкнуты в кольцо, имеющие в пределах досягаемости составляющих их мономеров двухцепочечные части и иммуномодулирующие CG-мотивы предпочтительно в одноцепочечных частях. Было полной неожиданностью, что эти полимеры, включающие тетрамеры, гексамеры или высокомолекулярные упорядоченные структуры ковалентно непрерывной иммуномодулирующей ДНК, обладают чрезвычайно улучшенным воздействием по сравнению с димерными молекулами из существующего уровня техники.
Заявленные полимерные молекулы представлены на фигурах 1 и 2 в отношении молекулярных свойств и на фигурах 3 и 4 в отношении функциональных свойств, которые, следуют для специалиста в данной области техники как результат способа изготовления по изобретению. Использование молекул нуклеиновой кислоты с палиндромными соответственно 5'- и 3'-концами в качестве продуктов выделения в описанном способе, приводит к образованию полимеров различных размеров, из которых только заявленные тетрамеры или высокомолекулярные упорядоченные структуры выполняют высокоактивную функцию. Поскольку характеристика по структурным свойствам невозможна вследствие увеличенного и различного молекулярного размера, характеристика полимеров посредством способа их изготовления является очень точной. Новый способ обеспечивает продуктом, отличным от такового, описанного в существующем уровне техники. Это может быть продемонстрировано четкими отличиями свойств димеров и полимеров по изобретению, как показано на фигуре 3. Высокомолекулярные полимеры по изобретению на удивление лучше подходят для иммунной модуляции, чем неполимерные структуры, известные из существующего уровня техники.
Молекулы по изобретению могут быть также изготовлены путем предоставления 5'-фосфорилированных дезоксирибонуклеиновых кислот в воде, если они очищены методом, эквивалентным электрофорезу в полиакриламидном геле, в частности, комбинированной очисткой с помощью HPLC с последующим применением FPLC. Специалистам в данной области техники известно, что путем комбинации нескольких высокоэффективных методов подобно HPLC или FPLC может быть получена степень очистки, аналогичная PAGE-очистке.
Как ни удивительно, хронология отдельных стадий способа приводит к образованию мультимерной молекулы, включающей кольцевые стабильно и ковалентно связанные друг с другом мономеры длиной, как минимум, 24 нуклеотида. Одновременно образуемые высокомолекулярные полимеры всегда состоят из четного числа мономерных составляющих. Образуемая цепь молекул не содержит свободных 5'- или 3'-концов. Мономеры, образующиеся посредством межмолекулярной этерификации молекулы по изобретению, характеризуются:
- включением участка, как минимум, из двух непрерывных нуклеотидов, который образует при подходящих условиях двухцепочечный стебель с другой частью мономера,
- между этими обратно комплементарными частями находятся, как минимум, 4 нуклеотида
- CG-мотивы, которые распознаются клеточными структурами, предпочтительно расположены в одноцепочечной части,
- модифицированные нуклеотиды могут также быть частью одноцепочечной области, которые ковалентно связаны с жирными кислотами, сахарами или аминокислотами.
Молекула по изобретению содержит, как минимум, четыре мономера и образуется с учетом ее конформации во время вышеупомянутого синтеза. Мономеры формируют посредством межмолекулярных связей цепи из двух, четырех, шести и более молекул путем образования ковалентной связи. В результате образуются так называемые ди-, тетра- или гексамеры, которые все, за исключением димеров, обозначаются как полимеры.
Молекула по изобретению может быть также определена как конкатемер. В предпочтительном варианте изобретения предполагается, что молекула по изобретению является конкатемерной молекулой, где, как минимум, четыре петли отдельных мономеров связаны друг с другом, предпочтительно линейно таким образом, что предпочтительно две, особенно предпочтительно несколько двухцепочечных частей отделены каждая друг от друга одноцепочечными элементами петли.
Молекула по изобретению способна модулировать активность иммунной системы человека или животных лучше молекул существующего уровня техники. Молекулы существующего уровня техники представляют собой известные иммуномодулирующие последовательности нуклеиновых кислот, которые эффективны в виде низкомолекулярных гантелевидных структур. Наиболее известные иммуномодифицирующие короткие олигодезоксирибонуклеиновые кислоты состоят из неметилированного цитозин-гуанозин-мотива. Под физиологическим действием таких нуклеиновых кислот также следует понимать иммунную модуляцию относительно модуляции активности иммунной системы в рамках данного изобретения. ЕР 1 196 178 рассматривает дополнительно несколько молекул, состоящих из стебля, как минимум, с одной петлей, как они рассмотрены, например, на фигурах 1 и 2 в ЕР 1 196 178. С точки зрения настоящего изобретения такие молекулы представляют собой димерные структуры. Настоящее изобретение не включает такие димеры. Следует отметить, что термин полимер используется в нескольких различных значениях в науке. Полимер может быть, например, более длинной нуклеиновой кислотой, а также структурой, включающей несколько одинаковых или подобных молекул, формирующих большую по размеру упорядоченную структуру. Полимер в рамках изобретения означает цепь молекул, включающую, как минимум, четыре мономера. При условии использования предпочтительных мономеров, молекулярный вес образующегося тетрамера соответствует приблизительно 170 кДа (срав. Фиг. 2). Полимеры в рамках изобретения представляют собой, например, стебель-петля-структуры, как изображено на Фиг. 1, образующие упорядоченные структуры с несколькими такими же или подобными стебель-петля-структурами с образованием структуры более высокого порядка (полимера). Полимер представляет собой молекулы по изобретению, которые больше 23 кДа. Описанные условия реакции вызывают во время лигирования временное соединение мономеров, которые могут быть этерифицированы лигазой. Окончательный полимер будет образован во время синтеза с учетом его конформации только в специальных условиях реакции. Невозможно произвести высокомолекулярные полимеры из димеров, которые уже были образованы. Мономерные структуры, образующие полимер, ковалентно связаны друг с другом. Образованный полимер стабилен в отношении нагревающих или денатурирующих агентов, что означает наоборот, что димеры не могут быть получены простыми физическими способами из высокомолекулярной молекулы по изобретению.
Поразительно, что в ходе сравнительно простых этапов метода можно получить такие полимерные структуры, имеющие улучшенные и не очевидные свойства по сравнению с димерными структурами. Изготовление высокомолекулярных упорядоченных структур, например, может быть выполнено посредством центрифугирования, электрофореза в геле или колоночной хроматографии для выявления и получения сложноорганизованных структур высокого порядка, подобно, например, тетрамерам, гексамерам или другим, которые по сравнению с димерами обладают улучшенными свойствами в отношении модуляции иммунной системы (сравни фиг. 3 и 4). Различные формы иммунной модуляции у лабораторных организмов или человека доказывают это.
Все дезоксирибонуклеиновые кислоты в соответствии с приведенной ниже характеристикой могут быть использованы в способе полимеризации.
5'-P-W-S-3', где
- P, W, S являются нуклеиновыми кислотами, связанными друг с другом в перечисленном порядке чтения посредством фосфодиэфирных связей «-«,
- последовательность нуклеиновой кислоты P, W или S содержит, как минимум, один мотив дезоксирибонуклеотидной последовательности CG.
- W имеет, как минимум, длину в 4 нуклеотида и
- последовательности частей нуклеиновых кислот S и P обратно комплементарны друг другу.
Образующиеся в конечном итоге полимеры соответствуют формуле:
 , где
, где
- нуклеиновая кислота Р с правой стороны формулы ковалентно связана с нуклеиновой кислотой W, расположенной слева
- «n» описывает степень конкатемеризации, указывая на число внутренних мономерных единиц.
Поскольку свойства заявленных полимеров определяются их конформацией, полимерная структура в рамках этой заявки может быть организована в виде упорядоченной структуры из идентичных не по последовательности мономеров. Группа W нуклеиновых кислот может содержать в этой связи молекулы с последовательностями B, U, K, Y, группа Р нуклеиновых кислот может содержать молекулы с последовательностями J, E, R, G, и группа S нуклеиновых кислот может содержать последовательности M, A, T, I. В зависимости от множества n мономеров в коровой части образующегося в результате полимера, присутствуют несколько различных частей последовательности J-U-A относительно R-Y-I, которые не должны быть идентичными по последовательности относительно друг друга, что отображается индексом «i» относительно «n-i+1». Заявленные полимеры с идентичными по последовательности или различающимися по последовательности мономерными компонентами соответствуют формуле:
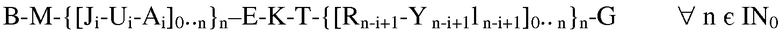 , где
, где
- A, B, E, G, I, J, K, M, R, T, U, Y являются дезоксирибонуклеотидными молекулами и
- последовательность компонента i молекулы нуклеиновой кислоты может отличаться, но не должна быть, в сравнении с (i+1), той же самой молекулой и
- как минимум, одна нуклеиновая кислота включает мотив с дезоксирибонуклеотидной последовательностью CG и
- B, Ui, K и Y n-i+1 в основном одноцепочечные и
- B, Ui, K и Y n-i+1 каждая собрана, как минимум, из 4 дезоксирибонуклеотидов и
- последовательности Ji по отношению к In-i+1, Ai по отношению к Rn-i+1, M по отношению к G, соответственно E по отношению к Т являются обратно комплементарными к друг другу и
- G ковалентно связана посредством фосфодиэфирной связи с В.
Предпочтительно, полимер по изобретению характеризуется тем, что дезоксирибонуклеиновая кислота, используемая в методе, содержит нижеприведенную последовательность:
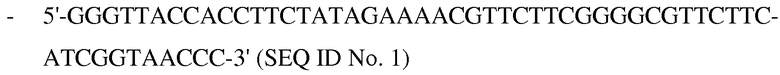
- где дезоксирибонуклеиновая кислота имеет длину от 20 до 400 нуклеотидов.
Результатом синтеза продукта с предпочтительными последовательностями являются молекулы, которые удивительным образом подходят для модуляции иммунного ответа. Особенно предпочтительно, если основная последовательность в пределах частей одноцепочечной молекулы частично или полностью соответствуют последовательности
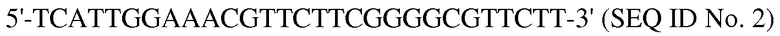
Поразительно, что присутствие этих последовательностей приводит к очень хорошей активности конкатемерных полимеров. Внутри конкатемерной структуры молекулы частично одноцепочечные ковалентно замкнутые цепи дезоксирибонуклеотидов отвечают за пролонгированное действие молекул в целевом организме, в который их вводят.
В дополнительном предпочтительном варианте осуществления изобретения предполагается, что мономер состоит из основной последовательности N1N2CGN3N4, где N1N2 является элементом группы GT, GG, GA, AT или AA, N3N4 является элементом группы CT или TT, также как С дезоксицитозин, G дезоксигуанозин, А дезоксиаденозин и Т дезокситимидин.
В особенно предпочтительном варианте осуществления изобретения предполагается, что основная последовательность N1N2CGN3N4 расположена в пределах одноцепочечной части замкнутой цепи дезоксирибонуклеотидов. В частности, эти предпочтительные молекулы оказывают очень сильное воздействие во время модуляции иммунных систем.
Очевидно, что молекула по изобретению может иметь одну или несколько заместителей, связанных посредством ковалентных связей. Такими заместителями могут быть, например, пептиды, белки, сахариды, липиды, антигенные структуры, ДНК и/или РНК.
Изобретение рассматривает, помимо вышеперечисленных структурных и функциональных свойств продукта, также способ изготовления молекулы, включающий нижеперечисленные стадии:
- обеспечения 5'-фосфорилированной молекулой ДНК в воде, очищенной электрофорезом в полиакриламидном геле,
- лиофилизация при 50°С до тех пор, пока не будет получен сухой остаток, и последующее ресуспендирование в буфере,
- добавления Т4-ДНК-лигазы, образуя реакционную смесь, и
- инкубации реакционной смеси при 37°С в течение, как минимум, 30 минут,
или
- обеспечения мономера дезоксирибонуклеиновой кислоты после осаждения с последующим высушиванием осадка при 50°С или лиофилизацией молекулы ДНК при 50°С в присутствии хлорида магния
- добавления Т4-ДНК-лигазы и
- инкубации, как минимум, в течение 10 минут при 37°С предпочтительно, как минимум, в течение 30 минут.
Те же результаты в отношении изготовления полимера могут быть получены с помощью осаждения или лиофилизации в присутствии хлорида магния, в частности, если дезоксирибонуклеиновая кислота была очищена электрофорезом в полиакриламидном геле или комбинацией HPLC и FPLC.
Было полной неожиданностью то, что результатом применения способа является получение различных молекулярных структур по сравнению с димерами, описанными в существующем уровне технике (WO 2007/131495 или WO 01/07055). Поскольку эти способы отличаются только по нескольким стадиям, удивительнее то, что результатом относительно небольших модификаций является получение различных молекул. Структуры, получаемые способом, известным в существующем уровне технике (WO 01/07055 или WO 2007/131495), демонстрируют значительные различия по их свойствам. Молекулы четко различаются в отношении иммуномодулирующего действия, но также по другим характеристикам, как, например, побочным эффектам. Помимо различных стадий способов, использование полученных продуктов с предпочтительными последовательностями приводит к образованию высокоспецифичного продукта реакции со специфическими и исключительными свойствами. Использование последовательностей по изобретению наряду с вышеупомянутыми стадиями способа приводит к образованию эффективных полимеров, демонстрируя предпочтительные свойства относительно таковых из существующего уровня техники.
Полимер по изобретению состоит предпочтительно из 2+2 мономеров (срав. Фиг. 1), предпочтительно частично одноцепочечных, ковалентно замкнутых цепей дезоксирибонуклеотидных компонентов, где мономеры имеют стебель и петлю, где стебель имеет, как минимум, 2 дезоксирибонуклеотида, и петля имеет, как минимум, 4 дезоксирибонуклеотида, и петля имеет от 1 до 6 CG-мотива, и вариабельный n является элементом из множества натуральных чисел.
Изобретение относится дополнительно к композиции, которая включает, как минимум, молекулу по изобретению и химиотерапевтический препарат. Поразительно то, что непредвиденное значительное улучшение иммунного ответа под действием молекулы по изобретению может быть дополнительно отчетливо улучшено сочетанием средства по изобретению с известными химиотерапевтическими препаратами и использованием композиции предпочтительно, например, для лечения опухолей. Хотя специалисту в данной области техники известно, что димеры согласно WO 01/07055 обладают иммуномодулирующим действием, и было дополнительно известно, что химиотерапевтические препараты воздействуют на опухоли, неожиданностью было то, что иммуномодулирующие димеры, состоящие из мономеров, вызывают в комбинации с химиотерапевтическими препаратами сверх-аддитивный эффект. Более неожиданным было то, что полимеры, состоящие из мономеров, соответственно конкатемеров, в комбинации с химиотерапевтическими препаратами демонстрировали более положительный эффект, чем димеры. Данные элементы, объединенные в композицию по изобретению, оказывают действие с той же целью для лечения патогенов, в частности, опухолей. Каждый элемент не определяет отдельный результат внутри композиции по изобретению, но взаимодействие между отдельными элементами приводит к неожиданному эффекту, который более выражен у полимеров, нежели у димеров. Композиция по изобретению может быть представлена в виде набора, в котором молекула по изобретению и химиотерапевтические препараты в соответствии с существующим уровнем техники представлены раздельно. Таким образом, в предпочтительном варианте осуществления изобретения, как минимум, два компонента наборов могут применяться одновременно или со сдвигом по времени. Применение композиции по изобретению может, например, активировать иммунную систему таким образом, что последующее применение химиотерапевтического препарата может оказать очень хорошее воздействие. Очевидно, что возможно применить человеку или животному сначала химиотерапевтический препарат и затем с задержкой по времени - молекулу по изобретению. Для определенных опухолей одновременное применение молекулы по изобретению и химиотерапевтического препарата предпочтительно.
В предпочтительном варианте осуществления изобретения химиотерапевтический препарат выбран из группы, включающей антитела, алкилирующие агенты, платиновые аналоги, интеркалирующие агенты, антибиотики, супрессоры митоза, таксаны, супрессоры топоизомераз, анти-метаболиты и/или L-аспарагиназу, гидроксикарбамид, митотаны и/или аманитины.
В предпочтительном варианте осуществления изобретения алкилирующие агенты выбраны из группы, включающей
- производные азотистого иприта, в частности
- циклофосфамид,
- ифосфамид,
- трофосфамид,
- мелфалан и/или
- хлорамбуцил
- алкилсульфонат, в частности
- бусульфан, и/или
- треосульфан
- нитрозомочевину, в частности
- кармустин,
- ломустин,
- нимустин
- эстрамустин и/или
- стрептозотоцин
- прокарбазин и дакарбазин,
- темозоломид и/или
- тиотепа.
Алкилирующие агенты обладают очень хорошим воздействием на опухоли, ингибируя их рост.
В предпочтительном варианте осуществления изобретения платиновые аналоги выбраны из группы, включающей:
- цисплатин,
- карбоплатин и/или
- оксалиплатин.
В дополнительном предпочтительном варианте осуществления изобретения предполагается, что интеркалирующие агенты выбраны из группы, включающей:
- антрациклин, в частности
- доксорубицин (адриамицин),
- даунорубицин,
- эпирубицин и/или
- идарубицин,
- митоксантрон
- амсакрин и/или
- доксифлуридин.
В дополнительном предпочтительном варианте осуществления изобретения предполагается, что антибиотики выбраны из группы, включающей:
- блеомицин,
- актиномицин D (дактиномицин) и/или
- митомицин.
Кроме того, в другом предпочтительном варианте осуществления изобретения запланирован как преимущество выбор супрессоров митоза из группы, включающей:
- алкалоиды барвинка, в частности
- винорелбин,
- винкристин (онковин),
- винбластин и/или
- виндезин.
В дополнительном особенно предпочтительном варианте осуществления изобретения таксаны выбраны из группы, включающей:
- паклитаксел и/или
- доцетаксел.
Далее, может быть целесообразным, чтобы супрессоры топоизомеразы были выбраны из группы, включающей:
- ингибиторы топоизомеразы I, в частности
- камптотецин,
- топотекан и/или
- иринотекан и/или
- ингибиторы топоизомеразы II, в частности,
- этопозид,
- тенипозид.
Далее, целесообразным в частном варианте осуществления изобретения является выбор антиметаболитов из группы, включающей:
- антагонисты фолиевой кислоты, в частности
- метотрексат,
- пиримидиновые аналоги, в частности
- 5-фторурацил,
- капецитабин,
- цитозина арабинозид (цитарабин) и/или
- гемцитабин
- пуриновые аналоги, в частности
- 6-тиогуанин,
- пентостатин,
- азатиоприн,
- 6-меркаптопурин,
- флударабин и/или
- кладрибин.
Кроме того, изобретение относится к набору, включающему молекулу по изобретению и химиотерапевтические препараты, при необходимости, вместе с информацией о комбинации содержимого набора. Изобретение относится также - как уже было описано - к фармацевтическому препарату, включающему молекулу по изобретению или композицию при необходимости с фармацевтическим совместимым носителем.
Кроме того, изобретение относится к использованию молекулы, композиции или фармацевтическому препарату для производства средства для модуляции иммунной системы человека или животного или для модуляции активности упомянутой иммунной системы. Под модуляцией иммунной системы человека или животного следует понимать влияние каждого на иммунную систему, обладая эффектом в том, что иммунная система ингибирует опухоли или рак. Модуляция активности иммунной системы может быть истолкована синонимично этому или быть описана для специалиста в данной области техники как известные активности иммунной системы, которые направлены против опухолей и на удивление оказываются повышенными в их действии в результате применения средств по изобретению. Модуляция представляет собой, в частности, стимуляцию или увеличение работы иммунной системы относительно самой по себе иммунной системы, означая подавляющий опухоль или ремиттирующий профилактический эффект. Таким образом, средство по изобретению может быть использовано в предпочтительном варианте осуществления изобретения для стимуляции опосредованного Т-клетками иммунного ответа, но также для изменения не зависимого от Т-клеток иммунного ответа. Этот процесс может включать в предпочтительном варианте осуществления изобретения пролиферацию В-клеток или активацию В-клеток.
В особенно предпочтительном варианте осуществления изобретения модуляция активности иммунной системы приводит к улучшению, в результате чего секреция цитокинов различными соответствующими клеточными популяциями изменяется, соответственно возвращается в прежнее состояние. Особенно предпочтительно то, что молекула по изобретению, соответственно композиция по изобретению, используется в качестве адъюванта в терапевтической или профилактической вакцинации. Средство по изобретению может быть использовано очень эффективно для лечения нарушений клеточного роста, где в предпочтительном варианте осуществления изобретения нарушением клеточного роста является опухолевое заболевание. Предпочтительно, опухолевое заболевание является заболеванием, выбранным из группы, включающей опухоли области ухо-горло-нос, включающие опухоли внутренней части носа, придаточной полости носа, носоглотки, губ, ротовой полости, ротовой части глотки, дыхательного горла, уха, слюнных желез и параганглиому, опухоли легких, включающие немелкоклеточную бронхиальную карциному, мелкоклеточную бронхиальную карциному, опухоли средостения, опухоли желудочно-кишечного тракта, включающие опухоли пищевода, желудка, поджелудочной железы, печени, желчного пузыря и желчных протоков, тонкого кишечника, толстого кишечника и карциному прямой кишки и карциному анального канала, урогенитальные опухоли, включающие опухоли почек, мочеточника, мочевого пузыря, предстательной железы, мочеиспускательного канала, полового члена и яичек, гинекологические опухоли, включающие опухоли шейки матки, влагалища, вульвы, рак матки, злокачественное заболевание трофобласта, карциному яичника, опухоли маточной трубы (фаллопиевой трубы), опухоли брюшной полости, карциному молочной железы, опухоли эндокринных органов, включающие опухоли щитовидной железы, паращитовидной железы, коры надпочечников, эндокринные опухоли поджелудочной железы, карциноидные опухоли и карциноидный синдром, множественные эндокринные неоплазии, саркомы костной и мягких тканей, мезотелиому, опухоли кожи, меланому, включающую кожную и интраокулярную меланому, опухоли центральной нервной системы, опухоли детского возраста, включающие ретинобластому, опухоль Вильмса, нейрофиброматоз, нейробластому, опухоли семейства саркомы Юинга, рабдомиосаркому, лимфомы, включающие неходжкиновскую лимфому, Т-клеточную лимфому кожи, первичную лимфому центральной нервной системы, болезнь Ходжкина, лейкемии, включающие острые лейкемии, хроническую миелоидную и лимфоцитарную лейкемию, неоплазии плазматической клетки, синдром миелодисплазии, паранеопластический синдром, метастазы с неизвестной первичной опухолью (синдром CUP), метастазирующие опухоли, включающие метастазы мозга, метастазы легкого, метастазы печени, метастазы кости, плевральные и перикардиальные метастазы и злокачественный асцит, перитонеальный карциноматоз, связанное с иммуносупрессией злокачественное новообразование, включающее СПИД-ассоциированное злокачественное новообразование, такое как саркома Капоши, СПИД-ассоциированная лимфома, СПИД-ассоциированная лимфома центральной нервной системы, СПИД-ассоциированная болезнь Ходжкина и СПИД-ассоциированные аногенитальные опухоли, связанное с трансплантацией злокачественное новообразование.
Далее изобретение проиллюстрировано примерами, не ограничиваясь этими примерами.
Примеры получения иммуномодулирующих молекул нуклеиновых кислот:
а) Изготовление незаявленного димерного мономера:
5'-фосфорилированный олигодезоксирибонуклеотид (ODN) с последовательностью  (SEQ ID No. 3) был нагрет в течение 5 минут до 90°С и впоследствии охлажден на льду, чтобы дать возможность образоваться шпилечной структуре. Самокомплементарные выступающие части были лигированы в конечной концентрации 1 мг/мл ДНК в присутствии Т4-ДНК-лигазы (0,1 Ед/мкг ODN) в течение 24 ч при 37°С.
(SEQ ID No. 3) был нагрет в течение 5 минут до 90°С и впоследствии охлажден на льду, чтобы дать возможность образоваться шпилечной структуре. Самокомплементарные выступающие части были лигированы в конечной концентрации 1 мг/мл ДНК в присутствии Т4-ДНК-лигазы (0,1 Ед/мкг ODN) в течение 24 ч при 37°С.
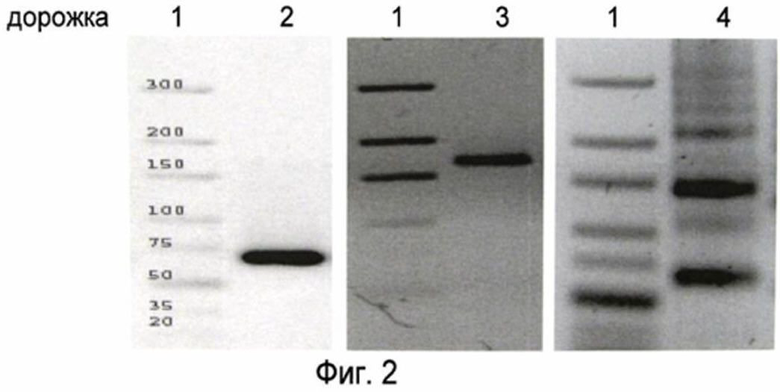
Фракционирование очищенного продукта лигирования в 3% агарозном геле, сравни фиг. 2 дорожка 2.
b) Изготовление тетрамера как примера заявленных полимеров:
На степень полимеризации может только повлиять до определенной степени концентрация используемой нуклеиновой кислоты. Для специфического изготовления димерного конкатемера, как показано на фиг. 2, способ изготовления был модифицирован следующим образом:
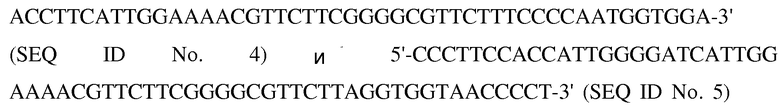 в эквимолярных концентрациях (50 мкМ) были денатурированы в течение 5 мин при 95°С и впоследствии медленно охлаждены в течение 50 мин при 25°С.
в эквимолярных концентрациях (50 мкМ) были денатурированы в течение 5 мин при 95°С и впоследствии медленно охлаждены в течение 50 мин при 25°С.
- к этой смеси 5'-фосфорилированная нуклеиновая кислота с последовательностью 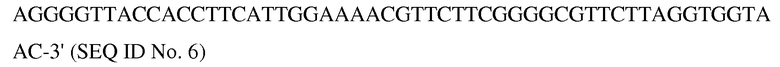
была добавлена в одномолярном избытке
- все дальнейшие этапы были выполнены в соответствии с вышеописанным методом.
Фракционирование очищенного продукта лигирования в 3% агарозном геле, сравни фиг. 2 дорожка 2.
с) изготовление высокомолекулярных полимеров:
Нуклеиновые кислоты с последовательностью 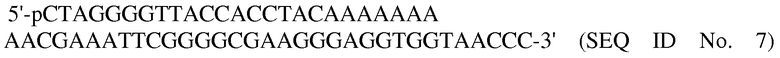
в концентрации 1 мг/мл были осаждены 0,3 М ацетатом натрия (рН 5,25), 10 мМ MgCl2 и тройным объемом этанола абс.. После центрифугирования (4°С, 13000 об/мин) ODN был высушен при 50°С в течение 10 мин. Осадок был непосредственно использован для лигирования (0,5 ед/мкг ODN) и инкубирован в течение 60 мин при 37°С. Фракционирование продукта лигирования в 3% агарозном геле, сравни фиг. 2 дорожка 4.
Описание фиг. 2:
Для определения молекулярных весов произведенные молекулы были фракционированы в 3% агарозном геле. Дорожка 1 слева демонстрирует молекулярные веса двухцепочечной ДНК с указанием массы каждой полосы, соответствуя различным расстояниям миграции. На дорожки со 2 по 4 были нанесены продукты различных реакций полимеризации. Можно наблюдать лишь одну полосу, соответствующую димеру (дорожка 2) относительно тетрамера (дорожка 3) относительно набора фрагментов, включающего все формы полимеров (дорожка 4).
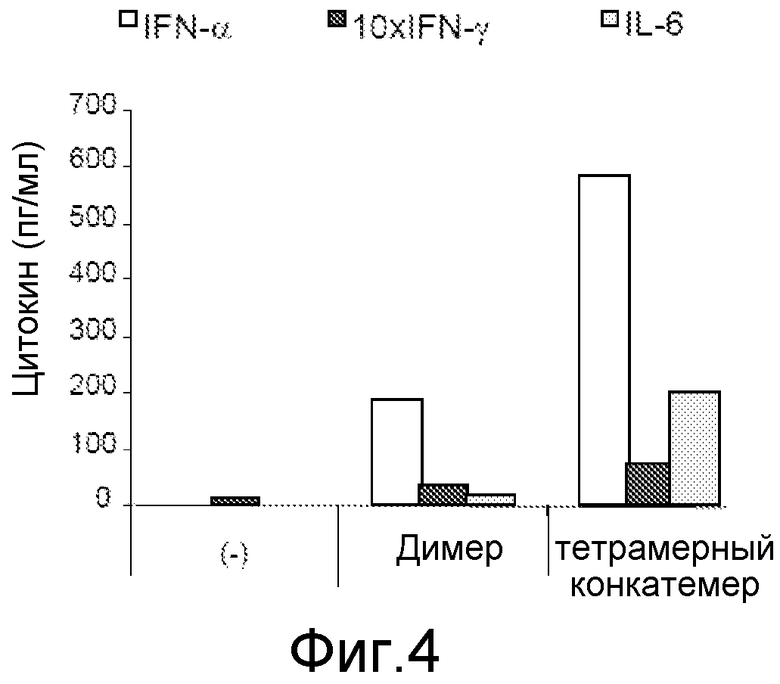
Демонстрация функциональных свойств молекул по изобретению:
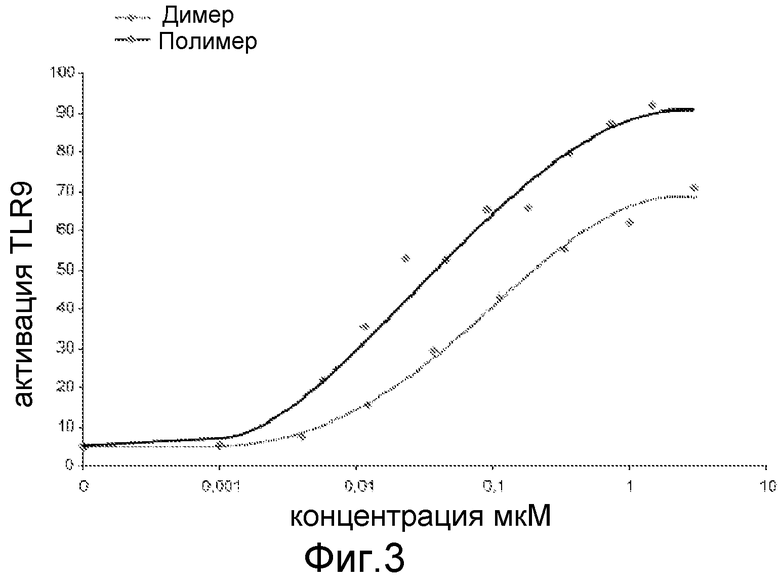
Различные эксперименты на клеточных культурах были выполнены для доказательства наличия иммуномодулирующих свойств молекул по изобретению. Способность стимулировать TLR9 была исследована путем использования мышиных макрофагов клеточной линии RAW 264, в которых экспрессия зеленого флуоресцирующего белка EGFP находится под контролем положительно регулируемого под действием TLR9 NF-κb промотора. Клетки были засеяны плотностью 125000 клеток/см2, и после 16ч димерные (произведенные по методу а) и полимерные (произведенные по методу с) молекулы по изобретению были применены. После 7 ч инкубации (37°С, 5% CO2) клетки были собраны, и была измерена экспрессия EGFP, используя клеточный сортер с активацией флуоресценции (FACS). Результаты были использованы для построения кривой концентрация-эффект, представленной на фиг. 3; в качестве молекулярного веса для обеих групп молекул вес димера был взят за основу для обеспечения прямого сопоставления.
Эффективность полимерных молекул по изобретению увеличивается в 10 раз (верхняя кривая с заштрихованными символами) по сравнению с низкомолекулярными молекулами (нижняя пунктирная линия с незаштрихованными символами). Высокомолекулярные полимеры по изобретению обладают явно лучшим эффектом в используемых эквивалентных количествах, таких как сопоставимые количества димерных или мономерных молекул. Более высокая эффективность в стимуляции TLR9 может быть обусловлена локально более высокой концентрацией, достигаемой мультимерными молекулами, которая не может, особенно in vivo, быть достигнута более высокими дозами, например, по причинам применяемого количества. В то же самое время, высокомолекулярные конкатемеры проявляют повышенную эффективность, что является полной неожиданностью и не может быть объяснено в соответствии с современными знаниями в науке.
Стимуляция PBMCs для продукции цитокинов
Для выполнения анализа по стимуляции мононуклеарные клетки периферической крови (PBMC) были выделены из цельной крови человека или так называемой «лейкоцитарной пленки». Выделенные клетки (PBMC) были осаждены в многолуночных планшетах. Первая смесь содержала нестимулированные клетки в качестве отрицательного контроля, вторая смесь была стимулирована димерами в качестве сравнения с существующим уровнем техники, третья - тетрамерными полимерами; та же самая масса димеров относительно полимеров была использована в том же объеме. Два дня спустя, методом ELISA была выявлена секреция цитокинов интерферона-γ, интерферона-α и интерлейкина-6 из супернатанта клеточной культуры, сравни фиг. 4.
В соответствии с фиг. 4 стимуляция PBMCs полимерными молекулами по изобретению приводит к удвоенной секреции интерферона по сравнению со стимуляцией димерными молекулами. Кроме того, чертеж демонстрирует, что секреция IL-6 вследствие стимуляции полимерными молекулами значительно выше по сравнению со стимуляцией димерами.
Можно получить молекулы по изобретению путем использования мономеров с нижеприведенными последовательностями:

с) каждая фосфорилированная по 5'-концу нуклеиновая кислота или смесь нуклеиновых кислот, имеющих последовательности, способные принимать конформацию, как показано на фигуре 1, выполняя изображенные критерии конформации, и гибридизоваться друг с другом через одноцепочечные выступающие части (липкие концы), как минимум, из четырех подходящих нуклеотидов.
Последовательности дезоксирибонуклеиновых кислот, используемые в качестве продуктов выделения, не подвергаются нагреванию перед лигированием и имеют степень очистки, сопоставимую с электрофорезом в полиакриламидном геле. Продукты выделения могут быть очищены методом HPLC с последующей FPLC. Результатом комбинирования HPLC и FPLC является степень очистки, эквивалентная электрофорезу в полиакриламидном геле. Впоследствии ДНК-продукты выделения лиофилизуют при 50°С до тех пор, пока не будет получен сухой остаток. Проводят ресуспендирование в буфере и добавляют Т4-ДНК-лигазу с последующей инкубацией при 37°С в течение 40 минут. Удивительным было то, что полученные конкатемеры вызывали улучшенную иммуномодуляцию у мышей. Поразительно, что комбинирование отдельных компонентов конкатемеров по изобретению с химиотерапевтическими препаратами приводит к улучшенному эффекту. Улучшенный эффект на удивление выше такового отдельных компонентов и больше аддитивного эффекта. В качестве химиотерапевтического препарата могут быть использованы антитела, алкилирующие агенты, платиновые аналоги, интеркалирующие агенты, антибиотики, супрессоры митоза, таксаны, супрессоры топоизомераз, анти-метаболиты и/или L-аспарагиназа, гидроксикарбамид, митотаны и/или аманитины.


Изобретение относится к области биохимии. Предложена конкатемерная молекула некодирующей нуклеиновой кислоты, содержащая по меньшей мере четыре одноцепочечных участка с неметилированными CG-мотивами, для модуляции активности иммунной системы человека и животного. Рассмотрены содержащие конкатемерную молекулу фармацевтические композиции и набор, а также применение для изготовления средства для модуляции иммунной системы или для модуляции активности иммунной системы человека или животного молекулы и композиции по изобретению. Данное изобретение может найти дальнейшее применение в качестве иммуномодулятора в терапии различных заболеваний. 5 н. и 15 з.п. ф-лы, 4 ил.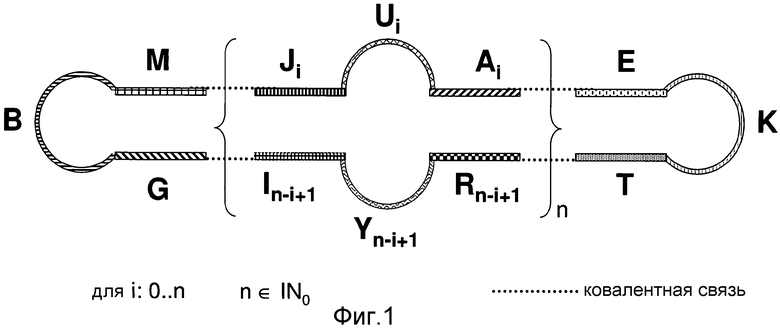
1. Конкатемерная молекула для модуляции активности иммунной системы человека или животного, где конкатемерная молекула содержит по меньшей мере четыре последовательности дезоксирибонуклеиновой кислоты в качестве мономерных единиц, которые ковалентно связаны и соответствуют формуле:
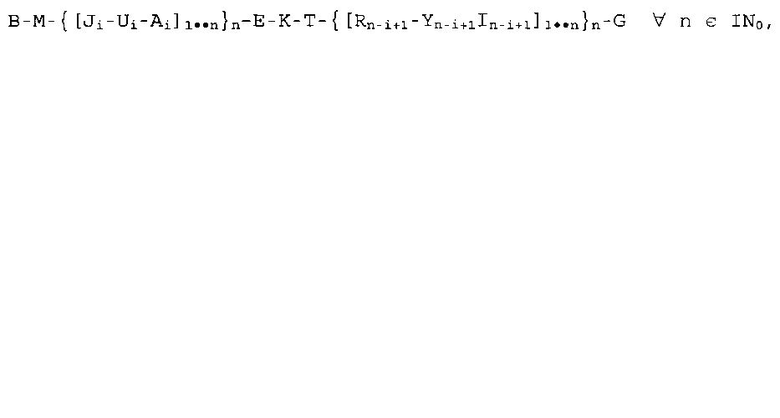 где
где
- IN0 относится к числу натурального ряда, и
- A, В, Е, G, I, J, K, М, R, Т, U, Υ являются нуклеиновыми кислотами, и
- «-» обозначает фосфодиэфирную связь, посредством которой нуклеиновые кислоты ковалентно связаны друг с другом, и
- последовательность компонента i нуклеиновой кислоты по сравнению с компонентом (i+1) той же самой нуклеиновой кислоты может отличаться или не отличаться, и
- B, Ui, K и Yn-i+1
_ одноцепочечные, и
- каждая одноцепочечная область содержит по меньшей мере один мотив с неметилированной дезоксирибонуклеотидной последовательностью CG,
- B, Ui, K и Yn-i+1 - каждая собрана по меньшей мере из 4 дезоксирибонуклеотидов, и
- последовательности Ji по отношению к In-i+1, Ai по отношению к Rn-i+1, Μ по отношению к G, и, соответственно, Ε по отношению к Τ являются обратно комплементарными друг другу, и
- G ковалентно связана посредством фосфодиэфирной связи с В, и
- где мономерные единицы дезоксирибонуклеиновой кислоты имеют до 400 нуклеотидов.
2. Молекула по п.1, отличающаяся тем, что мономерные единицы дезоксирибонуклеиновой кислоты содержат следующую последовательность:

3. Композиция для модуляции активности иммунной системы, содержащая эффективное количество молекулы по п. 1 или 2 и химиотерапевтическое средство, выбранное из группы, включающей антитела, алкилирующие агенты, платиновые аналоги, интеркалирующие агенты, антибиотики, супрессоры митоза, таксаны, супрессоры топоизомераз, антиметаболиты и/или L-аспарагиназу, гидроксикарбамид, митотаны и/или аманитины.
4. Композиция по п.3, отличающаяся тем, что алкилирующий агент выбран из группы, включающей:
- производные азотистого иприта, в частности
- циклофосфамид,
- ифосфамид,
- трофосфамид,
- мелфалан и/или
- хлорамбуцил,
- алкилсульфонат, в частности
- бусульфан и/или
- треосульфан,
- нитрозомочевину, в частности
- кармустин,
- ломустин,
- нимустин,
- эстрамустин и/или
- стрептозотоцин
- прокарбазин и дакарбазин,
- темозоломид и/или
- тиотепу.
5. Композиция по п.3, отличающаяся тем, что платиновые аналоги выбраны из группы, включающей:
- цисплатин,
- карбоплатин и/или
- оксалиплатин.
6. Композиция по п.3, отличающаяся тем, что интеркалирующие агенты выбраны из группы, включающей:
- антрациклин, в частности
- доксорубицин (адриамицин),
- даунорубицин,
- эпирубицин и/или
- идарубицин,
- митоксантрон,
- амсакрин и/или
- доксифлуридин.
7. Композиция по п.3, отличающаяся тем, что антибиотики выбраны из группы, включающей:
- блеомицин,
- актиномицин D (дактиномицин) и/или
- митомицин.
8. Композиция по п.3, отличающаяся тем, что супрессоры митоза выбраны из группы, включающей:
- алкалоиды барвинка, в частности
- винорелбин,
- винкристин (онковин),
- винбластин и/или
- виндезин.
9. Композиция по п.3, отличающаяся тем, что таксаны выбраны из группы, включающей:
- паклитаксел и/или
- доцетаксел.
10. Композиция по п.3, отличающаяся тем, что супрессоры топоизомеразы выбраны из группы, включающей:
- ингибиторы топоизомеразы I, в частности
- камптотецин,
- топотекан и/или
- иринотекан, и/или
- ингибиторы топоизомеразы II, в частности
- этопозид,
- тенипозид.
11. Композиция по п. 3, отличающаяся тем, что антиметаболиты выбраны из группы, включающей:
- антагонисты фолиевой кислоты, в частности
- метотрексат,
- пиримидиновые аналоги, в частности
- 5-фторурацил,
- капецитабин,
- цитозина арабинозид (цитарабин) и/или
- гемцитабин,
- пуриновые аналоги, в частности
- 6-тиогуанин,
- пентостатин,
- азатиоприн,
- 6-меркаптопурин,
- флударабин и/или
- кладрибин.
12. Набор для модуляции активности иммунной системы, содержащий эффективное количество молекулы по любому из пп.1 или 2 и/или композиции по любому из пп.3-11 и, в случае необходимости, информацию о комбинации содержимого набора.
13. Фармацевтическая композиция для модуляции активности иммунной системы, содержащая эффективное количество молекулы по любому из пп.1 или 2 и/или композиции по любому из пп.3-11, в случае необходимости, вместе с фармацевтическим приемлемым носителем.
14. Фармацевтическая композиция по п.13, характеризующаяся тем, что носитель выбран из группы, включающей антитела, алкилирующие агенты, платиновые аналоги, интеркалирующие агенты, антибиотики, супрессоры митоза, таксаны, супрессоры топоизомераз, антиметаболиты и/или L-аспарагиназу, гидроксикарбамид, митотаны и/или аманитины.
15. Применение молекулы по пп.1 или 2, композиции по пп.3-11 или фармацевтической композиции по пп.14 или 15 для изготовления средства для модуляции иммунной системы человека или животного или для модуляции активности указанной иммунной системы.
16. Применение по п.15, характеризуемое тем, что модуляция представляет собой увеличение активности иммунной системы, где активность отдельных клеток или клеточных субпопуляций иммунной системы стимулирована, или ускорена, или ингибирована, или ослаблена.
17. Применение по п.16, характеризуемое тем, что модуляция включает опосредованный Τ-клетками или не зависимый от Τ-клеток иммунный ответ.
18. Применение по п.17, характеризуемое тем, что иммунный ответ включает пролиферацию В-клеток и/или активацию В-клеток.
19. Применение по п.18, характеризуемое тем, что стимуляция иммунной системы включает секрецию цитокинов.
20. Применение по п.15, характеризуемое тем, что молекула по одному из пп.1 или 2 и/или композиция по пп.3-11 используется в качестве адъюванта в терапевтической или профилактической вакцинации.
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| ROBERTS T.L | |||
| et al., "Differences in macrophage activation by bacterial DNA and CpG-containing oligonucleotides." The Journal of Immunology (2005); 175(6): 3569-3576 | |||
| NARAYANAN S | |||
| et al | |||
| "CpG oligonucleotides with modified termini and nicked dumbbell structure show enhanced | |||
Авторы
Даты
2015-07-10—Публикация
2010-04-30—Подача