Настоящее изобретение относится к способу выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, включающему следующие стадии:
- Определение уровня proADM и/или его фрагментов, включающих по меньшей мере 6 аминокислот, в жидкости тела указанного субъекта
- Сопоставление указанного уровня с потребностью указанного пациента в жидкостной реанимации или во введении сосудосуживающего агента, причем указанного пациента выявляют в качестве пациента, нуждающегося в такой потребности, если уровень proADM и/или его фрагментов, включающих по меньшей мере 6 аминокислот, в жидкости тела указанного субъекта превышает пороговое значение.
Пептид адреномедуллин (adrenomedullin - ADM) впервые описан Kitamma с соавт. (ссылка [1], см. ниже список литературы) в качестве нового гипотензивного пептида, содержащего 52 аминокислоты, который выделен из феохромоцитомы человека. В тот же год также была описана кДНК, кодирующая пептид-предшественник, состоящий из 185 аминокислот, и полная аминокислотная последовательность пептида предшественника. Пептид-предшественник, включающий в частности сигнальную последовательность из 21 аминокислоты с N-конца, называют препроадреномедуллином (preproadrenomedullin - pre-proADM). Pre-proADM включает 185 аминокислот. Зрелая форма ADM имеет последовательность SEQ ID No. 4, ADM-Gly имеет последовательность SEQ No. 5.
Зрелая форма пептида адреномедуллина (adrenomedullin - ADM) является амидированным пептидом, включающим 52 аминокислоты (SEQ ID No: 4), а именно аминокислоты с 95 по 146 в pre-proADM, от которого она формируется в результате протеолитического расщепления. В настоящее время по существу более точно охарактеризовано только несколько пептидных фрагментов, сформированных в результате расщепления pre-proADM, в том числе физиологически активные пептиды адреномедуллин (ADM) и «РАМР» - пептид из 20 аминокислот (22-41), следующих за 21 аминокислотой сигнального пептида в pre-proADM. И для ADM, и для РАМР, кроме того, были открыты и более детально исследованы физиологически активные суб-фрагменты. Открытие и описание в 1993 году ADM стимулировали интенсивные исследования активности, а также поток публикаций, результаты которых суммированы в разнообразных обзорных статьях; в настоящем описании ссылки приводят в основном на статьи издания «Peptides», посвященного ADM (Peptides 22 (2001)), в особенности [2] и [3]. См. также обзор [4]. В настоящее время по результатам научных исследований установлено, что ADM в частности можно рассматривать в качестве полифункционального регуляторного пептида. Он высвобождается в кровяное русло в неактивной форме за счет удлинения молекулы путем присоединения глицина [5]. Также имеется связующий белок [6], специфичный в отношении ADM и предположительно также модулирующий действие ADM.
К физиологическим эффектам ADM и РАМР, которые в настоящее время имеют первостепенное значение и которые необходимо исследовать, относятся воздействия на кровяное давление. Поскольку ADM является эффективным сосудорасширителем, гипотензивный эффект может быть связан с определенными пептидными сегментами в C-концевой части ADM.
Кроме того, было установлено, что упомянутый выше физиологически активный пептид РАМР, сформированный из pre-proADM, также проявляет гипотензивный эффект, даже если его механизм действия отличается от механизма действия ADM (наряду с указанными выше обзорами [3] и [4] см. также публикации [7], [8] или [9] и [10]).
Также было установлено, что концентрации ADM, которые могут быть измерены в кровяном русле и в других биологических жидкостях в случаях рядя патологических состояний, существенно выше концентраций, установленных у здоровых людей, служащих контролем. Так уровень ADM у пациентов с застойной сердечной недостаточностью, инфарктом миокарда, болезнями почек, гипертензивными расстройствами, сахарным диабетом, в острой фазе удара, при сепсисе и септическом шоке существенно повышен, хотя и в разной степени. Концентрации РАМР также повышены при некоторых из указанных патологических состояний, но уровни в плазме снижены относительно ADM ([3]; с. 1702).
Также известно, что необычно высокие концентрации ADM наблюдают при сепсисе или септическом шоке ([3] и [11], [12], [13], [14] и [15]). Эти показатели связаны с характерными гемодинамическими изменениями, которые известны как типичные симптомы по мере развития заболевания пациента с сепсисом и другими тяжелыми синдромами, например, такими как синдром системного воспалительного ответа (ССВО).
Хотя принято считать, что ADM и РАМР сформированы из единого пептида-предшественника, pre-proADM, у которого аминокислотные последовательности, соответствующие этим пептидам, находятся в качестве частей пептидов в эквимолярных количествах, концентрации ADM или РАМР, измеряемые в биологических жидкостях, очевидно различны. В этом нет ничего необычного.
Таким образом, измеряемые концентрации разных продуктов распада одного и того же пептида-предшественника могут быть разными, например, потому, что они являются результатом разных конкурентных процессов распада, которые, например, в случае разных стадий патологии, приводят к разной фрагментации пептида-предшественника и, следовательно, к разным продуктам распада. Некоторые пептиды, являющиеся частью пептида-предшественника, могут быть сформированы в виде свободных пептидов или могут быть не сформированы, и/или разные пептиды формируются разными путями и в разных количествах. Даже если для процессинга пептида-предшественника предпринят единственный путь распада и, следовательно, все продукты распада происходят от одного и того же пептида-предшественника и должны быть сформированы per se первоначально в эквимолярных количествах, состояние стабильности концентраций разных частей пептидов и фрагментов, измеряемых в биологических жидкостях, могут сильно различаться, а именно, например, если отдельные из них формируются с разными скоростями и/или имеют разную индивидуальную стабильность (время существования) в соответствующей биологической жидкости, или если они удалены из кровообращения из-за различных механизмов клиренса и/или различных скоростей клиренса.
Адреномедуллин имеет важнейшее значение в развитии сепсиса [16, 17], а также в многочисленных острых и хронических заболеваниях [18, 4].
Описано несколько методов измерения уровня ADM в крови: непосредственное определение ADM или опосредованное путем определения более стабильного фрагмента исходного пептида-предшественника. Недавно опубликован метод, позволяющий измерять в крови зрелую форму ADM (Di Somma S, Magrini L, Travaglino F, Lalle I, Fiotti N, Cervellin G, Avanzi GC, Lupia E, Maisel A, Hein F с соавт.: Opinion paper on innovative approach of biomarkers for infectious diseases and sepsis management in the emergency department. Clinical chemistry and laboratory medicine: CCLM / FESCC 2013:1-9.)
Известны другие методы количественного измерения фрагментов, производных от предшественника ADM, например, измерение MR-proADM (Morgenthaler NG, Struck J, Alonso C, Bergmann A. Clin Chem. 2005 Oct; 51(10): 1823-9.), PAMP (Washimine H, Kitamura K, Ichiki Y, Yamamoto Y, Kangawa K, Matsuo H, Eto T. Biochem Biophys Res Commun. 1994 Jul 29; 202(2): 1081-7.), CT-proADM (EP211552). Известен коммерческий анализ по измерению MR-proADM (BRAHMS MR-proADM KRYPTOR; BRAHMS GmbH, Хеннигсдорф, Германия) (Clin Biochem. 2009 May; 42(7-8):725-8. doi: 10.1016/j.clinbiochem.2009.01.002. Epub 2009 Jan 23).
Гомогенный время-зависимый иммунофлуоресцентный анализ для измерения средне-регионального проадреномедуллина в плазме на полностью автоматизированной системе B.R.A.H.M.S KRYPTOR (Caruhel Р, Mazier С, Kunde J, Morgenthaler N.G, Darbouret В.). Поскольку эти пептиды вырабатываются в стехиометрическом соотношении из единого предшественника, их уровни в плазме до определенной степени коррелируют.
Только несколько исследований ADM в плазме проведено у пациентов с системным воспалением, сепсисом, тяжелым сепсисом или септическим шоком; уровни коррелировали с гемодинамическими параметрами:
В исследовании Hirata с соавт. установлено, что ADM в плазме у пациентов с сепсисом коррелирует с частотой сердцебиений, нормальным артериальным давлением, но не со средним артериальным давлением (mean arterial pressure - MAP) (Hirata Y, Mitaka C, Sato K, Nagura T, Tsunoda Y, Amaha K, Marumo F: Increased circulating adrenomedullin, a novel vasodilatory peptide, in sepsis. The Journal of clinical endocrinology and metabolism 1996, 81(4): 1449-1453).
Nishio с соавт. сообщают, что повышенные концентрации ADM в плазме коррелируют с расслаблением тонуса сосудов у пациентов с септическим шоком (корреляция с сердечным индексом, систолическим индексом, частотой сердцебиений, снижением диастолического артериального давления, системным индексом сосудистого сопротивления и индексом легочного сосудистого сопротивления), однако нет существенной корреляции со средним кровяным давлением [19].
У здоровых субъектов при физической нагрузке установлена существенная отрицательная корреляция ADM и MAP в плазме [20].
Ничего неизвестно о связи уровней циркулирующего ADM или родственных пептидов, например, pro-ADM или его фрагментов, с потребностью в жидкостной реанимации и во введении сосудосуживающего агента для жидкостной реанимации пациентам с развивающимся шоком. Это неудовлетворенная медицинская потребность, поскольку обычно сосудосуживающие агенты вводят слишком поздно, когда состояние пациента уже становится тяжелым. Необходимо уметь идентифицировать тех пациентов, которым требуется жидкостная реанимация и сосудосуживающие агенты до того, как состояние пациента станет тяжелым. В медицине существует потребность в умении прогнозировать потребность в лечении с помощью жидкостной реанимации и введения сосудосуживающего агента до того, как показание кровяного давления достигнет установленного критического значения 65 mm Hg [21]. При падении кровяного давления снабжение кислородом становится недостаточным, что приводит к дисфункции органов и смерти. Поэтому существует неудовлетворенная потребность в раннем выявлении пациентов с риском понижения кровяного давления. Если такие пациенты могут быть выявлены на более раннем этапе, например, при величине давления, превышающей критические значения среднего артериального давления, может быть начато применение жидкостной реанимации и лечение сосудосуживающим агентом. Повышенные пороговые уровни составляют <70 mm Hg, предпочтительно <75 mm Hg. Следовательно, подобную терапию начинают уже при значении выше 65 mm Hg.
Объектом настоящего изобретения является способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, повышающего кровяное давление, включающий следующие стадии:
- Определение в жидкости тела указанного субъекта уровня proADM и/или его фрагментов, включающих по меньшей мере 6 аминокислот,
- Сопоставление указанного уровня с потребностью указанного пациента в жидкостной реанимации или во введении сосудосуживающего агента, причем указанного субъекта или пациента выявляют в качестве пациента, нуждающегося в такой потребности, если в жидкости тела указанного субъекта уровень proADM и/или его фрагментов, включающих по меньшей мере 6 аминокислот, превышает пороговое значение.
В одном из вариантов осуществления настоящего изобретения в способах по настоящему изобретению среднее артериальное давление у субъектов составляет >65 mm Hg. Кроме того, у указанного субъекта среднее артериальное давление <75 mm Hg, в другом варианте осуществления настоящего изобретения оно составляет <70 mm Hg.
В одном из вариантов осуществления настоящего изобретения описанным способом является способ раннего выявления потребности в жидкостной реанимации или во введении сосудосуживающего агента, причем понятие «более раннее» означает, что указанные меры следует осуществить ранее, чем кровяное давление достигнет критической величины 65 mm Hg или до того, как кровяное давление упадет до 65 mm Hg.
Жидкостью тела по настоящему изобретению в одном из вариантов его осуществления является образец крови. Образец крови может быть выбран из группы, включающей цельную кровь, сыворотку и плазму.
В одном из вариантов осуществления настоящего изобретения указанный proADM и/или его фрагменты, включающие по меньшей мере 6 аминокислот, выбран/выбраны из группы, включающей:
SEQ ID No. 1 (proADM): 164 аминокислоты (22-185 в preproADM)
ARLDVASEF RKKWNKWALS RGKRELRMSS SYPTGLADVK AGPAQTLIRP QDMKGASRSP EDSSPDAARI RVKRYRQSMN NFQGLRSFGC RFGTCTVQKL AHQIYQFTDK DKDNVAPRSK ISPQGYGRRR RRSLPEAGPG RTLVSSKPQA HGAPAPPSGS APHFL
SEQ ID No. 2 (N-20 концевой пептид проадреномедуллина): пептиды 22-41
ARLDVASEF RKKWNKWALS R
SEQ ID No. 3 (средне-региональный проадреномедуллин (MidregionalproAdrenomedullin - MR-proADM)): пептиды 45-92
ELRMSS SYPTGLADVK AGPAQTLIRP QDMKGASRSP EDSSPDAARI RV
SEQ ID No. 4 (зрелая форма адреномедуллина (зрелая форма ADM); амидированная): пептиды 95-146 -CONH2
YRQSMN NFQGLRSFGC RFGTCTVQKL AHQIYQFTDK DKDNVAPRSK ISPQGY - CONH2
SEQ ID No. 5 (адреномедуллин 1-52-Gly (ADM 1-52-Gly)): пептиды 95-147 YRQSMN NFQGLRSFGC RFGTCTVQKL AHQIYQFTDK DKDNVAPRSK ISPQGYG
SEQ ID No. 6 (С-концевой проадреномедуллин, CT-proADM): пептиды 148-185
RRR RRSLPEAGPG RTLVSSKPQA HGAPAPPSGS APHFL
В одном из вариантов осуществления настоящего изобретения указанный proADM и/или его фрагменты, включающие по меньшей мере 6 аминокислот, выбран/выбраны из группы, включающей зрелую форму ADM (SEQ ID NO. 4)
и/или зрелую форму ADM 1-52-Gly (SEQ ID No. 5), MR-proADM (SEQ ID No. 3) и CT-proADM (SEQ ID No. 6).
В одном из вариантов осуществления настоящего изобретения или уровень иммунореактивности зрелой формы ADM (SEQ ID No. 4), и/или уровень иммунореактивности зрелой формы ADM 1-52-Gly (SEQ ID No. 5), или уровень иммунореактивности MR-proADM (SEQ ID No.3), или уровень иммунореактивности CT-ADM (SEQ ID No.6) определяют и соотносят с потребностью указанного пациента в жидкостной реанимации или во введении сосудосуживающего агента, причем указанного пациента выявляют в качестве имеющего такую потребность, если уровень иммунореактивности зрелой формы ADM (SEQ ID No. 4), и/или уровень иммунореактивности зрелой формы ADM 1-52-Gly (SEQ ID No. 5), или уровень иммунореактивности MR-proADM (SEQ ID No. 3), или уровень иммунореактивности CT-ADM (SEQ ID No. 6) в жидкости тела указанного субъекта превышает пороговое значение.
В одном из вариантов осуществления настоящего изобретения уровень proADM и/или его фрагментов определяют, используя по меньшей мере один связующий агент, выбранный из группы, включающей: связующий агент, который связывается с областью, входящей в последующую последовательность зрелой формы ADM (SEQ ID No. 4) и/или зрелой формы ADM 1-52-Gly (SEQ ID No. 5), и второй связующий агент, который связывается с областью, входящей в последовательность зрелой формы ADM (SEQ ID NO. 4) и/или зрелой формы ADM 1-52-Gly (SEQ ID No. 5).
В одном из вариантов осуществления настоящего изобретения уровень proADM и/или его фрагментов определяют, используя по меньшей мере один связующий агент, выбранный из группы, включающей: связующий агент, который связывается с областью, входящей в последовательность MR-proADM (SEQ ID No. 3), и второй связующий агент, который связывается с областью, входящей в последовательность MR-proADM (SEQ ID No. 3)
В одном из вариантов осуществления настоящего изобретения уровень proADM и/или его фрагментов определяют, используя по меньшей мере один связующий агент, выбранный из группы, включающей: связующий агент, который связывается с областью, входящей в последовательность CT-proADM (SEQ ID No. 6), и второй связующий агент, который связывается с областью, входящей в последовательность CT-pro ADM (SEQ ID No. 6).
В одном из вариантов осуществления настоящего изобретения применяют метод определения уровня proADM и/или его фрагментов, включающих по меньшей мере 6 аминокислот, причем чувствительность указанного метода позволяет определить количество ADM у здорового субъекта, составляющее <70 пг/мл, предпочтительно <40 пг/мл и более предпочтительно <10 пг/мл.
В одном из вариантов осуществления настоящею изобретения указанный связующий агент проявляет связывающее сродство с proADM и/или его фрагментами, составляющее по меньшей мере 107 М-1 предпочтительно 108 М-1 предпочтительное сродство превышает 109 М-1 наиболее предпочтительное сродство составляет 1010 М-1. Специалистам в данной области известно, что это можно рассматривать в качестве компенсации низкого сродства за счет применения повышенной дозы соединений и такая мера не выходит за рамки охвата настоящего изобретения.
Для определения сродства антител с адреномедуллином определяют кинетику связывания адреномедуллина с иммобилизованным антителом методами поверхностного плазмонного резонанса без метки, используя систему Biacore 2000 (фирма GE Healthcare Europe GmbH, Фрайбург, Германия). Обратимую иммобилизацию антител проводят, используя антитело против Fc-фрагмента мыши, ковалентно связанное с высокой плотностью с поверхностью сенсора СМ5, по инструкциям производителя (mouse antibody capture kit; фирма GE Healthcare) [22].
В одном из вариантов осуществления настоящего изобретения указанный связующий агент выбран из группы, включающей антитело, или фрагмент антитела, или каркас молекулы, не являющейся Ig, который связывается с proADM и/или его фрагментами.
В одном из вариантов осуществления настоящего изобретения проводят исследование для определения уровня proADM и/или его фрагментов, включающих по меньшей мере 6 аминокислот, причем такое исследование является иммуноферментным сэндвич-анализом, предпочтительно полностью автоматизированным.
В одном из вариантов осуществления настоящего изобретения это может быть так называемый тест в месте оказания помощи или тест у постели больного (point-of-care test - РОСТ), который представляет метод исследования, позволяющий проводить тестирование менее чем за 1 ч в месте нахождения пациента без необходимости использования полностью автоматизированной системы анализа. Одним из примеров такого метода является технология иммунохроматографического теста.
В одном из вариантов осуществления настоящего изобретения таким анализом является иммуноферментный сэндвич-анализ, в котором используют какой-либо тип способа обнаружения, включая, но ими не ограничиваясь, ферментную метку, хемилюминесцентную метку, электрохемилюминесцентную метку, предпочтительно анализ полностью автоматизирован. В одном из вариантов осуществления настоящего изобретения таким анализом является иммуноферментный сэндвич-анализ. К примерам автоматизированных или полностью автоматизированных анализов относятся анализы, которые могут проводиться в следующих системах: Roche Elecsys®, Abbott Architect®, Siemens Centauer®, Brahms Kryptor®, BiomerieuxVidas®, Alere Triage®.
Многочисленные известные иммуноисследования могут быть применены в анализах и методах по настоящему изобретению, к ним относятся: радиоиммуноисследования (radioimmunoassay - RIA), гомогенный иммунологический анализ с ферментативным усилением (enzyme-multiplied immunoassays technique - EMIT), фермент-связанный иммуносорбентный анализ (enzyme linked immunoadsorbent assays - ELISA), апоферментный реактивационный иммуноанализ (apoenzyme reactivation immunoassay - ARIS), иммуноанализ с индикаторной полоской и иммунохроматографические анализы.
В одном из вариантов осуществления настоящего изобретения, по меньшей мере один из связующих агентов несет выявляемую метку.
К предпочтительным методам обнаружения относятся иммуноисследования различных форматов, например, радиоиммуноисследование (radioimmunoassay - RIA), хемилюминесцентные и флуоресцентные иммуноанализы, фермент-связанные иммуноанализы (enzyme-linked immunoassays - ELISA), исследования на гранулах фирмы Luminex, исследования белковых микроматриц и быстрые тест-форматы, например, иммунохроматографические тесты на полосках (стрипах).
В предпочтительном варианте осуществления настоящего изобретения указанная метка выбрана из группы, включающей хемилюминесцентную метку, ферментную метку, флуоресцентную метку, радиоактивный йод.
Анализы могут быть гомогенными и гетерогенными, конкурентными и неконкурентными. В одном из вариантов осуществления настоящего изобретения применяют анализ в форме иммуноферментного сэндвич-анализа, который является неконкурентным иммуноанализом, причем молекула, которую обнаруживают и/или определяют ее количество, связана с первым антителом и со вторым антителом. Первое антитело может быть связано с твердой фазой, например, с гранулой, поверхностью лунки или другого контейнера, чипа или полоски, и второе антитело является антителом с меткой, например, красителем, радиоизотопом или частью молекулы реакционноспособного или каталитического действия. Количество меченого антитела, связанного с выявляемым при анализе веществом, затем определяют соответствующим методом. Общий состав и методы, используемые в «иммуноферментном сэндвич-анализе», хорошо обоснованы и известны специалистам в этой области [23].
В другом варианте осуществления настоящего изобретения анализ включает две молекулы захвата, предпочтительно антитела, которые оба содержатся в диспергированном виде в жидкой реакционной смеси, причем первый меченый компонент присоединен к первой молекуле захвата и первый меченый компонент является частью системы маркирования, основанной на флуоресцентном или хемилюминесцентном гашении или расширении, и второй меченый компонент указанной системы маркирования присоединен ко второй молекуле захвата таким образом, что при связывании обеих молекул захвата с выявляемым при анализе веществом вырабатывается измеряемый сигнал, который позволяет выявить сформированные сэндвич-комплексы в растворе, включающем образец.
В другом варианте осуществления настоящего изобретения указанная система маркирования включает редкоземельные криптаты или редкоземельные хелаты в комбинации с флуоресцентным красителем или хемилюмицесцентным красителем, особенно красителем типа цианина.
В контексте настоящего изобретения исследования на основе флуоресценции включают применение красителей, которые, например, могут быть выбраны из группы, включающей РАМ (5- или 6-карбоксифлуоресцеин), VIC, NED, флуоресцеин, флуоресцеинизотиоцианат (fluoresceinisothiocyanate FITC), IRD-700/800, цианиновые красители, например, CY3, CY5, CY3.5, CY5.5, Су7, ксантен, 6-карбокси-2',4',7',4,7-гексахлорфлуоресцеин (hexachlorofluorescein-HEX), ТЕТ, 6-карбокси-4',5'-дихлор-2',7'-диметодифлуоресцеин(JOE), N,N,N',N'-тетраметил-6-карбоксиродамин (TAMRA), 6-карбокси-Х-родамин (ROX), 5-карбоксиродамин-6G (R6G5), 6-карбоксиродамин-6G (RG6), родамин, родамин зеленый, родамин красный, родамин 110, красители BODIPY, например, BODIPY TMR, Орегон зеленый, кумарины, например, умбеллиферон, бензимиды, например Hoechst 33258, фенантридины, например Texas Red, Yakima Yellow, Alexa Fluor, PET, этидиумбромид, акридиновые красители, карбазоловые красители, феноксазиновые красители, порфириновые красители, полиметиновые красители и другие.
В контексте настоящего изобретения к анализам на основе хемилюминесценции относится применение красителей, в основе которых лежат физические принципы и которые охарактеризованы как хемилюминесцентные материалы в [24]. Предпочтительными хемилюминесцентными красителями являются эфиры акридина.
В контексте настоящего изобретения понятие «анализ» или «диагностическое исследование» означает какой-либо тип анализа, применяемый в диагностике. Такой анализ может основываться на связывании определяемого вещества с одним или несколькими зондами захвата с определенным сродством. Касательно взаимодействия молекул захвата с молекулами-мишенями или целевыми молекулами, следует отметить, что константа сродства предпочтительно превышает 108 М-1.
В контексте настоящего изобретения понятие «связующие молекулы» относится к молекулам, которые могут применяться для связывания молекул-мишеней или целевых молекул, т.е. выявляемого при анализе вещества (т.е. в контексте настоящего изобретения РСТ и его фрагментов) из образца. Таким образом, связующим молекулам должна быть придана адекватная форма, касающаяся пространственных и поверхностных показателей, например, относящаяся к поверхностному заряду, гидрофобности, гидрофильности, наличию или отсутствию льюисовых доноров и/или акцепторов для специфического связывания молекул-мишеней или целевых молекул. При этом связывание может быть, например, опосредовано ионными силами, Ван-дер-Ваальсовыми силами, взаимодействиями в парах pi-pi и sigma-pi, гидрофобными или водородными связями или комбинацией двух или более вышеупомянутых взаимодействий между молекулами захвата и молекулами-мишенями или целевыми молекулами. В контексте настоящего изобретения связывающие молекулы могут быть выбраны из группы, в которую входят, например, молекула нуклеиновой кислоты, молекула углевода, молекула РНК, белок, антитело, пептид или гликопротеин. Предпочтительно связующими молекулами являются антитела, включая их фрагменты с достаточным сродством с мишенью или целевой молекулой, а также включая рекомбинантные антитела или фрагменты рекомбинантных антител и химически и/или биохимически модифицированные производные указанных антител или фрагментов, производных от варианта цепи длиной не менее 12 аминокислот.
Хемилюминесцентной меткой может быть сложный эфир акридиния, стероидные метки, включая метки изолюминола и другие.
Ферментными метками могут быть лактатдегидрогеназа (dehydrogenase - LDH), креатинкиназа (creatinekinase - CPK), щелочная фосфатаза, аспартатаминотрансфераза (aspartateaminotransferace - AST), аланинаминотрансфераза (alanine aminotransferace - ALT), кислая фосфатаза, глюкозо-6-фосфатдегидрогеназа и другие.
В одном из вариантов осуществления настоящего по меньшей мере один из двух указанных связующих связан с твердой фазой, например, с магнитными частицами и поверхностями из полистирола.
В одном из вариантов осуществления настоящего изобретения по меньшей мере один из двух указанных связующих связан с твердой фазой.
В одном из вариантов осуществления настоящего изобретения концентрация ADM или его фрагментов, измеренные в образце, находятся в диапазоне 10-500 пг/мл в плазме или крови.
Уровни ADM по настоящему изобретению, или уровни proADM, или их фрагментов, соответственно, определяют методом исследования ADM, описанным в примерах (или исследования proADM, или исследования их фрагментов, соответственно). Указанные выше значение могут различаться в разных исследованиях ADM (или в исследованиях proADM, или в исследованиях их фрагментов, соответственно), в зависимости от способа калибровки. Указанные выше значения будут применять для таких по-разному калиброванных исследований ADM, соответственно, учитывая различия в калибровке. Исследования ADM могут быть откалиброваны путем корреляции и приведения в соответствие через их нормальные диапазоны (здоровая популяция) (или исследования proADM, или исследования их фрагментов, соответственно). В другом варианте, коммерчески доступные контрольные образцы могут применяться для приведения в соответствие разных калибровок (фирма ICI Diagnostics, Берлин, Германия).
В описанном анализе ADM среднее значение для нормальной популяции определено равным 24,7 пг/мл.
В одном из вариантов осуществления настоящего изобретения устанавливают пороговое значение для ADM в плазме 90 пг/мл, предпочтительно 70 пг/мл.
В одном из вариантов осуществления настоящего изобретения устанавливают пороговое значение для MR-proADM в плазме 0,9 нмоль/л, предпочтительно 0,7 нмоль/л.
В одном из вариантов осуществления настоящего изобретения устанавливают пороговое значение для CT-proADM в плазме 1,0 нмоль/л, предпочтительно 0,8 нмоль/л.
Если в плазме уровень ADM, или MR-proADM, ли CT-proADM выше указанных пороговых значений, субъект может нуждаться в лечении сосудосуживающим агентом.
В одном из вариантов осуществления настоящего изобретения указанный образец выбран из группы, включающей нитратную плазму, гепариновую плазму, плазму EDTA, цельную кровь человека.
Субъект, который может нуждаться в жидкостной реанимации или в лечении сосудосуживающим агентом, может находиться в состоянии, выбранном из группы, включающей: пациентов с риском развития состояний физиологического шока, согласно приведенному ниже более подробному описанию, а также при инфекциях, ССВО, сепсисе, сердечной недостаточности, сердечно-легочном угнетении, в период после операции на сердце, при инфаркте правого желудочка, мерцательной брадиаритмии, множественных травмах, ожогах, повреждении почек.
Этот тип шока может быть вызван:
- Тяжелым кровотечением.
- Легочной эмболией (сгустком крови в легких).
- Тяжелой рвотой и диареей.
- Травмой позвоночника.
- Отравлением.
Также существуют специфические типы физиологического шока с весьма характерными симптомами.
Кардиогенный шок:
Кардиогенный шок возникает при тяжелом поражении сердца, например, при тяжелом сердечном приступе, когда сердце больше не в состоянии качать кровь и должным образом обеспечивать кровоснабжение тела, что приводит к очень низкому кровяному давлению. Такие состояния возникают примерно в восьми процентах сердечных приступов. Их сложно лечить, но могут быть введены лекарства для усиления работы сердца. Этого может быть достаточно, чтобы пациент пережил наихудший период, пока сердце само не восстановится, но кардиогенный шок все еще заканчивается смертью в восьми случаях из десяти. Новые методы лечения для «реваскуляризации» или восстановления тока крови к сердечной мышце повышает выживаемость.
Септический шок:
Наблюдают при сокрушительной бактериальной инфекции, которая вызывает падение кровяного давления. Более чем в 50% случает пациенты умирают. Хотя септический шок вызывает бактериальная инфекция, лечение антибиотиками оказывается не таким простым, поскольку бактерии после своего уничтожения выделяют огромное количество токсина, который еще больше усугубляет шоковое состояние. Септический шок всегда следует лечить в клинике, где могут быть правильно выбраны лекарства и может поддерживаться водный баланс. Одним из типов септического шока является синдром токсического шока - редкое тяжелое заболевание, вызываемое некоторыми штаммами бактерии Staphylococcus aureus.
Анафилактический шок:
Это тяжелая аллергическая реакция. Обычно анафилактический шок вызывают укусы пчел и ос, орехи, ракообразные, яйца, латекс и некоторые медикаменты, включая пенициллин. К симптомам относятся:
- Жжение и разбухание губ и языка.
- Затрудненное дыхание (как при приступе удушья).
- Красная, покрытая пузырями или зудящая кожа, чихание.
- Слезящиеся глаза.
- Тошнота.
- Страх.
Анафилаксия требует неотложного лечения в условиях клиники. Людям с риском развития анафилаксии следует всегда иметь при себе набор для неотложного лечения, в состав которого входит адреналин.
Сепсис и формы его обострения (тяжелый сепсис, септический шок) по прежнему представляют сложную медицинскую задачу, смертность колеблется от 30 до 70%. Несмотря на успехи поддерживающей терапии ежегодно у 750000 людей развивается сепсис и только в США умирает 225000, причем ежегодно случаев сепсиса становится больше на 1,5-8% [4-6]. Для того чтобы спасти жизнь пациента с сепсисом, важно, во-первых, своевременно принять меры против признаков инфекции с помощью антибиотиков или других средств, и, во-вторых, своевременно распознать нарастающее осложнение ситуации, например, когда тяжелый сепсис переходит в септический шок, значит должная терапия с применением сосудосуживающего агента должна быть инициирована ранее. Отсрочка лечения могла повысить риск смерти пациента.
Признаки, при которых пациентов с прогрессированием септического шока рекомендуют начинать жидкостную реанимацию или терапию сосудосуживающим/инотропным агентом, описаны в рекомендациях Surviving Sepsis Campaign [3]: рекомендуют применить сосудосуживающие агенты при гипотонии, что не соответствует первоначальной жидкостной реанимации для поддержания среднего артериального давления (MAP)≥65 mm Hg. В этом руководстве также рекомендуют, какой сосудосуживающий/инотропный агент следует применить в такой ситуации. В настоящее время консолидированное мнение следующее: норэпинефрин (синоним - норадреналин) - сосудосуживающий агент первого выбора. Эпинефрин (синоним - адреналин; вводят для потенциального замещения норадреналина) применяют, если дополнительный агент необходим для поддержания должного кровяного давления. Сосудосуживающий агент в количестве 0,03 ед./мин может быть добавлен к норэпинефрину либо для повышения MAP, либо для снижения дозы норэпинефрина. В основном применяемыми в настоящее время в клинической практике сосудосуживающими и инотропными агентами являются [7, 8]: катехоламины (допамин, добутамин, норэпинефрин, эпинефрин, изопротеренол, фенилэфрин), ингибиторы фосфодиэстеразы III (милринон, амринон), вазопрессин, левосимендан.
Кроме того, разрабатывают другие соединения, активные в отношении сосудов, например, селепрессин - селективный агонист рецептора вазопрессина Via [9], и антитела против адреномедуллина.
Были исследованы другие соединения, но доступные результаты клинических исследований являются разбросанными, и полученные в большем масштабе результаты имеют неоднозначное толкование [10]. К ним относятся ингибиторы АТФ-зависимых K+-каналов (глибенкламид [11, 12]) NOS (NG-монометил-L-аргинин [13, 14]) и cGMP (метиленовый синий [15, 16]).
Сосудосуживающие агенты и инотропы клинически применимы для лечения и предупреждения различных типов физиологического шока и сердечнососудистых заболеваний (застойной сердечной недостаточности, остановки сердца, после операции на сердце, инфаркта правого желудочка, брадиаритмии) [7].
Поскольку всегда проводят мониторинг кровяного давления у пациентов, пребывающих в критическом состоянии, с клинической точки зрения пациенты с показателями, превышающими определенные пороговые значения, например, при высоком ADM (>70 пг/мл) без потребности в сосудосуживающем агенте при осмотре больного, следует лечить сосудосуживающим агентом путем адаптации точек принятия решения от величины MAP<66 mm Hg до, например, <75 mm Hg, принимая решение о более ранней поддержке кровообращения для защиты пациентов от дисфункций органов, связанных с низким кровяным давлением, и последующей высокой смертностью. Руководствуясь этим правилом для пациентов с ADM>70 пг/мл и лечения сосудосуживающими агентами при MAP<=75 mm Hg, пациентов (группа 3) следовало начинать лечить в среднем на 1,6 суток раньше, чем по стандартной схеме лечения (<=66 mm Hg).
Таким образом, в одном из вариантов осуществления настоящего изобретения указанного пациента определяют в качестве нуждающегося во введении сосудосуживающего агента, если уровень proADM и/или его фрагментов, содержащих по меньшей мере 6 аминокислот, в жидкости тела указанного субъекта выше порогового значения, и если у пациента MAP</=75 mm Hg, но предпочтительно >66 mm Hg, более предпочтительно MAP>70 mm Hg.
В одном из вариантов осуществления настоящего изобретения применяют порог ADM в плазме 90 пг/мл, предпочтительно 70 пг/мл, и/или у пациента MAP<=/75 mm Hg, но предпочтительно >66 mm Hg, более предпочтительно MAP>70 mm Hg.
В одном из вариантов осуществления настоящего изобретения применяют порог MR-proADM в плазме 0,9 нмоль/л, предпочтительно 0,7 нмоль/л, и/или у пациента MAP<=/75 mm Hg, но предпочтительно >66 mm Hg, более предпочтительно MAP>70 mm Hg.
В одном из вариантов осуществления настоящего изобретения применяют порог СТ proADM в плазме 1,0 нмоль/л, предпочтительно 0,8 нмоль/л, и/или у пациента MAP<=/75 mm Hg, но предпочтительно >66 mm Hg, более предпочтительно MAP>70 mm Hg.
Если уровень ADM в плазме, или MR-proADM в плазме, или СТ proADM в плазме выше указанного выше порогового значения, и/или если у пациента MAP</=75 mm Hg, но предпочтительно >66 mm Hg, более предпочтительно MAP>70 mm Hg, субъект нуждается в лечении сосудосуживающим агентом.
Замещение жидкости или жидкостная реанимация является медицинской практикой замещения жидкости тела, утраченной с потом, в результате кровотечения, перемещения жидкости в организме или в следствие других патологических процессов, описанных выше. Жидкость может быть замещена введением через рот (питье), внутривенно, ректально или введением жидкости в подкожную клетчатку, прямой инъекцией жидкости в подкожную ткань. Жидкости, введенные перорально и подкожно, всасываются медленнее, чем при внутривенном введении. Пероральная регидратационная терапия - пример простого метода лечения дегидратации, связанной с диареей, особенно с гастроэнтеритем/гастроэнтеропатией, например, вызванных холерой или ротавирусом. Пероральная регидратационная терапия заключается во введении через рот раствора солей и Сахаров.
При тяжелой форме дегидратации предпочтительнее внутривенное замещение жидкости, которое может привести к спасению жизни субъекта. Этот метод лечения особенно применим при истощении жидкости и во внутриклеточном пространстве, и в просветах сосудов.
Замещение жидкости также показано при истощении жидкости при каком-либо из описанных выше состояний.
В контексте настоящего изобретения антителом является белок, включающий один или более полипептидов, главным образом кодируемых генами иммуноглобулинов, специфически связывающих антиген. Установленными генами иммуноглобулинов являются гены константных областей каппа, лямбда, альфа (IgA), гамма (IgG1, IgG2, IgG3, IgG4), дельта (IgD), эпсилон (IgE) и мю (IgM), а также несметное количество генов вариабельных областей иммуноглобулинов. Легкие цепи иммуноглобулинов полной длины обычно имеют размер примерно 25 кДа или 214 аминокислот в длину. Тяжелые цепи иммуноглобулинов полной длины обычно имеют размер примерно 50 кДа или 446 аминокислот в длину. Легкие цепи кодируются геном вариабельной области с NН2-конца (примерно 110 аминокислот в длину) и геном константной области каппа или лямбда с COOH-конца. Тяжелые цепи сходным образом кодируются геном вариабельной области (примерно 116 аминокислот в длину) и одним из других генов константной области.
Основную структурную единицу антитела обычно представляет тетрамер, который состоит из двух идентичных пар цепей иммуноглобулина, каждая пара содержит одну легкую и одну тяжелую цепь. В каждой паре вариабельные области легкой и тяжелой цепей связываются с антигеном, и константные области опосредуют эффекторные функции. Иммуноглобулины также существуют в виде множества других форм, включая, например, Fv, Fab и (Fab')2, а также в виде бифункциональных гибридных антител и единичных цепей (например, Lanzavecchia с соавт., Eur. J. Immunol. 17, 1987, с. 105; Huston с соавт., Proc. Natl. Acad. Sci. U.S.A., 85, 1988, cc. 5879-5883; Bird с соавт., Science 242, 1988, cc. 423-426; Hood с соавт., Immunology, Benjamin, N.Y., 2nd ed., 1984; Hunkapiller and Hood, Nature 323, 1986, cc. 15-16). Вариабельная область легкой или тяжелой цепи иммуноглобулина включает каркасную область, прерываемую тремя гипервариабельными областями, также называемыми областями, определяющими комплементарность (complementary determining region - CDR) (см. Sequences of Proteins of Immunological Interest, E. Kabat с соавт., U.S. Department of Health and Human Services, 1983). Выше отмечено, что CDR главным образом ответственны за связывание с эпитопом антигена. Иммунным комплексом является антитело, например, моноклональное антитело, химерное антитело, гуманизированное антитело или антитело человека, или функциональный фрагмент антитела, специфически связывающиеся с антигеном.
Химерными являются антитела, в которых сконструированы гены легких и тяжелых цепей, обычно путем генной инженерии, от генов вариабельных и константных областей иммуноглобулинов, принадлежащих разным видам. Например, вариабельные сегменты генов моноклонального антитела мыши могут быть соединены с константными сегментами человека, например, каппа и гамма 1 или гамма 3. В одном из примеров терапевтическое химерное антитело является гибридным белком, состоящим из вариабельного или антиген-связывающего домена от антитела мыши и константного или эффекторного домена от антитела человека, хотя могут быть использованы и другие виды млекопитающих или вариабельная область может быть получена молекулярными методами. Методы получения химерных антител известны в данной области, например, см. US 5807715. Понятие «гуманизированный» иммуноглобулин означает иммуноглобулин, включающий каркасную область человека и одну или несколько областей, определяющих комплементарность (CDR), производных не от иммуноглобулина человека (производных, например, от мыши, крысы или синтетическую область/области). Иммуноглобулин, не являющийся иммуноглобулином человека, который служит источником CDR, называют «донором», а иммуноглобулин человека, который служит источником каркасной области, называют «акцептором». В одном из вариантов осуществления настоящего изобретения все CDR в гуманизированном иммуноглобулине происходят от иммуноглобулина-донора. Не требуется, чтобы присутствовали константные области, но если они есть, они должны быть в основном идентичны константным областям иммуноглобулина человека, например, идентичность должна составлять по меньшей мере примерно 85-90%, например, примерно 95% или более. Следовательно, все части гуманизированного иммуноглобулина, возможно за исключением CDR, в значительной степени идентичны соответствующим частям последовательностей природных иммуноглобулинов человека. Понятие «гуманизированное антитело» означает антитело, включающее гуманизированную легкую цепь и гуманизированную тяжелую цепь иммуноглобулина. Гуманизированное антитело связывается с тем же антигеном, что и антитело-донор, от которого происходят CDR. Акцепторный каркасный участок гуманизированного иммуноглобулина или антитела может иметь ограниченное число замещений аминокислотами, взятыми от каркасного участка донора. Гуманизированные или иные моноклональные антитела могут иметь дополнительные консервативные аминокислотные замещения, которые не оказывают значительного влияния на связывание антигена или иные функции иммуноглобулина. Примерами консервативных замещений являются, например, gly, ala; val, ile, leu; asp, glu; asn, gin; ser, thr; lys, arg; и phe, tyr. Гуманизированные иммуноглобулины могут быть сконструированы методами генетической инженерии (см., например, US 5585089). Антителом человека является антитело, в котором гены легкой и тяжелой цепей происходят от человека. Антитела человека могут быть выработаны методами, известными в данной области. Антитела человека могут быть получены путем иммортализации В-клеток человека, секретирующих требуемое антитело. Иммортализация может достигаться, например, инфицированием вирусом ЕВУ или гибридизацией В-клеток человека с миеломой или гибридомой для получения клеток триом. Антитела человека также могут быть получены методом фагового дисплея (см., например, WO 91/17271, WO 92/001047, WO 92/20791) или выбраны из библиотеки комбинаторных моноклональных антител человека (см. вебсайт фирмы Morphosys). Антитела человека также могут быть получены за счет использования трансгенных животных, несущих ген иммуноглобулина человека (см., например, WO 93/12227, WO 91/10741).
Таким образом, антитело может иметь конфигурации, известные в данной области. К примерам относятся антитела человека, моноклональные антитела, гуманизированные антитела, химерные антитела, CDR-трансплантированные антитела. В предпочтительном варианте осуществления настоящего изобретения антитела по настоящему изобретению являются рекомбинантно полученными антителами, например, IgG, типичным иммуноглобулином полной длины, или фрагментами антител, содержащими по меньшей мере F-вариабельный домен тяжелой и/или легкой цепи, например, химически соединенные антитела (связывание фрагментов антител), включая, но ими не ограничиваясь, Fab-фрагменты, включая минитела Fab, одноцепочечное Fab-антитело, моновалентное Fab-антитело с эпитопными метками, например, Fab-V5Sx2; бивалентное Fab (мини-антитело), димеризованное с доменом СНЗ; бивалентное Fab или мультивалентное Fab, например, сформированное путем мультимеризации с помощью гетерологичного домена, например, путем димеризации dHLX-доменов, например, Fab-dHLX-FSx2; F(ab')2-фрагменты, scFv-фрагменты, мультимеризованные мультивалентные и/или мультиспецифичные scFv-фрагменты, бивалентные и/или биспецифичные диантитела, BITE® (биспецифичный активатор Т-клеток), трифункциональные антитела, поливалентные антитела, например, от класса, не являющегося классом G; однодоменные антитела, например, напотела, производные от иммуноглобулинов семейства верблюдовых или рыб, и многие другие.
Помимо антител в данной области известны другие биополимерные каркасы для комплектования целевой молекулы, их применяют для получения биополимеров с высокой специфичностью к мишени. Примерами являются аптамеры, шпигельмеры, антикалины и конотоксины.
В предпочтительном варианте осуществления настоящего изобретения конфигурация антитела выбрана из группы, включающей Fv-фрагмент, scFv-фрагмент, Fab-фрагмент, scFab-фрагмент, (Fab) 2-фрагмент и гибридный белок scFv-Fc. В другом предпочтительном варианте осуществления настоящего изобретения конфигурация антитела выбрана из группы, включающей scFab-фрагмент, Fab-фрагмент, scFv-фрагмент и их биодоступные оптимизированные конъюгаты, например, ПЭГелированные фрагменты. Одной из наиболее предпочтительных конфигураций является конфигурация scFab.
Молекулами-каркасами помимо Ig могут быть белки, которые можно использовать в качестве миметиков антител, поскольку они способны связываться с лигандами или антигенами. Молекулы-каркасы, не являющиеся Ig, могут быть выбраны из группы, включающей молекулы-каркасы на основе тетранектина (см., например, US 2010/0028995), фибронектина (см., например, ЕР 1266 025), липокалина (см., например, WO 2011/154420), убиквитина (см., например, WO 2011/073214), переносящих молекул-каркасов (см., например, US 2004/0023334), белка А (см., например, ЕР 2231860), повторов анкирина (см., например, WO 2010/060748), микробелков, предпочтительно микробелков, формирующих цистиновый узел (см., например, ЕР 2314308), домена Fyn SH3 (см., например, WO 2011/023685), домена EGFR-A (см., например, WO 2005/040229) и домена Куница (см., например, ЕР 1941867).
В одном из вариантов осуществления настоящего изобретения антитела по настоящему изобретению могут быть получены следующим образом:
Мышь Balb/c иммунизируют 100 мкг конъюгата пептида-БСА в 0 и 14 сутки (эмульгированного в 100 мкл полного адъюванта Фрейнда) и 50 мкг на 21 и 28 сутки (в 100 мкл неполного адъюванта Фрейнда). За трое суток до проведения эксперимента по гибрдизации животное получает 50 мкг конъюгата, растворенного в 100 мкл физиологического раствора, введенного в виде одной внутрибрюшинной и одной внутривенной инъекции.
Спленоциты от иммунизированной мыши и клетки миеломы линии SP2/0 гибридизируют с 1 мл 50% полиэтиленгликоля в течение 30 сек при 37°C. После промывания клетки высевают в 96-луночный планшет для культуры клеток. Гибридные клоны отбирают по росту в среде HAT [культуральной среде RPMI 1640, обогащенной 20% фетальной сыворотки теленка и добавкой НАТ-Supplement]. Через две недели среду HAT заменяют средой НТ за три пассажа с последующим возвратом к нормальной среде для культуры клеток.
Через три недели после гибридизации супернатанты культур клеток в первую очередь подвергают скринингу на IgG-антитела, специфичные к антигену. Положительные микрокультуры переносят в 24-луночные планшеты для размножения. После повторной проверки отобранные культуры клонируют и реклонируют, используя метод серийных разведений, определяют изотипы (см. также Lane R.D.J. Immunol. Meth. 81, 1985, cc. 223-228; Ziegler В. с соавт. Horm. Metab. Res. 28, 1996, cc. 11-15).
Антитела могут быть получены методом фагового дисплея по следующей процедуре:
Библиотеки HAL7/8 генов антител человека, не подвергнутых какому-либо воздействию, применяют для выделения рекомбинантных одноцепочечных F-вариабельных доменов (scFv) против пептида адреномедуллина. Библиотеки генов антител подвергают скринингу методом пэннинга с применением пептидов, содержащих биотиновую метку, связанную через два разных спейсера с пептидной последовательностью адреномедуллина. Комбинацию циклов пэннинга, используя неспецифически связанный антиген и стрептавидин-связанный антиген, применяют для минимизации фонового воздействия неспецифических связующих. Элюированные фаги с третьего цикла пэннинга применяют для получения штаммов Е. coli, экспрессирующих моноклональные scFv. Супернатанты культур таких клоповых штаммов непосредственно используют для ELISA тестирования на антиген (см. М. Hust с соавт. Journal of Biotechnology 152, 2011, cc. 159-170; M.  с соавт. PLoS One 4, 2009, с. е6625).
с соавт. PLoS One 4, 2009, с. е6625).
Гуманизирование антител мышей могут проводить по описанной ниже процедуре.
Для гуманизации антитела, происходящего от мыши, последовательность антитела анализируют для определения структурного взаимодействия каркасных участков (framework regions - FR) с областями, определяющими комплементарность (complementary determining region - CDR), и антигена.
Основываясь на структурном моделировании, выбирают необходимый участок FR, происходящий от человека, и последовательности CDR мыши трансплантируют в FR человека. Вариации аминокислотной последовательности CDR или FR могут быть интродуцированы для восстановления структурных взаимодействий, которые были нарушены в результате переключения на последовательности FR других видов. Восстановление структурных взаимодействий может быть достигнуто случайным подходом, используя библиотеки фагового дисплея, или направленным подходом с помощью молекулярного моделирования (см. J.C. Almagro, J. Fransson. Front Biosci. 2008 Jan 1(13), 2008, cc. 1619-33).
Другим объектом настоящего изобретения является сосудосуживающий агент для лечения субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, причем указанного субъекта выявляют одним из описанных выше методов in vitro, включая все варианты осуществления указанных методов in vitro.
Описание фигур
Фиг. 1. Типичная кривая АДМ дозы/сигнала. Кривая АДМ дозы/сигнала в присутствии 100 мкг/мл антитела NT-H.
Фиг. 2. Прогнозирование больничной летальности по данным логистической регрессии.
Фиг. 3. Прогнозирование больничной летальности - ADM не зависит от APACHE и предоставляет дополнительную прогностическую информацию.
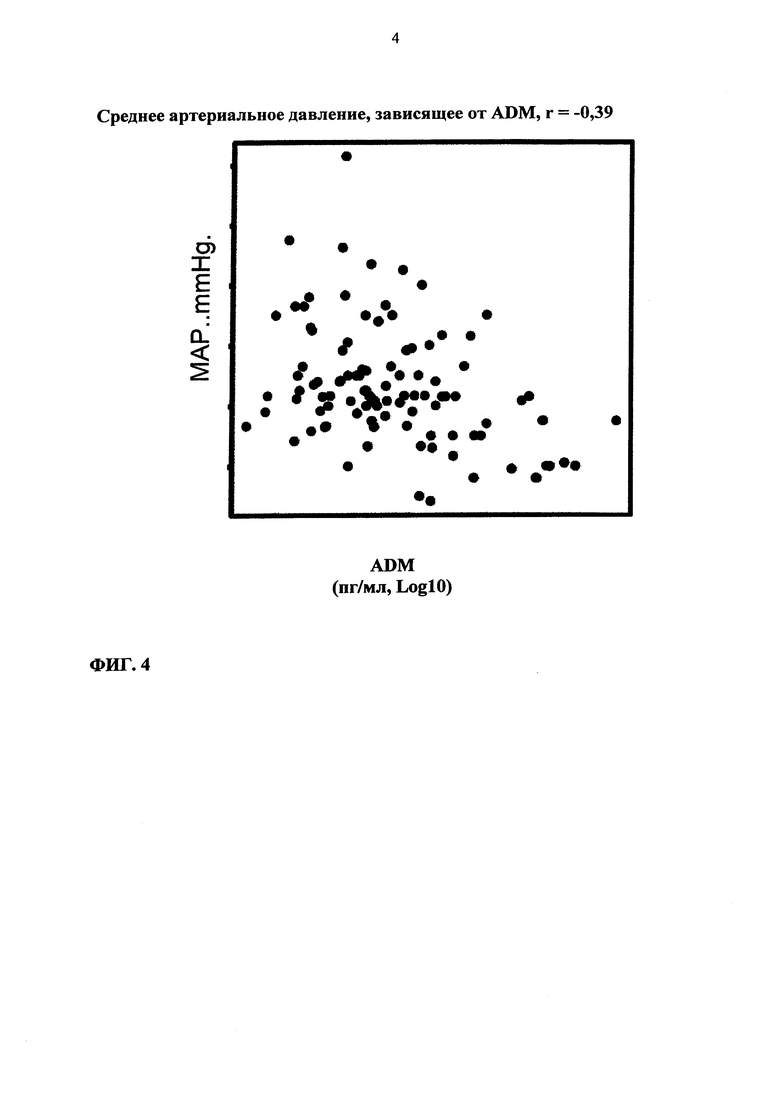
Фиг. 4. Среднее артериальное давление, зависящее от уровней ADM в плазме. Диаграмма разброса данных и коэффициент корреляции показаны для величин, полученных от пациентов при госпитализации. Статистическая значимость р<0,0001.
Фиг. 5. Концентрации адреномедуллина при госпитализации у пациентов, нуждающихся в лечении сосудосуживающим агентом, по сравнению с пациентами, не требующими лечения сосудосуживающим агентом. Различие между двумя группами статистически значимо (р<0,0001).
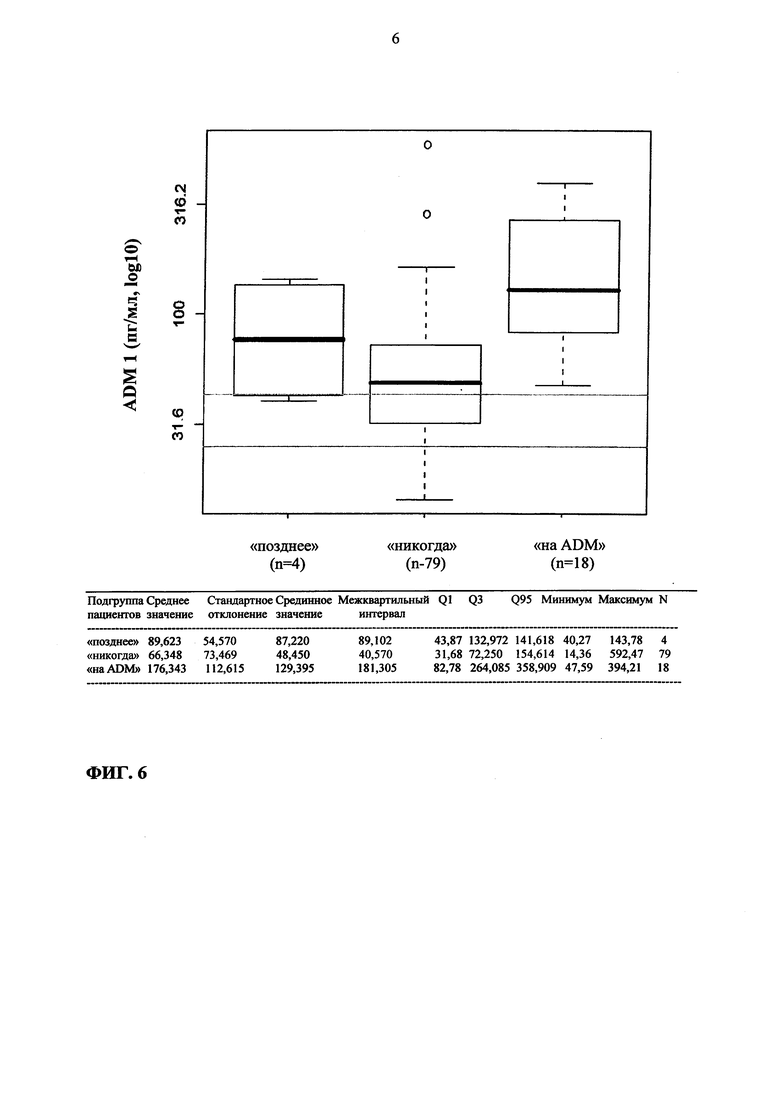
Фиг. 6. Концентрации ADM при госпитализации у пациентов, которых лечили сосудосуживающими агентами на момент госпитализации («на ADM»), кому не требуется лечение сосудосуживающими агентами в течение первых четырех суток после госпитализации («никогда»), и которым требуется лечение сосудосуживающим агентом в первые четверо суток после госпитализации, но не в день госпитализации («позднее»). На графике указан нормальный диапазон концентраций ADM.
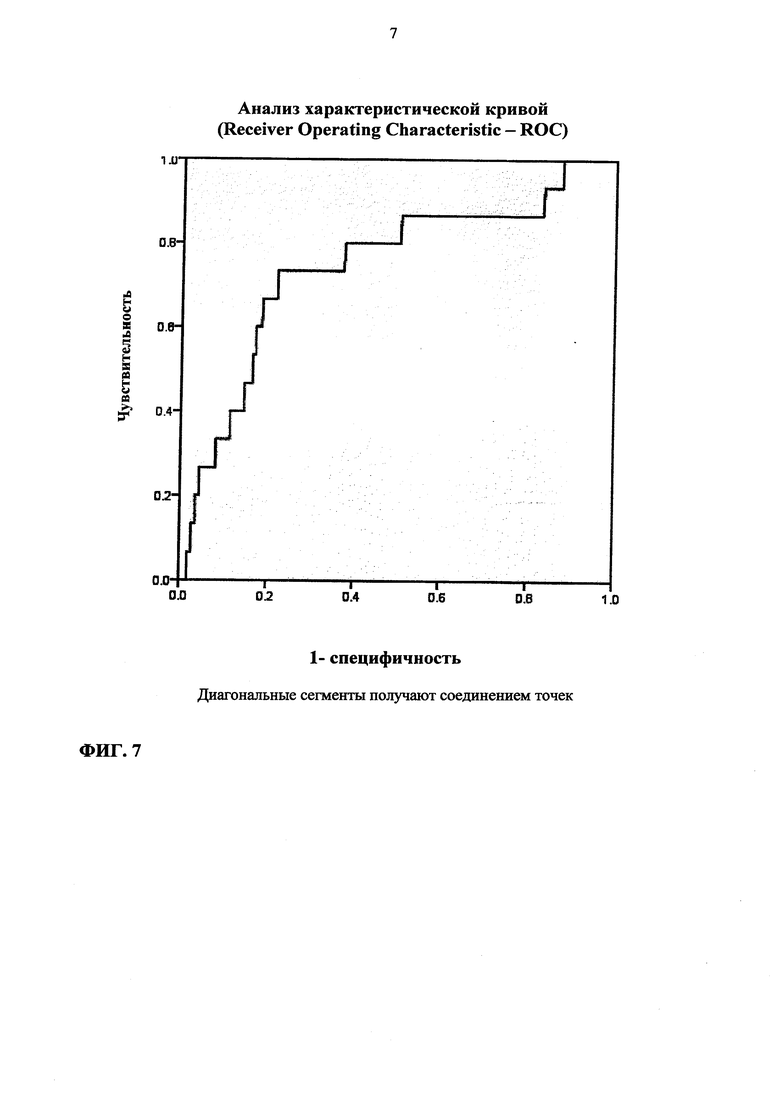
Фиг. 7. Анализ характеристической кривой (Receiver Operating Characteristic - ROC) для концентраций ADM у пациентов с острой сердечной недостаточностью, которым требуется (чувствительность) и не требуется (специфичность) лечение сосудосуживающими агентами.
Пример 1. Выработка антител и определение у них констант сродства
В настоящем изобретении получают моноклональные антитела мыши путем связывания с N-концевой, средней и C-концевой частями ADM и определяют у них константы сродства (табл. 1).
Пептиды для иммунизации
Используют пептиды фирмы JPT Peptide Technologies GmbH (Берлин, Германия). Пептиды соединяют с БСА, используя метод образования поперечных связей Sulfo-SMCC. Процедуру образования поперечных связей проводят по инструкциям производителя (фирма Thermo Fisher / Pierce).
Антитела мышей получают следующим методом: мышь A Balb/c иммунизируют 100 мкг конъюгата пептида-БСА в 0 и 14 сутки (эмульгированного в 100 мкл полного адъюванта Фрейнда) и 50 мкг на 21 и 28 сутки (в 100 мкл неполного адъюванта Фрейнда). За трое суток до проведения эксперимента по гибридизации животное получает 50 мкг конъюгата, растворенного в 100 мкл физиологического раствора, которое вводят в виде одной внутрибрюшинной и одной внутривенной инъекции.
Спленоциты от иммунизированных мышей и клетки миеломы линии SP2/0 гибридизируют с 1 мл 50% полиэтиленгликоля в течение 30 сек при 37°C. После промывания клетки высевают в 96-луночные планшеты для культур клеток. Гибридные клоны отбирают путем выращивания в среде HAT [культуральная среда RPMI 1640, обогащенная 20% фетальной сыворотки теленка и НАТ-добавкой]. Через 2 недели среду HAT заменяют средой НТ на протяжении трех пересевов с последующим возвращением к нормальной среде для культуры клеток.
Супернатанты культур клеток в первую очередь исследуют на наличие специфичных к антигену IgG антител через три недели после гибридизации. Микрокультуры с обнаруженным положительным результатом переносят в 24-луночные планшеты для размножения. После повторного исследования отобранные культуры клонируют и реклонируют, используя метод серийных разведений, и определяют изотипы. (R.D. Lane J. Immunol. Meth., 81, 1985, cc. 223-228; В. Ziegler с соавт. Horm. Metab. Res., 28, 1996, cc. 11-15).

Получение моноклонального антитела
Антитела получают стандартными методами получения антител (Marx с соавт., ATLA, 25, 1997, с. 121) и очищают с помощью белка А. Чистота антител составляет >95% по данным SDS гель-электрофореза.
Константы сродства
Для определения сродства антител с адреномедуллином определяют кинетику связывания адреномедуллина с иммобилизованным антителом с помощью поверхностного плазмонного резонанса без метки, используя систему Biacore 2000 (GE Healthcare Europe GmbH, Фрайбург, Германия). Обратимую иммобилизацию антител проводят, используя антитело против Fc-фрагмента мыши, связанное ковалентно с высокой плотностью с поверхностью сенсора СМ5 по инструкциям производителя (mouse antibody capture kit; фирма GE Healthcare).
Процедура нанесения метки (индикатора): 100 мкг (100 мкл) антитела (1 мг/мл в физиологическом растворе, рН 7,4,) смешивают с 10 мкл NHS-сложного эфира акридиния (1 мг/мл в ацетонитрилле, In Vent GmbH, Германия) [57] и инкубируют в течение 20 мин при комнатной температуре. СТ-Н с меткой очищают гель-фильтрационной ВЭЖХ на колонке Bio-Sil® SEC 400-5 (фирма Bio-Rad Laboratories, Inc., США). Очищенное меченое антитело разводят (в 300 ммоль/л фосфата калия, 100 ммоль/л NaCl, 10 ммоль/л Na-EDTA, 5 г/л Bovine Serum Albumin, pH 7,0). Итоговая концентрация составляет примерно 800000 относительных световых единиц (ОСЕ) меченого соединения (примерно 20 нг меченого антитела) на 200 мкл. Хемилюминесценцию сложного эфира акридиния измеряют с помощью люминометра AutoLumat LB 953 (фирма Berthold Technologies GmbH & Co. KG).
Твердая фаза: в пробирки из полистирола (фирма Greiner Bio-One International AG, Австрия) наносят в течение 18 ч при комнатной температуре антитело (1,5 мкг антитела/0,3 мл 100 ммоль/л NaCl, 50 ммоль/л TRIS/HCl, рН 7,8). После блокирования с помощью 5% бычьего сывороточного альбумина, пробирки промывают ФСБ8, рН 7,4, и высушивают в вакууме.
Калибраторы: Синтетический ADM человека (фирма Bachem, Швейцария) линейно разводят, используя 50 мМ Tris/HCl, 250 мМ NaCl, 0,2% Triton Х-100, 0,5% БСА, 20 таблеток/л Protease cOmplete Protease Inhibitor Cocktail Tablets (фирма Roche AG); pH 7,8. Калибраторы хранят при -20°C до применения.
Пример 2. Определение комбинации антител, которая дает высокое соотношение сигнала/шума
ADM иммуноанализ: 50 мкл образца (или калибратора) вносят пипеткой в пробирки с покрытием, затем добавляют меченое второе антитело (200 мкл), пробирки инкубируют в течение 2 ч при комнатной температуре. Несвязанный маркер удаляют путем пятикратного промывания (каждый раз по 1 мл) раствором для промывания (20 мМ ФСБ, рН 7.4, 0.1% Triton Х-100).
Хемилюминесценцию, связанную в пробирке, измеряют с помощью люминометра AutoLumat LB 953.
Все антитела, которые используют в иммуноферментном сэндвич-анализе, представлены в виде пробирки с покрытием и меченого антитела, которые объединены в приведенных ниже вариациях (табл. 2):
Инкубирование осуществляют согласно описанию hADM-иммуноисследования. Результаты приводят в виде соотношения специфического сигнала (при 10 нг/мл ADM) /сигналу среды (образец без ADM).


Неожиданно было установлено, что комбинация MR-ADM и CT-ADM обладает наивысшим соотношением сигнал/шум.
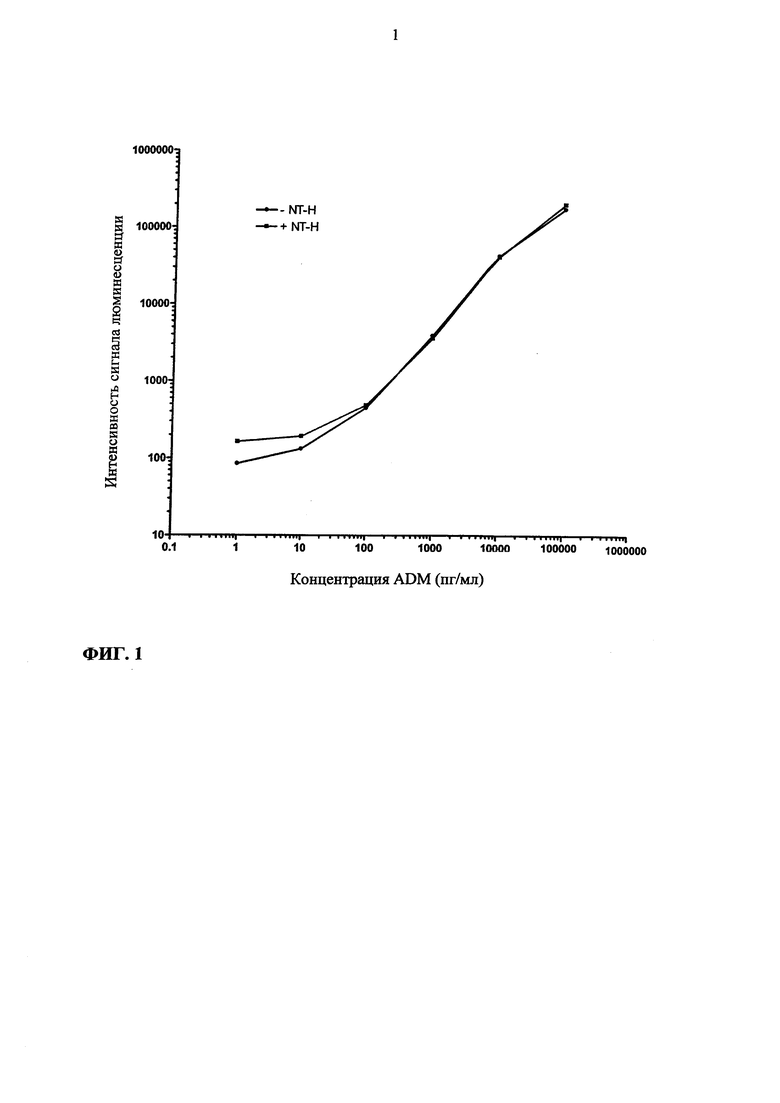
Затем полученную комбинацию с антителом используют для дальнейших исследований. Используют MR-ADM в качестве антитела твердой фазы и CT-ADM в качестве меченого антитела. Типичная кривая доза/сигнал показана на фиг. 1. Аналитическая чувствительность метода составляет 2 нг ADM/мл (в среднем 10 экспериментов, образец без ADM+2SD).
Пример 3. Стабильность адреномедуллина человека
ADM человека разводят в цитратной плазме человека (n=5, итоговая концентрация 10 нг ADM/мл) и инкубируют при 24°C. В определенные сроки берут аликвоты и замораживают при -20°C. Сразу же после оттаивания образцы hADM исследуют количественно, используя описанный выше hADM-иммуноанализ.
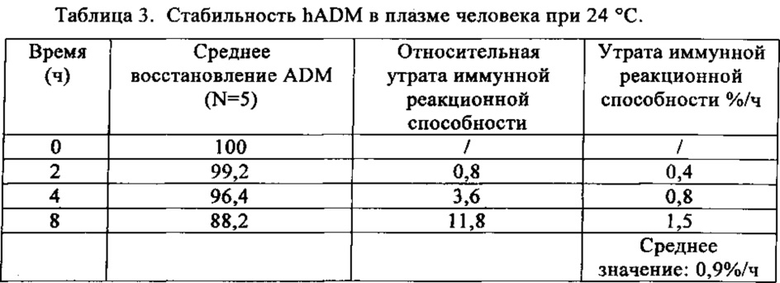
Неожиданно с помощью комбинаций MR-ADM и CT-ADM в иммуноферментном сэндвич-анализе было обнаружено, что стабильность вещества до начала проведения анализа высока (средняя потеря иммунной реактивности составляет всего лишь 0,9%/ч). Напротив, при использовании других методов анализа период полураспада в плазме составляет только 22 мин (Hinson 2000). Поскольку время от отбора образца до анализа в клинической лаборатории составляет менее 2 ч, используемый метод обнаружения ADM пригоден для рутинной диагностики. Следует отметить ценную особенность: какие-либо специфические добавки к образцам (например, апротинин, (20)) не требуются для достижения приемлемой стабильности ADM-иммунной реактивности.
Пример 4. Воспроизводимость калибратора-препаратов.
Установлено, что полученные результаты отличаются большой вариабельностью при подготовке калибраторов для ADM-анализов (средний коэффициент вариации (СУ) 8,5%, см. табл. 4). Это может быть связано с высокой адсорбцией hADM к поверхности пластика или стекла (см. также [58]). Этот эффект незначительно снижают добавлением детергентов (до 1% Triton X 100 или 1% Tween 20), белка (до 5% БСА), за счет высокой ионной силы (до 1М NaCl) или комбинаций перечисленных веществ. Неожиданно было установлено, что если избыток антитела против ADM (10 мкг/мл) вносят в буфер для разбавления калибратора, восстановление и воспроизводимость калибратора-препаратов ADM-анализа существенно улучшается до <1% коэффициента вариации (CV) при подготовке (табл. 4).
Ценное свойство заключается в том, что наличие N-концевых антител не влияет на ADM-сигнал, вырабатываемый комбинацией MR- и С-концевых антител (фиг. 1).
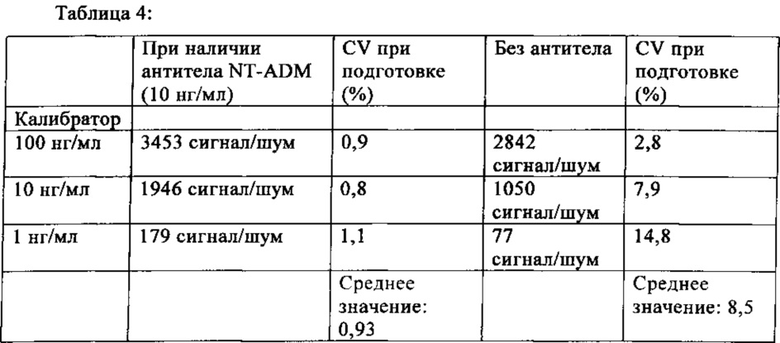
Вариации при подготовке калибраторов.
Калибраторы ADM-анализа получают согласно описанному выше с наличием 10 мкг/мл NT-ADM-антитела или без него. Коэффициенты вариации получают от пяти независимых циклов получения. Калибраторы измеряют, используя ADM-анализ, описанный выше.
Для всех последующих исследований применяют анализ ADM, основанный на калибраторах, приготовленных в присутствии 10 мкг/мл NT-ADM-антитела и 10 мкг/мл NT-ADM-антитела в качестве добавки к индикаторному буферу.
Пример 5. Чувствительность
Целью исследования анализа является полное изучение концентраций ADM у здоровых субъектов.
Концентрация ADM у здоровых субъектов:
Здоровых субъектов (n=100, средний возраст 56 лет) исследуют, используя ADM-анализ. Срединная величина составляет 24,7 пг/мл, наименьшая величина 11 пг/мл и 99й процентиль 43 пг/мл. Поскольку чувствительность метода составляет 2 пг/мл, 100% здоровых субъектов исследуют, используя описанный ADM-анализ.
Применяют коммерческий метод для измерения MR-proADM (BRAHMS MR-proADM KRYPTOR) (фирма BRAHMS GmbH, Хеннигсдорф, Германия) (ClinBiochem. 42(7-8), 2009, cc. 725-728).
Пример 6. Клиническое исследование
Пациентов отделения интенсивной терапии (101 человек), у которых определяют развитие сепсиса (R.P. Dellinger и др. Critical care medicine, 36(1), 2008, cc. 296-327), госпитализируют (средняя продолжительность госпитализация 5 суток) и подвергают стандартному лечению. EDTA-плазму получают через 1 сутки (после осмотра в отделении интенсивной терапии) и по одному образцу берут ежедневно на протяжении госпитализации. Время для замораживания образцов для последующего ADM-измерения составляет менее 4 ч.
Характеристики пациентов суммированы в табл. 5.
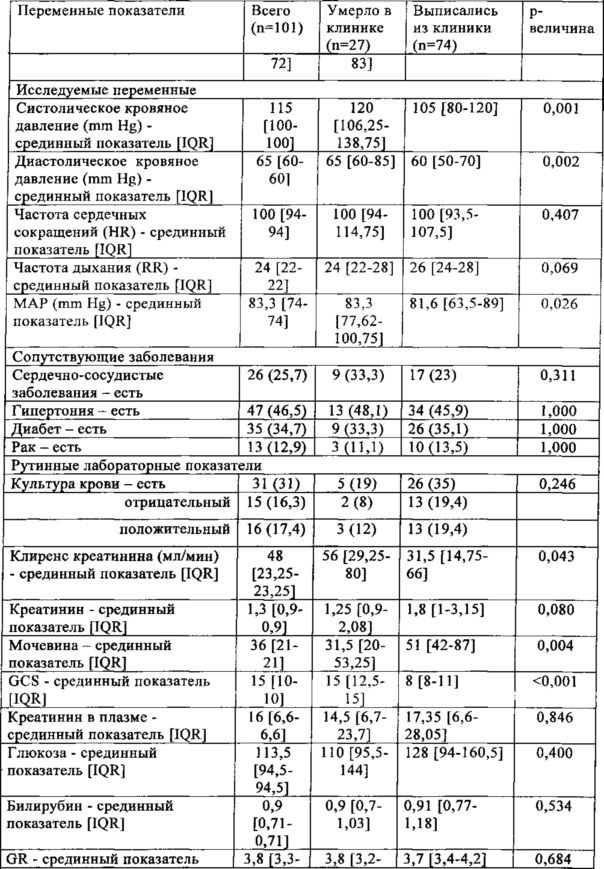
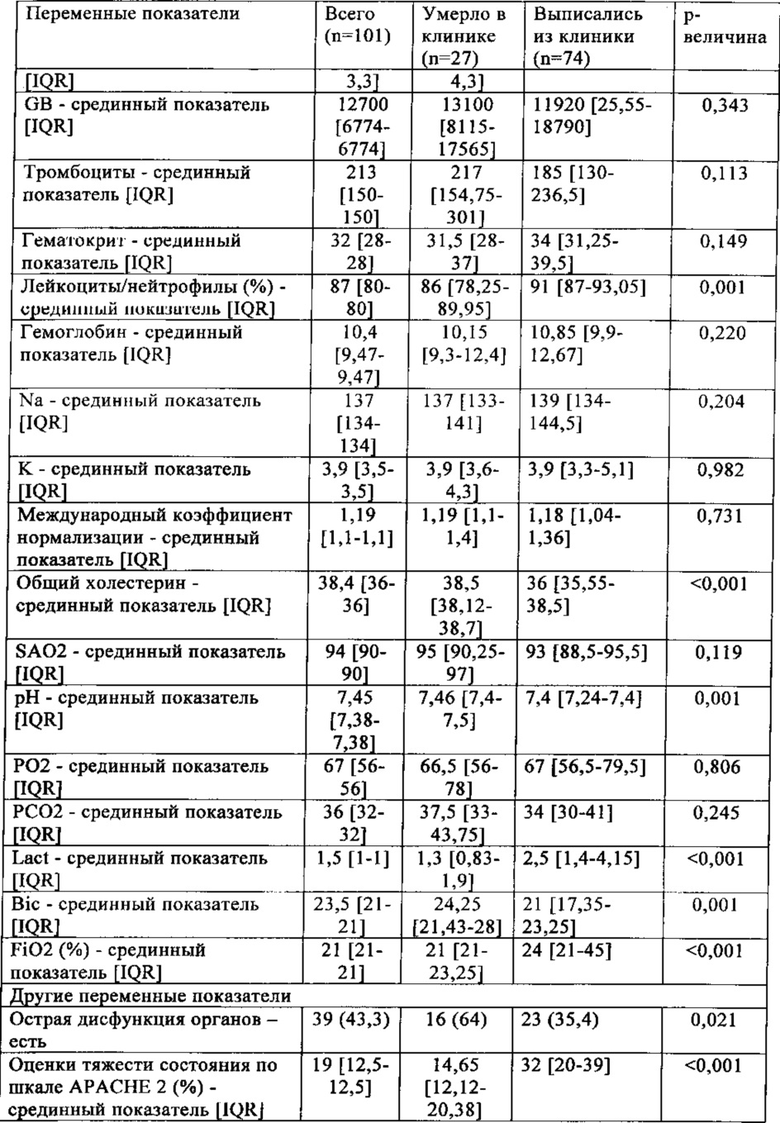

IQR (interquartile range) - межквартильный диапазон
26,7% пациентов умерло во время пребывания в госпитале, и они были учтены в качестве не отвечающих на лечение, 73,3% всех пациентов пережили сепсис и были учтены в качестве отвечающих на лечение.
У 66% всех пациентов с сепсисом показатель ADM отличается от нормы и составляет >43 пг/мл (99й процентиль), свидетельствуя, что ADM не является маркером инфекции.
Результаты клинических исследований
Первоначальный показатель ADM является высоко прогностическим признаком.
Сравнивают первоначальный показатель ADM с госпитальной смертностью и сопоставляют ADM по шкале оценки тяжести состояния APACHE 2. ADM является в высокой степени прогностическим признаком для оценки исхода сепсиса (см. фиг. 2) и данный показатель сопоставим с оценкой APACHE 2. Если ADM и APACHE 2 объединяют, получается существенная дополнительная информация (фиг. 3).
Мониторинг ADM при лечении
Пациентов лечат по стандартным методикам (табл. 5). Среднее время госпитализации составляет 5 суток. В госпитале ADM измеряют ежедневно (первые сутки = день госпитализации) и сопоставляют с показателем смертности в госпитале (табл. 6). За время пребывания в клинике ADM меняется, и изменение со временем улучшает прогностическое значение на 52% от первоначального значения Chi2 19,2 до 29,2 на пятые сутки.
Применение простой модели порогового значения 70 пг/мл ADM показывает 68% риск смерти для пациентов, у которых исходно были концентрации ADM>70 пг/мл и сохранялись на протяжении всего срока пребывания в клинике >70 пг/мл (пациент не отвечает на лечение). Среди пациентов, у которых все время величина ADM<70 пг/мл или меняется от >70 пг/мл до <70 пг/мл, смертность составляет только 11% (эффективное лечение/у пациента успешный отклик на лечение), а у пациентов, имеющих величины ADM>70 пг/мл, которые снижаются на протяжении времени лечения в клинике до величин <70 пг/мл, смертность составляет 0%. Не было пациентов, у которых показатель менялся бы с <70 пг/мл до >70 пг/мл на протяжении времени лечения в клинике. Среднее время, требуемое для получения информации, отвечает ли пациент на лечение или не отвечает, для всех пациентов составляет примерно 1 сутки. Для пациентов с показателем >70 пг/мл требуется примерно 2 суток, чтобы понять, является ли лечение успешным по ADM.

Связь ADM в плазме со средним артериальным давлением (MAP) и потребностью во введении сосудосуживающего агента
Была установлена корреляция концентраций ADM со средним артериальным давлением (фиг. 4) и с потребностью в терапии сосудосуживающим агентом для лечения/предупреждения шока (фиг. 5).
Также установлена временная связь концентраций ADM с потребностью в терапии сосудосуживающим агентом (фиг. 6): из 101 исследованного пациента 18 требовали терапии сосудосуживающим агентом уже при госпитализации; срединная концентрация ADM для этих пациентов при госпитализации составляет 129 пг/мл. У пациентов, не нуждавшихся в терапии сосудосуживающим агентом на протяжении первых четырех суток пребывания в клинике после госпитализации (n=79), срединная концентрация ADM составляет 48,5 пг/мл. Важно отметить, что пациенты, нуждающиеся в терапии сосудосуживающим агентом во время пребывания в клинике позднее, чем при госпитализации, имели повышенные уровни ADM уже при госпитализации (срединное значение 87,2 пг/мл), например: повышение концентрации ADM в плазме предшествовало терапии сосудосуживающим агентом.
В образцах плазмы также измеряют MR-proADM - стабильный фрагмент молекулы-предшественника ADM. MR-proADM рассматривают в качестве суррогатного маркера высвобождения зрелой формы ADM (J. Struck и др., Peptides, 25(8), 2004, cc. 1369-1372; N.G. Morgenthaler и др., Clinical chemistry 51(10), 2005, cc. 1823-1829). Коммерческий MR-proADM анализ осуществляют (BRAHMS MR-proADM KRYPTOR) по инструкциям производителя (BRAHMS GmbH, Хеннигсдорф, Германия). Срединные уровни в день госпитализации составляют 0,63 нмоль/л для пациентов, которые не нуждались в терапии сосудосуживающим агентом, и 1,57 нмоль/л для пациентов, нуждающихся в терапии сосудосуживающим агентом. Концентрации MR-proADM существенно коррелируют с концентрациями ADM (r=0,79).
Пример 7. Метод порогового значения для диагностики и прогнозирования потребности во введении сосудосуживающего агента
Характеристики пациентов приведены в примере 6. Исследование проводят, основываясь на результатах первого анализа крови, взятого при угрозе сепсиса у пациента.
Выбрано пороговое значение 70 пг/мл; величина <70 пг/мл свидетельствует о низком риске необходимости применения сосудосуживающего агента, а величина >70 пг/мл свидетельствует о высоком риске необходимости применения сосудосуживающего агента. В группе 1 находятся пациенты, которым не требуется применение сосудосуживающего агента (МАР<=66 mm Hg) и которые не получают сосудосуживающих агентов ни при первичном осмотре, ни за 4 последующих суток. В группе 2 находятся пациенты, которым требуются сосудосуживающие агенты (MAP<=66 mm Hg) или которые получают сосудосуживающие агенты при первичном осмотре. В группе 3 находятся пациенты, которым не требуются сосудосуживающие агенты и которые не получают сосудосуживающие агенты при первичном осмотре, но потребность в сосудосуживающих агентах возникает в последующие 4 суток. Пациентов (n=2) с недостоверной информацией по лечению сосудосуживающим агентом исключают.

Используя простой метод порогового значения с величиной отсечения 70 пг/мл, выявили 89,5% от общего числа пациентов, нуждающихся в терапии сосудосуживающими агентами при осмотре в отделении интенсивной терапии, руководствуясь показателем ADM (группа 2). 20 пациентов с показателем >70 пг/мл не нуждались в сосудосуживающих агентах при осмотре (группа 1/3), у 15 (75%) не возникает потребность в применении сосудосуживающих агентов на протяжении последующих 4 суток и у 5 (25%) пациентов возникла потребность в применении сосудосуживающих агентов на протяжении последующих 4 суток. Напротив, если ADM составляет <70 пг/мл у пациентов, не имеющих при осмотре потребности в сосудосуживающих агентах (группа 1/3), у 56 пациентов (96,5%) не возникает потребность в применении сосудосуживающих агентов на протяжении последующих 4 суток и только у 2 (3,5%) возникла потребность в применении сосудосуживающих агентов. Риск возникновения потребности в сосудосуживающих агентах в последующие 4 суток у пациентов с величиной ADM выше 70 пг/мл, в 7,1 раза выше, чем для пациентов с уровнями ADM ниже 70 пг/мл (25% против 3,5%).
Поскольку всегда проводят мониторинг кровяного давления, с клинической точки зрения пациентов с высоким содержанием ADM (>70 пг /мл) без потребности в сосудосуживающем агенте при осмотре следует лечить сосудосуживающим агентом путем адаптации точек принятия решения от величины MAP<66 mm Hg до, например, <75 mm Hg для более ранней поддержке кровообращения для защиты пациента от низкого кровяного давления, связанного с дисфункций органов и последующей высокой смертностью. Руководствуясь этим правилом для пациентов с >70 пг/мл ADM и проводя лечение сосудосуживающими агентами при MAP<=75 mm Hg, пациентов следует начинать лечить в среднем на 1,6 суток раньше, чем по стандартной схеме лечения (<=66 mm Hg).
Близкие результаты получают, когда MR-proADM с пороговым значением 0,78 нмоль/л применяют в анализе вместо ADM.

Пример 8. Клиническое исследование/острая сердечная недостаточность
Исследуемыми пациентами являются пациенты, поступившие в отделение неотложной помощи с острой сердечной недостаточностью. Характеристики пациентов: средний возраст ± SD составляет 74,3±12,2; n=1022 (643 мужчины, 63%); ранее имели ишемическое заболевание сердца - 31%, гипертонию - 58%, диабет - 33%, сердечную недостаточность - 35%. Пациентов наблюдают в течение 2 лет. Образцы плазмы для измерения ADM и других соединений получают в день госпитализации.
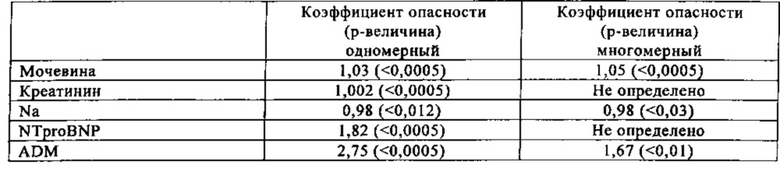
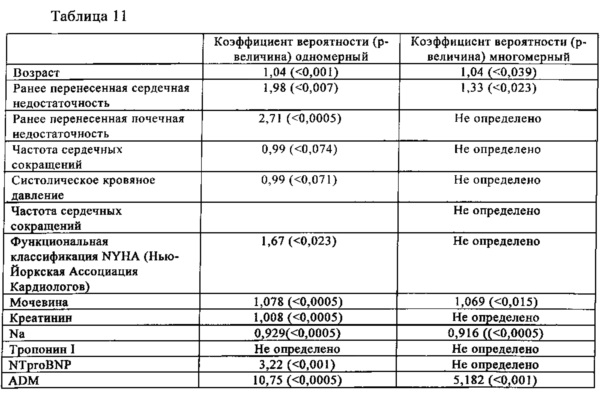
Анализ Сох показывает, что ADM является независимым прогностическим фактором смерти в течение 1 года (табл. 9) и смерти в течение 1 года/госпитализации из-за острой декомпенсированной сердечной недостаточности (табл. 10). Логистический регрессионный анализ показывает, что ADM является независимым прогностическим фактором госпитальной смерти (табл. 11).
У пациентов, нуждающихся в терапии сосудосуживающими агентами (инотропами), концентрации ADM существенно выше, чем у всех других пациентов (область под кривой - 0,75; р<0001; фиг. 7).


Литература
1. K. Kitamura с соавт. Adrenomedullin: A Novel Hypotensive Peptide Isolated From Human Pheochromocytoma. Biochemical and Biophysical Research Communications, 192(2), 1993, cc. 553-560.
2. Adrenomedullin: from a pheochromocytoma to the eyes. Под ред. K. Takahashi. Peptides, 22, 2001, с. 1691.
3. Т. Eto. A review of the biological properties and clinical implications of adrenomedullin and proadrenomedullin N-terminal 20 peptide (PAMP), hypotensive and vasodilating peptides. Peptides, 22, 2001, cc. 1693-1711.
4. Hinson с соавт. Adrenomedullin, a Multifunctional Regulatory Peptide. Endocrine Reviews. 21(2), 2000, cc. 138-167.
5. K. Kitamura с соавт. The intermediate form of glycine-extended adrenomedullin is the major circulating molecular form in human plasma. Biochem. Biophys. Res. Commun., 244(2), 1988, cc. 551-555. Abstract Only.
6. R. Pio с соавт. Complement Factor H is a Serum-binding Protein for Adrenomedulli, and the Resulting Complex Modulates the Bioactivities of Both Partners. The Journal of Biological Chemistry, 276(15), 2001, cc. 12292-12300.
7. K. Kuwasako с соавт. Purification and characterization of PAMP-12 (PAMP-20) in porcine adrenal medulla as a major endogenous biologically active peptide. FEBS Lett, 414(1), 1997, cc. 105-110. Abstract Only.
8. K. Kuwasaki с соавт. Increased plasma proadrenomedullin N-terminal 20 peptide in patients with essential hypertension. Ann. Clin. Biochem., 36 (часть 5), 1999, cc. 622-628. Abstract Only.
9. T. Tsuruda с соавт. Secretion of proadrenomedullin N-terminal20 peptide from cultured neonatal rat cardiac cells. Life Sci., 69(2), 2001, cc. 239-245. Abstract Only.
10. EP 0622458 A2, Shionogi & Co. Ltd.; Kangawa, Kenji
11. Hirata с соавт. Increased Circulating Adrenomedullin, a Novel Vasodilatory Peptide, in Sepsis. Journal of Clinical Endocrinology and Metabolism, 81(4), 1996, cc. 1449-1453.
12. K. Ehlenz с соавт. High levels of circulating adrenomedullin in severe illness: Correlation with C-reactive protein and evidence against the adrenal medulla as site of origin. ExpClinEndocrinol Diabetes, 105, 1997, cc 156-162.
13. Y. Tomoda с соавт. Regulation of adrenomedullin secretion from cultured cells. Peptides, 22, 2001, cc. 1783-1794.
14. S. Ueda с соавт. Increased Plasma Levels of Adrenomedullin in Patients with Systemic Inflammatory Response Syndrome. Am. J. Respir. Crit. Care Med., 160, 1999, cc. 132-136.
15. P. Wang. Andrenomedullin and cardiovascular responses in sepsis. Peptides, 22, 2001, cc. 1835-1840.
16. P. Wang. Adrenomedullin in sepsis and septic shock. Shock, 10(5), 1998, cc. 383-384.
17. P. Wang, Z.F. Ba, W.G. Cioffi, K.I. Bland, I.H. Chaudry. The pivotal role of adrenomedullin in producing hyperdynamic circulation during the early stage of sepsis. Archives of surgery, 133(12), 1998, cc. 1298-1304.
18. C. Parlapiano с соавт. Adrenomedulin assay and its clinical significance. European Review for Medical and Pharmacological Sciences, 3, 1999; cc. 53-61.
19. K. Nishio, Y. Akai, Y. Murao, N. Doi, S. Ueda, H. Tabuse, S. Miyamoto, K. Dohi, N. Minamino, H. Shoji с соавт.Increased plasma concentrations of adrenomedullin correlate with relaxation of vascular tone in patients with septic shock. Critical care medicine, 25(6), 1997, cc. 953-957.
20. K. Krzeminski, T. Mikulski, B. Kruk, K. Nazar. Plasma adrenomedullin response to maximal exercise in healthy subjects. Journal of physiology and pharmacology: an official journal of the Polish Physiological Society, 54(2), 2003, cc. 225-232.
21. R.P. Bellinger, M.M. Levy, A. Rhodes, D. Annane, H. Gerlach, S.M. Opal, J.E. Sevransky, C.L. Sprung, I.S. Douglas, R. Jaeschke с соавт. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Critical care medicine, 41(2), 2013, cc. 580-637.
22. D.C. Angus, W.T. Linde-Zwirble, J. Lidicker, G. Clermont, J. Carcillo, M.R. Pinsky. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Critical care medicine, 29(7), 2001, cc. 1303-1310.
23. G.S. Martin, D.M. Mannino, S. Eaton, M. Moss. The epidemiology of sepsis in the United States from 1979 through 2000. The New England journal of medicine, 348(16), 2003, cc. 1546-1554.
24. A. Melamed, F.J. Sorvillo. The burden of sepsis-associated mortality in the United States from 1999 to 2005: an analysis of multiple-cause-of-death data. Critical care, 13(1), 2009, c. R28.
25. C.B. Overgaard, V. Dzavik. Inotropes and vasopressors: review of physiology and clinical use in cardiovascular disease. Circulation, 118(10), 2008, cc. 1047-1056.
26. M.N. Bangash, M.L. Kong, R.M. Pearse. Use of inotropes and vasopressor agents in critically ill patients. British journal of pharmacology, 165(7), 2012, c. 2015-2033.
27. O.B. Boucheix, S.P. Milano, M. Henriksson, T.M. Reinheimer. Selepressin, a New V1A Receptor Agonist: Hemodynamic Comparison to Vasopressin in Dogs. Shock, 2013.
28. H. Bracht, E. Calzia, M. Georgieff, J. Singer, P. Radermacher, J.A. Russell. Inotropes and vasopressors: more than haemodynamics! British journal of pharmacology, 165(7), 2012, cc. 2009-2011.
29. M. Singer, F. Coluzzi, A. O'Brien, L.H. Clapp. Reversal of life-threatening, drug-related potassium-channel syndrome by glibenclamide. Lancet, 365(9474), 2005, cc. 1873-1875.
30. S. Warrillow, M. Egi, R. Bellomo. Randomized, double-blind, placebo-controlled crossover pilot study of a potassium channel blocker in patients with septic shock. Critical care medicine, 34(4), 2006, cc. 980-985.
31. J. Bakker, R. Grover, A. McLuckie, L. Holzapfel, J. Andersson, R. Lodato, D. Watson, S. Grossman, J. Donaldson, J. Takala с соавт. Administration of the nitric oxide synthase inhibitor NG-methyl-L-arginine hydrochloride (546C88) by intravenous infusion for up to 72 hours can promote the resolution of shock in patients with severe sepsis: results of a randomized, double-blind, placebo-controlled multicenter study (study no. 144-002). Critical care medicine, 32(1), 2004, cc. 1-12.
32. A. Lopez, J.A. Lorente, J. Steingrub, J. Bakker, A. McLuckie, S. Willatts, M. Brockway, A. Anzueto, L. Holzapfel, D. Breen с соавт. Multiple-center, randomized, placebo-controlled, double-blind study of the nitric oxide synthase inhibitor 546C88: effect on survival in patients with septic shock. Critical care medicine, 32(1), 2004, cc. 21-30.
33. M.Y. Kirov, O.V. Evgenov, N.V. Evgenov, E.M. Egorina, M.A. Sovershaev, B. Sveinbjornsson, E.V. Nedashkovsky, L.J. Bjertnaes. Infusion of methylene blue in human septic shock: a pilot, randomized, controlled study. Critical care medicine, 29(10), 2001, cc. 1860-1867.
34. N.P. Juffermans, M.G. Vervloet, C.R. Daemen-Gubbels, J.M. Binnekade, M. de Jong, A.B. Groeneveld. A dose-finding study of methylene blue to inhibit nitric oxide actions in the hemodynamics of human septic shock. Nitric oxide: biology and chemistry / official journal of the Nitric Oxide Society, 22(4), 2010, cc. 275-280.
35. N.G. Morgenthaler, J. Struck, C. Alonso, A. Bergmann. Measurement of midregional proadrenomedullin in plasma with an immunoluminometric assay. Clinical chemistry, 51(10), 2005, cc. 1823-1829.
36. J. Struck, C. Tao, N.G. Morgenthaler, A. Bergmann. Identification of an Adrenomedullin precursor fragment in plasma of sepsis patients. Peptides, 25(8), 2004, cc. 1369-1372.







Изобретение относится к медицине и может быть использовано для выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока. Для этого проводят определение уровня proADM (SEQ ID No. 1) и/или его фрагментов, включающих по меньшей мере 6 аминокислот, в жидкости тела указанного субъекта. Сопоставляют уровень proADM с потребностью указанного субъекта в жидкостной реанимации или во введении сосудосуживающего агента. Причем пациента выявляют в качестве субъекта, имеющего такую потребность, если уровень proADM (SEQ ID No. 1) и/или его фрагментов в жидкости тела указанного субъекта превышает пороговое значение. Изобретение позволяет выявить субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента. 18 з.п. ф-лы, 7 ил., 11 табл., 8 пр.
1. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока, включающий следующие стадии:
- определение уровня proADM (SEQ ID No. 1) и/или его фрагментов, включающих по меньшей мере 6 аминокислот, в жидкости тела указанного субъекта;
- сопоставление указанного уровня с потребностью указанного субъекта в жидкостной реанимации или во введении сосудосуживающего агента, причем указанного пациента выявляют в качестве субъекта, имеющего такую потребность, если уровень proADM (SEQ ID No. 1) и/или его фрагментов, включающих по меньшей мере 6 аминокислот, в жидкости тела указанного субъекта превышает пороговое значение.
2. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по п. 1, в котором указанный proADM (SEQ ID No. 1) и/или его фрагменты, включающие по меньшей мере 6 аминокислот, выбраны из группы, включающей зрелую форму ADM (SEQ ID No. 4), и/или зрелую форму ADM 1-52-Gly (SEQ ID No. 5) и MR-proADM (SEQ ID No. 3) и CT-proADM (SEQ ID No. 6).
3. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по п. 1 или 2, в котором или уровень иммунореактивности зрелой формы ADM (SEQ ID No. 4), и/или уровень иммунореактивности зрелой формы ADM 1-52-Gly (SEQ ID No. 5), или уровень иммунореактивности MR-proADM (SEQ ID No. 3), или уровень иммунореактивности CT-proADM (SEQ ID No. 6) определяют и соотносят с потребностью указанного пациента в жидкостной реанимации или во введении сосудосуживающего агента, причем указанного пациента выявляют в качестве имеющего такую потребность, если уровень иммунореактивности зрелой формы ADM (SEQ ID No. 4), и/или уровень иммунореактивности зрелой формы ADM 1-52-Gly (SEQ ID No. 5), или уровень иммунореактивности MR-proADM (SEQ ID No. 3), или уровень иммунореактивности CT-ADM (SEQ ID No. 6) в жидкости тела указанного субъекта превышает пороговое значение.
4. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по п. 1, в котором уровень pro-ADM (SEQ ID No. 1) и/или его фрагментов определяют с помощью по меньшей мере одного связующего агента, выбранного из группы, включающей: связующий агент, который связывается с областью, входящей в последовательность зрелой формы ADM (SEQ ID No. 4) и/или зрелой формы ADM 1-52-Gly (SEQ ID No. 5), и второй связующий агент, который связывается с областью, входящей в последовательность зрелой формы ADM (SEQ ID No. 4) и/или зрелой формы ADM 1-52-Gly (SEQ ID No. 5).
5. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по п. 1, в котором уровень pro-ADM (SEQ ID No. 1) и/или его фрагментов определяют с помощью по меньшей мере одного связующего агента, выбранного из группы, включающей: связующий агент, который связывается с областью, входящей в последовательность MR-proADM (SEQ ID No. 3), и второй связующий агент, который связывается с областью, входящей в последовательность MR-proADM (SEQ ID No. 3).
6. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по п. 1, в котором уровень pro-ADM (SEQ ID No. 1) и/или его фрагментов определяют с помощью по меньшей мере одного связующего агента, выбранного из группы, включающей: связующий агент, который связывается с областью, входящей в последовательность CT-proADM (SEQ ID No. 6), и второй связующий агент, который связывается с областью, входящей в последовательность CT-proADM (SEQ ID No. 6).
7. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по п. 1 или 2, в котором применяют метод для определения уровня proADM (SEQ ID No. 1) и/или его фрагментов, включающих по меньшей мере 6 аминокислот, причем чувствительность указанного метода позволяет определять количество ADM у здоровых субъектов и оно составляет < 70 пг/мл, предпочтительно < 40 пг/мл и более предпочтительно < 10 пг/мл.
8. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по одному из пп. 4-6, в котором указанный связующий агент проявляет связывающее сродство с proADM (SEQ ID No. 1) и/или его фрагментами, составляющее по меньшей мере 107 М-1.
9. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по одному из пп. 4-6, в котором указанный связующий агент выбран из группы, включающей антитело или фрагмент антитела, или каркас молекулы, не являющейся Ig, которые связываются с proADM (SEQ ID No. 1) и/или его фрагментами.
10. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по п. 1 или 2, в котором применяют метод для определения уровня proADM (SEQ ID No. 1) и/или его фрагментов, включающих по меньшей мере 6 аминокислот, причем такой метод является сэндвич-анализом, предпочтительно полностью автоматизированным.
11. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по одному из пп. 4-6, в котором по меньшей мере один из двух указанных связующих агентов имеет метку для обнаружения.
12. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по одному из пп. 4-6, в котором по меньшей мере один из двух указанных связующих агентов связан с твердой фазой.
13. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по п. 1 или 2, в котором используемое пороговое значение для ADM в плазме составляет 90 пг/мл, предпочтительно 70 пг/мл.
14. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по п. 1 или 2, в котором используемое пороговое значение для MR-proADM (SEQ ID No. 3) в плазме составляет 0,9 нмоль/л, предпочтительно 0,7 нмоль/л.
15. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по п. 1 или 2, в котором указанный образец выбран из группы, включающей цитратную плазму, гепариновую плазму, плазму EDTA, цельную кровь, сыворотку человека.
16. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по п. 1 или 2, в котором указанного пациента выявляют в качестве субъекта, имеющего такую потребность, если уровень proADM (SEQ ID No. 1) и/или его фрагментов, включающих по меньшей мере 6 аминокислот, в жидкости тела указанного субъекта выше порогового значения и если среднее артериальное значение у пациента > 66 mm Hg, более предпочтительно > 70 mm Hg.
17. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по п. 1 или 2, включающий следующие стадии:
- определение уровня proADM (SEQ ID No. 1) и/или его фрагментов, включающих по меньшей мере 6 аминокислот, в жидкости тела указанного субъекта;
- сопоставление указанного уровня с потребностью указанного субъекта в жидкостной реанимации или во введении сосудосуживающего агента, независимо от среднего артериального давления пациента, причем указанного пациента выявляют в качестве субъекта, имеющего такую потребность, если уровень proADM (SEQ ID No. 1) и/или его фрагментов, включающих по меньшей мере 6 аминокислот, в жидкости тела указанного субъекта превышает пороговое значение.
18. Способ выявления in vitro субъекта, нуждающегося в жидкостной реанимации или во введении сосудосуживающего агента, или выявления пациента с риском развития физиологического шока по п. 1 или 2, включающий следующие стадии:
- определение уровня proADM (SEQ ID No. 1) и/или его фрагментов, включающих по меньшей мере 6 аминокислот, в жидкости тела указанного субъекта;
- сопоставление указанного уровня с потребностью повысить для медицинского вмешательства пороговое значение среднего артериального давления пациента до 70 mm Hg, более предпочтительно до 75 mm Hg, еще более предпочтительно до 80 mm Hg, для инициации жидкостной реанимации или лечения сосудосуживающим агентом, причем указанного пациента выявляют в качестве субъекта, имеющего такую потребность, если уровень proADM (SEQ ID No. 1) и/или его фрагментов, включающих по меньшей мере 6 аминокислот, в жидкости тела указанного субъекта превышает пороговое значение.
19. Способ выявления in vitro субъекта, нуждающегося во введении сосудосуживающего агента, по п. 1 или 2, в котором указанный субъект проявляет следующие признаки или болезненные состояния: состояния физиологического шока, включая септический шок, кардиогенный шок и анафилактический шок; инфекции, сепсис, сердечную недостаточность, сердечно-легочное угнетение, состояние после операции на сердце, инфаркт правого желудочка, мерцательную брадиаритмию, множественные травмы, ожоги, повреждение почек.
| Имитатор ядохимикатов | 1976 |
|
SU622458A1 |
| BELLONI A.S | |||
| et al | |||
| Proadrenomedullin-derived peptides as autocrine-paracrine regulators of cell growth//Hystology and Histopathology, 2001, vol.16, pp.1263-1274 XP008164054 | |||
| NANDALUR M.R | |||
| et al | |||
| Vasopressor use in the critical care unit for treatment of persistent post-carotid artery stent induced hypotension//Neurocritical Care, vol.7, No3, 1 august 2007, pp | |||
| Крутильно-намоточный аппарат | 1922 |
|
SU232A1 |
| MAHATA M | |||
| et al | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| ВОДЯНОЕ КОЛЕСО | 1923 |
|
SU907A1 |
Авторы
Даты
2018-11-27—Публикация
2014-03-19—Подача