Объектом настоящего изобретения является способ:
а) диагностики деменции, или
b) определения риска развития деменции у субъекта, не страдающего деменцией, или
c) мониторинга терапии или мониторинга или управления вмешательством у субъекта, страдающего деменцией, или
d) мониторинга терапии или мониторинга или управления профилактическим вмешательством у субъекта с риском развития деменции,
в котором в образце физиологической жидкости субъекта определяют уровень зрелого ADM-NH2 согласно SEQ ID No. 4, и сравнивают указанный уровень зрелого ADM-NH2 с пороговым уровнем,
причем
а) у указанного субъекта диагностируют деменцию, если уровень зрелого ADM-NH2 согласно SEQ ID No. 4 ниже указанного порогового уровня, или причем
b) указанный субъект имеет повышенный риск развития деменции, если указанный уровень зрелого ADM-NH2 согласно SEQ ID No. 4 ниже указанного порогового уровня, или причем
c) статус субъекта, страдающего деменцией или имеющего риск развития деменции, улучшается при терапии или вмешательстве, если указанный уровень зрелого ADM-NH2 согласно SEQ ID No. 4 увеличивается во время курса терапии или вмешательства, и/или при этом вмешательство может быть продолжено, если указанный уровень зрелого ADM-NH2 согласно SEQ ID No. 4 увеличивается выше указанного порогового уровня.
Другим объектом настоящего изобретения является способ:
а) диагностики деменции, или
b) определения риска развития деменции у субъекта, не страдающего деменцией, или
c) мониторинга терапии или мониторинга или управления вмешательством у субъекта, страдающего деменцией, или
d) мониторинга профилактической терапии или мониторинга или управления профилактическим вмешательством у субъекта с риском развития деменции,
в котором определяют отношение маркеров, которое может представлять собой отношение уровня зрелого ADM-NH2 согласно SEQ ID No. 4, определенного в образце физиологической жидкости указанного субъекта, к уровню про-адреномедуллина или его фрагмента (который является незрелым ADM-NH2 согласно SEQ ID No. 4), определенному в образце физиологической жидкости указанного субъекта, и сравнивают указанное отношение маркеров с пороговым соотношением,
причем
а) у указанного субъекта диагностируют деменцию, если отношение маркеров ADM-NH2/про-адреномедуллин или его фрагмент ниже указанного порогового значения, или причем
b) указанный субъект имеет повышенный риск развития деменции, если отношение маркеров про-адреномедуллина или его фрагмента ниже указанного порогового значения, или причем
c) статус субъекта, страдающего деменцией или имеющего риск развития деменции, улучшается при терапии или вмешательстве, если указанное отношение маркеров увеличивается во время курса терапии или вмешательства, и причем вмешательство может продолжаться, если указанный уровень отношения маркеров увеличивается выше указанного порогового отношения.
Альтернативно, уровень зрелого ADM-NH2 согласно SEQ ID No. 4 определяют в образце физиологической жидкости указанного субъекта, и уровень про-адреномедуллина или его фрагмента (который не является зрелым ADM-NH2 согласно SEQ ID No. 4), определенный в образце физиологической жидкости указанного субъекта, объединяют в математическом алгоритме, причем результат указанного алгоритма используют для диагностики деменции или определения риска развития деменции у субъекта, не страдающего деменцией, или мониторинга терапии или мониторинга или управления вмешательством у субъекта, страдающего деменцией, или мониторинга профилактической терапии или мониторинга или управления профилактическим вмешательством у субъекта с риском развития деменции.
Деменция является клиническим синдромом, характеризующимся совокупностью симптомов и признаков, проявляющихся в нарушениях памяти, нарушениях речи, психологических и психиатрических изменениях и нарушениях повседневной активности. Различными причинами (иногда называемыми подтипами) синдрома деменции являются: болезнь Альцгеймера (примерно 50% случаев), сосудистая деменция (примерно 25%), болезнь Альцгеймера, смешанная с сосудистой деменцией (включенная в вышеуказанные выше, 25%), деменция с тельцами Леви (15%) и другие (примерно 5% в совокупности), включая лобно-височную деменцию, очаговые деменции (такие как прогрессирующая афазия), субкортикальные деменции (такие как деменция при болезни Паркинсона) и вторичные причины синдрома деменции (такие как внутричерепные поражения).
Болезнь Альцгеймера (AD) является наиболее распространенной формой деменции. Частота встречаемости AD возрастает по мере старения мировой популяции, и все больше людей вступают в период основного риска этого возрастного расстройства. К 2050 году число жертв в США, увеличится с 5,3 миллиона граждан, страдающих деменцией в настоящее время, до 13 миллионов и более, а во всем мире общее число заболевших людей возрастет до ошеломляющих 100 миллионов (Alzheimer’s Association. 2015 Alzheimer’s disease facts and figures. Alzheimers Dement 2015; 11:332-84). Ключевые молекулярные механизмы и гистопатологические признаки в мозге, пораженном AD, включают динамический каскад биохимических событий, включая патологическое амилоидогенный путь расщепления белка-предшественника амилоида (APP), образование различных видов бета-амилоида, включая димеры, тримеры, олигомеры бета-амилоидного пептида (Aβ1-42) и последующую агрегацию и отложение амилоидов в бляшках, аномальное гиперфосфорилирование и агрегацию тау-белка, прогрессирующую внутриклеточную нейрофибриллярную дегенерациб, изменения во врожденной иммунной системе и воспаление.
Примерно у 5% пациентов симптомы развиваются до 65 лет, и их относят к пациентам с «болезнью Альцгеймера с ранним началом» (EOAD). Большинство из этих пациентов имеют спорадическую форму заболевания, но 10-15% страдают генетической формой, которая обычно наследуется по аутосомно-доминантному типу. Предполагается, что в развитии EOAD участвует три гена: презенилин 1 и 2 и ген белка-предшественника амилоида (APP). Также изучают другие гены-кандидаты. Генетические формы обычно начинают проявляться в возрасте 30 или 40 лет и имеют агрессивное течение, в то время как спорадические EOAD начинают развиваться после 50 лет и, как правило, имеют временный профиль, аналогичный «болезни Альцгеймера с поздним началом» (LOAD).
Тестирование психического статуса позволяет оценить память, способность решать простые проблемы и другие мыслительные навыки. Такие тесты дают общее представление о том, осведомлен ли человек о симптомах, знает ли дату, время, место своего нахождения, может ли запомнить краткий список слов, следовать инструкциям и делать простые вычисления. Краткая шкала оценки психического состояния (MMSE) и тест Mini-Cog являются двумя наиболее часто используемыми тестами. Тест MMSE или тест Фольштейна (Folstein) представляет собой 30-бальную анкету, которая широко используется в клинических и исследовательских учреждениях для измерения когнитивных нарушений (Pangman, et al. 2000. Applied Nursing Research 13 (4):209-213; Folstein et al. 1975. Journal of Psychiatric Research. 12(3):189-98). В процессе MMSE медицинский работник задает пациенту несколько вопросов, предназначенных для проверки ряда повседневной умственной активности. Максимальная оценка MMSE - 30 баллов. Оценка от 20 до 24 баллов предполагает наличие легкой формы деменции, от 13 до 20 - умеренную форму деменции, а менее 12 - тяжелую форму деменции. В среднем, оценка MMSE у человека с болезнью Альцгеймера снижается примерно на два-четыре балла в год. Преимущества MMSE включают отсутствие необходимости в специальном оборудовании или обучении для применения, а также достоверность и надежность диагностики и продольной оценки болезни Альцгеймера. Во время теста mini-cog человека просят выполнить две задачи, запомнить и спустя несколько минут повторить названия трех общих объектов и нарисовать циферблат часов, показывающий все 12 цифр в нужных местах и время, определенное экзаменатором. Результаты этого краткого теста могут помочь врачу определить, нужна ли дальнейшая оценка. Также используются другие тесты, такие как сокращенный тест умственных способностей Ходкинсона (Hodkinson 1972. Age and ageing. 1(4):233-8), или компьютеризированные тесты по определению когнитивных способностей врачом общей практики, такие как CoP и система для получения профиля психических характеристик (Mental Attributes Profiling System), а также более длительные формальные тесты для более глубокого анализа определенных нарушений.
Легкое когнитивное нарушение (MCI) является гетерогенным клиническим состоянием, в основе которого лежит несколько причин. Тем не менее, значительная доля MCI представляет собой переходное состояние между здоровым старением и очень легкой формой AD (DeCarli 2003. Lancet Neurol. 2:15-21). Соответственно, исследования подтверждают, что у пациентов с MCI наблюдается тенденция к прогрессированию клинически вероятной AD со скоростью примерно 10-15% в год (Markesbery 2010. J Alzheimers Dis. 19:221-228).
Болезнь Альцгеймера обычно диагностируют на основе истории болезни человека, истории болезни родственников и наблюдений поведенческих реакций. Наличие характерных неврологических и нейропсихологических особенностей и отсутствие альтернативных условий является благоприятным. Для исключения наличия других патологий головного мозга или подтипов деменции может использоваться расширенная визуализация с помощью компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ), а также однофотонной эмиссионной компьютерной томографии (ОФЭКТ) или позитронно-эмиссионной томографии (ПЭТ). Более того, это позволяет предсказать переход от продромальных стадий (легкое когнитивное нарушение) к болезни Альцгеймера. Оценка интеллектуального функционирования, включая оценку памяти, позволяет дополнительно охарактеризовать состояние заболевания. Медицинские организации создали диагностические критерии, облегчающие практикующим врачам стандартизовать диагностический процесс. Диагноз может быть подтвержден с очень высокой точностью посмертно, когда доступен материал мозга, который может быть подвергнут гистологическому анализу.
На сегодняшний день существуют только симптоматические методы лечения этого заболевания, основанные на попытке восстановить баланс нейромедиаторов. В настоящее время доступны три ингибитора холинэстеразы, одобренные для лечения AD от легкой до умеренной степени. Другим терапевтическим вариантом, доступным для лечения умеренной и тяжелой AD, является мемантин, неконкурентный антагонист N-метил-D-аспартатного рецептора. Методы лечения, способные остановить или по меньшей мере эффективно изменить течение болезни Альцгеймера, именуемые «модифицирующими болезнь» лекарственными средствами, все еще находятся на стадии расширенных исследований.
Имеется высокая потребность в новых способах лечения больных пациентов, а также профилактики, отсрочки, замедления прогрессирования или облегчения симптомов AD. Подсчитано, что общая частота заболевания может быть снижена почти на 50% при возможности отсрочки начала заболевания на 5 лет. Симптоматическое лечение основано на лекарственных средствах, направленных на улучшение когнитивных функций или контроля психоневрологических симптомов, и обычно они действуют через нейротрансмиттерные механизмы; модифицирующая заболевание терапия или способы лечения (DMT) основаны на агентах, которые предотвращают, задерживают или замедляют прогрессирование заболевания и нацелены на основные патофизиологические механизмы AD. В настоящее время в конвейере разработки лекарственных средств для лечения AD находятся более 100 препаратов (Cummings et al. 2017. Alzheimer’s & Dementia: Translational Research & Clinical Interventions 3:367-384).
Деменция с тельцами Леви (DLB) представляет собой тип деменции, которая со временем ухудшается. Дополнительные симптомы могут включать колебания внимания, зрительные галлюцинации, замедление движений, проблемы при ходьбе и ригидность. DLB является наиболее распространенной причиной деменции после болезни Альцгеймера и сосудистой деменции. Она обычно проявляется после 50 лет. Страдает примерно 0,1% населения, старше 65 лет. Похоже, что мужчины болеют чаще, чем женщины. Основной механизм включает образование телец Леви в нейронах, состоящих из белка, альфа-синуклеина. Подозрение на диагноз может быть основано на симптомах, при этом следует сделать анализ крови и медицинскую визуализацию для исключения других возможных причин. В настоящее время не существует лекарства от DLB. Лечение является поддерживающим для облегчения некоторых моторных и психологических симптомов, ассоциированных с заболеванием. Могут быть полезны некоторую ингибиторы ацетилхолинэстеразы, такие как донепезил. Некоторые двигательные проблемы можно уменьшить с помощью леводопы. Для обзора см. McKeith et al. 2017. Neurology 89:88-100.
Сосудистая деменция (VaD), также известная как мультиинфарктная деменция (MID), и сосудистые когнитивные нарушения (VCI) относятся к деменции, вызванной проблемами, связанными с кровоснабжением головного мозга, обычно после серии небольших инсультов, приводящих к усилению снижения когнитивных способностей. Термин относится к синдрому, состоящему из сложного взаимодействия цереброваскулярного заболевания и факторов риска, что приводит к изменениям в структурах мозга результате инсультов и поражений и, как следствие, к изменениям когнитивной функции. Для постановки диагноза необходимо наличие временной связи между инсультом и дефицитом когнитивных функций. Различные синдромы деменции могут быть трудно различимыми из-за часто совпадающих клинических признаков и родственной патологии, лежащей в основе заболеваний. В частности, деменция при болезни Альцгеймера часто сочетается с сосудистой деменцией. Люди с сосудистой деменцией имеют прогрессирующее когнитивное нарушение, острое или подострое, как и легкое когнитивное нарушение, часто развивающееся постепенно, после нескольких цереброваскулярных событий (инсультов). Для обзора см. Venkat et al. 2015. Exp Neurol 272:97-108.
Лобно-височная деменция (FTD) относится к клиническим проявлениям лобно-височной долевой дегенерации, которая характеризуется прогрессирующей потерей нейронов, затрагивающей преимущественно лобные или височные доли, и типичной потерей более 70% нейронов веретена, тогда как другие типы нейронов остаются незатронутыми. 20% FTD приходится на случаи деменции, проявляющиеся в молодом возрасте. Признаки и симптомы обычно проявляются в более позднем возрасте, чаще в возрасте от 55 до 65 лет, примерно одинаково затрагивая мужчин и женщин. К общим признакам и симптомам относятся значительные изменения в социальном и личностном поведении, апатия, притупление эмоций и дефицит экспрессивной и рецептивной речи. В настоящее время отсутствует какой-либо способ лечения FTD, но есть способы лечения, которые позволяющие облегчить симптомы. Для обзора см. Bott et al. 2014. Neurodegener Dis Manag 4(6):439-454.
Пептид адреномедуллин (ADM) был впервые описан Kitamura et al. (Kitamura et al. 1993. Biochemical and Biophysical Research Communications 192(2):553-560) как новый гипотензивный пептид, содержащий 52 аминокислоты, который был выделен из клеточной линии феохромоцитомы человека. В том же году также были описаны кДНК, кодирующая пептид-предшественник, содержащий 185 аминокислот, и полная аминокислотная последовательность этого пептида-предшественника. Пептид-предшественник, который содержит, помимо прочего, сигнальную последовательность из 21 аминокислоты на N-конце, называют «пре-проадреномедуллином» (pre-proADM). Pre-proADM содержит 185 минокислот (SEQ ID No. 1). Зрелый ADM-NH2 приведен в SEQ ID No. 4, а ADM-Gly приведен в SEQ No. 5.
Зрелый пептид адреномедуллина представляет собой амидированный пептид (ADM-NH2), который содержит 52 аминокислоты (SEQ ID No: 4) и который содержит аминокислоты 95-146 pre-proADM, из которых он образуется в результате протеолитического расщепления. К настоящему времени, по существу, охарактеризованы лишь несколько пептидных фрагментов, образованных при расщеплении pre-proADM, в частности, физиологически активные пептиды адреномедуллина (ADM) и «PAMP», пептид, содержащий 20 аминокислот (22-41) (SEQ ID No. 2), который следует за 21 аминокислотой сигнального пептида в pre-proADM. Кроме того, обнаружены физиологически активные субфрагменты ADM и PAMP, которые исследованы более подробно. Открытие и изучение характеристик ADM в 1993 году вызвали интенсивную исследовательскую деятельность с потоком публикаций, результаты которых были недавно обобщены в различных обзорных статьях; в контексте настоящего описания, в частности, приведена ссылка на статьи Takahashi 2001. Peptides 22:1691; Eto et al. 2001. Peptides 22:1693-1711 and Hinson et al. 2000 Endocrine Reviews 21(2):138-167.
В научных исследованиях, проведенных к настоящему времени, помимо прочего, было обнаружено, что ADM можно рассматривать как полифункциональный регуляторный пептид. Он высвобождается в кровоток в неактивной форме, содержащей глицин (Kitamura et al. 1998. Biochem. Biophys. Res. Commun. 244(2):551-555). Также имеется связывающий белок (Pio et al. 2001. Journal of Biological Chemistry 276(15):12292-12300), который является специфическим по отношению к ADM и, вероятно, также модулирует его действие.
Физиологические эффекты ADM, а также PAMP, которым уделялось большое внимание в проводимых до настоящего времени исследованиях, являются эффектами, оказывающими влияние на кровяное давление. Таким образом, ADM является эффективным вазодилататором.
Кроме того, было обнаружено, что вышеупомянутый физиологически активный пептид PAMP, который образуется из pre-proADM, также проявляет гипотензивный эффект, несмотря на то, что его механизм действия, по-видимому, отличается от механизма действия ADM (Eto et al. 2001. Peptides 22:1693-1711; Hinson et al. 2000 Endocrine Reviews 21(2):138-167; Kuwasako et al. 1997. FEBS Lett 414(1):105-110; Kuwasaki et al. 1999. Ann. Clin. Biochem. 36:622-628; Tsuruda et al. 2001. Life Sci. 69(2):239-245; Kangawa et al. EP 0622458).
Кроме того, было обнаружено, что концентрации ADM, которые можно измерить в кровотоке и других биологических жидкостях, в ряде патологических состояний значительно превышают концентрации, характерные для здоровых контрольных субъектов. Таким образом, уровень ADM у пациентов с застойной сердечной недостаточностью, инфарктом миокарда, заболеваниями почек, гипертоническими расстройствами, сахарным диабетом, пациентов в острой фазе шока и при сепсисе и септическом шоке значительно повышен, хотя и в разной степени. В случае некоторых из указанных патологических состояний концентрации PAMP также увеличиваются, однако уровни в плазме ниже по сравнению с таковыми для ADM (Eto 2001. Peptides 22:1693-1711).
Также известно, что необычно высокие концентрации ADM наблюдаются при сепсисе или септическом шоке (Eto et al. 2001. Peptides 22:1693-1711; Hirata et al. 1996. Journal of Clinical Endocrinology and Metabolism 81(4):1449-1453; Ehlenz et al.1997. Exp Clin Endocrinol Diabetes 105:156-162; Tomoda et al. 2001. Peptides 22:1783-1794; Ueda et al. 1999 Am. J. Respir. Crit. Care Med.160:132-136; Wang et al. 2001. Peptides 22:1835-1840). Полученные данные связаны с типичными изменениями гемодинамики, которые известны как явления, типично наблюдаемые у пациентов с сепсисом и другими тяжелыми синдромами, такими как, например, SIRS. Адреномедуллин играет ключевую роль в развитии сепсиса (Wang, Shock 1998, 10(5):383-384; Wang et al. 1998. Archives of surgery 133(12):1298-1304) и многочисленных острых и хронических заболеваний (Parlapiano et al. 1999. European Review for Medical and Pharmacological Sciences 3:53-61; Hinson et al. 2000 Endocrine Reviews 21(2):138-167).
Описано несколько методов измерения уровней ADM в кровотоке: путем определения непосредственно ADM, либо опосредованно путем определения более стабильного фрагмента родственного ему пептида-предшественника. Недавно был опубликован метод, описывающий анализ измерения циркулирующего зрелого ADM (Weber et al. 2017. Journal of applied Labaratory Medicine, 2(2):222-233).
Описаны и другие способы количественного определения фрагментов, полученных из предшественника ADM, например, измерение MR-proADM (Morgenthaler et al. 2005. Clin Chem 51(10):1823-9), PAMP (Washimine et al. 1994. Biochem Biophys Res Commun 202 (2):1081-7) и CT-proADM (EP 2111552). Измерение MR-proADM в плазме можно выполнить с помощью коммерчески доступного гомогенного флюороиммуноанализ с временным разрешением в полностью автоматизированной системе (BRAHMS MR-proADM KRYPTOR; BRAHMS GmbH, Hennigsdorf, Germany) (Caruhel et al. 2009. Clin Biochem 42(7-8):725-8). Поскольку эти пептиды образуются в стехиометрическом отношении из одного и того же предшественника, их уровни в плазме коррелируют до определенной степени.
Роль MR-proADM в деменции и AD изучалась в нескольких исследованиях. Уровни MR-proADM в плазме, измеренные у пациентов с вероятной AD, были повышены по сравнению с пожилыми здоровыми контролями с нормальными когнитивными способностями (Buerger et al. 2009. Biological Psychiatry 2009; 65:979-984). Классификация по концентрации только одного MR-proADM в крови оказалась точной с чувствительностью 47% и специфичностью 81%, а при соотношении MR-proADM с другим биомаркером, CT-proET-1, чувствительность обнаружения AD составила 66% при специфичности 81%. Кроме того, концентрации MR-proADM в плазме имеют прогностическое значение в отношении прогрессирования от предшествующих деменции MCI до клинической AD (Buerger et al. 2010. J Clin Psychiatry 72 (4):556-563). MR-proADM также измеряли в популяционной когорте из более чем 5000 человек без преобладания деменции, и было показано, что его уровень является повышенным у участников, у которых впоследствии развилась деменция, но указывал на отсутствие повышенного фактора риска при этом после поправки на традиционные факторы риска (Holm et al. 2017. Journal of Internal Medicine 282:94-101). У пациентов, участвовавших в продольном исследовании артериосклероза, уровни MR-proADM значительно повышались по мере прогрессирования степени поражения глубокого белого вещества головного мозга (DWML) (Kuriyama et al. 2017. Journal of Alzheimer's Disease 56:1253-1262). Кроме того, значимая обратная корреляция наблюдалась между уровнями MR-proADM и результатами тестов на когнитивные способности.
Было показано, что уровень адреномедуллина повышается в лобной коре у пациентов с AD по сравнению с группой контроля соответствующего возраста (Ferrero et al. 2017. Mol Neurobiol. Doi: 10.1007/s12035-017-0700-6, E-Pub электронная публикация до выхода в печать). Однако ничего не известно об уровнях ADM в плазме у пациентов, страдающих деменцией, особенно с болезнью Альцгеймера.
Модель субкортикальной сосудистой деменции воспроизводили на мышах путем двустороннего размещения микроспиралей на общих сонных артериях. Используя мышей с увеличенным уровнем экспрессии циркулирующего ADM, оценивали влияние ADM на церебральную перфузию, церебральную ангиоархитектуру, окислительный стресс, изменение белого вещества, когнитивную функцию и уровни цАМФ в мозге, фактор роста эндотелия сосудов и основной фактор роста фибробластов. Эти данные показали, что ADM способствует артериогенезу и ангиогенезу, подавляет окислительный стресс, сохраняет целостность белого вещества и предотвращает снижение когнитивных функций после хронической гипоперфузии головного мозга. Таким образом, ADM может служить в качестве агента для борьбы с подкорковой сосудистой деменцией. (Maki et al. 2011. Stroke 42:1122-1128).
Удивительным открытием настоящего изобретения является то, что уровни зрелого ADM значительно снижены у здоровых пациентов, у которых впоследствии развивается деменция, в частности AD. Кроме того, неожиданно было обнаружено, что уровни зрелого ADM значительно снижены, если субъект страдает деменцией, в частности деменцией при болезни Альцгеймера. Из примеров видно, что базовые уровни адреномедуллина, в частности ADM-NH2 согласно SEQ ID No. 4, независимо позволяют предсказывать наличие деменции, в частности деменции при болезни Альцгеймера.
Кроме того, неожиданно было обнаружено, что у субъекта диагностируют деменцию, в частности AD, если отношение маркеров ADM-NH2/про-адреномедуллин или его фрагмент ниже определенного отношения уровней маркеров. Кроме того, неожиданно было обнаружено, что субъект имеет повышенный риск развития деменции, если отношение уровней маркеров ADM-NH2/про-адреномедуллин или его фрагмент ниже определенного порогового значения уровней маркеров. Кроме того, неожиданно было обнаружено, что статус субъекта, страдающего деменцией, в частности AD, или подверженного риску развития деменции, в частности AD, улучшается при терапии или вмешательстве, если указанное отношение уровней маркеров увеличивается во время курса терапии или вмешательства, причем вмешательство может быть продолжено, если указанный уровень отношения маркеров поднимается выше указанного порогового отношения.
Альтернативно, уровень зрелого ADM-NH2 согласно SEQ ID No. 4, определенный в образце физиологической жидкости указанного субъекта, и уровень про-адреномедуллина или его фрагмента (который не является зрелым ADM-NH2 согласно SEQ ID No. 4), определенный в образце физиологической жидкости указанного субъекта, объединяют в математической формуле или алгоритме, причем результат указанной формулы или алгоритма используют для диагностики деменции или определения риска развития деменции у субъекта, не страдающего деменцией, или мониторинга терапии или мониторинга или управления вмешательством у субъекта, страдающего деменцией, или мониторинга профилактической терапии или мониторинга или управления профилактическим вмешательством у субъекта с риском развития деменции.
Таким образом, неожиданным открытием изобретения является то, что уровень зрелого ADM (зрелого ADM-NH2 согласно SEQ ID No. 4) в кровотоке снижается у субъекта, страдающего деменцией или имеющего риск развития деменции. Помимо этого, уровень про-адреномедуллина или его фрагмента (который не является зрелым ADM-NH2 согласно SEQ ID No. 4) в кровотоке повышен у субъекта, страдающего деменцией или имеющего риск развития деменции. Известно, что зрелый ADM (зрелый ADM-NH2 согласно SEQ ID No. 4) является гормоном, отвечающим за целостность сосудов и функцию эндотелия сосудов. Также известно, что дисфункция эндотелия сосудов связана с широким спектром самых страшных заболеваний человека, таких как заболевания периферических сосудов, инсульт, болезни сердца, диабет, хроническая почечная недостаточность, а также развитие метастазов и деменция (Rajendran et al. 2013. Int. J. Biol. Sci. 9 (19:1057-1069).
Высокие уровни про-адреномедуллина или его фрагмента (который не является зрелым ADM-NH2 согласно SEQ ID No. 4) в кровотоке, по-видимому, является показателем того, что организм нуждается в восстановлении функции эндотелия сосудов и поддержании целостности сосудов. Тем не менее, низкие уровни зрелого ADM (зрелого ADM-NH2 согласно SEQ ID No. 4) указывают на то, что, несмотря на высокие уровни pro-ADM, по-видимому превращение ADM-Gly в зрелый ADM (зрелый ADM-NH2 соответственно SEQ ID No. 4) нарушено.
Известно, что концентрации MR-proADM в кровотоке повышены у пациентов с болезнью Альцгеймера, пациентов с MCI или субъектов, у которых может развиться AD, (Buerger et al. 2009. Biological Psychiatry 2009; 65:979-984; Buerger et al. 2010. J Clin Psychiatry 72(4):556-563; Holm et al. 2017. Journal of Internal Medicine 282:94-101). Это свидетельствует об активации пути синтеза ADM. Однако нет никаких сведений о концентрации биологически активного ADM. В настоящем изобретении продемонстрировано, что концентрация активного ADM (bio-ADM) в кровотоке на удивление ниже у пациентов с AD и пациентов с риском развития AD (пример 6). Более того, появляется все больше доказательств того, что нарушение микроциркуляции в головном мозге является фактором, участвующим в патофизиологии болезни Альцгеймера (Iadecola 2013. The pathobiology of vascular dementia. Neuron 2013;80(4):844-866). Результаты гистологической оценки и исследований образцов альбумина показывают, что повышенная проницаемость гематоэнцефалического барьера (BBB), вероятно, является ключевым механизмом (Benarroch 2007. Neurovascular unit dysfunction: a vascular component of Alzheimer disease? Neurology 68(20):1730-1732). В недавних исследованиях было продемонстрировано, что глобальная «утечка» BBB у пациентов с ранним AD ассоциирована со снижением когнитивных способностей (Nation et al. 2019. Nature Medicine https://doi.org/10.1038/s41591-018-0297-y; van de Haar et al. 2016 Radiology 281(2):527-535). Было показано, что N-концевые анти-ADM антитела стабилизируют адреномедуллин и приводят к увеличению активного ADM в кровотоке (Geven et al. 2018. Effects of humanized anti-adrenomedullin antibody Adrecizumab (HAM8101) on vascular barrier function and survival in rodent models of systemic inflammation and sepsis. Shock 50(6):648-654; Geven et al. 2018. Vascular effects of adrenomedullin and the anti-adrenomedullin antibody Adrecizumab in sepsis. Shock 50(2):132-140). Эффект индуцирования быстрого увеличения bio-ADM в крови здоровых пациентов показан в примере 7 и на фиг.8. Увеличение ADM в кровотоке приводит к благоприятному воздействию на эндотелиальные клетки, например, уменьшение капиллярной утечки. Например, на экспериментальных моделях системного воспаления и сепсиса было показано, что N-концевое анти-ADM антитело (HAM8101, Адрецизумаб) усиливает барьерную функцию эндотелия (Geven et al. 2018. Effects of humanized anti-adrenomedullin antibody Adrecizumab (HAM8101) on vascular barrier function and survival in rodent models of systemic inflammation and sepsis. Shock 50(6):648-654). Следовательно, N-концевое ADM-связующее вещество, более конкретно N-концевое анти-ADM антитело, может быть применено для увеличения концентрации bio-ADM в крови пациентов, страдающих деменцией или имеющих риск развития деменции, особенно у пациентов, страдающих деменцией при болезни Альцгеймера.
Таким образом, в целом низкие уровни ADM в кровотоке, в частности биологически активного ADM, у пациента, организм которого нуждается в восстановлении функции эндотелия сосудов и поддержании целостности сосудов, могут указывать на нарушение процессинга ADM у указанного пациента. Пациент, организм которого нуждается в восстановлении функции сосудистого эндотелия и поддержании целостности сосудов, может быть охарактеризован и идентифицирован путем определения уровня зрелого ADM-NH2 согласно SEQ ID No. 4 в образце физиологической жидкости субъекта, причем указанный уровень зрелого ADM-NH2 сравнивают с пороговым уровнем, как указано в способах по настоящему изобретению, или путем определения отношения маркеров, которое может представлять собой отношение уровня зрелого ADM-NH2 согласно SEQ ID No. 4, определенного в образце физиологической жидкости указанного субъекта, к уровню про-адреномедуллина или его фрагмента (который не является зрелым ADM-NH2 согласно SEQ ID No. 4), определенному в образце физиологической жидкости указанного субъекта, и причем указанное отношение маркеров сравнивают с пороговым отношением, как указано в способах по настоящему изобретению.
Дополнительно или альтернативно, пациент, организм которого нуждается в восстановлении функции сосудистого эндотелия и поддержании целостности сосудов, может быть пациентом с глобальной утечкой BBB или нарушением целостности BBB. Глобальная утечка BBB или нарушение целостности BBB могут быть определены следующим образом: путем измерения отношения спинномозговая жидкость (CSF)/сывороточный альбумин или иммуноглобулин G (IgG) (Akaishi et al. 2015. Neurology and Clinical Neuroscience 3:94-100) или методами визуализации, например магнитно-резонансной томографией в режиме динамической восприимчивости контраста (DSC-MRI) или динамической контраст-усиленной МРТ (DCE-MRI) (Raja et al. 2018. Neuropharmacology 134: 259-271).
Таким образом, стратификация и идентификация пациентов, нуждающихся в повышении уровней bio-ADM для предотвращения или предупреждения прогрессирования когнитивной дисфункции у человека или для профилактики или лечения деменции, осуществляется любым из описанных выше способов.
Было показано, что при введении N-концевого анти-ADM антитела происходит быстрое увеличение bio-ADM в крови здоровых пациентов, как показано в примере 7 и на фиг. 8, что может помочь восстановить «протекающий» или поврежденный гематоэнцефалический барьер. Поэтому имеется вероятность того, что введение N-концевого анти-ADM антитела окажется полезным в профилактике и лечении деменции у субъекта, идентифицированного и/или стратифицированного, как описано выше.
Следовательно, еще одна цель заключается в предоставлении терапии субъектам с пониженными уровнями зрелого ADM (зрелого ADM-NH2 согласно SEQ ID No. 4) и/или с пониженным отношением уровня зрелого ADM-NH2 согласно SEQ. ID No. 4, определенного в образце физиологической жидкости указанного субъекта, к уровню про-адреномедуллина или его фрагмента (который не является зрелым ADM-NH2 согласно SEQ ID No. 4), определенному в образце физиологической жидкости организма. Указанную группу пациентов можно лечить антителом к адреномедуллину (ADM) или фрагментом антитела к адреномедуллину или анти-ADM не-Ig каркасом для использования в профилактике и терапии деменции у субъекта, причем указанное анти-ADM антитело или фрагмент анти-ADM антитела или анти-ADM не-Ig каркас связывается с N-концевой частью (аа 1-21) адреномедуллина:
YRQSMNNFQGLRSFGCRFGTC (SEQ ID No. 21).
В другом варианте осуществления настоящего изобретения указанный субъект, подлежащий лечению, имеет дополнительно к вышеупомянутым критериям признаки умеренных когнитивных нарушений или признаки деменции.
Известно, что введение антитела к адреномедуллину (ADM) или фрагмента антитела к адреномедуллину или анти-ADM не-Ig каркаса субъекту повышает концентрацию зрелого ADM (зрелого ADM-NH2 согласно SEQ ID No. 4) в кровотоке субъекта и, таким образом, улучшает статус субъектов, страдающих деменцией или имеющих риск развития деменции.
Объектом настоящего изобретения является способ:
а) диагностики деменции, или
b) определения риска развития деменции у субъекта, не страдающего деменцией, или
c) мониторинга терапии или мониторинга или управления вмешательством у субъекта, страдающего деменцией, или
d) мониторинга терапии или мониторинга или управления профилактическим вмешательством у субъекта с риском развития деменции,
в котором определяют уровень зрелого ADM-NH2 согласно SEQ ID No. 4 в образце физиологической жидкости субъекта, и в котором сравнивают указанный уровень зрелого ADM-NH2 с пороговым уровнем,
причем
а) у указанного субъекта диагностируют деменцию, если уровень зрелого ADM-NH2 согласно SEQ ID No. 4 ниже указанного порогового уровня, или причем
b) указанный субъект имеет повышенный риск развития деменции, если указанный уровень зрелого ADM-NH2 согласно SEQ ID No. 4 ниже указанного порогового уровня, или причем
c) статус субъекта, страдающего деменцией или имеющего риск развития деменции, улучшается при терапии или вмешательстве, если указанный уровень зрелого ADM-NH2 согласно SEQ ID No. 4 увеличивается в ходе терапии или вмешательства, и/или причем вмешательство может быть продолжено, если указанный уровень зрелого ADM-NH2 согласно SEQ ID No. 4 увеличивается выше указанного порогового уровня.
В одном из вариантов осуществления объектом настоящего изобретения является способ:
а) диагностики деменции, или
b) определения риска развития деменции у субъекта, не страдающего деменцией, или
c) мониторинга терапии или мониторинга или управления вмешательством у субъекта, страдающего деменцией, или
d) мониторинга профилактической терапии или мониторинга или управления профилактическим вмешательством у субъекта с риском развития деменции,
в котором определяют отношение маркеров, которое может представлять собой отношение уровня зрелого ADM-NH2 согласно SEQ ID No. 4, определенного в образце физиологической жидкости указанного субъекта, к уровню про-адреномедуллина или его фрагмента (который является незрелым ADM-NH2 согласно SEQ ID No. 4), определенному в образце физиологической жидкости указанного субъекта, и в котором сравнивают указанное отношение маркеров с пороговым отношением,
причем
а) у указанного субъекта диагностируют деменцию, если отношение маркеров ADM-NH2/про-адреномедуллин или его фрагмент ниже указанного порогового значения, или причем
b) указанный субъект имеет повышенный риск развития деменции, если отношение маркеров ADM-NH2/про-адреномедуллин или его фрагмент ниже указанного порогового отношения, или причем
c) статус субъекта, страдающего деменцией или имеющего риск развития деменции, улучшается при терапии или вмешательстве, если указанное отношение маркеров увеличивается в ходе терапии или вмешательства, и причем вмешательство может быть продолжено, если указанный уровень отношения маркеров увеличивается выше указанного порогового отношения.
Альтернативно, уровень зрелого ADM-NH2 согласно SEQ ID No. 4, определенный в образце физиологической жидкости указанного субъекта, и уровень про-адреномедуллина или его фрагмента (который не является зрелым ADM-NH2 согласно SEQ ID No. 4), определенный в образце физиологической жидкости указанного субъекта, может быть объединен в математической формуле или алгоритме, причем результат указанной формулы или алгоритма используют для диагностики деменции или определения риска развития деменции у субъекта, не страдающего деменцией, или мониторинга терапии или мониторинга или управления вмешательством у субъекта, страдающего деменцией, или мониторинга профилактической терапии или мониторинга или управления профилактическим вмешательством у субъекта с риском развития деменции.
В любом случае в одном из вариантов осуществления изобретения определяют уровень обоих маркеров: уровень зрелого ADM-NH2 согласно SEQ ID No. 4, определенный в образце физиологической жидкости указанного субъекта, и уровень про-адреномедуллина или его фрагмента (который не является зрелым ADM-NH2 согласно SEQ ID No. 4), определенный в образце физиологической жидкости указанного субъекта. Оба уровня маркеров используют для проведения расчетов, которые могут представлять собой либо отношение обоих маркеров (например, отношение между зрелым ADM-NH2 и pro-ADM или его фрагментом, либо отношение между proADM или его фрагментом и зрелым ADM-NH2), либо математическую формулу, в которой используют оба маркера, или математический алгоритм, в котором используют оба маркера. Результатом такого отношения или математической формулы или математического алгоритма может быть значение, которое затем сравнивают с заданным пороговым значением, и это сравнение затем используют для диагностики деменции или определения риска развития деменции у субъекта, не страдающего деменцией, или мониторинга терапии или мониторинга или управления вмешательством у субъекта, страдающего деменцией, или мониторинга профилактической терапии или мониторинга или управления профилактическим вмешательством у субъекта с риском развития деменции.
В одном из вариантов осуществления объекта настоящего изобретения указанный фрагмент про-адреномедуллина выбирают из группы, содержащей PAMP (SEQ ID No. 2), MR-proADM (SEQ ID No. 3), ADM-Gly (SEQ ID No. 5) и CT-proADM (SEQ ID No. 6).
В одном из вариантов осуществления объекта настоящего изобретения пороговый уровень зрелого ADM-NH2 согласно SEQ ID No. 4 равен или ниже 15 пг/мл, предпочтительно равен или ниже 10 пг/мл, предпочтительно равен или ниже 5 пг/мл.
В одном из вариантов осуществления объекта настоящего изобретения пороговое отношение уровней маркеров находится в диапазоне от 0,2 до 0,75, предпочтительно от 0,3 до 0,6, предпочтительно от 0,4 до 0,5.
Для вычисления отношения концентрации двух маркеров предпочтительно должны быть выражены в одних и тех же единицах (например, пмоль/л).
В одном из вариантов осуществления объекта настоящего изобретения образец физиологической жидкости выбирают из группы пациентов с легкими когнитивными нарушениями (MCI), болезнью Альцгеймера, сосудистой деменцией, болезнью Альцгеймера, смешанной с сосудистой деменцией, деменцией с тельцами Леви, лобно-височной деменцией, очаговыми типами деменции (такими как прогрессирующая афазия), подкорковой деменцией (такой как деменция при болезни Паркинсона) и вторичными причинами синдрома деменции (такими как внутричерепные поражения).
В одном из вариантов осуществления объекта настоящего изобретения образец физиологической жидкости берут у субъекта, у которого до момента взятия образца никогда не была диагностирована деменция или MCI.
В одном из вариантов осуществления объекта настоящего изобретения определяют по меньшей мере один дополнительный клинический параметр, выбранный из группы, содержащей возраст, расу, результаты тестирования психического статуса (например, по краткой шкале оценки психического статуса (MMSE)), нейровизуализацию (CT, MRT, PET, SPECT), семейный анамнез, генотип ApoE4, β-амилоид 1-42 (Aβ1-42), β-амилоид 1-40 (Aβ1-40), общий Tau-белок, фосфорилированный Tau-белок (p-Tau 181, p-Tau 199, p-Tau 231).
В одном из вариантов осуществления объекта настоящего изобретения уровень указанного маркера определяют с помощью иммуноанализа.
В одном из вариантов осуществления объекта настоящего изобретения указанный способ используют для стратификации пациентов для выбора пациента для лечения антителом к адреномедуллину (ADM) или фрагментом антитела к адреномедуллину или анти-ADM не-Ig каркасом для примения в профилактике и терапии деменции у субъекта, причем указанное анти-ADM антитело или фрагмент анти-ADM антитела или анти-ADM не-Ig каркас связывается с N-концевой частью (aa 1-21) адреномедуллина:
YRQSMNNFQGLRSFGCRFGTC (SEQ ID No. 21).
Объектом настоящего изобретения является антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта, причем указанное анти-ADM антитело или фрагмент анти-ADM антитела или анти-ADM не-Ig каркас связывается с N-концевой частью (аа 1-21) адреномедуллина:
YRQSMNNFQGLRSFGCRFGTC (SEQ ID No. 21).
Объектом настоящего изобретения является антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта, причем указанный субъект имеет уровень зрелого ADM-NH2 согласно SEQ ID No. 4, определенный в образце физиологической жидкости указанного субъекта, ниже порогового уровня и/или имеет отношение маркеров, которое представляет собой отношение уровня зрелого ADM-NH2 согласно SEQ ID No. 4, определенного в образце физиологической жидкости указанного субъекта, к уровню про-адреномедуллина или его фрагмента, определенному в образце физиологической жидкости указанного субъекта, и причем указанное отношение уровней маркеров ниже порогового отношения.
Объектом настоящего изобретения является антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта, причем указанный фрагмент про-адреномедуллина выбирают из группы, содержащей PAMP (SEQ ID No. 2), MR-proADM (SEQ ID No. 3), ADM-Gly (SEQ ID No. 5) и CT-proADM (SEQ ID No. 6).
Объектом настоящего изобретения является антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта, причем указанного субъекта выбирают с помощью способа, описанного выше.
Объектом настоящего изобретения является антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину, или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта, причем пороговый уровень зрелого ADM-NH2 согласно SEQ ID No. 4 равен или ниже 15 пг/мл, предпочтительно равен или ниже 10 пг/мл, предпочтительно равен или ниже 5 пг/мл.
Объектом настоящего изобретения является антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта, причем отношение уровней маркеров находится в пределах от 0,2 до 0,75, предпочтительно от 0,3 до 0,6, предпочтительно от 0,4 до 0,5.
Объектом настоящего изобретения является антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта, причем указанного субъекта выбирают с помощью способа, описанного выше, при этом образец физиологической жидкости выбирают из группы: крови, сыворотки, плазмы, мочи, спинномозговой жидкости (CSF) и слюны.
Объектом настоящего изобретения является антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта, причем по меньшей мере один дополнительный клинический параметр выбирают из группы, содержащей возраст, расу, результаты тестирования психического статуса (например, по краткой шкале оценки психического статуса (MMSE)), нейровизуализацию (CT, MRT, PET, SPECT), семейный анамнез, генотип ApoE4, β-амилоид 1-42 (Aβ1-42), β-амилоид 1-40 (Aβ1-40), общий Tau-белок, фосфорилированный Tau-белок (p-Tau 181, p-Tau 199, p-Tau 231).
Объектом настоящего изобретения является антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину, или анти-ADM не-Ig каркас для применения для профилактики и лечения деменции у субъекта, причем уровень указанного маркера определяют с помощью иммуноанализа.
Зрелый ADM, bio-ADM и ADM-NH2 используются в настоящей заявке в качестве синонимов и представляют собой молекулу согласно SEQ ID No: 4.
Используемый в настоящем описании термин «PAMP» включает обе присутствующие в кровотоке формы PAMP, а именно биологически неактивный PAMP, удлиненный C-терминальным глицином (PAMP-Gly), и биологически активный C-терминально амидированный PAMP (PAMP-амид).
В конкретном варианте осуществления изобретения указанные proADM и/или его фрагменты, имеющие по меньшей мере 5 аминокислот и зрелый ADM, выбирают из группы, содержащей:
SEQ ID No. 1 (пре-проадреномедуллин (pre-proADM)): аминокислоты 1-185
MKLVSVALMYLGSLAFLGADTARLDVASEFRKKWNKWALSRGKRELRMSSSYPTGLADVKAGPAQTLIRPQDMKGASRSPEDSSPDAARIRVKRYRQSMNNFQGLRSFGCRFGTCTVQKLAHQIYQFTDKDKDNVAPRSKISPQGYGRRRRRSLPEAGPGRTLVSSKPQAHGAPAPPSGSAPHFL
SEQ ID No. 2 (N-20 терминальный пептид проадреномедуллина, PAMP): минокислоты 22-41 preproADM
ARLDVASEF RKKWNKWALS R
SEQ ID No. 3 (срединный проадреномедуллин, MR-proADM): минокислоты 45-92 preproADM
ELRMSS SYPTGLADVK AGPAQTLIRP QDMKGASRSP EDSSPDAARI RV
SEQ ID No. 4 (зрелый адреномедуллин (зрелый ADM); амидированный ADM; bio-ADM; hADM): аминокислоты 95-146-CONH2
YRQSMN NFQGLRSFGC RFGTCTVQKL AHQIYQFTDK DKDNVAPRSK ISPQGY - CONH2
SEQ ID No. 5 (адреномедуллин 1-52-Gly (ADM 1-52-Gly)): аминокислоты 95-147 preproADM
YRQSMN NFQGLRSFGC RFGTCTVQKL AHQIYQFTDK DKDNVAPRSK ISPQGYG
SEQ ID No. 6 (C-терминальный проадреномедуллин, CT-proADM): аминокислоты 148-185 preproADM
RRR RRSLPEAGPG RTLVSSKPQA HGAPAPPSGS APHFL
В конкретном варианте осуществления изобретения уровень зрелого ADM-NH2 (SEQ ID No. 4) - иммунореактивность в физиологической жидкости указанного субъекта находится ниже порогового значения.
В конкретном варианте осуществления изобретения уровень иммунореактивности PAMP (SEQ ID No. 2) или уровень иммунореактивности MR-proADM (SEQ ID No. 3), или уровень иммунореактивности CT-proADM (SEQ ID No. 6), или уровень иммунореактивности ADM 1-52-Gly (SEQ ID No. 5) в физиологической жидкости указанного субъекта превышает пороговое значение.
В конкретном варианте осуществления изобретения отношение уровня иммунореактивности зрелого ADM-NH2 (SEQ ID No. 4) к уровню иммунореактивности MR-proADM (SEQ ID No. 3) в физиологической жидкости указанного субъекта ниже порогового значения.
В конкретном варианте осуществления изобретения уровень зрелого ADM-NH2 определяют с помощью по меньшей мере одного связующего агента, выбранного из группы: связующего агента, который связывается с областью, содержащейся в последовательности зрелого ADM-NH2 (SEQ ID No. 4), и второго связующего агента, который связывается с областью, содержащейся в последовательности зрелого ADM-NH2 (SEQ ID NO. 4).
В конкретном варианте осуществления изобретения уровень proADM и/или его фрагментов определяют с помощью по меньшей мере одного связующего агента, выбранного из группы: связующего агента, который связывается с областью, содержащейся в последовательности MR-proADM (SEQ ID No. 3), и второго связующего агента, который связывается с областью, содержащейся в последовательности MR-proADM (SEQ ID No. 3).
В конкретном варианте осуществления изобретения уровень pro-ADM и/или его фрагментов определяют с помощью по меньшей мере одного связующего агента, выбранного из группы: связующего агента, который связывается с областью, содержащейся в последовательности CT-proADM (SEQ ID No. 6), и второго связующего агента, который связывается с областью, содержащейся в последовательности CT-pro-ADM (SEQ ID No. 6).
В конкретном варианте осуществления изобретения уровень pro-ADM и/или его фрагментов определяют с помощью по меньшей мере одного связующего агента, выбранного из группы: связующего агента, который связывается с областью, содержащейся в последовательности РАМР (SEQ ID No. 2), и второго связующего агента, который связывается с областью, содержащейся в последовательности РАМР (SEQ ID No. 2).
В конкретном варианте осуществления изобретения уровень pro-ADM и/или его фрагментов определяют с помощью по меньшей мере одного связующего агента, выбранного из группы: связующего агента, который связывается с областью, содержащейся в последовательности ADM 1-52-Gly (SEQ ID No. 5), и второго связующего агента, который связывается с областью, содержащейся в последовательности ADM 1-52-Gly (SEQ ID No. 5).
Объектом настоящего изобретения является способ по настоящему изобретению, в котором связующий агент выбирают из группы, содержащей антитело, фрагмент антитела или не-Ig каркас, связывающий про-адреномедуллин или его фрагменты из по меньшей мере 5 аминокислот.
Другой вариант осуществления настоящей заявки относится к способу согласно предшествующим вариантам осуществления, в котором указанная физиологическая жидкость может быть выбрана из группы, содержащей кровь, сыворотку, плазму, мочу, спинномозговую жидкость (CSF) и слюну. В более конкретном варианте осуществления настоящего изобретения указанная физиологическая жидкость представляет собой образец крови. Образец крови может быть выбран из группы, содержащей цельную кровь, сыворотку и плазму. В конкретном варианте осуществления изобретения указанный образец выбирают из группы, содержащей цитратную плазму человека, плазму с гепарином и плазму с EDTA.
Объектом настоящего изобретения является способ по настоящему изобретению, в котором указанное определение про-адреномедуллина или его фрагментов из по меньшей мере 5 аминокислот у одного пациента выполняют более одного раза.
Объектом настоящего изобретения является способ по настоящему изобретению, в котором указанный мониторинг выполняют для оценки реакции указанного субъекта на предпринятые профилактические и/или терапевтические меры.
Объектом настоящего изобретения является способ по настоящему изобретению, который используется для стратификации указанных субъектов на группы риска.
Используемый в настоящем изобретении термин «риск» относится к вероятности того, что субъект будет страдать от нежелательного события или эффекта (например, заболевания).
Другой вариант осуществления настоящей заявки относится к способу согласно предшествующим вариантам осуществления, в котором снижение уровня зрелого ADM-NH2 является прогностическим фактором повышенного риска развития деменции.
Другой вариант осуществления настоящей заявки относится к способу согласно предшествующим вариантам осуществления, в котором уменьшение отношения между зрелым ADM-NH2 и proADM или его фрагментами, выбранное из группы, содержащей MR-proADM, CT-proADM, ADM-Gly и/или PAMP, является прогностическим фактором повышенного риска развития деменции.
Объектом настоящего изобретения также является способ определения риска развития деменции, как определено в любом из предшествующих параграфов, причем указанный способ выполняют для стратификации указанных субъектов на группы риска, как дополнительно определено ниже. В конкретных вариантах осуществления изобретения способы используются для стратификации субъектов на группы риска, например субъектов с низким, средним или высоким риском развития деменции. Низкий риск развития деменции означает, что значение зрелого ADM-NH2 существенно не снижен по сравнению с заданным значением у здоровых субъектов, не страдающих деменцией. Средний риск существует, когда уровень зрелого ADM-NH2 снижен по сравнению с заданным значением у здоровых субъектов, не страдающих деменцией, и высокий риск существует, когда уровень зрелого ADM-NH2 значительно снижен при начальном измерении и продолжает снижаться в последующем анализе.
Риск развития деменции означает риск развития деменции в течение определенного периода времени. В конкретном варианте осуществления указанный период времени находится в пределах 10 лет или в пределах 7 лет, или в пределах 5 лет, или в пределах 2,5 лет.
Термин «повышенный уровень» означает уровень выше определенного порогового уровня.
Термин «пониженный уровень» означает уровень ниже определенного порогового уровня.
В конкретном варианте осуществления изобретения анализ используется для определения уровня зрелого ADM-NH2, причем чувствительность указанного анализа составляет <15 пг/мл, предпочтительно <10 пг/мл, более предпочтительно <5 пг/мл.
В конкретном варианте осуществления изобретения анализ используется для определения уровня MR-proADM, причем чувствительность указанного анализа позволяет осуществлять количественное определение MR-proADM у здоровых субъектов и составляет <0,5 нмоль/мл, предпочтительно <0,4 нмоль/мл и более предпочтительно <0,2 нмоль/мл.
В конкретном варианте осуществления изобретения анализ используется для определения уровня CT-proADM, причем чувствительность указанного анализа позволяет осуществлять количественное определение CT-proADM у здоровых субъектов и составляет <100 пмоль/мл, предпочтительно <75 пмоль/мл и более предпочтительно <50 пмоль/мл.
Другой вариант осуществления настоящей заявки относится к способу согласно предшествующим вариантам осуществления, в котором анализ используется для определения PAMP-амида, причем чувствительность указанного анализа позволяет осуществлять количественное определение PAMP-амида у здоровых субъектов и составляет <0,3 пмоль/л, предпочтительно <0,2 пмоль/л и более предпочтительно <0,1 пмоль/л.
Другой вариант осуществления настоящей заявки относится к способу согласно предшествующим вариантам осуществления, в котором анализ используется для определения PAMP-глицина, причем чувствительность указанного анализа позволяет осуществлять количественное определение PAMP-глицина у здоровых субъектов и составляет <0,5 пмоль/л, предпочтительно <0,25 пмоль/л и более предпочтительно <0,1 пмоль/л.
Другой вариант осуществления настоящей заявки относится к способу согласно предшествующим вариантам осуществления, в котором анализ используется для определения ADM-Gly, причем чувствительность указанного анализа позволяет осуществлять количественное определение ADM-Gly у здоровых субъектов и составляет 60 пмоль/л, предпочтительно 10 пмоль/л и более предпочтительно 2 пмоль/л.
В конкретном варианте осуществления изобретения указанный связующий агент имеет сродство связывания со зрелым ADM-NH2 или proADM и/или его фрагментами, равное по меньшей мере, 107 М-1, предпочтительно 108 М-1, предпочтительно сродство больше 109 М-1, наиболее предпочтительно больше 1010 М-1. Специалисту в данной области известно, что более низкое сродство можно компенсировать путем применения более высокой дозы соединений, и эта мера не приведет к выходу за рамки изобретения.
Для определения сродства антител к адреномедуллину определяли кинетику связывания адреномедуллина с иммобилизованным антителом методом поверхностного плазмонного резонанса, не включающего метку, с использованием системы Biacore 2000 (GE Healthcare Europe GmbH, Freiburg, Germany). Для осуществления обратимой иммобилизации антител применяли антитело к мышиному Fc, ковалентно связанное с высокой плотностью с сенсорным чипом CM5 согласно инструкциям производителя (набор мышиных антител для иммобилизации; GE Healthcare), (Lorenz et al. 2011. Antimicrob Agents Chemother. 55 (1):165-173).
В конкретном варианте осуществления изобретения указанный связующий агент выбирают из группы, содержащей антитело или фрагмент антитела или не-Ig каркас, связывающий зрелый ADM-NH2 или proADM и/или его фрагменты.
В конкретном варианте осуществления изобретения анализ используют для определения уровня зрелого ADM-NH2 и/или proADM или его фрагментов из по меньшей мере 5 аминокислот, причем такой анализ представляет собой сэндвич-анализ, предпочтительно полностью автоматизированный анализ.
В одном из вариантов осуществления изобретения это может быть так называемый POC-тест (в стационаре, «point-of-care»), который представляет собой технологию тестирования, позволяющую выполнять тестирование в течение менее 1 часа рядом с пациентом без необходимости использования системы полностью автоматизированного анализа. Одним из примеров этой технологии является технология иммунохроматографического анализа.
В одном из вариантов осуществления изобретения такой анализ представляет собой сэндвич-иммуноанализ с использованием любого метода обнаружения, включая, без ограничения, ферментную метку, хемилюминесцентную метку, электрохемилюминесцентную метку, который предпочтительно является полностью автоматизированным. В одном из вариантов изобретения такой анализ представляет собой сэндвич-иммуноферментный анализ. Примеры автоматизированного или полностью автоматизированного анализа включают анализы, которые можно использовать для одной из следующих систем: Roche Elecsys®, Abbott Architect®, Siemens Centauer®, Brahms Kryptor®, BiomerieuxVidas®, Alere Triage®, Ortho Clinical Diagnostics Vitros®.
Известно множество различных видов иммуноанализа, которые могут быть использованы в анализах и способах по настоящему изобретению, к ним относятся: радиоиммуноанализ («RIA»), гомогенный иммуноферментный анализ («EMIT»), иммуноферментный анализ («ELISA»), иммуноанализ на основе реактивации апофермента («ARIS»), иммуноферментный экспресс-анализ и иммунохроматографический анализ.
В конкретном варианте осуществления изобретения по меньшей мере один из указанных двух связующих агентов является меченым для обеспечения возможности детектирования.
Предпочтительные способы детектирования включают иммуноанализы в различных форматах, таких как, например, радиоиммуноанализ (RIA), хемилюминесцентный и флуоресцентный иммуноанализ, иммуноферментный анализ (ELISA), наборы сфер на основе Luminex, белковые микрочипы и форматы экспресс-тестов, такие как быстрый иммунохроматографический стрип-тест.
В предпочтительном варианте осуществления указанную метку выбирают из группы, содержащей хемилюминесцентную метку, ферментную метку, флуоресцентную метку, метку на основе радиоактивного йода.
Анализы могут быть гомогенными или гетерогенными, конкурентными и неконкурентными. В одном из вариантов осуществления анализ выполняют в форме сэндвич-анализа, который представляет собой неконкурентный иммуноанализ, в котором молекула, подлежащая детектированию и/или количественному определению, связывается с первым антителом и со вторым антителом. Первое антитело может быть связано с твердой фазой, например, сферой, поверхностью лунки или другого контейнера, чипом или полоской, а второе антитело представляет собой антитело, которое является меченным, например красителем, радиоизотопом или реакционноспособным или каталитически активным фрагментом. Затем соответствующим методом измеряют количество меченого антитела, связанного с аналитом. Общий состав и процедуры, имеющие отношение к «сэндвич-анализам», хорошо определены и известны специалисту (The Immunoassay Handbook, Ed. David Wild, Elsevier LTD, Oxford; 3rd ed. (May 2005); Hultschig et al. 2006. Curr Opin Chem Biol. 10(1):4-10).
В другом варианте осуществления анализ включает две молекулы захвата, предпочтительно антитела, оба из которых присутствуют в виде дисперсий в жидкой реакционной смеси, причем первый компонент мечения присоединен к первой молекуле захвата, причем указанный первый компонент мечения является частью системы мечения на основе гашения флуоресценции или хемилюминесценции или амплификации, и второй компонент мечения указанной системы мечения присоединен ко второй молекуле захвата, так что при связывании обеих молекул захвата с аналитом генерируется измеримый сигнал, который позволяет обнаружить образовавшиеся сэндвич-комплексы в растворе, содержащем образец.
В другом варианте осуществления указанная система мечения включает криптаты редкоземельных элементов или хелаты редкоземельных элементов в комбинации с флуоресцентным красителем или хемилюминесцентным красителем, в частности красителем цианинового типа.
В контексте настоящего изобретения анализы на основе флуоресценции включают использование красителей, которые, например, могут быть выбраны из группы, содержащей FAM (5- или 6-карбоксифлуоресцеин), VIC, NED, флуоресцеин, флуоресцеинизотиоцианат (FITC), IRD-700/800, цианиновые красители, такие как CY3, CY5, CY3.5, CY5.5, Cy7, ксантен, 6-карбокси-2',4',7',4,7-гексахлорфлуоресцеин (HEX), TET, 6-карбокси-4',5'-дихлор-2',7'-диметодифлуоресцеин (JOE), N,N,N',N'-тетраметил-6-карбоксиродамин (TAMRA), 6-карбокси-X-родамин (ROX), 5-карбоксиродамин-6G (R6G5), 6-карбоксиродамин-6G (RG6), родамин, родамин зеленый, родамин красный, родамин 110, красители BODIPY, такие как BODIPY TMR, орегон зеленый, кумарины, такие как умбеллиферон, бензимиды, такие как Hoechst 33258; фенантридины, такие как Texas Red, Yakima Yellow, Alexa Fluor, PET, этидийбромид, акридиниевые красители, карбазольные красители, феноксазиновые красители, порфириновые красители, полиметиновые красители и т.п.
В контексте настоящего изобретения анализы на основе хемилюминесценции включают использование красителей, основанных на физических принципах, описанных для хемилюминесцентных материалов в (Kirk-Othmer, Encyclopedia of chemical technology, 4th ed. 1993. John Wiley & Sons, Vol.15: 518-562, включенная в настоящее описание в качестве ссылки, включая ссылку на стр.551-562). Предпочтительными хемилюминесцентными красителями являются эфиры акридиния.
Как упомянуто в настоящем описании, «анализ» или «диагностический анализ» может быть любого типа, применяемый в области диагностики. Такой анализ может быть основан на связывании анализируемого вещества с одним или более зондами захвата с определенным сродством. Что касается взаимодействия между молекулами захвата и целевыми молекулами или представляющими интерес молекулами, константа сродства предпочтительно превышает 108 М-1.
В контексте настоящего изобретения «связующие молекулы» представляют собой молекулы, которые можно использовать для связывания целевых молекул или молекул, представляющих интерес, т.е. аналитов (т.е. в контексте настоящего изобретения ADM-NH2 и/или proADM и их фрагменты), из образца. Таким образом, для специфического связывания целевых молекул или представляющих интерес молекул молекулы связующего вещества должны иметь адекватную форму, как в терминах признаков, относящихся к пространственной форме, так и признаков, вязанных с поверхностью, таких как поверхностный заряд, гидрофобность, гидрофильность, наличие или отсутствие доноров и/или акцепторов Льюиса. Следовательно, связывание может, например, быть опосредовано взаимодействиями на основе ионных, ван-дер-ваальсовых, пи-пи, сигма-пи, гидрофобных или водородных связей или комбинацией двух или более вышеупомянутых взаимодействий между молекулами захвата и целевыми молекулами или представляющими интерес молекулами. В контексте настоящего изобретения молекулы связующего вещества могут, например, быть выбраны из группы, включающей молекулу нуклеиновой кислоты, молекулу углевода, молекулу ПНК, белок, антитело, пептид или гликопротеин. Предпочтительно, молекулы связующего вещества представляют собой антитела, включая их фрагменты с достаточным сродством по отношению к представляющей интерес мишени или молекуле, и включают рекомбинантные антитела или фрагменты рекомбинантных антител, а также химически и/или биохимически модифицированные производные указанных антител или фрагментов, полученные из варианта цепи длиной не менее 12 аминокислот.
Хемилюминесцентная метка может представлять собой метку сложного эфира акридиния, метку стероида, включая метки изолюминола, и т.п.
Метки на основе фермента могут представлять собой лактатдегидрогеназу (LDH), креатинкиназу (CPK), щелочную фосфатазу, аспартатаминотрансферазу (AST), аланинаминотрансферазу (ALT), кислую фосфатазу, глюкозо-6-фосфатдегидрогеназу и т.д.
В одном из вариантов осуществления изобретения по меньшей мере одно из указанных двух связующих веществ связано с твердой фазой в виде магнитных частиц и полистирольных поверхностей.
В конкретном варианте осуществления изобретения по меньшей мере одно из указанных двух связующих веществ связано с твердой фазой.
В конкретном варианте осуществления изобретения пороговое значение отношения уровня зрелого ADM-NH2 согласно SEQ ID No. 4, определенное в образце физиологической жидкости указанного субъекта, к уровню про-адреномедуллина или его фрагмента (который не является зрелым ADM-NH2 согласно SEQ ID No. 4) находится в диапазоне от 0,2 до 0,75, предпочтительно от 0,3 до 0,6, предпочтительно от 0,4 до 0,5.
Уровни ADM-NH2 по настоящему изобретению или уровни proADM или его фрагменты, соответственно, определяли с помощью описанного анализа ADM-NH2, проиллюстрированного в примерах (или анализов proADM или их фрагментов, соответственно). В других анализах упомянутые выше пороговые значения могут отличаться, если они были откалиброваны отличным от используемых в настоящем изобретении аналитических систем, способом. Следовательно, упомянутые выше пороговые значения должны применяться для таких по-другому откалиброванных анализов соответственно, с учетом отличий в калибровке. Одной из возможностей количественного определения разницы, возникающей при калибровке, является сравнительный анализ (корреляция) рассматриваемого анализа с соответствующим анализом биомаркеров, используемым в настоящем изобретении, путем измерения соответствующего биомаркера (например, bio-ADM) в образцах, используя оба метода. Другая возможность заключается в определении с помощью рассматриваемого анализа, учитывая, что данный тест имеет достаточную аналитическую чувствительность, среднего уровня биомаркеров в репрезентативной нормальной популяции, сравнении результатов со средними уровнями биомаркеров, описанными в литературе, и пересчете калибровки с учетом разницы, полученной в этом сравнении. С помощью калибровки, использованной в настоящем изобретении, были измерены образцы, полученные от нормальных (здоровых) субъектов: медианный уровень bio-ADM в плазме (зрелый ADM-NH2) составил 13,7 пг/мл (межквартильный диапазон [IQR] 9,6-18,7 пг/мл) (Weber et al. 2017. JALM, 2(2):222-233).
Средняя концентрация MR-proADM в плазме у нормальных (здоровых) субъектов составила 0,41 (межквартильный диапазон 0,23-0,64) нмоль/л (Smith et al. 2009. Clin Chem 55:1593-1595) согласно результатм автоматического сэндвич-флуоресцентного анализа для обнаружения MR-proADM, как описано в Caruhel et al. (Caruhel et al. 2009. Clin Biochem 42:725-8).
Средняя концентрация CT-proADM в плазме у нормальных здоровых субъектов (n=200) составила 77,6 пмоль/л (минимальная - 46,6 пмоль/л, максимальная - 136,2 пмоль/л), и 95%-ный процентиль составил 113,8 пмоль/л (EP 2111552 B1).
Концентрация PAMP-амида в плазме у нормальных здоровых субъектов (n=51) составила 0,51±0,19 пмоль/л (среднее значение ± стандартное отклонение) (Hashida et al. 2004. Clin Biochem 37:14-21).
Концентрация PAMP-глицина в плазме у нормальных здоровых субъектов (n=51) составила 1,15±0,38 пмоль/л (среднее значение ± стандартное отклонение) (Hashida et al. 2004. Clin Biochem 37:14-21).
В одном из вариантов осуществления пороговое значение может быть предварительно определено следующим образом:
сравнением концентрации маркера в физиологической жидкости, полученной от указанного субъекта, со средним значением маркера в физиологической жидкости, полученной из ансамбля предварительно определенных образцов, полученных из случайно выбранной популяции субъектов, имеющих сопоставимые исходные условия, что и указанный субъект,
сравнением концентрации маркера в физиологической жидкости, полученной от указанного субъекта, с квантилем уровней маркера и/или его фрагментов в физиологической жидкости, полученной из ансамбля заранее определенных образцов из популяции субъектов, имеющих сопоставимые исходные условия, что и указанный субъект,
путем вычисления, основанным на анализе пропорциональных рисков Кокса или путем вычислений индекса риска, таких как NRI (индекс чистой реклассификации) или IDI (интегрированный индекс дискриминации).
Кроме того, может быть определен по меньшей мере один клинический параметр или биомаркер, выбранный из группы, содержащей: возраст, расу, результаты тестирования психического статуса (например, по краткой шкале оценки психического статуса (MMSE)), нейровизуализацию (CT, MRT, PET, SPECT), семейный анамнез, генотип ApoE4, β-амилоид 1-42 (Aβ1-42), β-милоид 1-40 (Aβ1-40), общий Tau-белок, фосфорилированный Tau-белок (p-Tau 181, p-Tau 199, p-Tau 231).
В контексте настоящего изобретения термин «деменция» включает болезнь Альцгеймера, сосудистую деменцию, болезнь Альцгеймера, смешанную с сосудистой деменцией, деменцию с тельцами Леви, лобно-височную деменцию, очаговые типы деменции (такие как прогрессирующая афазия), подкорковые деменции (такие как деменция при болезни Паркинсона) и вторичные причины синдрома деменции (такие как внутричерепные поражения).
В более конкретном варианте осуществления изобретения указанную деменцию выбирают из группы: болезни Альцгеймера, сосудистой деменции и болезни Альцгеймера, смешанной с сосудистой деменцией.
Наиболее предпочтительной упомянутой деменцией является болезнь Альцгеймера.
Другим объектом настоящего изобретения является фармацевтическая композиция, содержащая раскрытое в настоящем описании связующее вещество по изобретению, в частности, содержащее анти-ADM антитело или фрагмент анти-ADM антитела или анти-ADM не-Ig каркас для применения в профилактике или лечении деменции.
В другом варианте осуществления настоящего изобретения указанная фармацевтическая композиция представляет собой раствор, предпочтительно готовый к применению раствор.
В другом варианте осуществления настоящего изобретения указанная фармацевтическая композиция представляет собой раствор, предпочтительно готовый к применению раствор, содержащий PBS, рН 7,4.
В другом варианте осуществления настоящего изобретения указанная фармацевтическая композиция находится в высушенном состоянии и требует восстановления перед использованием.
В другом варианте осуществления настоящего изобретения указанная фармацевтическая композиция находится в лиофилизированном состоянии и требует восстановления перед использованием.
В другом варианте осуществления настоящего изобретения указанную фармацевтическую композицию, предназначенную для использования для профилактики и/или лечения деменции, вводят перорально, накожно, подкожно, внутрикожно, подъязычно, внутримышечно, внутриартериально, внутрицеребрально, внутрицеребровентрикулярно, интратекально, внутривенно или внутрибрюшинно. В предпочтительном варианте осуществления настоящего изобретения указанную фармацевтическую композицию вводят внутривенно. В другом предпочтительном варианте осуществления настоящего изобретения указанную фармацевтическую композицию вводят через центральную нервную систему (ЦНС), например интрацеребрально, интрацеребровентрикулярно и интратекально.
Антитело по настоящему изобретению представляет собой белок, содержащий один или более полипептидов, по существу, кодируемых генами иммуноглобулина, которые специфически связываются с антигеном. Узнаваемые гены иммуноглобулина включают гены константной области каппа, лямбда, альфа (IgA), гамма (IgG1, IgG2, IgG3, IgG4), дельта (IgD), эпсилон (IgE) и мю (IgM), а также множество генов вариабельной области иммуноглобулинов. Полноразмерные легкие цепи иммуноглобулина обычно составляют в длину примерно 25 кДа или 214 аминокислот. Полноразмерные тяжелые цепи иммуноглобулина обычно составляют в длину примерно 50 кДа или 446 аминокислот. Легкие цепи кодируются геном вариабельной области на NH2-конце (длиной примерно 110 аминокислот) и геном константной области каппа или лямбда на COOH-конце. Тяжелые цепи кодируются аналогично геном вариабельной области (длиной примерно 116 аминокислот) и одним из других генов константной области.
Основной структурной единицей антитела обычно является тетрамер, который состоит из двух идентичных пар цепей иммуноглобулина, каждая из которых имеет одну легкую и одну тяжелую цепи. В каждой паре вариабельные области легкой и тяжелой цепей связываются с антигеном, а константные области обеспечивают эффекторные функции. Иммуноглобулины также существуют во множестве других форм, включая, например, Fv, Fab и (Fab')2, а также бифункциональные гибридные антитела и единичные цепи (например, Lanzavecchia et al. 1987. Eur. J. Immunol. 17:105; Huston et al. 1988, Proc. Natl. Acad. Sci. U.S.A., 85:5879-5883; Bird et al. 1988, Science 242:423-426; Hood et al., Immunology, Benjamin, N.Y., 2nd ed., 1984; Hunkapiller and Hood 1986. Nature 323:15-16). Вариабельная область легкой или тяжелой цепи иммуноглобулина включает каркасную область, прерываемую тремя гипервариабельными областями, также называемыми областями, определяющими комплементарность (CDR) (см. Sequences of Proteins of Immunological Interest, E. Kabatet al., U.S. Department of Health and Human Services, 1983). Как отмечено выше, CDR в первую очередь ответственны за связывание с эпитопом антигена. Иммунный комплекс представляет собой антитело, такое как моноклональное антитело, химерное антитело, гуманизированное антитело или человеческое антитело или функциональный фрагмент антитела, специфически связанный с антигеном.
Химерные антитела являются антителами, у которых гены легкой и тяжелой цепей сконструированы как правило методами генной инженерии из генов вариабельной и константной областей иммуноглобулинов, принадлежащих к разным видам. Например, вариабельные сегменты генов мышиного моноклонального антитела могут быть присоединены к человеческим константным сегментам, таким как каппа и гамма 1 или гамма 3. В одном из примеров терапевтическое химерное антитело является таким образом гибридным белком, состоящим из вариабельного или антигенсвязывающего домена мышиного антитела и константного или эффекторного домена человеческого антитела, хотя можно использовать другие виды млекопитающих, или вариабельную область можно получить методами молекулярной биологии. Способы получения химерных антител хорошо известны в данной области, например, см. патент США № 5,807,715). «Гуманизированный» иммуноглобулин представляет собой иммуноглобулин, включающий человеческую каркасную область и одну или более CDR нечеловеческого иммуноглобулина (апример, мыши, крысы или синтетический). Иммуноглобулин нечеловеческого происхождения, предоставляющий CDR, называют «донором», а человеческий иммуноглобулин, предоставляющий каркас, называют «акцептором». В одном из вариантов осуществления все CDR происходят из донорского иммуноглобулина в гуманизированном иммуноглобулине. Константные области не обязательно должны присутствовать, но если они имеются, они должны быть практически идентичными константным областям человеческого иммуноглобулина, т.е., идентичными на по меньшей мере примерно 85-90%, например, на примерно 95% или более. Следовательно, все части гуманизированного иммуноглобулина, за исключением, возможно, CDR, по существу идентичны соответствующим частям последовательностей природного человеческого иммуноглобулина. «Гуманизированное антитело» представляет собой антитело, содержащее гуманизированную легкую цепь и иммуноглобулин с гуманизированной тяжелой цепью. Гуманизированное антитело связывается с таким же антигеном, что и донорское антитело, предоставляющее CDR. Акцепторный каркас гуманизированного иммуноглобулина или антитела может иметь ограниченное количество замен аминокислотами, взятыми из донорского каркаса. Гуманизированные или другие моноклональные антитела могут иметь дополнительные консервативные аминокислотные замены, которые, по существу, не влияют на связывание антигена или другие функции иммуноглобулина. Примерами консервативных замен являются такие, как gly, ala; val, ile, leu; asp, glu; asn, gln; ser, thr; lys, arg; и phe, tyr. Гуманизированные иммуноглобулины могут быть сконструированы методами генной инженерии (например, см. патент США № 5580089). Человеческое антитело представляет собой антитело, в котором гены легкой и тяжелой цепей имеют человеческое происхождение. Человеческие антитела могут быть получены способами, известными в данной области. Человеческие антитела могут быть получены путем иммортализации человеческой В-клетки, секретирующей представляющее интерес антитело. Иммортализация может быть достигнута, например, путем инфицирования EBV или путем слияния человеческой В-клетки с клеткой миеломы или гибридомы с получением клетки триомы. Человеческие антитела также могут быть получены методами фагового дисплея (см., например, Dower et al., публикация PCT WO91/17271; McCafferty et al., публикация PCT WO92/001047; и Winter, публикация PCT WO92/20791), или могут быть выбраны из библиотеки комбинаторных моноклональных человеческих антител (см. Веб-сайт Morphosys). Человеческие антитела также могут быть получены с использованием трансгенных животных, несущих ген человеческого иммуноглобулина (см., например, Lonberget al., публикацию PCT WO93/12227; и Kucherlapati, публикацию PCT WO91/10741).
Таким образом, антитело может иметь форматы, известные в данной области. Примерами являются человеческие антитела, моноклональные антитела, гуманизированные антитела, химерные антитела, антитела с привитыми CDR. В предпочтительном варианте осуществления изобретения антитела по настоящему изобретению представляют собой антитела, полученные рекомбинантным путем, например, IgG, типичный полноразмерный иммуноглобулин или фрагменты антител, содержащие по меньшей мере F-вариабельный домен тяжелой и/или легкой цепи, например, химически связанные антитела (фрагмент, связывающий антиген), включая, без ограничения, Fab-фрагменты, включая Fab-минитела, одноцепочечные антитела Fab, моновалентное Fab-антитело с эпитопными метками, например, FAB-V5Sx2; бивалентный Fab (мини-антитело), димеризованный с доменом СН3; двухвалентный Fab или многовалентный Fab, например, образованный путем мультимеризации с помощью гетерологичного домена, например, путем димеризации доменов dHLX, например, FAB-dHLX-FSx2; F(ab‘)2-фрагменты, scFv-фрагменты, мультимеризованные, многовалентные и/или мультиспецифические scFv-фрагменты, бивалентные и/или биспецифические диатела, BITE® (биспецифический T-клеточный захватчик), трифункциональные антитела, поливалентные антитела, например, из класса, отличного от G; однодоменные антитела, например, нанотела, полученные из иммуноглобулинов верблюда или рыбы, и многие другие.
В дополнение к анти-ADM антителам в данной области техники хорошо известны другие биополимерные каркасы для получения комплексов молекулы-мишени, которые могут быть использованы для получения специфических для мишени биополимеров. Примерами являются аптамеры, шпигельмеры, антикалины и конотоксины.
В предпочтительном варианте осуществления формат антитела выбирают из группы, включающей Fv-фрагмент, scFv-фрагмент, Fab-фрагмент, scFab-фрагмент, F(ab)2-фрагмент и scFv-Fc слитый белок. В другом предпочтительном варианте осуществления формат антитела выбирают из группы, включающей scFab-фрагмент, Fab-фрагмент, scFv-фрагмент и их конъюгаты, оптимизированные по биодоступности, такие как пегилированные фрагменты. Одним из наиболее предпочтительных форматов является формат scFab.
Не-Ig каркасы могут быть белковыми каркасами и могут использоваться в качестве имитаторов антител, поскольку они способны связываться с лигандами или антигенами. Не-Ig каркасы могут быть выбраны из группы, состоящей из тетрактиновых не-Ig каркасов (например, описанных в US 2010/0028995), фибронектиновых каркасов (например, описанных в EP 1266025); липокалиновых каркасов (например, описанных в WO 2011/154420); убиквитиновых каркасов (например, описанных в WO 2011/073214), трансферриновых каркасов (например, описанных в US 2004/0023334), каркасов белка А (например, описанных в EP 2231860), каркасов на основе анкириновых повторов (например, описанных в WO 2010/060748), микропротеиновых каркасов (предпочтительно микропротеинов, образующих цистеиновый узел) (например, описанных в EP 2314308), каркасов на основе домена Fyn SH3 (например, описанных в WO 2011/023685), каркасов на основе EGFR-A домена (например, описанных в WO 2005/040229) и каркасов на основе домена Kunitz (например, описанных в EP 1941867).
Кроме того, в одном из вариантов осуществления изобретения антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас является моноспецифическими.
Моноспецифическое антитело к адреномедуллину (ADM) или фрагмент моноспецифического антитела к адреномедуллину или моноспецифический анти-ADM не-Ig каркас означает, что указанное антитело или фрагмент антитела или не-Ig каркас связывается с одной конкретной областью, охватывающей по меньшей мере 5 аминокислот в целевом ADM. Моноспецифическое антитело к адреномедуллину (ADM) или фрагмент моноспецифического антитела к адреномедуллину или моноспецифический анти-ADM не-Ig каркас представляют собой антитела к адреномедуллину (ADM) или фрагменты антител к адреномедуллину или анти-ADM не-Ig каркасы, все из которых имеют сродство к одному и того же антигену.
В другом конкретном и предпочтительном варианте осуществления анти-ADM антитело или фрагмент анти-ADM антитела или анти-ADM не-Ig-каркас, связывающий ADM, представляет собой моноспецифическое антитело, фрагмент антитела или не-Ig каркас, соответственно, причем моноспецифическое означает, что указанное антитело или фрагмент антитела или не-Ig каркас связывается с одной конкретной областью, охватывающей по меньшей мере 4 аминокислоты в целевом ADM. Моноспецифические антитела или фрагменты или не-Ig каркасы по изобретению представляют собой антитела или фрагменты или не-Ig каркасы, все из которых имеют сродство к одному и тому же антигену. Моноклональные антитела являются моноспецифическими, но моноспецифические антитела могут также продуцироваться другими способами, отличными от их продуцирования в обычной половой клетке.
Указанное анти-ADM антитело или фрагмент антитела, связывающий ADM, или не-Ig каркас, связывающий ADM, может представлять собой не-нейтрализующее антитело к ADM или фрагмент антитела, связывающего ADM, или не-Ig каркас, связывающий ADM.
В конкретном варианте осуществления указанное анти-ADM антитело, фрагмент анти-ADM антитела или анти-ADM не-Ig каркас представляет собой не-нейтрализующее антитело, фрагмент или не-Ig каркас. Нейтрализующее анти-ADM антитело, фрагмент анти-ADM антитела или анти-ADM не-Ig каркас способны блокировать биологическую активность ADM почти на 100%, по меньшей мере, более чем на 90%, предпочтительно, по меньшей мере, более чем на 95%.
Напротив, не-нейтрализующее анти-ADM антитело или фрагмент анти-ADM антитела или анти-ADM не-Ig каркас блокирует биологическую активность ADM менее чем на 100%, предпочтительно менее чем на 95%, предпочтительно менее чем на 90%, более предпочтительно менее чем на 80% и еще более предпочтительно менее чем на 50%. Это означает, что биологическая активность ADM снижается до менее чем 100%, до 95% или менее, но не более, до 90% или менее, но не более, до 80% или менее, но не более, до 50% или менее, но не более. Это означает, что остаточная биологическая активность ADM, связанного с не-нейтрализующим анти-ADM антителом или фрагментом анти-ADM антитела или анти-ADM не-Ig каркасом, будет составлять более 0%, предпочтительно более 5%, предпочтительно более 10%, более предпочтительно более 20%, более предпочтительно более 50%.
В этом контексте (а) молекула(ы), представляющая(ие) собой антитело или фрагмент антитела или не-Ig каркас с «не-нейтрализующей анти-ADM активностью», в совокупности обозначенные в настоящем описании для простоты как «не-нейтрализующее» анти-ADM-антитело, фрагмент антитела или не-Ig каркас, которые, например, блокируют биологическую активность ADM до менее чем 80%, определяется как
молекула или молекулы, связывающиеся с ADM, которая при добавлении к культуре эукариотической клеточной линии, экспрессирующей функциональный человеческий рекомбинантный рецептор ADM, состоящий из CRLR (рецептор, подобный кальцитониновому рецептору) и RAMP3 (белок 3, модифицирующий активность рецептора), уменьшает количество цАМФ, продуцируемого клеточной линией посредством действия параллельно добавленного синтетического ADM-пептида человека, причем указанный добавленный синтетический ADM человека добавляют в количестве, которое в отсутствие анализируемого не-нейтрализующего антитела приводит к полумаксимальной стимуляции синтеза цАМФ, при этом восстановление цАМФ, обусловленное связыванием указанной молекулы(молекул) с ADM, происходит в такой степени, которая составляет не более 80%, даже когда нейтрализующую молекулу(ы), связывающуюся(иеся) с анализируемым ADM, добавляют в количестве, в 10 раз превышающем количество, необходимое для достижения максимального снижения синтеза цАМФ, достигаемого с помощью анализируемого не-нейтрализующего антитела.
Такое же определение применимо к другим диапазонам: 95%, 90%, 50% и т.д.
В предпочтительном варианте осуществления настоящего изобретения указанное анти-ADM антитело или фрагмент антитела к адреномедуллину или анти-ADM не-Ig-каркас связывается с областью или эпитопом ADM, расположенным в N-концевой части (aa 1-21) адреномедуллина.
В другом предпочтительном варианте осуществления указанное анти-ADM антитело или фрагмент антитела к адреномедуллину или каркас анти-ADM не-Ig распознает и связывается с областью или эпитопом в пределах аминокислот 1-14 (SEQ ID No. 27) адреномедуллина; что указывает на N-концевую часть (аа 1-14) адреномедуллина. В другом предпочтительном варианте осуществления указанное анти-ADM антитело или фрагмент антитела к адреномедуллину или каркас анти-ADM не-Ig распознает и связывается с областью или эпитопом в пределах аминокислот 1-10 адреномедуллина (SEQ ID No. 28); что указывает на N-концевую часть (аа 1-10) адреномедуллина.
aa 1-14 ADM
YRQSMNNFQGLRSF (SEQ ID No. 27)
aa 1-10 ADM
YRQSMNNFQG (SEQ ID No. 28)
В другом предпочтительном варианте осуществления указанное анти-ADM антитело или фрагмент антитела к адреномедуллину или каркас анти-ADM не-Ig распознает и связывается с областью или эпитопом в пределах аминокислот 1-6 адреномедуллина (SEQ ID No. 29); что указывает на N-концевую часть (аа 1-6) адреномедуллина. Как указано выше, указанная область или эпитоп предпочтительно содержит в длину по меньшей мере 4 или по меньшей мере 5 аминокислот.
aa 1-6 ADM
YRQSMN (SEQ ID No. 29)
В другом предпочтительном варианте осуществления указанное анти-ADM антитело или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас распознает и связывается с N-терминальным концом (aa1) адреномедуллина. N-терминальный конец означает аминокислоту 1, которая представляет собой «Y» в SEQ ID No. 4, 5, 21, 27, 28 or 29; и является обязательной для связывания антитела. Антитело или его фрагмент, или каркас не связывается ни с удлиненным N-концом, ни с модифицированным N-концом адреномедуллина, ни с деградированным N-концом адреномедуллина. Это означает, что в другом предпочтительном варианте осуществления изобретения анти-ADM антитело или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас связывается только с областью в последовательности зрелого ADM, если N-конец ADM является свободным. В указанном варианте осуществления анти-ADM антитело или фрагмент антитела к адреномедуллину, или не-Ig каркас не будет связываться с областью в последовательности зрелого ADM, если указанная последовательность, например, содержится в pro-ADM.
Для ясности, номера в скобках для конкретных областей ADM, таких как «N-концевая часть (aa 1-21)» следует понимать как то, что N-концевая часть ADM состоит из аминокислот 1-21 зрелой последовательности ADM.
В одном из вариантов осуществления изобретения антитела по настоящему изобретению могут быть получены следующим образом:
Мышь Balb/c иммунизируют, используя 100 мкг конъюгата пептид ADM с BSA (эмульгированного в 100 мкл полного адъюванта Фрейнда) в день 0 и день 14 и 50 мкг (в 100 мкл неполного адъюванта Фрейнда) в день 21 и день 28. За три дня до проведения эксперимента по слиянию животным вводят 50 мкг конъюгата, растворенного в 100 мкл физиологического раствора посредством одной внутрибрюшинной и одной внутривенной инъекции.
Спленоциты, взятые из организма иммунизированной мыши, и клетки миеломы линии SP2/0 сливают, используя 1 мл 50% полиэтиленгликоля, в течение 30 с при 37°С. После отмывки клетки высевают в 96-луночные планшеты для клеточной культуры. Гибридные клоны отбирают по признаку роста в среде HAT [культуральная среда RPMI 1640, дополненная 20% эмбриональной сывороткой теленка и дополненная HAT]. Через две недели HAT-среду заменяют средой HT, осуществляя три пассажа, а затем возвращают стандартную среду для культуры клеток.
Супернатанты клеточной культуры подвергают первичному скринингу в отношении антигенспецифических антител класса IgG через три недели после слияния. Положительные по данным теста микрокультуры переносят в 24-луночные планшеты для размножения. После повторного тестирования выбранные культуры клонируют и повторно клонируют, используя метод серийных разведений, и определяют изотипы (см. также Lane 1985. J. Immunol. Meth. 81:223-228; Ziegler, B. et al. 1996 Horm. Metab. Res. 28:11-15).
Антитела также могут быть получены методом фагового дисплея согласно следующей процедуре:
Для выделения рекомбинантных одноцепочечных F-вариабельных доменов (scFv) к пептидам адреномедуллина применяют библиотеки человеческих наивных генов антител HAL7/8. Библиотеки генов антител подвергают скринингу, используя стратегию пэннинга, предусматривающую применение пептидов, которые содержат биотиновую метку, сцепленную через два разных спейсера с последовательностью пептида адреномедуллина. Для минимизации фона неспецифических связующих агентов используют комбинацию циклов пэннинга с использованием неспецифического связывания антигена и связанного со стрептавидином антигена. Фаги, элюированные после третьего цикла пэннинга, применяют для получения штаммов E.coli, экспрессирующих моноклональный scFv. Для оценки антигена с помощью ELISA используют непосредственно супернатанты, полученные после культивирования указанных клональных штаммов (см. Hust et al. 2011. Journal of Biotechnology 152:159-170; Schütte et al. 2009. PLoS One 4, e6625).
Гуманизацию мышиных антител можно выполнять в соответствии со следующей процедурой:
Для гуманизации антитела мышиного происхождения последовательность антитела анализируют в отношении структурных взаимодействий каркасных областей (FR) с определяющими комплементарность областями (CDR) и антигеном. На основе структурного моделирования выбирают соответствующий FR человеческого происхождения, и мышиные последовательности CDR трансплантируют на человеческий FR. Можно ввести вариации в аминокислотную последовательность CDR или FR-участков для восстановления структурных взаимодействий, которые были утеряны в результате видовой замены для FR-последовательностей. Для достижения указанного восстановления структурных взаимодействий можно применять неспецифический подход, основанный на использовании фаговых дисплейных библиотек или направленный подход, основанный на молекулярном моделировании (Almagro et al. 2008. Front Biosci. 2008; 13:1619-33).
Другой вариант осуществления настоящей заявки относится к способу согласно предшествующими вариантами осуществления, в котором анти-ADM антитело для лечения субъекта, которое связывается с N-концевой частью aa 1-21 адреномедуллина, представляет собой антитело с привитыми человеческими CDR, или фрагмент этого антитела, который связывается с ADM, причем антитело с привитыми человеческими CDR или фрагмент этого антитела содержит тяжелую цепь (Н-цепь) антитела, содержащую:
GYTFSRYW
SEQ ID NO. 8:
ILPGSGST
и/или
SEQ ID NO. 9:
TEGYEYDGFDY
и/или дополнительно содержит легкую цепь (L цепь) антитела, содержащую:
SEQ ID NO. 10:
QSIVYSNGNTY
SEQ ID NO. 11: (не упоминается в списке последовательностей из-за длины из 3 аминокислот)
RVS
и/или
SEQ ID NO. 12:
FQGSHIPYT.
В другом конкретном варианте осуществления настоящей заявки анти-ADM антитело для лечения субъекта представляет собой человеческое моноклональное антитело, которое связывается с ADM, или фрагмент этого антитела, в котором тяжелая цепь содержит по меньшей мере одну CDR, выбранный из группы, содержащей:
SEQ ID NO. 7:
GYTFSRYW
SEQ ID NO. 8:
ILPGSGST
SEQ ID NO. 9:
TEGYEYDGFDY
и в котором легкая цепь содержит по меньшей мере одну CDR, выбранный из группы, содержащей:
SEQ ID NO. 10:
QSIVYSNGNTY
SEQ ID NO. 11: (не упоминается в списке последовательностей из-за длины из 3 аминокислот)
RVS
SEQ ID NO. 12:
FQGSHIPYT.
В другом варианте осуществления настоящей заявки анти-ADM антитело для лечения субъекта представляет собой человеческое моноклональное антитело, которое связывается с ADM, или фрагмент этого антитела, в котором тяжелая цепь содержит последовательности
SEQ ID NO. 7:
GYTFSRYW
SEQ ID NO. 8:
ILPGSGST
SEQ ID NO. 9:
TEGYEYDGFDY
и в котором легкая цепь содержит последовательности
SEQ ID NO. 10:
QSIVYSNGNTY
SEQ ID NO. 11: (не упоминается в списке последовательностей из-за длины из 3 аминокислот)
RVS
SEQ ID NO. 12:
FQGSHIPYT.
Другой вариант осуществления настоящей заявки относится к способу согласно предшествующему варианту осуществления, где указанное антитело или фрагмент для лечения представляет собой человеческое моноклональное антитело или фрагмент, который связывается с ADM, или фрагмент этого антитела, в котором тяжелая цепь содержит последовательности
CDR1: SEQ ID NO. 7:
GYTFSRYW
CDR2: SEQ ID NO. 8:
ILPGSGST
CDR3: SEQ ID NO. 9:
TEGYEYDGFDY
и в котором легкая цепь содержит последовательности
CDR1: SEQ ID NO. 10:
QSIVYSNGNTY
CDR2: SEQ ID NO. 11: (не упоминается в списке последовательностей из-за длины из 3 аминокислот)
RVS
CDR3: SEQ ID NO. 12:
FQGSHIPYT.
Другой вариант осуществления настоящей заявки относится к способу согласно предшествующему варианту осуществления, в котором указанное антитело или фрагмент для лечения содержит следующие последовательности в качестве области VH:
SEQ ID NO. 13 (AM-VH-C):
QVQLQQSGAELMKPGASVKISCKATGYTFSRYWIEWVKQRPGHGLEWIGEILP
GSGSTNYNEKFKGKATITADTSSNTAYMQLSSLTSEDSAVYYCTEGYEYDGFD
YWGQGTTLTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWN
SGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKR
VEPKHHHHHH
SEQ ID NO. 14 (AM-VH1):
QVQLVQSGAEVKKPGSSVKVSCKASGYTFSRYWISWVRQAPGQGLEWMGRIL
PGSGSTNYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCTEGYEYDGFD
YWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWN
SGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKR
VEPKHHHHHH
SEQ ID NO. 15 (AM-VH2-E40):
QVQLVQSGAEVKKPGSSVKVSCKASGYTFSRYWIEWVRQAPGQGLEWMGRIL
PGSGSTNYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCTEGYEYDGFD
YWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWN
SGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKR
VEPKHHHHHH
SEQ ID NO. 16 (AM-VH3-T26-E55):
QVQLVQSGAEVKKPGSSVKVSCKATGYTFSRYWISWVRQAPGQGLEWMGEIL
PGSGSTNYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCTEGYEYDGFD
YWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWN
SGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKR
VEPKHHHHHH; или
SEQ ID NO. 17 (AM-VH4-T26-E40-E55):
QVQLVQSGAEVKKPGSSVKVSCKATGYTFSRYWIEWVRQAPGQGLEWMGEIL
PGSGSTNYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCTEGYEYDGFD
YWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWN
SGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKR
VEPKHHHHHH;
и содержит следующую последовательность в качестве области VL:
SEQ ID NO. 18 (AM-VL-C):
DVLLSQTPLSLPVSLGDQATISCRSSQSIVYSNGNTYLEWYLQKPGQSPKLLIYR
VSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGVYYCFQGSHIPYTFGGGTKLE
IKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNS
QESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGE
C
SEQ ID NO. 19 (AM-VL1):
DVVMTQSPLSLPVTLGQPASISCRSSQSIVYSNGNTYLNWFQQRPGQSPRRLIYR
VSNRDSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCFQGSHIPYTFGQGTKL
EIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGN
SQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRG
EC
SEQ ID NO. 20 (AM-VL2-E40):
DVVMTQSPLSLPVTLGQPASISCRSSQSIVYSNGNTYLEWFQQRPGQSPRRLIYRVSNRDSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCFQGSHIPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC.
Приведенные ниже варианты осуществления являются объектом настоящего изобретения:
1) Способ:
а) диагностики деменции, или
b) определения риска развития деменции у субъекта, не страдающего деменцией, или
c) мониторинга терапии или мониторинга или управления вмешательством у субъекта, страдающего деменцией, или
d) мониторинга терапии или мониторинга или управления профилактическим вмешательством у субъекта с риском развития деменции,
в котором определяют уровень зрелого ADM-NH2 согласно SEQ ID No. 4 в образце физиологической жидкости субъекта, и в котором сравнивают указанный уровень зрелого ADM-NH2 с пороговым уровнем,
причем
а) у указанного субъекта диагностируют деменцию, если уровень зрелого ADM-NH2 согласно SEQ ID No. 4 ниже указанного порогового уровня, или причем
b) указанный субъект имеет повышенный риск развития деменции, если указанный уровень зрелого ADM-NH2 согласно SEQ ID No. 4 ниже указанного порогового уровня, или причем
c) статус субъекта, страдающего деменцией или имеющего риск развития деменции, улучшается при терапии или вмешательстве, если указанный уровень зрелого ADM-NH2 согласно SEQ ID No. 4 увеличивается в ходе терапии или вмешательства, и/или причем вмешательство может быть продолжено, если указанный уровень зрелого ADM-NH2 согласно SEQ ID No. 4 увеличивается выше указанного порогового уровня.
2) Способ:
а) диагностики деменции, или
b) определения риска развития деменции у субъекта, не страдающего деменцией, или
c) мониторинга терапии или мониторинга или управления вмешательством у субъекта, страдающего деменцией, или
d) мониторинга профилактической терапии или мониторинга или управления профилактическим вмешательством у субъекта с риском развития деменции,
в котором определяют отношение маркеров, которое может представлять собой отношение уровня зрелого ADM-NH2 согласно SEQ ID No. 4, определенного в образце физиологической жидкости указанного субъекта, к уровню про-адреномедуллина или его фрагмента (который является незрелым ADM-NH2 согласно SEQ ID No. 4), определенному в образце физиологической жидкости указанного субъекта, и причем указанное отношение маркеров сравнивают с пороговым отношением,
причем
а) у указанного субъекта диагностируют деменцию, если отношение маркеров зрелый ADM-NH2/про-адреномедуллин или его фрагмент ниже указанного порогового значения, или причем
b) указанный субъект имеет повышенный риск развития деменции, если отношение маркеров зрелый ADM-NH2/про-адреномедуллин или его фрагмент ниже указанного порогового значения, или причем
c) статус субъекта, страдающего деменцией или имеющего риск развития деменции, улучшается при терапии или вмешательстве, если указанное отношение маркеров увеличивается во время курса терапии или вмешательства,
или альтернативно к вышеуказанному отношению маркеров, уровень зрелого ADM-NH2 согласно SEQ ID No. 4 определяют в образце физиологической жидкости указанного субъекта, и уровень про-адреномедуллина или его фрагмента (который не является зрелым ADM-NH2 согласно SEQ ID No. 4) определяют в образце физиологической жидкости указанного субъекта, и оба определенных уровня объединяют в математическом алгоритме, причем результат указанного математического алгоритма используют для диагностики деменции или определения риска развития деменции у субъекта, не страдающего деменцией, или мониторинга терапии или мониторинга или управления вмешательством у субъекта, страдающего деменцией, или мониторинга профилактической терапии или мониторинга или управления профилактическим вмешательством у субъекта с риском развития деменции.
3. Способ по п.2, в котором указанный фрагмент про-адреномедуллина выбирают из группы, содержащей PAMP (SEQ ID No. 2), MR-proADM (SEQ ID).No. 3), ADM-Gly (SEQ ID No. 5) и CT-proADM (SEQ ID No. 6).
4. Способ по п.1, в котором пороговый уровень зрелого ADM-NH2 согласно SEQ ID No. 4 равен или ниже 15 пг/мл, предпочтительно равен или ниже 10 пг/мл, предпочтительно равен или ниже 5 пг/мл.
5. Способ по п.2 или п.3, в котором пороговое отношение находится в диапазоне от 0,2 до 0,75, предпочтительно от 0,3 до 0,6, предпочтительно от 0,4 до 0,5.
6. Способ по любому из предшествующих пунктов, в котором указанный образец выбирают из группы: крови, сыворотки, плазмы, мочи, спинномозговой жидкости (CSF) и слюны.
7. Способ по пп.1-6, в котором образец физиологической жидкости берут у субъекта, у которого на момент взятия образца не была диагностирована деменции или MCI.
8. Способ по любому из предшествующих пунктов, в котором по меньшей мере один дополнительный клинический параметр выбирают из группы, содержащей возраст, расу, результаты тестирования психического статуса (например, по краткой шкале оценки психического статуса (MMSE)), нейровизуализацию (CT, MRT, PET, SPECT), семейный анамнез, генотип ApoE4, β-амилоид 1-42 (Aβ1-42), β-амилоид 1-40 (Aβ1-40), общий Tau-белок, фосфорилированный Tau-белок (p-Tau 181, p-Tau 199, p-Tau 231).
9. Способ по любому из предшествующих пунктов, в котором уровень указанного маркера определяют с помощью иммуноанализа.
10. Способ по любому из предшествующих пунктов, который используется для стратификации пациентов для выбора пациента для лечения антителом к адреномедуллину (ADM) или фрагментом антитела к адреномедуллину или анти-ADM не-Ig каркасом для применения для профилактики и терапии деменции у субъекта, причем указанное анти-ADM антитело или фрагмент анти-ADM антитела или анти-ADM не-Ig каркас связывается с N-концевой частью (aa 10-21) адреномедуллина:
YRQSMNNFQGLRSFGCRFGTC (SEQ ID No. 21).
11. Антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта, причем указанное анти-ADM антитело или фрагмент анти-ADM антитела или анти-ADM не-Ig каркас связывается с N-концевой частью (аа 1-21) адреномедуллина:
YRQSMNNFQGLRSFGCRFGTC (SEQ ID No. 21).
12. Антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта по п.11, причем указанный субъект имеет уровень зрелого ADM-NH2 согласно SEQ ID No. 4, определенный в образце физиологической жидкости указанного субъекта, ниже порогового уровня и/или имеет отношение маркеров, которое представляет собой отношение уровня зрелого ADM-NH2 согласно SEQ ID No. 4, определенного в образце физиологической жидкости указанного субъекта, к уровню про-адреномедуллина или его фрагмента, определенному в образце физиологической жидкости указанного субъекта, и причем указанное отношение уровней маркеров ниже порогового отношения.
13. Антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта по п.12, причем указанный фрагмент про-адреномедуллина выбирают из группы, содержащей PAMP (SEQ ID No. 2), MR-proADM (SEQ ID No. 3), ADM-Gly (SEQ ID No. 5) и CT-proADM (SEQ ID No. 6).
14. Антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину, или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта по пп.11-13, причем указанного пациента выбирают с помощью способа по п.10.
15. Антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину, или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта по любому из пп.12-14, причем пороговый уровень зрелого ADM-NH2 согласно SEQ ID No. 4 равен или ниже 15 пг/мл, предпочтительно равен или ниже 10 пг/мл, предпочтительно равен или ниже 5 пг/мл.
16. Антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта по пп.12-14, причем отношение уровней маркеров находится в пределах от 0,2 до 0,75, предпочтительно от 0,3 до 0,6, предпочтительно от 0,4 до 0,5.
17. Антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта по пп.11-16, причем указанного субъекта выбирают с помощью способа по п.10 и причем образец физиологической жидкости выбирают из группы: крови, сыворотки, плазмы, мочи, спинномозговой жидкости (CSF) и слюны.
18. Антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта по пп.11-16, причем по меньшей мере один дополнительный клинический параметр выбирают из группы, содержащей возраст, расу, результаты тестирования психического статуса (например, по краткой шкале оценки психического статуса (MMSE)), нейровизуализацию (CT, MRT, PET, SPECT), семейный анамнез, генотип ApoE4, β-амилоид 1-42 (Aβ1-42), β-амилоид 1-40 (Aβ1-40), общий Tau-белок, фосфорилированный Tau-белок (p-Tau 181, p-Tau 199, p-Tau 231).
19. Антитело к адреномедуллину (ADM) или фрагмент антитела к адреномедуллину, или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта по пп.12-18, причем уровень указанного маркера определяют с помощью иммуноанализа.
20. Антитело к адреномедуллину (ADM) или фрагмент анти-ADM антитела, связывающий адреномедуллин, или анти-ADM не-Ig каркас, связывающий адреномедуллин, для применения для профилактики и терапии деменции у субъекта по пп.12-19, причем указанное антитело или его фрагмент или каркас имеют сродство связывания с ADM, составляющее по меньшей мере 10-7 М.
21. Анти-ADM антитело или фрагмент антитела к адреномедуллину или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта по пп.12-20, причем указанное антитело или фрагмент, или каркас распознает и связывается с N-терминальным концом (аа 1) адреномедуллина.
22. Анти-ADM антитело или фрагмент антитела к адреномедуллину, или анти-ADM не-Ig каркас для применения для профилактики и терапии деменции у субъекта по пп.12-21, причем указанное антитело или фрагмент, или каркас блокирует биологическую активность ADM не более чем на 80%, предпочтительно не более чем на 50%.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1
На фиг.1 показана типичная кривая зависимости доза bio-ADM/сигнал и кривая зависимости сигнала от дозы bio-ADM в присутствии 100 мкг/мл антитела NT-H.
Фиг.2
На фиг. 2 показаны концентрации bio-ADM в когорте MPP и в независимой когорте с болезнью Альцгеймера.
Фиг.3
На фиг. 3 показан график Каплана-Мейера для концентраций bio-ADM в когорте MPP для прогнозирования болезни Альцгеймера.
Фиг.4
На фиг.4 представлена блочная диаграмма концентраций bio-ADM в подгруппе когорты MPP (случай-контроль) для прогнозирования болезни Альцгеймера и в независимой когорте с AD.
Фиг.5
На фиг. 5 представлена блочная диаграмма концентраций MR-proADM в подгруппе когорты MPP (случай-контроль) для прогнозирования болезни Альцгеймера.
Фиг.6
На фиг. 6 показана блочная диаграмма отношения bio-ADM/MR-proADM в подгруппе когорты MPP (случай-контроль) для прогнозирования болезни Альцгеймера.
Фиг.7
На фиг. 7 показан ROC-график bio-ADM (A) и отношения bio-ADM к MR-proADM (B) в подгруппе когорты MPP (случай-контроль) для прогнозирования болезни Альцгеймера.
Фиг.8
На фиг. 8 показаны значения bio-ADM у здоровых людей после введения NT-H антитела.
Примеры
Пример 1
Создание антител и определение их констант сродства
Получали несколько человеческих и мышиных антител и определяли их константы сродства (см. Таблицу 1).
Пептиды/конъюгаты для иммунизации:
Синтезировали пептиды для иммунизации, см. Таблицу 1 (JPT Technologies, Berlin, Germany) с дополнительным N-концевым остатком цистеина (если цистеин отсутствовал в выбранной последовательности ADM) для конъюгации пептидов с бычьим сывороточным альбумином (BSA). Пептиды ковалентно связывали с BSA с использованием связующего геля Sulfolink (Perbio-Science, Bonn, Germany). Процедуру связывания выполняли в соответствии с руководством Perbio.
Мышиные антитела получали следующим способом:
Мышь Balb/c иммунизировали, используя 100 мкг конъюгата пептид-BSA (эмульгированного в 100 мкл полного адъюванта Фрейнда) в день 0 и день 14 и 50 мкг (в 100 мкл неполного адъюванта Фрейнда) в день 21 и день 28. За три дня до проведения эксперимента по слиянию животным вводили 50 мкг конъюгата, растворенного в 100 мкл физиологического раствора посредством одной внутрибрюшинной и одной внутривенной инъекции.
Спленоциты, взятые из организма иммунизированной мыши, и клетки миеломы линии SP2/0 сливали, используя 1 мл 50% полиэтиленгликоля, в течение 30 с при 37°С. После отмывки клетки высевали в 96-луночные планшеты для клеточной культуры. Гибридные клоны отбирали по признаку роста в среде HAT [культуральная среда RPMI 1640, дополненная 20% эмбриональной сывороткой теленка и дополненная HAT]. Через две недели HAT-среду заменяли средой HT, осуществляя три пассажа, а затем возвращали стандартную среду для культуры клеток.
Супернатанты клеточной культуры подвергали первичному скринингу в отношении антигенспецифических антител класса IgG через три недели после слияния. Положительные по данным теста микрокультуры переносили в 24-луночные планшеты для размножения. После повторного тестирования выбранные культуры клонировали и повторно клонировали, используя метод серийных разведений, и определяли изотипы (см. также Lane 1985. J. Immunol. Meth. 81:223-228; Ziegler, B. et al. 1996 Horm. Metab. Res. 28:11-15).
Получение мышиных моноклональных антител:
Антитела получали стандартными методами получения антител (Marx et al., 1997. 1997. Monoclonal Antibody Production, ATLA 25, 121) и очищали на белке А. Чистота антител составляла >95% по результатам анализа SDS-гель-электрофореза.
Человеческие нтитела:
Человеческие антитела получали с помощью фагового дисплея согласно следующей процедуре:
Для выделения рекомбинантных одноцепочечных F-вариабельных доменов (scFv) к пептиду ADM применяли библиотеки человеческих наивных генов антитела HAL7/8. Библиотеки генов антител подвергали скринингу, используя стратегию пэннинга, предусматривающую применение пептидов, содержащих биотиновую метку, сцепленную через два разных спейсера с последовательностью пептида ADM. Для минимизации фона неспецифических связующих агентов применяли комбинацию циклов пэннинга с использованием неспецифически связанного антигена и связанного со стрептавидином антигена. Фаги, элюированные после третьего цикла пэннинга, применяли для получения штаммов E.coli, экспрессирующих моноклональные scFv. Для оценки антигена с помощью ELISA использовали непосредственно супернатант, полученные после культивирования указанных клональных штаммов (см. также Hust et al. 2011. Journal of Biotechnology 152, 159-170; Schütte et al. 2009. PLoS One 4, e6625).
Положительные клоны отбирали на основе сигнала ELISA, положительного в отношении антигена и отрицательного в отношении сенсибилизированных стрептавидином титрационных микропланшетов. Для дальнейшей характеризации открытую рамку считывания scFv клонировали в экспрессиионной плазмиде pOPE107 (Hust et al. 2011. Journal of Biotechnology 152, 159-170), выделяли из супернатанта культуры с помощью аффинной хроматографии с иммобилизованными ионами металлов и очищали с помощью эксклюзионной хроматографии.
Константы сродства
Для определения сродства антител к ADM определяли кинетику связывания ADM с иммобилизованным антителом методом поверхностного плазмонного резонанса, не включающего метку, используя систему Biacore 2000 (GE Healthcare Europe GmbH, Freiburg, Germany). Для осуществления обратимой иммобилизации антител применяли антитело к мышиному Fc, ковалентно связанное с высокой плотностью с сенсорным чипом CM5 согласно инструкциям производителя (набор мышиных антител для иммобилизации; GE Healthcare), (Lorenz et al. 2011. Antimicrob Agents Chemother. 55 (1):165-173).
Получали моноклональные антитела к указанным ниже областям человеческого ADM и мышиного ADM, соответственно. В приведенной ниже таблице представлен набор полученных антител, которые использовали в дальнейших экспериментах. Выбор был основан на области-мишени:
Таблица 1:
Kd (M)
Создание фрагментов антител ферментативным расщеплением:
Для получения фрагментов Fab и F(ab)2 применяли ферментативное расщепление мышиного полноразмерного антитела NT-M. Антитело NT-M расщепляли, используя a) набор на основе пепсина для получения F(ab)2 (Pierce 44988) и b) набор на основе папаина для получения Fab (Pierce 44985). Процедуры фрагментации выполняли согласно инструкциями производителя. В случае F(ab)2-фрагментации процедуру расщепления осуществляли в течение 8 часов при 37°С. Расщепление с получением Fab-фрагментов осуществляли в течение 16 часов, соответственно.
Процедура получения и очистка Fab
Иммобилизованный папаин уравновешивали путем отмывки смолы, используя 0,5 мл буфера для расщепления и путем центрифугирования на колонке при 5000 × g в течение 1 минуты. Затем буфер отбрасывали. Подготавливали обессоливающую колонку путем удаления раствора, в котором она хранилась, и отмывки ее буфером для расщепления с последующим центрифугированием каждый раз при 1000×g в течение 2 минут. В трубу вращающейся колонки, содержащую уравновешенный иммобилизованный папаин, добавляли по 0,5 мл полученного образца IgG. Расщепляемую реакционную смесь инкубировали в течение 16 часов на настольном шейкере при 37°С. Колонку центрифугировали при 5000×g в течение 1 минуты для отделения продуктов расщепления от иммобилизованного папаина. После этого смолу отмывали 0,5 мл PBS и центрифугировали при 5000×g в течение 1 минуты. Полученную при отмывке фракцию добавляли к расщепленному антителу, в результате общий объем образца составил 1,0 мл. Колонку, заполненную NAb-белком A, уравновешивали PBS и буфером для элюиции IgG при комнатной температуре. Колонку центрифугировали в течение 1 минуты для удаления раствора, в котором осуществляли хранение (содержащем 0,02% азида натрия), и уравновешивали, добавляя 2 мл PBS, снова центрифугировали в течение 1 минуты, и прошедший через колонку элюат отбрасывали. Образец вносили в колонку и ресуспендировали путем переворачивания. Инкубацию проводили при комнатной температуре при перемешивании в течение 10 минут. Колонку центрифугировали в течение 1 минуты, получая элюат, содержащий Fab-фрагменты. (Ссылки: Coulter and Harris 1983. J. Immunol. Meth. 59, 199-203.; Lindner et al. 2010. Cancer Res. 70, 277-87; Kaufmann et al. 2010. PNAS. 107, 18950-5.; Chen et al. 2010. PNAS. 107, 14727-32; Uysal et al. 2009 J. Exp. Med. 206, 449-62; Thomas et al. 2009. J. Exp. Med. 206, 1913-27; Kong et al. 2009 J. Cell Biol. 185, 1275-840).
Процедура получения и очистки F(ab’)2-фрагментов
Иммобилизованный пепсин уравновешивалипутем отмывки смолы, используя 0,5 мл буфера для расщепления, и центрифугировали на колонке при 5000×g в течение 1 минуты. Затем буфер отбрасывали. Подготавливали обессоливающую колонку путем удаления раствора, в котором она хранилась, и отмывки ее буфером для расщепления с последующим центрифугированием каждый раз при 1000×g в течение 2 минут. В трубу вращающейся колонки, содержащую уравновешенный иммобилизованный пепсин, добавляли 0,5 мл полученного образца IgG. Расщепляемую реакционную смесь инкубировали в течение 16 часов на настольном шейкере при 37°С. Колонку центрифугировали при 5000×g в течение 1 минуты для отделения продуктов расщепления от иммобилизованного папаина. После этого смолу отмывали, используя 0,5 мл PBS, и центрифугировали при 5000×g в течение 1 минуты. Полученную при отмывке фракцию добавляли к расщепленному антителу, в результате общий объем образца составил 1,0 мл. Колонку, заполненную NAb-белком A, уравновешивали PBS и буфером для элюции IgG при комнатной температуре. Колонку центрифугировали в течение 1 минуты для удаления раствора, в котором осуществляли хранение (содержащего 0,02% азида натрия), и уравновешивали путем добавления 2 мл PBS, снова центрифугировали в течение 1 минуты, и отбрасывали прошедший через колонку элюат. Образец вносили в колонку и ресуспендировали путем переворачивания. Инкубацию проводили при комнатной температуре при перемешивании в течение 10 минут. Колонку центрифугировали в течение 1 минуты, получая элюат, содержащий Fab-фрагменты. (Ссылки: Mariani et al. 1991. Mol. Immunol. 28:69-77; Beale 1987. Exp Comp Immunol 11:287-96; Ellerson et al. 1972. FEBS Letters 24(3):318-22; Kerbel and Elliot 1983. Meth Enzymol 93:113-147; Kulkarni et al. 1985. Cancer Immunol Immunotherapy 19:211-4; Lamoyi 1986. Meth Enzymol 121:652-663; Parham et al. 1982. J Immunol Meth 53:133-73; Raychaudhuri et al. 1985. Mol Immunol 22(9):1009-19; Rousseaux et al. 1980. Mol Immunol 17:469-82; Rousseaux et al. 1983. J Immunol Meth 64:141-6; Wilson et al. 1991. J Immunol Meth 138:111-9).
Гуманизация фрагмента антитела NT-H:
Фрагмент антитела гуманизировали методом трансплантации CDR (Jones et al. 1986. Nature 321, 522-525).
Для получения гуманизированной последовательности выполняли следующие этапы:
Экстракция общей РНК: Общую РНК экстрагировали из NT-H-гибридом, используя набор фирмы Qiagen.
Первый цикл ОТ-ПЦР: Использовали набор QIAGEN® OneStep RT-PCR (номер по каталогу 210210). ОТ-ПЦР осуществляли с использованием наборов праймеров, специфических для тяжелых и легких цепей. Для каждого образца РНК осуществляли реакций ОТ-ПЦР для 12 индивидуальных тяжелой цепи и 11 легких цепей, используя смесь вырожденных прямых праймеров, перекрывающих лидерные последовательности вариабельных областей. Обратные праймеры локализоали в константных областях тяжелых и легких цепей. В праймеры не встраивали сайты рестрикции.
Параметры реакции: 5x буфер из набора QIAGEN® OneStep RT-PCR, 5,0 мкл, смесь dNTP (содержащая по 10 мМ каждого dNTP), 0,8 мкл; набор праймеров, 0,5 мкл; смесь ферментов из набора QIAGEN® OneStep RT-PCR, 0,8 мкл; матричная РНК, 2,0 мкл; не содержащая РНКазу вода до 20,0 мкл; общий объем 20,0 мкл.
Условия осуществления ПЦР: обратная транскрипция: 50°С, 30 мин; начальная активация ПЦР: 95°С, 15 мин.
Программа циклической реакции: 20 циклов при 94°С, 25 с; 54°С, 30 с; 72°С, 30 с; конечное удлинение: 72°С, 10 мин.
Второй цикл с использованием полугнездовой ПЦР: ОТ-ПЦР продукты, полученные с помощью первого цикла реакций дополнительно амплифицировали во втором цикле ПЦР. Осуществляли ОТ-ПЦР реакции для 12 индивидуальных тяжелых цепей и 11 легких цепей с использованием наборов праймеров для полугнездовой ПЦР, специфических для вариабельных областей антител.
Параметры реакции: 2x смесь для ПЦР, 10 мкл; набор праймеров, 2 мкл; продукт, полученный в первом цикле ПЦР, 8 мкл; общий объем, 20 мкл; отчет о клонировании полученных с использованием гибридомы антител.
Условия проведения ПЦР: начальная денатурация в течение 5 мин при 95°С; 25 циклов при 95°С в течение 25 с, 57°С в течение 30 с, 68°С в течение 30 с; окончательное удлинение в течение 10 мин 68°С.
После завершения ПЦР осуществляли анализ образцов, полученных с помощью ПЦР-реакций, в агарозном геле для визуализации амплифицированных фрагментов ДНК. После секвенирования более 15 клонированных ДНК-фрагментов, амплифицированных методом гнездовой ОТ-ПЦР, клонировали несколько тяжелых и легких цепей мышиных антител, которые оказались правильными. Путем выравнивания последовательности белка и с помощью анализа CDR идентифицировали одну тяжелую цепь и одну легкую цепь. Поскольку аминокислоты в положениях 26, 40 и 55 в вариабельной области тяжелой цепи и аминокислота в положении 40 в вариабельной области легкой цепи имеют решающее значение для способности к связыванию, их можно превращать вновь в исходные мышиные аминокислоты. Полученные кандидаты представлены ниже. (Padlan 1991. Mol. Immunol. 28, 489-498; Harris and Bajorath.1995. Protein Sci. 4, 306-310).
Аннотация к последовательностям фрагментов антител (SEQ ID No. 13-22): выделены жирным шрифтом и подчеркнуты CDR 1, 2, 3, расположенные в хронологическом порядке; курсивом обозначены константные области; шарнирные области выделены жирным шрифтом, а гистидиновая метка выделена жирным шрифтом и курсивом.
SEQ ID No. 13 (AM-VH-C)
QVQLQQSGAELMKPGASVKISCKATGYTFSRYWIEWVKQRPGHGLEWIGEILPGSGST
NYNEKFKGKATITADTSSNTAYMQLSSLTSEDSAVYYCTEGYEYDGFDYWGQGTTLTVSSA
STKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRV EPKHHHHHH
SEQ ID No. 14 (AM-VH1)
QVQLVQSGAEVKKPGSSVKVSCKASGYTFSRYWISWVRQAPGQGLEWMGR
ILPGSGST NYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCTEGYEYDGFDY
WGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRV EPKHHHHHH
SEQ ID No. 15 (AM-VH2-E40)
QVQLVQSGAEVKKPGSSVKVSCKASGYTFSRYWIEWVRQAPGQGLEWMGR
ILPGSGST NYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCTEGYEYDGFDY
WGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRV EPKHHHHHH
SEQ ID No. 16 (AM-VH3-T26-E55)
QVQLVQSGAEVKKPGSSVKVSCKATGYTFSRYWISWVRQAPGQGLEWMGEILPGSGST
NYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCTEGYEYDGFDYW
GQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRV EPKHHHHHH
SEQ ID No. 17 (AM-VH4-T26-E40-E55)
QVQLVQSGAEVKKPGSSVKVSCKATGYTFSRYWIEWVRQAPGQGLEWMGEILPGSGST
NYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCTEGYEYDGFDYWGQGTTVTVSSA
STKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRV EPKHHHHHH
SEQ ID No. 18 (AM-VL-C)
DVLLSQTPLSLPVSLGDQATISCRSSQSIVYSNGNTYLEWYLQKPGQSPKLLIYRVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGVYYCFQGSHIPYTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID No. 19 (AM-VL1)
DVVMTQSPLSLPVTLGQPASISCRSSQSIVYSNGNTYLNWFQQRPGQSPRRLIYRVSNRDSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCFQGSHIPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID No. 20 (AM-VL2-E40)
DVVMTQSPLSLPVTLGQPASISCRSSQSIVYSNGNTYLEWFQQRPGQSPRRLIYRVSNRDSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCFQGSHIPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
Пример 2
Разработка иммуноанализа
Иммуноанализ разрабатывали, используя полученные антитела к человеческим пептидам ADM (NT-H, MR-H и CT-H; см. Таблицу 1).
Процедура мечения (индикатор (трейсер)): 100 мкг (100 мкл) антитела (1 мг/мл в PBS, pH 7,4) смешивали с 10 мкл NHS-эфира акридиния (1 мг/мл в ацетонитриле, InVent GmbH, Германия) (EP 0353971) и инкубировали в течение 20 мин при комнатной температуре. Меченое CT-H очищали гель-фильтрационной ВЭЖХ, используя устройство Bio-Sil® SEC 400-5 (Bio-Rad Laboratories, Inc., США). Очищенное меченое антитело разбавляли (300 ммоль/л фосфата калия, 100 ммоль/л NaCl, 10 ммоль/л Na-EDTA, 5 г/л бычьего сывороточного альбумина, рН 7,0). Конечная концентрация составила приблизительно 800000 относительных световых единиц (RLU) меченого соединения (приблизительно 20 нг меченого антитела) на 200 мкл. Хемилюминесценцию измеряли на приборе AutoLumat LB 953 (Berthold Technologies GmbH & Co. KG).
Твердая фаза: Полистироловые пробирки (Greiner Bio-One International AG, Австрия) покрывали (18 ч при комнатной температуре) антителом (1,5 мкл антитела/0,3 мл 100 ммоль/л NaCl, 50 ммоль/л TRIS/HCl, рН 7,8). После блокирования 5% бычьим сывороточным альбумином пробирки промывали PBS, pH 7,4, и сушили в вакууме.
Калибровочные маркеры: Выполняли серийное разведение синтетического человеческого ADM (hADM) (Bachem, Швейцария), используя 50 мМ TRIS/HCl, 250 мМ NaCl, 0,2% Тритон Х-100, 0,5% BSA, 20 таблеток/л полного коктейля ингибиторов протеаз (Roche AG); рН 7,8. Калибровочные маркеры хранили при -20°С до использования.
Иммуноанализ ADM: 50 мкл образца (или калибровочного маркера) вносили пипеткой в покрытые пробирки, после добавления меченого вторичного антитела (200 мкл) пробирки инкубировали в течение 2 ч при комнатной температуре. Несвязанную метку удаляли 5-кратной отмывкой (каждый раз по 1 мл) отмывочным раствором (20 мМ PBS, pH 7,4, 0,1% Тритон X-100). Связаннубю с пробиркой хемилюминесценцию измеряли на приборе LB 953 (Berthold Technologies GmbH & Co.KG). Антитела использовали в сэндвич-иммуноанализе в пробирках, покрытых меченным антителом, и объединяли в указанных ниже вариантах (см. Таблицу 2). Инкубацию выполняли, как описано в разделе Иммуноанализ hADM. Результаты приведены в отношении удельного сигнала (при 10 нг/мл ADM)/фоновый (образец без ADM) сигнал.
Таблица 2:
Неожиданно было обнаружено, что комбинация MR-ADM и CT-ADM является комбинацией с самым высоким отношением сигнал/шум. Впоследствии эту комбинацию антител использовали в дальнейших исследованиях для измерения bio-ADM. Анти-MR-ADM использовали в качестве твердофазного антитела и анти-CT-ADM в качестве меченого антитела. Типичная кривая доза/сигнал показана на фиг. 1.
Пример 3
Стабильность человеческого адреномедуллина
Человеческий ADM разбавляли в цитратной плазме человека (n=5, конечная концентрация 10 нг ADM/мл) и инкубировали при 24°C. В выбранные моменты времени отбирали аликвоты, которые замораживали при -20°C. Сразу после разморозки выполняли количественное определение hADM в образцах с помощью иммуноанализа hADM, описанного выше.
В таблице 3 показана стабильность hADM в плазме человека при 24°C.
Неожиданно было обнаружено, что при использовании комбинаций антител MR-ADM и CT-ADM в сэндвич-иммунноанализе преаналитическая стабильность аналита оказалась высокой (только 0,9%/ч средней потери иммуннореактивности). Напротив, при использовании других методов анализа период полувыведения из плазмы составлял всего 22 минуты (Hinson et al. 2000 Endocrine Reviews 21(2):138-167). Поскольку время от момента взятия образца до анализа в больничном отделении составляет менее 2 часов, используемый метод обнаружения ADM подходит для обычной диагностики. Примечательно то, что для достижения приемлемой стабильности ADM-иммунной реактивности отсутствует потребность в каких-либо нестандартных добавках к образцам (таким как апротинин (Ohta et al. 1999. Clin Chem 45(2):244-251)).
Пример 4
Воспроизводимость калибровочных маркеров-препаратов и интерпретация изменчивости калибровочных маркеров
При приготовлении калибровочных маркеров для анализов ADM обнаружена высокая изменчивость результатов (среднее значение CV 8,5%, см. Таблицу 4). Это может быть связано с высокой адсорбцией hADM на пластиковых и стеклянных поверхностях (Lewis et al. 1998. Clinical Chemistry 44(3):571-577). При добавлении детергентов (до 1% тритон X100 или 1% Твин 20), белка (до 5% BSA) и в условиях высокой ионной силы (до 1М NaCl) или их комбинаций этот эффект уменьшался лишь в незначительной степени. Неожиданно было обнаружено, что при добавлении избытка анти-NT-ADM антитела (10 мкг/мл) в буфер для разведения калибровочного маркера, существенно улучшает восстановление и воспроизводимость препаратов-калибровочных маркеров для анализа ADM до CV<1% между препаратами (Таблица 4). Коэффициенты вариации получали для 5 независимых тестирований препаратов. Калибровочные маркеры измеряли с помощью ADM-анализа, описанного выше (s/n-r=отношение сигнал/шум). Во всех последующих исследованиях использовали анализ ADM, основанный на калибровочных маркерах, приготовленных в присутствии 10 мкг/мл антитела NT-ADM и 10 мкг/мл антитела NT-ADM в качестве добавки к буферу для маркеров.
К счастью, присутствие N-концевых антител не оказывало влияния на bio-ADM-сигнал, генерируемый комбинацией MR- и C-концевых антител (фиг. 1).
Таблица 4:
Пример 5
Чувствительность
Цель анализа чувствительности заключалась в том, чтобы полностью охватить концентрацию ADM у здоровых субъектов и значительно более низкие концентрации.
Концентрация bio-ADM у здоровых людей
Измерение у здоровых субъектов (n=88, 57 женщин, 31 мужчина, средний возраст: 42,2 года) выполняли с помощью анализа bio-ADM (Weber et al. 2017. JALM, 2 (2):222-233). Средний межквартильный диапазон (IQR) составил 13,7 (9,6-18,7) пг/мл, а среднее значение (SD) составило 15,6 (9,2) пг/мл. Поскольку чувствительность анализа (предел обнаружения) составил 3 пг/мл, описанный анализ bio-ADM позволяет охватить 100% здоровых субъектов.
Пример 6
План исследования и популяция MPP
Проект профилактических мероприятий Malmö (MPP) был профинансирован в середине 1970-х годов для изучения факторов риска развития сердечно-сосудистых заболеваний (CV) среди населения в целом, и охватил 33346 человек, проживающих в Malmö (Fedorowski et al. 2010. Eur Heart J 31:85-91). В период с 2002 по 2006 год в общей сложности на приглашение откликнулись 18240 первых участников (уровень участия 70,5%), которые прошли скрининг, включая всесторонний физический осмотр и сбор образцов крови (Fava et al. 2013. Hypertension 2013; 61:319-26). Повторное исследование MPP в настоящем исследовании принято в качестве базового уровня. Субъектов с диагнозом CVD на момент первичного осмотра исключали из участия в исследовании. Bio-ADM измеряли в плазме, собранной у 4364 пациентов во время первичной оценки. 34 пациента уже имели диагноз болезни Альцгеймера во время забора крови. В течение следующих 7 лет у 187 пациентов развилась AD (инцидентная AD). Все участники дали информированное согласие, и Этический комитет Лундского университета, Лунд, Швеция, утвердил протокол исследования.
Информация о диагнозах деменции была запрошена из Шведского национального регистра пациентов (SNPR). Диагнозы в регистре собираны в соответствии с различными версиями кодов Международной классификации болезней (МКБ) 290, 293 (МКБ-8), 290, 331 (ICD-9) или F00, F01, F03, G30 (ICD-10). SNPR включает все случаи оказания стационарной помощи в Швеции с 1987 года и, помимо этого, содержит данные об амбулаторных посещениях, включая дневную хирургическую и психиатрическую помощь, оказанную как частными, так и государственными учреждениями, осуществляющими уход, зарегистрированные после 2000 года. Деменцию любой этиологии диагностировали в соответствии с критериями Диагностического и статистического руководства по психическим расстройствам (DSM)-III, пересмотренного издание, в то время как для диагностики болезни Альцгеймера и сосудистой деменции применяли критерии DSM-IV. Диагнозы подтверждали тщательным анализом медицинских карт, а также данных нейровизуализации, когда они были доступны. Врач-исследователь назначал окончательный диагноз каждому пациенту, и в спорных случаях консультировался с врачом-гериатром, специализирующимся на когнитивных расстройствах. Был отобран набор данных для исследования методом «случай-контроль», и в подгруппе MPP измеряли MR-proADM (n=250 контролей и n=150 субъектов с инцидентной AD). Кроме того, bio-ADM измеряли в независимой когорте пациентов, у которых уже была диагностирована болезнь Альцгеймера во время забора крови (= установленная AD; n=150).
Для измерения MR-proADM в плазме использовали полностью автоматизированный гомогенный флюороиммуноанализ (BRAHMS MR-proADM KRYPTOR; BRAHMS GmbH, Hennigsdorf, Germany) (Caruhel et al. 2009. Clin Biochem 42(7-8):725-8).
Статистический анализ: Значения выражены в виде средних и стандартных отклонений, медианы и межквартильных диапазонов (IQR) или, в зависимости от ситуации, в виде количества и процентов. Групповые сравнения непрерывных переменных выполняли с помощью критерия Крускала-Уоллиса. Данные по биомаркеру были логарифмически преобразованы. Регрессию пропорциональных рисков Кокса использовали для анализа влияния факторов риска на выживаемость в однофакторных и многомерных анализах. Предположения о пропорциональном риске проверяли для всех переменных. Для непрерывных переменных отношения риска (HR) были стандартизированы, чтобы описать HR для изменения биомаркера в пределах одного IQR. Для факторов риска задавали 95% доверительные интервалы (CI) и уровни значимости для хи-квадрат (критерий Вальда). Прогностическую ценность каждой модели оценивали с помощью критерия отношения правдоподобия, статистики хи-квадрат. Индекс соответствия (индекс C) использовали в качестве меры эффекта. Он эквивалентен концепции AUC, принятой для двоичного результата. Для многовариантных моделей дана версия индекса C, скорректированная методом бутстреп. Кривые выживания, построенные по методу Каплана-Мейера, использовали в иллюстративных целях. Для проверки независимости bio-ADM от клинических переменных, использовали критерий отношения правдоподобия хи-квадрат для вложенных моделей.
Все статистические тесты были двусторонними, и значение двустороннего уровня значимости p=0,05 считали достоверным. Статистический анализ выполняли, используя R версию 2.5.1 (http://www.r-project.org, Design Library, Hmisc, ROCR) и версию 22.0 статистического пакета для общественных наук (SPSS) (SPSS Inc., Чикаго, Иллинойс, США).
Результаты:
Исходные характеристики когорт показаны в таблице 5.
Концентрации bio-ADM в когорте MPP и в независимой когорте болезни Альцгеймера показаны на фиг. 2. Концентрации bio-ADM у пациентов, у которых развилась со временем AD (инцидентная AD), и у пациентов с AD на момент взятия образцов крови в независимой когорте (установленная AD) значительно ниже по сравнению с группой без AD (р=0,01 и <0,0001, соответственно). Группа с установленной AD из когорты MPP (n=34) также имела более низкие концентрации bio-ADM по сравнению с группой без AD, но эти различия не были статистически значимыми, что связано с небольшим размером выборки.
Низкая концентрация bio-ADM в плазме четко предсказывает болезнь Альцгеймера с коэффициентом риска (HR) 0,73 (CI 0,6-0,87; р<0,001). На фиг. 3 показан график Каплана-Мейера для прогнозирования болезни Альцгеймера с концентрациями bio-ADM (случаи установленной AD были исключены из анализа). Самый низкий квартиль связан с самым высоким риском развития AD.
Создан набор данных для метода случая-контроль путем выбора 400 пациентов из группы MPP (у которых не были диагностированы CVD и AD) с n=250 субъектами, у которых не развилась AD, и n=150 пациентами, у которых развилась AD в течение 7-ми летнего периода наблюдения. И в этом случае, концентрации bio-ADM были значительно ниже (p<0,0001 для всех сравнений) у пациентов с инцидентной AD и у пациентов с установленной AD (независимая когорта) по сравнению с группой без AD (фиг. 4). Кроме того, уровень MR-proADM измеряли у пациентов из группы MPP «случай-контроль», который оказался немного, не значительно, выше при инцидентной AD по сравнению с группой без AD (фиг. 5).
На следующем этапе объединяли оба биомаркера, bio-ADM и MR-proADM. Для вычисления отношения концентрации обоих маркеров предпочтительно должны быть выражены в одних и тех же единицах (например, пмоль/л). Следовательно, для вычисления отношения концентрации bio-ADM рассчитывали в пмоль/л. Отношение между bio-ADM и MR-proADM значительно снижено у субъектов с инцидентной AD по сравнению с субъектами без AD (р<0,0001; фиг. 6). Уже один только уровень bio-ADM четко предсказывает болезнь Альцгеймера с коэффициентом шансов (OR) 0,44 (CI 0,33-0,58). Однако отношение между bio-ADM и MR-proADM оказалось лучше, чем один bio-ADM (р<0,001) с OR 0,32 (CI 0,23-0,44). Соответствующие рабочие характеристические кривые (графики ROC) для bio-ADM и отношения bio-ADM и MR-proADM показаны на фиг.7 A и B, соответственно, с AUC 0,67 (95% CI 0,61-0,72) для bio-ADM и 0,73 (95% CI 0,68-0,78) для отношения между bio-ADM и МР-proADM. Более того, как bio-ADM, так и отношение bio-ADM и MR-proADM не зависят от возраста и пола.
Пример 7 - Введение NT-H здоровым людям
Исследование проводили с участием здоровых мужчин в виде рандомизированного, двойного слепого, плацебо-контролируемого исследования с однократной эскалацией доз антитела NT-H, вводимых в виде внутривенной (iv) инфузии, в 3 последовательных группах по 8 здоровых мужчин в каждой (1-я группа 0,5 мг/кг, 2-я группа 2 мг/кг, 3-я группа 8 мг/кг) (n=6 активных, n=2 плацебо в каждой группе).
Основными критериями включения были письменное информированное согласие, возраст 18-35 лет, согласие на использование надежного способа контрацепции и показатель BMI от 18 до 30 кг/м².
Испытуемые получали одну в/в дозу антитела NT-H (0,5 мг/кг; 2 мг/кг; 8 мг/кг) или плацебо путем медленной инфузии в течение 1-го часа в исследовательском отделении.
Базовые значения bio-ADM в 4 группах не различались. Медианные значения bio-ADM составляли 7,1 пг/мл в группе плацебо, 6,8 пг/мл в первой группе лечения (0,5 мг/кг), 5,5 пг/мл во второй группе лечения (2 мг/кг) и 7,1 пг/мл в третьей группе лечения (8 мг/мл).
Результаты показывают, что у здоровых людей значения bio-ADM быстро увеличивались в течение первых 1,5 часов после введения антитела NT-H, затем достигали плато и медленно снижались (фиг. 8).
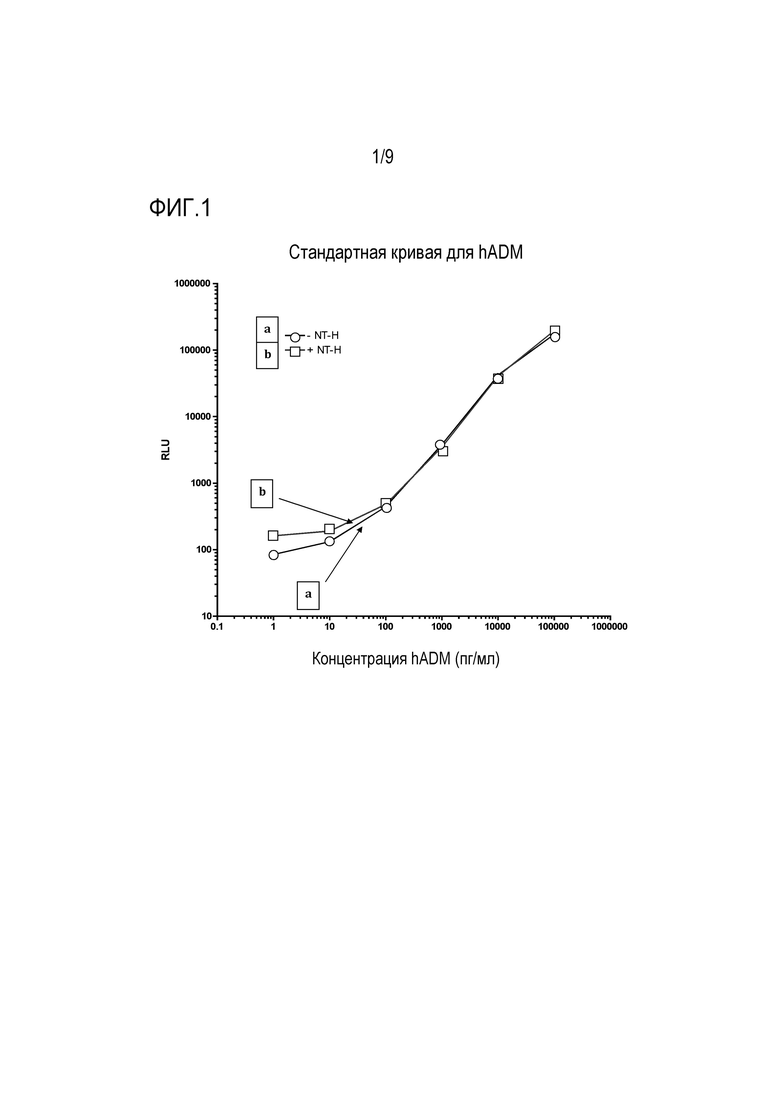
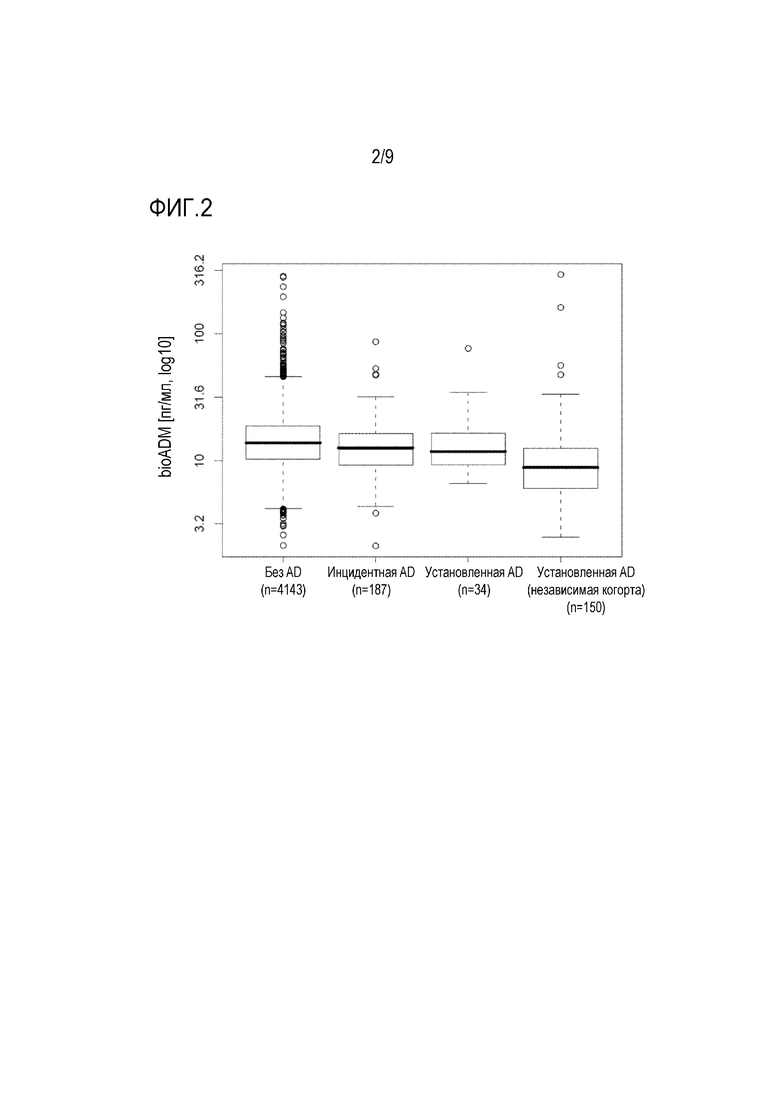
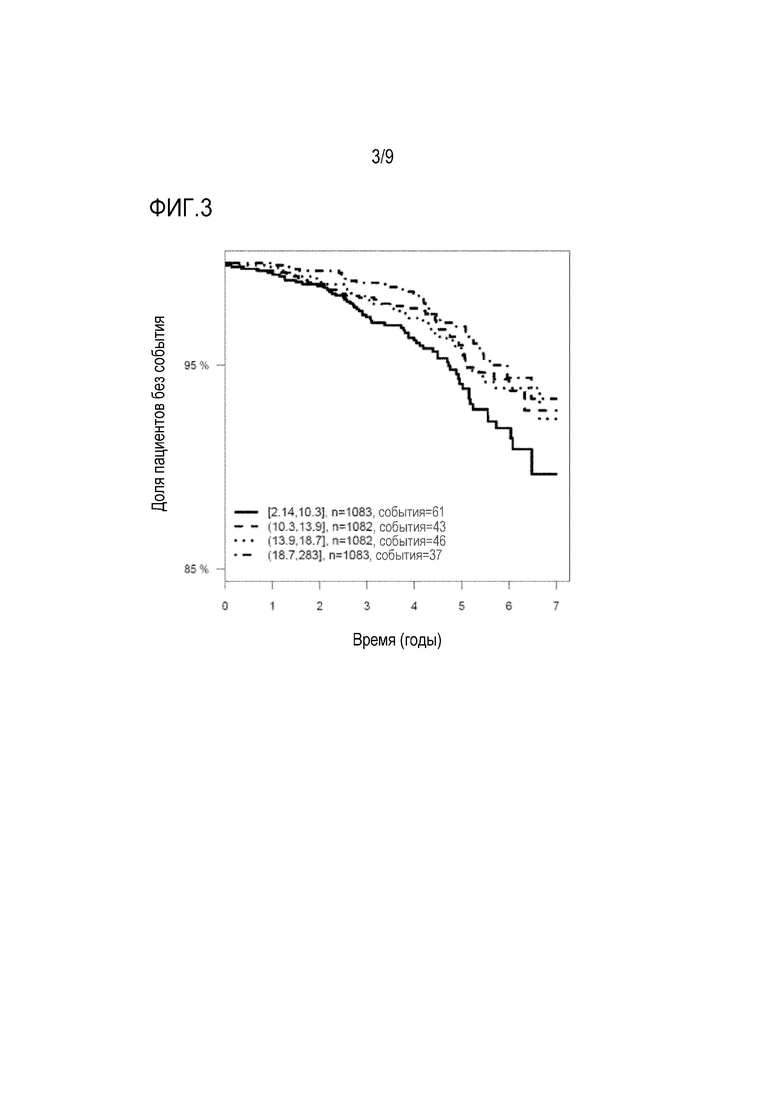
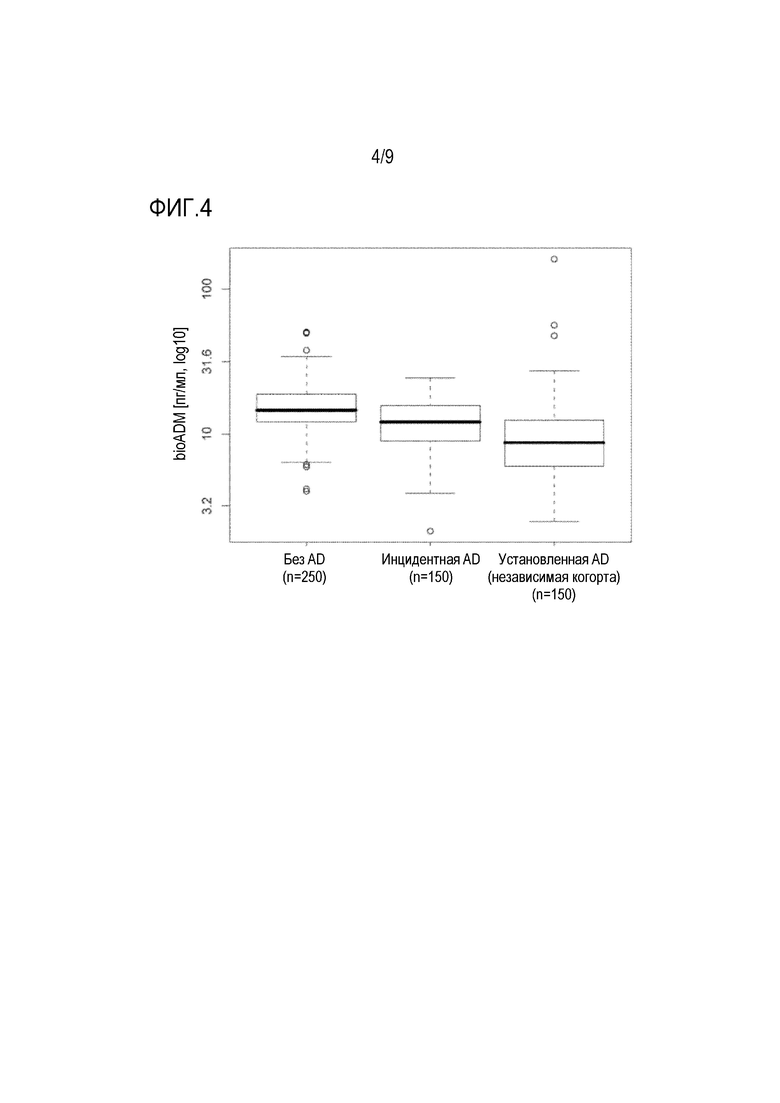

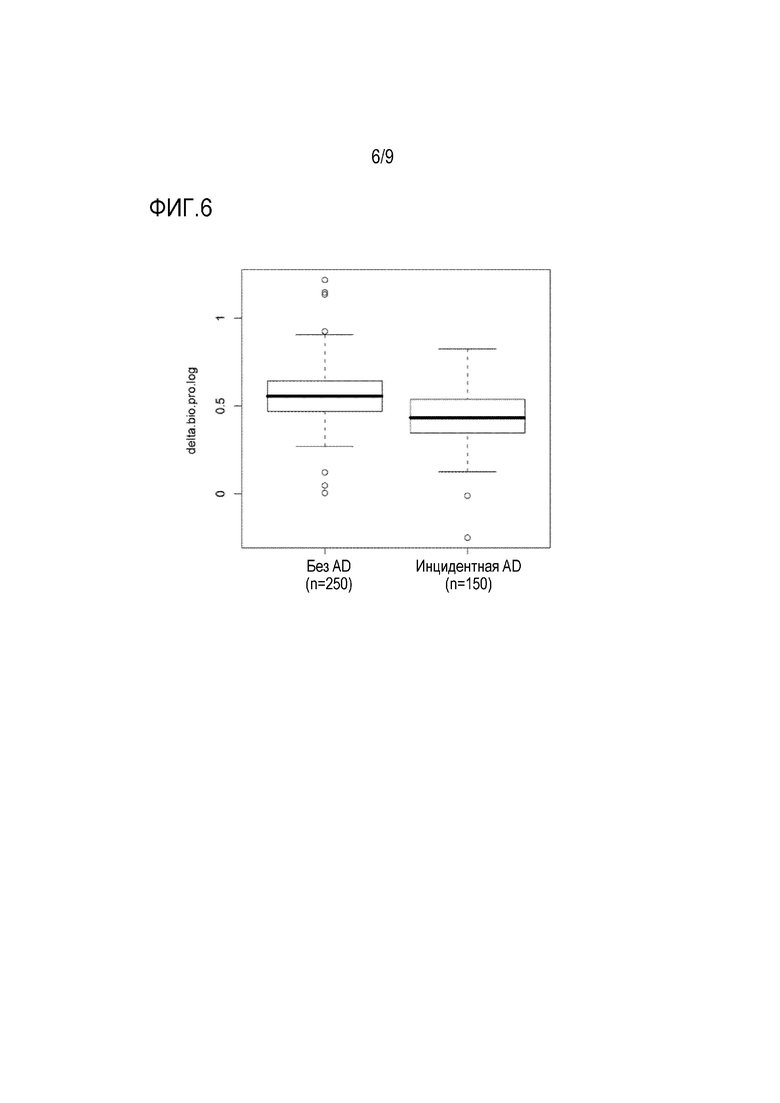

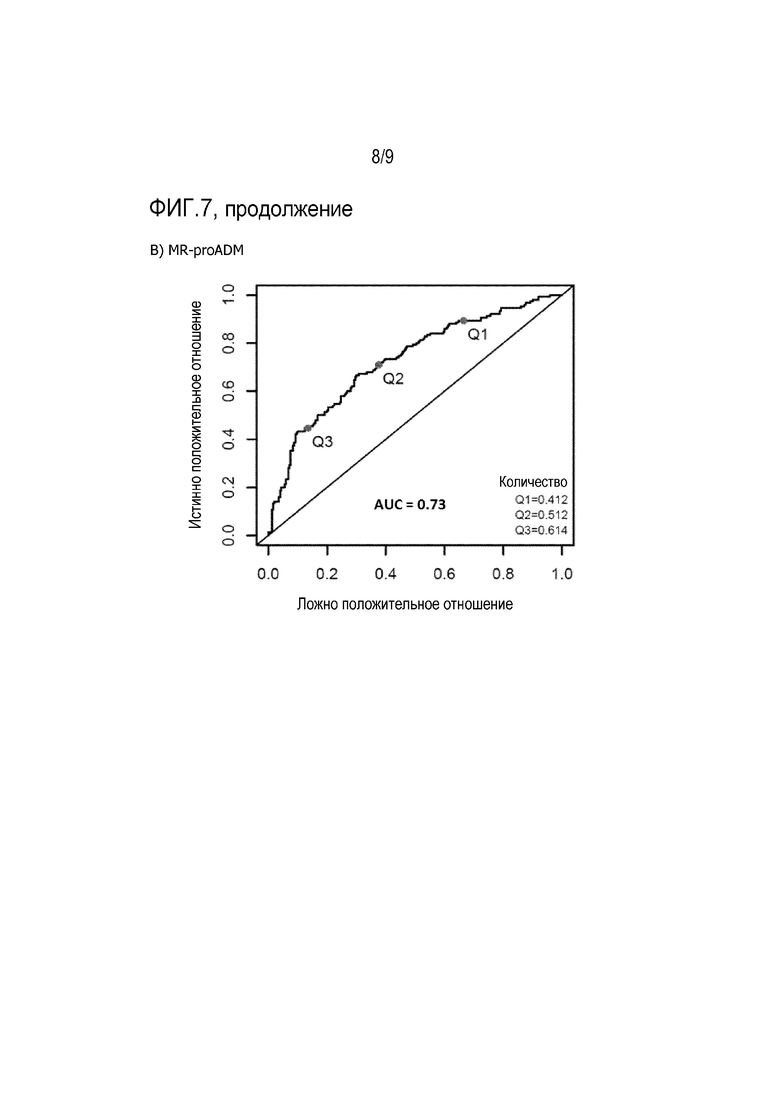
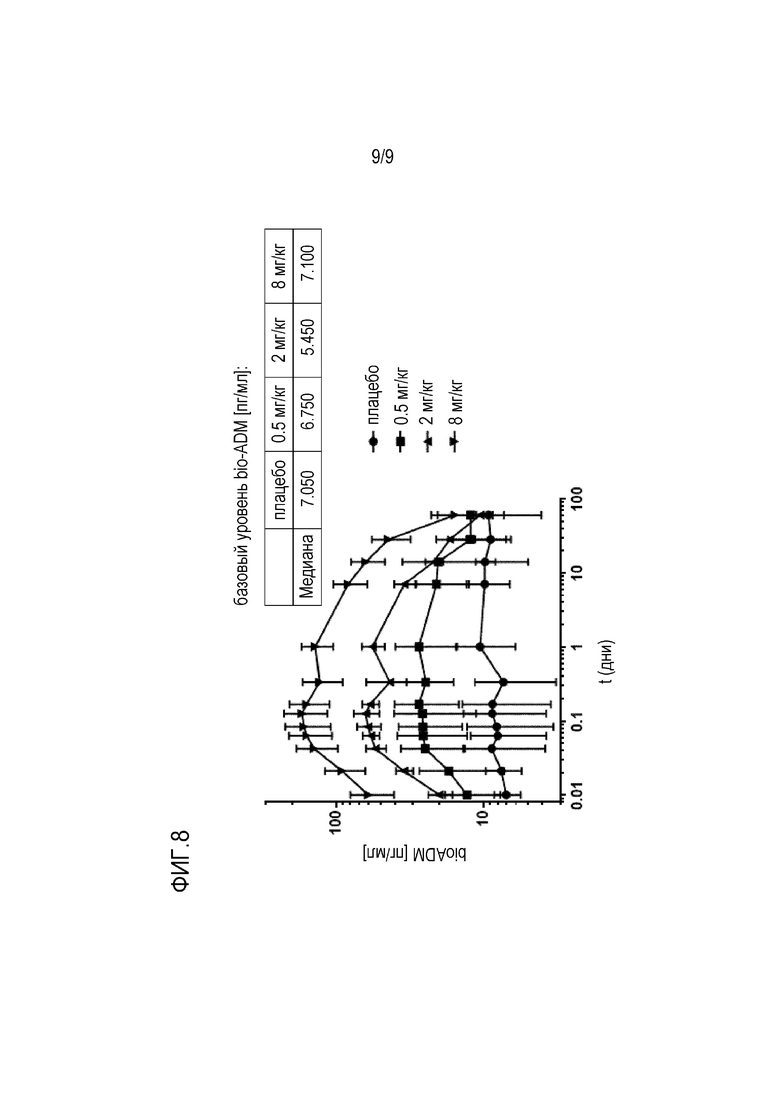
Группа изобретений относится к медицине, а именно к способам определения риска развития деменции у субъекта, не страдающего деменцией и к применению антитела к адреномедуллину (ADM) для профилактики и терапии деменции. Для этого определяют уровень зрелого ADM-NH2 согласно SEQ ID No. 4 в образце физиологической жидкости субъекта или отношение маркеров, которое может представлять собой отношение уровня зрелого ADM-NH2 согласно SEQ ID No. 4 к уровню про-адреномедуллина или его фрагмента, который является незрелым ADM-NH2 согласно SEQ ID No. 4. Уровень зрелого ADM-NH2 или отношение маркеров сравнивают с пороговым уровнем. Субъект имеет повышенный риск развития деменции, если уровень зрелого ADM-NH2 согласно SEQ ID No. 4 или отношение маркеров зрелый ADM-NH2/про-адреномедуллин ниже порогового уровня/отношения. Группа изобретений обеспечивает определение риска развития деменции. 3 н. и 10 з.п. ф-лы, 8 ил., 5 табл., 7 пр.
1. Способ определения риска развития деменции у субъекта, не страдающего деменцией, в котором определяют уровень зрелого ADM-NH2 согласно SEQ ID No. 4 в образце физиологической жидкости субъекта, и в котором указанный уровень зрелого ADM-NH2 сравнивают с пороговым уровнем, причем
указанный субъект имеет повышенный риск развития деменции, если указанный уровень зрелого ADM-NH2 согласно SEQ ID No. 4 ниже указанного порогового уровня.
2. Способ определения риска развития деменции у субъекта, не страдающего деменцией, в котором определяют отношение маркеров, которое может представлять собой отношение уровня зрелого ADM-NH2 согласно SEQ ID No. 4, определенного в образце физиологической жидкости указанного субъекта, к уровню про-адреномедуллина или его фрагмента, который является незрелым ADM-NH2 согласно SEQ ID No. 4, определенному в образце физиологической жидкости указанного субъекта, и причем указанный фрагмент про-адреномедуллина выбирают из группы, содержащей PAMP: SEQ ID No. 2, MR-proADM: SEQ ID No. 3, ADM-Gly: SEQ ID No. 5 и CT-proADM: SEQ ID No. 6 и, причем указанное отношение маркеров сравнивают с пороговым отношением и, причем,
указанный субъект имеет повышенный риск развития деменции, если отношение маркеров зрелый ADM-NH2/про-адреномедуллин или его фрагмент ниже указанного порогового значения
или альтернативно к вышеуказанному отношению маркеров, уровень зрелого ADM-NH2 согласно SEQ ID No. 4 определяют в образце физиологической жидкости указанного субъекта, и уровень про-адреномедуллина или его фрагмента, который не является зрелым ADM-NH2 согласно SEQ ID No. 4, определяют в образце физиологической жидкости указанного субъекта, и оба определенных уровня объединяют в математическом алгоритме, причем результат указанного математического алгоритма используют для определения риска развития деменции у субъекта, не страдающего деменцией.
3. Способ по п.1, в котором пороговый уровень зрелого ADM-NH2 согласно SEQ ID No. 4 равен или ниже 15 пг/мл, предпочтительно равен или ниже 10 пг/мл, предпочтительно равен или ниже 5 пг/мл.
4. Способ по п.2, в котором отношение порогового значения находится в диапазоне от 0,2 до 0,75, предпочтительно от 0,3 до 0,6, предпочтительно от 0,4 до 0,5.
5. Способ по любому из предшествующих пунктов, в котором указанный образец выбирают из группы: крови, сыворотки, плазмы, мочи, спинномозговой жидкости (CSF) и слюны.
6. Способ по пп.1-5, в котором образец физиологической жидкости берут у субъекта, у которого до момента взятия образца не была диагностирована деменция или легкое когнитивное нарушение (MCI).
7. Способ по п.1 или 2, в котором указанный способ используют для стратификации пациентов для выбора пациента для лечения антителом к адреномедуллину (ADM) или фрагментом антитела к адреномедуллину или анти-ADM не-Ig каркасом для применения в профилактике или терапии деменции у субъекта, причем указанное анти-ADM антитело или фрагмент анти-ADM антитела или анти-ADM не-Ig каркас связывается с N-концевой частью aa 1-21 адреномедуллина:
YRQSMNNFQGLRSFGCRFGTC SEQ ID No. 21.
8. Применение антитела к адреномедуллину (ADM) или фрагмента антитела к адреномедуллину или анти-ADM не-Ig каркаса для профилактики или терапии деменции у субъекта, причем указанное анти-ADM антитело или фрагмент анти-ADM антитела или анти-ADM не-Ig каркас связывается с N-концевой частью аа 1-21 адреномедуллина:
YRQSMNNFQGLRSFGCRFGTC SEQ ID No. 21, причем указанного субъекта выбирают способом по п.7.
9. Применение по п.8, причем указанный субъект имеет уровень зрелого ADM-NH2 согласно SEQ ID No. 4, определенный в образце физиологической жидкости указанного субъекта, ниже порогового уровня и/или имеет отношение маркеров, которое представляет собой отношение уровня зрелого ADM-NH2 согласно SEQ ID No. 4, определенного в образце физиологической жидкости указанного субъекта, к уровню про-адреномедуллина или его фрагмента, определенному в образце физиологической жидкости указанного субъекта, и причем указанное отношение уровней маркеров ниже порогового отношения.
10. Применение по п.9, причем указанный фрагмент про-адреномедуллина выбирают из группы, содержащей PAMP (SEQ ID No. 2), MR-proADM (SEQ ID No. 3), ADM-Gly (SEQ ID No. 5) и CT-proADM (SEQ ID No. 6).
11. Применение по п.9 или 10, причем пороговый уровень зрелого ADM-NH2 согласно SEQ ID No. 4 равен или ниже 15 пг/мл, предпочтительно равен или ниже 10 пг/мл, предпочтительно равен или ниже 5 пг/мл.
12. Применение по п.9 или 10, причем отношение уровней маркеров находится в пределах от 0,2 до 0,75, предпочтительно от 0,3 до 0,6, предпочтительно от 0,4 до 0,5.
13. Применение по п.8, причем образец физиологической жидкости выбирают из группы: крови, сыворотки, плазмы, мочи, спинномозговой жидкости (CSF) и слюны.
| WO 2013072513 A1, 23.05.2013 | |||
| МикроРНК - БИОМАРКЕРЫ, УКАЗЫВАЮЩИЕ НА БОЛЕЗНЬ АЛЬЦГЕЙМЕРА | 2012 |
|
RU2639509C2 |
| US 2016230227 A1, 11.08.2016 | |||
| WO 2004104597 A1, 02.12.2004 | |||
| BUERGER K | |||
| et al | |||
| Халат для профессиональных целей | 1918 |
|
SU134A1 |
Авторы
Даты
2024-01-11—Публикация
2019-02-07—Подача